Изобретение относится к медицине, в частности к реконструктивной хирургии, может быть использовано при реабилитации онкологических, травматологических больных для восстановления целостности гортаноглотки, полости рта, гортани и трахеи.
Известен способ реконструкции гортани с помощью кожно-мышечного лоскута из волокон большой грудной мышцы (RU 2259170 С1). Способ заключается в том, что восстановление просвета гортани осуществляют двухслойным кожно-мышечным лоскутом, для формирования которого кожный фрагмент рассекают в продольном направлении и складывают таким образом, что одна сторона кожной поверхности лоскута служит для формирования внутренней поверхности просвета гортани, а другую используют для закрытия кожной раны. Кожную поверхность лоскута, обращенную в просвет гортани, деэпидермизируют, осуществляют ее перфорацию и реэпителизацию путем фиксации пластин слизистой оболочки щеки в образованных лунках. Внутреннюю часть лоскута фиксируют в просвет гортани к краям ларингостомы после введения перфорированного стента-обтуратора, внешнюю часть лоскута фиксируют к краям кожной раны.
Преимуществом известного способа является возможность восстановления слизистой оболочки гортани при минимизации размера донорской раны на слизистой оболочке щеки. Но способ имеет ряд недостатков, таких как:
- невозможность восстановления описанным трансплантатом органов полости рта ввиду ограничения длины сосудистой ножки,
- применение стента-обтуратора из поролона, который вначале полностью обтурирует просвет органа, а после его удаления теряется каркасная функция,
- фрагменты слизистой имплантируют к краям ячеек, в результате чего возможна их миграция,
- адаптация неоднородных тканей (глотка с деэпидермизированной кожей) обуславливает высокую частоту несостоятельности швов с образованием вторичных орофарингостом и глоточных свищей. В связи с описанными недостатками способ не получил широкого распространения в клинической практике.
Известна также методика ортотопической биоинженерной реконструкции дефектов гортани, трахеи, глотки у онкологических больных с применением метода тканевой инженерии (Батухтина Е.В. Реконструкция верхних дыхательных путей с использованием тканевого эквивалента у онкологических больных. Диссертация на соискание ученой степени кандидата медицинских наук. Москва. 2006 г.). В соответствии с известным способом для реконструкции верхних дыхательных путей используют костно-мышечные лоскуты, включающие волокна кивательной мышцы и фрагмент рукоятки грудины с предварительной или одномоментной имплантацией тканевого эквивалента слизистой оболочки. Каркас гортани восстанавливают костным фрагментом лоскута и титановой пластиной. Реконструкцию верхних пищеварительных путей осуществляют в два этапа с использованием мышечных лоскутов из волокон большой грудной мышцы. На первом этапе всем пациентам производят имплантацию тканевого эквивалента на волокна большой грудной мышцы. Реконструктивный этап осуществляют в сроки от 7 суток до 30 дней после имплантации тканевого эквивалента. Восстановление мягкотканого дефекта орофарингеальной зоны осуществляют мышечной порцией лоскута, слизистую оболочку восстанавливают тканевым эквивалентом. Лоскут послойно фиксируют по периметру дефекта узловыми швами. Тканевая культура, имплаптируемая в просвет гортани, глотки включающая коллагеновый гель, аллогенную клеточную культуру фибробластов и эпидермальных кератиноцитов, являясь эквивалентом слизистой оболочки и закрывая ее дефект, оказывает непосредственное влияние на заживление и эпителизацию раны.
Преимуществом известной методики является то, что реконструкцию верхних дыхательных или пищеварительных путей осуществляют с восстановлением всех составляющих элементов органа, включая костно-хрящевой остов, мышечный каркас, эпителиальную выстилку, а также функционально достаточного объема и формы органа, Тканевой эквивалент слизистой оболочки способствует заживлению и формированию эпителиального слоя органов. Но методика имеет ряд недостатков, таких как:
- использование тканевого эквивалента слизистой из аллогенного материала требует разрешения этического комитета,
- для изготовления тканевого эквивалента слизистой из аллогенного материала требуется привлечение биологов и дополнительных затрат,
- костно-хрящевой остов формируют из рукоятки грудины с использованием титановой пластины, которая не является однородными, близким по морфологической структуре материалом, позволяющим полностью выполнять функции хряща,
- способ не позволяет замещать циркулярные дефекты гортани, трахеи.
Наиболее близким к заявляемому изобретению является способ формирования аутотрансплантата из фрагмента прямой мышцы живота на нижних эпигастральных сосудах (RU 2398529 С2). Принят в качестве прототипа.
Известный способ заключается в том, что свободный микрохирургический аутотрансплантат формируют из фрагмента прямой мышцы живота с париетальной брюшиной и фрагментом апоневроза из передней пластины влагалища прямой мышцы живота или надлежащей кожей. Длина сосудистой ножки лоскута может достигать 10-13 см. Аутотрансплантат переносят в реципиентную зону и фиксируют отдельными узловыми швами. Формирование лоскута описанным способом имеет ряд преимуществ, таких как:
- способ всегда обеспечивает возможность выкраивания комбинированного аутотрансплантата;
- длина сосудистой ножки лоскута позволяет произвести реваскуляризацию трансплантата с сосудами, находящимися вне полей облучения, что обеспечивает надежное приживление;
- использование данного пластического материала позволяет закрывать дефекты различной конфигурации;
- регенеративные способности париетальной брюшины позволяют изолировать жизненно важные и опасные по осложнениям структуры;
- отсутствует функциональный и эстетический ущерб в донорской зоне после формирования лоскута.
Но при устранении орофарингеальных дефектов указанным трансплантатом восстановление слизистой оболочки производят кожной или апоневротической частью трансплантата, которые не являются органотипическими тканями. При восстановлении эпителиальной выстилки кожной порцией трансплантатов наблюдается рост волос в просвет вновь сформированного органа, деятельность потовых и сальных желез внутренней выстилки. Адаптация слизистой оболочки с кожей обуславливает высокую частоту несостоятельности швов с образованием вторичных орофарингостом и слюнных свищей.
Заявляемое изобретение направлено на решение задачи восстановления органов верхних дыхательных или пищеварительных путей аутологичным префабрицированным биоинженерным лоскутом.
Использование в клинической практике заявляемого способа позволяет достичь следующих результатов:
- применение заявляемого способа возможно вне зависимости от проведенного ранее лечения - лучевой терапии или операции,
- способ может быть применен вне зависимости от резекционного этапа как одномоментно с удалением опухоли, так и отсроченно,
- способ позволяет устранить дефекты за один хирургический этап,
- способ применим при дефиците пластического материала и выраженном рубцовом процессе на голове и шее,
- способ позволяет восстановить эпителиальную выстилку органов без вмешательств в брюшную полость и использования висцеральных лоскутов,
- использование данного пластического материала позволяет восстанавливать дефекты различной конфигурации и размеров,
- способ позволяет восстановить слизистую оболочку, с использованием аутологичных тканей,
- префабрицированные фрагменты слизистой оболочки изолированы от агрессивной среды просвета верхних дыхательных и пищеварительных путей.
Указанные технические (лечебные) результаты при осуществлении изобретения достигаются за счет того, что также как в известном способе восстановление органов верхних дыхательных или пищеварительных путей производят путем формирования аутотрансплантата из фрагмента прямой мышцы живота на нижних эпигастральных сосудах, с последующим переносом аутотрансплантата в реципиентную зону.
Особенность заявляемого способа заключается в том, что формируют мышечно-апоневротический трансплантат в виде лоскута из волокон прямой мышцы живота на нижних эпигастральных сосудах, производят его префабрикацию путем имплантации микрографтов аутологичной слизистой оболочки в перфорации апоневротической порции трансплантата. Префабрицированную часть биоинженерного трансплантата укрывают сверху резорбируемой викриловой сеткой. Переносят трансплантат на область дефекта, восстанавливают эпителиальную выстилку органа префабрицированной частью трансплантата путем размещения ее в просвет полого органа с фиксацией краев апоневроза трансплантата к подслизистому слою краев раны. Мышечной порцией трансплантата восстанавливают мягкотканый каркас органа с последующим сшиванием мышечной порции трансплантата с мышцами шеи.
При реконструкции верхних дыхательных путей с целью восстановления каркаса используют дополнительно саморасправляющийся металлический стент.
Способ осуществляется следующим образом.
Под эндотрахеальным наркозом выполняют удаление опухоли глотки, полости рта или трахеи с формированием послеоперационных дефектов в случае одномоментной пластики. В случае отсроченной пластики иссекают послеоперационные рубцы, мобилизуют края раны. Целью проводимых манипуляций является подготовка реципиентной раны к пластике.
Учитывая полученный дефект, производят формирование мышечно-апоневротического трансплантата из волокон прямой мышцы живота на нижних эпигастральных сосудах. Мобилизуют необходимую часть прямой мышцы живота, при этом в месте пересечения сверху выделяют и перевязывают эпигастральные артерию и вену. В соответствии с топографо-анатомическими параметрами производят выделение сосудистой ножки у места ее отхождения от наружных подвздошных сосудов. Площадь выделяемой в составе трансплантата апоневротической части из передней пластины влагалища прямой мышцы живота определяется размерами дефекта слизистой оболочки, необходимого для замещения. Параллельно получают слизистую оболочку нижней носовой раковины с последующим отмыванием ее в растворах антисептиков, фрагментируют ее до размеров 1 мм2. Далее производят префабрикацию биоинженерного трансплантата путем имплантации микрографтов слизистой оболочки в перфорации апоневротической порции трансплантата с последующим их ушиванием атравматической иглой с рассасывающейся нитью. Сверху префабрицированную часть трансплантата укрывают резорбируемой викриловой сеткой (Фиг.1). После подготовки биоинженерного мышечно-апоневротического трансплантата и реципиентной области пересекают питающую сосудистую ножку и переносят трансплантат на область дефекта, располагают и предварительно фиксируют. Восстанавливают жизнеспособность трансплантата путем анастомозирования нижних эпигастральных и реципиентных сосудов. Далее префабрицированной частью трансплантата восстанавливают эпителиальную выстилку органа путем размещения ее в просвет полого органа с фиксацией краев апоневроза трансплантата к подслизистому слою краев раны. Мышечной порцией трансплантата восстанавливают мягкотканый каркас органа с последующим сшиванием мышечной порции трансплантата с мышцами шеи; укрывают микрососудистые анастомозы. При устранении дефекта трахеи или гортани в просвет устанавливают саморасправляющийся металлический стент для восстановления каркаса. Кожные покровы при необходимости восстанавливают путем аутодермопластики расщепленными лоскутами.
Пример выполнения.
Пациент Г., 50 лет, с клиническим диагнозом: Рак гортани IV ст T4aN2M0. Состояние после хирургического лечения в 02.2012 г., 03.2012 г. Фарингостома, трахеостома.
При контрольном обследовании признаков продолженного роста опухоли или генерализации опухолевого процесса не было выявлено.
17.10.2012 г. выполнена операция: отсроченная микрохирургическая фарингопластика биоинженерным трансплантатом с включением левой прямой мышцы живота.
Интубация через трахеостому. Произведен разрез, окаймляющий края орофарингостомы. Края слизистой, раны мобилизованы. Далее разрез мягких тканей продлен вниз по левой парастернальной линии до уровня средней трети грудины. Резецированы надхрящница и хрящевой отдел 3 ребра. Осуществлен доступ в передне-верхнее средостение. Выделены, мобилизованы внутренние грудные артерия и вена. Сосуды пересечены, проксимальные отделы сосудов перевязаны, дистальные - клипированы.
Далее в подвздошно-гипогастральной области слева произведен поперечный линейный разрез кожи. Кожные лоскуты отсепарованы, разведены в стороны. Выделена, мобилизирована левая прямая мышца живота. Сформирован мышечно-апоневротический трансплантат на питающей сосудистой ножке (нижние глубокие эпигастральные артерия и 2 вены) с включением наружного листка влагалища прямой мышцы. Тщательный гемостаз. Размер мышечной порции лоскута 30×8×2 см, фрагмент апоневроза размером 10×3 см. Выполнена нижняя конхэктомия, полученная слизистая оболочка отмыта в растворе антисептиков, фрагментирована. Далее выполнена имплантация микрографтов слизистой оболочки в перфорации апоневротической порции трансплантата с последующим их ушиванием атравматической иглой с рассасывающейся нитью, сверху префабрицированная часть лоскута укрыта резорбируемой викриловой сеткой. Сосудистая ножка сформированного лоскута клипирована и пересечена. Лоскут перемещен в зону дефекта шеи. Под оптическим увеличением при помощи микрохирургической техники сформированы сосудистые анастомозы между нижней эпигастральной артерией и внутренней грудной артерией по типу «конец в конец» и между нижней эпигастральной веной и внутренней грудной веной по типу «конец в конец». Вторая нижняя эпигастральная вена ушита наглухо под оптическим увеличением при помощи микрохирургической техники. Пуск кровотока, жизнеспособность лоскута восстановлена. Установлен назогастральный зонд.
Целостность шейного отдела пищевода и глотки восстановлена путем наложения узловых швов между подслизистым слоем фарингостомы и апоневротической порцией трансплантата. Мышечной порцией лоскута восстановлены мягкие ткани шеи. Подлоскутное пространство дренировано резиновыми выпускниками. Донорская рана послойно ушита наглухо с оставлением двух силиконовых дренажей. Спирт. Ас. повязки.
Течение послеоперационного периода гладкое. Лоскут прижился. Раны зажили первичным натяжением. Питание через рот восстановлено через 4 недели после операции.
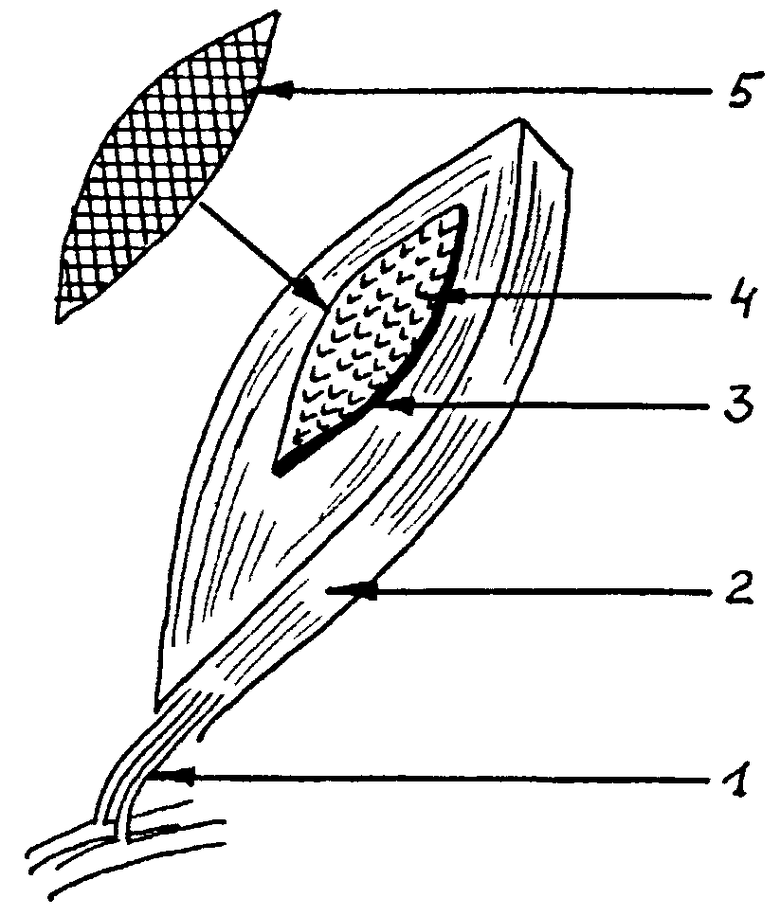
На фиг.1 представлена схема префабрицированного мышечно-апоневротического аутотрансплантата:
1. Питающая ножка - нижние эпигастральные артерия и вены.
2. Волокна прямой мышцы живота.
3. Наружное влагалище прямой мышцы живота.
4. Префабрицированная часть трансплантата.
5. Викриловая сетка.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДВУХЭТАПНОЙ БИОИНЖЕНЕРНОЙ РЕКОНСТРУКЦИИ ВЕРХНИХ ПИЩЕВАРИТЕЛЬНЫХ ПУТЕЙ | 2020 |
|
RU2726607C2 |
| СПОСОБ РЕКОНСТРУКЦИИ ГОРТАНИ | 2001 |
|
RU2197906C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ РАКА ГОРТАНИ | 2011 |
|
RU2475194C1 |
| СПОСОБ ФОРМИРОВАНИЯ АУТОТРАНСПЛАНТАТА | 2009 |
|
RU2398529C2 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ РАКА ГОРТАНИ | 2012 |
|
RU2487681C1 |
| СПОСОБ РЕКОНСТРУКЦИИ ВЕРХНЕЙ ЧЕЛЮСТИ | 2007 |
|
RU2341215C1 |
| СПОСОБ РЕКОНСТРУКЦИИ ГОРТАНИ | 2004 |
|
RU2259170C1 |
| СПОСОБ ФАРИНГОПЛАСТИКИ В УСЛОВИЯХ ДЕФИЦИТА ПЛАСТИЧЕСКОГО МАТЕРИАЛА | 2010 |
|
RU2427339C1 |
| СПОСОБ РЕКОНСТРУКЦИИ ВЕРХНИХ ОТДЕЛОВ АЭРОДИГЕСТИВНОГО ТРАКТА | 2014 |
|
RU2565830C1 |
| СПОСОБ МИКРОХИРУРГИЧЕСКОЙ РЕКОНСТРУКЦИИ ГЛОТКИ И ШЕЙНОГО ОТДЕЛА ПИЩЕВОДА ТОЛСТОКИШЕЧНО-САЛЬНИКОВЫМ АУТОТРАНСПЛАНТАТОМ У ОНКОЛОГИЧЕСКОГО БОЛЬНОГО | 2014 |
|
RU2565836C1 |
Изобретение относится к медицине, в частности к реконструктивной хирургии, может быть использовано при реабилитации онкологических, травматологических больных для восстановления целостности гортаноглотки, полости рта, гортани и трахеи. Формируют аутотрансплантат из фрагмента прямой мышцы живота на нижних эпигастральных сосудах, с последующим переносом аутотрансплантата в реципиентную зону. Осуществляют префабрикацию лоскута путем имплантации микрографтов аутологичной слизистой оболочки в перфорации апоневротической порции трансплантата. Префабрицированную часть биоинженерного лоскута укрывают сверху резорбируемой викриловой сеткой. Переносят трансплантат на область дефекта. Восстанавливают эпителиальную выстилку органа префабрицированной частью лоскута путем размещения ее в просвет полого органа с фиксацией краев апоневроза трансплантата к подслизистому слою краев раны. Мышечной порцией трансплантата восстанавливают мягкотканый каркас органа с последующим сшиванием мышечной порции трансплантата с мышцами шеи. Способ позволяет восстановить дефекты различной конфигурации и размеров за один хирургический этап, восстановить слизистую оболочку с использованием аутологичных тканей, обеспечивает изоляцию префабрицированных фрагментов слизистой оболочки от агрессивной среды просвета верхних дыхательных и пищеварительных путей. 1 з.п. ф-лы, 1 ил., 1 пр.
1. Способ реконструкции органов верхних дыхательных или пищеварительных путей, включающий формирование аутотрансплантата из фрагмента прямой мышцы живота на нижних эпигастральных сосудах, с последующим переносом аутотрансплантата в реципиентную зону, отличающийся тем, что формируют мышечно-апоневротический трансплантат в виде лоскута из волокон прямой мышцы живота на нижних эпигастральных сосудах, производят его префабрикацию путем имплантации микрографтов аутологичной слизистой оболочки в перфорации апоневротической порции трансплантата, префабрицированную часть биоинженерного трансплантата укрывают сверху резорбируемой викриловой сеткой, переносят трансплантат на область дефекта, восстанавливают эпителиальную выстилку органа префабрицированной частью трансплантата путем размещения ее в просвет полого органа с фиксацией краев апоневроза трансплантата к подслизистому слою краев раны, мышечной порцией трансплантата восстанавливают мягкотканый каркас органа с последующим сшиванием мышечной порции трансплантата с мышцами шеи;
2. Способ по п.1, отличающийся тем, что при реконструкции верхних дыхательных путей восстановление каркаса осуществляют путем размещения в просвете трахеи или гортани дополнительного саморасправляющегося металлического стента.
| СПОСОБ РЕКОНСТРУКЦИИ ГОРТАНИ | 2004 |
|
RU2259170C1 |
| СПОСОБ ЗАМЕЩЕНИЯ ОКОНЧАТЫХ ДЕФЕКТОВ ТРАХЕИ И ГОРТАНИ | 2010 |
|
RU2440789C1 |
| СПОСОБ ФОРМИРОВАНИЯ АУТОТРАНСПЛАНТАТА | 2009 |
|
RU2398529C2 |
| WO 2008146997 A1 04.12.2008 | |||
| БАТУРХИНА Е.В | |||
| Реконструкция верхних дыхательных путей с использованием тканевого эквивалента у онкологических больных | |||
| Автореф.дисс.на соиск | |||
| уч.ст.кмн, М., 2006 | |||
| DELAERE P.R | |||
| et al | |||
| Prefabrication of composite tissue for improved | |||
Авторы
Даты
2014-07-20—Публикация
2012-12-19—Подача