Изобретение относится к медицине, в частности к хирургии, травматологии, трансплантологии, комбустиологии, и может быть использовано при лечении ран различной этиологии.
Для местного лечения глубоких ожогов традиционно используется иссечение некротических тканей (некрэктомия) и восстановление кожного покрова путем аутотрансплантации расщепленного кожного лоскута. В качестве временного раневого покрытия после некрэктомии применяют кадаверную кожу. Она позволяет снизить раневые потери, предотвратить вторичное инфицирование раны и болезненность при перевязках. В то же время, являясь носителем аллогенных клеток донора, кадаверная кожа подвергается иммунному отторжению спустя 10-21 день после применения.
Перспективным направлением в лечении глубоких ожогов представляется использование децеллюляризированной (бесклеточной) кожи кадаверов. Основными преимуществами такого биологического материала являются состав и организация используемой дермы, аналогичные собственной дерме больного, а также возможность сохранения базальной мембраны. Для того чтобы использовать эту кожу как заменитель, необходимо тщательно удалить все иммунногенные факторы, которые могут привести к отторжению донорского материала. В то же время необходимо сохранить нативную структуру и состав кожи. Методы, используемые для достижения этих целей, имеют, как правило, противоположные эффекты: крайне агрессивное удаление иммунно-генных компонентов может разрушить структуру и состав ткани, в то время как более щадящие методы могут сохранить иммуногенность ткани [Fang L., Shen Y. An experimental study of bone marrow mesenchymal stem cells on the repair of skin wound combined with local radiation injury // J. Zhonghua Shao Shang Za . 19. - №1. - P.22-24]. В настоящее время предложены физические и химические методы децеллюляризации, позволяющие сохранять структуру и свойства аллогенных трансплантатов [Badiavas E.V., Abedi М., Butmarc J. et al. Participation of bone marrow derived cells in cutaneous wound healing // J. Cell. Physiol. - 2003. - Vol.196. - №2. - P.245-250; Сычевский М.B. Эффективность модифицированной повязки на основе коллагена типа I при лечении обширных ожоговых ран IIIA степени: автореф. дисс.канд. мед. наук. - М., 2010. - 21 с.]. Проведенные исследования показали, что бесклеточная кожная матрица поддерживает проникновение фибробластов, неоваскуляризацию и эпителизацию в отсутствие иммунного ответа [Richters С., Pirayesh А., Hoeksema Н. et al. Development of a dermal matrix from glycerol preserved allogeneic skin //Cell Tissue Bank - 2008. - Vol.9. - №4. - P.309-315]. Также показано, что косметические и функциональные результаты после применения аллогенных дермальных трансплантатов в области глубоких ожогов значительно превосходят результаты после аутодермопластики перфорированным лоскутом, а также способствуют более быстрому заживлению донорских ран в связи с тем, что требуют более тонких аутодермотрансплантатов [Киселевский М.В., Анисимова Н.Ю., Лебединская О.В. и др. Оптимизация способа получения и репопуляции матрикса трахеи для аллогенной трансплантации // Клеточные технологии в биологии и медицине. - 2011. - №1. - С.3-9].
Таким образом, разработка метода изготовления дермального матрикса (ДМ) с наименьшей степенью иммуногенности и одновременно с сохранением структуры остается актуальным.
Прототип
Наиболее близким техническим решением, принятым за прототип, является способ изготовления децеллюляризированного матрикса дермы из кожи, описанный в патенте «Method of Preparing Isolated Cell-FreeSkin, Cell-Free Dermal Matrix, Method of Producing the Sameand Composite Cultured Skin with The Use of the Cell-Free Dermal Matrix» [Патент US 2007/0269791 А1]. Для изготовления матрикса используют расщепленную кожу человека, животных, толщиной до 0,38 мм. На 1 этапе (Разделение эпидермиса и дермы) последовательно замораживают биологический материал до -80°C на 24 часа, до -196°C на 48 часов, размораживают нагреванием до 37°C в течение 5 минут, затем помещают в 1M раствор NaCl подогретый до 37°C на срок до 12 часов с постоянным перемешиванием. На II этапе (Децеллюляризация дермы) дерму обрабатывают при температуре 37°C с постоянным помешиванием раствором PBS в течение 148 часов, либо раствором детергента TritonX-100 в течение 4 часов, либо раствором детергента додецилсульфат натрия, sodium dodecyl sulfate (SDS) в течение 1 часа. На III этапе (Стерилизация) ДМ стерилизуют 0,1-10% раствором азида натрия в течение от нескольких минут до нескольких дней.
Недостатками метода являются:
- длительность. I этап - разделение эпидермиса и дермы требует до 84 часов. II этап, включающий использование раствора PBS при децеллюляризации дермы, увеличивает время изготовления на 148 часов. III этап - стерилизация дермального матрикса занимает до нескольких дней, кроме того, производство матрикса не подразумевает этапы отмывки от детергентов и раствора азида натрия, поэтому биосовместимость может быть снижена,
- невозможность получения дермального матрикса (ДМ) толще 0,35 мм без дополнительного склеивания по специальной технологии нескольких готовых матриксов [«Acellular matrix glue» US 2010/0063539 A1 или «Method of manufacturing acellular matrix glue» US 7927414 В2].
Таким образом, для укорочения сроков изготовления стерильного биосовместимого дермального матрикса из кожи человека толщиной до 1 мм требуется разработка нового метода, позволяющего обеспечить получение трансплантата разной толщины, а также уменьшить длительность этапов производства, что и явилось задачей, решаемой в настоящем изобретении.
Достигаемым техническим результатом является - получение дермального матрикса толщиной до 1 мм - бесклеточного, биосовместимого, с сохранением структур и ориентации волокон, длительностью производства до 36 часов. Результат достигается за счет:
- сокращения длительности этапа разделения эпидермиса и дермы путем последовательных циклов замораживания биоматериала до -96°C в течение 15 минут и размораживания до +37°C в течение 5 минут,
- обеспечения стерильности ДМ путем организации производства в помещениях надлежащего уровня чистоты, использования стерильного, по возможности одноразового, инструментария, расходных материалов, растворов, использование антибиотиков, антисептиков на этапе заготовки биоматериала, его хранения, индивидуальной упаковки биоматериала на некоторых этапах изготовления,
- оптимизации количества и концентрации реактивов для эффективного удаления клеток из кожи толщиной до 1 мм.
Благодаря свойствам разработанного дермального матрикса, он может быть использован не только для лечения ран в качестве раневого покрытия, а также при реконструктивной, пластической хирургии и герниопластике.
Способ осуществляется следующим образом
ДМ изготавливают из расщепленной кожи человекаЭ, заготовленной от донора-трупа, толщиной до 1 мм. Кожу заготавливают на основании Федерального закона Российской Федерации от 21.11.2011 №323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" после признания его пригодным для донорства в соответствии с действующими на территории РФ нормативно-правовыми актами.
Операцию по забору кожи проводят в операционной дерматомом по стандартной методике с соблюдением правил асептики и антисептики. Предварительно у донора берут кровь для оценки биологической безопасности.
Сразу после заготовки биологический материал помещают в стерильную емкость, содержащую водный раствор антибиотика широкого спектра действия. С сохранением стерильности емкость герметично закрывают. Биоматериал хранят при -40°C до получения результатов патологоанатомического исследования донора, исследования биологической безопасности тканей донора.
В случае выявления биологической опасности заготовленного биоматериала, он утилизируют в соответствии с СанПиН.
Биоматериал, с подтвержденной биологической безопасностью, используют для изготовления ДМ.
1 этап. Разделение эпидермиса и дермы
Лоскут кожи, с сохранением стерильности, упаковывают в индивидуальный стерильный пакет для криоконсервирования (КП) объемом 500 или 1000 мл. Объем криопакета выбирается в зависимости от размера биоматериала. Криопакет запаивают и ваакуумизируют.
Кожу замораживают до -96°C в течение 15 минут, размораживают до +37°C в течение 5 минут. Цикл замораживания-размораживания повторяют троекратно.
В криопакет объемом 500 мл вносят 250 мл и объемом 1000 мл вносят 400 мл стерильного 1,8М раствора NaCl и помещают при комнатной температуре на орбитальный перемешиватель со скоростью вращения 250 об/мин до отделения эпидермиса. Контроль проводят каждые 2 часа.
После отслоения эпидермиса дерму с сохранением стерильности перемещают в стерильную емкость объемом 400 мл (не более 2 лоскутов в одну емкость). Емкость стерильно и герметично закрывают.
2 этап. Децеллюляризация дермы
В емкость с дермой вносят 250-300 мл 0,2% раствора SDS. Емкость стерильно и герметично закрывают, помещают при комнатной температуре на орбитальный перемешиватель со скоростью вращения 250 об/мин на 1 час.
В завершении этапа децеллюляризации раствор SDS удаляют из емкости.
3 этап. Обеспечение биосовместимости трансплантата
В емкость с биоматериалом с сохранением стерильности вносят 250 мл стерильного физиологического раствора и помещают при комнатной температуре на орбитальный перемешиватель со скоростью вращения 250 об/мин. Каждые 10 минут проводят смену раствора в полном объеме в течение 1 часа.
После 6 смены раствора емкость с биоматериалом заполняют стерильным физиологическим раствором и помещают при комнатной температуре на орбитальный перемешиватель со скоростью вращения 220 об/мин раствором на 12 часов.
После этого ДМ готов к применению.
4 этап. Контроль качества дермального матрикса
Из готовой партии ДМ берут, для проведения контроля качества, 3 образца размером 1*1 см и 1 образец длиной не менее 6 см и шириной не менее 1 см. Контроль проводят по следующим параметрам: технический, бактериологический, морфологический, биосовместимость.
5 этап. Упаковка и хранение
Дермальный матрикс, с сохранением стерильности, упаковывают в индивидуальный стерильный криопакет объемом 500 или 1000 мл. Криопакет выбирается в зависимости от размера матрикса. Криопакет запаивают и ваакуумизируют, маркируют и указывают: код донора-трупа, дату изготовления, срок годности, геометрические размеры, заключение о результатах контроля качества дермального матрикса.
Упакованные дермальные матриксы хранят при температуре -80°C° в течение срока годности (1 год).
Параметры готовой продукции
Технический контроль путем оценки прочностных характеристик дермального матрикса.
ДМ подвергают разрывным нагрузкам - при сравнительном анализе прочностных свойств (нагрузка на разрыв) ДМ толщиной 0,5 мм и 1 мм совместно с нативной кожей (НК) соответствующей толщины. Испытания проводили на разрывной машине МТ 140, изготовитель ЗАО «Метротекс».
Результаты разрывных испытаний представлены в таблице №1.
Как видно из таблицы №1, прочностные параметры ДМ сопоставимы с характеристиками нативных образцов по нагрузке на разрыв (кгс) и удлинению (мм). Реагенты, используемые при получении ДМ, а также физические методы воздействия на него во время производства не оказывают серьезных и необратимых нарушений прочностных свойств. Незначительное увеличение максимального удлинения и нагрузки на разрыв ДМ по сравнению с соответствующими нативными образцами может быть обусловлено отсутствием эпидермального слоя и клеточных элементов в дерме.
Бактериологический контроль
Позволяет оценить бактериальную чистоту (стерильность) готовой продукции.
Образец ДМ помещают в культуральный флакон со средой ДМЕМ с индикатором без антибиотика. Флакон инкубируют в течение 3 дней в СО2-инкубаторе. Оценивают цвет среды, прозрачность. В случае изменения цвета среды, ее помутнения готовая продукция признают не стерильной.
Морфологический контроль
Исследование позволяет оценить эффективность удаления клеток, сохранение (состояние) структур ДМ.
Из образца ДМ, по стандартной методике, готовят гистологический препарат, который окрашивают по стандартной методике, применяемой для визуализации ядер клеток, коллагена и эластина межклеточного вещества.
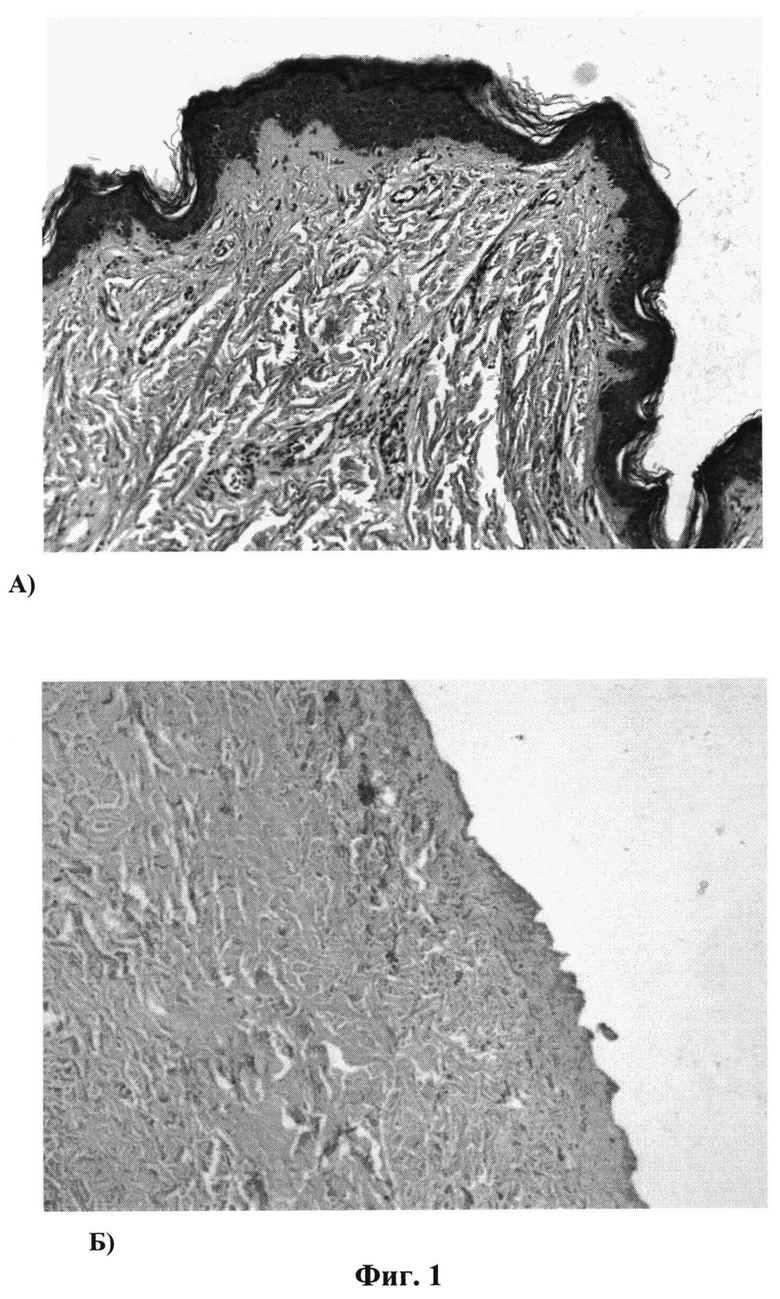
Исследование образцов ДМ, полученных предлагаемым способом, показало отсутствие клеток и их фрагментов в матриксе, в том числе и в труднодоступных для обработки придатках - сальные и потовые железы, мышцы, поднимающие волосы, и волосяные фолликулы. Структура и ориентация волокон в дермальном матриксе сохранена (фиг.1: А) кожа до обработки Б) кожа после обработки).
Биосовместимость дермального матрикса
Образец ДМ инкубируют с культурой клеток человека среде ДМЕМ с добавлением 10% фетальной сыворотки крупного рогатого скота при 37°C и концентрации CO2 5%. Оценку биосовместимости ДМ проводят в течение 7 суток. Оценивают количество живых клеток, адгезию их на пластик (контроль) и трансплантат (опыт), сохранение ими пролиферативной активности.
Было показано, что в присутствии ДМ клетки человека сохраняют свою пролиферативную активность и жизнеспособность (табл.2).
Как видно из таблицы №2, при исследовании в культурах различных клеток образцов дермального матрикса, полученного по предложенной методике, на 1, 3, 7 сутки культивирования различий в плотности монослоя не наблюдается. Также с помощью витальной окраски клеток флуорохромными красителями показана способность клеток человека (фибробласты) к адгезии и размножению на поверхности ДМ.
Таким образом, проведенные исследования показывают высокую пролиферативную активность культур клеток человека на дермальном матриксе, что свидетельствует о биосовместимости матрикса.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ДЕРМЫ ДЛЯ ПОСЛЕДУЮЩЕЙ РЕКОНСТРУКЦИИ ОБШИРНЫХ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ | 2018 |
|
RU2704489C1 |
| СПОСОБ КОНСЕРВАТИВНОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ СО СФОРМИРОВАННЫМИ КИШЕЧНЫМИ СВИЩАМИ НЕОПУХОЛЕВОГО ГЕНЕЗА | 2024 |
|
RU2839966C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕРМАЛЬНОГО МАТРИКСА | 2018 |
|
RU2694543C1 |
| КОМБИНИРОВАННЫЙ ТРАНСПЛАНТАТ ДЕРМАЛЬНОГО МАТРИКСА С МЕЗЕНХИМАЛЬНЫМИ МУЛЬТИПОТЕНТНЫМИ СТРОМАЛЬНЫМИ КЛЕТКАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ РАН С ЕГО ИСПОЛЬЗОВАНИЕМ | 2013 |
|
RU2526813C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕЛЛЮЛЯРНОГО ДЕРМАЛЬНОГО МАТРИКСА | 2019 |
|
RU2717088C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ КОЖНОГО ПОКРОВА У ПАЦИЕНТОВ С ОБШИРНЫМИ РАНАМИ С ДЕФЕКТОМ МЯГКИХ ТКАНЕЙ (ВАРИАНТЫ) | 2013 |
|
RU2526814C1 |
| СПОСОБ ДЕЦЕЛЛЮЛЯРИЗАЦИИ ДЕРМЫ СВИНЬИ ДЛЯ РЕКОНСТРУКТИВНОЙ ПЛАСТИЧЕСКОЙ ХИРУРГИИ | 2022 |
|
RU2791987C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕЛЛЮЛЯРНОГО ДЕРМАЛЬНОГО МАТРИКСА | 2021 |
|
RU2769248C1 |
| Способ получения биоинженерного трансплантата для пластики дефекта передней брюшной стенки | 2022 |
|
RU2792542C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕЦЕЛЛЮЛЯРИЗИРОВАННЫХ МАТРИКСОВ ПАРЕНХИМАТОЗНЫХ ОРГАНОВ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2016 |
|
RU2653489C2 |
Изобретение относится к медицине, в частности к хирургии, травматологии, трансплантологии, кумбостиологии, и представляет собой способ изготовления дермального матрикса (ДМ). Способ включает забор кожи у донора-трупа в операционной дерматомом по стандартной методике с соблюдением правил асептики и антисептики. Сразу после заготовки биологический материал помещают в стерильную емкость, содержащую водный раствор антибиотика широко спектра действия. С сохранением стерильности емкость герметично закрывают. Биоматериал хранят при -40°C до получения результатов патологоанатомического исследования донора, исследования биологической безопасности тканей донора. Биоматериал с подтвержденной биологической безопасностью используют для изготовления ДМ. Изготовление ДМ включает следующие этапы: разделение эпидермиса и дермы, децеллюляризация дермы, обеспечение биосовместимости трансплантата. Способ позволяет сократить производство до 36 ч и обеспечивает получение бесклеточного, биосовместимого дермального матрикса толщиной до 1 мм, с сохранением структур и ориентации волокон. 1 з.п. ф-лы, 2 табл., 1 ил.
1. Способ изготовления дермального матрикса, заключающийся в выполнении забора кожи человека, посредством использования дерматома, от донора-трупа, толщиной до 1 мм; биоматериал, с подтвержденной биологической безопасностью, в условиях стерильности, упаковывают в индивидуальный стерильный пакет для криоконсервирования (КП), объемом 500 или 1000 мл, в зависимости от размера биоматериала, криопакет запаивают и ваакуумизируют, затем замораживают до -96°C в течение 15 мин, размораживают до +37C° в течение 5 мин, причем цикл замораживания-размораживания повторяют троекратно; в криопакет объемом 500 мл вносят 250 мл, а объемом 1000 -400 мл стерильного 1,8М раствора NaCl и помещают при комнатной температуре на орбитальный перемешиватель со скоростью вращения 250 об/мин до отделения эпидермиса, после отслоения эпидермиса, дерму с сохранением стерильности перемещают в стерильную емкость объемом 400 мл, не более 2 лоскутов в одну емкость, емкость стерильно и герметично закрывают; в емкость с дермой вносят 250-300 мл 0,2% раствора додецилсульфат натрия, sodium dodecyl sulfate (SDS), в условиях стерильности герметично закрывают, помещают при комнатной температуре на орбитальный перемешиватель со скоростью вращения 250 об/мин на 1 ч, в завершении этапа децеллюляризации раствор SDS удаляют из емкости; в емкость с биоматериалом в условиях стерильности вносят 250 мл стерильного физиологического раствора и помещают при комнатной температуре на орбитальный перемешиватель со скоростью вращения 250 об/мин, каждые 10 мин проводят смену раствора в полном объеме, после 6 смены раствора емкость с биоматериалом заполняют стерильным физиологическим раствором и помещают при комнатной температуре на орбитальный перемешиватель со скоростью вращения 220 об/мин раствором на 12 ч, полученный биоматериал упаковывают, хранят при -80°C в течение 1 года.
2. Способ по п.1, отличающийся тем, что полученный от донора биологический материал до получения результатов патологоанатомического исследования донора и подтверждения биологической безопасности помещают в стерильную емкость, содержащую водный раствор антибиотика широкого спектра действия, в условиях стерильности емкость герметично закрывают, биоматериал карантинизируют при -40°C.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| CN 102218162 A, 19.10.2011 | |||
| СПОСОБ ПОЛУЧЕНИЯ БЕСКЛЕТОЧНОГО ДЕРМАЛЬНОГО МАТРИКСА | 2003 |
|
RU2240809C1 |
| СПОСОБ ПОДГОТОВКИ БЕСКЛЕТОЧНОГО ДЕРМАЛЬНОГО МАТРИКСА К ПЕРЕСАДКЕ ПРИ ЛЕЧЕНИИ РАН РАЗЛИЧНОЙ ЭТИОЛОГИИ, В ЧАСТНОСТИ ОЖОГОВЫХ | 2003 |
|
RU2259852C1 |
Авторы
Даты
2014-07-27—Публикация
2013-04-02—Подача