Изобретение относится к медицинской технике, а именно к биосовместимым износостойким нанокомпозиционным тонкопленочным материалам, используемым в качестве покрытий при изготовлении имплантатов, предназначенных для замены поврежденных участков костной ткани: ортопедические и дентальные имплантаты, имплантаты, используемые в челюстно-лицевой хирургии и хирургии позвоночника, искусственные сочленения, фиксаторы и др. Эти материалы должны обладать высокой прочностью, износо- и коррозионной стойкостью, био- и антибактериальной активностью.
Известно биосовместимое покрытие на основе нитрида титана и карбида натрия (SU 1803096, опубл. 23.03.93) при следующем соотношении компонентов, мас.%:
нитрид титана - 20-50
силицид титана - 2-5
гидрированный карбид натрия - 25-30
оксиды кремния - остальное.
Данное покрытие обладает повышенной прочностью сцепления пластмассы с металлической основой в ортопедической стоматологии, однако не обладает достаточно высокой износостойкостью, необходимой для долгого срока службы, и требуемыми остеоиндуктивными свойствами.
Известно биосовместимое покрытие с аморфным слоем гидрооксиапатита и титана (US №6344276, опубл. 05.02.02).
Данное покрытие имеет повышенную прочность его соединения с субстратом и низкую скорость растворения материала покрытия, однако оно не обладает всем комплексом физических, механических, химических и биологических свойств, необходимых для материала имплантата, работающего под нагрузкой.
Прототипом заявленного изобретения являются биосовместимые многокомпонентные наноструктурные покрытия для медицины (RU 2281122, опубл. 10.08.06) на основе карбонитрида титана с введением дополнительных элементов, улучшающих механические и трибологические свойства покрытий, а также обеспечивающих его биоактивность и биосовместимость, при определенном соотношении суммарных концентраций основных и дополнительных элементов. При этом концентрацию элементов в покрытии выбирают при следующем соотношении компонентов, ат.%: Ti 30-50, C 15-40, N 0.5-30, O 5-25, Са 0-7, Zr 0-20, Si 0-30, P 0-1.5, Mn 0-1.0, K 0-1.0.
К недостаткам данного покрытия относится отсутствие у него антибактериальных свойств.
В изобретении достигается технический результат, заключающийся в придании покрытиям принципиально нового качества - антибактериальной активности - при сохранении хорошей биосовместимости и повышенной биоактивности, а также обеспечении комплекса хороших механических и трибологических характеристик: высокой твердости, низкого модуля упругости, высокой величины упругого восстановления, низкого коэффициента трения и скорости изнашивания в различных физиологических средах.
Указанный технический результат достигается следующим образом.
Многокомпонентное нанокомпозиционное покрытие для металлических, полимерных и природных костных имплантатов предназначено для замены поврежденных участков костной ткани. Покрытие выполнено на основе карбонитрида титана с введением дополнительных элементов, обеспечивающих требуемый комплекс механических и трибологических свойств, а также биоактивные и антибактериальные свойства.
Суммарные концентрации основных и дополнительных элементов имеют следующее соотношение:
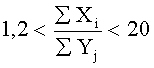
где Xi - суммарная концентрация основных элементов Ti, С, N в покрытии,
Yj - суммарная концентрация дополнительных элементов Ag, Ca, Zr, Si, O, P, K, Mn в покрытии.
Концентрацию элементов в покрытии выбирают при следующем соотношении компонентов, ат.%:
Ti - 25-50
C - 15-40
N - 0.5-35
O - 5-25
Ca - 0.5-7
Zr - 0-20
Si - 0-30
P - 0.1-1.5
Mn - 0-1.0
K - 0-1.0
Ag - 0.3-8.0.
Необходимое сочетание физических, механических, трибологических и биологических свойств покрытий достигается за счет включения в состав тонкопленочных материалов компонентов в количественных соотношениях, указанных выше. Это приводит к формированию нанокомпозиционной структуры в которой каждая структурная составляющая играет свою определенную роль: карбонитрид титана, в том числе легированный Zr, обеспечивает высокую твердость, износо- и коррозионную стойкость; Si, Ca, P, O, K и Mn образуют аморфную фазу, которая обеспечивает биоактивные характеристики поверхности, избыток углерода в виде алмазоподобных структур приводит к снижению коэффициента трения, а наличие серебра в виде металлической или оксидной фазы придает материалу антибактериальный эффект, который обусловлен выходом из его поверхности ионов серебра, приводящим к подавлению роста бактерий и их гибели.
Осаждение покрытий в среде аргона приводит к формированию грубой столбчатой структуры с повышенной пористостью. Введение в состав покрытия азота приводит к измельчению и уплотнению структуры, а в отдельных случаях и к полному подавлению роста колонной структуры. Шероховатость покрытий снижается при введении азота в состав покрытия.
Оптимальная верхняя граница содержания азота в покрытии, равная 35 ат.%, приводит к замещению атомами азота атомов углерода в металлической подрешетке гранецентрированной кубической фазы, а избыток углерода выделяется в виде алмазо- или графитоподобного углерода, что приводит к дополнительному снижению коэффициента трения.
Дополнительное снижение коэффициента трения достигается также в результате выбора нижней границы концентрации титана, равной 25 ат.%.
Оптимальным является соотношение металлических (Me) и неметаллических элементов (NMe) Me/NMe=1.0-1.7, при котором основная фаза покрытия имеет кубическую структуру типа NaCl.
Возникновение инфекции в зоне операции является одной из основных проблем, связанных с установкой имплантатов. Известно, что серебро является бактерицидным компонентом, однако при определенных, часто высоких концентрациях может приводить к негативному влиянию - гибели живых клеток. Введение серебра в указанных диапазонах 0.3-8 ат.% придает покрытиям новое качество - они приобретают антибактериальный эффект, сохраняя биоактивные свойства. При этом серебро может быть растворенным как в твердом растворе, так и выделяться в виде отдельных металлических частиц в объеме покрытия.
Добавки серебра не меняют высокие механические и трибологические характеристики покрытий, в частности твердость составляет 16-28 ГПа, модуль упругости находится в диапазоне 185-230 ГПа, коэффициент трения не превышает 0.27, а скорость изнашивания менее 3×10-6 мм3 Н-1 м-1. При этом покрытия сохраняют свои биоактивные характеристики.
Биоактивные свойства поверхности покрытия связываются с формированием гидроксил функциональных групп на отрицательно заряженной поверхности биоактивной керамики во внутренней среде организма. Для этого в покрытие вводятся такие элементы, как Са, P и O в заявляемом количестве. Наличие ионов кальция стимулирует рост клеток на поверхности имплантата. Увеличение содержания Са, P и O свыше заявляемого количества приводит к снижению механических и трибологических свойств покрытий, а также к разрушению актинового цитоскелета клеток.
Во всем исследованном диапазоне значений pH (4,5<pH<9) поверхность покрытий имеет отрицательный заряд. Это означает, что поверхность покрытий может притягивать положительно заряженные ионы Са2+, которые находятся во внутренней среде организма, что способствует образованию сначала промежуточных кальцийсодержащих фаз, а затем слоя гидроксиапатита, который является устойчивой фазой в физиологической среде.
Введение в состав покрытия элементов Са, Zr и О приводит к существенному снижению коэффициента трения до 0.17-0.25 по сравнению с покрытиями на основе карбида (Ктр.=0.85) или нитрида (Ктр.=0.55) титана.
Прикрепление клеток к поверхности имплантата определяется образованием интегрин-опосредованных фокальных контактов клеток с подлежащей поверхностью. Кремний способствует увеличению активности остеобластов и образованию слоя апатита. При его содержании менее 30 ат.% покрытия обладают однофазной гранецентрированной кубической структурой типа NaCl, что благоприятно сказывается на механических и трибологических свойствах.
Заявляемый технический результат может достигаться за счет введения в состав покрытий дополнительных элементов Ag, Ca, Zr, Si, O, P, K, Mn в различных соотношениях согласно формуле 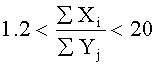
Указанные элементы в состав покрытия могут вводиться через прекурсор, например, путем легирования композиционных катодов-мишеней, с помощью которых осуществляют ионно-плазменное и/или ионно-лучевое распыление, и/или электродов, с помощью которых осуществляют электроискровое осаждение. В качестве легирующих применяются следующие неорганические добавки: Са10(PO4)6(ОН)2, Ca3(PO4)2, CaO, Si3N4, ZrO2, KMnO4 и TiO2, которые вводятся в шихтовую смесь на этапе получения композиционных катодов-мишеней и электродов.
Композиционные мишени и электроды могут быть получены методом самораспространяющегося высокотемпературного синтеза (СВС). В отличие от других известных методов получения композиционных катодов и электродов из тугоплавких соединений (прессование-спекание, газостатическое прессование, газотермическое напыление и др.) технология СВС имеет следующие преимущества: самоочистка продуктов горения от вредных растворимых и адсорбированных примесей в результате достижения высоких значений температуры (2500-3000°C) и скорости горения (2-10 см/с), развиваемых в волне горения СВС-систем; достижение высоких значений относительной плотности (97-99%) керамических материалов и тугоплавких соединений при сравнительно низких давлениях прессования; получение метастабильных состояний - пересыщенных твердых растворов; получение функциональных градиентных материалов (Левашов Е.А., Рогачев А.С., Курбаткина В.В., Максимов Ю.М., Юхвид В.И. Перспективные материалы и технологии самораспространяющегося высокотемпературного синтеза. Учебное пособие. ISBN 978-5-87623-463-6, 2011, Издательский дом МИСиС, 377 с.).
Основным технологическим преимуществом покрытий является наличие целого комплекса свойств, необходимых для материалов-имплантатов, работающих под нагрузкой:
- высокая твердость Н=16-28 ГПа,
- низкий модуль упругости Е=185-230 ГПа,
- низкий коэффициент трения µ=0.18-0.27,
- низкая скорость износа Vw - менее 2.7×10-6 мм3/Нм,
- гидрофильные характеристики поверхности,
- отсутствие разрушения актинового цитоскелета клеток - цитосовместимость,
- наличие биоактивной поверхности - более высокая активность щелочной фосфатазы по сравнению с контролем при культивировании остеобластов,
- наличие антибактериального эффекта, не менее 30% по сравнению с контролем.
Низкий модуль упругости покрытий благоприятен с точки зрения уменьшения напряжений между покрытием и имплантатом, в качестве которого часто используется нержавеющая сталь Е=190-200 ГПа или титан Е=116 ГПа. Низкий модуль Юнга также приводит к лучшему переносу костью функциональных нагрузок и стимулирует нарастание костной ткани. Комбинация высокой твердости и упругого восстановления характеризует покрытия как уникальный твердый, и в тоже время упругий материал, что является важнейшим фактором для материалов медицинского назначения, работающих под нагрузкой.
Отклонение хотя бы по одному из приведенных выше свойств покрытий влечет за собой потерю служебных характеристик всего изделия - имплантата в целом.
Примеры конкретного осуществления изобретения.
Пример 1
Технологический цикл получения многокомпонентного биоактивного нанокомпозиционного покрытия с антибактериальным эффектом TiCaP-CON-Ag состоит из двух основных стадий: получения композиционной мишени TiC0.5+Ca3(PO4)2 методом самораспространяющегося высокотемпературного синтеза (СВС) и ее последующего магнетронного распыления в одном технологическом цикле с распылением мишени из чистого серебра на подложку. Распыление мишени Ag осуществляли при ионном токе 50 мА, напряжении 1 кВ и диаметре диафрагмы 6 мм.
Осаждение покрытия TiCaPCON-Ag осуществляли в газовой среде Ar+N2 при парциальном давлении азота равном 14%. Получено покрытие следующего состава, ат. %:
C - 31.8
O - 5.1
N - 31.9
Ti - 28.1
Са - 1.3
P - 0.6
Ag - 1.2
Для измерения физико-механических и трибологических свойств покрытия осаждались на подложки из титанового сплава марки ВТ 1-0.
Физико-механические и трибологические свойства МНП определялись при использовании следующих высокопрецизионных приборов: Нанотвердомер (Nano-Hardness Tester, CSM Instruments, Швейцария); Скратч-тестер (Revetest, CSM Instruments, Швейцария); Машина трения (Tribometer, CSM Instruments, Швейцария); Оптический микроскоп AXIOVERT, оборудованный цифровой камерой и системой анализа изображения (Карл Цейс, Германия). Твердость и модуль упругости определялись по методу Оливера и Фара [G.M. Pharr, W.C. Oliver, F.R. Brotzen. J. Mater. Res. 3, 613 (1992)] с использованием индентора Берковича.
Величину упругого восстановления (We) покрытий рассчитывали по кривым нагружение - разгрузка по формуле: We=(hmax-hr)/hmax, где hmax - максимальная глубина проникновения индентора, a hr - остаточная глубина после снятия нагрузки. Коэффициент трения и скорость износа покрытий измерялись с помощью машины трения по схеме "шарик - диск" при нагрузке 1 N и линейной скорости 10 см/с. Испытания проводились в физиологическом растворе (100 мл H2O + 0.9 г NaCl). В качестве контртела использовался неподвижный шарик из спеченного Al2O3 диаметром 3 мм.
Полученное покрытие имело твердость 16 ГПа, модуль упругости 190 ГПа, упругое восстановление 51%, коэффициент трения 0.21 и скорость износа 2.5×10-6 мм3/Нм. Краевой угол смачивания составлял 53°.
В качестве модельной системы в биологических исследованиях были использованы остеобласты линии MC3T3-Е1, культивируемые на поверхности тестируемых материалов. Адгезия клеток с последующим распластыванием на поверхности подложки является первой фазой взаимодействия клеток организма и имплантата и поэтому качество этой первой фазы имеет решающее значение для биосовместимости материала. Морфометрический анализ площади распластывания клеток на поверхности покрытий показал, что остеобласты хорошо распластывались на поверхности тестируемых образцов. Иммуноморфологическое исследование актинового цитоскелета показало, что разрушения актинового цитоскелета клеток не происходит.
С помощью количественного колориметрического метода с использованием в качестве маркера раннего маркера дифференцировки, щелочной фосфатазы также проводилась оценка способности покрытий влиять на дифференцировку остеобластов MC3T3-Е1 при их росте в дифференцирующей среде. Проведенные исследования показали, что остеобласты, растущие на поверхности покрытий TiCaPCON-Ag способны дифференцироваться. После двух недель культивирования MC3T3-Е1 остеобластов количественный колориметрический анализ показал более высокий уровень активности щелочной фосфатазы в клетках, растущих на поверхности покрытий по сравнению с контролем.
В качестве тестовых культур микроорганизмов для исследования бактериостатической и бактерицидной активности покрытий были использованы одноклеточные дрожжевые грибы Saccharomyces cerevisiae (S.cerevisiae) и грамположительные молочно-кислые бактерии Lactobacillus acidophilus (L.acidophilus). Бактериостатическая активность оценивалась методом диффузии в агар и методом коинкубации образцов во взвеси микроорганизмов. Оценивалось изменение абсолютной концентрации дрожжевых грибов и бактерий во времени. Через 2 суток концентрация дрожжевых грибов уменьшилось на 55% по сравнению с контролем, а концентрация бактерий L.Acidophilus в 1 мл раствора снизилась в 2.5 раза.
Пример 2
Были изменены режимы распыления мишени из серебра. Распыление мишени Ag осуществляли при ионном токе 50 мА, напряжении 2.5 кВ и диаметре диафрагмы 16 мм.
Получено покрытие следующего состава, ат. %:
C - 30.4
O - 7.0
N - 25.8
Ti - 32.3
Ca - 1.5
Ag - 3.0
Полученное покрытие имело твердость 28 ГПа, модуль упругости 230 ГПа, упругое восстановление 68%, коэффициент трения 0.18 и скорость изнашивания 2.7×10-6 мм3Н-1м-1.
Разрушения актинового цитоскелета клеток не обнаружено. Исследования in-vitro показали, что покрытие TiCaPCON-Ag является биосовместимым и демонстрирует уровень активности щелочной фосфатазы на 30% больше, чем в контроле, что свидетельствует о его биоактивных характеристиках. Покрытие обладало антибактерицидным эффектом: через 2 суток концентрация дрожжевых грибов S.cerevisiae уменьшилось на 35% по сравнению с контролем, а концентрация бактерий L.Acidophilus на 21%.
Примеры 3-18
Для оптимизации состава покрытий были проведены многочисленные эксперименты по осаждению покрытий с использованием различных катодов-мишеней.
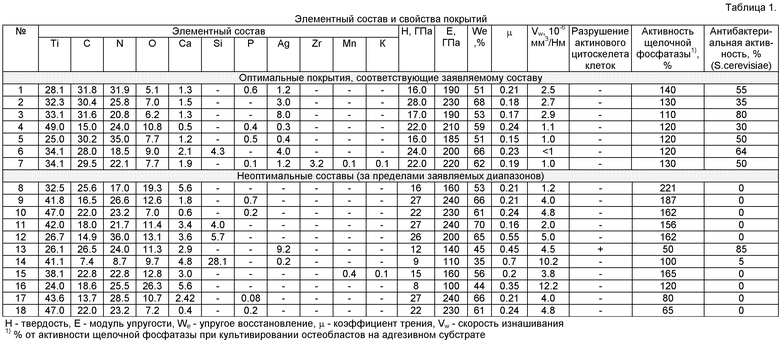
В таблице 1 в обобщенном виде представлены результаты исследований и свойства покрытий, подтверждающие правомерность заявляемых составов покрытий.
Покрытия обладают одним или несколькими конкурентными преимуществами, необходимыми для материалов имплантатов, работающих под нагрузкой: высокой твердостью; низким модулем упругости; низким коэффициентом трения и скоростью изнашивания; высокой стойкостью к упругой и пластической деформации; биосовместимостью, био- и антибактериальной активностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| Многокомпонентный двухслойный биоактивный материал с контролируемым антибактериальным эффектом | 2019 |
|
RU2697720C1 |
| МНОГОФУНКЦИОНАЛЬНЫЕ БИОСОВМЕСТИМЫЕ НАНОСТРУКТУРНЫЕ ПЛЕНКИ ДЛЯ МЕДИЦИНЫ | 2007 |
|
RU2333009C1 |
| БИОСОВМЕСТИМЫЕ МНОГОКОМПОНЕНТНЫЕ НАНОСТРУКТУРНЫЕ ПОКРЫТИЯ ДЛЯ МЕДИЦИНЫ | 2005 |
|
RU2281122C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОАКТИВНОГО ПОКРЫТИЯ С АНТИБАКТЕРИАЛЬНЫМ ЭФФЕКТОМ | 2014 |
|
RU2580628C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОАКТИВНОГО ПОКРЫТИЯ С АНТИБАКТЕРИАЛЬНЫМ ЭФФЕКТОМ | 2014 |
|
RU2580627C1 |
| МАТЕРИАЛ БАКТЕРИЦИДНОГО ПОКРЫТИЯ | 2014 |
|
RU2554773C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНОГО СТОМАТОЛОГИЧЕСКОГО ИМПЛАНТАТА С УГЛЕРОДНЫМ НАНОПОКРЫТИЕМ | 2014 |
|
RU2571559C1 |
| СПОСОБ НАНЕСЕНИЯ ПОКРЫТИЯ НА УСТРОЙСТВА И ИНСТРУМЕНТЫ ДЛЯ ОСТЕОСИНТЕЗА, ОРТОПЕДИЧЕСКИЕ ИМПЛАНТАТЫ ИЗ МЕТАЛЛА | 2018 |
|
RU2697855C1 |
| Способ изготовления дентального имплантата с использованием композитного нанопокрытия | 2018 |
|
RU2765921C1 |
| Способ изготовления дентального имплантата из нанотитана с использованием лазерного структурирования поверхности и наноструктурированного композитного покрытия и имплатат | 2019 |
|
RU2724437C1 |
Изобретение относится к медицинской технике, а именно к биосовместимым износостойким нанокомпозиционным тонкопленочным материалам, используемым в качестве покрытий при изготовлении имплантатов, предназначенных для замены поврежденных участков костной ткани. Покрытие выполнено на основе карбонитрида титана с введением дополнительных элементов, обеспечивающих требуемый комплекс механических и трибологических свойств, а также биоактивные и антибактериальные свойства. Суммарные концентрации основных и дополнительных элементов имеют следующее соотношение:
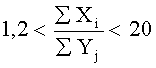
Многокомпонентное нанокомпозиционное покрытие для металлических, полимерных и природных костных имплантатов, предназначенных для замены поврежденных участков костной ткани, на основе карбонитрида титана с введением дополнительных элементов, обеспечивающих требуемый комплекс механических и трибологических свойств, а также биоактивные и антибактериальные свойства, при следующем соотношении суммарных концентраций основных и дополнительных элементов:
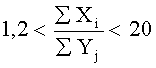
где Xi - суммарная концентрация основных элементов Ti, С, N в покрытии,
Yj - суммарная концентрация дополнительных элементов Ag, Ca, Zr, Si, О, Р, К, Mn в покрытии,
при этом концентрацию элементов в покрытии выбирают при следующем соотношении компонентов, ат.%:
Ti - 25-50
С - 15-40
N - 0.5-35
О - 5-25
Ca - 0.5-7
Zr - 0-20
Si - 0-30
Р - 0.1-1.5
Mn - 0-1.0
К - 0-1.0
Ag - 0.3-8.0.
| БИОСОВМЕСТИМЫЕ МНОГОКОМПОНЕНТНЫЕ НАНОСТРУКТУРНЫЕ ПОКРЫТИЯ ДЛЯ МЕДИЦИНЫ | 2005 |
|
RU2281122C1 |
| Способ обработки шламов медно-электролитного производства | 1925 |
|
SU12091A1 |
| ЭЛЕКТРИЧЕСКАЯ РУЧНАЯ ЛАМПА | 1926 |
|
SU12114A1 |
Авторы
Даты
2014-07-27—Публикация
2013-06-21—Подача