Изобретение относится к области медицинской техники, а именно к ортопедической стоматологии, и может быть использовано при изготовлении внутрикостных имплантатов.
В настоящее время широко используются стоматологические имплантаты из различных материалов: сплавов на основе железа, титана и его сплавов, керамики на основе оксидов алюминия и циркония [Патенты РФ 2140227, 2522934, 2441621]. Имплантаты из титана и его сплавов обладают рядом преимуществ по сравнению с имплантатами из сплавов на основе железа и керамики. Титановые сплавы обладают хорошей биосовместимостью и высокой коррозионной стойкостью.
Повышение прочностных свойств поверхности имплантата и улучшение процесса остеоинтеграции достигают полезной модификацией его поверхности посредством различных способов (ионно-плазменного, плазменного, электролитического) нанесения покрытий, улучшающих прочностные свойства и биосовместимость имплантата.
Известен способ изготовления имплантата с биосовместимым многокомпонентным наноструктурным покрытием на основе карбонитрида титана с дополнительными элементами (Са, Zr, Si, К, МnО при соответствующей концентрации), улучшающими механические и трибологические свойства покрытия, а также обеспечивающие его биоактивность, биосовместимость и нетоксичность [патент РФ 2281122].
Основным недостатком этого способа является трудность в обеспечении соответствующей процентной концентрации дополнительных элементов в многокомпонентном наноструктурном покрытии, получаемом при магнетронном распылении композиционных мишеней и катодов, содержащих элементы с различной скоростью распыления.
Известен способ изготовления имплантата путем нанесения кальций-фосфатного биологически активного покрытия на имплантат из корундовой или циркониевой керамики [патент RU 2507316] с нанесением промежуточного слоя титана толщиной 5-50 мкм в плазме непрерывного вакуумного дугового разряда и слоя кальций-фосфатного соединения, наносимого электрохимическим методом анодирования титана в режиме искрового или дугового разрядов.
Но для этого способа характерна недостаточная адгезия биологически активного покрытия, получаемого электрохимическим методом, к промежуточному слою из металлов вентильной группы (титана, тантала, ниобия или циркония). Это приводит к частичному отслоению биологически активного покрытия и, как следствие, к нарушению условий прорастания челюстной кости.
Известен также способ изготовления внутрикостного стоматологического имплантата с плазмонапыленным многослойным биоактивным покрытием [патент РФ 2146535], включающий напыление плазменным методом системы покрытий из пяти слоев различной дисперсности и толщины: первых двух из титана или гидрида титана, последующих двух слоев из смеси титана или гидрида титана с гидроксиапатитом, отличающихся содержанием компонентов в слоях, и наружного, пятого слоя из гидроксиапатита. Напыление ведут послойно при различных режимах, обеспечивающих плавный переход от компактной структуры титановой основы имплантата через многослойную систему переходного покрытия к тонкому биологически активному пористому слою.
Однако при плазменном напылении гидроксиапатитового покрытия вследствие высокой температуры распыления порошка существует проблема сохранения его исходного химического и фазового состава, которые оказывают существенное влияние на биологические свойства [Калита В.И. Физика и химия формирование биоактивных и биоинертных поверхностей на имплантатах. Обзор // Физика и химия обработки материалов. 2000, №5, с. 28-45].
Наиболее близким к заявляемому является способ изготовления внутрикостного стоматологического имплантата с углеродным нанопокрытием [Патент РФ 2490032], включающий пескоструйную обработку поверхности титановой основы имплантата частицами оксида алюминия, послойное напыление плазменным методом на основу имплантата биосовместимых покрытий из смеси порошков титана или гидрита титана различной дисперсности и гидроксиапатита кальция в количестве трех слоев, четвертым слоем напыляют гидроксиапатит, на эту систему биосовместимых покрытий методом магнетронного напыления наносят пленку металла из триады железа толщиной 20-35 нм, на которой химическим осаждением получают углеродное нанопокрытие толщиной до 1 мкм. При этом углеродное покрытие представляет собой углеродные нанотрубки и углеродные нановолокна диаметром 50-200 нм, обладающие наибольшим биоактивным эффектом.
Этот способ создания внутрикостного стоматологического материала состоит из нескольких технологических этапов и имеет ряд существенных недостатков:
1. Используется 3-ступенчатая технология изготовления материала покрытия, а именно: а) плазменное напыление многослойного биосовместимого покрытия с различной дисперсностью частиц титана или гидрида титана различной толщины с последующим напылением слоя гидроксиапатита; б) магнетронное напыление тонкого слоя пленки из триады железа (железа, никеля, кобальта) и в) химическое осаждение углеродного покрытия из смеси углеродосодержащих газов. При такой многоступенчатой технологии сложно выдержать все условия напыления покрытия соответствующего состава и структуры.
2. Пескоструйная обработка частицами оксида алюминия загрязняет поверхность титана примесными фазами, которые трудно удалить промывкой. Примесные фазы могут вызвать остелиоз и последующую резорбцию кости вокруг имплантата, что приводит к потере его стабильности.
3. Гидроксиапатит относится к биорезорбируемым материалам, т.е. он подвергается растворению и диссоциации в биологической среде. Вследствие резорбции гидроксиапатита возможно отслоение тонкой 20-35 нм адгезионной металлической пленки, полученной магнетронным напылением, т.к. она не является защитным барьером для диффузии ионов.
4. Структура углеродного нанопокрытия, состоящего из нанотрубок является пористой, что не препятствует проникновению во внутренние слои покрытия физиологической среды, под действием которой происходит резорбция гидроксиапатитового слоя, сопровождающаяся не только изменением его состава, но и отслоением верхних слоев многослойного покрытия. Жесткость нанотрубок может поранить ткань челюстной кости.
Таким образом, наиболее близкий к заявляемому способ не обеспечивает достаточной механической прочности многослойного гидроксиапатитового покрытия на поверхности металлического имплантата, и вследствие механических повреждений покрытия имеет место резорбция покрытия и понижение его антибактериальных свойств.
В основу изобретения положена задача повышения прочности поверхности металлического имплантата, улучшения ее биосовместимости и антибактериальных свойств.
Поставленная задача решается тем, что в способе изготовления внутрикостного стоматологического имплантата с углеродным нанопокрытием, включающем обработку поверхности имплантата, послойное напыление на основу имплантата многослойного покрытия и напыление на это покрытие углеродного нанопокрытия толщиной до 1 мкм, согласно изобретению обработку поверхности ведут ускоренными до 1 кэВ ионами аргона при давлении (2-6)·10-2 Па с подачей отрицательного напряжения-смещения на подложку с постепенным увеличением его от 800 до 1500 В в течение не менее 1 ч, многослойное покрытие выполняют из двух чередующихся слоев, с общим количеством слоев 20-30, при толщине каждого слоя 50-100 нм, при этом первый слой многослойного покрытия, состоящий из соединений титана с углеродом, напыляют одновременным дуговым распылением титанового катода и импульсно-дуговым распылением графитового катода с увеличением концентрации углерода в каждом последующем слое при суммарном увеличении концентрации в этих слоях от 14 до 75 вес.%, а второй - из твердого аморфного алмазоподобного углерода твердостью 70-100 ГПа напыляют импульсно-дуговым распылением графитового катода, углеродное нанопокрытие напыляют импульсно-дуговым распылением графитового катода в условиях конденсации алмазоподобной пленки при температуре не выше 150ºС и энергии ионов углеродане более 100 эВ.
Осуществление плазменной обработки поверхности имплантата аргоном при давлении (2-6)·10-2 Па с подачей отрицательного напряжения-смещения с постепенным увеличением его от 800 до 1500 В в течение не менее 1 ч обеспечивает очистку поверхности от загрязнений за счет удаления приповерхностного слоя и создает необходимый микрорельеф поверхности, что обеспечивает необходимую адгезию последующего многослойного покрытия.
Напыление многослойного покрытия из двух чередующихся слоев, с общим количеством слоев 20-30, при толщине каждого слоя 50-100 нм, при этом первый слой многослойного покрытия, состоящий из соединений титана с углеродом, напыляют одновременным дуговым распылением титанового катода и импульсно-дуговым распылением графитового катода с увеличением концентрации углерода в каждом последующем слое при суммарном увеличении концентрации в этих слоях от 14 до 75 вес.%, а второй - из твердого аморфного алмазоподобного углерода твердостью 70-100 ГПа, позволяет получить наноструктурное покрытие толщиной в несколько микрон, химически стойкое к окружающей среде. Химическая стойкость достигается снижением вероятности образования трещин в многослойном покрытии за счет увеличения объемной доли границ раздела в слое, состоящем из соединений титана с углеродом, структура которого включает частицы размером в несколько десятков нанометров, что тормозит движение дислокаций, блокируя развитие трещин на границах слоев.
Увеличение концентрации углерода в слое из соединения титана с углеродом от 14 до 75 вес.% по мере роста толщины многослойного покрытия обеспечивает достаточную твердость и механическую прочность наноструктурного покрытия. Низкая концентрация углерода в слое из соединения титана с углеродом, непосредственно контактирующем с поверхностью имплантата, повышает адгезию многослойного покрытия.
Углеродное нанопокрытие толщиной не менее 1,0 мкм, осажденное на многослойное покрытие импульсно-дуговым распылением графитового катода в условиях конденсации алмазоподобной пленки при температуре не выше 150ºС и энергии ионов углерода не более 100 эВ, повышает механическую прочность поверхности имплантата, его биосовместимость и антибактериальные свойства. Полученный в результате твердый аморфный алмазоподобный материал биологически совместим с тканями живых объектов, не токсичен, обладает остеоинтеграционными свойствами [Thomson L.F., Law F. С, Rushton N. et al. Biocompatibility of diamond-like carbon coatings // Biomaterials, 1991.-V.12.-P.37-40; Chai F., Mathis N., Blanchemain N. et al. Osteoblast interaction with DLC-coated Si substrates // Acta Biomater., 2008. - V. 4. - P. 1369-1381].
Таким образом, новый технический результат заключается в повышении прочности поверхности металлического имплантата, улучшении его биосовместимости и антибактериальных свойств.
На чертеже представлено электронно-микроскопическое изображение структуры многослойного покрытия.
Способ осуществляют следующим образом. Металлический имплантат, например, из титана, состоящий из внутрикостного элемента и заглушки, промывают в ультразвуковой ванне в смеси спирта с органикой. Это стандартная процедура предварительной очистки напыляемых поверхностей от загрязнений.
Детали имплантата на специальных держателях помещаются в камеру напылительной установки и вакуумируют до давления 10-3-10-4 Па.
Плазменным методом осуществляют очистку поверхности ускоренными до 1 кэВ ионами аргона при давлении (2-6)·10-2 Па с подачей отрицательного напряжения-смещения с постепенным увеличением его от 800 до 1500 В. Время обработки зависит от степени загрязнения поверхности и количества деталей, но не менее 1 ч.
После аргонной обработки проводят напыление многослойного покрытия, состоящего из чередующихся слоя соединений титана с углеродом переменной концентрации и слоя из твердого аморфного алмазоподобного углерода. Слои из соединения титана с углеродом получают при одновременном дуговом распылении титанового катода и импульсно-дуговом распылении графитового катода, с увеличением частоты прохождения импульсов углерода (см. таблицу).
Такой режим работы углеродного источника обеспечивает увеличение концентрации углерода в слоях из соединений титана с углеродом от 14,6 до 71 вес.%, а слои из твердого аморфного алмазоподобного углерода твердостью 70-100 ГПа напыляют импульсно-дуговым распылением графитового катода. Общее количество слоев 23. Структура многослойного покрытия, состоящая из нанометровых слоев пленки, имеет многочисленные межслойные границы, которые блокируют распространение трещин, обеспечивая более высокую механическую, а также химическую стойкость покрытия, что является важным для дентальных протезов, работающих под нагрузкой и в агрессивной среде (слюна, пищевые добавки и прочее).
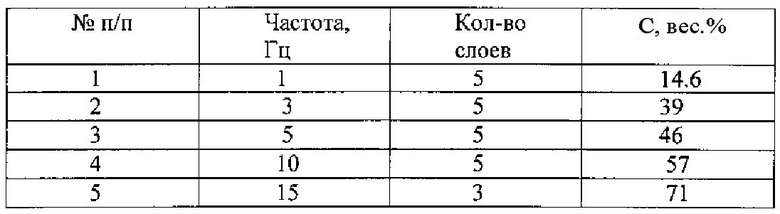
Методом импульсно-дугового распыления графитовой мишени на многослойное покрытие наносится алмазоподобное углеродное нанопокрытие при температуре на подложке не выше 150ºС и энергии ионов не больше 100 эВ. В таких условиях конденсации пленки образуется углеродная алмазоподобная структура с наибольшим количеством sp3 связей. Толщина алмазоподобного покрытия не более 1 мкм.
Достижение технического результата подтверждено клиническими примерами использования внутрикостного стоматологического имплантата с углеродным нанопокрытием в ООО «Частная стоматология» (г. Еманжелинск, Челябинская область).
Клинический пример 1: Пациент - возраст 62 года. Вторичная адентия верхней челюсти. Частичная адентия нижней челюсти. Установлены имплантаты из титанового сплава с углеродным нанопокрытием. В процессе установки внутрикостного имплантата использовался физиодиспенсер имплантологический. Установка имплантатов проводилась в режиме 30 оборотов и с нагрузкой 30 Н.
Результат: 1. Через три недели отмечена стабильность, наблюдалась хорошая вторичная фиксация имплантата в имплантном ложе.
2. Через три месяца состояние имплантата стабильно. Заглушки заменены на абатменты с шаровидными атачментами (замками), фиксирующие съемные протезы.
3. Через 10 месяцев наблюдения состояние имплантатов - стабильное.
Клинический пример 2: Пациент - возраст 58 лет. Со слов пациента состояние после коронарного шунтирования, принимает кроверазжижающие препараты. Установлены имплантаты из титанового сплава с углеродным нанопокрытием. Установка имплантатов проводилась в тех же режимах, что и в первом примере.
Результат: 1. Через три недели отмечена стабильность, контрольный срок прорастания трабекулярной кости в тело имплантата благоприятно сменил первичную фиксацию.
2. Через три месяца - имплантаты стабильны. Заглушки заменены на абатменты и проведено мостовидное протезирование пластмассовой конструкцией с фиксацией на имплантатах.
3. Через десять месяцев наблюдений состояние имплантатов - стабильно.
Клинический пример 3: Пациент - возраст 47 лет. Жалобы на отсутствие зубов в области 1.4, 2.4. Установлены имплантаты из титанового сплава с углеродным нанопокрытием. Установка имплантатов проведена при тех же режимах, что и в предыдущих примерах.
Результат: 1. Через три недели отмечена стабильность, наблюдалась хорошая вторичная фиксация имплантата в имплантном ложе, наблюдалось приростание костной ткани к телу имплантата.
2. Через три месяца - имплантаты стабильны. Заглушки заменены на абтменты с последующим протезированием пластмассовыми коронками.
3. Через 10 месяцев - состояние имплантатов стабильно.
В результате проведенных испытаний было установлено, что признаков отторжения, воспаления, нагноения, аллергических реакций у пациентов с установленными имплантатами не наблюдается.
Изобретение может использоваться в стоматологической имплантологии в поликлинических стоматологических учреждениях.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ДЕНТАЛЬНОГО ИМПЛАНТАТА | 2022 |
|
RU2798985C1 |
| Способ изготовления дентального имплантата с использованием композитного нанопокрытия | 2018 |
|
RU2765921C1 |
| Способ изготовления дентального имплантата из нанотитана с использованием лазерного структурирования поверхности и наноструктурированного композитного покрытия и имплатат | 2019 |
|
RU2724437C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМБИНИРОВАННОГО ИЗНОСО- И КОРРОЗИОННО-СТОЙКОГО КЕРАМИЧЕСКОГО ПОКРЫТИЯ НА ПОВЕРХНОСТИ СТОМАТОЛОГИЧЕСКОЙ КОНСТРУКЦИИ ИЗ УГЛЕРОДИСТОЙ КОНСТРУКЦИОННОЙ СТАЛИ | 2023 |
|
RU2823272C1 |
| СПОСОБ ВАКУУМНО-ДУГОВОГО НАНЕСЕНИЯ НАНОСТРУКТУРИРОВАННЫХ ПОКРЫТИЙ НА СТОМАТОЛОГИЧЕСКИЕ КОНСТРУКЦИИ | 2022 |
|
RU2791571C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНОГО СТОМАТОЛОГИЧЕСКОГО ИМПЛАНТАТА С УГЛЕРОДНЫМ НАНОПОКРЫТИЕМ | 2012 |
|
RU2490032C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНОГО СТОМАТОЛОГИЧЕСКОГО ИМПЛАНТАТА С ИОННО-ЛУЧЕВОЙ МОДИФИКАЦИЕЙ ПЛАЗМОНАПЫЛЕННОГО МНОГОСЛОЙНОГО БИОАКТИВНОГО ПОКРЫТИЯ | 2011 |
|
RU2458707C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИМПЛАНТАТОВ РАЗЛИЧНОЙ КОНФИГУРАЦИИ ИЗ СПЛАВА МАРКИ ВТ-6 С АЛМАЗОПОДОБНЫМ ДИЭЛЕКТРИЧЕСКИМ ЗАЩИТНЫМ НАНОПОКРЫТИЕМ | 2019 |
|
RU2713210C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНЫХ СТОМАТОЛОГИЧЕСКИХ ИМПЛАНТАТОВ С БИОАКТИВНЫМ ПОКРЫТИЕМ | 2015 |
|
RU2597750C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНОГО ИМПЛАНТАТА С ИОННО-ЛУЧЕВОЙ МОДИФИКАЦИЕЙ | 2013 |
|
RU2530568C1 |
Изобретение относится к области медицинской техники, а именно к ортопедической стоматологии, и может быть использовано при изготовлении внутрикостных имплантатов. Способ изготовления внутрикостного стоматологического имплантата с углеродным нанопокрытием включает обработку поверхности имплантата ускоренными до 1 кэВ ионами аргона при давлении (2-6)·10-2 Па с подачей отрицательного напряжения-смещения на подложку с постепенным увеличением его от 800 до 1500 В в течение не менее 1 ч, послойное напыление на основу имплантата многослойного покрытия из двух чередующихся слоев, с общим количеством слоев 20-30, при толщине каждого слоя 50-100 нм, и напыление на это покрытие углеродного нанопокрытия толщиной до 1 мкм. При этом первый слой многослойного покрытия, состоящий из соединений титана с углеродом напыляют одновременным дуговым распылением титанового катода и импульсно-дуговым распылением графитового катода с увеличением концентрации углерода в каждом последующем слое при суммарном увеличении концентрации в этих слоях от 14 до 75 вес.%, а второй - из твердого аморфного алмазоподобного углерода твердостью 70-100 ГПа напыляют импульсно-дуговым распылением графитового катода в условиях конденсации алмазоподобной пленки при температуре не выше 150ºС и энергии ионов углерода не более 100 эВ. Использование способа позволяет получить имплантат, имеющий высокую механическую и химическую стойкость покрытия, а также биосовместимость и антибактериальные свойства. 1 ил., 1 табл., 3 пр.
Способ изготовления внутрикостного стоматологического имплантата с углеродным нанопокрытием, включающий обработку поверхности имплантата, послойное напыление на основу имплантата многослойного покрытия и напыление на это покрытие углеродного нанопокрытия толщиной до 1 мкм, отличающийся тем, что обработку поверхности ведут ускоренными до 1 кэВ ионами аргона при давлении (2-6)·10-2 Па с подачей отрицательного напряжения-смещения на подложку с постепенным увеличением его от 800 до 1500 В в течение не менее 1 ч, многослойное покрытие выполняют из двух чередующихся слоев, с общим количеством слоев 20-30, при толщине каждого слоя 50-100 нм, при этом первый слой многослойного покрытия, состоящий из соединений титана с углеродом напыляют одновременным дуговым распылением титанового катода и импульсно-дуговым распылением графитового катода с увеличением концентрации углерода в каждом последующем слое при суммарном увеличении концентрации в этих слоях от 14 до 75 вес.%, а второй - из твердого аморфного алмазоподобного углерода твердостью 70-100 ГПа напыляют импульсно-дуговым распылением графитового катода, углеродное нанопокрытие напыляют импульсно-дуговым распылением графитового катода в условиях конденсации алмазоподобной пленки при температуре не выше 150°C и энергии ионов углерода не более 100 эВ.
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНОГО СТОМАТОЛОГИЧЕСКОГО ИМПЛАНТАТА С УГЛЕРОДНЫМ НАНОПОКРЫТИЕМ | 2012 |
|
RU2490032C1 |
| KR 20020094839 A, 18.12.2002 | |||
| СПОСОБ ВОЗДЕЛЫВАНИЯ ОЗИМОЙ ПШЕНИЦЫ | 2007 |
|
RU2331998C1 |
| US 6083570 A, 04.07.2000 | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2015-12-20—Публикация
2014-11-05—Подача