Известны способы прогнозирования эффективности защиты лимфоцитов от переокисления путем определения концентрации гидроксирадикалов [Microtubule dynamics and glutathione metabolism in phagocytizing human polymorphonuclear leukocytes / B.R. Burchill, J.M. Oliver, C.B. Pearson et al. // J. of Cell Biology. - 1978. - Vol.76, №2. - P.439-447.], но данная методика не позволяет оценить максимальный прирост концентрации гидроксирадикалов в среде инкубации, а следовательно прогнозировать эффективность защиты лимфоцитов от переокисления.
Известны способы прогнозирования эффективности защиты лимфоцитов от переокисления, оцениваемого по уровню гидроксирадикалов (Candeiasep et al., 1993, Crapski et al., 1992. Wolcott et al., 1994). Однако они не достаточно эффективны.
Известен также способ прогнозирования эффективности защиты лимфоцитов от гидроксирадикалов, основанный на исследовании концентрации гидроксильного радикала (·ОН) в среде инкубации [Thom Sr, Elbuken ME, 1991]. Данный способ является наиболее близким к предлагаемому по технической сущности и достигаемому результату и выбран в качестве прототипа.
Недостатком данного способа является невозможность прогнозирования эффективности защиты лимфоцитов от переокисления.
Целью предлагаемого изобретения является повышение эффективности и точности способа.
Указанная цель достигается дополнительным добавлением в инкубационную среду 1,4-дитиоэритритола и аскорбиновой кислоты в минимальной концентрации для оценки прогнозирования эффективности стимуляции антиоксидантной активности.
Новым в данном способе является внесение в инкубационную среду 1,4-дитиоэритритола и аскорбиновой кислоты в минимальной концентрации 2,5 мМ и 0,07 мМ, без которых невозможна стимуляция антиоксидантной активности и последующее угнетение роста концентрации в среде инкубации гидроксирадикалов.
Следовательно, только комплексная модернизация способа-прототипа позволяет получить желаемый результат. Только комплексное внесение в инкубационную смесь 1,4-дитиоэритритола и аскорбиновой кислоты в минимальной концентрации 2,5 мМ и 0,07 мМ соответственно позволяет повысить точность прогнозирования эффективности защиты лимфоцитов от переокисления, а именно оценить эффективность защиты лимфоцитов как эффективную при росте в среде гидроксирадикалов до 7% и менее, а неэффективную при росте в среде гидроксирадикалов до 8% и более.
Антиоксидантная система направлена на эффективную нейтрализацию гидроксирадикалов и снижение токсичной для организма гидроперекиси. Гидроксильный радикал (·ОН) участвует в микробицидном и цитотоксическом действии нейтрофилов, моноцитов и Т-лимфоцитов [Окислительный стресс. Прооксиданты и антиоксиданты / Е.Б. Меньшикова, В.З. Ланкин, И.К. Зенков и соавт. - М.: Слово. - 2006. - 556 с.]. Есть два основных механизма синтеза ·ОН нейтрофилами: первый - образование из пероксида водорода в присутствии металлов переменной валентности в так называемой «реакции Фентона»: Fe2++H2O2→Fe3++·ОН+ОН- [Лущак, В.И. Окислительный стресс и механизмы защиты от него у бактерий / В.И. Лущак // Биохимия. - 2001. - Т.66, вып.5. - С.592-609.], второй - в ходе ряда реакций с участием гипогалоидов: 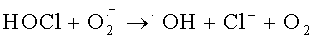 или взаимодействие гипохлорита с ионами Fe2+ [Spin trapping evidence for myeloperoxidase-dependent hydroxyl radical formation by human neutrophils and monocytes // C.L. Ramos, S. Pou, B.Е. Britigan et al. // J. Biol. Chem. - 1992. - Vol.267. - P.8307-8312; Candeias, L.P. Formation of hydroxyl radicals on reaction of hypochlorous acid with ferrocyanide, a model iron (II) complex / L.P. Candeias, М.R.L. Stratford, P. Wardman // Free Radical Res. - 1994. - Vol.20. - P.241-249.]. Следовательно, если в клетке нет металлов переменной валентности в свободном состоянии, для нее реакция Фентона и подобные реакции не будут опасными [Hampton М.В. Inside the Neutrophil Phagosome: Oxidants, Myeloperoxidase, and Bacterial Killing / М.B. Hampton, A.J. Kettle, C.C. Winterbourn // Blood. - 1998. - Vol.92, №9. - P.3007-3017.].
или взаимодействие гипохлорита с ионами Fe2+ [Spin trapping evidence for myeloperoxidase-dependent hydroxyl radical formation by human neutrophils and monocytes // C.L. Ramos, S. Pou, B.Е. Britigan et al. // J. Biol. Chem. - 1992. - Vol.267. - P.8307-8312; Candeias, L.P. Formation of hydroxyl radicals on reaction of hypochlorous acid with ferrocyanide, a model iron (II) complex / L.P. Candeias, М.R.L. Stratford, P. Wardman // Free Radical Res. - 1994. - Vol.20. - P.241-249.]. Следовательно, если в клетке нет металлов переменной валентности в свободном состоянии, для нее реакция Фентона и подобные реакции не будут опасными [Hampton М.В. Inside the Neutrophil Phagosome: Oxidants, Myeloperoxidase, and Bacterial Killing / М.B. Hampton, A.J. Kettle, C.C. Winterbourn // Blood. - 1998. - Vol.92, №9. - P.3007-3017.].
В нейтрофильных лейкоцитах предусмотрен ряд защитных реакций по блокированию свободных ионов Fe2+ и Cu+. Например, активированные нейтрофилы синтезируют лактоферрин, связывающий свободное железо и переводящий его в каталитически неактивную форму, а также продуцируют высокие концентрации таурина, коньюгирующего с гипохлоритом и защищающего клетку от его токсичных эффектов [Taurine chloramines, a product of activated netrophils, inhibits in vitro the genetation of nitric oxide and other macrofage inflammatory mediators / J. Marcinkiewiez, A. Grabowska, J. Bereta et al. // J. Leukocyte Biol. - 1995. - Vol.58. - P.667-674.].
Образование ·ОН показано в ходе микросомального окисления, окисления арахидоновой кислоты, в реакциях с флавиновыми ферментами, убихиноном, пероксинитритом. В ряде исследований нейтрофилов in vitro получены свидетельства продукции ·ОН данными клетками [Hydroxylation ofsalicylate by activated neutrophils / W.B. Davis, B.S. Mohammed, D.C. Mays et al. // Biochem Pharmacol. - 1989. - Vol.38. - P.4013-4019.]. Однако изучение этих реакций зачастую основывалось на использовании ингибиторов и измерении уровня вторичных продуктов. Следовательно, реакции, приписанные ·ОН, могли быть вызваны другими оксидантами, в частности 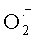 или гипохлорной кислотой [Do human neutrophils form hydroxyl radical. Evaluation of an unresolved controversy / M.S. Cohen, B.E. Britigan, D.J. Hassett et al. // Free Radic Biol Med. - 1988. - Vol.5. - P.81-90.]. Ряд авторов считает, что in vitro за счет реакции Фентона нейтрофилы производят незначительные количества ·ОН [Rosen, G.M. Free radicals and phagocytic cells / G.M.Rosen, S. Pou, C.L. Ramos // FASEB J. - 1995. - Vol.9. - P.200-211.].
или гипохлорной кислотой [Do human neutrophils form hydroxyl radical. Evaluation of an unresolved controversy / M.S. Cohen, B.E. Britigan, D.J. Hassett et al. // Free Radic Biol Med. - 1988. - Vol.5. - P.81-90.]. Ряд авторов считает, что in vitro за счет реакции Фентона нейтрофилы производят незначительные количества ·ОН [Rosen, G.M. Free radicals and phagocytic cells / G.M.Rosen, S. Pou, C.L. Ramos // FASEB J. - 1995. - Vol.9. - P.200-211.].
Генерация ·ОН стимулированными фагоцитами в очаге воспаления может существенно лимитироваться отсутствием в среде ионов железа. Исследование реакции Фентона в нейтрофилах выявило, что блокирование ионов железа лактоферрином ингибирует непосредственно саму реакцию [Rosen, G. M. Free radicals and phagocytic cells / G.M. Rosen, S. Pou, C.L. Ramos // FASEB J. - 1995. - Vol.9. - P.200-211.], а утилизация H2O2 миелопероксидазой ограничивает реакцию, даже если железо доступно [Winterboum, С.С. Myeloperoxidase as an effective inhibitor of hydroxyl radical production: Implications for the oxidative reactions of neutrophils / C.C. Winterboum // J. Clin. Invest. - 1986. - Vol.78. - P.545-557.]. Хотя большинство биологических форм железа каталитически неактивно, показана способность нейтрофилов к продукции ·ОН в присутствии трансферрина, подверженного протеолитической деградации [Phagocyte-derived free radicals stimulated by ingestion of ironrich Staphylococcus aureus: Aspin-trapping study / M.S. Cohen, B.E. Britigan, Y.S. Chai et al. // J. Infect Dis. - 1991. - Vol.163. - 819-826.], или железа в составе Pseudomonas aeruginosa, содержащего сидерофор пиохелин [Possible role of bacterial siderophores in inflammation-Iron bound to the pseudomonas siderophore pyochelin can function as a hydroxyl radical catalyst / T.J. Coffman, C.D. Cox, B.L. Edeker et al. / J. Clin. Invest. - 1990. - Vol.86. - P.1030-1038.]. Однако M.S. Cohen и соавторы обнаружили, что внутриклеточное железо не всегда доступно: в их экспериментах повышенного образования радикала ·ОН не отмечалось, даже если нейтрофилы поглощали Staphylococcus aureus, который был преинкубирован с Fe2+ [Phagocyte-derived free radicals stimulated by ingestion of ironrich Staphylococcus aureus: Aspin-trapping study / M.S. Cohen, B.E. Britigan, Y.S. Chai et al. // J. Infect Dis. - 1991. - Vol.163. - 819-826.].
С помощью чувствительных спиновых меток обнаружена наработка гидроксил-радикала нейтрофилами in vitro в результате реакции HOCl и 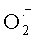 , причем преобразованию в ·ОН подверглась очень небольшая часть использованного клетками кислорода [Free hydroxyl radicals are formed on reaction between the neutrophilderived species superoxide and hypochlorous acid / L.P. Candeias, K.B. Patel, M. R.L. Stratford et al. // FEBS Lett. - 1993. - Vol.333. - P.151-159.]. Вопрос о том, достаточно ли такого количества ·ОН, чтобы играть существенную роль в цитотоксичности, до сих пор остается открытым. Здесь необходимо учитывать, что гораздо большей бактерицидной способностью ·ОН обладает в присутствии Cl- [Radiation induced generation of chlorine derivatives in N2O-saturated phosphate buffered saline: Toxic effects on Escherichia coli cells / G. Czapski, S. Goldstein, N. Andom et al. // Free Radic. Biol. Med. - 1992. - Vol.12. - P.353-361.], вероятно, вследствие реакции между ними с образованием гипохлорита [Bactericidal potency of hydroxyl radical in physiological environments / R.G. Wolcott, B.S. Franks, D.M. Hannum et al. // J. Biol. Chem. - 1994. - Vol.269. - P.9721-9734.].
, причем преобразованию в ·ОН подверглась очень небольшая часть использованного клетками кислорода [Free hydroxyl radicals are formed on reaction between the neutrophilderived species superoxide and hypochlorous acid / L.P. Candeias, K.B. Patel, M. R.L. Stratford et al. // FEBS Lett. - 1993. - Vol.333. - P.151-159.]. Вопрос о том, достаточно ли такого количества ·ОН, чтобы играть существенную роль в цитотоксичности, до сих пор остается открытым. Здесь необходимо учитывать, что гораздо большей бактерицидной способностью ·ОН обладает в присутствии Cl- [Radiation induced generation of chlorine derivatives in N2O-saturated phosphate buffered saline: Toxic effects on Escherichia coli cells / G. Czapski, S. Goldstein, N. Andom et al. // Free Radic. Biol. Med. - 1992. - Vol.12. - P.353-361.], вероятно, вследствие реакции между ними с образованием гипохлорита [Bactericidal potency of hydroxyl radical in physiological environments / R.G. Wolcott, B.S. Franks, D.M. Hannum et al. // J. Biol. Chem. - 1994. - Vol.269. - P.9721-9734.].
Гидроксильный радикал представляет собой один из наиболее реакционно-способных окислителей и может взаимодействовать почти с любой молекулой клетки. Он модифицирует дезоксирибозу и азотистые основания ДНК, окисляет молекулы белков, углеводов и липидов. Особенно активно ·ОН в ходе реакций перекисного окисления липидов атакует фосфолипиды, содержащие в жирнокислотных радикалах ненасыщенные связи, что ведет к образованию гидроперекисей [Дубинина, Е.Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико-биохимические аспекты / Е. Е. Дубинина. - СПб.: Медицинская пресса, 2006. - 400 с; Окислительный стресс. Прооксиданты и антиоксиданты / Е.Б. Меньшикова, В.З. Ланкин, Н.К. Зенков и соавт. - M.: Слово. - 2006. - 556 с.]. Основным компонентом антиокидантной системы является восстановленная форма глутатиона.
Глутатион - трипептид (L-γ-глутамил-L-цистеилглицин) с молекулярной массой 307 Da занимает особое место среди SH-содержащих соединений. Наличие у-глутамильной связи защищает трипептид от ферментативной деградации. В организме глутатион присутствует в двух формах: окисленной - GSSG и восстановленной - GSH, причем содержание GSH в клетках на несколько порядков выше, чем GSSG [Колесниченко Л.С., 1989; Wu G. et al., 2004; Смирнова Г.В., Октябрьский О.Н., 2005; Марри Р. и соавт., 2009]. По данным Р. Pietarinen-Runtti et al. (2000), концентрация GSH в нейтрофилах составляет около 5 нмоль/мг белка. Содержание глутатиона в сыворотке крови здоровых людей незначительно, поэтому клетки основную потребность в GSH обеспечивают путем нематричного синтеза [Wu G. et al., 2004] в ходе двух последовательных реакций, катализируемых γ-глутамилцистеин-синтетазой (КФ 6.3.2.2) и глутатион-синтетазой (КФ 6.3.2.3) [Кулинский В.И., 1990; Смирнова Г.В., Октябрьский О.Н., 2005; Марри Р. и соавт., 2009]. Лимитирующим звеном синтеза является образование γ-глутамилцистеина, зависящее от наличия L-цистеина и его способности окисляться в L-цистин [Зенков Н.К. и соавт., 2001]. В то же время недостаточность глутатион-синтетазы способствует развитию окислительных повреждений в нейтрофилах [Spielberg S.P. et al., 1979].
Глутатион при физиологических значениях рН имеет две анионные карбокси-группы, положительно заряженную аминогруппу и SH-группу цистеинового остатка, которая придает GSH свойства восстановителя и способность быстро обезвреживать свободные радикалы и АФК [Day R.M., 2005; Zhu Y., 2007; Circu C.L. et al., 2009]. Глутатин является типичным тиолом и, участвуя в одноэлектронных восстановительных реакциях, становится GS·, который димеризуется до GSSG, легко реагирующего со свободными SH-группами. Второй тип окислительно-восстановительных превращений с участием GSH - это реакции тиолдисульфидного обмена, которые известны как основной путь образования смешанных дисульфидов глутатиона с белками (белок-SSG) и играют роль в регуляции биологических процессов [Chai Y.C. et al., 1994]. В реакциях третьего типа происходит двухэлектронное окисление глутатиона с образованием интермедиата, который реагирует со второй молекулой GSH (получение GSSG) или иной молекулой (синтез смешанного дисульфида) [Смирнова Г.В., Октябрьский О.Н., 2005].
GSH является стабилизатором мембран [Биленко М.В, 1989; Udupi V., 1992; Trudel S. et al., 2009]. Он защищает клеточные структуры нейтрофилов от высокотоксичного OCI - [Carr А.С., Winterboum С.С., 1997], при этом GSH превращается в глутатион-сульфонамид и дегидроглутатион [Harwood D.T. et al., 2006]. Связывая NO, глутатион образует токсичные для клетки нитрозильные комплексы. Моно нитрозоглутатион может активировать апоптоз [Turpaev K.T. et al., 1997].
Не всегда восстановительного потенциала GSH достаточно для полной нейтрализации прооксидантов. Существует мнение, что взаимодействие GSH с органическими радикалами эффективно только в условиях удаления 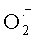 , поэтому глутатион образует с супероксиддисмутазой своеобразную антиоксидантную систему, ибо в противном случае развиваются реакции образования H2O2 и GS· [Ланкин В.З. и соавт., 1997; Меныцикова Е.Б. и соавт., 2006]. В сочетании с витамином B12 глутатион, а также N-ацетилцистеин, могут потенцировать прооксидантное и цитотоксическое действие на клетку [Соловьева М.Е. и соавт., 2007].
, поэтому глутатион образует с супероксиддисмутазой своеобразную антиоксидантную систему, ибо в противном случае развиваются реакции образования H2O2 и GS· [Ланкин В.З. и соавт., 1997; Меныцикова Е.Б. и соавт., 2006]. В сочетании с витамином B12 глутатион, а также N-ацетилцистеин, могут потенцировать прооксидантное и цитотоксическое действие на клетку [Соловьева М.Е. и соавт., 2007].
Основной антиоксидантный эффект GSH реализует посредством участия в работе ферментов. Глутатион выступает донором водорода при восстановлении H2O2 и перекисей липидов глутатион-пероксидазами и глутатион-S-трансферазами (ГТ) [Hirayama К., 1989; Sies Н. et al., 1997; Кулинский В.И, 1990; Hayes J.D. et al., 2005; Зенков Н.К.. и соавт., 2009; Liu G. et al., 2010]. Высокая активность глутатион-редуктазы и накопление GSH оказывает протекторный эффект в отношении альвеолярных макрофагов, инкубируемых с прооксидантами in vitro [Pietarinen P.К. 1995].
С изменением окислительно-восстановительного баланса сопряжено большое количество реакций, поэтому поддержание оптимального редокс-состояния цитозоля выступает важным условием нормальной жизнедеятельности клеток. Высокая концентрация глутатиона в цитоплазме, его редокс-активность и возможность поддержания в восстановленном состоянии делают систему GSH/GSSG важнейшим внутриклеточным редокс-буфером [Reed M.C. et al., 2008]. Концентрация GSH в клетке в 500-1000 раз превышает уровень НАДФН и других внутриклеточных редокс-систем, поэтому изменения соотношения GSH/GSSG прямо отражают изменения редокс-статуса клетки [Кулинский В.И., 2007; Asian M., Canatan D., 2008; Reed M.C., 2008]. Считают, что буферная емкость системы глутатиона защищает репликативную систему клетки, а дефицит GSH приводит к снижению синтеза ДНК и белков [Poot M., 1991; Ланкин В.З., 1997; Day R.M., Suzuki Y.J, 2005; Liu G. et al., 2010].
К природным антиоксидантам относят также аскорбиновую кислоту, которая играет важную роль в развитии окислительного стресса в организме.
Аскорбиновая кислота реализует свое антиоксидантное действие в плазме, межклеточной жидкости и на внеклеточном уровне. В организме человека аскорбиновая кислота преимущественно представлена в L-форме. Стрессовые ситуации увеличивают количество метаболитов витамина С в виде дегидроаскорбиновой кислоты.
Аскорбиновая кислота и дегидроаскорбиновая кислота играют активную роль в нескольких процессах, включая защиту от инфекции, повышении иммунности, в процессах заживления ран, а также принимая участие в образовании антистрессовых гормонов. Аскорбат является кофактором дофамин-β-гидроксилазы, которая катализирует синтез норадреналина и других катехоламинов. Аскорбиновая кислота является восстановителем для L-пролингидроксилазы, которая необходима для синтеза коллагена и соединительной ткани в целом. В организме с участием аскорбиновой кислоты происходит регенерация α-токоферола из токофероксильного радикала. Окислительный стресс коррелирует с ухудшением секреции инсулина, а терапия аскорбиновой кислотой прерывает повреждающее действие свободных радикалов, уменьшает степень проявления инсулиновой резистентности [М.И. Балаболкин и соавт., 2003]. Ионы аскорбата являются одним из активных элементов системы антиоксидантной защиты, предохраняя липиды от окисления их пероксидными радикалами. Антиоксидантный эффект аскорбата проявляется при достаточном количестве других антиоксидантов, таких как α-токоферол и глутатион. Глутатион восстанавливает дегидроаскорбиновую кислоту прямым и неферментативным путем до аскорбиновой кислоты.
Эта реакция является одним из основных механизмов антиоксидантной системы, часто описываемых как восстановительные циклы - глутатион/глутатиондисульфид и аскорбиновая/дегидроаскорбиновая кислота. При этом клетки периферических тканей поглощают экзогенную дегидроаскорбиновую кислоту и в присутствии глутатиона конвертируют ее в цитоплазме в аскорбиновую кислоту. Восстановление глутатиондисульфида в глутатион катализируется глутатион редуктазой и требует участия NADPH в качестве кофактора. Недостаточность глутатиона снижает содержание аскорбиновой кислоты в тканях и одновременно повышает концентрацию дегидроаскорбиновой кислоты.
При недостатке α-токоферола и глутатиона может превалировать прооксидантный эффект аскорбата и его метаболитов. Прооксидантный эффект аскорбиновой кислоты может наблюдаться не только при недостатке α-токоферола и глутатиона, но и при применении высоких доз аскорбиновой кислоты. Избежать прооксидантного эффекта аскорбиновой кислоты можно в случае создания адекватного внутриклеточного уровня восстановленного глутатиона.
Исходя из вышесказанного целесообразно использовать в эксперименте комплексное применение аскорбата с протектором SH-групп, а именно 1,4-дитиоэритритолом. Для проникновения внутрь клетки пассивным транспортом происходит превращение аскорбиновой кислоты в дегидроаскорбиновую кислоту, затем последняя подвергается обратимому превращению в аскорбиновую кислоту при участии восстановленного глутатиона. Следовательно, комплексная модернизация способа-прототипа позволяет повысить точность прогнозирования эффективности защиты лимфоцитов от переокисления.
Каждый вновь введенный в формулу изобретения признак выполняет функцию повышения точности и эффективности способа: дополнительное добавление в инкубационную среду 1,4-дитиоэритритола и аскорбиновой кислоты в минимальной концентрации для последующего определения концентрации гидроксирадикалов.
Роль антиоксидантной системы клетки заключается в снижении токсического эффекта свободных радикалов, в том числе и гидроперекисей липидов.
Антиоксидантную защиту обеспечивает широкий круг веществ, различных по происхождению, физико-химической природе и механизмам действия. Общим их свойством, по определению J.M. Gutteridge (1992), является способность, присутствуя в низких по сравнению с окисляемым субстратом концентрациях, существенно задерживать или ингибировать его окисление. Постоянное образование прооксидантов должно быть уравновешено их инактивацией, поэтому для поддержания гомеостаза необходима адекватная ситуации непрерывная регенерация антиоксидантной способности клеток [Зенков Н.К. и соавт., 2001; Blokhina O.et al., 2003].
Общепринятой номенклатуры антиоксидантов в настоящее время не существует, хотя ряд авторов [Dimascio Р., 1990; Kaira V. et al., 2001; Зайцев В.Г. и соавт., 2003] выделяет два класса: превентивные, снижающие скорость инициации цепной реакции окисления, и гасящие (прерывающие цепь), препятствующие развитию цепной реакции. К превентивным относят каталазу и пероксидазы, разрушающие ROOH, а также агенты, образующие хелатные комплексы с металлами переменной валентности, к прерывающим цепь - фенолы, ароматические амины. В условиях in vivo главными гасящими антиоксидантами являются: витамин Е, нейтрализующий ROO· в липидной фазе мембран [Jore D. et al., 1990; Hong J.H. et al., 2004], фермент СОД, улавливающий 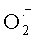 в водной фазе клетки [Fridovich L, 1989; Dimascio P., 1990; Ciurea D., 1992], и церулоплазмин - белок острой фазы, выполняющий антирадикальную функцию в крови [Maiklund S.L., 1987; Atanasiu R.L. et al., 1998].
в водной фазе клетки [Fridovich L, 1989; Dimascio P., 1990; Ciurea D., 1992], и церулоплазмин - белок острой фазы, выполняющий антирадикальную функцию в крови [Maiklund S.L., 1987; Atanasiu R.L. et al., 1998].
Более известно деление антиоксидантов на ферменты и соединения неферментативной природы. Последние в определенных концентрациях всегда присутствуют в липидной фазе мембран и водных средах организма и расходуются первыми при устранении проявлений окислительного стресса [Droge W., 2002; Blokhina O., 2003]. Ферменты наиболее активно присоединяется к антиоксидантной защите (АОЗ) после включения механизмов индукции [Лущак В. И., 2001]. При возникновении окислительного стресса (ОС) расход антиоксидантов возрастает и меняется экспрессия генов, кодирующих белковые компоненты АОЗ [Дубинина Е.Е., 2006]. Между ферментами и неферментативными элементами АОЗ существует равновесие, причем последние при ряде патологических состояний организма могут выступать в качестве прооксидантов [Зенков Н.К. и др., 2001].
Главную роль среди неферментавных антиоксидантных систем защиты отводят глутатиону.
В настоящее время в лабораторной практике наиболее распространен способ прогнозирования эффективности зашиты лимфоцитов от переокисления с помощью определения концентрации гидроксирадикалов.
Концентрацию гидроксирадикалов определяют методом, предложенным [Thorn S.R, Elbuken M.E., 1991]. Метод основан на разрушении модельного субстрата 2-дезокси-D-рибозы гидроксильным радикалом, образуемым опсонизированными лимфоцитами.
Содержание восстановленного глутатиона определяют методом, предложенным M.E. Anderson (1985) в модификации S. Kojima et al. (2004) [Kojima, S. Low dose gamma-rays activate immune functions via induction of glutathione and delay tumor growth / S. Kojima, K. Nakayama, H. Ishida // J. Radiat. Res. - 2004. - Vol.45, №1. - P.33-39.]. Принцип метода основан на взаимодействии GSH с 5,5'-дитио-бис(2-нитробензойной) кислотой (ДТНБ) с образованием тио-2-нитробензойной кислоты, водный раствор которой имеет максимум поглощения при длине волны 412 нм. При этом образуется GSSG, который восстанавливается глутатионредуктазой до GSH и вновь взаимодействует с ДТНБ. Скорость образования окрашенного продукта пропорциональна содержанию общего глутатиона. Для определения содержания GSSG пробы прединкубируются с блокатором SH-групп 2-винилпиридином («Wako», Япония), который необратимо связывает GSH и, следовательно, скорость образования окрашенного продукта пропорциональна содержанию GSSG.
Лизат лимфоцитов крови готовят на 5% сульфосалициловой кислоте, которая осаждает белки, но не ингибирует активность глутатионредуктазы.
Концентрацию белка в лимфоцитах крови определяют методом [A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding / M.M. Bradford // Analyt. Biochem. - 1976. - Vol.7, №1, 2. - P.248-254.], основанным на взаимодействии Кумасси голубого G-250 с остатками аргинина и лизина в белках. Свободный краситель красного цвета (максимум поглощения - 495 нм) при образовании комплекса с белком переходит в синюю форму (максимум поглощения - 595 нм).
К 0,1 мл лизата лимфоцитов крови добавляют 1,0 мл раствора Кумасси голубого (100 мг красителя, 50 мл 96° этанола, 100 мл 85% H3PO4, Н2О до 1,0 л), перемешивают, инкубируют 3 мин при комнатной температуре и измеряют оптическую плотность проб (длина волны 595 нм) против контроля, содержащего 0,1 мл воды и 1,0 мл раствора Кумасси голубого. Содержание белка рассчитывают по калибровочной кривой, построенной по разведениям стандартного раствора альбумина (1,0 мг/мл) и выражаютр в мг/мл.
Концентрацию гидроксирадикалов определяют биохимическим методом.
В настоящее время крайне важно для прогнозирования эффективности защиты лимфоцитов от переокисления оценить концентрацию гидроксирадикалов (·ОН) после стимуляции антиоксидантной активности минимальными концентрациями 1,4-дитиоэритритола и аскорбиновой кислоты. Для решения этой задачи предложен новый способ прогнозирования эффективности защиты лимфоцитов от переокисления после дополнительного добавления в инкубационную среду 1,4-дитиоэритритола и аскорбиновой кислоты в конечной концентрации 2,5 мМ и 0,07 мМ соответственно.
Все сказанное свидетельствует о крайней важности разработки способа прогнозирования эффективности защиты лимфоцитов от переокисления, а также для защиты клеток от токсического действия активных форм кислорода.
Популярность указанного выше способа обоснована его высокой чувствительностью, простотой осуществления и достаточной адекватностью получаемых результатов, лежащих в основе определения концентрации гидроксильных радикалов в среде инкубации лимфоцитов.
Существенные признаки, характеризующие изобретение, проявили в заявленной совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области, и не являются очевидными для специалиста.
Идентичной совокупности признаков не обнаружено при изучении патентной и научной медицинской литературы.
Данное изобретение может быть использовано в медицинской практике для повышения точности прогнозирования эффективности защиты лимфоцитов от переокисления при различных заболевания. Таким образом, следует считать предлагаемое изобретение соответствующим условиям патенте-способности: «новизна», «изобретательский уровень», «промышленная применимость».
Метод основан на определении концентрации гидроксирадикалов (·ОН).
Способ осуществляется следующим образом поэтапно:
1. Выделение лимфоцитов крови из венозной крови.
Пробирки с венозной гепаринизированной кровью (25 Ед/мл) выдерживают при температуре 37°С в течение 40 минут для отделения плазмы и эритроцитов. Затем пробирки переносят в стерильный ламинарный шкаф для выполнения процедуры выделения лимфоцитов крови. Полученную плазму наслаивают на градиент плотности Ficoll-Paque («Pharmacia», Швеция) (ρ=1,077 г/см3) в соотношении 1:2 и центрифугируют при 500 g в течение 20 минут [Bignold L.P., 1987]. После центрифугирования собирают образовавшееся интерфазное кольцо из смеси мононуклеарных клеток в стерильную центрифужную пробирку с 4,5 мл питательной среды ((90% RPMI-1640 («Вектор-Бест», Россия), 10% эмбриональной телячьей сыворотки («Биолот», Россия), инактивированной при температуре 56°С в течение 30 мин, 0,3 мг/мл L-глутамина («Борисовский ЗМП», Беларусь), 100 мкг/мл гентамицина, 2 ммоль/мл Hepes («Flow», Великобритания)), затем центрифугируют 10 минут при 500 g. Процедуру отмывки повторяют дважды: последовательно ресуспендируя клетки и затем центрифугируя в течение 10 минут при 500 g. Выделение лимфоцитов из мононуклеарной фракции клеток проводят на двойном градиенте Перколла [Ulmer A.J., 1979]. Стандартный изоосмотический раствор Перколла (SIP) получают смешиванием одного объема 10х PBS (фосфатно-солевого буфера (рН 7,4)) с девятью объемами Перколла («Sigma», США) (плотность полученного раствора - 1,130 г/мл). Затем готовят 47,5% стандартный изоосмотический раствор Перколла (47,5% SIP) и 15,0% стандартный изоосмотический раствор Перколла (15,0% SIP). К клеточной суспензии добавляют 1,5 мл SIP (4°C), перемешивают и переносят в новую стерильную пробирку. Сверху наслаивают 5 мл 47,5% SIP (4°C). Создают верхнюю фазу посредством 2 мл 15,0% SIP (4°C). Центрифугируют при 1500 g и 4°С 45 минут. Собирают интерфазное кольцо (лимфоцитарную фракцию клеток). Объем доводят до 5 мл питательной средой ((90% RPMI-1640 («Вектор-Бест», Россия), 10% эмбриональной телячьей сыворотки («Биолот», Россия), инактивированной при температуре 56°С в течение 30 мин, 0,3 мг/мл L-глутамина («Борисовский ЗМП», Беларусь), 100 мкг/мл гентамицина, 2 ммоль/мл Hepes («Flow», Великобритания)), температура раствора должна соответствовать 37°С. Далее проводят центрифугирование при 700 g и 20°С в течение 10 минут. Затем удаляют супернатант до конечного объема 1 мл.
2. Количественное определение численности жизнеспособных лимфоцитов крови с помощью окраски трипановым синим микроскопическим методом. Лимфоциты крови ресуспендируют в 1 мл клеточной взвеси. Отбирают 100 мкл ресуспендированной клеточной суспензии и добавляют 100 мкл 0,1% раствора трипанового синего на физ. растворе, хорошо перемешивают и заполняют камеру Горяева. Предварительно к камере притирают покровное стекло так, чтобы появлялись радужные, ньютоновые кольца (только при этих условиях соблюдался правильный объем камеры). Каплю клеточной взвеси с красителем вносят под притертое покровное стекло. Подсчет клеток производят в 5-ти больших квадратах по диагонали камеры Горяеева. Расчет клеточности лимфоцитов крови производят по формуле
А×106=(число клеток)/4
где, А - клеточность лимфоцитов крови.
3. Внесение в инкубационную смесь заявленных добавок.
В культуральную смесь добавляют соединения: 1,4-дитиоэритритол в концентрации 2,5 мМ и аскорбиновую кислоту в конечной концентрации 0,07 мМ.
4. Биохимическое исследование концентрации гидроксильного радикала.
Метод [Thorn S.R., Elbuken M.E., 1991] основан на разрушении модельного субстрата 2-дезокси-D-рибозы гидроксильным радикалом, образуемым опсонизированными лимфоцитами. Чем выше концентрация в среде ·ОН, тем больше разрушается модельного субстрата.
В две опытные пробы добавляли по 250 мкл суспензии лимфоцитов, содержащей 2·106 клеток в 1 мл, 250 мкл 15 мМ 2-дезокси-D-рибозы на среде Хэнкса (рН=7,4) и 30 мкл раствора зимозана. В одну из проб добавляли 250 мкл 240 мМ абсолютного этанола, в другую - 250 мкл среды Хэнкса. Обе пробы инкубировали 30 мин при 37°С, добавляли по 0,6 мл 1% тиобарбитуровую кислоту (ТБК) и по 0,6 мл 2,8% трихлоруксусной кислоты, затем инкубировали далее 15 мин при 100°С, охлаждали и центрифугировали 10 мин при 1000 g. Оптическую плотность проб измеряли при длине волны 532 нм. Расчет производили с учетом разведения и коэффициента молярной экстинкции образующегося продукта (1,56·105 М-1 см-1). Результаты выражали в нмоль/мг белка.
Прогнозирование эффективности защиты лимфоцитов от переокисления по способу-прототипу и предлагаемому способу выполнялось 40 раз. Результаты исследования обработаны статистически с использованием пакета программ Stat Soft Statistica 6.0.
При проведении исследования по способу-прототипу уровень гидроксирадикалов в среде инкубации лимфоцитов в норме составил 46,2±5,1 нмоль/мг белка, а при оценке по предлагаемому способу в случае эффективной защиты лимфоцитов от переокисления уровень гидроксирадикалов составил 44,0±4,2 нмоль/мг белка, а в случае неэффективной защиты лимфоцитов от переокисления уровень гидроксирадикалов составил 51,3±3,1 нмоль/мг белка. В случае не эффективной стимуляции антиоксидантной активности уровень восстановленного глутатиона составил 0,80±0,07 нмоль/мг белка (табл.1). То есть при эффективной стимуляции защиты лимфоцитов от переокисления уровень гидроксирадикалов возрастает на 7% и менее, а при неэффективной защите защиты лимфоцитов от переокисления уровень гидроксирадикалов увеличивается на 8% и более.
Полученные результаты уровня гидроксирадикалов в среде инкубации лифоцитов соответствуют данным литературы [Смирнова Г.В., Октябрьский О.Н., 2005].
Итак, при применении способа-прототипа был получен недостаточно точный результат, не позволивший установить эффективность прогнозирования защиты лимфоцитов от переокисления, что связано с отсутствием биохимической стимуляции процесса, а наиболее эффективным и точным был предлагаемый способ.
При этом предлагаемый способ прост в исполнении и интерпретации полученных результатов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЗАЩИТЫ КЛЕТОК ОТ АПОПТОЗА | 2013 |
|
RU2541774C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЗАЩИТЫ ЛИМФОЦИТОВ ОТ АПОПТОЗА | 2014 |
|
RU2568886C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАННЕЙ СТАДИИ АПОПТОЗА | 2013 |
|
RU2540500C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ СТИМУЛЯЦИИ АНТИОКСИДАНТНОЙ АКТИВНОСТИ | 2013 |
|
RU2516925C1 |
| СПОСОБ ДИАГНОСТИКИ АПОПТОЗА ЛИМФОЦИТОВ | 2013 |
|
RU2545900C2 |
| СПОСОБ СОЗДАНИЯ МОДЕЛИ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИМФОЦИТОВ | 2013 |
|
RU2541771C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ПРИ АЛКОГОЛЬНОМ ГЕПАТИТЕ | 2013 |
|
RU2559778C2 |
| Способ отбора лиц, работающих в условиях воздействия кремнийсодержащих аэрозолей, для последующего мониторинга состояния бронхолегочной системы | 2023 |
|
RU2813952C1 |
| СПОСОБ ГЕНОТИПИРОВАНИЯ ПОЛИМОРФИЗМА rs2551715 ГЕНА ГЛУТАТИОНРЕДУКТАЗЫ У ЧЕЛОВЕКА | 2013 |
|
RU2549688C1 |
| СОСТАВ ДЛЯ СТАБИЛИЗАЦИИ ЛИПИДОВ К ОКИСЛЕНИЮ | 2014 |
|
RU2565739C1 |
Изобретение относится к медицине и описывает способ прогнозирования эффективности защиты лимфоцитов от переокисления путем определения концентрации гидроксирадикалов, в котором при комплексном внесении в среду инкубации лимфоцитов 1,4-дитиоэритритола и аскорбиновой кислоты в конечной концентрации 2,5 мМ и 0,07 мМ соответственно защиту лимфоцитов от гидроксирадикалов оценивают как эффективную при росте в среде гидроксирадикалов до 7% и менее, а неэффективную при росте в среде гидроксирадикалов до 8% и более. Изобретение обеспечивает повышение точности прогнозирования, при этом способ прост в осуществлении и интерпретации полученных результатов. 1 табл., 1 пр.
Способ прогнозирования эффективности защиты лимфоцитов от переокисления путем определения концентрации гидроксирадикалов, отличающийся тем, что при комплексном внесении в среду инкубации лимфоцитов 1,4-дитиоэритритола и аскорбиновой кислоты в конечной концентрации 2,5 мМ и 0,07 мМ соответственно защиту лимфоцитов от гидроксирадикалов оценивают как эффективную при росте в среде гидроксирадикалов до 7% и менее, а неэффективную при росте в среде гидроксирадикалов до 8% и более.
| Coyan K | |||
| Et et al | |||
| Influence of methionine and dithioerythritol on sperm motility, lipid peroxidation and antioxidant capacities during liquid storage of ram semen | |||
| Res Vet Sci | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Bartoli G.M | |||
| et al | |||
| Antioxidant effect of diethyldithiocarbamate on microsomal lipid peroxidation | |||
Авторы
Даты
2014-08-10—Публикация
2013-05-07—Подача