Изобретение относится к композиции, содержащей антагонист c-Met, представляющий собой антитело, и соединение аминогетероарила, в частности в качестве лекарства. Настоящее изобретение также включает фармацевтическую композицию, содержащую антитело анти-c-Met и соединение аминогетероарила в виде комбинированных препаратов для одновременного, отдельного или последовательного применения. Изобретение относится к применению композиции по изобретению для лечения рака у млекопитающего.
c-Met является прототипичным членом подсемейства RTK, которое также включает RON и SEA. Семейство c-Met RTK является структурно отличным от других семейств RTK и является единственным известным рецептором высокого сродства к фактору роста гепатоцитов (HGF), также называемому рассеивающим фактором (scater factor, SF) [D.P. Bottaro et al., Science 1991, 251:802-804; L. Naldini et al., Eur. Mol. Biol. Org. J. 1991, 10:2867-2878]. c-Met и HGF широко экспрессируются в ряде тканей, и их экспрессия в норме ограничена клетками эпителиального и мезенхимного происхождения соответственно [M.F. Di Renzo et al., Oncogene 1991, 6:1997-2003; E. Sonnenberg et al., J. Cell. Biol. 1993, 123:223-235]. Оба они необходимы для нормального развития млекопитающего, и показано, что они особенно важны в клеточной миграции, морфогенетической дифференциации и организации трехмерных тубулярных структур, а также в росте и ангиогенезе [F. Baldt et al., Nature 1995, 376:768-771; С.Schmidt et al., Nature. 1995:373:699-702; Tsarfaty et al., Science 1994, 263:98-101]. Хотя показано, что контролируемая регуляция c-Met и HGF важна при развитии млекопитающего, поддержании и репарации тканей [Nagayama Т, Nagayama M, Kohara S, Kamiguchi Н, Shibuya M, Katoh Y, Itoh J, Shinohara Y., Brain Res. 2004, 5;999(2):155-66; Tahara Y, Ido A, Yamamoto S, Miyata Y, Uto Н, Hori T, Hayashi K, Tsubouchi Н., J Pharmacol Exp Ther. 2003, 307(1):146-51], нарушение их регуляции связывают с прогрессированием раков.
Аберрантная передача сигнала, направляемая несоответствующей активацией c-Met, является одним из наиболее частых изменений, наблюдаемых при раках человека, и играет критическую роль в канцерогенезе и метастазах [Birchmeier et al., Nat. Rev. Mol. Cell Biol. 2003, 4:915-925; L. Trusolino and Comoglio P. M., Nat Rev. Cancer. 2002, 2(4):289-300].
Активация с-Met может являться результатом различных механизмов, включающих i) связывание лиганда, ii) гиперэкспрессию рецептора, которая приводит к спонтанной, независимой от лиганда димеризации, или iii) мутации, в основном встречающиеся во внутриклеточном домене c-Met и приводящие в результате к повышенному и постоянному фосфорилированию c-Met или к конститутивной активации рецептора [J. G. Christensen, Burrows J. and Salgia R., Cancer Letters. 2005, 226:1-26].
Активированный c-Met рекрутирует эффекторы передачи сигнала в их множественном стыковочном сайте, локализованном в цитоплазматическом домене, что приводит в результате к активации нескольких ключевых биохимических путей передачи сигнала, включая Ras-MAPK, PI3K, Src и Stat3 [Gao CF, Vande Woude GF, Cell Res. 2005, 15(1):49-51; Furge KA, Zhang YW, Vande Woude GF, Oncogene. 2000, 19(49):5582-9]. Эти биохимические пути существенны для пролиферации опухолевых клеток, инвазии и ангиогенеза и для избегания апоптоза [Furge KA, Zhang YW, Vande Woude GF, Oncogene, 2000, 19(49):5582-9; Gu H, Neel BG, Trends Cell Biol. 2003 Mar, 13(3): 122-30; Fan S, Ma YX, Wang JA, Yuan RQ, Meng Q, Cao Y, Laterra JJ, Goldberg ID, Rosen EM, Oncogene. 2000 Apr 27, 19(18):2212-23]. Кроме того, уникальным аспектом передачи сигнала c-Met относительно других RTK является его описанное взаимодействие с фокальными адгезионными комплексами и некиназными партнерами связывания, такими как интегрины α6β4 [Trusolino L, Bertotti A, Comoglio PM, Cell. 2001, 107:643-54], CD44v6 [Van der Voort R, Taher ТЕ, Wielenga VJ, Spaargaren M, Prevo R, Smit L, David G, Hartmann G, Gherardi E, Pals ST, J Biol Chem. 1999, 274(10):6499-506], плексин В1 или семафорины [Giordano S, Corso S, Conrotto P, Artigiani S, Gilestro G, Barberis D, Tamagnone L, Comoglio PM, Nat Cell Biol. 2002, 4(9):720-4; Conrotto P, Valdembri D, Corso S, Serini G, Tamagnone L, Comoglio PM, Bussolino F, Giordano S, Blood. 2005, 105(11):4321-9; Conrotto P, Corso S, Gamberini S, Comoglio PM, Giordano S, Oncogene. 2004, 23:5131-7], которые могут дополнительно прибавлять сложность регуляции клеточной функции их рецептором. Наконец, последние данные демонстрируют, что c-Met может быть вовлечен в устойчивость опухоли к гефитинибу или эрлотинибу, что позволяет предположить, что комбинация соединения, направленная как на EGFR, так и на c-Met, могла бы представлять значительный интерес [Engelman JA at al., Science, 2007, 316:1039-43].
Более чем 20 мутаций открыто в пределах c-met RTK [Ma Р. С.et al. Cancer and metastasis rev. 2003, 22:309-25]. Большинство этих мутаций представляет собой миссенс-мутации, локализованные во внутриклеточном участке c-Met, в пределах тирозинкиназного домена, и которые могут нарушать сродство или связывающие свойства терапевтических соединений, направленных на этот тирозинкиназный домен. Таким образом, мутации c-Met могут в большей или меньшей степени реагировать на терапевтические ингибирования. Например, в доклинических исследованиях SU11274 (низкомолекулярного ингибитора тирозинкиназы против c-Met) некоторые мутации были разделены на чувствительные и устойчивые к действию этого агента [Schmidt L. et al. Nat Genet. 1997, 16:68-73; Zhuang Z. et al. Nat Genet. 1998, 20:66-9]. M1268T и H1112Y являются чувствительными мутациями, которые проявляли сниженный клеточный рост и подвижность. Другие мутации, такие как L1213V и Y1248, были обнаружены как устойчивые и не подверженные воздействию SU11274 [Hahn О. et al. Hematol Oncol Clin N Am. 2005, 19:343-67]. В этих исследованиях продемонстрировано прямое воздействие конкретных мутаций на терапии, направленные на c-Met. Однако олигомеризация c-Met в присутствии или в отсутствие лиганда требуется для регуляции связывающего сродства и кинетики связывания киназы по отношению к АТФ и тирозинсодержащим пептидным субстратам [Hays J.I., Watowich SJ, Biochemistry. 2004, 43:10570-8].
За последние несколько лет разработано много различных стратегий по ослаблению передачи сигнала c-Met в раковых клеточных линиях. Эти стратегии включают i) нейтрализующие антитела против c-Met или HGF/SF [Сао В, Su Y, Oskarsson M, Zhao P, Kort EJ, Fisher RJ, Wang LM, Vande Woude GF, Proc Natl Acad Sci USA. 2001, 98(13):7443-8; Martens T, Schmidt NO, Eckerich C, Fillbrandt R, Merchant M, Schwall R, Westphal M, Lamszus K, Clin Cancer Res. 2006, 12(20):6144-52] или использование HGF/SF антагониста NK4 для предотвращения связывания лиганда с c-Met [Kuba K, Matsumoto K, Date K, Shimura Н, Tanaka M, Nakamura T, Cancer Res., 2000, 60:6737-43], ii) низкомолекулярные ингибиторы АТФ-связывающего сайта c-Met, которые блокируют киназную активность [Christensen JG, Schreck R, Burrows J, Kuruganti P, Chan E, Le P, Chen J, Wang X, Ruslim L, Blake R, Lipson KE, Ramphal J, Do S, Cui JJ, Cherrington JM, Mendel DB, Cancer Res. 2003, 63:7345-55], iii) сконструированный полипептид SH2 домена, который препятствует доступу к множественному стыковочному сайту и PHKi или рибозим, который снижает экспрессию рецептора или лиганда. Большинство этих подходов проявляет селективное ингибирование c-Met, приводящее в результате к ингибированию опухоли, и показывает, что c-Met может представлять интерес для терапевтического вмешательства при раке.
Среди молекул, созданных для направленности на c-Met, некоторые представляют собой антитела.
Одним из наиболее широко описанных является антитело анти-c-Met 5D5, созданное Genentech [WO96/38557], которое действует как сильный агонист, когда его добавляют отдельно в различных моделях, и как антагонист, когда его используют в виде Fab фрагмента. Другое антитело, направленное на c-Met, описано Pfizer как антитело, действующее "преимущественно как антагонист c-Met и в некоторых случаях как агонист c-Met" [WO 2005/016382].
Автор изобретения продемонстрировал, что антитела, являющиеся антагонистами c-Met, названные 224G11, 227Н1, 223С4 и 11Е1, или их функциональный фрагмент, описанные в данной заявке и также описанные в заявках на патенты ЕР 073012312, поданной 12 июля 2007, и US 61/020639, поданной 11 января 2008, обладают свойством ингибирования димеризации c-Met и активны in vivo.
Таким образом, проблемой, которая должна быть решена изобретением, можно считать разработку реальной, а не только предполагаемой комбинации, полезной для лечения рака.
Более конкретно целью изобретения является разработка новой и неожиданной комбинации, способной влиять на все факторы, вовлеченные в активацию c-Met, как описано выше.
В общем аспекте изобретение относится к способу лечения рака у млекопитающего, который включает введение млекопитающему терапевтически эффективного количества комбинации активных ингредиентов, содержащей антагонист c-Met и соединение аминогетероарила.
В другом общем аспекте настоящее изобретение направлено на композицию, содержащую антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, и соединение аминогетероарила, предпочтительно для ее применения в качестве лекарства.
Далее настоящее изобретение направлено на фармацевтическую композицию, содержащую по меньшей мере:
i) один антагонист c-Met, представляющий собой антитело или его функциональный фрагмент; и
ii) соединение аминогетероарила,
в виде комбинированных препаратов для одновременного, отдельного или последовательного применения.
"Одновременное применение" понимают как означающее введение двух соединений композиции согласно изобретению в единой и идентичной фармацевтической форме.
"Отдельное применение" понимают как означающее введение в одно и то же время двух соединений композиции согласно изобретению в отдельных фармацевтических формах.
"Последовательное применение" понимают как означающее последовательное введение двух соединений композиции согласно изобретению, каждое в отдельной фармацевтической форме.
Согласно изобретению комбинацию предпочтительно смешивают с эксципиентом и/или с фармацевтически приемлемым носителем.
Также описана и заявлена композиция согласно изобретению в качестве лекарства.
В другой форме осуществления комбинация по изобретению может находиться в форме набора из частей. Изобретение, таким образом, включает препарат, содержащий антагонист c-Met, представляющий собой антитело или один из его функциональных фрагментов, и соединение аминогетероарила, предпочтительно способное к ингибированию протеинкиназной активности c-Met, как определено выше, в виде комбинированного препарата для одновременной, отдельной или последовательной доставки для лечения рака у млекопитающего, нуждающегося в этом. В одной форме осуществления препарат содержит антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, и соединение аминогетероарила, как определено выше, в виде комбинированного препарата для одновременного, отдельного или последовательного применения при лечении рака у млекопитающего, нуждающегося в этом.
В одной форме осуществления в изобретении предложена фармацевтическая упаковка, включающая курс противораковой терапии для одного индивидуального млекопитающего, которая содержит (а) по меньшей мере одну единицу антагониста c-Met, представляющего собой антитело, и (б) по меньшей мере одну единицу соединения аминогетероарила в стандартной лекарственной форме.
В более конкретном аспекте изобретение относится к способу лечения рака у млекопитающего, который включает введение млекопитающему терапевтически эффективного количества комбинации активных ингредиентов в соответствии с настоящим изобретением, содержащей антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, и соединение аминогетероарила.
Также в более конкретном аспекте изобретение относится к композиции, содержащей антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, и аминогетероарил согласно настоящему изобретению, для лечения рака, предпочтительно у млекопитающего, более предпочтительно у человека. Противораковая терапия включает введение млекопитающему терапевтически эффективного количества композиции по настоящему изобретению. Предпочтительно композиция дополнительно содержит фармацевтически приемлемый носитель и/или эксципиент.
В предпочтительной форме осуществления соединение аминогетероарила способно к ингибированию протеинкиназы c-Met. Более предпочтительны соединения аминогетероарила, обладающие по меньшей мере 25%, предпочтительно 40%, 50%, 60%, 75% и 85% ингибирующей активностью протеинкиназы c-Met, продемонстрированной для соединения аминогетероарила, называемого PF-02341066, в условиях такой же аналитической методики (см. в данной заявке полную структуру этого соединения PF-02341066).
Среди аналитических методик, которые можно использовать для определения уровня активности протеинкиназы c-Met в присутствии соединения аминогетероарила, авторы изобретения могут процитировать методику анализа, называемую "непрерывный сопряженный спектрофотометрический анализ HGFR", описанную на стр.100 в заявке на патент РСТ, опубликованной под номером WO 2006/021884.
Термины "антитело", "антитела" или "иммуноглобулин" используют взаимозаменяемо в самом широком смысле, и они включают моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела или мультиспецифические антитела (например, биспецифические антитела, насколько они проявляют желаемую биологическую активность).
Более конкретно такая молекула представляет собой гликопротеин, содержащий по меньшей мере две тяжелых (Н) цепи и две легких (L) цепи, взаимно соединенных дисульфидными связями. Каждая тяжелая цепь включает вариабельную область (или домен) тяжелой цепи (сокращенную здесь как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи включает три домена, СН1, СН2 и СН3. Каждая легкая цепь включает вариабельную область легкой цепи (сокращенную здесь как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL могут быть дополнительно подразделены на участки гипервариабельности, называемые участками определения комплементарности (CDR), разделенные участками, которые более консервативны, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепи содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (Clq) классической системы комплемента.
Они могут также включать некоторые фрагменты антител, как более подробно описано в данной заявке, которые могут обладать их желаемой связывающей специфичностью и сродством, независимо от источника или типа иммуноглобулина (то есть IgG, IgE, IgM, IgA и т.д.).
Как правило, для получения моноклональных антител или их функциональных фрагментов, в частности, мышиного происхождения, можно ссылаться на методики, которые описаны, в частности, в руководстве "Antibodies" (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp.726, 1988), или на методику получения из гибридом, описанную Kohlerand Milstein (Nature, 256:495-497, 1975).
Под выражением "антагонист" должно подразумеваться соединение, которое способно прямо или косвенно противодействовать, снижать или ингибировать биологическую активность c-Met.
Как правило, "терапевтически эффективное количество" относится к минимальным концентрациям или количествам соединения или соединений, которые эффективны для предупреждения, ослабления, уменьшения или облегчения симптомов заболевания или для продления жизни пациента, подлежащего лечению. Более конкретно, при ссылке на лечение рака, терапевтически эффективное количество относится к такому количеству, которое обладает эффектом (1) уменьшения размера (или предпочтительно устранения) опухоли; (2) ингибирования (то есть замедления до некоторой степени, предпочтительно остановки) метастазов опухоли; (3) ингибирования до некоторой степени (то есть замедления до некоторой степени, предпочтительно остановки) опухолевого роста; и/или (4) ослабления до некоторой степени (или предпочтительно устранения) одного или более чем одного симптома, обусловленного раком.
Более конкретно антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, выбран из группы, состоящей из:
- антитела (образованного из антитела 224G11) или его функционального фрагмента, включающего тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотные последовательности SEQ ID No. 1, 2 и 3; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотные последовательности SEQ ID No. 10, 11 и 12;
- антитела (образованного из антитела 227Н1) или его функционального фрагмента, включающего тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотные последовательности SEQ ID No. 4, 5 и 6; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотные последовательности SEQ ID No. 13, 11 и 14;
- антитела (образованного из антитела 223С4), включающего тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотные последовательности SEQ ID No. 7, 8 и 9; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотные последовательности SEQ ID No. 15, 16 и 17; и
- антитела (образованного из антитела 11Е1), включающего тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотные последовательности SEQ ID No. 47, 48 и 49; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотные последовательности SEQ ID No. 50, 51 и 52.
В более предпочтительной форме осуществления антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, выбран из группы, состоящей из:
- антитела (образованного из антитела 224G11) или его функционального фрагмента, включающего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID No. 18, и легкую цепь, содержащую аминокислотную последовательность SEQ ID No. 21;
- антитела (образованного из антитела 227Н1) или его функционального фрагмента, включающего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID No. 19, и легкую цепь, содержащую аминокислотную последовательность SEQ ID No. 22;
- антитела (образованного из антитела 223С4), тяжелая цепь которого содержит аминокислотную последовательность SEQ ID No. 20, а легкая цепь содержит аминокислотную последовательность SEQ ID No. 23; и
- антитела (образованного из антитела 11Е1), включающего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID No. 53, и легкую цепь, содержащую аминокислотную последовательность SEQ ID No. 54.
В другом конкретном аспекте антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, представляет собой рекомбинантное, химерное или гуманизированное антитело или его фрагмент, образованное из антитела 224G11, 227Н1, 223С4 или 11Е1 (под образованным следует подразумевать антитела или их фрагменты, содержащие по меньшей мере 6 CDR или по меньшей мере легкую и тяжелую цепь, как определено выше, для каждого из этих антител).
Более конкретно в предпочтительной форме осуществления настоящее изобретение относится к способу или композиции в соответствии с изобретением, где антагонист c-Met, представляющий собой антитело, выбран из 224G11, 227Н1, 223С4 и 11Е1.
Все эти моноклональные антитела были секретированы гибридомами, депонированными в CNCM 03/14/2007 под номерами CNCM I-3724 (соответствующим 11Е1), I-3731 (соответствующим 224G11), I-3732 (соответствующим 227Н1) и 07/06/2007 под номером I-3786 (соответствующим 223С4). Эти гибридомы состоят из мышиной гибридомы, являющейся результатом слияния спленоцитов иммунизированной мыши с клеточной линией миеломы (Sp20Ag14).
Под CDR участками или CDR подразумевают указание на гипервариабельные области тяжелых и легких цепей иммуноглобулинов, как определено IMGT.
Уникальная нумерация IMGT определена для сравнения вариабельных доменов независимо от рецептора антигена, типа цепи или вида [Lefranc M.-P., Immunology Today 18, 509 (1997); Lefranc M.-P., The Immunologist, 7, 132-136 (1999); Lefranc, M.-P., Pommie, С., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003)]. В уникальной нумерации IMGT консервативные аминокислоты всегда имеют одно и то же положение, например, цистеин 23 (1st-CYS), триптофан 41 (CONSERVED-TRP), гидрофобная аминокислота 89, цистеин 104 (2nd-CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). Уникальная нумерация IMGT обеспечивает стандартизованное определение границ каркасных областей (FR1-IMGT: положения 1-26, FR2-IMGT: 39-55, FR3-IMGT: 66-104 и FR4-IMGT: 118-128) и участков определения комплементарности: CDR1-IMGT: 27-38, CDR2-IMGT: 56-65 и CDR3-IMGT: 105-117. Поскольку гэпы представляют собой незанятые положения, длины CDR-IMGT (показанные между скобками и разделенные точками, например, [8.8.13]) становятся критической информацией. Уникальную нумерацию IMGT используют в 2D графических представлениях, обозначенных как IMGT Colliers de Perles [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002); Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)], и в 3D структурах в IMGT/3Dstructure-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)].
Существует три CDR тяжелой цепи и 3 CDR легкой цепи. Термин участок CDR или участки CDR используют в данной заявке для указания, в зависимости от ситуации, одного из этих участков или нескольких, или даже всех этих участков в целом, которые содержат большинство аминокислотных остатков, ответственных за связывание за счет сродства антитела с антигеном или с эпитопом, который оно распознает.
В приведенной ниже таблице 1 перегруппированы элементы, касающиеся предпочтительных антител.
В другой предпочтительной форме осуществления способа или композиции согласно изобретению антагонист c-Met, представляющий собой антитело, представляет собой антитело или один из его функциональных фрагментов, образованное от антитела, названного 224G11 (содержащее по меньшей мере 6 CDR SEQ ID No. 1, 2, 3, 10, 11 и 12 или по меньшей мере SEQ ID No. 18 и 21).
Как описано в заявке на патент WO 2006/021884, опубликованной 2 марта 2006 (положения которой включены в данную заявку посредством ссылки), соединения аминогетероарила известны как ингибитор c-Met и присутствующей активности протеинтирозинкиназы.
Как неожиданный результат, автором настоящей заявки впервые представлены результаты, иллюстрирующие релевантный синергизм при комбинировании моноклонального антитела, антагонистического к c-Met, как описано выше, с соединением аминогетероарила, таким как описано в опубликованной заявке на патент WO 2006/021884.
Изобретение относится к способу или композиции для лечения рака у млекопитающего, который включает введение млекопитающему терапевтически эффективного количества комбинации активных ингредиентов, содержащей по меньшей мере один антагонист c-Met, представляющий собой антитело, как описано выше, и соединение аминогетероарила, предпочтительно выбранное из описанных в опубликованной заявке на патент WO 2006/021884.
В качестве предпочтительного примера соединение аминогетероарила композиции по настоящему изобретению представляет собой энантиомерно чистое соединение формулы I
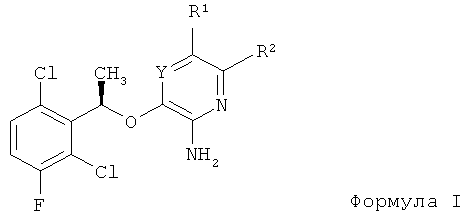
где:
Y представляет собой N или CR12;
R1 выбран из атома водорода, галогена, C6-12 арила, 5-12-членного гетероарила, С3-12 циклоалкила, 3-12-членного гетероалицикла, -O(CR6R7)nR4, -C(O)R4, -C(O)OR4, -CN, -NO2, -S(O)mR4, -SO2NR4R5, -C(O)NR4R5, -NR4C(O)R5, -C(=NR6)NR4R5, C1-8 алкила, С2-8 алкенила и C2-8 алкинила; и каждый атом водорода в R1 необязательно замещен одной или более чем одной группой R3;
R2 представляет собой атом водорода, галоген, C1-12 алкил, C2-12 алкенил, С2-12 алкинил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5 или -C(O)NR4R5, и каждый атом водорода в R2 необязательно замещен R8;
каждый R3 независимо представляет собой галоген, C1-12 алкил,
C2-12 алкенил, C2-12 алкинил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN,-C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nOR4, -(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, NR4C(O)NR5R6, -NR4S(O)PR5 или -C(O)NR4R5, каждый атом водорода в R3 необязательно замещен R8, и группы R3 на соседних атомах могут объединяться с образованием C6-12 арильной, 5-12-членной гетероарильной, C3-12 циклоалкильной или 3-12-членной гетероалициклической группы;
каждый R4, R5, R6 и R7 независимо представляет собой атом водорода, галоген, C1-12 алкил, C2-12 алкенил, C2-12 алкинил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом азота, могут быть объединены вместе с атомом азота, с которым они связаны, с образованием 3-12-членной гетероалициклической или 5-12-членной гетероарильной группы, необязательно содержащей от 1 до 3 дополнительных гетероатомов, выбранных из N, О и S; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом углерода, могут быть объединены с образованием С3-12 циклоалкильной, C6-12 арильной, 3-12-членной гетероалициклической или 5-12-членной гетероарильной группы; и каждый атом водорода в R4, R5, R6 и R7 необязательно замещен R8;
каждый R8 независимо представляет собой галоген, C1-12 алкил, C2-12 алкенил, C2-12 алкинил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -NH2, -CN, -ОН, -O-C1-12 алкил, -O-(СН2)nC3-12 циклоалкил, -O-(СН2)nC6-12 арил, -O-(СН2)n(3-12-членный гетероалицикл) или -O-(СН2)n(5-12-членный гетероарил); и каждый атом водорода в R8 необязательно замещен R11;
каждый R9 и R10 независимо представляет собой атом водорода, галоген, C1-12 алкил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nNCR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5 или -C(O)NR4R5; R9 или R10 могут объединяться с кольцевым атомом А или с заместителем А с образованием C3-12 циклоалкильного, 3-12-членного гетероалициклического, C6-12 арильного или 5-12-членного гетероарильного кольца, конденсированного с А; и каждый атом водорода в R9 и R10 необязательно замещен R3;
каждый R11 независимо представляет собой галоген, C1-12 алкил,
C1-12 алкокси, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -O-C1-12 алкил, -O-(СН2)nC3-12 циклоалкил, -O-(СН2)nC6-12 арил, -O-(СН2)n(3-12-членный гетероалицикл), -O-(СН2)n(5-12-членный гетероарил) или -CN, и каждый атом водорода в R11 необязательно замещен галогеном, -ОН, -CN, -C1-12 алкилом, который может быть частично или полностью галогенированным, -O-C1-12 алкилом, который может быть частично или полностью галогенированным, -СО, -SO или -SO2;
R12 представляет собой атом водорода, галоген, C1-12 алкил, C2-12 алкенил, С2-12 алкинил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5 или -C(O)NR4R5, и каждый атом водорода в R12 необязательно замещен R3;
каждый R13 независимо представляет собой галоген, C1-12 алкил,
C2-12 алкенил, C2-12 алкинил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nOR4, -(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, NR4C(O)NR5R6, -NR4S(O)PR5, -C(O)NR4R5, -(CR6R7)n(3-12-членный гетероалицикл), -(CR6R7)n(C3-12 циклоалкил), -(CR6R7)n(С6-12 арил), -(CR6R7)n(5-12-членный гетероарил), -(CR6R7)nC(O)NR4R5 или -(CR6R7)nC(O)R4, группы R13 на соседних атомах могут объединяться с образованием С6-12 арильной, 5-12-членной гетероарильной, С3-12 циклоалкильной или 3-12-членной гетероалициклической группы, и каждый атом водорода в R13 необязательно замещен R3;
каждое m независимо равно 0, 1 или 2;
каждое n независимо равно 0, 1, 2, 3 или 4;
каждое p независимо равно 1 или 2;
или его фармацевтически приемлемую соль, гидрат или сольват.
В другом предпочтительном примере соединение аминогетероарила представляет собой энантиомерно чистое соединение формулы Ia:
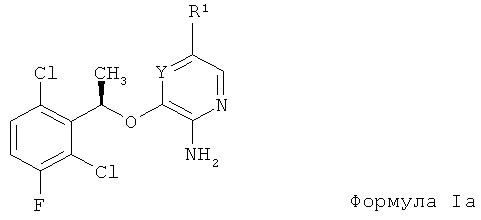
где:
Y представляет собой N или СН;
R1 представляет собой группу фуран, тиофен, пиррол, пирролин, пирролидин, диоксолан, оксазол, тиазол, имидазол, имидазолин, имидазолидин, пиразол, пиразолин, пиразолидин, изоксазол, изотиазол, оксадиазол, триазол, тиадиазол, пиран, пиридин, пиперидин, диоксан, морфолин, дитиан, тиоморфолин, пиридазин, пиримидин, пиразин, пиперазин, триазин, тритиан, азитидин или фенил; и каждый атом водорода в R1 необязательно замещен R3;
каждый R3 независимо представляет собой галоген, C1-12 алкил,
C2-12 алкенил, C2-12 алкинил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nOR4, -(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6, -NR4S(O)pR5 или -C(O)NR4R5, каждый атом водорода в R3 необязательно замещен R8, и группы R3 на соседних атомах могут объединяться с образованием C6-12 арильной, 5-12-членной гетероарильной, С3-12 циклоалкильной или 3-12-членной гетероалициклической группы;
каждый R4, R5, R6 и R7 независимо представляет собой атом водорода, галоген, C1-12 алкил, C2-12 алкенил, C2-12 алкинил, С3-12 циклоалкил, С6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом азота, могут быть объединены вместе с атомом азота, с которым они связаны, с образованием 3-12-членной гетероалициклической или 5-12-членной гетероарильной группы, необязательно содержащей от 1 до 3 дополнительных гетероатомов, выбранных из N, О и S; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом углерода, могут быть объединены с образованием С3-12 циклоалкильной, C6-12 арильной, 3-12-членной гетероалициклической или 5-12-членной гетероарильной группы; и каждый атом водорода в R4, R5, R6 и R7 необязательно замещен R8;
каждый R8 независимо представляет собой галоген, C1-12 алкил, С2-12 алкенил, C2-12 алкинил, C3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -NH2, -CN, -ОН, -O-C1-12 алкил, -O-(СН2)nC3-12 циклоалкил, -O-(СН2)nC6-12 арил, -O-(СН2)n(3-12-членный гетероалицикл) или -O-(СН2)n(5-12-членный гетероарил); и каждый атом водорода в R8 необязательно замещен R11;
каждый R9 и R10 независимо представляет собой атом водорода, галоген, C1-12 алкил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nNCR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5 или -C(O)NR4R5; R9 или R10 могут объединяться с кольцевым атомом А или с заместителем А с образованием С3-12 циклоалкильного, 3-12-членного гетероалициклического, C6-12 арильного или 5-12-членного гетероарильного кольца, конденсированного с А; и каждый атом водорода в R9 и R10 необязательно замещен R3;
каждый R11 независимо представляет собой галоген, C1-12 алкил,
C1-12 алкокси, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -O-C1-12 алкил, -O-(СН2)nC3-12 циклоалкил, -O-(CH2)nC6-12 арил, -O-(СН2)n(3-12-членный гетероалицикл), -O-(СН2)n(5-12-членный гетероарил) или -CN, и каждый атом водорода в R11 необязательно замещен галогеном, -ОН, -CN, -C1-12 алкилом, который может быть частично или полностью галогенированным, -O-C1-12 алкилом, который может быть частично или полностью галогенированным, -СО, -SO или -SO2;
каждый R13 независимо представляет собой галоген, C1-12 алкил,
C2-12 алкенил, C2-12 алкинил, С3-12 циклоалкил, C6-12 арил, 3-12-членный гетероалицикл, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nOR4, -(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5, -C(O)NR4R5, -(CR6R7)n(3-12-членный гетероалицикл), -(CR6R7)n(C3-12 циклоалкил), -(CR6R7)n(С6-12 арил), -(CR6R7)n(5-12-членный гетероарил), -(CR6R7)nC(O)NR4R5 или -(CR6R7)nC(O)R4, группы R13 на соседних атомах могут объединяться с образованием C6-12 арильной, 5-12-членной гетероарильной, C3-12 циклоалкильной или 3-12-членной гетероалициклической группы, и каждый атом водорода в R13 необязательно замещен R3;
каждое m независимо равно 0, 1 или 2;
каждое n независимо равно 0, 1, 2, 3 или 4;
каждое p независимо равно 1 или 2;
или его фармацевтически приемлемую соль, гидрат или сольват.
Более конкретно предпочтительные соединения аминогетероарила по изобретению выбраны из соединений аминопиридина или аминопиразина.
Соединение аминогетероарила предпочтительно в соответствии с формой осуществления изобретения выбрано из группы, состоящей из 5-бром-3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-иламина; 5-йод-3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-2-иламина; 5-бром-3-[1(R)-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-2-иламина; 4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-бензойной кислоты; (4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-фенил)-пиперазин-1-илметанона; 4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-бензоил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира; 3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-[4-(пиперазин-1-илкарбонил)фенил]пиридин-2-амина; 4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}-N-[2-(диметиламино)этил]-N-метилбензамида; (4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}фенил)метанол; 4-{6-амино-5-[(1Р)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}-N-[3-(диметиламино)пропил]-N-метилбензамид; трет-бутил-4-(4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}бензоил)пиперазин-1-карбоксилата; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-[1-(1-метилпиперидин-4-ил)-1Н-пиразол-4-ил]-пиридин-2-иламина; 1-[4-(4-{6-амино-5-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-3-ил}-пиразол-1-ил)-пиперидин-1-ил]-2-гидроксиэтанона; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиразин-2-иламина; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1Н-пиразол-4-ил)-пиразин-2-иламина; 1-[4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-пиразол-1-ил)-пиперидин-1-ил]-2-гидроксиэтанона; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-[1-(1-метилпиперидин-4-ил)-1Н-пиразол-4-ил]-пиразин-2-иламина; 1-[4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-пиразол-1-ил)-пиперидин-1-ил]-2-диметиламиноэтанона; 3-[(R)-1-(2-хлор-3,6-дифторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина; или их фармацевтически приемлемой соли, сольвата или гидрата.
В другой предпочтительной форме осуществления изобретения соединение аминогетероарила представляет собой 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина. Другим названием, данным этому химическому соединению, является PF-02341066 (также пишут PF-2341066).
Данное конкретное соединение подробно описано в Примере 13 опубликованной заявки на патент WO 2006/021884, и способ его получения описан в методике 62, которая цитируется ниже.
Общая методика 62:
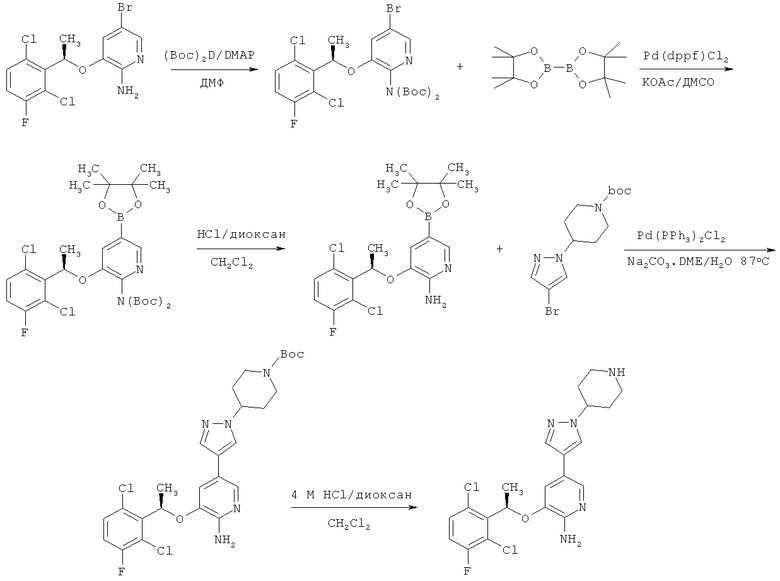
К раствору 5-бром-3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-2-иламина (12,83 г, 33,76 ммоль) в безводном ДМФ (100 мл) добавляли ди-трет-бутилдикарбонат (21,25 г, 97,35 ммоль) и 4-диметиламинопиридин (0,793 г, 6,49 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 часов в атмосфере азота. К смеси добавляли насыщенный раствор NaHCO3 (300 мл) и экстрагировали EtOAc (3×250 мл). Объединенные экстракты промывали водой (5×100 мл), насыщенным NaHCO3 и рассолом, затем высушивали над Na2SO4. После фильтрования, выпаривания и высушивания в высоком вакууме ди-Вос-защищенный 5-бром-3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-2-иламин получили в виде беловатого пенистого твердого вещества (19,59 г, выход 100%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 8.18 (d, 1H), 7.83 (d, 1H), 7.59 (dd, 1H), 7.48 (t, 1H), 6.25 (q, 1H), 1.75 (d, 3H), 1.39 (s, 9H), 1.19 (s, 9H).
К раствору ди-Вос-защищенного 5-бром-3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-2-иламина (19,58 г, 33,76 ммоль) в ДМСО (68 мл) добавляли ацетат калия (11,26 г, 114,78 ммоль) и бис(пинаколато)дибор (10,29 г, 40,51 ммоль). Смесь дегазировали и загружали азотом три раза, затем добавляли Pd(dppf)Cl2·CH2Cl2 (1,38 г, 1,69 ммоль). Реакционную смесь дегазировали и загружали азотом три раза, а затем перемешивали в 80°С масляной бане в атмосфере азота в течение 12 часов. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли этилацетатом (100 мл) и фильтровали через слой целлита, который промывали этилацетатом. Объединенный этилацетатный раствор (700 мл) промывали водой (5×100 мл), рассолом (100 мл) и высушивали над Na2SO4. После фильтрования и концентрирования остаток очищали на колонке силикагеля, элюируя EtOAc/гексаном (0%-50%), с получением ди-Вос-защищенного 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-2-иламина в виде пенистого твердого вещества (20,59 г, выход 97%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 8.20 (d, 1H), 7.70 (d, 1H), 7.63 (dd, 1H), 7.47 (t, 1H), 6.20 (q, 1H), 1.73 (d, 3H), 1.50-1.13 (m, 30Н).
К раствору ди-Вос-защищенного 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-2-иламина (20,34 г, 32,42 ммоль) в CH2Cl2 (80 мл) добавляли раствор сухой HCl в диоксане (4 н., 40,5 мл, 162 ммоль). Реакционный раствор перемешивали в 40°С масляной бане в атмосфере азота в течение 12 часов. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли EtOAc (400 мл), затем осторожно, но быстро промывали насыщенным NaHCO3 до тех пор, пока водный слой не стал основным (рН>8). Органический слой промывали рассолом и высушивали над Na2SO4. После фильтрования, выпаривания и высушивания в высоком вакууме 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-2-иламин получили в виде беловатого пенистого твердого вещества (13,48 г, выход 97%). 1Н ЯМР (ДМСО-d6, 400 МГц) δ 8.01 (d, 1H), 7.27 (dd, 1H), 7.17 (d, 1H), 7.03 (t, 1H), 6.12 (q, 1H), 5.08 (bs, 2H), 1.81 (d, 3Н), 1.30 (s, 6H), 1.28 (s, 6H).
К перемешанному раствору 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-2-иламина (4,2711 г, 10,0 ммоль) и 4-(4-бромпиразол-1-ил)-пиперидин-1-карбоновой кислоты трет-бутилового эфира (3,9628 г, 12,0 ммоль) в DME (40 мл) добавляли раствор Na2CO3 (3,1787 г, 30,0 ммоль) в воде (10 мл). Раствор дегазировали и загружали азотом три раза. К раствору добавляли Pd(PPh3J2Cl2 (351 мг, 0,50 ммоль). Реакционный раствор снова дегазировали и загружали азотом три раза. Реакционный раствор перемешивали в 87°С масляной бане в течение примерно 16 часов (или до расходования пинаколового эфира борана), охлаждали до температуры окружающей среды и разбавляли EtOAc (200 мл). Реакционную смесь фильтровали через слой целлита и промывали EtOAc. Раствор EtOAc промывали рассолом, высушивали над Na2SO4 и концентрировали. Сырой продукт очищали на колонке силикагеля, элюируя системой EtOAc/гексан (от 0% EtOAc до 100% EtOAc), с получением 4-(4-{6-амино-5-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-3-ил}-пиразол-1-ил)-пиперидин-1-карбоновой кислоты трет-бутилового эфира (3,4167 г, выход 65%, чистота ~95%) при Rf 0,15 (50% EtOAc/гексаны). МС m/е 550 (М+1)+.
К раствору 4-(4-{6-амино-5-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-3-ил}-пиразол-1-ил)-пиперидин-1 -карбоновой кислоты трет-бутилового эфира (566,7 мг, 1,03 ммоль) в метаноле (5 мл) или дихлорметане (30 мл) добавляли 4 н. HCl/диоксан (15 мл). Раствор перемешивали в течение примерно 1 часа или до полного удаления защиты. Растворители выпаривали, и остаток растворяли в метаноле и очищали на препаративной ВЭЖХ С-18 с обращенной фазой, элюируя смесью ацетонитрил/вода с 0,1% уксусной кислоты от 5% до 30% с линейным градиентом. После лиофилизации 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина ацетат получили в виде белого твердого вещества (410 мг, выход 78%, 100% чистота по ВЭЖХ, 96,4% эй). 1H ЯМР (ДМСО-d6, 400 МГц) δ 7.84 (s, 1H), 7.68 (d, 1H), 7.50 (dd, 1H), 7.46 (s, 1H), 7.37 (t, 1H), 6.83 (d, 1H), 6.02 (q, 1H), 5.57 (bs, 2H), 4.09 (m, 1H), 2.98 (m, 2H), 2.53 (m, 2H), 1.88 (m, 2H), 1.82 (s, 3Н), 1.73 (d, 3Н), 1.70 (m, 2H). МС m/е 450 (М+1)+.
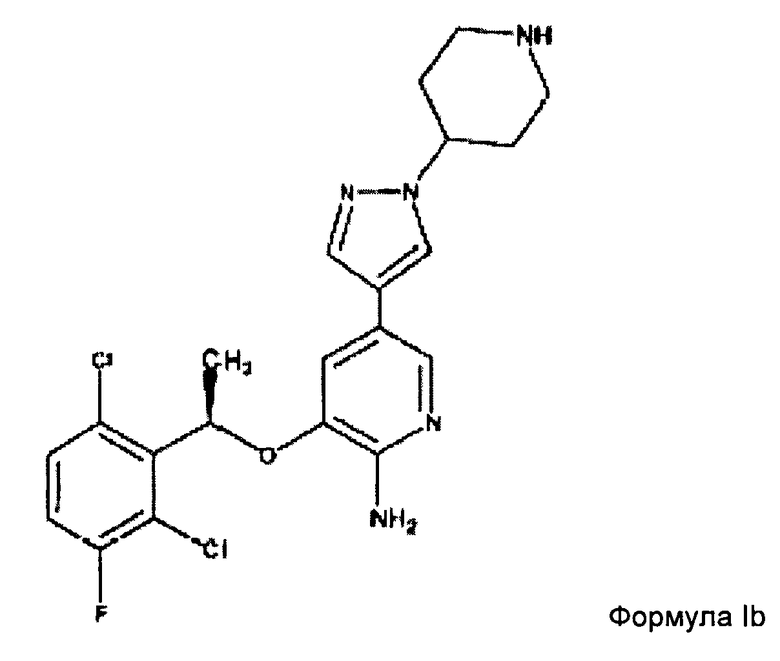
В конкретном аспекте изобретения рассмотрена композиция по настоящему изобретению, где соединение аминогетероарила представляет собой соединение формулы Ib:

В другом аспекте изобретение относится к способу, где рак выбран из раков с гиперэкспрессией c-Met и/или проявляющих аутофосфорилированный c-Met.
Более конкретно рак выбран из рака простаты, остеосарком, рака легкого, рака молочной железы, рака эндометрия, глиобластомы или рака ободочной кишки.
В предпочтительной форме осуществления изобретение относится к композиции, как упомянуто выше, где антагонист c-Met, представляющий собой антитело, выбран из антител, образованных из 224G11, 227Н1, 223С4 и 11Е1 или из их функциональных фрагментов.
Более конкретно антагонист c-Met, представляющий собой антитело, образован из антитела 224G11.
Еще в одной другой форме осуществления изобретения в данной заявке описана композиция, где соединение аминогетероарила выбрано из соединений аминопиридина или аминопиразина.
Более конкретно соединение аминогетероарила представляет собой соединение формулы Ib:

Изобретение также относится к применению композиции, как определено в настоящей заявке, для лечения рака у млекопитающего.
В конкретной предпочтительной форме осуществления рак выбран из раков с гиперэкспрессией c-Met и/или проявляющих аутофосфорилированный c-Met. Более конкретно рак выбран из рака простаты, остеосарком, рака легкого, рака молочной железы, рака эндометрия, глиобластомы или рака ободочной кишки.
Изобретение будет понято лучше по прочтении приведенных ниже примеров, где:
Фиг.1 иллюстрирует активность in vivo 224G11 и активность in vivo PF-2341066 на NCI-H441 NSCLC, и
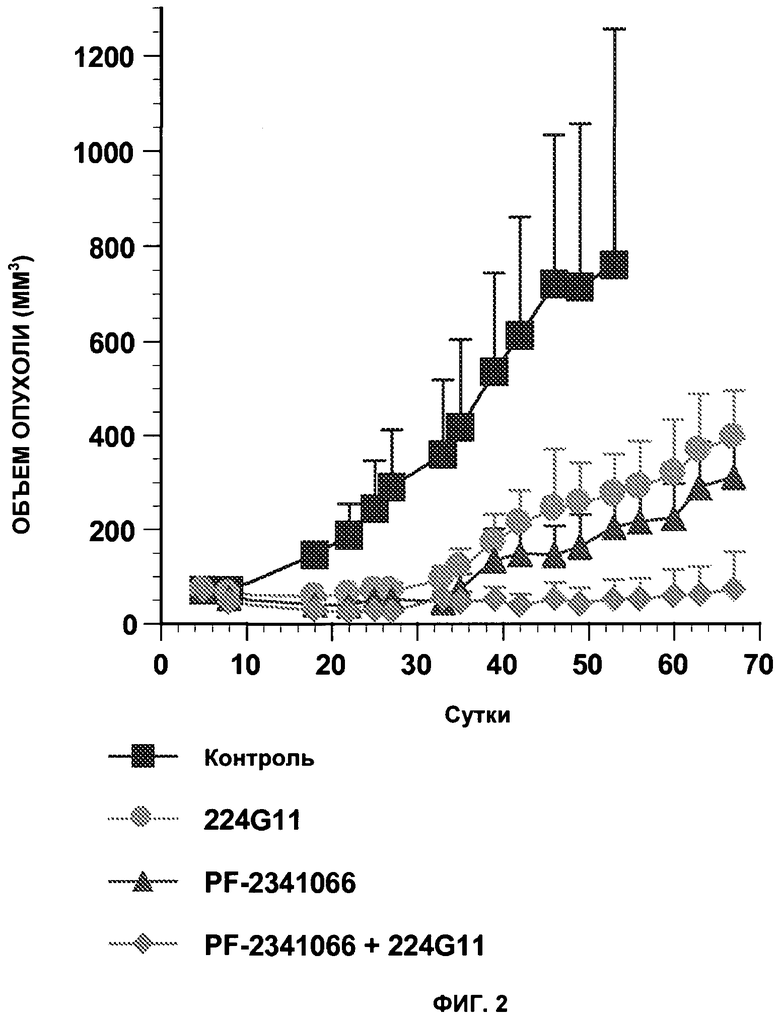
Фиг.2 иллюстрирует синергическую активность in vivo комбинации 224G11 и PF-2341066 на NCI-H441 NSCLC.
Пример 1: Активность in vivo 224G11 и PF-02341066 в виде отдельных терапий
Чтобы проверить, что модель NCI-H441 in vivo, доступная в лаборатории, чувствительна как к антителу 224G11, так и к соединению PF-2341066, использовали мышей с иммунной недостаточностью, трансплантированных подкожно NCI-H441. Кратко, клетки NCI-H441 NSCLC из АТСС культивировали в среде RPMI 1640, 10% ФСТ, 1% L-глутамин. Клетки делили за двое суток до трансплантации, чтобы они находились в экспоненциальной фазе роста. Десять миллионов клеток NCI-H441 инъецировали s.c. бестимусным мышам. Через пять суток после имплантации опухоли были измеримыми, и животных делили на группы по 6 мышей со сравнимым размером опухоли. Для обработки антителом мышей обрабатывали i.p. насыщающей дозой 2 мг 224G11 Mab/мышь, а затем дважды в неделю 1 мг антитела/мышь. 50 мг/кг PF-02341066 вводили р.о. (пероральный зонд), ежесуточно в течение недели, а затем 5 суток в неделю при двойной дозе на пятые сутки. Обработку продолжали в течение всего эксперимента. Объем опухоли измеряли дважды в неделю и вычисляли по формуле: π/6 Х длина Х ширина Х высота.
Результаты, описанные на фиг.1, показали значимое отличие в опухолевом росте мышей, обработанных как 224G11, так и PF-02341066. В данном эксперименте 224G11 и PF2341066 показали сравнимые противоопухолевые активности.
Пример 2: Активность in vivo комбинации 224G11 и PF-02341066
Клетки NCI-H441 из АТСС рутинно культивировали в среде RPMI 1640, 10% ФСТ, 1% L-глутамин. Клетки делили за двое суток до трансплантации, чтобы они находились в экспоненциальной фазе роста. Десять миллионов клеток NCI-H441 инъецировали s.c. бестимусным мышам. Через пять суток после имплантации опухоли были измеримыми, и животных делили на группы по 6 мышей со сравнимым размером опухоли. Для обработки антителом мышей обрабатывали i.p. насыщающей дозой 2 мг 224G11 Mab/мышь, а затем дважды в неделю 1 мг антитела/мышь. 50 мг/кг PF-02341066 вводили р.о. (пероральный зонд), ежесуточно в течение недели, а затем 5 суток в неделю при двойной дозе на пятые сутки. Группу мышей, получающих и 224G11, и PF-2341066, обрабатывали, следуя таким же способам обработки, как описано выше для каждого соединения. Объем опухоли измеряли дважды в неделю и вычисляли по формуле: π/6 Х длина Х ширина Х высота, и мониторинг массы тела животных проводили ежесуточно в течение всего периода обработки.
Статистический анализ проводили на каждое измерение, используя критерий Манна-Уитни. В данном эксперименте мышей контрольной группы умерщвляли на сутки 53 по этическим причинам. На сутки 53 после первой инъекции средний размер опухоли групп, обработанных одним способом, уменьшился на 64%, 73% и 93% для 224G11, PF-2341066 и 224G11+PF-2341066 соответственно. На сутки 53 комбинированная терапия значимо улучшала опухолевый рост по сравнению с обработками одной терапией (p≤0,002 по сравнению с одним PF-2341066 и p≤0,002 по сравнению с одним 224G11), причем у одной из 6 мышей в группе комбинированной терапии не было опухоли. Значимых различий не наблюдали между 2 обработками одной терапией.
Эти результаты, представленные на фиг.2, были подтверждены через 14 суток после окончания обработок (D67), где объем опухоли группы, получающей комбинированную терапию, остался значимо более низким, чем у тех, которых инъецировали способом одной терапии, и где 16% мышей, получающих комбинированную терапию, было все еще свободно от опухоли.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ c-Met | 2009 |
|
RU2560257C2 |
| НОВОЕ АНТИТЕЛО ПРОТИВ с-МЕТ | 2011 |
|
RU2607377C2 |
| НОВЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ ДИМЕРИЗАЦИЮ С-МЕТ, И ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2552161C2 |
| ЗАМЕЩЕННЫЙ 2-АМИНОПИРИДИН В КАЧЕСТВЕ ИНГИБИТОРА ПРОТЕИНКИНАЗЫ | 2014 |
|
RU2671212C2 |
| АНТИТЕЛА К В7-Н3 И КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА | 2017 |
|
RU2764651C2 |
| ПОЛИМОРФЫ С-MET/HGFR ИНГИБИТОРА | 2006 |
|
RU2387650C2 |
| ПРОИЗВОДНЫЕ 3-(5-АМИНО-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С БЕЛКОМ С "ЦИНКОВЫМИ ПАЛЬЦАМИ" 2 СЕМЕЙСТВА IKAROS (IKZF2) | 2019 |
|
RU2815714C2 |
| СПОСОБ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК | 2006 |
|
RU2384331C2 |
| СОДЕРЖАЩИЕ ФОСФОР СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНА3 | 2012 |
|
RU2598849C2 |
| ПРОИЗВОДНЫЕ 3-(5-ГИДРОКСИ-1-ОКСОИЗОИНДОЛИН-2-ИЛ) ПИПЕРИДИН-2,6-ДИОНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С БЕЛКОМ С "ЦИНКОВЫМИ ПАЛЬЦАМИ" 2 (IKZF2) СЕМЕЙСТВА IKAROS | 2019 |
|
RU2797559C2 |














Группа изобретений относится к композиции, содержащей антагонист c-Met, представляющий собой антитело, и соединение аминогетероарила, и предназначена для лечения рака. Также группа изобретений пердставляет фармацевтическую композицию, содержащую антитело анти-c-Met и соединение аминогетероарила в виде комбинированных препаратов. Использование группы изобретений обеспечивает более эффективное ингибирование роста опухоли и более длительный период отсутствия опухоли. 3 н. и 12 з.п. ф-лы, 2 ил., 1 табл., 2 пр.
1. Композиция для лечения рака, содержащая антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, и соединение аминогетероарила, где указанное соединение аминогетероарила выбрано из группы, состоящей из:
5-бром-3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-иламина; 5-йод-3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-2-иламина; 5-бром-3-[1(R)-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-2-иламина; 4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-бензойной кислоты; (4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-фенил)-пиперазин-1-илметанона; 4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-бензоил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира; 3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-[4-(пиперазин-1-илкарбонил)фенил]пиридин-2-амина; 4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}-N-[2-(диметиламино)этил]-N-метилбензамида; (4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}фенил)метанол; 4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}-N-[3-(диметиламино)пропил]-N-метилбензамид; трет-бутил-4-(4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}бензоил)пиперазин-1-карбоксилата; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-[1-(1 -метилпиперидин-4-ил)-1Н-пиразол-4-ил]-пиридин-2-иламина; 1-[4-(4-{6-амино-5-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-3-ил}-пиразол-1-ил)-пиперидин-1-ил]-2-гидроксиэтанона; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиразин-2-иламина; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1Н-пиразол-4-ил)-пиразин-2-иламина; 1-[4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-пиразол-1-ил)-пиперидин-1-ил]-2-гидроксиэтанона; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-[1-(1-метилпиперидин-4-ил)-1Н-пиразол-4-ил]-пиразин-2-иламина; 1-[4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-пиразол-1-ил)-пиперидин-1-ил]-2-диметиламиноэтанона; 3-[(R)-1-(2-хлор-3,6-дифторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина; или их фармацевтически приемлемой соли, сольвата или гидрата.
2. Композиция по п.1 в качестве лекарства.
3. Фармацевтическая композиция для лечения рака, содержащая по меньшей мере:
i) один антагонист с-Met, представляющий собой антитело или его функциональный фрагмент; и
ii) соединение аминогетероарила,
в виде комбинированных препаратов, где указанное соединение аминогетероарила выбрано из группы, состоящей из:
5-бром-3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-иламина; 5-йод-3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-2-иламина; 5-бром-3-[1(R)-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-2-иламина; 4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-бензойной кислоты; (4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-фенил)-пиперазин-1-илметанона; 4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-бензоил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира; 3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-[4-(пиперазин-1-илкарбонил)фенил]пиридин-2-амина; 4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}-N-[2-(диметиламино)этил]-N-метилбензамида; (4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}фенил)метанол; 4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}-N-[3-(диметиламино)пропил]-N-метилбензамид; трет-бутил-4-(4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}бензоил)пиперазин-1-карбоксилата; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-[1-(1-метилпиперидин-4-ил)-1Н-пиразол-4-ил]-пиридин-2-иламина; 1-[4-(4-{6-амино-5-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиридин-3-ил}-пиразол-1-ил)-пиперидин-1-ил]-2-гидроксиэтанона; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиразин-2-иламина; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-(1Н-пиразол-4-ил)-пиразин-2-иламина; 1-[4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-пиразол-1-ил)-пиперидин-1-ил]-2-гидроксиэтанона; 3-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-5-[1-(1-метилпиперидин-4-ил)-1Н-пиразол-4-ил]-пиразин-2-иламина; 1-[4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)-этокси]-пиразин-2-ил}-пиразол-1-ил)-пиперидин-1-ил]-2-диметиламиноэтанона; 3-[(R)-1-(2-хлор-3,6-дифторфенил)-этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)-пиридин-2-иламина; или их фармацевтически приемлемой соли, сольвата или гидрата.
4. Композиция по любому из пп.1-3, где антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, выбран из группы, состоящей из:
- антитела или его функционального фрагмента, включающего тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотные последовательности SEQ ID No. 1, 2 и 3; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотные последовательности SEQ ID No. 10, 11 и 12;
- антитела или его функционального фрагмента, включающего тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотные последовательности SEQ ID No. 4, 5 и 6; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотные последовательности SEQ ID No. 13, 11 и 14;
- антитела или его функционального фрагмента, включающего тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотные последовательности SEQ ID No. 7, 8 и 9; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотные последовательности SEQ ID No. 15, 16 и 17; и
- антитела или его функционального фрагмента, включающего тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотные последовательности SEQ ID No. 47, 48 и 49; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотные последовательности SEQ ID No. 50, 51 и 52.
5. Композиция по любому из пп.1-3, где антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, выбран из группы, состоящей из:
- антитела или его функционального фрагмента, включающего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID No. 18, и легкую цепь, содержащую аминокислотную последовательность SEQ ID No. 21;
- антитела или его функционального фрагмента, включающего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID No. 19, и легкую цепь, содержащую аминокислотную последовательность SEQ ID No. 22;
- антитела или его функционального фрагмента, тяжелая цепь которого содержит аминокислотную последовательность SEQ ID No. 20, а легкая цепь содержит аминокислотную последовательность SEQ ID No. 23; и
- антитела или его функционального фрагмента, включающего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID No. 53, и легкую цепь, содержащую аминокислотную последовательность SEQ ID No. 54.
6. Композиция по любому из пп.1-3, где антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, выбран из группы, состоящей из моноклональных антител, секретируемых гибридомами, депонированными в Collection Nationale de Cultures de Microorganismes (CNCM, Institut Pasteur, Rue du Docteur Roux, Paris, France) 14 марта 2007 под номерами I-3724, I-3731, I-3732 и 6 июля 2007 под номером I-3786.
7. Композиция по п.6, где антагонист c-Met, представляющий собой антитело, представляет собой моноклональное антитело, названное 224G11, секретируемое гибридомой, депонированной в CNCM 14 марта 2007 под номером I-3731, или антитело или его функциональный фрагмент, образованное из данного антитела 224G11, включающее:
- по меньшей мере 6 CDR, имеющих последовательности SEQ ID No. 1, 2, 3, 10, 11 и 12; или
- по меньшей мере тяжелую цепь, содержащую аминокислотную последовательность SEQ ID No. 18, и легкую цепь, содержащую аминокислотную последовательность SEQ ID No. 21.
8. Композиция по любому из пп.1-3, где соединение аминогетероарила представляет собой соединение формулы Ib:
9. Композиция по любому из пп.1-3, где рак выбран из раков с гиперэкспрессией c-Met и/или проявляющих аутофосфорилированный c-Met.
10. Композиция по любому из пп.1-3, где рак выбран из рака простаты, остеосарком, рака легкого, рака молочной железы, рака эндометрия, глиобластомы или рака ободочной кишки.
11. Композиция по любому из пп.1-3 для лечения рака у млекопитающего, предпочтительно человека.
12. Применение фармацевтической композиции по п.3, содержащей в виде комбинированных препаратов по меньшей мере антагонист c-Met, представляющий собой антитело или его функциональный фрагмент, и соединение аминогетероарила, как определено в любом из пп.4-9, для получения лекарства для лечения рака.
13. Применение по п.12, где рак выбран из раков с гиперэкспрессией c-Met и/или проявляющих аутофосфорилированный c-Met.
14. Применение по п.12, где рак выбран из рака простаты, остеосарком, рака легкого, рака молочной железы, рака эндометрия, глиобластомы или рака ободочной кишки.
15. Применение по любому из пп.12-14 для лечения рака у млекопитающего, предпочтительно человека.
| WO 2006015371 A2, 09.02.2006 | |||
| WO 2005016382 A1, 24.02.2005 | |||
| WO 2008053157 A1, 08.05.2008 | |||
| WO 2007066187 A2, 14.06.2007 | |||
| ZOU HY et al | |||
| An orally available small-molecule inhibitor of c-Met, PF-2341066, exhibits cytoreductive antitumor efficacy through antiproliferative and antiangiogenic mechanisms | |||
| Cancer Res., 2007, 67(9), p.4408-17, PMID: |
Авторы
Даты
2014-08-20—Публикация
2009-07-08—Подача