Настоящее изобретение относится к замещенные циклогексилдиаминам, которые обладают сродством к µ-опиоидному рецептору и ORL1-рецептору, к способу их получения, к лекарственным средствам, содержащим эти соединения и к применению этих соединений для получения лекарственных средств.
Производные циклогексана, которые обладают сродством к µ-опиоидному рецептору и ORL1-рецептору, известны из уровня техники. В связи с этим в полном объеме может быть сделана ссылка, например, на WO 2002/090317, WO 2002/90330, WO 2003/008370, WO 2003/008731, WO 2003/080557, WO 2004/043899, WO 2004/043900, WO 2004/043902, WO 2004/043909, WO 2004/043949, WO 2004/043967, WO 2005/063769, WO 2005/066183, WO 2005/110970, WO 2005/110971, WO 2005/110973, WO 2005/110974, WO 2005/110975, WO 2005/110976, WO 2005/110977, WO 2006/018184, WO 2006/108565, WO 2007/079927, WO 2007/079928, WO 2007/079930, WO 2007/079931, WO 2007/124903, WO 2008/009415 и WO 2008/009416.
Тем не менее, известные соединения в некотором отношении не являются удовлетворительными, и существует потребность в других соединениях с сопоставимыми или лучшими свойствами
Таким образом, известные соединения в пригодных анализах связывания иногда демонстрируют некоторое сродство к hERG-ионному каналу, к кальциевому ионному каналу L-типа (участки связывания фенилалкиламина, бензотиазепина, дигидропиридина) соответственно к натриевому каналу в ВТХ-анализе (батрахотоксин), что в каждом случае может толковаться как симптомы сердечно-сосудистых побочных действий. Далее многие их известных соединений обладают весьма незначительной растворимостью в водных средах, что, в частности, может оказывать негативное влияние на биодоступность. Кроме того, химическая стабильность известных соединений часто является недостаточной. Таким образом, иногда соединения не проявляют достаточной рН стабильности, устойчивости к УФ, соответственно, устойчивости к окислению, что, в частности, может отрицательно сказываться на стабильности при хранении, а также на оральной биодоступности. Кроме того, известные соединения частично обладают неблагоприятным PK/PD (фармакокинетика/фармакодинамика) профилем, что может проявляться, например, в длительности времени действия.
Также требует улучшений метаболическая стабильность известных соединений. Улучшенная метаболическая стабильность может указывать на повышенную биодоступность. Также слабое или отсутствующее взаимодействие с молекулами-переносчиками, которые участвуют в поступлении и выделении лекарственных веществ, следует расценивать как указание на улучшенную биодоступность и, во всяком случае, на незначительные взаимодействия лекарственных средств. Еще также как можно более незначительными должны быть взаимодействия с ферментами, участвующими в расщеплении и выведении лекарственных веществ, так как такие результаты тестов равным образом указывают на то, что, во всяком случае, следует ожидать незначительные или вообще отсутствующие взаимодействия лекарственных средств.
В основе изобретения лежит задача предоставить в распоряжение соединения, которые пригодны для фармацевтических целей и обладают преимуществами по сравнению с соединениями уровня техники.
Эта задача решается благодаря объекту формулы изобретения.
Неожиданно было обнаружено, что могут быть получены замещенные циклогексилдиамины, которые обладают сродством к р-опиоидному рецептору и ORL1-рецептору.
Изобретение относится к соединениям общей формулы (1),
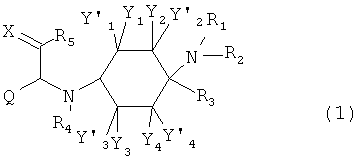
в которой
Y1, Y1', Y2, Y2', Y3, Y3', Y4 и Y4' каждый раз независимо друг от друга выбраны из группы, состоящей из -Н, -F, -Cl, -Br, -I, -CN, -NO2, -СНО, -R0, -C(=O)R0, -C(=O)H, -C(=O)-OH, -C(=O)OR0, -C(=O)NH2, -C(=O)NHR0, -C(=O)N(R0)2, -OH, -OR0, -OC(=O)H, -OC(=O)R0, -OC(=O)OR0, -OC(=O)NHR0, -OC(=O)N(R0)2, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NHC(=O)R0, -NHC(=O)OR0, -NHC(=O)NH2, -NHC(=O)NHR0 и -NHC(=O)N(R0)2; или Y1 и Y1', или Y2 и Y2', или Y3 и Y3', или Y4 и Y4' совместно означают =O;
преимущественно каждый раз независимо друг от друга выбраны из группы, состоящей из -Н, -F, -Cl, -CN и -C1-8-алифат; или Y1 и Y1', или Y2 и Y2', или Y3 и Y3', или Y4 и Y4' совместно означают =O;
Q означает -R0; предпочтительно означает -C1-8-алифат-арил или -C1-8-алифат-гетероарил; особенно предпочтительно означает -СН2-индолил;
X означает =O, =CR6R7 или =N-R6;
R0 каждый раз независимо означает -C1-8-алифат, -С3-12-циклоалифат, -арил, -гетероарил, -С1-8-алифат-С3-12-циклоалифат, -C1-8-алифат-арил, -C1-8-алифат-гетероарил, -С3-8-циклоалифат-C1-8-алифат, -С3-8-циклоалифат-арил или -С3-8-циклоалифат-гетероарил;
R1 и R2, независимо друг от друга означают -Н или -R0; или R1 и R2 вместе означают -CH2CH2OCH2CH2-, -(СН2)3-6- или -CH2CH2NR'CH2CH2- с R'=-Н, -R0 или -C(=O)R0;
R3 означает -R0;
R4 означает -Н, -C(=O)R0 или -R0;
R5 означает -Н, -F, -Cl, -Br, -I, -CN, -NO2, -СНО, -R0, -C(=O)H, -C(=O)R0, -С(=O)ОН, -C(=O)OR0, -C(=O)NH2, -C(=O)NHR0, -C(=O)N(R0)2, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NHC(=O)R0, -NHC(=O)OR0, -NHC(=O)NH2, -NHC(=O)NHR0 или -NHC(=O)N(R0)2;
R6 и R7 каждый раз независимо друг от друга означают -Н, -F, -Cl, -Br, -I, -CN, -NO2, -СНО, -R0, -C(=O)H, -C(=O)R0, -C(=O)OH, -C(=O)OR0, -C(=O)NH2, -C(=O)NHR0, -C(=O)N(R0)2, -OH, -OR0, -OC(=O)H, -OC(=O)R0, -OC(=O)OR0, -OC(=O)NHR0, -OC(=O)N(R0)2, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NHC(=O)R0, -NHC(=O)OR0, -NHC(=O)NH2, -NHC(=O)NHR0 или -NHC(=O)N(R0)2;
или R5 и R6 совместно образуют пятичленное или шестичленное кольцо, остальные кольцевые атомы которого каждый раз независимо друг от друга представляют собой С, N, S или О, причем кольцо является ароматическим или неароматическим, незамещенным или монозамещенным или полизамещенным заместителями, независимо друг от друга выбранными из группы, состоящей из -F, -Cl, -Br, -I, -CN, -NO2, -CHO,=O, -R0, -C(=O)R0, -C(=O)H, -C(=O)OH, -C(=O)OR0, -C(=O)NH2, -C(=O)NHR0, -C(=O)N(R0)2, -OH, -OR0, -OC(=O)H, -OC(=O)Ro, -OC(=O)OR0, -OC(=O)NHR0, -OC(=O)N(R0)2, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NHC(=O)R0, -NHC(=O)OR0, -NHC(=O)NH2, -NHC(=O)-NHR0 и -NH-C(=O)N(R0)2;
причем
«алифат» каждый раз представляет собой разветвленный или неразветвленный, насыщенный или мононенасыщенный или полиненасыщенный, незамещенный или монозамещенный или полизамещенный алифатический углеводородный остаток;
«циклоалифат» каждый раз представляет собой насыщенный или мононенасыщенный или полиненасыщенный, незамещенный или монозамещенный или полизамещенный, алициклический моноциклический или мультициклический углеводородный остаток, число циклических атомов углерода которого преимущественно находится в указанном пределе (т.е. «С3-8-»циклоалифат преимущественно имеет 3, 4, 5, 6, 7 или 8 циклических атомов углерода);
причем что касается «алифат» и «циклоалифат» под «монозамещенным или полизамещенным» понимается однократное или многократное замещение одного или нескольких атомов водорода, например, однократное, двукратное, трехкратное или полное замещение, заместителями, независимо друг от друга выбранными из группы, состоящей из -F, -Cl, -Br, -I, -CN, -NO2, -CHO, =O, -R0, -C(=O)R0, -C(=O)H, -C(=O)OH, -C(=O)OR0, -C(=O)NH2, -C(=O)NHR0, -C(=O)N(R0)2, -ОН, -OR0, -OC(=O)H, -OC(=O)R0, -OC(=O)OR0, -OC(=O)NHR0, -OC(=O)N(R0)2, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NHC(=O)R0, -NHC(=O)OR0, -NHC(=O)NH2, -NHC(=O)-NHR0, -NH-C(=O)N(R0)2, -Si(R0)3, -PO(OR0)2;
«арил» каждый раз независимо означает карбоциклическую кольцевую систему с, по меньшей мере, одним ароматическим кольцом, но без гетероатомов в этом кольце, причем арильные остатки при необходимости могут быть конденсированы с другими насыщенными, (частично) ненасыщенными или ароматическими кольцевыми системами и каждый арильный остаток может быть незамещенным или монозамещенным или полизамещенным, причем арильные заместители могут быть одинаковыми или различными и в любом и возможном положении арила;
«гетероарил» означает 5-, 6- или 7-членный циклический ароматический остаток, который содержит 1, 2, 3, 4 или 5 гетероатомов, причем гетероатомы одинаково или различно представляют собой азот, кислород или серу, и гетероцикл может быть незамещенным или монозамещенным или полизамещенным; причем в случае замещения в гетероцикле заместители могут быть одинаковыми или различными и в любом и возможном положении гетероарила; и причем гетероцикл также может быть частью бициклической или полициклической системы;
причем что касается «арил» и «гетероарил» под «монозамещенным или полизамещенным» понимается однократное или многократное замещение одного или нескольких атомов водорода кольцевой системы заместителями, выбранными из группы, состоящей из -F, -Cl, -Br, -I, -CN, -NO2, -СНО, =O, -R0, -C(=O)R0, -С(=O)Н, -С(=O)ОН, -C(=O)OR0, -C(=O)NH2, -C(=O)NHR0, -C(=O)-N(R0)2, -OH, -O(CH2)1-2O-, -OR0, -OC(=O)H, -OC(=O)R0, -OC(=O)OR0, -OC(=O)NHR0, -OC(=O)N(R0)2, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NHC(=O)R0, -NHC(=O)OR0, -NH-C(=O)NH2, -NHC(=O)NHR0, -NHC(=O)N(R0)2, -Si(R0)3, -PO(OR0)2; причем при необходимости имеющиеся N-кольцевые атомы каждый раз могут быть окисленными (N-оксид);
в виде отдельного стереоизомера или его смеси, свободных соединений и/или их физиологически совместимых солей и/или сольватов.
При обобщении различных остатков, например Y1, Y1', Y2, Y2', Y3, Y3', Y4 и Y4', a также обобщении остатков к их заместителям, таким как, например, -OR0, -OC(=O)R0, -OC(=O)NHR0, один заместитель, например R0, для двух или нескольких остатков, например -OR0, -OC(=O)R0, -OC(=O)NHR0, в пределах одного соединения может принимать различные значения.
Соединения согласно изобретению проявляют хорошее связывание с ORL1-рецептором и µ-опиоидным рецептором.
В одной предпочтительной форме осуществления соединения согласно изобретению имеют соотношение ORLI/µ-сродство, по меньшей мере, в 0,1. ORL1/µ-соотношение определено как 1/[Ki(ORL1)/Ki(µ)]. Особенно предпочтительно ORL1/µ-соотношение составляет, по меньшей мере, 0,2 или, по меньшей мере, 0,5, предпочтительнее, по меньшей мере, 1,0 или, по меньшей мере, 2,0, еще предпочтительнее, по меньшей мере, 3,0 или, по меньшей мере, 4,0, наиболее предпочтительно, по меньшей мере, 5,0 или, по меньшей мере, 7,5 и в особенности, по меньшей мере, 10 или, по меньшей мере, 15. В одной предпочтительной форме осуществления ORL1/µ-соотношение находится в пределах от 0,1 до 30, предпочтительнее от 0,1 до 25.
В другой предпочтительной форме осуществления соединения согласно изобретению имеют соотношение ORL1/µ-сродство более чем в 30, предпочтительнее, по меньшей мере, 50, еще предпочтительнее, по меньшей мере, 100, наиболее предпочтительно, по меньшей мере, 200 и в особенности, по меньшей мере, 300.
Соединения согласно изобретению предпочтительно имеет Ki-значение в µ-опиоидном рецепторе самое большее в 500 нМ, предпочтительнее самое большее 100 нМ, еще предпочтительнее 50 нМ, наиболее предпочтительно самое большее 10 нМ и в особенности самое большее 1,0 нМ.
Методы определения Ki-значения в µ-опиоидном рецепторе известны специалисту в данной области техники. Предпочтительно определение происходит так, как описано в связи с примерами.
Соединения согласно изобретению предпочтительно имеют Ki-значение в ORL1-рецепторе самое большее в 500 нМ, предпочтительнее самое большее 100 нМ, еще предпочтительнее 50 нМ, наиболее предпочтительно самое большее 10 нМ и в особенности самое большее 1,0 нМ.
Методы определения Ki-значения в ORL1-рецепторе известны специалисту в данной области техники. Предпочтительно определение происходит так, как описано в связи с примерами.
Неожиданно обнаружилось, что соединения со сродством к ORL1- и µ-опиоидному рецептору, в которых определенное посредством 1/[Ki(ORL1)/Ki(µ)] соотношение ORL1 к µ находится в пределах от 0,1 до 30, преимущественно от 0,1 до 25, имеют фармакологический профиль, который по сравнению с другим лигандом опиоидного рецептора имеет явные преимущества:
1. Соединения согласно изобретению демонстрируют эффективность в моделях острой боли, которая иногда сопоставима с употребительной стадией-3 опиоидов. Но одновременно они отличаются явно улучшенной совместимостью в отношении классических µ-опиоидов.
2. В противоположность к употребительной стадии-3 опиоидов соединения согласно изобретению демонстрируют явно более высокую эффективность в моделях мононевропатической боли и полиневропатической боли, что объясняется синергизмом ORL1- и µ-опиоидного компонента.
3. В противоположность к употребительной стадии-3 опиоидов соединения согласно изобретению у невропатических животных показывают значительное, предпочтительно полное, разделение антиаллодинического, соответственно, антигиперальгетического действия и антиноцицептивного эффекта.
4. В противоположность к употребительной стадии-3 опиоидов соединения согласно изобретению в экспериментальных моделях на животных для хронической воспалительной боли (в частности, каррагинан-индуцированная или CFA-индуцированная гипералгезия, висцеральная воспалительная боль) показывают явное усиление действия в отношении острой боли.
5. В противоположность к употребительной стадии-3 опиоидов типичные для µ-опиоидов побочные эффекты (в частности, угнетение дыхания, вызванная опиоидами гипералгезия, физическая зависимость/ломка, психическая зависимость/мания) в соединениях согласно изобретению в терапевтически эффективном интервале дозы явно снижены, соответственно, преимущественно не наблюдаются.
На основании сниженных µ-опиоидных побочных эффектов с одной стороны и повышенной эффективности при хронической, предпочтительно невропатической боли с другой стороны смешанные ORL1/µ-агонисты таким образом отличаются отчетливо возрастающими интервалами безопасности по сравнению с чистыми µ-опиоидами. Из этого следует явно увеличенное «терапевтическое окно» при лечении болезненных состояний, предпочтительно хронических болей, еще предпочтительнее невропатических болей.
Предпочтительны Y1, Y1', Y2, Y2', Y3, Y3', Y4 и Y'4, каждый раз независимо друг от друга выбранные из группы, состоящей из -Н, -F, -Cl, -Br, -I, -CN, -NH2, -NH-C1-6-алифат, -NH-С3-8-циклоалифат, -NH-C1-6-алифат-ОН, -N(С1-6-алифат)2, -N(С3-8-циклоалифат)2, -N(С1-6-алифат-ОН)2, -NO2, -NH-С1-6-алифат-С3-8-циклоалифат, -NH-C1-6-алифат-арил, -NH-C1-6-алифат-гетероарил, -NH-арил, -NH-гетероарил, -SH, -S-C1-6-алифат, -S-С3-8-циклоалифат, -S-С1-6-алифат-С3-8-циклоалифат, -S-C1-6-алифат-арил, -S-C1-6-алифат-гетероарил, -S-арил, -S-гетероарил, -ОН, -O-C1-6-алифат, -О-С3-8-циклоалифат, -O-C1-6-алифат-ОН, -O-С1-6-алифат-С3-8-циклоалифат, -O-C1-6-алифат-арил, -O-C1-6-алифат-гетероарил, -O-арил, -O-гетероарил, -O-С(=O)С1-6-алифат, -O-С(=O)С3-8-циклоалифат, -O-C(=O)C1-6-алифат-ОН, -O-С(=O)С1-6-алифат-С3-8-циклоалифат, -O-С(=O)С1-6-алифат-арил, -O-С(=O)С1-6-алифат-гетероарил, -O-С(=O)арил, -O-С(=O)гетероарил, -C1-6-алифат, -С3-8-циклоалифат, -С1-6-алифат-С3-8-циклоалифат, -C1-6-алифат-арил, -C1-6-алифат-гетероарил, -арил, -гетероарил, -С(=O)С1-6-алифат, -С(=O)С3-8-циклоалифат, -С(=O)С1-6-алифат-С3-8-циклоалифат, -С(=O)С1-6-алифат-арил, -С(=O)С1-6-алифат-гетероарил, -С(=O)арил, -С(=O)гетероарил, -CO2H, -CO2-C1-6-алифат, -CO2-С3-8-циклоалифат, -СО2-С1-6-алифат-С3-8-циклоалифат, -CO2-C1-6-алифат-арил, -CO2-С1-6-алифат-гетероарил, -СО2-арил, -CO2-гетероарил; или Y1 и Y1', или Y2 и Y2', или Y3 и Y3', или Y4 и Y4' совместно означают =O. Предпочтительны Y1, Y1', Y2, Y2', Y3, Y3', Y4 и Y4', каждый раз независимо друг от друга выбранные из группы, состоящей из -Н, -F, -Cl, -Br, -I, -CN, -NH2 и -ОН.
В одной предпочтительной форме осуществления один из остатков Y1, Y1', Y2, Y2', Y3, Y3', Y4 и Y4' не равен -Н и остальные остатки означают -Н.
Особенно предпочтительно Y1, Y1', Y2, Y2', Y3, Y3', Y4 и Y4' каждый раз означают -Н.
Предпочтительно Q означает -C1-8-алифат, -арил, -гетероарил, -C1-8-алифат-арил или -C1-8-алифат-гетероарил; предпочтительнее означает -C1-8-алифат-арил или -C1-8-алифат-гетероарил. При этом -алифат, -арил и -гетероарил каждый раз могут быть незамещенными или монозамещенными или полизамещенными, преимущественно заместителями, которые независимо друг от друга выбраны из группы, состоящей из -C1-8-алифат, -ОН, -OC1-8-алифат, -CF3, -F, -Cl, -Br, -NO2, -CN, -гетероарил, -C1-8-алифат-арил и -C1-8-алифат-гетероарил.
В одной предпочтительной форме осуществления Q выбран из группы, состоящей из при необходимости каждый раз через -C1-8-алифат, связанный мостиком -фенил, -пирролил, -фурил, -тиенил, -пиридил, -индолил, -бензофурил и -бензотиенил, причем они каждый раз могут быть незамещенными или монозамещенными или полизамещенными, преимущественно заместителями, которые независимо друг от друга выбраны из группы, состоящей из -C1-8-алифат, -ОН, -OC1-8-алифат, -CF3, -F, -Cl, -Br, -NO2, -CN, -гетероарил, -C1-8-алифат-арил и -C1-8-алифат-гетероарил (например, -этил-4-пиридил).
R0 предпочтительно каждый раз независимо означает -C1-8-алифат, -С3-12-циклоалифат, -арил, -гетероарил, -С1-8-алифат-С3-12-циклоалифат, -C1-8-алифат-арил или -С1-8-алифат-гетероарил. При этом означают -С1-8-алифат-С3-12-циклоалифат, -C1-8-алифат-арил или -C1-8-алифат-гетероарил, что остатки -С3-12-циклоалифат, -арил или -гетероарил каждый раз через двухвалентный мостик -C1-8-алифат- связаны. Предпочтительными примерами для -C1-8-алифат-арил являются -СН2-С6Н5, -CH2CH2-C6H5, и -СН=СН-С6Н5.
Предпочтительно R1 и R2 независимо друг от друга означают -Н; -C1-6-алифат; -С3-8-циклоалифат, -C1-6-алифат-арил, -С1-6-алифат-С3-8-циклоалифат или -C1-8-алифат-гетероарил; или остатки R1 и R2 вместе образуют кольцо и означают -CH2CH2OCH2CH2-, -CH2CH2NR'CH2CH2- или -(СН2)3-6-. Предпочтительнее R1 и R2 независимо друг от друга означают -Н; -С1-5-алифат; или остатки R1 и R2 вместе образуют кольцо и означают -CH2CH2OCH2CH2-, -CH2CH2NR'-CH2CH2- или -(СН2)3-6-, причем R' предпочтительно означает -Н или -C1-5-алифат. Особенно предпочтительны соединения, в которых R1 и R2 независимо друг от друга означают -СН3 или -Н, причем R1 и R2 не одновременно означают -Н; или R1 и R2 образуют кольцо и означают -(СН2)3-4-. В высшей степени предпочтительны соединения, в которых R1 и R2 означают -СН3 или где R1 означает -Н и R2 означает -СН3.
Особенно предпочтительно R1 и R2 вместе с атомом азота, к которому они привязаны, образуют одну из следующих функциональных групп:
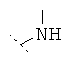
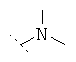
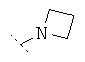
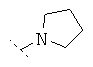 .
.
Предпочтительно R3 означает-C1-8-алифат, -С3-8-циклоалифат, -арил, -гетероарил; или означает каждый раз через -C1-3-алифат-группу связанный -арил, -гетероарил или -С3-8-циклоалифат.
Особенно предпочтительно R3 означает -этил, -пропил, -бутил, -пентил, -гексил, -гептил, -циклопентил, -циклогексил, -фенил, -бензил, -нафтил, -антраценил, -тиофенил, -бензотиофенил, -фурил, -бензофуранил, -бензодиоксоланил, -индолил, -инданил, -бензодиоксанил, -пирролил, -пиридил, -пиримидил или -пиразинил, каждый раз незамещенный или монозамещенный или полизамещенный; через насыщенную, неразветвленную -C1-3-алифат-группу связанный -С5-6-циклоалифат, -фенил, -нафтил, -антраценил, -тиофенил, -бензотиофенил, -пиридил, -фурил, -бензофуранил, -бензодиоксоланил, -индолил, -инданил, -бензодиоксанил, -пирролил, -пиримидил, -триазолил или -пиразинил, каждый раз незамещенный или монозамещенный или полизамещенный.
Предпочтительнее R3 означает -пропил, -бутил, -пентил, -гексил, -фенил, -фурил, -тиофенил, -нафтил, -бензил, -бензофуранил, -индолил, -инданил, -бензодиоксанил, -бензодиоксоланил, -пиридил, -пиримидил, -пиразинил, -триазолил или -бензотиофенил, каждый раз незамещенный или монозамещенный или полизамещенный; через насыщенную, неразветвленную -C1-3-алифат-группу связанный -фенил, -фурил или -тиофенил, каждый раз незамещенный или монозамещенный или полизамещенный.
Еще предпочтительнее R3 означает -пропил, -бутил, -пентил, -гексил, -фенил, -фенэтил, -тиофенил, -пиридил, -триазолил, -бензотиофенил или -бензил, каждый раз замещенный или незамещенный, особенно предпочтительно означает -пропил, -3-метоксипропил, -бутил, -пентил, -гексил, -фенил, -3-метилфенил, -3-фторфенил, -бензо[1,3]-диоксолил, -тиенил, -бензотиофенил, -4-хлорбензил, -бензил, -3-хлорбензил, -4-метилбензил, -2-хлорбензил, -4-фторбензил, -3-метилбензил, -2-метилбензил, -3-фторбензил, -2-фторбензил, -1-метил-1,2,4-триазолил или -фенэтил.
В высшей степени предпочтительно R3 означает -бутил, -этил, -3-метоксипропил, -бензотиофенил, -фенил, -3-метилфенил, -3-фторфенил, -бензо[1,3]-диоксолил, -бензил, -1-метил-1,2,4-триазолил, -тиенил или -фенэтил.
Предпочтительнее всего R3 означает -фенил, -бензил или -фенэтил, каждый раз незамещенный или в кольце монозамещенный или полизамещенный; -C1-5-алифат, -С4-6-циклоалифат, -пиридил, -тиенил, -тиазолил, -имидазолил, -1,2,4 триазолил или -бензимидазолил, незамещенный или монозамещенный или полизамещенный.
В особенности предпочтительно R3 означает -фенил, -бензил, -фенэтил, -тиенил, -пиридил, -тиазолил, -имидазолил, -1,2,4 триазолил, -бензимидазолил или -бензил, незамещенный или монозамещенный или полизамещенный посредсвтом -F, -Cl, -Br, -CN, -СН3, -С2Н5, -NH2, -NO2, -SH, -CF3, -ОН, -ОСН3, -ОС2Н5 или -N(СН3)2; -этил, -n-пропил, -2-пропил, -аллил, -n-бутил, -изо-бутил, -втор.-бутил, -трет.-бутил, -n-пентил, -изо-пентил, -neo-пентил, -n-гексил, -циклопентил или -циклогексил, каждый раз незамещенный или монозамещенный или полизамещенный посредством -ОН, -ОСН3 или -OC2H5, причем преимущественно -тиенил, -пиридил, -тиазолил, -имидазолил, -1,2,4 триазолил и -бензимидазолил являются незамещенными.
В особенности предпочтительно R3 означает -фенил, незамещенный или монозамещенный посредством -F, -Cl, -CN, -СН3; -тиенил; -этил, -n-пропил или -n-бутил, незамещенный или монозамещенный или полизамещенный посредством -ОСН3, -ОН или -OC2H5, в особенности посредством -ОСН3.
Предпочтительно R4 означает -Н, -C1-5-алифат, -С3-8-циклоалифат, -арил, -гетероарил, -C1-6-алифат-арил, -С1-6-алифат-С3-8-циклоалифат, -С1-6-алифат-гетероарил, -С(=O)арил, -С(=O)гетероарил, -С(=O)С1-6-алифат, -C(=O)C1-6-алифат-арил, -С(=O)С1-6-алифат-гетероарил, -С(=O)С3-8-циклоалифат-арил, -С(=O)С3-8-циклоалифат-гетероарил, предпочтительнее означает -Н или -C1-5-алифат, в особенности означает -Н или -СН3.
Х означает =O, =CR6R7 или =N-R6. Если Х означает =O, то соединение согласно изобретению общей формулы (1) имеет общую формулу (1-а). Если Х означает =NR6, то соединение согласно изобретению общей формулы (1) имеет общую формулу (1-b). Если Х означает =CR6R7, то соединение согласно изобретению общей формулы (1) имеет общую формулу (1-c):
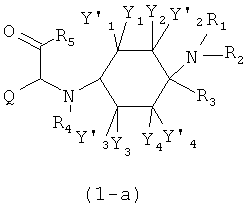
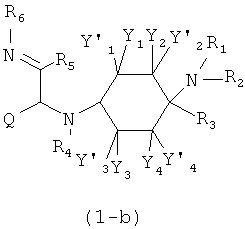
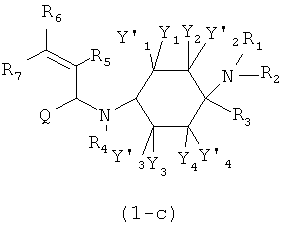
Предпочтительные формы осуществления соединений общей формулы (1-b) и (1-c) изображены ниже:
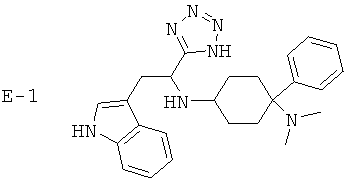
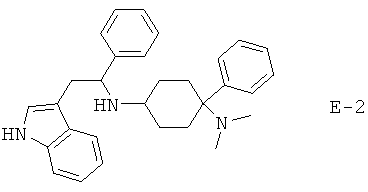
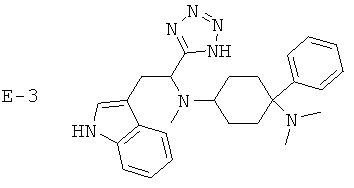
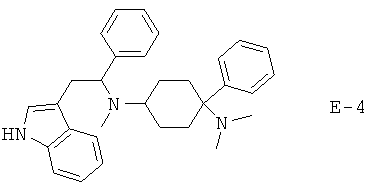
R5 предпочтительно означает -Н, -F, -Cl, -Br, -I, -C1-8-алифат, -С3-12-циклоалифат, -арил, -гетероарил, -С1-8-алифат-С3-12-циклоалифат, -C1-8-алифат-арил, -C1-8-алифат-гетероарил, -С(=O)Н, -С(=O)-С1-8-алифат, -С(=O)-С3-12-циклоалифат, -С(=O)-арил, -С(=O)-гетероарил, -С(=O)-С1-8-алифат-С3-12-циклоалифат, -С(=O)-С1-8-алифат-арил, -С(=O)-С1-8-алифат-гетероарил, -С(=O)O-С1-8-алифат, -С(=O)O-С3-12-циклоалифат, -С(=O)O-арил, -С(=O)O-гетероарил, -С(=O)O-С1-8-алифат-С3-12-циклоалифат, -С(=O)O-С1-8-алифат-арил, -С(=O)O-С1-8-алифат-гетероарил, -CN, -C(=O)NH2, -С(=O)-NH-С1-8-алифат, -С(=O)NH-С3-12-циклоалифат, -С(=O)NH-арил, -С(=O)NH-гетероарил, -C(=O)-NH-С1-8-алифат-С3-12-циклоалифат, -С(=O)NH-С1-8-алифат-арил, -C(=O)NH-C1-8-алифат-гетероарил, -С(=O)N(С1-8-алифат)2, -С(=O)N(С3-12-циклоалифат)2, -С(=O)N(арил)2, -С(=O)N-(гетероарил)2, -С(=O)N(С1-8-алифат-С3-12-циклоалифат)2, -С(=O)N(С1-8-алифат-арил)2, -С(=O)-N(С1-8-алифат-гетероарил)2, -NH2, -NO2, -NH-C1-8-алифат, -NH-С3-12-циклоалифат, -NH-арил, -NH-гетероарил, -NH-С1-8-алифат-С3-12-циклоалифат, -NH-C1-8-алифат-арил, -NH-C1-8-алифат-гетероарил, -N(С1-8-алифат)2, -N(С3-12-циклоалифат)2, -N(арил)2, -N(гетероарил)2, -N(С1-8-алифат-С3-12-циклоалифат)2, -N(С1-8-алифат-арил)2, -N(С1-8-алифат-гетероарил)2, -NHC(=O)-С1-8-алифат, -NHC(=O)-С3-12-циклоалифат, -NHC(=O)-арил, -NHC(=O)-гетероарил, -NHC(=O)-С1-8-алифат-С3-12-циклоалифат, -NHC(=O)-С1-8-алифат-арил, -NHC(=O)-C1-8-алифат-гетероарил, -NHC(=O)O-С1-8-алифат, -NHC(=O)O-С3-12-циклоалифат, -NHC(=O)O-арил, -NHC(=O)O-гетероарил, -NHC(=O)O-С1-8-алифат-С3-12-циклоалифат, -NHC(=O)O-С1-8-алифат-арил, -NHC(=O)O-С1-8-алифат-гетероарил, -NHC(=O)NH-C1-8-алифат, -NHC(=O)NH-C3-12-циклоалифат, -NHC(=O)NH-арил, -NHC(=O)-NH-гетероарил, -NHC(=O)NH-С1-8-алифат-С3-12-циклоалифат, -NHC(=O)NH-С1-8-алифат-арил, -NHC(=O)NH-С1-8-алифат-гетероарил, -NHC(=O)N(C1-8-алифат)2, -NHC(=O)N(C3-12-циклоалифат)2, -NHC(=O)N(арил)2, -NHC(=O)-N(гетероарил)2, -NHC(=O)N(С1-8-алифат-С3-12-циклоалифат)2, -NHC(=O)N(С1-8-алифат-арил)2, -NHC(=O)N(С1-8-алифат-гетероарил)2, -SH, -SC1-8-алифат, -SC3-12-циклоалифат, -Sарил, -Sгетероарил, -SC1-8-алифат-С3-12-циклоалифат, -SC1-8-алифат-арил, -SC1-8-алифат-гетероарил, -S(=O)1-2C1-8-алифат, -S(=O)1-2С3-12-циклоалифат, -S(=O)1-2арил, -S(=O)1-2гетероарил, -S(=O)1-2С1-8-алифат-С3-12-циклоалифат, -S(=O)1-2С1-8-алифат-арил, -S(=O)1-2C1-8-алифат-гетероарил, -S(=O)1-2OH, -S(=O)1-2OC1-8-алифат, -S(=O)1-2OC3-12-циклоалифат, -S(=O)1-2Oарил, -S(=O)1-2Oгетероарил, -S(=O)1-2OC1-8-алифат-С3-12-циклоалифат, -S(=O)1-2OC1-8-алифат-арил, -S(=O)1-2OC1-8-алифат-гетероарил, -S(=O)1-2NH2, -S(=O)1-2NHC1-8-алифат, -S(=O)1-2NHC3-12-циклоалифат, -S(=O)1-2NНарил, -S(=O)1-2NНгетероарил, -S(=O)1-2NHC1-8-алифат-С3-12-циклоалифат, -S(=O)1-2NHC1-8-алифат-арил, -S(=O)1-2NHC1-8-алифат-гетероарил, -S(=O)1-2N(C1-8-алифат)2, -S(=O)1-2N(С3-12-циклоалифат)2, -S(=O)1-2N(арил)2, -S(=O)1-2N(гетероарил)2, -S(=O)1-2N(С1-8-алифат-С3-12-циклоалифат)2, -S(=O)1-2N(C1-8-алифат-арил)2 или -S(=O)1-2N(С1-8-алифат-гетероарил)2.
R6 и R7 предпочтительно каждый раз независимо друг от друга означают -Н, -F, -Cl, -Br, -I, -C1-8-алифат, -С3-12-циклоалифат, -арил, -гетероарил, -C1-8-алифат-С3-12-циклоалифат, -C1-8-алифат-арил, -C1-8-алифат-гетероарил, -С(=O)Н, -С(=O)-C1-8-алифат, -С(=O)-С3-12-циклоалифат, -С(=O)-арил, -С(=O)-гетероарил, -С(=O)-С1-8-алифат-С3-12-циклоалифат, -С(=O)-С1-8-алифат-арил, -С(=O)-С1-8-алифат-гетероарил, -С(=O)O-С1-8-алифат, -С(=O)O-С3-12-циклоалифат, -С(=O)O-арил, -С(=O)O-гетероарил, -С(=O)O-С1-8-алифат-С3-12-циклоалифат, -C(=O)O-C1-8-алифат-арил, -С(=O)O-С1-8-алифат-гетероарил, -CN, -C(=O)NH2, -C(=O)-NH-C1-8-алифат, -С(=O)NH-С3-12-циклоалифат, -С(=O)NH-арил, -С(=O)NH-гетероарил, -С(=O)-NH-С1-8-алифат-С3-12-циклоалифат, -С(=O)NH-С1-8-алифат-арил, -С(=O)NH-С1-8-алифат-гетероарил, -С(=O)N(С1-8-алифат)2, -С(=O)N(С3-12-циклоалифат)2, -С(=O)N(арил)2, -С(=O)N-(гетероарил)2, -С(=O)N(С1-8-алифат-С3-12-циклоалифат)2, -С(=O)N(С1-8-алифат-арил)2, -С(=O)-N(С1-8-алифат-гетероарил)2, -ОН, -OC1-8-алифат, -ОС3-12-циклоалифат, -Оарил, -Огетероарил, -ОС1-8-алифат-С3-12-циклоалифат, -OC1-8-алифат-арил, -OC1-8-алифат-гетероарил, -ОС(=O)Н, -ОС(=O)-С1-8-алифат, -ОС(=O)-С3-12-циклоалифат, -ОС(=O)-арил, -ОС(=O)-гетероарил, -ОС(=O)-С1-8-алифат-С3-12-циклоалифат, -ОС(=O)-С1-8-алифат-арил, -ОС(=O)-С1-8-алифат-гетероарил, -OC(=O)O-C1-8-алифат, -ОС(=O)O-С3-12-циклоалифат, -ОС(=O)O-арил, -ОС(=O)-O-гетероарил, -ОС(=O)O-С1-8-алифат-С3-12-циклоалифат, -ОС(=O)O-С1-8-алифат-арил, -ОС(=O)-O-С1-8-алифат-гетероарил, -ОС(=O)NH-С1-8-алифат, -ОС(=O)NH-С3-12-циклоалифат, -ОС(=O)NH-арил, -ОС(=O)NH-гетероарил, -OC(=O)NH-C1-8-алифат-С3-12-циклоалифат, -ОС(=O)NH-С1-8-алифат-арил, -OC(=O)NH-C1-8-алифат-гетероарил, -ОС(=O)N(С1-8-алифат)2, -ОС(=O)N(С3-12-циклоалифат)2, -ОС(=O)N(арил)2, -ОС(=O)-N(гетероарил)2, -ОС(=O)N(С1-8-алифат-С3-12-циклоалифат)2, -ОС(=O)N(С1-8-алифат-арил)2, -ОС(=O)N(С1-8-алифат-гетероарил)2, -NH2, -NO2, -NH-C1-8-алифат, -NH-С3-12-циклоалифат, -NH-арил, -NH-гетероарил, -NH-С1-8-алифат-С3-12-цикпоалифат, -NH-C1-8-алифат-арил, -NH-С1-8-алифат-гетероарил, -N(С1-8-алифат)2, -N(С3-12-циклоалифат)2, -N(арил)2, -N(гетероарил)2, -N(С1-8-алифат-С3-12-циклоалифат)2, -N(С1-8-алифат-арил)2, -N(С1-8-алифат-гетероарил)2, -NHC(=O)-С1-8-алифат, -NHC(=O)-С3-12-циклоалифат, -NHC(=O)-арил, -NHC(=O)-гетероарил, -NHC(=O)-С1-8-алифат-С3-12-циклоалифат, -NHC(=O)-С1-8-алифат-арил, -NHC(=O)-С1-8-алифат-гетероарил, -NHC(=O)O-С1-8-алифат, -NHC(=O)O-С3-12-циклоалифат, -NHC(=O)O-арил, -NHC(=O)O-гетероарил, -NHC(=O)O-С1-8-алифат-С3-12-циклоалифат, -NHC(=O)O-С1-8-алифат-арил, -NHC(=O)O-С1-8-алифат-гетероарил, -NHC(=O)NH-С1-8-алифат, -NHC(=O)NH-С3-12-циклоалифат,-NHC(=O)NH-арил, -NHC(=O)-NH-гетероарил, -NHC(=O)NH-С1-8-алифат-С3-12-циклоалифат, -NHC(=O)NH-С1-8-алифат-арил, -NHC(=O)NH-С1-8-алифат-гетероарил, -NHC(=O)N(С1-8-алифат)2, -NHC(=O)N(С3-12-циклоалифат)2, -NHC(=O)N(арил)2, -NHC(=O)-N(гетероарил)2, -NHC(=O)N(С1-8-алифат-С3-12-циклоалифат)2, -NHC(=O)N(С1-8-алифат-арил)2, -NHC(=O)N(С1-8-алифат-гетероарил)2, -SH, -SC1-8-алифат, -SC3-12-циклоалифат, -Sарил, -Sгетероарил, -SC1-8-алифат-С3-12-циклоалифат, -SC1-8-алифат-арил, -SC1-8-алифат-гетероарил, -S(=O)1-2C1-8-алифат, -S(=O)1-2С3-12-циклоалифат, -S(=O)1-2арил, -S(=O)1-2гетероарил, -S(=O)1-2С1-8-алифат-С3-12-циклоалифат, -S(=O)1-2С1-8-алифат-арил, -S(=O)1-2C1-8-алифат-гетероарил, -S(=O)1-2OH, -S(=O)1-2OC1-8-алифат, -S(=O)1-2OC3-12-циклоалифат, -S(=O)1-2Oарил, -S(=O)1-2Oгетероарил, -S(=O)1-2OC1-8-алифат-С3-12-циклоалифат, -S(=O)1-2OC1-8-алифат-арил, -S(=O)1-2OC1-8-алифат-гетероарил, -S(=O)1-2NH2, -S(=O)1-2NHC1-8-алифат, -S(=O)1-2NHC3-12-циклоалифат, -S(=O)1-2NHарил, -S(=O)1-2NH-гетероарил, -S(=O)1-2NHC1-8-алифат-С3-12-циклоалифат, -S(=O)1-2NHC1-8-алифат-арил, -S(=O)1-2NHC1-8-алифат-гетероарил, -S(=O)1-2N(C1-8-алифат)2, -S(=O)1-2N(С3-12-циклоалифат)2, -S(=O)1-2N(арил)2, -S(=O)1-2М(гетероарил)2, -S(=O)1-2N(С1-8-алифат-С3-12-циклоалифат)2, -S(=O)1-2N(C1-8-алифат-арил)2 или -S(=O)1-2N(С1-8-алифат-гетероарил)2;
или R5 и R6 образуют совместно пятичленное или шестичленное кольцо, остальные кольцевые атомы которого (т.е. 3 соответственно 4 кольцевых атома наряду с Х и С-атомом, к которому Х привязан) каждый раз независимо друг от друга представляют собой С, N, S или О, причем кольцо является ароматическим или неароматическим, незамещенным или монозамещенным или полизамещенным. В этой форме осуществления R5 согласно этому представляет собой при необходимости замещенный кольцевой атом, выбранный из группы, состоящей из С, N, S или О. Если R5 образует кольцевой атом -О- или -S-, то он не является далее замещенным. Если R5 образует кольцевой атом -С-, то он является двукратно замещенным, причем заместители, в частности -Н, могут быть (-СН2-). Если R5 образует кольцевой атом =С-, то он является монозамещенным, причем заместитель среди других -Н может быть (=СН-). Если R5 образует кольцевой атом -N-, то он является монозамещенным, причем заместитель среди других -Н может быть (-NH-). Если R5 образует кольцевой атом =N-, то он не является далее замещенным.
Если от R5 и R6 образованное совместно кольцо замещено одним или несколькими заместителями, которые не равны -Н, то заместители предпочтительно независимо друг от друга выбраны из группы, состоящей из -F, -Cl, -Br, -I, -CN, -NO2, -СНО,=O, -R0, -ОН, -OR0, -NH2, -NHR0 и -N(R0)2; особенно предпочтительно =O и -СН3.
Если Х означает =O, то R5 предпочтительно означает -NH2, -NH-C1-8-алифат, -NH-С3-12-циклоалифат, -NH-арил, -NH-гетероарил, -NH-С1-8-алифат-С3-12-циклоалифат, -NH-C1-8-алифат-арил, -NH-C1-8-алифат-гетероарил, -N(C1-8-алифат)2, -N(С3-12-циклоалифат)2, -N(арил)2, -N(гетероарил)2, -N(С1-8-алифат-С3-12-циклоалифат)2, -N(С1-8-алифат-арил)2, или -N(С1-8-алифат-гетероарил)2; особенно предпочтительно означает -NH2, -NHC1-8-алифат или -N(С1-8-алифат)2.
Если Х означает =CR6R7 или =NR6, то R5 предпочтительно вместе с R6 означает пятичленное или шестичленное кольцо, остальные кольцевые атомы которого (т.е. 3 соответственно 4 кольцевых атома наряду с Х и С-атомом, к которому Х привязан) каждый раз независимо друг от друга представляют собой С, N, S или О, причем кольцо является ароматическим или неароматическим, незамещенным или монозамещенным или полизамещенным. Предпочтительно функциональная группа -CR5(=X) означает один из следующих остатков, которые могут быть незамещенными или монозамещенными или полизамещенными:
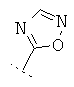
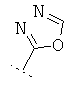
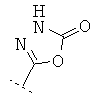
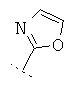

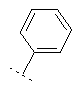
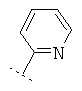
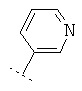
R7 предпочтительно означает -Н, -F, -Cl, -Br, -СН3, -ОН, -ОСН3, -CN или -NO2.
В целях описания углеводородные остатки подразделены на алифатические углеводородные остатки с одной стороны и ароматические углеводородные остатки с другой стороны.
Алифатические углеводородные остатки со своей стороны подразделены на нециклические алифатические углеводородные остатки с одной стороны (=«алифат») и циклические алифатические углеводородные остатки, т.е. алициклические углеводородные остатки, с другой стороны (=«циклоалифат»). Циклоалифаты могут быть моноциклическими или мультициклическими. Алициклические углеводородные остатки («циклоалифат») охватывают как чистые алифатические карбоциклы, так и алифатические гетероциклы, т.е. - если не указано специально - «циклоалифат» включает чистые алифатические карбоциклы (например, циклогексил), чистые алифатические гетероциклы (например, пиперидил или пиперазил), а также неароматические, мультициклические, при необходимости смешанные системы (например, декалинил, декагидрохинолинил).
Ароматические углеводороды со своей стороны подразделены на карбоциклические ароматические углеводороды с одной стороны (=«арил») и гетероциклические ароматические углеводороды с другой стороны (=«гетероарил»).
Распределение мультициклических, по меньшей мере, частично ароматических систем преимущественно зависит от того, имеет ли, по меньшей мере, одно ароматическое кольцо мультициклической системы, по меньшей мере, один гетероатом (обычно N, О или S) в кольце. Если, по меньшей мере, один такой гетероатом в этом кольце имеется, то предпочтительно он представляет собой «гетероарил» (даже если при необходимости в виде дополнительно имеющегося цикла мультициклической системы имеется другое карбоциклическое ароматическое или неароматическое кольцо с одним гетероатомом или без него); если ни в одном из при необходимости нескольких ароматических колец мультициклической системы такой гетероатом не присутствует, то предпочтительно речь идет об «ариле» (даже если в одном, при необходимости дополнительно имеющемся, неароматическом цикле мультициклической системы имеется один кольцевой гетероатом).
В пределах циклических заместителей согласно этому предпочтительно при упорядочении отдается следующий приоритет: гетероарил > арил > циклоалифат.
В целях описания одновалентные и поливалентные, например двухвалентные, углеводородные остатки не различаются понятийно, т.е. «C1-3-алифат» включает, в зависимости от смысловой связи, например, как -C1-3-алкил, -C1-3-алкенил и -C1-3-алкинил, так и, например, -C1-3-алкилен-, -C1-3-алкенилен- и С1-3-алкинилен-.
Предпочтительно алифат каждый раз представляет собой разветвленный или неразветвленный, насыщенный или мононенасыщенный или многократно ненасыщенный, незамещенный или монозамещенный или полизамещенный алифатический углеводородный остаток. Поскольку алифат является монозамещенным или полизамещенным, то заместители независимо друг от друга выбраны из группы, состоящей из -F, -Cl, -Br, -I, -CN, -NO2, -СНО, =O, -R0, -C(=O)R0, -C(=O)-OH, -C(=O)OR0, -C(=O)NH2, -C(=O)NHR0, -C(=O)N(R0)2, -OH, -OR0, -OC(=O)H, -OC(=O)R0, -OC(=O)OR0, -OC(=O)-NHR0, -OC(=O)N(R0)2, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NHC(=O)R0, -NHC(=O)OR0, -NHC(=O)NH2, -NHC(=O)NHR0, -NH-C(=O)N(R0)2, -Si(R0)3, -PO(OR0)2. Так «алифат» включает ациклические насыщенные или ненасыщенные углеводородные остатки, которые могут быть разветвленными или с прямой цепью, т.е. алканилы, алкенилы и алкинилы. При этом алкенилы имеют, по меньшей мере, одну С=С-двойную связь и алкинилы, по меньшей мере, одну С≡С-тройную связь. Предпочтительные незамещенные одновалентные алифаты охватывают -СН3, -СН2СН3, -СН2СН2СН3, -СН(СН3)2, -СН2СН2СН2СН3, -СН(СН3)СН2СН3, -СН2СН(СН3)2, -С(СН3)3, -CH2CH2CH2-СН2СН3 и -СН2СН2-СН2СН2СН2СН3; а также -СН=СН2, -С≡СН, -СН2СН=СН2, -СН=СНСН3, -СН2С≡СН, -С≡ССН3 и -СН=СНСН=СН2. Предпочтительные незамещенные двухвалентные алифаты охватывают -СН2-, -СН2СН2-, -СН2СН(СН3)-, -СН(СН3)-СН2-, -СН2СН2СН2-, -СН(СН3)СН2СН2-, -СН2СН(СН3)-СН2-, -СН2СН2СН(СН3)-, -СН-(СН2СН3)СН2- и -СН2СН2-СН2СН2-; а также -СН=СН-, -С≡С-, -СН2СН=СН-, -СН=СНСН2-, -СН2С≡С- и -С≡ССН2-. Предпочтительные замещенные одновалентные алифаты охватывают -CH2F, -CHF2, -CF3, -CH2CF3, -CF2CF3, -CH2OH, -CH2CH2OH, -СН2СНОНСН3, -CH2OCH3 и CH2CH2OCH3. Предпочтительные замещенные двухвалентные алифаты охватывают -CF2-, -CF2CF2-, -СН2СНОН-, -СНОНСН2- и -СН2СНОНСН2-. Особенно предпочтительны метил, этил, n-пропил и n-бутил.
Предпочтительно циклоалифат каждый раз представляет собой насыщенный или мононенасыщенный или многократно ненасыщенный, незамещенный или монозамещенный или полизамещенный, алифатический (т.е. не ароматический), моно- или мультициклический углеводородный остаток. Количество циклических атомов углерода преимущественно находится в указанном диапазоне (т.е. «С3-8-циклоалифат» имеет преимущественно 3, 4, 5, 6, 7 или 8 циклических атомов углерода). В целях описания «С3-8-циклоалифат» предпочтительно представляет собой циклический углеводород с 3, 4, 5, 6, 7 или 8 циклическими атомами углерода, насыщенный или ненасыщенный, но не ароматический, причем при необходимости один или два атома углерода независимо друг от друга замещены одним гетероатомом S, N или О. Поскольку циклоалкил является монозамещенным или полизамещенным, то заместители независимо друг от друга выбраны из группы, состоящей из -F, -Cl, -Br, -I, -CN, -NO2, -СНО, =O, -R0, -C(=O)R0, -C(=O)OH, -C(=O)OR0, -С(=O)NH2, -C(=O)NHR0, -C(=O)N(R0)2, -ОН, -OR0, -OC(=O)H, -OC(=O)R0, -OC(=O)OR0, -OC(=O)NHR0, -OC(=O)-N(R0)2, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NHC(=O)R0, -NHC(=O)OR0, -NHC(=O)NH2, -NHC(=O)NHR0, -NH-C(=O)N(R0)2, -Si(R0)3, -PO(OR0)2. Преимущественно С3-8-циклоалифат выбран из группы, состоящей из циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклопентенил, циклогексенил, циклогептенил и циклооктенил, а также тетрагидропиранил, диоксанил, диоксоланил, морфолинил, пиперидинил, пиперазинил, пиразолинонил и пирролидинил.
Предпочтительно в связи с «алифатом» соответственно «циклоалифатом» под «монозамещенным или полизамещенным» понимается однократное или многократное замещение, например одинарное, двукратное, трехкратное или четырехкратное замещение, одного или нескольких атомов водорода посредством -F, -Cl, -Br, -I, -ОН, -OC1-6-алкил, -ОС(=O)С1-6-алкил, -SH, -NH2, -NHC1-6-алкил, -N(С1-6-алкил)2, -С(=O)ОС1-6-алкил или -С(=O)ОН. Предпочтительны соединения, причем «алифат замещенный» или «циклоалифат замещенный» означает алифат или циклоалифат замещенный посредством -F, -Cl, -Br, -I, -CN, -СН3, -C2H5, -NH2, -NO2, -SH, -CF3, -ОН, -ОСН3, -ОС2Н5 или -N(СН3)2. Особенно предпочтительными заместителями являются -F, -Cl, -ОН, -SH, -NH2 и -С(=O)ОН.
Под многократно замещенными остатками следует понимать такие остатки, которые или в различных или в одинаковых атомах замещены многократно, например двукратно или трехкратно, например трехкратно в одинаковом С-атоме, как в случае -CF3 или -CH2CF3, или в различных местах, как в случае -CH(OH)-CH=CH-CHCl2. Многократное замещение может происходить одинаковым или различным заместителем. При необходимости один заместитель также со своей стороны может быть замещенным; так -Оалифат среди других также включает -OCH2CH2O-СН2СН2-ОН. Предпочтительно, если алифат или циклоалифат замещены посредством -F, -Cl, -Br, -I, -CN, -СН3, -С2Н5, -NH2, -NO2, -SH, -CF3, -ОН, -ОСН3, -ОС2Н5 или -N(СН3)2. В высшей степени предпочтительно, если алифат или циклоалифат замещены посредством -ОН, -ОСН3 или -ОС2Н5.
Предпочтительно арил каждый раз независимо означает карбоциклическую кольцевую систему с, по меньшей мере, одним ароматическим кольцом, но без гетероатомов в этом кольце, причем арильные остатки при необходимости могут быть конденсированы с другими насыщенными, (частично) ненасыщенными или ароматическими кольцевыми системами, и каждый арильный остаток может быть незамещенным или монозамещенным или полизамещенным, причем арильные заместители могут быть одинаковыми или различными и в любом и возможном положении арила. Предпочтительными арилами являются фенил, нафтил, антраценил, фенантренил, фторантенил, фторенил, инданил и тетралинил. Особенно предпочтительны фенил и нафтил. Если арил является монозамещенным или полизамещенным, то арильные заместители могут быть одинаковыми или различными и в любом и возможном положении арила, и независимо друг от друга выбраны из группы, состоящей из -F, -Cl, -Br, -I, -CN, -NO2, -СНО, =O, -R0, -C(=O)R0, -C(=O)OH, -C(=O)OR0, -C(=O)-NH2, -C(=O)NHR0, -C(=O)N(R0)2, -ОН, -O(CH2)1-2O-, -OR0, -OC(=O)H, -OC(=O)R0, -OC(=O)OR0, -OC(=O)-NHR0, -OC(=O)N(R0)2, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NHC(=O)R0, -NHC(=O)OR0, -NHC(=O)NH2, -NHC(=O)NHR0, -NH-C(=O)N(R0)2, -Si(R0)3, -PO(OR0)2. Предпочтительными замещенными арилами являются 2-фтор-фенил, 3-фтор-фенил, 4-фтор-фенил, 2,3-дифтор-фенил, 2,4-дифтор-фенил, 3,4-дифтор-фенил, 2-хлор-фенил, 3-хлор-фенил, 4-хлор-фенил, 2,3-дихлор-фенил, 2,4-дихлор-фенил, 3,4-дихлор-фенил, 2-метокси-фенил, 3-метокси-фенил, 4-метокси-фенил, 2,3-диметокси-фенил, 2,4-диметокси-фенил, 3,4-диметокси-фенил, 2-метил-фенил, 3-метил-фенил, 4-метил-фенил, 2,3-диметил-фенил, 2,4-диметил-фенил и 3,4-диметил-фенил.
Предпочтительно гетероарил означает 5-, 6- или 7-членный циклический ароматический остаток, который содержит 1, 2, 3, 4 или 5 гетероатомов, причем гетероатомы одинаково или различно представляют собой азот, кислород или серу, и гетероцикл может быть незамещенным или монозамещенным или полизамещенным; причем в случае замещения в гетероцикле заместители могут быть одинаковыми или различными и в любом и возможном положении гетероарила; и причем гетероцикл также может быть частью бициклической или полициклической системы. Предпочтительно «гетероарил» выбран из группы, состоящей из пирролил, индолил, фурил (фуранил), бензофуранил, тиенил (тиофенил), бензотиенил, бензотиадиазолил, бензооксадиазолил, бензотиазолил, бензооксазолил, бензотриазолил, бензодиоксоланил, бензодиоксанил, фталазинил, пиразолил, имидазолил, тиазолил, оксазолил, изоксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиранил, индазолил, пуринил, индолизинил, хинолинил, изохинолинил, хиназолинил, карбазолил, феназинил, фенотиазинил или оксадиазолил, причем связь может осуществляться через любой и возможный кольцевой член гетероарильного остатка. Если гетероарил является монозамещенным или полизамещенным, гетероарильные заместители могут быть одинаковыми или различными и в любом и возможном положении гетероарила, и независимо друг от друга выбраны из группы, состоящей из -F, -Cl, -Br, -I, -CN, -NO2, -СНО, =O, -R0, -C(=O)R0, -C(=O)OH, -C(=O)OR0, -C(=O)-NH2, -C(=O)NHR0, -C(=O)N(R0)2, -ОН, -O(CH2)1-2O-, -OR0, -OC(=O)H, -OC(=O)R0, -OC(=O)OR0, -OC(=O)NHR0, -OC(=O)-N(R0)2, -SH, -SR0, -SO3H, -S(=O)1-2-R0, -S(=O)1-2NH2, -NH2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -NH-C(=O)R0, -NHC(=O)OR0, -NHC(=O)NH2, -NHC(=O)NHR0, -NH-C(=O)N(R0)2, -Si(R0)3, -PO(OR0)2.
Что касается «арила» или «гетероарила» под «монозамещенным или полизамещенным» понимают однократное или многократное, например двукратное, трехкратное, четырехкратное или пятикратное, замещение одного или нескольких атомов водорода кольцевой системы.
Особенно предпочтительные заместители арила и гетероарила каждый раз независимо друг от друга, выбранные из -F, -Cl, -Br, -I, -CN, -СНО, -CO2H, -NH2, -NO2, -NHR0, -N(R0)2, -N+(R0)3, -N+(R0)2O-, -SH, -SR0, -OH, -OR0, -C(=O)R0, -CO2R0, -C(=O)NH2, -C(=O)NHR0, -C(=O)N(R0)2, -S(=O)1-2R0, -S(=O)2NH2, -SO3H, =O или -R0. Предпочтительными заместителями являются -F, -Cl, -Br, -I, -OH, -OC1-6-алкил, -O-С(=O)-С1-6-алкил, -SH, -NH2, -NHC1-6-алкил, -N(С1-6-алкил)2, -C(=O)OC1-6-алкил или -С(=O)ОН. Предпочтительны соединения, причем «арил замещенный» или «гетероарил замещенный» означает арил или гетероарил, замещенный с помощью -F, -Cl, -Br, -I, -CN, -СН3, -C2H5, -NH2, -NO2, -SH, -CF3, -ОН, -ОСН3, -ОС2Н5 или -N(CH3)2. Особенно предпочтительными заместителями являются -F, -Cl, -ОН, -SH, -NH2 и -С(=O)ОН.
Соединения согласно изобретению могут находиться в виде отдельного стереоизомера или его смеси, свободных соединений и/или их физиологически совместимых солей и/или сольватов.
Соединения согласно изобретению в зависимости от образца заместителя могут быть хиральными или ахиральными.
Соединения согласно изобретению в зависимости от замещения относительно циклогексанового кольца могут представлять собой изомеры, в которых образец заместителя в 1,4-положении (1-положении: >C(NR1R)R3; 4-положении: >CHNCHQC(=X)R5) также может быть обозначен с помощью син/анти. «Син/анти-изомеры» представляют собой подгруппу стереоизомеров (конфигурационные изомеры).
В одной предпочтительной форме осуществления избыток диастереомеров син-изомера составляет, по меньшей мере, 50%de, предпочтительнее, по меньшей мере, 75%de, еще предпочтительнее, по меньшей мере, 90%de, наиболее предпочтительно, по меньшей мере, 95%de и в особенности, по меньшей мере, 99%de. В другой предпочтительной форме осуществления избыток диастереомеров анти-изомера составляет, по меньшей мере, 50%de, предпочтительнее, по меньшей мере, 75%de, еще предпочтительнее, по меньшей мере, 90%de, наиболее предпочтительно, по меньшей мере, 95%de и в особенности, по меньшей мере, 99%de. Оба диастереомера отличаются своей полярностью так, что в дальнейшем неполярный диастереомер отличается от полярного диастереомера. Оба диастереомера существуют (в случае двух стереоцентров) как пара энантиомеров (RR+SS, соответственно RS+SR).
Приемлемые методы разделения изомеров (диастереомеры) известны специалисту в данной области техники. В качестве примеров могут быть названы колоночная хроматография, препаративная ВЭЖХ и способ кристаллизации. Полярность отвечает, например, за последовательность, в которой оба диастереомера подвергаются элюированию при тонкослойной хроматографии (никаких условий с обращенной фазой (reversed-phase)).
Если соединения согласно изобретению являются хиральными, то они преимущественно находятся в виде рацемата или в обогащенном виде энантиомера. В одной предпочтительной форме осуществления избыток энантиомеров (ее) S-энантиомера составляет, по меньшей мере, 50%ее, предпочтительнее, по меньшей мере 75%ее, еще предпочтительнее, по меньшей мере 90%ее, наиболее предпочтительно по меньшей мере 95%ее и в особенности по меньшей мере 99%ее. В другой предпочтительной форме осуществления избыток энантиомеров (ее) R-энантиомера составляет, по меньшей мере, 50%ее, предпочтительнее, по меньшей мере 75%ее, еще предпочтительнее, по меньшей мере 90%ее, наиболее предпочтительно по меньшей мере 95%ее и в особенности по меньшей мере 99%ее.
Пригодные методы разделения энантиомеров известны специалисту в данной области техники. В качестве примеров могут быть названы препаративная ВЭЖХ на хиральных неподвижных фазах и переведение в диастереомерные промежуточные продукты. Переведение в диастереомерные промежуточные продукты может происходить, например, как солеобразование с помощью хиральных, энантиомерно чистых кислот. После разделения образованных таким образом диастереомеров затем соль снова может быть переведена в свободное основание или другую соль.
Если не указано определенно, то каждая ссылка на соединения согласно изобретению включает все изомеры (например, стереоизомеры, диастереомеры, энантиомеры) в любом соотношении компонентов смеси.
Если не указано определенно, то каждая ссылка на соединения согласно изобретению включает свободные соединения (т.е. формы, которые находятся не в виде соли) и все физиологически совместимые соли.
В целях описания физиологически совместимые соли соединений согласно изобретению находятся в виде солей с анионами или кислот соответствующего соединения с неорганическими, соответственно, органическими кислотами, которые являются физиологически совместимыми - в особенности при применении у человека и/или млекопитающего.
Примерами физиологически совместимых солей определенных кислот являются соли: соляной кислоты, бромистоводородной кислоты, серной кислоты, метансульфоновой кислоты, муравьиной кислоты, уксусной кислоты, щавелевой кислоты, янтарной кислоты, яблочной кислоты, винной кислоты, миндальной кислоты, фумаровой кислоты, молочной кислоты, лимонной кислоты, глутаминовой кислоты, сахариновой кислоты, монометилсебациновой кислоты, 5-оксо-пролина, гексан-1-сульфоновой кислоты, никотиновой кислоты, 2-, 3- или 4-аминобензойной кислоты, 2,4,6-триметил-бензойной кислоты, α-липоновой кислоты, ацетилглицина, ацетилсалициловой кислоты, гиппуровой кислоты и/или аспарагиновой кислоты. Особенно предпочтительны гидрохлорид, цитрат и полуцитрат.
Физиологически совместимыми солями с катионами или основаниями являются соли соответствующего соединения - как анион с, по меньшей мере, одним, преимущественно неорганическим, катионом, которые являются физиологически совместимыми - в особенности при применении у человека и/или млекопитающего. Особенно предпочтительны соли щелочных и щелочноземельных металлов, а также соли аммония, но в особенности соли (моно-) или (ди-) натрия, (моно-) или (ди-) калия, магния или кальция.
В дальнейшем поясняются предпочтительные в каждом случае формы осуществления соединений согласно изобретению. Если не указано определенно, то имеют силу все в каждом случае поясненные ранее определения заместителей (т.е. например, от R0 до R7, от Y1 до Y4', Q, Х и т.д.) и, соответственно, их соответствующие предпочтительные формы осуществления и поэтому не повторяются.
Предпочтительные формы осуществления соединений согласно изобретению общей формулы (1) имеют общую формулу (1.1) или (1.2):
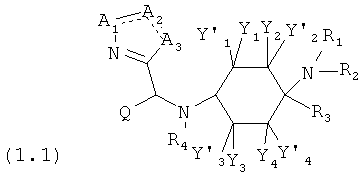
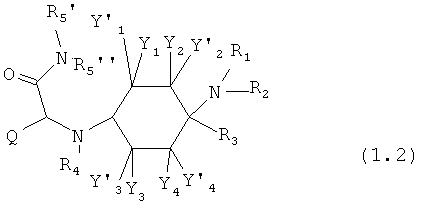
в которой, если имеется,
A1 означает -N=, -NH-, -NR8- или -CR8=;
A2 означает =N-, -C(=O)- или =CR9-;
А3 означает -O-, -NH- или -NR10-; и
R5', R5'', R8, R9 и R10 каждый раз независимо друг от друга означают -Н, =O или -C1-8-алифат.
Предпочтительно R5' и R5'' каждый раз независимо друг от друга означают -Н или -C1-8-алифат.
В целях описания « » означает двойную связь или одинарную связь.
» означает двойную связь или одинарную связь.
Специалист в данной области техники признает, что обычно связь между A1 и А2 не может быть двойной связью, если уже связь между А2 и А3 является двойной связью, и наоборот. Далее специалист в данной области техники признает, что при необходимости определенное количество атомов водорода имеется в качестве заместителей.
Другие предпочтительные формы осуществления соединений согласно изобретению общей формулы (1) имеют общую формулу (2), (3), (4), (5) или (6):
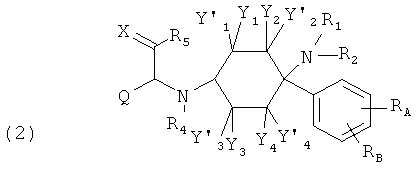
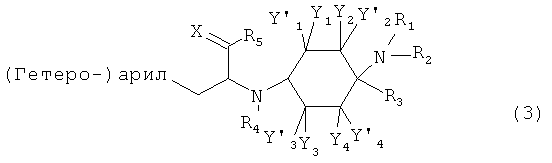
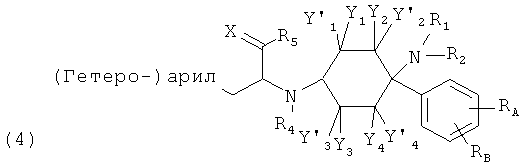
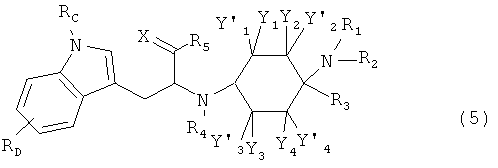
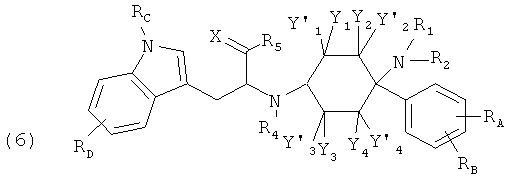
в которой, если имеется,
RA, RB, RC и RD каждый раз независимо друг от друга выбраны из группы, состоящей из -Н, -C1-8-алифат, -ОН, -OC1-8-алифат, -CF3, -F, -С1, -Br, -NO2, -CN, -гетероарил, -C1-8-алифат-арил и -C1-8-алифат-гетероарил; и (гетеро-)арил означает гетероарил или арил.
При этом -арил и -гетероарил каждый раз могут быть незамещенными или монозамещенными или полизамещенными, преимущественно заместителями, которые независимо друг от друга выбраны из группы, состоящей из -C1-8-алифат, -ОН, -OC1-8-алифат, -CF3, -F, -Cl, -Br, -NO2, -CN, -гетероарил, -C1-8-алифат-арил и -C1-8-алифат-гетероарил (например, -этил-4-пиридил).
В одной предпочтительной форме осуществления (гетеро-)арил выбран из группы, состоящей из фенил, бензил, пирролил, фурил, тиенил, пиридил, индолил, бензофурил и бензотиенил, причем они каждый раз могут быть незамещенными или монозамещенными или полизамещенными, преимущественно заместителями, которые независимо друг от друга выбраны из группы, состоящей из -C1-8-алифат, -ОН, -OC1-8-алифат, -CF3, -F, -Cl, -Br, -NO2, -CN, -арил, -гетероарил, -C1-8-алифат-арил и -C1-8-алифат-гетероарил (например, -этил-4-пиридил).
Предпочтительные формы осуществления соединений общей формулы (2) имеют общую формулу (2.1), (2.2), (2.3) или (2.4):
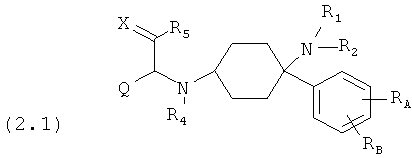
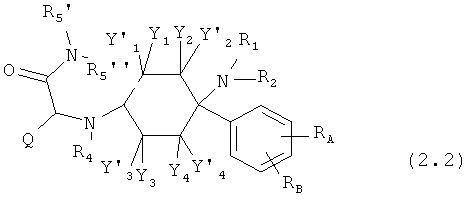

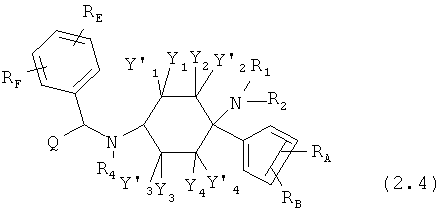
где, если имеется,
RE и RF каждый раз независимо друг от друга выбраны из группы, состоящей из -Н, -C1-8-алифат, -ОН, -OC1-8-алифат, -CF3, -F, -Cl, -Br, -NO2, -CN, -гетероарил, -C1-8-алифат-арил и -C1-8-алифат-гетероарил.
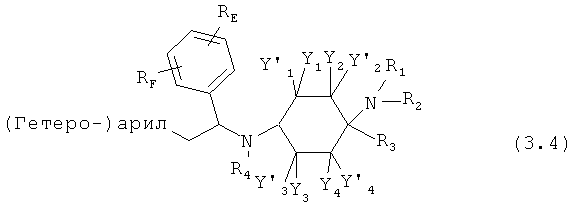
Предпочтительные формы осуществления соединений общей формулы (3) имеют общую формулу (3.1), (3.2), (3.3) или (3.4);

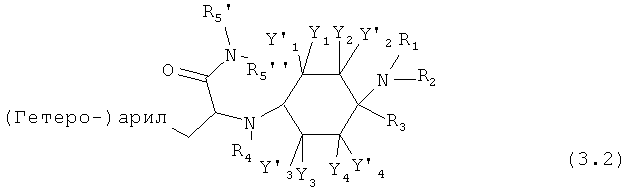
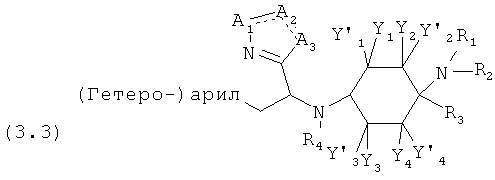
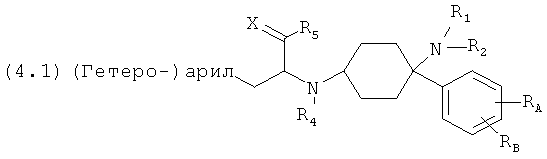
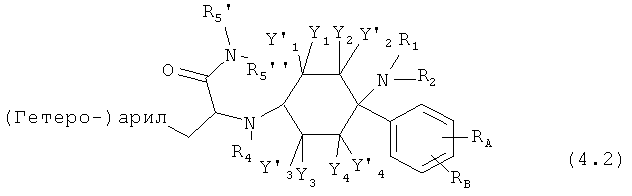
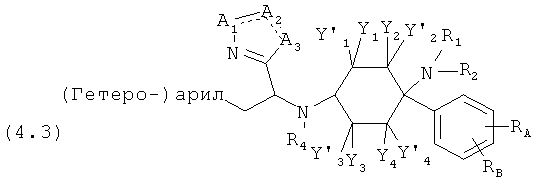
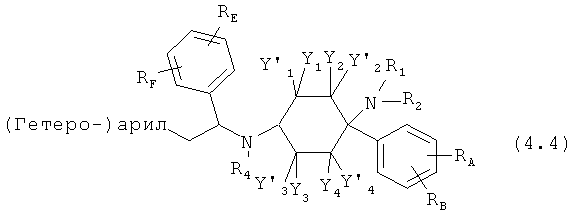
Предпочтительные формы осуществления соединений общей формулы (4) имеют общую формулу (4.1), (4.2), (4.3) или (4.4);
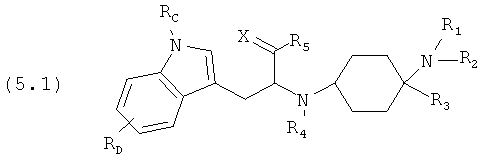
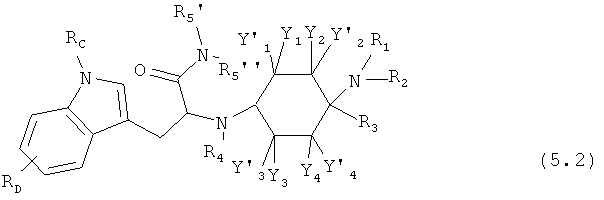
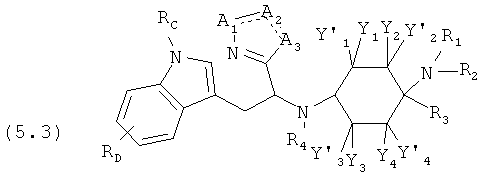
Предпочтительные формы осуществления соединений общей формулы (5) имеют общую формулу (5.1), (5.2), (5.3) или (5.4):
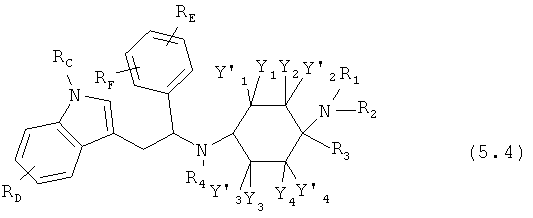
Предпочтительные формы осуществления соединений общей формулы (6) имеют общую формулу (6.1), (6.2), (6.3) или (6.4):
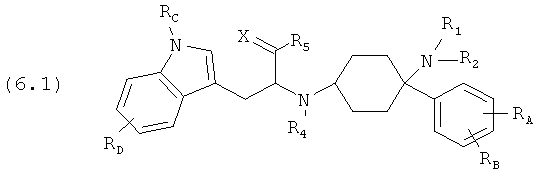
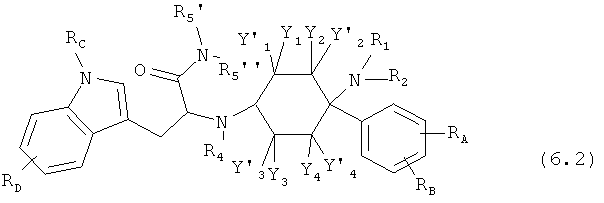
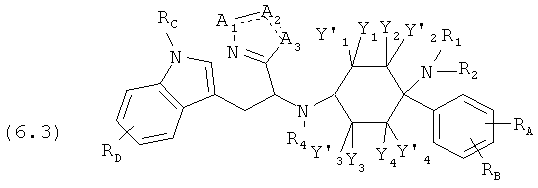
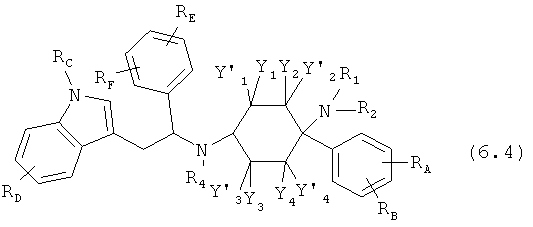
Соединения согласно изобретению определены заместителями, например, посредством R1, R2 и R3 (заместители 1-го поколения), которые со своей стороны при необходимости являются замещенными (заместители 2-го поколения). В зависимости от определения эти заместители заместителей со своей стороны могут быть снова замещены (заместители 3-го поколения). Если, например, Y1=-R0 причем R0=-C1-8-алифат (заместитель 1-го поколения), то -C1-8-алифат со своей стороны может быть замещенным, например, посредством -OR0 причем R0=-арил (заместитель 2-го поколения). Отсюда следует функциональная группа -C1-8-алифат-Оарил. Потом -арил со своей стороны может быть вновь замещенным, например, посредством -Cl (заместитель 3-го поколения). Тогда в целом отсюда следует функциональная группа -C1-8-алифат-Оарил-Cl.
Однако в одной предпочтительной форме осуществления заместители 3-го поколения не могут быть вновь замещенными, т.е. потом нет заместителей 4-го поколения.
В другой предпочтительной форме осуществления заместители 2-го поколения не могут быть вновь замещенными, т.е. в таком случае уже нет заместителей 3-го поколения. Другими словами, в этой форме осуществления функциональные группы для от R0 до R7 каждый раз при необходимости могут быть замещенными, однако соответствующие заместители в таком случае со своей стороны не могут быть вновь замещенными.
В другой предпочтительной форме осуществления уже заместители 1-го поколения не могут быть вновь замещенными, т.е. тогда нет заместителей ни 2-го поколения, ни заместителей 3-го поколения. Другими словами, в этой форме осуществления функциональные группы для от R0 до R7 каждый раз не могут быть замещенными.
В высшей степени предпочтительны соединения из группы:
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид;
- (±)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид;
- (±)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N,N-диметилпропанамид;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N,N-диметилпропанамид;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N-метилпропанамид;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N-метилпропанамид;
- 5-((S)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-он;
- 5-((S)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-он;
- N4-((S)-2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин;
- 5-((R)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(ЗН)-он;
- 5-((R)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(ЗН)-он;
- N4-((R)-2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин;
- N4-((R)-2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин;
- N4-((S)-2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин;
- N4-((S)-2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N1, N1-диметил-1-фенилциклогексан-1,4-диамин;
- N4-(2-(1Н-индол-3-ил)-1-(1Н-тетразол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин;
- N4-(2-(1Н-индол-3-ил)-1-фенилэтил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин;
- N4-(2-(1Н-индол-3-ил)-1-(1Н-тетразол-5-ил)этил)-N1,N1,N4-триметил-1-фенилциклогексан-1,4-диамин;
- N4-(2-(1Н-индол-3-ил)-1-фенилэтил)-N1,N1,N4-триметил-1-фенилциклогексан-1,4-диамин;
- N4-(2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N1,N1,N4-триметил-1-фенилциклогексан-1,4-диамин;
- N4-(2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N1,N1,N4-триметил-1-фенилциклогексан-1,4-диамин;
- 5-(1-((4-(диметиламино)-4-фенилциклогексил)(метил)амино)-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-он;
- 2-((4-(диметиламино)-4-фенилциклогексил)(метил)амино)-3-(1Н-индол-3-ил)-N,N-диметилпропанамид;
- N4-(2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-1-(3-фторфенил)-N1,N1-диметилциклогексан-1,4-диамин;
- N4-(2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-1-(3-фторфенил)-N1,N1-диметилциклогексан-1,4-диамин;
- N-(2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N-(4-(диметиламино)-4-(3-фторфенил)циклогексил)коричной кислоты амид; и
- N-(2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N-(4-(диметиламино)-4-(3-фторфенил)циклогексил)коричной кислоты амид;
- (R)-N4-(2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин;
- (S)-N4-(2-(1Н-индол-3-ил)-1-(4-метилтиазол-2-ил)этил)-N1,N1-диметил-1-фенилцикло-гексан-1,4-диамин;
- (R)-N4-(2-(1Н-индол-3-ил)-1-(4-метилтиазол-2-ил)этил)-N1,N1-диметил-1-фенилцикло-гексан-1,4-диамин;
- N4-(2-(1Н-индол-3-ил)-1-фенилэтил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин дигидрохлорид;
- N-(2-(1Н-индол-3-ил)-1-(1Н-тетразол-5-ил)этил)-N-(4-диметиламино-4-фенилциклогексил)-2,2,2-трифторацетамид;
- N4-(2-(1Н-индол-3-ил)-1-(1Н-тетразол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин;
или их физиологически совместимые соли и/или сольваты.
Соединения согласно изобретению воздействуют, например, на релевантный в связи с различными заболеваниями ORL1-рецептор, так что они пригодны в качестве фармацевтического действующего вещества в лекарственном средстве.
Поэтому другой объект изобретения относится к лекарственным средствам, которые содержат, по меньшей мере, одно соединение согласно изобретению, а также при необходимости пригодные добавки, и/или вспомогательные вещества, и/или при необходимости другие действующие вещества.
Соединения согласно изобретению обладают сродством к µ-опиоидному рецептору, соответственно, к ORL1-рецептору и поэтому пригодны для разработки лекарственных средств.
Лекарственные средства согласно изобретению наряду с, по меньшей мере, одним соединением согласно изобретению при необходимости содержат пригодные добавки и/или вспомогательные вещества, а также носители, наполнители, растворители, разбавители, красители и/или связующие вещества и могут применяться как жидкие лекарственные формы в виде растворов для инъекций, капель или соков, как полутвердые лекарственные формы в виде гранул, таблеток, пеллет, патчей, капсул, пластырей/распылительных пластырей или аэрозолей. Выбор вспомогательных веществ и т.д., а также их используемые количества зависят от того, как должно применяться лекарственное средство: орально, перорально, парентерально, внутривенно, внутрибрюшинно, внутрикожно, внутримышечно, интраназально, буккально, ректально или местно, например на кожу, слизистые оболочки или в глаза. Для орального применения пригодны препараты в виде таблеток, драже, капсул, гранул, капель, соков и сиропов, для парентерального, местного и ингаляционного применения пригодны растворы, суспензии, легко восстанавливаемые сухие препараты, а также спреи. Соединения согласно изобретению являются пригодными чрескожными препаратами для применения в форме с замедленным высвобождением, в растворенном виде или в пластыре, при необходимости с добавлением средств, способствующих кожному проникновению. Препаративные формы, применяемые орально или чрескожно, могут замедленно высвобождать соединения согласно изобретению. Соединения согласно изобретению могут также применяться в парентеральных формах пролонгированного действия, таких как, например, имплантаты или имплантационные насосы. В принципе, к лекарственным средствам согласно изобретению могут добавляться другие действующие вещества, известные специалисту в данной области техники.
Количества вводимого пациентам действующего вещества варьируются в зависимости от веса пациента, от вида применения, показания и степени тяжести заболевания. Обычно применяют от 0,00005 до 50 мг/кг, предпочтительно от 0,001 до 0,5 мг/кг, по меньшей мере, одного соединения согласно изобретению.
Для всех указанных выше форм лекарственных средств согласно изобретению является особенно предпочтительным, если лекарственное средство наряду с, по меньшей мере, одним соединением согласно изобретению содержит еще одно другое действующее вещество, в особенности опиоид, преимущественно сильный опиоид, в особенности морфин, или анестетик, преимущественно содержит гексобарбитал или галотан.
В предпочтительной форме лекарственного средства содержащееся соединение согласно изобретению находится в виде чистого диастереомера и/или энантиомера.
В особенности ORL1-рецептор был идентифицирован в возникновении боли. Соответственно, соединения согласно изобретению могут применяться для получения лекарственного средства для лечения боли, в особенности острой, невропатической или хронической боли.
Поэтому другой объект изобретения относится к применению соединения согласно изобретению для получения лекарственного средства для лечения боли, в особенности острой, висцеральной, невропатической или хронической боли.
Другой объект изобретения относится к применению одного соединения согласно изобретению для получения лекарственного средства для лечения состояний страха, стресса и связанных со стрессом синдромов, депрессий, эпилепсии, болезни Альцгеймера, старческого слабоумия, общих познавательных дисфункций, нарушений обучения и памяти (как ноотроп), синдромов отмены, злоупотребления алкоголем и/или злоупотребления наркотиками и/или лекарствами и/или алкогольной, наркотической и/или медикаментозной зависимости, сексуальных дисфункций, сердечно-сосудистых заболеваний, гипотонии, гипертензии, тиннитуса, зуда, мигрени, тугоухости, недостаточной подвижности кишечника, нарушений приема пищи, анорексии, ожирения, локомоторных расстройств, диареи, кахексии, недержания мочи, соответственно, как мышечный релаксант, противосудорожное средство или анестетик, соответственно, для совместного приема при лечении с опиоидным анальгетиком или с анестетиком, для диуреза или антинатрийуреза, для модуляции двигательной активности, для модуляции распределения нейромедиаторов и лечения связанных с этим нейродегенеративных заболеваний и для лечения синдромов отмены и/или для снижения наркотического потенциала опиоидов.
При этом в одном из указанных выше применений может быть предпочтительным, если применяемое соединение находится в виде чистого диастереомера и/или энантиомера, в виде рацемата или в виде неэквимолярной или эквимолярной смеси диастереомеров и/или энантиомеров.
Другой объект изобретения относится к способу лечения, в особенности, при одном из указанных выше показаний, нечеловеческого млекопитающего или людей, которому или которым необходимо лечение болей, в особенности хронических болей, путем введения терапевтически эффективной дозы соединения согласно изобретению, или лекарственного средства согласно изобретению.
Другой объект изобретения относится к способу получения соединений согласно изобретению, как приведено в последующем описании и примерах.
Синтез соединений типа 1
а) метод 1
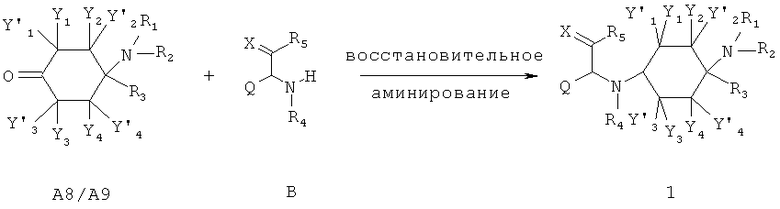
Кетоны общей формулы А8/А9 могут путем восстановительного аминирования подвергают взаимодействию с аминами общей структуры В в, по меньшей мере, одном органическом растворителе, преимущественно из группы, состоящей из диэтиловый эфир, тетрагидрофуран, метанол, этанол, дихлорэтан, дихлорметан и толуол, при добавлении по меньшей мере одного восстановителя, преимущественно из группы, состоящей из боран-пиридинового комплекса, боргидрид натрия, триацетоксиборгидрида натрия, цианоборгидрида натрия и триэтилсилана при необходимости в присутствии, по меньшей мере, одной кислоты, преимущественно выбранной из группы, состоящей из муравьиной кислоты, уксусной кислоты, соляной кислоты и трифторуксусной кислоты при температурах преимущественно от -70°С до 150°С при необходимости при облучении микроволнами до получения соединений общей формулы 1. При необходимости в соединениях общей формулы 1 с R4=H затем ацилируестя, алкилируется или сульфонируется или в соединениях R4=защищенному защитной группой H, по меньшей мере, один раз защитная группа отщепляется и при необходимости ацилируется, алкилируется или сульфонируется.
б) метод 2
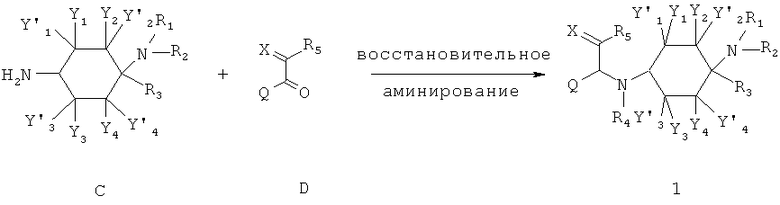
Альтернативно этому могут подвергать взаимодействию амины общей структуры С с кетонами общей структуры D в смысле восстановительного аминирования (см. выше) до получения соединений общей формулы 1.
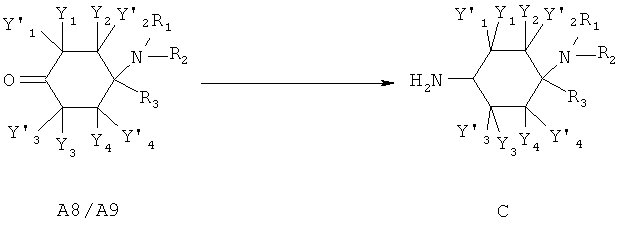
Амины общей структуры С могут быть получены из кетонов общей структуры А8/А9 согласно методам, известным специалисту в данной области техники, например путем переведения в соответствующие оксимы и последующего восстановления.
Синтез кетонового элементарного звена А8/А9
а) Дериватизация в 2,3,5 и/или 6-положении циклогександионкеталей
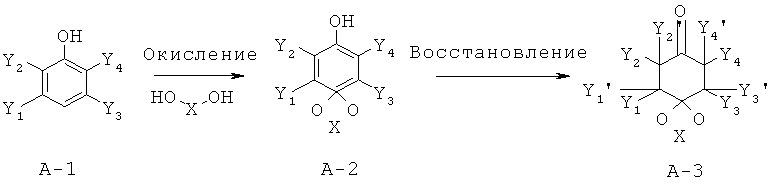
Замещенные циклогександионкетали типа А-3 могут быть синтезированы методами, известными специалисту в данной области техники из известных исходных продуктов А-1. В литературных источниках описывается окисление фенолов А-1 с помощью реагентов гипервалентного йода до получения промежуточных циклогексадиенонкеталей А-2 (Rose et al. Can. J. Chem., 74, 1996, 1836). Потом соединения формулы А-3 могут быть получены из соответствующих кеталей А-2, в соответствии с методами, известными специалисту в данной области техники путем восстановления под атмосферой водорода и в присутствии металлических катализаторов, например, на основе родия.
б) Дериватизация во 2-положении циклогександионкеталей
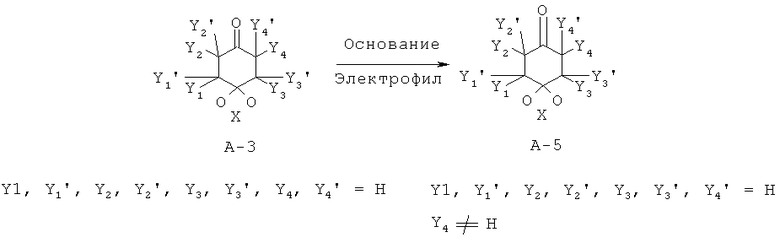
α-замещенные циклогександионкетали общей формулы А-5 путем взаимодействия незамещенных кеталей А-3 могут подвергаться взаимодействию с основанием, например диизопропиламидом лития (LDA), гексаметилдизилазидом лития (LHMDS), гексаметилдизилазидом калия (KHMDS), гидридом натрия (NaH), гидрид калия (КН), метанолат натрия (NaOMe), третбутоксилат калия (KtOBu), аминными основаниями, такими как, например, диэтиламин (HNEt2), диизопропилэтиламин (основание Хюнига (Hünig)), пиперидин, пирролидин, пролин, и с соответствующими электрофилами, например, типа Y4-X (с Х = например, Br, I, OTos, OTf и т.д. и Y4 = например, алкил, бензил) в органических растворителях или смесях растворителей, например дихлорметан (ДХМ), дихлорэтан (ДХЭ), диэтиловый эфир (Et2O), тетрагидрофуран (ТГФ), диметоксиэтан (ДМЭ), метанол (МеОН), этанол (ЕЮН), диметилформамид (ДМФ), диметилсульфоксид (ДМСО) при температурах между -78°С и 150°С. Кроме того, генерированный анион может подвергаться взаимодействию с соответствующими акцепторными системами Михаэля. Введение гетероатомов может происходить путем взаимодействия с соединениями дисеры (Y4 = S-алкил или S-арил), соответствующими электрофильными и фторирующими реагентами, такими как, например, Selectfluor™ (Y4=F), соответствующими электрофильными реагентами аминирования, такими как, например, N-алкоксикарбонил- или N-карбоксамидо-оксазиридин (Y4=NR2) или соответсвующими электрофильными реагентами гидроксилирования, такими как, например, оксодипероксимолибден(пиридин)(гексаметилфосфортриамид)-комплекс (MoOPH (Y4=ОН). Альдольноподобные взаимодействия могут также происходить в кислой среде. Кроме того, заместители могут быть введены с помощью реакции Манниха при кислых условиях (камфорсульфоновая кислота, p-TosOH и т.п.).
Синтезы производных циклогексанона с общей формулой А-3 известны из литературных источников (WO 05066183, WO 040043967, WO 0290317, US 4065573, Lednicer et al., J. Med. Chem., 23, 1980, 424-430).
в) Синтез аминоциклогексанонов
(1) аминонитрил-/триазоловый путь
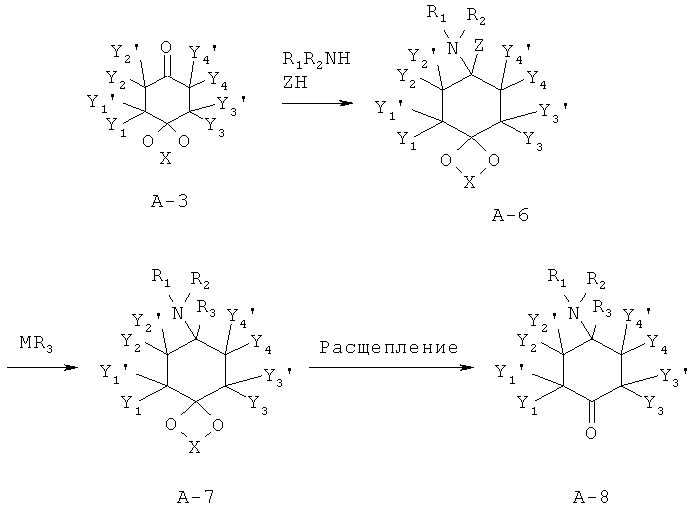
Структуры формулы А-6 могут быть получены путем реакции кетонов А-3 с аминами и кислотными реактантами Z-H. Пригодными реактантами Z-H являются, например, цианид водорода, 1,2,3-триазол, бензотриазол или пиразол.
Особенно предпочтительным путем до получения соединений структуры А-6 является взаимодействие кетонов с цианидами металлов и соответствующим амином в присутствии кислоты, преимущественно в спирте, при температурах от -40 до 60°С, преимущественно при комнатной температуре с цианидами щелочного металла в метаноле.
Другим особенно предпочтительным путем до получения соединений структуры А-6 является взаимодействие кетонов с 1,2,3-триазолом и соответствующим амином в присутствии при обезвоживающих условиях, преимущественно с применением водоотделителя при повышенной температуре в инертном растворителе или с применением молекулярного сита или другого осушителя. Аналогично могут быть введены А-6 аналогичные структуры с бензотриазоловыми группами или пиразоловыми группами вместо триазоловых групп.
В общем, кетали А-7 также могут быть получены путем замещения пригодных уходящих групп Z в структурах формулы А-6. Пригодными уходящими группами предпочтительно являются цианогруппы; 1,2,3-триазол-1-ил-группы. Другими пригодными уходящими группами являются 1H-бензо[дн.][1,2,3]триазол-1-ил-группы и пиразол-1-ил-группы (Katritzky et al., Synthesis 1989, 66-69).
Особенно предпочтительным путем до получения соединений структуры А-7 является взаимодействие аминонитрилов А-6 с соответствующими металлорганическими соединениями, преимущественно соединениями Гриньяра, преимущественно в простых эфирах, преимущественно при КТ. Металлорганические соединения или являются коммерчески доступными, или могут быть получены согласно известным методам. Другим особенно предпочтительным путем до получения соединений структуры А-7 является взаимодействие аминотриазолов А-6 с соответствующими металлорганическими соединениями, преимущественно соединениями Гриньяра, преимущественно в простых эфирах, преимущественно при КТ.
Металлорганические соединения или являются коммерчески доступными, или могут быть получены согласно методам, известным из литературных источников.
Соединения формулы А-8 могут быть выделены из соответствующих кеталей А-7, или из их солей, в соответствии с методами, известными специалисту в данной области техники путем снятия защиты с помощью кислот. При этом Х выбран из группы алкил, алкил/ алкилиден/ с арил или алкил (насыщенный/ненасыщенный) замещенным алкилиденом.
(2) иминный путь
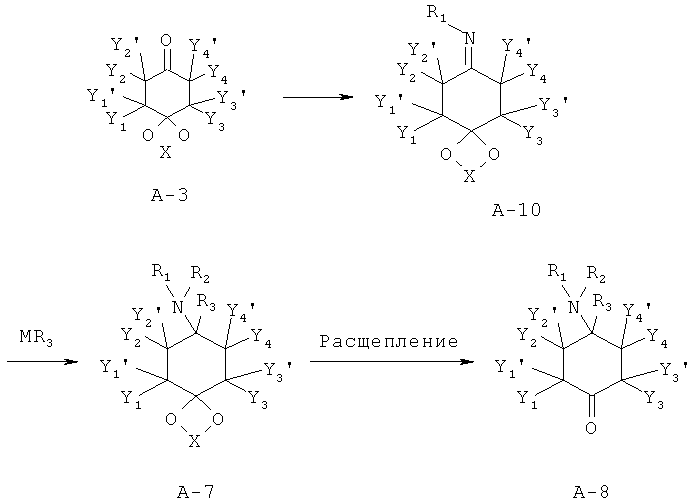
В иминном пути из предшественника кетона А-3 синтезируют имин А-10, который с применением нуклеофила MR3 переводят в элементарное звено А-7 и далее в А-8. Необходимые иминные элементарные звенья А-10 могут быть получены методами, известными специалисту в данной области техники (Layer, Chem. Rev., 1963, 8, 489-510). Для присоединения металлорганических соединений MR3 к имину А-10 прибегали к способу, известному из литературных источников (например, Maddox et al., J. Med. Chem., 1965, 8, 230-235; Kudzma et al., J. Med. Chem., 1989, 32, 2534-2542).
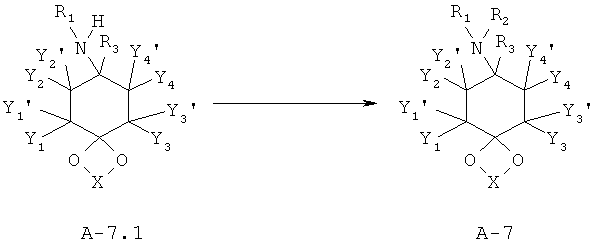
Аминоацетали А-7.1 с максимально одним заместителем в атоме азота в принципе в соответствии с известным специалисту в данной области техники способом, например, посредством восстановительного аминирования могут быть переведены в соответствующие аминоацетали А-7 с одним или двумя другими заместителями (R2≠Н) в азоте.
г) Дериватизация во 2-положении аминоциклогексанонов
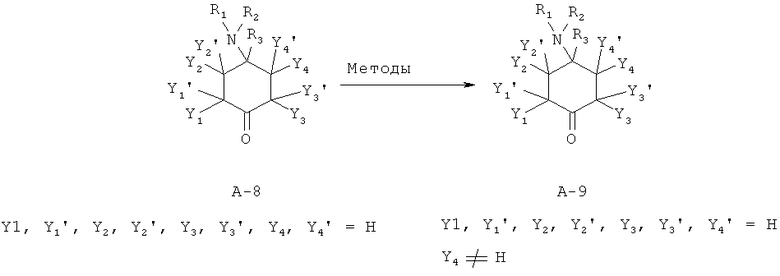
Замещенные аминоциклогексаноны типа А-9 могут быть синтезированы методами, известными специалисту в данной области техники, из известных исходных продуктов А-8.
Метод 1:
В литературных источниках описано α-арилирование кетонов А-8 с соответствующими арилгалогенидами, например, типа Y1-X (с Y1 = арил/гетарил и Х=Br, I) путем палладиевого катализа в присутствии пригодных фосфиновых лигандов, таких как, например, ксантфос (Xantphos) (Elliott et al. Bioorg. Med. Chem. Lett.; EN; 16; 11; 2006; 2929; Dirat et al. Tetrahedron Lett.; EN; 47; 8; 2006; 1295).
Метод 2:
α-замещенные аминоциклогексаноны типа А-9 могут подвергать взаимодействию путем взаимодействия незамещенных кеталей А-8 с основанием, например, диизопропиламид лития (LDA), гексаметилдизилазид лития (LHMDS), гексаметилдизилазид калия (KHMDS), гидрид натрия (NaH), гидрид калия (КН), метанолат натрия (NaOMe), третбутоксилат калия (KtOBu), аминные основания, такие как, например, диэтиламин (HNEt2), диизопропилэтиламин (основание Хюнига (Hünig)), пиперидин, пирролидин, пролин, и с соответствующими электрофилами, например, типа Y4-X (с Х = например, Br, I, OTos, OTf и т.д.) в органических растворителях или смесях растворителей, например, дихлорметан (ДХМ), дихлорэтан (ДХЭ), диэтиловый эфир (Et2O), тетрагидрофуран (ТГФ), диметоксиэтан (ДМЭ), метанол (МеОН), этанол (EtOH), диметилформамид (ДМФ), диметилсульфоксид (ДМСО) при температурах между -78°С и 150°С. Кроме того, генерированный анион может подвергаться взаимодействию с соответствующими акцепторными системами Михаэля. Введение гетероатомов может происходить путем взаимодействия с соединениями дисеры (Y4 = S-алкил или S-арил), соответствующими электрофильными фторирующими реагентами, такими как, например, Selectfluor™ (Y4=F), соответствующими электрофильными аминирующими реагентами, такими как, например, N-алкоксикарбонил- или N-карбоксамидо-оксазиридин (Y4=NR2) или соответствующими элетрофильными гидроксилирующими реагентами, такими как, например, оксодипероксимолибден(пиридин)(гексаметилфосфортриамид)-комплекс (MoOPH (Y4=ОН). Альдольноподобные взаимодействия могут также осуществляться в кислой среде. Кроме того, заместители могут быть введены с помощью реакции Манниха при кислотных условиях (камфорсульфоновая кислоты, p-TosOH и т.д.).
Синтез аминного элементарного звена типа В
а) аминные элементарные звенья В.1 для синтеза соединений типа 1-b

В стадии 1 известные из литературных источников или коммерчески доступные производные альфа-аминокарбоновой кислоты общей формулы Ia, в которой R11 представляет собой водород, алкил, арил или остатки, которые обычно служат для активирования карбоновых кислот (например, N-сукцинимидил или хлорид), и R12 - типичные аминные защитные группы (например, трет-бутокси карбон ил или бензилоксикарбонил), переводят в производные альфа-аминокарбоновой кислоты формулы Ib, в которых R13 представляет, например, следующие остатки: -NH2, -NH-NH2, -NH-CH2-C≡CH, -NH-CH2-CH2-OH, -O-N=С(NH2)-СН3.
В стадии 2 из соединений общей формулы Ib выделяют соединения общей формулы Ic, тем что соединения общей формулы Ib за одну или несколько стадий подвергают превращению до получения ароматических и неароматических гетероциклов общей формулы Ic. Так, например, из соединений общей формулы Ib с R13 равен -NH2 после дегидратации с обычными реагентами, такими как, например, трифторацетангидрид, получают соответствующие нитрилы, которые подвергают взаимодействию путем реакции с азидами до получения производных 1Н-тетразол-5-ила, путем реакции с гидроксиламином и реакции промежуточных продуктов с уксусным ангидридом до получения производных 5-метил-[1,2,4]-оксадиазол-3-ила или путем реакции с C1-элементраным звеном, как, например, N,N-диметилформамиддиметилацеталь и дальнейшей реакции промежуточного продукта с гидроксиламином до получения производных [1,2,4]оксадиазол-5-ила.
Из соединений общей формулы Ib с R13 равен -NH-NH2 после реакции с С1-элементраными звеньями, такими как, например, фосген или N,N'-карбонилдиимидазол получают производные 3Н-[1,3,4]оксадиазол-2-он-5-ила. Из соединений общей формулы Ib с R13 равен -NH-CH2-C≡CH путем воздействия каталитических количеств солей металлов, таких как, например, соли золота(III) или соли ртути(II), получают производные 5-метилоксазол-2-ила.
Из соединений общей формулы Ib с R13 равен NH-CH2-CH2-OH путем дегидратации с обычными реагентами, такими как, например, N,N-диэтиламиносеры трифторид или метоксикарбонилсульфамоил-триэтиламмония-гидроксид (реагент Бургесса), получают производные оксазолин-2-ила, которые путем окисления вступают в реакцию до получения оксазолов. Из соединений общей формулы Ib с R13 равен -O-N=С(NH2)-СН3 после дегидратации в присутствии, например, молекулярного сита образуются производные 3-метил-[1,2,4]оксадиазол-5-ила.
Синтезы гетероциклов согласно описанным выше путям известны из литературных источников (V. Bavetsias et al., J. Med. Chem. 43, 2000, 1910-1926; A. Hamze et al., J. Org. Chem. 68, 2003, 7316-7321; S. Lee et al., Bull. Korean Chem. Soc. 25, 2004, 207-212; A. S. К. Hashmi et al., Org. Lett. 6, 2004, 4391-4394; Т. Morwick et al., Org. Lett. 4, 2002, 2665-2668; К. Thompson et al., J. Med. Chem. 41, 1998, 3923-3927).
Для пояснения стадии 2
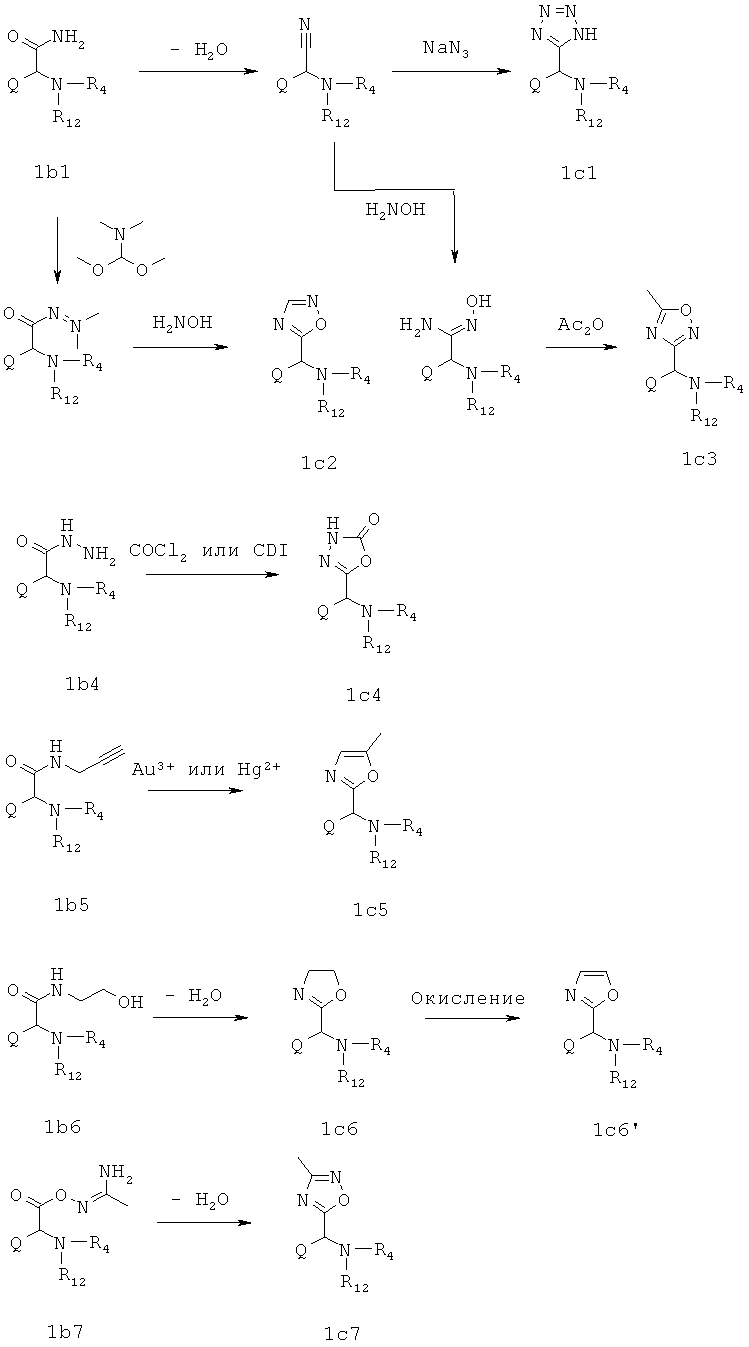
В стадии 3 из соединений общей формулы 1с защитные группы отщепляются обычным образом, вследствие чего получают соединения общей формулы В.1.
b) аминные элементарные звенья В.2 для синтеза соединений типа 1а
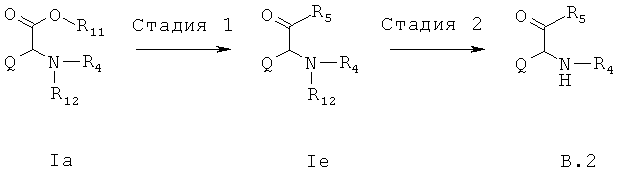
В стадии 1 из известных из литературных источников или коммерчески доступных производных альфа-аминокарбоновой кислоты общей формулы Ia, в которой R11 представляет собой водород, алкил, арил или остатки, которые обычно служат для активирования карбоновых кислот (например, N-сукцинимидил или хлорид), и R12 представляет собой типичные аминные защитные группы (например, трет-бутоксикарбонил или бензилоксикарбонил), переводят в производные альфа-аминокарбоновой кислоты формулы Ie, в которых R5 представляет, например, следующие остатки: -NH2, -NHMe, -NMe2.
В стадии 2 из соединений общей формулы 1е защитные группы отщепляются обычным образом, вследствие чего получают соединения общей формулы В.2.
Относительно других подробностей синтеза соединений согласно изобретению в полном объеме может быть сделана ссылка на WO 2002/090317, WO 2002/90330, WO 2003/008370, WO 2003/008731, WO 2003/080557, WO 2004/043899, WO 2004/043900, WO 2004/043902, WO 2004/043909, WO 2004/043949, WO 2004/043967, WO 2005/063769, WO 2005/066183, WO 2005/110970, WO 2005/110971, WO 2005/110973, WO 2005/110974, WO 2005/110975, WO 2005/110976, WO 2005/110977, WO 2006/018184, WO 2006/108565, WO 2007/079927, WO 2007/079928, WO 2007/079930, WO 2007/079931, WO 2007/124903, WO 2008/009415 и WO 2008/009416.
Примеры
Нижеследующие примеры служат для более подробного пояснения изобретения, однако не должны интерпретироваться как ограничивающие его.
Выходы полученных соединений не являются оптимизированными. Все температуры не поддаются корректировке. Указание «простой эфир» означает диэтиловый эфир, «ЕЕ» - этилацетат, и «ДХМ» - дихлорметан. Указание «эквиваленты» означает эквиваленты количества веществ, «Тпл.» - точка плавления, соответственно область плавления, «Разл.» - разложение, «КТ» - комнатной температуре, «абс.» - абсолютный (безводный), «рац.» - рацемический, «конц.» - концентрированный, «мин» - минуты, «ч» - часы, «дн» - дни, «объемн.%» - объемный процент, «m %» - массовый процент, и «М» представляет собой указание концентрации в моль/л.
В качестве неподвижной фазы для колоночной хроматографии использовали силикагель 60 (0.040-0.063 мм) фирмы Е. Merck, Дармштадт. Исследования тонкослойной хроматографией проводили с помощью готовых пластин ВЭТСХ, силикагель 60 F 254, фирмы Е. Merck, Дармштадт. Соотношение компонентов смеси растворителей для хроматографических исследований постоянно указывается в объемн./объемн.
Пример 1 и Пример 2:
Стадия 1:
(S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид (полярный и неполярный диастереомер)
Гидрохлорид L-триптофанамида (1,49 г, 6,3 ммоль) 15 мин сильно перемешивали с 1,2-дихлорэтан (30 мл), тетрагидрофуран (20 мл) и насыщенным раствором NaHCO3 (40 мл) и потом водную фазу тотчас экстрагировали смесью тетрагидрофуран/этилацетат (1:3, 5×40 мл). После высушивания посредством Na2SO4 органическую фазу концентрировали. Под аргоном растворяли выделенное основание (1,3 г, 6,3 ммоль) и 4-(диметиламино)-4-фенилциклогексанон (1,3 г, 6,3 ммоль) в тетрагидрофуране (40 мл) и 1,2-дихлорэтан (30 мл). К светлому раствору прибавляли ледяную уксусную кислоту (0,37 мл, 6,3 ммоль) и Na2SO4 (3,2 г). После продолжительности реакции в 15 мин реакционную смесь смешивали с NaBH(OAc)3 (2 г, 9 ммоль) и 2 дн перемешивали при комнатной температуре. Для переработки состава смесь смешивали с насыщенным раствором NaHCO3 (60 мл) и 15 мин перемешивали. Водную фазу экстрагировали дихлорметаном (2×40 мл). Объединенные органические фазы после высушивания концентрировали, причем получали светло-коричневое масло.
Хроматографическое разделение смеси веществ происходило на силикагеле 60 (50 г) с этилацетат/метанол (1:1).
Выход (неполярный диастереомер): 25% (631 мг), твердое вещество бежевого цвета
Выход (полярный диастереомер): 298 мг (12%), твердое вещество бежевого цвета
Стадия 2:
(S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид; дигидрохлорид (Пример 1, неполярный диастереомер)
Неполярный диастереомер из стадии 1 (600 мг, 1,4 ммоль) растворяли в этилметилкетоне (1000 мл) и смешивали с Me3SiCl (0,5 мл, 3,7 ммоль). Через 1 ч отсасывали белое, кристаллическое твердое вещество.
Выход: 340 мг (46%)
Точка плавления: 181-214°С
13С ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 22.1, 23.8, 25.0, 26.2, 38.1, 51.2, 58.0, 67.7, 107.2, 111.3, 118.4, 118.5, 120.9, 124.2, 127.2, 128.8, 129.5, 132.6, 135.9, 169.0
(S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид; дигидрохлорид (Пример 2, полярный диастереомер)
К раствору полярного диастереомера из стадии 1 (280 мг, 0,69 ммоль) в этилметилкетоне (20 мл) добавляли Me3SiCl (0,23 мл, 1,7 ммоль). После продолжительности реакции в 1 ч отсасывали твердое вещество.
Выход: 326 мг (93%)
Точка плавления: 201-210°С 13С ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 23.9, 25.4, 26.2, 28.2, 28.3, 37.2, 54.4, 57.6, 67.6, 106.9, 111.3, 118.3, 118.4, 120.9, 124.3, 127.1, 129.1, 129.6, 135.9, 169.1
Пример 3 и Пример 4:
Стадия 1:
2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид дигидрохлорид (полярный и неполярный диастереомер)
D,L-триптофанамид гидрохлорид (1,49 г, 6,25 ммоль) сильно перемешивали 15 мин с 1,2-дихлорэтаном (30 мл), тетрагидрофураном (20 мл) и насыщенным раствором NaHCO3 (40 мл) и потом водную фазу тотчас экстрагировали смесью тетрагидрофуран/этилацетат (1:3, 5×40 мл). После высушивания посредством Na2SO4 органическую фазу концентрировали. Под аргоном выделенное основание (1,03 г, 5,06 ммоль) и 4-(диметиламино)-4-фенилциклогексанон (1,09 г, 5,06 ммоль) растворяли в тетрагидрофуране (40 мл) и 1,2-дихлорэтан (30 мл). К светлому раствору прибавляли ледяную уксусную кислоту (0,291 мл, 5,06 ммоль) и Na2SO4 (2,53 г). После продолжительности реакции в 15 мин реакционную смесь смешивали с NaBH(OAc)3 (1,52 г, 7,08 ммоль) и 2 дн перемешивали при комнатной температуре. Для переработки состава смесь смешивали с насыщенным раствором NaHCO3 (60 мл) и 15 мин перемешивали. Водную фазу экстрагировали дихлорметаном (2×40 мл). Объединенные органические фазы после высушивания концентрировали, причем получали светло-коричневое масло. Хроматографическое разделение смеси веществ на силикагеле 60 (150 г) происходило с этилацетат/метанол (1:1).
Выход (неполярный диастереомер): 821 мг (41%), твердое вещество бежевого цвета
Выход (полярный диастереомер): 377 мг (19%), твердое вещество бежевого цвета
2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид дигидрохлорид (Пример 3, неполярный диастереомер)
Неполярный диастереомер из стадии 1 (870 мг, 2,1 ммоль) растворяли в этилметилкетоне (50 мл) и смешивали с Me3SiCl (0,73 мл, 5,3 ммоль). Через 1 ч отсасывали выпавшее в осадок твердое вещество.
Выход: 900 мг (93%), белое, кристаллическое твердое вещество
Точка плавления: 227-233°С
13С ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 22.1, 23.8, 24.9, 26.2, 38.1, 51.2, 58.0, 67.7, 107.3, 111.3, 118.4, 118.5, 120.9, 124.2, 127.2, 128.8, 129.5, 132.6, 135.9, 169.0
2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропанамид; дигидрохлорид (Пример 4, полярный диастереомер)
К раствору полярного диастереомера из стадии 1 (360 мг, 0,89 ммоль) в этилметилкетоне (250 мл) добавляли Me3SiCl (0,3 мл, 2,2 ммоль). После продолжительности реакции в 1 ч отсасывали выпавшее в осадок твердое вещество.
Выход: 444 мг (100%)
Точка плавления: 201-210°С
13С ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 24.0, 25.4, 26.2, 28.2, 28.3, 37.2, 54.3, 57.6, 67.6, 107.0, 111.3, 118.3, 118.4, 120.9, 124.3, 127.1, 129.1, 129.6, 129.7, 135,9, 169,1
Пример 5 и пример 6:
Стадия 1:
(S)-бензил 1-(диметиламино)-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамат
Под аргоном (S)-2,5-диоксопирролидин-1-ил 2-(бензилоксикарбониламино)-3-(1Н-индол-3-ил)пропаноат (2 г, 4,6 ммоль) растворяли в тетрагидрофуране (60 мл). К светлому раствору прибавляли диметиламин (2М в ТГФ, 4,6 мл, 9,2 ммоль). Сразу же после добавления выпадал белый осадок. Реакционную смесь перемешивали 24 ч при комнатной температуре. Для переработки состав устанавливали посредством 2N HCl до рН 1. Водную смесь экстрагировали этилацетатом (3×40 мл). Объединенные органические фазы промывали насыщенным раствором гидрокарбоната натрия (1×40 мл) и концентрировали после высушивания посредством NaSO4. Сырой продукт без последующей очистки подвергали дальнейшей переработке в следующей реакции.
Выход: 1,6 г (95%)
Стадия 2:
(S)-2-амино-3-(1Н-индол-3-ил)-N,N-диметилпропанамид
(S)-бензил 1-(диметиламино)-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамат (1,88 г, 5,14 ммоль) в абс. метаноле (60 мл) смешивали с палладием в виде катализатора (Pd/C, 5%, 800 мг) и 2 ч гидрировали при КТ (давление водорода: 3 бар). Катализатор удаляли через фритту, снабженную 1 см высокого слоя целита. Фритту тщательно промывали метанолом (400 мл). Растворитель отгоняли в вакууме.
Выход: 1 г (84%)
Стадия 3:
(S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N,N-диметилпропанамид (полярный и неполярный диастереомер)
4-(диметиламино)-4-фенилциклогексанон (1,1 г, 5,41 ммоль) под аргоном растворяли в смеси из 1,2-дихлорэтана (30 мл) и тетрагидрофурана (40 мл), смешивали с (S)-2-амино-3-(1Н-индол-3-ил)-N,N-диметилпропанамидом (1 г, 4,3 ммоль), уксусной кислотой (0,31 мл, 5,41 ммоль) и Na2SO4 (2,7 г). 15 мин перемешивали при КТ и потом смешивали с триацетоксиборгидридом натрия (1,65 г, 7,57 ммоль) и перемешивали 48 часов. Для переработки состава смесь смешивали с насыщенным раствором NaHCO3 (60 мл) и 15 мин перемешивали. Водную фазу экстрагировали дихлорметаном (2×40 мл). Объединенные органические фазы после высушивания концентрировали, причем получали светло-коричневое масло. Хроматографическое разделение смеси веществ на силикагеле 60 (100 г) происходило с этилацетат/метанол (1:1).
Выход (неполярный диастереомер): 250 мг (11%), твердое вещество бежевого цвета
Выход (полярный диастереомер): 430 мг (18%), твердое вещество бежевого цвета
Стадия 4:
(S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N,N-диметилпропанамид дигидрохлорид (Пример 5, неполярный диастереомер)
(S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N,N-диметилпропанамид (240 мг, 0,55 ммоль, неполярный диастереомер из стадии 3) растворяли в этилметилкетоне (10 мл) и смешивали с Me3SiCl (0,18 мл, 1,39 ммоль). Через 1 ч отсасывали белое, кристаллическое твердое вещество.
Выход: 160 мг (54%)
Точка плавления: 189-204°С 13С ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 22.7, 24.0, 24.8, 25.0, 26.5, 35.4, 36.3, 38.8, 51.5, 55.1, 67.7, 106.6, 111.5, 118.1, 118.5, 121.2, 124.5, 127.0, 128.8, 128.9, 129.4, 132.7, 135.9, 167.6
(S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N,N-диметилпропанамид дигидрохлорид (Пример 6, полярный диастереомер)
К раствору (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N,N-диметилпропанамида (420 мг, 0,9 ммоль, полярный диастереомер из стадии 3) в этилметилкетоне (10 мл) добавляли Me3SiCl (0,3 мл, 2,4 ммоль). После продолжительности реакции в 1 ч отсасывали твердое вещество.
Выход: 460 мг (93%)
Точка плавления: 199-212°С 13С ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 24.5, 25.2, 26.6, 28.3, 28.6, 35.3, 36.1, 37.2, 54.4, 54.5, 67.5, 106.3, 111.5, 117.9, 118.5, 121.1, 124.6, 127.0, 129.1, 129.5, 129.6, 135.9, 167.6
Пример 7 и Пример 8:
Стадия 1:
(S)-бензил 3-(1Н-индол-3-ил)-1-(метиламино)-1-оксопропан-2-илкарбамат
Под аргоном растворяли (S)-2,5-диоксопирролидин-1-ил 2-(бензилоксикарбониламино)-3-(1Н-индол-3-ил)пропаноат (1,5 г, 3,4 ммоль) в тетрагидрофуране (10 мл). К этому светлому раствору прибавляли метиламин (2М в ТГФ, 3,4 мл, 6,88 ммоль). Сразу же после добавления выпадал белый осадок. Реакционную смесь 24 ч перемешивали при комнатной температуре. Для переработки состав устанавливали с помощью 2N HCl до рН 1. Водную смесь экстрагировали этилацетатом (3×40 мл). Объединенные органические фазы промывали насыщенным раствором гидрокарбоната натрия (1×40 мл) и концентрировали после высушивания посредством NaSO4. Сырой продукт без последующей очистки подвергали дальнейшей переработке в следующей реакции.
Выход: 1,19 г (100%)
Стадия 2:
(S)-2-амино-3-(1Н-индол-3-ил)-N-метилпропанамид
(S)-бензил 3-(1Н-индол-3-ил)-1-(метиламино)-1-оксопропан-2-илкарбамат (187 мг, 0,5 ммоль) в абс. метаноле (30 мл) смешивали с палладием в виде катализатора (Pd/C, 5%, 80 мг) и 2 ч гидрировали при КТ (давление водорода: 3 бар). Катализатор удаляли через фритту, снабженную 1 см высокого слоя целита. Фритту метанол (200 мл) тщательно промывали. Растворитель отгоняли в вакууме.
Выход: 108 мг (99%)
Стадия 3:
(S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N-метилпропанамид (полярный и неполярный диастереомер)
4-(диметиламино)-4-фенилциклогексанон (781 мг, 3,6 ммоль) растворяли под аргоном в смеси из 1,2-дихлорэтана (20 мл) и тетрагидрофурана (30 мл), смешивали с (S)-2-амино-3-(1Н-индол-3-ил)-N-метилпропанамидом (790 мг, 3,6 ммоль), уксусной кислотой (0,2 мл, 3,6 ммоль) и Na2SO4 (1,8 г), 15 мин перемешивали при КТ и потом смешивали с триацетоксиборгидридом натрия (1,1 г, 5,04 ммоль). После 48 ч перемешивания при КТ исходный продукт не обнаруживался посредством тонкослойной хроматографии. Для переработки состава смесь смешивали с насыщенным раствор NaHCO3 (60 мл) и 15 мин перемешивали. Водную фазу экстрагировали дихлорметаном (2×40 мл). Объединенные органические фазы после высушивания концентрировали, причем получали светло-коричневое масло. Хроматографическое разделение смеси веществ на силикагеле 60 (100 г) происходило с этилацетатом/метанол (1:1).
Выход (неполярный диастереомер): 500 мг (33%), твердое вещество бежевого цвета
Выход (полярный диастереомер): 217 мг (14%), твердое вещество бежевого цвета
((S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N-метилпропанамид дигидрохлорид (Пример 7, неполярный диастереомер)
(S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N-метилпропанамид (480 мг, 1,15 ммоль, неполярный диастереомер из стадии 3) растворяли в этилметилкетоне (50 мл) и смешивали с Me3SiCl (0,39 мл, 2,8 ммоль). Через 1 ч отсасывали твердое вещество.
Выход: 570 мг (96%), белое, кристаллическое.
Точка плавления: 238-240°С 13С ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 22.2, 24.0, 24.7, 25.5, 26.1, 38.1, 51.0, 58.6, 67.8, 107.4, 111.4, 118.4, 118.5, 121.0, 124.0, 127.1, 128.9, 129.5, 132.6, 135.9, 167.5
((S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N-метилпропанамид дигидрохлорид (Пример 8, полярный диастереомер)
К раствору (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)-N-метилпропанамида (210 мг, 0,5 ммоль, полярный диастереомер из стадии 3) в этилметилкетоне (20 мл) добавляли Me3SiCl (0,17 мл, 1,26 ммоль). После продолжительности реакции в 1 ч отсасывали твердое вещество.
Выход: 240 мг (97%)
Точка плавления: 199-212°С
13С ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 24.1, 25.3, 25.6, 26.3, 28.2, 28.2, 37.2, 54.1, 57.8, 67.6, 107.0, 111.4, 118.2, 118.4, 120.9, 124.2, 127.0, 129.1, 129.6, 129.8, 135.9, 167.6
Пример 9 и Пример 10:
Стадия 1:
(S)-бензил 1-гидразинил-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамат
Раствор (S)-2-(бензилоксикарбониламино)-3-(1Н-индол-3-ил)пропионовой кислоты (5.00 г, 15 ммоль) в безводном тетрагидрофуране (100 мл) смешивали с 1,1'-карбонилдиимидазолом (2.91 г, 18 ммоль) и 2 ч перемешивали при комнатной температуре. После оконченного газовыделения прибавляли по каплям 1 М раствор гидразина в тетрагидрофуране (75 мл, 75 ммоль) и смесь 2 дня перемешивали при комнатной температуре. Выпавшее в осадок твердое вещество отфильтровывали и высушивали.
Выход: 1.57 г (30%), белое твердое вещество
Точка плавления: 204-208°С 1Н-ЯМР (ДМСО-d6): 2.80 (d, 1H, J=9.4, 14.4 Гц); 3.04 (d, 1H, J=14.7, 4.9 Гц); 4.21 (d, 2H, J=3.0 Гц); 4.23-4.28 (m, 1H); 4.93 (d, 2H, J=1.9 Гц); 6.97 (t, 1H, J=7.4 Гц); 7.06 (dt, 1H, J=7.0, 1.1 Гц); 7.14 (d, 1H, J=2.1 Гц); 7.23-7.37 (m, 6H); 7.40 (d, 1H, J=8.4 Гц); 7.62 (d, 1H, J=7.7 Гц); 9.24 (t, 1H, J=3.3 Гц); 10.79 (s, 1H).
13С-ЯМР (ДМСО-d6): 28.0; 54.1; 65.2; 110.0; 111.2; 118.2; 118.4; 120.8; 123.7; 126.7; 127.2; 127.4; 127.6; 128.2; 136.0; 137.0; 155,6; 171.0.
Стадия 2:
(S)-бензил 2-(1Н-индол-3-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этилкарбамат
Раствор (S)-бензил 1-гидразинил-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамата (1.57 г, 4.4 ммоль) в безводном тетрагидрофуране (220 мл) смешивали с 1,1'-карбонилдиимидазолом (848 мг, 5.23 ммоль) и триэтиламином (529 мг, 725 µл, 5.23 ммоль) и при комнатной температуре перемешивали в течение ночи. Затем реакционную смесь концентрировали в вакууме, и осадок (3.20 г) очищали посредством флеш-хроматографии (200 г, 20×5.7 см) с хлороформ/метанол (95:5).
Выход: 1.41 г (85%), белое твердое вещество
Точка плавления: 82-87°С
1Н-ЯМР (ДМСО-d6); 3.12 (dd, 1H, J=14.5, 8.4 Гц); 3.22 (dd, 1H, J=14.6, 6.9 Гц); 4.73 (q, 1H, J=8.1 Гц); 5.00 (s, 2H); 6.96 (t, 1H, J=7.4 Гц); 7.08 (dt, 1H, J=7.1, 0.9 Гц); 7.14 (d, 1H, J=2.3 Гц); 7.23-7.37 (m, 6H); 7.51 (d, 1H, J=7.8 Гц); 8.03 (d, 1Н,и=8.0 Гц); 10.85(s, 1H); 12.16 (brs, 1H).
13С-ЯМР (ДМСО-d6): 27.1; 48.9; 65.5; 109.0; 111.4; 117.9; 118.4; 120.9; 123.8; 127.0; 127.6; 127.7; 128.3; 136.0; 136.7; 154.7; 155.6; 156.4.
Стадия 3:
(S)-5-(1-амино-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-он
Раствор (S)-бензил 2-(1Н-индол-3-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этилкарбамата (1.41 г, 3.73 ммоль) в безводном тетрагидрофуране (100 мл) смешивали с 10% палладием на активированном угле (160 мг) и гидрировали 24 ч при комнатной температуре и 3 бар. Добавляли другую порцию 20% гидроксида палладия на активированном угле (160 мг) и смесь гидрировали последующие 24 ч при 3 бар и 40°С. Затем катализатор отфильтровывали, фильтрат концентрировали в вакууме и осадок (1.24 г) очищали посредством флеш-хроматографии (100 г, 20×4.0 см) с хлороформ/метанол (95:5).
Выход: 536 мг (59%), белое твердое вещество
Точка плавления: 79-85°С 1Н-ЯМР (ДМСО-d6): 3.01 (dd, 1H, J=14.3, 6.6 Гц); 3.09 (dd, 1H, J=14.2, 7.5 Гц); 3.96 (t, 1H, J=7.0 Гц); 6.96 (dt, 1H, J=7.0, 1.0 Гц); 7.05 (dt, 1H, J=8.1, 1.0 Гц); 7.11 (d, 1H, J=2.3 Гц); 7.32 (d, 1H, J=8.0 Гц); 7.47 (d, 1H, J=7.8 Гц); 10.85 (s, 1H). 13С-ЯМР (ДМСО-d6): 30.4; 49.5; 109.6; 111.4; 117.9; 118.3; 120.8; 123.6; 127.2; 136.0; 155.0; 159.6.
5-((S)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-он гидрохлорид (1:1) (Пример 9, неполярный диастереомер) и 5-((S)-1-(4-(диметиламино)-4-фенили,иклогексиламино)-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-он (Пример 10, полярный диастереомер)
Раствор (S)-5-(1-амино-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-она (485 мг, 1.98 ммоль) и 4-диметиламино-4-фенилциклогексанона (430 мг, 1.98 ммоль) в безводном тетрагидрофуране (40 мл) смешивали с сульфатом натрия (1.00 г) и 2 ч перемешивали при комнатной температуре. После добавления уксусной кислоты (297 мг, 283 µл, 4.95 ммоль) добавляли триацетоксиборгидрид натрия (633 мг, 2.97 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Растворитель затем удаляли в вакууме, осадок смешивали с 1 М раствором карбоната калия (50 мл) и экстрагировали этилацетатом (3×50 мл). Органическую фазу высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт (780 мг) очищали посредством флеш-хроматографии (38 г, 20×2.5 см) этилацетатом/метанол (9:1) и 1% триэтиламин.
Выход (Пример 10, полярный диастереомер): 158 мг (18%), белое твердое вещество
Точка плавления: 115-121°С
1Н-ЯМР (ДМСО-d6): 1.45-1.70 (m, 3H); 1.75-1.90 (m, 2H); 1.90 (s, 6H); 2.4O-2.48 (m, 3H); 2.50-2.56 (m, 2H); 2.98-3.03 (m, 2H); 3.84 (t, 1H, J=7.3 Гц); 6.91-6.96 (m, 1H); 7.01-7.06 (m, 2H); 7.24 (t, 1H, J=7.1 Гц); 7.27-7.41 (m, 6H); 10.8 (s, 1H). 13С-ЯМР (ДМСО-d6): 28.1; 28.9; 29.4; 30.5; 30.7; 38.0; 53.6; 54.8; 60.7; 109.5; 111.4; 117.7; 118.3; 120.8; 123.4; 126.1; 127.0; 127.5; 127.7; 136.0; 136.9; 154.9; 158.1.
[α]D24=-7.1 (c 1.0, MeOH)
Фракцию с неполярным диастереомером еще раз очищали с хлороформ/метанол (5:1). При этом получали гидрохлорид.
Выход (Пример 9, неполярный диастереомер): 426 мг (45%), белое твердое вещество
Точка плавления: 152-161°С
1Н-ЯМР (ДМСО-d6): 1.50-2.00 (m, 5H); 2.10-2.45 (brs, 10Н); 2.50-2.70 (br s, 1H); 3.05-3.20 (m, 2H); 3.88 (brs, 1H); 6.95-7.02 (m, 1H); 7.03-7.10 (m, 1H); 7.17 (br s, 1 H); 7.31-7.36 (m, 1H); 7.50 (br d, 4H, J=7.7 Гц); 7.63 (br s, 2H); 9.80-10.20 (br s, 1H); 10.89 (s, 1H); 12.00 (s, 1H).
13С-ЯМР (ДМСО-d6): 25.4; 27.7; 28.8; 37.1; 47.8; 53.4; 54.8; 109.5; 117.8; 118.4; 120.8; 123.7; 128.5 (очень широкий); 136.0; 154.8; 157.8.
[α]D24=-12.3 (c 1.0, MeOH)
Пример 11
Стадия 1:
N'-гидроксиацетимидамид
Раствор 50% гидроксиламина в воде (3.7 мл, 56 ммоль) смешивали с ацетонитрилом (30 мл) и 24 ч перемешивали при 90°С. Реакционный раствор затем охлаждали до 4°С, причем продукт выкристаллизовывали, отфильтровывали и высушивали в вакууме.
Выход: 2.66 г (64%), белые иголки
Точка плавления: 137°С
1Н-ЯМР (400 МГц, CDCl3): 1.83 (s, 3H), 4.53 (br s, 3H).
13С-ЯМР (100 МГц, CDCl3): 16.9; 151.1.
Стадия 2:
(S)-трет-бутил 1-(1-аминоэтилиденаминоокси)-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамат
Раствор N'-гидроксиацетимидамида (500 мг, 6.74 ммоль) и (S)-2-(трет-бутоксикарбониламино)-3-(1Н-индол-3-ил)пропионовой кислоты (1.7 г, 5.6 ммоль) в дихлорметан/N,N-диметилформамид (30 мл, 9:1) при -10°С смешивали с 1-гидроксибензотриазол-гидратом (910 мг, 6.74 ммоль) и 1,3-дициклогексилкарбодиимид (1.39 г, 6.74 ммоль) и перемешивали 20 мин при этой температуре. Затем 2 ч перемешивали при комнатной температуре. Реакционную смесь концентрировали в вакууме и осадок ресуспендировали в этилацетате. Органическую фазу промывали раствором гидрокарбоната натрия (2×30 мл), водой (30 мл) и раствором хлорида аммония (2×30 мл) и высушивали сульфатом магния.
Выход: 849 мг (42%), бесцветное твердое вещество
Точка плавления: 75-78°С
1Н-ЯМР (300 МГц, ДМСО-d6): 1.33 (s, 9H), 1.76 (s, 3H), 2.98 (dd, J=14.5, 9.1 Гц, 1Н), 3.15 (dd, J=14.5, 5.4 Гц, 1Н), 4.38 (dt, J=8.9, 5.4 Гц, 1Н), 6.36 (br s, 2H), 6.98 (t, J=6.9 Гц, 1Н), 7.06 (t, J=6.9 Гц, 1Н), 7.13 (d, J=2.2 Гц, 1Н), 7.24 (d, J=8.3 Гц, 1Н), 7.33 (d, J=7.9 Гц, 1Н), 7.58 (d, J=7.8 Гц, 1Н), 10.84 (s, 1Н). 13С-ЯМР (100 МГц, ДМСО-d6): 16.4; 27.7; 28.7; 54.6; 79.5; 110.2; 112.0; 118.9; 119.3; 121.8; 124.1; 127.6; 136.5; 156.3; 157.6; 170.5.
Стадия 3:
(S)-трет-бутил 2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этилкарбамат
Раствор (S)-трет-бутил 1-(1-аминоэтилиденаминоокси)-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамата (1.37 г, 4.0 ммоль) в ацетонитриле (40 мл) смешивали с молекулярным ситом 4 Å (500 мг) и 16 ч перемешивали при 120°С в тефлоновом сосуде под давлением. Молекулярное сито затем отфильтровывали и фильтрат концентрировали в вакууме. Остаток очищали посредством флеш-хроматографии (200 г, 20×3.6 см) с хлороформ/метанол/триэтиламин (10:0.2:0.01).
Выход: 879 мг (63%), бесцветное твердое вещество
Точка плавления: 45°С
1Н-ЯМР (300 МГц, ДМСО-d6): 1.33 (s, 9H), 2.31 (s, 3H), 3.22 (dd, J=14.6, 8.4 Гц, 1Н), 3.27 (dd, J=15.0, 6.7 Гц, 1Н), 4.99 (q, J=7.7 Гц, 1Н), 6.98 (t, J=6.8 Гц, 1Н), 7.07 (t, J=6.9 Гц, 1Н), 7.12 (d, J=2.1 Гц, 1Н), 7.33 (d, J=7.9 Гц, 1Н), 7.49 (d, J=7.7 Гц, 1Н), 7.74 (d, J=7.9 Гц, 1Н), 10.87 (s, 1Н).
Стадия 4:
(S)-2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этанамин
Раствор (S)-трет-бутил 2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этилкарбамата (879 мг, 2.6 ммоль) в дихлорметане (6 мл) смешивали с трифторуксусной кислотой (3 мл) и 30 мин перемешивали при комнатной температуре. Реакционную смесь затем концентрировали в вакууме, вследствие чего получали титульное соединение в виде трифторацетата.
Выход: 940 мг (100%), коричневое масло
1Н-ЯМР (300 МГц, ДМСО-d6) 2.30 (s, 3H), 3.40 (dd, J=14.6, 8.4 Гц, 1Н), 3.47 (dd, J=15.1, 5.8 Гц, 1Н), 5.06 (dd, J=8.3, 5.8 Гц, 1Н), 6.98 (t, J=6.9 Гц, 1Н), 7.09 (t, J=7.0 Гц, 1Н), 7.13 (dd, J=5.4, 3.0 Гц, 1Н), 7.36 (d, J=8.0 Гц, 1Н), 7.41 (d, J=7.8 Гц, 1Н), 9.01 (s, 3H), 11.05 (s, 1Н).
Для выделения основания трифторацетат растворяли в дихлорметане (30 мл) и промывали насыщенным раствором карбоната калия (3×20 мл). Органическую фазу высушивали сульфатом натрия и концентрировали в вакууме.
Выход: 640 мг (100%)
N4-((S)-2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (Пример 11, смесь диастереомеров)
Раствор (S)-2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этанамина (180 мг, 0.74 ммоль) и 4-диметиламино-4-фенилциклогексанона (161 мг, 0.74 ммоль) в безводном тетрагидрофуране (20 мл) смешивали с сульфатом натрия (500 мг) и 2 ч перемешивали при комнатной температуре. После добавления уксусной кислоты (111 мг, 1.85 ммоль) добавляли триацетоксиборгидрид натрия (235 мг, 1.11 ммоль) и реакционную смесь перемешивали 72 ч при комнатной температуре. Растворитель удаляли в вакууме, осадок смешивали с 1 М раствором карбоната калия (50 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органические фазы высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт очищали посредством флеш-хроматографии (80 г, 20×1.6 см) с хлороформ/метанол/триэтиламин (10:0.2:0.1→0:0.5:0.1). Так как продукт получился в виде гидрохлорида, осадок растворяли в этилацетате (30 мл) и промывали насыщенным раствором карбоната калия (40 мл). Водную фазу экстрагировали этилацетатом (3×40 мл) и объединенные органические фазы высушивали сульфатом натрия.
Выход (смесь диастереомеров, прибл. 2:1): 195 мг (59%), бесцветное твердое вещество
Точка плавления: 47-52°С
1Н-ЯМР (400 МГц, ДМСО-d6): 1.29-1.64 (m, 9Н), 1.87 (s, 2H), 1.88 (s, 4H), 2.24 (s, 1Н), 2.25 (s, 2H), 2.35 (d, J=8.4 Гц, О.ЗЗН), 2.42 (d, J=12.4 Гц, 0.67Н), 3.12 (d, J=7.4 Гц, 0.67Н), 3.22 (d, J=6.2 Гц, 1.33Н), 4.27 (q, J=7.5 Гц, 0.33Н), 4.38 (q, J=7.5 Гц, 0.67Н), 6.92 (t, J=6.9 Гц, 0.33Н), 6.94-6.99 (m, 0.67H), 6.99-7.03 (m, 0.33Н), 7.04-7.08 (m, 1H), 7.13-7.25 (m, 3H), 7.25-7.39 (m, 3.33H), 7.43 (d, J=7.85 Гц, 1.33Н), 10.77 (s, 0.33Н), 10.83 (s, 0.67H).
13С-ЯМР (100 МГц, ДМСО-d6): 11.1; 24.4; 25.3; 26.8; 28.0; 28.3; 29.4; 30.2Ä; 30.4; 30.5; 30.7; 37.4; 38.0; 53.0; 53.2; 53.3; 53.8; 58.6; 60.7; 109.3; 109.4; 111.3; 111.4; 117.8; 117.9; 118.3; 118.3; 120.8; 120.9; 123.4; 123.5; 126.1; 126.7; 126.9; 127.0; 127.0:127.2; 127.5; 127.6; 128.1; 128.8; 135.9; 136.0; 138.7; 166.3; 181.3; 181.4.
Пример 12 и Пример 13:
Стадия 1:
(R)-бензил 1-гидразинил-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамат
Раствор (R)-2-(бензилоксикарбониламино)-3-(1Н-индол-3-ил)пропионовой кислоты (6.76 г, 20 ммоль) в безводном тетрагидрофуране (100 мл) смешивали с 1,1'-карбонилдиимидазолом (3.89 г, 24 ммоль) и 2 ч перемешивали при комнатной температуре. После оконченного газовыделения по каплям прибавляли 1 М раствор гидразина в тетрагидрофуране (100 мл, 100 ммоль) и перемешивали 18 ч при комнатной температуре. Выпавшее в осадок твердое вещество отфильтровывали.
Выход: 2.42 г (34%), белое твердое вещество
Точка плавления: 205-210°С
1Н-ЯМР (ДМСО-d6): 2.91 (dd, 1H, J=14.2, 9.2 Гц); 3.04 (dd, 1H, J=14.4, 5.5 Гц); 4.20-4.27 (m, 1H); 4.93 (d, 1H, J=3.1 Гц); 6.97 (t, 2H, J=7.6 Гц); 7.05 (t, 1H, J=7.1 Гц); 7.14 (d, 1H, J=2.1 Гц); 7.24-7.40 (m, 6H); 7.61 (d, 1H, J=7.6 Гц); 9.22 (s, 1H); 10.79 (s, 1H). 3H под широким сигналом в 3.5-5.0 част. на млн.
Стадия 2:
(R)-бензил 2-(1Н-индол-3-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этилкарбамат
Раствор (R)-бензил 1-гидразинил-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамата (2.42 г 6.86 ммоль) в безводном тетрагидрофуране (100 мл) смешивали с 1,1'-карбонилдиимидазолом (1.31 г, 8.08 ммоль) и триэтиламином (817 мг, 1.12 мл, 8.08 ммоль) и перемешивали 2 дня при комнатной температуре. Затем реакционную смесь концентрировали в вакууме и осадок (4.50 г) очищали посредством флеш-хроматографии (100 г, 20×4.0 см) с хлороформ/метанол (9:1).
Выход: 2.30 г (88%), белое твердое вещество
Точка плавления: 81-88°С
1Н-ЯМР (ДМСО-d6): 3.13 (dd, 1H, J=14.5, 8.3 Гц); 3.23 (dd, 1H, J=14.5, 6.9 Гц); 4.73 (q, 1H, J=8.2 Гц); 5.00 (s, 2H); 6.98 (t, 1H, J=7.6 Гц); 7.07 (dt, 1H, J=7.5, 1.0 Гц); 7.15 (d, 1H, J=2.2 Гц); 7.25-7.40 (m, 6H); 7.52 (d, 1H, J=7.8 Гц); 8.05 (d, 1Н, J=7.8 Гц); 10.88 (s, 1H); 12.18 (brs, 1H).
13С-ЯМР (ДМСО-d6): 27.1; 48.9; 65.5; 109.0; 111.4; 117.9; 118.4; 120.9; 123.8; 127.0; 127.6; 127.7; 128.3; 136.0; 136.7; 154.7; 155.5; 156.4.
Стадия 3:
(R)-5-(1-амино-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-он
Раствор (R)-бензил 2-(1Н-индол-3-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этилкарбамата (2.00 г, 5.3 ммоль) в безводном тетрагидрофуране (100 мл) смешивали с 20% гидроксидом палладия на активированном угле (230 мг) и гидрировали 5 ч при 40°С и 3 бар. Снова добавляли катализатор (200 мг) и гидрировали последующие 18 ч при 40°С и 6 бар. Теперь прибавляли метанол (50 мл) и гидрировали в течение последующих 24 ч при 40°С и 6 бар. Катализатор отфильтровывали, фильтрат концентрировали в вакууме и осадок (1.43 г) очищали посредством флеш-хроматографии (100 г, 20×4.0 см) с хлороформ/метанол (9:1).
Выход: 684 мг (53%), желтоватое твердое вещество
Точка плавления: 66-80°С
1Н-ЯМР (ДМСО-d6): 3.01 (dd, 1H, J=14.5, 6.5 Гц); 3.09 (dd, 1H, J=14.3, 7.4 Гц); 3.97 (t, 1H, J=7.0 Гц); 6.96 (ddd, 1H, J=8.0, 7.0, 1.0 Гц); 7.06 (ddd, 1H, J=8.1, 7.0, 1.2 Гц); 7.12 (d, 1H, J=2.4 Гц); 7.33 (td, 1H, J=8.1, 0.9 Гц); 7.47 (d,1H, J=8.0 Гц); 10.84 (s, 1H). Три способные к обмену протона невозможно было идентифицировать.
13С-ЯМР (ДМСО-d6): 30.4; 49.5; 109.6; 111.4; 118.0; 118.3; 120.8; 123.6; 127.2; 136.0; 155.0; 159.6.
5-((R)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-он (Пример 12, неполярный диастереомер и Пример 13, полярный диастереомер)
Раствор (R)-5-(1-амино-2-(1Н-индол-3-ил)этил)-1,3,4-оксадиазол-2(3Н)-она (673 мг, 2.75 ммоль) и 4-диметиламино-4-фенилциклогексанона (597 мг, 2.75 ммоль) в безводном тетрагидрофуране (100 мл) смешивали с сульфатом натрия (1.00 г) и 4 ч перемешивали при комнатной температуре. После добавления уксусной кислоты (412 мг, 393 µл, 6.87 ммоль) добавляли триацетоксиборгидрид натрия (878 мг, 4.12 ммоль) и смесь перемешивали 2 дня при комнатной температуре. Затем растворитель концентрировали в вакууме, осадок смешивали с 1 М раствором карбоната калия (50 мл) и экстрагировали этилацетатом (3×30 мл). Органическую фазу высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт (1.15 г) очищали посредством флеш-хроматографии (100 г, 20×4.0 см) этилацетатом/метанол (9:1) и 1% триэтиламин.
Полученный неполярный продукт (635 мг) еще раз очищали посредством флеш-хроматографии (38 г, 20×2.5 см) с хлороформ/метанол (5:1).
Выделенное вещество (571 мг) ресуспендировали в 1 М растворе карбоната калия (20 мл) и экстрагировали этилацетатом (6×10 мл). Объединенные органические фазы высушивали сульфатом натрия и концентрировали в вакууме.
Выход (Пример 12, неполярный диастереомер): 423 мг (35%), белая пена
Точка плавления: 110-113°С
1Н-ЯМР (ДМСО-d6): 1.30-1.65 (m, 6H); 1.89 (s, 6H); 2.11 (br s, 1H); 2.38-2.48 (m, 2H); 3.07-3.12 (m, 2H); 3.94 (brs, 1H); 6.97 (dd, 1H, J=7.9, 7.1, 1.1 Гц); 7.02-7.09 (m, 1H); 7.12 (d, 1H, J=2.3 Гц); 7.18-7.36 (m, 6H); 7.47 (s, 1H, J=7.8 Гц); 10.85 (s, 1H); 11.90 (brs, 1H). 13С-ЯМР (ДМСО-d6): 20.7; 26.8; 28.3; 29.1; 30.1; 31.1; 53.4; 109.6; 111.4; 117.8; 118.4; 120.9; 123.6; 126.9; 127.1; 127.3; 136.0; 154.9; 158.2.
[α]D24=+9.5 (c 1.0, MeOH)
Полученный полярный продукт (183 мг (15%)) ресуспендировали в 1 М растворе карбоната калия (10 мл) и водную фазу экстрагировали этилацетатом (6×5 мл). Объединенные органические фазы высушивали сульфатом натрия и концентрировали в вакууме.
Выход (Пример 13, полярный диастереомер): 98 мг (8%), белое твердое вещество
Точка плавления: 90-105°С
1Н-ЯМР (ДМСО-d6): 0.80-1.00 (m, 2H); 1.40-1.82 (m, 6H); 1.88 (s, 6H); 2.40-2.47 (m, 2H); 2.98 (d, 2H, J=7.3 Гц); 3.82 (br s, 1H); 6.93 (add, 1H, J=7.9, 7.1, 1.0 Гц); 6.95-7.06 (m, 2H); 7.21-7.41 (m, 7H); 10.78 (s, 1H), 11.95(brs, 1H).
13С-ЯМР (ДМСО-d6): 20.7; 28.1; 28.9; 29.4; 30.5; 37.9; 53.5; 109.5; 111.4; 117.7; 118.3; 120.8; 123.4; 126.5; 127.0; 127.7; 127.9: 136.0; 154.9; 158.1.
[α]D24=+4.4 (c 1.0, MeOH)
Пример 14 и Пример 15:
Стадия 1:
(R)-трет-бутил 1-(1-аминоэтилиденаминоокси)-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамат
По аналогии с примером 11 (Стадия 2) подвергали взаимодействию N'-гидроксиацетимидамид (400 мг, 5.39 ммоль, получение см. стадия 1 из прим. 11) и (R)-2-(трет-бутоксикарбониламино)-3-(1Н-индол-3-ил)пропионовой кислоты (1.36 г, 4.48 ммоль).
Выход: 1.91 г (98%)
Точка плавления: 70-75°С
1Н-ЯМР (300 МГц, ДМСО-d6): 1.33 (s, 9H), 1.76 (s, ЗН), 2.99 (dd, J=14.2, 9.1 Гц, 1H), 3.16 (dd, J=14.5, 5.1 Гц, 1Н), 4.38 (dt, J=8.7, 5.3 Гц, 1H), 6.37 (br s, 2H), 6.98 (t, J=6.9 Гц, 1Н), 7.07 (t, J=6.9 Гц, 1H), 7.14 (d, J=2.2 Гц, 1H), 7.24 (d, J=8.4 Гц, 1H), 7.33 (d, J=7.9 Гц, 1H), 7.58 (d, J=7.7 Гц, 1H), 10.84 (s, 1H).
Стадия 2:
(R)-трет-бутил 2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этилкарбамат
Раствор (R)-трет-бутил 1-(1-аминоэтилиденаминоокси)-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамата (1.91 г, 5.3 ммоль) в ацетонитриле (40 мл) смешивали с молекулярным ситом 4 Å (1 г) и 48 ч перемешивали при 120°С в тефлоновом сосуде под давлением. Молекулярное сито затем отфильтровывали, и фильтрат концентрировали в вакууме. Остаток очищали посредством флеш-хроматографии (200 г, 20×33.6 см) с хлороформ/метанол/триэтиламин (10:0.2:0.01).
Выход: 1.81 г (100%)
Стадия 3:
(R)-2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этанамин
Раствор (R)-трет-бутил 2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этилкарбамата в дихлорметане (10 мл) смешивали с трифторуксусной кислотой (6 мл) и 5 ч перемешивали при комнатной температуре. Реакционную смесь затем концентрировали в вакууме. Остаток растворяли в дихлорметане (30 мл) и промывали насыщенным раствором карбоната калия (3×20 мл). Органическую фазу высушивали сульфатом натрия и концентрировали в вакууме. Остаток очищали посредством флеш-хроматографии (200 г, 20×3.6 см) с хлороформ/метанол/триэтиламин (10:0.2:0.1).
Выход: 727 мг (100%), коричневатое масло
1Н-ЯМР (300 МГц, ДМСО-d6) 2.27 (s, 5H), 3.13 (dd, J=14.3, 6.6 Гц, 1Н), 3.21 (dd, J=14.2, 7.2 Гц, 1Н), 4.36 (t, J=6.8 Гц, 1Н), 6.95 (t, J=6.9 Гц, 1Н), 7.05 (t, J=6.9 Гц, 2H), 7.31 (d, J=8.0 Гц, 1Н), 7.44 (d, J=7.6 Гц, 1Н), 10.84 (s, 1Н).
N4-((R)-2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (Пример 14, неполярный диастереомер и Пример 15, полярный диастереомер)
Раствор (R)-2-(1Н-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этанамина (400 мг, 1.65 ммоль) и 4-диметиламино-4-фенилциклогексанона (358.7 г, 1.65 ммоль) в безводном тетрагидрофуране (50 мл) смешивали с сульфатом натрия (1.1 г) и 2 ч перемешивали при комнатной температуре. После добавления уксусной кислоты (248 мг, 4.1 ммоль) добавляли триацетоксиборгидрид натрия (524 мг, 2.47 ммоль) и реакционную смесь 16 ч перемешивали при комнатной температуре. Растворитель удаляли в вакууме, осадок смешивали с 1 М раствором карбоната калия (50 мл) и экстрагировали этилацетатом (3×50 мл).
Объединенные органические фазы высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт очищали посредством флеш-хроматографии (400 г, 20×5.6 см) этилацетатом/изопропанол/триэтиламин (10:0.3:0.01→5:1:0.1).
Выход (Пример 14, неполярный диастереомер): 315 мг (43%), бесцветное твердое вещество
Точка плавления: 52-54°С
1Н-ЯМР (400 МГц, ДМСО-d6): 1.39 (t, J=14.5 Гц, 2Н), 1.48 (t, J=11.0, 2H), 1.58 (d, J=12.0 Гц, 2H), 1.89 (s, 6H), 2.25 (s, 3H), 2.36 (dd, J=9.2, 5.0 Гц, 2H), 2.42 (d, J=13.0 Гц, 2H), 3.22 (d, J=6.6 Гц, 2H), 4.38 (t, J=7.0 Гц, 1Н), 6.97 (ddd, J=7.9, 7.0, 1.0, Гц, 1Н), 7.05 (ddd, J=8.2, 7.2, 1.1 Гц, 2H), 7.21 (t, J=6.9 Гц, 1Н), 7.25-7.34 (m, 5H), 7.44 (d, J=7.9 Гц, 1Н), 10.81 (s, 1H).
13С-ЯМР (100 МГц, ДМСО-d6): 11.0; 26.8; 28.3; 30.4; 37.4; 53.1; 53.2; 58.6; 109.4; 111.3; 117.8; 118.3; 120.8; 123.5; 126.1; 126.6; 127.1;0; 127.2; 136.0; 138.8; 166.0; 181.4.
Выход (Пример 15, полярный диастереомер): 98 мг (13%), бесцветное твердое вещество
Точка плавления: 62-64°С
1Н-ЯМР (300 МГц, ДМСО-d6): 0.90 (q, J=9.8 Гц, 3H), 1.53 (m, 3H), 1.80 (d, J=13.1 Гц, 2H), 1.92 (s, 6H), 2.24 (s, 3H), 2.32-2.47 (m, 2H), 3.12 (d, J=7.2 Гц, 2H), 4.27 (t, J=7.0 Гц, 1Н), 6.92 (td, J=6.8, 4.1 Гц, 2H), 7.02 (t, J=6.9 Гц, 1Н), 7.22-7.43 (m,7H), 10.77(s, 1Н).
13С-ЯМР (100 МГц, ДМСО-d6): 11.0; 28.0; 29.3; 30.2; 30.4; 30.5; 37.9; 53.2; 53.7; 54.8; 109.3; 111.3; 117.8; 118.3; 120.8; 123.4; 126.3; 126.9; 127.4; 127.6; 127.8; 135.9; 166.3; 181.3.
Пример 16 и Пример 17:
Стадия 1:
(S)-трет-бутил 2-(1Н-индол-3-ил)-3-оксо-3-(проп-2-иниламино)пропилкарбамат
Раствор (S)-3-(трет-бутоксикарбониламино)-2-(1Н-индол-3-ил)пропионовой кислоты (1.0 г, 3.3 ммоль) в ТГФ (7 мл) при комнатной температуре порционно смешивали с карбонилдиимидазолом (535 мг, 3.3 ммоль) и 2 ч перемешивали при комнатной температуре, до того, как по каплям прибавляли пропаргиламин (270 мг, 5.0 ммоль). Через 1 ч при комнатной температуре разбавляли с диэтиловым эфиром (80 мл), промывали насыщенным раствором гидрокарбоната натрия (2×20 мл) и высушивали сульфатом натрия. Растворитель удаляли в вакууме и осадок перекристаллизовывали из диэтилового эфира.
Выход: 890 мг (79%), белое твердое вещество
1Н-ЯМР (CDCl3): 1.42 (9Н, s); 2.14 (1H, t, J=2.4 Гц); 3.15-3.33 (2H, m); 3.93 (2H, br s); 4.43 (1 H, br s); 5.10 (1H, br s); 6.00 (1H, br s); 7.06 (1H, d, J=2 Гц); 7.14 (1H, m); 7.21 (1H, m); 7.37 (1H, d, J=8 Гц); 7.65 (1H, d, J=8 Гц); 8.10 (1H, br s).
Стадия 2:
(S)-трет-6утил 2-(1Н-индол-3-ил)-2-(5-метилоксазол-2-ил)этилкарбамат
Раствор хлорида золота(III) (45 мг, 0.15 ммоль) в ацетонитриле (2 мл) при комнатной температуре смешивали с раствором (S)-трет-бутил 2-(1Н-индол-3-ил)-3-оксо-3-(проп-2-иниламино)пропилкарбамата (512 мг, 1.5 ммоль) в ацетонитриле (6 мл) и перемешивали 18 ч при 50°С. Растворитель удаляли в вакууме, и осадок очищали посредством флеш-хроматографии (20 г, 16×2.5 см) этилацетатом/циклогексан (1:1).
Выход: 330 мг (64%)
1Н-ЯМР (CDCl3): 1.41 (9H, s); 2.23 (3H, s); 3.38 (2H, m); 5.20 (2H, brs); 6.61 (1H, s); 6.90 (1H, s); 7.07 (1H, t, J=7.6 Гц); 7.16 (1H, t, J=7.6 Гц); 7.32 (1H, d, J=8 Гц); 7.43 (1H, d, J=8 Гц); 8.06 (1H, br s).
Стадия 3:
(S)-2-(1Н-индол-3-ил)-2-(5-метилоксазол-2-ил)этанамин
Раствор (S)-трет-бутил 2-(1Н-индол-3-ил)-2-(5-метилоксазол-2-ил)этилкарбамата (320 мг, 0.93 ммоль) в дихлорметане (10 мл) при 0°С по каплям смешивали с трифторуксусной кислотой (1.5 мл, 20 ммоль) и 3 ч перемешивали при комнатной температуре. Затем разбавляли с дихлорметаном (80 мл), промывали насыщенным раствором гидрокарбоната натрия (30 мл), высушивали сульфатом натрия и растворитель удаляли в вакууме.
Выход: 220 мг (98%), коричневое масло
1Н-ЯМР (CDCl3): 2.09 (2 Н, br s); 2.29 (3H, s); 3.18 (1H, dd, J=14.4 и 8.4 Гц); 3.42 (1H, dd, J=14.4 и 5 Гц); 4.38 (1H, m); 6.61 (1H, s); 7.05 (1H, s); 7.10 (1H, m); 7.19 (1H, m); 7.35 (1H, d, J=8 Гц); 7.55 (1H, d, J=8 Гц); 8.09 (1H, br s).
N4-((S)-2-(1H-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (Пример 16, неполярный диастереомер и Пример 17, полярный диастереомер)
Раствор (S)-2-(1Н-индол-3-ил)-2-(5-метилоксазол-2-ил)этанамина (220 мг, 0.91 ммоль) и 4-диметиламино-4-фенилциклогексанона (218 мг, 1.0 ммоль) в 1,2-дихлорэтане (15 мл) смешивали с порошковым триацетоксиборгидридом натрия (290 мг, 1.37 ммоль) и уксусной кислотой (100 мг, 1.67 ммоль) и 18 ч перемешивали при комнатной температуре. Затем разбавляли с этилацетатом (80 мл), промывали насыщенным раствором гидрокарбоната натрия (20 мл) и высушивали сульфатом натрия. Растворитель удаляли в вакууме и осадок очищали посредством флеш-хроматографии (15 г, 12×2.5 см) с метанол/дихлорметан (1:4).
Выход (Пример 16, неполярный диастереомер): 145 мг (36%), белое твердое вещество
Точка плавления: 65-70°С.
αD20: -11° (c 0.2, MeOH).
1Н ЯМР (CDCl3): δ 1.40-1.60 (6H, s); 1.90-2.20 (8H, m); 2.25 (3H, s); 2.35-2.47 (2H, m); 3.22-3.33 (2H, m); 4.27 (1H, m); 6.60 (1H, s); 7.10 (1H, t, J=7.6 Гц); 7.18 (1H, t, J=7.6 Гц); 7.26-7.37 (7H, m); 7.57 (1H, d, J=8 Гц); 8.20 (1H, br s).
13С ЯМР (CDCl3): δ 165.1; 148.5; 137.7; 136.2; 127.6; 127.5; 127.3; 126.8; 123.3; 122.3; 121.8; 119.2; 118.7; 111.6; 111.2; 60.9; 54.2; 52.2; 37.6; 31.1; 30.0; 29.5; 28.9:26.6; 10.9.
Выход (Пример 17, полярный диастереомер): 100 мг (25%), белое твердое вещество
Точка плавления: 70-75°С.
αD20: -7° (с 0.2, МеОН).
1Н ЯМР (CDCl3): δ 1.00 (2Н, m); 1.63 (1H, m); 1.82 (1H, m); 2.08 (6H, br s); 2.22 (3H, s), 2.40-2.80 (6 H, m); 3.18 (2H, m); 4.22 (1H, t, J=7 Гц); 6.60 (1H, s); 6.90 (1H, s); 7.06 (1H, t, J=7.6 Гц); 7.17 (1H, t, J=7.6 Гц); 7.26-7.36 (6H, m); 7.45 (1H, d, J=8 Гц); 7.96 (1H, brs).
13C ЯМР (CDCl3): δ 164.9; 148.4; 136.1; 135.6; 128.2; 128.0; 127.5; 126.8; 122.7; 122.4; 121.9; 119.3; 118.6; 111.5; 111.0; 62.3; 54.8; 54.6; 38.1; 31.5; 31.3; 31.0; 30.0:28.9; 10.9.
Пример 18 и Пример 19
Стадия 1:
(R)-трет.-бутил-3-(1Н-индол-3-ил)-1-оксо-1-(проп-2-иниламино)пропан-2-илкарбамат
Раствор (R)-2-(трет.-бутоксикарбониламино)-3-(1Н-индол-3-ил)пропионовой кислоты (3.0 г, 9.9 ммоль) в ТГФ (20 мл) при комнатной температуре порционно смешивали с N,N'-карбонилдиимидазолом (1.62 г, 10 ммоль) и 2 ч перемешивали при комнатной температуре, до того как по каплям добавляли пропаргиламин (826 мг, 15 ммоль). Через 1 ч при комнатной температуре разбавляли с диэтиловым эфиром (200 мл), промывали насыщенным раствором гидрокарбоната натрия (2×50 мл) и высушивали сульфатом натрия. Растворитель удаляли в вакууме и осадок перекристаллизовывали из диэтилового эфира.
Выход: 2.3 г (68%), белое твердое вещество
Точка плавления: 105-108°С
1H-ЯМР (CDCl3): 1.42 (9 Н, s); 2.14 (1H, t, J=2.4 Гц); 3.15-3.33 (2H, m); 3.93 (2H, br s); 4.43 (1H, br s); 5.10 (1H, br s); 6.00 (1H, br s); 7.06 (1H, d, J=2 Гц); 7.14 (1H, m); 7.21 (1H, m); 7.37 (1H, d, J=8 Гц); 7.65 (1H, d, J=8 Гц); 8.14 (1H, brs).
Стадия 2:
(R)-трет-бутил-2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этилкарбамат
Раствор (R)-трет.-бутил-3-(1Н-индол-3-ил)-1-оксо-1-(проп-2-иниламино)пропан-2-илкарбамата (2.20 г, 6.44 ммоль) в ацетонитриле (25 мл) при комнатной температуре смешивали с хлоридом золота(III) (190 мг, 0.63 ммоль) и 18 ч перемешивали при 50°С. Растворитель удаляли в вакууме и осадок очищали посредством флеш-хроматографии (60 г, 15×4 см) с этилацетатом/циклогексан (1:1).
Выход: 1.30 г (59%), коричневатое твердое вещество
Точка плавления: 110-112°С
1H-ЯМР (CDCl3): 1.41 (9Н, s); 2.23 (3H, s); 3.38 (2H, m); 5.20 (2H, br s); 6.61 (1H, s); 6.90 (1H, s); 7.07 (1H, t, J=7.6 Гц); 7.16 (1H, t, J=7.6 Гц); 7.32 (1H, d, J=8 Гц); 7.43 (1H, d, J=8 Гц); 8.00 (1H, br s).
Стадия 3:
(R)-2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этиламин
Раствор (R)-трет-бутил-2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этилкарбамата (1.0 г, 2.9 ммоль) в дихлорметане (30 мл) при 0°С по каплям смешивали с трифторуксусной кислотой (6 мл, 81 ммоль) и 1 ч перемешивали при комнатной температуре. Затем летучие компоненты удаляли в вакууме и осадок смешивали с насыщенным раствором гидрокарбоната натрия (20 мл). После экстракции дихлорметаном (3×20 мл) органическую фазу высушивали сульфатом натрия и растворитель удаляли в вакууме.
Выход: 560 мг (80%), коричневое масло
1H-ЯМР (CDCl3): 2.09 (2H, br s); 2.29 (3H, s); 3.18 (1H, dd, J=14.4 и 8.4 Гц); 3.42 (1H, dd, J=14.4 и 5 Гц); 4.38 (1H, m); 6.61 (1H, s); 7.05 (1H, s); 7.10 (1H, m); 7.19 (1H, m); 7.35 (1H, d, J=8 Гц); 7.55 (1H, d, J=8 Гц); 8.09 (1H, br s).
Стадия 4:
(R)-N4-(2-(1H-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (Пример 18, полярный диастереомер и Пример 19, неполярный диастереомер)
Раствор (R)-2-(1Н-индол-3-ил)-1-(5-метилоксазол-2-ил)этиламина (240 мг, 1.0 ммоль) и 4-диметиламино-4-фенилциклогексанона (218 мг, 1.0 ммоль) в 1,2-дихлорэтане (15 мл) смешивали с порошковым триацетоксиборгидридом натрия (317 мг, 1.5 ммоль) и уксусной кислотой (120 мг, 2.0 ммоль) и 18 ч перемешивали при комнатной температуре. Затем разбавляли с этилацетатом (80 мл), промывали насыщенным раствором гидрокарбоната натрия (20 мл) и высушивали сульфатом натрия. Растворитель удаляли в вакууме и осадок посредством флеш-хроматографии (15 г, 12×2.5 см) с метанол/дихлорметан (1:4) очищали.
Пример 18: (полярный диастереоизомер)
Выход: 120 мг (27%), белое твердое вещество
Точка плавления: 70-75°С.
[α]D 20: +11° (с 0.2, МеОН).
1H-RMP (CDCl3): 1.00 (2H, m); 1.63 (1Н, m); 1.82 (1H, m); 2.08 (6H, br s); 2.22 (3H, s), 2.40-2.80 (6H, m); 3.18 (2H, m); 4.22 (1H, t, J=7 Гц); 6.60 (1H, s); 6.90 (1H, s); 7.06 (1H, t, J=7.6 Гц); 7.17 (1H, t, J=7.6 Гц); 7.26-7.36 (6H, m); 7.45 (1H, d, J=8 Гц); 7.96 (1H, brs).
13С-ЯМР (CDCl3): 164.9; 148.4; 136.1; 135.6; 128.2; 128.0; 127.5; 126.8; 122.7; 122.4; 121.9; 119.3; 118.6; 111.5; 111.0; 62.3; 54.8; 54.6; 38.1; 31.5; 31.3; 31.0; 30.0; 28.9; 10.9.
ЖХ-NC (метод 8): m/z: [M+H]+=443.3, Rt=1.5 мин.
Пример 19: (неполярный диастереоизомер)
Выход: 170 мг (38%), белое твердое вещество
Точка плавления: 65-70°С.
[α]D 20: +14° (c 0.2, MeOH).
1H-ЯМР (CDCl3): 1.40-1.60 (6H, s); 1.90-2.20 (8H, m); 2.25 (3H, s); 2.35-2.47 (2H, m); 3.22-3.33 (2H, m); 4.27 (1H, m); 6.60 (1H, s); 7.10 (1H, t, J=7.6 Гц); 7.18 (1H, t, J=7.6 Гц); 7.26-7.37 (7 H, m); 7.57 (1H, d, J=8 Гц); 8.20 (1H, br s).
13С-ЯМР (CDCl3): 165.1; 148.5; 137.7; 136.2; 127.6; 127.5; 127.3; 126.8; 123.3; 122.3; 121.8; 119.2; 118.7; 111.6; 111.2; 60.9; 54.2; 52.2; 37.6; 31.1; 30.0; 29.5; 28.9; 26.6; 10.9.
ЖХ-NC (метод 8): m/z: [M+H]+=443.3, Rt=2.35 мин.
Пример 20 и Пример 21
Стадия 1:
(S)-трет-6утил-1-амино-3-(1Н-индол-3-ил)-1-тиоксопропан-2-илкарбамат
Раствор (S)-трет-бутил-1-амино-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамата (500 мг, 1.6 ммоль) в безводном 1,2-диметоксиэтане (10 мл) порционно смешивали с гидрокарбонатом натрия (520 мг, 6.2 ммоль) и пентасульфидом дифосфора (730 мг, 3.2 ммоль) и в течение ночи перемешивали при комнатной температуре. Реакционную смесь затем концентрировали в вакууме, осадок ресуспендировали в этилацетате (30 мл) и промывали водой и насыщенным раствором гидрокарбоната натрия (по 3×20 мл). Органическую фазу высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт (600 мг) ресуспендировали в диэтиловом эфире/циклогексан (по 10 мл) и снова концентрировали. При этом в осадок выпадало белое твердое вещество.
Выход: 510 мг (100%), белое твердое вещество
Точка плавления: 57-62°С
1H-ЯМР (ДМСО-d6): 1.30 (s, 9H); 2.88-3.00 (m, 1H); 3.10-3.20 (m, 1H); 4.40-4.56 (m, 1H); 6.72 (d, 1H, J=8.4 Гц); 6.94-7.10 (m, 2H); 7.17 (s, 1H); 7.32 (d, 1H, J=8.3 Гц); 7.65 (d, 1H, J=7.4 Гц); 9.16 (s, 1H); 9.61 (s, 1H); 10.80 (s, 1H).
Стадия 2:
Трет-бутил-(1S)-1-(4-аидрокси-4-метил-4,5-дигидротиазол-2-ил)-2-(1Н-индол-3-ил)этил]карбамат
Раствор (S)-трет-бутил-1-амино-3-(1Н-индол-3-ил)-1-тиоксопропан-2-илкарбамата (400 мг, 1.2 ммоль) в безводном 1,2-диметоксиэтане (20 мл) смешивали с порошковым гидрокарбонатом калия (600 мг, 6 ммоль) и хлорацетоном (556 мг, 447 µл, 6 ммоль) и 8 ч перемешивали при 70°С и в течение субботы и воскресенья при 45°С. Реакционную смесь затем фильтровали, и фильтрат концентрировали в вакууме.
Выход: 500 мг (100%), янтарно-желтое масло
Стадия 3:
(S)-трет.-бутил-2-(1Н-индол-3-ил)-1-(4-метилтиазол-2-ил)этилкарбамат
Раствор трет-бутил-(1S)-1-(4-гидрокси-4-метил-4,5-дигидротиазол-2-ил)-2-(1Н-индол-3-ил)этил]карбамата (280 мг, 0.74 ммоль) в толуоле (20 мл) смешивали с сульфатом натрия (1.00 г) и 1 ч перемешивали при кипячении в колбе с обратным холодильником. Смесь затем фильтровали, фильтрат концентрировали в вакууме и осадок (260 мг) очищали посредством флеш-хроматографии (18 г, 20×2.0 см) с этилацетатом/циклогексан (1:2).
Выход: 185 мг (70%), коричневатое масло
1H-ЯМР (ДМСО-d6): 1.31 (s, 9H); 2.36 (d, 3Н, J=1 Гц); 3.05-3.17 (m, 1H); 3.37-3.42 (m, 1H); 4.92-5.02 (m, 1H); 6.95-7.15 (m, 4H); 7.34 (d, 1H, J=8.0 Гц); 7.54 (d, 1H, J=7.8 Гц); 7.63 (d, 1H, J=8.3 Гц); 10.82 (s, 1H).
Стадия 4:
(S)-2-(1Н-индол-3-ил)-1-(4-метилтиазол-2-ил)этиламин
Раствор (S)-трет.-бутил-2-(1H-индол-3-ил)-1-(4-метилтиазол-2-ил)этилкарбамата (2.13 г, 5.95 ммоль) в безводном дихлорметане (15 мл) смешивали с трифторуксусной кислотой (5 мл) и 1 ч перемешивали при комнатной температуре. Раствор затем концентрировали в вакууме, осадок ресуспендировали в дихлорметане (100 мл) и промывали 2 М раствором карбоната калия (3×20 мл). Органическую фазу высушивали сульфатом натрия и концентрировали в вакууме.
Выход: 1.49 г (97%), коричневое масло
1H-ЯМР (ДМСО-d6): 2.07-2.17 (br s, 2H); 2.34 и 2.35 (d, 3Н, J=0.8 Гц); 2.91 (dd, 1H, J=14.2, 8.5 Гц); 3.28 (dd, 1H, J=14.2, 4.5 Гц); 4.35 (dd, 1H, J=8.5, 4.4 Гц); 6.93-7.00 (m, 1H); 7.02-7.09 (m, 2H); 7.15 (d, 1H, J=2.2 Гц); 7.33 (d, 1H, J=8.0 Гц); 7.49 (d, 1H, J=7.8 Гц); 10.85 (s, 1H).
13С-ЯМР (ДМСО-d6): 17.0; 29.3; 34.4; 54.0; 10.4; 111.3; 113.3; 118.3; 120.8; 123.8; 127.4; 136.2; 151.5; 177.7.
Стадия 5:
(S)-N4-(2-(1 Н-индол-3-ил)-1 -(4-метилтиазол-2-ил)этил)-N1,N1-диметил-1-penylциклогексан-1,4-диамин (Пример 20, неполярный диастереомер, Пример 21, полярный диастереомер)
Раствор (S)-2-(1Н-индол-3-ил)-1-(4-метилтиазол-2-ил)этиламина (500 мг, 1.94 ммоль) и 4-диметиламино-4-фенилциклогексанона (421 мг, 1.94 ммоль) в безводном тетрагидрофуране (40 мл) смешивали с сульфатом натрия (1.00 г) и 3 ч перемешивали при комнатной температуре. После добавления уксусной кислоты (291 мг, 287 µл, 4.85 ммоль) добавляли триацетоксиборгидрид натрия (574 мг, 2.71 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Смесь затем фильтровали, фильтрат концентрировали в вакууме, осадок смешивали с 1 М раствором карбоната калия (50 мл) и экстрагировали этилацетатом (3×30 мл). Объединенные органические фазы высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт (750 мг) очищали посредством флеш-хроматографии (100 г, 20×4.0 см) этилацетатом/метанол [97:3→9:1 и каждый раз 1% NH3 (33% в воде)].
Пример 20: (неполярный диастереоизомер)
Выход: 400 мг (45%), белое твердое вещество
Точка плавления: 70-72°С
1H-ЯМР (ДМСО-d6): 1.20-1.48 (m, 6H); 1.82 (s, 6H); 2.10-2.24 (m, 1H); 2.28-2.38 (m, 2H); 2.33 (d, 3H, J=1.0 Гц); 2.96 (dd, 1H, J=14.2, 8.5 Гц); 3.21 (dd, 1H, J=14.3, 4.5 Гц); 4.33 (dd, 1H, J=8.4, 4.7 Гц), 6.99 (ddd, 1H, J=8.0, 7.1, 1.1 Гц); 7.04-7.11 (m, 2H); 7.14-7.41 (m, 8H); 7.50 (d, 1H, J=7.5 Гц); 10.88 (s, 1H).
13С-ЯМР (ДМСО-d6): 17.0; 27.0; 28.7; 30.2; 30.5; 33.4; 37.4; 53.6; 57.9; 58.6; 110.0; 111.4; 113.5; 118.0; 120.9; 124.0; 126.1; 126.7; 127.2; 127.3; 136.2; 138.8; 151.6; 177.9.
ЖХ-NC (метод 7): m/z: [M+H]+=459.3, Rt=2.7 мин.
Число оборотов: [α]D 24=+1.4° (с 1.0, МеОН).
Пример 21: (полярный диастереоизомер)
Выход: 186 мг (21.%), желтоватое масло
1H-ЯМР (CDCl3): 0.66-0.77 (m, 1H); 0.85-1.07 (m, 1H); 1.43-1.76 (m, 4H); 1.97 (s, 6H); 2.23-2.33 (m, 1H); 2.45 (d, 3H, J=0.9 Гц); 2.39-2.53 (m, 2H); 2.98 (dd, 1H, J=14.5, 8.8 Гц); 3.30 (dd, 1H, J=14.5, 4.8 Гц), 4,43 (dd, 1H, J=8.8, 4.8 Гц); 6.75 (d, 1Н, J=1.0 Гц); 6.91 (d, 1H, J=2.3 Гц); 7.07 (ddd, 1H, J=8.0, 7.1, 1.0 Гц); 7.13-7.25 (m, 5H); 7.28-7.34 (m, 3H); 7.58 (d, 1H, J=7.9 Гц); 7.99 (s, 1H).
13С-ЯМР (CDCl3): 17.2; 28.7; 30.4; 31.3; 31.6, 34.0; 38.2; 55.0; 58.5, 61.5; 111.1; 111.7; 113.0; 118.8; 119.3; 122.0; 122.8; 126.4; 127.4; 127.7; 127.9; 136.2; 136.4; 152.3; 177.7.
ЖХ-NC (метод 7): m/z: [M+H]+=459.3, Rt=1.9 мин.
число оборотов: [α]D 24=-0.15° (с 1.0, МеОН).
Пример 22 и Пример 23
Стадия 1:
(R)-трет.-бутил-1-амино-3-(1Н-индол-3-ил)-1-оксопропан-2-илкарбамат
Раствор (R)-2-(трет.-бутоксикарбониламино)-3-(1Н-индол-3-ил)пропановой кислоты (7.00 г, 23 ммоль) и 1,1'-карбонилдиимидазола (4.44 г, 27.3 ммоль) в безводном тетрагидрофуране (200 мл) перемешивали 2 ч при комнатной температуре. Этот раствор затем впускали по каплям к раствору 33% водного аммиака (14 мл, 230 ммоль) в тетрагидрофуране (50 мл) и 20 ч перемешивали при комнатной температуре. Реакционный раствор концентрировали в вакууме и осадок ресуспендировали в воде (200 мл). Через 30 мин в осадок выпадал продукт в виде белого твердого вещества, которое отфильтровывали, промывали водой и высушивали над гидроксидом калия в эксикаторе.
Выход: 6.90 г (99%), белое твердое вещество
Точка плавления: 113-118°С
1H-ЯМР (ДМСО-d6): 1.31 (s, 9H); 2.89 (dd, 1H, J=14.5, 9.1 Гц); 3.07 (dd, 1H, J=14.5, 4.7 Гц); 4.09-4.19 (m, 1H); 6.62 (d, 1H, J=8.2 Гц); 6.93-7.14 (m, 4H); 7.29-7.38 (m, 2H); 7.60 (d, 1H, J=7.7 Гц); 10.77 (s, 1H).
Стадия 2:
(R)-трет.-бутил-1-амино-3-(1Н-индол-3-ил)-1-тиоксопропан-2-илкарбамат
Раствор (R)-трет.-бутил-1-амино-3-(1H-индол-3-ил)-1-оксопропан-2-илкарбамата (6.80 г, 22.4 ммоль) в безводном диметоксиэтане (100 мл) порционно смешивали с гидрокарбонатом натрия (7.14 г, 85.1 ммоль) и пентасульфидом дифосфора (10.2 г, 44.8 ммоль) и в течение ночи перемешивали при комнатной температуре. Реакционную смесь концентрировали в вакууме, осадок ресуспендировали в этилацетате (100 мл) и промывали водой и насыщенным раствором гидрокарбоната натрия (по 3×50 мл). Органическую фазу высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт ресуспендировали в диэтиловом эфире/циклогексан (по 50 мл) и снова концентрировали. При этом в осадок выпадал продукт в виде белого твердого вещества, которое отфильтровывали.
Выход: 6.49 г (91%), белое твердое вещество
Точка плавления: 55-65°С
1H-ЯМР (ДМСО-d6): 1.30 (s, 9H); 2.95 (dd, 1H, J=9.3 Гц); 3.17 (dd, 1H, J=14.3, 4.3 Гц); 4.44-4.54 (m, 1H); 6.70 (d, 1H, J=8.4 Гц); 6.95-7.09 (m, 2H); 7.16 (s, 1H); 7.33 (d, 1H, J=8.0 Гц); 7.65 (d, 1H, J=7.7 Гц); 9.15 (s, 1H); 9.61 (s, 1H); 10.80 (s, 1H).
Стадия 3:
Трет.-бутил-(1R)-1-(4-гидрокси-4-метил-4,5-дигидротиазол-2-ил)-2-(1Н-индол-3-ил)этилкарбамат
Раствор (R)-трет.-бутил-1-амино-3-(1H-индол-3-ил)-1-тиоксопропан-2-илкарбамата (6.49 г, 20.3 ммоль) в безводном диметоксиэтане (100 мл) смешивали с порошковым гидрокарбонатом калия (10.1 г, 101 ммоль) и хлорацетоном (9.69 г, 8.4 мл, 101 ммоль) и 8 ч при 70°С и перемешивали в течение субботы и воскресенья при 45°С. Затем реакционную смесь фильтровали и фильтрат концентрировали в вакууме.
Выход: 7.12 г (93%), янтарно-желтое масло
Стадия 4:
(R)-трет.-бутил-2-(1Н-индол-3-ил)-1-(4-метилтиазол-2-ил)этилкарбамат
Раствор трет.-бутил-(1R)-1-(4-гидрокси-4-метил-4,5-дигидротиазол-2-ил)-2-(1H-индол-3-ил)этилкарбамата (7.12 г, 18.9 ммоль) в толуоле (150 мл) смешивали с сульфатом натрия (9.00 г) и 1 ч перемешивали при кипячении в колбе с обратным холодильником. Смесь фильтровали, фильтрат концентрировали в вакууме и осадок (6.18 г) очищали посредством флеш-хроматографии (400 г, 20×7.5 см) этилацетатом/циклогексан (1:2).
Выход: 4.97 г (74%), коричневатое масло
1H-ЯМР (ДМСО-d6): 1.31 (s, 9H); 2.36 (s, 3Н); 3.03-3.20 (m, 1H); 3.35-3.45 (m, 1H); 4.97 (dt, 1H, J=10.0, 4.6 Гц); 6.95-7.14 (m, 4H); 7.33 (d, 1H, J=8.1 Гц); 7.53 (d, 1H, J=7.7 Гц), 7.60 (d, 1H, J=8.4 Гц); 10.80 (s, 1H).
Стадия 5:
(R)-2-(1Н-индол-3-ил)-1-(4-метилтиазол-2-ил)этиламин
Раствор (R)-трет.-бутил-2-(1H-индол-3-ил)-1-(4-метилтиазол-2-ил)этилкарбамата (4.97 г, 13.9 ммоль) в безводном дихлорметане (40 мл) смешивали с трифторуксусной кислотой (7 мл) и 24 ч перемешивали при комнатной температуре. Раствор затем концентрировали в вакууме, осадок ресуспендировали в дихлорметане (100 мл) и промывали 2 М раствором карбоната калия (3×30 мл). Органическую фазу высушивали сульфатом натрия и концентрировали в вакууме.
Выход: 3.47 г (97%), коричневое масло
1H-ЯМР (ДМСО-d6): 2.00-2.18 (brs, 2H); 2.34 (d, 3Н, J=1 Гц); 2.92 (dd, 1H, J=14.3, 8.4 Гц); 3.28 (dd, 1H, J=14.4, 4.7 Гц); 4.36 (dd, 1H, J=8.4, 4.4 Гц); 6.93-7.09 (m, 3Н); 7.15 (d, 1H, J=2.3 Гц); 7.31-7.36 (m, 1H); 7.50 (d, 1H, J=7.8 Гц); 10.85 (s, 1H).
Стадия 6:
(R)-N4-(2-(1H-индол-3-ил)-1-(4-метилтиазол-2-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (Пример 22, неполярный диастереомер и Пример 23, полярный диастереомер)
Раствор (R)-2-(1H-индол-3-ил)-1-(4-метилтиазол-2-ил)этиламина (500 мг, 1.94 ммоль) и 4-диметиламино-4-фенилциклогексанона (421 мг, 1.94 ммоль) в безводном тетрагидрофуране (40 мл) смешивали с сульфатом натрия (1.00 г) и 3 ч перемешивали при комнатной температуре. После добавления уксусной кислоты (291 мг, 287 µл, 4.85 ммоль) добавляли триацетоксиборгидрид натрия (574 мг, 2.71 ммоль) и смесь в течение ночи перемешивали при комнатной температуре. Смесь фильтровали, фильтрат концентрировали в вакууме, осадок смешивали с 1 М раствором карбоната калия (50 мл) и экстрагировали этилацетатом (3×30 мл). Объединенные органические фазы высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт (876 мг) очищали посредством флеш-хроматографии (100 г, 20×4.0 см) этилацетатом/метанол (95:5→9:1) и каждый раз 1% аммиаком (33% в воде). Неполярный диастереоизомер (450 мг) еще раз очищали посредством флеш-хроматографии (38 г, 20×2.5 см) с дихлорметаном/метанол (300:9) и 1% аммиаком (33% в воде). Полярный диастереоизомер (262 мг) равным образом снова очищали посредством флеш-хроматографии (18 г, 20×2.0 см) с дихлорметаном/метанол (24:1) и 1% аммиаком (33% в воде).
Пример 22: (неполярный диастереоизомер)
Выход: 252 мг (28%), белое твердое вещество
Точка плавления: 75-77°С
1H-ЯМР (ДМСО-d6): 1.12-1.47 (m, 6H); 1.81 (s, 6H); 2.10-2.24 (m, 1H); 2.27-2.37 (m, 2H); 2.33 (d, 3H, J=0.9 Гц); 2.96 (dd, 1H, J=14.3, 8.5 Гц); 3.21 (dd, 1H, J=14.2, 4.7 Гц); 4.33 (dd, 1H, J=8.4, 4.7 Гц); 6.99 (ddd, 1H, J=7.9, 7.1, 1.0 Гц); 7.04-7.11 (m, 2H); 7.14-7.37 (m, 7H); 7.50 (d, 1H, J=7.6 Гц); 10.87 (s, 1H). 1H невозможно было идентифицировать.
13С-ЯМР (ДМСО-d6): 17.0; 27.1; 28.7; 30.2; 30.5; 33.5; 37.4, 53.6; 57.9; 58.7; 110.1; 111.4; 113.6; 118.1; 118.4; 121.0; 124.0; 126.1; 126.7; 127.2; 127.3; 136.2; 138.8; 151.6; 177.9.
ЖХ-NC (метод 7): m/z: [M+H]+=459.3, Rt 2.0 мин.
Число оборотов: [α]D 24=+0.55° (с 1.0, CHCl3).
Пример 23: (полярный диастереоизомер)
Выход: 108 мг (12%), белое твердое вещество
Точка плавления: 71-74°С
1H-ЯМР (CDCl3): 0.68-0.84 (m, 1H); 0.98-1.14 (m, 1H); 1.39-1.84 (m, 5H); 1.97 (s, 6H); 2.26-2.40 (m, 1H); 2,42-2.58 (m, 2H); 2.44 (s, 3H); 3.03 (dd, 1H, J=14.4, 8.8 Гц); 3.35 (dd, 1H, J=14.4, 4.7 Гц); 4.49 (dd, 1H, J=8.8, 4.7 Гц); 6.78-6.81 (m, 1H); 6.91 (d, 1H, J=2.1 Гц); 7.05-7.40 (m, 8H); 7.61 (d, 1H, J=7.8 Гц); 8.48 (s, 1H).
13С-ЯМР (ДМСО-d6): 17.2; 28.7; 30.4; 31.3; 31.6; 34.0; 38.2; 55.0; 58.5; 61.3; 111.0; 111.5; 113.0; 118.8; 119.3; 121.9; 122.9; 126.3; 127.4; 127.7; 127.8; 136.2; 136.6; 152.2; 177.7.
ЖХ-NC (метод 7): m/z: [М+Н]+=459.3, Rt 2.0 мин.
число оборотов: [α]D 24=+1.97° (с 1.0, CHCl3).
Пример 24 и Пример 25
Стадия 1:
2-(1Н-индол-3-ил)-1-фенилэтанон
NaCN (1,4 г, 29 ммоль) помещали под аргоном в абсолютном диметилформамиде (10 мл). При температуре ванны в 35°С прибавляли по каплям бензальдегид (3 мл, 29 ммоль), растворенный в абсолютном диметилформамиде (10 мл), в течение 1.5 ч и еще последующие 0,5 ч перемешивали при этой температуре. К этому реакционному раствору прибавляли по каплям грамин (10,1 г, 58 ммоль), растворенный в абсолютном диметилформамиде (30 мл), в течение 2 ч при 70°С внутренней температуре. Перемешивали еще 1 ч при этой температуре. Для переработки содержимое колбы добавляли в воду (150 мл). Водную фазу подкисляли с помощью 2N HCl, чтобы отделить не вступивший во взаимодействие грамин в виде водорастворимого гидрохлорида. После этого водную фазу экстрагировали хлороформом (3×50 мл). Объединенные экстракты промывали насыщенным раствором NaHCO3 (50 мл) и высушивали над Na2SO4. Затем летучие компоненты полностью удаляли в вакууме. Полученный после отгонки растворителя остаток (9 г) очищали колоночной хроматографией [силикагель 60 (300 г); циклогексан/этилацетат 6:1 (1500 мл)]. Выход: 1 г (14%) желтое масло.
Стадия 2:
2-(1Н-индол-3-ил)-1-фенилэтанон-оксим
2-(1H-индол-3-ил)-1-фенилэтанон (0,97 г, 4,12 ммоль), растворенный в абсолютном этаноле (20 мл), добавляли к раствору гидроксиламин-гидрохлорид (0,97 г, 13,95 ммоль) и ацетат калия (1,54 г, 15,74 ммоль) в абсолютном этаноле (20 мл). Эту реакционную смесь 24 ч перемешивали при комнатной температуре. Затем состав 3 ч кипятили в колбе с обратным холодильником. После этого состав при 70°С растворяли в воде (20 мл). Затем составу давали отстояться 5 ч при 4°С. Так как в осадок не выпадало твердое вещество, то летучие компоненты полностью удаляли в вакууме. Остаток смешивали с водой (10 мл) и рН-значение раствора устанавливали посредством 5N раствора гидроксида натрия до рН 11. Затем экстрагировали этилацетатом (5×30 мл). Объединенные органические фазы высушивали сульфатом натрия, фильтровали и в вакууме освобождали от всех летучих компонентов. Выход: 90% (990 мг) желто-коричневое масло
Стадия 3:
2-(1Н-индол-3-ил)-1-фенилэтиламин
2-(1H-индол-3-ил)-1-фенилэтанон-оксим (0,2 г, 0,75 ммоль), растворенный в этаноле (10 мл), при температуре кипения порционно смешивали с кусочками натрия (500 мг, 21 ммоль). Эту реакционную смесь перемешивали до полного растворения металла в колбе с обратным холодильником. После охлаждения в ледяной ванне к реакционному раствору осторожно добавляли воду (15 мл). Затем летучие компоненты удаляли в вакууме. Водный остаток экстрагировали этилацетатом (3×30 мл). Объединенные органические фазы высушивали сульфатом натрия, фильтровали и в вакууме освобождали от всех летучих компонентов. Полученный после отгонки растворителя остаток (163 мг) очищали колоночной хроматографией [силикагель 60 (30 г); метанол (500 мл)]. Выход: 45 мг (25%), светло-желтое масло. Так как увеличение состава приводило к потерям выхода, то этот состав повторяли трижды.
Стадия 4:
N4-(2-(1H-индол-3-ил)-1-фенилэтил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (Пример 24, неполярный диастереоизомер и Пример 25, полярный диастереоизомер)
Под аргоном растворяли 2-(1H-индол-3-ил)-1-фенилэтиламин (135 мг, 0,57 ммоль) и 4-диметиламино-4-фенилциклогексанон (124 мг, 0,57 ммоль) в тетрагидрофуране (10 мл) и 1,2-дихлорэтан (5 мл). К светлому раствору прибавляли ледяную уксусную кислоту (0,035 мл, 0,57 ммоль). После продолжительности реакции в 15 мин реакционную смесь смешивали с NaBH(ОАс)3 (180 мг, 0,8 ммоль) и 2 дн перемешивали при комнатной температуре. Для переработки состава смесь смешивали с насыщенным раствором NaHCO3 (40 мл) и 15 мин перемешивали. Водную фазу экстрагировали дихлорметаном (2×30 мл). Объединенные органические фазы концентрировали после высушивания над Na2SO4, причем получали светло-коричневое масло. Хроматографическое разделение смеси веществ на силикагеле 60 (50 г) происходило с метанолом (600 мл). Неполярный амин получали с выходом в 67% (168 мг) в виде соединения бежевого цвета. Невозможно было определить точку плавления. Полярный амин получали с выходом в 30% (75 мг) в виде соединения бежевого цвета. Невозможно было определить точку плавления.
Пример 24: (неполярный диастереомер) 13С-ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 27.0, 29.4, 30.5, 30.9, 35.4, 37.8, 52.4, 59.6, 60.0, 111.1, 113.2, 118.9, 119.2, 121.9, 122.8, 126.2, 126.4, 126.7, 127.1, 127.2, 127.3, 127.6, 128.2, 136.4, 139.0, 145.3
Пример 25: (полярный диастереомер) 13С-ЯМР (101 МГц, ДМСО-D6) δ част. на млн.: 29.1, 30.8, 31.6, 318, 35.2, 38.354.4, 60.4, 61.4, 111.0, 113.0, 118.8, 119.2, 121.9, 122.5, 126.3, 126.7, 127.2, 127.6, 127.7, 128.0, 128.2, 136.2, 136.9, 145.2
Стадия 5:
N4-(2-(1H-индол-3-ил)-1-фенилэтил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин дигидрохлорид (Пример 24,неполярный диастереоизомер и Пример 25, полярный диастереоизомер)
Пример 24: (неполярный диастереомер)
Для получения гидрохлорида растворяли N4-(2-(1H-индол-3-ил)-1-фенилэтил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (неполярный амин) (160 мг, 0,36 ммоль) в этилметилкетоне (15 мл), смешивали с триметилхлорсиланом (115 µl, 0,9 ммоль) и 3 ч перемешивали при комнатной температуре. Выпавший в осадок бесцветный гидрохлорид отсасывали и высушивали. Гидрохлорид получали с выходом в 100 мг (53%) с точкой плавления в 198-202°С.
Пример 25: (полярный диастереомер)
Для получения гидрохлорида растворяли N4-(2-(1H-индол-3-ил)-1-фенилэтил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (полярный амин) (70 мг, 0,16 ммоль) в этилметилкетоне (7 мл), смешивали с триметилхлорсиланом (51 µl, 0,4 ммоль) и 3 ч перемешивали при комнатной температуре. Выпавший в осадок бесцветный гидрохлорид отсасывали и высушивали. Гидрохлорид получали с выходом в 70 мг (85%) с точкой плавления в 208-217°С.
Пример 26, Пример 27, Пример 28 и Пример 29
Стадия 1:
2-(4-диметиламино-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропионамид (неполярный диастереомер и полярный диастереомер)
DL-триптофанамид-гидрохлорид (5.00 г, 20.8 ммоль) ресуспендировали в 0.5 М растворе едкого натра (20 мл), затем раствор устанавливали с помощью 4 М раствора едкого натра до рН 9 и после этого экстрагировали этилацетатом (5×30 мл). Объединенные органические фазы высушивали сульфатом натрия и концентрировали в вакууме. Полученный таким образом DL-триптофанамид (3.87 г, 19.04 ммоль) растворяли в тетрагидрофуране (105 мл) и 1,2-дихлорэтане (60 мл) и смешивали с 4-диметиламино-4-фенилциклогексаноном (4.13 г, 19.0 ммоль). Раствор смешивали с ледяной уксусной кислотой (1.09 мл, 19.04 ммоль) и сульфатом натрия (9.52 г) и 15 мин перемешивали. Затем прибавляли триацетоксиборгидрид натрия (5.71 г, 26.6 ммоль), реакционную смесь в течение ночи перемешивали при комнатной температуре, потом смешивали с насыщенным раствором гидрокарбоната натрия (225 мл) и 15 мин перемешивали. После разделения фаз водную фазу экстрагировали дихлорметаном (2×40 мл). Объединенные органические фазы высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт (7.6 г) очищали посредством флеш-хроматографии (500 г, 20×7.6 см) с этилацетат/метанолом (1:1).
Неполярный диастереоизомер
Выход: 3.88 г (50%), белое, аморфное твердое вещество
1H-ЯМР (ДМСО-d6): 1.22-1.36 (m, 2H); 1.36-1.56 (m, 4H); 1.85 (s, 6H); 2.24-2.46 (m, 3Н); 2.81 (dd, 1H, J=14.2, 7.9 Гц); 3.01 (dd, 1H, J=14.3, 5.4 Гц); 3.39 (t, 1H, J=6.5 Гц); 6.94-7.01 (m, 2H); 7.06 (ddd, 1H, J=8.1, 7.0, 1.1 Гц); 7.16-7.38 (m, 9H); 7.56 (d, 1H, J=7.8 Гц); 10.83 (s, 1H).
Полярный диастереоизомер
Выход: 1.64 г (21%), белое, аморфное твердое вещество
1H-ЯМР (ДМСО-d6): 0.75 (m, 1H); 0.92 (m, 1H); 1.35-1.72 (m, 5H); 1.86 (s, 6H); 2.30-2.48 (m, 3Н); 2.71 (dd, 1H, J=14.3, 7.3 Гц); 2.91 (dd, 1H, J=14.3, 5.9 Гц); 3.28 (t, 1H, J=6.6 Гц); 6.87-6.96 (m, 2H); 7.03 (dt, 1H, J=7.5, 1.0 Гц); 7.07 (d, 1H, J=7.2 Гц); 7.18-7.39 (m, 7H); 7.49 (d, 1H, J=7.8 Гц); 10.74 (s, 1H).
Стадия 2:
N-[1-циано-2-(1Н-индол-3-ил)этил]-N-(4-диметиламино-4-фенилциклогексил)-2,2,2-трифторацетамид (непопярный диастереомер)
Раствор 2-(4-диметиламино-4-фенилциклогексиламино)-3-(1H-индол-3-ил)пропионамида (неполярный диастереомер) (500 мг, 1.23 ммоль) в безводном тетрагидрофуране (30 мл) и триэтиламин (2 мл) охлаждали до -15°С и смешивали с ангидридом трифторуксусной кислоты (777 мг, 514 µл, 3.69 ммоль). Смесь 3 ч перемешивали при -15°С и потом концентрировали в вакууме. Остаток смешивали с 5% раствором гидрокарбоната натрия (30 мл) и водную суспензию экстрагировали дихлорметаном (3×20 мл). Объединенные органические фазы высушивали раствором гидрокарбоната натрия (3×20 мл), сульфатом натрия и концентрировали в вакууме. Сырой продукт (539 мг) очищали посредством флеш-хроматографии (85 г, 20×3.7 см) дихлорметаном/метанол (95:5).
Выход: 382 мг (64%), желтое твердое вещество
Точка плавления: 230°С
1H-ЯМР (ДМСО-d6): 0.94-1-06 (m, 1H); 1.23-1.45 (m, 2H); 1.55-1.75 (m, 2H); 1.95-2.10 (m,2H); 1.91 (s, 6H); 2.75 (brd, 1H, J=11.7 Гц); 3.42 (dd, 1H, J=7.2 и 14.2 Гц); 3.66 (dd, 1H, J=8.4 и 14.2 Гц); 3.7O-3.85 (m, 1H); 4.70 (t, 1H, J=7.8 Гц); 7.04 (t, 1H, J=7.4 Гц); 7.12 (t, 1H, J=7.3 Гц); 7.21-7.38 (m, 6H); 7.41 (d, 1H, J=8.0 Гц); 7.63 (d, 1H, J=7.7 Гц); 11.07 (s, 1H).
13С-ЯМР (ДМСО-d6): 24.2; 24.9; 25.1; 25.9; 31.2; 37.2; 37.5; 45.6; 45.9; 54.7; 57.2; 57.3; 66.8; 107.2; 111.8; 115.7 (q, J=288 Гц); 116.9; 117.7; 118.6; 121.3; 125.1; 126.4; 126.6; 127.3; 128.1; 136.1; 138.1; 155.7 (q, J=36 Гц).
ЖХ-NC (метод 8): [M+H]+: m/z=483.3, Rt=2.7 мин.
Стадия 3:
N-(2-(1Н-индол-3-ил)-1-(1Н-тетразол-5-ил)этил)-N-(4-диметиламино-4-фенили,иклогексил)-2,2,2-трифторацетамид (Пример 26, неполярный диастереомер)
Раствор N-[1-циано-2-(1H-индол-3-ил)этил]-N-(4-диметиламино-4-фенилциклогексил)-2,2,2-трифторацетамида (неполярный диастереомер) (241 мг, 0.5 ммоль) в N,N-диметилформамиде (5 мл) и толуол (5 мл) смешивали с азидом натрия (325 мг, 5.0 ммоль) и триэтиламин-гидрохлоридом (688 мг, 5.0 ммоль) и 2 дн перемешивали при 80°С. Затем растворитель удаляли в вакууме. Остаток повторно смешивали с толуолом, и каждый раз снова концентрировали в вакууме. Сырой продукт очищали посредством флеш-хроматографии (37 г, 20×2.1 см) дихлорметаном/метанол [8:2+1% NH3 (32% в H2O)].
Пример 26: неполярный диастереомер
Выход: 219 мг (83%), твердое вещество бежевого цвета
Точка плавления: 216°С
1H-ЯМР (ДМСО-d6): 0.74 (d, 1H, J=10.8 Гц); 1.12-1.44 (m, 2H); 1.5O-1.68 (m, 1H); 1.70-1.80 (m, 1H); 1.86 (s, 5.4H); 2.00 (s, 0.6 H); 2.1O-2.28 (m, 1H); 2.39 (d, 1H, J=14.2 Гц); 2.78 (d, 1H); 3.68 (dd, 1H, J=14.3, 8.1 Гц); 3.70-3.80 (m, 1H); 3.97 (dd, 1H, J=6.8, 14.3 Гц); 5.20 (t, 0.9H, J=7.2 Гц); 5.44 (m, 0.1H); 7.02 (ddd, 1H, J=7.9, 7.0, 1.0 Гц); 7.09 (ddd, 1H, J=7.9, 7.0, 1.0 Гц); 7.14 (d, 1H, J=2.3 Гц), 7.20-7.40 (m, 6H); 7.36 (d, 1H (J=8.0 Гц); 7.67 (d, 1H, J=7.4 Гц); 10.75 (s, 0,1H); 10.91 (s, 0.9H).
ЖХ-NC (метод 8): [М+Н]+: m/z=526.3, tR=2.4 мин.
Стадия 4:
N4-(2-(1H-индол-3-ил)-1-(1H-тетразол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (Пример 27, неполярный диастереомер)
Суспензию N-(2-(1H-индол-3-ил)-1-(1H-тетразол-5-ил)этил)-N-(4-диметиламино-4-фенилциклогексил)-2,2,2-трифторацетамида (неполярный диастереомер) (200 мг, 0.38 ммоль) в метаноле (10 мл) смешивали с 37% соляной кислотой (10 мл) и 7 ч перемешивали при 100°С в тефлоновом сосуде под давлением. Затем снова прибавляли метанол (10 мл) и 37% соляную кислоту (10 мл) и смесь перемешивали последующие 6 ч при 100°С. Затем реакционный раствор концентрировали в вакууме и осадок (250 мг) очищали посредством флеш-хроматографии (37 г, 20×2.1 см) дихлорметаном/метанол [8:2+1% NH3 (32% в H2O)].
Пример 27: неполярный диастереомер
Выход: 98 мг (60%), аморфное, твердое вещество бежевого цвета
1H-ЯМР (ДМСО-d6): 1.35-2.00 (m, 8Н); 2.11 (s, 6Н); 2.55 (s, 1H); 3.46 (d, 2H, J=4.0 Гц); 4.61 (s, 1H); 6.85 (s, 1H); 6.95 (t, 1H, J=7.5 Гц); 7.03 (t, 1H, J=7.5 Гц); 7.10-7.80 (m, 9H); 10.82 (s, 1H).
ЖХ-NC (метод 8): [M+H]+: m/z=430.3, Rt=1.6 мин.
Стадия 5:
N-[1-циано-2-(1Н-индол-3-ил)этил]-N-(4-диметиламино-4-фенилциклогексил)-2,2,2-трифторацетамид (полярный диастереомер)
2-(4-диметиламино-4-фенилциклогексиламино)-3-(1Н-индол-3-ил)пропионамид (полярный диастереомер) (1.58 г, 3.92 ммоль) смешивали с безводным пиридином (20 мл) и растворяли путем перемешивания в колбе с обратным холодильником. Раствор охлаждали до комнатной температуры и смешивали с безводным дихлорметаном (20 мл) и триэтиламином (6 мл), потом охлаждали до -15°С и смешивали с ангидридом трифторуксусной кислоты (2.48 г, 1.64 мл, 11.8 ммоль). Смесь 3 ч перемешивали при -15°С. Затем растворители удаляли в вакууме. Остаток повторно смешивали с толуолом и раствор каждый раз снова концентрировали в вакууме. Остаток растворяли в этилацетате (20 мл) и промывали раствором гидрокарбоната натрия (3×20 мл). Органическую фазу высушивали сульфатом натрия и концентрировали в вакууме. Сырой продукт (1.6 г) очищали посредством флеш-хроматографии (120 г, 20×4.1 см) дихлорметаном/метанол [95:5+1% NH3 (32% в H2O)].
Выход: 693 мг (37%), желтоватое твердое вещество
Точка плавления: 248°С
1H-ЯМР (ДМСО-d6): 0.98-1.07 (m, 2H); 1.22-1.72 (m, 4H); 1.86 (s, 6H); 2.43-2.50 (m, 1H); 2.73 (brd, 1H; J=10.9 Гц); 3.20 (dd, 1H, J=14.0, 7.5 Гц); 3.45 (dd, 1H, J=14.0, 8.2 Гц); 3.73 (m, 1H); 3.99 (t, 1H; J=7.8 Гц); 6.99 (t, 1H, J=7.0 Гц); 7.06-7.15 (m, 3H); 7.24 (d, 2H, J=7.8 Гц); 7.35 (t, 2H, J=7.8 Гц); 7.43 (t, 2H, J=7.6 Гц); 11.02 (s, 1H).
13С-ЯМР (ДМСО-d6): 25.4; 25.9; 26.5; 30.7; 31.6; 38.0; 45.0: 45.6; 57.8; 60.1; 106.9; 111.6; 115.7 (q, J=287 Гц); 116.6; 117.6; 118.8; 121.2; 124.7; 126.5; 126.6; 127.7; 127.9; 135.3; 136.0; 155.6 (q, J=36 Гц).
ЖХ-NC (метод 8): [M+H]+: m/z=483.3, Rt=2.3 мин.
Стадия 6:
N-(2-(1Н-индол-3-ил)-1-(1Н-тетразол-5-ил)этил)-N-(4-диметиламино-4-фенилциклогексил)-2,2,2-трифторацетамид (Пример 28, полярный диастереомер)
Раствор N-[1-циано-2-(1Н-индол-3-ил)этил]-N-(4-диметиламино-4-фенилциклогексил)-2,2,2-трифторацетамида (полярный диастереомер) (613 мг, 1.27 ммоль) в N,N-диметилформамиде (5 мл) и толуоле (5 мл) смешивали с азидом натрия (825 мг, 12.7 ммоль) и триэтиламин-гидрохлоридом (1.74 г, 12.7 ммоль) и 2 дн перемешивали при 80°С в тефлоновом сосуде под давлением. Затем растворители концентрировали в вакууме, осадок повторно смешивали с толуолом и раствор каждый раз снова концентрировали в вакууме. Сырой продукт (1.62 г) очищали посредством флеш-хроматографии (200 г, 20×4.1 см) дихлорметаном/метанол [2:1+1% NH3 (32% в H2O)].
Пример 28, полярный диастереомер
Выход: 615 мг(92%)
Точка плавления: 195-228°С
1H-ЯМР (ДМСО-d6): 0.3O-2.10 (m, 4Н); 2.15 (s, 2Н), 2.20-2.30 (m, 1H); 2.35 (4Н, s); 2.64-3.00 (m, 2Н); 3.24 (dd, 1H, J=4.5 и 13.6 Гц); 3.5O-3.75 (m, 1H); 3.85 (dd, 1H, J=13.9, 10.2 Гц); 3.99 (m, 0.67 H); 4.25 (m, 0.33H); 5.32 (dd, 1H, J=9.9, 4.2 Гц); 6.80 (d, 0.67 H, J=2.0 Гц); 6.87 (d, 0.33H, J=2.0 Гц); 6.92-7.62 (m, 10Н); 10.77 (s, 0.66H); 10.92 (m, 0.33H).
ЖХ-NC (метод 8): [M+H]+: m/z=526.3, Rt=2.2 мин.
Стадия 7:
N4-(2-(1H-индол-3-ил)-1-(1H-тетразол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин (Пример 29, полярный диастереомер)
Суспензию N-(2-(1Н-индол-3-ил)-1-(1Н-тетразол-5-ил)этил)-N-(4-диметиламино-4-фенилциклогексил)-2,2,2-трифторацетамида (100 мг, 0.19 ммоль) в метаноле (10 мл) смешивали с 37% соляной кислотой (3 мл) и 7 ч перемешивали при 100°С в тефлоновом сосуде под давлением. Затем снова прибавляли 37% соляную кислоту (3 мл), смесь перемешивали последующие 24 ч при 100°С и после этого концентрировали в вакууме. Сырой продукт очищали посредством флеш-хроматографии (85 г, 20×3.6 см) дихлорметаном/метанол [2:1+1% NH3 (32% в H2O)].
Пример 29: полярный диастереомер
Выход: 43 мг (53%)
Точка плавления: 190-195°С
1H-ЯМР (ДМСО-d6): 1.00-1.44 (m, 6H); 1.73 (brd, 2Н, J=10.6 Гц); 1.88 (s, 6H); 2.08 (brd, 1H,J=12.1 Гц); 2.52-2.72 (m, 2Н); 3.31 (dd, 1H, J=13.7, 4.3 Гц); 3.36-3.48 (m, 1H); 4.63 (dd, 1H, J=9.8, 4.4 Гц); 6.73 (d, 1H, J=2.3 Гц); 6.93 (ddd, 1H, J=7.9, 7.1, 1.1H); 7.02 (ddd, 1H, J=8.0, 7.1, 1.1 Гц); 7.24-7.55 (m, 7H); 10.75 (s, 1H).
13С-ЯМР (ДМСО-d6): 24.6; 26.3; 28.6; 30.4; 30.5; 37.8; 51.6; 53.8; 60.9; 108.8; 111.3; 117.7; 118.3; 120.7; 123.5; 126.5; 126.9; 127.7; 127.9; 135.6; 135.7; 157.3.
ЖХ-NC (метод 8): [M+H]+: m/z=420.3, Rt=1.0 мин.
Исследования эффективности соединений согласно изобретению
Измерение ORL1-связывания
Соединения были исследованы в анализе связывания рецепторов с 3H-ноцицептин/орфанин FQ с мембранами рекомбинантных CHO-ORL1 клеток. Эта тестовая система была проведена согласно методу, представленному в Ardati et al. (Mol. Pharmacol., 51, 1997, сс.816-824). Концентрация 3H-ноцицептин/орфанин FQ при этих экспериментах составила 0.5 нМ. Анализы связывания были проведены с помощью по 20 µг мембранного протеина на каждые 200 µл состава в 50 мМ хепеса, рН 7,4, 10 мМ MgCl2 и 1 мМ EDTA. Связывание с ORL1-рецептором определяли с применением по 1 мг WGA-SPA микрошариков (Beads) (Amersnam-Pharmacia, Фрайбург), путем одночасовой инкубации состава при комнатной температуре и последующего измерения в сцинтилляционном счетчике Trilux (Wallac, Финляндия). Сродство указано в таблице 1 как наномолярное Ki-значение в или % ингибирования при с=1 µМ.
Измерение µ-связывания
Сродство рецепторов к человеческому µ-опиатному рецептору определяли в гомогенном составе в микротитрационных планшетах. Для этого в течение 90 минут при комнатной температуре инкубировали ряды разведении в каждом случае испытуемого соединения с рецепторным мембранным препаратом (15-40 µг протеина на 250 µл инкубационного состава) СНО-К1-клеток, которые выражают человеческий µ-опиатный рецептор (RB-HOM-рецепторный мембранный препарат фирмы NEN, Zaventem, Бельгия) в присутствии 1 нмоль/л радиоактивного лиганда [3H]-налоксон (NET719, фирма NEN, Zaventem, Бельгия), а также 1 мг WGA-SPA-Beads (Wheat germ agglutinin SPA Beads фирмы Amersham/Pharmacia, Фрайбург, Германия) в общем объеме 250 µл. В качестве инкубационного буфера применяли 50 ммоль/л трис-HCl, дополненную 0,05 мас.% азидом натрия и 0,06 мас.% альбумином сыворотки крупного рогатого скота. Для определения неспецифического связывания дополнительно добавляли 25 µмоль/л налоксона. После окончания девяностоминутного инкубационного периода микротитрационные планшеты в течение 20 минут при 1000 г отделяли центрифугированием и радиоактивность измеряли в β-счетчике (Microbeta-Trilux, фирма PerkinElmer Wallac, Фрайбург, Германия). Процентное вытеснение радиоактивного лиганда определяли из его связывания к человеческому µ-опиатному рецептору при концентрации контрольного вещества в 1 µмоль/л и указывали как процентное ингибирование (% ингибирования) специфического связывания. Частично исходя из процентного вытеснения, благодаря различным концентрациям контрольных соединений общей формулы I IC50, рассчитывали ингибирующие концентрации, которые способствовали 50-процентному вытеснению радиоактивного лиганда. Путем пересчета с помощью уравнения Ченга-Прусоффа (Cheng-Prusoff) получали Ki-значения для контрольных веществ. В некоторых случаях отказывались от определения Ki-значения и определяли только ингибирование в тестовой концентрации 1 µМ.
[3H]-BTX-связывание с натриевым каналом (участок связывания натриевгого канала 2; ВТХ-анализ)
[3H]-ВТХ-вытеснение испытуемыми веществами тестируется на синаптосомах (из корковой ткани самцов крыс Sprague Dawley, 150-350 г) в присутствии [3Н]-ВТХ, ТТХ и яда альфа-скорпиона
- батрахотоксин (ВТХ) связывается с участком связывания 2 Na+ рецептора и там ингибирует инактивацию канала
- тетродотоксин (ТТХ) связывается с участком связывания 2 рецептора и здесь снижает неспецифическое связывание ВТХ
- яд скорпиона улучшает специфическое связывание ВТХ с участком связывания 2 в 20-30 раз, тем, что он особенно связывает участок связывания 3
- вератридин (VTD) таким же образом, как ВТХ, связывает участок связывания 2 и тем самым конкурентно ингибирует связывание ВТХ
Опыты проводят при фиксированной концентрации калия в 5,4 мМ при 37°С. Инкубационный период составляет 120 мин. Неспецифические связывания определяют в присутствии VTD. По истечении инкубационного периода испытательную пластину отсасывают через фильтровальную пластину. Оставшиеся в фильтре и от [3H]-BTX связанные рецепторные молекулы теперь могут получить количественную оценку соответственно посредством измерения радиоактивности, из чего снова следуют показания о вытеснении ВТХ испытуемыми веществами. Другие детали могут быть взяты из методической части Catterall et al. (1981).
Литература: Binding of batrachotoxinin A 20-alpha-benzoate to a receptor site associated with sodium channels in synaptic nerve ending particles. Catterall WA, Morrow CS, Daly JW, Brown GB. J Biol Chem. 1981 Sep 10; 256 (17): 8922-7.
Модель Чанга (Chung): боль при мононевропатии после спинальной лигатуры нервов
Животные: самцов крыс Sprague Dawley (140-160 г), от коммерческого животновода (Janvier, Genest St. Isle, Франция), удерживали при 12:12 ч ритме свет-темнота. По желанию удерживали с кормом и водопроводной водой. Между доставкой животных и операцией выдержали интервал в одну неделю. После операции животных подвергали многократному тестированию в течение промежутка времени в 4-5 недель, причем было выдержано время промывания, по меньшей мере, в одну неделю.
Описание модели: под наркозом пентобарбитала (Narcoren®, 60 мг/кг i.p., Merial GmbH, Hallbergmoos, Германия), экспонировали левые L5, L6 спинальные нервы, в то время как были удалены кусок паравертебральной мышцы и часть левого спинального процесса L5 тела поясничного позвонка. Спинальные нервы L5 и L6 были осторожно изолированы и перевязаны прочной лигатурой (NC-silk black, USP 5/0, metric 1, Braun Melsungen AG, Melsungen, Германия) (Kim and Chung 1992). После лигатуры мышцу и соседние ткани зашили и рану закрыли с помощью металлических кламмеров
После периода отдыха в одну неделю животных поместили в клетки с проволочным дном для измерения механической аллодинии. На ипсилатеральной и контралатеральной задней лапе каждый раз определяли порог отдергивания с помощью электронного филамента Фрея (Somedic АВ, Maimö, Швеция). К каждому моменту измерения вычисляли срединное значение пяти последовательных стимуляций. Животных подвергали испытанию за 30 мин и в различные периоды времени после применения раствора испытуемого вещества или раствора лекарственной основы. Данные определяли как % максимально возможного действия (%МРЕ) из предварительных тестов отдельных животных (=0% МРЕ) и тестовых значений независимой имитационной (sham) контрольной группы (=100% МРЕ). Альтернативно были представлены пороги отдергивания в граммах.
Анализ статистических данных: ED50 значения и 95% доверительные пределы были определены посредством полулогарифмического регрессивного анализа на момент максимального действия. Данные были проанализированы дисперсионным анализом с повторными измерениями, а также с помощью вторичного анализа (post hoc) согласно Бонферрони (Bonferroni). Групповой размер обычно составлял n=10.
Ссылки: Kim, S.H. and Chung, J.M. An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat, Pain, 50 (1992) 355-363.
Нефелометрическое исследование растворимости (фосфатный буфер рН 7.4):
Этот метод исследует растворимость вещества при установленных концентрациях (1 µM, 3 µM, 10 µM, 30 µM и 100 µM) в 10 мМ растворе фосфатного буфера при рН 7.4.
Первоначально необходим 10 мМ раствор веществ в ДМСО, из которого получают 100-кратные основные растворы указанных выше уровней концентрации снова в ДМСО, конечная ДМСО концентрация в исследуемом составе составляет 1% (v/v). Эксперимент проводят с многократным определением. После добавления ДМСО основных растворов к буферу, состав 2 ч инкубируют при 37°С, прежде чем происходит определение абсорбции при 620 нм. Если абсорбция образцов повышается выше чистого раствора буфер/ДМСО, то это является индикатором образования осадка. Нижняя граница растворимости («lower bound») представляет собой концентрацию, которая предшествует той с первым образованием осадка (например, 3 µМ, если образование осадка было обнаружено при 10 µМ).
Соединения согласно изобретению типа Е с Z=-NH, R≠Н (Прим. 4, 6, 8, 13 и 15) сравнивали с соответствующими соединениями типа Е с Z=О или -NH, R=Н и Me и (от V-1 до V-3):
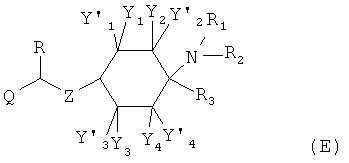
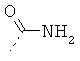
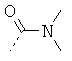
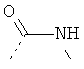
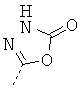
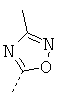
Как подтверждает вышеуказанное сравнение, соединения согласно изобретению, в особенности каждый раз полярный диастереомер, по сравнению со структурно подобными соединениями обладают незначительным сродством с ВТХ-ионным каналом, что в особенности должно повлечь за собой преимущества, принимая во внимание нежелательные сердечно-сосудистые побочные эффекты.
Соединения согласно изобретению типа Е с Z=-NH, R≠H (Прим. 1, 9, 18 и 20) сравнивали с соединениями типа F с Z=-NH или -NMe, R6=H или Me (R1 до R3, от Y1 до Y4 и от Y1' до Y4' каждый раз идентично) (от V-4 до V-6):

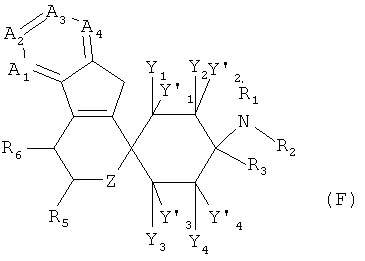

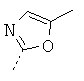
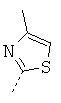
Как подтверждает вышеуказанное сравнение, соединения согласно изобретению из примеров 1,9, 18 и 20 по сравнению со структурно подобными соединениями (от V-4 до V-6) обладают лучшей растворимостью в водных средах, что в особенности должно повлечь за собой преимущества, принимая во внимание свойства всасывания и/или биодоступности.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРОКСИМЕТИЛЦИКЛОГЕКСИЛАМИНЫ | 2009 |
|
RU2514192C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 4-АМИНОЦИКЛОГЕКСАНА | 2009 |
|
RU2532545C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 4-АМИНОЦИКЛОГЕКСАНА | 2009 |
|
RU2503660C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 4-АМИНОЦИКЛОГЕКСАНА | 2009 |
|
RU2525236C2 |
| ПРОИЗВОДНЫЕ СПИРО(5.5)УНДЕКАНА | 2009 |
|
RU2515895C2 |
| ПРОИЗВОДНЫЕ (ГЕТЕРО)АРИЛЦИКЛОГЕКСАНА | 2009 |
|
RU2502733C2 |
| СОЕДИНЕНИЕ, НАЦЕЛЕННОЕ НА БЕЛОК И ЕГО ДЕГРАДАЦИЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2829459C1 |
| ЗАМЕЩЕННЫЕ ФЕНИЛМОЧЕВИНЫ И ФЕНИЛАМИДЫ В КАЧЕСТВЕ ЛИГАНДОВ ВАНИЛЛОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2553392C2 |
| СПИРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА | 2008 |
|
RU2470933C2 |
| Спироконденсированные производные 2,3-дигидроиндола, их применение в офтальмологии | 2017 |
|
RU2712039C2 |
Изобретение относится к соединению общей формулы (1), в которой Y1, Y1', Y2, Y2', Y3, Y3', Y4 и Y4' означают -H; R1 и R2 означают незамещенный -C1-8-алифат; R3 означает незамещенный -C6-16-арил; R4 означает -H или -C(=O)R0, где R0 означает -C1-8-алифат, незамещенный или моно- или полизамещенный заместителями, независимо друг от друга выбранными из группы, состоящей из -F, -Cl, -Br, -I и -CN; Q означает незамещенный -C1-8-алифат-гетероарил; X означает =O, =CR6R7 или =N-R6, причем R5 означает -NH2, -NH-(незамещенный-C1-8-алифат) или -N-(незамещенный-C1-8-алифат)2, если X означает =O, или R5 и R6 совместно образуют 5-членное кольцо, в котором остальные кольцевые атомы независимо друг от друга означают С, N, S или O, причем 5-членное кольцо означает 1,3,4-оксадиазолил, 1,2,4-оксадиазолил, оксазолил или тиазолил, в каждом случае незамещенный или монозамещенный незамещенным C1-C8алифатом или =O, или незамещенный - тетразолил, если X означает =N-R6, или R5 и R6 совместно образуют незамещенный - фенил, и R7 означает -H, если X означает =CR6R7, причем где "алифат" в каждом случае представляет собой разветвленный или неразветвленный, насыщенный углеводородный остаток; "арил" в каждом случае независимо означает карбоциклическую кольцевую систему, содержащую по меньшей мере одно ароматическое кольцо, которое не содержит гетероатомов, где арил при необходимости может быть конденсирован с другими насыщенными, (частично) ненасыщенными или ароматическими кольцевыми системами; "гетероарил" означает индолил; в виде отдельного стереоизомера или их смеси, в виде свободных соединений и/или их физиологически совместимых солей. Соединение формулы (1) используют для получения лекарственного средства, обладающего сродством к µ-опиоидному рецептору и к ORL1-рецептору, и для лечения боли. Технический результат - замещенные циклогексилдиамины, обладающие сродством к μ-опиоидному рецептору и к ORL1-рецептору. 4 н. и 3 з.п. ф-лы, 1 табл., 29 пр.
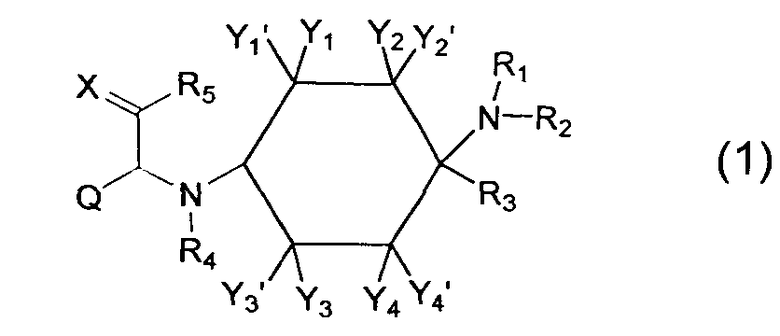
1. Соединение общей формулы (1)

в которой
Y1, Y1', Y2, Y2', Y3, Y3', Y4 и Y4' означают -H;
R1 и R2 означают незамещенный -C1-8-алифат;
R3 означает незамещенный -C6-16-арил;
R4 означает -H или -C(=O)R0, где
R0 означает -C1-8-алифат, незамещенный или моно- или полизамещенный заместителями, независимо друг от друга выбранными из группы, состоящей из -F, -Cl, -Br, -I и -CN;
Q означает незамещенный -C1-8-алифат-гетероарил;
X означает =O, =CR6R7 или =N-R6, причем
R5 означает -NH2, -NH-(незамещенный-C1-8-алифат) или -N-(незамещенный-C1-8-алифат)2, если X означает =O, или
R5 и R6 совместно образуют 5-членное кольцо, в котором остальные кольцевые атомы независимо друг от друга означают С, N, S или O, причем 5-членное кольцо означает 1,3,4-оксадиазолил, 1,2,4-оксадиазолил, оксазолил или тиазолил, в каждом случае незамещенный или монозамещенный незамещенным C1-C8алифатом или =O, или незамещенный - тетразолил, если X означает =N-R6, или
R5 и R6 совместно образуют незамещенный - фенил, и R7 означает -H, если X означает =CR6R7, причем
где "алифат" в каждом случае представляет собой разветвленный или неразветвленный, насыщенный углеводородный остаток;
"арил" в каждом случае независимо означает карбоциклическую кольцевую систему, содержащую по меньшей мере одно ароматическое кольцо, которое не содержит гетероатомов, где арил при необходимости может быть конденсирован с другими насыщенными, (частично) ненасыщенными или ароматическими кольцевыми системами;
"гетероарил" означает индолил;
в виде отдельного стереоизомера или их смеси, в виде свободных соединений и/или их физиологически совместимых солей.
2. Соединение по п.1, которое имеет общую формулу (1.1) или (1.2)
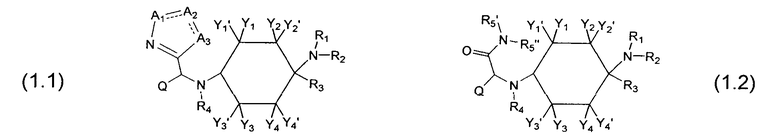
где, если имеется,
A1 означает -N=, -NH-, -NR8- или -CR8=;
A2 означает =N-, -C(=O)- или =CR9-;
A3 означает -O-, -NH- или -NR10-; и
R5', R5″, R8, R9 и R10 каждый раз независимо друг от друга означают -H или незамещенный -C1-8-алифат.
3. Соединение по п.1, которое имеет общую формулу (2), (3), (4), (5) или (6)

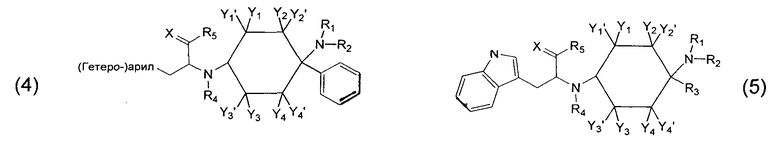

4. Соединение по п.1, выбранное из группы, состоящей из:
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1H-индол-3-ил)пропанамида, неполярный диастереомер;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1H-индол-3-ил)пропанамида, полярный диастереомер;
- (±)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1H-индол-3-ил)пропанамида, неполярный диастереомер;
- (±)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1H-индол-3-ил)пропанамида, полярный диастереомер;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1H-индол-3-ил)-N,N-диметилпропанамида, неполярный диастереомер;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1H-индол-3-ил)-N,N-диметилпропанамида, полярный диастереомер;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1H-индол-3-ил)-N-метилпропанамида, неполярный диастереомер;
- (S)-2-(4-(диметиламино)-4-фенилциклогексиламино)-3-(1H-индол-3-ил)-N-метилпропанамида, полярный диастереомер;
- 5-((S)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1H-индол-3-ил)этил)-1,3,4-оксадиазол-2(3H)-она, неполярный диастереомер;
- 5-((S)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1H-индол-3-ил)этил)-1,3,4-оксадиазол-2(3H)-она, полярный диастереомер;
- N4-((S)-2-(1H-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина;
- 5-((R)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1H-индол-3-ил)этил)-1,3,4-оксадиазол-2(3H)-она, неполярный диастереомер;
- 5-((R)-1-(4-(диметиламино)-4-фенилциклогексиламино)-2-(1H-индол-3-ил)этил)-1,3,4-оксадиазол-2(3H)-она, полярный диастереомер;
- N4-((R)-2-(1H-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина, неполярный диастереомер;
- N4-((R)-2-(1H-индол-3-ил)-1-(3-метил-1,2,4-оксадиазол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина, полярный диастереомер;
- N4-((S)-2-(1H-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина, неполярный диастереомер;
- N4-((S)-2-(1H-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина, полярный диастереомер;
- N4-(2-(1H-индол-3-ил)-1-(1H-тетразол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина;
- N4-(2-(1H-индол-3-ил)-1-фенилэтил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина;
- (R)-N4-(2-(1H-индол-3-ил)-1-(5-метилоксазол-2-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина;
- (S)-N4-(2-(1H-индол-3-ил)-1-(4-метилтиазол-2-ил)этил)-N1,N1-диметил-1-фенилцикло-гексан-1,4-диамина;
- (R)-N4-(2-(1H-индол-3-ил)-1-(4-метилтиазол-2-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина;
- N4-(2-(1H-индол-3-ил)-1-фенилэтил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамин дигидрохлорида;
- N-(2-(1H-индол-3-ил)-1-(1H-тетразол-5-ил)этил)-N-(4-диметиламино-4-фенилциклогексил)-2,2,2-трифторацетамида;
- N4-(2-(1H-индол-3-ил)-1-(1H-тетразол-5-ил)этил)-N1,N1-диметил-1-фенилциклогексан-1,4-диамина;
или их физиологически совместимых солей.
5. Лекарственное средство, обладающее сродством к ORL1-рецептору и µ-опиоидному рецептору, содержащее по меньшей мере одно соединение по любому из пп.1-4 в виде отдельного стереоизомера или их смеси, в виде свободных соединений и/или их физиологически совместимых солей, а также при необходимости пригодные добавки и/или вспомогательные вещества.
6. Применение соединения по одному из пп.1-4 в виде отдельного стереоизомера или их смеси, в виде свободного соединения и/или их физиологически совместимых солей, для получения лекарственного средства для лечения боли.
7. Применение соединения по одному из пп.1-4 в виде отдельного стереоизомера или их смеси, в виде свободных соединений и/или их физиологически совместимых солей и/или сольватов для получения лекарственного средства для лечения состояний страха, стресса и связанных со стрессом синдромов, депрессий, эпилепсии, болезни Альцгеймера, старческого слабоумия, общих познавательных дисфункций, нарушений обучения и памяти (как ноотроп), синдромов отмены, злоупотребления алкоголем и/или наркотиками, и/или злоупотребления медикаментами, и/или алкогольной, наркотической, медикаментозной зависимости, сексуальных дисфункций, сердечно-сосудистых заболеваний, гипотонии, гипертензии, тугоухости, недостаточной подвижности кишечника, нарушений приема пищи, анорексии, ожирения, локомоторных расстройств, диареи, недержания мочи, противосудорожного средства или анестетика соответственно для совместного приема при лечении с опиоидным анальгетиком, для диуреза или антинатрийуреза, для модуляции двигательной активности, для модуляции распределения нейромедиаторов и лечения связанных с этим нейродегенеративных заболеваний и для лечения синдромов отмены и/или для снижения наркотического потенциала опиоидов.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| US 4113866 A, 12.09.1978 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 2-ПИРИДИНЦИКЛОГЕКСАН-1, 4-ДИАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2002 |
|
RU2287523C2 |
Авторы
Даты
2014-08-20—Публикация
2009-03-25—Подача