Изобретение относится к новым спироконденсированным производным 2,3-дигидроиндола, обладающих свойствами лигандов мелатонинового рецептора подтипов МТ1, МТ2 и фермента - хинонредуктазы 2 (МТ3), ингибиторов MT3 подтипа мелатониновых рецепторов и их применению для лечения офтальмологических заболеваний.
В настоящее время во многих странах выпускаются препараты мелатонина, которые либо являются лекарственными средствами, либо относятся к БАД. Известная лекарственная форма биогенного амина мелатонина (N-ацетил-5-метокситриптамин) - мелаксен, используется при нарушении сна у больных с нарушением мозгового кровообращения, применяется при комплексной противопухолевой терапии, при лечении артериальной гипертензии и нейродегенеративных заболеваний. Более широкому внедрению использования мелатонина является его быстрый метаболизм в организме, особенно в светлое время суток, а также не селективное действие, связанное с наличием в организме многочисленных сайтов связывания мелатонина. У животных выделяют 3 подтипа мелатониновых рецепторов: трансмембранные GPCR рецепторы МТ1 и МТ2 и низкоафинный рецептор МТ3, который согласно некоторым исследованиям представляет собой фермент - хинонредуктазу 2. Кроме того, мелатонин способен связываться с ядерными рецепторами ROR/RZR. Несмотря на многочисленные исследования, вопрос, какие именно физиологические функции мелатонин регулирует, до сих пор остается открытым.
Известно, что местное применение мелатонина в виде инстилляций оказывает эффективное действие при воспалительных заболеваниях сосудистой оболочки глаза различного генеза, часто затрагивающее и другие структуры глаза, в том числе, сетчатку, и приводящее к слепоте (см. Н. Б. Чеснокова и др. Эффективность местного применения мелатонина в виде инстилляций при экспериментальном увеите у кроликов, VIII Российский общенациональный офтальмологический форум, Сборник научных трудов научно-практической конференции с международным участием, под редакцией В.В. Нероева, Москва, 22-24 сентября, 2015, т. 2, стр. 929-933).
В EA005409B1 /A61K31/437, опубл. 24.02.2005/, описываются спироконденсированные производные бензамидопиперидина и способ их получения с использованием N-(1'-метил-5'-метокси-2'-оксоcпиро[циклоалкан-1,3'-индолин]-6'-ил]изоникотинамидов. Соединения обладают свойствами антагонистов NK-1 рецептора и могут быть использованы, например, для лечения глазных и офтальмологических заболеваний.
J. Benjamin Garcia-Vazquez et al. (Structure elucidation of configurational isomers of nitrile-substituted spirocyclopropyloxindoles by NMR spectroscopy, molecular modeling, and X-ray crystallography, Magnetic Resonance in Chemistry (2015), 53(12), 1061-1070) описывает диастереомерные чистые формы нитрилзамещенных спироциклопропилоксиндолов общей формулы
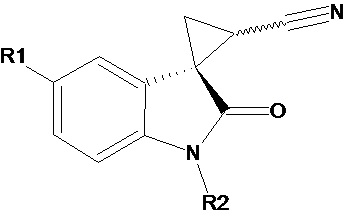
где R1 и R2 соответственно означают (а) R1 означает F, R2 означает Me; б) R1 означает F, R2 означает бензил; в) R1 означает F, R2 означает п-метоксибензил; г) R1 означает MeO, R2 означает бензил; д) R1 означает MeO, R2 означает п-метоксибензил; е) R1 означает Me, R2 означает Me. Описывается также способ их получения. Соединения могут быть использованы в качестве промежуточных продуктов и как соединения с биологическими и фармакологическими свойствами.
Marta S. Morales-Rios et al. (One -Pot synthesis of conformationally restricted spirooxindoles, Tetrahedron, 2007,63,7702-7707) описывает получение диастереомерных 1'-метил-2'-оксо-1',2'-дигидроспиро[С3-С7циклоалкан-1,3'-индол]-2-карбонитрилов, как соединений с биоактивной молекулой, имеющейся во множестве натуральных продуктов. Соединения получают по схеме

где n = 1, 2, 3, 4.
WO2013006738А1 /C07D401/12, опубл. 10.01.2013/ описывает 2'-оксоспиро[циклопропан-1,3'-индолин]карбоксамиды для получения гетероциклических соединений, которые могут быть использованы для лечения и профилактики вирусных заболеваний.
В WO201107039A2 /H01L33/00, опубл. 21.06.2012/ описываются стереоизомерные формы производных 2-фенил-1'-алкилспиро[циклопропан-1,3'-индолин]-2'-она в качестве медиаторов АМРК для лечения таких заболеваний, как ожирение, гиперглицемия, дилипидемия, диабет и рак.
WO 2004037247 А1 /C07D209/96, опубл. 06.05.2004/описывает производные спиро[циклопропан-1,3'-индолин]-2'-она для лечения вирусных заболеваний, в частности для лечения HIV инфекции, и способ их получения. Соединения соответствуют общей формуле

где R1, R2, R3 и R4 независимо выбираются из водорода, замещенного или незамещенного алкила, OR8, NO2, CN и галогена, R8 выбирается из H и замещенного или незамещенного алкила; R5 и R5’ независимо выбираются из Н, замещенного или незамещенного алкила, CN, SR9 и C(O)R9, где R9 независимо выбираются из Н, замещенного или незамещенного алкила, NR10R11 и OR1 l , где R10 независимо выбираются из Н, замещенного или незамещенного алкила и OR12, где R11 и R12 могут независимо выбираться из Н, замещенного или незамещенного алкила. R6 и R6’ независимо выбираются из Н, замещенного или незамещенного алкила и C(O)R16, где R16 может быть выбран из NR17R18 и OR17
Govindaraju Karthik et al. (Catalyst and solvent-free cyclopropanation of electron-deficient olefins with cyclic diazoamides for the synthesis of spiro[cyclopropane-1,3'-indolin]-2'-one derivatives. Tetrahedron Letters (2014), 55(51), 7064-7067) описывают способ получения 1',2'-дигидро-2'-оксоспиро[циклопропан-1,3'-индолин]-2-карбоновой кислоты и ее метилового эфира. Синтез проводят циклопропанированием диазосоединений по схеме: 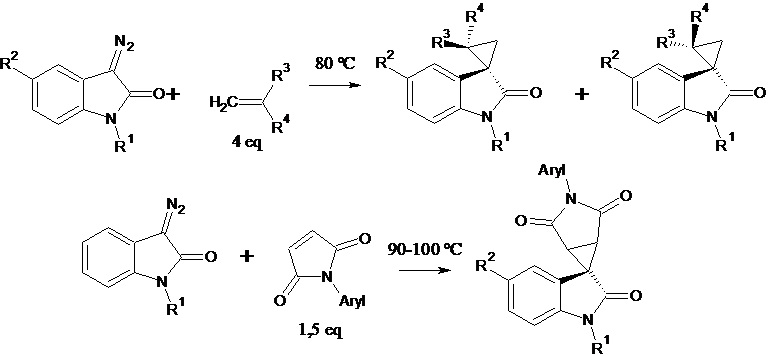
где R1 = H, Alk , R2 = Hal, Alk
Lozinskaya N.A. et al. (Syntheses of spiroindole melatonin analogues via 2-(indolin-3-ylidene)acetonitrile cycloadditions, Mendeleev Communications, 2014, 24 (5), р. 260-261) описывают синтез спироиндольных аналогов мелатонина путем циклоропанирования 2-(2-оксо-1,2-дигидро-3H-индол-3-илиден)ацетонитрилов с использованием диaзометана по следующей схеме
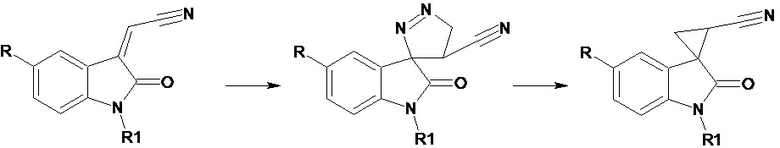
R - H, OMe, R1 - H.
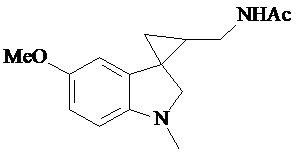
Gonzales-Juarex Daphne E et al. (Stereochemistry modulated the catalyst hydrogenolysis of nitrile-substituted cyclopropanes, Tetrahedron, 68 (35), 7187-7195) описывает региоселективный способ получения диастереомерных N-[[1’-метил-1’,2’-дигидро-2’-оксоспиро[циклопропан-1,3’-[3H]-индол]-2-ил]метил]ацетамида, которые могут быть замещены в положении 5 индола метокси-группой. Синтез осуществляют путем каталитического гидрогенолиза син-диастереомеров соответствующих нитрилзамещенных спироциклопропилоксиндолов.
Известно, что активация мелатониновых рецепторов глаза дает начало сигнальному каскаду, вызывающему снижению внутриглазного давления, что важно для лечения и профилактики глаукомы.
Учитывая большой потенциал аналогов лигандов мелатониновых рецепторов, разработка новых мелатониновых лигандов различных подтипов и их синтез, а также изучение активности является актуальной задачей.
Настоящее изобретение относится к изысканию и разработке способа получения новых спироконденсированных производных индолинона, обладающих свойствами лигандов подтипов МТ1, МТ2 и МТ3 (фермента хинонредуктазы 2) мелатонинового рецептора и к их применению для лечения офтальмологических заболеваний, в частности для лечения глаукомы.
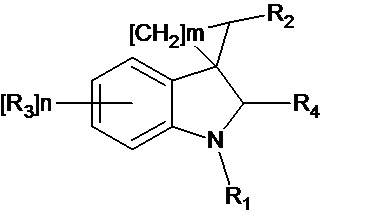
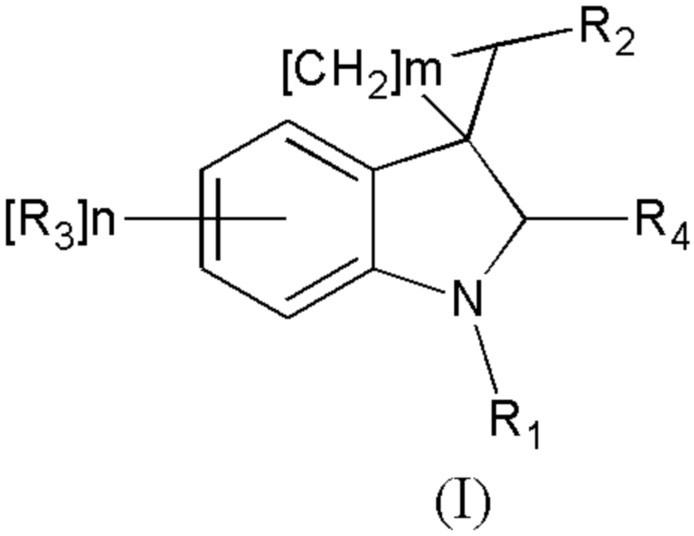
Спироконденсированные производные индолинона настоящего изобретения соответствуют общей формуле (I) или их стереоизомеры и фармацевтически приемлемые соли,
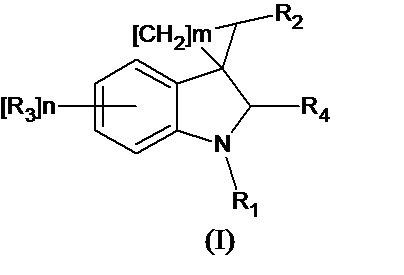
где R1 означает H, С1-С4алкил, бензил;
R2 означает -CH2NH(CO)СН3 (при условии, что R3 не означает Н, 5-метокси, 5-бром или 6,7-диметил), -CH2NH(CO)С2-С4алкил, -CH2NH(CO)С3-С6циклоалкил, - CH2NH(CO)С1-С4алкокси, -CH2NH(CO)галоалкил; -CH2NH(CO)(6-членный арил); - CH2NH(CO)(5-6-членный гетероарил), содержащий 1-2 атома кислорода, азота или серы;
R3 означает Н, галоген, С1-С4алкокси, С1-С4алкил, -NHС(О)С1-С4алкил,-NHC(O)OC1-C4алкил, -NH(CO)(6-членный арил); -NH(CO)(5-6-членный гетероарил), содержащий 1-2 атома кислорода, азота или серы; -NHС(О)-С3-С6циклоалкил, -NHС(О)СF3;
R4 означает =О, H2
n означают целое число от 1 по 2,
m означают целое число 1, 4.
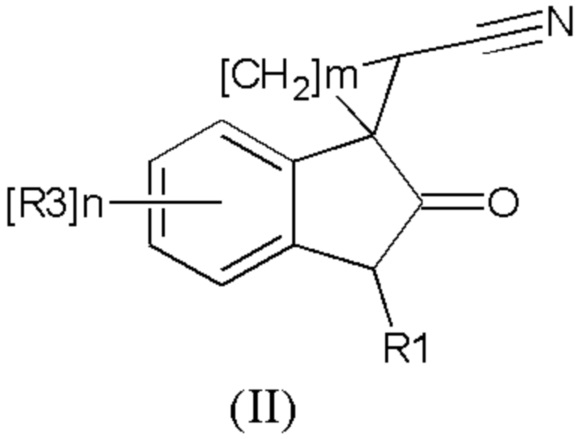
Изобретение также относится к применению соединения общей формулы (II) или его стереоизомеров и фармацевтически приемлемых солей,
(II)
где R1 означает H, С1-С4алкил, бензил;
R2 означает -CH2NH(CO)С1-С4алкил,- -CH2NH(CO)С3-С6циклоалкил, - CH2NH(CO)С1-С4алкокси,- -CH2NH(CO)СF3; -CH2NH(CO)(6-членный арил); - CH2NH(CO)(5-6-членный гетероарил), содержащий 1-2 атома азота, кислорода или серы; CN; СOR5, где R5 означает OH, OС1-С4алкил, NH2, N(С1-С4алкил)2
R3 означает Н, галоген, С1-С4алкокси, С1-С4алкил, С1-С4галоалкил, -NHС(О)С1-С4алкил,-NHC(O)OC1-C4алкил, -NH(CO)(6-членный арил); -NH(CO)(5-6-членный гетероарил), содержащий 1-2 атома азота, кислорода или серы; -NHС(О)-С3-С6циклоалкил, -NHС(О)галоалкил;
R4 означает =О или H2
n означают целое число от 1 по 2,
m означают целое число 1, 4.
в качестве лекарственного средства для лечения и профилактики офтальмологических заболеваний, например, при глаукоме.
Изобретение также относится к фармацевтической композиции, включающей эффективное количество соединения формулы (I) и традиционно применяемые для лечения офтальмологических заболеваний эксципиенты, такие как растворитель или носитель, консерванты.
Композиция может быть выполнена в виде капель. Растворяющей средой может быть вода. Композиция может также содержать, например, физиологически толерантный буфер, полиэтиленгликоль.
Способ получения соединений формулы (I), где R4 означает =О, R2 означает -NH(CO)С1-С4алкил, -NH(CO)С3-С6циклоалкил, -NH(CO)С1-С4алкокси, -NH(CO)СF3; -NH(CO)6-членный арил; -NH(CO)5-6-членный гетероарил, содержащий 1-2 атома азота или серы, заключается в том, что проводят селективное восстановление нитрильной группы в соответствующем соединении формулы (II), где R4 означает =О, R2 означает CN водородом на катализаторе в среде карбоновой кислоты R6COOH с одновременным ацилированием образующегося амина при добавлении ангидрида соответствующей кислоты (R6CO)2O или R6C(O)Hal, для получения ацилированного амина согласно следующей схеме:
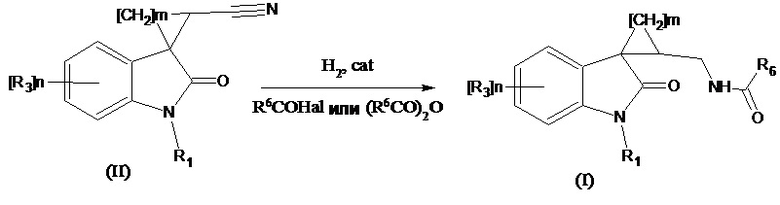
где значения R1, R3, m и n указаны выше, R6 означает -С1-С4алкил, -С3-С6циклоалкил, -С1-С4алкокси, -СF3; -6-членный арил; –5-6-членный гетероарил, содержащий 1-2 атома азота или серы, cat означает PtO2, Pt, Pd, в том числе и на инертном носителе. Способ позволяет получать продукты с высоким выходом с отсутствием побочных реакций. При проведении синтеза в указанных условиях можно проводить восстановление нитрилов, содержащих несколько амидных групп.
Получение соединений формулы (I), где R4 означают =О, R2 означает -NH(CO)С1-С4алкил, -NH(CO)С3-С6циклоалкил, -NH(CO)С1-С4алкокси, -NH(CO)СF3; -NH(CO)6-членный арил; -NH(CO)5-6-членный гетероарил, содержащий 1-2 атома азота или серы, также можно проводить восстановлением нитрильной группы в соответствующем соединении формулы (II) где R4 означает =О, R2 означает CN боргидридом металла в присутствии безводного хлорида никеля, с последующим ацилированием образующегося амина при добавлении ангидрида кислоты (R6C(O))2O или R6C(O)Hal согласно схеме:
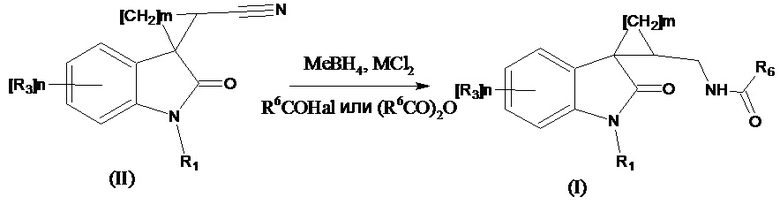
где значения R1, R3, m и n указаны выше, R6 означает -С1-С4алкил, -С3-С6циклоалкил, -С1-С4алкокси, -СF3; -6-членный арил; –5-6-членный гетероарил, содержащий 1-2 атома азота или серы, Me означает Li, Na, K, Al и др, Me означает Ni, Co. Этот способ позволяет более широко варьировать ацилирующие агенты.
Получение соединений формулы (I), где R4 означает Н2, проводится восстановлением соединений формулы (II), где R4 означает =О, R2 означает CN боргидридом металла в присутствии иода в среде безводного растворителя, с добавлением соответствующего ацилирующего агента (R6CO)2O или R6COHal согласно следующей схеме:
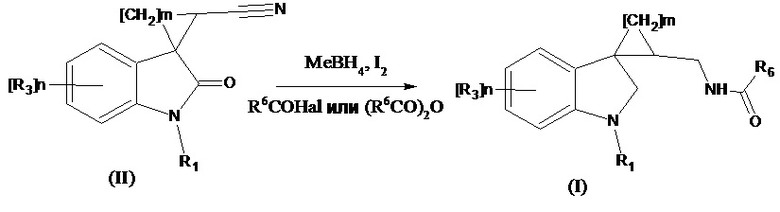
где значения R1, R3, m и n указаны выше, R6 означает -С1-С4алкил, -С3-С6циклоалкил, -С1-С4алкокси, -СF3; -6-членный арил; -5-6-членный гетероарил, содержащий 1-2 атома азота или серы Me означает Li, Na, K, Al и др. Соединение формулы (I’), где R3 означает метокси-группу, R1 означает метил, R2 означает -С1-С4алкил может быть также получено при длительном хранении соединения формулы (III) при 25°С в течение 10-30 дней в диметилсульфоксиде по схеме:
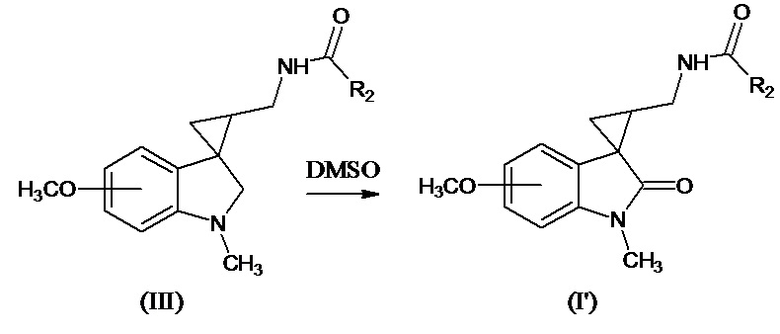
Стереоизомеры соединений формулы (I) получают методом стереоселективного каталитического гидрогенолиза соответствующего нитрила с последующим ацилированием образующегося амина при добавлении ангидрида кислоты (R6C(O))2O или R6C(O)Hal.
Для получения соединений формулы (I), где R3 означает группу -NHС(О)С1-С4алкил, -NHC(O)OC1-C4алкил, -NHC(O)NHC1-C4алкил, -NHC(O)6-членный арил; -NHC(O)5-6-членный гетероарил, содержащий 1-2 атома азота, кислорода или серы; -NHС(О)-С3-С6циклоалкил, -NHС(О)СF3 используют соединение формулы (II), где R3 означает нитрогруппу, где R4 означает =О, R2 означает CN. При этом проводят сначала каталитическое восстановление нитрогруппы под действием водорода. После этого в полученном соединении восстанавливают нитрильную группу, в условиях, указанных выше, с одновременной модификацией полученного амино-соединения.
Одним из предпочтительных способов является способ получения соединений формулы (II), где m =1, заключающийся в циклоприсоединении избытка диазометана к соединению (III), с последующим термическим разложением образующихся спиродиазолинов формулы (IV). Способ осуществляют по следующей схеме 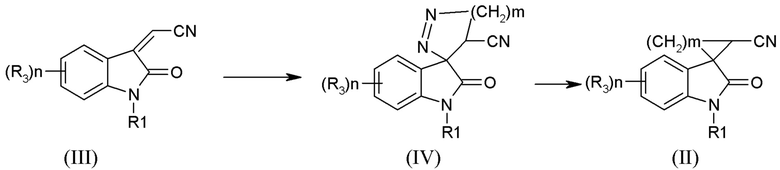
где R1 означает H, С1-С4алкил, бензил,
R3 означает Н, галоген. С1-С4алкил, С1-С4алкокси, галоген, нитро.
Соединение формулы (II), где R1 означает H, подвергают алкилированию или бензилированию соответствующим галогенидом, преимущественно иодидом в присутствии гидрида щелочного металла.
Вышеуказанный способ предпочтителен для получения нитрилов спироциклопропан-индолов формулы (III), из которых затем получают наиболее предпочтительные соединения формулы (I) согласно схеме
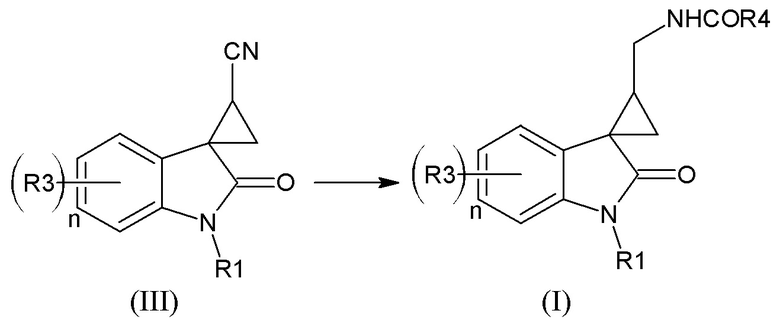
Для получения соединений формулы (II) со значением m=1, 4 также может быть использован метод спироциклизации описанный в Marta S. Morales-Rios et al. Способ заключается в алкилировании 2-(1-алкил-2-оксо-2,3-дигидроиндол-3-ил)ацетонитрила соответствующим дигалогеналканом в присутствии гидрида щелочного металла в диметилформамиде при комнатной температуре, с последующей циклизацией полученного соответствующего ацетонитрила замещенного в положении 3 индола галогеналкильной группой.
Либо может быть использован способ циклоприсоединения соответствующих диенов с терминальной алкеновой группой к циан(2-оксиндолин-3-илиден)уксусной кислоте в присутствии иодида цинка или без него, с последующим декарбоксилированием и восстановлением ненасыщенной двойной связи.
Соединения формулы (II) могут быть получены в виде стереомерных форм cо стереоселективной конфигурацией и превращены в соединения формулы (I) путем региоселективного каталитического гидрогенолиза.
Для определения конфигурации были использованы данные 1H-ЯМР-спектроскопии.
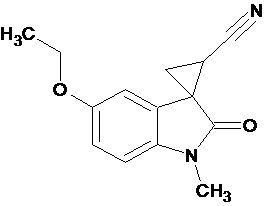
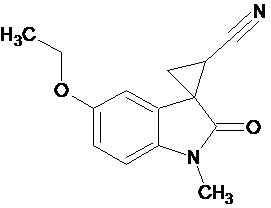
Пример 1. Получение 1'-метил-5'-этокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила.
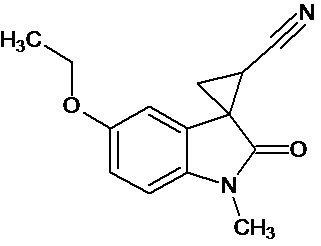
В колбу помещали раствор 0,22 моль гидроксида калия в 33 мл воды и 100 мл диэтилового эфира, прибавляли небольшими порциями 0,074 моль N-нитрозометилмочевины. К 0,0065 моль 1-метил-5-этокси-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила прибавили, фильтруя через слой безводного сульфата натрия, полученный раствор диазометана. Смесь перемешивали в течение 12-ти часов при комнатной температуре и кипятили в 30 мл толуола 8 часов. В результате был получен продукт в виде бежевого порошка. Выход составил 78%.
Спектр ЯМР 1Н (СDCl3, δ, м.д., J, Гц): 1.53(т, J = 5.0, 3Н), 1,88 (дд., J = 5,0, 6,8, 1Н), 2,14 (дд., J = 4,9, 9.35, 1H), 2,46 (дд., J = 6,9, 9,35, 1H), 3,29 (с., 3Н), 3,82 (кв., J = 5.0, 2Н), 6,82 (д., J = 2,26, 1H), 6,87 (д., J = 8,59, 1H), 6,92 (дд., J = 2,28, 8,46, 1H).
Спектр ЯМР 13С (СDCl3, δ, м.д.): 14,75, 15.25, 21,29, 26,66, 31,92, 55,81, 108,24, 109,08, 113,22, 116,93, 137,50, 156,03, 172,51.
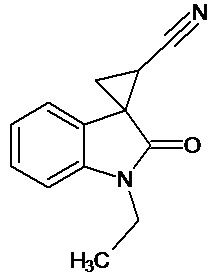
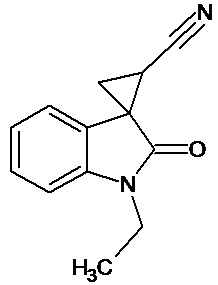
Пример 2. Получение 1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила
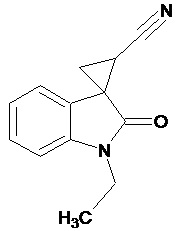
В колбу помещали раствор 15,2 г (0,27 моль) гидроксида калия в 41 мл воды и 124 мл диэтилового эфира, прибавляли небольшими порциями 7,5 г (0,085 моль) N-нитрозометилмочевины. К 1,5 г 1-этил-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила прибавили, фильтруя через слой безводного сульфата натрия, полученный раствор диазометана. Смесь перемешивали в течение 12-ти часов при комнатной температуре и кипятили в 30 мл толуола 8 часов. В результате реакции был получен продукт в виде светло-бежевого порошка. Выход составил 0,94 г (58%).
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 1.57 (т, J = 5, 3Н), 1,91 (дд., J = 5,05, 6,82, 1Н), 2,14 (дд., J = 5,06, 9,48, 1H), 2,45 (дд., J = 7,07, 9,46, 1H), 3,31 (кв, J = 5, 2Н), 6,98 (д., J = 7,71, 1H), 7,16 (т., J = 7,45, 1H), 7,22 (д., J = 6,83, 1H), 7,40 (т., J = 7,48, 1H).
Спектр ЯМР 13С (ДМСО-d6, δ, м.д.): 14,81, 15.28, 21,34, 26,88, 31,73, 108,71, 116,91, 118,88, 120,93,120,90, 128,85, 144,14, 172,96.
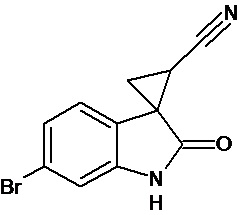
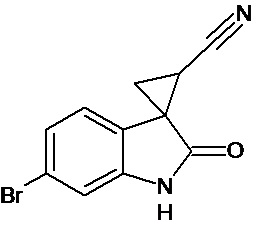
Пример 3. Получение 6'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила
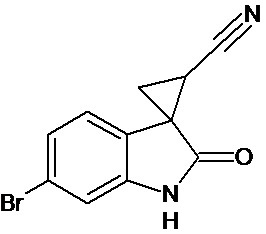
Аналогично примеру 1, используя 0,0027 моль 6-бром-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила получали 1'-метил-6'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрил с выходом 78%.
Спектр ЯМР 1Н (СDCl3, δ, м.д., J, Гц): 1,89 (дд., J = 5,1, 7.0, 1Н), 2,18 (дд., J = 4,9, 9.5, 1H), 2,5 (дд., J = 7.0, 9,5, 1H), 7.01 (д., J = 2,16, 1H), 7.25 (д., J = 8,7, 1H), 7.34 (дд., J = 2,16, 8,7, 1H), 9,89 (с, 1Н).
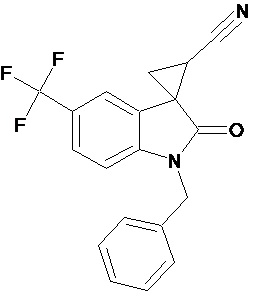
Пример 4. Получение 1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила
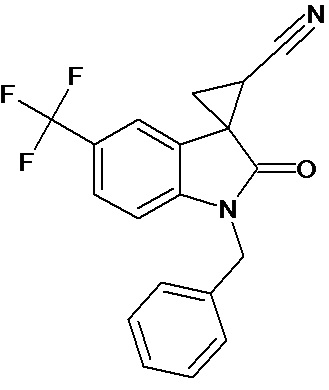
Аналогично примеру 1, используя 0,008 моль 1-бензил-5-трифторметил-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила получали 1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3’-индол]-3-карбонитрил с выходом 90%.
Спектр ЯМР 1Н (СDCl3, δ, м.д., J, Гц): 1,90 (дд., J = 5,0, 6,2, 1Н), 2,10 (дд., J = 4,9, 9.33, 1H), 2,5 (дд., J = 6,2, 9,33, 1H), 3,30 (с., 3Н), 4,8 (с, 2Н), 8.17 (д., J = 2,2, 1H), 7.31 (д., J = 8,59, 1H), 7,36 (м, 2Н), 7,45 (м, 3Н), 7.69 (дд., J = 2,2, 8,46, 1H), 8.17 (д., J = 2,2, 1H).
Спектр ЯМР 13С (СDCl3, δ, м.д.): 14,75, 15.25, 21,29, 26,66, 31,92, 44.82, 55,81, 108,24, 109,08, 113,22, 116,93, 122 (кв, J = 313), 124,39, 127,42, 128.54, 137,50, 156,03, 172,51.
Пример 5. Получение 6',7'-Диметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила и 1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила 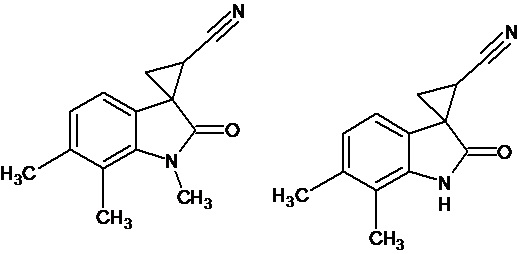
В колбу помещали раствор 0,18 моль гидроксида калия в 27 мл воды и 80 мл диэтилового эфира, прибавляли небольшими порциями 0,06 моль N-нитрозометилмочевины. К 0,006 моль 6,7-диметил-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила прибавили, фильтруя через слой безводного сульфата натрия, полученный раствор диазометана. Смесь перемешивали в течение 12-ти часов при комнатной температуре и кипятили в 25 мл толуола 8 часов. Полученная в результате смесь продуктов была разделена методом колоночной хроматографии. Таким образом, были выделены следующие продукты:
1) Продукт 1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила в виде белого порошка. Rf=0,25 (Элюент петролейный эфир: этилацетат 8:2). Выход составил 0,3 г (25%). Характеристики полученного вещества полностью совпадают с характеристиками продукта.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 1,80** (д.д., J = 5,0, 6,95, 1Н), 1,89* (д.д., J = 4.9, 9.2, 1H), 2.05** (д.д., J = 4,5, 9,4, 1H), 2.10* (д.д., J = 2,28, 5,05, 1H), 2,24* (д.д., J = 7,3, 9,1, 1H), 2,30** (с., 3Н), 2,32*(с., 3Н), 2,36** (д.д., J = 6,9, 9,4, 1H), 3,55** (с., 3Н), 3,59*(с., 3Н), 6,53* (д., J = 7,46, 1H), 6,84* (д., J = 7,46, 1H), 6,89** (д., J = 7,50, 1H), 6,94** (д., J = 7,50, 1H); ** - основной диастереомер, * - минорный диастереомер. Согласно спектру ПМР, соотношение диастереомеров составляет 3:1.
Спектр ЯМР 13С (ДМСО-d6, δ, м.д., J, Гц): 13,96, 15,09, 20,84, 21,26, 30,87, 38,65, 117,94, 119,70, 124,18, 129,69, 130,91, 138,62, 142,12, 173,98.
Элементный анализ: найдено (%): С 74,40, Н 6,36, N 12,42, вычислено для С14Н14N2О (%): С 74.31, Н 6.24, N 12.38.
1) Продукт 6',7'-диметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрил в виде бежевого порошка. Rf=0,1 (Элюент петролейный эфир: этилацетат 8:2). Выход составил 0,378 г (34%).
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 1,87 (дд., J = 5,05, 6,72, 1Н), 2,12 (дд., J = 4,93, 9,48, 1H), 2,23 (с., 3Н), 2,32 (с., 3Н), 2,44 (дд., J = 6,95, 9,47, 1H), 6,94 (д., J = 2,5, 2H), 9,87 (с., 1Н).
Спектр ЯМР 13С (СDCl3, δ, м.д.): 13,21, 14,80, 19,89, 20,94, 35,72, 118,04, 119,18, 123,88, 137,75, 138,71, 140,85, 142,10, 176,28.
Селективное восстановление нитрильной группы с одновременным ацилированием, типовые методики
Метод А. Исходный ацетонитрил гидрируют водородом в присутствии катализатора PtO2 и уксусного ангидрида при атмосферном давлении и комнатной температуре в растворе ледяной уксусной кислоты. Об окончании реакции судят по изменению объема затраченного на гидрирование водорода. По окончании реакции отфильтровывают осадок платинового катализатора и удаляют избыток уксусной кислоты в вакууме роторного испарителя. Остаток нейтрализуют насыщенным раствором гидрокарбоната натрия и экстрагируют хлористым метиленом.
Метод В. Исходный ацетонитрил растворяют в метаноле, в раствор вносят расчетное количество уксусного ангидрида и безводного хлорида никеля, затем при охлаждении медленно прибавляют боргидрид натрия. Реакционную смесь оставляют при интенсивном перемешивании на 4 суток. По окончании реакции избыток метанола удаляют в вакууме роторного испарителя, осадок промывают насыщенным раствором карбоната калия и экстрагируют хлористым метиленом.
По данным методикам были получены следующие соединения:
Пример 6. Получение N-[1'-метил-5'-этокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-ил-метил]ацетамида.
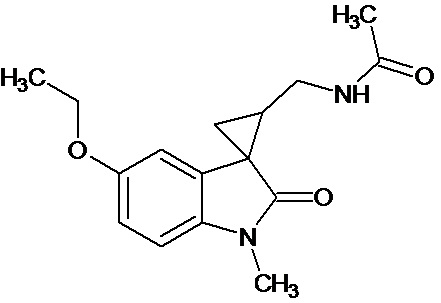
В смесь 0,485 ммоль 1'-метил-5'-этокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила, 25 мл ледяной уксусной кислоты, 0,98 ммоль уксусного ангидрида, 0,00004 моль PtO2 пропускают водород при атмосферном давлении и комнатной температуре в течение 4-х часов(до прекращения поглощения водорода. Продукт частично выпадает в осадок. Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход продукта 89%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,55 (т, J=5, 3H), 1,95 (с, 3Н); 1,98-2,09 (м, 1Н); 2,17-2,24 (м, 1Н); 3,41-3,51 (м, 2Н); 3,21 (с, 3Н), 3,77 (кв, 2Н); 6,58 (ушир. с, 1Н, NH); 6,72-6,75 (дд, J = 10,6, J = 6,4, 1Н); 6,79-6,81 (д, J = 8,4, 1Н); 6,9 (с, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 15.32, 23,04, 29,94, 36,96, 44,75, 47,56, 55,76, 110,38, 111,09, 112,75, 130,59, 135,01, 155,76, 170,82, 180,47.
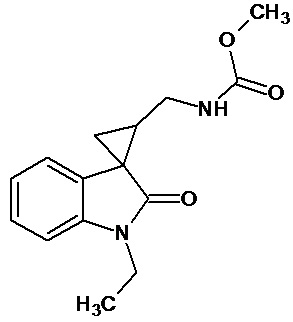
Пример 7. Получение метил [1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]карбамат.
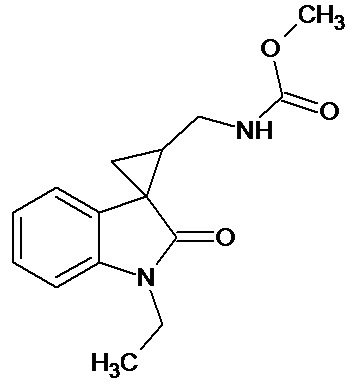
Перемешивали при комнатной температуре в течение 4 суток 0,00054 молей 1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила, 10 мл метанола, 14 мл метилхлороформата, 0,00012 ммоль свежеприготовленного безводного NiCl2, 0,0053 моль NaBH4. Добавляли дополнительно 2 раза в сутки по 0,0024 ммолей NaBH4. Выход продукта 66%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,28 (т, J=5, 3H), 1,90 (с, 3Н); 1,96-2,1 (м, 1Н); 2,18-2,27 (м, 1Н); 3,40-3,50 (м, 2Н); 3,21 (кв, 2Н); 3,76 (c, 3Н); 6,87 (ушир. с, 1Н, NH); 6,92 (дд, J = 10,6, J = 6,4, 1Н); 7.1 (д, J = 8,4, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 15.43, 22,04, 30,01, 44,75, 47,56, 58.75, 111,38, 110,2, 113,82, 130,74, 136,01, 154,53, 171,09, 181,64.
Пример 8. Получение N-[1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]ацетамида
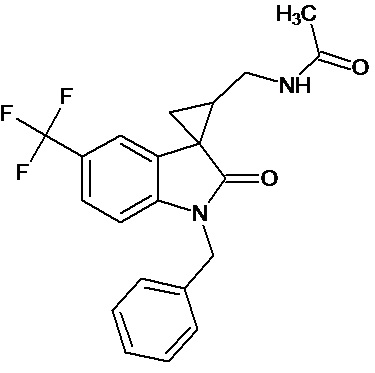
0,0039 моль 1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила растворяли в 15 мл уксусной кислоты, и добавляли 0,069 моль уксусного ангидрида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход продукта 76%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.84 (м, 1H), 1,18 (м, 1H), 1,51 (м, 1Н); 2.18 (с, 3Н); 3.14 (м, 2Н); 3,21 (кв, 2Н), 4,8 (с, 2Н), 6,87 (ушир. с, 1Н, NH); 6.92 (дд, J=6,2, 2.3, 1 Н), 7,23-7,59 (м, 5Н), 7.98 (д, J = 2.3, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 22.32, 23.43, 25,04, 32,05, 41.97, 45,72, 47,56, 111,38, 110,2, 113,82, 122,43 (кв, J= 312), 124,39, 127,42, 128.54, 130,74, 136,01, 154,53, 176,15, 189,25.
Пример 9. Получение N-[1'-метил-5'-трифторацетамидо-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]трифторметилацетамида
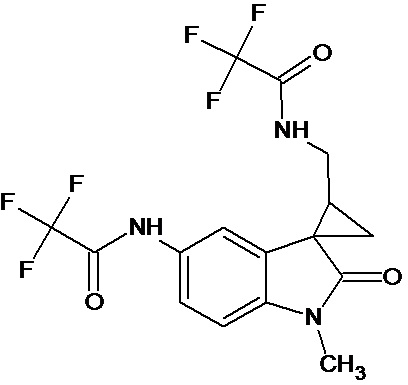
0,0021 моль 1'-метил-5'-нитро-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила растворяли в 15 мл трифторуксусной кислоты, и добавляли 0,069 моль трифторуксусного ангидрида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход N-[1'-метил-5'-трифторацетамидо-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]трифторметилацетамида 45%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.96 (м, 1H), 1,37 (м, 1H), 1,72 (м, 1Н); 3.17 (с, 3Н), 3.46 (м, 2Н), 6,87 (ушир. с, 1Н, NH); 6.89 (дд, J=7,2, 2.1, 1 Н), 7,91 (д, J=7,2, 1Н), 8.37 (д, J = 2.1, 1Н), 8.45 (с, 1Н), 8, 47(с, 1Н)
Спектр 13С (CDCl3, δ, м.д., J, Гц): 19.15, 28.10, 29,47, 31,80, 37.97, 109,56, 116,82 (кв, J= 247), 117,43 (кв, J= 247), 120,32, 125,36, 128.96, 135,61, 138,14, 155,53 (кв, J= 162), 157,093 (кв, J= 162), 176,4.
Пример 10. Получение N-[1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]циклопропанкарбоксамида
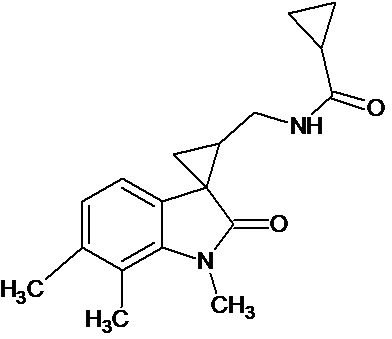
Аналогично примеру 8, используя 0,0028 моль 1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрил получают N-[1',6',7'-триметил -2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]циклопропанкарбоксамида с выходом 78%.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 0,82-0,89 (м, 4Н), 1,69 (м, 1Н), 1,87 (дд., J = 5,05, 6,72, 1Н), 2,12 (дд., J = 4,93, 9,48, 1H), 2,23 (с., 3Н), 2,26 (с., 3Н), 3.26 (с., 3Н), 6,54 (д, J = 6,95, 1H), 7.11 (д., J = 6,95, 2H).
Спектр ЯМР 13С (СDCl3, δ, м.д.): 13,21, 14,80, 19,89, 20,94, 35,72, 118,04, 119,18, 123,88, 137,75, 138,71, 140,85, 142,10, 176,28.
Пример 11. Получение N-[1'-бензил-5'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]бензамида
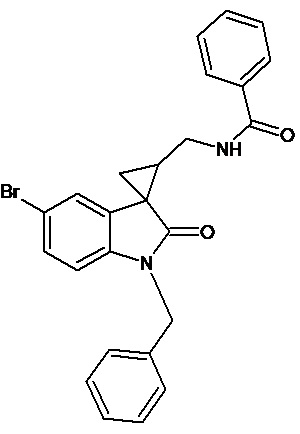
Аналогично примеру 7, используя 0,00054 моль 1'-бензил-5'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-ил]-3-карбонитрила и бензоил хлорид получали N-[1'-метил-6'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-бензамид с выходом 45%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,78-1,99 (м, 1Н); 2,15-2,21 (м, 1Н); 3,41-3,51 (м, 2Н); 4,82 (с, 2Н), 3,77 (кв, 2Н); 6,58 (ушир. с, 1Н, NH); 6,73 (дд, J = 9,6, J = 2.01, 1Н); 7.23-7.29 (м, 11Н); 7.59 (д, J = 2.01,1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 24,04, 28,84, 42,91, 44,75, 45,56, 113,09, 114,75, 124,92, 126,45, 128,37, 128,54,130,98, 131,38, 134,77, 135,01, 137,29, 140,49, 166,82, 176,15.
Пример 12. Получение N-[1'-метил-5'-фураноиламидо-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]фураноиламида
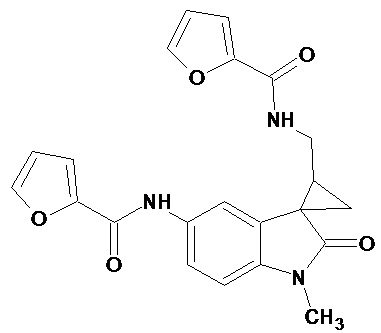
0,0021 моль 1'-метил-5'-нитро-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила растворяли в 15 мл фуранкарбоновой кислоты, и добавляли 0,069 моль фураноил хлорида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход N-[1'-метил-5'-фураноиламидо-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]фураноиламида 35%.
Спектр ЯМР 1H (CDCl3, δ, м.д., J, Гц): 0.96 (м, 1Н), 1,37 (м, 1Н), 1,72 (м, 1Н); 3.17 (с, 3Н), 3,31-3.39 (м, 2Н), 6,43 (ушир. с, 1Н, NH); 6.49 (м, 2 Н), 6,99 (д, J=8.7, 1Н) 7,38-7,42 (м, 2Н), 7,58 (дд, J=8.7, J=2.1Н), 8.14 (с, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 19.15, 28.10, 29,47, 31, 80, 38.79, 109,56, 110,70, 111,53, 114,33, 114,67, 118,24, 123,13, 133,59, 138,28, 142,00, 143,12, 147,78, 149,46, 171,10, 173,11, 176,40
Пример 13.1 Получение N-(2-циан-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-ил)ацетамида

0,121 ммоль Pd/C (10%-ный), добавляли к раствору 2,42 ммоль (1'-метил-5'-нитро-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-3-ил)карбонитрила в этилацетате. Смесь перемешивали при 70°C в атмосфере водорода в течение 48 часов. Катализатор отфильтровывали и получали продукт с выходом 67%. Полученный амин обрабатывали в уксусной кислоте ацетилхлоридом или уксусным ангидридом и получали N-(2-циан-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-илацетамид с выходом 82%.
Спектр ЯМР 1H (CDCl3, δ, м.д., J, Гц): 1,64-1,75 (м, 4Н), 1,92-2,13 (м, 4Н), 2,12 (с, 3Н), 2, 49-2, 53 (м, 1Н); 3.17 (с, 3Н), 6,43 (ушир. с, 1Н, NH); 7.04 (д, J=8.7, 2 Н), 7.62 (дд, J=8.7, J=2.1Н 1Н), 8.12 (д, J=2.1H, 1H).
Спектр 13C (CDCl3, δ, м.д., J, Гц): 23,98, 24,69, 25,78, 28.10, 29,25, 31,80, 32.33, 54,14, 109,30, 122,35, 124,26, 129,65, 133,46, 138,28, 142,95, 168,15, 177,19
Пример 13.2 Получение N-(2-(ацетиламинометил)-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-ил)ацетамида
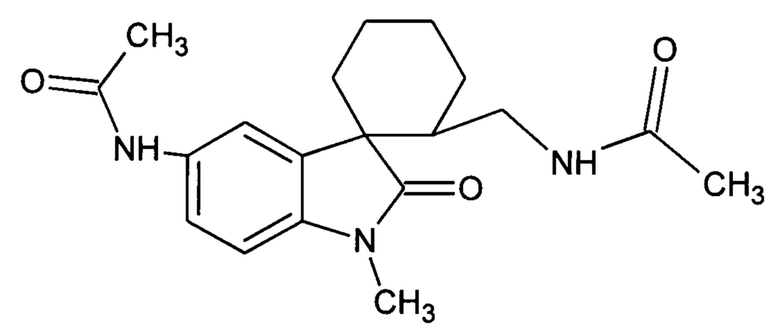
0,0021 моль N-(2-циан-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-ил)ацетамида растворяли в 15 мл уксусной кислоты, и добавляли 0,069 моль уксусного ангидрида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход N-(2-(ацетиламинометил)-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-ил)ацетамида 35%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,64-1,75 (м, 4H), 1,92-2,13 (м, 4H), 2,12 (с, 3Н), 2,49-2,53 (м, 1Н); 3.17 (с, 3Н), 6,43 (ушир. с, 1Н, NH); 7.04 (д, J = 8.7, 2 Н), 7.62 (дд, J = 8.7, J = 2.1Н 1Н), 8.12 (д, J = 2.1Н, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 23,98, 24,69, 25,78, 28.10, 29,25, 31,80, 32.33, 36,11, 54,14, 109,30, 121.45, 122,35, 128,79, 134,99, 142,05, 168,15, 170,71, 175.57
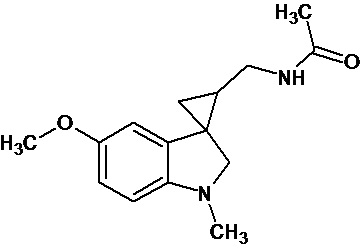
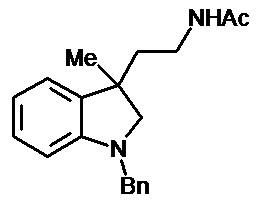
Пример 14. N-{1'-метил-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид
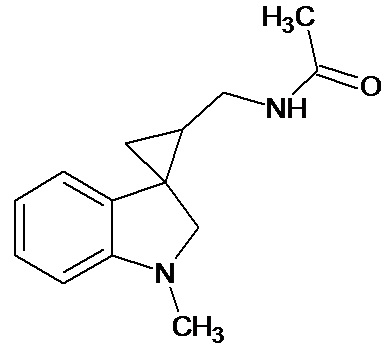
В трехгорлую колбу объемом 100 мл поместили 0,8 г (0,004 моль) 1'-метил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-2-карбонитрила, 30 мл абсолютного TГФ и 0,912 г (0,024 моль) боргидрида натрия. Постепенно прибавили 2,2 г (0,0086 моль) йода, растворенного в 7 мл ТГФ, кипятили 10 часов. По окончании кипячения реакционную смесь погасили 10 мл разбавленной соляной кислоты, экстрагировали метиленом и внесли 0,6 мл (0,0055 моль) уксусного ангидрида. В результате реакции соединение было выделено методом колоночной хроматографии (Rf=0,28, элюент - этилацетат) в виде красноватого масла. Выход 76 % (0,71 г).
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,27 (м., 1Н); 1,70 (с., 3Н); 1,81 (с., 1Н); 1,87 (с., 1Н); 2,61 (с., 3Н); 2,88 (м., 1Н); 3,04 (д, J = 8,47, 1Н); 3,16 (д, J = 8,46, 1Н); 3,34 (м., 1Н); 6,38 (д., J = 7,83, 1Н); 6,4 (с., 1Н); 6,51 (т., J = 7,45, 1Н); 6,63 (д., J = 7,20, 1Н); 6,93 (т., J = 7,58, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 21,88, 22,69, 25,11, 27,94, 35,92, 38,42, 65,45, 107,29, 117,74, 120,93, 127,28, 130,38, 134,51, 154,57, 170,46.
Масс-спектр (HRMS-ESI): 253,1311, С14H18N2O(М+nNa), рассчитано: 253,1313, С14H18N2ONa
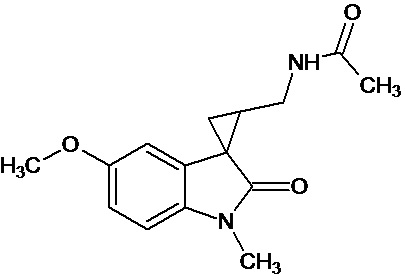
Пример 15. N-{1'-метил-5'-метокси-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид
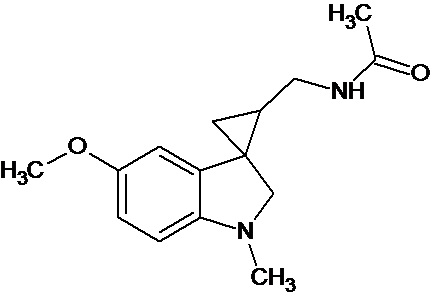
В трехгорлую колбу объемом 100 мл поместили 1,0 г (0,0045 моль) 1'-метил-5'-метокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-2-карбонитрила,20 мл абсолютного TГФ и 1,0 г (0,026 моль) боргидрида натрия. Постепенно прибавили 2,44 г (0,009 моль) йода, растворенного в 10 мл ТГФ, кипятили 16 часов. По окончании кипячения реакционную смесь погасили 10 мл разбавленной соляной кислоты, экстрагировали метиленом и внесли 1,0 мл (0,001 моль) уксусного ангидрида. В результате реакции соединение было выделено методом колоночной хроматографии в виде красноватого масла. Выход 77 % (0,9 г).
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,26 (т., J = 7,20, 1Н); 1,89 (м., 2Н); 1,94 (с., 3Н); 2,06 (с., 3Н); 2,91 (дд., J = 14,5, 7,5, 1Н); 3,03 (дд., J = 14,5, 5,5, 1Н); 3,47 (м., 2Н); 3,87 (c., 3H); 5,95 (с., 1Н); 6,88 (дд., J = 8,9, 2,27, 1Н); 7,13 (д., J = 2,28, 1Н); 7,16 (д., J = 8,85, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 20,84, 21,91, 22,65, 29,54, 32,59, 37,27, 55,77, 70,85, 109,11, 109,88, 111,62, 128,29, 132,55, 153,69, 173,74.
Пример 16. N-{5'-бром-1'-метил-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид

В трехгорлую колбу объемом 100 мл поместили 0,5 г (0,0018 моль) 1'-метил-5'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-2-карбонитрила, 25 мл абсолютного TГФ и 0,42 г (0,011 моль) боргидрида натрия. Постепенно прибавили 0,92 г (0,036 моль) йода, растворенного в 5 мл ТГФ, кипятили 15 часов. По окончании кипячения реакционную смесь погасили 10 мл разбавленной соляной кислоты, экстрагировали метиленом и внесли 0,8 мл (0,008 моль) уксусного ангидрида. В результате реакции соединение было выделено методом колоночной хроматографии (Rf=0,18, элюент - этилацетат) в виде темно-оранжевого масла. Выход 37 % (0,21 г).
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0,99 (т., J = 6,10, 1Н); 1,10 (дд., J = 8,88, 5,83, 1Н); 1,43 (м., 1Н); 1,85 (с., 3Н); 1,98 (м., 1Н); 2,04 (с., 3Н); 2,74 (с., 3Н); 2,85 (м., 1Н); 3,19 (д., J = 8,61, 1Н); 3,36 (д, J = 8,61, 1Н); 3,70 (м., 2Н); 5,64(с., 1Н); 6,37 (д., J = 8,21, 1Н); 6,79 (с., 1Н); 7,17 (д., J = 8,21, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 15,74, 21,04, 23,12, 28,63, 35,91, 38,45, 65,56, 108,50, 109,50, 123,73, 130,07, 132,92, 153,83, 170,35.
Пример 17. N-{1',6',7'-триметил-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид
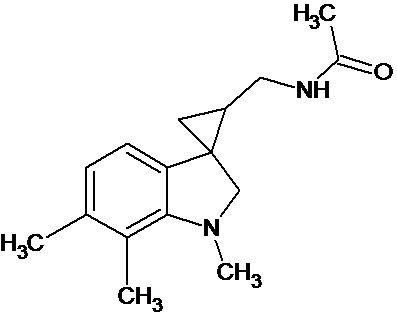
В трехгорлую колбу объемом 100 мл поместили 1,37 г (0,006 моль) 1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-2-карбонитрила, 20 мл абсолютного TГФ и 1,16 г (0,036 моль) боргидрида натрия. Постепенно прибавили 3,08 г (0,012 моль) йода, растворенного в 20 мл ТГФ, кипятили 24 часа. По окончании кипячения реакционную смесь погасили 10 мл разбавленной соляной кислоты, экстрагировали метиленом и внесли 0,9 мл (0,009 моль) уксусного ангидрида. В результате реакции соединение было выделено методом колоночной хроматографии (Rf=0,36, элюент - этилацетат) в виде желтого масла. Выход 35 % (0,538 г).
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0,95 (т., J = 5,81, 1Н); 1,04 (м., 1Н); 1,34 (м., 1Н); 1,80 (с., 3Н); 2,18 (с., 3Н); 2,22 (с., 3Н); 2,60 (м., 1Н); 2,87 (с., 3Н); 2,90 (м., 1Н); 3,15 (д, J = 9,8, 1Н); 3,42 (д, J = 9,7, 1Н); 3,55 (м., 1Н); 5,89 (с., 1Н); 6,52 (д., J = 7,45, 1Н); 6,66 (д., J = 7,50, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 14,28, 20,07, 20,73, 21,89, 27,43, 29,61, 37,17, 42,01, 71,96, 116,04, 121,28, 127,85, 129,58, 136,28, 142,49, 171,38.
Масс-спектр (HRMS-ESI): 258,1727, С16H22N2O(М), рассчитано: 258,1732, С14H20N2O
Пример 18. Получение N-(1'-бензил-5'-метокси-1',2'-дигидроспиро[циклогексан-1,3'-индол]-2-ил)трифторацетамида
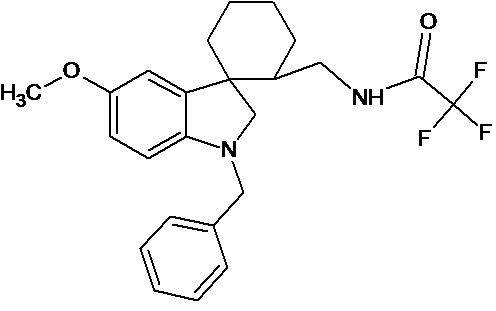
0,0021 моль 1'-бензил-5'-метокси-1',2'-дигидроспиро[циклогексан-1,3'-индол]-2-карбонитрила растворяли в 15 мл трифторуксусной кислоты, и добавляли 0,069 моль трифторуксусного ангидрида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход N-(1'-бензил-5'-метокси-1',2'-дигидроспиро[циклогексан-1,3’-индол]-2-ил)трифторацетамида 41%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,64-1,75 (м, 4H), 1,92-2,13 (м, 4H), 2,12 (с, 3Н), 2,49-2,53 (м, 1Н); 3.17 (с, 3Н), 6,43 (ушир. с, 1Н, NH); 7.04 (д, J = 8.7, 2 Н), 7.62 (дд, J = 8.7, J = 2.1Н 1Н), 8.12 (д, J = 2.1Н, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 23,98, 24,69, 25,78, 28.10, 29,25, 31,80, 32.33, 36,11, 54,14, 109,30, 121.45, 122,35, 128,79, 134,99, 142,05, 168,15, 170,71, 175.57
Пример 19. Получение гидрохлорида 1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила
К раствору 1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила в тетрагидрофуране при охлаждении по каплям добавляют насыщенный раствор газообразного хлороводорода в диэтиловом эфире. Целевую соль получают после удаления растворителя в вакууме роторного испарителя. Выход количественный
Пример 20. Получение гидрохлорида N-{1'-метил-5'-метокси-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид
К раствору N-{1'-метил-5'-метокси-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид в тетрагидрофуране при охлаждении по каплям добавляют насыщенный раствор газообразного хлороводорода в диэтиловом эфире. Целевую соль получают после удаления растворителя в вакууме роторного испарителя. Выход количественный
Изучение биологической активности новых производных мелатонина.
Проведены исследования афинности предлагаемых соединений общей формулы (I)по отношению к подтипам МТ1 и МТ2 мелатонинового рецептора и изучение антиглаукомной активности in vivo.
Исследования афинности проводились методом конкурентного ингибирования с использованием [125] иод-мелатонина, в качестве радиолиганда на СНО-К1 клетках, содержащих рекомбинантные МТ1 и МТ2 мелатониновые рецепторы человека. Было изучено связывание новых соединений по сравнению с мелатонином. Показатели по связыванию МТ1 и МТ2 приведены в таблице 2.
В таблице 1 приведены данные по антиглаукомной активности. Способность мелатонина и его синтезированных аналогов снижать ВГД оценивали на нормотензивных кроликах породы Шиншилла, самцах, массой около 2кг. Для всех исследованных веществ использовали концентрацию 0,1% (масса/объем), что для мелатонина составляет 4,3мкМ. Все вещества растворяли в 0,05М фосфатном буферном растворе рН7,4, содержащем 1% ДМСО (объем). Навеску растворяли в ДМСО и затем разводили до требуемой концентрации буферным раствором.
Растворы закапывали с помощью автоматического дозатора по 50 мкл в оба глаза. ВГД измеряли до закапывания и далее в течение 6 часов с интервалом в 1час с помощью автоматического тонометра для ветеринарии Tonovet (Icare, Финляндия). Оценку гипотензивного действия каждого вещества проводили в группе из 3 животных (6 глаз). Для введения поправки на нормальные суточные колебания ВГД одновременно проводили измерение ВГД у 3 интактных животных (6 глаз). В следующий опыт животных брали после перерыва не менее, чем в 7 дней. Поскольку скорость снижения ВГД у разных животных ВГД отличается, в ходе исследования мы ориентировались на максимальное снижение ВГД в каждом глазу, а не на среднее снижение в конкретной временной точке.
Таблица 1. Cнижение внутриглазного давления соединениями формулы (I)


мелатонин
1,35 (0,5 %), ( 2 часа)
тимолол
Афинности соединений формулы (I) по отношению к мелатониновым рецепторам МТ1, МТ2 и МТ3 (хинонредуктаза 2) подтипов измеряли in vitro. Исследования афинности проводились методом конкурентного ингибирования с использованием 2-[125]иод-мелатонина, в качестве радиолиганда на СНО-К1 клетках, содержащих рекомбинантные МТ1 и МТ2 мелатониновые рецепторы человека (таблица 2).
Таблица 2. Афинность соединений формулы (I) по отношению к мелатониновым рецепторам MT1 и MT2 подтипов
pKi (SD)
intrinsic activity
pKi (SD) intrinsic activity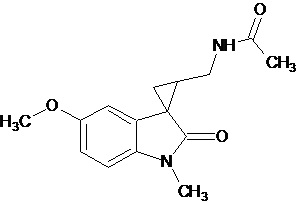
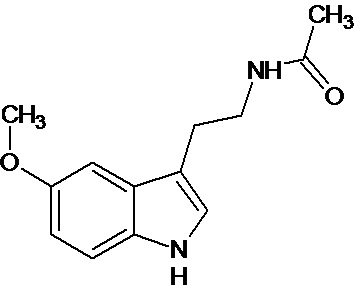
мелатонин
*концентрация веществ, необходимая для 50%-ного ингибирования активности рецептора
**условия измерения: МТТ = 200 μМ, концентрация хинонредуктазы 2 = 0,015 μМ, рН 8, длина волны 612 нм.
Измерение ингибирующей способности соединений формулы (I) по отношению к МТ3 подтипу мелатонинового рецептора (фермент хинонредуктаза 2) проводились спектрофотометрическим МТТ методом (таблице 3).
Таблица 3. Ингибирующая способность соединений формулы (I) по отношению к МТ3 подтипу мелатонинового рецептора (фермент хинонредуктаза 2)
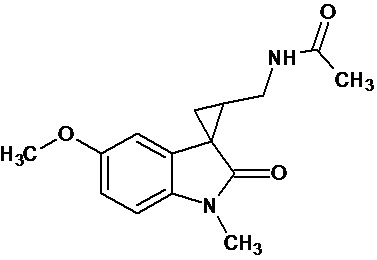
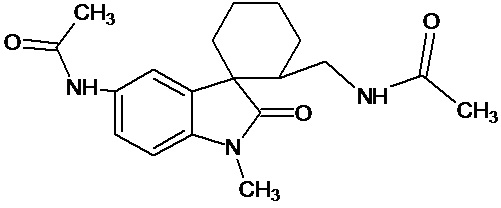
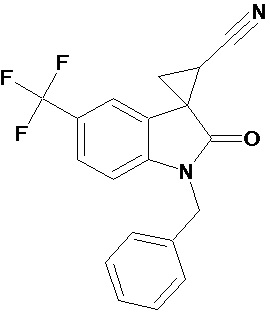
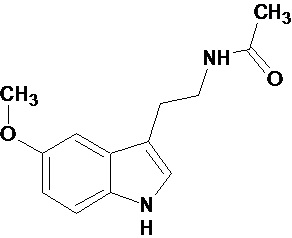
мелатонин
*условия измерения: МТТ = 200 μМ, концентрация хинонредуктазы 2 = 0,015 μМ, рН 8, длина волны 612 нм.
Исследования гипотензивной активности мелатонина и соединений формулы (I) по отношению к ангиотензинпревращающему ферменту показали, что все они не активны при концентрации до 1 мкМ.
| название | год | авторы | номер документа |
|---|---|---|---|
| Производные 2,3-дигидро-1Н-индола, обладающие свойствами лигандов мелатониновых рецепторов, способ получения и применение | 2017 |
|
RU2692239C2 |
| Производные индолинона, обладающих свойствами лигандов мелатонинового рецептора и их применение | 2017 |
|
RU2712036C2 |
| АМИДСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ 2-ОКСИНДОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2017 |
|
RU2685501C1 |
| ПРОИЗВОДНЫЕ АРИЛЦИКЛОАЛКИЛАМИНОВ, НЕЙРОПРОТЕКТОР (ВАРИАНТЫ), ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ СОЧЕТАННЫМ НЕЙРОПРОТЕКТОРНЫМ, АНАЛЬГЕТИЧЕСКИМ И АНТИДЕПРЕССИВНЫМ ДЕЙСТВИЕМ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ЕГО ОСНОВЕ | 2016 |
|
RU2637928C2 |
| Замещенные 4-(азол-1-илметил)-1-фенил-5,5-диалкилспиро-[2.5]октан-4-олы, способ их получения (варианты), фунгицидная и рострегуляторная композиции на их основе | 2016 |
|
RU2648240C1 |
| НОВЫЕ 2',5'-ДИАРИЛСПИРО[ИНДОЛ-3,3'-ПИРРОЛИДИН]-2(1Н)-ОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2730287C1 |
| НОВЫЕ ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2007 |
|
RU2443687C2 |
| СПОСОБ ЛЕЧЕНИЯ САХАРНОГО ДИАБЕТА | 2019 |
|
RU2734495C1 |
| ПРИМЕНЕНИЕ 1'-АРИЛДИСПИРО[ЦИКЛОАЛКАН-1,3'-АЗЕТИДИН-2',3''-ИНДОЛИН]-2'',4'-ДИОНОВ В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКИХ СРЕДСТВ | 2023 |
|
RU2809008C1 |
| НОВЫЕ ФОСФАТНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2617682C2 |
Изобретение относится к соединениям формулы (I), где значения R1-R4 определены в формуле изобретения, которые обладают свойствами лигандов мелатониновых рецепторов МТ1, МТ2 и МТ3 (фермента хинонредуктазы 2) подтипов и могут применяться в качестве лекарственного средства для лечения и профилактики офтальмологических заболеваний, в частности для лечения глаукомы. Изобретение также относится способу получения соединений формулы (I) и к их фармацевтическим композициям. 4 н. и 7 з.п. ф-лы, 3 табл., 18 пр.
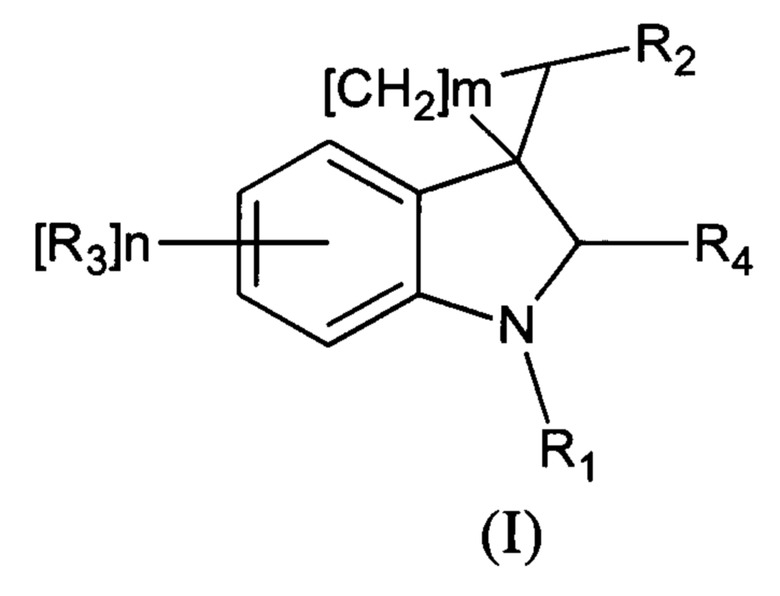
1. Соединение, выбранное из группы, состоящей из N-[1'-метил-5'-этокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-ил-метил]ацетамида, метил[1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]карбамата, N-[1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]ацетамида, N-[1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]циклопропанкарбоксамида, N-[1'-бензил-5'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]бензамида и соединений общей формулы (I)
где R1 означает Н, С1-С4алкил, бензил;
R2 означает -CH2NH(СО)С1-С4алкил, -CH2NH(СО)С3-С6циклоалкил, -CH2NH(СО)С1-С4алкокси, -CH2NH(СО)С1-С4-галоидалкил, -CH2NH(CO)(6-членный арил), -CH2NH(СО)(5-6-членный гетероарил, содержащий 1-2 атома кислорода, азота или серы);
R3 означает -NHC(O)С1-С4алкил, -NHC(O)ОС1-С4алкил, -NH(CO)галоалкил, -NH(СО)(6-членный арил), -NH(СО)(5-6-членный гетероарил, содержащий 1-2 атома кислорода, азота или серы), -NHC(O)-С3-С6циклоалкил, -NHC(O)CF3;
R4 означает =O;
n означает целое число от 1 по 2;
m означает целое число 1, 4;
и его фармацевтически приемлемая соль.
2. Соединение по п. 1, обладающее свойствами лиганда мелатониновых рецепторов.
3. Соединение по п. 1, обладающее свойствами лиганда мелатониновых рецепторов МТ1, МТ2, МТ3 подтипов.
4. Применение соединения по п. 1 в качестве лекарственного средства для лечения и профилактики офтальмологических заболеваний.
5. Применение по п. 4, где офтальмологическим заболеванием является глаукома.
6. Фармацевтическая композиция для лечения офтальмологических заболеваний, содержащая эффективное количество соединения по п. 1.
7. Фармацевтическая композиция по п. 6, где офтальмологическим заболеванием является глаукома.
8. Фармацевтическая композиция по п. 6, представляющая собой глазные капли.
9. Способ получения соединения по п. 1, включающий one-pot восстановление нитрильной группы и ацилирование образующегося амина в соединении, выбранном из группы, состоящей из 1'-метил-5'-этокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила, 1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила, 1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила, 1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила, 1'-бензил-5'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-ил]-3-карбонитрила и соединений формулы (II)
где R1 означает Н, С1-С4алкил, бензил;
R3 означает -NHC(O)С1-С4алкил, -NHC(O)ОС1-С4алкил, -NH(СО)галоалкил, -NHC(O)(6-членный арил), -NH(СО)(5-6-членный гетероарил, содержащий 1-2 атома кислорода, азота или серы), -NHC(O)-С3-С6циклоалкил, -NHC(O)CF3;
n означает целое число от 1 по 2;
m означает целое число 1, 4.
10. Способ по п. 9, отличающийся тем, что селективное восстановление нитрильной группы проводят в атмосфере водорода на катализаторе Адамса при комнатной температуре и атмосферном давлении в среде карбоновой кислоты R6COOH в присутствии в качестве ацилирующего агента ангидрида соответствующей карбоновой кислоты (R6C(O))2O или R6C(O)Hal, где R6 означает -С1-С4алкил, -С3-С6циклоалкил, -С1-С4алкокси, -CF3, -6-членный арил, -5-6-членный гетероарил, содержащий 1-2 атома кислорода, азота или серы.
11. Способ по п. 9, отличающийся тем, что восстановление проводят боргидридом щелочного металла в присутствии безводного хлорида никеля в спирте с последующим добавлением в качестве ацилирующего агента ангидрида (R6C(O))2O или R6C(O)Hal, где в качестве металла выступают Li, Na, K, Al, R6 означает -C1-С4алкил, -С3-С6циклоалкил, -С1-С4алкокси, -CF3, -6-членный арил, -5-6-членный гетероарил, содержащий 1-2 атома кислорода, азота или серы.
| WO 2004037247 A1, 06.05.2004 | |||
| Gonzalez-Juarez, Daphne E | |||
| et al., "Stereochemistry modulates the catalytic hydrogenolysis of nitrile-substituted cyclopropanes.", Tetrahedron, 2012, 68(35), 7187-7195 | |||
| Чеснокова Н.Б | |||
| и др | |||
| "ВЛИЯНИЕ ИНСТИЛЛЯЦИЙ МЕЛАТОНИНА НА ХАРАКТЕР ТЕЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНОГО УВЕИТА И БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В СЛЕЗНОЙ И ВНУТРИГЛАЗНОЙ |
Авторы
Даты
2020-01-24—Публикация
2017-01-30—Подача