РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет заявки США № 60/975104, поданной 25 сентября 2007, заявки США № 60/989840, поданной 22 ноября 2007 и заявки США № 60/989841, поданной 22 ноября 2007, содержание каждой из которых включено в настоящее описание в качестве ссылки в полном объеме.
Область, к которой относится изобретение
Настоящее изобретение относится к композициям и способам доставки ингибирующих молекул в микробные клетки, в частности метанопродуцирующие клетки. В особенности, настоящее изобретение относится к сигнальным пептидам и полипептидам, содержащим эти пептиды, а также полинуклеотидам, которые кодируют эти пептиды или полипептиды. Настоящее изобретение также относится к векторам экспрессии и клеткам-хозяевам для получения этих пептидов или полипептидов. Настоящее изобретение дополнительно относится к способам определения, направленной доставки, проникновения и ингибирования микробных клеток, в особенности, метанопродуцирующих клеток, с использованием описанных пептидов или полипептидов, полинуклеотидов, векторов экспрессии и клеток-хозяев.
Предпосылки к созданию изобретения
В Новой Зеландии сельскохозяйственная деятельность является причиной большинства выбросов парниковых газов. Следовательно, уменьшение сельскохозяйственного выброса парниковых газов является важным для соблюдения обязательств Новой Зеландией Киотского протокола. В соответствии с этим протоколом требуется сократить парниковые газы до уровней 1990 к концу первого периода обязательства (2008-2012). К концу этого срока группы аграрного сектора и правительство Новой Зеландии утвердили исследовательский консорциум по парниковым газам (Pastoral Greenhouse Gas Research Consortium (PGGRC)) для установления способов уменьшения выбросов парниковых газов сельского хозяйства Новой Зеландии.
Важной частью деятельности PGGRC было исследование в отношении уменьшения выбросов метана с новозеландских пастбищ. Уменьшение выбросов метана от жвачных животных представляет коммерческий интерес по двум причинам. Во-первых, несоблюдение обязательств по Киотскому протоколу заставит правительство приобретать квоты на выброс углерода. В настоящее время стоимость этого оценивается в $350 миллионов. Во-вторых, образование метана приводит к потере 8-12% общей энергии, производимой в рубце. Эта энергия могла быть использована, вместо этого, для улучшения продуктивности жвачного животного.
Метан продуцируется в рубце микроорганизмами, называемыми метанопродуцентами, которые являются частью таксономического типа Euryarchaeota в царстве Archaea. Большинство метаногенов растут в CO2 и H2, как единственных источниках энергии, но некоторые могут использовать для роста ацетат или метильные соединения. В рубце существует несколько различных родов метанопродуцентов archaea, но виды рода Methanobrevibacter, в особенности, M. ruminantium и M. smithii считаются преобладающими метанопродуцентами у жвачных животных Новой Зеландии. M. ruminantium в настоящее время является предметом проекта секвенирования генома, финансируемого PGGRC. Этот проект представляет собой первое секвенирование генома метанопродуцентов рубца, и его целью является улучшение понимания биологии Methanobrevibacter для обнаружения мишеней для ингибирования образования метана.
Для уменьшения продукции метана в рубце требуется ингибирование метанопродуцентов или инактивация их пути образования метана. Способом ингибирования образования метана является доставка специфических ингибирующих молекул в клетки метанопродуцентов. Это может достигаться, например, соединением ингибирующих молекул с проникающими в клетку пептидами. В микробных клетках сигнальные пептиды опосредуют транслокацию внеклеточных белков из внутренней среды клетки во внешнюю, и подходят для переноса ингибирующих молекул. Следовательно, было бы полезным идентифицировать сигнальные пептиды, которые обладают способностью проникать в клетки метанопродуцентов и доставлять ингибиторы.
Сигнальные пептиды, или сигнальные последовательности, обычно включены в белки-предшественники, секретируемые из прокариотических и эукариотических клеток. Сигнальные пептиды являются частью проникающего в клетку удлинения на N-конце предшественника. Первичная аминокислотная последовательность сигнальных пептидов не является консервативной, за исключением сайта расщепления для сигнальной пептидазы (von Heijne, 1985). Кроме того, сигнальные пептиды обладают структурными сходствами. Сигнальные пептиды обычно включают от одного до пяти положительно заряженных N-концевых аминокислотных остатков (n-область) за которыми следуют от 10 до 15 гидрофобных аминокислотных остатков (h-область). Остаток глицина или пролина обычно расположен в пределах гидрофобного домена, а остаток (остатки) треонина и/или серина образуют полярный домен (c-область) рядом с сайтом расщепления (Inouye and Halegoua, 1980; Vlasuk et al., 1983, von Heijne, 1985).
Была предложена петлевая модель транслокации сигнального пептида (Inouye et al., 1977; Inouye and Halagoua, 1980) посредством которой положительно заряженный N-конец сигнального пептида взаимодействует с отрицательно заряженной внутренней поверхностью клеточной мембраны. Гидрофобный домен затем погружается в гидрофобный липидный бислой мембраны путем образования петли. Эта петля в конечном итоге включает сайт расщепления, который подвергается воздействию сигнальной пептидазы для удаления сигнального пептида. Одним из препятствий для ингибирования или ограничения образования метана является способность доставлять ингибирующие компоненты в клетки метанопродуцентов. Таким образом, существует необходимость в идентификации сигнальных пептидов, которые способны присоединяться к клеточным мембранам и переносить молекулы через липидный бислой, в подходящих носителях для ингибиторов клеток.
Краткое изложение сущности изобретения
Изобретение относится к выделенному сигнальному пептиду или полипептиду, содержащему этот пептид, который содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-172. В отдельном аспекте, этот пептид или полипептид содержит по меньшей мере одну аминокислотную последовательность KKLIIILLLLILLLSI последовательности SEQ ID NO:117, или по меньшей мере одну аминокислотную последовательность KKIIIILLLLILLLISI последовательности SEQ ID NO:119. В другом аспекте, этот пептид или полипептид содержит фрагмент, например, содержащий по меньшей мере одну аминокислотную последовательность, содержащую аминокислоты 3-14, 3-16, или 2-16 последовательности SEQ ID NO:117, или по меньшей мере одну аминокислотную последовательность, содержащую аминокислоты 3-15, 3-17, или 2-17 последовательности SEQ ID NO:119. В дополнительном аспекте, этот пептид или полипептид содержит фрагмент, содержащий по меньшей мере одну консервативную коровую последовательность последовательности SEQ ID NO:1-172, описанной в настоящей заявке. Еще в одном дополнительном аспекте, этот пептид или полипептид кодируется по меньшей мере фрагментом полинуклеотида, выбранного из группы, состоящей из SEQ ID NO:173-341 или SEQ ID NO:342-533.
Настоящее изобретение также относится к выделенному полинуклеотиду, содержащему кодирующую последовательность по меньшей мере одного сигнального пептида или полипептида, содержащего этого пептид. В одном аспекте, этот полинуклеотид содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172. В особом аспекте, полинуклеотид содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности KKLIIILLLLILLLSI последовательности SEQ ID NO:117, или кодирующую последовательность по меньшей мере одной аминокислотной последовательности KKIIIILLLLILLLISI последовательности SEQ ID NO:119. В другом аспекте, полинуклеотид содержит фрагмент кодирующей последовательности, например, кодирующую последовательность по меньшей мере одной аминокислотной последовательности, содержащей аминокислоты 3-14, 3-16, или 2-16 последовательности SEQ ID NO:117, или кодирующую последовательность по меньшей мере одной аминокислотной последовательности, содержащей аминокислоты 3-15, 3-17, или 2-17 последовательности SEQ ID NO:119. В дополнительном аспекте, полинуклеотид содержит фрагмент кодирующей последовательности, например, нуклеотидной последовательности, кодирующей по меньшей мере одну консервативную коровую последовательность, описанной в настоящей заявке последовательности SEQ ID NO:1-172.
В дополнительном аспекте, настоящее изобретение относится к выделенному полинуклеотиду, содержащему последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:173-341 или SEQ ID NO:342-533. В особом аспекте, этот полинуклеотид содержит последовательность нуклеиновой кислоты SEQ ID NO:531, 532 или 533. В другом аспекте, полинуклеотид представляет собой фрагмент или олигонуклеотид, например, содержащий последовательность нуклеиновой кислоты, протяженностью от нуклеотидов 7-42, 7-48 или 4-48 последовательности SEQ ID NO:531, 532 или 533. Кроме того, изобретение охватывает выделенный полинуклеотид или его фрагмент, который гибридизируется с любой из последовательностей нуклеиновой кислоты SEQ ID NO:173-341 или SEQ ID NO:342-533. Настоящее изобретение дополнительно охватывает выделенный полинуклеотид, содержащий комплементарную, обратно комплементарную, обратную последовательность или их фрагменты, любой из последовательностей нуклеиновой кислоты, кодирующих сигнальный пептид или полипептид, содержащий этот пептид.
Настоящее изобретение относится к вектору экспрессии, содержащему полинуклеотид, который содержит кодирующую последовательность по меньшей мере одного сигнального пептида или полипептида, содержащего этот пептид. В одном аспекте, вектор экспрессии содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO:1-172. В особом аспекте, вектор экспрессии содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности KKLIIILLLLILLLSI последовательности SEQ ID NO:117, или кодирующую последовательность по меньшей мере одной аминокислотной последовательности KKIIIILLLLILLLISI последовательности SEQ ID NO:119. В другом аспекте, вектор экспрессии содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности, протяженностью от аминокислот 3-14, 3-16 или 2-16 последовательности SEQ ID NO:117, или кодирующую последовательность по меньшей мере одной аминокислотной последовательности, содержащей аминокислоты 3-15, 3-17, или 2-17 последовательности SEQ ID NO:119. Еще в одном аспекте, настоящее изобретение относится к клетке-хозяину, например, микробной клетке-хозяину, содержащей по меньшей мере один вектор экспрессии.
Настоящее изобретение в частности относится к антителу, направленному на пептид, полипептид, или полинуклеотид, описанный в настоящей заявке. В определенных аспектах, это антитело направлено по меньшей мере на одну последовательность сигнального пептида, выбранную из группы, состоящей из SEQ ID NO:1-172, или его модифицированную последовательность. В альтернативных аспектах, антитело направлено по меньшей мере на фрагмент последовательности сигнального пептида, например, консервативную коровую последовательность последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172. В дополнительном аспекте, это антитело связывается с полипептидом, содержащим последовательность сигнального пептида любой из последовательностей SEQ ID NO: 1-172. В альтернативных аспектах, это антитело направлено по меньшей мере на фрагмент полинуклеотида, выбранного из группы, состоящей из SEQ ID NO:173-341 или SEQ ID NO:342-533, или его комплементарную или модифицированную последовательность. В другом аспекте, антитело содержит одно или несколько слияний или конъюгатов по меньшей мере с одним клеточным ингибитором, например, соединениями против образования метана (например, бромэтансульфоновой кислотой), антителами и фрагментами антител, литическими ферментами, пептид-нуклеиновыми кислотами, антимикробными пептидами и другими антибиотиками, описанными подробно в настоящей заявке.
Настоящее изобретение также относится к модифицированным сигнальным пептидам и полипептидам, содержащим эти пептиды, и антителам, направленным на эти пептиды или полипептиды, включая биологически активные изменения, фрагменты, варианты и производные, описанные в настоящей заявке. Также описаны полинуклеотиды, кодирующие эти модифицированные пептиды или полипептиды, а также изменения, фрагменты, варианты и производные описанных полинуклеотидов, векторов экспрессии, содержащих эти последовательности нуклеиновых кислот, и клетки-хозяева, содержащие эти векторы. В особых аспектах, в композициях и способах по изобретению используются эти модифицированные полинуклеотиды, полипептиды или антитела, или соответствующие векторы экспрессии или клетки-хозяева. В конкретных аспектах, пептиды или полипептиды получены в виде слияний или конъюгатов по меньшей мере с одним клеточным ингибитором, например, соединениями против образования метана (например, бромэтансульфоновой кислотой), антителами и фрагментами антител, литическими ферментами, пептид-нуклеиновыми кислотами, антимикробными пептидами и другими антибиотиками, описанными подробно в настоящей заявке.
Изобретение дополнительно относится к композиции, содержащей выделенный сигнальный пептид (например, по меньшей мере один из SEQ ID NO:1-172, или их модифицированную последовательность) или полипептид, содержащий этот пептид, или антитело, направленное на этот пептид или полипептид. Также описана композиция, содержащая выделенный полинуклеотид (например, по меньшей мере один из SEQ ID NO:173-341 или SEQ ID NO:342-533, или их комплементарную или модифицированную последовательность). Дополнительно описана композиция, которая содержит вектор экспрессии, или клетка-хозяин, содержащая вектор экспрессии, в соответствии с настоящим изобретением. Композиция может содержать любые биологически активные изменения, фрагменты, варианты и производные, описанные в настоящей заявке. Композиции дополнительно могут содержать по меньшей мере один клеточный ингибитор, и могут быть получены, например, в виде фармацевтических композиций или в виде добавок к пище, в частности, компонентов кормов для жвачных животных.
В особом аспекте, изобретение относится к композиции по изобретению как части набора для определения и/или измерения, или направленной доставки, проникновения и/или ингибирования микробных клеток, в особенности, клеток метанопродуцентов, в соответствии с описанными способами. Эти наборы содержат: a) по меньшей мере одну композицию, описанную в настоящей заявке; и b) необязательно, инструкции по применению, например, по направленной доставке или проникновению в клетки или ингибированию клеточного роста, или репликации для метанопродуцентов или других микроорганизмов. В особых аспектах, пептид или полипептид, содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-172, или ее модифицированную последовательность.
Настоящее изобретение относится к способу получения сигнального пептида или полипептида, содержащего этот пептид, указанный способ предусматривает: a) культивирование вектора экспрессии или клетки-хозяина, содержащей вектор экспрессии, который содержит кодирующую последовательность по меньшей мере одного сигнального пептида или полипептида, содержащего этот пептид в условиях, подходящих для экспрессии этого пептида или полипептида; и b) извлечение пептида или полипептида из культуры. Также описаны способы получения описанных композиций. В особых аспектах, пептид или полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-172, или ее модифицированную последовательность.
Настоящее изобретение также относится к способу получения сигнального пептида или полипептида, содержащего этот пептид, который содержит слияние или конъюгат по меньшей мере с одним клеточным ингибитором, например, соединениями против образования метана (например, бромэтансульфоновой кислотой), антителами и фрагментами антител, литическими ферментами, пептид-нуклеиновыми кислотами, противомикробными пептидами и другими антибиотиками, подробно описанными в настоящей заявке. Такой способ предусматривает: a) культивирование вектора экспрессии или клетки-хозяина, содержащей вектор экспрессии, который содержит кодирующую последовательность по меньшей мере одного пептида или полипептида в условиях, подходящих для экспрессии пептида или полипептида; b) образования слияния или конъюгата (например, путем экспрессии слитой последовательности или химического конъюгата с клеточным ингибитором); и c) извлечение слияния или конъюгата. В особых аспектах, сигнальный пептид или полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-172, или ее модифицированную последовательность.
Настоящее изобретение относится к способу проникновения в микробную клетку, в частности, клетку метанопродуцент, предусматривающему: a) необязательно, получение или выделение по меньшей мере одного сигнально пептида или полипептида, содержащего этот пептид; и b) контактирование клетки с сигнальными пептидом или полипептидом. В особом аспекте, пептид или полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-172, или ее модифицированную последовательность. В дополнительных аспектах, пептид или полипептид содержит слияние или конъюгат по меньшей мере с одним клеточным ингибитором, например, одним или несколькими соединениями против образования метана (например, бромэтансульфоновой кислотой), антителами и фрагментами антител, литическими фрагментами, пептид-нуклеиновыми кислотами, антимикробными пептидами или другими антибиотиками, описанными подробно в настоящей заявке.
Настоящее изобретение также относится к способу ингибирования микробной клетки (например, ингибирования роста или репликации), в частности, клетки метанопродуцентов, предусматривающему: a) необязательно, получение или выделение по меньшей мере сигнального пептида или полипептида, содержащего этот пептид, который дополнительно содержит по меньшей мере один клеточный ингибитор; и b) контактирование клетки с сигнальным пептидом или полипептидом. В особом аспекте, пептид или полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-172, или ее модифицированную последовательность. В дополнительном аспекте клеточный ингибитор выбран из соединений против образования метана (например, бромэтансульфоновой кислоты), антител и фрагментов антител, литических ферментов, пептид-нуклеиновых кислот, антимикробных пептидов и других антибиотиков, подробно описанных в настоящей заявке.
Настоящее изобретение также относится к способу ингибирования микробной клетки (например, ингибирования роста или репликации), в частности, клетки метанопродуцента, предусматривающему: a) необязательно, получение или выделение по меньшей мере одного сигнального пептида или полипептида, содержащего этот пептид, который дополнительно содержит по меньшей мере один клеточный ингибитор; и b) контактирование клетки с сигнальным пептидом или полипептидом. В особом аспекте, пептид или полипептид содержит по меньшей мере одну аминокислотную последовательность из группы, состоящей из SEQ ID NO:1-172, или их модифицированных последовательностей. В дополнительном аспекте, клеточный ингибитор выбран из соединений против образования метана (например, бромэтансульфоновой кислоты), антител и фрагментов антител, литических ферментов, пептид-нуклеиновых кислот, антимикробных пептидов и других антибиотиков, подробно описанных в настоящей заявке.
Настоящее изобретение также относится к способу определения и/или измерения уровней сигнального пептида или соответствующего полипептида или полинуклеотида, предусматривающему: 1) контактирование образца, полученного от индивида, с антителом, направленным на сигнальный пептид (например, по меньшей мере, одного из SEQ ID NO:1-172, или их модифицированных последовательностей) или соответствующий полипептид или полинуклеотид; и 2) определение наличия или уровней антительного комплекса, образованного с сигнальным пептидом или соответствующим полипептидом или полинуклеотидом в образце. Такие способы также могут быть использованы для определения и/или измерения уровней микробных клеток, в частности, клеток метанопродуцентов.
Настоящее изобретение также относится к способу определения и/или измерения уровней сигнальной последовательности полинуклеотида (например, кодирующей последовательности сигнального пептида, или соответствующей кодирующей последовательности полипептида), предусматривающему: 1) контактирование образца, полученного от индивида, с комплементарным полинуклеотидом (например, последовательностью, комплементарной любой из последовательностей SEQ ID NO:173-341, или их модифицированным последовательностям); и 2) определение наличия или уровней гибридизационного комплекса, образованного с сигнальной последовательностью полинуклеотида в этом образце. Такие способы также могут быть использованы для определения и/или измерения уровней микробных клеток, в частности, клеток метанопродуцентов.
В особых аспектах, в способах по изобретению используются in vivo или in vitro компоненты экспрессии. В других аспектах, в способах используются пептиды или полипептиды, продуцируемые рекомбинантными, синтетическими или полусинтетическими способами, или пептиды или полипептиды, продуцируемые эндогенными способами.
Другие аспекты и варианты осуществления настоящего изобретения описаны ниже.
Краткое описание чертежей
Настоящее изобретение описано со ссылкой на конкретные варианты его осуществления и со ссылкой на чертежи.
ФИГ. 1A-1C: Сравнение геномов метанобактерий (ФИГ. 1A); статистика генома M. ruminantium (ФИГ. 1B); гены, предположительно вовлеченные в образование метана у видов метанобактерий (ФИГ. 1C).
ФИГ. 2: Выравнивание сигнального пептида Methanobrevibacter ruminantium. Коровая консервативная область каждого пептида показана жирным шрифтом.
ФИГ. 3A: Белковая последовательность logo из 102 последовательностей, созданная с использованием LogoBar. ФИГ. 3B: Белковая последовательность logo из 102 последовательностей, созданная с использованием LogoBar, показывающая наиболее консервативные аминокислотные остатки. ФИГ. 3C: Коровая консенсусная последовательность сигнального белка для M. ruminantium. ФИГ. 3D: Аминокислотная последовательность M. ruminantium проникающего в клетку пептида с добавлением N-концевого лизин-флуоресцеина.
ФИГ. 4: Проницаемость в клетки M. ruminantium пептида, меченого флуоресцином.
ФИГ. 5: Диаграмма Венна, показывающая предварительные определения сигнального пептида SignalP 3.0-HMM, с использованием трех различных моделей для M. ruminantium сигнальной последовательности M1093 ORFеомы.
ФИГ. 6: Гены M. ruminantium и соответствующие показатели сигнальных пептидов.
ФИГ. 7: Гены M. ruminantium и соответствующие сигнальные пептиды.
ФИГ. 8: Кодирующие последовательности сигнальных пептидов с ФИГ. 7.
ФИГ. 9: Кодирующие последовательности сигнальных пептидов с ФИГ. 7, с кодонами, оптимизированными для экспрессии в E. coli.
Подробное описание изобретения
Определения
«Измененные» последовательности нуклеиновых кислот, кодирующие сигнальные пептиды, в контексте настоящего изобретения, включают последовательности с делециями, вставками или заменами различных нуклеотидов, приводящие в результате к полинуклеотиду, который кодирует те же или функционально эквивалентные пептиды. Кодируемый пептид также может быть «измененным» и содержать делеции, вставки или замены аминокислотных остатков, которые дают молчащее изменение и приводят к функционально эквивалентному пептиду. Преднамеренные аминокислотные замены могут быть сделаны на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности, и/или амфипатической природы остатков, при условии сохранения биологической активности (например, ассоциации с клеткой или проникновения в клетку), или иммуногенной активности этого пептида. Например, отрицательно заряженные аминокислоты могут включать аспарагиновую и глутаминовую кислоту; положительно заряженные аминокислоты могут включать лизин и аргинин; и аминокислоты с незаряженными полярными концевыми группами, имеющими сходные значения гидрофобности, могут включать лейцин, изолейцин и валин, глицин и аланин, аспарагин и глутамин, серин и треонин, и фенилаланин и тирозин.
«Аминокислотная последовательность» в контексте настоящего изобретения, относится к олигопептиду, пептиду, полипептиду или белковой последовательности, или их фрагментам, и к природным, рекомбинантным, синтетическим или полусинтетическим молекулам. Последовательности по изобретению (например, SEQ ID NO:1-172) содержат по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 15, 17, 19, или 22 аминокислоты, предпочтительно, по меньшей мере 5-10, 5-15, 10-15, 12-15, 15-17, 17-19 или 17-22 аминокислот, и, предпочтительно, сохраняют биологическую активность (например ассоциацию с клеткой или проникновение в клетку) или иммунологическую активность (например, по меньшей мере один сайт связывания с антителом) исходной последовательности. В тех случаях, когда «аминокислотная последовательность», цитируемая в настоящем описании, относится к аминокислотной последовательности молекулы природного пептида или полипептида, считается, что аминокислотная последовательность и подобные термины не ограничивают аминокислотную последовательность до полной, природной аминокислотной последовательности, связанной с полноразмерной молекулой.
«Амплификация» в контексте настоящего изобретения, относится к получению дополнительных копий последовательности нуклеиновой кислоты и в основном проводится с помощью методик полимеразной цепной реакции (ПЦР), хорошо известных из уровня техники (Dieffenbach, C. W. and G. S. Dveksler (1995) PCR Primer, a Laboratory Manual, Cold Spring Harbor Press, Plainview, NY).
Термин «антитело» следует понимать в самом широком смысле и предполагается включение интактных моноклональных антител и поликлональных антител. Этот термин также охватывает фрагменты и производные антител, при условии, что они демонстрируют желаемую биологическую активность. Антитела охватывают молекулы иммуноглобулинов и иммунологически активные части молекул иммуноглобулинов (Ig), т.е., молекулы, которые содержат антиген-связывающий сайт, который специфически связывается (иммунологически взаимодействует) с антигеном. Антитела включают, но не только, поликлональные, моноклональные, химерные, одноцепочечные, Fc, Fab, Fab', и Fab2 фрагменты и экспрессионную библиотеку Fab.
Молекулы антитела относятся к любому из классов IgG, IgM, IgA, IgE, и IgD, которые отличаются друг от друга природой тяжелой цепи, находящейся в молекуле. Эти молекулы также включают подклассы, такие как IgG1, IgG2, и другие. Легкая цепь может представлять собой каппа цепь или лямбда цепь. Ссылка в настоящем описании на антитела включает ссылку на все классы, подклассы и типы. Также включены химерные антитела, например, моноклональные антитела или их фрагменты, которые специфичны более чем к одному источнику, например, одной или более, последовательностям мыши, человека или жвачного животного. Дополнительно включены антитела верблюдовых или нанотела. Будет понятно, что каждая ссылка на «антитела» или любой подобный термин, в настоящем описании включает интактные антитела, а также любые их фрагменты, измерения, производные или варианты.
Термины «биологически активный» или «функциональный», в контексте настоящего описания, относится к пептиду или полипептиду, сохраняющему одну или несколько структурных, иммуногенных или биохимических функций (например, ассоциацию с клеткой или проникновение в клетку) природной последовательности. В качестве одного примера, функциональная последовательность включает по меньшей мере одну из коровых консервативных областей, описанных в настоящей заявке.
Термины «клеточный ингибитор» или «ингибитор», в контексте настоящего писания, относится к средствам, которые снижают или блокируют рост или репликацию микробных клеток, в особенности клеток метанопродуцентов. Клеточный ингибитор может действовать для снижения или блокировки, например, клеточного деления. Ингибитор может снижать или блокировать, например, синтез ДНК, синтез РНК, синтез белка, или пост-трансляционные модификации. Ингибитор также может снижать или блокировать активность ферментов, вовлеченных в каскад образования метана. Ингибитор может делать мишенью клетку для распознавания компонентами иммунной системы. Ингибирование клетки также включает уничтожение клетки и клеточную гибель, например, в результате лизиса, апоптоза, некроза, и т.д. Подходящие ингибиторы включают, но не только, соединения против образования метана (например, бромэтансульфоновую кислоту), антитела и фрагменты антител, литические ферменты, пептид-нуклеиновые кислоты, антимикробные пептиды и другие антибиотики, подробно описанные в настоящей заявке.
Термины «комплементарный» или «комплементарность», в контексте настоящего изобретения, относится к природному связыванию полинуклеотидов в пермиссивных солевых и температурных условиях путем спаривания оснований. Для последовательности A-G-T, комплементарной последовательностью является T-C-A, обратно комплементарная последовательность представляет собой A-C-T, и обратная последовательность представляет собой T-G-A. Комплементарность между двумя одноцепочечными молекулами может быть частичной, при которой только некоторые из нуклеиновых кислот связываются, или может быть полной, когда существует абсолютная комплементарность между одноцепочечными молекулами. Степень комплементарности между цепями нуклеиновых кислот оказывает существенные воздействия на эффективность и прочность гибридизации между цепями нуклеиновых кислот. Это имеет особое значение в реакциях амплификации, которые зависят от связывания между цепями нуклеиновых кислот и в создании и применении молекул РНК.
Термин «производное» в контексте настоящего изобретения относится к химической модификации нуклеиновой кислоты, кодирующей сигнальный пептид, или нуклеиновой кислоты, комплементарной ей. Такие модификации включают, например, замену водорода алкилом, ацилом, или аминогруппой. В предпочтительных аспектах, производное нуклеиновой кислоты кодирует пептид, который сохраняет биологическую или иммунологическую функцию природной молекулы. Производный пептид представляет собой пептид, который модифицирован путем гликозилирования, пэгилирования или любым аналогичным способом, который сохраняет одну или несколько биологических функций (например, ассоциацию с клеткой или проникновение в клетку) или иммуногенную функцию последовательности, производным которой он является.
Термин «гомология» в контексте настоящего изобретения относится к степени комплементарности. Гомология может быть частичной (т.е. идентичность менее 100%) или полной (т.е. 100% идентичность). Частично комплементарную последовательность, которая по меньшей мере частично ингибирует гибридизацию идентичной последовательности с целевой нуклеиновой кислотой, называют с использованием функционального термина «по существу гомологичная». Ингибирование гибридизации полностью комплементарной последовательности с целевой последовательностью может быть исследовано с помощью гибридизационного анализа (Саузерн или нозерн блот, гибридизация в растворе и подобное) в условиях низкой жесткости. По существу гомологичная последовательность или гибридизационный зонд будет конкурировать за связывание или ингибировать связывание полностью гомологичной последовательности с целевой последовательностью в условиях низкой жесткости. Нельзя сказать, что условия низкой жесткости таковы, что допускается неспецифическое связывание; условия низкой жесткости требуют, чтобы связывание двух последовательностей друг с другом было специфичным (т.е. селективным) взаимодействием.
Термин «гибридизация» в контексте настоящего изобретения относится к любому процессу, посредством которого цепь нуклеиновой кислоты связывается с комплементарной цепью посредством спаривания оснований.
«Вставка» или «добавление» в контексте настоящего изобретения относится к изменению в аминокислотной или нуклеотидной последовательности, приводящему к добавлению одного или нескольких аминокислотных остатков или нуклеотидов, соответственно, по сравнению с природной молекулой.
«Метанопродуцент» в контексте настоящего изобретения относится к микроорганизмам, которые продуцируют газ метан, которые включают Methanobrevibacter, Methanothermobacter, Methanomicrobium, Methanobacterium, и Methanosarcina. Характерные метанопродуценты включают, но не только, Methanobrevibacter ruminantium, Methanobrevibacter smithii, Methanobrevibacter acididurans, Methanobrevibacter thaueri, Methanobacterium bryantii, Methanobacterium formicicum, Methanothermobacter marburgensis, Methanothermobacter wolfeii, Methanosphaera stadtmanae, Methanomicrobium mobile, Methanosarcina barkeri, Methanosarcina mazei, Methanococcoides burtonii, и Methanolobus taylorii. Все рода и виды метанопродуцентов охватываются этим термином.
«Микробные» клетки в контексте настоящего изобретения относятся к природным или генетически модифицированным микробным клеткам, в том числе архебактериям, таким как метанопродуценты, галофилы и термоацидофилы, и эубактериям, таким как цианобактерии, спирохеты, протеобактерии, а также грамположительным и грамотрицательным бактериям.
Термин «модифицированная» относится к измененным последовательностям и к фрагментам, вариантам и производным последовательностей, описанных в настоящем изобретении.
«Последовательность нуклеиновой кислоты» или «нуклеотидная последовательность» в контексте настоящего изобретения относится к последовательности полинуклеотида, олигонуклеотида или их фрагментам, и к ДНК или РНК природного, рекомбинантного, синтетического или полусинтетического происхождения, которая может быть односпиральной или двухспиральной, и может представлять смысловую или антисмысловую цепь, и кодирующие или некодирующие области. Последовательности по настоящему изобретению наиболее предпочтительно включают последовательности, кодирующие полипептид (например, SEQ ID NO:173-341 или 342-533, или их комплементарные или модифицированные последовательности), которые содержат по меньшей мере 15, 18, 21, 24, 27, 30, 33, 36, 39, 45, 51, 57 или 66 нуклеотидов, предпочтительно, по меньшей мере от 15 до 30, от 15 до 45, от 30 до 45, от 36 до 45, от 45 до 51, от 51 до 57, или от 51 до 66 нуклеотидов, или по меньшей мере 100 нуклеотидов, или по меньшей мере 1000 нуклеотидов. Будет понятно, что каждая ссылка на «последовательность нуклеиновой кислоты» или «нуклеотидную последовательность» в настоящем изобретении будет включать нативную полноразмерную последовательность (например, SEQ ID NO:173-341 или 342-533), а также любые ее комплементнарные последовательности, фрагменты, изменения, производные или варианты.
Термин «олигонуклеотид» относится к последовательности нуклеиновой кислоты, содержащей по меньшей мере 6, 8, 10, 12, 15, 18, 21, 25, 27, 30 или 36 нуклеотидов, или по меньшей мере от 12 до 36 нуклеотидов, или по меньшей мере от 15 до 30 нуклеотидов (например, по меньшей мере фрагмент последовательностей SEQ ID NO:173-341 или 342-533, или их комплементарная последовательность), которая может быть использована в ПЦР амплификации, секвенировании или гибридизационных анализах. В контексте настоящего изобретения олигонуклеотид по существу является эквивалентным терминам «амплимеры», «праймеры», «олигомеры», «олиги» и «зонды», как обычно определено в данной области.
Термин «полинуклеотид», используемый в единственном или множественном числе, в основном относится к любой последовательности нуклеиновой кислоты, например, любому полирибонуклеотиду или полидезоксирибонуклеотиду, которые могут представлять собой немодифицированную РНК или ДНК, или модифицированную РНК или ДНК. Этот термин включает, без ограничения, одноцепочечную и двухцепочечную ДНК, ДНК, содержащую односпиральные и двухспиральные области, односпиральную и двухспиральную РНК и РНК, содержащую односпиральные и двухспиральные области, гибридные молекулы, содержащие ДНК и РНК, которые могут быть односпиральными или, чаще, двухспиральными, или содержат односпиральные и двухспиральные области. Также включены РНК или ДНК, содержащие трехспиральные области, или как РНК, так и ДНК. В особенности, включены мРНК, кДНК и геномные ДНК, и любые их фрагменты. Этот термин включает ДНК и РНК, которые содержат одно или несколько модифицированных оснований, таких как оснований, меченых тритием, или необычных оснований, таких как инозин. Полинуклеотиды по настоящему изобретению могут охватывать кодирующие или некодирующие последовательности, или смысловые или антисмысловые последовательности, или iРНК, такие как siРНК. Будет понятно, что каждая ссылка на «полинуклеотид» или подобный термин в контексте настоящего изобретения, будет включать полноразмерные последовательности, а также любые их комплементарные последовательности, фрагменты, измерения, производные или варианты.
«Пептид-нуклеиновая кислота» или «ПНК» в контексте настоящего изобретения относится к антисмысловой молекуле, или противогенному средству, которая содержит основания, связанные посредством пептидного скелета.
Термин «жвачное животное» в контексте настоящего изобретения относится к животным, у которых имеется рубец как особый тип пищеварительного органа. Жвачные животные включают, но не только, крупный рогатый скот, овец, коз, быков, лосей, карибу и оленей.
«Сигнальные пептиды» в контексте настоящего изобретения относятся к выделенным пептидам по изобретению, полученным из любых видов, предпочтительно микроорганизмов, из любого источника, природного ли, синтетического, полусинтетического или рекомбинантного. В особенности, сигнальный пептид может быть получен из клеток метанопродуцентов, таких как клетки Methanobrevibacter, в частности, клеток M. ruminantium, или M. smithii. Для рекомбинатного получения сигнальный пептид по изобретению может быть получен из микробных или эукариотических клеток, например, Escherichia, Streptomyces, Bacillus, Salmonella, дрожжей, клеток насекомых, таких как Drosophila, клеток животных, таких как клетки COS и CHO, или клеток растений. Будет понятно, что каждая ссылка на «пептид» в контексте настоящего изобретения будет включать полноразмерную последовательность (например, SEQ ID NO:1-172), а также ее любые изменения, фрагменты, производные или варианты.
Термины «условия жесткости» или «жесткость» в контексте настоящего изобретения относятся к условиям гибридизации, определяемым нуклеиновой кислотой, солью и температурой. Эти условия хорошо известны из уровня техники и могут быть изменены в порядке для идентификации или выявления идентичных или родственных полинуклеотидных последовательностей. Смотри, например, Sambrook, J. et al. (1989) Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, Plainview, NY, and Ausubel, F. M. et al. (1989) Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY. Многочисленные эквивалентные условия, предусматривающие либо низкую, либо высокую жесткость, зависят от таких факторов, как длина и природа последовательности (ДНК, РНК, нуклеотидный состав), природы мишени (ДНК, РНК, нуклеотидный состав), окружающих условий (в растворе или иммобилизованы на твердом субстрате), концентрации солей или других компонентов (например, формамида, декстран сульфата и/или полиэтиленгликоля), и температуры реакций (в пределах интервала примерно от 5°C ниже температуры плавления зонда примерно до 20°C-25°C ниже температуры плавления). Один или несколько факторов могут быть изменены для создания условий либо низкой, либо высокой жесткости, отличных от перечисленных выше условий, но эквивалентных им.
Термин «индивид» включает людей и животных, не относящихся к людям. Животные, не относящиеся к людям, включают, но не только, птиц и млекопитающих, таких как жвачные животные, и, в частности, мышей, кроликов, кошек, собак, свиней, овец, коз, коров и лошадей.
Термины «по существу очищенный» или «выделенный» в контексте настоящего изобретения относится к последовательностям нуклеиновых или аминокислот, которые выделены из их клеточной, рекомбинантной или синтетической среды, и по меньшей мере на 60% свободны, предпочтительно на 75% свободны, и наиболее предпочтительно по меньшей мере на 90% свободны или по меньшей мере на 99% свободны от других компонентов, с которыми они связаны в клеточной, рекомбинантной или синтетической среде.
«Трансформация» в контексте настоящего изобретения описывает процесс, посредством которого экзогенная ДНК входит и изменяет клетку-реципиент. Это может происходить в природных или искусственных условиях с использованием различных способов, хорошо известных в данной области. Трансформация может основываться на любом известном способе вставки последовательностей чужеродных нуклеиновых кислот в прокариотическую или эукариотическую клетку-хозяин. Способ выбирают, исходя из типа трансформируемой клетки-хозяина, и он может включать, но не только, вирусное инфицирование, электропорацию, тепловой шок, липофекцию и бомбардировку частицами. Такие «трансформированные» клетки включают стабильно трансформированные клетки, в которых вставленная ДНК способна к репликации либо в виде автономно реплицирующейся плазмиды, либо как часть хромосомы хозяина. Они также включают клетки, которые транзиторно экспрессируют вставленную ДНК или РНК в течение ограниченных периодов времени.
«Вариант» пептида или полипептида в контексте настоящего изобретения относится к аминокислотной последовательности, которая изменена одной или несколькими аминокислотами. Вариант полинуклеотида изменен одним или несколькими нуклеотидами. Вариант может приводить к получению «консервативных» изменений, при которых замещенная аминокислота обладает аналогичными структурными или химическими свойствами, например, замена лейцина изолейцином. Реже, вариант может приводить к получению «неконсервативных» изменений, например, замена глицина триптофаном. Аналогичные незначительные изменения также могут включать аминокислотные делеции или вставки, или и то, и другое. Руководство по определению, какие аминокислотные остатки могут быть заменены, вставлены или удалены без потери биологической или иммуногенной активности, можно найти, используя компьютерные программы, хорошо известные в данной области, например, программное обеспечение LASERGENE (DNASTAR).
Настоящее изобретение также охватывает варианты, которые по меньшей мере сохраняют одну биологическую активность (например, ассоциацию с клеткой или проникновение в клетку) или функциональную активность пептида или полипептида. Предпочтительным вариантом является вариант, последовательность которого по меньшей мере на 80%, и более предпочтительно, по меньшей мере на 90%, идентична описанной последовательности. Наиболее предпочтительным вариантом является вариант, последовательность которого по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5%, по меньшей мере на 99,8%, или по меньшей мере на 99,9% идентична последовательности, описанной в настоящем изобретении. Процент идентичности определяется путем выравнивания двух сравниваемых последовательностей, как описано ниже, определения числа идентичных остатков в выравненной части, деления этого числа на общее число остатков в последовательности по изобретению (искомой), и умножения этого результата на 100. Подходящей программой выравнивания является AlignX (Vector NTI).
Описание изобретения
Метан образуется в передней части пищеварительного тракта жвачных животных метанопродуцентами, которые действуют как конечные восстановители углерода в системе рубца. Многостадийный путь образования метана хорошо освещен, главным образом из изучения метанопродуцентов не жвачных животных, но адаптации, которые позволяют метанопродуцентам расти и персистировать в рубце, не совсем понятны. Methanobrevibacter ruminantium является известным метанопродуцентом у новозеландских жвачных животных. Как описано в настоящей заявке, размер предварительной геномной последовательности M. ruminantium составляет приблизительно 3,0 Mb, и содержание GC составляет 33,68%. В качестве важного сведения, было обнаружено, что геном M. ruminantium содержит последовательности сигнальных пептидов для использования в направленной доставке и проникновения в клетки. Настоящее изобретение, следовательно, относится к сигнальным пептидам, в том числе тем, которые содержат SEQ ID NO:1-172, а также полипептидам, содержащим эти пептиды, и их изменениям, фрагментам, вариантам и производным.
Настоящее изобретение относится к применению этих пептидов или полипептидов для направленной доставки и проникновения в микробные клетки, в особенности, клетки метанопродуцентов. Настоящее изобретение дополнительно относится к применению пептидов или полипептидов для ингибирования роста или репликации таких клеток. Пептиды и полипептиды по настоящему изобретению могут быть экспрессированы и использованы в различных анализах для определения их биологической активности. Эти пептиды и полипептиды могут быть использованы для крупномасштабного синтеза и протоколов выделения, например, для коммерческого получения. Такие пептиды и полипептиды могут быть использованы для индукции антител, для выделения соответствующих последовательностей антител, и для количественного определения уровней аминокислотных последовательностей.
Полипептиды по настоящему изобретению также могут быть использованы в качестве композиций, например, фармацевтических композиций, и в качестве добавок к корму, например, компонентов корма для жвачных животных. Пептиды и полипептиды по настоящему изобретению также приносят пользу здоровью. Например, в аспектах, связанных со здоровьем, ингибиторы метанопродуцентов могут быть использованы для возвращения энергии индивиду, которая обычно теряется в виде метана. В конкретных аспектах, устройства медленного высвобождения в рубце могут быть использованы совместно с пептидами, полипептидами и композициями (например, фармацевтическими композициями и добавкам к кормам) по настоящему изобретению.
Пептиды и полипептиды по настоящему изобретению содержат по меньшей мере одну последовательность, выбранную из группы, состоящей из: (a) пептидов или полипептидов, содержащих по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-172, или ее изменений, фрагментов, вариантов или производных; (b) пептидов или полипептидов, содержащих функциональный домен (например, консервативную коровую область, описанную в настоящей заявке) по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172, или ее изменений, фрагментов, вариантов или производных; и (c) пептидов или полипептидов, содержащих по меньшей мере конкретно указанное количество смежных остатков по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172, или ее изменений, фрагментов, вариантов или производных. Все эти последовательности вместе в настоящем описании называются пептидами и полипептидами по настоящему изобретению. В одном варианте осуществления, изобретение относится к выделенному пептиду или полипептиду, содержащему аминокислотную последовательность по меньшей мере одну из SEQ ID NO:1-172.
Настоящее изобретение также относится к полинуклеотидам, которые кодируют по меньшей мере один сигнальный пептид, в том числе SEQ ID NO:1-172, а также полипептидам, содержащим такие пептиды, и их изменениям, фрагментам, вариантам или производным.
Настоящее изобретение охватывает применение этих полинуклеотидов для получения векторов экспрессии и клеток-хозяев для направленной доставки и проникновения в микробные клетки, в особенности клетки метанопродуцентов. Настоящее изобретение дополнительно охватывает применение этих полинуклеотидов для ингибирования роста или репликации таких клеток. Выделенные полинуклеотиды по настоящему изобретению также применимы в картировании генома, в физическом картировании и в клонировании генов более или менее родственных бактерий. Зонды, полученные с использованием полинуклеотидов по настоящему изобретению, могут быть использованы для выявления наличия и изучения профилей экспрессии генов в любом организме, имеющем достаточно гомологичные ДНК и РНК последовательности в их клетках, используя методики, которые хорошо известны в данной области, такие как слот-блоттинг или анализы на микрочипах. Праймеры, полученные с использованием полинуклеотидов по настоящему изобретению, могут быть использованы для секвенирования и ПЦР амплификаций.
Полинуклеотиды по настоящему изобретению также могут быть использованы в качестве композиций, например, фармацевтических композиций, и в качестве кормовых добавок, например, компонентов корма для жвачных животных. Полинуклеотиды по настоящему изобретению также приносят пользу здоровью. Для такого применения полинуклеотиды могут быть представлены в виде векторов экспрессии или клеток-хозяев, содержащих векторы экспрессии. В конкретных аспектах, могут быть использованы устройства медленного высвобождения в рубце совместно с полинуклеотидами, векторами, клетками-хозяевами и композициями (например, фармацевтическими композициями и кормовыми добавками) по настоящему изобретению.
Полинуклеотиды по настоящему изобретению содержат по меньшей мере одну последовательность, выбранную из группы, состоящей из: (a) последовательностей, содержащих кодирующую последовательность по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172, или ее изменений, фрагментов, вариантов или производных; (b) комплементарных последовательностей, обратных последовательностей и обратно комплементарных кодирующим последовательностям по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172, или ее изменений, фрагментов, вариантов или производных; (c) открытых рамок считывания, содержащихся в кодирующей последовательности по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172, или их изменений, фрагментов, вариантов или производных; (d) функциональных доменов (например, коровых консервативных областей, описанных в настоящей заявке) кодирующей последовательности по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172, или ее изменений, фрагментов, вариантов или производных; и (e) последовательностей, содержащих по меньшей мере конкретно указанное количество смежных остатков кодирующей последовательности по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172, или ее изменений, фрагментов, вариантов или производных. Также представлены олигонуклеотидные зонды и праймеры. Все эти полинуклеотидные и олигонуклеотидные зонды и праймеры вместе в настоящем описании называются полинуклеотидами по настоящему изобретению. В одном варианте осуществления, настоящее изобретение охватывает выделенный полинуклеотид, содержащий кодирующую последовательность по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-172.
Специалистам в данной области будет понятно, что как результат вырожденности генетического кода, может быть получено множество нуклеотидных последовательностей, кодирующих пептиды по настоящему изобретению, до некоторой степени несущие минимальную гомологию в отношении нуклеотидных последовательностей любого известного и природного гена. Следовательно, в настоящем изобретении рассматриваются все без исключения возможные варианты нуклеотидной последовательности, которая могла быть получена путем выбора сочетаний, исходя из возможных выборов кодонов. Эти сочетания получают в соответствии со стандартным триплетным генетическим кодом, применительно к природным аминокислотным последовательностям, и все такие варианты считаются описанными особо.
Нуклеотидные последовательности, которые кодируют сигнальные пептиды или полипептиды, или их модифицированные последовательности, предпочтительно способны гибридизироваться с нуклеотидной последовательностью природной последовательности в соответственно выбранных условиях жесткости. Однако, может быть предпочтительным получить нуклеотидные последовательности, кодирующие пептид или его производные, обладающие по существу иной частотой использования кодона. Кодоны могут быть выбраны для повышения скорости, при которой экспрессия этого пептида происходит в конкретном прокариотическом или эукариотическом хозяине в соответствии с частотой, с которой конкретные кодоны используются этим хозяином. Например, кодоны могут быть оптимизированы для экспрессии в E. coli, например, в соответствии с SEQ ID NO:342-533. Другие причины для изменения в значительной степени нуклеотидной последовательности, кодирующей пептиды и ее производные без изменения кодируемых аминокислотных последовательностей, включают получение РНК транскриптов, обладающих более желаемыми свойствами, такими как более длительный период полужизни, чем у транскриптов, полученных из природной последовательности.
Настоящее изобретение также охватывает получение последовательностей ДНК, или их фрагментов, которые кодируют пептиды или полипептиды, или их модифицированные последовательности, исключительно путем синтетической химии. После получения синтетическая последовательность может быть встроена в любой из многих доступных векторов экспрессии и клеточные системы, с использованием реактивов, которые хорошо известны в данной области. Более того, синтетическая химия может быть использована для введения мутаций в последовательность, кодирующую пептид или полипептид, или любые их изменения, варианты, производные или фрагменты. Изобретение также охватывает полинуклеотидные последовательности, которые способны гибридизироваться с заявленными нуклеотидными последовательностями, и, в частности, показанными в SEQ ID NO:173-341 или 342-533, или их комплементами, в различных условиях жесткости, как описано у Wahl, G. M. и S. L. Berger (1987; Methods Enzymol. 152:399-407) и Kimmel, A. R. (1987; Methods Enzymol. 152:507-511).
Способы секвенирования ДНК, которые хорошо известны и в основном доступны в данной области, и могут быть использованы для практического осуществления любого из вариантов осуществления настоящего изобретения. В способах могут использоваться такие ферменты, как Klenow фрагмент ДНК полимеразы I, SEQUENASE (U.S. Biochemical Corp, Cleveland, OH), Taq полимераза (Perkin Elmer), термостабильная T7 полимераза Amersham Pharmacia Biotech (Piscataway, NJ), или сочетания полимераз и корректирующих экзонуклеаз, таких как находящиеся в системе ELONGASE Amplification System, продаваемой Life Technologies (Gaithersburg, MD). Предпочтительно, этот процесс автоматизирован, такими устройствами, как Hamilton Micro Lab 2200 (Hamilton, Reno, NV), Peltier Thermal Cycler (PTC200; MJ Research, Watertown, MA) ABI Catalyst и 373 и 377 DNA Sequencers (Perkin Elmer), или Genome Sequencer 20TM (Roche Diagnostics).
Последовательности нуклеиновой кислоты, кодирующие эти пептиды, могут быть удлинены с использованием неполной нуклеотидной последовательности и с применением различных способов, известных в данной области для выявления вышележащих последовательностей, таких как промоторы и регуляторные элементы. Например, в одном способе, который может быть применен, ПЦР «сайт-рестрикции», используются универсальные праймеры для поиска неизвестной последовательности, смежной с известным локусом (Sarkar, G. (1993) PCR Methods Applic. 2:318-322). В частности, геномную ДНК сначала амплифицировали в присутствии праймера к линкерной последовательности и праймера, специфичного для известного участка. Амплифицированные последовательности затем подвергали второму раунду ПЦР с тем же линкерным праймером и другим специфичным праймером, находящимся внутри первого. Продукты каждого раунда ПЦР транскрибированы с подходящей РНК-полимеразой с последующим использованием обратной транскриптазы.
Системы капиллярного электрофореза, которые являются коммерчески доступными, могут быть использованы для анализа размера или подтверждения нуклеотидной последовательности секвенирования или продуктов ПЦР. В частности, в капиллярном секвенировании могут использоваться текучие полимеры для электрофоретического разделения, четыре различных флуоресцентных красителя (по одному на каждый нуклеотид), которые активируются лазером, и определение испускаемых длин волн с помощью телекамеры на приборах с зарядовой связью. Выходная/интенсивность светового излучения может быть преобразована в электрический сигнал, с использованием соответствующего программного обеспечения (например, GENOTYPER и Sequence NAVIGATOR, Perkin Elmer) и весь процесс от загрузки образцов до компьютерного анализа и электронного отображения данных может контролироваться компьютером. Капиллярный электрофорез особенно предпочтителен для секвенирования небольших частей ДНК, которые могут находиться в ограниченных количествах в конкретном образце.
В другом варианте осуществления настоящего изобретения, полинуклеотиды или их фрагменты, которые кодируют пептиды или полипептиды, могут быть использованы в рекомбинантных молекулах ДНК для направления экспрессии пептидов, полипептидов или их модифицированных последовательностей, в соответствующих клетках-хозяевах. Вследствие присущей генетическому коду вырожденности, могут быть получены другие последовательности ДНК, которые кодируют по существу такую же или функционально эквивалентную аминокислотную последовательность, и эти последовательности могут быть использованы для клонирования и экспрессии сигнальных пептидов или полипептидов. Нуклеотидные последовательности по настоящему изобретению могут быть сконструированы с использованием способов, в основном известных в данной области для изменения последовательностей, кодирующих аминокислоты, по целому ряду причин, в том числе, но не только, изменения, которые модифицируют клонирование, процессинг и/или экспрессию генного продукта. ДНК шаффлинг путем случайной фрагментации и ПЦР пересборки фрагментов гена и синтетических олигонуклеотидов, могут быть использованы для конструирования нуклеотидных последовательностей. Например, сайт-направленный мутагенез может быть использован для вставки новых сайтов рестрикции, изменения профилей гликозилирования, изменения предпочтения кодонов, введения мутаций, и так далее.
В другом варианте осуществления настоящего изобретения, природные, модифицированные или рекомбинантные последовательности нуклеиновой кислоты, кодирующие пептиды или полипептиды, могут быть лигированы с гетерологичной последовательностью для кодирования слитого белка. Например, может быть целесообразным кодировать химерную последовательность, которая может распознаваться коммерчески доступным антителом. Слитый белок также может быть сконструирован, таким образом, чтобы содержать сайт расщепления, распложенный между пептидом или полипептидом по изобретению и гетерологичной последовательностью белка, таким образом, чтобы пептид или полипептид можно было отщепить и очистить от гетерологичной части.
В другом варианте осуществления, последовательности, кодирующие пептиды или полипептиды, могут быть синтезированы, целиком или частично, с помощью химических способов, хорошо известных в данной области (смотри Caruthers, M. H. et al. (1980) Nucl. Acids Res. Symp. Ser. 215-223, Horn, T. et al. (1980) Nucl. Acids Res. Symp. Ser. 225-232). Альтернативно, сам пептид или полипептид может быть получен с помощью химических способов для синтеза аминокислотной последовательности или ее фрагмента. Например, пептидный синтез можно проводить с использованием различных твердофазных способов (Roberge, J. Y. et al. (1995) Science 269:202-204; Merrifield J. (1963) J. Am. Chem. Soc. 85:2149-2154) и автоматизированный синтез может достигаться, например, с помощью синтезатора пептидов ABI 431A Peptide Synthesizer (Perkin Elmer). Различные фрагменты пептидов или полипептидов могут быть химически синтезированы отдельно и объединены с использованием химических способов для получения полноразмерной молекулы.
Вновь синтезированный пептид или полипептид может быть выделен с помощью препаративной высокоэффективной жидкостной хроматографии (например, Creighton, T. (1983) Proteins Structures and Molecular Principles, WH Freeman and Co., New York, NY). Состав синтетических пептидов или полипептидов может быть подтвержден с помощью аминокислотного анализа или секвенирования (например, с помощью методики расщепления по Эдману; Creighton, supra). Дополнительно, аминокислотная последовательность пептида или полипептида, или любая ее часть, может быть изменена во время прямого синтеза и/или объединена с помощью химических способов с последовательностями из других белков, или любыми их частями, для получения модифицированной молекулы.
Для экспрессии биологически активных пептидов, нуклеотидные последовательности, кодирующие пептид или функциональные эквиваленты, могут быть встроены в соответствующий вектор экспрессии, т.е. вектор, который содержит необходимые элементы для транскрипции и трансляции встроенной кодирующей последовательности. Способы, которые хорошо известны специалистам в данной области, могут быть использованы для конструирования векторов экспрессии, содержащих последовательности, кодирующие этот пептид и соответствующие транскрипционные и трансляционные контрольные элементы. Эти способы включают in vitro технологии рекомбинантных ДНК, синтетические способы, и генетическую рекомбинацию in vivo. Такие технологии описаны у Sambrook, J. et al. (1989) Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, Plainview, NY, и Ausubel, F. M. et al. (1989) Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY.
Целый ряд векторов экспрессии/систем хозяев может быть использован для содержания и экспрессии последовательностей, кодирующих пептиды по изобретению. Они включают, но не только, микроорганизмы, такие как бактерии, трансформированные рекомбинантным бактериофагом, плазмиду или векторы экспрессии космидной ДНК; дрожжи, трансформированные дрожжевыми векторами экспрессии; клеточные системы насекомых, инфицированных вирусными векторами экспрессии (например, бакуловирусом); системы клеток растений, трансформированных вирусными векторами экспрессии (например, вирусом мозаики цветной капусты, CaMV; вирусом табачной мозаики, TMV) или бактериальными векторами экспрессии (например, Ti или pBR322 плазмидами); или системы клеток животных. Для бактерий, подходящие плазмиды включают pET, pRSET, pTrcHis2, и pBAD плазмиды от Invitrogen, pET и pCDF плазмиды от Novagen, и DirectorTM плазмиды от Sigma-Aldrich. Для метанопродуцентов, подходящие плазмиды включают, но не только, pME2001, pMV15, и pMP1. В частности, Escherichia coli может быть использована с вектором экспрессии pET. Настоящее изобретение не ограничивается использованным вектором экспрессии или клеткой-хозяином.
«Контрольные элементы» или «регуляторные последовательности» представляют собой нетранслируемые области векторов-энхансеров, промоторов 5' и 3' нетранслируемых областей, которые взаимодействуют с клеточными белками хозяина для осуществления транскрипции и трансляции. Такие элементы могут варьировать по силе и специфичности. В зависимости от используемой векторной системы и хозяина, может быть использовано любое количество подходящих транскрипционных и трансляционных элементов, в том числе конститутивных и индуцибельных промоторов. Например, при клонировании в бактериальные системы, могут быть использованы индуцибельные промоторы, такие как гибридный lacZ промотор BLUESCRIPT фагемиды (Stratagene, LaJolla, CA) или pSPORT1 плазмиды (Life Technologies) и подобные. Полигедриновый промотор бакуловируса может быть использован в клетках насекомых. Промоторы или энхансеры, полученные из геномов клеток растений (например, теплового шока, RUBISCO, и гены запасных белков) или из вирусов растений (например, вирусные промоторы или лидерные последовательности) могут быть клонированы в этот вектор.
В бактериальных системах, количество векторов экспрессии может быть выбрано в зависимости от применения этого пептида. Например, в тех случаях, когда необходимы большие количества пептида, могут быть использованы векторы, которые направляют высокий уровень экспрессии слитых белков, которые легко очистить. Такие векторы включают, но не только, многофункциональные E. coli клонирующие и экспрессирующие векторы, такие как BLUESCRIPT (Stratagene), в которых последовательность, кодирующая пептид, может быть лигирована в вектор в рамке с последовательностями для аминоконцевого Met и последующих 7 остатков β-галактозидазы, так, чтобы образовался гибридный белок; pIN векторы (Van Heeke, G. и S. M. Schuster (1989) J. Biol. Chem. 264:5503-5509); и подобные.
pGEX векторы (Promega, Madison, WI) также могут быть использованы для экспрессии чужеродных пептидов в виде слитых белков с глутатион S-трансферазой (GST). В основном, такие слитые белки являются растворимыми и могут быть легко очищены от лизированных клеток, путем адсорбции на глутатион-агарозные бусы с последующей элюцией в присутствии свободного глутатиона. Белки, полученные в таких системах, могут быть созданы содержащими сайты расщепления гепарин, тромбин или фактор Xa протеазой, так, чтобы клонированный пептид, представляющий интерес, мог быть освобожден от GST части по желанию. В дрожжах, Saccharomyces cerevisiae, может быть использован ряд векторов, содержащих конститутивные или индуцибельные промоторы, такие как альфа фактор, алкогольоксидаза, и PGH. Для обзора, смотри Ausubel et al. (supra) и Grant et al. (1987) Methods Enzymol. 153:516-544.
Специфические сигналы инициации также могут быть использованы для достижения более эффективной трансляции последовательностей, кодирующих пептиды по изобретению. Такие сигналы включают стартовый кодон ATG и смежные последовательности. В случаях, когда последовательности, кодирующие пептид, их стартовый кодон и вышележащие последовательности встроены в соответствующий вектор экспрессии, дополнительные транскрипционные или трансляционные контрольные сигналы могут не понадобиться. Однако в случаях, когда встроена только кодирующая последовательность, или ее фрагмент, должны быть предоставлены экзогенные трансляционные контрольные сигналы, включая стартовый кодон ATG. Более того, стартовый кодон должен находиться в правильной рамке считывания для обеспечения трансляции всей вставки. Экзогенные трансляционные элементы и стартовые кодоны могут быть различного происхождения, как природного, так и синтетического. Эффективность экспрессии может быть увеличена путем включения энхансеров, которые соответствуют используемой конкретной клеточной системе, такие, которые описаны в литературе (Scharf, D. et al. (1994) Results Probl. Cell Differ. 20:125-162).
Кроме того, штамм клетки-хозяина может быть выбран по его способности модулировать экспрессию встроенных последовательностей или процессировать экспрессированный пептид или полипептид желаемым образом. Такие модификации последовательности включают, но не только, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидирование и ацилирование. Пост-трансляционный процессинг, который расщепляет «препро» форму пептида или полипептида, также может быть использован для облегчения правильного встраивания, образования складчатой структуры и/или функции. Различные клетки-хозяева, которые имеют специфический клеточный механизм и характерные механизмы пост-трансляционных активностей, доступны из Американской коллекции типовых культур (ATCC; Bethesda, MD) и могут быть выбраны для обеспечения правильной модификации и процессинга последовательности. Особые клетки-хозяева включают, но не только, клетки метанопродуценты, такие как клетки Methanobrevibacter, в частности, клетки M. ruminantium, или M. smithii. Клетки-хозяева, представляющие интерес, включают, например, Rhodotorula, Aureobasidium, Saccharomyces, Sporobolomyces, Pseudomonas, Erwinia и Flavobacterium; или другие организмы, такие как Escherichia, Lactobacillus, Bacillus, Streptomyces, и подобные. Особые клетки-хозяева включают Escherichia coli, которая особенно подходит для использования в настоящем изобретении, Saccharomyces cerevisiae, Bacillus thuringiensis, Bacillus subtilis, Streptomyces lividans, и подобные.
Существуют некоторые методики введения нуклеиновых кислот в эукариотические клетки, культивированные in vitro. Эти методики включают химические способы (Felgner et al., Proc. Natl. Acad. Sci., USA, 84:7413 7417 (1987); Bothwell et al., Methods for Cloning and Analysis of Eukaryotic Genes, Eds., Jones and Bartlett Publishers Inc., Boston, Mass. (1990), Ausubel et al., Short Protocols in Molecular Biology, John Wiley and Sons, New York, NY (1992); и Farhood, Annal. NY Acad. Sci., 716:23 34 (1994)), применение протопластов (Bothwell, supra) или электрических импульсов (Vatteroni et al., Mutn. Res., 291:163 169 (1993); Sabelnikov, Prog. Biophys. Mol. Biol., 62: 119 152 (1994); Bothwell et al., supra; и Ausubel et al., supra), применение аттенуированных вирусов (Davis et al., J. Virol. 1996, 70(6), 3781 3787; Brinster et al. J. Gen. Virol. 2002, 83(Pt 2), 369 381; Moss, Dev. Biol. Stan., 82:55 63 (1994); and Bothwell et al., supra), а также физические способы (Fynan et al., supra; Johnston et al., Meth. Cell Biol., 43(Pt A):353 365 (1994); Bothwell et al., supra; and Ausubel et al., supra).
Успешная доставка нуклеиновых кислот в ткани животных может достигаться с помощью катионных липосом (Watanabe et al., Mol. Reprod. Dev., 38:268 274 (1994)), прямой инъекцией “голой” ДНК или РНК в мышечную ткань животного (Robinson et al., Vacc., 11:957 960 (1993); Hoffman et al., Vacc. 12:1529 1533; (1994); Xiang et al., Virol., 199:132 140 (1994); Webster et al., Vacc., 12:1495 1498 (1994); Davis et al., Vacc., 12:1503 1509 (1994); Davis et al., Hum. Molec. Gen., 2:1847 1851 (1993); Dalemans et al. Ann NY Acad. Sci. 1995, 772, 255 256. Conry, et al. Cancer Res. 1995, 55(7), 1397-1400), и эмбрионы (Naito et al., Mol. Reprod. Dev., 39:153 161 (1994); и Burdon et al., Mol. Reprod. Dev., 33:436 442 (1992)), внутримышечной инъекцией самореплицирующихся РНК вакцин (Davis et al., J Virol 1996, 70(6), 3781 3787; Balasuriya et al. Vaccine 2002, 20(11 12), 1609 1617) или внутрикожной инъекцией ДНК, используя технологию «генной пушки» (Johnston et al., supra).
Целый ряд протоколов для определения и измерения экспрессии пептидов или полипептидов по изобретению, с использованием либо поликлональных, либо моноклональных антител, специфичных к этому белку, известен из уровня техники. Примеры включают твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA), и активированную флуоресценцией сортировку клеток (FACS). Иммунологический анализ на основе моноклональных антител с двумя сайтами может быть использован с моноклональными антителами, реакционноспособными в отношении двух неинтерферирующих эпитопов пептида или полипептида, но также может быть использован анализ конкурентного связывания. Эти и другие анализы описаны, среди прочего, у Hampton, R. et al. (1990; Serological Methods, a laboratory Manual, APS Press, St Paul, MN) и Maddox, D. E. et al. (1983; J. Exp. Med. 158:1211-1216).
Целый ряд меток и способов конъюгации известен специалистам в данной области и может быть использован в различных анализах нуклеиновых кислот и аминокислот. Способы получения меченных гибридизационных или ПЦР зондов для выявления последовательностей, связанных с полинуклеотидами, включают олигомечение, ник-трансляцию, концевое мечение или ПЦР амплификацию с использованием меченного нуклеотида. Альтернативно, последовательности, кодирующие этот пептид или любые полипептиды, содержащие этот пептид, или любые их модифицированные последовательности, могут быть клонированы в вектор для получения мРНК зонда. Такие векторы известны в данной области, являются коммерчески доступными и могут быть использованы для синтеза РНК зондов in vitro путем добавления соответствующей РНК полимеразы, такой как T7, T3 или SP6 и меченых нуклеотидов. Эти методики можно проводить, используя целый ряд коммерчески доступных наборов Amersham Pharmacia Biotech, Promega, и US Biochemical. Подходящие репортерные молекулы или метки, которые могут быть использованы для облегчения выявления, включают радионуклиды, ферменты, флуоресцентные, хемилюминесцентные или хромогенные агенты, такие как субстраты, кофакторы, ингибиторы, магнитные частицы и подобные.
Векторы экспрессии или клетки-хозяева, трансформированные векторами экспрессии, могут быть культивированы в условиях, подходящих для экспрессии и извлечения пептида или полипептида из культуры. Эта культура может содержать компоненты для in vitro или in vivo экспрессии. Компоненты in vitro экспрессии включают компоненты для лизатов ретикулоцитов кролика, лизаты E. coli, и экстракты зародышей пшеницы, например, системы Expressway™ или RiPs от Invitrogen, системы GenelatorTM от iNtRON Biotechnology, EcoPro™ или системы STP3™ от Novagen, системы TNT® Quick Coupled от Promega, и системы EasyXpress от QIAGEN. Пептиды или полипептиды, полученные из культуры, могут быть секретированы или содержаться внутриклеточно в зависимости от используемой последовательности и/или вектора. Как будет понятно специалистам в данной области, векторы экспрессии, которые кодируют эти пептиды или полипептиды предпочтительно конструируют так, чтобы они содержали сигнальные последовательности с непосредственной секрецией этого пептида через прокариотическую или эукариотическую клеточную мембрану.
Другие конструкции могут включать аминокислотный домен, который будет облегчать очистку пептида или полипептида. Такие домены включают, но не только, металл хелатирующие пептиды, такие как модули гистидин-трипрофан (например, 6X-HIS (SEQ ID NO: 514)), которые позволяют проводить очистку на иммобилизованных металлах, домены белка А, которые позволяют проводить очистку на иммобилизованном иммуноглобулине, и домен, используемый в системе удлинения/аффинной очистки FLAG® (Immunex Corp., Seattle, WA). Подходящие эпитопные метки включают 3XFLAG®, HA, VSV-G, V5, HSV, GST, GFP, MBP, GAL4, и β-галактозидазу. Подходящие плазмиды включают плазмиды, содержащие биотиновую метку (например, PinPoint™ плазмиды от Promega), кальмодулин связывающий белок (например, pCAL плазмиды от Stratagene), стрептавидин связывающий белок (например, InterPlay™ плазмиды от Stratagene), метку c-myc или FLAG® (например, плазмиды иммунопреципитации от Sigma-Aldrich), или гистидиновую метку (например, QIAExpress плазмиды от QIAGEN).
Для облегчения очистки может быть использована расщепляемая линкерная последовательность, например, специфичную в отношении фактора Xa или энтерокиназы (Invitrogen, San Diego, CA). Например, этот вектор может включать один или более линкеров между доменом очистки и пептидом или полипептидом. В одном аспекте, вектор экспрессии может обеспечивать экспрессию слитого белка, содержащего пептид или полипептид по настоящему изобретению, и нуклеиновую кислоту, кодирующую 6 остатков гистидина (SEQ ID NO: 514), стоящих впереди тиоредоксина или сайта расщепления энтерокиназой. Остатки гистидина облегчают очистку на IMAC (аффинная хроматография с иммобилизованным ионом металла, описанная у Porath, J. et al. (1992) Prot. Exp. Purif. 3: 263-281), тогда как сайт расщепления энтерокиназой обеспечивает средство очистки пептида или полипептида из слитого белка. Рассмотрение векторов, которые содержат слитые белки, представлено у Kroll, D. J. et al. (1993; DNA Cell Biol. 12:441-453).
Антитела по настоящему изобретению могут быть получены с использованием способов, в основном известных из уровня техники, например, для использования в очистке или диагностических способах. В частности, очищенные пептиды, полипептиды или полинуклеотиды могут быть использованы для получения антител в соответствии с общеизвестными протоколами. Такие антитела могут включать, но не только, поликлональные, моноклональные, химерные и одноцепочечные антитела, Fab фрагменты и фрагменты, полученные с помощью Fab экспрессионной библиотеки. Нейтрализующие антитела (т.е., антитела, которые ингибируют функцию), являются особенно предпочтительными для использования в настоящем изобретении.
Для получения антител различные хозяева, в том числе, козы, кролики, крысы, мыши, люди и другие, могут быть иммунизированы путем введения пептида, полипептида, полинуклеотида или любого их фрагмента, который обладает иммуногенными свойствами. В зависимости от типа хозяина, могут быть использованы различные адъюванты для усиления иммунологической реакции. Такие адъюванты включают, но не только, адъювант Фрейнда, минеральные гели, такие как гидроксид алюминия, и поверхностно-активные вещества, такие как лизолецитин, плюрониловые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки и динитрофенол. Среди адъювантов, используемых у людей, особенно предпочтительными являются БЦЖ (бациллы Кальмета-Герена) и Corynebacterium parvum.
Предпочтительно, чтобы пептиды, полипептиды или фрагменты, используемые для индукции антител, имели аминокислотную последовательность, содержащую по меньшей мере пять аминокислот, и более предпочтительно по меньшей мере 10 аминокислот. Также предпочтительно, чтобы они были идентичны части аминокислотной последовательности природного белка, и они могли содержать всю аминокислотную последовательность небольшой природной молекулы. Короткие отрезки аминокислот могут быть слиты с таковыми другого белка, например, гемоцианином лимфы улитки, и антителом, полученным против этой химерной молекулы.
Моноклональные антитела могут быть получены. с использованием любой методики, которая обеспечивает получение молекул антител с помощью стабильной клеточной линии в культуре. Эти методики включают, но не только, гибридомную технологию, гибридомную технологию В-клеток человека и EBV-гибридомную технологию (Kohler, G. et al. (1975) Nature 256:495-497; Kozbor, D. et al. (1985) J. Immunol. Methods 81:31-42; Cote, R. J. et al. (1983) Proc. Natl. Acad. Sci. 80:2026-2030; Cole, S. P. et al. (1984) Mol. Cell Biol. 62:109-120). Антитела также могут быть получены путем индукции in vivo продукции в популяции лимфоцитов или путем скрининга библиотек иммуноглобулинов или панелей высокоспецифичных связывающих реагентов, как описано в литературе (Orlandi, R. et al. (1989) Proc. Natl. Acad. Sci. 86:3833-3837; Winter, G. et al. (1991) Nature 349:293-299).
Кроме того, могут быть использованы методики для очистки «химерных антител», например, объединение генов антител для получения молекулы с соответствующей антигенной специфичностью и биологической активностью (Morrison, S. L. et al. (1984) Proc. Natl. Acad. Sci. 81:6851-6855; Neuberger, M.S. et al. (1984) Nature 312:604-608; Takeda, S. et al. (1985) Nature 314:452-454). Альтернативно, методики, описанные для получения одноцепочечных антител, могут быть адаптированы, с использованием способов, известных в данной области, для получения специфичных одноцепочечных антител. Антитела с родственной специфичностью, но другого идиотипного состава, могут быть получены путем цепьевого шаффлинга из случайных комбинаторных библиотек иммуноглобулинов (Burton D. R. (1991) Proc. Natl. Acad. Sci. 88:11120-3).
Специалистам в данной области, к которой относится настоящее изобретение, будут понятны термины «диатела» и «триатела». Они представляют собой молекулы, которые содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) коротким пептидным линкером, который является слишком коротким, чтобы была возможность образования пары между двумя доменами на одной и той же цепи. Это способствует спариванию с комплементарными доменами одной или нескольких других цепей, и стимулирует образование димерных или тримерных молекул с двумя или более функциональными антигенсвязывающими сайтами. Полученные в результате молекулы антител могут быть моноспецифичными или мультиспецифичными (например, биспецифичными в случае диател). Такие молекулы антител могут быть получены из двух или более антител, с использованием методологии, стандартной в области, к которой относится настоящее изобретение; например, как описано у Todorovska et al. (Design and application of diabodies, triabodies and tetrabodies for cancer targeting. J. Immunol. Methods. 2001 Feb 1;248(1-2):47-66).
Также могут быть получены фрагменты антител, которые содержат специфические сайты связывания. Например, такие фрагменты включают, но не только, F(ab')2 фрагменты, которые могут быть получены путем расщепления пепсином молекулы антитела, и Fab фрагменты, которые могут быть получены путем восстановления дисульфидных мостиков фрагментов F(ab')2. Альтернативно, экспрессионные библиотеки Fab могут быть сконструированы для возможности быстро и несложно осуществлять идентификацию моноклональных Fab фрагментов с желаемой специфичностью (Huse, W. D. et al. (1989) Science 254:1275-1281).
Различные иммуноанализы могут быть использованы для скрининга для идентификации антител, обладающих специфичностью связывания. Многочисленные протоколы для конкурентного связывания или количественных радиоиммуноанализов с использованием либо поликлональных, либо моноклональных антител с установленными специфичностями, хорошо известны в данной области. Такие иммуноанализы обычно включают измерение образования комплекса между пептидом, полипептидом или полинуклеотидом и специфичным к нему антителом. Иммунологический анализ на основе моноклональных антител с двумя сайтами с использованием моноклональных антител, реакционно-способных в отношении двух неинтерферирующих эпитопов, является предпочтительным, но также может быть использован анализ конкурентного связывания (Maddox, supra).
Сигнальные пептиды, описанные в настоящем изобретении, обладают способностью входить в клетки и, следовательно, подходят в качестве молекул носителей для доставки ингибирующих молекул в микробные клетки. Химические реакции для соединения аминокислот и соединений, хорошо разработаны и ряд различных типов молекул может быть соединен с сигнальным пептидом. Самые распространенные способы соединения основываются на наличии свободных амино (альфа-амино или Lys), сульфгидрильных (Cys), или карбоксильных групп (Asp, Glu, или альфа-карбоксил). Способы соединения могут быть использованы для соединения пептида с клеточным ингибитором через карбокси- или аминоконцевой остаток. В некоторых случаях последовательность включает многочисленные остатки, которые могут взаимодействовать выбранным химизмом. Это может быть использовано для получения мультимеров, содержащих более одного клеточного ингибитора. Альтернативно, пептид или полипептид может быть укорочен или выбран таким образом, чтобы реакционно-способные остатки были расположены либо на амино, либо на карбоксильном конце последовательности.
Например, репортерная молекула, такая как флуоресцеин, может быть специально включена в остаток лизина (Ono et al., 1997) с использованием N-α-Fmoc-Nε-1-(4,4-диметил-2,6 диоксоциклогекс-1-илиден-3-метилбутил)-L-лизина во время пептидного синтеза. После синтеза сложные эфиры 5- и 6-карбоксифлуоресцеинсукцинимидила могут быть соединены, после чего 4,4-диметил-2,6 диоксоциклогекс-1-илиден удаляют путем обработки гидразином. Следовательно, соединение ингибирующей молекулы с сигнальным пептидом или полипептидом может осуществляться путем включения остатка лизина в проникающую последовательность, затем взаимодействием с подходящим производным клеточным ингибитором.
Также может быть использован EDC (1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид) или карбодиимидный способ соединения. Карбодиимиды могут активировать карбоксильные группы боковой цепи аспарагиновой и глутаминовой кислоты, а также карбоксиконцевую группу, чтобы сделать их реакционно-способными участками для соединения с первичными аминами. Активированные пептиды перемешивают с клеточным ингибитором для получения конечного конъюгата. Если клеточный ингибитор активирован первым, методом EDC клеточный ингибитор будет соединяться через N-концевой альфа амин и, возможно, через амин в боковой цепи Lys, если присутствует в последовательности.
Сложный эфир м-малеимидобензоил-N-гидроксисукцинимида (MBS) представляет собой гетеробифункциональный реагент, который может быть использован для соединения пептидов с клеточными ингибиторами через цистеины. Соединение происходит с тиоловой группой остатков цистеина. Если выбранная последовательность не содержит Cys, обычным является расположение остатка Cys на N- или C-конце для получения высококонтролируемого соединения пептида с клеточным ингибитором. Для целей синтеза, для цистеина может быть целесообразным расположение на N-конце пептида. MBS особенно подходит для использования в настоящем изобретении.
Глутаральдегид может быть использован в качестве бифункционального связующего реагента, который соединяет два соединения через их аминогруппы. Глутаральдегид обеспечивает спейсер высокой гибкости между пептидом и клеточным ингибитором для подходящей презентации. Глутаральдегид является очень реакционно-способным соединением и будет взаимодействовать с Cys, Tyr, и His до ограниченной степени. Способ глутаральдегидных сшивок особенно подходит в тех случаях, когда пептид содержит только одну свободную аминогруппу на его аминоконце. В тех случаях, когда пептид содержит более одной свободной аминогруппы, могут быть образованы крупные мультимерные комплексы.
В одном аспекте, пептиды или полипептиды по настоящему изобретению могут быть слиты (например, путем клонирования внутри рамки) или сшиты (например, путем химического соединения) с клеточными ингибиторами, такими как антимикробные средства. Среди этих средств включены антимикробные пептиды, например, бактерицидный/усиливающий проницаемость белок, катионные антимикробные белки, лизозимы, лактоферрины и кателицидины (например, из нейтрофилов; см., например, Hancock and Chapple, 1999, Antimicrob. Agents Chemother. 43:1317-1323; Ganz and Lehrer, 1997, Curr. Opin. Hematol. 4:53-58; Hancock et al., 1995, Adv. Microb. Physiol. 37:135-175). Антимикробные пептиды дополнительно включают дефенсины (например, из эпителиальных клеток или нейтрофилов) и тромбоцитарные микробиоцидные белки (смотри, например, Hancock and Chapple, 1999, Antimicrob. Agents Chemother. 43:1317-1323). Дополнительные антимикробные пептиды включают, но не только, грамицидин S, бацитрацин, полимиксин B, тахиплезин, бактенецин (например, бактенецин крупного рогатого скота), раналексин, цекропин A, индолицидин (например, индолицидин крупного рогатого скота), и низин (например, бактериальный низин).
В качестве противомикробных средств также включены ионофоры, которые облегчают перенос иона (например, натрия), через липидный барьер, такой как клеточная мембрана. Двумя ионофорными соединениями, особенно подходящими для настоящего изобретения, являются RUMENSINTM (Eli Lilly) и Lasalocid (Hoffman LaRoche). Другие ионофоры включают, но не только, салиномицин, авопарцин, аридцин и актапланин. Другие противомикробные средства включают Monensin™ и азитромицин, метронидазол, стрептомицин, канамицин и пенициллин, а также, в целом, ß-лактамы, аминогликозиды, макролиды, хлорамфеникол, новобиоцин, рифампин и флуорохинолоны (см., например, Horn et al., 2003, Applied Environ. Microbiol. 69:74-83; Eckburg et al., 2003, Infection Immunity 71:591-596; Gijzen et al., 1991, Applied Environ. Microbiol. 57:1630-1634; Bonelo et al., 1984, FEMS Microbiol. Lett. 21:341-345; Huser et al., 1982, Arch. Microbiol. 132:1-9; Hilpert et al., 1981, Zentbl. Bakteriol. Mikrobiol. Hyg. 1 Abt Orig. C 2:21-31).
Особенно эффективными ингибиторами являются соединения, которые блокируют или препятствуют образованию метана, в том числе бромэтансульфоновая кислота, например, 2-бромэтансульфоновая кислота (BES) или их соли, например, натриевая соль. Молибдат натрия (Mo) является ингибитором восстановления сульфата, и может быть использован с бромэтансульфоновой кислотой. Другие соединения против метанообразования включают, но не только, нитрат, формиат, метилфторид, хлороформ, хлоралгидрат, сульфат натрия, этилен и ненасыщенные углеводороды, ацетилен, жирные кислоты, такие как линолевая и цис-олеиновая кислота, насыщенные жирные кислоты, такие как бегеновая и стеариновая кислота, а также лумазин (например, 2,4-птеридиндион). Дополнительные соединения включают 3-бромпропансульфонат (BPS), пропионовую кислоту и этил 2-бутиноат.
Дополнительно включенными в качестве противомикробных агентов являются литические ферменты, в том числе лизоцим, эндолизин, лизоцим, лизин, фаговый лизин, мурализин, мурамидаза, и виролизин. Подходящие ферменты демонстрируют способность к гидролизу специфических связей в клеточной стенке бактерий. Конкретные литические ферменты включают, но не только, глюкозаминидазы, которые гидролизуют гликозидные связи между аминосахарами (например, N-ацетилмураминовой кислотой и N-ацетилглюкозамином) пептидогликана, амидазы, которые расщепляют N-ацетилмурамоил-L-аланинамидную связь между гликановой цепью и поперечно-сшивающим пептидом, и эндопептидазы, которые гидролизуют межпептидную связь (например, цистеиновые эндопептидазы) и эндоизопептидазы, которые воздействуют на псевдомуреин метанопродуцентов семейства Methanobacteriacaea.
Дополнительно, ПНК включены в качестве противомикробных средств. ПНК представляют собой гибридные пептид-нуклеиновые кислоты, в которых фосфатный скелет был заменен ахиральным и нейтральным скелетом, образованным из N-(2-аминоэтил)-глициновых единиц (смотри, например, Eurekah Bioscience Collection. PNA and Oligonucleotide Inhibitors of Human Telomerase. G. Gavory and S. Balasubramanian, Landes Bioscience, 2003). Основания A, G, T, C присоединяются к аминоазоту скелета через метиленкарбонильные связи (P.E. Nielsen et al., Science 1991. 254: 1497-1500; M. Egholm et al., Nature 1993. 365: 566-568). ПНК связывают комплементарные последовательности с высокой специфичностью и более высокой аффинностью относительно аналогичных ДНК или РНК (M. Egholm et al., supra). Гибриды ПНК/ДНК или ПНК/РНК также демонстрируют более высокую термическую стабильность по сравнению с соответствующими дуплексами ДНК/ДНК или ДНК/РНК (M. Egholm et al., supra). ПНК также обладают высокой химической и биологической стабильностью вследствие неприродного амидного скелета, который не распознается нуклеазами или протеазами (V. Demidov et al., Biochem Pharmacol 1994. 48: 1310-1313). Обычно ПНК представляют собой по меньшей мере 5 оснований в длину, и включают концевой лизин. ПНК могут быть пэгилированы для дополнительного увеличения продолжительности их жизни (Nielsen, P. E. et al. (1993) Anticancer Drug Des. 8:53-63).
В одном конкретном аспекте, пептиды или полипептиды по изобретению могут быть слиты (например, клонированием внутри рамки) или сшиты (например, путем химического соединения) с клеточными ингибиторами, такими как антитела или их фрагменты. Антитела или фрагменты антител могут быть направлены на микробные клетки или конкретно клетки метанопродуцентов, или один или несколько компонентов клетки. Например, белки клеточной поверхности, например, рецепторы, могут быть мишенью. Включены молекулы иммуноглобулинов и иммунологически активные части молекул иммуноглобулинов (Ig), т.е. молекул, которые содержат антигенсвязывающий сайт, который специфически связывается (иммунологически взаимодействует) с антигеном.
Пептиды или полипептиды по изобретению находят практическое применение в направленной доставке в микробную клетку, в частности, клетку метанопродуцента. В некоторых аспектах, пептиды и полипептиды могут быть использованы для связывания с клеточной стенкой или мембраной и/или проницаемости в клетку. Как таковые, пептиды или полипептиды могут быть использованы для транзиторного или длительного присоединения к клетке, или для пенетрации клеточной стенки или мембраны и/или накопления во внеклеточном окружении. Понятно, что пептиды, полипептиды, а также соответствующие полинуклеотиды, векторы экспрессии, клетки-хозяева и антитела по изобретению могут быть использованы для направления на различные микроорганизмы, например, Methanobrevibacter ruminantium, который является обычным метанопродуцентом у жвачных животных, и Methanobrevibacter smithii, который является широко распространенным метанопродуцентом у людей. Для осуществления направленного действия, микробную клетку можно привести в контакт с сигнальным пептидом или полипептидом, содержащим этот пептид, выделенным из одного или нескольких природных источников, или полученным с помощью векторов экспрессии и/или клеток-хозяев, или синтетической или полусинтетической химии, как подробно описано в настоящей заявке. В конкретных аспектах, пептид или полипептид доставляется индивидам в виде композиции, подробно описанной в настоящей заявке, например, посредством использования устройства для медленного высвобождения у жвачных животных.
В некоторых вариантах осуществления, полипептид слит или сшит с клеточным ингибитором, например, соединением против образования метана (например, бромэтансульфоновой кислотой), антителом или фрагментом антитела, литическим ферментом, пептид-нуклеиновой кислотой, антимикробным пептидом, или другим антибиотиком. Этот пептид-ингибитор или полипептид-ингибитор доставляется индивиду в виде композиции для ингибирования роста или репликации микробных клеток, в частности, клеток метанопродуцентов. Эта композиция содержит, например: a) выделенный сигнальный пептид или полипептид, содержащий этот пептид, или его изменение, фрагмент, вариант или производное; b) выделенный полинуклеотид, или его изменение, фрагмент, вариант или производное; c) вектор экспрессии, содержащий этот полинуклеотид; или d) клетку-хозяин, содержащий этот вектор экспрессии. Композиции по изобретению могут быть особым образом упакованы как часть наборов для направленной доставки, проникновения и/или ингибирования микробных клеток, в особенности, клеток метанопродуцентов, в соответствии с описанными способами. Эти наборы содержат по меньшей мере одну композицию, представленную в настоящем описании и инструкции по применению для проницаемости в клетки или ингибирования клеточного роста или репликации метанопродуцентов или других микроорганизмов.
В качестве дополнительного варианта осуществления изобретение относится к фармацевтической композиции в сочетании с фармацевтически приемлемым носителем, для использования с любым из способов, описанных выше. Такие фармацевтические композиции могут содержать сигнальный пептид или полипептид, содержащий этот пептид, в сочетании с клеточным ингибитором. Альтернативно, фармацевтические композиции могут содержать вектор экспрессии или клетку-хозяин, подробно описанные в настоящей заявке. Композиции могут быть введены отдельно или в сочетании по меньшей мере с одним другим средством, таким как стабилизирующее соединение, которое может быть введено в любом стерильном, биосовместимом фармацевтическом носителе, в том числе, но не только, физиологическом растворе, забуференном физиологическом растворе, декстрозе или воде. Композиции можно вводить индивиду отдельно или в сочетании с другими средствами, лекарствами (например, противомикробными средствами), или гормонами.
Помимо активных ингредиентов, эти фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, содержащие эксципиенты и вспомогательные вещества, которые облегчают обработку активных соединений в препараты, которые могут быть использованы фармацевтически. Дополнительные подробности по технологии получения и введения можно найти в последней редакции Remington's Pharmaceutical Sciences (Maack Publishing Co., Easton, PA). Фармацевтические композиции, используемые в настоящем изобретении, могут быть введены любыми путями, включая, но не только, пероральный, внутривенный, внутримышечный, внутриартериальный, интрамедуллярный, интратекальный, внутрижелудочковый, чрескожный, подкожный, внутрибрюшинный, интраназальный, энтеральный, местный, подъязычный или ректальный способ.
Фармацевтические композиции для перорального введения могут быть получены с использованием фармацевтически приемлемых носителей, хорошо известных из уровня техники, в дозах, подходящих для перорального введения. Такие носители позволяют получать фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, суспензий и подобного для приема внутрь. Фармацевтические препараты для перорального применения могут быть получены путем объединения активных соединений с твердым эксципиентом, необязательно измельчения полученной в результате смеси, и обработки смеси гранул, с последующим добавлением подходящих вспомогательных веществ, при желании, для получения таблеток или ядер драже. Подходящими эксципиентами являются углеводные или белковые наполнители, такие как сахара, в том числе, лактоза, сахароза, маннитол или сорбитол; крахмал из кукурузы, пшеницы, риса, картофеля, или других растений; целлюлоза, например, метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза натрия; камеди, в том числе, аравийская и трагакантовая; и белки, такие как желатин и коллаген. При желании, могут быть добавлены дезинтегранты или солюбилизаторы, такие как поперечносшитый поливинилпирролидон, агар, альгиновая кислота, или ее соль, такая как альгинат натрия.
Фармацевтические препараты, которые могут быть использованы перорально, включают капсулы, удобные для глотания, изготовленные из желатина, а также мягкие, запечатанные капсулы, изготовленные из желатина, и покрытие, такое как глицерин или сорбит. Удобные для глотания капсулы могут содержать активные ингредиенты, смешанные с наполнителем или связующими, такими как лактоза или крахмалы, смазывающие вещества, такие как тальк или стеарат магния, и, необязательно, стабилизаторы. В мягких капсулах, активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкость или жидкий полиэтиленгликоль со стабилизаторами или без них. Ядра драже могут быть использованы в сочетании с подходящими покрытиями, такими как концентрированные растворы сахаров, которые также могут содержать аравийскую камедь, тальк, поливинилпирролидон, карбопол гель, полиэтиленгликоль и/или диоксид титана, растворы глазури и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены к покрытиям таблеток или драже для идентификации продукта или для характеристики количества активного вещества, т.е. дозы.
Фармацевтические композиции, подходящие для парентерального введения, могут быть получены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера, или физиологически забуференный солевой раствор. Водные инъекционные суспензии могут содержать вещества, которые повышают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Дополнительно, суспензии активных соединений могут быть получены в виде соответствующих масляных инъекционных суспензий. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или сложные эфиры синтетических жирных кислот, такие как этилолеат или триглицериды, или липосомы. Нелипидные поликатионные аминополимеры также могут быть использованы для доставки. Необязательно, суспензия также может содержать подходящие стабилизаторы или средства, которые повышают растворимость соединений для возможности получать растворы высокой концентрации. Для местного или назального введения, в композиции используют пенетранты, соответствующие конкретному барьеру, подлежащему пенетрации. Такие пенетранты в основном известны из уровня техники.
Фармацевтические композиции по настоящему изобретению могут быть получены способом, известным в данной области, например, путем обычного перемешивания, растворения, грануляции, изготовления драже, отмучивания, эмульгирования, инкапсулирования, включения, или процессами лиофилизации. Фармацевтическая композиция может быть представлена в виде соли и может быть образована со многими кислотами, в том числе, но не только, соляной, серной, уксусной, молочной, винной, яблочной, янтарной и т.д. Соли имеют тенденцию быть более растворимыми в водных или других протонных растворителях, чем соответствующие формы свободных оснований. В других случаях, предпочтительным препаратом может быть лиофилизированный порошок, который может содержать любое или все из следующего: 1-50 мМ гистидина, 0,1%-2% сахарозы и 2-7% маннитола, при pH в интервале от 4,5 до 5,5, объединенный с буфером до использования. После получения фармацевтических композиций, они могут быть помещены в соответствующий контейнер и снабжены этикеткой для лечения указанного состояния. Для применения композиции по изобретению такая этикетка содержала бы количество, частоту и способ введения.
Фармацевтические композиции, подходящие для использования в настоящем изобретении, включают композиции, в которых активные ингредиенты содержатся в эффективном количестве для достижения заданной цели. Для любого соединения, терапевтически эффективную дозу можно определить сначала либо в клеточных исследованиях, например, в микробных клетках, или, в частности, в клетках метанопродуцентов, или на животных моделях, обычно мышах, кроликах, собаках или свиньях, или у жвачных видов животных, таких как овцы, крупный рогатый скот, олени и козы. Животная модель также может быть использована для определения подходящего диапазона концентраций и пути введения. Такая информация затем может быть использована для определения подходящих доз и путей введения индивиду. Нормальные количества дозы могут варьировать от 0,1 до 100000 микрограммов, вплоть до суммарной дозы около 1 г, в зависимости от пути введения. Руководство, касающееся конкретных доз и способов доставки, представлено в литературе и в основном доступно для специалистов, практикующих в данной области. Специалисты в данной области будут использовать другие составы для полинуклеотидов, чем для пептидов или полипептидов. Аналогично, доставка полинуклеотидов или полипептидов будет особой для конкретных клеток, условий, локализаций и т.д.
Лекарственные средства, основанные на пептидах и полипептидах широко известны, и способы получения таких композиций являются общепринятыми в уровне техники. Приводимые в качестве примера пептидные и полипептидные лекарственные средства и их получение описано, например, для денилейкин дифитокса, октеотида, вапреотида, ланреотида, пептидов серий RC-3940, декапептила, лупрона, золадекса, цетрореликса (смотри, например, Lu et al., 2006, AAPS J 8:E466-472), гемоцидинов, стафопенов (см., например, Dubin et al., 2005, Acta Biochemica Polonica, 52:633-638), а также индолицидина, дефенсинов, лантибиотиков, микроцидина B17, гистатинов и маганина (см., например, Yeaman and Yount, 2003, Pharmacol Rev 55:27-55). Общее руководство по пептидным и полипептидным лекарственным средствам также можно найти у Degim et al., 2007, Curr Pharm Des 13:99-117 и Shai et al., 2006, Curr Prot Pept Sci, 7:479-486. Одобренные в последнее время лекарственные средства на основе пептидов включают Hematide™ (синтетическое средство на пептидной основе, стимулирующее эритропоэз, Affymax, Inc.), эксенатид (синтетический экзендин-4, Amylin/Eli Lilly), натрекор (незиритид, натриуретический пептид, Scios), пленаксис (абареликс, Praecis Pharmaceuticals), и SecreFlo (секретин, Repligen).
Точная доза будет определяться практикующим специалистом, с учетом факторов, связанных с индивидом, для которого требуется лечение. Дозу и введение устанавливают для обеспечения достаточных уровней активного агента или для поддержания желаемого эффекта. Факторы, которые могут быть приняты во внимание, включают тяжесть патологического состояния, общее состояние здоровья индивида, возраст, массу тела и пол индивида, рацион питания, время и частоту введения, сочетание(я) лекарственных средств, реакции чувствительности и толератности/ответа на лечение. Фармацевтические композиции длительного действия можно вводить каждые 3 - 4 дня, каждую неделю или однократно каждые две недели в зависимости от периода полужизни и скорости выведения конкретной композиции.
Особенно подходят для композиций по изобретению (например, фармацевтических композиций) составы или механизмы медленного высвобождения. Например, внутрирубцовые устройства включают, но не только, Time Capsule™ Bolus от Agri-Feeds Ltd., New Zealand, первоначально разработанные в AgResearch Ltd., New Zealand, как описано в WO 95/19763 и NZ 278977, и CAPTEC фирмой Nufarm Health & Sciences, отделом Nufarm Ltd., Auckland, New Zealand, как описано в AU 35908178, PCT/AU81/100082, и Laby et al., 1984, Can. J. Anim. Sci. 64 (Suppl.), 337-8, каждая из которых включена в настоящее описание в качестве ссылки. В качестве конкретного примера, устройство может включать пружину и поршень, который проталкивает композицию к отверстию на конце сосуда.
В качестве дополнительного варианта осуществления, настоящее изобретение относится к композиции для водной добавки, например, орошающей композиции или кормовой добавки, например, добавки к корму для жвачных животных, для использования с любым из способов, рассмотренных выше. В конкретных аспектах, кормовая добавка содержит по меньшей мере одно съедобное растительное вещество и пептид или полипептид по настоящему изобретению. Альтернативно, кормовая добавка содержит по меньшей мере одно съедобное растительное вещество и полипептид или пептид, или полинуклеотид, кодирующий пептид или полипептид, описанный в настоящей заявке, например, в виде вектора экспрессии или клетки-хозяина, содержащей вектор экспрессии. В частности, композиция дополнительно включает клеточный ингибитор, слитый или соединенный с полученной в результате последовательностью. Предпочтительный растительный материал включает любой из сена, травы, зерна или кормовой крупы, например, бобовые, сено, травяное сено, кукурузный силос, силос из злаковых культур, бобовый силос, кукурузное зерно, овес, ячмень, дробину, пивная дробина, соевую муку и муку из семян хлопчатника. В частности, силос из злаковых культур применим в качестве кормовой композиции для жвачных животных. Растительный материал может быть генетически модифицирован, таким образом, чтобы он содержал один или несколько компонентов по изобретению, например, один или несколько полипептидов или пептидов, полинуклеотидов или векторов.
В другом варианте осуществления, антитела, которые специфически связываются с пептидами, полипептидами или полинуклеотидами по настоящему изобретению, могут быть использованы для определения присутствия микроорганизмов, в особенности, метанопродуцентов, или в анализах для мониторинга уровней таких микроорганизмов. Антитела, подходящие для диагностических целей, могут быть получены таким же образом, как описано выше. Диагностические исследования включают способы, в которых используется антитело и метка для выявления пептида или полипептида в жидкостях организма человека или экстрактах клеток или тканей. Антитела могут быть использованы с модификацией или без модификации и могут быть помечены путем соединения их, либо ковалентно, либо нековалентно, с репортерной молекулой. Может быть использован целый ряд репортерных молекул, которые известны из уровня техники, некоторые из которых описаны выше.
Ряд протоколов для измерения уровней пептида, полипептида или полинуклеотида известен в данной области (например, ELISA, RIA, FACS, и блоттинг), и обеспечивают основу для определения наличия или уровней микроорганизма, в особенности, метанопродуцентов. Нормальные или стандартные уровни, установленные путем объединения жидкостей организма или клеточных экстрактов, взятых у здоровых индивидов, например, здоровых людей или жвачных животных, с антителом в условиях, подходящих для образования комплекса. Величина стандартного комплексообразования может быть определена количественно различными способами, но, предпочтительно, фотометрическим способом. Количества пептида, полипептида или полинуклеотида, экспрессируемого у индивида, и в обработанных образцах (например, образцах от индивидов, прошедших обработку), сравнивают со стандартными значениями. Отклонение между стандартными значениями и значениями, полученными у индивида, устанавливает параметры для определения присутствия или уровней микроорганизма.
В конкретном варианте осуществления настоящего изобретения, полинуклеотиды могут быть использованы для диагностических целей с использованием конкретных гибридизационных и/или амплификационных методик. Полинуклеотиды, которые могут быть использованы, включают олигонуклеотиды, комплементарные РНК и ДНК молекулы и ПНК. Полинуклеотиды могут быть использованы для выявления и количественного анализа генной экспрессии в образцах, в которых экспрессия может коррелировать с присутствием или уровнями микроорганизма. Диагностический анализ может быть использован для проведения различия между отсутствием, присутствием и изменением уровней микроорганизмов и для мониторинга уровней во время терапевтического вмешательства.
В одном аспекте, гибридизация с ПЦР зондами может быть использована для идентификации последовательностей нуклеиновых кислот, в особенности геномных последовательностей, которые кодируют пептиды или полипептиды по настоящему изобретению. Специфичность зонда, получен ли он из высокоспецифичной области, например, 10 уникальных нуклеотидов в 5'-регуляторной области, или менее специфичной области, например, в 3'-кодирующей области, и жесткости гибридизации или амплификации (максимальной, высокой, промежуточной или низкой) будет определять, идентифицирует ли зонд только природные последовательности, аллели, или родственные последовательности. Зонды также могут быть использованы для выявления родственных последовательностей, и предпочтительно должны содержать по меньшей мере 50% нуклеотидов из любой из кодирующих последовательностей. Гибридизационные зонды предмета изобретения могут представлять собой ДНК или РНК и происходить из нуклеотидной последовательности SEQ ID NO:173-341 или 342-533, или комплементов, или их модифицированных последовательностей, или из геномных последовательностей, включая промотор, энхансерные элементы, и интроны природной последовательности.
Способы получения специфических гибридизационных зондов для ДНК включают клонирование последовательностей нуклеиновой кислоты в векторы для получения зондов мРНК. Такие векторы известны из уровня техники, коммерчески доступны и могут быть использованы для синтеза РНК зондов in vitro путем добавления соответствующих РНК полимераз и соответствующих меченых нуклеотидов. Гибридизационные зонды могут быть мечены рядом репортерных групп, например, радионуклидами, такими как 32P или 35S, или ферментными метками, такими как щелочная фосфатаза, соединенная с зондом через системы соединения авидин/биотин, и подобные. Полинуклеотиды могут быть использованы в Саузерн или нозерн анализе, дот-блоттинге или других мембранных методиках; в ПЦР методах; или в тест-полосках, стержнях, ELISA анализах, или микрочипах с использованием жидкостей или тканей из биоптатов индивида для выявления присутствия или уровней микроорганизма. Такие качественные и количественные способы известны в данной области.
В особом аспекте, последовательности нуклеиновой кислоты могут применяться в различных анализах, меченые стандартными способами и добавленные в жидкость или образец ткани от индивида в условиях, подходящих для гибридизации и/или амплификации. После соответствующего периода инкубирования, образец промывают, и сигнал измеряют и сравнивают со стандартной величиной. Если величина сигнала в тестируемом образце значительно изменяется по сравнению с величиной сигнала контрольного образца, присутствие измененных уровней нуклеотидных последовательностей в образце указывает на присутствие или уровни микроорганизма. Такие анализы также могут быть использованы для оценки эффективности конкретного режима лечения в исследованиях на животных, в клинических испытаниях или при мониторинге лечения индивида.
Для обеспечения основы для диагностики присутствия или уровней микроорганизма, устанавливают нормальный или стандартный профиль экспрессии. Это может осуществляться путем объединения жидкостей организма или клеточных экстрактов, взятых от здоровых индивидов, с полинуклеотидом или его фрагментом, в условиях, подходящих для гибридизации и/или амплификации. Стандартные уровни могут быть количественно определены путем сравнения уровней, полученных от здоровых индивидов с уровнями из эксперимента, в котором используется известное количество по существу очищенного полинуклеотида. Стандартные значения, полученные из нормальных образцов, можно сравнить со значениями, полученными из образцов от индивидов, прошедших обработку против микробного роста. Отклонение между стандартными значениями и значениями индивида используют для установления присутствия или уровней микроорганизма.
После идентификации микроорганизма и начала осуществления протокола обработки, гибридизацию и/или амплификационные анализы можно повторять регулярно для определения начала снижения уровня экспрессии у индивида по сравнению с уровнем, который наблюдается у нормального индивида. Результаты, полученные из последующих анализов, могут быть использованы для демонстрации эффективности лечения на протяжении периода времени в интервале от нескольких дней до месяцев.
Конкретные диагностические применения для олигонуклеотидов, полученных из последовательностей нуклеиновых кислот, могут включать применение ПЦР. Такие олигомеры могут быть синтезированы химически, получены ферментативно или получены in vitro. Олигомеры предпочтительно будут состоять из двух нуклеотидных последовательностей, одной со смысловой ориентацией (5'.fwdarw.3') и другой с антисмысловой ориентацией (3'.fwdarw.5'), применяемых в оптимизированных условиях для идентификации специфического гена или состояния. Те же два олигомера, набор олигомеров для гнездовой ПЦР, или даже вырожденный пул олигомеров можно использовать в менее строгих условиях для выявления и/или количественного анализа близкородственных ДНК или РНК последовательностей.
Способы, которые также могут быть использованы для количественного анализа экспрессии, включают радиоактивно меченые или биотинилированные нуклеотиды, ко-амплификацию контрольной нуклеиновой кислоты и стандартные кривые, на которые интреполированы результаты экспериментов (Melby, P. C. et al. (1993) J. Immunol. Methods, 159:235-244; Duplaa, C. et al. (1993) Anal. Biochem. 229-236). Скорость количественного анализа многочисленных образцов может быть увеличена путем проведения этого исследования в формате ELISA, где олигомер, представляющий интерес, находится в различных разведениях и спектрофотометрический или колориметрический ответ дает быстрое количественное определение.
В дополнительных вариантах осуществления, олигонуклеотиды или более длинные фрагменты, полученные из любых полинуклеотидов, описанных в настоящей заявке, могут быть использованы в качестве мишеней в микрочипе. Микрочип может быть использован для мониторинга уровня экспрессии огромного числа генов одновременно (для получения образа транскрипта), и для идентификации генетических вариантов, мутаций и полиморфизмов. Эта информация может быть использована для определения функции гена, для понимания генетической основы заболевания, для диагностики заболевания и для развития и мониторинга активностей терапевтических средств. В одном варианте осуществления, микрочип получают и используют в соответствии со способами, известными в данной области, например, описанными в заявке PCT WO 95/11995 (Chee et al.), Lockhart, D. J. et al. (1996; Nat. Biotech. 14: 1675-1680) и Schena, M. et al. (1996; Proc. Natl. Acad. Sci. 93: 10614-10619).
В одном аспекте олигонуклеотиды могут быть синтезированы на поверхности микрочипа, с использованием методики химического соединения и прибора чернильно-струйного нанесения, например, описанного в заявке PCT WO95/251116 (Baldeschweiler et al.). В другом аспекте матрица «с координатной сеткой» аналогичная дот или слот блоту (HYBRIDOT apparatus, Life Technologies) может быть использована для систематизирования и соединения фрагментов кДНК или олигонуклеотидов с поверхностью субстрата, с использованием вакуумной системы, термического, УФ, механического способа или способа химического связывания. Еще в одном аспекте, матрица может быть получена вручную, или путем использования доступных устройств, материалов и приборов (в том числе многоканальных микродозаторов или робототехнических инструментов; Brinkmann, Westbury, N.Y.) и может содержать 8, 24, 96, 384, 1536 или 6144 олигонуклеотидов, или любую другую кратную величину от 2 до 1000000, которая подходит для эффективного использования коммерчески доступного применения технических средств.
Для проведения анализа образца с использованием микрочипов, полинуклеотиды экстрагируют из биологического образца. Биологические образцы могут быть получены из любой жидкости организма (крови, мочи, слюны, мокроты, желудочного сока и т.д.), культивированных клеток, биоптатов или других тканевых препаратов. Для получения зондов полинуклеотиды, экстрагированные из образца, используют для получения последовательностей нуклеиновых кислот, которые комплементарны нуклеиновым кислотам на микрочипе. Если микрочип состоит из кДНК, антисмысловые РНК являются подходящими зондами. Следовательно, в одном аспекте, мРНК используют для получения кДНК, которая, в свою очередь и в присутствии флуоресцентных нуклеотидов, используется для получения фрагментов или антисмысловых РНК зондов. Эти флуоресцентно меченные зонды инкубируют с микрочипом, так, чтобы последовательности зонда гибридизировались с кДНК олигонуклеотидами микрочипа. В другом аспекте последовательности нуклеиновых кислот, используемые в качестве зондов, могут содержать полинуклеотиды, фрагменты и комплементарные или антисмысловые последовательности, полученные с использованием ферментов рестрикции, ПЦР способов и наборов олигомечения (Amersham Pharmacia Biotech), хорошо известных в области гибридизационной технологии.
В другом варианте осуществления настоящего изобретения, пептиды или полипептиды по изобретению или их функциональные или иммуногеные фрагменты или олигопептиды, могут быть использованы для скрининга библиотек соединений в любом из целого ряда способов скрининга лекарственных средств. Фрагмент, используемый в таком скрининге, может быть свободным в растворе, фиксирован на твердой подложке, перенесен на клеточную поверхность или расположен внутриклеточно. Можно измерить образование связывающих комплексов, между пептидом или полипептидом и тестируемым веществом.
Одна методика скрининга лекарственных средств, которая может быть использована, предусматривает высокопроизводительный скрининг соединений, имеющих аффинность связывания в отношении пептида или полипептида, представляющего интерес, как описано в опубликованной заявке PCT WO 84/03564. В этом способе большое количество различных небольших тестируемых соединений синтезируют на твердом субстрате, например, пластиковых штифтах, или некоторых других поверхностях. Тестируемые соединения приводят во взаимодействие с пептидом или полипептидом, или его фрагментами, и промывают. Связанный пептид или полипептид затем выявляют способами, хорошо известными в данной области. Очищенный пептид или полипептид также может быть нанесен непосредственно на планшеты для использования в упомянутых выше способах скрининга лекарственных средств. Альтернативно, не нейтрализующие антитела могут быть использованы для захвата пептида и иммобилизации его на твердой подложке.
В другом способе, можно использовать конкурентные анализы для скрининга лекарственных средств, в которых нейтрализующие антитела способные связываться с пептидом или полипептидом, специфически конкурируют с тестируемым соединением за связывание с этим пептидом или полипептидом. Таким образом, антитела могут быть использованы для выявления присутствия тестируемого соединения, которое делит с антителом один или несколько антигенсвязывающих сайтов.
ПРИМЕРЫ
Примеры, описанные в настоящей заявке, предназначены для иллюстрации вариантов осуществления настоящего изобретения. Другие варианты осуществления, способы и типы анализов находятся в пределах компетенции специалистов в области молекулярной диагностики и не нуждаются в подробном описании. Другие варианты осуществления в объеме уровня техники считаются частью этого изобретения.
ПРИМЕР 1: Материалы и методы
Оценка размера генома
Штамм Methanobrevibacter ruminantium M1T (DSM1093) выращивали в среде BY+ (минимальная среда, Joblin et al., 1990), которая состоит из [г/л] NaCl (1), KH2PO4 (0,5), (NH4)2SO4 (0,25), CaCL2.2H2O (0,13), MgSO4.7H2O (0,2), K2HPO4 (1), осветленной рубцовой жидкости (300 мл), dH2O (360 мл), NaHCO3 (5), резазурина (0,2 мл), L-цистеин-HCl (0,5), экстракта дрожжей (2), и раствора следовых элементов Balch (10 мл) (добавленные следовые элементы; Balch et al., 1979), который состоит из (г/л) нитрилтрехуксусной кислоты (1,5), MgSO4.7H2O (3), MnSO4.H2O (0,5), NaCl (1), FeSO4.7H2O (0,1), CoCl2.6H2O (0,1), CaCl2 (0,1), ZnSO4.7H2O (0,1), CuSO4.5H2O (0,01), AlK(SO4)2.12H2O (0,01), H3BO3 (0,01), Na2MoO4.2H2O (0,01), NiSO4.6H2O (0,03), Na2SeO3 (0,02), и Na2Wo4.2H2O (0,02). Геномную ДНК экстрагировали, используя способ измельчения замораживанием. Клетки собирали центрифугированием, и клеточный дебрис помещали в предварительно охлажденную ступку, замораживали жидким азотом, и осторожно растирали в мелкий порошок, используя предварительно охлажденную стерильную ступку и пестик. Гомогенаты клеток погружали в агарозные пробки, и последующие манипуляции проводили в этих пробках для уменьшения физической фрагментации геномной ДНК. Расщепления проводили эндонуклеазами рестрикции, и фрагменты ДНК отделяли, используя гель-электрофорез в градиенте пульсирующего поля (PFGE).
Клонирование и секвенирование ДНК
ДНК генома M. ruminantium была секвенирована Agencourt Biosciences Corporation (Massachusetts, USA) с помощью клонирующего подхода стохастических геномных фрагментов (Fleischmann et al., 1995) и Macrogen Corporation (Rockville, MD, USA) с помощью пиросеквенирования. Библиотеки ДНК M. ruminantium конструировали в Escherichia coli путем случайного физического разрушения геномной ДНК и отделения фрагментов гель-электрофорезом. Крупные фрагменты в дипазоне 40 Kb извлекали из геля и использовали для получения крупной вставочной фосмидной библиотеки. Фрагменты ДНК в диапазоне от 2 до 4 Kb извлекали и использовали для получения небольшой вставочной плазмидной библиотеки. Клоны, полученные как из больших, так и из небольших вставочных библиотек, выращивали, их фосмидную или плазмидную ДНК извлекали и секвенировали, используя технологию высокопроизводительного секвенирования. Соответствующие клоны секвенировали для получения, теоретически, 8 кратного охвата генома M. ruminantium. Пиросеквенирование проводили на произвольно расщепленных фрагментах геномной ДНК с получением конечного теоретического 10 кратного охвата.
Сборка и анализ последовательности
Последовательности ДНК выравнивали для нахождения перекрываний последовательностей и собирали в непрерывные (контиг) последовательности, используя Paracel Genome Assembler (Paracel Inc, CA, USA) и Staden package (Staden et al., 1998) в сочетании с последовательностью, как из стандартных, так и инвертированных ПЦР. Контиги анализировали, используя искатель открытой рамки считывания (ORF) GLIMMER (Gene Locator Interpolated Markov Model ER, Salzberg et al., 1998) и каждую ORF анализировали, с помощью BLAST (Basic Local Alignment Search Tool (Altschul et al., 1997) относительно пополняемых нуклеотидных и белковых баз данных Национального центра биотехнологической информации (NCBI).
Контиги из 8 кратной предварительной последовательности соединяли случайным образом путем искусственного соединения последовательностей для получения «псевдомолекулы», и представляли на рассмотрение в Институт геномных исследований (TIGR, DC, USA) для автоаннотации. Контиги, собранные в результате 10 кратного пиросеквенирования, повторно анализировали с помощью GLIMMER, и ORF автоаннотировали с использованием GAMOLA (Global Annotation of Multiplexed On-site Blasted DNA sequences; Altermann and Klaenhammer, 2003). Автоматизированные аннотации впоследствии проверяли вручную. ORF классифицировали по функции, используя базу данных кластеров ортологичных белков (COG) (порог 1e-02) (Tatusov et al., 2001).
Белковые мотивы определяли с помощью HMMER (hypertext transfer protocol://hmmer.wustl.edu), используя библиотеки PFAM HMM и TIGRFAM, и общее и локальное выравнивание (hypertext transfer protocol://pfam.wustl.edu) и стандартные и фрагментарные модели TIGRFAM HMM (hypertext transfer protocol://www.tigr.org/TIGRFAMs), соответственно (порог 1e-02). тРНК идентифицировали, используя TRNASCAN-SE (Lowe and Eddy, 1997) и нуклеотидные повторы идентифицировали, используя пакет программ KODON (Applied Maths, Austin, TX, USA) и REPUTER (Kurtz and Schleiermacher, 1999). Геномный атлас визуализаций составляли, используя GENEWIZ (Jensen et al., 1999). Путь реконструкций из прогнозируемого M. ruminantium ORFеома проводили в сочетании с KEGG (Kyoto Encyclopedia of Genes and Genomes, Kanehisa et al., 2004) базы данных «on-line», используя программное обеспечение собственной разработки (PathwayVoyager; Altermann and Klaenhammer, 2005).
Идентификация сигнального пептида
К настоящему времени отсутствует модель сигнального пептида для Archaea. Существует просто лишь немного экспериментально верифицированных секреторных белков, доступных для Archaea для формирования специфичной модели. По этой причине, последовательности открытых рамок считывания (ORF) анализировали на наличие сигнальных пептидов, используя SignalP Version 3.0 (Bendtsen et al., 2004), подготовленную в отношении грамположительных, грамотрицательных и эукариотических моделей. SignalP-HMM (скрытая марковская модель) использовали для проведения различия между ORF сигнального пептида и несигнального пептида, тогда как SignalP-NN (нейронные сети) использовали для предварительного определения сайтов расцепления, как описано Emanuelsson et al., 2007.
SignalP прогнозирует присутствие и локализацию сайтов расщепления сигнальных пептидов в аминокислотных последовательностях из различных организмов. Этот способ включает предварительное определение сайтов расщепления и предварительное определение сигнального пептида/несигнального пептида на основе сочетания нескольких искусственных нейрональных сетей и скрытых марковских моделей. Последовательности сигнального пептида, идентифицированные из грамположительных наборов данных, выравнивали и вычисляли консенсусную последовательность, используя программу AlignX Vector NTI (версия 9.1.0, Invitrogen Corporation). Консервативное гидрофобное ядро идентифицировали путем анализа аминокислотной гидрофобности.
Консенсусный набор данных идентифицировали из всех трех моделей SignalP, и соответствующие последовательности сигнальных пептидов выравнивали, используя ClustalW (Larkin et al., 2007), и обрабатывали, используя BioEdit (hypertext transfer protocol://world wide web.mbio.ncsu.edu/BioEdit/bioedit.html). Белковую последовательность logo (ФИГ. 3A) получали, используя LogoBar (Perez-Bercoff et al., 2006) для представления информации, находящейся в этом множественном выравнивании последовательностей. В этом исследовании ORF, содержащие сигнальный пептид и три или более трансмембранных доменов, считались мембранными белками и были исключены из дальнейших анализов. Лучший Y-критерий из каждой из трех моделей принимали за предполагаемый сайт расщепления (ФИГ. 6). Оптимизированную частоту использования кодона (ФИГ. 9) вычисляли, используя собственный perl script: opt_codons.pl (Altermann, E) на основе таблицы кодонов Escherichia coli K12.
Пептидный синтез и флуоресцентное мечение
Коровый консенсусный пептид был синтезирован коммерчески, с использованием Invitrogen's custom peptide service (Invitrogen NZ Ltd). Этот пептид синтезировали с помощью Fmoc химии в небольшом масштабе (10-12 мг) и очищали с помощью HPLC до чистоты >95%. Этот пептид метили флуоресцином на N-концевом лизине (K).
Исследование клеточной проницаемости
Вхождение меченного пептида в клетки M. ruminantium сопровождалось флуоресцентным анализом. Культуру M. ruminantium выращивали в 10 мл среды BY+ и собирали центрифугированием при 10000×g в течение 10 мин при 4°C. Клетки переносили в 1,5 мл полипропиленовые пробирки Eppendorf и промывали в 1 мл TE буфера (10 мМ Tris-HCl, 1 мМ этилендиаминтетрауксусной кислоты, pH 8) и собирали центрифугированием в микроцентрифуге при 13000×g в течение 10 мин при 4°C. Клетки (приблизительно 1×108) ресуспендировали в общем объеме 200 мкл TE буфера и добавляли 20 мкг флуоресцентно меченного пептида. Эту смесь инкубировали в течение 30 минут при 37°C, а затем центрифугировали при 13000×g в течение 10 мин при 4°C. Жидкость над клеточным дебрисом оставляли, и составляли фракцию супернатанта. Клеточный дебрис промывали 3 раза 200 мкл TE буфера, путем повторного ресуспендирования клеток в буфере, и центрифугировали при 13000×g в течение 10 мин при 4°C.
Промывочные растворы собирали и составляли клеточную промывочную фракцию. Клеточный дебрис, оставшийся после третьей промывки, ресуспендировали в 200 мкл TE буфера, содержащего 1% додецилсульфата натрия. Клетки центрифугировали при 13000×g в течение 10 мин при 4°C для осаждения клеток, и жидкость над клетками собирали и составляли клеточно-ассоциированную фракцию. Оставшийся клеточный дебрис замораживали в жидком N2, и клетки физически разрушали, путем измельчения замороженного дебриса стеклянной палочкой. Полученный в результате клеточный гомогенат центрифугировали при 20000×g в течение 30 мин при 4°C. Жидкость над дебрисом собирали и представляли внутриклеточную фракцию, тогда как оставшееся осажденное вещество ресуспендировали в TE буфере и представляли фракцию клеточной стенки/мембраны. Флуоресценцию в каждой из этих фракций измеряли, герметическим закрытием образца каждой фракции в стеклянном капилляре, и измеряли излучаемую флуоресценцию при 510-533 нм относительно флуоресцентно меченных пептидных стандартов, используя флуоресцентный датчик (Канал 1) Lightcycler (Roche).
ПРИМЕР 2: результаты экспериментов
Оценка размера генома M. ruminantium путем расщепления ферментами рестрикции геномной ДНК, и определение размеров фрагментов посредством PFGE, показала одну хромосому приблизительно 2,5-2,9 Mb. Начальное секвенирование больших и маленьких вставочных клонов (6-кратных) и сборка последовательности в контиги, показало, что область генома 40 Kb была высоко представлена (>20 раз), особенно в пределах небольшой вставочной библиотеки. Из-за этого большого искажения последовательности, проводили дополнительное секвенирование (2-кратный теоретический охват генома) только для больших вставочных клонов с получением на выходе конечного 8-кратного охвата в результате секвенирования по Сенгеру. 8-кратную фазовую последовательность собирали в 756 контигов, которые соединялись посредством 105 каркасов. Дальнейшее пиросеквенирование проводили до дополнтительного ~10-кратного охвата и включения этих последовательностей в сборку, приводящую в результате к количеству контигов, снижающемуся до 27. Последующее закрытие разрывов, с использованием технологий инвертированной ПЦР и ПЦР длинных фрагментов, снижало количество контигов до 14.
Объединенная длина 14-контиг последовательности указывает на то, что геном немного больше (2937347 пар нуклеотидов), чем размер по оценкам PFGE (ФИГ. 1A) и значительно больше, чем у его ближайшего родственника, M. smithii (1,9 Mb). %G+C 32,64% близок к указанному диапазону от 27,5% до 31,6%, описанному для штаммов M. ruminantium (Balch et al, 1979). Анализ последовательности предполагает 2239 ORF и общее число попаданий в семейства белков (TIGRFam и PFam) и кластеры ортологичных групп (Clusters of Orthologous Groups (COG)) представлены на ФИГ. 1B. Представлены все гены, предположительно вовлеченные в образование метана из H2+CO2 и формиата (ФИГ. 1C). Однако черновая последовательность M. ruminantium лишена системы метилкоэнзим редуктазы II (mcr II или mrt). У других метанопродуцентов, кластер mcrII кодирует изофермент метил CoM редуктазу I, фермент, который активируется во время роста при высоких парциальных давлениях H2 (Reeve et al., 1997). H2 быстро используется в рубце и не накапливается до высоких уровней, поэтому, по-видимому, M. ruminantium адаптирована использовать низкие уровни H2 только через систему mcr I.
Всего 169 сигнальных пептидов, содержащих ORF, было идентифицировано в геноме M. ruminantium. (ФИГ. 7). Из них 102 сигнальных пептида было идентифицировано с помощью всех трех моделей SignalP, и аминокислотные последовательности этих сигнальных пептидов выравнивали (ФИГ. 2) и получали белковую последовательность logo (ФИГ. 3A). Была идентифицирована коровая последовательность 17 гидрофобных аминокислот (KKIIIILLLLILLLISI; SEQ ID NO:119). SignalP-HMM рассчитывает вероятность содержания в этой последовательности сигнального пептида. Вероятность этого сигнального пептида составляет величину от 0 до 1, с установленной величиной отсечки 0,5 для проведения различия между сигнальным пептидом и несигнальным пептидом для этого анализа. SignalP-NN Y-критерий дает наилучшую оценку места расщепления SP (ФИГ. 6). Y-критерий определяется как среднее геометрическое C-критерия (raw cleavage site score) и выровненного наклона S-критерия (критерий сигнального пептида), полученных с помощью SignalP-NN. Y-критерий представляет собой величину от 0 до 1 с более высокими показателями, указывающими на правильное прогнозирование сайта расщепления.
Консенсусную аминокислотную последовательность (ФИГ. 3C) синтезировали и конъюгировали с флуоресцентной меткой флуоресцеином через дополнительный N-концевой остаток лизина (ФИГ. 3D), получая конечную длину пептида 17 аминокислот. Очищенный FITC-пептид тестировали на проницаемость в клетки M. ruminantium (ФИГ. 4). В анализе клеточной проницаемости M. ruminantium 23,5% пептида, осталось в супернатанте неприсоединенным к клеткам через 30 минут при 37°C. Еще 3,4% пептида могло быть удалено из клеток 3 промываниями буфером. Приблизительно 62,9% пептида было восстановлено после 1% SDS экстракции клеток, указывая на то, что большая часть пептида была ассоциирована с клетками. Из оставшегося пептида, 5,8% было обнаружено во внутриклеточной фракции и 4,4% было связано с фракцией клеточной стенки/мембраны. Следовательно, 5,8% исходного пептида (эквивалент 1,16 мкг) было способно связываться с M. ruminantium и пройти через клеточную мембрану, чтобы войти в цитоплазму клетки, что представляет приблизительно 2,3×106 пептидных молекул на клетку.
ПРИМЕР 3: Обзор
Methanobrevibacter ruminantium выбрали для секвенирования генома, вследствие доминирования в рубце при различных условиях питания (исходя из данных культивирования и молекулярного определения), доступности культур, удобства для рутинного выращивания в условиях лаборатории, и сравнительно большого количества предварительных исследований и первоисточников, доступных по этому организму. Значительному числу последовательностей у M. ruminantium была присвоена функция, и таким образом, была возможность получить подробную картину образа жизни этого микроорганизма в рубце. Зависимость M. ruminantium от простых субстратов (H2+CO2, формиат) и его взаимодействие с окружением рубца через поверхностные белки и экзополисахариды являются мишенями для ингибирования. Данные по этим последовательностям поясняют метаболизм этого организма и его взаимодействие с другими микроорганизмами, и указывают на консервативные системы и компоненты среди метанопродуцентов, которые могут быть инактивированы для предотвращения или уменьшения образования метана в рубце.
Ссылки
Altermann E, Klaenhammer TR (2005) PathwayVoyager: pathway mapping using the Kyoto Encyclopedia of Genes and Genomes (KEGG) database. BMC Genomics 6:60-66.
Altermann, E., and T. R. Klaenhammer. 2003. GAMOLA: a new local solution for sequence annotation and analyzing draft and finished prokaryotic genomes. Omics 7:161-169.
Altschul SF, Madden TL, Schaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ (1997) Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Research 25, 3389-3402.
Balch WE, Fox GE, Magrum LJ, Woese CR, Wolfe RS (1979) Methanogens: reevaluation of a unique biological group. Microbiological Reviews 43, 260-296.
Baresi, L. and Bertani, G. 1984. Isolation of a bacteriophage for a methanogenic bacterium. In Abstracts of the Annual Meeting of the American Society for Microbiology. Washington DC: American Society for Microbiology, p. 133.
Bendtsen, J.D., Nielsen, H., von Heijne, G. and Brunak, S. 2004. Improved prediction of signal peptides: SignalP 3.0. J Mol Biol. 16(4):783-95.
Bickle, T. A. and D. H. Kruger. 1993. Biology of DNA restriction. Microbiol. Rev. 57:434-450.
Bult CJ, et al. (1996) Complete genome sequence of the methanogenic archaeon, Methanococcus jannaschii. Science 273, 1058-1073.
Coutinho PM, Henrissat B (1999) Carbohydrate-active enzymes: an integrated database approach. In 'Recent Advances in Carbohydrate Bioengineering' (Eds HJ Gilbert, G Davies, B Henrissat and B Svensson) pp. 3-12 (The Royal Society of Chemistry, Cambridge) (Carbohydrate Active Enzymes database, http://www.cazy.org/).
Delcher AL, Harmon D, Kasif S, White O, Salzberg SL (1999) Improved microbial gene identification with GLIMMER. Nucleic Acids Research 27, 4636-4641.
Emanuelsson, O., Brunak, S., von Heijne, G. and Nielsen, H. 2007. Locating proteins in the cell using TargetP, SignalP and related tools. Nat Protoc. 2(4):953-71.
Fleischmann et al., 1995. Whole-genome random sequencing and assembly of Haemophilus influenzae Rd Science 269:496-512.
Fricke WF, Seedorf H, Henne A, Kruer M, Liesegang H, Hedderich R, Gottschalk G, Thauer RK (2006) The genome sequence of Methanosphaera stadtmanae reveals why this human intestinal archaeon is restricted to methanol and H2 for methane formation and ATP synthesis. Journal of Bacteriology 188, 642-658.
Galagan et al. 2002. The genome of Methanosarcina acetivorans reveals extensive metabolic and physiological diversity. Genome Res. 12:532-542.
Godde JS, Bickerton A (2006) The repetitive DNAe called CRISPRs and their associated genes: evidence of horizontal transfer among prokaryotes. Journal of Molecular Evolution 62, 718-729.
Haft DH, Selengut J, Mongodin EF, Nelson KE (2005) A guild of 45 CRISPR-associated (Cas) protein families and multiple CRISPR/Cas subtypes exist in prokaryotic genomes. PLoS Computational Biology 1:474-483.
Hamilton, P. T. and J. N. Reeve. 1985. Sequence divergence of an archaebacterial gene cloned from a mesophilic and a thermophilic methanogen. J. Mol. Evol. 22:351-360.
Jansen R, Embden JD, Gaastra W, Schouls LM (2002) Identification of genes that are associated with DNA repeats in prokaryotes. Molecular Microbiology 43, 1565-1575.
Jansen R, van Embden JD, Gaastra W, Schouls LM (2002) Identification of a novel family of sequence repeats among prokaryotes. OMICS: A journal of integrative biology 6, 23-33.
Jensen, L. J., Friis, C. and Ussery, D. W. 1999 Three views of microbial genomes. Res. Microbiol. 150, 773-777.
Joblin KN, Naylor GE, Williams AG (1990) Effect of Methanobrevibacter smithii on xylanolytic activity of anaerobic ruminal fungi. Applied and Environmental Microbiology 56, 2287-2295.
Kanehisa M, Goto S, Kawashima S, Okuno Y, Hattori M (2004) The KEGG resource for deciphering the genome. Nucleic Acids Research 32, D277-D280.
Kiener, A., Konig, H., Winter, J. and Leisinger, T. 1987. Purification and use of Methanobacterium wolfei pseudomurein endopeptidase for lysis of Methanobacterium thermoautotrophicum . J. Bacteriol. 169, 1010-1016.
Knox, M. R. and Harris, J. E. 1986. Isolation and characterisation of a bacteriophage of Methanobrevibacter smithii. In Abstracts of the XIV International Congress on Microbiology. Manchester: International Union of Microbiological Societies.
Kurtz S, Schleiermacher C (1999) REPuter: fast computation of maximal repeats in complete genomes. Bioinformatics 15, 426-427.
Larkin, M.A., Blackshields, G., Brown, N.P., Chenna, R., McGettigan, P.A., McWilliam, H., Valentin, F., Wallace, I.M., Wilm, A., Lopez, R., Thompson, J.D., Gibson, T.J. and Higgins, D.G. Clustal W and Clustal X version 2.0. Bioinformatics 23(21):2947-8.
Lowe TM, Eddy SR (1997) tRNAscan-SE: a program for improved detection of transfer RNA genes in genomic sequence. Nucleic Acids Research 25, 955-964.
Loenen, W. and N. Murray. 1986. Modification enhancement by restriction alleviation protein (Ra1) of bacteriophage lambda. J. Mol. Biol. 190:11-22.
Lucchini, S., F. Desiere, and H. Brussow. 1999. Comparative genomics of Streptococcus thermophilus phage species supports a modular evolution theory. J. Virol. 73:8647-8656.
Luo, Y. N., Pfister, P., Leisinger, T. and Wasserfallen, A. 2002. Pseudomurein endoisopeptidases PeiW and PeiP, two moderately related members of a novel family of proteases produced in Methanothermobacter strains. FEMS Microbiol. Lett. 208, 47-51.
Makarova, K. S., Aravind, L. and Koonin, E. V. 1999. A superfamily of archaeal, bacterial, and eukaryotic proteins homologous to animal transglutaminases. Protein Sci. 8, 1714-1719.
Makarova KS, Grishin NVShabalina, SA, Wolf YI, Koonin EV (2006) A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biology Direct 1:7-32.
New Zealand Statistics 2005 (www.stats.govt.nz)
New Zealand's Greenhouse Gas Inventory 1990 - 2004. The National Inventory Report and Common Reporting Format. (2006) Ministry for the Environment. hypertext transfer protocol://www.mfe.govt.nz/publications/climate/nir-apr06/nir-apr06.pdf.
Nielsen, H. Engelbrecht, J. Brunak S. and von Heijne, G. 1997 Identification of prokaryotic and eukaryotic signal peptides and prediction of their cleavage sites. Prot. Eng., 10:1-6.
Ono, M., Wada, Y., Wu, Y., Nemori, R., Jinbo, Y., Wang, H., Lo, K. M., Yamaguchi, N., Brunkhorst, B., Otomo, H. et al. (1997) FP-21399 blocks HIV envelope protein mediated membrane fusion and concentrates in lymph nodes. Nat. Biotechnol. 15, 343-348.
Pérez-Bercoff, A., Koch, J. and Bürglin, T.R. 2006. LogoBar: bar graph visualization of protein logos with gaps. Bioinformatics 22(1):112-4.
Rawlings, N. D., Morton, F. R. and Barrett, A. J. 2006. MEROPS: the peptidase database. Nucleic Acids Res. 34, D270-D272.
Reeve JN, Nolling J Morgan RM, Smith DR (1997) Methanogenesis: genes, genomes and who's on first? Journal of Bacteriology 179, 5975-5986.
Samuel BS, Hansen EE, Manchester JK, Coutinho PM, Henrissat B, Fulton R, Latreille P, Kim K, Wilson RK, Gordon JI (2007) Genomic adaptations of Methanobrevibacter smithii to the human gut. Proceedings of the National Academy of Sciences USA 104, 10643-10648.
Salzberg et al., 1998. Microbial gene identification using interpolated Markov models. Nucleic Acids Res. 26:544-8.
Smith et al., 1997. Complete genome sequence of Methanobacterium thermoautotrophicum deltaH: functional analysis and comparative genomics J. Bacteriol. 179:7135-7155.
Smith PH, Hungate RE (1958) Isolation and characterization of Methanobacterium ruminantium n. sp. Journal of Bacteriology 75, 713-718.
Staden R, Beal KF, Bonfield JK (1998) The Staden Package. Methods in Molecular Biology: Bioinformatics Methods and Protocols 132, 115-130.
Tatusov RL, Natale DA, Garkavtsev IV, Tatusova TA, Shankavaram UT, Rao BS, Kiryutin B, Galperin MY, Fedorova ND, Koonin EV (2001) The COG database: new developments in phylogenetic classification of proteins from complete genomes Nucleic Acids Research 29, 22-28.
von Heijne, G. 1985. Signal sequences: The limits of variation J. Mol. Biol. 184, 99-105.
Все публикации и патенты, упомянутые в представленном выше описании, включены в качестве ссылки.
Там, где ссылка представленного выше описания дана к целым числам, имеющим известные эквиваленты, эти эквиваленты включены как отдельно указанные.
Хотя настоящее изобретение было описано применительно к особенно предпочтительным вариантам осуществления, должно быть понятно, что настоящее изобретение, как заявлено, не должно ненадлежащим образом ограничиваться такими особыми вариантами осуществления.
Понятно, что дополнительные модификации могут быть проведены в отношении настоящего изобретения, как описано в настоящей заявке, без отклонения от сущности и объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНЫ И КОМПОНЕНТЫ ВАКЦИН ДЛЯ ПОДАВЛЕНИЯ МИКРОБНЫХ КЛЕТОК | 2008 |
|
RU2528854C2 |
| ПОЛИНУКЛЕОТИДЫ И ПОЛИПЕПТИДЫ ФАГА φ-mru, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2520738C2 |
| ЭКСПРЕССИЯ НОВЫХ КЛЕТОЧНЫХ МЕТОК | 2018 |
|
RU2796334C2 |
| СИГНАЛЬНЫЕ ПЕПТИДЫ ТАТ ДЛЯ ПРОДУКЦИИ БЕЛКОВ В ПРОКАРИОТАХ | 2008 |
|
RU2487937C2 |
| НОВЫЕ ГЕНЫ, КОДИРУЮЩИЕ НОВЫЕ ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ | 2002 |
|
RU2423525C2 |
| МНОГОЦЕПОЧЕЧНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР И ЕГО ПРИМЕНЕНИЯ | 2013 |
|
RU2663725C2 |
| ИММУНОГЕНЫ ДЛЯ ВАКЦИНАЦИИ ПРОТИВ ВИЧ | 2013 |
|
RU2648791C2 |
| ПОЛИНУКЛЕОТИД, МОДУЛИРУЮЩИЙ ПРОЛИФЕРАЦИЮ РАКОВЫХ КЛЕТОК (ВАРИАНТЫ), ПОЛИПЕПТИД, МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА-ХОЗЯИН, ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНОГО ЗАБОЛЕВАНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРИМЕНЕНИЕ ПОЛИПЕПТИДА ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2002 |
|
RU2307666C2 |
| НОВЫЕ ГЕНЫ, КОДИРУЮЩИЕ НОВЫЕ ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ | 2002 |
|
RU2296160C2 |
| БЕЛКИ ШЕЛКА | 2006 |
|
RU2467015C2 |
















































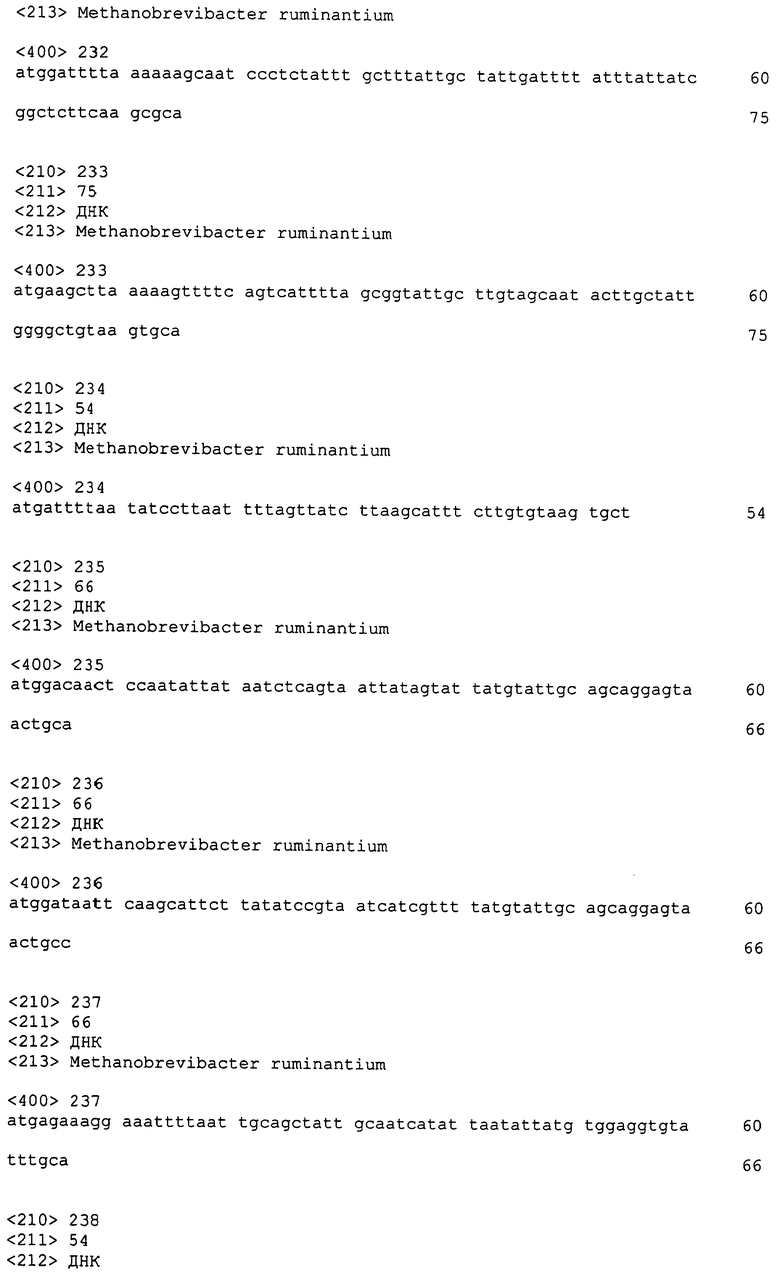
























































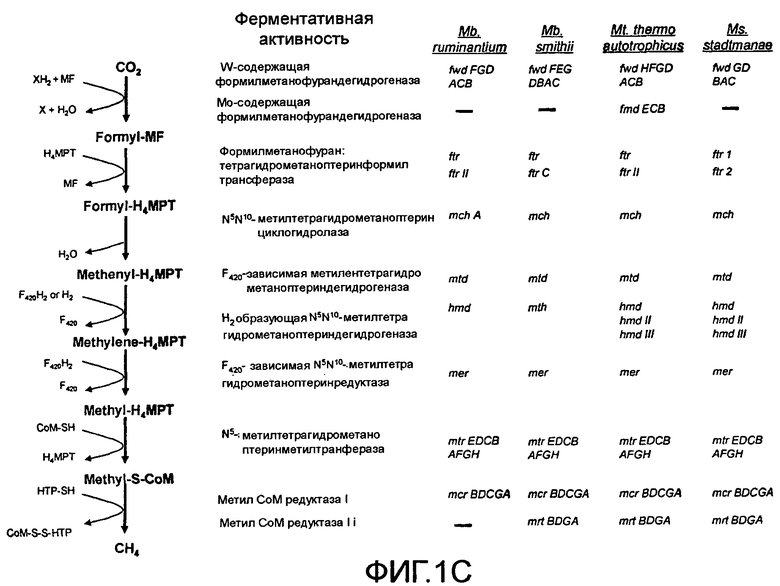



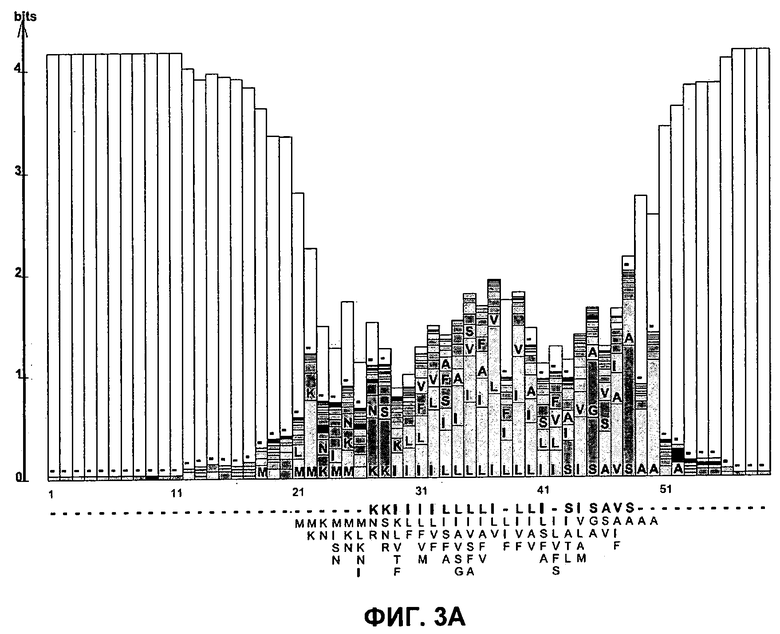


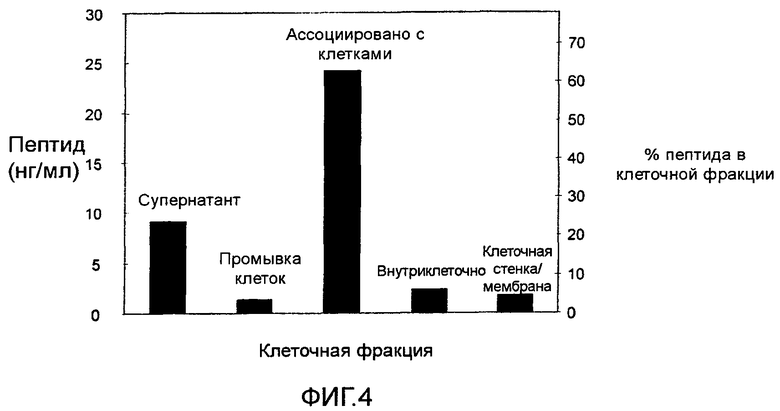
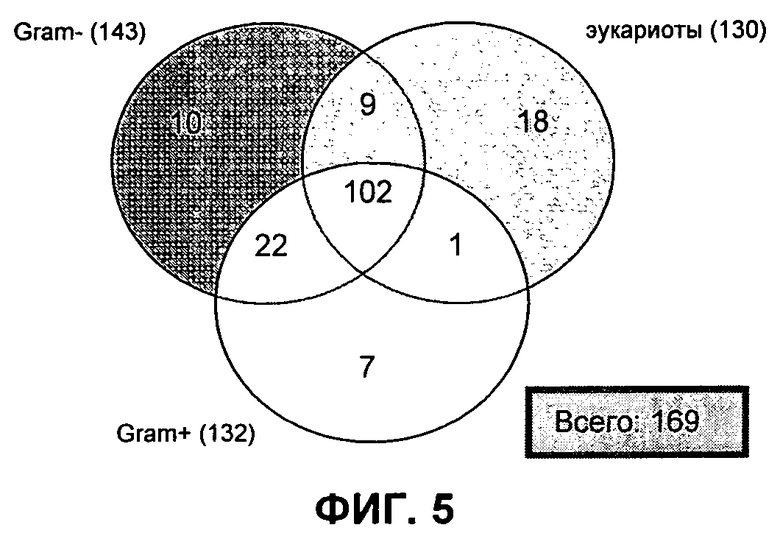
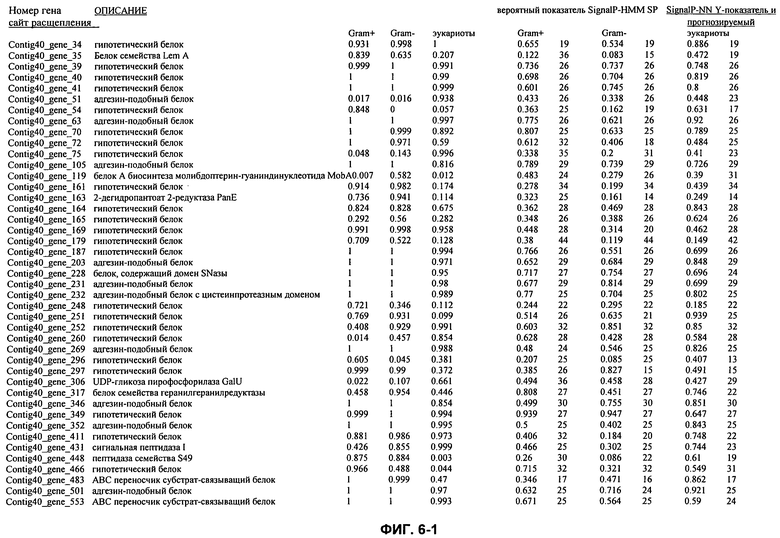
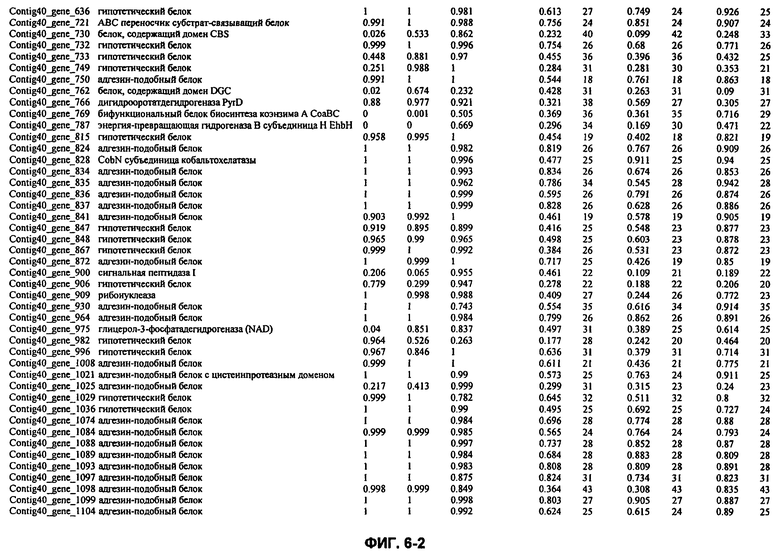

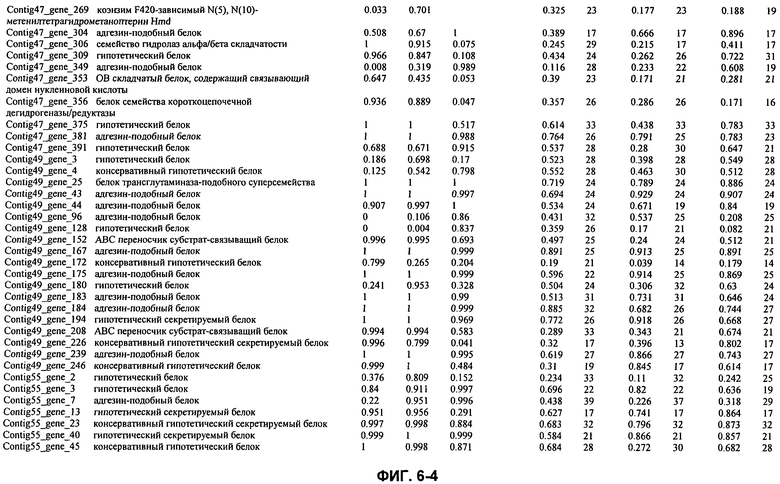









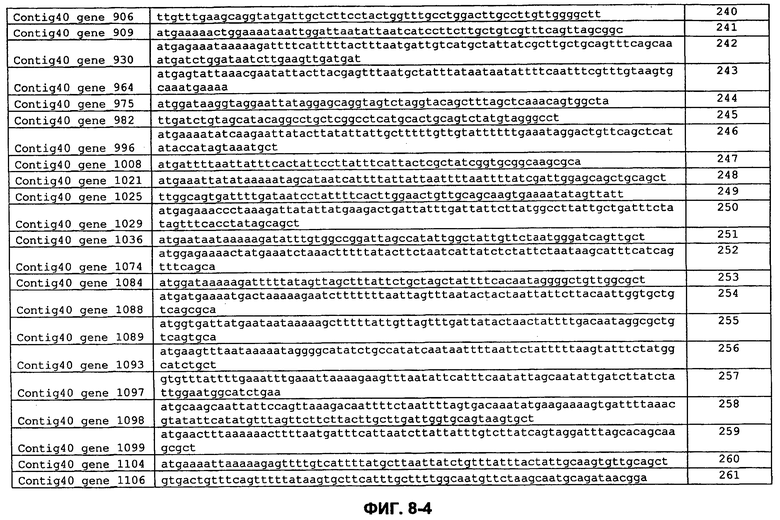
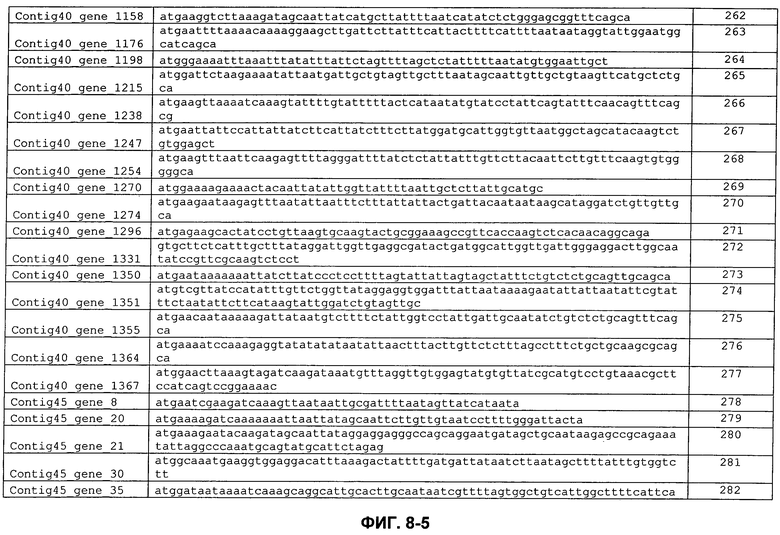


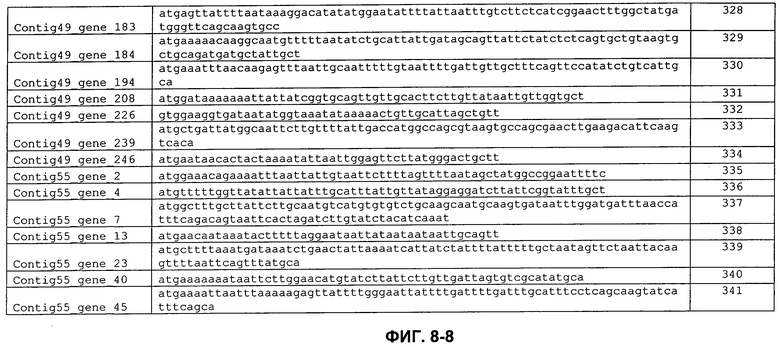
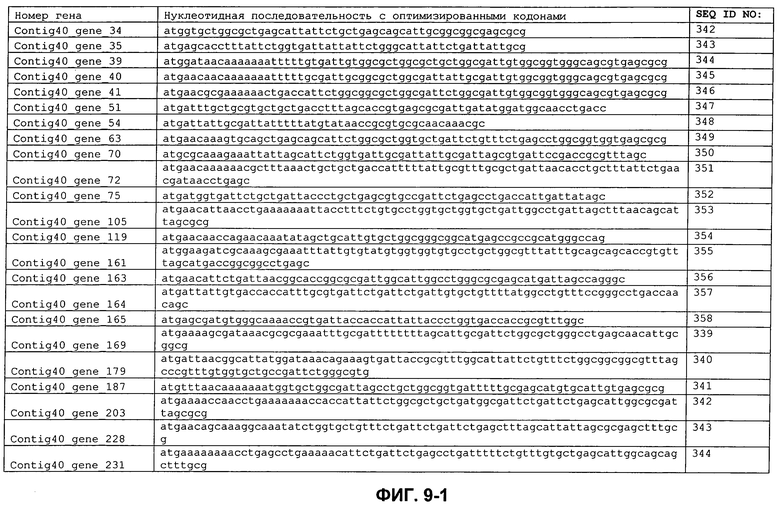
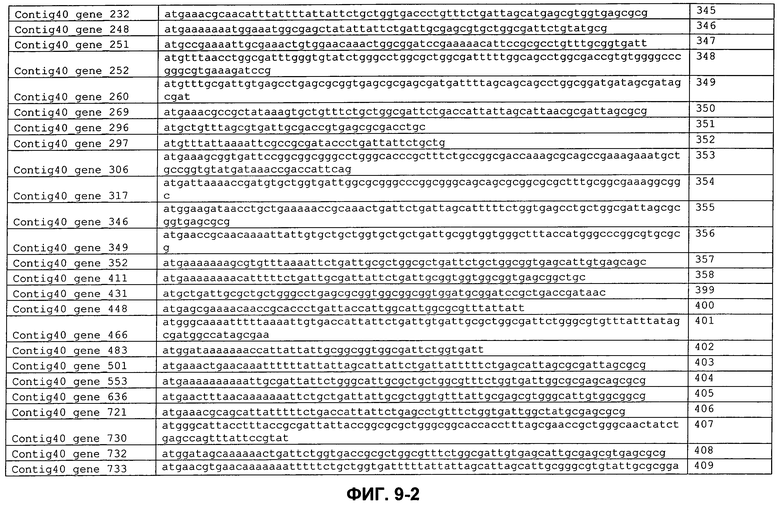

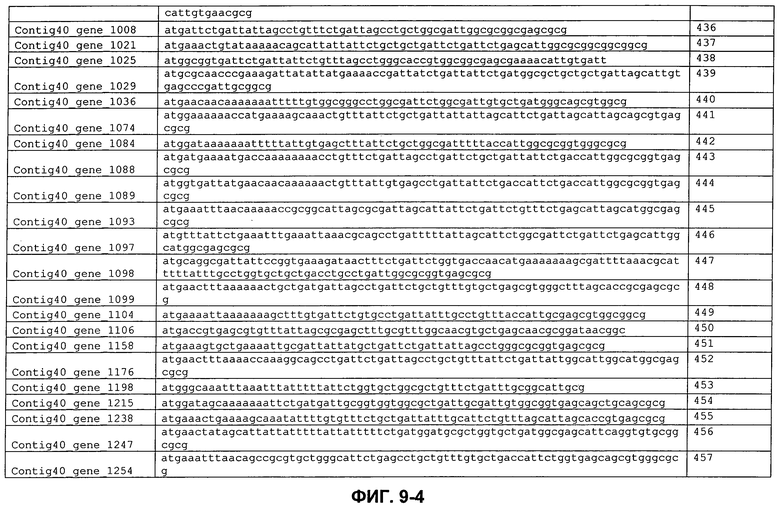



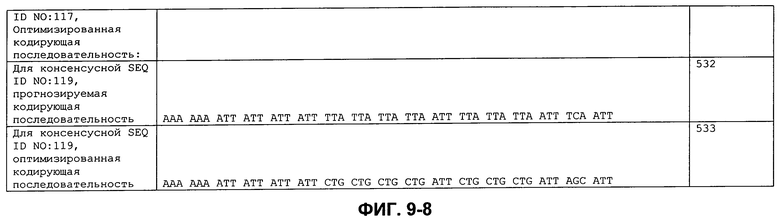
Изобретение относится к области генной инженерии и может быть использовано для регулирования проницаемости метан-продуцирующей клетки. Получают полипептид, который способен проникать в метан-продуцирующую клетку и повышать ее проницаемость, характеризующийся аминокислотной последовательностью SEQ ID NO:117, 118 или 119 или по меньшей мере 90% идентичностью к указанной последовательности или по меньшей мере 15 последовательно расположенными аминокислотами указанной последовательности. Также получают полинуклеотид, кодирующий указанный полипептид, клонирующий и экспрессирующий векторы, которые используют для получения клеток-хозяев, продуцирующих полипептид или предназначенных для репликации вектора. Полипептид может содержать флуоресцентную метку на N-концевом аминокислотном остатке. Изобретение позволяет повысить проницаемость метанпродуцирующей клетки. 14 н. и 4 з.п. ф-лы, 35 ил., 3 пр.
1. Выделенный полипептид или пептид, который способен проникать в метан-продуцирующую клетку, характеризующийся аминокислотной последовательностью SEQ ID NO:117, 118 или 119.
2. Выделенный полипептид или пептид, который способен проникать в метан-продуцирующую клетку, характеризующийся:
a) аминокислотной последовательностью, которая по меньшей мере на 90% идентична SEQ ID NO:117;
b) аминокислотной последовательностью, которая по меньшей мере на 95% идентична SEQ ID NO:118; или
c) аминокислотной последовательностью, которая по меньшей мере на 90% идентична SEQ ID NO:119.
3. Выделенный полипептид или пептид, который способен проникать в метан-продуцирующую клетку, характеризующийся:
a) по меньшей мере 15 последовательно расположенными аминокислотами последовательности SEQ ID NO:117 или 118; или
b) по меньшей мере 15 последовательно расположенными аминокислотами последовательности SEQ ID NO:119.
4. Выделенный полинуклеотид, который кодирует полипептид или пептид, который способен проникать в метанпродуцирующую клетку, характеризующийся:
a) нуклеотидной последовательностью, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:117, 118 или 119; или
b) нуклеотидной последовательностью, комплементарной последовательности (a).
5. Выделенный полинуклеотид, который кодирует полипептид или пептид, который способен проникать в метанпродуцирующую клетку, характеризующийся:
a) нуклеотидной последовательностью, которая кодирует аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO:117;
b) нуклеотидной последовательностью, которая кодирует аминокислотную последовательность, которая по меньшей мере на 95% идентична последовательности SEQ ID NO:118;
c) нуклеотидной последовательностью, которая кодирует аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO:119; или
d) нуклеотидной последовательностью, комплементарной последовательности по любому из (a)-(c).
6. Выделенный полинуклеотид, который кодирует полипептид или пептид, который способен проникать в метанпродуцирующую клетку, характеризующийся:
a) нуклеотидной последовательностью, которая кодирует 15 последовательно расположенных аминокислот последовательности SEQ ID NO:117 или 118;
b) нуклеотидной последовательностью, которая кодирует по меньшей мере 15 последовательно расположенных аминокислот последовательности SEQ ID NO:119; или
c) нуклеотидной последовательностью, комплементарной последовательности по любому из (a) или (b).
7. Выделенный полинуклеотид, который кодирует полипептид или пептид, который способен проникать в метанпродуцирующую клетку, характеризующийся нуклеотидной последовательностью SEQ ID NO:511, 512 или 513 или нуклеотидной последовательностью, комплементарной им.
8. Клонирующий вектор, который содержит полинуклеотид по любому из пп.4-7, или полинуклеотид, который кодирует полипептид или пептид по любому из пп.1-3.
9. Вектор экспрессии, который содержит полинуклеотид по любому из пп.4-7, или полинуклеотид, который кодирует полипептид или пептид по любому из пп.1-3.
10. Клетка-хозяин, трансформированная вектором по п.8 или 9, для продукции полипептида или пептида по любому из пп.1-3, или полинуклеотида по любому из пп.4-7.
11. Клетка-хозяин для репликации вектора по п.8 или п.9, трансформированная вектором по п.8 или 9.
12. Клетка-хозяин по п.10 или 11, которая выбрана из прокариотической клетки или клетки метанопродуцента.
13. Клетка-хозяин по п.12, которая выбрана из Escherichia coli и Methanobrevibacter ruminantium, включая Methanobrevibacter ruminantium штамм M1T (DSM1093).
14. Конъюгированная молекула или слитая молекула, которая способна проникать в метанпродуцирующую клетку и которая содержит полипептид или пептид по любому из пп.1-3 и флуоресцентную метку на N-концевом аминокислотном остатке.
15. Способ повышения проницаемости метанпродуцирующей клетки, который включает: приведение этой клетки в контакт с полипептидом или пептидом по любому из пп.1-3.
16. Способ повышения проницаемости метанпродуцирующей клетки, включающий: приведение этой клетки в контакт с конъюгированной молекулой или слитой молекулой по п.14.
17. Способ по п.16, в котором клетка представляет собой Methanobrevibacter ruminantium.
18. Способ по п.17, в котором клетка представляет собой Methanobrevibacter ruminantium штамм M1T (DSM1093).
| DATABASE GENBANK N ZP_01872031, размещено 19.06.2007, найдено он-лайн [15.11.2012] в БД "NCBI" | |||
| US 6617156 A, 09.09.2003 | |||
| КОМБИНИРОВАННАЯ СЕЯЛКА ПО ПНЯМ | 1990 |
|
RU2077183C1 |
| WO 9600308 A2, 04.01.1996 | |||
| SAMUEL B.S | |||
| ET AL., Genomic and metabolic adaptations of Methanobrevibacter smithii to the human gut, PNAS, 2007, v.104, n.25, p | |||
| Паровой котел | 1928 |
|
SU10643A1 |
| АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 2000 |
|
RU2269525C2 |
Авторы
Даты
2014-08-20—Публикация
2008-09-25—Подача