По настоящей заявке испрашивается приоритет по предварительной заявке США 60/936,183, поданной 18 июня 2007 года, и предварительной заявке США 60/936,186, поданной 18 июня 2007 года.
ГОСУДАРСТВЕННАЯ ПОДДЕРЖКА
Часть данной работы финансировалась контрактом № BAA ECBC-04 с центром Edgewood Chemical Biological Center (ECBC) армии США. Соответственно, правительство Соединенных Штатов может иметь некоторые права на данное изобретение.
ОБЛАСТЬ ТЕХНИКИ
Изобретение касается полинуклеотидов, кодирующих слитые с ТАТ белки, и способов продукции представляющих интерес белков в микроорганизмах. В частности, настоящее изобретение относится к полинуклеотидам, векторам, полипептидам и способам экспрессии ферментов, разрушающих фосфорорганические соединения, например, органофосфатгидролазы (ОРН), в клетке-хозяине, такой как клетка-хозяин рода Streptomyces.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
У прокариот известны два механизма переноса белков через цитоплазматическую мембрану. У большинства бактерий наиболее хорошо описанным путем белкового экспорта является общий секреторный путь (Sec). Перенос через мембрану белков, экспортируемых по Sec-пути, осуществляется в развернутом состоянии через погруженный в мембрану транслокон, к которому они направляются с помощью отщепляемых N-концевых сигнальных пептидов.
Вторым основным путем экспорта является диаргининовый механизм переноса (Tat). В отличие от Sec-системы Tat-система участвует в транспорте свернутых белков. Белки направляются по Tat-пути при наличии N-концевых сигнальных пептидов, включающих консервативный диаргининовый мотив в N-концевой области Tat-сигнального пептида.
Благодаря способности к секреции свернутых белковых субстратов, Tat-перенос представляет важный механизм получения секретируемых белков, и его можно применять для крупномасштабной продукции белков, используемых для нейтрализации фосфорорганических соединений, которые применяются во многих сельскохозяйственных пестицидах и в качестве боевых отравляющих веществ, таких как зарин, зоман и VX [О-этил-S-(2-диизопропиламиноэтил)метилфосфонотиоат].
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Идея настоящего изобретения основана, по меньшей мере, частично, на обнаружении того, что продукцию некоторых белков можно осуществлять в бактериальных клетках-хозяевах с использованием Tat-механизма. Соответственно, настоящее изобретение касается полинуклеотидов, кодирующих ТАТ-слитые белки, и способов продукции представляющих интерес белков в клетке-хозяине. В частности, настоящее изобретение относится к полинуклеотидам, векторам, полипептидам и способам экспрессии ферментов, разрушающих фосфорорганические соединения, например, органофосфатгидролазы (ОРН), в клетке-хозяине, такой как клетка-хозяин рода Streptomyces.
В одном варианте осуществления изобретение относится к выделенному полинуклеотиду, включающему первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8. В другом варианте осуществления изобретения выделенный полинуклеотид по изобретению включает первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ с аминокислотной последовательностью, выбранный из SEQ ID NO:1-5, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8. В другом варианте осуществления изобретения выделенный полинуклеотид по изобретению включает первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей органофосфатгидролазу (ОРН). В другом варианте осуществления изобретения органофосфатгидролаза представляет собой ОРН с последовательностью SEQ ID NO:18 или ее вариант. В другом варианте осуществления изобретения выделенный полинуклеотид по изобретению включает первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8, в котором кодоны второй нуклеиновой кислоты выделенного полинуклеотида оптимизированы для экспрессии гидролазы триэфира фосфорной кислоты в клетке-хозяине видов рода Streptomyces. В еще одном варианте осуществления изобретение касается выделенного полинуклеотида по изобретению, содержащего первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как ЕС 3.1.8, в котором выделенный полинуклеотид дополнительно функционально связан с промотором А4 с последовательностью SEQ ID NO:23.
В другом варианте осуществления изобретение относится к экспрессионному вектору, включающему выделенный полинуклеотид, содержащий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8. В некоторых вариантах осуществления изобретения экспрессионный вектор включает первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ с любой из последовательностей SEQ ID NOS:1-5, и вторую последовательность нуклеиновой кислоты, кодирующую гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8. В некоторых вариантах осуществления изобретения экспрессионный вектор включает выделенный полинуклеотид, содержащий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей органофосфатгидролазу. В некоторых вариантах осуществления изобретения органофосфатгидролаза представляет собой ОРН с последовательностью SEQ ID NO:18 или ее вариант. В некоторых вариантах осуществления изобретения выделенный полинуклеотид, включающий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, которая функционально связана со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, дополнительно функционально связан с промотором А4 с последовательностью SEQ ID NO:23. В других вариантах осуществления кодоны нуклеотидной последовательности, кодирующей гидролазу триэфира фосфорной кислоты, оптимизированы для экспрессии в клетке-хозяине видов рода Streptomyces. В некоторых вариантах осуществления изобретения клетка-хозяин рода Streptomyces представляет собой клетку-хозяина Streptomyces lividans.
В другом варианте осуществления изобретение касается выделенной клетки-хозяина, которая содержит экспрессионный вектор, включающий выделенный полинуклеотид, содержащий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8. В некоторых вариантах осуществления изобретения клетка-хозяин содержит экспрессионный вектор, который включает первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ с любой из последовательностей SEQ ID NOS:1-5, и вторую последовательность нуклеиновой кислоты, кодирующую гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8. В другом варианте осуществления изобретения клетка-хозяин содержит экспрессионный вектор, включающий выделенный полинуклеотид, содержащий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей органофосфатгидролазу. В некоторых вариантах осуществления изобретения органофосфатгидролаза представляет собой ОРН с последовательностью SEQ ID NO:18 или ее вариант. В другом варианте осуществления изобретения экспрессионный вектор, содержащийся в клетке-хозяине, включает выделенный полинуклеотид, содержащий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, которая функционально связана со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, дополнительно функционально связан с промотором А4 с последовательностью SEQ ID NO:23. В других вариантах осуществления кодоны нуклеотидной последовательности, кодирующей гидролазу триэфира фосфорной кислоты, оптимизированы для экспрессии в клетке-хозяине рода Streptomyces. В некоторых вариантах осуществления изобретения клетка-хозяин по изобретению представляет собой клетку-хозяина рода Streptomyces, например, клетку-хозяина Streptomyces lividans.
В другом варианте осуществления изобретение касается выделенного слитого полипептида, включающего сигнальный пептид ТАТ2 или ТАТ3, связанный с органофосфатгидролазой с последовательностью SEQ ID NO:18. В другом варианте осуществления сигнальный пептид ТАТ, содержащийся в выделенном слитом полипептиде, выбран из SEQ ID NO:1 или 5.
В другом варианте осуществления изобретение касается способа получения фермента, разрушающего фосфорорганические соединения, включающего: экспрессию выделенного полинуклеотида, содержащего первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8; и продукцию указанного фермента, разрушающего фосфорорганические соединения. В одном варианте осуществления изобретения разрушающий фосфорорганические соединения фермент, полученный способом по изобретению, представляет собой органофосфатгидролазу. В некоторых вариантах осуществления изобретения органофосфатгидролаза представляет собой ОРН с последовательностью SEQ ID NO:18 или ее вариант. В другом варианте осуществления способ по изобретению дополнительно включает выделение фермента, полученного в клетке-хозяине. В другом варианте осуществления изобретения клетка-хозяин способа по изобретению представляет собой клетку-хозяина рода Streptomyces.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Специалисту в данной области понятно, что чертежи представлены только для иллюстративных целей. Подразумевается, что чертежи никаким образом не ограничивают объем настоящего изобретения.
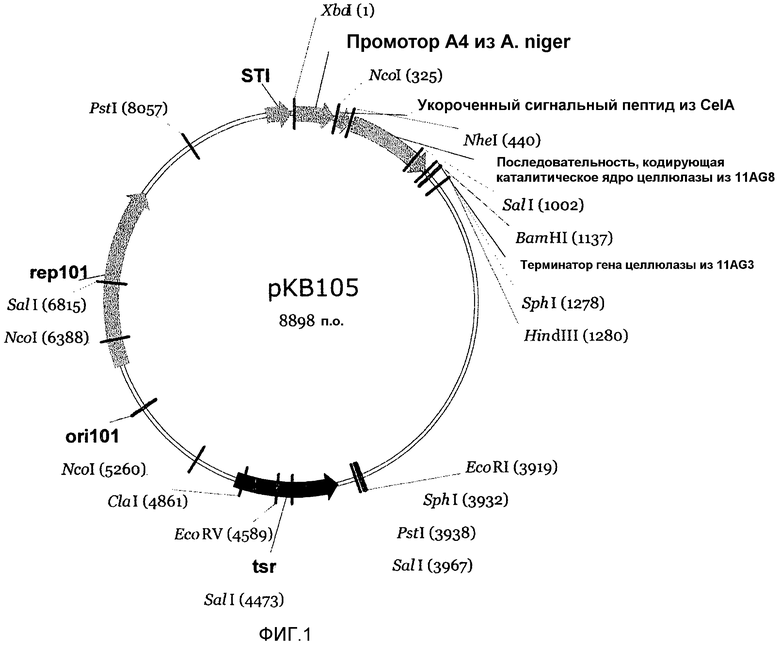
На фигуре 1 показан вектор рКВ105, содержащий промотор А4 из Aspergillus niger, укороченную сигнальную последовательность целлюлазы из S. lividans (CelA), полинуклеотид, кодирующий ген целлюлазы штамма 11AG8 рода Actinomyces, и последовательность терминатора целлюлазы из штамма 11AG3.
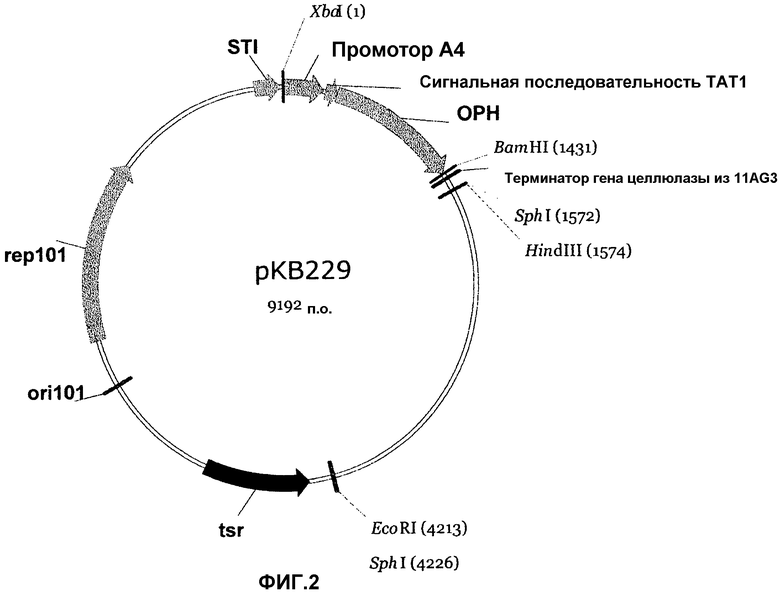
На фигуре 2 показан вектор рКВ229, полученный из вектора рКВ105 фигуры 1, в котором сигнальный пептид CelA замещен сигнальной последовательностью ТАТ1, а ген целлюлазы замещен геном ОРН с оптимизированными кодонами.
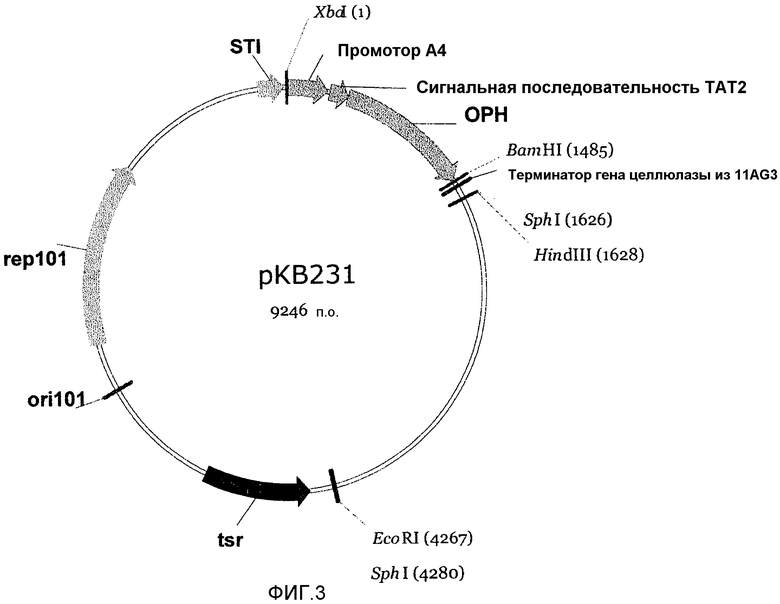
На фигуре 3 показан вектор рКВ231, полученный из вектора рКВ105 фигуры 1, в котором сигнальный пептид CelA замещен сигнальной последовательностью ТАТ2, а ген целлюлазы замещен геном ОРН с оптимизированными кодонами.
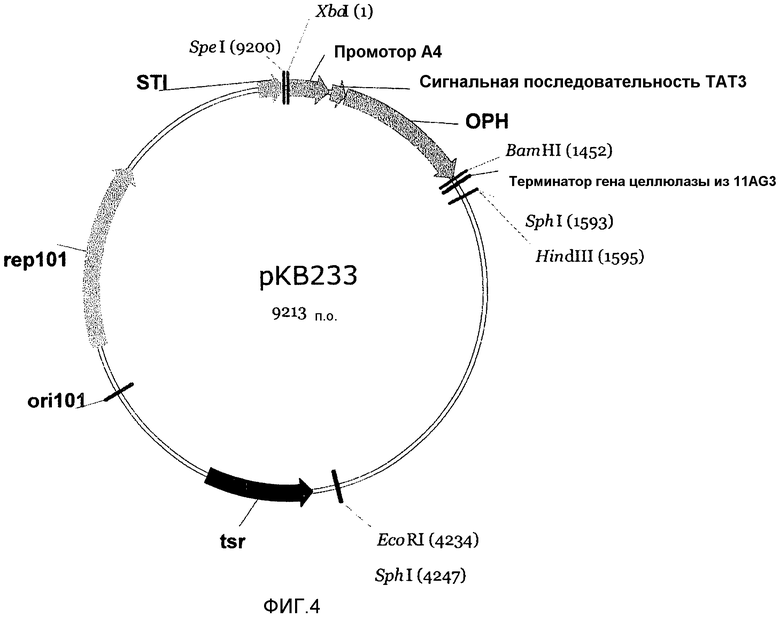
На фигуре 4 показан вектор рКВ233, полученный из вектора рКВ105 фигуры 1, в котором сигнальный пептид CelA замещен сигнальной последовательностью ТАТ3, а ген целлюлазы замещен геном ОРН с оптимизированными кодонами.
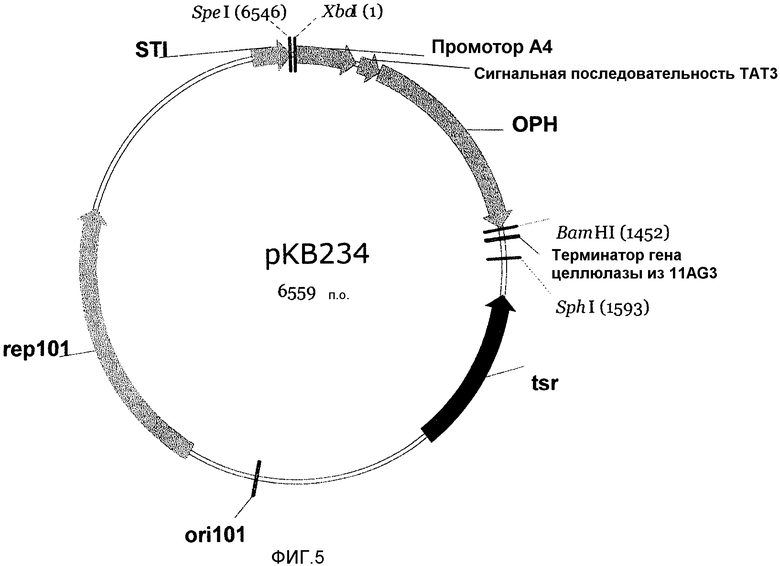
На фигуре 5 показан вектор рКВ234, полученный из вектора рКВ233 удалением ДНК-последовательностей E. coli между сайтами рестрикции SphI и EcoRI.
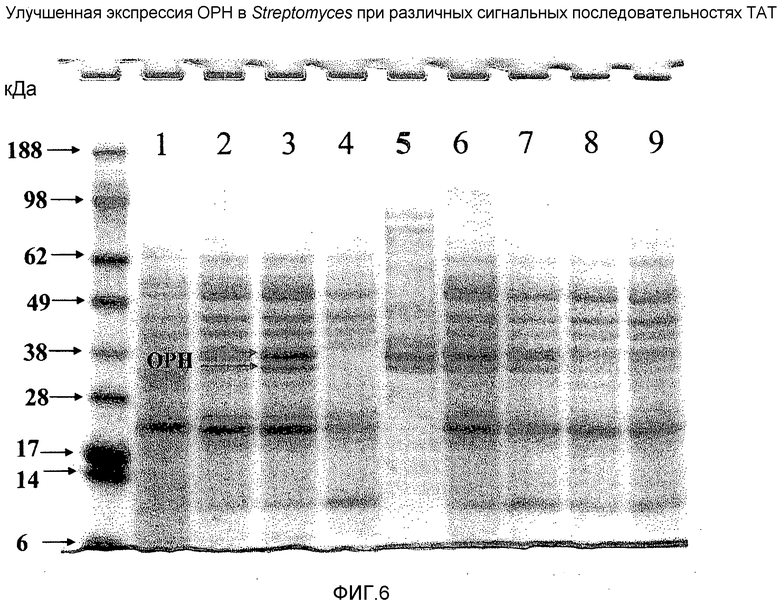
На фигуре 6 показан ДСН-ПААГЭ анализ ОРН, полученной в Streptomyces и экспрессированной в клетках-хозяевах в виде белка, слитого с сигнальными пептидами ТАТ1, ТАТ2 и ТАТ3.
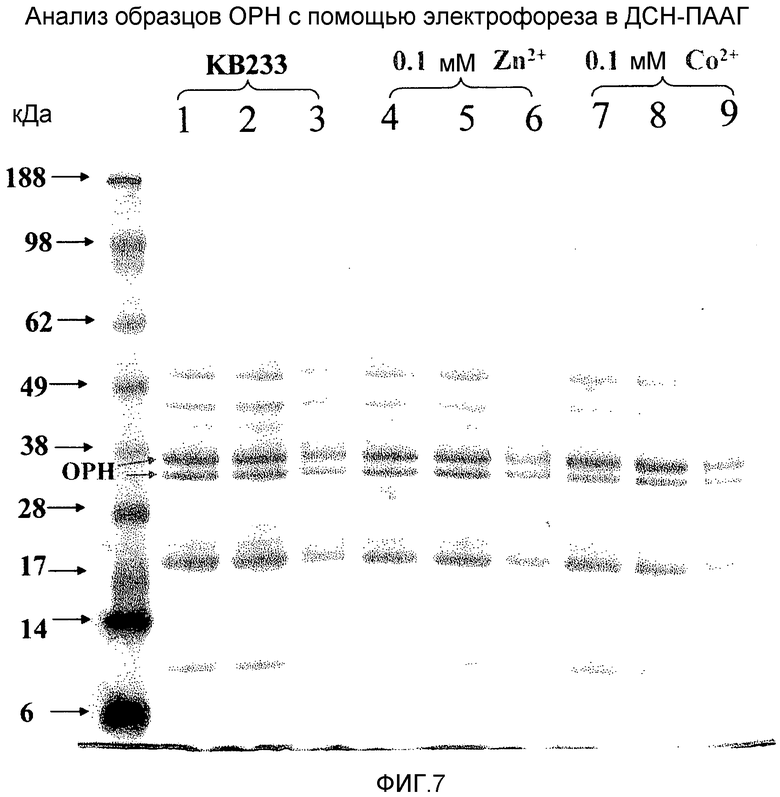
На фигуре 7 показан эффект добавления ионов Zn2+ и Co2+ на получение и стабильность при хранении ОРН, экспрессированной в Streptomyces в виде белка, слитого с ТАТ3.
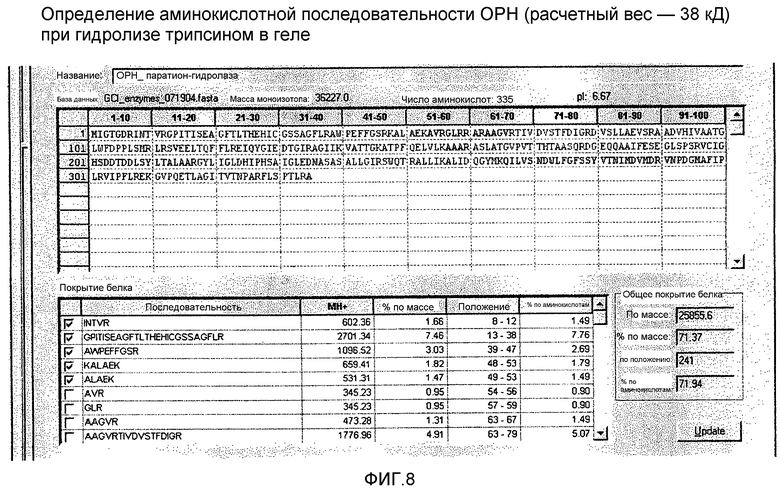
На фигуре 8 показана идентификация предполагаемой ОРН, полученной в клетках Streptomyces, с помощью трипсинового гидролиза в геле и пептидного картирования с помощью MALDI-масс спектрометрии.
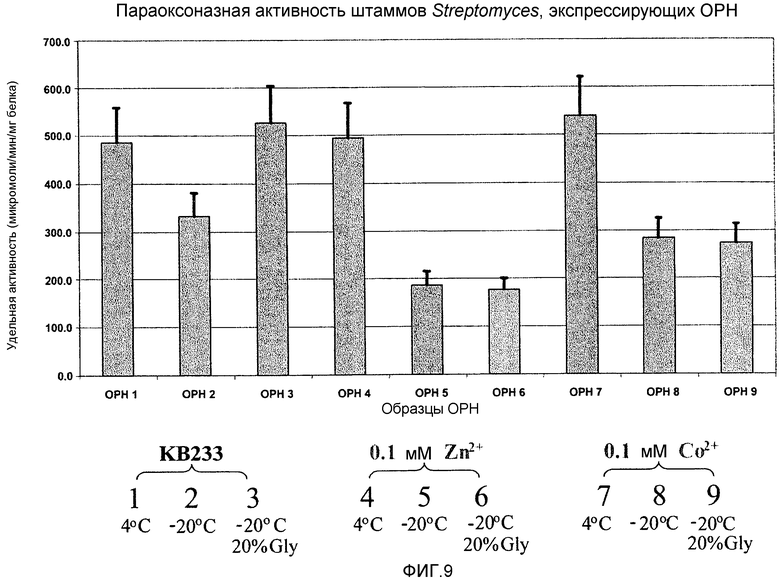
На фигуре 9 показана параоксоназная активность ОРН, полученной в клетках-хозяевах Streptomyces.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к полинуклеотидам, кодирующим слитые с ТАТ белки, и способам получения представляющих интерес белков в клетке-хозяине. В частности, настоящее изобретение относится к полинуклеотидам, векторам, полипептидам и способам экспрессии органофосфатгидролазы (ОРН) в клетке-хозяине, такой как клетка-хозяин рода Streptomyces.
Идея настоящего изобретения далее будет подробно описана путем ссылки только с использованием следующих определений и примеров. Все патенты и публикации, включая все последовательности, раскрытые в таких патентах и публикациях, упоминаемые в настоящем описании, прямо включены путем ссылки.
Если в описании не указано иное, то все технические и научные термины, используемые в настоящем описании, имеют такое же значение, какое обычно понимает под ними средний специалист в области, к которой относится изобретение. Специалисты в данной области могут найти общее описание многих терминов, используемых в изобретении, например, в Singleton and Sainsbury, Dictionary of Microbiology and Molecular Biology, 2d Ed., John Wiley and Sons, NY (1994); и в Hale and Markham, The Harper Collins Dictionary of Biology, Harper Perennial, NY (1991). Хотя в претворении на практике настоящего изобретения находят применение любые способы и материалы, аналогичные или эквивалентные способам и материалам, описанным в настоящем документе, предпочтительные способы и материалы описаны в настоящем документе. Соответственно, термины, определение которых приведено ниже, более полно описаны путем ссылки на описание изобретения в целом. Также, используемое в настоящем описании единственное число включает множественное, если контекст ясно не указывает иное. Численные диапазоны включают числа, ограничивающие диапазон. Если не указано иное, то нуклеотидные кислоты приведены слева направо в направлении от 5' к 3'; аминокислотные последовательности приведены слева направо в направлении от амино- к карбокси-концу, соответственно. Следует понимать, что это изобретение не ограничено конкретными описанными методикой, протоколами и реагентами, так как они могут варьировать в зависимости от контекста, в котором они используются специалистами в данной области.
Подразумевается, что каждое максимальное числовое ограничение, приведенное в этом описании, включает каждое меньшее числовое ограничение, как если бы такие меньшие числовые ограничения были ясно указаны в настоящем описании. Каждое минимальное числовое ограничение, приведенное в этом описании, будет включать каждое большее числовое ограничение, как если бы такие большие числовые ограничения были ясно указаны в настоящем описании. Каждый числовой диапазон, приведенный в этом описании, будет включать каждый более узкий числовой диапазон внутри такого более широкого числового диапазона, как если бы такие более узкие числовые диапазоны были ясно указаны в настоящем описании.
Приведенные в настоящем описании заголовки не являются ограничениями различных аспектов или вариантов осуществления, которые могут быть даны путем ссылки на описание изобретения в целом. Соответственно, термины, определение которых приведено ниже, более полно описаны путем ссылки на описание изобретения в целом.
ОПРЕДЕЛЕНИЯ
В настоящем описании термин «разрушающие фосфорорганические соединения ферменты» относится к ферментам, катализирующим гидролиз фосфоэфирных связей в фосфорорганических соединениях.
В настоящем описании термины «гидролаза триэфира фосфорной кислоты» или «фосфотриэстераза» относятся к ферменту, классифицируемому как EC 3.1.8, который действует на фосфорорганические соединения (такие как параоксон), включая эфиры фосфоновой и фосфиновой кислот. Гидролазы триэфира фосфорной кислоты включают арилдиалкилфосфатазы (EC 3.1.8.1), также известные как ОРН, и диизопропилфторфосфатазу (EC 3.1.8.2), также известную как ДФФаза.
Используемый в настоящем описании термин «полипептид» относится к соединению, представляющему одну цепь из аминокислотных остатков, соединенных пептидными связями. Используемый в настоящем описании термин «белок» может быть синонимом термину «полипептид» или может относиться, кроме того, к комплексу из двух или нескольких полипептидов. В настоящем описании используются стандартные трехбуквенные или однобуквенные обозначения аминокислотных остатков, где (А) обозначает аланин; (R) - аргинин; (N) - аспарагин; (D) - аспарагиновую кислоту; (С) - цистеин; (Е) - глутаминовую кислоту; (Q) - глутамин; (G) - глицин; (Н) - гистидин; (I) - изолейцин; (L) - лейцин; (К) - лизин; (М) - метионин; (F) - фенилаланин; (Р) - пролин; (S) - серин; (Т) - треонин; (W) - триптофан; (Y) - тирозин и (V) - валин.
Используемый в настоящем описании термин «слитый полипептид» или «слитый с Tat полипептид» относится к сигнальному пептиду Tat, соединенному или напрямую или через линкер с представляющим интерес белком.
Используемый в настоящем описании «сигнальный пептид» относится к аминокислотной последовательности на N-конце секретируемого белка. Практически все секретируемые белки имеют эту аминокислотную последовательность, которая играет важную роль в транспорте белка-предшественника к мембране и переносе через нее, и которая обычно протеолитически удаляется сигнальной пептидазой в ходе переноса белка через мембрану или сразу после него.
«Сигнальный пептид Tat» относится к N-концевой последовательности, включающей два последовательных аргининовых остатка, и которая участвует в секреции белков в свернутой конформации. «Сигнальный пептид Tat» можно взаимозаменяемо называть «Tat-пептид» или «Tat-полипептид».
Используемые в настоящем описании «представляющий интерес белок» или «представляющий интерес полипептид» относится к белку, экспрессируемому и секретируемому клеткой-хозяином. Представляющим интерес белком может быть любой белок, который до сегодняшнего момента рассматривался как белок, подходящий для экспрессии в прокариотах. Представляющий интерес белок может быть или гомологичным или гетерологичным для хозяина. В случае гомологичного представляющего интерес белка сверхэкспрессия представляет собой экспрессию выше обычного содержания белка в указанном хозяине. В случае гетерологичного представляющего интерес белка любая экспрессия представляет собой сверхэкспрессию.
Используемый в настоящем описании термин «гетерологичный белок» относится к белку или полипептиду, который в природе не встречается в клетке-хозяине. Примеры гетерологичных белков включают, но не ограничены, ферменты, такие как гидролазы, включая эстеразы, протеазы, гликозилазы; изомеразы, такие как рацемазы, эпимеразы, таутомеразы или мутазы; лиазы; лигазы; трансферазы, такие как киназы, трансаминазы и фосфотрансферазы; или оксидоредуктазы, такие как оксидазы и дегидрогеназы. Гетерологичный ген может кодировать терапевтические важные белки или пептиды, такие как ростовые факторы, цитокины, лиганды, рецепторы и ингибиторы, а также вакцины и антитела. Ген может кодировать коммерчески важные промышленные белки или пептиды, такие как эстеразы, протеазы, карбогидразы, такие как амилазы и глюкоамилазы, целлюлазы, оксидазы и липазы. Представляющий интерес ген может представлять собой природный ген, мутированный ген или синтетический ген.
Термин «гомологичный белок» относится к белку или полипептиду, нативному или встречающемуся в природе в клетке-хозяине. Изобретение включает гомологичные белки, которые представляют собой варианты, например, содержащие вставку, делецию или разрыв, по сравнению со встречающимся в природе гомологичным белком.
Термин «нуклеиновая кислота» и «полинуклеотид» используются взаимозаменяемо и охватывают молекулы РНК, ДНК и кДНК. Используемый в настоящем описании термин относится к полимерной форме нуклеотидов любой длины, или рибонуклеотидов или дезоксирибонуклеотидов. Термин относится только к первичной структуре молекулы и, поэтому, включает двух- и одноцепочечную ДНК и РНК. Он также включает известные типы модификаций, включающих, но не ограниченных, метки, известные в данной области, метилирование, «кэпирование», замену одного или несколько природных нуклеотидов аналогами; модификации внутри нуклеотидов, такие как, например, модификации нуклеотидов с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, включающие дополнительные части, такие как, например, белки (включая, например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации с интеркалирующими агентами (например, акридином, псораленом и т.д.), модификации, включающие хелаты (например, металлы, радиоактивные металлы, бор, окисляющие металлы и т.д.), модификации, включающие алкилирующие агенты, модификации с модифицированными связями (например, альфа аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида. В общем, нуклеотидные сегменты по настоящему изобретению можно собирать из фрагментов генома и коротких олигонуклеотидных линкеров, или из ряда олигонуклеотидов, или из отдельных нуклеотидов, чтобы получить синтетическую нуклеиновую кислоту, способную экспрессироваться в рекомбинантной транскрипционной единице, включающей регуляторные элементы, полученные из микробного или вирусного оперона или эукариотического гена. Поскольку генетический код является вырожденным, одна конкретная аминокислота может кодироваться более чем одним кодоном, а настоящее изобретение охватывает все полинуклеотиды, которые кодируют конкретную аминокислотную последовательность.
То, что полинуклеотид или полипептид имеет некоторый процент (например, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%) идентичности по последовательности с другой последовательностью, означает, что при выравнивании этот процент оснований или аминокислотных остатков одинаков при сравнении двух последовательностей. Это выравнивание можно провести и определить процент гомологии или идентичности, используя любое подходящее программное обеспечение, известное в данной области, например, описанное в Current Protocols in Molecular Biology (F. M. Ausubel et al. (eds) 1987, Supplement 30, section 7.7.18). В некоторых вариантах осуществления изобретения программы включают программу GCG Pileup, FASTA (Pearson et al. (1988) Proc. Natl, Acad. Sci USA 85:2444 2448) и BLAST (BLAST Manual, Altschul et al., Natl Cent. Biotechnol. Inf., Natl Lib. Med. (NCIB NLM NIH), Bethesda, Md., и Altschul et al., (1997) NAR 25:3389 3402). Другими примерами программ выравнивания являются ALIGN Plus (Scientific and Educational Software, PA), при этом предпочтительно использовать параметры по умолчанию, и TFASTA Data Searching Program, доступная в пакете программ Sequence Software Package Version 6.0 (Genetics Computer Group, University of Wisconsin, Madison, Wis.). Специалист в данной области поймет, что последовательности, охватываемые изобретением, включают последовательности, гибридизующиеся при жестких условиях с полинуклеотидами по изобретению.
«Гетерологичная» конструкция нуклеиновой кислоты или последовательность, также именуемая в настоящем описании как «химерный ген», содержит часть последовательности, которая не является нативной для клетки, в которой она экспрессируется. Определение «гетерологичная» в отношении регуляторной последовательности относится к регуляторной последовательности (например, промотору или энхансеру), которая в природе не участвует в регуляции этого гена, экспрессию которого в настоящей момент она регулирует. В общем, гетерологичные последовательности нуклеиновой кислоты не являются эндогенными для клетки или частью генома клетки, в которой они присутствуют, и они введены в клетку с помощью инфекции, трансфекции, микроинъекции, электропорации или аналогичного метода. «Гетерологичная» конструкция нуклеиновой кислоты может содержать комбинацию регуляторной последовательности и кодирующей последовательности ДНК, которые одинаковы с комбинацией регуляторной последовательности и кодирующей последовательности ДНК, присутствующих в нативной клетке, или отличаются от нее. Регуляторная последовательность, например, последовательность, регулирующая транскрипцию, обычно функционально связана с гетерологичной кодирующей белок последовательностью, или (в химерном гене селектируемого маркера) с геном селектируемого маркера, кодирующего белок, придающий трансформированным клеткам устойчивость к антибиотику. Типичные химерный ген или гетерологичная конструкция нуклеиновой кислоты по настоящему изобретению включают область регуляции транскрипции, последовательность, кодирующую сигнальный пептид, последовательность, кодирующую белок и терминаторную последовательность. Область регуляции транскрипции может быть конститутивной или индуцируемой.
Используемый в настоящем описании термин «вектор» относится к полинуклеотидной последовательности, разработанной для введения нуклеиновых кислот в один или несколько типов клеток. Векторы включают векторы для клонирования, векторы для экспрессии (экспрессионные), «челночные» векторы, плазмиды, кассеты и т.д.
Используемый в настоящем описании термин «экспрессионный вектор» относится к вектору, который способен включать и экспрессировать гетерологичный ДНК-фрагмент в чужеродной клетке. В продаже имеется множество векторов для экспрессии в прокариотах и эукариотах.
Используемые в настоящем описании термины «конструкция нуклеиновой кислоты» и «экспрессионный вектор» используются взаимозаменяемо для описания нуклеиновой кислоты, используемой для введения последовательности в клетку или организм-хозяина. Нуклеиновую кислоту можно получить in vitro с помощью ПЦР или любых других подходящих методик, известных специалистам в данной области. Конструкцию нуклеиновой кислоты или рекомбинантную экспрессионную кассету можно включить в плазмиду, хромосому, митохондриальную нуклеиновую кислоту, плазмидную нуклеиновую кислоту, вирус или фрагмент нуклеиновой кислоты. Обычно, часть рекомбинантной экспрессионной кассеты экспрессионного вектора или конструкции нуклеиновой кислоты включает, помимо других последовательностей, транскрибируемую последовательность нуклеиновой кислоты и промотор. В некоторых вариантах осуществления изобретения экспрессионные векторы обладают способностью включать и экспрессировать гетерологичные фрагменты нуклеиновой кислоты в клетке-хозяине. В продаже имеется множество прокариотических и эукариотических экспрессионных векторов. Выбор подходящих экспрессионных векторов входит в компетенцию специалистов в данной области.
Используемый в настоящем описании термин «плазмида» относится к кольцевой двухцепочечной (дц) ДНК-конструкции, используемой в качестве вектора для клонирования, и которая образует внехромосомный самореплицирующийся генетический элемент в многих бактериях и некоторых эукариотах.
Используемый в настоящем описании термин «промотор» относится к последовательности нуклеиновой кислоты, которая управляет транскрипцией гена. Промотор должен генетически соответствовать клетке-хозяину, в которой экспрессируется представляющий интерес ген. Промотор вместе с другими транскрипционными и трансляционными регуляторными последовательностями нуклеиновой кислоты (также называемыми «регуляторные последовательности») необходимы для экспрессии данного гена. В общем, транскрипционные и трансляционные регуляторные последовательности включают, но не ограничены, промоторные последовательности, сайты связывания рибосомы, последовательности начала и остановки транскрипции, последовательности начала и остановки трансляции, и энхансерные или активаторные последовательности.
Нуклеиновая кислота «функционально связана», когда она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, нуклеиновая кислота, кодирующая секреторный лидер, функционально связана с нуклеиновой кислотой, кодирующей полипептид, если она экспрессируется в составе белка-предшественника, который участвует в секреции полипептида; промотор или энхансер являются функционально связаны с кодирующей последовательностью, если они влияют на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если его местоположение способствует трансляции. В общем, «функционально связан» означает, что связанные последовательности нуклеиновой кислоты являются непрерывными, а в случае секреторного лидера, непрерывными и с сохранением рамки считывания. Однако энхансеры и промоторы не обязательно должны быть непрерывными. Связывание выполняется при лигировании по удобным сайтам рестрикции. Если такие сайты не существуют, то используют синтетические олигонуклеотидные адапторы или линкеры в соответствии с общепринятой практикой.
Первый полипептид, «связанный» со вторым полипептидом, обычно означает, что связанные полипептидные последовательности непрерывны и образуют слитый белок.
Используемый в настоящем описании термин «ген» относится к полинуклеотиду (например, ДНК-фрагменту), участвующему в продукции полипептидной цепи, он может включать или может не включать области, расположенные перед и после кодирующей области, например 5'-нетранслируемую (5'-UTR) или «лидерную» последовательности и 3'-UTR или «хвостовую» последовательности, а также промежуточные последовательности (интроны) между отдельными кодирущими фрагментами (экзонами).
Термин «рекомбинантная» («рекомбинантный») при использовании в отношении клетки, нуклеиновой кислоты, белка или вектора указывает, что клетка, нуклеиновая кислота, белок или вектор были модифицированы путем введения гетерологичной нуклеиновой кислоты или белка, или путем изменения нативной нуклеиновой кислоты или белка; или что клетка получена из клетки, модифицированной таким образом, что белок экспрессируется в ненативном или генетически модифицированном окружении, например, в экспрессионном векторе для прокариотической или эукариотической системы. Поэтому, например, рекомбинантные клетки экспрессируют нуклеиновые кислоты или полипептиды, которые не найдены в нативном (не рекомбинантном) состоянии клетки, или экспрессируют нативные гены, которые иным образом аномально экспрессируются, экспрессия которых снижена, повышена или отсутствует совсем.
Используемые в настоящем описании термины «трансформированная», «стабильно трансформированная» и «трансгенная» в отношении клетки означают, что в геном клетки включена ненативная (например, гетерологичная) последовательность нуклеиновой кислоты, или она существует в клетке в качестве эписомной плазмиды, сохраняющейся в клетке в течение многих поколений.
Используемый в настоящем описании термин «экспрессия» относится к процессу, посредством которого получается полипептид исходя из последовательности нуклеиновой кислоты гена. Процесс включает как транскрипцию, так и трансляцию.
Используемый в настоящем описании термин «функционально связанный» означает, что транскрипционная и трансляционная регуляторная нуклеиновая кислота расположена относительно кодирующей последовательности таким образом, что инициируется транскрипция. В общем, это будет означать, что промотор и последовательности инициации или старта транскрипции расположены в 5'-положении относительно кодирующей области. Транскрипционная и трансляционная регуляторная нуклеиновая кислота должна обычно соответствовать клетке-хозяину, используемой для экспрессии белка. В данной области известны много типов соответствующих экспрессионных векторов и подходящих регуляторных последовательностей для разных клеток-хозяев.
Термины «продукция» и «секреция» в отношении желаемого белка, например, ОРН, охватывают процессы, следующие за экспрессией и включают стадии процессинга: удаление сигнального пептида, которое, как известно, происходит в ходе секреции белка, и перенос представляющего интерес белка за пределы клетки-хозяина.
Термин «процессинг» или «процессированная» в отношении ОРН относятся к процессу созревания, в ходе которого полноразмерный белок, например, ОРН, становится активным зрелым ферментом.
Используемый в настоящем описании термин «под транскрипционным контролем» указывает, что транскрипция полинуклеотидной последовательности, обычно ДНК-последовательности, зависит от ее функциональной связи с элементом, принимающим участие в инициации транскрипции или обеспечивающим транскрипцию.
Используемый в настоящем описании термин «под трансляционным контролем» указывает на регуляторный процесс, происходящий после образования мРНК.
Используемый в настоящем описании термин «плазмида» относится к кольцевой двухцепочечной (дц) ДНК-конструкции, используемой в качестве вектора для клонирования, и которая образует внехромосомный самореплицирующийся генетический элемент в некоторых эукариотах или прокариотах, или встраивается в хромосому хозяина.
Термин «введенная» в контексте введения последовательности нуклеиновой кислоты в клетку означает «трансфекцию» или «трансформацию» или «трансдукцию» и относится к включению последовательности нуклеиновой кислоты в эукариотическую или прокариотическую клетку, в которых последовательность нуклеиновой кислоты может быть встроена в геном клетки (например, хромосому, плазмиду, ДНК пластид или митохондрий), превращена в автономный репликон или может экспрессироваться транзиентно (например, трансфецированная мРНК).
Используемые в настоящем описании термины «полученные», «выделенные» и «разделенные» относятся к соединению, белку, клетке, нуклеиновой кислоте или аминокислоте, которые удалены от, по меньшей мере, одного компонента, с которым они ассоциированы в природе.
Используемый в настоящем описании термин «активность» или «биологическая активность» относится к активности, ассоциированной с конкретным белком, например, ферментативной активности. Биологическая активность относится к любой активности, которая в норме может относиться к этому белку по мнению специалиста в данной области.
Используемый в настоящем описании термин «удельная активность» обозначает единицу фермента, определенную как число молей субстрата, превращенных в продукт препаратом фермента за единицу времени при определенных условиях. Удельную активность обычно выражают в единицах (Ед)/мг белка.
Термин «полученный» охватывает термины «происходит из», «полученный», «получаемый из» и «выделенный из».
Термины «клетка-хозяин» или «штамм-хозяин» обозначают клетку, которая содержит вектор и поддерживает репликацию и/или транскрипцию, или транскрипцию и трансляцию (экспрессию) экспрессионной конструкции. В некоторых вариантах осуществления изобретения, клетки-хозяева или штаммы-хозяева являются прокариотическими, например, бактериальными клетками, включающими, но не ограниченными клетки Streptomyces.
Термин «вариант» относится к области нуклеиновой кислоты или белка, которая содержит один или несколько отличающихся, дополнительных или отсутствующих нуклеотидов или аминокислот по сравнению с исходными нуклеиновой кислотой или белком, например, природными или дикого типа нуклеиновой кислотой или белком. Предполагается, что вариантный белок сохраняет функцию исходного белка, т.е. вариантный белок представляет собой активный вариант исходного белка. В некоторых вариантах осуществления изобретения способность вариантного белка выполнять такую функцию равна или выше способности исходного белка.
Используемый в настоящем описании термин «род Streptomyces» включает все виды рода Streptomyces, известные специалистам в данной области, включающие, но не ограниченные, S. achromogenes, S. albicans, S. albogriseolus, S. ambofaciens, S. avermitilis, S. carbophilus, S. clavuligerus, S. coelicolor, S. felleus, S. ferralitis, S. filamentosus, S. griseus, S. Helvaticus, S. hygroscopicus, S. lysosuperficus, S. lividans, S. noursei, S. plicatosporus, S. rubiginosus, S. scabies, S. somaliensis, S. thermoviolaceus и S. violaceoruber.
Идея настоящего изобретения основана на открытии, что некоторые белки можно получить в бактериальных клетках-хозяевах, используя Tat-механизм секреции. Соответственно, идея настоящего изобретения касается способов получения представляющего интерес белка в клетке-хозяине. Идея настоящего изобретения также касается полинуклеотидов, кодирующих представляющий интерес белок и последовательность сигнального пептида Tat, и слитых полипептидов, кодируемых полинуклеотидами. В частности, настоящее изобретение относится к полинуклеотидам, векторам, полипептидам и способам экспрессии ферментов, разрушающих фосфорорганические соединения, например, органофосфатгидролазы (ОРН), в клетках-хозяевах, таких как клетки-хозяева видов рода Streptomyces.
В одном аспекте идея настоящего изобретения касается полинуклеотида, содержащего первую последовательность нуклеиновой кислоты и вторую последовательность нуклеиновой кислоты. Первая последовательность нуклеиновой кислоты кодирует сигнальный пептид Tat, а вторая последовательность нуклеиновой кислоты кодирует представляющий интерес белок. Первая последовательность нуклеиновой кислоты обычно функционально связана со второй последовательностью нуклеиновой кислоты.
Сигнальный пептид Tat, кодируемый первой последовательностью нуклеиновой кислоты, может быть любым из известных Tat-сигнальных пептидов, известных на сегодняшний момент и открытых позднее, которые принимают участие в секреции полипептида по Tat-пути. Обычно Tat-сигнальный пептид включает аминокислотную последовательность, содержащую диаргининовый (т.е., «RR») мотив, в котором RR представляет две смежных аминокислоты аргинина. В некоторых вариантах осуществления изобретения последовательность сигнального пептида Tat содержит RR-мотив в первых 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотах от N-конца полипептида. В других вариантах осуществления изобретения последовательность сигнального пептида Tat содержит RR-мотив, который не находится в первых 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотах от N-конца полипептида.
В некоторых вариантах осуществления изобретения сигнальным пептидом Tat является сигнальный пептид ТАТ2 или ТАТ3, например, пептид, содержащий аминокислотную последовательность любой из SEQ ID NO:1-4, или сигнальный пептид TAT3 (SEQ ID NO:5), а представляющим интерес белком является эстераза, например, фосфотриэстераза. В некоторых вариантах осуществления изобретения сигнальным пептидом Tat является сигнальный пептид ТАТ2 или ТАТ3, или сигнальный пептид белков SCO2286 (SEQ ID NO:6), SCO3790long (SEQ ID NO:7), SCO6580long (SEQ ID NO:8), SCO1590 (SEQ ID NO:9), SCO1824 (SEQ ID NO:10), SCO6580short (SEQ ID NO:11), SCO3790short (SEQ ID NO:12), SCO736 (SEQ ID NO:13), SCO2068 (SEQ ID NO:14), SCO3471 (SEQ ID NO:15) или SCO7677 (SEQ ID NO:16), а представляющим интерес белком является ОРН или ее биологически активный вариант или фрагмент (смотри, например, заявку РСТ № GB/004816). В некоторых вариантах осуществления сигнальный пептид Tat содержит аминокислотную последовательность, по существу идентичную, например, идентичную на 80%, 85%, 90%, 95%, 97%, 98% 99% или 100%, аминокислотной последовательности любой из SEQ ID NO:1-16, описанных в таблице 1. В некоторых вариантах осуществления изобретения сигнальным пептидом Tat является сигнальный пептид ТАТ2 или ТАТ3. В некоторых вариантах осуществления изобретения сигнальным пептидом Tat является сигнальный пептид ТАТ3. В некоторых вариантах осуществления изобретения сигнальным пептидом Tat является сигнальный пептид ТАТ3 (последовательность SEQ ID NO:5), а представляющим интерес белком является фосфотриэстераза, например, ОРН из штамма ATCC27551 рода Flavobacterium (Mulbry et Karns J supra), ОРН из Pseudomonas diminuta (Munnecke supra) или из Agrobacterium radiobacter (Home et al. supra), или ее биологически активный вариант или фрагмент.
Вторая последовательность нуклеиновой кислоты кодирует представляющий интерес белок или его фрагмент. Представляющим интерес белком может быть любой белок или полипептид, известный на сегодняшний день или открытый позднее, который может секретироваться клеткой-хозяином по Tat-пути. Примеры таких белков включают, но не ограничены, гидролазы, включающие эстеразы, протеазы, гликозилазы; изомеразы, такие как рацемазы, эпимеразы, таутомеразы или мутазы; лиазы; лигазы; трансферазы, такие как киназы, трансаминазы и фосфотрансферазы; или оксидоредуктазы, такие как оксидазы и дегидрогеназы. Представляющим интерес белком также может быть терапевтически важный белок или пептид, такой как ростовой фактор, цитокин, лиганд, рецептор или ингибитор, а также вакцина и антитело. Представляющим интерес белком может быть коммерчески важный промышленный белок или пептид, такой как эстераза, протеаза, карбогидраза, такая как амилаза и глюкоамилаза, целлюлаза, оксидаза или липаза.
Представляющим интерес белком может быть природный белок, мутированный белок или синтетический полипептид. Представляющим интерес белком также может быть биологически активный фрагмент полноразмерного белка. Специалист в данной области может выбрать такие фрагменты исходя из планируемой активности или функции представляющего интерес белка. Кроме того, представляющий интерес белок может быть гетерологичным или гомологичным белком. Гомологичный белок может содержать аминокислотную последовательность природного белка, или он может включать последовательность, содержащую вставку, делецию или разрыв, по сравнению с природным гомологичным белком.
В некоторых вариантах осуществления изобретения кодоны нуклеиновой кислоты, кодирующей представляющий интерес белок, могут (необязательно) быть оптимизированы для экспрессии в конкретном хозяине. Оптимизация кодонов является хорошо известной специалисту в данной области методикой эффективной трансляции гетерологичного полипептида в чужеродной клетке-хозяине. Оптимизацию кодонов, например, можно провести с помощью коммерческого сервиса, например, предоставляемого компанией GeneArt (Toronto, Canada), которая проводит оптимизацию гена, кодирующего конкретный представляющий интерес белок, для экспрессии в выбранной клетке-хозяине.
В некоторых вариантах осуществления изобретения представляющий интерес белок является ферментом, разрушающим фосфорорганические соединения. В одном варианте осуществления изобретения ферментом, разрушающим фосфорорганические соединения, является гидролаза триэфира фосфорной кислоты (ЕС 3.1.8), т.е. арилдиалкилфосфатаза (ЕС 3.1.8.1) или диизопропилфторфосфатаза (ЕС 3.1.8.2.). Арилдиалкилфосфатаза также известна как органофосфатгидролаза (ОРН); параоксоназа; А-эстераза; арилтрифосфатаза; органофосфатэстераза; эстераза В1; эстераза Е4; параоксонэстераза; пиримифосметилоксонэстераза; ОРА-ангидраза; органофосфатгидролаза; фосфотриэстераза; параоксонгидролаза; ОРН; или кислая органофосфатангидраза. Диизопропилфторфосфатаза также известна как ДФФаза; табуназа; зоманаза; кислая органофосфатангидролаза; кислая органофосфатангидраза; ОРА-ангидраза; диизопропилфосфофторидаза; диалкилфторфосфатаза; диизопропилфосфофторидгидролаза; изопропилфосфофторидаза; и диизопропилфторфосфонат-дегалогеназа. Фосфотриэстеразы (ОРН) являются членами суперсемейства амидогидролаз (Seibert & Raushel, Biochemistry, 44, 6383-6391 [2005]), ферментов, катализирующих гидролиз широкого спектра соединений с различными химическими свойствами (фосфоэфиров, эфиров, амидов и т.д.). Изобретение охватывает ферменты ОРН из бактерий, включая штамм АТСС27551 рода Flavobacterium (Mulbry et Karns J. Bacteriol. 171:6740-6746 [1989]), ОРН из Pseudomonas diminuta (Munnecke, DM. Appl. Environ. Microbiol. 32, 7-13 [1976]) и очень похожую (90% идентичности по последовательности) OpdA из Agrobacterium radiobacter (Home et al., FEMS Microbiol. Lett. 222, 1-8 [2003]). В некоторых вариантах осуществления изобретения ОРН имеет последовательность SEQ ID NO:18 или ее вариант.
Органофосфатгидролаза (ОРН, ЕС 3.1.8.1) является димерным бактериальным ферментом, нейтрализующим многие фосфорорганические нейротоксины путем гидролиза ряда фосфонатных связей. Основные успехи в производстве сельскохозяйственных культур были достигнуты за счет использования пестицидов для борьбы с вредителями. Одним из наиболее популярных типов пестицидов является семейство фосфорорганических соединений (ФОС), которые эффективно уничтожают вредителей вследствие своей сильной нейротоксичности. Эффективность ФОС в качестве пестицидов и инсектицидов также делает их опасными для людей и окружающей среды. ФОС являются сильными нейротоксинами, которые имеют структурное сходство с боевыми отравляющими веществами, такими как зарин, зоман и VX [O-этил-S-(2-диизопропиламиноэтил)метилфосфонотиоат]. Они действуют как ингибиторы холинэстеразы и таким образом нарушают передачу нервных импульсов как у насекомых, так и у людей. ОРН обладает способностью гидролизовать ряд ФОС нейротоксинов, включающих традиционные инсектициды и структурно похожих на боевые отравляющие вещества, такие как зарин и зоман (Dumas et al. J boil Chem 261: 19659-19665 [1989]).
Хотя субстрат и функция фермента в природе остаются неизвестными, с наибольшей эффективностью он гидролизует связь Р-О в фосфотриэфирном инсектициде параоксоне, причем скорость катализа приближается к пределам диффузии (108-109 М-1с-1). Активность нативной ОРН варьирует между различными фосфонотиоатными субстратами с наиболее ограниченной эффективностью в отношении P-S связи в Деметоне-S (kcat=4 с-1) (Lai et al., Archives of Biochem Biophys 318:59-64 [1995], Kolakowski et al., Biocatal. Biotransform.15:297-312 [1997]; diSioudi et al., Chem Biol Interact 119-120:211-223 [1999]). Боевые отравляющие вещества VX (O-этил-S-диизопропиламинометил-метилфосфонотиоат) и VR (O-изобутил-S-N,N-диэтиламиноэтил-метилфосфонотиоат) принадлежат к этому классу медленно гидролизуемых соединений (связи P-S) (Lai et al., 1995 supra; Kolakowski et al., 1997 supra; Rastogi et al., 1997 supra). С целью усиления способности ОРН разрушать эти фосфонотиоатные нервно-паралитические агенты исследования были сфокусированы на увеличении каталитической эффективности и субстрат-специфичности ОРН путем создания вариантов нативной ОРН (Lai et al., 1996 supra; diSioudi et al., Biochemistry 38:2866-2872 [1999]). (Hill et al., Am. Chem. Soc. 125:8990-8991 [2003]). Поэтому, в некоторых вариантах осуществления изобретения представляющим интерес белком является вариант ОРН. Предполагается, что вариант ОРН сохраняет способность к гидролизу фосфорорганических соединений.
В другом варианте осуществления изобретения ферментом, разрушающим фосфорорганические соединения, является пролидаза, например, кислая органофосфатангидролаза (ОРАА), например, ОРАА была найдена в штамме рода Alteromonas (Cheng et al., Appl. Environ. Microbiol. 59, 3138-3140 [1993]). В еще одном варианте осуществления изобретения ферментом, разрушающим фосфорорганические соединения, является HDL-ассоциированная параоксоназа человека (HPON) (Harel, M. et al., Nature Struct. Mol. Biol. 11:412-419 [2004]).
В некоторых вариантах осуществления изобретения представляющим интерес белком является гидролаза; оксидоредуктаза, например, оксидаза; трансфераза; лиаза; изомераза; лигаза; или коммерчески или терапевтически важный белок, или полипептид. В некоторых вариантах осуществления изобретения гидролазой является эстераза или металлозависимая гидролаза. В некоторых вариантах осуществления изобретения эстеразой является фосфотриэстераза, например, фосфотриэстераза, классифицируемая как белок ЕС 3.1.8.
В некоторых вариантах осуществления изобретения представляющим интерес белком является металлозависимая гидролаза, связанная с, по меньшей мере, одним двухвалентным ионом металла. Суперсемейство металлозависимых гидролаз (также называемое суперсемейством амидогидролаз) представляет собой большую группу белков, консервативных по третичной структуре (TIM-бочонок) и своему активному сайту. Подавляющее большинство членов семейства имеют консервативный металл-связывающий участок, включающий четыре гистидина и один остаток аспарагиновой кислоты. В обычном механизме реакции ион металла (или ионы) депротонирует молекулу воды для нуклеофильной атаки на субстрат. Семейство включает уреазу альфа, аденозиндеаминазу, фосфотриэстеразу, дигидрооротазы, аллантоиназы, гидантоиназы, АМФ-, аденин- и цитозин-деаминазы, имидазолонпропионазу, арилдиалкилфосфотазу, хлоргидролазы, формилметанофуран-дегидрогеназы и другие.
В некоторых вариантах осуществления изобретения металлозависимой гидролазой является ОРН. ОРН может функционально взаимодействовать с многими различными металлами. Содержащая Zn2+ форма ОРН представляет собой один из наиболее стабильных димерных белков (когда-либо известных) с величиной конформационной стабильности 40 ккал/моль, а содержащая Со2+ форма является наиболее активной из связанных с металлом форм (Grimsley et al., Biochemistry 36:14366-14374 [1997]). Примеры двухвалентных ионов металлов, которые могут связываться с ОРН, включают, но не ограничены, Mg2+, Ca2+, Mn2+, Co2+, Ni2+, Zn2+ и Cd2+. В некоторых вариантах осуществления изобретения двухвалентные ионы металлов включают, но не ограничены, Mn2+, Co2+, Ni2+, Zn2+ и Cd2+. В некоторых вариантах осуществления изобретения представляющим интерес белком является металлозависимая гидролаза, которая связана с двумя двухвалентными ионами металлов. Два двухвалентных иона металла могут быть одинаковыми или могут отличаться. В некоторых вариантах осуществления изобретения металлозависимой гидролазой является ОРН, а два двухвалентных иона металлов, с которыми связана ОРН, выбраны из группы, состоящей из Mn2+, Co2+, Ni2+, Zn2+, Cd2+ и их комбинации.
В некоторых вариантах осуществления изобретения представляющим интерес белком является органофосфат-гидролаза («ОРН»), гексоза-оксидаза («НОХ»), сорбит-оксидаза («SOX»), ацетилтрансфераза («АСТ») или их биологически активные варианты или фрагменты. В некоторых вариантах осуществления изобретения представляющим интерес белком является ОРН или ее биологически активный вариант или фрагмент.
В некоторых вариантах осуществления изобретения представляющим интерес белком является ОРН, а кодоны второй последовательности нуклеиновой кислоты, кодирующей ОРН, оптимизированы для экспрессии ОРН в прокариотической клетке-хозяине. В некоторых вариантах осуществления изобретения клеткой-хозяином является клетка-хозяин рода Streptomyces, например, клетка-хозяин Streptomyces lividans.
В некоторых вариантах осуществления изобретения представляющим интерес белком является гидролаза, но не гликозилаза или гликозидгидролаза. В некоторых вариантах осуществления изобретения представляющим интерес белком является гидролаза, но не фермент, классифицируемый как белок ЕС 3.2.1. В некоторых вариантах осуществления изобретения представляющим интерес белком является гидролаза, но не ксиланаза А или хитозаназа.
В некоторых вариантах осуществления изобретения полинуклеотиды по изобретению функционально связаны с промотором. Полинуклеотиды могут быть связаны с любым подходящим промотором, известным в данной области на сегодняшний день или открытым позднее. Промотор может быть нативным или гетерологичным для прокариотического хозяина, в котором экспрессируется представляющий интерес белок. Примеры промоторов включают, но не ограничены, промотор А4 из Aspergillus niger (в настоящем описании - SEQ ID NO:23), длинный промотор А4 из Aspergillus niger (A4-длинный промотор), промотор A4-5' из Aspergillus niger (патентная публикация США 2006/0105425), промотор глюкозоизомеразы (GI) из Actinoplanes missouriensis и промотор - производное GI (GIT) (патент США №6,562,612 и EPA 351029); промотор глюкозоизомеразы (GI) из Streptomyces lividans (SEQ ID NO:1), короткий промотор GI дикого типа, промотор 1.5 GI, промотор 1.20 GI или любой из вариантов промоторов GI, раскрытых в WO 03/089621, промотор aph гена аминогликозид-3'-фосфотрансферазы из Streptomyces fradiae, промотор ssi и промотор xlnA ксиланазы из Streptomyces lividans. В некоторых вариантах осуществления изобретения полинуклеотид по изобретению, который содержит первую нуклеиновую кислоту, кодирующую сигнальный пептид ТАТ, функционально связанную со второй нуклеиновой кислотой, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как ЕС 3.1.8, функционально связан с промотором А4 с последовательностью SEQ ID NO:23:
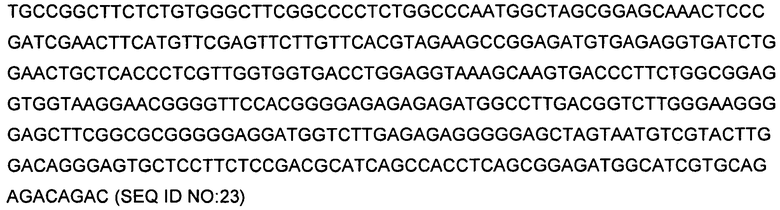
Последовательности иллюстративных сигнальных пептидов и представляющих интерес белков, и кодирующих их нуклеиновых кислот



В другом аспекте идея настоящего изобретения касается слитого полипептида, содержащего сигнальный пептид ТАТ и представляющий интерес белок по изобретению. Любой из перечисленных в настоящем описании сигнальных пептидов ТАТ можно слить с представляющим интерес белком. В некоторых вариантах осуществления изобретение касается выделенного слитого полипептида, который содержит сигнальный пептид ТАТ2 (например, SEQ ID NO:1-4) или TAT3 (например, SEQ ID NO:5), функционально связанный с органофосфатгидролазой с последовательностью SEQ ID NO:18 или ее вариантом. В другом варианте осуществления изобретения сигнальный пептид ТАТ выбран из SEQ ID NO:1 или 5.
Слитый полипептид необязательно включает линкерный пептид, расположенный между сигнальным пептидом ТАТ и представляющим интерес белком, например ОРН. Линкерный пептид может быть любой подходящей длины, включающей, но не ограниченной, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот. В некоторых вариантах осуществления изобретения линкерный пептид содержит от 1 до 10 аминокислот или от 1 до 5 аминокислот. В некоторых вариантах осуществления изобретения линкерный пептид содержит от 1 до 2 аминокислот. Линкерный полипептид может содержать любую природную или модифицированную аминокислоту. В некоторых вариантах осуществления изобретения линкерный пептид содержит аланин. В некоторых вариантах осуществления изобретения линкер представляет собой расщепляемый линкер, который легко расщепляется, высвобождая зрелый белок из белка-предшественника, дополнительно содержащего сигнальный пептид.
В некоторых вариантах осуществления идея настоящего изобретения касается экспрессионного вектора, содержащего полинуклеотиды по изобретению. Вектором может быть любой вектор, известный на сегодняшний день или открытый позднее, который подходит для экспрессии представляющего интерес белка в клетке-хозяине. Вектор может представлять собой встраивающийся вектор или реплицирующийся вектор. В общем, вектор содержит точку инициации репликации, функциональную, по меньшей мере, в одном организме, удобные сайты рестрикции и селектируемый маркер для клетки-хозяина. Примеры векторов, которые можно использовать, включают, но не ограничены, pKB105, pKB229, pKB231, pKB233 и pKB234. В некоторых вариантах осуществления изобретения экспрессионный вектор содержит выделенный полинуклеотид, включающий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8, например, органофосфатгидролазу. В некоторых вариантах осуществления изобретения экспрессионный вектор содержит первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ любой из последовательностей SEQ ID NO:1-5, и вторую последовательность нуклеиновой кислоты, кодирующую гидролазу триэфира фосфорной кислоты. В некоторых вариантах осуществления изобретения выделенный полинуклеотид, включающий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, которая функционально связана со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, дополнительно функционально связан с промотором А4 с последовательностью SEQ ID NO:23. В других вариантах осуществления кодоны последовательности нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, оптимизированы для экспрессии в клетке-хозяине рода Streptomyces. В некоторых вариантах осуществления изобретения клетка-хозяин рода Streptomyces представляет собой клетку-хозяина Streptomyces lividans.
В некоторых вариантах осуществления идея настоящего изобретения касается клетки-хозяина, содержащей полинуклеотиды по изобретению. Клеткой-хозяином может быть любая клетка, например, клетка высших эукариот, низших эукариот или прокариот, как известно, обладающая способностью к экспрессии представляющего интерес белка и секреции его по Tat-пути. В некоторых вариантах осуществления изобретения клетка-хозяин является прокариотической клеткой, например, бактериальной клеткой. Бактериальная клетка-хозяин может быть грамположительной или грамотрицательной бактерией. В некоторых вариантах осуществления изобретения клетка-хозяин является грамположительной бактерией. Ряд видов грамположительных клеток, которые могут функционировать в качестве подходящих клеток-хозяев для получения представляющего интерес белка, включают, например, клетки родов Streptomyces, Bacillus и Lactococcus.
В некоторых вариантах осуществления изобретения клетка-хозяин является клеткой Streptomyces. Используемый в настоящем изобретении род Streptomyces включает всех членов, известных специалистам в данной области, включая, но не ограничиваясь, S. achromogenes, S. albicans, S. albogriseolus, S. ambofaciens, S. avermitilis, S. carbophilus, S. clavuligerus, S. coelicolor, S. felleus, S. ferralitis, S. filamentosus, S. griseus, S. helvaticus, S. hygroscopicus, S. lysosuperficus, S. lividans, S. noursei, S. plicatosporus, S. rubiginosus, S. scabies, S. somaliensis, S. thermoviolaceus и S. violaceoruber. В некоторых вариантах осуществления изобретения клетка-хозяин является клеткой видов рода Bacillus, включающего, но не ограниченного, клетки B. clausii, B. subtilis, B. licheniformis и B. lentus. В некоторых вариантах осуществления изобретения клетка-хозяин является клеткой S. albogriseolus, S. carbophilus, S. coelicolor, S. lividans, S. rubiginosus, S. helvaticus или B. subtilis.
В еще одном аспекте идея настоящего изобретения касается способа получения представляющего интерес белка в клетке-хозяине. Способ включает экспрессию полинуклеотида по изобретению в клетке-хозяине. Как уже обсуждалось выше, клеткой-хозяином может быть любая подходящая клетка, например, прокариотическая клетка или бактериальная клетка, включая, но не ограничиваясь, клетку видов рода Streptomyces или Bacillus. В некоторых вариантах осуществления изобретения представляющий интерес белок продуцируется в свернутой форме. В некоторых вариантах осуществления изобретения представляющий интерес белок продуцируется в активной форме. В некоторых вариантах осуществления клетка-хозяин по изобретению, например, клетка-хозяин рода Streptomyces, содержит экспрессионный вектор, включающий выделенный полинуклеотид, содержащий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8, например, органофосфатгидролазу. В некоторых вариантах осуществления изобретения экспрессионный вектор содержит первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ любой из последовательностей SEQ ID NO:1-5, и вторую последовательность нуклеиновой кислоты, кодирующую гидролазу триэфира фосфорной кислоты. В некоторых вариантах осуществления изобретения выделенный полинуклеотид, включающий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ, которая функционально связана со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, дополнительно функционально связан с промотором А4 с последовательностью SEQ ID NO:23. В других вариантах осуществления кодоны нуклеотидной последовательности, кодирующей гидролазу триэфира фосфорной кислоты, оптимизированы для экспрессии в клетке-хозяине видов рода Streptomyces. В некоторых вариантах осуществления изобретения клетка-хозяин рода Streptomyces представляет собой клетку-хозяина Streptomyces lividans.
В некоторых вариантах осуществления изобретения клетки-хозяева и трансформированные клетки по настоящему изобретению культивируют в обычной питательной среде. Подходящие условия культивирования, такие как температура, рН и т.п., известны специалистам в данной области. Кроме того, некоторые предпочтительные условия культивирования можно найти в научной литературе, например, в Hopwood (2000) Practical Streptomyces Genetics, John Innes Foundation, Norwich UK; Hardwood et al., (1990) Molecular Biological Methods for Bacillus, John Wiley и из методических указаний Американской коллекции типовых культур (ATCC).
В некоторых вариантах осуществления изобретения клетки-хозяева, трансформированные полинуклеотидными последовательностями, кодирующими слитые с ТАТ белки, например, слитые белки ТАТ-ОРН, культивируют при условиях, подходящих для экспрессии и выделения из клеточной культуры кодируемого белка. Продуцируемый рекомбинантной клеткой-хозяином белок секретируется в культуральную среду. В некоторых вариантах осуществления изобретения другие рекомбинантные конструкции соединяют гетерологичные полинуклеотидные последовательности, кодирующие белки ТАТ-ОРН, с последовательностью нуклеиновой кислоты, кодирующей полипептидный домен, который облегчает очистку растворимых белков (Kroll DJ et al (1993) DNA Cell Biol 12:441-53).
Такие облегчающие очистку домены включают, но не ограничены, металл-хелатирующие пептиды, такие как гистидин-триптофановые модули, которые позволяют очистку на иммобилизованных металлах (Porath J (1992) Protein Expr Purif 3:263-281), домены белка А, которые позволяют очистку на иммобилизованных иммуноглобулинах, и домен, используемый в системе аффинной очистки антителами на FLAG-пептиде (Immunex Corp, Seattle WA). Также для облегчения очистки между доменом, используемым для очистки, и гетерологичным белком можно включить линкерную последовательность, расщепляемую Фактором ХА или энтерокиназой (Invitrogen, San Diego CA).
В некоторых предпочтительных вариантах осуществления изобретения культивирование трансформированных клеток-хозяев по настоящему изобретению осуществляют в подходящей питательной среде при условиях, позволяющих экспрессию настоящей ОРН, после которой полученную ОРН выделяют из культуры. Используемая для культуры клеток среда включает любую обычную среду, подходящую для роста клеток-хозяев, такая как минимальная или комплексная среда, содержащая соответствующие добавки. Подходящая среда доступна от коммерческих поставщиков, или ее можно приготовить по опубликованным прописям (например, в каталогах Американской коллекции типовых культур). В некоторых вариантах осуществления изобретения ОРН, продуцируемую клетками, выделяют из культуральной среды стандартными методиками, включающими, но не ограниченными, отделение клеток-хозяев от среды, с помощью центрифугирования или фильтрации, осаждение белкового компонента надосадочной жидкости или фильтрата с помощью соли (например, сульфата аммония), хроматографическую очистку (например, ион-обменную, гель-фильтрационную, аффинную и т.д.). Таким образом, в настоящем изобретении можно использовать любой способ, подходящий для выделения ОРН. Без сомнения, не предполагается, что настоящее изобретение ограничено каким-либо конкретным способом очистки.
В некоторых вариантах осуществления идея настоящего изобретения касается способа получения представляющего интерес белка в клетке-хозяине. Способ включает экспрессию полинуклеотида по изобретению в клетке-хозяине, культивирование клетки-хозяина в среде и выделение представляющего интерес белка из среды.
Способы по изобретению можно применять на практике, а экспрессированный белок можно выделять в мелком или крупном масштабе, например, в промышленном масштабе. В некоторых вариантах осуществления идея настоящего изобретения касается представляющего интерес белка, продуцируемого способами по изобретению. В некоторых вариантах осуществления изобретения представляющий интерес белок находится в свернутой форме или в своей активной форме.
Аспекты идеи настоящего изобретения можно далее понять из нижеследующих примеров, которые не следует толковать, как ограничивающие объем идеи настоящего изобретения. Для специалистов в данной области будет очевидно, что на практике можно использовать различные модификации (как материалов, так и способов), не отходя от идеи настоящего изобретения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В следующем ниже описании экспериментов используют следующие сокращения: эк. (эквиваленты); М (Молярная); мкМ (микромолярная); N (нормальная); моль (моли); ммоль (миллимоли); мкмоль (микромоли); нмоль (наномоли); г (граммы); мг (миллиграммы); кг (килограммы); мкг (микрограммы); л (литры); мл (миллилитры); мкл (микролитры); см (сантиметры); мм (миллиметры); мкм (микрометры); нм (нанометры); °С (градусы Цельсия); ч (часы); мин (минуты); с (секунды); мсек (миллисекунды); TY, триптон-дрожжевой экстракт; Ар, ампициллин; ДТТ, дитиотреитол; Em, эритромицин; HPDM, среда с высоким содержание фосфата; ММ, минимальная среда; OD, оптическая плотность; ПААГЭ, электрофорез в полиакриламидном геле; ПЦР, полимеразная цепная реакция.
ПРИМЕР 1: Создание экспрессионных плазмид для продукции ОРН в клетках-хозяевах Streptomyces
Экспрессируемый в клетках-хозяевах штамма g3s3 Streptomyces lividans белок ОРН содержал следующую аминокислотную последовательность:

И его кодирует соответствующий ген ОРН (SEQ ID NO:22), который был синтезирован компанией GeneArt Inc. (Toronto, Canada) с оптимизацией кодонов под гены видов рода Streptomyces.

Для экспрессии ОРН в клетках-хозяевах Streptomyces lividans использовали следующие полинуклеотиды, кодирующие сигнальные последовательности:
1. Укороченную сигнальную последовательность celA;
2. Сигнальную последовательность ASP;
3. ТАТ1: сигнальную последовательность ОРН, оптимизированную для экспрессии в Streptomyces
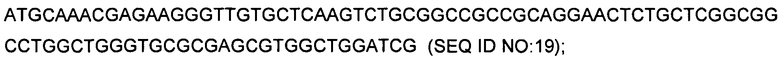
4. ТАТ2: модифицированный возможный сигнальный пептид из SCO6272

5. ТАТ3: возможный сигнальный пептид SCO624

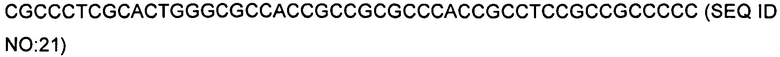
Плазмида рКВ229 была сконструирована на основе плазмиды рКВ105 путем замещения сегмента, кодирующего сигнальный пептид celA и каталитическое ядро целлюлазы, на слитую полинуклеотидную последовательность, кодирующую сигнальный пептид ОРН (TAT1; SEQ ID NO:19) и белок OPH (SEQ ID NO:18). Смотри фигуру 2.
Плазмида рКВ231 была сконструирована на основе плазмиды рКВ105 путем замещения сегмента, кодирующего сигнальный пептид celA и каталитическое ядро целлюлазы, на слитую полинуклеотидную последовательность (SEQ ID NO:20), кодирующую сигнальный пептид TAT2 (SEQ ID NO:1) и белок OPH (SEQ ID NO:18). Смотри фигуру 3.
Плазмида рКВ233 была сконструирована на основе плазмиды рКВ105 путем замещения сегмента, кодирующего сигнальный пептид celA и каталитическое ядро целлюлазы, на слитую полинуклеотидную последовательность (SEQ ID NO:21), кодирующую сигнальный пептид TAT3 (SEQ ID NO:5) и белок OPH (SEQ ID NO:18). Смотри фигуру 4.
Для получения ОРН в ферментере, экспрессионный вектор рКВ234 получали из рКВ233 путем удаления ДНК-последовательностей E. coli в рКВ233. Для удаления последовательностей E. coli рКВ233 расщепляли SphI, EcoRI и HindIII в течение ночи при 37°С. Расщепленную ДНК очищали с использованием набора от компании Qiagen, и повторно лигировали для трансформации в клетки-хозяева Streptomyces. На фигуре 5 показан вектор рКВ234.
ПРИМЕР 2: Экспрессия и активность ОРН, продуцируемой клетками-хозяевами Streptomyces
В следующем примере описан эффект различных сигнальных пептидов ТАТ на экспрессию и активность ОРН.
Трансформация и экспрессия:
В этом примере использовали экспрессионные векторы рКВ229, рКВ231 и рКВ233, описанные выше.
В этих экспериментах клетки-хозяева Streptomyces lividans трансформировали векторами, описанными выше. Методикой трансформации являлся метод трансформации протопластов, описанный в Hopwood, et al., GENETIC MANIPULATION OF STREPTOMYCES, A LABORATORY MANUAL. The John Innes Foundation, Norwich, United Kingdom (1985).
Клетки Streptomyces lividans трансформировали одним из экспрессионных векторов, описанных выше. Трансформированные клетки высевали на чашки со средой R5 (Твердая среда R5 на 1 л: 206 г сахарозы, 0,5 г K2SO4, 20,24 г MgCl2, 20 г глюкозы, 0,2 г казаминовых кислот Difco, 10 г дрожжевого экстракта Difco и 11,46 TES, 4 г L-Asp, 4 мл микроэлементов и 44 г агара Difco в 800 мл Н2О. После автоклавирования добавляли 20 мл 5% К2НРО4, 8 мл 5М CaCl2*2Н2О и 14 мл NaOH (1н) до конечного объема 1л. Трансформантов растили в 20 мл TSG в встряхиваемых колбах (250 мл) в течение 2 дней в присутствии 50 мкг/мл тиострептона при 30°С. Затем клетки переносили в среду для продукции (50 мл), свободную от антибиотиков, и клетки продолжали растить в течение еще трех дней. Образцы отбирали для электрофоретического анализа и анализа ферментативной активности.
Среда TSG содержала 16 г триптона Difco, 4 г сойтона Difco, 20 г казеина (гидролизата) Sigma и 5 г К2НРО4 на 1 литр. После автоклавирования добавляли 50% раствор глюкозы (стерилизованный фильтрованием) до конечной концентрации 1,5%.
Среда для продукции: 2,4 г лимонной кислоты (гидрат); 8,3 г дрожжевого экстракта Biospringer; 2,4 г (NH4)2SO4; 72,4 г MgSO4*7H2O; 0,1 г CaCl2*2H2O; 0,3 мл Mazu DF204 (противовспениватель); 5 мл модифицированных микроэлементов для Streptomyces (1 литр концентрированного раствора содержит: 250 г лимонной кислоты (гидрат); 3,25 г FeSO4*7H2O; 5 г ZnSO4*7H2O; 5 Г MnSO4*H2O; 0,25 г H3BO3); 10 г глюкозы, довести объем до 1 литра. Подвести рН до 6,9 с помощью NaOH. В некоторых экспериментах в среду для экспрессии добавляли или Zn2+, или Co2+.
Выделение
Отбирали образец (1 мл клеточной культуры) из каждой встряхиваемой колбы и центрифугировали при скорости 14000 об/мин, чтобы осадить клетки. Секретируемый в культуральную среду фермент ОРН анализировали с помощью электрофореза в ДСН-ПААГ, а активность фермента проверяли, как описано ниже.
Анализ активности ОРН и электрофорез в ДСН-ПААГ
(А) Экспрессию ОРН с вышеперечисленных векторов в клетках S. lividans (дорожки 1-4 и 6-9) анализировали электрофорезом в ДСН-ПААГ, как показано на фигуре 6. Двойная стрелка указывает, что ОРН мигрирует в виде дублета в невосстановительных условиях. Дорожка 1: прямая экспрессия ОРН под контролем промотора А4 без какого-либо сигнального пептида; дорожка 2: экспрессия ОРН с сигнальной последовательностью ТАТ1; дорожка 3: экспрессия ОРН с сигнальной последовательностью ТАТ3; дорожка 4: отрицательный контроль экспрессии с «пустым» вектором (содержащим только промотор А4); дорожка 5: экспрессия ОРН в E. coli в тельцах включения (положительный контроль); дорожка 6: аналогична дорожке 3; дорожка 7: аналогична дорожке 3 за исключением добавки кобальта (до конечной концентрации 0,5 мМ) в среду для продукции; дорожка 8: экспрессия ОРН с сигнальной последовательностью ТАТ2, в среду для продукции был добавлен кобальт до конечной концентрации 0,5 мМ; дорожка 9: экспрессия ОРН с сигнальной последовательностью ТАТ1 с кобальтом в конечной концентрации 0,5 мМ.
В результате было показано, что продукция ОРН бактериальными клетками-хозяевами была выше при экспрессии ОРН в виде слитых белков ТАТ2-ОРН или ТАТ3-ОРН по сравнению с продукцией ТАТ1-ОРН. Экспрессия слитого полинуклеотида ТАТ3-ОРН приводила к наибольшей продукции ОРН клетками-хозяевами Streptomyces.
(B) Исследовали эффект добавления ионов Zn2+ и Co2+ среду для продукции на продукцию ОРН. На фигуре 7 показан эффект добавления Zn2+ и Co2+ на продукцию ОРН и стабильность при хранении ОРН при экспрессии ее с сигнальным пептидом ТАТ3. На дорожках 1, 2 и 3 показан уровень продукции ОРН, экспрессированной как ТАТ3-ОРН, с последующим хранением при 4°С, -20°С и -20°С в 20% глицерине, соответственно. На дорожках 4, 5 и 6 показан уровень продукции ОРН, экспрессированной как ТАТ3-ОРН в присутствии 0,1 мМ Zn2+, с последующим хранением при 4°С, -20°С и -20°С в 20% глицерине, соответственно. На дорожках 7, 8 и 9 показан уровень продукции ОРН, экспрессированной в виде ТАТ3-ОРН в присутствии 0,1 мМ Со2+, с последующим хранением при 4°С, -20°С и -20°С в 20% глицерине, соответственно. Последовательность предполагаемой полосы ОРН подтверждали с помощью масс-спектрометрического пептидного картирования, и оно приведено на фигуре 8.
Эти данные указывают на то, что уровень экспрессии ОРН аналогичен в присутствии или в отсутствие ионов металлов, и что лучше всего хранить ОРН или при 4°С или, при -20°С.
(С) Проверяли активность образцов, соответствующих образцам 1-9 на фигуре 7 (Caldwell et al. Biochemistry 30:7438-7444 [1991]; Rastogi et al., Biochem Biophys Res Commun 241:294-296 [1997]). Поскольку субстраты параоксон и VX, используемые для определения активности ОРН, высокотоксичны, то для анализа удельной активности ОРН надосадочные жидкости из различных встряхиваемых колб для качания посылали в армию США (US Army-ECBC, AMSRD-ECB-RT-BP, E-3150 Kingscreek St. N. APG, MD 21010).
Удельная активность ОРН показана на фигуре 9. Столбцы, приведенные как ОРН 1-9, соответствуют образцам в дорожках 1-9 на фигуре 7. Эти данные свидетельствуют, что ОРН, экспрессируемая в виде белка, слитого с сигнальным пептидом ТАТ3 и получаемая в клетках-хозяевах Streptomyces, сохраняет способность к разложению фосфорорганических соединений.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОГЕНЫ ДЛЯ ВАКЦИНАЦИИ ПРОТИВ ВИЧ | 2013 |
|
RU2648791C2 |
| ПОЛИПЕПТИДЫ С ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2005 |
|
RU2393224C2 |
| СПОСОБ АМПЛИФИЦИРОВАНИЯ ЛОКУСОВ В БАКТЕРИАЛЬНОЙ КЛЕТКЕ | 2009 |
|
RU2577985C2 |
| ПРОТЕАЗА Streptomyces | 2008 |
|
RU2486244C2 |
| ЭКСПРЕССИОННЫЕ ВЕКТОРЫ ДЛЯ УЛУЧШЕННОЙ СЕКРЕЦИИ БЕЛКА | 2012 |
|
RU2661790C2 |
| УЛУЧШЕННАЯ ПРОДУКЦИЯ БЕЛКА В BACILLUS | 2008 |
|
RU2515112C2 |
| ГИДРОЛАЗЫ, КОДИРУЮЩИЕ ИХ НУКЛЕИНОВЫЕ КИСЛОТЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2009 |
|
RU2525675C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ ЭНДОПЕПТИДАЗНОЙ АКТИВНОСТЬЮ, И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2011 |
|
RU2583293C2 |
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИОННАЯ КАССЕТА ДЛЯ ЭКСПРЕССИИ ПОЛИПЕПТИДА С ВЫСОКИМ ВЫХОДОМ | 2013 |
|
RU2682884C2 |
| ИММУНОГЕНЫ ДЛЯ ВАКЦИНАЦИИ ПРОТИВ ВИЧ | 2013 |
|
RU2721274C2 |
Изобретение относится к области биотехнологии. Представлен слитый пептид для нейтрализации или разрушения фосфорорганических соединений, содержащий сигнальный пептид ТАТ3 с аминокислотной последовательностью SEQ ID NO: 5, представленной в описании, функционально связанный с последовательностью органофосфатгидролазы SEQ ID NO: 18, классифицируемую как белок ЕС 3.1.8. Описаны выделенный полинуклеотид, кодирующий указанный слитый белок; вектор, содержащий указанный полинуклеотид; и прокариотическая клетка-хозяин, содержащая указанный вектор и экспрессирующая указанный слитый белок. Предложен способ получения фермента, разрушающего фосфорорганические соединения, включающий экспрессию указанного полинуклеотида в прокариотической клетке-хозяине, и продукцию указанного фермента. Изобретение позволяет повысить экспрессию органофосфатгидролазы в клетке-хозяине. 5 н. и 8 з.п. ф-лы, 1 табл., 9 ил., 2 пр.
1. Выделенный полинуклеотид, кодирующий слитый пептид для нейтрализации или разрушения фосфорорганических соединений, содержащий первую последовательность нуклеиновой кислоты, кодирующую сигнальный пептид ТАТ3 с аминокислотной последовательностью SEQ ID NO:5, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей гидролазу триэфира фосфорной кислоты, классифицируемую как белок ЕС 3.1.8.
2. Выделенный полинуклеотид по п.1, в котором указанной гидролазой является органофосфатгидролаза (ОРН).
3. Выделенный полинуклеотид по п.1, в котором указанной гидролазой является органофосфатгидролаза (ОРН) с последовательностью SEQ ID NO:18.
4. Выделенный полинуклеотид по п.1, в котором указанная вторая нуклеиновая кислота, кодирующая указанную гидролазу, оптимизирована для экспрессии указанной гидролазы в клетке-хозяине видов рода Streptomyces.
5. Выделенный полинуклеотид по п.1, в котором указанный выделенный полинуклеотид функционально связан с промотором А4 с последовательностью SEQ ID NO:23.
6. Экспрессионный вектор, содержащий выделенный полинуклеотид по п.1.
7. Выделенная прокариотическая клетка-хозяин, экспрессирующая слитый пептид для нейтрализации или разрушения фосфорорганических соединений, содержащая экспрессионный вектор по п.6.
8. Выделенная прокариотическая клетка-хозяин по п.7, где указанной клеткой-хозяином является клетка-хозяин Streptomyces.
9. Выделенный слитый полипептид для нейтрализации или разрушения фосфорорганических соединений, содержащий сигнальный пептид ТАТ3 с аминокислотной последовательностью SEQ ID NO:5, связанный с органофосфатгидролазой с последовательностью SEQ ID NO:18.
10. Способ получения фермента, разрушающего фосфорорганические соединения, включающий:
(a) экспрессию полинуклеотида по п.1 в прокариотической клетке-хозяине; и
(b) продукцию указанного фермента.
11. Способ по п.10, в котором выделяют указанный фермент, продуцируемый указанной клеткой-хозяином.
12. Способ по п.10, в котором указанной клеткой-хозяином является клетка-хозяин Streptomyces.
13. Способ по п.10, в котором указанным ферментом является органофосфатгидролаза.
| US 20060154329 A1, 13.07.2006 | |||
| US 6469145 B1, 22.10.2002 | |||
| SHARON S | |||
| ROWLAND "The effect of signal sequences on the efficiency of secretion of a heterologous phosphotriesterase by Streptomyces fividans", Appl Microbiol Biotechnol (1992) 38: 94-100 | |||
| DILKS K | |||
| et al., «Prokaryotic utilization of the twin-arginine translocation pathway: a genomic |
Авторы
Даты
2013-07-20—Публикация
2008-06-02—Подача