ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к области хирургии и дерматологии.
Данное изобретение относится к инъецируемой композиции, содержащей агонист адренергических рецепторов, предпочтительно бримонидин, и наполнитель, предпочтительно гиалуроновую кислоту. Оно относится к применению композиции для профилактики и/или лечения поверхностных гематом и кровотечений, вызванных эстетическими процедурами.
УРОВЕНЬ ТЕХНИКИ
Поверхностная гематома и, в меньшей степени, кровотечение являются весьма обычными последствиями - согласно опубликованным данным, на них тратится в среднем примерно одна треть времени - многих эстетических процедур, включая кожные наполнители, ботулинические токсины и лазерную шлифовку.
Более выраженная гематома может возникнуть во время хирургических процедур, таких как липосакция, увеличение/лифтинг груди, лифтинг лица и абдоминопластика.
Особый интерес представляет управление мгновенными вторичными реакциями, возникающими в результате подкожной или внутрикожной инъекции наполнителей, приводящей к повреждению сосудов или ломке стенок сосудов, инициируя возникновение кровоподтеков, гематом, утечку компонентов крови, непосредственное действие которых вызывает воспаление, появление красноты и отека.
Хотя красноту, эритему, гематому и кровотечение, как правило, не рассматривают в качестве серьезной проблемы, большинство врачей готовит своих пациентов к подобным возможным последствиям, предупреждая до проведения процедуры о том, чтобы они были к этому готовы. В частности, врачи часто предостерегают от использования до и после процедуры аспирина или других лекарственных веществ-антикоагулянтов, интенсивно используют куски льда сразу после процедуры и довольно часто рекомендуют траву арнику, обычно используемую для ускорения процесса заживления. Эти отрицательные моменты могут отпугивать некоторых пациентов, в частности от проведения эстетических процедур. В частности, что касается таких последствий, как гематомы/кровотечения, то согласно сообщениям врачей, одной из самых значимых проблем для пациентов является время вынужденного бездействия: в случае гематом пациенты предпочитают оставаться дома, а не возвращаться в среду рабочей и социальной активности.
Следовательно, существует потребность купирования гематом/кровотечений, которые случаются во время эстетических или хирургических процедур, главным образом при введении наполнителей.
Настоящее изобретение основано на демонстрации заявителями того, что инъекция агониста адренергических рецепторов вместе с наполнителем уменьшает возникновение кожных реакций, возникающих в результате инъекции.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение предоставляет комбинацию некоторого количества агониста адренергических рецепторов, предпочтительно продукта, известного как бримонидин, с наполнителями или ботулиническими токсинами, предпочтительно гиалуроновой кислотой. Данная комбинация вводится системно нуждающемуся в этом индивидууму.
Данное изобретение предоставляет применение к нуждающемуся в этом индивидууму некоторого количества агониста адренергических рецепторов, предпочтительно продукта, известного как бримонидин, в комбинации с ботулиническими токсинами или наполнителями, предпочтительно гиалуроновой кислотой.
Данное изобретение предоставляет способ сокращения, или уменьшения, или избегания возникновения гематом и, в меньшей степени, кровотечения, в частности, в ходе эстетических процедур, включая кожные наполнители и, предпочтительно, гиалуроновую кислоту, путем предоставления нуждающемуся в этом индивидууму некоторого количества агонистов адренергических рецепторов, предпочтительно продукта, известного как бримонидин.
В первом аспекте изобретение относится к композиции, содержащей: наполнитель или ботулинический токсин; агонист адренергических рецепторов.
Из данного описания очевидно, что данное изобретение относится к профилактике и лечению дефектов кожи, в частности дефектов кожи, возникающих в результате ее старения (складок, морщин, вдавлений кожи, …) или повреждений кожи (рубцов, …).
В последнее время лечение дефектов кожи стало пользоваться большим интересом. В результате были предложены соединения для внутрикожного и подкожного введения.
В качестве одной из возможностей могут быть инъецированы локально ботулинические токсины, которые способны вызывать паралич или сокращение мышц.
Альтернативно и в предпочтительном варианте осуществления можно вводить наполнитель. Наполнитель, согласно общему определению, представляет собой биоматериал, способный заполнять кожные ткани. Инъецируемая заявленная композиция, содержащая указанный наполнитель в водной среде и демонстрирующая свойства наполнения, также может быть определена как “кожный наполнитель”.
В этом контексте могут использоваться такие соединения, как полиакриламидные гели, полиметилметакрилатные (PMMA) частицы или силиконы.
Наиболее предпочтительные соединения представляют собой рассасывающиеся молекулы, такие как гиалуроновая кислота, коллаген, альгинат, декстран, эластин или полиуретановые гели.
Гиалуроновая кислота или гиалуронат представляет собой несульфатированный гликозаминогликан, широко распространенный в соединительных, эпителиальных и нервных тканях. Он является одним из главных компонентов внеклеточного матрикса. Он играет существенную роль в пролиферации и миграции клеток, а также в гидратации кожи и придании ей эластичности. Уровень гиалуроновой кислоты с возрастом уменьшается как в количественном, так и в качественном отношениях, вызывая сухость кожи и появление морщин.
Гиалуроновая кислота является биополимером природного происхождения, который образует очень вязкие водные растворы и поэтому широко используется в качестве фармацевтического продукта. Кроме того, предполагается, что это соединение является практически безопасным, поскольку не вызывает никакой иммуногенной реакции. До настоящего момента наблюдалось лишь несколько незначительных нежелательных эффектов.
Вследствие этого и предпочтительно, наполнителем является гиалуроновая кислота или ее фармацевтически приемлемая соль или производное, в частности соль калия или натрия. Гиалуроновая кислота может использоваться в разных формах: в виде солей, производных, таких как сложные эфиры или амиды, линейных или сшитых молекул. В частности, молекулярная масса, обычно находящаяся между 500 кДа и 5000 кДа, и степень сшивки зависят от применения, главным образом от глубины заполняемых морщин.
Второй компонент заявленной композиции представляет собой агонист адренергических рецепторов. Известно, что агонисты адренергических рецепторов связывают и активизируют адренергические рецепторы.
В данной области техники хорошо известно, что адренергические рецепторы включают в себя как α, так и β рецепторы. Что касается α-адренорецепторов, в 1970-х были идентифицированы α1 и α2 рецепторы. За эти десять лет было обнаружено, что α2 рецепторы встречаются в гладкой мускулатуре сосудов и принимают опосредованное участие в сосудосуживающей реакции (“Subtypes of functional α 1 - and α 2 -adrenoceptors” JR Docherty; European Journal of Pharmacology 361 (1998) 1-15). Таким образом, молекулы, демонстрирующие действие α адренергического агониста, преимущественно α2 адренергического агониста, обладают периферическим сосудосуживающим действием.
Агонисты, используемые в заявленной композиции, могут быть направлены на α и/или β рецепторы. Однако молекулы, действующие как β адренергические агонисты, главным образом исключаются из-за вызываемых ими возможных побочных эффектов. Далее в настоящей заявке молекулы, не обладающие сродством к β адренергическим рецепторам, называются “агонистами α-адренергических рецепторов”.
Что касается α рецепторов, агонист может представлять собой агонист как α1, так α2 рецепторов, или он может быть специфичным к α1 или α2 рецептору. Предпочтительно, когда выбранная молекула обладает более высоким сродством к α2 по сравнению с α1 рецептором, и далее в настоящей заявке, как правило, называемая “агонистом α2-адренергических рецепторов”.
В предпочтительном варианте осуществления агонист адренергических рецепторов представляет собой агонист α2-адренергических рецепторов, предпочтительно бримонидин.
Агонисты α2 адренорецепторов использовались для лечения ряда состояний, включая гипертензию, острую сердечную недостаточность, стенокардию, спастичность, глаукому, диарею, и для подавления наркотической абстиненции (J. P. Heible and R. R. Ruffolo, Therapeutic Applications of Agents Interacting with α-Adrenoceptors, p. 180-206 in Progress in Basic and Clinical Pharmacology Vol. 8, P. Lomax and E. S. Vesell Ed., Karger, 1991).
Агонисты адренорецепторов, такие как клонидин, изначально вводились перорально, хотя известна лекарственная форма в виде пластыря. Известно, что α2 агонисты принимают опосредованное участие в сужении сосудов пациента как центральных, так и периферических. В частности, известно, что агонисты α2 адренорецепторов вызывают сужение сосудов мелких периферических артерий в ответ на стимуляцию холодом или стрессом.
В ряде патентов описано применение бримонидина для лечения глазных состояний и глазных болезней. В канадском патенте CA2326690 описано использование глазных препаратов локального применения для их нанесения только на глаза с целью лечения глазных болезней.
Как уже указывалось выше, наиболее предпочтительное соединение в контексте настоящего изобретения представляет собой (5-бром-хиноксалин-6-ил)-(4,5-дигидро-1H-имидазол-2-ил)-амин (обычно называемое бримонидином) и его фармацевтически приемлемые соли, в частности соль винной кислоты.
Другие соединения, известные как агонисты α2 адренорецепторов, которые могут быть использованы в рамках настоящего изобретения, представляют собой клонидин и апоклонидин.
В более широком смысле, другие соединения, которые являются агонистами адренорецепторов, представляют собой: синефрин, октодрин, вазопрессин и аналоги, орнипрессин, мидодрин, фенилэфрин, ксилометазолин, оксиметазолин, норэпинефрин, метоксамин.
Соединения, которые также обладают сродством к β рецепторам, но которые могут использоваться в определенных условиях, представляют собой: эпинефрин, эфедрин, этилефрин.
В объем настоящего изобретения, безусловно, также включены фармацевтически приемлемые соли всех этих соединений.
Согласно настоящему изобретению используемый здесь термин “фармацевтически приемлемая соль(и)” означает такие соли соединений по изобретению, которые являются безопасными и эффективными для топического применения млекопитающими, и которые обладают требуемой биологической активностью. Фармацевтически приемлемые соли включают соли кислых или основных групп, присутствующих в соединениях по изобретению.
Фармацевтически приемлемые кислые соли включают, без ограничений, гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Некоторые соединения по изобретению могут образовывать фармацевтически приемлемые соли с различными аминокислотами.
Подходящие основные соли включают, без ограничений, соли алюминия, кальция, лития, магния, калия, натрия, цинка и соли диэтаноламина. Краткий обзор фармацевтически приемлемых солей см. BERGE ET AL., 66 J. PHARM.Sci. 1-19 (1977).
Согласно первому варианту осуществления заявленная композиция содержит только наполнитель или его смесь и агонист адренергических рецепторов или их смесь, преимущественно гиалуроновую кислоту и бримонидин.
Согласно альтернативному варианту осуществления заявленная композиция также содержит один или несколько дополнительных компонентов.
Один или несколько других компонентов могут быть активными компонентами, например обезболивающим средством. Предпочтительное обезболивающее средство представляет собой лидокаин или его фармацевтически приемлемую соль. Другие активные компоненты представляют собой, например, факторы роста, пептиды …
Заявленная композиция также может содержать другие фармацевтические приемлемые компоненты, такие как носители, наполнители, консерванты …
В одном из вариантов осуществления соединения по изобретению вводят нуждающемуся в этом пациенту системно, предпочтительно в виде инъекции. Следовательно, в контексте настоящего изобретения соединения доставляются в пораженную область кожи в фармацевтически приемлемом носителе. Используемый здесь фармацевтически приемлемый носитель представляет собой любую фармацевтически приемлемую лекарственную форму, которая может быть нанесена на кожу для кожной, внутрикожной или подкожной доставки фармацевтического средства или лекарственного средства. Комбинация фармацевтически приемлемого носителя и соединения по изобретению называется инъецируемой лекарственной формой по изобретению.
В объеме данного изобретения композиция представляет собой фармацевтически приемлемую инъецируемую лекарственную форму. В контексте настоящего изобретения “фармацевтически приемлемая инъецируемая лекарственная форма” означает любую лекарственную форму, которая является фармацевтически приемлемой для системной доставки. Предпочтительно, композицию вводят в поверхностные, срединные или глубокие слои кожи подкожно или внутрикожно. Как правило, заявленная композиция предоставляется в виде раствора или геля, предпочтительно в виде водного раствора или геля.
Заявленная композиция составлена или содержит терапевтически эффективное количество агонистов адренергических рецепторов и наполнителей. Используемое здесь “терапевтически эффективное количество соединения по изобретению” означает минимальное количество соединения, которое эффективно для получения желаемого эффекта в контексте изобретения.
Как правило, заявленная композиция содержит:
- наполнитель, предпочтительно ГК, в количестве от 1% до 2,5% от массы композиции;
- агонист адренергических рецепторов, предпочтительно бримонидин, в количестве от 0,0001% до 1% от массы композиции;
- необязательно обезболивающее средство в количестве от 0,01% до 3% от массы композиции.
Как уже указывалось выше, заявленная композиция предназначена для введения субъекту или пациенту, главным образом в виде инъекции в лицевую область (лоб, глаза, носогубные складки …). Используемые здесь термины “субъект” или “пациент” являются взаимозаменяемыми и означают любое животное, предпочтительно млекопитающее, более предпочтительно человека, которому будет или было введено соединение или лекарственная форма по изобретению. Используемый здесь термин “млекопитающие” включает любое млекопитающее.
Следовательно, изобретение также предоставляет лекарственную форму для доставки системной дозы соединения пациенту. На практике, в ходе лечения, количество активных соединений является следующим:
- для наполнителя, предпочтительно ГК: от 0,05 мг/кг до 2 мг/кг массы тела, что составляет от 5 мг до 100 мг;
- для агониста адренергического рецептора, предпочтительно бримонидина: от 5·10-3 мкг до 0,8 мг/кг массы тела, что составляет от 0,5 мкг до 40 мг.
В предпочтительном варианте осуществления объем вводимой заявленной композиции составляет от 0,1 до 10 мл, обычно от 0,5 до 4 мл. Предпочтительно, указанный объем предоставляется в шприце в виде единичной дозы. Указанную инъекцию можно повторять, например через 4-18 месяцев.
Другой аспект изобретения относится к производству изделия, содержащего лекарственную форму для системного введения по изобретению в подходящем контейнере с этикеткой и инструкцией по применению. Контейнер преимущественно представляет собой шприц с единичной дозой.
Предпочтительно, инструкция находится в упаковке вместе с лекарственной формой по изобретению, например в виде брошюры или этикетки на упаковке. В инструкции на этикетке даны указания по введению лекарственной формы по изобретению, по количеству и продолжительности, достаточной для лечения пациента. Предпочтительно, этикетка содержит дозировку и инструкции по введению, состав композиции, клиническую фармакологию, резистентность к лекарственному веществу, фармакокинетические параметры, проницаемость, биоусвояемость и противопоказания.
Инъецируемая заявленная композиция затем может быть включена в набор, содержащий шприцы, заполненные указанной композицией. В указанном наборе два активных агента, т.е. наполнитель и агонист адренергических рецепторов, могут быть представлены в виде смеси, содержащейся в шприце, или могут находиться в двух раздельных шприцах для приготовления смеси непосредственно перед введением.
Заявленная композиция преимущественно стерилизована в условиях, подходящих для сохранения эффективности активных агентов.
Как уже было указано выше, заявленная композиция предназначена для профилактики и/или лечения дефектов кожи, главным образом складок, морщин, вдавлений кожи и рубцов. Оно относится к области косметологии или терапевтического лечения.
Согласно изобретению было показано, что основное преимущество заявленной комбинации заключается в сокращении, уменьшении или избегании возникновения эритемы, экхимозов, гематом или кровотечений, главным образом, инициированных инъекцией кожного наполнителя.
Другие потенциальные преимущества заявленной композиции являются следующими:
- если композиция дополнительно содержит обезболивающее средство, например лидокаин, то эффективность указанного обезболивающего средства улучшается: сосудосуживающий эффект, обеспечиваемый α-адренергическим агонистом, ограничивает распространение обезболивающего на большую площадь, таким образом способствуя проявлению эффективности обезболивающего средства строго на участке инъекции;
- за счет уменьшения воспаления наполнитель сохраняется дольше, возможно благодаря более медленной деградации: чем сильнее воспаление, вызываемое наполнителем, тем более серьезная реакция ткани и тем выше уровень различных воспалительных реакций, приводящих, таким образом, к более быстрой деградации наполнителя. Введение в наполнитель сосудосуживающих молекул может ограничить возникновение воспалительных реакций до участка инъекции;
- наблюдается уменьшение отека и припухлости: по той же самой причине, что и в случае предыдущего преимущества, сосудосуживающая активность наполнителя ограничивает приток жидкости в результате реакции на инъекцию, таким образом препятствуя концентрированию жидкости в районе участка инъекции.
В более широком смысле, заявленная композиция предназначена для сокращения, уменьшения или избегания возникновения всех нежелательных кожных реакций (непосредственно и/или опосредованно) на инъекцию, которые включает экхимозы, гематомы или кровотечения, а также, возможно, красноту, эритему, отек, некроз, изъязвление, припухлость и воспаление.
Заявленная композиция, содержащая два активных агента, может применяться одновременно, отдельно или последовательно. Другими словами, настоящее изобретение предоставляет набор, объединяющий некоторое количество агониста адренергических рецепторов, и, предпочтительно, продукт, известный как бримонидин, с наполнителями, предпочтительно гиалуроновой кислотой.
Дополнительно к сказанному выше предоставляются приведенные ниже примеры с целью иллюстрации конкретных вариантов осуществления, а не ограничения объема изобретения.
ПРИМЕРЫ
ОПИСАНИЕ ЧЕРТЕЖЕЙ
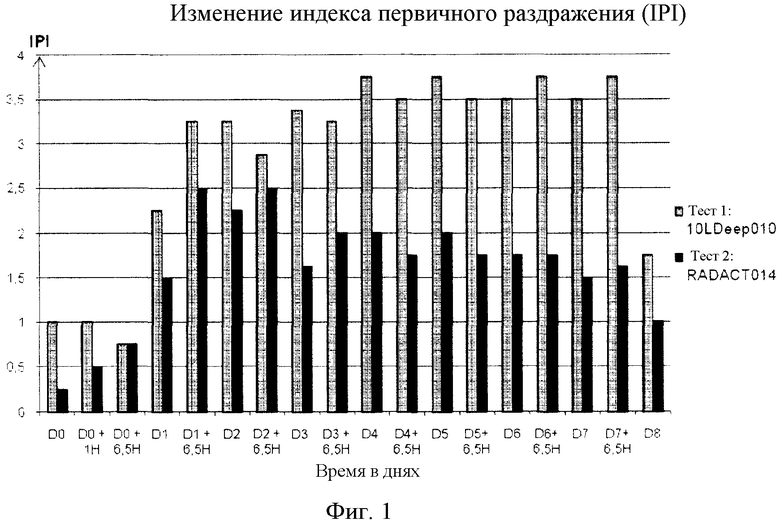
На Фиг.1 показано изменение индекса первичного раздражения (IPI) между Днем 0 и Днем 8 для заявленной композиции (тест 2) по сравнению с одним только наполнителем (тест 1).
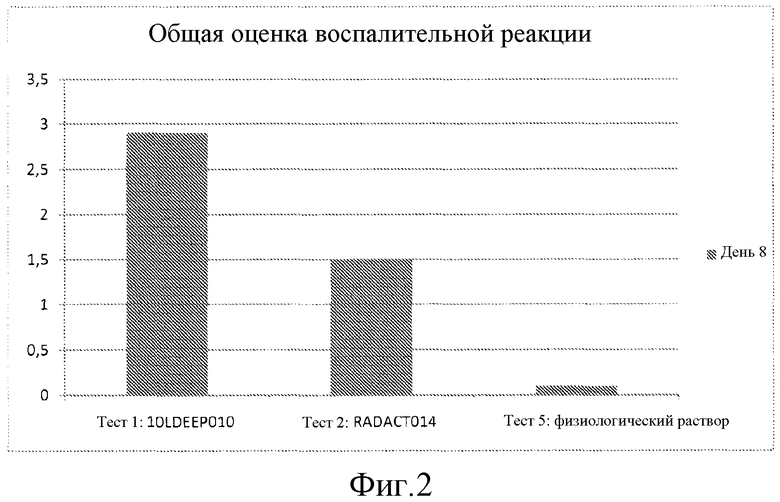
На Фиг.2 показан общий показатель воспалительной реакции на День 8 для заявленной композиции (тест 2) по сравнению с одним только наполнителем (тест 1).
КРАТКОЕ ОПИСАНИЕ ИССЛЕДОВАНИЯ
Внутрикожное тестирование кожного наполнителя на основе гиалуроновой кислоты, содержащего лидокаин и сосудосуживающее средство (бримонидин) под названием RADACT014, вводили для оценки потенциальных возможностей бримонидина уменьшать раздражение после внутрикожной инъекции наполнителя кролику.
Двум взрослым кроликам внутрикожно вводили 0,2 мл тестируемого продукта RADACT014 (тест 2), 0,9% NaCl (тест 5: отрицательный контроль) и 10LDEEP010 (такой же наполнитель в виде гиалуроновой кислоты, что и в RADACT014, но без лидокаина или бримонидина; тест 1: положительный контроль).
Результаты, полученные с использованием наполнителя, содержащего бримонидин (партия RADACT014 (тест 2)), сравнивали с кожным наполнителем без бримонидина (положительный контроль: тест 1).
Участки изучали с Дня 0 до Дня 8 после инъекции на наличие явной кожной реакции, такой как эритема, отек и некроз (Фиг.1), а изучение реакции тканей на микроскопическом уровне проводили с помощью гистологического исследования после умерщвления животных на День 8 (Фиг.2).
Исследования проводили согласно требованиям стандарта ISO 10993: Биологическая оценка медицинских устройств, часть 10: Тест на раздражение и гиперчувствительность замедленного типа (Biological Evaluation of medical devices, Part 10: Test for irritation and delayed type hypersensitivity).
МАТЕРИАЛЫ И СПОСОБЫ
ПРИГОТОВЛЕНИЕ КОНТРОРЛЬНОГО СШИТОГО ГИАЛУРОНОВОГО НАПОЛНИТЕЛЯ: 10LDEEP010
Наполнитель 10LDEEP010 в виде сшитой гиалуроновой кислоты (тест 1) получали сшивкой гиалуроната натрия бактериального происхождения с характерной молекулярной массой примерно 2-4·106 Да, используя 25% BDDE. В конце процесса сшивки к сшитой гиалуроновой кислоте добавляли гидрохлорид лидокаина до достижения концентрации 03%. Гомогенную смесь лидокаина получали путем экструзии смеси через сетку. Полученный гель упаковывали в шприцы объемом 1 мл с концентрацией 20 мг/мл и стерилизовали паром.
ПРИГОТОВЛЕНИЕ КОНТРОЛЬНОГО СШИТОГО ГИАЛУРОНОВОГО НАПОЛНИТЕЛЯ, СОДЕРЖАЩЕГО БРИМОНИДИН: RADACT014
Ту же самую гиалуроновую кислоту сшивали в тех же самых условиях сшивки для получения наполнителя без лидокаина. Параллельно, готовили 4 н раствор гидроксида натрия, используя 8 г NaOH и 42 г очищенной воды. Другой раствор, содержащий бримонидин и лидокаин, получали путем растворения 0,22 г тартрата бримонидина и 0,33 г гидрохлорида лидокаина в 9,45 мл фосфатного буфера. Раствором NaOH доводили pH до 6. Затем бримонидин и раствор лидокаина фильтровали через 0,22-микронный фильтр.
Наполнитель, содержащий бримонидин и лидокаин, называемый RADACT014 (тест 2), получали путем осторожного смешивания 5 г раствора, содержащего 2 активных вещества, с 50 г ранее сшитого гиалуронового геля в 3 стадии: 5 минутного механического перемешивания с последующим 15-минутным перерывом, а затем дополнительное 5-минутное перемешивание. Полученный гель упаковывали в шприцы объемом 1 мл и стерилизовали паром. Конечную концентрацию активных агентов определяли после расщепления гиалуронидазой: для бримонидина, как равной 0,16% методом ВЭЖХ/МС/МС; а для лидокаина, как равной 0,29% методом ВЭЖХ.
ИЗУЧЕНИЕ УМЕНЬШЕНИЯ НЕМЕДЛЕННО ВОЗНИКАЮЩИХ НЕЖЕЛАТЕЛЬНЫХ ЯВЛЕНИЙ
Потенциальные возможности RADACT014 уменьшать раздражение оценивали с помощью тестов, проводимых на животных согласно требованиям стандарта ISO 10993-10: Биологическая оценка медицинских устройств, часть 10: Тест на раздражение и гиперчувствительность замедленного типа (Biological Evaluation of medical devices, Part 10: Test for irritation and delayed type hypersensitivity).
Протокол исследований
В День 0 (D0) двум взрослым кроликам вводили внутрикожно по 0,2 мл тестируемых продуктов (тест 1: 10LDEEP010 и тест 2: RADACT014) и отрицательного контроля (тест 5: физиологический раствор) в виде инъекции, используя 27G иглу. В этих условиях были введены все 4 продукта в 4-е участка.
Затем участки введения инъекций осматривали два раза в сутки со Дня 0 до Дня 8 на наличие явной кожной реакции, такой как эритема, отек, изъязвление и некроз, которая оценивалась согласно следующим критериям:
(1) слабый
(2) средний
(3) заметный
(4) сильный
(1) слабый
(2) средний
(3) заметный
(4) сильный
На День 8 животные были подвергнуты эвтаназии, а участки введения инъекций были собраны и зафиксированы для гистологического анализа. Для оценки указанных ниже критериев проводили микроскопические исследования:
Фибрин
Некроз
Дегенерация ткани
Гранулоцит
PMN эозинофилы
Лимфоциты
Плазмоциты
Макрофаги
Гигантские клетки
Фиброциты
Новые сосуды
Реконструкция пери- и интраимплантатной ткани
Деградация материала
(0) нет
(1) слабый
(2) средний
(3) заметный
(4) сильный
Обсуждение результатов
В этом исследовании не было ни отека, ни некроза. Кроме того, только в отношении 10LDEEP010 наблюдалось небольшое и постоянное изъязвление со Дня 2 до Дня 8.
1. Индекс первичного раздражения (IPI)
IPI тестируемого продукта определяли для каждой временной точки обследования следующим образом:

Отрицательный контроль, тест 5: физиологический раствор
В каждом осмотре IPI отрицательный контроль был равен 0.
Полученные результаты показаны на Фиг.1.
10LDEEP010 (тест 1) показал в эксперименте самую высокую оценку индекса раздражения: индекс увеличивался в День 0 и День 1, а затем оставался стабильным. Этот продукт является очень раздражающим.
Содержащий бримонидин продукт, называемый RADACT014, тест 2, показал самую низкую оценку IPI: увеличение наблюдалось со Дня 0 до Дня 2, а затем ко Дню 7 стабилизировалось и в День 8 наконец уменьшалось.
Уменьшение воспалительного действия кожного наполнителя в продукте RADACT014 было очевидным и стабильным со Дня 3; таким образом, был продемонстрирован положительный эффект бримонидина на раздражение.
2. Гистологический анализ
Общую оценку воспаления определяли на основе гистологических наблюдений количества и типа клеток, репрезентативных относительно локальной толерантности.
На Фиг.2 приведена общая оценка воспаления по каждому продукту.
На День 8 были отмечены умеренные (10LDEEP010) до ограниченных (RADACT014) воспалительных инфильтратов, основная популяция клеток представляла собой макрофаги с несколькими эозинофилами. В отрицательном контроле (физиологический раствор, тест 5) не наблюдалась никакая определенная реакция.
3. Заключение
Это исследование показало, что кожный наполнитель (тест 1: 10LDeep010), инъецируемый на участок кожи, вызывает некоторую воспалительную реакцию с небольшим изъязвлением. Воспалительную реакцию можно уменьшить путем введения активной молекулы (бримонидина) в кожный наполнитель такого вида (RADACT014). Преимущества, обеспечиваемые использованием молекулы бримонидина в комбинации с наполнителем, демонстрируют как явные симптомы (эритема, отек, изъязвление и некроз), так и гистологические исследования.
Изобретение относится к фармацевтической промышленности и представляет собой инъецируемую композицию в виде комбинированного препарата для одновременного, раздельного или последовательного применения для сокращения, уменьшения или избегания возникновения кожных реакций, инициируемых инъекцией, в частности красноты, экхимоза, гематомы, кровотечения, эритемы, отека, некроза, изъязвления, припухлости и/или воспаления, содержащую наполнитель, способный заполнить кожные ткани, или ботулинический токсин, агонист α-адренергических рецепторов. Изобретение обеспечивает уменьшение кожных реакций, возникающих в результате инъекции наполнителей, способных заполнить кожные ткани. 3 н. и 11 з.п. ф-лы, 2 ил.
1. Инъецируемая композиция в виде комбинированного препарата для одновременного, раздельного или последовательного применения для сокращения, уменьшения или избегания возникновения кожных реакций, инициируемых инъекцией, в частности красноты, экхимоза, гематомы, кровотечения, эритемы, отека, некроза, изъязвления, припухлости и/или воспаления, содержащая:
наполнитель, способный заполнить кожные ткани, или ботулинический токсин;
агонист α-адренергических рецепторов.
2. Композиция по п.1, где агонист адренергических рецепторов представляет собой агонист α2-адренергических рецепторов, предпочтительно бримонидин.
3. Композиция по п.1, где наполнитель представляет собой гиалуроновую кислоту.
4. Композиция по п.1, где композиция дополнительно включает обезболивающее средство, предпочтительно лидокаин.
5. Композиция по п.1, где композиция содержит:
наполнитель, предпочтительно гиалуроновую кислоту в количестве от 1% до 2,5% от массы композиции;
агонист адренергических рецепторов, предпочтительно бримонидин, в количестве от 0,0001% до 1% от массы композиции;
необязательно, обезболивающее средство в количестве от 0,01% до 3% от массы композиции.
6. Композиция по п.1 в виде комбинированного препарата для одновременного, раздельного или последовательного применения.
7. Композиция по п.1 в виде комбинированного препарата для одновременного, раздельного или последовательного применения для профилактики или лечения дефектов кожи, в частности складок, морщин, вдавлений кожи и рубцов.
8. Композиция по п.1 для применения с целью профилактики или лечения дефектов кожи, в частности складок, морщин, вдавлений кожи и рубцов.
9. Композиция по п.8 для применения с целью сокращения, уменьшения или избегания возникновения кожных реакций, инициируемых инъекцией, в частности красноты, экхимоза, гематомы, кровотечения, эритемы, отека, некроза, изъязвления, припухлости и/или воспаления.
10. Косметический способ профилактики или лечения дефектов кожи, в частности складок, морщин, вдавлений кожи и рубцов, посредством введения нуждающемуся в этом индивидууму композиции по п.1.
11. Способ по п.10 для сокращения, уменьшения или избегания возникновения кожных реакций, инициируемых инъекцией, в частности красноты, экхимоза, гематомы, кровотечения, эритемы, отека, некроза, изъязвления, припухлости и/или воспаления.
12. Набор, содержащий шприцы и композицию по п.1.
13. Набор по п.12 для применения с целью профилактики или лечения дефектов кожи, в частности складок, морщин, вдавлений кожи и рубцов.
14. Набор по п.13 для применения с целью сокращения, уменьшения или избегания возникновения кожных реакций, инициируемых инъекцией, в частности красноты, экхимоза, гематомы, кровотечения, эритемы, отека, некроза, изъязвления, припухлости и/или воспаления.
| US 20090060852 А1, 05.03.2009 | |||
| US 2008293728 А1, 27.11.2008 | |||
| WO 2006092619 А1, 08.09.2006 | |||
| US 20060171974 А1, 03.08.2006 | |||
| Способ испытания на растяжение керамической массы и устройство для его осуществления | 1990 |
|
SU1762236A1 |
| КОМПОЗИЦИЯ ДЛЯ УХОДА ЗА КОЖЕЙ ЛИЦА | 1999 |
|
RU2159111C1 |
Авторы
Даты
2014-10-10—Публикация
2010-05-28—Подача