УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
УФ-облучение, как было показано, является причиной широкого спектра повреждений кожи от преждевременного старения до рака кожи, наиболее распространенного среди всех злокачественных опухолей в Соединенных Штатах. Рак кожи представляет собой злокачественное новообразование эпидермиса/дермы, то есть оно обладает неконтролируемым ростом, поражает соседние ткани, и, если его не лечить, может распространиться по всему телу, метастазируя и, в конечном итоге, убивая организм «хозяина». Базальноклеточная карцинома и плоскоклеточная карцинома представляют собой большинство случаев рака кожи. Лидирующее число смертельных случаев из-за рака кожи связано со злокачественной меланомой. По оценкам в течение всей продолжительности жизни у 20% популяции в Соединенных Штатах будет обнаружен рак кожи.
Помимо рака кожи существуют также доброкачественные опухоли кожи и предраковые опухоли кожи. Доброкачественная опухоль кожи не трансформируется в рак кожи. Примеры доброкачественных опухолей кожи могут включать, но не ограничиваться, родимые пятна (невусы), себорейный кератоз, мягкие бородавки (также называемые папилломы), эпидермоиды или атеромы и дерматофиброму. Предраковая опухоль кожи представляет собой локализованную массу, которая не поражает соседние ткани, и, таким образом, не является злокачественной по определению. Однако со временем они могут дедифференцировать, и становиться злокачественными. Одной из обычных форм предраковой опухоли является внутриэпителиальный рак, при котором клетки являются опухолевыми, и продолжают делиться, но не покидают свое ограниченное пространство.
Опухоли кожи лечат различными методами лечения, такими как хирургическое удаление или удаление методом иссечения, криохирургия, прижигание электрическим током, прижигание химическими веществами, а также радиацией или местными цитотоксическими средствами. Если злокачественные опухоли кожи обнаружены рано, лечение, как правило, является эффективным. Однако лечение все еще остается инвазивным.
Агонист альфа-адренергического рецептора представляет собой лекарство, которое селективно стимулирует альфа-адренергические рецепторы. Альфа-адренергический рецептор имеет два подкласса α1 и α2. Полная селективность между рецепторным агонизмом достигается редко, некоторые агенты обладают частичной селективностью.
Агонисты α-адренорецепторов использовали в терапевтических целях для ряда состояний, включая гипертонию, острую сердечную недостаточность, стенокардию, мышечную спастичность, глаукому, диарею и подавление симптомов наркотической ломки (J.P. Heible and R.R. Ruffolo Therapeutic Applications of Agents Interacting with a-Adrenoceptors, p.180-206 in Progress in Basic and Clinical Pharmacology Vol.8, P.Lomax and E.S. Vesell Ed., Karger, 1991).
Сообщалось о том, что активация альфа-адренорецепторов агонистами альфа-адренорецепторов (например, клонидином, оксиметазолином, дексмедетомидином и проч.) сопряжено с увеличением пролиферации клеточных линий опухоли эпителия грудной железы у субъекта или клеточной линии опухоли грудной железы у мыши. См., например, Vazquez et al., Cancer Chemother Pharmacol. 2006 Jul; 58 (1): 50-61. Epub 2005 Nov 15; and Bruzzone et al., Br J Pharmacol. 2008 Oct; 155 (4): 494-504. Epub 2008 Jul 7. Также сообщалось о том, что агонист альфа2-адренорецептора йохимбин ингибирует пролиферицию и вызывает апоптоз клеток рака поджелудочной железы, указывая на то, что йохимбин можно использовать в качестве противоопухолевого лекарственного средства при раке поджелудочной железы. Shen et al., World J Gastroenterol. 2008 Apr 21; 14(15):2358-63. Дополнительно сообщалось, что стимуляция альфа 2-адренергического рецептора ингибирует холангиокарциному, рак желчных протоков. Kanno et al., Hepatology, 2002, Volume 35, Issue 6 (р 1329-1340). Текущая литература, хоть и не обширная, отмечает, что альфа-адренергические рецепторы могут играть роль в образовании опухолей, и стимуляция или антагонизм этих рецепторов могут привести либо к усилению роста, либо к подавлению ткани опухоли, в зависимости от лежащего в основе клеточного подтипа.
Существует потребность в неинвазивных способах и композициях, которые бы эффективно предотвращали образование опухоли кожи или уменьшали распространение опухоли кожи, в частности для опухолей кожи, вызываемых УФ-облучением. Настоящее изобретение относится к таким улучшенным способам и композициям.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Неожиданно обнаружено, что лечение агонистом α2-адренергического рецептора приводит к значительной отсрочке образования опухоли кожи и к значительной регрессии роста опухоли кожи у субъектов, подвергшихся воздействию УФ-облучения.
В одном общем аспекте варианты осуществления настоящего изобретения относятся к способу предотвращения образования опухоли кожи у субъекта. Способ включает введение субъекту композиции, содержащей эффективное количество агониста α2-адренергического рецептора и фармацевтически приемлемый носитель.
В другом общем аспекте варианты осуществления настоящего изобретения относятся к способу ингибирования прогрессирования существующей опухоли кожи у субъекта, включающему введение субъекту композиции, содержащей терапевтически эффективное количество агониста α2-адренергического рецептора и фармацевтически приемлемый носитель.
В другом общем аспекте варианты осуществления настоящего изобретения относятся к способу индуцирования гибели или ингибирования роста клеток опухоли кожи, включающему контактирование клеток опухоли кожи с композицией, содержащей агонист α2-адренергического рецептора в количестве, достаточном для того, чтобы индуцировать гибель или ингибировать рост клеток опухоли кожи соответственно.
В другом общем аспекте варианты осуществления настоящего изобретения относятся к способу защиты кожи, губ или кожи головы субъекта от повреждающих эффектов УФ-облучения. Способ включает введение субъекту композиции, содержащей безопасное и эффективное количество агониста α2-адренергического рецептора.
В другом общем аспекте варианты осуществления настоящего изобретения относятся к способу обеспечения загара кожи субъекта, где способ включает введение субъекту композиции, содержащей безопасное и эффективное количество агониста α2-адренергического рецептора.
Другой аспект настоящего изобретения относится к косметическому продукту, содержащему:
(1) композицию для наружного применения, содержащую безопасное и эффективное количество агониста α2-адренергического рецептора; и
(2) инструкции по нанесению композиции для наружного применения на кожу, губы или кожу головы субъекта от повреждающих эффектов УФ-облучения.
В еще другом аспекте настоящее изобретение относится к композиции для наружного применения для обеспечения загара кожи субъекта, содержащей:
(1) безопасное и эффективное количество агониста α2-адренергического рецептора; и
(2) безопасное количество средства для загара.
Другие аспекты, характеристики и преимущества изобретения будут очевидны из нижеследующего раскрытия, включая подробное описание изобретения и его предпочтительных вариантов осуществления и прилагаемую формулу изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
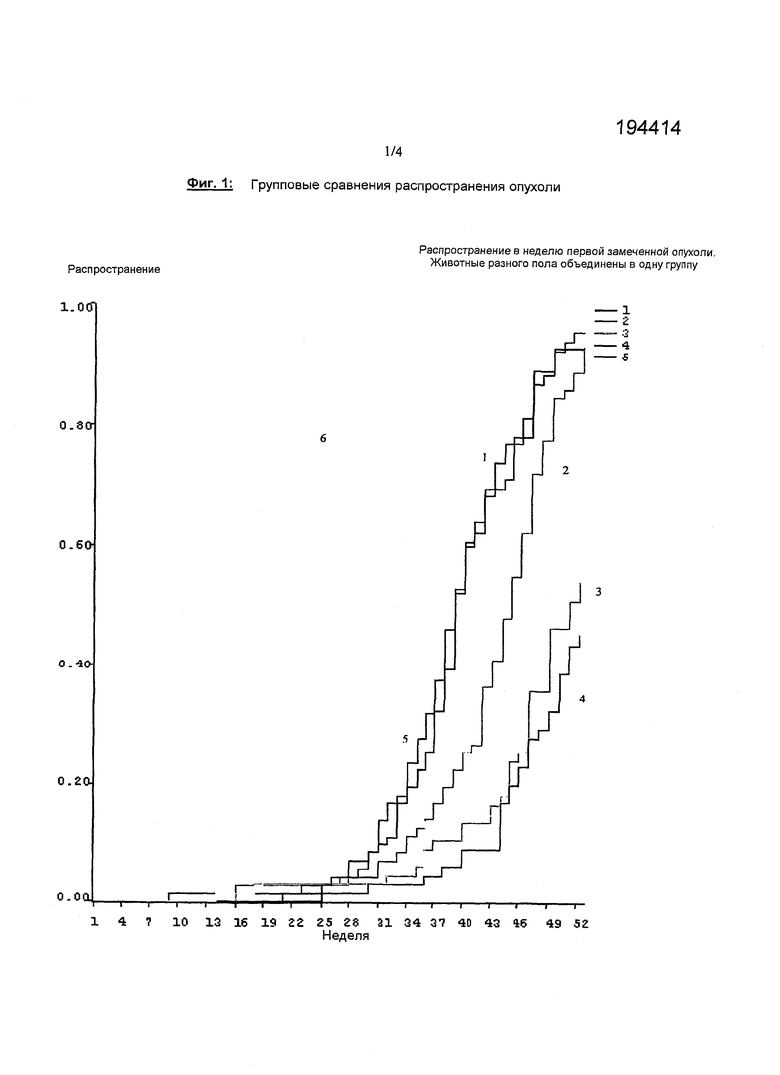
Фигура 1. Групповые сравнения распространения опухоли. Распространение в неделю первой замеченной опухоли. Животные разного пола объединены в одну группу.
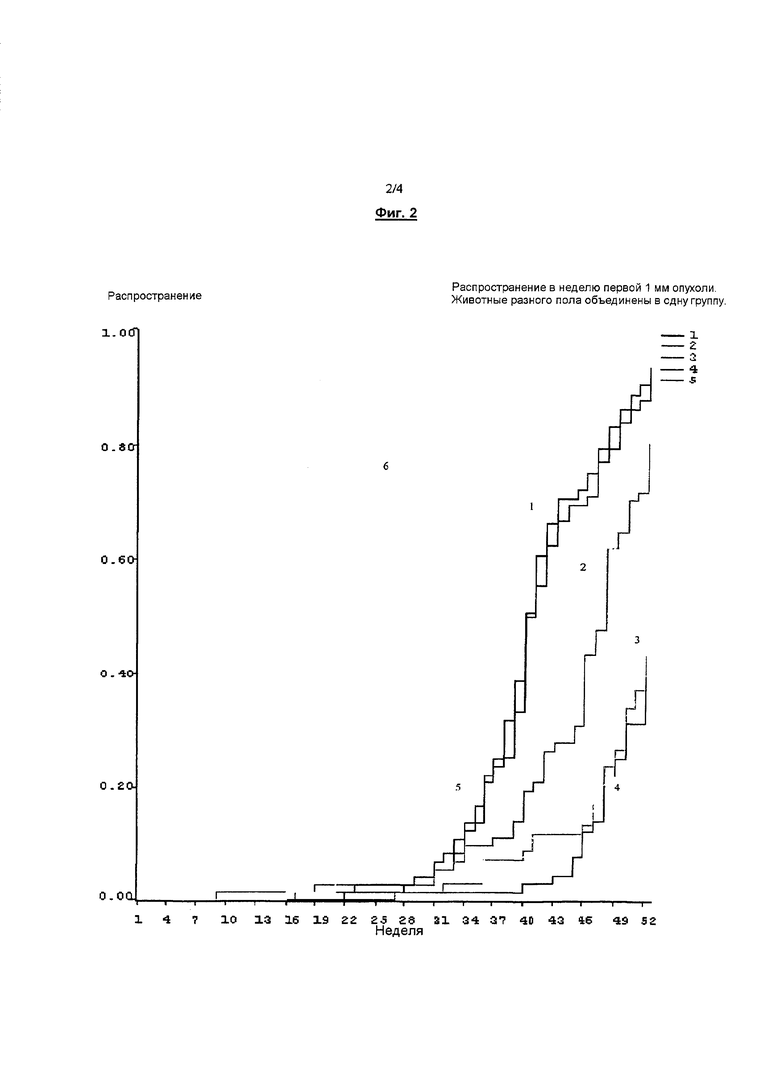
Фигура 2. Распространение в неделю первой 1 мм опухоли. Животные разного пола объединены в одну группу.
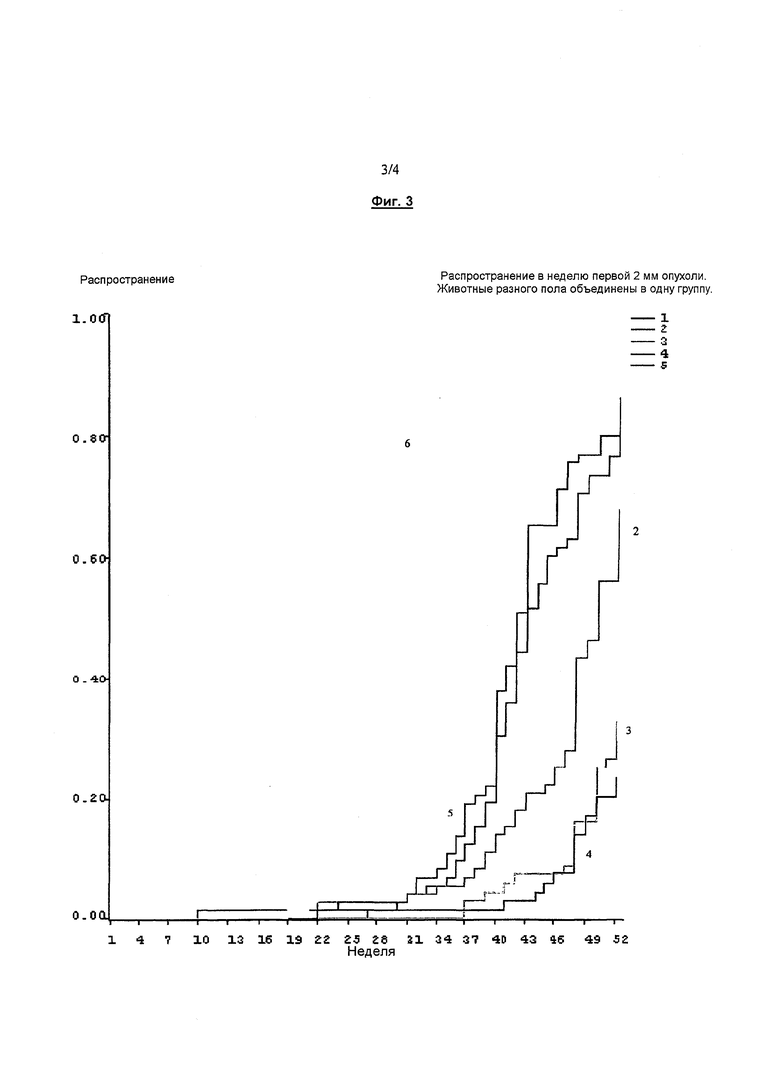
Фигура 3. Распространение в неделю первой 2 мм опухоли. Животные разного пола объединены в одну группу.
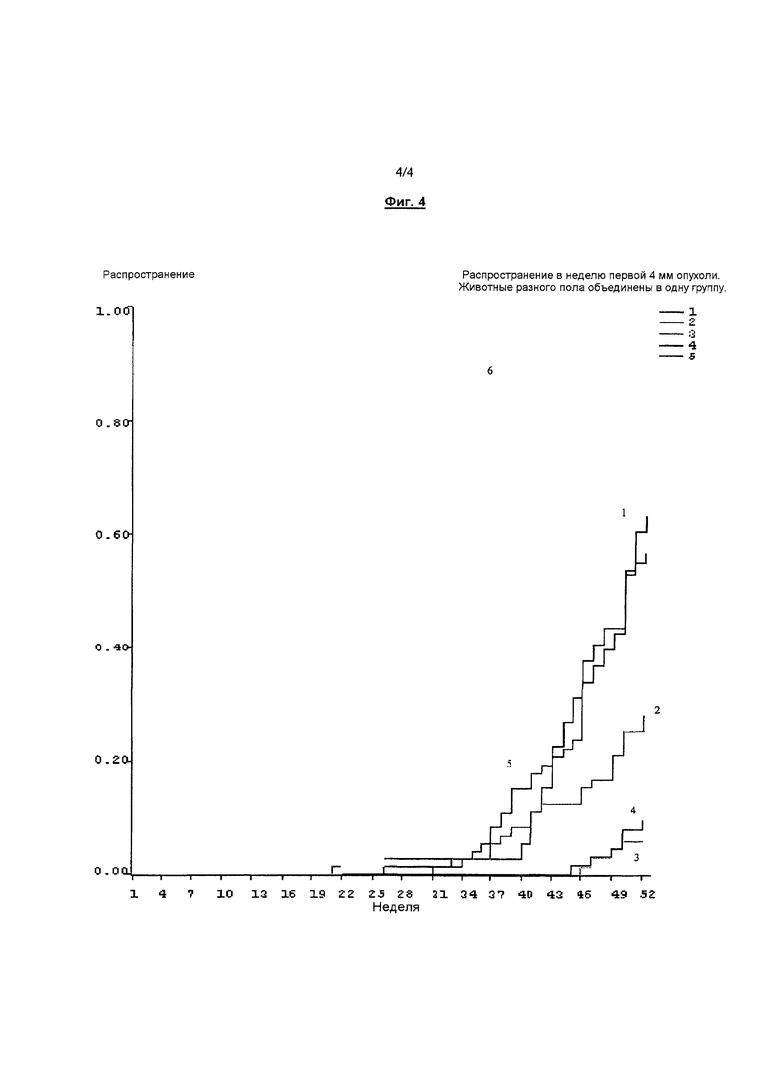
Фигура 4. Распространение в неделю первой 4 мм опухоли. Животные разного пола объединены в одну группу.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Многочисленные публикации, статьи и патенты цитированы или описаны в уровне техники и на всем протяжении описания; каждая из этих ссылок введена в данный документ посредством ссылки во всей полноте. Обсуждение документов, актов, материалов, устройств, статей и т.п., которое включено в настоящее описание, сделано с целью обеспечения контекста настоящего изобретения. Такое обсуждение не является допущением того, что любой или все из этих материалов образуют часть предыдущего уровня техники в отношении любых раскрытых или заявленных изобретений.
Если не определено иначе, используемые здесь специфические и технические термины имеют то же значение, которое обычно подразумевается обычными специалистами в той области, к которой принадлежит данное изобретение. В остальных случаях используемые здесь определенные термины имеют значение, определенное в данном описании. Все цитируемые здесь патенты, опубликованные патентные заявки и публикации введены сюда посредством ссылки, как если бы они излагались здесь полностью. Следует отметить, что в том виде, как они использованы здесь и в прилагаемой формуле изобретения, формы единственного числа включают ссылку на множественное число, если только контекст явно не диктует обратное.
Используемый здесь «агонист α2-адренергического рецептора» или «агонист α2-адренорецептора» означает соединение, которое связывается и стимулирует альфа-адренергический рецептор подкласса α2.
Используемое здесь название соединения предназначено для того, чтобы охватить все возможные изомерные формы (например, оптический изомер, энантиомер, диастереомер, рацемат или рацемическую смесь), сложные эфиры, пролекарства, метаболические формы или фармацевтически приемлемые соли соединения. Например, «бримонидин» может представлять собой соединение (5-бром-хиноксалин-6-ил)-(4,5-дигидро-1Н-имидазол-2-ил)-амин и любую фармацевтически приемлемую соль соединения, такую как бримонидин тартрат.
Используемая здесь фраза «фармацевтически приемлемая соль(и)» обозначает те соли целевого соединения, которые являются безопасными и эффективными для местного использования у млекопитающих и которые обладают требуемой биологической активностью. Фармацевтически приемлемые соли включают соли кислых или основных групп, присутствующих в упомянутых соединениях. Фармацевтически приемлемые соли присоединения кислоты включают, но не ограничиваются перечисленными, гидрохлориды, гидробромиды, гидройодиды, нитраты, сульфаты, бисульфаты, фосфаты, кислые фосфаты, изоникотинаты, ацетаты, лактаты, салицилаты, цитраты, тартраты, пантотенаты, битартраты, аскорбаты, сукцинаты, малеаты, гентизинаты, фумараты, глюконаты, глюкаронаты, сахараты, формиаты, бензоаты, глутаматы, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты и памоаты (то есть 1,1'-метилен-бис-(2-гидрокси-3-нафтоаты)). Отдельные соединения, используемые в настоящем изобретении, могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Подходящие соли присоединения основания включают, но не ограничиваются перечисленными, соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламина. Для обзора по фармацевтически приемлемым солям см. BERGE ЕТ AL., 66 J. PHARM. SCI. 1-19 (1977), введенную сюда посредством ссылки.
Используемый в данном описании термин «гидрат» обозначает целевое соединение или его фармацевтически приемлемую соль, которое дополнительно содержит стехиометрическое или нестехиометрическое количество воды, связанной с ним нековалентными межмолекулярными силами.
В варианте осуществления настоящего изобретения агонисты α2-адренергического рецептора включают, но не ограничиваются перечисленными, агонисты α2-адренергического рецептора, раскрытые в опубликованной патентной заявке США US20050276830, которая введена сюда посредством ссылки, как единое целое.
Типичные агонисты α2-адренергического рецептора, которые могут использоваться в настоящем изобретении, включают, но не ограничиваются теми, которые перечислены в Таблице 1.
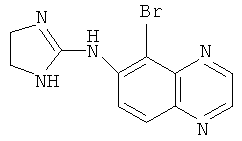
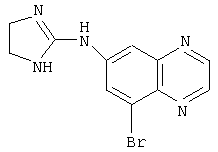
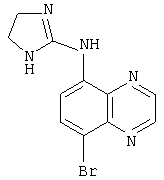
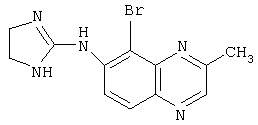
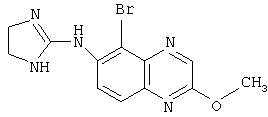
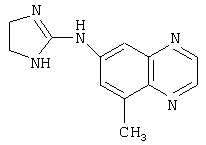
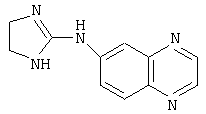
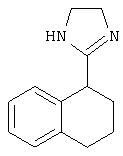
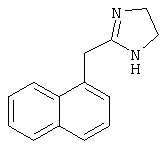
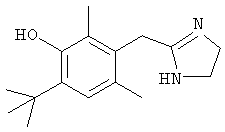
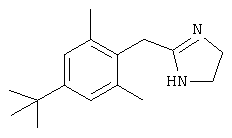
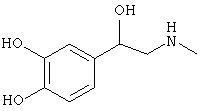
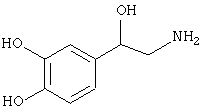
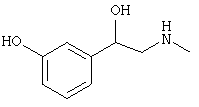
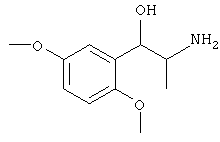
Наиболее предпочтительным агонистом α2-адренергического рецептора является бримонидин (5-бром-хиноксалин-6-ил)- (4,5-дигидро-1Н-имидазол-2-ил)-амин и его фармацевтически приемлемые соли, такие как виннокислая соль бримонидина.
Другие примеры агонистов α2-адренергического рецептора, которые могут использоваться в настоящем изобретении, включают, но не ограничиваются перечисленными, дексмедетомидин, медетомидин, ромифидин, клонидин, детомидин, лофексидин, ксилазин, тизанидин, гуанфацин и амитраз.
Согласно настоящему изобретению, агонисты α2-адренергического рецептора можно вводить субъекту путем наружной, накожной, чрескожной, подкожной или внутримышечной доставки. В предпочтительном варианте осуществления, агонисты α2-адренергического рецептора доставляют в место опухоли, или в область кожи субъекта с УФ повреждениями посредством подкожной доставки или наружного нанесения на кожу.
Используемые здесь выражения «наружное применение» и «применяемый наружно» обозначают непосредственное наложение на кожу или распределение по коже, нуждающейся в лечении, например, при помощи рук или аппликатора.
Используемое здесь выражение «подкожная доставка» означает внесение непосредственно в кожу или под поверхность кожи, или в подкожный жировой слой, посредством использования аппликатора, такого как игла, многоигольчатая матрица, система доставки, активируемая при физической активности, способная к подкожной доставке, система доставки, активируемая при надавливании, способная к подкожной доставке, безыгольная система доставки, способная к подкожной доставке или аналогичное медицинское устройство.
Используемый здесь термин «опухоль кожи» включает рак кожи, доброкачественную опухоль кожи и предраковую опухоль кожи. Рак кожи включает, но не ограничивается, базальноклеточную и плоскоклеточную карциномы и злокачественную меланому. Примеры доброкачественных опухолей кожи включают, но не ограничиваются перечисленными, родимые пятна (невусы), себорейный кератоз, мягкие бородавки (также называемые папалломы), эпидермоиды или атеромы и дерматофиброму. Предраковые опухоли кожи включают, но не ограничиваются перечисленными, внутриэпителлиальный рак.
Один вариант осуществления настоящего изобретения относится к способу предотвращения образования опухоли кожи у субъекта, который включает введение субъекту композиции, содержащей
эффективное количество агониста α2-адренергического рецептора и фармацевтически приемлемый носитель.
Используемое здесь «эффективное количество агониста α2-адренергического рецептора» означает количество агониста α2-адренергического рецептора, которого достаточно для предотвращения или отсрочки образования опухолей кожи в тканевой массе, у млекопитающего, или у человека.
Используемый в данном описании термин «субъект» означает любое млекопитающее, предпочтительно человека, к которому будут или были применены соединения или рецептуры для наружного применения, согласно вариантам осуществления изобретения.
Используемый в данном описании термин «композиция» предназначен для того, чтобы охватить продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, который получается в результате, прямо или косвенно, из комбинаций определенных ингредиентов в определенных количествах.
Используемые здесь «предотвращение» или «предотвращающий» относятся к уменьшению риска возникновения опухоли- кожи. В предпочтительном способе варианта осуществления описываемые соединения применяют в качестве превентивной меры к субъекту, обладающему предрасположенностью к опухоли кожи, даже если симптомы нарушения отсутствуют или минимальны.
Используемый здесь «фармацевтически приемлемый носитель» означает носитель, который пригоден для применения по настоящему изобретению не обладающий чрезмерной токсичностью, несовместимостью, нестабильностью, раздражением, аллергической реакцией и т.п. Этот термин не предназначен для того, чтобы ограничить описываемые им ингредиенты.
Другой вариант осуществления настоящего изобретения относится к способу игнибирования прогрессирования существующей опухоли кожи у субъекта, который включает введение субъекту композиции, содержащей терапевтически эффективное количество агониста 0,2-адренергического рецептора и фармацевтически приемлемый носитель.
Используемое здесь «терапевтически эффективное количество агониста α2-адренергического рецептора» означает количество агониста α2-адренергического рецептора, которого достаточно для предотвращения или отсрочки прогрессирования опухолей кожи в тканевой массе, у млекопитающего, или у человека.
Специалисту в данной области будет понятно, что терапевтически эффективное количество агониста α2-адренергического рецептора, которое следует использовать в данном изобретении, может варьироваться в зависимости от различных факторов, таких как особенности субъекта, например возраст, диета, здоровье, проч., степени воздействия УФ-облучения, тяжести и осложнения опухоли кожи, которую пытаются лечить или предотвратить, используемой рецептуры и проч. С точки зрения настоящего раскрытия, можно провести стандартную процедуру для оценки эффекта от применения композиции субъектом, позволяя, таким образом, специалисту в данной области определить терапевтически эффективное количество агониста α2-адренергического рецептора, которое следует принимать субъекту. Например, наблюдаемый клинически полезный эффект агониста α2-адренергического рецептора в предотвращении образования или в предотвращении или отсрочке прогрессирования опухоли кожи.
Наблюдаемый клинически полезный эффект может представлять собой ситуацию, что если композиция по настоящему изобретению применяется субъектом после того, как наблюдаются признаки и/или симптомы, связанные с опухолью кожи, то признаки и/или симптомы предотвращаются от дальнейшего развития или обострения или развиваются в меньшей степени, чем без применения описываемой композиции согласно вариантам осуществления настоящего изобретения. Наблюдаемый клинически полезный эффект может также быть таким, что если композиция по настоящему изобретению вводится субъекту до того, как наблюдаются признаки и/или симптомы, связанные с опухолью кожи, признаки и/или симптомы предотвращаются от возникновения или впоследствии возникают в меньшей степени, чем без применения композиции по настоящему изобретению.
В другом варианте осуществления терапевтически эффективное количество агониста α2-адренергического рецептора будет понижать дискомфорт субъекта, связанный с опухолью кожи или связанными с ней признаками и/или симптомами.
Способы настоящего изобретения можно использовать в сочетании с одним или несколькими другими процедурами или медикаментами для предотвращения образования опухоли кожи, или ингибирования прогрессирования, или лечения существующей опухоли кожи или связанных с ней признаков и/или симптомов.
Например, терапевтически эффективное количество агониста α2-адренергического рецептора можно использовать в сочетании с лечением опухоли кожи, таким как удаление хирургическим скальпелем, криохирургией, электрохирургией, хемохирургией или облучением и обработкой цитотоксическими средствами, такими как алкилирующие агенты, например, азотистым ипритом, этиленимином, фторурацилом и циклофосфамидом; антиметаболитами, например, 8-азагуанином, 6-меркаптопурином, аминоптерином, метотрексатом; антибиотиками, например, саркомицином, адиномицином, карцинофирином, митомицином-С, хромомицином, блеомицином, винбластином; гормонами, например, половыми гормонами, АСТН, кортикостероидами; радиоизотопами - Р32, I131, Со60, Au190; или растительными производными, например, подофиллином, колхицином, молочаем или индийской лакрицей.
Другие медикаменты или процедуры можно вводить субъекту одновременно с или в последовательности и во временные интервалы с введением агониста α2-адренергического рецептора, так что активные ингредиенты или средства могут действовать совместно для того, чтобы лечить или предотвращать опухоль кожи и связанные с ней признаки и/или симптомы. Например, другие медикаменты или процедуры и агонист α2-адренергического рецептора можно применять в одной или в отдельных рецептурах в один или в разные моменты времени.
Любой подходящий способ применения можно использовать для доставки дополнительной процедуры или медикамента, включая, но не ограничиваясь перечисленными, пероральный, внутриротовой, ректальный, парентеральный, наружный, накожный, чрескожный, подкожный, внутримышечный, интраназальный, подъязычный, щечный, интрадуральный, внутриглазной, респираторный или путем назальной ингаляции.
Другой вариант осуществления настоящего изобретения относится к способу индуцирования гибели или ингибирования роста клеток опухоли кожи, который включает контактирование клеток опухоли кожи с композицией, содержащей агонист α2-адренергического рецептора в количестве, достаточном для индуцирования гибели или ингибирования роста клеток опухоли кожи, соответственно. Клетка, подвергаемая обработке, может находиться в клеточной культуре in vitro, или быть клеткой в теле млекопитающего in vivo.
Настоящее изобретение также относится к способу защиты кожи, губ и кожи головы субъекта от повреждающих эффектов УФ-облучения, в котором способ включает введение субъекту композиции, содержащей безопасное и эффективное количество агониста α2-адренергического рецептора.
Используемое здесь выражение «безопасное и эффективное количество агониста α2-адренергического рецептора» относится к количеству агониста α2-адренергического рецептора, достаточному для защиты кожи от повреждающих эффектов УФ-облучения, в частности, от вызываемых УФ-облучением опухолей кожи, но достаточно низкое, для того чтобы избежать серьезных побочных эффектов. Безопасное и эффективное количество агониста α2-адренергического рецептора будет варьироваться с возрастом субъекта, его здоровьем и воздействием на него УФ-облучения окружающей среды, продолжительностью и особенностью лечения, используемым специфическим ингредиентом или композицией, используемым специфическим фармацевтически приемлемым носителем и подобными факторами.
Агонист α2-адренергического рецептора можно применять совместно с безопасным и эффективным количеством солнцезащитного средства, средства, которое поглощает или отражает некоторое количество УФ радиации в солнечном свете, помогая, таким образом, защищать кожу от солнечного или УФ повреждений.
Используемое здесь выражение «безопасное и эффективное» относится к количеству солнцезащитного средства, достаточному для обеспечения фотозащиты, когда применяют композицию, но не такому большому, чтобы вызвать любые нежелательные побочные эффекты или кожные реакции. Количество варьируется в зависимости от выбранного солнцезащитного средства и требуемого фактора противосолнечной защиты (Sun Protection Factor, SPF). Коммерчески доступные солнцезащитные продукты обладают величинами SPF в диапазоне от 2 до 40 или более. Согласно вариантам осуществления настоящего изобретения композиция для наружного применения содержит безопасное и эффективное для защиты от УФ повреждения количество агониста α2-адренергического рецептора и от приблизительно 1% масс. до приблизительно 20% масс. солнцезащитного средства.
Подходящее солнцезащитное средство способно смешиваться с агонистом α2-адренергического рецептора по настоящему изобретению таким способом, чтобы не происходило взаимодействие, которое бы существенно понизило эффективность композиции для лечения и/или предотвращения опухоли кожи и фотозащиту. Многочисленные солнцезащитные средства пригодны для использования в комбинации с агонистом α2-адренергического рецептора, включая, но не ограничиваясь перечисленными: п-аминобензойную кислоту и ее соли и производные (этиловый, изобутиловый, глицериловый сложные эфиры; п-диметиламинобензойная кислота); антранилаты (например, о-аминобензоаты; метиловый, ментиловый, фениловый, бензиловый, фенилэтиловый, линалиловый, терпиниловый и циклогексениловый сложные эфиры); салицилаты (амиловый, пентиловый, бензиловый, ментиловый, глицериловый и дипропиленгликолевый сложные эфиры); производные коричной кислоты (ментиловый и бензиловый сложные эфиры, α-фенилциннамонитрил; бутилциннамоилпируват); производные дигидроксикоричной кислоты (умбеллиферон, метилумбеллиферон, метилацетоумбеллиферон); производные тригидроксикоричной кислоты (эскулетин, метилэскулетин, дафнетин, и гликозиды, эскулин и дафнин); углеводороды (дифенилбутадиен, стильбен); дибензальацетон и бензальацетофенон; нафтолсульфонаты (натриевые соли 2-нафтол-3,6-дисульфоновой и 2-нафтол-6,8-дисульфоновой кислот); дигидроксинафтойную кислоту и ее соли; о- и п-гидроксидифенилдисульфонаты; производные кумарина (7-гидрокси, 7-метил, 3-фенил); диазолы (2-ацетил-3-броминдазол, фенилбензоксазол, метилнафтоксазол, различные арилбензотиазолы); соли хинина (бисульфат, сульфат, хлорид, олеат, и таннат); производные хинолина (соли 8-гидроксихинолина, 2-фенилхинолина); гидрокси- или метокси-замещенные бензофеноны; мочевая и виолуровая кислоты; дубильная кислота и ее производные (например, простой гексаэтиловый эфир); (бутил кабритил) (6-пропил пиперонил) простой эфир; гидрохинон; бензофеноны (оксибензон, сулисобензон, диоксибензон, бензорезорцинол, 2,2',4,4'-тетрагидроксибензофенон, 2,2'-дигидрокси-4,4'-диметоксибензофенон, октабензон; 4-изопропилдибензоилметан; бутилметоксидибензоилметан; этокрилен; и 4-изопропилдибензоилметан. См., например, Segarin, et al., at Chapter VIII, pages 189 et seq., of Cosmetics Science and Technology.
Предпочтительные солнцезащитные средства, полезные в композициях по настоящему изобретению, включают, например, 2-этилгексил п-метоксициннамат, бутилметоксидибензоилметан, 2-гидрокси-4-метоксибензофенон, октилдиметил п-аминобензойную кислоту и их смеси.
Другой аспект настоящего изобретения относится к композиции и способу загорания кожи субъекта, в котором способ включает введение субъекту композиции, содержащей безопасное и эффективное количество агониста α2-адренергического рецептора.
Используемое здесь безопасное и эффективное количество агониста α2-адренергического рецептора относится к количеству агониста α2-адренергического рецептора, достаточному для защиты кожи от повреждающих эффектов УФ-облучения, в особенности от вызываемых УФ-облучением опухолей кожи, но достаточно малому, чтобы избежать серьезных побочных эффектов. Безопасное и эффективное количество агониста α2-адренергического рецептора будет варьироваться от средства для загара и его концентрацией, продолжительностью и типом УФ-облучения субъекта, продолжительностью и типом лечения, специфическим ингредиентом или используемой композицией, особенностями используемого фармацевтически приемлемого носителя и подобными факторами.
Агонист α2-адренергического рецептора можно применять совместно с безопасным количеством средства для загара, средства, которое помогает усилить и/или продлить загорание кожи после воздействия естественного или искусственного солнечного света. Согласно варианту осуществления настоящего изобретения композиция для наружного применения для загара кожи субъекта содержит безопасное и эффективное количество агониста α2-адренергического рецептора и безопасное количество средства для загара.
Подходящее средство, способствующее загару, способно смешиваться с агонистом α2-адренергического рецептора, используемым в настоящем изобретении, таким способом, что не будет происходить взаимодействия, которое могло бы существенно понизить эффективность композиции для предотвращения опухоли кожи и/или лечения и загорания кожи. Примеры средства для загара, которые можно использовать в настоящем изобретении, включают, но не ограничиваются перечисленными, тирозин, рибофлавин, коллаген гидролизат и их комбинации.
Композиция согласно вариантам осуществления настоящего изобретения содержит эффективное количество, или терапевтически эффективное количество, или безопасное и эффективное количество агониста α2-адренергического рецептора и фармацевтически приемлемый носитель.
С точки зрения данного раскрытия, композицию можно составить по рецептуре для различных способов доставки, таких как наружная, накожная, чрескожная, подкожная или внутримышечная доставки. В предпочтительном варианте осуществления агонисты α2-адренергического рецептора включают в состав рецептуры для подкожного применения или для наружного применения.
Один вариант осуществления настоящего изобретение относится к композиции для наружного применения, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество агониста α2-адренергического рецептора. Носители, пригодные для доставки при наружном нанесении описываемых соединений согласно вариантам осуществления изобретения, могут представлять собой любой носитель, известный в данной области для наружного применения лекарственных средств, включая, но не ограничиваясь перечисленными, фармацевтически приемлемые растворители, такие как многоатомный спирт или воду; эмульсии (либо эмульсии типа «масло в воде», либо эмульсии типа «вода в масле»), такие как кремы или лосьоны; микроэмульсии; гели; мази; липосомы; порошки; водные растворы или суспензии. Фармацевтически приемлемый носитель включает необходимые и инертные фармацевтические наполнители, включая, но не ограничиваясь перечисленными, связующие, суспендирующие средства, лубриканты, ароматизаторы, консерванты, красители и обволакивающие средства.
Композицию для наружного применения согласно вариантам осуществления настоящего изобретения получают путем смешивания фармацевтически приемлемого носителя с терапевтически эффективным количеством агониста α2-адренергического рецептора в соответствии со способами, известными в данной области, например, способами, представленными в стандартно упоминаемых текстах, таких как, REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY 1577-1591, 1672-1673, 866-885 (Alfonso R. Gennaro ed. 19th ed. 1995); Ghosh, T.K.; et al. TRANSDERMAL AND TOPICAL DRUG DELIVERY SYSTEMS (1997), оба из которых введены в данное описание посредством ссылки.
В одном варианте осуществления композиция для наружного применения по изобретению существует в виде эмульсии. Эмульсии, такие как кремы и лосьоны, являются подходящими рецептурами для наружного применения для использования в изобретении. Эмульсия представляет собой диспергированную систему, содержащую по меньшей мере две несмешивающиеся фазы, где одна фаза диспергирована в другой в виде капель с распределением по диаметрам от 0,1 мкм до 100 мкм. Для улучшения стабильности обычно включают эмульгаторы. Если вода находится в дисперсионной фазе, а масло находится в диспергирующей среде, эмульсию называют «эмульсией вода в масле». Если масло диспергировано в виде капель в водной фазе, эмульсию называют «эмульсией масло в воде». Эмульсии, такие как кремы или лосьоны, которые можно использовать в качестве носителей для наружного нанесения, и их изготовление раскрыто в REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY 282-291 (Alfonso R. Gennaro ed. 19th ed. 1995), введенной в данное описание посредством ссылки.
В другом варианте осуществления композиция для наружного применения по изобретению существует в виде геля, например двухфазного геля или однофазного геля. Гели представляют собой полутвердые системы, состоящие из суспензий небольших неорганических частиц или больших органических молекул, наполненных жидкостью. Если масса геля содержит сетку, состоящую из отдельных небольших неорганических частиц, то его классифицируют как двухфазный гель. Однофазные гели состоят из органических макромолекул, равномерно распределенных в жидкости, так что не существует видимых границ между диспергированными макромолекулами и жидкостью. Подходящие гели для применения в изобретении раскрыты в REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY 1517-1518 (Alfonso R. Gennaro ed. 19th ed. 1995), введенной сюда посредством ссылки. Другие подходящие гели для применения в изобретении раскрыты в патенте США No.6387383 (опубликованном 14 мая 2002); Патенте США No.6517847 (опубликованном 11 февраля 2003); и патенте США No.6468989 (опубликованном 22 октября 2002), все патенты введены в данное описание посредством ссылки.
В варианте осуществления композиция для наружного применения дополнительно содержит водорастворимый гель, содержащий воду и образующее из воды гель количество фармацевтически приемлемого гелеобразователя, выбираемого из группы, состоящей из карбомеров, глицеринполиакрилата и их смесей, и композиция для наружного применения имеет физиологически приемлемый рН.
Используемый здесь «карбомер» представляет собой обозначение, данное USP для различных полимерных кислот, которые диспергируются, но не растворяются в воде. Если дисперсию кислоты нейтрализовать основанием, то образуется прозрачный устойчивый гель. Карбомер 934Р является физиологически инертным, и не является первичным ирритантом или сенсибилизатором. Другие карбомеры включают 910, 940, 941 и 1342. Полимерные загустители (гелеобразователи), которые можно использовать в композициях, согласно вариантам осуществления настоящего изобретения, включают те, которые известны специалисту в данной области, такие как гидрофильные и гидроспиртовые гелеобразователи, часто применяемые в косметической и фармацевтической промышленности. Предпочтительно гидрофильный или гидроспиртовой гелеобразователь содержит «CARBOPOL®» (B.F. Goodrich, Cleveland, Ohio), «HYPAN®» (Kingston Technologies, Dayton, N.J.), «NATROSOL®» (Aqualon, Wilmington, Del), "KLUCEL®" (Aqualon, Wilmington, Del) или «STABILEZE®» (ISP Technologies, Wayne, N.J.). Предпочтительно гелеобразователь содержится в пределах от приблизительно 0,2% масс. до приблизительно 4% масс. от массы композиции. Конкретнее, предпочтительный весовой процент для «CARBOPOL®» в композиции лежит в пределах от приблизительно 0,5% масс. до приблизительно 2% масс., в то время как предпочтительный весовой процентный диапазон для «NATROLSOL®» и «KLUCEL®» находится между приблизительно 0,5% и приблизительно 4%. Предпочтительный массовой процент в композиции как «HYPAN®», так и для «STABILEZE®» лежит в пределах между 0,5% и приблизительно 4%.
«CARBOPOL®» представляет собой один из многочисленных сшитых полимеров акриловой кислоты, которым присвоено общее название карбомер. Эти полимеры растворяются в воде и образуют прозрачный, слегка мутноватый гель после нейтрализации каустическим веществом, таким как гидроксид натрия, гидроксид калия, триэтаноламин или другие аминовые основания. «KLUCEL®» представляет собой целлюлозный полимер, который диспергируется в воде и образует однородный гель после полной гидратации. Другие предпочтительные гелеобразующие полимеры включают гидроксиэтилцеллюлозу, целлюлозную камедь, MVE/MA декадиеновый кроссполимер, PVM/MA сополимер или их комбинации.
В другом предпочтительном варианте осуществления композиция для наружного применения по изобретению существует в виде мази. Мази представляют собой маслянистые полутвердые вещества, которые содержат небольшое количество воды или не содержат ее вовсе. Предпочтительно мазь является мазью на углеводородной основе, такой как воск, вазелин или загущенное минеральное масло. Подходящие мази для применения в изобретении хорошо известны в данной области, и раскрыты в REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY 1585-1591 (Alfonso R. Gennaro ed. 19th ed. 1995), введенной в данное описание посредством ссылки.
В варианте осуществления настоящего изобретения композиция для наружного применения по изобретению включает, по меньшей мере, что-нибудь одно из крема или мази, причем каждый содержит средство, выбираемое из группы, состоящей из стеариновой кислоты, стеарилового спирта, цетилового спирта, глицерина, воды и их смесей, и композиция для наружного применения имеет физиологически приемлемый рН.
В другом варианте осуществления композиция для наружного применения по изобретению существует в виде водного раствора или суспензии, предпочтительно в виде водного раствора. Подходящие рецептуры для наружного применения на водной основе для применения по изобретению включают те, которые раскрыты в REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY 1563-1576 (Alfonso R. Gennaro ed. 19th ed. 1995), введенной в данное описание посредством ссылки. Другие подходящие системы-носители на водной основе для наружного применения включают те, которые раскрыты в Патенте США No.5424078 (опубликованном 13 июня 1995); Патенте США No.5736165 (опубликованном 7 апреля 1998); Патенте США No.6194415 (опубликованном 27 февраля 2001); Патенте США No.6248741 (опубликованном 19 июня 2001); Патенте США No.6465464 (опубликованном 15 октября 2002), все патенты введены в данное описание посредством ссылки.
рН рецептур для наружного применения по изобретению находится предпочтительно в пределах физиологически приемлемых рН, например, в пределах диапазона от приблизительно 5 до приблизительно 8, более предпочтительно, от приблизительно 5,5 до приблизительно 6,5. Для стабилизации рН предпочтительно включают эффективное количество буфера. В одном варианте осуществления забуферивающее средство присутствует в рецептуре для наружного применения на водной основе в количестве от приблизительно 0,05 до приблизительно 1 масс. процента от массы рецептуры. Для регуляции рН можно использовать кислоты и основания в необходимом количестве.
В рецептуры для наружного применения по изобретению на водной основе можно включить средства, регулирующие тоничность. Примеры подходящих средств, регулирующих тоничность, включают, но не ограничиваются перечисленными, хлорид натрия, хлорид калия, маннит, декстрозу, глицерин и пропиленгликоль. Количество средства, регулирующего тоничность, можно варьировать в широких пределах, в зависимости от требуемых свойств рецептуры. В одном варианте осуществления, средство, регулирующее тоничность, присутствует в рецептуре для наружного применения на водной основе в количестве от приблизительно 0,5 до приблизительно 0,9 массовых процентов от массы рецептуры.
Предпочтительно рецептуры для наружного применения по изобретению на водной основе обладают вязкостью в диапазоне от приблизительно 15 сПз до приблизительно 25 сПз. Вязкость водных растворов по изобретению можно контролировать путем добавления средств для контроля вязкости, например, но не ограничиваясь перечисленными, поливиниловый спирт, повидон, гидроксипропилметилцеллюлозу, полоксамеры, карбоксиметилцеллюлозу или гидроксиэтилцеллюлозу.
В предпочтительном варианте осуществления рецептура для наружного применения по изобретению на водной основе представляет собой изотонический солевой раствор, содержащий консервант, такой как бензалконий хлорид или двуокись хлора, средство для контроля вязкости, такое как поливиниловый спирт и буферную систему, такую как цитрат натрия и лимонную кислоту.
Композиция для наружного применения согласно вариантам осуществления изобретения может содержать фармацевтически приемлемые наполнители, такие как те, что перечислены в REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY 866-885 (Alfonso R. Gennaro ed. 19th ed. 1995; Ghosh, T.K.; et al. TRANSDERMAL AND TOPICAL DRUG DELIVERY SYSTEMS (1997), введенные в данное описание посредством ссылки, включая, но не ограничиваясь перечисленными, защитные средства, сорбенты, успокоительные средства, смягчающие средства, консерванты, антиоксиданты, увлажнители, забуферивающие агенты, солюбилизаторы, средства, способствующие проникновению через кожу, и поверхностно-активные вещества.
В варианте осуществления композиция для наружного применения по изобретению дополнительно содержит одно или несколько средств, выбираемых из группы, состоящей из консерванта, местного анестетика и средства, увлажняющего кожу.
Подходящие консерванты включают, но не ограничиваются перечисленными, соединения четвертичного аммония, такие как бензалконий хлорид, бензетоний хлорид, цетримид, деквалиний хлорид и цетилпиридиний хлорид; ртутьсодержащие средства, такие как нитрат фенилртути, ацетат фенилртути и тимеросал; спиртсодержащие средства, например, хлорбутанол, фенилэтиловый спирт и бензиловый спирт; антибактериальные сложные эфиры, например, сложные эфиры парагидроксибензойной кислоты; и другие противомикробные средства, такие как хлоргексидин, хлорокрезол, бензойная кислота и полимиксин.
Композиция для наружного применения согласно вариантам осуществления изобретения может содержать фармацевтические препараты или их фармацевтически приемлемые соли, такие как агонист α2-адренергического рецептора, и необязательно один или несколько других фармацевтически активных ингредиентов, включая, но не ограничиваясь перечисленными, кортикостероиды и другие противовоспалительные средства, такие как бетаметазон, дифторазон, амцинонид, флюоцинолон, мометазон, гидрокортизон, преднизолон и триамцинолон; анестетики и анальгетики для наружного применения, такие как камфора, ментол, лидокаин, дибукаин и прамоксин; фунгициды, такие как циклопирокс, хлороксиленол, триацетин, сульконазол, нистатин, ундеценовая кислота, толнафтат, миконизол, клотримазол, оксиконазол, гризеофульвин, эконазол, кетоконазол и амфотерицин В; антибиотики и противоинфекционные препараты, такие как мупироцин, эритромицин, клиндамицин, гентамицин, полимиксин, бацитрацин и сульфадиазин серебра; и антисептики, такие как йод, повидин-йод, бензалконий хлорид, бензойная кислота, хлоргексидин, нитрофуразин, бензоил пероксид, пероксид водорода, гексахлорофен, фенол, резорцин и цетилпиридиний хлорид.
В предпочтительном варианте осуществления композиция для наружного применения согласно вариантам осуществления изобретения дополнительно содержит" диоксид титана (TiO2), предпочтительно в количестве, которое достаточно для маскировки цвета бримонидина или другого цветного ингредиента в рецептуре, но которое не вызывает раздражения кожи. TiO2 может вызывать легкое раздражение и покраснение глаз, таким образом, следует избегать контакта глаз с содержащей TiO2 применяемой наружно композицией.
Дозировки и частота приема будет определяться обученным медицинским специалистом в зависимости от активности используемых соединений, характеристик конкретной рецептуры для наружного применения и особенностей и тяжести лечимого или предотвращаемого дерматологического нарушения.
В варианте осуществления настоящего изобретения композиция для наружного применения содержит 0,01% масс. - 5% масс. агониста α2-адренергического рецептора. Например, композиция может содержать 0,01% масс., 0,05% масс., 0,1% масс., 0,2% масс., 0,3% масс., 0,4% масс., 0,5% масс., 0,6% масс., 0,7% масс., 0,8% масс., 0,9% масс., 1% масс., 2% масс., 3% масс., 4% масс. или 5% масс. агониста α2-адренергического рецептора.
Для лечения или предотвращения опухоли кожи с точки зрения данного раскрытия, например, композиции для наружного применения по изобретению наружно наносят непосредственно на область, облученную солнечным светом или область, подвергшуюся другому воздействию, любым подходящим способом, хорошо известным в данной области, например, при помощи пипетки или аппликатора, в виде аэрозольного облака при помощи аэрозольного аппликатора, посредством накожного или чрескожного пластыря, или путем простого распределения рецептуры по изобретению пальцами по области, подвергшейся воздействию. Вообще количество рецептуры для наружного применения по изобретению, наносимое на область пораженной кожи, варьируется от приблизительно 0,1 г/см2 площади поверхности кожи до приблизительно 5 г/см2, предпочтительно от 0,2 г/см2 до приблизительно 0,5 г/см2 площади поверхности кожи. Обычно рекомендуется от одного до четырех нанесений в день в течение курса лечения.
Другой вариант осуществления настоящего изобретения относится к косметическому продукту, содержащему:
(1) композицию для наружного применения, содержащую безопасное и эффективное количество агониста α2-адренергического рецептора; и
(2) инструкции по нанесению композиции для наружного применения на кожу, губы и кожу головы субъекта от повреждающих эффектов УФ-облучения.
Используемый в данном описании термин «инструкции», если его используют в случае набора, включает публикацию, запись, диаграмму или любой другой способ выражения, который можно использовать для информирования о полезности набора для его целевого использования. Инструкции могут, например, быть прикрепленными к или включенными в контейнер для набора.
Косметический продукт может дополнительно содержать вторую композицию для наружного применения, содержащую безопасное и эффективное количество солнцезащитного средства.
Агонист α2-адренергического рецептора и солнцезащитное средство можно включить в состав одной или отдельных композиций для наружного применения, помещенных в один или два отдельных контейнера, таких как пипетка, баночка или тюбик с подходящим небольшим размером отверстия, такой как тюбик с вытянутым кончиком, изготовленные из любого фармацевтически пригодного материала.
Рецептуры для наружного применения по изобретению можно залить или упаковать в мягкий пластиковый флакон или тюбик. Подходящие системы упаковки типа контейнер с крышкой для рецептур для наружного применения по изобретению являются коммерчески доступными, например, на фирме Wheaton Plastic Products, 1101 Wheaton Avenue, Millville, N.J. 08332.
Предпочтительно инструкции пакуют вместе с рецептурами по изобретению, например, с листовкой или этикеткой. Инструкция на этикетке объясняет, как наносить рецептуры для наружного применения по изобретению, в количестве и в течение периода времени, достаточного для лечения или предотвращения опухоли кожи и связанных с ней признаков и/или симптомов. Предпочтительно этикетка включает инструкции по применению, состав рецептуры для наружного применения, клиническую фармакологию, устойчивость к лекарственному средству, фармакокинетику, всасывание, биодоступность и противопоказания.
Это изобретение будет лучше понятно посредством обращения к неограничивающим примерам, следующим ниже, но специалистам в данной области легко будет понять, что примеры являются только иллюстративными к изобретению, которое более полно описано в следующей за ними формуле изобретения.
ПРИМЕР 1
Водные рецептуры для наружного применения
Этот пример иллюстрирует водные рецептуры для наружного применения, которые можно использовать в настоящем изобретении.
Первая водная рецептура для наружного применения содержит: бримонидин тартрат (от 0,01% до 5% масс./масс.); пуритег (0,005% масс./масс.) (стабилизированную двуокись хлора) в качестве консерванта; и неактивные ингредиенты: борную кислоту; хлорид кальция; хлорид магния; хлорид калия; очищенную воду; борат натрия; натрий карбоксиметилцеллюлозу; хлорид натрия; с соляной кислотой и/или гидроксидом натрия для контролирования рН от 5,6 до 6,6. Осмолярность находилась в пределах 250-350 мОсмоль/кг.
Вторая водная рецептура для наружного применения содержит: бримонидин тартрат (от 0,2% до 2% масс./масс.); бензалконий хлорид (0,005% масс./масс.) в качестве консерванта; и неактивные ингредиенты: борную кислоту; хлорид кальция; хлорид магния; хлорид калия; очищенную воду; борат натрия; натрий карбоксиметилцеллюлозу; хлорид натрия; с соляной кислотой и/или гидроксидом натрия для контролирования рН от 5,6 до 6,6. Осмолярность находилась в пределах 250-350 мОсмоль/кг.
ПРИМЕР 2
Рецептуры кремов или мазей для наружного применения
Этот пример иллюстрирует рецептуры кремов и мазей для наружного применения, которые можно использовать в настоящем изобретении.
Первая рецептура крема для наружного применения описана в таблице 2 ниже.
Для изготовления рецептуры стеариловый спирт и медицинский вазелин плавили на паровой бане и нагревали приблизительно до 75°С. Затем добавляли другие ингредиенты, предварительно растворенные в воде и нагретые до 75°С, и смесь перемешивали до тех пор, пока она не загустевала. Смеси затем давали остыть при перемешивании и затем добавляли бримонидин тартрат в виде концентрированного раствора.
Рецептура мази для наружного применения (гидрофильной мази) описана в таблице 3 ниже.
Для изготовления рецептуры стеариловый спирт и белый воск плавили на паровой бане. Затем добавляли холестерин и перемешивали до полного растворения. Затем добавляли медицинский вазелин, и перемешивали. Смесь снимали с бани, и перемешивали до тех пор, пока она не загустевала. При постоянном перемешивании добавляли бримонидин тартрат в виде концентрированной суспензии.
ПРИМЕР 3
Рецептуры гелей для наружного применения
Этот пример иллюстрирует рецептуры гелей для наружного применения, которые можно использовать в настоящем изобретении.
Первая рецептура геля для наружного применения описана в таблице 4 ниже.
Вторая рецептура геля для наружного применения описана в таблице 5 ниже.
Ингредиенты смешивали вместе и к смеси медленно прибавляли водный раствор гидроксида натрия до тех пор, пока рН не достигал примерно 7, и не образовывался гель.
Третья рецептура геля для наружного применения описана в таблице 6 ниже.
Четвертая рецептура геля для наружного применения описана в таблице 7 ниже.
Ингредиенты смешивали вместе и перемешивали. Добавляли триэтаноламин до тех пор, пока не достигали величины рН приблизительно равной 7.
ПРИМЕР 4
Рецептуры пены для наружного применения
Этот пример иллюстрирует рецептуры пены для наружного применения, которые можно использовать в настоящем изобретении. Первая рецептура пены описана в таблице 8 ниже.
Воду нагревали до 80-85°С, после чего добавляли стеариновую кислоту. Как только стеариновая кислота расплавлялась, добавляли лаурет-23, расплавляли и хорошо перемешивали. Затем добавляли Триэтаноламин, и получившуюся в результате композицию хорошо перемешивали в течение 30 минут до образования мыла. Получившееся в результате мыло затем охлаждали приблизительно до 65°С, после чего добавляли натрий лаурил сульфат. Композицию затем хорошо перемешивали. Затем добавляли ВНТ и бримонидин тартрат с последующим перемешиванием. Получившуюся в результате композицию затем охлаждали до комнатной температуры, и добавляли отдушку. Продукт затем упаковывали с Аэрон А-31 пропеллентом в аэрозольный баллончик, используя обычные технологические приемы, и механически встряхивали в течение 5 минут. Продукт дозировался в виде аэрозоля конической формы, который наносился на кожу в виде слоя обильной пены, которая быстро покрывала большую площадь кожи и начинала облегчать симптомы в пределах приблизительно 2 минут после нанесения.
Вторая рецептура пены описана в таблице 9 ниже.
Водную фазу готовили следующим образом. Воду нагревали до 80°С, затем добавляли пальмитиновую кислоту. Как только пальмитиновая кислота расплавлялась, добавляли лаурет-23, расплавляли и хорошо перемешивали. Затем добавляли триэтаноламин, и получившуюся в результате композицию хорошо перемешивали в течение приблизительно 15 минут до образования мыла.
Стеариловый спирт, минеральное масло, лаурамид DEA, цетил диметикон сополиол, ПЭГ-150 дистеарат и ВНТ смешивали и нагревали до 55°С до образования масляной фазы. Масляную фазу объединяли с водной фазой при 80°С и хорошо перемешивали в течение приблизительно 15 минут. Получившуюся в результате смесь затем охлаждали до комнатной температуры и добавляли имидазолидинилмочевину, метилпарабен и пропилпарабен и затем хорошо перемешивали. Затем добавляли бримонидин тартрат и хорошо перемешивали. Затем добавляли отдушку с последующим легким перемешиванием. Алоэ затем растворяли в воде, входящей в состав, и добавляли при медленном перемешивании до образования рецептуры продукта, которую затем упаковывали в аэрозольный баллончик как описано для первой рецептуры пены.
Продукт дозировался в виде аэрозоля конической формы, который наносился на кожу в виде слоя обильной пены, которая быстро покрывала большую площадь кожи и начинала облегчать симптомы в пределах приблизительно 2 минут после нанесения.
Третья рецептура немыльной пены описана в таблице 10 ниже.
Спиртовую фазу готовили путем растворения этилового эфира PVM/MA сополимера в этаноле, после которого добавляли диметикон и хорошо перемешивали. Водную фазу готовили путем нагревания воды до 65°С, после чего добавляли PVP/VA сополимер, и хорошо перемешивали. Масляную фазу готовили путем смешивания олет-20, кокамид МЕА и стеарет-16 при 60°С до образования смеси. Масляную фазу затем добавляли к водной фазе при 65°С и хорошо перемешивали. Затем к смеси добавляли метилпарабен с последующим перемешиванием, после чего к смеси добавляли аминометилпропанол, стеаралкониум хлорид и пантенол и перемешивали до равномерного состояния. Получившуюся в результате композицию охлаждали до комнатной температуры, после чего добавляли спиртовую фазу и хорошо перемешивали. Затем добавляли отдушку и слегка перемешивали до получения продукта. Продукт затем упаковывали в аэрозольный баллончик.
Продукт дозировался в виде аэрозоля конической формы, который наносился на кожу в виде слоя обильной пены, которая быстро покрывала большую площадь кожи и начинала облегчать симптомы в пределах приблизительно 2 минут после нанесения.
ПРИМЕР 5
Исследование фотоканцерогенности с бримонидином
Безволосых мышей-альбиносов SKH1-hr (36/смеш.пол/группа) обрабатывали в течение 40 недель УФ-облучением и гелем с бримонидином или наполнителем лекарственной формы в соответствии с планом, представленным в таблице 11. За мышами затем наблюдали в течение 12 недель без какой-либо обработки. Местные обработки проводили приблизительно за один час до УФ-облучения по понедельникам, средам и пятницам каждой недели и приблизительно через один час после УФ-облучения по вторникам и четвергам каждой недели. См. таблицу 11.
Все эксперименты с участием животных проводили в полностью аккредитованном виварии и в соответствии с заранее одобренными протоколами.
Согласно результатам, представленным в таблице 12, местное применение бримонидина в концентрациях 0,18%, 1% и 2% неожиданно замедлило развитие поражения кожи опухолью. Бримонидин вызывал дозозависимую отсрочку образования вызываемой УФ-облучением опухоли кожи.
Наблюдали отсрочку по средней по медиане неделе до возникновения опухоли (≥1 мм). Фактически, препараты с 1% и 2% бримонидина оказались столь эффективными, что менее чем половина членов групп приобретала одну или несколько соответствующих установленным критериям опухолей за 52-недельный период исследования. Отсрочку также наблюдали в росте опухоли (≥1 мм) По сравнению с группой с наполнителем лекарственной формы, 0,18% бримонидина понижали рост опухоли в 1,7 раза, 1% бримонидина в 4,7 раза; и 2% бримонидина в 8,1 раза. Эти результаты представляют значительную отсрочку в возникновении онкогенеза.
Кроме того, фигура 1 показывает групповые сравнения по распространению опухоли. Отметим, что номер у каждой линии указывает номер группы, подвергаемой обработке, представленной в таблицах 11 и 12. Как показано на фигуре 1, с возрастанием концентрации бримонидина размеры опухолей также уменьшались. Это указывает на то, что применяемый наружно бримонидин также промотирует регрессию опухоли.
Специалистам в данной области следует иметь в виду, что в описанных выше вариантах осуществления можно сделать изменения без отступления от их широкой изобретательской концепции. Следует понимать, таким образом, что это изобретение не ограничивается раскрытыми здесь частными вариантами осуществления, но предназначено для того, чтобы охватить модификации в пределах объема и сущности настоящего изобретения, как определено в прилагаемой формуле изобретения.
Группа изобретений относится к медицине и касается способов предотвращения образования опухоли кожи или ингибирования развития существующей опухоли кожи, индуцированной УФ-облучением, включающих применение композиции, содержащей бримонидин или бримонидина тартрат. Кроме того, описан способ защиты кожи и губ от повреждающих эффектов УФ-облучения, включающий применение композиции, содержащей бримонидин или бримонидина тартрат. Группа изобретений обеспечивает неинвазивные способы, позволяющие эффективно предотвращать образование или уменьшать распространение опухолей кожи, вызываемых УФ-облучением. 5 н. и 8 з.п. ф-лы, 4 ил., 5 пр., 12 табл.
1. Способ предотвращения индуцированного УФ-облучением образования опухоли кожи у субъекта, нуждающегося в этом, включающий введение субъекту композиции, содержащей эффективное количество агониста α2-адренергического рецептора и фармацевтически приемлемый носитель, в котором агонист α2-адренергического рецептора представляет собой бримонидин или бримонидина тартрат.
2. Способ индуцирования гибели клеток и ингибирования прогрессирования существующей индуцированной УФ-облучением опухоли кожи у субъекта, нуждающегося в этом, включающий введение субъекту композиции, содержащей эффективное количество агониста α2-адренергического рецептора и фармацевтически приемлемый носитель, в котором агонист α2-адренергического рецептора представляет собой бримонидин или бримонидина тартрат.
3. Способ индуцирования гибели клеток и ингибирования роста клеток индуцированной УФ-облучением опухоли кожи у субъекта, нуждающегося в этом, включающий местное применение у субъекта композиции, содержащей агонист α2-адренергического рецептора в количестве, достаточном для индуцирования гибели или ингибирования роста клеток опухоли кожи, в котором агонист α2-адренергического рецептора представляет собой бримонидин или бримонидина тартрат.
4. Способ защиты кожи, губ или кожи головы субъекта, нуждающегося в этом, от повреждающих эффектов УФ-облучения, включающий введение субъекту композиции, содержащей безопасное и эффективное количество агониста α2-адренергического рецептора, в котором агонист α2-адренергического рецептора представляет собой бримонидин или бримонидина тартрат.
5. Способ по любому из пп. 1-4, в котором композиция содержит от приблизительно 0,01% масс. до приблизительно 5% масс. агониста α2-адренергического рецептора.
6. Способ по п. 5, в котором композиция содержит от приблизительно 0,1% масс. до приблизительно 2% масс. агониста α2-адренергического рецептора.
7. Способ по любому из пп. 1, 2 и 4, в котором композицию вводят субъекту путем наружной, накожной, чрескожной, подкожной или внутримышечной доставки.
8. Способ по п. 7, в котором композицию вводят субъекту путем подкожной доставки в область кожи, нуждающейся в таком введении.
9. Способ по п. 7, в котором композицию вводят субъекту путем наружного нанесения на область кожи, нуждающейся в таком введении.
10. Способ по любому из пп. 1-3, в котором опухоль кожи выбирают из группы, состоящей из папилломы, актинического кератоза, базально-клеточной карциномы, плоскоклеточной карциномы, кератоакантомы, меланомы, саркомы и лимфомы.
11. Способ по п. 1 или 2, дополнительно включающий введение субъекту другого лечения или активного ингредиента для предотвращения или лечения опухоли кожи.
12. Способ по п. 11, где опухолью кожи является актинический кератоз.
13. Применение агониста α2-адренергического рецептора в получении лекарственного средства для:
(а) предотвращения образования индуцированной УФ-облучением опухоли кожи;
(б) индуцирования гибели клеток и ингибирования роста клеток индуцированной УФ-облучением опухоли кожи; или
(в) защиты кожи, губ или кожи головы от повреждающих эффектов УФ-облучения,
в котором агонист α2-адренергического рецептора представляет собой бримонидин или бримонидина тартрат.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА С ПОМОЩЬЮ ОТОБРАННЫХ АНТАГОНИСТОВ ИНТЕГРИНОВ | 2000 |
|
RU2255765C2 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Г.Д | |||
| Жабоедов и др., Адреномиметики в лечении открытоугольной глаукомы, Газета "Новости медицины и фармации" 3(308) 2010; найдено в интернете: http://www.mif-ua.com/archive/article_print/11649. | |||
Авторы
Даты
2016-06-10—Публикация
2011-06-29—Подача