Настоящее изобретение относится к способу синтеза конъюгатов гликозаминогликанов (GAG) с биологически активными молекулами различной природы, включающими низкомолекулярные соединения и макромолекулы. Конкретно, настоящее изобретение относится к конъюгации гиалуроновой кислоты (HA) и ее производных с полипептидами и белками с биологической функцией, такими как, например, интерфероны, эритропоэтины, факторы роста, инсулин, цитокины, антитела и гормоны.
Применение полимеров в области биомедицины является общеизвестным и широко распространенным. Гидрогели на полимерной основе широко используются, например, для восстановления плотного соединения в хирургических операциях при полостной хирургии, при восстановительной и косметической хирургии, в системах с контролируемым высвобождением, состоящих из желеобразных матриксов, или используются в качестве биоматериалов.
Другой важный пример представляет собой модификацию молекул с фармакологическим действием, содержащих полимерные цепи, которые улучшают растворимость и маскируют молекулы по отношению к процессам деградации, пролонгируя действие молекул.
Наиболее типичным примером в данном контексте является полиэтиленгликоль (ПЭГ), который, хотя и не присутствует в живых организмах, при этом является полностью биосовместимым и неиммуногенным. ПЭГ широко применяется для осуществления действия биологических лекарственных средств (терапевтических белков). Стоит упомянуть, например, пэгилированный альфа-интерферон или пэг-интерферон, который заменил простой рекомбинатный вариант белка, став предпочтительной терапией вирусного гепатита (европейский патент EP0809996). Ограничение функциональности белков с ПЭГ связано с получением конъюгатов с аномальной функциональностью или, в любом случае, с полидисперсными профилями. Кроме того, различные полученные изомеры могут характеризоваться различной биологической активностью, биодоступностью, периодом полужизни, иммуногенной эффективностью.
По этой причине в девяностые годы ПЭГ методом пэгилирования вводили так, чтобы получить белки, модифицированные только в специфических сайтах, среди которых N-концевая область является наиболее доступной благодаря тому, что ее pKa существенно отличается по отношению ко всем другим аминогруппам, присутствующим в белках.
В связи с этим Пепински и сотр. (Pepinsky R.B., Le Page D.J., Gill A., et al. J. Pharmac. Exp. Ther., 2001 297 (3): 1059-1066), конкретно изучали введение ПЭГ-цепи в N-концевую область интерферона-бета 1 (который используется в лечении рассеянного склероза) посредством восстановительного алкилирования полученного из альдегидного производного ПЭГ. Полученный аддукт продемонстрировал лучшую эффективность in vivo благодаря увеличенному периоду полужизни.
Другой белок, который модифицировали с помощью ПЭГ благодаря этому методу, - это G-CSF, фактор роста и активации нейтрофильных гранулоцитов, который Kinstler et al. функционализировали в N-концевой области (патент США № 6153655). Соответствующий продукт (Pegfilgrastim) уже имеется на рынке с 2002 года.
В группе полимеров в области биомедицины биополимеры представляют особый интерес. Некоторые из них естественным образом присутствуют в тканях человека, и обладают свойствами биосовместимости, и неиммуногенны, что характеризует их важную дополнительную ценность в этом контексте. Среди этих биополимеров гликозаминогликаны (GAG) представляют особый интерес, т.е. это неразветвленные полисахариды, имеющие высокую молекулярную массу, состоящие из повторяющихся элементов дисахаридов. GAG, например, обладают структурной функцией в соединительной ткани, сухожилиях и в хряще, или они могут действовать в качестве антикоагулянтов.
Гиалуроновая кислота (HA) представляет собой GAG, который можно обнаружить во внеклеточном матриксе, где у нее структурная роль, вовлеченная в процесс сократительной способности, но, кроме того, она обладает вязкоупругими свойствами дополнительно к тому, что она является агентом гидратации и пролиферации. Благодаря этим конкретным характеристикам, HA и ее производные используются в качестве матрикса для биоматериалов (EP 216453) и систем с контролируемым высвобождением (патентная заявка США № 4582865 и патент США № 4636524; K. Motokawa et al., Journal of Biomedical Materials Research Part A, (2006), pag. 459).
HA также вовлечена в механизмы молекулярного распознавания и регуляции, которые распознаются с помощью клеточных рецепторов, таких как RHAMM (CD168), CD44, LYVEl, Layilin. Специфичность взаимодействия HA с CD44 представляет большую важность. Фактически этот рецептор сверхэспрессируется в большинстве твердых опухолей эпителиального происхождения; с помощью связывания лекарственных средств, имеющих противоопухолевую активность, с HA может применяться активная направленность биополимера, которая дает возможность эндоцитоза и высвобождает противоопухолевое средство внутри неопластической клетки (WO2009001209).
Модификация терапевтических средств с использованием водорастворимых полимеров (как, например, GAG) особо полезна в случае полипептидов, полипептидных гормонов и белков. Этот класс молекул фактически обладает структурой, которая чрезвычайно чувствительна даже к небольшим модификациям, вызванным окружающей средой, в которой они присутствуют. Кроме того, полипептиды и белки обычно обладают временным диапазоном эффективности, очень ограниченным коротким периодом полужизни. Поэтому их функционализация с использованием водорастворимых полимеров чрезвычайно важна, что улучшает также их растворимость, биодоступность и уменьшает иммуногенность.
Способы конъюгации GAG с белками посредством дивинилсульфона (патент США № 7034127, который конкретно относится к IFN), дисульфидных мостиков (патент США № 7417021), известны из уровня техники. Единственный способ, который дает возможность контролировать сайт модификации, - это реакция с образованием дисульфидных мостиков; в этом случае полимер может связываться только сам с собой в соответствующих остатках цистеина в восстановленной форме.
Если полипептидная цепь содержит только один доступный остаток цистеина и в восстановленной форме, то способ модификации фактически является специфическим, но это достаточно редкий случай. Фактически белки часто содержат многочисленные остатки цистеина, но, главным образом, часто случается, что эти остатки уже вовлечены в дисульфидные мостики, чье восстановление включает значительную перестановку, которая может приводить к потере функциональности белка.
Ни один из методов, известных из уровня техники, не дает возможности получения однозначного профиля функциональности, даже с поддержанием биологической активности белка и соответственно эффективно монодисперсного и эффективного продукта.
На основе вышесказанного становится очевидной необходимость создания доступного способа конъюгации биоактивных молекул, таких как белки и полипептиды, с GAG (т.e. HA) без нарушения функциональности белка.
Авторы настоящего изобретения предлагают способ конъюгации с помощью гликозаминогликанов, содержащих биологически активные молекулы (т.e. белки и полипептиды), способные преодолевать ограничения, свойственные предшествующему уровню техники, поскольку они позволяют GAG (таким как HA) связываться без модификации основной структуры белка и риска потери функциональности. Следующая характеристика, которая позволяет отличить конъюгаты между GAG и терапевтическим средством (TA) по настоящему изобретению и конъюгаты, известные из уровня техники, заключается в том, что настоящий способ конъюгации приводит к образованию почти монодисперсного аддукта и не приводит к образованию смеси изомерных продуктов с различными химическими, физическими, биологическими характеристиками, чье поведение, терапевтическая эффективность и токсикологический профиль отличаются.
Кроме того, путем подходящего варьирования некоторых из параметров способа (т.e. pH) также возможно выбрать аминогруппы биологически активной молекулы, с которыми связывается гликозаминогликан; возможно, например, специфическое связывание водорастворимого полимера HA с N-концевой областью.
В случае лекарственных средств, таких как белки и полипептиды, конденсация аминогруппы часто происходит посредством ацилирования, которое приводит к образованию амидов, чей атом азота более не способен к участию в равновесии кислоты-основания.
Способ конъюгации по настоящему изобретению характеризуется тем, что он не подразумевает никакого изменения суммарного заряда, имеющегося на активных частицах, что приводит к трансформации первичного амина во вторичный амин, который поддерживает способность обмена протонов. Это очевидное преимущество по части поддержания биологической активности TA.
Еще более удивительным оказался обнаруженный авторами изобретения факт, состоящий в том, что биоконъюгаты по настоящему изобретению способны повышать эффективность конъюгированного лекарственного средства и поддерживать ее в течение времени (см. Пример 10 конъюгат HA-инсулин).
Конъюгация терапевтического средства с водорастворимым полимером улучшает его характеристики, делая его более растворимым, биодоступным и более активным. В отличие от водорастворимых полимеров, описанных в современной науке и технике (таких как, например, полиэтиленгликоль, ПЭГ), использование гликозаминогликанов дает возможность получения отличной системы доставки лекарственного средства, которая способна направлять терапевтическое средство со специфичностью, недоступной другим типам полимеров. Эта специфичность определяется сложной системой рецепторных взаимодействий, которые включают GAG. Кроме того, использование биополимеров, которые хотя и взаимодействуют с клеточными рецепторами, но не стимулируют иммунологического ответа, приводят в результате к синергическому действию с более высокой эффективностью.
Настоящее изобретение описывает способ синтеза конъюгатов гликозаминогликанов (GAG) с биологически активными молекулами, включающий следующие стадии:
a) модификация GAG по меньшей мере одной альдегидной группой (CHO) путем взаимодействия GAG со спейсерной молекулой (SP), где указанная спейсерная молекула включает в качестве первой функциональной группы одну или несколько альдегидных групп (SP-CHO), причем указанные альдегидные группы (SP-CHO) необязательно защищены, и в качестве второй функциональной группы нуклеофильную группу, подходящую для конъюгации с GAG;
a1) гидролиз активированного промежуточного соединения с помощью водных растворов кислот, когда указанные одна или несколько альдегидных групп защищены;
b) взаимодействие аддукта, полученного на стадии a) или a1) по меньшей мере с одной биологически активной молекулой (TA), характеризующейся тем, что она включает функциональную группу, способную к взаимодействию с альдегидной группой.
Гидрогели, состоящие из гиалуроновой кислоты, функционализированной с помощью амино- или альдегидной групп (защищенных или не защищенных), известны из уровня техники, однако эти производные затем поперечно сшивают с другими молекулами того же полисахарида, возможно, модифицированного с помощью различных функциональных групп, таких, которые реагируют с аминогруппой или с альдегидной группой исходной функционализированной гиалуроновой кислоты (EP1757314; Bulpitt P., et al. J. of Biomedical Materials Research, 1999 47(2): 152-169).
Как уже было упомянуто, гликозаминогликаны (GAG) представляют собой неразветвленные полисахариды, имеющие высокую молекулярную массу, состоящие из повторяющихся элементов дисахаридов. Общая характеристика GAG - это присутствие карбоксильной функциональной группы на дисахаридном элементе, которая имеется в естественном состоянии в кислой форме или в форме соли, генерируя таким образом полианионы. В настоящем изобретении аббревиатура GAG индифферентно указывает на кислую форму или форму соли полисахаридов, и в этом случае наиболее типичные противоионы - это щелочные и щелочноземельные металлы, такие как натрий, калий, магний, кальций. Полимеры, классифицированные как GAG, включают гиалуроновую кислоту, хондроитинсульфат, дерматансульфат, кератансульфат, гепарин, гепарансульфат. GAG, используемые по настоящему изобретению, могут быть представлены в нативной форме полусинтетических производных, включающих соли четвертичного аммония, эфиры карбоновых кислот, O-эфиры, амиды, перкарбоксилированные производные, O-сульфатированные производные, N-деацетилированные производные, N-сульфатированные производные или смешанные производные, характеризующиеся одновременным присутствием этих модификаций. Аббревиатура GAG используется далее для обозначения как упомянутых полимеров в нативной форме, так и соответствующих полусинтетических производных.
Даже если GAG, представленные в виде обычной структурной формулы, не несут альдегидной группы, стоит упомянуть, что естественное равновесие, которое устанавливается в растворе между открытой формой и закрытой формой области восстановления, проходит через образование функциональной альдегидной группы. Это присутствие количественно чрезвычайно ограничено, однако длина полимерных цепей создает низкое количество областей восстановления. Когда молекулярная масса GAG уменьшается, с другой стороны, соответствующее количество областей восстановления, доступных в альдегидной форме, прогрессивно увеличивается до тех пор, пока оно не становится количественно приемлемым для олигомеров GAG; это единственный случай, в котором области восстановления могут эффективно использоваться для воздействия на способ конъюгации, описанный в настоящем документе.
Во всех других случаях, предполагающих, что альдегидная группа скорее нестабильна даже в мягких условиях, удобно вводить ее синтетически в водорастворимый полимер в форме защищенного альдегида.
Таким образом, возможно выделение активированного промежуточного продукта, который затем реагирует с TA, без необходимости контакта всех компонентов в одной реакционной смеси.
Конъюгаты согласно настоящему изобретению соединены с терапевтическим средством TA, связанным с водорастворимым полимером в виде вторичного или третичного амина. Присутствие альдегидной группы (возможно защищенной, как описано на стадии a)) в качестве средства для обеспечения возможности образования связи между терапевтическим средством и GAG и способ синтеза, осуществленный авторами изобретения, проиллюстрированные в настоящем документе, следует рассматривать как отличительный признак настоящего изобретения.
Аддукт, полученный таким образом на стадии a), достаточно стабилен, чтобы его можно было выделить, но после высвобождения альдегидных групп он доступен по отношению к взаимодействию модификации с терапевтическим средством, представляющим интерес.
Полученный конъюгат может быть описан следующей общей формулой:
GAG-SP-TA,
где GAG обозначает гликозаминогликан, SP - спейсер и TA терапевтическое средство.
В переводе на систему обозначения в данном способе модификации получали следующее:
Стадия a. GAG+SP-(CHO) → GAG-SP-(CHO)
Стадия a1. GAG-SP-(CHO) → GAG-SP-CHO
Стадия b. GAG-SP-CHO+TA → GAG-SP-TA,
где CHO обозначает функциональную альдегидную группу, защищенную, если она находится между группами.
Данная защита может быть легко получена с помощью методов органического синтеза, известных специалисту в данной области. Подходящая форма защиты, например, заключается в использовании гемиацеталей или ацеталей, полученных посредством взаимодействия альдегидов с алифатическими или арилалифатическими спиртами или с диолами, включающими, например, метанол, этанол, н-пропанол, изопропанол, н-бутанол, втор-бутанол, трет-бутанол, изобутанол, этиленгликоль, пропиленгликоль, 1,3-пропандиол, 1,4-бутандиол и структурно подобные молекулы, способные к взаимодействию с альдегидами с образованием выделяемых ацеталей. Продукт стадии (a) характеризует то, что определяется как "активированное промежуточное соединение" или "активированное, но выделяемое полусинтетическое промежуточное соединение".
Химические взаимодействия, используемые для функционализации GAG с помощью спейсеров для получения активированного промежуточного соединения, могут выбираться каждый раз с использованием функциональных групп, присутствующих в полимере или в соответствующем полусинтетическом производном, т.e. карбоксильной группы, гидроксильных групп (4 для каждого повторяющегося элемента), иногда присутствуют в форме алкил- или О-сульфатированных эфиров, N-ацетильной группы, N-сульфатированной группы. Кроме того, условия конденсации между GAG и спейсером должны быть такими, чтобы не изменить альдегидную группу или не удалить ее защиту, если она есть.
Спейсер должен содержать функциональную группу, подходящую для ковалентного соединения с GAG, предпочтительно нуклеофильную, такую как, например, аминогруппа или спиртовая группа. Аминогруппа в свободной форме или в форме соли с использованием подходящих солей является предпочтительной для ее большей нуклеофильности. Спейсерная молекула SP-(CHO) предпочтительно представляет собой аминоальдегид, еще более предпочтительно защищенный в виде ацетали.
Примеры молекул, которые могут использоваться в качестве спейсера типа GAG-SP-(CHO), включают аминоальдегидные ацетали, состоящие из
• аминогруппы, свободной или в форме соли,
• углеводородной цепи, предпочтительно алифатической, с количеством углеродных атомов в интервале от 1 до 20,
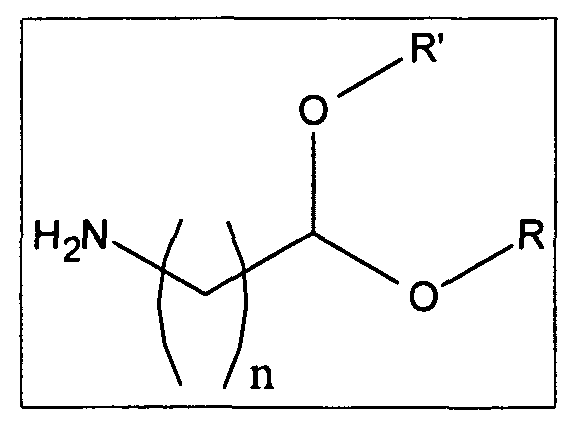
• альдегидной группы, предпочтительно в форме ацеталя согласно следующей схеме, в которой n находится в интервале от 1 до 20, тогда как R и R' могут быть алифатическими или арилалифатическими остатками, одинаковыми или различными, или одинаковыми цепями, которые несут различные гидроксильные группы
Алифатическая цепь дополнительно к линейной форме может быть разветвленной или может содержать арильные группы.
Авторы изобретения подтвердили, что удобный способ конденсации включает образование амидов, в которых GAG участвует в качестве карбоновой кислоты, а спейсер в качестве амина. Этот тип взаимодействия осуществляется согласно методам органического синтеза, известным специалисту в данной области, и может проводиться, например, с помощью конденсирующих агентов, которые стимулируют нуклеофильную атаку на карбоновые кислоты. Эти реагенты включают те, которые могут использоваться в пептидном синтезе в гомогенной или гетерогенной фазе. Примеры этих агентов представляют собой карбонилдиимидазол, дисукцинимидил карбонат, карбодиимиды, такие как например, l-этил-3-(3-диметиламинопропил)карбодиимид (EDC); N,N'-дициклогексилкарбодиимид; N-аллил-N'-(β-гидроксиэтил)карбодиимид N-(α-диметиламинопропил-N'-трет-бутилкарбодиимид; N-(α-диметиламинопропил)-N'-(β-бромаллил)карбодиимид; 1-(3-диметиламинопропил)-3-(6-бензоиламиногексил)карбодиимид; циклогексил-β-(N-метилморфолин)этилкарбодиимид, п-толуолсульфонат (CMC) и подобные продукты.
Реакция может проводиться в водной среде или в органическом растворителе при температуре в интервале от -10 до 70°C в зависимости от типа используемой активации. Когда проводят получение в безводной среде, то удобно использовать соли GAG, которые более растворимы в этих условиях, например соли тетраалкиламмония. Противоионы должны в любом случае быть исключены посредством процесса ионообмена, проводимого в отношении модифицированного полимера перед его удалением.
Тетрааммонийные соли GAG (конкретно, HA), как правило, растворимы в апротонных полярных растворителях, таких как N-метилпирролидон (NMP), диметилсульфоксид (DMSO), диметилформамид (DMF), которые подходят в качестве реакционной среды. Использование этих растворителей удобным образом совпадает с использованием карбонилдиимидазола в качестве конденсирующего агента, чьему действию способствует слабо кислая среда благодаря небольшим количествам сильных кислот, например газообразной соляной кислоты, пропускаемой через раствор метансульфокислоты. Другие органические растворители, подходящие для осуществления этого типа синтеза активированного промежуточного соединения, представляют собой органические карбонаты, включающие пропиленкарбонат, диэтилкарбонат и, как правило, органические карбонаты, замещенные алифатическими, ароматическими или арилалифатическими цепями.
Реакцию прекращают путем добавления насыщенного раствора галогенида щелочного металла, например NaCl, NaBr, KCl, KBr. Гидратация реакционной смеси дезактивирует стимуляторы образования амидных связей, тогда как соль, добавляемая в таком количестве, чтобы быть в сильном избытке по отношению к молярному количеству повторяющегося элемента GAG, вызывает эффективный ионообмен. Требование стехиометрического избытка удовлетворяется путем добавления количества насыщенного раствора галогенида щелочного металла в интервале от 0,5% до 30% об. и предпочтительно от 5 до 15% по об.
Соответствующую соль щелочного металла и активированного промежуточного соединения последовательно очищают с помощью диализа, затем лиофилизируют. Хотя этот продукт можно выделить и он стабилен, при этом он активен по отношению к последующей реакции функционализации с терапевтическими средствами, содержащими функциональные группы, восприимчивые к взаимодействию с альдегидами.
Альтернативный способ очистки/выделения активированного промежуточного соединения состоит в применении циклов осаждения-промывания с использованием смеси растворителей соответствующей полярности. Осаждение-промывание может осуществляться, например, с использованием спиртов, таких как метанол, этанол, н-пропанол, изопропанол и высшие гомологи, возможно, смешанные с водой; другие подходящие растворители представляют собой ацетон, этилацетат, тетрагидрофуран, диоксан, ацетонитрил, апротонные полярные растворители (например, диметилформамид, диметилсульфоксид, н-метилпирролидон, н-метилацетамид), органические карбонаты. Каждый из вышеупомянутых растворителей может использоваться индивидуально или в смеси с любым растворителем или с водой с целью получения с большей точностью полярности и других физико-химических характеристик. Смеси, включающие вышеуказанные спирты, ацетон и воду, являются предпочтительными.
Стадия (b), которая описывает конденсацию между GAG-SP-(CHO) и TA, происходит через первую стадию a1) для высвобождения альдегидной группы (когда она защищена), которое состоит из гидролиза ацеталя, который осуществляется путем обработки водными растворами кислот согласно стандартным методам, известным специалистам в данной области.
Указанная стадия гидролиза a1) активированных промежуточных соединений с использованием водных растворов кислот для высвобождения альдегидной группы предпочтительно осуществляется при pH в интервале от 1,5 до 3,0, предпочтительно при pH в интервале от 2,0 до 2,5, при температуре в интервале от 25 до 65°C, предпочтительно от 40 до 60°C, в течение по меньшей мере 30 мин.
Свободный альдегид теперь является восприимчивым к нуклеофильной атаке со стороны терапевтического средства, активированного через аминогруппу, присутствующую в молекуле TA, которая приводит к образованию имина, восстанавливаемого до амина посредством неорганических гидридов, как правило, используемых в реакциях восстановительного аминирования, например, с использованием цианоборгидрида, алюмогидрида лития, раствора боргидрида и тому подобных.
Активные компоненты с фармацевтическим действием, представляющим интерес в рамках настоящего изобретения, включают, например, "низкомолекулярные соединения" с фармакологическим действием и/или полипептиды, гормоны, белки, гликопротеины, ферменты, цитокины, факторы роста или факторы клеточной дифференцировки, антитела, терапевтические полимеры, нуклеиновые кислоты или их комбинацию. Согласно предпочтительному воплощению настоящего изобретения "активный компонент", который может конъюгироваться с HA с использованием способа, описанного в настоящем изобретении, включает
полипептиды и/или белки, конкретно
- иммуномодуляторы, конкретно белки, принадлежащие к семейству интерферонов, такие как, например, интерфероны типа I, т.е. те, которые связываются с одним рецептором IFNα, который дополнительно к IFNα включает IFNβ и IFNω; интерфероны типа II и типа III, т.е. интерфероны, которые связываются с рецептором IFNγ и IFNλ соответственно;
- факторы роста, конкретно
1. Эритропоэтины и вообще молекулы, идентифицированные как ESA (агент, стимулирующий эритропоэз), включающие эритропоэтин-α и эритропоэтин-β, эритропоэтин-ω, эритропоэтин-δ, дарбепоэтин, CERA и вещества, генерированные или полученные на их основе, такие как сшитые белки, полученные при стимулировании эритропоэза;
2. Факторы, которые стимулируют гемопоэз, такие как факторы GM-CSF, G-CSF, которые также могут использоваться в области онкологии;
3. Факторы роста для костей и хряща, включающие белки, принадлежащие к семейству костного морфогенетического белка (BMP), такие как например, BMP1, BMP2, BMP3, BMP4, BMP5, BMP6, BMP7 (также обозначаемый в литературе как OP1), BMP8a, BMP8b, BMP10, BMP15, BMP9, также известный как GDF2 (фактор дифференцировки 2), белки, принадлежащие к суперсемейству TGF-бета, VEGF, PDGF, белки, принадлежащие к семейству FGF;
- цитокины и их рецепторные антагонисты, такие как, например, IL2, TNF с его растворимыми рецепторами или соответствующие моноклональные антитела; IL1-ra (рецепторный антагонист IL1 для лечения артрита и ревматоидного артрита) и, как правило, растворимые рецепторы провоспалительных цитокинов;
- гликопротеины, конкретно лубрицин;
- ферменты: конкретно супероксиддисмутаза (SOD); рибонуклеаза и глюкоцереброзидаза;
- антитела: конкретно, моноклональные антитела или их конъюгаты или сшитые белки; моноклональные антитела, которые вызывают противоопухолевое действие; моноклональные антитела, которые вызывают противовоспалительное действие;
- гормоны: белковые гормоны или по меньшей мере частично содержащие полипептидную цепь, конкретно кальцитонин, инсулин и его аналоги и гормон роста (GH или hGH).
Терапевтические средства, содержащие аминогруппы, не принципиальные для биологического функционирования:
- противоопухолевые лекарственные средства, конкретно:
1. Таксаны, алкалоиды барвинка; камптотецины;
2. Замещенные мочевины;
3. Комплексы платины, золота, серебра и других металлов, используемых, например, в терапии опухолей, или остеоартрита, и/или ревматоидного артрита, или бактериостатические/противобактериальные агенты;
4. Метотрексат, триметрексат, пеметрексат, тетрагидрофолат;
5. Аналоги пиримидина; цитидин, пурин;
6. Антибиотики для лечения онкологических заболеваний и аналоги; антрацендионы;
- противовирусные средства и антибиотики;
- протеазные и полимеразные ингибиторы;
- противовоспалительные, анальгезирующие, анестетические, обезболивающие лекарственные средства с центральным или периферическим действием;
- наркотики опиатного или неопиатного ряда;
- стероиды;
- миноксидил (обычно используемый в дерматологии).
Нуклеиновые кислоты, конкретно
1. Малая интерферирующая РНК (или короткая интерферирующая РНК, общеизвестная как киРНК (siRNA) - это молекула РНК длиной от 20 до 25 нуклеотидов. Более конкретно, киРНК вовлечена в ингибирование экспрессии одиночных генов, и их использование для лечения макулярной дегенерации в настоящее время находится на стадии эксперимента).
2. МикроРНК (микроРНК, миРНК (miRNA), представляет собой короткую некодирующую молекулу РНК, которая модулирует экспрессию специфических генов-мишеней. Таким образом, они могут функционировать в качестве опухолевых супрессоров в отношении специфических злокачественных гемопоэтических образований).
3. Антисмысловая РНК
Вещества, перечисленные выше, обозначаются далее как "терапевтические средства" (сокращенно TA) или "активные компоненты".
Молекулярная структура TA должна нести функциональную группу, способную к взаимодействия с альдегидами, например аминогруппу. Если этой группы нет в TA, то она может быть введена посредством реакций органического синтеза, известных специалистам в данной области. Таким образом, фактически возможно связать любую молекулу с GAG.
В рамках настоящего изобретения особый интерес представляет применение гиалуроновой кислоты (HA) и ее солей, указанных выше. HA, используемая по настоящему изобретению, может быть получена из любого источника; она может быть получена, например, путем ферментативной или биотехнологической экстракции из петушиного гребня, и она имеет молекулярную массу в интервале от 400 до 3×106 Да, предпочтительно от 1×103 Да до 1×106 Да, еще более предпочтительно от 10000 до 750000 Да.
Реакция модификации по изобретению может применяться как к полисахариду как таковому, так и к ранее модифицированному полисахариду. Таким образом получают молекулярные сетки (Molecular networks), начиная с гиалуроновой кислоты, модифицированной различными способами согласно известным методам, и конкретно:
- HA в форме соли с органическими и/или неорганическими основаниями (EP 138572 B1);
- HYAFF®: эфиры HA со спиртами алифатического, арилалифатического, циклоалифатического, ароматического, циклического и гетероциклического ряда, с процентом этерификации, который может варьироваться согласно типу и длине используемого спирта, предпочтительно, от 20 до 80%, тогда как оставшийся процент неэтерифицированной HA может быть превращен в форму соли с использованием органических и/или неорганических оснований (EP 216453);
- HYADD®: амиды HA с аминами алифатического, арилалифатического, циклоалифатического, ароматического, циклического и гетероциклического ряда с процентом амидирования 0,1-50%, тогда как оставшийся процент HA, не подвергнутой амидированию, может быть превращен в форму соли с использованием органических и/или неорганических оснований (EP 1095064);
- O-сульфатированные производные HA до 4-й степени сульфатирования (EP 702699);
- ACP®: внутренние эфиры HA с процентом этерификации не выше чем 20%, предпочтительно от 0,05 до 10% этерификации, тогда как оставшийся процент неэтерифицированной HA может быть превращен в форму соли с использованием органических и/или неорганических оснований (EP 341745);
- деацетилирование HA: эти производные получают путем деацитилирования остатков N-ацетилглюкозамина, присутствующих в HA, с процентом деацитилирования предпочтительно в интервале от 0,1 до 30%, тогда как все карбоксильные группы HA могут быть превращены в форму соли с использованием органических и/или неорганических оснований (EP 1313772);
- HYOXX™: перкарбоксилатные производные HA, полученные в результате окисления первичного гидроксила фракции N-ацетилглюкозамина со степенью перкарбоксилирования 0,1-100% и предпочтительно от 25 до 75%. Все карбоксильные группы HA могут быть превращены в форму соли с использованием органических и/или неорганических оснований (EP 1339753).
Согласно предпочтительному воплощению изобретения способ конъюгации HA и терапевтических средств включает следующие стадии:
a) взаимодействие модификации HA с помощью защищенных аминоальдегидов SP-(CHO), в которых HA участвует во взаимодействиях с карбоксильной группой, которая образует амид с амином аминоальдегида. Эту ступень проводят, начиная с HATBA (тетрабутиламмониевая соль HA) или с другой соли, растворимой в органическом апротонном полярном растворителе (DMSO, NMP, DMF, органические карбонаты). Активированное, но выделяемое промежуточное соединение получают из этой ступени;
a1) гидролиз активированного промежуточного соединения, т.е. HA-SP-(CHO) → HA-SP-CHO для высвобождения альдегидной группы: реакция с фосфорной кислотой при pH в интервале 1,5-3, предпочтительно при pH в интервале от 2 до 2,5, при температуре в интервале от 25 до 65°C, предпочтительно от 40°C до 60°C, в течение по меньшей мере 30 минут;
b) взаимодействие конъюгации активированного промежуточного соединения с молекулой TA, предпочтительно с белком. Путем добавления белка в восстанавливающих условиях с использованием цианоборгидрида натрия происходит образование имина и, таким образом, амина. Если выбранное терапевтическое средство представляет собой полифункциональное соединение, то существует возможность создания различных позиционных изомеров с различными химическими, физическими и биологическими характеристиками. Это состояние, как правило, подтверждается в случае белков, таких как, например, интерферон, который имеет 12 потенциальных сайтов связывания. Путем изменения pH, при котором осуществляется эта реакция, генерируют специфическую функционализацию в N-концевой области (pH=6,0) со всеми преимуществами, которые это подразумевает, или функционализацию HA, связанной с белком в различных точках, по невоспроизводимой схеме (pH≥7,5).
Химические взаимодействия, используемые для получения конъюгатов согласно настоящему изобретению, дают возможность эффективного выбора профиля функционализации.
Этот важный результат достигается благодаря использованию альдегидной группы, чья особенная реакционноспособность по отношению к нуклеофильным атакам дает возможность достаточной селективности по отношению к нуклеофильной силе входящей группы. Специфичные условия для соответствующего оказания влияния этой селективности определяются от случая к случаю посредством прогрессивной оптимизации. Возвращаясь к примеру наиболее важных полифункциональных активных компонентов, т.е. белков, нуклеофильные аминогруппы могут находиться в положениях с различной доступностью, но, кроме того, могут отличаться по отношению к их силе в качестве оснований, выраженной в pKa. Аминогруппы в ε-положении, присутствующие в остатках лизина, как правило, демонстрируют pKa в интервале от 9,3 до 9,5, тогда как аминогруппы в α-положении у карбоксила имеют pKa, как правило, в интервале от 7,6 до 8. С целью способствования взаимодействию аминов в ε-положении процесс конденсации должен проводиться при pH выше чем 8,0, предпочтительно в интервале от 8,5 до 9,0; с другой стороны, с целью способствования реакционноспособности аминов в N-концевой области pH должно быть в интервале 5-6,5 и предпочтительно в интервале 5,5-6,2. Этот второй случай является наиболее важным, поскольку белки, как правило, содержат только одну свободную α-аминогруппу, расположенную в N-концевой области. Установленные реакционные условия, когда главным образом реагирует данная аминогруппа, приводят к образованию почти монодисперсного конъюгата между GAG и белками.
Хотя указанные значения в основном характеризуют белки, представляющие интерес для настоящего изобретения, они являются показательными, поскольку они могут слегка варьироваться для различных молекул.
Эта процедура синтеза дает возможность получения биоактивных конъюгатов, обладающих по существу более высокой эффективностью по отношению к конъюгатам, известным из уровня техники. Путем исследования биологических свойств этих новых конъюгатов авторы изобретения фактически обнаружили по существу превосходящие характеристики по отношению к полимерным конъюгатам, известным из уровня техники.
Конкретно, конъюгаты по изобретению, полученные после модификации с использованием гиалуроновой кислоты, поддерживают биологические свойства как активного компонента, так и исходного полисахарида, но они характеризуются различными механическими и реологическими свойствами. Условия, при которых осуществляется процесс конденсации, такие, что не происходит модификации биологической функциональности TA.
Авторы изобретения фактически применили способ синтеза согласно настоящему изобретению для синтеза новых биоконъюгатов:
• между гиалуроновой кислотой (HA) и интерфероном (IFNα)
• между гиалуроновой кислотой (HA) и гормоном роста (hGH)
• между гиалуроновой кислотой (HA) и РНКазой А
• между гиалуроновой кислотой (HA) и инсулином
• между гиалуроновой кислотой и кальцитонином лосося (HA-sCT)
• между гиалуроновой кислотой и IL1-ra
• между гиалуроновой кислотой и лубрицином, которые, таким образом, являются задачей настоящего изобретения.
Получение конъюгата HA-IFNα описано в Примере 3. Рекомбинантный человеческий IFN альфа 2a представляет собой белок, имеющий молекулярную массу примерно 20 кДа, чья структура характеризуется наличием 4 цистеинов, которые образуют 2 дисульфидных мостика, и наличием 12 аминогрупп, из которых 11 находятся в боковой цепи остатков лизина, плюс N-концевая область. Следует заметить, что из двух дисульфидных мостиков, присутствующих в нативном белке, тот который включен между остатками 29 и 138, является фундаментальным для биологической активности, следовательно восстанавливающие условия, необходимые для применения способа согласно патенту США № 7417021, будут деструктивными.
Используемые условия синтеза таковы, что получают почти монодисперсный конъюгат, где HA связана главным образом с N-концевой областью цитокина. Эта специфичность отражается на поддержании и/или повышении биологической активности IFN и/или других биоконъюгатов, для определения характеристик которых разработан способ согласно Примеру 4.
Эксперименты флуоресцентной томографии осуществляли для того же конъюгата HA-IFN для наблюдения биораспределения in vivo после внутривенного введения. Для того чтобы была возможность обнаружения с использованием этого метода, биоконъюгат получали согласно Примеру 6, так чтобы был включен ковалентно связанный флуоресцентный зонд. Обнаруженный профиль биораспределения (Пример 7) демонстрирует, что в более быстром временном масштабе флуоресцентность главным образом накапливается на уровне печени и в меньшей степени в области груди благодаря неспецифическому захвату в легочной микроциркуляции. В более продолжительные промежутки времени также наблюдали накопление в области таза, конкретно в области мочевого пузыря, не очень оправданное механизмом всасывания-выведения биоконъюгата, но скорее медленным гидролизом и высвобождением флуоресцентного зонда. Очевидность этого существенного накопления в печени и легких обнаруживает дополнительное интересное свойство, которое не представлено у конъюгатов, известных из уровня техники, т.е. возможно конкретное направление терапевтических компонентов в определенные типы ткани.
Следующая задача изобретения, таким образом, относится к применению конъюгатов согласно изобретению в области медицины, конкретно в противовирусной и противоопухолевой терапии. Согласно предпочтительному воплощению задача изобретения состоит в применении конъюгатов HA-IFN в качестве системы стимулирования иммунной системы по отношению к инфекциям вирусного типа, таким как гепатит (предпочтительно, путем внутривенного введения), или патологии, вызванные вирусными агентами, такими как, например, herpes labialis, genitalis, или к применению при инфекциях, вызванных HPV (вирус папилломы человека), способных вызывать верруциформные эпидермодисплазии (предпочтительно с помощью местного применения), или при раковом заболевании шейки матки. Конъюгат HA-IFN, таким образом, также может предпочтительно использоваться в качестве противоопухолевого средства.
Как продемонстрировано в Примере 10, конъюгат HA-инсулин не только в два раза увеличивает фармакологическую эффективность терапевтического средства, но также поддерживает способность инсулина контролировать базальный уровень глюкозы в течение времени. В этом случае обнаруживается следующее свойство биоконъюгата, которое состоит в создании систем контролируемого высвобождения терапевтических средств.
В Примере 9, который иллюстрирует получение биоконъюгата HA-РНКаза A, поддержание биологической активности связанного фермента еще более очевидно, поскольку измерение ферментативной активности осуществляется сразу после концентрации субстрата с использованием методов спектроскопии.
Авторы изобретения также подтверждают, что после конъюгации с HA и внутривенного введения терапевтическое средство демонстрирует быстрое и количественное накопление в печени и легких. Этот аспект изобретения делает данное применение особенно предпочтительным в терапии, относящейся к патологиям, которые связаны с печенью, таким как, например, коррелированная вирусом гепатопатия, фиброз печени, цирроз печени, болезнь Гоше, опухоли печени и легкого. Кинетика и эффективность захвата печенью и легкими конъюгата зависит от HA, путем модификации ее молекулярной массы профиль накапливания может быть модифицирован до тех пор, пока он не станет ничтожно малым.
Внутривенное введение, с другой стороны, не является единственно возможным путем введения. Авторы изобретения фактически подтвердили, что подкожное введение конъюгата эффективно при медленном высвобождении TA (Пример 10).
Пример 11 иллюстрирует процесс получения биоконъюгата HA-кальцитонин: кальцитонин представляет собой линейный полипептидный гормон из 32 аминокислот, который продуцируется у людей главным образом парафолликулярными клетками щитовидной железы, этот гормон участвует в метаболизме кальция (Ca2+) и фосфора. Будучи специфичным, кальцитонин воздействует на уровень Ca2+ в крови четырьмя путями:
• ингибирует всасывание Ca2+ кишечником
• ингибирует активность остеокластов в костях
• ингибирует повторное всасывание фосфата почечными канальцами
• повышает абсолютное всасывание Ca2+ и повторное всасывание Mg2+ почечными канальцами, кальцитонин представляет собой почечный Ca-консервирующий гормон.
Таким образом, кальцитонин используется для лечения
• постклимактерического остеопороза
• гипокальциемии
• болезни Педжета
• метастаз в кости
Кальцитонин обладает коротким полупериодом всасывания и выведения, составляющим 50-80 минут, соответственно. Кальцитонин лосося главным образом и почти исключительно деградирует в почках, образуя фармакологически неактивные фрагменты молекулы.
Таким образом, новый конъюгат HA-кальцитонин является чрезвычайно важным благодаря тому факту, что, как описано в Примере 11, он обнаруживает более продолжительное гипокальциемическое действие по отношению к свободному гормону, давая возможность более заметного эффекта, который дает нам возможность исследовать новые клинические применения, такие как внутрисуставное введение для защиты хряща и костей в дегенеративных патологиях, таких как ревматоидный артрит и артроз.
Пример 13 иллюстрирует процесс синтеза биоконъюгата HA-лубрицин: лубрицин присутствует в синовиальной жидкости и на поверхности суставного хряща и, таким образом, играет важную роль в смазке сустава и в синовиальном гомеостазе. Было продемонстрировано, что человеческие синовиальные фибробласты продуцируют лубрицин.
Оптимальная функциональность синовиальных соединений зависит от чрезвычайно низких коэффициентов трения между суставными тканями. Обычно смежные хорошо смазанные поверхности поддерживаются на суставном хряще. Однако при остеоартрите (OA) уменьшение смазки способствует деградации и фибрилляции хрящевого матрикса; это, в свою очередь, способствует дисфункции соединения и боли. Уменьшенная смазка также приводит к дисфункции соединения и боли в других формах артрита, включая ревматоидный артрит (RA). Также детектировали экспрессию лубрицина, и белок был локализован в сухожилиях, мениске, легких, печени, сердце, кости, связках, мышцах и в коже.
Для этих тканей смазанная поверхность также способствует оптимальной функциональности. Дополнительно к требованию смазанной поверхности, для нормальной функции сухожилий требуется предотвращение клеточной адгезии на поверхность сухожилий.
Таким образом, авторы изобретения предлагают новое применение для нового биоконъюгата HA-лубрицин в качестве смазывающих веществ, противоадгезионных средств и/или внутрисуставных добавок для, например, синовиальных соединений, мениска, сухожилий, брюшинной полости, перикардия и плевры, обеспечивая время удерживания in situ и более высокую эффективность, чем описано для неконъюгированных TA.
В данном контексте конъюгаты согласно настоящему изобретению могут предпочтительно использоваться в качестве систем для контролируемого высвобождения TA. Эти системы чрезвычайно удобны для TA, которые обладают пределом терапевтической эффективности, лимитированным ограниченным периодом существования. Типичные примеры TA, обладающих этими характеристиками, представляют собой терапевтические белки, включающие цитокины, факторы роста, ферменты, гормоны, такие как, например, GH, глюкоцереброзидаза, SOD, IL1-ra, инсулин и аналоги, GM-CSF, GCSF, EPO и, как правило, ESA, описанные выше, интерфероны типа I, II, III, моноклональные антитела, сшитые белки и другие. Инсулин, например, был первым биотехнологическим лекарственным средством и продолжает обладать первоочередной важностью в качестве фундаментального средства для растущего количества людей, страдающих диабетом. В настоящий момент доступны замедленные формы инсулина, но систем доставки лекарственного средства на рынке нет (конъюгация с полимерами, микронаночастицы).
Как продемонстрировано в Примере 10, способ конъюгации согласно настоящему изобретению подходит для создания систем с контролируемым высвобождением, которые эффективны при медленном высвобождении TA в активной форме и с большей продолжительностью действия, удваивается терапевтическая эффективность. Также следует принять во внимание следующий аспект, относящийся к соблюдению пациентами, кто при текущем терапевтическом режиме должен подвергаться воздействию различных ежедневных подкожных введений с очевидными неудобствами для социальной жизни и с прогрессирующим истощением мест, подходящих для инъекции. Аналогичные предположения также подтверждаются для других терапевтических веществ, перечисленных в настоящем документе.
Конъюгаты между гиалуроновой кислотой (предпочтительно, ее производными) и терапевтическими средствами согласно настоящему изобретению могут, таким образом, предпочтительно использоваться для получения биоматериалов с более высокими характеристиками эффективности, биодоступности, возможности направления TA к конкретным типам клеток или тканям органов и с возможностью улучшения профиля фармакокинетики с помощью контролируемого высвобождения и повышения продолжительности существования TA.
Конъюгаты между гиалуроновой кислотой и терапевтическими средствами согласно настоящему изобретению могут предпочтительно использоваться для получения фармацевтических композиций, подходящих для парентерального и непарентерального введения, включающих составы для перорального применения, инъецируемые растворы для внутрикожной, внутривенной, внутримышечной, подкожной, внутриартериальной, внутриоболочечной, внутрисердечной, внутрисиновиальной, внутрибрюшинной, внутрипузырной инъекции или гели, кремы, мази, пенки, сухие порошки, спреи, кожные или чрескожные пластыри для местного применения, а также фармацевтические препараты для ректального, внутривагинального, подъязычного, внутриглазного применения.
Согласно предпочтительному воплощению настоящего изобретения фармацевтические композиции подходят для внутривенного введения для локализации в печени и легких. Согласно следующему предпочтительному воплощению фармацевтические композиции подходят для подкожного введения посредством систем с контролируемым высвобождением.
Конъюгаты согласно изобретению поддерживают биологическую функцию активных компонентов, содержащихся в них, но по отношению к их выделенной форме они могут использоваться в качестве систем для их переноса и контролируемого высвобождения. Перенос к конкретным тканям или типам клеток осуществляют путем удобного выбора типа GAG или полусинтетического производного, тогда как высвобождение кинетики модулируется через природу связи между GAG или полусинтетическим производным и активным компонентом.
Наконец, изобретение относится к биоматериалу, характеризующемуся матриксом, включающим конъюгаты, определенные выше.
Настоящее изобретение теперь описывается с целью иллюстрации, но не ограничения, согласно его предпочтительным воплощениям с конкретной ссылкой на фигуры прилагаемых чертежей, в которых
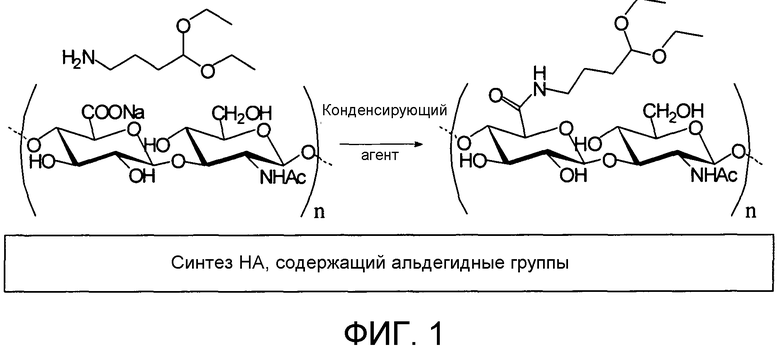
на Фиг.1 показана схема синтеза альдегидсодержащего GAG, представленного для иллюстративных целей с помощью гиалуроновой кислоты (HA), тогда как прототип спейсера, который несет защищенную альдегидную группу, представляет собой 4-аминобутиральдегиддиацеталь.
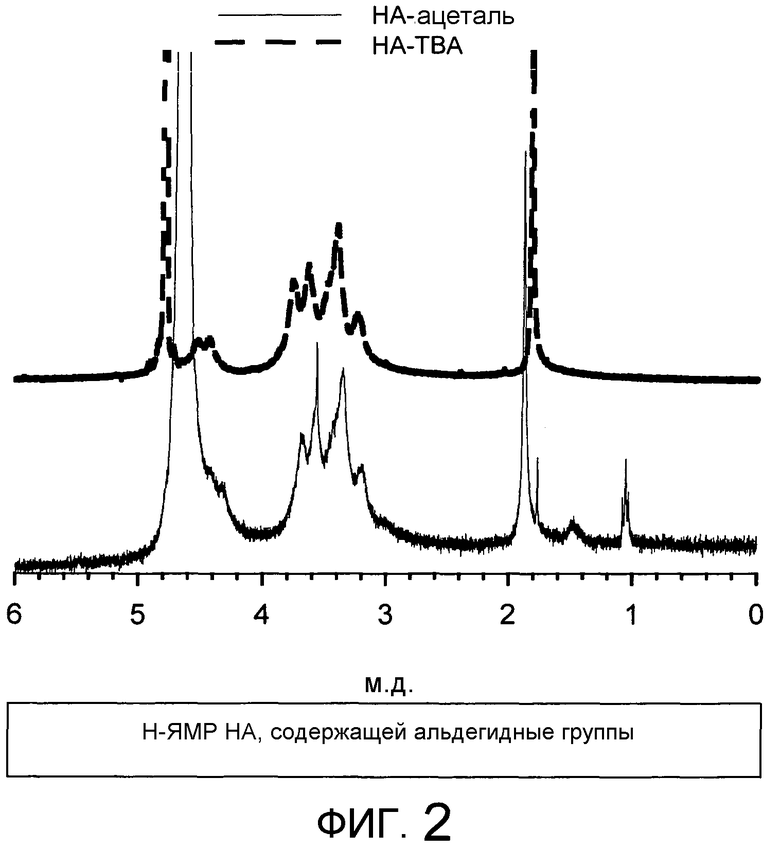
На Фиг.2 представлен H-ЯМР спектр альдегидсодержащей гиалуроновой кислоты. Это спектры протонного ЯМР, регистрируемые в дейтериевой воде. Сигнал протона метила ацетильной группы, присутствующей в HA (1,88 м.д.), фланкируется дополнительным сигналом в результате вклада протона метила ацетали (1,05 м.д.).
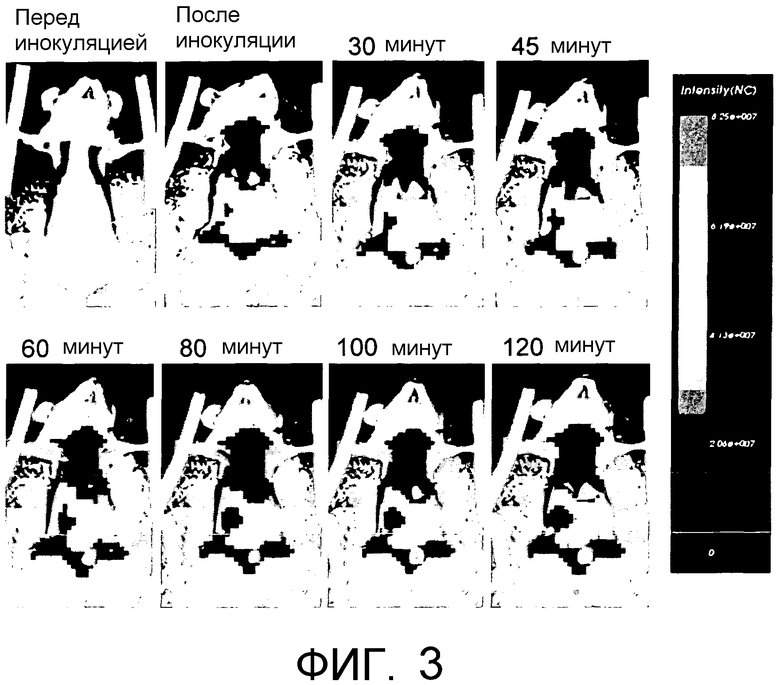
На Фиг.3 показано изображение флуоресцентной томографии после внутривенного введения мышам конъюгата HA-IFN, помеченного флуоресцентным зондом.
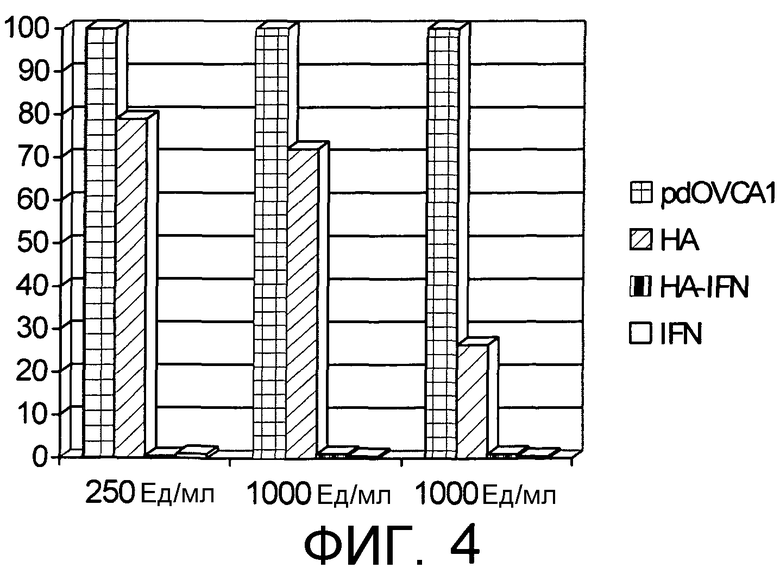
На Фиг.4 представлены результаты теста на цитотоксичность (ATPlite) в HA-IFN, проводимого на первичных клетках клеточной линии карциномы яичника человека (pdOVCAl), чувствительных к антипролиферативному действию IFN.
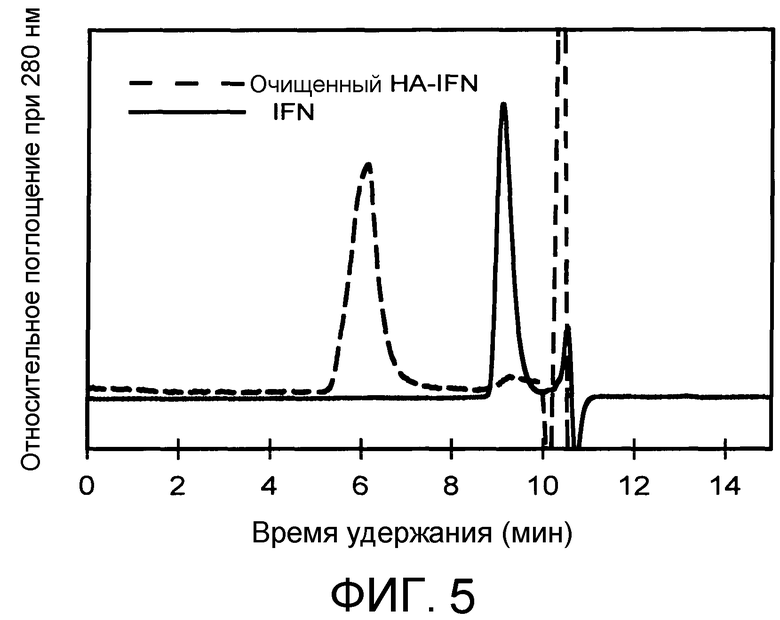
На Фиг.5 представлена хроматограмма конъюгата HA-IFN, которая соответственно демонстрирует свободный и конъюгированный IFN.
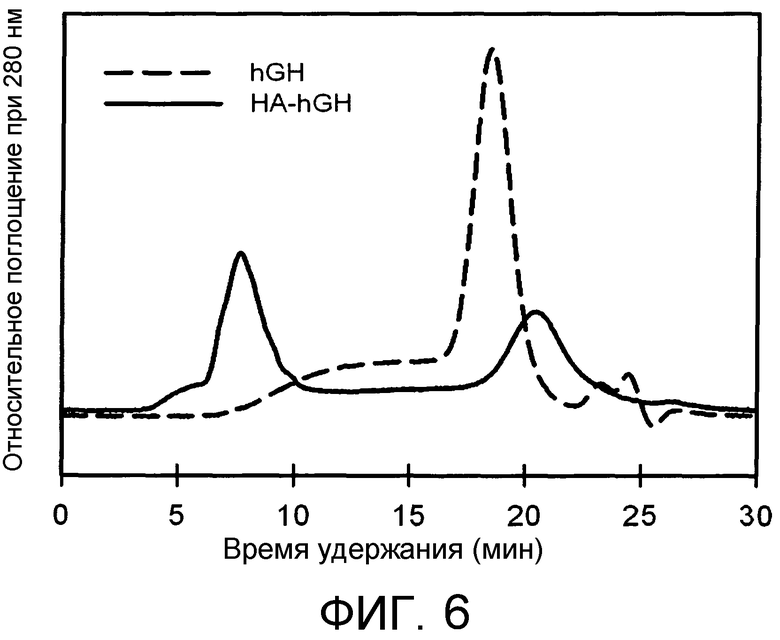
На Фиг.6 представлена хроматограмма конъюгата HA-hGH, которая соответственно демонстрирует свободный и конъюгированный hGH.
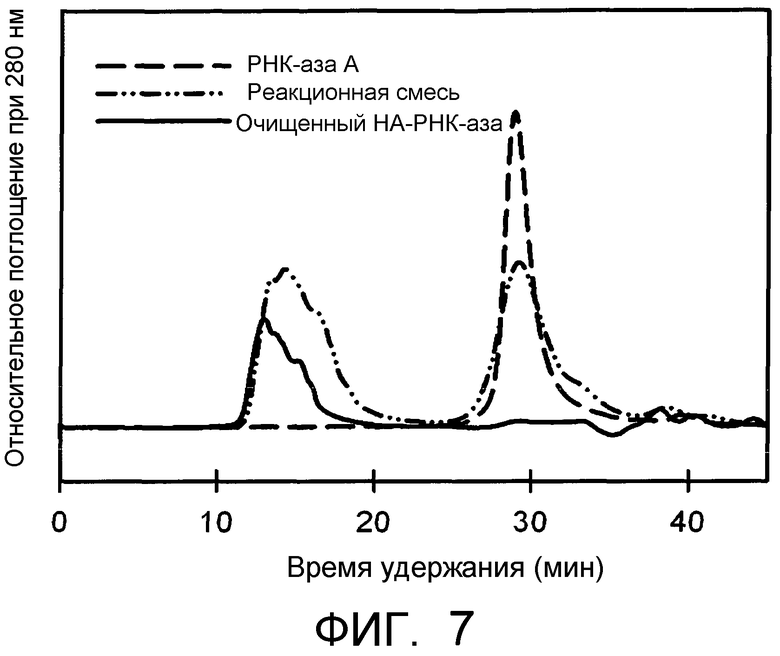
На Фиг.7 представлена хроматограмма конъюгата HA-РНКаза, которая соответственно демонстрирует свободный и конъюгированный фермент РНКаза.
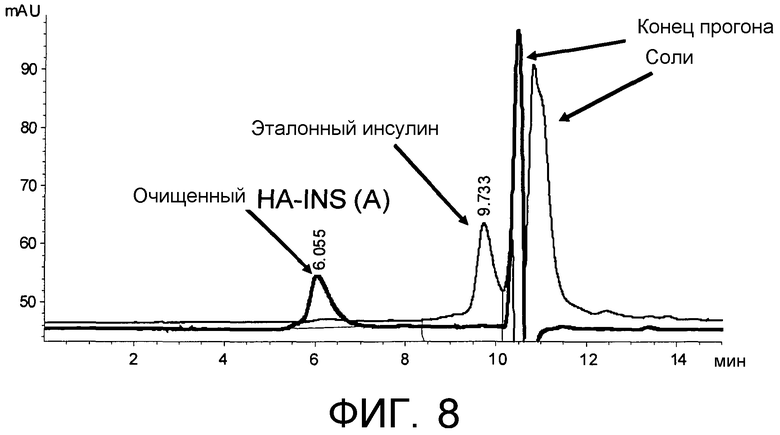
На Фиг.8 представлена хроматограмма конъюгата HA-инсулин, которая соответственно демонстрирует свободный и конъюгированный инсулин.
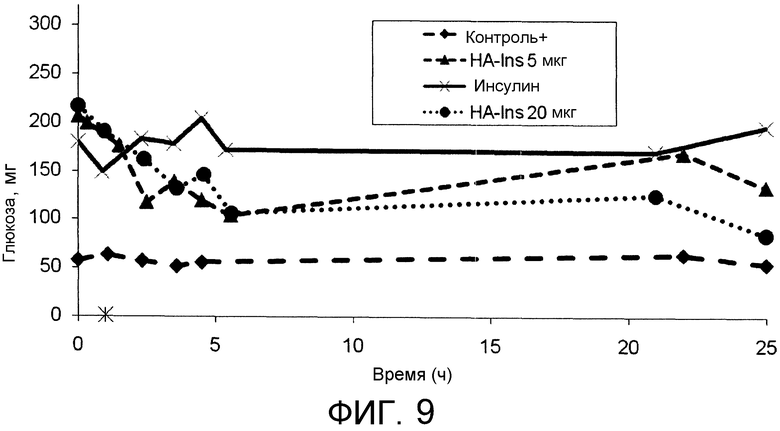
На Фиг.9 показана биологическая активность in vivo конъюгата HA-инсулин, вводимого подкожно в дозе 5 мкг или 20 мкг инсулина при определении уровня глюкозы в крови обработанных животных по отношению к контрольным и необработанным животным.
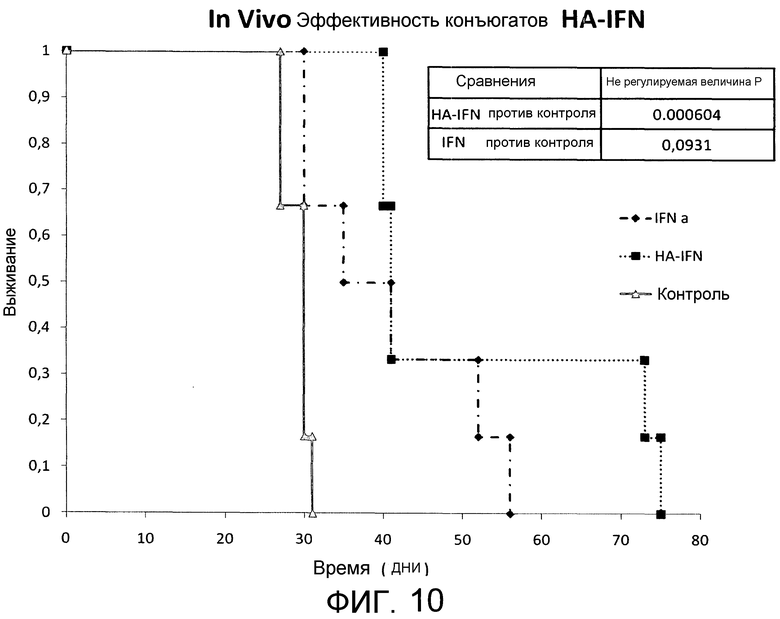
На Фиг.10 показана эффективность in vivo биоконъюгата HA-IFN против IFN против не обработанного продукта.
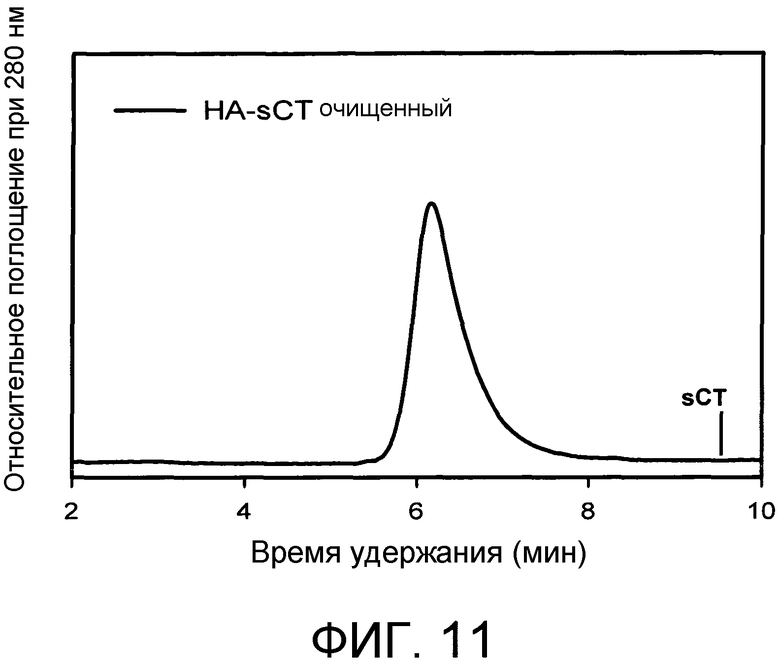
На Фиг.11 представлены результаты анализа эксклюзионной хроматографии HA-sCT с использованием колонки GF-250 (Agilent, 4,6×25 см) со скоростью потока 0,3 мл/мин. Элюент: буфер Na2HPO4 0,1M, NaCl 0,2M, pH 7,2, содержащий 20% ацетонитрила. Элюат из колонки отслеживали путем измерения поглощения при 280 нм. Кальцитонин, который элюируется в момент 9,2 мин, полностью удаляли. Рабочий буфер инъецировали для демонстрации того, что пик в момент 11 мин соответствует завершению объема разделения используемой колонки.
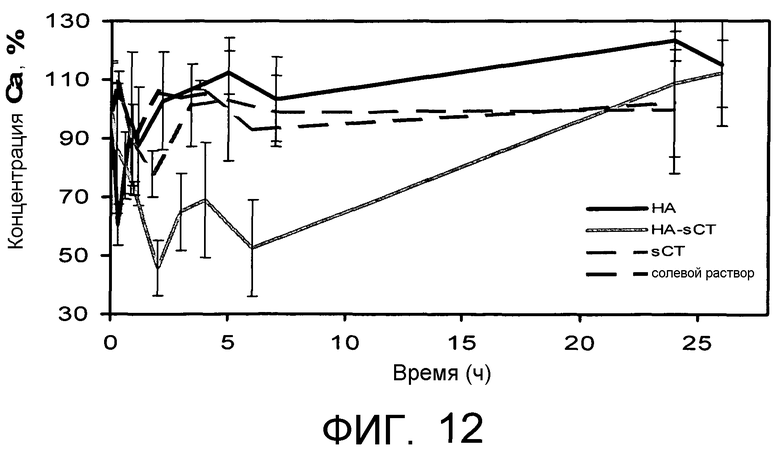
Фиг.12 представляет профиль уровня кальция в крови после внутривенного введения sCT, HA-sCT, HA и солевого раствора. Данные представляют среднее значение для трех крыс и характеризуются относительными средними значениями стандартных отклонений.
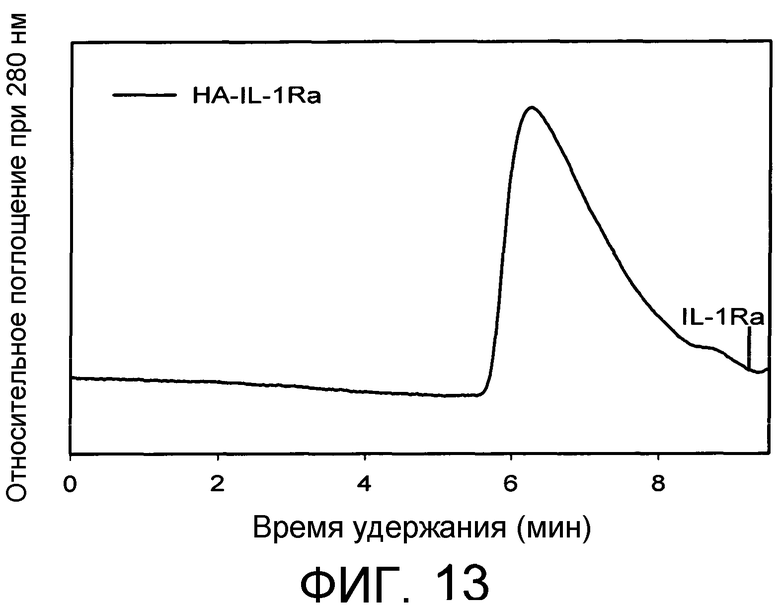
Фиг.13 демонстрирует анализ эксклюзионной хроматографии HA-IL1-ra с использованием колонки GF-250 (Agilent, 4,6×25 см) со скоростью потока 0,3 мл/мин. Элюент: буфер Na2HPO4 0,1М, NaCl 0,2M, pH 7,2, содержащий 20% ацетонитрила. Элюат из колонки отслеживали путем измерения поглощения при 280 нм. IL-1-ra, который элюируется в момент 9,75 мин, полностью удаляли.
Изобретение теперь описывается более подробно в следующих примерах без ограничения его возможных применений с целью обеспечения лучшего понимания и иллюстрации его возможных воплощений, которые могут в любом случае варьироваться специалистом в данной области без риска выйти за рамки основной сущности изобретения.
ПРИМЕРЫ
Схема на Фиг.1 иллюстрирует последовательность реакций процесса синтеза конъюгатов GAG-TA, описанных выше, с описанием молекулярной структуры включенных компонентов. Гиалуроновая кислота (HA) представлена в иллюстративных целях в качестве GAG, тогда как прототип спейсера, который несет защищенную альдегидную группу, представляет собой 4-аминобутиральдегиддиацеталь.
ПРИМЕР 1: Синтез альдегидного производного HA, имеющей среднюю молекулярную массу 200 кДа
5,00 г натриевой соли гиалуроновой кислоты ферментативного происхождения из гиаластиновой фракции (MW 200 кДа) растворяли в 250 мл воды и полученный в результате раствор пропускали через стеклянную колонку, заполненную 100 см3 смолы Dowex, в форме тетрабутиламмония. Элюированный раствор соли HA и TBA собирали и лиофилизировали. Получали 7,50 г продукта, который растворяли в 400 мл N-метилпирролидона (NMP).
После полного растворения соли HA, добавляли 300 мг карбонилдиимидазола (CDI), 450 мкл метансульфокислоты и 387 мг 4-аминобутиральдегид диэтилацетали и смесь оставляли для взаимодействия при 40°C в течение ночи с мягким помешиванием. Реакцию останавливали путем добавления 0,1 объема насыщенного водного раствора NaCl и через 30 минут раствор добавляли к 3 объемам абсолютного этанола для отделения производного HA согласно Фиг.1 из реакционной смеси.
Осадок промывали снова в этаноле и наконец сушили в глубоком вакууме при 40°C. Получали 4,49 г производного, содержащего 13% в молях защищенных альдегидных групп по отношению к повторяющимся элементам HA. ЯМР-спектр продукта, чей синтез был осуществлен, как указано в настоящем документе, продемонстрирован на фиг.2.
ПРИМЕР 2: Синтез альдегидного производного HA, имеющей среднюю молекулярную массу 100 кДа
4,00 г натриевой соли гиалуроновой кислоты экстрактивного происхождения, имеющей среднюю молекулярную массу 100 кДа, растворяли в 500 мл воды для инъекционных препаратов. Полученный раствор помещали при температуре 4°C и затем добавляли 290 мг (15% в молях) EDC, 175 мг NHS и 245 мг 4-аминобутиральдегид диэтилацетали. Через 18 часов взаимодействия продукт осаждали путем добавления 4 объемов абсолютного этанола и промывали с помощью водно-спиртовых смесей с повышением содержания этанола до момента достижения абсолютного этанола. Было доказано, что продукт является замещенным в соотношении 11,9% моль/моль.
ПРИМЕР 3: Синтез конъюгата HA-интерферон
3,00 г альдегидного производного HA (активированное промежуточное соединение) согласно Примеру 1 растворяли в концентрации 10 мг/мл в кислой среде благодаря присутствию фосфорной кислоты при температуре 60°C в течение 2 часов. 4×10-5 моль рекомбинантного человеческого интерферона альфа 2a, 4×10-4 моль цианоборгидрида добавляли к гидролизованному продукту, ранее охлажденному, и pH регулировали до 6,0. Через 24 ч взаимодействия аддукт очищали путем диализа против воды и затем лиофилизировали. Чистоту подтверждали с помощью эксклюзионной хроматографии (GPC) с соответствующей хроматограммой, проиллюстрированной на Фиг.5.
Биоконъюгат HA-IFN подвергали SDS-PAGE + Western-блотингу с человеческими анти-IFN альфа антителами. Присутствие свободного белка менее чем 5% обнаруживали посредством денсиометрических методов. Этот результат связан с тем, что было получено при эксклюзионной хроматографии (Фиг.5).
ПРИМЕР 4: Определение in vitro биологической активности конъюгата HA-IFN
Определение биологической активности конъюгата HA-IFN осуществляли посредством специально разработанного метода.
Эксперименты проводили на первичных клетках клеточной линии карциномы яичника человека (pdOVCA1), чувствительных к антипролиферативному действию IFN. Клетки сеяли в концентрации 10000 клеток/лунка и инкубировали без добавок и в присутствии
- биоконъюгата HA-IFN, полученного как в Примере 3, в концентрации 1000, 500, 250 Ед/мл в качестве эквивалентных Единиц IFN;
- рекомбинантного человеческого интерферона альфа 2a в концентрации 1000, 500, 250 Ед/мл;
- HA, имеющей молекулярную массу 200 кДа, т.e. такой же, как использовалась при получении конъюгата, в концентрации 323,5, 162,75, 81,375 мкг/мл.
Через 5 дней инкубации измеряли жизнеспособность клеток посредством теста ATPlite на цитотоксичность. Полученные результаты суммировали на Фиг.4, где жизнеспособность клеток выражается в процентном содержании по отношению к уровню, полученному для клеток, инкубированных без добавок.
Как можно наблюдать, рекомбинантный человеческий интерферон альфа 2a вызывает заметное цитотоксическое действие по отношению к этой клеточной линии. Это свойство почти количественно поддерживается в конъюгате, тогда как неконъюгированная HA не способна вызывать такого действия.
ПРИМЕР 5: Определение in vivo биологической активности конъюгата HA-IFN
Эксперименты проводили на первичных клетках клеточной линии карциномы яичника человека (pdOVCA1) (чувствительных к антипролиферативному действию IFN), с внутрибрюшинным введением мышам, принадлежащим к группе SCID F, в количестве 3×106 клеток/мышь. Эксперимент осуществляли с использованием 3 различных групп животных, 6 мышей на группу:
1-я группа: обработка на 7-й, 14-й и 21-й день с помощью рекомбинантного человеческого интерферона альфа 2a (IFN) в концентрации 1000 Ед/мл, в качестве положительного контроля;
2-я группа: обработка на 7-й, 14-й и 21-й день с помощью целевого биоконъюгата по настоящему изобретению (HA-IFN), полученного, как описано в Примере 3, в концентрации 1000 Ед/мл в качестве эквивалентных единиц IFN;
3-я группа представляла не обработанный фармакологически контроль, а только содержащий инокулированные клетки pdOVCA1.
Результаты суммированы на Фиг.10: вышеописанный эксперимент очевидно демонстрирует более высокую эффективность in vivo биоконъюгата HA-IFN против эталонного лекарственного средства IFN. В качестве дополнительного подтверждения результата статистические оценки выявляют существенную значимость биоконъюгата против необработанного контроля, тогда как никакой статистической значимости не обнаружено для результата, полученного для положительного контроля против не обработанного продукта.
ПРИМЕР 6: Синтез конъюгата HA-интерферон, меченного с помощью флуоресцентного зонда
Аккуратно осуществляя каждый пассаж в стерильных условиях, 12,5 мг рекомбинантного человеческого интерферона альфа 2a метили с помощью 0,5 мг Cy5 согласно инструкциям, полученным от поставщика (GE Healthcare). Реакцию конденсации осуществляли с меченым белком, очищенным с помощью исчерпывающего диализа против воды согласно инструкциям, представленным в Примере 3. Получали 90,4 мг продукта.
ПРИМЕР 7: Биораспределение in vivo, определенное с помощью флуоресцентной томографии, конъюгата HA-интерферон, меченного с помощью флуоресцентного зонда
Биораспределение конъюгата после эндогенного введения определяли in vivo посредством системы Explore Optix (GE Healthcare) преклинического оптического изображения. Система состоит из прибора для измерения биолюминесценции, который адаптирован для томографической реконструкции изображений всего тела небольших грызунов. Используемая технология представляет собой "коррелированный во времени однофотонный подсчет" для измерения поглощения и флуоресценции (с периодом существования) флуоресцентных зондов, давая возможность получения их трехмерной локализации. Изображения, продемонстрированные на Фиг.3, представляют результат эксперимента инокуляции анестезированным мышам меченого конъюгата согласно Примеру 6. Перед инокуляцией сигнала не обнаруживали. Сразу после инокуляции наблюдали накопление в печени, ассоциированное с меньшей интенсивностью флуоресценции в соседней легочной области, которая главным образом была вызвана неспецифичным захватом в легочной микроциркуляции. Накопление в тазовой области ассоциировано с этими сигналами, которые при более продолжительном временном масштабе приводили к накоплению в мочевом пузыре.
ПРИМЕР 8: Синтез конъюгата HA-hGH
1,00 г альдегидного производного HA согласно Примеру 1 растворяли в концентрации 10 мг/мл в кислой среде благодаря присутствию фосфорной кислоты при температуре 60°C в течение 2 часов. 2×10-5 моль рекомбинантного человеческого гормона роста, 2×10-4 моль цианоборгидрида добавляли к гидролизованному продукту, ранее охлажденному, и pH регулировали до 6,0. Через 24 ч взаимодействия аддукт очищали путем диализа против воды и затем лиофилизировали.
ПРИМЕР 9: Синтез конъюгата HA-РНКаза А
1,00 г альдегидного производного HA согласно Примеру 1 растворяли в концентрации 8 мг/мл в кислой среде благодаря присутствию фосфорной кислоты при температуре 50°C в течение 2 часов. pH регулировали до 6,0 и 2×10-5 моль РНКазы А и 2×10-4 моль цианоборгидрида добавляли к гидролизованному продукту, ранее охлажденному. При данном значении pH реакция проходит специфично по N-концевой области белка. Через 24 ч взаимодействия аддукт очищали путем диализа против воды и затем лиофилизировали. Соответствующую хроматограмму GPC, регистрированную при условиях, описанных в Примере 14, можно обнаружить на Фиг.7. Данный тип конъюгата оптимально подходит для измерений in vitro остаточной активности фермента с использованием специфического набора реагентов на основе оценки увеличения поглощения при 287 нм в течение времени, определяемого с помощью гидролиза специфического субстрата в виде циклического 2',3'-цитидинмонофосфата (2',3'-CMC).
Сравнение остаточной активности фермента, свободного или связанного с HA, дало следующие результаты:
Количественное поддержание ферментативной активности демонстрирует, что реакция конъюгации никоим образом не разрушает белок.
ПРИМЕР 10: Синтез и активность in vivo конъюгата HA-инсулин
3,00 г альдегидного производного HA (активированное промежуточное соединение) согласно Примеру 1 растворяли в концентрации 10 мг/мл в кислой среде благодаря присутствию фосфорной кислоты при температуре 60°C в течение 2 часов. 4×10-5 моль инсулина, 4×10-4 моль цианоборгидрида добавляли к гидролизованному продукту, ранее охлажденному, и pH регулировали до 6,0. Через 24 ч взаимодействия аддукт очищали и анализировали с помощью эксклюзионной хроматографии; относительная хроматограмма представлена на Фиг.8. Активность in vivo конъюгата оценивали на модели индуцированного диабета типа I у крыс после введения стрептозоцина в дозе 70 мг/кг.
Конъюгат HA-инсулин вводили подкожно в дозе, эквивалентной 5 или 20 мкг инсулина. Биологическую активность конъюгата тестировали посредством определения уровня глюкозы в крови животных, измеренного посредством коммерческих наборов реагентов (OneTouch®II, LifeScan, Johnson & Johnson). Контроль состоит из здоровых крыс (группа 1) и крыс с индуцированным диабетом, подвергнутым обработке с помощью инсулина (группа 2). Результаты представлены на Фиг.9.
Крысы, подвергнутые обработке инсулином, принадлежащие к группе 2, демонстрируют резкое снижение уровня глюкозы в крови, который однако возвращается к высокому значению за относительно короткий промежуток времени. Конъюгат HA-инсулин обладает эффектом, который проявляется более медленно, но имеет значительно большую продолжительность во времени, приводя концентрацию глюкозы за временной интервал 5 часов к более низкому уровню, чем у группы, подвергнутой обработке только инсулином, и поддерживая этот эффект продолжительностью в течение 24 часов эксперимента.
Эти результаты демонстрируют, что биоконъюгат согласно изобретению способен удваивать эффективность конъюгированного лекарственного средства (в этом специфическом случае инсулина), поддерживая его в течение времени.
Таким образом, тест демонстрирует, что биоконъюгаты согласно настоящему изобретению или биоматериалы, полученные для этого, подходят для получения систем для продолжительного высвобождения терапевтических средств, включающих терапевтические белки, благодаря их способности повышать терапевтическую эффективность, поддерживая ее в течение времени.
ПРИМЕР 11: Синтез и определение биологической активности конъюгата HA-кальцитонин (HA-sCT)
10 мг HA-ацетали растворяли в концентрации 10 мг/мл в фосфорной кислоте 10 мМ, pH 2,1 при температуре 60°C в течение 1 часа. После того как регулировали pH до 6 с помощью NaOH 0,1 N и оставляли раствор охлаждаться до комнатной температуры, 1,25×10-3 ммоль кальцитонина лосося (sCT) добавляли к гидролизованному продукту и через 30 минут добавляли 5,8×10-2 ммоль цианоборгидрида. Через 48 ч взаимодействия аддукт очищали и диализовали путем диализа против воды (2 л) в течение 24 часов с использованием мембраны с пределом пропускания 50 кДа. После диализа продукт лиофилизировали, концентрацию белка определяли с помощью анализа с использованием бицинхониновой кислоты (BCA; Sigma Aldrich) и с использованием поглощения при 280 нм.
Чистоту конъюгата подтверждали посредством гель-фильтрационной хроматографии (GPC), соответствующая хроматограмма представлена на Фиг.11.
Нагрузка кальцитонина в конъюгате составила 9,1% (масс./масс.).
Активность in vivo конъюгированного кальцитонина (HA-sCT) оценивали после гипокальцемического эффекта, измеренного после внутривенного введения крысам.
Эксперименты проводили на крысах Sprangue-Dawley с массой 180-250 г. Крыс делили на 4 группы по 3 животных в каждой группе и вводили каждой группе различные препараты: sCT, HA-sCT, HA и солевой раствор. sCT и HA-sCT и HA растворяли в физиологическом растворе и фильтровали с использованием фильтра 0,22 мкм. Кальцитонин и конъюгат вводили в дозировке 40 мкг/кг (эквивалентно кальцитонину). HA вводили в качестве контроля в таких же количествах, в каких она присутствует в конъюгате. После введения через хвостовую вену образцы крови забирали в установленное время (0, 0,5, 1, 2, 3, 4, 5, 6, 24 часа) и сохраняли в холодильнике до момента использования. После центрифугирования в течение 20 минут при 1000×g плазму собирали и оценивали присутствие кальцитонина в плазме посредством колориметрического анализа (Colorimetric Calcium Assay kit, Vinci-Biochem).
Полученные результаты суммированы на Фиг.12, где вариация процентного содержания кальция в плазме выражена в зависимости от времени. sCT обладал максимальным эффектом через час после введения, и через 6 часов уровень кальция снова повышался до своего исходного значения. Конъюгат, напротив, демонстрирует более продолжительное гипокальцемическое действие и более заметный эффект. HA и солевой раствор не вызывали никаких вариаций в уровне кальция в крови.
ПРИМЕР 12: Синтез конъюгата HA-IL1-ra
10 мг HA-ацетали растворяли в концентрации 10 мг/мл в фосфорной кислоте 10 мМ, pH 2,1 при температуре 60°C в течение 1 часа. После того как регулировали pH до 6 с помощью NaOH 0,1 N и оставляли раствор охлаждаться до комнатной температуры, 2,46×10-4 ммоль IL1-ra добавляли к гидролизованному продукту и через 30 минут добавляли 1,16×10-2 ммоль цианоборгидрида натрия. Через 48 ч взаимодействия аддукт очищали и диализовали путем диализа против фосфатного буфера 0,1 М рН 6,5 (2 л) в течение 24 часов с использованием мембраны с пределом пропускания 50 кДа. После диализа концентрацию белка определяли с помощью колориметрического анализа (BCA-анализ; Sigma Aldrich). Конъюгат поддерживали в растворе при 4°C. Чистоту подтверждали посредством гель-фильтрационной хроматографии (GPC), соответствующая хроматограмма представлена на Фиг.13.
ПРИМЕР 13: Синтез конъюгата HA-лубрицин
10 мг HA-ацетали растворяли в концентрации 10 мг/мл в фосфорной кислоте 10 мМ, pH 2,1 при температуре 60°C в течение 1 часа. После того как регулировали pH до 6 с помощью NaOH 0,1 N и оставляли раствор охлаждаться до комнатной температуры, 2,5×10-4 ммоль лубрицина добавляли к гидролизованному продукту и через 30 минут добавляли 1,16×10-2 ммоль цианоборгидрида натрия. Через 48 ч взаимодействия аддукт очищали и диализовали путем диализа против фосфатного буфера 0,1 М рН 6,5 (2 л) в течение 24 часов с использованием мембраны с пределом пропускания 50 кДа. После диализа концентрацию белка определяли с помощью колориметрического анализа (BCA-анализ; Sigma Aldrich). Конъюгат поддерживали в растворе при 4°C. Чистоту подтверждали посредством гель-фильтрационной хроматографии (GPC).
ПРИМЕР 14: Характеризация синтетических конъюгатов посредством GPC
С целью определения присутствия свободного белка в синтезированных конъюгатах препараты согласно Примерам 3, 8, 9 и 10 подвергали эксклюзионной хроматографии высокого давления. Для конъюгата HA-IFN согласно Примеру 3 и конъюгата HA-инсулин согласно Примеру 10 снимали хроматограмму (Фиг.5 и Фиг.8) на колонке Agilent GF-250 с элюентом, состоящим из фосфатного буфера 0,2M при pH=7 + NaCl 10-1M 80% + ацетонитрил 20%, со скоростью потока 0,3 мл/мин.
Хроматограммы, относящиеся к другим конъюгатам (Фиг.6, Фиг.7), снимали с использованием колонки Superose 12, УФ-детектирование при 280 нм, с элюентом, состоящим из фосфатного буфера 10-1M при pH=7,2 + NaCl 0,2M 80% + ацетонитрил 20%, со скоростью потока 0,8 мл/мин.
ПРИМЕР 15: Синтез альдегидного производного хондроитинсульфата в качестве активированного промежуточного соединения
5,00 г хондроитинсульфата экстракционного происхождения (с сульфатной группой, главным образом присутствующей в положении элемента 4 N-ацетилгалактозамина) растворяли в 250 мл воды и полученный в результате раствор пропускали через стеклянную колонку, заполненную 100 см3 смолы Dowex, в форме тетрабутиламмония. Элюированный раствор TBA-соли хондроитинсульфата собирали и лиофилизировали. Получали 7,75 г продукта, который растворяли в 400 мл N-метилпирролидона (NMP).
После полного растворения добавляли 345 мг карбонилдиимидазола (CDI), 460 мкл метансульфокислоты и 396 мг 4-аминобутиральдегид диэтилацетали и смесь оставляли для взаимодействия при 45°C в течение ночи с мягким помешиванием.
Процесс модификации останавливали путем добавления 0,1 объема насыщенного водного NaCl. Реакционную смесь диализовали против солевого раствора с помощью NaCl 0,9%, затем против чистой воды и лиофилизировали. Получали 4,13 г гранулированного твердого вещества светло-коричневого цвета.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ КОНЪЮГАТОВ | 2006 |
|
RU2401283C2 |
| КОНЪЮГАТЫ ДЛЯ ВВЕДЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2567667C2 |
| КОНЪЮГАТЫ ИНТЕРФЕРОНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466138C1 |
| ПЕГИЛИРОВАННЫЙ КОНЪЮГАТ ВАРИАНТА РЕКОМБИНАНТНОГО КОНСЕНСУСНОГО ИНТЕРФЕРОНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ, И ПРИМЕНЕНИЕ | 2011 |
|
RU2575796C9 |
| ПОЛИПЕПТИДНЫЙ КОМПЛЕКС, СОДЕРЖАЩИЙ НЕПЕПТИДИЛЬНЫЙ ПОЛИМЕР, ОБЛАДАЮЩИЙ ТРЕМЯ ФУНКЦИОНАЛЬНЫМИ КОНЦАМИ | 2009 |
|
RU2483081C2 |
| Улучшенный способ получения конъюгата физиологически активного полипептида | 2013 |
|
RU2639256C2 |
| АЛЬДЕГИДНЫЕ ПРОИЗВОДНЫЕ СИАЛОВОЙ КИСЛОТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, КОНЪЮГАТЫ АЛЬДЕГИДНЫХ ПРОИЗВОДНЫХ СИАЛОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2004 |
|
RU2333223C2 |
| КОНЪЮГАТЫ ПОЛИПЕПТИДА И ОЛИГОСАХАРИДА | 2006 |
|
RU2443713C2 |
| ЖИДКИЕ КОМПОЗИЦИИ ДЛИТЕЛЬНО ДЕЙСТВУЮЩЕГО КОНЪЮГАТА ИНТЕРФЕРОНА АЛЬФА | 2011 |
|
RU2613905C2 |
| КОНЪЮГАТЫ БЕЛКОВ СВЕРТЫВАНИЯ КРОВИ | 2010 |
|
RU2595442C2 |
Изобретение относится к медицине. Описан способ синтеза конъюгатов гликозаминогликанов (GAG) с биологически активными молекулами различной природы, включающими низкомолекулярные соединения и макромолекулы. Конкретно, изобретение относится к конъюгации гиалуроновой кислоты (HA) и ее производных с полипептидами и белками с биологической функцией, такими как, например, интерфероны, эритропоэтины, факторы роста, инсулин, цитокины, антитела и гормоны. Изобретение позволяет выделять промежуточные соединения, полученные с помощью частичного или полного взаимодействия GAG с защищенными аминоальдегидами в способе конъюгации. Конъюгаты способны повышать эффективность конъюгированного лекарственного средства и поддерживать ее в течение времени. 6 н. и 19 з.п. ф-лы, 13 ил., 15 пр.
1. Способ синтеза конъюгата гликозаминогликанов (GAG) с биологически активными молекулами, включающий следующие стадии:
a) модификация GAG по меньшей мере одной альдегидной группой (СНО) путем взаимодействия GAG со спейсерной молекулой (SP), где указанная спейсерная молекула включает в качестве первой функциональной группы одну или несколько альдегидных групп (SP-CHO), причем указанные альдегидные группы (SP-CHO) необязательно защищены, и в качестве второй функциональной группы нуклеофильную группу, подходящую для конъюгации с GAG;
a1) гидролиз активированного промежуточного соединения с помощью водных растворов кислот в случае, когда указанные одна или несколько альдегидных групп защищены;
b) взаимодействие аддукта, полученного на стадии a) или a1) по меньшей мере с одной биологически активной молекулой (ТА), характеризующейся тем, что она включает функциональную группу, способную к взаимодействию с альдегидной группой, и выбрана из группы, состоящей из полипептидов и белков, нуклеиновых кислот и терапевтических средств, содержащих по меньшей мере одну аминогруппу, не принципиальную для биологического функционирования,
где гликозаминогликан (GAG) представляет собой гиалуроновую кислоту в кислой форме или в форме соли, или ее производные, или хондроитинсульфат в кислой форме, или в форме соли, или его производные и спейсерная молекула выбрана из аминоальдегидов и аминоальдегидных ацеталей, имеющих следующую общую формулу 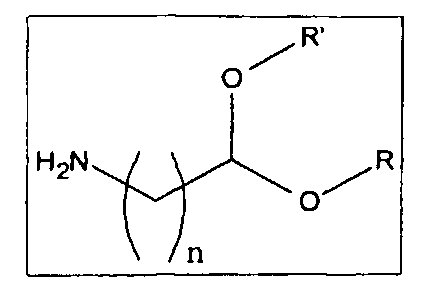 ,
,
в которой n находится в интервале от 1 до 20, тогда как R и R′ могут быть алифатическими или арилалифатическими остатками, одинаковыми или различными, или одинаковыми цепями, которые несут различные гидроксильные группы.
2. Способ по п.1, где указанная защита альдегидной группы осуществляется с использованием гемиацеталей или ацеталей посредством взаимодействия альдегидов с алифатическими или арилалифатическими спиртами или диолами, выбранными из метанола, этанола, н-пропанола, изопропанола, н-бутанола, втор-бутанола, трет-бутанола, изобутанола, этиленгликоля, пропиленгликоля, 1,3-пропандиола, 1,4-бутандиола, с образованием выделяемых ацеталей.
3. Способ по п.1, где стадию a1) гидролиза активированного промежуточного соединения с помощью водных растворов кислот для высвобождения альдегидной группы осуществляют при pH в интервале от 1,5 до 3,0, предпочтительно при pH в интервале от 2,0 до 2,5, при температуре в интервале от 25 до 65°C, предпочтительно от 40 до 60°C, в течение по меньшей мере 30 минут.
4. Способ по п.1, где нуклеофильная группа на стадии a) представляет собой аминогруппу в свободной форме или в форме соли или представляет собой спиртовую группу.
5. Способ по п.1, где функциональная группа биологически активной молекулы, способной к взаимодействию с альдегидами, представляет собой аминогруппу, которая может присутствовать естественным образом или может быть введена с помощью синтеза.
6. Способ по п.1, где указанные производные гиалуроновой кислоты (HA) и хондроитинсульфата выбраны из солей со щелочными или щелочноземельными металлами, выбранными из натрия, калия, магния, кальция; из четвертичных аммониевых солей; эфиров карбоновых кислот, O-эфиров; амидов, перкарбоксилированных производных; O-сульфатированных производных; N-деацетилированных производных; N-сульфатированных производных.
7. Способ по п.1, где биологически активную молекулу, представляющую собой полипептид или белок, выбирают из группы, состоящей из
- иммуномодуляторов, предпочтительно выбранных из группы, состоящей из интерферонов типа I, интерферонов типа II, интерферонов типа III;
- факторов роста, предпочтительно выбранных из группы, состоящей из эритропоэтинов и из молекул, в целом идентифицированных как ESA, факторов, стимулирующих эритропоэз, таких как факторы GM-CSF и G-CSF, факторы роста для костей и хрящей;
- цитокинов, предпочтительно выбранных из группы, состоящей из IL2, TNF и их рецепторов-антагонистов вместе с их растворимыми рецепторами, IL1-ra и из растворимых рецепторов провоспалительных цитокинов;
- гликопротеинов, предпочтительно лубрицина;
- ферментов, предпочтительно выбранных из группы, состоящей из супероксиддисмутазы, РНКазы и глюкоцереброзидазы;
- антител;
- гормонов, предпочтительно выбранных из группы, состоящей из кальцитонина, инсулина и его аналогов, и гормона роста.
8. Способ по п.1, где биологически активная молекула, которая представляет собой терапевтическое средство, содержащее аминогруппы, не принципиальные для биологического функционирования, выбрана из группы, состоящей из
- противоопухолевых лекарственных средств, выбранных из группы, состоящей из таксанов, алкалоидов барвинка, камптотецинов, замещенных мочевин; комплексов платины, золота, серебра или других металлов; метотрексата, триметрексата, пеметрекседа, тетрагидрофолата; аналогов пиримидина, цитидина, пурина; антибиотиков для лечения онкологических заболеваний и антрацендионов;
- противовирусных средств и антибиотиков;
- протеазных и полимеразных ингибиторов;
- противовоспалительных, анальгезирующих, анестетических, обезболивающих лекарственных средств;
- наркотиков;
- стероидов;
- миноксидила.
9. Способ по п.1, где биологически активная молекула, представляющая собой нуклеиновую кислоту, выбрана из группы, состоящей из малой интерферирующей РНК, микроРНК, антисмысловой РНК.
10. Способ по п.1, включающий следующие стадии:
a) модификация HA или соли HA, растворимой в апротонном органическом полярном растворителе, по меньшей мере одной альдегидной группой (СНО) путем взаимодействия HA с аминоальдегидами или аминоальдегидными ацеталями, имеющими следующую общую формулу
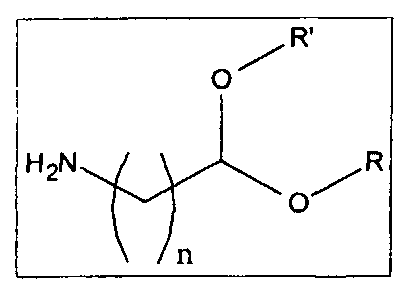 ,
,
в которой n находится в интервале от 1 до 20, тогда как R и R′ могут быть алифатическими или арилалифатическими остатками, одинаковыми или различными, или одинаковыми цепями, которые несут различные гидроксильные группы, в водной среде в EDC+NHS с образованием амида или в апротонном растворителе;
a1) гидролиз промежуточных соединений стадии a) для высвобождения альдегидной группы, осуществляемый в фосфорной кислоте при pH в интервале от 1,5 до 3,0, предпочтительно при pH в интервале от 2,0 до 2,5, в температурном интервале от 25 до 65°C, предпочтительно от 40 до 60°C, в течение по меньшей мере 30 минут;
b) взаимодействие промежуточного соединения, полученного на стадии a) или a1) с биологически активной молекулой (ТА), характеризующейся тем, что она включает функциональную группу, способную к взаимодействию с альдегидной группой.
11. Способ по п.10, где гиалуроновая кислота или ее производные выбраны из гиалуроновой кислоты, образующей соль с органическими и/или неорганическими основаниями; из эфиров гиалуроновой кислоты со спиртами алифатического, арилалифатического, циклоалифатического, ароматического, циклического и гетероциклического ряда с процентом этерификации в интервале от 20 до 80%; из амидов HA с аминами алифатического, арилалифатического, циклоалифатического, ароматического, циклического и гетероциклического ряда с процентом амидирования в интервале от 0,1 до 50%; O-сульфатированных производных гиалуроновой кислоты вплоть до четвертой степени сульфатирования; внутренних эфиров гиалуроновой кислоты с процентом этерификации ниже чем 20%; деацитилированных соединений гиалуроновой кислоты с процентом деацитилирования 0,1-30%; перкарбоксилированных производных гиалуроновой кислоты со степенью перкарбоксилирования 0,1-100% и, предпочтительно, от 25 до 75%.
12. Способ по п.10 или 11, где биологически активная молекула представляет собой белок или полипептид и функциональная группа представляет собой аминогруппу.
13. Способ по п.12, где белок или полипептид добавляют к промежуточному продукту, полученному на стадии a) или a1) в восстанавливающих условиях с применением цианоборгидрида натрия, или алюмогидрида лития, или боргидрида натрия.
14. Способ по п.10, где полипептид или белок выбирают из группы, состоящей из интерферонов, эритропоэтинов, факторов, стимулирующих гемопоэз, факторов роста кости/хряща, гормона роста, лубрицина, инсулина, кальцитонина, IL1-ra.
15. Способ по п.10, где соль HA представляет собой HAТВА.
16. Конъюгат гиалуроновой кислоты в кислой форме или в форме соли, или ее производных, или хондроитинсульфата в кислой форме, или в форме соли, или его производных с биологически активными молекулами, полученный способом по пп.1-15.
17. Конъюгат гиалуроновой кислоты (HA) с биологически активными молекулами, полученный способом по пп.11-15.
18. Конъюгат по п.17, выбранный из группы, состоящей из HA-IFN, HA-ЕРО, HA-GCSF, HA-факторы роста кости/хряща, HA-hGH, HA-лубрицин, HA-инсулин, HA-sCT, HA-IL1-ra.
19. Конъюгат по любому из пп.16-18 для применения в области медицины.
20. Применение конъюгата по п.19 для получения лекарственного средства, обладающего противовирусным или противоопухолевым действием.
21. Применение по п.20, где указанным конъюгатом является HA-IFN.
22. Фармацевтическая композиция, включающая в качестве активного компонента конъюгат, определенный по любому из пп.16-19 в качестве активного компонента, в сочетании с одним или несколькими фармакологически приемлемыми вспомогательными веществами.
23. Фармацевтическая композиция по п.22 для перорального, ректального, внутривагинального, подъязычного, внутриглазного применения или в форме растворов для инъекции с помощью внутрикожной, внутривенной, внутримышечной, подкожной, внутриартериальной, внутриоболочечной, внутрисердечной, внутрисиновиальной, внутрисуставной, внутрибрюшинной, внутрипузырной инъекции или фармацевтическая композиция, составленная для местного применения, такая как гели, кремы, мази, пены, сухие порошки, спреи, кожные или чрескожные пластыри.
24. Фармацевтическая композиция по п.23, составленная в форме растворов для внутривенных инъекций для печеночной и/или легочной локализации или в форме систем с контролируемым высвобождением для подкожного, и/или внутрикожного, и/или внутрисуставного введения.
25. Биоматериал, характеризующийся матриксом, включающим конъюгат, определенный по любому из пп.16-18.
| EP1757314 A1, 28.02.2007 | |||
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| СПОСОБ ПОЛУЧЕНИЯ ОБЛАДАЮЩИХ ПОНИЖЕННОЙ РАСТВОРИМОСТЬЮ В ВОДЕ ПЛЕНОЧНЫХ МАТЕРИАЛОВ НА ОСНОВЕ МОДИФИЦИРОВАННЫХ АМИНОСАЛИЦИЛОВЫМИ КИСЛОТАМИ КАРБОКСИЛСОДЕРЖАЩИХ ПОЛИСАХАРИДОВ | 2007 |
|
RU2343932C1 |
Авторы
Даты
2014-10-10—Публикация
2010-06-04—Подача