Настоящее изобретение относится к новым коньюгатам полипептидов и олигосахаридов, к способам их изготовления, к фармацевтическим композициям, содержащим в качестве активных компонентов эти соединения, а также к использованию указанных соединений для изготовления лекарств.
Последние разработки технологий рекомбинантных ДНК и усовершенствованных способов синтеза белков позволили осуществлять коммерческое производство полезных с медицинской точки зрения количеств терапевтических полипептидов. Вместе с тем, в силу короткого периода полувыведения многих терапевтических полипептидов, исторически стояла проблема введения этих соединений. Применяется ряд важных лекарственных препаратов на полипептидной основе, которые в силу увеличенного периода полувыведения могли бы обладать преимуществом. Их примерами являются эритропоэтин, инсулин, α-2b-интерферон, β-интерферон, γ-интерферон, гранулоцитарный колониестимулирующий фактор, человеческий гормон роста, гранулоцитарно-макрофагальный колониестимулирующий фактор, релаксин, урокиназа, стрептокиназа, активатор тканевого плазмогена, кальцитонин, интерлeйкин-2 и фактор некроза опухоли, периоды полувыведения которых составляют менее (значительно) нескольких часов. Например, период полувыведения человеческого инсулина составляет всего лишь около 12 минут. Другими примерами полипептидов, разработанных в качестве потенциальных терапевтических средств, но имеющих недостаток в виде короткого периода полувыведения, являются адреномедуллин, глюкагоноподобный пептид (ГПП-1) и кисспептин (метастин). Увеличение периода полувыведения терапевтических полипептидов способно улучшить современное лечение путем возможного снижения количества доз и частоты дозирования (Curr. Opin. Drug Disc. Dev. 2005, 8, 590-600).
Исследования ряда белков, проводимые за последнее время, были направлены на увеличение периода полувыведения in vivo, например, путем применения адаптации посредством пегилирования (то есть конъюгацией с полиэтиленгликолевой функциональной группой в 1-30 кДа; Drug Discovery Today 2005, 10, 1451-1458). Например, в настоящее время доступны аналоги пегилированного инсулина с увеличенным периодом полувыведения. Важными аспектами созданных в последнее время производных инсулина, помимо сниженной скорости клиренса, является сниженная иммуногенность (например, патент США 4179337) и повышенная растворимость. Дополнительно, разработки по пегилированию инсулина также привели к получению более физически и протеолитически стабильных коньюгатов по сравнению с нативным инсулином (см., например, WO 2004/091494, WO 2002/098232, США 2005/0152848).
Например, в WO 2004/022577 приведено описание пегилированного эритропоэтина с более длинным периодом полувыведения из сыворотки. Было дополнительно выявлено, что измененное гликозилирование эритропоэтина увеличивает период полувыведения. Кроме того, сообщалось, что гипергликозилированные аналоги эритропоэтина имели более высокую активность in vivo (WO 2000/24893). Другими примерами пегилированных (поли)пептидов с длительной продолжительностью действия являются глюкагоноподобный пептид-1 (ГПП-1) (WO 2005/058954, WO 2004/093823; Bioconjugate Chem. 2005, 16, 377-382; Biomaterials, 2005, 26, 3597-3606), глюкозозависимый инсулинотропный полипептид (ГИП) (Bioorg. Med. Chem. Lett, 2005, 75, 4114-4117), кальцитонин (Pharm. Dev. Technol. 1999, 4, 269-275) и октреотид (Pharm. Res. 2005, 22, 743-749).
Вместе с тем, существуют ограничения для применения ПЭГ. Получение ПЭГ осуществляют химическим синтезом и, как все синтетические полимеры, он является полидисперсным. Это означает, что порция ПЭГ состоит из молекул, имеющих различное число мономеров, что приводит к гауссовскому распределению молекулярного веса. Пегилирование полипептида приводит к получению набора коньюгатов, которые могут обладать различными биологическими свойствами, в особенности, периодами полувыведения и иммуногенностью. В этой связи воспроизводимость фармакологического действия пегилированных полипептидов может быть серьезным недостатком такой технологии. Известно также, что пегилирование белков часто сопровождается потерей биологической активности. Дополнительно, применение ПЭГ может вызывать проблемы, связанные с экскрецией из организма. ПЭГ с высокими значениями молекулярного веса могут накапливаться в печени, что приводит к макромолекулярному синдрому. Следовательно, пегилирование лекарственных препаратов необходимо осуществлять с большой осторожностью.
Результаты, сходные с результами пегилирования, были получены путем дериватизации полипептидов с полисахаридами, в частности, с цепочками полисиаловой кислоты (например, WO 92/22331 и WO 2001/87922).
В JP 02/231077 описаны коньюгаты гепарина, представляющие собой супероксиддисмутазы (СОД). Предпочтительно, несколько молекул гепарина присоединяют к СОД, получая коньюгат, имеющий более длинный период полувыведения, чем нативный СОД, в то же время сохраняющий около 90% ферментативной активности.
Другие коньюгаты полипептидов с увеличенным периодом полувыведения представлены конъюгированными производными инсулина (WO 2003/013573, WO 05/012346), или ГПП-1 (Bioorg. Med. Chem. Lett. 2004, 14, 4395-4398), которые связываются с сывороточным циркулирующим альбумином. Связывание с сывороточным альбумином в таких соединениях основано, в частности, на гидрофобных взаимодействиях связывающей функциональной группы с человеческим сывороточным альбумином в конъюгате. Чем выше гидрофобность этой функциональной группы, тем сильнее связывающая аффинность к человеческому сывороточному альбумину. Несмотря на то, что подходит широкий диапазон связывающих функциональных групп, недостаток таких коньюгатов заключается в низкой аффинности и селективности взаимодействия конъюгатов с человеческим сывороточным альбумином, в результате чего фармакодинамическое поведение является плохо прогнозируемым. Альтернативно, прямое слияние гена человеческого инсулина с геном человеческого сывороточного альбумина приводит к получению формы инсулина длительного действия, которая в течение длительного периода после подкожного введения активно снижает уровень глюкозы крови (Duttaroy et al. Diabetes 2005, 54, 251-258). Вместе с тем, в этом случае снижается биодоступность слитого полипептида, а также связывающая аффинность с рецептором-мишенью.
Дополнительно, в WO 2000/40253 раскрыты коньюгаты, например, пептида и, конкретно, цепочки (цепочек) гликозамингликана, которые считаются синтетическими протеогликанами. На терапевтическую активность этих коньюгатов оказывает значительное влияние фармакологическая активность конъюгированного гликозамингликана.
Также для повышения растворимости к фармацевтически активным соединениям присоединяют олигосахариды (WO 2004/03971).
Настоящее изобретение относится к новым коньюгатам полипептидов с увеличенными периодами полувыведения, представляющим собой коньюгаты полипептидов и олигосахаридов, при этом полипептид коньюгирован по меньшей мере к одному синтетическому сульфатированному олигосахаридно-спейсерному остатку, и олигосахарид содержит от 4 до 18 моносахаридных единиц и по существу обладает аффинностью к антитромбину III и к спейсеру, являющемуся связью, или по существу фармакологически неактивным гибким сшивающим остатком, или его фармацевтически приемлемой солью. Предпочтительные олигосахариды состоят из 4-6 моносахаридных единиц, и особенно предпочтительными являются пентасахариды. Коньюгаты настоящего изобретения имеют улучшенные фармакокинетические свойства, и, таким образом, обладают улучшенными фармакологическими свойствами по сравнению с исходными полипептидами (то есть, по существу, с соответствующими неконъюгированными полипептидами).
Настоящее изобретение дополнительно касается новой технологии, основанной на способе изготовления терапевтически активного конъюгата, содержащего полипептид и имеющего незначительную антитромбическую активность, содержащем стадию, в которой синтетический сульфатированный олигосахарид, в частности пентасахарид, который по существу обладает аффинностью к антитромбину III (ATIII), ковалентно присоединяют к полипептиду посредством связи или посредством по существу фармакологически неактивного гибкого сшивающего остатка.
ATIII представляет собой ингибитор сериновой протеазы, присутствующий в плазме крови, который прерывает каскад коагуляции для обеспечения петли обратной связи. Период полувыведения сульфатированного пентасахарида в значительной степени основан на его аффинности к ATIII (см., например, F. Paolucci et al. Clin. Pharmacokinet. 2002; 41 Suppl. 2: 11-18). В конъюгатах настоящего изобретения сывороточный период полувыведения является более длинным, чем период полувыведения исходного полипептида, благодаря периоду полувыведения пентасахарида, которым в значительной степени обусловлен период полувыведения конъюгата. Кроме того, коньюгаты настоящего изобретения не только имеют более продолжительный период полувыведения, но также обладают изменяемыми фармакокинетическими свойствами, основанными на специфическом взаимодействии между пентасахаридной частью конъюгата и ATIII (указанное взаимодействие описано, например, в публикациях Westerduin et al. Bioorg. Med. Chem. 1994, 1267-1280; van Amsterdam et al., Arterioscler Thromb Vasc Biol. 1995; 15:495-503). В варианте осуществления настоящего изобретения уровень циркуляции в плазме у олигосахаридно-полипептидного конъюгата (в частности, у олигосахарида, состоящего из 4-6 моносахаридных единиц и в особенности предствляющего собой пентасахарид), составляет ≤50 нМ. Ниже указанного уровня концентрации антикоагулянтная активность олигосахарида (в частности, пентасахарида), опосредованная ATIII, является незначительной, в частности относительно риска кровотечения (см. например, публикации (1) F. Donat et al, Clin. Pharmacokinet. 2002; 41 Suppl. 2: 1-9; (2) S. J. Keam et al. Drugs 2002; 62 (11):1673-1685 и (3) The Rembrandt Investigators Circulation 2000; 102: 2726-2731). Согласно варианту осуществления настоящего изобретения используемый в конъюгатах олигосахарид (в частности, состоящий из 4-6 моносахаридных единиц и в особенности представляющий собой пентасахарид) по существу обладает антикоагулянтной активностью, которая имеет субтерапевтический уровень по сравнению с фармакологической активностью полипептида самого по себе. Термин «субтерапевтический» в этом отношении означает, что он обладает эффектом ниже терапевтического и не имеет побочных эффектов, таких как риск кровотечения. Например, больные диабетом 1 типа нуждаются в инъекциях инсулина (с продолжительным периодом полувыведения) до комплементарных (базальных) терапевтических уровней в плазме, составляющих от около 0,1 до 1,0 нМ, которые совпадают с субтерапевтическим диапазоном пентасахаридов, используемых в коньюгатах настоящего изобретения. Специалист в данной области техники будет понимать, как выбирать коньюгаты с подходящим балансом между терапевтическими уровнями полипептида и пентасахарида, соответственно.
Полипептиды в конъюгатах настоящего изобретения сохраняют свою биологическую активность. Кроме того, фармакокинетическая кривая ATIII-связанного пентасахарида в конъюгатах настоящего изобретения обуславливает высоко прогнозируемый терапевтический эффект конъюгированных полипептидов, поскольку коньюгаты после внутривенного (в/в) или подкожного (п/к) введения в значительной степени остаются во внутрисосудистом русле.
Олигосахаридный остаток в конъюгатах настоящего изобретения представляет собой остаток синтетического сульфатированного олигосахарида, который по существу обладает аффинностью к антитромбину III (ATIII). Сульфатированные олигосахариды, и в частности пентасахариды, в общем обладают аффинностью к ATIII, вместе с тем, специалист в данной области техники легко сможет проверить аффинность олигосахарида к ATIII (van Amsterdam et al., Arterioscler Thromb Vase Biol. 1995; 15:495-503) и выбрать желательный уровень аффинности. Подходящие синтетические олигосахаридные остатки и в частности, пентасахаридные остатки можно получать из олиго- и пентасахаридов, раскрытых в EP 0454220, EP 0529715, WO 98/03554, WO 99/36428, J. Med. Chem. 2005; 48, 349-352, Angew. Chem. Intl. Ed. Engl. 1994, 32, 1671-1690 и подобных публикациях.
Олиго- и пентасахаридные остатки можно конъгировать в полипептид прямым путем или посредством сшивающего остатка, присоединенного к любому химически подходящему положению в пентасахаридном остатке. Таким образом, в варианте осуществления настоящего изобретения коньюгаты представляют собой коньюгаты, в которых олигосахаридно-спейсерный остаток имеет структуру (I)
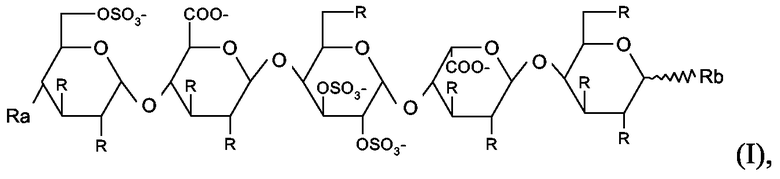
в которой присутствует один по существу фармакологически неактивный гибкий сшивающий остаток, и в которой R независимо представляет собой OSO3 -, (1-8C)алкокси или по существу фармакологически неактивный гибкий сшивающий остаток, и
Rа независимо представляет собой OSO3 -, (1-8C)алкокси, по существу фармакологически неактивный гибкий сшивающий остаток или олигосахаридный остаток, содержащий от 1 до 13 моносахаридных единиц, и
Rb независимо представляет собой (1-8C)алкокси, по существу фармакологически неактивный гибкий сшивающий остаток или олигосахаридный остаток, содержащий от 1 до 13 моносахаридных единиц, и заряд компенсирован положительно заряженными противоионами.
Более предпочтительными являются коньюгаты, в которых олигосахаридно-спейсерный остаток представляет собой пентасахаридно-спейсерный остаток, имеющий структуру (II)
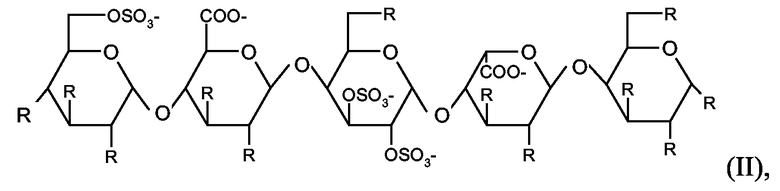
в которой присутствует один по существу фармакологически неактивный гибкий сшивающий остаток, и в которой R независимо представляет собой OSO3 - или (1-8C)алкокси, или по существу фармакологически неактивный гибкий сшивающий остаток, и заряд компенсирован положительно заряженными противоионами.
Дополнительно предпочтительными являются коньюгаты, в которых пентасахаридный остаток имеет структуру (III)
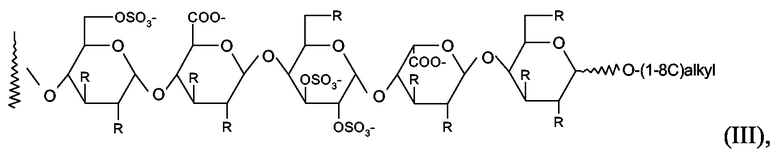
в которой R независимо представляет собой OSO3 - или (1-8C)алкокси, и заряд компенсирован положительно заряженными противоионами.
Согласно настоящему изобретению высоко предпочтительными соединениями являются соединения, в которых пентасахаридный остаток имеет структуру (IV)
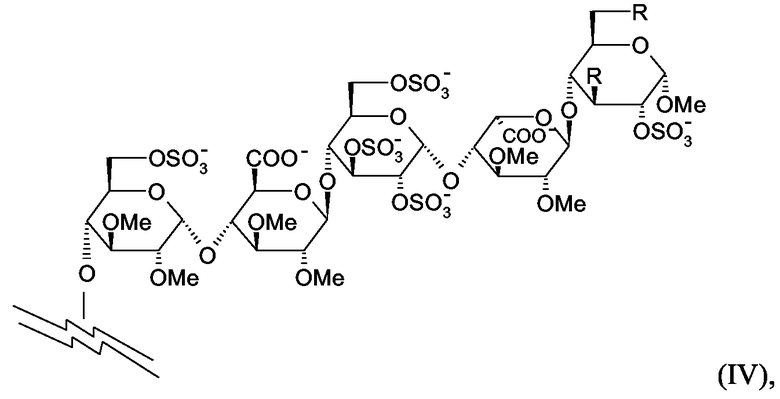
в которой R независимо представляют собой OCH3 или OSO3 -, и в особенности обе группы R в (II) являются OSO3 -.
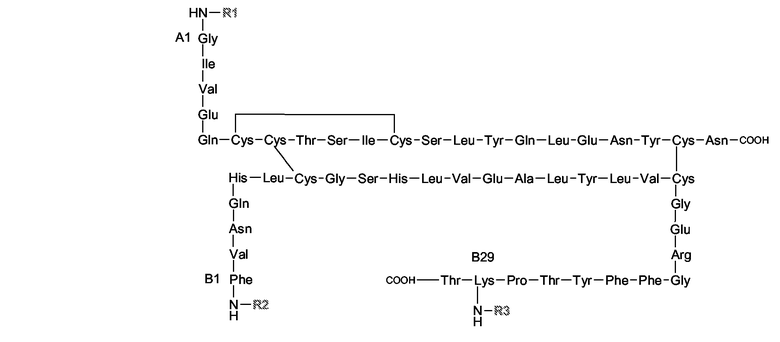
Согласно настоящему изобретению синтетические сульфатированные олигосахаридные остатки, в особенности пентасахаридные остатках, обладающие аффинностью к ATIII, можно конъгировать к любому полипептиду. Например, полипептид может являться биологически активным пептидом (например, длиной от 3 до 50 аминокислот) или может быть более длинным полипептидом, который может иметь или не иметь каталитической активности. Неограничивающие примеры биологически активных пептидов включают в себя медиаторы, такие как конантокин G, динорфин, эндорфин, энкефалин или нейротензин; активаторы желудочных функций, такие как бомбезин, мотилин или гастрин; регуляторы кальция, такие как кальцитонин или паратиреоидный гормон (ПТГ); модуляторы резорбции костей, такие как остеопротегерин (ОПГ); стимуляторы остеобластической активности, такие как адреномедуллин или его усеченные производные, такие как АДМ(27-52); гормоны, такие как вазоактивный кишечный полипептид, кортикотропин, секретин; гормональные ингибиторы, такие как соматостатин; гормональные стимуляторы, такие как меланоцитостимулирующий гормон, релизинг-фактор лютеинизирующего гормона или серморелин; антидиабетические вещества, такие как глюкагоны, амилин, глюкагоноподобный пептид-1 (ГПП-1) или его усеченные производные, такие как ГПП-1(7-36), ГПП-2, глюкозозависимый инсулинотропный полипептид (ГИП) или инсулин ("Humulin", Eli Lilly); противоинфекционные вещества, такие как лизостафин; гормоны, подавляющие аппетит, такие как обестатин; вазоконстрикторы, такие как ангиотензин II; вазодилятаторы, такие как брадикинин, субстанция P или каллидин; натрийуретические вещества, такие как атриальный натрийуретический полипептид (ANP); антидиуретические гормоны, такие как вазопрессин или десмопрессин; и стимуляторы родовой дятельности, такие как окситоцин. Дополнительные примеры возможных для использования полипептидов включают в себя человеческий гормон роста ("Humantrope", Genentech); релизинг-фактор лютеинизирующего гормона (ЛГРФ); рекомбинантный гранулоцитарный колониестимулирующий фактор rG-CSF ("Neupogen", Amgen); эритропоэтин ("Epogen", Amgen); интерферон α-2a, интерферон α-2b, интерферон β, или интерферон γ; фактор VIII или другие факторы свертывания крови, такие как белок C или фактор VIIa; фолликулостимулирующий гормон (ФСГ); цитокин, такой как интерлeйкин (ИЛ) (например, ИЛ-1, -2, -3, -4, - 5, -6, -7, -8, -9, -10, -11, -12 или -18); гемоглобин; супероксиддисмутаза; растворимый CD4 или рецептор CD4; тромбоцитарные аналоги GpIIb/IIIa и их рецепторы ("ReoPro", Johnson & Johnson); глюкоцереброзидаза ("Ceredase" или "Cerezyme", Genzyme); АКТГ; соматотропин; паратиреоидный гормон, антидиуретический гормон; пролактин; рекомбинантный человеческий гормон роста рЧГР, такой как пегвизомант ("Somavert", Pfizer); агонисты ГнРГ, такие как лейпролид ("Lupron", "Leprorelin", Takeda) или нафарелин ("Synarel", Roche) и антагонисты ГнРГ, такие как ганиреликс ("Antagon", Organon); агонисты соматотропин-высвобождающего гормона GHRH, такие как серморелин ("Geref, Serono); октреотид ("Sandostatin", Novartis); или тромболитикс, такой как стрептокиназа, стафилокиназа, урокиназа, или тканевой активатор плазминогена ("Activase", Genentech); метастин (KISS1 или кисспептин-54) или их усеченные производные, такие как кисспептин-10.
Молекулярный вес предпочтительных полипептидов составляет примерно от 0,3 до 50 кДа. Молекулярный вес других предпочтительных полипептидов составляет примерно от 0,3 до 20 кДа. Также предпочтительными являются полипептиды, молекулярный вес которых составляет примерно от 0,3 до 7,5 кДа.
Дополнительно предпочтительными полипептидами являются инсулин (период полувыведения t Ѕ = 12 минут; мол.вес = 5,8 кДа), кальцитонин (t Ѕ = 20 минут; мол.вес = 3,4 кДа), ГПП-1(7-36) (t Ѕ = 6 минут; мол.вес = 3,4 кДа), адреномедуллин (t Ѕ = 20 минут; мол.вес = 6,0 кДа), АДМ(27-52) (мол.вес 3,0 кДа), октреотид (t Ѕ = 1,7 часа, мол.вес = 1,0 кДа), интерлeйкин-2 (t Ѕ = 20 минут; мол.вес = 15 кДа) и ганиреликс (t Ѕ = 12 часов; мол.вес = 1,6 кДа). В особенности предпочтительными являются инсулин и [D-Ala8]-ГПП-1(7-36). Дополнительный вариант осуществления настоящего изобретения представляет собой полипептидный конъюгат, монозамещенный пентасахаридно-спейсерным остатком.
Спейсер представляет собой связь или по существу фармакологически неактивный гибкий сшивающий остаток. Предпочтительно, спейсер является по существу фармакологически неактивным гибким сшивающим остатком, имеющим в частности от 10 до 50 атомов, расположенных вдоль "скелета" спейсера, и не включающим в себя кислород из олигосахаридного остатка. Используемый в настоящем изобретении термин "по существу фармакологически неактивный" означает, что спейсер не содержит атомы или группы, которые сами по себе проявляют фармакологически активность в дозах, при которых соединения настоящего изобретения обладают терапевтическим эффектом. Таким образом, свойства спейсера не обуславливают доказуемые фармакологические побочные эффекты в дозах, в которых применяют соединения настоящего изобретения в качестве терапевтических лекарственных препаратов.
Спейсер может содержать несколько жестких элементов, таких как кольцевые структуры и ненасыщенные связи. Спейсер соединений настоящего изобретения предпочтительно является гибким. Специалист в данной области техники может с легкостью разработать подходящие спейсеры. Более длинные спейсеры считаются менее подходящими для синтеза, вместе с тем более длинные спейсеры могут успешно применяться в соединениях настоящего изобретения. Предпочтительные спейсеры содержат по меньшей мере один элемент -(CH2CH2O)-.
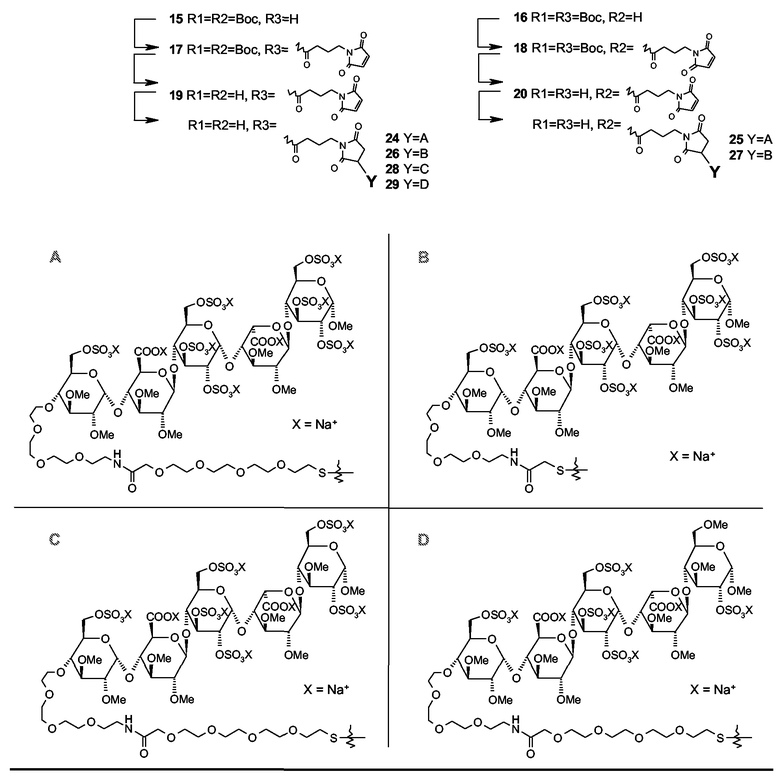
Типичные примеры конъюгатов настоящего изобретения представляют собой коньюгаты со следующими структурами:
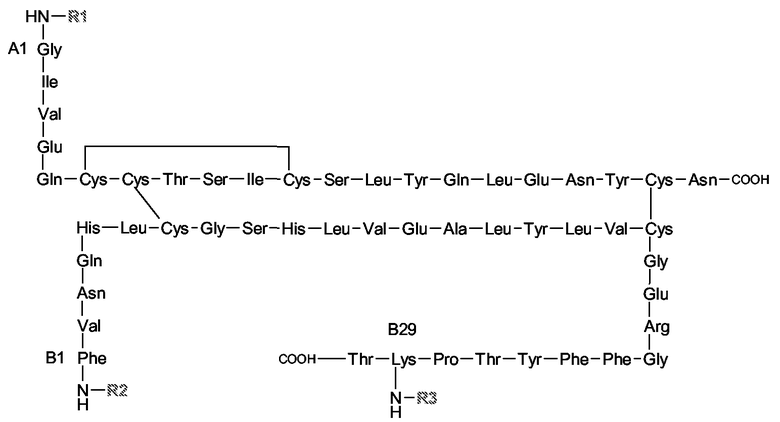
в которых R1=R2=H, R3=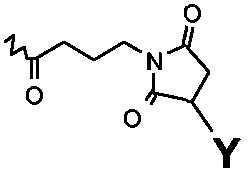
или в которых R1=R3=H, R2=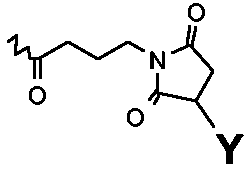
и в которых Y выбирают из структур A, B, C и D
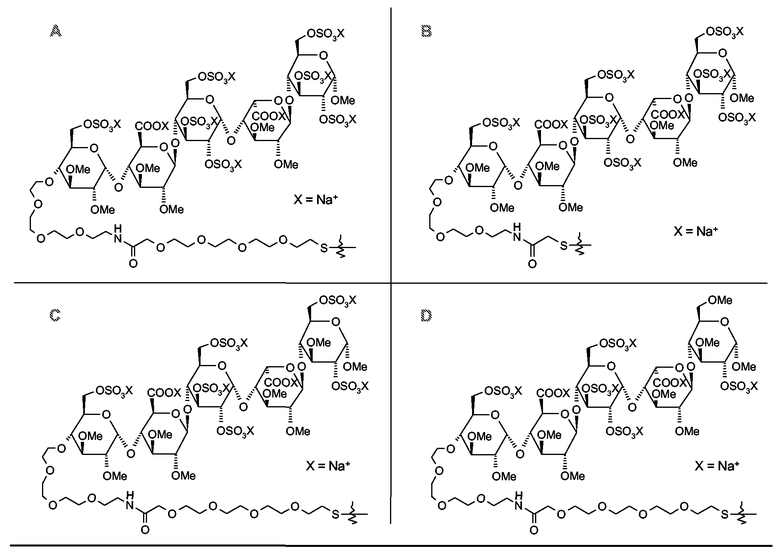
или их другие соли, но также и коньюгаты, в которых спейсер отличается от указанных или присоединен к пентасахариду в другом положении. Предпочтительной является натриевая соль. И предпочтительно, Y выбирают из структур A и B.
Общепринято используемые химические сокращения, которые явно не определены в настоящем раскрытии, можно найти в справочниках The American Chemical Society Style Guide, Second Edition, American Chemical Society, Washington, DC (1997), "2001 Guidelines for Authors" J. Org. Chem. 66(1), 24A (2001), "A Short Guide to Abbreviations and Their Use in Polypeptide Science" J. Polypeptide. Sci. 5, 465-471 (1999).
Термин «полипептид» относится к цепочке по меньшей мере из трех аминокислот, независимо от посттрансляционных модификаций. Полипептиды могут быть полимерами аминокислот природного происхождения, синтезированными химически или полученными рекомбинантным путем. Полипептиды, имеющие от трех до 50 аминокислот, обычно классифицируют как пептиды.
Выражение "полипептид с каталитической активностью" означает фермент.
Используемый в настоящем изобретении термин «инсулин» относится к гипогликемическим полипептидам природного происхождения, обнаруживаемым у млекопитающих, включающих в себя человека, крысу, морскую свинку и кролика, а также к рекомбинантному инсулину и подобным гипогликемическим полипептидам, раскрытым в патентах США 4652525, 4431740, 5268453, 5506202, 5514646, и 5700662.
В описании конъюгатов настоящего изобретения дополнительно использованы следующие определения.
Термины (1-4C)алкил и (1-8C)алкил означают разветвленную или неразветвленную алкильную группу, имеющую, соответственно, от 1 до 4 и от 1 до 8 атомов углерода, например, метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, гексил и октил. Предпочтительными алкильными группами являются метил и этил.
Термин (1-8C)алкокси означает алкокси группу, имеющую от 1 до 8 атомов углерода, алкильная функциональная группа имеет вышеуказанное значение. Метоксигруппа является предпочтительной алкоксигруппой.
Длина спейсера обозначается числом атомов в спейсере, расположенных по самой короткой цепочке между олигосахаридным остатком и полипептидом, не считая связанный со спейсером атом кислорода олигосахаридного остатка.
Вариантом осуществления настоящего изобретения дополнительно является способ изготовления терапевтически активного конъюгата, содержащего полипептид, конъюгата, имеющего незначительную антитромбическую активность, в котором конъюгат обладает более длинным периодом полувыведения из плазмы, чем исходный полипептид, вместе с тем, по существу сохраняя его биологическую активность, и указанный способ содержит стадию, в которой синтетический сульфатированный олигосахарид, в частности, в которой олигосахарид состоит из 4-6 моносахаридных единиц, и наиболее конкретно является сульфатированным пентасахаридом, по существу обладающим аффинностью к антитромбину III, присоединен к полипептиду, необязательно посредством по существу фармакологически неактивного гибкого связывающего остатка.
Общие аспекты синтеза и анализа
Синтез пентасахаридов
Можно изготавливать ATIII - связывающий олигосахарид, в особенности пентасахарид, из соединений настоящего изобретения, например, согласно описанию в Angew. Chem. Intl. Ed. Engl. 1994, 32, 1671-1690. Можно получать различные олиго- и пентасахариды с измененной аффинностью к ATIII, варьируя промежуточные моно-, ди- или тетрасахаридные структурные блоки, например, путем введения (постоянных) алкильных групп или путем применения различных (временных) защитных групп, дающих регулируемый доступ к различным образом сульфатированным олиго- и пентасахаридам (например, Westerdu et al. in Bioorg. Med. Chem. 1994, 1267). Например, спейсер можно вводить согласно описанию WO 2001/42262. Для возможности прямого связывания с необязательно модифицированным полипептидом, олиго- и пентасахаридно-спейсерную молекулу дополнительно можно дериватизировать со сшивающими остатками, такими как гамма-малеимидобутирильная (GMB) группа, N-гидроксисукцинимидная (NHS) группа или с необязательно защищенной тиоловой группой (например, Angew. Chem. Intl. Ed. Engl. 1996, 35, 331-333).
Конъюгирование
В общем, коньюгаты настоящего изобретения получают согласно способу, содержащему (a) необязательную стадию, в которой полипептид адаптируют для конъюгирования, и (b) стадию связывания, в которой необязательно адаптированный полипептид реагирует с олиго- или пентасахаридно-спейсерной молекулой.
Общие способы синтетиза для производства биоконъюгатов описаны в "Bioconjugate Techniques" by Greg T. Hermanson, 1996, Academic Press. Для конъюгирования можно дополнительно учитывать лигирование Штаудингера (Staudinger) (например, как описано K.L. Kiick et al. Proc. Nat. Acad. Sci. 2002; 99:19-24) или 1,3-диполярное циклоприсоединение Хьюсгена (Huisgen) с использованием пентасахаридного производного и полипептида, независимо модифицированного с функциональной группой алкина или азида. Альтернативно, для конъюгирования пентасахаридного спейсерного остатка к необязательно модифицированному полипептиду можно адаптировать ферментативные реакции, такие как опосредованная региоселективной IgA протеазой элонгация полипептидов на N-конце (как описано авторами М. Lewinska et al. в Bioconjugate Chem. 2004, 75, 231-234), или катализированное трансглутаминазами введение аминоспейсера, содержащего олигосахариды (как описано М. Sato et al. в J. Chem. Soc. 2004, 126, 14013-14022).
Дополнительно, хорошо описано пегилирование, например, инсулина, ГПП-1 и октреотида. В эти белки можно вводить функциональную группу ПЭГ примерно от 5 до 30 кДа без нарушения их биологической активности; такие стратегии можно осуществлять для (сайт-специфичного) введения пентасахаридной (спейсерной) функциональной группы. Кроме того, необходимым условием является то, что присоединение пентасахаридного конъюгата к ATIII (около 50 кДа) не имеет какого-либо существенного вредного воздействия на биологическую активность полипептида.
Инсулин: Для биологической активности инсулина не являются необходимыми функциональные аминогруппы лизина N-конца B-1 и B-29 около C-конца. Изготовляли В1-пегилированный инсулин (S.W. Kim et al, Adv. Drug Del. Rev. 2002, 54, 505-530) с общим выходом 20% посредством реакции производного ПЭГ, активированного N-гидроксисукцинимидом (NHS) с инсулином, защищенным ди-N-Boc (бутилоксикарбонил). Подобная реакция с бифункциональным реактивом присоединения, таким как сложный эфир N-малеимидобутирилоксисукцинимида (GMBS), дает доступ к пентасахаридным коньюгатам В1-модифицированного инсулина. Альтернативно, можно селективно модифицировать остаток B29 Lys незащищенного Zn2+-инсулина избытком сложного эфира NHS при уровне pH примерно 10-11 с выходом около 60%. Другие общепринятые способы региоселективного конъюгирования к инсулину могут быть адаптированными способами из WO 98/02460, WO 2004/091494, WO 2005/012346, US 2005/0152848, Jensen et al. J. Pept. Sci. 2005, 11, 339-346, Lee et al. Bioconj. Chem. 2005, 16, 615-620, Jain et al. Biochim. Biophys. Act. 2003, 1622, 42-49, Tessmar et al. Tissue Engin. 2004, 10, 3, 441-453).
Ганиреликс: Пентасахаридные производные сложного эфира NHS можно конъгировать к свободному N-концу аминогруппы де-N-Ac ганиреликса или можно конъгировать аминоспейсер, содержащий пентасахаридное производное, необязательно посредством дополнительного спейсера, к свободной концевой карбоксильной кислотной группе дезамидоганиреликса, который в свою очередь можно получать усовершенствованным (твердофазным) синтезом белка, например, согласно описанию в J. Med. Chem. 1992, 55, 3942-3948.
Октреотид: N-концевой аминокислотный остаток D-Phe октреотида, являющегося коммерчески доступным пептидом, можно модифицировать с ПЭГ до 5 кДа без нарушения биологической активности (D. Hee et al. Pharm. Res. 2005, 22, 743-749). Можно достичь региоспецифической функционализации N-концевой аминогруппы с избытком бифункционального реактива присоединения сложного эфира NHS при уровне pH около 6, после чего можно осуществлять дальнейшее конъюгирование к пентасахаридному носителю согласно обычным способам синтеза для производства биоконъюгатов, как описано выше (например, путем конъюгирования пентасахаридного спейсерного остатка, содержащего тиоловую группу, к малеимидному производному октреотида).
АДМ(27-52): N-концевая половина от полноразмерного адреномедуллина (АДМ) не является необходимой для его остеогенной активности и действия, ингибирующего кальцификацию сосудов. Можно достичь региоспецифического конъюгирования пентасахаридно-спейсерного остатка к N-концевому остатку Ala из АДМ(27-52) путем синтеза необязательно модифицированного на N-конце АДМ(27-52) с использованием общепринятых способов, в которых применяется твердофазный синтез белка, и обычных способов синтеза для производства биоконъюгатов, как описано выше.
[D-Ala 8 ]-ГПП-1(7-36): C-концевая часть ГПП-1(7-36) и ее производные, такие как Эксендин-4(1-39), образуют α-спиральную структуру, в которой расположены аминокислотные остатки, важные для рецепторного связывания. Тем не менее, удлинение этой аминокислотной последовательности с помощью дополнительного лизинового остатка, модифицированного в Nε-положении, с малеимидной функциональной группой, с использованием адаптированного твердофазного синтеза белка, например, согласно описанию WO 2005/058954, проявляет рецепторное связывание и функциональную активность in vivo после ковалентного присоединения к Cys34 аминокислоте человеческого сывороточного альбумина, тогда как протеолитическую стабильность можно (дополнительно) улучшить включением в положение 2 остатка D-Ala (Bioorg. Med. Chem. Lett. 2004, 14, 4395-4398). Сходным способом можно конъгировать ГПП-1(7-36) или его аналоги к функционализированной подходящим образом пентасахаридно-спейсерной функциональной группе (например, содержащей тиоловую группу). Альтернативно, Cys аминокислоту можно включать в пептидную последовательность, предпочтительно в положении (положениях) 11, 12, 16, 22, 23, 24, 25, 26, 27, 30, 34, 35 или 36 или добавлять в положении 37, которую при этом можно присоединять к функционализированной подходящим образом пентасахаридно-спейсерной функциональной группе (например, содержащей малеимидную группу), используя способы, подобные описанным способам пегилирования производных ГПП-1 (WO 2004/093823). Кроме того, коньюгаты ГПП-1 можно получать прямым присоединением ГПП-1 к бифункциональному сложному эфиру NHS реактиву присоединения, с последующим разделением позиционных изомеров (например, как описано для прямого пегилирования ГПП-1 Lee et al. Bioconjugate Chem. 2005, 16, 377-382) и присоединением к функционализированной подходящим образом пентасахаридно-спейсерной функциональной группе.
Интерлeйкин-2 (ИЛ-2): свободная Cys125 аминокислота из коммерчески доступного нативного рекомбинантного человеческого ИЛ-2 (рЧ-ИЛ2) или свободные (дополнительные) Cys аминокислоты мутеинов ИЛ2, являющиеся тем не менее биологически активными, могут реагировать с пентасахаридно-спейсерной функциональной группой, содержащей малеимидную группу, согласно схеме, сходной с описанной для пегилирования ИЛ2 (патент США 5206344) с ПЭГ-малеимидом.
Связывание белков, представляющее собой возможную процедурную стадию в вышеупомянутом описанном способе изготовления соединений настоящего изобретения, можно осуществлять способами, общепринято известными в данной области техники, для связывания, или конденсации, фрагментов белка, такими как азидный способ, смешанный ангидридный способ, способ сложноэфирной активации, способ карбодиимида, или, предпочтительно, под действием солей аммония/урана, например, TBTU (2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурана тетрафторборат), особенно с добавлением соединений, подавляющих катализ и рацемизацию, таких как N-гидроксисукцинимид, N-гидроксибензотриазол и 7-аза-N-гидроксибензотриазол. Краткие обзоры этих тем приведены в следующей литературе: The Peptides, Analysis, Synthesis, Biology, Vol. 3, E. Gross and J. Meienhofer, eds. (Academic Press, New York, 1981) и Peptides: Chemistry and Biology. N. Sewald and H.-D. Jakubke (Wiley-VCH, Weinheim, 2002).
Присутствующие в соединениях функциональные аминогруппы во время процедуры синтеза можно защищать N-защитной группой, что означает общепринято используемую в химии белков группу для защиты α-аминогруппы, например, группу трет-бутилоксикарбонила (Boc), группу бензилоксикарбонила (Z), группу 9-флуоренилметилоксикарбонила (Fmoc) или группу фталоила (Phth), или их можно вводить путем демаскирования функциональной группы азида. Краткие обзоры защитных аминогрупп и способов их удаления приведены в вышеупомянутых изданиях The Peptides, Analysis, Synthesis, Biology, Vol. 3 и Peptides: Chemistry and Biology.
Соединения настоящего изобретения, которые могут находиться в виде свободного основания, можно выделять из реакционной смеси в виде фармацевтически приемлемой соли. Фармацевтически приемлемые соли также можно получать путем обработки свободного основания формулы (I) органической или неорганической кислотой, такой как хлористый водород, бромистый водород, йодистый водород, серная кислота, фосфорная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, метансульфоновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота, аскорбиновая кислота и подобными кислотами.
Соединения настоящего изобретения или их промежуточные продукты могут иметь хиральные атомы углерода, и поэтому могут быть получены в виде чистого энантиомера или в виде смеси энантиомеров, или в виде смеси, содержащей диастереомеры. В данной области техники известны способы получения чистых энантиомеров, например, способ кристаллизации солей, полученных из оптически активных кислот и рацемических смесей, или путем хроматографии с использованием хиральных колонок. Для диастереомеров можно использовать колонки с прямой фазой или обращенной фазой.
Физико- и биохимический анализ
Являются доступными ряд технологий, контролирующих влияние реакции с бифункциональными линкерами и/или реагирующими пентасахаридно-функциональными группами на биологическую активность белка. В этом отношении ценным инструментом является анализ биомолекулярных взаимодействий (BIA) с использованием в качестве агентов комплиментарного связывания (инсулин) растворимых рецепторных молекул и определение активности фермента. Исследование связывания пентасахаридного конъюгата с ATIII также можно включать в эти анализы.
Ионнообменная, эксклюзионная хроматография и афинная хроматография ATIII являются доступными способами субфракционирования пентасахаридных коньюгатов, тогда как технологии электрофореза подходят для ортогонального, качественного и количественного параметров (например, для электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия SDS-PAGE, для капиллярного зонного электрофореза CZE). Части соединения можно идентифицировать анализом время-пролетной масс-спектрометрии с лазерной ионизацией и десорбцией из матрицы MS MALDI-TOF и N-концевым секвенированием конъюгатов.
Фармакокинетические (ФК) исследования
Для определения периода полувыведения in vivo немодифицированного полипептида и соответствующих пентасахаридных коньюгатов можно проводить ФК исследования на крысах. Доступны несколько вариантов, например, введение радиоактивных изотопов с применением Iodogen с 125I или лактопероксидазная ионизация для индукции электрофильного замещения, или использование реактива Болтона-Хантера в качестве группы мечения и определение гамма-излучения в образцах плазмы. Другие способы, известные в данной области техники, основаны на инъекции немеченных коньюгатов с последующим иммунохимическим анализом посредством твердофазного иммуноферментного анализа ELISA или люминисцентной технологии (Luminex).
Фармакологическая оценка
Фармакологические эффекты конъюгирования полипептидов настоящего изобретения к ATIII-связывающему пентасахариду можно изучать в анализах in vitro и in vivo на моделях животных, как описано ниже.
Инсулин является белком в 5,8 кДа, состоящим из двух пептидных цепочек, которые скрепляются двумя дисульфидными мостиками. Хорошо изучена сайт-специфическая химическая модификация в одной из Lys ε-аминогрупп или N-концевых α-аминогрупп. Действие конъюгирования пентасахарида к инсулину можно изучать путем анализа образцов сыворотки на содержание глюкозы, инсулина и C-белка (биомаркера для коррекции эндогенной секреции инсулина). Глюкометр, человеческий инсулин и радиоиммуноанализы C-белка являются коммерчески доступными. В условиях in vivo можно измерять действие инсулина на уровни глюкозы крови у крыс или собак породы бигль.
Фармакологическое действие пентасахаридного конъюгирования декапептидного миметика антагониста ГнРГ ганиреликса in vitro и in vivo можно изучать общепринятыми анализами и на моделях животных. Усовершенствованный полипептидный синтез даст четко определенную молекулу, действие которой можно сравнивать с действием ганиреликса по блокированию созревания ооцитов и овуляции у мыши и крысы. Сравнение периода полувыведения ганиреликса и его пентасахаридно-конъюгированной копии можно изучать, например, определением времени после введения, за которое восстанавливается естественный механизм созревания и овуляции.
ГПП-1(7-36) является известным и хорошо изученным инсулинотропным эндокринным гормоном, индуцирующим множество биологических действий, таких как стимуляция секреции инсулина, ингибирование секреции глюкагона, желудочной или кишечной моторики, повышение утилизации глюкозы и индукция потери веса. Он быстро расщепляется дипептидилпептидазой IV (ДППIV). Можно обойти указанное преждевременное расщепление, например, заменой аминокислотного остатка в положении 8 (например, D-аланином). Другие подходы, такие как модификация большими цепочками жирных кислот или ПЭГ, приводили к получению биологически активного ГПП-1 или его аналогов (как указано, например, в WO 2004/093823). Используя иммунохимический анализ, можно изучать стабилизирующее (дополнительное) действие конъюгирования необязательно модифицированного производного ГПП-1(7-36) к пентасахаридному носителю путем измерения стабильности конъюгата in vitro в присутствии ДППIV, и in vivo путем измерения периода полувыведения из плазмы. Функциональную активность ГПП-1 пентасахаридного конъюгата можно определять in vitro, измеряя способность связываться с рецептором ГПП-1 и активировать его, и фармакодинамические эффекты in vivo можно изучать путем анализов образцов сыворотки на содержание глюкозы и инсулина.
Адреномедуллин представляет собой полипептид с 52 аминокислотами, имеющий множество биологических функций, таких как вазодилатация, бронходилатация, нейротрансмиссия, регуляция роста и регуляция формирования кости. Усеченный фрагмент АДМ(27-52) по структурным параметрам не имеет вазодилятаторного действия, но вместе с тем может стимулировать рост у культивируемых остеобластов крыс дозозависимым образом (Regulatory Peptides 2003, 112, 79-86). Дополнительно, в последнее время было установлено, что АДМ(27-52) ингибирует кальцификацию сосудов у крыс (Regulatory Peptides 2005, 129, 125-132) и, таким образом, может иметь потенциальное терапевтическое применение для предотвращения кальцификации артерий. Действие конъюгирования АДМ(27-52) к пентасахаридному носителю можно оценивать общепринятыми анализами путем измерения in vitro остеогенной активности в культурах активно растущих фетальных остеобластов крысы, или in vivo измерением роста индекса формирования кости (не затрагивая резорбцию кости).
Октреотид является синтетическим октапептидным аналогом соматостатина и используется в клинической практике для лечения акромегалии и некоторых эндокринных опухолей. Было показано, что по сравнению с тремя подкожными инъекциями, рецептуры с замедленным всасыванием (депо) с продолжительным действием (например, Sanostatin LAR депо, Novartis Pharma, Базель, Швейцария) имеют по меньшей мере такое же действие снижения уровней гормона роста и инсулиноподобного фактора роста (ИФР-I) в плазме. Действие конъюгирования октреотида к пентасахариду на его фармакокинетические и фармакодинамические свойства можно изучать на самцах крыс с использованием общепринятых радиоиммуноанализов, для определения уровней конъюгированного октреотида и измененных уровней ИФР-I.
Интерлeйкин-2 (ИЛ-2) является белком, вырабатываемым лейкоцитами (T-лимфоцитами) в организме естественным путем и представляет собой важный белок иммунной системы. В качестве лекарственного средства он является коммерчески доступным (Aldesleukin, Пролейкин®, Chiron, США) и применяется для лечения некоторых типов рака (лейкоз ворсистых клеток), и используется в соединении с антиВИЧ-терапией для индукции повышения количества клеток CD4. Можно определять специфическую биологическую активность коньюгатов пентасахарида - ИЛ-2 in vitro, используя биоанализ пролиферации клеток ИЛ-2, описанный Gillis et al. (J. Immunol. 1978, 120, 2027-2032).
Фармацевтические рецептуры
Конъюгаты настоящего изобретения можно вводить энтерально или парентерально. Конкретная доза и схема введения этих соединений и их композиций будут обязательно зависеть от биологической активности самого полипептида, потребностей отдельного субъекта, которому вводят лекарство, степени тяжести заболевания или от потребностей и точки зрения врача. В общем, при парентеральном введении необходимы более низкие дозы, чем при других способах введения, которые в большей степени зависят от абсорбции. Вместе с тем, для людей ежедневные дозы предпочтительно составляют от 0,0001 до 1 мг на кг веса тела, более предпочтительно, от 0,001 до 0,1 мг на кг веса тела.
Лекарство, изготовляемое с соединениями настоящего изобретения, также можно использовать в терапии в качестве адъюванта. В таком случае лекарство вводят с другими соединениями, полезными в лечении таких состояний заболевания.
При смешивании с фармацевтически подходящими вспомогательными веществами, например, описанными в стандартной ссылке Gennaro et al., Remington's Pharmaceutical Sciences, (18th ed., Mack Publishing Company, 1990, в частности см. Part 8: Pharmaceutical Preparations and Their Manufacture), соединения можно прессовать в твердые лекарственные формы, такие как пилюли, таблетки, или обрабатывать для изготовления капсул или суппозиториев. При помощи фармацевтически подходящих жидкостей соединения также можно применять в виде раствора, суспензии, эмульсии, например, для использования в виде препарата для инъекции или в виде аэрозоля.
Для изготовления дозированных форм, например, таблеток, предполагается использование общепринятых добавок, таких как наполнители, красители, полимерные связующие вещества и тому подобных. В общем, можно использовать любое фармацевтически приемлемое вспомогательное вещество, которое не влияет на функцию активных соединений.
Подходящие носители, с которыми можно вводить композиции настоящего изобретения, включают в себя лактозу, крахмал, производные целлюлозы и т.п., или их смеси, используемые в подходящем количестве. При внутривенном введении можно применять фармацевтические композиции в виде болюса, в двух или больше дозах, разделенных во времени, или в виде постоянного или нелинейного вливания. Таким образом, можно создавать рецептуру композиций настоящего изобретения для любого пути введения.
Обычно композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости композиция также может включать в себя солюбилизирующее вещество, стабилизирующее вещество и местно анестезирующее вещество, такое как лидокаин, для ослабления боли в месте инъекции. В общем, компоненты могут поставляться или раздельно, например, в наборе, или быть смешанными вместе в монолитной лекарственной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата. Композицию можно сохранять в герметично закрытом контейнере, таком как ампула или саше с указанием количества активного вещества в единицах активности. Если композицию вводят путем вливания, ее можно расфасовывать в инфузионный флакон, содержащий стерильную "воду для инъекции" фармацевтического качества, физиологический раствор или другие подходящие внутривенные жидкости. Если композиция должна вводиться путем инъекции, для возможности смешивания компонентов перед введением можно обеспечивать ампулу стерильной воды для инъекции или ампулу физиологического раствора. Фармацевтические композиции настоящего изобретения содержат соединения настоящего изобретения и их фармацевтически приемлемые соли, с любым фармацевтически приемлемым компонентом, наполнителем, носителем, адъювантом или средством транспорта.
Если не указано иначе, все технические и научные термины, используемые в настоящем изобретении, имеют то же значение, что и значение, общепринято понимаемое рядовым специалистом в данной области техники, к которому относится настоящее изобретение. Хотя способы и материалы, подобные или эквивалентные описанным в настоящем изобретении, можно использовать для осуществления или тестирования настоящего изобретения, в настоящем документе описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие упомянутые в настоящем изобретении ссылки включены отсылочно во всей их полноте. В случае противоречий, включающих в себя определения, они будут урегулированы в настоящем описании. Дополнительно, материалы, способы и примеры приведены только в иллюстративных целях и не предназначены для ограничения объема настоящего изобретения.
Настоящее изобретение дополнительно проиллюстрировано без ограничения следующими примерами. Подразумевается, что можно проводить различные модификации с пентасахаридами, спейсерами и полипептидами, отличными от указанных, не отступая от сущности и объема настоящего изобретения.
НАДПИСИ К ФИГУРАМ
Фиг.1.
Распознавание пентасахаридно-инсулинового коньюгата 6 (Инсулин-пента) посредством инсулин-специфического анализа ELISA.
Фиг.2A.
Анализ биомолекулярных взаимодействий (BIA) пентасахаридно (ПС) - инсулинового коньюгата 6.
Реакция иммобилизированных антиинсулиновых антител с инсулиновым коньюгатом с последующим связыванием с рецептором человеческого инсулина.
Фиг.2B.
Анализ Biacore пентасахаридно (ПС) - инсулинового коньюгата 6.
Реакция иммобилизированных антиинсулиновых антител с инсулиновым коньюгатом с последующим связыванием с человеческим ATIII.
Фиг.3.
Анализ MALDI-TOF монозамещенного пентасахаридно-инсулинового коньюгата 6.
Фиг.4.
Анализ высокоэффективной жидкостной эксклюзионной хроматографии HP-SEC монозамещенного пентасахаридно-инсулинового коньюгата 6 на Superdex 30.
Фиг.5.
Связывание человеческим ATIII (чATIII) пентасахаридно-спейсерных остатков 7, 8 и 9 (исследование BIA).
Фиг.6.
Связывание чATIII инсулинопентасахаридных коньюгатов 24, 28 и 29 (исследование BIA).
Фиг.7.
Масс-спектральный анализ (масс-спектрометр ESI-QTOF) инсулинопентасахаридного коньюгата 24.
Фиг.7A.
Сравнение экспериментально определенного и рассчитанного обычного распределения изотопа инсулинопентасахаридного конъюгата (ESI-QTOF, M5+, соединение 24).
Фиг.8.
Связывание чATIII соединений 31, 32, 36, 37 (исследование Biacore).
Фиг.9.
Связывание чАТIII соединения 39 (определяемого BIA).
Фиг.10.
Профиль связывания чАТIII соединения 41 (определяемого BIA).
Фиг.11.
Профиль связывания чАТIII соединения 44 (определяемого BIA).
Фиг.12.
Анализы SDS-PAGE и Вестерн-блоттинг соединения 47.
Фиг.13.
Средние уровни в плазме (среднее значение ± стандартная ошибка средней (s.e.m.)), определенные измерением концентрации инсулина после в/в введения 3,5 нмоль/кг рекомбинантого человеческого (рЧ) инсулина (незаштрихованные кружки) или пентасахаридно-инсулинового конъюгата 6 (треугольники).
Фиг.14.
Средние уровни в плазме (среднее значение ± s.e.m.), выраженные в виде % от концентрации, измеренной в точке времени T=1 минута после в/в введения меченного 125I конъюгата 29 (незаштрихованные квадратики), 24 (незаштрихованные кружки) и 28 (незаштрихованные треугольники), и непосредственно рЧ инсулина (заштрихованные кружки).
Фиг.15.
Средние уровни в плазме (среднее значение ± s.e.m.), выраженные в виде % от концентрации, измеренной в точке времени T=1 минута после в/в введения меченного 125I конъюгата 31 (незаштрихованные квадратики) и 32 (заштрихованные треугольники). (Данные без коррекции для дегалогенирования).
Фиг.16.
Средние уровни в плазме (среднее значение ± s.e.m.), выраженные в виде % от концентрации, измеренной в точке времени T=1 минута после в/в введения меченного 125I конъюгата 39 (незаштрихованные квадратики) и меченного 125I АДМ(27-52) (заштрихованные треугольники), (данные без коррекции для дегалогенирования).
Фиг.17.
Средние уровни в плазме (среднее значение ± s.e.m.), выраженные в виде % от концентрации, измеренной в точке времени T=1 минута после в/в введения меченного 125I конъюгата 41 (заштрихованные треугольники) и меченного 125I ГПП-1 (незаштрихованные квадратики).
Фиг.18.
Выявление пентасахаридно-инсулинового коньюгата 6 - комплекса ATIII с античеловеческими и антикроличьими антителами к ATIII.
Фиг.19.
Уровни глюкозы (среднее значение ± s.e.m.) после в/в введения 7 нмоль/кг пентасахаридно-инсулинового конъюгата 6 (незаштрихованные треугольники) или 3,5 нмоль/кг рЧ-инсулина (незаштрихованные кружки).
Фиг.20.
Уровни глюкозы (среднее значение ± s.e.m.) после в/в введения 12 нмоль/кг пентасахаридно-инсулинового конъюгата 26 (заштрихованные треугольники) или 24 (заштрихованные кружки) по сравнению с уровнями глюкозы после введения 9 нмоль/кг рЧ-инсулина (незаштрихованные кружки).
Фиг.21.
Уровни глюкозы (среднее значение ± s.e.m.) после в/в введения 24 нмоль/кг пентасахаридно-инсулинового конъюгата 27 (заштрихованные квадратики) или 25 (заштрихованные ромбики) по сравнению с уровнями глюкозы после введения 9 нмоль/кг рЧ-инсулина (незаштрихованные кружки) или 48 нмоль/кг инсулина Detemir (незаштрихованные треугольники).
Фиг.22.
Уровни глюкозы (среднее значение ± s.e.m.) после в/в введения 24 нмоль/кг пентасахаридно-инсулинового конъюгата 24 (заштрихованные треугольники), 28 (заштрихованные кружки) или 29 (заштрихованные квадратики) по сравнению с уровнями глюкозы после введения 9 нмоль/кг рЧ-инсулина (незаштрихованные кружки) или 24 нмоль/кг инсулина Detemir (незаштрихованные ромбики).
ПРИМЕРЫ
Использованные сокращения:
ACN - ацетонитрил
AcOH - уксусная кислота
ADM (АДМ) - адреномедуллин
(h)ATIII ((ч)ATIII) - (человеческий) антитромбин III
AUC - область под кривой
BIA - анализ биомолекулярных взаимодействий
Boс2O - ди-трет-бутил-дикарбонат
Cl - клиренс
DCCI - N,N'-дициклогексилкарбодиимид
DIPEA - диизопропилэтиламин
DMF (ДМФ) - N,N'-диметилформамид
DMSO (ДМСО) - диметилсульфоксид
EDTA (ЭДТА) - этилендиаминтетраацетат
ELISA - твердофазный иммуноферментный анализ
Equiv. (Экв.) - эквиваленты
ESI -ионизация электронным распылением
GLP-1 (ГПП-1) - глюкагоноподобный пептид - 1
GMB (ГМБ) - гамма-малеимидобутирил
GMBS - сложный эфир N-гидроксисукцинил-гамма-малеимидомасляной кислоты
HBS-EP - буферный солевой раствор Hepes, содержащий полиэтиленгликоль и ЭДТА
ВЭЖХ - высокоэффективная жидкостная хроматография
HP-SEC - высокоэффективная жидкостная эксклюзионная хроматография
HRP - пероксидаза хрена
в/в - внутривенный
IL-2 (ИЛ-2) - интерлeйкин-2
MALDI-TOF - времяпролетная лазерная ионизация и десорбция из матрицы
Моab - моноклональное антитело
MRT - среднее время нахождения
MS - масс-спектрометрия
NMM - N-метилморфолин
NMR (ЯМР) - ядерный магнитный резонанс
PAGE - электрофорез в полиакриламидном геле
PBS (ФБР) - фосфатно-буферный раствор
PS (ПС) - пентасахарид
Q-TOF -квадрупольное время пролета
recH (рЧ) - рекомбинантный человеческий
КТ - комнатная температура
Rt - время удержания
SDS - додецилсульфат натрия
TBTU - 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурана тетрафторборат
TCA (ТХУ) - трихлоруксусная кислота
ТЕА (ТЭА) - триэтиламин
TFA (ТФУ) - трифторуксусная кислота
THF (ТГФ) - тетрагидрофуран
Vss - объем распределения в устойчивом состоянии
Материалы и способы
Спектры 1H-ЯМР регистрировали при 400 МГц на приборе Bruker DRX-400 (ultra shield). Химические изменения в органических растворителях выражены в частицах на миллион (ppm) (δ) по отношению к тетраметилсилану. Использовали ДМФ, 1,4-диоксан, NMM, ацетат аммония, Boс2O, ТФУ, диметилсульфоксид, DCCI (Acros), гидроксиламин (50% веса в H2O), йодоуксусный ангидрид, GMBS (Sigma Aldrich), рЧ инсулин (Diosynth), ТЭА, 6-аминокапроновую кислоту, гидроксисукцинимид (Janssen), ТГФ (Biosolve), 2-меркапто-[S-ацетил]уксуснокислого N-гидроксисукцинимида сложный эфир (13), TBTU (Fluka), ACN (Merck), AcOH и Na2HPO4 (J.T. Baker) в том виде, как были получены от указанных коммерческих поставщиков.
Колоночную хроматографию проводили на кизельгеле 60 MP Biomedicals Germany GmbH (MP silica 32-63, 60 Е) и на Merck LiChroprep RP 18 (40-63 мкм). Анализ тонкослойной хроматографии (ТСХ) осуществляли на планшетах Merck TLC с кизельгелем 60 F254. Соединения визуализировали ультрафиолетовой (УФ) абсорбцией (254 нм) и/или карбонизацией с реактивом USUI (фосфорно-молибденовая кислота/AcOH/H2SO4 в EtOH).
Спектры MALDI получали на приборе Voyager DE PRO (Applied Biosystems, Framingham, MA, USA) в режиме замедленной линейной экстракции с запаздыванием с режимами определения положительных и отрицательных ионов. В качестве матрицы использовали рекристаллизованную альфа-цианогидроксикоричную кислоту (CHCA, 3 г/л в 500 мл/л ACN/1 мл/л ТФУ). Значения молекулярного веса измеряли с использованием двухточечной калибровки (например, определяя для рЧ инсулина и одной из цепочек его фрагмента или миоглобина отношение массы к заряду m/z 16953 и m/z 8477).
Спектры Q-TOF получали на приборе PE Sciex API Q-star Pulsar с режимом определения положительных ионов с источником ESI. Образцы растворяли в H2O и обессоливали при помощи обращенно-фазовой ZIP Tip®. По умолчанию аналитическую ВЭЖХ проводили с автоматической пипеткой Gilson 234 с тремя насосами Gilson (305) с градиентной системой, используя колонку Luna™ С18(2) (обращенная фаза, 150×4,6 мм, 5 мкм). Для обнаружения использовали УФ-детектор Gilson (118) при 210 нм. Градиентное элюирование осуществляли при температуре колонки 40єC и скорости потока 1 мл/в минуту, начиная с 95% элюента А (0,1% ТФУ в H2O/ACN, 9:1) и 5% элюента B (0,1% ТФУ в ACN) в течение 5 минут, после чего применяли линейный градиент от 15 до 50% ACN через 25 минут.
Аналитический анализ (ВЭЖХ) соединения 4 проводили на приборе Shimadzu SCL-10A vp (системный контроллер) с двухпоточной насосной градиентной системой, используя колонку Luna™ С18 (2) (обращенная фаза, 150×2,0 мм, 5 мкм). Для обнаружения использовали УФ-детектор с диодной матрицей Shimadzu (SPD-М10A vp) при 214 нм. Градиентное элюирование осуществляли при температуре колонки 40°C и скорости потока 0,4 мл/в минуту.
Анализ препаративной ВЭЖХ проводили на устройстве для обработки проб Waters 2769 с единственным насосом (Waters 600) с градиентной системой, используя колонку Luna™ С18(2) (обращенная фаза, 250×50 мм, 10 мкм). Для обнаружения использовали УФ-детектор Gilson (2996 с фотодиодной матрицей) при 210 нм. Градиентное элюирование осуществляли при скорости потока 50 мл/в минуту, начиная с 90% элюента А (0,1% ТФУ в H2O/ACN, 9:1) и 10% элюента B (0,1% ТФУ в ACN) в течение 10 минут, после чего применяли линейный градиент от 15 до 50% элюента B через 50 минут.
Аналитическую анионообменную хроматографию проводили на приборе Pharmacia Akta Explorer с градиентной системой насоса Pharmacia (P-900), используя колонку Pharmacia Biotech MonoQ HR 5/5. Для обнаружения использовали УФ-детектор Pharmacia (УФ 900) при 210 нм в комбинации с датчиком уровня pH Pharmacia и датчиком проводимости (pH/C 900). Детектор AD (AD900) использовали в комбинации с прибором Chiralyser (IBZ). Кроме того, использовали фракционный коллектор Pharmacia (Frac 950) и автоматическую пипетку Pharmacia (А900). Элюирование по умолчанию выполняли со скоростью потока 1 мл/в минуту, начиная с 74% элюента А (ACN/H2O 2:8) и 26% элюента B (ACN/2M NaCl 2:8) в течение 5 минут, после чего применяли градиент до 20% элюента A и 80% элюента B через 15 минут.
Анализ препаративной анионообменной хроматографии проводили на системе Pharmacia с насосом Pharmacia (P-50) и градиентной системой с градиентным смесителем Pharmacia (LKB GP-10), используя колонку Pharmacia Biotech XK16 Q-sepharose Fast-Flow. Для обнаружения использовали УФ-детектор Pharmacia (LKB-UV-MII) при 214 нм в комбинации с датчиком проводимости Biotechnics. Градиентное элюирование по умолчанию осуществляли при скорости потока 4,6 мл/в минуту, начиная с 80% элюента А (H2O) и 20% элюента B (2M NaCl в H2O) в течение 20 минут, после чего применяли градиент до 20% элюента A и 80% элюента B через 210 минут.
Препаративную гель-фильтрацию на Sephadex G25 (обессоливание) проводили на системе Pharmacia с насосом Watson-Marlow (101V) с использованием тонкой колонки Pharmacia Biotech XK26 Sephadex-G25. Для обнаружения использовали УФ-детектор Pharmacia (LKB-UV-MII) при 214 нм в комбинации с датчиком проводимости Biotechnics. Изократическое элюирование осуществляли с H2O при скорости потока H2O 1 мл/в минуту в течение 10 часов.
Аналитическую HP-SEC с соединением 6 осуществляли на колонке Pharmacia Superdex™ 30 HR 10/30, установленной в хроматографической системе HP1100. Элюирование проводили с натриево-фосфатным буфером в количестве 0,2 моль/л с уровнем pH 7,0 при скорости потока 0,4 мл/л.
Аналитическую HP-SEC с другими коньюгатами проводили на системе Akta Explorer, как описано для аналитической Q-сефарозной хроматографии с колонкой Pharmacia Superdex™ 75 HR 10/30. Изократическое элюирование проводили с 50 мМ ацетата аммония при скорости потока 1 мл/в минуту.
Препаративную HP-SEC осуществляли на той же системе Akta Explorer, как описано для аналитической Q-сефарозной хроматографии, с препаративно-эсклюзионной колонкой Pharmacia Superdex™ 75 XK26 Hiload 26/60. Изократическое элюирование проводили с 50 мМ ацетата аммония при скорости потока 1,32 мл/в минуту.
Используя технологию анализа BIA, изучали связывание пентасахаридных коньюгатов с ATIII, антиинсулиновым антителом и инсулиновым рецептором. Сенсограммы и точки данных анализировали по удалению из прозрачной проточной кюветы, используя оценку BIA 3,2. Значения IC50 вычисляли с использованием программы GraphPad Prism 3.0.
Измерения A280 проводили на спектрофотометре Nano Drop® ND-1000 UV-VIS.
Схема 1. Синтез соединения 4
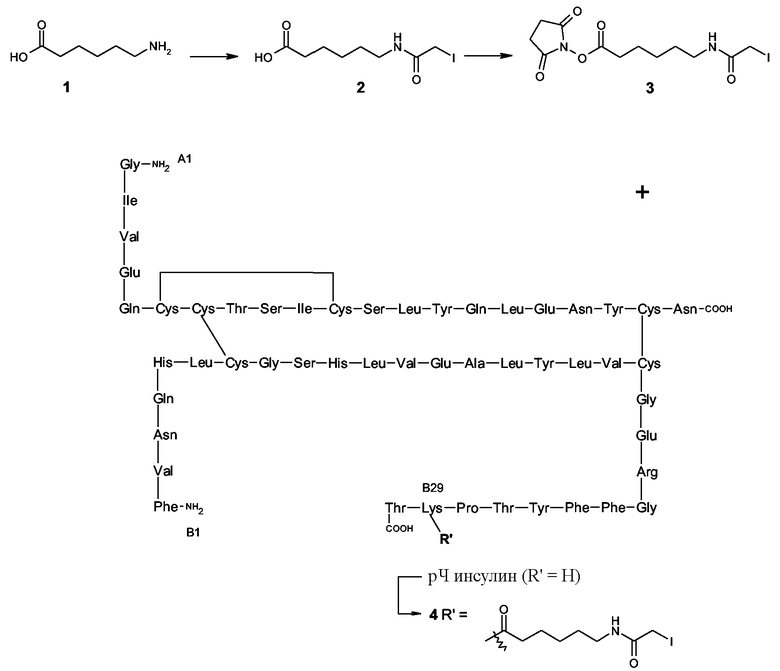
ПРИМЕР 1
6-(2-йодоацетиламино)гексаноевая кислота (2)
К суспензии 6-аминогексаноевой кислоты (1) (0,37 г, 2,8 ммоль) в 1,4-диоксане (60 мл) добавляли йодоуксусный ангидрид (0,50 г, 1,4 ммоль). Реакционную смесь перемешивали при 50°C в течение 3 часов и в течение 16 часов при температуре окружающей среды, после чего анализ ТСХ (CH2Cl2/MeOH/AcOH, в объемном соотношении (об./об./об.) 98/10/1) показывал полное превращение соединения 1 в менее липофильный продукт. Добавляли EtOAc (100 мл) и реакционную смесь промывали водным раствором 0,10 М HCl (50 мл). Затем органический слой дважды промывали солевым раствором (50 мл) и объединенные водные слои дважды экстрагировали EtOAc (75 мл). Объединенные органические слои высушивали (MgSO4) и выпаривали в вакууме. Остаток хроматографировали на силикагеле (CH2Cl2/MeOH/AcOH, об./об./об. 98/10/1,) для получения 6-(2-йодоацетиламино)гексаноевой кислоты (2) (0,45 г, >100%).
1H ЯМР (MeOD): δ 3,67 (с, 2H), 3,17 (т, 2H), 2,29 (т, 2H), 1,66-1,33 (м, 6H).
ПРИМЕР 2
Сложный эфир 6-(2-йодоацетиламино)гексаноевокислого 2,5-диоксопирролидин-1-ила (3)
К раствору 6-(2-йодоацетиламино)гексаноевой кислоты (2) (0,20 г, 0,67 ммоль) в ТГФ (10 мл) добавляли гидроксисукцинимид (85 мг, 0,74 ммоль) и N,N'-дициклогексилкарбодиимид (0,21 г, 1,0 ммоль). Реакционную смесь перемешивали в темноте в течение 16 часов. Когда анализ ТСХ (EtOAc/Hep/AcOH, об./об./об. 80/20/1) показывал полное превращение в активированный сложный эфир 3, добавляли семь капель уксусной кислоты. Затем смесь сохраняли в течение ночи в морозильнике (при -20°C). Неочищенную смесь фильтровали и фильтрат выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (EtOAc/Hep/AcOH, об./об./об. 40/60/5 → 20/80/5), и выпаривание подходящих фракций давало производное 3 сложного эфира N-гидроксисукцинимида (0,18 г, 67%). 1H ЯМР (MeOD): δ 3,67 (с, 2H), 3,18 (т, 2H), 2,82 (с, 4H), 2,63 (т, 2H), 2,0-1,0 (м, 6H).
ПРИМЕР 3
Соединение 4
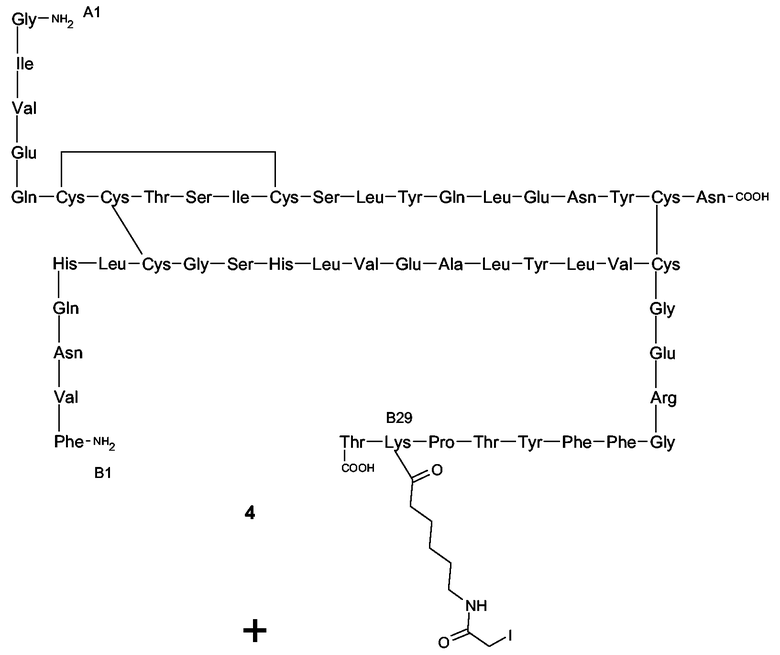
К суспензии рЧ инсулина (50 мг, 8,6 мкмоль) в ДМФ (15 мл) добавляли H2O (9,0 мл) до получения прозрачного раствора. Раствор перемешивали в течение 15 минут, чтобы довести его температуру до комнатной. Уровень рН раствора регулировали до 10, добавляя по капле 0,1 М NaOH в H2O. После этого реакционную колбу заворачивали в оловянную фольгу. Через 1 минуту к реакционной смеси по капле добавляли раствор 3 (5,0 мг, 8,6 мкмоль) в ДМФ (1,0 мл). Реакционную смесь перемешивали при использовании магнитного перемешивающего бруска и поддерживали уровень pH 10. Через 30 минут для подавления реакции добавляли избыток 0,1% ТФУ в H2O (5,0 мл). Добавляли H2O (200 мл) и реакционную смесь лиофилизировали для получения соединения 4 (60 мг, >100%, максимально 8,6 мкмоль). Анализом ВЭЖХ (Shimadzu, с обращенной фазой), начиная с 80% элюента А (0,1% ТФУ в H2O) и 20% элюента B (ACN) в течение 5 минут, после чего, применяя через 30 минут градиент до 20% элюента A и 80% элюента B, выявляли присутствие 45% монозамещенного продукта (Rt (время удержания) рЧ инсулина: 12,84 минут; Rt соединения 4: 13,54 минут; двузамещенный продукт B29/A1: Rt 14,16 минут). В следующей реакции использовали неочищенный продукт без очистки.
ПРИМЕР 4
Соединение 6
Неочищенное соединение 4 (60 мг) растворяли в дегазированном (посредством пропускания через N2) 0,05 М растворе NH2OH в 0,1 М Na2HPO4 буфере (25 мл, pH 7,0). Реакционную смесь перемешивали с использованием магнитного перемешивающего бруска и дегазировали в течение 30 минут (посредством пропускания через N2). Затем в виде твердого вещества добавляли пентасахаридно-спейсерное соединение 5 (95 мг, 43 мкмоль), которое изготовляли согласно описанию в Angew. Chem. Intl. Ed. (1996), 35, 331-333, и реакционную смесь перемешивали в атмосфере азота в течение 16 часов.
Схема 2. Синтез соединения 6.
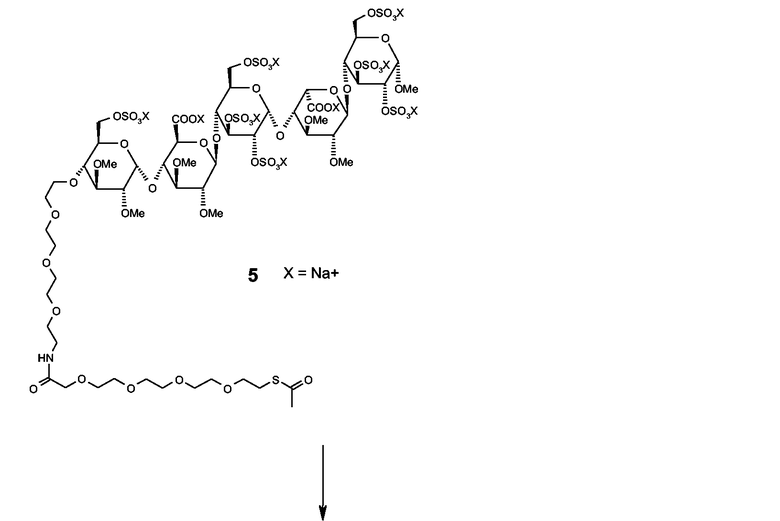
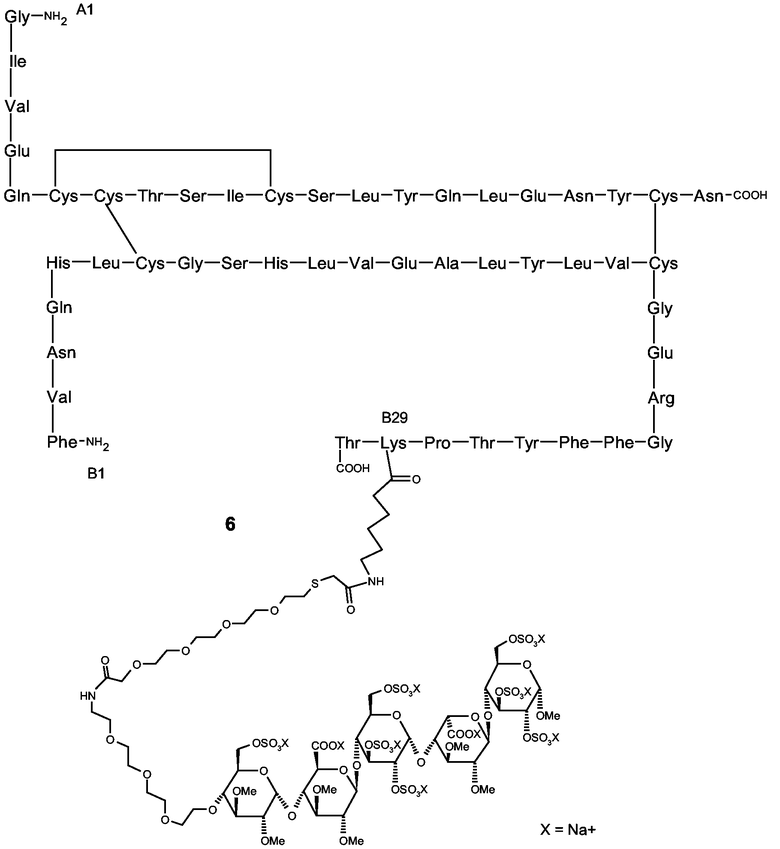
Очистка пентасахаридно-инсулинового коньюгата 6
Монозамещенный пентасахаридно-инсулиновый коньюгат 6 очищали из реакционной смеси по предыдущему пункту до почти гомогенного состояния путем анионообменной хроматографии (стадия захвата) и эксклюзионной хроматографии (стадия тонкой очистки).
Конъюгат-содержащий раствор вносили в колонку Q-Sepharose FF, уравновешивали 20 ммоль/л натриево-фосфатного буфера с уровнем рH 8,0. После прохождения оставшейся фракции белка через колонку осуществляли обильное промывание с уравновешивающим буфером, пока A280 не возвращалось к исходному уровню. Связанный, непрореагировавший инсулин элюировали примерно 0,4 моль/л NaCl и монозамещенным пентасахаридно-инсулиновым конъюгатом в 0,7 моль/л NaCl, что определяли посредством аналитической HP-SEC на Superdex 30 и посредством MS-MALDI-TOF. Фракцию конъюгата выпаривали или ультрафильтрацией, или анионообменной хроматографией, используя ударно 2 моль/л NaCl на стадии элюирования, и вносили в препаративную колонку Superdex 30, уравновешенную в фосфатно-буферном растворе. Соединяли фракции, содержащие чистый моноконъюгат, что определяли HP-SEC и MALDI-MS. Конечный продукт после мгновенного замораживания в смеси этанол/сухой лед сохраняли при -70°C. Оценку концентрации конъюгата проводили измерением A280, используя коэффициент поглощения 0,8 для 1 мг/мл.
Характеристика соединения 6
Идентичность очищенного пентасахаридно-инсулинового коньюгата 6 определяли анализом ELISA для инсулина и анализом биомолекулярных взаимодействий (BIA) с использованием в качестве веществ, определяемых при анализе, человеческого инсулинового рецептора и человеческого ATIII. Чистоту и мономерность оценивали посредством HP-SEC на Superdex 30 и посредством MALDI-MS.
Как показано на фиг.1, две порции пентасахаридно-инсулинового конъюгата 6 распознавались инсулин-специфическим ELISA, что указывало на присутствие иммунореактивной функциональной группы инсулина. На основании исследований BIA с Biacore можно прийти к заключению, что пентасахаридно-инсулиновый конъюгат тем не менее обладает способностью связываться с человеческим инсулиновым рецептором (фиг.2A). В этих исследованиях на сенсорном чипе CM5 иммобилизировали МоАb к человеческому инсулину (клон M3222213, 10-130, партия 223, Fitzgerald Industries International, обозначаемый МоAb 13), используя стандартное аминоприсоединение. В качестве выравнивающего буфера использовали HBS-EP (Biacore, cat. No. 22-0512-44) при скорости потока 5 мкл/мин. Инъекция инсулинового конъюгата приводила к связыванию конъюгата с иммобилизированным антителом. Иммуносвязанный инсулиновый конъюгат был способен реагировать с человеческим инсулиновым рецептором, а также с ATIII, и ATIII являлся индикатором для ковалентного присоединения пентасахарида (фиг.2B).
Спектры MALDI-TOF пентасахаридно-инсулинового конъюгата 6 получали согласно описанию в разделе «Материалы и способы». Перед анализами образцы обессоливали и выпаривали на приборе μC18-ZipTips (Корпорация Millipore, Billerica МА, США). Элюирование осуществляли непосредственно на мишень MALDI из нержавеющей стали в 1 мкл раствора, содержащего 10 г/л альфа-циано в 500 мл/л ACN/1 мл/л ТФУ. На фиг.3 показан характерный профиль MALDI-TOF MS монозамещенного пентасахаридно-инсулинового конъюгата с пиками около m/z 6700 и 7400. Очевидная гетерогенность вызвана лазер-индуцированным десульфатированием пентасахаридной функциональной группы, что приводит к последовательной потере 80 Да. Анализ MS MALDI-TOF не обнаружил какой-либо двузамещенный пентасахаридно-инсулиновый конъюгат, поскольку не были обнаружены никакие пики в диапазоне m/z 9400, характерном для двузамещенного инсулина. Нужно заметить, что также отсутствовали пики для непрореагировавшего инсулина, т (m/z 5808).
Анализ HP-SEC (фиг.4) показывал основной пик со временем удержания 22 минуты. Чистоту оценивали в 97%. (Выявлено, что непрореагировавший инсулин и двузамещенные конъюгаты отсутствуют).
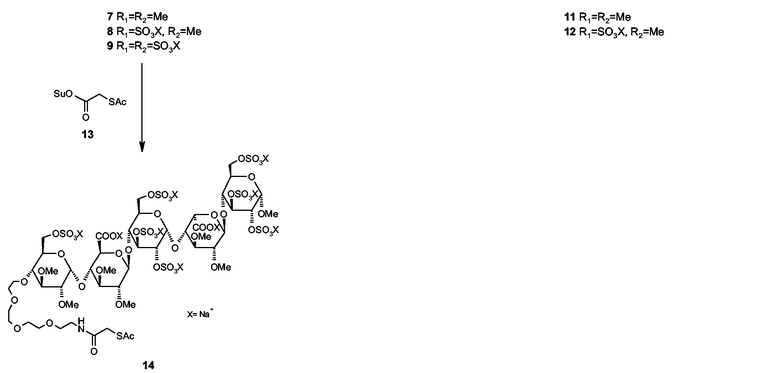
ПРИМЕР 5
Соединение 11
Пентасахарид 7 (46 мг) [который можно получать присоединением дериватизированного моносахарида 5, описанного в WO 2001/42262, к тетрасахариду, получаемому проведением синтеза до тетрасахарида 30, описанного в Bioorg. Med. Chem. (1994), 2, 1267-1280, в котором редуцирующий концевой моносахаридный структурный блок 12 замещен метил-2,3-ди-O-бензил-6-O-метил-α-D-глюкозой с использованием способов, подобных описанным в указанных публикациях, включающих в себя снятие защитных групп и сульфатирование] и гликолевое производное 10 (18 мг, 1,6 экв.) растворяли в ДМФ (5 мл) в атмосфере азота. Добавляли NMM (61 мкл, 5 экв.) и реакционную смесь перемешивали в течение ночи при температуре окружающей среды. Растворитель выпаривали в вакууме и оставшийся остаток очищали препаративной анионообменной хроматографией. Подходящие фракции соединяли и обессоливали на препаративной колонке G25. Объединенные фракции лиофилизировали для получения соединения 11 (29 мг, 57%) в виде белого порошка. Чистота составляла > 98% (аналитический анионный обмен, УФ210 нм).
1H-ЯМР (D2O, 400 МГц, HH-COSY): δ 5,31 (д, 1H), 5,23 (м, 1H), 4,91 (м, 1H), 4,45-4,35 (м, 1H), 4,48-3,93 (м, 11H), 3,87-3,62 (м, 9H), 3,60-3,45 (м, 39H), 3,41-3,34 (м, 15H), 3,33-3,23 (м, 7H), 3,18-3,08 (м, 2H), 2,97 (т, 2H), 2,23 (с, 3H).
ПРИМЕР 6
Соединение 12
Пентасахарид 8 (0,2 г), который изготовляли согласно описанию WO 2001/42262, и гликолевое производное 10 (53 мг, 1,3 экв.), изготовленное согласно описанию в Angew. Chem. Intl. Ed. (1996), 35, 331-333, растворяли в ДМФ (5,0 мл). Добавляли NMM (61 мкл, 5 экв.) и реакционную смесь перемешивали в течение ночи при температуре окружающей среды. Растворитель выпаривали в вакууме и остаток очищали препаративной анионообменной хроматографией. Подходящие фракции соединяли и обессоливали на препаративной колонке G25. Объединенные фракции лиофилизировали для получения соединения 12 (0,13 г, 55%) в виде белого порошка. Чистота составляла >95% (аналитический анионный обмен, УФ210 нм).
1H-ЯМР (D2O, 400 МГц, HH-COSY): δ 5,12 (д, 1H), 5,03 (д, 1H), 4,70 (д, 1H), 4,34-4,18 (м, 2H), 4,09-4,03 (м, 1H), 3,98-3,90 (м, 5H), 3,85-3,74 (м, 6H), 3,66-3,48 (м, 7H), 3,43-3,24 (м, 41H), 3,23-3,15 (м, 13H), 3,12 (м, 2H), 3,10-3,01 (м, 7H), 2,99-2,88 (м, 3H), 2,78 (т, 2H), 2,04 (с, 3H).
ПРИМЕР 7
Соединение 14
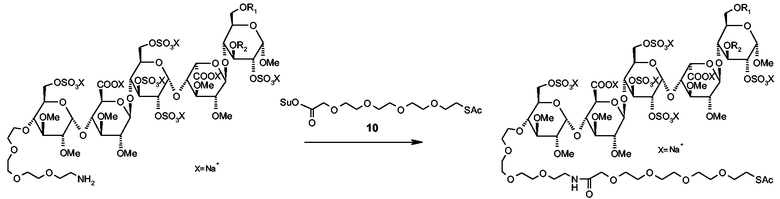
Пентасахарид 9 (100 мг) [который можно получать присоединением дериватизированного моносахарида 5, описанного в WO 01/42262, к тетрасахариду 48, описанному в 2004/0024197, используя подобные описанным в этих патентных заявках способы, включающие в себя снятие защитных групп и сульфатирование] и соединение 13 (18 мг, 1,5 экв.) растворяли в ДМФ. Добавляли NMM (15 мкл, 2,5 экв.) и реакционную смесь перемешивали в течение ночи при температуре окружающей среды. Растворитель выпаривали в вакууме и оставшийся остаток очищали на препаративной колонке G25. Подходящие фракции соединяли и лиофилизировали для получения соединения 14 (84 мг, 79%) в виде белого порошка. Чистота составляла >95% (аналитический анионный обмен, УФ210 нм).
1H-ЯМР (D2O, 400 МГц, HH-COSY): δ 5,12 (д, 1H), 5,09 (д, 1H), 4,82 (д, 1H), 4,40-4,26 (м, 1H), 4,10-3,87 (м, 8H), 3,82-3,73 (м, 4H), 3,67-3,43 (м, 11Н), 3,41-3,35 (м, 14H), 3,31-3,26 (м, 13H), 3,24-3,15 (м, 8H), 3,14-3,02 (м, 5H), 3,01-2,87 (м, 3H), 2,08 (с, 3H).
Схема 3. Синтез пентасахаридно-спейсерных производных 11, 12 и 14
ПРИМЕР 8
Соединение 15
Растворяли рЧ инсулин (779 мг) в безводном диметилсульфоксиде (25 мл) и AcOH (465 мкл). К раствору добавляли Boс2O (73 мг, 2,5 экв.) и получаемую смесь перемешивали в течение 5 часов при температуре окружающей среды. Реакцию гасили добавлением 0,1% ТФУ в H2O/ACN (об./об. 9/1, 150 мл) и раствор лиофилизировали четыре раза. Остаток растворяли в 0,1% ТФУ в H2O/ACN (9/1)/ACN (3:1) и основной продукт выделяли препаративной ВЭЖХ. Подходящие фракции соединяли и лиофилизировали для получения А1, В1-диBoc инсулина 15 (200 мг, 26%) в виде белого порошка. Чистота составляла 98% (аналитическая ВЭЖХ). Рассчитанная для C267H399N65O81S6 MS масса составляла 6008, выявленная MALDI-TOF составляла 6008 (с использованием в качестве внутреннего стандартного образца рЧ инсулина).
ПРИМЕР 9
Соединение 16
Растворяли рЧ инсулин (752 мг) в безводном диметилсульфоксиде (20 мл) и ТЭА (0,75 мл). К раствору добавляли Boс2O (66 мг, 2,5 экв.) в диметилсульфоксиде (5 мл) и реакционную смесь перемешивали при температуре окружающей среды в течение 1,5 часов. Реакцию гасили добавлением 0,1% ТФУ в H2O/ACN (об./об. 9/1, 150 мл) и смесь трижды лиофилизировали. Получаемый остаток растворяли в 0,1% ТФУ в H2O/ACN (9/1) и подвергали препаративной ВЭЖХ. Подходящие фракции соединяли и лиофилизировали для получения А1,B29-диBoc инсулина 16 в виде белого порошка (332 мг, 43%). Чистота составляла >98% (аналитическая ВЭЖХ). Рассчитанная для C267H399N65O81S6 MS = 6008, выявленная MALDI-TOF = 6008 (с использованием в качестве внутреннего стандартного образца рЧ инсулина).
ПРИМЕР 10
Соединение 17
Растворяли А1,В1-диBoc инсулин 15 (200 мг) в безводном диметилсульфоксиде (5 мл) и триэтиламине (145 мкл). Добавляли GMBS (45 мг, 5 экв.) и реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды. Реакционную смесь гасили добавлением 0,1% ТФУ в H2О/ACN (об./об. 9/1, 150 мл) и получаемую смесь лиофилизировали для получения A1,B1-диBoc-B29-GMB инсулина 17 (0,5 г, неочищенного), который использовали на следующей стадии без дополнительной очистки.
ПРИМЕР 11
Соединение 18
А1,B29-диBoc инсулин 16 (330 мг) растворяли в безводном диметилсульфоксиде (5 мл) и ТЭА (332 мкл). Добавляли GMBS (230 мг, 15 экв.) и реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды. Реакционную смесь гасили добавлением 0,1% ТФУ в H2О/ACN (9/1, об./об. 150 мл) и получаемый раствор лиофилизировали для получения А1,В29-диBoc-В1-GMB инсулина 18 (0,6 г, неочищенного), который использовали на следующей стадии без дополнительной очистки.
ПРИМЕР 12
Соединение 19
А1,B1-диBoc-B29-GMB инсулин 17 (0,5 г, неочищенный) растворяли в ТФУ (5 мл) и перемешивали в течение 10 минут при температуре окружающей среды. При пониженном давлении удаляли ТФУ, остаток растворяли в 0,1% ТФУ в H2О/ACN (2/1, об./об.) и раствор немедленно подвергали препаративной ВЭЖХ. Подходящие фракции соединяли и лиофилизировали для получения B29-GMB инсулина 19 в виде белого порошка (93 мг, 47%). Чистота составляла >99% (аналитическая ВЭЖХ).
ПРИМЕР 13
Соединение 20
А1,B29-диBoc-B1-GMB инсулин 18 (0,6 г, неочищенный) растворяли в ТФУ (5 мл) и смесь перемешивали в течение 10 минут при температуре окружающей среды. ТФУ выпаривали в вакууме, неочищенный продукт растворяли в 0,1% ТФУ в H2О/ACN (9/2, об./об.) и получаемый раствор немедленно подвергали препаративной ВЭЖХ. Подходящие фракции соединяли и лиофилизировали для получения В1-GMB инсулина 20 в виде белого порошка (127 мг, 40%). Чистота составляла >99% по аналитической ВЭЖХ). Рассчитанная для C267H399N65O81S6 MS = 5973, выявленная MALDI-TOF = 5973 (с использованием в качестве внутреннего стандартного образца рЧ инсулина).
ПРИМЕРЫ 14-19
Общая методика для конъюгирования GMB-инсулина с пентасахаридом
GMB-инсулин 19 или 20 (25 мг) растворяли в 0,1 М буфере Na2HPO4 (12 мл, pH 7,0, дегазированном посредством прохождения N2 через раствор). Раствор перемешивали с использованием магнитного перемешивающего бруска и дегазировали в течение дополнительных 30 минут. Затем добавляли пентасахарид 5, 11, 12 или 14 (23 мг, 2,5 экв.) в виде твердого вещества, с последующим добавлением NH2OH (50 мкл, 0,05 M). Реакционную смесь перемешивали в атмосфере азота при температуре окружающей среды. Через 16 часов реакционную смесь подвергали препаративной HP-SEC (S75). Подходящие фракции соединяли и лиофилизировали для получения коньюгатов инсулина-пента 24, 25, 26, 27, 28, 29 в виде белого порошка с обычным выходом от 30% до 50%. Выход определяли измерениями A280, используя тот же коэффициент молярной экстинкции, что и для рЧ инсулина.
ПРИМЕР 14
Соединение 24
Инсулин B29-GMB 19 (25 мг) конъюгировали к пентасахариду 5 (23 мг) согласно общепринятой методике получения B29-пентасахаридного производного инсулина 24 (15 мг, 45%). Рассчитанная для C320H487N67O137S14 ESI-MS = 7913, выявленная Q-TOF = 2638,7 M3+; 1979,2 M4+; 1583,6 M5+, 1319,8 M6+. Чистота составляла >98% (аналитическая HP-SEC, аналитический анионный обмен).
ПРИМЕР 15
Соединение 25
В1-GMB инсулин 20 (25 мг) конъюгировали к пентасахариду 5 (23 мг) согласно общепринятой процедуре для получения В1-пентасахаридного производного инсулина 25 (16 мг, 47%). Рассчитанная для C320H487N67O137S14 ESI-MS = 7913, выявленная Q-TOF = 2637 M3+; 1978 M4+; 1583 M5+. Чистота составляла >95% (аналитическая HP-SEC), >98% (аналитический анионный обмен).
ПРИМЕР 16
Соединение 26
Инсулин B29-GMB 19 (13 мг) конъюгировали к пентасахариду 14 (12 мг) согласно общепринятой процедуре для получения B29-пентасахаридного производного инсулина 26 (5 мг, 31%). Рассчитанная для C312H471N67O133S14 ESI-MS = 7737, выявленная Q-TOF = 2578 M3+; 1934 M4+. Чистота составляла >98% (аналитическая HP-SEC).
ПРИМЕР 17
Соединение 27
В1-GMB инсулин 20 (15 мг) конъюгировали к пентасахариду 14 (13 мг) согласно общепринятой процедуре для получения В1-пентасахаридного производного инсулина 27 (8 мг, 40%). Рассчитанная для ESI-MS C312H471N67O133S14 = 7737, выявленная Q-TOF 2578 M3+; 1934 M4+. Чистота составляла >98% (аналитическая HP-SEC).
ПРИМЕР 18
Соединение 28
Инсулин B29-GMB 19 (15 мг) конъюгировали к пентасахариду 12 (13 мг) согласно общепринятой процедуре для получения B29-пентасахаридного производного инсулина 28 (6 мг, 30%). Рассчитанная для C321H489N67O134S13 ESI-MS = 7847, выявленная по Q-TOF = 1962 M4+; 1570 M5+; 1308 M6+. Чистота по HP-SEC составляла >98%.
ПРИМЕР 19
Соединение 29
B29-GMB инсулин 19 (15 мг) конъюгировали к пентасахариду 11 (13 мг) согласно общепринятой процедуре для получения B29-пентасахаридного производного инсулина 29 (7 мг, 33%). Рассчитанная для C322H491N67O131S12 ESI-MS = 7782, выявленная Q-TOF = 2593 M3+; 1945 M4+; 1556 M5+. Чистота составляла >98% (аналитическая HP-SEC).
Схема 4. Синтез инсулин-пентасахаридных коньюгатов 24-29
Параметры
Аналитическая эксклюзионная хроматография
Соединения 24-29 подвергали аналитическому анализу HP-SEC на колонке Superdex 75 26/10. Проводили элюирование 50 мМ ацетатом аммония при скорости потока 1,0 мл/мин.
Все коньюгаты наблюдали в виде единственных пиков (чистота составляла по меньшей мере >95%), что показывало отсутствие аггрегированных форм инсулина-пентасахарида.
N-концевое секвенирование
Инсулин-пентасахаридные коньюгаты 24-29, а также соответствующие предшественники 15, 16, 19 и 20 подвергали N-концевому секвенированию (расщепление по Эдману). В каждом из проведенных циклов B29 замещенные производные инсулина 15, 19, 24, 26, 28 и 29 приводили к получению эквимолярного количества как А-, так и B-цепочечных аминокислот до уровня, сопоставимого с уровнем исходного количества конъюгатов. Это указывает на полную доступность обоих N-концов, и таким образом, на отсутствие конъюгированных функциональных групп, которые, следовательно, ограничены положением B29. Напротив, в ходе N-концевого секвенирования В1-замещенных производных инсулина 16, 20, 25 и 27 были обнаружены только А-цепочечные аминокислоты, что демонстрирует конъюгирование в В1-положении как с последующим ингибированием расщепления по Эдману на N-конце B-цепочки.
Исследование конкурентного связывания чАТIII с использованием анализа биомолекулярных взаимодействий
Принцип и цель теста: Анализ биомолекулярных взаимодействий (BIA) изучает взаимодействие между (био)молекулами посредством ковалентной иммобилизации одного из взаимодействующих членов на поверхности сенсорного чипа, и введение другого взаимодействующего члена при постоянном омывании буфером этой поверхности. Связывание отмечают, как изменение показателя преломления на этой поверхности, и оно является пропорциональным молекулярному весу (мол.вес) взаимодействующих членов.
Для изучения взаимодействия между чАТIII и пентасахаридным коньюгатом соединение 9 соединяли ковалентной связью с поверхность сенсорного чипа. Связывание чАТIII с пентасахаридом создавало сильный сигнал, являвшийся результатом различия мол.веса между связываемым (маленьким) пентасахаридным лигандом и (большим) чАТIII, выявляемым при анализе. На поверхность вводили предварительно инкубированные образцы, содержащие чАТIII в постоянной концентрации, и свободный пентасахарид или конъюгат в переменных концентрациях. Связывание пентасахарида или конъюгата к ATIII во время предварительной инкубации будет приводить к уменьшению связывания ATIII с иммобилизированным пентасахаридом. Этот анализ конкурентного связывания позволяет определить значения IC50 для каждого пентасахаридного конъюгата.
Методика эксперимента: Соединение 9 соединяли ковалентной связью с сенсорным чипом CM5 аминоприсоединением при pH 8,5. Сенсорный чип активировали EDC/NHS в течение 15 минут и после этого вводили соединение 9 в концентрации 100 мкг/мл. Непрореагировавшие группы гидроксисукцинимида реагировали с этаноламином в течение 7 минут. Поверхность восстанавливали тремя кратковременными инъекциями 5 мкл 5 моль/л NaCl, при скорости потока 25 мкл/мин. Было невозможно выявить иммобилизацию пентасахарида, вместе с тем, было обнаружено, что связывание чАТIII на поверхности, обработанной согласно описанию, является специфическим, что показывало присутствие пентасахарида на поверхности.
Для оценки концентрации, чувствительной для ингибирования, тестировали серии концентраций чАТIII (при 80% максимального связывания). При скорости потока 20 мкл/мин последовательно осуществляли трехминутные инъекции как на чистую, так и на иммобилизированную поверхность при 25°C. Устанавливали точки данных на 170 сек. Поверхность восстанавливали 12 инъекцией 5 моль/л NaCl.
Образцы тестировали против постоянной концентрации чАТIII (то есть 15 нмоль/л) и концентраций пентасахаридного конъюгата в диапазоне от 0,78 до 100 нм. Введение чАТIII или точку данных без пентасахаридного конъюгата устанавливали при 100% связывании. Использовали % относительного связывания пентасахаридов и коньюгатов по сравнению с максимальным связыванием для построения сигмоидальной кривой (с переменным наклоном) путем построения логарифмической зависимости [концентрации] от % связывания, из которого были получены значения IC50.
Вывод - различие значений IC50 между рассматриваемыми пентасахаридными носителями 7-9 (фиг.5, таблица 2) подтверждает, что их конкурентный связывающий потенциал к ATIII, являющийся мерой связывающей аффинности к ATIII, можно регулировать изменением числа сульфатных групп, содержащихся в этих молекулах. (Конкурентный) связывающий с чАТIII потенциал (IC50) всех соответствующих инсулин-пентасахаридных коньюгатов (24-29) находится в том же диапазоне, если его сравнивать с исходными рассматриваемыми пентасахаридами 7-9 (фиг.6, таблица 2). Эти данные указывают, что можно регулировать фармакокинетические свойства конъюгатов использованием альтернативного пентасахаридного носителя с другой связывающей аффинностью к ATIII.
Масс-спектрометрия
Обычный масс-спектрометрический анализ пентасахаридного конъюгата изображен в фиг.7. Например, соединение 24 с брутто-формулой C320H487N67O137S14 и расчетной моноизотопной массой 7913, анализировали с системой ESI-QTOF. В спектре ESI-MS встречались множество заряженных ионов с соотношениями m/z 1319,8 (6+), 1583,6 (5+), 1979,2 (4+), 2638,7 (3+) указанных в соответствии с распределением заряда в рЧ инсулине. Кроме того, распределение изотопов случайно выбранных пиков групповых зарядов (например, 5+) для C320H487N67O137S14 (соединение 24) соответствует теоретически рассчитанным в программе Isopro распределением изотопов (см. фиг.7A, показано пунктиром).
Общепринятая методика конъюгирования антагонистических декапептидов ГнРГ с пентасахаридом (ПРИМЕРЫ 20, 21, 24, 25)
Производные ганиреликса 30 или 35 (70 мг) растворяли в ДМФ (20 мл) в атмосфере азота. Добавляли TBTU (14 мг, 1,05 экв.) и NMM (25 мкл, 5 экв.) и смесь перемешивали в течение 1 часа при температуре окружающей среды. Пентасахариды 8 или 9 (88 мг, 1,1 экв.) растворяли в ДМФ (10 мл) для получения суспензии. Эту суспензию добавляли к реакционной смеси и оставшуюся смесь перемешивали в течение 16 часов при температуре окружающей среды. Реакционную смесь растворяли водой (200 мл) и лиофилизировали. Получающийся остаток очищали на силикагеле с обращенной фазой (C18) с 0,01 М ацетата аммония (pH 7) и градиентом от 10 до 50% ACN в блок-элюировании. Подходящие фракции соединяли и лиофилизировали для получения ганиреликс - пентасахаридного конъюгата 31, 32, 36 или 37 в виде белого порошка. Проводили аналитическую ВЭЖХ с градиентным элюированием, начиная с 90% элюента А (0,01 M ацетат аммония) и 10% элюента B (ACN) в течение 5 минут, после чего через 30 минут применяли градиент до 100% элюента B.
ПРИМЕР 20
Соединение 31
Производное ганиреликса 30 (70 мг), изготовленное твердофазным синтезом белка, согласно описанию в J. Med. Chem. 1992, 35, 3942-3948, конъюгировали к пентасахариду 8 (88 мг) согласно общепринятой процедуре для получения соединения 31 (16 мг, 40%). Чистота составляла 96% (аналитическая ВЭЖХ), 97% (аналитический анионный обмен). Рассчитанная для C126H191ClN18O62S6 ESI-MS = 3175,0359, выявленная = 792,7390 [М-4Н]4-, 10573258 [М-3Н]3-, 1062,9883 [М+NН3-3Н]3-.
1H-ЯМР (D2O, 400 МГц, HH-COSY): δ 8,56 (м, 1H), 8,53 (м, 1H), 8,10 (м, 1H), 7,76 (м, 2H), 7,68 (м, 2H), 7,47 (м, 1H), 7,39 (м, 2H), 7,16 (м, 3H), 7,04 (м, 2H), 6,95 (м, 2H), 6,63 (м, 2H), 5,35-5,25 (м, 2H), 4,95 (м, 1H), 4,68-4,61 (м, 1H), 4,61-4,51 (м, 2H), 4,50-4,38 (м, 2H), 4,38-4,25 (м, 3H), 4,24-3,96 (м, 15H), 3,90-3,84 (м, 1H), 3,84-3,67 (м, 8H), 3,67-3,20 (м, 53H), 3,19-3,09 (м, 4H), 3,09-2,98 (м, 12H), 2,98-2,84 (м, 8H), 2,77 (м, 2H), 2,13 (м, 1H), 1,96-1,72 (м, 5H), 1,68-1,42 (м, 5H), 1,42-1,20 (м, 7H), 1,18-0,89 (м, 13H), 0,85-0,71 (м, 5H).
ПРИМЕР 21
Соединение 32
Производное ганиреликса 30 (70 мг) конъюгировали к пентасахариду 9 (88 мг) согласно общепринятой процедуре, для получения соединения 32 (52 мг, 35%). Рассчитанная масса C125H189ClN18O65S7 = 3240,9770; выявленная ESI-QTOF = 809,2219 [М-4H]4-, 1079,2994 [М-3H]3-, 1084,9739 [М+NH3]3-, 1090,6340, [М+2NH3-3H]3-.
1H-ЯМР (D2O, 400 МГц, HH-COSY): δ 8,45 (м, 1H), 8,38 (м, 1H), 7,90 (м, 1H), 7,78 (д, 1H), 7,73 (м, 2H), 7,59 (м, 1H), 7,50 (м, 1H), 7,43 (м, 2H), 7,20 (м, 3H), 7,05 (д, 2H), 6,97 (м, 2H), 6,66 (м, 2H), 5,40-5,30 (м, 2H), 5,09 (д, 1H), 4,67-4,48 (м, 2H), 4,40-3,92 (м, 18H), 3,92-3,75 (м, 7H), 3,77-3,17 (м, 56H), 3,12-3,02 (м, 11H), 3,02-2,98 (м, 8H), 2,97-2,83 (м, 4H), 2,81-2,75 (м, 2H), 2,14 (м, 1H), 1,99-1,86 (м, 5H), 1,82-1,23 (м, 12H), 1,22-0,90 (м, 13H), 0,87-0,72 (м, 5H). Чистота: 95% (аналитическая ВЭЖХ), 97% (аналитический анионный обмен).
ПРИМЕР 22
Соединение 34
Соединение 30 (100 мг) растворяли в ДМФ. Добавляли TBTU (36 мг, 2 экв.) и NMM (60 мкл, 10 экв.) и реакционную смесь перемешивали в течение 1 часа при температуре окружающей среды. Затем добавляли соединение 33 (34 мг, 2 экв.), которое изготовляли согласно описанию WO 2005090382, и реакционную смесь перемешивали в течение 16 часов при температуре окружающей среды. Растворитель удаляли в вакууме, оставшийся остаток растворяли в воде/ACN и получаемый раствор подвергали препаративной ВЭЖХ (градиент: 80% элюента А (0,1% ТФУ в H2O) и 20% элюента B (ACN) до 20% элюента A и 80% элюента B через 45 минут). Подходящие фракции соединяли, чтобы после лиофилизации получить соединение 34 (60 мг, 60%) в виде белого порошка. Осуществляли аналитическую ВЭЖХ, применяя градиент, начиная с 75% элюента А (0,1% ТФУ в H2O) и 25% элюента B (CH3CN) до 20% элюента A и 80% элюента B через 15 минут. Рассчитанная масса C94H139ClN18O19 = 1859, выявленная MALDI-TOF = 1860 [M+H]+ и 1882 [M+Na]+. Чистота составляла: >90% (аналитическая ВЭЖХ).
ПРИМЕР 23
Соединение 35
Соединение 34 (60 мг) растворяли в H2О/ТФУ/ACN (7 мл, 5:1:1) и перемешивали в течение 2 часов при температуре окружающей среды. Добавляли дополнительное количество ТФУ (2,5 мл) и реакционную смесь перемешивали в течение еще 22 часов. Выпаривали ТФУ в вакууме и лиофилизировали оставшийся раствор для получения соединения 35 (45 мг, 77%) в виде белого порошка. Рассчитанная масса для C90H131ClN18O19 = 1803, выявленная MALDI-TOF 1804 [M+H]+ и 1826 [M+Na]+. Чистота составляла >95% (аналитическая ВЭЖХ).
ПРИМЕР 24
Соединение 36
Производное ганиреликса 35 (17 мг) конъюгировали к пентасахариду 8 (19 мг) согласно общепринятой процедуре. Дополнительную очистку осуществляли препаративной ВЭЖХ (градиент: 90% элюента А (0,01 М ацетат аммония) и 10% элюента B (CH3CN) в течение 5 минут, после чего доводили до 100% B через 50 минут). Подходящие фракции соединяли и лиофилизировали для получения соединения 36 (2 мг, 6%). Чистота составляла: 94% (аналитическая ВЭЖХ), >98% (аналитический анионный обмен).
ПРИМЕР 25
Соединение 37
Производное ганиреликса 35 (17 мг) конъюгировали с пентасахаридом 9 (19 мг) согласно общепринятой процедуре. Дополнительную очистку осуществляли препаративной ВЭЖХ, согласно описанию для соединения 36. Подходящие фракции соединяли и лиофилизировали для получения соединения 37 (1,16 мг, 3%). Чистота составляла: 88% (аналитическая ВЭЖХ). Аналитическая анионообменная чистота: >95%.
Схема 5. Синтез соединений 31, 32, 36 и 37.

Вывод: различия конкурентного связывающего потенциала к ATIII между конъюгатами 31 и 32 с одной стороны и конъюгатами 36 и 37 с другой стороны (как изображено на фиг.8) показывают, что независимо от длины сшивающего остатка можно регулировать аффинность к ATIII изменением числа сульфатных групп, содержащихся в этих молекулах. Эти данные дополнительно указывают, что фармакокинетические свойства этих конъюгатов in vivo можно регулировать выбором пентасахарида (см. ниже фармакокинетические исследования). Кроме того, связывание конъюгатов к ATIII является специфическим, поскольку неконъюгированный исходный пептид ганиреликс не проявляет конкурентного связывания с ATIII.
ПРИМЕР 24
Соединение 39
Соединение 38 (26,5 мг, 8,4 мкмоль), поставляемое NeoMPS (Страсбург, Франция), растворяли в 0,1 М дегазированном буфере Na2HPO4/NaH2PO4 (16 мл, pH 7,0). Пентасахарид 5 (45,5 мг, 21 мкмоль, 2,5 экв.) добавляли в атмосфере азота и получаемую смесь перемешивали примерно в течение 10 минут. Затем добавляли водный раствор NH2OH (50% веса, 69 мкл) и реакционную смесь перемешивали в течение 16 часов. Продукт очищали на колонке Q-Sepharose (2M NaCl(водн.)/H2O/ACN, об./об./об. 10/40/1→40/10/1). Осуществляли обессоливание соответствующих фракций, используя G25 сефадексную хроматографию, согласно вышеприведенному описанию для получения соединения 39 (15,7 мг, 35%). Выход определяли измерением A280, используя теоретическое спектральное поглощение 0,48 для раствора на 1 мг/мл. Рассчитанная масса для C196H309N41O101S8 = 5108,8; выявленная ESI-Q-TOF = 1740,6 [M+5Na]3+, 1311,2 [M-lH+6Na]4+, 1053,5 [M-2H+7Na]5+.
Схема 6. Синтез соединения 39
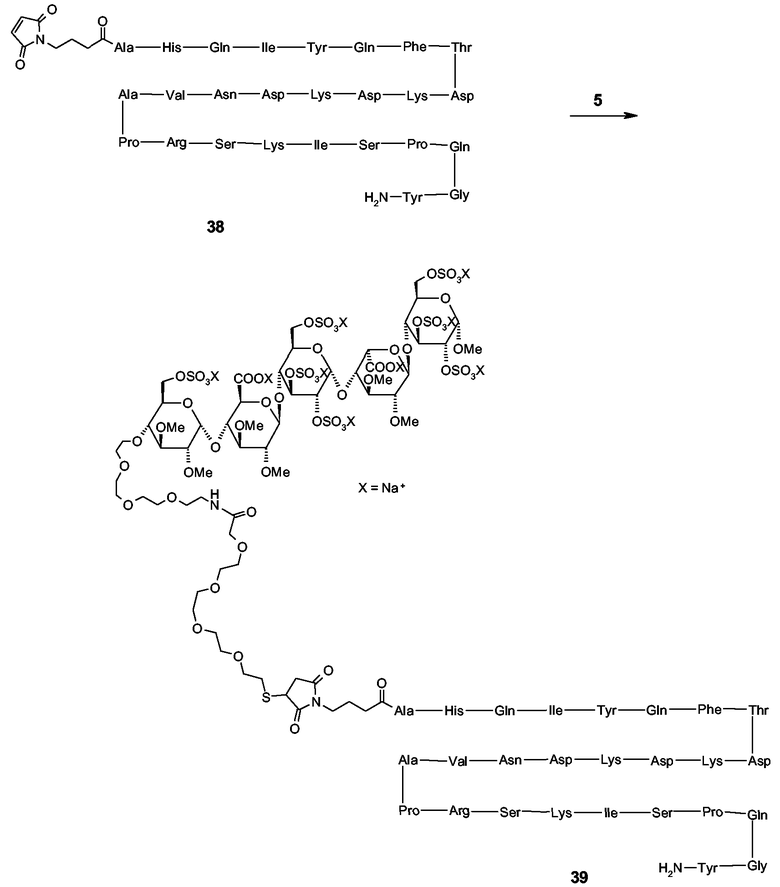
Вывод: Как изображено на фиг.9, конкурентный связывающий потенциал к ATIII конъюгата 39 сохранялся по сравнению с исходным пентасахаридно-спейсерным остатком (см. фиг.5, соединение 9). Эти данные предполагают, что значительное увеличение периода полувыведения пептида in vivo можно достигнуть конъюгированием к ATIII связывающего пентасахаридного носителя (см. фармакокинетические исследования ниже). Кроме того, связывание конъюгата к ATIII является специфическим, поскольку неконъюгированный исходный пептид АДМ(27-52) не показывает какого-либо значительного конкурентного связывания с ATIII.
ПРИМЕР 25
Соединение 41
Соединение 40 (15 мг, 4,2 мкмоль), изготовляемое NeoMPS (Страсбург, Франция), растворяли в 0,1 М дегазированном буфере Na2HPO4/NaH2PO4 (8 мл, pH 7,0). В атмосфере азота добавляли пентасахарид 5 (22,7 мг, 10,4 мкмоль, 2,5 экв.) и смесь перемешивали примерно в течение 10 минут. Затем добавляли водный раствор NH2OH (50% веса, 0,14 мл) и реакционную смесь перемешивали в течение 16 часов. Продукт очищали согласно описанию для соединения 39 для получения соединения 41 (1,38 мг, 6%). Выход определяли измерением A280, используя теоретическое спектральное поглощение 1,22 для 1 мг/мл раствора. Рассчитанная масса для C218H342N44O106S8 = 5528; выявленная ESI Q-TOF = 1843,7 [M+3H]3+, 1383,0 [M+4H]4+, 1107 M+5H]5+.
Вывод: конкурентный связывающий потенциал к ATIII конъюгата 41 сохранялся по сравнению с исходным пентасахаридно-спейсерным остатком соединения 9 (см. фиг.10). Эти данные предполагают, что значительное увеличение периода полувыведения пептида in vivo можно достигнуть конъюгированием к ATIII связывающего пентасахаридного носителя (см. фармакокинетические исследования ниже).
Схема 7. Синтез соединения 41
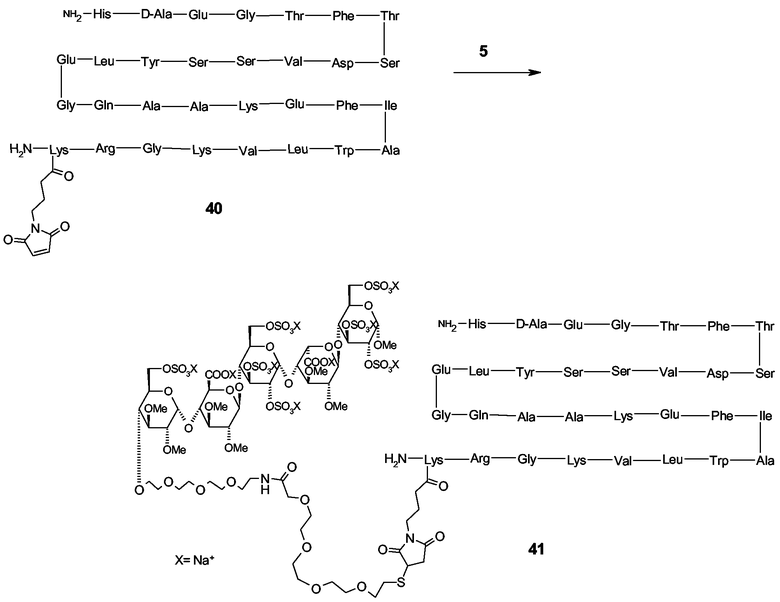
ПРИМЕР 26
Соединение 44
Октреотид (соединение 42, 50 мг, 0,04 ммоль), который можно получить от коммерческих поставщиков, таких как Bachem (Weil am Rhein, Германия), растворяли в диметилсульфоксиде (5 мл). Добавляли AcOH (7 мкл) для получения слегка кислого раствора. После этого добавляли GMBS (11,2 мг, 0,04 ммоль, 1,0 экв.) и полученный раствор перемешивали в атмосфере азота в течение 1 часа. Анализ MS-LC показывал почти полное превращение в GMB октреотида 43, в который вводили функциональную группу GMB в N-концевой остаток Phe в высоко региоселективном режиме. Реакцию охлаждали примерно до 5°C, после чего добавляли раствор NaH2PO4/Na2HPO4 (20 мл, pH 7,0). Через 10 минут смеси давали возможность дойти до КТ, и через раствор пропускали N2 в течение 10 минут. Затем в атмосфере азота добавляли пентасахарид 5 (21,8 мг, 0,01 ммоль, 0,25 экв.) в виде твердого вещества, с последующим добавлением водного раствора NH2OH (0,11 мл, 50% веса), и реакционную смесь перемешивали в течение 16 часов. Продукт очищали ионнообменной хроматографией, как описано выше для получения соединения 44 (6,3 мг, 19%). Рассчитанная масса для C112H170N12O70S10 = 3122,7; выявленная ESI-Q-TOF = 1562,3 [M+2H]2+, 1041,9 [M+3H]3+. 1H-ЯМР (D2O, 400 MГц, HH-COSY): δ 7,52-7,29 (м, 10H), 7,26-7,14 (м, 4H), 7,03 (с, 1H), 5,44 (м, 1H), 5,37 (м, 1H), 5,14 (м, 1H), 5,12-4,89 (м, 2H), 4,77-4,60 (м, 3H), 4,45-3,97 (м, 18H), 3,95-3,76 (м, 13H), 3,75-3,35 (м, 57H), 3,33-2,59 (м, 18H), 2,22-1,16 (м, 2H), 1,85-1,76 (м, 3H), 1,71-1,38 (м, 3H), 1,32-1,15 (м, 7H), 0,81-0,61 (м, 2H).
Схема 8. Синтез соединения 44.
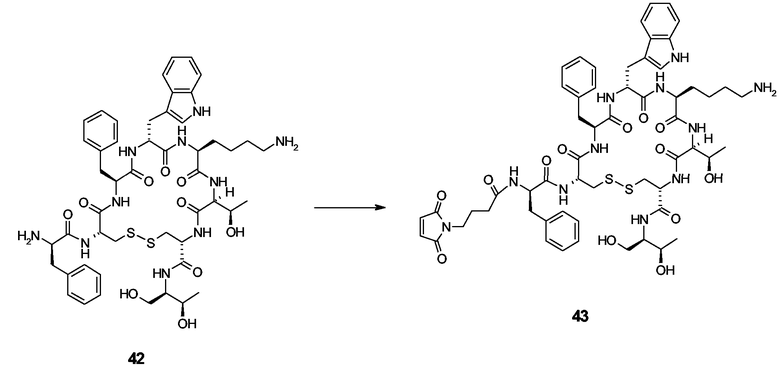
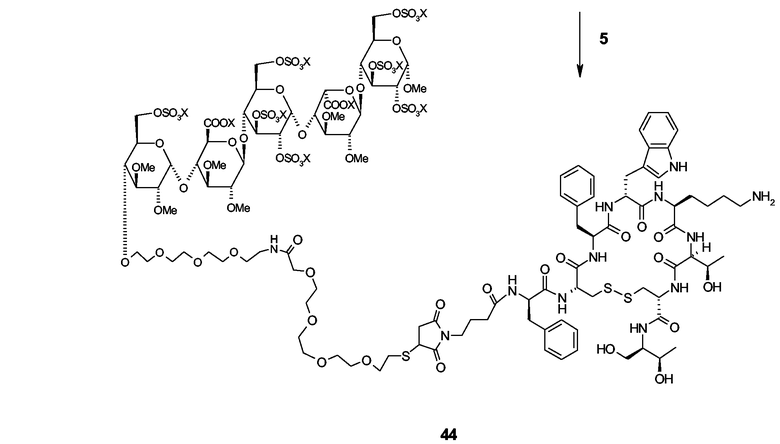
Вывод: конкурентный связывающий потенциал к ATIII конъюгата 44 сохранялся по сравнению с исходным пентасахаридно-спейсерным остатком соединения 9 (см. фиг.11). Эти данные являются показателем значительного увеличения периода полувыведения пептида in vivo путем конъюгирования к ATIII связывающего пентасахаридного носителя.
ПРИМЕР 27
Соединение 46
Пентасахарид 9 (100 мг) и GMBS (22 мг, 1,5 экв.) растворяли в ДМФ (10 мл). Добавляли DIPEA (18 мкл, 2 экв.) и реакционную смесь перемешивали в течение ночи при температуре окружающей среды. Растворитель выпаривали в вакууме, и остаток очищали на препаративной колонке G25. Объединенные фракции лиофилизировали для получения соединения 46 (50 мг, 46%) в виде белого порошка. Рассчитанная для C53H77N2O55S7Na9 ESI-MS масса = 2052; выявленная ESI-Q-TOF = 1027 M2+.
ПРИМЕР 28
Соединение 47
Пентасахаридно-малеимидное производное 46 конъюгировали к свободному Cys125 нативного рЧ-ИЛ2 (R&D systems, 202-IL/CF). Перед конъюгированием рЧ-ИЛ-2 анализировали с помощью анализов HP-SEC, SDS-PAGE и MS MALDI-TOF, которые указывали на преобладание мономерной композиции. Обрабатывали рЧ-ИЛ2 (1 мг, 800 мкл, 1,26 мг/мл в ФБР, содержащей 0,5% додецилсульфат натрия (SDS)) в течение ночи при КТ на качалке с избытком соединения 46 (59 мкл 10 мг/мл водного раствора, 5 экв.) для достижения полного превращения исходного материала. Затем непрореагировавший малеимид 46 блокировали 5-кратным молярным избытком цистеамина (16 мкл, 10 мг/мл) в течение 3 часов. Проводили диализ реакционной смеси (отрезки 6-8 кДа) против 0,5% SDS в ФБР для удаления избытка цистеамина и соединения 46, и конечное количество продукта, определяемое A280, составляло 0,69 мг.
Параметры конечного коньюгата 47 определяли SDS-PAGE (4-12%) и Вестерн-блоттингом (см. фиг.12). По полосам 3 и 4 делали вывод, что соединение 47 имеет более высокий мол.вес относительно рЧ-ИЛ2 (что соответствует присутствию пентасахаридной функциональной группы). Анализ Вестерн-блоттинг с последующим инкубированием в a) 10 мкг/мл чАТIII (HAT 950A2L - Kordia); b) a-чАТIII (МоАb чАТIII 200 - Kordia); c) GAM-HRP (W402B 20373201 - Promega) и конечное обнаружение с реактивом DAB отчетливо показывали специфическое ATIII связывание с содержащим пентасахарид ИЛ2 (полоса 7 по сравнению с 8).
Схема 9. Синтез конъюгата 47
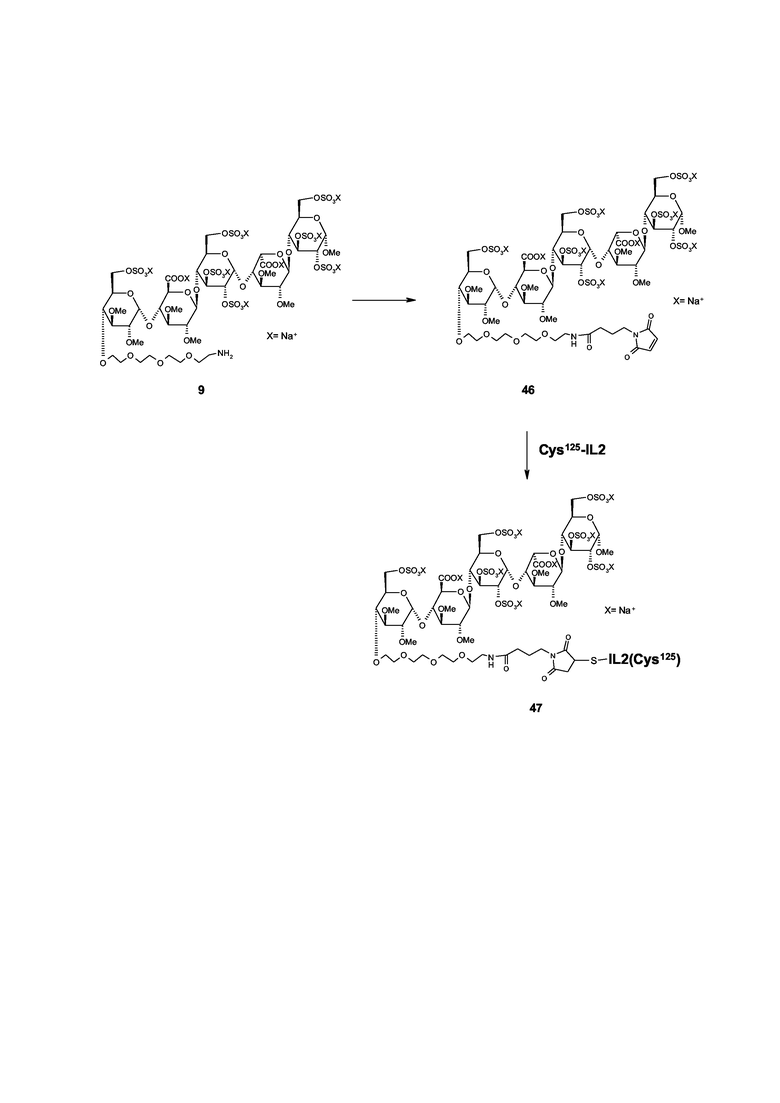
Фармакология
Определение фармакокинетики конъюгированных (поли)пептидов
Определение фармакокинетических свойств типичных примеров соединений настоящего изобретения проводили согласно описанию в следующих параграфах.
Анализ ELISA человеческого инсулина для определения инсулина в плазме крысы
Для измерения уровня человеческого инсулина в плазме человека и крысы или в буферной системе был разработан твердофазный иммуноферментный анализ для человека (ELISA). Таким образом, можно использовать ELISA для определения концентрации инсулина в образцах плазмы, полученных в фармакокинетических экспериментах.
Тест основан на иммунохимическом принципе "сэндвича", с использованием двух моноклональных антител, то есть твердофазного связывания, иммобилизованного антитела и первичного антитела, меченного пероксидазой хрена (HRP).
Для определения фармакокинетических свойств пентасахаридно-инсулинового конъюгата 6 и рекомбинантного человеческого инсулина (рЧ инсулин, партия SIHR017, полученного от компании Diosynth, Нидерланды), образцы плазмы крысы инкубировали в течение 1 часа при комнатной температуре на шейкере при 10 Гц. Во время этого инкубирования пентасахаридно-инсулиновый коньюгат 6 или рЧ инсулин связывается с иммобилизированным антиинсулиновым антителом. После второй процедуры промывания для связывания с иммобилизированным инсулиновым комплексом добавляли антиинсулиновые первичные антитела, конъюгированные с HRP. Планшеты промывали для удаления несвязанных ферментно-меченых антител, после чего добавляли субстратный раствор 3,3',5,5'-тетраметилбензидина/H2O2. Реакцию прекращали 0,5 М серной кислотой и осуществляли спектрофотометрическое считывание микротитровального планшета при 450 нм. Интенсивность окрашивания была прямо пропорциональна концентрации инсулина. Затем для каждого образца плазмы определяли среднюю концентрацию инсулина (моль/л).
Определение фармакокинетических свойств соединения 6
Фармакокинетическое поведение инсулинового коньюгата 6 и рЧ инсулина изучали на самцах крыс Wistar весом 300-400 грамм. Крыс анестезировали ингаляционной смесью O2/N2O/изофлуран, после чего катетеризировали правую яремную вену. На следующий день крысам в/в вводили дозы 3,5 нмоль/кг соединения 6 или рЧ инсулина, после чего с несколькими интервалами времени отбирали кровь. Кровь центрифугировали, после этого плазму откачивали и сохраняли до использования при -20°С. Концентрацию тестовых соединений в образцах плазмы определяли с использованием анализа ELISA для человека против калибровочной кривой, которую создавали непосредственно из исходного раствора тестового соединения. Концентрацию в образцах выражали в нмоль/л и кинетические параметры вычисляли на непараметрической модели WinNonlin.
Вывод: Как можно отметить на фиг.13 и таблице 3, фармакокинетические свойства пентасахаридно-инсулинового конъюгата 6 были значительно улучшены по сравнению со свойствами исходного рЧ инсулина.
Определение фармакокинетики после мечения 125 I
Осуществляли мечение 125I пентасахаридных коньюгатов 24, 28, 29, 31, 32, 39 и 41 с использованием лактопероксидазного способа, согласно Machalonis и др. (Biochem J. 1969, 113: 299-305). После мечения конъюгаты очищали гель-фильтрацией на Sephadex G25 и анионообменной HiTrap Q1O. Повторяли кинетические эксперименты, как описано для соединения 6, но с использованием вместо него меченного 125I коньюгата. Для предотвращения накопления 125I- в щитовидной железе перед введением соединения крысам перорально вводили 10 мг/кг йодида калия.
На правильное определение судьбы 125I-меченного коньюгата могло влиять метаболическое внутриклеточное эндогенное дегалогенирование, дающее в циркулирующей крови свободный 125I-. Поскольку свободный 125I- сам по себе показывает период полувыведения у крыс 3,2 часа (контроль, данные не показаны), измеренный общий период полувыведения меченных 125 I соединений с относительно коротким периодом полувыведения мог быть продолжительнее, и экспериментально определенный период полувыведения соединений с относительно длинным периодом полувыведения мог быть короче. В действительности, наблюдаемые периоды полувыведения конъюгатов 31, 32 и 39 качественным образом показывают, что конъюгирование пептидов к пентасахаридному носителю ведет к пролонгации времени нахождения.
Адаптация вышеописанного способа путем измерения радиоактивности в пилюле (0,1 мл) после преципитации в ТХУ в 40-кратном объеме (конечная концентрация 10%) приводит к получению фармакокинетических параметров соединений 24, 28, 29 и 41 с коррекцией для конкурентного эндогенного 125I-дегалогенирования.
Фармакокинетика инсулин-пентасахаридных коньюгатов 24, 28 и 29 по сравнению с рЧ инсулином
Вывод: фармакокинетические свойства инсулин-пентасахаридного конъюгата 24, определяемые способом мечения 125I (фиг.14, таблица 4), согласовывались со свойствами, полученными со сходным инсулин-пентасахаридным конъюгатом (соединение 6), определяемым анализом ELISA (фиг.13, таблица 3). Различия кинетических параметров для рЧ инсулина, определяемые двумя аналитическими способами, можно объяснить различиями экстраполяции кривой (для вычисления Vss и Cl) в силу быстрого исчезновения метки из циркулирующей крови в течение первых 15 минут.
Кроме того, отмечаемые различия в AUC, Cl и Vss у инсулин-пентасахаридных конъюгатов 24, 28, 29 (фиг.14, таблица 4) отчетливо показывают, что фармакокинетические свойства конъюгатов можно регулировать использованием альтернативных пентасахаридных носителей с различной связывающей аффинностью к ATIII (что согласуется с результатами исследования BIA, см. фиг.6 и таблицу 2).
Фармакокинетика пентасахаридных коньюгатов 31 и 32
Вывод: период полувыведения свободного ганиреликса (T Ѕ 1,4 часа у крыс, в/в, Chan et al. Drug. Metab. Dispos, 1991, 19, 858), значительно увеличивается при коньюгировании к пентасахаридному носителю (фиг.15, таблица 5). Сравнение фармакокинетики соединения 31 с соединением 32 показывает, что улучшение Vss, Cl и T1/2 полувыведения получено при использовании пентасахарида с более высокой аффинностью к ATIII. Эти данные в комбинации с результатами исследования BIA (см. фиг.8) указывают, что фармакокинетические свойства конъюгатов можно регулировать использованием альтернативных пентасахаридных носителей с разной связывающей аффинностью к ATIII.
Фармакокинетика пентасахаридного конъюгата 39 и АДМ(27-52)
Вывод: фармакокинетические свойства АДМ(27-52) были улучшены путем конъюгирования к ATIII связывающего пентасахаридного носителя (соединение 39, фиг.16, таблица 6). Возможно, что T1/2 АДМ(27-52) по существу, является завышенным, так как данные не были скорректированы для дегалогенирования. Кроме того, период полувыведения у человека свободного адреномедуллина составляет всего лишь 22 минуты (Meeran et al. J. Clin. Endocrin. Met. 1997, 82, 95-100). Эти и предыдущие наблюдения в исследовании BIA (фиг.9) поддерживают вывод, что можно достичь улучшения фармакокинетических свойств (поли)пептида превращением в (носитель) конъюгат со специфической связывающей аффинностью к циркулирующему ATIII.
Фармакокинетика пентасахаридного конъюгата 41 по сравнению с [D-Ala 8 ]-ГПП-1(7-36)
Вывод: фармакокинетические свойства [D-Ala8]-ГПП-1(7-36) были улучшены путем конъюгирования к ATIII связывающего пентасахаридного носителя (соединение 41, фиг.17, таблица 7). Cl соединения 41 был уменьшен в 100 раз и Vss в 13 раз, что приводит к 100-кратному увеличению AUC (экспозиция) по сравнению с неконъюгированным пептидом. В сочетании с данными BIA (фиг.10) эти наблюдения поддерживают вывод, что улучшение фармакокинетических свойств (поли)пептида можно достичь превращением в ATIII связывающий конъюгат.
Выявление (поли)пептидно-пентасахаридного-ATIII комплекса в плазме крысы
Чтобы гарантировать связывание (поли)пептидного пентасахаридного коньюгата с антитромбином III in vivo, с образцами плазмы из фармакокинетического исследования соединения 6 осуществляли анализ ELISA с принципом сэндвича при использовании антиинсулинового Мoab в качестве захвата и HRP-конъюгированные антиантитела ATIII в качестве детектора. Очевидно, что в этом типе анализа было возможно обнаружить только интактный пентасахаридно-инсулиновый комплекс ATIII, в котором рЧ инсулин использовали в качестве отрицательного контроля).
В образцах плазмы, получаемой через 1 минуту после в/в введения крысе 3,5 нмоль/кг соединения 6 или рЧ инсулина, определяли связывание пентасахаридно-инсулинового коньюгата 6 и рЧ инсулина к ATIII крысы. Результаты показаны на фиг.18.
Вывод: Пентасахаридно-инсулиновый конъюгат 6 является связанным с ATIII, в отличие от рЧ-инсулина, который не способен образовать комплекс с ATIII. Антикроличье антитело ATIII было менее чувствительным, но вместе с тем оба антитела ATIII были способны обнаруживать комплекс пентасахаридно-инсулинового конъюгата 6 - ATIII. Эти результаты показывают, что соединение 6 связано с ATIII в циркулирующей крови и что длительный период полувыведения ATIII - связывающих пентасахаридов является результатом этого комплексообразования. Поэтому можно прийти к заключению, что улучшение фармакокинетических свойств (поли)пептидно-пентасахаридного коньюгата (такого, как соединение 6) по сравнению со свойствами исходного неконъюгированного (поли)пептида можно приписать специфическому связыванию конъюгата с ATIII.
Тест подавления уровня глюкозы in vivo у крыс
Биологические действия инсулина и инсулиновых конъюгатов тестировали на модели крыс путем измерения уровней подавления глюкозы. Перед экспериментом животных не кормили в течение ночи (16 часов). Утром производили отбор крови у всех крыс путем отрезания маленького кусочка хвоста, после чего кровь накапывали на тестовую полоску и измеряли уровни глюкозы посредством прибора для контроля уровня глюкозы крови ACCU-Check Sensor (Roche Diagnostics). Пентасахаридно-инсулиновый коньюгат 6 и инсулин вводили в/в в хвостовую вену после предварительного согревания крыс в согревающейся камере при температуре 39°C в течение 10 минут. Применяемые дозы составляли 7 нмоль/кг для пентасахаридно-инсулинового конъюгата 6 и 3,5 нмоль/кг для рЧ инсулина. С различными интервалами времени отбирали образцы крови путем удаления засохшей корочки крови, после чего немедленно определяли содержание глюкозы, как описано выше.
Фармакодинамика пентасахаридно-инсулинового конъюгата 6
Улучшенные фармакокинетические свойства пентасахаридно-инсулинового конъюгата 6 по сравнению со свойствами рЧ-инсулина подтверждаются длительным подавлением уровня глюкозы после в/в. введения (см. фиг.19).
В экспериментах, проведенных с соединениями 24, 25, 26, 27 и инсулином Determir (контроль), крысы голодали непосредственно перед введением соединения (чтобы гарантировать постоянные уровни глюкозы в группе контроля).
Сравнение B29-инсулинового коньюгата 24 с B29-инсулиновым конъюгатом 26 (фиг.20) и В1-инсулинового конъюгата 25 с В1-инсулиновым конъюгатом 27 (фиг.21) показывает, что подобная продолжительность действия подавления уровня глюкозы достигается независимо от длины спейсера.
Было неожиданно выявлено, что начало действия всех тестированных инсулиновых коньюгатов было более медленным, чем начало действия рЧ инсулина или инсулина Detemir (при в/в введении), и что экспозиция увеличивалась посредством более долгой продолжительности действия.
Непосредственное сравнение B29-инсулиновых коньюгатов 24, 28 и 29 в рамках одного эксперимента в дозе 24 нмоль/кг доказывает различие в продолжительности их действия на снижение уровня глюкозы крови (см. фиг.22). Таким образом, подавление уровней глюкозы соединением 24 продолжалось более 7 часов, тогда как коньюгаты 28 и 29 не проявляли активность более 5,5 часов после в/в введения. Фармакодинамические различия соответствуют вышеупомянутым фармакокинетическим различиям по объему распределения и клиренсу соединения 24 по сравнению, соответственно, с соединениями 28 и 29. Наконец, инсулин Detemir, показывающий менее явную и менее длительную активность в дозах 24 и 48 нмоль/кг, тестировали в качестве сравнительного примера (фиг.21, 22).
| название | год | авторы | номер документа |
|---|---|---|---|
| ЧУВСТВИТЕЛЬНЫЕ К ГЛЮКОЗЕ КОНЪЮГАТЫ ИНСУЛИНА | 2014 |
|
RU2676307C2 |
| ДВОЙНЫЕ АНТИТРОМБОТИЧЕСКИЕ ИНГИБИТОРЫ, СОДЕРЖАЩИЕ ОСТАТОК БИОТИНА | 2005 |
|
RU2403259C2 |
| КОНЪЮГАТЫ АНАЛОГОВ ЭКСЕНАТИДА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ | 2017 |
|
RU2764547C2 |
| АНТИТРОМБОТИЧЕСКИЕ ДВОЙНЫЕ ИНГИБИТОРЫ, ВКЛЮЧАЮЩИЕ БИОТИНОВУЮ МЕТКУ | 2006 |
|
RU2434876C2 |
| ПЕНТАСАХАРИДНЫЙ КОНЪЮГАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2000 |
|
RU2266913C2 |
| СПОСОБ КОНЪЮГАЦИИ ПЕПТИДОВ, ОПОСРЕДОВАННОЙ ТРАНСГЛУТАМИНАЗОЙ | 2005 |
|
RU2385879C2 |
| КОНЪЮГАТЫ ИНСУЛИНА | 2019 |
|
RU2809189C2 |
| СВЯЗЫВАЮЩЕЕ ВЕЩЕСТВО ДЛЯ ПЕПТИДОВ | 2019 |
|
RU2808687C2 |
| ПРОИЗВОДНОЕ ПОЛИПЕПТИДА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2020 |
|
RU2792236C1 |
| КОНЪЮГАТЫ ИНСУЛИН-ИНКРЕТИН | 2014 |
|
RU2678134C2 |
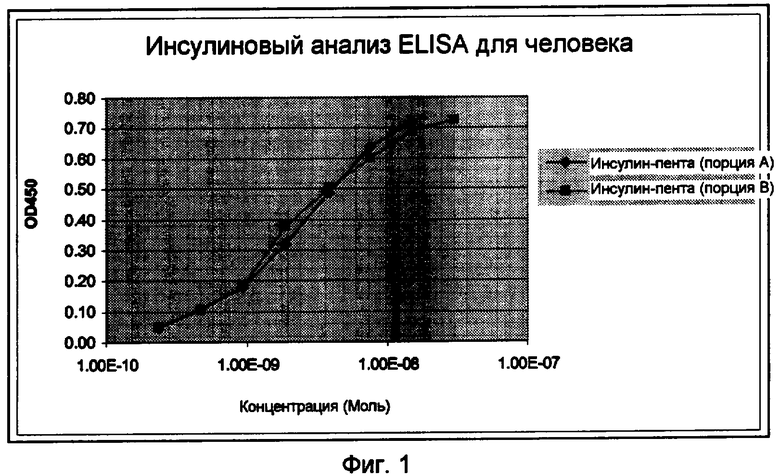
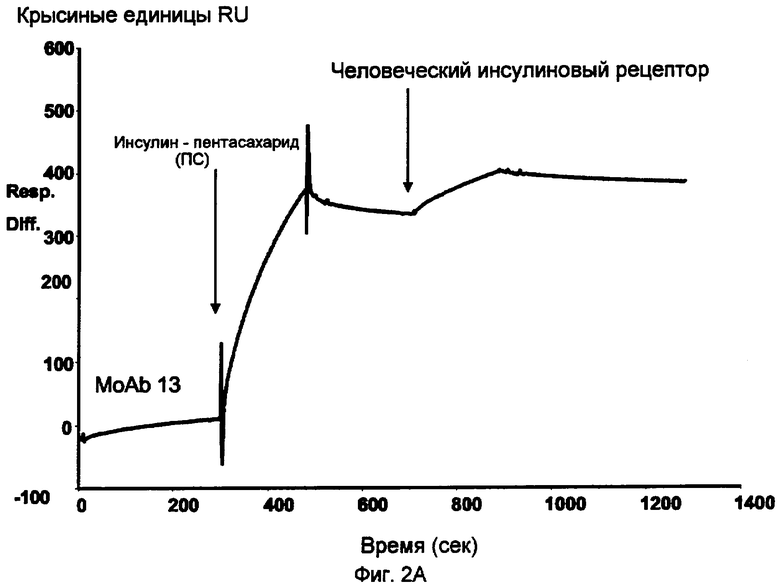
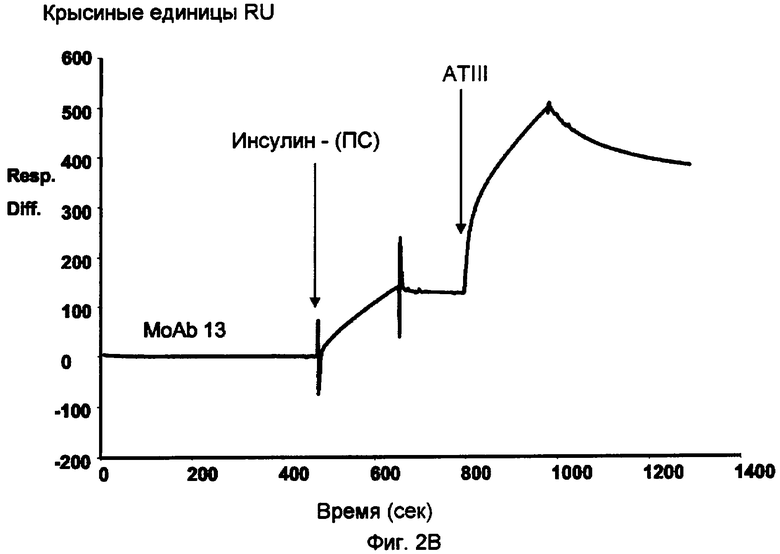
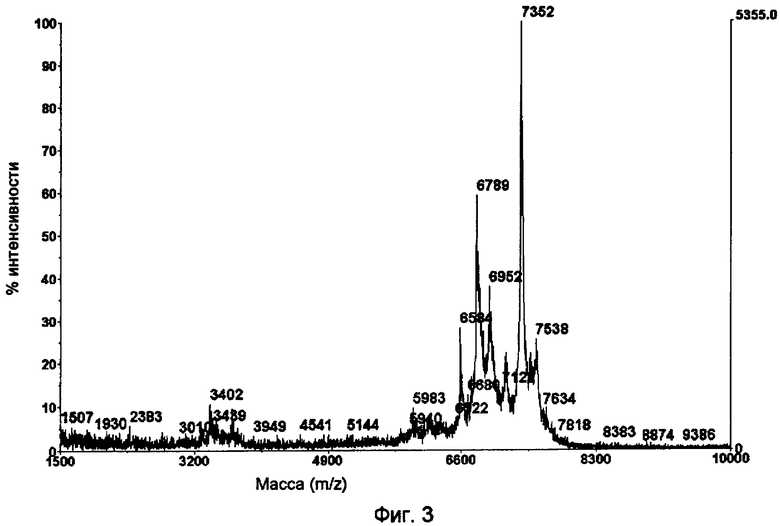
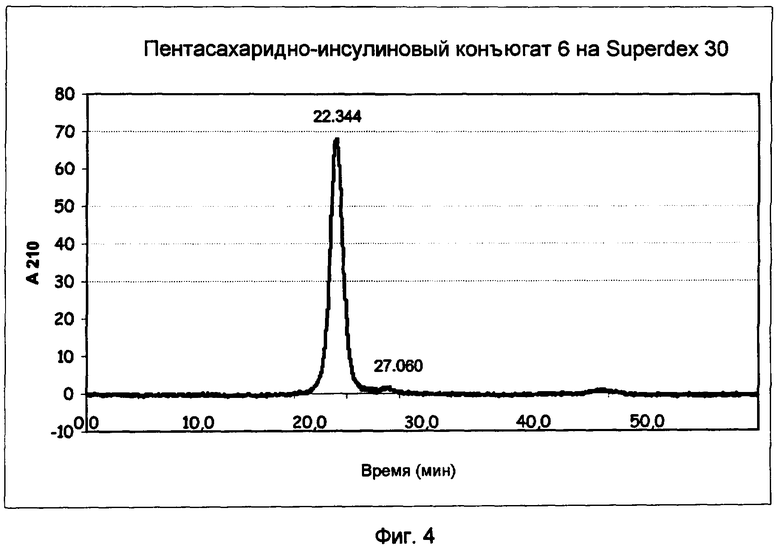
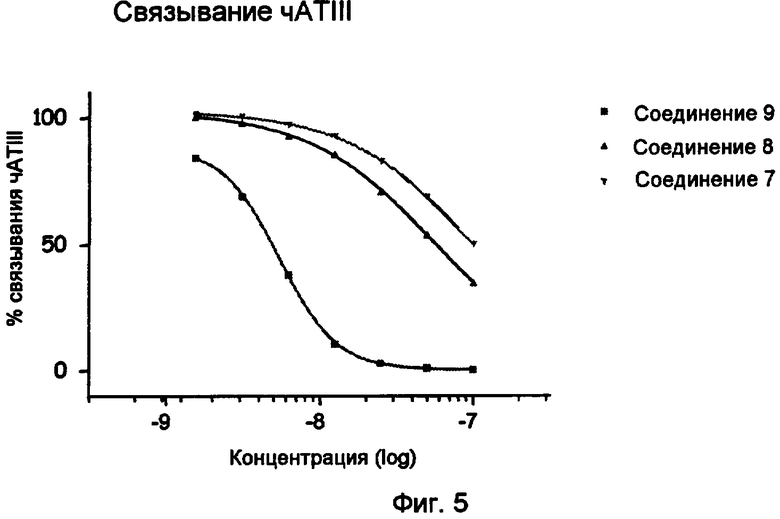
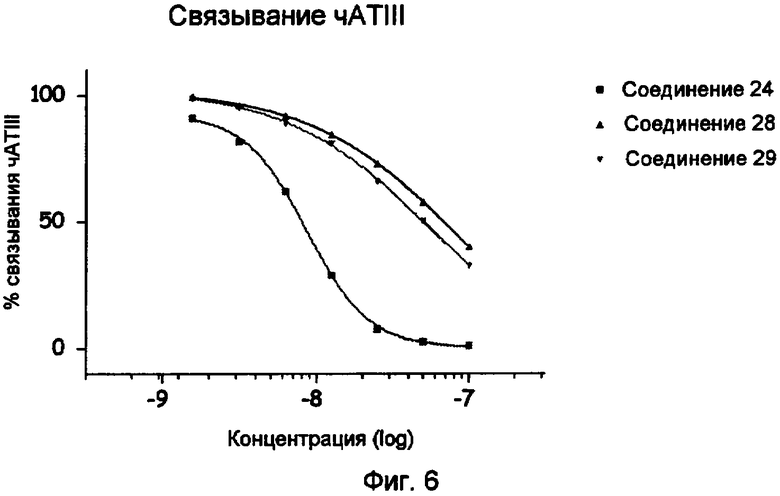
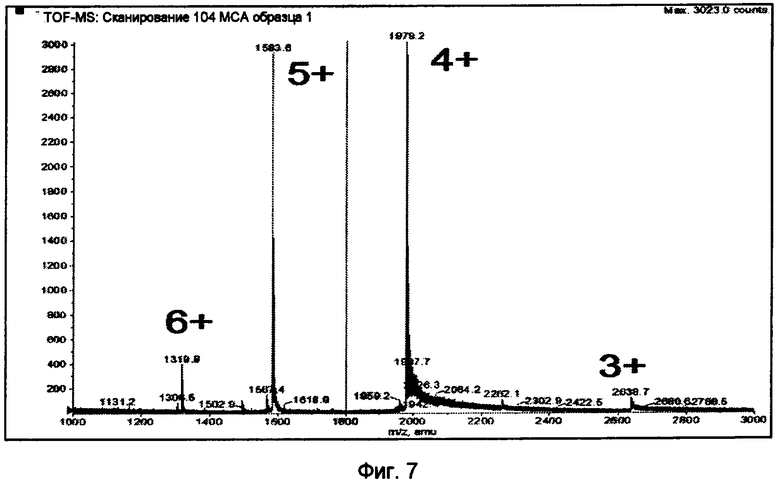
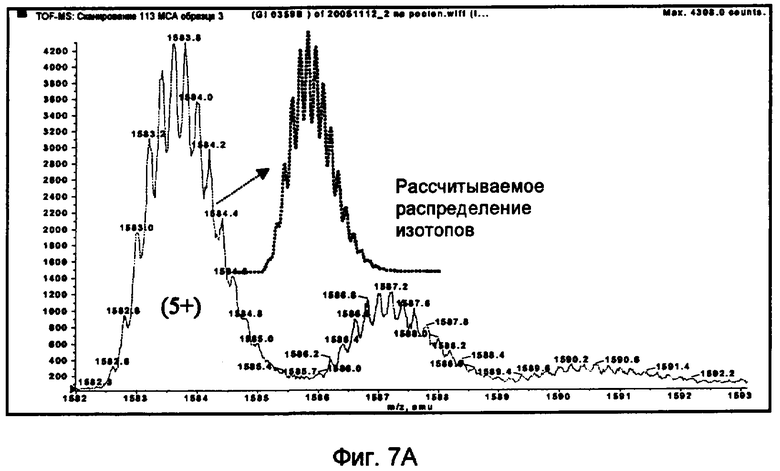
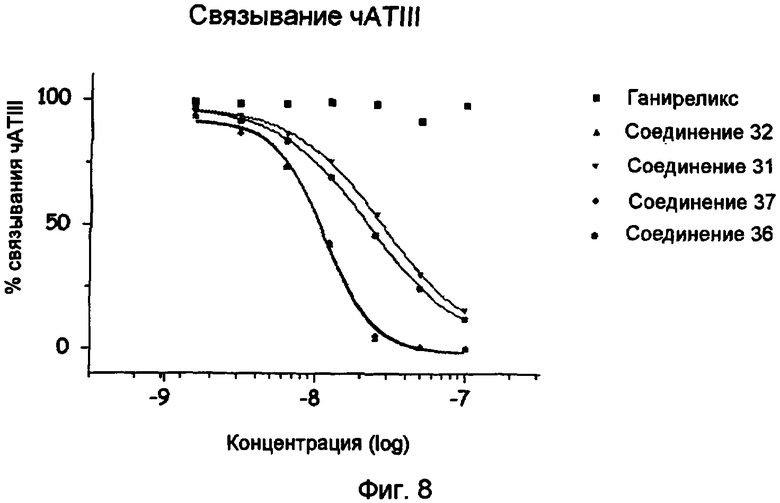
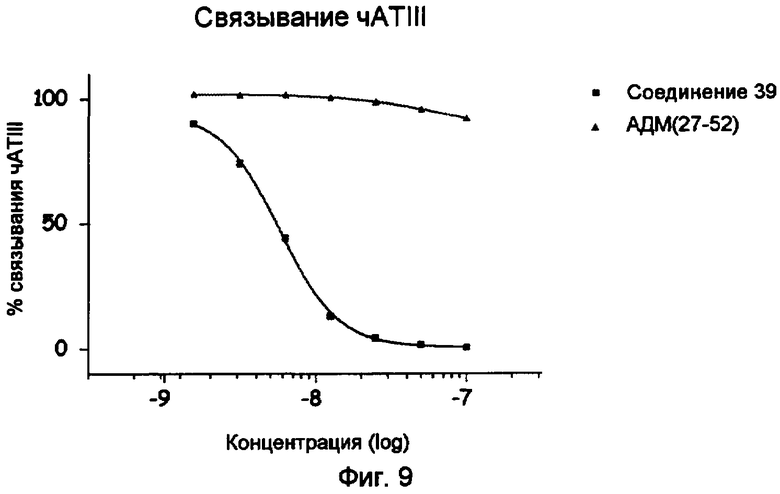
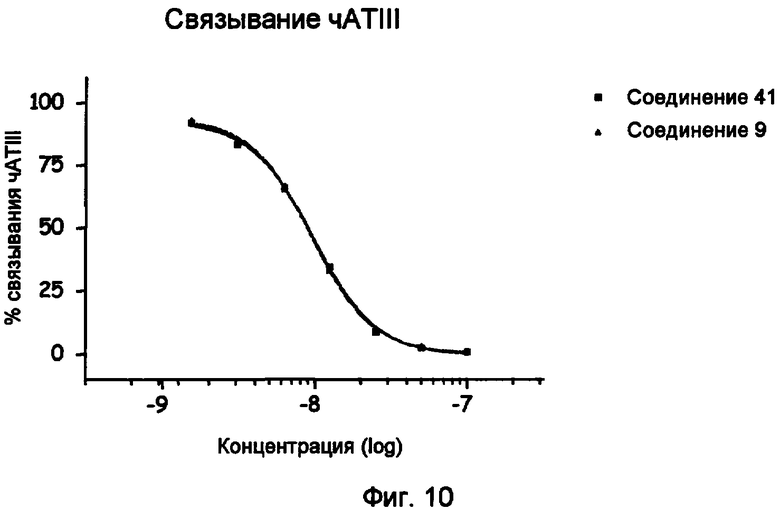
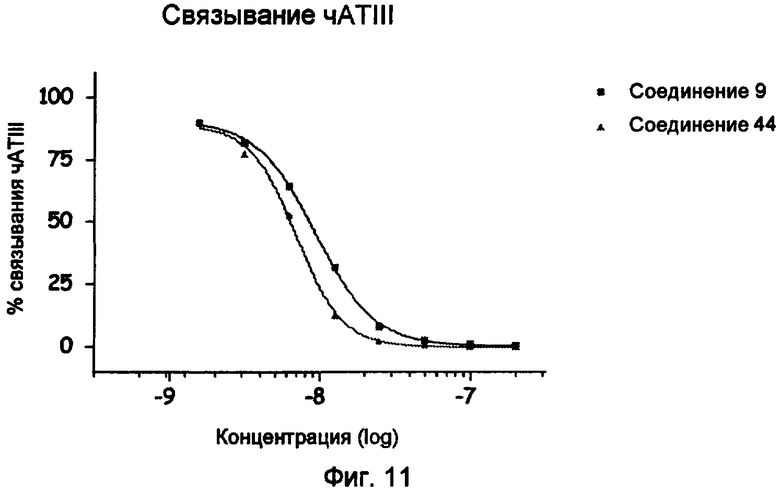
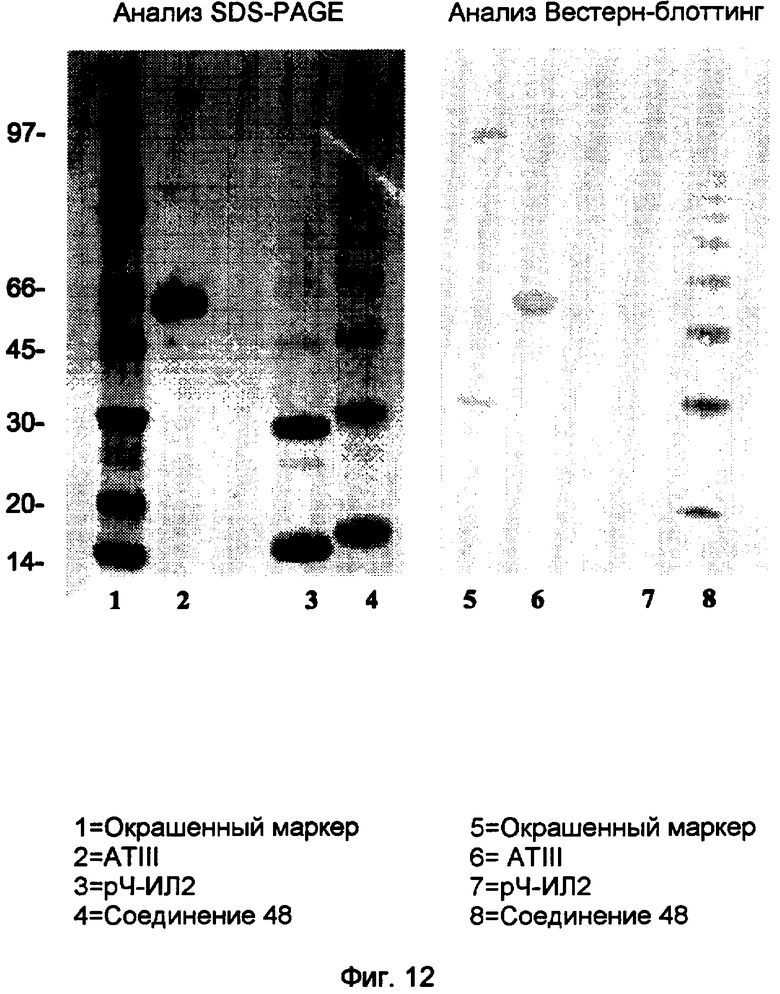
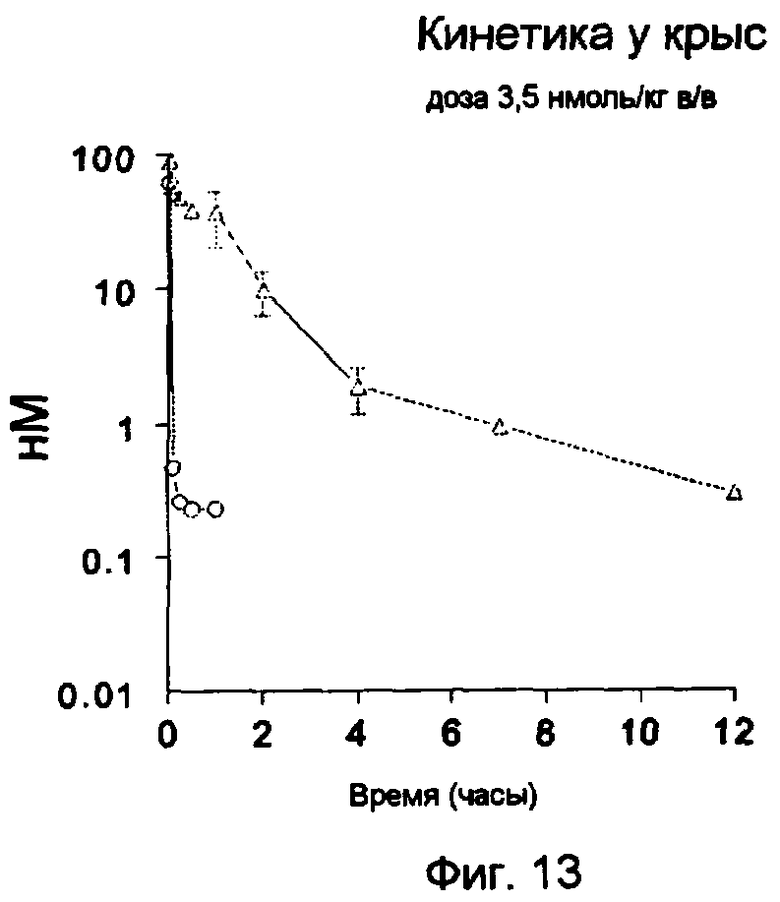
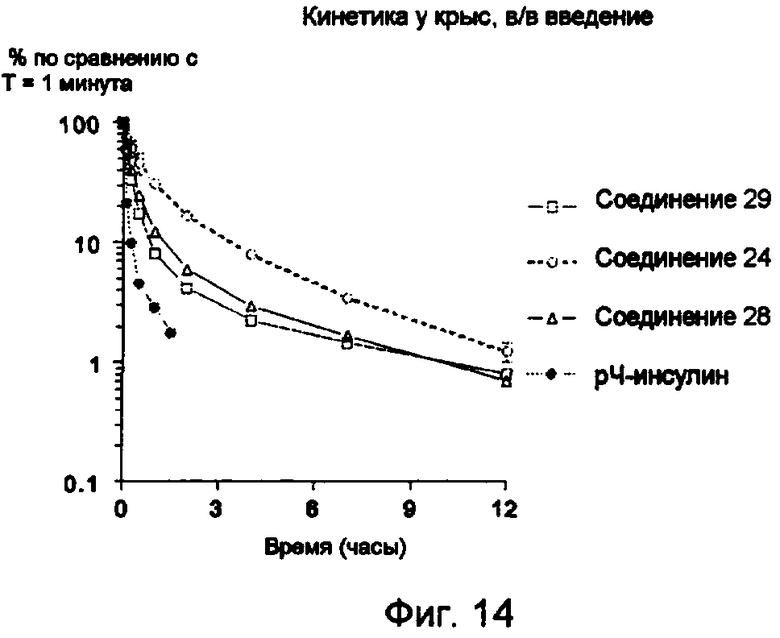
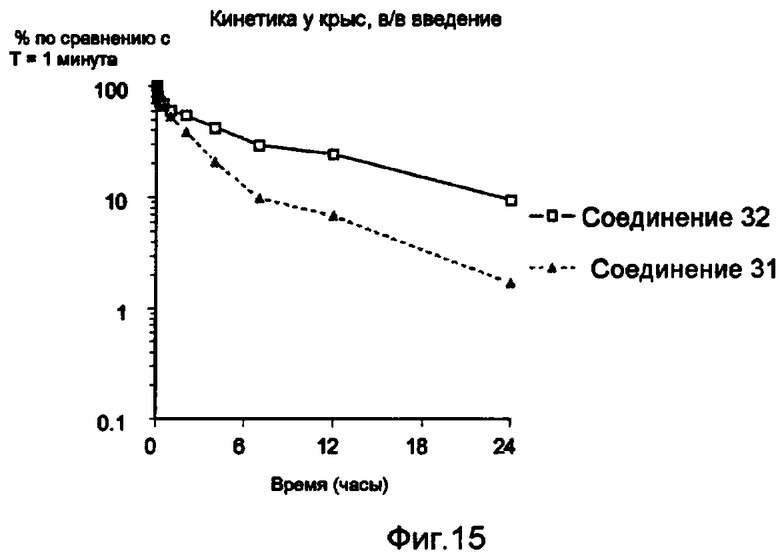
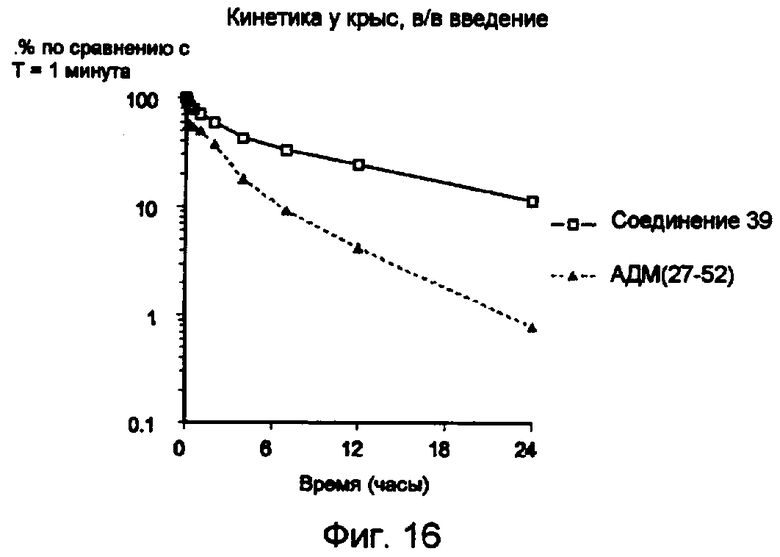
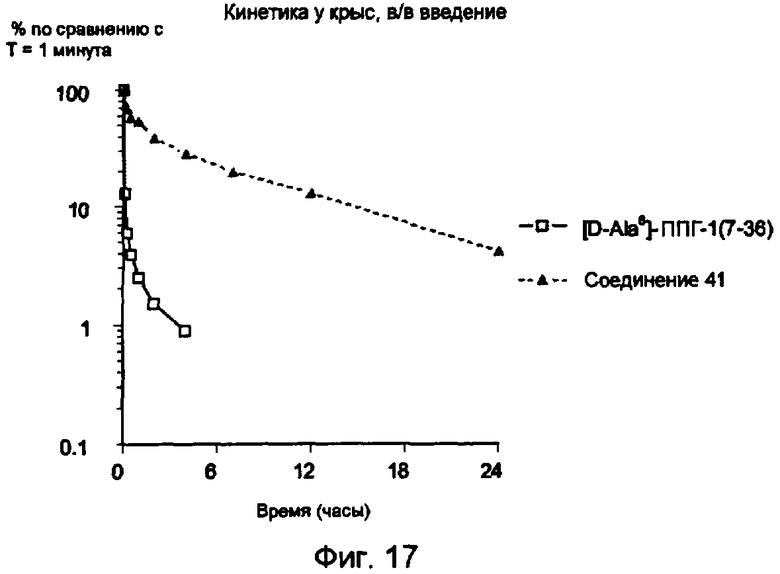
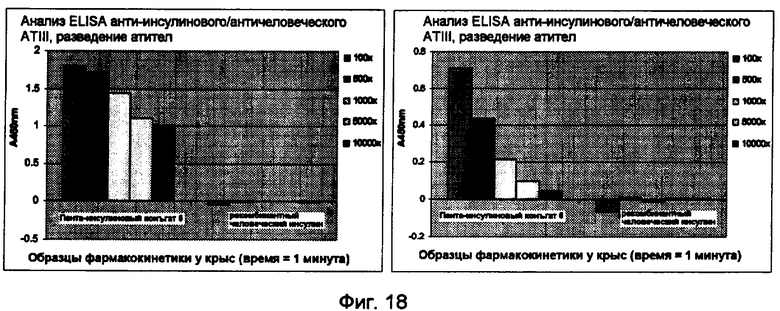
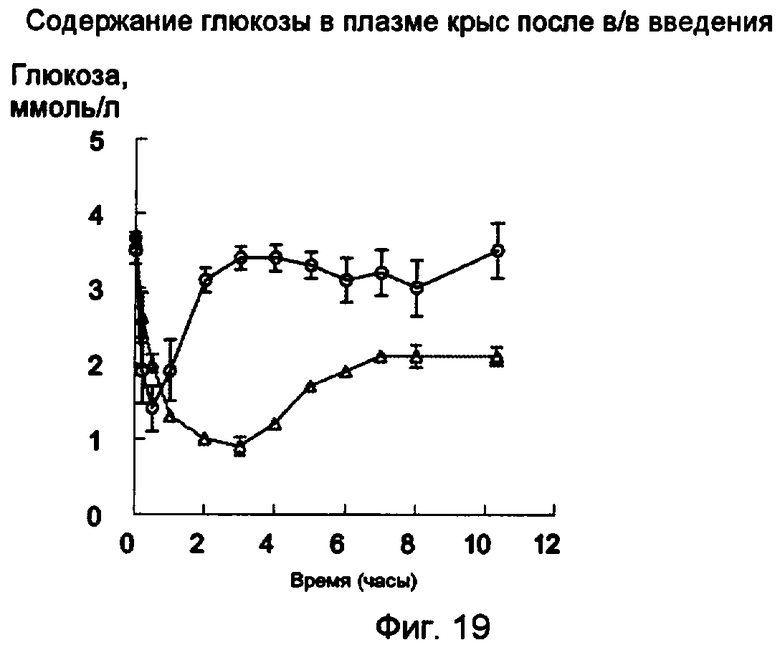
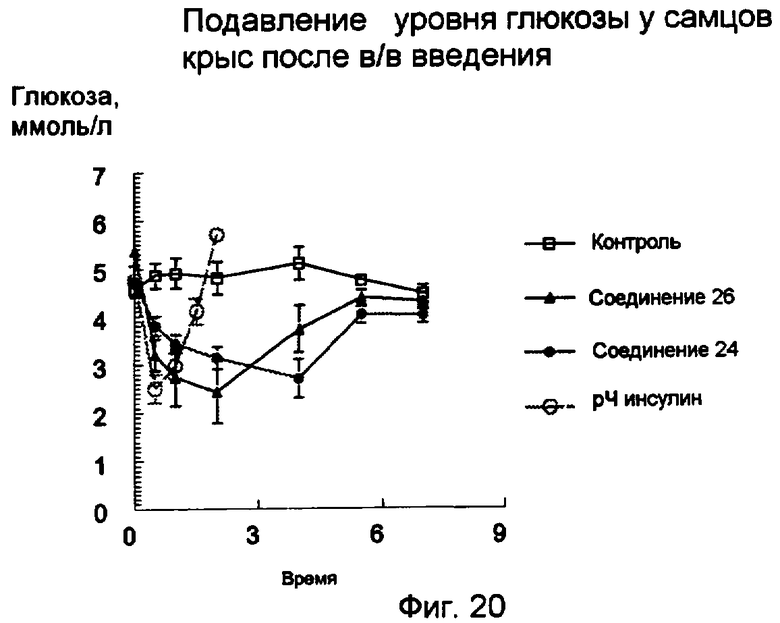
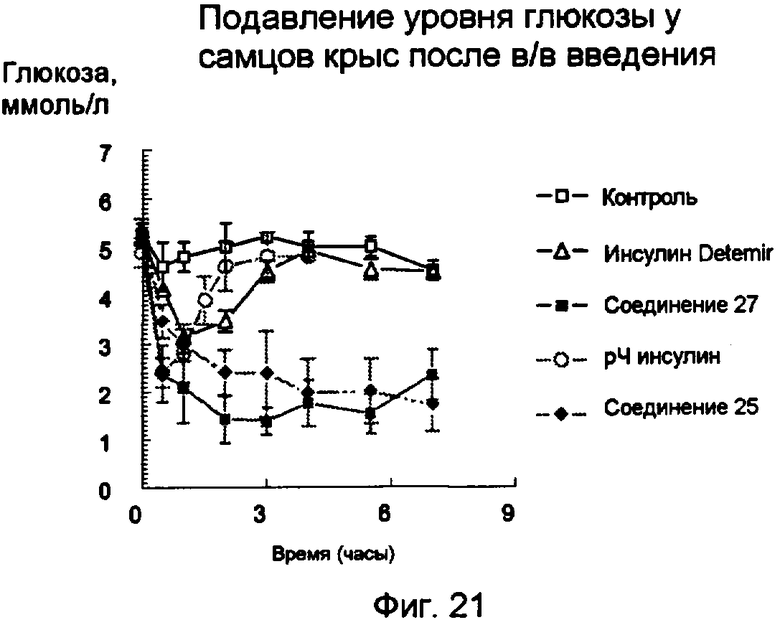
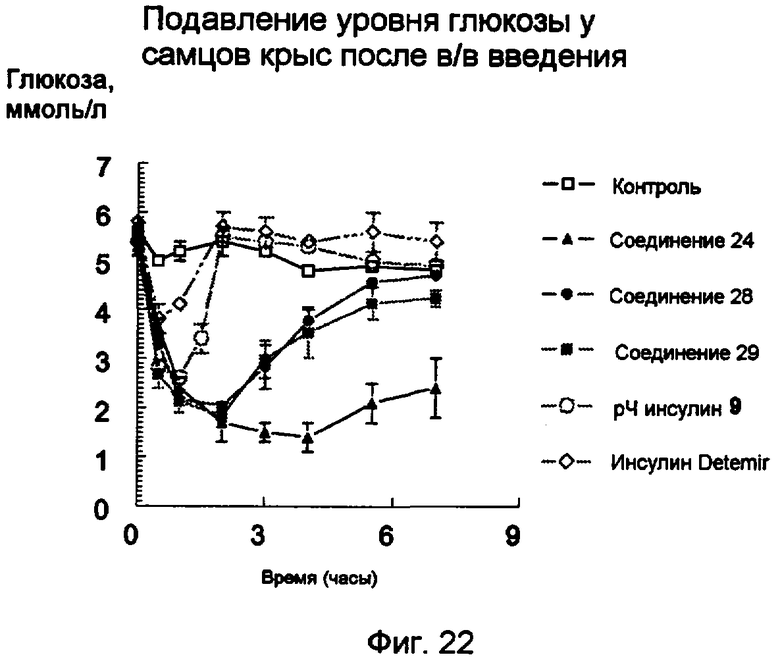
Настоящее изобретение относится к коньюгатам полипептида и олигосахарида или его фармацевтически приемлемой соли, в которых полипептид коньюгирован по меньшей мере к одному олигосахаридно-спейсерному остатку, олигосахарид представляет собой синтетический сульфатированный пентасахаридный остаток и по существу обладает аффинностью к антитромбину III, и спейсер является связью или по существу фармакологически неактивным гибким сшивающим остатком. Коньюгаты настоящего изобретения имеют улучшенные фармакокинетические свойства по сравнению с соответствующими неконъюгированными полипептидами. 2 н. и 11 з.п. ф-лы, 24 ил., 7 табл., 28 пр.
1. Конъюгат полипептида и олигосахарида, в котором полипептид конъюгирован по меньшей мере к одному олигосахаридно-спейсерному остатку, где олигосахарид представляет собой пентасахаридный остаток, имеющий структуру (IV)
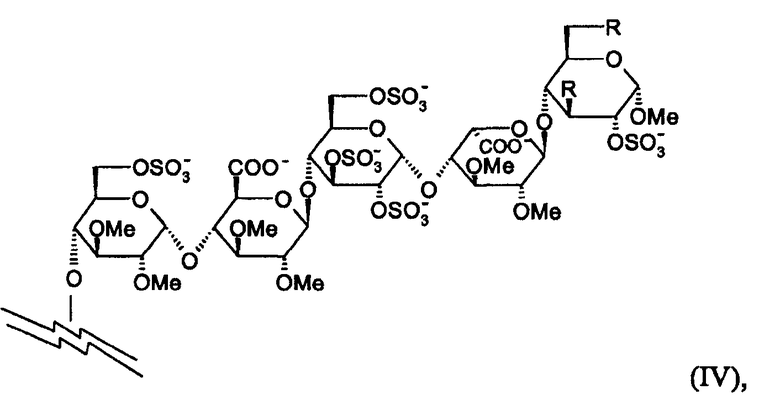
где R независимо представляют собой ОСН3 или OSO3 -, и где пентасахарид обладает аффинностью per se к антитромбину III, и спейсер является связью или по существу фармакологически неактивным гибким сшивающим остатком, за счет чего конъюгат не обладает терапевтически значимой антитромботической активностью при уровне циркуляции в плазме менее или равном 50 нМ; и полипептид выбирают из инсулина, кальцитонина, ганиреликса, глюкагоноподобного пептида (ГПП-1), [D-Ala8]-ГПП-1(7-36), адреномедуллина, усеченное производное адреномедуллина АДМ(27-52), кисспептина-10, октреотида или интерлейкина 2;
или его фармацевтически приемлемая соль.
2. Конъюгат по п.1, в котором обе группы R в (IV) представляют собой OSO3 -.
3. Конъюгат по п.1, в котором полипептид выбирают из инсулина, АДМ(27-52) и [D-Ala8]-ГПП-1(7-36).
4. Конъюгат по любому из пп.1-3, в котором полипептид является монозамещенным пентасахаридно-спейсерным остатком.
5. Конъюгат по любому из пп.1-3, в котором спейсер является по существу фармакологически неактивным гибким сшивающим остатком.
6. Конъюгат по п.5, в котором спейсер имеет длину от 10 до 50 атомов.
7. Конъюгат по любому из пп.1-3, в котором спейсер содержит по меньшей мере один элемент -(CH2CH2O)-.
8. Конъюгат по п.1, выбранный из следующих структур:
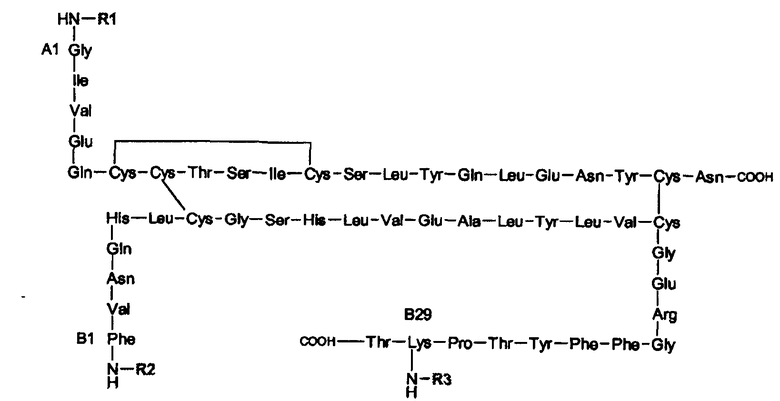
в которых R1=R2=H, R3=
или в которых R1=R3=H, R2=
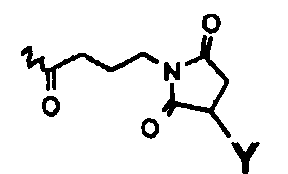
и в которых Y выбирают из структур А, В, С и D:
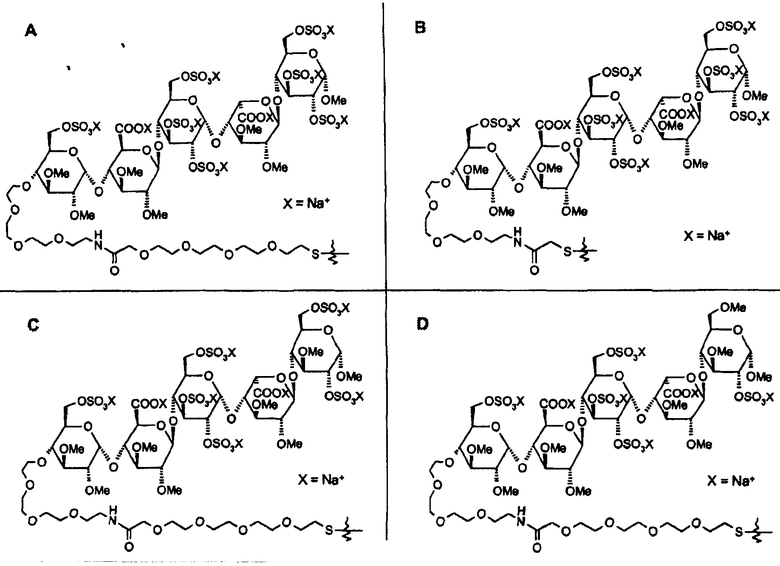
9. Конъюгат по п.8, в котором Y выбирают из структур А и В.
10. Конъюгат по п.9, имеющий структуру:
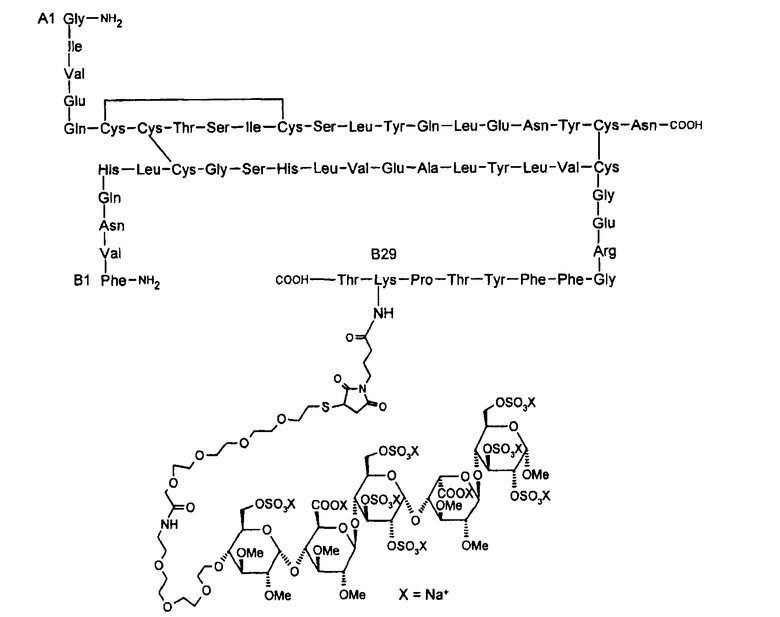
11. Конъюгат по п.1, имеющий структуру:
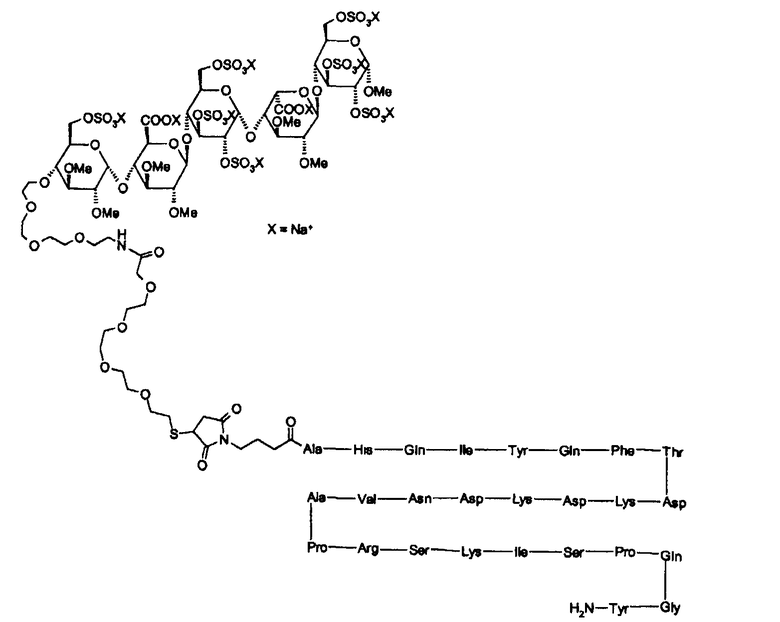
12. Конъюгат по п.1, имеющий структуру:
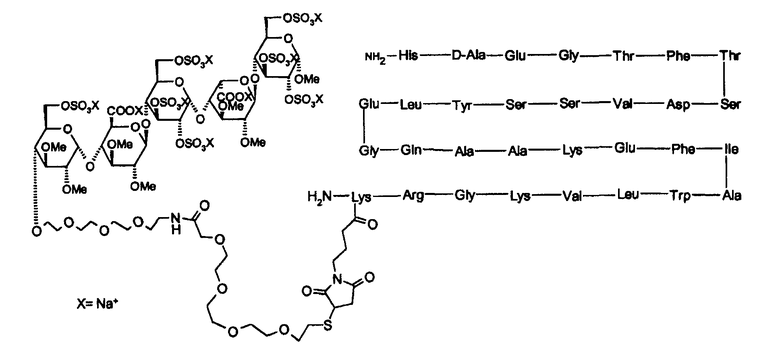
13. Фармацевтическая композиция для увеличения времени полувыведения пептида из плазмы, где композиция содержит полипептид в форме конъюгата по любому из пп.1-12 и фармацевтически приемлемое вспомогательное вещество или вещества.
| GLP-1 ПРОИЗВОДНЫЕ | 1997 |
|
RU2214419C2 |
| US 6514500 B1, (CONJUCHEM INC), 04.02.2003 | |||
| Плавучее устройство для сбора нефти с водной поверхности | 1946 |
|
SU69911A1 |
| WO 9946283 A1, (ZEALAND PHARMACEUTICALS A S), 16.09.1999 | |||
| WO 2004060404 A1, (CHUGAI PHARMACEUTICAL CO LTD), 22.07.2004 | |||
| BUIJSMAN, ROGIER C | |||
| ET AL: "Synthesis of a pentasaccharide-oligodeoxyribonucleotide conjugate: a novel | |||
Авторы
Даты
2012-02-27—Публикация
2006-01-31—Подача