Изобретение относится к химии производных адамантана, а именно к новому способу получения 1-(1-адамантил)-3,4-динитро-5-(N-нитропиразолил)-1H-пиразолов нуклеофильным замещением нитрогруппы нитропиразолами общей формулы:
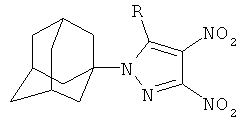
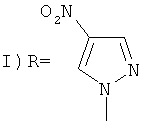

нуклеофильным замещением нитропиразолами. Полученные пиразолы потенциально являются исходными соединениями для синтеза терапевтически активных веществ.
Имеется большое число публикаций, подтверждающих различные виды биологической активности у соединений, содержащих в своей структуре пиразольный фрагмент.
В литературе описаны несколько содержащих адамантан производных пиразола, уже нашедших непосредственное применение.
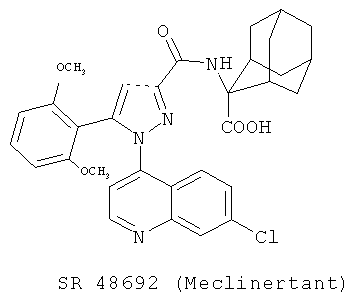
К таким соединениям принадлежат SR 48692 (Mcclinertant) и SR 192948А, антагонисты рецепторов нейротензина. [Biochemical and pharmacological profile of a potent and selective nonpeptide antagonist of the neurotensin receptor. D. Gully, M. Canton, R. Boigegrain, F. Jeanjean, J.C. Molimard, M. Poncelet, C. Gueudet, M. Heaulme, R. Leyris, A. Brouard. // Proc. Natl. Acad. Sci. U.S.A., 1993, January 1; 90 (1): 65-69.].
Данные соединения активно исследуются как перспективные противоопухолевые препараты, нейролептики. (Rebecca М. Myers, James W. Shearman, Matthew О. Kitching, Antonio Ramos-Montoya, David E. Neal, and Steven V. Ley. Cancer, Chemistry, and the Cell: Molecules that Interact with the Neurotensin Receptors. // ACS Chemical Biology, Vol.4, №.7, 503-525, 2009.].
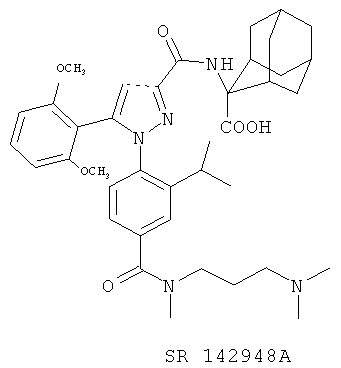
SR 142948A. Это селективный антагонист NTR1 (142948A может рассматриваться как представитель второго поколения мощных, избирательных, непептидных антагонистов NTRs. Он имеет биодоступность, пересекает гематоэнцефалический барьер и имеет долгосрочные последствия от применения. Кроме того, в отличие от SR 48692, он препятствует переохлаждению и антиноцицептивным последствиям от централизованного введения NT (нейротензина), предполагают, что SR 142948А, возможно, взаимодействуют с NTR подтипами. SR 142948А является более мощным, чем SR 48692 в большинстве in vitro и в естественных моделях, в частности, в пробах связывания с человеческими рецепторами. SR 142948А антагонизирует классическим vitroNT эффектам, т.е. образованию инозитол монофосфата в НТ 29 клеток (IC50=3,9 нм) или внутриклеточной мобилизации кальция в клетках яичников китайского хомяка, трансфицированных с человеческими рецепторами. Таким образом, SR 142948А сохраняет свойства соединения SR 48692 (нет существенной активности агонистов, биодоступности, длительность действия и хорошего доступа к мозгу), показывает более широкий спектр активности, чем SR 48692 (вероятно, из-за торможения NT подтипов рецепторов). [Gully, D., Labeeuw, В., Boigegrain, R., Oury-Donat, F., Bachy, A., Poncelet, M., Steinberg, R., Suaud-Chagny, M.F., Santucci, V., Vita, N., Peccu, F., Labbe ′-Jullie′, C., Kitagbi, P., Soubrie', Le Fur, G., Maffrand, J.-P. Biochemical and pharmacological activities of SR 142948A, a new potent neurotensin receptor anatagonist. // J. Pharm. Exp. Ther., 1996, 280, 802 812; Labeeuw Bernard, Gully Danielle, Jeanjean Francis, Molimard Jean-Charles, Boigegrain Robert. 1-Phenylpyrazole-3-carboxamides acting on neurotensin receptors. Patent WO 96/32382, 1996.].
Описано применение соединений SR 48692 и SR 142948A как потенциальных антагонистов на нейротензин NT2 рецепторов. Оба соединения, после связывания с рецептором нейротензин NT2, повышают образование инозитол фосфатов (IP) с последующей мобилизацией ионов [Ca2+|, вызывают высвобождение арахидоновой кислоты, а также стимулируют активность митоген-активированной протеин киназы (МАРК). Данные виды активности антагонизируются нейротензином и левокабастином в зависимости от концентрации. [Vita, N., Oury-Donat, F., Chalon, P., Guillemot, M., Kaghad, M., Bachy, A., Thurneyssen, O., Garci ′a, S., Poinot-Chazel, C., Casellas, P., Keane, P., Le Fur, G., Maffrand, J.-P., Soubrie′ P., Caput, D., Ferrara, P. Neurotensin is an antagonist of the human neurotensin NT2 receptor expressed in Chinese hamster ovary cells. // Eur. J. Pharmacol., 1998, 360, 265-272.].

1-R1-3-R3-4-(1-Адамантилкарбамоил)-5-R2-пиразолы описаны как ингибиторы 11β-гидроксистеройдной дегидрогеназы. [Kevin William Anderson, Nader Fotouhi, Paul Gillespie, Robert Alan Goodnow, Kevin Richard Guertin, Nancy-Ellen Haynes, Michael Paul Myers, Sherrie Lynn Pietranico-Cole, Lida Qi, Pamela Lorren Rossman, Nathan Robert Scott, Kshitij Chhabilbhai Thakkar, Jefferson Wright Tilley, Qiang Zhang. Adamantyl-pyrazole carboxamides as inhibitors of 11B-hydroxysteroid dehydrogenase. // US 20070225280 A1].
Подобным действием обладают препараты схожей структуры:

4-[4-(1-Адамаитилкарбамоил)-5-трет-бутил-пиразол-1-ил]бензойная кислота и ее метиловый эфир исследуются как перспективные ингибиторы 11β-гидроксистеройдной дегидрогеназы 1 тина энзима (11BHSD1). [Packer Martin, Scott James, Stocker Andrew, Whitamore Paul Robert Owen. 4-[4-(2-adamantylcarbamoyl)-5-tert-butyl-pyrazol-1-yl]benzoic acid 465 // WO 2009/060232 A1].

Доказана противовирусная активность 5-(1-адамантил)-1H-пиразола на вирусах гриппа (FVP, strain A/rostock/34(H7N1)) и герпеса (type I(HSV-I, strain 1С)). [Бореко Е.И., Павлова И.И., Макарова Н.В., Владыко Г.В., Моисеев И.К., Земцова М.Н. Николаева С.Н. Противовирусная активность адамантансодержащих гетероциклов // Химико-фармацевтический журнал, 2002. - №1. - С.5-7.].
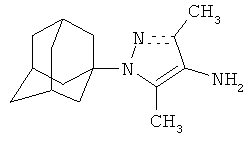

Описана активность адамант-1-илпиразолов против вируса гриппа A/Puerto Rico/8/34 (H1N1). [Vladimir V. Zarubaev, Efim L. Golod, Pavel M. Anfimov, Anna A. Shtro, Victor V. Saraev, Alexey S. Gavrilov, Alexander V. Logvinov, Oleg I. Kiselev. Synthesis and anti-viral activity of azolo-adamantanes against influenza A virus. // Bioorg. Med. Chem., 2010, 18, 839-848.].
Существуют несколько основных направлений в способах получения N-адамант-1-илсодержащих пиразолов.
Непосредственное взаимодействие N незамещенного пиразола с галоген-, гидрокси- и другими производными адамантана.
Известен способ получения адамантилсодержащих производных пиразола окислительным алкилированием пиразолов 1-иодадамантаном в диоксане при 90°C, окислитель йодноватый ангидрид (I2O5). Выход N-адамаитилпиразола составляет 11-18%. [В.Г. Цыпин, М.С.Певзнер, Е.Л. Голод. Окислительное алкилирование азолов. VII. Адамантилирование азолов в условиях окислительного генерирования 1-адамантильных карбокатионов. // ЖОрХ, 2001. - Т.37, - Вып №12. - с.1843-1847.].
К недостаткам данного способа можно отнести: низкие выходы адамант-1-илсодержащих пиразолов, сильную зависимость реакции адамантилирования от основности исходного азола, высокую температуру реакции, необходимость применения окислителя; протекание двух параллельных реакций (в диоксане 1-йодадамантан реагирует с йодноватым ангидридом и в отсутствие гетероароматического субстрата - образуется смесь 1-адамантанола (выход 53%) и 1,1′-диадамантилового эфира (выход 9%)). По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Известен способ получения N-адамант-1-илсодержащих пиразолов взаимодействием 1Н-пиразолов с 1-бромадамантаном при повышенной температуре. [Pilar Cabildo, Rosa Maria Claramunt, Isabelle Forfary, Jose Elguero. Regioselective adamantylation of N-unsubstituted pyrazole derivatives // Tetrahedron Letters, 1994, Vol.35, No.1, pp 183-184.].
Основными недостатками этого способа являются высокая температура реакции 120-240°C, а также необходимость применение автоклава. По данному способу не получают адамант 1-илсодержащих пиразолов заявляемой структуры.
Известен способ получения N-адамант-1-илсодержащих пиразолов при взаимодействии 1-бромадамантана с 1-аминопиразолом при температуре 160-170°C в течение 2 ч, реакция приводит N- и С-адамантилсодержащим пиразолам: 1-(1-адамантил)-3(5)-амино-1Н-пиразол (40%), 1,4-ди(1-адамантил)-3-амино-1Н-пиразол (30%). Получаемый N-адамантилпиразол находится в виде двух изомеров 3(5)-положения аминогруппы с суммарным выходом 70%. [Dionisia Sanz, Rosa Ma. Claramunt, Jose Elguero, Loreto Salazar, Modesta Espada. Rearrangement of 1-amino- and 1-alkylamino-pyrazoles to 5-aminopyrazoles. // Journal of the Chemical Society, Perkin Transactions 1, 1990, p.809-810.].
К недостаткам данного способа можно отнести необходимость применения достаточно высокой температуры 160-170°C, низкую селективность реакции, описано только использование в реакции 1-амино-1H-пиразола и получение из него 1-(1-адамантил)-3(5)-амино-1H-пиразола и 1-(1-адамантил)-3-амино-4-(1-адамантил)-1H-пиразола. По данному способу не получают адамант-1-ил содержащих пиразолов заявляемой структуры.
Существует способ получения N адамантилпиразола с применением в качестве адамантилирующего агента 1-адамантанола, подобная реакция является кислотно-катализируемой.
При применении в качестве катализатора 85%-ной H2SO4 в случае 3-карбокси-4-нитро-1Н-пиразола 

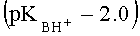
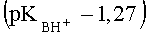
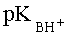


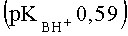
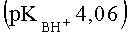
К недостаткам данного способа можно отнести необходимость применения сильно кислых сред, большую продолжительность реакции, большие ограничения но основности исходных азолов (время реакции значительно возрастает и снижается выход, либо реакция не протекает). По данному способу не получают адамант 1-илсодержащих пиразолов заявляемой структуры.
Известен способ получения N-адамантилсодержащих пиразолов реакцией 1,3-дегидроадамантана с N-незамещенным 1H-пиразолом при нагревании до 100°C в массе исходных реагентов при соотношении 1:1 в течение 4,5-5 ч с выходом 70,3-90,2%. [Пат. 2280032. Российская Федерация, МПК C07D 233/58. 2005.].
К недостаткам данного способа следует отнести сравнительно более высокую температуру реакции, чем у заявляемого способа, что имеет значение в случае термически неустойчивых соединений (3,4,5-тринитро-1H-пиразол и его N-алкилзамещенные производные [P. Ravia, Girish М. Goreb, Arun К. Sikderb, Surya P. Tewaria. Thermal decomposition kinetics of 1-methyl-3,4,5-trinitropyrazole // Thermochimica Acta, Vol.528, 20 January 2012, p.53-57.]), в случае галогензамещенных пиразолов более низкая температура препятствует отщеплению галогена. По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Вторым описываемым в литературе направлением получения N-адамантилпиразолов является циклизация, по реакции гидразинов с 1,3-дикарбонильными и непредельными соединениями (алкенами).
Известен способ получения N-адамантилпиразола при взаимодействии 1-адамантилгидразина с нитрилом β-аминокротоновой кислоты в течение 12 ч в этаноле при кипячении, но которому был получен с выходом 40% 1-(1-адамантил)-5-амино-3-метил-1Н-пиразол, а с метиловым эфиром фторсульфоновой кислоты в дихлорэтане за 48 ч при 20°C с выходом 90% соль (1-(1-адамантил)-2-метил-1H-пиразолий фторсульфонат). [P. Cabildo, R.M. Claramunt, J. Elquero. Synthesis and Reactivity of new 1-(1-adamantyl)pyrazoles. // J. Heterocyclic Chem., 1984, 21, 249-251.]
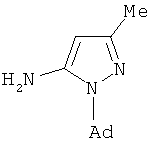
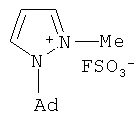
К недостаткам данного способа можно отнести большую продолжительность реакции, многостадийность процесса, связанную с необходимостью получения 1-адамантилгидразина, труднодоступность исходных реагентов (нитрила β-аминокротоновой кислоты и метилового эфира фторсульфоновой кислоты). По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Известен способ получения N-адамантилпиразола при взаимодействии дигидрохлорида 1-адамантилгидразина с 1,3-дикетонами или 4,4-диметоксибутан-2-оном. В исходный дигидрохлорид адамантилгидразина в спирте добавляли раствор эквимолярного количества гидроксида калия в спирте, затем добавляли 2-гидроксиимино-1,3-дикетон в эквимолярном количестве относительно дигидрохлорида 1-адамантилгидразина и реакционную массу выдерживали 12 ч (для соединения (3-(гидроксиимиио)пентан-2,4-дион)) или 24 ч (для соединения (2-(гидроксиимино)-1-фенилбутан-1,3-дион)) при 24°C. Отфильтровали белый осадок хлористого калия, фильтрат упарили, охлаждали до 0°C, отфильтровали выпавший осадок. Соответственно были получены: адамантил-3,5-диметил-4-нитрозо-1Н-пиразол с выходом 40% и 1-(1-адамантил)-5-метил-4-нитрозо-3-фенил-1Н-пиразол с выходом 35%.
Взаимодействием дигидрохлорида 1-адамаитилгидразина с 4,4-диметоксибутан-2-оном был получен 1-(1-адамантил)-3-метил-4-нитрозо-1Н-пиразол с выходом 69%. Эквимолярную смесь 4,4 диметоксибутан-2-она с 1 н соляной кислотой перемешивали при 20°C 0,5 ч, охлаждали до 0°C и в течение 0,5 ч добавляли но каплям раствор нитрита натрия (в мольном соотношении 4,4-диметоксибутан-2-он: нитрит натрия 1:1,1) в воде. Затем из реакционной смеси отдували окислы азота в вакууме водоструйного насоса, и добавляли раствор дигидрохлорида адамантилгидразина (в мольном соотношении 4,4-диметоксибутан-2-он: дигидрохлорид адамантилгидразина 1:0,75) в воде. Реакционную смесь перемешивали 10 мин при 20°C. Выпавший осадок отфильтровывали, растворяли в спирте и нагревали на водяной бане 3 ч. Спирт упаривали в вакууме, выпавший 1-(1-адамантил)-3-метил-4-нитрозо-1H-пиразол отфильтровывали. [Т.А. Фроленко, Н.С. Семиченко, М.Г. Мельникова, Н.Л. Гаврилова, Г.А. Субоч. Синтез нитрозо- и амино-N-адамантилпиразолов. // Журнал сибирского федерального университета. Серия «Химия»., 2011, т.4, №3, 301-306.].
К недостаткам данного способа можно отнести большую продолжительность реакции (в случае реакции дигидрохлорида адамантилгидразина с 1,3-дикстонами), многостадийность процесса, связанную с необходимостью получения 1-адамантилгидразина. По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Третьим описываемым в литературе направлением получения N-адамантилпиразолов является непосредственное взаимодействие N-незамещенного пиразолина с галоген - производным адамантана.
Описан синтез N-адамаитилпиразолов из пиразолинов с применением 1-хлорадамантана. Вначале исходный пиразолин обрабатывается дисилазаном (Me3SiNHSiMe3, получаемым из 1,1 эквивалента смеси триметилхлорсилана и триэтиламина 1:1) в течение 12 ч при комнатной температуре, затем к реакционной смеси добавляют 1-хлорадамантан и кислоту Льюиса (AlCl3) при 0°C в хлороформе. Таким образом, из 5-метилпиразолина была получена смесь 1(1-адамантил)-5-метилпиразолина с выходом 18% и продукта его дегидрирования 1-(1-адамантил)-5-метилпиразола с выходом 37%. [Sasaki Т., Hakamashi А., Ohno М. Synthesis of Adamantane Derivatives. LVIII. Reaction of 1-Adamantyl Chloride with Some Heterocyclic Unsaturated Silanes. // Chem. Pharm. Bull., 1982., Vol.30., №6, pp.2051-2060.].
К недостаткам данного способа можно отнести большую продолжительность реакции, не универсальность способа в случае 4-метилпиразолина по данному способу был получен исключительно 1-(1-адамантил)-4-метилпиразолин с выходом 60%, образование продукта его дегидрирования (1-адамантил)-4-метилииразола отсутствовало. По данному способу не получают адамант-1-ил содержащих пиразолов заявляемой структуры.
Задачей предлагаемого изобретения является разработка универсального, технологичного, малостадийного метода синтеза 1-(1-адамантил)-3,4-динитро-5-(N-нитропиразолил)-1H-пиразолов, протекающего с высоким выходом целевого продукта.
Техническим результатом является расширение спектра получаемых целевых соединений с достаточно большим выходом.
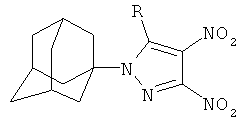
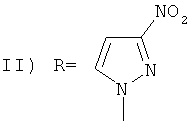
Поставленный технический результат достигается в новом способе получения 1-(адамант-1-ил)-3,4-динитро-5-(N-нитропиразолил)-1Н-пиразолов общей формулы:
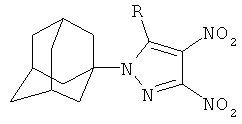
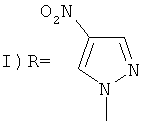
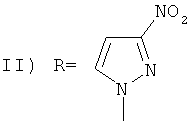 ,
,
заключающийся во взаимодействии 1-(1-адамантил)-3,4,5-трииитро-1Н-пиразола с нитропиразолами выбранным из ряда: 4-нитро-1Н-пиразол, 3-нитро-1Н-пиразол в присутствии гидроксида натрия при мольном соотношении 1-(1-адамантил)-3,4,5-тринитро-1Н-пиразол, нитропиразол, гидроксид натрия равном 1:1:1, в среде вода: ацетонитрил при объемном соотношении 1:2 соответственно, при температуре 25°C в течение 1 ч.
Сущностью метода является реакция нуклеофильного замещения в 1-(1-адамантил)-3,4,5-тринитро-1Н-пиразоле 5-NO2-группы нитропиразолом.
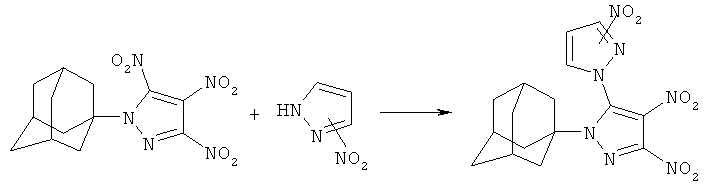
Реакция 1-(1-адамаитил)-3,4,5-тринитро-1H-пиразола с тиолами протекает при температуре 25°C исключительно по 5-NO2-группе.
Высокая реакционная способность 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола позволяет получать продукты реакции с высокими выходами в мягких условиях в одну стадию.
Преимуществами данного метода является достаточно высокий выход продукта (81-84%), небольшая продолжительность реакции (1 ч), а также возможность получения практически любых гомологов данного ряда, которые также являются исходными соединениями для синтеза терапевтически активных веществ.
Найдено, что оптимальным условием проведения реакции 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола с нитропиразолом является ее осуществление в присутствии гидроксида натрия при мольном соотношении 1-(1-адамантил)-3,4,5-тринитро-1H-пиразол, нитропиразол, гидроксид натрия 1:1:1 соответственно. Увеличение избытка исходного нуклеофила не влияло на выход целевых продуктов и является нецелесообразным. Оптимальное время выдерживания реакционной массы составило 1 ч и подбиралось в зависимости от полной конверсии исходных реагентов, определяемой методом ТСХ.
Способ осуществляется следующим образом.
К раствору гидроксида натрия в H2O прибавляют нитропиразол, перемешивают 10 мин. К полученному раствору прибавляли 1-(1-адамантил)-3,4,5-тринитро-1H-пиразол в ацетонитриле. Раствор перемешивают при температуре 25°C, выдерживают при этой температуре 1 ч.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 1-(1-адамантил)-3,4-динитро-5-(4-нитропиразол-1-ил)-1H-пиразола (I).

К раствору 0,012 г (0,30 ммоль) NaOH в 1 мл H2O прибавляют 0,034 г (0,30 ммоль) 4-нитро-1H-пиразола, перемешивают 10 мин. К полученному раствору прибавляют 0,1 г (0,30 ммоль) 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола в 2 мл CH3CN. Реакционную смесь перемешивают 1 ч при комнатной температуре. Из маточного раствора растворитель удаляют в вакууме, добавляют 3 мл H2O, растирают с 1 мл гексаиа, отфильтровывают выпавший осадок, сушат над P2O5 в вакууме. Кристаллизуют из смеси МеОН-H2O. Выход 81%, т.пл. 229-230°C. Спектр ЯМР 1H (300 МГц, DMSO-d6, δ, м.д.): 1.62 (с, 6H, Ad), 2.05 (с, 6Н, Ad), 2.14 (с, 3H, Ad), 8.88 (с, 1H, С(3), Pz), 9.6 (с, 1H, С(5), Pz). Спектр ЯМР 13С (75 МГц, DMSO-d6, δ, м.д.): 29.11 (γ-С, Ad), 34.67 (δ-С, Ad), 40.53 (β-С, Ad), 69.09 (α-С, Ad), 122.80 (уш.с, С(4), Pz), 133.71 (С(5) Pz), 136.00 (С(5′) Pz), 137.48 (уш.с, С(4′), Pz), 138.82 (С(3′) Pz), 145.22 (уш.с, С(3), Pz). Масс-спектр, m/z (интенсивность, %): 404 (M+1, 1%), 403 (М+, 7%), 387 (3,4%), 386 (18,5%), 356 (2%), 246 (2%), 136 (11%), 135 (Ad+, 100%), 107 (9%), 93 (22%), 91 (14,3%), 81 (7,6%), 79 (29%), 77 (13,5%), 67 (13,5%), 55 (11%), 41 (19,3%).
Пример 2. Синтез 1-(1-адамантил)-3,4 динитро-5-(3-нитроииразол-1-ил)-1H-пиразола (II).
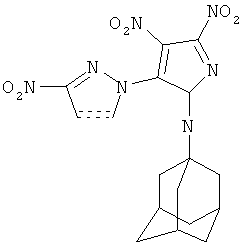
К раствору 0,012 г (0,30 ммоль) NaOH в 1 мл H2O прибавляют 0,034 г (0,30 ммоль) 3-нитро-1Н-пиразола, перемешивают 10 мин. К полученному раствору прибавляют 0,1 г (0,30 ммоль) 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола в 2 мл CH3CN. Реакционную смесь перемешивают 1 ч при комнатной температуре. Из маточного раствора растворитель удаляют в вакууме, добавляют 3 мл H2O, растирают с 1 мл гексана, отфильтровывают выпавший осадок, сушат над Р2О5 в вакууме. Кристаллизуют из смеси МеОН-H2O. Выход 84%, т.пл. 154-155°C. Спектр ЯМР 1H (300 МГц, DMSO-d6, δ, м.д.): 1.60 (с, 6Н, Ad), 2.03 (с, 6Н, Ad), 2.15 (с, 3H, Ad), 7.50 (с, 1H, С(4), Pz), 8.46 (с, 1Н, С(5), Pz). Спектр ЯМР 13С (75 МГц, DMSO-d6, δ, м.д.): 29.11 (γ-С, Ad), 34.69 (δ-С, Ad), 40.52 (β-С, Ad), 69.00 (α-С, Ad), 105.01 (С(4′), Pz), 133.76 (уш. с, С(4), Pz), 140.18 (С(5′), Pz), 145.22 (уш. с, С(5), Pz), 155.94 (уш. с, С(3), Pz), 158.10 (уш.с, С(3′), Pz). Macc-спектр, m/z (интенсивность, %): 403 (M+, 6%), 386 (4,2%), 357 (2%), 316 (2,5%), 202 (4,2%), 136 (11%), 135 (Ad+, 100%), 107 (10%), 93 (24,4%), 91 (18,5%), 79 (33,6%), 77 (15%), 67 (15%), 55 (12,6%), 52 (7,6%), 41 (22%).
Таким образом, разработан технологичный метод синтеза 1-(1-адамантил)-3,4-динитро-5-(N-нитропиразолил)-1H-пиразолов, получаемых с достаточно большим выходом (81-84%).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 1-(1-АДАМАНТИЛ)-3,4-ДИНИТРО-5-(ТИО-R)-1Н-ПИРАЗОЛОВ | 2013 |
|
RU2533711C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АМИНОЗАМЕЩЕННЫХ 1-(1-АДАМАНТИЛ)-3,4-ДИНИТРО-1Н-ПИРАЗОЛОВ | 2013 |
|
RU2533557C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(1-АДАМАНТИЛ)-3,4,5-ТРИНИТРО-1Н-ПИРАЗОЛА | 2012 |
|
RU2528404C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(1-АДАМАНТИЛ)-3,4-ДИНИТРО-5-(O-R)-1H-ПИРАЗОЛОВ | 2013 |
|
RU2533558C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТ-1-ИЛСОДЕРЖАЩИХ АЗОЛОВ | 2005 |
|
RU2280032C1 |
| 1-(1-АДАМАНТИЛ)-4-НИТРОЗОПИРАЗОЛЫ | 2011 |
|
RU2471785C1 |
| N-АДАМАНТИЛБЕНЗОТРИАЗОЛЫ, ПРОЯВЛЯЮЩИЕ АКТИВНОСТЬ ПРОТИВ ВИРУСА ГРИППА А, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2553987C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТ-1-ИЛСОДЕРЖАЩИХ ЭФИРОВ 3-R-4,5-ДИГИДРОИЗОКСАЗОЛ-5-КАРБОНОВЫХ КИСЛОТ | 2011 |
|
RU2461547C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(1-АДАМАНТИЛ)-5R-ТЕТРАЗОЛОВ, ПРОЯВЛЯЮЩИХ АКТИВНОСТЬ ПРОТИВ ВИРУСА ГРИППА А | 2013 |
|
RU2526263C1 |
| Калиевая соль 1,1-динитро-1-(4-нитро-3-(1Н-тетразол-1-ил)-1Н-пиразол-1-ил)метана и способ ее получения | 2018 |
|
RU2674964C1 |
Изобретение относится к химии производных адамантана, а именно к новому способу получения 1-(1-адамантил)-3,4-динитро-5-(N-нитропиразолил)-1H-пиразолов нуклеофильным замещением с нитропиразолами, которые могут являться исходными соединениями для синтеза терапевтически активных веществ. Предложенный способ получения 1-(1-адамантил)-3,4-динитро-5-(N-нитропиразолил)-1H-пиразолов общей формулы, приведенной ниже, заключается во взаимодействии 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола с нитропиразолами, выбранными из ряда: 4-нитро-1H-пиразол, 3-нитро-1H-пиразол в присутствии гидроксида натрия при мольном соотношении 1-(1-адамантил)-3,4,5-тринитро-1H-пиразол, нитропиразол, гидроксид натрия, равном 1:1:1, в среде вода:ацетонитрил при объемном соотношении 1:2 соответственно, при температуре 25°C в течение 1 ч. Техническим результатом является расширение спектра получаемых целевых соединений с достаточно большим выходом. 2 пр.
 ;
;  .
.
Способ получения 1-(1-адамантил)-3,4-динитро-5-(N-нитропиразолил)-1H-пиразолов общей формулы:


 ,
,
заключающийся во взаимодействии 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола с нитропиразолами, выбранными из ряда: 4-нитро-1H-пиразол, 3-нитро-1H-пиразол в присутствии гидроксида натрия при мольном соотношении 1-(1-адамантил)-3,4,5-тринитро-1H-пиразол, нитропиразол, гидроксид натрия, равном 1:1:1, в среде вода:ацетонитрил при объемном соотношении 1:2 соответственно, при температуре 25°C в течение 1 ч.
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТ-1-ИЛСОДЕРЖАЩИХ АЗОЛОВ | 2005 |
|
RU2280032C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ВОДКИ | 1992 |
|
RU2008341C1 |
| КЛИНОВАЯ УДАРНО-ВОЛНОВАЯ ГАЗОДИНАМИЧЕСКАЯ УСТАНОВКА ДЛЯ ФОРМОВАНИЯ БЕТОНОВ | 1999 |
|
RU2163543C2 |
| ГАВРИЛОВ А.С | |||
| И ДР | |||
| "Адамантил азолы: VII | |||
| Кислотно-катализируемое адамантилироваие C-C- и С-N-связанных азолилпиразолов", Журнал общей химии, 74 (5), с.819-829 | |||
Авторы
Даты
2014-11-10—Публикация
2013-08-06—Подача