Изобретение относится к области медицинской химии, химии азолоадамантанов, которые могут рассматриваться как перспективные вещества-кандидаты на роль лекарственных противовирусных веществ, используемых для лечения заболеваний, вызываемых вирусом гриппа А, в том числе пандемически опасных штаммов вируса H1N1. Изобретение может быть использовано при производстве лекарственных веществ, применяемых в терапии заболеваний, вызываемых возбудителями вирусных инфекций.
Техническим результатом заявленного способа является синтез серии новых 1-(1-адамантил)-4R-бензотриазолов, 1-(1-адамантил)-5R-бензотриазолов, 2-(1-адамантил)-4R-бензотриазолов, 2-(1-адамантил)-5R-бензотриазолов (R=H, NO2), проявляющих активность против вируса гриппа А, а также разработка методов синтеза 1-(1-адамантил)-1Н-бензотриазолов из NH-бензотриазолов (незамещенный бензотриазол, 4-нитробензотриазол и 5-нитробензотриазол) и эквимолярного количества 1-адамантанола в среде 94%-ной серной кислоты при 25°C в течение 3-4 часов и 2-(1-адамантил)-2Н-бензотриазолов из эквимолярных количеств NH-бензотриазолов и 1-адамантанола путем длительного кипячения в четыреххлористом углероде в присутствии незначительных количеств 94%-ной серной кислоты.
Первым из известных противовирусных препаратов - производных адамантана - был амантадин (1-аминоадамантан). Он положил начало целому классу противовирусных препаратов, содержащих в молекулярной структуре адамантильный фрагмент. В СССР, вместо амантадина, в практику лечения гриппозной инфекции был внедрен более эффективный и менее токсичный препарат ремантадин [1, 2].

Амантадин и ремантадин имеют одну и ту же мишень: адамантансвязывающий сайт вирусного белка М2 Про25-Сер31. Однако резистентные вирусные штаммы, являющиеся причиной пандемии гриппа в 21-м веке, такие как вирус гриппа A (H1N1), устойчивы к действию указанных выше препаратов. В связи с этим чрезвычайно актуальными являются поиск и разработка новых, активных в отношении вируса гриппа А лекарственных средств с аналогичным амантадину и ремантадину механизмом действия.
Перспективным направлением создания более эффективных лекарственных веществ - аналогов амантадина и ремантадина - является синтез адамантильных производных пятичленных азотсодержащих гетероциклов - азолов. Многие из соединений данного строения показали высокую противовирусную активность, метаболитическую стабильность и сравнительно низкую токсичность [3-6]. Известен способ получения некоторых адамантилимидазолов, адамантилпиразолов, адамантил-1,2,4-триазолов адамантилтетразолов путем нагревания дегидроадамантана и соответствующих NH-гетероциклов в отсутствии растворителя [4]. Еще одним подходом к синтезу адамантилазолов явилось адамантилирование азолов 1-адамантанолом в средах с высокой кислотностью [5, 6].
Известен способ получения 2-(1-адамантил)-5-арилтетразолов [5], который основан на адамантилировании 5-арилтетразолов (RC6H4CN4H, R=H, 4-F, 3-NO2, 2-NO2) 1-адамантанолом в растворе серной кислоты с концентрацией 94% мас. Область применения способа-аналога [5] ограничена получением соединений, содержащих 5-арилтетразолильные производные адамантана. Данная методология позже была усовершенствована в работе [6]. Это позволило синтезировать ряд новых соединений: 2-(адамант-1-ил)-тетразолы, содержащие заместители различной природы в положении 5 тетразольного цикла, а также некоторые неаннелированные 1-(адамант-1-ил)-1,2,4-триазолы [6]. Описанный выше метод не позволяет синтезировать N-адамантилбензотриазолы.
Известен способ [6], который по достигаемому в заявленном изобретении техническому результату и обшей стадии адамантилирования является наиболее близким и выбран в качестве прототипа.
Недостатками известного способа являются невысокий выход конечных продуктов, их недостаточно высокое качество за счет использования не оптимальных кислотных сред на стадии адамантилирования. В прототипе [6] не исследована также возможность адамантилирования 1,2,3-триазола, его производных и соответствующих бензаннелированных аналогов в упомянутых выше условиях. На стадии адмантилирования азолов в известном способе [6] применяют либо серную кислоту с концентрацией 94% мас., либо систему серная кислота : уксусная кислота в массовом соотношении 4:1. При использовании известного способа [6] для адамантилирования 5R-тетразолов с различными заместителями R необходимо каждый раз подбирать оптимальную кислотность среды. Отметим, что все известные на сегодняшний день способы прямого адамантилирования азолов 1-адамантанолом в кислотных средах, в том числе и способ, описанный в прототипе [6], позволяли получать лишь один из возможных N-адамантил региоизомеров.
Заявленный способ восполняет вышеуказанные недостатки прототипа [6].
Техническим результатом заявленного способа является синтез N-адамантилбензотриазолов, проявляющих активность против вируса гриппа А, имеющих общие формулы 1 и 2 [1-(1-адамантил)-1Н-бензотриазолы 1 и 2-(1-адамантил)-2Н-бензотриазолы 2],
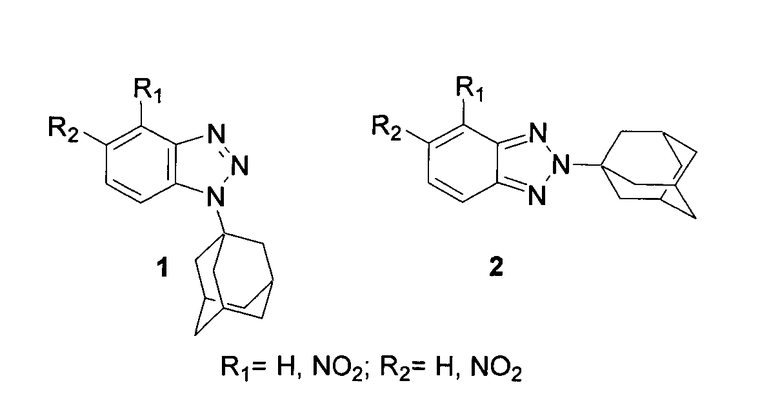
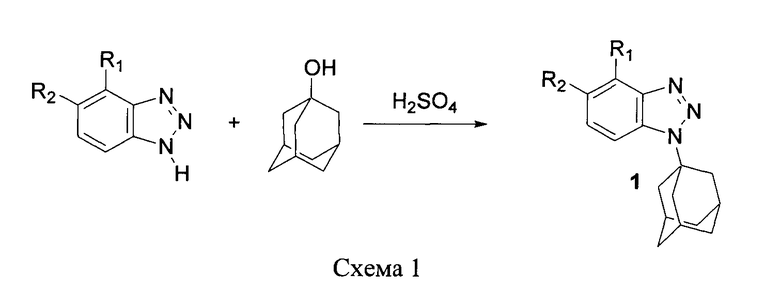
а также разработка методов синтеза 1-(1-адамантил)-1H-бензотриазолов 1 из NH-бензотриазолов (незамещенный бензотриазол, 4-нитробензотриазол и 5-нитробензотриазол) и эквимолярного количества 1-адамантанола в среде 94%-ной серной кислоты при 25°C в течение 3-4 часов (Схема 1)
и 2-(1-адамантил)-2Н-бензотриазолов 2 из эквимолярных количеств NH-бензотриазолов и 1-адамантанола путем длительного кипячения в четыреххлористом углероде в присутствии незначительных количеств 94%-ной серной кислоты (Схема 2) с последующим выделением целевых продуктов путем кристаллизации.
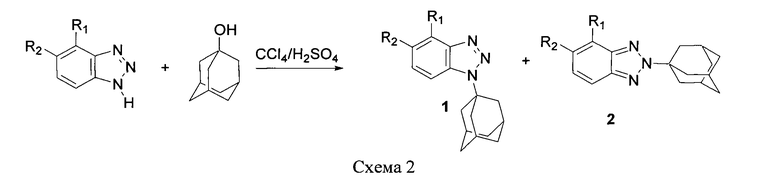
Указанный технический результат достигается тем, что в 94%-ной серной кислоте реакция NH-бензотриазолов с 1-адамантанолом протекает региоспецифично с образованием соответсвующих 1-(1-адамантил)-1,2,3-бензотриазолов (1), в то время как в кипящем четыреххлористом углероде с добавлением нескольких капель серной кислоты исходные соединения реагируют с соединением 1-адамантанолом с образованием, в основном, 2-(1-адамантил)-1,2,3-бензотриазолов (2) с незначительной примесью (по данным ТСХ) изомеров 1. Заявленный технический результат позволяет в препаративных количествах получать оба региоизомера N-адамантилбензотриазолов.
При растворении в концентрированной серной кислоте 2-(1-адамантил)-1,2,3-бензотриазолы (2), по данным ТСХ, быстро разлагаются на исходные соединения, которые в свою очередь превращаются далее в соединения (1). Найденные методы получения соединений (1) и (2) обеспечивают удовлетворительные выходы продуктов реакций и проще в исполнении, чем ранее опубликованные методы - алкилирование триметилсилильного производного 1,2,3-бензотриазола 1-хлорадамантаном в присутствии АlСl3 [7] или алкилирование 1,2,3-бензотриазола 1-бромадамантаном в автоклаве при 190-200°C [8]. Заявленный способ получения соединений 1 и 2 является безопасным и может быть использован для наработки укрупненных количеств данных соединений, активных против вируса гриппа А.
Исследование антивирусной активности соединений 1 и 2, полученных заявляемым способом, выполняли в лаборатории молекулярных основ химиотерапии НИИ Гриппа Минздрава РФ. Для in vitro экспериментов был использован вирус гриппа A/Puerto Rico 8/34 (H1N1). В результате исследований показано, что N-адамантилбензотриазолы 1 и 2 обладают противовирусной активностью, превышающей эталон - ремантадин.
Заявленный способ апробирован в лабораторных условиях в Санкт-Петербургском государственном университете, а также в Санкт-Петербургском государственном технологическом институте (техническом университете) и НИИ Гриппа Минздрава Российской Федерации.
Результаты апробации, полученные в режиме реального времени, представлены в виде конкретных примеров:
Пример 1
1-(1-Адамантил)-1,2,3-бензотриазол. 2.98 г (0.025 моль) 1,2,3-бензотриазола и 3.8 г (0.025 моль) 1-адамантанола растворяли в 50 мл 94%-ной серной кислоты и выдерживали 4 часа при комнатной температуре. Реакционную массу выливали в 1 л ледяной воды, осадок целевого соединения отфильтровывали. Выход 4.7 г (74%). Т. пл. 149-151°C (из этанола). Спектр ЯМР 1H (400 MHz, CDCl3), δ, м.д.: 1.89 с (6Н, Ad), 2.35 с (3Н, Ad), 2.54 с (6Н, Ad), 7.33-7.44 м, 7.83 д, 8.09 д (4Н, бензольное кольцо). Спектр ЯМР 13С (100 MHz, CDCl3), δ, м.д.: 29.63, 36.17, 42.12, 61.52 (адамантил), 112.35, 120.31, 123.26, 126.16, 131.63, 147.00 (бензотриазол). Найдено, %: С 75.69; Н 7.52; N 16.34. C16H19N3. Вычислено, %: С 75.84; Н 7.57; N 16.59.
Пример 2
1-(1-Адамантил)-4-нитро-1,2,3-бензотриазол. Получен аналогично из 0.82 г (0.005 моль) 4-нитро-1,2,3-бензотриазола и 0.76 г (0.005 моль) 1-адамантанола в 25 мл 94%-ной серной кислоты. Выдержка 1.5 часа. Выход 1.33 г (89%). Т. пл. 227-229°C (из толуола). Спектр ЯМР 1Н (400 MHz, CDCl3), δ, м.д.: 1.91 с (6Н, Ad), 2.39 с (3Н, Ad), 2.56 с (6Н, Ad), 7.58 т, 8.23 т (3Н, бензольное кольцо). Спектр ЯМР 13С (100 MHz, CDCl3), δ, м.д.: 29.60, 35.98, 42.31, 62.99 (адамантил), 119.04, 120.55, 125.30, 134.098, 139.59 (бензотриазол). Найдено, %: С 64.89; Н 6.34; N 19.21. C16H18N4O2. Вычислено, %: С 64.40; Н 6.09; N 18.78.
Пример 3
1-(1-Адамантил)-5-нитро-1,2,3-бензотриазол. Получен аналогично из 0.66 г (0.004 моль) 4-нитро-1,2,3-бензотриазола и 0.61 г (0.004 моль) 1-адамантанола в 25 мл 94%-ной серной кислоты. Выдержка 3 часа. Технический продукт (0.79 г, 66%) очищали хроматографированием на колонке (силикагель L 200/250µ фирмы Chemapol, элюент - хлороформ), испаряли растворитель, остаток перекристаллизовывали из толуола и получали 0.13 г продукта (11%). Т. пл. 240-243°C. Спектр ЯМР 1Н (400 MHz, CDCl3), δ, м.д.: 1.93 с (6Н, Ad), 2.41 с (3Н, Ad), 2.57 с (6Н, Ad), 8.22 к, 8.78 с (3Н, бензольное кольцо). Спектр ЯМР 13С (100 MHz, CDCl3), δ, м.д.: 29.60, 35.95, 42.44, 63.19 (адамантил), 109.41, 118.44, 121.01, 130.71, 145.39, 149.04 (бензотриазол). Найдено, %: С 64.12; Н 6.38; N 18.52. C16H18N4O2. Вычислено, %: С 64.40; Н 6.09; N 18.78.
Пример 4
2-(1-Адамантил)-1,2,3-бензотриазол. 0.6 г (0.005 моль) 1,2,3-бензотриазола и 0.76 г (0.005 моль) 1-адамантанола растворяли в 30 мл ССl4, добавляли 4 капли 94%-ной серной кислоты и кипятили 30 часов с обратным холодильником. Реакционную массу разбавляли 20 мл CCl4, промывали 2%-ным раствором Na2СО3 и водой, растворитель испаряли. Остаток (1.2 г), содержавший также по данным ТСХ 1H-изомер, перекристаллизовывали из водного этанола и выделяли целевой продукт. Выход 0.66 г (52%). Т. пл. 102-103°C [5]. Спектр ЯМР 1H (400 MHz, CDCl3), δ, м.д.: 1.86 с (6Н, Ad), 2.33 с (3Н, Ad), 2.48 с (6Н, Ad), 7.38 кв, 7.90 кв (4Н, бензольное кольцо). Спектр ЯМР 13С (100 MHz, CDCl3), δ, м.д.: 29.69, 36.08, 42.84, 64.67 (адамантил), 118.07, 125.83, 143.64 (бензотриазол). Найдено, %: С 75.82; Н 7.45; N 16.70. C16H19N3. Вычислено, %: С 75.84; Н 7.57; N 16.59.
Пример 5
2-(1-Адамантил)-4-нитро-1,2,3-бензотриазол. Получали аналогично из 0.82 г (0.005 моль) 4-нитро-1,2,3-бензотриазола и 0.76 г (0.005 моль) 1-адамантанола в 35 мл CCl4 с 6 каплями серной кислоты. Выдержка 72 часа. Технический продукт (0.88 г), содержавший также по данным ТСХ 1H-изомер, перекристаллизовывали из 2-пропанола и выделяли целевой продукт. Выход 0.2 г (13%). Т. пл. 150-152°C. Спектр ЯМР 1Н (400 MHz, CDCl3), δ, м. д.: 1.87 с (6Н, Ad), 2.37 с (3Н, Ad), 2.54 с (6Н, Ad), 7.52 т, 8.29 д, 8.38 д (3Н, бензольное кольцо). Спектр ЯМР 13С (100 MHz, CDCl3), δ, м. д.: 29.67, 35.92, 42.76, 66.52 (адамантил), 123.85, 124.31, 126.17, 136.72, 145.95 (бензотриазол). Найдено, %: С 64.46; Н 6.34; N 19.21. C16H18N4O2. Вычислено, %: С 64.40; Н 6.09; N 18.78.
Заявленный способ получения N-адамантилбензотриазолов [1-(1-адамантил)-1Н-бензотриазолов 1 и 2-(1-адамантил)-2Н-бензотриазолов 2 (R=H, NO2)], проявляющих активность против вируса гриппа А, имеет существенные технико-экономические преимущества по сравнению с известным мировым уровнем техники: он является пожаробезопасным, поскольку в процессе синтеза практически не используются горючие материалы; позволяет синтезировать раздельно два региоизомера N-адамантилбензотриазолов, используют различные условия с высоким выходом; все операции, входящие в данный процесс, легко масштабируемы, данный способ может быть использован для производства укрупненных количеств целевых продуктов.
Источники информации
1. US Pat. 3,852,352, С07 с 87/40, Dec. 3, 1974.
2. US Pat. 4,551,552, C07 с 85/11, Nov. 5, 1985.
3. Киселев O.H. Химиопрепараты и химиотерапия гриппа. - СПб: «Росток», 2012. - 272 с.
4. RU Патент РФ №2,280,032.
5. Сараев В.В., Гаврилов А.С., Голод Е.Л. Адаматилтетразолы II. Реакции 1-Адамантанола с тетразолом и 5-замещенными тетразолами в серной кислоте. Журн. Орг.Хим., 1999, т.35, вып.7, с.1093-1096.
6. Zarubaev V.V., Golod Е.L., Anfimov Р.М, Shtro A.A., Saraev V.V., Gavrilov A.S., Logvinov А.V., Kiselev О.I. Synthesis and anti-viral activity of azolo-adamantanes against influenza A virus. Bioorganic & Medicinal Chemistry 2010, vol.18, p.839-848 (прототип).
7. Sasaki Т., Hakamishi A., Ohno M. // Chem. Pharm. Bull. 1982. Vol.30. N 6. P.2051-2060.
8. Gonzalez M.E., Alarcon В., Cabildo P., Claramunt R.M., Sanz D., Elguero J. // Eur. J. Med. Chem. 1985. Vol.20. N 4. P.359-362.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-(1-АДАМАНТИЛ)-5R-ТЕТРАЗОЛОВ, ПРОЯВЛЯЮЩИХ АКТИВНОСТЬ ПРОТИВ ВИРУСА ГРИППА А | 2013 |
|
RU2526263C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АДАМАНТИЛИРОВАННЫХ АМИДОВ | 2013 |
|
RU2549901C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АМИНОЗАМЕЩЕННЫХ 1-(1-АДАМАНТИЛ)-3,4-ДИНИТРО-1Н-ПИРАЗОЛОВ | 2013 |
|
RU2533557C1 |
| Способ получения (1-адамантил)фуранов | 2017 |
|
RU2661482C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-(1-АДАМАНТИЛ)АНИЛИНА | 2014 |
|
RU2549902C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТ-1-ИЛСОДЕРЖАЩИХ АЗОЛОВ | 2005 |
|
RU2280032C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(1-АДАМАНТИЛ)-3,4,5-ТРИНИТРО-1Н-ПИРАЗОЛА | 2012 |
|
RU2528404C2 |
| ЗАМЕЩЁННЫЕ ИЗОКСАЗОЛЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2733945C2 |
| [1,2,4]Триазоло[3,4-b][1,3,4]тиадиазины, проявляющие активность против вируса гриппа А, и способ их получения | 2022 |
|
RU2824814C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(1-АДАМАНТИЛ)-3,4-ДИНИТРО-5(N-НИТРОПИРАЗОЛИЛ)-1H-ПИРАЗОЛОВ | 2013 |
|
RU2532268C1 |
Изобретение относится к области органической химии, а именно к производным N-адамантилбензотриазола 1 и 2, где R1 и R2 являются водород или нитрогруппа. Также изобретение относится к способу получения соединения формул 1 и 2. Технический результат: получены новые производные N-адамантилбензотриазола, проявляющие активность против вируса гриппа А. 3 н.п. ф-лы. 5 пр.
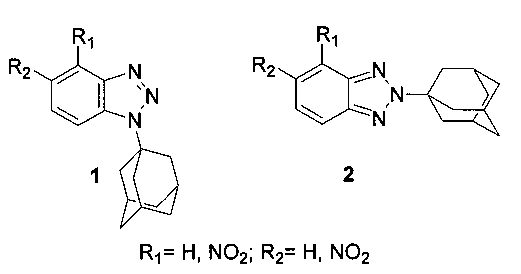
1. N-Адамантилбензотриазолы, проявляющие активность против вируса гриппа А, имеющие общие формулы 1 и 2 [1-(1-адамантил)-1Н-бензотриазолы 1 и 2-(1-адамантил)-2Н-бензотриазолы 2], которые могут быть использованы в качестве лекарственных веществ,

где R1 и R2 есть водород или нитрогруппа.
2. Способ получения N-адамантилбензотриазолов, проявляющих активность против вируса гриппа А, заключающийся в том, что для получения 1-(1-адамантил)-1Н-бензотриазолов 1 исходные NH-бензотриазолы (незамещенный бензотриазол, 4-нитробензотриазол и 5-нитробензотриазол) обрабатывают эквимолярным количеством 1-адамантанола в среде 94%-ной серной кислоты, после чего реакционную массу смешивают с водой, нейтрализуют водным раствором карбоната натрия, выпавший продукт отфильтровывают и очищают кристаллизацией из водного этанола, отличающийся тем, что для получения 1Н-изомеров 1 реакционную массу выдерживают при 25°С в течение 3-4 часов.
3. Способ получения N-адамантилбензотриазолов, проявляющих активность против вируса гриппа А, заключающийся в том, что для получения 2-(1-адамантил)-2Н-бензотриазолов 2 раствор эквимолярных количеств NH-бензотриазолов и 1-адамантанола в органическом растворителе нагревают в присутствии 94%-ной серной кислоты, после чего реакционную массу смешивают с водой, нейтрализуют водным раствором карбоната натрия, отделяют и испаряют органический слой, полученный продукт очищают кристаллизацией из водного этанола, отличающийся тем, что для получения 2Н-изомеров 2 в качестве растворителя используют четыреххлористый углерод, в котором нагревают реакционную смесь до температуры кипения и выдерживают в течение 30-70 часов, 94%-ную серную кислоту берут в соотношении четыреххлористый углерод/серная кислота 100/1.
| Kolocouris N | |||
| et al: "Synthesis and antiviral activity evaluation of some new aminoadamantane derivatives | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Zarubaev V.V | |||
| et al: "Synthesis and anti-viral activity of azolo-adamantanes against influenza A virus", Bioorganic & Medicinal Chemistry, 18(2), 2010, pp.839-848 | |||
| ПРОИЗВОДНЫЕ КАРБАМОИЛБЕНЗОТРИАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ЛИПАЗ И ФОСФОЛИПАЗ | 2006 |
|
RU2430096C2 |
Авторы
Даты
2015-06-20—Публикация
2013-12-26—Подача