Уровень техники, к которой относится изобретение
Настоящее изобретение относится в целом к области радиофармацевтических соединений и к их применению в области ядерной медицины в качестве радиометок, визуализирующих агентов, а также для лечения различных болезненных состояний. Хорошо известно, что опухоли могут экспрессировать уникальные белки, связанные с их злокачественным генотипом, или же они могут суперэкспрессировать структурные белки в большем количестве, чем нормальные клетки. Экспрессия отдельных белков на поверхности опухолевых клеток предоставляет возможность диагностировать и охарактеризовывать болезнь, устанавливая фенотипическую идентичность и биохимический состав, а также активность опухоли. Радиоактивные молекулы, которые селективно связываются со специфическими белками поверхности опухолевой клетки предлагают заманчивый путь визуализации и лечения опухолей в неинвазивных условиях. В частности, авторы настоящего изобретения обнаружили, что радиомеченые лиганды для белка PSMA, часто сверхэкспрессируемого на многих раковых клетках, предлагают заманчивый путь для неинвазивной визуализации и селективного нацеливания на раковые клетки.
По меньшей мере 1 миллион мужчин болеют раком простаты и, согласно расчетам, эта болезнь поразит каждого шестого мужчину в США в возрасте от 60 до 80 лет. Каждый год диагностируется более 300000 новых случаев рака простаты. Рак простаты затронет каждого шестого мужчину в Соединенных штатах, а смертность от этой болезни уступает только раку легких. По расчету во всем мире в настоящее время расходуется 2 миллиарда долларов на хирургическое, радиационное, лекарственное лечение и на минимально инвазивные методы лечения, из которых 1 миллиард расходуется в США. В настоящее время не существует эффективной терапии для рецидивирующего, метастатического и андроген-независимого рака простаты. Необходимы новые агенты, которые сделают возможной быструю визуализацию рака простаты и специфическое нацеливание для проведения радиотерапии.
N-Ацетилированная альфа-связанная кислотная дипептидаза (NAALADapзa), известная также как глутамат-карбоксипептидаза II (GCPII), является нейропептидазой, которая расщепляет N-ацетиласпартилглутамат (NAAG) до N-ацетиласпартата и глутамата в нервной системе (см. ниже описание гидролитического расщепления NAAG с помощью NAALDaзы через тетраэдрический интермедиат). Ферментом является белок типа II сокаталитического класса металлопептидаз, содержащий в активном центре два атома цинка
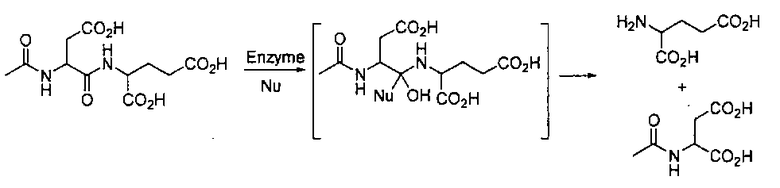
Было показано, что независимо от ее характеристик в нервной системе одна из форм NAALADaзы экспрессируется в простатических аденокарциномах человека, по причине чего получила название: простата-специфичный мембранный антиген (PSMA). Известно, что ген NAALADaзы/PSMA продуцирует множество сплетенных форм mРНК, и на основе иммуногистохимических свидетельств пришли к выводу, что человеческие мозг и простата экспрессируют разные изоформы фермента.
Простата-специфический мембранный антиген (PSMA) человека, известный также как фолатгидрогеназа I (FOLH1), представляет собой трансмембранный гликопротеин типа II с 750 аминокислотными остатками, который экспрессируется главным образом в нормальном эпителии простаты человека, но регулируется с повышением в раковой простате, включая метастазирование. PSMA является уникальной экзопептидазой, обладающей реактивностью в отношении поли-гамма-глутаминированных фолатов и способной удалять поли-гамма-глутамильные концевые группы. Поскольку PSMA экспрессируется практически всеми раками простаты и его экспрессия еще больше усиливается в низкодифференцированных, метастатических и гормононезависимых карциномах, он является весьма привлекательной целью для визуализации и терапии простаты. Разработка лигандов, которые взаимодействуют с PSMA и несут на себе подходящие радионуклиды, может предоставить многообещающий и при этом новый вариант нацеливания для детектирования, лечения и отслеживания развития рака простаты.
Радиоиммуноконъюгатная форма моноклонального aнти-PSMA-антитела (mAb) 7Е11, известного как PROSTASCENT scan, используется в настоящее время для диагностирования метастаза и рецидивов рака простаты. Относительно недавно были разработаны моноклональные антитела, которые связываются с экстрацеллюлярным доменом PSMA. С помощью нанесенных на эти антитела радиометок было показано, что эти антитела накапливаются в PSMA-положительных моделях опухоли простаты у животных.
Хотя моноклональные антитела и являются многообещающими с точки зрения детектирования и терапии, клинические успехи, если не считать лимфомы, ограничены из-за низкой проникающей способности этих антител в солидные опухоли. Низкомолекулярные миметики, обладающие более высокой проникающей способностью в солидные опухоли, имеют решающее преимущество, позволяя достигать высокого содержания на грамм и высокой степени специфического связывания.
Селективное нацеливание на раковые клетки радиофармацевтическими средствами, как для визуализации, так и с терапевтической целью, является стимулирующим фактором. Известно множество радионуклидов, которые могут быть использованы для радиовизуализации, в том числе Ga-67, Tc-99m, In-111, I-123 и I-131. Предпочтительным радиоизотопом для медицинской визуализации является Тс-99m, поскольку он имеет малое (6 ч) время полураспада, легко доступен по относительно низкой цене и излучает гамма-фотоны 140 кэВ. Кроме того, в солевом растворе при давлении 1 атм оксида углерода (СО) могут быть легко приготовлены комплексы Тс-99m, такие как стойкий к воде и воздуху Тс(I)-комплекс [99mТс(ОН2)3(СО)3]+.
Раскрытие изобретения
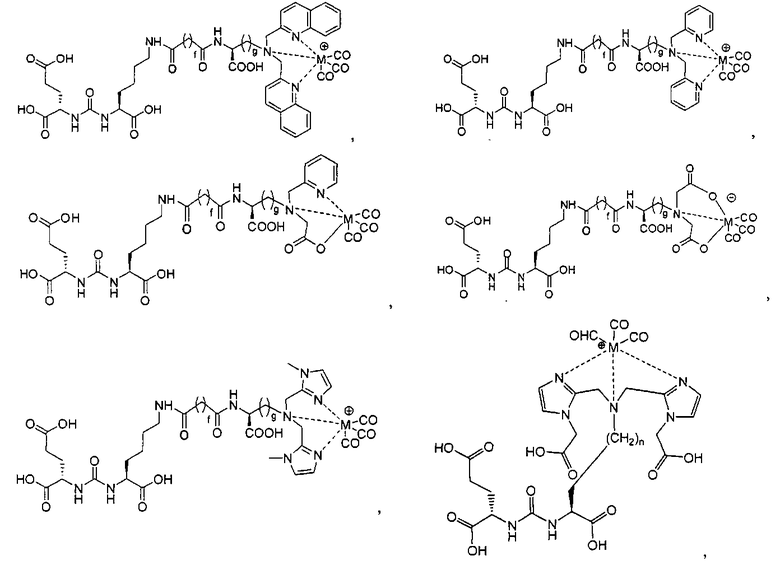
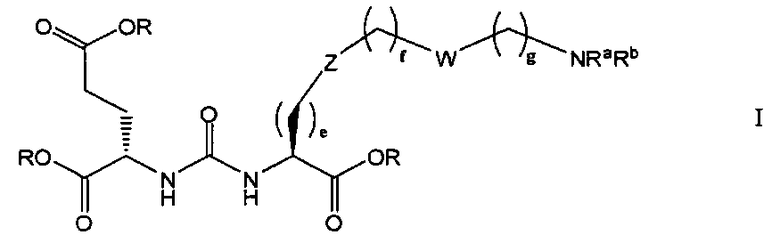
В одном из аспектов получено соединение формулы I или его фармацевтически приемлемая соль или ее сольват:
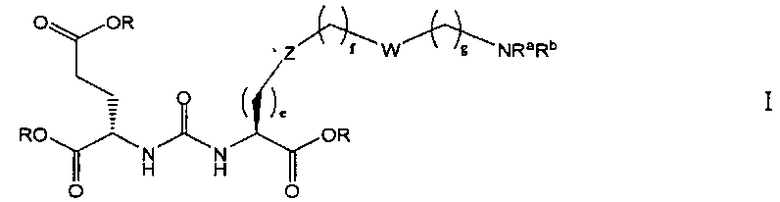
где R обозначает Н, ион аммония, ион алкиламмония, ион щелочноземельного металла, ион редкоземельного металла или алкильную группу; W обозначает связь, -NHC(O)-, -CH(NH2)-, -NH-C(O)-NH-, -C(O)-NH-, -C(O)-NH-CH(COOH)-, -O-(CH2)n-O-(CH2)n-, -(CH2)nO(CH2)nO(CH2)n; -CH(NHFmoc)-; Z обозначает связь, -CO(O)-, -NH-, -NHC(O)-, -NH-C(O)-NH-, -NH-C(O)-(CH2)n-, -NH-C(O)-CH(NH2)-, -C(O)-NH-CH(COOH)- или -NH-C(O)-C6H4-(CH2)n-NH-; NRaRb обозначает хелаторную группу формулы:
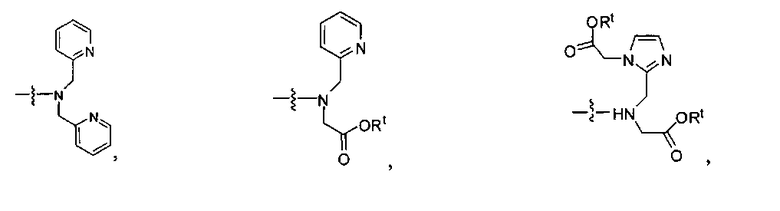
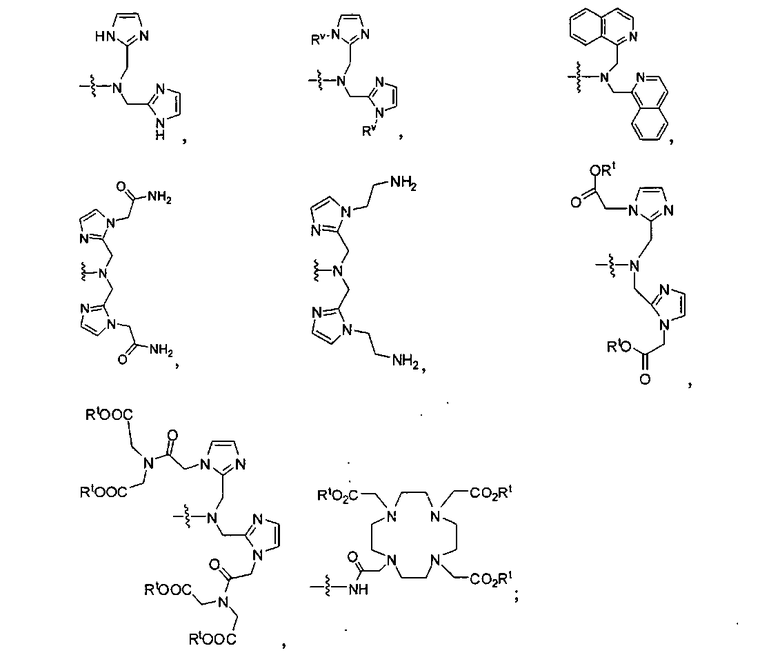
Rt обозначает Н, C1-C8-алкильную группу, ион аммония, ион алкиламмония или ион щелочного или щелочноземельного металла; Rv обозначает алкилалкил, замещенный аминоалкил, аминоалкил или ацетамидоалкил; е есть целое число от 0 до 15; f есть целое число от 0 до 15; g есть целое число от 0 до 15; и n есть целое число от 0 до 10; при условии, что когда NRaRb является:
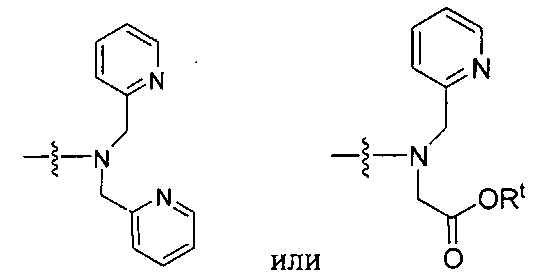
то, когда W является связью, Z не является связью, -C(O)-NH- или -NHC(O)-; и когда Z является связью, W не является связью, -C(O)-NH- или -NHC(O)-.
В некоторых вариантах осуществления Rv является метилом, этилом, н-пропилом, н-бутилом, изобутилом, трет-бутилом, аминоалкилом, гидроксиалкилом или карбоксиалкилом. В некоторых вариантах осуществления Rv является метилом. В некоторых вариантах осуществления каждый Rt независимо является Н или трет-бутилом. В некоторых вариантах осуществления Rt является водородом. В некоторых вариантах осуществления е есть целое число от 0 до 4, f есть целое число от 0 до 12, и g есть целое число от 0 до 6. В некоторых вариантах осуществления W означает -C(O)-NH-.
В некоторых вариантах осуществления соединением формулы I является:
фармацевтически приемлемая соль или ее сольват; е есть целое число от 0 до 10; f есть целое число от 0 до 12; g есть целое число от 0 дo 12; и n есть целое число от 0 до 10.
В некоторых вариантах осуществления Z обозначает -NH-C(O)-. В некоторых вариантах осуществления Z обозначает -C(O)-NH-CH(COOH)-. В некоторых вариантах осуществления Z обозначает -NH-C(O)-CH(NH2)-.
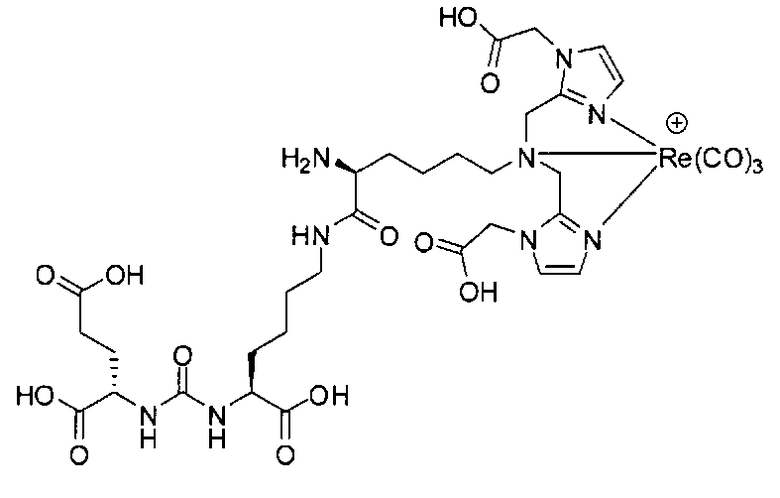
В другом аспекте получен комплекс, включающий металл и соединение формулы I. В некоторых вариантах осуществления металлом является Re, Тс, Y, Lu, Ga, In или Сu. В некоторых вариантах осуществления металлом является радионуклид. В некоторых вариантах осуществления металлом является технеций-99m, рений-186 или рений-188.
В некоторых вариантах осуществления металлом в комплексе является Y, Lu, Ga, In или Сu, и при этом комплекс включает NRaRb, представляющий собой группу формулы:
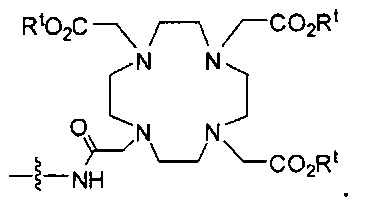
В некоторых вариантах осуществления комплексом является:
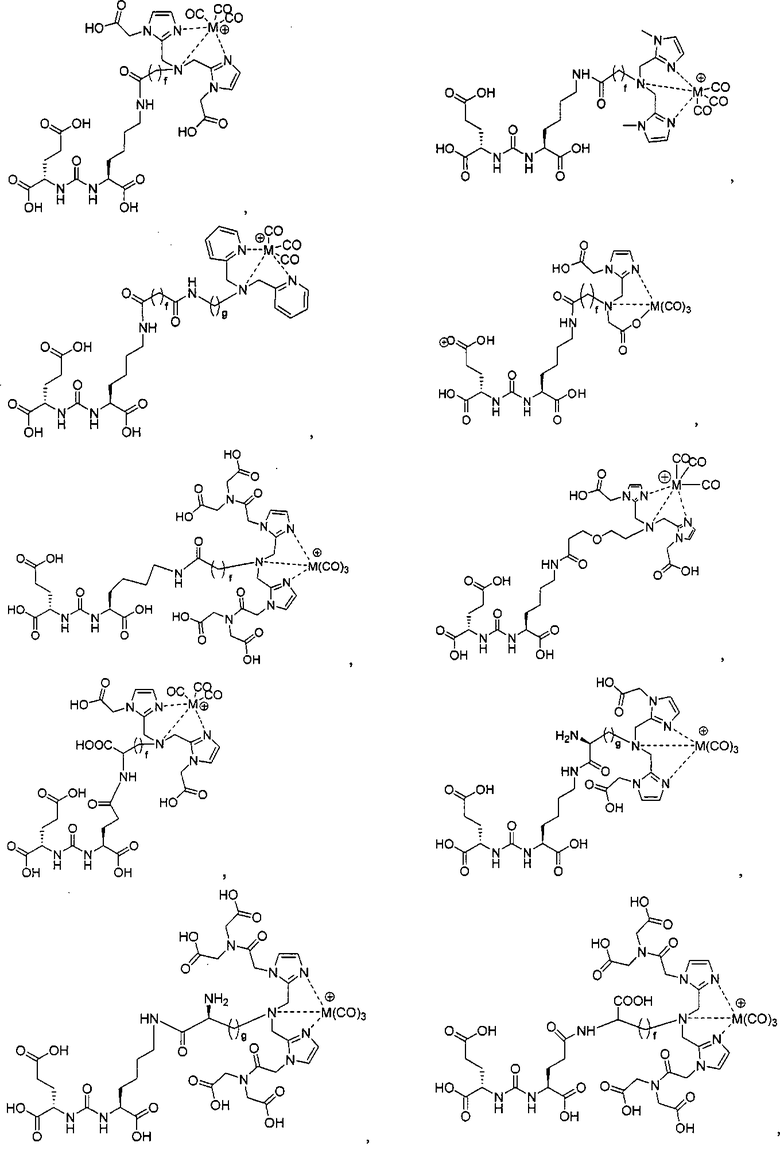
их фармацевтически приемлемые соли и сольваты; Re, Тс, Y, Lu, Ga, Сu; е есть целое число от 0 до 10; f есть целое число от 0 до 12; g есть целое число от 0 до 12; и n есть целое число от 0 до 10.
В еще одном аспекте предлагается фармацевтический состав, включающий в себя соединение формулы I, его фармацевтически приемлемую соль или сольват и фармацевтически приемлемый наполнитель.
В еще одном аспекте предлагается метод визуализации какой-либо области у пациента, включающий введение пациенту диагностически эффективного количества соединения формулы I, его фармацевтически приемлемой соли или сольвата и получение изображения этой области у пациента.
В еще одном аспекте предлагается метод визуализации ткани, такой как ткань селезенки, ткань почек или ткань PSMA-экспрессирующей опухоли, включающий осуществление контакта ткани с комплексом, имеющим радиоактивный металл и соединение, включающее в себя группу формулы:
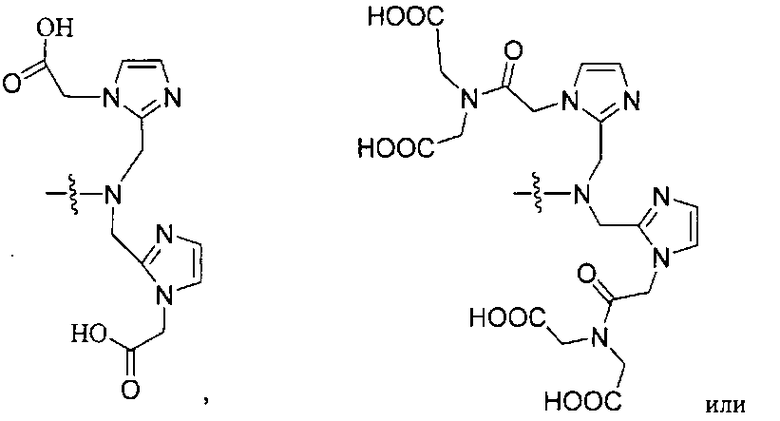
ее фармацевтически приемлемую соль или сольват. В некоторых вариантах осуществления тканью является PSMA-экспрессирующая опухолевая ткань. В других вариантах осуществления PSMA-экспрессирующей опухолевой тканью является рак простаты.
Краткое описание чертежей
Фиг.1 - график распределения по тканям 99mТс-комплекса соединения примера 3 у мыши LNCaP Xenograft в % лекарства на орган.
Фиг.2 - кривые конкурентного связывания для сравнительных и иллюстративных соединений согласно формуле I для белка PSMA.
Фиг.3 - график биораспределения по тканям 99mТс-комплекса соединения примера 8, выраженного в виде % инъецируемой дозы/г.
Фиг.4 - график биораспределения по тканям 99mТс-комплекса соединения примера 7, выраженного в виде % ID/г.
Фиг.5 - график, сравнивающий биораспределение по тканям для 99mТс-комплекса у мыши LNCaP Xenograft в виде % ID/г.
Фиг.6 - рисунок, иллюстрирующий биораспределение по тканям для 99mТс-комплекса соединения примера 6 у мыши LNCaP Xenograft в разные отрезки времени и согласно некоторым вариантам осуществления.
Осуществление изобретения
Существуют две категории радиофармацевтических соединений: (i) соединения, биологическое распределение которых определяется исключительно кровотоком или перфузией и нацеленным на высокоемкие системы, такие как гломерулярная фильтрация, фагоцитоз, клиренс гепатоцитов и абсорбция в костную ткань; и (ii) соединения, распределение которых определяется специфическими энзиматическими взаимодействиями или взаимодействиями при связывании с рецепторами, которые представляют собой малоемкие центры. Радиофармацевтические соединения изобретения принадлежат ко второй категории и синтезируются путем сопряжения координационного комплекса радионуклида с биологически активной молекулой, селективной для какого-либо конкретного белка или представляющего интерес рецептора.
Хотя в качестве носителей может быть использовано множество биологически активных молекул (БАМ), небольшие молекулы и небольшие пептиды имеют преимущества над антителами или белками. Например, небольшие молекулы и небольшие пептиды характеризуются повышенной диффузией, более высоким клиренсом в крови и более низкой фоновой радиацией. Эти носители обеспечивают легкий синтез аналогов с высоким выходом. Кроме того, небольшие пептиды можно легко превращать в пептидные миметики или небольшие молекулярные аналоги, обладающие повышенной стабильностью и повышенным сродством к целевому ферменту или рецептору.
В одном из аспектов предлагаются синтез и методы использования селективных в отношении PSMA комплексов технеция и рения согласно формулам I-IV в качестве новых радиофармацевтических соединений для обработки и визуализации раковых клеток. Более конкретно, эти соединения могут использоваться для нацеливания на карциному простаты
Определения
Для удобства здесь собраны некоторые термины, используемые в тексте и в приложенной формуле изобретения.
В рамках представлений заявки выражение «примерно (приблизительно)» должно быть понятно специалисту и до определенной степени меняться в зависимости от контекста, в котором это выражение используется. Если встречается использование этого выражения, которое для специалиста не ясно из контекста, в котором оно использовано, «примерно (приблизительно)» будет означать до плюс-минус 10% от конкретного выражения.
Описанные в заявке варианты осуществления могут быть вполне использованы на практике в отсутствие какого-либо элемента или элементов, ограничения или ограничений, которые не раскрыты в заявке специальным образом. Так, например, выражения «содержащий», «включающий (в себя)» и т.д. будут иметь расширительный смысл и не иметь ограничений. Кроме того, используемые в заявке термины и выражения использованы как средства описания, а не ограничения, и использование таких терминов или выражений не преследует цели исключения каких-либо эквивалентов показанных и описанных признаков или их частей, но принимается, что в рамках сути заявленной технологии возможны различные модификации. Кроме того, выражение «состоящий в основном из» следует понимать как включение специально названных элементов, а также дополнительных элементов, которые не влияют материальным образом на базовые и новые характеристики заявленной технологии. Выражение «состоящий из» исключает какой-либо из неназванных элементов.
Используемые в заявке термины «липофильная группа» и «липофильный фрагмент» относятся к группе, фрагменту или заместителю, имеющим большее сродство к неполярным или неводным средам, чем к полярным или водным средам. Например, доступный в интернете словарь Merriam Webster определяет "липофильный» как «имеющий сродство к липидам (таким как жиры)». К числу типичных липофильных фрагментов относятся алифатические углеводородные радикалы, например алкильные радикалы, ароматические углеводородные радикалы и длинноцепочечные ацильные радикалы, у всех из которых липофильность возрастает с увеличением числа структурных углеродных атомов. Как правило, добавление липофильного фрагмента к какому-либо соединению будет повышать сродство этого соединения к октанолу в стандартном детерминационном протоколе, который может быть использован в качестве меры относительной гидрофобности (липофильности) и гидрофильности.
Термины «основание Льюиса» и «основный по Льюису» относятся к химическому фрагменту, способному в определенных реакционных условиях отдать пару электронов. В случае некоторых комплексов в зависимости от конкретного основания Льюиса и иона металла может оказаться возможным характеризовать основание Льюиса как отдающее один электрон, однако для большинства целей основание Льюиса в наилучшей степени воспринимается как донор двух электронов. В число основных фрагментов Льюиса входят незаряженные соединения, такие как спирты, тиолы и амины, и заряженные фрагменты, такие как алкоксиды, тиолаты, карбанионы и множество других органических анионов. В некоторых примерах основание Льюиса может состоять из единственного атома, такого как оксид (О2 -). В некоторых менее типичных обстоятельствах основание или лиганд Льюиса может быть положительно заряженным. При координировании с ионом металла основание Льюиса часто называют лигандом.
Термин «лиганд» относится к частице, которая тем или иным образом взаимодействует с другой частицей. В одном из примеров лигандом может быть основание Льюиса, способное образовывать с кислотами Льюиса координационную связь. В других примерах лиганд является частицей, часто органической, которая образует координационную связь с ионами металлов. Будучи координированы с ионами металлов, лиганды могут иметь различного рода связи, известные специалистам, которые включают в себя, например, концевую связь (т.е. связь с одним ионом металла) или мостиковую связь (т.е. связь основания Льюиса с более чем одним ионом металла).
Термин «хелатирующий агент» относится к молекуле, часто к органической молекуле и часто к основанию Льюиса, имеющим две или более неподеленные электронные пары, доступные для передачи иону металла. Ион металла обычно координируется с хелатирующим агентом с помощью двух или более электронных пар. Выражения «бидентатный хелатирующий агент», «тридентатный хелатирующий агент» и «тетрадентатный хелатирующий агент» узаконены на практике и относятся к хелатирующим агентам, имеющим, соответственно, две, три или четыре электронные пары, легко доступные для одновременной отдачи координированному с хелатирующим агентом иону металла. Обычно электронные пары хелатирующего агента образуют координационные связи с более чем одним ионом металла при использовании для этого различных возможных способов связывания.
Термин «координация» относится к взаимодействию, в котором один донор с несколькими электронными парами координационно связывается (координируется) с одним ионом металла.
Термин «комплекс» относится к соединению, образованному одной (одним) или более способными к независимому существованию молекулами или атомами, имеющими избыток или дефицит электронов, с одной (одним) или более способными к независимому существованию электронодефицитными молекулами или атомами
Fmoc является аббревиатурой химической группы: фторфенилметилоксикарбонил.
Используемое в заявке выражение «терапевтически эффективное количество» означает количество соединения, материала или композиции, содержащей соединение, которое эффективно для оказания некоторого желаемого терапевтического эффекта для по крайней мере субпопуляции клеток у какого-либо животного при разумном балансе пользы и риска и которое может быть использовано для какого-либо медицинского лечения.
В рамках представлений заявки выражение «лечащий» или «лечение» предполагает также включение сюда диагностики, профилактики, терапии и излечения. Пациентом, получающим такое лечение, является любое нуждающееся в таком лечении животное, включая приматов, в частности человека и других млекопитающих, таких как лошади, крупный рогатый скот, свиньи и овцы, а также домашняя птица и комнатные животные в целом.
Выражение «фармацевтически приемлемый» используется в заявке в отношении соединений, материалов, композиций и/или дозированных форм, которые, с точки зрения здравого медицинского суждения, являются пригодными для их применения в контакте с тканями человека и животных без проявления излишней токсичности, раздражения, аллергических реакций или какой-либо другой проблемы или осложнения, соответствуя разумному балансу между пользой и риском.
Используемое в заявке выражение «фармацевтически приемлемый носитель» означает фармацевтически приемлемый материал, композицию или основу, такую как жидкий или твердый наполнитель, разбавитель, эксципиент или растворитель, в которые заключен материал, участвующие в переносе или транспорте представляющего интерес соединения из одного органа или части тела в другой орган или часть тела. Каждый носитель может быть «приемлемым» в том смысле, что он совместим с другими ингредиентами состава и не приносит вреда пациенту. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают в себя (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатина; (7) тальк; (8) эксципиенты, такие как масло какао и парафины для суппозиториев; (9) масла, такие как кокосовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) не содержащую пирогенов воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) забуференные растворы; (21) полиэстеры, поликарбонаты и/или полиангидриды и (22) другие нетоксичные совместимые вещества, используемые в фармацевтических составах.
Используемые в заявке выражения «парентеральное введение» или «принятое парентерально» означает введение, отличное от введения внутрь или местного применения, обычно в виде инъекции, которое (без ограничения изобретения) включает внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, внутрипозвоночную и интрастернальную инъекцию и вливание.
Используемые в заявке выражения «системное введение», «системно введенное», «периферическое введение» и «периферически введенное» означают введение какого-либо соединения, лекарства или другого материала иначе чем непосредственно в центральную нервную систему, так как они поступают в систему пациента и, таким образом, подвергаются метаболизму или каким-либо другим подобным процессам, например подкожное введение.
Термин «аминокислота» относится ко всем соединениям, природным или синтетическим, которые включают в себя как аминную функцию, так и кислотную функцию, в том числе аналоги и производные аминокислот.
Термин «гетероатом» относится к атому какого-либо элемента, отличному от углерода и водорода. Иллюстративные гетероатомы включают в себя бор, азот, кислород, фосфор, серу и селен.
Как правило, «замещенный» относится к алкильной или алкенильной группе, которые определены ниже (например, к алкильной группе), в которых одна или более содержащихся в них связей с атомом водорода заменены связью с неводородным или неуглеродным атомами. Замещенные группы также включают в себя группы, в которых одна или более связей с атомом(ами) углерода или водорода заменены одной или более связями, включающими двойные или тройные связи, с гетероатомом. Таким образом, замещенная группа, если не указано иное, будет замещена одним или более заместителями. В некоторых вариантах осуществления замещенная группа замещена 1, 2, 3, 4, 5 или 6 заместителями. Примеры групп-заместителей включают галогены (т.е. F, Сl, Вr и I); гидроксилы; группы алкокси, алкенокси, алкинокси, арилокси, аралкилокси, гетероциклилокси и гетероциклилалкокси; карбонилы (оксо); карбоксилы; сложные эфиры; уретаны; оксимы; гидроксиламины; алкоксиамины; аралкоксиамины; тиолы; сульфиды; сульфоксиды; сульфоны; сульфонилы; сульфонамиды; амины; N-оксиды; гидразины; гидразиды; гидразоны; азиды; амиды; мочевины; амидины; гуанидины; енамины; имиды; изоцианаты; изотиоцианаты; цианаты; тиоцианаты; имины; нитрогруппы; нитрилы (т.е. CN) и т.п.
Алкильные группы включают в себя нормальные или разветвленные алкильные группы, имеющие от 1 до 12 атомов углерода, типично от 1 до 10 атомов углерода, в некоторых вариантах осуществления от 1 до 8, от 1 до 6 или от 1 до 4 атомов углерода. Примеры нормальных алкильных групп включают такие группы как метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил и н-октил. Примеры разветвленных алкильных групп включают (но не ограничиваясь ими) группы изопропил, изобутил, втор-бутил, трет-бутил, неопентил, изопентил и 2,2-диметилпропил. Алкильные группы могут быть замещенными или незамещенными. Если не указано какое-либо иное число атомов углерода, «низший алкил» подразумевает определенную выше алкильную группу, но имеющую при этом от одного до примерно десяти углеродов, в альтернативном случае от одного до примерно шести атомов углерода в структуре скелета. Аналогичным образом, «низший алкенил» и «низший алкинил» имеют подобные длины цепи.
Термин «алкилкарбонил» обозначает группу С1-С8-алкил-С(O), в которой один или более метиленов в C1-C8-алкильной группе заменен группой С(О). Типичные примеры включают (но не ограничены ими) ацетил, пропионил и группу СН3(СН2)2С(O).
Термин «циклический алкил» или «циклоалкил» относится к насыщенным или частично насыщенным неароматическим циклическим алкильным группам, содержащим от 3 до 14 атомов углерода при отсутствии в цикле гетероатомов и имеющим единственное кольцо или множество колец, включая сюда конденсированные и мостиковые кольцевые системы. Циклоалкильные группы могут быть замещенными или незамещенными. В число циклоалкильных или циклических алкильных групп входят моно-, би- или трициклические алкильные группы, имеющие от 3 до 14 атомов углерода в кольце (кольцах) или, в некоторых вариантах осуществления, от 3 до 12, от 3 до 10, от 3 до 8 или от 3 до 4, 5, 6 или 7 атомов углерода. В число типичных моноциклических циклоалкильных групп входят (но не ограничиваясь ими) циклопропильная, циклобутильная, циклопентильная, циклогексильная, циклогептильная и циклооктильная группы. Би- и трициклические кольцевые системы включают как мостиковые циклоалкильные группы, так и конденсированные группы, такие как (но без ограничения ими) бицикло[2.1.1]гексан, адамантил, декалинил и т.п.
Алкенильные группы включают нормальную или разветвленную цепь и циклоалкильные группы, как определены выше, за исключением того, что по меньшей мере одна двойная связь находится между двумя атомами углерода. При этом алкенильные группы имеют от 2 до примерно 12 атомов углерода в некоторых вариантах осуществления, от 2 до 10 атомов углерода в других вариантах осуществления и от 2 до 8 атомов углерода в других вариантах осуществления. Примеры включают в числе других (но ограничиваются ими) винил, аллил, -СН=СН(СН3), -СН=С(СН3)2, -С(СН3)=СН2, -С(СН3)=СН(СН3), -С(СН2СН3)=СН2, циклогексенил, циклопентенил, циклогексадиенил, бутадиенил, пентадиенил и гексадиенил. Алкенильные группы могут быть замещенными или незамещенными. Типичные замещенные алкенильные группы могут быть монозамещенными или замещенными более одного раза, такими как (но ограничиваясь ими) моно-, ди- и тризамещенные, такие как перечисленные выше.
Алкинильные группы включают нормальную и разветвленную цепь и циклоалкильные группы, как определены выше, за исключением того, что между двумя атомами углерода имеется по меньшей мере одна тройная связь. Примеры С2-С8-алкинильной группы включают (но ограничиваются ими) ацетилен, пропин, 1-бутин, 2-бутин, 1-пентин, 2-пентин, 1-гексин, 2-гексин, 3-гексин, 1-гептин, 2-гептин, 3-гептин, 1-октин, 2-октин, 3-октин и 4-октин. Алкинильная группа может быть незамещенной или необязательно замещенной одним или более заместителями, как описано ниже.
Арильными группами являются циклические ароматические углеводороды, которые не содержат гетероатомов. Арильные группы включают в себя моноциклические, бициклические и полициклические кольцевые системы. В частности, арильные группы включают (но не ограничены ими) группы фенил, азуленил, гепталенил, бифениленил, индаценил, флуоренил, фенантренил, трифениленил, пиренил, нафтаценил, хризенил, бифенил, антраценил, инденил, инданил, пенталенил и нафтил. В некоторых вариантах осуществления арильные группы содержат 6-14 углеродов, а в других от 6 до 12 или даже 6-10 атомов углерода в кольцевых участках групп. Арильная группа предполагает как замещенную, так и незамещенную арильную группы. Замещенные арильные группы могут быть монозамещенными или замещенными более одного раза. Например, монозамещенные арильные группы включают (но не ограничены ими) 2-, 3-, 4-, 5- или 6-замещенные фенильные или нафтильные группы, которые могут быть замещены заместителями, такими как перечисленные выше.
Аралкильными группами являются определенные выше алкильные группы, у которых водород-углеродная связь в алкильной группе заменена связью с определенной выше арильной группой. В некоторых вариантах осуществления аралкильные группы содержат от 7 до 20 атомов углерода, от 7 до 14 атомов углерода или от 7 до 10 атомов углерода.
Гетероциклильные группы включают в себя неароматические кольцевые соединения, содержащие 3 или более кольцевые члена, из которых один или более являются гетероатомами, такими как (но не ограничиваясь ими) N, О и S. В некоторых вариантах осуществления гетероциклильные группы включают от 3 до 20 кольцевых членов, в то время как другие такого рода группы имеют от 3 до 6, от 3 до 10, от 3 до 12 или от 3 до 15 кольцевых членов. В число гетероциклильных групп входят ненасыщенные, частично насыщенные и насыщенные кольцевые системы, такие, например, как имидазолильная, имидазолинильная и имидазолидинильная группы. Гетероциклильные группы могут быть замещенными или незамещенными. Гетероциклильные группы включают в себя (но ограничиваются ими) группы азиридинил, азетидинил, пирролидинил, имидазолидинил, пиразолидинил, тиазолидинил, тетрагидротиофенил, тетрагидрофуранил, диоксолил, фуранил, тиофенил, пирролил, пирролинил, имидазолил, имидазолинил, пиразолил, пиразолинил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, тиазолинил, изотиазолил, тиадиазолил, оксадиазолил, пиперидил, пиперазинил, морфолинил, тиоморфолинил, тетрагидропиранил, тетрагидротиопиранил, оксатиан, диоксил, дитианил, пиранил, пиридил, пиримидинил, пиридазинил, пиразинил, тиазинил, дигидропиридил, дигидродитиинил, дигидродитионил, гомопиперазинил, хинуклидил, индолил, индолинил, изоиндолил, азаиндолил (пирролопиридил), индазолил, индолизинил, бензотриазолил, бензимидазолил, бензофуранил, бензотиофенил, бензтиазолил, безоксадиазолил, бензоксазинил, бензотиинил, бензоксатиинил, бензотиазинил, бензоксазолил, бензотиазолил, бензотиадиазолил, бензо[1,3]диоксолил, пиразолопиридил, имидазопиридил (азабензимидазолил), триазолопиридил, изоксазолопиридил, пуринил, ксантинил, аденинил, гуанинил, хинолинил, изохинолинил, хинолизинил, хиноксалинил, хиазолинил, циннолинил, фталазинил, нафтиридинил, птеридинил, тианафталенил, дигидробензотиазинил, дигидробензофуранил, дигидроиндолил, дигидробензодиоксинил, тетрагидроиндолил, тетрагидроиндазолил, тетрагидробензимидазолил, тетрагидробензотриазолил, тетрагидропирролопиридил, тетрагидропиразолопиридил, тетрагидроимидазолопиридил, тетрагидротриазолопиридил и тетрагидрохинолинил. Гетероциклильные группы могут быть замещенными или незамещенными. Типичными замещенными гетероциклильными группами могут быть монозамещенные или замещенные более одного раза группы, такие как (но без ограничения ими) пиридильная или морфолинильная группы, которые являются 2-, 3-, 4-, 5- или 6-замещенными или дизамещенными различными заместителями, такими как перечисленные выше.
Гетероарильными группами являются ароматические кольцевые соединения, содержащие 5 или более членов кольца, из которых один или более являются гетероатомами, такими как (но не ограничиваясь ими) N, О и S. Гетероарильные группы могут быть замещенными или незамещенными. Гетероарильные группы включают в себя (но не ограничиваясь ими) такие группы как пирролил, пиразолил, тиазолил, тетразолил, оксазолил, изоксазолил, тиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, тиофенил, бензотиофенил, фуранил, бензофуранил, индолил, азаиндолил (пирролопиридил), индазолил, бензимидазолил, имидазопиридил (азабензимидазолил), пиразолопиридил, триазолопиридил, бензотриазолил, имидазопиридил, изоксазолопиридил, тианафталинил, пуринил, ксантинил, аденинил, гуанинил, хинолинил, изохинолинил, тетрагидрохинолинил, хиноксалинил и хиназолинил.
Алкоксигруппами являются гидроксильные группы (-ОН), у которых связь с атомом водорода заменена связью с атомом углерода замещенной или незамещенной определенной выше алкильной группы. Примеры линейных алкоксигрупп включают в себя (но не ограничены ими) метокси, этокси, пропокси, бутокси, пентокси, гексокси и т.п. Примеры разветвленных алкоксигрупп включают в себя (но не ограничены ими) изопропокси, втор-бутокси, трет-бутокси, изопентокси, изогексокси и т.п. Примеры циклоалкоксигрупп включают в себя (но не ограничены ими) циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и т.п. Алкоксигруппы могут быть замещенными один или более раз заместителями, такими как перечисленные выше.
Термины «полициклил» или «полициклическая группа» относятся к двум или более циклам (например, циклоалкилам, циклоалкенилам, циклоалкинилам, арилам и/или гетероциклилам), у которых два или более углерода являются общими у двух смежных колец (например, кольца являются «конденсированными кольцами»). Кольца, которые соединены между собой через несмежные атомы, называются «мостиковыми кольцами». Каждое из колец полицикла может быть замещено такими заместителями, как описаны выше, такими, например, как галоген, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, моноалкиламино, диалкиламино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонил, карбоксил, силил, эфирная группа, алкилтио, сульфонил, кетонная группа, альдегидная группа, сложноэфирная группа, гетероциклил, ароматический или гетероароматический фрагмент, -CF3, -CN и т.п.
Термин «карбоцикл» относится к ароматическому или неароматическому кольцу, у которого все кольцевые атомы являются углеродами.
Термин «нитро» относится к -NO2; термин «галоген» принят на практике и относится к -F, -Cl, -Вr или -I; термин «сульфгидрил» принят на практике и относится к -SH; термин «гидроксил» относится к -ОН; и термин «сульфонил» принят на практике и относится к -SO2. «Галогенид» означает соответствующий галогенам анион, а «псевдогалогенид» имеет определение, приведенное в Advanced Inorganic Chemistry", Cotton и Wilkinson (с.560).
Термин «амин» или «амино» относится к группе -NRcRd, в которой каждый из Rc и Rd независимо обозначает группу C1-C8-алкил, арил, гетероарил и гетероциклоалкил. Если Rc и Rd связаны с одним и тем же атомом азота, они могут совместно с этим атомом азота образовывать 5-, 6- или 7-членное кольцо. Например, -NRcRd предполагает включение кольца пирролидинила, пиридинила или 4-морфолинила.
Термин «амидо» принят на практике для обозначения аминозамещенного карбонила и включает фрагмент, который может быть представлен группой общей формулы -C(O)NRcRd, в которой Rc и Rd определены выше. Согласно некоторым вариантам осуществления, амид не включает в себя имиды, которые могут быть нестабильными.
Термины «карбоксил» и «карбоксилат» включают в себя такие фрагменты, которые могут быть представлены общими формулами:
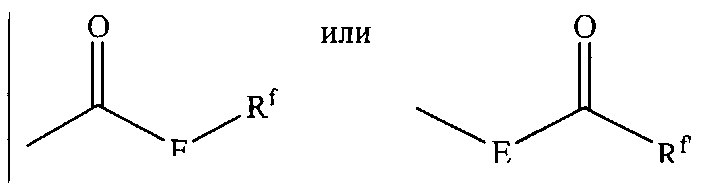
где Е обозначает связь или О или S, Rf и Rf независимо обозначают 'Н, алкил, алкенил, арил или фармацевтически приемлемую соль. Если Е представляет О, a Rf как определено выше, фрагмент в этом случае называется карбоксильной группой, и, в частности, если Rf является водородом, формула представляет «карбоксильную (карбоновую) кислоту». Как правило, если четко показано, что кислород заменен серой, формула представляет «тиокарбонильную» группу.
Термины «алкоксил» или «алкокси» относятся к определенной выше алкильной группе, к которой присоединен кислородный радикал. К числу типичных алкоксильных групп относятся метокси, этокси, пропокси, бутокси, трет-бутокси и т.п. «Эфир» представляет собой два углеводорода, ковалентно связанные кислородом. «Эфир» охватывает также полиэфиры, где в данной группе могут присутствовать более одной эфирной группы или связи. «Эфир» охватывает также циклические эфиры и краун-эфиры, где эфирная связь находится в циклической группе.
Термин «сульфонат» относится к фрагменту, который может быть представлен общей формулой -S(O)2ORg, в которой Rg обозначает электронную пару, водород, алкил, циклоалкил или арил. Термин «сульфат» включает в себя фрагмент, который может быть представлен общей формулой -OS(O)2ORg, в которой Rg как определен выше. Термин «сульфамид» относится к фрагменту, который может быть представлен общей формулой -S(O)2NReRf, в которой Re и Rf обозначают водород, C1-C8-алкил или арил. Термин «сульфонил» относится к фрагменту, который может быть представлен общей формулой -S(O)2Rh, в которой Rh одно из следующих: водород, алкил, алкенил, алкинил, циклоалкил, гетероциклил или гетероарил.
Предполагается, что определение каждого выражения, например алкила, m, n и т.п., когда оно появляется более одного раза в какой-либо структуре, является независимым от его определения в другом месте в той же структуре.
Выражения трифлил, тозил, мезил и нонафлил относятся, соответственно, к трифторметансульфонильной, п-толуолсульфонильной и нонафторбутансульфонильной группам. Выражения трифлат, тозилат, мезилат и нонафлат являются тривиальными и относятся, соответственно, к функциональным группам эфира трифторметансульфоновой кислоты, эфира п-толуолсульфоновой кислоты, эфира метансульфоновой кислоты и эфира нонафторбутансульфоновой кислоты и к молекулам, которые содержат эти группы. Аббревиатуры Me, Et, Ph, Tf, Nf, Ts и Ms относятся, соответственно, к метилу, этилу, фенилу, трифторметансульфонилу, нонафторбутансульфонилу, п-толуолсульфонилу и метансульфонилу. Более полный список используемых рядовыми химиками-органиками аббревиатур приводится в первом выпуске каждого тома Journal of Organic Chemistry и, как правило, в виде таблицы под заголовком Standard List of Abbreviations (Стандартный список аббревиатур).
Некоторые содержащиеся в композициях соединения могут существовать в конкретных геометрических и стереоизомерных формах. При этом соединения могут быть также оптически активными. Соединения могут также включать цис- и транс-изомеры, R-и S-энантиомеры, диастереомеры, (D)-изомеры, (L)-изомеры, их рацемические смеси и другие их смеси. В заместителе, таком как алкильная группа, могут находиться дополнительные асимметрические атомы углерода. Если, например, желателен какой-либо конкретный энантиомер, его можно приготовить с помощью асимметрического синтеза или путем получения производного с помощью хирального вспомогательного агента, в процессе чего образовавшуюся диастереомерную смесь отделяют и отщепляют вспомогательную группу, получая чистые желаемые энантиомеры. В альтернативном случае, когда молекула содержит основную функциональную группу, такую как аминогруппа, или кислотную функциональную группу, такую как карбоксил, образуются диастереомерные соли с соответствующими оптически активными кислотой или основанием, после чего происходит разрешение образовавшихся таким образом диастереомеров с помощью фракционной кристаллизации или хорошо известных в данной области хроматографических средств с последующим выделением чистых энантиомеров.
Используемый в заявке термин «защитная группа» означает временные заместители, которые защищают потенциально реакционноспособную функциональную группу от нежелательных химических превращений. Примеры таких защитных групп включают эфиры карбоновых кислот, силильные эфиры спиртов и ацетали и кетали альдегидов и кетонов, соответственно. Имеется обзор области химии защитных групп (Greene, T.W.; Wuts, P.G.M. Protective Groups in Organic Synthesis, 3rd ed.; Wiley: New York, 1999).
Если не указано иное, «стереоизомер» означает стереоизомер соединения, которое по существу не содержит других стереоизомеров того же соединения. Таким образом, стереоизомерно чистое соединение, имеющее один хиральный центр, будет в существенной степени свободным от противоположного энантиомера этого соединения. Стереоизомерно чистое соединение, имеющее два хиральных центра, будет в существенной степени свободным от других диастереомеров этого соединения. Типичное стереоизомерно чистое соединение содержит более чем примерно 80 вес.% одного стереоизомера соединения и менее чем примерно 20 вес.% других стереоизомеров соединения, например более чем примерно 90 вес.% одного стереоизомера соединения и менее чем примерно 10 вес.% других стереоизомеров соединения или более чем примерно 95 вес.% одного стереоизомера соединения и менее чем примерно 5 вес.% других стереоизомеров соединения, или более чем примерно 97 вес.% одного стереоизомера соединения и менее чем примерно 3 вес.% других стереоизомеров соединения В случае возможных расхождений между изображенной структурой и названием, данным этой структуре, приоритет отдается изображенной структуре. Кроме того, если стереохимия структуры или части структуры не приведена, например, с помощью жирных или прерывистых линий, эта структура или часть структуры должна интерпретироваться как включающая в себя все ее стереоизомеры.
Хелаторные соединения и их синтез
В одном из аспектов предлагается соединение формулы I, его фармацевтически приемлемые соли и сольваты:
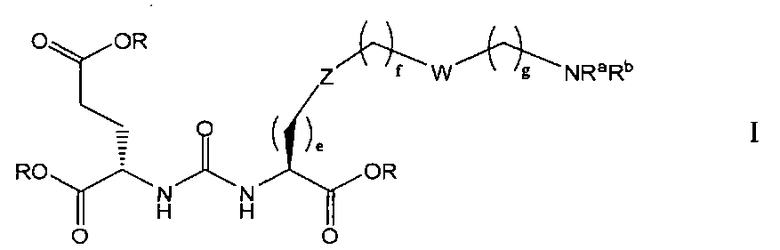
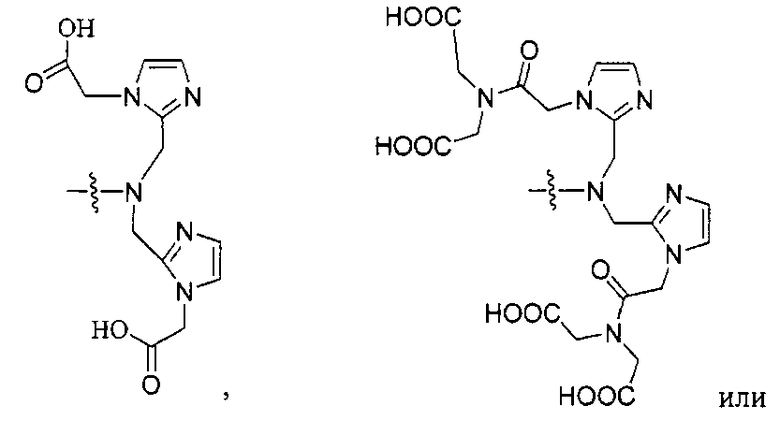
где R обозначает Н, ион аммония, ион алкиламмония, ион щелочноземельного металла, ион редкоземельного металла или алкильную группу; W обозначает связь, -NHC(O)-, -CH(NH2)-, -NH-C(O)-NH-, -C(O)-NH-, -C(O)-NH-CH(COOH)-, -O-(CH2)n-O-(CH2)n-, -(CH2)nO(CH2)nO(CH2)n-, -CH(NHFmoc)-; Z обозначает связь, -CO(O)-, -NH-, -NHC(O)-, -NH-C(O)-NH-, -NH-C(O)-(CH2)n-, -NH-C(O)-CH(NH2)-, -C(O)-NH-CH(COOH)- или -NH-C(O)-C6H4-(CH2)n-NH-; NRaRb обозначает хелаторную группу формулы:
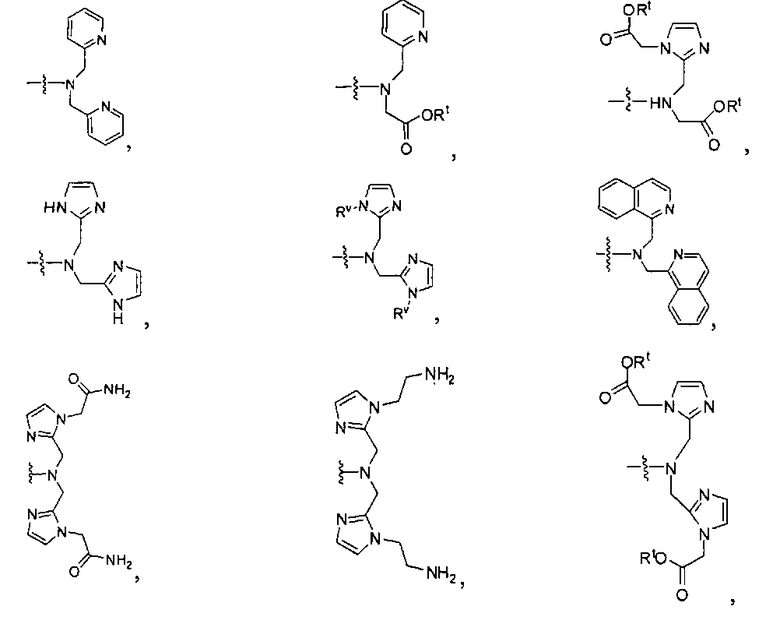
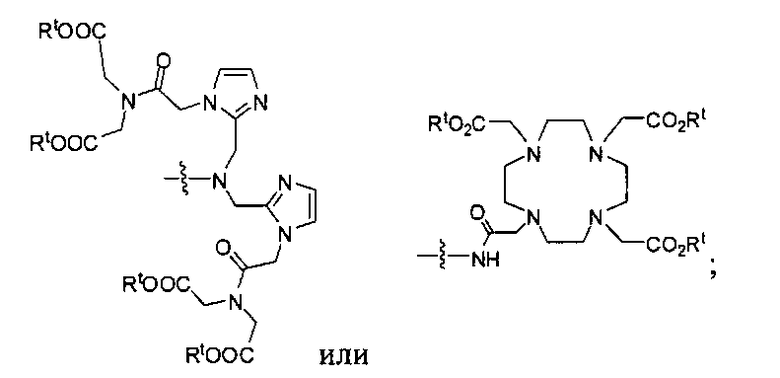
Rt обозначает H, C1-C8-алкильную группу, ион аммония, ион алкил аммония или ион щелочного или щелочноземельного металла; Rv обозначает алкилалкил, замещенный аминоалкил, аминоалкил или ацетамидоалкил; е есть целое число от 0 до 15; f есть целое число от 0 до 15; g есть целое число от 0 до 15; и n есть целое число от 0 до 10; при условии, что когда NRaRb является:
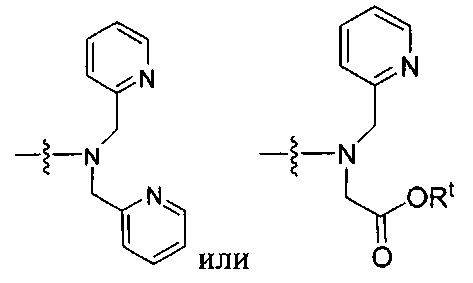
то когда W является связью, Z не является связью, -C(O)-NH- или -NHC(O)-; и когда Z является связью, W не является связью, -C(O)-NH- или -NHC(O)-. B некоторых вариантах осуществления R является алкилом. В других вариантах осуществления Rv является метилом, этилом, н-пропилом, н-бутилом, изобутилом или трет-бутилом. В некоторых других вариантах осуществления Rt является независимо Н или трет-бутилом. В некоторых вариантах осуществления Rt является водородом.
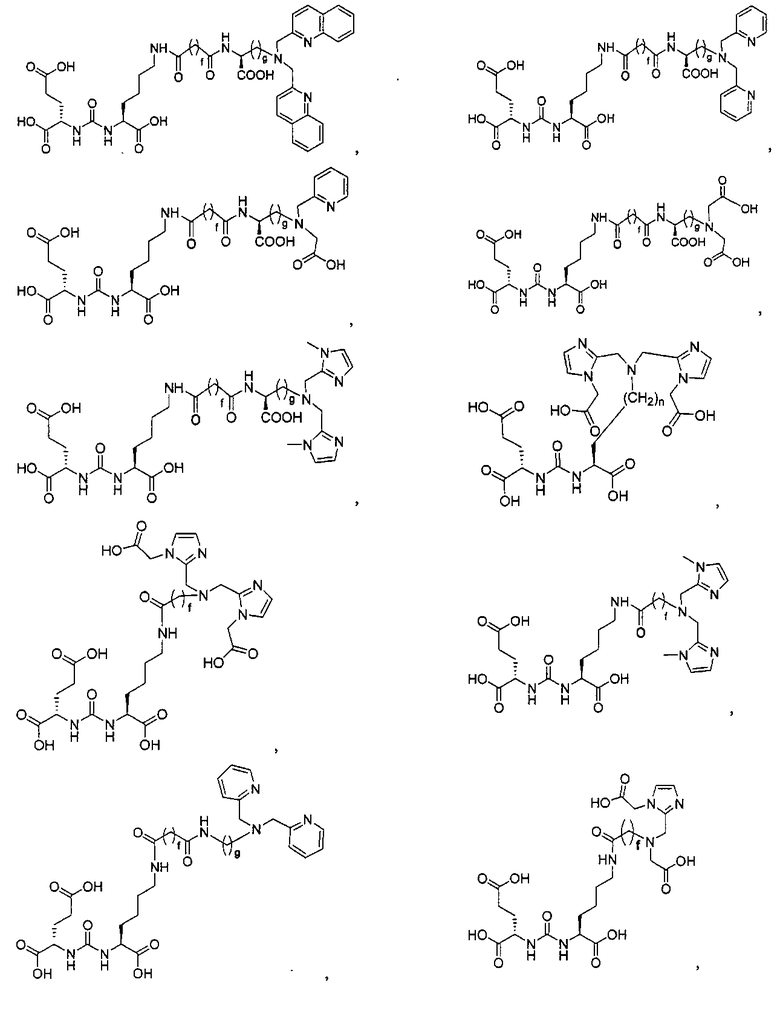
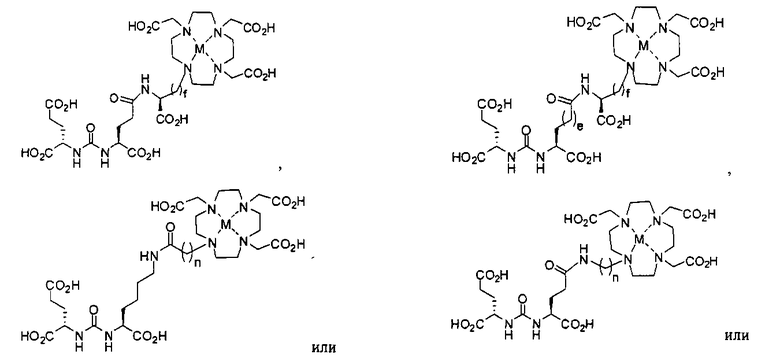
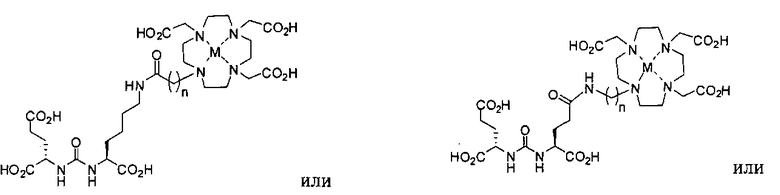
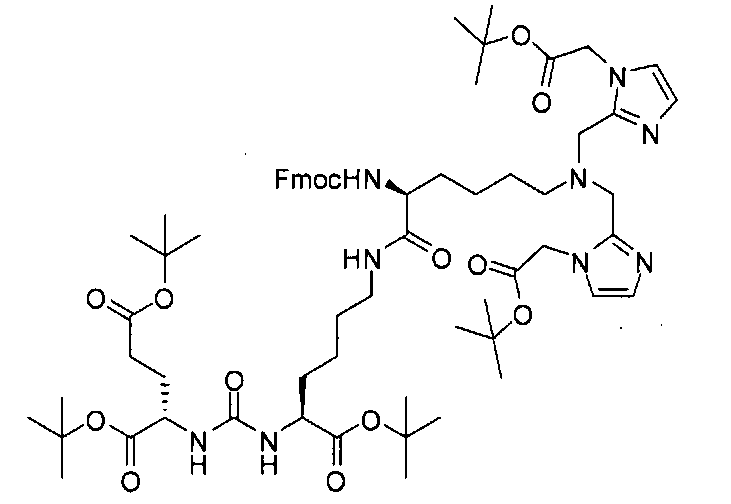
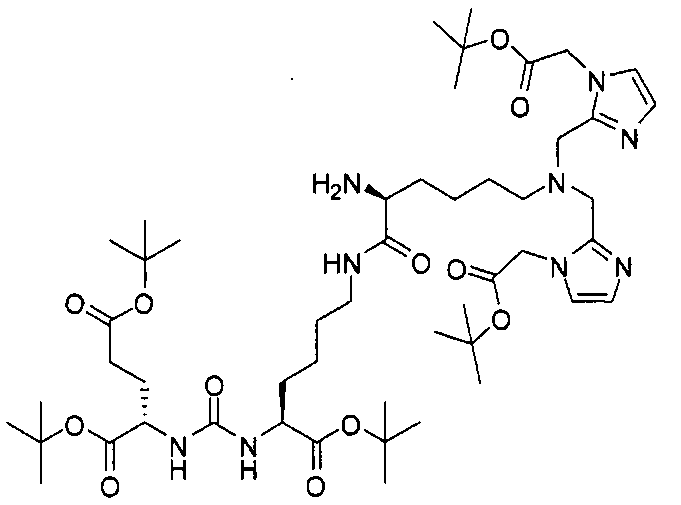
Типичные соединения согласно формуле I включают (но не ограничены ими)
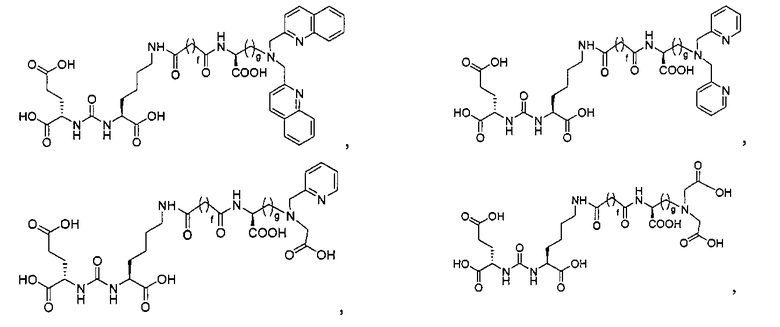
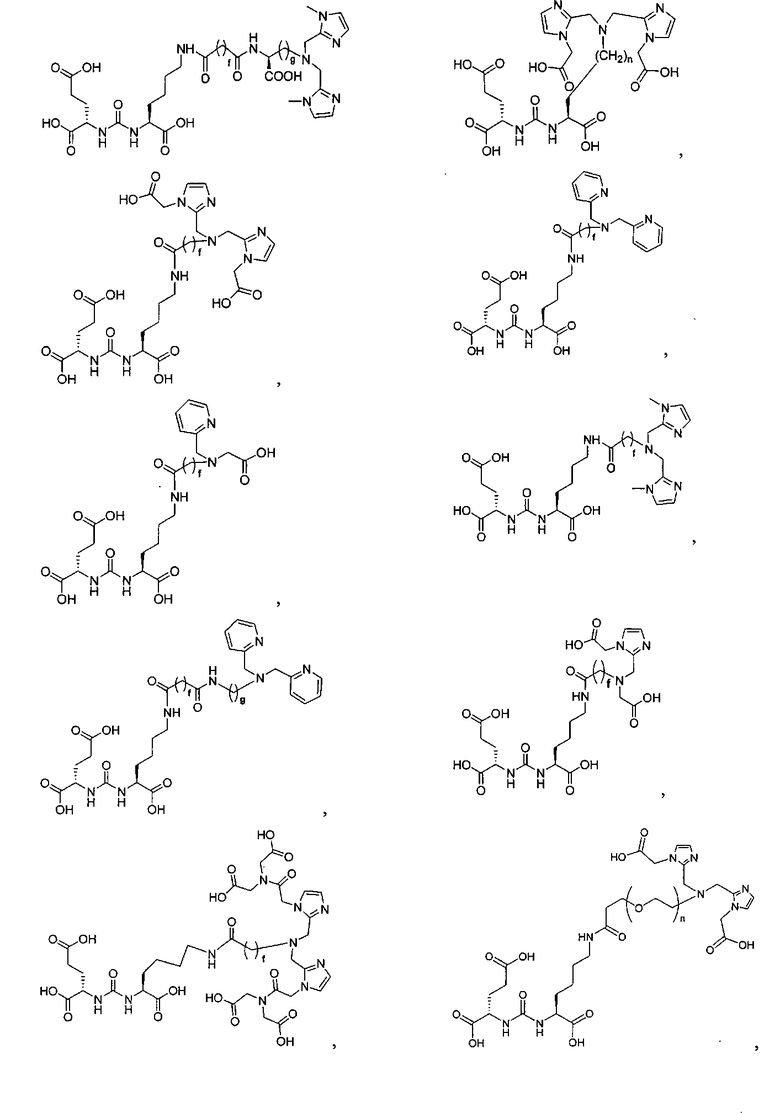
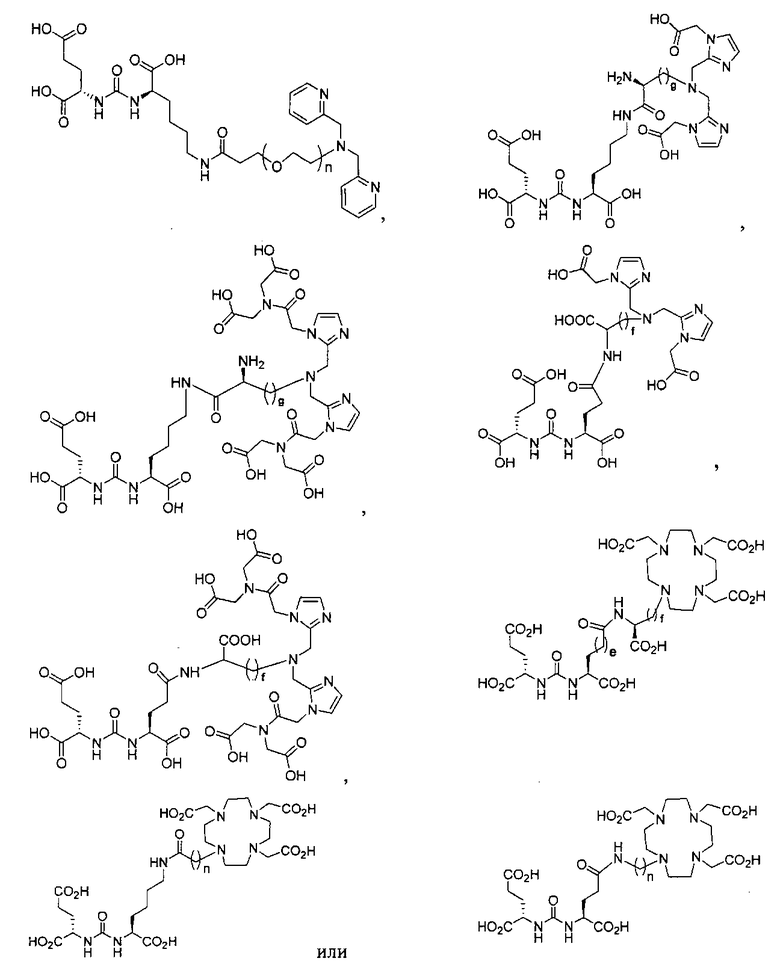
или их фармацевтически приемлемые соли и сольваты, где е есть целое число от 0 до 10, f есть целое число от 0 до 12, g есть целое число от 0 до 12, и n есть целое число от 0 до 10.
Согласно различным вариантам осуществления, группа NRaRb соединения может дополнительно образовывать хелат с металлом. В некоторых вариантах осуществления металлом является радиоактивный нуклид. Например, металлом может быть технеций-99m или рений-186m/188m. Такие комплексы как [NЕt4]2[МВr3(СО)3]; (М=Тс или Re) можно вводить в реакцию с соединением формулы I в спиртовом растворителе. В результате такой реакции получают хелатный комплекс изображенной ниже формулы I-М:
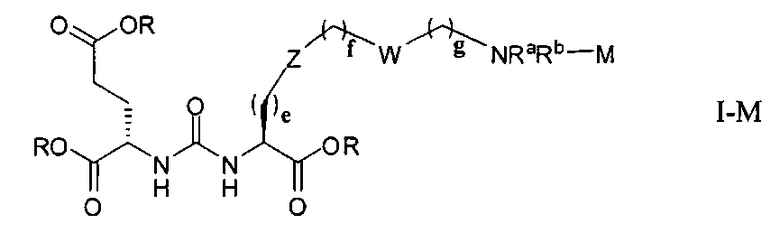
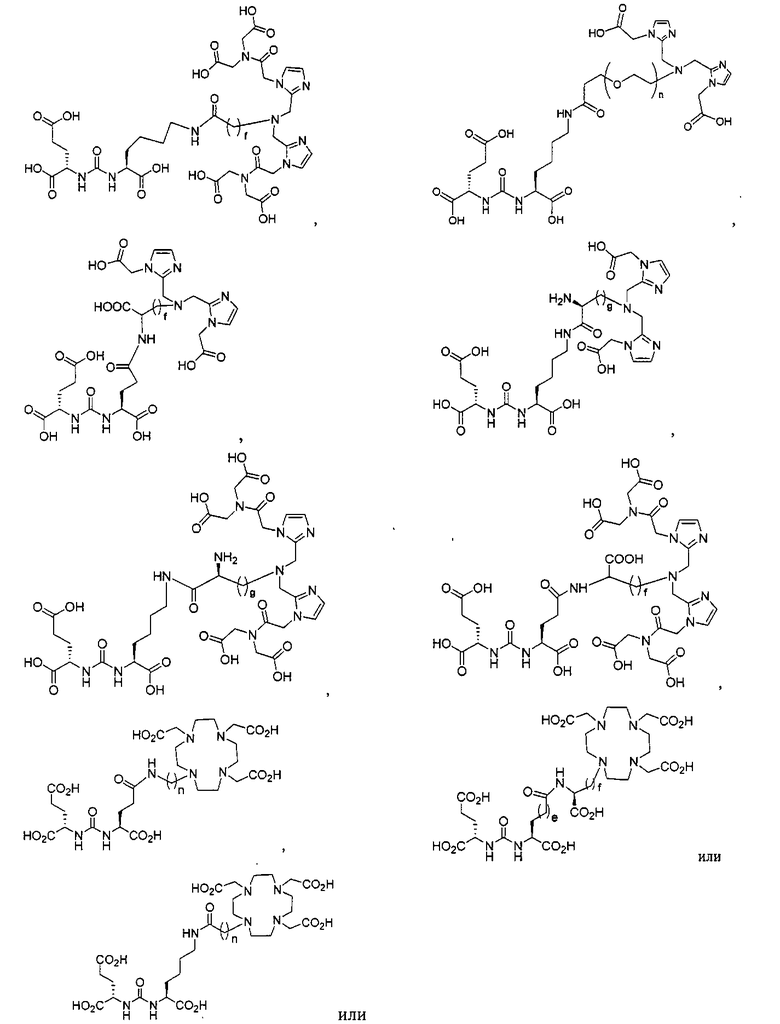
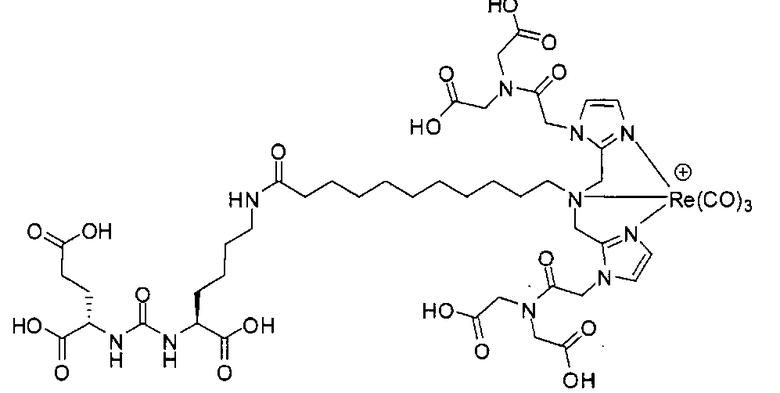
Иллюстративные соединения согласно формуле I-М включают (но не ограничены ими) любое из следующих:
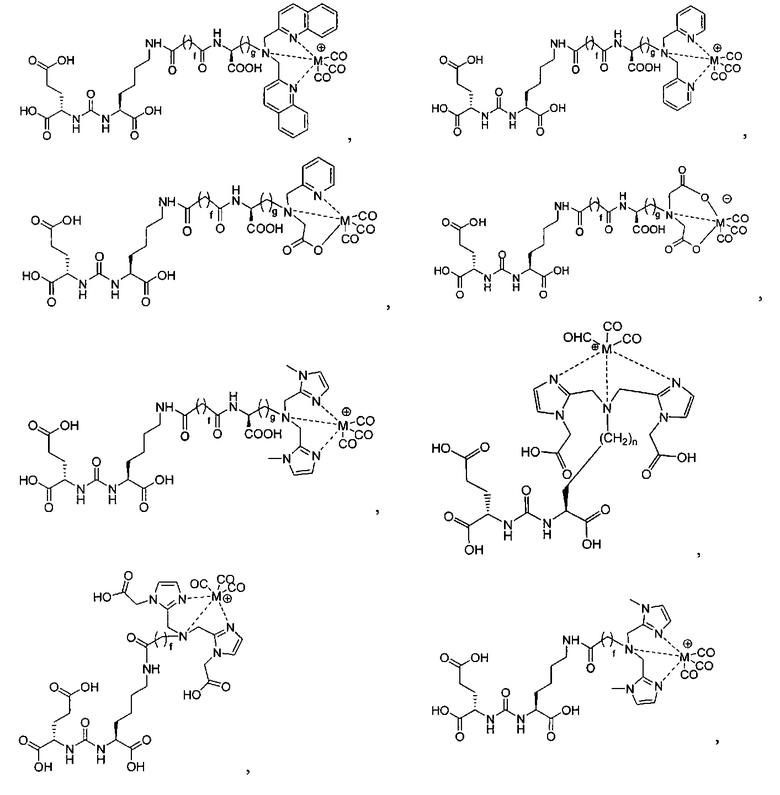
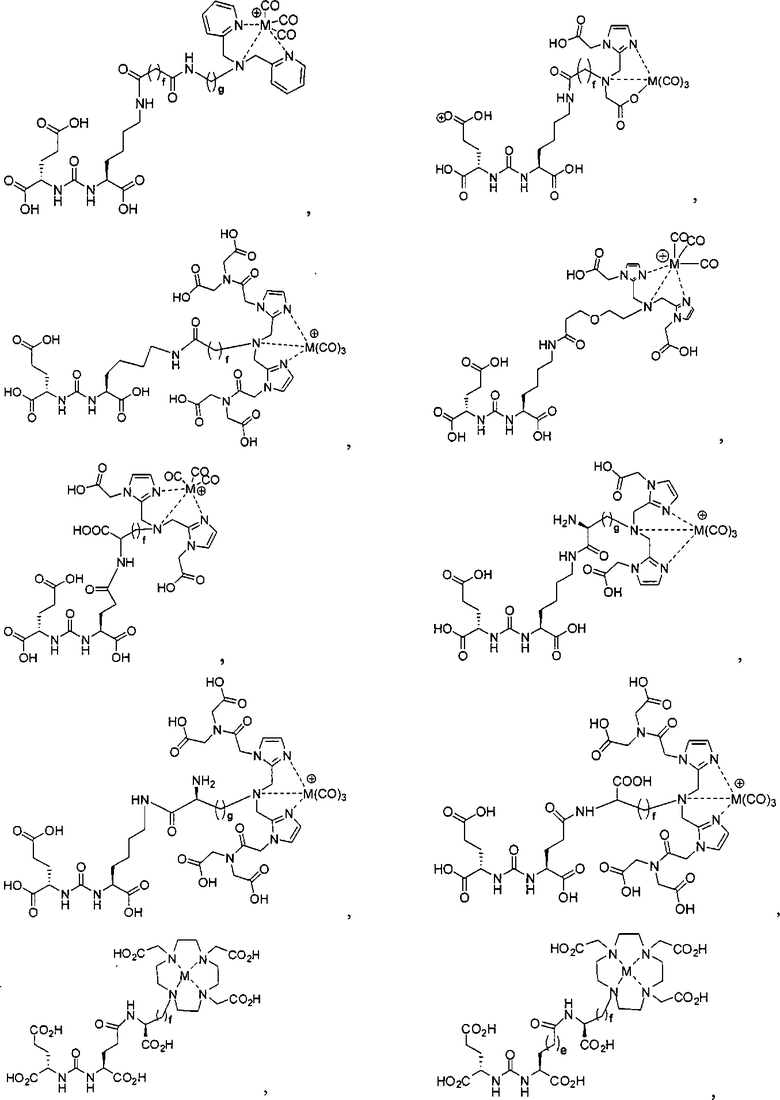
их фармацевтически приемлемые соли и сольваты, где М обозначает Re или Тс, е есть целое число от 0 до 10, f есть целое число от 0 до 12, g есть целое число от 0 до 12, и n есть целое число от 0 до 10.
В некоторых вариантах осуществления соединения включают не только их фармацевтически приемлемые соли и сольваты, но также стереоизомеры, таутомеры и пролекарства таких соединений.
Как уже отмечалось выше, комплексы соединения формулы I могут содержать один или более радионуклидов, которые пригодны для их применения в качестве радиоактивных визуализационных агентов и в качестве лекарственных средств для лечения быстро пролиферирующих клеток. Соответственно, в одном из вариантов осуществления предлагается фармацевтическая композиция, содержащая комплекс, который включает металл и соединение формулы I, его соль, сольват, стереоизомер или таутомер и фармацевтически приемлемый носитель.
Как правило, комплексы металлов с соединениями формулы I или их фармацевтические композиции могут вводиться перорально или парентеральным путем, обычно в виде инъекции. Парентеральные способы введения включают внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, внутрипозвоночную и интрастернальную инъекцию и вливание. В некоторых вариантах осуществления соединение или его фармацевтическая композиция вводится перорально. Такие композиции могут иметь форму таблеток, пилюль, капсул, полутвердых материалов, порошков, растворов, суспензий, эликсиров, аэрозолей или любых других подходящих композиций.
Согласно другому аспекту, предлагается фармацевтическая композиция, которая пригодна для визуализации in vivo. Такие подходящие визуализационные фармацевтические композиции содержат визуализационный агент, который включает радионуклид, либо в виде элемента, например радиоактивного йода, либо в виде хелатного комплекса радиоактивного металла с соединением формулы I в количестве, достаточном для визуализации, вместе с фармацевтически приемлемым радиологическим наполнителем. Радиологический наполнитель должен быть пригодным для инъекции или аспирации, такой как сывороточный альбумин человека, водные буферные растворы, например трис(гидроксиметил)аминометан (и его соли), фосфат, цитрат, бикарбонат и т.д.; стерильная вода, физиологический раствор и сбалансированные ионные растворы, содержащие хлоридные или бикарбонатные соли, или обычные катионы кровяной плазмы, такие как кальций, калий, натрий и магний.
Концентрация визуализационного агента в радиологическом наполнителе должна быть достаточной для обеспечения удовлетворительной визуализации. Например, при использовании водного раствора дозировка составляет от 1,0 до 50 милликюри. Визуализационный агент должен применяться таким образом, чтобы сохраняться в организме пациента в течение примерно от 1 до 24 ч, хотя приемлемы и как более длительные, так и более короткие временные отрезки. Следовательно, удобно приготовлять ампулы, содержащие от 1 до 10 мл водного раствора.
Визуализация может проводиться обычным образом, например путем инъецирования достаточного количества визуализационной композиции для обеспечения адекватной визуализации с последующим сканированием с помощью подходящего устройства, например гамма-камеры. В некоторых вариантах осуществления метод визуализации какой-либо области у пациента включает стадии: введение пациенту диагностически эффективного количества какого-либо соединения, скомплексованного с каким-либо радионуклидом; облучение какой-либо области у пациента и получение изображения этой области пациента. В некоторых вариантах осуществления изображаемой областью является голова или грудная клетка. В некоторых вариантах осуществления соединения и комплексы формулы I нацелены на белок PSMA.
Таким образом, в некоторых вариантах осуществления предлагается метод визуализации ткани, такой как ткань селезенки, ткань почки или экспрессирующая PSMA опухолевая ткань, включающий осуществление контакта ткани с комплексом, содержащим радиоактивный металл и соединение, содержащее группу формулы:
ее фармацевтически приемлемую соль или сольват. В некоторых вариантах осуществления тканью является экспрессирующая PSMA опухолевая ткань. Специфичность таких соединений иллюстрируется на фиг.5.
Описанное таким образом в общих чертах настоящее изобретение станет более понятным со ссылками на следующие примеры, которые приводятся как иллюстрация и не предназначены для ограничения настоящего изобретения.
ПРИМЕРЫ
Общие методы синтеза
Общая процедура комплексования соединений с металлами. Как это проиллюстрировано в заявке на примерах, в качестве металла используется рений из соображений доступности его нерадиоактивных изотопов и безопасности работников. Однако, как это несложно понять, аналогичные синтетические процедуры могут проводиться и с использованием технециевых аналогов, так как технеций и рений, обладают подобной реакционной способностью и имеют близкий размер вследствие лантанидного сжатия. Следовательно, там, где определенным образом указан Re, следует допускать и включение комплексов Тс.
Общие условия эксперимента для образовании комплексов рения
Комплексы рения/технеция с соединениями формулы I удобно выделять из реакционных смесей этих соединений с легко доступным предшественником [NEt4]2[Re(CO)3Br3]. Поскольку донорные наборы, снабженные концевыми группами SAAC, хорошо документированы в качестве эффективных хелаторов для центрального атома {М(СО)3}+1 и сконструированы таким образом, чтобы принимать требуемое лицевое расположение относительно металлического центра, приготовление таких комплексов не вызывает затруднений.
Система {Re(I)(CO)3}+ характеризуется реакционной способностью аналогичной реакционной способности центрального атома трикарбонила 99mТс. Использование в качестве исходного материала [NEt4]2[ReBr3(CO)3] приводит к легкому образованию ядра fac-{Re(CO)3(L)3}. [NEt4]2[ReBr3(CO)3] легко получается из [ReBr(CO)5]. Синтез комплексов Re(I) осуществляется реакцией [NEt4]2[ReBr3(CO)3] с подходящим хелатирующим лигандом в отношении 1:1,2 в 10 мл метанола. Реакционной смеси дают нагреваться в течение 4 ч при 80°С. После охлаждения все продукты реакции очищают на колонках с С18 Sep Раk с выходами от 20 до 50%.
Если не указано иное, синтез комплексов Re(I) осуществляется реакцией [NEt4]2[ReBr3(CO)3] (или [99mТс(СО)3(Н2O)3]+) с подходящим лигандом (10-6 М - 10-4 М) в отношении 1:1,2 в 10 мл метанола. Герметизированный сосуд нагревают или дают нагреваться в течение 4 ч при 100°С. После охлаждения реакционную смесь анализируют на чистоту с помощью жидкостной хроматографии высокого разрешения (ЖХВР) с обращенной фазой и очищают продукт с использованием кремнеземной колонки с метанолом в качестве элюента. Радиохимическая чистота (RCP) после очистки методом ЖХВР, приводящая к «свободным от носителей» продуктам, определялась методом ЖХВР и, как было показано, устойчиво составляет ≥95%. Хотя начальные результаты продемонстрировали наличие радиометки при малых концентрациях вплоть до 10-6 М, RCY составлял ≤80%. RCY - аббревиатура радиохимического выхода. Чтобы достичь RCY >95% при 75°С, необходимо было повысить концентрацию реакционной смеси до 10-4 М. Во многих случаях соответствующие комплексы Тс приготовляют и испытывают как Re комплексы, чтобы получить нерадиоактивные аналоги для целей испытаний и работы с ними.
Радиомечение соединений
Радиомечение соединений формулы I проводили с целью образования комплексов либо со свободными α-аминокислотами, либо с соответствующим образом N-защищенными производными аминокислот, используя аналогичную методологию. Радиомечение с помощью 99mТс(I)(СО)3 + проводили в две стадии, используя продажные наборы IsoLink™ kits (Covidien) для образования интермедиата [99mТс(СО)3(Н2О)3]+, который вводили в реакцию с подходящим соединением формулы I (10-6 М - 10-4 М) в равнообъемной смеси (1:1) ацетонитрила и фосфатного буфера. Герметизированный сосуд нагревают 30 мин при 100°С. После охлаждения реакционную смесь анализируют на чистоту методом ЖХВР с обращенной фазой. Радиохимическая чистота (RCP) после ЖХВР-очистки, приводящей к «свободным от носителей» продуктам, определялась методом ЖХВР и, как было показано, устойчиво составляла ≥95%. Хотя начальные результаты продемонстрировали наличие радиометки при малых концентрациях вплоть до 10-6 М, RCY составлял ≤80%. Чтобы достичь RCY >95% при 75°С, необходимо было повысить концентрацию реакционной смеси до 10-4 М. Во многих случаях соответствующие комплексы Re приготовляют и испытывают как Тс комплексы, чтобы получить нерадиоактивные аналоги для целей испытаний и работы с ними. Таким образом, в тех случаях, когда речь конкретно идет о Re, следует принимать это также и на счет комплексов Тс.
Синтез типичных соединений формулы I
Схема 1 является иллюстрацией общего синтетического пути для соединений на основе глутамино-карбамидо-имидазола. Первая стадия, изображенная на схеме 1, проводится при 0°С в инертных условиях с использованием ди-трет-бутилового эфира глутаминовой кислоты с CDI (N,N-карбонилдиимидазолом, КДИ) в присутствии основания, в результате чего образуется интермедиат Glu-карбамидо-имидазол (производное 2). Этот интермедиат активируется с помощью MeOTf в щелочных условиях с образованием метилированного имидазола, который легко реагирует в инертных условиях с аминами. Сложноэфирные трет-бутильные защитные группы удаляются с помощью реакции с 20% TFA (трифторуксусной кислоты) в дихлорметане (ДХМ) при комнатной температуре в течение 1-4 ч. После завершения деблокирования реакционную смесь упаривают на роторном испарителе или продувают досуха азотом и очищают на колонке с кремнеземом или перекристаллизовывают.
Схема 1
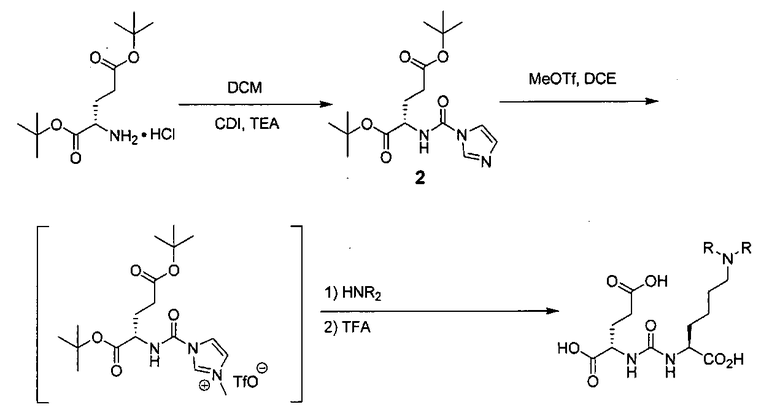
Соединения с общей структурой Е получают с конечными выходами в пределах 10-50%, используя общий путь, изображенный на схеме 2. Ключевой синтетический интермедиат, основание Шиффа, образуется при реакции соответствующего альдегида при комнатной температуре в течение одного часа. Шиффово основание не выделяют, а восстанавливают in situ триацетоксиборогидридом натрия с образованием дизамещенного амина (В). Последний сочетают с ди-трет-бутиловым эфиром 2-[3-(5-амино-1-трет-бутоксикарбонилпентил)уреидо]пентандиовой кислоты (А) с использованием концевой карбоксильной кислоты HATU (2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония) и основания (на схеме триэтиламин), в результате чего образуется защищенный интермедиат С. Синтез комплексов Re(I) (D) осуществляют реакцией [NEt4]2[ReBr3(CO)3] с соответствующим лигандом в отношении 1:1,2 в 10 мл метанола. Реакционную смесь оставляют нагреваться при 80°С в течение 4 ч. После охлаждения все из образовавшихся продуктов реакции очищают на колонках с С18 Sep Рак с выходами в пределах 20-50%.
Схема 2. Общий путь синтеза аналогов M-Glu-карбамидо-Lys-X (Е) (где L обозначает гетероциклические или алифатические донорные группы)
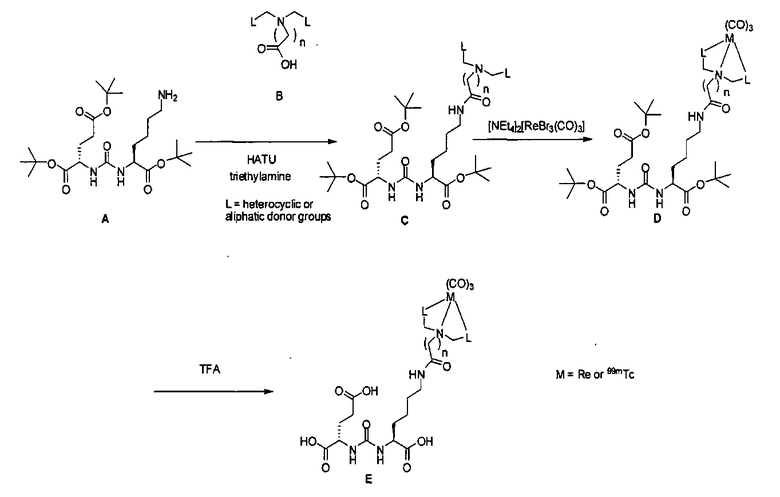
Сложноэфирные трет-бутильные защитные группы удаляются с помощью реакции с 20%) TFA (трифторуксусной кислотой) в ДХМ при комнатной температуре в течение 12 ч. После завершения деблокирования реакционную смесь упаривают на роторном испарителе и очищают методом ЖХВР или флэш-хроматографией, получая желаемые продукты (Е) с выходом 10-50%.
Пример 1: [Rе(СО)3{(S)-2-(3-((R)-5-(бис((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)амино)-1-карбоксипентил)уреидо)пентандиовая кислота}]
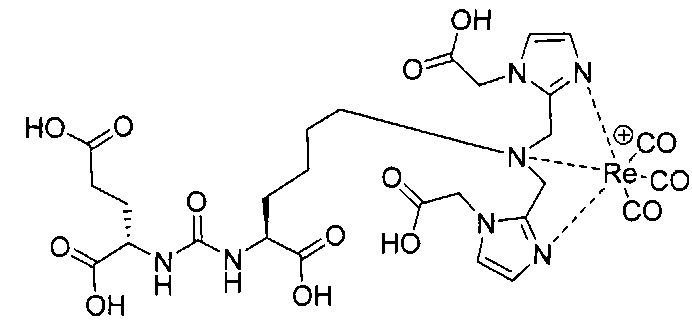
(S)-2-(3-((R)-5-(бис((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)амино)-1-карбоксипентил)уреидо)пентандиовую кислоту получают согласно той же общей последовательности операций, которая показана на схеме 1, используя ди-трет-бутиловый эфир 2-(3-(5-амино-1-карбоксипентил)уреидо)пентандиовой кислоты. Сложноэфирный комплекс рения получают согласно той же общей последовательности операций, которая описана в общей экспериментальной части для рения. Соединение деблокируют с использованием описанных ранее методов с помощью TFA, получая желаемый продукт (4,0 мг, 29%) в виде грязно-белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) δ 7,2 (s, 2Н), 7,0 (s, 2Н), 6,3 (s, 2Н), 4,85 (s, 4Н), 4,55 (d, 2Н), 4,4 (d, 2Н), 4,10 (s, 2Н), 3,5 (s, 2Н), 2,2 (m, 2Н), 1,7 (m, 6Н), 1,25 (m, 2Н). ESMS (масс-спектрометрия с электрораспылением) m/z: 866 (М+Н)+.
Пример 2: [Rе(СО)3{(14R,18S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота}]
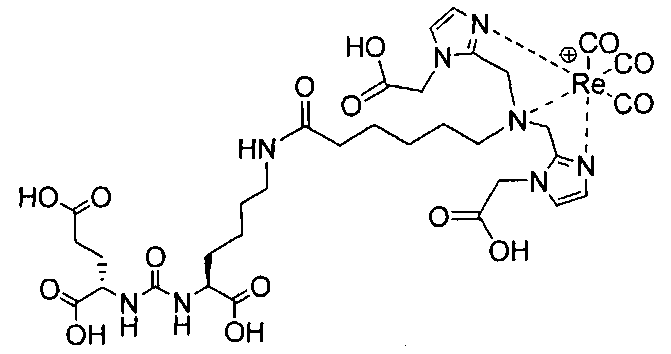
(14R,18S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновую кислоту получают согласно той же общей последовательности операций, которая показана на схеме 1, используя предварительно полученный и защищенный ди-трет-бутиловый эфир 2-[3-(5-амино-1-карбоксипентил)уреидо]пентандиовой кислоты. Сложноэфирный комплекс рения получают согласно той же общей последовательности операций, которая описана в общей экспериментальной части для рения. Соединение деблокируют с использованием описанных ранее методов с помощью TFA, получая желаемый продукт (8,0 мг, 13%) в виде грязно-белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) δ 7,9 (s, Н), 7,2 (s, 2Н), 7,0 (2, 2Н), 6,3 (s, 2Н), 4,85 (s, 4Н), 4,55 (d, 2Н), 4,4 (d, 2Н), 4,1 (m, 2Н), 3,5 (s, 2Н), 2,9 (s, 4Н), 2,2 (m, 2Н), 2,05 (m, 2Н), 1,85 (m, 2Н), 1,6 (m, 6Н), 1,3 (m, 4Н). ESMS m/z: 979 (М+Н)+.
Пример 3: [Rе(СО)3{(19R,23S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоновая кислота}]
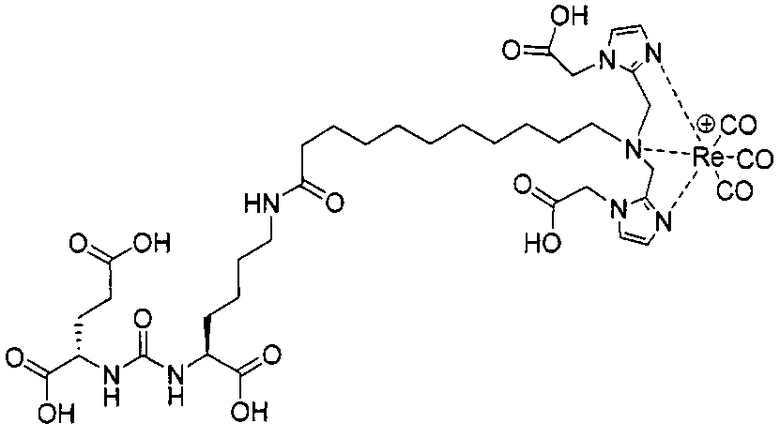
(19R,23S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоновую кислоту получают согласно той же общей последовательности операций, которая показана на схеме 1, используя предварительно полученный и защищенный ди-трет-бутиловый эфир 2-[3-(5-амино-1-карбоксипентил)уреидо]пентандиовой кислоты. Сложноэфирный комплекс рения получают согласно той же общей последовательности операций, которая описана в общей экспериментальной части для рения. Соединение деблокируют с использованием описанных ранее методов с помощью TFA, получая желаемый продукт (7,0 мг, 24%) в виде грязно-белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) δ 7,8 (s, Н), 7,2 (s, 2Н), 7,0 (2, 2Н), 6,3 (s, 2Н), 4,8 (s, 4Н), 4,55 (d, 2Н), 4,4 (d, 2Н), 4,1 (m, 2Н), 3,5 (m, 2Н), 2,9 (m, 2Н), 2,2 (m, 2Н), 2,05 (m, 4Н), 1,9 (m, 4Н), 1,6 (m, 4Н), 1,4 (m, 2Н) 1,3 (m, 16Н). ESMS/m/z: 525 (М/2).
Пример 4: [Rе(СО)3{(17R,21S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-11,19-диоксо-5,8-диоксо-2,12,18,20-тетраазатрикозан-17,21,23-трикарбоновая кислота}]
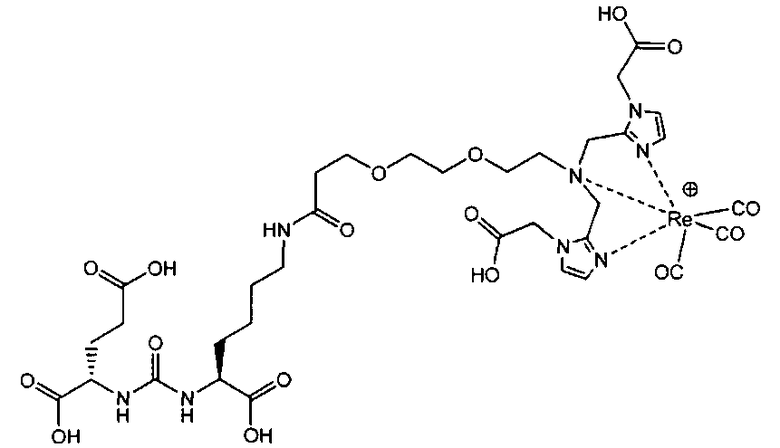
(17R,21S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-11,19-диоксо-5,8-диокса-2,12,18,20-тетраазатрикозан-17,21,23-трикарбоновую кислоту получают согласно той же общей последовательности операций, которая показана на схеме 1, используя предварительно полученный и защищенный ди-трет-бутиловый эфир 2-[3-(5-амино-1-карбоксипентил)уреидо]пентандиовой кислоты. Сложноэфирный комплекс рения получают согласно той же общей последовательности операций, которая описана в общей экспериментальной части для рения. Соединение деблокируют с использованием описанных ранее методов с помощью TFA, получая желаемый продукт (6,0 мг, 38%) в виде грязно-белого твердого вещества. Н ЯМР (400 МГц, DMSO-d6) δ 7,9 (s, Н), 7,2 (s, 2Н), 7,0 (s, 2Н), 6,3 (s, 2Н), 4,85 (s, 4Н), 4,6 (d, 2Н), 4,5 (d, 2Н), 3,80 (m, 12Н), 3,5 (m, 10Н), 2,4 (m, 4Н). ESMS m/z: 738 (М+Н)+.
Пример 5:
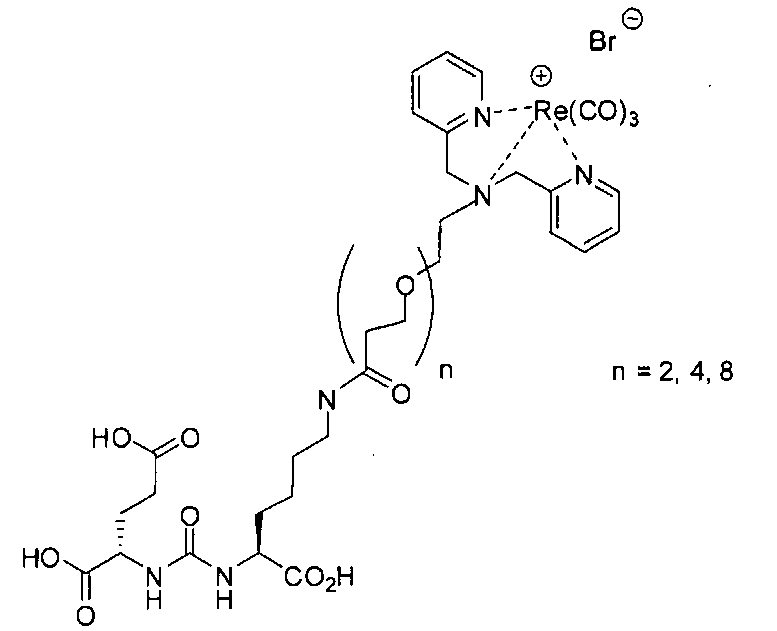
Пример 5а (n=2): Glu-карбамидо-Lys-PEG2-ReDP: [Re(CO)3{(17R,21S)-11,19-диоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8-диокса-2,12,18,20-тетраазатрикозан-17,21,23-трикарбоновая кислота}][Вr]. (17R,21S)-11,19-диоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8-диокса-2,12,18,20-тетраазатрикозан-17,21,23-трикарбоновую кислоту получают согласно той же общей последовательности операций, которая показана на схеме 1, используя предварительно полученный и защищенный ди-трет-бутиловый эфир 2-[3-(5-амино-1-карбоксипентил)уреидо]пентандиовой кислоты. Сложноэфирный комплекс рения получают согласно той же общей последовательности операций, которая описана в общей экспериментальной части для рения. Соединение деблокируют с использованием описанных ранее методов, получая желаемый продукт (2,0 мг, 20%) в виде грязно-белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) δ 8,8 (d), 8,00 (dd), 7,55 (d), 7,42 (dd), 6,45 (s), 3,95 (m), 3,4-3,6 (m), 2,45 (m), 1,25 (m), 1,1 (m), 0,8 (m). ESMS m/z: 931 (M+H)+.
Пример 5b (n=4): Glu-карбамидо-Lуs-РЕG4-RеDР: [Re(CO)3{(23R,27S)-17,25-диоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8,11,14-тетраоксо-2,18,24,26-тетраазанонакозан-23,27,29-трикарбоновая кислота}][Br]. (23R,27S)-17,25-диоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8,11,14-тетраокса-2,18,24,26-тетраазанонакозан-23,27,29-трикарбоновую кислоту получают согласно той же общей последовательности операций, что и для примера 5а, используя предварительно полученный и защищенный ди-трет-бутиловый эфир 2-[3-(5-амино-1-карбоксипентил)уреидо]пентандиовой кислоты. Сложноэфирный комплекс рения получают согласно той же общей последовательности операций, которая описана в общей экспериментальной части для рения. Соединение деблокируют с использованием описанных ранее методов, получая желаемый продукт (5,1 мг, 29,6%) в виде белого твердого вещества. ESMS m/z: 1019 (М+Н)+.
Пример 5с (n=8): Glu-карбамидо-Lys-PEG8-ReDP: [Re(CO)3{(35R,39S)-29,37-диоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8,11,14,17,20,23,26-октаоксо-2,30,36,38-тетраазагентетраконтан-35,39,41-трикарбоновая кислота}][Вr]. PEG8-дипиридильное соединение, (35R,39S)-29,37-диоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8,11,14,17,20,23,26-октаокса-2,30,36,38-тетраазагентетраконтан-35,39,41-трикарбоновую кислоту получают согласно той же общей последовательности операций, что и для примера 5а, используя предварительно полученный и защищенный ди-трет-бутиловый эфир 2-[3-(5-амино-1-карбоксипентил)уреидо]пентандиовой кислоты. Сложноэфирный комплекс рения получают согласно той же общей последовательности операций, которая описана в общей экспериментальной части для рения. Соединение деблокируют с использованием описанных ранее методов, получая желаемый продукт (8,0 мг, 30,4%) в виде белого твердого вещества. ESMS m/z: 1195 (М+Н)+.
Пример 6: [Rе(СО)3][(19S,23S)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоновая кислота]
Стадия 1. 11-((2-трет-бутокси-2-оксоэтил)((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановая кислота
Суспензию 11-аминоундекановой кислоты (603 мг, 3,0 ммоль), 2-пиридинкарбоксальдегида (630 мг, 3,0 ммоль) и АсОН (0,20 мл) в дихлорэтане (20 мл) кипятят 30 мин под азотом. Охлаждают реакционную смесь до 0°С и добавляют последовательно NaBH(OAc)3 (1,908 г, 9,0 ммоль) и неочищенный тpeт-бутилглиоксалат (1,50 г, 11,5 ммоль). Перемешивают реакционную смесь при комнатной температуре в течение ночи и разлагают водой, после чего реакционную смесь экстрагируют ДХМ. Органический слой осушают и упаривают при пониженном давлении. Остаток очищают хроматографированием методом Biotage на силикагелевой колонке, получая 11-((2-трет-бутокси-2-оксоэтил)((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановую кислоту (343 мг, 22%) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3) 7,01 (d, J=1,2 Гц, 0,46Н), 6,99 (d, J=1,2 Гц, 0,54Н), 6,88 (d, J=1,2 Гц, 0,54 Н), 6,86 (d, J=1,2 Гц, 0,46Н), 5,30 (s, 1,08Н), 5,07 (s, 0,92Н), 4,67 (s, 2Н), 4,66 (s, 2Н), 3,83 (s, 0,92Н), 3,17 (s, 1,08Н), 2,41-2,32 (m, 2Н), 1,66-1,63 (m, 2Н), 1,47 (s, 9Н), 1,45 (s, 9 Н), 1,42-1,10 (m, 14Н); MS (ESI), 510 (М+Н)+.
Стадия 2. (19S,23S)-тетра-трет-бутил-2-((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоксилат
Раствор (S)-ди-трет-бутил-2-(3-((S)-6-амино-1-трет-бутокси-1-оксигексан-2-ил)-уреидо)пентандиоата (85 мг, 0,175 ммоль), 11-((2-трет-бутокси-2-оксоэтил)((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановой кислоты (89 мг, 0,175 ммоль), EDCI (1-этил-3-(3-диметиламинопропил)карбодиимида) (38 мг, 0,20 ммоль), HOBt (1-гидроксибензотриазола) (26 мг, 0,20) и DIPEA (N,N-диизопропилэтиламина) (0,30 мл) в ДХМ (5,0 мл) перемешивают 3 суток при комнатной температуре. Очищают реакционную смесь хроматографированием методом Biotage, элюируя 1-10%-ным МеОН в ДХМ, в результате чего получают (19S,23S)-тетра-трет-бутил-2-((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоксилат (111 мг, 65%) в виде желтого масла. MS (ESI), 490,5 (М/2+Н)+.
Стадия 3. [Rе(СО)3][(19S,23S)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоновая кислота] (221). Раствор (19S,23S)-тетра-трет-бутил-2-((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоксилата (18,8 мг, 0,019 ммоль) в TFA (1,0 мл)/ДХМ (1,0 мл) перемешивают в течение ночи при комнатной температуре. Упаривают растворитель, получая (19S,23S)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоновую кислоту в виде бесцветного масла. К раствору полученного незащищенного продукта в воде (1,0 мл) после доведения pH до 9 с помощью 2 н. NaOH добавляют Re(CO)3(H2O)OTf (0,50 мл, 0,10 мл/ммоль). Реакционные смеси перемешивают в течение ночи при комнатной температуре и очищают методом ЖХВР, получая названное в заголовке соединение (4,0 мг, 19%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) 7,70 (t, J=5,6 Гц, 1Н), 7,33 (s, 1Н), 7,13 (s, 2Н), 6,29 (d, J=8,4 Гц, 1 Н), 6,26 (d, J=8,4 Гц, 1Н), 4,96 (d, J=4,8 Гц, 2Н), 4,56 (d, J=16,4 Гц, 1Н), 4,12 (d, J=16,8 Гц, 1Н), 4,07-3,90 (m, 2Н), 3,70 (d, J=17,2 Гц, 1Н), 3,40 (d, J=17,2 Гц, 1Н), 2,98-2,94 (m, 4Н), 2,21 (q, J=7,73, 2Н), 1,99 (t, J=7,6 Гц, 2Н), 1,70-1,22 (m, 24Н); MS (ESI) (масс-спектрометрия с ионизацией под действием электрораспыления) 485,2 (М/2+Н)+.
Пример 7: [Rе(СО)3][(7S,14S,18S)-7-амино-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота]
Стадия 1. (5S,12S,16S)-три-трет-бутил-5-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-1-(9Н-флуорен-9-ил)-3,6,14-триоксо-2-окса-4,7,13,15-тетраазаоктадекан-12,16,18-трикарбоксилат
Раствор (S)-ди-трет-бутил-2-(3-((S)-6-амино-1-трет-бутокси-1-оксигексан-2-ил)-уреидо)пентандиоата (97 мг, 0,20 ммоль), соединения 2 (151 мг, 0,20 ммоль), HOBt (26 мг, 0,20) и DIPEA (0,30 мл) в ДХМ (5,0 мл) перемешивают в течение ночи при комнатной температуре. Очищают реакционную смесь хроматографированием методом Biotage, элюируя 1-10%-ным МеОН в ДХМ, в результате чего получают (5S,12S,16S)-три-трет-бутил-5-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-1-(9Н-флуорен-9-ил)-3,6,14-триоксо-2-окса-4,7,13,15-тетраазаоктадекан-12,16,18-трикарбоксилат (85,7 мг, 35%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) 7,75 (d, J=7,6 Гц, 2Н), 7,64 (d, J=7,6 Гц, 2Н), 7,38 (t, J=7,4 Гц, 2Н), 7,29 (dd, J=7,6, 4,4 Гц, 2Н), 7,02 (широкий s, 1Н), 6,93 (s, 2Н), 6,80 (s, 2Н), 6,08 (d, J=8,0 Гц, 1Н), 5,75 (d, J=8,8 Гц, 1Н), 5,67 (d, J=7,6 Гц, 1Н), 4,58 (s, 2Н), 4,56 (s, 2Н), 4,55-4,52 (m, 1Н), 4,36-4,29 (m, 3Н), 4,21 (d, J=7,0 Гц, 1Н), 4,13 (t, J=6,8 Гц, 1Н), 3,63 (s, 4Н), 3,48-3,46 (m, 1Н), 3,05-3,01 (m, 1Н), 2,53 (t, J=7,2 Гц, 2Н), 2,33-2,26 (m, 2Н), 2,07-2,00 (m, 2Н), 1,77-1,26 (m, 55Н); MS (ESI), 614,0 (М/2+Н)+.
Стадия 2. (7S, 14S, 18S)-три-трет-бутил-7-амино-1-(1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-трет-бутокси-2-оксозтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилат
К раствору (5S,12S,16S)-три-трет-бутил-5-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-1-(9Н-флуорен-9-ил)-3,6,14-триоксо-2-окса-4,7,13,15-тетраазаоктадекан-12,16,18-трикарбоксилата (84 мг, 0,069 ммоль) в DMF (0,50 мл) добавляют пиперидин (0,50 мл). Перемешивают смесь 2 часа при комнатной температуре. Упаривают растворитель при пониженном давлении, получая остаток, который очищают хроматографированием методом Biotage, элюируя 5-25%-ным МеОН в ДХМ, в результате чего получают (7S,14S,18S)-три-трет-бутил-7-амино-1-(1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилат (59 мг, 86%). 1Н ЯМР (400 МГц, CDCl3) 6,96 (d, J=0,8 Гц, 2Н), 6,85 (d, J=0,8 Гц, 2Н), 5,55 (широкий s, 1Н), 5,43 (широкий s, 1Н), 4,59 (s, 4Н), 4,37-4,28 (m, 2Н), 3,61 (s, 4Н), 3,35-3,27 (m, 2Н), 3,18-3,12 (m, 1Н), 2,53 (t, J=7,4 Гц, 2Н), 2,34-2,28 (m, 2Н), 2,10-2,00 (m, 2Н), 1,85-1,26 (m, 55Н); MS (ESI), 503,0 (М/2+Н)+.
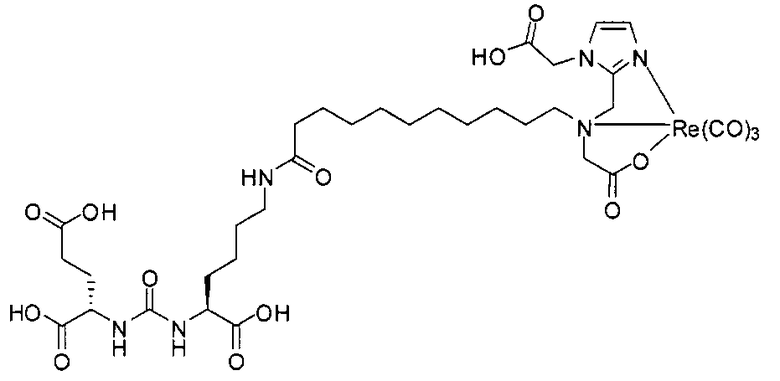
Стадия 3. [Rе(СО)3][(7S,14S,18S)-7-амино-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота]. Раствор (7S,14S,18S)-три-трет-бутил-7-амино-1-(1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилата (42 мг, 0,042 ммоль) и [NEt4]2[Re(CO)3Br3] (42 мг, 0,055 ммоль) в МеОН (5 мл) перемешивают 4 часа в герметизированном сосуде при 90°С. Упаривают растворитель, получая остаток, который непосредственно используют на следующей стадии. Раствор полученного продукта в TFA (3,0 мл)/ДХМ (3,0 мл) перемешивают в течение ночи при комнатной температуре. Отгоняют растворитель, получая сырой продукт, который очищают методом ЖХВР, получая названное в заголовке соединение (27,9 мг, 67% по 2 стадиям) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) 8,42 (широкий s, 1Н), 8,10 (широкий s, 2Н), 7,18 (s, 2Н), 7,04 (s, 2Н), 6,32 (d, J=8,4 Гц, 1Н), 6,29 (d, J=8,0 Гц, 1Н), 4,02 (s, 4H), 4,56-4,37 (m, 4H), 4,08-4,01 (m, 2H), 3,68-3,61 (m, 3H), 3,11-3,08 (m, 2H), 2,23-1,29 (m, 16H); MS (ESI), 497.7 (M/2+H)+.
Пример 8: [Re(CO)3][(19S,23S)-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоновая кислота]
Стадия 1. Трет-бутил-2,2'-(2-бромацетилазанедиил)диацетат. К раствору трет-бутил-2,2'-азанедиил-диацетата (3,00 г,12,24 ммоль) и 2-бромацетилбромида (1,39 мл, 3,23 г, 16,00 ммоль) в ДХМ (100 мл) добавляют Et3N (2,0 мл) при комнатной температуре. Реакционную смесь перемешивают 2 часа при комнатной температуре, разбавляют ДХМ (300 мл), промывают водой и высушивают над Na2SO4. Упаривают растворитель при пониженном давлении, получая остаток, который очищают хроматографированием методом Biotage, элюируя от 10 до 50%-ным гексаном в ЕtOАс, в результате чего получают трет-бутил-2,2'-(2-бромацетилазанедиил)диацетат, (4,68 г, 100%). 1Н ЯМР (400 МГц, CDCl3) 4,09 (s, 2Н), 4,07 (s, 2Н), 3,86 (s, 2 Н), 1,49 (s, 9Н), 1,46 (s, 9Н); MS (ESI), 388, 390 (M+Na)+.
Стадия 2. Трет-бутил-2,2,-(2-(2-формил-1Н-имидазол-1-ил)ацетилазанедиил)-диацетат
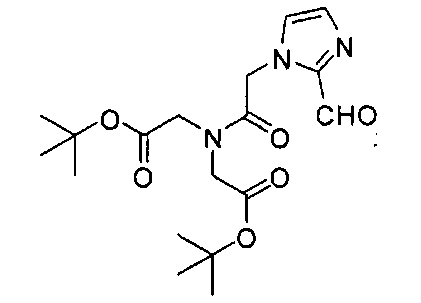
Раствор трет-бутил-2,2'-(2-бромацетилазанедиил)диацетата (4,55 г, 12,43 ммоль), 1H-имидазол-2-карбальдегида (1,536 г, 16,0 ммоль), DIPEA (5,0 мл) и KI (0,64 г, 4,0 ммоль) перемешивают в течение ночи при 80°С. После отгонки растворителя при пониженном давлении реакционную смесь разбавляют ДХМ, промывают водой и высушивают. Упаривают растворитель при пониженном давлении, получая остаток, который очищают хроматографированием методом Biotage, элюируя от ДХМ до 3% МеОН в ДХМ, в результате чего получают трет-бутил-2,2'-(2-(2-формил-бромацетилазанедиил)диацетат-1Н-имидазол-1-ил)ацетилазанедиил)диацетат (3,96 г, 84%). 1Н ЯМР (400 МГц, CDCl3) 9,76 (s, 1Н), 7,31 (s, 1Н), 7,25 (s, 1Н), 5,30 (s, 2Н), 4,14 (s, 2Н), 4,07 (s, 2Н), 1,51 (s, 9Н), 1,43 (s, 9Н); MS (ESI), 382 (М+Н)+.
Стадия 3. 11-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановая кислота
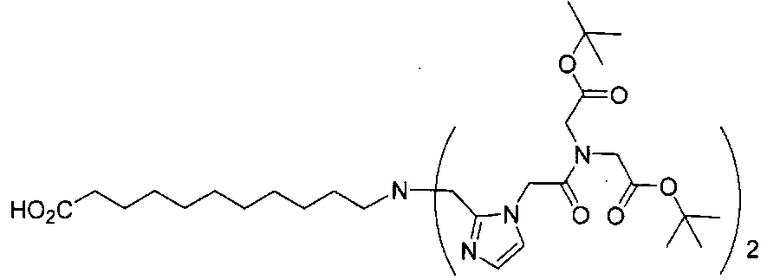
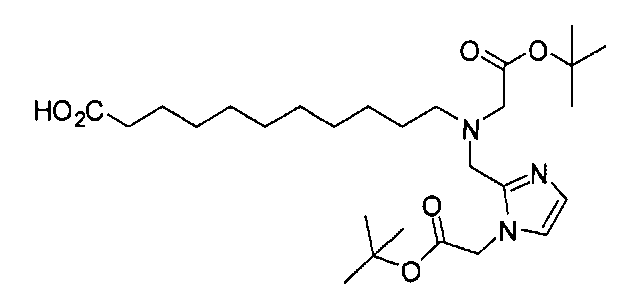
Раствор 11-аминоундекановой кислоты (100 мг, 0,50 ммоль), трет-бутил-2,2'-(2-(2-формил-1Н-имидазол-1-ил)ацетилазанедиил)диацетата (381 мг, 1,0 ммоль) и АсОН (0,02 мл) в дихлорэтане (30 мл) перемешивают 30 мин при 75°С под азотом. Охлаждают реакционную смесь до 0°С и добавляют NаВН(ОАс)3 (0,3165 г, 1,5 ммоль). Перемешивают реакционную смесь в течение ночи при комнатной температуре и разлагают водой. Упаривают растворитель при пониженном давлении с образованием остатка, который очищают хроматографированием методом Biotage, элюируя 1-10% МеОН в ДХМ 11-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановую кислоту (368 мг, 79%). 1Н ЯМР (400 МГц, DMSO-d6) 6,93 (s, 2 Н), 6,76 (s, 2Н), 5,02 (s, 4Н), 4,29 (s, 4Н), 3,93 (s, 4Н), 3,44 (s, 4Н), 2,30 (t, J=7,6 Гц, 2Н), 2,09 (t, J=7,6 Гц, 2Н), 1,43 (s, 18Н), 1,35 (s, 18Н), 1,29-1,00 (m, 16 Н); MS (ESI), 466,9 (М/2+Н)+.
Стадия 4. (19S,23S)-три-трет-бутил-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоксилат
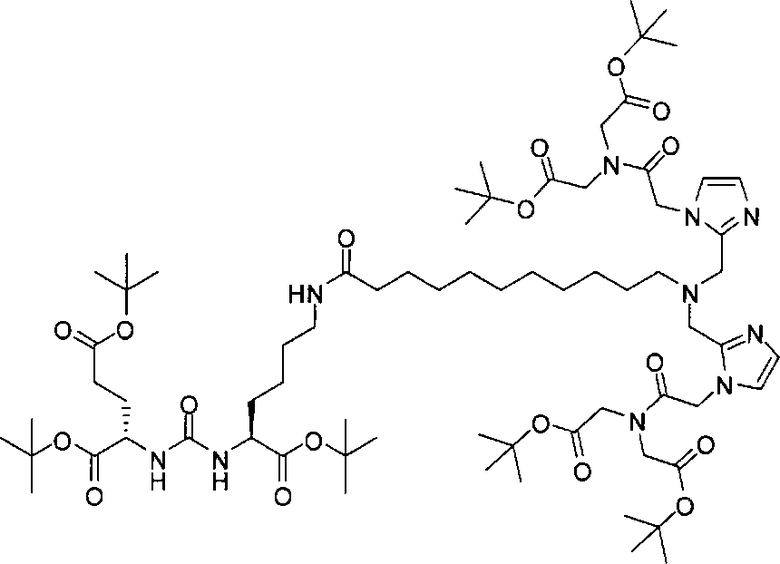
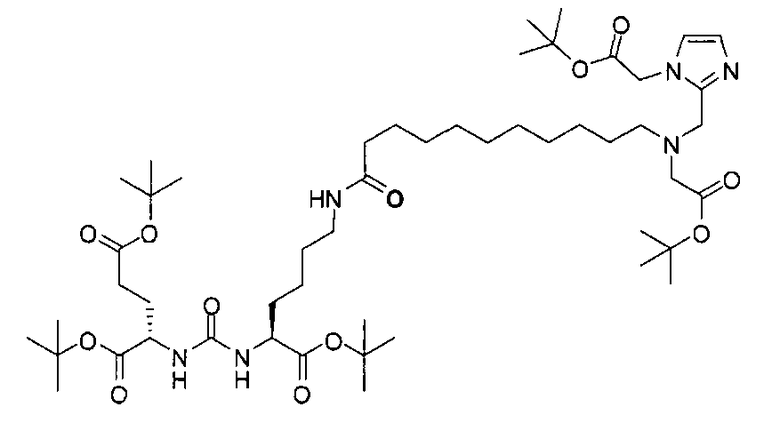
Раствор (S)-ди-трет-бутил-2-(3-((S)-6-амино-1-трет-бутокси-1-оксогексан-2-ил)уреидо)пентандиоата (85 мг, 0,174 ммоль), 11-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановой кислоты (118 мг, 0,127 ммоль), EDCI (38 мг, 0,20 ммоль), HOBt (26 мг, 0,20) и DIPEA (0,30 мл) в ДХМ (5,0 мл) перемешивают в течение ночи при комнатной температуре. Очищают реакционную смесь хроматографированием методом Biotage, элюируя 1-10%-ным МеОН в ДХМ, в результате чего получают (19S,23S)-три-трет-бутил-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоксилат (38 мг, 21%) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3) 6,95 (d, J=1,2 Гц, 2Н), 6,83 (d, J=0,80 Гц, 2Н), 5,97 (s, 1Н), 5,28 (d, J=7,6 Гц, 1Н), 5,23 (d, J=8,4 Гц, 1Н), 4,94 (s, 4Н), 4,33-4,25 (m, 2Н), 4,12 (s, 4Н), 4,03 (s, 4Н), 3,63 (s, 4Н), 3,25-3,16 (m, 2Н), 2,53 (t, J=7,4 Гц, 2Н), 2,33-2,24 (m, 2Н), 2,15 (t, J=7,6 Гц, 2Н), 2,08-2,03 (m, 2Н), 2,02-1,20 (m, 85Н); MS (ESI), 701,6 (М/2+Н)+.
Стадия 5. [Rе(СО)3][(19S,23S)-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоновая кислота] (223). Раствор (19S,23S)-три-трет-бутил-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоксилата (28 мг, 0,02 ммоль) и [NEt4]2[Re(CO)3Br3] (30 мг, 0,039 ммоль) в МеОН (5 мл) перемешивают в герметизированном сосуде в течение ночи при 90°С. Упаривают растворитель с образованием остатка, который непосредственно используют на следующей стадии. Раствор полученного продукта в TFA (3,0 мл)/ДХМ (3,0 мл) перемешивают 3 часа при комнатной температуре, упаривают растворитель, получая сырой продукт, который очищают методом ЖХВР, получая указанное в заголовке соединение (17,6 мг, 69% по 2 стадиям) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) 7,70 (t, J=4,8 Гц, 1Н), 7,10 (s, 2Н), 7,03 (s, 2Н), 6,29 (d, J=8,4 Гц, 1Н), 6,26 (d, J=8,4 Гц, 1Н), 5,02 (s, 4Н), 4,37-3,97 (m, 14Н), 3,60-3,57 (m, 2Н), 3,01-2,94 (m, 2Н), 2,24-1,22 (m, 28Н); MS (ESI), 640,3 (М/2+Н)+.
Пример 9: [Re(CO)3][(7S,14S,18S)-7-амино-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота]
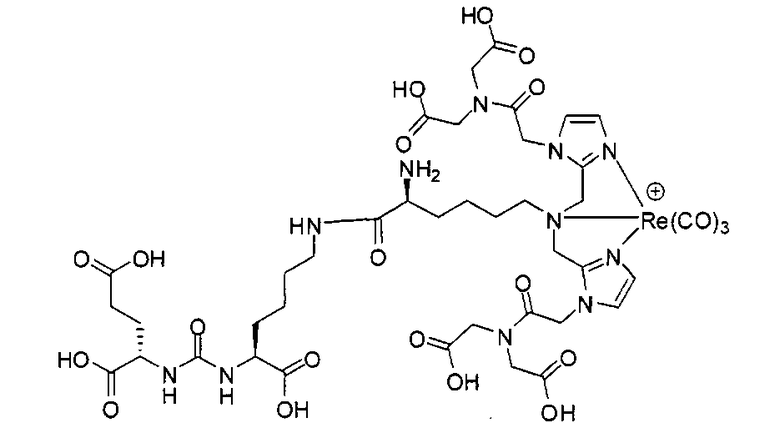
Стадия 1. 2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановая кислота
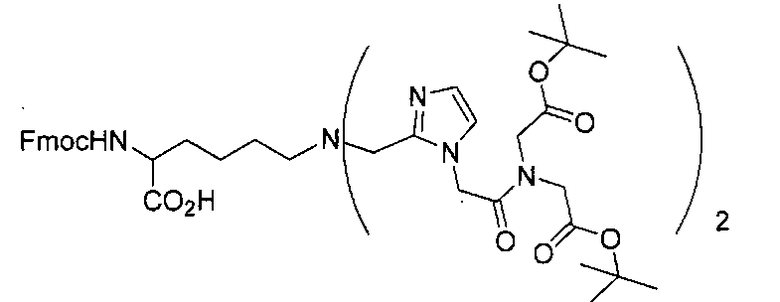
Суспензию L-Fmoc-лизин-ОН (0,202 г, 0,50 ммоль) и трет-бутил-2,2'-(2-(2-формил-1Н-имидазол-1-ил)ацетилазанедиил)диацетат (0,381 г, 1,00 ммоль) в дихлорэтане (30 мл) нагревают 30 мин при 80°С. Охлаждают реакционную смесь до 0°С и добавляют NaBH(OAc)3 (0,3165 г, 1,50 ммоль). Перемешивают реакционную смесь 12 ч при комнатной температуре и разлагают водой, после чего реакционную смесь экстрагируют ДХМ. Органический слой высушивают и концентрируют при пониженном давлении. Остаток очищают с помощью Biotage SP4, используя градиентный метод с 5-25% метанолом в ДХМ, в результате чего получают 2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановую кислоту в виде белого твердого вещества (0,408 г, выход 74%). 1Н ЯМР (400 МГц, CDCl3) 7,74 (d, J=7,6 Гц, 2Н), 7,67 (t, J=6,0 Гц, 2Н), 7,38 (t, J=7,4 Гц, 2Н), 7,29 (d, J=7,6 Гц, 2Н), 6,92 (s, 2Н), 6,29 (s, 2Н), 6,19 (широкий s, 1Н), 5,09-5,04 (m, 2Н), 4,81-4,79 (m, 1Н), 4,39-4,30 (m, 4Н), 4,23 (t, J=7,2 Гц, 1Н), 4,22-3,58 (m, 10Н), 3,48 (s, 2Н), 2,34-2,30 (m, 2Н), 1,67-1,26 (m, 6Н), 1,50 (s, 18Н), 1,42 (s, 18Н). ESMS m/z: 550,5 (М/2+Н)+.
Стадия 2. (7S,14S,18S)-три-трет-бутил-7-амино-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазоикозан-14,18,20-трикарбоксилат
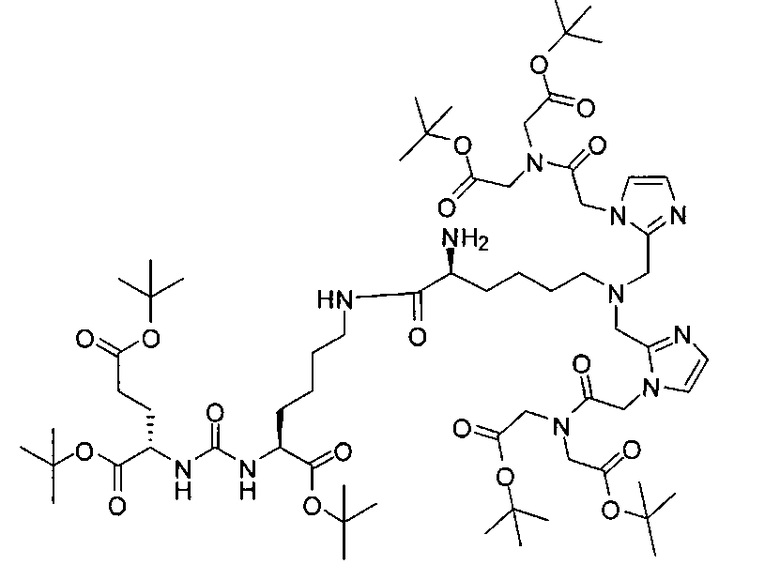
Раствор (S)-ди-трет-бутил-2-(3-((S)-6-амино-1-трет-бутокси-1-оксогексан-2-ил)-уреидо)пентандиоата (97 мг, 0,20 ммоль), 2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановой кислоты (132 мг, 0,12 ммоль), EDCI (38 мг, 0,20 ммоль), HOBt (26 мг, 0,20) и DIPEA (0,30 мл) в ДХМ (5,0 мл) перемешивают двое суток при комнатной температуре. Реакционную смесь очищают хроматографированием методом Biotage, элюируя 1% МеОН в ДХМ, в результате чего получают (5S,12S,16S)-три-трет-бутил-7-амино-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазоикозан-14,18,20-трикарбоксилат (неочищенный) в виде масла.
К раствору полученного выше продукта, (5S,12S,16S)-три-трет-бутил-7-амино-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксозтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазоикозан-14,18,20-трикарбоксилата в DMF (1,0 мл) добавляют пиперидин (0,50 мл). Смесь перемешивают 2 часа при комнатной температуре. Растворитель отгоняют при пониженном давлении, получая при этом остаток, который очищают хроматографированием методом Biotage, элюируя начиная с 5% МеОН до 50% МеОН в ДХМ, в результате чего получают (7S,14S,18S)-три-трет-бутил-7-амино-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилат (40 мг, 25%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) 6,96 (s, 2Н), 6,83 (d, 2Н), 6,37 (широкий s, 1Н), 6,33 (широкий s, 1Н), 5,05 (s, 4Н), 4,87 (широкий s, 2Н), 4,27-4,24 (m, 2Н), 4,18 (s, 4Н), 4,10 (s, 4Н), 3,88 (d, J=15,2 Гц, 2Н), 3,62 (d, J=15,2 Гц, 2Н), 3,14-3,12 (m, 1Н), 2,30-1,24 (m, 83Н); MS (ESI), 674,1 (М/2+Н)+.
Стадия 3. [Rе(СО)3][(7S,14S,18S)-7-амино-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота] (224). Раствор (7S,14S,18S)-три-трет-бутил-7-амино-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилата (19 мг, 0,014 ммоль) и [NEt4]2[Re(CO)3Br3] (19 мг, 0,024 ммоль) в МеОН (3 мл) перемешивают 3 часа в герметизированном сосуде при 90°С. Растворитель упаривают с образованием остатка, который непосредственно используют на следующей стадии. Раствор полученного продукта в TFA (3,0 мл)/ДХМ (3,0 мл) перемешивают в течение ночи при комнатной температуре. Растворитель отгоняют, в результате чего получают сырой продукт, который очищают методом ЖХВР, получая [Rе(СО)3][(7S,14S,18S)-7-aмино-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновую кислоту] (14,1 мг, 82% по двум стадиям) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) 8,43 (широкий s, 1Н), 8,09 (широкий s, 3Н), 7,10 (s, 2Н), 7,03 (s, 2Н), 6,51 (широкий s, 1Н), 6,31 (d, J=8,0 Гц, 1Н), 6,28 (d, J=8,4 Гц, 1Н), 5,00 (s, 4Н), 4,40-4,01 (m, 14Н), 3,70-3,64 (m, 3Н), 3,11-3,08 (m, 2Н), 2,26-1,29 (m, 16Н); MS (ESI), 612,8 (М+Н)/2+.
Пример 10: [Re(CO)3][(7S,12S,16S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15-тетраазаоктадекан-7,12,16,18-тетракарбоновая кислота]
Стадия 1. (S)-ди-трет-бутил-2-(3-((S)-1-трет-бутокси-5-(2,5-диоксопирролидин-1-илокси)-1,5-диоксопентан-2-ил)уреидо)пентандиоат
Раствор (S)-5-трет-бутокси-4-(3-((S)-1,5-ди-трет-бутокси-1,5-диоксопентан-2-ил)уреидо)-5-оксопентановой кислоты (Kularatne, S.A.; et. al. Mol. Pharmaceutics, 2009, 6, 790-800) (164 мг, 0,336 ммоль), N,N'-дисукцинимидил-карбоната (128 мг, 0,50 ммоль) и пиридин (0,10 мл) в CH3CN (5,0 мл) перемешивают в течение ночи при комнатной температуре. Растворитель удаляют при пониженном давлении с образованием остатка, который очищают хроматографированием методом Biotage, элюируя 10-70% ЕtOАс в гексанах, в результате чего получают (S)-ди-трет-бутил-2-(3-((S)-1-трет-бутокси-5-(2,5-диоксопирролидин-1-илокси)-1,5-диоксопентан-2-ил)уреидо)пентандиоат (190 мг, 97%) в виде белого твердого вещества.
Стадия 2. (2S,7S,11S)-2-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овая кислота
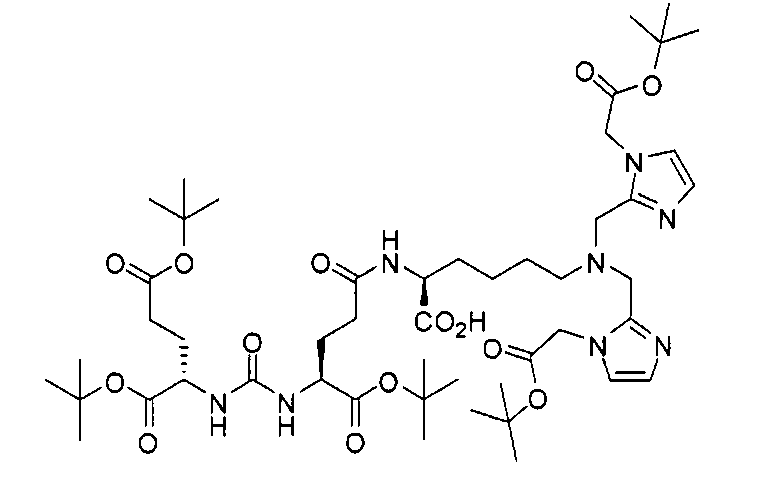
Раствор (S)-ди-трет-бутил 2-(3-((S)-1-трет-бутокси-5-(2,5-диоксопирролидин-1-илокси)-1,5-диоксопентан-2-ил)уреидо)пентандиоата (138 мг, 0,236 ммоль), (S)-2-амино-6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановой кислоты (127 мг, 0,237 ммоль) и DIPEA (0,50 мл) в DMF (1,0 мл) перемешивают в течение ночи при комнатной температуре. Растворитель удаляют при пониженном давлении с образованием осадка, который очищают хроматографированием методом Biotage, элюирая 1-50% МеОН в ДХМ, в результате чего получают (2S,7S,11S)-2-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-16,16-дометил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овую кислоту (203 мг, 86%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) 7,40 (широкий s, 1Н), 6,99 (s, 2Н), 6,79 (s, 2Н), 6,12 (широкий s, 1Н), 5,62 (широкий s, 1Н), 4,67-4,28 (m, 7Н), 3,68 (d, J=14,0 Гц, 2Н), 3,62 (d, J=14,0 Гц, 2Н), 2,62-2,53 (m, 2Н), 2,34-2,02 (m, 8Н), 1,83-1,42 (m, 51Н); MS (ESI), 503,5 (М/2+Н)+.
Стадия 3. [Re(CO)3][(7S,12S,16S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15-тетраазаоктадекан-7,12,16,18-тетракарбоновая кислота] (225). Раствор ((2S,7S,11S)-2-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овой кислоты (45 мг, 0,0448 ммоль) и [NEt4]2[Re(CO)3Br3] (45 мг, 0,058 ммоль) в МеОН (5 мл) в герметизированном сосуде перемешивают 4 часа при 90°С. Упаривают растворитель с образованием остатка, который непосредственно используют на следующей стадии. Раствор полученного выше продукта в TFA (2,0 мл)/ДХМ (3,0 мл) перемешивают в течение ночи при комнатной температуре. Упаривают растворитель с образованием сырого продукта, который очищают методом ЖХВР, в результате чего получают [Re(CO)3][(7S,12S,16S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15-тетраазаоктадекан-7,12,16,18-тетракарбоновую кислоту] (30 мг, 67% на двух стадиях) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) 8,14 (d, J=7,2 Гц, 1Н), 7,19 (d, J=0,8 Гц, 2Н), 7,05 (d, J=1,2 Гц, 2Н), 6,37-6,34 (m, 2Н), 4,85 (s, 4Н), 4,58 (dd, J=16,4, 2,8 Гц, 2Н), 4,40 (dd, J=16,0, 2,8 Гц, 2Н), 4,22-4,04 (m, 3Н), 3,65 (t, J=7,6 Гц, 2Н), 2,25-1,32 (m, 16Н); MS (ESI), 995.3 М+.
Пример 11: [Rе(СО)3][(7S,12S,16S)-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15-тетраазаоктадекан-7,12,16,18-тетракарбоновая кислота]
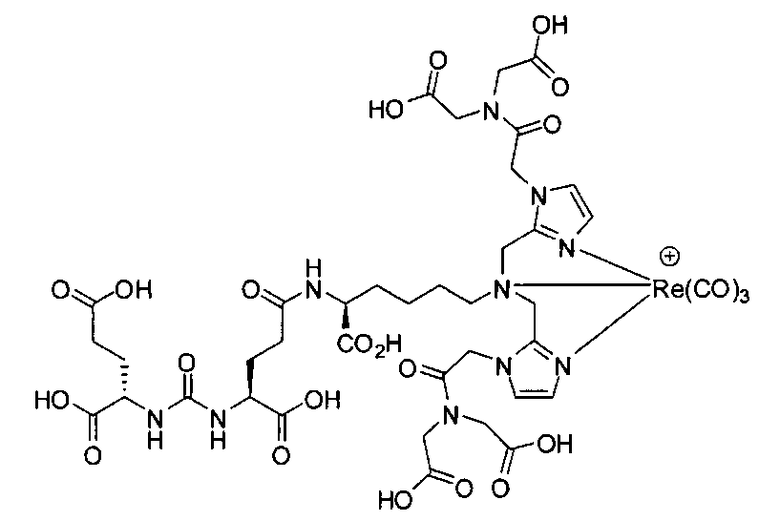
Стадия 1. (S)-2-амино-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановая кислота
Раствор 2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановой кислоты (190 мг, 0,173 ммоль) и пиперидина (0,50 мл) в DMF (0,50 мл) перемешивают 1 час при комнатной температуре. Растворитель отгоняют при пониженном давлении, получая сырой продукт. Сырой продукт очищают с помощью Biotage SP4 градиентным методом с 5-50% метанола в ДХМ, в результате чего получают (S)-2-амино-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановую кислоту (0,120 г, 79%). 1Н ЯМР (400 МГц, DMSO-d6) 6,92 (s, 2Н), 6,76 (s, 2Н), 5,01 (s, 4Н), 4,32 (s, 2Н), 4,31 (s, 2Н), 3,92 (s, 4Н), 3,44 (s, 4Н), 3,01-2,99 (m, 1Н), 2,30 (t, J=7,2 Гц, 2Н), 1,60-1,57 (m, 2Н), 1,43 (s, 18Н), 1,35 (m, 18Н). 1,30-1,12 (m, 4Н); MS (ESI), 439.4 (М/2+Н)+.
Стадия 2. (2S,7S,11S)-2-(4-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овая кислота
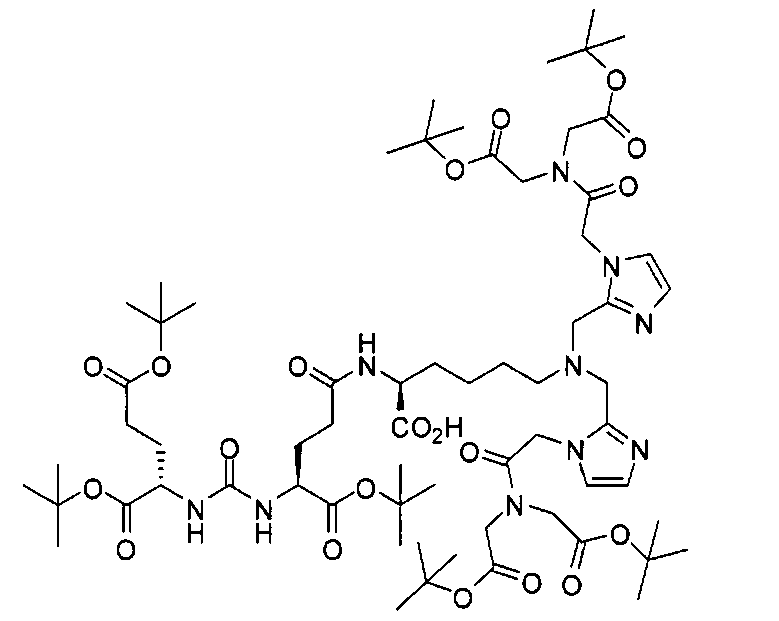
Раствор (S)-ди-трет-бутил-2-(3-((S)-1-трет-бутокси-5-(2,5-диоксопирролидин-1-илокси)-1,5-диоксопентан-2-ил)уреидо)пентандиоата (82 мг, 0,14 ммоль), ((S)-2-амино-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановой кислоты (98 мг, 0,11 ммоль) и DIPEA (0,50 мл) в DMF (2,0 мл) перемешивают в течение ночи при комнатной температуре. Растворитель отгоняют при пониженном давлении с образованием остатка, который очищают хроматографированием методом Biotage, элюирая 1-40% МеОН в ДХМ, в результате чего получают (2S,7S,1lS)-2-(4-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овую кислоту (125 мг, 84%) в виде белого твердого вещества. MS (ESI), 674.6 (М/2+Н)+.
Стадия 3. [Re(CO)3][(7S,12S,16S)-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15-тетраазаоктадекан-7,12,16,18-тетракарбоновая кислота] (226). Раствор (2S,7S,11S)-2-(4-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11 -бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овой кислоты (54 мг, 0,040 ммоль) и [NEt4]2[Re(CO)3Br3] (47 мг, 0,060 ммоль) в МеОН (5 мл) перемешивают 4 часа в герметизированном сосуде при 90°С. Удаляют растворитель с образованием остатка, который непосредственно используют на следующей стадии. Раствор полученного выше продукта в TFA (2,0 мл)/ДХМ (3,0 мл) перемешивают в течение ночи при комнатной температуре. Растворитель отгоняют, получая сырой продукт, который очищают методом ЖХВР, в результате чего получают соединение, названное в заголовке (44,8 мг, 91% на двух стадиях) в виде белого твердого продукта. 1Н ЯМР (400 МГц, DMSO-d6) 8,17 (d, J=7,6 Гц, 1Н), 7,11 (d, J=1,2 Гц, 2Н), 7,03 (d, J=1,2 Гц, 2Н), 6,37-6,33 (m, 2Н), 5,02 (s, 4Н), 4,40-3,98 (m, 15Н), 3,65 (t, J=7,6 Гц, 2Н), 2,25-1,32 (m, 14Н); MS (ESI), 613,3 (М+Н)/2+.
С помощью приведенных выше методов получены дополнительные соединения, выбор реагентов для которых дается в приведенных ниже примерах 14-20.
Пример 12: (7S,22S,26S)-9,16,24-триоксо-1-(хинолин-2-ил)-2-(хинолин-2-илметил)-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновая кислота
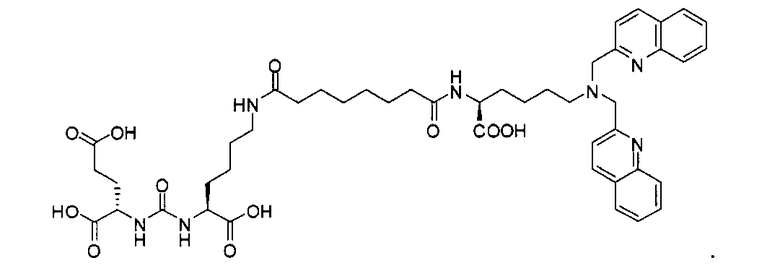
Пример 13: (7S,22S,26S)-9,16,24-триоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновая кислота
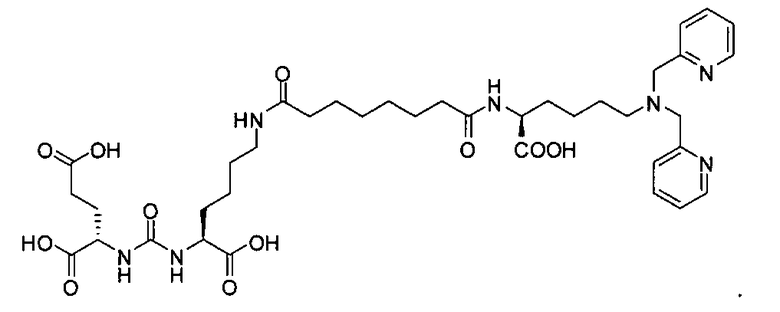
Пример 14: (22S,26S)-9,16,24-триоксо-2-(пиридин-2-илметил)-2,8,17,23,25-пентаазаоктакозан-1,7,22,26,28-пентакарбоновая кислота
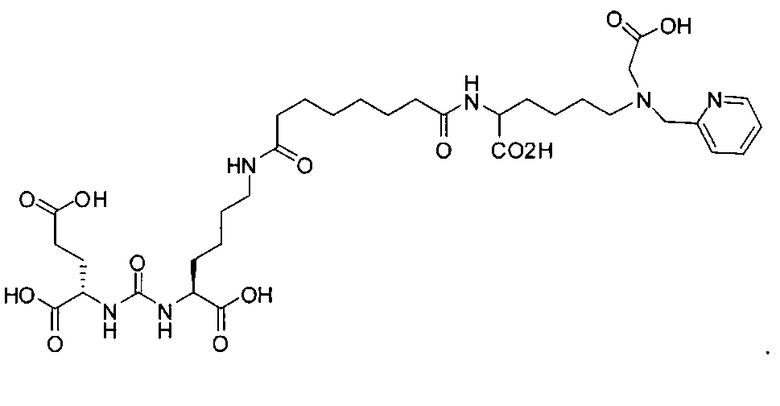
Пример 15: (7S,22S,26S)-1-(1-(карбоксиметил)-1Н-имидазол-1-ил)-2-((3-(карбоксиметил)-3Н-пиррол-2-ил)метил)-9,16,24-триоксо-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновая кислота
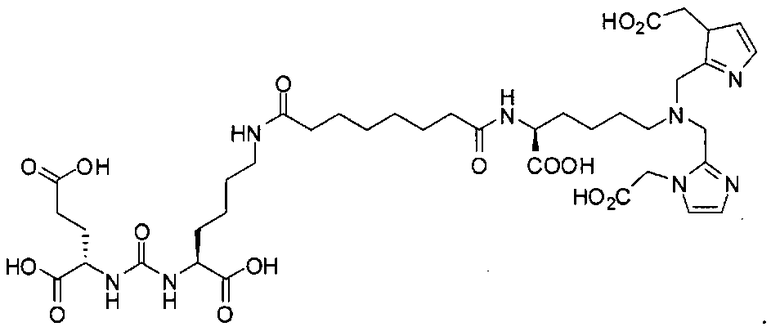
Пример 16: (19S,23S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазаоктакозан-19,23,25-трикарбоновая кислота
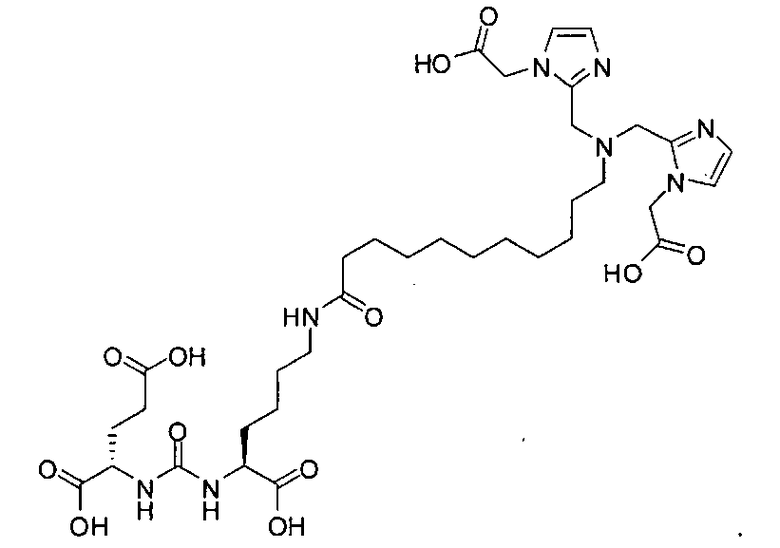
Пример 17: (7S,11S,26S)-26-(4-(бис((1-метил-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-2,2-диметил-4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овая кислота
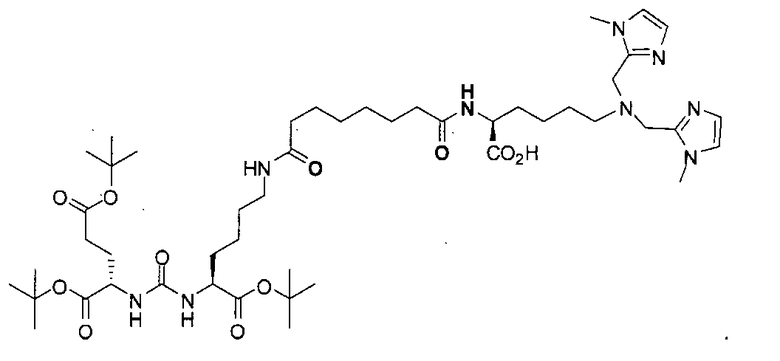
Другие соединения могут быть получены при введении хелатора на основе 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты (DOTA). Такие хелаторы на основе DOTA могут быть использованы для хелатирования визуализационных металлов, включающих (но без ограничения ими) иттрий, лютеций, галлий и индий. Хелаторы на основе DOTA могут быть получены как описано выше с использованием одной из кислотных групп DOTA для связи с другими R-группами. Типичные соединения на основе DOTA включают (но без ограничения ими) следующие (у которых М обозначает Y, Lu, Ga или In, а n равно от 0 до 20):
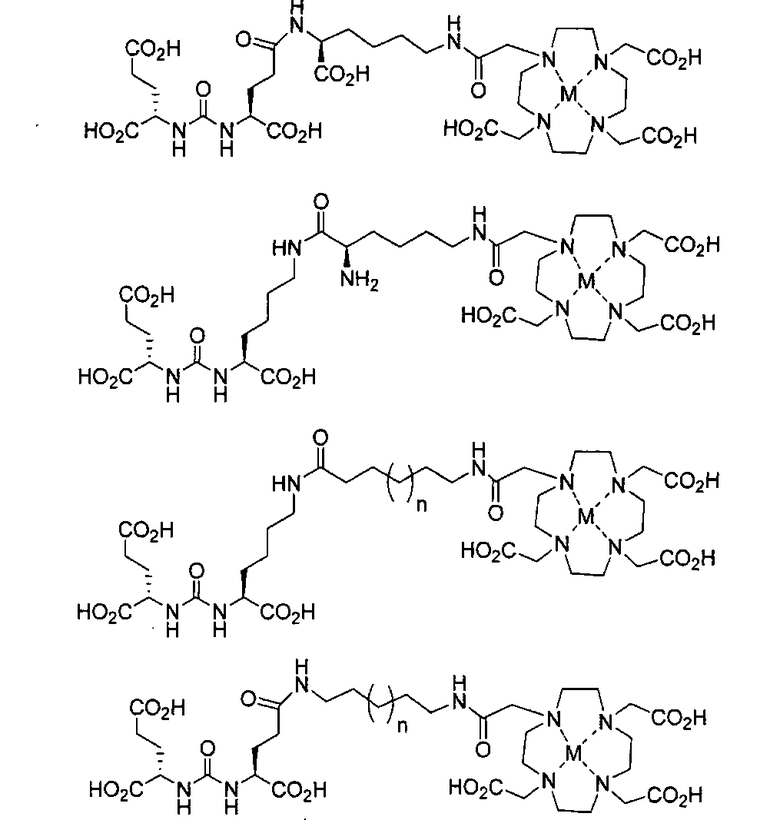
Пример 18: Комплекс Rе(СО)3 с (7S,22S,26S)-1-(1-метил-1Н-имидазол-2-ил)-2-((1-метил-1Н-имидазол-2-ил)метил)-9,16,24-триоксо-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновой кислотой
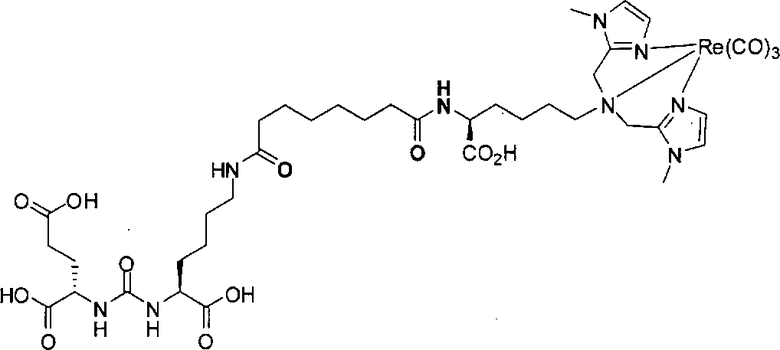
Раствор (S)-ди-трет-бутил-2-(3-((S)-1-трет-бутокси-6-(8-(2,5-диоксопирролидин-1-илокси)-8-оксооктанамидо)-1-оксогексан-2-ил)уреидо)пентандиоата (0,356 г, 0,48 ммоль), соединения 13 (0,16 г, 0,48 ммоль) и DIPEA (1,0 мл) в DMF (5,0 мл) перемешивают в течение ночи при комнатной температуре. Упаривают растворитель с образованием остатка, который очищают хроматографированием методом Biotage, элюирая смесью ДХМ/МеОН, в результате чего получают (7S,11S,26S)-26-(4-(бис((1-метил-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-2,2-диметил-4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овую кислоту (81 мг, 18%). MS (ESI), 481 (М/2+Н)+.
Раствор (7S,11S,26S)-26-(4-(бис((1-метил-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-2,2-диметил-4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овой кислоты (72 мг, 0,075 ммоль) и [NEt4]2[Re(CO)3Br3] (72 мг, 0,094 ммоль) в МеОН (4 мл) перемешивают в герметизированном сосуде 4 часа при 95°С. Упаривают растворитель с образованием остатка, который используется непосредственно на следующей стадии. Раствор полученного выше продукта в TFA/ДХМ перемешивают в течение ночи при комнатной температуре. Упаривают растворитель, получая сырой продукт, который очищают методом ЖХВР, в результате чего получают [Re(CO)3][(7S,22S,26S)-1-(1-метил-1Н-имидазол-2-ил)-2-((1-метил-1Н-имидазол-2-ил)метил)-9,16,24-триоксо-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновую кислоту] (4,0 мг) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) 8,08 (d, J=8,0 Гц, 1 Н), 7,72 (t, J=5,4 Гц, 1Н), 7,24 (d, J=1,2 Гц, 2Н), 7,05 (d, J=1,2 Гц, 2Н), 6,31 (d, J=8,4 Гц, 1Н), 6,28 (d, J=8,0 Гц, 1Н), 4,69 (d, J=16,8 Гц, 2Н), 4,54 (d, J=16,8 Гц, 2Н), 4,28-4,23 (m, 1Н), 4,11-4,03 (m, 2Н), 3,78 (s, 6Н), 2,97-2,92 (m, 2Н), 2,26-2,20 (m, 2Н), 2,11 (t, J=7,2 Гц, 2 Н), 1,99 (t, J=7,6 Гц, 2Н), 1,90-1,20 (m, 24Н); MS (ESI), 531,8 (М/2+Н)+.
С помощью приведенных выше в качестве иллюстрации методов получены другие комплексы соединений формулы I с рением и технецием, а также другие хелатные комплексы с металлами. В результате лантанидного сжатия рений и технеций имеют близкие размер и реакционную способность. Поскольку рений, как таковой, имеет порядковый номер стабильных изотопов, которые не являются радиоактивными, комплексы рения выполняют роль хороших синтетических и испытательных моделей для поведения соответствующих комплексов радиоактивного технеция. Таким образом, в тех случаях, когда в качестве примеров предлагаются комплексы рения, могут быть также получены и комплексы технеция, и наоборот.
Примеры в приведенной ниже таблице 1 были получены или получают с помощью приведенных выше методов, либо в выделенном виде, либо in situ, как описано выше в связи с защитными группами.
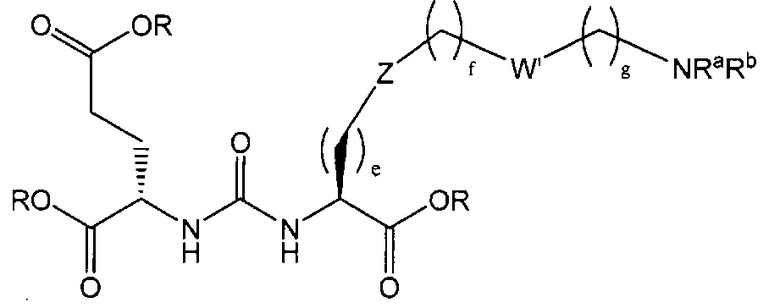
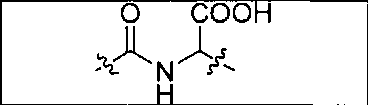
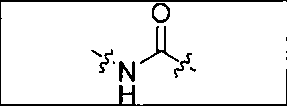
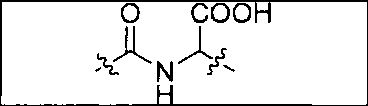
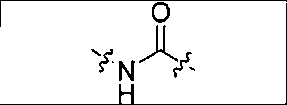
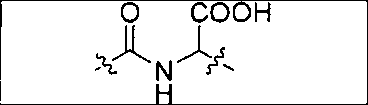
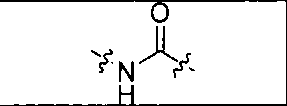
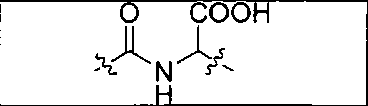
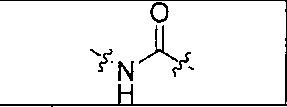
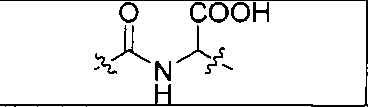
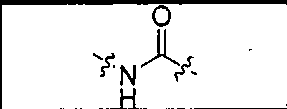
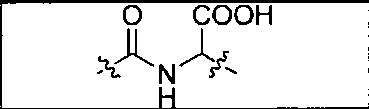
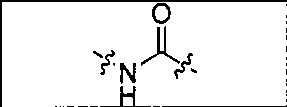
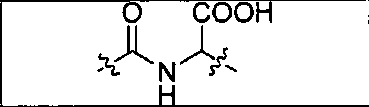
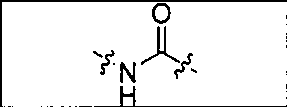
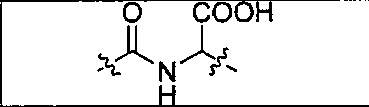
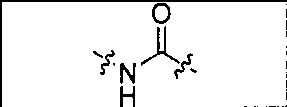
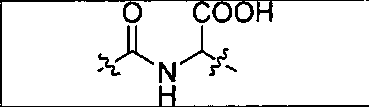
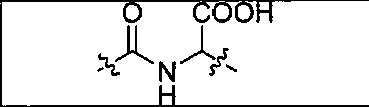
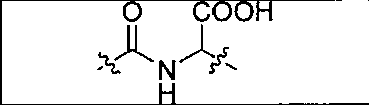
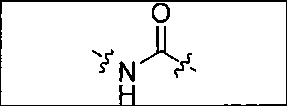
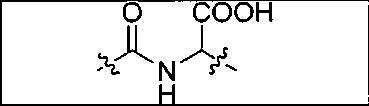
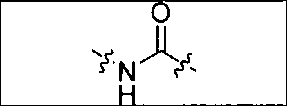
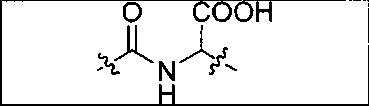
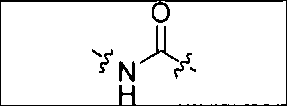
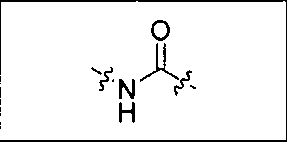
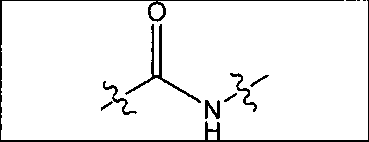
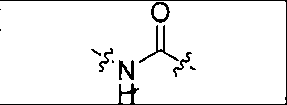
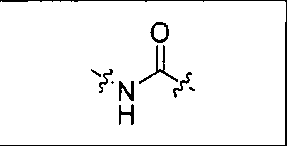
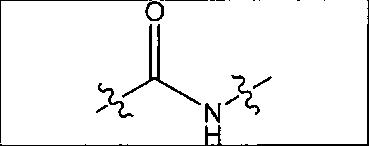
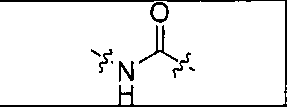
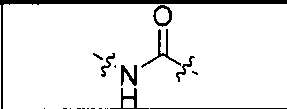
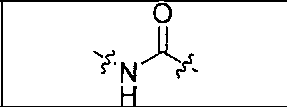
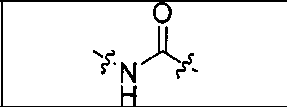
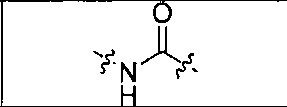
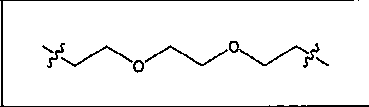
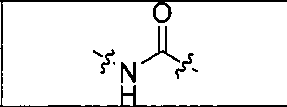
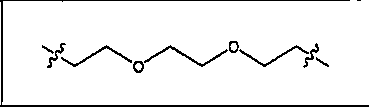
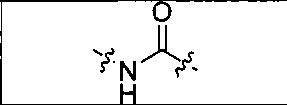
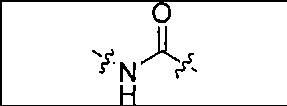
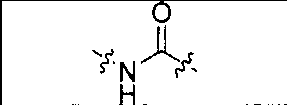
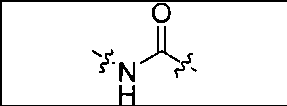
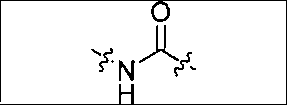
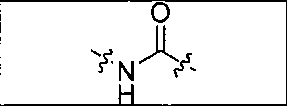
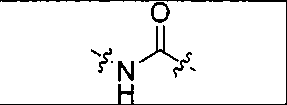
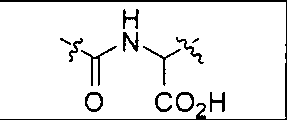
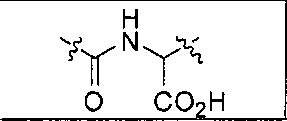
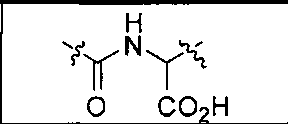
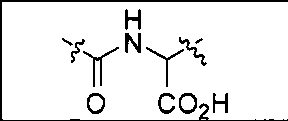
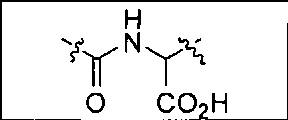
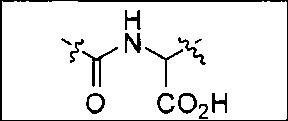
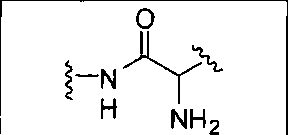
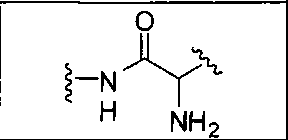
Примечание: аббревиатуры в приведенной таблице, касающиеся группы NRaRb, соответствуют следующим структурам:
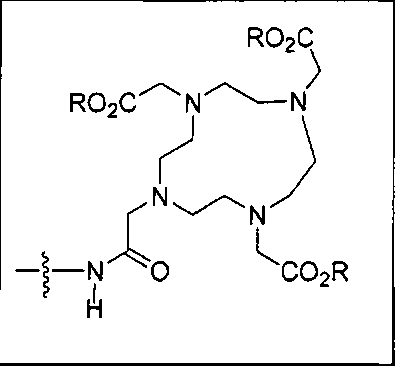
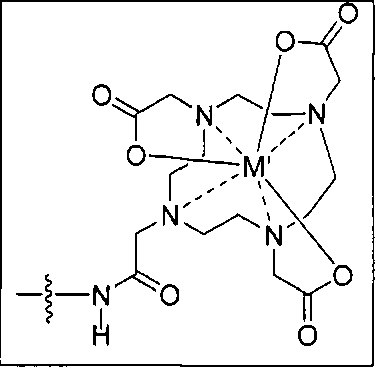
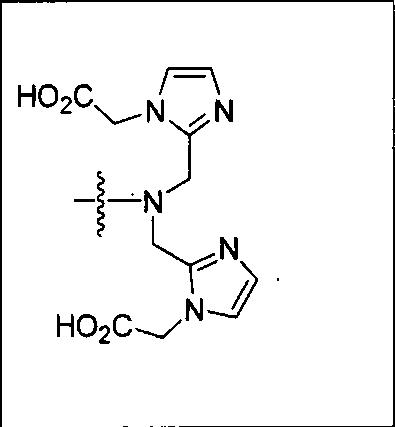
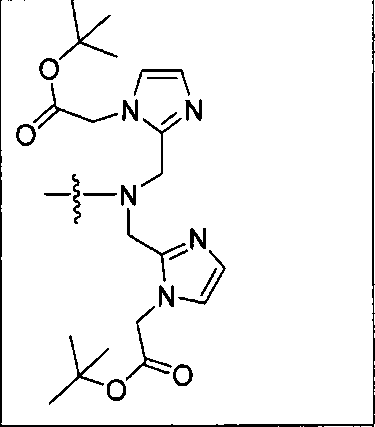
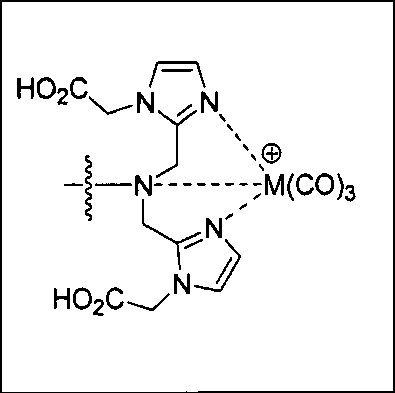
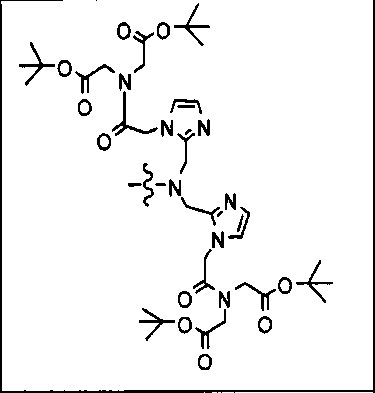
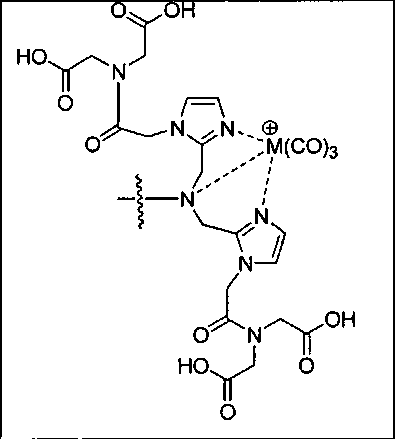
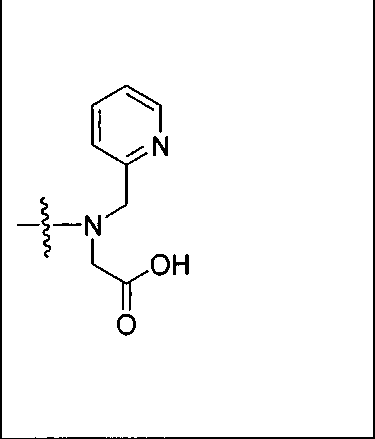
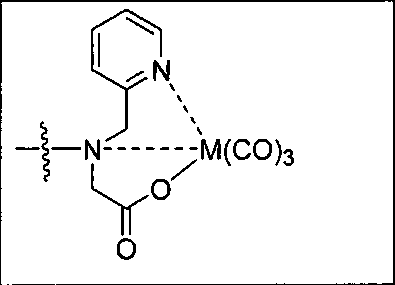
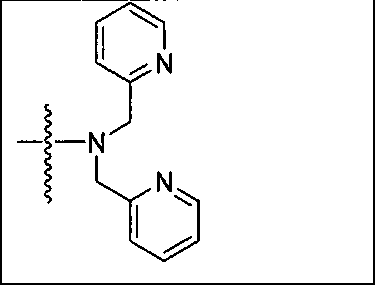
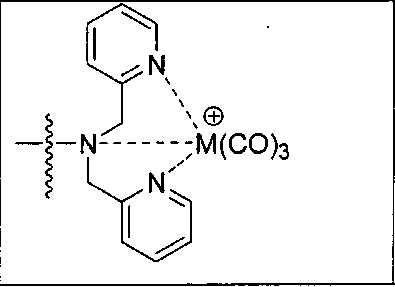
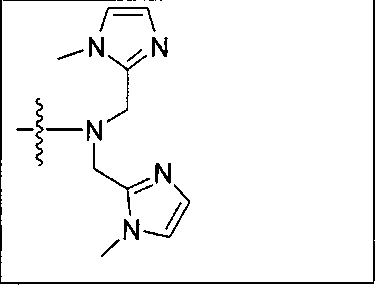
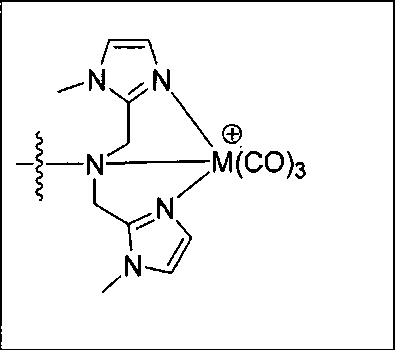
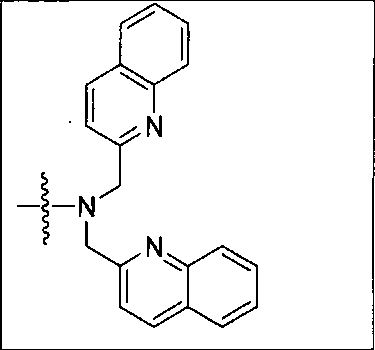
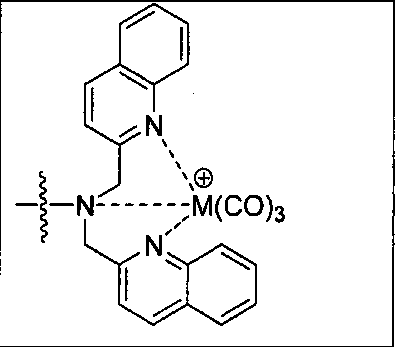
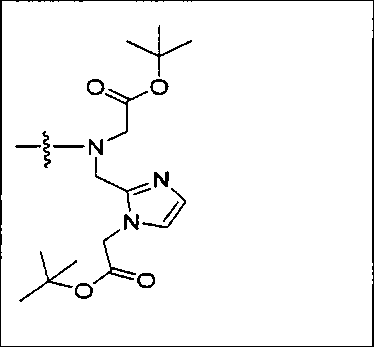
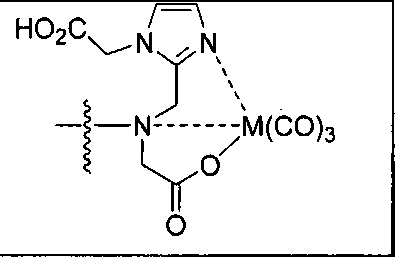
Общая биология
Вновь полученные аналоги общей структуры 5 были подвергнуты скринингу с помощью анализа на связывание с клетками рака простаты человека в концентрации 3 нМ с использованием PSMA-положительных (+) клеток LnCap. Результаты этого скрининга продемонстрировали нам наличие или отсутствие специфического связывания соединений с PSMA-(+) клетками. Соединения, которые обнаружили специфическое связывание с PSMA-(+) клетками, были после этого оценены с помощью пробы на конкурентное связывание в сравнении с известным ингибитором PSMA -N-[N-[(S)-1,3-дикарбоксипропил]карбамоил]-S-3-йодо-L-тирозином (DCIT), на основании чего были рассчитаны значения IC50.
Предварительный скрининг in vitro
Клетки рака простаты человека LNCaP и РС3 были получены из Американской типовой коллекции клеточных культур (American Type Culture Collection), Rockville, MD. Клетки LNCaP хранились в среде RPMI-1640 с добавкой 10% фетальной сыворотки быка (FBS). Связывание радиомеченого соединения и конкуренция с нерадиоактивными производными за клетки LNCaP проводятся согласно соответственным образом модифицированным известным процедурам. Клетки помещают на 12-луночные планшеты с приблизительно 4×105 клетками на лунку и инкубируют 48 ч в увлажненном инкубаторе при 37°С/5% СО2, после чего добавляют соединение. Каждое Glu-карбамидо-Х-производное приготовляют и разбавляют бессывороточной клеточной культуральной средой, содержащей 0,5% сывороточного альбумина быка (BSA) в сочетании с 3 нМ 123I DCIT (известный ингибитор). Полное связывание определяют инкубированием 123I DCIT без тестируемого соединения. Планшеты инкубируют в течение 1 часа при комнатной температуре. Клетки удаляют с планшет и переносят в трубки Эппендорфа. Образцы подвергают микроцентрифугированию в течение 15 с при 10K×g. Среду отсасывают и дважды промывают лепешку путем диспергирования в свежей аналитической среде с последующим микроцентрифугированием. Связывание 123I DCIT с клетками определяют подсчетом отсчетов от клеточной лепешки на автоматизированном гамма-счетчике. Неспецифическое связывание определяют подсчетом отсчетов, относящихся к клеткам после инкубирования с 2 uМ не-радиомеченого соединения или 2-фосфонометил-пентандиовой кислотой (РМРА). Главные контрольные соединения изображены на фигуре ниже.
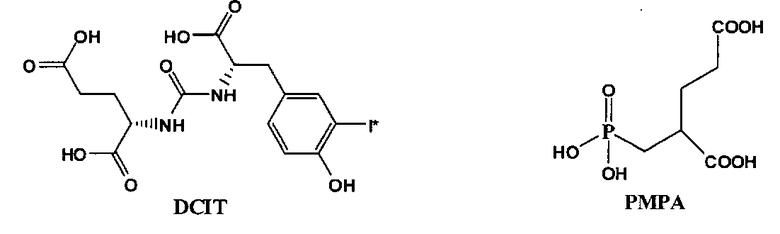
Биологический анализ
Результаты распределения по биологическим тканям оказались совместимыми с данными in vitro и продемонстрировали значительное поглощение PSMA-положительными опухолями LNCaP. Результаты обнаружили также высокую степень специфичности при очень низкой активности в PSMA-отрицательных опухолях РС3.
Биологическая оценка с использованием N-[N-[(S)-1,3-дикарбоксипропил]карбамоил]-S-3-йодо-L-тирозина (1-131-DCIT) в сравнении с нерадиоактивными комплексами оказалась экспресс-оценкой, за которой следуют дозовые кривые, позволяющие точно определять значения IC50. Ведущая группа соединений показала значения IC50<50 нМ. По данным in vivo ведущая группа показала высокое сродство с 3% ID/г аккумуляции в опухолях LNCaP и высокую специфичность с отношением LNCaP/РС3, превышающим 15:1.
NAALADазные пробы
Связывание NAAG с PSMA определяют следующим образом. (а) Приготовление реакционной смеси. Реакционную смесь приготовляют смешением лизата клеток LNCaP (200 µг) с 600 uL реакционного буфера (реакционный буфер: 50 мМ Tris-HCl, pH 7,4, 20 мМ СоСl2, 32 мМ NaCl). Перед использованием смесь выдерживают для преинкубации в течение 3 мин при 37°С. (b) Приготовление радиомеченого раствора NAAG: заготовку радиомеченого NAAG приготовляют разбавлением 1 µл 100 мМ заготовки до 100 µл с использованием реакционного буфера (1 мМ). (с) Проба. Проба проводится добавлением 6 µл 1 мМ NAAG (конечная концентрация: 1 µМ) с радиоактивным дополнением реакционной смеси из 1000000 отсчетов/мин от H-NAAG (100 µл 1 мМ NAAG + 10 µл 3Н-NAAG (10 микрокюри)). Для изучения конкурентного связывания нужно добавить РМРА […некоторую концентрацию…] и инкубировать полученный раствор в течение 30 мин при 37°С. Реакцию останавливают в определенные моменты времени путем удаления 100 uL реакционной смеси и добавления равного объема ледяного 0,25 М KН2РО4, pH 4,3. Приблизительно половину забуференной смеси загружают в катионообменную колонку с 250 мг AG 50W-X4 (200-400 меш, Н+-форма, перед использованием смола набухает в деионизованной воде). Загруженную колонку промывают 500 µл смеси реакционный буфер/0,25МKН2РО4 и элюируют 3 М KСl (1,5 мл). Концентрацию связанной в колонке радиометки определяют с помощью сцинтилляционного счетчика и 100 µл элюента (разбавленного 1:6) для минимизации затухания.
Терапевтическое лечение
Соединения настоящего изобретения могут использоваться для ингибирования NAALADaзы при терапевтическом лечении. К числу заболеваний, которые можно лечить методом воздействия на NAALADазы, относятся болезненная и сенсорная диабетическая невропатия, нейронное нарушение и рак простаты, шизофрения, колоректальный рак, воспаление, боковой амиотрофический склероз и диабетическая невропатия. Настоящие соединения могут также использоваться как болеутоляющие средства. Руководство по моделированию таких терапевтических лечений можно найти: Goodman & Gilman, The Pharmacological Basis of Therapeutics (Фармакологическая основа терапевтических средств), McGraw Hill, 10 edition, 2001; Pharmaceutical Preformulation and Formulation: A Practical Guide from Candidate Drug Selection to Commercial Dosage Form (Фармацевтическая разработка и технология приготовления лекарственных средств), CRC, 2001 и Handbook of Pharmaceutical Excipients (Руководство по фармацевтическим наполнителям), AphA Publications, 5 edition, 2005.
На приведенных фигурах в целях сравнения показаны несколько соединений. Эти соединения сравнения и их структуры даются ниже:
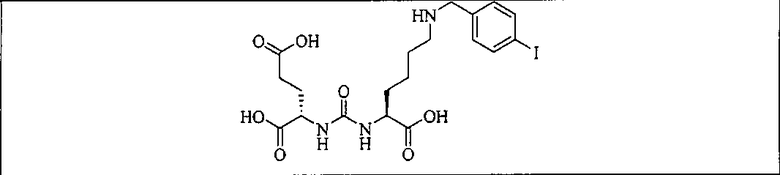
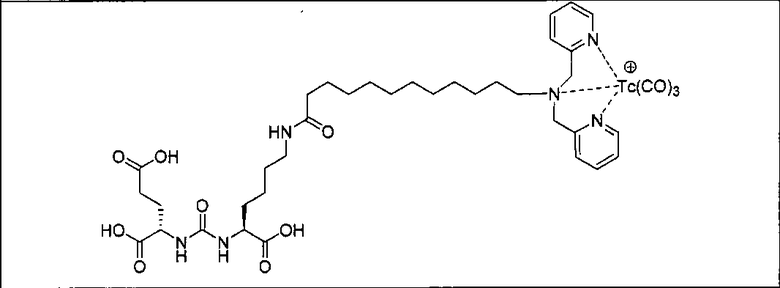
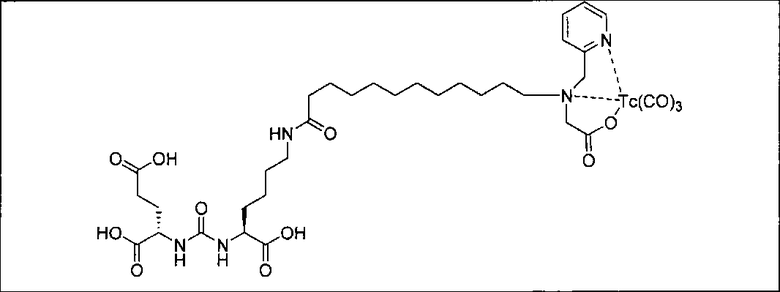
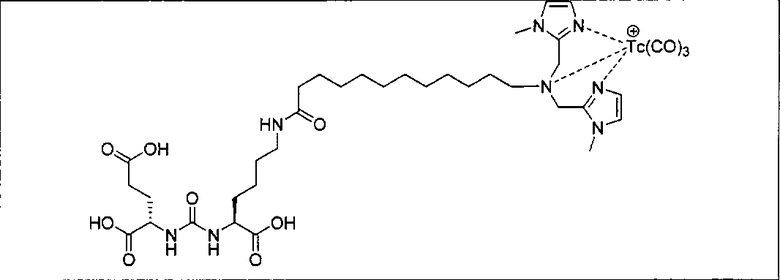
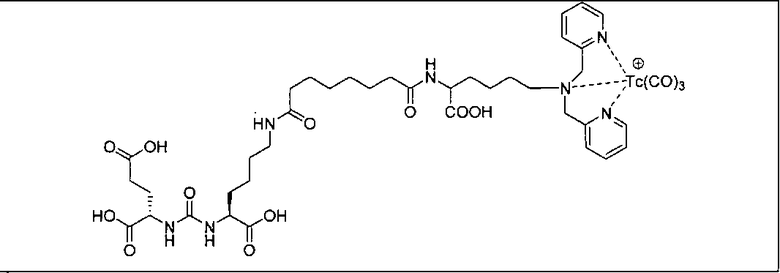
Распределение по тканям типичных радиофармацевтических соединений
Ряд приготовленных в изобретении соединений и комплексов были оценены на распределение по тканям и в некоторых случаях в сопоставлении со сравнительными соединениями. На фиг.1, 3, 4 и 5 эти данные представлены графически. Фиг.6 представляет радиоизображение, иллюстрирующее биораспределение по тканям для 99mТс-комплекса соединения примера 6.
ЭКВИВАЛЕНТЫ
Хотя проиллюстрированы и описаны определенные варианты осуществления, следует иметь в виду, что в них, согласно общепринятым правилам, могут быть произведены изменения и модификации, не выходящие за рамки технологии в ее более широких аспектах, определенных в приведенной ниже формуле изобретения.
Настоящее раскрытие не должно быть ограничено конкретными вариантами осуществления, описанными в настоящей заявке. Для специалистов очевидно, что многие модификации и варианты могут быть произведены без выхода за рамки сути и объема. Из приведенных выше описаний специалистам станут очевидны те методы и композиции в рамках объема раскрытия, которые функционально эквивалентны методам и композициям, приведенным в заявке. Предполагается, что такие модификации и варианты входят в рамки приложенной формулы изобретения. Настоящее раскрытие должно быть ограничено только терминами приложенной формулы изобретения по всему объему эквивалентов, которые допускаются формулой изобретения. Следует иметь в виду, что используемая в заявке терминология имеет целью лишь описание конкретных вариантов осуществления и не имеет целью быть ограничительной.
Кроме того, как это известно специалистам, там, где признаки или аспекты раскрытия описаны с помощью терминов групп Маркуша, раскрытие тем самым описывается также и терминами любого отдельного элемента или подгруппы элементов группы Маркуша.
Специалистам должно быть очевидно, что для любой и всех целей, в частности при создании письменного описания, все раскрытые в нем диапазоны охватывают также любой или все возможные его поддиапазоны или комбинации поддиапазонов. Любой приведенный диапазон вполне может быть признан в достаточной степени описывающим и позволяющим существование того же диапазона, разбитого на по меньшей мере равные половины, трети, четверти, пятые части, десятые части и т.д. В качестве не ограничивающего собой примера: каждый обсуждаемый в заявке диапазон можно вполне разбить на низшую треть, среднюю треть, высшую треть и т.д. Как также должно быть очевидно специалистам, все выражения типа «вплоть до», «по меньшей мере», «более чем», «менее чем» и т.п. включают в себя указанное число и относятся к диапазонам, которые могут быть далее разбиты на поддиапазоны, о которых было сказано выше. Наконец, как должно быть очевидно специалистам, какой-либо диапазон включает в себя каждый индивидуальный член, включая первое и последнее указанное для диапазона число.
Все публикации, патентные заявки, выданные патенты и другие упомянутые в настоящем описании документы включены в настоящую заявку в качестве ссылочного материала, так как если бы каждая отдельная публикация, патентная заявка, выданный патент или какой-либо другой документ были бы специальным образом и отдельно указаны как полностью включенные в качестве ссылочного материала. Определения, содержащиеся во включенном в качестве ссылочного материала тексте, исключаются, если они противоречат определениям в настоящем раскрытии.
Другие варианты осуществления даются в приведенной ниже формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКСЫ ТЕХНЕЦИЯ И РЕНИЯ С БИС(ГЕТЕРОАРИЛАМИ) И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2539584C2 |
| СА-IX СПЕЦИФИЧЕСКИЕ РАДИОФАРМПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ И ВИЗУАЛАЗИЦИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2009 |
|
RU2539565C2 |
| ПРОИЗВОДНЫЕ 2-АМИНОПИРАЗИНА В КАЧЕСТВЕ ИНГИБИТОРОВ CSF-1R КИНАЗЫ | 2013 |
|
RU2642777C2 |
| ПРОИЗВОДНЫЕ 4-ЗАМЕЩЕННОЙ ФЕНОКСИФЕНИЛУКСУСНОЙ КИСЛОТЫ | 2007 |
|
RU2463292C2 |
| ПРОИЗВОДНЫЕ ОКСОАЗЕТИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ В МЕДИЦИНЕ И КОСМЕТОЛОГИИ | 2009 |
|
RU2671189C1 |
| ПРОИЗВОДНЫЕ ОКСОАЗЕТИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ В МЕДИЦИНЕ И КОСМЕТОЛОГИИ | 2009 |
|
RU2569886C2 |
| МОДУЛЯТОРЫ КАЛЬПАИНА И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2773288C2 |
| ЗАМЕЩЕННЫЕ ДИАЛКИЛ (ОКСИДО)-Λ-СУЛЬФАНИЛИДЕН НИКОТИНАМИД ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2014 |
|
RU2711749C2 |
| ЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2658919C2 |
| КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА (ADC) И КОНЪЮГАТЫ АНТИТЕЛА И ПРОЛЕКАРСТВА (APDC), СОДЕРЖАЩИЕ ФЕРМЕНТАТИВНО РАСЩЕПЛЯЕМЫЕ ГРУППЫ | 2016 |
|
RU2751512C2 |
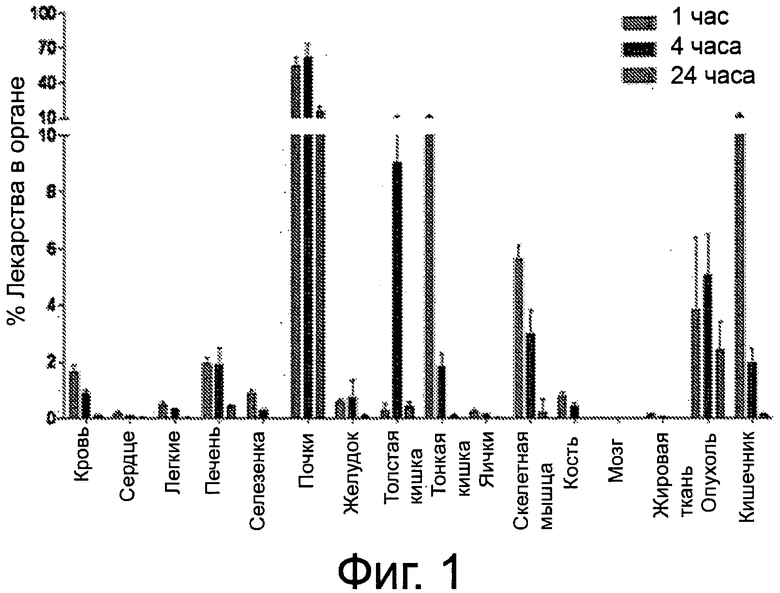
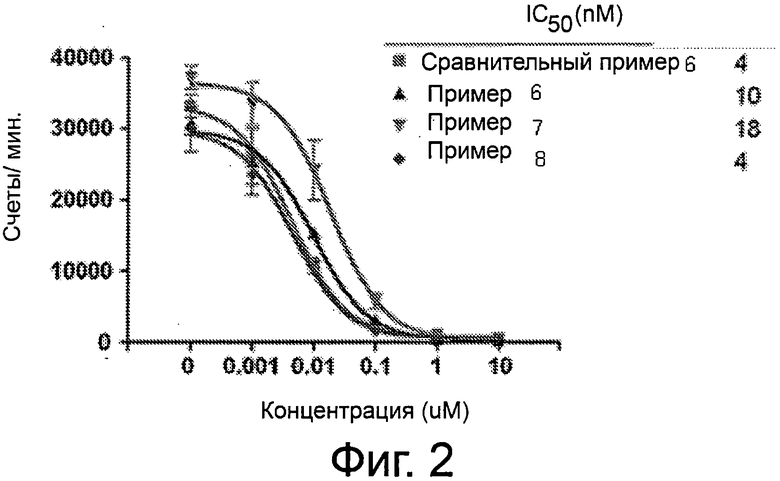
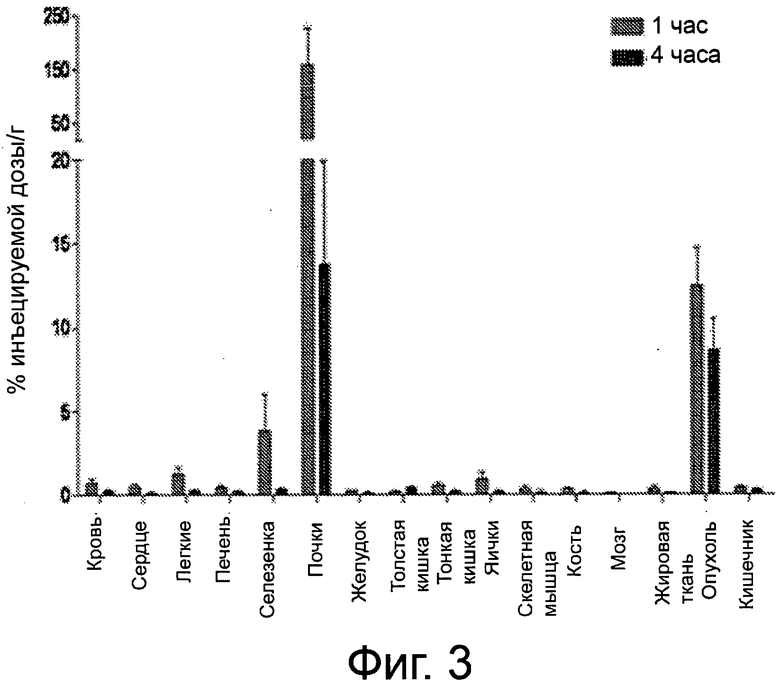
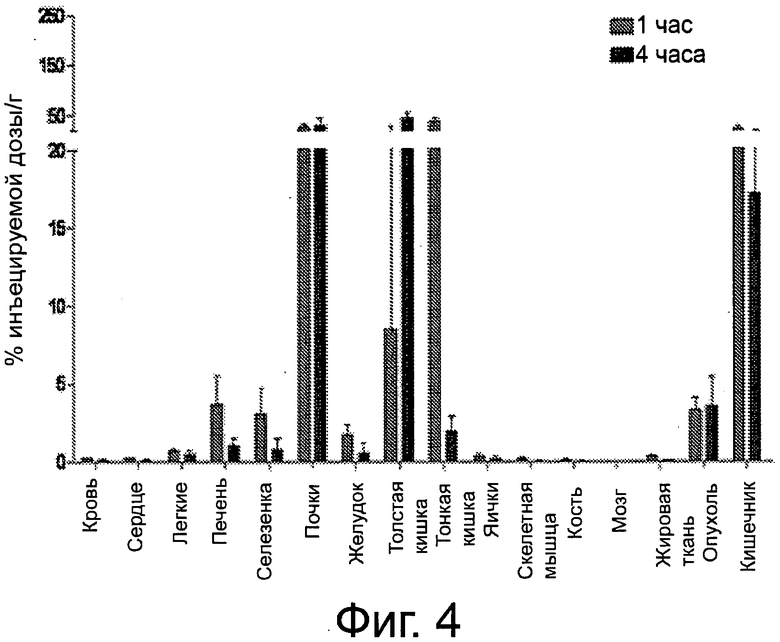
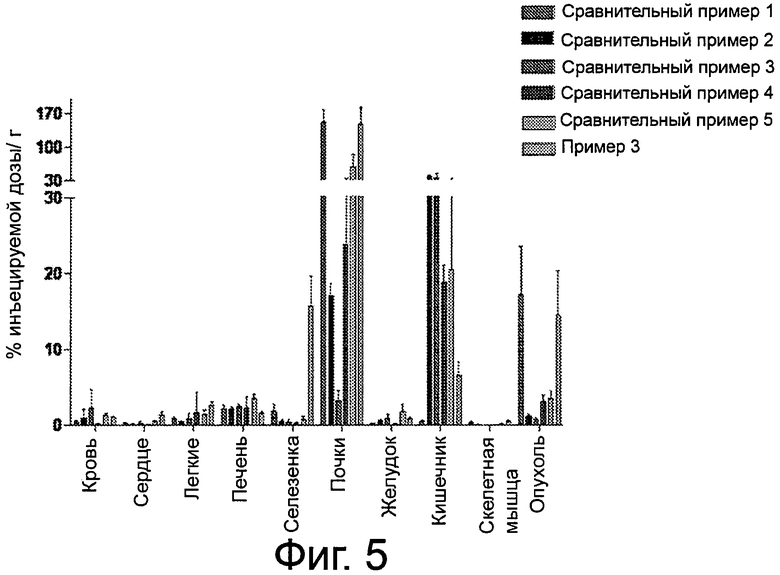
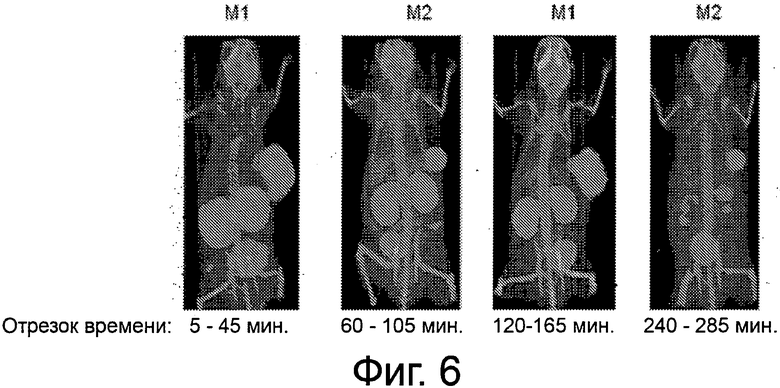
Изобретение относится к новым радиофармацевтическим соединениям структурной формулы I. В формуле I R обозначает Н или (C1-C8)алкильную группу; W обозначает связь, -CH(NH2)-, -C(O)-NH-CH(COOH)-, -O-(CH2)n-O-(CH2)n- или -(CH2)nO(CH2)nO(CH2)n; Z обозначает -NHC(O)-, -NH-C(O)-CH(NH2)- или -C(O)-NH-CH(COOH)-; e целое число от 1 до 4; f целое число от 0 до 10; g целое число от 0 до 10; n целое число от 0 до 2; значения радикала NRaRb приведены в формуле изобретения. Изобретение также относится к радионуклидному комплексу, содержащему радиоактивный металл и указанные соединения, к фармацевтическому составу для визуализации и к способу визуализации какой-либо области у пациента, например ткани, выбранной из ткани селезенки, ткани почки или экспрессирующей PSMA опухолевой ткани. 8 н. и 13 з.п. ф-лы, 6 ил., 1 табл., 18 пр.
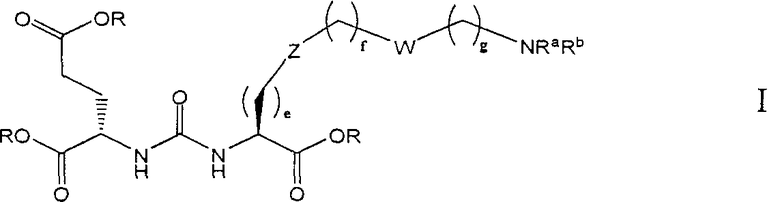
1. Соединение формулы I или его фармацевтически приемлемая соль:

где
R обозначает Н или (C1-C8)алкильную группу;
W обозначает связь, -CH(NH2)-, -C(O)-NH-CH(COOH)-, -O-(CH2)n-O-(CH2)n- или -(CH2)nO(CH2)nO(CH2)n;
Z обозначает -NHC(O)-, -NH-C(O)-CH(NH2)- или -C(O)-NH-CH(COOH)-;
NRaRb обозначает хелатор из группы формул:
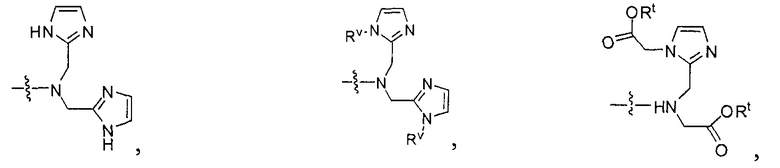
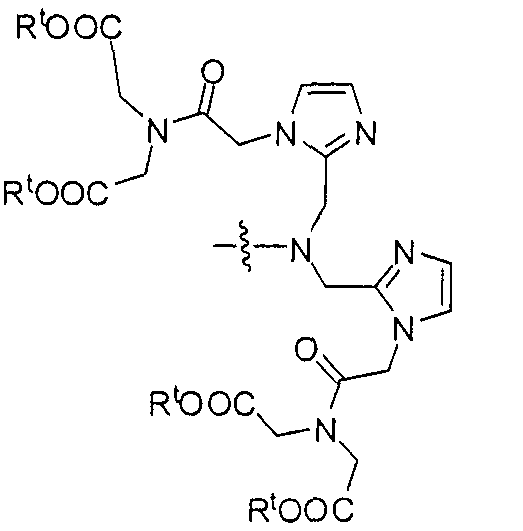 ;
;
Rt обозначает Н, C1-C8-алкильную группу;
Rv обозначает C1-C8алкил;
e есть целое число от 1 до 4;
f есть целое число от 0 до 10;
g есть целое число от 0 до 10; и
n есть целое число от 0 до 2.
2. Соединение по п.1, у которого Rv обозначает метил, этил, н-пропил, изопропил, н-бутил, изобутил или трет-бутил.
3. Соединение по п.2, у которого Rv обозначает метил.
4. Соединение по п.1, у которого каждый Rt независимо обозначает Н или трет-бутил.
5. Соединение по п.4, у которого Rt обозначает Н.
6. Соединение по п.1, у которого e есть целое число от 0 до 4, f есть целое число от 0 до 4, и g есть целое число от 0 до 6.
7. Соединение формулы I или его фармацевтически приемлемая соль:
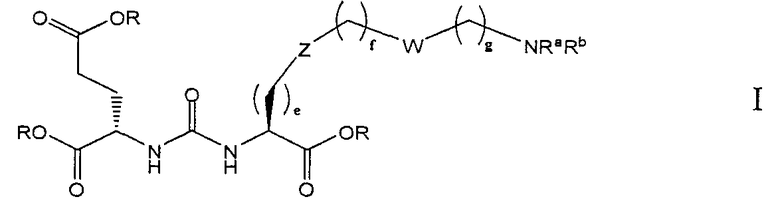
где
R обозначает Н или (C1-C8)алкильную группу;
W обозначает -C(O)-NH-;
Z обозначает -NHC(O)-, -NH-C(O)-CH(NH2)- или -C(O)-NH-CH(COOH)-;
NRaRb обозначает хелатор из группы формул:
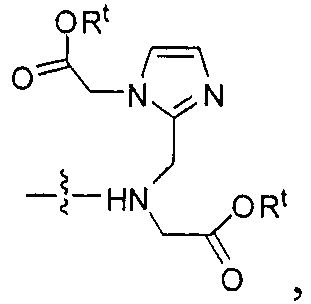
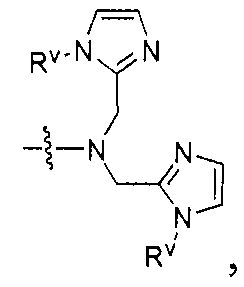
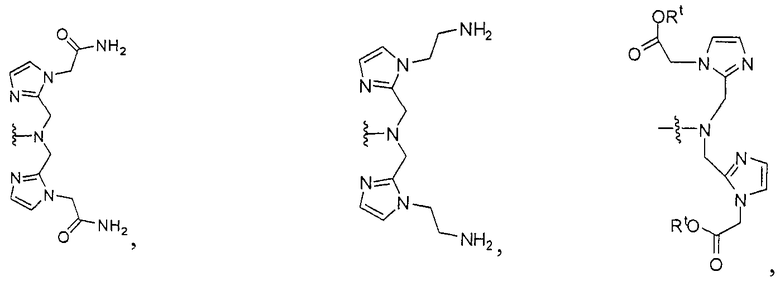
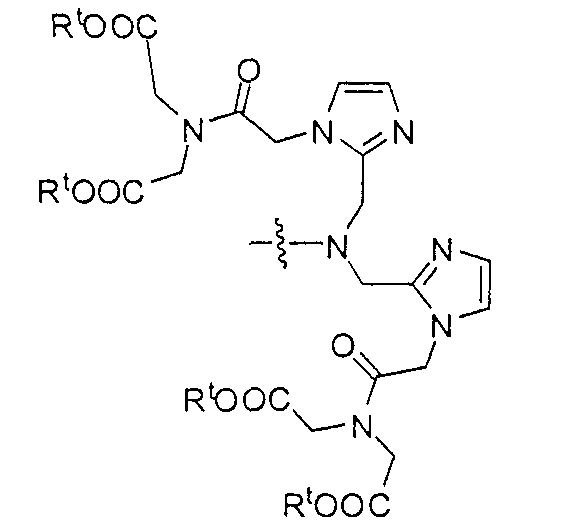
Rt обозначает Н, C1-C8-алкильную группу;
Rv обозначает C1-C8алкил;
e есть целое число от 1 до 4;
f есть целое число от 0 до 10;
g есть целое число от 0 до 10; и
n есть целое число от 0 до 2.
8. Соединение по п.1, представляющее
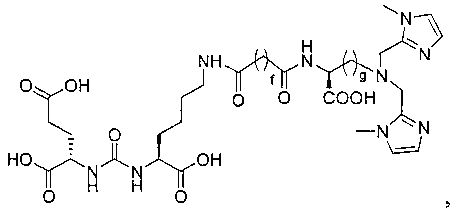
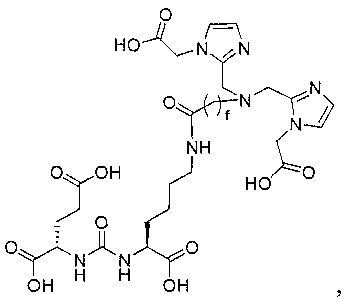
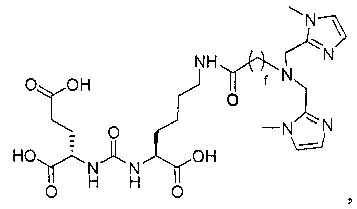
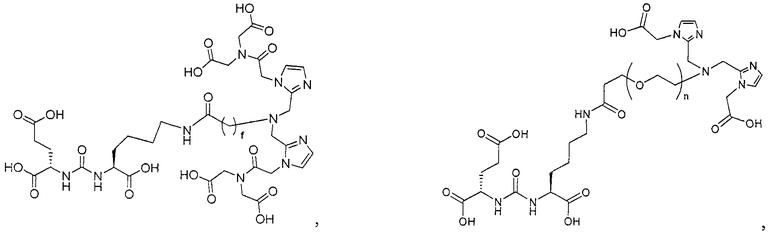
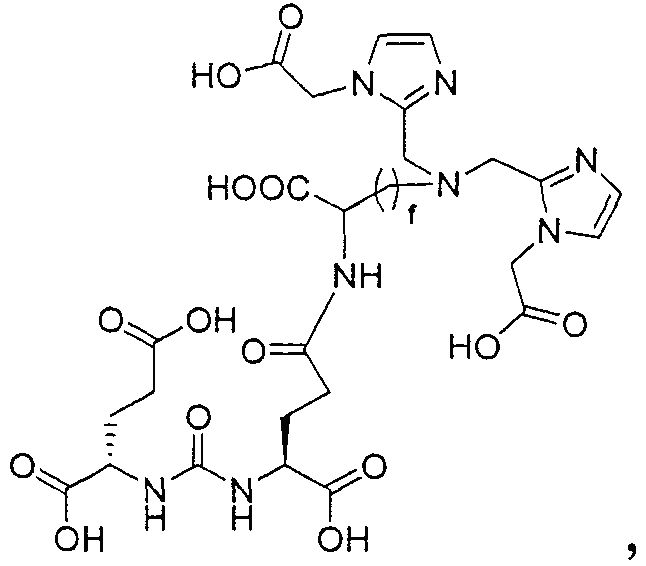
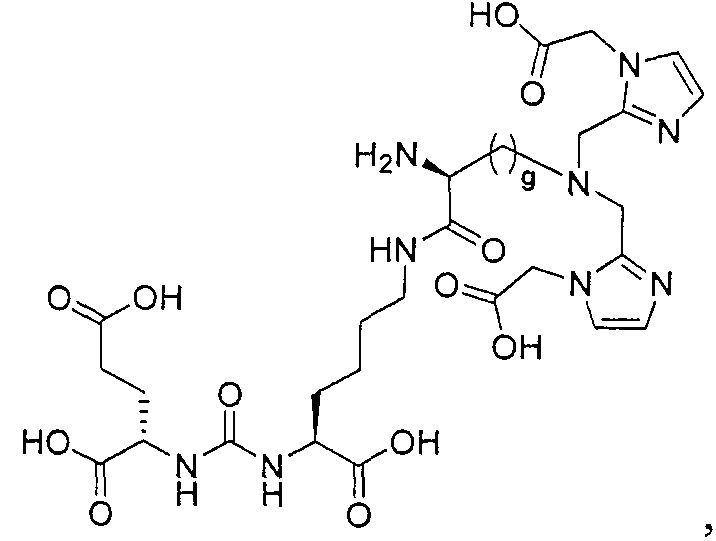
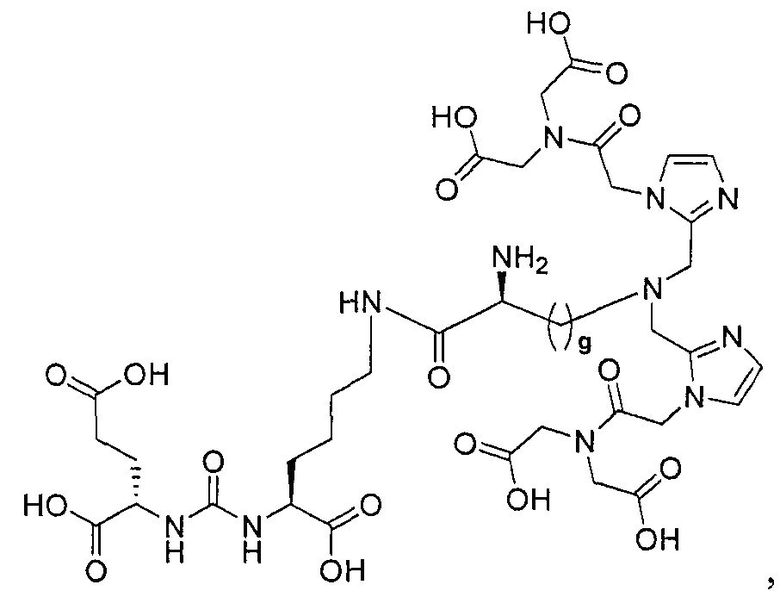
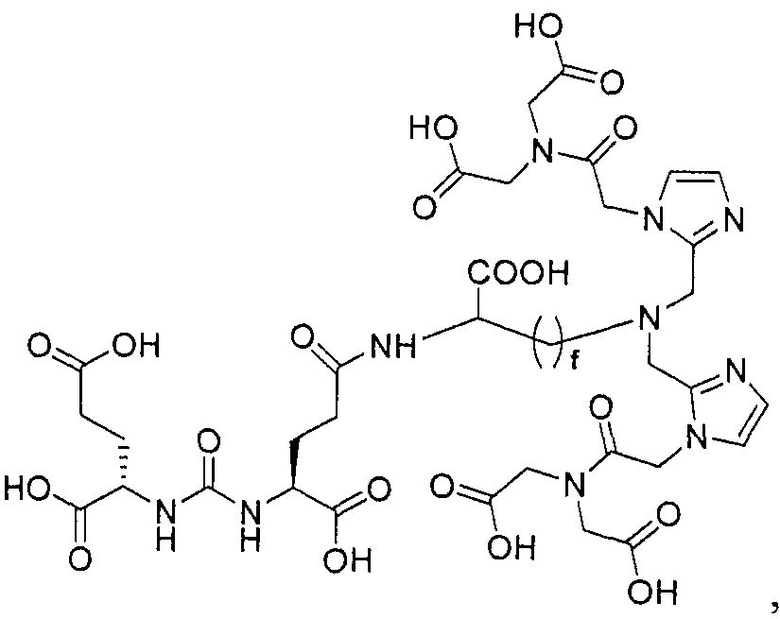
или его фармацевтически приемлемую соль;
e есть целое число от 1 до 4;
f есть целое число от 0 до 10;
g есть целое число от 0 до 10; и
n есть целое число от 0 до 2.
9. Соединение по п.1, у которого Z обозначает -NH-C(O)-.
10. Соединение по п.1, у которого Z обозначает -C(O)-NH-CH(COOH)-.
11. Соединение по п.1, у которого Z обозначает -NH-C(O)-CH(NH2)-.
12. Радионуклидный комплекс, содержащий радиоактивный металл и соединение по п.1.
13. Комплекс по п.12, в котором радиоактивным металлом является технеций-99m, рений-186 или рений-188.
14. Комплекс по п.12, представляющий собой
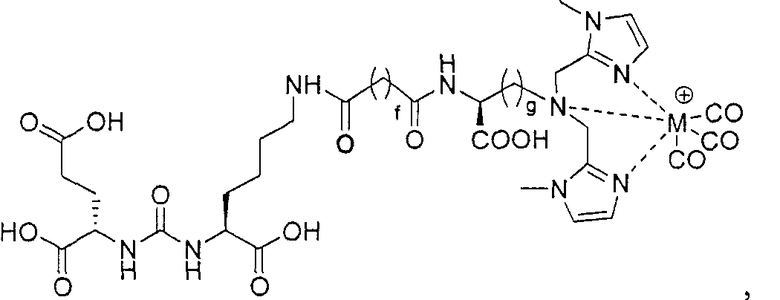
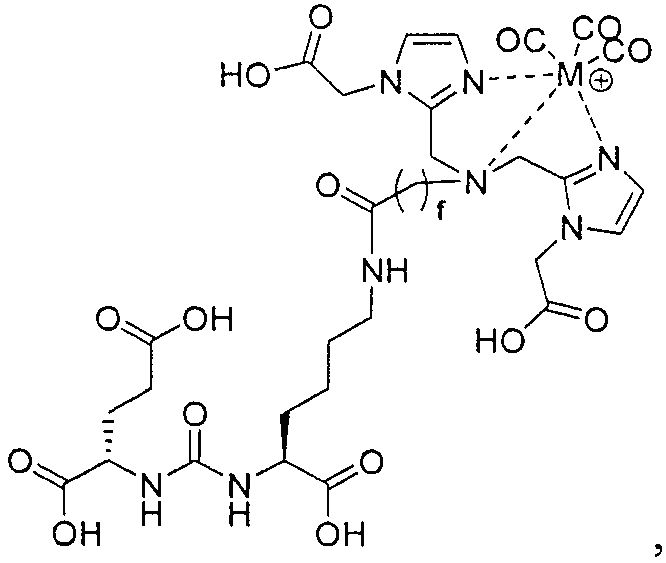
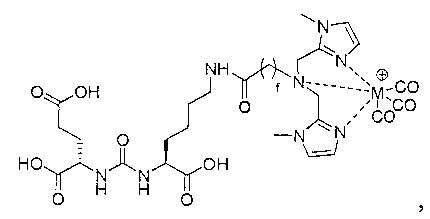
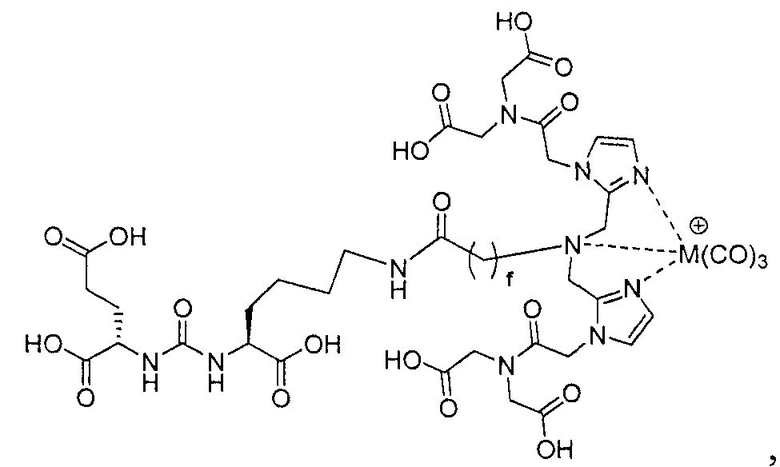
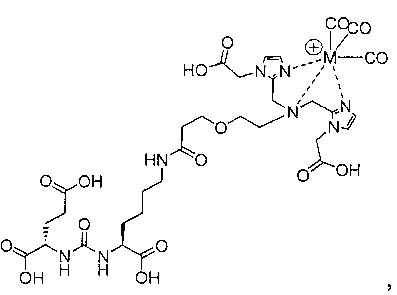
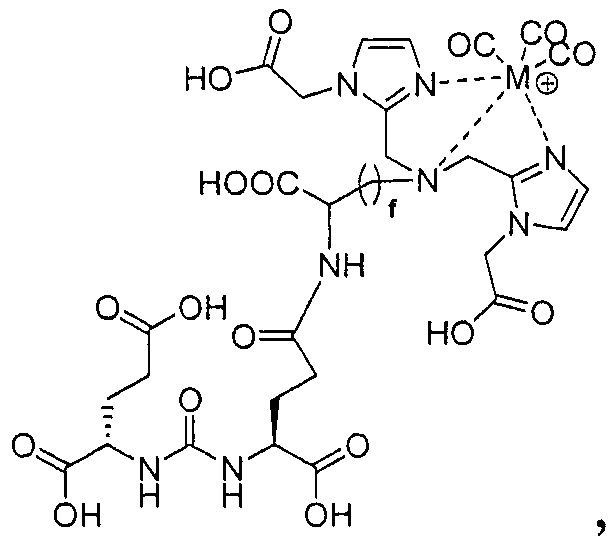
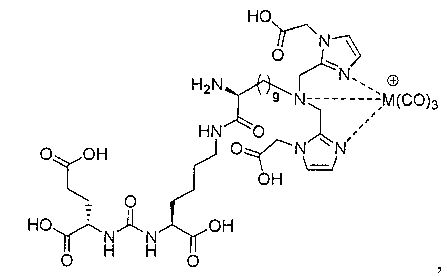
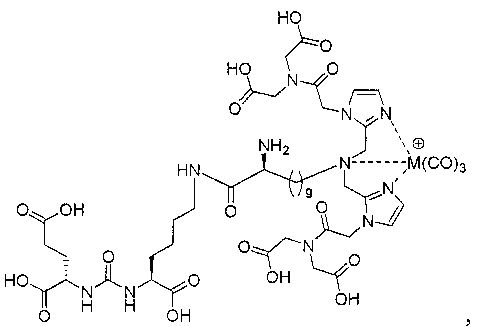
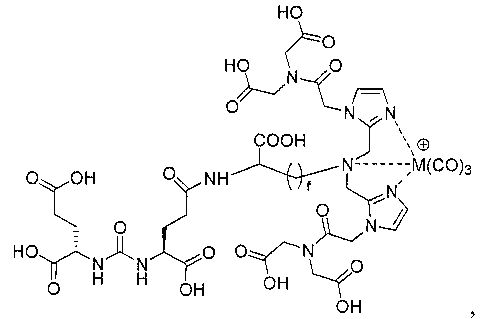
или его фармацевтически приемлемую соль;
М обозначает Re или Tc;
e есть целое число от 1 до 4;
f есть целое число от 0 до 10;
g есть целое число от 0 до 10; и
n есть целое число от 0 до 2.
15. Фармацевтический состав для визуализации, содержащий комплекс по п.12 или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель.
16. Способ визуализации какой-либо области у пациента, включающий введение пациенту диагностически эффективного количества комплекса по п.12 или его фармацевтически приемлемой соли и получение изображения этой области у пациента.
17. Способ визуализации ткани, выбранной из ткани селезенки, ткани почки или экспрессирующей PSMA опухолевой ткани, включающий осуществление контакта ткани с комплексом, содержащим радиоактивный металл и соединение по п.1, в котором -NRaRb представляет собой хелатную группу, выбранную из
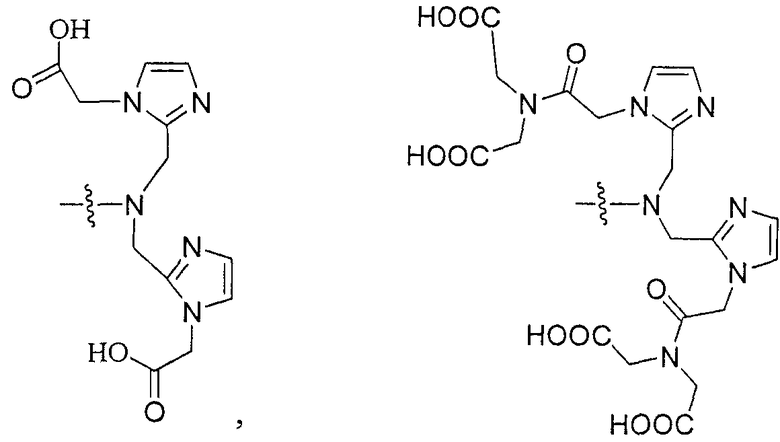
или ее фармацевтически приемлемой соли.
18. Способ по п.17, в котором тканью является экспрессирующая PSMA опухолевая ткань.
19. Соединение, представленное формулой:
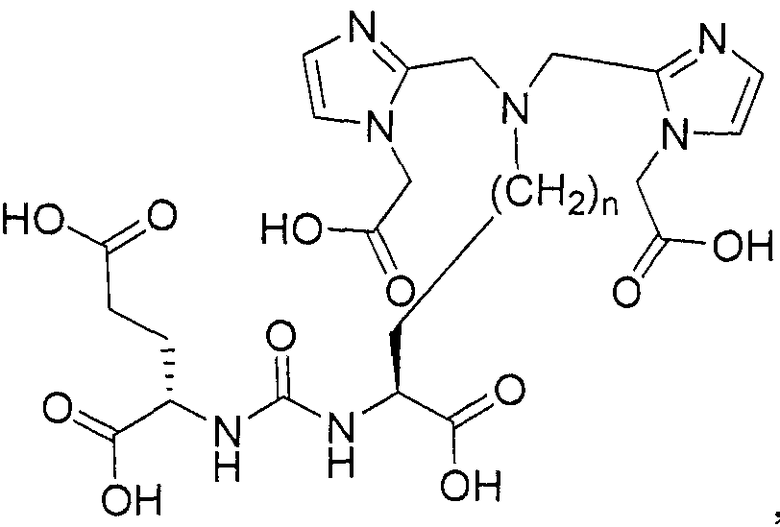
где n представляет собой целое число от 0 до 2.
20. Радионуклидный комплекс, представленный формулой:
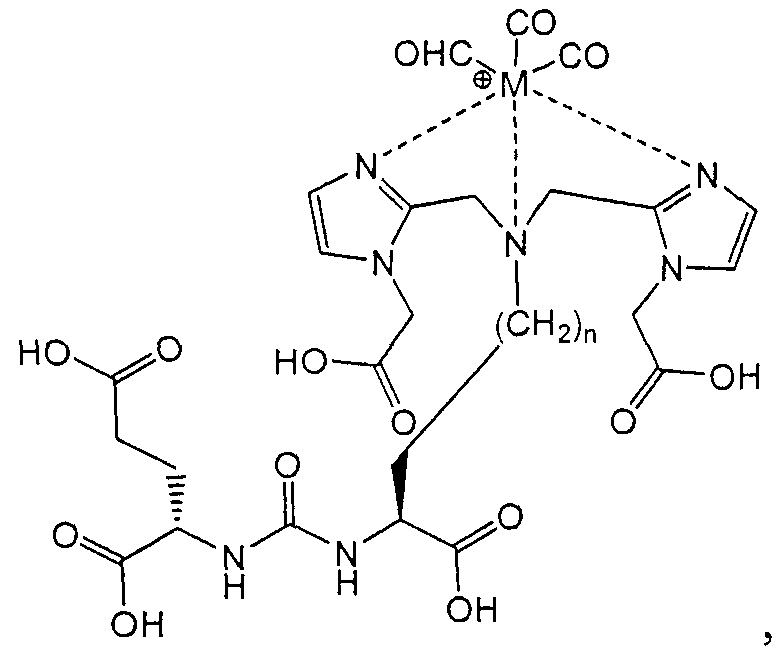
где М является радиоактивным металлом, и n является целым числом от 0 до 2.
21. Комплекс по п.20, в котором радиоактивным металлом является технеций-99m, рений-186 или рений-188.
| WO2008058192 A2, 15.05.2008 | |||
| WO2008028000 A2, 06.03.2008 | |||
| WO2003077727 A2, 25.09.2003 | |||
| ПРИМЕНЕНИЕ ПЕРФТОРАЛКИЛСОДЕРЖАЩИХ КОМПЛЕКСОВ МЕТАЛЛОВ В КАЧЕСТВЕ КОНТРАСТНЫХ ВЕЩЕСТВ ПРИ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ ДЛЯ ВИЗУАЛИЗАЦИИ ВНУТРИСОСУДИСТЫХ ТРОМБОВ | 2003 |
|
RU2328310C2 |
| S.R | |||
| BANERJEE ET AL., “Synthesis and evaluation of technetium-99m- and rhenium-labeled inhibitors of the prostate-specific membrane antigen (PSMA)”, Journal of Medicinal Chemistry, vol.51, 2008, pp.4504-4517 | |||
| S.R | |||
| BANERJEE | |||
Авторы
Даты
2014-11-20—Публикация
2009-12-04—Подача