Изобретение относится к области медицины, а именно к сердечно-сосудистой хирургии, анестезиологии и реаниматологии, и может быть использовано для прогнозирования развития осложнений в раннем послеоперационном периоде (в первые 6 суток после операций) у пациентов при выполнении операции шунтирования коронарных артерий (АКШ) в условиях искусственного кровообращения, которые могут быть выражены в виде органных дисфункций, в частности острой почечной недостаточности, дыхательной недостаточности, острой сердечно-сосудистой недостаточности, острого инфаркта миокарда, фибрилляции предсердий, энцефалопатии и нарушений мозгового кровообращения. При этом прогноз наступления неблагоприятных событий, согласно заявляемому способу, делают в процессе проведения операции или после завершения процедуры искусственного кровообращения по критериям риска - параметрам гомеостаза и гемодинамики, снимаемым непосредственно во время проведения операции.
В настоящее время операции шунтирования коронарных артерий - один из наиболее распространенных видов кардиохирургических вмешательств. В РФ за последние 5 лет количество ежегодно выполняемых операций увеличилось почти в 1,5 раза, составив в 2010 г. более 27,5 тысяч [Бокерия Л.А., Гудкова Р.Г., 2010]. Развитие хирургической техники, методов анестезиологического пособия и органной протекции в условиях искусственного кровообращения (ИК) позволили значительно улучшить результаты таких операций и снизить уровень летальности до 1-2,5% [Бокерия Л.А., Гудкова Р.Г., 2010; Miyata Н., et al., 2012]. Однако, несмотря на очевидные успехи, до конца нерешенной остается проблема послеоперационных осложнений, большая часть которых связана с агрессивным воздействием искусственного кровообращения.
Развитие в раннем послеоперационном периоде вначале изолированных органных дисфункций затем приводит к декомпенсации предсуществующих нарушений у пациентов с исходно сложной сопутствующей патологией и формированию полиорганной недостаточности, сопровождающейся увеличением госпитальной летальности в десятки раз.
Частота развития послеоперационной острой почечной недостаточности после операций в условиях ИК, по данным различных авторов, составляет от 1% до 30%, при этом у 23-25% таких больных требуется применение гемодиализа, а летальность в данной группе увеличивается до 40% [Rodrigues A.J. et al., 2009; Shahzad D Raja, 2005; Stall wood M.I. et al., 2004]. Развитие левожелудочковой недостаточности после шунтирующих вмешательств может являться следствием реперфузионного повреждения миокарда [Hammon J.W. et al., 2003] и потребовать применения инотропной поддержки или методов вспомогательного кровообращения. По данным Wongcharoen W. et al. (2012), частота развития острого инфаркта миокарда после коронарного шунтирования может достигать 30%. Фибрилляция предсердий является наиболее часто встречающимся осложнением операций коронарного шунтирования и отмечается у 20-40% пациентов, перенесших данный вид вмешательств [Zangrillo A. et al., 2004]. Ведущую роль в патогенезе послеоперационной фибрилляции предсердий предположительно играет воздействие ИК и кардиоплегии [Archbold A., et al., 2003]. Инфаркты головного мозга развиваются в послеоперационном периоде примерно в 3% случаев, а основную роль в их патогенезе играет микроэмболия мозговых артерий в процессе ИК Knipp S.C., et al., 2004.
Развитие послеоперационных осложнений даже при изолированной дисфункции значительно повышает вероятность летального исхода, а в благоприятном случае приводит к удлинению сроков пребывания в отделении интенсивной терапии, сроков госпитализации, затрудняет проведение послеоперационной реабилитации пациента и ухудшает последующее качество жизни. Тогда как восстановление качества жизни пациентов с хронической ИБС является первоочередной задачей операций реваскуляризации миокарда.
Решению проблемы оценки рисков и прогнозирования наступления неблагоприятных исходов операций коронарного шунтирования были посвящены работы многих исследователей в течение нескольких последних десятилетий. Результатами этих исследований, основанных на анализах баз данных, стали разработки интегральных шкал оценки вероятности развития осложнений и наступления летального исхода. Примерами наиболее распространенных систем оценки рисков являются шкалы Euroscore, QMMI и т.д. При этом была показана их высокая предсказательная способность [Giedrius V., et al., 2004; Nashef S.A. et al., 1999].
Однако следует отметить, что указанные системы предназначены исключительно для предоперационного использования и основываются на оценке анамнестических данных и результатов лабораторных исследований, проведенных непосредственно перед вмешательством. При таком подходе остается нерешенной задача интраоперационного мониторинга витальных функций и прогнозирования развития неблагоприятных событий с учетом изменений, происходящих в организме пациента непосредственно в течение хирургического вмешательства в условиях ИК. Особенно актуально это в группах пациентов с одинаковым исходным уровнем риска наступления неблагоприятных событий, то есть, например, равным числом баллов по Euroscore.
Из уровня техники известен способ прогнозирования результатов кардиохирургических операций в раннем послеоперационном периоде у больных с изолированными, сочетанными и комбинированными поражениями клапанного аппарата сердца - патент RU 2251964 C1. Для прогнозирования риска послеоперационной смертности используется анализ наличия нескольких критериев риска из перечисленного перечня: наличие функционального класса недостаточности кровообращения выше третьего, величины исходной фракции левого желудочка менее 45%, величины исходной легочной гипертензии не менее 60 мм рт.ст., концентрации сывороточного креатинина в предоперационном периоде более 102 МкМ/л, времени искусственного кровообращения более 230 минут. При наличии трех или более из вышеперечисленных критериев риска прогноз считают неблагоприятным.
Однако данный способ информативен только в отношении наступления летального исхода в послеоперационном периоде и не позволяет прогнозировать развитие нелетальных осложнений в виде органных дисфункций, которые при развитии в послеоперационном периоде приводят к удлинению сроков пребывания пациентов в отделении интенсивной терапии, в стационаре, приводят к увеличению стоимости лечения и снижению качества жизни на послегоспитальном этапе. В известном способе используются дооперационные критерии риска без учета изменений параметров гомеостаза, происходящих во время оперативного вмешательства в условиях искусственного кровообращения. Единственным критерием риска, связанным с проведением искусственного кровообращения (ИК), является продолжительность ИК более 230 минут, что малоприменимо для операций коронарного шунтирования, продолжительность которых значительно меньше.
Также из уровня техники известен способ оценки риска развития неблагоприятных событий после операций шунтирования коронарных артерий в условиях искусственного кровообращения, раскрытый в статье «Stratification of adverse outcomes by preoperative risk factors in coronary artery bypass graft patients: an artificial neural network prediction model» Chee-Fah Chong, Yu-Chuan Li, Tzong-Luen Wang, Hang Chang AMIA Annu Symp Proc. 2003; 2003: 160-164. Авторами данной статьи на основе ретроспективного анализа данных 563 пациентов, которым выполнялись операции аортокоронарного шунтирования в условиях искусственного кровообращения, предложена методика оценки риска развития неблагоприятных событий: смерти, остановки сердца, развития комы, почечной недостаточности, требующей диализа, а также необходимости в искусственной вентиляции легких в течение более чем 14 дней. Для формирования прогноза использовался метод нейронных сетей. В качестве предикторов в способе использованы более 20 переменных, характеризующих дооперационные признаки. Интраоперационные параметры авторами для прогноза не использовались.
Однако в этом способе для оценки риска использовались только дооперационные показатели, что также не позволяет оценить влияние оперативного вмешательства и процедуры ИК на величину риска развития неблагоприятных событий после операций. Также прогнозировались только крайне тяжелые осложнения, частота встречаемости которых после операций аортокоронарного шунтирования в настоящее время не превышает 1-5%.
Наиболее близким к заявляемому является способ прогнозирования респираторного дистресс-синдрома взрослых и полиорганной недостаточности при коронарном шунтировании с использованием искусственного кровообращения по патенту RU 2138049 C1, согласно которому рассчитывают в баллах степень операционного риска по шкале клинических, анамнестических и лабораторных факторов риска (клинической шкале) с дополнительным определением в баллах степени риска по шкале иммунологических и метаболических факторов риска (патогенетической шкале). При сопоставлении риска по обеим шкалам делают вывод о прогнозе. При совпадении степени риска по обеим шкалам точность прогноза повышается. При высоком риске по любой из шкал делается вывод о неблагоприятном прогнозе.
Недостатком данного способа является большое количество показателей-предикторов, для определения которых необходимо проведение сложных иммунологических тестов с использованием дорогостоящих реактивов и специального лабораторного оборудования, длительных по времени выполнения, что ограничивает применимость предлагаемого метода для прогнозирования развития осложнений в раннем послеоперационном периоде.
Другим недостатком данного способа является сложность его применения в повседневной клинической практике в связи с необходимостью проведения расчетов по нескольким шкалам и неоднозначность трактовки результатов прогноза при разнонаправленных предсказаниях используемых шкал. Определение большинства параметров-предикторов производится в предоперационном периоде, что не позволяет полностью учитывать влияние процедуры искусственного кровообращения на гомеостаз. В описании метода отсутствуют четкие критерии диагностики респираторного дистресс-синдрома и полиорганной недостаточности. Кроме того, метод разработан на выборке пациентов, оперативные вмешательства которым выполнялись в условиях искусственного кровообращения и умеренной гипотермии, и неизвестна возможность использования данного метода и точность прогноза при операциях коронарного шунтирования в условиях нормотермии.
Задачей изобретения является создание для клинической практики нового способа прогнозирования развития осложнений в раннем периоде после операций шунтирования коронарных артерий в условиях искусственного кровообращения на основании данных интраоперационного мониторинга.
Техническим результатом, на достижение которого направлено заявленное изобретение, является повышение скорости получения результатов прогноза при сохранении высокой прогностической точности, а также возможность получения результатов в режиме онлайн - непосредственно в процессе проведения операции шунтирования коронарных артерий по завершении процедуры искусственного кровообращения.
Поставленная задача решается тем, что способ интраоперационного определения риска развития органных дисфункций в раннем периоде после проведения операции изолированного шунтирования коронарных артерий в условиях искусственного кровообращения включает измерение в диапазоне 25-35 минут с момента начала проведения процедуры искусственного кровообращения показателей центральной гемодинамики, включающих уровень артериального (АР) и центрального венозного давлений (CVP), показателей гомеостаза, включающих концентрацию лактата в крови (Lact), парциальное давление кислорода в венозной (pvO2) и артериальной крови (paO2), уровень гематокрита (Ht), а также определение показателей длительности искусственного кровообращения (t1) и пережатия аорты (t2), и возраста больного (age) с последующим определением значения дискриминантной функции по формуле:
D=3,321+(0,006)*АР+(0,011)*CVP+(1,030)*Lact+(-0,009)*раО2+(0,005)*pvO2+(-0,124)*Ht+(-0,023)*Age+(0,014)*t1+(-0,019)*t2,
и при получении значения D<-0,6 делают вывод о низком риске развития органных дисфункций в раннем периоде после проведения операции, при получении значений D>0,6 делают вывод о высоком риске развития органных дисфункций, при этом интервал значений -0,6<D<0,6 характеризуют как интервал неопределенности, при получении значения D из данного интервала осуществляют контроль состояния пациента, включая более частое измерение стандартных параметров.
Изобретение поясняется чертежами, представленными на фиг.1-4.
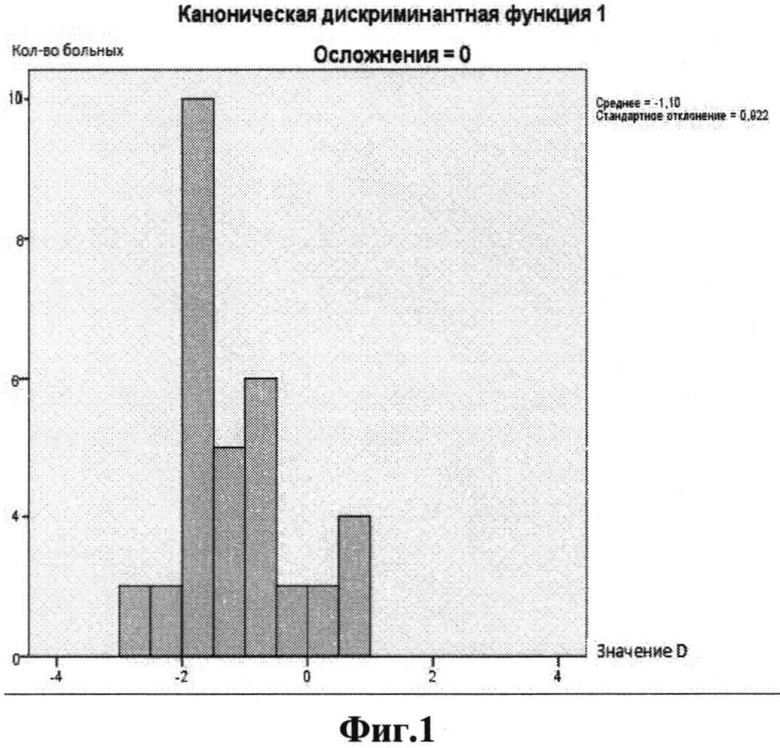
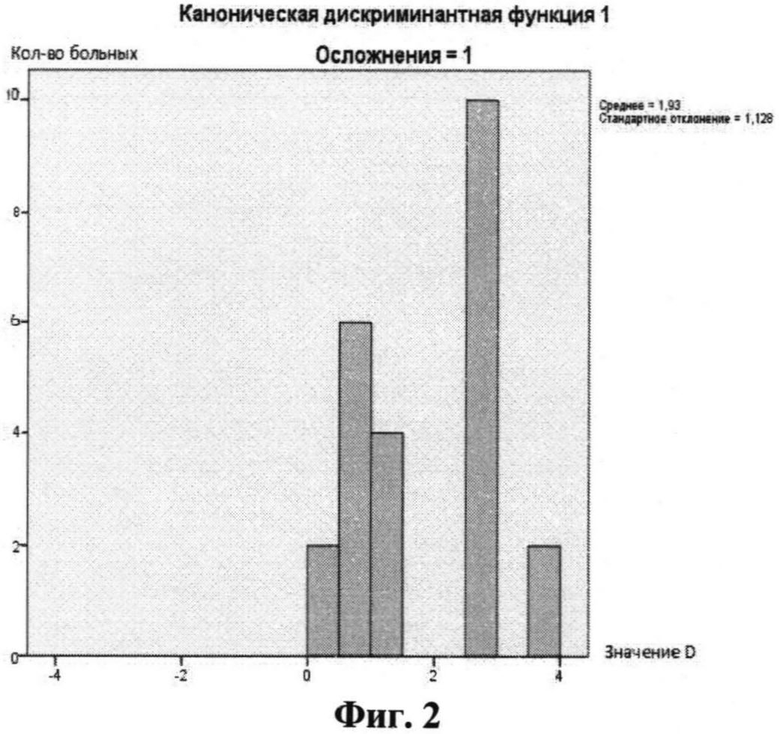
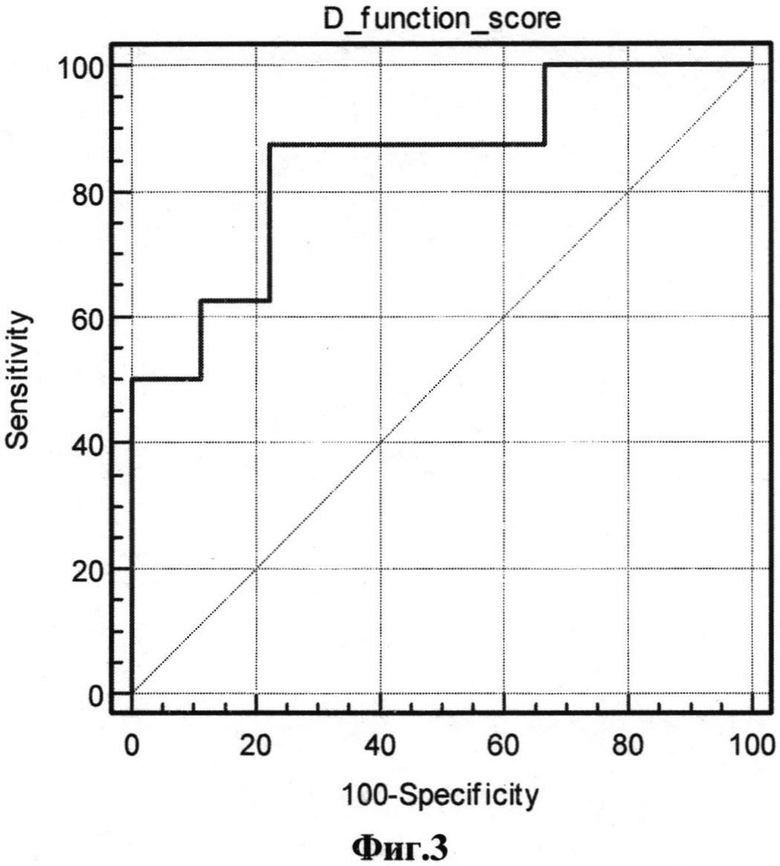
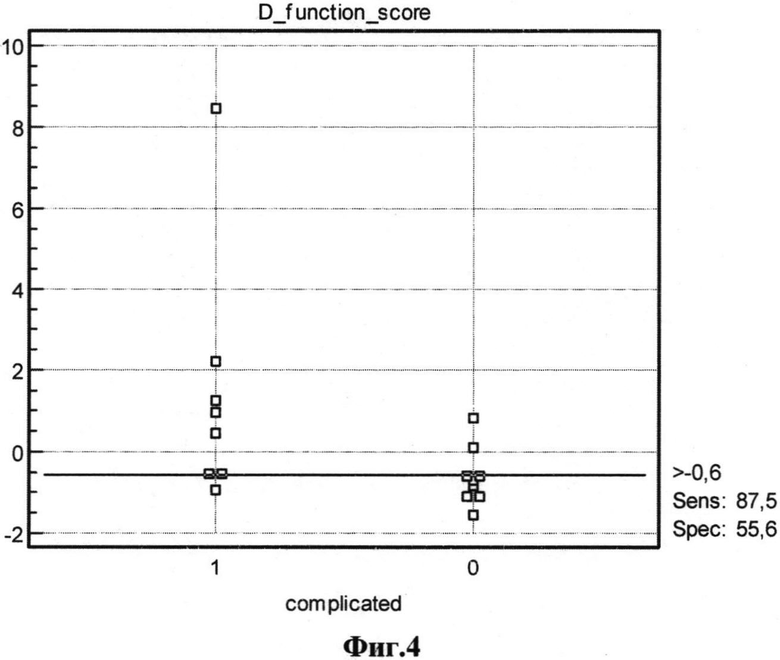
На фиг.1 представлена диаграмма группировки значений дискриминантной функции (D-функции) для пациентов без послеоперационных осложнений, на фиг.2 - для пациентов с послеоперационными осложнениями; на фиг.1 и 2 по оси X обозначено значение функции D, по оси Y - количество пациентов с соответствующим значением D; на фиг.3 представлена ROC-кривая для разработанной модели (AUC=0,847; p=0,016; доверительный интервал 0,656-1,0) для контрольной выборки; на фиг.4 представлено графическое распределение значений D-функции пациентов контрольной выборки с послеоперационными осложнениями (точка 1 по оси X) и без них (точка 0 по оси X), по оси Y отложены значения функции D. Значения D для каждого из пациентов обозначено квадратами.
Заявляемый способ был разработан на основе анализа ретроспективно подобранной выборки из 33 пациентов, которым в ГУЗ «Областной кардиохирургический центр» г.Саратова были выполнены операции изолированного шунтирования коронарных артерий в условиях искусственного кровообращения. Выборка была разделена на две группы:
- Группа 0 - без послеоперационных осложнений, в которую вошли 33 пациента: мужчин - 26 (80%), женщин - 7 (20%), средний возраст пациентов в данной группе составил 58,4±8,5 лет (42-76 лет);
- Группа 1-е осложненным течением послеоперационного периода (структура осложнений представлена в Таблице 1), в которую вошли 24 пациента: мужчин - 19 (79,3%), женщин - 6 (20,7%), средний возраст пациентов в группе составил 59,6±7,9 лет (42-73 года).
Обе группы по результатам статистического сравнения с использованием непараметрических методов были сопоставимы по полу, возрасту, характеру поражения коронарных артерий и структуре сопутствующей патологии (см. Таблицу 2), что позволило использовать данную выборку для разработки модели для прогнозирования послеоперационных осложнений
Осложненным считали ранний (1-6 суток с момента оперативного вмешательства) послеоперационный период при наличии хотя бы одного из следующих состояний:
- развитие почечной недостаточности - повышение уровня креатинина крови более 200 мкмоль/л или более 50% от дооперационного уровня;
- развитие дыхательной недостаточности, требующей применения продленной искусственной вентиляции легких;
- развитие пароксизма фибрилляции предсердий;
- нестабильность гемодинамики, требующая применения инотропной или вазопрессорной поддержки и/или методов вспомогательного кровообращения;
- признаки острого инфаркта миокарда;
- симптомы энцефалопатии и признаки острого нарушения мозгового кровообращения (ОНМК).
Структура послеоперационных осложнений, развитие которых было отмечено в первые 6 суток после оперативного вмешательства, представлена в таблице 1.
Развитие полиорганной недостаточности (с вовлечением 3 и более систем) было отмечено у 11 (45,8%) пациентов данной группы. Летальность в группе 1 составила 37,5% - умерли 9 пациентов.
Краткие дооперационные характеристики групп и параметры хирургических вмешательств представлены в таблице 2.
Как следует из представленной таблицы, между группами имеются статистически достоверные различия по продолжительности ИК и времени пережатия аорты. Полученные результаты полностью согласуются с данными других авторов [Wesselink R.M., 1997; Бабаев М.А., 2011] о том, что при увеличении времени ИК возрастает вероятность развития органной недостаточности и тяжесть ее клинических проявлений.
Перед оперативным вмешательством в обеих группах производилась оценка риска развития неблагоприятных исходов с использованием шкалы Euroscore. Всем пациентам выполнялись операции изолированного шунтирования коронарных артерий в условиях ИК нормотермии. Анестезия и ИК проводились по унифицированному протоколу, принятому в клинике, использовалась фармакохолодовая кардиоплегия. Проводился мониторинг общепринятых гемодинамических параметров.
Для дальнейшего анализа были отобраны следующие показатели: уровень артериального давления (АР, мм рт.ст.), центрального венозного давления (CVP, мм вод.ст.), уровень лактата крови (Lact, ммоль/л), гематокрит (Ht, %), парциальное давление кислорода в артериальной и венозной крови (paO2 и pvO2, мм рт.ст.). Для прогноза использовались значения предикторов, определяемые в сроки 25-35 минут от начала искусственного кровообращения. Следует отметить, что на протяжении всего периода интраоперационного мониторинга значения указанных параметров находились в пределах референтного диапазона нормальных значений у пациентов обеих групп. Также для прогноза использовались показатели: возраст пациента (age), длительность ИК (t1) и время пережатия аорты (t2).
Для определения прогностической значимости изменений выбранных параметров в отношении развития послеоперационных осложнений был использован метод дискриминантного анализа. Для проведения дискриминантного анализа был использован программный пакет IBM SPSS 19.0, для графического отображения результатов ROC-анализа, характеризующего прогностическую точность полученной модели, использовали программу MedCalc 7.4.
Дискриминантный анализ является статистическим методом, позволяющим решать задачи отнесения какого-либо изучаемого объекта к одной из нескольких имеющихся групп на основании определения у него некоторого числа признаков. Технология автоматизированного проведения дискриминантного анализа с получением дискриминантной функции подробно представлена в книге Наследов А.Д. SPSS: профессиональный статистический анализ данных / А.Д. Наследов, Санкт-Петербург, 2011. Полученная в результате дискриминантного анализа прогностическая модель представляет собой линейную дискриминантную функцию. Отнесение пациентов к группе с послеоперационными осложнениями или без них при помощи предлагаемой диагностической модели основывается на сравнении значения полученной линейной дискриминантной функции конкретного пациента со средними значениями соответствующих функций для пациентов исследуемых групп. Для расчета дискриминантной функции в программу SPSSS 19.0. вводили значения отобранных для прогноза интраоперационных предикторов, а также данные об известных исходах. В результате была получена линейная дискриминантная функция вида:
D=3,321+(0,006)*АР+(0,011)*CVP+(1,030)*Lact+(-0,009)*раО2+(0,005)*pvO2+(-0,124)*Ht+(-0,023)*Age+(0,014)*t+(-0,019)*t2,
где D - значение дискриминантной функции.
Полученная модель характеризуется высокой степенью предсказательной точности, которая подтверждается значением коэффициента канонической корреляции, который для данной функции равен 0,833. Для данного коэффициента уровень достоверности p<0,001, что свидетельствует о высокой предсказательной точности полученной модели.
Различия между группами также характеризуются различными средними значениями D-функции для каждой из исследуемых групп. На фиг.1 графически представлено распределение пациентов каждой из групп обучающей выборки на плоскости в соответствии со значениями функции D, рассчитанными для каждого из пациентов. Видно, что наибольшее число пациентов группы 1 с послеоперационными осложнениями группируется в положительной полуплоскости вблизи среднего значения D для данной группы, которое равно 1,93. В то же время большинство пациентов без послеоперационных осложнений (группа 0) по значению функции D группируется в отрицательной полуплоскости, вблизи среднего для данной группы, которое равно -1,10. Таким образом, на фиг.1 и фиг.2 видно, что значения D для групп с послеоперационными осложнениями и без них смещены относительно 0 координатной плоскости в положительную и отрицательную части, соответственно.
Наиболее точное отнесение конкретного пациента к одной из групп будет происходить в случаях, когда линейная дискриминантная функция будет принимать значения, близкие к средним групповым, или же при расположении значений дискриминантной функции, соответственно, в зонах менее отрицательного и более положительного значения средних групповых значений. В случае же «попадания» значений дискриминантной функции исследуемого пациента в зону, располагающуюся «между группами», особенно вблизи значения, условно делящего расстояние между средними групп надвое, точность работы данной математической модели будет очевидно снижаться, формируя, таким образом, некий «диапазон неопределенности».
Точность разработанной модели была проверена на дополнительной контрольной выборке из 20 пациентов, перенесших операцию шунтирования коронарных артерий, с известными исходами. Для проверки прогностической точности разработанной модели в контрольной выборке использовали процедуру ROC-анализа (результаты графически представлены на фиг.3 и 4). Численная оценка клинической значимости исследуемого параметра производилась при помощи показателя AUC (area under curve) в соответствии с общепринятой экспертной шкалой для значений AUC.
В ходе ROC-анализа значение D сопоставлялось с известным исходом наличия или отсутствия ранних послеоперационных осложнений. На фиг.3 представлена собственно ROC-кривая, по осям, соответственно, показатели чувствительности и 100-специфичности, представленные в процентах (%). Площадь под ROC-кривой, полученной для нашей модели, а соответственно, и точность прогнозирования равна 0,847. На фиг.4 представлена оценка порогового значения D-функции, а именно схематичная группировка значений D-функции, соответствующих пациентам с послеоперационными осложнениями и без них, также указано значение функции D с оптимальным сочетанием чувствительности и специфичности, позволяющее разграничить исследуемые группы.
Полученное значение AUC=0,847 соответствует экспертной оценке качества модели «очень хорошее», при этом значение p=0,016 свидетельствует о статистической достоверности рассчитанных параметров. «Критическим» признано значение D=-0,6, которое позволяет разграничивать группы с осложнениями и без них, Таким образом, при использовании данной модели при получении значений меньше -0,6 наиболее вероятным будет гладкое течение послеоперационного периода; больше -0,6 прогнозируется развитие послеоперационных осложнений; при получении значения =-0,6 прогноз следует считать неопределенным, в клинической практике, исходя из большей опасности нераспознавания развития осложнений, нежели их гипердиагностики, следует таких больных относить к группе с прогнозируемым развитием осложнений. При использовании данной модели в клинической практике очевидна необходимость дифференцированного лечебного и тактического подходов в зависимости от результатов отнесения пациента к той или иной группе.
В течение оперативного вмешательства по завершении процедуры искусственного кровообращения производят расчет прогноза, подставив в формулу значения параметров исследуемого пациента. При получении значения D<-0,6 делают вывод о низком риске развития органных дисфункций в раннем периоде после проведения операции, при получении значений D>0,6 делают вывод о высоком риске развития органных дисфункций, при этом в случае получения значения D=-0,6 прогноз характеризуют как сомнительный, и при получении значения D из данного интервала осуществляют наблюдение за пациентом, контролируя состояние внутренней среды организма, включая более частое измерение стандартных параметров (гемодинамики, биохимического анализа крови, диуреза и т.д.). Данная категория пациентов подлежит более пристальному наблюдению в условиях палаты интенсивной терапии.
Пример 1. Пациентка К., 58 лет. Выполнено маммарокоронарное шунтирование ПМЖВ и аортокоронарное шунтирование 3 артерий. Длительность ИК 79 минут, длительность пережатия аорты 30 минут. На 30-й минуте ИК определяемые параметры имели значения: АД=49 мм рт.ст., ЦВД=70 мм вод.ст., уровень лактата в крови - 2,3 ммоль/л; pvO2=39 мм рт.ст., paO2=204 мм рт.ст., гематокрит=25%. При расчете значений дискриминантной функции путем подстановки указанных значений в формулу D=1,215 - значение более критического «-0,6», приближено к среднему для группы с осложнениями. В послеоперационном периоде у данной пациентки наблюдалась гипотония, потребовавшая инотропной поддержки.
Пример 2. Пациент С., 59 лет. Выполнено маммарокоронарное шунтирование ПМЖВ и аортокоронарное шунтирование 3 артерий. Длительность ИК 55 минут, длительность пережатия аорты 34 минут. На 30-й минуте ИК определяемые параметры имели значения: АД=41 мм рт.ст., ЦВД=0 мм вод.ст., уровень лактата в крови -1,1 ммоль/л; pvO2=29,5 мм рт.ст., paO2=293 мм рт.ст., гематокрит=21,9%. При расчете значений дискриминантной функции путем подстановки указанных значений в формулу D=-1,738 - значение меньше «критического». Отмечено гладкое течение послеоперационного периода. Следует отметить, что в обоих случаях значения мониторируемых показателей не выходили за пределы нормальных значений, однако классифицировались моделью по-разному.
Таким образом, использование заявляемого изобретения - прогностических моделей в динамическом мониторинге клинико-лабораторных параметров позволяет корректировать лечебную тактику на начальных этапах формирования патологических процессов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОСЛОЖНЕНИЙ ПОСЛЕ ОПЕРАЦИЙ ШУНТИРОВАНИЯ КОРОНАРНЫХ АРТЕРИЙ В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ | 2013 |
|
RU2536279C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ОСЛОЖНЕНИЙ В РАННЕМ ГОСПИТАЛЬНОМ ПЕРИОДЕ У ПАЦИЕНТОВ ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ | 2017 |
|
RU2642238C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ РАННИХ АБДОМИНАЛЬНЫХ ОСЛОЖНЕНИЙ У ПАЦИЕНТОВ ПОСЛЕ КОРРЕКЦИИ ПРИОБРЕТЕННЫХ ПОРОКОВ СЕРДЦА В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ | 2020 |
|
RU2734056C1 |
| Способ прогнозирования риска развития ранних абдоминальных осложнений у пациентов, перенесших коронарное шунтирование в условиях искусственного кровообращения | 2018 |
|
RU2692455C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ПОСТПЕРФУЗИОННОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ ПРИ ОПЕРАЦИЯХ ПРЯМОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА С ИСКУССТВЕННЫМ КРОВООБРАЩЕНИЕМ У ВЗРОСЛЫХ ПАЦИЕНТОВ | 2017 |
|
RU2663640C1 |
| Способ профилактики предоперационными аэробными физическими тренировками послеоперационных когнитивных расстройств у пациентов при коронарном шунтировании в условиях искусственного кровообращения | 2020 |
|
RU2734717C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ НЕБЛАГОПРИЯТНЫХ СЕРДЕЧНО-СОСУДИСТЫХ СОБЫТИЙ В ТЕЧЕНИЕ 12 МЕСЯЦЕВ ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ | 2024 |
|
RU2830502C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ | 2007 |
|
RU2363390C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СКРЫТОЙ СИСТОЛИЧЕСКОЙ ДИСФУНКЦИИ ПРАВОГО ЖЕЛУДОЧКА | 2022 |
|
RU2811760C1 |
| Способ компьютерной когнитивной реабилитации с использованием мультизадачного подхода у пациентов в раннем послеоперационном периоде коронарного шунтирования в условиях искусственного кровообращения | 2022 |
|
RU2790936C1 |
Изобретение относится к медицине, а именно к сердечно-сосудистой хирургии, анестезиологии и реаниматологии, и может быть использовано при прогнозировании развития осложнений в виде органных дисфункций в раннем послеоперационном периоде (в первые 6 суток после операций) у пациентов при выполнении операции шунтирования коронарных артерий (АКШ) в условиях искусственного кровообращения. Для этого в диапазоне 25-35 минут с момента начала проведения процедуры искусственного кровообращения осуществляют измерение показателей центральной гемодинамики: уровень артериального (АР) и центрального венозного давлений (CVP), показателей гомеостаза, включающих концентрацию лактата в крови (Lact), парциальное давление кислорода в венозной (pvO2) и артериальной крови (paO2), уровень гематокрита (Ht). Дополнительно определяют показатели длительности искусственного кровообращения (t1), времени пережатия аорты (t2) и возраста больного (age) с последующим определением значения дискриминантной функции по формуле: D=3,321+(0,006)*АР+(0,011)*CVP+(1,030)*Lact+(-0,009)*раО2+(0,005)*pvO2+(-0,124)*Ht+(-0,023)*age+(0,014)*t1+(-0,019)*t2. При получении значения D<-0,6 делают вывод о низком риске развития органных дисфункций в раннем периоде после проведения операции. При получении значений D>0,6 делают вывод о высоком риске развития органных дисфункций. Интервал значений -0,6<D<0,6 характеризуют как интервал неопределенности, и при получении значения D из данного интервала осуществляют контроль состояния пациента, включая более частое измерение стандартных параметров. Способ обеспечивает повышение скорости получения результатов прогноза при сохранении высокой прогностической точности, а также возможность получения результатов непосредственно в процессе проведения операции шунтирования по завершении процедуры искусственного кровообращения. 2 табл., 4 ил., 2 пр.
Способ интраоперационного определения риска развития органных дисфункций в раннем периоде после проведения операции изолированного шунтирования коронарных артерий в условиях искусственного кровообращения, включающий измерение в диапазоне 25-35 минут с момента начала проведения процедуры искусственного кровообращения показателей центральной гемодинамики, включающих уровень артериального (AP) и центрального венозного давлений (CVP), показателей гомеостаза, включающих концентрацию лактата в крови (Lact), парциальное давление кислорода в венозной (pvO2) и артериальной крови (paO2), уровень гематокрита (Ht), а также определение показателей длительности искусственного кровообращения (t1), времени пережатия аорты (t2), и возраста больного (age) с последующим определением значения дискриминантной функции по формуле:
D=3,321+(0,006)*АР+(0,011)*CVP+(1,030)*Lact+(-0,009)*раО2+(0,005)*pvO2+(-0,124)*Ht+(-0,023)*age+(0,014)*t1+(-0,019)*t2,
и при получении значения D<-0,6 делают вывод о низком риске развития органных дисфункций в раннем периоде после проведения операции, при получении значений D>0,6 делают вывод о высоком риске развития органных дисфункций, при этом интервал значений -0,6<D<0,6 характеризуют как интервал неопределенности, при получении значения D из данного интервала осуществляют контроль состояния пациента, включая более частое измерение стандартных параметров.
| СПОСОБ ПРОГНОЗИРОВАНИЯ РЕСПИРАТОРНОГО ДИСТРЕСС-СИНДРОМА ВЗРОСЛЫХ И ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ ПРИ КОРОНАРНОМ ШУНТИРОВАНИИ С ИСПОЛЬЗОВАНИЕМ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ | 1997 |
|
RU2138049C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ У КАРДИОХИРУРГИЧЕСКИХ БОЛЬНЫХ | 2010 |
|
RU2422092C1 |
| WO 2008149103 A1, 11.12.2008 | |||
| СОТНИКОВ А.В | |||
| Прогнозирование, профилактика и упреждающая интенсивная терапия полиорганной недостаточности при постгеморрагических и септических состояниях | |||
| Автореф | |||
| дисс | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| TURINA J., et al., Predictors of the long-term outcome after | |||
Авторы
Даты
2014-12-20—Публикация
2013-11-25—Подача