Изобретение относится к генной инженерии, биохимии, биотехнологии и иммунологии, в частности, к получению синтетических генов D3S, D3E и D3D, оптимизированных для гетерологичной экспрессии в непатогенных лабораторных штаммах Escherichia coli и кодирующих рецептор-связывающие домены III белка Ε оболочки вируса клещевого энцефалита (ВКЭ). На основе генов D3S, D3E и D3D получают рекомбинантные плазмиды pDBD2-D3S, pDBD2-D3E и pDBD2-D3D, которые кодируют бифункциональные рекомбинантные белки, различающиеся по аминокислотному составу в позициях 166, 170, 184, 211 и определяющие принадлежность к трем основным генетическим типам вируса. Изобретение также включает штаммы-продуценты химерных белков Е. coli M15 [pREP4, pDBD2-D3S], Ε. coli M15 [pREP4, pDBD2-D3E] и Ε. coli M15 [pREP4, pDBD2-D3D], а также способ иммобилизации, концентрирования и очистки полученных белков на декстрансодержащем сорбенте.
Изобретение относится непосредственно к рекомбинантным белкам DBD2-D3S, DBD2-D3E и DBD2-D3D, предназначенным для использования в качестве антигенов, иммобилизованных в лунках 96-луночного планшета или стрипах, в составе набора диагностических маркеров для выявления антител к ВКЭ в сыворотке крови и ликворе человека методом ИФА, а также к иммуногенной композиции, содержащей иммобилизованные на декстране рекомбинантные белки и направленной на специфическую активацию иммунитета и формирование иммунологической памяти в отношении вируса. Сущность изобретения состоит в способе получения штаммов-продуцентов, обеспечивающих высокий уровень продукции рекомбинантных белковых антигенов DBD2-D3S, DBD2-D3E и DBD2-D3D, с целью последующего использования для иммунопрофилактики ВКЭ, дифференциальной диагностики флавивирусных инфекций и оценки напряженности иммунитета.
Описание изобретения
Область техники, к которой относится изобретение
Изобретение относится к генной инженерии, биохимии, биотехнологии и иммунологии, в частности, к получению синтетических генов D3S, D3E и D3D, рекомбинантных плазмид pDBD2-D3S, pDBD2-D3E и pDBD2-D3D, кодирующих слитые с декстрансвязывающим доменом белковые антигены домена III белка Ε оболочки ВКЭ Сибирского, Европейского и Дальневосточного подтипов, а также штаммов-продуцентов химерных белков DBD2-D3S, DBD2-D3E и DBD2-D3D Escherichia coli, обеспечивающих высокий уровень экспрессии целевых продуктов - белковых антигенов трех различных подтипов ВКЭ, которые могут быть получены, иммобилизованы и очищены с использованием декстрансодержащего сорбента.
Уровень техники
ВКЭ является членом семейства флавивирусов (Flaviviridae, род Flavivirius). Помимо ВКЭ к роду Flavivirus относится еще более 60 видов вирусов, в том числе вирус японского энцефалита, желтой лихорадки, Западного Нила, Дэнге, Омской геморрагической лихорадки и другие. Все эти вирусы вызывают тяжелые заболевания человека и активно изучаются. Так, например, ВКЭ широко представлен на обширной территории Евразийского континента (на территории многих Европейских стран, России, Восточной Азии и Японии) [1-3] и может приводить к развитию тяжелых форм энцефалита, таких как менингеальная, полиомиелитическая, полиоэнцефало-миелитическая и церебральная, с серьезными последствиями до полной инвалидизации и смерти, что обуславливает социальную значимость данной флавивирусной инфекции в эндемичных областях.
Несмотря на относительно невысокую заболеваемость клещевым энцефалитом (КЭ) в Центральном и Дальневосточном федеральных округах, на территории ряда субъектов этих округов часто регистрируют летальные исходы. При этом одним из основных факторов, обусловливающих неблагополучную эпидемиологическую обстановку по КЭ в России, является недостаточная иммунизация населения на эндемичных по ВКЭ территориях субъектов Российской Федерации [4].
В России для специфической профилактики КЭ разрешены к использованию следующие вакцинные препараты: отечественные цельновирионные вакцины - клещевого энцефалита культуральная очищенная концентрированная инактивированная сухая (Предприятие по производству бактерийных и вирусных препаратов (ФГБУ «ИПВЭ им. М.П.Чумакова» РАМН, Россия) и Энцевир (НПО «Вирион», Россия), и зарубежные - ФСМЕ-Иммун («Baxter», Австрия) и Энцепур («Novartis», Германия), основным компонентом которых является поверхностный антиген ВКЭ, полученный после разрушения размноженного в культуре клеток вируса. При этом для производства отечественных вакцин используются штаммы ВКЭ Дальневосточного генетического типа Софьин (выделен из мозга умершего больного на Дальнем Востоке в 1937 г.) и 205 (выделен от клеща Ixodes persulcatus в Хабаровском крае в 1973 г.). В свою очередь, для производства зарубежных вакцин в Австрии и Германии применяют штаммы западноевропейского генетического типа: Найдорф (выделен от клеща Ixodes ricinus в 1971 г.) и К23 (выделенный от клеща Ixodes ricinus в 1975 г.).
Для выявления инфицирования вирусом и установления диагноза КЭ повсеместно используются лабораторные методы иммуноферментного анализа (ИФА) антигенов ВКЭ, преимущественно к поверхностному гликопротеину Е, а также антител к антигенам ВКЭ в сыворотке крови и ликворе пациента (тест-системы «Векто-ВКЭ-IgG-CTpHn» и «Векто-ВКЭ-IgM-CTpHn» фирмы Вектор-Бест, Новосибирск, Россия, www.vector-best.ru; «FSME/TBEV IgG ELISA» и «FSME/TBEV IgM ELISA» фирмы HYCOR Biomedical Inc., США, www.hycorbiomedical.com).
В настоящее время производство инактивированных вакцин и диагностических тест-систем, основным компонентом которых является вирионный антиген ВКЭ, связано с культивированием инфекционных штаммов вируса, который относится к патогенам II группы, что требует обеспечения особых условий безопасности в соответствии с требованиями Санитарных правил 1.3.1285-03 для работы с I-II группой патогенности. Культивирование инфекционных штаммов ВКЭ представляет собой сложный производственно-технологический процесс, который требует использования дорогих питательных сред или куриных SPF (specific pathogen free) эмбрионов, многоэтапных схем очистки и применения токсичных веществ (формальдегида) для инактивации вирусных частиц, при этом выделение и очистка антигенных компонентов производится на основе сложных многостадийных процессов, требующих дорогого оборудования и сорбентов. Кроме того, при любом производстве биопрепаратов, связанном с культивированием высоко патогенных микроорганизмов, существует опасность заражения персонала и контаминации окружающей среды.
Производство инактивированных вакцинных препаратов также предполагает использование высоко вариабельной последовательности вирионного белка Ε определенного штамма ВКЭ, что приводит к формированию ненапряженного иммунитета к остальным подтипам вируса, наличие которого обуславливает снижение вероятности развития КЭ или его тяжести, но не дает гарантии предотвращения заболевания [5]. При этом вакцинные штаммы были выделены 40-70 лет назад и с тех пор культивировались в лаборатории, что привело к их отличиям от циркулирующих в природе современных штаммов, что, в свою очередь, может являться причиной детектируемых случаев заболевания КЭ среди полностью привитых людей [6-8].
Помимо этого имеются многочисленные данные о поствакцинальных осложнениях различной степени тяжести после проведения иммунопрофилактики инактивированными препаратами против ВКЭ, развитие которых в большинстве случаев связано с недостаточной степенью очистки вакцин от яичных белков, компонентов клеток вирусных частиц и антибиотиков, используемых в технологическом процессе наращивания патогенных штаммов [9].
В случае диагностических тест-систем для определения антигенов ВКЭ и антител к ним в сыворотке крови и ликворе пациента с использованием лабораторных методов ИФА к недостаткам диагностики можно отнести высокую стоимость анализа, поскольку для его проведения требуются высокоочищенные антигены и антитела (патенты RU 2402606, RU 2016897, RU 2359269). При этом необходимость использования формальдегида для инактивации вируссодержащих культуральных жидкостей, из которых впоследствии получают препараты вирионного антигена ВКЭ, приводит к возникновению множественных модификаций белка Ε по ключевым аминокислотным остаткам - Lys и Arg, что может обуславливать изменение нативной структуры белка и его антигенных свойств, и, как следствие, приводить к формированию ненапряженного иммунитета при проведении вакцинопрофилактики, а также затруднять определение антител к структурному белку Ε ВКЭ в сыворотках человека при использовании в диагностических тест-системах.
Несмотря на наличие эффективных и относительно безопасных вакцин для специфической профилактики большинства известных флавивирусных инфекций и накопленный опыт по их разработке и применению, продолжается поиск новых подходов к созданию вакцинных препаратов. Актуальность исследований обусловлена высокой распространенностью флавивирусов и отсутствием универсальных вакцин против нескольких подтипов вируса, производство которых было бы эффективным и безопасным, при этом выработка иммунного ответа была бы как минимум равноценна таковой при индукции стандартными инактивированными вакцинными препаратами.
Разработка вакцин нового поколения ведется по нескольким направлениям:
- Производство новых ослабленных или инактивированных вакцин: патенты на изобретения CN 102397539 A, CN 102329782 A; US 8241638; RU 2230573 C1, RU 2070929 C1.
- Конструирование рекомбинантных вирусов, содержащих клонированные гены наиболее распространенных флавивирусов в составе вируса осповакцины или других дефектных в репликации флавивирусов: патенты на изобретения US 8227587; RU 2208635 С2, RU 2136312 C1.
- Оптимизация условий культивирования: патент на изобретение RU 2203089 С2.
- ДНК-вакцины: патенты на изобретения US 20030022849 A1; RU 2112038 C1.
- Субъединичные препараты: патенты на изобретения ЕР 2345665 A3; US 8221768, US 6432411 B1, US 20130295162 A1; RU 2084242 C1.
1. Иммуногенные композиции на основе живых ослабленных и инактивированных вакцин
Для создания живых ослабленных и инактивированных вакцин продолжаются поиски ослабленных штаммов флавивирусов Денге, вируса Западного Нила, ВКЭ и вируса Лангат. В последнее время широкое распространение получил подход сайт-направленного мутагенеза, при использовании которого нуклеотидные замены вводят в клонированные полноразмерные ДНК-копии геномов флавивирусов, а последующая транскрипция in vitro при помощи фаговых РНК-полимераз и введение РНК в эукариотические клетки могут приводить к появлению инфекционно ослабленных вирусов. Достижения в области генной инженерии позволяют использовать различные аттенуированные ДНК- и РНК-содержащие вирусы в качестве векторов для экспрессии чужеродной генетической информации [10]. Кандидаты в живые вакцины против флавивирусных инфекций могут быть также получены на основе рекомбинантного вируса осповакцины, экспрессирующего ген поверхностного гликопротеина Ε или ген протеазы NS3. Так, например, известно изобретение RU 2136312 C1, которое предназначено для специфической иммунопрофилактики КЭ и описывает интраназальный способ иммунизации живой рекомбинантной вакциной против КЭ на основе вируса осповакцины.
Очевидными недостатками рекомбинантных вирусов являются дорогостоящая процедура их получения в клеточных культурах и выработка слабого иммунного ответа из-за кратковременной одновременной экспрессии генов нескольких вирусов. Применение живых аттенуированных вакцин также ограничено из-за возможности реверсии инфекционного агента к дикому типу (патент RU 2070929 C1).
Отдельно следует отметить, что в соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ) с 1995 г. разработка вакцин проводится с использованием в качестве субстрата не куриных эмбрионов, а перевиваемых культур клеток, аттестованных в соответствии с международными требованиями к клеточным субстратам [11]. Такие культуры клеток обладают рядом преимуществ, но при этом могут накапливать посторонние агенты из питательных сред, сывороток, трипсина и т.п. в процессе серийного пассирования. Кроме того, применение любых культур клеток сопряжено с риском их контаминации [12].
Таким образом, в связи с существующими трудностями, работ, посвященных созданию новых живых вакцин на основе природных аттенуированных флавивирусов, в настоящее время становится все меньше (патенты CN 102329782 A; US 8241638).
2. ДНК-вакцины
Преимуществами генной иммунизации являются простота получения ДНК-вакцин. Использование плазмидных векторов для клонирования различных вирусных генов под контролем сильных промоторов, узнаваемых эукариотическими РНК-полимеразами, в значительной мере упрощает способ получения и сокращает сроки на разработку потенциальных вакцин. Отсутствие необходимости работы с патогенными вирусами или бактериями и дорогостоящей процедуры очистки антигенов позволяет существенно снизить себестоимость рекомбинантных ДНК-вакцин [13, 14].
В состав ДНК-вакцин входят гены поверхностных относительно консервативных гликопротеинов, находящихся на поверхности вирионов и инфицированных клеток. Наиболее консервативными генами флавивирусов являются Ε (42% гомологии среди различных видов рода Flavivirus), NS1 (42%), NS3 (44%) и NS5 (55%). Так, например, известно изобретение RU 2112038 C1, которое описывает способ получения рекомбинантной плазмидной ДНК pC-NS3, обеспечивающей интеграцию комплекса генов С, PrM, Е, NS1, NS2A, NS2B и NS3 ВКЭ в геном вируса осповакцины. После проведения вакцинации рекомбинантный вирус осповакцины должен обеспечивать экспрессию комплекса антигенов ВКЭ в клетках иммунизированного организма, что, в свою очередь, должно способствовать формированию протективного иммунитета против заражения ВКЭ. При этом следует отметить, что высокомолекулярные молекулы ДНК являются слабыми иммуногенами из-за подвижной конформации в растворе. Кроме того, механизм проникновения ДНК в клетки иммунизируемого организма недостаточно ясен.
Помимо этого экзогенные ДНК могут деградировать в эукариотических клетках под действием нуклеаз, есть риск возникновения мутаций в ДНК-последовательности, а также возможно исчезновение нереплицирующихся плазмид из-за последовательного уменьшения их относительных количеств в процессе деления эукариотических клеток. Таким образом, нестабильность, многочисленные мутации и возможность встраивания плазмид в клеточные хромосомы может обуславливать снижение защитного эффекта генной иммунизации.
3. Субъединичные вакцины
Субъединичные вакцины получают на основе как рекомбинантных, так и нативных флавивирусных белков (патент RU 2084242 C1), выделенных из культур инфицированных клеток методами аффинной хроматографии с различными вариантами элюции (патент RU 2230573 C1). Рекомбинантные белки Ε (патент US 6432411 В1), prM (патент US 8221768) и NS1 (патент ЕР 2345665 A3), а также фрагменты белков Ε и NS1 могут быть использованы для специфической профилактики флавивирусных инфекций.
Наработку рекомбинантных белков можно проводить как в трансформированных бактериальных клетках, так и в трансфицированных эукаритических клетках, в частности, в клетках насекомых (патент US 6432411 В1). Подобные генно-инженерные аналоги описаны для всех флавивирусных белков, однако, несмотря на их иммуногенные свойства, только введение белков Μ, Ε и NS1 рода Flavivirus обеспечивает защиту от инфекции.
Флавивирусные антигены также могут формировать частицы, содержащие белки Ε и PrM/М. Иммунизация экспериментальных животных такими вирусоподобными частицами позволяет обеспечить защитный гуморальный иммунный ответ [15], однако стоимость получения и очистки вирусоподобных частиц, состоящих из структурных гликопротеинов флавивирусов, очень высока, поэтому широкое применение таких вакцин не представляется возможным.
Отдельно следует отметить, что, поскольку РНК-содержащим флавивирусам свойственны генетическая изменчивость и вариабельность, в настоящее время продолжается поиск наиболее консервативных фрагментов вирусных белков, локализованных на поверхности оболочки вирионов или инфицированных клеток и включающих эпитопы для вирус-нейтрализующих и протективных антител. При этом основной мишенью вируснейтрализующих антител является белок Ε оболочки вируса, а именно дистальный домен III, который отвечает за связывание нейтрализующих вирус иммунопротективных антител, в связи с чем в последнее время все большее развитие получают подходы к созданию вакцин, основанные на получении именно рекомбинантного домена III вирионного белка Ε [16-18]. В основе этих работ лежит исследование Bhardwaj и соавт. [19], в котором было показано, что домен III белка Ε вируса Лангат (относящегося к группе флавивирусов) образует в растворе правильно уложенную и стабильную пространственную структуру, соответствующую структуре домена в кристаллизованном полноразмерном белке Ε [20]. Также в работе [19] на культуре клеток было показано, что домен III обладает защитным эффектом от вирусов, переносимых клещами. Эта работа показала, что домен III белка Ε может быть перспективен для разработки новых вакцин.
В работе Chu и соавт. [17] рекомбинантный домен III белка Ε вируса лихорадки Западного Нила был протестирован на мышах линии BALB/C в качестве потенциального компонента субъединичной вакцины. Иммунизация мышей рекомбинантным доменом III белка Ε в сочетании с олигодезоксинуклеотидами CpG ODN, используемыми в качестве адъюванта, приводила к появлению у иммунизированных мышей высокого титра нейтрализующих антител к вирусу лихорадки Западного Нила. Селезеночные макрофаги, выделенные из иммунизированных мышей (домен III белка Ε с CpG ODN в качестве адъюванта, либо только домен III белка Е), показывали высокий уровень пролиферации Т-клеток в присутствии домена III белка Ε по сравнению с контрольными группами. Также селезеночные макрофаги, полученные от иммунизированных мышей, обнаруживали высокий уровень экспрессии цитокинов. При этом селезеночные макрофаги мышей, иммунизированных только доменом III, показывали преимущественно Тh1 тип иммунного ответа, а селезеночные макрофаги мышей, иммунизированных доменом III белка Ε в сочетании с CpG ODN в качестве адъюванта, демонстрировали высокий уровень как Тh1, так и Th2 цитокинов. Таким образом, было показано, что иммунизация мышей рекомбинантным доменом III белка Ε предотвращает инфекцию соответствующего вируса в отсутствие полноразмерного белка Ε или вирусных частиц. Добавление CpG ODN в качестве адъюванта усиливало иммунный ответ. В работе Chiang и соавт. [16, 18] описана разработка вакцины против вируса Денге, основанной на использовании консенсусной последовательности к 4 подтипам вируса Денге домена III белка Ε в мультифазной эмульсионной системе, при этом авторами было показано, что титр нейтрализующих антител получается невысоким, что определяет необходимость ревакцинаций.
Несомненными достоинствами рекомбинантных белков являются их безопасность при производстве и применении, а также низкая себестоимость вследствие использования стандартных генно-инженерных подходов при их конструировании и очистке. В свою очередь недостатком рекомбинантных белков является их относительно низкая иммуногенность. При этом данный недостаток может быть преодолен при использовании адъювантов [17, 18].
4. Применение аффинных доменов, полисахаридных сорбентов и молекулярных адъювантов
Субъединичные генно-инженерные препараты, содержащие протективные антигены, представляют большой интерес и обладают такими существенными преимуществами как низкая реактогенность, высокая чистота получаемого продукта, а также безопасность для людей с ослабленным иммунитетом. Основным способом получения таких антигенов является клонирование генов целевых белков в клетки непатогенных микроорганизмов и получение на их основе штаммов-продуцентов. При этом на этапе получения рекомбинантных антигенов могут возникать различные биотехнологические сложности: низкий уровень синтеза, нестабильность чужеродного белка, многостадийное выделение и очистка целевых продуктов.
Одним из часто применяемых способов решения этих проблем является использование технологии создания слитных (химерных) белков. Данная технология основана на соединении в одной рамке трансляции нескольких генов - гена целевого продукта (антигена) и гена белка-носителя, что приводит к синтезу химерного белка.
Внедрение хроматографических методов способствовало развитию tag-аффинных систем, позволяющих проводить выделение и очистку белков методом аффинной хроматографии. Известные аффинные домены имеют разный химический состав, молекулярную массу, неодинаковые условия элюирования и позволяют решать основные биотехнологические задачи. Среди больших аффинных доменов (12 кДа и более) широко распространены и активно используются в биотехнологии карбогидрат-связывающие домены, взаимодействующие с такими сорбентами как кристаллическая и некристаллическая целлюлоза, β-1,3-глюкан и смешанный β-1,3-1,4-глюкан, ксилан, маннан, крахмал (патенты US 6174700, US 6331416, US 6048715, US 20100317588).
Возможность применения природного полисахаридного сорбента для повышения иммуногенности была показана в работах профессора А.Е. Гурвича, в лаборатории которого впервые химическим способом были получены белково-целлюлозные комплексы и изучены их иммуногенные свойства [21]. Была продемонстрирована принципиально более высокая иммуногенность белково-полисахаридных комплексов по сравнению с иммуногенностью свободных неиммобилизованных антигенов (патент RU 01669918 C1).
В последние годы также большое внимание уделяется исследованию и возможному применению молекулярных адъювантов, обладающих иммуномодулирующей активностью и способных поляризовать иммунный ответ по Th1- или Th2-типу. Данный эффект достигается за счет стимуляции врожденного иммунитета молекулярными адъювантами: консервативными структурами микроорганизмов РАМР (pathogen associated molecular patterns) или сигналами опасности DAMP (danger associated molecular pattern), распознаваемыми специальными рецепторами (pattern recognition receptors - PRR - TLR, NLR и др.), или цитокинами. Так, например, повышение иммуногенности вакцины было отмечено при использовании комплекса рекомбинантных цитокинов IL-1β, IL-2 и TNFα человека [22]: исследуемые препараты цитокинов повышали протективный эффект вакцин против КЭ, оцениваемый по уровню резистентности мышей линии BALB/c к заражению штаммом Абсеттаров ВКЭ по сравнению с животными, иммунизированными вакциной без адъюванта.
В свою очередь, одним из наиболее применяемых в настоящее время адъювантов являются олигонуклеотиды с CpG-мотивами [23]. Для усиления иммуномодулирующих свойств CpG ODN возможно конъюгирование с высокомолекулярными соединениями или наночастицами [24]. Добавление CpG-ДНК к вакцинным препаратам смещает баланс иммунного ответа в сторону Th1, а именно увеличивает продукцию IgG2a по сравнению с IgG1 и синтез ИФН-γ (патенты US 20050043529 A1, US 20090087446 A1, US 8227446 B2, US 8263091 В2).
Таким образом, в настоящее время представляется актуальной разработка недорогой в производстве вакцины против КЭ, которая будет оказывать протективное действие после проведения нескольких иммунизаций и обеспечивать формирование длительного иммунитета, при этом эффективность выработки иммунного ответа будет равноценна таковому при иммунизации инактивированными вакцинными препаратами.
Прототипом настоящего изобретения в части использования для иммунопрофилактики является способ получения четырехвалентной вакцины против вируса Денге, которая включает в себя полипептиды домена III (dIII) вирионного белка Ε для каждого из серотипов вируса DEN1-DEN4 (патент US 20130295162 A1). Также к прототипам можно отнести изобретение, описанное в международной заявке на патент WO2012118559, которое относится к созданию иммуногенных композиций и вакцин против флавивирусных инфекций, а именно к улучшению вакцин против лихорадки Денге и разработке вакцин с повышенной иммуногенностью на основе слитых бивалентных белков флагеллина и вируса Денге, которые могут быть объединены с другими моно- и бивалентными антигенами вируса с целью производства поливалентной вакцины.
Прототипом настоящего изобретения в части использования для дифференциальной диагностики флавивирусных инфекций и оценки напряженности иммунитета является способ идентификации иммуноглобулинов, выработка которых происходит в ответ на специфическую иммунизацию или заражение вирусом, с использованием иммобилизованных антигенных композиций на основе домена III белка Ε оболочки флавивирусов на примере детекции серокомплекса ВКЭ и вирусов лихорадки Западного Нила (патент US 7785799 В2). При этом способ, описанный изобретением US 7785799 В2, не предполагает антигенной дифференциации разных штаммов ВКЭ, поскольку антигенные препараты, которые предполагаются к использованию для определения антител класса IgG к ВКЭ, содержат не уникальные, а унифицированные последовательности, характеризующиеся высокой консервативностью среди разных флавивирусов.
Также, согласно описанию изобретения US 7785799 В2, рекомбинантные домены III белка Ε оболочки вируса Западного Нила и серокомплекса ВКЭ могут быть экспрессированы в Е. coli в виде слитых белков для последующего получения растворимого белка, который далее может быть очищен. При этом на данный момент отсутствуют оптимизированные методики получения, выделения и очистки антигенных детерминант структурных фрагментов белка Ε оболочки ВКЭ в необходимой для сохранения антигенных свойств конформации, что не позволяет принципиально снизить трудозатраты на их производство, и, как следствие, определяет ряд ресурсных, спросовых и экологических ограничений на рынке вакцинных препаратов и лабораторной диагностики.
В связи с этим актуальной задачей является разработка антигенного препарата на основе отдельных белковых компонентов оболочки ВКЭ и декстрансвязывающего домена DBD2, определяющего способность рекомбинантного белка взаимодействовать с декстрансодержащим сорбентом, с высоким уровнем экспрессии и стабильности этих белков в бактериальной системе, с высокой степенью очистки и стабильности компонентов.
Такой способ обеспечивается настоящим изобретением. То есть техническим результатом заявленной группы изобретений является, в частности, разработка антигенного препарата на основе отдельных белковых компонентов оболочки ВКЭ и декстрансвязывающего домена DBD2, определяющего способность рекомбинантного белка взаимодействовать с декстрансодержащим сорбентом, с высоким уровнем экспрессии и стабильности этих белков в бактериальной системе, с высокой степенью очистки и стабильности компонентов и создание на его основе недорогой в производстве вакцины против КЭ, которая будет оказывать протективное действие после проведения нескольких иммунизаций и обеспечивать формирование длительного иммунитета, при этом эффективность выработки иммунного ответа будет равноценна таковому при иммунизации инактивированными вакцинными препаратами.
Раскрытие изобретения: сущностью изобретения является способ создания синтетических генов D3S, D3D и D3E, рекомбинантных плазмид pDBD2-D3S, pDBD2-D3E и pDBD2-D3D, кодирующих слитые с декстрансвязывающим доменом белковые антигены домена III белка Ε оболочки ВКЭ Сибирского, Европейского и Дальневосточного подтипов, а также штаммов-продуцентов химерных белков DBD2-D3S, DBD2-D3E и DBD2-D3D Escherichia coli, обеспечивающих высокий уровень экспрессии целевых продуктов - белковых антигенов трех различных подтипов ВКЭ, которые могут быть получены, иммобилизованы и очищены с использованием декстрансодержащего сорбента.
Таким образом, еще одним техническим результатом является создание новых генов, кодирующих белки рецептор-связывающего домена III белка Ε оболочки ВКЭ, позволяющих оптимизировать процесс воспроизведения указанных белков в клетках Е. coli.
В основе изобретения лежит подход конструирования химерных белков из нескольких модулей (белковых доменов) за счет соединения в одной трансляционной рамке двух и более генов - гена смыслового белка (антигена) и гена, кодирующего белок-носитель, который аффинно взаимодействует с определенным сорбентом. В результате, при индукции экспрессии генов в бактериальной системе синтезируется химерный рекомбинантный белок.
Фрагменты гликопротеина Ε оболочки ВКЭ, используемые для включения в состав набора диагностических маркеров и иммуногенной композиции для профилактики КЭ, были выбраны на основе данных литературы и результатов биоинформатического анализа строения вирусов КЭ, обнаруженных на территории Российской Федерации:
1. Белок Ε оболочки ВКЭ является наиболее значимым компонентом внешней поверхности вириона, поскольку играет ключевую роль в процессах сборки вирусной частицы, в связывании вируса с клеточной поверхностью и в последующем слиянии вирусной и клеточной мембран, определяя тем самым тропизм вируса. На поверхности вируса белок Ε представляет собой отдельную объемную единицу, состоящую из комплекса двух молекул вирусного белка Е, при этом каждая молекула белка Ε в димере представляет собой продолговатую структуру, состоящую из трех доменов (Ι-ΙΙΙ) и собранную определенным образом из единой полипептидной цепи (Фиг. 1).
2. Домен III белка Ε представляет собой достаточно автономную структуру и может быть отщеплен от остальной части белковой молекулы трипсиновой обработкой нативного вириона или синтезирован отдельно методами генной инженерии, при этом технически возможно воссоздать необходимую конформацию данного антигенного домена с присущей ему иммунохимической активностью, нейтрализация которой происходит впоследствии специфическими антителами, что дает основание использовать структурный домен III белка Ε оболочки ВКЭ в качестве минимально необходимого и достаточного компонента для создания субъединичной вакцины [25].
3. В соответствии с молекулярно-генетическими маркерами выделяют 3 основных генетических типа ВКЭ - Сибирский, Европейский и Дальневосточный подтипы вируса, при этом в последнее время по результатам таксономических исследований различных штаммов ВКЭ предполагаются к существованию 5 генетических типов, в том числе штаммы 178-79 и 886-84 (Фиг. 2). При этом из представленного на рисунке филогенетического дерева, построенного на основе аминокислотных последовательностей домена III белка Ε оболочки ВКЭ методом Neighbor-Joining, следует, что по последовательности домена III белка Ε оболочки ВКЭ можно выделить только три основных подтипа вируса, тогда как штаммы, относящиеся по аминокислотной последовательности домена III к 4 и 5 подтипу, сходны со штаммами Дальневосточного подтипа. Таким образом, для максимального покрытия изменчивости ВКЭ необходимо и достаточно использовать по одной последовательности каждого генетического типа, а именно последовательности домена III белка Ε оболочки ВКЭ классических Сибирского, Европейского и Дальневосточного штаммов вируса.
Фрагменты генов гликопротеина Ε оболочки ВКЭ, кодирующие рецептор-связывающие домены III и определяющие принадлежность к Сибирскому (D3S), Европейскому (D3E) и Дальневосточному (D3D) подтипам вируса, были получены синтетическим способом. Для обеспечения высокого уровня экспрессии генов в гетерологичной бактериальной системе проводили оптимизацию кодонов под Escherichia coli. Спланированные синтетические гены D3S, D3E и D3D отличались от генов нативного гликопротеина Ε по нуклеотидному составу, но сохраняли кодируемые аминокислотные последовательности (последовательности №1-3 соответственно; здесь и далее жирным шрифтом указаны характеристические аминокислотные остатки, которые позволяют отнести последовательность к Сибирскому (A-T-T-I, белок D3S), Европейскому (T-A-T-I, белок D3E) или Дальневосточному (T-I-A-M, белок D3D) подтипу вируса). Идентичность нуклеотидных последовательностей генов белков D3S, D3E и D3D была подтверждена секвенированием.
Далее были получены рекомбинантные белки, состоящие из двух компонентов: аффинного декстрансвязывающего домена DBD2 декстрансукразы Leuconostoc citreum КМ20 и последовательности рецептор-связывающего домена III белка Ε оболочки ВКЭ, определяющей принадлежность к Сибирскому (D3S), Европейскому (D3E) или Дальневосточному (D3D) подтипу вируса. Использование предварительно спланированных последовательностей генов белка Ε оболочки ВКЭ позволило получить эффективные штаммы-продуценты, синтезирующие 20-30% рекомбинантных антигенов DBD2-D3S, DBD2-D3E и DBD2-D3D от тотального белка клетки.
В синтезируемых химерных белках первый белковый домен сформирован из последовательности декстрансвязывающего домена декстрансукразы из Leuconostoc citreum КМ20, которая определяет способность продукта взаимодействовать с декстрансодержащим сорбентом (аминокислотные остатки 1-140). Далее следует соединяющая (спейсерная) аминокислотная последовательность из нескольких чередующихся остатков глицина и серина (Gly-Ser спейсер, остатки 141-150), а также второй белковый домен, представляющий собой последовательности рецептор-связывающего домена III белка Ε оболочки ВКЭ (остатки 151-255), различающиеся по аминокислотному составу в позициях 166, 170, 184 и 211, характеристические остатки в которых позволяют отнести последовательность к одному из трех генетических типов: Α-Τ-Τ-Ι - к наиболее распространенному Сибирскому варианту (рекомбинантный белок DBD2-D3S с молекулярной массой 28 кДа, последовательность №4), Τ-Α-Τ-Ι - к Европейскому варианту (белок DBD2-D3E, последовательность №5) и Τ-Ι-Α-Μ - к Дальневосточному подтипу вируса (белок DBD2-D3D, последовательность №6). Белковые продукты нарабатываются в непатогенных лабораторных штаммах Е. coli.
Наличие в составе рекомбинантных белков DBD2 позволяет проводить их иммобилизацию на декстрансодержащем носителе, в результате которой происходит одновременная очистка, концентрирование и стабилизация белкового продукта, а также обеспечивается защита от протеаз бактерий-продуцентов. Иммобилизация на декстрановом сорбенте происходит за счет присутствия в рекомбинантном белке декстрансвязывающего домена декстрансукразы из Leuconostoc citreum КМ20, который обладает высоким сродством к декстранам и обеспечивает связывание химерного белка с носителем, при этом исходные антигенные свойства функционально активного белкового домена не нарушаются. Очистка рекомбинантных антигенов включает иммобилизацию белков DBD2-D3S, DBD2-D3E и DBD2-D3D, входящих в состав клеточных экстрактов штаммов Е. coli M15 [pREP4, pDBD2-D3S], Ε. coli Μ15 [pREP4, pDBD2-D3E] и Ε. coli M15 [pREP4, pDBD2-D3D] соответственно, на декстрановом сорбенте в процессе инкубации за счет аффинного взаимодействия с последующей отмывкой от несвязавшихся бактериальных белков, при этом происходит концентрирование, очистка и выделение целевого продукта.
Помимо использования декстрансодержащего носителя для одновременного выделения и очистки антигенного препарата с сохранением нативной структуры, в составе иммуногенной композиции декстран может выполнять роль адъюванта, обеспечивающего укрупнение антигенов (патент RU 2520737), а также их депонирование, обуславливая эффективный эндоцитоз компонентов иммуногенной композиции антиген-презентирующими клетками и способствуя, таким образом, активации гуморального иммунитета и иммунологической памяти [26-27]. При этом к преимуществам использования декстранов для иммобилизации антигенов и последующего включения в состав иммуногенной композиции для профилактики КЭ можно отнести биосовместимость и биодеградируемость данной группы полисахаридов.
Иммобилизированные на декстране антигены представляют собой суспензию сорбента с адсорбированными на нем белками. В свою очередь, неиммобилизованные на декстране антигены в свободном состоянии представляют собой растворы с определенной ионной силой, свободные от примесей липополисахаридов и ДНК штамма-продуцента.
Таким образом, еще одним техническим результатом заявляемой группы изобретений является получение оптимальных для гетерологичной экспрессии синтетических фрагментов домена III белка Ε оболочки ВКЭ; создание штаммов Е. coli, обеспечивающих высокий уровень продукции рекомбинантных белковых антигенов DBD2-D3S, DBD2-D3E и DBD2-D3D, определяющих принадлежность к Сибирскому, Европейскому и Дальневосточному генетическим типам вируса соответственно; использовать простую и эффективную схему очистки рекомбинантных белков; создание наборов диагностических маркеров и иммуногенных композиций на основе рекомбинантных белков, в том числе иммобилизованных на декстране.
Указанный результат достигается посредством синтеза рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D в клетках рекомбинантных штаммов Е. coli M15 [pREP4, pDBD2-D3S], Ε. coli Μ15 [pREP4, pDBD2-D3E] и Ε. coli M15 [pREP4, pDBD2-D3D], несущих рекомбинантные плазмиды pDBD2-D3S, pDBD2-D3E и pDBD2-D3D соответственно (Фиг. 3).
Включенные в заявку рекомбинантные плазмиды pDBD2-D3S (последовательность №7), а также pDBD2-D3E и pDBD2-D3D (последовательности не приведены, но могут быть получены посредством совмещения нуклеотидных последовательностей №2 и №7 в случае плазмиды pDBD2-D3E или №3 и №7 для плазмиды pDBD2-D3D), обеспечивающие экспрессию бифункциональных рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D соответственно, размером 3786 п.н., содержат следующие существенные для их функционирования структурные элементы:
а) искусственный бактериальный оперон одного из рекомбинантных белков DBD2-D3S, DBD2-D3E или DBD2-D3D, включающий:
- промоторную область раннего промотора бактериофага Т5 (7-87 п. н.), обеспечивающую эффективную транскрипцию мРНК;
- ген рекомбинантного белка (117-881 п.н.), состоящего из декстрансвязывающего домена декстрансукразы Leuconostoc citreum КМ20, Gly-Ser спейсера и последовательностей рецептор-связывающего домена III белка Ε оболочки ВКЭ, определяющих принадлежность к Сибирскому, Европейскому и Дальневосточному подтипам вируса и различающихся по аминокислотному составу в позициях 166, 170, 184 и 211 (последовательности №4-6);
- нетранслируемую область терминации транскрипции (1021-1115 п.н.), обеспечивающую эффективное окончание транскрипции рекомбинантной плазмиды;
б) бактериальный оперон бета-лактамазы (2721-3571 п.н.), обеспечивающий устойчивость к ампицилину;
в) бактериальный участок инициации репликации типа ColE1 (1954-1964 п.н.), обеспечивающий репликацию плазмиды в штамме Е. сoli М15.
Таким образом, сконструированы три рекомбинантные плазмиды pDBD2-D3S, pDBD2-D3E и pDBD2-D3D (3786 п.н.), кодирующие бифункциональные рекомбинантные белки DBD2-D3S, DBD2-D3E и DBD2-D3D соответственно, способные самопроизвольно связываться с декстрансодержащим сорбентом. В свою очередь, бактериальные продуценты рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D получают трансформацией клеток Е. coli штамма M15 [pREP4] плазмидами pDBD2-D3S, pDBD2-D3E и pDBD2-D3D соответственно. Индукцию экспрессии генов проводят химическим индуктором изопропил-β-D-тио-галактопиранозидом (ИПТГ). Уровень экспрессии рекомбинантных белков составляет 20-30% от тотального белка клетки (Фиг. 4).
Рекомбинантные штаммы Е. coli M15 [pREP4, pDBD2-D3S], Ε. coli M15 [pREP4, pDBD2-D3E] и Ε. coli M15 [pREP4, pDBD2-D3D], несущие плазмиды pDBD2-D3S, pDBD2-D3E и pDBD2-D3D соответственно, характеризуются следующими признаками:
Морфологические признаки. Клетки прямые, палочковидные, неподвижные, грамотрицательные.
Культуральные особенности. Клетки хорошо растут на плотных и жидких питательных средах (LB-бульон, LB-агар, ΜΠΑ, МПБ), клетки растут при температуре от +4°С до +42°С при оптимуме рН 6,8-7,5.
Биохимические свойства. Штаммы Е. coli M15 [pREP4, pDBD2-D3S], Ε. coli M15 [pREP4, pDBD2-D3E] и Ε. coli M15 [pREP4, pDBD2-D3D] разлагают глюкозу, маннит с образованием кислоты, не разлагают сахарозу, арабинозу, галактозу, сбраживают мальтозу, ксилозу сорбит, рамнозу, чувствительны к налидиксовой кислоте (25 мг/мл), стрептомицину (20 мг/мл), рифампицилину (25 мг/мл).
Технический результат по созданию набора диагностических маркеров, содержащего рекомбинантные белки DBD2-D3S, DBD2-D3E и DBD2-D3D, предназначенные для использования в качестве антигенов при выявлении антител к ВКЭ в сыворотке крови и ликворе человека методом ИФА, достигается за счет иммобилизации в лунках 96-луночного планшета или стрипах рекомбинантных белков, очищенных посредством аффинного взаимодействия декстрансвязывающего домена, входящего в состав слитых белковых антигенов, с декстрансодержащим сорбентом. Таким образом, наличие в структуре рекомбинантных белков домена DBD2 определяет способность слитого белка связываться с декстрансодержащим сорбентом и позволяет проводить концентрирование и очистку белкового продукта на полисахаридном носителе. Правильность антигенной структуры полученных рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D подтверждена результатами анализа данных белковых антигенов с поликлональными антителами человека из сывороток крови больных КЭ из различных областей ареала вируса методами ИФА (Фиг. 5) и иммуноблоттинга (Фиг. 6).
Технический результат по созданию иммуногенной композиции, содержащей иммобилизованные на декстране рекомбинантные белки DBD2-D3S, DBD2-D3E и DBD2-D3D, специфически активирующей развитие клеточного иммунного ответа, а также обуславливающей формирование гуморального иммунитета посредством эффективного эндоцитоза декстрана в комплексе с антигеном и декстрансвязывающим доменом с последующим экспонированием антигена на поверхности антиген-презентирующих клеток в контексте молекул главного комплекса гистосовместимости МНС II с целью дальнейшей индукции адаптивного иммунного ответа, также достигается за счет иммобилизации полученных белковых антигенов на декстране. При этом следует отметить, что клетки Е. coli не содержат белков, связывающихся с декстраном, в связи с чем только рекомбинантные белки DBD2-D3S, DBD2-D3E и DBD2-D3D, синтезируемые штаммами Е. coli М15 [pREP4, pDBD2-D3S], Ε. coli Μ15 [pREP4, pDBD2-D3E] и Ε. coli M15 [pREP4, pDBD2-D3D] соответственно, являются белками бактериального продуцента, способными связываться с декстраном, что и обеспечивает возможность получения высокоочищенных препаратов белковых антигенов, иммобилизованных на данном полисахаридном сорбенте.
По биологической активности рекомбинантных белков представляемый технический результат достигается за счет проверки антигенных (Фиг. 5, Фиг. 6) и иммуногенных свойств полученного препарата. Иммуногенность рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D, иммобилизованных на декстране, была подтверждена посредством (а) определения титра специфических антител к ВКЭ с использованием нативного вируса методом ИФА в сыворотках лабораторных животных, полученных после вакцинации рекомбинантным препаратом GamTBEVac на основе антигенов DBD2-D3S, DBD2-D3E, DBD2-D3D и/или инактивированной вакциной сравнения «Клещ-Э-Вак» (ФГУП «ПИПВЭ им. М.П. Чумакова РАМН», Россия) по стандартной схеме или схеме «prime-boost», и (б) оценки протективного действия кандидатного вакцинного препарата GamTBEVac в реакции нейтрализации со штаммами ВКЭ Дальневосточного, Сибирского и Европейского генетических типов вируса (Фиг. 7).
Генно-инженерные и микробиологические манипуляции, амплификацию и секвенирование ДНК проводили по стандартным методикам [28-30].
Штаммы Е. coli M15 [pREP4, pDBD2-D3S], Ε. coli M15 [pREP4, pDBD2-D3E] и Ε. coli M15 [pREP4, pDBD2-D3D] депонированы в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ - Оболенск».
Краткое описание графических изображений
Фиг. 1. Общий вид димера эктодомена белка Ε оболочки ВКЭ [20].
Фиг. 2. Филогенетическое дерево, построенное на основе аминокислотных последовательностей домена III белка Ε оболочки ВКЭ методом Neighbor-Joining. Генетические типы отмечены овалами.
Фиг. 3. Карты экспрессионных плазмид (a) pDBD2-D3S, (б) pDBD2-D3E и (в) pDBD2-D3D, содержащих гены D3S, D3E и D3D соответственно.
Фиг. 4. Электрофореграмма анализа экспрессии белков DBD2-D3S, DBD2-D3E и DBD2-D3D в клетках Е. coli М15 [pRep4]: трек 1 соответствует штамму Е. coli М15 [pRep4] до индукции; 2-Е. coli M15 [pRep4] после индукции; 3-Е. coli M15 [pRep4, pDBD2-D3S] до индукции; 4,5 - Ε. coli M15 [pRep4, pDBD2-D3S] после индукции, клон №1 и №2 - 28 кДа; 6 - Ε. coli M15 [pRep4, pDBD2-D3E] до индукции; 7,8 - Ε. coli Μ15 [pRep4, pDBD2-D3E] после индукции, клон №1и №2 - 28,1 кДа; 9 - Е. coli M15 [pRep4, pDBD2-D3D] до индукции; 10 - Ε. coli M15 [pRep4, pDBD2-D3D] после индукции, клон №1-28,1 кДа; 11 - маркер молекулярного веса («Fermentas», Литва).
Фиг. 5. Результаты анализа антигенных свойств рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D в ИФА с охарактеризованными сыворотками пациентов, больных КЭ, из различных областей ареала вируса, (а) Результаты определения оптической плотности и титра антител в сыворотках больных КЭ с набором «ВектоВКЭ-IgG»: №1 и №2 - пробы поставлены в двух параллелях; K - соответствует отрицательному контролю ИФА; К+ - положительный контроль ИФА; статистически значимые результаты выделены курсивом с подчеркиванием, (б) Результаты определения оптической плотности в ИФА рекомбинантных белковых антигенов DBD2-D3S, DBD2-D3E и DBD2-D3D с сыворотками больных из различных областей ареала КЭ, разведенными 1:500.
Фиг. 6. Результаты анализа антигенных свойств рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D методом иммуноблоттинга с охарактеризованными сыворотками пациентов, больных КЭ, из различных областей ареала вируса, (а) Иммуноблоттинг рекомбинантных белков с сыворотками больных КЭ: треки 1, 5, 9 соответствуют очищенному белку DBD2-D3S; 2, 6, 10 - очищенному белку DBD2-D3D; 3, 7, 11 - очищенному белку DBD2-D3E; 4, 8, 12 - очищенному белку DBD2 (отрицательный контроль). Треки 1-4 проявлены сывороткой М2549; 5-8 - сывороткой 375; 9-12 - сывороткой 96. (б) Результаты «вестерн-блот» анализа рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D с сыворотками больных из различных областей ареала КЭ: «+» означает, что белок взаимодействовал с исследуемой сывороткой; «-» - белок не взаимодействовал с исследуемой сывороткой.
Фиг. 7. Результаты ИФА и реакции нейтрализации сывороток мышей, вакцинированных рекомбинантным препаратом GamTBEVac по стандартной схеме или в сочетании с референс-вакциной «Клещ-Э-Вак» по схеме «prime-boost».
Осуществление изобретения
Задачей настоящего изобретения является получение трех гибридных белков Ε оболочки ВКЭ, определяющих принадлежность к Сибирскому (DBD2-D3S), Европейскому (DBD2-D3E) и Дальневосточному (DBD2-D3D) подтипам вируса с целью дальнейшего использования в качестве антигенов, иммобилизованных в лунках 96-луночного планшета или стрипах, в составе набора диагностических маркеров для выявления антител к ВКЭ в сыворотке крови и ликворе человека методом ИФА, а также в составе иммуногенной композиции, содержащей иммобилизованные на декстране рекомбинантные белки и направленной на специфическую активацию иммунитета и формирование иммунологической памяти в отношении вируса.
Методология исследования
1) получение экспрессионных плазмид pDBD2-D3S, pDBD2-D3E и pDBD2-D3D;
2) получение штаммов-продуцентов рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D;
3) получение рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D в свободном состоянии и после иммобилизации на декстране;
4) оценка антигенной структуры рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D с поликлональными антителами человека из сывороток крови больных КЭ;
5) изучение иммуногенности рекомбинантных антигенов.
1) Получение экспрессионных плазмид pDBD2-D3S, pDBD2-D3E и pDBD2-D3D
а) получение фрагментов гена, кодирующего домен III белка Ε оболочки ВКЭ Синтетические фрагменты гена белка Ε оболочки ВКЭ планировали на основе нативной последовательности белка таким образом, что аминокислотный состав синтезируемого рекомбинантного белка не изменялся. Для создания векторных генетических конструкций в качестве исходных использовали последовательности генов, кодирующих рецептор-связывающий домен III белка Ε оболочки ВКЭ трех генетических типов: подтипа Сибирский (D3S; штамм Заусаев, GenBank ID: АА043537), подтипа Европейский (D3E; штамм Абсеттаров, GenBank ID: ААС62088.1) и подтипа Дальневосточный (D3D; штамм Софьин, GenBank ID: АЕР25267).
Для целей клонирования и последующего создания штаммов-продуцентов на основе клеток Е. coli, последовательности фланкировали дополнительными аминокислотными остатками (последовательности №1-3, аминокислотные остатки 1-3 и 104, 105). Нуклеотидные последовательности, кодирующие рецептор-связывающий домен III белка Ε оболочки ВКЭ подтипов Сибирский (D3S), Европейский (D3E) и Дальневосточный (D3D) с дополнительными аминокислотными остатками на Ν- и С-концах, планировали с использованием оптимальных кодонов для экспрессии в Е. coli с учетом отсутствия выраженной вторичной структуры мРНК. Для улучшения вторичной структуры мРНК генов D3S, D3E и D3D проводили синонимичные замены нуклеотидов в некоторых кодонах. Фрагменты генов белка Ε оболочки ВКЭ были синтезированы твердофазным амидофосфитным методом (ЗАО «Евроген», Россия) на синтезаторе Applied Biosystems ABI 3900 с последующим клонированием синтезированных нуклеотидных последовательностей в плазмиду pQE6 под промотор фага Т5.
Для клонирования генов D3S, D3E и D3D плазмидный вектор pQE6 и синтезированные в фирме Евроген плазмиды pAT-D3S, pAT-D3E и pAT-D3D гидролизовали эндонуклеазами рестрикции NcoI и Kpn2I при +37°С в буфере, содержащем 33 мМ Трис-ацетата (рН 7,9 при +37°С), 10 мМ ацетата магния, 66 мМ ацетата калия и 0,1 мг/мл BSA в течение 1 ч. В 1,2% агарозном геле проводили разделение продуктов рестрикции. Выделенный из агарозного геля фрагмент вектора pQE6 (размером 3016 п.н.) объединяли с соответствующим фрагментом плазмиды pAT-D3S (320 п.н.), pAT-D3E (320 п.н.) или pAT-D3D (320 п.н.). Далее фрагменты лигировали при +25°С в буфере, содержащем 40 мМ Трис-HCl, 10 мМ MgCl2, 10 мМ DTT, 0,5 мМ АТФ (рН 7,8 при +37°С) с помощью ДНК лигазы бактериофага Т4 в течение 1 ч. Продукты реакции переосаждали при -20°С 96% этиловым спиртом с добавлением ацетата аммония в течение 1,5 ч. После переосаждения смесь растворяли в деионизированной воде. Методом электропорации полученной лигазной смесью трансформировали компетентные клетки Е. coli штамма M15 [pREP4] (NalS, StrS, rifS, lac-, ara-, gal-, mtl-, F-, recA+, uvr+). После трансформации клоны отбирали на агаризованной среде LB, содержащей антибиотики ампициллин (50 мг/мл) и канамицин (25 мг/мл). Плазмидную ДНК из колоний выделяли методом щелочного лизиса; анализировали методом рестрикционного картирования эндонуклеазами рестрикции BgII, BglII, BspMII и NcoI. Отбирали клоны плазмидной ДНК pD3S (3336 п. н.), pD3E (3336 п.н.) и pD3D (3336 п.н.), содержащие в своем составе последовательности генов белка D3S, D3E или D3D соответственно. Первичную структуру полученных генно-инженерных конструкций подтверждали секвенированием.
б) получение экспрессионных плазмид, содержащих последовательности декстрансвязывающего домена, Gly-Ser спейсера и рецептор-связывающего домена III белка Ε оболочки ВКЭ
Для получения экспрессионных генетических конструкций, кодирующих слитые с декстрансвязывающим доменом белковые антигены домена III белка Ε оболочки ВКЭ с тремя вариантами последовательностей, определяющих принадлежность антигенной детерминанты к определенному подтипу ВКЭ, последовательности генов D3S, D3E и D3D были переклонированы в плазмиду pL125, содержащую ген DBD2 из Leuconostoc citreum КМ20 и Gly-Ser спейсер.
Для клонирования генов белков DBD2-D3S, DBD2-D3E и DBD2-D3D плазмиду pL125, кодирующую последовательность декстрансвязывающего домена и Gly-Ser спейсера, и плазмиды pD3S, pD3E и pD3D, кодирующие последовательности домена III гликопротеина Ε штамма ВКЭ трех основных генетических типов, гидролизовали эндонуклеазами рестрикции BglII-BglI и BamHI-BglI, соответственно, при +37°С в буфере, содержащем 33 мМ Трис-ацетата (рН 7,9 при +37°С), 10 мМ ацетата магния, 66 мМ ацетата калия и 0,1 мг/мл BSA в течение 1 ч. В 1,2% агарозном геле проводили разделение продуктов рестрикции. Выделенный из агарозного геля фрагмент вектора pL125 (размером 1442 п. н.) объединяли с фрагментом одной из трех плазмид pD3S, pD3E или pD3D (2344 п.н.). Далее фрагменты лигировали при +25°С в буфере, содержащем 40 мМ Трис-HCl, 10 мМ MgCl2, 10 мМ DTT, 0,5 мМ АТФ (рН 7,8 при +37°С) с помощью ДНК лигазы бактериофага Т4 в течение 1 ч. Продукты реакции переосаждали при -20°С 96% этиловым спиртом с добавлением ацетата аммония в течение 1,5 ч. После переосаждения смесь растворяли в деионизированной воде.
Методом электропорации полученной лигазной смесью трансформировали компетентные клетки Е. coli штамма M15 [pREP4] (NalS, StrS, rifS, lac-, ara-, gal-, mtl", F-, recA+, uvr+). После трансформации клоны отбирали на агаризованной среде LB, содержащей антибиотики ампициллин (150 мг/мл) и канамицин (25 мг/мл). Плазмидную ДНК из колоний выделяли методом щелочного лизиса и далее анализировали методом рестрикционного картирования эндонуклеазами рестрикции BglI, BglII, BspMII и NcoI. Отбирали клоны плазмидных ДНК pDBD2-D3S, pDBD2-D3E и pDBD2-D3D (3786 п.н.), содержащих в своем составе нуклеотидные последовательности декстрансвязывающего домена, Gly-Ser спейсера и рецептор-связывающего домена III белка Ε оболочки ВКЭ одного из трех генетических типов вируса. Первичную структуру полученных конструкций подтверждали секвенированием.
2) Получение штаммов-продуцентов рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D
Для получения штаммов-продуцентов рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D клетки Е. coli Ml 5 [Rep4] трансформировали рекомбинантными плазмидами pDBD2-D3S, pDBD2-D3E и pDBD2-D3D методом электропорации и получали штаммы-продуценты Е. coli Ml5 [Rep4, pDBD2-D3S], Ε. coli M15 [Rep4, pDBD2-D3E] и Ε. coli M15 [Rep4, pDBD2-D3D].
а) выращивание клеток Ε. coli
Клетки Ε. coli выращивали в жидкой среде LB или на твердой среде, содержащей среду LB, 2% агара и 2% глюкозы. Для селекции в среды добавляли антибиотики: ампицилин и канамицин в концентрациях 150 мкг/мл и 25 мкг/мл соответственно. Количество бактерий определяли с помощью оптического стандарта мутности. Температура культивирования составляла +37°С.
б) приготовление компетентных клеток
Клетки Е. coli штамм Ml5 [Rep4] пересевали на твердую среду LB с антибиотиком, культивировали ночь при +37°С. На следующий день ночную культуру суспендировали в 3,5 мл среды LB, измеряли оптическую плотность при длине волны λ=550 нм (D550) и засевали в колбу со средой для электропорации (модифицированная среда LB с пониженным содержанием солей) из расчета 1,5 оптических единицы (о.е.) - 1/100 от объема. В культуру добавляли соответствующий антибиотик и растили на качалке при +37°С и 200 об/мин до D550=0,3-0,5 о.е.
Когда значения оптической плотности культуры достигали D550=0,3-0,5 о.е., на холоду готовили компетентные клетки. Охлажденную культуру переносили в пробирки объемом 50 мл, центрифугировали при 3700 об/мин в течение 15 минут и отмывали последовательно 1 объемом (от исходного) бидистиллированной воды, 1/2 объема бидистиллированной воды и 1 мл 10% глицерина. После последнего центрифугирования осадок суспендировали в глицерине из расчета 80 мкл на одну пробу (50 мл культуры - 10 проб). Для длительного использования аликвоты клеток хранили при -70°С.
в) электропорация
В размороженную во льду аликвоту компетентных клеток E. coli штамм M15 [Rep4] добавляли аликвоту одной из трех рекомбинантных плазмид pDBD2-D3S, pDBD2-D3E или pDBD2-D3D, осторожно перемешивали, оставляли во льду на 1-2 мин. Смесь переносили в охлажденную сухую кювету для электропорации, доводили до контактов прибора. После приложения к суспензии бактериальных клеток импульсов электрического поля, в кювету добавляли 1 мл среды LB (без антибиотиков), энергично перемешивали, переносили в пробирку типа Эппендорф объемом 1,7 мл и подращивали на качалке при +37°С и 60 об/мин в течение 1 часа. Культуру высевали на селективную среду.
г) выращивание штаммов-продуцентов
Трансформированные клетки выращивали в среде LB, содержащей антибиотики ампициллин и канамицин, при +37°С до оптической плотности, соответствующей 1 ед. поглощения при длине волны 550 нм. В культуру добавляли 0,1 M раствора ИПТГ и выращивали до стабильных значений оптической плотности. Для контроля продукции рекомбинантных белков в штаммах Е. coli Ml5 [Rep4, pDBD2-D3S], Ε. coli M15 [Rep4, pDBD2-D3E] и Ε. coli M15 [Rep4, pDBD2-D3D] применяли метод электрофореза по Лэммли в присутствии додецилсульфата натрия (ДСН). Разделение белков проводили в 12% полиакриламидном геле (ПААГ) в стандартной системе буферов. Гели окрашивали 0,15% раствором Кумасси G250 в 25% изопропаноле и 10% уксусной кислоте и отмывали в 10% уксусной кислоте (согласно патенту RU 2520737).
При сравнении спектра белков в штамме Е. coli Ml5 [pREP4] и штаммах Ε. coli М15 [Rep4, pDBD2-D3S], Ε. coli M15 [Rep4, pDBD2-D3E], E. coli M15 [Rep4, pDBD2-D3D] обнаруживали появление дополнительной белковой полосы, молекулярная масса которой составляла 28,0-28,1 кДа, что соответствовало расчетной массе для белков DBD2-D3S, DBD2-D3E и DBD2-D3D. Уровень синтеза белков в Е. coli определяли, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой соответствующего белка-стандарта Unstained Protein Molecular Weight Marker («Fermentas», Литва).
Для проверки растворимости синтезируемых белков биомассу выращенных штаммов Е. coli M15 [Rep4, pDBD2-D3S], Ε. coli M15 [Rep4, pDBD2-D3E] и Ε. coli M15 [Rep4, pDBD2-D3D] подвергали разрушению в 1% TES буфере в соотношении биомасса-буфер 1:2 и гомогенизировали до однородной массы. После центрифугирования пробы разделяли на 2 фракции: растворимых клеточных белков (надосадочная жидкость) и нерастворимых (осадок). Обе фракции подвергали разрушению в лизирующем буфере, содержащем Triton Х-100 и лизоцим в соотношении 1:1, гомогенизировали до однородной массы и прогревали при +95°С. Результаты контролировали с помощью электрофореза по Лэммли. Было отмечено, что рекомбинантные белки DBD2-D3S, DBD2-D3E и DBD2-D3D синтезируются в клетках Е. coli как в растворимой фракции, так и в виде телец-включений.
3) получение рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D в свободном состоянии и после иммобилизации на декстране
Для получения рекомбинантных белков ночные культуры штаммов Е. coli M15 [Rep4, pDBD2-D3S], Ε. coli M15 [Rep4, pDBD2-D3E], E.coli M15 [Rep4, pDBD2-D3D] выращивали в 5 мл среды LB с 25 мкг/мл канамицина и 150 мкг/мл ампициллина. В качестве контроля выращивали штамм Е. coli M15 [pREP4] без рекомбинантных плазмид.
На следующий день 100 мкл каждой ночной культуры пересевали в стеклянную пробирку с 3,5 мл среды LB с соответствующими антибиотиками и выращивали культуры на качалке при +37°С и 200 об/мин. При оптической плотности 0,9-1,2 (550 нм) добавляли индуктор - 3,5 мкл 0,1 M ИПТГ. Перед этим отбирали 0,5 мл культуры (проба «до индукции»). Индуцированную культуру выращивали в течение 3 часов при 200 об/мин. Каждые полчаса измеряли оптическую плотность. После окончания индукции отбирали по 0,5 мл биомассы (пробы «после индукции»).
а) электрофорез белков в полиакриламидном геле
Пробы «до индукции» и «после индукции» центрифугировали при 13000 об./мин в течение 5 мин и удаляли надосадочную жидкость. В соответствии с измеренной оптической плотностью добавляли в пробирки с замороженными клетками (пробы «до индукции» и «после индукции») однократный лизирующий буфер, необходимый для нанесения на акриламидный гель. При оптической плотности, соответствующей 1 ед. поглощения при длине волны 550 нм, на 0,5 мл биомассы добавляли 50 мкл лизирующего буфера. Клетки ресуспендировали в лизирующем буфере. Перед нанесением на гель пробы прогревали в течение 10 мин при +95°С, центрифугировали и наносили на гель по 3 мкл. Электрофорез белков проводили в 12% полиакриламидном геле в течение 1-2 часов по методу Лэммли. Образцы наносили в лизирующем буфере, содержащем 50 мМ Трис-HCl (рН 6,8), 2% ДСН, 2% 2-меркаптоэтанол, 10% глицерин и 0,01% бромфеноловый синий. После электрофореза гели в течение 30 мин окрашивали раствором, содержащим 25% изопропанола, 10% ледяной уксусной кислоты и 500 мг/мл Кумасси R-250, далее отмывали раствором, содержащим 10% ледяную уксусную кислоту и 10% изопропанол.
б) получение рекомбинантных белков в свободном состоянии После окончания индукции клетки осаждали центрифугированием при 5500 об./мин в течение 15 мин. Осадок ресуспендировали в лизирующем буфере, содержащем 50 мМ Трис-HCl (рН 8,0), 0,25 мМ NaCl, 5 мМ MgCl2, 0,15 мМ PMSF, 0,1% Тритон-X100, 0,5 мг/мл лизоцима и 20 мг/мл ДНКазы, из расчета 1 г биомассы на 4 мл буфера. Дополнительно суспензию обрабатывали ультразвуком 3 раза по 20 с. После центрифугирования при 16000 об/мин в течение 30 мин фракция нерастворимых клеточных белков оставалась в осадке, растворимых - в надосадочной жидкости.
Осадок (нерастворимую фракцию) суспендировали в лизирующем буфере (50 мМ Трис-HCl (рН 8,0), 10 мМ ЭДТА, 0,002 объема β-меркаптанола) и добавляли равный (по массе) объем мочевины. После перемешивания выдерживали на водяной бане при +37°С до полного растворения мочевины. Центрифугировали при 12000 об/мин в течение 30 мин и отбирали надосадочную жидкость. Для очистки рекомбинантных белков надосадочную жидкость переносили на колонку с Sephadex G200 (ООО «ХИМБИМЕД», Россия). Элюцию белков с декстрансодержащего сорбента проводили градиентным раствором (8-2 М) мочевины и 50 мМ Трис-HCl (рН 8,0). Для удаления мочевины образцы диализовали против PBS буфера при +25°С в течение ночи (согласно патенту RU 2520737).
в) получение рекомбинантных белков, иммобилизованных на декстране
Растворимую фракцию белков использовали для иммобилизации на декстране. Комплексные препараты рекомбинантного белка и декстрана получали на основе разрешенного к применению в фармацевтической промышленности декстрана с молекулярной массой 500 кДа - Dextran 500 («Pharmacosmos», Англия). Для этого после элюции рекомбинантных белков с декстрансодержащего сорбента Sephadex G-200 и измерения концентрации к фракции растворенных белков добавляли 1/3 объема 30% суспензии декстрана и инкубировали в течение 1 часа при +25°С с постоянным перемешиванием. В иммобилизованном на сорбенте состоянии белки представляют собой суспензию. Концентрацию белков в свободной и иммобилизованной форме определяли по Бредфорду при длине волны 595 нм. Образцы подвергали лиофилизации. Таким образом, были получены белковые антигены DBD2-D3S, DBD2-D3E, DBD2-D3D со степенью чистоты не менее 95% в свободном виде, предназначенные для дифференциальной диагностики и оценки напряженности иммунитета в составе набора диагностических маркеров, а также в иммобилизованном виде на декстране (DBD2-антиген-декстран) с целью последующего использования для профилактики КЭ в составе иммунологической композиции.
4) оценка антигенной структуры рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D с поликлональными антителами человека из сывороток крови больных КЭ
Исследование антигенной структуры рекомбинантных белков DBD2-D3S, DBD2-D3E с поликлональными антителами человека из сывороток крови пациентов, больных КЭ, из различных областей ареала вируса проводили методами непрямого ИФА и иммуноблоттинга.
а) оценка антигенной структуры методом ИФА
ИФА проводили согласно стандартной методике, предлагаемой в руководстве по использованию меченых пероксидазой хрена антител против первичных антител: первый слой - вирусный или рекомбинантный антиген, представляющий собой домен III белка Ε оболочки ВКЭ с тремя вариантами последовательностей, определяющих принадлежность к основным подтипам ВКЭ, слитый с декстрансвязывающим доменом; второй слой - сыворотки крови пациентов, содержащие антитела против КЭ, третий слой - антитела против первичных антител человека, меченые пероксидазой хрена. В качестве вирусного антигена использовалась культуральная жидкость клеток СПЭВ, зараженных ВКЭ, после осветления центрифугированием и концентрирования с помощью ультрацентрифугирования. В качестве отрицательного контроля использовалась культуральная жидкость незараженных клеток, которая была обработана таким же образом, а также сыворотки здоровых доноров.
Сыворотки крови, полученные от больных людей из различных областей ареала КЭ, предварительно анализировали методом ИФА с помощью набора фирмы «Вектор-Бест» для выявления антител к ВКЭ «ВектоВКЭ-IgG» в соответствии с инструкцией производителя. Согласно инструкции к используемому набору ИФА положительными на наличие антигена ВКЭ считаются пробы, превышающие оптическую плотность (К-+0,2).
ИФА с иммобилизацией рекомбинантных антигенов проводили по следующей методике: рекомбинантный белок суспендировали в 1-кратном 60 мМ натрий-бикарбонатном буфере (приготовленный буфер изначально является 10-кратным) рН 9,2-9,6 в течение 18-20 часов при +4°С и перемешивании, и далее иммобилизовали в лунках полистироловой 96-луночной микропанели (Corning) с концентрацией 20 мкг/мл в лунке. Лунки дважды промывали дистиллированной водой и трижды PBS с 0,05% Tween 20 (PBST) рН 7,2. Затем в лунки вносили исследуемые сыворотки и инкубировали в течение часа на шейкере при +37°С. Затем панель отмывали, как описано выше, и в лунки вносили предварительно оттитрованный антивидовой иммунопероксидазный конъюгат в рабочем разведении 1:5000-1:10000. Инкубацию проводили при +37°С на шейкере. Затем планшет отмывали, как описано выше, и для проявления реакции в лунки вносили по 100 мкл готовой субстрат-индикаторной смеси, содержащей 0,01% 3,3′,5,5′-тетраметилбензидина (ТМБ) (Sigma, США). Инкубацию с субстратом проводили при комнатной температуре в течение 15 минут. Реакцию останавливали добавлением 50 мкл 4 M H2SO4 в каждую лунку. Оптическое поглощение (OD) окрашенного продукта пероксидазной реакцией определяли на фотометре Multiscan Ascent (ThermoLabsystems) при длине волны 450 нм. Результат ИФА считали положительным, если оптическая плотность в лунке с образцом была в 2 раза выше, чем оптическая плотность в лунке с отрицательной сывороткой.
б) оценка антигенной структуры методом иммуноблоттинга
При проведении «вестерн-блот» анализа в качестве положительной сыворотки, содержащей антитела к вирусу КЭ, использовали гипериммунную асцитную жидкость (ИАЖ) мыши, полученную к штамму ЭК-328 Сибирского подтипа вируса КЭ. В качестве отрицательной сыворотки использовали асцитную жидкость (АЖ) неиммунизированных животных.
Перед постановкой иммуноблоттинга проводили фракционирование белков методом электрофореза в 12% ПААГ по стандартной методике в денатурирующих условиях в прерывистой буферной системе с использованием вертикального прибора для минигелей Protean II («Bio-Rad», США). После проведения электрофореза осуществляли перенос белков из ПААГ на PVDF-мембрану. Для этого гель снимали со стекла и инкубировали в течение 10 мин в буфере для переноса (30,3 г Tris-аминометана; 144 г глицина на 1 л дистиллированной воды). PVDF-мембраны вымачивали в течение 1-2 мин в 96% этиловом спирте, а затем 15 мин - в буфере для переноса. Гель и мембрану собирали в ячейку BioRad и проводили перенос белков в течение 1 ч при +4°С, 150 В и 350 мА. Затем прибор разбирали, мембрану с перенесенными белками помещали в буфер для забивки (5% сухое молоко, приготовленное на 1х PBS-буфере) и инкубировали в течение ночи на качалке при +4°С. Перед переносом гель окрашивали краской 1% Panceau в 5% уксусной кислоте для проверки наличия белков в геле и отмывали.
Мембрану инкубировали с первичными антителами, в качестве которых использовали сыворотки крови пациентов, больных КЭ из разных частей ареала вируса. Разведения антител готовили с использованием буфера для забивки. Инкубацию проводили в течение 1 ч при комнатной температуре на качалке. Мембраны промывали 3 раза по 10 мин в 1х PBS-буфере и инкубировали в течение 1 ч при комнатной температуре на качалке со вторичными антителами (anti-human, «Fermentas», Литва). После инкубации мембраны отмывали от избыточных антител в 1х PBS-буфере 5 раз по 10 мин. Далее проводили окрашивание мембран диаминобензидином (6,1 мл 0,1 M лимонной кислоты; 6,4 мл 0,2 M Na2HPÜ4; 4 мкл 30% перекиси водорода; 10 мкл DAB; 10 мкл DMSO) в темноте до проявления четко видимых полос. После проведения реакции мембрану высушивали и сканировали для фиксирования результата.
5) изучение иммуногенности рекомбинантных антигенов
Для оценки иммуногенности рекомбинантных белков DBD2-D3S, DBD2-D3E и DBD2-D3D была проведена подкожная иммунизация мышей линии BALB/c рекомбинантным препаратом GamTBEVac на основе антигенов DBD2-D3S, DBD2-D3E и DBD2-D3D в комплексе с полисахаридом и адьювантом, а именно декстраном и CpG ODN, которые специфически взаимодействуют с toll-подобным рецептором 9 типа и способствуют развитию клеточного иммунного ответа (30 мкг каждого антигена на мышь по содержанию рецептор-связывающего домена III белка Ε оболочки ВКЭ). Схема иммунизации животных включала 3 инъекции рекомбинантных препаратов с интервалами 1 неделя между иммунизациями.
Иммунизацию мышей линии BALB/c проводили в двух вариантах: а) стандартная трехкратная иммунизация рекомбинантным препаратом GamTBEVac; б) иммунизация по схеме «prime-boost», включающая первичную иммунизацию референс-вакциной «Клещ-Э-Вак» и далее две бустерные иммунизации кандидатным вакцинным препаратом GamTBEVac.
В качестве референс-вакцины использовали вакцинный препарат «Клещ-Э-Вак» - «Вакцина против клещевого энцефалита культуральная очищенная концентрированная инактивированная сухая», Предприятие по производству бактерийных и вирусных препаратов ФГБУ Института полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН, РФ. Схема иммунизации животных референс-вакциной включала в себя 2 инъекции препарата с интервалами 1 неделя между иммунизациями.
В качестве контрольной группы использовались мыши, которым был трехкратно введен эквивалентный объем физиологического раствора (0,5 мл 0,9% натрия хлорида).
а) оценка иммуногенной активности методом ИФА
Для определения наличия антител к ВКЭ в сыворотках мышей, иммунизированных рекомбинантным препаратом GamTBEVac и/или вакциной сравнения, был проведен ИФА с использованием вирусного антигена на основе штамма Софьин ВКЭ согласно стандартной методике: первый слой - вирусный антиген, второй слой - сыворотки мышей, третий слой - антитела против антител мыши, меченные пероксидазой хрена.
В качестве контрольной сыворотки использовали ИАЖ мышей, иммунизированных штаммом ЭК-328 Сибирского подтипа ВКЭ; в качестве отрицательной сыворотки использовали АЖ неиммунного животного. Реакция ИФА считалась достоверной, если оптическая плотность стандартной сыворотки с контрольным антигеном была не выше 0,3, при этом в лунке с положительной сывороткой с вирусным антигеном была в 2 раза выше, чем в лунке с нормальным антигеном. Оценку титра антител проводили при помощи построения стандартной кривой серии последовательных двукратных разведений ИАЖ, полученной против штамма ЭК-328 ВКЭ. Результат ИФА образца считали положительным, если оптическая плотность в лунке с образцом с вирусным антигеном была в 2 раза выше, чем оптическая плотность в лунке с нормальным антигеном.
б) оценка иммуногенной активности в реакции нейтрализации бляшек в культуре клеток
Реакцию нейтрализации бляшек проводили в культуре клеток СПЭВ на пластиковых 6-луночных панелях через 72 часа после посадки клеток. Для проведения реакции нейтрализации в культуре клеток СПЭВ использовали сыворотки крови, полученные после иммунизации по разным схемам лабораторных животных препаратом GamTBEVac на основе рекомбинантных антигенов DBD2-D3S, DBD2-D3E, DBD2-D3D и/или референс-вакциной «Клещ-Э-Вак», объединенные в пулы с равновесным количеством сывороток животных внутри каждой группы.
Разведения исследуемых сывороток готовили в среде 199 на растворе Эрла с 2% FBS, с заданным шагом (4 или 5), начиная с 1:10. К исследуемым разведениям сыворотки добавляли вирус в 199 среде на растворе Эрла с 2% FBS с известным титром в соотношении (1:1). Проводили инкубацию в течение 1 часа при +37°С в СО2-инкубаторе, затем вносили по 200 мкл в лунку 6-луночной панели и инкубировали в течение 1 часа при +37°С. Затем добавляли 4,5 мл 1% агарового покрытия, содержащего из расчета на одну панель: 3 мл 10 × раствора Эрла; 20,7 мл воды для инъекций; 0,15 мл смеси антибиотиков; 0,45 мл 0,1% нейтрального красного; 2,25 мл FBS; 0,9 мл 7,5% бикарбоната натрия; 0,3 г агара («Difco»). На 7 сутки проводили учет бляшек и фотографирование панелей. За титр сыворотки принимали максимальное разведение сыворотки, подавляющее образования 50% бляшек по сравнению с контролем. Расчет проводили по методу Рида и Менча. В каждом опыте проводили контроль культуры клеток, контроль вируса против сыворотки с известным титром и отрицательной сыворотки.
Список использованных источников
1. Ecker М., Allison S.L., Meixner T., Heinz F.X. Sequence analysis and genetic classification of tick-bome encephalitis viruses from Europe and Asia // J. Gen. Virol. - 1999. - Vol. 80. - P. 179-185.
2. Takashima I., Monta К., Chiba M et al. A case of tick-borne encephalitis in Japan and isolation of the the virus. // J. Clin. Microbiol - 1997. - Vol. 35, №8. - P. 1943-1947.
3. Mansfield K.L., Johnson N., Phipps LP. et al. Tick-borne encephalitis virus - a review of an emerging zoonosis // J. Gen. Virol. - 2009. - Vol. 90. - P. 1781-1794.
4. Леонова Г.Н. Клещевой энцефалит: актуальные аспекты / Москва: Издатель И.В. Балабанов. - 2009. - 168 с.
5. Прохорова О.Г., Романенко В.В., Злобин В.И. Сравнительная характеристика иммунологической активности вакцин против клещевого энцефалита, используемых в ходе кампании массовой вакцинации населения Свердловской области // Эпидемиология и вакцинопрофилактика - 2006 - Т. 4 (29). - С.33-36.
6. Bender Α., Jager G., Scheuerer W. et al. Two severe cases of tick-borne encephalitis despite complete active vaccination - the significance of neutralizing antibodies // J. Neurol. - 2004. - Vol. 251, №3. - P. 353-354.
7. Kleiter I., Jilg W., Bogdahn U., Steinbrecher A. Delayed humoral immunity in a patient with severe tick-borne encephalitis after complete active vaccination // Infection. - 2007. - Vol. 35, №1. - P. 26-29.
8. Pogodina V.V., Levina L.S., Skrynnik S.M. et al. Tick-borne encephalitis with fulminant course and lethal outcome in patients after plural vaccination // Vopr. Virasol 2013. - Vol. 58, №2. - P. 33-37.
9. Леонова Г.Н., Крылова H.B., Павленко E.B., Майстровская О.С. Влияние реактогенности вакцин против клещевого энцефалита на иммунный ответ у вакцинированных людей // Бюллетень сибирской медицины. - 2006. - Прилож. 1. - С.72-78.
10. Hewson R. A. RNA viruses: emerging vectors for vaccination and gene therapy // Mol. Med. Today. - 2000. - Vol. 6, №1. - P. 28-35.
11. WHO Cell culture as a substrate for the production of influenza vaccine: memorandum from a WHO meeting // Bull World Health Organ. - 1995 - Vol. 73, №4. - P. 431-435.
12. Pulmanausahakul R., Khakpoor Α., Smith D.R. The development of flavivirus vaccines // Afr. J. Biotechnol. - 2010. - Vol. 9, №4. - P. 409-415.
13. Дебабов В.Г. ДНК-вакцинация и генотерапия на основе транзиентной экспрессии нуклеиновых кислот в соматических клетках человека и животных // Молекулярная биология. - 1997. - Т. 31, №2. - С. 209-215.
14. Schmaljohn С, Vanderzanden L., Bray M. et al. Naked DNA vaccines expressing the prM and Ε genes of Russian Spring Summer Encephalitis virus and Central European Encephalitis virus protect mice from homologus and heterologous challenge // J. Virol. - 1997. - Vol. 71, №12. - P. 9563-9569.
15. Heinz F.X., Turna W., Kunz C. Antigenic and immunogenic properties of defined physical forms of TBEV structural proteins // Infect. Immun - 1981 - Vol. 33, №1 - P. 250-257.
16. Chiang С.Y., Liu S.J., Tsai J.P. et al. A novel single-dose dengue subunit vaccine induces memory immune responses // PLoS One. - 2011. - Vol.6, №8 - P. e23319.
17. Chu J.H., Chiang C.C., Ng M.L. Immunization of flavivirus West Nile recombinant envelope domain III protein induced specific immune response and protection against West Nile virus infection // J. Immunol - 2007 - Vol. 178, №5. - P. 2699-2705.
18. Chiang C.Y., Huang M.H., Hsieh CH. et al. Dengue-1 envelope protein domain III along with PELC and CpG oligodeoxynucleotides synergistically enhances immune responses // PLoS Negl Trop Dis - 2012 - Vol. 6, №5 - P. el645.
19. Bhardwaj S., Holbrook M., Shope R.E. et al. Biophysical characterization and vector-specific antagonist activity of domain III of the tick-borne flavivirus envelope protein // J. Virol - 2001. - Vol. 75, №8. - P. 4002-4007.
20. Rey F.A., Heinz F.X., Mandl C. et al. The envelope glycoprotein from tick-borne encephalitis virus at 2 A resolution // Nature - 1995 - Vol. 375, №6529 - P. 291-298.
21. Гурвич A.E. Усиление иммуногенности белков путем их присоединения к целлюлозной матрице // В кн. «Иммуносорбенты и их использование в биотехнологии» / Москва - 1987 - С.67-76.
22. Авдеева Ж.И., Акользина С.Е., Алпатова Н.А. и др. Влияние цитокинов на иммуногенные свойства вакцины против клещевого энцефалита // Цитокины и воспаление. - 2009. - Т. 8, №2. - С.16-21.
23. Karlin S., Doerfler W., Cardon L.R. Why is CpG suppressed in the genomes of virtually all small eukaryotic viruses but not in those of large eukaryotic viruses? // J. Virol. - 1994. - Vol. 68, №5. - P. 2889-2897.
24. Huang M.H., Lin S.C., Hsiao CH. et al. Emulsified nanoparticles containing inactivated influenza virus and CpG oligodeoxynucleotides critically influences the host immune responses in mice // PLoS One - 2010 - Vol.5, №8 - P. el2279.
25. Аммосов А.Д. Клещевой энцефалит / Кольцово: Издатель ЗАО «Вектор-Бест». - 2006. - 116 с.
26. Sallusto F., Celia M., Danieli С, Lanzavecchia A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products // J. Exp. Med. - 1995 - Vol. 182, №2 - P. 389-400.
27. Sztein M. В., Ahmed R., Crotty S. New Generation Vaccines / Recent Advances in Immunology: Impact on vaccine development - 1997 - Chapter 17 - pp. 1040 - ISBN 9781420060737.
28. Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование / Москва: Изд-во Мир. - 1984. - 479 с.
29. Saiki R.K., Gelfand D.H., Stoffel S. et al. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase // Science. - 1988. - Vol. 239, №4839. - P. 487-491.
30. Sanger F., Nicklen S., Coulson A.R. DNA sequencing with chain-terminating inhibitors (DNA polymerase/nucleotide sequences/bacteriophage 4X174) // Proc. Nat. Acad. Sci. USA. - 1977. - Vol.74, №12. - P. 5463-5467.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГИБРИДНОГО БЕЛКА pESAT6-DBD И ДЕКСТРАНА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА pESAT6-DBD, ШТАММ Escherichia coli, ХИМЕРНЫЙ БЕЛОК ESAT6-DBD И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2520737C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГИБРИДНОГО БЕЛКА Ag85A-DBD И ДЕКСТРАНА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА pAg85A-DBD, ШТАММ Escherichia coli [pREP4, pAg85A-DBD], ХИМЕРНЫЙ БЕЛОК Ag85A-DBD | 2013 |
|
RU2520078C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГИБРИДНОГО БЕЛКА CFP10-DBD И ДЕКСТРАНА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА pCFP10-DBD, ШТАММ Escherichia coli [pREP4, pCFP10-DBD], ХИМЕРНЫЙ БЕЛОК CFP10-DBD И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2546875C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pESAT6-CFP10-DBD, РЕКОМБИНАНТНЫЙ ШТАММ Escherichia coli M15 [pREP4, pESAT6-CFP10-DBD], СПОСОБ ПОЛУЧЕНИЯ, ИММОБИЛИЗАЦИИ, КОНЦЕНТРИРОВАНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОГО БЕЛКА ESAT6-CFP10-DBD НА ДЕКСТРАНЕ, РЕКОМБИНАНТНЫЙ БЕЛОК ESAT6-CFP10-DBD И ИММУНОГЕННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БЕЛОК ESAT6-CFP10-DBD | 2013 |
|
RU2539026C1 |
| Иммуногенная композиция на основе рекомбинантных псевдоаденовирусных частиц, а также на основе белковых антигенов и способ получения иммуногенной композиции | 2018 |
|
RU2691302C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО БЕЛКА TUL4spCBD, ШТАММ ESCHERICHIA COLI M15 [pREP4, pTUL4spCBD] - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО БЕЛКА TUL4spCBD, РЕКОМБИНАНТНЫЙ БЕЛОК TUL4spCBD И СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К БЕЛКУ TUL4spCBD | 2004 |
|
RU2270249C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pAg85A-CBD, ШТАММ Escherichia coli [pREP4, pAg85A-CBD], ХИМЕРНЫЙ БЕЛОК Ag85A-CBD И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2429292C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pD4spGBD, ШТАММ Escherichia coli - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО БЕЛКА D4-GBD, РЕКОМБИНАНТНЫЙ БЕЛОК D4-GBD И СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ИССЛЕДОВАНИЯ СВЯЗЫВАНИЯ БЕЛКА D4-GBD С АНТИТЕЛАМИ СЫВОРОТОК БОЛЬНЫХ, СПОСОБ ПОЛУЧЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К БЕЛКУ D4-GBD | 2008 |
|
RU2401305C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pD1spGBD, ШТАММ Escherichia coli - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО БЕЛКА D1-GBD, РЕКОМБИНАНТНЫЙ БЕЛОК D1-GBD И СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ИССЛЕДОВАНИЯ СВЯЗЫВАНИЯ БЕЛКА D1-GBD С АНТИТЕЛАМИ СЫВОРОТОК БОЛЬНЫХ, СПОСОБ ПОЛУЧЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К БЕЛКУ D1-GBD | 2008 |
|
RU2401302C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pD5spGBD, ШТАММ Escherichia coli - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО БЕЛКА D5-GBD, РЕКОМБИНАНТНЫЙ БЕЛОК D5-GBD И СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ИССЛЕДОВАНИЯ СВЯЗЫВАНИЯ БЕЛКА D5-GBD С АНТИТЕЛАМИ СЫВОРОТОК БОЛЬНЫХ, СПОСОБ ПОЛУЧЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К БЕЛКУ D5-GBD | 2008 |
|
RU2401304C2 |






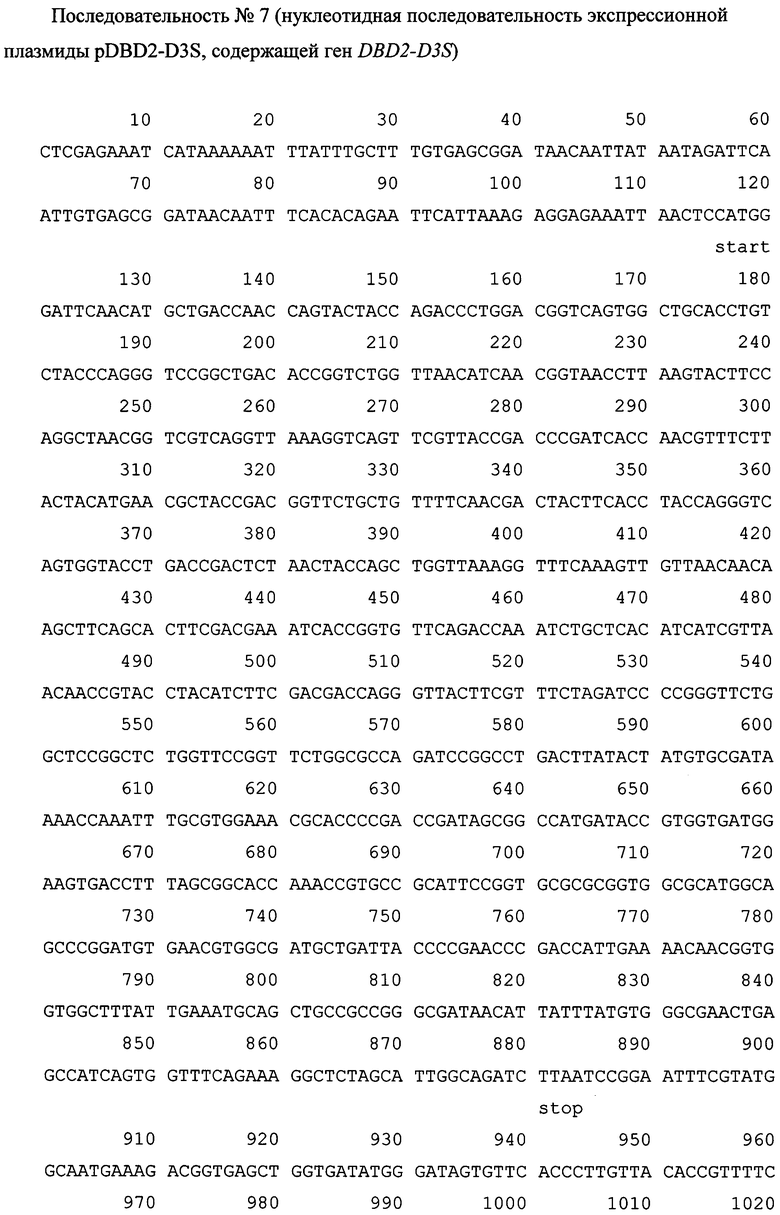

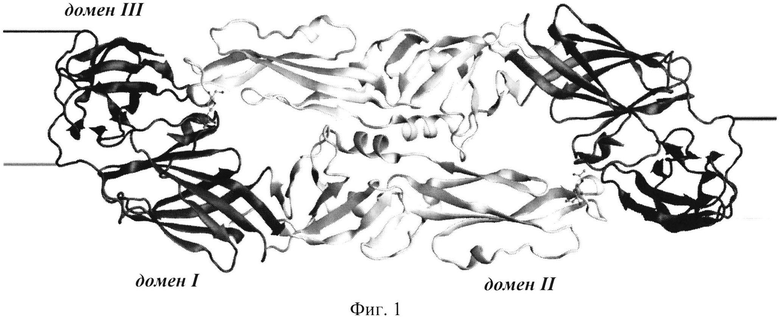

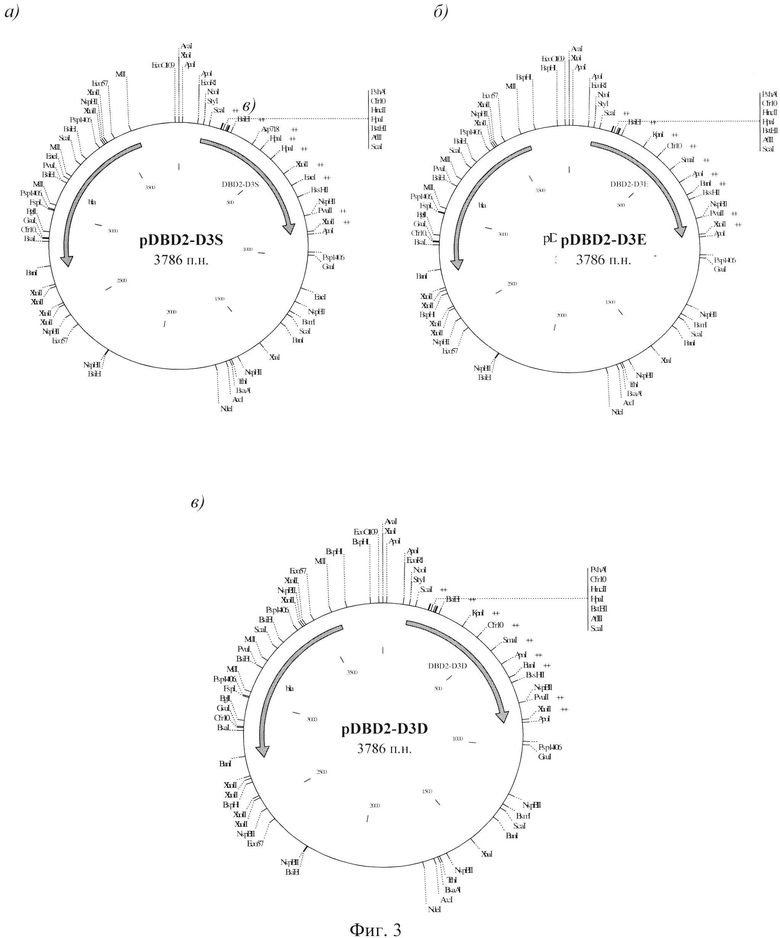
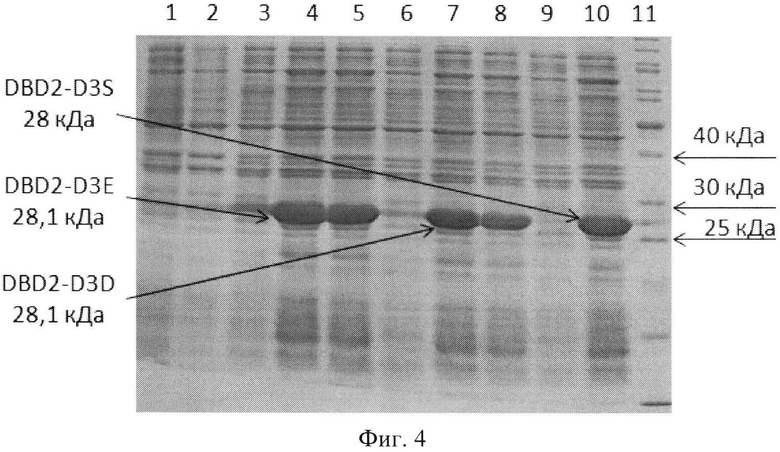
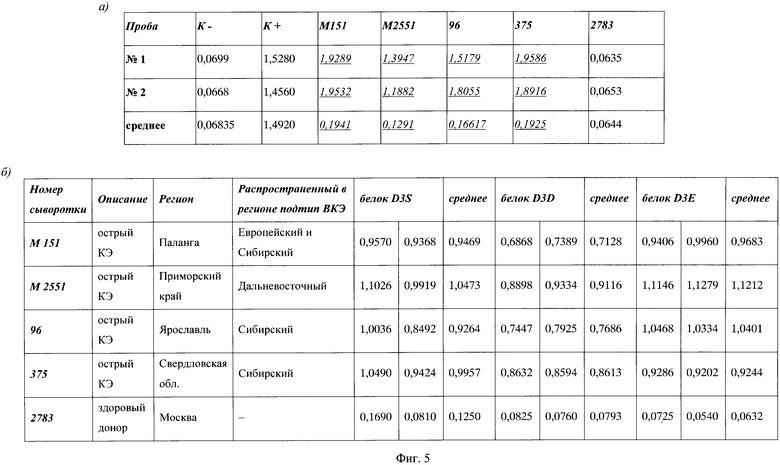
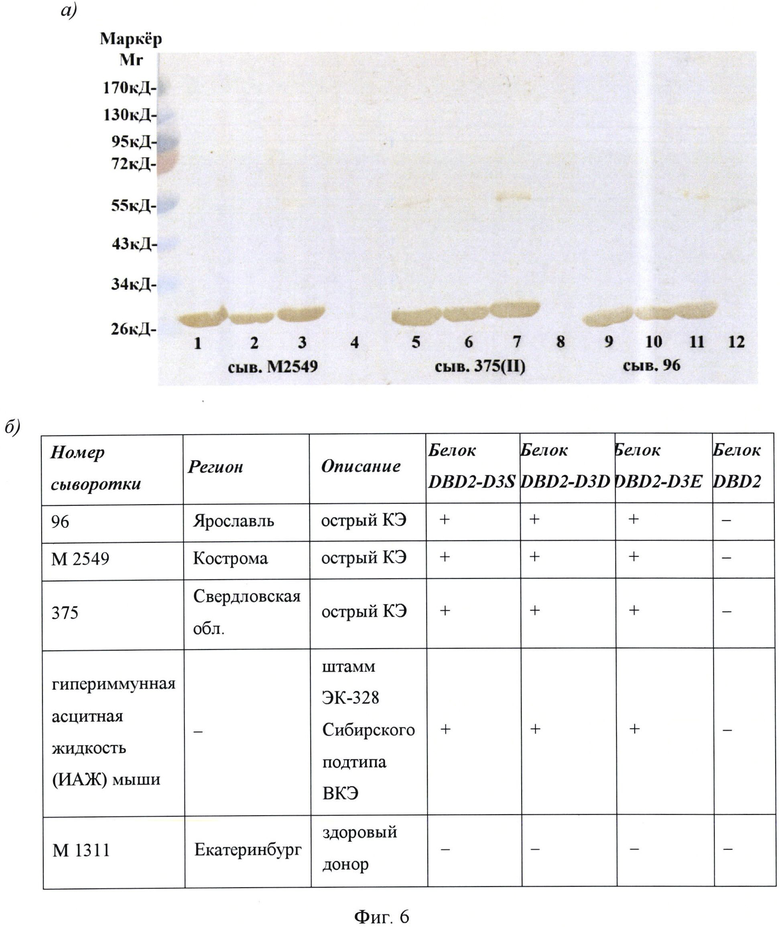
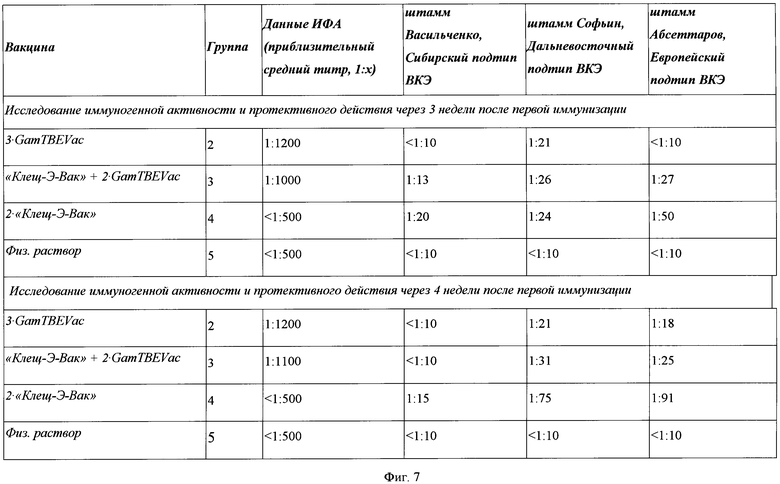
Изобретение относится к генной инженерии, биохимии, биотехнологии и иммунологии. Описано получение синтетических генов D3S, D3E и D3D, оптимизированных для гетерологичной экспрессии в непатогенных лабораторных штаммах Escherichia coli. Указанные гены кодируют рецептор-связывающие домены III белка Ε оболочки вируса клещевого энцефалита (ВКЭ). На основе генов D3S, D3E и D3D получают рекомбинантные плазмиды pDBD2-D3S, pDBD2-D3E и pDBD2-D3D, которые кодируют бифункциональные рекомбинантные белки, различающиеся по аминокислотному составу в позициях 166, 170, 184, 211 и определяющие принадлежность к трем основным генетическим типам вируса. Изобретение также включает штаммы-продуценты химерных белков Е. coli M15 [pREP4, pDBD2-D3S], Ε. coli M15 [pREP4, pDBD2-D3E] и Ε. coli M15 [pREP4, pDBD2-D3D], а также способ иммобилизации, концентрирования и очистки полученных белков на декстрансодержащем сорбенте. Изобретение относится к рекомбинантным белкам DBD2-D3S, DBD2-D3E и DBD2-D3D, предназначенным для использования в качестве антигенов, иммобилизованных в лунках 96-луночного планшета или стрипах, в составе набора диагностических маркеров для выявления антител к ВКЭ в сыворотке крови и ликворе человека методом ИФА, а также к иммуногенной композиции, содержащей иммобилизованные на декстране рекомбинантные белки и направленной на специфическую активацию иммунитета и формирование иммунологической памяти в отношении вируса. Изобретение позволяет получать штаммы-продуценты, обеспечивающие высокий уровень продукции рекомбинантных белковых антигенов DBD2-D3S, DBD2-D3E и DBD2-D3D, с целью последующего использования для иммунопрофилактики ВКЭ, дифференциальной диагностики флавивирусных инфекций и оценки напряженности иммунитета. 7 н. и 7 з.п. ф-лы, 7 ил.
1. Синтетический ген, состоящий из 315 п.н., кодирующий рецептор-связывающий домен III вирионного белка Ε вируса клещевого энцефалита (ВКЭ), представленный SEQ ID NO: №1, №2 или №3, с кодонами, оптимизированными для гетерологичной экспрессии в непатогенных лабораторных штаммах Escherichia coli.
2. Синтетический ген по п. 1, где ген кодирует рецептор-связывающий домен III вирионного белка Ε вируса клещевого энцефалита подтипа Сибирского (D3S).
3. Синтетический ген по п. 1, где ген кодирует рецептор-связывающий домен III вирионного белка Ε вируса клещевого энцефалита подтипа Европейского (D3E).
4. Синтетический ген по п. 1, где ген кодирует рецептор-связывающий домен III вирионного белка Ε вируса клещевого энцефалита подтипа Дальневосточного (D3D).
5. Рекомбинантная плазмида pDBD2-D3, обеспечивающая экспрессию бифункциональных рекомбинантных белков DBD2-D3S, DBD2-D3E или DBD2-D3D, представленных SEQ ID NO: №4-6 соответственно, состоящих из декстрансвязывающего домена декстрансукразы Leuconostoc citreum КМ20, Gly-Ser спейсера и последовательностей рецептор-связывающего домена III белка Ε оболочки ВКЭ, определяющих принадлежность к Сибирскому, Европейскому или Дальневосточному подтипам вируса и различающихся по аминокислотному составу в позициях 166, 170, 184 и 211, размером 3786 п.н., состоящая из следующих структурных элементов:
искусственный бактериальный оперон одного из рекомбинантных белков DBD2-D3S, DBD2-D3E или DBD2-D3D, включающий: промоторную область раннего промотора бактериофага Т5 (7-87 п.н.), ген рекомбинантного белка (117-881 п.н.), нетранслируемую область терминации транскрипции (1021-1115 п.н.);
бактериальный оперон бета-лактамазы, обеспечивающий устойчивость к ампицилину (2721-3571 п.н.);
бактериальный участок инициации репликации типа ColE1 (1954-1964 п.н.), обеспечивающий репликацию плазмиды в штамме Е. сoli M15.
6. Микроорганизм Е. coli, полученный трансформацией штамма Е. coli М15 [pREP4] плазмидой pDBD2-D3 по п. 5, продуцент белка DBD2-D3.
7. Микроорганизм по п. 6, где микроорганизм представляет собой штамм Е. coli M15 [pREP4, pDBD2-D3S].
8. Микроорганизм по п. 6, где микроорганизм представляет собой штамм Е. coli М15 [pREP4, pDBD2-D3E].
9. Микроорганизм по п. 6, где микроорганизм представляет собой штамм Е. coli M15 [pREP4, pDBD2-D3D].
10. Способ получения очищенного рекомбинантного белка DBD2-D3S, DBD2-D3E или DBD2-D3D посредством иммобилизации на декстрансодержащем сорбенте, включающий выращивание клеток штаммов Е. coli М15 [pREP4, pDBD2-D3S], [pREP4, pDBD2-D3E] или [pREP4, pDBD2-D3D]; иммобилизацию белков DBD2-D3S, DBD2-D3E или DBD2-D3D в составе клеточных экстрактов штаммов Е. coli М15 [pREP4, pDBD2-D3S], [pREP4, pDBD2-D3E] или [pREP4, pDBD2-D3D], соответственно, на декстрансодержащем сорбенте за счет аффинного взаимодействия при инкубации с последующей отмывкой от несвязавшихся бактериальных белков с концентрированием целевого продукта, последующей его очисткой и выделением целевого продукта.
11. Рекомбинантный белок DBD2-D3, обладающий иммуногенными свойствами, содержащий декстрансвязывающий домен декстрансукразы из L. citreum КМ20 (аминокислотные остатки 1-140), Gly-Ser спейсер (остатки 141-150) и одну из последовательностей рецептор-связывающего домена III белка Ε оболочки ВКЭ (остатки 151-255), различающихся по аминокислотному составу в позициях 166, 170, 184 и 211, характеристические остатки в которых позволяют отнести последовательность к одному из трех генетических типов: Α-Τ-Τ-Ι - к наиболее распространенному Сибирскому варианту, Τ-Α-Τ-Ι - к Европейскому варианту и Τ-Ι-А-М к Дальневосточному подтипу вируса.
12. Рекомбинантный белок DBD2-D3 по п. 11, где белок является белком DBD2-D3S с SEQ ID NO: №4 и имеет молекулярную массу 28 кДа, или является белком DBD2-D3E с SEQ ID NO: №5 и имеет молекулярную массу 28,1 кДа, или является белком DBD2-D3D с SEQ ID NO: №6 и имеет молекулярную массу 28,1 кДа.
13. Набор диагностических маркеров, содержащий рекомбинантные белки по п. 11 DBD2-D3S, DBD2-D3E и DBD2-D3D, предназначенный для диагностики подтипа клещевого энцефалита.
14. Иммуногенная композиция, содержащая иммобилизованные на декстране рекомбинантные белки по п. 11 DBD2-D3S, DBD2-D3E и DBD2-D3D в эффективном количестве и фармацевтически приемлемый носитель.
| СПОСОБ ИММУНИЗАЦИИ ПРОТИВ ИНФЕКЦИИ, ВЫЗЫВАЕМОЙ ВИРУСОМ КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1997 |
|
RU2136312C1 |
| US 0007785799 В2, 31.08.2010 | |||
Авторы
Даты
2015-08-20—Публикация
2014-10-09—Подача