ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к профилям экспрессии генов в патогенезе воспалительного заболевания кишечника. Это открытие применимо в выявлении и диагностике воспалительного заболевания кишечника.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Воспалительное заболевание кишечника (IBD), хроническое воспалительное расстройство желудочно-кишечного тракта, которым в США страдает приблизительно один миллион пациентов, состоит из двух основных групп заболеваний: язвенный колит (UC) и болезнь Крона (CD). При обеих формах IBD микроорганизмы кишечника могут инициировать заболевание у генетически предрасположенных индивидов. UC часто ограничивается толстым кишечником, в то время как CD, как правило, возникает в подвздошной кишке тонкого кишечника и в толстом кишечнике (Podolsky, D.K., N. Engl. J. Med. 347:417-429 (2002)). Определение профиля экспрессии генов в тканях пациентов с IBD обеспечило некоторое понимание возможных мишеней для лечения и/или диагностики (см., например, Dieckgraefe, B.K. et al., Physiol. Genomics 4:1-11 (2000); Lawrance I.C. et al., Hum Mol Genet. 10:445-456 (2001); Dooley T.P. et al., Inflamm. Bowel Dis. 10:1-14 (2004); и Uthoff S.M., Int J Oncol. 19:803-810 (2001)). Другие исследования нарушения регуляции генов у пациентов, страдающих воспалительным заболеванием кишечника, включают, например, исследование Lawrance, I.C. et al., которые описали характерные профили генной экспрессии для нескольких генов при UC и CD (Lawrance, I.C. et al., Human Mol. Genetics 10(5):445-456 (2001)). Uthoff, S.M.S. et al. описали идентификацию генов-кандидатов для UC и CD с использованием анализа на микрочипах (Uthoff, S.M.S. et al., Int'l. J. Oncology 19:803-810 (2001)). Dooley, T.P. et al. описали корреляцию экспрессии генов при IBD с медикаментозным лечением нарушения (Dooley, T.P. et al., Inflamm. Bowel Dis. 10(1):1-14 (2004)).
Существует необходимость в идентификации дополнительных биологических маркеров воспалительного заболевания кишечника для применения в диагностике этого хронического заболевания. Настоящее описание удовлетворяет эту необходимость.
Полное содержание всех цитированных в настоящем описании документов включено в настоящий документ в качестве ссылки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе описано уникальное открытие того, что члены суперсемейства генов LY6 активированы на поверхности эпителиальных клеток кишечника (IEC) в моделях колита на мышах и в ткани кишечника пациентов (людей), страдающих IBD, причем эти гены не экспрессируются на здоровых IEC. Большинство членов семейства LY6 представляют собой GPI-заякоренные гликопротеины клеточной поверхности, широко распространенные на клетках гематопоэтического происхождения и более ограниченно экспрессирующиеся на негематопоэтических клетках. Несмотря на широкое применение в качестве маркеров дифференцировки иммунных клеток (Sunderkotter, C. et al., J. Immunol. 172:4410-4417 (2004)), функции семейства LY6 трудно установить (Shevach, E.M. и P.E. Korty, Immunol. Today 10:195-200 (1989)). В отчетах показано, что молекулы LY6 вовлечены в ряд различных функций, включая активацию T-клеток (Zhang, Z.X. et al., Eur. J. Immunol. 32:1584-1592 (2002) и Henderson, S.C. et al., J. Immunol. 168:118-126 (2002)), обоняние (Chou, J.H. et al., Genetics 157:211-224 (2001)) и адгезию клеток (Jaakkola, I. et al., J. Immunol. 170:1283-1290 (2003)).
В наиболее широком смысле изобретение относится к способу выявления повышенной экспрессии генов семейства генов LY6 человека в ткани кишечника первого млекопитающего, страдающего расстройством кишечника, по сравнению с контрольным млекопитающим. Более конкретно, ожидается, что способ будет применим для диагностики расстройств, связанных с нарушениями кишечника, ассоциированными с экспрессией LY6H, LYPD1, LYPD3 и LYPD5 человека, эти расстройства включают, но не ограничиваются ими, воспалительное заболевание кишечника (IBD), такое как язвенный колит (UC) и болезнь Крона (CD). В одном варианте осуществления способ по изобретению пригоден для выявления лиц, отвечающих и не отвечающих на терапевтическое лечение IBD. В одном варианте осуществления IBD представляет собой язвенный колит (UC). В одном варианте осуществления IBD представляет собой болезнь Крона (CD). В одном варианте осуществления ткань кишечника представляет собой ткань толстого кишечника. В одном варианте осуществления ткань толстого кишечника представляет собой сигмовидную кишку. В одном варианте осуществления экспрессия генов LY6H, LYPD1, LYPD3 и/или LYPD5 повышена в ткани кишечника (такой как ткань толстого кишечника) млекопитающего с IBD, UC или CD по сравнению с нормальным кишечником (таким как нормальная ткань толстого кишечника) млекопитающего, не страдающего IBD, CD или UC. В одном варианте осуществления ген LY6H включает нуклеиновую кислоту SEQ ID NO:1 и кодирует полипептид LY6H, включающий SEQ ID NO:2. В одном варианте осуществления ген LYPD1 включает нуклеиновую кислоту SEQ ID NO:3 или 4 и кодирует полипептид LYPD1, включающий SEQ ID NO:5. В одном варианте осуществления ген LYPD3 включает нуклеиновую кислоту SEQ ID NO:6 и кодирует полипептид LYPD3, включающий SEQ ID NO:7. В одном варианте осуществления ген LYPD5 включает нуклеиновую кислоту SEQ ID NO:8 или 9 и кодирует полипептид LYPD5, включающий SEQ ID NO:10.
В одном варианте осуществления способ по изобретению включает получение образца ткани у тестируемого млекопитающего, предположительно страдающего расстройством кишечника, контактирование ткани с детектируемым средством, которое взаимодействует с белком LY6H, LYPD1, LYPD3 и/или LYPD5, или с нуклеиновой кислотой, кодирующей LY6H, LYPD1, LYPD3 и/или LYPD5, и определение уровня экспрессии LY6H, LYPD1, LYPD3 и/или LYPD5 по сравнению с контрольной тканью. В одном варианте осуществления повышенная экспрессия LY6H, LYPD1, LYPD3 и/или LYPD5 по сравнению с контролем указывает на IBD у тестируемого млекопитающего. В одном варианте осуществления повышенная экспрессия LY6H, LYPD1, LYPD3 и/или LYPD5 в тестируемой ткани кишечника по сравнению с контрольной тканью кишечника указывает на UC у тестируемого млекопитающего. В одном варианте осуществления повышенная экспрессия LY6H, LYPD1, LYPD3 и/или LYPD5 в тестируемой ткани кишечника по сравнению с контрольной тканью кишечника указывает на CD у тестируемого млекопитающего. В одном варианте осуществления ткань или клетки тестируемого и контрольного млекопитающих представляют собой ткань или клетки из толстого кишечника.
В одном варианте осуществления экспрессию LY6H, LYPD1, LYPD3 и/или LYPD5 определяют посредством выявления экспрессии генов, например посредством выявления мРНК, кодирующей LY6H, LYPD1, LYPD3 и/или LYPD5 в образце ткани или клеток. В одном варианте осуществления контрольный образец представляет собой образец ткани или клеток того же типа ткани или клеток, полученный у млекопитающего, о котором известно, что оно не страдает желудочно-кишечным расстройством, таким как IBD, UC или CD. В одном варианте осуществления контрольный образец представляет собой универсальный стандарт, содержащий РНК из нескольких нормальных тканей или из множества клеточных линий. В анализе на микрочипах такие универсальные стандарты пригодны для мониторинга и контроля внутриэкспериментальных и межэкспериментальных вариаций. В одном варианте осуществления универсальный стандарт (или универсальную стандартную РНК (URR)) получают, как описано в Novoradovskaya, N. et al. (2004) BMC Genomics 5:20, которая включена в настоящий документ в качестве ссылки в полном объеме. В одном варианте осуществления для применения в качестве контроля в анализе на микрочипах РНК мыши, URR представляет собой универсальную стандартную РНК мыши от Stratagene® (каталожный #740100, Stratagene®, La Jolla, CA). В одном варианте осуществления для применения в качестве контроля в анализе на микрочипах РНК человека, URR представляет собой универсальную стандартную РНК человека от Stratagene® (каталожный #740000). В одном варианте осуществления для применения в качестве контроля в анализе на микрочипах РНК крысы, URR представляет собой универсальную стандартную РНК крысы от Stratagene® (каталожный #740200). В одном варианте осуществления, где РНК представляет собой РНК мыши, клеточные линии, из которых экстрагирована тотальная РНК, включают клеточные линии, полученные из эмбриона, фибробластов эмбриона, почки, гепатоцитов печени, альвеолярных макрофагов легких, B-лимфоцитов, T-лимфоцитов (тимус), молочной железы, мышечных миобластов, кожи и семенника. В одном варианте осуществления, где РНК представляет собой РНК человека, клеточные линии, из которых экстрагирована тотальная РНК, включают клеточные линии, полученные из аденокарциномы молочной железы, гепатобластомы печени, аденокарциномы шейки матки, эмбриональной карциномы или карциномы яичка, глиобластомы головного мозга, меланомы, липосаркомы, гистиоцитарной лимфомы (макрофаги, гистоциты), T-лимфобластного лейкоза, B-лимфобластной плазмацитомы и меланомы. В одном варианте осуществления, где РНК представляет собой РНК крысы, клеточные линии, из которых экстрагирована тотальная РНК, включают клеточные линии, полученные из крови при базофильном лейкозе, из крови при T-лимфоцитарной лимфоме, из B-лимфобластной гибридомы крови, глиомы мозга, карциномы желточного мешка эмбриона, нормальных фибробластов эмбриона, нормальной почки, гепатомы печени, нормальных альвеолярных макрофагов легкого, нормальных альвеолярных клеток II типа легкого, аденокарциномы молочной железы, мышечных миобластов, нормальной кожи и опухоли клеток Лейдига семенника.
В одном аспекте изобретение относится к изделию, содержащему контейнер и композицию, содержащуюся в контейнере, где композиция содержит нуклеиновую кислоту, кодирующую LY6H, LYPD1, LYPD3 и/или LYPD5, или комплементарную ей нуклеиновую кислоту, и/или антитело или антитела против LY6H, LYPD1, LYPD3 и/или LYPD5, или их связывающий LY6H, LYPD1, LYPD3 и/или LYPD5 фрагмент, где нуклеиновые кислоты и/или антитела являются детектируемыми. В одном варианте осуществления композиция содержит детектирующие средства для детекции связывания нуклеиновых кислот, таких как, но не ограничиваясь ими, нуклеиновые кислоты, кодирующие LY6H, LYPD1, LYPD3 и/или LYPD5, или комплементарные им нуклеиновые кислоты, с нуклеиновой кислотой LY6H, LYPD1, LYPD3 и/или LYPD5 в образце ткани тестируемого млекопитающего, предположительно страдающего расстройством кишечника. В одном варианте осуществления композиция содержит детектирующие средства для детекции антитела, связывающегося, например, с LY6H, LYPD1, LYPD3 и/или LYPD5 в образце ткани тестируемого млекопитающего, предположительно страдающего расстройством кишечника. В одном варианте осуществления антитело композиции является детектируемо меченным. В одном варианте осуществления антитело композиции детектируют с помощью второго антитела, это второе антитело является детектируемым или является детектируемо меченным. Кроме того, изделие необязательно может содержать ярлык, прикрепленный к контейнеру, или вкладыш в упаковку, включенный вместе с контейнером, которые относятся к применению нуклеиновой кислоты LY6H, LYPD1, LYPD3 и/или LYPD5 или комплементарной ей нуклеиновой кислоты и/или антитела против LY6H, LYPD1, LYPD3 и/или LYPD5 или его связывающего LY6H, LYPD1, LYPD3 и/или LYPD5 фрагмента для выявления повышенной экспрессии LY6H, LYPD1, LYPD3 и/или LYPD5 в ткани кишечника, включая, но не ограничиваясь этим, ткань толстого кишечника. В одном варианте осуществления расстройство кишечника представляет собой IBD. В одном варианте осуществления расстройство кишечника представляет собой UC или CD. В одном варианте осуществления полипептид LYPD1 и антитело против LYPD1 представляют собой полипептид и антитело, как описано в US 7157558 и US 7144990 соответственно.
В одном аспекте настоящее изобретение относится к способу диагностики наличия расстройства кишечника у млекопитающего, включающему детекцию уровня экспрессии гена, кодирующего полипептид LY6H, LYPD1, LYPD3 и/или LYPD5 (a) в тестируемом образце ткани или клеток, полученном у указанного млекопитающего, и (b) в контрольном образце известных нормальных клеток у млекопитающего, не страдающего расстройством кишечника, из ткани того же происхождения или типа, где более высокий уровень экспрессии полипептида LY6H, LYPD1, LYPD3 и/или LYPD5 в тестируемом образце, по сравнению с контрольным образцом, указывает на наличие расстройства кишечника у млекопитающего, у которого был получен тестируемый образец. В одном варианте осуществления расстройство кишечника представляет собой IBD. В одном варианте осуществления IBD представляет собой UC. В одном варианте осуществления IBD представляет собой CD. В одном варианте осуществления детекцию проводят посредством контактирования антитела с полипептидом LY6H, LYPD1, LYPD3 и/или LYPD5, или связывающего фрагмента антитела, с тестируемым и контрольным образцами и определения относительного количества образования комплекса антитело-полипептид. Более высокий уровень образования комплекса антитело-полипептид в тестируемом образце по сравнению с контрольным образцом указывает на расстройство кишечника, такое как IBD, UC или CD, у тестируемого млекопитающего. Антитело по изобретению является детектируемо меченным, или, альтернативно, антитело выявляют посредством последующего связывания второго антитела, которое является детектируемым.
В другом варианте осуществления настоящее изобретение относится к способу диагностики наличия расстройства кишечника у млекопитающего, включающему (a) контактирование тестируемого образца, содержащего ткань или клетки, полученные у тестируемого млекопитающего, с олигонуклеотидом, который гибридизуется в условиях высокой строгости с нуклеиновой кислотой LY6H, LYPD1, LYPD3 и/или LYPD5 (или комплементарной ей нуклеиновой кислотой) или антителом, которое специфично связывается с полипептидом LY6H, LYPD1, LYPD3 и/или LYPD5, и (b) детекцию образования комплекса между олигонуклеотидом или антителом и нуклеиновой кислотой LY6H, LYPD1, LYPD3 и/или LYPD5 (или комплементарной ей нуклеиновой кислотой) или полипептидом LY6H, LYPD1, LYPD3 и/или LYPD5 соответственно, в тестируемом образце, где повышенное образование такого комплекса в тестируемом образце по сравнению с контрольным образцом указывает на наличие расстройства кишечника (такого как IBD, UC или CD) у тестируемого млекопитающего. В одном варианте осуществления расстройство кишечника представляет собой IBD. В одном варианте осуществления расстройство представляет собой UC. В одном варианте осуществления расстройство представляет собой CD. В одном варианте осуществления ткань тестируемого и контрольного млекопитающих представляет собой ткань толстого кишечника. Необязательно, связывающее полипептид LY6H, LYPD1, LYPD3 и/или LYPD5 антитело или гибридизующийся с геном LY6H, LYPD1, LYPD3 и/или LYPD5 олигонуклеотид, используемые в способе по изобретению, являются детектируемыми, детектируемо меченными, связанными с твердой подложкой, или сходные с ними, и/или тестируемый образец ткани или клеток получают у индивида, предположительно страдающего расстройством кишечника, где расстройство представляет собой IBD, такое как, но не ограничиваясь ими, UC или CD.
В другом варианте осуществления настоящее изобретение относится к применению (a) полипептида LY6H, LYPD1, LYPD3 и/или LYPD5, (b) нуклеиновой кислоты, кодирующей полипептид LY6H, LYPD1, LYPD3 и/или LYPD5, или вектора или клетки-хозяина, содержащих нуклеиновую кислоту (a), (c) антитела против полипептида LY6H, LYPD1, LYPD3 и/или LYPD5 или (d) связывающего LY6H, LYPD1, LYPD3 и/или LYPD5 олигопептида, для получения лекарственного средства, пригодного для диагностического выявления расстройства кишечника, включая, но не ограничиваясь ими, IBD CD или UC, в ткани кишечника млекопитающего, включая, но не ограничиваясь этим, ткань толстого кишечника.
В одном аспекте изобретение относится к способу выявления ответа на терапевтическое лекарственное средство у млекопитающего, подвергаемого лечению лекарственным средством против IBD, где способ включает определение экспрессии LY6H, LYPD1, LYPD3 и/или LYPD5 в желудочно-кишечной ткани тестируемого млекопитающего по сравнению с контрольной желудочно-кишечной тканью контрольного млекопитающего, где более высокий уровень экспрессии LY6H, LYPD1, LYPD3 и/или LYPD5 в тестируемой ткани по сравнению с контрольной тканью указывает на болезненное состояние или продолжение болезненного состояния. Отличие экспрессии LY6H, LYPD1, LYPD3 и/или LYPD5 в тестируемой ткани, которое не является значимо превышающим нормальные контрольные уровни экспрессии или уровни, которые находятся в диапазоне нормальных уровней экспрессии для LY6H, LYPD1, LYPD3 и/или LYPD5 в популяции млекопитающих, указывает на улучшение или смягчение расстройства кишечника, и это улучшение или смягчение может быть связано с лекарственным средством. В одном варианте осуществления ответ на лечение определяют, когда уровни экспрессии LY6H, LYPD1, LYPD3 и/или LYPD5 в желудочно-кишечных тканях или клетках или тканях или клетках толстого кишечника млекопитающего, подвергаемого лечению лекарственным средством, отличаются (экспрессия является более сходной с нормальными контрольными уровнями, т.е. уровни LY6H, LYPD1, LYPD3 и/или LYPD5 являются более низкими, чем уровни экспрессии LY6H, LYPD1, LYPD3 и/или LYPD5, у млекопитающего до лечения).
Другие варианты осуществления настоящего изобретения будут очевидны специалисту в данной области при прочтении настоящего описания.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фигурах 1A и 1B представлена последовательность нуклеиновой кислоты (SEQ ID NO:1), кодирующая полипептид LY6H человека, и аминокислотная последовательность полипептида LY6H человека (SEQ ID NO:2).
На фигурах 2A и 2B представлены последовательности нуклеиновых кислот (SEQ ID NO:3 и 4), кодирующие полипептид LYPD1 человека, и на фигуре 2C представлена аминокислотная последовательность полипептида LYPD1 человека (SEQ ID NO:5).
На фигурах 3A и 3B представлена последовательность нуклеиновой кислоты (SEQ ID NO:6), кодирующая полипептид LYPD3 человека, и аминокислотная последовательность полипептида LYPD3 человека (SEQ ID NO:7).
На фигурах 4A и 4B представлены последовательности нуклеиновых кислот (SEQ ID NO:8 и 9), кодирующие полипептид LYPD5 человека, и на фигуре 4C представлена аминокислотная последовательность полипептида LYPD5 человека (SEQ ID NO:10).
На фигурах 5A и 5B представлена последовательность нуклеиновой кислоты (SEQ ID NO:11), кодирующая полипептид LY6D человека, и аминокислотная последовательность полипептида LY6D человека (SEQ ID NO:12).
На фигурах 6A и 6B представлена последовательность нуклеиновой кислоты (SEQ ID NO:13), кодирующая полипептид LY6E человека, и аминокислотная последовательность полипептида LY6E человека (SEQ ID NO:14).
На фигурах 7A и 7B представлена последовательность нуклеиновой кислоты (SEQ ID NO:15), кодирующая полипептид LYPD2 человека, и аминокислотная последовательность полипептида LYPD2 человека (SEQ ID NO:16).
На фигурах 8A-8H представлены последовательности молекул GLG-1 (ESL-1): (A-B) регистрационный номер No. U64791, последовательность нуклеиновой кислоты (SEQ ID NO:17), кодирующая полипептид GLG-1 (ESL-1) человека (SEQ ID NO:18); (C-D) регистрационный номер No. NM_012201, последовательность нуклеиновой кислоты (SEQ ID NO:19), кодирующая полипептид GLG-1 (ESL-1) человека (SEQ ID NO:20); (E-F) регистрационный номер No. AK172806, последовательность нуклеиновой кислоты (SEQ ID NO:21), кодирующая полипептид GLG-1 (ESL-1) человека (SEQ ID NO:22); и регистрационный No. AK131501, последовательность нуклеиновой кислоты (SEQ ID NO:23), кодирующая полипептид GLG-1 (ESL-1) человека (SEQ ID NO:24).
На фигурах 9A и 9B представлена последовательность нуклеиновой кислоты (SEQ ID NO:25), кодирующая полипептид LY6A человека, и аминокислотная последовательность полипептида LY6A человека (SEQ ID NO:26).
На фигурах 10A и 10B представлена последовательность нуклеиновой кислоты (SEQ ID NO:27), кодирующая полипептид LY6C мыши, и аминокислотная последовательность полипептида LY6C мыши (SEQ ID NO:28).
На фигурах 11A и 11B представлена последовательность нуклеиновой кислоты (SEQ ID NO:29), кодирующая полипептид LY6D мыши, и аминокислотная последовательность полипептида LY6D мыши (SEQ ID NO:30).
На фигурах 12A и 12B представлена последовательность нуклеиновой кислоты (SEQ ID NO:31), кодирующая полипептид LY6E мыши и аминокислотная последовательность полипептида LY6E мыши (SEQ ID NO:32).
На фигурах 13A и 13B представлена последовательность нуклеиновой кислоты (SEQ ID NO:33), кодирующая полипептид LY6F мыши, и аминокислотная последовательность полипептида LY6F мыши (SEQ ID NO:34).
На фигурах 14A и 14B представлена последовательность нуклеиновой кислоты (SEQ ID NO:35), кодирующая полипептид LY6I мыши, и аминокислотная последовательность полипептида LY6I мыши (SEQ ID NO:36).
На фигурах 15A и 15B представлена последовательность нуклеиновой кислоты (SEQ ID NO:37), кодирующая полипептид LY6K мыши, и аминокислотная последовательность полипептида LY6K мыши (SEQ ID NO:38).
На фигурах 16A и 16B представлена последовательность нуклеиновой кислоты (SEQ ID NO:45), кодирующая полипептид LYPD3 мыши, и аминокислотная последовательность полипептида LYPD3 мыши (SEQ ID NO:46).
На фигурах 17A и 17B представлена последовательность нуклеиновой кислоты (SEQ ID NO:47), кодирующая полипептид LY6H мыши, и аминокислотная последовательность полипептида LY6H мыши (SEQ ID NO:48).
На фигурах 18A и 18B представлена последовательность нуклеиновой кислоты (SEQ ID NO:49), кодирующая полипептид LYPD1 мыши, и аминокислотная последовательность полипептида LYPD1 мыши (SEQ ID NO:50).
На фигурах 19A и 19B представлена последовательность нуклеиновой кислоты (SEQ ID NO:51), кодирующая полипептид LYPD2 мыши, и аминокислотная последовательность полипептида LYPD2 мыши (SEQ ID NO:52).
На фигурах 20A и 20B представлена последовательность нуклеиновой кислоты (SEQ ID NO:53), кодирующая полипептид LY6g5c мыши, и аминокислотная последовательность полипептида LY6g5c мыши (SEQ ID NO:54).
На фигурах 21A и 22B представлена последовательность нуклеиновой кислоты (SEQ ID NO:55), кодирующая полипептид LY6g6c мыши, и аминокислотная последовательность полипептида LY6g6c мыши (SEQ ID NO:56).
На фигурах 22A и 22B представлена последовательность нуклеиновой кислоты (SEQ ID NO:57), кодирующая полипептид SLURP2/LYNX1 мыши, и аминокислотная последовательность полипептида SLURP2/LYNX1 мыши (SEQ ID NO:58).
На фигуре 23 показано, что члены семейства LY6 активируются в IEC в моделях колита на мышах. IEC, как в модели IL10-/- (фигура 23A), так и в модели перенесенного колита CD45RBHi (фигура 23B), выделяли посредством LCM и РНК очищали. Проводили анализ на микрочипах и анализировали, как описано в разделе "Примеры". Числовые значения соответствуют среднему значению изменения в кратности по сравнению с универсальным стандартом РНК для мышей с колитом по сравнению со здоровыми мышами. Числовые значения ниже тепловой карты указывают на показатель воспаления у отдельной мыши.
На фигурах 24A-24D показано, что поверхностная экспрессия молекул LY6 активируется на IEC в модели колита IL10-/-. В моделях перенесенного колита мышей дикого типа (фигура 24A) или IL10 -/- (фигура 24B) проводили окрашивание на поверхностную экспрессию LY6A (зеленый, с контрастирующим окрашиванием DAPI). Аналогично, для мышей дикого типа (фигура 24C) или IL10 -/- (фигура 24D) проводили окрашивание на поверхностную экспрессию LY6C.
На фигурах 25A-25I показано, что поверхностная экспрессия LY6A и LY6C повышается в ответ на воспалительные цитокины, в частности IFNγ. Клетки YAMC обрабатывали указанным цитокином в течение 15 часов и окрашивали на поверхностную экспрессию LY6C (фигура 25A) и LY6A (фигура 25B). Клетки YAMC культивировали в течение 15 часов в присутствии возрастающих доз IFNγ и анализировали проточной цитометрией в отношении экспрессии LY6C (фигура 25C) и LY6A (фигура 25D). Стимулированные посредством IFNγ клетки YAMC собирали в различные моменты времени, как указано, и анализировали проточной цитометрией в отношении экспрессии LY6C (фигура 25E) и LY6A (фигура 25F). IL-22 повышал экспрессию как LY6C (фигура 25G), так и LY6A (фигура 25H). Уровни как LY6A, так и LY6C были повышены в линии IEC мышей, CMT93, в ответ на обработку посредством IFNγ (фигура 25I).
Фигуры 26A-26E. Истощение липидных рафтов приводит к ингибированию опосредуемой LY6C продукции хемокинов. Клетки YAMC с истощением холестерина (темные столбики) или без истощения (незакрашенные столбики) инкубировали со связанным с планшетом антителом против KLH или против LY6C, как указано, в течение 15 часов. РНК собирали и определяли уровни экспрессии CXCL2, CXCL5 и CCL7 (фигуры 26A-26C). Поверхностные уровни LY6A (фигура 26D) и LY6C (фигура 26E) снижались в ответ на истощение холестерина.
На фигурах 27A-27D показано, что поперечное связывание LY6C, но не LY6A, индуцирует повышение поверхностной экспрессии LY6A и LY6C. Клетки YAMC инкубировали в течение 24 часов на планшетах, покрытых контрольным антителом против KLH, антителом против LY6A или антителом против LY6C, и анализировали проточной цитометрией в отношении экспрессии LY6C (фигура 27A) или LY6A (фигура 27B). Клетки предварительно обрабатывали в течение 12 часов 100 ед./мл IFNγ и аналогично помещали в покрытые антителом планшеты и анализировали в отношении экспрессии LY6C (фигура 27C) или LY6A (фигура 27D).
На фигурах 28A-28C показано, что поперечное связывание LY6C, но не LY6A, индуцирует секрецию хемокинов. Фигура 28A: клетки YAMC предварительно инкубировали, как указано, с 100 ед./мл IFNγ в течение 15 часов, или предварительно не инкубировали, и культивировали на планшетах, покрытых 10 мкг/мл антитела LY6A (черные столбики) или антитела против LY6C (заштрихованный столбики) или контрольным антителом против KLH (незакрашенные столбики). РНК выделяли через 24 (слева), 48 (центр) и 72 (справа) часов и анализировали в отношении экспрессии CXCL5 или CCL7 (A). Данные указывают на среднее значение ± SD изменение в кратности (как определяют способом 2-∆∆Ct) по сравнению с необработанными клетками, поперечно-связанными изотипическим антителом. Фигура 28B: Супернатанты собирали через 48 часов в клетках, поперечно-связанных, как указано выше, посредством 1, 5 или 10 мкг/мл (как указано) антитела, и в супернатанте определяли секрецию CXCL5 посредством ELISA. *<0,05. Фигура 28C: Уровни как CXCL5, так и CXCL2 в ответ на поперечное связывание LY6C снижались, когда уровни LY6C снижали посредством siРНК.
На фигурах 29A-29B показано, что IEC при колите обладают сходным паттерном экспрессии генов хемокинов. IEC как в модели IL10-/- (фигура 29A), так и в модели перенесенного колита CD45RBHi (фигура 29B) выделяли посредством LCM и РНК очищали. Проводили анализ на микрочипах и анализировали, как описано в разделе "Примеры". Числовые значения соответствуют среднему значению изменений в кратности по сравнению с универсальным стандартом РНК для мышей с колитом относительно здоровых мышей. Числовые значения ниже тепловой карты указывают на показатель воспаления у отдельной мыши.
На фигурах 30A-30C показано, что экспрессия генов семейства LY6 человека повышается в клетках толстого кишечника, обработанных цитокинами. Клетки Colo-205 человека обрабатывали указанными цитокинами или сочетаниями цитокинов в течение 18 или 24 часов. Возрастание в кратности экспрессии LY6H человека (фигура 30A), LYPD3 человека (фигура 30B) и LYPD5 человека (фигура 30C) показано по сравнению с контролем, представляющим собой β-актин человека.
На фигурах 31A-31B показано, что пациенты с болезнью Крона обладают повышенными уровнями LYPD1 (фигура 31A) и LYPD5 (фигура 31B) в толстом кишечнике. Получали образцы тканей у людей-пациентов с IBD и определяли экспрессию генов LYPD1 и LYPD5. Наблюдали статистически значимое повышение экспрессии LYPD1 и LYPD5 в воспаленной ткани пациентов с CD. Также наблюдали статистически значимое повышение экспрессии LYPD5 в воспаленной ткани пациентов с UC. Значения на оси Y отражают экспрессию генов относительно универсального стандарта РНК.
На фигурах 32A и 32B показаны (A) нетрансфицированные клетки COS и (B) клетки COS, трансфицированные полипептидом GLG-1 (ESL-1), окрашенные белком LYPD5-Fc.
На фигуре 33A представлена структура GLG-1 или ESL-1 и различные фрагменты, пригодные для охарактеризации связывания LYPD5, а на фигуре 33B показаны результаты исследования коиммунопреципитации, характеризующие связывание LYPD5 и лиганда LYPD5.
На фигуре 34A представлена структура GLG-1 или ESL-1 и различных фрагментов, пригодных для охарактеризации связывания LYPD5, а на фигуре 34B показаны результаты исследования коиммунопреципитации, характеризующие связывание LYPD5 и лиганда LYPD5.
На фигуре 35A представлена структура GLG-1 или ESL-1 и различных фрагментов, пригодных для охарактеризации связывания LYPD5, а на фигуре 35B показаны результаты исследования коиммунопреципитации, характеризующие связывание LYPD5 и лиганда LYPD5.
На фигурах 36A и 36B представлена последовательность нуклеиновой кислоты (SEQ ID NO:68), кодирующая интегрин бета 7 человека, и аминокислотная последовательность полипептида интегрина бета 7 человека (SEQ ID NO: 69).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
“Воспалительное заболевание кишечника” или “IBD” используют в настоящем документе взаимозаменяемо для определения заболеваний кишечника, которые вызывают воспаление и/или изъязвление, и они включают, но не ограничивается ими, болезнь Крона и язвенный колит.
“Болезнь Крона (CD)” или “язвенный колит (UC)” представляют собой хронические воспалительные заболевания кишечника неизвестной этиологии. Болезнь Крона, в отличие от язвенного колита, может поражать любую часть кишечника. Наиболее выделяющимся признаком болезни Крона является гранулярное красновато-фиолетовое отечное утолщение стенки кишечника. При развитии воспаления эти гранулемы часто теряют их ограниченные границы и интегрируются с окружающей тканью. Преобладающими клиническими признаками являются диарея и обструкция кишечника. Как и в случае язвенного колита, течение болезни Крона может быть постоянным или рецидивирующим, мягким или тяжелым, но, в отличие от язвенного колита, болезнь Крона не поддается излечению резекцией вовлеченного сегмента кишечника. Большинству пациентов с болезнью Крона в некоторый момент времени требуется хирургическая операция, однако часто происходит последующее обострение и обычным является постоянное медикаментозное лечение.
Болезнь Крона может поражать любую часть пищеварительного тракта от ротовой полости до анального отверстия, хотя, как правило, она возникает в подвздошно-ободочной области, области тонкого кишечника или области толстой кишки и заднего прохода. Гистопатологически заболевание проявляется дискретными гранулемами, абсцессами крипт, трещинами и афтозными язвами. Воспалительный инфильтрат является смешанным, состоящим из лимфоцитов (как T-, так и B-клеток), плазматических клеток, макрофагов, и нейтрофилов. Происходит непропорциональное повышение IgM- и IgG-секретирующих плазматических клеток, макрофагов и нейтрофилов.
Противовоспалительные лекарственные средства сульфасалазин и 5-аминосалициловая кислота (5-ASA) пригодны для лечения болезни Крона в толстом кишечнике с мягкой активностью, и их обычно назначают для поддержания ремиссии заболевания. Метронидазол и ципрофлоксацин обладают эффективностью, сходной с сульфасалазином, и оказываются особенно пригодными для лечения перианального заболевания. В более тяжелых случаях для лечения активных обострений эффективны кортикостероиды, и они могут даже поддерживать ремиссию. Азатиоприн и 6-меркаптопурин также продемонстрировали успех у пациентов, которым требуется длительное введение кортикостероидов. Также возможно, что эти лекарственные средства могут участвовать в длительной профилактике. К сожалению, у некоторых пациентов перед возникновением эффекта может быть очень длительная задержка (вплоть до шести месяцев).
Лекарственные средства против диареи также могут обеспечить смягчение симптомов у некоторых пациентов. Лечебное питание или элементная диета могут улучшить состояние питания пациентов и индуцировать улучшение симптомов острого заболевания, однако они не индуцируют длительных клинических ремиссий. Для лечения вторичного избыточного роста бактерий и лечения гнойных осложнений применяют антибиотики.
“Язвенный колит (UC)” поражает толстый кишечник. Течение заболевания может быть постоянным или рецидивирующим, мягким или тяжелым. Наиболее ранним повреждением является воспалительная инфильтрация с образованием абсцесса в основании либеркюновых крипт. Сращение этих растянутых и разорвавшихся крипт обеспечивает тенденцию к разделению вышележащей слизистой оболочки и кровоснабжения, что ведет к изъязвлению. Симптомы заболевания включают спазм, боль в нижней части живота, кровотечение из прямой кишки и частые опорожнения с жидким стулом, состоящим, главным образом, из крови, гноя и слизи со скудными частицами кала. При остром, тяжелом или хроническом неремитирующем язвенном колите может требоваться колэктомия.
Клинические признаки UC в значительной степени варьируют, и начало может быть постепенным или внезапным, и оно может включать диарею, тенезмы и рецидивирующее кровотечение из прямой кишки. При быстром вовлечении всего толстого кишечника может произойти токсический мегаколон, угрожающая жизни ситуация. Внекишечные проявления включают артрит, гангренозную пиодермию, увеит и узловатую эритему.
Лечение UC включает сульфасалазин и сходные салицилат-содержащие лекарственные средства при мягких случаях и кортикостероидные лекарственные средства в тяжелых случаях. Иногда является эффективным местное введение либо салицилатов, либо кортикостероидов, в частности когда заболевание ограничено дистальным отделом кишечника, и оно ассоциировано со сниженными побочными эффектами по сравнению с системным применением. Иногда показаны поддерживающие меры, такие как введение железа и средств против диареи. Также иногда назначают азатиоприн, 6-меркаптопурин и метотрексат для применения в рефрактерных кортикостероид-зависимых случаях.
Как используют в настоящем документе, “член семейства генов LY6” или “член суперсемейства генов LY6” используют в настоящем документе взаимозаменяемо для определения гена, имеющего гомологию с членами семейства генов LY6, большинство из которых представляют собой GPI-заякоренные гликопротеины клеточной поверхности, широко распространенные на клетках гематопоэтического происхождения и более ограниченно экспрессирующиеся на негематопоэтических клетках. Члены этого семейства генов используют в качестве маркеров дифференцировки иммунных клеток (Sunderkotter, C. et al., J. Immunol. 172:4410-4417 (2004)). Гены семейства LY6 были изучены (Shevach, E.M. и P.E. Korty, Immunol. Today 10:195-200 (1989)), и их функции включают активацию T-клеток (Zhang, Z.X. et al., Eur. J. Immunol. 32:1584-1592 (2002) и Henderson, S.C. et al., J. Immunol. 168:118-126 (2002)), обоняние (Chou, J.H. et al., Genetics 157:211-224 (2001)) и клеточную адгезию (Jaakkola, I. et al., J. Immunol. 170:1283-1290 (2003)). Члены семейства генов LY6 включают, но не ограничиваются ими, члены семейства генов LY6 млекопитающих, такие как гены семейства LY6 мыши или человека. Как используют в настоящем документе, “ген LY6” относится к члену семейства генов LY6, а “полипептид LY6” относится к полипептиду, кодируемому геном LY6. Члены семейства генов LY6 мыши включают, но не ограничиваются ими, LY6A (NM_010738, нуклеиновая кислота SEQ ID NO:25, которая кодирует полипептид SEQ ID NO:26), LY6C (NM_010741, нуклеиновая кислота SEQ ID NO:27, которая кодирует полипептид SEQ ID NO:28), LY6D (NM_003695, нуклеиновая кислота SEQ ID NO:29, которая кодирует полипептид SEQ ID NO:30), LY6E (NM_002346, нуклеиновая кислота SEQ ID NO:31, которая кодирует полипептид SEQ ID NO:32), LY6F (NM_008530, нуклеиновая кислота SEQ ID NO:33, которая кодирует полипептид SEQ ID NO:34), LY6I (NM_020498, нуклеиновая кислота SEQ ID NO:35, которая кодирует полипептид SEQ ID NO:36) и LY6K (NM_017527, нуклеиновая кислота SEQ ID NO:37, которая кодирует полипептид SEQ ID NO:38). Члены семейства генов LY6 человека включают, но не ограничиваются ими, LY6H (NM_002347, нуклеиновая кислота SEQ ID NO:1, которая кодирует полипептид SEQ ID NO:2), LYPD1 (NM_144586, нуклеиновая кислота SEQ ID NO:3 или 4, которая кодирует полипептид SEQ ID NO:5), LYPD3 (NM_014400, нуклеиновая кислота SEQ ID NO:6, которая кодирует полипептид SEQ ID NO:7), LYPD5 (NM_182573, нуклеиновая кислота SEQ ID NO:8 или 9, которая кодирует полипептид SEQ ID NO:10), LY6D (NM_003695, нуклеиновая кислота SEQ ID NO:11, которая кодирует полипептид SEQ ID NO:12), LY6E (NMNM_002346, нуклеиновая кислота SEQ ID NO:13, которая кодирует полипептид SEQ ID NO:14), LYPD2 (NM_205545, нуклеиновая кислота SEQ ID NO:15, которая кодирует полипептид SEQ ID NO:16). В вариантах осуществления полинуклеотид каждого члена семейства генов LY6, описанного в настоящем документе, включает по меньшей мере 15, по меньшей мере 25, по меньшей мере 50, по меньшей мере 100, по меньшей мере 250, по меньшей мере 500, по меньшей мере 750, по меньшей мере 1000, по меньшей мере 1250, по меньшей мере 1500, по меньшей мере 1750, по меньшей мере 2000 или по меньшей мере 2040 последовательных нуклеотидов SEQ ID NO:1, 3, 4, 6, 8, 9, 11, 13, 15, 25, 27, 29, 31, 33, 35, 37, 45, 47, 49, 51, 53, 55, или 57, или полинуклеотид члена семейства генов LY6 содержит SEQ ID NO:1, 3, 4, 6, 8, 9, 11, 13, 15, 25, 27, 29, 31, 33, 35, 37, 45, 47, 49, 51, 53, 55 или 57. В одном варианте осуществления полинуклеотид, который связывает полинуклеотид члена семейства генов LY6 (SEQ ID NO:1, 3, 4, 6, 8, 9, 11, 13, 15, 25, 27, 29, 31, 33, 35, 37, 45, 47, 49, 51, 53, 55 или 57), или его фрагмент обладает по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 99% или 100% идентичностью последовательности с полипептидом LY6 или его фрагментом. В одном варианте осуществления полипептид члена семейства генов LY6 содержит по меньшей мере 10, по меньшей мере 25, по меньшей мере 50, по меньшей мере 75, по меньшей мере 100, по меньшей мере 125, по меньшей мере 150, по меньшей мере 175, по меньшей мере 200, по меньшей мере 225, по меньшей мере 250, по меньшей мере 275, по меньшей мере 300 или по меньшей мере 325, по меньшей мере последовательных аминокислот SEQ ID NO:2, 5, 7, 10, 12, 14, 26, 28, 30, 32, 34, 36, 38, 46, 48, 50, 52, 54, 56 или 58, или полипептид семейства генов LY6 содержит SEQ ID NO:2, 5, 7, 10, 12, 14, 26, 28, 30, 32, 34, 36, 38, 46, 48, 50, 52, 54, 56 или 58.
“Полипептид с нативной последовательностью” любого из членов семейства генов LY6 содержит полипептид, имеющий ту же аминокислотную последовательность, что и соответствующий природный полипептид члена семейства генов LY6. Такие полипептиды с нативной последовательностью LY6 можно выделять из природных источников или их можно получать рекомбинантными или синтетическими способами. Термин “полипептид LY6 с нативной последовательностью” конкретно охватывает природные укороченные или секретируемые формы конкретного полипептида LY6 (например, последовательности внеклеточного домена), природные формы вариантов (например, альтернативно-сплайсированные формы) и природные аллельные варианты полипептида. В одном конкретном аспекте полипептиды LY6 с нативной последовательностью, описанные в настоящем документе, представляют собой зрелые или полноразмерные полипептиды с нативной последовательностью, соответствующие последовательностям на фигурах 1-7 и SEQ ID NO:2, 5, 7, 10, 12, 14, 26, 28, 30, 32, 34, 36, 38, 46, 48, 50, 52, 54, 56 или 58.
Как используют в настоящем документе, “вариант полипептида LY6” означает полипептид LY6, предпочтительно его биологически активные формы, как определено выше, обладающий по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности с полноразмерной последовательностью полипептида LY6 с нативной последовательностью, как описано в настоящем документе, и его формами вариантов, лишенными сигнального пептида, внеклеточного домена, или любым другим фрагментом полноразмерного полипептида LY6 с нативной последовательностью, таким как фрагменты, упоминаемые в настоящем документе. Такие варианты полипептидов включают, например, полипептиды, где добавлены или удалены один или несколько аминокислотных остатков на N- или C-конце полноразмерной нативной аминокислотной последовательности. В конкретном аспекте такие варианты полипептидов будут обладать по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью аминокислотной последовательности, с последовательностью полноразмерного полипептида LY6 с нативной последовательностью, как описано в настоящем документе, и его формами вариантов, лишенными сигнального пептида, внеклеточного домена, или любым другим фрагментом полноразмерного полипептида LY6 с нативной последовательностью, таким как фрагмент, описанный в настоящем документе.
"Процентную (%) идентичность аминокислотных последовательностей" в отношении последовательности полипептида LY6, идентифицированного в настоящем документе, определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в конкретной последовательности полипептида LY6, после выравнивания последовательностей и внесения разрывов, если необходимо, для достижения максимальной процентной идентичности последовательностей, и не считая какие-либо консервативные замены частью идентичности последовательностей. Выравнивание для целей определения процентной идентичности аминокислотных последовательностей можно проводить различными способами, которые находятся в пределах специальных знаний, например с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для проведения выравнивания, включая любые алгоритмы, требуемые для достижения максимального выравнивания на протяжении всей длины сравниваемых последовательностей. Однако для целей, представленных в настоящем документе, значения % идентичности аминокислотных последовательностей получают с использованием компьютерной программы для сравнения последовательностей ALIGN-2, где полный исходный текст для программы ALIGN-2 предоставлен в таблице 1 ниже. Компьютерная программа для сравнения последовательностей ALIGN-2 была составлена в Genentech, Inc. и исходный текст, представленный в таблице 1 ниже, был представлен с пользовательской документацией в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован под U.S. Copyright Registration No. TXU510087. Программа ALIGN-2 является общедоступной через Genentech, Inc., South San Francisco, California, или ее можно составить из исходного текста, представленного в таблице 1 ниже. Программа ALIGN-2 должна быть составлена для применения на операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не изменяются.
Как используют в настоящем документе, “вариант полинуклеотида LY6”, или “вариант последовательности нуклеиновой кислоты LY6”, или “ген LY6” относится к молекуле нуклеиновой кислоты, которая кодирует полипептид члена семейства генов LY6, предпочтительно его биологически активную форму, как определено в настоящем документе, и которая обладает по меньшей мере приблизительно 80% идентичностью последовательности нуклеиновой кислоты с последовательностью нуклеиновой кислоты, кодирующей последовательность полноразмерного полипептида LY6 с нативной последовательностью, идентифицированного в настоящем документе, или любой другой фрагмент соответствующей последовательности полноразмерного полипептида LY6, как указано в настоящем документе (такой как фрагменты, кодируемые нуклеиновой кислотой, которая соответствует только части полной кодирующей последовательности для полноразмерного полипептида LY6). Как правило, такие варианты полинуклеотидов будут обладать по меньшей мере приблизительно 80% идентичностью последовательности нуклеиновой кислоты, альтернативно по меньшей мере приблизительно 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности нуклеиновой кислоты с последовательностью нуклеиновой кислоты, кодирующей соответствующую полноразмерную последовательность полипептида LY6 с нативной последовательностью или любой другой фрагмент соответствующей полноразмерной последовательности полипептида LY6, идентифицированный в настоящем документе. Такие варианты полинуклеотидов не охватывают нативную нуклеотидную последовательность.
Как правило, длина таких вариантов полинуклеотидов варьирует по меньшей мере приблизительно на 50 нуклеотидов относительно полипептида с нативной последовательностью, альтернативно вариабельность длины может составлять по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 или 1000 нуклеотидов, где в этом контексте термин “приблизительно” означает указанную длину нуклеотидной последовательности плюс или минус 10% этой указанной длины.
"Процентная идентичность (%) последовательностей нуклеиновых кислот" в отношении последовательностей нуклеиновых кислот, кодирующих полипептид гена LY6, идентифицированных в настоящем документе, определяют как процент нуклеотидов в последовательности-кандидате, которые идентичны нуклеотидам в представляющей интерес последовательности нуклеиновой кислоты гена LY6, соответственно, после выравнивания последовательностей и внесения разрывов, если необходимо, для достижения максимальной процентной идентичности последовательностей. Выравнивание для целей определения процентной идентичности последовательностей нуклеиновых кислот можно проводить различными способами, которые находятся в пределах специальных знаний, например с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Однако для целей, представленных в настоящем документе, значения % идентичности последовательностей нуклеиновых кислот получают с использованием компьютерной программы для сравнения последовательностей ALIGN-2, где полный исходный текст для программы ALIGN-2 предоставлен в таблице 1 ниже. Компьютерная программа для сравнения последовательностей ALIGN-2 была составлена в Genentech, Inc. и исходный текст, представленный в таблице 1 ниже, был представлен с пользовательской документацией в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован под U.S. Copyright Registration No. TXU510087. Программа ALIGN-2 является общедоступной через Genentech, Inc., South San Francisco, California, или ее можно составить из исходного текста, представленного в таблице 1 ниже. Программа ALIGN-2 должна быть составлена для применения на операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не изменяются.
В случаях, когда ALIGN-2 используют для сравнения последовательностей нуклеиновых кислот, % идентичность последовательностей нуклеиновых кислот для данной последовательности нуклеиновой кислоты C относительно, с или против данной последовательности нуклеиновой кислоты D (которая альтернативно может быть сформулирована как данная последовательность нуклеиновой кислоты C, которая имеет или включает определенную % идентичность последовательности нуклеиновой кислоты относительно, с или против данной последовательности нуклеиновой кислоты D) вычисляют следующим образом:
100, умноженное на частное W/Z
где W представляет собой количество нуклеотидов, оцененных как идентичные совпадения программой для выравнивания последовательностей ALIGN-2 при выравнивании этой программой C и D, и где Z представляет собой общее число нуклеотидов в D. Будет понятно, что когда длина последовательности нуклеиновой кислоты C не равна длине последовательности нуклеиновой кислоты D, % идентичность последовательности нуклеиновой кислоты C относительно D не будет равна % идентичности последовательности нуклеиновой кислоты D относительно C. В качестве примеров вычисления % идентичности последовательностей нуклеиновых кислот в таблицах 4 и 5 показано, как вычислять % идентичность последовательностей нуклеиновых кислот для последовательности нуклеиновой кислоты, обозначенной “ДНК для сравнения” с последовательностью нуклеиновой кислоты, обозначенной “REF-DNA”, где "REF-DNA" представляет собой гипотетическую представляющую интерес последовательность нуклеиновой кислоты, кодирующую ген LY6, "ДНК для сравнения" представляет собой нуклеотидную последовательность молекулы нуклеиновой кислоты, с которой сравнивают представляющую интерес молекулу нуклеиновой кислоты "REF-DNA", и каждый из "N", "L" и "V" представляют собой отличающиеся гипотетические нуклеотиды. Если конкретно не указано иное, все значения % идентичности последовательностей нуклеиновых кислот, используемые в настоящем документе, получают, как описано в предыдущем абзаце с использованием компьютерной программы ALIGN-2.
В других вариантах осуществления варианты полинуклеотидов гена LY6 представляют собой молекулы нуклеиновых кислот, которые кодируют полипептид LY6 соответственно и которые способны гибридизоваться в строгих условиях гибридизации и промывания с нуклеотидными последовательностями, кодирующими полноразмерный полипептид LY6 соответственно, как описано в настоящем документе. Такие варианты полипептидов могут представлять собой полипептиды, которые кодируются такими вариантами полинуклеотидов.
“Выделенный” при применении для описания различных полипептидов LY6, описанных в настоящем документе, означает полипептид, который идентифицирован и отделен и/или выделен из компонента его природного окружения. Загрязняющие компоненты его природного окружения представляют собой материалы, которые, как правило, препятствуют диагностическому и терапевтическому применению полипептида, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления такие полипептиды будут очищать (1) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом, или (2) до гомогенности при SDS-PAGE в восстанавливающих или невосстанавливающих условиях с использованием кумасси синего или предпочтительно окрашивания серебром. Такие выделенные полипептиды включают соответствующие полипептиды в рекомбинантных клетках in situ, поскольку в этом случае будет отсутствовать по меньшей мере один компонент природного окружения полипептида LY6. Однако, как правило, такие полипептиды будут получать посредством по меньшей мере одной стадии очистки.
“Выделенная” нуклеиновая кислота, кодирующая полипептид LY6, представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена по меньшей мере у одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в природном источнике кодирующей полипептид нуклеиновой кислоты. Любая из указанных выше таких выделенных молекул нуклеиновых кислот отличается формой или окружением, в котором она встречается в природе. Любые такие молекулы нуклеиновых кислот, таким образом, отличаются от конкретной кодирующей полипептид молекулы нуклеиновой кислоты, которая существует в природных клетках.
Термин “контрольные последовательности” относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Контрольные последовательности, которые пригодны для прокариот, включают, например, промотор, необязательно последовательность оператора и участок связывания рибосом. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является "функционально связанной", если она находится в функциональной связи с другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или секреторной лидерной последовательности функционально связана с ДНК полипептида, если она экспрессируются в качестве пребелка, который участвует в секреции полипептида; промотор или энхансер является функционально связанным с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или участок связывания рибосом является функционально связанным с кодирующей последовательностью, если он расположен таким образом, чтобы облегчить трансляцию. Как правило, "функционально связанный" означает, что связанные последовательности ДНК являются смежными и, в случае секреторной лидерной последовательности, являются смежными и находятся в рамке считывания. Однако энхансеры не должны быть смежными. Связывание осуществляют посредством лигирования в соответствующих участках рестрикции. Если таких участков нет, используют синтетические олигонуклеотидные соединительные элементы или линкеры в соответствии с общепринятой практикой.
Как используют в настоящем документе, “экспрессия”, как применяют в отношении экспрессии гена, относится к транскрипции гена, кодирующего белок, с образованием мРНК, а также к трансляции мРНК с образованием белка, кодируемого геном. Таким образом, повышенная или сниженная экспрессия относится к повышенной или сниженной транскрипции гена и/или повышенной или сниженной трансляции мРНК, образовавшейся при транскрипции.
"Строгость" реакций гибридизации легко определяет специалист в данной области, и, как правило, она представляет собой эмпирическое вычисление, зависящее от длины зонда, температуры промывания и концентрации соли. Как правило, для надлежащего отжига более длинные зонды требуют более высоких температур, в то время как более короткие зонды требуют более низких температур. Гибридизация, как правило, зависит от способности денатурированной ДНК к повторному отжигу, когда комплементарные цепи присутствуют в окружающей среде при температуре ниже их температуры отжига. Чем более высокой является степень требуемой гомологии между зондом и гибридизуемой последовательностью, тем более высокой является относительная температура, которую можно использовать. В результате из этого следует, что более высокие относительные температуры будут обеспечивать тенденцию к более строгим условиям реакции, в то время как более низкие температуры снижают строгость. Для дополнительных деталей и разъяснения строгости реакций гибридизации см. Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers (1995).
"Строгие условия" или "условия высокой строгости", как определено в настоящем документе, можно определить как условия, в которых: (1) используют низкую ионную силу и высокую температуру промывания, например 0,015 M хлорид натрия/0,0015 M цитрат натрия/0,1% додецилсульфат натрия при 50°С; (2) используют в ходе гибридизации денатурирующее средство, такое как формамид, например 50% (об./об.) формамид с 0,1% бычьим сывороточным альбумином/0,1% Ficoll/0,1% поливинилпирролидоном/50 мМ натрий-фосфатным буфером при pH 6,5 с 750 мМ хлоридом натрия, 75 мМ цитратом натрия при 42°C; или (3) проводят гибридизацию в течение ночи в растворе, в котором используется 50% формамид, 5 × SSC (0,75 M NaCl, 0,075 M цитрат натрия), 50 мМ фосфат натрия (pH 6,8), 0,1% пирофосфат натрия, 5 x раствор Денхардта, обработанная ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% сульфат декстрана при 42°C, с промыванием в течение 10 минут при 42°C в 0,2 × SSC (хлорид натрия/цитрат натрия) с последующим промыванием высокой строгости в течение 10 минут, состоящим из 0,1 × SSC, содержащего EDTA, при 55°C.
"Условия умеренной строгости" можно определить, как описано в Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989, и они включают применение менее строгого раствора для промывания и условий гибридизации (например, температуры, ионной силы и % SDS), чем раствор для промывания и условия гибридизации, описанные выше. Примером умеренно строгих условий является инкубация в течение ночи при 37°C в растворе, содержащем: 20% формамид, 5 × SSC (150 мМ NaCl, 15 мМ трицитрат натрия), 50 мМ фосфат натрия (pH 7,6), 5 x раствор Денхардта, 10% сульфат декстрана и 20 мг/мл денатурированной расщепленной ДНК спермы лосося, с последующим промыванием фильтров в 1 x SSC при приблизительно 37-50°С. Специалисту будет понятно, каким образом корректировать температуру, ионную силу и т.д., в случае необходимости приспосабливания к таким факторам, как длина зонда и т.п.
Термин "меченный эпитопом" при применении в настоящем документе относится к химерному полипептиду, содержащему полипептид LY6, или к связывающему LY6 агенту, которые являются слитыми с "полипептидом-меткой". Полипептид-метка имеет достаточное количество остатков для обеспечения эпитопа, против которого можно получать антитело, но в то же время является достаточно коротким, чтобы не препятствовать активности полипептида, с которым он слит. Также полипептид-метка предпочтительно является совершенно уникальным, так что антитело по существу не вступает в перекрестные реакции с другими эпитопами. Пригодные полипептиды-метки, как правило, имеют по меньшей мере шесть аминокислотных остатков и, как правило, между приблизительно 8 и 50 аминокислотных остатков (предпочтительно между приблизительно 10 и 20 аминокислотных остатков).
“Активный” или “активность” для целей, представленных в настоящем документе, относится к форме(ам) полипептидов, которые сохраняют биологическую и/или иммунологическую активность нативного или природного полипептида, где “биологическая” активность относится к биологической функции (либо ингибиторной, либо стимулирующей), обеспечиваемой нативным или природным полипептидом, отличной от способности индуцировать образование антитела против антигенного эпитопа, которым обладает нативный или природный полипептид, и “иммунологическая” активность относится к способности индуцировать образование антитела против антигенного эпитопа, которой обладает нативный или природный полипептид. Активный полипептид, как используют в настоящем документе, представляет собой антиген, который экспрессируется иначе, либо количественно, либо качественно, в ткани IBD, относительно его экспрессии в аналогичной ткани, которая не поражена IBD.
Термин “антагонист” используют в наиболее широком смысле, и он включает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность нативного полипептида, описанного в настоящем документе. Пригодные молекулы антагонистов конкретно включают антитела-антагонисты или фрагменты антител, фрагменты или варианты аминокислотной последовательности нативных полипептидов, пептиды, антисмысловые олигонуклеотиды, низкомолекулярные органические молекулы и т.д. Способы идентификации антагонистов могут включать контактирование такого полипептида, включая экспрессирующую его клетку, с молекулой-кандидатом агониста или антагониста и измерение детектируемого изменения одного или нескольких видов биологической активности, в норме ассоциированных с таким полипептидом.
"Проведение лечения", или "лечение", или "смягчение течения" относится как к терапевтическим, так и к профилактическим или превентивным мерам, где целью является предотвратить или замедлить (уменьшить) прогрессирование заболевания. Также лечение относится к модификации прогрессирования IBD.
“Диагностика” относится к процессу идентификации или определения отличительных признаков заболевания, включая, но не ограничиваясь ими, IBD, UC и/или болезнь Крона. Процесс диагностики также иногда отражает определение стадии или классификацию заболевания, исходя из тяжести или прогрессирования заболевания, а также локализации (например, такой как локализация в желудочно-кишечном тракте или вдоль него, где обнаружено воспаление и/или измененная экспрессия генов).
Субъекты, нуждающиеся в диагностике, включают субъектов, уже имеющих измененную экспрессию LY6, а также субъектов, предрасположенных к наличию измененной экспрессии LY6, или субъектов, у которых подлежит провести профилактику измененной экспрессии LY6. Таким образом, аспектом изобретения является выявление терапевтического ответа на лекарственное средство у млекопитающего, которого лечат лекарственным средством для лечения IBD, где способ включает определение экспрессии Ih LY6 в ткани желудочно-кишечного тракта тестируемого млекопитающего по сравнению с контролем и определение того, что уровни экспрессии LY6 не отличаются значимо от нормальных контрольных уровней экспрессии. В одном варианте осуществления терапевтический ответ определяют, когда уровни экспрессии LY6 млекопитающего, подвергаемого лечению лекарственным средством, отличаются (экспрессия более сходна с нормальным контролем, т.е. уровни экспрессии LY6 являются более низкими, чем уровни экспрессии LY6 у млекопитающего до лечения).
Указанные выше параметры для оценки успешного лечения и улучшения течения заболевания могут быть легко определены стандартными процедурами, известными клиническим специалистам. В случае терапии IBD эффективность может быть измерена, например, оценкой времени прогрессирования заболевания (ТТР) и/или определением скорости ответа (RR). Могут быть взяты биопсии для оценки экспрессии гена и наблюдения гистопатологии желудочно-кишечной ткани пациента. Изобретение, описанное в настоящем документе, относящееся к способу составления прогноза и/или диагностирования, включает определение и оценку стимуляции экспрессии гена LY6.
"Млекопитающее" для целей лечения, смягчения симптомов или диагностики IBD относится к любому животному, классифицируемому как млекопитающее, включая человека, домашних и сельскохозяйственных животных, животных зоопарков, спортивных животных или комнатных животных, таких как собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи, козы, кролики, одомашненные хорьки и т.д. Предпочтительно млекопитающее представляет собой человека.
Введение "в сочетании с" одним или несколькими дополнительными лекарственными средствами включает одновременное (совместное) и последовательное введение в любом порядке.
Как используют в настоящем документе, "носители" включают фармацевтически приемлемые носители, эксципиенты или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, подвергаемых их воздействию, в используемых дозировках и концентрациях. Часто физиологически приемлемый носитель представляет собой водный pH-буферный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; спирты сахаров, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEEN®, полиэтиленгликоль (PEG) или PLURONICS®.
Под "твердой фазой" или "твердой подложкой" подразумевают неводную матрицу, к которой полипептид, нуклеиновая кислота, антитело или связывающее LY6 средство могут быть присоединены или связаны. Примеры твердой фазы, охватываемые в настоящем документе, включают твердую фазу, образованную частично или полностью из стекла (например, стекла с контролируемым размером пор), полисахаридов (например, агарозы), полиакриламидов, полистирола, поливинилового спирта и силиконов. В определенных вариантах осуществления, в зависимости от контекста, твердая фаза может включать лунку планшета для анализа; в других вариантах осуществления она представляет собой колонку для очистки (например, колонку для аффинной хроматографии). Также этот термин включает дисперсную твердую фазу из дискретных частиц, такую как твердая фаза, описанная в патенте США No. 4275149.
"Липосома" представляет собой небольшую везикулу, состоящую из различных типов липидов, фосфолипидов и/или поверхностно-активного вещества, которые пригодны для доставки лекарственного средства млекопитающему. Компоненты липосомы обычно образуют двухслойную структуру, сходную с размещением липидов биологических мембран.
"Низкомолекулярная молекула" или "низкомолекулярная органическая молекула" согласно настоящему документу имеет молекулярную массу ниже примерно 500 Дальтон.
"Эффективное количество" средства-антагониста представляет собой количество, достаточное для достижения физиологического эффекта, такого как, но не ограничиваясь ими, ингибирование, частичное или полное, функции гена или кодируемого им белка. "Эффективное количество" можно определять эмпирически и общепринятыми способами, в зависимости от поставленной цели.
Термин "терапевтически эффективное количество" относится к количеству антагониста или другого лекарственного средства, эффективному для "лечения" заболевания или расстройства у субъекта или млекопитающего. В случае IBD терапевтически эффективное количество лекарственного средства будет восстанавливать измененную экспрессию LY6 до нормальных физиологических уровней; снижать воспаление в желудочно-кишечном тракте; снижать количество очагов повреждения в желудочно-кишечном тракте; и/или смягчать в некоторой степени один или несколько симптомов, ассоциированных с IBD, UC и/или CD. См. определение “лечения” в настоящем документе.
"Ингибирующее рост количество" антагониста представляет собой количество, способное ингибировать рост клетки, особенно опухолевой, например злокачественной клетки, либо in vitro, либо in vivo. Для целей ингибирования неопластического клеточного роста такое количество можно определять эмпирически и общепринятыми способами.
"Цитотоксическое количество" антагониста представляет собой количество, способное вызывать разрушение клетки, особенно пролиферирующей клетки, например злокачественной клетки, либо in vitro, либо in vivo. Для целей ингибирования неопластического клеточного роста такое количество можно определять эмпирически и общепринятыми способами.
Термин "антитело" используют в наиболее широком смысле, и конкретно он охватывает, например, моноклональные антитела против LY6 (включая антагонистические и нейтрализующие антитела), композиции антител LY6 с плейотропной специфичностью, поликлональные антитела, одноцепочечные антитела против LY6, полиспецифичные антитела (например, биспецифичные) и антигенсвязывающие фрагменты (см. ниже) всех из перечисленных выше антител, при условии, что они проявляют требуемую биологическую или иммунологическую активность. В настоящем документе термины “иммуноглобулин” (Ig) и "антитело" используют взаимозаменяемо.
"Выделенное" антитело представляет собой антитело, которое идентифицировано и отделено и/или извлечено из компонента его естественных окружающих условий. Загрязняющие компоненты его естественных окружающих условий представляют собой вещества, которые препятствуют применению антитела для диагностики или лечения, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления антитело очищают (1) до более чем 95% по массе антитела, как определяют способом Лоури, и наиболее предпочтительно до более чем 99% по массе, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом, или (3) до гомогенности при SDS-PAGE в восстанавливающих или невосстанавливающих условиях с использованием кумасси синего или предпочтительно окрашивания серебром. Выделенное антитело включает антитело в рекомбинантных клетках in situ, поскольку в этом случае отсутствует по меньшей мере один компонент условий естественного окружения антитела. Однако, как правило, выделенное антитело будет получено посредством по меньшей мере одной стадии очистки.
Основной элемент антитела из 4-цепей представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей (антитело IgM состоит из 5 основных гетеротетрамерных элементов вместе с дополнительным полипептидом, называемым J-цепью, и, таким образом, оно содержит 10 антигенсвязывающих участков, в то время как секретируемые антитела IgA могут полимеризоваться с образованием поливалентных систем, содержащих 2-5 основных элементов из 4-цепей вместе с J-цепью). В случае IgG элемент из 4-цепей, как правило, имеет массу 150000 дальтон. Каждая L-цепь связана с H-цепью одной ковалентной дисульфидной связью, в то время как две H-цепи связаны друг с другом одной или несколькими дисульфидными связями, в зависимости от изотипа H-цепи. Каждая H- и L-цепь имеет расположенные с равными интервалами межцепочечные дисульфидные мостики. Каждая H-цепь имеет на N-конце вариабельный домен (VH), за которым следуют три константных домена (CH) для каждой из α- и γ-цепей и четыре CH-домена для изотипов μ и ε. Каждая L-цепь имеет на N-конце вариабельный домен (VL), за которым следует константный домен (CL) на ее другом конце. VL выравнивается с VH и CL выравнивается с первым константным доменом тяжелой цепи (CH1). Полагают, что конкретные аминокислотные остатки образуют поверхность контакта между вариабельными доменами легкой цепи и тяжелой цепи. Образование пары VH и VL формирует один антигенсвязывающий участок. Для структуры и свойств различных классов антител см., например, Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, page 71 and Chapter 6.
L-цепь любых видов позвоночных может быть отнесена к одному из двух четко отличающихся типов, называемых каппа и лямбда, на основе аминокислотных последовательностей их константных доменов. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей (CH), иммуноглобулины можно отнести к различным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющих тяжелые цепи, обозначаемые как α, δ, ε, γ и μ соответственно. Классы γ и α далее подразделяются на подклассы на основе относительно небольших различий в последовательности CH и функции, например у человека экспрессируются следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Термин "вариабельный" относится к тому факту, что последовательности определенных сегментов вариабельных доменов значительно отличаются среди антител. V-домен опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако вариабельность не является равномерной на протяжении участка вариабельных доменов из 110 аминокислот. Вместо этого, V-участки состоят из относительно инвариантных участков, называемых каркасными областями (FR), из 15-30 аминокислот, разделенных более короткими участками высокой вариабельности, называемыми "гипервариабельными участками", длина которых составляет 9-12 аминокислот. Вариабельные домены нативных тяжелых и легких цепей содержат четыре FR, главным образом, приминающих конфигурацию β-слоев, соединенных тремя гипервариабельными участками, которые формируют петли, объединяющие структуру β-слоев и в некоторых случаях формирующие ее часть. Гипервариабельные области в каждой цепи расположены вместе в непосредственной близости от FR и, совместно с гипервариабельными областями другой цепи, участвуют в формировании антигенсвязывающего центра антител (см. Kabat et al., Sequences of Protein of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены не вовлечены непосредственно в связывание антитела с антигеном, но они проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
Как используют в настоящем документе, термин "гипервариабельная область" относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из "определяющей комплементарность области" или "CDR" (например, остатки по Kabat 24-34 (L1), 50-56 (L2) и 89-97 (L3) в VL и остатки по Kabat 31-35 (H1), 50-65 (H2) и 95-102 (H3) в VH (Kabat et al., Sequences of Protein of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) (1991)) и/или остатки из "гипервариабельной петли" (например, остатки по Chothia 26-32 (L1), 50-52 (L2) и 91-96 (L3) в VL и остатки по Chothia 26-32 (H1), 53-55 (H2) и 96-101 (H3) в VH (Chothia and Lesk J. Mol. Biol. 196:901-917) (1987)).
Как используют в настоящем документе, термин "моноклональное антитело" относится к антителу из совокупности по существу гомогенных антител, например отдельные антитела, составляющие совокупность, являются идентичными и/или связывают один и тот же эпитоп (эпитопы), за исключением возможных вариантов, которые могут появляться в процессе получения моноклонального антитела, которые могут быть представлены в небольших количествах. Такое моноклональное антитело, как правило, включает антитело, содержащее полипептидную последовательность, которая связывает мишень, где связывающая мишень полипептидная последовательность получена посредством процесса, который включает селекцию единичной связывающей мишень полипептидной последовательности из множества полипептидных последовательностей. Например, процесс селекции может представлять собой селекцию единичного клона из множества клонов, таких как пул гибридомных клонов, фаговых клонов или клонов рекомбинантных ДНК. Следует понимать, что отобранную связывающую мишень последовательность можно дополнительно изменять, например, для повышения аффинности к мишени, для гуманизации связывающей мишень последовательности, для повышения ее продукции в клеточной культуре, для снижения ее иммуногенности in vivo, для создания полиспецифичного антитела и т.д. и что антитело, содержащее измененную связывающую мишень последовательность, также является моноклональным антителом по этому изобретению. В противоположность препаратам поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклонального антитела направлено против одной детерминанты на антигене. В дополнение к их специфичности, препараты моноклонального антитела является преимущественными в том, что они, как правило, не содержат примесей других иммуноглобулинов. Определение "моноклональный" указывает на тот признак антитела, что его получают из по существу гомогенной совокупности антител, и не подразумевает того, что антитело должно быть получено каким-либо конкретным способом. Например, моноклональные антитела, предназначенные для применения в соответствии с настоящим изобретением, можно получать множеством способов, включая, например, способ гибридом (например, Kohler et al., Nature, 256:495 (1975); Harlow et al., Antivodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., Monoclonal Antibodies and T-Cell Hybrodimas 563-681 (Elsevier, N.Y., 1981)), способы рекомбинантных ДНК (см., например, патент США No. 4816567), технологии фагового дисплея (см., например, Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Sidhu et al., J. Mol. Biol. 338(2):299-310 (2004); Lee et al., J.Mol.Biol.340(5):1073-1093 (2004); Fellouse, Proc. Nat. Acad. Sci. USA 101(34):12467-12472 (2004); и Lee et al. J. Immunol. Methods 284(1-2):119-132 (2004)), и технологии продуцирования антитела человека или антител, подобных антителам человека, у животных, которые имеют части локусов или генов иммуноглобулинов человека, кодирующие последовательности иммуноглобулинов, или все эти локусы или гены (см., например, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al., Year in Immuno., 7:33 (1993); патенты США No. 5545806; 5569825; 5591669 (all of GenPharm); 5545807; WO 1997/17852; патенты США No. 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016; Marks et al., Bio/Technology, 10: 779-783 (1992); Lonberg et al., Nature, 368: 856-859 (1994); Morrison, Nature, 368: 812-813 (1994); Fishwild et al., Nature Biotechnology, 14: 845-851 (1996); Neuberger, Nature Biotechnology, 14: 826 (1996); и Lonberg and Huszar, Intern. Rev. Immunol., 13: 65-93 (1995)).
"Химерные" антитела (иммуноглобулины) имеют участок тяжелой и/или легкой цепи, идентичный или гомологичный соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как оставшаяся часть цепи(ей) является идентичной или гомологичный соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США No 4816567; и Morrison et al., Proc. Natl. Acad. Sci USA, 81:6851-6855 (1984)). Как используют в настоящем документе, гуманизированное антитело представляет собой тип химерных антител.
"Гуманизированные" формы не являющихся человеческими антител (например, грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, не являющегося человеческим. В основном гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное акцепторное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области видов, не относящихся к человеку (донорное антитело), таких как мышь, крыса, кролик или не относящиеся к человеку приматы, которые обладают требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки Fv каркасной области (FR) иммуноглобулина человека заменяют соответствующими остатками, не являющиеся человеческими. Более того, гуманизированные антитела могут содержать остатки, которые отсутствуют в реципиентном антителе или в донорном антителе. Эти модификации проводят для дополнительного улучшения параметров антитела. Как правило, гуманизированное антитело содержит по существу все по меньшей мере из одного и, как правило, из двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям иммуноглобулина, не являющегося человеческим, и все или по существу все FR-области представляют собой FR-области из последовательности иммуноглобулина человека, хотя FR-области могут включать одну или несколько аминокислотных замен, которые повышают аффинность связывания. Количество этих аминокислотных замен в FR, как правило, составляет не более 6 в H-цепи и не более 3 в L-цепи. Также гуманизированное антитело необязательно содержит по меньшей мере участок константного домена (Fc) иммуноглобулина, как правило, константного домена иммуноглобулина человека. Для более подробной информации см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
"Фрагменты антитела" содержат часть интактного полноразмерного антитела (включая, например, антитела человека), предпочтительно антигенсвязывающий или вариабельный участок интактного антитела. Примеры фрагментов антител включают Fab, Fab', F(ab')2 и Fv-фрагменты, димерные антитела (diabody), линейные антитела (см., например, патент США No. 5641870, пример 2, Zapata et al., Protein Eng., 8(10): 1057-1062 (1995)); одноцепочечные молекулы антител; и полиспецифичные антитела, образованные фрагментами антител.
Расщепление антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых "Fab"-фрагментами, и остаточного "Fc"-фрагмента, название которого отражает его способность легко кристаллизоваться. Fab-фрагмент состоит из целой L-цепи вместе с доменом вариабельного участка H-цепи (VH), и первым константным доменом одной тяжелой цепи (CH1). Каждый Fab-фрагмент является одновалентным в отношении связывания антигена, т.е. он обладает одним антигенсвязывающим участком. Обработка антитела пепсином приводит к одному крупному F(ab')2-фрагменту, который приблизительно соответствует двум связанным дисульфидом Fab-фрагментам, имеющим двухвалентную антигенсвязывающую активность, и, кроме того, способен к перекрестному связыванию антигена. Fab'-фрагменты отличаются от Fab-фрагментов наличием дополнительных нескольких остатков на C-конце домена CH1, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH представляет собой обозначение для Fab', в котором остаток(ки) цистеина константных доменов обладает свободной тиольной группой. F(ab')2-фрагменты антитела исходно были получены в качестве пар Fab'-фрагментов, которые обладают шарнирными цистеинами между ними. Также известно другое химическое связывание фрагментов антител.
Fc-фрагмент содержит C-концевые части обеих H-цепей, удерживаемые вместе дисульфидами. Эффекторные функции антител определяются последовательностями Fc-участка, который также является частью, распознаваемой Fc-рецепторами (FcR), встречающимися на определенных типах клеток.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антигенраспознающий и антигенсвязывающий центр. Этот фрагмент состоит из димера, состоящего из одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, связанных прочной нековалентной связью. Сворачивание этих двух доменов образует шесть гипервариабельных петель (3 петли в каждой из H- и L-цепи), которые предоставляют аминокислотные остатки для связывания антигена и обеспечивают специфичность связывания антигена антителом. Однако даже один вариабельный домен (или полвина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем целый участок связывания.
"Одноцепочечные Fv", также сокращаемые как "sFv" или "scFv", представляют собой фрагменты антител, которые содержат VH и VL-домены антитела, соединенные в единую полипептидную цепь. Предпочтительно полипептид sFv также необязательно содержит полипептидный линкер между VH и VL-доменами, который обеспечивает возможность формирования в sFv структуры, требуемой для связывания антигена. Для обзора sFv см. Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994); Borrebaeck 1995, infra.
Как используют в настоящем документе, “связывающий LY6 полипептид” представляет собой олигопептид, который связывается, предпочтительно специфично, с полипептидом LY6, лигандом или компонентом передачи сигнала соответственно, или его связывающую LY6 часть, или фрагмент. Такие олигопептиды можно химически синтезировать с использованием известных способов синтеза олигопептидов или их можно получать и очищать с использованием рекомбинантной технологии. Такие олигопептиды, как правило, имеют длину по меньшей мере приблизительно 5 аминокислот, альтернативно по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислот или более. Такие олигопептиды можно идентифицировать без излишнего экспериментирования с использованием хорошо известных способов. В этом отношении следует отметить, что способы скрининга олигопептидных библиотек на олигопептиды, которые способны специфично связываться с полипептидной мишенью, хорошо известны в данной области (см., например, патенты США No. 5556762, 5750373, 4708871, 4833092, 5223409, 5403484, 5571689, 5663143; публикации PCT No. WO 84/03506 и WO 84/03564; Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81:3998-4002 (1984); Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 82:178-182 (1985); Geysen et al., Synthetic Peptides as Antigens, 130-149 (1986); Geysen et al., J. Immunol. Meth., 102:259-274 (1987); Schoofs et al., J. Immunol., 140:611-616 (1988), Cwirla, S. E. et al. Proc. Natl. Acad. Sci. USA, 87:6378 (1990); Lowman, H.B. et al. Biochemistry, 30:10832 (1991); Clackson, T. et al. Nature, 352: 624 (1991); Marks, J. D. et al., J. Mol. Biol., 222:581 (1991); Kang, A.S. et al. Proc. Natl. Acad. Sci. USA, 88:8363 (1991), и Smith, G. P., Current Opin. Biotechnol., 2:668 (1991)).
Антагонист LY6 (например, антитело, полипептид, олигопептид или низкомолекулярное соединение), “который связывает” представляющий интерес антиген-мишень, например LY6, представляет собой антагонист, который связывает мишень с аффинностью, достаточной для того, чтобы он был пригодным диагностическим, прогностическим и/или терапевтическим средством для нацеливания на клетку или ткань, экспрессирующую антиген, и по существу не реагирует перекрестно с другими белками. Степень связывания с нежелательным маркерным полипептидом будет составлять менее чем приблизительно 10% от связывания с конкретной желательной мишенью, что определяется общепринятыми способами, такими как анализ посредством активированной флуоресценцией сортировки клеток (FACS) или радиоиммунопреципитация (RIA).
Более того, термин “специфичное связывание”, или “специфично связывается с”, или “является специфичным к” конкретному полипептиду LY6 эпитопу на конкретном полипептиде-мишени LY6 означает связывание, которое отличается от неспецифичного взаимодействия на поддающемся измерению уровне. Специфичное связывание можно определять, например, посредством определения связывания молекулы по сравнению со связыванием контрольной молекулы, которая, как правило, представляет собой молекулу со сходной структурой, которая не обладает связывающей активностью. Например, специфичное связывание можно определить по конкуренции с контрольной молекулой, которая сходна с мишенью, например, с избытком немеченой мишени. В этом случае признаком специфичного связывания является конкурентное ингибирование связывания меченой мишени с зондом избытком немеченой мишени. В одном варианте осуществления такие термины относятся к связыванию, где молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде без существенного связывания с любым другим полипептидом или эпитопом полипептида. Альтернативно такие термины могут быть описаны посредством молекулы, имеющей Kd к мишени по меньшей мере приблизительно 10-4 M, 10-5 M, 10-6 M, 10-7 M, 10-8 M, 10-9 M, 10-10 M, 10-11 M, 10-12 M или более.
Желудочно-кишечная клетка или ткань “сверхэкспрессирует” LY6, если показано, что эта клетка или ткань имеет повышенное количество нуклеиновой кислоты, кодирующей LY6 в клетках, или если эта клетка или ткань обладает избыточной продукцией и секрецией белка LY6 по сравнению с нормальной желудочно-кишечной клеткой или тканью того же типа. Такая сверхэкспрессия может быть результатом амплификации гена или повышенной транскрипции или трансляции. Известны различные диагностические или прогностические анализы, которые измеряют измененные уровни экспрессии, приводящие к повышенным или сниженным уровням секретируемого белка на поверхности клетки, и они включают, но не ограничиваются ими, иммуногистохимический анализ с использованием антител против LY6, анализ FACS и т.д. Альтернативно уровни кодирующей LY6 нуклеиновой кислоты или мРНК можно измерять в клетке, например, посредством флуоресцентной гибридизации in situ с использованием зонда на основе нуклеиновой кислоты, соответствующего кодирующей LY6 нуклеиновой кислоте или нуклеиновой кислоте, комплементарной ей (FISH; см. WO98/45479, опубликованную в октябре 1998 года), саузерн-блоттинга, нозерн-блоттинга или способов полимеразной цепной реакции (PCR), таких как количественная PCR (RT-PCR) с детекцией в реальном времени. Альтернативно сверхэкспрессию полипептида LY6 определяют измерением "слущивающегося" антигена в биологической жидкости, такой как сыворотка, например, с использованием анализа на основе антител (также см., например, патент США No. 4933294, выданный 12 июня 1990 года; WO 91/05264, опубликованную 18 апреля 1991 года; патент США 5401638, выданный 28 марта 1995 года; и Sias et al., J. Immunol. Methods, 132:73-80 (1990)). В дополнение к указанным выше анализам квалифицированному специалисту доступны различные анализы in vivo. Например, можно подвергать клетки в организме действию антитела, которое является необязательно детектируемо меченным, например, радиоактивным изотопом, и связывание антитела с клетками у пациента можно оценивать, например, посредством внешнего сканирования на радиоактивность или анализа биоптата, взятого у пациента, на которого ранее воздействовали лекарственным средством.
Как используют в настоящем документе, термин "иммуноадгезин" означает подобные антителу молекулы, которые сочетают специфичность связывания гетерологичного белка ("адгезин") с эффекторными функциями константных доменов иммуноглобулинов. Структурно иммуноадгезины содержат аминокислотную последовательность с требуемой специфичностью связывания, отличающуюся от участка распознавания антигена и участка связывания антитела (т.е. являющуюся "гетерологичной"), слитую с последовательностью константного домена иммуноглобулина. Часть адгезина в молекуле иммуноадгезина, как правило, представляет собой непрерывную аминокислотную последовательность, содержащую по меньшей мере участок связывания рецептора или лиганда. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, такого как изотипы IgG-1, IgG-2, IgG-3 или IgG-4, IgA (включая IgA-1 и IgA-2), IgE, IgD или IgM.
Слово "метка" при использовании в настоящем документе относится к детектируемому соединению или композиции, которые конъюгированы непосредственно или опосредованно с антителом, олигопептидом или другой органической молекулой с образованием "меченого" антитела, олигопептида или другой органической молекулы. Метка сама может быть детектируемой (например, радиоизотопные метки или флуоресцентные метки), или, в случае ферментной метки, она может катализировать химическое изменение соединения или композиции субстрата, которые являются детектируемыми.
Термин "цитотоксическое средство", как используют в настоящем документе, относится к веществу, которое ингибирует функционирование клеток, или препятствует ему, и/или вызывает разрушение клеток. Подразумевают, что термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические средства, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины из бактерий, грибов, растений или животных, включая их фрагменты и/или варианты, и различные противоопухолевые средства или средства против злокачественной опухоли, как описано ниже. Другие цитотоксические средства описаны ниже. Уничтожающее опухолевые клетки средство вызывает разрушение опухолевых клеток.
"Химиотерапевтическое средство" представляет собой химическое соединение, пригодное для лечения расстройства или заболевания. Примеры химиотерапевтических или лекарственных средств для лечения IBD включают, но не ограничиваются ими, противовоспалительные лекарственные средства сульфасалазин и 5-аминосалициловую кислоту (5-ASA); метронидазол и ципрофлоксацин обладают эффективностью, сходной с сульфасалазином, и они оказываются особенно пригодными для лечения перианального заболевания; в более тяжелых случаях для лечения активных обострений эффективны кортикостероиды, и они могут даже поддерживать ремиссию; азатиоприн и 6-меркаптопурин также продемонстрировали успех у пациентов, которым требуется длительное введение кортикостероидов; лекарственные средства против диареи также могут обеспечить смягчение симптомов у некоторых пациентов; лечебное питание или элементная диета могут улучшить состояние питания пациентов и индуцировать улучшение симптомов острого заболевания; для лечения вторичного избыточного роста бактерий и лечения гнойных осложнений применяют антибиотики. Химиотерапевтические средства от IBD, кроме того, включают следующие биологические средства и другие средства: антитела против бета 7 (см., например, WO 2006026759), антитела против альфа4 (такие как ANTEGEN®), антитело против TNF (REMICADE®) или небелковые соединения, включающие, но не ограничивающиеся ими, соединения 5-ASA ASACOL®, PENTASA™, ROWASA™, COLAZAL™, и другие соединения, такие как пуринемол и стероиды, такие как преднизон. Примеры химиотерапевтических средств для лечения злокачественной опухоли включают гидроксиуреатаксаны (такие как паклитаксел и доксетаксел) и/или антрациклиновые антибиотики; алкилирующие средства, такие как тиотепа и циклофосфамид CYTOXAN®; алкилсульфонаты, такие как бисульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополетин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги на основе адозелезина, карзелезина и бизелезина); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкриастатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлолрнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новэмбихин, фенестерин, преднемустин, трофосфамид, иприт урацила; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как эндииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма1I и калихеамицин омегаI1 (см., например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор на основе неокарциностатина и сходные хромопротеиновые хромофоры на основе эндииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, сактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, декторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® доксорубицин (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марселломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренальные средства, такие как аминоглутетимид, митотан, трилостан; средства для восполнения фолиевой кислоты, такие как фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангвидин); уретан; виндезин (ELDISINE®, FILDESIN®); декарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); тиотепу; таксоиды, например паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANETM, не содержащий Cremophor, сконструированный с альбумином состав паклитаксела в виде частиц (American Pharmaceutical Partners, Schaumberg, Illinois), и доксетаксел TAXOTERE® (Rhône-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейковорин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (XELODA®); фармацевтически приемлемые соли, кислоты или производные любого из указанных выше; а также сочетания двух или нескольких из указанных выше, такие как CHOP, сокращенное название для комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращенное название для схемы лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейковорином.
Термин "цитокин" является общим термином для белков, высвобождаемых одной популяцией клеток, которые воздействуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. Цитокины включают гормоны роста, такие как гормон роста человека, гормон роста человека с N-метионилом и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреоидстимулирующий гормон (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-α и -β; ингибирующее вещество Мюллера; гонадотропин-ассоциированный пептид мыши; ингибин; активин; сосудисто-эндотелиальный фактор роста; интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-β; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12; фактор некроза опухолей, такой как TNF-α или TNF-β; и другие полипептидные факторы, в том числе LIF и kit-лиганд (KL). Как используют в рамках настоящей заявки, термин цитокин включает в себя белки из природных источников или из рекомбинантных клеточных культур и биологически активные эквиваленты цитокинов с нативной последовательностью.
Термин "вкладыш в упаковку" используют для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждения, касающиеся применения таких терапевтических продуктов.
“Эпителиальная ткань,” “эпителиальный” и “эпителий” относятся к клеточному покрытию внутренних и наружных поверхностей тела (кожному, слизистому и серозному), включая железы и другие структуры, образованные из них, например эпителиальные клетки роговицы, пищевода, эпидермы и волосяного фолликула. Другая иллюстративная эпителиальная ткань включает: обонятельный эпителий - псевдомногослойный эпителий, выстилающий обонятельную область полости носа и содержащий рецепторы для ощущения запаха; железистый эпителий - эпителий, состоящий из секретирующих клеток; плоский эпителий - эпителий, содержащий один или несколько клеточных слоев, наиболее поверхностный из которых состоит из плоских, чешуйчатых или пластинчатых клеток. Также эпителий может относиться к переходному эпителию, такому как эпителий, который обычно выстилает полые органы, которые подвергаются значительному механическому изменению вследствие сокращения и растяжения, например ткань, которая представляет собой переходную ткань между многослойным плоским и столбчатым эпителием.
“Состояние роста” клетки относится к скорости пролиферации клетки и/или состоянию дифференцировки клетки. “Состояние измененного роста” представляет собой состояние роста, характеризующееся аномальной скоростью пролиферации, например клетка, проявляющая повышенную или сниженную скорость пролиферации относительно нормальной клетки.
Термин “LY6” или “полипептид LY6” используют в настоящем документе для общего обозначения любого из гомологов млекопитающих из семейства генов LY6 млекопитающих. Термин “LY6” может быть использован для описания белка или нуклеиновой кислоты.
Термин “сверхэкспрессия”, как используют в настоящем документе, относится к клеточным уровням экспрессии генов в ткани, которые превышают нормальные уровни экспрессии для этой ткани. Термин “сниженная экспрессия”, как используют в настоящем документе, относится к клеточным уровням экспрессии генов, которые являются более низкими, чем нормальные уровни экспрессии для этой ткани. В любом случае, более высокая или более низкая экспрессия значимо отличается от нормальной экспрессии в контролируемых условиях исследования.
“Контроль” включает образец, полученный для применения в целях определения базовой или нормальной экспрессии или активности у млекопитающего, которое не страдает IBD. Таким образом, контрольный образец можно получать множеством способов, включая получение из ткани или клеток, не пораженных воспалением и/или IBD, UC или CD (как определяют стандартными способами); из клеток или ткани не IBD, например из клеток субъекта, не страдающего IBD; у субъектов, не имеющих IBD, болезни Крона или язвенного колита; у субъектов, предположительно не имеющих риска IBD, CD или UC; или из клеток или клеточных линий, полученных у таких субъектов. Также контроль включает ранее установленный стандарт. Для анализов, таких как анализы мРНК, включающих анализы на микрочипах, контроль может представлять собой универсальный контроль. Такой универсальный контроль относится к информации об экспрессии РНК конкретного гена LY6, полученного из РНК, выделенной из смеси здоровых тканей или смеси клеточных линий, полученных из различных тканей, таких как, но не ограничиваясь ими, универсальные стандартные РНК, описанные в настоящем документе. Таким образом, любой тест или анализ, проведенный согласно изобретению, можно сравнивать с установленным стандартом, и может быть необязательным получение контрольного образца для сравнения каждый раз.

















(число идентично совпавших аминокислотных остатков между двумя полипептидными последовательностями, при определении посредством ALIGN-2), деленное на (общее количество аминокислотных остатков эталонного полипептида)
= 5, деленное на 15 = 33,3%
(число идентично совпавших аминокислотных остатков между двумя полипептидными последовательностями, при определении посредством ALIGN-2), деленное на (общее количество аминокислотных остатков эталонного полипептида)
= 5, деленное на 10 = 50%
(число идентично совпавших нуклеотидов между двумя последовательностями нуклеиновых кислот, при определении посредством ALIGN-2), деленное на (общее количество нуклеотидов последовательности нуклеиновой кислоты эталонной ДНК)
= 6, деленное на 14 = 42,9%
(число идентично совпавших нуклеотидов между двумя последовательностями нуклеиновых кислот, при определении посредством ALIGN-2), деленное на (общее количество нуклеотидов последовательности нуклеиновой кислоты эталонной ДНК)
= 4, деленное на 12 = 33,3%
Диагностические способы по изобретению
Кроме того, предусматривается, что применение лекарственных средств от IBD может быть специфически нацелено на расстройства, где пораженная ткань и/или клетки проявляют повышенную экспрессию LY6 по сравнению с контролем. Таким образом, предусматривается, что выявление повышенной экспрессии LY6 можно использовать для детекции IBD, такой как CD или UC, в желудочно-кишечной ткани млекопитающего и/или для идентификации тканей и расстройств, для которых будет особенно полезным лечение лекарственным средством от IBD, включая химиотерапевтическое средство, пригодное для смягчения IBD, UC и/или CD у пациента-человека.
В предпочтительных вариантах осуществления уровни экспрессии LY6 выявляют либо посредством прямого выявления транскрипта гена, либо посредством выявления уровней или активности белка. Транскрипты можно выявлять с использованием любого из широкого диапазона способов, которые, главным образом, основаны на гибридизации или зондах для транскриптов мРНК LY6, для кДНК, синтезированных с них, или для ДНК, где присутствует амплификация гена LY6. Хорошо известные способы включают нозерн-блоттинг, PCR с обратной транскриптазой и анализ уровней транскрипта на микрочипах. Способы детекции уровней белка LY6 включают вестерн-блоттинг, иммунопреципитацию, двумерный полиакриламидный гель-электрофорез (2D SDS-PAGE - предпочтительно по сравнению со стандартом, где положение белков LY6 определено) и масс-спектроскопию. Масс-спектроскопия может быть сопряжена с серией стадий очистки для обеспечения высокопроизводительной идентификации уровней множества различных белков в конкретном образце. Масс-спектроскопию и 2D SDS-PAGE также можно использовать для идентификации посттранскрипционных модификаций белков, включая протеолитические процессы, убиквинитинилирование, фосфорилирование, модификацию липидами и т.д. Активность LY6 также можно оценивать посредством анализа связывания с ДНК-субстратом или транскрипционной активации промоторов-мишеней in vitro. Способами, которые можно использовать для оценки наличия белка, способного связываться с участками связывания Gli на ДНК, являются анализ задержки в геле, анализы ДНК-дактилоскопии и анализы перекрестного связывания ДНК-белок. См. J Mol. Med 77(6):459-68 (1999); Cell 100(4): 423-34 (2000); Development 127(19): 4923-4301 (2000).
В определенных вариантах осуществления измеряют уровни транскрипта LY6, и подвергшиеся заболеванию или расстройству ткани, демонстрирующие значительно повышенные уровни LY6 по сравнению с контролем, обрабатывают терапевтическим соединением против IBD. Таким образом, уровни экспрессии LY6 являются мощным диагностическим показателем для определения того, страдает ли пациент IBD и должен ли пациент получать лекарственное средство от IBD.
Композиции антител для применения в способах по изобретению
A. Антитела против LY6
В одном варианте осуществления настоящее изобретение относится к применению антител против LY6, которые при этом можно применять в качестве терапевтических, диагностических и/или прогностических средств при определении наличия, тяжести и/или прогноза течения воспалительного заболевания кишечника, такого как UC. Иллюстративные антитела, которые можно использовать для таких целей, включают поликлональные, моноклональные, гуманизированные, биспецифичные антитела и гетероконъюгаты антител. Термин “антитела” также иногда включает антигенсвязывающие фрагменты. Антитела против LY6 являются коммерчески доступными, например, такие как от R&D Systems, Minneapolis, MN. Для применения в способе по изобретению антитела, которые специфично связываются с LY6 в качестве антигена, можно приобретать коммерчески или получать стандартными способами химии антител и белков, известными в данной области. Антитела к LYPD1 описаны, например, в US 7144990, описание этого патента включено в настоящий документ в качестве ссылки в полном объеме.
1. Поликлональные антитела
Поликлональные антитела предпочтительно индуцируют у животных многократными подкожными (sc) или внутрибрюшинными (ip) инъекциями соответствующего антигена и адъюванта. Может быть пригодной конъюгация соответствующего антигена (особенно когда используют синтетические пептиды) с белком, который является иммуногенным у видов, подлежащих иммунизации. Например, антиген можно конъюгировать с гемоцианином лимфы улитки (KLH), сывороточным альбумином, бычьим тиреоглобулином или ингибитором трипсина сои, с использованием бифункционального или образующего производное средства, например сложного эфира малеимидобензоилсульфосукцинимида (конъюгация через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутаральдегида, янтарного ангидрида, SOCl2 или R1N=C=NR, где R и R1 являются отличающимися алкильными группами.
Животных иммунизируют против антигена, иммуногенных конъюгатов или производных комбинированием, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей соответственно) с 3 объемами полного адъюванта Фрейнда и инъекцией раствора внутрикожно в несколько областей. Через один месяц животным проводят повторную иммунизацию от 1/5 до 1/10 от исходного количества пептида или конъюгата в полном адъюванте Фрейнда посредством подкожной инъекции в несколько областей. Через от семи до 14 суток у животных отбирают кровь и сыворотку анализируют в отношении титра антител. Животным проводят повторные иммунизации до достижения титрами плато. Конъюгаты также можно получать в рекомбинантной клеточной культуре в качестве белковых слитых молекул. Также для усиления иммунного ответа пригодным образом используют вызывающие агрегацию средства, такие как квасцы.
2. Моноклональные антитела
Моноклональные антитела можно получать с использованием способа гибридом, впервые описанного Kohler et al, Nature, 256:495 (1975), или их можно получать способами рекомбинантных ДНК (патент США No. 4816567).
В способе гибридом мышь или другого пригодного животного-хозяина, такого как хомяк, иммунизируют, как описано выше, для получения лимфоцитов, которые продуцируют или способны продуцировать антитела, которые специфично связываются с белком, используемым для иммунизации. Альтернативно лимфоциты можно иммунизировать in vitro. После иммунизации лимфоциты выделяют, а затем подвергают слиянию с миеломной клеточной линией с использованием пригодного средства, вызывающего слияние клеток, такого как полиэтиленгликоль, с получением гибридомных клеток (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и выращивают в пригодной культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или выживание неслитых исходных клеток миеломы (также называемых партнерами по слиянию). Например, если исходные клетки миеломы лишены фермента гипоксантин-гуанин-фосфорибозил-трансферазы (HGPRT или HPRT), селективная культуральная среда для гибридом, как правило, включает вещества гипоксантин, аминоптерин и тимидин (среда HAT), которые препятствуют росту клеток, дефицитных по HGPRT.
Предпочтительные миеломные клетки-партнеры представляют собой клетки, которые эффективно подвергаются слиянию, которые поддерживают стабильно высокий уровень продукции антител отобранными антителпродуцирующими клетками и являются чувствительными к селективной среде, которая осуществляет селекцию против неслитых исходных клеток. Предпочтительными миеломными клеточными линиями являются линии миеломы мышей, такие как линии, полученные из опухолей мышей MOPC-21 и MPC-11, доступные в Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или X63-Ag8-653, доступные в American Type Culture Collection, Manassas, Virginia USA. Также для продукции моноклональных антител человека описаны миеломные клеточные линии и линии гетеромиеломы мыши-человека (Kozbor, J. Immunol, 133:3001 (1984); и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают гибридомные клетки, оценивают на продукцию моноклональных антител, направленных против антигена. Предпочтительно специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют посредством иммунопреципитации или анализа связывания in vitro, такого как радиоиммунный анализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела можно определять, например, посредством анализа Скэтчарда, описанного в Munson et al, Anal. Biochem., 107:220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела с требуемой специфичностью, аффинностью и/или активностью, клоны можно субклонировать способами лимитирующих разведений и выращивать стандартными способами (Goding, Monoclonal antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Пригодные для этой цели культуральные среды включают, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки можно выращивать in vivo у животных в качестве асцитных опухолей, например, посредством инъекции клеток мышам.
Моноклональные антитела, секретируемые субклонами, пригодным способом выделяют из культуральной среды, асцитной жидкости или сыворотки общепринятыми способами очистки антител, например, такими как аффинная хроматография (например, хроматография с использованием системы белок A или белок G-сефароза) или ионообменная хроматография, хроматография с гидроксилапатитом, гель-электрофорез, диализ и т.д.
ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют использованием общепринятых способов (например, с использованием олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антител мыши). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. Для обеспечения синтеза моноклональных антител в рекомбинантных клетках-хозяевах, после выделения ДНК можно встраивать в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в ином случае не продуцируют белок антитела. Обзорные статьи по рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al, Curr. Opinion in Immunol, 5:256-262 (1993), и Pluckthun, Immunol. Revs., 130:151-188 (1992).
В следующем варианте осуществления моноклональные антитела или фрагменты антител можно выделять из фаговых библиотек антител, созданных с использованием способов, описанных в McCafferty et al., Nature, 348:552-554 (1990). В Clackson et al, Nature, 352:624-628 (1991), и Marks et al, J. Mol Biol, 222:581-597 (1991), описано выделение антител мыши и человека соответственно с использованием фаговых библиотек. В более поздних публикациях описана продукция высокоаффинных (нМ-порядок) антител человека посредством перестановки цепей (Marks et al, Bio/Technology, 10:779-783 (1992)), а также комбинаторной инфекции и рекомбинации in vivo в качестве стратегии для конструирования очень крупных фаговых библиотек (Waterhouse et al, Nuc. Acids. Res., 21:2265-2266 (1993)). Таким образом, эти способы представляют собой приемлемые альтернативы традиционным способам гибридомных моноклональных антител для выделения моноклональных антител.
Также ДНК, которая кодирует антитело, можно модифицировать для получения химерных или слитых полипептидов антител, например, посредством замены последовательностями константного домена тяжелой и легкой цепи (CH и CL) человека гомологичными последовательностями мыши (патент США No. 4816567; и Morrison, et al, Proc. Natl Acad. Sci USA, 81:6851 (1984)) или слияния кодирующей иммуноглобулин последовательности со всей кодирующей последовательностью для полипептида, не являющегося иммуноглобулином (гетерологичным полипептидом), или ее частью. Последовательностями полипептидов, не являющихся иммуноглобулинами, заменяют константные домены антитела или ими заменяют вариабельные домены одного антигенсвязывающего центра антитела с получением химерного двухвалентного антитела, содержащего один антигенсвязывающий центр со специфичностью к одному антигену и другой антигенсвязывающий центр со специфичностью к другому антигену.
3. Антитела человека и гуманизированные антитела
Антитела против LY6, пригодные для применения изобретения на практике, кроме того, могут включать гуманизированные антитела или антитела человека. "Гуманизированные" формы антител не человека (например, грызуна) представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, образованную из иммуноглобулина не человека. Гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены остатками CDR не относящегося к человеку вида (донорное антитело), такого как мышь, крыса или кролик, имеющими требуемую специфичность, аффинность и емкость. В некоторых случаях остатки каркасной области Fv иммуноглобулина человека заменяют соответствующими остатками не человека. Гуманизированные антитела также могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в импортных последовательностях CDR или каркасной области. Как правило, гуманизированное антитело будет содержать по существу все по меньшей мере из одного и, как правило, двух вариабельных доменов, в которых все или по существу все из областей CDR соответствуют CDR иммуноглобулина не человека, и все или по существу все из областей FR представляют собой области FR консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело также в оптимальном случае будет содержать по меньшей мере часть константного участка (Fc) иммуноглобулина, как правило, константного участка иммуноглобулина человека. Для более подробного описания см. Jones et al., Nature 321:522-525 (1986); Riechmann et al, Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Способы гуманизации антител, не являющихся человеческими, описаны в данной области. Как правило, гуманизированное антитело обладает одним или несколькими встроенными в него аминокислотными остатками из источника, который не является человеческим. Такие не являющиеся человеческими аминокислотные остатки часто называют "импортными" остатками, которые, как правило, взяты из "импортной" вариабельной области. Гуманизацию, главным образом, можно проводить в соответствии со способом Winter и коллег (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), посредством замены CDR или последовательностями CDR крысы соответствующих последовательностей антитела человека. Таким образом, такие "гуманизированные" антитела представляют собой химерные антитела (патент США No. 4816567), где по существу менее целой вариабельной области человека замещено соответствующей последовательностью вида, не относящегося к человеку. На практике гуманизированные антитела, как правило, представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
Выбор вариабельных доменов человека, как легких, так и тяжелых цепей, для использования при получении гуманизированных антител является очень важным для снижения антигенности и ответа HAMA (антитела человека против антител мыши), когда антитело предназначено для терапевтического применения у человека. В соответствии с так называемым способом "наилучшего соответствия" последовательность вариабельного домена антитела грызуна анализируют относительно целой библиотеки известных последовательностей вариабельных доменов человека. Идентифицируют последовательность V-домена человека, которая является наиболее сходной с последовательностью грызуна, и каркасную область (FR) человека в ней принимают для гуманизированного антитела (Sims et al., J. Immunol, 151:2296 (1993); Chothia et al, J. Mol. Biol, 196:901 (1987)). В другом способе используют конкретную каркасную область, полученную из консенсусной последовательности всех антител человека из конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких различных гуманизированных антител (Carter et al, Proc. Natl. Acad. Sci USA, 89:4285 (1992); Presta et al, J. Immunol, 151:2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности связывания к антигену и других положительных биологических свойств. Для достижения этой цели в соответствии с предпочтительным способом гуманизированные антитела получают с помощью процесса анализа исходных последовательностей и различных предполагаемых гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются широко доступными и известны специалистам в данной области. Доступными являются компьютерные программы, которые иллюстрируют и выводят на экран возможные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов-кандидатов. Исследование этих выведенных на экран данных позволяет проводить анализ возможной роли остатков в функционировании предполагаемых последовательностей иммуноглобулинов, т.е. анализ остатков, которые влияют на способность иммуноглобулина-кандидата связывать свой антиген. Таким образом, можно отобрать остатки FR и комбинировать их из реципиентной и импортной последовательностей таким образом, чтобы были достигнуты требуемые свойства антител, такие как повышенная аффинность к антигену(ам)-мишени. Как правило, непосредственное и наиболее значительное влияние на связывание антигена оказывают остатки гипервариабельной области.
Предусмотрены различные формы гуманизированных антител против LY6. Например, гуманизированное антитело может представлять собой фрагмент антитела, такой как Fab, который необязательно конъюгирован с одним или несколькими цитотоксическим средством(ами) для получения иммуноконъюгата. Альтернативно гуманизированное антитело может представлять собой интактное антитело, такое как интактное антитело IgG1.
В качестве альтернативы гуманизации, можно получать антитела человека. Например, в настоящее время возможным является получение трансгенных животных (например, мышей), которые способны, при иммунизации, продуцировать полный набор антител человека в отсутствие продукции эндогенных иммуноглобулинов. Например, было описано, что гомозиготная делеция гена участка соединения тяжелых цепей антител (JH) у химерных мышей и мутантных мышей зародышевой линии приводит к полному ингибированию продукции эндогенных антител. Перенос системы генов иммуноглобулинов зародышевой линии человека в таких мутантных мишенях зародышевой линии приводит к продукции антител человека при антигенной стимуляции. См., например, Jakobovits et al, Proc. Natl. Acad. Sci USA, 90:2551 (1993); Jakobovits et al, Nature, 362:255-258 (1993); Bruggermann et al, Year in Immuno., 7:33 (1993); и патенты США No. 5545806, 5569825, 5591669 (все GenPharm), 5545807; и WO 97/17852.
Альтернативно для получения антител человека и фрагментов антител in vitro можно использовать технологию фагового дисплея (McCafferty et al, Nature 348:552-553 (1990)), из наборов генов вариабельных (V) доменов иммуноглобулинов неиммунизированных доноров. В соответствии с этим способом гены V домена антител клонируют в рамке считывания либо главного, либо второстепенного гена оболочки нитевидного бактериофага, такого как M13 или fd, и они экспонируются в качестве функциональных фрагментов антител на поверхности частицы фага. Вследствие того, что нитевидная частица содержит одноцепочечную копию ДНК генома фага, селекция на основе функциональных свойств антитела также приведет к селекции гена, кодирующего антитело, проявляющее такие свойства. Таким образом, фаг имитирует некоторые из свойств B-клетки. Фаговый дисплей можно проводить в различных формах, рассмотренных, например, в Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для фагового дисплея можно использовать несколько источников сегментов V-генов. Clackson et al., Nature, 352:624-628 (1991), выделили набор разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученной из селезенок иммунизированных мышей. Можно сконструировать набор V-генов из неиммунизированных доноров-людей и можно выделять антитела против широкого набора антигенов (в том числе против собственных антигенов), главным образом, в соответствии со способами, описанными Marks et al., J. Mol Biol. 222:581-597 (1991), или Griffith et al, EMBO J. 12:725-734 (1993). См. также патенты США No. 5565332 и 5573905.
Как рассмотрено выше, антитела человека также можно получать посредством активированных B-клеток in vitro (см. патенты США 5567610 и 5229275).
4. Фрагменты антител
В некоторых случаях преимущественным является использование фрагментов антител, вместо целых антител. Меньший размер фрагментов позволяет быстрое выведение при сохранении специфичности связывания антигена, сходной с соответствующей полноразмерной молекулой, и может обеспечить улучшенный доступ к солидным опухолям.
Для получения фрагментов антител были разработаны различные способы. Традиционно эти фрагменты получали посредством протеолитического расщепления полноразмерных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992); и Brennan et al, Science, 229:81 (1985)). Однако эти фрагменты в настоящее время можно получать непосредственно с помощью рекомбинантных клеток-хозяев. Fab-, Fv- и scFv-фрагменты антител могут быть экспрессированы и секретированы в E. coli, таким образом, позволяя простой способ получения больших количеств этих фрагментов. Фрагменты антител можно выделять из фаговых библиотек антител, описанных выше. Альтернативно фрагменты Fab'-SH можно выделять непосредственно из E. coli и химически связывать с получением фрагментов F(ab')2 (Carter et al, Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом фрагменты F(ab')2 можно выделять непосредственно из рекомбинантной культуры клеток-хозяев. Fab- и F(ab')2-фрагмент с повышенным временем полужизни in vivo, содержащий остатки связывающего рецептор спасения эпитопа, описан в патенте США No. 5869046. Другие способы получения фрагментов антител будут очевидны квалифицированному специалисту. В других вариантах осуществления предпочтительное для выбора антитело представляет собой одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185; патент США No. 5571894; и патент США No. 5587458. Fv и sFv являются единственными типами с интактными антигенсвязывающими участками, которые лишены константных участков; таким образом, они пригодны для снижения неспецифического связывания в ходе применения in vivo. Можно конструировать слитые с sFv белки с получением эффекторного белка либо на амино-, либо на С-конце sFv. См. Antibody Engineering, ed. Borrebaeck, выше. Фрагмент антитела также может представлять собой "линейное антитело", например, как описано в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифичными или биспецифичными.
5. Биспецифичные антитела
Биспецифичные антитела представляют собой антитела, которые обладают специфичностью связывания по меньшей мере двух различных эпитопов. Иллюстративные биспецифичные антитела могут связывать различные антигены или могут связываться с двумя различными эпитопами конкретного полипептида LY6, описанного в настоящем документе. Другие такие антитела могут сочетать в себе указанный выше участок связывания LY6 и участок(ки) связывания других белков. В случае когда биспецифичное антитело пригодно в диагностическом способе по изобретению, второе плечо антитела может связывать детектируемый полипептид. Биспецифичные антитела можно получать в качестве полноразмерных антител или фрагментов антител (например, F(ab')2-биспецифичные антитела).
Способы получения биспецифичных антител известны в данной области. Общепринятый способ получения полноразмерных биспецифичных антител основан на совместной экспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулинов, где две цепи обладают различной специфичностью (Millstein et al, Nature, 305:537-539 (1983)). Вследствие случайной сборки тяжелых и легких цепей иммуноглобулинов такие гибридомы (квадромы) потенциально продуцируют смесь из 10 различных молекул антител, из которых только одна обладает правильной биспецифичной структурой. Очистка правильных молекул, которую обычно проводят посредством стадий аффинной хроматографии, является довольно трудоемкой и выход продукта является низким. Аналогичные способы описаны в WO 93/08829 и в Traunecker et al, EMBO J., 10:3655-3659 (1991).
В соответствии с другим подходом проводят слияние вариабельных доменов антитела с требуемой специфичностью связывания (участками связывания антитело-антиген) с последовательностями константных доменов иммуноглобулинов. Предпочтительно проводят слияние с константным доменом тяжелой цепи Ig, содержащим по меньшей мере часть шарнирной области, CH2 и CH3. Предпочтительно, чтобы по меньшей мере один из компонентов, предназначенных для слияния, обладал первым константным доменом тяжелой цепи (CH1), содержащим участок, необходимый для связывания легкой цепи. ДНК, кодирующую предназначенные для слияния компоненты тяжелых цепей иммуноглобулинов и, если желательно, легкой цепи иммуноглобулина, встраивают в отдельные экспрессирующие векторы и котрансфицируют в пригодный организм-хозяин. Это обеспечивает значительную гибкость при регулировании соотношений трех полипептидных фрагментов друг с другом в вариантах осуществления, где неравные соотношения трех полипептидных цепей в конструкции обеспечивают оптимальный выход требуемого биспецифичного антитела. Однако возможным является встраивание двух или всех трех полипептидных цепей в один экспрессирующий вектор, если экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высокому выходу продукта или если соотношения не имеют существенного влияния на требуемое сочетание цепей.
В предпочтительном варианте осуществления этого подхода биспецифичные антитела состоят из тяжелой цепи гибридного иммуноглобулина с одной специфичностью связывания на одном плече и пары тяжелая цепь-легкая цепь гибридного иммуноглобулина (обладающей другой специфичностью связывания) на другом плече. Было обнаружено, что такая ассиметричная структура облегчает разделение требуемого биспецифичного соединения и нежелательных сочетаний цепей иммуноглобулинов, поскольку наличие легкой цепи иммуноглобулина только в одной половине биспецифичной молекулы обеспечивает легкий способ разделения. Этот подход описан в WO 94/04690. Для более подробного описания получения биспецифичных антител см., например, Suresh et al., Methods in Enzymology, 121:210 (1986).
В соответствии с другим подходом, описанным в патенте США No. 5731168, для максимального увеличения процентного количества гетеродимеров, которые выделяют из рекомбинантных клеточных культур, можно сконструировать область контакта между парой молекул антител. Предпочтительная область контакта содержит по меньшей мере часть CH3-домена константного домена антитела. В этом способе одну или несколько небольших боковых цепей аминокислот из области контакта первой молекулы антитела заменяют на более крупные боковые цепи (например, тирозин или триптофан). В области контакта второй молекулы антитела создают компенсирующие "полости" идентичного или сходного с крупной боковой цепью(ями) размера посредством замены крупных боковых цепей аминокислот на цепи меньших размеров (например, аланин или треонин). Это обеспечивает механизм для повышения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифичные антитела включают поперечно-сшитые антитела или "гетероконъюгаты" антител. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое с биотином. Такие антитела, например, были предложены для нацеливания клеток иммунной системы против нежелательных клеток (патент США No. 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгаты антител также можно применять в способе по настоящему изобретению посредством предоставления множества (либо различных, либо одинаковых) детектируемых маркеров на каждом антителе для усиления детекции в анализе. Гетероконъюгаты антител можно получать с использованием любого пригодного способа поперечного сшивания. Пригодные средства для поперечного сшивания хорошо известны в данной области и описаны в патенте США No. 4676980, совместно с рядом способов поперечного сшивания.
Способы получения биспецифичных антител из фрагментов антител также описаны в литературе. Например, биспецифичные антитела можно получать с использованием образования химических связей. В Brennan et al., Science, 229: 81 (1985), описан способ, где полноразмерные антитела протеолитически расщепляют с получением F(ab')2-фрагментов. Эти фрагменты восстанавливают в присутствии вещества, образующего комплексы с дитиолами, арсенита натрия, для стабилизации соседних дитиолов и предотвращения образования межмолекулярного дисульфида. Затем полученные Fab'-фрагменты превращают в производные с тионитробензоатом (TNB). Одно из производных Fab'-TNB затем повторно превращают в Fab'-тиол восстановлением меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с получением биспецифичного антитела. Полученные биспецифичные антитела можно использовать в качестве средств для селективной иммобилизации ферментов.
Последние достижения упростили прямое выделение из E. coli фрагментов Fab'-SH, которые можно химически связывать с получением биспецифичных антител. В Shalaby et al, J. Exp. Med., 175: 217-225 (1992), описано получение полностью гуманизированной молекулы F(ab')2 биспецифичного антитела. Осуществляли секрецию из E. coli каждого Fab'-фрагмента по отдельности и их подвергали прямому химическому соединению in vitro с образованием биспецифичного антитела. Биспецифичное антитело, полученное таким образом, обладало способностью связываться с клетками, сверхэкспрессирующими рецептор ErbB2, и нормальными T-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека против мишеней, представляющих собой рак молочной железы человека.
Также были описаны различные способы получения и выделения фрагментов биспецифичных антител непосредственно из рекомбинантной клеточной культуры. Например, были получены биспецифичные антитела с использованием лейциновых молний. См. Kositelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии белков Fos и Jun связывали с Fab'-участками двух различных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области с получением мономеров, а затем повторно окисляли с получением гетеродимеров антител. Этот способ также можно использовать для получения гомодимеров антител. Способ получения "димеров антител", описанный Hollinger et al., Proc. Natl. Acad. Sci USA, 90:6444-6448 (1993), обеспечивает альтернативный механизм получения биспецифичных фрагментов антител. Фрагменты содержат VH, связанный с VL посредством линкера, который является слишком коротким для возможности образования пары между двумя доменами на одной и той же цепи. Таким образом, домены VH и VL одного фрагмента вынуждены образовывать пару с комплементарными доменами VL и VH другого фрагмента, таким образом, формируя два антигенсвязывающих центра. Также описана другая стратегия для получения фрагментов биспецифичных антител с использованием димеров одноцепочечных Fv (sFv). См. Gruber et al, J. Immunol, 152:5368 (1994).
Также предусмотрены антитела более чем c двумя валентностями. Например, можно получать триспецифичные антитела. См. Tutt et al. J. Immunol. 147: 60 (1991).
6. Поливалентные антитела
Поливалентное антитело может интернализовываться (и/или катаболизироваться) быстрее, чем двухвалентное антитело, клеткой, экспрессирующей антиген, с которым антитела связываются. Антитела по настоящему изобретению могут представлять собой поливалентные антитела (которые могут относиться к классу, отличному от класса IgM) с тремя или более антигенсвязывающими участками (например, четырехвалентные антитела), которые можно легко получать посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих участков. Предпочтительный домен димеризации содержит (или состоит из них) Fc-участок или шарнирную область. В этом случае антитело будет содержать Fc-область и три или более антигенсвязывающих участка со стороны N-конца Fc-участка. Предпочтительное поливалентное антитело, представленное в настоящем документе, содержит (или состоит из них) от трех до приблизительно восьми, однако предпочтительно четыре, антигенсвязывающих участков. Поливалентное антитело содержит по меньшей мере одну полипептидную цепь (и предпочтительно две полипептидные цепи), где полипептидная цепь(и) содержит два или более вариабельных доменов. Например, полипептидная цепь(и) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидуную цепь Fc-участка, X1 и X2 представляют собой аминокислоту или полипептид и n равно 0 или 1. Например, полипептидная цепь(и) может содержать: цепь VH-CH1-подвижный линкер-VH-CH1-Fc-участок; или цепь VH-CH1-VH-CH1-Fc-участок. Поливалентное антитело, представленное в настоящем документе, предпочтительно дополнительно содержит по меньшей мере два (и предпочтительно четыре) полипептида вариабельного домена легкой цепи. Поливалентное антитело, представленное в настоящем документе, например, может содержать от приблизительно двух до приблизительно восьми полипептидов вариабельного домена легкой цепи. Полипептиды вариабельного домена легкой цепи, рассматриваемые в настоящем документе, содержат вариабельный домен легкой цепи и, необязательно, дополнительно содержат CL-домен.
7. Инженерия эффекторных функций
Может быть желательной модификация антитела по изобретению в отношении эффекторной функции, например, чтобы усилить антигензависимую клеточноопсредуемую цитотоксичность (ADCC) и/или комплементзависимую цитотоксичность (CDC) антитела. Этого можно достигать внесением одной или нескольких аминокислотных замен в Fc-участок антитела. Альтернативно или дополнительно, в Fc-участок можно вносить остаток(и) цистеина, обеспечивая, таким образом, формирование дисульфидной связи между цепями в этом участке. Полученное таким образом гомодимерное антитело может обладать улучшенной способностью к интернализации и/или усиленным комплементзависимым уничтожением клеток и повышенной антителозависимой клеточной цитотоксичностью (ADCC). См. Caron et al, J. Exp Med. 176:1191-1195 (1992), и Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью также можно получать с использованием гетеробифункциональных поперечных линкеров, как описано в Wolff et al. Cancer Research 53:2560-2565 (1993). Альтернативно можно сконструировать антитело, которое обладает дублированными Fc-участками и, таким образом, может обладать повышенной способностью в отношении лизиса комплементом и ADCC. См. Stevenson et al. Anti-Cancer Drug Design 3:219-230 (1989). Для увеличения времени полужизни антитела в сыворотке можно встраивать в антитело (особенно в фрагмент антитела) связывающий рецептор спасения эпитоп, как описано, например, в патенте США 5739277. Как используют в рамках настоящей заявки, термин "связывающий рецептор спасения эпитоп" относится к эпитопу Fc-участка молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который отвечает за повышение периода полураспада в сыворотке молекулы IgG in vivo.
8. Иммуноконъюгаты
Это изобретение также относится к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, ингибирующее рост средство, токсин (например, ферментативно активный токсин бактерий, грибов, растений или животных, в том числе его фрагменты и/или варианты), или с радиоактивным изотопом (т.е. радиоконъюгатом) и/или детектируемой меткой.
a. Химиотерапевтические средства
Химиотерапевтические средства, пригодные для получения таких иммуноконъюгатов, описаны выше. Ферментативно активные токсины и их фрагменты, которые можно использовать, включают в себя A-цепь дифтерийного токсина, несвязывющие активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки-диантаны, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. Для получения радиоконъюгированных антител доступны различные радионуклиды. Их примеры включают 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антитела и цитотоксического средства можно получать с использованием множества бифункциональных связывающих белки веществ, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCL), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола) и вторичные активные соединения фтора (такие как l,5-дифтор-2,4-динитробензол). Например, иммунотоксин на основе рицина можно получать, как описано в Vitetta et al. Science 238: 1098 (1987). Меченная углеродом 14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративный хелатирующий агент для конъюгации радионуклеотида с антителом. См. WO 94/11026.
Конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, майтанзиноиды, трихотецен и CC1065, и производные этих токсинов, которые обладают активностью токсинов, также предусмотрены в настоящем документе.
B. Связывающие LY6 олигопептиды
Связывающие LY6 олигопептиды по настоящему изобретению представляют собой олигопептиды, которые связываются, предпочтительно специфично, с полипептидом LY6, как описано в настоящем документе. Связывающие LY6 олигопептиды можно химически синтезировать с использованием известных способов синтеза олигопептидов или их можно получать и очищать с использованием рекомбинантной технологии. Связывающие LY6 олигопептиды обычно имеют длину приблизительно 5 аминокислот, альтернативно, они имеют длину по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислот или более, где такие олигопептиды способны связываться, предпочтительно специфично, с полипептидом LY6, как описано в настоящем документе. Связывающие LY6 олигопептиды можно идентифицировать без излишнего экспериментирования с использованием хорошо известных способов. В этом отношении следует отметить, что способы скрининга олигопептидных библиотек на олигопептиды, которые способны специфично связываться с полипептидом-мишенью, хорошо известны в данной области (см., например, патенты США No. 5556762, 5750373, 4708871, 4833092, 5223409, 5403484, 5571689, 5663143; публикации PCT No. WO 84/03506 и WO 84/03564; Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81:3998-4002 (1984); Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 82:178-182 (1985); Geysen et al., in Synthetic Peptides as Antigenes, 130-149 (1986); Geysen et al., J. Immunol. Meth., 102:259-274 (1987); Schoofs et al., J. Immunol., 140:611-616 (1988), Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6378; Lowman, H.B. et al. (1991) Biochemistry, 30:10832; Clackson, T. et al. (1991) Nature, 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol., 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363, и Smith, G. P. (1991) Current Opin. Biotechnol., 2:668).
В этом отношении бактериофаговый (фаговый) дисплей является одним из хорошо известных способов, который позволяет проводить скрининг больших олигопептидных библиотек с целью идентификации члена(ов) этих библиотек, который способен специфично связываться с полипептидом-мишенью. Фаговый дисплей представляет собой способ, посредством которого варианты полипептидов экспонируют в качестве белков, слитых с белком оболочки, на поверхности частиц бактериофага (Scott, J.K. and Smith, G. P. (1990) Science 249: 386). Применимость фагового дисплея основана на том факте, что большие библиотеки селективно рандомизированных вариантов белков (или случайным образом клонированных кДНК) можно быстро и эффективно сортировать по тем последовательностями, которые связываются с молекулой-мишенью с высокой аффинностью. Экспонирование пептидных (Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6378) или белковых (Lowman, H.B. et al. (1991) Biochemistry, 30:10832; Clackson, T. et al. (1991) Nature, 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol., 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363) библиотек на фаге использовали для скрининга миллионов полипептидов или олигопептидов на полипептиды и олигопептиды со свойствами специфичного связывания (Smith, G. P. (1991) Current Opin. Biotechnol., 2:668). Сортировка фаговых библиотек случайных мутантов требует стратегии для конструирования и воспроизведения большого количества вариантов, процесса аффинной очистки с использованием рецептора-мишени и способов оценки результатов усиления связывания. Патенты США No. 5223409, 5403484, 5571689 и 5663143.
Несмотря на то что в большинстве способов фагового дисплея использовали нитевидные фаги, также известны системы дисплея лямбдоидных фагов (WO 95/34683; U.S. 5627024), системы дисплея фага T4 (Ren et al., Gene, 215: 439 (1998); Zhu et al., Cancer Research, 58(15): 3209-3214 (1998); Jiang et al., Infection & Immunity, 65(11): 4770-4777 (1997); Ren et al., Gene, 195(2):303-311 (1997); Ren, Белок Sci., 5: 1833 (1996); Efimov et al., Virus Genes, 10: 173 (1995)) и системы дисплея фага T7 (Smith and Scott, Methods in Enzymology, 217: 228-257 (1993); U.S. 5766905).
В настоящее время разработано множество других усовершенствований и вариантов основной концепции фагового дисплея. Эти усовершенствования повышают способность систем дисплея к скринингу пептидных библиотек в отношении связывания с отдельными молекулами-мишенями и к экспонированию функциональных белков с возможностью скрининга этих белков в отношении требуемых свойств. Разработаны комбинаторные реакционные устройства для реакций фагового дисплея (WO 98/14277) и библиотеки фагового дисплея использовали для анализа и контроля бимолекулярных взаимодействий (WO 98/20169; WO 98/20159) и свойств ограниченных спиральных пептидов (WO 98/20036). В WO 97/35196 описан способ выделения аффинного лиганда, в котором библиотеку фагового дисплея контактируют с одним раствором, в котором лиганд будет связываться с молекулой-мишенью, и вторым раствором, в котором аффинный лиганд не будет связываться с молекулой-мишенью, для селективного выделения связывающих лигандов. В WO 97/46251 описан способ биопэннинга случайной библиотеки фагового дисплея с очищенным аффинным способом антителом, а затем выделения связывающегося фага, с последующим процессом микропэннинга с использованием лунок микропланшета для выделения связывающего фага с высокой аффинностью. Также описано применение белка A Staphlylococcus aureus в качестве аффинной метки (Li et al. (1998) Mol Biotech., 9:187). В WO 97/47314 описано применение библиотек с удалением субстрата для выявления отличия специфичностей ферментов с использованием комбинаторной библиотеки, которая может представлять собой библиотеку фагового дисплея. Способ селекции ферментов, пригодных для применения в детергентах с использованием фагового дисплея, описан в WO 97/09446. Дополнительные способы селекции специфичных связывающих белков описаны в патентах США No. 5498538, 5432018 и WO 98/15833.
Способы получения пептидных библиотек и скрининга этих библиотек также описаны в патентах США No. 5723286, 5432018, 5580717, 5427908, 5498530, 5770434, 5734018, 5698426, 5763192 и 5723323.
В одном аспекте настоящее изобретение относится к лигандам для полипептида LYPD5. На фигуре 32 это продемонстрировано, где показаны нетрансфицированные клетки COS (A) и клетки COS, трансфицированные GLG-1 и окрашенные с помощью белка LYPD5-Fc. В одном варианте осуществления лиганд для LYPD5 представляет собой полипептид локализованного в комплексе Гольджи гликопротеина 1 (GLG-1) или E-селектина 1 (ESL-1), как показано в SEQ ID NO:18, 20, 22 или 24, кодируемый нуклеиновой кислотой, представленной в качестве SEQ ID NO:17, 19, 21 или 23 соответственно. В другом варианте осуществления полинуклеотид, кодирующий полипептид GLG-1, содержит по меньшей мере 15, по меньшей мере 25, по меньшей мере, по меньшей мере 50, по меньшей мере 100, по меньшей мере 250, по меньшей мере 500, по меньшей мере 750, по меньшей мере 1000, по меньшей мере 1250, по меньшей мере 1500, по меньшей мере 1750, по меньшей мере 2000, по меньшей мере 2040, по меньшей мере 2090, по меньшей мере 2150, по меньшей мере 2200, по меньшей мере 2300, по меньшей мере 2400, по меньшей мере 2500, по меньшей мере 2600, по меньшей мере 2700, по меньшей мере 2800, по меньшей мере 2900, по меньшей мере 3000, по меньшей мере 3100, по меньшей мере 3200, по меньшей мере 3300, по меньшей мере 3400, по меньшей мере 3500, по меньшей мере 3600, по меньшей мере 3700 или по меньшей мере 3720 последовательных нуклеотидов SEQ ID NO 17, 19, 21 или 23, или полинуклеотид, кодирующий GLG-1, содержит SEQ ID NO 17, 19, 21 или 23. В одном варианте осуществления полинуклеотид, который связывает полинуклеотид, кодирующий GLG-1 (SEQ ID NO:17, 19, 21 или 23), или его фрагмент обладает по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 99% или 100% идентичностью последовательности с полипептидом GLG-1 или его фрагментом. В одном варианте осуществления полипептид GLG-1 содержит по меньшей мере 10, по меньшей мере 25, по меньшей мере 50, по меньшей мере 75, по меньшей мере 100, по меньшей мере 125, по меньшей мере 150, по меньшей мере 175, по меньшей мере 200, по меньшей мере 225, по меньшей мере 250, по меньшей мере 275, по меньшей мере 300, по меньшей мере 325, по меньшей мере 350, по меньшей мере 400, по меньшей мере 450, по меньшей мере 500, по меньшей мере 550, по меньшей мере 600, по меньшей мере 650, по меньшей мере 700, по меньшей мере 750, по меньшей мере 800, по меньшей мере 850, по меньшей мере 900, по меньшей мере 950, по меньшей мере 1000, по меньшей мере 1050, по меньшей мере 1100, по меньшей мере 1150 или по меньшей мере 1200 последовательных аминокислот SEQ ID NO:18, 20, 22 или 24, или полипептид GLG-1 содержит SEQ ID NO:18, 20, 22 или 24. GLG-1 или ESL-1 экспрессируются на нейтрофилах, предположительно они вовлечены в экстравазацию нейтрофилов в ткани, и считают, что они играют важную роль в воспалении (см. Hidalgo et al. (2007) Immunity, 26(4): 477-489, включенную в настоящий документ в качестве ссылки в полном объеме). GLG-1 или ESL-1 имеют 14 цистеин-богатых доменов GLG1. Внеклеточный домен (ECD) является длинным, и, как описано ниже, было выявлено, что варианты или фрагменты GLG-1 ECD обладают способностью связывать LYPD5.
В другом варианте осуществления лиганд LYPD5 представляет собой вариант или фрагмент молекулы GLG-1 или ESL-1, описанной в настоящем документе. Как представлено на фигурах 33A-B, GLG-1 или ESL-1 можно рассматривать как фрагменты 1, 2, 3 и 4, и, как описано в примере 11, любой из 4 фрагментов является достаточным для связывания LYPD5.
В другом варианте осуществления лиганд LYPD5 представляет собой вариант или фрагмент GLG-1 или ESL-1, который представляет собой единичный домен GLG-1. Как представлено на фигурах 34A-B, GLG-1 состоит из множества доменов GLG-1, и, как описано в примере 11, единичных доменов GLG-1 достаточно для связывания LYPD5.
В другом варианте осуществления лиганд LYPD5 представляет собой вариант или фрагмент GLG-1 или ESL-1, который является специфичным для LYPD5. Как показано на фигурах 35A-B, GLG-1 включает домены 26-114, домен 115 и домен 150, и, как описано в примере 11, домен 115 связывает LYPD5, однако домены 26-114 не связывают LYPD5.
Настоящее изобретение предусматривает варианты GLG-1, также оно предусматривает варианты членов семейства LY6.
C. Варианты полипептидов
В дополнение к полипептидам, антителам и связывающим LY6 полипептидам, описанным в настоящем документе, предусматривается, что можно получать варианты таких молекул для применения с представленным в настоящем документе изобретением. Такие варианты можно получать посредством внесения соответствующих нуклеотидных изменений в кодирующую ДНК и/или посредством синтеза требуемого антитела или полипептида. Специалисты в данной области поймут, что аминокислотные изменения могут изменять посттрансляционные процессы этих молекул, например они могут изменять количество или положение участков гликозилирования или изменять характеристики заякоривания на мембране.
Изменения аминокислотной последовательности можно проводить, например, с использованием любого из способов и руководств для консервативных и неконсервативных мутаций, указанных, например, в патенте США No. 5364934. Изменение может представлять собой замену, делецию или вставку одного или нескольких кодонов, кодирующих аминокислотную последовательность, которые приводят к изменению аминокислотной последовательности по сравнению с нативной последовательностью. Необязательно изменение представляет собой замену по меньшей мере одной аминокислоты другой аминокислотой в одном или нескольких доменах представляющей интерес аминокислотной последовательности. Информацию о том, какой аминокислотный остаток может быть вставлен, замещен или удален без неблагоприятного влияния на требуемую активность, можно найти посредством сравнения последовательности представляющей интерес аминокислотной последовательности с последовательностью гомологичной известной белковой молекулы и минимизации количества замен аминокислотной последовательности в участках высокой гомологии. Аминокислотные замены могут быть результатом замены одной аминокислоты другой аминокислотой, имеющей сходные структурные и/или химические свойства, такой как замена лейцина серином, т.е. они могут представлять собой консервативные аминокислотные замены. Размер вставок, делеций или замен необязательно может находиться в диапазоне приблизительно от 1 до 5 аминокислот. Допустимое изменение можно определять систематическим проведением вставок, делеций или замен аминокислот в последовательности и тестированием полученных вариантов в отношении активности, проявляемой полноразмерной или зрелой нативной последовательностью.
В настоящем документе предусмотрены фрагменты различных полипептидов. Такие фрагменты могут быть укорочены с N-конца или C-конца, или они могут быть лишены внутренних остатков, например, по сравнению с полноразмерным нативным антителом или белком. Такие фрагменты, которые лишены аминокислотных остатков, которые не являются необходимыми для требуемой биологической активности, также пригодны для описанных способов.
Указанные выше полипептидные фрагменты можно получать любым из множества общепринятых способов. Требуемые пептидные фрагменты можно химически синтезировать. Альтернативный подход включает получение антитела или полипептидных фрагментов ферментативным расщеплением, например, посредством обработки белка ферментом, о котором известно, что он расщепляет белки в областях, определяемых конкретными аминокислотными остатками, или посредством расщепления ДНК пригодными ферментами рестрикции и выделения требуемого фрагмента. Другой пригодный способ включает выделение и амплификацию фрагмента ДНК, кодирующего требуемое антитело или полипептидный фрагмент, посредством полимеразной цепной реакции (PCR). В качестве 5' и 3'-праймеров в PCR используют олигонуклеотиды, которые определяют концы фрагмента ДНК. Предпочтительно такие фрагменты имеют по меньшей мере один вид биологической и/или иммунологической активности, совпадающий с видами активности полноразмерной молекулы.
В конкретных вариантах осуществления представляющие интерес консервативные замены представлены в таблице 6 под заголовком "предпочтительные замены". Если такие замены приводят к изменению биологической активности, тогда вносят более существенные изменения, обозначаемые в таблице 6 "иллюстративными заменами", или как описано ниже в отношении классов аминокислот, и проводят скрининг продуктов для идентификации требуемого варианта.
норлейцин
Met; Ala; Phe
Ala; норлейцин
Существенные модификации функции или иммунологических свойств антагониста полипептида LY6 проводят, выбирая замены, которые значительно отличаются по их эффекту на поддержание (a) структуры полипептидного остова в области замены, например, такой как конформация в виде слоя или спирали, (b) заряда или гидрофобности молекулы в участке-мишени, или (c) объема боковой цепи. Природные остатки можно разделить на группы на основе общих свойств их боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияют на ориентацию цепи: Gly, Pro; и
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены вызывают замену члена одного из этих классов членом из другого класса. Такие замещенные остатки также можно вносить в участки консервативных замен или более предпочтительно в остальные (неконсервативные) участки.
Изменения можно проводить с использованием способов, известных в данной области, таких как опосредуемый олигонуклеотидом (сайт-направленный) мутагенез, сканирование аланином и мутагенез посредством PCR. Сайт-направленный мутагенез (Carter et al, Nucl. Acids Res., L3:4331 (1986); Zoller et al, Nucl. Acids Res., 10:6487 (1987)), кассетный мутагенез (Wells et al, Gene. 34:315 (1985)), мутагенез с рестрикцией-селекцией (Wells et al, Philos. Trans. R. Soc. London SerA, 317:415 (1986)) или другие известные способы можно осуществлять на клонированной ДНК с получением молекулы против LY6.
Для идентификации одной или нескольких аминокислот вдоль непрерывной последовательности можно использовать анализ сканирования аминокислотами. К предпочтительным сканирующим аминокислотам относятся относительно небольшие нейтральные аминокислоты. Такие аминокислоты включают аланин, глицин, серин и цистеин. Аланин, как правило, является предпочтительной сканирующей аминокислотой в этой группе, поскольку она устраняет боковую цепь кроме бета-углерода и с меньшей вероятностью изменит конформацию основной цепи варианта (Cunningham и Wells, Science. 244: 1081-1085 (1989)). Также аланин обычно является предпочтительным, поскольку он представляет собой наиболее распространенную аминокислоту. Кроме того, он часто встречается как в углубленных, так и в экспонированных положениях (Creighton, The Proteins (W.H. Freeman & Co., N.Y.); Chothia, J. Mol. Biol. 150:1 (1976)). Если замена аланином не приводит к достаточным количествам варианта, можно использовать изостерную аминокислоту.
Любой остаток цистеина, не вовлеченный в поддержание надлежащей конформации полипептида LY6, также можно заменять, главным образом, серином, повышая стабильность молекулы к окислению и препятствуя аберрантному поперечному сшиванию. Напротив, для повышения стабильности в такую молекулу можно вносить цистеиновую связь(и) (в частности, где антитело представляет собой фрагмент антитела, такой как Fv-фрагмент).
Особенно предпочтительный тип варианта с заменами включает замену одного или нескольких остатков гипервариабельного участка исходного антитела (например, гуманизированного антитела или антитела человека). Как правило, полученный вариант(ы), выбранный для дальнейшей разработки, будет обладать улучшенными биологическими свойствами относительно исходного антитела, из которого они получены. Удобный способ получения таких вариантов с заменами включает созревание аффинности с использованием фагового дисплея. В кратком изложении несколько областей гипервариабельного участка (например, 6-7 областей) подвергают мутации с получением всех возможных аминокислотных замен в каждом участке. Полученные таким образом варианты антитела экспонируют в качестве одновалентных антител из частиц нитевидных фагов в качестве молекул, слитых с продуктом гена III M13 и упакованных в каждую частицу. Затем экспонированные на фаге варианты подвергают скринингу в отношении их биологической активности (например, аффинности связывания), как описано в настоящем документе. В целях идентификации областей гипервариабельного участка-кандидата для модификации, можно проводить сканирующий аланином мутагенез, идентифицируя остатки гипервариабельного участка, участвующие в значительной степени в связывании антигена. Альтернативно или дополнительно, может быть целесообразным анализ кристаллической структуры комплекса антиген-антитело в целях идентификации точек контакта между антителом и белком-мишенью. Такие контактные остатки и соседние остатки являются кандидатами для замены в соответствии со способами, описанными в настоящем документе. После получения таких вариантов панель вариантов подвергают скринингу, как описано в настоящем документе, и антитела с наилучшими свойствами в одном или нескольких соответствующих анализах можно отбирать для дальнейшей разработки.
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотной последовательности полипептидов LY6, получают различными способами, известными в данной области. Эти способы включают, но не ограничиваются ими, выделение из природного источника (в случае природных вариантов аминокислотной последовательности) или получение олигонуклеотид-опосредуемым (или сайт-направленным) мутагенезом, мутагенезом посредством PCR и кассетным мутагенезом нативной последовательности или ранее полученного варианта.
D. Модификации полипептидов
В объеме этого изобретения также могут быть пригодны ковалентно модифицированные полипептиды и/или антитела. Один тип ковалентной модификации включает проведение реакции заданных аминокислотных остатков таких антител и полипептидов с органическим образующим производное веществом, которое способно реагировать с определенными боковыми цепями или N- или C-концевыми остатками таких антител и полипептидов. Пригодным является преобразование бифункциональными веществами, например, для поперечного сшивания указанных выше молекул с нерастворимой в воде матрицей подложки или поверхностью для применения в очистке. Обычно используемые поперечно-сшивающие вещества включают, например, 1,1-бис(диазоацетил)-2-фенилэтан, глутаральдегид, сложные эфиры N-гидроксисукцинимида, например сложные эфиры с 4-азидосалициловой кислотой, гомобифункциональные сложные имидоэфиры, включая дисукцинимидиловые сложные эфиры, такие как 3,3'-дитиобис(сукцинимидилпропионат), бифункциональные малеинимиды, такие как бис-N-малеимидо-1,8-октан, и такие вещества, как метил-3-[(п-азидофенил)дитио]пропиоимидат.
Другие модификации включают дезамидацию глутаминильных и аспарагинильных остатков до соответствующих глутамильных и аспартильных остатков соответственно, гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных и треонильных остатков, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (T.E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-концевого амина и амидацию любой C-концевой карбоксильной группы.
Другой тип ковалентной модификации полипептидов или антител включает изменение нативного паттерна гликозилирования антитела или полипептида. "Изменение нативного паттерна гликозилирования" определяют как удаление одной или нескольких углеводных групп, встречающихся в нативной последовательности (либо посредством удаления основного участка гликозилирования, либо посредством устранения гликозилирования химическими и/или ферментативными способами), и/или добавление одного или нескольких участков гликозилирования, которые не присутствуют в нативной последовательности. Кроме того, это выражение включает количественные изменения гликозилирования нативных белков, включающие изменение структуры и соотношений различных присутствующих углеводных групп.
Гликозилирование антител и других полипептидов, как правило, является либо N-связанным, либо O-связанным. N-связанное гликозилирование относится к присоединению углеводной группы к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту, за исключением пролина, представляют собой последовательности, распознаваемые для ферментативного присоединения углеводной группы к боковой цепи аспарагина. Таким образом, наличие любой из этих трипептидных последовательностей в полипептиде создает потенциальный участок гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров, представляющих собой N-ацетилгалактозамин, галактозу или ксилозу, к гидроксиаминокислоте, обычно к серину или треонину, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление участков гликозилирования можно проводить, изменяя аминокислотную последовательность, чтобы она содержала одну или несколько из описанных выше трипептидных последовательностей (для участков N-связанного гликозилирования). Также изменение можно проводить посредством добавления к последовательности или замены посредством одного или нескольких остатков серина или треонина в последовательности исходного такого антитела или полипептида. Такую последовательность антитела или полипептида необязательно можно изменять посредством изменений на уровне ДНК, в частности посредством мутации ДНК, кодирующей последовательность, в предварительно выбранных основаниях, чтобы получить кодоны, которые будут транслировать требуемые аминокислоты.
Другим способом увеличения количества углеводных групп является химическое или ферментативное присоединение гликозидов к полипептиду. Такие способы описаны в данной области, например, в WO 87/05330, опубликованной 11 сентября 1987 года, и в Aplin and Wriston, CRC Crit. Rev. Biochem. pp. 259-306 (1981).
Удаление углеводных групп можно проводить химически или ферментативно или посредством мутационного замещения кодонов, кодирующих аминокислотные остатки, которые служат в качестве мишеней для гликозилирования. Химические способы дегликозилирования известны в данной области и описаны, например, Hakimuddin, et al., Arch. Biochem. Biophys. 259:52 (1987), и Edge et al, Anal. Biochem. 118:131 (1981). Ферментативное отщепление углеводных групп на полипептидах можно проводить с использованием множества эндо- и экзогликозидаз, как описано Thotakura et al., Meth. Enzymol., 138:350 (1987).
Другой тип ковалентной модификации включает связывание последовательности с одним из множества небелковых полимеров, например полиэтиленгликолем (PEG), полипропиленгликолем или полиоксиалкиленами, способом, указанным в патентах США No. 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337. Полипептид LY6 также можно заключать в микрокапсулы, полученные, например, способами коацервации или межфазной полимеризации (например, микрокапсулы на основе гидроксиметилцеллюлозы или желатина и микрокапсулы на основе поли-(метилметакрилата) соответственно), в коллоидные системы для доставки лекарственного средства (например, липосомы, микросферы на основе альбумина, микроэмульсии, наночастицы и нанокапсулы) или в микроэмульсии. Такие способы описаны в Remington's Pharmaceutical Science 16th edition, Oslo, A., Ed. (1980).
Для применения в способах по настоящему изобретению предусмотрены модификации, приводящие к образованию химерных молекул, являющихся результатом слияния одного полипептида с другим гетерологичным пептидом или аминокислотной последовательностью.
В одном варианте осуществления такая химерная молекула содержит молекулу полипептида, слитую с полипептидом-меткой, который обеспечивает эпитоп, с которым может селективно связываться антитело против метки. Эпитоп-метку, как правило, помещают на N- или С-конец такого антитела или полипептида. Детекцию присутствия таких меченных эпитопом форм таких антител или полипептидов можно проводить с использованием антитела против полипептида-метки. Также предоставление эпитопа-метки обеспечивает простоту очистки таких антител или полипептидов способами аффинной очистки с использованием антитела против метки или другого типа аффинной матрицы, которая связывается с эпитопом-меткой. Различные полипептиды-метки и соответствующие антитела к ним хорошо известны в данной области. Их примеры включают метки полигистидина (poly-his) или полигистидин-глицина (poly-his-gly); полипептид-метку flu HA и антитело к нему 12CA5 [Field et al, Mol. Cell. Biol. 8:2159-2165 (1988)]; метку c-myc и антитела к ней 8F9, 3C7, 6E10, G4, B7 и 9E10 [Evan et al, Molecular and Cellular Biology, 5:3610-3616 (1985)]; и метку в виде гликопротеина D (gD) вируса простого герпеса и антитело к ней [Paborsky et al, Protein Engineering, 3(6):547-553 (1990)]. Другие полипептиды-метки включают Flag-пептид [Hopp et al, BioTechnologv, 6:1204-1210 (1988)]; пептид-эпитоп KT3 [Martin et al, Science, 255:192-194 (1992)]; пептид-эпитоп α-тубулина [Skinner et al, J. Biol. Chem. 266:15163-15166 (1991)]; и пептидную метку белка гена 10 T7 [Lutz-Freyermuth et al, Proc. Natl. Acad. Sci. USA, 87:6393-6397 (1990)].
В альтернативном варианте осуществления химерная молекула может содержать молекулу полипептида, слитую с иммуноглобулином или конкретной областью иммуноглобулина. Для двухвалентной формы химерной молекулы (также обозначаемой как “иммуноадгезин”) такое слияние может быть с Fc-областью молекулы IgG. Слияние молекул Ig предпочтительно включает замену растворимой (удаленный или инактивированный трансмембранный домен) формой указанного антитела или полипептида по меньшей мере одного вариабельного участка в молекуле Ig. В особенно предпочтительном варианте осуществления слитая молекула иммуноглобулина включает шарнирную область CH2 и CH3 или шарнирную область CH1-, CH2- и CH3-участки молекулы IgG1. Для получения слитых молекул иммуноглобулином также см. патент США No. 5428130, выданный 27 июня 1995 года.
E. Получение полипептидов
Представленное ниже описание относится, главным образом, к получению полипептидов посредством культивирования клеток, трансформированных или трансфицированных вектором, содержащим кодирующую нуклеиновую кислоту, кодирующую такие антитела, полипептиды и олигопептиды. Термин "полипептиды" может включать антитела, полипептиды и олигопептиды. Безусловно, предусмотрено, что для получения таких антител, полипептидов и олигопептидов можно использовать альтернативные способы, которые хорошо известны в данной области. Например, соответствующую аминокислотную последовательность или ее части можно получать прямым пептидным синтезом с использованием твердофазных способов [см., например, Stewart et al, Solid-Phase Peptide Synthesis, W.H. Freeman Co., San Francisco, CA (1969); Merrifield, J. Am. Chem. Soc, 85:2149-2154 (1963)]. Синтез белков in vitro можно проводить с использованием ручных способов или с помощью автоматов. Автоматизированный синтез можно проводить, например, с использованием Applied Biosystems Peptide Synthesizer (Foster City, CA) с применением инструкций изготовителя. Различные части таких антител, полипептидов или олигопептидов можно химически синтезировать по отдельности и комбинировать с использованием химических или ферментативных способов с получением требуемого продукта.
1. Выделение ДНК, кодирующей полипептид
ДНК, кодирующую полипептид, можно получать из библиотеки кДНК, полученной из ткани, предположительно обладающей мРНК такого антитела, полипептида или олигопептида, и экспрессирующей ее на детектируемом уровне. Таким образом, ДНК, кодирующую такие полипептиды, можно удобным образом получать из библиотеки кДНК, полученной из ткани человека, геномной библиотеки или известными способами синтеза (например, автоматизированным синтезом нуклеиновой кислоты).
Библиотеки можно подвергать скринингу с помощью зондов (таких как олигонуклеотиды по меньшей мере приблизительно из 20-80 оснований), предназначенных для идентификации представляющего интерес гена или кодируемого им белка. Скрининг кДНК или геномной библиотеки определенным зондом можно проводить с использованием стандартных способов, как описано в Sambrook et al., Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989). Альтернативно, можно использовать технологию PCR [Sambrook et al., выше; Dieffenbach et al., PCR Primer: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1995)].
Способы скрининга библиотеки кДНК хорошо известны в данной области. Последовательности олигонуклеотидов, отобранные в качестве зондов, должны обладать достаточной длиной и должны быть достаточно уникальными, чтобы минимизировать ложноположительные результаты. Предпочтительно олигонуклеотид является меченым, чтобы его можно было выявить при гибридизации с ДНК в библиотеке, подвергаемой скринингу. Способы мечения хорошо известны в данной области и включают применение радиоактивных меток, таких как меченный 32P ATP, биотинилирование или мечение ферментом. Условия гибридизации, включая условия умеренной строгости и высокой строгости, представлены в Sambrook et al., выше.
Последовательности, идентифицированные в таких способах скрининга библиотек, можно сравнивать и выравнивать с другими известными последовательностями, депонированными и доступными в общедоступных базах данных, таких как GenBank или другие частные базы данных последовательностей. Идентичность последовательностей (на уровне либо аминокислот, либо нуклеотидов) в определенных участках молекулы или на протяжении полноразмерной последовательности можно определять с использованием способов, известных в данной области и как описано в настоящем документе.
Нуклеиновую кислоту, имеющую кодирующую белок последовательность, можно получать скринингом определенных библиотек кДНК или геномных библиотек с использованием установленной аминокислотной последовательности, описанной в настоящем документе впервые, и, если необходимо, с использованием общепринятых способов удлинения праймеров, как описано в Sambrook et al, выше, для детекции предшественников и промежуточных форм при процессинге мРНК, которые могут не подвергаться обратной транскрипции в кДНК.
2. Выбор и трансформация клеток-хозяев
Клетки-хозяева трансфицируют или трансформируют экспрессирующими или клонирующими векторами, описанными в настоящем документе, для продукции полипептида LY6 и культивируют в общепринятых питательных средах, модифицированных соответствующим образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности. Условия культивирования, такие как среды, температура, pH и т.п., квалифицированный специалист может выбрать без излишнего экспериментирования. Как правило, принципы, протоколы и практические способы для максимизации продуктивности клеточных культур можно найти в Mammalian Cell Biotechnology: A Practical Approach, M. Butler, ed. (IRL Press, 1991), и Sambrook et al, выше.
Способы трансфекции эукариотических клеток и трансформации прокариотических клеток известны специалисту в данной области, например опосредуемый CaCl2, CaPO4, липосомами способ и электропорация. В зависимости от используемой клетки-хозяина, трансформацию проводят с использованием стандартных способов, пригодных для таких клеток. Обработку кальцием с использованием хлорида кальция, как описано в Sambrook et al, выше, или электропорацию, как правило, используют для прокариот. Для трансформации определенных клеток растений используют инфицирование посредством Agrobacterium tumefaciens, как описано в Shaw et al, Gene. 23:315 (1983), и WO 89/05859, опубликованной 29 июня 1989 года. Для клеток млекопитающих без таких клеточных стенок можно использовать способ осаждения фосфатом кальция по Graham and van der Eb, Virology, 52:456-457 (1978). Основные аспекты трансфекций систем клеток-хозяев млекопитающих описаны в патенте США No. 4399216. Трансформации дрожжей, как правило, проводят в соответствии со способом Van Solingen et al, J. Bact, 130:946 (1977), и Hsiao et al, Proc. Natl. Acad. Sci. (USA), 76:3829 (1979). Однако также можно использовать другие способы введения ДНК в клетки, например посредством микроинъекции в ядро, электропорации, слияния протопласта бактерий с интактными клетками, или поликатионов, например полибрена, полиорнитина. Для различных способов трансформации клеток млекопитающих см. Keown et al, Methods in Enzymology, 185:527-537 (1990), и Mansour et al, Nature. 336:348-352 (1988).
Пригодные клетки-хозяева для клонирования или экспрессии ДНК в векторы, представленные в настоящем документе, включают клетки прокариот, дрожжей или высших эукариот. Пригодные прокариоты включают, но не ограничиваются ими, эубактерии, такие как грамотрицательные или грамположительные организмы, например Enterobacteriaceae, такие как E. coli. Различные штаммы E. coli являются общедоступными, такие как E. coli K12 штамм MM294 (ATCC 31446); E. coli X1776 (ATCC 31537); E. coli штамм W3110 (ATCC 27325) и K5 772 (ATCC 53635). Другие пригодные прокариотические клетки-хозяева включают Enterobacteriaceae, такие как Escherichia, например E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанная в DD 266710, опубликованной 12 апреля 1989 года), Pseudomonas, такие как P. aeruginosa и Streptomyces. Эти примеры являются иллюстративными, но не ограничивающими. Штамм W3110 является одним особенно предпочтительным хозяином или родителем, поскольку он представляет собой распространенный штамм-хозяин для ферментации продукта рекомбинантной ДНК. Предпочтительно клетка-хозяин секретирует минимальные количества протеолитических ферментов. Например, штамм W3110 можно модифицировать для достижения генетической мутации в генах, кодирующих белки, эндогенные для хозяина, примеры таких хозяев включают E. coli W3110 штамм 1A2, который имеет полный генотип tonA; E. coli W3110 штамм 9E4, который имеет полный генотип tonA ptr3; E. coli W3110 штамм 27C7 (ATCC 55244), который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ampT kanr; E. coli W3110 штамм 37D6, который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ampT rbs7 ilvG kanr; E. coli W3110 штамм 40B4, который представляет собой штамм 37D6 с делеционной мутацией degP без устойчивости к канамицину; и штамм E. coli, имеющий мутантную периплазматическую протеазу, описанную в патенте США No. 4946783, выданном 7 августа 1990 года. Альтернативно пригодны способы клонирования in vitro, например PCR или другие полимеразные реакции нуклеиновых кислот.
Полноразмерное антитело, фрагменты антитела и слитые белки антитела можно продуцировать в бактериях, в частности, когда гликозилирование и эффекторная функция Fc не требуются, например когда терапевтическое антитело конъюгировано с цитотоксическим средством (например, токсином) и сам иммуноконъюгат демонстрирует эффективность в отношении разрушения опухолевых клеток. Полноразмерные антитела обладают более длительным временем полужизни в кровотоке. Продукция в E. coli является более быстрой и более экономичной. Для экспрессии фрагментов антитела и полипептидов в бактериях см., например, U.S. 5648237 (Carter et. al), U.S. 5789199 (Joly et al) и U.S. 5840523 (Simmons et al.), в которых описаны участок инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции, эти патенты включены в настоящий документ в качестве ссылок. После экспрессии антитело выделяют из клеточной массы E. coli в растворимой фракции, и его можно очищать, например, посредством колонки с белком A или G, в зависимости от изотипа. Конечную очистку можно проводить аналогично процессу очистки антитела, экспрессируемого в пригодных клетках (например, в клетках CHO).
В дополнение к прокариотам, пригодными хозяевами для клонирования и экспрессии векторов, кодирующих требуемые полипептиды, являются эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи. Часто используют низший эукариотический микроорганизм-хозяин Saccharomyces cerevisiae. Другие хозяева включают Schizosaccharomyces pombe (Beach and Nurse, Nature, 290: 140 [1981]; EP 139383, опубликованный 2 мая 1985 года); хозяева Kluyveromyces (патент США No. 4943529; Fleer et al, Bio/Technology. 9:968-975 (1991)), например, такие как K. lactis (MW98-8C, CBS683, CBS4574; Louvencourt et al, J. Bacteriol. 154(2):737-742 [1983]), K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906; Van den Berg et al, Bio/Technology. 8: 135 (1990)), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070; Sreekrishna et al, J. Basic Microbiol. 28:265-278 [1988]); Candida; Trichoderma reesia (EP 244234); Neurospora crassa (Case et al, Proc. Natl. Acad. Sci. USA. 76:5259-5263 [1979]); Schwanniomyces, такие как Schwanniomyces occidentalis (EP 394538, опубликованный 31 октября 1990 года); и нитчатые грибы, например, такие как Neurospora, Penicillium, Tolypocladium (WO 91/00357, опубликованная 10 января 1991 года), и хозяева Aspergillus, такие как A. nidulans (Ballance et al, Biochem. Biophys. Res. Commun., 112:284-289 [1983]; Tilburn et al, Gene. 26:205-221 [1983]; Yelton et al, Proc. Natl. Acad. Sci. USA. 81: 1470-1474 [1984]) и A. niger (Kelly and Hynes, EMBO J. 4:475-479 [1985]). Метилотрофные дрожжи пригодны здесь и включают, но не ограничиваются ими, дрожжи, способные расти на метаноле, выбранные из родов, состоящих из Hansenula, Candida, Kloeckera, Pichia, Saccharomyces, Torulopsis и Rhodotorula. Перечень конкретных видов, которые являются примерами этого класса дрожжей, можно найти в C. Anthony, The Biochemistry of Methylotrophs, 269 (1982).
Источником пригодных клеток-хозяев для экспрессии гликозилированного полипептида являются многоклеточные организмы. Примеры клеток беспозвоночных включают клетки насекомых, такие как Drosophila S2 и Spodoptera Sf9, а также клетки растений, такие как клеточные культуры хлопка, кукурузы, картофеля, сои, петунии, томата и табака. Было идентифицировано множество штаммов и вариантов бакуловирусов и соответствующие пермиссивные клетки-хозяева насекомых из хозяев, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (москит), Aedes albopictus (москит), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Общедоступным для трансфекции является множество штаммов вирусов, например вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы здесь в качестве вируса в соответствии с настоящим изобретением, в частности для трансфекции клеток Spodoptera frugiperda.
Однако наибольший интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (культура тканей) стало общепринятым способом. Примерами пригодных клеточных линий млекопитающих являются линия почки обезьяны CV1, трансформированная SV40 (COS-7, ATCC CRL 1651); линия почки эмбриона человека (клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки детенышей хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al, Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы буффало (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al, Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и линия гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для продукции требуемого полипептида и культивируют в общепринятых питательных средах, модифицированных пригодным образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности.
3. Выбор и применение реплицируемого вектора
Нуклеиновую кислоту (например, кДНК или геномной ДНК), кодирующую соответствующий полипептид LY6, можно встраивать в реплицируемый вектор для клонирования (амплификации ДНК) или для экспрессии. Различные векторы являются общедоступными. Например, вектор может быть представлен в форме плазмиды, космиды, вирусной частицы или фага. Соответствующую последовательность нуклеиновой кислоты можно встраивать в вектор множеством способов. Как правило, ДНК встраивают в соответствующий участок(ки) для эндонуклеазы рестрикции с использованием способов, известных в данной области. Компоненты вектора, как правило, включают, но не ограничиваются ими, одну или несколько сигнальных последовательностей, ориджин репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. При конструировании пригодных векторов, содержащих один или несколько из этих компонентов, используют стандартные способы лигирования, которые известны квалифицированному специалисту.
Требуемый полипептид можно продуцировать рекомбинантными способами не только прямо, но также в качестве полипептида, слитого с гетерологичным полипептидом, который может представлять собой сигнальную последовательность, или другим полипептидом, имеющим определенный участок расщепления на N-конце зрелого белка или полипептида. Как правило, сигнальная последовательность может быть компонентом вектора, или она может быть частью ДНК, кодирующей зрелую последовательность, которую встраивают в вектор. Сигнальная последовательность может представлять собой прокариотическую сигнальную последовательность, выбранную, например, из группы, состоящей из лидерных последовательностей щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II. В случае секреции в дрожжах, сигнальная последовательность может представлять собой, например, лидерную последовательность инвертазы дрожжей, лидерную последовательностью альфа-фактора (включая лидерные последовательности α-фактора Saccharomyces и Kluyveromyces, последняя из которых описана в патенте США No. 5010182) или лидерную последовательность кислой фосфатазы, лидерную последовательность глюкоамилазы C. albicans (EP 362179, опубликованный 4 апреля 1990 года) или сигнальную последовательность, описанную в WO 90/13646, опубликованной 15 ноября 1990 года. При экспрессии в клетках млекопитающих для направления секреции белка можно использовать сигнальные последовательности млекопитающих, такие как сигнальные последовательности из секретируемых полипептидов того же или родственного вида, а также вирусные секреторные лидерные последовательности.
Векторы, как для экспрессии, так и для клонирования, содержат последовательность нуклеиновой кислоты, которая обеспечивает репликацию вектора в одной или нескольких выбранных клетках-хозяевах. Такие последовательности хорошо известны для множества бактерий, дрожжей и вирусов. Ориджин репликации из плазмиды pBR322 является пригодным для большинства грамотрицательных бактерий, плазмидный ориджин 2µ пригоден для дрожжей, и различные вирусные ориджины (SV40, полиомы, аденовируса, VSV или BPV) пригодны для клонирования векторов в клетках млекопитающих.
Векторы для экспрессии и клонирования, как правило, содержат ген для селекции, также называемый селектируемым маркером. Типичные гены для селекции кодируют белки, которые (a) придают устойчивость к антибиотикам или другим токсинам, например ампициллину, неомицину, метотрексату или тетрациклину, (b) комплементируют дефициты ауксотрофов или (c) обеспечивают основные питательные вещества, которые не доступны из комплексных сред, например ген, кодирующий D-аланинрацемазу для Bacilli.
Примером пригодных селектируемых маркеров для клеток млекопитающих являются маркеры, которые позволяют идентификацию клеток, способных захватывать нуклеиновую кислоту, кодирующую требуемый белок, такие как гены DHFR или тимидинкиназы. Пригодной клеткой-хозяином при применении DHFR дикого типа является клеточная линия CHO с дефектом активности DHFR, получаемая и размножаемая, как описано Urlaub et al, Proc. Natl. Acad. Sci. USA. 77:4216 (1980). Пригодным геном для селекции для применения в дрожжах является ген trp1, присутствующий в плазмиде дрожжей YRp7 [Stinchcomb et al., Nature. 282:39 (1979); Kingsman et al, Gene. 7:141 (1979); Tschemper et al, Gene. 10: 157 (1980)]. Ген trp1 обеспечивает селектируемый маркер для мутантного штамма дрожжей, лишенного способности расти на триптофане, например ATCC No. 44076 или PEP4-1 [Jones, Genetics, 85: 12 (1977)].
Экспрессирующие и клонирующие векторы, как правило, содержат промотор, функционально связанный с последовательностью нуклеиновой кислоты, кодирующей требуемую аминокислотную последовательность, для регуляции синтеза мРНК. Хорошо известны промоторы, распознаваемые во множестве потенциальных клеток-хозяев. Промоторы, пригодные для применения в прокариотических хозяевах, включают промоторные системы β-лактамазы и промоторную систему лактозы [Chang et al., Nature. 275:615 (1978); Goeddel et al, Nature. 281 :544 (1979)], промотор щелочной фосфатазы, промоторную систему триптофана (trp) [Goeddel, Nucleic Acids Res. 8:4057 (1980); EP 36776] и гибридные промоторы, такие как промотор tac [deBoer et al, Proc. Natl. Acad. Sci. USA, 80:21-25 (1983)]. Промоторы для применения в бактериальных системах также содержат последовательность Шайна-Дальгарно (S.D.), функционально связанную с ДНК, кодирующей последовательность требуемого белка.
Примеры пригодных промоторных последовательностей для применения в дрожжевых хозяевах включают промоторы 3-фосфоглицераткиназы [Hitzeman et al., J. Biol. Chem., 255:2073 (1980)] или других гликолитических ферментов [Hess et al., J. Adv. Enzyme Reg., 7:149 (1968); Holland, Biochemistry, 17:4900 (1978)], таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкоза-6-фосфатизомераза, 3-фосфоглицеромутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкоизомераза и глюкокиназа.
Другие дрожжевые промоторы, которые представляют собой индуцибельные промоторы, обладающие дополнительным преимуществом контролируемой условиями выращивания транскрипции, представляют собой промоторные участки алкогольдегидрогеназы 2, изоцитохрома C, кислой фосфатазы, ферментов деградации, связанных с метаболизмом азота, металлотеонеина, глицеральдегид-3-фосфат дегидрогеназы и ферментов, ответственных за употребление мальтозы и галактозы. Пригодные векторы и промоторы для применения для экспрессии в дрожжах описаны в EP 73657.
Транскрипция ДНК в клетках-хозяевах млекопитающих контролируется, например, промоторами, получаемыми из геномов вирусов, таких как вирус полиомы, вирус оспы птиц (UK 2211504, опубликованный 5 июля 1989 года), аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита B и вирус обезьяны 40 (SV40), гетерологичными промоторами млекопитающих, например промотором актина или промотором иммуноглобулина, и промоторами теплового шока, при условии, что такие промоторы являются совместимыми с системами клеток-хозяев.
Транскрипцию ДНК, кодирующей требуемый полипептид, можно повышать встраиванием в вектор энхансерной последовательности. Энхансеры представляют собой цис-регуляторные элементы ДНК, как правило, приблизительно из от 10 до 300 п.о., которые действуют на промотор, повышая его транскрипцию. В настоящее время известно множество энхансерных последовательностей из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако, как правило, используют энхансер из вируса эукариотической клетки. Их примеры включают энхансер SV40 на поздней стороне ориджина репликации (п.о. 100-270), энхансер раннего промотора цитомегаловируса, энхансер полиомы на поздней стороне ориджина репликации и энхансеры аденовируса. Энхансер может быть присоединен к вектору в 5'- или 3'-положении относительно последовательности, кодирующей указанные аминокислотные последовательности, однако предпочтительно он расположен в участке, расположенном в 5'-направлении от промотора.
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (в клетках дрожжей, грибов, насекомых, растений, животных, человека или содержащих ядро клетках из других многоклеточных организмов), также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны на 5'- и иногда на 3'-нетранслируемых участках эукариотических или вирусных ДНК или кДНК. Эти участки содержат нуклеотидные фрагменты, транскрибируемые в качестве полиадинилированных фрагментов в нетранслируемом участке мРНК, кодирующей соответствующее антитело, полипептид или олигопептид, описанные в этом разделе.
Другие способы, векторы и клетки-хозяева, пригодные для адаптации для синтеза соответствующего антитела, полипептида или олигопептида в культуре рекомбинантных клеток позвоночных, описаны в Gething et al, Nature. 293:620-625 (1981); Mantei et al, Nature. 281:40-46 (1979); EP 117060 и EP 117058.
4. Культивирование клеток-хозяев
Клетки-хозяева, используемые для продукции полипептида LY6, можно культивировать в различных средах. Для культивирования клеток-хозяев пригодными являются коммерчески доступные среды, такие как среда Хэма F10 (Sigma), минимальная поддерживающая среда ((MEM), (Sigma)), RPMI-1640 (Sigma), и среда Игла, модифицированная способом Дульбекко ((DMEM), Sigma). Кроме того, для клеток-хозяев в качестве культуральной среды можно использовать любую из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal Biochem. 102:255 (1980), патентах США No. 4767704; 4657866; 4927762; 4560655 или 5122469; WO 9003430; WO 87/00195; или патенте США Re. 30985. Любые из этих сред можно дополнять при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCIN™), микроэлементами (определяемыми как неорганические соединения, обычно представленные в конечных концентрациях микромолярного диапазона), и глюкозой или эквивалентными источниками энергии. Также можно добавлять любые другие необходимые дополнительные вещества в соответствующих концентрациях, которые известны специалистам в данной области. Условия культивирования, такие как температура, pH и т.п., представляют собой условия, которые ранее использовали для выбранных для экспрессии клеток-хозяев, и они будут понятны специалисту в данной области.
5. Детекция амплификации/экспрессии гена
Амплификацию и/или экспрессию гена можно определять непосредственно в образце, например, посредством общепринятого саузерн-блоттинга, нозарен-блоттинга для количественного определения транскрипции мРНК [Thomas, Proc. Natl. Acad. Sci. USA. 77:5201-5205 (1980)], дот-блоттинга (анализ ДНК) или гибридизации in situ, с использованием соответствующим образом меченого зонда на основе последовательностей, представленных в настоящем документе. Альтернативно можно использовать антитела, которые могут распознавать определенные дуплексы, включая дуплексы ДНК, дуплексы РНК и гибридные дуплексы ДНК-РНК или дуплексы ДНК-белок. Антитела в свою очередь можно метить и можно проводить анализ, где дуплекс связан с поверхностью, так чтобы при образовании дуплекса на поверхности можно было выявить присутствие антитела, связанного с дуплексом.
Альтернативно экспрессию гена можно определять иммунологическими способами, такими как иммуногистохимическое окрашивание клеток или срезов тканей и анализ клеточной культуры или жидкостей организма, для количественного определения непосредственно экспрессии продукта гена. Антитела, пригодные для иммуногистохимического окрашивания и/или анализа образцов жидкостей, могут быть либо моноклональными или поликлональными, и их можно получать у любого млекопитающего. Удобно, чтобы антитела, пригодные для способа по настоящему изобретению, можно было получать против полипептида или олигопептида с нативной последовательностью или против экзогенной последовательности, слитой с ДНК и кодирующей специфичный для антитела эпитоп такого полипептида или олигопептида.
6. Очистка белка
Полипептиды можно выделять из культуральной среды или из лизатов клеток-хозяев. В случае связанной с мембраной формы, его можно высвобождать из мембраны с использованием пригодного раствора детергента (например, Triton-X 100) или посредством ферментативного расщепления. Клетки, используемые для экспрессии указанного полипептида, можно разрушать различными физическими или химическими способами, такими как циклы замораживания и оттаивания, орабатывания ультразвуком, механическое разрушение или средства для лизиса клеток.
Может быть желательной очистка указанного полипептида из рекомбинантных белков или полипептидов клеток. Следующие способы иллюстрируют пригодные способы очистки: фракционирование на ионообменной колонке; осаждение этанолом; обращенно-фазовая ВЭЖХ; хроматография на диоксиде кремния или на катионообменной смоле, такой как DEAE; хроматофокусирование; SDS-PAGE; осаждение сульфатом аммония; гель-фильтрация с использованием, например, Sephadex G-75; колонки с белком A-сефарозой для удаления примесей, таких как IgG; и хелатирующие металлы колонки для связывания меченных эпитопом форм требуемых молекул. Можно использовать различные способы очистки белков, и такие способы известны в данной области и описаны, например, Deutscher, Methods in Enzymology, 182 (1990); Scopes, Protein Purification: Principles and Practice, Springer-Verlag, New York (1982). Выбранная стадия(и) очистки будет зависеть, например, от характера используемого процесса получения и конкретного антитела, полипептида или олигопептида, получаемого для заявленных способов.
При использовании рекомбинантных способов полипептид LY6 может продуцироваться внутриклеточно, в периплазматическом пространстве, или непосредственно секретироваться в среду. Если такие молекулы продуцируются внутриклеточно, на первой стадии, дебрис в виде частиц либо клеток-хозяев, либо лизированных фрагментов удаляют, например, посредством центрифугирования или ультрафильтрации. В Carter et al, Bio/Technology 10:163-167 (1992), описан способ выделения антител, которые секретируются в периплазматическое пространство E. coli. В кратком изложении, клеточную массу размораживают в присутствии ацетата натрия (pH 3,5), EDTA и фенилметилсульфонилфторида (PMSF) в течение приблизительно 30 мин. Клеточный дебрис можно удалять центрифугированием. Когда антитело секретируется в среду, супернатанты из таких экспрессирующих систем, как правило, сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белка, например элемента для ультрафильтрации Amicon или Millipore Pellicon. На любой из предшествующих стадий можно включать ингибитор протеаз, такой как PMSF, для ингибирования протеолиза и для предотвращения роста ненужных контаминирующих организмов можно добавлять антибиотики.
Очистку можно проводить с использованием, например, хроматографии с гидроксилапатитом, гель-электрофореза, диализа и аффинной хроматографии, причем аффинная хроматография является предпочтительным способом очистки. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в антителе. Белок A можно использовать для очистки антител, которые основаны на тяжелых цепях γ1, γ2 или γ4 человека (Lindmark et al, J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендован для всех изотипов мыши и для и γ3 человека (Guss et al, EMBO J. 5: 15671575 (1986)). Матрицей, к которой присоединяют аффинный лиганд, наиболее часто является агароза, однако доступны другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, позволяют более быстрые скорости потока и более короткое время обработки, чем скорости потока и время обработки, которые можно достигать посредством агарозы. Когда антитело содержит CH3-домен, для очистки пригодна смола Bakerbond ABXTM (J. T. Baker, Phillipsburg, NJ). Также доступны другие способы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на диоксиде кремния, хроматография на heparin-SEPHAROSETM, хроматография на анионо- или катионообменной смоле (такая как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония, в зависимости от подлежащего выделению антитела.
После предварительной стадии(ий) очистки смесь, содержащую представляющее интерес антитело и примеси, можно подвергать хроматографии гидрофобного взаимодействия с низким значением pH с использованием буфера для элюирования при pH между приблизительно 2,5-4,5, предпочтительно проводимой при низких концентрациях соли (например, от приблизительно 0-0,25 M соли).
H. Фармацевтические составы
Терапевтические составы ("терапевтическое средство"), используемые в соответствии с настоящим изобретением, можно получать для хранения смешиванием терапевтического средства(средств), имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington: The Science of Practice of Pharmacy, 20th edition, Gennaro, A. et al., Ed., Philadelphia College of Pharmacy и Science (2000)) в форме лиофилизированных составов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозировках и концентрациях и включают буферы, такие как ацетат, Tris, фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензэтония; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; изменяющие тоничность вещества, такие как трегалоза и хлорид натрия; сахара, такие как сахароза, маннит, трегалоза или сорбит; поверхностно-активное вещество, такое как полисорбат; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN®, PLURONICS® или полиэтиленгликоль (PEG). Антитело предпочтительно содержится в концентрации между 5-200 мг/мл, предпочтительно между 10-100 мг/мл.
Составы, представленные в настоящем документе, также могут содержать более одного активного соединения, если необходимо для конкретного показания, подлежащего лечению, предпочтительно соединения с дополняющими видами активности, которые не оказывают неблагоприятного эффекта друг на друга. Например, в дополнение к указанному терапевтическому средству(ам), может быть желательным включение в один состав дополнительного антитела, например второго такого терапевтического средства, или антитела к какой-либо другой мишени, такой как фактор роста, который влияет на рост глиомы. Альтернативно или дополнительно, композиция может далее содержать химиотерапевтическое средство, цитотоксическое средство, цитокин, ингибирующее рост средство, антигормональное средство и/или кардиопротектор. Такие молекулы соответственно присутствуют в сочетании в количествах, которые эффективны для поставленной цели.
Активные ингредиенты также могут быть заключены в микрокапсулы, полученные, например, способами коацервации или межфазной полимеризации, например микрокапсулы на основе гидроксиметилцеллюлозы или желатина, микрокапсулы на основе поли-(метилметакрилата), соответственно, в коллоидные системы для доставки лекарственного средства (например, липосомы, микросферы на основе альбумина, микроэмульсии, наночастицы и нанокапсулы) или в микроэмульсии. Такие способы описаны в Remington: The Science and Practice of Pharmacy, выше.
Можно получать препараты с замедленным высвобождением. Пригодные примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащие антитело, которые представлены в виде имеющих форму изделий, например пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США No. 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, недеградируемый этиленвинилацетат, деградируемые сополимеры молочная кислота-гликолевая кислота, такие как LUPRON DEPOT® (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата леупролида), и поли-D-(-)-3-гидроксимасляную кислоту.
Составы, подлежащие применению для введения in vivo, должны быть стерильными. Этого легко достигают фильтрацией через стерильные фильтрационные мембраны.
Способы диагностики и/или лечения воспалительного заболевания кишечника
Для определения экспрессии LY6 в желудочно-кишечной ткани или клетках млекопитающих, таких как млекопитающее, страдающее IBD, доступны различные диагностически анализы. В одном варианте осуществления сверхэкспрессию полипептида LY6 можно анализировать посредством RT-PCR, гибридизации in-situ, анализа на микрочипах и/или иммуногистохимии (IHC). Свежие, замороженные и/или погруженные в парафин срезы тканей из желудочно-кишечного биоптата (такого как биоптат толстого кишечника или, более конкретно, сигмовидной кишки) у млекопитающего (такого как, но не ограничиваясь этим, человек) можно подвергать RT-PCR, гибридизации in situ, анализу на микрочипах и/или анализу IHC.
Альтернативно или дополнительно, можно проводить анализы FISH, такие как INFORM® (продаваемый Ventana, Arizona) или PATHVISION® (Vysis, Illinois) на фиксированной формалином погруженной в парафин ткани для определения степени (при наличии) экспрессии и/или активации LY6 в образце ткани или биоптате.
Экспрессию LY6 можно оценивать с использованием диагностического анализа in vivo, например, посредством введения молекулы (такой как антитело, олигопептид или органическая молекула), которая связывает молекулу, подлежащую детекции, и является детектируемо меченной (например, радиоактивным изотопом или флуоресцентной меткой), и внешнего сканирования пациента в отношении локализации метки.
В настоящее время, в зависимости от стадии IBD, лечение включает один или сочетание из следующих способов лечения: хирургическая операция для удаления пораженной ткани кишечника, введение лекарственных средств, включая, но не ограничиваясь этим, химиотерапию; изменение режима питания и контроль образа жизни. Лекарственные средства или химиотерапевтические средства, пригодные для лечения IBD, известны в данной области, и репрезентативные терапевтические и химиотерапевтические средства описаны в настоящем документе.
В частности, предусматривается комбинированная терапия паклитакселом и его модифицированными производными (см., например, EP 0600517). Указанное антитело, полипептид, олигопептид или органическую молекулу будут вводить с терапевтически эффективной дозой химиотерапевтического средства. В другом варианте осуществления такое антитело, полипептид, олигопептид или органическую молекулу вводят вместе с химиотерапией для усиления активности и эффективности химиотерапевтического средства, например паклитаксела. В Physician's=Desk Reference (PDR) описаны дозировки этих средств, которые применяют для лечения различных злокачественных опухолей. Режим дозирования и дозировки этих указанных выше химиотерапевтических лекарственных средств, которые являются терапевтически эффективными, будут зависеть от конкретной подлежащей лечению злокачественной опухоли, области заболевания и других факторов, известных врачу, и они могут быть определены врачом.
Лекарственные средства или химиотерапевтические средства вводят пациенту-человеку известными способами, такими как внутривенное введение, например, в качестве болюсной инъекции или посредством непрерывной инфузии в течение периода времени, посредством внутричерепного, интрацереброспинального, внутрисуставного, интратекального, внутривенного, внутриартериального, подкожного, перорального, местного или ингаляционного способов.
Настоящее изобретение относится к способам, которые включают стадию диагностики и стадию терапевтического лечения. В одном варианте осуществления настоящее изобретение относится к способам детекции воспалительного заболевания кишечника (IBD) у млекопитающего, которые включают стадии (1) детекции уровня экспрессии нуклеиновой кислоты или гена, кодирующего полипептид LY6 (a) в тестируемом образце ткани или клеток, полученном у субъекта, и (b) в контрольном образце, где более высокий уровень экспрессии нуклеиновой кислоты LY6 или гена в тестируемом образце, по сравнению с контрольным образцом, указывает на наличие IBD у субъекта, у которого был получен тестируемый образец; и (2) введения субъекту эффективного количества лекарственного средства от IBD. В одном варианте осуществления лекарственное средство от IBD представляет собой антагонист другой ассоциированной с IBD молекулы. Настоящее изобретение предусматривает различные ассоциированные с IBD молекулы, которые обладают отличающейся экспрессией при IBD. В одном варианте осуществления ассоциированная с IBD молекула представляет собой молекулу, которая обладает отличающейся экспрессией при IBD. В другом варианте осуществления ассоциированная с IBD молекула сверхэкспрессируется при IBD. В другом варианте осуществления сверхэкспрессированная ассоциированная с IBD молекула представляет собой интегрин. В одном варианте осуществления ассоциированная с IBD молекула представляет собой интегрин бета 7 (ITGB2) (см. WO 2006/026759, которая включена в настоящий документ в качестве ссылки в полном объеме). Термин "лекарственное средство от IBD", как используют в настоящем документе, относится к антагонисту ассоциированной с IBD молекулы. В одном варианте осуществления лекарственное средство от IBD представляет собой антагонист интегрина. В другом варианте осуществления лекарственное средство от IBD представляет собой антагонист ITGB7. В другом варианте осуществления лекарственное средство от IBD представляет собой антагонист полипептида, представленного как SEQ ID NO:69, кодируемого последовательностью нуклеиновой кислоты, представленной как SEQ ID NO:68.
J. Изделия и наборы
Для диагностического применения изделие содержит контейнер и ярлык или вкладыш в упаковку на контейнере или прилагаемые к контейнеру, на которых указано применение для детекции экспрессии LY6 (такого как, но не ограничиваясь ими, LY6, LYPD1, LYPD3 и/или LYPD5) в желудочно-кишечной ткани или клетке млекопитающего. В одном варианте осуществления млекопитающим является человек. В одном варианте осуществления ткань или клетка представляет собой желудочно-кишечную ткань или клетку. В одном варианте осуществления детекция включает количественное определение по сравнению с контрольным образцом. В одном варианте осуществления на контейнере, ярлыке или вкладыше в упаковку указано, что источником желудочно-кишечной ткани или клеток является толстый кишечник млекопитающего. В одном варианте осуществления на контейнере, ярлыке или вкладыше в упаковку указано, что повышенная экспрессия LY6 по сравнению с контрольным образцом указывает на IBD, включая, но не ограничиваясь ими, CD и/или UC, у млекопитающего. Пригодные контейнеры включают, например, бутыли, флаконы, шприцы и т.д. Контейнеры могут быть образованы из различных материалов, таких как стекло или пластмасса. Кроме того, изделие может дополнительно содержать второй контейнер, содержащий буфер или другой реагент (такой как детектируемая метка), пригодные для проведения детекции. Кроме того, оно может включать другие материалы, желательные с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры и красители.
Для выделения и очистки полипептида LY6 набор может содержать связывающий LY6 реагент, связанный с гранулами (например, гранулами сефарозы). Может быть предоставлен набор, который содержит такие молекулы для выявления и количественного определения полипептида LY6 in vitro, например, в ELISA или вестерн-блоте. Как и в случае изделия, набор содержит контейнер и ярлык или вкладыш в упаковку на контейнере или прилагаемые к контейнеру. В контейнере содержится композиция, содержащая по меньшей мере одно такое связывающее LY6 антитело, олигопептид или органическую молекулу, пригодные для изобретения. Могут быть включены дополнительные контейнеры, которые содержат, например, разбавители, буферы и контрольные антитела. На ярлыке или вкладыше в упаковку может быть предоставлено описание композиции, а также инструкции для предполагаемого in vitro или диагностического применения.
K. Смысловые и антисмысловые кодирующие LY6 нуклеиновые кислоты
Молекулы, которые предположительно могут связываться с нуклеиновыми кислотами, кодирующими ген LY6, включают смысловые и антисмысловые олигонуклеотиды, которые содержат одноцепочечную последовательность нуклеиновой кислоты (либо РНК, либо ДНК), способную связываться с последовательностями-мишенями мРНК или ДНК LY6. Антисмысловые или смысловые олигонуклеотиды в соответствии с настоящим изобретением содержат фрагмент кодирующей области ДНК LY6 или комплементарный ему фрагмент. Возможность получения антисмыслового или смыслового олигонуклеотида на основе последовательности кДНК, кодирующей данный белок, описана, например, в Stein and Cohen (Cancer Res. 48:2659, 1988) и van der Krol et al. (BioTechniques 6:958, 1988).
Смысловые и/или антисмысловые олигонуклеотиды, гибридизующиеся с геном LY6, пригодны, например, для детекции наличия ДНК или мРНК LY6 в ткани или клеточном образце желудочно-кишечной ткани или клетках млекопитающего согласно изобретению. Смысловые и/или антисмысловые соединения, применяемые согласно этому изобретению, можно получать удобным и общепринятым хорошо известным способом твердофазного синтеза. Оборудование для такого синтеза продается несколькими поставщиками, включая, например, Applied Biosystems (Foster City, Calif.). Дополнительно или альтернативно можно использовать любые другие способы такого синтеза, известные в данной области. Хорошо известно применение сходных способов для получения олигонуклеотидов, таких как фосфоротиоаты и алкилированные производные. Соединения по изобретению также можно смешивать, инкапсулировать, конъюгировать или иным образом связывать с другими молекулами, структурами молекул или смесями соединений, например, как липосомы, нацеленные на рецептор молекулы, пероральные, ректальные, местные или другие составы, для способствования захвату, распределению и/или всасыванию. Патенты, в которых указано получение таких способствующих захвату, распределению и/или всасыванию составов, включают, но не ограничиваются ими, патенты США No. 5108921; 5354844; 5416016; 5459127; 5521291; 5543158; 5547932; 5583020; 5591721; 4426330; 4534899; 5013556; 5108921; 5213804; 5227170; 5264221; 5356633; 5395619; 5416016; 5417978; 5462854; 5469854; 5512295; 5527528; 5534259; 5543152; 5556948; 5580575 и 5595756, каждый из которых включен в настоящий документ в качестве ссылки.
Смысловые и антисмысловые олигонуклеотиды включают, но не ограничиваются ими, праймеры и зонды, пригодные для способов PCR, RT-PCR, гибридизации, гибридизации in-situ и т. п.
Другие примеры смысловых или антисмысловых олигонуклеотидов включают олигонуклеотиды, которые ковалентно связаны с органическими группами, такими как группы, описанные в WO 90/10048, и другие группы, которые повышают аффинность олигонуклеотида к последовательности нуклеиновой кислоты-мишени, такие как поли-(L-лизин). Кроме того, со смысловыми или антисмысловыми олигонуклеотидами могут быть связаны интеркалирующие средства, такие как эллиптицин, и алкилирующие средства или комплексы металлов, для модификации специфичности связывания антисмыслового или смыслового олигонуклеотида с нуклеотидной последовательностью-мишенью.
Антисмысловые или смысловые молекулы РНК или ДНК, как правило, имеют длину по меньшей мере приблизительно 5 нуклеотидов, альтернативно по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 или 1000 нуклеотидов, где в этом контексте термин “приблизительно” означает указанную длину нуклеотидной последовательности плюс или минус 10% от этой указной длины.
ПРИМЕРЫ
Следующие неограничивающие примеры предоставлены для иллюстративных целей и не предназначены для ограничения объема изобретения. Коммерчески доступные реагенты, указанные в примерах, использовали согласно инструкциям изготовителя, если нет иных указаний. Источником клеточных линий, указанных в следующих примерах и/или в описании, под регистрационными номерами ATCC является American Type Culture Collection, Manassas, VA.
Пример 1: Материалы и способы
Реагенты, клетки и мыши: IFNγ, TNFα и IL1β получали от Peprotech™ (Rocky Hill, NJ). IFNα получали от Hycult Biotechnology™ (The Netherlands). Для экспериментов по поперечному связыванию контрольное антитело против KLH, антитело против LY6A (клон E13-161.7 или D7) получали от Pharmingen™ (San Diego, CA). Антитело против LY6C (клон HK1.4) получали от Southern Biotech™ (Birmingham, AL).
Хронический перенесенный колит CD45RBhigh индуцировали, как описано ранее, у мышей SCID на фоне Balb/c (Powrie, F. et al. (1994) Immunity 1:553-562). Мышей IL10-/- (Kuhn, R. et al. (1993) Cell 75:263-274) на фоне 129, у которых развивался спонтанный колит, умерщвляли в возрасте между 11 и 13 неделями. Толстые кишечники подвергали быстрому замораживанию в OCT до применения в экспериментах, как описано. Проксимальный толстый кишечник, средний толстый кишечник, дистальный толстый кишечник и прямую кишку оценивали с использованием шкалы 0-5 (0 = нормальный кишечник, 5 = тяжелое заболевание). Баллы суммировали для определения общей тяжести колита у каждого животного.
Клеточную линию колоноцитов молодой мыши (YAMC) (полученную Robert Whitehead, Vanderbilt University Medical Center, Nahville, TN) получали из трансгенного животного Immortomouse™, содержащего термочувствительный T-антиген (tsTag) под контролем зависимого от интерферона-γ промотора, как описано ранее (Whitehead, R.H. et al. (1993) Proc Natl Acad Sci USA 90:587-591). Клетки YAMC пролиферируют в пермиссивных условиях, состоящих в 32°C в присутствии 5 единиц/мл IFN-γ (Peprotech™, New Jersey), но далее не пролиферируют при удалении IFN-γ при 37°C (непермиссивные условия).
Клетки YAMC культивировали в RPMI, содержащей 5% FBS, 2 мМ L-глутамин, пенициллин/стрептомицин, 5 ед./мл IFNγ и добавку N-2 (Invitrogen™, Carlsbad, CA). Клетки культивировали в непермиссивных условиях в течение 24 часов перед экспериментами и в продолжение экспериментирования.
Клетки CMT93 получали от ATCC (ATCC Number® CCL-223™, ATCC, Manassas, VA) и культивировали в DMEM, содержащей 10% FBS, 2 мМ L-глутамин и пенициллин/стрептомицин.
Микроскопия с лазерным захватом и очистка РНК: 10-12-мкм срезы наносили на покровные стекла LCM (Molecular Machines™, Glattbrugg, Switzerland). Стекла подвергали укороченному окрашиванию H&E (общее время составляло приблизительно пять минут), а затем эпителиальные клетки крипт гистологически идентифицировали и разрезали с использованием микроскопа MMI Cellcut™ (Molecular Machines, Glattbrugg, Switzerland). Из нарезанных клеток очищали РНК с использованием набора для очистки РНК Arcturus™ Picopure™ и протоколов изготовителя (Arcturus™, Sunnyvale, CA) и количественно определяли с использованием спектрофотометра NanoDrop ND-1000™ (NanoDrop Technologies™, Wilmington, DE).
Гибридизация на микрочипах и анализ данных: Количество и качество исходных образцов тотальной РНК определяли с использованием спектрофотометра ND-1000 (NanoDrop™ Technologies, Montchanin, DE) и Bioanalyzer 2100™ (Agilent™ Technologies, Palo Alto, CA) соответственно. Способ получения меченной Cy-красителем кРНК и гибридизации на матрицы был предоставлен Agilent™ Technologies (Palo Alto, CA). В кратком изложении, образец тотальной РНК превращали в двухцепочечную кДНК, а затем в меченую кРНК с использованием набора Low RNA Input Fluorescent Linear Amplification™ kit (Agilent™, # продукта 5184-3523). Меченую кРНК очищали с использованием набора RNeasy™ mini kit (Qiagen™, San Diego, CA), а затем количественно определяли с использованием спектрофотометра ND-1000™ (Nanodrop™ Technologies). Включение Cy-красителя определяли по разделению меченой кРНК на геле Novex™ с TBE-мочевиной (Invitrogen™, Carlsbad, CA), а затем гель сканировали на сканере Typhoon™ (GE Healthcare™, Piscataway, NJ). Для определения флуоресцентных импульсов Cy-красителя изображения гелей анализировали с использованием программного обеспечения ImageQuant™ (GE Healthcare™). Приблизительно 500000 импульсов меченной Cy-красителем кРНК фрагментировали и гибридизовывали с полногеномным чипом мыши Agilent, как описано в наборе In situ Hybridization kit-plus от Agilent (Agilent™, # продукта 5184-3568). Образцы LCM метили красителем Cy5 и гибридизовывали против меченного красителем Cy3 универсального стандарта мыши (Stratagene™, La Jolla, CA). После гибридизации чипы промывали, сушили ацетонитрилом и сканировали на сканере для микрочипов ДНК Agilent™. Файлы с изображением чипов анализировали с использованием программного обеспечения Feature Extraction™ 7.5 от Agilent™ и дальнейший анализ данных проводили с использованием Resolver™ (Merck™, Seattle, WA).
Данные анализировали с использованием программного обеспечения Rosetta ResolverTM (Rosetta Biosoftware™, Seattle, WA). В кратком изложении нормальные и колитические образцы группировали по отдельности и отбирали зонды, которые проходили двухсторонний anova (p<0,05). Эти зонды далее анализировали в отношении зондов, которые демонстрировали двукратное или более изменение в колитических образцах против нормальных образцов.
Количественная RT-PCR с детекцией в реальном времени: RT-PCR проводили на экстрагированной РНК с использованием набора и реагентов для RT-PCR Taqman™ Gold™ (Applied Biosystems™, Foster City, CA). Все образцы анализировали с праймерами, специфичными к гену, с использованием меченных 5'-FAM и 3'-TAMRA зондов. Анализ проводили по сравнению с праймерами, специфичными к гену домашнего хозяйства, SPF31, способом 2-∆∆Ct, как описано (Livak, K.J., and T.D. Schmittgen (2001) Methods 25:402-408). Праймеры и зонды либо конструировали с использованием программного обеспечения Primer3™ (Rozen, S., and H. Skaletsky (2000) Methods Mol Biol 132:365-386) либо получали коммерчески (Applied Biosystems™). Праймеры и зонды, используемые для этих анализов, были следующими, и они представлены в 5'-3'-направлении:
LY6A:
Смысловой: CTT ACC CAT CTG CCC TCC TA (SEQ ID NO:39)
Антисмысловой: CCT CCA TTG GGA ACT GCT AC (SEQ ID NO:40)
Зонд: TCC TGT TGC CAG GAA GAC CTC TGC (SEQ ID NO:41)
LY6C:
Смысловой: ACT TCC TGC CCA GCA GTT AC (SEQ ID NO:42)
Антисмысловой: GGC ACT GAC GGG TCT TTA GT (SEQ ID NO:43)
Зонд: CTG CCG CGC CTC TGA TGG AT (SEQ ID NO:44)
Иммунофлуоресцентное окрашивание: Замороженные ткани нарезали на 5-мкм срезы и окрашивали биотинилированным антителом против LY6C (Southern Biotech™, Birmingham, AL) или антителом против SCA-1 в количестве 2,5 нг/мл (R&D Systems™, Minneapolis, MN). Стекла промывали и метили Alexa Fluor™ 488, конъюгированным со стрептавидином, закрепляли с использованием Prolong Gold™ с DAPI (Invitrogen™, Carlsbad, CA) и визуализировали посредством конфокальной микроскопии.
Поперечное связывание молекул LY6: Способность поперечно-связанного полипептида LY6 вызывать продукцию хемокинов тестировали посредством инкубации клеток YAMC со связанными с планшетом антителами против LY6C или против KLH (контроль) и измеряли продукцию хемокинов CXCL2, CXCL5 и CCL7. Поскольку для поперечного связывания требуется образование липидных рафтов в клеточной мембране, продукцию хемокинов тестировали в условиях нормального образования рафтов (без истощения холестерина) и в условиях истощения холестерина.
Для поперечного связывания с использованием связанного с планшетом антитела, 100 мкл антитела против LY6C или антитела против KLH (контроль) в концентрации 5 мкг/мл добавляли в 96-луночный планшет или добавляли 2 мл в 60-мм2 чашку и позволяли связываться с планшетом в течение 15 часов при 4°С. Клетки YAMC, выращенные в условиях истощения холестерина или без истощения холестерина (как представлено в примере 5 настоящего документа), инкубировали со связанными с планшетом антителами в течение 15 часов при 32°С в условиях с истощением холестерина, РНК собирали и определяли уровни экспрессии CXCL2, CXCL5 и CCL7. Анализ дополнительно описан и результаты представлены в примере 5 настоящего документа.
Ингибирование siРНК: Отдельные siРНК, направленные против LY6C мыши, получали от Dharmacon (Lafayette, CO). siRNA трансфицировали в клетки YAMC с использованием липофектамина 2000 (Invitrogen) и стандартных протоколов. Через 72 часа после трансфекции клетки собирали для определения эффективности нокдауна. Для экспериментов по поперечному связыванию выбрали одну siРНК, исходя из наивысшей эффективности нокдауна (95% ингибирование посредством количественной RT-PCR).
Секреция CXCL5: Супернатанты стимулированных клеток собирали в указанный момент времени и определяли концентрации цитокина CXCL5 посредством ELISA с использованием коммерчески доступного набора от R&D Systems™ и протоколов изготовителя. Уровень детекции составил 15 пг/мл CXCL5.
Истощение холестерина: Клетки YAMC культивировали в течение 72 часов в бессывороточной среде при 37°С в присутствии 4 мкМ ловастатина и 250 мкМ мевалоната (Sigma). Клетки высевали и поддерживали в ловастатине и мевалонате на протяжении эксперимента.
Статистика: Для сравнения групп использовали t-критерий Стьюдента (* указывает на p<0,05).
Пример 2: Паттерны экспрессии генов IEC изменяются в ходе колита
В исследованиях было показано, что паттерны экспрессии генов IEC значительно изменяются в моделях колита на мышах, а также при IBD человека (Fahlgren, A., et al. (2004) Clin Exp Immunol 137:379-385; Brand, S. et al. (2006) Am J Physiol Gastrointest Liver Physiol 290:G827-838; Ruiz, P.A. et al. (2005) J Immunol 174:2990-2999). В этом примере оцененные паттерны экспрессии генов в IEC здоровых мышей и мышей с колитом исследовали для выявления новых генов и каскадов, измененных при IBD.
Идентификацию генов, вовлеченных в иммунопатологию IBD, проводили посредством оценки эпителиальных клеток кишечника (IEC) в модели перенесенного колита T-клеток CD45RBHi на мышах, а также в модели колита на мышах IL10-/-, обе из которых являются следствием нарушения регуляции Th1 и имеют много общих признаков с болезнью Крона человека (Elson, C.O. et al. (2005) Immunol Rev 206:260-276; Bouma, G., and W. Strober (2003) Nat Rev Immunol 3:521-533). Микродиссекцию с лазерным захватом (LCM) использовали для выделения IEC крипт из толстого кишечника здоровых мышей и мышей с колитом в двух моделях IBD мыши. Из этих образцов экстрагировали РНК и анализировали посредством технологии микрочипов, как описано в настоящем документе в примере 1. Профиль экспрессии генов IEC мышей с колитом в модели перенесенного колита привел к идентификации 1770 зондов > 2-кратным изменением экспрессии по сравнению с контрольными мышами, в то время как для модели IL10 -/- было идентифицировано 1140 зондов. В обоих моделях перекрывались 540 зондов с >2-кратным изменением экспрессии, соответствующие приблизительно 400 различным генам (данные не представлены).
Пример 3: Каскады и гены, измененные в IEC ходе колита
Среди приблизительно 400 генов, измененных в обеих моделях, в наибольшей степени были представлены гены, вовлеченные в представление антигена, передачу сигнала TLR и миграцию клеток (таблица 7). В таблице 7 числа соответствуют среднему значению изменения в кратности со стандартным отклонением по сравнению с универсальной стандартной РНК для мышей с колитом относительно здоровых мышей либо в модели колита IL10-/-, либо в модели колита CD45RBHi, как указано. Результаты указывают на то, что некоторые экспрессированные в IEC гены демонстрировали измененные паттерны в моделях IBD на мышах. Многие из этих генов, включая TLR2, CCL7, CXCL5 и ICAM-1, были описаны ранее как обладающие повышенной экспрессией в эпителии в ходе колита (Breider, M.A. et al. (1997) Vet Pathol 34:598-604; Uguccioni, M. et al. (1999) Am J Pathol 155:331-336; Z'Graggen, K. et al. (1997) Gastroenterology 113:808-816; Singh, J.C. et al. (2005) Am J Physiol Gastrointest Liver Physiol 288:G514-524), позволяя предположить, что паттерн экспрессии генов, полученный в этих микрочипах, точно отражает биологию IEC при колите.
Изменение в кратности (значение p)
IEC могут функционировать в качестве непрофессиональных APC (Snoeck, V. et al. (2005) Microbes Infect 7:997-1004; и Shao, L et al. (2005) Immunol Rev 206:160-176), и паттерн экспрессии генов, полученный на этих микрочипах, указывает на то, что эти функции усиливаются в ходе колита посредством активации генов, ассоциированных с процессингом антигенов, таких как LMP7 и TAP1, а также генов MHC класса I и II, которые могут служить для усиления представления антигенов на поверхности IEC.
Данные микрочипов подтверждают концепцию о том, что IEC при колите привлекают иммунные клетки к толстому кишечнику посредством измененной экспрессии хемокинов, и могут представлять антиген инфильтрирующим T-клеткам посредством повышения экспрессии генов, ассоциированных с представлением антигенов.
Пример 4: Экспрессия членов семейства LY6 строго повышается на поверхности IEC при колите
Члены семейства молекул LY6 мыши избыточно представлены по количеству и степени активации как в модели перенесенного колита на мышах, так и в модели IL10-/- на мышах (фигуры 23A и 23B). Эти результаты были подтверждены количественной RT-PCR в реальном времени объединенной и амплифицированной РНК IEC в модели перенесенного колита (данные не представлены). Экспрессия членов семейства LY6 была уникальной для болезненного состояния, так что у здоровых мышей не экспрессировались поддающиеся оценке уровни любого из этих членов семейства LY6.
Несмотря на то что известна экспрессия молекул LY6 мыши на поверхности клеток гемопоэтического происхождения, экспрессия на IEC ранее не была описана (Bamezai, A. (2004) Arch Immunol Ther Exp (Warsz) 52:255-266; и Rock, K.L. et al. (1989) Immunol Rev 111:195-224). Экспрессия LY6A и LY6C мыши является детектируемой на множестве неэпителиальных клеток, имеющихся в толстом кишечнике, таких как T-клети и гранулоциты. Иммунофлуоресцентное окрашивание проводили как для LY6A, так и для LY6C мыши, на здоровом и пораженном колитом толстом кишечнике. Уровни LY6A и LY6C мыши были минимальными или отсутствовали на поверхности здорового IEC (фигуры 24A и 24C соответственно). Экспрессия как LY6A, так и LY6C мыши была детектируемой на поверхности IEC на протяжении толстого кишечника мышей с колитом (фигуры 24B и 24D соответственно). Не было доказательств поляризации либо LY6A, либо LY6C, и окрашивание присутствовало как на апикальной, так и на базолатеральной мембранах, что делает молекулы LY6 потенциально доступными для лигандов на любой поверхности. Эти данные указывают на то, что результаты анализа на микрочипах, демонстрирующие активацию LY6A и LY6C мыши в моделях колита на мышах, не были следствием влияния контаминирующих иммунных клеток.
Пример 4: Транскрипция генов LY6 стимулируется воспалительными цитокинами
Экспрессия LY6 на T-клетках индуцируется и усиливается IFN как I, так и типа II (Khodadoust, M.M., K.D. Khan, and A.L. Bothwell. 1999. Complex regulation of Ly-6E gene transcription in T cells by IFNs. J Immunol 163:811-819). Более того, экспрессия ряда цитокинов повышается в толстом кишечнике при активном колите (Niessner, M., and B.A. Volk. 1995. Altered Th1/Th2 cytokine profiles in the intestinal mucosa of patients with inflammatory bowel disease as assessed by quantitative reversed transcribed polymerase chain reaction (RT-PCR). Clin Exp Immunol 101:428-435).
Для определения влияния присутствующих в ходе колита цитокинов на транскрипцию членов семейства LY6 в IEC, авторы настоящего изобретения обработали клетки YAMC, условно иммортализованную линию IEC мышей, посредством IL-1β, IFNα, TNFα, IFNγ или сочетанием TNFα и IFNγ и анализировали транскрипцию всех идентифицированных генов LY6 мыши количественной RT-PCR с детекцией в реальном времени (таблица 8). В кратком изложении, уровни мРНК указанного члена семейства LY6 в IEC определяли количественной RT-PCR с детекцией в реальном времени через 15 часов после обработки указанным цитокином. Числовые значения соответствуют изменению в кратности (определенному способом 2-∆∆Ct) по сравнению с контролем с необработанной средой. *, P<0,05 против контрольной среды. †, p<0,05 против обработанных IFNγ клеток. Следующие члены семейства LY6 были протестированы, но не были выявлены в образцах, независимо от обработки: LY6K, Lypd3, Lypd4, Lypd5, LY6g5b, LY6g6d, LY6g6e, Slurp1. Результаты указывают, что в ответ на воспалительные цитокины в IEC активируются члены семейства LY6.
Несмотря на то что многие из членов семейства LY6 не выявлялись либо в присутствии, либо в отсутствие воспалительных цитокинов, авторы настоящего изобретения выявили выраженную активацию транскрипции LY6A, LY6C и LY6F мыши в ответ на большинство тестируемых цитокинов, а также более умеренную активацию LY6E, LY6H и LYPD1 мыши в ответ на некоторые тестируемые цитокины. Однако IFNγ несомненно был наиболее эффективным цитокином в отношении индукции активации LY6. Более того, TNFα усиливал эффекты IFNγ на экспрессию LY6A, LY6F, LY6E и LYPD1. Сходную активацию членов семейства LY6 наблюдали в другой линии IEC мыши, CMT93 (данные не представлены).
Для исследования поверхностной экспрессии членов семейства LY6 в ответ на цитокины, клетки YAMC подвергали воздействию указанных выше цитокинов и анализировали проточной цитометрией в отношении экспрессии LY6A и LY6C мыши, для которых доступны коммерческие антитела, как описано в настоящем документе в примере 1. Высокие уровни LY6A мыши экспрессировались на клетках YAMC даже в отсутствие добавленных цитокинов (фигура 25B, среда). Экспрессия LY6C мыши (фигура 25A, среда) была значительно ниже, чем экспрессия LY6A.
IL-1β и TNFα индуцировали небольшое повышение поверхностной экспрессии как LY6A, так и LY6C мыши, что согласуется с экспрессией РНК (фигуры 25A и 25B). Более умеренное повышение экспрессии было отмечено, когда к клеткам добавляли IFNα, в то время как IFNγ индуцировал резкое повышение поверхностной экспрессии как LY6A, так и LY6C (фигура 25A и 25B). Поверхностная экспрессия белка точно отражала экспрессию РНК. Th2-цитокины, такие как IL4, IL10 или IL13, не оказывали эффекта на поверхностную экспрессию либо LY6A, либо LY6C (данные не представлены).
Индукция как LY6A (фигура 25D), так и LY6C (фигура 25C) посредством IFNγ была дозозависимой. Уже дозы 6,25 единиц/мл IFNγ приводили к детектируемому повышению уровня обеих молекул LY6 посредством проточной цитометрии. Более того, повышение поверхностной экспрессии как LY6A (фигура 25F), так и LY6C (фигура 25E) стало очевидным между 2 и 4 часами после обработки IFNγ, и экспрессия постоянно возрастала в течение по меньшей мере 24 часов после обработки IFNγ. Эти данные указывают на то, что относительно низкие концентрации IFNγ являются достаточными для повышения поверхностной экспрессии молекулы LY6 в пределах часов.
Существуют данные, что IL-22, который секретируется, главным образом, из активированных T-клеток, функционирует через комплекс IL-22R, представленный на IEC, обеспечивая продукцию цитокинов и воспалительный фенотип (Brand, S.F. et al. Am J Physiol Gastrointest Liver Physiol 290:G827-838 (2006)). Более того, IL-22 вовлечен в иммунопатогенез болезни Крона. Для исследования того, влияет ли IL-22 на экспрессию молекулы LY6 на IEC мыши, клетки YAMC культивировали в присутствии IL-22 и анализировали в отношении экспрессии LY6C (фигура 25G) и LY6A (фигура 25H). Уровни обеих молекул LY6 значительно возрастали в присутствии IL-22, что сравнимо с уровнями при индукции, наблюдаемой после обработки IFNγ.
Чтобы убедиться, что активация молекул LY6 не была специфичной для клеточной линии YAMC, исследовали уровни РНК LY6A и LY6C мыши в опухолевой клеточной линии эпителия толстого кишечника мыши CMT93. Уровни как LY6A мыши, так и LY6C мыши повышались при обработке IFNγ (фигура 25I). Хотя уровни активации молекул LY6 были более умеренными в клетках CMT93, анализ проточной цитометрией показал, что уровни были достаточно высокими даже в необработанных клетках (данные не представлены), что, вероятно, является результатом опухолевого фенотипа клеток CMT93.
Эти данные подтверждают данные, полученные количественной RT-PCR с детекцией в реальном времени, о том, что в ответ на воспалительные цитокины в IEC активируются члены семейства LY6.
Пример 5: Стимуляция IEC посредством LY6 ассоциирована с образованием липидных рафтов
Как GPI-заякоренные белки, члены семейства LY6 не обладают уникальным внутриклеточным доменом, ассоциированным с традиционной передачей сигнала снаружи внутрь. Вместо этого они находятся в микродоменах липидных рафтов (Bohuslav, J. et al. Eur J Immunol 23:825-831(1993)). Однако было сделано предположение, что поперечное связывание членов семейства LY6 на поверхности клеток приводит к перераспределению других молекул клеточной поверхности, а также к реорганизации структур липидных рафтов, демонстрируя механизм, посредством которого молекулы LY6 могут влиять на передачу сигнала и последующие клеточные функции (Simons, K. et al., Nat Rev Mol Cell Biol 1:31-39 (2000)).
К настоящему времени идентифицировано несколько лигандов для белков LY6, а лиганды для LY6A или LY6C в настоящее время не известны (Paret, C. et al. (2005) Int J Cancer 115:724-733; Apostolopoulos, J. et al. (2000) Immunity 12:223-232; и Classon, B.J. (2001) Trends Immunol. 22:126-127). Для поддержания целостности липидных рафтов требуется холестерин (Simons, K., et al. J Clin Invest 110:597-603 (2002)), и истощение холестерина часто используют для ингибирования биосинтеза липидных рафтов in vitro (von Tresckow, B. et al. J Immunol 172:4324-4331 (2004)).
Для анализа того, происходит ли реорганизация липидных рафтов в IEC в ответ на поперечное связывание LY6, клетки YAMC выращивали в условиях истощения холестерина (условия, при которых липидные рафты устраняются в клетах) и в условиях без истощения холестерина (условия, позволяющие образование липидных рафтов). Для условий истощения холестерина клети YAMC выращивали в отсутствие сыворотки и в присутствии 4 мкМ ловастатина и 0,25 мМ мевалоната (Sigma Chemical Co., St. Louis, MO) в течение 72 часов при 37°С. Те же условия роста использовали для клеток YAMC в условиях без истощения холестерина, за исключением того, что к среде для роста не добавляли ловастатин или мевалонат. Затем клетки поднимали и LY6C подвергали поперечному связыванию, как описано выше в примере 1. РНК собирали и определяли уровни экспрессии CXCL2, CXCL5 и CCL7.
Результаты этих исследований указывают на то, что устранение липидных рафтов приводит к ингибированию опосредуемой LY6C продукции хемокинов. На фигурах 26A-26C показано, что клетки YAMC с истощением холестерина (темные столбцы) продуцировали меньшее количество хемокина, чем клетки без истощения холестерина (незакрашенные столбцы). Истощение холестерина влияло на продукцию хемокинов в контрольных стимулированных антителом против KLH группах, независимо от стимуляции LY6C, однако ответ был минимальным и не имел постоянного направления. Для исследования того, влияет ли истощение холестерина на жизнеспособность клеток в целом, авторы настоящего изобретения определяли гибель клеток, по исключению 7AAD, и выявили, что истощение холестерина не оказывало значительного влияния на жизнеспособность клеток YAMC (жизнеспособность 92% относительно 86% в клетках с истощением холестерина, данные не представлены). Поверхностная экспрессия как LY6A (фигура 26D), так и LY6C (фигура 26E) была значительно ниже в клетках YAMC с истощением холестерина, позволяя предположить, что уровни холестерина плазматической мембраны и целостность липидных рафтов влияют на уровни экспрессии LY6 на поверхности клеток. Эти данные подтверждают, что целостность липидных рафтов, на которую влияет биосинтез холестерина, делает возможной экспрессию молекул LY6 на поверхности и потенциально вовлечена в опосредуемую LY6C индукцию хемокинов. Таким образом, усиление продукции хемокинов, опосредуемое взаимодействием полипептидов LY6C в клеточной мембране, требует наличия липидных рафтов на клеточной поверхности.
Пример 6: Поперечное связывание LY6C приводит к повышенной поверхностной экспрессии молекул LY6
Было описано, что поперечное связывание LY6C на поверхности T-клеток приводит к "слущиванию" LY6C (Jaakkola, I. et al. (2003) J Immunol 170:1283-1290). Однако в отличие от T-клеток, когда LY6C мыши подвергали поперечному связыванию на поверхности IEC, не происходило "слущивания" ни LY6A, ни LY6C (фигуры 27A и 27B соответственно). В противоположность этому, в отсутствие IFNγ уровни поверхностной экспрессии как LY6A, так и LY6C возрастали на IEC с поперечно-связанным LY6C, но не LY6A. Когда IEC предварительно инкубировали с IFNγ, большая часть этого эффекта устранялась (фигура 27C), однако все еще выявлялась небольшая активация LY6A (фигура 27D).
Эти данные указывают на положительную обратную связь, при которой стимуляция через LY6C на IEC приводит к повышенной поверхностной экспрессии молекул LY6.
Пример 7: Стимуляция LY6A приводит к повышенной секреции хемокинов
Функции молекулы LY6 полностью не выяснены. Для исследования роли молекул LY6 в иммунопатологии колита исследовали эффекты стимуляции молекул LY6 на транскрипцию и секрецию хемокинов из IEC.
Для анализа продукции хемокинов из IEC в ответ на поперечное связывание молекул LY6 мыши, клетки YAMC, либо предварительно обработанные IFNγ, либо не обработанные, культивировали на планшетах, покрытых либо контрольным антителом против KLH, либо антителом против LY6A, либо антителом против LY6C. Через двадцать четыре часа получали мРНК из этих клеток и анализировали посредством количественной RT-PCR в отношении экспрессии CCL2, CCL4, CCL5, CCL7, CCL8, CCL25, CXCL1, CXCL2, CXCL5, CXCL10, CXCL12 и CX3CL1, которые являются хемокинами, вовлеченными в колит (таблица 9) (Papadakis, K.A. (2004) Curr Allergy Asthma Rep 4:83-89; Banks, C. et al. (2003) J Pathol 199:28-35; и Papadakis, K.A., and S.R. Targan (2000) Inflamm Bowel Dis 6:303-313). Анализ проводили в непермиссивных условиях роста (37°С в отсутствие IFNγ) для исключения возможности повышенной пролиферации IEC в ответ на стимуляцию IFNγ.
(0,56)
(1,14)
(0,49)
(1,17)
(0,48)
(0,69)
(0,56)
(0,10)
(0,02)
(0,15)
(0,13)
(0,23)
(0,27)
(0,11)
(0,08)
(0,15)
(0,44)
(0,33)
(0,51)
(0,30)
(0,37)
(3,14)
(8,94)
(9,81)
(3,36)
(0,16)
(0,11)
(0,00)
(0,36)
(0,15)
(0,19)
(0,35)
(1,10)
(3,13)
(3,30)
(3,05)
(16,23)
(0,53)
(65,14)
(1,15)
(55,50)
(0,51)
(0,06)
(0,08)
(0,15)
(0,07)
(0,11)
(0,16)
(0,42)
Клетки, предварительно обработанные IFNγ, продемонстрировали активацию большинства из этих генов хемокинов (см. группу "среда, антитело против KLH", относительно группы "IFNγ, антитело против KLH" таблицы 9). Однако за исключением активации CCL8 и подавления CXCL1, стимулированные антителом против LY6A клетки YAMC продемонстрировали сходные паттерны экспрессии генов с клетками YAMC, стимулированными антителом против KLH. Однако клетки YAMC, стимулированные антителом против LY6C, продемонстрировали повышенную экспрессию всех анализированных хемокинов за исключением CCL25, который оставался по существу неизменным, и CXCL12, который подавлялся в ответ на стимуляцию LY6C. Несмотря на то что повышенная экспрессия хемокинов, индуцированная поперечным связыванием LY6C, не зависела от IFNγ, клетки, предварительно обработанные IFNγ, продемонстрировали повышенную экспрессию хемокинов относительно клеток, которые не были предварительно обработаны IFNγ.
Для анализа кинетики индукции хемокинов стимуляцией LY6C на 96-луночные планшеты наносили антитело против KLH или моноклональное антитело либо против LY6A, либо против LY6C. Добавляли клетки YAMC, либо предварительно обработанные, либо предварительно не обработанные IFNγ, на 24, 48 или 72 часа. В указанный момент времени РНК собирали для анализа посредством количественной RT-PCR и супернатанты собирали для ELISA.
В течение 24 часов был выявлен пик транскрипции как CXCL5, так и CCL7 на клетках с поперечно-связанным LY6C, но не LY6A (фигура 28A). Повышенная экспрессия CXCL5 и CCL7 снижалась с течением времени, но все еще выявлялась через 72 часа в культуре. Несмотря на то что IFNγ не требовался для повышения транскрипции хемокинов, IFNγ действовал синергично со стимуляцией LY6C при индукции транскрипции как CXCL5, так и CCL7 в ранние моменты времени.
Параллельно с экспрессией генов супернатанты клеток с поперечно связанным LY6C, но не LY6A, содержали значительно более высокие концентрации CXCL5 через 48 часов (фигура 28B). Эффект был дозозависимым, и детектировался уже при 1 мкг/мл нанесенного антитела против LY6C. Подобно транскрипции, секреция CXCL5 усиливалась, когда клетки предварительно обрабатывали IFNγ, однако IFNγ не требовался для эффекта. Повышенную секрецию CXCL5 также отмечали в моменты времени как 24, так и 72 часа.
Для того чтобы убедиться, что LY6C вовлечен в наблюдаемую активацию хемокинов, авторы настоящего изобретения использовали siРНК для нокдауна LY6C. Транскрипт LY6C ингибировался на 95% в отсутствие IFNγ и приблизительно на 90% в присутствии IFNγ при определении количественной RT-PCR, что соответствовало значительно более низким уровням LY6C на поверхности клеток YAMC (данные не представлены). Клетки со сниженными уровнями LY6C на поверхности продемонстрировали сниженный ответ на поперечное связывание LY6C в отношении транскрипции хемокинов (фигура 28C). Секреция CXCL5 также значительно ингибировалась нокдауном LY6C (данные не представлены).
Эти результаты указывают на то, что поперечное связывание LY6C, но не LY6A, на поверхности IEC приводит к повышенной секреции хемокинов.
Пример 8: IEC in vivo демонстрируют сходную экспрессию генов хемокинов со стимулированными LY6C клетками
Указанные выше данные определяют модель, посредством которой IEC, стимулированные через LY6C мыши, значительно повышают экспрессию генов хемокинов.
Анализируя данные микрочипов от IEC, подвергнутых лазерной микродиссекции, в моделях колита на мышах, исследовали экспрессию тех же 12 генов хемокинов у здоровых мышей и мышей с колитом в двух моделях колита на мышах для определения того, коррелируют ли хемокины, стимулированные поперечным связыванием LY6C in vitro, с хемокинами, секретируемыми IEC in vivo (фигуры 29A и 29B). Хотя паттерн экспрессии не является идентичным активации хемокинов вследствие стимуляции LY6C, экспрессия CXCL5, который был наиболее высоко активированным геном хемокина в исследованиях in vitro, также наиболее активировалась в моделях колита на мышах. Авторы настоящего изобретения наблюдали значительную активацию экспрессии CXCL1, CXCL10, CCL5 и CCL7 в обеих моделях колита. Кроме того, авторы настоящего изобретения наблюдали активацию CCL4 и CCL8 в модели перенесенного колита или в модели IL10 -/- соответственно.
Интересно, что единственный хемокин, который подавлялся в результате стимуляции LY6C мыши in vitro, CXCL12, также был единственным из этих хемокинов, который подавлялся in vivo.
Пример 9: Экспрессия генов LY6 человека в клетках толстого кишечника
Исследовали экспрессию LY6H, LYPD1, LYPD3 и LYPD5 человека в клеточной линии толстого кишечника человека, клетках Colo 205 (клеточная линия, полученная из карциномы толстого кишечника человека, регистрационный номер ATCC™ CCL-222™). Клетки Colo 205 человека обрабатывали цитокинами IFN-r, LPS, TNFα, IFN-r + TNFα, IFN-r + LPS или LPS + TNFα (все в концентрации 100 нг/мл, за исключением LPS с концентрацией 1 мкг/мл) в течение 18 часов (LYPD3) или 24 часов (LY6H или LYPD5). РНК собирали и очищали и экспрессию указанного члена семейства LY6 определяли посредством количественной RT-PCR с использованием реагентов от Applied Biosystems™ согласно инструкциям изготовителя. Праймеры и зонды, используемые для анализа посредством RT-PCR, были следующими:
LYPD1:
Смысловой: CAT GAT CCT CCG AAT CTG GT (SEQ ID NO:59)
Антисмысловой: AGC ACA GAA CAG AGG GGC TA (SEQ ID NO:60)
Зонд: ATA CGG CCA ATG TCA CAA CA (SEQ ID NO:61)
LYPD3:
Смысловой: ACT TCC TGT TCC CAC CAC TG (SEQ ID NO:62)
Антисмысловой: AGA GGA CAA GCG GAG AGA CA (SEQ ID NO:63)
Зонд: TTC TGG CAG GGG TGT TCT AG (SEQ ID NO:64)
LY6H:
Смысловой: AGC AGC AGC AGG AAG GAT (SEQ ID NO:65)
Антисмысловой: AAA AGT GCC GCT TAA CGA AG (SEQ ID NO:66)
Зонд: CAA GAT GTG TGC TTC CTC CTG CGA (SEQ ID NO:67)
Праймеры и зонды для LYPD5 были приобретены от Applied Biosysems™ (каталожный номер HS00289062_m1).
Результаты, нанесенные на график на фигурах 30A-30C, указывают на повышение в кратности экспрессии этих генов LY6 человека по сравнению с контролем в виде B-актина человека. После обработки указанными цитокинами наблюдали значительное повышение экспрессии LY6H, LYPD3 и LYPD5 человека.
Пример 10: Экспрессия генов LY6 человека в биоптате ткани толстого кишечника
Для дальнейшего изучения источника повышенной экспрессии LYPD1 и LYPD5 в толстом кишечнике пациентов с CD и UC проводили анализ в группе биоптатов пациентов с UC, CD и контролей. Анализ на микрочипах экспрессии LYPD1 с использованием РНК, экстрагированной из биоптатов толстого кишечника, показал статистически значимую повышенную экспрессию в воспаленной ткани толстого кишечника пациентов с CD (фигура 31A). В биоптатах UC и CD, взятых из толстого кишечника, наблюдали статистически значимую повышенную экспрессию LYPD5 в воспаленной ткани пациентов с UC и CD (фигура 31B). Это не наблюдалось в невоспаленных контрольных биоптатах.
Экспрессию LY6H человека в биоптатах терминального отдела подвздошной кишки воспаленной ткани IBD анализировали относительно контрольных биоптатов (не-IBD) терминального отдела подвздошной кишки с использованием анализа RT-PCR (Taqman™). Экспрессия LY6H человека в биоптатах с воспалением при IBD по меньшей мере в 1,5 раза превышала его экспрессию в контроле.
Экспрессия LYPD3 человека в биоптатах воспаленной толстой кишки UC активировалась и в биоптатах с воспалением при IBD менее чем в 2 раза превышала его экспрессию в контроле.
Результаты этих примеров демонстрируют экспрессию молекул LY6 на поверхности IEC и, кроме того, указывают на то, что экспрессия является уникальной для IEC в условиях воспаления. Более того, уровни поверхностной экспрессии LY6A и LY6C были высокими на IEC у мышей с колитом и практически одинаковыми на протяжении толстого кишечника. Поскольку молекулы как являются специфичными для болезненного состояния, так и повсеместно экспрессируются при заболевании, выявление экспрессии гена LY6 или полипептида человека, в частности LY6H, LYPD1, LYPD3 и LYPD5, является пригодным способом детекции IBD, включая UC и/или CD у человека. Кроме того, способ детекции экспрессии LY6 человека пригоден для диагностики IBD, UC и/или CD у человека и мониторинга ответа на лекарственные средства от IBD.
В примерах, описанных в настоящем документе, было показано функциональное значение экспрессии LY6 в IEC. Клетки YAMC были строго положительными по LY6A и экспрессировали более низкие уровни LY6C. Однако при стимуляции рядом цитокинов, присутствующих в толстом кишечнике при колите, включая IL-1β, TNFα, IFNα, и в частности IL-22 и IFNγ, уровни экспрессии обеих молекул LY6 значительно повышались. Клетки YAMC, предварительно обработанные IFNγ для повышения экспрессии молекул LY6, были пригодной моделью in vitro для анализа функционального значения экспрессии LY6.
Зависимая от условий иммортализованная природа клеток YAMC является следствием запускаемой промотором MHC II экспрессии большого T-антигена SV40; для запуска пролиферации в этих клетках используют низкие уровни (2,5-5 ед./мл) IFNγ (Whitehead, R.H. et al. (1993) Proc Natl Acad Sci USA 90:587-591; Whitehead, R.H., and J.L. Joseph. (1994) Epithelial Cell Biol 3:119-125). Клетки YAMC часто используют в качестве модели in vitro для обработки цитокинами IEC мыши (Mei, J.M. et al. (2000) Faseb J 14:1188-1201; Yan, F., and D.B. Polk (2002) J Biol Chem 277:50959-50965). Большой T-антиген SV40, который содержат эти клетки, является термочувствительным и является нефункциональным при 37°С. Все эксперименты, проведенные в данном исследовании, включали обработку посредством IFNγ в этих непермиссивных условиях. Кроме того, клетки YAMC подвергали бессывороточному голоданию (и голоданию IFNγ) при 37°С в течение 24 часов перед экспериментами. В таких условиях не наблюдались эффекты, указывающие на остаточную экспрессию T-антигена, такие как пролиферация клеток. В результате эффекты обработки IFNγ были следствием эффектов IFNγ, а не эффектов, обусловленных запуском экспрессии T-антигена. Более того, активацию членов семейства LY6 наблюдали во второй клеточной линии мыши, CMT93, подтверждая, что этот эффект является широко применимым для IEC.
Более того, IFNγ не был уникален среди цитокинов для индукции молекул LY6, поскольку умеренную активацию экспрессии LY6 наблюдали после обработки посредством TNFα, IL-1β и IL-22. Активация молекулы LY6 на IEC в ответ на IL-22 является интересной ввиду недавних данных, демонстрирующих потенциальную роль IL-22 при болезни Крона (Wolk, K., et al. J Immunol 178:5973-5981 (2007)). Несмотря на то что гомология между молекулами LY6 мыши и человека часто является сложной, существуют данные, позволяющие предположить, что активация молекул LY6 не ограничивается мышами. Предшествующие исследования на крысах показали активацию молекул LY6 в тонком кишечнике в моделях колита, и было предположено, что такая экспрессия вовлечена в воспаление, межклеточные взаимодействия, а также в передачу сигнала в IEC крысы (Baksheev, L. et al. J Gastroenterol 41:1041-1052 (2006)).
Данные, описанные выше, указывают на то, что существует вероятность того, что в опосредуемую LY6C передачу сигнала в IEC вовлечена целостность липидных рафтов. Это подразумевает, что нарушение липидных рафтов может служить для ослабления последующих эффектов стимуляции LY6C как посредством подавления экспрессии LY6C, так и посредством нарушения структурных компонентов передачи сигнала LY6C. Недавно было определено, что истощение холестерина в IEC статинами ингибирует экспрессию провоспалительных генов через модулирование NF-κB (Lee, J. et al., Int Immunopharmacol 7:241-248 (2007)). Более того, статины были эффективными лекарственными средствами в моделях колита на мышах (Naito, Y., et al. Int J Mol Med 17:997-1004 (2006)). Механизм, связывающий подвижность липидных рафтов и блокаду NF-κB, остается неопределенным, однако наши данные показывают, что активация через LY6C может быть одной из гипотез для объяснения механизма действия.
В этом исследовании авторы настоящего изобретения идентифицировали молекулы LY6 в качестве потенциального вышерасположенного переключателя экспрессии генов хемокинов. Поперечное связывание рецептора LY6C моноклональными антителами привело к резкой активации практически всех анализируемых хемокинов, включая CXCL5. Кроме того, авторы настоящего изобретения подтвердили, что секреция CXCL5 значительно усиливается в IEC с поперечно-связанным LY6C. Интересно, что даже несмотря на то, что как LY6A, так и LY6C заякорены на клеточной поверхности группой GPI, и несмотря на более высокие уровни экспрессии LY6A, чем LY6C, на поверхности IEC, последующие эффекты на секрецию хемокинов наблюдаются при поперечном связывании LY6C и непостоянно при поперечном связывании LY6A.
Пример 11: Идентификация лиганда для LYPD5
В этом исследовании специалисты в данной области клонировали для экспрессии приблизительно 14000 генов человека под промотором CMV в клетках COS. Пулы из 100 генов трансфицировали в клетки COS, выращенные в 140 лунках на 12-луночных планшетах. После трансфекции клетки окрашивали белком LYPD5-Fc (см. фигуру 32). Идентифицировали лунки с положительным окрашиванием и отдельные клоны трансфицировали в клетки COS. Идентифицировали единичную лунку, экспрессирующую единичный белок, GLG-1 (ESL-1) в качестве лиганда для LYPD5. GLG-1 характеризуется длинным внеклеточным доменом (ECD), трансмембранным доменом и цитоплазматическим доменом. Для оценки способности различных участков GLG-1 ECD связываться с LYPD5 проводили серию исследований коиммунопреципитации с использованием способов, известных средним специалистам в данной области. Было выявлено, что варианты или фрагменты GLG-1 ECD (см. фигуры 33-35) были способны служить в качестве лиганда для LYPD5. На фигуре 33B представлены результаты исследований коиммунопреципитации с использованием фрагментов 1, 2, 3 или 4, как изображено на фигуре 33A, и показано, что любой из этих фрагментов является достаточным для связывания LYPD5.
Кроме того, было выявлено, что сам ECD-домен GLG-1 является достаточным для связывания LYPD5. Как представлено на фигуре 33, GLG-1 состоит из множества доменов GLG-1, и единичные домены GLG-1 могут связывать LYPD5. На фигуре 34B представлены результаты коиммунопреципитации, демонстрирующие, что фрагменты 1, 2, 3 и 4, а также единичные домены GLG-1 115, 150, 215, 538, 609, 670, 729 и 858 (как представлено на фигуре 34A) были способны связывать LYPD5.
В другом исследовании коиммунопреципитации было показано, что связывание является специфичным на основе фрагментов LYPD5 (см. фигуру 35A), где было выявлено, что LYPD5 не связывается с отрицательным контролем BAP, было выявлено, что отрицательный контроль FN14 не связывает фрагмент 2 GLG-1, домен 115 GLG-1 человека связывает LYPD5, домен 115 не всегда экспрессируется на детектируемых уровнях, однако подавляет LYPD5, и фракция фрагмента 1 GLG-1 человека, которая лишена домена 115 (остатки 26-114), не связывает LYPD5 (фигура 35B).
На фигурах 34A и 35A “*” указан потенциальный участок фукозилирования.
Несмотря на то что представленное изобретение довольно подробно описано посредством иллюстрации и примеров для ясности понимания, описание и примеры не следует истолковывать как ограничивающие объем изобретения. Описания всей патентной и научной литературы, цитированной в настоящем документе, включены в настоящий документ в качестве ссылок в полном объеме.
| название | год | авторы | номер документа |
|---|---|---|---|
| Антигены, ассоциированные с воспалительным заболеванием кишечника | 2012 |
|
RU2612878C2 |
| НОВАЯ КОМПОЗИЦИЯ И СПОСОБЫ ЛЕЧЕНИЯ СВЯЗАННЫХ С ИММУНИТЕТОМ ЗАБОЛЕВАНИЙ | 2004 |
|
RU2375078C2 |
| ЖЕЛУДОЧНО-КИШЕЧНЫЙ ПРОЛИФЕРАТИВНЫЙ ФАКТОР И ЕГО ПРИМЕНЕНИЯ | 2005 |
|
RU2343158C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ LIGHT И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2542394C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ ИНТЕГРИН АЛЬФА-V БЕТА-8 | 2012 |
|
RU2614252C2 |
| НОВЫЙ ЛИГАНД РЕЦЕПТОРА ЦИТОКИНА ZCYTOR17 | 2003 |
|
RU2490276C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ КИШЕЧНИКА | 2006 |
|
RU2418594C2 |
| ГЕТЕРОДИМЕРНЫЕ ПОЛИПЕПТИДЫ IL-17 A/F И ВОЗМОЖНОСТИ ИХ ЛЕЧЕБНОГО ПРИМЕНЕНИЯ | 2007 |
|
RU2440134C2 |
| ПОЛИПЕПТИД ОЖИРЕНИЯ (ОВ)(ВАРИАНТЫ), ЕГО АНАЛОГ (ВАРИАНТЫ) И СЛИТЫЙ БЕЛОК (ВАРИАНТЫ), ИЗОЛИРОВАННАЯ МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ, МОЛЕКУЛА ДНК, РЕКОМБИНАНТНЫЙ ВЕКТОР КЛОНИРОВАНИЯ, РЕКОМБИНАНТНЫЙ ВЕКТОР ЭКСПРЕССИИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, МОНОКЛОНАЛЬНОЕ И ПОЛИКЛОНАЛЬНОЕ АНТИТЕЛО | 1995 |
|
RU2273645C9 |
| НУКЛЕОТИДНЫЕ И АМИНОКИСЛОТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ ФАКТОРОВ ЯЙЦЕКЛЕТОК ДЛЯ ИЗМЕНЕНИЯ РОСТА ЯИЧНИКОВЫХ ФОЛЛИКУЛОВ IN VIVO ИЛИ IN VITRO | 2001 |
|
RU2270862C2 |
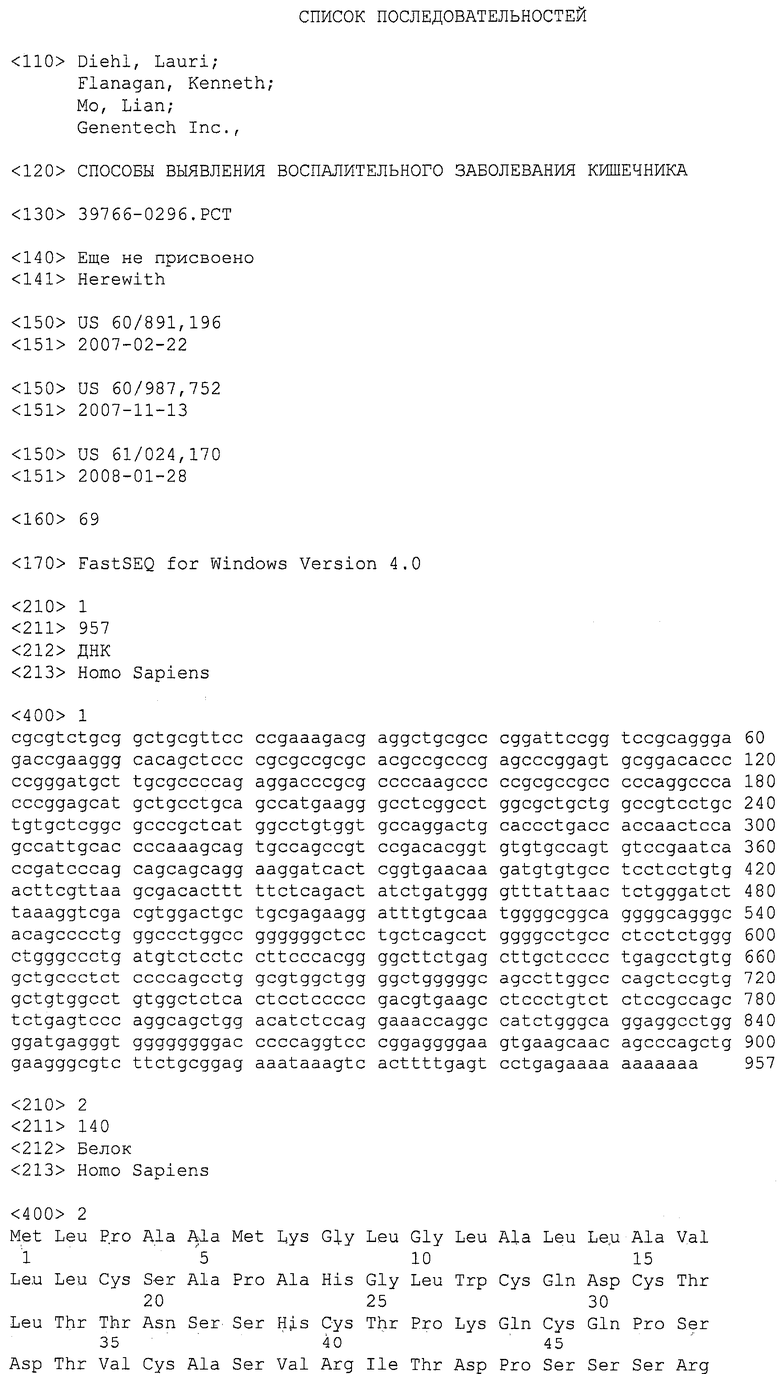

























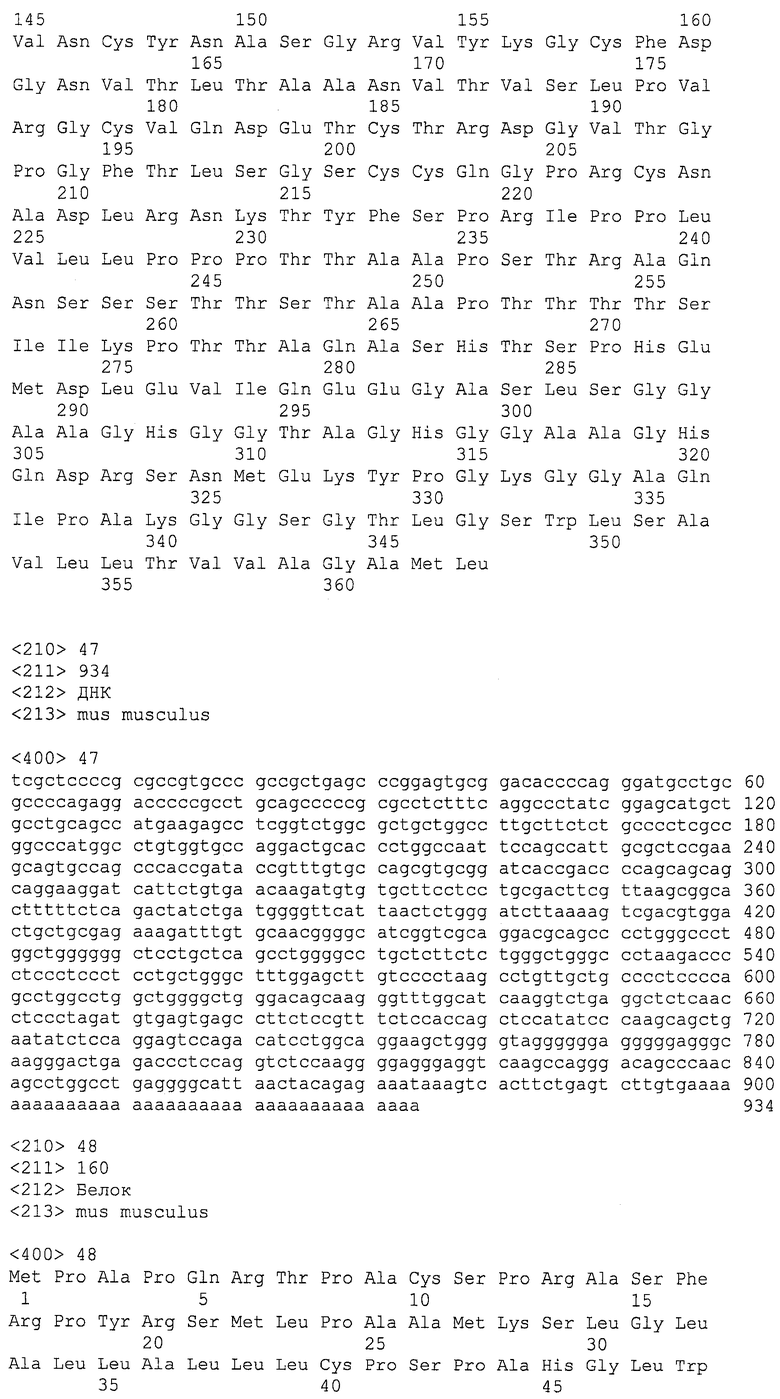










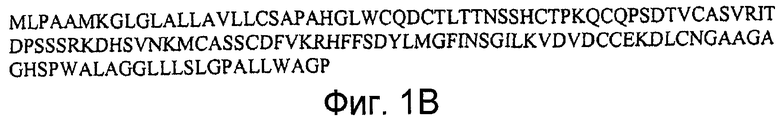




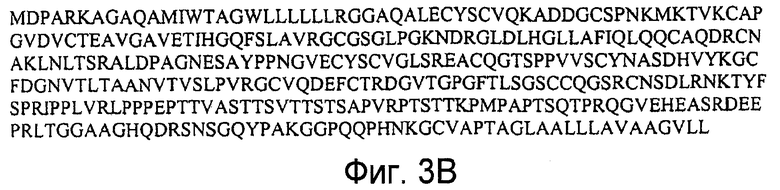


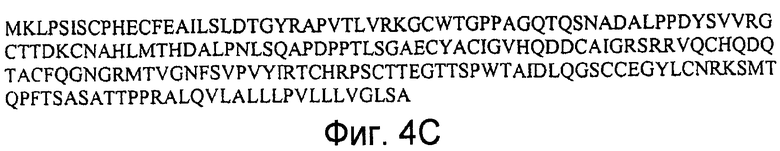













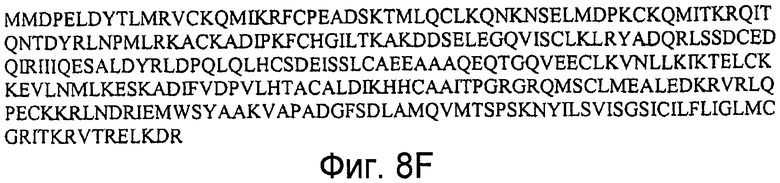





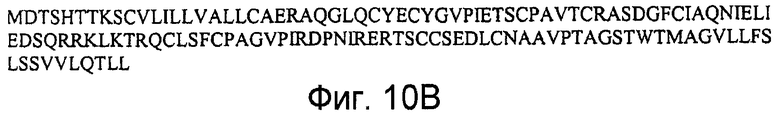

















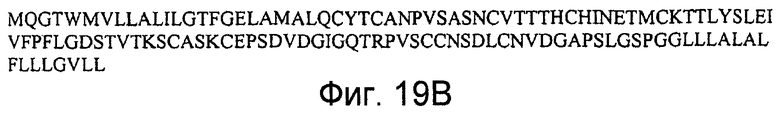

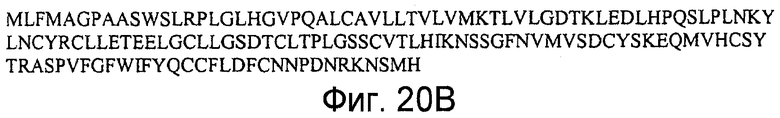





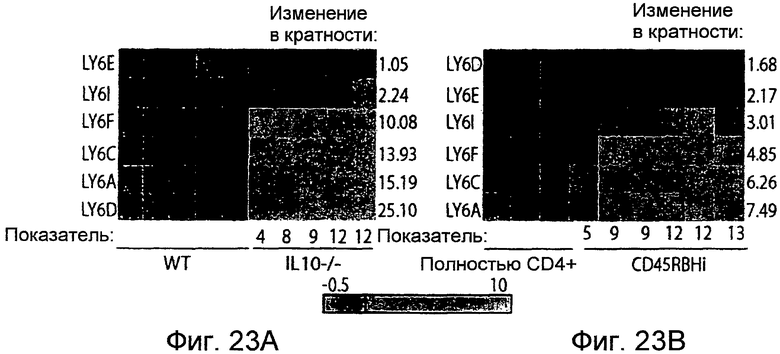
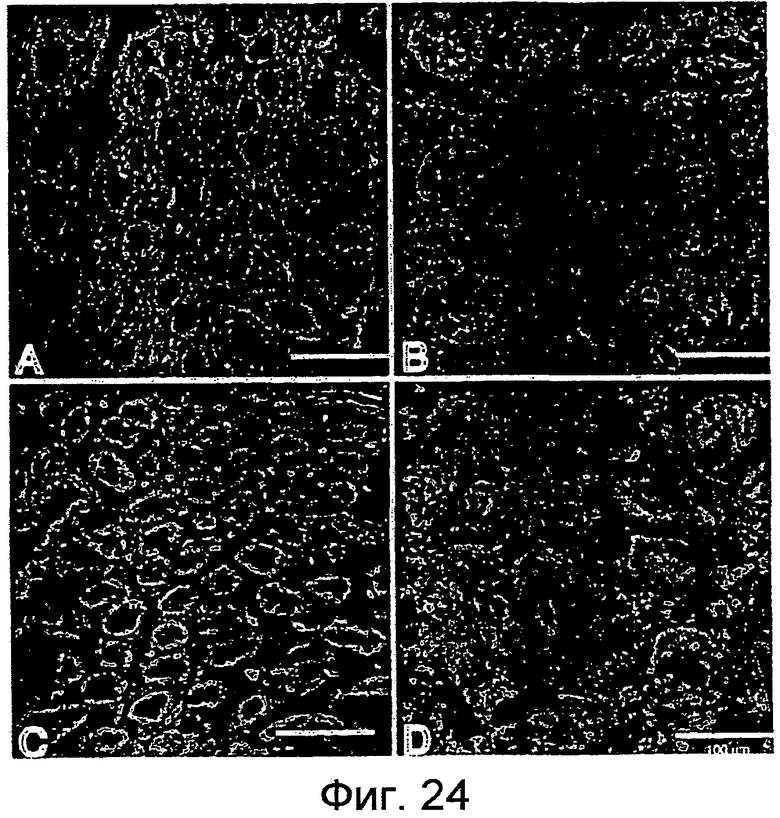
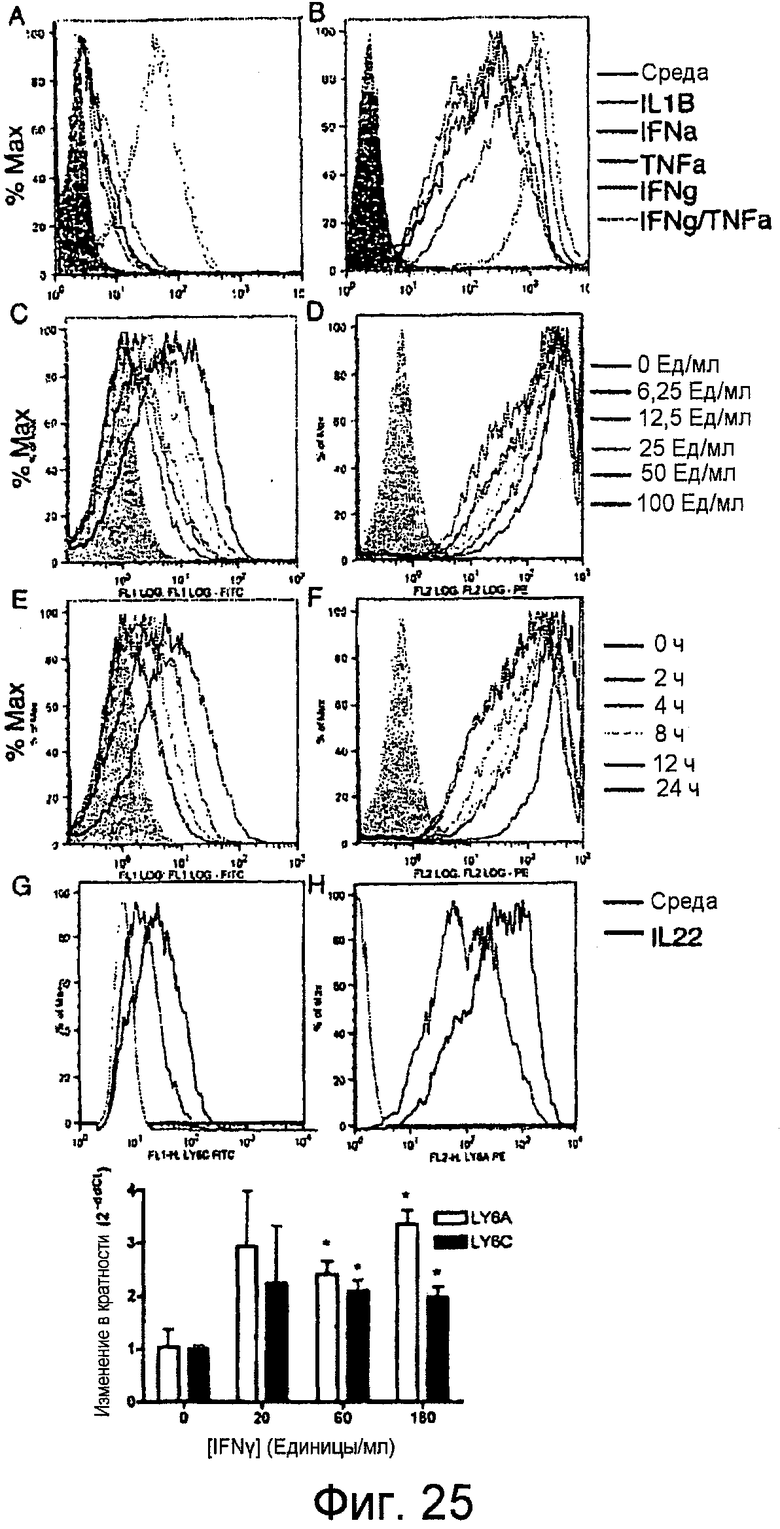
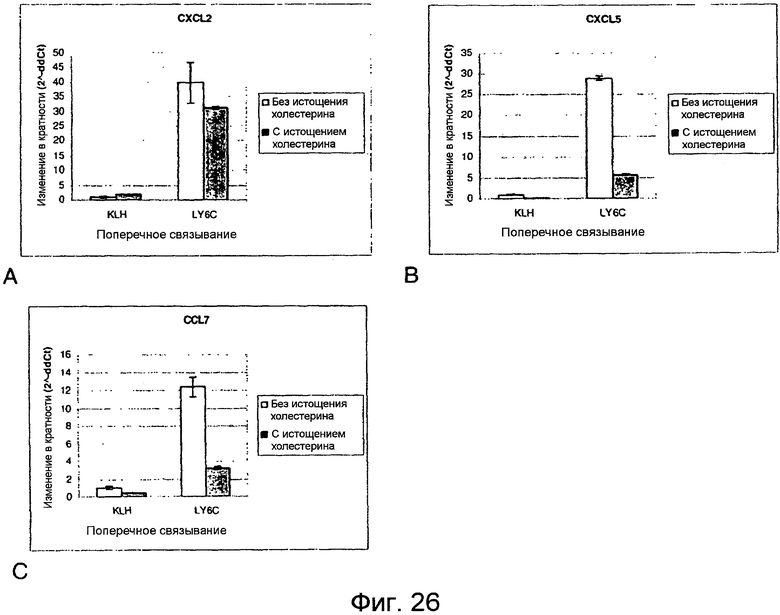
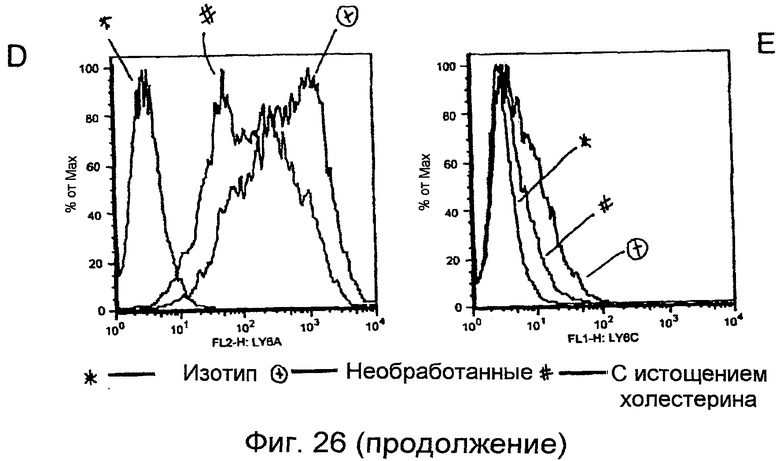
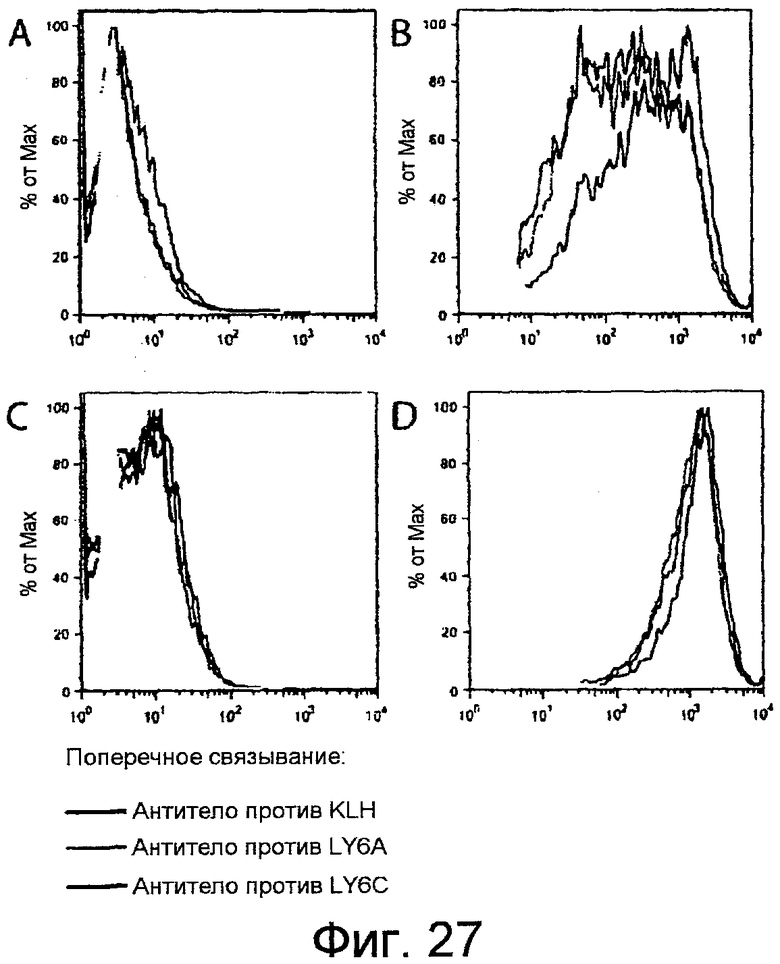
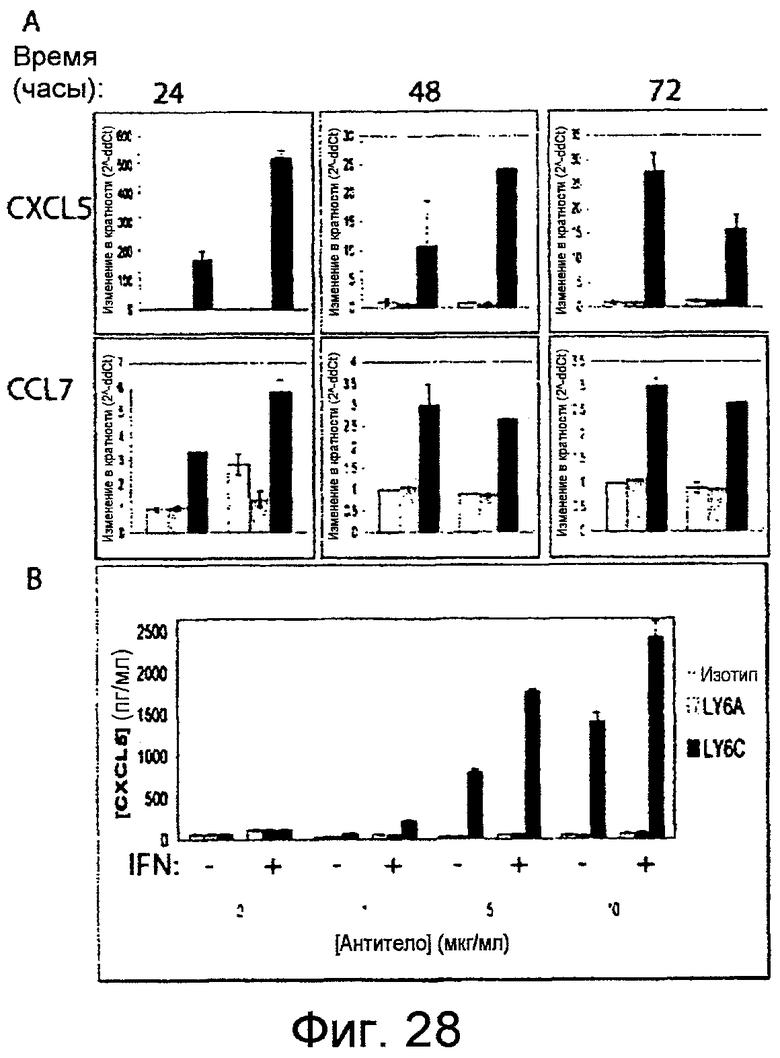
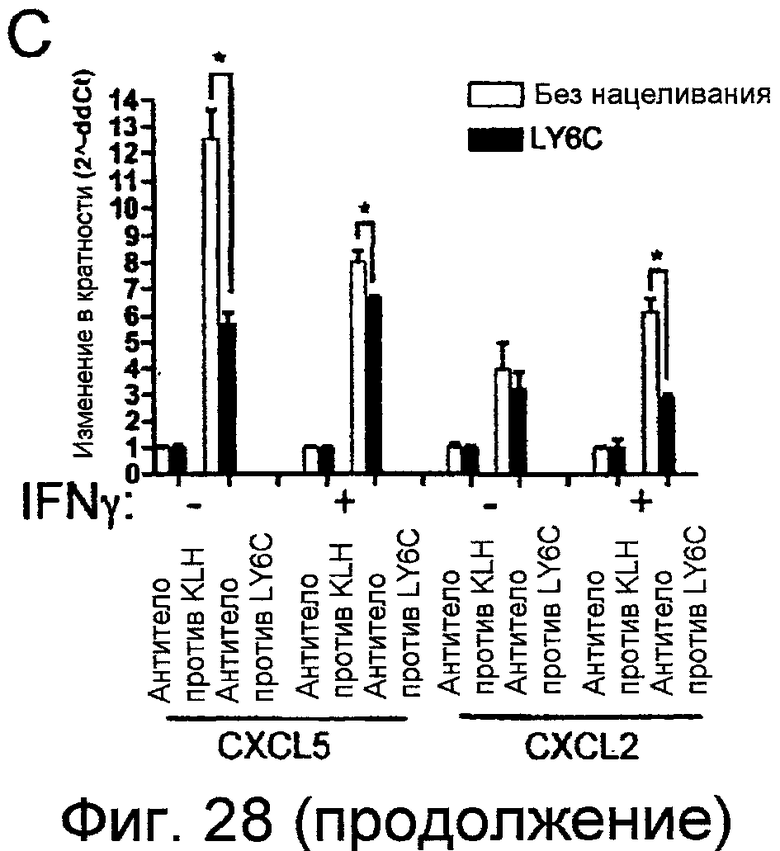
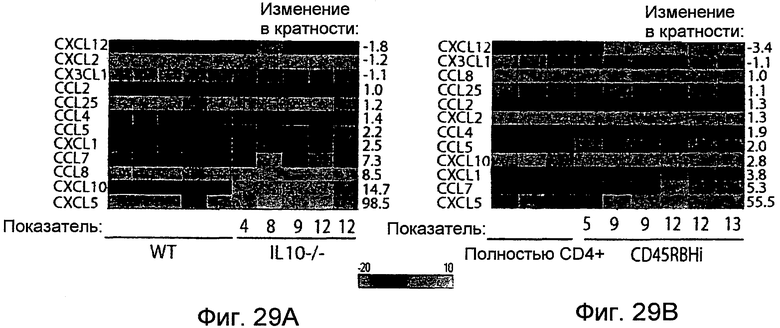

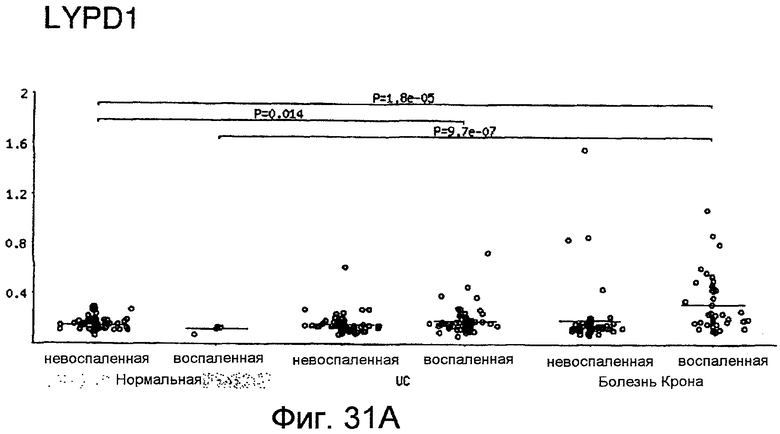
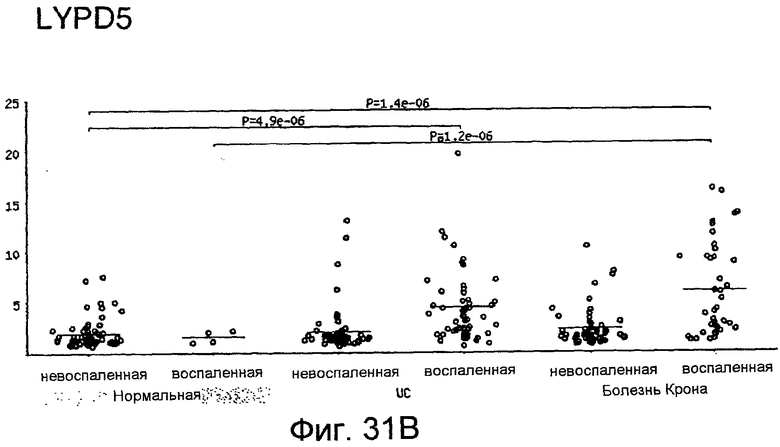


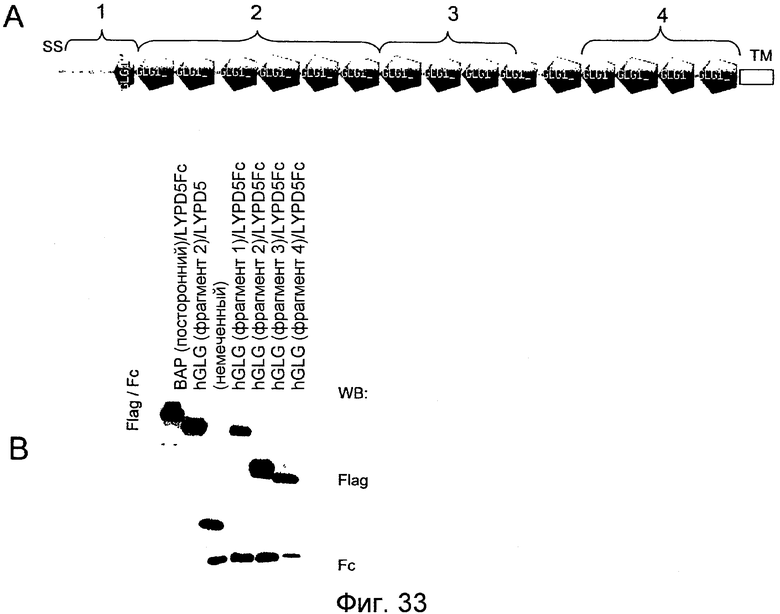
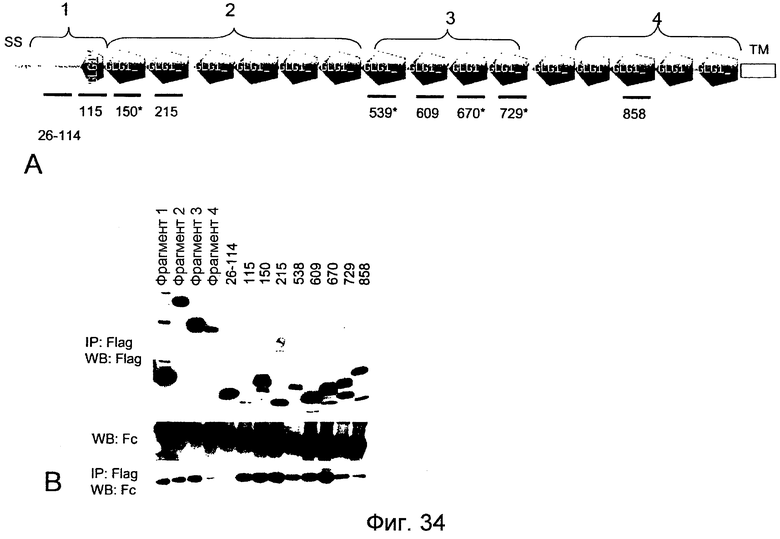
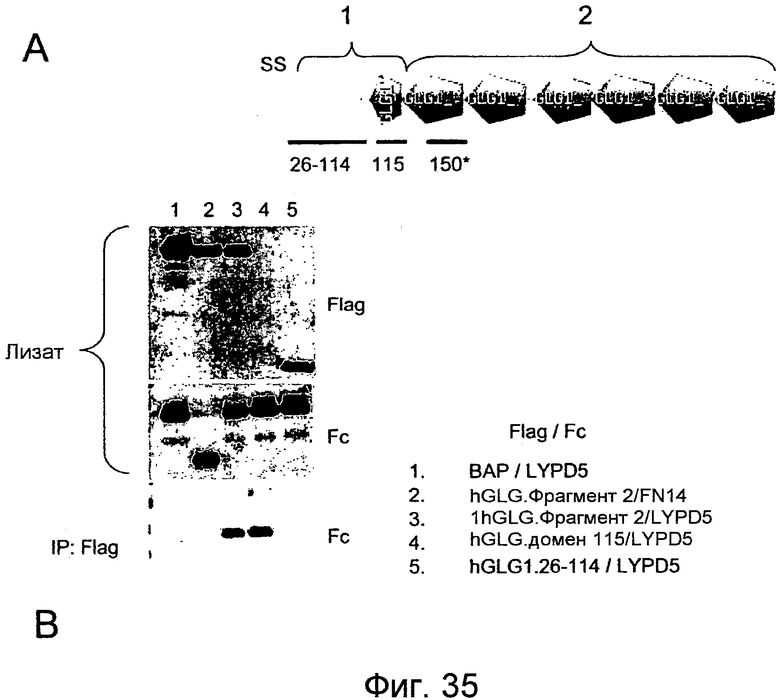



Изобретение относится к области молекулярной биологии и генной инженерии. Предложен способ выявления воспалительного заболевания кишечника млекопитающего посредством детекции повышенной экспрессии генов LY6 в желудочно-кишечных тканях или клетках по сравнению с контролем. Изобретение может быть использовано в медицине для диагностики воспалительных заболеваний кишечника. 3 н. и 52 з.п. ф-лы, 36 ил., 9 табл.
1. Способ выявления воспалительного заболевания кишечника (IBD) у млекопитающего, включающий
а) контактирование (i) очищенной РНК из тестируемого образца ткани или клеток, полученного у указанного млекопитающего, и (ii) контрольного образца с детектирующим средством, содержащим смысловой или антисмысловой олигонуклеотид, связанный с детектируемой меткой, который представляет собой одноцепочечную последовательность нуклеиновой кислоты, способную связываться с последовательностями-мишенями мРНК или ДНК LY6; и
b) детекцию уровня экспрессии гена, кодирующего полипептид LY6, в тестируемом образце и контрольном образце, где более высокий уровень экспрессии нуклеиновой кислоты или полипептида LY6 в тестируемом образце по сравнению с контрольным образцом указывает на наличие IBD у млекопитающего, у которого был получен тестируемый образец.
2. Способ по п.1, где тестируемый образец ткани или клеток получен у млекопитающего, предположительно страдающего IBD.
3. Способ по п.1, где тестируемый образец ткани или клеток получен у млекопитающего, предположительно страдающего язвенным колитом (UC).
4. Способ по п.1, где ткани или клетки млекопитающего подвергали контактированию с лекарственным средством и где уровень экспрессии LY6 указывает на наличие или отсутствие ответа на лекарственное средство в ткани или клетках млекопитающего.
5. Способ по п.1, где ткани или клетки млекопитающего подвергали контактированию с лекарственным средством, где детекция является второй или последующей детекцией и где уровень экспрессии LY6 указывает на наличие или отсутствие ответа на лекарственное средство в ткани или клетках млекопитающего.
6. Способ по п.1, где источником ткани или клеток тестируемого образца является желудочно-кишечный тракт млекопитающего.
7. Способ по п.6, где источником ткани или клеток тестируемого образца является толстый кишечник млекопитающего.
8. Способ по п.1, где контрольный образец представляет собой образец нормальной ткани или клеток того же источника или типа ткани без IBD, или множество образцов тканей или клеток того же происхождения или типа ткани без IBD, уровни экспрессии в которых усреднены, или универсальный контроль, соответствующий экспрессии генов во множестве образцов здоровой нормальной ткани того же вида.
9. Способ по п.1, где ткань или клетки тестируемого образца являются воспаленными.
10. Способ по п.1, где ткань или клетки тестируемого образца не являются воспаленными.
11. Способ по п.1, в котором детекция b) включает детекцию образования комплекса между нуклеиновой кислотой и полинуклеотидом тестируемого образца и контрольного образца, где повышенное образование комплекса в тестируемом образце по сравнению с контрольным образцом указывает на упомянутый более высокий уровень экспрессии нуклеиновой кислоты или полипептида LY6 в тестируемом образце по сравнению с контрольным образцом.
12. Способ выявления воспалительного заболевания кишечника (IBD) у млекопитающего, включающий
(a) контактирование (i) очищенной РНК из тестируемого образца ткани или клеток, полученного у указанного млекопитающего, и (ii) контрольного образца с детектирующим средством, содержащим смысловой или антисмысловой олигонуклеотид, связанный с подложкой, который представляет собой одноцепочечную последовательность нуклеиновой кислоты, способную связываться с последовательностями-мишенями мРНК или ДНК LY6; и
(b) детекцию уровня экспрессии гена, кодирующего полипептид LY6, в тестируемом образце и контрольном образце, где более высокий уровень экспрессии нуклеиновой кислоты или полипептида LY6 в тестируемом образце по сравнению с контрольным образцом указывает на наличие IBD у млекопитающего, у которого был получен тестируемый образец.
13. Способ по п.12, где тестируемый образец ткани или клеток получен у млекопитающего, предположительно страдающего IBD.
14. Способ по п.12, где тестируемый образец ткани или клеток получен у млекопитающего, предположительно страдающего язвенным колитом UC.
15. Способ по п.12, где ткани или клетки млекопитающего подвергали контактированию с лекарственным средством и где уровень экспрессии LY6 указывает на наличие или отсутствие ответа на лекарственное средство в ткани или клетках млекопитающего.
16. Способ по п.12, где ткани или клетки млекопитающего подвергали контактированию с лекарственным средством, где детекция является второй или последующей детекцией и где уровень экспрессии LY6 указывает на наличие или отсутствие ответа на лекарственное средство в ткани или клетках млекопитающего.
17. Способ по п.12, где источником ткани или клеток тестируемого образца является желудочно-кишечный тракт млекопитающего.
18. Способ по п.17, где источником ткани или клеток тестируемого образца является толстый кишечник млекопитающего.
19. Способ по п.12, где контрольный образец представляет собой образец нормальной ткани или клеток того же источника или типа ткани без IBD, или множество образцов тканей или клеток того же происхождения или типа ткани без IBD, уровни экспрессии в которых усреднены, или универсальный контроль, соответствующий экспрессии генов во множестве образцов здоровой нормальной ткани того же вида.
20. Способ по п.12, где ткань или клетки тестируемого образца являются воспаленными.
21. Способ по п.12, где ткань или клетки тестируемого образца не являются воспаленными.
22. Способ по п.12, в котором детекция b) включает детекцию образования комплекса между нуклеиновой кислотой и полинуклеотидом тестируемого образца и контрольного образца, где повышенное образование комплекса в тестируемом образце по сравнению с контрольным образцом указывает на упомянутый более высокий уровень экспрессии нуклеиновой кислоты или полипептида LY6 в тестируемом образце по сравнению с контрольным образцом.
23. Способ по п.22, где полинуклеотид тестируемого образца содержит последовательность нуклеиновой кислоты SEQ ID NO: 8, 9, 1, 3, 4, 6 или ее фрагмент, содержащий по меньшей мере 15 последовательных нуклеотидов SEQ ID NO: 8, 9, 1, 3, 4, 6.
24. Способ по п.22, где источником ткани или клеток тестируемого образца является желудочно-кишечный тракт млекопитающего.
25. Способ по п.24, где источником ткани или клеток тестируемого образца является толстый кишечник млекопитающего.
26. Способ по п.25, где контрольный образец представляет собой образец нормальной ткани или клеток того же источника или типа ткани без IBD, или множество образцов тканей или клеток того же происхождения или типа ткани без IBD, уровни экспрессии в которых усреднены, или универсальный контроль, соответствующий экспрессии генов во множестве образцов здоровой нормальной ткани того же вида.
27. Способ по любому из пунктов 1, 10 и 21, где детектируемая метка является непосредственно детектируемой.
28. Способ по любому из пунктов 1, 10 и 21, где детектируемая метка является опосредованно детектируемой.
29. Способ по любому из пунктов 1, 10 и 21, где детектируемая метка является флуоресцентной меткой.
30. Способ по п.1, где способ представляет собой анализ гибридизации in situ.
31. Способ по п.1, где способ содержит анализ полимеразной цепной реакцией (RT-PCR) с детекцией в реальном времени.
32. Способ выявления воспалительного заболевания кишечника (IBD) у млекопитающего, включающий:
(a) контактирование (i) выделенного LY6 полипептида или его фрагмента из тестируемого образца ткани или клеток, полученного у указанного млекопитающего, и (ii) контрольного образца с детектирующим средством, содержащим антитело или его связывающий фрагмент с детектируемой меткой, который специфично связывает полипептид LY6 или его фрагмент; и
(b) детекцию уровня экспрессии полипептида LY6 в тестируемом образце и контрольном образце, где более высокий уровень экспрессии LY6 в тестируемом образце по сравнению с контрольным образцом указывает на наличие IBD у млекопитающего, у которого был получен тестируемый образец.
33. Способ по п.32, в котором детекция b) включает детекцию образования комплекса между детектирующим средством и полипептидом тестируемого образца и контрольного образца, где повышенное образование комплекса в тестируемом образце по сравнению с контрольным образцом указывает на упомянутый более высокий уровень экспрессии полипептида LY6 в тестируемом образце по сравнению с контрольным образцом.
34. Способ по п.32, где полипептид LY6 содержит SEQ ID NO: 10, 2, 5, 7 или его фрагмент, содержащий по меньшей мере 10 последовательных аминокислот SEQ ID NO: 10, 2, 5 или 7.
35. Способ по п.32, где источником ткани или клеток тестируемого образца является желудочно-кишечный тракт млекопитающего.
36. Способ по п.35, где источником ткани или клеток тестируемого образца является толстый кишечник млекопитающего.
37. Способ по п.32, где ткань или клетки тестируемого образца являются воспаленными.
38. Способ по п.32, где ткань или клетки тестируемого образца не являются воспаленными.
39. Способ по п.32, где детектируемая метка является непосредственно детектируемой.
40. Способ по п.32, где детектируемая метка является опосредованно детектируемой.
41. Способ по п.32, где детектируемая метка представляет собой флуоресцентную метку или радиоактивную метку.
42. Способ по п.32, где тестируемый образец ткани или клеток получен у млекопитающего, предположительно страдающего IBD.
43. Способ по п.32, где тестируемый образец ткани или клеток получен у млекопитающего, предположительно страдающего язвенным колитом UC.
44. Способ по п.32, где ткани или клетки млекопитающего подвергали контактированию с лекарственным средством и где уровень экспрессии LY6 указывает на наличие или отсутствие ответа на лекарственное средство в ткани или клетках млекопитающего.
45. Способ по п.32, где ткани или клетки млекопитающего подвергали контактированию с лекарственным средством, где детекция является второй или последующей детекцией и где уровень экспрессии LY6 указывает на наличие или отсутствие ответа на лекарственное средство в ткани или клетках млекопитающего.
46. Способ по п.1 или 23, где полипептид LY6 кодируется полинуклеотидом, содержащим SEQ ID NO: 8.
47. Способ по п.1 или 23, где полипептид LY6 кодируется полинуклеотидом, содержащим SEQ ID NO: 9.
48. Способ по п.1 или 23, где полипептид LY6 кодируется полинуклеотидом, содержащим SEQ ID NO: 1.
49. Способ по п.1 или 23, где полипептид LY6 кодируется полинуклеотидом, содержащим SEQ ID NO: 3.
50. Способ по п.1 или 23, где полипептид LY6 кодируется полинуклеотидом, содержащим SEQ ID NO: 4.
51. Способ по п.1 или 23, где полипептид LY6 кодируется полинуклеотидом, содержащим SEQ ID NO: 6.
52. Способ по п.1 или 34, где полипептид LY6 содержит SEQ ID NO: 10.
53. Способ по п.1 или 34, где полипептид LY6 содержит SEQ ID NO: 2.
54. Способ по п.1 или 34, где полипептид LY6 содержит SEQ ID NO: 5.
55. Способ по п.1 или 34, где полипептид LY6 содержит SEQ ID NO: 7.
| Сальник для электродов электропечей | 1937 |
|
SU61629A1 |
| Термос-холодильник | 1948 |
|
SU77026A1 |
| Способ диагностики протяженности активного воспаления в толстой кишке при неспецифическом язвенном колите | 1987 |
|
SU1650094A1 |
Авторы
Даты
2013-12-27—Публикация
2008-02-22—Подача