Ссылка на перечень последовательностей
Данная заявка содержит перечень последовательностей в форме, которую способен прочитать компьютер. Форма, которую способен прочитать компьютер, включена в данную заявку путем ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к чистящим композициям, содержащим варианты альфа-амилазы, которые имеют улучшенную чистящую эффективность по сравнению с их родительской амилазой в процессах обработки поверхности в холодной воде.
Уровень техники
Альфа-амилазы (альфа-1,4-глюкан-4-глюканогидролазы, Е.С. 3.2.1.1) составляют группу ферментов, которые катализируют гидролиз крахмала и других линейных и разветвленных 1,4-глюкозидных олиго- и полисахаридов.
Среди первых бактериальных альфа-амилаз, которые использовались, были альфа-амилаза из B. licheniformis, также известная как термамил, который в значительной степени был охарактеризован, и для данного фермента была определена кристаллическая структура. Щелочные амилазы, такие как альфа-амилаза, полученные из Bacillus sp., как раскрыто в WO 95/26397, образуют конкретную группу альфа-амилаз, которые нашли применение в моющих средствах. Большинство из данных известных бактериальных амилаз были модифицированы для того, чтобы улучшить их функциональность в конкретном применении.
Способы повышения термостабильности альфа-амилаз были хорошо изучены. Suzuki et al. (1989) раскрывает химерные альфа-амилазы, в которых конкретные области В. amyloliquefaciens альфа-амилазы замещены на соответствующие области В. licheniformis альфа-амилазы. Химерные альфа-амилазы были сконструированы с целью идентифицирования областей, отвечающих за термостабильность. Обнаружено, что такие области включают аминокислотные остатки 177-186 и аминокислотные остатки 255-270 В. amyloliquefaciens альфа-амилазы. Igarashi et al. 1998 показали, что термостабильность амилаз AmyS-типа может быть повышена путем делеции двух аминокислотных остатков, R179-G180, (AmyS нумерация) из петли (от F 178 до А184). Однако, Shiau et al. (2003) показали, что AmyS фермент с делецией в той же петле имеет более низкую специфическую активность для гидролиза кукурузного крахмала при высокой температуре, чем исходный фермент, отрицая одно из принципиальных преимуществ AmyS амилаз.
По экологическим причинам все более важным было понизить температуру в процессах стирки, мытья посуды и/или очистки. Тем не менее, большинство ферментов, включая амилазы, имеют оптимальную температуру, которая является выше температуры, обычно используемой в низкотемпературной стирке. Альфа-амилаза является ключевым ферментом для использования в композициях моющего средства, и ее использование становится все более важным для удаления крахмалистых пятен во время стирки белья или мытья посуды. Таким образом, важно найти варианты альфа-амилазы, которые сохраняют свою моющую эффективность, эффект и/или активность по удалению пятен при снижении температуры. Однако, несмотря на эффективность, имеющихся на данный момент ферментных композиций моющих средств, существует много пятен, которые трудно удалить полностью. Данные проблемы усложняются возросшим использованием низких температур стирки (например, холодная вода) и более коротких циклов стирки. Таким образом, желательно иметь амилолитические ферменты, которые могут функционировать при низкой температуре и в тоже время сохранять или повышать другие желательные свойства, такие как удельная активность (амилолитическая активность), стабильность и/или моющая эффективность.
Таким образом, целью настоящего изобретения является обеспечение чистящих композиций, содержащих варианты альфа-амилаз, которые могут быть использованы в процессах стирки, мытья посуды и/или очистки при низких температурах, таких как температуры 5-35°С. Дополнительной целью настоящего изобретения является обеспечение вариантов альфа-амилазы, которые имеют улучшенную моющую эффективность при низких температурах по сравнению с родительской альфа-амилазой или по сравнению с альфа-амилазой с любой из SEQ ID NO: 1, 2, 3,4, 5, 6, 7, 8, 9, 10, 11 или 12.
Сущность изобретения
В первом аспекте изобретение обеспечивает чистящую композицию, содержащую:
(а) вариант родительской альфа-амилазы, содержащий изменение в двух или больше (нескольких) положениях, соответствующих положениям G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477 зрелого полипептида SEQ ID NO: 1, при этом каждое изменение независимо представляет собой замещение, делецию или вставку, и причем вариант имеет, по меньшей мере, 80% или, по меньшей мере, 87%, но меньше, чем 100% идентичность последовательности со зрелым полипептидом любой из SEQ ID NO 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, и при этом вариант имеет активность альфа-амилазы;
(b) и чистящее вспомогательное вещество, предпочтительно, в количестве от 0,01 до 99,9 мас. %.
Изобретение также обеспечивает способ обработки поверхности, предпочтительно текстиля, который включает стадии, на которых:
(i) образовывают водный моющий раствор, содержащий воду и чистящую композицию, содержащую:
(a) вариант родительской альфа-амилазы, содержащий изменение в двух или больше (нескольких) положениях, соответствующих положениям G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477 зрелого полипептида SEQ ID NO: 1, при этом каждое изменение независимо представляет собой замещение, делецию или вставку, и причем вариант имеет, по меньшей мере, 80% или, по меньшей мере, 87%, но меньше, чем 100% идентичность последовательности со зрелым полипептидом любой из SEQ ID NO 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, и при этом вариант имеет активность альфа-амилазы; и
(b) и чистящее вспомогательное вещество, предпочтительно, в количестве от 0,01 до 99,9 мас. %;
(ii) обрабатывают поверхность водным моющим раствором, предпочтительно, при температуре 40°C или меньше, или, более предпочтительно, при температуре 30°C или меньше, наиболее предпочтительно, при температуре 20°C или меньше; и
(iii) промывают поверхность.
В соответствии со следующим аспектом изобретения обеспечена чистящая композиция, содержащая: вариант родительской альфа-амилазы, содержащий изменение в двух или больше (нескольких) положениях, соответствующих положениям G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477 зрелого полипептида SEQ ID NO: 1, при этом каждое изменение независимо представляет собой замещение, делецию или вставку, и причем вариант имеет, по меньшей мере, 80%, или, по меньшей мере, 87%, но меньше, чем 100% идентичность последовательности со зрелым полипептидом любой из SEQ ID NO 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, и при этом вариант имеет, активность альфа-амилазы; и чистящее вспомогательное вещество, предпочтительно в количестве от 0,01 до 99,9 мас. %.
Изобретение также обеспечивает способ обработки поверхности, предпочтительно текстиля, который включает стадии, на которых:
(i) образовывают водный моющий раствор, содержащий воду и такую чистящую композицию,
(ii) обрабатывают поверхность водным моющим раствором, предпочтительно, при температуре 40°С или меньше, или, более предпочтительно, при температуре 30°С или меньше, наиболее предпочтительно, при температуре 20°С или меньше; и
(iii) промывают поверхность.
Детальное описание изобретения
Настоящее изобретение обеспечивает чистящую композицию, содержащую:
(a) вариант родительской альфа-амилазы, содержащий изменение в двух или больше (нескольких) положениях, соответствующих положениям G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477 зрелого полипептида SEQ ID NO: 1, при этом каждое изменение независимо представляет собой замещение, делецию или вставку, и причем вариант имеет, по меньшей мере, 80%, или, по меньшей мере, 87%, но меньше, чем 100% идентичность последовательности со зрелым полипептидом любой из SEQ ID NO 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, и при этом вариант имеет, активность альфа-амилазы;
(b) чистящее вспомогательное вещество, предпочтительно в количестве от 0,01 до 99,9 мас. %.
Определения
Активность альфа-амилазы: Термин «активность альфа-амилазы» означает активность альфа-1,4-глюкан-4-глюканогидролаз, Е.С. 3.2.1.1, которые составляют группу ферментов, которые катализируют гидролиз крахмала и других линейных и разветвленных 1,4-глюкозидных олиго- и полисахаридов.
Вариант: Термин «вариант» означает полипептид, имеющий активность альфа-амилазы, который включает изменение, то есть замещение, вставку и/или делецию, в одном или больше (нескольких) положениях. Замещение означает замену аминокислоты, занимающей положение, на отличающуюся аминокислоту; делеция означает удаление аминокислоты, занимающей положение; и вставка означает добавление 1-3 аминокислот по соседству к аминокислоте, занимающей положение.
Мутант: Термин «мутант» означает полинуклеотид, кодирующий вариант.
Фермент дикого типа: Термин альфа-амилаза «дикого типа» означает альфа-амилазу, экспрессированную существующим в природе микроорганизмом, таким как бактерия, дрожжи или нитчатый гриб, найденный в природе.
Родитель или родительская альфа-амилаза: Термин «родитель» или «родительская альфа-амилаза» означает альфа-амилазу, в которой изменение делают для того, чтобы получить варианты фермента в соответствии с настоящим изобретением. Родитель может быть встречающимся в природе (дикого типа) полипептидом или его вариантом.
Выделенный вариант: Термин «выделенный вариант» означает вариант, который является модифицированным руками человека. В одном аспекте, вариант является, по меньшей мере, на 1% чистым, например, по меньшей мере, на 5% чистым, по меньшей мере, на 10% чистым, по меньшей мере, на 20% чистым, по меньшей мере, на 40% чистым, по меньшей мере, на 60% чистым, по меньшей мере, на 80% чистым, и, по меньшей мере, на 90% чистым, как определено с помощью ДСН-ПААГ-электрофореза.
По существу чистый вариант: Термин «по существу чистый вариант» означает препарат, который содержит не больше, чем 10%, не больше, чем 8%, не больше, чем 6%, не больше, чем 5%, не больше, чем 4%, не больше, чем 3%, не больше, чем 2%, не больше, чем 1%, и не больше, чем 0,5% по массе другого полипептидного материала, с которым он нативно или рекомбинантно связан. Предпочтительно, вариант является, по меньшей мере, на 92% чистым, например, по меньшей мере, на 94% чистым, по меньшей мере, на 95% чистым, по меньшей мере, на 96% чистым, по меньшей мере, на 97% чистым, по меньшей мере, на 98% чистым, по меньшей мере, на 99%, по меньшей мере, на 99,5% чистым, и на 100% чистым по массе от общего полипептидного материала, присутствующего в препарате. Варианты в соответствии с настоящим изобретением, предпочтительно, находятся по существу в чистой форме. Это может быть осуществлено, например, путем получения варианта с помощью хорошо известных рекомбинантных способов или с помощью классических способов очистки.
Зрелый полипептид: Термин «зрелый полипептид» означает полипептид в его конечной форме после трансляции и любых пост-трансляционных модификаций, таких как N-терминальный процессинг, С-терминальный процессинг, гликозилирование, фосфорилирование, и т.д.
Зрелый полипептид, кодирующий последовательность: Термин «зрелый полипептид, кодирующий последовательность» означает полинуклеотид, который кодирует зрелый полипептид, имеющий активность альфа-амилазы.
Идентичность последовательностей: Сходство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается параметром «идентичность последовательностей».
Применительно к настоящему изобретению, степень идентичности последовательностей между двумя аминокислотными последовательностями определяют, используя алгоритм Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который выполняется в Needle программе EMBOSS пакета (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 3.0.0 или более поздней. Необязательными параметрами, которые используются, являются штраф на внесение делеции в выравнивание 10, штраф на продолжение делеции 0,5 и EBLOSUM62 (EMBOSS версии BLOSUM62) подстановочная матрица. Результаты выполнения Needle, обозначенные «самая длинная идентичность» (полученная, используя - опцию без замечаний), используют, как процентную идентичность и рассчитывают следующим образом:
(Идентичные остатки x 100)/(длина выравнивания - общее количество делеций в выравнивании)
Применительно к настоящему изобретению, степень идентичности последовательностей между двумя дезоксирибонуклеотидными последовательностями определяют, используя алгоритм Нидлмана-Вунша (Needleman and Wunsch, 1970, ранее), который выполняется в Needle программе EMBOSS пакета (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, ранее), предпочтительно версии 3.0.0 или более поздней. Необязательными параметрами, которые используются, являются штраф на внесение делеции в выравнивание 10, штраф на продолжение делеции 0,5, и EDNAFULL (EMBOSS версии NCBI NUC4.4) подстановочная матрица. Результаты выполнения Needle, обозначенные «самая длинная идентичность» (полученная, используя - опцию без замечаний) используют, как процентную идентичность и рассчитывают следующим образом:
(Идентичные дезоксирибонуклеотиды x 100)/(длина выравнивания - общее количество делеций в выравнивании)
Фрагмент: Термин «фрагмент» означает полипептид, имеющий одну или больше (несколько) аминокислот, удаленных с аминого и/или карбоксильного конца зрелого полипептида; при этом фрагмент имеет активность альфа-амилазы.
Подпоследовательность: Термин «подпоследовательность» означает полинуклеотид, имеющий одну или больше (несколько) нуклеотидов, удаленных с 5'-и/или 3'-конца зрелого полипептида, кодирующего последовательность; при этом подпоследовательность кодирует фрагмент, имеющий активность альфа-амилазы.
Аллельный вариант: Термин «аллельный вариант» означает любую из двух или больше альтернативных форм гена, занимающих один и тот же хромосомный локус. Аллельная вариация возникает в природе за счет мутации, и может в результате приводить к полиморфизму в пределах популяций. Генные мутации могут быть молчащими (без изменений в кодированном полипептиде) или могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельный вариант полипептида представляет собой полипептид, кодированный аллельным вариантом гена.
Выделенный полинуклеотид: Термин «выделенный полинуклеотид» означает полинуклеотид, который является модифицированным руками человека. В одном аспекте, выделенный полинуклеотид является, по меньшей мере, на 1% чистым, например, по меньшей мере, на 5% чистым, по меньшей мере, на 10% чистым, по меньшей мере, на 20% чистым, по меньшей мере, на 40% чистым, по меньшей мере, на 60% чистым, по меньшей мере, на 80% чистым, по меньшей мере, на 90% чистым, и, по меньшей мере, на 95% чистым, как определено с помощью агарозного электрофореза. Полинуклеотиды могут быть геномного, кДНК, РНК, полусинтетического, синтетического происхождения, или любыми их комбинациями.
По существу чистый полинуклеотид: Термин «по существу чистый полинуклеотид» означает полинуклеотидный препарат, свободный от других посторонних или нежелательных нуклеотидов и в форме, приемлемой для использования в генно-инженерных системах продуцирования полипептида. Таким образом, по существу чистый полинуклеотид содержит не больше, чем 10%, не больше, чем 8%, не больше, чем 6%, не больше, чем 5%, не больше, чем 4%, не больше, чем 3%, не больше, чем 2%, не больше, чем 1%, и не больше, чем 0,5% по массе другого полинуклеотидного материала, с которым он нативно или рекомбинантно связан. По существу чистый полинуклеотид может, однако, включать существующие в природе 5'- и 3'- нетранслируемые области, такие как промоторы и терминаторы. Предпочтительным является то, что по существу чистый полинуклеотид является, по меньшей мере, на 90% чистым, например, по меньшей мере, на 92% чистым, по меньшей мере, на 94% чистым, по меньшей мере, на 95% чистым, по меньшей мере, на 96% чистым, по меньшей мере, на 97% чистым, по меньшей мере, на 98% чистым, по меньшей мере, на 99% чистым, и, по меньшей мере, на 99,5% чистым по массе. Полинуклеотиды в соответствии с настоящим изобретением, предпочтительно, находятся по существу в чистой форме.
Кодирующая последовательность: Термин «кодирующая последовательность» означает полинуклеотид, который непосредственно определяет аминокислотную последовательность его полипептидного продукта. Границы кодирующей последовательности, как правило, определяют с помощью открытой рамки считывания, которая обычно начинается с ATG инициирующего кодона или альтернативных инициирующих кодонов, таких как GTG и TTG, и заканчивается терминирующим кодоном, таким как ТАА, TAG и TGA. Кодирующей последовательностью может быть ДНК, кДНК, синтетический или рекомбинантный полинуклеотид.
кДНК: Термин «кДНК» означает молекулу ДНК, которая может быть получена путем обратной транскрипции из зрелой, сплайсированной, молекулы мРНК, полученной из эукариотической клетки. кДНК не содержит интронные последовательности, которые могут присутствовать в соответствующей геномной ДНК. Исходный, первичный РНК транскрипт представляет собой предшественник мРНК, который является процессированным за счет серии стадий, включая сплайсинг, перед появлением в виде зрелой сплайсированной мРНК.
Конструкт нуклеиновой кислоты: Термин «конструкт нуклеиновой кислоты» означает молекулу нуклеиновой кислоты, или одно- или двух-цепочечную, которая выделена из встречающегося в природе гена или модифицирована, чтобы содержать сегменты нуклеиновых кислот до некоторой степени, которые иначе не могли бы существовать в природе, и которые являются синтетическими. Термин конструкт нуклеиновой кислоты является равнозначным термину «экспрессионная кассета», когда конструкт нуклеиновой кислоты содержит контрольные последовательности, необходимые для экспрессии кодирующей последовательности в соответствии с настоящим изобретением.
Контрольные последовательности: Термин «контрольные последовательности» означает все компоненты, необходимые для экспрессии полинуклеотида, кодирующего вариант в соответствии с настоящим изобретением. Каждая контрольная последовательность может быть нативной или чужеродной к полинуклеотиду, который кодирует вариант, или нативной, или чужеродной друг к другу. Такие контрольные последовательности включают, но не ограничиваются этим, лидерную последовательность, полиаденилированную последовательность, пропептидную последовательность, промотор, сигнальную пептидную последовательность и транскрипционный терминатор. Как минимум, контрольные последовательности включают промотор и транскрипционные и трансляционные стоп сигналы. Контрольные последовательности могут быть обеспечены с линкерами с целью введения специфических сайтов рестрикции, которые облегчают лигирование контрольных последовательностей с кодирующей областью полинуклеотида, кодирующего вариант.
Функционально связанный: Термин «функционально связанный» означает конфигурацию, в которой контрольная последовательность расположена в соответствующем положении по отношению к кодирующей последовательности полинуклеотида таким образом, что контрольная последовательность направляет экспрессию кодирующей последовательности.
Экспрессия: Термин «экспрессия» включает любую стадию, вовлеченную в продуцирование варианта, включая, но не ограничиваясь этим, транскрипцию, пост-транскрипционную модификацию, трансляцию, пост-трансляционную модификацию и секрецию.
Вектор экспрессии: Термин «вектор экспрессии» означает молекулу линейной или циклической ДНК, которая содержит полинуклеотид, кодирующий вариант, и функционально связана с дополнительными нуклеотидами, которые обеспечивают ее экспрессию.
Клетка-хозяин: Термин «клетка-хозяин» означает любой тип клетки, который является восприимчивым к трансформации, трансфекции, трансдукции, и подобным с конструктом нуклеиновой кислоты или вектором экспрессии, содержащим полинуклеотид в соответствии с настоящим изобретением. Термин «клетка-хозяин» охватывает любое потомство родительской клетки, которое не является идентичным к родительской клетке из-за мутаций, которые происходят во время репликации.
Способ удаления крахмала: Выражение «способ удаления крахмала» относится к любому виду способа, в результате которого крахмал удаляется (или превращается), такого как в способах стирки, где крахмал удаляют с текстиля, например, очистка текстиля, такая как стирка. Способ удаления крахмала также мог быть очисткой твердой поверхности, такой как мытье посуды, или это мог быть способ очистки в целом, такой как промышленная чистка и чистка в учреждениях. Выражение также включает другие способы удаления крахмала или превращения крахмала, получения этанола, превращения крахмала в жидкое состояние, расшлихтовку текстиля, производства бумаги и целлюлозы, приготовления пива и, в основном, моющих средств.
Улучшенное свойство: Термин «улучшенное свойство» означает характеристику, связанную с вариантом, который является улучшенным по сравнению с родительским. Такие улучшенные свойства включают, но не ограничиваются этим, термическую активность, термостабильность, pH активность, pH стабильность, субстрат/кофакторная специфичность, улучшенные поверхностные свойства, специфичность продукта, повышенную стабильность или растворимость в присутствии предварительно обработанной биомассы, улучшенную стабильность в условиях хранения и химическую стабильность.
Моющая эффективность: В представленном контексте термин «моющая эффективность» используется как способность фермента удалять крахмал или крахмал-содержащие пятна, присутствующие на объекте, который подвергают чистке, во время, например, стирки или очистки твердой поверхности, такой как мытье посуды. Моющая эффективность может быть количественно определена путем расчета так называемого параметра интенсивности (Int), определенного в описании AMSA или в испытании моющей эффективности в стакане в разделе Способы, представленном ниже.
Улучшенная моющая эффективность: Термин «улучшенная моющая эффективность» в данной заявке определяется как вариант фермента, показывающий изменение моющей эффективности варианта амилазы по отношению к моющей эффективности родительской амилазы или по отношению к альфа-амилазе, имеющей идентичную аминокислотную последовательность указанного варианта, но не имеющей делеции в одном или больше из определенных положений, или по отношению к активности альфа-амилазы, имеющей аминокислотную последовательность, показанную в SEQ ID NO 4, например, путем усиленного удаления пятна. Термин «моющая эффективность» включает очистку в целом, например, очистку твердой поверхности, в виде мытья посуды, а также моющую эффективность на текстиле, такую как стирка, и также промышленную чистку и чистку в учреждении.
Низкая температура: «Низкая температура» представляет собой температуру 5-35°С, предпочтительно 5-30°С, более предпочтительно 5-25°С, более предпочтительно 5-20°С, наиболее предпочтительно 5-15°С, и, в частности, 5-10°С. В предпочтительном варианте осуществления, «низкая температура» представляет собой температуру 10-35°С, предпочтительно 10-30°С, более предпочтительно 10-25°С, наиболее предпочтительно 10-20°С, и, в частности, 10-15°С.
Правила для обозначения вариантов
Применительно к настоящему изобретению, зрелый полипептид, раскрытый в SEQ ID NO: 1, используют для определения соответствующего аминокислотного остатка в другой альфа-амилазе. Аминокислотную последовательность другой альфа-амилазы выравнивают со зрелым полипептидом, раскрытым в SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, и исходя из выравнивания, номер положения аминокислоты, соответствующий любому аминокислотному остатку в зрелом полипептиде, раскрытом в SEQ ID NO: 1, определяют, используя алгоритм Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который выполняется в Needle программе EMBOSS пакета (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 3.0.0 или более поздней.
Идентификация соответствующего аминокислотного остатка в другой альфа-амилазе может быть подтверждена путем выравнивания множественных полипептидных последовательностей, используя «ClustalW» (Larkin et al., 2007, Bioinformatics 23: 2947-2948).
Когда другой фермент отличается от зрелого полипептида SEQ ID NO: 2, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6 таким образом, что сравнение, основываясь на традиционной последовательности, дает сбой при обнаружении их взаимосвязи (Lindahl and Elofsson, 2000, J. Mol. Biol. 295: 613-615), то могут быть использованы другие алгоритмы сравнения последовательность попарно. Большая чувствительность поиска на основе последовательности может быть достигнута, используя программы поиска, которые используют вероятностные представления семейств полипептидов (профилей), чтобы проводить поиск по базам данным. Например, PSI-BLAST программа генерирует профили за счет итеративного процесса поиска по базе данных и является способной к обнаружению отдаленных гомологов (Atschul et al., 1997, Nucleic Acids Res. 25: 3389-3402). Еще большая чувствительность может быть достигнута, если семейство или суперсемейтво полипептида имеет один или больше представителей в базе данных структуры белка. Программа, такая как GenTHREADER (Jones, 1999, J. Mol. Biol. 287: 797-815; McGuffin and Jones, 2003, Bioinformatics 19: 874-881) использует информацию из различных источников (PSI-BLAST, прогнозирование вторичной структуры, профили структурного выравнивания и возможности сольватации), как входящие данные к нейронной сети, что предсказывает структурную складку для запрашиваемой последовательности. Аналогичным образом, способ по Gough et al., 2000, J. Mol. Biol. 313: 903-919 может быть использован для выравнивания последовательности неизвестной структуры с моделями суперсемейства, представленными в SCOP базе данных. Данные выравнивания могут быть последовательно использованы, чтобы сгенерировать гомологичные модели для полипептида, и такие модели могут оценивать на правильность использования инструменты, разработанные для такой цели.
Для белков известной структуры, некоторые инструменты и ресурсы являются доступными для восстановления и генерирования структурных выравниваний. Например, SCOP суперсемейства белков были структурно выравнены, и данные выравнивания являются доступными и загружаемыми. Две или больше белковые структуры могут быть выравнены, используя многообразие алгоритмов, таких как матрица выравнивания расстояния (Holm and Sander, 1998, Proteins 33: 88-96) или комбинаторное удлинение (Shindyalov and Bourne, 1998, Protein Engineering 11: 739-747), и внедрение данных алгоритмов дополнительно может быть использовано в базе данных запрашиваемой структуры со структурой, представляющей интерес, для того чтобы обнаружить возможные структурные гомологи (например, Holm and Park, 2000, Bioinformatics 16: 566-567).
В описании вариантов альфа-амилазы в соответствии с настоящим изобретением, описанная ниже номенклатура адаптирована для легкости ссыки. В общепринятой номенклатуре IUPAC используется однобуквенное или трехбуквенное сокращение аминокислоты.
Замещения. Для аминокислотного замещения используют следующую номенклатуру: исходная аминокислота, положение, замещенная аминокислота. Соответственно, замещение треонина на аланин в положении 226 обозначают как «Thr226Ala» или «Т226А». Различные мутации разделяются путем добавления отметки («+»), например, «Gly205Arg+Ser411Phe» или «G205R+S411F», представляющие замещения в положениях 205 и 411 глицина (G) на аргинин (R) и серина (S) на фенилаланин (F), соответственно.
Делеции. Для аминокислотной делеции используют следующую номенклатуру: исходная аминокислота, положение*. Соответственно, делецию глицина в положении 195 обозначают как «Glyl95*» или «G195*». Различные делеции разделены путем добавления отметки («+»), например, «Gly195*+Ser411*» или «G195*+S411*».
Вставки. Для аминокислотной вставки используют следующую номенклатуру: исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота. Соответственно, вставка лизина после глицина в положение 195 обозначают как «Gly195GlyLys» или «G195GK». Вставку множественных аминокислот обозначают как [исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота #1, вставленная аминокислота #2; и т.п.]. Например, вставка лизина и аланина после глицина в положение 195 представлена как «Gly195GlyLysAla» или«C195GKA».
В таких случаях вставленный(е) аминокислотный(е) остаток(и) является пронумерованным путем добавления строчных букв у номера положения аминокислотного остатка, предшествующего вставленному(ым) аминокислотному(ым) остатку(ам). В примере, описанном выше, последовательность должна быть представлена таким образом:
Множественные изменения. Варианты, содержащие множественные изменения разделены путем добавления отметок («+»), например, «Arg170Tyr+Gly195Glu» или «R170Y+G195E», представляя замещение тирозина и глутаминовой кислоты на аргинин и глицин в положениях 170 и 195, соответственно.
Различные замещения. Когда различные замещения могут быть введены в положение, различные замещения разделяют, используя запятую, например, «Arg170Tyr,Glu» представляет собой замещение аргинина на тирозин или глутаминовую кислоту в положении 170. Таким образом, «Tyr167Gly,Ala+Arg170Gly,Ala» обозначает следующие варианты:
«Tyr167Gly+Arg170Gly», «Tyr167Gly+Arg170Ala», «Tyr167Ala+Arg170Gly» и «Tyr167Ala+Arg170Ala».
Родительские альфа-амилазы
Родительская альфа-амилаза может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 1.
В аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 1, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 1.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 1. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 1.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 1.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 2.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 2, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 2.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 2. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 2.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 2.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 3.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 3, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 3.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 3. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 3.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 3.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 4.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 4, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 4.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 4. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 4.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 4.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 5.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 5, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 5.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 5. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 5.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 5.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 6.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 6, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 6.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 6. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 6.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 6.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 7.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 7, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 7.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 7. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 7.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 7.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 8.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 8, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 8.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 8. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 8.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 8.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 9.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 9, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 9.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 9. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 9.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 9.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 10.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 10, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%», по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 10.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 10. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 10.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 10.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 11.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 11, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 11.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 11. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 11.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 11.
Родительская альфа-амилаза также может быть полипептидом с, по меньшей мере, 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 12.
В другом аспекте, предшественник имеет идентичность последовательности со зрелым полипептидом SEQ ID NO: 12, по меньшей мере, 80%, например, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%, который имеет активность альфа-амилазы. В одном аспекте, аминокислотная последовательность предшественника отличается не больше, чем десятью аминокислотами, например, пятью аминокислотами, четырьмя аминокислотами, тремя аминокислотами, двумя аминокислотами и одной аминокислотой от зрелого полипептида SEQ ID NO: 12.
Предшественник предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 12. В другом аспекте, предшественник содержит или состоит из зрелого полипептида SEQ ID NO: 12.
В другом варианте осуществления, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO: 12.
Аминокислотная последовательность SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, или ее фрагмент, может быть использована для создания зондов нуклеиновых кислот для идентификации и клонирования ДНК, кодирующей предшественник, из штаммов различных семейств и видов в соответствии со способами, хорошо известными в данной области техники. В частности, такие зонды могут быть использованы для гибридизации с геномным или кДНК родом или видом, представляющим интерес, следуя стандартным процедурам саузерн-блоттинга, для того чтобы идентифицировать и выделить соответствующий ген в этом процессе. Такие зонды могут быть в значительной степени более короткими, чем целая последовательность, но должны составлять, по меньшей мере, 14, например, по меньшей мере, 25, по меньшей мере, 35, или по меньшей мере, 70 нуклеотидов в длину. Предпочтительно, зонд нуклеиновой кислоты составляет, по меньшей мере, 100 нуклеотидов в длину, например, по меньшей мере, 200 нуклеотидов, по меньшей мере, 300 нуклеотидов, по меньшей мере, 400 нуклеотидов, по меньшей мере, 500 нуклеотидов, по меньшей мере, 600 нуклеотидов, по меньшей мере, 700 нуклеотидов, по меньшей мере, 800 нуклеотидов, или по меньшей мере, 900 нуклеотидов в длину. Могут быть использованы как ДНК, так и РНК зонды. Зонды, как правило, метят для обнаружения соответствующего гена (например, используя 32Р, 3H, 35S, биотин или авидин). Настоящее изобретение охватывает такие зонды.
Геномную ДНК или кДНК библиотеку, полученную из таких других организмов, могут подвергать скринингу на ДНК, которая гибридизирует с зондами, описанными выше, и кодируют предшественник. Геномную или другую ДНК из таких других организмов могут отделять, используя агарозный или полиакриламидный гель-электрофорез или другие способы разделения. ДНК из библиотек или отделенная ДНК может быть перенесена и иммобилизирована на нитроцеллюлозе или другом приемлемом материале-носителе, который используется в саузерн-блоттинге.
Применительно к настоящему изобретению, гибридизация показывает, что полинуклеотид гибридизирует до меченного нуклеотидного зонда, соответствующего полинуклеотиду, который кодирует SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или ее подпоследовательность, при от низко до очень высоко жестких условиях. Молекулы, до которых зонд гибридизирует, могут быть обнаружены, используя, например, рентгеночувствительную пленку или любые другие способы обнаружения, известные из уровня техники.
В одном аспекте, зонд нуклеиновой кислоты представляет собой полинуклеотид, который кодирует полипептид SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или его фрагмент.
Для длинных зондов, по меньшей мере, 100 нуклеотидов в длину, условия от очень низко до очень высоко жестких определяют как предварительную гибридизацию, так и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл резаной и денатурированной ДНК из молок лососевых, и или 25% формамида для очень низкой и низкой жесткостей, 35% формамида для средней и средне-высокой жесткостей или 50% формамида для высокой и очень высокой жесткостей, следуя стандартным процедурам саузерн-блоттинга, оптимально, в течение от 12 до 24 часов. Материал-носитель окончательно промывают три раза каждый в течение 15 минут, используя 2Х SSC, 0,2% SDS при 45°С (очень низкая жесткость), 50°С (низкая жесткость), 55°С (средняя жесткость), 60°С (средне-высокая жесткость), 65°С (высокая жесткость) или 70°С (очень высокая жесткость).
Для коротких зондов, которые составляют от приблизительно 15 нуклеотидов до приблизительно 70 нуклеотидов в длину, жесткость условий определяют как предварительную гибридизацию, так и гибридизацию при температуре, которая на от приблизительно 5°С до приблизительно 10°С ниже рассчитанной Tm, используя расчеты в соответствии с Болтоном (Bolton) и Мак-Карти (McCarthy) (1962, Ρroc. Natl. Acad. Sci. USA 48: 1390) в 0,9 M NaCl, 0,09 M Tris-HCl pH 7,6, 6 мМ ЭДТУ, 0,5% NP-40, 1X раствора Денхардта, 1 мМ пирофосфате натрия, 1 мМ моноосновном фосфате натрия, 0,1 мМ АТФ, и 0,2 мг РНК дрожжей на мл, следуя стандартным процедурам Саузерн-блоттинга, оптимально в течение от 12 до 24 часов. Материал-носитель окончательно промывают один раз в 6Х SCC плюс 0,1% SDS в течение 15 минут и дважды, каждый в течение 15 минут, используя 6Х SSC при температуре, которая на от 5°С до 10°С ниже рассчитанной Tm.
Предшественник может быть получен из микроорганизмов любых семейств. Применительно к настоящему изобретению, термин «полученный из», как используется в данной заявке в связи с заданным источником, должен означать, что предшественник, кодированный полинуклеотидом, продуцируется источником или клеткой, в которую введен полинуклеотид из источника. В одном аспекте, предшественник секретируется внеклеточно.
Предшественник может быть бактериальной альфа-амилазой. Например, предшественник может быть грам-положительным бактериальным полипептидом, таким как Bacillus, Clostridium, Enterococcus, Geobacillus, Lactobacillus, Lactococcus, Oceanobacillus, Staphylococcus, Streptococcus или Streptomyces альфа-амилаза, или грам-отрицательным бактериальным полипептидом, таким как Campylobacter, Ε. coli, Flavobacterium, Fusobacterium, Helicobacter, Ilyobacter, Neisseria, Pseudomonas, Salmonella или Ureaplasma альфа-амилаза.
В одном аспекте, предшественник является Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis или Bacillus thuringiensis альфа-амилазой.
В другом аспекте, предшественник является Streptococcus equisimilis, Streptococcus pyogenes, Streptococcus uberis или Streptococcus equi подвид. Zooepidemicus альфа-амилазой.
В другом аспекте, предшественник является Streptomyces ахромогенез, Streptomyces avermitilis, Streptomyces coelicolor, Streptomyces griseus или Streptomyces lividans альфа-амилазой.
Предшественник может быть грибковой альфа-амилазой. Например, предшественник может быть дрожжевой альфа-амилазой, такой как Candida, Khiyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia альфа-амилаза. Например, предшественник может быть мицелиальной грибковой альфа-амилазой, такой как Acremonium, Agaricus, Alternaria, Aspergillus, Aureobasidium, Botryospaeria, Ceriporiopsis, Chaetomidium, Chrysosporium, Claviceps, Cochliobolus, Coprinopsis, Coptotermes, Corynascus, Cryphonectria, Cryptococcus, Diplodia, Exidia, Filibasidium, Fusarium, Gibberella, Holomastigotoides, Humicola, Irpex, Lentinula, Leptospaeria, Magnaporthe, Melanocarpus, Meripilus, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Pénicillium, Phanerochaete, Piromyces, Poitrasia, Pseudoplectania, Pseudotrichonympha, Rhizomucor, Schizophyllum, Scytalidium, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trichoderma, Trichophaea, Verticillium, Volvariella или Xylaria альфа-амилаза.
В другом аспекте, предшественник является Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis или Saccharomyces oviformis альфа-амилазой.
В другом аспекте, предшественник является Acremonium cellulolyticus, Aspergillus aculeatus, Aspergillus awamori, Aspergillus foetidus, Aspergillus fumigatus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Chrysosporium inops, Chrysosporium keratinophilum, Chrysosporium lucknowense, Chrysosporium merdarium, Chrysosporium pannicola, Chrysosporium queenslandicum, Chrysosporium tropicum, Chrysosporium zonatum, Fusarium bactridioides, Fusarium cerealis, Fusarium сгооклунковыиете, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides, Fusarium venenatum, Humicola grísea, Humicola insolens, Humicola lanuginosa, Irpex lacteus, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Pénicillium funiculosum, Pénicillium purpurogenum, Phanerochaete chrysosporium, Thielavia achromatica, Thielavia albomyces, Thielavia albopilosa, Thielavia australeinsis, Thielavia fimeti, Thielavia microspora, Thielavia ovispora, Thielavia peruviana, Thielavia setosa, Thielavia spededonium, Thielavia subthermophila, Thielavia terrestris, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei или Trichoderma viride альфа-амилазой.
В другом аспекте, предшественник представляет собой Bacillus sp. альфа-амилазу, например, альфа-амилазу SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6.
Будет понятно, что для указанных выше видов, изобретение охватывает, как совершенные, так и несовершенные состояния, и другие таксономические эквиваленты, например, анаморфы, независимо от названия вида, под которым они известны. Специалисты в данной области техники легко смогут распознать идентичность соответствующих эквивалентов
Штаммы этих видов были легко доступны для общественности в ряде коллекций культур, таких как Американская коллекция типовых культур (American Type Culture Collection (АТСС)), Немецкая коллекция микроорганизмов и клеточных культур GmbH (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSM)), Центральное бюро по грибным культурам (Centraalbureau Voor Schimmelcultures (CBS)) и Служба сельскохозяйственных исследований патентованых коллекций культур, Северный региональный исследовательский центр (Agricultural Research Service Patent Culture Collection, Northern Regional Research Center (NRRL)).
Предшественник может быть идентифицирован и получен из других источников, включая микроорганизмы, выделенные из природных (например, почвы, компостов, воды и т.д.) или ДНК образцов, полученных непосредственно из природных материалов (например, почвы, компостов, воды и т.д.), используя указанные выше зонды. Способы выделения микроорганизмов и ДНК непосредственно из природных сред обитания хорошо известные в данной области техники. Полинуклеотид, кодирующий предшественник, затем может быть получен путем аналогичного скрининга геномной или кДНК библиотеки другого микроорганизма или смешанного ДНК образца. Как только полинуклеотид, кодирующий предшественник, детектируют с зондом(ами), полинуклеотид может быть выделен или клонирован путем использования способов, которые известны специалисту в данной области техники (см., например, Sambrook et al., 1989, ранее).
Предшественник может быть гибридным полипептидом, в котором часть одного полипептида слита по N-концу или С-концу с частью другого полипептида.
Предшественник также может быть слитым полипептидом или легко расщепляемым слитым полипептидом, в котором один полипептид слит по N-концу или С-концу с другим полипептидом. Слитый полипептид получают путем сливания полинуклеотида, кодирующего один полипептид, с полинуклеотидом, кодирующим другой полипептид. Способы получения слитых полипептидов известны в данной области техники, и включают лигирование кодирующих последовательностей, которые кодируют полипептиды таким образом, что они находятся внутри рамки, и что экспрессия слитого полипептида находится под контролем того же промотора(ов) и терминатора. Слитые белки также могут быть сконструированы, используя интеиновую технология, в которой слития создают пост-трансляционно (Cooper et al., 1993, EMBO J. 12: 2575-2583; Dawson et al., 1994, Science 266: 776-779).
Слитый полипептид дополнительно может содержать сайт расщепления между двумя полипептидами. При секреции слитого белка сайт расщепляется, высвобождая два полипептида. Примеры сайтов расщепления включают, но не ограничиваются этим, сайты, раскрытые в Martin et al., 2003, J. Ind. Microbiol. Biotechnol. 3: 568-576; Svetina et al., 2000, J. Biotechnol. 76: 245-251; Rasmussen-Wilson et al., 1997, Appl. Environ. Microbiol. 63: 3488-3493; Ward et ai, 1995, Biotechnology 13: 498-503; и Contreras et ai, 1991, Biotechnology 9: 378-381; Eaton et al., 1986, Biochemistry 25: 505-512; Collins-Racie et al., 1995, Biotechnology 13: 982-987; Carter et al, 1989, Proteins: Structure, Function, and Genetics 6: 240-248; и Stevens, 2003, Drug Discovery World 4: 35-48.
Получение вариантов
Способ получения варианта, имеющего активность альфа-амилазы, может включать стадии, на которых: (а) вводят в родительскую альфа-амилазу изменение в двух или больше (нескольких) положениях, которые соответствуют положениям 140, 181, 189, 134,, 260, 262, 284, 304, 347, 439, 469, 476 и 477, необязательно в дополнение к одному или больше изменениям в положениях, которые соответствуют положениям 195, 206, 243 зрелого полипептида SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12, при этом нумерация является соответствующей SEQ ID NO 1, и вариант имеет активность альфа-амилазы; и (b) восстанавливают вариант.
В одном аспекте способ получения варианта, полезном в настоящем изобретении, который имеет активность альфа-амилазы, может включать стадии, на которых: (а) вводят в родительскую альфа-амилазу изменение в двух или больше (нескольких) положениях, которые соответствуют W140, R181, W189, D134,, Е260, F262, W284, G304, W347, W439, W469, G476 и G477, необязательно в дополнение к одному или больше изменениям в положениях, которые соответствуют положениям 195, 206, 243 зрелого полипептида SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12, при этом нумерация является соответствующей SEQ ID NO 1, и вариант имеет активность альфа-амилазы; и (b) восстанавливают вариант.
В одном варианте осуществления введенное изменение является замещением.
В еще другом варианте осуществления способ получения варианта, имеющего активность альфа-амилазы, может включать стадии, на которых: (а) вводят в родительскую альфа-амилазу замещение в двух или больше (нескольких) положениях, которые соответствуют G304RKEQ, W140YF, W189EGT, D134E, E260ADCQLMFPSWVGHIKNRTY, F262GP, W284DHFYR, W347HFY, W439RG, G476EQRK, G477EQKMR зрелого полипептида SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12, при этом нумерация является соответствующей SEQ ID NO 1 и вариант имеет активность альфа-амилазы; и (b) восстанавливают вариант.
В предпочтительном варианте осуществления, введенные замещения представляют собой два или больше из G304R, W140YF, W189EGT, D134E, E260GHIKNRTY, W284DFR, W439RG, G476EK, G477EKMR. В более предпочтительном варианте осуществления, введенные замещения представляют собой G304R, W140YF, E260GHIKNPRTY и G476EQRK. В еще более предпочтительном варианте осуществления, способ получения варианта, имеющего активность альфа-амилазы, включает стадии, на которых: (а) вводят в родительскую альфа-амилазу замещения G304R, W140Y, E260G и G476K в любую из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12, при этом нумерация является соответствующей SEQ ID NO 1, и вариант имеет активность альфа-амилазы; и (b) восстанавливают вариант.
Варианты могут быть получены, используя любой способ мутагенеза, известный из уровня техники, такой как сайт-направленный мутагенез, синтетическое конструирование гена, полусинтетическое конструирование гена, произвольный мутагенез, перестановка и т.д.
Сайт-направленный мутагенез является способом, в котором создают одну или больше (несколько) мутаций в одном или больше определенных сайтах в полинуклеотиде, кодирующем предшественник.
Сайт-направленный мутагенез может быть усовершенствован in vitro посредством ПЦР, включая использование олигонуклеотидных праймеров, содержащих желаемую мутацию. Сайт-направленный мутагенез, кроме того, могут выполнять in vitro посредством кассетного мутагенеза, включая расщепление с помощью фермента рестрикции в сайте в плазмиде, содержащей полинуклеотид, кодирующий предшественник, и последующего лигирования олигонуклеотида, содержащего мутацию в полинуклеотиде. Как правило, фермент рестрикции, который частично расщепляется в плазмиде и олигонуклеотиде, является одинаковым, что позволяет липким концам плазмиды и вставки лигировать друг с другом. См., например, Scherer and Davis, 1979, Proc. Natl. Acad. Sci. USA 76: 4949-4955; и Barton et al., 1990, Nucleic Acids Res. 18: 7349-4966.
Сайт-направленный мутагенез также может быть усовершенствован in vivo посредством способов, известных из уровня техники. См., например, публикация заявки на патент США 2004/0171154; Storici et al., 2001, Nature Biotechnol. 19: 773-776; Kren et al., 1998, Nat. Med. 4: 285-290; и Calissano and Macino, 1996, Fungal Genet. Newslett. 43: 15-16.
Любой способ сайт-направленного мутагенеза может быть использован в настоящем изобретении. Существует много доступных коммерческих наборов, которые могут быть использованы в получении вариантов.
Синтетическое конструирование гена влечет за собой in vitro синтез молекулы сконструированного полинуклеотида для кодирования полипептида, представляющего интерес. Синтез гена могут выполнять, используя ряд способов, таких как мультиплексная технология на основе микросхем, описанная Tian et al. (2004, Nature 432: 1050-1054), и подобные технологии, в которых олигонуклеотиды синтезируют и собирают на фото-программируемых микрофлюидальных микросхемах.
Одиночные или множественные аминокислотные замещения, делеции и/или вставки могут быть сделаны и исследованы, используя известные способы мутагенеза, рекомбинации и/или перестановки, с последующей соответствующей процедурой скрининга, такой как те, которые раскрыты Reidhaar-Olson and Sauer, 1988, Science 241: 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413; или WO 95/22625. Другие способы, которые могут быть использованы, включают подверженный погрешностям ПЦР, фаговый дисплей (например, Lowman et al., 1991, Biochemistry 30: 10832-10837; патент США 5,223,409; WO 92/06204) и область-направленный мутагенез (Derbyshire et al., 1986, Gene 46: 145; Ner et al., 1988, DNA 7: 127).
Способы мутагенеза/перестановки могут комбинировать с высокопроизводительными, автоматизированными способами скрининга, чтобы детектировать активность клонированных, мутагенезированных полипептидов, экспрессированных клетками-хозяинами (Ness et al., 1999, Nature Biotechnology 17: 893-896). Молекулы мутагенезированных ДНК, которые кодируют активные полипептиды, могут быть выделены из клеток-хозяев и быстро задана последовательность, используя стандартные способы в данной области техники. Данные способы позволяют быстрое определение важности индивидуальных аминокислотных остатков в полипептиде.
Полусинтетическое конструирование гена осуществляют путем комбинирования аспектов синтетического конструирования гена и/или сайт-направленного мутагенеза, и/или произвольного мутагенеза, и/или перестановки. Полусинтетическое конструирование является типичным примером способа, который использует фрагменты полинуклеотида, который синтезируют, в комбинации с ПЦР способами. Определенные области генов, таким образом, могут быть синтезированы de novo, тогда как другие области могут быть амплифицированы, используя сайт-специфические мутагенные праймеры, в то время как еще другие области могут подвергать амплификации ПЦР, подверженному погрешностям, или ПЦР, неподверженному погрешностям. Полинуклеотидные подпоследовательности потом могут перестанавливать.
Варианты
Варианты родительской альфа-амилазы, приемлемые в настоящем изобретении, содержащие изменение в двух или больше (нескольких) положениях, соответствующих положениям G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477 зрелого полипептида SEQ ID NO: 1, и при этом каждое изменение независимо представляет собой замещение, вставку или делецию (предпочтительно замещение), и вариант имеет активность альфа-амилазы. Таким образом, обеспечены варианты, которые имеют улучшенную моющую эффективность при низкой температуре, по сравнению с родительской альфа-амилазой, или по сравнению с альфа-амилазой SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12.
В варианте осуществления, вариант имеет идентичность последовательности, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99%, но меньше, чем 100%, с аминокислотной последовательностью родительской альфа-амилазы.
Варианты, полезные в настоящем изобретении, являются выделенными вариантами альфа-амилазы, содержащими изменение в двух или больше (нескольких) положениях, соответствующих положениям G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477 зрелого полипептида SEQ ID NO: 1, при этом каждое изменение независимо представляет собой замещение, делецию или вставку, и причем вариант имеет, по меньшей мере, 80%, но меньше, чем 100% идентичность последовательности со зрелым полипептидом любой из SEQ ID NO 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, и при этом вариант имеет активность альфа-амилазы.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 1.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 2.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 3.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 4.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 5.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 6.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 7.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 8.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 9.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 10.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 11.
В другом варианте осуществления, вариант имеет, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 95%, как например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99%, но меньше, чем 100%, идентичность последовательности со зрелым полипептидом SEQ ID NO: 12.
В одном аспекте, число изменений в вариантах в соответствии с настоящим изобретением составляет 1-20, например, 1-10 и 1-5, как например 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 изменений.
В одном аспекте, вариант содержит изменение в двух или больше (нескольких) положениях, которые соответствуют положениям G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477. В другом аспекте, вариант содержит изменение в двух положениях, которые соответствуют любому из положений G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477. В другом аспекте, вариант содержит изменение в трех положениях, которые соответствуют любому из положений G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477. В другом аспекте, вариант содержит изменение в четырех положениях, которые соответствуют любому из положений G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477. В другом аспекте, вариант содержит изменение в пяти положениях, которые соответствуют любому из положений G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477. В другом аспекте, вариант содержит изменение в шести положениях, которые соответствуют любому из положений G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477. В другом аспекте, вариант содержит изменение в каждом положении, которое соответствует положениям G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477. Положения соответствуют положениям SEQ ID NO: 1. Предпочтительно, изменениями являются замещения.
В одном варианте осуществления, вариант содержит замещение в двух, трех или четырех положениях, выбранных из группы, состоящей из G304, W140, W189, D134, Е260, F262, W284, W347, W439, W469, G476 и G477, также необязательно содержит замещение в одном, двух или трех положениях, выбранных из группы, соответствующей положениям N195, V206 и Y243.
В предпочтительном варианте осуществления, вариант содержит замещение в двух, трех или четырех положениях, выбранных из группы, состоящей из G304, W140, Е260 и G476.
В одном аспекте изобретения, вариант содержит два или больше (несколько) замещений, выбранных из группы, состоящей из G304RKEQ, W140YF, W189EGT, D134E, E260ADCQLMFPSWVGHIKNRTY, F262GP, W284DHFYR, W347HFY, W439RG, G476EQRK, G477EQKMR.
Предпочтительно, что вариант в соответствии с изобретением содержит замещения в двух, трех или четырех положениях, выбранных из группы, состоящей из G304R, W140YF, E260GHIKNPRTY и G476EQRK. В более предпочтительном варианте осуществления, замещения в двух, трех или четырех положениях выбирают из группы, состоящей из G304R, W140Y, E260G и G476K.
В одном варианте осуществления, вариант также содержит одно или больше замещений, выбранных из группы, состоящей из T51IL, S52Q, N54K, G109A, E194D, N195F, V206Y, Y243F, G109A, G273DV, G337N, K72R, R181H, S303G и Y100I. В предпочтительном варианте осуществления одно или больше дополнительных замещений выбирают из группы, состоящей из N195F, V206Y, Y243F. Предпочтительно, вариант содержит два или три из данных замещений. Таким образом, обеспечены варианты, которые имеют улучшенную моющую эффективность при низкой температуре, а также улучшенную стабильность к уменьшению Са2+, по сравнению с родительской альфа-амилазой или по сравнению с альфа-амилазой SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12.
В другом аспекте, вариант, полезный в настоящем изобретении, содержит два или больше (несколько) замещений зрелого полипептида SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12, выбранных из группы, состоящей из D134E, E260G, Е260Н, E260I, Е260К, E260N, E260R, Е260Т, G109A, G273D, G273V, G337N, G476E, G477E, G477M, G477R, K72R, R181H, S303G, W140F, W140Y, W189E, W189G, W189T, W284D и Y100I.
Варианты могут дополнительно содержать изменение в одном или больше (нескольких) других положениях. Например, варианты могут содержать изменение в положении, которое соответствует положениям N195F+V206Y+Y243F и/или G182*+D183* или D183*+G184*.
В другом аспекте, изобретение относится к вариантам, которые содержат замещения в положениях, которые соответствуют положениям полипептида SEQ ID NO: 1, выбранным из группы, состоящей из:
W140Y+N195F+V206Y+Y243F+E260G+G477E,
W140Y+N195F+V206Y+Y243F+E260T+W284D,
W140Y+N195F+V206Y+Y243F+W284D,
G109A+W140Y+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G,
N195F+V206Y+Y243F+E260K+W284D,
D134E+G476E,
W140Y+N195F+V206Y+Y243F+E260G+G476E,
W140Y+W189G+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+S303G,
W140Y+W189T+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+W284D,
Y100I+W140Y+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+G337N,
W140Y+N195F+V206Y+Y243F+E260G+W439R,
G109A+W140Y+E194D+N195F+V206Y+Y243F+E260G,
G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
T51I+Y100I+G109A+W140Y+N195F+V206Y+Y243F+E260G,
T51I+G109A+W140Y+N195F+V206Y+Y243F+E260G+W439R,
T51I+S52Q+N54K+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
W140Y+N195F+V206Y+Y243F+E260G+G304R+G476K,
W140Y+N195F+V206Y+Y243F+E260G+W284R+G477K,
W140Y+N195F+V206Y+Y243F+E260G+W284F+G477R и
N195F+V206Y+Y243F+E260G+W284D.
В другом аспекте, изобретение относится к вариантам, которые состоят из замещений в положениях, которые соответствуют положениям полипептида SEQ ID NO: 1, выбранным из группы, состоящей из:
W140Y+N195F+V206Y+Y243F+E260G+G477E,
W140Y+N195F+V206Y+Y243F+E260T+W284D,
W140Y+N195F+V206Y+Y243F+W284D,
G109A+W140Y+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G,
N195F+V206Y+Y243F+E260K+W284D,
D134E+G476E,
W140Y+N195F+V206Y+Y243F+E260G+G476E,
W140Y+W189G+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+S303G,
W140Y+W189T+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+W284D,
Y100I+W140Y+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+G337N,
W140Y+N195F+V206Y+Y243F+E260G+W439R,
G109A+W140Y+E194D+N195F+V206Y+Y243F+E260G,
G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
T51I+Y100I+G109A+W140Y+N195F+V206Y+Y243F+E260G,
T51I+G109A+W140Y+N195F+V206Y+Y243F+E260G+W439R,
T51I+S52Q+N54K+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
W140Y+N195F+V206Y+Y243F+E260G+G304R+G476K,
W140Y+N195F+V206Y+Y243F+E260G+W284R+G477K,
W140Y+N195F+V206Y+Y243F+E260G+W284F+G477R и
N195F+V206Y+Y243F+E260G+W284D.
В еще другом аспекте, приемлемые варианты содержат изменения в положениях, которые соответствуют положениям полипептида SEQ ID NO: 1, выбранным из группы, состоящей из:
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G477E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260T+W284D,
D183*+G184*+W140Y+N195F+V206Y+Y243F+W284D,
D183*+G184*+G109A+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+N195F+V206Y+Y243F+E260K+W284D,
D183*+G184*+D134E+G476E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+W140Y+W189G+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+S303G,
D183*+G184*+W140Y+W189T+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284D,
D183*+G184*+Y100I+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G337N,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W439R,
D183*+G184*+G109A+W140Y+E194D+N195F+V206Y+Y243F+E260G,
D183*+G184*+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+T51I+Y100I+G109A+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+T51I+G109A+W140Y+N195F+V206Y+Y243F+E260G+W439R,
D183*+G184*+T51I+S52Q+N54K+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G304R+G476K,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284R+G477K,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284F+G477R и
D183*+G184*+N195F+V206Y+Y243F+E260G+W284D.
В другом аспекте, приемлемые варианты состоят из изменений в положениях, которые соответствуют положениям полипептида SEQ ID NO: 1, выбранным из группы, состоящей из:
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G477E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260T+W284D,
D183*+G184*+W140Y+N195F+V206Y+Y243F+W284D,
D183*+G184*+G109A+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+N195F+V206Y+Y243F+E260K+W284D,
D183*+G184*+D134E+G476E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+W140Y+W189G+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+S303G,
D183*+G184*+W140Y+W189T+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284D,
D183*+G184*+Y100I+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G337N,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W439R,
D183*+G184*+G109A+W140Y+E194D+N195F+V206Y+Y243F+E260G,
D183*+G184*+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+T51I+Y100I+G109A+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+T51I+G109A+W140Y+N195F+V206Y+Y243F+E260G+W439R,
D183*+G184*+T51I+S52Q+N54K+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G304R+G476K,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284R+G477K,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284F+G477R и
D183*+G184*+N195F+V206Y+Y243F+E260G+W284D.
Обязательные аминокислоты в предшественнике могут быть идентифицированы в соответствии с процедурами, известными в данной области техники, такими как сайт-направленный мутагенез или сканирующий аланином мутагенез (Cunningham and Wells, 1989, Science 244: 1081-1085). В последнем способе, единичные аланиновые мутации вводят в каждый остаток в молекуле, и полученные в результате мутантные молекулы исследуют на активность альфа-амилазы, чтобы идентифицировать аминокислотные остатки, которые являются критическими для активности молекулы. См. также, Hilton et al., 1996, J. Biol. Chem. 271: 4699-4708. Активный сайт альфа-амилазы или другое биологическое взаимодействие также может быть определено путем физического анализа структуры, которая определяется посредством таких способов, как ядерно-магнитный резонанс, кристаллография, структурная электронография или фотоаффинное мечение, в сочетании с мутацией предполагаемых аминокислот в сайте контакта. См., например, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, J. Mol. Biol. 224: 899-904; Wlodaver et al., 1992, FEBS Lett. 309: 59-64. Идентичности обязательных аминокислот также могут быть выведены из анализа идентичностей с полипептидами, которые связаны с предшественником.
Композиции
Настоящее изобретение также относится к композициям, содержащим вариант в соответствии с настоящим изобретением. Предпочтительно, композиции являются обогащенными таким вариантом. Термин «обогащенный» означает, что активность альфа-амилазы композиции возрастает, например, с фактором обогащения 1.1.
Композиция может содержать вариант, как основной ферментный компонент, например, монокомпонентная композиция. Альтернативно, композиция может содержать множественные активности ферментов, таких как аминопептидаза, амилаза, карбогидраза, карбоксипептидаза, каталаза, целлюлаза, хитиназа, кутиназа, циклодекстрингликозилтрансфераза, дезоксирибонуклеаза, эстераза, альфа-галактозидаза, бета-галактозидаза, глюкоамилаза, альфа-глюкозидаза, бета-глюкозидаза, галопероксидаза, инвертаза, лакказа, липаза, маннозидаза, оксидаза, пектинолитический фермент, пептидоглутаминаза, пероксидаза, фитаза, полифенолоксидазы, протеолитический фермент, рибонуклеаза, трансглутаминаза или ксиланаза. Дополнительный фермент(ы) может продуцироваться, например, микроорганизмом, принадлежащим к семейству Aspergillus, например, Aspergillus aculeatus, Aspergillus awamori, Aspergillus foetidus, Aspergillus fumigatus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, или Aspergillus oryzae; Fusarium, например, Fusarium bactridioides, Fusarium cerealis, Fusarium crookiyHKoebiiiense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sulphureum, Fusarium toruloseum, Fusarium trichothecioides, или Fusarium venenatum; Humicola, например, Humicola insolens или Humicola lanuginosa; или Trichoderma, например, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei или Trichoderma viride.
Композиции могут быть получены в соответствии со способами, известными в данной области техники и могут находиться в виде жидкой или сухой композиции. Например, композиция может быть в форме гранулята или микрогранулята. Вариант может быть стабилизированным в соответствии со способами, известными в данной области техники.
Чистящие композиции
Настоящее изобретение, предпочтительно, относится к продуктам и/или способам, связанных с, и/или к использованию заявленных композиций, которые представляют собой освежитель воздуха, средство по уходу за автомобилем, средство для мытья посуды, средство для кондиционирования ткани (включая смягчители), моющее средство для стирки белья, добавка для стирки и полоскания белья и/или по уходу за бельем, средство для очистки и/или обработки твердой поверхности, и другие чистящие средства для потребительского использования или использования в учреждении. В соответствии с изобретением, указанные выше варианты альфа-амилазы, как правило, могут быть компонентом в чистящей композиции, такой как твердой, жидкой, гелевой и/или единично дозированной композиции моющего средства, например, композиции моющего средства для стирки или композиции моющего средства для мытья посуды. Особенно предпочтительной является жидкая композиция моющего средства для стирки.
Такие чистящие композиции содержат чистящее/моющее вспомогательное вещество, предпочтительно, смесь компонентов. Как правило, чистящее вспомогательное вещество будет присутствовать в композиции в количестве от 0,001 до 99,9 мас. %, более типично, от 0,01 до 80 мас. % чистящего вспомогательного вещества. Приемлемые чистящие вспомогательные вещества содержат: поверхностно-активные вещества, моющие компоненты, отбеливатели, катализаторы отбеливателя, окрашивающие вещества, усилители отбеливателя, хелатирующие агенты, агенты переноса красителя, вспомогательные средства осаждения, диспергаторы, дополнительные ферменты и стабилизаторы ферментов, каталитические вещества, активаторы отбеливателя, перекись водорода, источники перекиси водорода, оптические отбеливатели, фотоактиваторы, люминофоры, оттеночные агенты для ткани, кондиционеры для ткани, предварительно образованные перкислоты, полимерные диспергирующие агенты, агенты для удаления/против повторного отложения глинистых загрязнений, соли-наполнители, гидротропы, блескообразователи, пеногасители, агенты придающие эластичность структуре, смягчители для тканей, поверхностно-активные вещества, способные к гидролизу, консерванты, антиоксиданты, агенты против усадки, гермициды, фунгициды, средства против тускнения, противокоррозионные агенты, источники щелочности, солюбилизирующие агенты, носители, технологические вспомогательные вещества, пигменты, красители, отдушки и агенты для контроля pH, инкапсуляты, полимеры. Например, они могут включать: отбеливающие ингредиенты, такие как иминные усилители отбеливателя; источники перекиси водорода, такие как перкарбонат и/или перборат, особенно перкарбонат, покрытый веществом, таким как карбонатная и/или сульфатная соль, силикатная соль, борсиликат и любая их смесь; предварительно образованная перкислота, включая предварительно образованную перкислоту в инкапсулированной форме; катализаторы на основе переходных металлов; пеногасители или системы гасителя, такие как пеногасители на основе силиконе и/или пеногасители на основе жирной кислоты; смягчители для тканей, такие как глина, силикон и/или четвертичные аммониевые соединения; флокулянты, такие как полиэтиленоксид; ингибиторы переноса красителя, такие как поливинилпирролидон, поли-4-винилпиридин N-оксид и/или сополимер винилпирролидона и винилимидазола; компоненты для целостности ткани, такие как олигомеры, получаемые путем конденсации имидазола и эпихлоргидрина; диспергаторы загрязнения и вспомогательные средства против повторного осаждения загрязнений, такие как алкоксилированные полиамины и этоксилированные этилениминные полимеры; компоненты против повторного осаждения, такие как сложные полиэфиры; карбоксилатные полимеры, такие как полимеры малеиновой кислоты или сополимеры малеиновой и акриловой кислоты; отдушки, такие как микрокапсулы отдушки, инкапсулированные аккорды крахмала, распыляемая отдушка; мыльные кольца; эстетические частицы; красители; наполнители, такие как сульфат натрия, хотя предпочтительно, чтобы композиция была, по существу, свободна от наполнителей, силикатная соль, такая как силикат натрия, включая 1.6R и 2.0R силикат натрия, или метасиликат натрия; сложные со-полиэфиры дикарбоновых кислот и диолов; целлюлозные полимеры, такие как метилцеллюлоза, карбоксиметилцеллюлоза, гидроксиэтоксицеллюлоза, или другая алкил или алкилалкоксицеллюлоза; растворители, такие как 1,2-пропандиол, моноэтаноламин; диэтиленгликоль, этанол и любая их смесь; гидротропы, такие как натрия кумолсульфонат, натрия ксиленсульфонат, натрия толуолсульфонат и любые смеси; органические кислоты, такие как лимонная кислота; и любая их комбинация.
В другом предпочтительном аспекте композиция содержит одно или больше поверхностно-активных веществ, которые могут быть неионными, включая полу полярные, и/или анионные, и/или катионные, и/или цвитерионные, и/или амфолитические, и/или полуполярные неионные, и/или их смеси. Поверхностно-активные вещества, как правило, присутствуют в количестве от 0,1% до 60% по массе, или от 0,5 до 50 мас. %, или 1 до 40 мас. % композиции.
При включении в данную заявку чистящая композиция, как правило, будет содержать от приблизительно 1% до приблизительно 40% анионного поверхностно-активного вещества, такого как линейный алкилбензолсульфонат, альфа-олефинсульфонат, алкилсульфат (сульфат жирного спирта), этоксисульфат спирта, вторичный алкансульфонат, метиловый эфир жирной альфа-сульфокислоты, алкил- или алкенилянтарная кислота или мыло.
При включении в данную заявку чистящий агент, как правило, будет содержать от приблизительно 0,2% до приблизительно 40% неионного поверхностно-активного вещества, такого как этоксилат спирта, этоксилат нонилфенола, алкилполигликозид, алкилдиметиламин-оксид, моноэтаноламид этоксилированной жирной кислоты, моноэтаноламид жирной кислоты, амид жирной полигидроксиалкильной кислоты, или N-ацил-N-алкильные производные глюкозамина («глюкамиды»).
Чистящая композиция может содержать один или больше других ферментов, таких как протеаза, липаза, пероксидаза, другой амилолитический фермент, например, другую альфа-амилазу, глюкоамилазу, мальтогенную амилазу, CGTase и/или целлюлазу, маннаназу (такую как MANNAWAY™ от Novozymes, Denmark), пектиназу, пектатлиазу, кутиназу и/или лакказу.
В основном свойства выбранного(ых) фермента(ов) должны быть совместимыми с выбранным моющим средством, (то есть, оптимальный pH, совместимость с другими ферментными и неферментными ингредиентами и т.д.), и фермент(ы) должен присутствовать в эффективных количествах.
Протеазы: Приемлемые протеазы включают металлопротеазы и/или серинпротеазы, включая нейтральные или щелочные микробные серинпротеазы, такие как субтилизины (ЕС 3.4.21.62). Приемлемые протеазы включают протеазы животного, растительного или микробного происхождения. В одном аспекте, такая приемлемая протеаза может быть микробного происхождения. Приемлемые протеазы включают химически или генетически модифицированные мутанты указанных выше приемлемых протеаз. В одном аспекте, приемлемая протеаза может быть серинпротеазой, такой как щелочная микробная протеаза, или/и протеазой трипсинового типа. Примеры приемлемых нейтральных или щелочных протеаз включают:
(a) субтилизины (ЕС 3.4.21.62), включая те, которые получены из Bacillus, таких как Bacillus lentus, В. alkalophilus, В. subtilis, В. amyloliquefaciens, Bacillus pumilus и Bacillus gibsonii, описанные в US 6,312,936 B1, US 5,679,630, US 4,760,025, US 7,262,042 и WO 09/021867;
(b) протеазы трипсинового типа или химотрипсинового типа, такие как трипсин (например, свинного или коровьего происхождения), включая Fusarium протеазу, описанную WO 89/06270, и химотрипсиновые протеазы, полученные из Cellumonas, описанные в WO 05/052161 и WO 05/052146;
(c) металлопротеазы, включая те, которые получены из Bacillus amyloliquefaciens, описанные в WO 07/044993 А2.
Предпочтительные протеазы включают те, которые получены из Bacillus gibsonii или Bacillus Lentus.
Приемлемые коммерчески доступные протеазные ферменты включают те, которые продаются под торговыми названиями Alcalase®, Savinase®, Primase®, Durazym®, Polarzyme®, Kannase®, Liquanase®, Liquanase Ultra®, Savinase Ultra®, Ovozyme®, Neutrase®, Everlase® и Esperase® от Novozymes A/S (Denmark), которые продаются под торговыми названиями Maxatase®, Maxacal®, Maxapem®, Properase®, Purafect®, Purafect Prime®, Purafect Ox®, FN3®, FN4®, Excellase® и Purafect ОХР® от Genencor International, которые продаются под торговыми названиями Opticlean® и Optimase® от Solvay Enzymes, которые доступны от Henkel/Kemira, a именно BLAP (последовательность показана на фигуре 29 US 5,352,604 со следующими мутациями S99D+S101R+S103A+V104I+G159S, в данной заявке в дальнейшем называется как BLAP), BLAP R (BLAP с S3T+V4I+V199M+V205I+L217D), BLAP X (BLAP с S3T+V4I+V205I) и BLAP F49 (BLAP с S3T+V4I+А194Р+V199M+V205I+L217D) - все от Henkel/Kemira; и КАР (Bacillus alkalophilus субтилизин с мутациями A230V+S256G+S259N) от Као. Дополнительные приемлемые протеазы описаны в WO 2011/03623, WO 2011/140316, WO 2011/140364 и WO 2012/05778.
Липазы: Приемлемые липазы включают липазы бактериального или грибкового происхождения. Включенными являются химически модифицированные или протеин-сконструированные мутанты. Примеры полезных липаз включают липазы от Humicola (синоним Thermomyces), например, от Н. lanuginosa (T. lanuginosus), как описано в ЕР 258068 и ЕР 305216, или от Н. Insolens, как описано в WO 96/13580, Pseudomonas липаза, например, от P. alcaligenes или P. pseudoalcaligenes (ЕР 218272), P. cepacia (ЕР 331376), P. stutzeri (GB 1,372,034), P. fluorescens, Pseudomonas sp. штамм SD 705 (WO 95/06720 и WO 96/27002), P. wisconsinensis (WO 96/12012), Bacillus липаза, например, от В. subtilis (Dartois et al. (1993), Biochemica et Biophysica Acta, 1131, 253-360), В. stearothermophilus (JP 64/744992) или В. pumilus (WO 91/16422).
Липаза может быть «липазой первого цикла», такой как та, что описана в патенте США 6,939,702 В1 и заявке на патент США 2009/0217464. В одном аспекте, липаза представляет собой липазу первого цикла стирки, предпочтительно, вариант липазы дикого типа от Thermomyces lanuginosus, содержащий T231R и N233R мутации. Последовательность дикого типа представляет собой 269 аминокислот (аминокислоты 23 - 291) Swissprot номер доступа Swiss-Prot O59952 (полученный от Thermomyces lanuginosus (Humicola lanuginosa)). Предпочтительные липазы включали бы те, которые продаются под торговыми названиями Lipex®, Lipolex® и Lipoclean®.
Целлюлазы: Приемлемые целлюлазы включают целлюлазы бактериального или грибкового происхождения. Включенными являются химически модифицированные или протеин-сконструированные мутанты. Приемлемые целлюлазы включают целлюлазы из семейства Bacillus, Pseudomonas, Humicola, Fusarium, Thielavia, Acremonium, например, грибковые целлюлазы, полученные из Humicola insolens, Myceliophthora thermophila и Fusarium oxysporum, раскрытый в US 4,435,307, US 5,648,263, US 5,691,178, US 5,776,757, WO09/148983, US 7,141,403B2 и WO 89/09259.
В одном аспекте, предпочтительные ферменты включают микробно-полученные эндоглюканазы, демонстрирующие активность эндо-бета-1,4-глюканазы (Е.С. 3.2.1.4), предпочтительно, выбранные из группы, которая включает:
(a) бактериальный полипептид, эндогенный к члену семейства Bacillus, который имеет последовательность с, по меньшей мере, 90%, 94%, 97% и даже 99% идентичностью к аминокислотной последовательности SEQ ID NO: 2 в US 7,141,403 В2;
(b) гликозилгидролаза, имеющая ферментную активность, как к ксилоглюкану, так и к аморфным целлюлозным субстратам, при этом гликозилгидролазу выбрана из GH семейств 5, 12, 44 или 74;
(c) гликозилгидролаза, имеющая последовательность с, по меньшей мере, 90%, 94%, 97% и даже 99% идентичностью к аминокислотной последовательности SEQ ID NO: 3 в WO 09/148983;
(b) и их смеси.
Приемлемые эндоглюканазы продают под торговыми названиями Celluclean® и Whitezyme® (Novozymes A/S, Bagsvaerd, Denmark).
Другие коммерчески доступные целлюлазы включают CELLUZYME® и CAREZYME® (Novozymes A/S), CLAZINASE®, и PURADAX НА® (Genencor International Inc.) и KAC-500(B)® (Kao Corporation).
Пероксидазы/оксидазы: Приемлемые пероксидазы/оксидазы включают те, которые имеют растительное, бактериальное или грибковое происхождение. Включенными являются химически модифицированные или протеин-сконструированные мутанты. Примеры полезных пероксидаз включают пероксидазы от Coprinus, например, от С. cinereus, и их варианты, как те, которые описаны в WO 93/24618, WO 95/10602 и WO 98/15257.
Коммерчески доступные пероксидазы включают GUARDZYME® (Novozymes A/S).
Другие ферменты: Другие предпочтительные ферменты включают пектатлиазы, продаваемые под торговыми названиями Pectawash®, Pectaway®, и маннаназы, продаваемые под торговыми названиями Mannaway® (все от Novozymes A/S, Bagsvaerd, Denmark), и Purabrite® (Genencor International Inc., Palo Alto, California).
Фермент(ы) моющего средства может быть включен в композицию моющего средства путем добавления отдельных добавок, содержащих один или больше ферментов, или путем добавления комбинированной добавки, содержащей все из данных ферментов. Добавки моющего средства согласно изобретению, то есть, отдельная добавка или комбинированная добавка, могут быть сформулированы в состав, например, гранулят, жидкость, суспензия и т.д. Предпочтительные составы добавки моющего средства представляют собой грануляты, в частности, непылящие грануляты, жидкости, в частности, стабилизированные жидкости или суспензии.
Непылящие грануляты могут быть получены, например, как раскрыто в US 4,106,991 и 4,661,452 и необязательно могут быть покрыты, используя способы известные в данной области техники. Примеры восковых покрывающих материалов представляют собой поли(этиленоксид)ные продукты (полиэтиленгликоль, ПЭГ) со средними молярными массами от 1000 до 20000; этоксилированные нонил-фенолы, имеющие от 16 до 50 этиленоксидных единиц; этоксилированные жирные спирты, в которых спирт содержит от 12 до 20 атомов углерода, и в которых присутствует от 15 до 80 этиленоксидных единиц; жирные спирты; жирные кислоты; и моно-, и ди- и триглицериды жирных кислот.Примеры пленкообразующих покрывающих материалов, приемлемых для применения с помощью способов псевдоожиженного слоя, представлены в GB 1483591. Жидкие ферментные составы могут, например, быть стабилизированы путем добавления полиолов, таких как пропиленгликоль, сахар или сахароспирт, молочная кислота или борная кислота в соответствии с установленными способами. Защищенные ферменты могут быть получены в соответствии со способом, раскрытым в ЕР 238,216.
Композиция может содержать оттеночный агент для ткани (иногда называемые как оттеняющие, подсинивающие или отбеливающие агенты). Как правило, оттеночный агент обеспечивает синий или фиолетовый оттенок ткани. Оттеночные агенты могут использоваться или самостоятельно, или в комбинации, чтобы создать определенный оттенок оттеночного красителя и/или оттенить различные типы тканей. Это может обеспечиваться, например, путем смешивания красного и сине-зеленого красителя, чтобы получить синий или фиолетовый оттенок. Оттеночные агенты могут быть выбраны из любого известного химического класса красителя, включая, но не ограничиваясь этим, акридин, антрахинон (включая полициклические хиноны), азин, азокраситель (например, моноазо-, диазо-, триазо-, тетраазо-, полиазокраситель), включая металлсодержащий азокраситель, бензодифуран и бензодифуранон, каротеноид, кумарин, цианин, диазагемицианин, дифенилметан, формазан, гемициан, индигоиды, метан, нафталимиды, нафтохиноны, нитро- и нитрозокрасители, оксазин, фталоцианин, пиразолы, стильбен, стирил, триарилметан, трифенилметан, ксантены и их смеси.
Приемлемые оттеночные агенты для ткани включают красители, конъюгаты краситель-глина и органические и неорганические пигменты. Приемлемые красители включают низкомолекулярные красители и полимерные красители. Приемлемые низкомолекулярные красители включают низкомолекулярные красители, выбранные из группы, состоящей из красителей, попадающих в классификации показателя цвета (Colour Index (C.I.)) прямого, основного, реактивного или гидролизованного реактивного, растворимого в органических средах или дисперсного красителей, например, те, которые классифицируются как синий, фиолетовый, красный, зеленый или черный, и обеспечивают требуемый оттенок или самостоятельно, или в комбинации. В другом аспекте, приемлемые низкомолекулярные красители включают низкомолекулярные красители, выбранные из группы, состоящей из красителей по показателю цветности (Society of Dyers and Colourists, Bradford, UK) прямые фиолетовые красители, такие как 9, 35, 48, 51, 66 и 99, прямые синие красители, такие как 1, 71, 80 и 279, кислотные красные красители, такие как 17, 73, 52, 88 и 150, кислотные фиолетовые красители, такие как 15, 17, 24, 43, 49 и 50, кислотные синие красители, такие как 15, 17, 25, 29, 40, 45, 75, 80, 83, 90 и 113, кислотные черные красители, такие как 1, основные фиолетовые красители, такие как 1, 3, 4, 10 и 35, основные синие красители, такие как 3, 16, 22, 47, 66, 75 и 159, дисперсные или растворимые в органической среде красители, такие как те, которые описаны в ЕР 1794275 или ЕР 1794276, или красители, как раскрыто в US 7,208,459 В2, и их смеси. В другом аспекте, приемлемые низкомолекулярные красители включают низкомолекулярные красители, выбранные из группы, состоящей из красителей по показателю цветности кислотный фиолетовый 17, прямой синий 71, прямой фиолетовый 51, прямой синий 1, кислотный красный 88, кислотный красный 150, кислотный синий 29, кислотный синий 113 или их смеси.
Приемлемые полимерные красители включают полимерные красители, выбранные из группы, состоящей из полимеров, которые содержат ковалентно связанные (иногда называемые как конъюгированные) хромогены, (конъюгаты краситель-полимер), например полимеры с хромогенами, сополимеризированными в скелет полимера и их смеси. Полимерные красители включают те, которые описаны в WO 2011/98355, WO 2011/47987, US 2012/090102, WO 2010/145887, WO 2006/055787 и WO 2010/142503.
В другом аспекте, приемлемые полимерные красители включают полимерные красители, выбранные из группы, состоящей из субстантивных красителей для ткани, которые продаются под названием Liquitint® (Milliken, Spartanburg, South Carolina, USA), конъюгаты краситель-полимер, образованные из, по меньшей мере, одного реакционноспособного красителя и полимера, выбранного из группы, состоящей из полимеров, содержащих фрагмент, выбранный из группы, состоящей из гидроксильного фрагмента, фрагмента первичного амина, фрагмента вторичного амина, тиольного фрагмента и их смесей. В еще другом аспекте, приемлемые полимерные красители включают полимерные красители, выбранные из группы, состоящей из Liquitint® фиолетового СТ, карбоксиметилцеллюлозы (CMC), ковалентно связанной с реакционноспособным синим, реакционноспособным фиолетовым или реакционноспособным красным красителем, такие как CMC, конъюгированная с С.I. реакционноспособным синим 19, продаваемым Megazyme, Wicklow, Ireland под названием продукта AZO-CM-CELLULOSE, код продукта S-ACMC, алкоксилированные трифенилметановые полимерные красители, алкоксилированные тиофеновые полимерные красители и их смеси.
Предпочтительные оттеночные красители включают отбеливающие агенты, представленные в WO 08/87497 A1, WO 2011/011799 и WO 2012/054835. Предпочтительные оттеночные агенты для использования в настоящем изобретении могут быть предпочтительными красителями, раскрытыми в данных ссылках, включая, выбранные с примеров 1-42 в таблице 5 WO 2011/011799. Другие предпочтительные красители раскрыты в US 8138222.
Приемлемые конъюгаты краситель-глина включают конъюгаты краситель-глина, выбранные из группы, которая включает, по меньшей мере, один катионный/основный краситель и смектитовую глину, и их смеси. В другом аспекте, приемлемые конъюгаты краситель-глина включают конъюгаты краситель-глина, выбранные из группы, состоящей из одного катионного/основного красителя, выбранного из группы, состоящей из С.I. основного желтого с 1 по 108, С.I. основного оранжевого с 1 по 69, С.I. основного красного с 1 по 118, С.I. основного фиолетового с 1 по 51, С.I. основного синего с 1 по 164, С.I. основного зеленого с 1 по 14, С.I. основный коричневого с 1 по 23, С.I. основного черного с 1 по 11, и глины, выбранной из группы, состоящей из монтмориллонитовой глины, гекторитовой глины, сапонитовой глины и их смесей. В еще другом аспекте, приемлемые конъюгаты краситель-глина включают конъюгаты краситель-глина, выбранные из группы, состоящей из: конъюгата монтмориллонит-основной синий В7 С.I. 42595, конъюгата монтмориллонит-основной синий В9 С.I. 52015, конъюгата монтмориллонит-основной фиолетовый V3 С.I. 42555, конъюгата монтмориллонит-основной зеленый G1 С.I. 42040, конъюгата монтмориллонит-основной красный R1 С.I. 45160, конъюгата монтмориллонит-C.I. основной черный 2, конъюгата гекторит-основной синий В7 С.I. 42595, конъюгата гекторит-основной синий В9 С.I. 52015, конъюгата гекторит-основной фиолетовый V3 С.I. 42555, конъюгата гекторит-основной зеленый G1 С.I. 42040, конъюгата гекторит-основной красный R1 С.I. 45160, конъюгата гекторит-С.I. основной черный 2, конъюгата сапонит-основной синий В7 С.I. 42595, конъюгата сапонит-основной синий В9 С.I. 52015, конъюгата сапонит-основной фиолетовый V3 С.I. 42555, конъюгата сапонит-основной зеленый G1 С.I. 42040, конъюгата сапонит-основной красный R1 С.I. 45160, конъюгата сапонит-C.I. основной черный 2 и их смесей.
Приемлемые пигменты включают пигменты, выбранные из группы, состоящей из флавантрона, индантрона, хлорированного индантрона, содержащего от 1 до 4 атомов хлора, пирантрона, дихлорпирантрона, монобромдихлорпирантрона, дибромдихлорпирантрона, тетрабромпирантрона, диимида перилен-3,4,9,10-тетракарбоновой кислоты, в котором имидные группы могут быть незамещенными или замещенными С1-С3-алкилом или фенилом или гетероциклическим радикалом, и в котором фенильный и гетероциклический радикалы могут дополнительно нести заместители, которые не обеспечивают растворимость в воде, амидов антрапиримидинкарбоновой кислоты, виолантрона, изовиолантрона, диоксазиновых пигментов, фталоцианина меди, которые могут содержать до 2 атомов хлора на молекулу, полихлорфталоцианина меди или полибромхлорфталоцианина меди, содержащих до 14 атомов брома на молекулу, и их смеси.
В другом аспекте, приемлемые пигменты включают пигменты, выбранные из группы, состоящей из ультрамарина синего (С.I. пигмента синего 29), ультрамарина фиолетового (С.I. пигмента фиолетового 15) и их смеси.
Моющие компоненты - Чистящая композиция, кроме того, может содержать моющие компоненты, такие как моющие компоненты на основе карбоната, бикарбоната или силикатов, которые могут быть цеолитами, такими как цеолит А, цеолит MAP (максимум алюминиевого типа Р). Цеолиты, пригодные для стирки белья, предпочтительно, имеют формулу Na12(AlO2)12(SiO2)12⋅27H2O и размер частиц, как правило, составляет 1-10 мкм для цеолита А и 0,7-2 мкм для цеолита MAP. Другие моющие компоненты представляют собой сильный щелочной метасиликат натрия (Na2SiO3⋅nH2O или Na2Si2O5⋅nH2O) и, предпочтительно, используется при мытье посуды. В предпочтительных вариантах осуществления, количество моющего компонента моющего средства может составлять больше 5%, больше 10%, больше 20%, больше 30%, больше 40% или больше 50%, и может составлять ниже 80%, 65%. В моющем средстве для мытья посуды, уровень моющего компонента, как правило, составляет 40-65%, в частности 50-65% или даже 75-90%.
Инкапсуляты - Композиция может содержать инкапсулят. В одном аспекте, инкапсулят содержит сердцевину, оболочку, имеющую внутреннюю и внешнюю поверхность, при этом указанная оболочка инкапсулирует указанную сердцевину.
В одном аспекте указанного инкапсулята, указанная сердцевина может содержать вещество, выбранное из группы, состоящей из отдушки; блескообразователей; красителей; репеллентов насекомых; силиконов; восков; ароматизаторов; витаминов; умягчающих агентов для ткани; агентов по уходу за кожей, в одном аспекте, парафинов; ферментов; анти-бактериальных агентов; отбеливателей; органолептики; и их смеси; и указанная оболочка может содержать вещество, выбранное из группы, состоящей из полиэтиленов; полиамидов; полистиролов; полиизопренов; поликарбонатов; сложных полиэфиров; полиакрилатов; аминопластов, в одном аспекте указанный аминопласт может содержать полимочевины, полиуретаны и/или полимочевинауретаны, в одном аспекте указанная полимочевина может содержать полиоксиметиленмочевину и/или меламинформальдегид; полиолефинов; полисахаридов, в одном аспекте указанный полисахарид может содержать альгинат и/или хитозан; желатина; шеллака; эпоксидных смол; винильных полимеров; нерастворимых в воде неорганических веществ; силикона; и их смесей.
В одном аспекте указанного инкапсулята, указанная сердцевина может содержать отдушку. Такие инкапсуляты представляют собой микрокапсулы отдушки.
В одном аспекте указанного инкапсулята, указанная оболочка может содержать меламинформальдегид и/или перекрестно сшитый меламинформальдегид.
В одном аспекте раскрыто, что приемлемые инкапсуляты могут содержать вещество сердцевины и оболочку, при этом указанная оболочка, по меньшей мере, частично окружает указанное вещество сердцевины. По меньшей мере, 75%, 85% или даже 90% указанных инкапсулятов могут иметь прочность на разрушение от приблизительно 0,2 МПа до приблизительно 10 МПа, от приблизительно 0,4 МПа до приблизительно 5 МПа, от приблизительно 0,6 МПа до приблизительно 3,5 МПа или даже от приблизительно 0,7 МПа до приблизительно 3 МПа; и просачивание полезного агента составляет от 0% до приблизительно 30%, от 0% до приблизительно 20% или даже от 0% до приблизительно 5%.
В одном аспекте, по меньшей мере, 75%, 85% или даже 90% указанных инкапсулятов могут иметь размер частицы от приблизительно 1 микрон до приблизительно 80 микрон, от приблизительно 5 микрон до 60 микрон, от приблизительно 10 микрон до приблизительно 50 микрон или даже от приблизительно 15 микрон до приблизительно 40 микрон.
В одном аспекте, по меньшей мере, 75%, 85% или даже 90% указанных инкапсулятов могут иметь толщину стенки частицы от приблизительно 30 нм до приблизительно 250 нм, от приблизительно 80 нм до приблизительно 180 нм или даже от приблизительно 100 нм до приблизительно 160 нм.
В одном аспекте, указанное вещество сердцевины инкапсулятов может содержать вещество, выбранное из группы, состоящей из сырьевого материала отдушки и/или необязательно вещества, выбранного из группы, состоящей из растительного масла, включая неразбавленное и/или смешанные растительные масла, включая касторовое масло, кокосовое масло, хлопковое масло, виноградное масло, рапсовое масло, соевое масло, кукурузное масло, пальмовое масло, льняное масло, подсолнечное масло, оливковое масло, арахисовое масло, кокосовое масло, косточковое пальмовое масло, касторовое масло, лимонное масло и их смеси; сложные эфиры растительных масел, сложные эфиры, включая дибутиладипат, дибутилфталат, бутилбензиладипат, бензилоктиладипат, трикрезилфосфат, триоктилфосфат и их смеси; углеводороды с линейной или разветвленной цепью, включая те углеводороды с линейной или разветвленной цепью, которые имеют температуру кипения выше, чем приблизительно 80°С; частично гидрированные терфенилы, диалкилфталаты, алкилбифенилы, включая моноизопропилбифенил, алкилированный нафталин, включая дипропилнафталин, петролейные спирты, включая керосин, минеральное масло и их смеси; ароматические растворители, включая бензол, толуол и их смеси; силиконовые масла; и их смеси.
В одном аспекте, указанный материал стенки инкапсулятов может содержать приемлемую смолу, включая продукт реакции альдегида и амина, приемлемые альдегиды включают формальдегид. Приемлемые амины включают меламин, мочевину, бензогуанамин, гликолурил и их смеси. Приемлемые меламины включают, метилол меламин, метилированный метилолмеламин, иминомеламин и их смеси. Приемлемые мочевины включают диметилолмочевину, метилированную диметилолмочевину, мочевину-резорцинол, и их смеси.
В одном аспекте, приемлемые уловители формальдегида могут применяться с инкапсулятами, например, в капсульной суспензии, и/или добавляться в потребительский продукт перед, во время или после того, как инкапсуляты добавляют к такому потребительскому продукту.
Приемлемые капсулы могут быть изготовлены, следуя методикам USPA 2008/0305982 A1; и/или USPA 2009/0247449 A1. Альтернативно, приемлемые капсулы могут поставляться от Appleton Papers Inc. Appleton, Wisconsin USA.
Кроме того, материалы для получения упомянутых выше инкапсулятов могут быть получены от Solutia Inc. (St Louis, Missouri U.S.A.), Cytec Industries (West Paterson, New Jersey U.S.A.), Sigma-Aldrich (St. Louis, Missouri U.S.A.), CP Kelco Corp. of San Diego, California, USA; BASF AG of Ludwigshafen, Germany; Rhodia Corp. of Cranbury, New Jersey, USA; Hercules Corp. of Wilmington, Delaware, USA; Agrium Inc. of Calgary, Alberta, Canada, ISP of New Jersey U.S.A., Akzo Nobel of Chicago, IL, USA; Stroever Shellac Bremen of Bremen, Germany; Dow Chemical Company of Midland, MI, USA; Bayer AG of Leverkusen, Germany; Sigma-Aldrich Corp., St. Louis, Missouri, USA.
В одном аспекте, композиция может содержать стабилизатор фермента, выбранный из группы, состоящей из (а) неорганических солей, выбранных из группы, состоящей из кальциевых солей, магниевых солей и их смесей; (b) углеводов, выбранных из группы, состоящей из олигосахаридов, полисахаридов и их смесей; (с) масс-эффективных обратимых ингибиторов протеазы, выбранных из группы, состоящей из фенилбороновой кислоты и ее производной; и (d) их смеси.
В другом варианте осуществления, композиция содержит: (1) обратимые ингибиторы протеазы, такие как борсодержащее соединение; (2) 1,2-пропандиол; (3) формиат кальция и/или формиат натрия; и (4) любую их комбинацию.
В одном аспекте, композиция может содержать структурирующий агент, выбранный из группы, состоящей из диглицеридов и триглицеридов, этиленгликольдистеарата микрокристаллической целлюлозы, материалов на основе целлюлозы, микроволокнистой целлюлозы, биополимеров, ксантановой камеди, геллановой камеди и их смеси.
Полимеры
Потребительский продукт может содержать один или больше полимеров. Примерами являются карбоксиметилцеллюлоза, поли(винилпирролидон), поли(этиленгликоль), поли(виниловый спирт), поли(винилпиридин-N-оксид), поли(винилимидазол), поликарбоксилаты, такие как полиакрилаты, сополимеры малеиновой/акриловой кислоты и сополимеры лаурилметакрилата/акриловой кислоты и амфифильные полимеры.
Амфифильные чистящие полимеры
Предпочтительно, амфифильный чистящий полимер представляет собой соединение, имеющее следующую общую структуру:
бис((C2H5O)(C2H4O)n)(CH3)-N+-CxH2x-N+-(CH3)-бис((C2H5O)(C2H4O)n),
где n = от 20 до 30, и x = от 3 до 8, или их сульфатированные или сульфированные варианты.
Амфифильные алкоксилированные чистящие жир полимеры в соответствии с настоящим изобретением относятся к любому алкоксилированному полимеру, имеющему сбалансированные гидрофильные и гидрофобные свойства, таким образом, что они удаляют частицы жира с тканей и поверхностей. Конкретные варианты осуществления амфифильных алкоксилированных чистящих жир полимеров в соответствии с настоящим изобретением включают каркасную структуру и множество алкоксилатных групп, присоединенных к такой каркасной структуре. Они могут содержать алкоксилированные полиалкиленимины, предпочтительно, имеющие внутренний полиэтиленоксидный блок и внешний полипропиленоксидный блок.
Каркасная структура может содержать полиалкилениминную структуру, содержащую, в сжатой форме, повторяющиеся единицы формулы (I), (II), (III) и (IV):
где # в каждом случае обозначает половинную связь между атомом азота и свободным связывающим положением группы А1 двух соседних повторяющихся единиц формул (I), (II), (III) или (IV); * в каждом случае обозначает половинную связь с одной из алкоксилатных групп; и А1 независимо выбран из линейного или разветвленного С2-С6-алкилена; где структура полиалкиленимина состоит из 1 повторяющейся единицы формулы (I), x повторяющихся единиц формулы (II), у повторяющихся единиц формулы (III) и y+1 повторяющихся единиц формулы (IV), где x и y в каждом случае имеют значение в диапазоне от 0 до приблизительно 150; где среднемассовая средняя молекулярная масса, Mw, полиалкилениминной каркасной структуры имеет значение в диапазоне от приблизительно 60 до приблизительно 10000 г/моль.
Каркасная структура может, альтернативно, содержать полиалканоламинную структуру продуктов конденсации, по меньшей мере, одного соединения, выбранного из N-(гидроксиалкил)аминов формули (I.a) и/или (I.b)
где А независимо выбран из C1-С6-алкилена; R1, R1*, R2, R2*, R3, R3*, R4, R4*, R5 и R5* независимо выбраны из водорода, алкила, циклоалкила или арила, где последние три указанные радикала необязательно могут быть замещенными; и R6 выбран из водорода, алкила, циклоалкила или арила, где последние три указанные радикала необязательно могут быть замещенными.
Множество алкиленоксигрупп, присоединенных к каркасной структуре, независимо выбраны из алкиленоксиединиц формулы (V)
где * в каждом случае обозначает половинную связь между атомом азота повторяющейся единицы формулы (I), (II) или (IV); А2, в каждом случае, независимо выбрано из 1,2-пропилена, 1,2-бутилена и 1,2-изобутилена; А3 представляет собой 1,2-пропилен; R, в каждом случае, независимо выбран из водорода и С1-С4-алкила; m имеет среднее значение в диапазоне от 0 до приблизительно 2; n имеет среднее значение в диапазоне от приблизительно 20 до приблизительно 50; и p имеет среднее значение в диапазоне от приблизительно 10 до приблизительно 50.
Конкретные варианты осуществления амфифильных алкоксилированных чистящих жир полимеров могут быть выбраны из алкоксилированных полиалкилениминов, имеющих внутренний полиэтиленоксидный блок и внешний полипропиленоксидный блок, степень этоксилирования и степень пропоксилирования которых не находится выше или ниже конкретных ограничивающих значений. Конкретные варианты осуществления алкоксилированных полиалкилениминов в соответствии с представленным изобретением имеют минимальное соотношение полиэтиленовых блоков к полипропиленовым блокам (n/p) приблизительно 0,6 и максимум - приблизительно 1,5(x+2y+1)1/2. Обнаружено, что алкоксилированные полиалкиленимины, имеющие соотношение n/p от приблизительно 0,8 до приблизительно 1,2(x+2y+1)1/2, имеют особенно полезные свойства.
Алкоксилированные полиалкиленимины в соответствии с настоящим изобретением имеют скелет, который состоит из атомов азота первичного, вторичного и третичного амина, которые присоединены один к другому с помощью алкиленовых радикалов А и являются произвольно упорядоченными. Первичные аминофрагменты, которые начинают или завершают главную цепь и боковые цепи полиалкилениминового скелета, и чьи остающиеся атомы водорода впоследствии замещают на алкиленокси единицы, называют как повторяющиеся единицы формул (I) или (IV), соответственно. Вторичные аминофрагменты, чей остающийся атом водорода впоследствии замещают на алкиленоксиединицы, называют как повторяющиеся единицы формулы (II). Третичные аминофрагменты, которые разветвляют главную цепь и боковые цепи, называют как повторяющиеся единицы формулы (III).
Так как циклизация может происходить с образованием полиалкилениминового скелета, то также возможно, что циклические аминофрагменты присутствуют в небольшой степени в скелете. Такие полиалкиленимины, содержащие циклические аминофрагменты, конечно, являются алкоксилированными тем же способом, как и те, которые состоят из нециклических первичных и вторичных аминофрагментов.
Полиалкилениминный скелет, состоящий из атомов азота и групп А1, имеет среднюю молекулярную массу Mw от приблизительно 60 до приблизительно 10000 г/моль, предпочтительно от приблизительно 100 до приблизительно 8000 г/моль и более предпочтительно от приблизительно 500 до приблизительно 6000 г/моль.
Сумма (x+2y+1) соответствует общему количеству алкилениминных единиц, присутствующих в одном конкретном полиалкилениминном скелете, и, таким образом, напрямую зависит от молекулярной массы полиалкилениминного скелета. Значения, данные в заявке, однако, зависят от среднего количества всех полиалкилениминов, присутствующих в смеси. Сумма (x+2y+2) соответствует общему количеству аминогрупп, присутствующих в одном конкретном полиалкилениминном скелете.
Радикалы А1, связывающие атомы азота аминогруппы могут быть идентичными или различными, линейными или разветвленными С2-С6-алкиленовыми радикалами, такими как 1,2-этилен, 1,2-пропилен, 1,2-бутилен, 1,2-изобутилен, 1,2-пентандиил, 1,2-гександиил или гексаметилен. Предпочтительным разветвленным алкиленом является 1,2-пропилен. Предпочтительными линейными алкиленами являются этилен и гексаметилен. Более предпочтительным алкиленом является 1,2-этилен.
Атомы водорода первичных и вторичных аминогрупп полиалкилениминного скелета заменены на алкиленоксиединицы формулы (V).
В данной формуле, переменные предпочтительно имеют одно из значений, приведенных ниже:
А2 в каждом случае выбран из 1,2-пропилена, 1,2-бутилена и 1,2-изобутилена; предпочтительно А2 является 1,2-пропиленом. А3 является 1,2-пропиленом; R в каждом случае выбран из водорода и С1-С4-алкила, такого как метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил; предпочтительно R является водородом. Индекс m в каждом случае имеет значение от 0 до приблизительно 2; предпочтительно m означает 0 или приблизительно 1; более предпочтительно m означает 0. n имеет среднее значение в диапазоне от приблизительно 20 до приблизительно 50, предпочтительно в диапазоне от приблизительно 22 до приблизительно 40, и более предпочтительно в диапазоне от приблизительно 24 до приблизительно 30. Индекс р имеет среднее значение в диапазоне от приблизительно 10 до приблизительно 50, предпочтительно в диапазоне от приблизительно 11 до приблизительно 40, и более предпочтительно в диапазоне от приблизительно 12 до приблизительно 30.
Предпочтительно, алкиленоксиединица формулы (V) представляет собой непроизвольную последовательность алкоксилированных блоков. Под непроизвольной последовательностью понимают, что [-А2-O-]m добавляют первым (то есть, самый близкий к связи с атомом азота повторяющейся единицы формулы (I), (II) или (III)), [-CH2-СН2-O-]n добавляют вторым, и [-А3-O-]p добавляют третьим. Данная ориентация предусматривает алкоксилированный полиалкиленимин с внутренним полиэтиленоксидным блоком и внешним полипропиленоксидным блоком.
Субстанциальная часть данных алкиленоксиединиц формулы (V) образуется с помощью этиленоксиединиц -[CH2-CH2-O)]n- и пропиленоксиединиц -[CH2-СН2(CH3)-O]p-. Алкиленоксиединицы также могут дополнительно иметь небольшой процент пропиленокси или бутиленоксиединиц -[А2-O]m-, то есть полиалкилениминный скелет, насыщенный атомами водорода, может реагировать на начальной стадии с небольшими количествами до приблизительно 2 молей, главным образом, от приблизительно 0,5 до приблизительно 1,5 моль, в частности от приблизительно 0,8 до приблизительно 1,2 моль, пропиленоксида или бутиленоксида на моль присутствующих NH-фрагментов, то есть начально алкоксилированный.
Данная начальная модификация полиалкилениминного скелета позволяет, если необходимо, понизить вязкость реакционной смеси при алкоксилировании. Однако, модификация, как правило, не влияет на свойства эффективности алкоксилированного полиалкиленимина и вследствие этого не создают предпочтительного критерия.
Амфифильные алкоксилированные чистящие жир полимеры присутствуют в продуктах по уходу за тканями и домом, включая, но не ограничиваясь этим, моющие средства в соответствии с настоящим изобретением на уровнях в диапазоне от приблизительно 0,05% до 10% по массе продукта по уходу за тканями и домом. Варианты осуществления продуктов по уходу за тканями и домом могут содержать от приблизительно 0,1% до приблизительно 5% по массе. Более конкретно, варианты осуществления могут содержать от приблизительно 0,25 до приблизительно 2,5% чистящего жир полимера.
Карбоксилатный полимер - Потребительские продукты в соответствии с настоящим изобретением также могут включать один или больше карбоксилатных полимеров, таких как малеатный/акрилатный произвольный сополимер или полиакрилатный гомополимер. В одном аспекте, карбоксилатный полимер представляет собой полиакрилатный гомополимер, имеющий молекулярную массу от 4000 Да до 9000 Да, или от 6000 Да до 9000 Да.
Высвобождающий загрязнение полимер - Потребительские продукты в соответствии с настоящим изобретением также могут включать один или больше высвобождающих загрязнение полимеров, имеющих структуру, как определено в одной из следующих структур (I), (II) или (III):
(I) -[(OCHR1-CHR2)a-O-OC-Ar-CO-]d
(II) -[(OCHR3-CHR4)b-O-OC-sAr-CO-]e
(III) -[(OCHR5-CHR6)c-OR7]f
где:
a, b и с означают от 1 до 200;
d, е и f означают от 1 до 50;
Ar является 1,4-замещенным фениленом;
sAr является 1,3-замещенным фениленом, замещенным в положении 5 SO3Me;
Me является Li, K, Mg/2, Ca/2, Al/3, аммонием, моно-, ди-, три- или тетраалкиламмонием, где алкильные группы являются C1-C18 алкилом или С2-С10 гидроксиалкилом, или их смесями;
R1, R2, R3, R4, R5 и R6 независимо выбраны из H или С1-С18 н- или изо-алкила; и
R7 является линейным или разветвленным С1-C18 алкилом, или линейным или разветвленным С2-С30 алкенилом, или циклоалкильной группой с 5-9 атомами углерода, или C8-С30 арильной группой, или С6-С30 арилалкильной группой.
Приемлемые высвобождающие загрязнение полимеры представляют собой сложные полиэфирные высвобождающие загрязнение полимеры, такие как Repel-o-tex полимеры, включая Repel-o-tex SF, SF-2 и SRP6, поставляемые компанией Rhodia. Другие приемлемые, высвобождающие загрязнение полимеры включают Texcare полимеры, включая Texcare SRA100, SRA300, SRN100, SRN170, SRN240, SRN300 и SRN325, поставляемые компанией Clariant. Другие приемлемые, высвобождающие загрязнение полимеры являются Marloquest полимерами, такими как Marloquest SL, поставляемые компанией Sasol.
Целлюлозный полимер - Потребительские продукты в соответствии с настоящим изобретением также могут включать один или больше целлюлозных полимеров, включая те, которые выбраны из алкилцеллюлозы, алкилалкоксиалкилцеллюлозы, карбоксиалкилцеллюлозы, алкилкарбоксиалкилцеллюлозы. В одном аспекте, целлюлозные полимеры выбраны из группы, которая включает карбоксиметилцеллюлозу, метилцеллюлозу, метилгидроксиэтилцеллюлозу, метилкарбоксиметилцеллюлозу и их смеси. В одном аспекте, карбоксиметилцеллюлоза имеет степень карбоксиметильного замещения от 0,5 до 0,9 и молекулярную массу от 100000 Да до 300000 Да.
Моющее средство может содержать отбеливающую систему, которая может содержать источник Н2О2, такой как перборат или перкарбонат, который может находиться в комбинации с активатором отбеливателя, образующим перкислоту, таким как тетраацетилэтилендиамин или нонаноилоксибензолсульфонат.Альтернативно, отбеливающая система может содержать пероксикислоты, например, амидного, имидного или сульфонового типа. В основном, когда используют отбеливающий агент, то композиции в соответствии с настоящим изобретением могут содержать от приблизительно 0,1% до приблизительно 50% или даже от приблизительно 0,1% до приблизительно 25% отбеливающего агента по массе данной чистящей композиции.
Хелатирующие агенты - Потребительские продукты в данной заявке могут содержать хелатирующий агент. Приемлемые хелатирующие агенты включают хелатирующие агенты на основе меди, железа и/или магния и их смеси. Когда используют хелатирующий агент, потребительский продукт в соответствии с изобретением может содержать от приблизительно 0,005% до приблизительно 15% или даже от приблизительно 3,0% до приблизительно 10% хелатирующего агента по массе потребительского продукта в соответствии с изобретением. Приемлемые хелатирующие агенты включают DTPA (диэтилентриаминпентауксусная кислота), HEDP (гидроксиэтандифосфоновая кислота), DTPMP (диэтилентриаминпента(метиленфосфоновая кислота)), гидрат динатриевой соли 1,2-дигидроксибензол-3,5-дисульфоновой кислоты, этилендиамин, диэтилентриамин, этилендиаминдиянтарная кислота (EDDS), N-гидроксиэтилэтилендиаминтриуксусная кислота (HEDTA), триэтилентетраамингексауксусная кислота (ΤΤHΑ), N-гидроксиэтилиминодиуксусная кислота (HEIDA), дигидроксиэтилглицин (DHEG), этилендиаминтетрапропионовая кислота (EDTP) и их производные.
Варианты фермента в соответствии с изобретением могут быть стабилизированы, используя традиционные стабилизирующие агенты, и/или ингибиторы протеазы, например, полиол, такой как пропиленгликоль или глицерин, сахар или сахароспирт, соли, такие как хлорид натрия и хлорид калия, молочная кислота, муравьиная кислота, борная кислота или производное борной кислоты, например, ароматический сложный эфир бороновой кислоты, или производное фенилбороновой кислоты, такое как 4-формилфенилбороновая кислота, или пептидный альдегид, такой как ди-, три- или тетрапептидальдегиды или аналоги альдегида (или формы B1-B0-R, где R является H, СН3, СХ3, СНХ2 или СН2Х (Х=галоген), В0 является единичным аминокислотным остатком (предпочтительно, необязательно, с замещенной алифатической или ароматической боковой цепью); и В1 состоит из одного или больше аминокислотных остатков (предпочтительно одного, двух или трех), необязательно содержащих N-терминальную защитную группу, или как описано в WO 09118375, WO 98/13459) или ингибитор протеазы белкового типа, такой как RASI, BASI, WASI (бифункциональные альфа-амилазные/субтилизиновые ингибиторы из риса, ячменя и пшеницы) или CI2 или SSI. Композиция может быть сформулированной, как описано, например, в WO 92/19709 и WO 92/19708 или US 6472364. В некоторых вариантах осуществления, ферменты, используемые в данной заявке, стабилизируют присутствием водорастворимых источников ионов цинка (II), кальция (II) и/или магния (II) в конечных композициях, которые обеспечивают такие ионы с ферментами, а также другие ионы металлов (например, бария (II), скандия (II), железа (II), марганца (II), алюминия (III), олова (II), кобальта (II), меди (II), никеля (II) и оксованадила (IV)).
Композиция также может содержать другие традиционные ингредиенты моющего средства, такие как, например, кондиционеры для ткани, включая глины, усилители пены, пеногасители, противокоррозионные агенты, суспендирующие загрязнение агенты, агенты против повторного осаждения загрязнений, красители, бактерицидные вещества, оптические отбеливатели, гидротропы, ингибиторы потускнения, органические растворители, такие как этанол, или отдушки. Более того, моющее средство может содержать предварительный пятновыводитель или вспомогательное средство, который добавляют при стирке, чтобы увеличить общий уровень очистки, некоторые из данных добавок также могут использовать как агент для предварительной обработки, который применяют для текстиля перед стадией стирки.
В настоящее время предполагается, что в композиции моющего средства любой фермент, в частности, фермент в соответствии с изобретением, может быть добавлен в количестве, соответствующем 0,001-100 мг ферментного белка на литр моющего раствора, предпочтительно 0,005-5 мг ферментного белка на литр моющего раствора, более предпочтительно, 0,01-1 мг ферментного белка на литр моющего раствора и, в частности 0,1-1 мг ферментного белка на литр моющего раствора. Однако, композиции в соответствии с настоящим изобретением содержат, по меньшей мере, от 0,0001 до приблизительно 0,1% массового процента чистого ферментного белка, как например от приблизительно 0,0001% до приблизительно 0,01%, от приблизительно 0,001% до приблизительно 0,01% или от приблизительно 0,001% до приблизительно 0,01%. Однако, когда используется сформулированный фермент, композиция моющего средства содержит от приблизительно 0,02% до приблизительно 20% массовых процентов, как например или от приблизительно 0,05% до приблизительно 15% мае, или от приблизительно 0,05 до приблизительно 20%, или от приблизительно 0,05% до приблизительно 5%, или от приблизительно 0,05% до приблизительно 3%.
Варианты альфа-амилазы, полезные в настоящем изобретении, могут дополнительно вводиться в составы моющего средства, раскрытые в WO 97/07202, который включен в данную заявку путем ссылки.
Композиция моющего средства в соответствии с изобретением может находиться в любой общепринятой форме, например, куска, таблетки, порошка, гранулы, пасты, геля или жидкости. Композиция может быть порошковой формой многоцелевого «высокопроизводительного» моющего агента, многоцелевой пастообразной формой, высокопроизводительным жидким типом, жидкостью для тонких тканей, моющим агентом для мытья посуды вручную, облегченным моющим агентом для мытья посуды, типом с высоким пенообразованием, моющим агентом для машинного мытья посуды, различной таблеткой, гранулированным средством для мытья посуды, жидкостью для мытья посуды, ополаскивателем. Композиция также может быть в единичных дозированных упаковках, включая те, которые известны из уровня техники, и те, которые являются водорастворимыми, нерастворимыми в воде и/или водопроницаемыми. Жидкое моющее средство может быть водным, как правило, содержащим до 70% воды и 0-30% органического растворителя, или неводным или раствором, содержащим больше, чем 0,5 г/л моющего средства композиции.
Композиция согласно изобретению, например, может быть сформулирована в виде композиции моющего средства для ручной или машинной стирки белья, включая композицию с добавками для стирки белья, приемлемую для предварительной обработки тканей с пятнами, и композицию с добавленным для полоскания смягчителем ткани, или может быть сформулирована в виде композиция моющего средства для использования в основном в домашнем хозяйстве для операций очистки твердой поверхности, или может быть сформулирована для операций ручного или машинного мытья посуды. Моющее средство может быть порошком или гранулированной формой, или оно может быть в форме жидкости, геля или пасты, или в форме единичного дозированного продукта, такого как таблетка или пакетик, включая пакетики с несколькими отделениями, или моющее средство может быть в форме салфетки.
ПРИМЕРЫ
PNP-G7 анализ для определения активности альфа-амилазы
Активность альфа-амилазы может быть определена с помощью способа, в котором используют G7-pNP субстрат.G7-pNP, который является сокращением для 4,6-этилиден(G7)-n-нитрофенил(G1)-α,D-мальтогептаозида, блокированный олигосахарид, который может быть расщеплен эндо-амилазой, такой как альфа-амилаза. После расщепления альфа-глюкозидазу, включенная в набор, перерабатывает гидролизованный субстрат, кроме того, с высвобождением свободной ΡΝΡ молекулы, которая имеет желтый цвет, и, таким образом, может быть измерена с помощью спектрофотометрии видимой части спектра при λ=405 нм (400-420 нм.). Наборы, содержащие G7-pNP субстрат и альфа-глюкозидазу, производятся компанией Roche/Hitachi (кат. №11876473).
РЕАГЕНТЫ:
G7-pNP субстрат из данного набора содержит 22 мМ 4,6-этилиден-G7-pNP и 52,4 мМ HEPES (2-[4-(2-гидроксиэтил)-1-пиперазинил]-этансульфоновой кислоты), pH 7,0).
Альфа-глюкозидазный реагент содержит 52,4 мМ HEPES, 87 мМ NaCl, 12,6 мМ MgCl2,0,075 мМ CaCl2, ≥4 кЕд/л альфа-глюкозидазы).
Рабочий раствор субстрата готовят путем смешивания 1 мл альфа-глюкозидазного реагента с 0,2 мл G7-pNP субстрата. Данный рабочий раствор субстрата готовят непосредственно перед использованием.
Буфер разбавления: 50 мМ MOPS, 0,05% (мас./об.) Triton X100 (полиэтиленгликоль n-(1,1,3,3-тетраметилбутил)фенилового простого эфира (C14H22O(C2H4O)n (n=9-10))), 1 мМ CaCl2, pH 8,0.
ПРОЦЕДУРА:
Образец амилазы, который анализируют, разбавляли буфером разбавления, чтобы обеспечить pH в разбавленном образце, равное 7. Анализ выполняли путем переноса 20 мкл образцов разбавленного фермента в 96 лунковый титрационный микропланшет и добавляя 80 мкл рабочего раствора субстрата. Раствор смешивали и предварительно инкубировали 1 минуту при комнатной температуре, и поглощение измеряют каждые 20 секунд в течение 5 минут при OD 405 нм.
Наклон (поглощение на минуту) кривой зависимости поглощения от времени является прямо пропорциональным удельной активности (активность на мг фермента) альфа-амилазы, взятой при заданной совокупности условий. Образец амилазы должен быть разбавленным до уровня, где наклон составляет ниже 0,4 единиц поглощения на минуту.
Автоматический механический стрессовый анализ (AMSA) для стирки
Для того, чтобы оценить моющую эффективность при стирке эксперименты со стиркой выполняют, используя автоматический механический стрессовый анализ (AMSA). С AMSA могут проводить исследование моющей эффективности большого количества растворов небольшого объема ферментного моющего средства. AMSA планшет имеет ряд выемок для исследуемых растворов и крышку, плотно прижимающую образец белья для стирки, где текстиль моют, когда все выемки открыты. Во время мытья, планшет, исследуемые растворы, текстиль и крышку энергично встряхивают, чтобы привести исследуемый раствор в контакт с текстилем, и применяют механический стресс регулярным, периодически вибрирующим способом. Для дополнительного описания смотри WO 02/42740, в частности, параграф «Special method embodiments)) на странице 23-24.
Общее описание моющей эффективности
Готовят исследуемый раствор, содержащий воду (10°dH), моющее средство, например 5,1 г/л Европейского жидкого моющего средства, как описано ниже, и фермент в соответствии с изобретением, например, в концентрации 0, 0,8 и/или 1,2 мг ферментного белка/л. Ткани, запятнанные крахмалом (например, CS-28 из Center For Testmaterials BV, P.O. Box 120, 3133 KT, Vlaardingen, The Netherlands), добавляют и стирают в течение 20 минут при 20°C. После тщательного полоскания в проточной водопроводной воде и сушки в темноте затем измеряют значения интенсивности света или отражения запятнанных тканей, как меру моющей эффективности. Испытание с 0 мг ферментного белка/л используют как холостое определение, чтобы получить дельта значение ремиссии. Предпочтительно, механическое действие применяют на протяжении стадии мытья, например, в форме встряхивания, вращения или перемешивания раствора для мытья с тканями.
Эксперименты по AMSA моющей эффективности проводили при экспериментальных условиях, определенных ниже:

Амилазный буфер разбавления: Амилазу разбавляли в ультрачистой воде (MilliQ вода) с небольшой концентрацией кальция (0,1 мМ), чтобы стабилизировать амилазу во время хранения, и 0,01% Triton Х-100, чтобы снизить риск адсорбции ферментного белка на контейнерах и пипетках.
Жесткость воды регулировали до 10°dH путем добавления CaCl2, MgCl2 и NaHCO3 (Са2+:Mg2+:HCO3-=3:1:4.5) к исследуемой системе. После мытья текстиль промывали сильным напором струи водопроводной воды и сушили.
Моющую эффективность измеряли, как яркость цвета стираного текстиля. Яркость также могут выражать, как интенсивность отражения света от образца, когда освещается белым светом. Когда образец является загрязненным интенсивность отраженного света ниже, чем от чистого образца. Вследствие этого, интенсивность отражаемого света может быть использована для измерения моющей эффективности.
Измерения цвета делают, используя профессиональный планшетный сканер (Kodak iQsmart, Kodak, Midtager 29, DK-2605 BrØndby, Denmark), который используется для улавливания изображения стиранного текстиля.
Для получения значения интенсивности света от отсканированных изображений, 24-битные пиксельные значения от изображения превращают в значения для красного, зеленого и синего (RGB). Значение интенсивности (Int) рассчитывают путем сложения RGB значений вместе как векторы и, потом берут длину результирующего вектора:
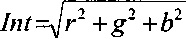 .
.
Текстиль: Образец текстиля CS-28 (рисовый крахмал на хлопке) получают из Center For Testmaterials BV, P.O. Box 120, 3133 KT Vlaardingen, the Netherlands.
Результаты AMSA исследования стирки различных вариантов показаны в Таблице 3. В результате показатель составляет 100. Эффективный результат родительской альфа-амилазы обозначают как значение 100, а результаты вариантов сравнивают с данным значением.
AM SA моющая эффективность
Моющая эффективность вариантов и соответствующих родительских альфа-амилаз исследовали, используя AMSA-тест способ, как описано в разделе Способы. Результаты приведены как (эффективность варианта минус эффективность в холостом определении), деленные на (эффективность предшественника минус эффективность в холостом определении), умноженное на 100, где холостое определение представляет собой эффективность, полученную при стирке в тех самых условиях, но в отсутствие альфа-амилазы. Окончательно, рассчитывали среднее значение относительной эффективности при двух концентрациях 0,8-1,2 мг/л.
Результаты представлены в Таблице 3.
Анализ стирки с использованием терготометра (ТОМ)
Терготометр (ТОМ) представляет собой среднемасштабную модель системы стирки, которая может применяться, чтобы исследовать 12 различных условий стирки одновременно. ТОМ, в основном, представляет собой водяную баню с контролируемой большой температурой с вплоть до 12 открытыми металлическими стаканами, погруженными в нее. Каждый стакан создает одну маленькую стиральную машину с вертикальной загрузкой, и во время эксперимента, каждая из них будет содержать раствор конкретного моющего средства/ферментной системы и загрязненные и незагрязненные ткани, чтобы исследовать их эффективность. Механический стресс достигают с помощью вращающейся лопасти мешалки, которая перемешивает жидкость внутри каждого стакана. Так как ТОМ стаканы не имеют крышку, то является возможным извлекать образцы во время ТОМ эксперимента и проводить анализ для информации в режиме «он-лайн» во время стирки.
ТОМ модель системы стирки, в основном, используют в среднемасштабном исследовании моющих средств и ферментов в US или LA/АР условиях стирки. В ТОМ эксперименте, факторы, такие как соотношение балласта к загрязнению и соотношение ткани к моющему раствору, могут варьировать. Вследствие этого, ТОМ обеспечивает связь между маломасштабными экспериментами, такими как AMSA и мини-стиркой, и больше времени, которое тратиться на полномасштабные эксперименты в стиральных машинах с вертикальной загрузкой.
Оборудование: Водяная баня с 12 стальными стаканами и 1 вращающейся лопастью на стакан вместимостью 500 или 1200 мл раствора моющего средства. Температура находится в диапазоне от 5 до 80°С. Водяная баня должна быть заполнена деионизированной водой. Скорость вращения может быть установлена до от 70 до 120 оборотов/минуту.
ТОМ моющая эффективность
Жесткость воды регулировали по ионной силе, как описано ниже, путем добавления CaCl2, MgCl2 и NaHCO3. Моющие растворы готовили с требуемым количеством моющего средства, температурой и жесткостью воды в емкости, как описано ниже. Моющее средство растворяли во время перемешивания с помощью магнитной мешалки в течение 10 минут (моющий раствор использовали в пределах от 30 до 60 мин после приготовления).
Температура и вращение (оборотов в минуту) в водяной бане в терготометре устанавливали в соответствии с параметрами, представленными ниже. Когда температуру регулировали в соответствии с параметрами (допускаемая величина отклонения составляла +/- 0,5°С) моющий раствор добавляли в ТОМ стакан в соответствии с количеством, описанным ниже.
Перемешивание в стакане проводили при 120 оборотах в минуту. 2 рисовых крахмальных образца (CS-28) и загрязняющий балласт добавляли в каждый из стаканов и стирку проводили в соответствии со временем, установленным ниже. Образцы промывали в холодной водопроводной воде в течение 5 минут. Образцы оставляли высыхать в темноте в течение ночи.
Текстиль: Образец текстиля CS-28 (рисовый крахмал на хлопке) получали из Center for Testmaterials BV, P.O. Box 120, 3133 KT Vlaardingen, the Netherlands.
Загрязняющий балласт: Загрязняющий балласт с рисовым крахмалом на хлопке/полиэфире (ЕМРА 162) получали из Center for Testmaterials BV, P.O. Box 120, 3133 KT Vlaardingen, the Netherlands. Закусочный соус (063KC), Frij шоколадный молочный коктейль, Heinz спагетти (113KC), двойной шоколад Херши (Herseys) получали из Warwick Equest Ltd, Unit 55, Consett Business Park, Consett, County Durham, DH8 6BN UK.
Результаты ТОМ исследования стирки разных вариантов показаны в Таблице 3. В результате показатель составляет 100. Эффективный результат родительской альфа-амилазы (SEQ ID NO:7) обозначают как значение 100 и результаты вариантов сравнивают с данным значением.
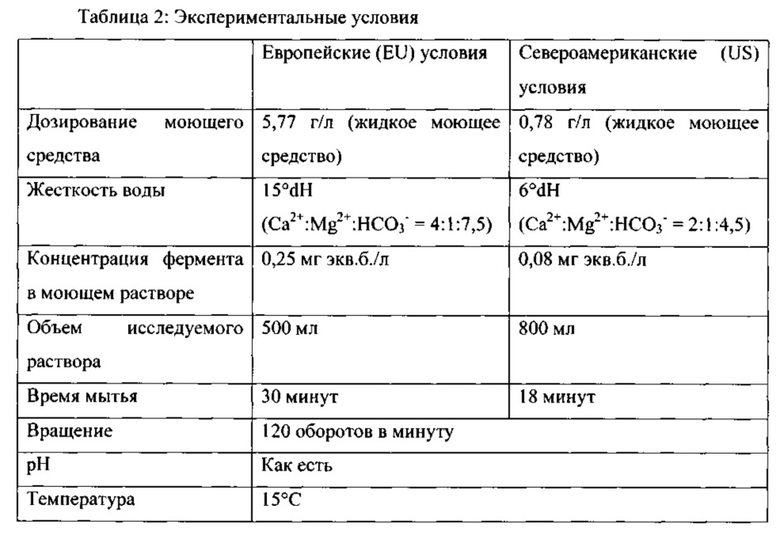
Моющие средства и исследуемые вещества были такими, как представлено ниже
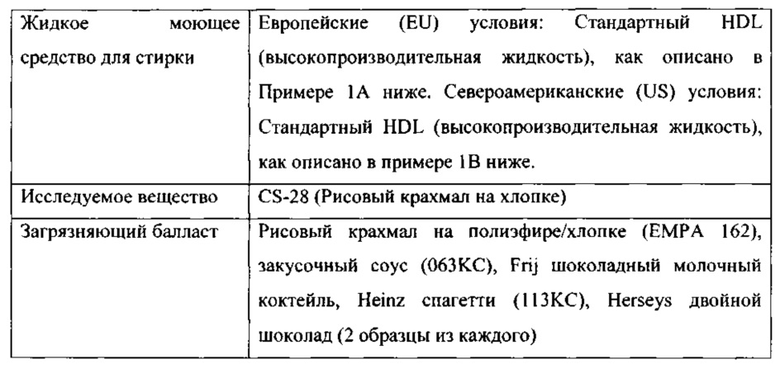
Моющую эффективность измеряли как яркость цвета выстиранного текстиля, выраженную в значениях ремиссии. Измерения ремиссии делали, используя Macbeth 7000 Color Eye спектрофотометр. Измеряли каждый из сухих образцов. Так как существует риск интерференции от фона, образцы располагали на вершине 4 слоев ткани во время измерения ремиссии. Ремиссию измеряли при 460 нм. УФ фильтр не включали. Рассчитывали средний результат для ремиссии образцов.
ПРИМЕР 1
Моющая эффективность альфа-амилаз в Европейском (EU) (Пример 1А) и Североамериканском (Пример 1B) (US) жидком моющем средстве
Моющую эффективность исследуемого варианта и соответствующей родительской альфа-амилазы (SEQ ID NO: 7) исследовали, как описано выше. Результаты представлены как (эффективность варианта минус эффективность в холостом определении), деленная на (эффективность предшественника минус эффективность в холостом определении), умноженная на 100, где холостое определение представляет собой эффективность, полученную при стирке в тех самых условиях, но в отсутствие альфа-амилазы.
Пример 1А: Европейская высокопроизводительная жидкая композиция моющего средства для стирки

Пример 1В: Североамериканская высокопроизводительная жидкая композиция моющего средства для стирки
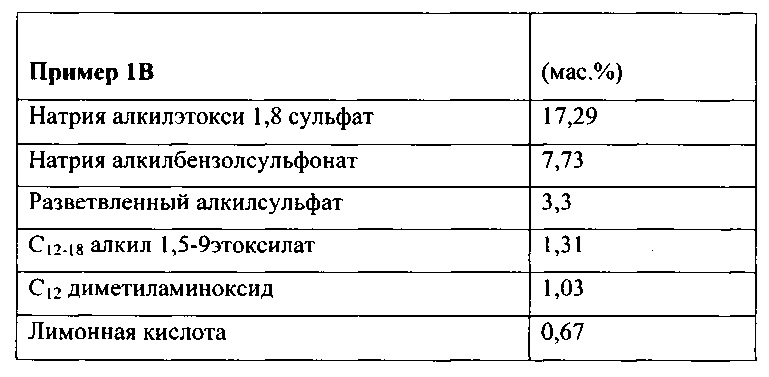

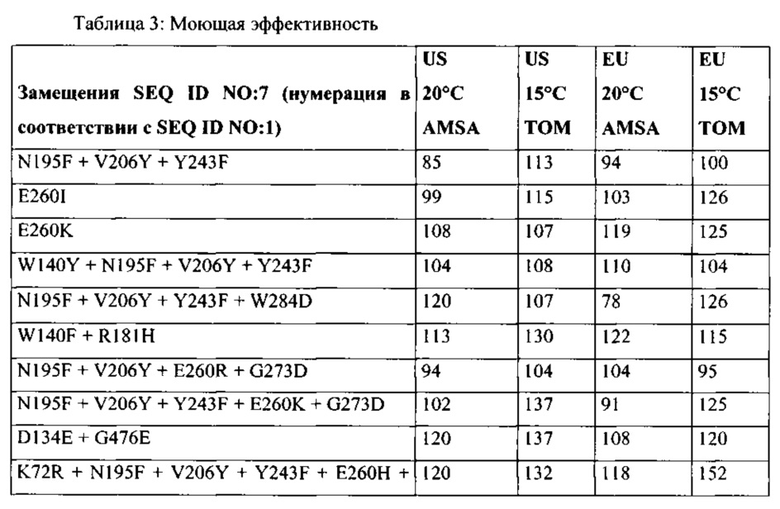
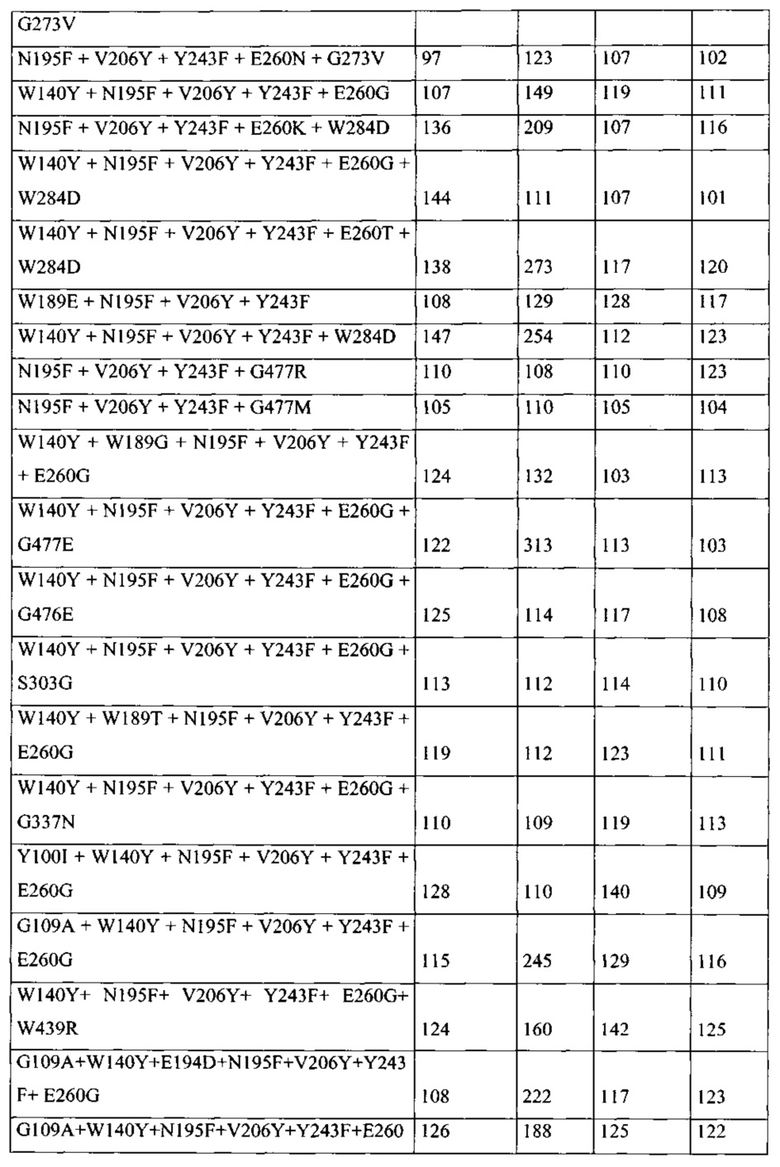
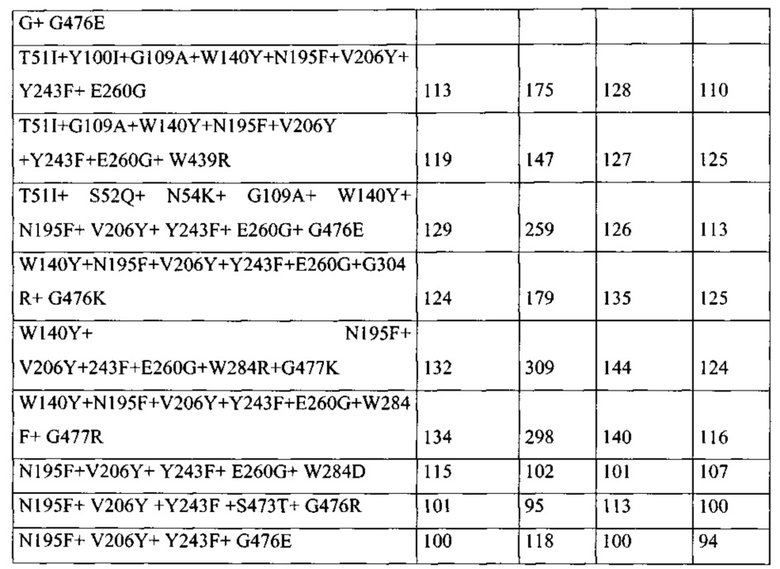
Результаты исследования моющей эффективности ясно демонстрируют, что эффективности вариантов являются улучшенными по отношению к их соответствующей исходной молекуле (SEQ ID NO 7) при исследуемых температурах.
ПРИМЕР 2
Оценка эффективности амилазных вариантов в жидком моющем средстве в полномасштабной стиральной машине
I. Приготовления исследуемых композиций моющего средства
В данном эксперименте четыре исследуемые композиции готовили на основе жидкого моющего средства Состава 2А. Основу моющего средства готовили из Состава 2А, которой не содержит ферменты и имеет конечный pH 8,2.
Пример 20 Высокопроизводительная жидкая композиция моющего средства для стирки
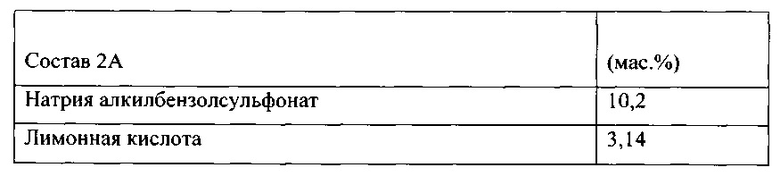
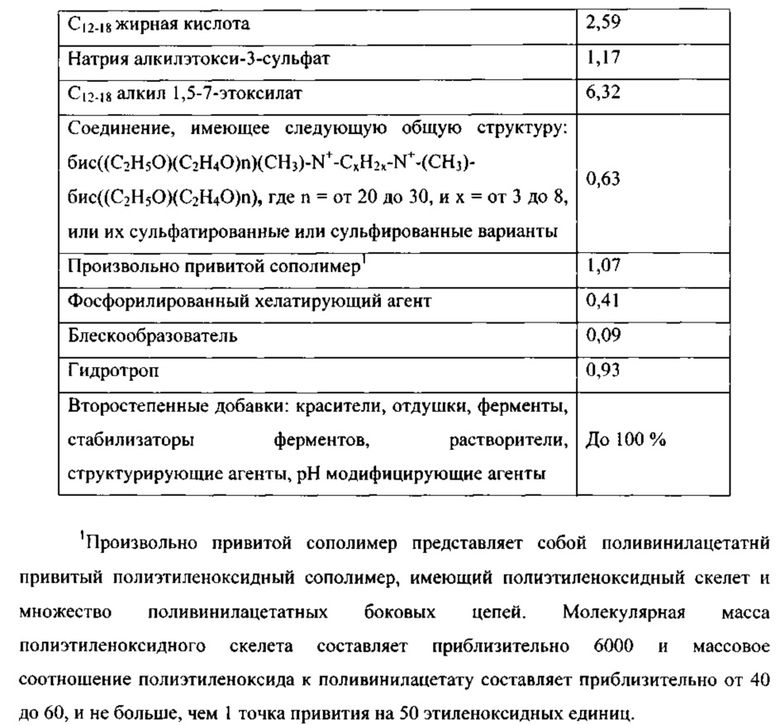
Готовили следующие семь составов моющего средства:
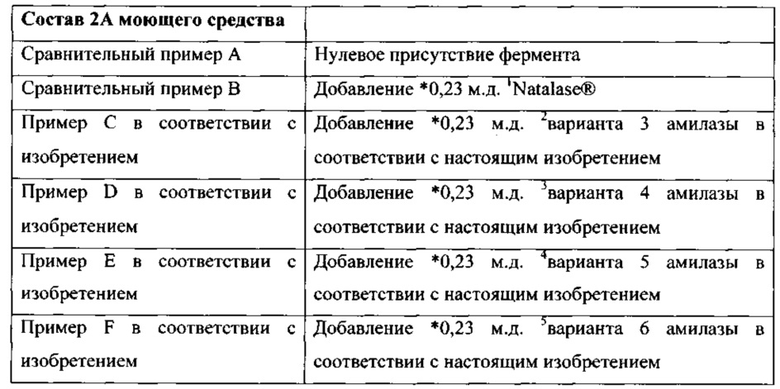

II. Исследуемые ткани
Три пятна, чувствительных к амилазе; PCS-28 рисовый крахмал, С3-128 застарелый рисовый крахмал и CS-26 кукурузный крахмал 5 см × 5 см (поставляемые Centre For Test materials, Netherlands) ставили на 20 см × 20 см белый хлопчатобумажный трикотаж (поставляемый Warwick Equest, Durham, United Kingdom). Два пятна, чувствительных к амилазе; Мясо в остром соусе с красным перцем и фасолью и Heinz спагетти, 2,5 см в диаметре ставили на 20 см × 20 см белый хлопчатобумажный трикотаж (поставляемый Warwick Equest, Durham, United Kingdom). Для каждого исследуемого состава использовали восемь повторений (по 2 повторения на 4 разных машинах).

III. Процедура исследования стирки
Способ включает использование западно-европейских стиральных машин Hotpoint, модели Aquarius WF541. Исследуемые составы, как описано выше, использовали для отстирывания пятен, чувствительных к амилазе, с добавлением смешанных загрязнений и чистого балласта, которые загружали, как описано выше.
Стиральные машины, содержащие 6 г/л исследуемого состава, 13 л воды с жесткостью 10° по Кларку, плюс исследуемые ткани и балласт, осуществляли стирку при 15°С на быстром цикле стирки хлопка длительностью 1 час и 15 минут. После стирки исследуемые ткани сушили в расправленном виде в помещении.
Процесс стирки повторяли, дополнительно, 3 цикла стирки.
Индекс удаления пятна (SRI) (который измеряли путем сравнения нестиранного со стиранным L* a* b* значениями) затем измеряли для того, чтобы количественно определить эффективность удаление пятна композициями моющего средства.
Индекс эффективности, кроме того, измеряли, используя расчет (эффективность из примера C, D, E, F или G минус эффективность сравнительного примера А), деленная на (эффективность сравнительного примера В минус эффективность сравнительного примера А), умноженная на 100.
IV. Сравнение образцов.
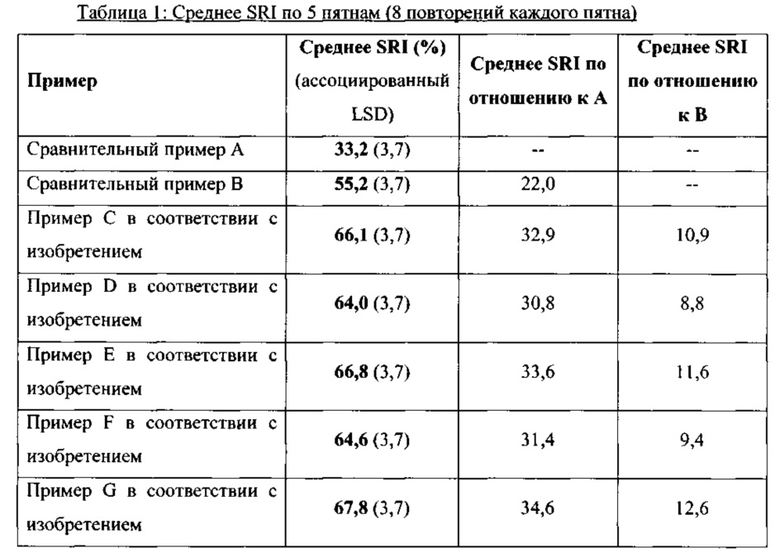


При сравнении образцов, которые стирали композицией из примера А (нулевое присутствие фермента) с композицией из примера В (содержащим Natalase), C, D, E, F и G (содержащим вариант 3, 4, 5, 6 и 7, соответственно), наблюдается, что эффективность удаления пятна улучшается при добавлении амилазного фермента.
При сравнении образцов, которые стирали композицией из примера В (содержащей Natalase) с примерами C, D, E, F и G (содержащими вариант 3, 4, 5, 6 и 7, соответственно) в соответствии с примером А, как эталонным (нулевое присутствие фермента), наблюдается, что варианты 3, 4, 5, 6 и 7 согласно изобретению способны достигать значительно более высоких уровней удаления пятен, чем Natalase®.
ПРИМЕР 3
Оценка эффективности амилазных вариантов в жидком моющем средстве в полномасштабной стиральной машине.
I. Приготовления исследуемых композиций моющего средства
В данном эксперименте четыре исследуемые композиции готовили на основе жидкого моющего средства Состава 3А. Основу моющего средства готовили из Состава 3А, которой не содержит ферменты и имеет конечный pH 8.2.
Состав 3А. Высокопроизводительная жидкая композиция моющего средства для стирки


Готовили следующие шесть составов моющего средства:

II. Исследуемые ткани
Три пятна, чувствительных к амилазе; PCS-28 рисовый крахмал, PS-28 рисовый крахмал и CS-29 крахмал из тапиоки 5 см × 5 см (поставляемые Centre For Test materials, Netherlands) ставили на 20 см × 20 см белый хлопчатобумажный трикотаж (поставляемый Warwick Equest, Durham, United Kingdom). Одно пятно, чувствительное к амилазе; Heinz спагетти, 2,5 см в диаметре ставили на 20 см × 20 см белый хлопчатобумажный трикотаж (поставляемый Warwick Equest, Durham, United Kingdom). Одно пятно, чувствительное к амилазе; соус-подлива 2,5 см в диаметре ставили на 25 см × 24 см белый хлопчатобумажный трикотаж (поставляемый Accurate Product Development, Fairfield, Ohio, USA). Для каждого исследуемого состава использовали восемь повторений (по 2 повторения на 4 разных машинах).


(III) Процедура исследования стирки
Способ включает использование североамериканской стиральной машины Kenmore, модели серии 600. Исследуемые составы, как описано выше, использовали для отмывания пятен, чувствительных к амилазе, с добавлением смешанных загрязнений и чистого балласта, которые загружали, как описано выше.
Стиральные машины, содержащие 0,78 г/л исследуемого состава, 64 л воды с жесткостью 6° по Кларку, плюс исследуемые ткани и балласт, стирали при 15°С на 12 минутном цикле суперстирки с одним полосканием. После стирки исследуемые ткани сушили в расправленном виде в помещении. Процесс стирки повторяли, дополнительно, 3 цикла стирки.
Индекс удаления пятна (SRI) (который измеряли путем сравнения нестиранного со стиранным L* a* b* значениями) затем измеряли для того, чтобы количественно определить эффективность удаление пятна композициями моющего средства.
Индекс эффективности, кроме того, измеряли, используя расчет (эффективность из примера С, D, Е или F минус эффективность сравнительного примера А), деленная на (эффективность сравнительного примера В минус эффективность сравнительного примера А), умноженная на 100.
(IV). Сравнение образцов.
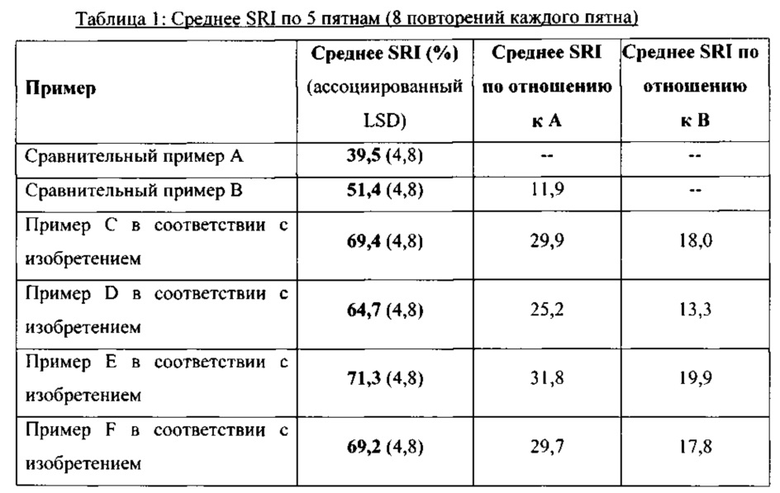
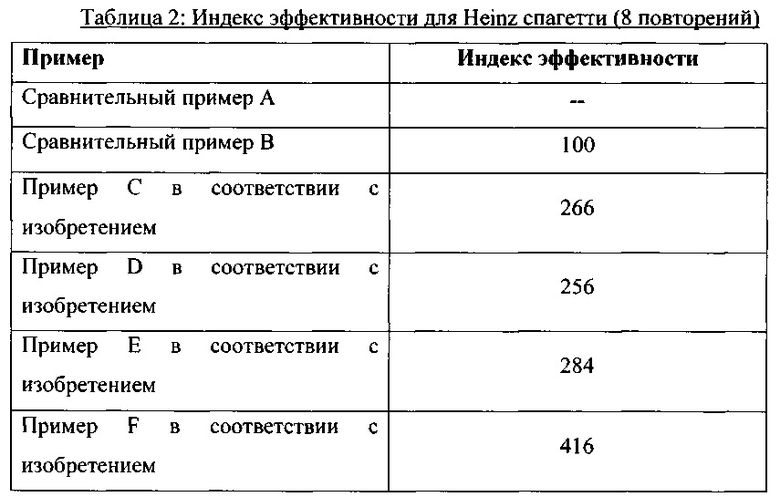
При сравнении образцов, которые стирали композицией из примера А (нулевое присутствие фермента) с примером В (содержащим Natalase), С, D, Е и F (содержащим вариант 5, 6, 7 и 8, соответственно), наблюдается, что эффективность удаления пятна улучшается при добавлении амилазного фермента.
При сравнении образцов, которые стирали с композицией из примера B (содержащей Natalase) с примерами C, D, E и F (содержащими вариант 5, 6, 7 и 8 соответственно) в соответствии с примером А, как эталонным (нулевое присутствие фермента), наблюдается, что варианты 5, 6, 7 и 8 согласно изобретению способны достигать значительно более высоких уровней удаления пятен, чем Natalase®.
Изобретение, описанное и заявленное в данной заявке, не ограничивается в объеме, определенном аспектами, раскрытыми в данной заявке, так как данные аспекты предназначены как иллюстрации нескольких аспектов изобретения. Имеется в виду, что любые эквивалентные аспекты находятся в пределах объема настоящего изобретения. Безусловно, различные модификации изобретения в дополнение к тем, что показаны и описаны в данной заявке будут очевидными для специалиста в данной области техники из вышеизложенного описания. Кроме того, имеется в виду, что такие модификации попадают в пределы объема прилагаемой формулы изобретения. В случае конфликта, представленное раскрытие, включая определеня, будут контролироваться.
Способ использования
Настоящее изобретение включает способ очистки и/или обработки участка, в частности, поверхности или ткани. В одном аспекте, такой способ включает стадии, необязательно, стирки и/или промывания указанной поверхности или ткани, на которых указанную поверхность или ткань вводят в контакт с любым потребительским продуктом, раскрытым в данном описании, потом, необязательно, стирка и/или промывание указанной поверхности или ткани являются раскрытыми.
Как используется в данной заявке, стирка включает, но не ограничивается этим, стирку и механическое перемешивание. Сушка таких поверхностей или тканей может быть выполнена путем любого одного из обычных способов, используемых или в домашних или в промышленных условиях. Такие средства включают, но не ограничиваются этим, продувочный воздух или еще сушку на воздухе при температуре окружающей среды или повышенных температурах при давлении от 5 до 0,01 атмосфер в присутствии или в отсутствие электромагнитного излучения, в том числе солнечного света, инфракрасного, ультрафиолетового и микроволнового излучения. В одном аспекте, указанная сушка может быть выполнена при температурах выше температуры окружающей среды, используя утюг, при этом, например, указанная ткань может находиться в непосредственном контакте с указанным утюгом в течение относительно коротких или даже продолжительных периодов времени, и при этом давление может оказаться выше того, которое в противном случае обычно присутствует из-за силы тяжести. В другом аспекте указанная сушка может быть выполнена при температурах выше температуры окружающей среды, используя сушильную машину. Аппарат для сушки ткани хорошо известен, и часто упоминается, как сушильная машина для одежды. В дополнение к одежде такую бытовую технику используются для сушки многих других предметов, включая полотенца, простыни, наволочки, пеленки и т.д., и такое оборудование было принято как стандартное устройство во многих стран мира, существенно заменяющее использование веревок для сушки одежды и тканей. Большинство сушильных машин, используемых сегодня, используют нагретый воздух, который проходит над и/или через ткань, при этом в сушильной машине их перемешивают с переворачиванием. Воздух может быть нагретым, например, или электронным образом, с помощью газового пламени, или даже микроволновым излучением. Такой воздух может быть нагрет от приблизительно 15°С до приблизительно 400°С, от приблизительно 25°С до приблизительно 200°С, от приблизительно 35°С до приблизительно 100°С или даже от приблизительно 40°С до приблизительно 85°С и может использоваться в сушильной машине для того, чтобы высушить поверхность и/или ткань. Также специалистом в данной области техники будет оценено, что чистящие композиции в соответствии с настоящим изобретением идеально подходят для использования при стирке. Соответственно, настоящее изобретение включает способ стирки ткани. Способ включает стадии, на которых вводят в контакт ткань, которую подвергают стирке, с указанным чистящим раствором для стирки, содержащим, по меньшей мере, один вариант осуществления чистящей композиции, чистящую добавку или их смесь в соответствии с изобретением. Ткань может содержать большинство любых тканей, способных быть постиранными в обычных потребительских или промышленных условиях использования. Раствор предпочтительно имеет pH от приблизительно 8 до приблизительно 10,5. Композиции могут применять в концентрациях от приблизительно 500 м.д. до приблизительно 15000 м.д. в растворе. Температуры воды, как правило, находятся в диапазоне от приблизительно 5°С до приблизительно 90°С. Соотношение вода: ткань, как правило, составляет от приблизительно 1:1 до приблизительно 30:1.
ПРИМЕРЫ МОЮЩИХ СРЕДСТВ
Примеры 1-6
Гранулированные композиции моющего средства для стирки, созданные для ручной стирки или для стиральных машин с вертикальной загрузкой.
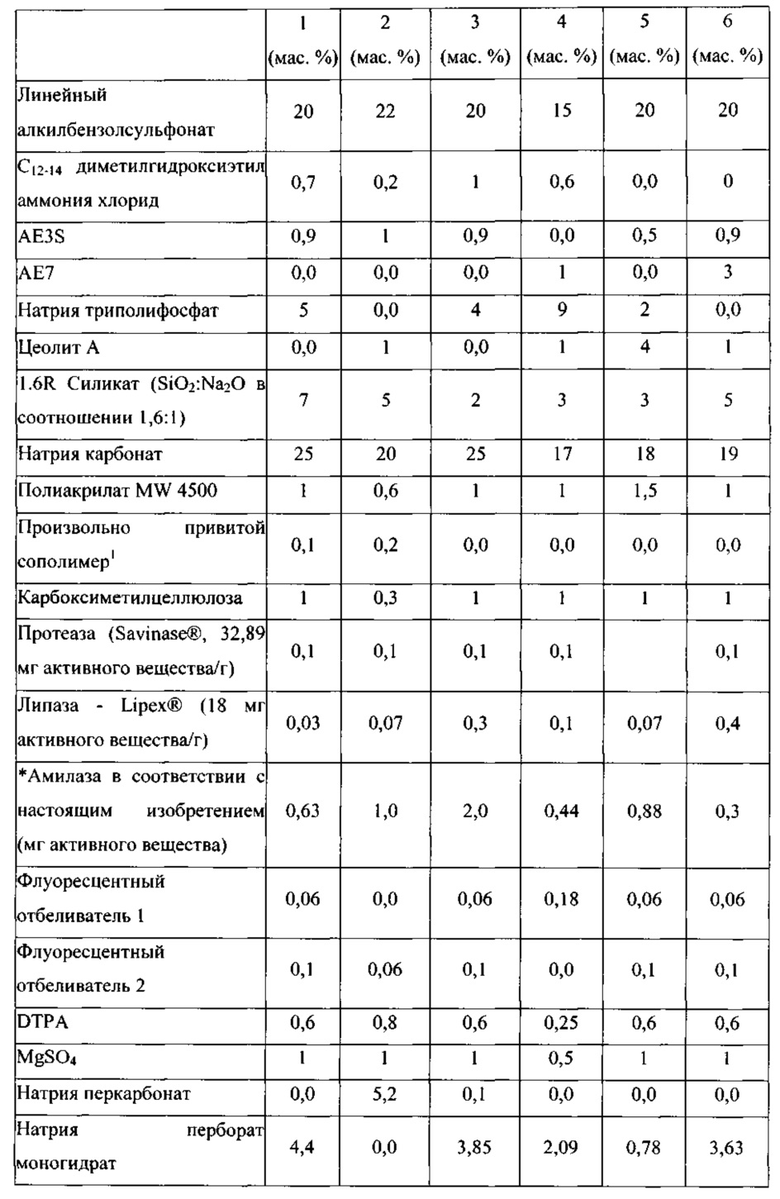
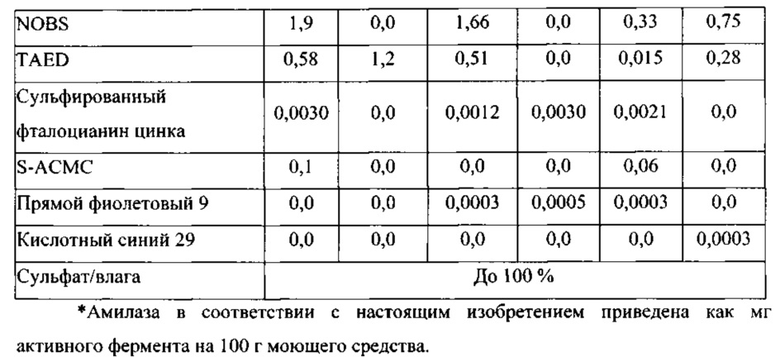
Примеры 7-12
Гранулированные композиции моющего средства для стирки, созданные для автоматических стиральных машин с фронтальной загрузкой.
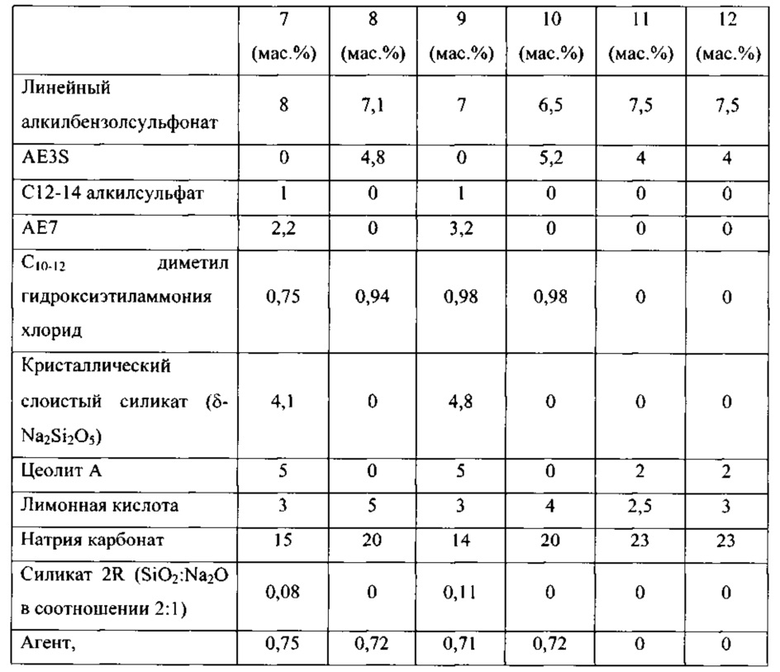
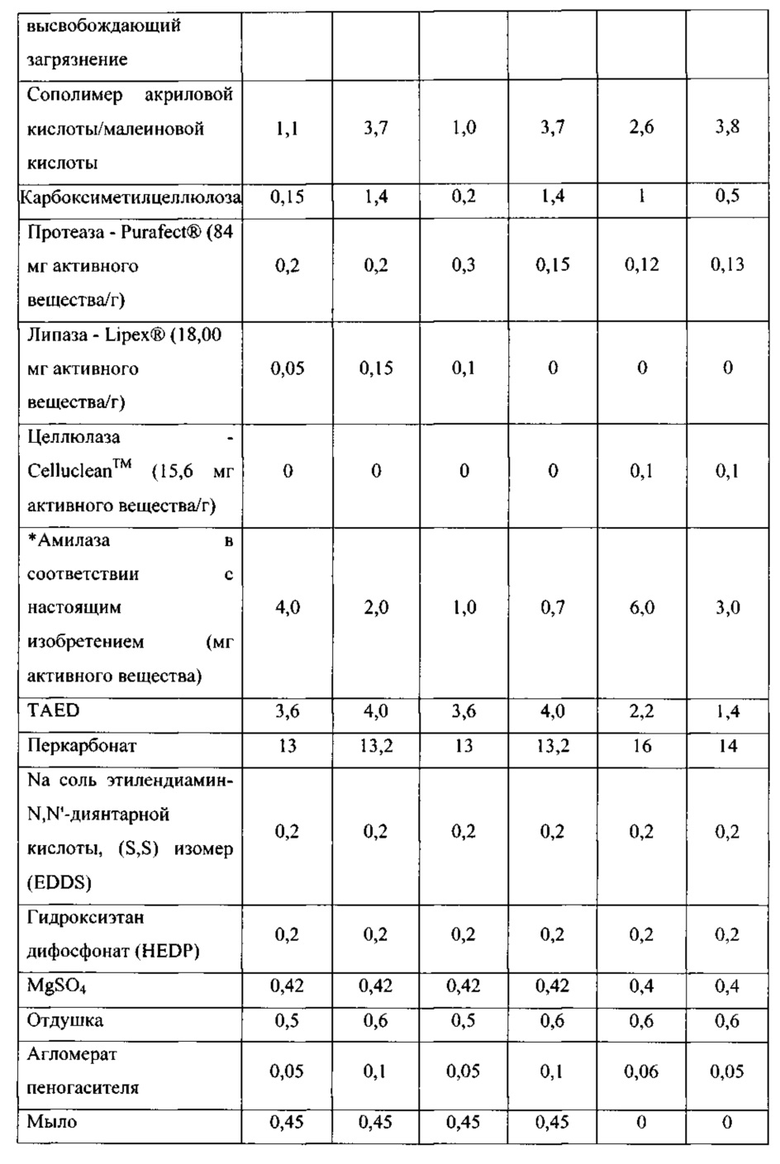
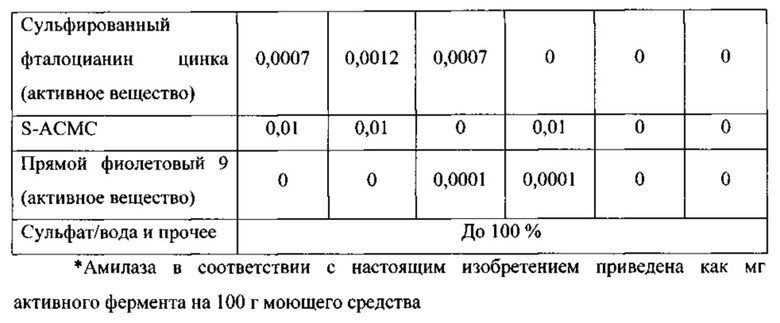
Примеры 13-18
Высокопроизводительные жидкие композиции моющего средства для стирки
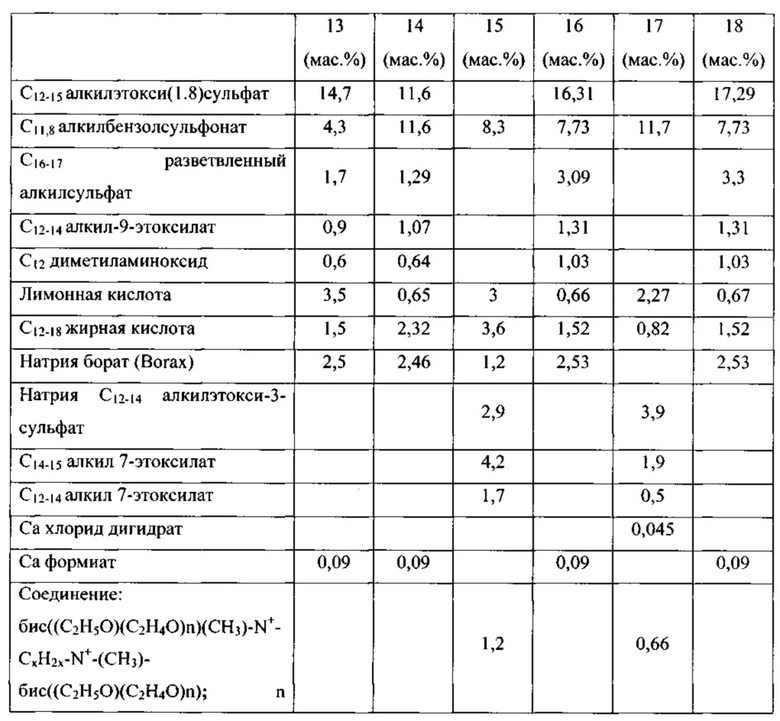
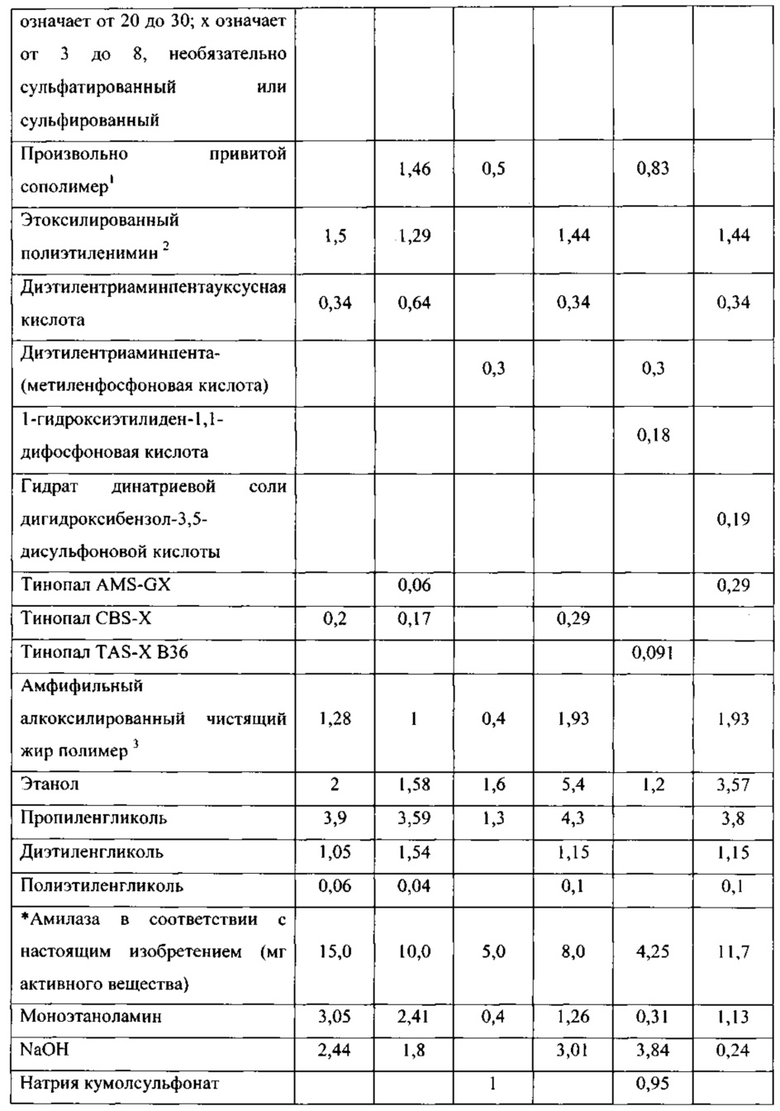
Примеры 19-21
Высокопроизводительная жидкая композиция моющего средства для стирки
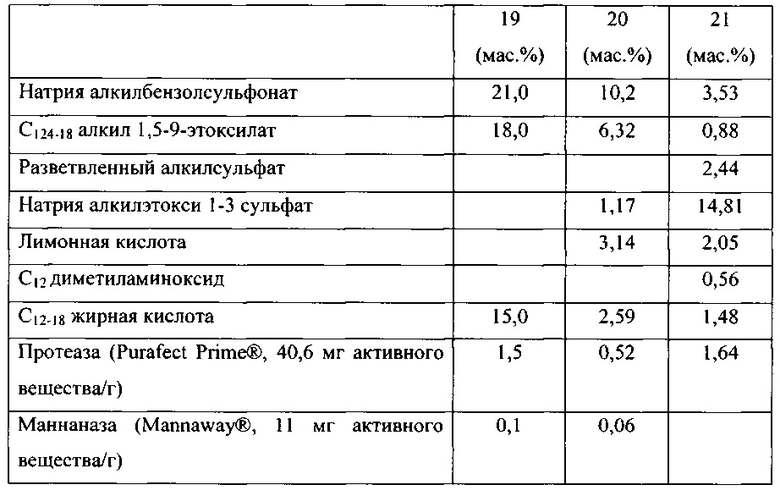
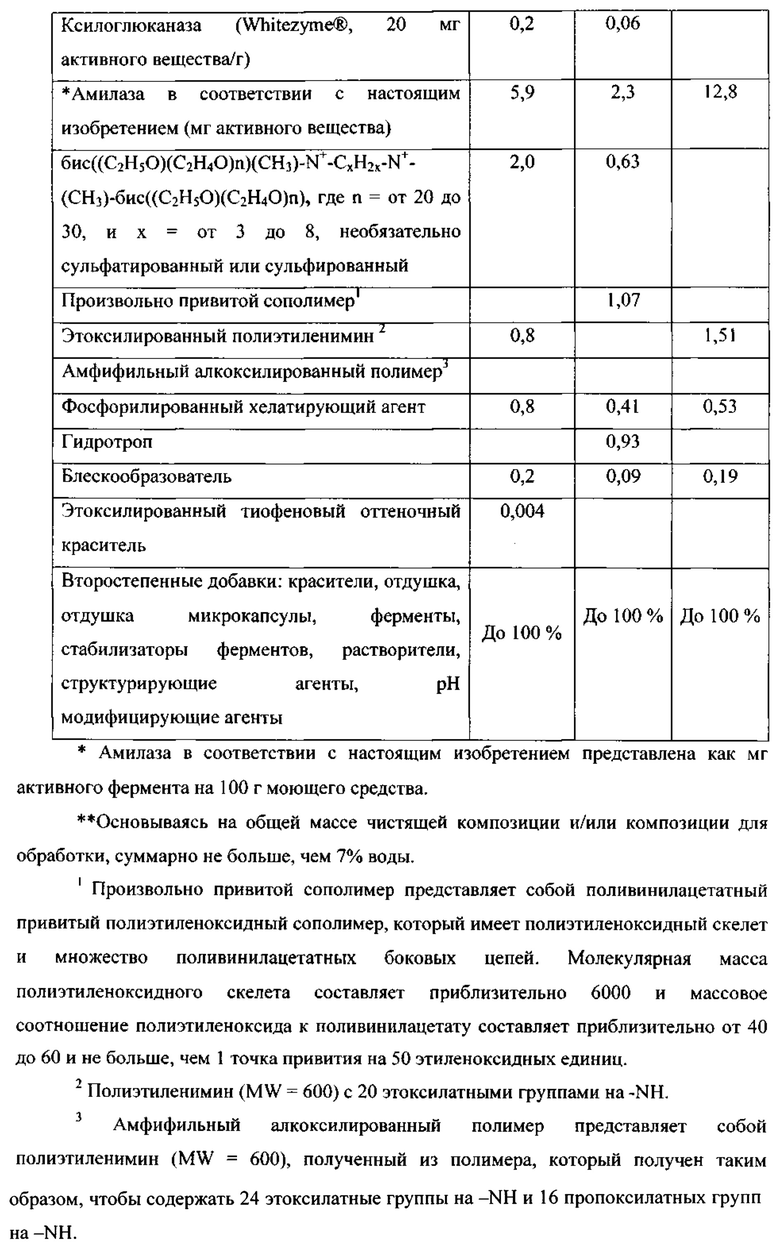
Исходные материалы и примечания для примеров 1-21 композиции
Линейный алкилбензолсульфонат, который имеет среднюю длину алифатической углеродной цепи C11-C18.
С12-18 диметилгидроксиэтиламмония хлорид.
AE3S представляет собой С12-15 алкилэтокси (3) сульфат.
АЕ7 представляет собой С12-15 этоксилат спирта, со средней степенью этоксилирования 7.
АЕ9 представляет собой С12-16 этоксилат спирта, со средней степенью этоксилирования 9.
HSAS представляет собой разветвленный в середине цепи первичный алкилсульфат с длиной углеродной цепи приблизительно 16-17, как раскрыто в US 6,020,303 и US 6,060,443.
Полиакрилат MW 4500 поставляется компанией BASF.
Карбоксиметилцеллюлоза представляет собой Finnfix® V, поставляемый компанией CP Kelco, Arnhem, Netherlands.
Фосфонатные хелатирующие агенты представляют собой, например, диэтилентетрааминпентауксусную кислоту (DTPA) гидроксиэтандифосфонат (HEDP).
Savinase®, Natalase®, Stainzyme®, Lipex®, Celluclean™, Mannaway® и Whitezyme® все представляют собой продукты от Novozymes, Bagsvaerd, Denmark.
Флуоресцентный отбеливатель 1 представляет собой Тинопал® AMS, флуоресцентный отбеливатель 2 представляет собой Тинопал® CBS-X.
Прямой Фиолетовый 9 представляет собой Pergasol®.
Фиолетовый BN-Z NOBS представляет собой натрия нонаноилоксибензолсульфонат.
TAED представляет собой тетраацетилэтилендиамин.
S-ACMC представляет собой карбоксиметилцеллюлозу, конъюгированную с С.I. реактивным синим 19 продуктом под названием AZO-CM-CELLULOSE.
Высвобождающий загрязнение агент представляет собой Repel-o-tex® PF.
Сополимер акриловой кислоты/малеиновой кислоты имеет молекулярную массуа 70000 и соотношение акрилата:малеата 70:30.
EDDS представляет собой натриевую соль этилендиамин-N,N'-диянтарной кислоты, (S,S) изомер.
Агломерат пеногасителя поставляется компанией Dow Corning, Midland, Michigan, USA.
HSAS представляет собой разветвленный в середине цепи алкилсульфат.
Liquitint® фиолетовый СТ поставляется компанией Milliken, Spartanburg, South Carolina, USA.
Примеры 22-26
Композиции моющего средства единичной дозы для стирки. Такие составы единичной дозы могут содержать одно или несколько отделений.
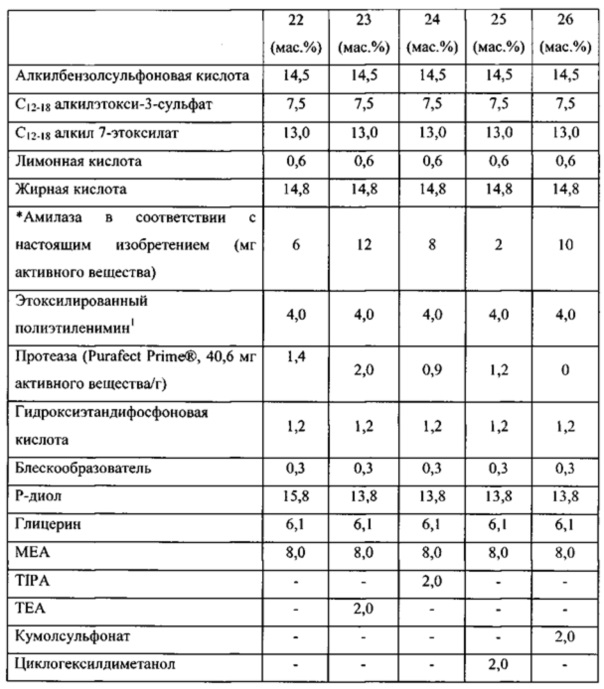
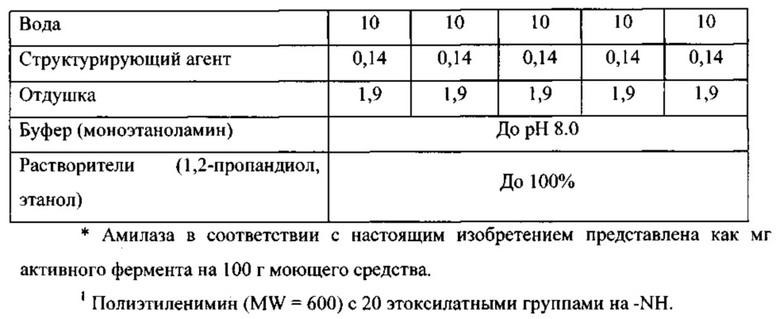
Пример 27
Композиции единичной дозы с несколькими отделениями
Составы моющего средства единичной дозы для стирки с несколькими отделениями в соответствии с настоящим изобретением представлены ниже. В данных примерах единичная доза имеет три отделения, но подобные композиции могут быть сделаны с двумя, четырьмя или пятью отделениями. Пленка, используемая для инкапсулирования отделений, является поливиниловым спиртом.
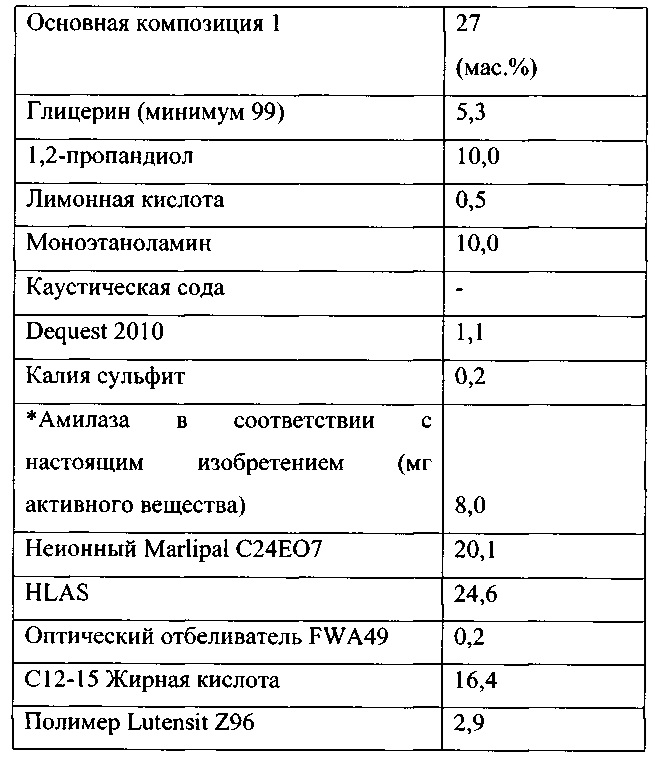
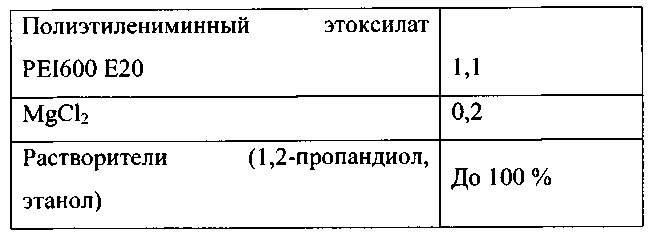
Составы с несколькими отделения
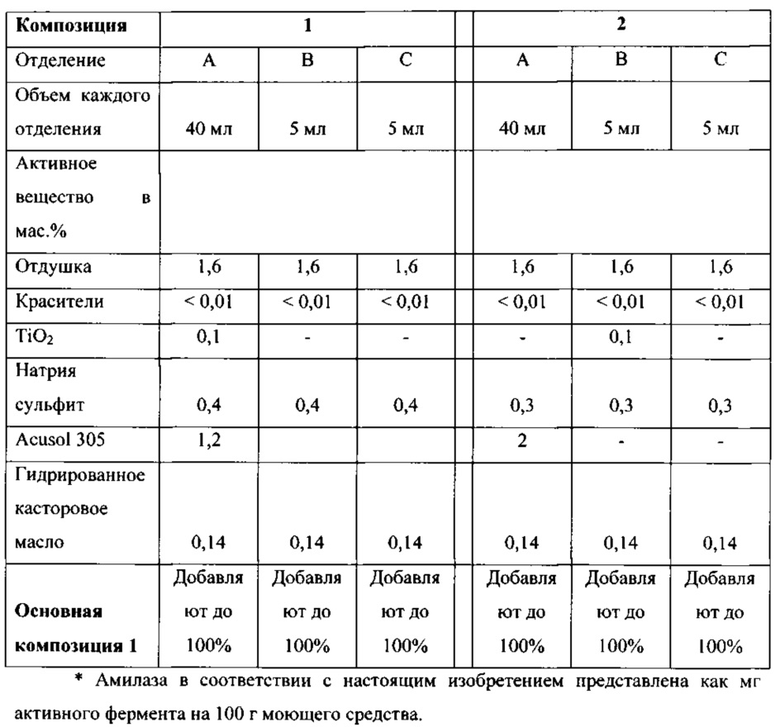
Размеры и значения, описанные в данной заявке, не следует понимать как строго ограниченные в точности приведенными численными значениями. Вместо этого, если не указано иное, каждый такой размер должен обозначать как приведенное значение, так и функционально эквивалентный диапазон, окружающий данное значение. Например, размер, раскрытый как «40 мм», должен обозначать «приблизительно 40 мм».
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЮЩАЯ КОМПОЗИЦИЯ | 2015 |
|
RU2737535C2 |
| СТАБИЛЬНОЕ ПРИ ХРАНЕНИИ ЖИДКОЕ МОЮЩЕЕ ИЛИ ЧИСТЯЩЕЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ПРОТЕАЗУ И АМИЛАЗУ | 2012 |
|
RU2617406C2 |
| Композиции, содержащие липазы, и способы обработки поверхности | 2013 |
|
RU2612215C2 |
| ПРИМЕНЕНИЕ ПОЛИПЕПТИДА | 2015 |
|
RU2690681C2 |
| Способы и композиции, содержащие варианты сериновой протеазы | 2012 |
|
RU2663114C2 |
| ВАРИАНТЫ ПРОТЕАЗЫ И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2014 |
|
RU2670946C9 |
| ПРИМЕНЕНИЕ ВАРИАНТОВ ПРОТЕАЗЫ | 2010 |
|
RU2639534C2 |
| ВАРИАНТЫ СУБТИЛАЗ | 2010 |
|
RU2651525C2 |
| ПОЛИПЕПТИДЫ С ЛИЗОЦИМНОЙ АКТИВНОСТЬЮ И ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИХ | 2012 |
|
RU2619051C2 |
| МОЮЩИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЛИПАЗЫ | 2018 |
|
RU2775700C2 |






























Группа изобретений относится к области биотехнологии. Предложена чистящая композиция, содержащая: (а) вариант родительской альфа-амилазы, имеющий улучшенную моющую эффективность при температуре 15-20°С по сравнению с родительской альфа-амилазой, причем вариант содержит изменение в двух или более положениях, соответствующих положениям G304, W140, W189, D134, Е260, W284, W439, G476 и G477 зрелого полипептида SEQ ID NO: 1, при этом каждое изменение независимо представляет собой замещение, делецию или вставку, причем одно из изменений представляет собой замещение в положении, соответствующем положению Е260 зрелого полипептида SEQ ID NO: 1, и заместитель выбран из группы, состоящей из G, K, R, и Т; и (b) чистящую добавку. Предложен способ обработки поверхности, предпочтительно текстиля, с помощью водного моющего раствора, содержащего указанную композицию. Группа изобретений позволяет повысить эффективность удаления пятен, чувствительных к амилазе, в холодной воде. 2 н. и 19 з.п. ф-лы, 22 табл., 3 пр.
1. Чистящая композиция, содержащая:
(a) вариант родительской альфа-амилазы, предпочтительно выделенный вариант, имеющий по меньшей мере 97%, но меньше чем 100% идентичность последовательности со зрелым полипептидом SEQ ID NO: 1, и при этом вариант имеет активность альфа-амилазы и улучшенную моющую эффективность при температуре 15-20°С по сравнению с альфа-амилазой SEQ ID NO: 1, причем вариант содержит изменение в двух или более положениях, соответствующих положениям G304, W140, W189, D134, Е260, W284, W439, G476 и G477 зрелого полипептида SEQ ID NO: 1, при этом каждое изменение независимо представляет собой замещение, делецию или вставку, причем одно из изменений представляет собой замещение в положении, соответствующем положению Е260 зрелого полипептида SEQ ID NO: 1, и заместитель выбран из группы, состоящей из G, K, R, и Т; и
(b) чистящую добавку.
2. Композиция по п.1, отличающаяся тем, что чистящая добавка содержится в количестве от 0,01 до 99,9 мас. %.
3. Композиция по п.1, отличающаяся тем, что изменение является замещением.
4. Композиция по п.1 или 3, в которой вариант содержит замещение в трех положениях, выбранных из группы, состоящей из G304, W140, W189, D134, Е260, W284, W439, G476 и G477.
5. Композиция по п.1 или 3, отличающаяся тем, что вариант содержит замещение в четырех положениях, выбранных из группы, состоящей из G304, W140, W189, D134, Е260, W284, W439, G476 и G477.
6. Композиция по п.1 или 3, отличающаяся тем, что вариант содержит замещение в двух, трех или четырех положениях, выбранных из группы, состоящей из G304, W140, Е260 и G476.
7. Композиция по п.1 или 3, отличающаяся тем, что в дополнение к E260GKRT вариант содержит одно или более замещений, выбранных из группы, состоящей из G304R, W140YF, W189EGT, D134E, W284DFR, W439RG, G476EK, G477EKMR.
8. Композиция по п.1 или 3, отличающаяся тем, что в дополнение к E260GKRT вариант содержит замещения в одном, двух, или трех положениях, выбранные из группы, состоящей из G304R, W140YF и G476EK.
9. Композиция по п.8, отличающаяся тем, что замещения в варианте, содержащиеся в двух, трех или четырех положениях, выбраны из группы, состоящей из G304R, W140Y, E260G и G476K.
10. Композиция по п.1 или 3, отличающаяся тем, что вариант дополнительно содержит одно или более замещений, выбранных из группы, состоящей из N195F, V206Y, Y243F, G109A, G273DV, G337N, K72R, R181H, S303G и Y100I.
11. Композиция по п.1 или п.3, отличающаяся тем, что количество изменений в варианте составляет 2-12, например, 2-10 и 2-5, например 2, 3, 4, 5, 6, 7, 8, 9 или 10 изменений.
12. Композиция по п.1 или 3, отличающаяся тем, что вариант родительской альфа-амилазы имеет по меньшей мере 98%, по меньшей мере 99%, но меньше чем 100% идентичность последовательности со зрелым полипептидом SEQ ID NO: 1, или тем, что вариант родительской альфа-амилазы содержит или состоит из аминокислотной последовательности зрелого полипептида, выбранной из (i) SEQ ID NO: 2; (ii) SEQ ID NO: 3.
13. Композиция по п.1 или 3, отличающаяся тем, что вариант содержит замещения в положениях, которые соответствуют положениям полипептида SEQ ID NO: 1, выбранные из группы, состоящей из:
W140Y+N195F+V206Y+Y243F+E260G+G477E,
W140Y+N195F+V206Y+Y243F+E260T+W284D,
G109A+W140Y+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G,
N195F+V206Y+Y243F+E260K+W284D,
W140Y+N195F+V206Y+Y243F+E260G+G476E,
W140Y+W189G+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+S303G,
W140Y+W189T+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+W284D,
Y100I+W140Y+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+G337N,
W140Y+N195F+V206Y+Y243F+E260G+W439R,
G109A+W140Y+E194D+N195F+V206Y+Y243F+E260G,
G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
T51I+Y100I+G109A+W140Y+N195F+V206Y+Y243F+E260G,
T51I+G109A+W140Y+N195F+V206Y+Y243F+E260G+W439R,
T51I+S52Q+N54K+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
W140Y+N195F+V206Y+Y243F+E260G+G304R+G476K,
W140Y+N195F+V206Y+Y243F+E260G+W284R+G477K,
W140Y+N195F+V206Y+Y243F+E260G+W284F+G477R и
N195F+V206Y+Y243F+E260G+W284D.
14. Композиция по п.1 или 3, отличающаяся тем, что вариант состоит из замещений в положениях, которые соответствуют положениям полипептида SEQ ID NO: 1, выбранных из группы, состоящей из:
W140Y+N195F+V206Y+Y243F+E260G+G477E,
W140Y+N195F+V206Y+Y243F+E260T+W284D,
G109A+W140Y+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G,
N195F+V206Y+Y243F+E260K+W284D,
W140Y+N195F+V206Y+Y243F+E260G+G476E,
W140Y+W189G+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+S303G,
W140Y+W189T+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+W284D,
Y100I+W140Y+N195F+V206Y+Y243F+E260G,
W140Y+N195F+V206Y+Y243F+E260G+G337N,
W140Y+N195F+V206Y+Y243F+E260G+W439R,
G109A+W140Y+E194D+N195F+V206Y+Y243F+E260G,
G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
T51I+Y100I+G109A+W140Y+N195F+V206Y+Y243F+E260G,
T51I+G109A+W140Y+N195F+V206Y+Y243F+E260G+W439R,
T51I+S52Q+N54K+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
W140Y+N195F+V206Y+Y243F+E260G+G304R+G476K,
W140Y+N195F+V206Y+Y243F+E260G+W284R+G477K,
W140Y+N195F+V206Y+Y243F+E260G+W284F+G477R и
N195F+V206Y+Y243F+E260G+W284D.
15. Композиция по п.1 или 3, отличающаяся тем, что вариант содержит изменения в положениях, которые соответствуют положениям полипептида SEQ ID NO: 1, выбранные из группы, состоящей из:
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G477E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260T+W284D,
D183*+G184*+G109A+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+W140Y+W189G+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+S303G,
D183*+G184*+W140Y+W189T+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284D,
D183*+G184*+Y100I+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G337N,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W439R,
D183*+G184*+G109A+W140Y+E194D+N195F+V206Y+Y243F+E260G,
D183*+G184*+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+T51I+Y100I+G109A+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+T51I+G109A+W140Y+N195F+V206Y+Y243F+E260G+W439R,
D183*+G184*+T51I+S52Q+N54K+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G304R+G476K,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284R+G477K,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284F+G477R и
D183*+G184*+N195F+V206Y+Y243F+E260G+W284D.
16. Композиция по п.1 или 3, отличающаяся тем, что вариант состоит из изменений в положениях, которые соответствуют положениям полипептида SEQ ID NO: 1, выбранных из группы, состоящей из:
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G477E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260T+W284D,
D183*+G184*+G109A+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+N195F+V206Y+Y243F+E260K+W284D,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+W140Y+W189G+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+S303G,
D183*+G184*+W140Y+W189T+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284D,
D183*+G184*+Y100I+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G337N,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W439R,
D183*+G184*+G109A+W140Y+E194D+N195F+V206Y+Y243F+E260G,
D183*+G184*+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+T51I+Y100I+G109A+W140Y+N195F+V206Y+Y243F+E260G,
D183*+G184*+T51I+G109A+W140Y+N195F+V206Y+Y243F+E260G+W439R,
D183*+G184*+T51I+S52Q+N54K+G109A+W140Y+N195F+V206Y+Y243F+E260G+G476E,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+G304R+G476K,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284R+G477K,
D183*+G184*+W140Y+N195F+V206Y+Y243F+E260G+W284F+G477R и
D183*+G184*+N195F+V206Y+Y243F+E260G+W284D.
17. Композиция по п.1 или 3, отличающаяся тем, что дополнительно содержит делеции в положениях, соответствующих положениям G182*+D183* или D183*+G184* из SEQ ID NO: 1.
18. Композиция по п.1 или 3, отличающаяся тем, что вариант дополнительно содержит замещения в положениях, соответствующих положениям N195F+V206Y+Y243F из SEQ ID NO: 1.
19. Композиция по п.1 или 3, отличающаяся тем, что чистящая добавка включает одно или более выбранное из группы, состоящей из (i) микрокапсул отдушки; (ii) оттеночного агента для ткани; (iii) протеазы; (iv) амфифильного чистящего полимера; (v) липазы или (vi) их смесей.
20. Композиция по п.1 или 3, отличающаяся тем, что композиция представляет собой жидкую композицию моющего средства для стирки или композицию моющего средства единичной дозы.
21. Способ обработки поверхности, предпочтительно текстиля, включающий стадии, на которых:
(i) формируют водный моющий раствор, содержащий воду и композицию по любому из предыдущих пунктов,
(ii) обрабатывают поверхность водным моющим раствором, предпочтительно, при температуре 15-20°С; и
(iii) промывают поверхность.
| US6309871 В1, 30.10.2001 | |||
| СПОСОБ ПОЛУЧЕНИЯ ФУРИЛАЛКАНОНОВ-3 | 0 |
|
SU166712A1 |
| Гибочный штамп | 1984 |
|
SU1199356A1 |
| WO9920723 А2, 29.04.1999 | |||
| RU2009128054 А, 27.01.2011. | |||
Авторы
Даты
2017-04-28—Публикация
2012-06-29—Подача