ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к анализу перфузии. Более конкретно, настоящее изобретение относится к количественному анализу перфузионных изображений, содержащих элементы изображения, которые имеют значения интенсивности, связанные с ними.
УРОВЕНЬ ТЕХНИКИ
Анализ перфузии используется, например, при формировании медицинских изображений для ряда различных целей. Например, дифференциальный диагноз между доброкачественными и злокачественными поражениями легких, такими как узелки в легких, можно выполнить с использованием формирования перфузионного изображения и его анализа. Другим примером является дифференцирование положительной или отрицательной реакции опухолей на лечение рака. Кроме того, можно использовать динамические сканы для компьютерной томографии (КТ). Такой динамический КТ-скан содержит временной ряд двухмерных или трехмерных сканов, включая сканы, выполненные до и после введения контрастного вещества, такого как йод. Сканы приводят к изображениям, содержащим элементы изображения, такие как воксели (в случае трехмерных изображений) или пиксели (в случае двухмерных изображений). "Поглощение" или "усиление", которое можно увидеть на изображениях и которое вследствие поступления контрастного вещества в область, представляющую интерес, представляет собой, например, поражение или опухоль, можно интерпретировать как замену для ангиогенеза. Такой ангиогенез может быть знаком злокачественности и/или метаболической активности.
Поглощение или усиление определяется с использованием поэлементного (например, повоксельного или попиксельного) сравнения значений интенсивности у следующих друг за другом изображений в последовательности изображений, так как в момент поступления контрастного вещества в область, представляющую интерес, будут изменяться значения интенсивности вокселей (или пикселей) в области, представляющей интерес. Однако поглощение или усиление является часто маленьким по сравнению с контрастом изображения. Например, изменение значений интенсивности, вызванное контрастным веществом, может составлять только 1%. Поэтому трудно точно определить синхронизацию и/или интенсивность поглощения или усиления. Более того, изображения или объемы изображений временного ряда нельзя идеально совместить в пространстве. Например, пациент может переместить или изменить положение своего тела или может деформировать внутренний орган в результате, например, дыхания, сердцебиения или перемещения кишечника.
В работе "Текстурный анализ пораженных перфузионных объемов при динамической МРТ груди с повышенным контрастом" Сэнг Хо Ли и др.: 5-й Международный симпозиум IEEE по формированию биомедицинских изображений: от нано до макро, Труды ISBI, 2008, стр. 1545-1548 ("Texture analysis of lesion perfusion volumes in dynamic contrast-enhanced breast MRI", by Sang Ho Lee et al., in: 5th IEEE International Symposium on Biomedical Imaging: From Nano to Macro, Proceedings, ISBI, 2008, pages 1545-1548), здесь и далее Ли и др., раскрыта схема текстурного анализа, которая применима к перфузионным объемам при динамической МРТ груди с повышенной контрастностью, для выполнения способа распознавания поражения. Автоматическая сегментация была выполнена для выделения объема поражения, который был поделен на целостную, крайнюю и центральную части объема. Перфузионные объемы поражения классифицируются с использованием способа трех моментов времени (3ТР) медицинской компьютерной диагностики. Согласно известному способу 3ТР, три выбранных момента времени вдоль кривой поглощения используются для оценки поведения накопления и вымывания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задача настоящего изобретения заключается в том, чтобы выполнить, предпочтительно, усовершенствованную систему для количественного анализа перфузионных изображений, содержащих элементы изображения, которые имеют значения интенсивности, связанные с ними. Для решения этой задачи, согласно первому аспекту настоящего изобретения, выполнена система, которая содержит:
- подсистему для вычисления частотного распределения, предназначенную для вычисления множества частотных распределений значений интенсивности, по меньшей мере, части изображений; и
- экстрактор информации о перфузии для извлечения информации, которая относится к перфузии, из множества частотных распределений.
Области изображения, для которых требуется количественная информация о перфузии, могут содержать маленькие сосуды, которые трудно сегментировать и которые трудно идентифицировать и совмещать на последовательных изображениях из множества изображений. Частотное распределение представляет информацию из множества элементов изображения, что делает ненужным выполнение сравнений отдельных элементов изображения. Более того, поскольку частотное распределение хранит информацию о различных значениях интенсивности, имеющих место в изображении, можно сравнить области изображения, имеющие конкретный диапазон значений интенсивности, без необходимости явной сегментации этих областей изображения. Изменение в частотном распределении можно обнаружить и использовать в качестве индикатора для перфузии ткани, к которой относится изображение.
Экстрактор информации о перфузии может содержать детектор сдвига для сравнения, по меньшей мере, двух частотных распределений, вычисленных для различных изображений. Таким образом, можно обнаружить сдвиг значений интенсивности частотного распределения. Экстрактор информации о перфузии можно выполнить с возможностью извлечения информации, которая относится к перфузии, на основании обнаруженного сдвига. Сдвиг гистограммы является индикатором поступления контраста, который делает возможной точную квантизацию свойств перфузии.
Детектор сдвига можно выполнить с возможностью сравнения множества частотных распределений с одним опорным частотным распределением для обнаружения соответствующих сдвигов соответствующих частотных распределений относительно опорного частотного распределения. В этом случае преимущество заключается в том, что соответствующие сдвиги можно легко сравнить друг с другом.
Детектор сдвига может содержать кросс-коррелятор с возможностью выполнения взаимной корреляции, по меньшей мере, двух частотных распределений для получения кривой взаимной корреляции, при этом детектор сдвига выполнен также с возможностью обнаружения сдвига на основании кривой взаимной корреляции. По кривой взаимной корреляции можно относительно надежным способом определить сдвиг частотного распределения.
Детектор сдвига может дополнительно содержать детектор пиков для обнаружения пика кривой взаимной корреляции. Расположение пика можно использовать в качестве индикатора значения сдвига.
Экстрактор информации о перфузии может содержать формирователь кривой сдвига, который объединяет сдвиги, обнаруженные для соответствующих частотных распределений, для формирования кривой сдвига, причем экстрактор информации о перфузии содержит детектор перфузионного поглощения для обнаружения перфузионного поглощения на основании кривой сдвига. Кривая сдвига позволяет извлечь из данных дополнительные количественные характеристики. Примером такой количественной характеристики является перфузионное поглощение.
Система может содержать подсистему для идентификации области, предназначенную для идентификации области, представляющей интерес, на изображениях, причем подсистема для вычисления частотного распределения выполнена с возможностью вычисления частотных распределений для области, представляющей интерес, на изображениях. Таким образом, получение количественных характеристик более специфично для конкретной анатомической структуры, такой как опухоль или ее часть.
Подсистему для идентификации области можно выполнить с возможностью идентификации, по меньшей мере, части крайней области, окружающей центральную область поражения, в качестве области, представляющей интерес. Окружающая область может играть важную роль при оценке опухоли.
Подсистема для идентификации области может содержать элемент пользовательского интерфейса, который позволяет пользователю указать границу между центральной областью и крайней областью с помощью одной степени свободы, причем одна степень свободы относится к размеру центральной области. Этот способ регулировки упомянутой границы считается особенно эффективным и/или удобным для пользователя способом.
Система может содержать подсистему сосудистости для связи значения сосудистости с элементом изображения, причем значение сосудистости представляет собой вероятность того, что элемент изображения принадлежит сосуду, при этом подсистема для вычисления частотного распределения выполнена с возможностью взвешивания вклада значения интенсивности элемента изображения в частотное распределение на основании значения сосудистости. Это делает частотное распределение более уместным для перфузии сосудов. Эта особенность основана на идее того, что не только значение интенсивности представляет интерес, но также и структура изображения (в этом случае сосудистость) может указывать, какие участки изображения являются важными.
Информация, которая относится к перфузии, может содержать, по меньшей мере, одно из следующего: время поступления контрастного вещества, количество контрастного вещества, протекающего через область, максимальное усиление, продолжительность максимального усиления, максимальная крутизна нарастания или производная по времени значения интенсивности, продолжительность максимальной крутизны нарастания, аппроксимация аналитической кривой перфузии со свободными параметрами с наблюдаемой кривой в зависимости от времени. Такое определение количественных характеристик уместно при оценке клинических случаев, и их можно получить с использованием способов, основанных на частотном распределении, описанных здесь.
В дополнение к упомянутой системе, рабочая станция для формирования медицинских изображений может содержать устройство отображения, предназначенное для отображения информации, которая относится к перфузии. Это позволяет, например, рентгенологу, использовать упомянутую систему.
Устройство формирования изображения может содержать сканер для формирования перфузионного изображения и упомянутую систему. Это позволяет, например, оператору сканера или специалисту, выполняющему интервенционное вмешательство, использовать упомянутую систему.
Способ выполнения количественного анализа перфузионных изображений, содержащий элементы изображения, которые имеют значения интенсивности, связанные с ними, содержит этапы, на которых:
- вычисляют множество частотных распределений значений интенсивности изображений; и
- извлекают информацию, которая относится к перфузии, из множества частотных распределений.
Компьютерный программный продукт может содержать инструкции для предписания процессорной системе выполнять этапы упомянутого способа.
Специалисты в данной области техники могут оценить, что два или более вышеупомянутых вариантов осуществления, реализаций и/или аспектов настоящего изобретения можно объединить любым пригодным способом.
Специалисты в данной области техники могут выполнить на основе настоящего описания модификации и изменения устройства получения изображения, рабочей станции, системы и/или компьютерного программного продукта, которые соответствуют описанным модификациям и изменениям системы.
Специалисты в данной области техники могут оценить, что способ можно применить к данным многомерного изображения, например, к двухмерному (2-D), трехмерному (3-D) или четырехмерному (4-D) изображениям, полученным с помощью различных способов формирования изображения, таких как, но не ограниченных перечисленным, стандартное рентгеновское формирование изображения, компьютерная томография (КТ), магнитно-резонансная томография (МРТ), ультразвук (УС), позитронно-эмиссионная томография (ПЭТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ) и ядерная медицина (ЯМ).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Эти и другие аспекты настоящего изобретения дополнительно пояснены и описаны ниже со ссылкой на чертежи, на которых:
фиг.1 - блок-схема системы для количественного анализа перфузионных изображений, содержащих элементы изображений, которые имеют значения интенсивности, связанные с ними; и
фиг.2 - алгоритм, иллюстрирующий способ выполнения количественного анализа перфузионных изображений, содержащих элементы изображений, имеющие значения интенсивности, связанные с ними.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Несмотря на пространственное взаимное совмещение, движение объекта, например, дыхательное движение, усложняет прямое повоксельное сравнение значений Хаунсфилда (Hounsfield) в перфузионных изображениях, таких как перфузионные КТ-изображения. К тому же, опухоль, изображение которой формируют, может упруго деформироваться между сканами. Сегментация опухоли часто является неоднозначной. Однако сегментация опухоли влияет на кривую перфузии, если ее вычисляют из значений плотности внутри сегментированной опухоли.
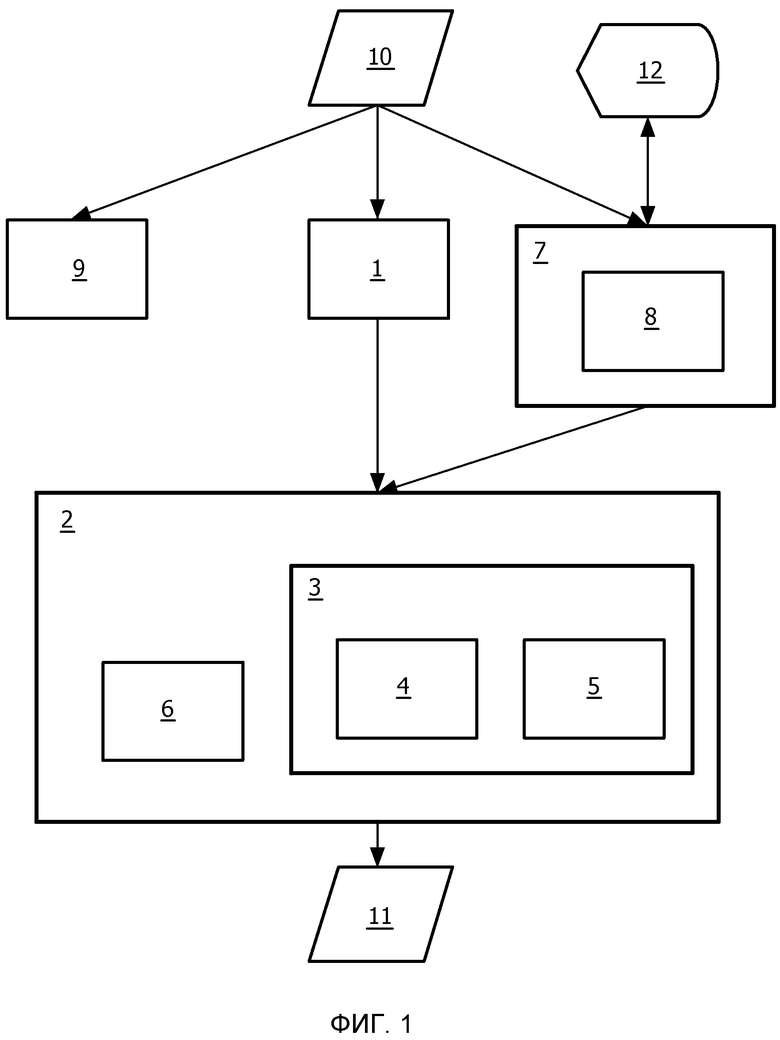
На фиг.1 изображена блок-схема системы для количественного анализа перфузионных изображений 10. Перфузионные изображения 10 могут содержать элементы изображения, имеющие значения интенсивности, связанные с ними. Эти значения интенсивности могут представлять собой, например, значения яркости, значения серого или значения составляющих цветов.
Система может содержать процессор для выполнения инструкций и память для хранения программного обеспечения в виде инструкций. Более того, память можно выполнить с возможностью хранения информации изображения. Память может принимать вид энергозависимой памяти, такой как оперативное запоминающее устройство (ОЗУ), и/или энергонезависимой памяти, такой как флэш-память или магнитный диск. Система может дополнительно содержать порты связи для обмена данных. Например, данные изображения можно принимать через порт связи и количественные данные о перфузии можно передавать через порт связи. Порт связи может быть совместимым с любым стандартом порта. Например, порт связи может содержать сетевой интерфейс для поддержания связи с удаленным компьютером, таким как сервер системы архивирования и передачи изображений (PACS), через сеть, такую как Интернет. Система может дополнительно содержать устройство 12 отображения для отображения изображений 10 и/или количественной информации о перфузии. Устройство 12 отображения можно дополнительно использовать для показа конкретной области изображения, такой как центральная область поражения и/или крайняя область поражения. Система может дополнительно содержать пользовательский интерфейс, который позволяет пользователю интерактивно управлять системой. Пользовательский интерфейс может содержать оконную систему для отображения данных, организованных в виде окон на устройстве 12 отображения, клавиатуру и/или указательное устройство, такое как мышь, для приема команд пользовательского ввода.
Система может содержать подсистему 1 для вычисления частотного распределения для вычисления множества частотных распределений значений интенсивности, по меньшей мере, части изображений 10. Например, частотное распределение значений интенсивности сегментированной области, содержащей поражение, вычисляют для каждого изображения из множества изображений 10. Например, сегментированную область можно сегментировать на одно изображение и совмещать с другими изображениями, или сегментированную область можно сегментировать по отдельности на каждое изображение. Частотное распределение может содержать гистограмму. Частотное распределение содержит указание, как часто конкретное значение интенсивности наблюдается в изображении (или в сегментированной области изображения).
Система может дополнительно содержать экстрактор 2 информации о перфузии для извлечения информации 11, которая относится к перфузии, из множества частотных распределений. Путем извлечения информации 11 о перфузии из множества частотных распределений объединяют информацию о ряде элементов изображения, что делает более точной и/или надежной информацию, которая относится к перфузии.
Экстрактор 2 информации о перфузии может содержать детектор 3 сдвига для сравнения, по меньшей мере, двух частотных распределений, вычисленных для различных изображений, с целью обнаружения сдвига значений интенсивности частотных распределений. Такое сравнение может быть основано, например, на способах распознавания образов. К тому же, среднее значение или медиану можно вычислить из частотного распределения и сравнить. Альтернативно, модель, такую как распределение Гаусса, можно аппроксимировать в гистограммах и можно сравнить параметры модели, такие как среднее значение и дисперсия. Сдвиг слова относится к ситуации, в которой общее распределение значений интенсивности ориентировочно сдвигается к более высокому диапазону интенсивностей или более низкому диапазону интенсивностей. Этот сдвиг может относиться ко всему частотному распределению или к его части, такой как часть частотного распределения, которая относится к конкретному диапазону значений интенсивности.
Экстрактор 2 информации о перфузии можно выполнить с возможностью извлечения информации, которая относится к перфузии, на основании обнаруженного сдвига. Экстрактор информации о перфузии можно выполнить с возможностью обнаружения поступления контрастного вещества путем обнаружения сдвига в гистограмме. Аналогично, объем контрастного вещества можно обнаружить, принимая во внимание величину сдвига, а также продолжительность между сдвигом, соответствующим уменьшению значений интенсивности, и сдвигом, соответствующим последующему увеличению значений интенсивности. Альтернативно, за увеличением значений интенсивности может следовать уменьшение значений интенсивности, что позволяет установить продолжительность между ними.
Детектор 3 сдвига можно выполнить с возможностью сравнения множества частотных распределений с одним опорным частотным распределением. Это позволяет выполнить постоянное измерение величины контрастного вещества, обнаруженного на основании гистограммы. Например, соответствующие сдвиги соответствующих частотных распределений можно обнаружить относительно опорного частотного распределения. Таким образом, сдвиги можно легко сравнить.
Детектор сдвига может содержать кросс-коррелятор 4 для выполнения взаимной корреляции, по меньшей мере, двух частотных распределений для получения кривой взаимной корреляции. Детектор 3 сдвига можно выполнить с возможностью обнаружения сдвига на основании кривой взаимной корреляции. Например, детектор 3 сдвига может дополнительно содержать детектор 5 пиков для обнаружения пика на кривой взаимной корреляции. Расстояние между началом координат и положением пика указывает сдвиг.
Экстрактор 2 информации о перфузии может содержать формирователь 6 кривой сдвига. Этот формирователь 6 кривой сдвига может формировать кривую, которая представляет собой сдвиг в зависимости от времени. Точки данных на кривой могут соответствовать сдвигам, вычисленным для отдельных изображений. Таким образом, сдвиги, обнаруженные для отдельных частотных распределений, объединяются для формирования кривой сдвига.
Система может содержать подсистему 7 для идентификации области, предназначенную для идентификации области, представляющей интерес, на изображениях. Например, алгоритм автоматической сегментации можно выполнить с возможностью автоматической сегментации поражения. Сегментированное поражение может быть областью, представляющей интерес. Подсистема 1 для вычисления частотного распределения может быть выполнена для вычисления частотных распределений для области, представляющей интерес, на изображениях. Область, представляющая интерес, может быть той же самой, то есть повоксельной, областью в каждом изображении. Область, представляющую интерес, можно сегментировать отдельно в каждом изображении. Область, представляющую интерес, можно сегментировать для одного изображения, при этом сегментированную область можно идентифицировать в других изображениях с использованием способов совмещения изображений.
Подсистему 7 для идентификации области можно выполнить с возможностью идентификации, по меньшей мере, части крайней области, окружающей центральную область поражения, в виде области, представляющей интерес. Такую крайнюю область можно установить путем рассмотрения крайней области определенной толщины вокруг обнаруженной центральной области, например. Альтернативно, особенности изображения используются для обнаружения крайней области.
Подсистема 7 для идентификации области может содержать элемент 8 пользовательского интерфейса, который позволяет пользователю указывать границу между центральной областью и крайней областью с помощью одной степени свободы, при этом одна степень свободы относится к размеру центральной области. Например, для этой цели можно использовать колесо мыши или графический слайдер.
Система может содержать подсистему 9 сосудистости для связи значения сосудистости с элементом изображения, причем значение сосудистости представляет собой вероятность того, что элемент изображения принадлежит сосуду. Такие значения сосудистости можно вычислить способом, известным по существу в технике, например, можно использовать известный фильтр сосудистости. Подсистему 1 для вычисления частотного распределения можно выполнить с возможностью взвешивания вклада значения интенсивности элемента изображения в частотное распределение на основании значения сосудистости. Например, операция взвешивания может содержать вычисление веса сосудистости на основании значения сосудистости элемента изображения. Вес сосудистости может быть равен значению сосудистости. Вес сосудистости можно вычислить путем нормирования значений сосудистости. Вместо вычисления элементов изображения, имеющих конкретное значение интенсивности для получения значений частоты частотного распределения, веса сосудистости элементов изображения, имеющие конкретные значения интенсивности, складываются для получения значения частоты частотного распределения.
Информация, которая относится к перфузии, может содержать, по меньшей мере, одно из следующего: время поступления контрастного вещества, величину контрастного вещества, протекающего через область, максимальное усиление, продолжительность максимального усиления, максимальную крутизну нарастания или производную по времени значения интенсивности, продолжительность максимальной крутизны нарастания, аппроксимацию аналитической кривой перфузии с помощью свободных параметров с наблюдаемой кривой в зависимости от времени. Эти величины можно получить из частотного распределения. Например, эти величины могут быть основаны на кривой сдвига. Способы получения этих величин из кривых интенсивности изображения в зависимости от времени известны по существу в предшествующем уровне техники. Эти способы можно адаптировать для использования кривой сдвига вместо кривой интенсивности изображения в зависимости от времени.
Упомянутую систему можно интегрировать в рабочую станцию для формирования медицинских изображений. Например, подходящее программное обеспечение можно установить в рабочей станции для формирования медицинских изображений. Такое программное обеспечение имеет инструкции, реализующие различные аспекты упомянутой системы. Более того, упомянутая система может быть интегрирована в устройство формирования изображений, содержащее сканер для выработки перфузионного изображения. Такой сканер может содержать КТ-сканер, или МРТ-сканер, или рентгеновское устройство формирования изображений или другой вид медицинского сканирующего устройства.
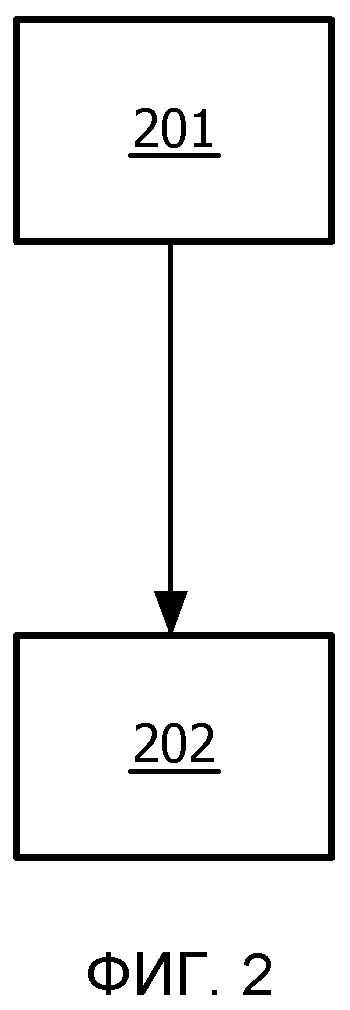
На фиг.2 изображен способ выполнения количественного анализа перфузионных изображений, содержащих элементы изображения, которые имеют значения интенсивности, связанные с ними. Способ содержит этап 201 вычисления множества частотных распределений значений интенсивности изображений. Более того, способ может содержать этап 202 извлечения информации, которая относится к перфузии, из множества частотных распределений. Другие этапы можно добавить на основании описания функциональности системы, описанной выше. Способ можно реализовать в виде компьютерной программы. Компьютерную программу можно хранить на машиночитаемом носителе.
Ниже приводится описание интерактивного комбинированного способа визуализации и измерения для наборов данных четырехмерных пространственно-временных изображений, например, перфузии опухоли (например, динамической КТ). В этом способе пользователь может определить область, представляющую интерес (ОПИ), вокруг опухоли и диапазон значений интенсивности. Пользователь может интерактивно изменить область, представляющую интерес, а также рассматриваемую область значений интенсивности, и квалифицирующие воксели можно интерактивно отобразить в объеме изображения. Из квалифицирующих элементов изображения можно вычислить и отобразить гистограмму значений интенсивности для каждого скана временного ряда. Все гистограммы могут быть взаимно-коррелированными с гистограммами чистого скана. Чистый скан представляет собой скан, в котором не видно контрастного вещества, например, так как скан был получен перед введением контрастного вещества. Для каждого скана кривую взаимной корреляции можно вычислить с помощью применения положительного и/или отрицательного сдвигов к гистограмме и корреляции, например, с чистым сканом. Корреляционные кривые можно отобразить пользователю для проведения конфиденциального измерения на основании гладкости корреляционных кривых. Пики кривых можно определить и выбрать их в качестве эффективных значений перфузионного поглощения для формирования кривой перфузии в зависимости от времени, которую можно отобразить пользователю. Любое дополнительное интерактивное изменение в ОПИ или диапазоне значений интенсивности может запустить мгновенное повторное вычисление корреляционных кривых и/или полученных в результате кривых перфузии в зависимости от времени. Это дает пользователю интуитивное ощущение стабильности кривой перфузии в зависимости от времени.
Способы, описанные в этом изобретении, позволяют выполнить относительно надежное измерение от начала до конца 'эффективной' кривой перфузии в зависимости от времени, которая может быть относительно нечувствительной к недостающим частям изображения, неточному оконтуриванию границ опухоли, несущественным ошибкам совмещения, упругой деформации опухоли и/или дыхательному движению.
В принципе, любой подходящий алгоритм сегментации можно использовать для сегментации центральной области и/или крайней области опухоли. Более того, высота пика корреляционной кривой позволяет выполнить конфиденциальное измерение кривой перфузии в зависимости от времени, полученной из нее.
Интерактивный выбор области, представляющий интерес, вокруг опухоли можно выполнить, например, путем показа круга или прямоугольника, содержащего в себе опухоль, при этом их размером можно управлять с помощью, например, колеса мыши. Альтернативно, можно выполнить полуавтоматическую или полностью автоматическую сегментацию опухоли и/или ее крайней области, по меньшей мере, в одном из изображений. Существует несколько различных способов сегментации, которые можно использовать, например, в зависимости от способа формирования изображения. Сегментацию можно выполнить только по одному объему изображения и затем распространить на другие совмещенные объемы изображения. Альтернативно, сегментацию можно выполнить независимо от каждого из объемов изображения временного ряда.
Можно выполнить автоматическое выделение сети сосудов вокруг опухоли. Это автоматическое выделение можно выполнить отдельно для каждого из изображений временного ряда. В качестве альтернативы использования способов совмещения можно выполнить выделение сосуда независимо от каждого объема изображения, так как может быть недостаточно точности совмещения для переноса одного выделения сосуда поверх других объемов изображения, особенно в упругих органах, таких как легкие, грудь или печень. В настоящее время существует несколько способов выделения сосудов. Например, фильтр сосудистости можно применить к каждому элементу изображений, при этом фильтр сосудистости основан, например, на первой или второй производной (тензор структуры или матричные фильтры Гессе (Hesse)). Такой фильтр сосудистости может работать при необходимости на многочисленных масштабах (способ масштабирования пространства). Фильтр сосудов можно, например, применить во всей ОПИ вокруг опухоли или, альтернативно, его можно использовать в качестве назначения приоритетов в алгоритме роста области, который начинается с сегментации опухоли (так, чтобы выделялись только структуры, которые связаны с опухолью). Выделение опухоли может привести, например, к бинарному изображению (в котором каждый элемент изображения помечается как принадлежащий сосуду меткой "да" или "нет"), или нечеткому или вероятностному изображению веса сосудистости.
Визуализацию выделенной сети сосудов можно выполнить с использованием, например, проекции максимальной интенсивности весов сосудистости элементов изображения. Сегментацию опухоли можно наложить в качестве цветного изображения для улучшения визуальной ориентации.
Можно выполнить вычисление и отображение гистограмм значений интенсивности (например, одной гистограммы для каждого скана временного ряда). Гистограммы можно вычислить из всех элементов изображения в области, представляющей интерес, такой как центральная или крайняя область. Каждый воксель можно взвесить на предмет своей нечеткой или вероятностной сосудистости, например, сосудистости, возникающей из фильтра сосудистости.
Можно интерактивно изменить диапазон значений интенсивности, который будет рассматриваться с помощью количественных характеристик перфузии. В этом случае, при вычислении количественных характеристик перфузии рассматриваются только элементы изображения, имеющие значения интенсивности в этом диапазоне, и/или только часть гистограммы, которая относится к этому диапазону. Диапазон значений интенсивности можно показать, например, с помощью блока в отображении гистограммы, и им можно управлять, например, с помощью щелчка клавишей мыши и/или операций перетаскивания по гистограмме.
Воксели, которые включены в текущую область, представляющую интерес, и/или диапазон значений интенсивности, можно показать на изображении, например, с использованием наложения цветов. Это наложение цветов может обновляться всякий раз, когда пользователь или система изменяют свои параметры.
Можно выполнить вычисление и отображение кривых взаимной корреляции пар гистограмм, причем две гистограммы относятся к различным изображениям. Например, кривые взаимной корреляции вычисляются из гистограмм чистого скана, взаимно коррелированного с гистограммой соответствующих последующих сканов.
Можно выполнить определение пиковых положений кривых взаимных корреляций и/или отображение полученной в результате кривой перфузии в зависимости от времени. Пиковое положение на кривой взаимной корреляции соответствует положению сдвига, который дает самую высокую корреляцию с гистограммой чистого скана. Альтернативно, можно вычислить и сравнить среднее значение, моду или медиану каждой гистограммы.
Можно вычислить и/или отобразить пространственную кривую "сердцевина-край" опухоли. Такая кривая позволяет показать среднюю плотность или относительную плотность, то есть поглощение по отношению к чистому скану, например, как функцию расстояния от центральной области.
Пользователь может изменить ОПИ или диапазон значений интенсивности после или до вычислений и отобразить результаты. Всякий раз, когда пользователь изменяет ОПИ или диапазон значений интенсивности, можно интерактивно обновлять отображаемые результаты. Пользователь может интерактивно изменить разбиение на центральную и крайнюю области опухоли путем регулировки с одной степенью свободы (например, колесо мыши, перемещение мыши по пространственной кривой сердцевина-край), и для пользователя можно предусмотреть непосредственную визуальную обратную связь при наложении цветов на опухоль. Более того, отображаемые кривые зависимости от времени для центральной и крайней областей можно интерактивно обновлять всякий раз, когда пользователь изменяет разбиение на центральную и крайнюю области.
Сегментацию выбранной пользователем опухоли на центральную область и периферийную крайнюю область можно выполнить автоматически. Усиление (кривые перфузионного поглощения) можно усреднить по этим областям. Для пользователя можно предусмотреть элемент пользовательского интерфейса для интерактивного изменения разбиения между центральной и крайней областями путем манипулирования или регулировки с одной степенью свободы (например, путем использования колеса мыши, элемента управления "ползунок" или мыши, перемещающей указатель по кривой-профилю от центра до края). Система позволяет автоматически поддерживать форму опухоли на основании содержания изображения, если пользователь производит изменение с одной степенью свободы. Одна степень свободы может представлять собой размер опухоли. Это можно легко выполнить путем вычисления трехмерного преобразования расстояний сегментированного объема. Воксели сегментации опухоли можно упорядочить путем увеличения расстояния до границы опухоли. Затем, любое разбиение включает в себя все воксели вплоть до конкретного значения расстояния. То же самое разбиение можно применить к любому из изображений ряда изображений с использованием предварительного взаимного совмещения локального объема, представляющего интерес.
После регулировки центральной или крайней области кривые зависимости от времени для центральной и/или крайней области можно обновить при интерактивной скорости. Это позволяет пользователю получить понимание и/или количественный анализ пространственно изменяющихся временных перфузионных характеристик опухоли. Вместо двух отдельных областей (и таким образом, кривых) также число N слоев можно идентифицировать в изображении, при этом слои образуют оболочки вокруг центральной области. Гистограммы и кривые перфузии можно вычислить и отобразить для любого из слоев.
Автоматическое выделение можно выполнить из соседней сети сосудов, характерной для данной опухоли, в соответствующих изображениях временного ряда. Выделенную сеть сосудов можно отобразить пользователю или можно наложить на автоматически сегментированную опухоль. Затем можно построить гистограмму плотности из локальной области, представляющей интерес (ОПИ), в которой частоты взвешиваются на предмет сосудистости каждого вокселя так, чтобы гистограмма отражала плотность сосудистой сети больше, чем плотность окружающей паренхимы (которая может изменяться по плотности вследствие своего упругого характера, не имея значения для диагностики).
Следует оценить, что изобретение также охватывает компьютерные программы, в частности, компьютерные программы на или в носителе, выполненном с возможностью применения изобретения на практике. Программа может иметь форму исходной программы, объектной программы, промежуточного источника кода или объектной программы, такой как частично компилированная форма, или любую другую форму, подходящую для использования при осуществлении способа согласно настоящему изобретению. Будет также оценено, что такая программа может иметь многочисленные различные архитектурные построения. Например, управляющую программу, реализующую функциональные возможности способа или системы согласно настоящему изобретению, можно разделить на одну или несколько подпрограмм. Специалистам в данной области техники будут очевидны многочисленные различные способы для распределения функциональных возможностей среди этих подпрограмм. Подпрограммы можно хранить вместе в одном исполняемом файле для формирования независимой программы. Такой исполняемый файл может содержать машиноисполняемые инструкции, например, инструкции процессора и/или инструкции интерпретатора (например, инструкции интерпретатора Java). Альтернативно, одна, или более или все подпрограммы могут храниться, по меньшей мере, в одном внешнем библиотечном файле и могут быть связаны статическим или динамическим способом с основной программой, например, во время прогона программы. Основная программа содержит, по меньшей мере, одно обращение, по меньшей мере, к одной из подпрограмм. К тому же, подпрограммы могут содержать функциональные обращения друг к другу. Варианты осуществления, которые относятся к компьютерному программному продукту, содержат машиноисполняемые инструкции, соответствующие каждому из этапов обработки, по меньшей мере, изложенных способов. Эти инструкции можно разделить на подпрограммы и/или хранить в одном или более файлах, которые могут быть связаны статическим или динамическим способом. Другой вариант осуществления, который относится к компьютерному программному продукту, содержит машиноисполняемые инструкции, соответствующие каждому из средств, по меньшей мере, одной из изложенных систем и/или продуктов. Эти инструкции можно разделить на подпрограммы и/или хранить в одном или более файлах, которые могут быть связаны статическим или динамическим способом.
Носитель компьютерной программы может представлять собой любой объект или устройство, которое может нести на себе программу. Например, носитель может включать в себя носитель информации, такой как ПЗУ, например, CD ROM, или полупроводниковую ПЗУ, или носитель магнитной записи, например, гибкий диск или жесткий диск. Кроме того, носитель может быть передаваемым носителем, таким как электрический или оптический сигнал, который можно передавать по электрическому или оптическому кабелю или с помощью радиоволн или другого средства. Когда программа реализуется в таком сигнале, носитель может быть образован с помощью такого кабеля или другого устройства или средств. Альтернативно, носитель может быть интегральной схемой, в которой встроена программа, или интегральной схемой, выполненной с возможностью выполнения или использования при выполнении соответствующего способа.
Следует отметить, что вышеупомянутые варианты осуществления иллюстрируют, а не ограничивают изобретение, и специалисты в данной области техники могут выполнить многочисленные альтернативные варианты осуществления без отклонения от объема прилагаемой формулы изобретения. В формуле изобретения любые ссылочные позиции, заключенные в скобки, не следует толковать как ограничивающие формулу изобретения. Использование глагола "содержать" и его спряжений не исключает наличия элементов или этапов, которые отличаются от тех, которые изложены в формуле изобретения. Единственное число не исключает наличия множества элементов. Изобретение можно осуществить посредством аппаратных средств, содержащих несколько отдельных элементов, и посредством компьютера, запрограммированного подходящим способом. В пункте формулы изобретения устройства, в котором перечислено несколько средств, несколько из этих средств можно осуществить с помощью одного или того же самого пункта аппаратных средств. Тот факт, что конкретные характеристики изложены во взаимно-различных зависимых пунктах формулы изобретения, не показывает, что комбинацию этих характеристик нельзя использовать с пользой.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оконтуривания аномальных зон на результатах перкуссионного томографического сканирования | 2022 |
|
RU2815435C2 |
| СПОСОБ БЕСКОНТАКТНОГО ЦВЕТОВОГО ДОПЛЕРОВСКОГО КАРТИРОВАНИЯ КРОВОТОКА В СОСУДАХ СЕТЧАТКИ ГЛАЗА И ЗРИТЕЛЬНОГО НЕРВА | 2020 |
|
RU2763677C1 |
| Способ прогнозирования эффективности химиотерапии при раке мочевого пузыря по данным магнитно-резонансной томографии | 2022 |
|
RU2800817C1 |
| ОЦЕНКА ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ УЛЬТРАЗВУКОВЫХ КОНТРАСТНЫХ ВЕЩЕСТВ | 2009 |
|
RU2492812C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ АНАЛИЗА ОБЛАСТИ, ПРЕДСТАВЛЯЮЩЕЙ ИНТЕРЕС, В ОБЪЕКТЕ С ИСПОЛЬЗОВАНИЕМ РЕНТГЕНОВСКИХ ЛУЧЕЙ | 2011 |
|
RU2575495C2 |
| Интеллектуальный способ диагностики и обнаружения новообразований в легких | 2018 |
|
RU2668699C1 |
| МОМЕНТАЛЬНАЯ КОРРЕКЦИЯ РЕЗУЛЬТАТОВ СЕГМЕНТАЦИИ ОПУХОЛИ | 2009 |
|
RU2531568C2 |
| Способ диагностики рака легкого на основе интеллектуального анализа формы, внутренней и внешней структур новообразований | 2018 |
|
RU2694476C1 |
| ВИЗУАЛИЗАЦИЯ ПЕРФУЗИИ | 2010 |
|
RU2541126C2 |
| ОЦЕНКА КАРОТИДНОЙ БЛЯШКИ С ПРИМЕНЕНИЕМ УЛЬТРАЗВУКОВОЙ ВИЗУАЛИЗАЦИИ С КОНТРАСТИРОВАНИЕМ | 2015 |
|
RU2690445C2 |
Изобретение относится к средствам анализа перфузионных изображений. Техническим результатом является повышение точности извлечения, относящееся к перфузии информации из изображения. Система содержит подсистему (7) идентификации части крайней области, окружающей центральную область поражения, являющуюся областью интереса, подсистему (1) вычисления множества частотных распределений значений интенсивности области интереса на изображениях; экстрактор (2) информации о перфузии для извлечения информации, которая относится к перфузии, из множества частотных распределений. 5 н. и 8 з.п. ф-лы, 2 ил.
1. Система для количественного анализа перфузионных изображений, содержащих элементы изображений, которые имеют значения интенсивности, связанные с ними, содержащая:
- подсистему (7) для идентификации области, предназначенную для идентификации, по меньшей мере, части крайней области, окружающей центральную область поражения, в качестве области, представляющей интерес;
- подсистему (1) для вычисления частотного распределения, предназначенную для вычисления множества частотных распределений значений интенсивности области, представляющей интерес, на изображениях; и
- экстрактор (2) информации о перфузии для извлечения информации, которая относится к перфузии, из множества частотных распределений.
2. Система по п.1, в которой экстрактор (2) информации о перфузии содержит детектор (3) сдвига для сравнения, по меньшей мере, двух из частотных распределений, вычисленных для различных изображений, для того, чтобы обнаружить сдвиг значений интенсивности частотного распределения;
- причем экстрактор (2) информации о перфузии выполнен с возможностью извлечения информации, которая относится к перфузии, на основании обнаруженного сдвига.
3. Система по п.2, в которой детектор (3) сдвига выполнен с возможностью сравнения множества частотных распределений с одним опорным частотным распределением для обнаружения соответствующих сдвигов соответствующих частотных распределений относительно опорного частотного распределения.
4. Система по п.2, в которой детектор сдвига содержит кросс-коррелятор (4) для выполнения взаимной корреляции, по меньшей мере, двух частотных распределений для получения кривой взаимной корреляции, причем детектор (3) сдвига выполнен с возможностью обнаружения сдвига на основании кривой взаимной корреляции.
5. Система по п.4, в которой детектор (3) сдвига дополнительно содержит детектор (5) пиков для обнаружения пика на кривой взаимной корреляции.
6. Система по п.2, в которой экстрактор (2) информации о перфузии содержит формирователь (6) кривой сдвига с возможностью объединения сдвигов, обнаруженных для соответствующих частотных распределений, для формирования кривой сдвига.
7. Система по п.1, в которой подсистема (7) для идентификации области содержит элемент (8) пользовательского интерфейса, позволяющий пользователю показывать границу между центральной областью и крайней областью с помощью одной степени свободы, причем одна степень свободы относится к размеру центральной области.
8. Система по п.1, дополнительно содержащая подсистему (9) сосудистости для связи значения сосудистости с элементом изображения, причем значение сосудистости представляет собой вероятность того, что элемент изображения принадлежит сосуду, при этом подсистема (1) для вычисления частотного распределения выполнена с возможностью взвешивания вклада значения интенсивности элемента изображения в частотное распределение на основании значения сосудистости.
9. Система по п.1, в которой информация, которая относится к перфузии, содержит, по меньшей мере, одно из следующего: время поступления контрастного вещества, количество контрастного вещества, протекающего через область, максимальное усиление, продолжительность максимального усиления, максимальную крутизну нарастания или производную по времени значений интенсивности, продолжительность максимальной крутизны нарастания, аппроксимацию аналитической кривой перфузии со свободными параметрами с наблюдаемой кривой в зависимости от времени.
10. Рабочая станция для формирования медицинских изображений, содержащая устройство отображения для отображения информации, которая относится к перфузии, дополнительно содержащая систему по п.1.
11. Устройство формирования изображения, содержащее сканер для формирования перфузионного изображения и систему по п.1.
12. Способ выполнения количественного анализа перфузионных изображений, содержащих элементы изображения, которые имеют значения интенсивности, связанные с ними, содержащий этапы, на которых:
- идентифицируют, по меньшей мере, часть крайней области, окружающей центральную область поражения, в качестве области, представляющей интерес;
- вычисляют (201) множество частотных распределений значений интенсивности области, представляющей интерес, на изображениях; и
- извлекают (202) информацию, которая относится к перфузии, из множества частотных распределении.
13. Машиночитаемый носитель, содержащий компьютерную программу, сохраненную на нем и содержащую инструкции для предписания процессорной системе выполнять этапы способа по п.12.
| US 20040106864 A1, 01.06.2004 | |||
| US 6665335 B1, 16.12.2003 | |||
| WO 2006015971 A1, 16.02.2006 | |||
| УСИЛЕНИЕ ЯДЕРНОГО МАГНИТНОГО РЕЗОНАНСА (ЯМР) И МАГНИТОРЕЗОНАНСНОЙ ВИЗУАЛИЗАЦИИ (МРВ) В ПРИСУТСТВИИ ГИПЕРПОЛЯРИЗОВАННЫХ БЛАГОРОДНЫХ ГАЗОВ | 1997 |
|
RU2186405C2 |
| СПОСОБ СТЕРЕОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ СТРУКТУРНОЙ ОРГАНИЗАЦИИ ОБЪЕКТОВ | 2002 |
|
RU2291488C9 |
| . | |||
Авторы
Даты
2015-02-10—Публикация
2010-06-23—Подача