Область техники, к которой относится изобретение
Настоящее изобретение относится к химическому устройству и способу синтеза и очистки радиофармацевтических препаратов, предназначенных для применения в позитронно-эмиссионной томографии (ПЭТ). Более конкретно, настоящее изобретение относится к системе для анализа жидкого образца биомаркера ПЭТ.
Уровень техники
Биомаркер используется для детального исследования биологической системы, и его можно получить путем "мечения" или маркировки определенных молекул, включая биомолекулы, с помощью радиоизотопов. Биомаркер, включающий в себя позитрон-излучающий радиоизотоп, требуется для позитронно-эмиссионной томографии (ПЭТ), неинвазивной диагностической процедуры для формирования изображений, которая используется для оценки перфузионной или метаболической, биохимической или функциональной активности различных систем органов человеческого тела. Так как ПЭТ является очень чувствительной биохимической технологией формирования изображений, и ранние предшественники болезни являются по своей природе, в основном, биохимическими, ПЭТ позволяет обнаружить многие болезни до того, как начинают происходить анатомические изменения, и часто до того, как становятся очевидными медицинские симптомы. ПЭТ похожа на другие технологии ядерной медицины, в которых радиофармацевтический препарат вводят пациенту для оценки метаболической активности в одной или более областях тела. Однако ПЭТ позволяет получить информацию, которая недоступна для традиционных технологий формирования изображений, таких как магниторезонансная томография (МРТ), компьютерная томография (КТ) и ультразвуковая эхография, которые изображают анатомическое строение пациента, а не физиологические особенности. Физиологическая активность позволяет обеспечить гораздо более раннюю степень обнаружения определенных форм болезни, в частности рака, по сравнению с протекающими во времени анатомическими изменениями.
Позитрон-излучающий радиоизотоп подвергается радиоактивному распаду, посредством чего его ядра испускают позитроны. В ткани человека позитрон неизбежно перемещается менее чем на несколько миллиметров перед взаимодействием с электроном, вследствие которого полная масса позитрона и электрона преобразуется в два фотона энергии. Фотоны направлены приблизительно на 180 градусов относительно друг друга, и их можно обнаружить одновременно в виде "синхронных" фотонов на противоположных сторонах тела человека. Современный ПЭТ-сканер обнаруживает один или оба фотона, и компьютерное восстановление полученных данных позволяет получить визуальное изображение распределения изотопа, и, следовательно, меченой молекулы внутри изображаемого органа.
Большая часть клинически важных позитрон-излучающих радиоизотопов производится на циклотронах. Циклотроны работают за счет ускорения электрически заряженных частиц вдоль внешних, квази-сферических орбит до заданной энергии выпуска, составляющей обычно порядка миллионов электрон-вольт.Электрически заряженные частицы с высокой энергией образуют непрерывный пучок, который проходит вдоль заданной траектории и бомбардирует мишень. Когда бомбардирующие частицы взаимодействуют с мишенью, на субатомном уровне происходит ядерная реакция, которая приводит к получению радиоизотопа. Радиоизотоп затем образует химическое соединение с другими веществами для синтеза радиохимического или радиофармацевтического препарата (здесь и далее "радиофармацевтический препарат"), подходящего для введения в тело человека. Циклотроны, которые обычно используются для производства радиоизотопов, предназначенных для применения в ПЭТ, представляют собой большие машины, которые требуют больших затрат, связанных с физическим пространством и радиационной защитой. Эти требования, наряду с соображениями стоимости, приводят к невозможности установки оборудования для производства радиофармацевтических препаратов, предназначенных для применения в ПЭТ, в отдельных больницах и томографических центрах.
Таким образом, в современной стандартной практике радиофармацевтические препараты для применения в ПЭТ синтезируются на централизованном производственном оборудовании. Радиофармацевтические препараты затем транспортируются в больницы и томографические центры на расстояния свыше трехсот километров (200 миль). Из-за относительно короткого периода полураспада небольшого числа клинически важных позитрон-излучающих радиоизотопов, предполагается, что большая часть радиоизотопов при такой перевозке будет распадаться и становиться бесполезной уже на стадии транспортировки. Чтобы гарантировать возможность введения пациенту достаточно большого образца активного радиофармацевтического препарата во время применения в процедуре ПЭТ, перед транспортировкой необходимо синтезировать гораздо большее количество радиофармацевтического препарата. Это включает в себя производство радиоизотопов и синтез радиофармацевтических препаратов в количествах, которые гораздо больше чем одна (1) единичная доза, в предположении, что многие из активных атомов распадутся во время транспортировки.
Необходимость транспортировки радиофармацевтических препаратов от производственного оборудования до больницы или томографического центра (в дальнейшем "место лечения") также определяет и природу изотопов, выбранных для процедур ПЭТ. В настоящее время наиболее широкое применение находят изотопы фтора и особенно фтор-18 (или F-18). Для применения в ПЭТ радиоизотоп F-18 обычно синтезируется в виде [18F] фтордезоксиглюкозы или [18F] FDG. F-18 широко используются главным образом из-за того, что его период полураспада, составляющий приблизительно 110 минут, дает достаточное время для транспортировки количества, пригодного для применения. Сложившаяся система централизованного производства и распределения в значительной степени препятствует применению других возможных радиоизотопов. В частности, углерод-11 применялся для ПЭТ, но его относительно короткий период полураспада, который составляет 20,5 минут, делает его применение затруднительным в тех случаях, когда радиофармацевтический препарат необходимо транспортировать на хоть сколько-нибудь значительное расстояние. Аналогичные соображения по большому счету исключают применение азота-13 (период полураспада 10 минут) и кислорода-15 (период полураспада 2,5 минуты).
Как и в любом медицинском приложении, включающем в себя использование радиоактивных материалов, контроль качества является важным при синтезе и использовании радиофармацевтических препаратов на основе биомаркера ПЭТ как для защиты пациента, так и для обеспечения эффективности вводимого радиофармацевтического препарата. Например, для синтеза [18F]FDG из трифлата маннозы существует ряд тестов контроля качества. Окончательный продукт [18F]FDG должен быть чистым, прозрачным раствором, свободным от твердых примесей; поэтому важно тестировать цвет и прозрачность окончательного радиофармацевтического раствора. Окончательный радиофармацевтический раствор обычно перед введением фильтруется через стерильный фильтр, и рекомендуется тестировать целостность этого фильтра после того, как синтезированный радиофармацевтический раствор прошел через него. Кислотность окончательного радиофармацевтического раствора должна находиться в допустимых пределах (для [18F]FDG pH находится приблизительно между 4,5 и 7,5, хотя этот диапазон может быть и другим в зависимости от применения и используемого радиофармацевтического индикатора). Окончательный радиофармацевтический раствор следует тестировать на наличие и уровни летучих органических соединений, таких как этанол или метилцианид, которые могут оставаться после завершения процесса синтеза. Кроме того, раствор следует тестировать на наличие краун-эфиров или других реагентов, которые используются в процессе синтеза, так как наличие этих реагентов в окончательной дозе приводит к проблемам. Более того, следует проводить тест на чистоту радиофармацевтического препарата окончательного раствора для того, чтобы гарантировать, что она является достаточно высокой для применяемого раствора. Другие тесты, такие как тесты на чистоту радионуклеидов, тесты на наличие бактериальных эндотоксинов и тесты на стерильность системы синтеза, известны в предшествующем уровне техники.
В настоящее время большинство из этих тестов выполняют для каждой партии радиофармацевтического препарата, которая включает несколько доз. Тесты контроля качества выполняются специалистами по отдельности, и время, необходимое для проведения всех тестов обычно находится в пределах 45 и 60 минут.
Сущность изобретения
В настоящем изобретении система для производства биомаркера ПЭТ включает в себя генератор радиоизотопов, радиофармацевтический производственный модуль и модуль контроля качества. Система для производства биомаркера ПЭТ предназначена для очень эффективного производства приблизительно одной (1) единичной дозы радиофармацевтического биомаркера. Установка в целом включает в себя маленький, маломощный циклотрон, ускоритель частиц или другой радиоизотопный генератор (в дальнейшем "ускоритель") для производства приблизительно одной (1) единичной дозы радиоизотопа. Система также включает в себя микрожидкостной химический производственный модуль. Химический производственный модуль или СРМ принимает единичную дозу радиоизотопа и реагентов для синтеза единичной дозы радиофармацевтического препарата.
Ускоритель производит за один цикл максимальное количество радиоизотопа, которое приблизительно равно количеству радиоизотопа, необходимому для микрожидкостного химического производственного модуля для синтеза единичной дозы биомаркера. Химический синтез, использующий микрореакторы или микрожидкостные чипы (или и то, и другое одновременно), гораздо более эффективен, чем химический синтез, использующий традиционную (макромасштабную) технологию. Выход продукта в процентах выше и время реакции меньше, таким образом, значительно уменьшается количество радиоизотопа, требуемого для синтеза единичной дозы радиофармацевтического препарата. Соответственно, так как ускоритель предназначен для производства за один цикл только таких относительно небольших количеств радиоизотопа, максимальная мощность пучка, вырабатываемого ускорителем, приблизительно на два-три порядка меньше по величине по сравнению с традиционным ускорителем частиц. В качестве прямого следствия этого существенного снижения максимальной мощности пучка, ускоритель становится значительно меньше и легче по сравнению с традиционным ускорителем частиц, имеет менее строгие требования к инфраструктуре и требует гораздо меньше электрической энергии. Помимо этого многие из компонентов маленького, маломощного ускорителя являются менее дорогостоящими, чем компоненты традиционных ускорителей. Поэтому можно использовать маломощный ускоритель совместно с СРМ на территории места лечения. Так как не нужно синтезировать радиофармацевтические препараты в центральном местоположении и затем транспортировать в отдаленные места лечения, снижаются необходимые количества получаемого радиофармацевтического препарата, а, кроме того, при необходимости можно использовать другие изотопы, такие как углерод-11.
Если ускоритель и СРМ находятся в подвальном помещении больницы или находятся в здании напротив томографического центра, то радиофармацевтические препараты для ПЭТ можно вводить пациентам почти сразу же после синтеза. Однако исключение или значительное укорочение фазы транспортировки не устраняет необходимость проведения тестов контроля качества СРМ и самого полученного в результате радиофармацевтического раствора. До сих пор весьма важным является уменьшение промежутка времени, который требуется для выполнения этих тестов контроля качества, для того, чтобы получить преимущество от сокращения времени между синтезом и вводом. Обычных 45-60 минут, которые длятся тесты контроля качества радиофармацевтических препаратов, произведенных в макромасштабе, становится явно недостаточно. Кроме того, поскольку ускоритель и СРМ производят радиофармацевтический раствор, который приблизительно равен только одной (1) единичной дозе, важно, чтобы в тестах контроля качества не использовалось слишком много радиофармацевтического раствора; после того как некоторую часть раствора отбирают для тестирования, должно остаться достаточное количество радиофармацевтического раствора, необходимого для составления эффективной единичной дозы.
Карта образцов и модуль контроля качества позволяют оператору проводить тесты контроля качества за меньшее время с использованием микроскопических тестовых образцов из радиофармацевтического раствора. Карта образцов работает совместно с СРМ для отбора образцов радиофармацевтического раствора объемом вплоть до 100 микролитров на образец. Карта образцов затем взаимодействует с модулем контроля качества (или QCM) для подачи образцов в ряд тестовых сосудов, где образцы подвергаются ряду автоматизированных диагностических тестов. Так как тесты контроля качества автоматизированы и проводятся параллельно на маленьких образцах, процесс тестирования контроля качества можно завершить меньше чем за 20 минут. Кроме того, в традиционной схеме макромасштабного радиофармацевтического синтеза и тестирования контроля качества, радиофармацевтический раствор будет производиться в виде партии, и тесты контроля качества будут выполняться всей партии целиком, хотя в каждой партии производится несколько доз радиофармацевтического препарата. В данном случае, так как система для производства биомаркера ПЭТ производит приблизительно одну единичную дозу за цикл, по меньшей мере, некоторые тесты контроля качества можно выполнять для каждой дозы, а не для партии в целом.
Краткое описание чертежей
Вышеупомянутые особенности настоящего изобретения будут более очевидны из следующего подробного описания изобретения, которое дается со ссылками на сопроводительные чертежи, на которых:
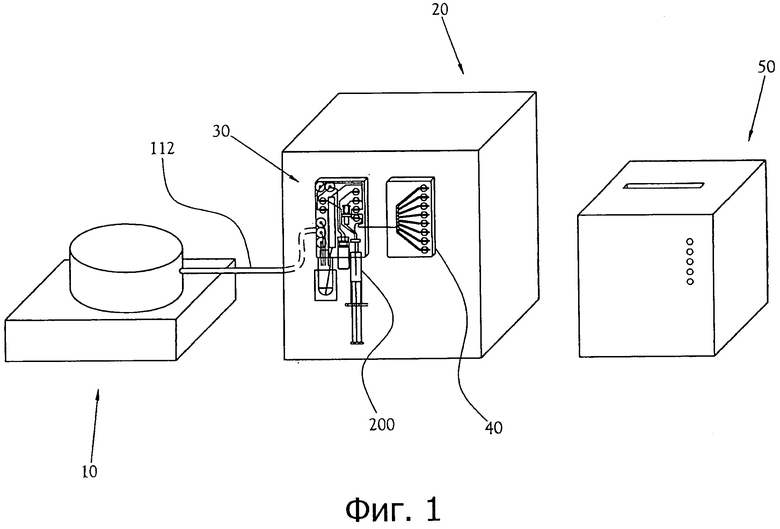
фиг.1 - схематичное изображение одного из вариантов осуществления всей системы для производства биомаркера ПЭТ, включающей в себя ускоритель, химический производственный модуль (СРМ), карту синтеза дозы, карту образцов и модуль контроля качества (QCM);
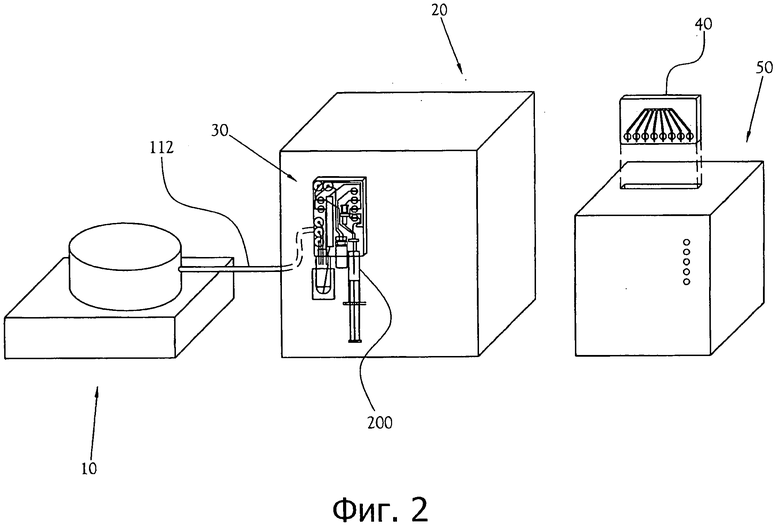
фиг.2 - другой вид варианта осуществления, показанного на фиг.1, показывающий карту образцов, взаимодействующую с модулем контроля качества (QCM);
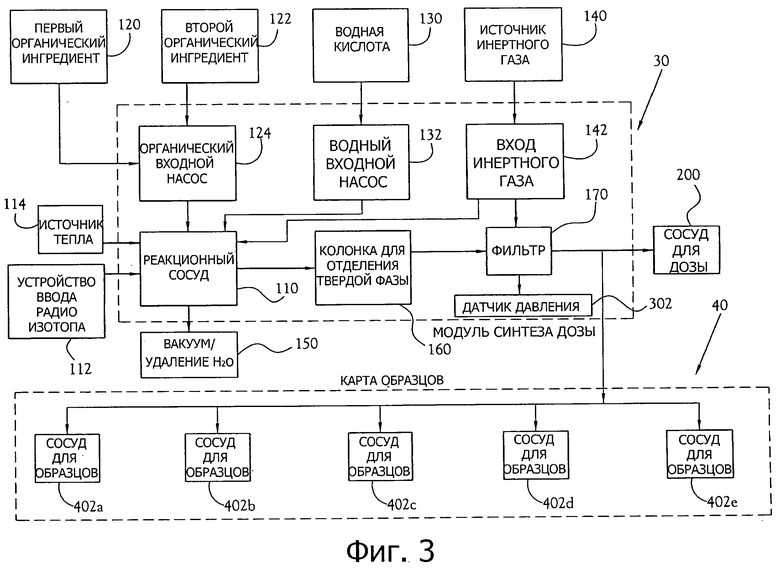
фиг.3 - блок-схема одного из вариантов осуществления химического производственного модуля (СРМ), карты синтеза дозы и карты образцов;
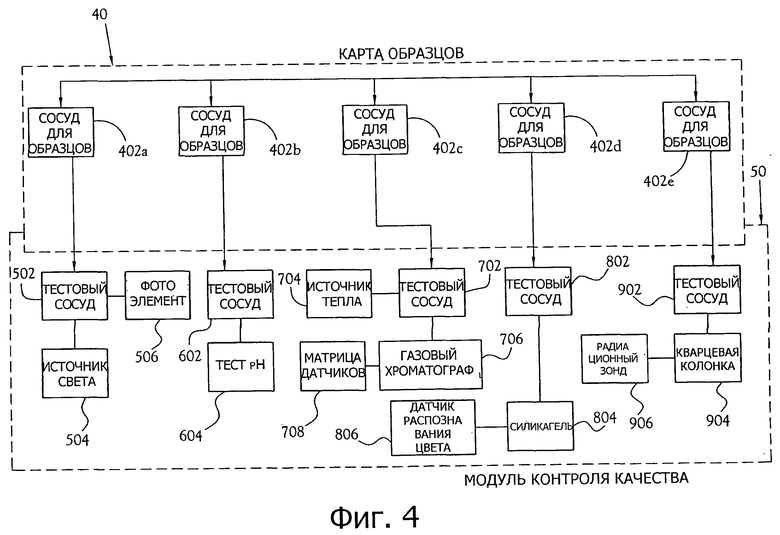
фиг.4 - блок-схема одного из вариантов осуществления карты образцов, взаимодействующей с одним вариантом осуществления модуля контроля качества (QCM); и
фиг.5 - схематичное изображение одного из вариантов осуществления карты синтеза дозы и карты образцов.
Осуществление изобретения
Ниже приводится подробное описание химического производственного модуля и карты синтеза дозы для радиофармацевтической производственной схемы биомаркера ПЭТ. Однако настоящее изобретение можно воплотить в многочисленных различных формах, и его не следует толковать как ограниченное изложенными здесь вариантами осуществления.
В значительной степени, эти варианты осуществления описаны для того, чтобы гарантировать, что это раскрытие является исчерпывающим и полным, и чтобы гарантировать, что оно полностью передает масштаб изобретения специалистам в данной области техники.
Химический производственный модуль, карта синтеза дозы и карта образцов работают совместно с полной системой для производства биомаркера ПЭТ. Как показано на фиг.1, один из вариантов осуществления системы для производства биомаркера ПЭТ содержит ускоритель 10, который производит радиоизотопы; химический производственный модуль (или СРМ) 20; карту синтеза дозы 30; карту образцов 40; и модуль контроля качества (или QCM) 50. После получения радиоизотопа в ускорителе 10 радиоизотоп перемещается через трубку для подачи радиоизотопа 112 в карту синтеза дозы 30, прикрепленную к СРМ 20. СРМ 20 содержит реагенты и растворители, которые требуются во время процесса синтеза радиофармацевтического препарата. В карте синтеза дозы 30 радиофармацевтический раствор синтезируется из радиоизотопа и затем очищается для тестирования и введения. После синтеза и очистки малая часть полученного в результате радиофармацевтического раствора отводится в карту образцов 40, тогда как оставшаяся часть перетекает в сосуд дозы 200. Как показано на фиг.2, после того, как образцы радиофармацевтического раствора перетекли в карту образцов 40, оператор удаляет карту образцов 40 из СРМ 20 и соединяет ее с QCM 50, где ряд диагностических инструментов выполняет автоматизированные тесты контроля качества по отношению к образцам.
На фиг.3 и 4 представлен более подробный общий вид полных процессов синтеза и тестирования контроля качества для одного варианта осуществления настоящего изобретения. В этом варианте осуществления, содержащийся радиоизотоп представляет собой фтор-18 (F-18), полученный в результате бомбардировки в циклотроне тяжелой воды, содержащей изотоп кислорода-18. Однако карта образцов и модуль контроля качества также работают с системами синтеза радиофармацевтического препарата, которые используют другие радиоизотопы, включая углерод-11, азот-13 и кислород-15.
Как показано на фиг.3, радиоизотоп поступает в реакционную камеру или реакционный сосуд 110 из трубки 112 для подачи радиоизотопа. На этом этапе радиоизотоп F-18 все еще смешан с тяжелой водой из генератора биомаркера. Далее первый органический ингредиент вводится в реакционный сосуд 110 из камеры для хранения реагента 120 с помощью входного насоса 124 для органических реагентов. В некоторых вариантах осуществления, первый органический ингредиент включает в себя раствор калия, закомплексованного с 1,10-диаза-4,7,13,16,21,24-гексаоксабицикло[8.8.8]гексакозаном (который обычно называется Криптофиксом 222™, здесь и далее "Криптофикс") или аналогичным краун-эфиром. Во многих вариантах осуществления, комплекс калий-криптофикс или аналогичный органометаллический комплекс переносится ацетонитрилом в качестве растворителя. Калий активирует радиоизотоп фторида F-18, тогда как криптофикс связывает атомы калия и препятствует образованию комплекса калий-фторид. Далее через вход газа 142 реакционный сосуд 110 заполняется инертным газом, таким как сухой азот, при этом газ хранится в зоне для хранения 140 внутри или рядом с СРМ 20. Далее смесь в реакционном сосуде 110 нагревается с помощью находящегося поблизости теплового источника 114 для удаления оставшейся тяжелой воды путем испарения азеотропной смеси вода/ацетонитрил. Вакуум 150 помогает удалить испаренную воду. Затем входной насос 124 для органических реагентов добавляет второй органический ингредиент из камеры для хранения второго реагента 122 в смесь, находящуюся в реакционном сосуде 110. Во многих вариантах осуществления второй органический ингредиент представляет собой трифлат маннозы в сухом ацетонитриле. Раствор затем нагревают при приблизительно 110 градусах по Цельсию в течение приблизительно двух минут. На этом этапе F-18 соединяется с маннозой с образованием непосредственного предшественника [18F]FDG, обычно 18F-тетраацетат фтордезоксиглюкозы (FTAG). Далее водную кислоту (во многих вариантах осуществления водную соляную кислоту) вводят из камеры для хранения 130 через водный входной насос 132. Соляная кислота удаляет защитные ацетиловые группы на 18F-FTAG, оставляя 18F-фтордезоксиглюкозу (то есть [18F]FDG).
Синтезированный [18F]FDG необходимо очистить перед тестированием и введением. [18F]FDG, находящийся в растворе, проходит из реакционного сосуда 110 через колонку для твердофазной экстракции 160. В некоторых вариантах осуществления настоящего изобретения, колонка для твердофазной экстракции 160 содержит участок, наполненный ионно-обменной смолой, участок, наполненный оксидом алюминия, и участок, наполненный углеродом-18. [18F]FDG затем проходит через фильтр 170, который во многих вариантах осуществления включает в себя ультратонкий фильтр с диаметром пор 0,22 микрометра.
После того как радиофармацевтический раствор прошел через фильтр 170, некоторая часть раствора отводится в карту образцов 40, которая содержит ряд сосудов для образцов 402(а-е), каждый из которых в некоторых вариантах осуществления удерживает приблизительно 10 микролитров раствора. Число сосудов для образцов может меняться в соответствии с числом тестов контроля качества, которые будут выполнять для данного цикла, и система адаптирована для работы с различными картами образцов, содержащими переменное число сосудов для образцов. Оставшаяся часть радиофармацевтического раствора (то есть та часть раствора, которая не была отведена для тестирования контроля качества) втекает в дозаторный сосуд 200, подготовленный для введения пациенту.
Когда образцы находятся в сосудах для образцов 402а-е карты образцов 40, оператор вставляет карту образцов 40 в QCM 50, как показано на фиг.2. Как показано на фиг.4, радиофармацевтические образцы перемещаются из сосудов для образцов 402а-е в тестовые сосуды 502, 602, 702, 802 и 902 в QCM 50. Внутри QCM 50 существуют инструменты для выполнения ряда автоматизированных тестов контроля качества для каждой партии радиофармацевтического препарата, произведенного с помощью системы для синтеза радиофармацевтического препарата.
Для проведения тестирования на цвет и прозрачность источник 504 света просвечивает белым светом насквозь образец, который находится в тестовом сосуде 502. Фотоэлемент 506 затем обнаруживает свет, который прошел через образец, и измеряет интенсивность этого света и цвет, сравнивая их с контрольными образцами.
Для того чтобы тестировать кислотность радиофармацевтического раствора, устройство тестирования pH 604 (то есть пробник pH или полоска с цветовой шкалой для определения pH) измеряет pH образца в сосуде для образца 602.
Для проведения теста на наличие летучих органических веществ тепловой источник 704 нагревает образец в тестовом сосуде 702 приблизительно до 150 градусов по Цельсию таким образом, чтобы водные компоненты образца (теперь в форме газа) попадали в расположенный рядом газовый хроматограф 706. Микроматрица датчиков газа 708 (неофициально "электронный нос") обнаруживает затем наличие и концентрацию (например, в частях на миллион (ppm)) таких химических веществ, как метилцианид и этанол.
Для проведения тестирования на наличие криптофикса образец в тестовом сосуде 802 размещают на геле 804, содержащем силикагель с йодоплатинатом. Образец и гель 804 затем нагревают, и датчик распознавания цвета 806 измеряет полученный в результате цвет образца, при этом желтый цвет показывает наличие криптофикса.
Для проведения тестирования радиохимической чистоты образца образец в тестовом сосуде 902 элюирует через колонку 904, заполненную диоксидом кремния, с использованием смеси носителей из ацетонитрила и воды. В некоторых вариантах осуществления ацетонитрил и вода смешиваются в соотношении 9:1. Радиационный зонд 906 измеряет активность раствора, когда тот элюируется. Так как [18F]FDG характеризуется временем элюирования, которое можно предсказать с высокой точностью, зонд 906 измеряет процентное соотношение активности элюирующегося, в тот или в близкий момент, который соответствует предсказанному времени элюирования для [18F]FDG. Процентное соотношение 95% или выше означает допустимую радиохимическую чистоту.
Кроме того, для каждой производимой дозы выполняют также тестирование целостности фильтра. Как показано на фиг.3, после того, как радиофармацевтический раствор прошел через фильтр 170, целостность фильтра 170 тестируют путем пропускания инертного газа из входа инертного газа 142 через фильтр 170 при повышенном давлении. Датчик 302 давления измеряет давление инертного газа после фильтра 170 и обнаруживает, остался ли фильтр 170 неповрежденным. Фильтр 170 должен поддерживать целостность при давлениях, по меньшей мере, 3,5 кг/см2 (50 psi).
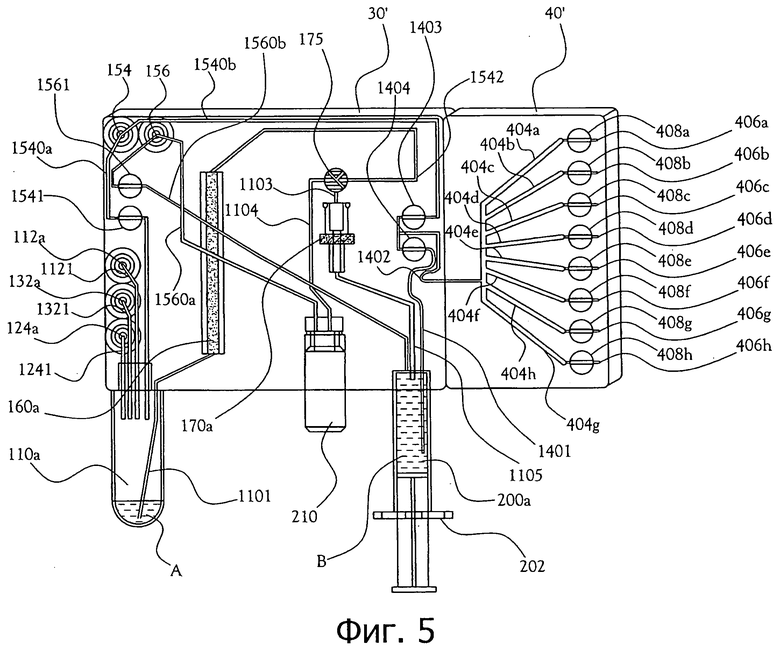
На фиг.5 изображен схематичный вид одного из вариантов осуществления карты синтеза дозы 30' совместно с прикрепленной картой образцов 40'. Карта синтеза дозы 30' включает в себя реакционный сосуд 110а, где синтезируется радиофармацевтический раствор. Устройство ввода радиоизотопа 112а вводит радиоизотоп F-18 в реакционный сосуд 110а через входной канал для радиоизотопов 1121. На этом этапе радиоизотоп все еще смешан с тяжелой водой из генератора биомаркера. Далее устройство ввода органических веществ 124а вводит раствор комплекса калий-криптофикс в ацетонитриле в реакционный сосуд 110а через канал для ввода органических веществ 1241. Комбинированное с вакуумным насосом устройство для ввода азота 154 накачивает газообразный азот в реакционный сосуд 110а через газовый канал 1540а и клапан 1541, причем клапан находится в это время в открытом положении. Смесь А в реакционном сосуде 110а нагревается в атмосфере азота для азеотропного удаления воды из смеси А, причем испаренная вода откачивается через газовый канал 1540а и вакуумный насос 154. Далее устройство ввода органических веществ 124а вводит трифлат маннозы в сухом ацетонитриле в реакционный сосуд 110а через канал для ввода органических веществ 1241. Раствор нагревается приблизительно до 110 градусов по Цельсию в течение приблизительно двух минут. На этом этапе F-18 соединяется с маннозой с образованием FTAG, промежуточного предшественника [18F]FDG. Далее водный раствор соляной кислоты вводится в реакционный сосуд 110а через вход для воды 132а и канал для воды 1321. Соляная кислота удаляет защитные ацетильные группы у промежуточного соединения [18F]FTAG с получением [18F]-фтордезоксиглюкозы (то есть [18F]FDG).
После завершения синтеза [18F]FDG, находящийся в растворе, переходит из реакционного сосуда 110а через постреакционный канал 1101 в колонку для твердофазной экстракции 160а, в которой некоторые нежелательные вещества удаляются из раствора, очищая таким образом радиофармацевтический раствор. В некоторых вариантах осуществления настоящего изобретения, колонка для твердофазной экстракции (SPE) 160а содержит участок с ионообменной смолой, участок, наполненный оксидом алюминия, и участок, наполненный углеродом-18. Радиофармацевтический препарат проходит через колонку SPE 160а с подвижной фазой, которая во многих вариантах осуществления включает в себя ацетонитрил из устройства ввода органического вещества 124а. Так как некоторая часть из подвижной фазы и примеси появляются из колонки SPE 160а, они проходят через второй постреакционный канал 1542 и через трехходовой клапан 175 и канал для отходов 1104 в емкость для отходов 210. После того, как очищенный радиофармацевтический раствор выходит из колонки SPE 161, он затем проходит через второй постреакционный канал 1542 и через трехходовой клапан 175 в фильтровальный канал 1103 и затем через фильтр 170а. Фильтр 170а удаляет другие примеси (включающие примеси в виде твердых частиц), дополнительно очищая таким образом радиофармацевтический раствор. Во многих вариантах осуществления фильтр 170а включает в себя ультратонкий фильтр с диаметром пор приблизительно 0,22 микрометра.
После того, как радиофармацевтический раствор прошел через фильтр 170а, очищенный радиофармацевтический раствор перемещается через канал для пропускания очищенного раствора 1105 в емкость 200а для введения стерильной дозы, который в проиллюстрированном варианте осуществления входит в состав шприца 202. В некоторых вариантах осуществления сосуд для введения дозы заранее заполняется смесью фосфатного буфера и физиологического раствора. Когда очищенный радиофармацевтический раствор заполнит емкость для введения стерильной дозы 200а, некоторая часть раствора В отводится через канал для выделения 1401, открытый клапан 1403 и передаточный канал 1402 в карту образцов 40'. Карта образцов 40' содержит ряд ответвлений 404a-h для образцов, которые удерживают отдельные аликвоты раствора для предстоящего тестирования, и ряд клапанов 408a-h, которые на этой стадии закрыты. После того, как аликвоты тестовых образцов радиофармацевтического раствора собраны, карта образцов 40' отделяется от карты синтеза дозы 30' и вставляется в QCM, как показано на фиг.2 и 4. Аликвоты затем перемещаются через теперь уже открытые клапаны 408a-h в выходные разъемы для образцов 406a-h, из которых аликвоты проходят в тестовые сосуды, как показано на фиг.4. В некоторых вариантах осуществления каждое из ответвлений для образцов 404a-h удерживает приблизительно 10 микролитров раствора образца. Количество ответвлений для образцов может изменяться в зависимости от числа тестов контроля качества, которые будут выполняться для данной партии, кроме того, система адаптирована для работы с различными картами образцов, которые содержат различное количество ответвлений для образцов. После того, как аликвоты образцов прошли в карту образцов 40', любой избыточный раствор, оставшийся в сосуде для введения дозы 200а, удаляется через вентиляционное отверстие 156 через первый вентиляционный канал 1560b и оттуда перемещается через открытый клапан 1561 и через второй вентиляционный канал 1560а в емкость для отходов 210. Вакуумный насос 154 откачивает оставшийся раствор из передаточного канала 1402 через теперь уже открытый клапан 1403 и канал для откачки раствора 1540b.
В некоторых вариантах осуществления настоящего изобретения СРМ 20 содержит достаточное количество реагентов и растворителей, необходимых для выполнения многочисленных циклов синтеза радиофармацевтического препарата без перезагрузки. В самом деле, в некоторых вариантах осуществления СРМ 20 загружается реагентами и растворителями приблизительно один раз в месяц, чего оказывается достаточно для производства нескольких десятков или даже нескольких сотен доз радиофармацевтического препарата. Поскольку реагенты и растворители хранятся в СРМ 20, по сравнению с известными системами становится легче хранить реагенты и растворители стерильными и незагрязненными. В некоторых вариантах осуществления с загрязнением борются и стерильность среды поддерживают путем удаления карты синтеза 30 и карты образцов 40 после каждого цикла; эти компоненты системы адаптированы для одноразового использования.
Таким образом, каждая партия реагентов и растворителей, которые периодически загружаются в СРМ 20, может являться источником для нескольких доз радиофармацевтического препарата, причем каждая доза будет производиться в отдельном цикле. Некоторые тесты контроля качества выполняются для каждой произведенной дозы, в то время как другие тесты контроля качества выполняются для партии доз. Например, в одном варианте осуществления настоящего изобретения, тест на целостность фильтра, тест на цвет и прозрачность, тест на кислотность, тест на летучие органические вещества, тест на химическую чистоту и тест на радиохимическую чистоту выполняются для каждой дозы. С другой стороны, некоторые тесты контроля качества необходимо выполнять только один раз или два раза на партию, например это могут быть такие тесты, как тест на радионуклеидную чистоту (с использованием радиационного зонда для измерения периода полураспада F-18 в [18F]FDG), тест на бактериальную интоксикацию и тест на стерильность. Эти тесты выполняются обычно для первой и последней дозы из каждой партии. Так как тесты контроля качества для партии проводятся реже, их можно не включать в QCM, а поручать специалистам, использующим отдельное лабораторное оборудование.
Хотя настоящее изобретение проиллюстрировано с помощью одного варианта осуществления, и хотя проиллюстрированный вариант осуществления был описан в деталях, заявитель не намеревается ограничивать или так или иначе сужать объем прилагаемой формулы изобретения этими подробностями. Специалистам в данной области техники очевидны дополнительные модификации настоящего изобретения. Поэтому настоящее изобретение в своих более широких аспектах не ограничивается специфическими подробностями, иллюстративными устройством и способами, а также показанными и описанными примерами. Соответственно, возможны отступления от таких специфических подробностей без отклонения от сущности и объема общей изобретательной концепции заявителя.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСОВЕРШЕНСТВОВАННЫЙ ГЕНЕРАТОР БИОМАРКЕРОВ | 2011 |
|
RU2581032C2 |
| СПОСОБЫ И УСТРОЙСТВО ДЛЯ СИНТЕЗИРОВАНИЯ РАДИОФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ И ИХ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ | 2011 |
|
RU2631500C2 |
| СПОСОБ ОСУЩЕСТВЛЕНИЯ МНОЖЕСТВА ПРОЦЕССОВ СИНТЕЗА ДЛЯ ПОЛУЧЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКОГО СРЕДСТВА СЕРИЯМИ, УСТРОЙСТВО И КАССЕТА ДЛЯ ОСУЩЕСТВЛЕНИЯ ДАННОГО СПОСОБА | 2016 |
|
RU2721551C2 |
| КОМПОЗИЦИЯ 18F- ФЛУЦИКЛОВИНА В ЦИТРАТНЫХ БУФЕРАХ | 2012 |
|
RU2623163C2 |
| СТЕРЕОСЕЛЕКТИВНЫЙ СИНТЕЗ АМИНОКИСЛОТ ДЛЯ ПОЛУЧЕНИЯ ИЗОБРАЖЕНИЯ ОПУХОЛИ | 2006 |
|
RU2376282C2 |
| СТАБИЛИЗАЦИЯ РАДИОФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ | 2008 |
|
RU2474435C2 |
| Раствор элюента | 2011 |
|
RU2608932C2 |
| РАДИОФАРМАЦЕВТИЧЕСКИЕ ПРОДУКТЫ | 2007 |
|
RU2448733C2 |
| НУКЛЕОФИЛЬНОЕ ФТОРИРОВАНИЕ В ТВЕРДОЙ ФАЗЕ | 2002 |
|
RU2315769C9 |
| СПОСОБ ПОЛУЧЕНИЯ О-(2'-[F]ФТОРЭТИЛ)-L-ТИРОЗИНА | 2015 |
|
RU2583371C1 |
Изобретение относится к микрожидкостной радиофармацевтической системе. Система включает реакционный сосуд, адаптированный для приема радиоизотопа, выбранного из углерода-11 и фтора-18, и одного реагента, причем реакционный сосуд связан с источником тепла, посредством которого, когда радиоизотоп и реагент смешиваются в реакционном сосуде, к реакционному сосуду из теплового источника подводится тепло, и синтезируется радиофармацевтический раствор. Система также включает колонку для твердофазной экстракции, адаптированную для очистки радиофармацевтического раствора, фильтр, адаптированный для стерилизации радиофармацевтического раствора, и сосуд, адаптированный для приема радиофармацевтического раствора после его прохождения через колонку и через фильтр. При этом реакционный сосуд, колонка для твердофазной экстракции и фильтр входят в состав одноразовой карты, причем карта выбрасывается после одного цикла. Указанная система отмасштабирована для производства за один цикл очищенного радиофармацевтического раствора в количестве, равном одной единичной дозе радиофармацевтического препарата, но не меньше одной единичной дозы радиофармацевтического препарата. Заявленная система обеспечивает ускорение процесса получения радиофармацевтического препарата без загрязнения компонентов системы после предыдущего цикла синтеза/очистки. 2 з.п. ф-лы, 5 ил.
1. Микрожидкостная радиофармацевтическая система синтеза, содержащая:
реакционный сосуд, адаптированный для приема радиоизотопа и по меньшей мере одного реагента, причем реакционный сосуд связан с источником тепла, посредством которого, когда упомянутый радиоизотоп и упомянутый по меньшей мере один реагент смешиваются в упомянутом реакционном сосуде, к упомянутому реакционному сосуду из упомянутого теплового источника подводится тепло, и синтезируется радиофармацевтический раствор;
колонку для твердофазной экстракции, адаптированную для очистки упомянутого радиофармацевтического раствора;
фильтр, адаптированный для стерилизации упомянутого радиофармацевтического раствора; и
сосуд, адаптированный для приема упомянутого радиофармацевтического раствора после его прохождения через упомянутую колонку для твердофазной экстракции и через упомянутый фильтр, где указанный сосуд предназначен для приема очищенного радиофармацевтического раствора в количестве, приблизительно равном одной (1) единичной дозе радиофармацевтического препарата, но не меньше одной единичной дозы радиофармацевтического препарата;
где упомянутый реакционный сосуд, упомянутая колонка для твердофазной экстракции и упомянутый фильтр входят в состав одноразовой карты, причем упомянутая карта выбрасывается после одного (1) цикла, и где указанная система отмасштабирована для производства за один цикл очищенного радиофармацевтического раствора в количестве, приблизительно равном одной (1) единичной дозе радиофармацевтического препарата, но не меньше одной единичной дозы радиофармацевтического препарата,
при условии, что упомянутый радиоизотоп выбран из углерода-11 и фтора-18.
2. Система по п.1, дополнительно содержащая карту образцов, адаптированную для приема множества аликвот упомянутого очищенного радиофармацевтического раствора для тестирования после упомянутого прохождения очищенного радиофармацевтического раствора через упомянутую колонку для твердофазной экстракции и через упомянутый фильтр.
3. Система по п.1, в которой упомянутый радиофармацевтический препарат представляет собой [18F]-2-фтор-2-дезокси-D-глюкозу.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2015-02-10—Публикация
2010-09-21—Подача