УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
1. Область техники, к которой относится изобретение
Для настоящей заявки испрашивается приоритет в соответствии с предварительной заявкой США № 61/148,610, поданной 30 января 2009 г.
Настоящее изобретение относится к поддерживающим ткани медицинским устройствам и, в частности, к расширяющимся (расширяемым) несъемным устройствам, которые имплантируют в просвет тела живого животного или человека для поддержки органа и сохранения раскрытого состояния и которые содержат отверстия для доставки множества лечебных средств к месту вмешательства, а также поверхностное покрытие из антитромботического средства.
2. Обзор состояния техники
Раньше уже разрабатывали постоянные или биоразлагаемые устройства для имплантации в проход в теле, чтобы поддерживать раскрытое состояние прохода. Данные устройства обычно вводили чрескожно и проводили транслюминально до установки в требуемое место. Затем данные устройства либо расширяют механически, например расширением оправки или баллона, расположенного внутри устройства, либо расширяются самостоятельно путем высвобождения накопленной энергии после активизации внутри тела. После расширения внутри просвета данные устройства, называемые стентами, инкапсулируются внутри ткани тела и становятся постоянным имплантатом.
Известные конструкции стентов содержат спиральные стенты из одножильной проволоки (патент США № 4969458); сварные металлические каркасы (патенты США №№ 4733665 и 4776337); и, в основном, тонкостенные металлические цилиндры с осевыми прорезями, сформированными по окружности (патенты США №№ 4733665; 4739762; и 4776337). Известные конструкционные материалы для применения в стентах содержат полимеры, органические тканые материалы и биосовместимые металлы, например нержавеющую сталь, золото, серебро, тантал, титан и сплавы с памятью формы, например никель-титановый сплав.
В патенте США № 6241762, который в полном объеме включен в настоящую заявку путем отсылки, предлагается непризматическая конструкция стента, которая устраняет некоторые недостатки функциональных характеристик предшествующих стентов. Кроме того, предпочтительные варианты осуществления, описанные в данном патенте, обеспечивают стент с крупными недеформирующимися распорными и соединительными элементами, которые могут содержать лунки, не снижающие механических свойств распорных и соединительных элементов или устройства в целом. Кроме того, данные лунки могут служить как крупные защищенные емкости для доставки различных лечебных средств в место имплантации устройства, без обязательного поверхностного покрытия на стенте.
Среди многих проблем, которые можно решить посредством локальной доставки лечебных средств из стента, одной из наиболее важных является рестеноз. Рестеноз является основным осложнением, которое может возникать после таких сосудистых вмешательств, как ангиопластика и имплантация стентов. Согласно простому определению, рестеноз является ранозаживляющим процессом, который уменьшает диаметр просвета сосуда в результате отложения внеклеточного матрикса и пролиферации сосудистых гладкомышечных клеток, и который может, в конечном счете, иметь следствием повторное сужение или даже повторную закупорку просвета. Несмотря на внедрение усовершенствованных хирургических методов, устройств и фармакологических средств, общая скорость рестеноза для обнаженных металлических стентов, согласно сообщениям, остается в диапазоне от приблизительно двадцати пяти процентов до приблизительно пятидесяти процентов в течение от шести до двенадцати месяцев после операции ангиопластики. Для лечения данного состояния часто требуются дополнительные процедуры реваскуляризации, что усиливает травмы и повышает риск для пациента.
Обычные стенты с поверхностными покрытиями из различных лечебных средств показали перспективные результаты по ослаблению рестеноза. В патенте США № 5716981, например, предложен стент, который снабжен поверхностным покрытием из композиции, содержащей полимер-носитель и паклитаксел. В патенте подробно описаны способы нанесения покрытий на поверхности стентов, например распыление и окунание, а также требуемый характер самого покрытия, а именно: покрытие должно «покрывать стент гладко и ровно» и «обеспечивать равномерное, предсказуемое, продолжительное высвобождение антиангиогенного фактора». Однако поверхностные покрытия, могут обеспечивать лишь малозначительное фактическое регулирование кинетики высвобождения лечебных средств. Данные покрытия неизбежно являются очень тонкими, обычно, глубиной от пяти до восьми микрометров. Площадь поверхности стента является сравнительно очень большой, и поэтому весь объем лечебного средства характеризуется очень коротким путем диффузии до выделения в окружающую ткань. Получаемый профиль кумулятивного высвобождения лекарства характеризуется значительным начальным резким подъемом, завершаемым быстрым достижением асимптоты, вместо требуемого «равномерного продолжительного высвобождения» или линейного высвобождения.
Увеличение толщины поверхностного покрытия оказывает положительное влияние в отношении улучшения кинетики высвобождения лекарства, в том числе, дает возможность лучше регулировать высвобождение лекарства и увеличивать лекарственную закладку. Однако увеличение толщины покрытия приводит к увеличению общей толщины стенки стента. Это нежелательно по ряду причин, включая возможность усиления травм просвета сосуда во время имплантации, уменьшение доступного кровотоку поперечного сечения просвета после имплантации и повышенную уязвимость покрытия для механического повреждения или повреждения во время расширения и имплантации. Толщина покрытия является одним из нескольких факторов, которые влияют на кинетику высвобождения лечебного средства, и, следовательно, ограничения толщины ограничивают диапазон скоростей, сроков и подобных характеристик высвобождения, которые можно обеспечивать.
Поверхностные покрытия могут также ограничивать доставку нескольких лекарств из стента. Например, если из поверхностного покрытия требовалось доставлять несколько лекарств, то скорости высвобождения, периоды доставки и другие характеристики высвобождения невозможно было легко регулировать взаимно независимым способом. Однако рестеноз вовлекает несколько биологических процессов и наиболее эффективно может лечиться комбинацией лекарств, выбранных для воздействия на данные разные биологические процессы.
В статье «Physiological Transport Forces Govern Drug Distribution for Stent-Based Delivery», авторов Chao-Wei Hwang et al., показана важная взаимосвязь между характеристиками пространственно-временного распределения лекарств элюирующими лекарства стентами и механизмами клеточного транспорта лекарств. В попытках добиться повышенных механических рабочих характеристик и структурных свойств, конструкциям стентов стали придавать более сложные геометрические формы со специфической неоднородностью окружного и продольного распределения распорок стентов. Примерами данной тенденции являются типичные коммерчески доступные стенты, которые расширяются до приближенно ромбовидной или многогранной формы, при развертывании в просвете тела. Стенты обеих форм применялись для доставки лечебного средства в форме поверхностного покрытия. Исследования показали, что участки тканей просвета, непосредственно прилегающие к распоркам, получают более высокие концентрации лекарства, чем более удаленные участки тканей, например участки, расположенные в середине «ромбовидных» распорных ячеек. Характерно, что данный градиент концентраций лекарства внутри стенки просвета остается со временем выше для гидрофобных лечебных средств, например паклитаксела или рапамицина, которые оказались наиболее эффективными антирестенотическими препаратами на настоящее время. Поскольку локальные концентрации лекарств и их градиенты сложным образом связаны с биологическими действиями, то начальное пространственное распределение источников лечебного средства (распорок стента) является решающим фактором эффективности.
Помимо субоптимального пространственного распределения лечебных средств, существуют другие потенциальные недостатки стентов с поверхностным покрытием. Некоторые полимерные носители с химически связанной матрицей, применяемые в покрытиях устройства, обычно неопределенно долго удерживают значительный процент лечебного средства в покрытии. Поскольку данные лечебные средства, например паклитаксел, могут быть цитотоксичными, то могут возникать подострые и хронические проблемы, например хроническое воспаление, поздний тромбоз и позднее или неполное заживление стенки сосуда. Кроме того, сами полимеры-носители часто вызывают воспаление ткани стенки сосуда. С другой стороны, применение биологически рассасывающихся полимерных носителей на поверхностях стента может приводить к «плохому контакту» или пустым пространствам между стентом и тканью стенки сосуда после рассасывания полимерного носителя. Пустые пространства допускают относительное движение между стентом и прилегающей тканью. Возникающие, в результате, проблемы включают в себя микроистирание и воспаление, медленное перемещение стента и невозможность осуществления реэндотелизации стенки сосуда.
Начальные клинические испытания на людях предполагают возможность некоторых недостатков, связанных с доставляющими лекарства устройствами первого поколения. Последующее исследование пациентов, участвовавших в клинических испытаниях, через шесть - восемнадцать месяцев после имплантации стента с лекарственным покрытием показывает, что плохой контакт распорок стента с артериальными стенками и краевой рестеноз могут иметь место для большого числа пациентов. Краевой рестеноз появляется непосредственно за проксимальным и дистальным краями стента и развивается вблизи краев стента и во внутреннее (просветное) пространство, что часто требует повторной реваскуляризации пациента.
Другой потенциальный недостаток состоит в том, что расширение стента может создать напряжение в нанесенном на него полимерном покрытии, в результате чего покрытие отслаивается, растрескивается или рвется, что может влиять на кинетику высвобождения лекарства или вызывать другие неблагоприятные эффекты. Данные эффекты наблюдались в стентах первого поколения с лекарственными покрытиями, когда данные стенты расширялись до больших диаметров, что препятствовало до сих пор применению упомянутых стентов в артериях большего диаметра. Кроме того, расширение упомянутых стентов с покрытиями в атеросклеротическом кровеносном сосуде будет приводить к воздействию окружных усилий сдвига на полимерное покрытие, что могло привести к отделению покрытия от нижележащей поверхности стента. Такое отделение может снова вызывать неблагоприятные эффекты, включая эмболизацию фрагментов покрытия, вызывающую закупорку сосудов.
Другая проблема, которую можно решить посредством локальной доставки лечебных средств из стента, состоит в тромбозе. Стент можно покрыть антитромботическим средством в дополнение к, по меньшей мере, одному терапевтическому средству для терапии рестеноза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
С учетом недостатков известного уровня техники, целесообразно создание стента, способного доставлять относительно большой объем лекарственного средства в травмированное место в просвете сосуда, с исключением, при этом, многочисленных потенциальных проблем, связанных с поверхностными покрытиями, содержащими лекарственные средства, но без увеличения эффективной толщины стенки стента и без неблагоприятного воздействия на механические свойства расширения стента.
Кроме того, целесообразно создание поддерживающего ткани устройства с разными лечебными средствами, находящимися в разных лунках, чтобы получать требуемое пространственное распределение, по меньшей мере, двух лечебных средств.
Кроме того, целесообразно создание поддерживающего ткань устройства с разными лечебными средствами, находящимися в разных лунках, чтобы получать требуемую разную кинетику высвобождения для, по меньшей мере, двух разных лечебных средств из одного и того же устройства.
Кроме того, целесообразно создание поддерживающего ткань устройства со всеми поверхностями, покрытыми антитромботическим средством, и затем применение грунтовки в лунках или отверстиях в упомянутом устройстве, чтобы усилить адгезию, по меньшей мере, одного лечебного средства, которое заполняет лунки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеописанные и другие признаки и преимущества изобретения очевидны из нижеприведенного подробного описания предпочтительных вариантов осуществления изобретения, представленных на прилагаемых чертежах.
Фигура 1 - изометрическое изображение расширяемого медицинского устройства с лечебным средством на концах в соответствии с настоящим изобретением.
Фигура 2 - изометрическое изображение расширяемого медицинского устройства с лечебным средством на центральном участке и без лечебного средства на концах в соответствии с настоящим изобретением.
Фигура 3 - изометрическое изображение расширяемого медицинского устройства с разными лечебными средствами в разных отверстиях в соответствии с настоящим изобретением.
Фигура 4 - изометрическое изображение расширяемого медицинского устройства с разными лечебными средствами в чередующихся отверстиях в соответствии с настоящим изобретением.
Фигура 5 - увеличенный вид сбоку участка расширяемого медицинского устройства с отверстиями под лечебные средства в соединительных элементах в соответствии с настоящим изобретением.
Фигура 6 - увеличенный вид сбоку участка расширяемого медицинского устройства с бифуркационным отверстием в соответствии с настоящим изобретением.
Фигура 7 - сечение расширяемого медицинского устройства, содержащего комбинацию из первого активного вещества, например противовоспалительного средства, в первом множестве отверстий, и второго активного вещества, например антипролиферативного средства, во втором множестве отверстий, в соответствии с настоящим изобретением.
Фигура 8 - график скоростей высвобождения одного примера противовоспалительного средства и антипролиферативного средства, доставляемых расширяемым медицинским устройством, показанным на фигуре 7, в соответствии с настоящим изобретением.
Фигуры 9A-9С - местные схематические изображения альтернативного примерного варианта осуществления расширяемого медицинского устройства в соответствии с настоящим изобретением.
Фигура 10 - схема реакции конъюгации между PLGA (сополимером молочной и гликолевой кислот) с карбоксильной концевой группой и низкомолекулярным PEI (полиэтиленимином) в соответствии с настоящим изобретением.
Фигура 11 - схема реакции конъюгации между PLGA с карбоксильной концевой группой и высокомолекулярным или разветвленным PEI в соответствии с настоящим изобретением.
Фигура 12 - кинетика высвобождения из емкости в зависимости от поверхностного покрытия в соответствии с настоящим изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
На фигуре 1 изображено расширяемое медицинское устройство, содержащее множество отверстий, содержащих лечебное средство для доставки в ткань расширяемым медицинским устройством. Расширяемое медицинское устройство 10, изображенное на фигуре 1, вырезано из трубчатого материала для формирования цилиндрического расширяемого устройства. Расширяемое медицинское устройство 10 содержит множество цилиндрических секций 12, соединенных между собой множеством соединительных элементов 14. Соединительные элементы 14 позволяют поддерживающему ткани устройству аксиально изгибаться при прохождении по извилистому пути в сосудистой сети к месту развертывания и позволяют устройству аксиально изгибаться, при необходимости, соответственно кривизне просвета, который следует поддерживать. Каждая из цилиндрических трубок 12 сформирована сеткой удлиненных распорок 18, которые соединены между собой пластическими шарнирами 20 и окружными распорками 22. Во время расширения медицинского устройства 10, пластические шарниры 20 деформируются, а распорки 18 не деформируются. Дополнительные сведения об одном примере расширяемого медицинского устройства приведены в патенте США № 6241762, который целиком включен в настоящее описание путем отсылки.
Как показано на фигуре 1, удлиненные распорки 18 и окружные распорки 22 содержат отверстия 30, некоторые из которых содержат лечебное средство для доставки в просвет, в который имплантировано расширяемое медицинское устройство. Кроме того, другие участки устройства 10, например соединительные элементы 14, могут содержать отверстия, как описано ниже со ссылкой на фигуру 5. В предпочтительном варианте отверстия 30 находятся в недеформирующихся участках устройства 10, например распорках 18, чтобы отверстия были недеформирующимися, и лечебное средство доставлялось без риска разрушения, вытеснения или иного повреждения во время расширения устройства. Дополнительное описание одного примера способа, каким лечебное средство может быть заложено в отверстия 30, приведено в заявке на патент США № 09/948,987, поданной 7 сентября 2001 г., которая целиком включена в настоящую заявку путем отсылки.
Примерные варианты осуществления настоящего изобретения можно дополнительно оптимизировать с использованием анализа методом конечных элементов и другими методами, чтобы оптимизировать размещение лечебных средств в отверстиях 30. По существу, форму и местоположение отверстий 30 можно модифицировать, чтобы максимально увеличить объем пустот, при одновременном сохранении относительно высокой прочности и жесткости распорок по отношению к пластическим шарнирам 20. В соответствии с одним предпочтительным вариантом осуществления настоящего изобретения, отверстия имеют площадь, по меньшей мере, 5×10-6 квадратных дюймов и, предпочтительно, по меньшей мере, 7×10-6 квадратных дюймов. Обычно, отверстия заполняют лечебным средством на от приблизительно пятидесяти процентов до приблизительно девяносто пяти процентов.
Определения
Термины «активное вещество», «терапевтическое средство» или «лечебное средство», как предполагается в контексте настоящей заявки, имеют максимально широкое возможное толкование и применяются так, чтобы включать в себя любое терапевтическое средство или лекарство, а также инертные вещества, например барьерные слои, слои-носители, терапевтические слои или защитные слои.
Термины «лекарство» или «терапевтическое средство» применяются равнозначно для обозначения любого терапевтически активного вещества, которое доставляется в просвет тела живого существа для создания требуемого, обычно полезного, эффекта. Лечебные средства могут содержать, по меньшей мере, одно лекарство или терапевтическое средство.
Настоящее изобретение особенно хорошо подходит, в частности, для доставки противоопухолевых средств, антиангиогенных средств, ангиогенных факторов, противовоспалительных средств, иммунодепрессантов, например рапамицина, антирестенотических средств, антитромбоцитарных средств, сосудорасширяющих средств, антитромботических средств, антипролиферативных средств, например паклитаксела, и антиромбиновых средств, например гепарина.
Термин «размытие» означает процесс, в ходе которого компоненты среды или матрицы биологически рассасываются и/или разлагаются, и/или разрушаются химическими или физическими, или ферментативными процессами. Например, что касается биоразлагаемых полимерных матриц, размытие может происходить посредством разрыва или гидролиза полимерных цепей, с повышением, тем самым, растворимости матрицы и удерживаемых в виде взвеси лечебных средств.
Термин «скорость размытия» является мерой количества времени, которое занимает процесс размытия, и измеряется обычно в единицах площади на единицу времени.
Термины «матрица» или «биологически рассасывающаяся матрица» применяются равнозначно для обозначения среды или материала, который, после имплантации в человека, не вызывает вредной ответной реакции, достаточной, в результате, для отторжения матрицы. Сама по себе, матрица обычно не обеспечивает никаких терапевтических ответных реакций, хотя, матрица может содержать или окружать лечебное средство, которому дано определение в настоящей заявке. Матрица является также средой, которая может просто обеспечивать опору, конструктивную целостность или конструктивные барьеры. Матрица может быть полимерной, неполимерной, гидрофобной, гидрофильной, липофильной, амфифильной и т.п. Кроме того, следует понимать, что термин «биологически рассасывающаяся матрица» подразумевает полное рассасывание матрицы организмом со временем.
Термин «отверстия» включает в себя как сквозные отверстия, так и углубления.
Термин «фармакологически приемлемый» относится к особенности отсутствия токсичности в отношении реципиента или пациента и пригодности для поддержки стабильности лечебного средства и обеспечения доставки лечебного средства к клеткам-мишеням или намеченной ткани.
Термин «полимер» относится к молекулам, сформированным в виде химического соединения, по меньшей мере, двух повторяющихся элементарных звеньев, называемых мономерами. Соответственно, термин «полимер» может охватывать, например, димеры, триммеры и олигомеры. Полимер может быть синтетическим, натуральным или полусинтетическим. В предпочтительной форме, термин «полимер» относится к молекулам, которые обычно имеют молекулярную массу (Mw) больше чем приблизительно 3000 и, предпочтительно, больше чем приблизительно 10,000, и Mw, которая меньше чем приблизительно 10 миллионов, но, предпочтительно, меньше чем приблизительно один миллион и, еще более предпочтительно, меньше чем приблизительно 200,000. Примеры полимеров включают в себя, но без ограничения, сложные полиэфиры альфа-оксикислот, например полимолочную кислоту (PLLA или DLPLA (D,L-полимолочная кислота)), полигликолевую кислоту, сополимер полимолочной кислоты и гликолевой кислоты (PLGA), сополимер полимолочной кислоты и капролактона; полимеры типа (блок-этиленоксид-блок-сополимер лактида и гликолида), (PEO (полиэтиленоксид)-блок-PLGA и PEO-блок-PLGA-блок-PEO); полиэтиленгликоль и полиэтиленоксид, полимер типа (блок-этиленоксид-блок-пропиленоксид-блок-этиленоксид); поливинилпирролидон; сложные полиортоэфиры; полисахариды и производные полисахаридов, например полигиалуроновую кислоту, поли(глюкозу), полиальгиновую кислоту, хитин, хитозан, производные хитозана, целлюлозу, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, карбоксиметилцеллюлозу, циклодекстрины и замещенные циклодекстрины, например сульфобутиловые эфиры бета-циклодекстрина; полипептиды и белки, например полилизин, полиглютаминовую кислоту, альбумин; полиангидриды; полиоксиальконоаты, например полиоксивалерат, полиоксибутират и т.п.
Термин «в основном», применительно к направленной доставке, означает, что в основном направлении доставляется количество, большее, чем приблизительно пятьдесят процентов от общего количества терапевтического средства, доставляемого в кровеносный сосуд.
Различные примерные варианты осуществления настоящего изобретения, описанные в настоящей заявке, предусматривают закладку разных лечебных средств в разных отверстиях в расширяемом устройстве или лечебного средства в некоторых отверстиях, а не в других. Конкретное строение расширяемого медицинского устройства можно изменять без выхода за пределы существа изобретения. Поскольку каждое отверстие заполняют по отдельности, лечебному средству в каждом отверстии можно придавать особые химические композиции и фармакокинетические свойства.
Один пример применения разных лечебных средств в разных отверстиях в расширяемом медицинском устройстве или лечебных средств в некоторых отверстиях, а не в других, относится к устранению краевого рестеноза. Как изложено выше, нынешнее поколение стентов с покрытиями может сталкиваться со сложной проблемой краевого рестеноза или рестеноза, возникающего непосредственно за краями стента и развивающегося вокруг стента и во внутреннее просветное пространство.
Причины краевого рестеноза при использовании доставляющих лекарства стентов первого поколения не вполне понятны в настоящее время. Возможно, что область повреждения тканей вследствие ангиопластики и/или имплантации стента продолжается за пределы области диффузии лечебных средств современного поколения, например паклитаксела, которые, обычно, интенсивно распадаются в ткани. Аналогичное явление наблюдалось при лучевой терапии, в ходе которой небольшие дозы излучения на краях стента оказывались стимулирующими в присутствии повреждения. В данном случае, облучение на длине, увеличенной настолько, чтобы облучать неповрежденную ткань, решало проблему. В случае доставляющих лекарства стентов, размещение более крупных доз или более высоких концентраций лечебных средств по краям стентов, размещение на краях стентов отличающихся активных средств, которые быстрее диффундируют сквозь ткань, или размещение отличающихся лечебных средств или комбинаций лечебных средств на краях устройства может способствовать устранению проблемы краевого рестеноза.
На фигуре 1 изображено расширяемое медицинское устройство 10 с, так называемыми, «активными концами» или с лечебным средством, обеспеченным в отверстиях 30a на концах устройства, чтобы лечить и ослаблять краевой рестеноз. Остальные отверстия 30b на центральном участке устройства могут быть пустыми (как показано) или могут содержать меньшую концентрацию лечебного средства.
Другие механизмы краевого рестеноза могут затрагивать цитотоксичность специфических лекарств или комбинаций лекарств. Данные механизмы могут содержать физическое или механическое сокращение ткани, аналогичное сокращению, наблюдаемому при образовании эпидермальной рубцовой ткани, и стент может предотвращать ответную реакцию сокращения в пределах его собственных границ, но не за его краями. Кроме того, механизм данной последней формы рестеноза может быть связан с последствиями длительной или локальной доставки лекарства в артериальную стенку, которые проявляются даже после того, как само лекарство больше не присутствует в стенке. То есть рестеноз может быть ответной реакцией на вид токсического поражения, связанного с лекарством и/или носителем лекарства. В данной ситуации, возможно, было бы полезно исключить некоторые активные средства из применения на краях устройства.
На фигуре 2 изображен альтернативный примерный вариант осуществления расширяемого медицинского устройства 200, содержащего множество отверстий 230, из которых отверстия 230b в центральной части устройства заполнены лечебным средством, и отверстия 230a на краях устройства остаются пустыми. Устройство, показанное на фигуре 2, называется устройством с «инертными концами».
В дополнение к использованию для ослабления краевого рестеноза, расширяемое медицинское устройство 200, показанное на фигуре 2, можно применять в сочетании с расширяемым медицинским устройством 10, показанным на фигуре 1, или другим доставляющим лекарство стентом, когда исходную процедуру стентирования следует дополнить дополнительным стентом. Например, в некоторых случаях устройство 10, показанное на фигуре 1, с «активными концами» или устройство с равномерным распределением лекарства может быть имплантировано ненадлежащим образом. Если врач определяет, что устройство не перекрывает достаточный участок просвета, то на одном конце существующего устройства можно добавить дополнительное устройство, немного перекрывающее существующее устройство. Когда имплантируют дополнительное устройство, то устройство 200, показанное на фигуре 2, применяют так, чтобы «инертные концы» медицинского устройства 200 предотвращали удвоение дозы лечебного средства на участках перекрытия устройств 10, 200.
На фигуре 3 изображен дополнительный альтернативный примерный вариант осуществления изобретения, в котором в разных отверстиях расширяемого медицинского устройства 300 находятся разные лечебные средства. Первое лечебное средство обеспечено в отверстиях 330a на концах устройства, и второе лечебное средство обеспечено в отверстиях 330b на центральном участке устройства. Лечебное средство может содержать разные лекарства, одинаковые лекарства в разных концентрациях или разные варианты одного и того же лекарства. Примерный вариант осуществления, показанный на фигуре 3, можно применять для обеспечения расширяемого медицинского устройства 300 либо с «активными концами», либо с «инертными концами».
В предпочтительном варианте, каждый концевой участок устройства 300, который содержит отверстия 330a, содержащие первое лечебное средство, продолжается в длину на от, по меньшей мере, одного отверстия до приблизительно пятнадцати отверстий от края. Данное расстояние соответствует участку от приблизительно 0,005 до приблизительно 0,1 дюймов от края нерасширенного устройства. Расстояние от края устройства 300, которое содержит первое лечебное средство, предпочтительно, приблизительно равно одной секции, где секция ограничена между соединительными элементами.
Разные лечебные средства, содержащие разные лекарства, могут находиться в разных отверстиях в стенте. Это допускает доставку, по меньшей мере, двух лечебных средств из одного стента по любой требуемой схеме доставки. В альтернативном варианте, разные лечебные средства, содержащие одно и то же лекарство в разных концентрациях, могут находиться в разных отверстиях. Это дает возможность лекарству равномерно распределяться в ткань, при неоднородной конструкции устройства.
По меньшей мере, два разных лечебных средства, обеспеченных в устройствах, описанных в настоящей заявке, могут содержать (1) разные лекарства; (2) одно и то же лекарство в разных концентрациях; (3) одно и то же лекарство с разными кинетиками высвобождения, т.е. разными скоростями размытия матрицы; или (4) разные формы одного и того же лекарства. Примеры разных лечебных средств, содержащих одно и то же лекарства с разными кинетиками высвобождения могут использовать разные носители для получения профилей элюирования с разными формами. Некоторые примеры разных форм одного и того же лекарства содержат формы лекарства, обладающие изменяющимися гидрофильностью или липофильностью.
В одном примере устройства 300, показанного на фигуре 3, отверстия 330a на концах устройства заправлены первым лечебным средством, содержащим лекарство с высокой липофильностью, тогда как отверстия 330b на центральном участке устройства заправлены вторым лечебным средством со сниженной липофильностью. Первое высоколипофильное лекарственное средство на «активных концах» будет диффундировать в окружающую ткань быстрее и, тем самым, ослаблять краевой рестеноз.
Устройство 300 может содержать резкую линию перехода, на которой лекарственное средство сменяется с первого средства на второе средство. Например, все отверстия в пределах 0,05 дюймов от края устройства могут содержать первое средство, тогда как остальные отверстия содержат второе средство. В альтернативном варианте, устройство может содержать постепенный переход между первым средством и вторым средством. Например, концентрация лекарства в отверстиях может последовательно повышаться (или снижаться) к концам устройства. В другом примере количество первого лекарства в отверстиях увеличивается, тогда как количество второго лекарства в отверстиях уменьшается с перемещением к концам устройства.
На фигуре 4 изображен дополнительный альтернативный примерный вариант осуществления расширяемого медицинского устройства 400, в котором разные лечебные средства находятся в разных отверстиях 430a, 430b в устройстве, с чередованием или вразброс. Таким образом, несколько лечебных средств можно доставлять в ткань по всей зоне или участку зоны поддержки устройством. Данный примерный вариант осуществления будет полезен для доставки нескольких лечебных средств, когда объединение нескольких средств в одной композиции для заправки в устройство невозможно из-за проблем с взаимодействием между лечебными средствами или с их стабильностью.
В дополнение к применению разных лечебных средств в разных отверстиях для получения разных концентраций лекарств в разных заданных зонах ткани, заправку разных лечебных средств в разные отверстия можно применять для обеспечения более равномерного пространственного распределения лечебного средства, доставляемого в случаях, когда расширяемое медицинское устройство имеет неравномерное распределение отверстий в расширенной конфигурации.
Применение разных лекарств в разных отверстиях вразброс или с чередованием допускает доставку двух разных лекарств, которые нельзя было бы доставить при их объединении внутри одной и той же композиции матрицы полимера/лекарства. Например, сами лекарства могут взаимодействовать нежелательным образом. В альтернативном варианте, два лекарства могут быть несовместимы с одинаковыми полимерами для формирования матрицы или с одинаковыми растворителями для доставки матрицы полимера/лекарства в отверстия.
Кроме того, примерный вариант осуществления, показанный на фигуре 4, содержащий разные лекарства в разных отверстиях по схеме вразброс, обеспечивает возможность доставлять разные лекарства с очень разными требуемыми кинетиками высвобождения из одного и того же медицинского устройства или стента и оптимизировать кинетику высвобождения, в зависимости от механизма действия и свойств отдельных активных средств. Например, водорастворимость активного средства сильно влияет на высвобождение активного средства из полимерной или другой матрицы. Соединение с высокой водорастворимостью обычно будет очень быстро доставляться из полимерной матрицы, тогда как липофильное средство будет доставляться из той же самой матрицы в течение более продолжительного времени. Следовательно, если гидрофильное средство и липофильное средство требуется доставлять в виде комбинации двух лекарств из медицинского устройства, то, для двух данных активных средств, доставляемых из одной и той же полимерной матрицы, трудно получить требуемый профиль высвобождения.
Система, показанная на фигуре 4, допускает удобную доставку гидрофильного и липофильного лекарства из одного и того же стента. Кроме того, система, показанная на фигуре 4, позволяет доставлять два активных средства с двумя разными кинетиками высвобождения и/или периодами введения. Каждую характеристику из начального высвобождения за первые двадцать четыре часа, скорости высвобождения после первых двадцати четырех часов, суммарного периода введения и любых других характеристик высвобождения двух лекарств можно контролировать независимо. Например, скорости высвобождения первого лечебного средства можно отрегулировать так, чтобы доставлять, по меньшей мере, сорок процентов (предпочтительно, по меньшей мере, пятьдесят процентов) доставляемого лекарства за первые двадцать четыре часа, и второго лекарственного средства можно отрегулировать так, чтобы доставлять менее, чем двадцать процентов (предпочтительно, менее, чем десять процентов) доставляемого лекарства за первые двадцать четыре часа. Период введения первого лекарственного средства может составлять около трех недель или менее (предпочтительно, двух недель или менее), и период введения второго лекарственного средства может составлять около четырех недель или более.
Рестеноз или рецидив окклюзии после вмешательства включает в себя комбинацию или последовательность биологических процессов. Данные процессы содержат активацию тромбоцитов или макрофагов. Цитокины и факторы роста вносят вклад в пролиферацию гладкомышечных клеток, и повышающая регуляция генов и металлопротеиназ приводят к росту клеток, перестройке внеклеточного матрикса и миграции гладкомышечных клеток. Лекарственная терапия, которая подавляет множество данных процессов с помощью комбинации лекарств, может быть наиболее успешной антирестенотической терапией. Настоящее изобретение обеспечивает средство для достижения данной успешной комбинированной лекарственной терапии.
Нижеописанные примеры поясняют некоторые из комбинированных лекарственных систем, которые извлекают пользу из способности высвобождать разные лекарства в разных лунках или отверстиях. Одним примером лечебной системы для доставки двух лекарств из расположенных вразброс или чередующихся лунок является доставка противовоспалительного средства или иммунодепрессанта в комбинации с антипролиферативным средством или антимиграционным средством. Для целенаправленного воздействия на несколько биологических процессов, участвующих в рестенозе, можно также использовать другие комбинации данных активных средств. Противовоспалительное средство ослабляет начальную воспалительную ответную реакцию сосуда на ангиопластику и стентирование и доставляется сначала с высокой скоростью, с последующей замедленной доставкой в течение временного периода около двух недель для согласования с максимумом развития роста макрофагов, которые стимулируют воспалительную ответную реакцию. Антипролиферативное средство доставляется с относительно равномерной скоростью в течение более длительного временного периода для ослабления миграции и пролиферации гладкомышечных клеток.
В дополнение к примерам, которые приведены ниже, в нижеследующей таблице проиллюстрированы некоторые из полезных вариантов двухлекарственной комбинированной фармакотерапии, которые можно обеспечить путем закладки лекарств в разные отверстия в медицинском устройстве.
Закладка лекарств в разные отверстия позволяет регулировать кинетику высвобождения соответственно конкретному активному веществу, независимо от гидрофобности или липофобности лекарства. Примеры некоторых схем размещения для доставки липофильного лекарства с, по существу, постоянной или линейной скоростью высвобождения описаны в документе WO 04/110302, опубликованном 23 декабря 2004 г., который целиком включен в настоящую заявку путем отсылки. Примеры некоторых из схем размещения для доставки гидрофильного лекарства описаны в документе WO 04/043510, опубликованном 27 мая 2004 г., который целиком включен в настоящую заявку путем отсылки. Вышеперечисленные гидрофильные лекарства включают в себя CdA, Гливек, комплекс VIP, инсулин и ApoA-I MILANO. Вышеперечисленные липофильные лекарства включают в себя паклитаксел, эпотилон D, рапамицин, пимекролимус, PKC-412 и дексаметазон. Фарглитазар (faglitazar) является частично липофильным и частично гидрофильным.
В дополнение к доставке нескольких лекарств для прицельного воздействия на разные биологические процессы, участвующие в рестенозе, настоящее изобретение позволяет доставлять два разных лекарства из одного и того же стента для лечения разных заболеваний. Например, стент может доставлять антипролиферативное лекарство, например паклитаксел или лимус, из одного набора отверстий для лечения рестеноза, с одновременной доставкой стабилизирующего миокард лекарства, например инсулина, из других отверстий для лечения острого инфаркта миокарда.
Во многих известных расширяемых устройствах и для устройства, показанного на фигуре 5, покрытие устройства 500 больше на цилиндрических трубчатых участках 512 устройства, чем на соединительных элементах 514. Покрытие определяется как отношение площади поверхности устройства к площади просвета, в котором развернуто устройство. Когда устройство с изменяющимся покрытием применяют для доставки лечебного средства, содержащегося в отверстиях в устройстве, концентрация лечебного средства, доставляемая в ткань вблизи цилиндрических трубчатых участков 512, выше, чем концентрация лечебного средства, доставляемая в ткань вблизи соединительных элементов 514. Для учета такого продольного изменения в конструкции устройства и других изменений рабочей зоны устройства, которые приводят к неравномерности доставляемых концентраций лечебного средства, концентрацию лечебного средства можно изменять в отверстиях на участках устройства для обеспечения более равномерного распределения лечебного средства по всей ткани. В случае примерного варианта осуществления, показанного на фигуре 5, отверстия 530a в трубчатых участках 512 содержат лечебное средство с меньшей концентрацией лекарства, чем отверстия 530b в соединительных элементах 514. Равномерность доставки активного средства можно обеспечить множеством методов, включая изменение концентрации лекарства, диаметра или формы отверстия, количества активного средства в отверстии (т.е. процентного коэффициента заполнения отверстия), материала матрицы или лекарственной формы.
Другим примером прикладной задачи использования разных лечебных средств в разных отверстиях является расширяемое медицинское устройство 600, показанное на фигуре 6, выполненное с возможностью применения в бифуркации в сосуде. Бифуркационные устройства содержат боковое отверстие 610, которое расположено так, чтобы обеспечивать возможность протекания крови через боковую ветвь сосуда. Один пример бифуркационного устройства описан в патенте США № 6293967, который целиком включен в настоящую заявку путем отсылки. Бифуркационное устройство 600 содержит конструктивный элемент в виде бокового отверстия 610, прерывающего регулярную структуру стержней, которые формируют остальную часть устройства. Поскольку зона вокруг бифуркации является особенно проблематичной зоной с точки зрения рестеноза, то, в отверстиях 830a в зоне, окружающей боковое отверстие 610 устройства 600, концентрацию антипролиферативного лекарства можно увеличить, чтобы доставлять повышенные концентрации лекарства, при необходимости. Остальные отверстия 630b в зоне, удаленной от бокового отверстия, содержат лечебное средство с меньшей концентрацией антипролиферативного лекарства. Увеличенное количество антипролиферативного лекарства, доставляемое в область, окружающую бифуркационное отверстие, может быть обеспечено другим лечебным средством, содержащим другое лекарство, или другим лечебным средством, содержащим более высокую концентрацию того же лекарства.
В дополнение к доставке разных лечебных средств к муральной или аблюминальной стороне расширяемого медицинского устройства для лечения стенки сосуда, лечебные средства могут доставляться к люминальной стороне расширяемого медицинского устройства для предотвращения или ослабления тромбоза. Лекарства, которые доставляются в кровоток с люминальной стороны устройства, могут располагаться на проксимальном конце устройства или дистальном конце устройства.
Способы закладки различных лечебных средств в разные отверстия в расширяемом медицинском устройстве могут включать в себя известные методы, например окунание и нанесения покрытия, а также известные микроструйные пьезоэлектрические методы. Микроинъекторные устройства могут работать с компьютерным управлением для подачи точных количеств, по меньшей мере, двух жидких лечебных средств в точные позиции на расширяемом медицинском устройстве известным методом. Например, струйное устройство для двух активных средств может подавать два активных средства в отверстия одновременно или последовательно. Когда лечебные средства закладываются в сквозные отверстия в расширяемом медицинском устройстве, люминальную сторону сквозных отверстий можно перекрывать во время закладки упругой оправкой, позволяющей подавать лечебные средства в жидкой форме, например с растворителем. Лечебные средства можно также закладывать ручными впрыскивающими устройствами.
ПРИМЕР 1
На фигуре 7 изображен двухлекарственный стент 700, содержащий противовоспалительное средство и антипролиферативное средство, доставляемые из разных отверстий в стенте, для обеспечения независимых кинетик высвобождения двух лекарств, которые специально запрограммированы соответственно биологическим процессам рестеноза. В соответствии с данным примером, двухлекарственный стент содержит противовоспалительное средство пимекролимус в первом наборе отверстий 710 в комбинации с антипролиферативным средством паклитаксел во втором наборе отверстий 720. Каждое активное средство обеспечено в материале матрицы внутри отверстий стента по специальной схеме закладки, предназначенной для обеспечения кинетики высвобождения, показанной на фигуре 8. Каждое из лекарств доставляется, в основном, в муральную область для лечения рестеноза.
Как показано на фигуре 7, пимекролимус обеспечен в стенте для направленной доставки к муральной стороне стента, с использованием барьера 712 на люминальной стороне отверстия. Барьер 712 сформирован биологически рассасывающимся полимером. Пимекролимус заправляют в отверстия таким методом, который создает кинетику высвобождения, имеющую две фазы. Первая фаза высвобождения пимекролимуса обеспечивается муральной областью 716 матрицы, которая характеризуется быстровысвобождающимся составом, содержащим пимекролимус и биологически рассасывающийся полимер (PLGA) с высокой процентной концентрацией лекарства, например приблизительно девяносто процентов лекарства на приблизительно десять процентов полимера. Вторая фаза высвобождения обеспечивается центральной областью 714 матрицы с пимекролимусом и биологически рассасывающимся полимером (PLGA) в соотношении, приблизительно, пятьдесят процентов лекарства на пятьдесят процентов полимера. Как можно видеть на графике, показанном на фигуре 8, в первой фазе высвобождения пимекролимуса доставляются приблизительно пятьдесят процентов заправленного лекарства за приблизительно первые двадцать четыре часа. Во второй фазе высвобождения доставляются остальные пятьдесят процентов в течение приблизительно двух недель. Данное высвобождение запрограммировано, в частности, так, чтобы соответствовать развитию воспалительного процесса после ангиопластики и стентирования. В дополнение, или в качестве альтернативы изменению концентрации лекарства между двумя областями для обеспечения двухфазного высвобождения, можно применить разные полимеры или разные соотношения сомономеров одного и того же полимера в разных областях для двух лекарств, чтобы обеспечить две разные скорости высвобождения.
Паклитаксел заправляют в отверстия 720 таким образом, чтобы создавать кинетику высвобождения, характеризующуюся, по существу, линейным высвобождением после первых приблизительно двадцати четырех часов, как показано на фигуре 8. Отверстия 720 под паклитаксел заправлены с созданием трех областей, включая базовую область 722 из, в основном, полимера, с минимальным содержанием лекарства, на люминальной стороне отверстия, центральную область 724 с паклитакселем и полимером (PLGA), с обеспечением градиентного изменения их концентраций, и покровную область 726, в основном, с полимером, который регулирует высвобождение паклитаксела. Паклитаксел высвобождается с первоначальным высвобождением в первые сутки, приблизительно, от пяти до пятнадцати процентов от суммарной заправки лекарства и последующим, по существу, линейным высвобождением в течение приблизительно от двадцати до девяноста суток. Дополнительные примеры схем размещения паклитаксела в лунках с градиентным изменением концентрации описано в вышеупомянутом документе WO 04/110302.
На фигуре 7, лекарственная, барьерная и покровная области показаны в виде отдельных областей внутри отверстий для облегчения пояснения. Следует понимать, что данные области не имеют четких границ и сформированы смешением разных зон. Таким образом, хотя барьерные слои представлены, в основном, полимером без лекарства, в зависимости от применяемых технологий изготовления, некоторые небольшие количества лекарства последующей области могут быть инкорпорированы в барьерную область.
Количество доставляемых лекарств изменяется в зависимости от размера стента. Для стента с размерами три мм на шесть мм, количество пимекролимуса составляет от приблизительно пятидесяти до приблизительно трехсот микрограмм, предпочтительно от приблизительно ста до приблизительно двухсот пятидесяти микрограмм. Количество паклитаксела, доставляемое из такого стента, составляет от приблизительно пяти до приблизительно пятидесяти микрограмм, предпочтительно от приблизительно десяти до приблизительно тридцати микрограмм. В одном примере доставляются приблизительно двести микрограмм пимекролимуса и приблизительно двести микрограмм паклитаксела. Лекарства могут находиться в чередующихся отверстиях стента. Однако ввиду большого различия между подлежащими доставке дозами двух лекарств, возможно, было бы желательно помещать паклитаксел в каждое третье из четырех отверстий в стенте. В альтернативном варианте отверстия для доставки лекарства, подлежащего доставке малыми дозами, (паклитаксела) можно делать меньше, чем отверстия для больших доз.
Закладки полимера/лекарства формируют методами пьезоэлектрического впрыскивания с компьютерным управлением, описанными в документе WO 04/026182, опубликованном 1 апреля 2004 г., который целиком включен в настоящую заявку путем отсылки. Закладки первого активного средства можно формировать первыми, с последующим формированием закладок второго активного средства, с использованием пьезоэлектрического струйного насоса. В альтернативном варианте, систему, описанную в документе WO 04/02182, можно снабдить сдвоенными пьезоэлектрическими дозаторами для одновременной закладки двух активных средств.
ПРИМЕР 2
В соответствии с данным примером, двухлекарственный стент содержит вещество Гливек (Gleevec) в первом наборе отверстий 710 в комбинации с антипролиферативным средством паклитаксел во втором наборе отверстий 720. Каждое активное средство обеспечено в материале матрицы внутри отверстий стента по специальной схеме закладки, предназначенной для обеспечения кинетики высвобождения, показанной на фигуре 8.
Вещество Гливек доставляется по схеме двухфазного высвобождения, включая интенсивное первоначальное высвобождение за первые сутки и последующее медленное высвобождение в течение от одной до двух недель. В первой фазе высвобождения вещества Гливек доставляются приблизительно пятьдесят процентов заправленного лекарства за первые, приблизительно, двадцати четыре часа. Во второй фазе высвобождения доставляются остальные пятьдесят процентов в течение приблизительно от одной до двух недель. Паклитаксел заправляют в отверстия 720 таким образом, чтобы создавать кинетику высвобождения, обеспечивающую, по существу, линейное высвобождение по истечении первых, приблизительно, двадцати четырех часов, как показано на фигуре 8 и поясняется выше в примере 1.
Количество доставляемых лекарств изменяется в зависимости от размера стента. Для стента с размерами три мм на шесть мм, количество вещества Гливек составляет от приблизительно двухсот до приблизительно пятисот микрограмм, предпочтительно, от приблизительно трехсот до приблизительно четырехсот микрограмм. Количество паклитаксела, доставляемое из такого стента, составляет от приблизительно пяти до приблизительно пятидесяти микрограмм, предпочтительно, от приблизительно десяти до приблизительно тридцати микрограмм. Как в примере 1, лекарства могут находиться в чередующихся отверстиях стента или вразброс, нечередующимся способом. Закладки полимера/лекарства формируют таким образом, как описано в примере 1.
ПРИМЕР 3
В соответствии с данным примером, двухлекарственный стент содержит PKC-412 (регулятор клеточного роста) в первом наборе отверстий, в комбинации с антипролиферативным средством паклитаксел во втором наборе отверстий. Каждое активное средство обеспечено в материале матрицы внутри отверстий стента по специальной схеме закладки, предназначенной для обеспечения кинетики высвобождения, поясняемой далее.
Вещество PKC-412 доставляется, по существу, с постоянной скоростью высвобождения по истечении первых, приблизительно, двадцати четырех часов, в течение периода высвобождения от приблизительно четырех до приблизительно шестнадцати недель, предпочтительно, приблизительно от шести до двенадцати недель. Паклитаксел заправляют в отверстия таким образом, чтобы создавать кинетику высвобождения, характеризующуюся, по существу, линейным высвобождением по истечении первых, приблизительно, двадцати четырех часов, в течение периода высвобождения приблизительно от четырех до шестнадцати недель, предпочтительно, приблизительно от шести до двенадцати недель.
Количество доставляемых лекарств изменяется в зависимости от размера стента. Для стента с размерами три мм на шесть мм, количество вещества PKC-412 составляет от приблизительно ста до приблизительно четырехсот микрограмм, однако предпочтительно, от приблизительно ста пятидесяти до приблизительно двухсот пятидесяти микрограмм. Количество паклитаксела, доставляемое из такого стента, составляет от приблизительно пяти до приблизительно пятидесяти микрограмм, однако предпочтительно, от приблизительно десяти до приблизительно тридцати микрограмм. Как в примере 1, лекарства могут находиться в чередующихся отверстиях стента или вразброс, нечередующимся способом. Закладки полимера/лекарства формируют методами, описанными в примере 1.
Терапевтические средства
Настоящее изобретение относится к доставке антирестеностических средств, включая паклитаксел, рапамицин, кладрибин (CdA) и их производные, а также другие цитотоксические или цитостатические средства и средства, стабилизирующие микроканалы. Хотя, в настоящей заявке, описаны, в основном, антирестеностические средства, настоящее изобретение может также служить для доставки других активных средств по одному или в комбинации с антирестеностическими средствами. Некоторые из терапевтических средств для применения с настоящим изобретением, которые могут передаваться, в основном, в люминальную сторону, в основном, в муральную сторону или в обе стороны и могут доставляться по одному или в комбинации, содержат, но без ограничения, антипролиферативные вещества, антитромбины, иммунодепрессанты, включая сиролимус, антилипидные средства, противовоспалительные средства, противоопухолевые средства, антитромбоцитарные средства, ангиогенные средства, антиангиогенные средства, витамины, антимитотические средства, ингибиторы металлопротеиназы, доноры NO (оксида азота), эстрадиолы, антисклеротические средства и вазоактивные средства, эндотелиальные факторы роста, эстроген, бета-блокаторы, AZ-блокаторы, гормоны, статины, инсулиноподобные факторы роста, антиоксиданты, мембраностабилизирующие средства, антагонисты кальция, ретиноиды, бивалирудин, феноксодиол, этопозид, тиклопидин, дипиридамол и трапидил, по одиночке или в комбинации с любым терапевтическим средством, упомянутым в настоящей заявке. Терапевтические средства содержат также пептиды, липопротеины, полипептиды, полинуклеотиды, кодирующие полипептиды, липиды, белковые лекарства, лекарства-конъюгаты белков, ферменты, олигонуклеотиды и их дериваты, рибозимы, другой генетический материал, клетки, антисмысловые олигонуклеотиды, моноклональные антитела, тромбоциты, прионы, вирусы, бактерии и эукариотные клетки, например эндотелиальные клетки, стволовые клетки, ингибиторы ACE (ангиотензин-конвертирующего фермента), моноциты/макрофаги или сосудистые гладкомышечные клетки, которые составляют лишь небольшую часть примеров. Терапевтическое средство может быть также пролекарством, которое превращается в процессе обмена веществ в требуемое лекарство, когда его вводят в реципиента. Кроме того, терапевтические средства могут быть предварительно составлены в виде микрокапсул, микросфер, микропузырьков, липосом, ниосом, эмульсий, дисперсий или чего-то подобного до того, как их инкорпорируют в лечебный слой. Терапевтические средства могут быть также радиоактивными изотопами или активными веществами, активируемыми энергией некоторой другой формы, например световой или ультразвуковой энергией, или другими циркулирующими в организме молекулами, которые можно вводить системными методами. Терапевтические средства могут выполнять несколько функций, включая модуляцию ангиогенеза, рестеноза, пролиферации клеток, тромбоза, агрегации тромбоцитов, свертывания крови и сосудорасширения.
Противовоспалительные средства включают в себя, но без ограничения, нестероидальные противовоспалительные средства (NSAID), например производные арилуксусной кислоты, например диклофенак; производные арилпропионовой кислоты, например напроксен; и производные салициловой кислоты, например дифлунизал. Противовоспалительные средства включают в себя также глюкокоритикоиды (стероиды), например дексаметазон, аспирин, преднизолон и триамцинолон, пирфенидон, меклофенаминовую кислоту, траниласт и нестероидальные противовоспалительные средства. Противовоспалительные средства можно использовать в комбинации с антипролиферативными средствами для ослабления реакции ткани на антипролиферативное средство.
Активные средства могут также содержать средства с антилимфоцитарной активностью; вещества с антимакрофагальной активностью; иммуномодуляторные средства; ингибиторы циклооксигеназы; антиоксиданты; гипохолестеринемические лекарства; статины и ангиотензины в конвертирующем ферменте (ACE); фибринолитические средства; ингибиторы внутреннего коагуляционного каскада; антигиперлипопротеинемические средства; и антитромбоцитарные средства; антиметаболиты, например 2-хлордезоксиаденозин (2-CdA или кладрибин); иммунодепрессанты, включая сиролимус, эверолимус, такролимус, этопозид и митоксантрон; вещества с антилейкоцитарной активностью, например 2-CdA, ингибиторы IL-1, моноклональные антитела анти-CD116/CD18, моноклональные антитела к VCAM или ICAM (адгезивным молекулам), цинк-протопорфирин; вещества с антимакрофагальной активностью, например лекарства, которые повышают NO (оксид азота); клеточные сенсибилизаторы к инсулин-содержащим глитазонам; липопротеины высокой плотности (HDL) и дериваты; и синтетическую копию HDL, например липатор (lipator), ловестатин (lovestatin), пранастатин (pranastatin), аторвастатин, симвастатин и производные статинов; сосудорасширяющие средства, например аденозин и дипиридамол; доноры оксида азота; простагландины и их производные; соединения с активностью против фактора некроза опухолей (анти-TNF активностью); лекарства против гипертензии, содержащие бета-блокаторы, ингибиторы ACE и блокаторы кальциевых каналов; вазоактивные вещества, содержащие вазоактивные кишечные пептиды (VIP); инсулин; клеточные сенсибилизаторы к инсулин-содержащим глитазонам, агонисты PPAR (специфических ядерных рецепторов) и метморфин; протеинкиназы; антисмысловые олигонуклеотиды, содержащие рестен-NG (resten-NG); антитромбоцитарные средства, включая тирофибан, эптифибатид и абциксимаб; кардиопротективные средства, включая VIP, гипофизарный аденилатциклаза-активирующий пептид (PACAP), средство apoA-l milano, амлодипин, никорандил, цилостаксон (cilostaxone) и тиенопиридин; ингибиторы циклооксигеназы, включая ингибиторы COX-1 и COX-2; и ингибиторы петидозы (petidose), которые усиливают гликолитический метаболизм, включая омнипатрилат. Другие лекарства, которые можно применять для лечения воспаления, содержат гиполипедемические средства, эстроген и прогестин, агонисты рецепторов эндотелина и антагонисты интерлейкина-6, и адипонектин. Терапевтические средства могут также содержать ингибиторы фосфодиэстеразы (PDEi), например циластазол (cilastazol) и агонисты рецепторов аденозина, предпочтительно, агонисты A2A-рецептора, например регаденозон.
Активные средства можно также доставлять с применением способа, основанного на генной терапии, в сочетании с расширяемым медицинским устройством. Генная терапия относится к доставке экзогенных генов в клетку или ткань, что вынуждает клетки-мишени экспрессировать продукт экзогенных генов. Гены обычно доставляются либо механическими, либо векторными способами.
Некоторые из активных средств, описанных в настоящей заявке, можно сочетать с добавками, которые сохраняют их активность. Например добавки, содержащие поверхностно-активные вещества, антацидные средства, антиоксиданты и детергенты, можно применять для сведения к минимуму денатурацию и агрегацию белкового лекарства. Использовать можно анионные, катионные или неионные поверхностно-активные вещества. Примеры неионных наполнителей включают в себя, но без ограничения, сахара, содержащие сорбитол, сахарозу, трегалозу; декстраны, содержащие декстран, карбоксиметил-(CM)-декстран, диэтиламиноэтил-(DEAE)-декстран; дериваты сахаров, включая D-глюкозаминовую кислоту и диэтилмеркаптал D-глюкозы; синтетические простые полиэфиры, включая полиэтиленгликоль (PEG) и поливинилпирролидон (PVP); карбоновые кислоты, включая D-молочную кислоту, гликолевую кислоту и пропионовую кислоту; поверхностно-активные вещества со сродством к гидрофобным поверхностям раздела, включая н-додецил-бета-D-мальтозид, н-октил-бета-D-глюкозид, сложные эфиры полиэтиленоксида (PEO) и жирных кислот (например, стеарат (средство myrj 59) или олеат), сложные эфиры PEO, сорбитана и жирных кислот (например, Tween 80, PEO-20 сорбитанмоноолеат), сложные эфиры сорбитана и жирных кислот (например, SPAN 60, сорбитанмоностеарат), сложные эфиры PEO, глицерила и жирных кислот; сложные эфиры глицерила и жирных кислот (например, глицерилмоностеарат), простые эфиры PEO с углеводородами (например, простой PEO-10-олеилэфир); средство тритон X-100; и луброл. Примеры ионных детергентов содержат, но без ограничения, соли жирных кислот, включая стеарат кальция, стеарат магния и стеарат цинка; фосфолипиды, включая лецитин и фосфатидилхолин; (PC) CM-PEG; холевую кислоту; додецилсульфат натрия (SDS); докусат (AOT); и таурохолевую кислоту.
В соответствии с другим примерным вариантом осуществления, стент или интралюминальный каркас, описанный в настоящей заявке, можно снабдить покрытием из антитромботического средства в дополнение к, по меньшей мере, одному терапевтическому средству, заложенному в лунки или отверстия. В одном примерном варианте осуществления, стент может быть изготовлен с отверстиями в стенте, и, до введения или закладки в отверстия других терапевтических средств, к стенту или его участку можно присоединять антитромботическое средство со связующим носителем (полимером или полимерной матрицей) или без него. В данном примерном варианте осуществления, на люминальную и аблюминальную поверхности стента, а также на поверхности стенок отверстий можно нанести антитромботическое средство или покрытие. В альтернативном примерном варианте осуществления, на стент можно сначала наносить антитромботическое средство или покрытие, и затем можно формировать отверстия. В данном примерном варианте осуществления, только люминальная и аблюминальная поверхности будут содержать антитромботическое средство или покрытие, а на стенках отверстий такого покрытия не будет. В каждом из данных вариантов осуществления, ко всей поверхности стентов или их участкам можно присоединять любое число антитромботических средств. Кроме того, для присоединения антитромботического средства к стенту можно использовать любое число известных методов, например таких методов, которые применяют с покрытием HEPACOAT™ на коронарном стенте Bx Velocity® компании Cordis Corporation. В альтернативном варианте, стенты могут быть изготовлены с поверхностями с неровной текстурой или могут обладать микротекстурой для усиления сцепления клеток и эндотелиализации, независимо от антитромботического покрытия или в дополнение к нему. Кроме того, в отверстия можно закладывать любое число терапевтических средств, и в разных областях стента можно использовать разные активные средства.
Как изложено выше, важно отметить, что, в соответствии с настоящим изобретением, возможно использование любого числа лекарств и/или активных средств, включая: антипролиферативные/антимитотические активные средства, в том числе натуральные продукты, например алкалоиды барвинка (Vinca) (т.е. винбластин, винкристин и винорелбин), паклитаксел, эпидиподофилотоксины (т.е. этопозид, тенипозид), антибиотики (дактиномицин (актиномицин D), даунорубицин, доксорубицин и идарубицин), антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин, ферменты (L-аспарагиназу, которая системно гидролизует L-аспарагин и отнимает его у клеток, которые не обладают способностью синтезировать собственный аспарагин); антитромбоцитарные средства, например ингибиторы G(GP) IIb/IIIa и антагонисты рецептора витронектина; антипролиферативные/антимитотические алкилирующие средства, например нитроиприты (мехлорэтамин, циклофосфамид и аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкил-сульфонаты - бусульфан, нитрозомочевины (кармустин (BCNU) и аналоги, стрептозоцин), тразены - дакарбазинин (DTIC); антипролиферативные/антимитотические антиметаболиты, например аналоги фолиевой кислоты (метотрексат), аналоги пиримидина (флуороурацил, флоксуридин и цитарабин), аналоги пурина и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин {кладрибин}); координационные комплексы платиновых металлов (цисплатин, карбоплатин), прокарбазин, оксимочевину, митотан, аминоглютетимид; гормоны (т.е. эстроген); антикоагулянты (гепарин, синтетические соли гепарина и другие ингибиторы тромбина); фибринолитические средства (например, активатор плазминогена ткани, стрептокиназу и урокиназу), аспирин, дипиридамол, тиклопидин, клопидогрель, абциксимаб; антимиграционные средства; антисекреторные вещества (брефелдин (breveldin)); противовоспалительное средство: например адренокортикальные стероиды (кортизол, кортизон, флудрокортизон, преднизон, преднизолон, 6α-метилпреднизолон, триамцинолон, бетаметазон и дексаметазон), нестероидные средства (производные салициловой кислоты, т.е. аспирин; производные пара-аминофенола, т.е. ацетаминофен; индол- и инден-уксусные кислоты (индометацин, сулиндак и этодалак), гетероарилуксусные кислоты (толметин, диклофенак и кеторолак), арилпропионовые кислоты (ибупрофен и производные), антраниловые кислоты (мефенаминовую кислоту и меклофенаминовую кислоту), эноловые кислоты (пироксикам, теноксикам, фенилбутазон и оксифентатразон (oxyphenthatrazone)), набуметон, соединения золота (ауранофин, ауротиоглюкоза, тиомалат золота-натрия); иммунодепрессанты: (циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, микофенолат мофетил); ангиогенные средства: васкулярный эндотелиальный фактор роста (VEGF), фибробластовый фактор роста (FGF); тромбоцитарный фактор роста (PDGF), эритропоэтин, блокиратор ангиотензиновых рецепторов; доноры оксидов азота; антисмысловые олигонуклеотиды и их комбинации; ингибиторы клеточного цикла, ингибиторы mTOR (мишени рапамицина у млекопитающих) и ингибиторы киназы в трансдукции сигнала рецептора фактора роста.
Далее на фигурах 9A, 9B и 9C схематически представлен участок стента.
Как показано на фигуре 9A, стент 900 содержит множество, по существу, круглых отверстий 902. В данном примерном варианте осуществления, множество, по существу, круглых отверстий 902 продолжается сквозь стенку стента 900. Другими словами, множество, по существу, круглых отверстий 902 продолжается от аблюминальной поверхности 904 стента до аблюминальной поверхности 906 стента, при этом толщина стенки определяется как расстояние между люминальной и аблюминальной поверхностями. Однако в других вариантах осуществления отверстия не обязательно должны продолжаться сквозь стенку стента 900. Например, отверстия или емкости могут продолжаться частично либо от люминальной, либо от аблюминальной поверхностей, либо от обеих. Стент 900, показанный на фигуре 9A, содержит необработанные поверхности 904 и 906 и пустые отверстия 902.
Как видно на фигуре 9B, на, по меньшей мере, одну поверхность нанесено покрытие из терапевтического средства 908. Терапевтическое средство предпочтительно содержит антитромботическое средство, например гепарин; однако можно применить любое антитромботическое средство. Антитромботическое средство можно присоединять с использованием любого метода, кратко описанного выше. В данном примерном варианте осуществления, как аблюминальная, так и люминальная поверхности содержат присоединенное к ним антитромботическое средство. Кроме того, так как, в настоящий момент, во множестве, по существу, круглых отверстий 902 ничего не содержится, то стенки отверстий 902 могут также содержать некоторое присоединенное к ним антитромботическое средство. Количество антитромботического средства, присоединенного к стенкам 910 отверстий, зависит от того, каким методом присоединено упомянутое средство. Например, если упомянутое средство присоединено нанесением покрытия методом окунания, то стенки отверстий будут содержать больше присоединенного к ним активного средства, чем в случае, когда активное средство присоединяют с использованием метода нанесения покрытия распылением. Как изложено в настоящей заявке, в данном примерном варианте осуществления, все открытые поверхности содержат присоединенное к ним массивное антитромботическое покрытие; однако в альтернативных примерных вариантах осуществления, только определенные поверхности могут содержать присоединенное к ним антитромботическое покрытие. Например, в одном примерном варианте осуществления, антитромботическим средством может быть обработана только поверхность, находящаяся в контакте с кровью. В еще одном альтернативном примерном варианте осуществления, покрытие из антитромботического средства может быть нанесено на одну или обе поверхности, но без нанесения на стенки отверстий. Данный результат можно получить множеством способов, включая заделку отверстий перед нанесением покрытия или создание отверстий после присоединения антитромботического средства.
На фигуре 9C изображен окончательно приготовленный стент в соответствии с данным примерным вариантом осуществления. Как показано на данной фигуре, множество, по существу, круглых отверстий 902 заполнено, по меньшей мере, одним терапевтическим средством для лечения сосудистых заболеваний, например, рестеноза и воспаления или любых других заболеваний, описанных в настоящей заявке. Каждое отверстие 902 может быть заполнено одним и тем же терапевтическим средством или разными активными средствами, как подробно пояснялось выше. Как показано на данной фигуре, упомянутые разные активные средства 912, 914 и 916 применяют по конкретной схеме; однако, как подробно пояснялось выше, возможно любое сочетание, а также использование единственного активного средства в разных концентрациях. Лекарства, например, рапамицин, можно закладывать в отверстия 902 любым подходящим способом. Методы закладки активного средства включают в себя закапывание микропипетками и/или струйное заполнение. В одном примерном варианте осуществления, заполнение лекарством можно выполнять так, что лекарство и/или матрица лекарство/полимер в отверстии будут находиться ниже уровня поверхностей стента, чтобы не было контакта с окружающей тканью. В альтернативном варианте, отверстия можно заполнить так, что лекарство и/или матрица лекарство/полимер может контактировать с окружающей тканью. Кроме того, суммарную дозу каждого из лекарств, если применяется несколько лекарств, можно рассчитывать с максимальной гибкостью. Кроме того, скорость высвобождения каждого из лекарств можно регулировать индивидуально. Например, отверстия вблизи концов могут содержать больше лекарств для лечения краевого рестеноза.
В соответствии с данным примерным вариантом осуществления, лунки или отверстия могут быть выполнены не только для максимально эффективной лекарственной терапии, но также для создания физического разделения между разными лекарствами. Данное физическое разделение может способствовать предотвращению взаимодействия между активными веществами.
В контексте настоящей заявки, термин рапамицин охватывает рапамицин и все его аналоги, производные и конъюгаты, которые связываются с FKBP12 и другими иммунофилинами и обладают такими же фармакологическими свойствами, как рапамицин, включая ингибирование TOR. Кроме того, все лекарства и активные вещества, описанные в настоящей заявке, включают в себя их аналоги, производные и конъюгаты.
Как изложено в настоящей заявке, на стент, содержащий выполненные в нем сквозные отверстия, лунки, емкости или отверстия, можно наносить покрытие из антитромботического средства и/или лекарства или комбинации лекарств, например лекарств, описанных в настоящей заявке, и отверстия можно заполнять, по меньшей мере, одним только терапевтическим средством или в комбинации с, по меньшей мере, одним полимером. По существу, стент можно изготавливать с выполненными в нем отверстиями, и, до введения или осаждения только терапевтических средств или в комбинации с, по меньшей мере, одним полимером в отверстия, к стенту или его участку можно присоединить антитромботическое средство со связующим носителем или без него. В примерном варианте осуществления, описанном в настоящей заявке, антитромботическое средство можно наносить на люминальную и аблюминальную поверхности стента, а также на поверхности стенок отверстий. В данном примерном варианте осуществления, антитромботическое средство содержит гепарин или его различные производные, например низкомолекулярный гепарин (LMWH), хотя, возможно использование любого числа подходящих антитромботических средств. Гепарин и/или LMWH имеют очень высокие отрицательные заряды.
На всю поверхность стента, описанного в настоящей заявке, включая внутренние поверхности сквозных отверстий или отверстий, которые становятся емкостями для терапевтического средства и/или комбинации из полимеров и терапевтического средства, сначала наносят ковалентно связанное гепариновое покрытие. Само гепариновое покрытие связывают с металлической поверхностью стента с помощью его собственной грунтовки, содержащей чередующиеся слои поли(этиленимина), сильно катионного полимера, обозначаемого известным сокращением PEI, и сульфата декстрана, анионного полимера. Нанесение грунтовки данного типа известно в технике и описано в ряде патентов, включая патенты США №№ 5213898, 5049403, 6461665 и 6767405. В частности, гепарин ковалентно связывается с грунтовкой, содержащей слои PEI-сульфата декстрана, которая, в свою очередь, связывается с металлической поверхностью. После того, как на все поверхности наносят гепариновую смесь, каждую из лунок или емкостей наполняют с использованием одного из технологических процессов, описанных в настоящей заявке.
В соответствии с другим примерным вариантом осуществления, настоящее изобретение относится к композициям и конфигурациям грунтовок для усиления адгезии доставляющей лекарство матрицы, например комбинации терапевтического средства и полимера, к покрытой гепарином поверхности медицинского устройства, например стента. Настоящее изобретение полезно, в частности, когда гепариновое покрытие ковалентно связывается с металлической или полимерной поверхностью медицинского устройства. В соответствии с настоящим изобретением, грунтовка предпочтительно содержит высокомолекулярный компонент или низкомолекулярный компонент, и доставляющая лекарство матрица содержит лекарство и/или другое лечебное средство и наполнитель, предпочтительно, полимерный наполнитель. Кроме того, грунтовка может также, предпочтительно, содержать материал, имеющий электрический заряд, противоположный электрическому заряду в нижележащем слое, например гепарина, и плотность заряда, аналогичную плотности нижележащего заряда.
Принцип грунтовки, нанесенной поверх гепаринового слоя или покрытия, для усиления сцепления покрытой гепарином поверхности с любой другой матрицей или любым другим покрытием представляется оригинальным, с учетом того, что, обычно, гепариновую поверхность применяют для придания антитромботических свойств и, следовательно, не закрывают при практическом применении. В настоящем изобретении, только внутренние поверхности стенок лунок или отверстий в стенте, который содержит емкости с лекарством и полимером, будут покрывать грунтовкой в соответствии с настоящим изобретением, чтобы, тем самым, усиливать адгезию между двумя слоями и ограничивать возможную потерю матрицы лекарство-полимер, без существенного негативного влияния на гепариновую поверхность снаружи емкостей. Важно отметить, что блокирующие гепарин грунтовки в соответствии с настоящим изобретением являются биосовместимыми при их новом предполагаемом применении.
Грунтовку в соответствии с настоящим изобретением можно применять со стентом любого типа. В примерном варианте осуществления, описанном в настоящей заявке, грунтовку применяют со стентом или стентами, показанными на фигурах 1, 2, 3 и 4.
В соответствии с одним примерным вариантом осуществления, грунтовка содержит конъюгаты полимер-поли(этиленимин), например сополимер молочной и гликолевой кислот (PLGA) и поли(этиленимин) (PEI) и/или PLGA-протамин. Поли(этиленимин) является сильно катионным полимером, который связывается с некоторыми отрицательно заряженными белками или полисахаридами. В дополнение к PEI, другим материалом, полезном в упомянутом конъюгате, является протамин. Протамин представляет собой апробированное низкомолекулярное белковое лекарство, которое применяется в качестве антидота по отношению к гепарину. Протамин редко бывает водным раствором. При этом грунтовка может одновременно сильно взаимодействовать как с гепариновым покрытием, так и с содержащей лекарство матрицей, и, тем самым усиливать адгезию между двумя веществами. Поскольку гепарин является поли(анионным) веществом, то ожидается, что поли(катионное) вещество, например протамин, будет прочно связываться с гепарином, но будет достаточно гидрофобным в других звеньях его структуры, чтобы допускать прочную связь компонента PLGA матрицы лекарство-полимер в резервуаре.
Реакции связывания между PLGA и PEI и между PEI и гепарином могут быть реакциями ионного связывания или ковалентного связывания. На фигуре 10 изображен пример ковалентного связывания между PLGA и PEI. В частности, на фигуре 10 показана реакция конъюгации между PLGA с карбоксильной концевой группой и низкомолекулярным PEI. В альтернативном варианте, грунтовка может содержать высокомолекулярный PEI или разветвленный PEI. На фигуре 11 показана реакция конъюгации между PLGA с карбоксильной концевой группой и высокомолекулярным PEI или разветвленным PEI. Как показано, реакцию можно отрегулировать на отношение один к одному или конъюгат PLGA-PEI-PLGA с отношением 2:1 между PLGA и PEI.
В нижеприведенной таблице представлена эффективность PEI в качестве грунтовки для усиления адгезии комплекса лекарство/полимер к покрытым гепарином поверхностям. Опытные стенты погружали в испытательную среду, содержащую фосфатно-солевой буферный раствор и бычий сывороточный альбумин, которая моделирует условия физиологической жидкости. Комплекс лекарство/полимер содержит рапамицин и PLGA.
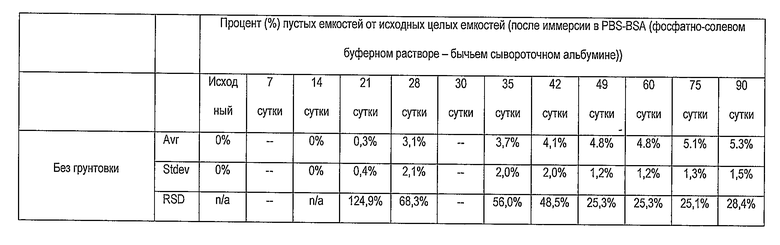
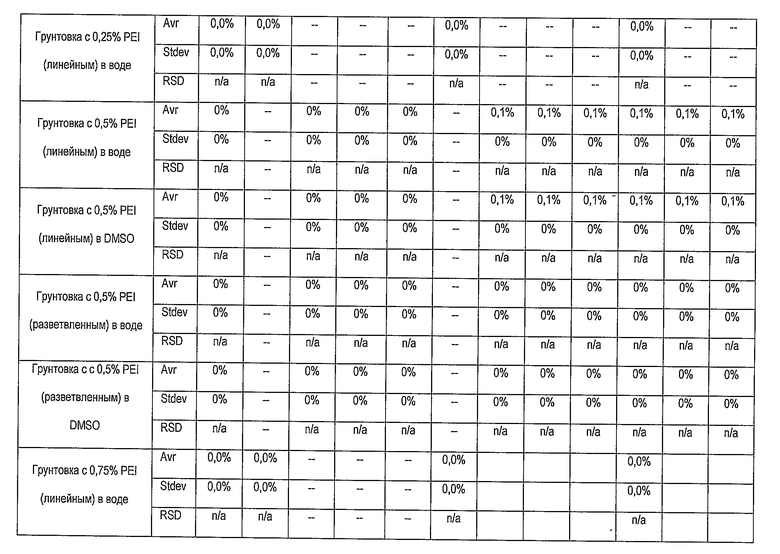
PEI = Полиэтиленимин
DMSO = Диметилсульфоксид
Avg = среднее значение
Stdev = среднеквадратическое отклонение
RSD = относительное стандартное отклонение
n/a = неприменимо
В альтернативном примерном варианте осуществления грунтовка может содержать низкомолекулярные катионы, образующие комплексы с гепарином, включая бензалконий хлорид и/или олигомерные, содержащие аргинин пептиды, или высокомолекулярные комплексообразующие катионы, включая полилизин, поли(аргинин), протамин, поли(диметиламиноэтил)метакрилат или поли(диметиламиноэтил)акрилат.
В соответствии с настоящим изобретением, процесс для усиления адгезии лекарственного комплекса к гепарину может содержать нанесение грунтовки-усилителя адгезии и последующее нанесение раствора для наполнения полимером/лекарством или нанесение грунтовки-усилителя адгезии и последующее нанесение раствора для наполнения PLGA с карбоксильными концевыми группами или смесью PLGA с карбоксильными концевыми группами и регулярного строения и PLGA/лекарство.
Грунтовку в соответствии с настоящим изобретением будут наносить на внутренние, покрытые гепарином стенки лунок или отверстий в стенте перед наполнением отверстий матрицей для локальной доставки лекарства. Другими словами, в готовом, элюирующим лекарство стенте, грунтовка будет занимать пространство между поверхностью гепаринового покрытия и основой доставляющей лекарство матрицы и будет усиливать адгезию между гепариновым покрытием и доставляющей лекарство матрицей. Усиление адгезии достигается за счет нескольких факторов, включающих в себя уменьшение осмотической концентрации раствора/инфильтрации воды в гепариновое покрытие во время использования, после нейтрализации заряда катионной грунтовкой, уменьшение водорастворимости комплекса гепарин/катионная грунтовка по сравнению с одной гепариновой поверхностью, ионное связывание, ковалентное связывание и более сильную физическую адгезию между грунтовкой и матрицей полимер/лекарство благодаря поверхностному натяжению и т.п.
В другом примерном варианте осуществления настоящего изобретения, грунтовка в соответствии с настоящим изобретением будет предпочтительно содержать участок ее молекулярной структуры, который заряжен положительно для связывания с отрицательно заряженным гепариновым покрытием, и участок, который является гидрофобным, гидрофильным или сбалансированным для связывания с полимерным компонентом доставляющей лекарство матрицы. Данный участок грунтовки будет изменяться в зависимости от характера доставляющей лекарство матрицы. В частности, грунтовка предназначена для усиления адгезии доставляющей лекарство матрицы к покрытым гепарином отверстиям стента, чтобы никакие или, по существу, никакие из отверстий или емкостей не теряли своего содержимого, когда стент приходит в контакт с текучими средами на водной основе, например физиологическим раствором, кровью и/или межклеточной жидкостью.
Хотя описание грунтовки в соответствии с настоящим изобретением приведено для специальной цели усиления адгезии между покрытыми гепарином внутренними стенками емкости стента и смесью лекарство/полимер, заполняющей емкость, данная грунтовка может быть полезна для соединения или связывания любой подложки с участком покрытой гепарином поверхности. Например, на пластиковые медицинские устройства, контактирующие с кровью, часто наносят гепариновое покрытие для сведения к минимуму тромбоза на устройстве, но, возможно, желательно было бы наносить упомянутое покрытие на данную поверхность позднее. Смесь грунтовок в соответствии с настоящим изобретением в растворителе можно наносить на выбранную зону устройства, растворитель можно испарять для создания покрытой грунтовкой зоны на гепариновой поверхности, после чего с загрунтованной зоной можно связывать новую подсистему.
Материал грунтовки предпочтительно наносить в виде раствора полимерной грунтовки в растворителе, например диметилсульфиде (DMSO), N-метилпирролидоне, или в виде ее водных смесей и можно вносить в емкости с использованием любого из методов заполнения, описанных в заявке, рассматриваемой в настоящий момент. Затем данный раствор грунтовки можно высушить для обеспечения покрытия слоем грунтовки по покрытой гепарином поверхности. В предпочтительном варианте, нанесение слоя грунтовки потребует только одного этапа осаждения в процессе наполнения стента. Выбор подходящего растворителя для осаждения катионной грунтовки определяется, в основном его способностью растворять грунтовку и его совместимостью с устройством заполнения и технологическим процессом, описанным в настоящей заявке.
Настоящее изобретение можно охарактеризовать просто как имплантируемое медицинское устройство. Медицинское устройство содержит интралюминальный каркас, содержащий множество выполненных в нем отверстий, первое покрытие, содержащее материал, имеющий первый электрический заряд, присоединенное к, по меньшей мере, участку поверхности интралюминального каркаса и поверхности множества отверстий, второе покрытие, содержащее материал, имеющий второй электрический заряд, присоединенное к, по меньшей мере, участку первого покрытия, при этом второй электрический заряд противоположен первому электрическому заряду, и, по меньшей мере, одно терапевтическое средство, заложенное в, по меньшей мере, одно из множества отверстий, причем, второе покрытие выполнено в виде промежуточного слоя между первым покрытием и, по меньшей мере, одним терапевтическим средством.
Первое покрытие может содержать любое подходящее антитромботическое средство, описанное в настоящей заявке. Например, можно использовать полисахарид, например гепарин. Второе покрытие может содержать полимерный катион или полимерный конъюгат, содержащий катионные сегменты, описанные в настоящей заявке. Примеры полимерных катионов содержат олигомерные, содержащие аргинин пептиды, полилизин, поли(аргинин), протамин, поли(диметиламиноэтил)поли(этиленимин). Примеры полимерных катионных конъюгатов содержат первый компонент, например сополимер молочной и гликолевой кислот, и второй компонент, содержащий любой из вышеописанных катионов. Терапевтическое средство может содержать антирестенотическое средство, противовоспалительное средство, антитромботическое средство, антипролиферативное средство, средство для сведения к минимуму повреждения пораженной инфарктом ткани или любую комбинацию перечисленных средств.
В более общем смысле, принцип настоящего изобретения можно расширить, чтобы включить в него грунтовки, которые усиливают прочность адгезии между гидрофильными и гидрофобными поверхностями. Например, другие представляющие интерес гидрофильные поверхности представляют собой, так называемые, «скользкие» покрытия, например покрытия, используемые в связи с катетерами. Данные гидрофильные поверхности часто также ковалентно связаны, но могут быть всего лишь конформными покрытиями. Примерами химических структур, которые встречаются в скользких покрытиях, являются структуры на основе поливинилпирролидона, гидроксиэтилметакрилата, поли(этиленоксида) или поли(этиленгликоля) и т.п.
В соответствии с другим примерным вариантом осуществления, настоящее изобретение относится к управлению кинетикой высвобождения терапевтического средства из емкости в стенте.
Стент NEVO™ (Menlo Park, CA) использует технологию RES Technology для доставки сиролимуса. Доставка сиролимуса из емкостей (технология RES Technology), содержащих PLGA, который благополучно всасывается в течение 90-120 суток стентирования, обеспечивает возможность достижения клинической эффективности стента CYPHER® и характеристик заживления, аналогичных непокрытым металлическим стентам. Безопасность 3,5-мм опытного стента NEVO™ подтверждают опубликованные данные доклинических исследований. Текущее исследование проводилось для проверки безопасности и кинетики высвобождения для опытной конструкции стента NEVO™ диаметром 2,5 мм.
Опытный стент NEVO™ диаметром 2,5 мм, непокрытые металлические стенты (BMS; стенты с пустыми емкостями) и стенты CYPHER® имплантировали в LAD (левую переднюю нисходящую), LCx (левую огибающую) и/или правую коронарные артерии свиней на 1, 3, 8, 14, 30, 60 и 90 суток (с), чтобы оценить кинетику высвобождения сиролимуса, и на 30, 90 или 180 с, чтобы оценить гистопатологию и гистоморфометрию.
Кинетика высвобождения сиролимуса из стента NEVO™ с использованием технологии RES Technology характеризовалась немного меньшей скоростью, чем со стентами CYPHER® в течение 1-14 суток после имплантации (фигура 12). Однако содержание сиролимуса, полученное в артериях с использованием стента NEVO™, было немного выше, чем со стентами CYPHER®. Количество поглощенного сиролимуса/высвобожденного сиролимуса из стента NEVO™ было, приблизительно, в 3,2 раза больше, чем количество поглощенного сиролимуса/высвобожденного сиролимуса из стентов CYPHER®. Приведенные данные показывают, что сиролимус, доставляемый с использованием технологии RES Technology, может быть более эффективным, чем при доставке стентами CYPHER®. Однако содержание сиролимуса, полученное в артериях с использованием стента NEVO™, находится в безопасном и эффективном диапазоне, как ранее установлено. Хотя содержание сиролимуса, полученное в артериях с использованием стента NEVO™, было немного выше, чем со стентами CYPHER®, заживление сосудов со стентом NEVO™ было подобным полученному со стентами BMS и CYPHER®. Все стенты эндотелизировались к 30-ым суткам. Показатель воспаления около распорок в стенте NEVO™ был минимальным и значительно ниже, чем в стентах BMS на 30-е сутки (NEVO™: 0,87±0,60 по сравнению со стентами BMS: 1,05±0,19, p<0,05; стентами CYPHER®: 1,07±0,60). Воспаление оставалось минимальным на 90-е и 180-е сутки; и не различалось между группами. Толщина неоинтимального образования не различалась между группами стентов (на 30-е сутки, NEVO™: 0,21±0,07 мм, стенты CYPHER®: 0,22±0,10 мм, BMS: 0,18±0,05 мм). Как ожидалось, фибрина около распорок через 30 суток в стентах NEVO™ и CYPHER® было значительно больше, чем в стентах BMS, и постепенно уменьшалось к 90-ым и 180-ым суткам. Приведенные результаты согласуются с результатами, наблюдавшимися ранее с опытным стентом NEVO™ диаметром 3,5 мм.
Опытный стент NEVO™, использующий технологию RES Technology для доставки сиролимуса, является более эффективным, чем стенты CYPHER®; однако заживление сосудов сравнимо со стентами CYPHER® и BMS. Кроме того, опытные стенты NEVO™ с диаметрами 2,5 и 3,5 мм обладают сходными характеристиками безопасности.
Выше показаны и описаны варианты осуществления, которые считаются наиболее целесообразными и предпочтительными, однако следует понимать, что специалистам в данной области станут очевидными отклонения от конкретных показанных и описанных конструкций и способов, которые можно будет применить без выхода за пределы существа и объема изобретения. Настоящее изобретение не ограничено конкретными конструкциями, которые описаны и показаны на фигурах, но подлежит истолкованию как согласующееся со всеми модификациями, которые могут находиться в пределах объема притязаний прилагаемой формулы изобретения.
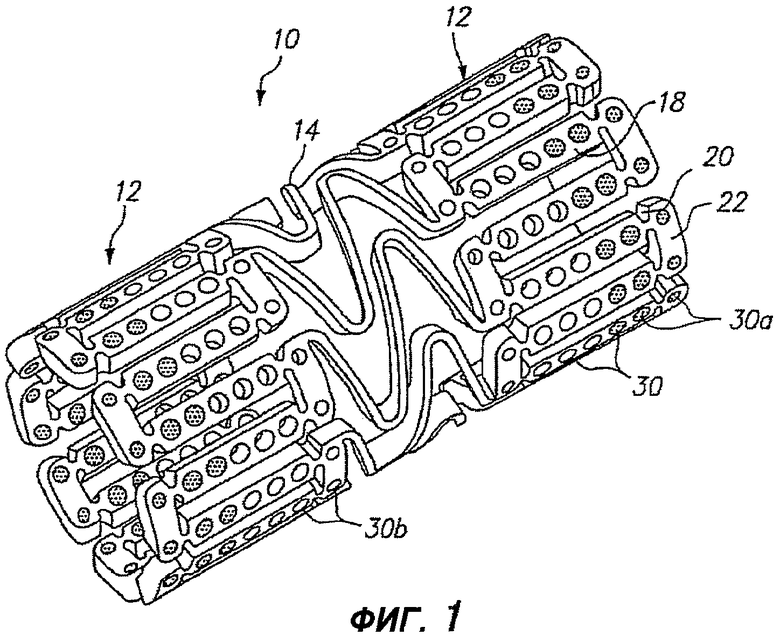
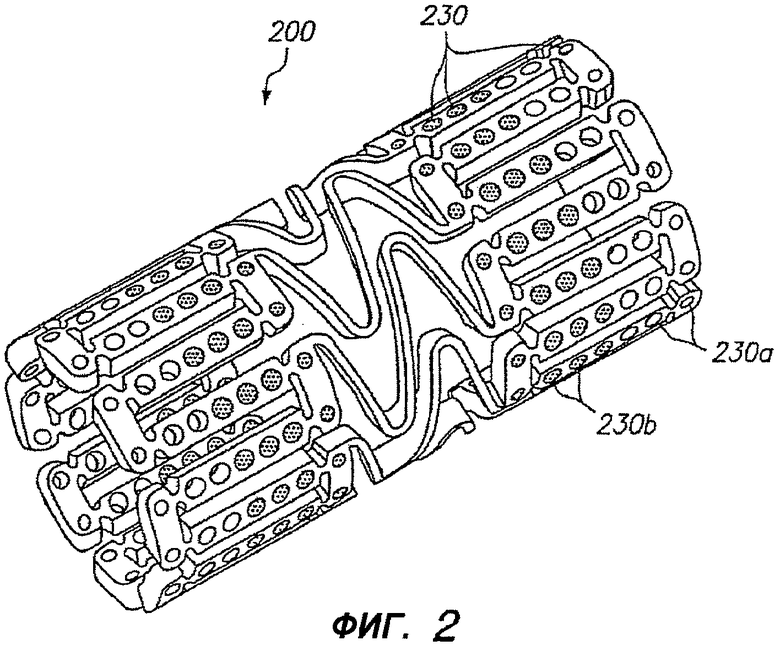
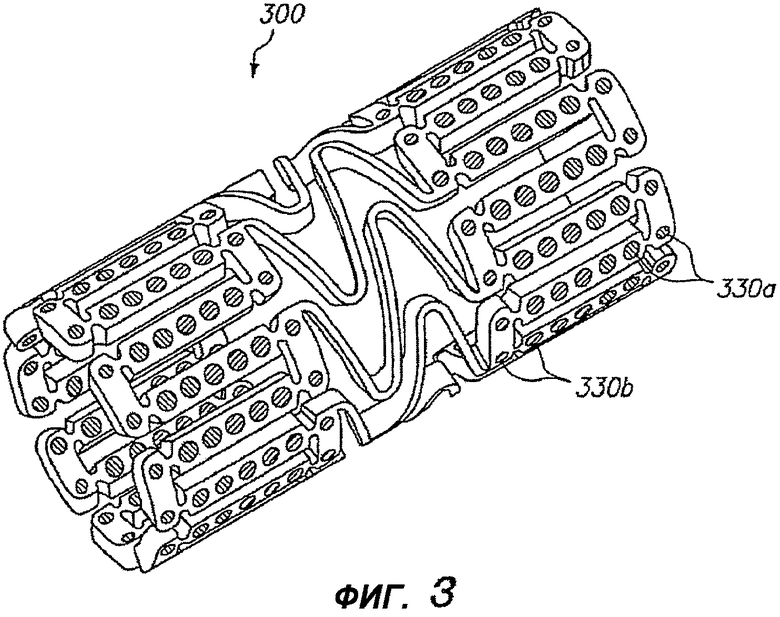
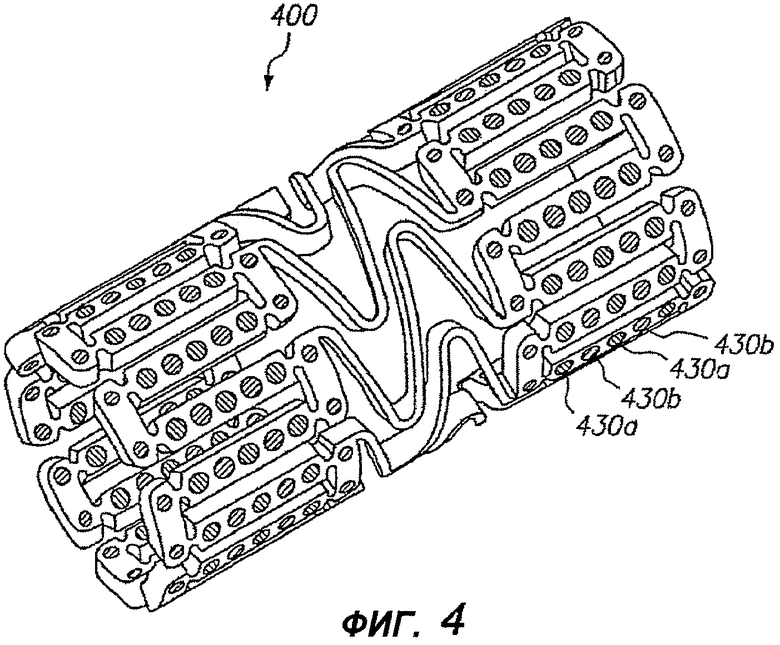
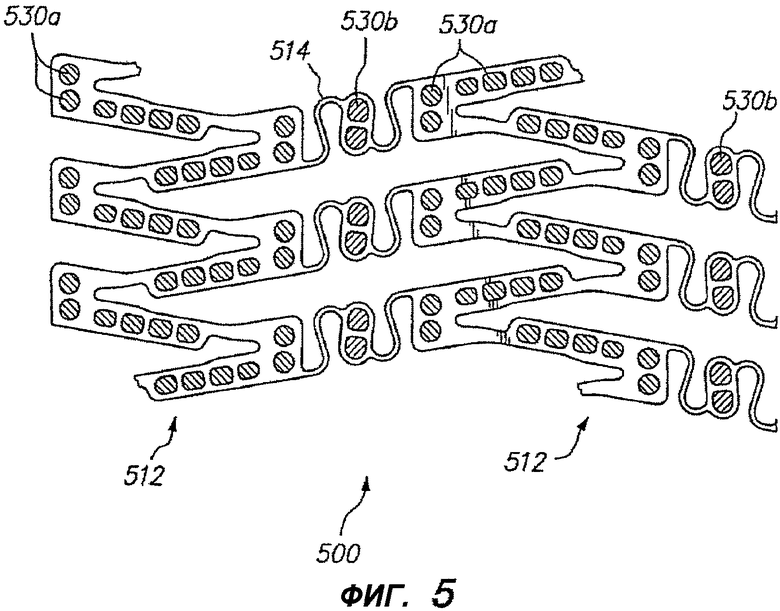
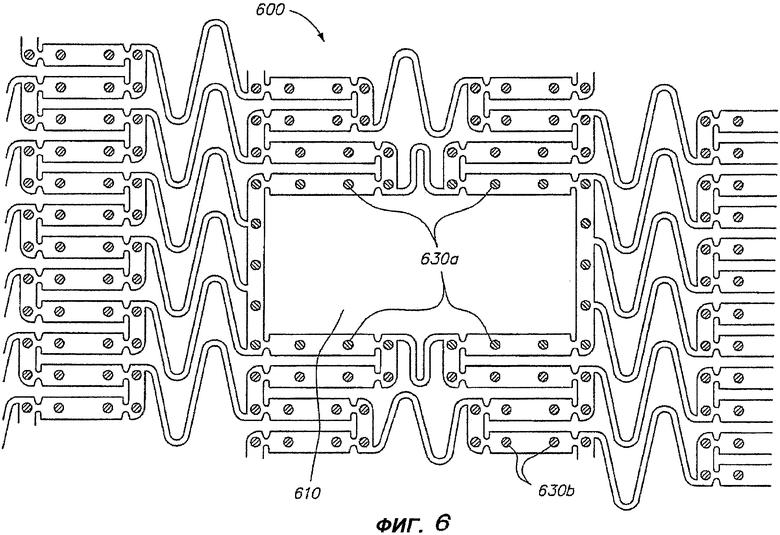
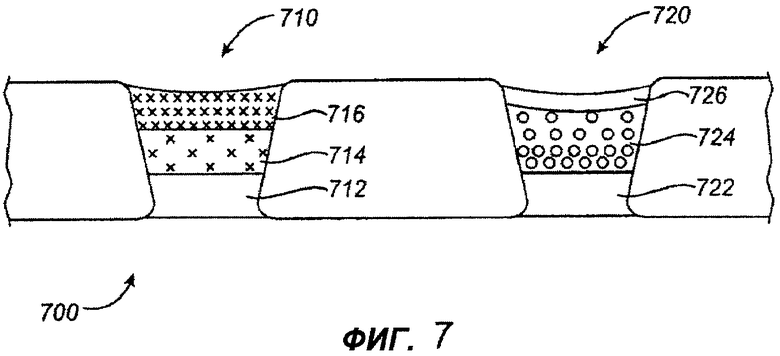
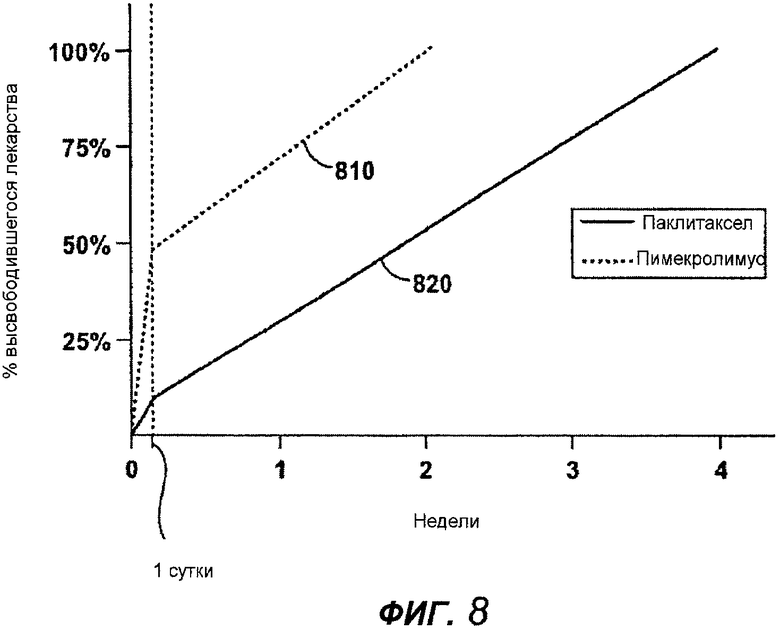
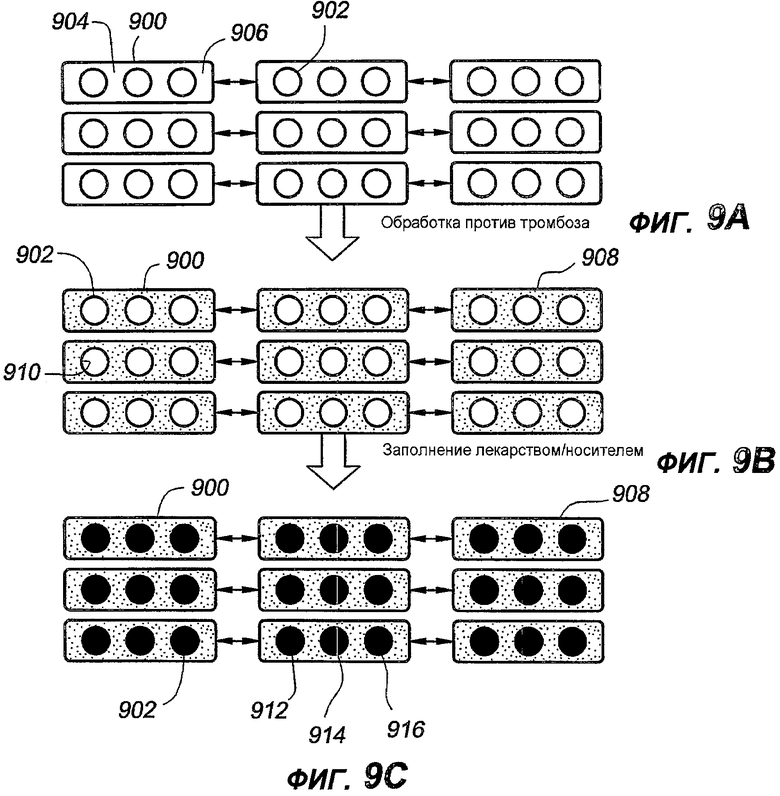
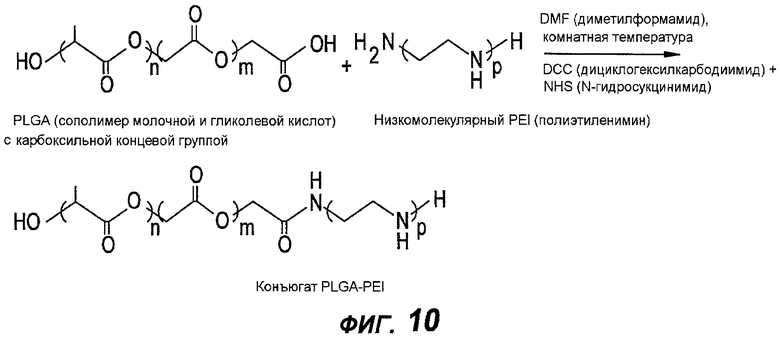
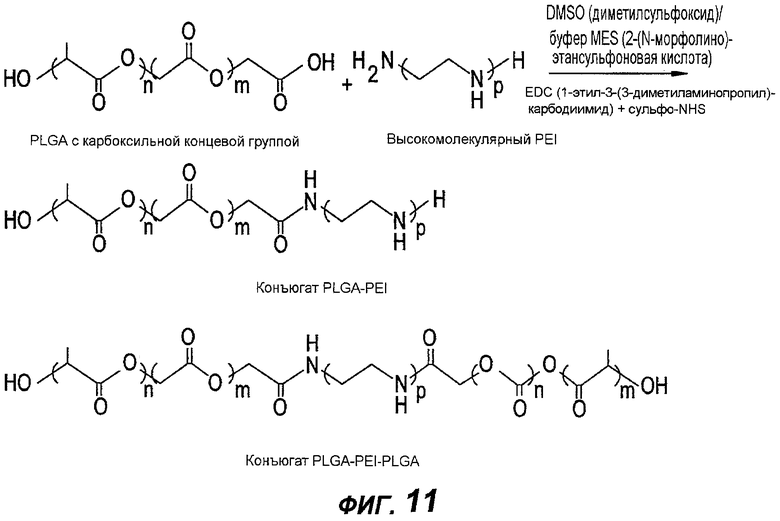
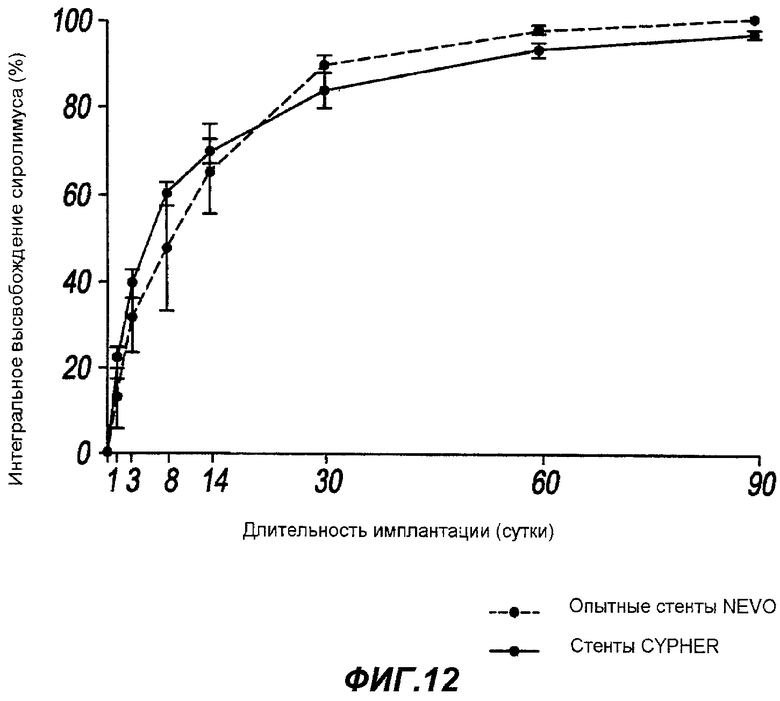
Изобретение относится к медицине, а именно к разработке расширяемых медицинских устройств, в частности стентов, и может быть использовано для лечения рестеноза в просвете сосуда. Предложенное имплантируемое медицинское устройство включает интралюминальный каркас (ИК), содержащий множество выполненных в нём отверстий. При этом ИК имеет трубчатую конфигурацию и включает множество цилиндрических секций, соединенных между собой множеством соединительных элементов. Каждая из цилиндрических секций ИК сформирована из сетки удлиненных распорок, которые соединены между собой пластическими шарнирами и окружными распорками. При этом в разные отверстия ИК заложены по меньшей мере два разных лечебных средства. По меньшей мере одно лечебное средство, заложенное по меньшей мере в одно из множества отверстий, инкорпорировано в матрицу сополимера молочной и гликолевой кислот (PLGA) для управления скоростью высвобождения и кумулятивной высвобожденной дозой лечебного средства в окружающую ткань. Изобретение обеспечивает эффективную комбинированную лекарственную терапию за счёт использования двух и более лекарств и/или активных веществ, закладываемых в разные отверстия устройств без увеличения толщины его стенки и без ограничения его подвижности, а также за счёт возможности доставки лекарственных средств с разными кинетиками высвобождения и/или периодами выведения. 5 з.п. ф-лы, 2 табл., 3 пр.
1. Имплантируемое медицинское устройство, содержащее:
интралюминальный каркас, содержащий множество выполненных в нем отверстий, при этом интралюминальный каркас содержит, по существу, трубчатую конфигурацию и содержит множество цилиндрических секций, соединенных между собой множеством соединительных элементов, каждая из цилиндрических секций сформирована из сетки удлиненных распорок, которые соединены между собой пластическими шарнирами и окружными распорками; и
по меньшей мере два разных лечебных средства, заложенных в разные отверстия,
причем по меньшей мере одно лечебное средство, заложенное в по меньшей мере одно из множества отверстий, инкорпорировано в матрицу сополимера молочной и гликолевой кислот (PLGA) для управления скоростью высвобождения и кумулятивной высвобожденной дозой лечебного средства в окружающую ткань.
2. Имплантируемое медицинское устройство по п.1, где по меньшей мере одно лечебное средство содержит рапамицин.
3. Имплантируемое медицинское устройство по п.1, где разные лечебные средства представляют собой разные лекарства.
4. Имплантируемое медицинское устройство по п.1 или 2, где разные лечебные средства представляют собой одно и то же лекарство в разных концентрациях.
5. Имплантируемое медицинское устройство по п.1 или 2, где разные лечебные средства представляют собой одно и то же лекарство с разными кинетиками высвобождения.
6. Имплантируемое медицинское устройство по п.1 или 2, где разные лечебные средства представляют собой разные формы одного и того же лекарства.
| US 6562065 B1 13.05.2003 | |||
| RU 2004129281 A 10.09.2005 | |||
| US 6241762 B1 05.06.2001 | |||
| WO 2004110302 А2 23.12.2004 | |||
| WO 2004043510 A1 27.05.2004 | |||
| EA 200401484 A1 30.06.2005 | |||
| ЛЕШКЕВИЧ К.Ф | |||
| и др | |||
| "Интервенционные методы лечения больных со стенозирующим атеросклерозом коронарных артерий" // "Рецепт", N4(54), 2007 [он-лайн] [Найдено 2013.10.28] найдено из |
Авторы
Даты
2015-02-20—Публикация
2010-01-29—Подача