Перекрестная ссылка на родственные заявки
Рассматриваемая заявка испрашивает приоритет относительно предварительной заявки США № 61/131599, поданной 10 июня 2008, предварительной заявки США № 61/131602, поданной 10 июня 2008, предварительной заявки США № 61/190159, поданной 26 августа 2008, и предварительной заявки США № 61/201064, поданной 5 декабря 2008, содержание которых включено в настоящий документ.
Уровень техники
В настоящем изобретении предложены новый класс соединений, фармацевтические композиции, включающие такие соединения, и способы использования таких соединений для лечения или профилактики заболеваний или нарушений, связанных с аномальной или разрегулированной киназной активностью, в частности, заболеваний или нарушений, которые включают аномальную активацию Jak1, Jak2, Jak3, Tyk2, KDR, Flt-3, CDK2, CDK4, TANK, Trk, FAK, Abl, Bcr-Abl, cMet, b-RAF, FGFR3, c-kit, PDGF-R, Syk, PKC киназ или Aurora киназ.
Протеинкиназы представляют собой обширное семейство белков, которые играют центральную роль в регулировании широкого круга клеточных процессов и в сохранении клеточных функций. Частичный, не лимитирующий список указанных киназ включает: нерецепторные тирозинкиназы, такие как семейство киназ Janus (Jak1, Jak2, Jak3 и Tyk2); гибридные киназы, такие как BCR-Abl, киназы фокальной адгезии (FAK), Fes, Lck и Syk; рецепторные тирозинкиназы, такие как киназы рецепторов факторов роста, полученных из тромбоцитов (PDGF-R), рецепторные киназы для фактора стволовых клеток, c-kit, рецептора фактора роста гепатоцитов, c-Met, и рецептора фактора роста фибробластов FGFR3; и серин/треонин киназы, такие как b-RAF, митоген-активированные протеинкиназы (например, MKK6) и SAPK2β. Абберантная киназная активность наблюдалась при многих болезненных состояниях, включая доброкачественные и злокачественные пролиферативные нарушения, также как заболевания, являющиеся результатом неадекватной активации иммунной и нервной систем. Новые соединения настоящего изобретения ингибируют активность одной или более из протеинкиназ, и поэтому ожидается, что они могут быть полезны при лечении опосредованных киназами заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом варианте осуществления настоящее изобретение предлагает соединение формулы (I)
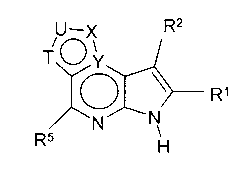
Формула (I)
его фармацевтически приемлемые соли, пролекарства, биологически активные метаболиты, стереоизомеры и изомеры, где
T представляет собой N, U представляет собой N, X представляет собой CR3 и Y представляет собой N; или
T представляет собой CR6, U представляет собой N, X представляет собой CR3 и Y представляет собой N; или
T представляет собой N, U представляет собой CR4, X представляет собой CR3 и Y представляет собой N; или
T представляет собой CR6, U представляет собой CR4, X представляет собой CR3 и Y представляет собой N; или
T представляет собой CR6, U представляет собой N, X представляет собой NR3 и Y представляет собой C; или
T представляет собой O, U представляет собой N, X представляет собой CR3 и Y представляет собой C; или
T представляет собой NR6, U представляет собой N, X представляет собой CR3 и Y представляет собой C; или
T представляет собой CR6, U представляет собой CR4, X представляет собой NR3 и Y представляет собой C; или
T представляет собой S, U представляет собой N, X представляет собой CR3 и Y представляет собой C;
R1, R2 и R5 каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -C(OH)RaRb, -N(Ra)S(O)2-Rb, -S(O)2N(Ra)(Rb), -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, или необязательно замещенный (C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R3 представляет собой водород, необязательно замещенный мостиковый (C5-C12)циклоалкил, необязательно замещенный мостиковый (C2-C10)гетероциклил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил; или
R3 представляет собой -A-D-E-G, где А присоединен к Х и;
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-OC(O)-Re-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
E представляет собой  ,
,
где во всех случаях, E связан или с атомом углерода, или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -OC(O)N(Ra), -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10)гетероциклил, необязательно замещенный -(C6-C10)арил, необязательно замещенный -(C1-C6)алкил-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкил-(C6-C10)арил, необязательно замещенный -(C1-C6)алкил-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкил-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R4 и R6 каждый независимо представляет собой водород, галоген, дейтерий, необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил или -J-L-M-Q;
где:
J представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
L представляет собой связь, необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
M представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, -Re-OC(O)-Re-, -Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-О-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
M представляет собой  ;
;
где во всех случаях, M связан или с атомом углерода, или с атомом азота в L;
Q представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкил-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкил-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
Ra и Rb каждый независимо представляет собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный (C1-C10)алкил-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re в каждом случае независимо представляет собой связь, необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-C10)алкинилен, необязательно замещенную -(C1-C10)алкилен-O-(C1-C10)алкиленовую группу, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, или необязательно замещенный (C1-C10)гетероциклилен;
при условии, что если соединение представляет собой
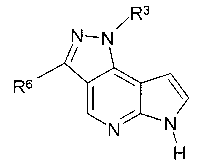
R3 имеет указанные выше значения, и R6 не связан с пиразольным кольцом через атом азота или кислорода; и
при условии, что если соединение представляет собой

если R3 представляет собой H, CH3 или -C(O)OH, тогда R4 не представляет собой H, -C(O)OCH2CH3, -C(O)NH-необязательно замещенный фенил, -NHC(O)-необязательно замещенный фенил или -S(O)2-фенил.
Во втором варианте осуществления настоящее изобретение предлагает соединение формулы (II)

Формула (II)
его фармацевтически приемлемые соли, пролекарства, биологически активные метаболиты, стереоизомеры и изомеры, где
если T представляет собой NR6, U представляет собой N, X представляет собой CR3 и существует двойная связь между U и X;
если T представляет собой O, U представляет собой N, X представляет собой CR3 и существует двойная связь между U и X;
если T представляет собой CR6, U представляет собой N, X представляет собой NR3 и существует двойная связь между T и U;
если T представляет собой CR6, U представляет собой CR4, X представляет собой NR3 и существует двойная связь между T и U;
R1, R2 и R5 каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -N(Ra)S(O)2-, -S(O)2N(Ra)-, -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, или необязательно замещенный (C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил, связанный через азот;
R3 представляет собой необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный адамантил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил или -A-D-E-G;
где:
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re -, -C(O)-Re-, -C(O)C(O)-Re-, -C(O)O-Re-, -C(O)C(O)N(Ra)-Re-, -O-Re-, -S(O)2-Re-, -S(O)-Re-, -S-Re-, -N(Ra)-Re-, -N(Ra)C(O)-Re-, -C(O)N(Ra)-Re-, -OC(O)N(Ra)-Re-, -OC(O)-Re-, -N(Ra)C(O)N(Rb)-Re-, -N(Ra)S(O)2-Re или -S(O)2N(Ra)-Re-; или
E представляет собой  ;
;
где во всех случаях, E связан или с атомом углерода или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкил-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, включающем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb), представляет собой необязательно замещенный (C2-C10)гетероциклил, связанный через азот;
R6 представляет собой водород, дейтерий, необязательно замещенную мостиковую (C3-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный адамантил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C2-C10)гетероциклил; или R6 представляет собой -J-L-M-Q, где:
J представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -C(O-Ra)(Rb)-Re-, или -S(O)2N(Ra)Re-;
L представляет собой связь, необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен; или
L представляет собой  ;
;
M представляет собой связь, -Re-, -C(O)-Re-, -C(O)C(O)-Re-, -C(O)O-Re-, -C(O)C(O)N(Ra)-Re-, -O-Re-, -S(O)2-Re-, -S(O)-Re-, -S-Re-, -N(Ra)-Re -, -N(Ra)C(O)-Re-, -C(O)N(Ra)-Re-, -OC(O)N(Ra)-Re-, -OC(O)-Re-, -N(Ra)C(O)N(Rb)-Re-, -N(Ra)S(O)2-Re- или -S(O)2N(Ra)-Re-;
Q представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкил-(C1-C10)гетероарил или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, включающем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил, связанный через азот;
R4 представляет собой водород, дейтерий, необязательно замещенную мостиковую (C3-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный адамантил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C2-C10)гетероциклил; или
R4 представляет собой -V-W-Y-Z, где:
V представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C12)циклоалкил, необязательно замещенный (C2-C6)гетероциклил, -C(O)N(Ra)-Re-, -C(O-Ra)(Rb)-Re-, или -S(O)2N(Ra)Re-;
W представляет собой связь, необязательно замещенный (C1-C8)алкил, необязательно замещенный мостиковый (C5-C12)циклоалкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный мостиковый (C2-C10)гетероциклил или необязательно замещенный (C2-C10)гетероциклил; или
W представляет собой 
Y представляет собой связь, -Re-, -C(O)-Re-, -C(O)C(O)-Re-, -C(O)O-Re-, -C(O)C(O)N(Ra)-Re-, -O-Re-, -S(O)2-Re-, -S(O)-Re-, -S-Re-, -N(Ra)-Re-, -N(Ra)C(O)-Re-, -C(O)N(Ra)-Re-, -OC(O)N(Ra)-Re-, -OC(O)-Re-, -N(Ra)C(O)N(Rb)-Re-, -N(Ra)S(O)2-Re- или -S(O)2N(Ra)-Re-;
Z представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, S(O)2Ra, -NO2, -C(O)ORb, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Rb, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкил-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, включающем -N(Ra)(Rb), указанный азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил, связанный через азот;
Ra и Rb каждый независимо представляет собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный -(C1-C10)алкилен-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re представляет собой связь, или его независимо выбирают из необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-C10)алкинилен, необязательно замещенная -(C1-C10)алкилен-O-(C1-C10)алкиленовая группа, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, или необязательно замещенный (C1-C10)гетероциклилен;
при условии, что если соединение представляет собой
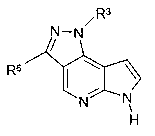
R6 не связан с пиразольным кольцом через атом азота или кислорода; и
при условии, что если соединение представляет собой

где если R3 представляет собой H, CH3 или -C(O)OH, тогда R4 не представляет собой H, -C(O)OCH2CH3, -C(O)NH-необязательно замещенный фенил, -NHC(O)-необязательно замещенный фенил или -S(O)2-фенил.
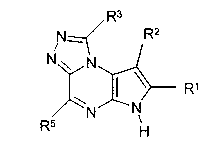
В третьем варианте осуществления настоящее изобретение предлагает соединение формулы (Ig)
Формула (Ig)
его фармацевтически приемлемые соли, пролекарства, биологически активные метаболиты, стереоизомеры и изомеры, где
R1, R2 и R5 каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -N(Ra)S(O)2-, -S(O)2N(Ra)-, -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10)гетероциклил, или необязательно замещенный -(C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил, связанный через азот;
R3 представляет собой необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный адамантил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C2-C10)гетероциклил; или R3 представляет собой -A-D-E-G, где:
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re-, -C(O)-Re-, -C(O)C(O)-Re-, -С(О)О-Re-, -С(О)С(О)N(Ra)-Re-, -O-Re-, -S(O)2-Re-, -S(O)-Re-, -S-Re-, -N(Ra)-Re-, -N(Ra)C(O)-Re-, -C(O)N(Ra)-Re-, -OC(O)N(Ra)-Re-, -OC(O)-Re-, -N(Ra)C(O)N(Rb)-Re-, -N(Ra)S(O)2-Re- или -S(O)2N(Ra)-Re-;
или
E представляет собой 
где во всех случаях, E связан или с атомом углерода или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10) гетероциклил, необязательно замещенный -(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил, связанный через азот;
R4 представляет собой водород, дейтерий, необязательно замещенную мостиковую (C3-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный адамантил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C2-C10)гетероциклил; или
R4 представляет собой -J-L-M-Q, где:
J представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -C(O-Ra)(Rb)-Re-, или -S(O)2N(Ra )Re-;
L представляет собой связь или необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
или L представляет собой 
M представляет собой связь, -Re-, -C(O)-Re-, -C(O)C(O)-Re-, -C(O)O-Re-, -C(O)C(O)N(Ra)-Re-, -O-Re-, -S(O)2-Re-, -S(O)-Re-, -S-Re-, -N(Ra)-Re-, -N(Ra)C(O)-Re-, -C(O)N(Ra)Re-, -OC(O)N(Ra)-Re-, -OC(O)-Re-, -N(Ra)C(O)N(Rb)-Re-, -N(Ra)S(O)2-Re-, или -S(O)2N(Ra)-Re-;
Q представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил, связанный через азот;
Ra и Rb независимо представляют собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный (C1-C10)алкилен-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re представляет собой связь, необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-C10)алкинилен, необязательно замещенную -(C1-C10)алкилен-O-(C1-C10)алкиленовую группу, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, или необязательно замещенный (C1-C10)гетероциклилен;
В четвертом варианте осуществления настоящее изобретение предлагает соединение формулы (III)
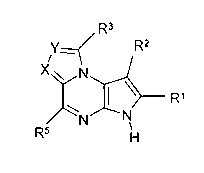
Формула (III)
его фармацевтически приемлемые соли, пролекарства, биологически активные метаболиты, стереоизомеры и изомеры, где
X представляет собой CR6 или N; Y представляет собой CR4 или N;
R1, R2 и R5 каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -C(OH)RaRb, -N(Ra)S(O)2-Rb, -S(O)2N(Ra)(Rb), -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, или необязательно замещенный (C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанный через азот;
R3 представляет собой необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил; или R3 представляет собой -A-D-E-G, где:
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-N(Ra)C(O)ORe-, -Re-C(O)ORe-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
E представляет собой 
где во всех случаях, E связан или с атомом углерода или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10)гетероциклил, необязательно замещенный -(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R6 представляет собой водород, дейтерий, необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C2-C10)гетероциклил или R6 представляет собой -J-L-M-Q, где:
J представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
L представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
M представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, -Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -ReC(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-N(Ra)C(O)ORe-, -Re-C(O)ORe-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
M представляет собой  ;
;
где во всех случаях, M связан или с атомом углерода или с атомом азота в L;
Q представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10) гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R4 представляет собой водород, дейтерий, необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C2-C10)гетероциклил; или R4 представляет собой -U-V-W-Z, где:
U представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
V представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
W представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, Re-C(O)C(O)N(Ra)-Re-, Re-N(Ra)-C(O)C(O)-Re-, -Re -O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, Re-C(O)N(Ra)Re-, Re-OC(O)N(Ra)-Re-, Re-N(Ra)C(O)ORe-, -Re-N(Ra)C(O)ORe-, -Re-C(O)ORe-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re- или -Re-S(O)2N(Ra)-Re-; или
W представляет собой  ;
;
где во всех случаях, W связан или с атомом углерода или с атомом азота в V;
Z независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10)гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
Ra и Rb каждый независимо представляет собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный (C1-C10)алкилен-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re в каждом случае независимо представляет собой связь, необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-C10)алкинилен, необязательно замещенную -(C1-C10)алкилен-O-(C1-C10)алкиленовую группу, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен или необязательно замещенный (C1-C10)гетероциклилен;
В пятом варианте осуществления настоящее изобретение предлагает соединение формулы (Ia)
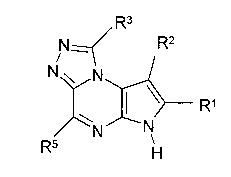
Формула (Ia)
его фармацевтически приемлемые соли, пролекарства, биологически активные метаболиты, стереоизомеры и изомеры, где
R1, R2 и R5 каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -N(Ra)S(O)2-, -S(O)2N(Ra)-, -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, или необязательно замещенный (C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил, связанный через азот;
R3 представляет собой необязательно замещенный мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный адамантил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C2-C10)гетероциклил; или R3 представляет собой -A-D-E-G, где:
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re-, -C(O)-Re-, -C(O)C(O)-Re-, -C(O)O-Re-, -C(O)C(O)N(Ra)-Re-, -O-Re-, -S(O)2-Re-, -S(O)-Re-, -S-Re-, -N(Ra)-Re-, -N(Ra)C(O)-Re-, -C(O)N(Ra)Re-, -OC(O)N(Ra)-Re-, -OC(O)-Re-, -N(Ra)C(O)N(Rb)-Re-, -N(Ra)S(O)2-Re- или -S(O)2N(Ra)-Re-; или
E представляет собой  ;
;
где во всех случаях, E связан или с атомом углерода или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10)гетероциклил, необязательно замещенный -(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил, связанный через азот;
Ra и Rb независимо представляют собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный (C1-C10)алкилен-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкил-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re в каждом случае независимо представляет собой связь, необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-C10)алкинилен, необязательно замещенную -(C1-C10)алкилен-O-(C1-C10)алкильную группу, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, или необязательно замещенный (C1-C10)гетероциклилен.
В шестом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где R1, R2 и R5 каждый независимо представляет собой водород, дейтерий, галоген, -ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -CF3, -OCF3, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, -(C1-C10)гетероциклил или необязательно замещенный -(C6-C10)арил.
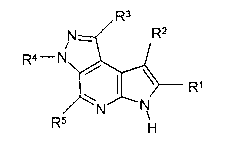
В седьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где T представляет собой N, U представляет собой N, X представляет собой CR3, Y представляет собой N и образует соединение формулы (Ia)
Формула (Ia)
В восьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где T представляет собой CR6, U представляет собой N, X представляет собой CR3 и Y представляет собой N и образует соединение формулы (Ib)
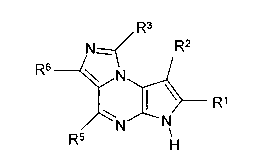
Формула (Ib)
В девятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где T представляет собой N, U представляет собой CR4, X представляет собой CR3, и Y представляет собой N и образует соединение формулы (Ic)
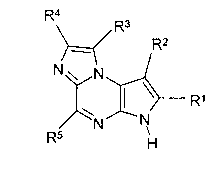
Формула (Ic)
В десятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где T представляет собой CR6, U представляет собой CR4, X представляет собой CR3 и Y представляет собой N и образует соединение формулы (Id)

Формула (Id)
В одиннадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где T представляет собой CR6, U представляет собой N, X представляет собой NR3 и Y представляет собой C и образует соединение формулы (Ie)
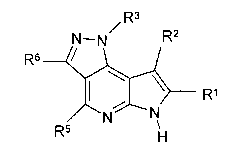
Формула (Ie)
В двенадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где T представляет собой O, U представляет собой N, X представляет собой CR3 и Y представляет собой C и образует соединение формулы (If)

Формула (If)
В тринадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где T представляет собой NR6, U представляет собой N, X представляет собой CR3, и Y представляет собой C и образует соединение формулы (Ig)
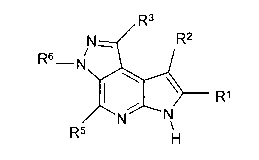
Формула (Ig)
В четырнадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где T представляет собой CR6, U представляет собой CR4, X представляет собой NR3, и Y представляет собой C и образует соединение формулы (Ih)
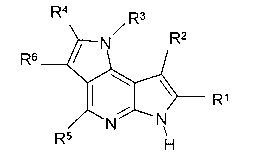
Формула (Ih)
В пятнадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где T представляет собой S, U представляет собой N, X представляет собой CR3 и Y представляет собой C и образует соединение формулы (Ii)
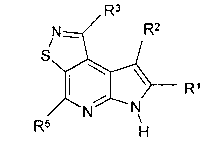
Формула (Ii)
В шестнадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым вариантом, где R3 представляет собой водород, необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C2-C10)гетероциклил.
В семнадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где R3 представляет собой водород, необязательно замещенный циклопропил, необязательно замещенный циклобутил, необязательно замещенный циклопентил, необязательно замещенный циклогексил, необязательно замещенный фенил, необязательно замещенный адамантил, необязательно замещенный азетидинил, необязательно замещенный бицикло[2.1.1]гексил, необязательно замещенный бицикло[2.2.1]гептил, необязательно замещенный бицикло[2.2.2]октил, необязательно замещенный бицикло[3.2.1]октил, необязательно замещенный бицикло[4.3.1]децил, необязательно замещенный бицикло[3.3.1]нонил, необязательно замещенный борнил, необязательно замещенный борненил, необязательно замещенный норборнил, необязательно замещенный норборненил, необязательно замещенный бицикло[3.1.1]гептил, необязательно замещенный трициклобутил, необязательно замещенный азанорборнил, необязательно замещенный квинуклидинил, необязательно замещенный изоквинуклидинил, необязательно замещенный тропанил, необязательно замещенный азабицикло[3.2.1]октанил, необязательно замещенный азабицикло[2.2.1]гептанил, необязательно замещенный 2-азабицикло[3.2.1]октанил, необязательно замещенный азабицикло[3.2.1]октанил, необязательно замещенный азабицикло[3.2.2]нонанил, необязательно замещенный азабицикло[3.3.0]нонанил, необязательно замещенный азабицикло[3.3.1]нонанил, необязательно замещенный бицикло[2.2.1]гепт-2-енил, необязательно замещенный пиперидинил, необязательно замещенный пирролидинил или необязательно замещенный тетрагидрофуранил.
В восемнадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где R3 представляет собой необязательно замещенный циклопропил, необязательно замещенный циклобутил, необязательно замещенный циклопентил, необязательно замещенный циклогексил, необязательно замещенный фенил, необязательно замещенный адамантил, необязательно замещенный азетидинил, необязательно замещенный бицикло[2.1.1]гексил, необязательно замещенный бицикло[2.2.1]гептил, необязательно замещенный бицикло[2.2.2]октил, необязательно замещенный бицикло[3.2.1]октил, необязательно замещенный бицикло[3.1.1]гептил, необязательно замещенный азабицикло[3.2.1]октанил, необязательно замещенный азабицикло[2.2.1]гептанил, необязательно замещенный 2-азабицикло[3.2.1]октанил, необязательно замещенный азабицикло[3.2.2]нонанил, необязательно замещенный бицикло[2.2.1]гепт-2-енил, необязательно замещенный пиперидинил, необязательно замещенный пирролидинил или необязательно замещенный тетрагидрофуранил.
В девятнадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где R3 представляет собой A-D-E-G.
В двадцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
В двадцать первом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где D представляет собой необязательно замещенный азетидинил, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C5-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен, или необязательно замещенный (C2-C10)гетероциклилен.
В двадцать втором варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где E представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)-Re-, -Re-N(Ra)S(O)2-Re-, -Re-N(Ra)C(O)N(Rb)-Re- или -Re-S(O)2N(Ra)-Re-.
В двадцать третьем варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где G представляет собой -ORa, CN, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), необязательно замещенный (C1-C6)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил или необязательно замещенный фенил.
В двадцать четвертом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где R3 представляет собой A-D-E-G и A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-, -N(Ra)-, -S-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-, -N(Ra)S(O)2- или -N(Ra)C(O)N(Rb)-.
В двадцать пятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где D представляет собой необязательно замещенный азетидинил, необязательно замещенный бицикло[2.2.2]октанилен, необязательно замещенный бицикло[2.2.1]гептилен, необязательно замещенный бицикло[2.1.1]гексилен, необязательно замещенный циклобутилен, необязательно замещенный циклопентилен, необязательно замещенный циклогексилен, необязательно замещенный бицикло[2.2.1]гепт-2-енилен, необязательно замещенный пиперидин, или необязательно замещенный пирролидин.
В двадцать шестом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где E представляет собой -Re-C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-N(Ra)S(O)2-Re- или -Re-S(O)2N(Ra)R-e.
В двадцать седьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где G представляет собой -ORa, -CN, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), необязательно замещенный (C1-C6)алкил, необязательно замещенный циклопропил, необязательно замещенный циклобутил, необязательно замещенный циклопентил, необязательно замещенный фенил, необязательно замещенный пиридазин, необязательно замещенный пиразин, необязательно замещенный пиримидин, необязательно замещенный пиразол, необязательно замещенный пирролидин, необязательно замещенный хиназолин, необязательно замещенный пиридин, необязательно замещенный тиазолидин или необязательно замещенный триазол.
В двадцать восьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где A представляет собой связь или необязательно замещенный (C1-C6)алкилен.
В двадцать девятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где D представляет собой необязательно замещенный циклобутилен, необязательно замещенный циклопентилен, необязательно замещенный циклогексилен, необязательно замещенный азетидинил, необязательно замещенный бицикло[2.2.1]гептилен, необязательно замещенный бицикло[2.1.1]гексилен, бицикло[2.2.2]октанилен, необязательно замещенный пиперидин, или необязательно замещенный пирролидин;
E представляет собой -Re-C(O)-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)S(O)2-Re-, -Re-S(O)2-Re- или -Re-S(O)2N(Ra)-Re-, где Re в каждом случае представляет собой независимо связь, необязательно замещенный (C1-C6)алкилен или необязательно замещенный (C3-C6)циклоалкилен; и
G представляет собой -CN, необязательно замещенный (C1-C6)алкил, необязательно замещенный циклопропил, необязательно замещенный циклобутил, необязательно замещенный циклопентил, необязательно замещенный фенил, необязательно замещенный пиразинил, необязательно замещенный пиридазинил, необязательно замещенный пиримидинил, необязательно замещенный пиразолил, необязательно замещенный пиридинил, необязательно замещенный тиазолидинил или необязательно замещенный триазолил.
В тридцатом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где D представляет собой необязательно замещенный циклобутилен, необязательно замещенный циклопентилен, необязательно замещенный циклогексилен, необязательно замещенный азетидинил, необязательно замещенный пиперидин, необязательно замещенный бицикло[2.2.1]гептилен, или бицикло[2.2.2]октанилен.
В тридцать первом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где G представляет собой -CN, необязательно замещенный (C1-C6)алкил, необязательно замещенный циклопропил, необязательно замещенный циклобутил, необязательно замещенный циклопентил или необязательно замещенный фенил, необязательно замещенный пиразинил, необязательно замещенный пиридазинил, необязательно замещенный пиразолил, или необязательно замещенный пиридинил.
В тридцать втором варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где A представляет собой связь, D представляет собой необязательно замещенный циклопентилен, необязательно замещенный бицикло[2.2.2]октанил, необязательно замещенный азетидинил, или необязательно замещенный пиперидин;
E представляет собой -Re-C(O)-Re-, -Re-N(Ra)-Re-, -Re-S(O)2N(Ra)-Re-, -Re-S(O)2-Re- или -Re-N(Ra)S(O)2-Re-;
где Re в каждом случае представляет собой независимо связь или необязательно замещенный (C1-C6)алкилен; и
G представляет собой -CN, необязательно замещенный циклопропил, необязательно замещенный циклобутил, необязательно замещенный циклопентил, необязательно замещенный фенил, необязательно замещенный пиразин, необязательно замещенный пиридазин, необязательно замещенный пиразол или необязательно замещенный пиридин.
В тридцать третьем варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где G представляет собой -CN, необязательно замещенный циклопропил или необязательно замещенный циклопентил.
В тридцать четвертом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где R1, R2, R4, R5 и R6, если присутствуют, каждый независимо представляет собой водород или необязательно замещенный -(C1-C4)алкил.
В тридцать пятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым, вторым, четвертым, пятым, седьмым и шестнадцатым-тридцать третьим вариантами, где указанное соединение представляет собой соединение формулы (Ia)

Формула (Ia)
В тридцать шестом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым, четвертым, восьмым и шестнадцатым-тридцать третьим вариантами, где соединение представляет собой соединение формулы (Ib)
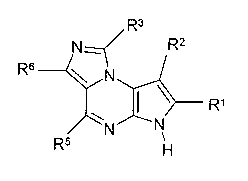
Формула (Ib)
В тридцать седьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым, четвертым, девятым, шестнадцатым-тридцать третьим вариантами, где соединение представляет собой соединение формулы (Ic)
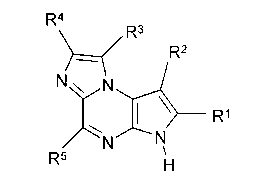
Формула (Ic)
В тридцать восьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где T представляет собой N, U представляет собой N, X представляет собой CR3 и Y представляет собой N.
В тридцать девятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым, четвертым, пятым, шестнадцатым-тридцать третьим вариантами, где соединение представляет собой

В сороковом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым, четвертым, пятым, шестнадцатым-тридцать третьим вариантами, где соединение представляет собой

В сорок первом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где соединение представляет собой
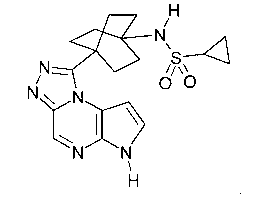
В сорок втором варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-четырнадцатым вариантами, где A представляет собой связь, D представляет собой необязательно замещенный циклопентилен или необязательно замещенный пиперидин, E представляет собой -Re-N(Ra)-Re-, -Re-S(O)2N(Ra)-Re-, -Re-C(O)-Re-, -Re- S(O)2-Re-, или -Re-N(Ra)S(O)2-Re-; и G представляет собой -CN, необязательно замещенный фенил, необязательно замещенный пиразин, необязательно замещенный пиридазин, необязательно замещенный пиразол, или необязательно замещенный пиридин.
В сорок третьем варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где T представляет собой CR6.
В сорок четвертом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где U представляет собой N.
В сорок пятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где X представляет собой CR3.
В сорок шестом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где Y представляет собой N.
В сорок седьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где T представляет собой CR6, U представляет собой N, X представляет собой CR3 и Y представляет собой N.
В сорок восьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым четвертым, восьмым, шестнадцатым-тридцать третьим, тридцать шестым и сорок вторым-сорок седьмым вариантами осуществления, где соединение представляет собой
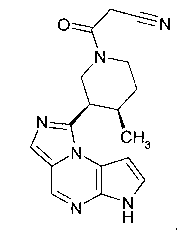
В сорок девятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с любым из предшествующих вариантов, где G представляет собой необязательно замещенный фенил, необязательно замещенный пиразин, необязательно замещенный пиразол, необязательно замещенный пиридазин или необязательно замещенный пиридин.
В пятидесятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-шестнадцатым вариантами, где R2 и R5 каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -C(OH)RaRb, -N(Ra)S(O)2-Rb, -S(O)2N(Ra)(Rb), -CF3, -OCF3, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C3-C6)циклоалкил, необязательно замещенный бензо(b)тиенил, необязательно замещенный бензимидазол, необязательно замещенный бензофуран, необязательно замещенный бензоксазол, необязательно замещенный бензотиазол, необязательно замещенный бензотиадиазол, необязательно замещенный фуран, необязательно замещенный имидазол, необязательно замещенный индолин, необязательно замещенный индол, необязательно замещенный имидазол, необязательно замещенный изоксазол, необязательно замещенный изоиндолин, необязательно замещенный морфолин, необязательно замещенный оксадиазол, необязательно замещенный фенил, необязательно замещенный пиперазин, необязательно замещенный пиперидин, необязательно замещенный пиран, необязательно замещенный пиразол, необязательно замещенный пиразоло[3,4-d]пиримидин, необязательно замещенный пиридин, необязательно замещенный пиримидин, необязательно замещенный пирролидин, необязательно замещенный пиррол, необязательно замещенный пирроло[2,3-d]пиримидин, необязательно замещенный хинолин, необязательно замещенный тиоморфолин, необязательно замещенный тетрагидропиран, необязательно замещенный тетрагидрофуран, необязательно замещенный тетрагидроиндол, необязательно замещенный тиазол, или необязательно замещенный тиенил.
В пятьдесят первом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-шестнадцатым и сорок седьмым вариантами, где R1 представляет собой необязательно замещенный (C6-C10)арил или необязательно замещенный (C1-C10)гетероарил.
В пятьдесят втором варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-шестнадцатым, сорок седьмым и пятидесятым вариантами, где R2 представляет собой водород, галоген, -CN, -C(O)NRaRb, -CF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C3-C12)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C1-C10)гетероциклил.
В пятьдесят третьем варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-пятнадцатым, сорок седьмым и сорок девятым вариантами, где R1 представляет собой необязательно замещенный азаиндол, необязательно замещенный бензофуран, необязательно замещенный бензотиазол, необязательно замещенный бензоксазол, необязательно замещенный дигидропирролоимидазол, необязательно замещенный фуран, необязательно замещенный имидазол, необязательно замещенный имидазоксазол, необязательно замещенный имидазопиразин, необязательно замещенный имидазопиридин, необязательно замещенный индазол, необязательно замещенный индол, необязательно замещенный изохинолин, необязательно замещенный изотиазол, необязательно замещенный изоксазол, необязательно замещенный оксадиазол, необязательно замещенный оксазол, необязательно замещенный пиразол, необязательно замещенный пиридин, необязательно замещенный пиримидин, необязательно замещенный пиразолопиридин, необязательно замещенный пиррол, необязательно замещенный хинолин, необязательно замещенный хиназолин, необязательно замещенный тиазол, или необязательно замещенный тиофен.
В пятьдесят четвертом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-пятнадцатым и сорок седьмым-пятьдесят вторым вариантами, где R5 представляет собой водород, галоген, NH2 или N(Ra)(Rb).
В пятьдесят пятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-пятнадцатым и сорок седьмым-пятьдесят третьим вариантами, где T представляет собой CH, U представляет собой N, Y представляет собой N, и X представляет собой CR3, где R3 представляет собой (C1-C6)необязательно замещенный алкил, (C3-C12)необязательно замещенный циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, или необязательно замещенный (C1-C10)гетероциклил.
В пятьдесят шестом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-пятнадцатым и сорок седьмым-пятьдесят четвертым вариантами, где R3 представляет собой необязательно замещенный пирролидин, необязательно замещенный пиперидин, необязательно замещенный пиперазин, необязательно замещенный азетидин, необязательно замещенный (C6-C10)арил, или необязательно замещенный (C1-C10)гетероциклил.
В пятьдесят седьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-пятнадцатым и сорок седьмым-пятьдесят четвертым вариантами, где T представляет собой CH, U представляет собой N, Y представляет собой C и X представляет собой NR3, где R3 представляет собой (C1-C6)необязательно замещенный алкил, (C3-C10)необязательно замещенный циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, или необязательно замещенный (C1-C10)гетероциклил.
В пятьдесят восьмом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-пятнадцатым и сорок восьмым-пятьдесят седьмым вариантами, где R3 представляет собой необязательно замещенный пирролидин, необязательно замещенный пиперидин, необязательно замещенный пиперазин, необязательно замещенный азетидин, необязательно замещенный (C6-C10)арил, или необязательно замещенный (C1-C10)гетероциклил.
В пятьдесят девятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-пятнадцатым и сорок восьмым-пятьдесят восьмым вариантами, где T представляет собой N, U представляет собой N, Y представляет собой N и X представляет собой CR3, где R3 представляет собой (C1-C6)необязательно замещенный алкил, (C3-C12)необязательно замещенный циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, или необязательно замещенный (C1-C10)гетероциклил.
В шестидесятом варианте осуществления настоящее изобретение предлагает соединение в соответствии с первым-пятнадцатым и сорок восьмым-пятьдесят девятым вариантами, где R3 представляет собой необязательно замещенный пирролидин, необязательно замещенный пиперидин, необязательно замещенный пиперазин, необязательно замещенный азетидин, необязательно замещенный (C6-C10)арил, или необязательно замещенный (C1-C10)гетероциклил.
В шестьдесят первом варианте осуществления настоящее изобретение предлагает использование соединения формулы 2:
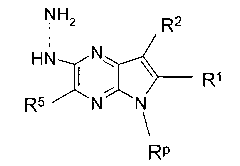
Формула 2
для получения соединение формулы (Ia)

Формула (Ia)
его фармацевтически приемлемых солей, пролекарств, биологически активных метаболитов, стереоизомеров и изомеров, где
Rp представляет собой водород, -SO2N(CH3)2, -SO2(2,4,6-триметилфенил), -SO2-фенил, -SO2(4-бутилфенил), -SO2(4-метилфенил), -SO2(4-метоксифенил), -C(O)OCH2CCl3, -C(O)OCH2CH2Si(CH3)3, -C(O)OC(CH3)3, -C(O)OC(CH3)2(CCl3), -C(O)O-1-адамантил, -CH=CH2, -CH2CH2Cl, -CH(OCH2CH3)CH3, -CH2CH2-2-пиридил, -CH2CH2-4-пиридил, -Si(C(CH3)3)(CH3)2, -Si(CH(CH3)2)3, -CH2-фенил, -CH2(4-CH3O-фенил), -CH2(3,4-диметоксифенил), -CH2(2-нитрофенил), -(2,4-динитрофенил), -CH2C(O)фенил, -C(фенил)3, -CH(фенил)2, -C(фенил)2(4-пиридил), -N(CH3)2, -CH2OH, -CH2OCH3, -CH(OCH2CH3)2, -CH2OCH2CH2Cl, -CH2OCH2CH2Si(CH3)3, -CH2OC(CH3)3, -CH2OC(O)C(CH3)3, -CH2OCH2-фенил, -(2-тетрагидропиранил), -C(O)H, или -P(S)(фенил)2;
R1, R2 и R5, каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -С(ОН)RaRb, -N(Ra)S(O)2-Rb, -S(O)2N(Ra)(Rb)-, -, -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, или необязательно замещенный (C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C2-C10)гетероарил, связанные через азот;
R3 представляет собой водород, необязательно замещенный мостиковый (C5-C12)циклоалкил, необязательно замещенный мостиковый (C2-C10)гетероциклил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил или необязательно замещенный (C2-C10)гетероциклил; или
R3 представляет собой -A-D-E-G, где:
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)-Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, Re-C(O)C(O)N(Ra)-Re-, Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-OC(O)-Re-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
E представляет собой 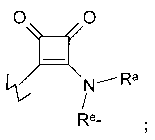
где во всех случаях, E связан или с атомом углерода или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb-, -OC(O)N(Ra)-, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10)гетероциклил, необязательно замещенный -(C6-C10)арил, необязательно замещенный -(C1-C6)алкил-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
Ra и Rb независимо представляют собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный (C1-C10)алкилен-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re в каждом случае независимо представляет собой связь, необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-C10)алкинилен, необязательно замещенную -(C1-C10)алкилен-O-(C1-C10)алкильную группу, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, или необязательно замещенный (C1-C10)гетероциклилен;
В шестьдесят втором варианте осуществления настоящее изобретение предлагает использование соединения формулы 3:
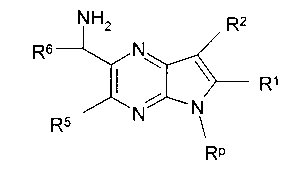
Формула 3
для получения соединение формулы (Ib)
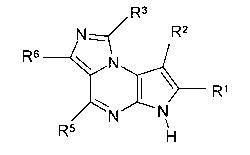
Формула (Ib)
его фармацевтически приемлемых солей, пролекарств, биологически активных метаболитов, стереоизомеров и изомеров, где
Rp представляет собой водород, -SO2N(CH3)2, -SO2(2,4,6-триметилфенил), -SO2-фенил, -SO2(4-бутилфенил), -SO2(4-метилфенил), -SO2(4-метоксифенил), -C(O)OCH2CCl3, -C(O)OCH2CH2Si(CH3)3, -C(O)OC(CH3)3, -C(O)OC(CH3)2(CCl3), -C(O)O-1-адамантил, -CH=CH2, -CH2CH2Cl, -CH(OCH2CH3)CH3, -CH2CH2-2-пиридил, -CH2CH2-4-пиридил, -Si(C(CH3)3)(CH3)2, -Si(CH(CH3)2)3, -CH2-фенил, -CH2(4-CH3O-фенил), -CH2(3,4-диметоксифенил), -CH2(2-нитрофенил), -(2,4-динитрофенил), -CH2C(O)фенил, -C(фенил)3, -CH(фенил)2, -C(фенил)2(4-пиридил), -N(CH3)2, -CH2OH, -CH2OCH3, -CH(OCH2CH3)2, -CH2OCH2CH2Cl, -CH2OCH2CH2Si(CH3)3, -CH2OC(CH3)3, -CH2OC(O)C(CH3)3, -CH2OCH2-фенил, -(2-тетрагидропиранил), -C(O)H, или -P(S)(фенил)2;
R1, R2 и R5, каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -C(OH)RaRb, -N(Ra)S(O)2-Rb, -S(O)2N(Ra)(Rb), -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, или необязательно замещенный (C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R3 представляет собой водород, необязательно замещенный мостиковый (C5-C12)циклоалкил, необязательно замещенный мостиковый (C2-C10)гетероциклил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10) гетероциклил; или
R3 представляет собой -A-D-E-G, где:
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, Re-C(O)C(O)N(Ra)-Re-, Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-OC(O)-Re-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re- или -Re-S(O)2N(Ra)-Re-; или
E представляет собой 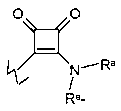 ;
;
где во всех случаях, E связан или с атомом углерода или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -OC(O)N(Ra)-, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10)гетероциклил, необязательно замещенный -(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R6 представляет собой водород, галоген, дейтерий, необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил или -J-L-M-Q;
где:
J представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
L представляет собой связь, необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
M представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, -Re-OC(O)-Re-, -Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-О-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
M представляет собой; 
где во всех случаях, M связан или с атомом углерода или с атомом азота в L;
Q представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
Ra и Rb каждый независимо представляет собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный (C1-C10)алкилен-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re в каждом случае независимо представляет собой связь, необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-C10)алкинилен, необязательно замещенную -(C1-C10)алкилен-O-(C1-C10)алкиленовую группу, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, или необязательно замещенный (C1-C10)гетероциклилен;
В шестьдесят третьем варианте осуществления настоящее изобретение предлагает использование соединения формулы 4:

Формула 4
для получения соединение формулы (Ic)
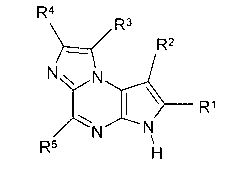
Формула (Ic)
или его фармацевтически приемлемых солей, пролекарств, биологически активных метаболитов, стереоизомеров и изомеров, где
Rp1 представляет собой водород, -SO2N(CH3)2, -SO2(2,4,6-триметилфенил), -SO2-фенил, -SO2(4-бутилфенил), -SO2(4-метилфенил), -SO2(4-метоксифенил), -C(O)OCH2CCl3, -C(O)OCH2CH2Si(CH3)3, -C(O)OC(CH3)3, -C(O)OC(CH3)2(CCl3), -C(O)O-1-адамантил, -CH=CH2, -CH2CH2Cl, -CH(OCH2CH3)CH3, -CH2CH2-2-пиридил, -CH2CH2-4-пиридил, -Si(C(CH3)3)(CH3)2, -Si(CH(CH3)2)3, -CH2-фенил, -CH2(4-CH3O-фенил), -CH2(3,4-диметоксифенил), -CH2(2-нитрофенил), -(2,4-динитрофенил), -CH2C(O)фенил, -C(фенил)3, -CH(фенил)2, -C(фенил)2(4-пиридил), -N(CH3)2, -CH2OH, -CH2OCH3, -CH(OCH2CH3)2, -CH2OCH2CH2Cl, -CH2OCH2CH2Si(CH3)3, -CH2OC(CH3)3, -CH2OC(O)C(CH3)3, -CH2OCH2-фенил, -(2-тетрагидропиранил), -C(O)H, или -P(S)(фенил)2;
Rp2 представляет собой водород, -C(O)O-C(CH3)3, -C(O)OCH2-фенил, -C(O)O-флуорен-9-ил, -C(O)CH3, -C(O)CF3, -C(O)-CH(CH3)2, -CH2-фенил, -CH2-(4-метоксифенил), -S(O)2-фенил или -S(O)2-(4-метилфенил);
R1, R2 и R5 каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -C(OH)RaRb, -N(Ra)S(O)2-Rb, -S(O)2N(Ra)(Rb), -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, или необязательно замещенный (C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R3 представляет собой водород, необязательно замещенный мостиковый (C5-C12)циклоалкил, необязательно замещенный мостиковый (C2-C10)гетероциклил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил; или
R3 представляет собой -A-D-E-G, где:
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-OC(O)-Re-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
E представляет собой 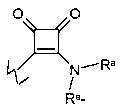 ;
;
где во всех случаях, E связан или с атомом углерода или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -OC(O)N(Ra), -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10)гетероциклил, необязательно замещенный -(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R4 представляет собой водород, галоген, дейтерий, необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил или -J-L-M-Q;
где:
J представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
L представляет собой связь, необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
M представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-С(О)О-Re-, -Re-ОС(О)-Re-, -Re-С(О)С(О)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
M представляет собой 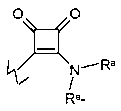 ;
;
где во всех случаях, M связан или с атомом углерода или с атомом азота в L;
Q представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
Ra и Rb каждый независимо представляет собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный (C1-C10)алкилен-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re в каждом случае независимо представляет собой связь, необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-C10)алкинилен, необязательно замещенную -(C1-C10)алкилен-O-(C1-C10)алкиленовую группу, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, или необязательно замещенный (C1-C10)гетероциклилен.
В шестьдесят четвертом варианте осуществления настоящее изобретение предлагает использование соединения формулы 5
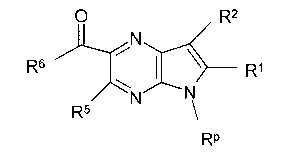
Формула 5
для получения соединения формулы (Id)
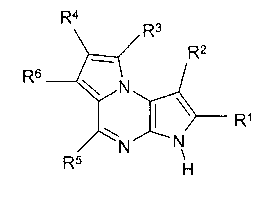
Формула (Id)
его фармацевтически приемлемых солей, пролекарств, биологически активных метаболитов, стереоизомеров и изомеров, где
Rp представляет собой водород, -SO2N(CH3)2, -SO2(2,4,6-триметилфенил), -SO2-фенил, -SO2(4-бутилфенил), -SO2(4-метилфенил), -SO2(4-метоксифенил), -C(O)OCH2CCl3, -C(O)OCH2CH2Si(CH3)3, -C(O)OC(CH3)3, -C(O)OC(CH3)2(CCl3), -C(O)O-1-адамантил, -CH=CH2, -CH2CH2Cl, -CH(OCH2CH3)CH3, -CH2CH2-2-пиридил, -CH2CH2-4-пиридил, -Si(C(CH3)3)(CH3)2, -Si(CH(CH3)2)3, -CH2-фенил, -CH2(4-CH3O-фенил), -CH2(3,4-диметоксифенил), -CH2(2-нитрофенил), -(2,4-динитрофенил), -CH2C(O)фенил, -C(фенил)3, -CH(фенил)2, -C(фенил)2(4-пиридил), -N(CH3)2, -CH2OH, -CH2OCH3, -CH(OCH2CH3)2, -CH2OCH2CH2Cl, -CH2OCH2CH2Si(CH3)3, -CH2OC(CH3)3, -CH2OC(O)C(CH3)3, -CH2OCH2-фенил, -(2-тетрагидропиранил), -C(O)H, или -P(S)(фенил)2;
R1, R2 и R5 каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -C(OH)RaRb, -N(Ra)S(O)2-Rb, -S(O)2N(Ra)(Rb), -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, или необязательно замещенный (C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R3 представляет собой водород, необязательно замещенный мостиковый (C5-C12)циклоалкил, необязательно замещенный мостиковый (C2-C10)гетероциклил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил; или
R3 представляет собой -A-D-E-G, где:
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-OC(O)-Re-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
E представляет собой  ;
;
где во всех случаях, E связан или с атомом углерода или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -OC(O)N(Ra), -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10)гетероциклил, необязательно замещенный -(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкил-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R4 и R6 каждый независимо представляет собой водород, галоген, дейтерий, необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил или -J-L-M-Q;
где:
J представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
L представляет собой связь, необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
M представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, -Re-OC(O)-Re-, -Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
M представляет собой  ;
;
где во всех случаях, M связан или с атомом углерода или с атомом азота в L;
Q представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкил-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо, так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
Ra и Rb каждый независимо представляет собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный (C1-C10)алкилен-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re в каждом случае независимо представляет собой связь, необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-С10)алкинилен, необязательно замещенную -(C1-С10)алкилен-О-(C1-С10)алкиленовую группу, необязательно замещенный (С3-С10)циклоалкилен, необязательно замещенный (С6-С10)арилен, необязательно замещенный (C1-С10)гетероарилен, или необязательно замещенный (C1-С10)гетероциклилен.
В шестьдесят пятом варианте осуществления настоящее изобретение предлагает использование соединения формулы 6
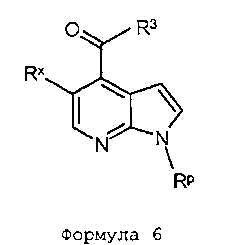
для получения соединения формулы (Ig) или формулы (If) или формулы (Ii)
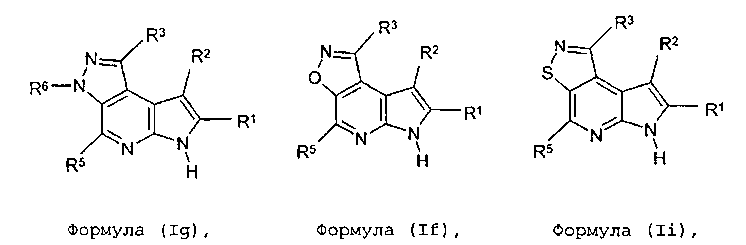
их фармацевтически приемлемых солей, пролекарств, биологически активных метаболитов, стереоизомеров и изомеров, где
Rp представляет собой водород, -SO2N(CH3)2, -SO2(2,4,6-триметилфенил), -SO2-фенил, -SO2(4-бутилфенил), -SO2(4-метилфенил), -SO2(4-метоксифенил), -С(О)OCH2CCl3, -C(O)OCH2CH2Si(CH3)3, -С(O)ОС(СН3)3, -С(О)ОС(СН3)2(CCl3), -С(O)O-1-адамантил, -CH=CH2, -CH2CH2Cl, -CH(OCH2CH3)CH3, -CH2CH2-2-пиридил, -CH2CH2-4-пиридил, -Si(C(CH3)3)(CH3)2, -Si(CH(CH3)2)3, -CH2-фенил, -CH2(4-CH3O-фенил), -CH2(3,4-диметоксифенил), -CH2(2-нитрофенил), -(2,4-динитрофенил), -CH2C(O)фенил, -C(фенил)3, -CH(фенил)2, -C(фенил)2(4-пиридил), -N(CH3)2, -CH2OH, -CH2OCH3, -CH(OCH2CH3)2, -CH2OCH2CH2Cl, -CH2OCH2CH2Si(CH3)3, -CH2OC(CH3)3, -CH2OC(O)C(CH3)3, -CH2OCH2-фенил, -(2-тетрагидропиранил), -C(O)H, или -P(S)(фенил)2;
Rx представляет собой водород, фтор, хлор, бром, йод, -OS(O)2CH3, -OS(O)2CF3, -OS(O)2фенил, или -OS(O)2(4-метилфенил);
R1, R2 и R5 каждый независимо представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)(Rb), -C(O)Ra, -C(OH)RaRb, -N(Ra)S(O)2-Rb, -S(O)2N(Ra)(Rb), -CF3, -OCF3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, или необязательно замещенный (C6-C10)арил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R3 представляет собой водород, необязательно замещенный мостиковый (C5-C12)циклоалкил, необязательно замещенный мостиковый (C2-C10)гетероциклил, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил; или
R3 представляет собой -A-D-E-G, где:
A представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
D представляет собой необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
E представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-OC(O)-Re-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
E представляет собой  ;
;
где во всех случаях, E связан или с атомом углерода или с атомом азота в D;
G представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -OC(O)N(Ra), -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный -(C1-C6)алкил, необязательно замещенный -(C2-C6)алкенил, необязательно замещенный -(C2-C6)алкинил, необязательно замещенный -(C3-C10)циклоалкил, необязательно замещенный -(C1-C10)гетероарил, необязательно замещенный -(C1-C10) гетероциклил, необязательно замещенный -(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
R6 представляет собой водород, галоген, дейтерий, необязательно замещенную мостиковую (C5-C12)циклоалкильную группу, необязательно замещенную мостиковую (C2-C10)гетероциклильную группу, необязательно замещенный (C1-C8)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C3-C8)циклоалкенил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C2-C10)гетероциклил или -J-L-M-Q;
где:
J представляет собой связь, -C(O)-, необязательно замещенный (C1-C6)алкилен, необязательно замещенный (C2-C6)алкенилен, необязательно замещенный (C2-C6)алкинилен, необязательно замещенный (C3-C12)циклоалкилен, необязательно замещенный (C2-C6)гетероциклилен, -C(O)N(Ra)-Re-, -N(Ra)C(O)-Re-, -O-Re-, -N(Ra)-Re-, -S-Re-, -S(O)2-Re-, -S(O)Re-, -C(O-Ra)(Rb)-Re-, -S(O)2N(Ra)-Re-, -N(Ra)S(O)2-Re- или -N(Ra)C(O)N(Rb)-Re-;
L представляет собой связь, необязательно замещенный (C1-C8)алкилен, необязательно замещенный мостиковый (C5-C12)циклоалкилен, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный мостиковый (C5-C10)циклоалкенилен, необязательно замещенный (C3-C10)циклоалкенилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, необязательно замещенный мостиковый (C2-C10)гетероциклилен или необязательно замещенный (C2-C10)гетероциклилен;
M представляет собой связь, -Re-, -Re-C(O)-Re-, -Re-C(O)C(O)-Re-, -Re-C(O)O-Re-, -Re-OC(O)-Re-, -Re-C(O)C(O)N(Ra)-Re-, -Re-N(Ra)-C(O)C(O)-ORe-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-S(O)-Re-, -Re-S-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-OC(O)N(Ra)-Re-, -Re-N(Ra)C(O)ORe-, -Re-N(Ra)C(O)N(Rb)-Re-, -Re-N(Ra)S(O)2-Re-, или -Re-S(O)2N(Ra)-Re-; или
M представляет собой  ;
;
где во всех случаях, M связан или с атомом углерода или с атомом азота в L;
Q представляет собой водород, дейтерий, -N(Ra)(Rb), галоген, -ORa, -SRa, -S(O)Ra, -S(O)2Ra, -NO2, -C(O)ORa, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -N(Ra)C(O)ORb, -N(Ra)C(O)N(Rb)2, -C(O-Ra)(Rb)2, -C(O)Ra, -CF3, -OCF3, -N(Ra)S(O)2Rb, -S(O)2N(Ra)(Rb), -S(O)2N(Ra)C(O)Rb, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C2-C6)алкенил, необязательно замещенный (C2-C6)алкинил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10) гетероциклил, необязательно замещенный (C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (C2-C10)гетероциклил или необязательно замещенный (C1-C10)гетероарил, связанные через азот;
Ra и Rb каждый независимо представляет собой водород, дейтерий, необязательно замещенный (C1-C10)алкил, необязательно замещенный (C2-C10)алкенил, необязательно замещенный (C2-C10)алкинил, необязательно замещенный (C1-C10)алкил-O-(C1-C10)алкил, необязательно замещенный (C3-C10)циклоалкил, необязательно замещенный (C6-C10)арил, необязательно замещенный (C1-C10)гетероарил, необязательно замещенный (C1-C10)гетероциклил, необязательно замещенный -(C1-C6)алкилен-(C3-C10)циклоалкил, необязательно замещенный -(C1-C6)алкилен-(C6-C10)арил, необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероарил, или необязательно замещенный -(C1-C6)алкилен-(C1-C10)гетероциклил; и
Re в каждом случае независимо представляет собой связь, необязательно замещенный (C1-C10)алкилен, необязательно замещенный (C2-C10)алкенилен, необязательно замещенный (C2-C10)алкинилен, необязательно замещенную -(C1-C10)алкилен-O-(C1-C10)алкиленовую группу, необязательно замещенный (C3-C10)циклоалкилен, необязательно замещенный (C6-C10)арилен, необязательно замещенный (C1-C10)гетероарилен, или необязательно замещенный (C1-C10)гетероциклилен.
В шестьдесят шестом варианте осуществления настоящее изобретение предлагает фармацевтическую композицию, включающую соединение формулы (I) по п.1

Формула (I)
фармацевтически приемлемый носитель и эксципиент и второй терапевтический агент, выбранный из группы, состоящей из цитокин-подавляющих противовоспалительных лекарств, антител к другим человеческим цитокинам или антагонистов других человеческих цитокинов, или факторов роста, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-12, IL-15, IL-16, IL-21, IL-23, интерферонов, EMAP-II, GM-CSF, FGF, PDGF, CTLA или их лигандов, включая D154, HUMIRA™, REMICADE™, SIMPONI™ (голимумаб), CIMZIA™, ACTEMRA™, CDP 571, растворимые p55 или p75 рецепторы TNF, ENBREL™, ленерцепт, ингибиторы TNFα-превращающего фермента, ингибиторы IL-1, интерлейкин 11, антагонисты IL-18, антагонисты IL-12, антитела против IL-12, растворимые рецепторы IL-12, белки, связывающие IL-12, неистощающие анти-CD4 ингибиторы FK506, рапамицин, микофенолат мофетила, лефлуномид, NSAID, ибупрофен, кортикостероиды, ингибиторы фосфодиэстеразы, агонисты аденозина, противотромботические агенты, ингибиторы комплемента, адренергические агенты, ингибиторы IL-11β-превращающего фермента, ингибиторы сигнальной системы Т-клеток, ингибиторы металлопротеиназы, сульфасалазин, 6-меркаптопурины, производные p75TNFRIgG, sIL-1RI, sIL-1RII, sIL-6R, целекоксиб, гидроксихлорохинсульфат, рофекоксиб, инфликсимаб, напроксен, вальдекоксиб, сульфасалазин, мелоксикам, ацетат, натрийтиомалат золота, аспирин, триамцинолонацетонид, пропоксифена напсилат/арар (ацетаминофен), фолат, набуметон, диклофенак, пироксикам, этодолак, диклофенак-натрий, оксапрозин, оксикодон HCl, гидрокодон битартрат/apap, диклофенак-натрий/мизопростол, фентанил, анакинра, трамадол HCl, салсалат, сулиндак, цианокобаламин/fa/пиридоксин, ацетаминофен, алендронат-натрий, морфинсульфат, лидокаингидрохлорид, индометацин, глюкозаминсульфат/хондроитин, амитриптилин HCl, сульфадиазин, оксикодон HCl/ацетаминофен, олопатадин HCl мизопростол, напроксен-натрий, омепразол, циклофосфамид, ритуксимаб, IL-1 TRAP, MRA, CTLA4-IG, IL-18 BP, анти-IL-12, анти-IL15, VX-740, рофлумиласт, IC-485, CDC-801, агонисты S1P1, FTY720, ингибиторы семейства PKC, рубоксистаурин, AEB-071, мезопрам, метотрексат, лефлуномид, кортикостероиды, буденозид, дексаметазон, сульфасалазин, 5-аминосалициловая кислота, олсалазин, ингибиторы IL-1β - превращающего фермента, IL-1ra, ингибиторы сигнальной системы T-клеток, ингибиторы тирозинкиназы, 6-меркаптопурины, IL-11, месаламин, преднизон, азатиоприн, меркаптопурин, инфликсимаб, метилпреднизолонсукцинат-натрий, дифеноксилат/atrop (атропин) сульфат, лоперамидгидрохлорид, омепразол, фолат, ципрофлоксацин/декстроза-вода, гидрокодон, битартрат/apap, тетрациклингидрохлорид, флуоцинонид, метронидазол, тимеросал/борная кислота, холестирамин/сахароза, ципрофлоксацингидрохлорид, хиосциаминсульфат, меперидингидрохлорид, мидазоламгидрохлорид, оксикодон HCl/ацетаминофен, прометазингидрохлорид, натрийфосфат, сульфаметоксазол/триметоприн, поликарбофил, пропоксифеннапсилат, гидрокортизон, поливитамины, динатрийбалсалазид, кодеинфосфат/apap, колесевелам HCl, цианокобаламин, фолиевая кислота, левофлоксацин, натализумаб, гамма-интерферон, метилпреднизолон, азатиоприн, циклофосфамид, циклоспорин, метотрексат, 4-аминопиридин, тизанидин, интерферон-β1a, AVONEX®, интерферон-β1b, BETASERON®, интерферон α-n3, интерферон-α, интерферон β1A-IF, пегинтерферон α 2b, сополимер 1, COPAXONE®, гипербарический кислород, внутривенный иммуноглобулин, кладрибин, циклоспорин, FK506, микофенолат мофетил, лефлуномид, NSAID, кортикостероиды, преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, противотромботические агенты, ингибиторы комплемента, адренергические агенты, противовоспалительные цитокины, интерферон-β, IFNβ1a, IFNβ1b, копаксон, кортикостероиды, ингибиторы каспазы, ингибиторы каспазы-1, антитела к лиганду CD40 и CD80, алемтузумаб, дронабинол, даклизумаб, митоксантрон, ксалипроденгидрохлорид, фампридин, глатирамерацетат, натализумаб, синнабидол, α-иммунокин NNSO3, ABR-215062, AnergiX.MS, антагонисты хемокиновых рецепторов, BBR-2778, калагуалин, CPI-1189, включенный в липосомы митоксантрон, THC.CBD, агонисты канабиноида, MBP-8298, мезопрам, MNA-715, антитело против IL-6 рецепторов, нейровакс, пирфенидоналлотрап 1258 (RDP-1258), sTNF-R1, телампанел, терифлуномид, TGF-бета2, типлимотид, антагонисты VLA-4, антагонисты гамма-интерферона, агонисты IL-4, диклофенак, мизопростол, напроксен, мелоксикам, индометацин, диклофенак, метотрексат, азатиоприн, миноциклин, преднизон, этанэрцепт, рофекоксиб, сульфасалазин, напроксен, лефлуномид, ацетатаметилпреднизолон, индометацин, гидроксихлорохинсульфат, преднизон, сулиндак, бетаметазон diprop (дипропионат) (усиленное), инфликсимаб, метотрексат, фолат, триамцинолонацетонид, диклофенак, диметилсульфоксид, пироксикам, диклофенак-натрий, кетопрофен, мелоксикам, метилпреднизолон, набуметон, толметин-натрий, кальципотриен, циклоспорин, диклофенак-натрий/мизопростол, флуоцинонид, глюкозаминсульфат, натрийтиомалата золота, гидрокодонбитартрат/apap, ризедронат-натрий, сульфадиазин, тиогуанин, вальдекоксиб, алефацепт, и эфализумаб, диклофенак, напроксен, ибупрофен, пироксикам, индометацин, ингибиторы COX2, рофекоксиб, вольдекоксиб, гидроксихлорохин, стероиды, преднизолон, буденозид, дексаметазон, цитотоксические препараты, азатиоприн, циклофосфамид, микофенолат мофетила, ингибиторы PDE4, ингибитор синтеза пурина, сульфасалазин, 5-аминосалициловая кислота, олсалазин, Imuran®, CTLA-4-IgG, антитела против семейства B7, антитела против семейства PD-1, анти-цитокиновые антитела, фонотолизумаб, антитело против IFNg, антирецепторные антитела, антитела против рецептора IL-6, антитела против поверхностных молекул B-клеток, LJP 394, ритуксимаб, антитела против CD20 и лимфостат-B.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Протеинкиназы представляют собой обширный и разнообразный класс, более чем 500 ферментов, который включает онкогены, рецепторы факторов роста, промежуточные соединения сигнальной трансдукции, связанные с апоптозом киназы и циклин-зависимые киназы. Они ответственны за перенос фосфатной группы на специфические тирозиновые, сериновые или треониновые аминокислотные остатки, и, в общем, классифицируются как тирозин и серин/треонин киназы, в результате их субстратной специфичности.
Киназы Jak семейства (Jak1, Jak2, Jak3 и Tyk2) представляют собой цитоплазмические тирозинкиназы, которые ассоциируют со связанными с мембранами цитокиновыми рецепторами. Связывание цитокинов со своими рецепторами инициирует активацию Jak киназы за счет процессов транс- и автофосфорилирования. Активированные Jak киназы фосфорилируют остатки на цитокиновых рецепторах, создавая сайты связывания фосфотирозина для SH2 домена, содержащего белки, такие как активаторы сигнальной трансдукции факторов транскрипции (STAT) и других регуляторов сигналов трансдукции, таких как SOCS белки и SHIP фосфатазы. Активация STAT факторов за счет таких процессов приводит к их димеризации, ядерной транслокации и новой мРНК транскрипции, что приводит к экспрессии пролиферации иммуноцитов и факторов выживания, также как дополнительных цитокинов, хемокинов и молекул, которые облегчают клеточный трафик (см. Journal of Immunology, 2007, 178, p. 2623). Jak киназы трансдуцируют сигналы для многих различных семейств цитокинов и, следовательно, потенциально играют роли в заболеваниях с широко различающимися патологиями, включая, но ими не ограничиваясь, следующие примеры. И Jak1 и Jak3 регулируют сигнальные пути так называемых общих гамма-цепных цитокинов (IL2, IL4, IL7, IL9, IL15 и IL21), следовательно, одновременное ингибирование, или ингибирование или Jak1 или Jak3 может вызвать прогностический эффект в отношении Th1-опосредованных заболеваний, таких как ревматоидный артрит, за счет блокады сигнальной системы IL2, IL7 и IL15. С другой стороны, недавно было показано, что сигнальная система IL2 является существенной для развития и гомеостаза T-регуляторных клеток (Malek T R et. al., Immunity, 2002, 17(2), p. 167-78). Так, на основании генетических данных предполагают, что блокада только сигнальной системы IL2 скажется на иммунитете (Yamanouchi J et al., Nat. Genet., 2007, 39(3), p. 329-37, и Willerford D M et al., Immunity, 1995, 3(4), p. 521-30). Th2 опосредуют заболевания, такие как астма или атопический дерматит, за счет блокады сигнальной системы IL4 и IL9. Jak1 и Tyk2 опосредуют сигналы IL13 (см. Int. Immunity, 2000, 12, p. 1499). Следовательно, можно предположить, что их блокада будет оказывать терапевтическое воздействие в случае астмы. Считают также, что две указанные киназы опосредуют сигналы интерферона типа I; поэтому предполагают, что их блокада уменьшит тяжесть системной красной волчанки (SLE). Tyk2 и Jak2 опосредуют сигналы IL12 и IL23. Действительно, блокада указанных цитокинов с помощью моноклональных антител оказалась эффективной при лечении псориаза. Поэтому можно предположить, что блокада такой схемы с помощью ингибиторов указанных киназ окажется эффективной также при лечении псориаза. В итоге в настоящем изобретении раскрыты низкомолекулярные соединения, которые ингибируют, регулируют и/или модулируют активности киназ Jak семейства, которые являются основой нескольких механизмов, которые считаются критическими для развития аутоиммунных заболеваний, включая, но ими не ограничиваясь, ревматоидный артрит (RA), системную красную волчанку (SLE), рассеянный склероз (MS), болезнь Крона, псориаз и астму.
Некоторые патологически значимые цитокины проводят сигналы только через Jak1 (Guschin D, et al., EMBO J. 1995 Apr. 3; 14(7):1421-9; Parganas E, et al., Cell. 1998 May 1; 93(3):385-95; Rodig S. J., et al., Cell. 1998 May 1; 93(3):373-83). Было показано, что блокада одного из них, IL6, с использованием нейтрализующего IL6R антитела, значительно улучшает показатели заболевания у пациентов с ревматоидным артритом (Nishimoto N. et al., Ann Rheum Dis., 2007, 66(9), p. 1162-7). Аналогично, блокада сигнальной системы GCSF, которые также опосредованы одним только Jak1, с использованием нейтрализующих моноклональных антител или мишеневых генных делеций защищает мышей от экспериментально вызванных артритов (Lawlor K. E. et al., Proc Natl Acad Sci U.S.A., 2004, 101(31), p. 11398-403). Соответственно, идентификация низкомолекулярных соединений, которые ингибируют, регулируют и/или модулируют сигнальную трансдукцию киназы, таких как Jak1, представляет собой желательное средство для профилактики или лечения аутоиммунных заболеваний или других заболеваний, связанных с абберантной функцией Jak1.
Jak2 также активируются при широком круге раковых заболеваний человека, таких как рак простаты, рак прямой кишки, рак яичников и раки молочной железы, меланома, лейкемия и при других гематопоэтических злокачественных новообразованиях. Кроме того, было обнаружено, что соматические точечные мутации гена Jak2 тесно связаны с классическими миелопролиферативными нарушениями (MPD) и редко с другими миелоидными нарушениями. Конститутивная активация активности Jak2 также вызывается хромосомальной транслокацией в гематопоэтических злокачественных новообразованиях. Было также показано, что ингибирование пути Jak/STAT, и особенно ингибирование активности Jak2, приводит к анти-пролиферативным и про-апоптотическим эффектам в значительной степени за счет ингибирования фосфорилирования STAT. Более того, фармакологическая модуляция или ингибирование активности Jak2 способно эффективно блокировать рост опухолей и вызывать апоптоз за счет уменьшения фосфорилирования STAT в клеточной культуре и в случае опухоли ксенотрансплантатов у человека in vivo. Соответственно, идентификация низкомолекулярных соединений, которые ингибируют, регулируют и/или модулируют сигнальную трансдукцию киназы, в частности Jak2, представляется желательной в качестве средств лечения или профилактики заболеваний и состояний, связанных с раковыми заболеваниями.
Jak киназы также проводят сигналы, регулирующие важные физиологические процессы, ингибирование которых может оказаться нежелательным. Например, Jak2 опосредует сигнальную систему эритропоэтина (Epo) и фактора, стимулирующего гранулоцит/моноцит-колонии. У индивидуумов с генетическими, врожденными или приобретенными дефектами с указанных схемах передачи сигналов могут развиться потенциально опасные для жизни осложнения, такие как анемия и дисфункция нейтрофилов. Соответственно, один неограничивающий аспект настоящего изобретения также относится к способу идентификации соединений, которые могут иметь благоприятный безопасный профиль, как результат того, что они селективно избегают ингибирования Jak2.
Семейство протеинкиназ C представляет собой группу серин/треонин киназ, которая включает двенадцать родственных изоферментов. Ее члены кодируются различными генами, и разделяются на подклассы в соответствии с их требованиями в отношении активации. Классические ферменты (cPKC) для активации требуют диацилглицерина (DAG), фосфатидилсерина (PS) и кальция. Новые PKC (nPKC) требуют DAG и PS, но являются кальций-независимыми. Атипичные PKC (aPKC) не требуют кальция или DAG.
РКСтета представляет собой член подсемейства nPKC (Baier, G., et al., J. Biol. Chem., 1993, 268, 4997). Он обладает ограниченной схемой экспрессии, обнаружен, главным образом, в T-клетках и скелетных мышцах (Mischak, H. et al., FEBS Lett., 1993, 326, p. 51), причем сообщается о некоторой экспрессии в тучных клетках (Liu, Y. et al., J. Leukoc. Biol., 2001, 69, p. 831) и эндотелиальных клетках (Mattila, P. et al., Life Sci., 1994, 55, p. 1253).
После активации T-клеток супрамолекулярный активационный комплекс (SMAC) образуется в сайте контакта между Т-клетками и антиген-представляющими клетками (APC). РКСтета представляет собой единственную PKC изоформу, которая, как обнаружено, локализована у SMAC (Monks, C. et al., Nature, 1997, 385, 83), приближая ее к другим сигнальным ферментам, которые опосредствуют процессы активации T-клеток.
В другом исследовании (Baier-Bitterlich, G. et al., Mol. Cell. Biol., 1996, 16, 842) была подтверждена роль РКСтета в активации AP-1, фактора транскрипции, который играет важную роль в активации IL-2 гена. В нестимулированных T-клетках конститутивно активные РКСтета стимулируют AP-1 активность, тогда как в клетках с доминантно негативными РКСтета, AP-1 активность не индуцируется после активации за счет PMA.
В других исследованиях продемонстрировано, что РКСтета, за счет активации IκB киназы бета, опосредуют активацию NF-κB, вызванную совместной стимуляцией Т клеточный рецептор/CD28 (N. Coudronniere et al., Proc. Nat. Acad. Sci. U.S.A., 2000, 97, p. 3394; и Lin, X. et al., Mol. Cell. Biol., 2000, 20, p. 2933).
Пролиферация периферических T клеток от РКСтета нокаутных мышей, в ответ на стимуляцию Т клеточный рецептор(TCR)/CD28 заметно уменьшена по сравнению со стимуляцией для T клеток от мышей дикого типа. Кроме того, также существенно уменьшено количество IL-2, выделенных из Т-клеток (Sun, Z. et al., Nature, 2000, 404, p. 402). Было также показано, что РКСтета-дефицитные мыши демонстрируют ослабленное воспаление легких и уменьшенную гиперреактивность дыхательных путей (AHR) в модели Th2-зависимой астмы у мышей, при отсутствии дефектов в вирусном клиренсе и функциях Th1-зависимых цитотоксических T-клеток (Berg-Brown, N. N. et al., J. Exp. Med., 2004, 199, p. 743; Marsland, B. J. et al., J. Exp. Med., 2004, 200, p. 181). Ослабленные Th2 клеточные реакции приводят к пониженным уровням IL-4 и иммуноглобулина E (IgE), что вносит вклад в AHR и патофизиологию воспалений. В остальных отношениях РКСтета нокаутные мыши казались здоровыми и фертильными.
Существуют также доказательства того, что РКСтета участвуют в опосредованной IgE рецепторами (FcεRI) реакции тучных клеток (Liu, Y. et al., J. Leukoc. Biol., 2001, 69, p. 831). Было продемонстрировано, что в человеческих культивируемых тучных клетках (HCMC), активность PKC киназы быстро локализуется на мембране с последующим перекрестным связыванием с FcεRI (Kimata, M. et al., Biochem. Biophys. Res. Commun., 1999, 257(3), p. 895). Последние исследования in vitro активности тучных клеток костного мозга (BMMC), полученных от мышей дикого типа и РКСтета-дефицитных мышей, показали, что после перекрестного связывания с FceRI, BMMC у РКСтета-дефицитных мышей снижают уровни IL-6, фактора-альфа некроза опухоли (TNFα) и IL-13 по сравнению с BMMC у мышей дикого типа, что предполагает потенциальную роль РКСтета в продуцировании цитокина тучными клетками, помимо активации Т-клеток (Ciarletta, A. B. et al., постерная презентация на конференции 2005 American Thoracic Society International Conference).
Цитированные выше исследования, как и другие исследования, подтверждают критическую роль РКСтета в активации Т-клеток и в сигнальной системе тучных клеток (MC). Таким образом, ингибиторы РКСтета могут предоставить терапевтические преимущества при лечении иммунологических нарушений и других заболеваний, опосредованных неадекватной активацией Т-клеток и сигнальной системы MC.
Было обнаружено, что многие киназы, будь то рецепторные или нерецепторные тирозинкиназы, или S/T киназы, участвуют в клеточных путях передачи сигналов, вовлеченных во множество патологических состояний, включая иммуномодуляцию, воспаления или пролиферативные нарушения, такие как рак.
Многие аутоиммунные заболевания и болезни, связанные с хроническими воспалениями, также как острые реакции, связаны с избыточным или неупорядоченным продуцированием или активностью одного или более из цитокинов.
Соединения настоящего изобретения можно также использовать для лечения сердечно-сосудистых нарушений, таких как острый инфаркт миокарда, острый коронарный синдром, хроническая сердечная недостаточность, инфаркт миокарда, атеросклероз, вирусный миокардит, отторжение сердечного аллотрансплантата и сердечная дисфункция, связанные с сепсисом. Кроме того, соединения настоящего изобретения можно также использовать для лечения нарушений центральной нервной системы, таких как менингококковый менингит, болезнь Альцгеймера и болезнь Паркинсона.
Соединения настоящего изобретения можно также использовать при лечении глазных заболеваний, рака, твердых опухолей, саркомы, фибросаркомы, остеомы, меланомы, ретинобластомы, рабдомиосаркомы, глиобластомы, нейробластомы, тератокарциномы, гиперчувствительных реакций, гиперкинетических нарушений движения, гиперчувствительного пневмонита, гипертензии, гипокинетических нарушений движения, аневризмы аорты и периферических аневризм, для оценки гипоталамо-гипофизарно-надпочечниковой оси, расслоения аорты, артериальной гипертензии, атеросклероза, артериовенозной фистулы, атаксии, спиноцеребеллярных дегенераций, стрептококкового миозита, структурных язв церебеллума, подострого склерозирующего панэнцефалита, синкопа, сифилиса сердечно-сосудистой системы, системной анафилаксии, синдрома системной воспалительной реакции, возникновения системного ювенильного ревматоидного артрита, T-клеток или FAB ALL, телангиоэктазии, тромбоангиита (thromboangitis obliterans), при трансплантациях, при кровотечениях при травмах, при реакциях гиперчувствительности типа III, гиперчувствительности типа IV, нестабильной стенокардии, для лечении уремии, уросепсиса, уртикарии, заболеваний клапанов сердца, варикозных вен, васкулитов, венозных заболеваний, венозного тромбоза, вентрикулярных фибрилляций, вирусных и грибковых инфекций, витального энцефалит/асептического менингита, угрожающего жизни гемафагоцитного синдрома, синдрома Вернике-Корсакова, болезни Вильсона, отторжения ксенотрансплантатов любых органов или тканей, отторжения трансплантированного сердца, гемахроматоза, при гемодиализе, для лечения синдрома гемолитической уремии/тромболитической тромбоцитопении purpura, при кровотечениях, для лечения идиопатического фиброза легких, антитело-опосредованной цитотоксичности, астении, инфантильной спинальной мышечной атрофии, воспаления аорты, гриппа A, при экспонировании ионизирующему излучению, для лечения иридоциклит/увеит/оптического неврита, ювенильной спинальной мышечной атрофии, лимфомы, миеломы, лейкемии, злокачественного асцита, гематопоэтических раков, диабетических состояний, таких как инсулинозависимая глаукома, связанная с сахарным диабетом, диабетическая ретинопатия или микроангиопатия, для лечения серповидноклеточной анемии, хронического воспаления, гломерулонефрита, отторжения трансплантата, болезни Лайма, болезни Гиппеля-Линдау, пемфигоида, болезни Педжета, фиброза, саркоидоза, цирроза, тироидита, синдрома гипервязкости, болезни Osler-Weber-Rendu, хронической окклюзивной болезни легких, астмы или отека после ожога, травмы, при радиации, при ударе, для лечения гипоксии, ишемии, синдрома гиперстимуляции яичников, постперфузионного синдрома, постперфузионного синдрома, пост-MI кардиотомического синдрома, преэклампсии, менометроррагии, эндометриоза, легочной гипертонии, младенческой гемангиомы или для лечения простого герпеса, опоясывающего герпеса, при лечении заболеваний, вызванных вирусом человеческого иммунодефицита, парапоксвирусом, простейшими или при лечении токсоплазмоза, прогрессирующего супрануклеарного паралича (progressive supranucleo palsy), для лечения первичной легочной гипертонии, при радиационной терапии, при феномене Рейно, для лечения болезни Рейно, болезни Рефсума, постоянной узкой QRS тахикардии (regular narrow QRS tachycardia), почечно-сосудистой гипертонии, облитерирующей кардиомиопатии, саркомы, сенильной хореи, сенильной деменции по типу болезни диффузных телец Леви, шока, отторжения кожного аллотрансплантата, синдрома изменений кожи, отека глаза или при дегенерации желтого пятна, неоваскулярного глазного заболевания, склерита, при радиальной кератотомии, для лечения увеита, витрита, миопии, ямок диска зрительного нерва, хронической отслойки сетчатки, осложнений после лазерного облучения, конъюнктивита, болезни Штаргардта, болезни Илза, ретинопатии, дегенерации желтого тела, рестеноза, ишемических/реперфузионных поражений, ишемического удара, закупорки сосуда, обструктивного каротидного заболевания, язвенного колита, воспалительного заболевания кишечника, диабета, сахарного диабета, инсулинозависимого сахарного диабета, аллергических заболеваний, склеродермального дерматита, реакции "трансплантат против хозяина", при отторжении трансплантированного органа (включая, но ими не ограничиваясь, отторжения костного мозга и твердых органов), для лечения острых или хронических иммунных заболеваний, связанных с трансплантацией органов, саркоидоза, рассеянной внутрисосудистой коагуляции, болезни Кавасаки, нефротического синдрома, синдрома хронической полноты, грануломатоза Вегенера, пурпура Геноха-Шенлейна, микроскопического васкулита почек, хронического острого гепатита, септического шока, синдрома токсического шока, синдрома сепсиса, кахексии, инфекционных заболеваний, паразитарных заболеваний, синдрома приобретенного иммунодефицита, острого поперечного миелита, хореи Хантингтона, удара, первичного билиарного цирроза, гемолитической анемии, злокачественных образований, болезни Аддисона, идиопатической болезни Аддисона, спорадических заболеваний, полигландулярного дефицита типа I и полигландулярного дефицита типа II, синдрома Шмидта, (острого) респираторного дистресс-синдрома у взрослых, алопеции, круговой алопеции, серонегативной артропатии, артропатии, болезни Рейтера, псориатической артропатии, артропатии язвенного колита, энтеропатического синовита, хламидиоза, артропатии, связанной с иерсиниями (yersinia) и сальмонеллой (salmonella), атероматозного заболевания/артериосклероза, атопической аллергии, аутоиммунной буллезной болезни, вульгарного пемфигуса, пемфигуса пузырькового заболевания, напоминающего пузырчатку, линеарного IgA заболевания, аутоиммунной гемолитической анемии, Кумбс- положительной гемолитической анемии, приобретенной пернициозной анемии, ювенильной пернициозной анемии, периферических сосудистых нарушений, перитонита, пернициозной анемии, миалгического энцефалита/синдрома хронической усталости, хронического слизисто-кожного кандидоза, гигантоклеточного артрита, первичного склерозирующего гепатита, криптогенного аутоиммунного гепатита, Синдрома приобретенного иммунодефицита, заболеваний, связанных с приобретенным иммунодефицитом, гепатита A, гепатита B, гепатита C, аритмии, связанной с пучком Гиса, HIV инфекции/HIV невропатии, обычного вариабельной иммунодефицита (обычной вариабельной гипогаммаглобулинемии), дилатационной кардиомиопатии, женского бесплодия, нарушения овуляции, преждевременного нарушения овуляции, фиброзной болезни легких, хронического заживления ран, криптогенного фиброзного альвеолита, пост-воспалительной интерстициальной болезни легких, интерстициального пневмонита, интерстициальнрой плазмоклеточной пневмонии, пневмонии, заболевания соединительной ткани, связанного с интерстициальной болезнью легких, смешанного заболевания соединительной ткани, связанного с болезнью легких, системного склероза, связанного с болезнью легких, ревматоидного артрита, связанного с интерстициальной болезнью легких, системной красной волчанки, связанной с болезнью легких, дерматомиозита/полимиозита, связанного с болезнью легких, болезни Шегрена, связанной с болезнью легких, анкилозирующего спондилита, связанного с болезнью легких, васкулитной диффузной болезни легких, гемосидероза, связанного с болезнью легких, вызванной лекарствами интерстициальной болезни легких, радиационного фиброза, облитерирующего бронхолита, хронической эозинофильной пневмонии, лимфоцитарной инфильтративной болезни легких, постинфекционной интерстициальной болезни легких, подагрического артрита, аутоиммунного гепатита, типа-1 аутоиммунного гепатита (классического аутоиммунного или люпоидного гепатита), типа-2 аутоиммунного гепатита (анти-LKM антитело гепатита), аутоиммунно опосредованной гипогликемии, инсулиноустойчивости типа B с акантокератодермией, гипопаратироидизма, острого иммунного заболевания, связанного с трансплантацией органа, хронического иммунного заболевания, связанного с трансплантацией органа, остеоартрита, первичного склерозирующего холангита, псориаза типа 1, псориаза типа 2, идиопатической лейкопении, аутоиммунной нейтропении, заболевания почек NOS, гломерулонефрита, микроскопического васкулита почек, болезни Лайма, дискоидной красной волчанки, мужского бесплодия идиопатического или NOS, аутоиммунитета спермы, рассеянного склероза (всех подтипов), симпатической офтальмии, легочной гипертонии, вторичной относительно заболевания соединительной ткани, острой и хронической боли (различных типов боли), синдрома Гудпасчера, легочных проявлений узелкового полиартрита, острой ревматоидной лихорадки, ревматоидного спондилита, болезни Стилла, системного склероза, синдрома Шегрена, болезни Такаясу/артрита, аутоиммунной тромбоцитопении, токсичности, трансплантатов, и заболеваний включающих неадекватную васкуляризацию, например, диабетическую ретинопатию, преждевременную ретинопатию, хороидальную неоваскуляризацию, вызванную возрастной дегенерацией желтого тела, и младенческую гемангиому у людей. Кроме того, такие соединения могут оказаться полезными при лечении нарушений, таких как асцитов, выпотов, и экссудатов, включая, например, отек желтого тела, церебральный отек, острое поражение легких, респираторный дистресс-синдром у взрослых (ARDS), пролиферативные нарушения, такие как рестеноз, фиброзные нарушения, такие как цирроз печени и атеросклероз, пролиферативные нарушения мезангиальных клеток, такие как диабетическая нефропатия, злокачественный нефросклероз, синдрома тромбозной микроангиопатии и гломерулопатии, ангиогенез миокарда, коронарные и церебральные коллатерали, ангиогенез ишемизированной конечности, ишемические/реперфузионные поражения, пептическая язва, связанная с Helicobacter, вызванные вирусом ангиогенные нарушения, преэклампсия, менометрорагия, лихорадка от кошачьих царапин, рубеоз, неоваскулярная глаукома и ретинопатии, такие как те, что связаны с диабетической ретинопатией, ретролентальная фиброплазия или возрастная дегенерация желтого пятна. Кроме того, указанные соединения можно использовать в качестве активных агентов против гиперпролиферативных нарушений, таких как тироидная гиперплазия (особенно болезнь Граве), и цисты (такие как гиперваскулярность яичниковой стромы, характерные для синдрома поликистозных яичников (синдром Стейн-Левенталя) и поликистозная болезнь почек, так как такие заболевания требуют пролиферации клеток кровеносных сосудов для роста и/или метастазирования.
Соединения формулы (I) настоящего изобретения можно использовать отдельно или в комбинации с дополнительным агентом, например, с терапевтическим агентом, причем указанные дополнительные агенты выбирает специалист в данной области для предполагаемого их использования. Например, дополнительным агентом может быть терапевтический агент, который, как известно специалистам, можно использовать для лечения указанного, подлежащего лечению заболевания или состояния соединением настоящего изобретения. Дополнительный агент может также быть агентом, который придает благоприятные свойства терапевтической композиции, например, агентом, который влияет на вязкость композиции.
Следует также понимать, что комбинациями, которые должны быть включены в настоящее изобретение, являются такие комбинации, которые полезны для их предполагаемого использования. Далее представлены агенты, которые являются только иллюстративными, и не должны быть лимитирующими. Комбинации, которые являются частью настоящего изобретения, могут состоять из соединений настоящего изобретения и, по меньшей мере, одного дополнительного агента, выбранного из перечисленных далее. Такая комбинация может также включать более одного дополнительного агента, например, два или три дополнительных агента, если указанная комбинация такова, что полученная композиция может выполнять предназначенные ей функции.
Предпочтительными комбинациями являются нестероидные противовоспалительные лекарственные средства, именуемые также как NSAIDS, которые включают лекарства, подобные ибупрофену. Другими предпочтительными комбинациями являются кортикостероиды, включая преднизолон; хорошо известные побочные эффекты использования стероидов можно уменьшить или даже исключить, уменьшая дозу стероидов, необходимую для лечения пациентов, в комбинации с соединениями настоящего изобретения. Неограничивающие примеры терапевтических агентов для лечения ревматоидного артрита, с которыми можно объединить соединения формулы (I) настоящего изобретения, включают следующие: цитокин-подавляющее противовоспалительное лекарство (лекарства) (CSAID); антитела к другим человеческим цитокинам, или антагонисты других человеческих цитокинов, или факторы роста например, TNF, LT, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-12, IL-15, IL-16, IL-21, IL-23, интерфероны, EMAP-II, GM-CSF, FGF, и PDGF. Соединения настоящего изобретения можно объединять с антителами к молекулам клеточных поверхностей, такими как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, CTLA или их лиганды, включая CD154 (gp39 или CD40L).
Предпочтительные комбинации терапевтических агентов могут создавать помехи в различных точках аутоиммунного и последующего воспалительного каскадов; предпочтительные примеры включают антагонисты TNF, подобные химерическим, гуманизированным или человеческим TNF антителам, D2E7 (U.S. Pat. No. 6090382 HUMIRA™), CA2 (REMICADE™), SIMPONI™ (голимумаб), CIMZIA™, ACTEMRA™, CDP 571, и растворимые p55 или p75 TNF рецепторы, их производные, (p75TNFRIgG (ENBREL™) или p55TNFRIgG (ленерцепт), и также ингибиторы TNFα-превращающего фермента (TACE); аналогичные IL-1 ингибиторы (ингибиторы интерлейкин-1-превращающего фермента, IL-IRA и т.д.) могут оказаться эффективными по той же самой причине. Другие предпочтительные комбинации включают интерлейкин 11. Другими предпочтительными комбинациями являются другие ключевые игроки аутоиммунных реакций, которые могут действовать параллельно, зависимо или совместно с функционированием IL-18; особенно предпочтительными являются антагонисты IL-12, включая антитела к IL-12 или растворимые рецепторы IL-12, или связывающие IL-12 белки. Было показано, что IL-12 и IL-18 обладают перекрывающимися, но различающимися функциями, и комбинация обоих антагонистов может оказаться наиболее эффективной. Еще другой предпочтительной комбинацией являются неистощающие анти-CD4 ингибиторы. Еще другие предпочтительные комбинации включают антагонисты ко-стимуляторных путей CD80 (B7.1) или CD86 (B7.2), включая антитела, растворимые рецепторы или антагонистические лиганды.
Соединение формулы (I) настоящего изобретения можно также объединить с агентами, такими как метотрексат, 6-MP, азатиопринсульфасалазин, месалазин, олсалазин хлорхинин/гидроксихлороквин, пеницилламин, ауротиомалат (внутримышечный и пероральный), азатиоприн, колхицин, кортикостероиды (для перорального введения, для ингаляций или локальных инъекций), агонисты бета-2 адренорецепторов (салбутамол, тербуталин, недокромил), ксантины (теофиллин, аминофиллин), кромогликат, недокромил, кетотифен, ипратропий и окситропий, циклоспорин, FK506, рапамицин, микофенолят мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэфстеразы, агонисты аденозина, противотромботические агенты, ингибиторы комплементов, адренергические агенты, агенты, которые препятствуют передаче сигналов провоспалительными цитокинами, такими как TNFα или IL-1 (например, NIK, IKK, p38 или ингибиторы MAP киназы), ингибиторы IL-1β-превращающих ферментов, ингибиторы сигнальной системы T-клеток, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, 6-меркаптопурины, ингибиторы ангиотензин-превращающих ферментов, растворимые цитокиновые рецепторы и их производные (например, растворимые p55 или p75 TNF рецепторы и производные p75TNFRIgG (Enbrel™) и p55TNFRIgG (ленерцепт), sIL-1RI, sIL-1RII, sIL-6R), противовоспалительные цитокины (например IL-4, IL-10, IL-11, IL-13 и TGFβ), целекоксиб, фолиевая кислота, гидроксихлороквинсульфат, рофекоксиб, этанэрцепт, инфликсимаб, напроксен, вальдекоксиб, сульфасалазин, метилпреднизолон, мелоксикам, ацетат метилпреднизолона, натрийтиомалат золота, аспирин, триамцинолонацетонид, пропоксифеннапсилат/apap фолат, набуметон, диклофенак, пироксикам, этодолак, натрийдиклофенак, оксапрозин, оксикодон HCl, гидрокодонбитартрат/apap натрийдиклофенак/мизопростол, фентанил, анакинра, трамадол HCl, салсалат, сулиндак, цианокобаламин/fa/пиридоксин, ацетаминофен, натрийалендронат, преднизолон, морфинсульфат, лидокаингидрохлорид, индометацин, глюкозаминсульфат/хондроитин, амитриптилен HCl, сульфадиазин, оксикодон HCl/ацетаминофен, олопатадин HCl мизопростол, натрийнапроксен, омепразол, циклофосфамид, ритуксимаб, IL-1 TRAP, MRA, CTLA4-IG, IL-18 BP, анти-IL-12, анти-IL15, BIRB-796, SCIO-469, VX-702, AMG-548, VX-740, рофлумиласт, IC-485, CDC-801, S1P1 агонисты (такие как FTY720), ингибиторы семейства PKC (такие как рубоксистаурин или AEB-071) и мезопрам. Предпочтительные комбинации включают метотрексат или лефлуномид и в случаях умеренного или тяжелого ревматоидного артрита, циклоспорин и анти-TNF антитела, как указано выше.
Неограничивающие примеры терапевтических агентов для лечения воспалительные заболевания кишечника, с которыми можно объединить соединение формулы (I) настоящего изобретения, включают следующие: буденозид; эпидермальный фактор роста; кортикостероиды; циклоспорин, сульфасалазин; аминосалицилаты; 6-меркаптопурин; азатиоприн; метронидазол; ингибиторы липоксигеназы; месаламин; олсалазин; балсалазид; антиоксиданты; ингибиторы тромбоксана; антагонисты рецептора IL-1; анти-IL-1β моноклональные антитела; анти-IL-6 моноклональные антитела; факторы роста; ингибиторы эластазы; соединения пиридинил-имидазола; антитела к другим человеческим цитокинам или факторам роста или их антагонисты, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, IL-15, IL-16, IL-23, EMAP-II, GM-CSF, FGF, и PDGF; молекулы клеточной поверхности, такие как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лиганды; метотрексат; циклоспорин; FK506; рапамицин; микофенолят мофетил; лефлуномид; NSAID, например, ибупрофен; кортикостероиды, такие как преднизолон; ингибиторы фосфодиэфстеразы; агонисты аденозина; противотромботические агенты; ингибиторы комплемента; адренергические агенты; агенты, которые нарушают сигнальную систему провоспалительных цитокинов, таких как TNFα или IL-1 (например NIK, IKK, или ингибиторы MAP киназы); ингибиторы IL-1β превращающих ферментов; ингибиторы TNFα-превращающих ферментов; ингибиторы сигнальной системы T-клеток, такие как ингибиторы киназы; ингибиторы металлопротеиназы; сульфасалазин; азатиоприн; 6-меркаптопурины; ингибиторы ангиотензин-превращающих ферментов; растворимые цитокиновые рецепторы и их производные (например, растворимые p55 или p75 TNF рецепторы, sIL-1RI, sIL-1RII, sIL-6R) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ). Предпочтительные примеры терапевтических агентов для лечения болезни Крона, с которыми можно скомбинировать соединения формулы (I), включают следующие: антагонисты TNF, например, анти-TNF антитела, D2E7 (U.S. Pat. No. 6090382, HUMIRA™), CA2 (REMICADE™), CDP 571, конструкции TNFR-Ig, ингибиторы (p75TNFRIgG (ENBREL™) и p55TNFRIgG (LENERCEPT™) и ингибиторы PDE4. Соединение формулы (I) можно объединить с кортикостероидами, например, буденозидом и дексаметазоном; сульфасалазином, 5-аминосалициловой кислотой; олсалазином; и агентами, которые нарушают синтез или функционирование провоспалительных цитокинов, такими как IL-1, например, ингибиторы IL-1β-превращающих ферментов и IL-Ira; ингибиторами сигнальной системы Т-клеток, например, ингибиторами тирозинкиназы 6-меркаптопуринами; IL-11; месаламином; преднизоном; азатиоприном; меркаптопурином; инфликсимабом; натрийсукцинметилпреднизолоном; дифеноксилат/atrop сульфатом; лоперамидгидрохлоридом; метотрексатом; омепразолом; фолатом; ципрофлоксацин/декстроза-водой; гидрокодонбитартрат/apap; тетрациклингидрохлоридом; флуоцинонидом; метронидазолом; тимеросал/борной кислотой; холестирамин/сахарозой; ципрофлоксацингидрохлоридом; хиосциаминсульфатом; меперидингидрохлоридом; мидазоламгидрохлоридом; оксикодон HCl/ацетаминофеном; прометазингидрохлоридом; натрийфосфатом; сульфаметоксазол/триметопримом; целекоксибом; поликарбофилом; пропоксифеннапсилатом; гидрокортизоном; поливитаминами; динатрийбалсалазидом; кодеинфосфат/apap; колесевелам HCl; цианокобаламином; фолиевой кислотой; левофлоксацином; метилпреднизолоном; натализумабом и гамма-интерфероном.
Неограничивающие примеры терапевтических агентов для лечения рассеянного склероза, с которыми можно объединить соединение формулы (I), включают следующие: кортикостероиды; преднизолон; метилпреднизолон; азатиоприн; циклофосфамид; циклоспорин; метотрексат; 4-аминопиридин; тизанидин; интерферон-β1a (AVONEX®; Biogen); интерферон-β1b (BETASERON®; Chiron/Berlex); интерферон α-n3) (Interferon Sciences/Fujimoto), интерферон-α (Alfa Wassermann/J&J), интерферон β1A-IF (Serono/Inhale Therapeutics), пегинтерферон α2b (Enzon/Schering-Plough), сополимер 1 (Cop-1; COPAXONE®; Teva Pharmaceutical Industries, Inc.); гипербарический кислород; иммуноглобулины для внутривенного введения; кладрибин; антитела к другим человеческим цитокинам или антагонисты других человеческих цитокинов или факторы роста и их рецепторы, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, IL-23, IL-15, IL-16, EMAP-II, GM-CSF, FGF, и PDGF. Соединение формулы (I) можно объединить с антителами к молекулам клеточной поверхности, такими как CD2, CD3, CD4, CD8, CD19, CD20, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 или их лигандами. Соединение формулы (I) можно также объединить с агентами, такими как метотрексат, циклоспорин, FK506, рапамицин, микофенолят мофетил, лефлуномид, агонист S1P1, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэфстеразы, агонисты аденозина, противотромботические агенты, ингибиторы комплемента, адренергические агенты, агенты, которые нарушают сигнальную систему провоспалительных цитокинов, такие как TNFα, или IL-1 (например, NIK, IKK, p38 или ингибиторы MAP киназы), ингибиторы IL-1β-превращающих ферментов, ингибиторы TACE, ингибиторы сигнальных систем T-клеток, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-превращающих ферментов, растворимые цитокиновые рецепторы и их производные (например, растворимые p55 или p75 TNF рецепторы, sIL-1RI, sIL-1RII, sIL-6R) и противовоспалительные цитокины (например, IL-4, IL-10, IL-13 и TGFβ).
Предпочтительные примеры терапевтических агентов для лечения рассеянного склероза, с которыми можно объединить соединение формулы (I), включают интерферон-β, например, IFNβ1a и IFNβ1b; копаксон, кортикостероиды, ингибиторы каспазы, например ингибиторы каспазы-1, ингибиторы IL-1, ингибиторы TNF, и антитела к CD40 лиганду и CD80.
Соединение формулы (I) можно также объединить с агентами, такими как алемтузумаб, дронабинол, даклизумаб, митоксатрон, ксалипроденгидрохлорид, фампридин, глатирамерацетат, натализумаб, синнабидол, α-иммунокин NNSO3, ABR-215062, AnergiX.MS, антагонисты хемокиновых рецепторов, BBR-2778, калагуалин, CPI-1189, LEM (инкапсулированный в липосоме митоксатрон), THC.CBD (агонист каннабиноида), MBP-8298, мезопрам (PDE4 ингибитор), MNA-715, анти-IL-6 рецепторное антитело, нейровакс, пирфенидоналлотрап 1258 (RDP-1258), sTNF-R1, талампанел, терифлуномид, TGF-beta2, типлимотид, антагонисты VLA-4 (например, TR-14035, VLA4 Ultrahaler, Antegran-ELAN/Biogen), антагонисты гамма-интерферона и агонисты IL-4.
Неограничивающие примеры терапевтических агентов для лечения анкилозирующего спондилита, с которыми можно объединить соединение формулы (I), включают следующие: ибупрофен, диклофенак, мизопростол, напроксен, мелоксикам, индометацин, диклофенак, целекоксиб, рофекоксиб, сульфасалазин, метотрексат, азатиоприн, миноциклин, преднизон и анти-TNF антитела, D2E7 (U.S. Pat. No. 6090382; HUMIRA™), CA2 (REMICADE™), CDP 571, конструкции TNFR-Ig, (p75TNFRIgG (ENBREL™) и p55TNFRIgG (LENERCEPT™)
Неограничивающие примеры терапевтических агентов для лечения астмы, с которыми можно объединить соединение формулы (I), включают следующие: албутерол, салметерол/флутиказон, натриймонтелукаст, флутиказонпропионат, буденозид, преднизон, салметеролксинафолат, левалбутерол HCl, албутеролсульфат/ипратропий, преднизолоннатрийфосфат, триамцинолонацетонид, беклометазондипропионат, ипратропийбромид, азитромицин, пирбутеролацетат, преднизолон, безводный теофиллин, метилпреднизолоннатрийсукцинат, кларитромицин, зафирлукаст, формотеролфумарат, вакцину вируса гриппа, тригидрат амоксициллина, флунизолид, allergy injection, кромолиннатрий, фексофенадингидрохлорид, флунизолид/ментол, амоксициллин/клавуланат, левофлоксацин, вспомогательное устройство для ингаляции, гуаифенезин, дексаметазоннатрийфосфат, моксифлоксацин HCl, доксициклинхиклат, гуаифенезин/d-меторфан, p-эфедрин/код/хлорфенир, гатифлоксацин, цетиризингидрохлорид, мометазонфуроат, салметеролксинафоат, бензонатат, цефалексин, пе/гидрокодон/хлорфенир, цетиризин HCl/псевдоэфед, фенилэфрин/код/прометазин, кодеин/прометазин, цефпрозил, дексаметазон, гуаифенезин/псевдоэфедрин, хлорфенирамин/гидрокодон, недокромил-натрий, тербуталинсульфат, эпинефрин, метилпреднизолон, анти-IL-13 антитело и метапротеренолсульфат.
Неограничивающие примеры терапевтических агентов для лечения COPD, с которыми можно объединить соединение формулы (I), включают следующие: албутерол сульфат/ипратропий, ипратропий бромид, салметерол/флутиказон, албутерол, салметеролксинафоат, флутиказонпропионат, преднизон, безводный теофиллин, метилпреднизолон натрий сукцинат, монтелукаст-натрий, буденозид, формотеролфумарат, триамцинолонацетонид, левофлоксацин, гуаифенезин, азитромицин, беклометазондипропионат, левалбутерол HCl, флунизолид, цефтриаксон-натрий, тригидрат амоксициллина, гатифлоксацин, зафирлукаст, амоксициллин/клавуланат, флунизолид/ментол, хлорфенирамин/гидрокодон, метапротеренолсульфат, метилпреднизолон, мометазонфуроат, p-эфедрин/код/хлорфенир, пирбутеролацетат, п-эфедрин/лоратадин, тербуталинсульфат, тиотропийбромид, (R,R)-формотерол, TgAAT, циломиласт и рофлумиласт.
Неограничивающие примеры терапевтических агентов для лечения HCV, с которыми можно объединить соединение формулы (I), включают следующие: Интерферон-альфа-2α, Интерферон-альфа-2β, Интерферон-альфа con1, Интерферон-альфа-n1, пегилированный интерферон-альфа-2α, пегилированный интерферон-альфа-2β, рибавирин, пегинтерферон альфа-2b+рибавирин, урсодезоксихолевая кислота, глициррициновая кислота, тималфазин, максамин, VX-497 и любые соединения, которые используют для лечения HCV за счет интервенции в следующие мишени: в HCV полимеразу, HCV протеазу, HCV геликазу, и HCV IRES (внутренний сайт связывания рибосомы).
Неограничивающие примеры терапевтических агентов для лечения идиопатического легочного фиброза, с которыми можно объединить соединение формулы (I), включают следующие: преднизон, азатиоприн, албутерол, колхицин, албутеролсульфат, дигоксин, гамма-интерферон, метилпреднизолоннатрийсукцинат, лоракзепам, фуросемид, лизиноприл, нитроглицерин, спиронолактон, циклофосфамид, ипратропийбромид, актиномицин d, альтеплазу, флутиказонпропионат, левофлоксацин, метапротеренолсульфат, морфинсульфат, оксикодон HCl, хлорид калия, триамцинолонацетонид, безводный такролимус, кальций, интерферон-альфа, метотрексат, микофенолят мофетил и интерферон-гамма-1β.
Неограничивающие примеры терапевтических агентов для лечения инфаркта миокарда, с которыми можно объединить соединение формулы (I), включают следующие: аспирин, нитроглицерин, метопрололтартрат, эноксапариннатрий, гепарин натрий, клопидогрел бисульфат, карведилол, атенолол, морфина сульфат, метопролол сукцинат, варфарин-натрий, лизиноприл, изосорбид мононитрат, дигоксин, фуросемид, симвастатин, рамиприл, тенектеплаз, эналаприл малеат, торсемид, ретаваз, лозартан калий, хинаприлгидрохлорид/карбонат магния, буметанид, альтеплазу, эналаприлат, амиодаронгидрохлорид, тирофибан HCl м-гидрат, дилтиаземгидрохлорид, каптоприл, ирбесартан, валсартан, пропранололгидрохлорид, фозиноприл натрий, лидокаингидрохлорид, эптифибатид, цефазолин натрий, атропин сульфат, аминокапроевую кислоту, спиронолактон, интерферон, соталолгидрохлорид, хлорид калия, докузат натрий, добутамин HCl, алпрозолам, правастатин натрий, аторвастатин кальций, мидазоламгидрохлорид, меперидингидрохлорид, изосорбиддинитрат, эпинефрин, допамингидрохлорид, бивалирудин, розувастатин, эзетимиб/симвастатин, авасимиб и карипорид.
Неограничивающие примеры терапевтических агентов для лечения псориаза, с которыми можно объединить соединение формулы (I), включают следующие: кальципотриен, клобетазолпропионат, триамцинолонацетонид, галобетазолпропионат, тазаротен, метотрексат, флуоцинонид, бетаметазон дипроп augumented, флуоцинолонацетонид, ацитретин, дегтярный шампунь, бетаметазонвалерат, мометазонфуроат, кетоконазол, прамоксин/флуоцинолон, гидрокортизонвалерат, флурандренолид, мочевину, бетаметазон, клобетазолпропионат/емолл, флутиказонпропионат, азитромицин, гидрокортизон, увлажняющую формулу, фолиевую кислоту, дезонид, пимекролимус, каменноугольный деготь, дифлоразон диацетат, этанэрцептфолат, молочную кислоту, метоксален, hc/bismuth subgal/znox/resor, метилпреднизолон ацетат, преднизон, солнцезащитный экран, галицинонид, салициловую кислоту, антралин, клокортолон пивалат, угольный экстракт, деготь/салициловая кислота, деготь/салициловая кислота/сера, дезоксиметазон, диазепам, эммолиент, флуоцинонид/эммолиент, минеральное масло/касторовое масло/na lact, минеральное масло/арахисовое масло, петроль/изопропилмиристат, псорален, салициловую кислоту, мыло/трибромсалан, тимеросал/борная кислота, целекоксиб, инфликсимаб, циклоспорин, алефацепт, эфализумаб, такролимус, пимекролимус, PUVA, UVB, сульфасалазин, ABT-874 и узтекинамаб.
Неограничивающие примеры терапевтических агентов для лечения псориатических артритов, с которыми можно объединить соединение формулы (I), включают следующие: метотрексат, этанэрцепт, рофекоксиб, целекоксиб, фолиевую кислоту, сульфасалазин, напроксен, лефлуномид, метилпреднизолон ацетат, индометацин, гидроксихлороквинсульфат, преднизон, сулиндак, бетаметазон дипроп аугментед, инфликсимаб, метотрексат, фолат, триамцинолон ацетонид, диклофенак, диметилсульфоксид, пироксикам, диклофенак-натрий, кетопрофен, мелоксикам, метилпреднизолон, набуметон, толметин натрий, кальципотриен, циклоспорин, диклофенак-натрий/мизопростол, флуоцинонид, глюкозамин сульфат, натрийтиомалат золота, гидрокодон битартрат/apap, ибупрофен, ризедронат натрий, сульфадиазин, тиогуанин, вальдекоксиб, алефацепт, D2E7 (U.S. Pat. No. 6090382, HUMIRA™), и эфализумаб.
Неограничивающие примеры терапевтических агентов для лечения рестеноза, с которыми можно объединить соединение формулы (I), включают следующие: сиролимус, паклитаксел, эверолимус, такролимус, ABT-578 и ацетаминофен.
Неограничивающие примеры терапевтических агентов для лечения ишиаса, с которыми можно объединить соединение формулы (I), включают следующие: гидрокодон битартрат/apap, рофекоксиб, циклобензаприн HCl, метилпреднизолон, напроксен, ибупрофен, оксикодон HCl/ацетаминофен, целекоксиб, вальдекоксиб, метилпреднизолон ацетат, преднизон, кодеин фосфат/apap, трамадол HCl/ацетаминофен, метаксалон, мелоксикам, метокарбамол, лидокаингидрохлорид, диклофенак-натрий, габапентин, дексаметазон, каризопродол, кеторолак трометамин, индометацин, ацетаминофен, диазепам, набуметон, оксикодон HCl, тизанидин HCl, диклофенак-натрий/мизопростол, пропоксифен n-pap, asa/оксикод/оксикодон ter, ибупрофен/гидрокодон bit, трамадол HCl, этодолак, пропоксифен HCl, амитриптилен HCl, каризопродол/кодеин phos/asa, морфина сульфат, поливитамины, напроксен-натрий, орфенадрин цитрат и темазепам.
Предпочтительные примеры терапевтических агентов для лечения системной красной волчанки (SLE (Lupus)), с которыми можно объединить соединение формулы (I), включают следующие: NSAIDS, например, диклофенак, напроксен, ибупрофен, пироксикам, индометацин; ингибиторы COX2, например, целекоксиб, рофекоксиб, вальдекоксиб; противомалярийные агенты, например, гидроксихлороквин; стероиды, например, преднизон, преднизолон, буденозид, дексаметазон; цитотоксические агенты, например, азатиоприн, циклофосфамид, микофенолят мофетил, метотрексат; ингибиторы PDE4 или ингибитор синтеза пурина, например Cellcept®. Соединение формулы (I) можно также объединить с агентами, такими как сульфасалазин, 5-аминосалициловая кислота, олсалазин, Imuran® и агенты, которые препятствуют синтезу, продуцированию или действию провоспалительных цитокинов, такие как IL-1, например, ингибиторы каспазы, подобные ингибиторам IL-1β-превращающих ферментов и IL-1ra. Соединение формулы (I) можно также использовать с ингибиторами сигнальной системы T клеток, например, ингибиторами тирозинкиназы; или молекулами, которые направлены на молекулы, активирующие T-клетки, например, CTLA-4-IgG или антитела к анти-B7 семейству, антитела к анти-PD-1 семейству. Соединение формулы (I) можно объединить с IL-11 или анти-цитокиновыми антителами, например, с фонотолизумабом (антитело к анти-IFNg), или анти-рецептор рецепторными антителами, например, анти-IL-6 рецептор антителом и антителами к поверхностным молекулам B-клеток. Соединение формулы (I) можно также использовать с LJP 394 (абетимус), агентами, которые истощают или инактивируют B-клетки, например, с ритуксимабом (антитело к анти-CD20), лимфостат-B (антитело к анти-BlyS), антагонистами TNF, например, антителами к анти-TNF, D2E7 (U.S. Pat. No. 6090382; HUMIRA™), CA2 (REMICADE™), CDP 571, конструкции TNFR-Ig, (p75TNFRIgG (ENBREL™) и p55TNFRIgG (LENERCEPT™).
В рассматриваемом изобретении приняты следующие определения:
Термин “терапевтически эффективное количество” представляет собой такое количество соединения формулы (I) или комбинации двух или более таких соединений, которые ингибируют, полностью или частично, развитие состояния, или облегчают, по меньшей мере частично, один или более из симптомов состояния. Терапевтически эффективное количество может также быть количеством, которое является профилактически эффективным. Количество, которое является терапевтически эффективным, будет зависеть от массы пациента и его пола, подлежащего лечению состояния, тяжести состояния и необходимого результата. Для конкретного пациента терапевтически эффективное количество можно определить способами, известными специалистам в данной области.
Термин “фармацевтически приемлемые соли” относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований, и которые получают, осуществляя взаимодействие с неорганическими кислотами, например, с хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой, или с органическими кислотами, такими как сульфоновая кислота, карбоновая кислота, фосфорорганическая кислота, метансульфоновая кислота, этансульфоновая кислота, p-толуолсульфоновая кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, бензойная кислота, салициловая кислота, молочная кислота, виннокаменная кислота (например, (+) или (−)-виннокаменная кислота или их смеси), аминокислоты (например, (+) или (−)-аминокислоты или их смеси) и т.п. Указанные соли можно получить способами, известными специалистам в данной области.
Некоторые соединения формулы (I), у которых имеются кислотные заместители, могут существовать в виде солей с фармацевтически приемлемыми основаниями. Настоящее изобретение включает такие соли. Примеры таких солей включают соли натрия, соли калия, соли лизина и соли аргинина. Указанные соли можно получить способами, известными специалистам в данной области.
Некоторые соединения формулы (I) и их соли могут существовать в более чем одной кристаллической форме, и настоящее изобретение включает каждую кристаллическую форму и их смеси.
Некоторые соединения формулы (I) и их соли могут также существовать в форме сольватов, например гидратов, и настоящее изобретение включает каждый такой сольват и их смеси.
Некоторые соединения формулы (I) могут иметь один или более из хиральных центров и существовать в различных оптически активных формах. Если соединения формулы (I) содержат один хиральный центр, указанные соединения существуют в двух энантиомерных формах, и настоящее изобретение включает оба энантиомера и смеси энантиомеров, такие как рацемические смеси. Такие энантиомеры можно разделить способами, известными специалистам в данной области, например путем образования диастереоизомерных солей, которые можно разделить, например, путем кристаллизации; путем образования диастереоизомерных производных или комплексов, которые можно разделить, например, путем кристаллизации, с помощью газо-жидкостной или жидкостной хроматографии; с помощью селективной реакции одного энантиомера с энантиомер-специфическим реагентом, например путем ферментативной этерификации; или используя газо-жидкостную или жидкостную хроматографию в хиральном окружении, например, на хиральной подложке, силикагеле, который связывает хиральный лиганд, или в присутствии хирального растворителя. Следует понимать, что если нужный энантиомер превращают в другое химическое соединение с помощью одной из раскрытых выше процедур разделения, понадобится дополнительная стадия для высвобождения необходимой энантиомерной формы. Альтернативно, конкретные энантиомеры можно синтезировать, используя асимметрический синтез, используя оптически активные реагенты, субстраты, катализаторы или растворители, или превращая один энантиомер в другой, используя асимметрическое превращение.
Если соединение формулы (I) содержит более одного хирального центра, оно может существовать в диастереоизомерных формах. Диастереоизомерные соединения можно разделить способами, известными специалистам в данной области, например, используя хроматографию или кристаллизацию, и индивидуальные энантиомеры можно разделить, как раскрыто выше. Настоящее изобретение включает каждый из диастереоизомеров соединения формулы (I) и их смеси.
Некоторые соединения формулы (I) могут существовать в различных таутомерных формах или в виде различных геометрических изомеров, и настоящее изобретение включает каждый из таутомеров и/или геометрических изомеров соединений формулы (I) и их смеси.
Некоторые соединения формулы (I) могут существовать в различных стабильных конформационных формах, которые можно разделить. Торсионная асимметрия, связанная с ограниченным вращением вокруг асимметричной простой связи, например, из-за стерических затруднений или напряжений в цикле, может предоставить возможность разделить различные конформеры. Настоящее изобретение включает каждый из конформационных изомеров соединений формулы (I) и их смеси.
Некоторые соединения формулы (I) могут существовать в форме цвиттерионов, и настоящее изобретение включает каждую из цвиттерионных форм соединений формулы (I) и их смеси.
В том смысле, как здесь использован термин “пролекарство”, он относится к агенту, который превращается в исходное лекарство in vivo в результате некоторого физиологического химического процесса (например, если pH пролекарства довести до физиологических значений, пролекарство превращается в необходимую лекарственную форму). Пролекарства используют довольно часто, так как в некоторых ситуациях их может быть легче вводить, чем исходные лекарства. Так например, они могут оказаться биодоступными при пероральном введении, тогда как исходные лекарства - нет. Пролекарства могут также обладать повышенной растворимостью в фармакологических композициях по сравнению с исходным лекарством. Например, но без ограничений, пролекарством может быть соединение настоящего изобретения, когда его вводят в виде сложного эфира (“пролекарство”) для облегчения проникновения через клеточные мембраны, когда растворимость в воде не является выгодной, но затем оно метаболически гидролизуется до карбоновой кислоты, уже внутри клетки, где растворимость в воде является выгодным свойством.
Пролекарства обладают множеством полезных свойств. Например, может оказаться, что пролекарство лучше растворяется в воде, чем конечное лекарство, тем самым, облегчая внутривенное введение лекарства. Пролекарство может также обладать более высокой степенью биодоступности при пероральном введении, чем конечное лекарство. После введения пролекарство ферментативно или химически расщепляется, доставляя конечное лекарство в кровь или ткань.
Примеры пролекарств после расщепления выделяют соответствующую свободную кислоту, и такие гидролизуемые, образующие сложные эфиры остатки соединений настоящего изобретения включают, но ими не ограничиваются, заместители карбоновой кислоты, в которых свободный водород заменен (C1-C4)алкилом, (C1-C12)алканоилоксиметилом, (C4-C9)1-(алканоилокси)этилом, 1-метил-1-(алканоилокси)этилом, содержащими от 5 до 10 атомов углерода, алкоксикарбонилоксиметилом, содержащим от 3 до 6 атомов углерода, 1-(алкоксикарбонилокси)этилом, содержащим от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилокси)этилом, содержащим от 5 до 8 атомов углерода, N-(алкоксикарбонил)аминометилом, содержащим от 3 до 9 атомов углерода, 1-(N-(алкоксикарбонил)амино)этилом, содержащим от 4 до 10 атомов углерода, 3-фталидилом, 4-кротонолактонилом, гамма-бутиролактон-4-илом, ди-N,N-(C1-C2)алкиламино(C2-C3)алкилом, (таким как β-диметиламиноэтил), карбамоил-(C1-C2)алкилом, N,N-ди(C1-C2)-алкилкарбамоил-(C1-C2)алкилом и пиперидино-, пирролидино- или морфолино(C2-C3)алкилом.
Другими примерами пролекарств, которые выделяют спирт формулы (I), где свободный водород гидроксильного заместителя (например, R1 содержит гидроксил) заменен (C1-C6)алканоилоксиметилом, 1-((C1-C6)алканоилокси)этилом, 1-метил-1-((C1-C6)алканоилокси)этилом, (C1-C12)алкоксикарбонилоксиметилом, N-(C1-C6)алкоксикарбониламинометилом, сукциноилом, (C1-C6)алканоилом, α-амино(C1-C4)алканоилом, арилацилом и α-аминоацилом, или α-аминоацил-α-аминоацилом, где указанные α-аминоацильные фрагменты представляют собой независимо любую из природных L-аминокислот, находящихся в белках, P(O)(OH)2, -P(O)(O(C1-C6)алкил)2 или гликозил (радикал, образующийся в результате удаления гидроксила из полуацеталя или углевода).
В том смысле, как здесь использован термин “мостиковая (C5-C12)циклоалкильная группа”, он обозначает насыщенную или ненасыщенную, бициклическую или полициклическую мостиковую углеводородную группу, содержащую два или три C3-C10 циклоалкильных кольца. Немостиковые циклоалкилы исключены. Мостиковые циклические углеводороды могут включать такие, как бицикло[2.1.1]гексил, бицикло[2.2.1]гептил, бицикло[2.2.2]октил, бицикло[3.2.1]октил, бицикло[4.3.1]децил, бицикло[3.3.1]нонил, борнил, боренил, норборнил, норборненил, 6,6-диметилбицикло[3.1.1]гептил, трициклобутил и адамантил.
В том смысле, как здесь использован, термин “мостиковый (C2-C10)гетероциклил”, он обозначает бициклические или полициклические аза-мостиковые углеводородные группы и может включать азанорборнил, хинуклидинил, изохинуклидинил, тропанил, азабицикло[3.2.1]октанил, азабицикло[2.2.1]гептанил, 2-азабицикло[3.2.1]октанил, азабицикло[3.2.1]октанил, азабицикло[3.2.2]нонанил, азабицикло[3.3.0]нонанил, и азабицикло[3.3.1]нонанил.
Термины “гетероциклические”, “гетероциклил” или “гетероциклилен”, в том смысле, как здесь использован, включают неароматические кольцевые системы, включая, но ими не ограничиваясь, моноциклические, бициклические, трициклические и спироциклические кольца, которые могут быть полностью насыщенными или которые могут содержать одно или более из звеньев ненасыщенности (причем, чтобы избежать сомнений, степень ненасыщенности не приводит к ароматической системе), и содержат от 5 до 12 атомов, включая, по меньшей мере, один гетероатом, такой как азот, кислород или сера. В качестве примеров, которые не следует рассматривать как ограничивающие объем настоящего изобретения, можно привести следующие примеры гетероциклических колец: азепинил, азетидинил, индолинил, изоиндолинил, морфолинил, пиперазинил, пиперидинил, пирролидинил, хинуклидинил, тиоморфолинил, тетрагидропиранил, тетрагидрофуранил, тетрагидроиндолил, тиоморфолинил и тропанил.
Термины “гетероарил” или “гетероарилен” в том смысле, как здесь использованы, включают ароматические кольцевые системы, включая, но ими не ограничиваясь, моноциклические, бициклические и трициклические кольца, и содержат от 5 до 12 атомов, включая по меньшей мере, один гетероатом, такой как азот, кислород или сера. В качестве примеров, которые не следует рассматривать как ограничивающие объем настоящего изобретения, можно привести: азаиндолил, бензо[b]тиенил, бензимидазолил, бензофуранил, бензоксазолил, бензотиазолил, бензотиадиазолил, бензоксадиазолил, фуранил, имидазолил, имидазопиридинил, индолил, индазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пуринил, пиранил, пиразинил, пиразолил, пиридинил, пиримидинил, пирролил, пирроло[2,3-d]пиримидинил, пиразоло[3,4-d]пиримидинил, хинолинил, хиназолинил, триазолил, тиазолил, тиофенил, тетразолил, тиадиазолил или тиенил.
Термин “гетероциклоалкильная” группа в том смысле, как здесь использован, представляет собой гетероциклическую группу, которая связана с соединением алифатической группой, содержащей от одного до около восьми атомов углерода. Например, гетероциклоалкильная группа представляет собой морфолинометильную группу.
В том смысле, как здесь использованы термины “алкил”, “алкилен” или обозначения, такие как “(C1-C8)”, включают неразветвленные или разветвленные углеводороды, которые полностью насыщены. Примерами алкилов служат метил, этил, пропил, изопропил, бутил, пентил, гексил и их изомеры. В том смысле, как здесь использованы термины “алкенил”, “алкенилен”, “алкинилен” и “алкинил”, означают C2-C8 и включают неразветвленные или разветвленные углеводороды, которые содержат одно или более из звеньев ненасыщенности, одну или более из двойных связей для алкенила и одну или более из тройных связей для алкинила.
В том смысле, как здесь использован термин “ароматические” группы (или “арильная” или “ариленовая” группы), включают ароматические карбоциклические кольцевые системы (например фенил) и конденсированные полициклические ароматические кольцевые системы (например, нафтил, бифенил и 1,2,3,4-тетрагидронафтил).
В том смысле, как здесь использованы термины “циклоалкил” или “циклоалкилен”, они означают C3-C12 моноциклические или полициклические (например, бициклические, трициклические, спироциклические, и т.д.) углеводороды, которые полностью насыщены, или содержат одну или более из ненасыщенных связей, но это количество не приводит к образованию ароматической группы. Примеры циклоалкильных групп представляют собой циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил и циклогексенил.
В том смысле, как здесь использованы, многие фрагменты или заместители именуют как или “замещенные” или “необязательно замещенные”. Если фрагмент обозначен одним из этих терминов, если нет других указаний, это означает, что любая часть указанного фрагмента, который, как известно специалистам, доступен для замещения, может быть замещен, что включает один или более из заместителей, и где имеется более одного заместителя, тогда каждый из заместителей выбирают независимо. Такие обозначения для замещения хорошо известны специалистам в данной области и/или приняты в настоящем описании. В качестве примеров, которые не следует рассматривать как ограничивающие объем настоящего изобретения, можно привести некоторые группы, которые являются заместителями: (C1-C8)алкильные группы, (C2-C8)алкенильные группы, (C2-C8)алкинильные группы, (C3-C10)циклоалкильные группы, галоген (F, Cl, Br или I), галогенированные (C1-C8)алкильные группы (например, но им не ограничиваясь, -CF3), -O-(C1-C8)алкильные группы, -OH, -S-(C1-C8)алкильные группы, -SH, -NH(C1-C8)алкильные группы, -N((C1-C8)алкил)2 группы, -NH2, -C(O)NH2, -C(O)NH(C1-C8)алкильные группы, -C(O)N((C1-C8)алкил)2 группы, -NHC(O)H, -NHC(O)(C1-C8)алкильные группы, -NHC(O)(C3-C8)циклоалкильные группы, -N((C1-C8)алкил)C(O)H, -N((C1-C8)алкил)C(O)(C1-C8)алкильные группы, -NHC(O)NH2, -NHC(O)NH(C1-C8)алкильные группы, -N((C1-C8)алкил)C(O)NH2 группы, -NHC(O)N((C1-C8)алкил)2 группы, -N((C1-C8)алкил)C(O)N((C1-C8)алкил)2 группы, -N((C1-C8)алкил)C(O)NH((C1-C8)алкил), -C(O)H, -C(O)(C1-C8)алкильные группы, -CN, -NO2, -S(O)(C1-C8)алкильные группы, -S(O)2(C1-C8)алкильные группы, -S(O)2N((C1-C8)алкил)2 группы, -S(O)2NH(C1-C8)алкильные группы, -S(O)2NH(C3-C8)циклоалкильные группы, -S(O)2NH2 группы, -NHS(O)2(C1-C8)алкильные группы, -N((C1-C8)алкил)S(O)2(C1-C8)алкильные группы, -(C1-C8)алкил-O-(C1-C8)алкильные группы, -O-(C1-C8)алкил-O-(C1-C8)алкильные группы, -C(O)OH, -C(O)O(C1-C8)алкильные группы, NHOH, NHO(C1-C8)алкильные группы, -O-галогенированные (C1-C8)алкильные группы (например, но ими не ограничиваясь, -OCF3), -S(O)2-галогенированные (C1-C8)алкильные группы (например, но ими не ограничиваясь, -S(O)2CF3), -S-галогенированные (C1-C8)алкильные группы (например, но ею не ограничиваясь, -SCF3), -(C1-C6)гетероциклы (например, но ими не ограничиваясь, пирролидин, тетрагидрофуран, пиран или морфолин), -(C1-C6)гетероарил (например но ими не ограничиваясь, тетразол, имидазол, фуран, пиразин или пиразол), -фенил, -NHC(O)O-(C1-C6)алкильные группы, -N((C1-C6)алкил)C(O)O-(C1-C6)алкильные группы, -C(=NH)-(C1-C6)алкильные группы, -C(=NOH)-(C1-C6)алкильные группы, или -C(=N-O-(C1-C6)алкил)-(C1-C6)алкильные группы.
 в формуле (I) представляет собой ароматическое кольцо.
в формуле (I) представляет собой ароматическое кольцо.
Одно или более из соединений настоящего изобретения можно вводить пациентам-людям как они есть, или в фармацевтических композициях, где их смешивают с биологически подходящими носителями или эксципиентом (эксципиентами) в дозах, достаточных для лечения или облегчения заболевание или состояния, как здесь раскрыто. Смеси указанных соединений можно также вводить пациенту в виде простой смеси или в виде подходящим образом приготовленной фармацевтической композиции. Понятие терапевтически эффективная доза относится к такому количеству соединения или соединений, которого достаточно для обеспечения профилактики или для ослабления заболевания или состояния, как здесь раскрыто. Технологии приготовления лекарственного средства и введения соединений рассматриваемой заявки можно найти в ссылках, которые хорошо известны специалистам в данной области, таких как “Remington's Pharmaceutical Sciences,” Mack Publishing Co., Easton, Pa., latest edition.
Подходящие способы введения могут, например, включать пероральное, с помощью глазных капель, ректальное, трансмукозальное, наружное или интестинальное введение; парентеральную доставку, включая внутримышечные, подкожные, интрамедуллярные инъекции, также как интратекальные, прямые интравентрикулярные, внутривенные, интраперитонеальные, интраназальные или интраокулярные инъекции.
Альтернативно, можно вводить указанное соединение локально, а не системно, например, за счет инъекции соединения непосредственно в отечную область, часто в виде депо-препаратов или композиций с замедленным выделением.
Кроме того, можно вводить лекарственное средство в виде направленной системы доставки лекарств, например, в виде липосомы, покрытой эндотелиальным клетко-специфическим антителом.
Фармацевтические композиции настоящего изобретения можно приготовить известными способами, например, с помощью процессов обычного перемешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, включения или лиофилизации.
Таким образом, фармацевтические композиции для использования в соответствии с настоящим изобретением можно приготавливать обычными способами, используя один или более из физиологически приемлемых носителей, включающих эксципиенты и вспомогательные вещества, которые облегчают переработку активных соединений в препараты, которые можно использовать фармацевтически. Подходящие формы зависят от выбранного способа введения.
Для инъекций агенты настоящего изобретения можно приготовить в виде водных растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнка, раствор Рингера или физиологический раствор. Для трансмукозального введения в препаратах используют пенетранты, подходящие для преодоления барьера. Такие пенетранты обычно известны специалистам в данной области.
Для перорального введения соединения можно легко приготовить, комбинируя активные соединения с фармацевтически приемлемыми носителями, хорошо известными специалистам в данной области. Такие носители облегчают получение соединений настоящего изобретения в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.п., для усвоения подлежащим лечению пациентом при перорально приеме. Фармацевтические препараты для перорального использования можно получить, комбинируя активное соединение с твердым эксципиентом, необязательно измельчая полученную смесь, и превращая смесь в гранулы после добавления подходящих вспомогательных веществ, при желании, для получения таблеток или внутреннего содержания драже. Подходящими эксципиентами являются, в частности, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, смола трагаканта, метилцеллюлоза, гидроксипропилметил-целлюлоза, натрийкарбоксиметилцеллюлоза и/или поливинилпирролидон (PVP). При желании можно добавлять разрыхляющие агенты, такие как сшитый поливинилпирролидон, агар или альгиновую кислоту или их соли, такие как альгинат натрия.
Внутреннее содержание драже снабжают соответствующей оболочкой. Для этой цели можно использовать концентрированные растворы сахаров, которые могут необязательно содержать гуммиарабик, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль и/или диоксид титана, растворы лаков и подходящие органические растворители или смеси растворителей. Красители или пигменты можно добавлять к таблеткам или в оболочки драже для идентификации или для обозначения различных комбинаций доз активного соединения.
Фармацевтические препараты, которые можно использовать перорально, включают разъемные желатиновые капсулы, также как мягкие, герметичные капсулы, сделанные из желатина и пластификатора, такого как глицерин или сорбит. Разъемные капсулы могут содержать активные ингредиенты в смеси с наполнителями, такими как лактоза, связующими, такими как крахмалы, и/или смазывающими агентами, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жидкие масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, можно добавлять стабилизаторы. Все препараты для перорального введения должны быть приготовлены в дозах, подходящих для такого введения.
Композиции для буккального введения могут иметь форму таблеток или пастилок, приготовленных обычным способом.
Для введения с помощью ингаляций соединения для использования в соответствии с настоящим изобретением, обычно поставляют в форме аэрозольных спреев, заключенных в контейнеры под давлением, или небулайзеров, в которых используют подходящий пропеллент, например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае аэрозоля под давлением единичную дозу может обеспечивать клапан, отмеряющий определенное количество. Капсулы и картриджи, например, из желатина, для использования в ингаляторе или в инсуффляторе могут быть приготовлены так, чтобы содержать смесь порошков соединений и подходящего базового порошка, такого как лактоза или крахмал.
Соединения настоящего изобретения можно приготовить для парентерального введения путем инъекций, например болюсных инъекций или непрерывных вливаний. Композиции для инъекций могут быть в единичных дозовых формах, например в ампулах или в мульти-дозовых контейнерах, с добавленным консервантом. Такие композиции могут быть в форме суспензий, растворов или эмульсий в маслянистых или водных носителях, и могут содержать способствующие созданию формы агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты.
Фармацевтические композиции для парентерального введения включают водные растворы активных соединений в водорастворимой форме. Кроме того, суспензии активных соединений можно получить в виде подходящих маслянистых суспензий для инъекций. Подходящие лиофильные растворители или носители включают жидкие масла, такие как кунжутное масло, или синтетические эфиры жирных кислот, такие как этилолеат, или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, которые повышают вязкость суспензии, такие как натрий карбоксиметилцеллюлоза, сорбит или декстран. Необязательно, суспензия может также содержать подходящие стабилизаторы или агенты, которые повышают растворимость соединений, давая возможность получать растворы с высокой концентрацией.
Альтернативно, активный ингредиент может быть в виде порошка для разбавления перед использованием подходящим носителем, например, стерильной, не содержащей пирогена водой.
Соединения настоящего изобретения можно также приготовить в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие обычные основания для суппозиториев, такие как масло какао или другие глицериды.
Кроме описанных выше препаратов, соединения настоящего изобретения могут также быть приготовлены в виде депо-препаратов. Такие препараты длительного действия можно вводить, используя имплантацию (например, подкожно или внутримышечно или путем внутримышечного введения). Так, например, соединения настоящего изобретения можно приготовить в смеси с подходящими полимерными или гидрофобными материалами (например, как эмульсии в приемлемом масле) или с ионообменными смолами, или в виде слабо растворимых производных, например, в виде слабо растворимых солей.
Примером фармацевтического носителя для гидрофобных соединений настоящего изобретения является система сорастворителей, включающая бензиловый спирт, неполярный поверхностно-активный агент, смешивающийся с водой органический полимер и водную фазу. Такая система сорастворителей может быть системой VPD сорастворителя. VPD представляет собой раствор 3 вес./об.% бензилового спирта, 8 вес./об.% неполярного поверхностно активного агента полисорбата 80, и 65 вес./об.% полиэтиленгликоля 300, доведенного до объема в абсолютном этаноле. Система сорастворителя VPD (VPD:5W) состоит из VPD разбавленного 1:1 5% декстрозой в водном растворе. Указанная система сорастворителей хорошо растворяет гидрофобные соединения, и сама является низко токсичной при системном введении. Естественно, что пропорции в системе сорастворителей могут значительно меняться, не нарушая ее характеристик растворяющей способности и токсичности. Кроме того, идентичность компонентов со-растворителей может меняться: например, можно использовать другие неполярные поверхностно активные агенты с низкой токсичностью вместо полисорбата 80; может меняться размер фракций полиэтиленгликоля; другие биосовместимые полимеры могут заменить полиэтиленгликоль, например, поливинилпирролидон; и другие сахара или полисахариды могут заменить декстрозу.
Альтернативно, можно использовать другие системы доставки гидрофобных фармацевтических соединений. Липосомы и эмульсии являются хорошо известными примерами носителей для доставки или носителей для гидрофобных лекарственных средств. Можно также использовать некоторые органические растворители, такие как диметилсульфоксид, хотя обычно ценой более высокой токсичности. Кроме того, соединения настоящего изобретения можно доставлять, используя системы с замедленным высвобождением, такие как полупроницаемые матрицы твердых гидрофобных полимеров, содержащие терапевтический агент. Установлены различные материалы, обеспечивающие замедленное высвобождение, и они хорошо известны специалистам в данной области. Капсулы с замедленным высвобождением могут, в зависимости от их химической природы, выделять соединения настоящего изобретения в течение нескольких недель, вплоть до более 100 дней. В зависимости от химической природы и биологической стабильности терапевтического реагента можно использовать дополнительные подходы к стабилизации белков.
Фармацевтические композиции также могут включать подходящие носители или эксципиенты в твердой или в гелевой фазах. Примеры таких носителей или эксципиентов включают, но ими не ограничиваются, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
Многие из соединений настоящего изобретения можно предложить в виде солей с фармацевтически совместимыми противоионами. Фармацевтически совместимые соли можно получить со многими кислотами, включая, но ими не ограничиваясь, хлористоводородную, серную, уксусную, молочную, виннокаменную, яблочную, янтарную и т.д. Соединения в форме солей являются более растворимыми в водном или других протонных растворителях, чем соответствующие им формы свободных оснований.
Фармацевтические композиции, подходящие для использования в настоящем изобретении, включают композиции, в которых активные ингредиенты содержатся в эффективном количестве для достижения заданной цели. Более конкретно, терапевтически эффективное количество означает такое количество, которое эффективно предотвращает развитие или ослабляет уже существующие симптомы у подлежащего лечению субъекта. Определение эффективных количеств находится целиком в рамках компетентности специалистов в данной области.
Для любого из соединений, использованных в способе настоящего изобретения, терапевтически эффективная доза может быть установлена вначале на основании клеточных анализов. Например, в клеточном анализе или в моделях на животных можно приготовить дозу для достижения циркулирующих концентраций в интервале, который включает ИК50, как определено в клеточных анализах (т.е., концентрацию тестируемого соединения, которая обеспечивает половину максимального ингибирования активности конкретной протеинкиназы). В некоторых случаях удобно определять величину ИК50 в присутствии от 3 до 5% сывороточного альбумина, так как такое определение аппроксимирует эффекты связывания плазменного белка с соединением. Такую информацию можно использовать для более точного определения дозы для людей. Кроме того, наиболее предпочтительные соединения для системного введения эффективно ингибируют сигналы протеинкиназы в интактных клетках на уровнях, которые безопасно достижимы в плазме.
Выражение терапевтически эффективная доза относится к такому количеству соединения, которое приводит к облегчению симптомов у пациента. Токсичность и терапевтическую эффективность таких соединений можно определить, используя стандартные фармацевтические процедуры в клеточных культурах или на экспериментальных животных, например, для определения максимальной переносимой дозы (MTD) и ЭД50 (эффективная доза для 50% максимальной реакции). Соотношение доз между токсическим и терапевтическим эффектами представляет собой терапевтический индекс, и его можно выразить как отношение между MTD и ЭД50. Предпочтительны соединения, которые демонстрируют высокие значения терапевтических индексов. Результаты, полученные в результате анализа клеточных культур и исследований на животных, можно использовать при определении интервала доз, которые применимы для людей. Дозы таких соединений лежат, предпочтительно, в интервале циркулирующих концентраций, которые включают ЭД50 при небольшой токсичности или в ее отсутствии. Дозы могут варьироваться в указанном интервале в зависимости от используемой дозовой формы и используемого способа введения. Конкретную композицию, способ введения и дозы может выбрать лечащий врач с учетом состояния пациента (см., например, Fingl et al., 1975, в “The Pharmaceutical Basis of Therapeutics”, Ch. 1 p. 1). При лечении кризисных состояний для достижения быстрой реакции может понадобиться введение экстренного болюса или для достижения быстрой реакции может понадобится вливание, приближенное к максимально переносимой дозе (MTD).
Количество доз и интервалы между введениями можно устанавливать индивидуально, чтобы создать такие уровни активного агента в плазме, которых достаточно для поддержания модулирующих киназу эффектов, или минимальной эффективной концентрации (MEC). Величина MEC будет меняться для каждого из соединений, но ее можно установить на основании результатов, полученных in vitro; например, концентрации, необходимой для достижения 50-90% ингибирования протеинкиназы с использованием раскрытых здесь анализов. Дозы, необходимые для достижения MEC, будут зависеть от индивидуальных характеристик и способов введения. Кроме того, для определения концентраций в плазме можно использовать анализы ВЭЖХ или биоанализы.
Дозовые интервалы также можно определить, используя значения MEC. Соединения следует вводить, используя такой режим, который поддерживает уровни содержания в плазме выше, чем MEC в течение 10-90% времени, предпочтительно от 30 до 90% и наиболее предпочтительно от 50 до 90%, до тех пор, пока не будет достигнуто желательное ослабление симптомов. В случаях локального введения или селективного захвата, эффективная локальная концентрация лекарства может не быть связана с концентрациями в плазме.
Вводимое количество композиции, естественно будет зависеть от подлежащего лечению субъекта, от веса субъекта, тяжести поражения, способа введения и суждения лечащего врача.
Композиции при желании могут быть представлены в форме упаковок или дозирующих устройств, которые могут содержать одну или более из единичных дозовых форм, содержащих активный ингредиент. Упаковка может, например, представлять собой металлическую или пластиковую фольгу, например, может быть блистерной упаковкой. Такая упаковка или дозирующее устройство может сопровождаться инструкцией относительно введения. Можно также приготовить композиции, включающие соединение настоящего изобретения в фармацевтически совместимом носителе, поместить их в соответствующий контейнер и маркировать для лечения указанного состояния.
В некоторых лекарственных формах может оказаться выгодным использовать соединения настоящего изобретения в форме частиц очень маленького размера, например таких, которые получают, используя гидроэнергетическое измельчение.
Использование соединений настоящего изобретения при приготовлении фармацевтических композиций иллюстрируется следующим описанием. В этом описании термин “активное соединение” обозначает любое соединение настоящего изобретения, но более конкретно, любое соединение, которое является конечным продуктом одного из следующих примеров.
a) Капсулы
При приготовлении капсул, 10 весовых частей активного соединения и 240 весовых частей лактозы измельчают и перемешивают. Полученной смесью заполняют твердые желатиновые капсулы, причем каждая капсула содержит единичную дозу или часть единичной дозы активного соединения.
b) Таблетки
Таблетки получают, например, из следующих ингредиентов.
Весовые части
Активное соединение, лактозу и некоторое количество крахмала измельчают, перемешивают, и полученную смесь гранулируют, используя раствор поливинилпирролидона в этаноле. Сухие гранулы смешивают со стеаратом магния и остальной частью крахмала. Затем полученную смесь прессуют в таблетки, используя таблеточную машину, получая таблетки, каждая из которых содержит единичную дозу или часть единичной дозы активного соединения.
c) Таблетки с кишечнорастворимым покрытием
Таблетки можно получить раскрытым выше (b) способом. Затем на таблетки наносят кишечнорастворимое покрытие обычным образом, используя раствор 20% ацетатфталата целлюлозы и 3% диэтилфталата в смеси этанол:дихлорметан (1:1).
d) Суппозитории
Для получения суппозиториев, например, 100 весовых частей активного соединения включают в 1300 весовых частей триглицеридной основы для суппозиториев, и полученную смесь формируют в виде суппозиториев, каждый из которых содержит терапевтически эффективное количество активного ингредиента.
В композициях настоящего изобретения активное соединение, при желании, может быть объединено с другими совместимыми фармакологически активными ингредиентами. Например, соединения настоящего изобретения можно вводить в комбинации с другим терапевтическим агентом, который, как известно, лечит раскрытое здесь заболевание или состояние. Например, с одним или более из дополнительных фармацевтических агентов, которые ингибируют или предотвращают продуцирование фактора роста эндотелия сосудов (VEGF=ФРЭС) или ангиопоэтинов, ослабляют внутриклеточные реакции на ФРЭС или ангиопоэтины, блокируют внутриклеточную передачу сигналов, ингибируют сосудистую гиперпроницаемость, уменьшают воспаление, или ингибируют или предотвращают образование отека или неоваскуляризацию. Соединения настоящего изобретения можно вводить до, после или одновременно с дополнительным фармацевтическим агентом, в зависимости от того, какой режим введения подходит больше. Дополнительные фармацевтические агенты включают, но ими не ограничиваются, противоотечные стероиды, NSAIDS, ингибиторы ras, анти-TNF агенты, анти-IL1 агенты, антигистамины, PAF-антагонисты, ингибиторы COX-1, ингибиторы COX-2, ингибиторы NO синтазы, ингибиторы Akt/PTB, ингибиторы IGF-1R, ингибиторы PKC, ингибиторы киназы PT3, ингибиторы кальциневрина и иммунодепрессанты. Соединения настоящего изобретения и дополнительные фармацевтические агенты действуют или аддитивно или синергично. Так, введение такой комбинации веществ, которые ингибируют ангиогенез, сосудистую гиперпроницаемость и/или ингибируют образование отека, могут обеспечить более значительное облегчение вредных эффектов гиперпролиферативного заболевания, ангиогенеза, сосудистой гиперпроницаемости или отека, чем введение каждого из указанных веществ отдельно. При лечении злокачественных нарушений комбинации с противопролиферативными или цитотоксическими химиотерапиями или с радиационным облучением включены в объем настоящего изобретения.
Настоящее изобретение также включает использование соединения формулы (I) в качестве лекарственного средства.
В следующем аспекте настоящего изобретения предложено использование соединения формулы (I) или его соли при изготовлении лекарственного средства для лечения сосудистой гиперпроницаемости, ангиогенез-зависимых нарушений, пролиферативных заболеваний и/или нарушений иммунной системы у млекопитающих, особенно у человека.
В настоящем изобретении также предложен способ лечения сосудистой гиперпроницаемости, неадекватной неоваскуляризации, пролиферативных заболеваний и/или нарушений иммунной системы, который включает введение нуждающемуся в этом млекопитающему, в частности человеку, терапевтически эффективного количества соединения формулы (I).
СОКРАЩЕНИЯ
Анализы
In Vitro активность Jak1 киназы, измеренная с помощью гомогенной флуоресценции с временным разрешением (HTRF)
Очищенный Jak1 фермент (aa 845-1142; экспресированный в SF9 клетках как GST гибрид и очищенный с помощью глютатион аффинной хроматографии) смешивают с 2 мкМ пептидного субстрата (биотин-TYR2, Последовательность: биотин-(Ahx)-AEEEYFFLFA-амид) в различных концентрациях ингибитора в реакционном буфере: 50 мМ MOPSO pH 6,5, 10 мМ MgCl2, 2 мМ MnCl2, 2,5 мМ DTT, 0,01% BSA, 0,1 мМ Na3VO4 и 0,001 мМ ATP. Примерно после 60 мин инкубирования при комнатной температуре, реакционную смесь гасят, добавляя EDTA (конечная концентрация: 100 мМ) и развивают, добавляя revelation реагенты (конечные приблизительные концентрации: 30 мМ HEPES pH 7,0, 0,06% BSA, 0,006% Tween-20, 0,24 M KF, 80 нг/мл PT66K (меченое европием анти-фосфотирозиновое антитело, номер в каталоге №61T66KLB Cisbio, Bedford, MA.) и 3,12 мкг/мл SAXL (Phycolink стрептавидин-аллофикоцианин акцептор, кат. №PJ52S, Prozyme, San Leandro, CA.). Реакционную смесь инкубируют в темноте или при около 4°C в течение около 14 час, или около 60 мин при комнатной температуре, затем показания считывают, используя флуоресцентный детектор с временным разрешением (Rubystar, BMG) и лазер с длиной волны возбуждения 337 нм и длинами волн испускания 620 нм и 665 нм. В линейном интервале анализа отношение наблюдаемого сигнала на 620 нм и 665 нм непосредственно связано с фосфорилированным продуктом, и эти значения используют для расчета величин ИК50.
Осуществляют анализы других киназ, используя аналогичный протокол. Дополнительные очищенные ферменты Tyk2 (aa 880-1185 с N-концевым гистидиновым-tag и C-концевым FLAG tag; очищенные самостоятельно с помощью аффинной хроматографии с иммобилизованными ионами металла), RET (aa 711-1072 с N-концевым гистидиновым-tag; очищенные с помощью аффинной хроматографии с иммобилизованными ионами металла) и KDR (aa 792-1354 с N-концевым гистидиновым-tag; очищенные самостоятельно с помощью аффинной хроматографии с иммобилизованными ионами металла) экспрессируют в SF9 клетках и Aurora 1/B (aa1-344 с N-концевым гистидиновым-tag и очищенные с помощью аффинной хроматографии с иммобилизованными ионами металла) экспрессируют в E. coli. Другие использованные ферменты доступны из коммерческих источников. Ферменты смешивают с биотинилированными субстратами при различных концентрациях ингибитора в различных реакционных буферах (см. таблицу 1). После около 60 мин инкубирования при комнатной температуре, реакцию гасят, добавляя EDTA и развивают, добавляя проявляющие реагенты (конечные приблизительные концентрации: 30 мМ HEPES pH 7,0, 0,06% BSA, 0,006% Tween-20, 0,24 M KF, при меняющихся количествах донора, меченых европием антител, и акцептора, меченого стрептавидином аллофикоцианина (SAXL)). Реакционные смеси инкубируют в темноте при около 4°C в течение около 14 час или около 60 мин при комнатной температуре, затем считывают показания, используя флуоресцентный детектор с временным разрешением (Rubystar, BMG Labtech), как раскрыто выше.
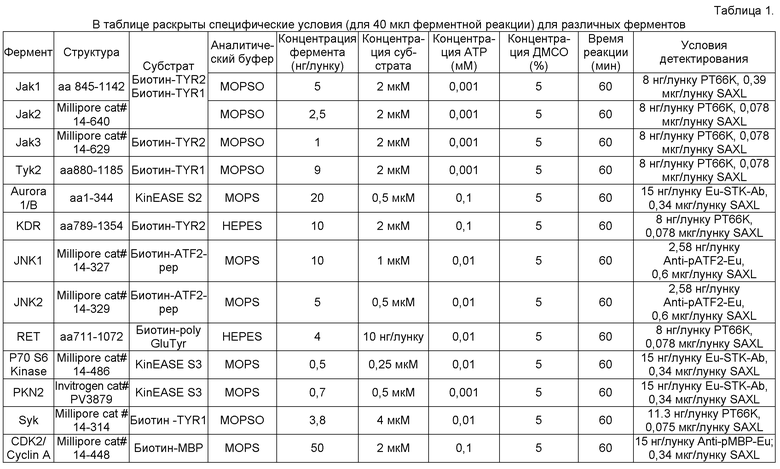
Реакционные буферы:
MOPSO буфер содержит: 50 мМ MOPSO pH 6,5, 10 мМ MgCl2, 2 мМ MnCl2, 2,5 мМ DTT, 0,01% BSA, и 0,1 мМ Na3VO4
HEPES буфер содержит: 50 мМ HEPES pH 7,1, 2,5 мМ DTT, 10 мМ MgCl2, 2 мМ MnCl2, 0,01% BSA, и 0,1 мМ Na3VO4
MOPS буфер содержит: 20 мМ MOPS pH 7,2, 10 мМ MgCl2, 5 мМ EGTA, 5 мМ Бета-фосфоглицерин, 1 мМ Na3VO4, 0,01% Triton-X-100 и 1 мМ DTT.
Субстраты:
Биотин-ATF2-пептидная последовательность: Биотин-(Ahx)-AGAGDQTPTPTRFLKRPR-амид
Биотин-TYR1-пептидная последовательность: Биотин-(Ahx)-GAEEEIYAAFFA-COOH
Биотин-TYR2-пептидная последовательность: Биотин-(Ahx)-AEEEYFFLFA-амид
Биотин-MBP-пептидная последовательность: Биотин-(Ahx)-VHFFKNIVTPRTPPPSQGKGAEGQR-амид
Пептид биотин-polyGluTyr получен от Cisbio (кат. №61GT0BLA, Bedford, MA.)
Пептиды KinEASE S2 и S3 получены от Cisbio (кат. №62ST0PEB, Bedford, MA.)
Реагенты детектирования:
Анти-pATF2-Eu, меченый по индивидуальному заказу Cisbio (Bedford, MA.)
Анти-pMBP-Eu, меченый по индивидуальному заказу Cisbio (Bedford, MA.)
PT66K получен от Cisbio (кат. №61T66KLB, Bedford, MA.)
SAXL получен от Prozyme (кат. №PJ25S, San Leandro, Calif.)
In Vitro активность Syk киназы, измеренная с помощью гомогенной флуоресценции с временным разрешением (HTRF)
1 нМ очищенного, полной длины Syk фермента (получен от Millipore, Billerica, MA., кат. №14-314) смешивают с 0,1 мкМ пептидного субстрата (биотин-TYR1, последовательность: Биотин-(Ahx)-GAEEEIYAAFFA-COOH) при различных концентрациях ингибитора в реакционном буфере: 50 мМ MOPSO pH 6,5, 10 мМ MgCl2, 2 мМ MnCl2, 2,5 мМ DTT, 0,01% BSA, 0,1 мМ Na3VO4 и 0,01 мМ ATP. После около 60 мин инкубирования при комнатной температуре, реакцию гасят, добавляя EDTA (конечная концентрация: 100 мМ) и возобновляют, добавляя проявляющие реагенты (конечные приблизительные концентрации: 30 мМ HEPES pH 7,0, 0,06% BSA, 0,006% Tween-20, 0,24 M KF, 90 нг/мл PT66K (меченое европием анти-фосфотирозиновое антитело кат. №61T66KLB Cisbio, Bedford, Mass.) и 0,6 мкг/мл SAXL (Phycolink стрептавидин-аллофикоцианиновый акцептор, cat №PJ52S, Prozyme, San Leandro, Calif.). Обработанную реакционную смесь инкубируют в темноте или при около 4°C в течение около 14 час, или около 60 мин при комнатной температуре, затем показания считывают, используя флуоресцентный детектор с временным разрешением (Rubystar, BMG), используя лазер с длиной волны возбуждения 337 нм и длинами волн испускания 620 нм и 665 нм. В линейном интервале анализа отношение наблюдаемого сигнала на 620 нм и 665 нм непосредственно связано с фосфорилированным продуктом, и эти значения используют для расчета величин ИК50.
Клеточный анализ T-бластов IL-2 pSTAT5 человека
Материалы:
Обработанные фитогемагглютинином Т-бласты получают из Leukopacks, полученных от Biological Specialty Corporation, Colmar, Pa. 18915, и криосохраненных в 5% ДМСО/среде до анализа. Для указанного анализа клетки оттаивают в аналитической среде следующего состава: RPMI 1640 среда (Gibco 11875093) с 2 мМ L-глутамина (Gibco 25030-081), 10 мМ HEPES (Gibco 15630-080), 100 мкг/мл Пен/Стреп (Gibco 15140-122), и 10% термоинактивированной FBS (Gibco 10438026). Другие материалы, использованные в анализе: ДМСО (Sigma D2650), 96-луночные планшеты для разбавлений (полипропилен) (Corning 3365), 96-луночные аналитические планшеты (белые, 1/2 площади, 96 лунок) (Corning 3642), D-PBS (Gibco 14040133), IL-2 (R&D 202-IL-10 (10 мкг)), набор Alphascreen pSTAT5 (Perkin Elmer TGRS5S10K) и набор Alphascreen protein A (Perkin Elmer 6760617M)
Методы:
T-бласты оттаивают и культивируют в течение около 24 час без IL-2 до анализа. Тестируемые соединения или контроли растворяют и отдельно разбавляют в 100% ДМСО. Исходные растворы в ДМСО последовательно разбавляют 1:50 в среде для клеточных культур до получения растворов 4×исходный раствор соединения (содержащих 2% ДМСО). Используя белые 96-луночные планшеты Corning, 1/2 площади планшета, клетки помещают в лунки в концентрации 2×105/10 мкл/лунку в 10 мкл среды с последующим добавлением 5 мкл 4×тестового соединения в двух экземплярах. Клетки инкубируют с соединением в течение около 0,5 час при температуре около 37°C. Затем добавляют 5 мкл IL-2 исходного раствора в конечной концентрации 20 нг/мл. IL-2 хранят как исходный 4 мкг/мл раствор, как рекомендовано изготовителем, при температуре около −20°C в аликвотах, и разбавляют 1:50 аналитической средой (до 80 нг/мл) непосредственно перед использованием. Содержимое лунок смешивают, осторожно постукивая по краям планшета (планшетов) несколько раз, затем инкубируют при около 37°C в течение около 15 мин. Анализ заканчивают, добавляя 5 мкл 5×AlphaScreen лизисного буфера и встряхивая на орбитальном шейкере в течение около 10 мин при комнатной температуре. Смесь шариков Alphascreen акцептора восстанавливают в соответствии с протоколом Perkin Elmer. Добавляют 30 мкл/лунку смеси шариков восстановленного Alphascreen акцептора, покрывают фольгой, затем встряхивают на орбитальном шейкере в течение около 2 мин с высокой скоростью, затем около 2 часов с низкой скоростью. Смесь донорных шариков восстанавливают в соответствии с Perkin Elmer's Alphascreen протоколом; добавляют 12 мкл/лунку, покрывают фольгой, затем встряхивают в течение около 2 мин с высокой скоростью, затем около 2 часов с низкой скоростью. Результаты для планшетов считывают, используя считывающее устройство EnVision в соответствии с инструкциями протокола Perkin Elmer's Alphascreen.
Клеточный анализ TF-1 IL-6 pSTAT3
Материалы:
TF-1 клетки (ATCC № CRL-2003). Культурная среда: DMEM среда (Gibco 11960-044) с 2 мМ L-глутамина (Gibco 25030-081), 10 мМ HEPES (Gibco 15630-080), 100 мкг/мл Пен/Стреп (Gibco 15140-122), 1,5 г/л бикарбоната натрия (Gibco 25080-094), 1 мМ пирувата натрия (Gibco 11360-070), 10% термоинактивированной FBS (Gibco 10437-028), и 2 нг/мл GM-CSF (R&D 215-GM-010). Другие материалы, использованные в указанном анализе: ДМСО (Sigma D2650), 96-луночные планшеты для разбавлений (полипропилен) (Corning 3365), 96-луночные аналитические планшеты (белые, 1/2 площади, 96 лунок) (Corning 3642), D-PBS (Gibco 14040133), IL-6 (R&D 206-IL/CF-050 (50 мкг)), набор Alphascreen pSTAT3 (Perkin Elmer TGRS3S10K) и набор Alphascreen protein A (Perkin Elmer 6760617M).
Методы:
Перед анализом клетки культивируют в течение около 18 час в питательной среде для культур без GM-CSF. Тестируемые соединения или контроли растворяют и отдельно разбавляют в 100% ДМСО. Исходные растворы в ДМСО последовательно разбавляют 1:50 в культурной среде до получения 4× исходный раствор соединения (содержащих 2% ДМСО). Используя белые планшеты Corning 96 лунок, 1/2 площади, клетки помещают в количестве 2×107/10 мкл/лунку в 10 мкл среды с последующим добавлением 5 мкл 4× исходный раствор тестируемого соединения в двух экземплярах. Клетки инкубируют с соединением в течение около 0,5 час при около 37°C с последующим добавлением 5 мкл 400 нг/мл IL-6. IL-6 хранят в 10 мкг/мл аликвотах, используя не содержащий эндотоксина D-PBS (0,1% BSA) при температуре около −20°C. Перед анализом IL-6 разбавляют до 400 нг/мл в культурной среде и помещают (5 мкл/лунку) во все лунки, за исключением лунок с негативным контролем, в которые добавляют 5 мкл/лунку среды. Содержимое лунок осторожно перемешивают, постукивая по краям планшетов несколько раз. Планшеты инкубируют при около 37°C в течение около 30 мин. Клетки лизируют, добавляя 5 мкл 5× лизисный буфер Alphascreen клеток во все лунки, встряхивают в течение около 10 мин при комнатной температуре, затем анализируют. Альтернативно, аналитические планшеты можно заморозить при около −80°C, и оттаивать позднее при комнатной температуре. Используя аналитический набор pSTAT3 SureFire Assay (Perkin Elmer №TGRS3S10K), смесь акцепторных шариков восстанавливают в соответствии с инструкциями в протоколе Perkin Elmer's Alphascreen. Добавляют 30 мкл в лунку, затем планшеты покрывают фольгой и встряхивают, используя орбитальный шейкер в течение около 2 мин на высокой скорости, затем около 2 час на низкой скорости при комнатной температуре. Смесь донорных шариков восстанавливают в соответствии с инструкциями протокола Perkin Elmer's Alphascreen. В каждую лунку добавляют 12 мкл, затем покрывают фольгой и встряхивают, используя орбитальный шейкер в течение около 2 мин на высокой скорости, затем около 2 час на низкой скорости при комнатной температуре. Результаты планшетов считывают, используя считывающее устройство EnVision в соответствии с инструкциями протокола Perkin Elmer's Alphascreen при комнатной температуре.
Клеточный анализ UT7/EPO pSTAT5
Материалы:
UT7/EPO клетки пассируют с эритропоэтином (EPO), расщепляют дважды в неделю, и свежую культурную среду оттаивают и добавляют во время расщепления. Культурная среда: DMEM среда (Gibco 11960-044) с 2 мМ L-глутамина (Gibco 25030-081), 10 мМ HEPES (Gibco 15630-080), 100 Ед/мл Пен/Стреп (Gibco 15140-122), 10% термоинактивированный FBS (Gibco 10437-028), EPO (5 мкл/мл=7,1 мкл 7 мкг/мл исходного раствора на мл среды). Аналитическая среда: DMEM, 2 мМ L-глутамина, 5% FBS, 10 мМ HEPES. Другие материалы, использованные в анализе: ДМСО (Sigma D2650), 96-луночные планшеты для разбавления (полипропилен) (Corning 3365), 96-луночные аналитические планшеты (белый, 1/2 площади, 96 лунок) (Corning 3642), D-PBS (Gibco 14040133), IL-2 (R&D 202-IL-10 (10 мкг)), набор Alphascreen pSTAT5 (Perkin Elmer TGRS5 S10K) и набор Alphascreen protein A (Perkin Elmer 6760617M)
Методы:
Клетки культивируют в течение около 16 час без EPO до проведения анализа. Тестируемые соединения или контроли растворяют и отдельно разбавляют в 100% ДМСО. Исходные растворы в ДМСО последовательно разбавляют 1:50 в клеточной культурной среде до получения 4× исходные растворы соединений (содержащие 2% ДМСО). Используя белые 96-луночные планшеты Corning, 1/2 площади, клетки помещают в количестве 2×105/10 мкл/лунку в 10 мкл среды с последующим добавлением 5 мкл 4× исходный раствор тестируемого соединения в двойном экземпляре. Клетки инкубируют с соединением в течение около 0,5 час при температуре около 37°C. После инкубирования добавляют 5 мкл EPO до достижения конечной концентрации 1 нм EPO. Содержимое лунок перемешивают, осторожно постукивая по краям планшета несколько раз, с последующим инкубированием при температуре около 37°C в течение около 20 мин. Добавляют 5 мкл 5× лизисный буфер AlphaScreen, затем встряхивают, используя орбитальный шейкер в течение около 10 мин при комнатной температуре. Добавляют 30 мкл/лунку акцепторных шариков после восстановления в соответствии с протоколом Perkin Elmer's Alphascreen, покрывают фольгой, и встряхивают, используя орбитальный шейкер в течение около 2 мин при высокой скорости, затем около 2 часов при низкой скорости. Донорные шарики восстанавливают в соответствии с инструкциями протокола Perkin Elmer AlphaScreen, с последующим добавлением 12 мкл/лунку, покрывают фольгой и встряхивают, используя орбитальный шейкер, в течение около 2 мин на высокой скорости и около 2 часов на низкой скорости. Показания планшетов считывают, используя считывающее устройство EnVision в соответствии с инструкциями протокола Perkin Elmer's Alphascreen.
Вызванная антигеном дегрануляция RBL-2H3 клеток:
RBL-2H3 клетки поддерживают в T75 колбах при температуре около 37°C и 5% CO2, и пассируют каждые 3-4 дня. Для сбора клеток используют 20 мл PBS, промывая колбу один раз, затем добавляют 3 мл трипсин-EDTA и инкубируют при температуре около 37°C в течение около 2 мин. Клетки переносят в ампулу с 20 мл среды, вращают при скорости 1000 об/мин при комнатной температуре в течение около 5 мин, и снова суспендируют при концентрации 1×106 клеток/мл. Клетки сенсибилизируют, добавляя DNP-специфический мышиный IgE до конечной концентрации 0,1 мкг/мл. Добавляют 50 мкл клеток в каждую лунку 96-луночного планшета с плоским дном (50×103 клеток/лунку), и инкубируют в течение ночи при температуре около 37°C в 5% CO2. На следующий день соединения приготавливают в 100% ДМСО при концентрации 10 мМ. Каждое соединение затем отдельно разбавляют 1:4 шесть раз в 100% ДМСО. Каждое из разбавлений соединений разбавляют затем 1:20 и затем 1:25, причем оба разбавления делают в Tyrode's буфере. Среду отсасывают из планшетов с клетками, и клетки дважды промывают 100 мкл буфера Tyrode (предварительно нагретого до около 37°C). В каждую лунку добавляют 50 мкл соединений, разбавленных в буфере Tyrode, и планшеты инкубируют в течение около 15 мин при температуре около 37°C в 5% СО2. Затем в каждую лунку добавляют 50 мкл 0,2 мкг/мл DNP-HSA в буфере Tyrode, и планшеты инкубируют в течение около 30 мин при температуре около 37°C в 5% CO2. Конечная концентрация различных компонент в инкубационной смеси составляет 0,002-10 мкМ соединения, 0,1% ДМСО и 0,1 мкг/мл DNP-HSA. В качестве одного контроля 0,2% ДМСО (без соединения) в буфере Tyrode добавляют к набору лунок для определения максимально стимулируемого выделения. В качестве второго контроля буфер Tyrode без DNP-HSA добавляют к набору лунок, содержащих 0,2% ДМСО без соединения для определения нестимулируемого выделения. Каждое условие (соединения и контроли) повторено в лунках трижды. В конце 30 минутного инкубирования 50 мкл надосадочной жидкости переносят в новый 96-луночный планшет. Оставшуюся надосадочную жидкость в планшетах с клетками отсасывают, и заменяют 50 мкл 0,1% Triton X-100 в буфере Tyrode для осуществления лизиса клеток. Затем добавляют 50 мкл свежеприготовленного 1,8 мМ 4-нитрофенил N-ацетил-β-D-глюкозамида (pNAG) в каждую лунку с надосадочной жидкостью и клеточным лизатом, и планшеты инкубируют в течение около 60 мин при температуре около 37°C в 5% CO2. В каждую лунку добавляют 100 мкл 7,5 мг/мл бикарбоната натрия для остановки реакции. Показания с планшетов считывают на длине волны 405 нм, используя считывающее устройство для планшетов Molecular Devices SpectraMax 250.
Обработка результатов
1) Фоновые значения ОП405, полученные для лунок, содержащих буфер Tyrode и pNAG (без надосадочной жидкости или лизата) вычитают из значений ОП405, считываемых для каждой из лунок, содержащих надосадочную жидкость или лизат.
2) Выделение для каждой из лунок выражают как процент от общего выделения для лунки, где полное выделение дважды превышает выделение в случае надосадочной жидкости плюс выделение в случае клеточного лизата. Такой расчет вносит поправку на неодинаковое количество клеток в каждой лунке.
3) Максимальная реакция представляет собой среднюю реакцию для лунок, содержащих DNP-HSA, но не содержащих соединения.
4) Минимальная реакция представляет собой среднюю реакцию для лунок, не содержащих ни DNP-HAS, ни соединения.
5) Реакцию в каждой из лунок, содержащих соединение, рассчитывают как процент от максимальной реакции (выраженной как % контроля), где максимальная реакция составляет 100%, и минимальная реакция составляет 0%.
6) Кривую зависимости доза-реакция строят для каждого из соединений, и ИК50 для кривой рассчитывают, используя программное обеспечение Prism GraphPad и нелинейный регрессионный анализ наименьших квадратов.
Реальные in vivo измерения ингибирования JAK соединениями осуществляют, используя:
Продуцирование цитокинов у крыс индуцированное конкавалином A (Con A) у крыс Льюиса
Тестируемое соединение приготавливают в инертном носителе (например, но им не ограничиваясь, 0,5% гидроксипропилметилцеллюлозы (Sigma, кат. №H3785)/0,02% Tween 80 (Sigma, кат. №470) в воде) в концентрации, необходимой для достижения дозы в интервале от 0,01 до 100 мг/кг. Шестинедельным самцам крыс Льюиса (125 г-150 г) (Charles River Laboratories) вводят перорально дозы, в момент времени (0 мин). Через примерно 30 мин крысам внутривенно вводят инъекцией (i.v.) 10 мг/кг конканавалин A (Con A, Amersham Bioscience, кат. №17-0450-01), растворенный в PBS (Invitrogen, кат. №14190). Примерно через 4 часа у крыс отбирают кровь из сердца, и полученную плазму анализируют в отношении уровней содержания IL-2 (ELISA набор: R&D Systems кат. №R2000) и IFN-γ (ELISA набор: R&D Systems кат. №RIF00).
Реальные in vivo измерения ингибирования соединениями передачи сигнала Fcγ рецепторами осуществляют, используя:
Обратная пассивная модель Артуса
В день 0 приготавливают OVA в концентрации 17,5 мг/мл в PBS, осторожно переворачивая до тех пор, пока не образуется раствор. Затем добавляют 2% (Evans Blue) раствор Эванса голубой (Sigma Aldrich, кат. № E2129) так, чтобы удвоить объем до конечной концентрации 8,75 мг/мл OVA и 1% красителя Эванса голубого. Анти-OVA антитело (Abazyme), исходная концентрация 10 мг/мл, оттаивают, и приготавливают раствор 400 мкг/100 мкл, используя PBS. Соединения приготавливают, добавляя носитель, 0,5% HPMC с 0,02% Tween 80, и интенсивно вращая в течение около 15 секунд с последующей гомогенизацией в течение минимум около 2 минут при скорости 28000 об/мин, до тех пор, пока не образуется тонкая суспензия частиц без комков соединения. Крыс взвешивают, и вводят t-max дозу соединения, заранее определенную на основании фармакокинетических исследований. Затем животным дают общий наркоз, используя смесь 5% изофлоурана и кислорода, и бреют. Используя инсулиновый шприц на 1/2 мл осуществляют интрадермальные инъекции в два сайта; в один сайт вводят 100 мкл 400 мкг/100 мкл анти-OVA антител, и в другой сайт вводят 100 мкл стерильного PBS. Затем каждый сайт очерчивают несмываемым маркером для последующих наблюдений. Сразу после внутридермальных инъекций животным вводят инъекцией 200 мкл OVA (10 мг/кг)/смесь Эванс голубого внутривенно i.v., используя инсулиновый шприц ½ мл. Примерно через 4 часа после инъекций животных эвтаназируют, кровь отбирают, используя иглу для сердечной пункции, и кровь помещают в ампулу, выделяющую плазму. Образцы крови хранят на льду до центрифугирования (в течение около 2 часов после сбора). Каждый сайт инъекций удаляют, используя одноразовый дерматом (Acuderm Acu-Punch Disposable 12 мм), разрезают на 4 кусочка и помещают в 2 мл, заранее меченые пробирки Эппендорфа. Один мл ДМФА добавляют в каждую склянку с биопсией и помещают в термоблок примерно на 24 час при около 50°C. После около 24 час инкубирования добавляют 100 мкл каждого образца в 96-луночный плоскодонный планшет. Показания планшетов считывают на 620 нм, используя считывающее с планшетов устройство, используя программное обеспечение Softmax. Фоновые значения исключают, вычитая ОП для сайтов, в которые была осуществлена инъекция PBS, из значений ОП для сайтов, в которые была осуществлена инъекция анти-OVA, для каждого индивидуального животного.
Образцы плазмы осаждают в микроцентрифуге в течение около 5 мин при 16,1 rcf. 200 мкл плазмы помещают в 1,7 мл пробирку Эппендорфа для измерения уровня содержания лекарства, и хранят при −80°C до измерений.
Измеряют хронические in vivo эффекты соединений в модели анкилозирующего артрита, используя:
Вызванный адъювантом артрит (AIA) у крыс Льюиса
Самок крыс Льюиса (в возрасте 6 недель, весом 125 г-150 г из Charles River Laboratories) иммунизируют интрадермально (i.d.) в подушечку правой задней лапы 100 мкл суспензии минерального масла (Sigma, кат. №M5905), содержащего 200 мкг M. tuberculosis, H37RA (Difco, кат. №231141). Воспаление появляется на противоположной (левой) задней лапе через 7 дней после иммунизации. Через семь дней после иммунизации соединение приготавливают в инертном носителе (например, но им не ограничиваясь, 0,5% гидроксипропилметилцеллюлоза (Sigma, кат. №H3785)/0,02% Tween 80 (Sigma, кат. №4780) в воде) и дозы вводят перорально один или два раза в день в течение, по меньшей мере, 10 дней. Базовый объем лапы измеряют в день (0), используя плетизмограф, основанный на вытеснении воды (Vgo Basile North America Inc. PA 19473, Model №7140). Крыс слегка анестезируют ингаляционным анестезирующим средством (изофлуран) и контра-латеральную (левую) заднюю лапу погружают в плетизмограф, и регистрируют объем лапы. Крыс оценивают через день, вплоть до 17 дня после иммунизации, причем всех крыс обескровливают, используя иглу для пункции сердца под анестезией изофлураном, и левую заднюю лапу вырезают для оценки воздействия на костную эрозию с помощью микро-КT сканов (SCANCO Medical, Southeastern, PA, Model №μCT 40) при размере объемного изображения 18 мкм, с пороговой величиной 400, sigma-gauss 0,8, support-gauss 1,0. Объем костей и плотность определяют для 360 мкм (200 срезов) вертикальных сечений, включающих предплюсновую часть лапы. Полученные 360 мкм срезы анализируют от основания плюсны до верхней части большой берцовой кости, причем нижняя точка фиксирована в точке соединения большеберцового и таранного суставов. Воздействие лекарства определяют в плазме, используя ЖХ/МС.
или:
Вызванный коллагеном артрит (CIA) у крыс Льюиса
В день-1 коллаген типа II (CII), растворимый, из бычьей носовой перегородки (Elastin Products, кат. № CN276) взвешивают для дозы 600 мкг/крысу, добавляют 0,01M уксусную кислоту (150 мкл HOAc USP степень чистоты. J. T. Baker, order № 9522-03, и 250 мл Milli Q Water) для достижения концентрации в 4 мг/мл. Ампулу покрывают алюминиевой фольгой и помещают на качалку при температуре около 4°C на ночь. В день 0 коллагеновый исходный раствор разбавляют 1:1, используя неполный адьювант Фрейнда (IFA) (Difco labs, кат. №263910), используя стеклянный шприц Hamilton с наконечником Люера (SGE Syringe Perfection VWR кат. №007230), до конечной концентрации 2 мг/мл. Самок крыс Льюиса (Charles River Laboratories), акклиматизировавшихся в течение 7 дней к моменту иммунизации, весом примерно 150 г анестезируют в анестезиционной камере, используя изофлуран (5%) и кислород. После того, как крысы полностью анестезированы, их переносят в защитный конус для сохранения анестезии во время инъекции. Крыс бреют у основания хвоста, 300 мкл коллагена вводят инъекцией интрадермально (i.d.) в крестец крысы, n=9 в группе, 100 мкл в три сайта 500 мкл шприцом с наконечником Люера и иглой калибра 27. IFA для контрольных крыс вводят таким же образом (n=6). IFA представляет собой 1:1 эмульсию с 0,01M уксусной кислотой. Бустерную инъекцию проводят на 6 день исследования. В этот день крыс не бреют, и инъекцию осуществляют также как при иммунизации. Воспаление появляется на обеих задних лапах через 10 дней после начальной иммунизации. Через 10 дней после иммунизации соединение приготавливают в инертном носителе (например, но им не ограничиваясь, 0,5% гидроксипропилметилцеллюлоза (Sigma, кат. № H3785)/0,02% Tween 80 (Sigma, кат. №4780) в воде) и дозируют перорально один или два раза в день в течение, по меньшей мере, 9 дней. Базовый объем лапы определяют в день 7, используя pleythsmograph, использующий вытеснение воды (Vgo Basile North America Inc. PA 19473, Model №7140). Крыс слегка анестезируют ингаляционным анестетиком (изофлураном) и обе задние лапы погружают в плетизмограф, и регистрируют объем лап. Крыс оценивают 2-3 раза в неделю вплоть до 18 дня после иммунизации. На 18 день после иммунизации всех крыс обескровливают, используя иглу для пункции сердца под анестезией изофлураном, и задние лапы вырезают для оценки воздействия на костную эрозию с помощью микро-КT сканов (SCANCO Medical, Southeastern, PA, Model № μCT 40) при размере объемного изображения 18 мкм, с пороговой величиной 400, sigma-gauss 0,8, support-gauss 1,0. Объем костей и плотность определяют для 360 мкм (200 срезов) вертикальных сечений включающих предплюсновую часть лапы. Полученные 360 мкм срезы анализируют от основания плюсны до верхней части большой берцовой кости, причем нижняя точка фиксирована у соединения большеберцового и таранного суставов. Воздействие лекарства определяют из плазмы, используя ЖХ/МС.
Содержание всех ссылок, включая журнальные статьи, патенты и публикации патентных заявок, включены в настоящий документ ссылкой во всей своей полноте. Следующие примеры приведены для целей иллюстрации, и их не следует рассматривать как ограничивающие объем настоящего изобретения.
ОБЩИЕ СХЕМЫ СИНТЕЗА
Соединения настоящего изобретения можно получить, используя синтетические превращения, представленные на схемах I-XII. Исходные материалы коммерчески доступны, их можно получить раскрытыми здесь способами, раскрытыми в литературе способами или способами, которые хорошо известны специалистам в области органической химии. Способы получения пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина, соединения настоящего изобретения, проиллюстрированы на схеме I. На схеме I на стадии a, коммерчески доступный 2-бром-5H-пирроло[2,3-b]пиразин (также именуемый как 5-бром-4,7-диазаиндол, от Ark Pharm, Inc) защищают как сульфонамид, используя условия, такие как раскрыты в примере получения № 1, или способами, известными специалистам в данной области (например, Larock, R. C. “Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd edition”, 1999, Wiley-VCH or Greene, T. W. and Wuts, P. G. M. “Protective Groups in Organic Synthesis, 3rd Edition”, 1999, Wiley-Interscience). Альтернативно, защищенный пирроло[2,3-b]пиразин 2 можно получить из коммерчески доступного 3,5-дибромпиразин-2-амина, используя реакцию перекрестного сочетания Соногашира (Sonogashira) (Схема 1, стадия g), получая алкин 9, который можно циклизовать (Схема 1, стадия h), получая пирролопиразины 2, используя способы, известные специалистам в данной области (например, пример получения № 7, способ B). На схеме I, на стадии b вводят замещенный гидразин, осуществляя взаимодействие с пирролопиразинами 2 в условиях аминирования Бухвальда-Хартвига (Buchwald-Hartwig) (например, пример получения № 2 или в Advanced Synthesis & Catalysis 2004, 346, 1599-1626), получая пирролопиразины 3. Если R″ принимает такие значения, что пирролопиразины 3 содержат гидразид (R″=-C(O)R′″) или гидразон, материал можно непосредственно циклизовать до пирролотриазолопиразинов 6, используя условия, такие как раскрыты в Общей процедуре C, в начальной стадии примера № 1, в общей процедуре G или способами, известными специалистам в данной области (например, Bioorganic & Medicinal Chemistry Letters 2007, 17(12), 3373-3377 or Journal of Medicinal Chemistry 1990, 33(9), 2326-34). В некоторых случаях, пирролотриазолопиразины 6 можно подвергнуть взаимодействию in situ, получая пирролотриазолопиразины 7 (например, пример № 1 или общие процедуры B и E). Могут также происходить дополнительные реакции без выделения исходных пирролотриазолопиразинов 6 или 7, как представлено в общих процедурах D и F. Если R″ представляет собой защитную группу, удаление защитных групп у соединений 3 до получения гидразинилпирролопиразинов 4 можно осуществить, используя условия, такие как раскрыты в общей процедуре I, в общей процедуре J, или у Greene, T. W. and Wuts, P. G. M. “Protective Groups in Organic Synthesis, 3rd Edition”, 1999, Wiley-Interscience. Например, защитную группу, такую как трет-бутоксикарбонильная группа, можно удалить с помощью кислоты, используя условия, такие как раскрыты в примере получения № 3, в общей процедуре I, или способами, известными специалистам в данной области (например, в книгах от Larock, R. C. or Greene, T. W. and Wuts, P. G. M. См. ссылку выше). Альтернативно, реакция пирролопиразинов 2 с гидразином в условиях аминирования Бухвальда-Хартвига, как раскрыто выше, может привести непосредственно к гидразинилпирролопиразинам 4. Получение гидразидов 5 из гидразинилпирролопиразинов 4 (Схема I, стадия d) можно осуществить различными способами, известными специалистам в данной области, включая in situ условия, такие как раскрыты в примере № 1, в общей процедуре A, или стандартными способами пептидного связывания, такими как раскрыты у Larock, R. C. (см. ссылку выше). Гидразиды 5 можно циклизовать до пирролотриазолопиразинов 6, используя условия, такие как раскрыты в примере № 1, в общей процедуре C, или способами, известными специалистам в данной области (например, Bioorganic & Medicinal Chemistry Letters 2007, 17(12), 3373-3377 или Journal of Medicinal Chemistry 1990, 33(9), 2326-34). Дальнейшую функционализацию пирролотриазолопиразинов 6 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины или гетероариламины можно получить из пирролотриазолопиразинов 6, содержащих первичный или вторичный амин (например, примеры № 3 и № 4 или общие процедуры L, M, N или O). Кроме того удаление защитных групп у пирролотриазолопиразинов 6 можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J. Например, защитную группу, такую как бензилоксикарбонильная группа, можно удалить у защищенного амина, получая незащищенный амин (например, пример № 2), и соединения 6 с удаленными защитными группами можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше. Удаление сульфонамидных защитных групп у пирролотриазолопиразинов 6 можно осуществить, используя условия, такие как раскрыты в примере № 1, в общей процедуре H, или способами, известными специалистам в данной области (например, книги от Larock, R. C. или Greene, T. W. and Wuts, P. G. M. (см. ссылку выше)), получая пирролотриазолопиразины 7 (Схема I, стадия f). Дальнейшую функционализацию R′″ группы в пирролотриазолопиразинах 7 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины, или гетероариламины можно получить из пирролотриазолопиразинов 7, в которых R′″ содержит первичный или вторичный амин (например, примеры № 3 и № 4 или общие процедуры L, M, N или O). Кроме того, удаление R′″ группы в пирролотриазолопиразинах 7 до получения незащищенных соединений можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в Общих процедурах I или J. Например, защитную группу, такую как бензилоксикарбонильная группа, можно удалить из защищенного амина, получая незащищенный амин (например, пример № 2 или общая процедура J), и соединение 7 с удаленной защитной группой можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше.
Схема I
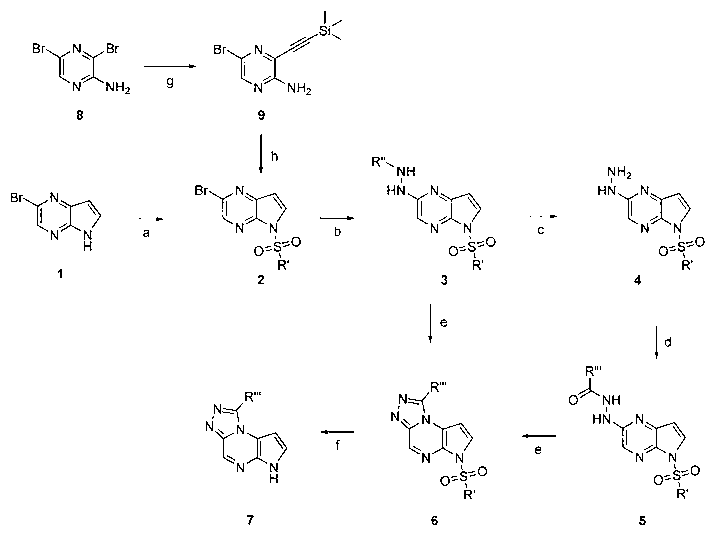
Образование гидразонов 10 из гидразинилпирролопиразинов 4 (Схема II, стадия a) можно осуществить различными способами, известными специалистам в данной области, включая in situ условия, такие как раскрыты в общей процедуре G. Гидразоны 10 можно циклизовать до пирролотриазолопиразинов 6, используя условия, такие как раскрыты в общей процедуре G, или способами, известными специалистам в данной области. Дальнейшую функционализацию пирролотриазолопиразинов 6 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Дальнейшая функционализация пирролотриазолопиразинов 6, включая гидролиз сульфонамидов до получения пирролотриазолопиразинов 7 (Схема I, стадия f) раскрыты выше.
Схема II
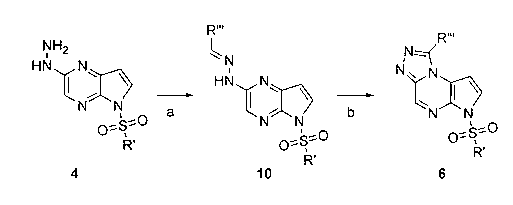
Способы получения имидазо[1,2-a]пирроло[2,3-e]пиразинов, соединений настоящего изобретения, проиллюстрированы на схеме III. На стадии a, вводят карбамат, осуществляя взаимодействие пирролопиразинов 2 с трет-бутилкарбаматом в условиях аминирования Бухвальда-Хартвига (например, пример № 8, стадия A; пример получения № 2, или Advanced Synthesys & Catalysis 2004, 346, 1599-1626), получая пирролопиразин-2-илкарбаматы 11. Удаление защитных групп у соединений 11 до получения 2-аминопирролопиразинсульфонамидов 12 можно осуществить, используя условия, такие как раскрыты в примере № 8, стадия B; в общей процедуре I, или у Greene, T. W. and Wuts, P. G. M. “Protective Groups in Organic Synthesis, 3rd Edition”, 1999, Wiley-Interscience. Образования имидазопирролопиразинов 13, замещенных в 7-положении, можно достичь, осуществляя взаимодействие 2-аминопирролопиразинсульфонамидов 12 с соответствующим образом замещенными 2-галогенометилкетонами способами, известными специалистам в данной области (например, Journal of Medicinal Chemistry, 1987, 30(11), 2031-2046 или пример № 8, стадия C). Дальнейшую функционализацию имидазопирролопиразинов 13 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины или гетероариламины можно получить из имидазопирролопиразинов 13, содержащих первичный или вторичный амин (например, примеры № 3 и № 4 или общие процедуры L, M, N или O). Кроме того, удаление защитных групп у имидазопирролопиразинов 13 можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J, и соединения 13 с удаленными защитными группами можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше. Удаление сульфонамидных защитных групп у имидазопирролопиразинов 13 можно осуществить, используя условия, такие как раскрыты в примере № 8, стадия D; в общей процедуре H, или способами, известными специалистам в данной области (например, книги от Larock, R. C. или у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше)), получая имидазопирролопиразины 14. Альтернативно, алкилирование пирролопиразин-2-илкарбаматов 11 соответствующим образом замещенными 2-галогенометилкетонами способами, известными специалистам в данной области (например, пример № 9, стадия A; Tetrahedron Letters, 2006, 47(34), 6113-6115; или Journal of Medicinal Chemistry, 2005, 48(14), 4535-4546), приводит к получению пирролопиразинов 15. Циклизацию пирролопиразинов 15 до имидазопирролопиразинов 16 можно осуществить способами, известными специалистам в данной области (например, пример № 9, стадия B; European Journal of Medicinal Chemistry, 2001, 36(3), 255-264; или Bioorganic @ Medicinal Chemistry Letters, 2007, 17(5), 1233-1237). Дальнейшую функционализацию R′″ групп в имидазопирролопиразинах 16 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины или гетероариламины можно получить из имидазопирролопиразинов 16 с R′″ группами, содержащими первичные или вторичные амины (например, примеры № 3 и № 4 или Общие процедуры L, M, N или O). Также, удаление R′″ групп в имидазопирролопиразинах 16 до получения незащищенных соединений 17 можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J, и незащищенные соединения 17 можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше. Удаление сульфонамидных защитных групп у имидазопирролопиразинов 16 можно осуществить, используя условия, такие как раскрыты в примере № 9, стадия C; в общей процедуре H, или способами, известными специалистам в данной области (например, в книгах от Larock, R. C. или у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше)), получая имидазопирролопиразины 17.
Схема III
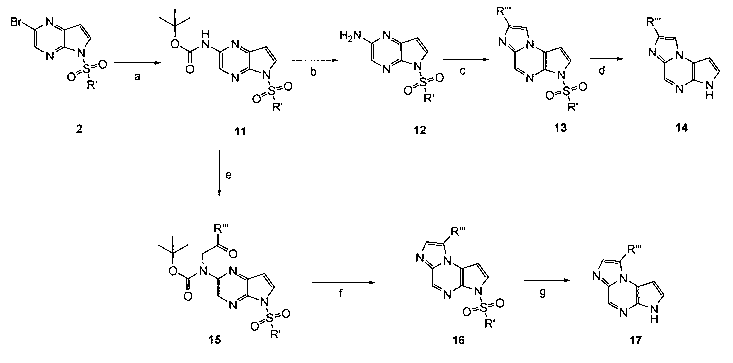
Способы получения имидазо[1,5-a]пирроло[2,3-e]пиразинов, соединений настоящего изобретения, проиллюстрированы на схеме IV. На стадии a, вводят винильную группу, осуществляя взаимодействие пирролопиразинов 2 с бороновой кислотой в условиях перекрестного сочетания Сузуки (например, пример № 10, стадия A). Окислительное расщепление алкенов 18, приводит к получению альдегидов 19 (например, пример № 10, стадия B). Превращение в соответствующие первичные амины можно осуществить, используя вначале конденсацию с гидроксиламинами с последующим восстановлением цинком, получая амины 21 (например, пример № 10, стадия C). Альтернативно, амины 21 можно получить, восстанавливая альдегиды 19 до соответствующих спиртов (например, пример № 13, стадия D), превращая спирт в хлорид, и замещая азидом до получения азидов 20 (например, пример № 13, стадия E). Восстановление азидов приводит к получению аминов 21 (например, пример № 13, стадия F). Альтернативно, амины 21 можно получить в результате превращения бромидов 2 в соответствующие нитрилы 25 (например, пример получения № 28), с последующим восстановлением до аминов 21 (например, пример получения № 28). Реакция сочетания аминов 21 с кислотами приводит к получению амидов 22 (например, пример № 10, стадия C). Циклизацию амидов 22 можно осуществить путем превращения в тиоамиды с последующей обработкой активирующим агентом (таким как соль ртути, соль серебра или соль меди), получая имидазо[1,5-a]пирроло[2,3-e]пиразины 23 (например, пример № 10, стадия D). Удаление защитных групп у соединений 23 до получения имидазо[1,5-a]пирроло[2,3-e]пиразинов 24 можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. “Protective Groups in Organic Synthesis, 3rd Edition”, 1999, Wiley-Interscience, в общей процедуре H, или в примере № 10, на стадии E. Дальнейшую функционализацию R′″ групп в имидазо[1,5-a]пирроло[2,3-e]пиразинах 23 или имидазо[1,5-a]пирроло[2,3-e]пиразинах 24 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины или гетероариламины можно получить из соединений 23 или 24 с R′″ группами, содержащими первичные или вторичные амины (например, общие процедуры L, M, N или O). Кроме того, удаление R′″ групп в соединениях 23 или 24 до получения незащищенных соединений можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J, и незащищенные соединения можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше.
Схема IV

Способы получения 3H-дипирроло[1,2-a:2′,3′-e]пиразинов, соединений настоящего изобретения, проиллюстрированы на схеме V. На стадии a, альдегид 19 подвергают взаимодействию в условиях Хорнера-Эммонса (Horner-Emmons), получая α,β-ненасыщенные кетоны 26 (например, пример № 11, стадия A). Восстановление двойной связи приводит к получению насыщенных кетонов 27 (например, пример № 11, стадия B). Циклизацию до трициклических соединений 28 можно осуществить, обрабатывая соединения 27 активирующим агентом способами, известными специалистам в данной области (например, пример № 11, стадия C). Удаление защитных групп у соединений 28 до получения 3H-дипирроло[1,2-a:2′,3′-e]пиразинов 29 можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. “Protective Groups in Organic Synthesis, 3rd Edition”, 1999, Wiley-Interscience; в общей процедуре H, или в примере № 11, на стадии D. Дальнейшую функционализацию R′″ групп в 3H-дипирроло[1,2-a:2′,3′-e]пиразинах 28 или 29 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины, или гетероариламины можно получить из соединений 28 или 29 с R′″ группами, содержащими первичные или вторичные амины (например, общие процедуры L, M, N или O). Кроме того, удаление R′″ групп в соединениях 28 или 29 до получения незащищенных соединений можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J, и незащищенные соединения можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше.
Схема V
Способы получения замещенных циклопентилкарбоновых кислот 38 для использования при получении соединений настоящего изобретения проиллюстрированы на схеме VI. На стадии a, сложные β-кетоэфиры 31 можно конденсировать с метил 4-хлорацетоацетатами 30, получая циклические соли β-кетоэфиренолят 32 (например, Общая процедура BB). Удаление защитных групп у соединений 32 до получения α,β-ненасыщенных кетонов 33 осуществляют стандартными способами, известными специалистам в данной области (например, общая процедура CC). Как показано на стадии c, гидрирование α,β-ненасыщенных кетонов 33 приводит к получению насыщенных кетонов 34 (например, общая процедура DD). Восстановительное аминирование кетонов 34 дибензиламинами приводит к получению соединений 35, с использованием условий, таких как раскрыты в общей процедуре EE. Дебензилирование соединений 35 можно осуществить путем гидрирования, как раскрыто в общей процедуре FF, до получения аминов 36. Альтернативные условия можно использовать для получения аминов 36 из кетонов 34, например, как раскрыто у Larock, R. C. “Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd edition”, 1999, Wiley-VCH. Амины 36 можно подвергнуть дальнейшей функционализации, используя реакции известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины, или гетероариламины можно получить из аминов 36 (например, общие процедуры L, M, N или O), получая соединения 37. Сложные эфиры соединений 37 можно гидролизовать в водных щелочных или кислотных условиях, получая нужные карбоновые кислоты 38 (например, общая процедура GG или у Larock, R. C. (см. ссылку выше)). При желании, можно осуществить хиральное разделение соединений 33, 34, 35, 36, 37 или 38, используя способы, известные специалистам в данной области, такие как хиральная препаративная ВЭЖХ (например, общая процедура II).
Схема VI

Способы получения 4-замещенной пиперидин-3-карбоновой кислоты, соединения настоящего изобретения, проиллюстрированы на схеме VII. На стадии a, 4-замещенные или незамещенные никотиновые кислоты 39 можно полностью насытить, используя способы которые известны специалистам в данной области (например, пример № 13, стадия G). Полученную пиперидинкарбоновую кислоту 40 можно защитить подходящей аминозащитной группой, такой как раскрыто у Greene, T. W. and Wuts, P. G. M. “Protective Groups in Organic Synthesis, 3rd Edition”, 1999, Wiley-Interscience; Larock, R. C. “Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd edition”, 1999, Wiley-VCH; или в примере № 13, на стадии G, получая пиперидинкарбоновые кислоты 41.
Схема VII

Способы получения дигидропиразоло[4,3-d]пирроло[2,3-b]пиридина, соединения настоящего изобретения, проиллюстрированы на схеме VIII. На стадии a, реакция альдегида 42 с реагентом Гриньяра приводит к получению спиртов 43 при использовании способов, известных специалистам в данной области (например, пример № 23, стадия A). Получение кетонов 44 (стадия b) можно осуществить, обрабатывая спирты 43 окисляющим агентом способами, известными специалистам в данной области (например, пример № 23, стадия B). Альтернативно, кетоны 44 можно получить, осуществляя взаимодействие гетероарилиодида 45 с альдегидом (стадия С) до получения спиртов 43 (например, пример № 24, стадия A) с последующим окислением, как раскрыто ранее. Получение кетонов 44 можно осуществить непосредственно, осуществляя взаимодействие гетероарилиодида 45 с соответствующим образом замещенным хлорангидридом способами, известными специалистам в данной области (такими, как раскрыты в Heterocycles, 2003, 59(1), 369-385). Кетоны 44 можно затем превратить в гидразоны 46, используя реакцию с гидразином, используя условия, такие как раскрыты в примере № 24, для стадии C. Циклизацию гидразонов 46 для получения дигидропиразоло[4,3-d]пирроло[2,3-b]пиридинов 47 можно осуществить с помощью внутримолекулярной циклизации Бухвальда-Хартвига (например, пример № 24, стадия B, или в Organic Letters, 2008, 10(18), 4109-4112). Дальнейшую функционализацию R′″ группы в дигидропиразоло[4,3-d]пирроло[2,3-b]пиридинах 47 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины или гетероариламины можно получить из соединений 47 с R′″ группой, содержащей первичные или вторичные амины (например, в общих процедурах L, M, N или O). Кроме того, удаление защитных групп у R′″ группы в соединениях 47 до получения незащищенного соединения можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J, и полученные незащищенные соединения можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше.
Схема VIII
Способы получения изоксазоло[4,5-d]пирроло[2,3-b]пиридина, соединения настоящего изобретения, представлены на схеме IX. Кетоны 44 можно подвергнуть взаимодействию с гидроксиламингидрохлоридом (стадия a) до получения оксимов 48 способами, известными специалистам в данной области (например, в примере № 28, на стадии A). Циклизацию оксимов 48 до получения необходимых изоксазоло[4,5-d]пирроло[2,3-b]пиридинов 49 (стадия b) осуществляют, используя способы, известные специалистам в данной области (например, пример № 28, стадия B или в Tetrahedron, 2007, 63(12), 2695-2711). Дальнейшую функционализацию R′″ группы в изоксазоло[4,5-d]пирроло[2,3-b]пиридинах 49 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины, или гетероариламины можно получить из соединений 49 с R′″ группой, содержащей первичные или вторичные амины (например, общие процедуры L, M, N или O). Кроме того, удаление защитных групп R′″ в соединениях 49 до получения незащищенных соединений можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J, и соединения с удаленными защитными группами можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше.
Схема IX
Способы получения 1,6-дигидропиразоло[3,4-d]пирроло[2,3-b]пиридина, соединения настоящего изобретения, представлены на схеме X. Коммерчески доступный 4-хлор-1H-пирроло-[2,3-b]пиридин-5-карбальдегид 50 подвергают взаимодействию с соответствующим образом замещенным гидразином или гидразингидрохлоридом (Схема X, стадия a) до получения необходимых 1,6-дигидропиразоло[3,4-d]пирроло[2,3-b]пиридинов 51 способами, известными специалистам в данной области (например, пример № 27). Кроме того, 1,6-дигидропиразоло[3,4-d]пирроло[2,3-b]пиридины 51 можно защитить как сульфонамиды (Схема X, стадия b), используя условия, такие как раскрыты в примере получения № 1 или способами, известными специалистам в данной области (например, Larock, R. C. “Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd edition”, 1999, Wiley-VCH или Greene, T. W. and Wuts, P. G. M. “Protective Groups in Organic Synthesis, 3rd Edition”, 1999, Wiley-Interscience). Защищенные соединения 52 можно йодировать способами, известными специалистам в данной области (например, пример № 42, стадия C). Галогенированные трициклические соединения 53 подвергают взаимодействию с соответствующим образом замещенной бороновой кислотой или эфиром в условиях перекрестного сочетания Сузуки с последующим удалением защитных групп до получения дигидропиразоло[3,4-d]пирроло[2,3-b]пиридинов 54, используя условия, такие как раскрыты в примере № 42, стадия D. Дальнейшую функционализацию R′″ группы в дигидропиразоло[3,4-d]пирроло[2,3-b]пиридинах 54 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины, или гетероариламины можно получить из соединений 54 с R′″ группой, содержащей первичные или вторичные амины (например, в общих процедурах L, M, N или O). Кроме того, удаление защитных групп у R′″ групп в соединениях 54 до получения незащищенного соединения можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J, и соединения с удаленными защитными группами можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше.
Схема Х
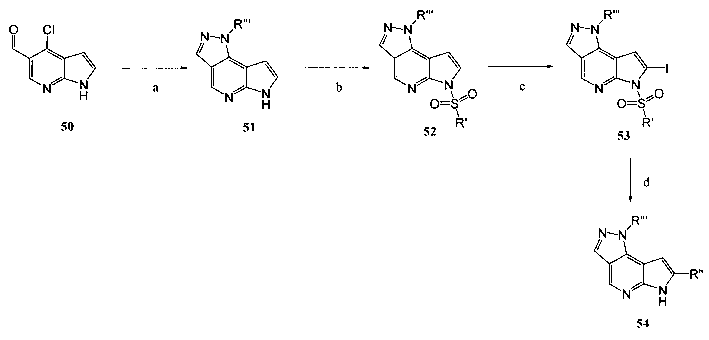
Способы получения 1,6-дигидродипирроло[2,3-b:2′,3′-d]пиридинов, соединений настоящего изобретения, представлены на схеме XI. Как видно, на стадии a, гетероарилхлориды 55 подвергают взаимодействию с соответствующим образом замещенным амином, используя способы, такие как раскрыты у Larock, R. C. “Comprehensive Organic Transformations: A Guide to Functional Group Preparation, 2nd edition”, 1999, Wiley-VCH, получая сложные эфиры 56 с одновременным удалением защитных групп. Сложные эфиры 56 можно превратить в соответствующие альдегиды 57 (стадия b) и затем циклизовать до получения искомых 1,6-дигидродипирроло[2,3-b:2′,3′-d]пиридинов 58, используя способы, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Дальнейшую функционализацию R′″ групп в 1,6-дигидродипирроло[2,3-b:2′,3′-d]пиридинах 58 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины или гетероариламины можно получить из соединений 58 с R′″ группой, содержащей первичные или вторичные амины (например, общие процедуры L, M, N или O). Также, удаление защитных групп у R′″ группы в соединениях 58 до получения незащищенного соединения можно осуществить, используя условия, такие, как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J, и соединения с удаленными защитными группами можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше.
Схема XI

Способы получения имидазо[1,5-a]пирроло[2,3-e]пиразинов 66 настоящего изобретения проиллюстрированы на схеме XII. 5-бром-3-((триметилсилил)этинил)пиразин-2-амин 9 можно подвергнуть взаимодействию с соответствующим образом функционализированным галогенидом до получения замещенных алкинов 59 (Схема XII, стадия a) способами, известными специалистам в данной области (например, пример № 20, стадия B). Алкины 59 можно подвергнуть взаимодействию в щелочных условиях до получения пирроло[2,3-b]пиразинов 60 (как в примере № 20, стадия C). Пирроло[2,3-b]пиразины 60 можно функционализировать соответствующей защитной группой, такой как (2-(триметилсилил)этокси)метил, способами, известными специалистам в данной области (например, Greene, T. W. and Wuts, P. G. M. “Protective Groups in Organic Synthesis, 3rd Edition”, 1999, Wiley-Interscience или в примере № 20, на стадии D). Пирроло[2,3-b]пиразины 61 можно превратить в соответствующие гидроксиметильные производные 62 в результате введения алкена с помощью перекрестного сочетания Сузуки с последующим оксидативным расщеплением и восстановлением промежуточного альдегида, используя способы, известные специалистам в данной области (например, у Larock, R. C. “Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd edition”, 1999, Wiley-VCH или в примере № 20, стадия E). Метанамины 63 можно получить из гидроксилметильного соединения 62 (стадия e) путем превращения в азид (например, пример № 20, стадия F) с последующим восстановлением Стаудингера (Staudinger), используя способы, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше) или в пример № 20, стадия G). Метанамины 63 можно превратить в соответствующим образом функционалоизированные амиды 64, используя способы, известные специалистам в данной области (например, пример № 20, стадия H). У амидов 64 можно удалить защитные группы, используя способы, известные специалистам в данной области (например, Greene, T. W. and Wuts (см. ссылку выше) или в примере № 20, на стадии I) до получения функционализированных пирроло[2,3-b]пиразинов 65 (стадия g). На схеме XII, стадия h, циклизацию амидов 65 можно осуществить путем превращения в тиоамиды с последующей обработкой активирующим агентом, получая имидазо[1,5-a]пирроло[2,3-e]пиразины 66 (например, пример № 20, стадия J). Альтернативно, циклизацию амидов 64 можно осуществить, используя раскрытые выше условия (Схема XII, стадия i) (например, пример № 22, стадия B) с последующим удалением защитных групп имидазо[1,5-a]пирроло[2,3-e]пиразинов 67 (Схема XII, стадия j), используя способы, известные специалистам в данной области (например, Greene, T. W. and Wuts (см. ссылку выше) или пример № 22, стадия C). Дальнейшую функционализацию R′″ группы в имидазо[1,5-a]пирроло[2,3-e]пиразинах 66 или 67 можно осуществить, при желании, используя реакции, известные специалистам в данной области (например, Larock, R. C. (см. ссылку выше)). Например, амиды, мочевины, сульфонамиды, ариламины, или гетероариламины можно получить из соединений 66 или 67 с R′″ группой, содержащей первичные или вторичные амины (например, Общие процедуры L, M, N или O). Кроме того, удаление защитных групп у R′″ группы в соединениях 66 или 67 до получения незащищенных соединений можно осуществить, используя условия, такие как раскрыты у Greene, T. W. and Wuts, P. G. M. (см. ссылку выше) или в общих процедурах I или J, и соединения с удаленными защитными группами можно затем подвергнуть дальнейшему взаимодействию, как раскрыто выше.
Схема XII
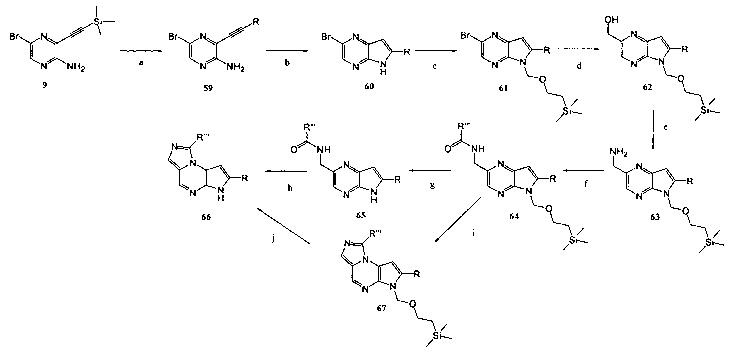
ОБЩИЕ ПРОЦЕДУРЫ И ПРИМЕРЫ
Далее на схемах 1-39 представлены общие схемы синтеза, которые использованы для получения большинства соединений, раскрытых в рассматриваемой заявке. Указанные схемы представлены только с иллюстративными целями и их не следует рассматривать как ограничивающие настоящее изобретение.
Схема 1. Получение гидразида из карбоновой кислоты (Общая процедура A)

Схема 2. Получение гидразида хлорангидрида с последующей циклизацией и гидролизом сульфонамида (Общая процедура B)
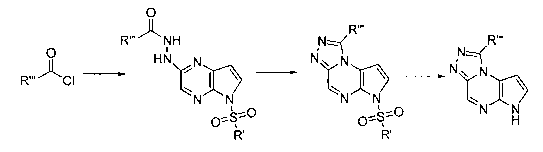
Схема 3. Циклизация гидразида (Общая процедура C)
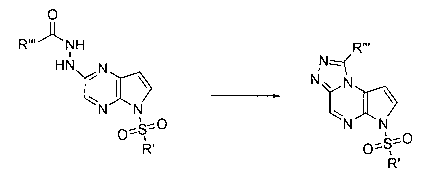
Схема 4. Циклизация гидразида с последующим гидролизом сульфонамида и удалением Boc-защитных групп (Общая процедура D)
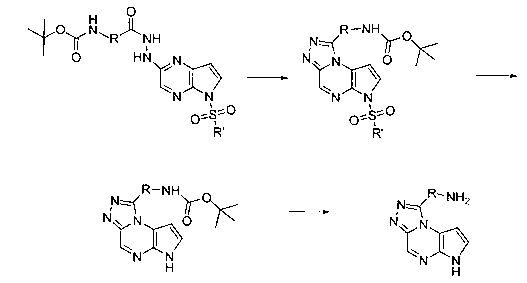
Схема 5. Циклизация гидразида с последующим гидролизом сульфонамида (Общая процедура E)

Схема 6. Циклизация гидразида с потерей Boc-защитной группы с последующим гидролизом сульфонамида (Общая процедура F)
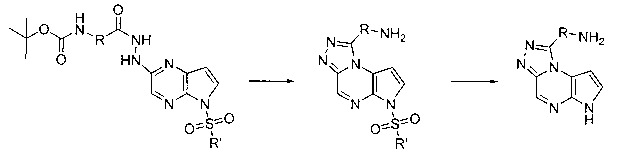
Схема 7. Получение гидразона с последующей циклизацией и с гидролизом сульфонамида (Общая процедура G)
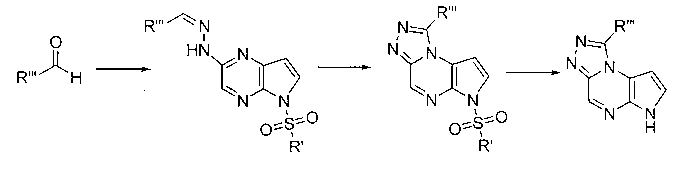
Схема 8. Гидролиз сульфонамида (Общая процедура H)
Схема 9. Кислотное расщепление Boc-защищенного амина (Общая процедура I)
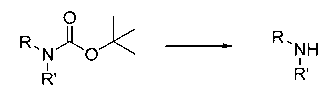
Схема 10. Удаление защитных групп у Cbz-защищенного амина (Общая процедура J)
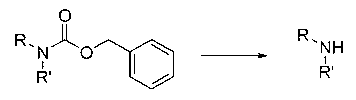
Схема 11. Получение амида из активированной кислоты и амина (Общая процедура K)

Схема 12. Получение амида из карбоновой кислоты и амина (Общая процедура L)
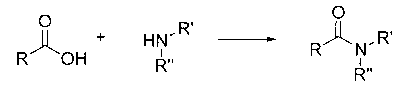
Схема 13. Получение мочевины из амина и карбамоилхлорида (Общая процедура M)
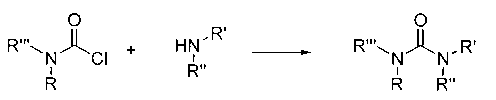
Схема 14. Получение сульфонамида из амина (Общая процедура N)

Схема 15. Замещение арилгалогенида или гетероарилгалогенида амином (Общая процедура O или О.1)
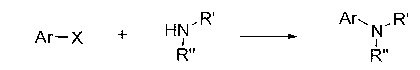
Схема 16. Введение Boc-защитной группы в амин (Общая процедура P)

Схема 17. Введение Cbz-защитной группы в амин (Общая процедура Q)
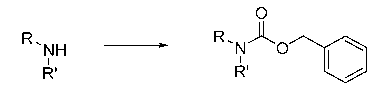
Схема 18. Восстановление пиридина (Общая процедура R)
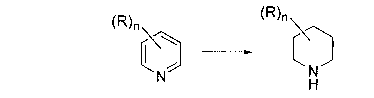
Схема 19. Восстановление сложного эфира до спирта (Общая процедура S)
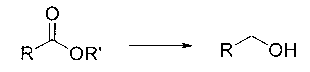
Схема 20. Окисление спирта до альдегида (Общая процедура T)
Схема 21. Получение семикарбазида (Общая процедура U)
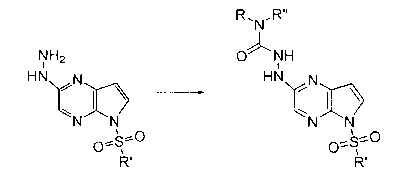
Схема 22. Циклизация семикарбазида(Общая процедура V)

Схема 23. Получение хлорангидрида (Общая процедура W)
Схема 24. Получение мочевины с использованием CDI (Общая процедура X)
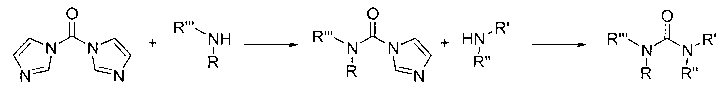
Схема 25. Получение сложного эфира из карбоновой кислоты (Общая процедура Y)
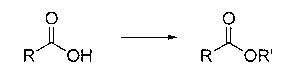
Схема 26. N-алкилирование с использованием алкилгалогенида или α-галогенкетона (Общая процедура Z)

Схема 27. Циклизация амида с использованием дитиафосфэтанового реагента (Общая процедура AA)
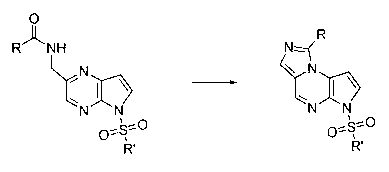
Схема 28. Конденсация Knoevenagel для получения замещенного циклопентадиена (Общая процедура BB)
Схема 29. Декарбоксилирование енолята β-кетоэфира (Общая процедура CC)
Схема 30. Гидрирование алкена (Общая процедура DD)
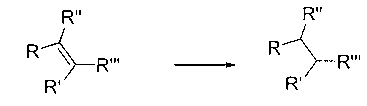
Схема 31. Восстановительное аминирование кетона или альдегида (Общая процедура EE)
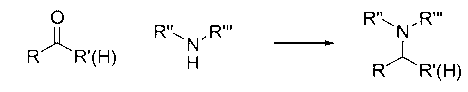
Схема 32. Дебензилирование амина (Общая процедура FF)
Схема 33. Гидролиз сложного эфира до получения карбоновой кислоты (Общая процедура GG)

Схема 34. Дегидрирование амида до нитрила (Общая процедура HH)
Схема 35. Разделение стереоизомеров с помощью хиральной препаративной ВЭЖХ (Общая процедура II)
Схема 36. Кислотный гидролиз ацетил-замещенного амина (Общая процедура JJ)

Схема 37. Циклопропанирование с использованием хлориодометана (Общая процедура KK)
Схема 38. Получение бромметилкетона из хлорангидрида (Общая процедура LL)
Схема 39. Восстановление α,β-ненасыщенного кетона до аллилового спирта (Общая процедура ММ)
СПИСОК ОБЩИХ ПРОЦЕДУР
Общая процедура A: Получение гидразида из карбоновой кислоты
Общая процедура B: Получение гидразида из хлорангидрида с последующей циклизацией и гидролизом сульфонамида
Общая процедура C: Циклизация гидразида
Общая процедура D: Циклизация гидразида с последующим гидролизом сульфонамида и удалением Boc-защитных групп
Общая процедура E: Циклизация гидразида с последующим гидролизом сульфонамида
Общая процедура F: Циклизация гидразида с потерей Boc-защитной группы с последующим гидролизом сульфонамида
Общая процедура G: Получение гидразон с последующей циклизацией и гидролизом сульфонамида
Общая процедура H: Гидролиз сульфонамида
Общая процедура I: Кислотное расщепление Boc-защищенного амина
Общая процедура J: Удаление защитных групп у Cbz-защищенного амина
Общая процедура K: Получение амида из активированной кислоты и амина
Общая процедура L: Получение амида из карбоновой кислоты и амина
Общая процедура M: Получение мочевины из амина и карбамоилхлорида
Общая процедура N: Получение сульфонамида из амина
Общая процедура O: Замещение арилагалогенида или гетероарилгалогенида амином
Общая процедура P: Введение Boc-защитных группы в амин
Общая процедура Q: Введение Cbz-защитной группы в амин
Общая процедура R: Восстановление пиридина
Общая процедура S: Восстановление сложного эфира до спирта
Общая процедура T: Окисление спирта до альдегида
Общая процедура U: Получение семикарбазида
Общая процедура V: Циклизация семикарбазида
Общая процедура W: Получение хлорангидрида
Общая процедура X: Получение мочевины с использованием CDI
Общая процедура Y: Получение эфира из карбоновой кислоты
Общая процедура Z: N-алкилирование с использованием алкилгалогенида или α-галогенкетона
Общая процедура AA: Циклизация амида с использованием дитиафосфэтанового реагента
Общая процедура BB: Конденсация Knoevenagel для получения замещенного циклопентадиена
Общая процедура CC: Декарбоксилирование енолята β-кетоэфира
Общая процедура DD: Гидрирование алкена
Общая процедура EE: Восстановительное аминирование кетона или альдегида
Общая процедура FF: Дебензилирование амина
Общая процедура GG: Гидролиз сложного эфира до получения карбоновой кислоты
Общая процедура HH: Дегидрирование амида до нитрила
Общая процедура II: Разделение стереоизомеров с помощью хиральной препаративной ВЭЖХ
Общая процедура JJ: Кислотный гидролиз ацетил-замещенного амина
Общая процедура KK: Циклопропанирование с использованием хлориодометана
Общая процедура LL: Получение бромметилкетона из хлорангидрида
Общая процедура ММ: Восстановление α,β-ненасыщенного кетона до аллилового спирта
Следующие примеры расположены в соответствии с конечной общей процедурой, используемой при их получении. Способы синтеза всех новых промежуточных соединений детализированы с помощью последующего перечисления общих процедур (буквенные обозначения) в скобках после их названия с дополнительными соответствующими реагентами. Рабочий пример указанного протокола приведен далее с использованием примера № H.1.1 в качестве неограничивающей иллюстрации. Пример № H.1.1 представляет собой N-(4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)-3-хлорбензолсульфонамид, который получают из 3-хлор-N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)бензолсульфонамида, используя общую процедуру H, как представлено на схеме A.
Схема А
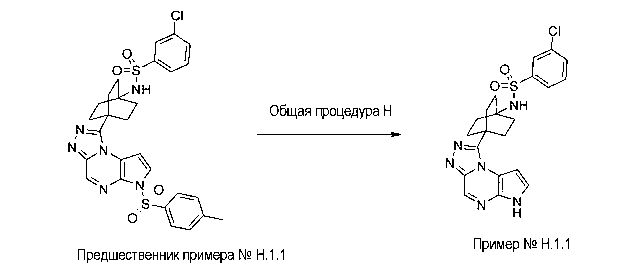
Предшественник примера № H.1.1, 3-хлор-N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)бензолсульфонамид, получают способом, представленным на схеме B. 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин (пример получения № 9) и 4-(трет-бутоксикарбониламино)бицикло-[2.2.2]октан-1-карбоновую кислоту подвергают взаимодействию, в соответствии с условиями, представленными в общей процедуре A, получая трет-бутил 4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)бицикло[2.2.2]октан-1-илкарбамат. Полученный гидразид циклизуют, используя условия, представленные в общей процедуре C, до получения трет-бутил 4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-илкарбамата. У полученного карбамата удаляют защитные группы, используя общую процедуру I, получая в результате 4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-амин. Полученный амин сульфонилируют, используя условия, указанные в общей процедуре N, получая предшественник примера № H.1.1. Детализированную выше последовательность реакций повторяют в разделе “примеры” получения и примеры в выражениях типа “используя A из примера получения № 9 и 4-(трет-бутоксикарбониламино)бицикло-[2.2.2]октан-1-карбоновую кислоту [Prime Organics], C с TEA, I, N из 3-хлорбензолсульфонилхлорида”.
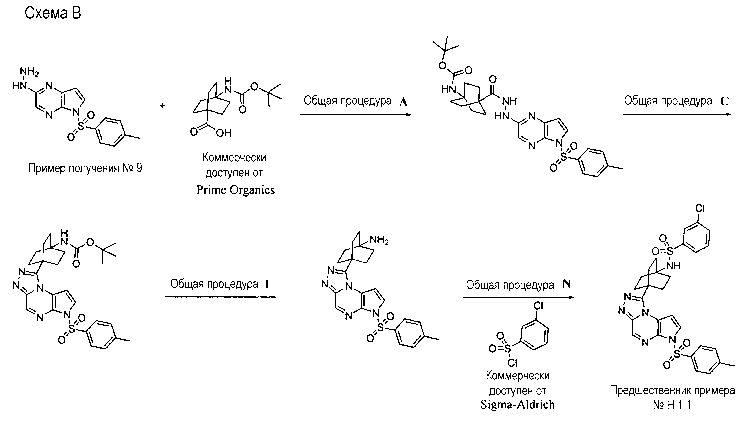
Аналитические методы
Аналитические результаты включены в раскрытые далее процедуры, в иллюстрации общих процедур, или в таблицы примеров. Если нет других указаний, все результаты 1H ЯМР получены на приборах Varian Mercury Plus 400 МГц или Varian Inova 600 МГц и химические сдвиги выражены как части на миллион (мд). Результаты ЖХ/МС и ВЭЖХ относятся к условиям ЖХ/МС и ВЭЖХ, приведенным в таблице, и обозначены мелкими буквами, указанными далее в таблице 2.
Способы ЖХ/МС и ВЭЖХ
MeCN. Колонка, которую используют для хроматографии: 21,2×250 мм Hypersil HS C18 колонка (8 мкм частицы). Способ детектирования: УФ, λ=380 нм.
скорость потока). Подвижная фаза A: 0,05 н. буфер, водный раствор ацетата аммония (pH 4,5) и подвижная фаза В: ВЭЖХ степени чистоты MeCN. Способ детектирования: УФ, λ=254 нм.
Способы хиральной ВЭЖХ
Примеры получений и примеры
Далее приводятся общие способы синтеза, которые используют в каждой общей процедуре и которые включают иллюстрацию соединения, которое синтезируют, используя обозначенную общую процедуру. Ни одно из перечисленных здесь конкретных условий и ни один из конкретных реагентов не следует рассматривать как ограничивающие объем настоящего изобретения, и они представлены здесь только для иллюстративных целей. Все исходные материалы коммерчески доступны от Sigma-Aldrich (включая Fluka и Discovery CPR) если только нет других указаний после химического наименования. Названия реагентов даны в соответствии с названиями на коммерческих флаконах или в соответствии с номенклатурой IUPAC, CambridgeSoft® Chemdraw Ultra 9.0.7 или AutoNom 2000. Соединения, обозначенные как соли (например гидрохлорид, ацетат) могут содержать более одного молярного эквивалента соли.
Пример получения № 1: 2-бром-5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин

Раствор 2-бром-5H-пирроло[2,3-b]пиразина (5,00 г, 25,2 ммоль, Ark Pharm) в ДМФ (150 мл) охлаждают на бане со льдом до около 0°C, и затем добавляют NaH (60% дисперсия в минеральном масле, 1,21 г, 30,3 ммоль). Примерно через 15 мин, добавляют 4-трет-бутилбензол-1-сульфонилхлорид (6,46 г, 27,8 ммоль). Температуру реакции поддерживают между 0 и 10°C в течение около 2 часов. Затем реакционную смесь разбавляют водой (200 мл), получая суспензию желтого цвета. Твердый продукт собирают вакуумным фильтрованием, промывая дополнительным количеством воды (100 мл), и сушат в вакуумном термостате при температуре около 70°C, получая 2-бром-5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин (9,05 г, 91%): ЖХ/МС (Таблица 2, Способ a) Rt=3,05 мин; МС m/z: 394/396 (M+H)+ .
Пример получения № 2: трет-бутил 2-(5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат и трет-бутил 1-(5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат
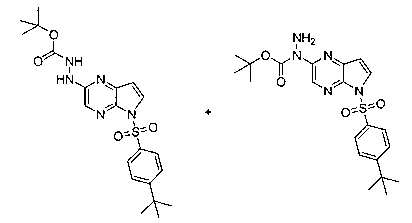
В колбу добавляют Pd2(dba)3 (5,06 г, 5,53 ммоль), ди-трет-бутил-(2′,4′,6′-триизопропилбифенил-2-ил)фосфан (4,70 г, 11,06 ммоль) и 1,4-диоксан (350 мл). Смесь катализатор-лиганд дегазируют, используя цикл вакуум/продувка азотом (3 раза) и нагревают при температуре около 80°C в течение около 10 мин. Реакционную смесь быстро снимают с масляной бани, затем добавляют 2-бром-5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин (21,8 г, 55,3 ммоль, пример получения № 1), трет-бутил гидразинкарбоксилат (36,5 г, 276 ммоль), и NaOt-Bu (7,97 г, 83 ммоль). После дополнительного цикла вакуум/продувка азотом, реакционную смесь нагревают при температуре около 80°C в течение около 5,5 часа. Реакционную смесь охлаждают до комнатной температуры и фильтруют через Celite®, промывая при этом EtOAc (500 мл). Полученный фильтрат промывают насыщенным водным раствором NH4Cl (3×500 мл), насыщенным водным раствором NaHCO3 (500 мл) и солевым раствором (500 мл), сушат над безводным Na2SO4, фильтруют, и затем концентрируют при пониженном давлении, получая около 55 г сырого масла коричневого цвета. Коричневое масло адсорбируют на двуокиси кремния и очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 10-50% EtOAc в гептане, получая трет-бутил 2-(5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат (4,51 г, 18% выход) и 4,68 г смеси трет-бутил 2-(5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [основной региоизомер] и трет-бутил 1-(5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [второстепенный региоизомер]: ЖХ/МС (Таблица 2, Способ a) Rt=2,68 мин; МС m/z: 446 (M+H)+ [основной региоизомер]; Rt=2,77 мин; МС m/z: 446 (M+H)+ [второстепенный региоизомер].
Пример получения № 3: 5-(4-трет-бутилфенилсульфонил)-2-гидразинил-5H-пирроло[2,3-b]пиразин
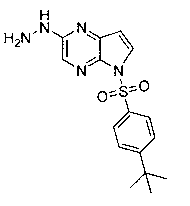
К смеси трет-бутил 2-(5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата и трет-бутил 1-(5-(4-трет-бутилфенилсульфонил)-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата (11,24 г, 25,2 ммоль, пример получения № 2) в 1,4-диоксане (125 мл) добавляют HCl (4 M в 1,4-диоксане, 125 мл, 500 ммоль). Полученную реакционную смесь нагревают при температуре около 60°C в течение около 1 часа, и затем реакционную смесь охлаждают до комнатной температуры. Полученную смесь фильтруют, промывая при этом Et2O (150 мл), и твердый продукт разделяют между EtOAc (500 мл) и насыщенным водным раствором NaHCO3 (500 мл). Полученные слои выделяют, и органический слой промывают насыщенным водным раствором NaHCO3 и солевым раствором (200 мл каждый), сушат над безводным Na2SO4, фильтруют, концентрируют при пониженном давлении, и сушат в вакуумном термостате при температуре около 70°C, получая 5-(4-трет-бутилфенилсульфонил)-2-гидразинил-5H-пирроло[2,3-b]пиразин в виде твердого вещества желто-коричневого цвета (7,54 г, 87%): ЖХ/МС (Таблица 2, Способ a) Rt=2,20 мин; МС m/z: 346 (M+H)+.
Пример получения № 4: 2-метилциклогексанкарбонилхлорид

К раствору 2-метилциклогексанкарбоновой кислоты (6,00 мл, 42,6 ммоль, смесь цис- и транс-) в DCM (60 мл) добавляют оксалилхлорид (4,80 мл, 55,3 ммоль), затем добавляют ДМФ (0,03 мл, 0,4 ммоль). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 4 часов перед тем, как ее концентрируют при пониженном давлении до постоянного веса до получения 2-метилциклогексанкарбонилхлорида (смесь диастереоизомеров) в виде масла желтого цвета (7,0 г, 97%): 1Н-ЯМР (400 МГц, CDCl3) δ 2,98-2,94 (м, 1Н), 2,39-2,35 (м, 1Н), 1,91-1,82 (м, 1Н), 1,79-1,72 (м, 1Н), 1,69-1,60 (м, 2Н), 1,57-1,47 (м, 2Н), 1,42-1,36 (м, 1Н), 1,34-1,26 (м, 1Н), 1,04-0,96 (м, 3Н).
Пример получения № 5: Бензил 4-(хлоркарбонил)пиперидин-1-карбоксилат
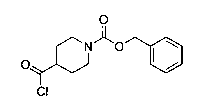
Стадия A: 1-(бензилоксикарбонил)пиперидин-4-карбоновая кислота
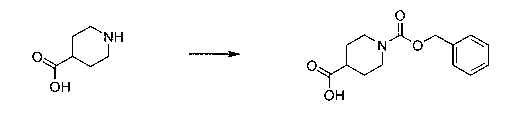
К раствору пиперидин-4-карбоновой кислоты (10,0 г, 77,4 ммоль) и Na2CO3 (8,21 г, 77,4 ммоль) в воде (100 мл) добавляют раствор бензил 2,5-диоксопирролидин-1-илкарбоната (19,3 г, 77,4 ммоль) в MeCN (100 мл). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 16 часов и затем концентрируют при пониженном давлении. Полученный водный раствор гасят, используя NH4Cl и затем экстрагируют EtOAc (2×100 мл). Объединенные органические экстракты сушат над безводным Na2SO4 и концентрируют при пониженном давлении, получая 1-(бензилоксикарбонил)пиперидин-4-карбоновую кислоту в виде твердого вещества белого цвета (4,56 г, 22%): ЖХ/МС (Таблица 2, Способ a) Rt=1,93 мин; МС m/z: 262 (M−H)−.
Стадия B: Бензил 4-(хлоркарбонил)пиперидин-1-карбоксилат
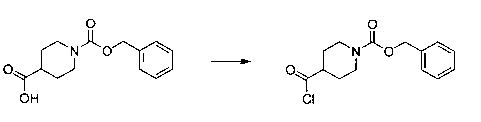
К раствору 1-(бензилоксикарбонил)пиперидин-4-карбоновой кислоты (4,50 г, 17,1 ммоль, пример получения № 5, Стадия A) в DCM (40 мл) при комнатной температуре добавляют оксалилхлорид (3,00 мл, 34,2 ммоль) с последующим добавлением ДМФ (0,10 мл, 1,3 ммоль). Примерно через 3 часа, реакционную смесь концентрируют при пониженном давлении до постоянного веса до получения бензил 4-(хлоркарбонил)пиперидин-1-карбоксилата в виде масла желтого цвета (3,88 г, 81%): 1Н-ЯМР (CDCl3) δ 7,44-7,35 (м, 5Н), 5,16 (с, 2Н), 4,20-4,10 (м, 2Н), 3,03-2,89 (м, 3Н), 2,15-2,05 (м, 2Н), 1,81-1,76 (м, 2Н).
Пример получения № 6: Перфторфенил 2-цианоацетат
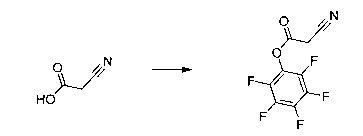
К раствору 2,3,4,5,6-пентафторфенола (1,08 г, 5,88 ммоль) и 2-цианоуксусной кислоты (0,50 г, 5,9 ммоль) в DCM (20 мл) добавляют DCC (1,21 г, 5,88 ммоль). После перемешивания в течение около 4 часов при комнатной температуре реакционную смесь концентрируют при пониженном давлении и затем очищают на силикагеле (20 г), используя DCM в качестве элюента до получения перфторфенил 2-цианоацетата в виде твердого вещества белого цвета (1,39 г, 94%): 1H ЯМР (400 МГц, CDCl3 ) δ 3,85 (с, 2H).
Пример получения № 7: 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин
(Способ A)
Раствор 2-бром-5H-пирроло[2,3-b]пиразина (78,0 г, 394 ммоль, Ark Pharm) в безводном ДМФ (272 мл) по каплям добавляют в течение около 60 мин к перемешиваемой суспензии NaH (1,8 г, 532 ммоль) в безводном ДМФ (543 мл) при температуре около 0-5°C. Коричневый реакционный раствор перемешивают в течение около 30 мин при температуре около 0-5°C. Затем по каплям добавляют раствор p-толуолсульфонилхлорида (94,0 г, 492 ммоль) в безводном ДМФ (272 мл) в течение около 60 мин при температуре около 0-5°C. Полученную реакционную смесь перемешивают при температуре около 0-5°C в течение около 1 часа, затем оставляют нагреться до комнатной температуры и перемешивают в течение около 18 часов при комнатной температуре. Полученную реакционную смесь медленно выливают в ледяную воду (6 л), затем добавляют водный раствор 2,5 н. NaOH (50,0 мл, 125 ммоль). Полученный осадок собирают фильтрованием и перемешивают с холодной водой (3×200 мл). Твердый продукт собирают фильтрованием и сушат до постоянного веса в вакуумном термостате печи при температуре около 55°C, получая в результате 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (134,6 г, 97%) в виде твердого вещества бледно бежевого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,58 мин; МС m/z: 352/354 (M+H)+.
Пример получения № 7: 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин
(Способ B)
Стадия A: 5-бром-3-((триметилсилил)этинил)пиразин-2-амин
К раствору 3,5-дибромопиразин-2-амина (40,0 г, 158 ммоль), TEA (66,1 мл, 475 ммоль) и иодида меди(I) (0,301 г, 1,58 ммоль) в ТГФ (1172 мл) добавляют PdCl2(PPh3)2 (1,11 г, 1,58 ммоль). Полученную реакционную смесь охлаждают при температуре около 0°C, и по каплям добавляют раствор (триметилсилил)ацетилена (20,8 мл, 150 ммоль) в ТГФ (146 мл). Полученную реакционную смесь перемешивают при температуре около 0-10°C в течение около 7 часов, и затем концентрируют при пониженном давлении. Темно-коричневый остаток растворяют в DCM (600 мл) и фильтруют через слой Celite® (3 см в высоту×9 см в диаметре), элюируя при этом DCM (300 мл). Полученный фильтрат промывают водой (2×500 мл) и солевым раствором (500 мл), сушат над безводным MgSO4, фильтруют через слой Florisil® (1 см в высоту и 9 см в диаметре), промывая при этом DCM/MeOH (9:1, 200 мл), и концентрируют при пониженном давлении, получая твердое вещество коричневого цвета. Твердый продукт тщательно растирают и обрабатывают ультразвуком в теплом петролейном эфире (Т.кипения 30-60°C, 250 мл), охлаждают и собирают, промывая петролейным эфиром (Т.кипения 30-60°C; 2×100 мл), и сушат в вакуумном термостате при температуре около 70°C, получая 5-бром-3-((триметилсилил)этинил)пиразин-2-амин (34,6 г, 70%): ЖХ/МС (Таблица 2, Способ d) Rt=1,59 мин; МС m/z: 272 (M+H)+.
Стадия B: 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин
К раствору 5-бром-3-((триметилсилил)этинил)пиразин-2-амина (3,00 г, 11,1 ммоль) в ДМФ (60 мл) при температуре около 0°C добавляют NaH (60% дисперсия в минеральном масле, 0,577 г, 14,4 ммоль) тремя порциями. Примерно через 15 мин добавляют p-толуолсульфонилхлорида (2,75 г, 14,4 ммоль), и реакционную смесь оставляют медленно нагреваться до комнатной температуры. Примерно через 16 часов полученную реакционную смесь выливают в ледяную воду (120 мл), и полученный осадок собирают вакуумным фильтрованием. Сырое твердое вещество растворяют в DCM (15 мл) и очищают на хроматографической колонке с силикагелем, элюируя DCM. Содержащие продукт фракции концентрируют при пониженном давлении, получая 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (2,16 г, 52%): ЖХ/МС (Таблица 2, Способ d) Rt=1,58 мин; МС m/z: 352/354 (M+H)+.
Пример получения № 8: трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат
В колбу добавляют Pd2(dba)3 (3,90 г, 4,26 ммоль), ди-трет-бутил-(2′,4′,6′-триизопропилбифенил-2-ил)фосфан (3,62 г, 8,52 ммоль), и безводный 1,4-диоксан (453 мл). Смесь катализатор-лиганд дегазируют, используя цикл вакуум/продувка азотом (3 раза) и нагревают при температуре около 80°C в течение около 10 мин. Полученную реакционную смесь быстро удаляют с масляной бани, затем добавляют 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (30,0 г, 85 ммоль, пример получения № 7), трет-бутилгидразинкарбоксилат (16,9 г, 128 ммоль) и NaOt-Bu (12,28 г, 128 ммоль). После дополнительного цикла вакуум/продувка азотом, реакционную смесь нагревают при температуре около 80°C. Примерно через 50 мин, полученную реакционную смесь охлаждают до комнатной температуры и фильтруют через слой силикагеля (6 см в высоту×6 см в диаметре), со слоем Celite® наверху (1 см в высоту×6 см в диаметре), промывая при этом EtOAc (3×150 мл). К фильтрату добавляют воду (300 мл), и органический слой выделяют. Водный слой экстрагируют дополнительным количеством EtOAc (3×200 мл). Объединенные органические экстракты промывают насыщенным водным раствором NH4Cl, насыщенным водным раствором NaHCO3 и солевым раствором (400 мл каждый), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая масло темно коричневого цвета (45 г). Коричневое масло растворяют в DCM (250 мл), добавляют силикагель (200 г), и полученную смесь концентрируют при пониженном давлении. Полученную смесь силикагеля очищают, используя хроматографию на силикагеле, осуществляя градиентное элюирование 25-65% EtOAc в гептане, получая смесь трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [основной региоизомер] и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [второстепенный региоизомер] (18,8 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,47 мин; МС m/z: 404 (M+H)+.
Пример получения № 9: 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин
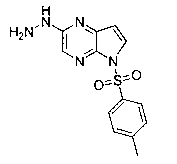
К смеси трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата (18,8 г, 46,6 ммоль, пример получения № 8) в 1,4-диоксане (239 мл) добавляют HCl (4 M в 1,4-диоксане, 86 мл, 345 ммоль). Реакционную смесь нагревают при температуре около 60°C в течение около 1 часа и затем охлаждают до около 15-20°C. Твердый продукт собирают вакуумным фильтрованием, промывают холодным 1,4-диоксаном (2×20 мл), и затем перемешивают с насыщенным раствором NaHCO3 и водой (1:1, 150 мл). Примерно через 1 час выделение газа прекращается, и твердый продукт собирают вакуумным фильтрованием, промывают ледяной водой (3×20 мл), и сушат в вакуумном термостате до постоянного веса до получения 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразина в виде твердого вещества светлого желтовато-коричневого цвета (8,01 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,28 мин; МС m/z: 304 (M+H)+.
Пример получения № 10: (R)-трет-бутил 1-(хлоркарбонил)пирролидин-3-илкарбамат
В колбу загружают (R)-трет-бутил пирролидин-3-илкарбамат (1,0 г, 5,4 ммоль, Lancaster) в DCM (15 мл), получая бесцветный раствор. Добавляют пиридин (0,89 мл, 10,8 ммоль) и полученный раствор охлаждают до около 0°C, затем добавляют трифосген (0,64 г, 2,1 ммоль). Полученную смесь перемешивают в течение около 1 часа, при этом медленно нагревая до комнатной температуры. К реакционному раствору добавляют DCM (50 мл), и полученный раствор промывают водой (20 мл) и HCl (1 н, 10 мл). Органическую часть выделяют, сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая (R)-трет-бутил 1-(хлоркарбонил)пирролидин-3-илкарбамат (1,3 г, 98%) в виде масла желтого цвета: 1Н-ЯМР (ДМСО-d6) δ 7,28 (с, 1Н), 4,03 (м, 1Н), 3,73-3,20 (м, 4Н), 2,05 (м, 1Н), 1,81 (м, 1Н), 1,39 (с, 9Н).
Пример получения № 11: (1R,2S,4R,5S)-4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоновая кислота и (1S,2R,4S,5R)-4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоновая кислота
Стадия A: (1R,2S,4R,5S)-этил 4-гидрокси-1-метилбицикло[3.1.0]гексан-2-карбоксилат и (1S,2R,4S,5R)-этил 4-гидрокси-1-метилбицикло[3.1.0]гексан-2-карбоксилат

Цис-этил-4-гидрокси-2-метилциклопент-2-енкарбоксилат (0,96 г, 5,64 ммоль, пример получения № MM.1) и хлориодометан (4,97 г, 28,2 ммоль) подвергают взаимодействию в соответствии с общей процедурой KK, получая (1R,2S,4R,5S)-этил 4-гидрокси-1-метилбицикло[3.1.0]гексан-2-карбоксилат и (1S,2R,4S,5R)-этил 4-гидрокси-1-метилбицикло[3.1.0]гексан-2-карбоксилат (0,59 г, 57%) после очистки с использованием флеш-хроматографии на силикагеле, осуществляя градиентное элюирование 30-60% EtOAc/гептан: 1H ЯМР (400 МГц, CDCl3 ) δ 4,60-4,51 (м, 1H), 4,23-4,10 (м, 2H), 2,74 (дд, J=8,0, 10,9 Гц, 1H), 2,13 (м, 1H), 1,51 (м, 1H), 1,46-1,40 (м, 1H), 1,35-1,29 (м, 1H), 1,28 (м, 6H), 1,09-1,04 (м, 1H), 0,37 (дд, J=5,7, 7,9 Гц, 1H).
Стадия B: (1R,2S,5S)-этил 1-метил-4-оксобицикло[3.1.0]гексан-2-карбоксилат и (1S,2R,5R)-этил 1-метил-4-оксобицикло[3.1.0]гексан-2-карбоксилат
Смесь (1R,2S,4R,5S)-этил 4-гидрокси-1-метилбицикло[3.1.0]гексан-2-карбоксилата и (1S,2R,4S,5R)-этил 4-гидрокси-1-метилбицикло[3.1.0]гексан-2-карбоксилата (0,59 г, 3,2 ммоль) обрабатывают в соответствии с общей процедурой T, получая (1R,2S,5S)-этил 1-метил-4-оксобицикло[3.1.0]гексан-2-карбоксилат и (1S,2R,5R)-этил 1-метил-4-оксобицикло[3.1.0]гексан-2-карбоксилат (0,38 г, 65%) после очистки с помощью хроматографической обработки на силикагеле, осуществляя градиентное элюирование 20-50% EtOAc/пентан: 1H ЯМР (400 МГц, CDCl3) δ 4,35-4,15 (м, 2H), 3,12 (т, J=9,3 Гц, 1H), 2,60 (дд, J=9,2, 18,3 Гц, 1H), 2,37-2,23 (м, 1H), 1,68 (дд, J=3,4, 9,2 Гц, 1H), 1,48 (с, 3H), 1,41 (дд, J=3,4, 5,2 Гц, 1H), 1,34 (т, J=7,1 Гц, 3H), 1,14 (дд, J=5,3, 9,2 Гц, 1H).
Стадия C: (1R,2S,4R,5S)-этил 4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоксилат и (1S,2R,4S,5R)-этил 4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоксилат
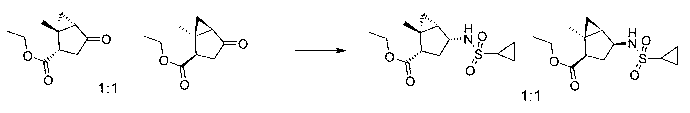
В ампулу, содержащую (1R,2S,5S)-этил 1-метил-4-оксобицикло[3.1.0]гексан-2-карбоксилат и (1S,2R,5R)-этил 1-метил-4-оксобицикло[3.1.0]гексан-2-карбоксилат (0,305 г, 1,67 ммоль), добавляют раствор аммиака (2 Nin EtOH) с последующим добавлением изопропоксида титана(IV) (0,54 мл, 1,8 ммоль). Ампулу закрывают, и полученную реакционную смесь перемешивают при комнатной температуре в течение ночи. Добавляют боргидрид натрия (0,095 г, 2,5 ммоль), и реакционную смесь перемешивают в течение около 5 часов. Добавляют концентрированный NH4OH (5 мл), и полученную смесь перемешивают в течение около 5 мин. Полученную суспензию фильтруют, и фильтровальную лепешку промывают EtOAc (60 мл). Полученный фильтрат разделяют, и водный слой экстрагируют EtOAc (30 мл). Объединенный водный слой промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют, получая в результате (1R,2S,4R,5S)-этил 4-амино-1-метилбицикло[3.1.0]гексан-2-карбоксилат и (1S,2R,4S,5R)-этил 4-амино-1-метилбицикло[3.1.0]гексан-2-карбоксилат (0,21 г, 69%). Этот амин (0,212 г, 1,16 ммоль) подвергают взаимодействию с циклопропансульфонилхлоридом (0,244 г, 1,74 ммоль), используя общую процедуру N, получая (1R,2S,4R,5S)-этил 4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоксилат и (1S,2R,4S,5R)-этил 4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоксилат (0,11 г, 33%): ЖХ/МС (Таблица 2, Способ a) Rt=2,06 мин; МС m/z: 286 (M−H)−.
Стадия D: (1R,2S,4R,5S)-4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоновая кислота и (1S,2R,4S,5R)-4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоновая кислота.

Смесь (1R,2S,4R,5S)-этил 4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоксилата и (1S,2R,4S,5R)-этил 4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоксилата (0,109 г, 0,379 ммоль) гидролизуют, используя общую процедуру GG, получая (1R,2S,4R,5S)-4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоновую кислоту и (1S,2R,4S,5R)-4-(циклопропансульфонамидо)-1-метилбицикло[3.1.0]гексан-2-карбоновую кислоту (0,113 г, 100%): ЖХ/МС (Таблица 2, Способ a) Rt=1,57 мин; МС m/z: 258 (M−H)−.
Пример получения № 12: (1R,2R,4S)-4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоновая кислота и (1S,2S,4R)-4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоновая кислота

Стадия A: (2R,4S)-этил 4-(дибензиламино)-2-этил-1-метилциклопентанкарбоксилат и (2S,4R)-этил 4-(дибензиламино)-2-этил-1-метилциклопентанкарбоксилат
К раствору LDA (1,8 M в ТГФ, 3,04 мл, 5,47 ммоль) и ТГФ (40 мл) при температуре около −78°C добавляют этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат (1,0 г, 2,7 ммоль, пример получения № EE.1) в ТГФ (4 мл). Полученную реакционную смесь перемешивают при температуре около −78°C в течение около 1 часа. Добавляют MeI (2,57 мл, 41,0 ммоль), и реакционную смесь перемешивают при температуре около −78°C в течение около 1 часа и затем нагревают до около −40°C. Добавляют DCM (150 мл), с последующим добавлением насыщенного водного раствора NH4Cl (50 мл). Слои разделяют, и водный слой экстрагируют DCM (2×30 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Полученный остаток очищают с использованием флеш-хроматографии на силикагеле, осуществляя градиентное элюирование 0-10% EtOAc в DCM, получая (2R,4S)-этил 4-(дибензиламино)-2-этил-1-метилциклопентанкарбоксилат и (2S,4R)-этил 4-(дибензиламино)-2-этил-1-метилциклопентанкарбоксилат (0,864 г, 84%). ЖХ/МС (Таблица 2, Способ a) Rt=2,25 мин; МС m/z: 380 (M+H)+.
Стадия B: (2R,4S)-этил 4-амино-2-этил-1-метилциклопентанкарбоксилат и (2S,4R)-этил 4-амино-2-этил-1-метилциклопентанкарбоксилат
Смесь (2R,4S)-этил 4-(дибензиламино)-2-этил-1-метилциклопентанкарбоксилата и (2S,4R)-этил 4-(дибензиламино)-2-этил-1-метилциклопентанкарбоксилата (0,864 г, 2,28 ммоль) дебензилируют, используя общую процедуру FF, получая (2R,4S)-этил 4-амино-2-этил-1-метилциклопентанкарбоксилат и (2S,4R)-этил 4-амино-2-этил-1-метилциклопентанкарбоксилат (0,45 г, 100%). ЖХ/МС (Таблица 2, Способ a) Rt=1,55 мин; МС m/z: 200 (M+H)+.
Стадия C: (1S,2R,4S) и (1R,2S,4R)-этил 4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоксилат, (1R,2R,4S) и (1S,2S,4R)-этил 4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоксилат

Смесь (2R,4S)-этил 4-амино-2-этил-1-метилциклопентанкарбоксилата и (2S,4R)-этил 4-амино-2-этил-1-метилциклопентанкарбоксилата (0,454 г, 2,28 ммоль) защищают, используя общую процедуру P. Сырую реакционную смесь очищают с помощью хроматографической обработки на силикагеле, осуществляя градиентное элюирование 0-25% EtOAc/гептаном до получения (1S,2R,4S) и (1R,2S,4R)-этил 4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоксилата (0,180 г, 26%): 1H ЯМР (400 МГц, CDCl3) δ 4,46 (с, 1H), 4,12 (кв, J=7,1 Гц, 2H), 4,07-3,93 (м, 1H), 2,65 (дд, J=9,2, 13,8 Гц, 1H), 2,36 (с, 1H), 2,24-2,08 (м, 1H), 1,57 (м, 1H), 1,54-1,39 (м, 10H), 1,34-1,17 (м, 4H), 1,17-1,05 (м, 4H), 0,87 (т, J=7,4 Гц, 3H), (1R,2R,4S) и (1S,2S,4R)-этил 4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоксилат (0,430 г, 63%): 1H ЯМР (400 МГц, CDCl3) δ 5,18 (с, 1H), 4,24-4,04 (м, 3H), 2,46-2,33 (м, 1H), 1,97 (м, 2H), 1,63-1,50 (м, 2H), 1,48-1,34 (м, 9H), 1,3-1,17 (м, 7H), 1,04-0,92 (м, 1H), 0,89 (т, J=7,1 Гц, 3H).
Стадия D: (1R,2R,4S) и (1S,2S,4R)-4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоновая кислота
Смесь (1R,2R,4S) и (1S,2S,4R)-этил 4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоксилата (0,430 г, 1,44 ммоль) гидролизуют в соответствии с общей процедурой GG, получая (1R,2R,4S) и (1S,2S,4R)-4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоновую кислоту (0,256 г, 86%): ЖХ/МС (Таблица 2, Способ a) Rt=2,22 мин; МС m/z: 270 (M−H)−.
Пример получения № 13: (1S,2R,4S) и (1R,2S,4R)-4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоновая кислота
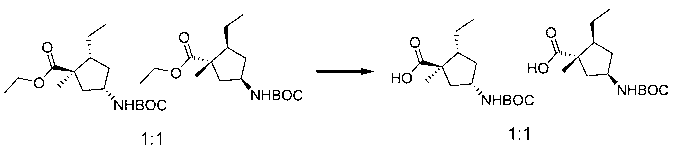
Смесь (1S,2R,4S) и (1R,2S,4R)-этил 4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоксилата (0,180 г, 0,600 ммоль) гидролизуют в соответствии с общей процедурой GG, получая (1S,2R,4S)-4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоновую кислоту и (1S,2R,4S)-4-(трет-бутоксикарбониламино)-2-этил-1-метилциклопентанкарбоновую кислоту (0,083 г, 51%): ЖХ/МС (Таблица 2, Способ a) Rt=2,23 мин; МС m/z: 270 (M−H)−.
Пример получения № 14: (1R,2S,4R,5R)-4-(трет-бутоксикарбониламино)-6-(триметилсилил)бицикло[3.1.0]гексан-2-карбоновая кислота
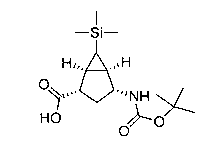
Стадия A: (1R,4S)-трет-бутил 3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилат
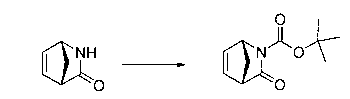
К раствору (1R,4S)-2-азабицикло[2.2.1]гепт-5-ен-3-она (1,50 г, 13,7 ммоль) в ТГФ (100 мл) добавляют TEA (1,90 мл, 13,7 ммоль) и DMAP (0,27 г, 2,2 ммоль). Полученную смесь перемешивают в течение около 5 мин при температуре около 0°C. Затем добавляют ди-трет-бутилдикарбонат (3,40 мл, 14,4 ммоль) в ТГФ (15 мл). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 24 часов. Полученный растворитель удаляют при пониженном давлении, и сырой остаток помещают в DCM (50 мл) и промывают водой (25 мл) и солевым раствором (25 мл). Органический слой сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал очищают с помощью хроматографической обработки на силикагеле, осуществляя градиентное элюирование 0-30% EtOAc/гептаном до получения (1R,4S)-трет-бутил 3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата (2,7 г, 93%) в виде твердого вещества белого цвета: 1H ЯМР (400 МГц, ДМСО-d 6) δ 7,26-6,86 (дд, 1H), 6,86-6,64 (м, 1H), 5,08-4,78 (д, 1H), 3,52-3,21 (дд, 1H), 2,32-2,24 (д, 1H), 2,09-2,02 (д, 1H), 1,05-1,36 (с, 9H).
Стадия B: Трет-бутиловый эфир (1S,2R,4R,5R)-7-оксо-3-триметилсиланил-6-аза-трицикло[3.2.1.0(2,4)]октан-6-карбоновой кислоты
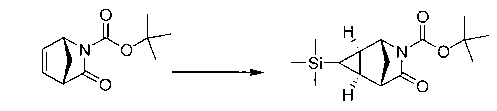
К раствору (1R,4S)-трет-бутил 3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата (1,3 г, 6,2 ммоль) и ацетата палладия(II) (0,070 г, 0,31 ммоль) в Et2O (62 мл) по каплям добавляют триметилсилилдиазометан (2 M в гексанах, 3,00 мл, 11,5 ммоль) при комнатной температуре в течение около 1 часа. Полученную смесь перемешивают при комнатной температуре в течение около 18 часов и фильтруют через Celite®. Лепешку целита промывают Et2O (50 мл), и полученный фильтрат концентрируют при пониженном давлении. Сырой материал очищают с помощью хроматографической обработки на силикагеле, осуществляя градиентное элюирование 0-30% EtOAc/гептана до получения трет-бутилового эфира (1S,2R,4R,5R)-7-оксо-3-триметилсиланил-6-азатрицикло[3.2.1.0(2,4)]октан-6-карбоновой кислоты (1,7 г, 92%). 1H ЯМР (400 МГц, ДМСО-d 6) δ 4,37 (с, 1H), 2,70 (с, 1H), 1,45 (м, 10H), 1,23 (т, 1H), 0,76 (т, 1H), 0,10 (с, 2H), -0,03 (с, 9H).
Стадия C: (1R,2S,4R,5R)-4-(трет-бутоксикарбониламино)-6-(триметилсилил)бицикло[3.1.0]гексан-2-карбоновая кислота

Смесь трет-бутилового эфира (1S,2R,4R,5R)-7-оксо-3-триметилсиланил-6-азатрицикло[3.2.1.0(2,4)]октан-6-карбоновой кислоты (1,7 г, 5,7 ммоль) и фторида калия на окиси алюминия (2,10 г, 14,1 ммоль) в ТГФ (38 мл) нагревают при около 60°C в течение около 18 часов. Полученную смесь охлаждают до комнатной температуры и фильтруют через Celite®. Слой целита промывают EtOAc (50 мл), и полученный фильтрат концентрируют при пониженном давлении до получения (1R,2S,4R,5R)-4-(трет-бутоксикарбониламино)-6-(триметилсилил)бицикло[3.1.0]гексан-2- карбоновой кислоты (1,82 г, 100%): ЖХ/МС (Таблица 2, Способ a) Rt=2,62 мин; МС m/z: 312 (M−H)-.
Пример получения № 15: (1R,2R,4S,5S)-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[3.1.0]гексан-2-амин
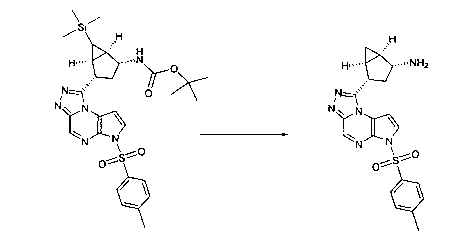
К раствору трет-бутил (1R,2R,4S,5R,)-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)-6-(триметилсилил)бицикло[3.1.0]гексан-2-илкарбамата (0,780 г, 1,34 ммоль, полученного с использованием A из примера получения № 9 и примера получения № 14, с HATU, C с TEA) в DCM (20 мл) добавляют трифторметансульфоновую кислоту (0,48 мл, 5,4 ммоль). После перемешивания при комнатной температуре в течение около 18 часов, добавляют дополнительно трифторметансульфоновую кислоту (0,48 мл, 5,4 ммоль), и полученную смесь перемешивают дополнительно в течение около 18 часов. Полученную реакционную смесь разбавляют DCM (40 мл) и медленно выливают в интенсивно перемешиваемую суспензию в ледяной воде (30 мл). Примерно через 5 минут полученную реакционную смесь нейтрализуют, используя насыщенный водный раствор NaHCO3. Слои разделяют, и водный слой экстрагируют DCM (40 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении до получения (1R,2R,4S,5S)-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[3.1.0]гексан-2-амина в виде твердого вещества светло коричневого цвета (0,55 г, 87%): ЖХ/МС (Таблица 2, Способ a) Rt=1,75 мин; МС m/z: 409 (M+H)+.
Пример получения № 16: Литий (R)-4-(трет-бутоксикарбонил)-1-метилпиперазин-2-карбоксилат
Стадия A: (R)-1-трет-бутил 3-метил 4-метилпиперазин-1,3-дикарбоксилат
К (R)-1-трет-бутил 3-метилпиперазин-1,3-дикарбоксилату (1,2 г, 4,9 ммоль, ASW Med Chem Inc) в MeCN и MeOH (1:1, 100 мл) добавляют формальдегид (37% водный, 13,2 мл, 177 ммоль), затем добавляют триацетоксиборгидрид натрия (5,20 г, 24,5 ммоль). Полученную смесь перемешивают в течение около 15 мин при комнатной температуре. По каплям добавляют AcOH (5,6 мл, 98 ммоль), и полученную смесь перемешивают в течение около 1 часа. Растворитель удаляют при пониженном давлении, и полученный остаток растворяют в DCM (100 мл) и нейтрализуют, используя водный 2 н. NaOH. Добавляют насыщенный водный раствор NaHCO3 (50 мл) и слои разделяют. Органический слой промывают солевым раствором (50 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал очищают с помощью хроматографической обработки на силикагеле, осуществляя градиентное элюирование 20-80% EtOAc/гептаном до получения (R)-1-трет-бутил 3-метил 4-метилпиперазин-1,3-дикарбоксилата (1,1 г, 85%): ЖХ/МС (Таблица 2, Способ a) Rt=1,91 мин; МС m/z: 259 (M+H)+.
Стадия B: Литий (R)-4-(трет-бутоксикарбонил)-1-метилпиперазин-2-карбоксилат
К раствору (R)-1-трет-бутил 3-метил 4-метилпиперазин-1,3-дикарбоксилата (1,2 г, 4,6 ммоль) в 1,4-диоксане (18 мл) и воде (18 мл) добавляют LiOH.H2O (0,290 г, 6,91 ммоль). После нагревания при температуре около 80°C в течение около 1 часа, полученную реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют при пониженном давлении. Твердый продукт сушат в вакуумном термостате при температуре около 65°C в течение около 18 часов до получения литий (R)-4-(трет-бутоксикарбонил)-1-метилпиперазин-2-карбоксилата (1,46 г, количественно): ЖХ/МС (Таблица 2, Способ a) Rt=1,17 мин; МС m/z: 245 (M+H)+.
Пример получения № 17: (1S,4R)-4-(трет-бутоксикарбониламино)циклопент-2-енкарбоновая кислота

К раствору (1R,4S)-2-азабицикло[2.2.1]гепт-5-ен-3-она (5,0 г, 46 ммоль) в воде (30,5 мл) добавляют водный раствор HCl (2 M, 23,0 мл, 46,0 ммоль). После нагревания при температуре около 80°C в течение около 2 часов, полученную реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют при пониженном давлении. Твердый продукт сушат в вакуумном термостате при температуре около 70°C и используют без дальнейшей очистки. К раствору гидрохлорида (1S,4R)-4-аминоциклопент-2-енкарбоновой кислоты (9,20 г, 45,8 ммоль) в 1,4-диоксане (15 мл) и воде (18,3 мл) при температуре около 0°C добавляют DIEA (32,0 мл, 183 ммоль). После перемешивания в течение около 5 мин добавляют раствор ди-трет-бутилдикарбоната (11,7 мл, 50,4 ммоль) в 1,4-диоксане (5 мл). Полученную реакционную смесь нагревают до комнатной температуры и перемешивают в течение около 18 часов. Растворитель удаляют при пониженном давлении, и сырое масло сушат в вакуумном термостате при температуре около 65°C в течение около 3 часов. Сырой продукт очищают с помощью хроматографической обработки на силикагеле, осуществляя градиентное элюирование 80-100% EtOAc/гептаном до получения (1S,4R)-4-(трет-бутоксикарбониламино)циклопент-2-енкарбоновой кислоты (5,2 г, 50% за 2 стадии): ЖХ/МС (Таблица 2, Способ a) Rt=1,81 мин; МС m/z: 226 (M−H)−.
Пример получения № 18: (1S,2R,4S,5R)-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[3.1.0]гексан-2-амин

К раствору этил (1S,2R,4S,5R)-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[3.1.0]гексан-2-илкарбамата (0,16 г, 0,34 ммоль, полученному с использованием GG из примера получения № KK.1, A из примера получения № 9 с HATU и TEA, C с TEA) в DCM (2,3 мл) добавляют триметилсилилиодид (0,11 мл, 0,75 ммоль). После перемешивания при комнатной температуре в течение около 24 часов добавляют дополнительно триметилсилилиодид (0,11 мл, 0,75 ммоль), и полученную реакционную смесь нагревают при около 40°C в течение около 4 дней. Полученную реакционную смесь охлаждают до комнатной температуры, затем добавляют насыщенный водный раствор NaHCO3 (20 мл). Полученную смесь перемешивают в течение около 5 мин и слои разделяют. Водный слой далее экстрагируют DCM (20 мл). Объединенные органические слои промывают солевым раствором (20 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении до получения (1S,2R,4S,5R)-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[3.1.0]гексан-2-амина, который содержит 1 молярный эквивалент DCM (0,17 г, 100%): ЖХ/МС (Таблица 2, Способ a) Rt=1,76 мин; МС m/z: 409 (M+H)+.
Пример получения № 19: (9H-флуорен-9-ил)метил 4-метил-3-(3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбоксилат
К раствору (9H-флуорен-9-ил)метил 3-(2-(трет-бутоксикарбонил(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)амино)ацетил)-4-метилпиперидин-1-карбоксилата (0,627 г, 0,836 ммоль, полученного с использованием W из примера получения № 20, LL, Z из примера № 8, Стадия A) в DCM (10 мл) добавляют TFA (1,50 мл, 19,5 ммоль), и полученную смесь перемешивают при комнатной температуре в атмосфере азота в течение около 1 часа. Полученный раствор концентрируют, и полученный остаток разделяют между насыщенным водным раствором NaHCO3 (25 мл) и EtOAc (25 мл). Органическую фазу промывают солевым раствором (20 мл), сушат над безводным MgSO4, фильтруют и концентрируют, получая в результате сырой (9H-флуорен-9-ил)метил 4-метил-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-иламино)ацетил)пиперидин-1-карбоксилат в виде аморфного твердого вещества коричневого цвета. Сырой материал добавляют к 1,4-диоксану (5 мл), добавляют реагент Лоуссона (0,2,3 г, 0,502 ммоль), и полученную суспензию нагревают при температуре около 80°C в течение около 20 мин. Растворитель удаляют при пониженном давлении, и полученный остаток очищают с помощью хроматографической обработки на силикагеле, осуществляя градиентное элюирование от 0 до 1,5% MeOH/DCM, получая (9H-флуорен-9-ил)метил 4-метил-3-(3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбоксилат в виде твердого вещества не совсем белого цвета (0,21 г, 40%): ЖХ/МС (Таблица 2, Способ a) Rt=2,68 мин; МС m/z: 632 (M+H)+.
Пример получения № 20: 1-(((9H-флуорен-9-ил)метокси)карбонил)-4-метилпиперидин-3-карбоновая кислота

К раствору 1-(трет-бутоксикарбонил)-4-метилпиперидин-3-карбоновой кислоты (1,50 г, 6,17 ммоль, пример № 13, Стадия G) в 1,4-диоксане (10 мл) добавляют водный раствор HCl (4 н. в 1,4-диоксане (4,62 мл, 18,5 ммоль). Полученную реакционную смесь нагревают при температуре около 60°C в течение около 16 часов перед тем, как дают остыть до комнатной температуры. К полученной смеси добавляют NaHCO3 (2,07 г, 24,7 ммоль) и воду (10,0 мл) затем добавляют (9H-флуорен-9-ил)метил 2,5-диоксопирролидин-1-илкарбонат (4,16 г, 12,3 ммоль). Полученную реакционную смесь перемешивают при температуре около 25°C в течение около 16 часов. Реакционную смесь подкисляют до около pH 1 водным раствором 1 н. HCl и экстрагируют EtOAc (75 мл). Органический слой промывают солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Продукт очищают с помощью хроматографической обработки на силикагеле (40 г колонка), осуществляя градиентное элюирование 1-5% MeOH в DCM, получая 1-(((9H-флуорен-9-ил)метокси)карбонил)-4-метилпиперидин-3-карбоновую кислоту (0,72 г, 31%) в виде прозрачного масла: ЖХ/МС (Таблица 2, Способ a) Rt=2,44 мин; МС m/z: 366 (M+H)+.
Пример получения № 21: 5-циано-N-((1R,3S)-2,2-диметил-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклобутил)пиридин-2-сульфонамид
К раствору 5-бром-N-((1R,3S)-2,2-диметил-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклобутил)пиридин-2-сульфонамида (0,69 г, 1,1 ммоль, полученного с использованием A из (1S,3R)-3-ацетамидо-2,2-диметилциклобутанкарбоновой кислоты [Tetrahedron: Asymmetry 2008, 19, 302-308] и примера получения № 9 с EDC, C с DIEA, JJ, N из 5-бромпиридин-2-сульфонилхлорид [Chem Impex]) в дегазированном ДМФ (1,5 мл) добавляют дицианоцинк (0,321 г, 2,74 ммоль) затем добавляют Pd(Ph3P)4 (0,063 г, 0,055 ммоль, Strem). Реакционную смесь нагревают при температуре около 80°C в течение около 16 часов в атмосфере азота. Полученную реакционную смесь оставляют остывать до комнатной температуры перед тем, как ее разбавляют водным раствором NaOH (1 н, 10 мл) и экстрагируют EtOAc (25 мл). Органический слой промывают солевым раствором (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный продукт очищают с помощью хроматографической обработки на силикагеле (12 г), осуществляя градиентное элюирование 1-10% MeOH в DCM, получая 5-циано-N-((1R,3S)-2,2-диметил-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклобутил)пиридин-2-сульфонамид (0,09 г, 14%) в виде твердого вещества желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,14 мин; МС m/z: 577 (M+H)+.
Пример получения № 22: 2-ацетиламино-5-карбоксиадамантан

К гидрохлориду метилового эфира E-2-амино-5-карбоксиадамантана (1,0 г, 4,1 ммоль, полученному по способу Org. Process Res. Dev., 2008, 12 (6), 1114-1118), и DIEA (2,13 мл, 12,2 ммоль) в 1,4-диоксане (15 мл) добавляют Ac2O (0,576 мл, 6,10 ммоль). Полученную реакционную смесь перемешивают при температуре около 25°C в течение около 3 часов перед добавлением водного раствора NaOH (2 н, 8,14 мл, 16,3 ммоль). Полученную реакционную смесь перемешивают при температуре около 25°C в течение около 16 часов перед тем, как ее разделяют между EtOAc (100 мл) и водным раствором 1 н. HCl (50 мл). Органический слой промывают солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая 2-ацетиламино-5-карбоксиадамантан (0,47 г, 49%) в виде твердого вещества белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,43 мин; МС m/z: 236 (M−H)−.
Пример получения № 23: 6-фтор-4-метилникотинамид
В круглодонную колбу загружают 6-фтор-4-метилникотиновую кислоту (1,13 г, 7,28 ммоль, Frontier) и DCM (73 мл), получая прозрачный раствор. По каплям добавляют тионилхлорид (5,32 мл, 72,8 ммоль), и полученную смесь перемешивают при комнатной температуре в течение ночи. Полученную реакционную смесь концентрируют досуха при пониженном давлении, и полученный остаток растворяют в EtOAc (10 мл) и по каплям добавляют к быстро перемешиваемой смеси EtOAc (40 мл) и концентрированного водного раствора NH4OH (36,9 мл, 947 ммоль). Полученную смесь перемешивают в течение около 1 часа, и слои разделяют. Водный слой далее экстрагируют EtOAc (50 мл), и объединенные экстракты промывают солевым раствором, сушат над безводным Na2SO4, фильтруют и концентрируют досуха при пониженном давлении, получая 6-фтор-4-метилникотинамид (0,69 г, 61%) в виде твердого вещества белого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,03 мин; МС m/z 153 (M−H)−.
Пример получения № 24: Гидрохлорид 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)этанамина
Стадия A: 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)этанол
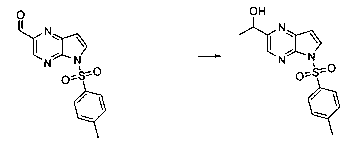
К раствору метилмагнийхлорида (0,232 мл, 0,697 ммоль) в ТГФ (10 мл) при температуре около −78°C добавляют раствор 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегида (0,210 г, 0,697 ммоль, пример № 10, Стадия B) в DCM (10,0 мл). Примерно через 10 мин к полученной реакционной смеси добавляют насыщенный водный раствор NH4Cl. После нагревания до комнатной температуры, к полученной реакционной смеси добавляют EtOAc (30 мл), и органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырой материал очищают с помощью хроматографической обработки на силикагеле, элюируя 20-80% EtOAc/гептан, получая 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)этанол (0,050 г, 23%) в виде масла желтого цвета. ЖХ/МС (Таблица 2, Способ a) Rt=2,04 мин; МС m/z: 318 (M+H)+.
Стадия B: 2-(1-азидоэтил)-5-тозил-5H-пирроло[2,3-b]пиразин

К раствору 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)этанола (0,600 г, 1,89 ммоль) в DCM (10 мл) добавляют SOCl2 (0,690 мл, 9,45 ммоль) при комнатной температуре. Примерно через 4 часа полученную реакционную смесь разбавляют EtOAc (50 мл), и насыщенный водный раствор NaHCO3 (50 мл) добавляют к полученной реакционной смеси. После того, как прекращается бурное выделение газа органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток растворяют в ДМФ (10 мл), и азид натрия (0,615 г, 9,45 ммоль) добавляют к полученной реакционной смеси. Примерно через 15 часов к полученной реакционной смеси добавляют EtOAc (50 мл) и воду (50 мл). Органический слой выделяют, концентрируют при пониженном давлении, и очищают с помощью хроматографической обработки на силикагеле, элюируя 20-80% EtOAc/гептаном, получая 2-(1-азидоэтил)-5-тозил-5H-пирроло[2,3-b]пиразин (0,65 г, 100%) в виде бесцветного твердого вещества: ЖХ/МС (Таблица 2, Способ a) Rt=2,67 мин; МС m/z: 343 (M+H)+.
Стадия C: Гидрохлорид 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)этанамина
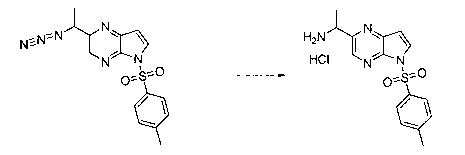
К раствору 2-(1-азидоэтил)-5-тозил-5H-пирроло[2,3-b]пиразина (0,65 г, 1,9 ммоль) в ТГФ (10 мл) и воде (5 мл) добавляют трифенилфосфин (0,598 г, 2,28 ммоль). Полученную реакционную смесь нагревают до около 45°C, и примерно через 12 часов полученную реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Полученный остаток растворяют в EtOAc (40 мл), и через полученный раствор пропускают газообразный HCl до достижения pH=1. Медленно добавляют Et2O (40 мл) и растворитель декантируют, получая твердое вещество. Твердый продукт сушат в вакууме, получая гидрохлорид 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)этанамина (0,65 г, 97%) в виде твердого вещества желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,56 мин; МС m/z: 317 (M+H)+.
Пример получения № 25: 2,2-диметил-4-оксоциклопентанкарбоновая кислота
К раствору 4,4-диметилциклопент-2-енона (2,0 г, 18 ммоль) в EtOH (50 мл), воде (7,5 мл) и AcOH (1,5 мл) добавляют цианид калия (2,36 г, 36,3 ммоль). Полученную реакционную смесь нагревают до около 40°C и примерно через 15 часов реакционную смесь концентрируют при пониженном давлении. Полученный остаток разбавляют EtOAc (50 мл) и промывают солевым раствором. Органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют. Полученный остаток растворяют в водном растворе HCl (6 н, 50 мл) и нагревают при кипении с обратным холодильником. Примерно через 3 дня полученную реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении, получая 2,2-диметил-4-оксоциклопентанкарбоновую кислоту (3,7 г, 90%, ~70% чистоты по данным 1H ЯМР), которую используют без дополнительной очистки: ЖХ/МС (Таблица 2, Способ a) Rt=1,30 мин; МС m/z: 155 (M−H)−.
Пример получения № 26: 4-(трет-бутоксикарбониламино)бицикло[2.2.1]гептан-1-карбоновая кислота
Стадия A: 4-(метоксикарбонил)бицикло[2.2.1]гептан-1-карбоновая кислота
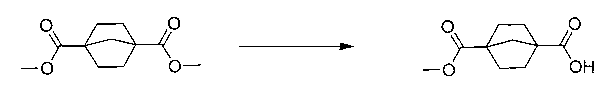
К раствору диметил бицикло[2.2.1]гептан-1,4-дикарбоксилата (2,00 г, 9,44 ммоль, по способу Aust. J. Chem., 1985, 38, 1705-18) в MeOH (47 мл) добавляют KOH (0,475 г, 8,46 ммоль) и воду (2,5 мл). Полученную реакционную смесь перемешивают при кипении с обратным холодильником в течение около 16 часов и затем охлаждают до комнатной температуры и концентрируют досуха при пониженном давлении. К оставшемуся остатку добавляют воду (25 мл), и полученную смесь экстрагируют Et2O (2×25 мл). Водный слой подкисляют до около pH 4, используя водный раствор 6 н. HCl, и экстрагируют DCM (3×20 мл). Объединенные DCM экстракты сушат над безводным MgSO4, фильтруют и концентрируют, получая 4-(метоксикарбонил)бицикло[2.2.1]гептан-1-карбоновую кислоту в виде твердого вещества не совсем белого цвета (1,19 г, 71%): 1H ЯМР (400 МГц, ДМСО-d 6) δ 12,19 (с, 1H), 3,61 (с, 3H), 1,92 (д, J=6,6 Гц, 4H), 1,76 (с, 2H), 1,65-1,54 (м, 4H).
Стадия B: Метил 4-(трет-бутоксикарбониламино)бицикло[2.2.1]гептан-1-карбоксилат
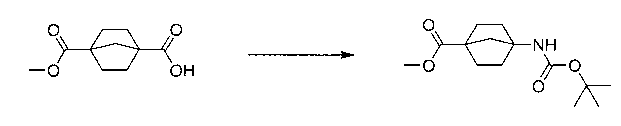
К раствору 4-(метоксикарбонил)бицикло[2.2.1]гептан-1-карбоновой кислоты (2,01 г, 10,1 ммоль) в толуоле (30 мл) добавляют дифенилфосфорилазид (2,20 мл, 10,2 ммоль) и TEA (1,60 мл, 11,5 ммоль). Полученную смесь перемешивают при комнатной температуре в течение около 1 часа, затем нагревают при температуре около 50°C в течение около 3 часов, и затем нагревают при температуре около 70°C в течение около 2 часов. Реакционную смесь охлаждают до комнатной температуры и концентрируют досуха при пониженном давлении. Полученный остаток разбавляют в трет-бутаноле (10,0 мл, 105 ммоль), и полученную смесь нагревают при температуре около 80°C в течение около 16 часов. Полученную реакционную смесь охлаждают до комнатной температуры и растворяют в Et2O (50 мл). Органический слой промывают водой, водным раствором 1 M NaOH, водой и солевым раствором (25 мл каждый). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют, получая метил 4-(трет-бутоксикарбониламино)бицикло[2.2.1]гептан-1-карбоксилат в виде твердого вещества не совсем белого цвета (2,22 г, 81%): 1H ЯМР (400 МГц, ДМСО-d6) δ 7,03 (с, 1H), 3,59 (с, 3H), 1,95-1,74 (м, 6H), 1,60 (с, 4H), 1,37 (с, 9H).
Стадия C: 4-(трет-бутоксикарбониламино)бицикло[2.2.1]гептан-1-карбоновая кислота
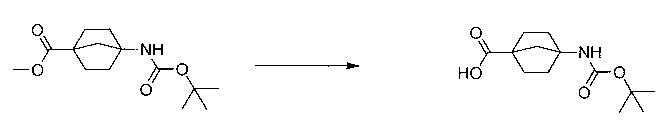
К раствору метил 4-(трет-бутоксикарбониламино)бицикло[2.2.1]гептан-1-карбоксилата (2,21 г, 8,20 ммоль) в ТГФ (27 мл) и MeOH (14 мл) добавляют водный раствор NaOH (1 н, 20,0 мл, 20,0 ммоль). Полученную смесь перемешивают при комнатной температуре в течение около 16 часов и концентрируют досуха при пониженном давлении. К оставшемуся остатку добавляют воду (25 мл), и полученную смесь экстрагируют Et2O (2×25 мл), и Et2O экстракты сливают. Водный слой подкисляют до около pH 4, используя водный раствор 6 н. HCl и экстрагируют Et2O (3×10 мл). Объединенные органические слои сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая 4-(трет-бутоксикарбониламино)бицикло[2.2.1]гептан-1-карбоновую кислоту в виде твердого вещества не совсем белого цвета (1,69 г, 81%): 1H ЯМР (400 МГц, ДМСО-d 6) δ 12,07 (с, 1H), 7,00 (с, 1H), 2,00-1,69 (м, 6H), 1,67-1,45 (м, 4H), 1,37 (с, 9H).
Пример получения № 27: 6-хлор-4-(трифторметил)никотинамид
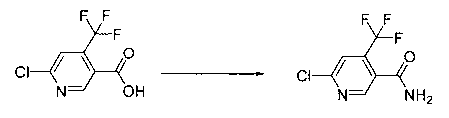
6-хлор-4-(трифторметил)никотиновую кислоту (1,0 г, 4,4 ммоль, Oakwood) растворяют в DCM (44 мл), получая прозрачный раствор, по каплям добавляют SOCl2 (3,2 мл, 44 ммоль), и полученную реакционную смесь перемешивают при комнатной температуре в течение ночи и затем при кипении с обратным холодильником в течение около 16 часов. Полученную смесь концентрируют при пониженном давлении, получая масло желтого цвета, которое растворяют в EtOAc (10 мл). Полученный раствор по каплям добавляют к быстро перемешиваемой смеси EtOAc (20 мл) и концентрированного водного раствора NH4 OH (22 мл, 580 ммоль). Полученную мутную смесь перемешивают в течение около 2 часов и разделяют. Водный слой далее экстрагируют EtOAc (30 мл). Объединенные органические экстракты промывают солевым раствором, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая 6-хлор-4-(трифторметил)никотинамид (0,85 г, 85%) в виде твердого вещества не совсем белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,62 мин; МС m/z: 223 (M+H)+.
Пример получения № 28: Гидрохлорид (5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метанамина
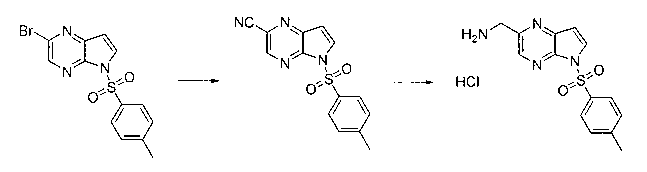
В 5-л реактор загружают 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (98,8 г, 281 ммоль, пример получения № 7), цинковую пыль (3,50 г, 53,3 ммоль), трифторацетат палладия (II) (4,0 г, 12 ммоль), и рацемический-2-(ди-трет-бутилфосфино)-1,1′-бинафтил (9,8 г, 24,7 ммоль). Колбу снабжают устройством для добавления порошка, в которое помещают цианид цинка (10,0 г, 157 ммоль), чтобы добавить его на последней стадии. Реактор продувают аргоном не дольше, чем около 30 мин, и затем в реактор добавляют DMA (2 л), разбрызгиваемый аргоном. Полученную смесь перемешивают и нагревают при около 50°C, продолжая поддерживать разбрызгивание аргоном. Полученный темно коричневый раствор продолжают нагревать при около 95°C, добавляя при этом цианид цинка из устройства для добавления порошка, порциями в течение около 15 мин. После достижения около 95°C, коричневую смесь перемешивают в течение дополнительно около 16 часов. Полученную реакционную смесь охлаждают до комнатной температуры, получая в осадке соли. Полученную смесь фильтруют через воронку Бюхнера, содержащую фильтрующий агент, и фильтровальную лепешку промывают DMA (20 мл). Раствор сырого продукта в DMA добавляют в холодную (<10°C) воду (16 л), и перемешивают в течение около 30 мин. Полученную суспензию фильтруют, и фильтровальную лепешку снова промывают водой (1 л). Полученную влажную лепешку сушат в вакуумном термостате при температуре около 50°C. Сырое твердое вещество растворяют в DCM (1,5 л) и сушат далее над безводным MgSO4. После фильтрования, полученный раствор пропускают через слой двуокиси кремния (140 г), промывая дополнительным количеством растворителя до тех пор, пока только заранее определенные примеси не будут детектированы как элюирующиеся из слоя. Полученный растворитель удаляют, и сырое твердое вещество тщательно растирают с MeOH/DCM (4:1, 10 объемов растворителя на грамм сырого твердого вещества) при комнатной температуре в течение около 5 часов. Твердый продукт фильтруют и промывают MeOH (300 мл). Полученный продукт сушат в вакуумном термостате, получая 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбонитрил (58,8 г, 70%) в виде бесцветного твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1H), 8,21 (д, J=4,2 Гц, 1H), 8,07 (д, J=8,4 Гц, 2H), 7,34 (д, J=8,1 Гц, 2H), 6,89 (д, J=4,2 Гц, 1H), 2,42 (с, 3H). В 2-литровый реактор из нержавеющей стали 316 под давлением загружают 5% Pd/C (15,4 г 63,6 вес % воды, влажный материал, 5,6 г в расчете на сухой вес, Johnson Matthey A503032-5), 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбонитрил (55 г, 184 ммоль), ТГФ (1,1 л), деионизированную воду (165 мл), водный раствор HCl, (37 вес %, 30 мл, 369 ммоль) и хинолин (1,1 мл, 9,0 ммоль). Реактор продувают, герметизируют и поддерживают давление 275 кПа водорода, подаваемого из резервуара под высоким давлением. Полученную смесь интенсивно перемешивают при температуре около 25°C. Примерно через 5 часов реактор открывают и продувают азотом для удаления большей части растворенного водорода, и полученную реакционную смесь фильтруют для удаления катализатора. Реактор и лепешку катализатора промывают смесью ТГФ:H2O (1:1, 2×40 мл). Объединенные фильтрат и промывки концентрируют, и добавляют EtOH (500 мл). После двух дополнительных замен растворителя на EtOH (2×500 мл), сырой остаток концентрируют, получая остаток (76 г), который суспендируют в EtOH (550 мл) и перемешивают при комнатной температуре в течение около 4 часов. Твердый продукт собирают фильтрованием и промывают холодным EtOH (50 мл). Влажную лепешку сушат в вакуумном термостате, получая гидрохлорид (5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метанамина (51,2 г, 82%) в виде бесцветного твердого вещества: ЖХ/МС (Таблица 2, Способ a) Rt=1,44 мин; МС m/z: 303 (M+H)+.
Общая процедура A: Получение гидразида из карбоновой кислоты
К смеси 2-гидразинилпирроло[2,3-b]пиразина (предпочтительно, 1 эквивалент) и карбоновой кислоты (1-2 эквивалента, предпочтительно, 1,1-1,3 эквивалента) в растворителе, таком как DCM или ТГФ, предпочтительно, DCM, добавляют связующий агент, такой как EDC.HCl или HATU (1,0-2,0 эквивалента, предпочтительно, 1,2-1,6 эквивалента) с органическим основанием (или без него) таким как TEA или DIEA (2-5 эквивалентов, предпочтительно, 3-4 эквивалента). Примерно через 1-72 часа (предпочтительно, 2-6 часов) при температуре около 20-60°C (предпочтительно, около комнатной температуры), реакционную смесь обрабатывают, используя один из следующих способов. Способ 1: Добавляют воду и слои разделяют. Необязательно полученную смесь фильтруют через Celite® до разделения слоев. Водный слой затем экстрагируют органическим растворителем, таким как EtOAc или DCM. Объединенные органические слои необязательно промывают солевым раствором, сушат над безводным Na2SO4 или MgSO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 2: Реакционную смесь разбавляют органическим растворителем, таким как EtOAc или DCM и промывают или водой или солевым раствором или обоими сразу. Водный слой затем необязательно экстрагируют органическим растворителем, таким как EtOAc или DCM. Затем органический слой или объединенные органические слои необязательно промывают солевым раствором, сушат над безводным Na2SO4 или MgSO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 3: Реакционную смесь разбавляют органическим растворителем, таким как EtOAc или DCM и добавляют воду. Слои разделяют, и органический слой непосредственно очищают, используя хроматографию. Во всех случаях сырой материал необязательно очищают осаждением, кристаллизацией и/или тщательно растирая с соответствующим растворителем или растворителями и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры A
Пример получения № A.1: Трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамат
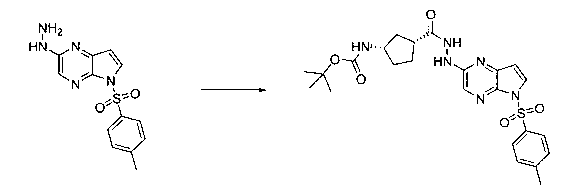
К смеси 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразина (2,50 г, 8,24 ммоль, пример получения № 9) и (1R,3S)-3-(трет-бутоксикарбониламино)циклопентанкарбоновой кислоты (2,08 г, 9,07 ммоль, Peptech) в DCM (30 мл) добавляют EDC.HCl (1,90 г, 9,89 ммоль). Примерно через 4,5 часа при комнатной температуре, добавляют воду (30 мл) и слои разделяют. Водный слой затем экстрагируют EtOAc (15 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал растворяют в DCM (15 мл) и очищают с помощью хроматографической обработки на силикагеле, осуществляя градиентное элюирование 40-100% EtOAc в гептане, получая трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамат (4,20 г, 97%): ЖХ/МС (Таблица 2, Способ a) Rt=2,27 мин; МС m/z: 515 (M+H)+.
Общая процедура B: Получение гидразида из хлорангидрида с последующей циклизацией и гидролизом сульфонамида
К раствору 5-сульфонил-2-гидразинил-5H-пирроло[2,3-b]пиразина (предпочтительно, 1 эквивалент) и TEA или DIEA (1-10 эквивалентов, предпочтительно, 4 эквивалента) в 1,4-диоксане при температуре около 0-25°C (предпочтительно, комнатной температуре) добавляют хлорангидрид (1-1,5 эквивалента, предпочтительно, 1 эквивалент). После завершения добавления, реакционную смесь оставляют нагреться до комнатной температуры, если вначале ее охлаждали. Примерно через 0,5-2 часа (предпочтительно, около 1 часа), добавляют SOCl2 (1-10 эквивалентов, предпочтительно, 3 эквивалента) и реакционную смесь нагревают при температуре около 60-100°C (предпочтительно, около 80-90°C) в течение около 0,25-8 часов (предпочтительно, около 1 часа). Реакционную смесь оставляют охлаждаться до комнатной температуры, и затем добавляют водный раствор основания (такой как водный раствор Na2CO3 или водный раствор NaOH, предпочтительно, водный раствор NaOH) с последующим необязательным, но предпочтительным, добавлением MeOH (5-50% реакционного объема, предпочтительно, 50%). Реакционную смесь нагревают при температуре около 50-90°C в течение около 1-96 часов (предпочтительно, около 3 часов при температуре около 60°C, если используют водный раствор NaOH, или около 3 дней при температуре около 90°C, если используют водный раствор Na2CO3). Реакционную смесь концентрируют при пониженном давлении и затем разделяют между органическим растворителем (таким как EtOAc или DCM, предпочтительно, EtOAc) и водой, насыщенным водным раствором NaHCO3 и/или солевым раствором, предпочтительно, насыщенным водным раствором NaHCO3. Органический слой выделяют, и необязательно промывают водой и/или солевым раствором, сушат над безводным Na2SO4 или MgSO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Сырой материал необязательно очищают осаждением, кристаллизацией, и/или тщательно растирая с соответствующим растворителем или растворителями и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры B
Пример № B.1.1 1-(2-метилциклогексил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин
К раствору 5-(4-трет-бутилфенилсульфонил)-2-гидразинил-5H-пирроло[2,3-b]пиразина (0,40 г, 1,2 ммоль, пример получения № 3) и DIEA (0,20 мл, 1,2 ммоль) в 1,4-диоксане (12 мл) при температуре около 0°C добавляют 2-метилциклогексанкарбонилхлорид (0,19 г, 1,2 ммоль, пример получения № 4). После завершения добавления, баню со льдом удаляют, и реакционную смесь оставляют нагреваться до комнатной температуры. Примерно через 1 час, добавляют SOCl2 (0,42 мл, 5,8 ммоль), и реакционную смесь нагревают при температуре около 90°C в течение около 1 часа. Реакционной смеси дают остыть до комнатной температуры и затем добавляют 2 M водный раствор Na2CO3 (2 н, 11,6 мл, 23,2 ммоль) и MeOH (12 мл). Реакционную смесь нагревают при температуре около 90°C в течение около 3 дней. Реакционную смесь концентрируют при пониженном давлении и затем разделяют между EtOAc (50 мл) и насыщенным водным раствором NaHCO3 (40 мл). Органический слой выделяют и сушат над безводным Na2SO4, фильтруют и полученный растворитель концентрируют при пониженном давлении. Полученный остаток очищают на силикагеле (12 г), используя EtOAc в качестве элюента и затем очищают далее, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ b). Объединенные содержащие продукт фракции концентрируют при пониженном давлении для удаления MeCN, и полученный осадок собирают вакуумным фильтрованием до получения 1-(2-метилциклогексил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина в виде твердого вещества белого цвета (0,10 г, 35%): ЖХ/МС (Таблица 2, Способ a) Rt=1,84 мин; МС m/z: 256 (M+H)+.
Общая процедура C: Циклизация гидразида
К раствору 2-гидразинил-5H-пирроло[2,3-b]пиразина (предпочтительно, 1 эквивалент) в органическом растворителе (например, 1,4-диоксане) добавляют основание, такое как TEA или DIEA (1-5 эквивалентов, предпочтительно, 2-4 эквивалента) и SOCl2 (1-5 эквивалентов, предпочтительно, 1-2 эквивалента). Полученную смесь нагревают при температуре около 60-100°C (предпочтительно, около 80°C) в течение около 1-16 часов (предпочтительно, около 1-2 часов). Полученную реакционную смесь охлаждают до комнатной температуры и обрабатывают, используя один из следующих способов. Способ 1: Добавляют органический растворитель (такой как EtOAc или DCM) и воду. Слои разделяют, и водный слой необязательно экстрагируют дополнительным количеством органического растворителя. Объединенные органические слои необязательно промывают водным раствором основания (такого как NaHCO3) и/или солевым раствором, сушат над безводным Na2SO4 или MgSO4, затем декантируют или фильтруют до концентрирования при пониженном давлении. Способ 2: Добавляют органический растворитель (такой как EtOAc или DCM) и органический слой необязательно промывают солевым раствором или водой, сушат над безводным MgSO4 или Na2SO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 3: Полученную реакционную смесь разделяют между органическим растворителем (таким как EtOAc или DCM) и насыщенным водным раствором NaHCO3 или солевым раствором, сушат над безводным Na2SO4 или MgSO4, затем декантируют или фильтруют до концентрирования при пониженном давлении. Сырой материал необязательно очищают осаждением, кристаллизацией, и/или тщательно растирая с соответствующим растворителем или растворителями и/или, используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры C
Пример получения № C.1: Трет-бутил-(1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат
К раствору трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамата (9,30 г, 18,1 ммоль, пример получения № A.1) в 1,4-диоксане (100 мл) добавляют TEA (10,0 мл, 72,3 ммоль) и SOCl2 (2,11 мл, 28,9 ммоль). Полученную смесь нагревают при температуре около 80°C в течение около 1,5 часа. Полученную реакционную смесь охлаждают до комнатной температуры, добавляют EtOAc и воду (200 мл каждого), и слои разделяют. Водный раствор экстрагируют EtOAc (2×100 мл) и объединенные органические слои промывают насыщенным водным раствором NaHCO3 и солевым раствором (100 мл каждый). Органические экстракты сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырой материал очищают с помощью хроматографической обработки на силикагеле, осуществляя градиентное элюирование 25-100% EtOAc в DCM, получая трет-бутил-(1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат (7,65 г, 85%): ЖХ/МС (Таблица 2, Способ a) Rt=2,37 мин; МС m/z: 497 (M+H)+.
Общая процедура D: Циклизация гидразида с последующим гидролизом сульфонамида и удалением Boc-защитных групп
В круглодонную колбу загружают 5-сульфонил-2-гидразинил-5H-пирроло[2,3-b]пиразин (предпочтительно, 1 эквивалент), органический растворитель (такой как 1,4-диоксан или ТГФ, предпочтительно, 1,4-диоксан), SOCl2 (2-5 эквивалентов, предпочтительно, 2 эквивалента) и органическое основание, такое как DIEA или TEA (0-5 эквивалентов, предпочтительно, 3 эквивалента). Полученную смесь перемешивают при температуре около 25-120°C (предпочтительно, около 90°C) в течение около 0,25-5 часов (предпочтительно, около 1 часа) и затем оставляют охлаждаться до комнатной температуры. К полученной реакционной смеси добавляют водный раствор основания (такой как водный раствор Na2CO3 или водный раствор NaOH, 1-30 эквивалентов, предпочтительно, 1-2 эквивалента для водного раствора NaOH, предпочтительно, 15-20 эквивалентов для водного раствора Na2CO3) и полученную смесь нагревают при температуре около 60-120°C (предпочтительно, около 90°C) в течение около 1-10 часов (предпочтительно, около 5 часов) затем оставляют остывать до комнатной температуры. MeOH (5-50% реакционного объема, предпочтительно, 20-30%) добавляют к полученной реакционной смеси, и полученный раствор нагревают при температуре около 60-120°C (предпочтительно, около 90°C) в течение около 5-24 часов (предпочтительно, около 16 часов) и затем оставляют охлаждаться до комнатной температуры. Слои разделяют, и органический растворитель концентрируют при пониженном давлении. К полученному остатку добавляют органический растворитель (такой как 1,4-диоксан или ТГФ, предпочтительно, 1,4-диоксан) затем раствор HCl, такой как 4 M HCl в 1,4-диоксане (20-40 эквивалентов, предпочтительно, 25 эквивалентов). Полученную суспензию перемешивают при температуре около 20-80°C (предпочтительно, около 60°C) в течение около 1-16 часов (предпочтительно, около 1 часа) и затем оставляют охлаждаться до комнатной температуры. Твердый продукт собирают вакуумным фильтрованием, промывают органическим растворителем (таким как 1,4-диоксан, EtOAc и/или Et2O, предпочтительно, 1,4-диоксаном и затем Et2O), получая в результате сырой продукт как соль HCl. Сырой материал необязательно очищают осаждением, кристаллизацией, или тщательно растирая с соответствующим растворителем или растворителями или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры D
Пример № D.1.1 Гидрохлорид цис-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанамина и цис-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанамин
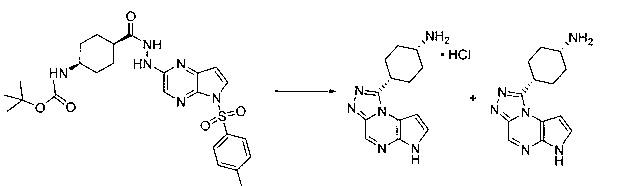
В круглодонную колбу загружают цис-трет-бутил-4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклогексилкарбамат (0,415 г, 0,785 ммоль, полученный с использованием A из цис-4-(трет-бутоксикарбониламино)циклогексанкарбоновой кислоты [AMRI] и примера получения № 9), 1,4-диоксан (9 мл) и SOCl2 (0,115 мл, 1,57 ммоль). Полученную смесь нагревают при температуре около 90°C в течение около 1 часа, и затем оставляют охлаждаться до комнатной температуры. К полученной реакционной смеси добавляют водный раствор Na2CO3 (5 н, 7,85 мл, 15,7 ммоль), и полученную реакционную смесь нагревают при температуре около 90°C в течение около 5 часов. MeOH (5 мл) добавляют к полученной реакционной смеси, и полученную смесь нагревают при температуре около 90°C в течение около 16 часов и затем оставляют охлаждаться до комнатной температуры. Слои разделяют, и органический слой концентрируют при пониженном давлении. К полученному остатку добавляют 1,4-диоксан (10 мл) затем HCl (4 M в 1,4-диоксане, 5 мл, 20,0 ммоль). Полученную суспензию нагревают при температуре около 60°C в течение около 1 часа и затем оставляют охлаждаться до комнатной температуры. Твердый продукт собирают вакуумным фильтрованием, промывают вначале 1,4-диоксаном (1 мл), затем Et2O (50 мл), получая в результате сырой продукт, гидрохлорид цис-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанамина (0,42 г, 98%, 84% чистоты). Часть сырой соли HCl (0,075 г) затем очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ g), получая цис-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанамин (0,044 г) с 3 эквивалентами NH4OAc в качестве эксципиента. ЖХ/МС (Таблица 2, Способ a) Rt=0,92 мин; МС m/z: 257 (M+H)+.
Примеры получения с использованием общей процедуры D
(полученный с использованием A из (1S,3R)-3-(трет-бутоксикарбониламино)-циклопентанкарбоновой кислоты [PepTech] и примера получения № 9)
(полученный с использованием A из транс-4-(трет-бутоксикарбониламино)-циклогексанкарбоновой кислоты [AMRI] и примера получения № 9)
Общая процедура E: Циклизация гидразида с последующим гидролизом сульфонамида
К раствору 5-сульфонил-2-гидразинил-5H-пирроло[2,3-b]пиразина (предпочтительно, 1 эквивалент) в растворителе, таком как 1,4-диоксан, добавляют SOCl2 (1-5 эквивалентов, предпочтительно, 1-2 эквивалента). Необязательно, органическое основание, такое как TEA или DIEA, (1-5 эквивалентов, предпочтительно, 2-4 эквивалента) добавляют, перед SOCl2, особенно для Boc-защищенных субстратов. Реакционную смесь нагревают при температуре около 60-100°C (предпочтительно, около 80°C). Примерно через 0,5-6 часов (предпочтительно, около 1-2 часов), добавляют водный раствор основания (такой как водный раствор Na2CO3 или водный раствор NaOH, 1-90 эквивалентов, предпочтительно, 15-20 эквивалентов для водного раствора Na2CO3 или 1-2 эквивалента для водного раствора NaOH), и нагревание возобновляют при температуре около 60-90°C. (предпочтительно, около 80°C) в течение около 1-72 часов (предпочтительно, около 1-16 часов). Необязательно, но, предпочтительно, реакционную смесь охлаждают до комнатной температуры на период времени 5 мин-72 часа, причем в это время MeOH и/или дополнительный водный раствор основания (такой как насыщенный раствор Na2CO3 или 1 н. NaOH) можно добавить, и нагревание необязательно возобновляют при температуре около 60-90°C (предпочтительно, около 80°C) в течение около 1-72 часов (предпочтительно, около 1-16 часов). Указанный цикл необязательного охлаждения до комнатной температуры и добавления основания может происходить вплоть до четырех раз. Реакционную смесь обрабатывают, используя один из следующих способов. Способ 1: Органический растворитель, такой как EtOAc или DCM добавляют при необязательном добавлении воды, солевого раствора, или насыщенного водного раствора NH4Cl (предпочтительно, воды), и слои разделяют. Водный слой затем необязательно экстрагируют дополнительным количеством органического растворителя, такого как EtOAc или DCM. Объединенные органические слои необязательно промывают солевым раствором или водой, сушат над безводным MgSO4 или Na2SO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 2: Полученную реакционную смесь декантируют, и нерастворимый материал промывают органическим растворителем, таким как EtOAc. Объединенные органические слои концентрируют при пониженном давлении. Способ 3: Полученную реакционную смесь концентрируют при пониженном давлении для удаления растворителя. Добавляют воду, и водный слой экстрагируют органическим растворителем, таким как EtOAc или DCM. Объединенные органические слои необязательно промывают солевым раствором или водой, сушат над безводным MgSO4 или Na2SO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 4: Реакционную смесь, содержащую осадок, фильтруют для сбора целевого соединения, при этом необязательно промывая водой. Полученный фильтрат необязательно концентрируют и очищают, получая в результате дополнительное целевое соединение. Способ 5: рН полученной реакционной смеси доводят до нейтрального значения, используя дополнительное количество подходящего водного раствора кислоты (такого как водный раствор HCl) перед экстрагированием органическим растворителем, таким как EtOAc или DCM. Объединенные органические слои необязательно промывают солевым раствором или водой, сушат над безводным MgSO4 или Na2SO4, фильтруют или декантируют и концентрируют при пониженном давлении. Во всех случаях сырой материал необязательно очищают осаждением, кристаллизацией и/или тщательно растирая с соответствующим растворителем или растворителями и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры E
Пример № E.1: Трет-бутил (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат
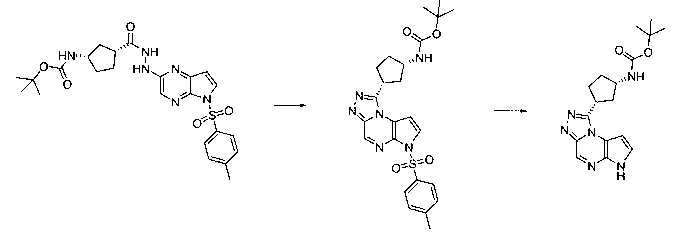
К раствору трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамата (4,73 г, 9,19 ммоль, пример получения № A.1) в 1,4-диоксане (50 мл) добавляют TEA (5,10 мл, 36,8 ммоль) и SOCl2 (1,34 мл, 18,4 ммоль). Полученную реакционную смесь нагревают при температуре около 80°C. Примерно через 1,5 часа добавляют насыщенный водный раствор Na2CO3 (100 мл) и нагревание возобновляют при температуре около 80°C в течение около 6 часов. Реакционную смесь охлаждают до комнатной температуры в течение около 3 дней, и затем нагревают при температуре около 80°C в течение около 16 часов. Добавляют воду и EtOAc (100 мл каждый) и слои разделяют. Водный слой затем экстрагируют дополнительным количеством EtOAc (2×100 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырое твердое вещество тщательно растирают с петролейным эфиром (Т.кипения 30-60°C; 30 мл) и собирают вакуумным фильтрованием, промывая при этом дополнительным количеством петролейного эфира (Т.кипения 30-60°C; 20 мл), получая трет-бутил (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат в виде твердого вещества светло коричневого цвета (2,86 г, 86%): ЖХ/МС (Таблица 2, Способ a) Rt=1,75 мин; МС m/z: 343 (M+H)+.


Общая процедура F: Циклизация гидразида с удалением Boc-защитных групп с последующим гидролизом сульфонамида
К раствору 5-сульфонил-2-гидразинил-5H-пирроло[2,3-b]пиразина (предпочтительно, 1 эквивалент) и TEA или DIEA (0-6 эквивалентов, предпочтительно 1 эквивалент) в 1,4-диоксане, добавляют SOCl2 (2,0-6,0 эквивалентов, предпочтительно, 3 эквивалента). Реакционную смесь нагревают при температуре около 60-120°C (предпочтительно, около 80-90°C) в течение около 1-8 часов (предпочтительно, около 1-4 часов). Реакционную смесь оставляют охлаждаться до комнатной температуры, затем необязательно, но предпочтительно, разбавляют сорастворителем (таким как MeOH или EtOH, предпочтительно, MeOH), используя 5-50% реакционного объема (предпочтительно, 50%). Добавляют водный раствор основания (такой, как водный раствор Na2CO3 или водный раствор NaOH, 1-30 эквивалентов, предпочтительно, 1-2 эквивалента для водного раствора NaOH, предпочтительно, 15-20 эквивалентов для водного раствора Na2CO3) и реакционную смесь нагревают при температуре около 40-90°C (предпочтительно, около 60°C) в течение около 1-24 часов (предпочтительно, около 2 часов) перед тем, как ее концентрируют при пониженном давлении. Сырой материал необязательно очищают осаждением, осаждением полученной соли, кристаллизацией, и/или тщательно растирая с соответствующим растворителем или растворителями и/или, используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры F
Пример № F.1.1: Гидрохлорид ((1R,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)метанамина

К раствору трет-бутил((1R,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентил)метилкарбамата (0,60 г, 1,1 ммоль, полученный с использованием A из (1R,3R)-3-((трет-бутоксикарбониламино)метил)циклопентанкарбоновой кислоты [AFID] и примера получения № 9) и DIEA (0,79 мл, 4,5 ммоль) в 1,4-диоксане (5 мл) добавляют SOCl2 (0,166 мл, 2,27 ммоль). Полученную реакционную смесь нагревают при температуре около 80°C в течение около 1 часа перед тем, как ее оставляют охлаждаться до комнатной температуры. Водный раствор NaOH (2 н, 4 мл, 8 ммоль) добавляют к полученной реакционной смеси и ее нагревают при температуре около 60°C в течение около 2 часов. Полученную реакционную смесь оставляют охлаждаться до комнатной температуры перед тем, как ее концентрируют при пониженном давлении. К полученному остатку добавляют HCl (4 н. в 1,4-диоксане (20 мл). Органический раствор декантируют из полученного осадка до получения гидрохлорида ((1R,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)метанамина в виде твердого вещества желтого цвета (0,11 г, 33%): ЖХ/МС (Таблица 2, Способ a) Rt=1,01 мин; МС m/z: 257 (M+H)+.
Примеры получений с использованием общей процедуры F
Общая процедура G: Получение гидразона с последующей циклизацией и гидролизом сульфонамида
К раствору 2-гидразинил-5-сульфонил-5H-пирроло[2,3-b]пиразина (предпочтительно, 1 эквивалент) в органическом растворителе или растворителях, таких как MeOH или MeOH/DCM (предпочтительно, MeOH) добавляют раствор альдегида (1,0-1,3 эквивалента, предпочтительно, 1,0 эквивалент) в органическом растворителе таком как DCM. Полученную реакционную смесь перемешивают при температуре около 15-30°C (предпочтительно, при комнатной температуре) в течение около 1-8 часов (предпочтительно, около 2 часов) перед тем, как добавляют диацетат иодобензола (1-3 эквивалента, предпочтительно, 1 эквивалент). Реакционную смесь перемешивают при температуре около 15-30°C (предпочтительно, при комнатной температуре) в течение около 15-60 минут (предпочтительно, около 30 минут) перед тем, как ее концентрируют до постоянного веса. К полученному остатку добавляют органический растворитель, такой как 1,4-диоксан, ТГФ, MeOH или EtOH (предпочтительно, 1,4-диоксан), затем водный раствор основания, такой как водный раствор Na2CO3 или NaOH (2-50 эквивалентов), предпочтительно, NaOH (2 эквивалента). Реакционную смесь нагревают при температуре около 40-80°C (предпочтительно, около 60°C) в течение около 1-24 часов (предпочтительно, около 2 часов). Сырой продукт необязательно очищают осаждением, кристаллизацией, и/или тщательно растирая с соответствующим растворителем или растворителями и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры G
Пример № G.1.1: 1-(тетрагидро-2H-пиран-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин

К раствору 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразина (0,100 г, 0,330 ммоль, пример получения № 9) в MeOH (2 мл) добавляют тетрагидро-2H-пиран-4-карбальдегид (0,038 г, 0,330 ммоль, J&W PharmLab) в DCM (1 мл). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 2 часов перед тем, как добавляют диацетат иодобензола (0,106 г, 0,330 ммоль). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 15 мин перед тем, как ее концентрируют до постоянного веса. К полученному остатку добавляют MeOH (2 мл) затем водный раствор NaOH (2 н, 0,330 мл, 0,659 ммоль). Полученную реакционную смесь нагревают при температуре около 60°C в течение около 1 часа. Сырую реакционную смесь очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ f). Объединенные содержащие продукт фракции концентрируют при пониженном давлении для удаления MeCN, и затем лиофилизируют до получения 1-(тетрагидро-2H-пиран-4-ил)-6H-пирроло[2,3-e][1,2,4]-триазоло[4,3-a]пиразина в виде твердого вещества белого цвета (0,028 г, 35%): ЖХ/МС (Таблица 2, Способ a) Rt=1,25 мин; МС m/z: 244 (M+H)+.
Примеры получений из 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразина (Пример получения № 9) с использованием общей процедуры G
Общая процедура H: Гидролиз сульфонамида
В колбу, содержащую сульфонамид, например, сульфонил-защищенный пиррол, (предпочтительно, 1 эквивалент) в органическом растворителе (таком как 1,4-диоксан, MeOH, или ТГФ/MeOH, предпочтительно, 1,4-диоксан) добавляют водный раствор основания (такой как водный раствор Na2CO3 или водный раствор NaOH, 1-30 эквивалентов, предпочтительно, 1-2 эквивалента для водного раствора NaOH, предпочтительно, 15-20 эквивалентов для водного раствора Na2CO3). Полученную смесь перемешивают при температуре около 25-100°C (предпочтительно, около 60°C) в течение около 1-72 часов (предпочтительно, около 1-16 часов). В том случае, если по данным ТСХ, ЖХ/МС или ВЭЖХ реакция не полностью завершена, добавляют дополнительный водный раствор основания (такой как водный раствор Na2CO3, 10-20 эквивалентов, предпочтительно, 10 эквивалентов или водный раствор NaOH, 1-5 эквивалентов, предпочтительно, 1-2 эквивалента), и реакцию продолжают при температуре около 25-100°C (предпочтительно, около 60°C) в течение около 0,25-3 часов (предпочтительно, около 1-2 часов). Реакционную смесь обрабатывают, используя один из следующих способов. Способ 1. Органический растворитель необязательно удаляют при пониженном давлении, и водный раствор нейтрализуют, добавляя водный раствор соответствующей кислоты (такой как водный раствор HCl). Добавляют подходящий органический растворитель (такой как EtOAc или DCM) и воду, слои разделяют, и органический раствор сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая целевое соединение. Способ 2. Органический растворитель необязательно удаляют при пониженном давлении, добавляют подходящий органический растворитель (такой как EtOAc или DCM) и воду, слои разделяют, и органический раствор сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая целевое соединение. Способ 3. Полученную реакционную смесь концентрируют и непосредственно очищают одним из следующих способов. Сырой материал, полученный любым из предшествующих способов, необязательно очищают осаждением, кристаллизацией и/или тщательно растирая с соответствующим растворителем или растворителями и/или, используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры H
Пример № H.1.1: N-(4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)-3-хлорбензолсульфонамид
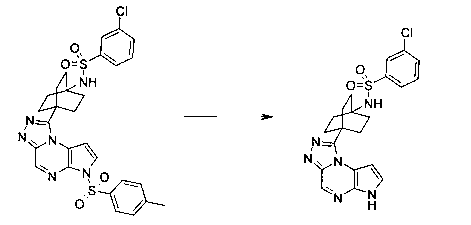
В 100 мл круглодонную колбу загружают 3-хлор-N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)бензолсульфонамид (0,14 г, 0,22 ммоль, полученный с использованием A из примера получения № 9 и 4-(трет-бутоксикарбониламино)бицикло[2.2.2]октан-1-карбоновой кислоты [Prime Organics], C с TEA, I и N из 3-хлорбензолсульфонилхлорида) и 1,4-диоксана (5 мл), получая суспензию желто-коричневого цвета, и затем добавляют водный раствор NaOH (1 н, 0,45 мл, 0,45 ммоль, J. T. Baker). Полученную суспензию нагревают при температуре около 60°C в течение около 3 часов. Полученную реакционную смесь охлаждают до комнатной температуры, и растворители удаляют при пониженном давлении. После добавления NH4OAc (50 мМ водный буферированный раствор), твердый осадок, который собирают вакуумным фильтрованием, промывают водой и сушат, получая N-(4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)-3-хлорбензолсульфонамид в виде твердого вещества белого цвета (0,088 г, 86%): ЖХ/МС (Таблица 2, Способ a) Rt=1,88 мин; МС m/z: 457 (M+H)+.
Примеры получений с использованием общей процедуры H
Общая процедура I: Кислотное расщепление Boc-защищенного амина
К раствору Boc-защищенного амина (предпочтительно 1 эквивалент) в органическом растворителе (таком как DCM, 1,4-диоксан или MeOH) добавляют TFA или HCl (предпочтительно, 4 н. HCl в 1,4-диоксане, 2-35 эквивалентов, предпочтительно 2-15 эквивалентов). Реакционную смесь перемешивают при температуре около 20-100°C (предпочтительно при комнатной температуре до около 60°C) в течение около 1-24 часов (предпочтительно около 1-6 часов). Необязательно дополнительное количество TFA или HCl (предпочтительно 4 н. HCl в 1,4-диоксане, 2-35 эквивалентов, предпочтительно 2-15 эквивалентов) можно добавить к полученной реакционной смеси в случаях, когда по данным ТСХ, ЖХ/МС, или ВЭЖХ реакция не завершается. Затем реакцию продолжают при комнатной температуре или необязательно нагревают вплоть до около 100°C (предпочтительно, нагревают при температуре около 60°C) в течение около 1-24 часов (предпочтительно около 1-6 часов). Если в полученной реакционной смеси присутствует твердый продукт, полученную реакционную смесь можно фильтровать, и полученный твердый продукт промывают органическим растворителем, таким как 1,4-диоксан или Et2O. Полученную твердую часть затем необязательно сушат при пониженном давлении. Альтернативно, отфильтрованный материал можно разделить между органическим растворителем (таким как EtOAc, DCM или 1,4-диоксан) и водным раствором основания (таким как насыщенный водный раствор NaHCO3 или насыщенный водный раствор Na2CO3, предпочтительно, насыщенным водным раствором NaHCO3). Полученную смесь перемешивают в течение около 1-5 часов (предпочтительно, около 1 часа). Весь нерастворимый материал собирают фильтрованием и промывают подходящим растворителем (таким как холодная вода и/или Et2O) затем необязательно сушат при пониженном давлении. Органический слой необязательно промывают солевым раствором, сушат над безводным Na2SO4 или MgSO4, затем декантируют или фильтруют, перед тем, как концентрируют при пониженном давлении, получая целевое соединение. Альтернативно, реакционную смесь разделяют между щелочным водным раствором (таким как раствор Na2CO3, NaHCO3 или NaOH, предпочтительно NaOH) и органическим растворителем (таким как EtOAc или DCM). Водный слой затем необязательно экстрагируют дополнительным органическим растворителем, таким как EtOAc или DCM. Объединенные органические слои необязательно промывают солевым раствором, сушат над безводным Na2SO4 или MgSO4, затем декантируют или фильтруют, перед тем, как концентрируют при пониженном давлении, получая целевое соединение. Необязательно, сырой материал очищают, используя хроматографию, тщательное растирание с соответствующим растворителем или кристаллизацию из одного или более растворителей, получая целевое соединение.
Пример № I.1.1 Гидрохлорид (R)-1-(пиперидин-3-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина
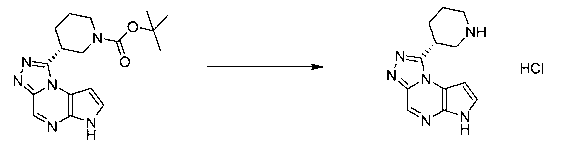
В круглодонную колбу загружают (R)-трет-бутил 3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)пиперидин-1-карбоксилат (0,92 г, 2,68 ммоль; полученный с использованием A из примера получения № 9, (R)-1-(трет-бутоксикарбонил)пиперидин-3-карбоновой кислоты [CNH Technologies], EDC и TEA и E, используя SOCl2, TEA и насыщенный водный раствор Na2CO3), HCl (4 н. в 1,4-диоксане, 2,9 мл, 11,5 ммоль), и 1,4-диоксан (20 мл). Полученную реакционную смесь нагревают при температуре около 60° C в течение около 3 часов. Полученную реакционную смесь охлаждают до комнатной температуры, затем фильтруют в вакууме и промывают Et2O (35 мл). Твердый продукт затем сушат в течение около 16 часов в нагретом вакуумном сушильном шкафу (при температуре около 70°C), получая гидрохлорид (R)-1-(пиперидин-3-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина в виде твердого вещества коричневого цвета (0,69 г, 82%): ЖХ/МС (Таблица 2, Способ a) Rt=0,45 мин; МС m/z 243 (M+H)+.
Примеры получения с использованием общей процедуры I
Общая процедура J: Удаление защитных групп у Cbz-защищенного амина
Смесь O-бензилкарбамата (предпочтительно 1 эквивалент) и 10% Pd-на-угле (0,05-0,30 эквивалента, предпочтительно, 0,10 эквивалента) в протонном растворителе (таком как MeOH, EtOH, AcOH, предпочтительно EtOH) встряхивают или перемешивают в атмосфере водорода при около 103-690 кПа (предпочтительно около 414 кПа) в течение около 4-48 часов (предпочтительно, около 4-16 часов) при комнатной температуре. Реакционную смесь фильтруют через Celite® и концентрируют досуха при пониженном давлении. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем или растворителями и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры J
Пример № J.1.1: 1-(пиперидин-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин
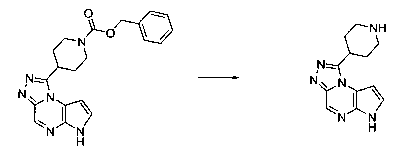
Бензил 4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)пиперидин-1-карбоксилат (0,34 г, 0,90 ммоль, пример № 2, стадия A) и 10% Pd-на-угле (0,10 г, 0,09 ммоль) в MeOH (30 мл) встряхивают в атмосфере водорода при около 414 кПа в течение около 5 часов при комнатной температуре. Реакционную смесь фильтруют через Celite® и концентрируют при пониженном давлении до постоянного веса, до получения 1-(пиперидин-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина в виде твердого вещества желтого цвета (0,18 г, 77%): ЖХ/МС (Таблица 2, Способ a) Rt=0,70 мин; МС m/z: 243 (M+H)+.
Примеры получения с использованием общей процедуры J
Общая процедура K: Получение амида из активированной кислоты и амина
В круглодонную колбу, содержащую амин или соль амина (предпочтительно 1 эквивалент) в органическом растворителе (таком как DCM, ДМФ или 1,4-диоксан, предпочтительно DCM или ДМФ), добавляют органическое основание, такое как DIEA или TEA (0-5 эквивалентов, предпочтительно 3 эквивалента). Полученную реакционную смесь необязательно гомогенизируют, нагревая или обрабатывая ультразвуком (предпочтительно обрабатывая ультразвуком). К полученной реакционной смеси добавляют активированную кислоту (такую как производное перфторфенилового эфира или хлорангидрида). Полученную смесь перемешивают при комнатной температуре в течение около 1-24 часов (предпочтительно около 16 часов). Полученную реакционную смесь непосредственно очищают, используя хроматографию. Альтернативно, растворитель концентрируют при пониженном давлении или добавляют подходящий органический растворитель (такой как EtOAc или DCM), и полученный раствор промывают водой или солевым раствором. Слои разделяют, и органический раствор необязательно сушат над безводным Na2SO4 или MgSO4, фильтруют или декантируют, и концентрируют досуха при пониженном давлении. Сырой материал необязательно очищают осаждением, кристаллизацией, и/или тщательно растирая с соответствующим растворителем или растворителями и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры K
Пример № K.1.1: N-(цис-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексил)-2-цианоацетамид

К суспензии гидрохлорида цис-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанамина (0,106 г, 0,206 ммоль, Пример № D.1) в DCM (4 мл) добавляют TEA (0,086 мл, 0,62 ммоль). Полученную реакционную смесь обрабатывают ультразвуком до тех пор, пока реакционная смесь не становится гомогенной. К реакционному раствору добавляют перфторфенил 2-цианоацетат (0,078 г, 0,31 ммоль, пример получения № 6). Полученный раствор перемешивают при комнатной температуре в течение около 16 часов. Сырую реакционную смесь очищают с помощью хроматографической обработки на силикагеле (40 г), осуществляя градиентное элюирование 0-20% EtOAc в DCM и затем далее очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ e), получая N-(цис-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексил)-2-цианоацетамид с 3 эквивалентами NH4OAc в качестве эксципиента (0,025 г, 22%). ЖХ/МС (Таблица 2, Способ a) Rt= 1,33 мин; МС m/z: 324 (M+H)+.
Примеры получения из перфторфенил 2-цианоацетата (Пример получения № 6) с использованием общей процедуры К
Общая процедура L: Получение амида из карбоновой кислоты и амина
К раствору или суспензии карбоновой кислоты (1-5 эквивалентов, предпочтительно 1,5 эквивалента) и амина (1-5 эквивалентов, предпочтительно 1 эквивалент) в органическом растворителе (таком как DCM, DCE, ТГФ, или 1,4-диоксан, предпочтительно DCM) добавляют связывающий пептид реагент (такой как BOP-Cl, IBCF, HATU, или EDC.HCl, предпочтительно EDC.HCl, 1-10 эквивалентов, предпочтительно 1 эквивалент), основание (такое как TEA, DIEA, или пиридин, предпочтительно TEA, 0-20 эквивалентов, предпочтительно 2 эквивалента) и HOBt (0-5 эквивалентов, предпочтительно 0-1 эквивалент, если используют EDC.HCl). Полученную реакционную смесь затем перемешивают при комнатной температуре в течение от около 15 мин до 24 часов (предпочтительно около 16 часов). Полученную реакционную смесь затем обрабатывают, используя один из следующих способов. Способ 1: Полученную реакционную смесь разбавляют водой или насыщенным водным раствором NaHCO3. Слои разделяют. Водный слой необязательно экстрагируют дополнительным органическим растворителем, таким как EtOAc или DCM. Органический слой (или объединенные слои) необязательно промывают водой, насыщенным водным раствором NaHCO3 и/или солевым раствором, сушат над безводным MgSO4 или Na2SO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 2: Сырую реакционную смесь фильтруют через слой силикагеля, промывая соответствующим растворителем (таким как EtOAc, MeOH, или DCM, предпочтительно MeOH), и концентрируют при пониженном давлении. Способ 3: Сырую реакционную смесь непосредственно очищают, используя хроматографию без обработки. Во всех случаях сырой материал необязательно далее очищают осаждением, кристаллизацией и/или тщательно растирая с соответствующим растворителем или растворителями, и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры L
Пример № L.1.1: (R)-3-(3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)пиперидин-1-ил)-3-оксопропаннитрил
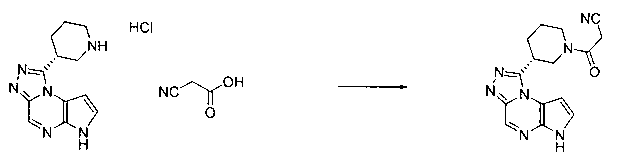
К суспензии гидрохлорида (R)-1-(пиперидин-3-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина (0,074 г, 0,265 ммоль; пример № I.1.1) и 2-цианоуксусной кислоты (0,034 г, 0,398 ммоль) в ДМФ (3 мл) добавляют HOBt (0,041 г, 0,265 ммоль), EDC.HCl (0,051 г, 0,265 ммоль) и DIEA (0,093 мл, 0,531 ммоль). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 16 часов. Сырую реакционную смесь очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ f). Соответствующие фракции концентрируют в вакууме и лиофилизируют до получения (R)-3-(3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)пиперидин-1-ил)-3-оксопропаннитрила в виде твердого вещества белого цвета (0,052 г, 63%): ЖХ/МС (Таблица 2, Способ a) Rt=1,30 мин; МС m/z: 310 (M+H)+.
Примеры получения из (R)-1-(пиперидин-3-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина (пример № I.1.1) с использованием общей процедуры L
Примеры получения из цис-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанаминацетата (полученного с использованием A из примера получения № 3 и цис-3-(трет-бутоксикарбониламино)циклогексанкарбоновой кислоты [AMRI]; F) с использованием общей процедуры L
Дополнительные примеры получения из 2-цианоуксусной кислоты с использованием общей процедуры L
Примеры получения из 1-цианоциклопропанкарбоновой кислоты с использованием общей процедуры L
Примеры получения из транс-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанаминацетата (Пример № F.1.2) с использованием общей процедуры L
Пример получения из гидрохлорида (R)-1-(1-метилпиперазин-2-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина (полученного с использованием A из примера получения № 9 и примера получения № 16, C с TEA, H, I с 4 н. HCl в 1,4-диоксане) с использованием общей процедуры L
Общая процедура M: Получение мочевины из амина и карбамоилхлорида
В колбу, содержащую амин или соль амина (1 эквивалент) в органическом растворителе (таком как ТГФ, или 1,4-диоксан, предпочтительно ТГФ) добавляют основание (такое как DIEA или TEA, предпочтительно TEA (3-5 эквивалентов, предпочтительно 3 эквивалента) и перемешивают при комнатной температуре в течение около 0-30 минут (предпочтительно около 5 минут) затем добавляют карбамоилхлорид (0,5-2 эквивалента, предпочтительно 0,75 эквивалента). Полученную смесь перемешивают при температуре около 0-90°C (предпочтительно около 60-65°C) в течение около 2-24 часов (предпочтительно около 16 часов). Полученную реакционную смесь оставляют остывать до комнатной температуры. Органический растворитель необязательно удаляют при пониженном давлении. Сырой материал разделяют между органическим растворителем (таким как EtOAc или DCM) и водой, водным раствором основания (таким как насыщенный водный раствор NaHCO3) или солевым раствором. Слои разделяют, и органический слой необязательно промывают водой, водным раствором основания (таким как насыщенный водный раствор NaHCO3) и/или солевым раствором, сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют при пониженном давлении, получая целевое соединение. Сырой материал необязательно очищают осаждением, кристаллизацией или тщательно растирая с соответствующим растворителем или растворителями, или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры M
Пример № M.1.1: N-((1R,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)пирролидин-1-карбоксамид

В круглодонную колбу загружают гидрохлорид (1R,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (0,150 г, 0,62 ммоль, пример № D.1.4) и TEA (0,26 мл, 1,9 ммоль) в ТГФ (5,7 мл). Полученную реакционную смесь перемешивают в течение около 5 минут при комнатной температуре перед добавлением пирролидин-1-карбонилхлорида (0,052 мл, 0,46 ммоль). Реакционную смесь нагревают при температуре около 60°C в течение около 16 часов, охлаждают до комнатной температуры, и концентрируют при пониженном давлении. Сырой продукт растворяют в DCM (40 мл) и промывают насыщенным водным раствором NaHCO3 (20 мл), солевым раствором (20 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Полученный материал очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ i). Соответствующие фракции объединяют, полученный растворитель в основном удаляют при пониженном давлении, и твердый продукт отфильтровывают и сушат лиофилизацией, получая N-((1R,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)пирролидин-1-карбоксамид (0,018 г, 8%): ЖХ/МС (Таблица 2, Способ a) Rt=1,40 мин; МС m/z 340 (M+H)+.
Примеры получения из пирролидин-1-карбонилхлорида с использованием общей процедуры M
Общая процедура N: Получение сульфонамида из амина
К смеси или раствору (предпочтительно, раствору) амина или соли амина (предпочтительно, 1 эквивалент) в растворителе, таком как ТГФ, DCM или ДМФ (предпочтительно, ДМФ) добавляют органическое основание такое, как TEA или DIEA (1-10 эквивалентов, предпочтительно 2-4 эквивалента) или водный раствор основания, такой как насыщенный водный раствор NaHCO3 (5-20 эквивалентов, предпочтительно 5-10 эквивалентов) (предпочтительно, органического основания) и сульфонилхлорид (0,85-3 эквивалента, предпочтительно 1-1,5 эквивалента). Реакционную смесь перемешивают при −10-80°C (предпочтительно, при комнатной температуре) в течение около 0,5-72 часов (предпочтительно, около 1-2 часов). Необязательно добавляют дополнительное основание (1-10 эквивалентов) и/или сульфонилхлорид (0,4-2 эквивалента) в любой момент на протяжении времени реакции. Реакционную смесь обрабатывают, используя один из следующих способов. Способ 1: Реакционную смесь разбавляют водой и экстрагируют органическим растворителем, таким как DCM или EtOAc. Объединенные органические слои необязательно промывают солевым раствором, сушат над безводным Na2SO4 или MgSO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 2: Сырую реакционную смесь очищают, используя непосредственно препаративную ВЭЖХ или после добавления органического растворителя, такого как MeOH или ДМФ или водного буферированного раствора, такого как 50 мМ NH4OAc с предварительным концентрированием (или без него) полученной смеси при пониженном давлении. Способ 3: Реакционную смесь разбавляют органическим растворителем, таким как DCM или EtOAc, и промывают водой и/или солевым раствором. Органический слой необязательно сушат над безводным Na2SO4 или MgSO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 4: Реакционную смесь разбавляют водой, и полученный твердый материал собирают вакуумным фильтрованием. Во всех случаях сырой материал необязательно очищают осаждением, кристаллизацией и/или тщательно растирая с соответствующим растворителем или растворителями и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры N
Пример № N.1.1: N-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид

К смеси гидрохлорида (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (0,300 г, 0,952 ммоль, примера № 6, стадия C) в ДМФ (9 мл) добавляют TEA (0,462 мл, 3,33 ммоль) и циклопропансульфонилхлорид (0,097 мл, 0,95 ммоль). Примерно через 1,5 часа при комнатной температуре реакционную смесь разбавляют водой (10 мл) и экстрагируют DCM (3×15 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. К сырому материалу добавляют MeOH (~50 мл) и небольшое количество нерастворившегося материала (<0,01 г) удаляют фильтрованием. К полученному фильтрату добавляют силикагель (2 г), и полученную смесь концентрируют при пониженном давлении. Полученную смесь очищают с помощью хроматографической обработки на силикагеле, осуществляя постадийное градиентное элюирование DCM/MeOH/NH4OH 990:9:1 до 980:18:2, получая твердое вещество не совсем белого цвета, которое сушат в вакуумном термостате при температуре около 70°C. Твердый продукт растворяют в горячем MeOH, фильтруют в горячем виде для удаления осадков, и затем полученный фильтрат обрабатывают ультразвуком при охлаждении, получая тонкую суспензию, которую концентрируют при пониженном давлении и сушат в вакуумном термостате при температуре около 100°C, получая N-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид (0,21 г, 64%): ЖХ/МС (Таблица 2, Способ a) Rt=1,51 мин; МС m/z: 347 (M+H)+.
Примеры получения с использованием циклопропилсульфонилхлорида и общей процедуры N
Примеры получения из гидрохлорида (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (пример № 6, стадия C) с использованием общей процедуры N
Примеры получения из гидрохлорида (S)-1-(пиперидин-3-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина (полученного с использованием A из примера получения № 3 и (S)-1-(трет-бутоксикарбонил)пиперидин-3-карбоновой кислоты, EDC•HCl, и TEA, C, H, и I) с использованием общей процедуры N
Примеры получения из гидрохлорида цис-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанамина (Пример № F.1.3) с использованием общей процедуры N
Примеры получения из цис-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклобутанамина (Пример № J.1.4) с использованием общей процедуры N
Общая процедура O: Замена арил- или гетероарилгалогенида амином
В микроволновой реактор помещают амин или соль амина (предпочтительно 1 эквивалент), арил- или гетероарилгалогенид (1-10 эквивалентов, предпочтительно 1,5 эквивалента), растворитель, такой как MeCN, н-PrOH, н-BuOH, толуол, ДМСО, или EtOH (предпочтительно EtOH), и основание, такое как K2CO3, NaCO3, TEA или DIEA, предпочтительно TEA или DIEA (1-5 эквивалентов, предпочтительно 2-4 эквивалента). Полученную реакционную смесь нагревают за счет микроволнового излучения при температуре около 100-200°C (предпочтительно около 130-150°C) в течение около 0,5-8 часов (предпочтительно около 1-2 часов). В тех случаях, когда по данным ТСХ, ЖХ/МС или ВЭЖХ реакция не завершается, реакционную смесь можно снова подвергнуть облучению при температуре около 120-200°C (предпочтительно около 130-150°C) в течение дополнительно 1-8 часов (предпочтительно около 1-2 часов), сопровождая это добавлением дополнительного количества арил- или гетероарилгалогенида (1-10 эквивалентов, предпочтительно, 1,5 эквивалента) и/или основания, такого как K2CO3, Na2CO3, TEA или DIEA, предпочтительно TEA или DIEA (1-5 эквивалентов, предпочтительно 2-4 эквивалента). Указанный процесс повторяют до тех пор, пока реакция не прекращается. После охлаждения до комнатной температуры реакционную смесь обрабатывают, используя один из следующих способов. Способ 1: Реакционную смесь концентрируют при пониженном давлении. Способ 2: Реакционную смесь, содержащую осадок, фильтруют для сбора целевого соединения, при этом необязательно промывая органическим растворителем (или растворителями) таким как Et2O, DCM и/или петролейный эфир. Способ 3: Полученную реакционную смесь разбавляют органическим растворителем, таким как MeOH, добавляют силикагель, и полученную смесь концентрируют при пониженном давлении для подготовки к выделению с помощью хроматографии. Способ 4: Полученную реакционную смесь концентрируют при пониженном давлении перед добавлением органического растворителя, такого как EtOAc или DCM, и затем необязательно промывают водой и/или солевым раствором, сушат над безводным Na2SO4 или MgSO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 5: Добавляют органический растворитель, такой как EtOAc или DCM, при необязательном добавлении воды или солевого раствора, и слои разделяют. Водный слой затем необязательно экстрагируют дополнительным органическим растворителем, таким как EtOAc или DCM. Объединенные органические слои необязательно промывают солевым раствором или водой, сушат над безводным MgSO4, или Na2SO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Во всех случаях, сырой материал необязательно очищают осаждением, кристаллизацией, и/или тщательно растирая с соответствующим растворителем или растворителями и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры O
Пример № O.1.1: 6-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)никотинонитрил
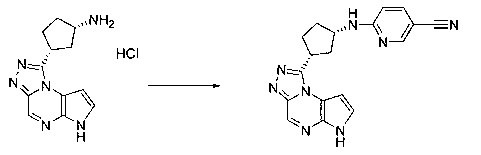
В микроволновой реактор добавляют гидрохлорид (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (0,0979 г, 0,311 ммоль, пример № 6, стадия C), EtOH (2 мл), 6-хлорникотинонитрил (0,057 г, 0,41 ммоль), и TEA (0,130 мл, 0,932 ммоль). Полученную реакционную смесь нагревают, используя микроволновую CEM™ при температуре около 130°C в течение около 1 часа (1724 кПа максимальное давление, 5 мин максимально до выхода на режим, 300 максимум Ватт). После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении и очищают с помощью хроматографической обработки на силикагеле, элюируя DCM/MeOH/Et2NH (970:27:3), получая 6-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)никотинонитрил (0,027 г, 25%): ЖХ/МС (Таблица 2, Способ a) Rt=1,24 мин; МС m/z: 345 (M+H)+.
Примеры получения из гидрохлорида (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (пример № 6, стадия C) с использованием общей процедуры O
Примеры получения из гидрохлорида (R)-1-(пиперидин-3-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина (пример № I.1.1) и гетероарилгалогенида с использованием общей процедуры O
Примеры получения из гидрохлорида (1R,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (пример № D.1.4) с использованием общей процедуры O
Пример получения из гидрохлорида цис-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанамина (пример № F.1.3) с использованием общей процедуры O
Пример получения из 4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-амина (полученного с использованием A из примера получения № 9, 4-(трет-бутоксикарбониламино)бицикло[2.2.2]октан-1-карбоновой кислоты [Prime Organics], HATU, и TEA, C с TEA, и I с HCl в 1,4-диоксане) и гетероарилгалогенида, с использованием общей процедуры O
Пример получения из гидрохлорида (1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (полученного с использованием C из примера получения № A.1 с TEA, I с 4 н. HCl в 1,4-диоксане) с использованием общей процедуры O
Пример получения из гидрохлорида (1R,4S)-3,3-диметил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина и гидрохлорида (1S,4R)-3,3-диметил-4-(6H-пирроло[2,3- e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (полученных с использованием способа получения EE из примера получения № 25 и N,N-дибензиламина, Y с MeOH, FF, P, GG с LiOH, A из примера получения № 9 с HATU и TEA, C с TEA, H, I с 4 н. HCl в 1,4-диоксане) с использованием общей процедуры O
Пример получения из гидрохлорида (R)-1-(1-метилпиперазин-2-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина (полученного с использованием A из примера получения № 9 и примера получения № 16, C, H, I) с использованием общей процедуры O
Общая процедура O.1: Замена арил- или гетероарилгалогенида амином (в термических условиях)
В круглодонную колбу помещают смесь амина или соли амина (предпочтительно 1 эквивалент), арил- или гетероарилгалогенида (1-10 эквивалентов, предпочтительно 1,5 эквивалентов), растворитель, такой как MeCN, толуол, DMSO, EtOH, или ДМФ (предпочтительно ДМФ) и основание, такое как K2CO3, Na2CO3, TEA или DIEA, предпочтительно TEA или K2CO3 (1-5 эквивалентов, предпочтительно 2-4 эквивалента). Полученную реакционную смесь нагревают при температуре около 40-220°C (предпочтительно около 65°C) в течение около 0,5-16 часов (предпочтительно около 8,5 часа). В тех случаях, когда по данным ТСХ, ЖХ/МС, или ВЭЖХ реакция не завершается, ее можно возобновить, нагревая при температуре около 40-220°C (предпочтительно около 65°C) в течение дополнительно около 1-12 часов (предпочтительно около 1-2 часов) при необязательном добавлении еще арил- или гетероарилгалогенидов (1-10 эквивалентов, предпочтительно 1,5 эквивалента) и/или основания, такого как K2CO3, Na2CO3, TEA или DIEA, предпочтительно TEA или K2CO3 (1-5 эквивалентов, предпочтительно 2-4 эквивалента). Этот процесс повторяют до тех пор, пока реакция не заканчивается. После охлаждения до комнатной температуры, полученную реакционную смесь обрабатывают одним из следующих способов. Способ 1: Реакционную смесь концентрируют досуха при пониженном давлении. Способ 2: Реакционную смесь, содержащую осадок, фильтруют для сбора целевого соединения, при этом необязательно промывая органическим растворителем (или растворителями), таким как Et2O, DCM и/или петролейный эфир. Способ 3: Полученную реакционную смесь разбавляют органическим растворителем (таким как MeOH), добавляют силикагель, и полученную смесь концентрируют при пониженном давлении до подготовки к выделению с помощью хроматографии. Способ 4: Полученную реакционную смесь концентрируют при пониженном давлении перед добавлением органического растворителя, такого как EtOAc или DCM и затем необязательно промывают водой и/или солевым раствором, сушат над безводным Na2SO4 или MgSO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Способ 5: Добавляют органический растворитель, такой как EtOAc или DCM, при необязательном добавлении воды или солевого раствора, и слои разделяют. Водный слой затем необязательно экстрагируют дополнительным количеством органического растворителя, такого как EtOAc или DCM. Объединенные органические слои необязательно промывают солевым раствором или водой, сушат над безводным MgSO4 или Na2SO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Во всех случаях, сырой материал необязательно очищают осаждением, кристаллизацией и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры O.1
Пример получения № O.1.1: N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)бензо[d]оксазол-2-амин
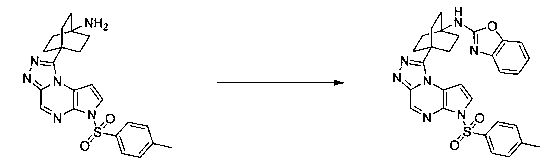
В грушевидную колбу загружают 4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-амин (0,20 г, 0,46 ммоль, пример № 7, стадия B) и 2-хлорбензо[d]оксазол (0,18 г, 1,1 ммоль, TCI) в ДМФ (5,0 мл). К полученной суспензии добавляют K2CO3 (0,16 г, 1,1 ммоль), и полученную смесь нагревают при около 65°C в течение около 8,5 часа. Полученную смесь охлаждают до комнатной температуры, и полученный растворитель удаляют при пониженном давлении. Полученный остаток растворяют в EtOAc (25 мл) и промывают водой и солевым раствором (25 мл каждый). Органический раствор сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)бензо[d]оксаазол-2-амин (0,26 г, 95%, 95% чистота по данным ELSD): ЖХ/МС (Таблица 2, Способ d) Rt=1,48 мин; МС m/z: 554 (M+H)+.
Общая процедура P: Boc-защита амина
К раствору амина (предпочтительно 1 эквивалент) в органическом растворителе (например MeCN, 1,4-диоксан или ТГФ, предпочтительно ТГФ) необязательно добавляют водный раствор основания, такого как Na2CO3, NaOH, K2CO3 или NaHCO3 (2-20 эквивалентов, предпочтительно 10 эквивалентов Na2CO3) или органическое основание, такое как TEA или DIEA (1-5 эквивалентов, предпочтительно 1-2 эквивалента) с последующим добавлением ди-трет-бутилдикарбоната (1-1,5 эквивалентов, предпочтительно 1,2 эквивалента). Реакционную смесь перемешивают при температуре около 10-40°C (предпочтительно при комнатной температуре) в течение около 2-24 часов (предпочтительно около 2-6 часов) и обрабатывают, используя один из следующих способов. Способ 1: Добавляют органический растворитель (такой как Et2O, EtOAc или DCM) и воду, и слои разделяют. Водный слой экстрагируют дополнительным количеством органического растворителя, и объединенные органические слои необязательно промывают солевым раствором, сушат над безводным Na2SO4 или MgSO4, и затем декантируют или фильтруют перед тем, как концентрируют при пониженном давлении. Способ 2: Полученную реакционную смесь разделяют между органическим растворителем (таким как Et2O, EtOAc или DCM) и водным раствором кислоты (такой как HCl). Кислотный слой экстрагируют дополнительным органическим растворителем, и объединенные органические слои необязательно промывают солевым раствором. Органический слой необязательно сушат над безводным Na2SO4 или MgSO4, и затем декантируют или фильтруют перед тем, как концентрируют при пониженном давлении. Способ 3: Добавляют органический растворитель (такой как Et2O, EtOAc или DCM) и воду, и слои разделяют. Водный слой подкисляют, используя кислоту (такую как AcOH), что вызывает образование осадка, который затем декантируют или фильтруют, при этом необязательно промывают избыточным количеством воды. Сырой материал необязательно очищают осаждением, кристаллизацией, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры P
Пример получения № P.1: (1R,3S)-3-((трет-бутоксикарбониламино)метил)циклопентанкарбоновая кислота
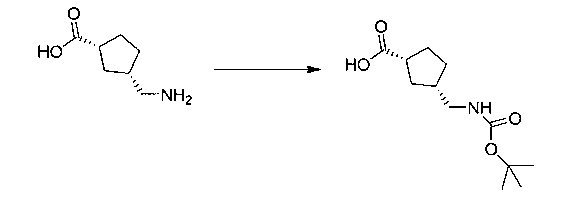
К раствору (1R,3S)-3-(аминометил)циклопентанкарбоновой кислоты (0,500 г, 3,49 ммоль, AFID) в ТГФ (4 мл) и воде (4 мл) добавляют Na2CO3 (1,11 г, 10,5 ммоль) и ди-трет-бутилдикарбонат (0,915 г, 4,19 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение около 4 часов. Добавляют EtOAc (15 мл) и водный раствор HCl (1 н, 15 мл), и слои разделяют. Водный слой экстрагируют EtOAc (2×10 мл) и объединенные органические слои промывают солевым раствором (10 мл). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая (1R,3S)-3-((трет-бутоксикарбониламино)метил)циклопентанкарбоновую кислоту (0,300 г, 35% выход). 1H ЯМР (ДМСО-d 6) δ 11,97 (с, 1H), 6,83 (с, 1H), 2,87 (т, J=6,4, 2H), 2,73-2,58 (м, 1H), 2,04-1,87 (м, 2H), 1,82-1,68 (м, 2H), 1,68-1,58 (м, 1H), 1,37 (с, 9H), 1,34-1,19 (м, 2H).
Общая процедура Q: Cbz-защита амина
К раствору амина (предпочтительно, 1 эквив.) и основания (например, Na2CO3, 1-3 эквив., предпочтительно, 3 эквив.) в воде или в водном органическом растворителе (например, смеси вода/MeCN) добавляют раствор бензил 2,5-диоксопирролидин-1-ил карбоната (1-2 эквив., предпочтительно, 1,3 эквив.) в органическом растворителе, таком как MeCN. Реакционную смесь перемешивают при комнатной температуре в течение около 8-24 час (предпочтительно, около 16 час) и затем концентрируют при пониженном давлении. Полученный водный раствор подкисляют, добавляя кислоту, такую как водный раствор NH4Cl или HCl и затем экстрагируют органическим растворителем (такой как EtOAc или DCM). Объединенные органические экстракты необязательно промывают водой и/или солевым раствором, сушат над безводным Na2SO4 или MgSO4, фильтруют или декантируют, и концентрируют при пониженном давлении. Сырой материал затем необязательно очищают путем осаждения, кристаллизации, и/или тщательного растирая в соответствующем растворителе (или растворителях) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры Q
Пример получения № Q.1: 1-(бензилоксикарбонил)пиперидин-4-карбоновая кислота
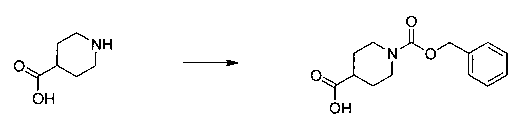
К раствору пиперидин-4-карбоновой кислоты (10,0 г, 77,4 ммоль) и Na2CO3 (8,21 г, 77,4 ммоль) в воде (100 мл) добавляют раствор бензил 2,5-диоксопирролидин-1-илкарбоната (19,3 г, 77,4 ммоль) в MeCN (100 мл). Реакционную смесь перемешивают при комнатной температуре в течение около 16 час и затем концентрируют при пониженном давлении. Полученный водный раствор гасят, используя водный раствор NH4Cl, и затем экстрагируют EtOAc (2×100 мл). Объединенные органические экстракты сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая 1-(бензилоксикарбонил)пиперидин-4-карбоновую кислоту в виде твердого вещества белого цвета (4,56 г, 22%): ЖХ/МС (Таблица 2, Способ a) Rt=1,93 мин; МС m/z: 262 (M−H)−.
Общая процедура R: Восстановление пиридин
Замещенный пиридин (предпочтительно, 1 эквив.) и оксид платины(IV) (0,05-0,20 эквив., предпочтительно, 0,09 эквив.) в AcOH встряхивают в атмосфере водорода при давлении около 103-620 кПа (предпочтительно, около 414 кПа) в течение около 1-10 дней (предпочтительно, около 3-5 дней). Реакционную смесь фильтруют через Celite®, затем концентрируют при пониженном давлении и затем необязательно очищают, используя осаждение, кристаллизацию и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры R
Пример получения № R.1: Ацетат 4-метилпиперидин-3-карбоновой кислоты

4-метилникотиновую кислоту (2,00 г, 14,6 ммоль) и оксид платины (IV) (0,30 г, 1,3 ммоль) в AcOH (70 мл) встряхивают в атмосфере водорода при давлении около 414 кПа в течение около 3 дней. Реакционную смесь фильтруют через Celite®, затем концентрируют при пониженном давлении до получения ацетата 4-метилпиперидин-3-карбоновой кислоты в виде масла (2,9 г, 98%): ЖХ/МС (Таблица 2, Способ a) Rt=0,55 мин; МС m/z: 144 (M+H)+.
Общая процедура S: Восстановление сложного эфира до спирта
Восстанавливающий агент (2,0-2,5 эквив., предпочтительно, 2,1 эквив.), такой как раствор DIBAL-H, по каплям добавляют к раствору сложного эфира (предпочтительно, 1 эквив.) в органическом растворителе (таком как ТГФ или Et2O, предпочтительно, ТГФ) при температуре около 0-25°C (предпочтительно, около 0°C). Реакционную смесь перемешивают в течение около 1-3 час (предпочтительно, около 1 часа) перед тем, как реакцию гасят, используя 10% водный раствор калий-натрий тартрата рН 5,5. Реакционную смесь оставляют при перемешивании примерно на 1 час перед тем, как ее концентрируют при пониженном давлении. Полученный остаток разделяют органическим растворителем (таким как EtOAc или DCM, предпочтительно, EtOAc) и затем промывают солевым раствором. Органический слой сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют до постоянного веса. Сырой материал необязательно затем очищают, используя осаждение, кристаллизацию, и/или тщательное растирая с соответствующим растворителем (или растворителями) и/или с помощью хроматографии, получая целевое соединение.
Иллюстрация общей процедуры S
Пример получения № S.1: Трет-бутил 3-(гидроксиметил)-4-метилпиперидин-1-карбоксилат

DIBAL-H (1 M в толуоле, 27,3 мл, 27,3 ммоль) по каплям добавляют к раствору 1-трет-бутил 3-метил 4-метилпиперидин-1,3-дикарбоксилата (3,35 г, 13,02 ммоль, полученного с использованием R из примера получения № Y.1 и P) в ТГФ (40 мл) при температуре около 0°C. Полученную реакционную смесь перемешивают в течение около 1 часа перед тем, как ее гасят, используя 10% водный раствор калий-натрий тартрата (50 мл). Полученную реакционную смесь оставляют при перемешивании в течение около 1 часа перед тем, как ее концентрируют при пониженном давлении. Полученный остаток разделяют, используя EtOAc (200 мл) и солевой раствор (3×100 мл). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют до постоянного веса до получения трет-бутил 3-(гидроксиметил)-4-метилпиперидин-1-карбоксилата в виде прозрачного масла (2,58 г, 86%): ЖХ/МС (Таблица 2, Способ a) Rt=2,10 мин; МС m/z: 230 (M+H)+.
Общая процедура T: Окисление спирта до альдегида
К раствору спирта (предпочтительно, 1 эквив.) в DCM добавляют периодинан Dess-Martin (1,0-1,5 эквив., предпочтительно, 1,2 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение около 4-24 час (предпочтительно, около 8-16 час). Реакционную смесь разделяют между органическим растворителем, таким как EtOAc или DCM (предпочтительно, EtOAc) и водным раствором основания, такого как насыщенный водный раствор NaHCO3 или Na2CO3(предпочтительно, Na2CO3). Органический слой выделяют, фильтруют через Celite®, и промывают водным раствором основания, такого как насыщенный водный раствор NaHCO3 или Na2CO3 (предпочтительно, Na2CO3). Органический слой сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют при пониженном давлении до постоянного веса. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры T
Пример получения № T.1: Трет-бутил 3-формил-4-метилпиперидин-1-карбоксилат

К раствору трет-бутил 3-(гидроксиметил)-4-метилпиперидин-1-карбоксилата (2,58 г, 11,2 ммоль, примера получения № S.1) в DCM (50 мл) добавляют периодинан Dess-Martin (5,73 г, 13,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение около 16 час перед тем, как ее разделяют между EtOAc (150 мл) и насыщенным водным раствором NaHCO3 (150 мл). Органический слой фильтруют через Celite®, затем промывают насыщенным водным раствором Na2CO3 (2×150 мл). Органический слой выделяют и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении до постоянного веса до получения трет-бутил 3-формил-4-метилпиперидин-1-карбоксилата в виде прозрачного масла (1,49 г, 58%): ЖХ/МС (Таблица 2, Способ a) Rt=2,39 мин; МС m/z: 228 (M+H)+.
Общая процедура U: Получение семикарбазида
В колбу, содержащую гидразин (предпочтительно, 1 эквив.) в органическом растворителе (таком как CHCl3, ТГФ, или DCM, предпочтительно, CHCl3) добавляют органическое основание (1-3 эквив., предпочтительно, 1 эквив.), такое как TEA, DIEA, NMM, или пиридин (предпочтительно, TEA). Полученную реакционную смесь необязательно охлаждают до около −10-10°C (предпочтительно, около 0°C) и добавляют карбамоилхлорид (чистый или в виде раствора в подходящем органическом растворителе, таком как перечислено выше, предпочтительно, в виде раствора в подходящем органическом растворителе) (1-2 эквив., предпочтительно, 1,2 эквив.). Полученную реакционную смесь перемешивают при температуре около 0-60°C (предпочтительно, около 45°C) в течение около 1-24 час (предпочтительно, около 16 час). Добавляют соответствующий органический растворитель (такой как EtOAc или DCM), и полученный раствор промывают водой и солевым раствором. Слои разделяют, и органический раствор сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая целевое соединение. Сырой материал необязательно затем очищают, используя осаждение, кристаллизацию, или тщательно растирая с соответствующим растворителем (или растворителями) или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры U
Пример получения № U.1: N'-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)пиперидин-1-карбогидразид
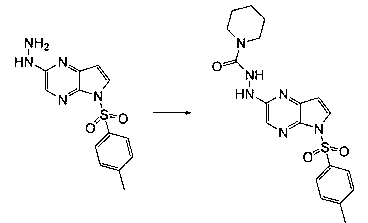
В 25 мл круглодонную колбу помещают 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин (0,075 г, 0,25 ммоль, пример получения № 9) и TEA (0,041 мл, 0,29 ммоль) в CHCl3 (1,2 мл), получая суспензию коричневого цвета. Добавляют пиперидин-1-карбонилхлорид (0,040 г, 0,27 ммоль), и реакционную смесь перемешивают при комнатной температуре в течение около 3 час. Полученную реакционную смесь нагревают при около 45°C в течение около 16 час. Полученную смесь охлаждают до комнатной температуры, добавляют DCM (25 мл), и полученный раствор промывают водой и солевым раствором (около 5 мл каждый). Слои разделяют и органический раствор сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая N′-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)пиперидин-1-карбогидразид (0,11 г, 100%): ЖХ/МС (Таблица 2, Способ a) Rt=2,09 мин; МС m/z: 415 (M+H)+.
Общая процедура V: Циклизация семикарбазида
В колбу, содержащую семикарбазид (предпочтительно, 1 эквив.) добавляют POCl3 (10-100 эквив., предпочтительно, 50 эквив.). Полученную реакционную смесь перемешивают при температуре около 25-120°C (предпочтительно, около 70-100°C) в течение около 1-10 час (предпочтительно, около 2-4 час). Необязательно, полученную реакционную смесь перемешивают при комнатной температуре в течение около 1-48 час (предпочтительно, около 24-36 час). Если полученную смесь нагревают при повышенной температуре, ее охлаждают до комнатной температуры перед тем, как выливают на лед или в ледяную воду. К полученной смеси добавляют подходящий органический растворитель (такой как EtOAc или DCM) и водный раствор основания (такого как Na2CO3, NaHCO3, или NaOH), и органический слой выделяют. Необязательно, полученный водный раствор затем экстрагируют подходящим органическим растворителем (таким как EtOAc или DCM). Объединенные органические экстракты сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая целевое соединение. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, или тщательно растирая с соответствующим растворителем (или растворителями), или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры V
Пример получения № V.1: 1-(пиперидин-1-ил)-6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин
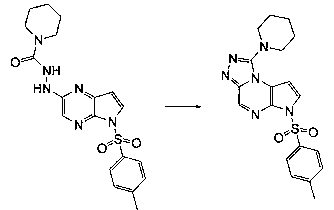
В колбу помещают N′-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)пиперидин-1-карбогидразид (0,18 г, 0,43 ммоль, пример получения № U.1) с последующим добавлением POCl3 (2,0 мл, 21,5 ммоль). Полученную смесь нагревают при около 100°C в течение около 2 часов. Полученную реакционную смесь охлаждают до комнатной температуры и перемешивают в течение около 36 час при комнатной температуре. Полученную смесь медленно выливают на лед (около 15 г), с последующим добавлением к полученной суспензии DCM (50 мл) и насыщенного водного раствора Na2CO3 (25 мл). Слои разделяют, и органический раствор сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая 1-(пиперидин-1-ил)-6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин (0,11 г, 63%) в виде твердого вещества коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,36 мин; МС m/z: 397 (M+H)+.
Общая процедура W: Получение хлорангидрида
К раствору карбоновой кислоты (предпочтительно, 1 эквив.) в органическом растворителе (предпочтительно, DCM) добавляют оксалилхлорид (1,2-2,0 эквив., предпочтительно, 2 эквив.) с последующим добавлением ДМФ (0,01-0,10 эквив., предпочтительно, около 0,05 эквив.). Реакционную смесь перемешивают при температуре около 0-40°C (предпочтительно, при комнатной температуре) в течение около 3-6 час (предпочтительно, около 4 часов) перед тем, как ее концентрируют при пониженном давлении до постоянного веса, получая целевое соединение.
Иллюстрация общей процедуры W
Пример получения № W.1: 2-метилциклогексанкарбонилхлорид

К раствору 2-метилциклогексанкарбоновой кислоты (6,00 мл, 42,6 ммоль, смесь цис- и транс-) в DCM (60 мл) добавляют оксалилхлорид (4,80 мл, 55,3 ммоль) с последующим добавлением ДМФ (0,03 мл, 0,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение около 4 часов перед тем, как ее концентрируют при пониженном давлении до постоянного веса, до получения 2-метилциклогексанкарбонилхлорид (смесь диастереоизомеров) в виде масла желтого цвета (7,0 г, 97%): 1H ЯМР (400 МГц, CDCl3) δ 2,98-2,94 (м, 1H), 2,39-2,35 (м, 1H), 1,91-1,82 (м, 1H), 1,79-1,72 (м, 1H), 1,69-1,60 (м, 2H), 1,57-1,47 (м, 2H), 1,42-1,36 (м, 1H), 1,34-1,26 (м, 1H), 1,04-0,96 (м, 3H).
Общая процедура X: Получение мочевины с использованием CDI
В колбу, содержащую амин или соль амина (предпочтительно, 1 эквив.) добавляют CDI (1-2 эквив., предпочтительно, 1,10 эквив.) и органический растворитель (такой как 1,4-диоксан, ТГФ, DCM, ДМФ, или пиридин, предпочтительно, пиридин). Если используют соль амина, пиридин используют в качестве растворителя. Полученную реакционную смесь перемешивают при комнатной температуре в течение около 2-24 час (предпочтительно, около 16 час). Затем к полученной смеси добавляют вторую порцию амина (1-3 эквив., предпочтительно, 1,10 эквив.), и смесь перемешивают при комнатной температуре в течение около 2-24 час (предпочтительно, около 16 час). Органический растворитель необязательно удаляют при пониженном давлении. Сырой материал разделяют между органическим растворителем (таким как EtOAc или DCM) и водой, водным раствором основания (таким как насыщенный водный раствор NaHCO3) или солевым раствором. Слои разделяют, и органический раствор необязательно промывают водой, водным раствором основания (таким как насыщенный водный раствор NaHCO3) и/или солевым раствором, сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют при пониженном давлении, получая целевое соединение. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, или тщательно растирая с соответствующим растворителем (или растворителями) или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры X
Пример № X.1.1: N-(цис-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексил)пирролидин-1-карбоксамид
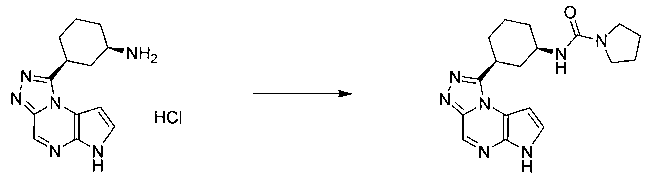
В колбу, содержащую гидрохлорид цис-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексанамида (0,050 г, 0,171 ммоль, пример № F.1.3) добавляют CDI (0,030 г, 0,188 ммоль) и пиридин (2 мл). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 16 час. К полученной реакционной смеси добавляют пирролидин (0,016 мл, 0,188 ммоль), и перемешивают в течение около 16 час. Растворитель удаляют при пониженном давлении, и сырой материал очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ j). Соответствующие фракции объединяют, большую часть растворителя удаляют при пониженном давлении, и твердый продукт отфильтровывают и сушат, используя лиофилизацию, получая N-(цис-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклогексил)пирролидин-1-карбоксамид (0,010 г, 16%): ЖХ/МС (Таблица 2, Способ a) Rt=1,45 мин; МС m/z 354 (M+H)+.
Общая процедура Y: Получение эфира из карбоновой кислоты
Раствор карбоновой кислоты (предпочтительно, 1 эквив.) и минеральной кислоты (такой как H2SO4 или HCl, предпочтительно, 0,2-3 эквив. H2SO4, предпочтительно, насыщенный раствор HCl в спирте (таком как MeOH или EtOH, предпочтительно, MeOH) перемешивают при температуре около 0-80°C (предпочтительно, при около 60°C, если используют H2SO4, или предпочтительно, при комнатной температуре если используют HCl) в течение около 8-24 час (предпочтительно, около 16 час). Реакционную смесь концентрируют при пониженном давлении, и затем разделяют, используя EtOAc или DCM (предпочтительно, EtOAc) и насыщенный водный раствор NaHCO3. Органический слой сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют при пониженном давлении до постоянного веса. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры Y
Пример получения № Y.1 Метил 4-метилникотинат

Раствор 4-метилникотиновой кислоты (2,00 г, 14,6 ммоль) и концентрированную H2SO4 (4,66 мл, 87,6 ммоль) в MeOH (50 мл) нагревают при температуре около 60°C в течение около 16 час. Реакционную смесь концентрируют при пониженном давлении, затем разделяют, используя EtOAc (150 мл) и насыщенный водный раствор NaHCO3 (200 мл). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении до постоянного веса до получения метил 4-метилникотината в виде прозрачной жидкости (2,30 г, 94%): ЖХ/МС (Таблица 2, Способ a) Rt=1,67 мин; МС m/z: 152 (M+H)+.
Общая процедура Z: N-алкилирование с использованием алкилгалогенида или α-галогенкетона
В круглодонную колбу помещают основание (такое как NaH, 60% дисперсия в минеральном масле), K2CO3, или Cs2CO3, предпочтительно, NaH (60% дисперсия в минеральном масле), 1-1,5 эквив., предпочтительно, 1,2 эквив.) и органический растворитель (такой как ДМФ или NMP, предпочтительно, ДМФ). Полученную смесь охлаждают до около −10-10°C (предпочтительно, около 0°C) и добавляют раствор соответствующим образом замещенного амина (предпочтительно, 1 эквив.) в органическом растворителе (таком как ДМФ). Полученную реакционную смесь перемешивают в течение около 5-90 мин (предпочтительно, около 15 мин) при температуре около −10°C-комнатной температуре (предпочтительно, около 0°C) с последующим добавлением алкилгалогенида или α-галогенкетона (1-2 эквив., предпочтительно, 1,5 эквив.). Полученную реакционную смесь перемешивают при температуре около −10°C-комнатной температуре (предпочтительно, около 0°C) в течение около 0,5-2 час (предпочтительно, около 0,5 час), и затем нагревают до комнатной температуры (в тех случаях, когда полученную смесь охлаждают на протяжении всей реакции). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 1-20 час (предпочтительно, около 2 час). Органический растворитель удаляют при пониженном давлении, и полученную смесь очищают одним из следующих способов. Способ 1) Полученную смесь разбавляют водой и органическим растворителем (например, EtOAc или DCM). Слои разделяют, и водный раствор экстрагируют органическим растворителем (таким как EtOAc и/или DCM). Объединенные органические слои необязательно промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Способ 2) Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями), и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры Z
Пример получения № Z.1: N-метил-N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид

В круглодонную колбу помещают гидрид натрия (60% дисперсия в минеральном масле, 0,013 г, 0,33 ммоль) и ДМФ (1 мл), получая суспензию белого цвета. Полученную суспензию охлаждают до около 0°C с последующим добавлением раствора N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамида (0,15 г, 0,27 ммоль, пример № 7, стадия C) в ДМФ (2 мл). Полученную реакционную смесь перемешивают в течение около 15 мин и добавляют йодометан (0,06 г, 0,41 ммоль). Полученную реакционную смесь перемешивают при температуре около 0°C в течение около 30 мин, нагревают до комнатной температуры и перемешивание продолжают в течение около 2 час. Растворитель удаляют при пониженном давлении. Полученный остаток растворяют в DCM (5 мл), затем очищают с использованием флеш-хроматографии на силикагеле, используя EtOAc в качестве элюента, получая N-метил-N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид (0,068 г, 45%) в виде твердого вещества желтого цвета: ЖХ/МС (Таблица 1, Способ a) Rt=2,35 мин; ЖХ/МС m/z 555 (M+H)+.
Общая процедура AA: Циклизация амида с использованием дитиадифосфэтанового реагента
К раствору амида (предпочтительно, 1 эквив.) в органическом растворителе (предпочтительно, 1,4-диоксане) добавляют тиолирующий реагент, такой как Реагент Лоусона или реагент Belleau (2,4-бис(4-феноксифенил)-1,3-дитиа-2,4-дифосфэтан-2,4-дисульфид) (предпочтительно, Реагент Лоусона) (0,5-2,0 эквив., предпочтительно, 0,6 эквив.). Реакционную смесь нагревают при температуре около 25-120°C (предпочтительно, около 80°C) в течение около 0,5-10 час (предпочтительно, около 1 часа). Полученную реакционную смесь оставляют охлаждаться до комнатной температуры и добавляют кислоту Льюиса, такую как диацетоксиртуть, дихлорид ртути, нитрат серебра, бромид меди (предпочтительно, диацетоксиртуть) (1-3 эквив., предпочтительно, 1 эквив.). Полученную реакционную смесь перемешивают при температуре около 20-60°C (предпочтительно, при комнатной температуре) в течение около 0,5-4 час (предпочтительно, около 1 часа). Необязательно добавляют дополнительное количество кислоты Льюиса (предпочтительно, диацетоксиртуть) (0,2-1,0 эквив., предпочтительно, 0,5 эквив.) и реакцию продолжают в течение около 10 минут -3 часов (предпочтительно, около 15 мин). Полученную реакционную смесь добавляют к органическому растворителю (предпочтительно, EtOAc) и фильтруют, предпочтительно, через слой Celite®. Полученный фильтрат концентрируют при пониженном давлении, получая целевое соединение. Необязательно полученный продукт очищают, используя кристаллизацию или тщательно растирая с соответствующим растворителем (или растворителями), или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры AA
Пример получения № AA.1: Трет-бутил 4-метил-3-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)пиперидин-1-карбоксилат
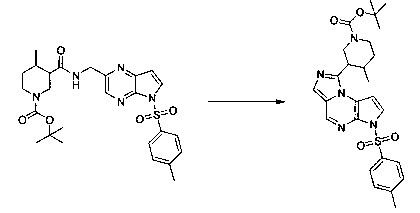
К раствору трет-бутил 4-метил-3-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метилкарбамоил)пиперидин-1-карбоксилата (44 г, 83 ммоль, пример № 13, стадия H) в 1,4-диоксане (500 мл) добавляют Реагент Лоусона (20,2 г, 50,0 ммоль). Реакционную смесь нагревают при температуре около 80°C в течение около 1 часа. Реакционную смесь оставляют остывать до комнатной температуры с последующим добавлением диацетоксиртути (26,6 г, 83,0 ммоль). Через примерно 1 час добавляют дополнительное количество диацетоксиртути (13,3 г, 42,0 ммоль). Примерно через 15 мин, реакционную смесь выливают в перемешиваемый EtOAc (2 л). Примерно через 15 мин реакционную смесь фильтруют через Celite® и фильтрат концентрируют при пониженном давлении. Полученный остаток тщательно растирают с EtOAc (500 мл) и фильтруют. Полученный фильтрат концентрируют при пониженном давлении и очищают на хроматографической колонке с силикагелем (330 г колонка), осуществляя градиентное элюирование 10-50% EtOAc в гептане, получая трет-бутил 4-метил-3-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)пиперидин-1-карбоксилат (19 г, 44%) в виде твердого вещества белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,57 мин; МС m/z: 510 (M+H)+.
Общая процедура BB: Конденсация Knoevenagel для получения замещенного циклопентадиена
В круглодонную колбу помещают органический растворитель (например ТГФ или диметиловый эфир диэтиленгликоля; предпочтительно, ТГФ), с последующим порционным добавлением гидрида натрия (60% дисперсия в минеральном масле) (предпочтительно, 1 эквив.). Необязательно добавляют органический растворитель. Полученную реакционную смесь охлаждают до около −10°C до 0°C (предпочтительно, около 0°C). β-кетоэфир (предпочтительно, 1 эквив.) по каплям добавляют с такой скоростью, чтобы поддерживать внутреннюю температуру ниже, чем около 10°C. Полученную смесь перемешивают при температуре около 0-25°C (предпочтительно, около 25°C) в течение около 0,5-2 час (предпочтительно, около 0,5 час), с последующим добавлением по каплям α-галогенокетона (предпочтительно, 0,45-0,55 эквив.). Полученную смесь нагревают при около 40-80°C (предпочтительно, около 50°C) в течение около 3-24 час (предпочтительно, около 19 час). Органический растворитель удаляют при пониженном давлении, и полученный сырой материал обрабатывают водой и помещают на баню со льдом. Полученную суспензию фильтруют примерно через 1-3 час (предпочтительно, около 2 час), и фильтровальную лепешку промывают водой и сушат в вакууме в течение около 1-3 час (предпочтительно, около 1 часа). Полученный твердый материал суспендируют в органическом растворителе (предпочтительно, Et2O) и собирают вакуумным фильтрованием, промывают органическим растворителем (предпочтительно, Et2O), и сушат в вакууме, получая нужный продукт в виде натриевой соли енолята.
Иллюстрация общей процедуры BB
Пример получения № BB.1: Натрий 4-(этоксикарбонил)-3-этил-2-(метоксикарбонил)циклопента-1,3-диенолят
В круглодонную колбу помещают ТГФ (1,5 л) с последующим порционным добавлением гидрида натрия (60% дисперсия в минеральном масле, 70,0 г, 1,75 моль). Добавляют дополнительное количество ТГФ (500 мл), и полученную смесь охлаждают до около −10° и по каплям добавляют этилпропионилацетат (250 мл, 1,80 моль) в течение около 1 часа для того, чтобы поддерживать внутреннюю температуру ниже, чем около 10°C. Полученную смесь перемешивают при комнатной температуре в течение около 0,5 час, получая прозрачный желтый раствор, и по каплям добавляют метил 4-хлорацетоацетат (100 мл, 0,88 моль) в течение около 5 мин. Полученную смесь нагревают при температуре около 50°C в течение около 19 час, получая суспензию красно-оранжевого цвета. Полученную реакционную смесь охлаждают до комнатной температуры, концентрируют при пониженном давлении, и полученную жидкость переносят в химический стакан и разбавляют водой (350 мл). Полученную смесь перемешивают и помещают на баню со льдом примерно на 2 час. Твердый продукт собирают вакуумным фильтрованием и фильтровальную лепешку промывают водой (150 мл) и сушат в вакууме в течение около 1 часа. Твердый продукт суспендируют в Et2O (1,5 л), фильтруют, промывают Et2O (1,5 л), и сушат в вакууме. Полученный твердый материал азеотропно перегоняют с толуолом (1 л), получая твердый материал, который снова суспендируют в Et2O (1 л) и собирают вакуумным фильтрованием. Фильтровальную лепешку промывают Et2O (500 мл) и сушат в вакууме, получая натрий 4-(этоксикарбонил)-3-этил-2-(метоксикарбонил)циклопента-1,3-диенолят (204,2 г, 89%) в виде твердого вещества бежевого цвета: 1H ЯМР (ДМСО-d 6) δ 3,94 (кв, J=7,1 Гц, 2H), 3,46 (с, 3H), 3,04 (кв, J=7,2 Гц, 2H), 2,66 (с, 2H), 1,13 (т, J=7,1 Гц, 3H), 0,99 (т, J=7,3 Гц, 3H).
Общая процедура CC: Декарбоксилирование енолят сложного β-кетоэфира
В круглодонную колбу помещают соответствующий сложный β-кетоэфир или его натрийенолят (предпочтительно, 1 эквив.), органический растворитель (например диметиловый эфир диэтиленгликоля) и AcOH (2-5 эквив., предпочтительно, 2,5 эквив.). К полученной смеси порциями добавляют иодид натрия (2-5 эквив., предпочтительно, 3,5 эквив.). Реакционную смесь нагревают при кипении с обратным холодильником в течение около 1-5 час (предпочтительно, около 3 час). Реакционную смесь охлаждают до комнатной температуры и выливают в смесь льда и насыщенного раствора бикарбоната натрия. Полученную смесь экстрагируют органическим растворителем (предпочтительно, Et2O). Объединенные органические слои сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Сырой материал необязательно очищают, используя вакуумную перегонку, осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры CC
Пример получения № CC.1: Этил 2-этил-4-оксоциклопент-2-енкарбоксилат

В круглодонную колбу помещают натрий 4-(этоксикарбонил)-3-этил-2-(метоксикарбонил)циклопента-1,3-диенолят (250 г, 0,94 моль, пример получения № BB.1) и диглим (1,1 л), получая суспензию зеленого цвета, с последующим добавлением AcOH (140 мл, 2,4 моль). К полученной смеси порциями добавляют иодид натрия (490 г, 3,3 моль) в течение около 5-10 мин. После добавления температура повышается с около 16°C до около 36°C. Полученную реакционную смесь затем нагревают при кипении с обратным холодильником в течение около 3 час, охлаждают до комнатной температуры, и выливают на смесь льда (2 л) и насыщенного водного раствора NaHCO3 (4 л). Полученный материал экстрагируют Et2O (4×1,2 л), и объединенные органические слои сушат над безводным MgSO4 и фильтруют. Растворитель удаляют при пониженном давлении, получая жидкость коричневого цвета (250 мл), которую очищают, используя вакуумную перегонку (80-92°C, 40 Па), получая этил 2-этил-4-оксоциклопент-2-енкарбоксилата (95,7 г, 56%) в виде сиропа желтого цвета: 1H ЯМР (CDCl3) δ 6,04 (м, 1H), 4,26-4,15 (м, 2H), 3,76-3,69 (м, 1H), 2,75-2,57 (м, 2H), 2,56-2,44 (м, 2H), 1,32-1,26 (м, 3H), 1,23-1,18 (м, 3H).
Общая процедура DD: Гидрирование алкена
В круглодонную колбу помещают 10% палладий-на-угле (около 0,02-0,05 эквив., предпочтительно, 0,02 эквив.). Колбу откачивают, затем продувают азотом 2-5 раз (предпочтительно, 3 раза), затем необязательно охлаждают до около −10-10°C (предпочтительно, около 0°C.) перед добавлением органического растворителя (предпочтительно, EtOAc) в атмосфере азота. Охлаждающую баню удаляют, и к полученной смеси добавляют алкен (предпочтительно, 1 эквив.) в чистом виде или необязательно в виде раствора в органическом растворителе (предпочтительно, EtOAc). Газообразный водород барботируют через полученную реакционную смесь в течение около 5-20 мин (предпочтительно, около 5 мин), и полученную смесь перемешивают в атмосфере водорода в течение около 12-60 час (предпочтительно, около 48 час). В тех случаях, когда по данным TLC, ЖХ/МС или ВЭЖХ реакция не протекает до завершения, источник водорода удаляют, полученную реакционную смесь барботируют азотом в течение около 5-20 мин (предпочтительно, около 5 мин) и затем фильтруют через слой Celite®, и полученный фильтрат концентрируют при пониженном давлении. Сырой материал снова обрабатывают в указанных выше условиях реакции в течение около 2-20 час (предпочтительно, около 5 час). Источник водорода удаляют, и полученную смесь барботируют азотом в течение около 5-20 мин (предпочтительно, около 5 мин) и затем фильтруют через слой Celite®. Фильтровальную лепешку промывают органическим растворителем (предпочтительно, EtOAc), и полученный фильтрат концентрируют при пониженном давлении, получая сырой продукт. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательное растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры DD
Пример получения № DD.1: Этил 2-этил-4-оксоциклопентанкарбоксилат
В круглодонную колбу помещают 10% палладий-на-угле (10 г, 9,4 ммоль). Колбу охлаждают до около 0°C, и в атмосфере азота добавляют EtOAc (400 мл). Охлаждающую баню удаляют и добавляют этил 2-этил-4-оксоциклопент-2-енкарбоксилат (47,8 г, 263 ммоль, пример получения № CC.1). Газообразный водород барботируют через полученную смесь в течение около 5 мин, и затем полученную смесь перемешивают в атмосфере водорода в течение около 48 час. Источник водорода удаляют, полученную смесь барботируют азотом в течение около 5 мин и фильтруют через слой Celite®. Фильтровальную лепешку промывают EtOAc (400 мл). Полученный фильтрат концентрируют при пониженном давлении, получая этил 2-этил-4-оксоциклопентанкарбоксилат (около 9:1 смесь цис:транс)(48 г, 99%) в виде жидкости желтого цвета: 1H ЯМР (CDCl3) δ 4,23-4,10 (м, 2H), 3,22 (м, 1H), 2,59-2,50 (м, 1H), 2,44-2,28 (м, 3H), 2,26-2,16 (м, 1H), 1,58-1,46 (м, 1H), 1,41-1,30 (м, 1H), 1,30-1,23 (м, 3H), 1,02-0,91 (м, 3H).
Общая процедура EE: Восстановительное аминирование кетона или альдегида
В круглодонную колбу помещают кетон или альдегид (1-40 эквив.; предпочтительно, 1 эквив.) в органическом растворителе (таком как DCE, MeCN, MeOH, или MeCN/MeOH; предпочтительно, DCE). Полученную смесь необязательно охлаждают до около −10-10°C (предпочтительно, около 0°C) и по каплям добавляют AcOH (1-3 эквив.; предпочтительно, 1,5 эквив.) и амин (1-3 эквив., предпочтительно, 1 эквив.), с последующим порционным добавлением подходящего восстанавливающего агента, такого как триацетоксиборгидрид натрия, цианоборгидрид натрия, боргидрид натрия, предпочтительно триацетоксиборгидрид натрия (1-6 эквив., предпочтительно, 1,5 эквив.). Альтернативно, к раствору амина (1-3 эквив., предпочтительно, 1 эквив.) в органическом растворителе (таком как DCE, MeCN, или MeOH; предпочтительно, DCE) добавляют кетон или альдегид (1-40 эквив.; предпочтительно, 1 эквив.) с последующим порционным добавлением соответствующего восстанавливающего агента, такого как триацетоксиборгидрид натрия, цианоборгидрид натрия, боргидрид натрия, предпочтительно триацетоксиборгидрид натрия (1-6 эквив., предпочтительно, 1,5 эквив.). Полученную смесь перемешивают в течение около 5-20 мин (предпочтительно, около 15 мин) с последующим добавлением по каплям AcOH (1-3 эквив.; предпочтительно, 1,5 эквив.). Если полученная реакционная смесь становится слишком вязкой, чтобы ее было легко перемешивать, дополнительный органический растворитель (такой как DCE, MeCN, MeOH, или смесь MeCN/MeOH; предпочтительно, DCE) необязательно добавляют для облегчения перемешивания. Полученную реакционную смесь перемешивают при комнатной температуре в течение около 1-48 час (предпочтительно, около 20 час). Полученную реакционную смесь медленно выливают в водный раствор основания (такой как насыщенный водный раствор NaHCO3) с последующим необязательным добавлением твердого NaHCO3, и перемешивают в течение около 0,5-3 час (предпочтительно, около 2 час). Слои разделяют, и органический раствор сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры EE
Пример получения № EE.1: Этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат
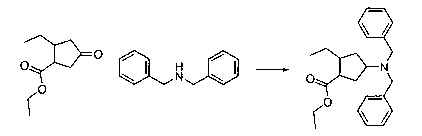
В круглодонную колбу помещают этил 2-этил-4-оксоциклопентанкарбоксилат (95,9 г, 521 ммоль, пример получения № DD.1) и DCE (1,8 л). Полученный раствор охлаждают до около 0°C и по каплям добавляют AcOH (45 мл, 780 ммоль) и дибензиламин (120 мл, 625 ммоль), что приводит к образованию густой суспензии. Полученную реакционную смесь нагревают до около 10°C и добавляют дополнительно DCE (500 мл). Порциями добавляют триацетоксиборгидрид натрия (166 г, 781 ммоль), и полученную реакционную смесь перемешивают при комнатной температуре в течение около 20 час. Полученную реакционную смесь медленно выливают в перемешиваемый насыщенный водный раствор NaHCO3 (1,5 л), с последующим порционным добавлением твердого бикарбоната натрия (175 г). Полученную смесь перемешивают в течение около 2 час и органический слой выделяют, сушат над безводным Na2SO4, и концентрируют досуха при пониженном давлении. Сырое масло желтого цвета очищают на хроматографической колонке с силикагелем, используя EtOAc/гептан в качестве элюента (0-20% EtOAc в гептане). Растворитель удаляют при пониженном давлении, получая в результате этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат (136,6 г, 72%) в виде твердого вещества белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=3,26 мин; МС m/z: 366 (M+H)+.
Общая процедура FF: Дебензилирование амина
К суспензии палладиевого катализатора (например Pd(OH)2 -C или Pd/C; предпочтительно, Pd(OH)2-C) (0,01-0,1 эквив., предпочтительно, 0,02 эквив.) в органическом растворителе (предпочтительно, EtOH) добавляют соединение дибензиламина (предпочтительно, 1 эквив.). Полученную смесь встряхивают или перемешивают при температуре около 25-60°C (предпочтительно, около 50°C) в течение около 1-96 час (предпочтительно, около 1,5 час) при давлении около 30-414 кПа Н2 (предпочтительно, около 207 кПа Н2). После удаления источника Н2, полученную смесь фильтруют через слой Celite®, и полученный фильтрат концентрируют при пониженном давлении, получая искомый продукт. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры FF
Пример получения № FF.1: Этил 4-амино-2-этилциклопентанкарбоксилат
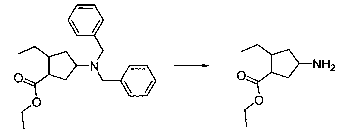
В реактор, содержащий суспензию 20% Pd(OH)2-C (12,9 г, 92,0 ммоль) в EtOH (1,0 л) добавляют этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат (129 г, 352 ммоль, пример получения № EE.1). Реакционную смесь встряхивают в течение около 90 мин при температуре около 50°C при давлении Н2 около 207 кПа. После удаления источника Н2, полученную смесь фильтруют через слой Celite®, и полученный фильтрат концентрируют при пониженном давлении, получая этил 4-амино-2-этилциклопентанкарбоксилат (64,5 г, 99%) в виде сиропа желтого цвета: 1H ЯМР (CDCl3) δ 4,03-3,88 (м, 2H), 3,17 (м, 1H), 2,68 (м, 1H), 2,09-2,02 (м, 2H), 2,02-1,94 (м, 2H), 1,84 (м, 1H), 1,58-1,48 (м, 1H), 1,32-1,18 (м, 1H), 1,09 (м, 3H), 1,03 (м, 2H), 0,78-0,69 (м, 3H).
Общая процедура GG: Гидролиз сложного эфира до карбоновой кислоты
В колбу, содержащую сложный эфир (предпочтительно, 1 эквив.) или в чистом виде или в органическом растворителе (таком как 1,4-диоксан, MeOH, или ТГФ/MeOH, предпочтительно, 1,4-диоксан) добавляют водный раствор основания (такой как водный раствор NaOH или LiOH, 1-10 эквив., предпочтительно, 2-6 эквив.). Полученную смесь перемешивают при температуре около 0-100°C (предпочтительно, при комнатной температуре) в течение около 1-12 час (предпочтительно, около 4-8 час). Полученную реакционную смесь затем подкисляют, добавляя подходящий водный раствор кислоты (такой как водный раствор HCl). Слои разделяют, и водный слой необязательно экстрагируют дополнительным органическим растворителем (таким как EtOAc или DCM, предпочтительно, DCM). Органический слой или слои необязательно сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют досуха при пониженном давлении, получая сырое целевое соединение. Альтернативно, полученную реакционную смесь концентрируют при пониженном давлении, получая сырое целевое соединение в виде карбоксилата (соли). Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры GG
Пример получения № GG.1: (1S,2R,4S)-4-(циклопропансульфонамидо)-2-этилциклопентанкарбоновая кислота

В колбу, содержащую (1S,2R,4S)-этил 4-(циклопропансульфонамидо)-2-этилциклопентанкарбоксилат (11,1 г, 38,4 ммоль, пример № 15, стадия F) добавляют водный раствор NaOH (1 н, 210 мл, 210 ммоль). После перемешивания при комнатной температуре в течение около 8 час, реакционную смесь подкисляют до около pH 1, используя 6 н. водный раствор HCl, и экстрагируют DCM (3×150 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая (1S,2R,4S)-4-(циклопропансульфонамидо)-2-этилциклопентанкарбоновую кислоту с 25 мол.% DCM в качестве эксципиента (10,7 г, 99%): ЖХ/МС (Таблица 2, Способ a) Rt=1,71 мин; МС m/z: 260 (M−H)−.
Общая процедура HH: Дегидратация амида до нитрила
Смесь бензамида (предпочтительно, 1 эквив.) и дегидратирующего агента (предпочтительно, POCl3) (10-30 эквив.; предпочтительно, 20 эквив.) нагревают при температуре около 30-80°C (предпочтительно, около 60°C) при перемешивании в течение около 1-3 час (предпочтительно, около 1 часа). Полученную реакционную смесь затем концентрируют досуха при пониженном давлении. Полученный сырой продукт разделяют между органическим растворителем (таким как EtOAc) и насыщенным водным раствором NaHCO3. Слои разделяют, и органический раствор промывают солевым раствором и сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры HH
Пример получения № HH.1: 6-хлор-4-(трифторметил)никотинонитрил

Смесь 6-хлор-4-(трифторметил)никотинамида (0,847 г, 3,77 ммоль, пример получения № 27) и POCl3 (7,03 мл, 75,0 ммоль) нагревают при температуре около 60°C при перемешивании в течение около 1 часа. Полученную реакционную смесь охлаждают до комнатной температуры и концентрируют досуха при пониженном давлении и полученный материал разделяют между охлажденным насыщенным водным раствором NaHCO3 (30 мл) и EtOAc (30 мл). Слои разделяют, и органический раствор промывают насыщенным водным раствором NaHCO3 (30 мл) и солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют досуха при пониженном давлении, получая 6-хлор-4-(трифторметил)никотинонитрил (0,67 г, 86%) в виде жидкости коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,31 мин; 1Н ЯМР (CDCl3) δ 8,87 (с, 1H), 7,75 (с, 1H).
Общая процедура II: Процесс очистки с помощью хиральной препаративной ВЭЖХ
Хиральную очистку осуществляют, используя Varian 218 ЖХ насосы, Varian CVM 500 с переключаемыми клапанами и нагревателями для автоматического контроля за растворителем, колонкой и температурой и сборщик фракций Varian 701. Способы детектирования включают детектор с переменной длиной волны Varian 210, встроенный поляриметр (PDR-хиральный усовершенствованный лазерный поляриметр, модель ALP2002), который используют для количественного определения оптического вращения (+/−) и испарительный детектор светорассеяния (ELSD) (PS-ELS 2100 (Polymer Laboratories)), используя 100:1 разделенный поток. Используют следующие ELSD параметры: испаритель: 46°C, небулайзер: 24°C и поток газа: 1,1 SLM.
Примеры получения с использованием общей процедуры II из рацематов
Способ)
(M+Н)+
Примеры получения с использованием общей процедуры II для разделения скалемических смесей
(M+Н)+
Общая процедура JJ: Кислотный гидролиз ацетил-замещенного амина
К раствору N-ацетамида (предпочтительно, 1 эквив.) в органическом растворителе (таком как 1,4-диоксан) добавляют кислоту, такую как 6 н. водный раствор HCl (3-100 эквив., предпочтительно, 40 эквив.). Полученную реакционную смесь нагревают при температуре около 60-100°C (предпочтительно, около 100°C) в течение около 1-24 час (предпочтительно, около 16 час). Полученную реакционную смесь оставляют охлаждаться до комнатной температуры перед тем, как ее разделяют между органическим растворителем (таким как EtOAc или DCM) и водным раствором основания (такого как NaHCO3, NaCO3 или NaOH, предпочтительно, NaHCO3) и водный слой необязательно экстрагируют дополнительным органическим растворителем (таким как EtOAc или DCM). Органический слой сушат над безводным MgSO4 или Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры JJ
Пример получения № JJ.1: (1R,3S)-2,2-диметил-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклобутанамин

К раствору N-((1R,3S)-2,2-диметил-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклобутил)ацетамида (2,20 г, 4,86 ммоль, полученному с использованием A из примера получения № 9, и (1S,3R)-3-ацетамидо-2,2-диметилциклобутанкарбоновой кислоты [полученной как раскрыто в Tetrahedron: Asymmetry 2008, 19, 302-308] с EDC, C с DIEA) в 1,4-диоксане (30 мл), добавляют 6 н. водный раствор HCl (32,4 мл, 194 ммоль). Реакционную смесь нагревают при температуре около 100°C в течение около 16 час. Реакционной смеси дают остыть до комнатной температуры и ее разделяют между EtOAc (500 мл) и водным раствором NaHCO3 (500 мл). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая (1R,3S)-2,2-диметил-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклобутанамин (1,56 г, 78%) в виде твердого вещества желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,60 мин; МС m/z: 411 (M+H)+.
Общая процедура KK: Циклопропанирование с использованием хлориодометана
К алкену, циклоалкену или α,β-ненасыщенному кетону (предпочтительно, 1 эквив.) в органическом растворителе (например, в Et2O, толуоле или DCM, предпочтительно, DCM) по каплям добавляют диэтилцинк (предпочтительно, 1,1 M в толуоле, 1-10 эквив., предпочтительно, 5 эквив.). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 10-40 мин (предпочтительно, около 10 мин). Полученную реакционную смесь охлаждают до около 0°C, с последующим добавлением по каплям раствора хлориодометана (1-10 эквив., предпочтительно, 5 эквив.) в органическом растворителе (например, в Et2O, толуоле или DCM, предпочтительно, DCM). Полученную реакционную смесь нагревают до комнатной температуры и перемешивают в течение около 1-20 час (предпочтительно, около 18 час). К полученной реакционной смеси затем добавляют насыщенный водный раствор NH4Cl и перемешивают в течение около 10-60 минут (предпочтительно, около 20 мин). Полученную смесь экстрагируют органическим растворителем (предпочтительно, DCM). Органический слой необязательно промывают насыщенным водным раствором NaHCO3 и/или солевым раствором. Во всех случаях полученный раствор сушат над безводным Na2SO4 или MgSO4, затем декантируют или фильтруют перед концентрированием при пониженном давлении. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры KK
Пример получения № KK.1: (1R,2S,4R,5S)-метил 4-(этоксикарбониламино)бицикло[3.1.0]гексан-2-карбоксилат

К (1S,4R)-4-(трет-бутоксикарбониламино)циклопент-2-енкарбоновой кислоте (2,70 г, 11,8 ммоль, пример получения № 17) в DCM (170 мл) медленно добавляют диэтилцинк (1,1 M в толуоле, 54,0 мл, 59,4 ммоль). Полученную смесь перемешивают в течение около 10 мин при комнатной температуре, охлаждают до около 0°C, и обрабатывают по каплям раствором хлориодометана (4,30 мл, 59,4 ммоль) в DCM (24 мл). Полученную реакционную смесь оставляют нагреться до комнатной температуры и перемешивают в течение около 18 час. Добавляют насыщенный водный раствор NH4Cl (10 мл), и полученную смесь перемешивают в течение около 20 мин. Слои разделяют, и водный слой затем экстрагируют DCM (20 мл). Объединенные органические слои промывают солевым раствором (20 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-100% EtOAc/гептан до получения (1R,2S,4R,5S)-метил 4-(этоксикарбониламино)бицикло[3.1.0]гексан-2-карбоксилата (0,95 г, 35%): ЖХ/МС (Таблица 2, Способ a) Rt=1,88 мин; МС m/z: 228 (M+H)+.
Общая процедура LL.1: Получение бромметилкетона из хлорангидрида, используя 1-метил-3-нитро-1-нитрозогуанидин
К смеси водного раствора основания (такого как 45% KOH) (100-200 эквив., предпочтительно, 125 эквив.) и органического растворителя (такого как Et2O) при температуре около −20-20°C (предпочтительно, около 0°C) добавляют 1-метил-3-нитро-1-нитрозогуанидин [TCI] (5-20 эквив., предпочтительно, 12 эквив.) порциями для получения CH2N2 in situ. Через примерно 0,5-2,0 час (предпочтительно, около 0,5 час) слои разделяют, и органический слой медленно добавляют к раствору соответствующим образом замещенного хлорангидрида (предпочтительно, 1 эквив.) в органическом растворителе (таком как ТГФ, 1,4-диоксан или Et2O, предпочтительно, ТГФ) при температуре около −20-20°C (предпочтительно, около 0°C). Полученную реакционную смесь перемешивают в течение около 0,5-2,0 час (предпочтительно, около 0,5 час) при температуре около −20-20°C (предпочтительно, около 0°C) перед тем, как по каплям добавляют 48% водный раствор HBr (10-40 эквив., предпочтительно, 14 эквив.). Примерно через 15-30 мин, (предпочтительно, около 15 мин) полученную реакционную смесь промывают солевым раствором после необязательного добавления органического растворителя (такого как EtOAc). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры LL.1
Пример получения № LL.1.1: (R)-(9H-флуорен-9-ил)метил 3-(2-бромацетил)пиперидин-1-карбоксилат

К смеси 45% водного раствора KOH (30 мл, 2,70 ммоль) и Et2O (100 мл) при температуре около 0°C порциями добавляют 1-метил-3-нитро-1-нитрозогуанидин (5,0 г, 34 ммоль, TCI). Примерно через 30 мин слои разделяют, и органический слой медленно добавляют к раствору (R)-(9H-флуорен-9-ил)метил 3-(хлоркарбонил)пиперидин-1-карбоксилата (1,0 г, 2,7 ммоль), полученному с использованием W из (R)-1-(((9H-флуорен-9-ил)метокси)карбонил)пиперидин-3-карбоновой кислоты (Fluka) в ТГФ (10 мл). Полученную реакционную смесь медленно перемешивают в течение около 30 мин при температуре около 0°C перед тем, как по каплям добавляют 48% водный раствор HBr (2,0 мл, 37 ммоль). Примерно через 15 мин, полученную реакционную смесь промывают солевым раствором (2×100 мл). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая (R)-(9H-флуорен-9-ил)метил 3-(2-бромацетил)пиперидин-1-карбоксилат (1,10 г, 95%) в виде прозрачного масла: ЖХ/МС (Таблица 2, Способ a) Rt=2,59 мин; МС m/z: 428/430 (M+H)+.
Общая процедура LL.2: Получение бромметилкетона из хлорангидрида с использованием триметилсилилдиазометана
Раствор соответствующим образом замещенного хлорангидрида (предпочтительно, 1 эквив.) в органическом растворителе (таком как ТГФ, MeCN, Et2O, или ТГФ/MeCN, предпочтительно, ТГФ/MeCN) добавляют к раствору 2,0 M триметилсилилдиазометана (2 M в Et2O) (2-10 эквив., предпочтительно, 4 эквив.) при температуре около −20-20°C (предпочтительно, около 0°C) в подходящем органическом растворителе, таком как ТГФ, MeCN, Et2O, или ТГФ/MeCN, предпочтительно, ТГФ/MeCN). Полученную реакционную смесь перемешивают в течение около 0,5-5 час (предпочтительно, около 4 часов) при температуре около −20-20°C (предпочтительно, около 0°C) перед тем, как по каплям добавляют 48% водный раствор HBr (5-40 эквив., предпочтительно, 10 эквив.). Примерно через 0-30 мин, (предпочтительно, около 0 мин) полученную реакционную смесь концентрируют досуха, получая искомый продукт, или необязательно промывают солевым раствором после необязательного добавления органического растворителя (такого как EtOAc). В тех случаях, когда полученную реакционную смесь подвергают обработке водой, органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырой материал необязательно очищают, используя осаждение, кристаллизацию, и/или тщательно растирая с соответствующим растворителем (или растворителями) и/или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры LL.2
Пример получения № LL.2.1 (R)-(9H-флуорен-9-ил)метил 3-(2-бромацетил)пиперидин-1-карбоксилат

(R)-(9H-флуорен-9-ил)метил 3-(хлоркарбонил)пиперидин-1-карбоксилат (4,21 г, 11,4 ммоль, полученный с использованием W из (R)-1-(((9H-флуорен-9-ил)метокси)карбонил)пиперидин-3-карбоновой кислоты [Fluka]) растворяют в смесь ТГФ и MeCN (1:1, 16 мл) и добавляют к раствору триметилсилилдиазометана (2 M в Et2O, 22,8 мл, 45,5 ммоль) и ТГФ/MeCN (1:1, 16 мл) при температуре около 0°C. Полученную смесь перемешивают при температуре около 0°C в течение около 4 часов с последующим добавлением по каплям HBr (48% водный раствор, 6,2 мл, 114 ммоль). Органические растворители удаляют, и полученный осадок собирают фильтрованием и сушат на воздухе, получая (R)-(9H-флуорен-9-ил)метил 3-(2-бромацетил)пиперидин-1-карбоксилат (4,46 г, 92%): ЖХ/МС (Таблица 2, Способ a) Rt=2,59 мин; МС m/z: 428/430 (M+H)+.
Общая процедура MM: Восстановление α,β-ненасыщенного кетона до аллилового спирта
В круглодонную колбу помещают α,β-ненасыщенный кетон (предпочтительно, 1 эквив.), органический растворитель (такой как MeOH или EtOH, предпочтительно, MeOH) и гептагидрат хлорида церия(III) (1-2 эквив., предпочтительно, 1,25 эквив.) с последующим добавлением порциями восстанавливающего агента, такого как боргидрид натрия (1-2 эквив., предпочтительно, 1,25 эквив.). Полученную смесь перемешивают при комнатной температуре в течение около 5-24 час (предпочтительно, около 16 час). Полученную реакционную смесь гасят водным раствором кислоты (таким как насыщенный водный раствор NH4Cl). Полученную смесь перемешивают в течение около 5-30 мин (предпочтительно, около 10 мин), с последующим добавлением органического растворителя (такого как Et2O). Слои разделяют, и водный слой экстрагируют органическим растворителем (таким как Et2O). Объединенные органические слои промывают насыщенным водным раствором NaHCO3, сушат над безводным Na2SO4 или MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Сырой материал необязательно очищают далее, используя осаждение, кристаллизацию, или тщательно растирая с соответствующим растворителем (или растворителями) или используя хроматографию, получая целевое соединение.
Иллюстрация общей процедуры ММ
Пример получения № MM.1: Цис- и транс-этил-4-гидрокси-2-метилциклопент-2-енкарбоксилат
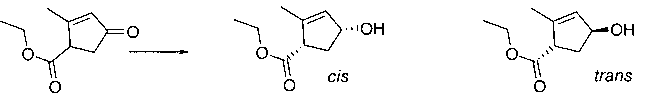
В круглодонную колбу помещают этил 2-метил-4-оксоциклопент-2-енкарбоксилат (2,04 г, 12,1 ммоль, пример получения № CC.1), MeOH (30 мл), и гептагидрат хлорида церия(III) (5,65 г, 15,2 ммоль) с последующим добавлением порциями боргидрида натрия (0,574 г, 15,2 ммоль). Полученную суспензию перемешивают при комнатной температуре в течение около 16 час. Добавляют насыщенный водный раствор NH4Cl (50 мл). Полученную смесь перемешивают в течение около 10 мин и добавляют Et2O (60 мл). Слои разделяют, и водный слой экстрагируют Et2O (3×30 мл). Объединенные органические слои промывают насыщенным водным раствором NaHCO3, сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Полученный остаток очищают, используя хроматографическую обработку на силикагеле, элюируя смесью 20-60% EtOAc/пентана, получая в результате цис-этил 4-гидрокси-2-метилциклопент-2-енкарбоксилат (0,96 г, 46%): 1H ЯМР (400 МГц, CDCl3) δ 5,77-5,71 (м, 1H), 4,63 (м, 1H), 4,28-4,11 (м, 2H), 3,27-3,20 (м, 1H), 2,59 (уш.с, 1H), 2,41-2,30 (м, 1H), 2,00 (д, J=14,2 Гц, 1H), 1,79 (д, J=1,2 Гц, 3H), 1,30 (т, J=7,1 Гц, 3H) и транс-этил 4-гидрокси-2-метилциклопент-2-енкарбоксилат (0,69 г, 33%):1H ЯМР (400 МГц, CDCl3) δ 5,63 (дд, J=1,8, 3,4 Гц, 1H), 4,98 (м, 1H), 4,20-4,11 (м, 2H), 3,60-3,53 (м, 1H), 2,57 (ддд, J=4,4, 7,1, 13,9 Гц, 1H), 1,98 (ддд, J=3,5, 8,4, 13,9 Гц, 1H), 1,80 (д, J=1,4, 3H), 1,46 (уш.с, 1H), 1,27 (т, J=7,1 Гц, 3H).
Пример № 1: 1-(2-метилциклогексил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин
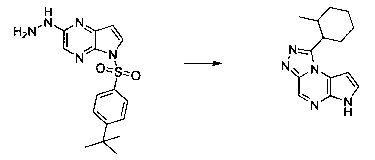
К раствору 5-(4-трет-бутилфенилсульфонил)-2-гидразинил-5H-пирроло[2,3-b]пиразина (0,40 г, 1,2 ммоль, пример получения № 3) и DIEA (0,20 мл, 1,2 ммоль) в 1,4-диоксане (12 мл) при температуре около 0°C добавляют 2-метилциклогексанкарбонилхлорид (0,19 г, 1,2 ммоль, пример получения № 4). После завершения добавления, баню со льдом удаляют, и реакционную смесь оставляют нагреться до комнатной температуры. Примерно через 1 час, добавляют SOCl2 (0,42 мл, 5,8 ммоль), и реакционную смесь нагревают при температуре около 90°C в течение около 1 часа. Реакционную смесь оставляют остывать до комнатной температуры и затем добавляют водный раствор Na2CO3 (2 M, 11,6 мл, 23,2 ммоль) и MeOH (12 мл). Реакционную смесь нагревают при температуре около 90°C в течение около 3 дней. Реакционную смесь концентрируют при пониженном давлении для удаления MeOH, и затем разделяют между EtOAc (50 мл) и насыщенным водным раствором NaHCO3 (40 мл). Органический слой выделяют и сушат над безводным Na2SO4 и растворитель концентрируют при пониженном давлении. Полученный остаток очищают на силикагеле (12 г), используя EtOAc в качестве элюента, и затем очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ b). Объединенные содержащие продукт фракции концентрируют при пониженном давлении для удаления MeCN, и полученный осадок собирают вакуумным фильтрованием до получения 1-(2-метилциклогексил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина в виде твердого вещества белого цвета (0,10 г, 35%): ЖХ/МС (Таблица 2, Способ a) Rt=1,84 мин; МС m/z: 256 (M+H)+.
Пример № 2: 1-(пиперидин-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин

Стадия A: Бензил 4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)пиперидин-1-карбоксилат
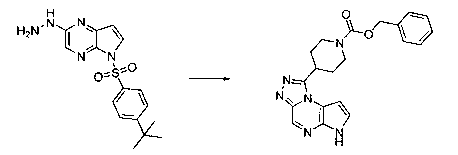
Бензил 4-(хлоркарбонил)пиперидин-1-карбоксилат (0,41 г, 1,4 ммоль, пример получения № 5) добавляют к раствору 5-(4-трет-бутилфенилсульфонил)-2-гидразинил-5H-пирроло[2,3-b]пиразина (0,50 г, 1,4 ммоль, пример получения № 3) и DIEA (0,25 мл, 1,4 ммоль) в 1,4-диоксане (15 мл) при температуре около 0°C. После завершения добавления, баню со льдом удаляют, и реакционную смесь оставляют нагреться до комнатной температуры. Примерно через 1 час добавляют SOCl2 (0,53 мл, 7,2 ммоль), и реакционную смесь нагревают при температуре около 90°C в течение около 1 часа. Реакционную смесь оставляют остывать до комнатной температуры, затем добавляют водный раствор Na2CO3 (2 M, 14,5 мл, 29,0 ммоль), и реакционную смесь нагревают при температуре около 90°C в течение около 3 дней. Реакционную смесь разделяют, используя EtOAc (50 мл) и насыщенный водный раствор NaHCO3 (40 мл). Органический слой сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Полученный остаток очищают на силикагеле (12 г), элюируя 50-100% EtOAc в гептане до получения бензил 4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)пиперидин-1-карбоксилата в виде твердого вещества желтого цвета (0,34 г, 61%): ЖХ/МС (Таблица 2, Способ a) Rt=1,89 мин; МС m/z: 377 (M+H)+.
Стадия B: 1-(пиперидин-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин
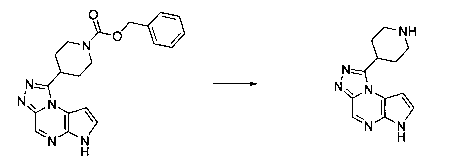
Бензил 4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)пиперидин-1-карбоксилат (0,34 г, 0,90 ммоль) и 10% Pd-на-угле (0,10 г, 0,09 ммоль) в MeOH (30 мл) встряхивают в атмосфере водорода при давлении около 414 кПа в течение около 5 час. Источник Н2 удаляют, и реакционную смесь фильтруют через Celite® и концентрируют при пониженном давлении, получая 1-(пиперидин-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин в виде твердого вещества желтого цвета (0,18 г, 77%): ЖХ/МС (Таблица 2, Способ a) Rt=0,70 мин; МС m/z: 243 (M+H)+.
Пример № 3: 3-(4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)пиперидин-1-ил)-3-оксопропаннитрил
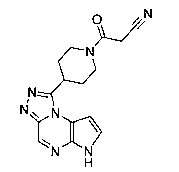
К суспензии 1-(пиперидин-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина (0,090 г, 0,37 ммоль, пример № 2) и пиридина (0,12 мл, 1,5 ммоль) в ДМФ (5 мл) добавляют перфторфенил 2-цианоацетат (0,14 г, 0,56 ммоль, пример получения № 6). Примерно через 3 час при комнатной температуре, полученную реакционную смесь гасят, используя MeOH (0,5 мл) и затем очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ b). Соответствующие фракции концентрируют и лиофилизируют до получения 3-(4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)пиперидин-1-ил)-3-оксопропаннитрила в виде твердого вещества белого цвета (0,005 г, 4%): ЖХ/МС (Таблица 2, Способ a) Rt=1,24 мин; МС m/z: 310 (M+H)+.
Пример № 4: 1-(1-(циклопропилсульфонил)пиперидин-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин
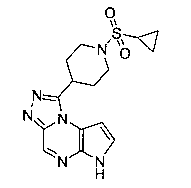
К суспензии 1-(пиперидин-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина (0,090 г, 0,37 ммоль, пример № 2) и пиридина (0,12 мл, 1,5 ммоль) в ДМФ (5 мл) добавляют циклопропансульфонилхлорид (0,060 г, 0,41 ммоль). Примерно через 3 часа при комнатной температуре, полученную реакционную смесь гасят, используя MeOH (0,5 мл), и затем очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ b). Соответствующие фракции концентрируют и лиофилизируют до получения 1-(1-(циклопропилсульфонил)пиперидин-4-ил)-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразина в виде твердого вещества белого цвета (0,008 г, 6%): ЖХ/МС (Таблица 2, Способ a) Rt=1,52 мин; МС m/z: 347 (M+H)+.
Пример № 5: 1-циклогексил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин
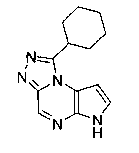
К раствору 5-(4-трет-бутилфенилсульфонил)-2-гидразинил-5H-пирроло[2,3-b]пиразина (0,39 г, 1,1 ммоль; пример получения № 3) и DIEA (0,20 мл, 1,1 ммоль) в 1,4-диоксане (12 мл) при температуре около 0°C добавляют циклогексанкарбонилхлорид (0,17 г, 1,1 ммоль). Реакционную смесь затем нагревают при комнатной температуре в течение около 1 часа. Добавляют SOCl2 (0,41 мл, 5,6 ммоль) и реакционную смесь нагревают при около 90°C в течение около 1 часа. Реакционную смесь охлаждают до комнатной температуры, и медленно добавляют водный раствор Na2CO3 (2 M, 12 мл, 24 ммоль) с последующим добавлением 1,4-диоксана (5 мл). Реакционную смесь нагревают при температуре около 60°C в течение около 72 час. Реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Сырой продукт разбавляют EtOAc (40 мл) и промывают насыщенным водным раствором NaHCO3 (40 мл) и солевым раствором (40 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-100% гептан/EtOAc (12 г колонка), и сушат в вакуумном термостате при температуре около 55°C в течение около 18 час, получая 1-циклогексил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин (0,109 г, 40%): ЖХ/МС (Таблица 2, Способ a) Rt=1,66 мин; МС m/z: 242 (M+H)+.
Пример № 6: N-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид

Стадия A: Трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамат

К смеси 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразина (2,50 г, 8,24 ммоль, пример получения № 9) и (1R,3S)-3-(трет-бутоксикарбониламино)циклопентанкарбоновой кислоты (2,08 г, 9,07 ммоль, Peptech) в DCM (30 мл) добавляют EDC.HCl (1,90 г, 9,89 ммоль). Примерно через 4,5 часа добавляют воду (30 мл), и слои разделяют. Водный слой затем экстрагируют EtOAc (15 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал растворяют в DCM (15 мл) и очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 40-100% EtOAc в гептане, получая трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамат (4,20 г, 97%): ЖХ/МС (Таблица 2, Способ a) Rt=2,27 мин; МС m/z: 515 (M+H)+.
Стадия B: Трет-бутил (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат
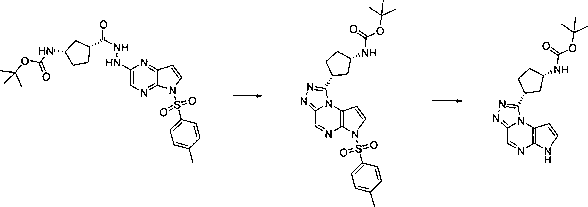
К раствору трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамата (4,73 г, 9,19 ммоль) в 1,4-диоксане (50 мл) добавляют TEA (5,10 мл, 36,8 ммоль) и SOCl2 (1,34 мл, 18,4 ммоль). Полученную реакционную смесь нагревают при температуре около 80°C. Примерно через 1,5 часа добавляют насыщенный водный раствор Na2CO3 (100 мл) и нагревание возобновляют при температуре около 80°C в течение около 6 часов. Полученную реакционную смесь охлаждают до комнатной температуры в течение около 3 дней и затем нагревают при температуре около 80°C в течение около 16 час. Добавляют воду и EtOAc (100 мл каждый), и слои разделяют. Водный слой затем экстрагируют дополнительным количеством EtOAc (2×100 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный сырой твердый материал тщательно растирают с петролейным эфиром (Т. кипения 30-60°C; 30 мл), и собирают вакуумным фильтрованием, промывая при этом дополнительным петролейным эфиром (Т. кипения 30-60°C; 20 мл), получая трет-бутил (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат в виде твердого вещества светло коричневого цвета (2,86 г, 86%): ЖХ/МС (Таблица 2, Способ a) Rt=1,75 мин; МС m/z: 343 (M+H)+.
Стадия C: Гидрохлорид (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина
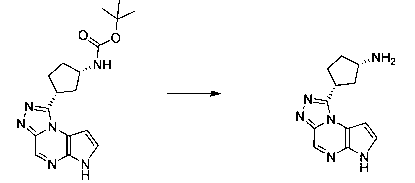
К смеси трет-бутил (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамата (1,57 г, 4,59 ммоль) в 1,4-диоксане (45 мл) добавляют HCl (4 M в 1,4-диоксане, 8,0 мл, 32,0 ммоль). Полученную реакционную смесь затем нагревают при температуре около 60°C. Примерно через 2 часа полученную реакционную смесь охлаждают до комнатной температуры, фильтруют, промывая при этом Et2O (50 мл), и твердый продукт сушат в вакуумном термостате в течение ночи при температуре около 60°C, получая гидрохлорид (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (1,38 г, 95%): ЖХ/МС (Таблица 2, Способ a) Rt=0,74 мин; МС m/z: 243 (M+H)+.
Стадия D: N-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид
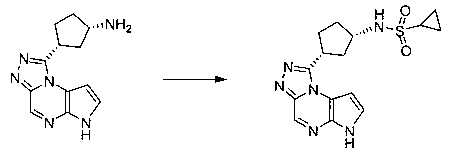
К смеси гидрохлорида (1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (0,300 г, 0,952 ммоль) в ДМФ (9 мл) добавляют TEA (0,462 мл, 3,33 ммоль) и циклопропансульфонилхлорид (0,097 мл, 0,95 ммоль). Примерно через 1,5 часа при комнатной температуре, реакционную смесь разбавляют водой (10 мл) и экстрагируют DCM (3×15 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. К сырому материалу добавляют MeOH (~50 мл) и отфильтровывают небольшое количество нерастворимого материала (<0,01 г). К полученному фильтрату добавляют силикагель (2 г), и полученную смесь концентрируют при пониженном давлении. Смесь с силикагелем очищают на хроматографической колонке с силикагелем, элюируя постадийно с градиентом DCM/MeOH/NH4OH от 990:9:1 до 980:18:2, получая твердое вещество не совсем белого цвета, которое сушат в вакуумном термостате при температуре около 70°C. Твердый продукт растворяют в горячем MeOH. Полученный материал фильтруют пока он горячий для удаления осадков. Полученный фильтрат обрабатывают ультразвуком пока он охлаждается, чтобы получить тонкую суспензию, которую затем концентрируют при пониженном давлении и сушат в вакуумном термостате при температуре около 100°C, получая N-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид (0,21 г, 64%): ЖХ/МС (Таблица 2, Способ a) Rt=1,51 мин; МС m/z: 347 (M+H)+.
Пример № 7: N-(4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид
Стадия A: Трет-бутил 4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)бицикло[2.2.2]октан-1-илкарбамат
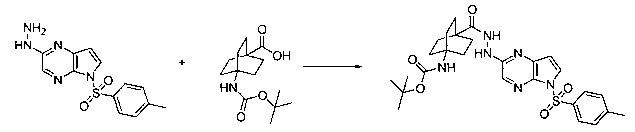
В круглодонную колбу помещают 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин (3,75 г, 11,1 ммоль, пример получения № 9), 4-(трет-бутоксикарбониламино)бицикло[2.2.2]октан-1-карбоновую кислоту (3,0 г, 11 ммоль, Prime Organics), HATU (4,23 г, 11,1 ммоль), TEA (6,2 мл, 44 ммоль), и DCM (65 мл). Полученную реакционную смесь перемешивают при комнатной температуре в течение около 16 час. Полученную реакционную смесь разбавляют водой (30 мл), и слои разделяют. Полученную реакционную смесь фильтруют через Celite® и промывают DCM (60 мл). Органический слой промывают водой (3×50 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-100% EtOAc в DCM до получения трет-бутил 4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)бицикло[2.2.2]октан-1-илкарбамата в виде твердого аморфного вещества коричневого цвета (5,38 г, 87%): ЖХ/МС (Таблица 2, Способ a) Rt=2,40 мин; МС m/z 555 (M+H)+.
Стадия B: 4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-амин

В круглодонную колбу помещают трет-бутил 4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)бицикло[2.2.2]октан-1-илкарбамат (5,38 г, 9,40 ммоль), SOCl2 (0,69 мл, 9,40 ммоль), TEA (1,57 мл, 11,3 ммоль) и 1,4-диоксан (72 мл). Полученную реакционную смесь нагревают при температуре около 80°C в течение около 2 час. Полученную реакционную смесь охлаждают до комнатной температуры, добавляют EtOAc (100 мл), и слои разделяют. Органический слой промывают водой (3×30 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая сырую смесь трет-бутил 4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-илкарбамата и 4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-амина в виде твердого вещества коричневого цвета (8,5 г). К этой сырой смеси добавляют HCl (4 н. в 1,4-диоксане, 12 мл, 48,0 ммоль), и 1,4-диоксан (56 мл). Полученную реакционную смесь перемешивают при температуре около 60°C в течение около 4 часов. Дополнительно добавляют HCl (4 M в 1,4-диоксане, 12 мл, 48,0 ммоль) и перемешивание продолжают при температуре около 60°C в течение около 3 час. Полученную реакционную смесь охлаждают до комнатной температуры. Полученный осадок фильтруют и промывают Et2O (около 50 мл). Твердый продукт перемешивают с NaHCO3 (5% в воде, 15 мл) в течение около 2 час. Твердый продукт отфильтровывают, промывают водой, и сушат в вакуумном термостате при температуре около 60°C в течение около 15 час, получая 4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-амин в виде твердого вещества желто-коричневого цвета (2,95 г, 72% за 2 стадии): ЖХ/МС (Таблица 2, Способ a) Rt=1,57 мин; МС m/z 437 (M+H)+.
Стадия C: N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид
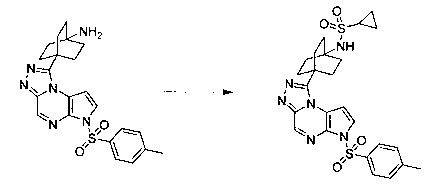
В круглодонную колбу помещают 4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-амин (0,40 г, 0,92 ммоль), TEA (0,51 мл, 3,7 ммоль) в DCM (3 мл) и ДМФ (6 мл). По каплям добавляют циклопропансульфонилхлорид (0,16 г, 1,1 ммоль), и полученную суспензию перемешивают при комнатной температуре в течение около 18 час. Растворитель удаляют при пониженном давлении и добавляют DCM (10 мл). Сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-10% MeOH/DCM, получая N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид (0,27 г, 55%): ЖХ/МС (Таблица 2, Способ a) Rt=2,14 мин; МС m/z 541 (M+H)+.
Стадия D: N-(4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид
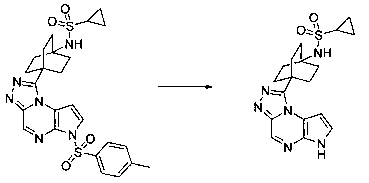
В круглодонную колбу помещают N-(4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид (0,27 г, 0,50 ммоль), водный раствор NaOH (1 н, 1,0 мл, 1,0 ммоль) и 1,4-диоксан (8 мл). Полученную реакционную смесь перемешивают при температуре около 60°C в течение около 2 час. Добавляют NH4OAc (50 мМ водный буфер, 2 мл) и ДМФ (7 мл), и нерастворимый материал удаляют, используя фильтрование. Полученный фильтрат очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ c). Соответствующие фракции объединяют, органический растворитель концентрируют при пониженном давлении, полученный твердый материал собирают фильтрованием, промывают водой (20 мл) и лиофилизируют, получая N-(4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид в виде твердого вещества (0,11 г, 56%): ЖХ/МС (Таблица 2, Способ a) Rt=1,53 мин; МС m/z 387 (M+H)+.
Пример № 8: 7-циклогексил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин

Стадия A: Трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамат
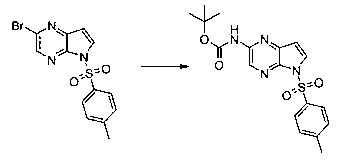
В колбу помещают Pd2(dba)3 (1,3 г, 1,42 ммоль), ди-трет-бутил-(2′,4′,6′-триизопропилбифенил-2-ил)фосфан (1,21 г, 2,84 ммоль) и 1,4-диоксан (75 мл). Смесь катализатор-лиганд дегазируют, используя цикл вакуум/продувка азотом (3 раза) и нагревают при температуре около 80°C в течение около 10 мин. Затем добавляют 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (5,0 г, 14,2 ммоль, пример получения № 7), трет-бутилкарбамат (2,5 г, 21,29 ммоль) и NaOt-Bu (2,05 г, 21,29 ммоль). После дополнительного цикла вакуум/продувка азотом, реакционную смесь нагревают при температуре около 80°C в течение около 16 часов. Реакционную смесь охлаждают до комнатной температуры и разбавляют EtOAc (70 мл). Реакционную смесь фильтруют, и полученный фильтрат промывают водой (3×20 мл). Органический слой сушат над безводным MgSO4, фильтруют и растворитель удаляют при пониженном давлении, получая твердое вещество красно-коричневого цвета. Сырой материал очищают, используя хроматографическую обработку на силикагеле, осуществляя градиентное элюирование 10-50% EtOAc в гептане, получая в результате трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамат в виде аморфного вещества желтого цвета (1,0 г, 18%): ЖХ/МС (Таблица 2, Способ a) Rt=2,63 мин; МС m/z: 389 (M+H)+.
Стадия B: Гидрохлорид 5-тозил-5H-пирроло[2,3-b]пиразин-2-амина
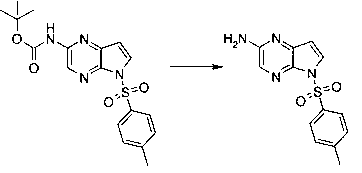
Трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамат (1,00 г, 2,57 ммоль) обрабатывают в соответствии с общей процедурой I до получения гидрохлорида 5-тозил-5H-пирроло[2,3-b]пиразин-2-амина (0,40 г, 54%): ЖХ/МС (Таблица 2, Способ a) Rt=1,94 мин; МС m/z: 289 (M+H)+.
Стадия C: 7-циклогексил-3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин
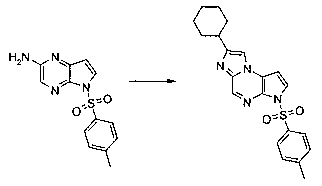
К суспензии гидрохлорида 5-тозил-5H-пирроло[2,3-b]пиразин-2-амина (0,10 г, 0,35 ммоль) и 2-бром-1-циклогексилэтанона (0,078 г, 0,38 ммоль, 3B Pharmachem) в n-BuOH (1,5 мл) добавляют DIEA (0,067 г, 0,52 ммоль), и полученный раствор нагревают при температуре около 170°C в микроволновом CEM™ в течение около 30 мин. Растворитель удаляют при пониженном давлении до получения 7-циклогексил-3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразина в виде сырого твердого вещества, которое используют на стадии D без дальнейшей очистки: ЖХ/МС (Таблица 2, Способ a) Rt=2,71 мин; МС m/z: 395 (M+H)+.
Стадия D: 7-циклогексил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин
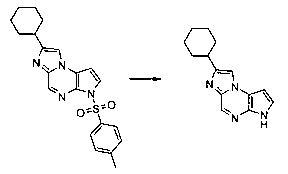
7-циклогексил-3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин (0,13 г, 0,33 ммоль) растворяют в 1,4-диоксане (5 мл) и добавляют водный раствор NaOH (2 н, 0,5 мл). Полученную смесь нагревают при кипячении с обратным холодильником в течение около 30 мин. Органический растворитель удаляют при пониженном давлении. Водную фазу нейтрализуют, используя 1 н. водный раствор HCl и экстрагируют EtOAc (2×25 мл). Объединенные органические экстракты промывают солевым раствором (15 мл), сушат над безводным MgSO4, и концентрируют при пониженном давлении. Полученный остаток очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ h), получая в результате 7-циклогексил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин в виде твердого вещества не совсем белого цвета (0,011 г, 14%): ЖХ/МС (Таблица 2, Способ a) Rt=2,06 мин; МС m/z: 241 (M+H)+.
Пример № 9: 8-циклогексил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин
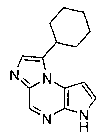
Стадия A: Трет-бутил 2-циклогексил-2-оксоэтил-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)карбамат
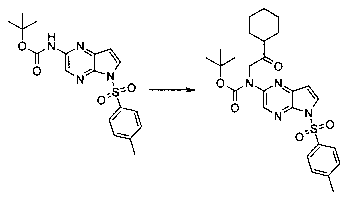
NaH (60% в минеральном масле, 0,020 г, 0,49 ммоль) добавляют к сухому ДМФ (3 мл). Полученную суспензию охлаждают до около 0°C, и по каплям добавляют раствор трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамата (0,19 г, 0,489 ммоль, пример № 8, стадия A) в сухом ДМФ (2 мл). Реакционной смеси дают нагреться до комнатной температуры и добавляют 2-бром-1-циклогексилэтанон (0,10 г, 0,49 ммоль, 3B PharmaChem). Полученную реакционную смесь перемешивают в течение около 2 часов, и затем концентрируют при пониженном давлении. В результате очистки с использованием флеш-хроматографии на силикагеле при элюировании 100% гептаном в течение 10 мин, затем с градиентом 10-20% EtOAc в гептане в течение 20 мин получают трет-бутил 2-циклогексил-2-оксоэтил(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)карбамат в виде аморфного вещества желтого цвета (0,080 г, 32%): ЖХ/МС (Таблица 2, Способ a) Rt=3,13 мин; МС m/z: 513 (M+H)+.
Стадия B: 8-циклогексил-3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин

Концентрированную H2SO4 (4 мл) добавляют к трет-бутил 2-циклогексил-2-оксоэтил-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)карбамату (0,07 г, 0,14 ммоль), и реакционную смесь перемешивают в течение около 30 мин при комнатной температуре. Реакционную смесь выливают в ледяную воду (75 мл) и экстрагируют EtOAc (2×50 мл). Объединенные органические экстракты промывают солевым раствором, сушат над безводным MgSO4, и концентрируют, получая в результате 8-циклогексил-3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин в виде масла желтого цвета, которое используют в примере № 9, на стадии C без дальнейшей очистки (0,051 г, 95%): ЖХ/МС (Таблица 2, Способ a) Rt=2,79 мин; МС m/z: 395 (M+H)+.
Стадия C: 8-циклогексил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин
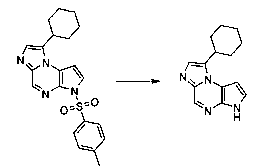
Водный раствор NaOH (2 н, 0,3 мл) добавляют к 8-циклогексил-3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразину (0,051 г, 0,13 ммоль) в 1,4-диоксане (3 мл), и полученную смесь нагревают при кипячении с обратным холодильником в течение около 1 часа. Органический растворитель удаляют при пониженном давлении, и водную фазу нейтрализуют водным раствором 1 н. HCl и экстрагируют EtOAc (2×15 мл). Объединенные органические экстракты промывают солевым раствором (1×10 мл), сушат над безводным MgSO4 и концентрируют в вакууме. Остаток снова суспендируют в MeCN (2 мл) и полученный осадок собирают фильтрованием и сушат, получая в результате 8-циклогексил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин в виде твердого вещества желто-коричневого цвета (0,006 г, 19%): ЖХ/МС (Таблица 2, Способ a) Rt=2,12 мин; МС m/z: 241 (M+H)+.
Пример № 10: 1-циклогексил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин
Стадия A: (E)-2-стирил-5-тозил-5H-пирроло[2,3-b]пиразин

К раствору 2-бром-5-тозил-5H-пирроло[2,3-b]пиразина (3,1 г, 8,8 ммоль, пример получения № 7), PdCl2(dppf).DCM (0,719 г, 0,880 ммоль) и (E)-стирилбороновой кислоты (2,60 г, 17,6 ммоль) в ТГФ (3 мл) и воде (2 мл) добавляют Na2CO3 (2,33 г, 22,0 ммоль). Полученную реакционную смесь дегазируют аргоном в течение около 5 мин. Полученную реакционную смесь нагревают до около 50°C. Примерно через 24 час, к полученной реакционной смеси добавляют дополнительно PdCl2(dppf).DCM (0,719 г, 0,880 ммоль), (E)-стирилбороновую кислоту (2,60 г, 17,6 ммоль) и Na2CO3 (2,33 г, 22,0 ммоль). После нагревания при температуре около 50°C в течение около 48 час, полученную реакционную смесь охлаждают до комнатной температуры и разбавляют DCM (200 мл) и водой (200 мл). Органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 20-60% EtOAc в гептане, содержащем 5% DCM, получая (E)-2-стирил-5-тозил-5H-пирроло[2,3-b]пиразин в виде твердого вещества желтого цвета (1,2 г, 36%). ЖХ/МС (Таблица 2, Способ a) Rt=2,99 мин; МС m/z: 376 (M+H)+.
Стадия B: 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегид
К раствору (E)-2-стирил-5-тозил-5H-пирроло[2,3-b]пиразина (1,2 г, 3,2 ммоль) в 1,4-диоксане (20 мл) и воде (2,0 мл) добавляют периодат натрия (2,73 г, 12,8 ммоль) с последующим добавлением тетраоксида осмия (2,5% в t-BuOH, 4,01 мл, 0,320 ммоль). Примерно через 1 день при комнатной температуре, добавляют дополнительное количество периодата натрия (2,73 г, 12,78 ммоль) и тетраоксида осмия (2,5% в t-BuOH, 4,01 мл, 0,320 ммоль). Примерно через 2 дня, добавляют водный раствор Na2S2O3 (100 мл) и EtOAc (100 мл). Органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный твердый материал тщательно растирают с гептаном для удаления бензальдегида. Полученный твердый материал сушат в вакууме, получая 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегид в виде твердого вещества коричневого цвета (0,77 г, 80%): ЖХ/МС (Таблица 2, Способ a) Rt=2,01 мин; МС m/z: 334 (M+H)+.
Стадия C: N-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метил)циклогексанкарбоксамид
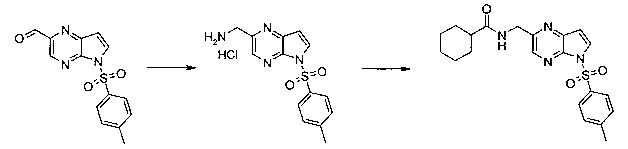
К раствору 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегида (0,150 г, 0,498 ммоль) в MeOH (10 мл) добавляют гидроксиламин (50% раствор в воде, 0,061 мл, 1,0 ммоль). Полученную реакционную смесь нагревают до около 45°C. Примерно через 2 часа полученную реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении, получая сырой 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегидоксим в виде твердого вещества желто-коричневого цвета. ЖХ/МС (Таблица 2, Способ a) Rt=2,15 мин; МС m/z: 317 (M+H)+. К раствору сырого оксима в ТГФ (20 мл) добавляют AcOH (0,285 мл, 4,98 ммоль) с последующим добавлением цинковой пыли (<10 микрон, 0,130 г, 1,99 ммоль). Еще через 2 часа к полученной реакционной смеси добавляют дополнительное количество AcOH (0,285 мл, 4,98 ммоль) и цинковой пыли (<10 микрон, 0,130 г, 1,99 ммоль). Еще через 2 часа к полученной реакционной смеси добавляют дополнительное количество AcOH (0,285 мл, 4,98 ммоль) и цинковой пыли (<10 микрон, 0,130 г, 1,99 ммоль). Примерно через 15 час, полученную реакционную смесь разбавляют DCM (около 5 мл) и фильтруют. Полученный фильтрат промывают насыщенным водным раствором NaHCO3 и солевым раствором. Органический слой сушат над безводным Na2SO4, фильтруют, обрабатывают HCl (4 M в 1,4-диоксане, 1 мл) и концентрируют при пониженном давлении, получая гидрохлорид (5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метанамина: ЖХ/МС (Таблица 2, Способ a) Rt=1,64 мин; МС m/z: 303 (M+H)+. К суспензии сырого амингидрохлорида в DCM (10 мл) добавляют TEA (0,208 мл, 1,49 ммоль) с последующим добавлением циклогексанкарбонилхлорида (0,101 мл, 0,747 ммоль). Примерно через 30 мин, полученную реакционную смесь разбавляют DCM и промывают насыщенным водным раствором NaHCO3 (25 мл) и солевым раствором (25 мл). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырой амид очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 40-80% EtOAc в DCM, получая N-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метил)циклогексанкарбоксамид в виде твердого вещества желто-коричневого цвета (0,081 г, 39% за 2 стадии). ЖХ/МС (Таблица 2, Способ a) Rt=2,40 мин; МС m/z: 413 (M+H)+.
Стадия D: 1-циклогексил-6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин
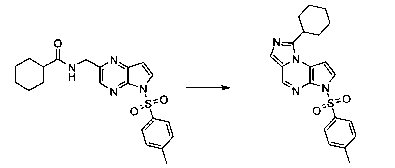
К раствору N-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метил)циклогексанкарбоксамида (0,081 г, 0,196 ммоль) в ТГФ (1 мл) при комнатной температуре добавляют 2,4-бис(4-феноксифенил)-1,3-дитиа-2,4-дифосфэтан-2,4-дисульфид (0,104 г, 0,196 ммоль, TCI). Примерно через 15 час, полученную реакционную смесь концентрируют при пониженном давлении. Полученный остаток суспендируют в EtOAc/DCM (1:1) и фильтруют через лепешку силикагеля (5 г), элюируя EtOAc/DCM (1:1, приблизительно 100 мл). В результате концентрирования полученного фильтрата получают сырой N-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метил)циклогексанкарботиоамид. Сырой тиоамид растворяют в ТГФ (1 мл) и добавляют диацетоксиртуть (0,0626 г, 0,196 ммоль). Примерно через 30 мин при комнатной температуре, добавляют дополнительно диацетоксиртуть (0,0626 г, 0,196 ммоль). Примерно через 4 часа полученную реакционную смесь разбавляют EtOAc, фильтруют, концентрируют при пониженном давлении и очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 50-95% EtOAc в гептане, получая 1-циклогексил-6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин в виде масла желтого цвета (0,020 г, 25%): ЖХ/МС (Таблица 2, Способ a) Rt=2,77 мин; МС m/z: 395 (M+H)+.
Стадия E: 1-циклогексил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин

К раствору 1-циклогексил-6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразина (0,020 г, 0,051 ммоль) в 1,4-диоксане (3 мл) добавляют водный раствор NaOH (2 н, 0,380 мл, 0,760 ммоль). Полученную реакционную смесь нагревают при около 90°C. Примерно через 5 часов полученную реакционную смесь охлаждают до комнатной температуры, разбавляют EtOAc (10 мл) и насыщенным водным раствором NH4Cl (10 мл). Органический слой выделяют и промывают водой (10 мл), затем солевым раствором (10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая 1-циклогексил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин в виде твердого вещества желто-коричневого цвета (0,011 г, 90%): ЖХ/МС (Таблица 2, Способ a) Rt=1,92 мин; МС m/z: 241 (M+H)+.
Пример № 11: 8-циклогексил-3H-дипирроло[1,2-a:2′,3′-e]пиразин

Стадия A: (E)-1-циклогексил-3-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)проп-2-ен-1-он
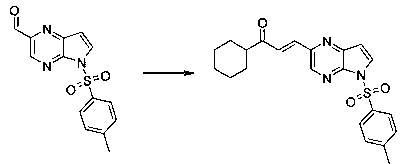
К раствору диэтил 2-циклогексил-2-оксоэтилфосфоната (0,609 г, 2,32 ммоль) в ТГФ (10 мл) добавляют NaH (60% дисперсия в минеральном масле, 0,0664 г, 1,66 ммоль). Примерно через 30 мин, добавляют раствор 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегида (0,20 г, 0,64 ммоль, пример № 10, стадия B) в ТГФ (10 мл). Примерно через 2 часа к полученной реакционной смеси добавляют EtOAc (50 мл) и насыщенный водный раствор NH4 Cl (50 мл). Органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток тщательно растирают с IPA (20 мл), получая (E)-1-циклогексил-3-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)проп-2-ен-1-он в виде твердого вещества желто-коричневого цвета (0,20 г, 73%): ЖХ/МС (Таблица 2, Способ a) Rt=3,06 мин; МС m/z: 410 (M+H)+.
Стадия B: 1-циклогексил-3-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)пропан-1-он
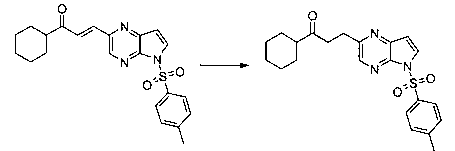
К раствору (E)-1-циклогексил-3-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)проп-2-ен-1-она (0,050 г, 0,12 ммоль) в EtOAc (5 мл) добавляют палладий (10% на угле, 0,0065 г, 0,0061 ммоль). Полученную реакционную смесь продувают водородом, и атмосферу водорода поддерживают, используя баллон. Примерно через 1 час при комнатной температуре, полученную реакционную смесь фильтруют и концентрируют при пониженном давлении, получая 1-циклогексил-3-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)пропан-1-он в виде масла (0,050 г, 100%): ЖХ/МС (Таблица 2, Способ a) Rt=2,94 мин; МС m/z: 412 (M+H)+.
Стадия C: 8-циклогексил-3-тозил-3H-дипирроло[1,2-a:2′,3′-e]пиразин
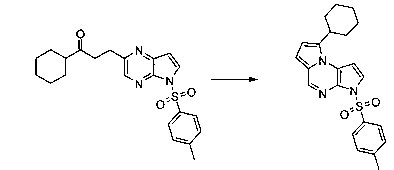
К раствору 1-циклогексил-3-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)пропан-1-она (0,050 г, 0,12 ммоль) в ТГФ (2 мл) добавляют 2,4-бис(4-феноксифенил)-1,3-дитиа-2,4-дифосфэтан-2,4-дисульфид (0,071 г, 0,13 ммоль, TCI). Примерно через 6 час при комнатной температуре, полученную реакционную смесь разбавляют EtOAc (50 мл) и NaHCO3 (50 мл). Органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 40-90% EtOAc в гептанах, получая 8-циклогексил-3-тозил-3H-дипирроло[1,2-a:2′,3′-e]пиразин в виде твердого вещества желто-коричневого цвета (0,020 г, 42%). ЖХ/МС (Таблица 2, Способ a) Rt=3,39 мин; МС m/z: 394 (M+H)+.
Стадия D: 8-циклогексил-3H-дипирроло[1,2-a:2′,3′-e]пиразин
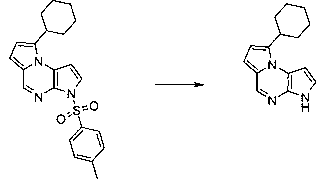
К раствору 8-циклогексил-3-тозил-3H-дипирроло[1,2-a:2′,3′-e]пиразина (0,015 г, 0,038 ммоль) в 1,4-диоксане (3 мл) добавляют водный раствор NaOH (2 н, 0,29 мл, 0,57 ммоль). Полученную реакционную смесь нагревают при около 90° C. Примерно через 15 часов полученную реакционную смесь охлаждают до комнатной температуры и разбавляют EtOAc (5 мл) и насыщенным водным раствором NH4Cl (5 мл). Органический слой выделяют, промывают водой (5 мл) затем солевым раствором (5 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток тщательно растирают со смесью EtOAc/гептан (1:1, 1 мл). Полученный твердый материал собирают фильтрованием и сушат в вакууме, получая 8-циклогексил-3H-дипирроло[1,2-a:2',3′-e]пиразин в виде твердого вещества желто-коричневого цвета (0,005 г, 55%). ЖХ/МС (Таблица 2, Способ a) Rt=2,78 мин; МС m/z: 240 (M+H)+.
Пример № 12 N-(4-(6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид
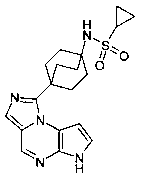
Стадия A: Трет-бутил 4-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метилкарбамоил)бицикло[2.2.2]октан-1-илкарбамат
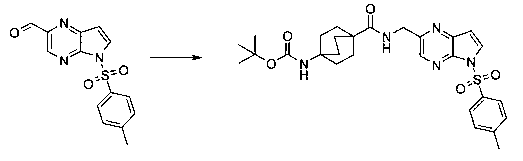
К раствору 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегида (0,49 г, 1,6 ммоль, пример № 10, стадия B) в MeOH (10 мл) добавляют гидроксиламин (50% в воде, 0,199 мл, 3,25 ммоль). Полученную реакционную смесь нагревают до около 40°C. Примерно через 2 часа полученную реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. К раствору сырого оксима в ТГФ (10 мл) и AcOH (0,93 мл, 16 ммоль) добавляют цинковую пыль (<10 микрон, 0,425 г, 6,50 ммоль). Примерно через 4 часа при комнатной температуре, полученную реакционную смесь разбавляют DCM и насыщенным водным раствором NaHCO3 и фильтруют через Celite®. Слои разделяют, и органический слой сушат над безводным Na2SO4, фильтруют, обрабатывают HCl (4 н. в 1,4-диоксане, 1 мл) и концентрируют при пониженном давлении. К раствору сырого амина в DCM (10 мл) добавляют 4-(трет-бутоксикарбониламино)бицикло[2.2.2]октан-1-карбоновую кислоту (0,48 г, 1,8 ммоль, Prime Organics), TEA (0,23 мл, 1,6 ммоль) и HATU (0,618 г, 1,63 ммоль). Примерно через 4 часа при комнатной температуре, полученную реакционную смесь разбавляют DCM и насыщенным водным раствором NaHCO3 и фильтруют через Celite®. Слои разделяют, и органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный сырой амид очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 20-80% EtOAc в DCM, получая трет-бутил-4-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метилкарбамоил)бицикло[2.2.2]октан-1-илкарбамат в виде твердого вещества желто-коричневого цвета (0,205 г, 23%). ЖХ/МС (Таблица 2, Способ a) Rt=2,52 мин; МС m/z: 554 (M+H)+.
Стадия B: Трет-бутил 4-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)бицикло[2.2.2]октан-1-илкарбамат

К раствору трет-бутил 4-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метилкарбамоил)бицикло[2.2.2]октан-1-илкарбамата (0,205 г, 0,370 ммоль) в ТГФ (5 мл) добавляют 2,4-бис(4-феноксифенил)-1,3-дитиа-2,4-дифосфэтан-2,4-дисульфид (0,215 г, 0,407 ммоль, TCI America). Примерно через 15 час при комнатной температуре к полученной реакционной смеси добавляют диацетоксиртуть (0,295 г, 0,926 ммоль). Примерно через 2 час, полученную реакционную смесь разбавляют EtOAc (30 мл) и фильтруют через Celite®. Полученный фильтрат концентрируют при пониженном давлении, и сырую смесь очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 20-80% EtOAc в DCM, получая трет-бутил 4-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)бицикло[2.2.2]октан-1-илкарбамат в виде твердого вещества желто-коричневого цвета (0,175 г, 84%). ЖХ/МС (Таблица 2, Способ a) Rt=2,84 мин; МС m/z: 536 (M+H)+.
Стадия C: N-(4-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид
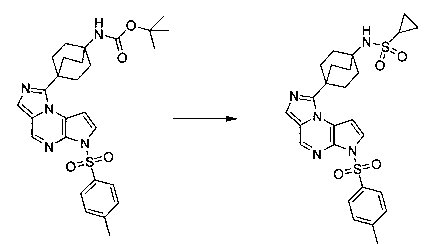
В колбу, содержащую трет-бутил 4-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)бицикло[2.2.2]октан-1-илкарбамат (0,175 г, 0,327 ммоль) добавляют раствор HCl (4 н. в 1,4-диоксане, 5 мл). Примерно через 2 часа при комнатной температуре полученную реакционную смесь концентрируют при пониженном давлении. Сырой аминогидрохлорид растворяют в DCM (10 мл) и к полученной реакционной смеси добавляют TEA (0,36 мл, 2,6 ммоль) с последующим добавлением циклопропансульфонилхлорида (0,18 г, 1,3 ммоль). Примерно через 2 часа при комнатной температуре добавляют ДМФ (3 мл), и полученную реакционную смесь концентрируют при пониженном давлении для удаления DCM. Затем после около 4 часов при комнатной температуре, к полученной реакционной смеси добавляют EtOAc (20 мл) и насыщенный водный раствор NaHCO3 (20 мл). Органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырую реакционную смесь очищают на хроматографической колонке с силикагелем, используя 20-80% EtOAc в DCM, получая N-(4-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид в виде твердого вещества желто-коричневого цвета (0,025 г, 14%). ЖХ/МС (Таблица 2, Способ a) Rt=2,34 мин; МС m/z: 540 (M+H)+.
Стадия D: N-(4-(6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид

К раствору N-(4-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамида (0,025 г, 0,046 ммоль) в 1,4-диоксане (3 мл) добавляют водный раствор NaOH (2 н, 0,35 мл, 0,70 ммоль). Полученную реакционную смесь нагревают до около 90°C. Примерно через 6 час, полученную реакционную смесь охлаждают до комнатной температуры и добавляют EtOAc (3 мл) и насыщенный водный раствор NH4Cl (1,5 мл). Слои разделяют, и органический слой промывают водой (1,5 мл), затем солевым раствором (1,5 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая N-(4-(6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамид в виде твердого вещества желто-коричневого цвета (0,012 г, 67%). ЖХ/МС (Таблица 2, Способ a) Rt=1,65 мин; МС m/z: 386 (M+H)+.
Пример № 13: 3-((3R,4R)-3-(6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)-4-метилпиперидин-1-ил)-3-оксопропаннитрил

Стадия A: 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин
Раствор 2-бром-5H-пирроло[2,3-b]пиразина (78,0 г, 394 ммоль, Ark Pharm) в безводном ДМФ (272 мл) по каплям добавляют за около 60 мин к перемешиваемой суспензии NaH (60% дисперсия в минеральном масле, 12,8 г, 532 ммоль) в безводном ДМФ (543 мл) при температуре около 0-5°C. Реакционный раствор коричневого цвета перемешивают в течение около 30 мин при температуре около 0-5°C. Затем по каплям добавляют раствор p-толуолсульфонилхлорида (94,0 г, 492 ммоль) в безводном ДМФ (272 мл) в течение около 60 мин при температуре около 0-5°C. Полученную реакционную смесь перемешивают при температуре около 0-5°C в течение около 1 часа, затем оставляют нагреваться до комнатной температуры и перемешивают в течение около 18 час при комнатной температуре. Полученную реакционную смесь медленно выливают в ледяную воду (6 л), с последующим добавлением водного раствора NaOH (2,5M, 50,0 мл, 125 ммоль). Полученный осадок собирают фильтрованием и перемешивают с холодной водой (3×200 мл). Твердый продукт собирают фильтрованием и сушат до постоянного веса в вакуумном термостате при температуре около 55°C, получая в результате 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин: (134,6 г, 97%) в виде твердого вещества бежевого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,58 мин; МС m/z: 352/354 (M+H)+.
Стадия B: (E)-2-стирил-5-тозил-5H-пирроло[2,3-b]пиразин

К раствору 2-бром-5-тозил-5H-пирроло[2,3-b]пиразина (75 г, 213 ммоль), аддукта PdCl2(dppf)-CH2Cl2 (8,69 г, 10,6 ммоль) и (E)-стирилбороновой кислоты (39,4 г, 266 ммоль) в ТГФ (600 мл) добавляют Na2CO3 (27,1 г, 256 ммоль) и воду (300 мл). Полученную реакционную смесь дегазируют азотом в течение около 45 мин. Полученную реакционную смесь нагревают при около 65°C в течение около 16 час, затем добавляют аддукт PdCl2(dppf)-CH2Cl2 (3,50 г, 4,29 ммоль). Примерно через 18 час, реакционную смесь охлаждают до комнатной температуры. Слои разделяют, и органический слой концентрируют при пониженном давлении. Полученный остаток тщательно растирают с EtOH (300 мл)/DCM (100 мл) и фильтруют. Полученный осадок тщательно растирают с горячим EtOH (400 мл) и фильтруют, затем промывают EtOH (200 мл) и Et2O (400 мл). Полученные фильтраты объединяют, концентрируют при пониженном давлении, и полученный остаток тщательно растирают с EtOH (300 мл)/DCM (100 мл) и перемешивают в течение ночи, предоставляя возможность DCM медленно испаряться. Полученную смесь фильтруют и промывают EtOH (100 мл) и Et2O (100 мл), получая вторую партию. Объединенные фильтровальные лепешки сушат в вакууме, получая (E)-2-стирил-5-тозил-5H-пирроло[2,3-b]пиразин (72,7 г, 91%) в виде твердого вещества желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,66 мин; МС m/z: 376 (M+H)+.
Стадия C: 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегид

К раствору (E)-2-стирил-5-тозил-5H-пирроло[2,3-b]пиразина (72,3 г, 193 ммоль) в 1,4-диоксане (1500 мл) и воде (300 мл) добавляют NaIO4 (165 г, 770 ммоль), затем добавляют OsO4 (5,00 г, 19,7 ммоль). Реакционную смесь перемешивают при температуре около 25°C в течение около 16 час. Реакционную смесь концентрируют при пониженном давлении, затем разделяют, используя 10% водный раствор Na2S2O3 (1000 мл) и DCM (1000 мл). Органический слой промывают водой (2×500 мл), и слои фильтруют для удаления нерастворившегося осадка, и разделяют. Органический слой сушат над безводным Na2SO4, фильтруют через Celite®, и концентрируют. Полученный остаток очищают фильтрованием через слой силикагеля (1000 г), элюируя 0-5% EtOAc в DCM. Полученные фракции концентрируют, и твердый продукт тщательно растирают с гептаном. Полученную смесь фильтруют, и фильтровальную лепешку промывают гептаном. Указанную процедуру повторяют для того, чтобы собрать нерастворившийся осадок. Твердый материал собирают, затем растворяют в 2% EtOAc в DCM и пропускают через слой силикагеля (100 г), элюируя 2% EtOAc в DCM. Полученный фильтрат концентрируют при пониженном давлении. Две партии объединяют, получая 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегид (39,1 г, 67%) в виде твердого вещества не совсем белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,17 мин; МС m/z: 302 (M+H)+.
Стадия D: (5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метанол

К раствору 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбальдегида (37,6 г, 125 ммоль) в EtOH (500 мл) и 1,4-диоксане (500 мл) добавляют NaBH4 (4,72 г, 125 ммоль) одной порцией. Примерно через 3 часа к полученной реакционной смеси медленно добавляют водный раствор HCl (1 н, 400 мл). Полученную смесь концентрируют до половины исходного объема при пониженном давлении, и к полученной смеси добавляют EtOAc (1000 мл) и воду (500 мл). Слои разделяют, и водный слой экстрагируют EtOAc (500 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая (5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метанол (35,9 г, 95% выход) в виде твердого вещества желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,97 мин; МС m/z: 304 (M+H)+.
Стадия E: 2-(азидометил)-5-тозил-5H-пирроло[2,3-b]пиразин
К раствору (5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метанола (35,8 г, 118 ммоль) в DCM (600 мл) добавляют SOCl2 (21,5 мл, 295 ммоль). Примерно через 4 часа при комнатной температуре добавляют дополнительно SOCl2 (8,60 мл, 118 ммоль). Примерно через 16 часов реакционную смесь концентрируют при пониженном давлении и промывают насыщенным водным раствором NaHCO3 (1000 мл). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток растворяют в DCM (600 мл) и снова обрабатывают SOCl2 (21,51 мл, 295 ммоль). Примерно через 16 час при комнатной температуре, реакционную смесь концентрируют при пониженном давлении, затем добавляют DCM (500 мл) и насыщенный водный раствор NaHCO3 (500 мл). Слои разделяют, и органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. К полученному остатку добавляют ДМФ (500 мл) затем добавляют NaN3 (38,3 г, 589 ммоль). Примерно через 16 час при комнатной температуре добавляют EtOAc (500 мл), и органический раствор промывают смесью вода:солевой раствор (1:1, 2000 мл). Слои разделяют, и водный слой затем экстрагируют EtOAc (500 мл). Объединенные органические слои промывают солевым раствором (3×1000 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая 2-(азидометил)-5-тозил-5H-пирроло[2,3-b]пиразин (32,65 г, 82% выход) в виде твердого вещества желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,31 мин; МС m/z: 329 (M+H)+.
Стадия F: Гидрохлорид (5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метанамина
К раствору 2-(азидометил)-5-тозил-5H-пирроло[2,3-b]пиразина (32,6 г, 99,0 ммоль) в ТГФ (100 мл) и воде (50 мл) добавляют Ph3P (31,3 г, 119 ммоль). Полученную реакционную смесь нагревают при около 45°C в течение около 16 час. Полученную смесь оставляют охлаждаться до комнатной температуры с последующим удалением ТГФ при пониженном давлении. Полученную смесь разделяют между EtOAc (500 мл) и солевым раствором (250 мл), сушат над безводным Na2SO4 и фильтруют. Полученный фильтрат разбавляют EtOAc до 1 л полного объема. К быстро перемешиваемому раствору по каплям добавляют 4 н. HCl (4 н. в диоксане, 30,0 мл, 120 ммоль), что приводит к образованию осадка желто-коричневого цвета. Добавляют MeOH (10 мл), и полученную смесь фильтруют через примерно 15 мин. Полученный осадок тщательно растирают с Et2O (1000 мл) в течение около 10 мин, фильтруют и промывают Et2O (500 мл), получая гидрохлорид (5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метанамина (32,0 г, 90%) в виде твердого вещества желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,44 мин; МС m/z: 303 (M+H)+.
Стадия G: 1-(трет-бутоксикарбонил)-4-метилпиперидин-3-карбоновая кислота
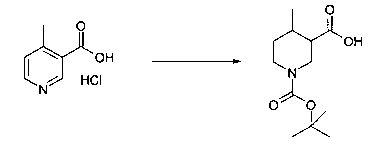
Гидрохлорид 4-метилникотиновой кислоты (5,00 г, 36,5 ммоль, ASDI) и оксид платины(IV) (0,35 г, 1,54 ммоль) встряхивают в AcOH (100 мл) при давлении водорода около 414 кПа в течение около 72 час. Полученную реакционную смесь фильтруют через Celite® и концентрируют при пониженном давлении, получая гидрохлорид 4-метилпиперидин-3-карбоновой кислоты (7,4 г, содержащий остаточный AcOH), который используют далее без дополнительной очистки. К раствору кислоты (7,40 г, 36,4 ммоль) и NaHCO3 (15,3 г, 182 ммоль) в MeCN (75 мл) и воде (125 мл) добавляют Boc2O (11,0 мл, 47,3 ммоль). Реакционную смесь перемешивают при температуре около 25°C в течение около 16 час. Полученную реакционную смесь разбавляют Et2O (100 мл) и подкисляют до pH 1, используя 4 н. водный раствор HCl. Слои разделяют, и органический раствор промывают солевым раствором (2×100 мл), сушат над безводным Na2SO4, фильтруют и концентрируют. Образуется белое твердое вещество, которое тщательно растирают с гептаном и собирают вакуумным фильтрованием, получая 1-(трет-бутоксикарбонил)-4-метилпиперидин-3-карбоновую кислоту (5,2 г, 58% за 2 стадии): ЖХ/МС (Таблица 2, Способ a) Rt=2,01 мин; МС m/z: 242 (M−H)−.
Стадия H: Трет-бутил 4-метил-3-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метилкарбамоил)пиперидин-1-карбоксилат
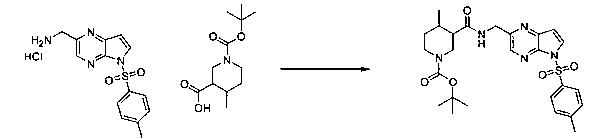
К суспензии гидрохлорида (5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метанамина (29,6 г, 87,0 ммоль, стадия F), 1-(трет-бутоксикарбонил)-4-метилпиперидин-3-карбоновой кислоты (21,2 г, 87,0 ммоль, стадия G) и HATU (33,2 г, 87,0 ммоль) в DCM (400 мл) добавляют DIEA (46,0 мл, 263 ммоль). После перемешивания в течение около 18 час при комнатной температуре, полученную реакционную смесь промывают насыщенным водным раствором NaHCO3 (400 мл). Органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают на хроматографической колонке с силикагелем, (330 г колонка), осуществляя градиентное элюирование 50-100% EtOAc в гептане, получая трет-бутил 4-метил-3-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метилкарбамоил)пиперидин-1-карбоксилат (44 г, 95%) в виде пены желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,38 мин; МС m/z: 528 (M+H)+.
Стадия I: Трет-бутил 4-метил-3-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)пиперидин-1-карбоксилат

К раствору трет-бутил 4-метил-3-((5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)метилкарбамоил)пиперидин-1-карбоксилата (44 г, 83 ммоль) в 1,4-диоксане (500 мл) добавляют Реагент Лоусона (20,2 г, 50,0 ммоль). Реакционную смесь нагревают при температуре около 80°C в течение около 1 часа. Реакционную смесь оставляют остывать до комнатной температуры, затем добавляют диацетоксиртуть (26,6 г, 83,0 ммоль). Примерно через 1 час добавляют дополнительно диацетоксиртуть (13,3 г, 42,0 ммоль). Примерно через 15 мин, реакционную смесь выливают в перемешиваемый EtOAc (2 л). Через 15 мин, реакционную смесь фильтруют через Celite®, и полученный фильтрат концентрируют при пониженном давлении. Полученный остаток тщательно растирают с EtOAc (500 мл) и фильтруют. Полученный фильтрат концентрируют при пониженном давлении и очищают на хроматографической колонке с силикагелем (330 г колонка), осуществляя градиентное элюирование 10-50% EtOAc в гептане, получая трет-бутил 4-метил-3-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)пиперидин-1-карбоксилат (19 г, 44%) в виде твердого вещества белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,57 мин; МС m/z: 510 (M+H)+.
Стадия J: Трет-бутил 3-(6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)-4-метилпиперидин-1-карбоксилат
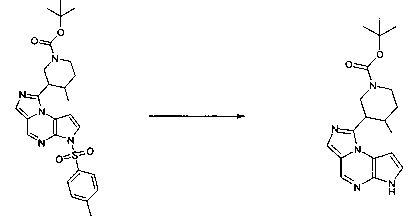
К раствору трет-бутил 4-метил-3-(6-тозил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)пиперидин-1-карбоксилата (19,0 г, 37,3 ммоль) в 1,4-диоксане (100 мл) добавляют водный раствор NaOH (1 н, 74,6 мл, 74,6 ммоль). Реакционную смесь нагревают при температуре около 60°C в течение около 30 мин и оставляют остывать до комнатной температуры с последующим добавлением 10% водного раствора AcOH (250 мл). Полученную смесь экстрагируют EtOAc (2×250 мл), и объединенные органические слои промывают солевым раствором (200 мл), сушат над безводным Na2SO4 и фильтруют. Полученный фильтрат концентрируют при пониженном давлении и очищают на хроматографической колонке с силикагелем (330 г), осуществляя градиентное элюирование 10-70% EtOAc в гептане, получая трет-бутил 3-(6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)-4-метилпиперидин-1-карбоксилат (12,3 г, 93%) в виде пены белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,96 мин; МС m/z: 356 (M+H)+.
Стадия K: Гидрохлорид 1-(4-метилпиперидин-3-ил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразина

К раствору трет-бутил 3-(6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)-4-метилпиперидин-1-карбоксилата (12,2 г, 34,3 ммоль) в 1,4-диоксане (100 мл) добавляют 4 н. HCl (4 н. в 1,4-диоксане, 25,7 мл, 103 ммоль). Полученную реакционную смесь нагревают при температуре около 60°C в течение около 2 час. Полученную смесь оставляют остывать до комнатной температуры и разбавляют Et2O (100 мл). Полученную смесь тщательно растирают и фильтруют и полученный осадок промывают Et2O (100 мл), получая гидрохлорид 1-(4-метилпиперидин-3-ил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразина (10 г, 98% выход) в виде твердого вещества желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,05 мин; МС m/z: 256 (M+H)+.
Стадия L: 3-((3R,4R)-3-(6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)-4-метилпиперидин-1-ил)-3-оксопропаннитрил
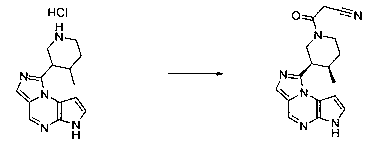
К раствору гидрохлорида 1-((3)-4-метилпиперидин-3-ил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразина (10,0 г, 34,3 ммоль), DIEA (23,9 мл, 137 ммоль) и 2-цианоуксусной кислоты (4,37 г, 51,4 ммоль) в ДМФ (100 мл) добавляют EDC (7,88 г, 41,1 ммоль). Полученную реакционную смесь перемешивают при температуре около 25°C в течение около 16 час. Добавляют дополнительный EDC (7,88 г, 41,1 ммоль) и примерно через 5 часов реакционную смесь гасят водой (30 мл) и концентрируют при пониженном давлении. Полученный остаток разделяют между DCM (2×500 мл) и солевым раствором (500 мл). Объединенные органические слои сушат над безводным Na2SO4 и фильтруют. Полученный фильтрат концентрируют при пониженном давлении и очищают на хроматографической колонке с силикагелем (120 г колонка), осуществляя градиентное элюирование 0-10% MeOH в DCM с последующим использованием хиральной хроматографии, получая 3-((3R,4R)-3-(6H-имидазо[1,5-a]пирроло[2,3-e]пиразин-1-ил)-4-метилпиперидин-1-ил)-3-оксопропаннитрил [Таблица 3, Способ 9, Rt 14,5 мин, опт.вр=позитив] (2,1 г, 24%) в виде твердого вещества не совсем белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,05 мин; МС m/z: 256 (M+H)+.
Пример № 14: N-((1S,3R,4S)-3-метил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид

Стадия A: Натрий 4-(этоксикарбонил)-2-(метоксикарбонил)-3-метилциклопента-1,3-диенолят
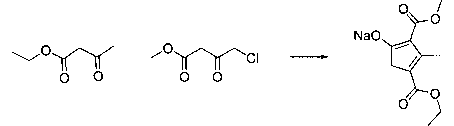
В круглодонную колбу помещают ТГФ (1 л) с последующим порционным добавлением гидрида натрия (60% дисперсия в минеральном масле, 30,7 г, 0,77 моль). Полученную смесь охлаждают до около −10°C и по каплям добавляют этил 3-оксобутаноат (97 мл, 0,77 моль) в течение около 1 часа для того, чтобы поддерживать внутреннюю температуру ниже, чем около 10°C. Полученную смесь перемешивают при комнатной температуре в течение около 1 часа, получая прозрачный желтый раствор, и по каплям добавляют метил 4-хлорацетоацетат (44,3 мл, 0,384 моль) в течение около 5 мин. Полученную смесь нагревают при около 50°C в течение около 19 час, получая суспензию желто-оранжевого цвета. Полученную реакционную смесь затем концентрируют при пониженном давлении, и полученный твердый материал переносят в химический стакан и разбавляют водой (350 мл). Твердый продукт собирают вакуумным фильтрованием, и фильтровальную лепешку промывают водой (150 мл) и сушат в вакууме в течение около 1 часа. Твердый продукт суспендируют в Et2O (500 мл), фильтруют, промывают Et2O (500 мл), и сушат в вакууме, получая натрий 4-(этоксикарбонил)-2-(метоксикарбонил)-3-метилциклопента-1,3-диенолят (77,4 г, 81%) в виде твердого вещества бежевого цвета: 1H ЯМР (ДМСО-d 6) δ 3,96 (кв, J=7,1 Гц, 2H), 3,33 (с, 3H), 2,72 (д, J=2,2 Гц, 2H), 2,47 (т, J=2,1 Гц, 3H), 1,15 (т, J=7,1 Гц, 3H).
Стадия B: Этил 2-метил-4-оксоциклопент-2-енкарбоксилат

В круглодонную колбу помещают натрий 4-(этоксикарбонил)-2-(метоксикарбонил)-3-метилциклопента-1,3-диенолят (105 г, 0,420 моль) и диглим (1 л), получая суспензию желтого цвета. К полученной смеси добавляют AcOH (100 мл, 1,7 моль), и порциями добавляют иодид натрия (280 г, 1,9 моль) в течение около 5-10 мин. Полученную реакционную смесь затем нагревают при кипении с обратным холодильником в течение около 3 час, охлаждают до комнатной температуры, и выливают в ледяную воду (800 мл). Полученный материал экстрагируют Et2O (3×500 мл). Объединенные органические экстракты промывают солевым раствором (2×500 мл), сушат над безводным MgSO4, и фильтруют. Растворитель удаляют при пониженном давлении, получая жидкость коричневого цвета, которую очищают, используя вакуумную перегонку (80-85°C, 40 Па), получая этил 2-метил-4-оксоциклопент-2-енкарбоксилат (40,6 г, 57%) в виде масла желтого цвета: 1H ЯМР (CDCl3) δ 6,06-5,98 (м, 1H), 4,30-4,11 (м, 2H), 3,72-3,65 (м, 1H), 2,77-2,66 (м, 1H), 2,66-2,57 (м, 1H), 2,17 (с, 3H), 1,30 (т, J=7,1 Гц, 3H).
Стадия C: Этил 2-метил-4-оксоциклопентанкарбоксилат
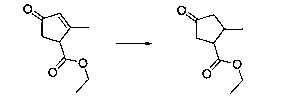
В круглодонную колбу помещают 10% палладий-на-угле (7,6 г, 7,1 ммоль). Колбу охлаждают до около 0°C и добавляют EtOAc (580 мл) в атмосфере азота. Охлаждающую баню удаляют, и добавляют этил 2-метил-4-оксоциклопент-2-енкарбоксилат (60,0 г, 357 ммоль). Газообразный водород барботируют через полученную смесь в течение около 5 мин, и полученную смесь затем перемешивают в атмосфере водорода (1 атм.) в течение около 48 час. Источник водорода удаляют, и полученную смесь барботируют азотом в течение около 5 мин и фильтруют через слой Celite®. Фильтровальную лепешку промывают EtOAc (500 мл). Полученный фильтрат концентрируют при пониженном давлении, получая этил 2-метил-4-оксоциклопентанкарбоксилат (59,9 г, 99%) в виде жидкости желтого цвета: 1H ЯМР (CDCl3) δ 4,23-4,14 (м, 2H), 3,18 (ддд, J=5,6, 6,8, 8,1 Гц, 1H), 2,73-2,65 (м, 1H), 2,60 (ддд, J=1,7, 5,5, 18,7 Гц, 1H), 2,42-2,29 (м, 2H), 2,15 (ддд, J=1,7, 7,9, 18,3 Гц, 1H), 1,29 (т, J=7,1 Гц, 3H), 1,07 (д, J=7,0 Гц, 3H).
Стадия D: Этил 4-(дибензиламино)-2-метилциклопентанкарбоксилат
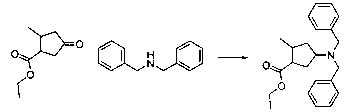
В круглодонную колбу помещают этил 2-метил-4-оксоциклопентанкарбоксилат (10,0 г, 58,8 ммоль) и DCE (180 мл). Полученный раствор охлаждают до около 0°C и по каплям добавляют AcOH (5,7 мл, 100 ммоль) и дибензиламин (11,3 мл, 58,8 ммоль), что приводит к образованию густой суспензии. Полученную реакционную смесь нагревают до около 10°C и порциями добавляют триацетоксиборгидрид натрия (21,2 г, 100 ммоль), и полученную реакционную смесь перемешивают при комнатной температуре в течение около 20 час. Полученную реакционную смесь медленно выливают в перемешиваемый насыщенный водный раствор NaHCO3 (300 мл) в течение около 20 мин. Слои разделяют, и водную фазу экстрагируют DCM (3×100 мл). Объединенные органические экстракты промывают солевым раствором (2×100 мл), сушат над безводным Na2SO4 и концентрируют досуха при пониженном давлении. Сырое масло желтого цвета очищают, используя колоночную флеш-хроматографию, осуществляя градиентное элюирование 0-30% EtOAc в гептане. Растворитель удаляют при пониженном давлении, получая этил 4-(дибензиламино)-2-метилциклопентанкарбоксилат (15,5 г, 75%) в виде бесцветного масла: 1H ЯМР (пиридин-d 5) δ 7,53 (дд, J=0,9, 7,9 Гц, 4H), 7,43-7,35 (м, 4H), 7,33-7,25 (м, 2H), 4,22-4,06 (м, 2H), 3,79 (д, J=14,2 Гц, 2H), 3,70 (д, J=14,2 Гц, 2H), 3,34-3,22 (м, 1H), 2,76 (дд, J=7,9, 16,6 Гц, 1H), 2,25-2,13 (м, 1H), 2,09-1,94 (м, 2H), 1,88-1,79 (м, 1H), 1,52 (дд, J=10,5, 22,5 Гц, 1H), 1,16 (т, J=7,1 Гц, 3H), 0,98 (д, J=7,0 Гц, 3H).
Стадия E: Этил 4-амино-2-метилциклопентанкарбоксилат
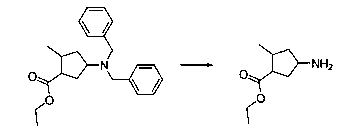
В реактор, содержащий суспензию 20% влажности Pd(OH)2-C (5,00 г, 35,6 ммоль) в EtOH (355 мл), добавляют этил 4-(дибензиламино)-2-метилциклопентанкарбоксилат (50,0 г, 142 ммоль). Реакционную смесь встряхивают в течение около 60 мин при температуре около 50°C при давлении Н2 около 207 кПа. Полученную смесь фильтруют через слой Celite®, и полученный фильтрат концентрируют при пониженном давлении, получая этил 4-амино-2-метилциклопентанкарбоксилат (23,5 г, 96%) в виде масла желтого цвета: 1H ЯМР (CDCl3) δ 4,24-4,02 (м, 2H), 3,41-3,27 (м, 1H), 2,81 (дд, J=7,6, 15,4 Гц, 1H), 2,36-2,20 (м, 1H), 2,21-2,02 (м, 4H), 1,81-1,69 (м, 1H), 1,33-1,15 (м, 4H), 0,98 (д, J=7,0 Гц, 3H).
Стадия F: Этил 4-(циклопропансульфонамидо)-2-метилциклопентанкарбоксилат
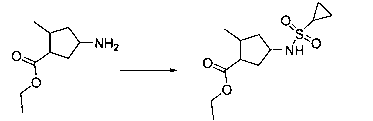
Раствор этил 4-амино-2-метилциклопентанкарбоксилата (15,0 г, 88,0 ммоль) в ДМФ (210 мл) охлаждают до около 0°C на бане со льдом. Добавляют TEA (30,5 мл, 219 ммоль), и перемешивание продолжают при температуре около 0°C в течение около 15 мин и затем по каплям добавляют циклопропансульфонилхлорид (12,3 г, 88,0 ммоль, Matrix). Полученный раствор перемешивают при температуре около 0°C в течение около 2 час. Баню со льдом удаляют, и перемешивание полученной реакционной смеси продолжают при комнатной температуре в течение около 3 час. Реакционную смесь концентрируют при пониженном давлении и добавляют EtOAc (200 мл) и воду (100 мл). Слои разделяют, и органический слой промывают насыщенным водным раствором NaHCO3 (60 мл) и солевым раствором (60 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая масло красно-коричневого цвета. Сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 10-30% EtOAc в гептане, получая этил 4-(циклопропансульфонамидо)-2-метилциклопентанкарбоксилат (21,3 г, 88%) в виде масла желтого цвета: 1H ЯМР (CDCl3) δ 5,25 (д, J=9,9 Гц, 1H), 4,23-4,06 (м, 2H), 4,03-3,90 (м, 1H), 2,80 (тд, J=3,1, 7,5 Гц, 1H), 2,46-2,30 (м, 2H), 2,29-2,14 (м, 2H), 1,97 (ддд, J=3,2, 4,2, 14,2 Гц, 1H), 1,42 (ддд, J=7,5, 11,5, 13,1 Гц, 1H), 1,29 (т, J=7,1 Гц, 3H), 1,20-1,14 (м, 2H), 1,02 (д, J=6,9 Гц, 3H), 1,00-0,96 (м, 2H).
Стадия G: 4-(циклопропансульфонамидо)-2-метилциклопентанкарбоновая кислота
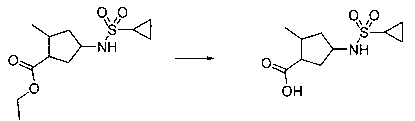
В колбу, содержащую этил 4-(циклопропансульфонамидо)-2-метилциклопентанкарбоксилат (7,5 г, 27,3 ммоль) добавляют водный раствор NaOH (1 н, 150 мл, 150 ммоль). После перемешивания при комнатной температуре в течение около 5 час, реакционную смесь подкисляют до pH около 1 водным раствором 6 н. HCl и экстрагируют DCM (3×100 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая сырую 4-(циклопропансульфонамидо)-2-метилциклопентанкарбоновую кислоту, содержащую около 5 моль % DCM (6,6 г, 97%), в виде твердого вещества белого цвета: 1H ЯМР (ДМСО-d 6) δ 12,09 (с, 1H), 7,11 (д, J=8,1 Гц, 1H), 3,66-3,53 (м, 1H), 2,78-2,68 (м, 1H), 2,50 (ткв, J=5,1, 7,7 Гц, 1H), 2,29-2,17 (м, 1H), 2,17-2,01 (м, 2H), 1,82 (дт, J=9,9, 12,7 Гц, 1H), 1,24 (дт, J=8,9, 12,4 Гц, 1H), 0,98-0,85 (м, 7H).
Стадия H: 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин
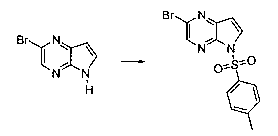
Раствор 2-бром-5H-пирроло[2,3-b]пиразина (78,0 г, 394 ммоль, Ark Pharm) в безводном ДМФ (272 мл) по каплям добавляют в течение около 60 мин к перемешиваемой суспензии NaH (60% дисперсия в минеральном масле, 12,8 г, 532 ммоль) в безводном ДМФ (543 мл) при температуре около 0-5°C. Реакционный раствор коричневого цвета перемешивают в течение около 30 мин при температуре около 0-5°C. Затем по каплям добавляют раствор p-толуолсульфонилхлорида (94,0 г, 492 ммоль) в безводном ДМФ (272 мл) в течение около 60 мин при температуре около 0-5°C. Полученную реакционную смесь перемешивают при температуре около 0-5°C в течение около 1 часа, затем оставляют нагреваться до комнатной температуры и перемешивают в течение около 18 час при комнатной температуре. Полученную реакционную смесь медленно выливают в ледяную воду (6 л), с последующим добавлением водного раствора NaOH (2,5 M, 50,0 мл, 125 ммоль). Полученный осадок собирают фильтрованием и перемешивают с холодной водой (3×200 мл). Твердый продукт собирают фильтрованием и сушат до постоянного веса в вакуумном термостате при температуре около 55°C, получая в результате 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (134,6 г, 97%) в виде твердого вещества бледно бежевого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,58 мин; МС m/z: 352/354 (M+H)+.
Стадия I: Трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат
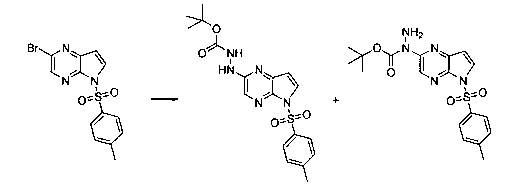
В колбу добавляют Pd2(dba)3 (3,90 г, 4,26 ммоль), ди-трет-бутил-(2′,4′,6′-триизопропилбифенил-2-ил)фосфан (3,62 г, 8,52 ммоль) и безводный 1,4-диоксан (453 мл). Смесь катализатор-лиганд дегазируют, используя цикл вакуум/продувка азотом (3 раза) и нагревают при температуре около 80°C в течение около 10 мин, затем добавляют 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (30,0 г, 85 ммоль), трет-бутил гидразинкарбоксилат (16,9 г, 128 ммоль) и NaOt-Bu (12,3 г, 128 ммоль). После дополнительного цикла вакуум/продувка азотом, реакционную смесь нагревают при температуре около 80°C. Примерно через 50 мин, полученную реакционную смесь охлаждают до комнатной температуры и фильтруют через слой силикагеля, поверх которого расположен слой Celite®, промывая при этом EtOAc (3×150 мл). К полученному фильтрату добавляют воду (300 мл), и органический слой выделяют. Водный слой экстрагируют дополнительным количеством EtOAc (3×200 мл). Объединенные органические экстракты промывают насыщенным водным раствором NH4Cl, насыщенным водным раствором NaHCO3 и солевым раствором (400 мл каждый), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая масло темно коричневого цвета (45 г). Коричневое масло растворяют в DCM (250 мл), добавляют силикагель (200 г), и полученную смесь концентрируют при пониженном давлении. Полученную смесь с силикагелем очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 25-65% EtOAc в гептане, получая смесь трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [основной региоизомер] и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [второстепенный региоизомер] (18,8 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,47 мин; МС m/z: 404 (M+H)+.
Стадия J: 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин

К смеси трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата (18,8 г, 46,6 ммоль) в 1,4-диоксане (239 мл) добавляют HCl (4 M в 1,4-диоксане, 86 мл, 345 ммоль). Реакционную смесь нагревают при температуре около 60°C в течение около 1 часа и затем охлаждают до около 15-20°C. Твердый продукт собирают вакуумным фильтрованием, промывают холодным 1,4-диоксаном (2×20 мл), и затем перемешивают с насыщенным водным раствором NaHCO3 и водой (1:1, 150 мл). Примерно через 1 час бурное вспенивание прекращается, и твердый продукт собирают вакуумным фильтрованием, промывают ледяной водой (3×20 мл) и сушат в вакуумном термостате до постоянного веса, получая 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин в виде твердого вещества светлого желто-коричневого цвета (8,01 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,28 мин; МС m/z: 304 (M+H)+.
Стадия K: N-(3-метил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид

К раствору 4-(циклопропансульфонамидо)-2-метилциклопентанкарбоновой кислоты (15,3 г, 61,8 ммоль, стадия G) в DCM (300 мл) добавляют 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин (18,3 г, 57,2 ммоль, стадия J), HATU (22,9 г, 60,1 ммоль) и TEA (32,0 мл, 229 ммоль). После перемешивания при комнатной температуре в течение около 1 часа, реакционную смесь разбавляют водой (250 мл). Слои разделяют, и водный слой экстрагируют DCM (2×200 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал разбавляют DCM, в результате чего образуется густая суспензия. К полученной суспензии добавляют гептан, смесь фильтруют, получая твердое вещество не совсем белого цвета. К полученному фильтрату добавляют силикагель (25 г), и полученную смесь концентрируют при пониженном давлении. Полученную смесь с силикагелем очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 60-100% EtOAc в гептане. Содержащие продукт фракции объединяют и концентрируют при пониженном давлении. Полученный твердый материал желто-коричневого цвета добавляют собранному ранее осадку, и сушат, используя вакуумный насос, в течение около 14 час, получая нечистый N-(3-метил-4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентил)циклопропансульфонамид (25,2 г), загрязненный примерно 50 моль % тетраметилмочевины. К раствору нечистого N-(3-метил-4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентил)циклопропансульфонамида (25,2 г, 47,4 ммоль) в 1,4-диоксане (395 мл) добавляют TEA (26,5 мл, 189 ммоль) и тионилхлорид (3,5 мл, 48 ммоль). Реакционную смесь нагревают при температуре около 80°C в течение около 1,5 часа, причем к этому времени реакционная смесь отверждается. Реакционную смесь охлаждают до комнатной температуры, и твердый продукт растворяют в DCM (1 л). Органическую часть промывают водой (2×500 мл) и солевым раствором (2×500 мл), сушат над MgSO4, фильтруют и концентрируют до половины объема при пониженном давлении. Добавляют силикагель (75 г), и оставшийся растворитель удаляют при пониженном давлении. Полученную смесь очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-50% ацетоном в DCM. Содержащие продукт фракции объединяют и концентрируют при пониженном давлении, причем к этому времени образуется густой гель, который затем отверждается, в результате чего получают N-(3-метил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид (18,1 г, 62%) в виде твердого вещества светло-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,16 мин; МС m/z: 515 (M+H)+.
Стадия L: N-((1S,3R,4S)-3-метил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид
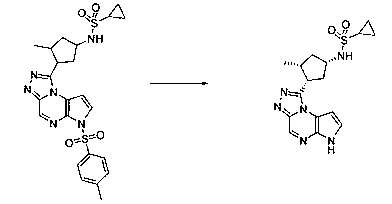
Смесь N-(3-метил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамида (7,1 г, 13,9 ммоль), 1,4-диоксана (139 мл) и водного раствора 1 н. NaOH (30,0 мл, 30,0 ммоль) нагревают при температуре около 60°C в течение около 2 час. Реакционную смесь охлаждают до комнатной температуры, разбавляют водой (150 мл) и экстрагируют EtOAc (3×150 мл). Объединенные органические слои промывают солевым раствором (200 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырую смесь тщательно растирают с EtOAc (50 мл) и фильтруют, получая твердый материал желто-коричневого цвета, который очищают, используя хиральную препаративную ВЭЖХ (Таблица 3, Способ 3, Rt=18 мин, опт.вр.=негатив). Содержащие продукт фракции объединяют и концентрируют, получая твердое вещество бледно желтого цвета. Твердый продукт растворяют в смеси 1:1 DCM:MeOH (около 100 мл), добавляют 10 г силикагеля, и полученную смесь концентрируют. Полученную смесь очищают на хроматографической колонке с силикагелем, используя градиентное элюирование 0-100% DCM/MeOH/Et2NH от (990:9:1) до DCM/MeOH/Et2NH (970:27:3). Содержащие продукт фракции объединяют и концентрируют, получая твердое вещество белого цвета. Твердый продукт растворяют в кипящем EtOH (150 мл), и обрабатывают ультразвуком в течение около 1 часа. Растворитель удаляют при пониженном давлении, и твердый продукт сушат в вакуумном термостате при температуре около 70°C в течение около 72 час. Добавляют воду (12 мл) и EtOH (3 мл), и полученную суспензию кипятят с обратным холодильником в течение 2 час. Суспензию охлаждают до комнатной температуры, с последующим охлаждением до температуры около 0°C на бане со льдом. Твердые продукты отфильтровывают, промывая охлажденной льдом водой (около 3 мл) и сушат в вакуумном термостате, получая N-((1S,3R,4S)-3-метил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид (0,5 г, 10,4%) в виде твердого вещества белого цвета, содержащего 0,5% EtOH: ЖХ/МС (Таблица 2, Способ a) Rt=1,61 мин; МС m/z: 361 (M+H)+.
Пример № 15: N-((1S,3R,4S)-3-этил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид

Стадия A: Натрий 4-(этоксикарбонил)-3-этил-2-(метоксикарбонил)циклопента-1,3-диенолят
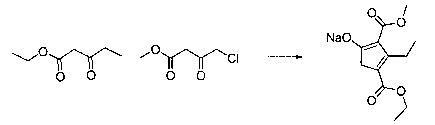
В круглодонную колбу помещают ТГФ (1,5 л) с последующим порционным добавлением гидрида натрия (60% дисперсия в минеральном масле, 70,0 г, 1,75 моль). Добавляют дополнительное количество ТГФ (500 мл), и полученную смесь охлаждают до около −10°С и по каплям добавляют этилпропионилацетат (250 мл, 1,8 моль) в течение около 1 часа для того, чтобы поддерживать внутреннюю температуру ниже, чем около 10°C. Полученную смесь перемешивают при комнатной температуре в течение около 0,5 час, получая прозрачный желтый раствор, и по каплям добавляют метил 4-хлорацетоацетат (100 мл, 0,88 моль) в течение около 5 мин. Полученную смесь нагревают при около 50°C в течение около 19 час, получая суспензию красновато-оранжевого цвета. Полученную реакционную смесь затем концентрируют при пониженном давлении и полученную жидкость переносят в химический стакан и разбавляют водой (350 мл). Полученную смесь перемешивают и помещают на баню со льдом в течение около 2 час. Твердый продукт собирают вакуумным фильтрованием и фильтровальную лепешку промывают водой (150 мл) и сушат в вакууме. Твердый продукт суспендируют в Et2O (1,5 л), фильтруют, промывают Et2O (1,5 л), и сушат в вакууме. Полученный твердый материал азеотропно перегоняют с толуолом (1 л), получая твердый продукт, который снова суспендируют в Et2O (1 л) и собирают вакуумным фильтрованием. Фильтровальную лепешку промывают Et2O (500 мл) и сушат в вакууме, получая натрий 4-(этоксикарбонил)-3-этил-2-(метоксикарбонил)циклопента-1,3-диенолят (204,2 г, 89%) в виде твердого вещества бежевого цвета: 1H ЯМР (ДМСО-d 6) δ 3,94 (кв, J=7,1 Гц, 2H), 3,46 (с, 3H), 3,04 (кв, J=7,2 Гц, 2H), 2,66 (с, 2H), 1,13 (т, J=7,1 Гц, 3H), 0,99 (т, J=7,3 Гц, 3H).
Стадия B: Этил 2-этил-4-оксоциклопент-2-енкарбоксилат
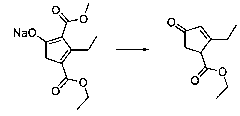
В круглодонную колбу помещают натрий 4-(этоксикарбонил)-3-этил-2-(метоксикарбонил)циклопента-1,3-диенолят (250 г, 0,94 моль) и диглим (1,1 л), получая суспензию зеленого цвета, затем добавляют AcOH (140 мл, 2,4 моль). К полученной смеси порциями добавляют иодид натрия (490 г, 3,3 моль) в течение около 5-10 мин. После добавления температура повышается с около 16°C до около 36°C. Полученную реакционную смесь нагревают при кипении с обратным холодильником в течение около 3 час, охлаждают до комнатной температуры, и выливают на смесь льда (2 л) и насыщенного водного раствора NaHCO3 (4 л). Полученный материал экстрагируют Et2O (4×1,2 л), и объединенные органические слои сушат над безводным MgSO4 и фильтруют. Растворитель удаляют при пониженном давлении, получая жидкость коричневого цвета (250 мл) которую очищают, используя вакуумную перегонку (80-92°C, 40 Па), получая этил 2-этил-4-оксоциклопент-2-енкарбоксилат (95,7 г, 56%) в виде сиропа желтого цвета: 1H ЯМР (CDCl3) δ 6,04 (м, 1H), 4,26-4,15 (м, 2H), 3,76-3,69 (м, 1H), 2,75-2,57 (м, 2H), 2,56-2,44 (м, 2H), 1,32-1,26 (м, 3H), 1,23-1,18 (м, 3H).
Стадия C: Этил 2-этил-4-оксоциклопентанкарбоксилат
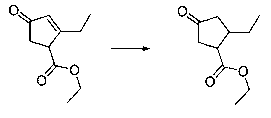
В круглодонную колбу помещают 10% палладий-на-угле (10 г, 9,4 ммоль). Колбу охлаждают до около 0°C, и EtOAc (400 мл) добавляют в атмосфере азота. Охлаждающую баню удаляют, и добавляют этил 2-этил-4-оксоциклопент-2-енкарбоксилат (47,8 г, 263 ммоль). Газообразный водород барботируют через полученную смесь в течение около 5 мин, и смесь затем перемешивают в атмосфере водорода в течение около 48 час. Источник водорода удаляют, полученную смесь барботируют азотом в течение около 5 мин и фильтруют через слой Celite®. Фильтровальную лепешку промывают EtOAc (400 мл). Полученный фильтрат концентрируют при пониженном давлении, получая этил 2-этил-4-оксоциклопентанкарбоксилат (48,0 г, 99%) в виде жидкости желтого цвета: 1H ЯМР (CDCl3) δ 4,23-4,10 (м, 2H), 3,22 (м, 1H), 2,59-2,50 (м, 1H), 2,44-2,28 (м, 3H), 2,26-2,16 (м, 1H), 1,58-1,46 (м, 1H), 1,41-1,30 (м, 1H), 1,30-1,23 (м, 3H), 1,02-0,91 (м, 3H).
Стадия D: Этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат
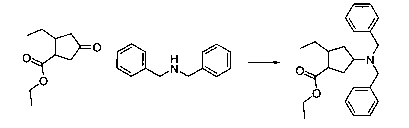
В круглодонную колбу помещают этил 2-этил-4-оксоциклопентанкарбоксилат (95,9 г, 521 ммоль) и DCE (1,8 л). Полученный раствор охлаждают до около 0°C и по каплям добавляют ледяной AcOH (45 мл, 780 ммоль) и дибензиламин (120 мл, 625 ммоль), что приводит к образованию густой суспензии. Полученную реакционную смесь нагревают до около 10°C, удаляя охлаждающую баню и добавляют дополнительное количество DCE (500 мл). Порциями добавляют триацетоксиборгидрид натрия (166 г, 781 ммоль), и полученную реакционную смесь перемешивают при комнатной температуре в течение около 20 час. Полученную реакционную смесь медленно выливают в перемешиваемый насыщенный водный раствор NaHCO3 (1,5 л), с последующим порционным добавлением твердого NaHCO3 (175 г, 2083 ммоль). Полученную смесь перемешивают в течение около 2 час, и органический слой выделяют, сушат над безводным Na2SO4 и концентрируют досуха при пониженном давлении. Сырое масло желтого цвета очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-20% EtOAc/гептан. Растворитель удаляют при пониженном давлении, получая в результате этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат (136,6 г, 72%) в виде твердого вещества белого цвета: LC/МС (Таблица 2, Способ a) Rt=3,26 мин; МС m/z: 366 (M+H)+.
Стадия E: Этил 4-амино-2-этилциклопентанкарбоксилат

В реактор, содержащий суспензию 20% влажн. Pd(OH)2-C (12,9 г, 92,0 ммоль) в EtOH (1,0 л), добавляют этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат (129 г, 352 ммоль). Реакционную смесь встряхивают в течение около 90 мин при температуре около 50°C при давлении Н2 около 207 кПа. Полученную смесь фильтруют через нейлоновую мембрану, и полученный фильтрат концентрируют при пониженном давлении, получая этил 4-амино-2-этилциклопентанкарбоксилат (64,5 г, 99%) в виде сиропа желтого цвета: 1H ЯМР (CDCl3) δ 4,03-3,88 (м, 2H), 3,17 (м, 1H), 2,68 (м, 1H), 2,09-2,02 (м, 2H), 2,02-1,94 (м, 2H), 1,84 (м, 1H), 1,58-1,48 (м, 1H), 1,32-1,18 (м, 1H), 1,09 (м, 3H), 1,03 (м, 2H), 0,78-0,69 (м, 3H).
Стадия F: (1S,2R,4S)-этил 4-(циклопропансульфонамидо)-2-этилциклопентанкарбоксилат

Раствор этил 4-амино-2-этилциклопентанкарбоксилата (20,5 г, 111 ммоль) в ДМФ (340 мл) охлаждают до около 0°C на бане со льдом. Добавляют TEA (38,6 мл, 277 ммоль), и перемешивание продолжают при температуре около 0°C в течение около 15 мин, и затем по каплям добавляют циклопропансульфонилхлорид (15,6 г, 111 ммоль, Matrix). Полученный раствор перемешивают при температуре около 0°C в течение около 2 час. Баню со льдом удаляют, и продолжают перемешивание полученной реакционной смеси при комнатной температуре в течение около 3 час. Реакционную смесь концентрируют при пониженном давлении и добавляют EtOAc (200 мл) и воду (60 мл). Слои разделяют, и органический слой промывают насыщенным водным раствором NaHCO3 (60 мл) и солевым раствором (60 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая масло красновато-коричневого цвета. Сырой материал очищают на хроматографической колонке с силикагелем, элюируя постадийно с градиентом 10% EtOAc в гептане, затем 15% EtOAc в гептане, с последующим 20% EtOAc в гептане, получая масло желтого цвета (27,3 г) которое очищают, используя хиральную препаративную ВЭЖХ (Таблица 3, Способ 9, Rt=9,5 мин, опт.вр.=негатив), получая (1S,2R,4S)-этил 4-(циклопропансульфонамидо)-2-этилциклопентанкарбоксилат (11,1 г, 35%): ЖХ/МС (Таблица 2, Способ a) Rt=2,25 мин; МС m/z: 290 (M+H)+.
Стадия G: (1S,2R,4S)-4-(циклопропансульфонамидо)-2-этилциклопентанкарбоновая кислота
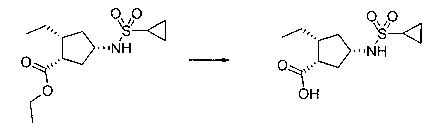
В колбу, содержащую (1S,2R,4S)-этил) 4-(циклопропансульфонамидо)-2-этилциклопентанкарбоксилат (11,1 г, 38,4 ммоль) добавляют 1н водный раствор NaOH (210 мл, 210 ммоль). После перемешивания при комнатной температуре в течение около 8 час, реакционную смесь подкисляют до около pH 1, используя 6 н. водный раствор HCl, и экстрагируют DCM (3×150 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая сырую (1S,2R,4S)-4-(циклопропансульфонамидо)-2-этилциклопентанкарбоновую кислоту, содержащую около 25 моль % DCM (10,7 г, 99%): ЖХ/МС (Таблица 2, Способ a) Rt=1,71 мин; МС m/z: 260 (M−H)−.
Стадия H: 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин
Раствор 2-бром-5H-пирроло[2,3-b]пиразина (78,0 г, 394 ммоль, Ark Pharm) в безводном ДМФ (272 мл) по каплям добавляют в течение около 60 мин к перемешиваемой суспензии NaH (60% дисперсия в минеральном масле, 12,8 г, 532 ммоль) в безводном ДМФ (543 мл) при температуре около 0-5°C. Реакционный раствор коричневого цвета перемешивают в течение около 30 мин при температуре около 0-5°C. Затем по каплям добавляют раствор p-толуолсульфонилхлорида (94,0 г, 492 ммоль) в безводном ДМФ (272 мл) в течение около 60 мин при температуре около 0-5°C. Полученную реакционную смесь перемешивают при температуре около 0-5°C в течение около 1 часа, затем оставляют нагреваться до комнатной температуры и перемешивают в течение около 18 час. Полученную реакционную смесь медленно выливают в ледяную воду (6 л) с последующим добавлением водного раствора NaOH (2,5 M, 50,0 мл, 125 ммоль). Полученный осадок собирают фильтрованием и перемешивают с холодной водой (3×200 мл). Твердый продукт собирают фильтрованием и сушат до постоянного веса в вакуумном термостате при температуре около 55°C, получая в результате 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (134,6 г, 97%) в виде твердого вещества бежевого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,58 мин; МС m/z: 352/354 (M+H)+.
Стадия I: Трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат
В колбу помещают Pd2(dba)3 (3,90 г, 4,26 ммоль), ди-трет-бутил-(2′,4′,6′-триизопропилбифенил-2-ил)фосфан (3,62 г, 8,52 ммоль) и безводный 1,4-диоксан (453 мл). Смесь катализатор-лиганд дегазируют, используя цикл вакуум/продувка азотом (3 раза) и нагревают при температуре около 80°C в течение около 10 мин, затем добавляют 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (30,0 г, 85 ммоль), трет-бутил гидразинкарбоксилат (16,9 г, 128 ммоль), и NaOt-Bu (12,28 г, 128 ммоль). После дополнительного цикла вакуум/продувка азотом, реакционную смесь нагревают при температуре около 80°C. Примерно через 50 мин, полученную реакционную смесь охлаждают до комнатной температуры и фильтруют через слой силикагеля (6 см в высоту×6 см в диаметре), поверх которого расположен слой Celite® (1 см в высоту×6 см в диаметре), промывая при этом EtOAc (3×150 мл). К полученному фильтрату добавляют воду (300 мл), и органический слой выделяют. Водный слой экстрагируют дополнительным количеством EtOAc (3×200 мл). Объединенные органические экстракты промывают насыщенным водным раствором NH4Cl, насыщенным водным раствором NaHCO3, и солевым раствором (400 мл каждый), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая масло темно коричневого цвета (45 г). Коричневое масло растворяют в DCM (250 мл), добавляют силикагель (200 г), и полученную смесь концентрируют при пониженном давлении. Полученную смесь с силикагелем очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 25-65% EtOAc в гептане, получая смесь трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [основной региоизомер] и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [второстепенный региоизомер] (18,8 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,47 мин; МС m/z: 404 (M+H)+.
Стадия J: 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин
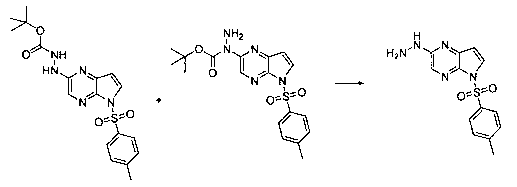
К смеси трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата (18,8 г, 46,6 ммоль) в 1,4-диоксане (239 мл) добавляют HCl (4 M в 1,4-диоксане, 86 мл, 345 ммоль). Реакционную смесь нагревают при температуре около 60°C в течение около 1 часа и затем охлаждают до около 15-20°C. Твердый продукт собирают вакуумным фильтрованием, промывают холодным 1,4-диоксаном (2×20 мл), и затем перемешивают с насыщенным раствором NaHCO3 и водой (1:1, 150 мл). Примерно через 1 час, бурное выделение газа прекращается, и твердый продукт собирают вакуумным фильтрованием, промывают ледяной водой (3×20 мл), и сушат в вакуумном термостате до постоянного веса, получая 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин в виде твердого вещества светлого желтовато-коричневого цвета (8,01 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,28 мин; МС m/z: 304 (M+H)+.
Стадия K: N-((1S,3R,4S)-3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид
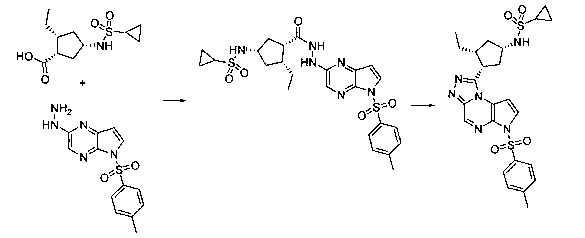
К смеси (1S,2R,4S)-4-(циклопропансульфонамидо)-2-этилциклопентанкарбоновой кислоты (8,43 г, 30,1 ммоль, стадия G) в DCM (160 мл) добавляют 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин (9,20 г, 28,8 ммоль, стадия J), HATU (11,5 г, 30,3 ммоль) и TEA (16,0 мл, 115 ммоль). После перемешивания при комнатной температуре в течение около 1 часа, реакционную смесь разбавляют водой (150 мл). Слои разделяют, и водный слой экстрагируют DCM (2×150 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал растворяют в DCM и очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 60-100% EtOAc в гептане. Содержащие продукт фракции объединяют, концентрируют при пониженном давлении, и сушат, используя вакуумный насос, получая N-((1S,3R,4S)-3-этил-4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентил)циклопропансульфонамид (14,1 г) в виде пены желто-коричневого цвета, содержащей около 50 моль % тетраметилмочевины и около 35 моль % EtOAc. К раствору нечистого N-((1S,3R,4S)-3-этил-4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентил)циклопропансульфонамида (14,0 г, 22,9 ммоль) в 1,4-диоксане (125 мл) добавляют TEA (13 мл, 93 ммоль) и тионилхлорид (2,5 мл, 34,3 ммоль). Реакционную смесь нагревают при температуре около 80°C в течение около 2,5 часа, затем реакционную смесь охлаждают до комнатной температуры и добавляют воду и EtOAc (150 мл каждый). Слои разделяют, и водный слой экстрагируют дополнительным количеством EtOAc (2×100 мл). Объединенные органические слои промывают солевым раствором (100 мл), сушат над безводным Na2SO4, фильтруют, концентрируют при пониженном давлении, и сушат в вакууме. Сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 60-100% EtOAc в гептане при этом осуществляя контроль на длине волны 330 нм. Содержащие продукт фракции объединяют, и концентрируют при пониженном давлении, получая твердое вещество светло-коричневого цвета. Твердый продукт обрабатывают ультразвуком с EtOAc (60 мл) в течение около 10 мин, оставляют при комнатной температуре в течение около 5 мин, собирают вакуумным фильтрованием, промывая при этом дополнительным количеством EtOAc (20 мл), и сушат в вакуумном термостате при температуре около 60°C, получая N-((1S,3R,4S)-3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид, с примерно 40 моль % EtOAc (8,08 г, 50% за 2 стадии): ЖХ/МС (Таблица 2, Способ a) Rt=2,30 мин; МС m/z: 529 (M+H)+.
Стадия L: N-((1S,3R,4S)-3-этил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид
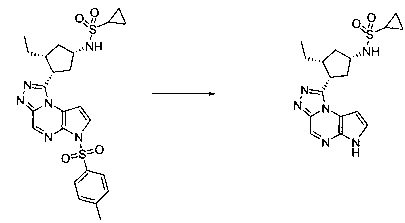
Смесь N-((1S,3R,4S)-3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамида (8,00 г, 13,8 ммоль), 1,4-диоксана (80 мл) и 1 н. водного раствора NaOH (30,0 мл, 30,0 ммоль) нагревают при температуре около 60°C в течение около 2 час. Затем реакционную смесь разбавляют водой (100 мл) и экстрагируют EtOAc (3×100 мл). Объединенные органические слои промывают солевым раствором (100 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырую смесь очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-100% DCM/MeOH/Et2NH (970:27:3) в DCM затем элюирование DCM/MeOH/Et2NH (950:45:5). Содержащие продукт фракции объединяют, концентрируют при пониженном давлении, и сушат в вакуумном термостате при температуре около 70°C в течение около 12 час, получая твердый продукт, который тщательно растирают с Et2O, фильтруют, промывая при этом дополнительным количеством Et2O, и растворяют в горячем MeOH. Полученный раствор концентрируют при пониженном давлении, получая твердый продукт, который растворяют в горячем MeOH (200 мл), обрабатывают ультразвуком, при этом охлаждая до образования суспензии, концентрируют при пониженном давлении, и сушат в вакуумном термостате при температуре около 50°C, получая твердое вещество не совсем белого цвета. К твердому продукту добавляют EtOAc (30 мл), получая суспензию, которую быстро нагревают, используя струйный сушильный аппарат, и затем обрабатывают ультразвуком в течение около 15 мин. После выдерживания при комнатной температуре в течение около 15 мин, полученный твердый белый продукт собирают вакуумным фильтрованием, промывают дополнительным количеством EtOAc (15 мл), и сушат в вакуумном термостате при температуре около 50°C. Твердый продукт растворяют в горячем EtOH (~200 мл), фильтруют для удаления второстепенного нерастворимого материала (<10 мг), обрабатывают ультразвуком в течение около 10 мин при охлаждении, получая суспензию белого цвета, которую концентрируют при пониженном давлении. Полученный твердый белый материал сушат в вакуумном термостате при температуре около 60°C, получая N-((1S,3R,4S)-3-этил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)циклопропансульфонамид (3,43 г, 67%): ЖХ/МС (Таблица 2, Способ a) Rt=1,67 мин; МС m/z: 375 (M+H)+.
Пример № 16: (R)-1-(3-(3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбонил)циклопропанкарбонитрил
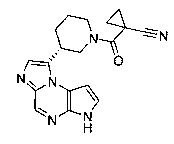
Стадия A: Трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамат
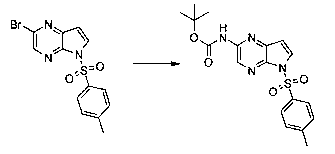
В колбу помещают Pd2(dba)3 (1,3 г, 1,4 ммоль), ди-трет-бутил-(2′,4′,6′-триизопропилбифенил-2-ил)фосфан (1,21 г, 2,84 ммоль), и 1,4-диоксан (75 мл). Смесь катализатор-лиганд дегазируют, используя цикл вакуум/продувка азотом (3 раза) и нагревают при температуре около 80°C в течение около 10 мин. Добавляют 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (5,0 г, 14 ммоль, пример получения № 7), трет-бутилкарбамат (2,5 г, 21 ммоль) и NaOt-Bu (2,05 г, 21,3 ммоль). После дополнительного цикла вакуум/продувка азотом, реакционную смесь нагревают при температуре около 80°C в течение около 16 час. Реакционную смесь охлаждают до комнатной температуры и разбавляют EtOAc (70 мл). Полученную реакционную смесь фильтруют, и полученный фильтрат промывают водой (3×20 мл). Органический слой сушат над безводным MgSO4, фильтруют, и растворитель удаляют при пониженном давлении, получая твердое вещество красновато-коричневого цвета. Сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 10-50% EtOAc в гептане, получая в результате трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамат в виде аморфного вещества желтого цвета (1,0 г, 18%): ЖХ/МС (Таблица 2, Способ a) Rt=2,63 мин; МС m/z: 389 (M+H)+.
Стадия B: (R)-(9H-флуорен-9-ил)метил 3-(2-(трет-бутоксикарбонил(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)амино)ацетил)пиперидин-1-карбоксилат
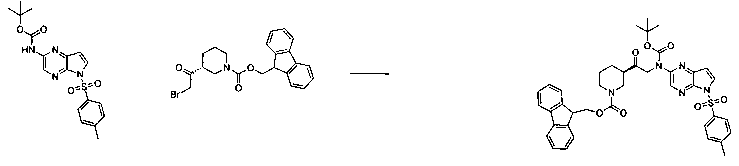
NaH (60% дисперсия в минеральном масле, 0,041 г, 1,0 ммоль) добавляют к безводному ДМФ (5 мл). Полученную суспензию охлаждают до около 0°C и по каплям добавляют раствор трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамата (0,40 г, 1,0 ммоль) в безводном ДМФ (5 мл). Полученную реакционную смесь оставляют нагреться до комнатной температуры и добавляют (R)-(9H-флуорен-9-ил)метил 3-(2-бромацетил)пиперидин-1-карбоксилат (0,441 г, 1,03 ммоль, пример получения № LL.1). Полученную реакционную смесь перемешивают в течение около 30 мин перед тем, как ее разделяют между EtOAc (30 мл) и солевым раствором (2×100 мл). Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают на хроматографической колонке с силикагелем (12 г колонка), осуществляя градиентное элюирование 10-50% EtOAc в гептане, получая (R)-(9H-флуорен-9-ил)метил-3-(2-(трет-бутоксикарбонил(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)амино)ацетил)пиперидин-1-карбоксилат в виде прозрачного масла (0,21 г, 26%): ЖХ/МС (Таблица 2, Способ a) Rt=3,16 мин; МС m/z: 736 (M+H)+.
Стадия C: (R)-(9H-флуорен-9-ил)метил 3-(3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбоксилат
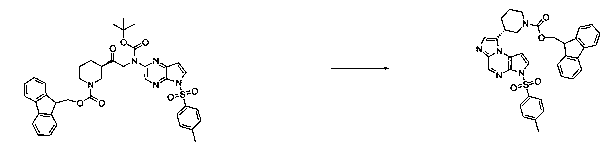
Смесь (R)-(9H-флуорен-9-ил)метил 3-(2-(трет-бутоксикарбонил(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)амино)ацетил)пиперидин-1-карбоксилата (0,20 г, 0,27 ммоль), TFA (1,0 мл, 13 ммоль) и TFAA (1,0 мл, 7,1 ммоль) перемешивают при температуре около 25°C в течение около 16 час. Полученную реакционную смесь разделяют между EtOAc (50 мл) и насыщенным водным раствором NaHCO3 (2×50 мл). Органический слой выделяют, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая (R)-(9H-флуорен-9-ил)метил 3-(3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбоксилат в виде прозрачного масла (0,17 г, 99%): ЖХ/МС (Таблица 2, Способ a) Rt=2,68 мин; МС m/z: 618 (M+H)+.
Стадия D: (R)-1-(3-(3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбонил)циклопропанкарбонитрил

К раствору (R)-(9H-флуорен-9-ил)метил 3-(3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбоксилата (0,20 г, 0,32 ммоль) в 1,4-диоксане (3 мл) добавляют водный раствор NaOH (2 N, 0,97 мл, 1,9 ммоль). Полученную реакционную смесь нагревают при температуре около 100°C в течение около 3 час перед тем, как ее оставляют остывать до комнатной температуры. Реакционную смесь нейтрализуют, используя 4 н. HCl в 1,4-диоксане (0,5 мл) и концентрируют при пониженном давлении. К полученному остатку добавляют MeCN (25 мл) перед тем, как его концентрируют при пониженном давлении. Эту процедуру повторяют перед тем, как добавляют 1-циано циклопропанкарбоновую кислоту (0,072 г, 0,65 ммоль), HATU (0,111 г, 0,291 ммоль) и ДМФ (2 мл) с последующим добавлением DIEA (0,170 мл, 0,971 ммоль). После перемешивания при комнатной температуре в течение около 3 час, реакционную смесь разделяют между EtOAc (2×50 мл) и водным раствором NaHCO3 (50 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырую реакционную смесь очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ j). Объединенные содержащие продукт фракции концентрируют при пониженном давлении для удаления MeCN и затем лиофилизируют, получая (R)-1-(3-(3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбонил)циклопропанкарбонитрил в виде твердого вещества белого цвета (0,010 г, 9%): ЖХ/МС (Таблица 2, Способ a) Rt=1,67 мин; МС m/z: 335 (M+H)+.
Пример № 17: 5-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил
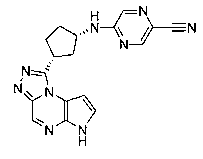
Стадия A: 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин

Раствор 2-бром-5H-пирроло[2,3-b]пиразина (78,0 г, 394 ммоль, Ark Pharm) в безводном ДМФ (272 мл) по каплям добавляют в течение около 60 мин к перемешиваемой суспензии NaH (12,8 г, 532 ммоль) в безводном ДМФ (543 мл) при температуре около 0-5°C. Коричневый реакционный раствор перемешивают в течение около 30 мин при температуре около 0-5°C. Затем по каплям добавляют раствор p-толуолсульфонилхлорида (94,0 г, 492 ммоль) в безводном ДМФ (272 мл) в течение около 60 мин при температуре около 0-5°C. Полученную реакционную смесь перемешивают при температуре около 0-5°C в течение около 1 часа, затем оставляют нагреваться до комнатной температуры и перемешивают в течение около 18 час при комнатной температуре. Полученную реакционную смесь медленно выливают в ледяную воду (6 л), с последующим добавлением водного раствора 2,5 н. NaOH (50,0 мл, 125 ммоль). Полученный осадок собирают фильтрованием и перемешивают с холодной водой (3×200 мл). Твердый продукт собирают фильтрованием и сушат на воздухе в течение около 3 дней и, наконец, сушат до постоянного веса в вакуумном термостате при температуре около 55°C, получая в результате 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (134,6 г, 97%) в виде твердого вещества бежевого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,58 мин; МС m/z: 352/354 (M+H)+.
Стадия B: Трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат

В колбу добавляют Pd2(dba)3 (3,90 г, 4,26 ммоль), ди-трет-бутил-(2′,4′,6′-триизопропилбифенил-2-ил)фосфан (3,62 г, 8,52 ммоль) и безводный 1,4-диоксан (453 мл). Смесь катализатор-лиганд дегазируют, используя цикл вакуум/продувка азотом (3 раза) и нагревают при температуре около 80°C в течение около 10 мин. Последовательно добавляют 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (30,0 г, 85 ммоль пример получения № 7), трет-бутил гидразинкарбоксилат (16,9 г, 128 ммоль) и NaOt-Bu (12,28 г, 128 ммоль). После дополнительного цикла вакуум/продувка азотом, реакционную смесь нагревают при температуре около 80°C. Примерно через 50 мин, полученную реакционную смесь охлаждают до комнатной температуры и фильтруют через слой силикагеля (6 см в высоту×6 см в диаметре), поверх которого расположен слой Celite® (1 см в высоту×6 см в диаметре), промывая при этом EtOAc (3×150 мл). К полученному фильтрату добавляют воду (300 мл), и органический слой выделяют. Водный слой экстрагируют дополнительным количеством EtOAc (3×200 мл). Объединенные органические экстракты промывают насыщенным водным раствором NH4Cl, насыщенным водным раствором NaHCO3 и солевым раствором (400 мл каждый), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая масло темно коричневого цвета (45 г). Коричневое масло растворяют в DCM (250 мл), добавляют силикагель (200 г), и полученную смесь концентрируют при пониженном давлении. Полученную смесь с силикагелем очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 25-65% EtOAc в гептане, получая смесь трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [основной региоизомер] и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [второстепенный региоизомер] (18,8 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,47 мин; МС m/z: 404 (M+H)+.
Стадия C: 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин
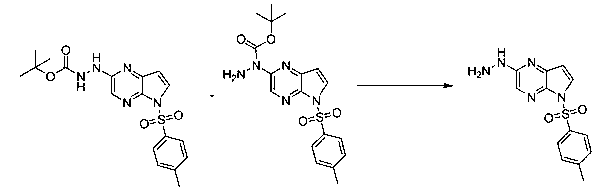
К смеси трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата (18,8 г, 46,6 ммоль) в 1,4-диоксане (239 мл) добавляют HCl (4 M в 1,4-диоксане, 86 мл, 345 ммоль). Реакционную смесь нагревают при температуре около 60°C в течение около 1 часа и затем охлаждают до около 15-20°C. Твердый продукт собирают вакуумным фильтрованием, промывают холодным 1,4-диоксаном (2×20 мл), и затем перемешивают с насыщенным водным раствором NaHCO3 и водой (1:1, 150 мл). Примерно через 1 час, интенсивное выделение газа прекращается, и твердый продукт собирают вакуумным фильтрованием, промывают ледяной водой (3×20 мл), и сушат в вакуумном термостате до получения 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин в виде твердого вещества светлого желтовато-коричневого цвета (8,01 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,28 мин; МС m/z: 304 (M+H)+.
Стадия D: Трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамат
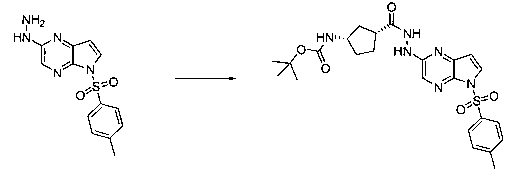
К смеси 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразина (2,50 г, 8,24 ммоль) и (1R,3S)-3-(трет-бутоксикарбониламино)циклопентанкарбоновой кислоты (2,08 г, 9,07 ммоль, Peptech) в DCM (30 мл) добавляют EDC.HCl (1,90 г, 9,89 ммоль). После перемешивания в течение около 4,5 час при комнатной температуре добавляют воду (30 мл) и слои разделяют. Водный слой затем экстрагируют EtOAc (15 мл). Объединенные органические слои промывают солевым раствором, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал растворяют в DCM (15 мл) и очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 40-100% EtOAc в гептане, получая трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамат (4,20 г, 97%): ЖХ/МС (Таблица 2, Способ a) Rt=2,27 мин; МС m/z: 515 (M+H)+.
Стадия E: Трет-бутил-(1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат
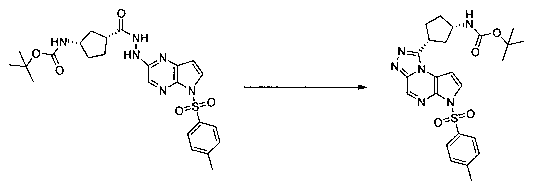
К раствору трет-бутил (1S,3R)-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамата (9,30 г, 18,1 ммоль) в 1,4-диоксане (100 мл) добавляют TEA (10,0 мл, 72,3 ммоль) и SOCl2 (2,11 мл, 28,9 ммоль). Полученную смесь нагревают при температуре около 80°C в течение около 1,5 час. Полученную реакционную смесь охлаждают до комнатной температуры, добавляют EtOAc и воду, и слои разделяют. Водный раствор экстрагируют EtOAc (2×100 мл), и объединенные органические слои промывают насыщенным водным раствором NaHCO3 и солевым раствором (100 мл каждый). Органические экстракты сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 25-100% EtOAc в DCM, получая трет-бутил-(1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат (7,65 г, 85%): ЖХ/МС (Таблица 2, Способ a) Rt=2,37 мин; МС m/z: 497 (M+H)+.
Стадия F: Гидрохлорид (1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина
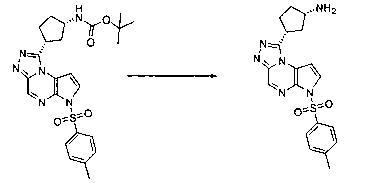
К раствору трет-бутил (1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамата (8,22 г, 16,6 ммоль) в 1,4-диоксане (32 мл) добавляют HCl (4 н. в 1,4-диоксане, 16,6 мл, 66,2 ммоль), и полученную реакционную смесь нагревают при температуре около 60°C в течение около 1,5 час, затем перемешивают при комнатной температуре в течение ночи. Полученную реакционную смесь фильтруют, при этом промывая Et2O (100 мл). Фильтровальную лепешку сушат в вакууме, получая твердое вещество светло коричневого цвета, которое далее сушат в вакуумном термостате при температуре около 50°C, получая гидрохлорид (1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (7,61 г, 93%) в виде твердого вещества бежевого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,09 мин; МС m/z: 397 (M+H)+.
Стадия G: 5-((1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил

В микроволновой реактор помещают гидрохлорид (1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамина (0,500 г, 1,06 ммоль), н-пропанол (10 мл), 5-хлорпиразин-2-карбонитрил (0,223 г, 1,60 ммоль) и DIEA (0,837 мл, 4,79 ммоль). Полученную смесь нагревают, используя микроволновое излучение, при температуре около 150°C в течение около 30 мин. Добавляют DCM (100 мл) и образуется раствор. Органический раствор промывают водой и солевым раствором (50 мл каждый), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая твердое вещество коричневого цвета. Полученный остаток помещают в DCM (30 мл) и адсорбируют на силикагеле (5 г). Полученный материал очищают на хроматографической колонке с силикагелем (80 г картридж), элюируя чистым EtOAc, получая 5-((1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил (0,43 г, 80%) в виде твердого вещества светло желтого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,40 мин; МС m/z: 500 (M+H)+.
Стадия H: 5-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил
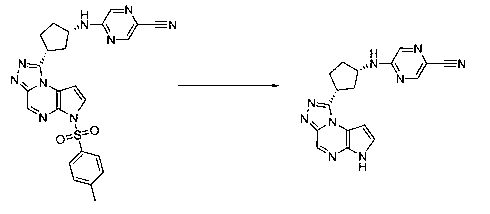
Смесь 5-((1S,3R)-3-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрила (0,426 г, 0,853 ммоль) и водного раствора NaOH (1 н, 1,71 мл, 1,71 ммоль) в 1,4-диоксане (4,4 мл) нагревают при температуре около 60°C в течение около 80 мин. Полученную смесь охлаждают до комнатной температуры и разбавляют водой (40 мл). Твердый осадок собирают вакуумным фильтрованием и промывают водой, получая твердое вещество не совсем белого цвета. Полученный материал растворяют в горячем EtOH и оставляют остывать до комнатной температуры. Полученный осадок собирают фильтрованием и сушат в вакууме, получая твердое вещество не совсем белого цвета, которое сушат в вакуумном термостате при температуре около 70°C, получая твердое вещество не совсем белого цвета (0,199 г). Полученный материал помещают в EtOAc (10 мл) и нагревают при температуре около 70°C в течение около 1,5 час. Твердый продукт собирают вакуумным фильтрованием, при этом промывая EtOAc. Этот материал сушат в вакууме, получая 5-((1S,3R)-3-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил (0,19 г, 64%) в виде твердого вещества не совсем белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,55 мин; МС m/z: 346 (M+H)+.
Пример № 18: 5-((1S,3R,4S)-3-этил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил и 5-((1R,3S,4R)-3-этил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил
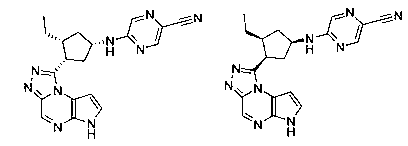
Стадия A: Натрий 4-(этоксикарбонил)-3-этил-2-(метоксикарбонил)циклопента-1,3-диенолят

В круглодонную колбу помещают ТГФ (1,5 л) затем порционно добавляют гидрид натрия (60% дисперсия в минеральном масле, 70,0 г, 1,75 моль). Добавляют дополнительное количество ТГФ (500 мл). Полученную смесь охлаждают до около −10°С и по каплям добавляют этилпропионилацетат (250 мл, 1,8 моль) в течение около 1 часа для того, чтобы поддерживать внутреннюю температуру ниже, чем около 10°C. Полученную смесь перемешивают при комнатной температуре в течение около 0,5 час, получая прозрачный желтый раствор, и по каплям добавляют метил 4-хлорацетоацетат (100 мл, 0,88 моль) в течение около 5 мин. Полученную смесь нагревают при около 50°C в течение около 19 час, получая суспензию красновато оранжевого цвета. Полученную реакционную смесь затем концентрируют при пониженном давлении, и полученную жидкость разбавляют водой (350 мл). Полученную смесь перемешивают и помещают на баню со льдом примерно на 2 часа. Твердый продукт собирают вакуумным фильтрованием и фильтровальную лепешку промывают водой (150 мл) и сушат в вакууме. Твердый продукт суспендируют в Et2O (1,5 л), фильтруют, промывают Et2O (1,5 л), и сушат в вакууме. Полученный твердый материал азеотропно перегоняют с толуолом (1 л), получая твердый материал, который снова суспендируют в Et2O (1 л) и собирают вакуумным фильтрованием. Фильтровальную лепешку промывают Et2O (500 мл) и сушат в вакууме, получая натрий 4-(этоксикарбонил)-3-этил-2-(метоксикарбонил)циклопента-1,3-диенолят (204,2 г, 89%) в виде твердого вещества бежевого цвета: 1H ЯМР (ДМСО-d 6) δ 3,94 (кв, J=7,1 Гц, 2H), 3,46 (с, 3H), 3,04 (кв, J=7,2 Гц, 2H), 2,66 (с, 2H), 1,13 (т, J=7,1 Гц, 3H), 0,99 (т, J=7,3 Гц, 3H).
Стадия B: Этил 2-этил-4-оксоциклопент-2-енкарбоксилат

В круглодонную колбу помещают натрий 4-(этоксикарбонил)-3-этил-2-(метоксикарбонил)циклопента-1,3-диенолят (250 г, 0,94 моль) и диглим (1,1 л), получая суспензию зеленого цвета, с последующим добавлением AcOH (140 мл, 2,4 моль). К полученной смеси порциями добавляют иодид натрия (490 г, 3,3 моль) в течение около 5-10 мин. После добавления температура повышается с около 16°C до около 36°C. Полученную реакционную смесь затем нагревают при кипении с обратным холодильником в течение около 3 час, охлаждают до комнатной температуры, и выливают на смесь льда (2 л) и насыщенного водного раствора NaHCO3 (4 л). Полученный материал экстрагируют Et2O (4×1,2 л) и объединенные органические слои сушат над безводным MgSO4 и фильтруют. Растворитель удаляют при пониженном давлении, получая жидкость коричневого цвета (250 мл), которую очищают, используя вакуумную перегонку (80-92°C, 40 Па), получая этил 2-этил-4-оксоциклопент-2-енкарбоксилат (95,7 г, 56%) в виде сиропа желтого цвета: 1H ЯМР (CDCl3) δ 6,04 (м, 1H), 4,26-4,15 (м, 2H), 3,76-3,69 (м, 1H), 2,75-2,57 (м, 2H), 2,56-2,44 (м, 2H), 1,32-1,26 (м, 3H), 1,23-1,18 (м, 3H).
Стадия C: Этил 2-этил-4-оксоциклопентанкарбоксилат
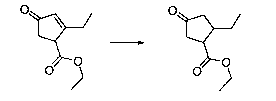
В круглодонную колбу помещают 10% палладий-на-угле (10 г, 9,4 ммоль). Колбу охлаждают до около 0°C и добавляют EtOAc (400 мл) в атмосфере азота. Охлаждающую баню удаляют, и добавляют этил 2-этил-4-оксоциклопент-2-енкарбоксилат (47,8 г, 263 ммоль). Газообразный водород барботируют через полученную смесь в течение около 5 мин, и полученную смесь затем перемешивают в атмосфере водорода в течение около 48 час при комнатной температуре. Источник водорода удаляют, полученную смесь барботируют азотом в течение около 5 мин и фильтруют через слой Celite®. Фильтровальную лепешку промывают EtOAc (400 мл). Полученный фильтрат концентрируют при пониженном давлении, получая этил 2-этил-4-оксоциклопентанкарбоксилат (около 9:1 смесь цис:транс) (48,0 г, 99%) в виде жидкости желтого цвета: 1H ЯМР (CDCl3) δ 4,23-4,10 (м, 2H), 3,22 (м, 1H), 2,59-2,50 (м, 1H), 2,44-2,28 (м, 3H), 2,26-2,16 (м, 1H), 1,58-1,46 (м, 1H), 1,41-1,30 (м, 1H), 1,30-1,23 (м, 3H), 1,02-0,91 (м, 3H).
Стадия D: Этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат
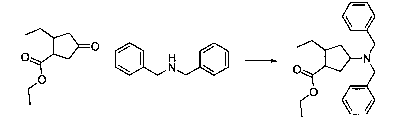
В круглодонную колбу помещают этил 2-этил-4-оксоциклопентанкарбоксилат (95,9 г, 521 ммоль) и DCE (1,8 л). Полученный раствор охлаждают до около 0°C и по каплям добавляют AcOH (45 мл, 780 ммоль) и дибензиламин (120 мл, 625 ммоль), получая в результате густую суспензию. Полученную реакционную смесь нагревают до около 10°C, удаляют охлаждающую баню и добавляют дополнительное количество DCE (500 мл). Триацетоксиборгидрид натрия (166 г, 781 ммоль) добавляют порциями, и полученную реакционную смесь перемешивают при комнатной температуре в течение около 20 час. Полученную реакционную смесь медленно выливают в насыщенный водный раствор NaHCO3 (1,5 л) при перемешивании с последующим порционным добавлением твердого NaHCO3 (175 г, 2083 ммоль). Полученную смесь перемешивают в течение около 2 час, и органический слой выделяют, сушат над безводным Na2SO4, и концентрируют досуха при пониженном давлении. Сырое масло желтого цвета очищают, используя флеш-хроматографию на силикагеле, используя EtOAc/гептан в качестве элюента (0-20% EtOAc), получая в результате этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат (136,6 г, 72%) в виде твердого вещества белого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=3,26 мин; МС m/z: 366 (M+H)+.
Стадия E: Этил 4-амино-2-этилциклопентанкарбоксилат
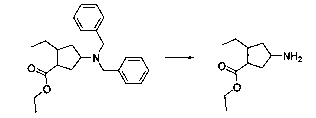
В реактор, содержащий суспензию 20% влажн. Pd(OH)2-C (12,9 г, 92,0 ммоль) в EtOH (1,0 л) добавляют этил 4-(дибензиламино)-2-этилциклопентанкарбоксилат (129 г, 352 ммоль). Реакционную смесь встряхивают в течение около 90 мин при температуре около 50°C при давлении Н2 около 207 кПа. Полученную смесь фильтруют через слой Celite®, и полученный фильтрат концентрируют при пониженном давлении, получая этил 4-амино-2-этилциклопентанкарбоксилат (64,5 г, 99%) в виде сиропа желтого цвета: 1H ЯМР (CDCl3) δ 4,03-3,88 (м, 2H), 3,17 (м, 1H), 2,68 (м, 1H), 2,09-2,02 (м, 2H), 2,02-1,94 (м, 2H), 1,84 (м, 1H), 1,58-1,48 (м, 1H), 1,32-1,18 (м, 1H), 1,09 (м, 3H), 1,03 (м, 2H), 0,78-0,69 (м, 3H).
Стадия F: (Этил 4-(трет-бутоксикарбониламино)-2-этилциклопентанкарбоксилат
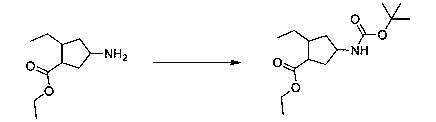
В 250 мл круглодонную колбу помещают этил 4-амино-2-этилциклопентанкарбоксилат (1,96 г, 10,6 ммоль) и DCM (100 мл), получая бесцветный раствор. Полученный раствор охлаждают до около 10°C и добавляют TEA (3,70 мл, 26,5 ммоль) и ди-трет-бутил дикарбонат (2,77 г, 12,7 ммоль). Полученный раствор перемешивают при температуре около 0°C в течение около 1 часа, затем полученную смесь медленно нагревают до комнатной температуры и перемешивают в течение около 16 час. Добавляют солевой раствор (10 мл), и слои разделяют. Органический слой сушат над безводным MgSO4, фильтруют и растворитель удаляют при пониженном давлении, получая (этил 4-(трет-бутоксикарбониламино)-2-этилциклопентанкарбоксилат (3,3 г, 90% чистоты по данным ЯМР, 98%) в виде мутного масла: 1H ЯМР (CDCl3) δ 5,22-5,19 (м, 1 H), 4,18-4,07 (м, 3 H), 2,86-2,81 (м, 1 H), 2,33-2,26 (м, 1 H), 2,24-2,16 (м, 1 H), 2,03-1,94 (м, 1 H), 1,76-1,71 (м, 1 H), 1,48-1,41 (м, 1 H), 1,43 (с, 9 H), 1,27 (т, 3 H), 1,27-1,21 (м, 2 H), 0,92 (т, 3 H).
Стадия G: 4-(трет-бутоксикарбониламино)-2-этилциклопентанкарбоновая кислота
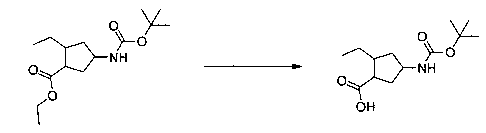
В 250 мл круглодонную колбу помещают этил 4-(трет-бутоксикарбониламино)-2-этилциклопентанкарбоксилат (3,00 г, 10,5 ммоль) в ТГФ (96 мл), получая бесцветный раствор. Добавляют водный раствор NaOH (1 н, 16,0 мл, 16,0 ммоль), и полученную реакционную смесь перемешивают в течение около 24 час при комнатной температуре. Добавляют дополнительно водный раствор NaOH (1 н, 5,00 мл, 5,00 ммоль), и перемешивание продолжают в течение около 48 час при комнатной температуре. Полученную реакционную смесь нагревают при около 50°C в течение около 24 час. Растворитель удаляют при пониженном давлении. Добавляют AcOH до тех пор, пока pH не достигает значения 5. Добавляют EtOAc (50 мл), и слои разделяют. Водный слой затем экстрагируют EtOAc (2×30 мл). Объединенные органические экстракты сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая масло желтого цвета. Полученное масло затем сушат в высоком вакууме, что приводит к образованию твердого вещества, которое растворяют в DCM и концентрируют досуха, снова суспендируют в DCM и снова концентрируют досуха. Полученный остаток затем суспендируют в Et2O и концентрируют досуха и затем сушат в вакууме в течение около 3 час, получая 4-(трет-бутоксикарбониламино)-2-этилциклопентанкарбоновую кислоту (2,36 г, 87%): ЖХ/МС (Таблица 2, Способ a) Rt=2,09 мин; МС m/z: 256 (M−H)−.
Стадия H: 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин
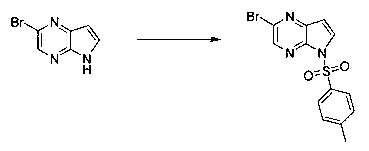
Раствор 2-бром-5H-пирроло[2,3-b]пиразина (78,0 г, 394 ммоль, Ark Pharm) в безводном ДМФ (272 мл) по каплям добавляют в течение около 60 мин к перемешиваемой суспензии NaH (12,8 г, 532 ммоль) в безводном ДМФ (543 мл) при температуре около 0-5°C. Коричневый реакционный раствор перемешивают в течение около 30 мин при температуре около 0-5°C. Затем по каплям добавляют раствор p-толуолсульфонилхлорида (94,0 г, 492 ммоль) в безводном ДМФ (272 мл) в течение около 60 мин при температуре около 0-5°C. Полученную реакционную смесь перемешивают при температуре около 0-5°C в течение около 1 часа, затем оставляют нагреваться до комнатной температуры и перемешивают в течение около 18 час при комнатной температуре. Полученную реакционную смесь медленно выливают в ледяную воду (6 л), с последующим добавлением водного раствора 2,5 н. NaOH (50,0 мл, 125 ммоль). Полученный осадок собирают фильтрованием и перемешивают с холодной водой (3×200 мл). Твердый продукт собирают фильтрованием и сушат до постоянного веса в вакуумном термостате при температуре около 55°C, получая в результате 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (134,6 г, 97%) в виде твердого вещества бежевого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,58 мин; МС m/z: 352/354 (M+H)+.
Стадия I: Трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилат

В колбу помещают Pd2(dba)3 (3,90 г, 4,26 ммоль), ди-трет-бутил-(2′,4′,6′-триизопропилбифенил-2-ил)фосфан (3,62 г, 8,52 ммоль) и безводный 1,4-диоксан (453 мл). Смесь катализатор-лиганд дегазируют, используя цикл вакуум/продувка азотом (3 раза) и нагревают при температуре около 80°C в течение около 10 мин. Последовательно добавляют 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин (30,0 г, 85 ммоль), трет-бутил гидразинкарбоксилат (16,9 г, 128 ммоль) и NaOt-Bu (12,28 г, 128 ммоль). После дополнительного цикла вакуум/продувка азотом, реакционную смесь нагревают при температуре около 80°C. Примерно через 50 мин, полученную реакционную смесь охлаждают до комнатной температуры и фильтруют через слой силикагеля (6 см в высоту × 6 см в диаметре), поверх которого расположен слой Celite® (1 см в высоту × 6 см в диаметре), промывая при этом EtOAc (3×150 мл). К полученному фильтрату добавляют воду (300 мл), и органический слой выделяют. Водный слой экстрагируют дополнительным количеством EtOAc (3×200 мл). Объединенные органические экстракты промывают насыщенным водным раствором NH4Cl, насыщенным водным раствором NaHCO3 и солевым раствором (400 мл каждый), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая масло темно коричневого цвета (45 г). Коричневое масло растворяют в DCM (250 мл), добавляют силикагель (200 г), и полученную смесь концентрируют при пониженном давлении. Полученную смесь с силикагелем очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 25-65% EtOAc в гептане, получая смесь трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [основной региоизомер] и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата [второстепенный региоизомер] (18,8 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,47 мин; МС m/z: 404 (M+H)+.
Стадия J: 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин
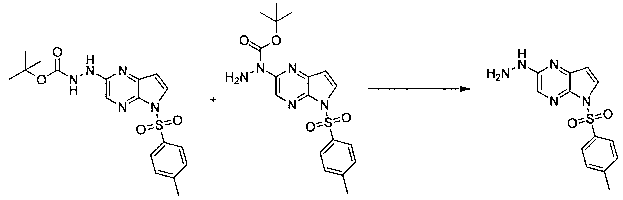
К смеси трет-бутил 2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата и трет-бутил 1-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбоксилата (18,8 г, 46,6 ммоль) в 1,4-диоксане (239 мл) добавляют HCl (4 M в 1,4-диоксане, 86 мл, 345 ммоль). Реакционную смесь нагревают при температуре около 60°C в течение около 1 часа и затем охлаждают до около 15-20°C. Твердый продукт собирают вакуумным фильтрованием, промывают холодным 1,4-диоксаном (2×20 мл), и затем перемешивают с насыщенным раствором NaHCO3 и водой (1:1, 150 мл). Примерно через 1 час, бурное выделение газа заканчивается, и твердый продукт собирают вакуумным фильтрованием, промывают ледяной водой (3×20 мл), и сушат в вакуумном термостате до постоянного веса, получая 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин в виде твердого вещества светлого желтовато-коричневого цвета (8,01 г, 50%): ЖХ/МС (Таблица 2, Способ d) Rt=1,28 мин; МС m/z: 304 (M+H)+.
Стадия K: трет-бутил-3-этил-4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамат
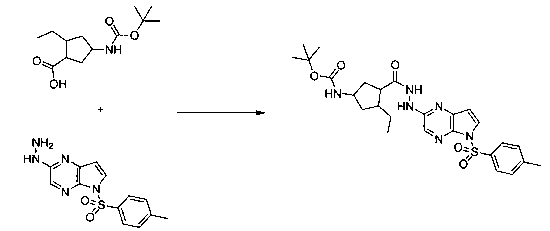
В круглодонную колбу помещают 2-гидразинил-5-тозил-5H-пирроло[2,3-b]пиразин (2,0 г, 6,6 ммоль, стадия J) и DCM (40 мл), получая суспензию коричневого цвета. К полученной суспензии добавляют 4-(трет-бутоксикарбониламино)-2-этилциклопентанкарбоновую кислоту (2,0 г, 7,8 ммоль, стадия G), HATU (2,51 г, 6,59 ммоль), и TEA (4,59 мл, 33,0 ммоль) и полученную смесь перемешивают при комнатной температуре в течение около 24 час, причем растворение происходит примерно через 2 часа. Добавляют воду (20 мл), и слои разделяют. Органический слой промывают дополнительным количеством воды (2×15 мл), солевым раствором (2×25 мл), сушат над безводным MgSO4, фильтруют и растворитель удаляют при пониженном давлении, получая остаток коричневого цвета. Сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-10% MeOH/DCM. Выделенный нечистый материал снова очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-10% MeOH/DCM. Содержащие продукт фракции из двух колонок объединяют и концентрируют, получая трет-бутил-3-этил-4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамат (2,45, 69%) в виде твердого вещества коричневого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,47 мин; МС m/z: 543 (M+H)+.
Стадия L: Трет-бутил-3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат
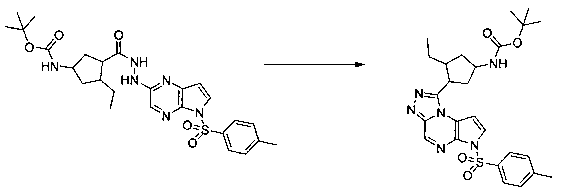
В круглодонную колбу помещают трет-бутил-3-этил-4-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)гидразинкарбонил)циклопентилкарбамат (2,45 г, 4,55 ммоль) и 1,4-диоксан (24 мл), получая раствор коричневого цвета. Добавляют TEA (2,54 мл, 18,2 ммоль), затем добавляют SOCl2 (0,50 мл, 6,8 ммоль). Полученную реакционную смесь нагревают при температуре около 80°C в течение около 5 час. Полученную смесь охлаждают до комнатной температуры и добавляют EtOAc (100 мл) и воду (30 мл). Слои разделяют, и органический слой промывают водой (2×30 мл) и солевым раствором (2×30 мл), сушат над безводным MgSO4, фильтруют и растворитель удаляют при пониженном давлении, получая остаток коричневого цвета. Сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-10% MeOH/DCM. Содержащие продукт фракции объединяют и концентрируют, получая трет-бутил (1S,3R,4S)-3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат (1,7 г, 71%): ЖХ/МС (Таблица 2, Способ a) Rt=2,50 мин; МС m/z: 525 (M+H)+.
Стадия M: 3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамин

В круглодонную колбу помещают трет-бутил-3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентилкарбамат (1,7 г, 3,2 ммоль) и 1,4-диоксан (20 мл), получая раствор коричневого цвета. Добавляют HCl (4 н. в 1,4-диоксане, 4,05 мл, 16,2 ммоль), и полученную смесь перемешивают при температуре около 40°C в течение около 3 час. Растворитель удаляют при пониженном давлении. Добавляют EtOAc (50 мл) и насыщенный водный раствор NaHCO3 (20 мл). Полученный твердый материал собирают вакуумным фильтрованием и сушат, используя лиофилизацию, получая твердый материал серого цвета (0,93 г). Слои полученного фильтрата разделяют, и водный слой экстрагируют EtOAc (3×40 мл). Органический слой сушат над безводным MgSO4, фильтруют и растворитель удаляют при пониженном давлении, получая остаток коричневого цвета (0,52 г). Полученный материал объединяют, получая 3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамин (1,45 г, со степенью чистоты 80% по данным УФ, 84%): ЖХ/МС (Таблица 2, Способ a) Rt=1,76 мин; МС m/z: 425 (M+H)+.
Стадия N: 5-((1S,3R,4S)-3-этил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил и 5-((1R,3S,4R)-3-этил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил
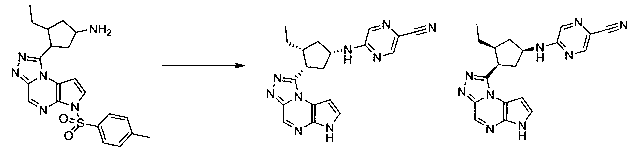
В 5 мл микроволновую реакционную ампулу помещают 3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентанамин (0,30 г, 0,71 ммоль) в EtOH (2,0 мл), получая суспензию коричневого цвета. Добавляют 5-хлорпиразин-2-карбонитрил (0,118 г, 0,848 ммоль, Ark Pharm) и DIEA (0,49 мл, 2,8 ммоль). Полученную суспензию нагревают, используя микроволновое излучение, при температуре около 150°C в течение около 1 часа. Растворитель удаляют при пониженном давлении и добавляют EtOAc (50 мл) и воду (20 мл). Слои разделяют, и органический слой промывают солевым раствором (20 мл), сушат над безводным MgSO4, фильтруют и растворитель удаляют при пониженном давлении, получая сырой 5-(−3-этил-4-(6-тозил-6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил (0,24 г, степень чистоты 40% по данным УФ, 0,18 ммоль), который растворяют в 1,4-диоксане (10 мл), получая раствор коричневого цвета. Добавляют насыщенный водный раствор Na2CO3 (10 мл, 27 ммоль), и полученную реакционную смесь перемешивают в течение около 96 час при температуре около 50°C. Полученную реакционную смесь охлаждают до комнатной температуры, и к реакционной смеси добавляют EtOAc (50 мл). Слои разделяют, и органический слой промывают водой (25 мл) и солевым раствором (25 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой материал очищают, используя ВЭЖХ с обращенной фазой (Таблица 2, Способ m), получая смесь 1:1 5-((1S,3R,4S)-3-этил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрила и 5-((1R,3S,4R)-3-этил-4-(6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрила (0,0025 г, 1,5%): ЖХ/МС (Таблица 2, Способ a) Rt=1,81 мин; МС m/z: 374 (M+H)+.
Пример № 19: 3-((3R,4R)-3-(3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)-4-метилпиперидин-1-ил)-3-оксопропаннитрил
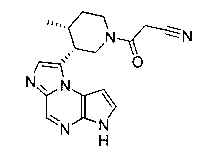
Стадия A: 1-(бензилоксикарбонил)-4-метилпиперидин-3-карбоновая кислота
Гидрохлорид 4-метилникотиновой кислоты (5,00 г, 36,5 ммоль, ASDI) и оксид платины (IV) (0,35 г, 1,54 ммоль) встряхивают в AcOH (100 мл) при давлении водорода около 414 кПа в течение около 72 час при комнатной температуре. Полученную реакционную смесь фильтруют через Celite® и концентрируют при пониженном давлении, получая гидрохлорид 4-метилпиперидин-3-карбоновой кислоты (7,4 г, содержащий остатки AcOH), который используют далее без дополнительной очистки. К порции кислоты (1,0 г, 4,92 ммоль) в 1,4-диоксане (10 мл) добавляют HCl (4 н. в 1,4-диоксане, 4,0 мл, 16 ммоль). Полученную смесь перемешивают в течение около 10 мин перед тем, как добавляют Et2O (10 мл). Полученный осадок собирают вакуумным фильтрованием, промывают Et2O (5 мл), получая твердый материал (0,27 г). К полученному фильтрату добавляют HCl (4 н. в 1,4-диоксане, 4,0 мл, 16 ммоль), и полученную смесь концентрируют при пониженном давлении до постоянного веса, при этом добавляя к полученному остатку DCM (20 мл), получая густое масло желтого цвета (0,56 г). Две порции объединяют, получая гидрохлорид 4-метилпиперидин-3-карбоновой кислоты (0,83 г, 93%). К кислоте (0,83 г, 4,6 ммоль) добавляют N-(бензилоксикарбонилокси)сукцинимид (1,27 г, 5,08 ммоль), Na2CO3 (1,71 г, 16,2 ммоль) и смесь вода:1,4-диоксан (1:1, 20 мл). Полученную смесь перемешивают при комнатной температуре в течение около 16 час, и органический растворитель удаляют при пониженном давлении. Водную фазу нейтрализуют, добавляя 1 н. HCl. Полученный раствор экстрагируют EtOAc (2×25 мл), и объединенные органические экстракты промывают солевым раствором и сушат над безводным MgSO4. Полученный раствор фильтруют и концентрируют при пониженном давлении, получая 1-(бензилоксикарбонил)-4-метилпиперидин-3-карбоновую кислоту (1,28 г, 100%): ЖХ/МС (Таблица 2, Способ a) Rt=1,97 мин; МС m/z: 278 (M+H)+.
Стадия B: Бензил 3-(2-бромацетил)-4-метилпиперидин-1-карбоксилат

К раствору 1-(бензилоксикарбонил)-4-метилпиперидин-3-карбоновой кислоты (1,28 г, 4,62 ммоль) в DCM (40 мл) добавляют оксалилхлорид (0,930 мл, 10,6 ммоль) с последующим добавлением по каплям ДМФ (0,072 мл, 0,92 ммоль). Полученную реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют, получая в результате сырой бензил 3-(хлоркарбонил)-4-метилпиперидин-1-карбоксилат (1,4 г, 4,7 ммоль), который растворяют в смеси Et2O и MeCN (1:1, 16 мл) и добавляют к раствору триметилсилилдиазометана (2 M в Et2O, 9,47 мл, 18,5 ммоль) в Et2O и MeCN (1:1, 16 мл), который охлаждают до около 0°C. Полученную смесь перемешивают при температуре около 0°C в течение около 4 часов и гасят, по каплям добавляя 48% водный раствор HBr. Органические растворители удаляют, и полученный остаток очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 10-40% EtOAc в гептане. Содержащие продукт фракции концентрируют при пониженном давлении, получая бензил 3-(2-бромацетил)-4-метилпиперидин-1-карбоксилат (0,78 г, 47%): ЖХ/МС (Таблица 2, Способ a) Rt=2,50 мин; МС m/z: 356 (M+H)+.
Стадия C: 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин

Раствор 2-бром-5H-пирроло[2,3-b]пиразина (78,0 г, 394 ммоль, Ark Pharm) в безводном ДМФ (272 мл) по каплям добавляют в течение около 60 мин к перемешиваемой суспензии NaH (60% дисперсия в минеральном масле, 12,8 г, 532 ммоль) в безводном ДМФ (543 мл) при температуре около 0-5°C. Коричневый реакционный раствор перемешивают в течение около 30 мин при температуре около 0-5°C, затем по каплям добавляют раствор p-толуолсульфонилхлорида (94,0 г, 492 ммоль) в безводном ДМФ (272 мл) в течение около 60 мин при температуре около 0-5°C. Полученную реакционную смесь перемешивают при температуре около 0-5°C в течение около 1 часа, затем оставляют нагреваться до комнатной температуры и перемешивают в течение около 18 час при комнатной температуре. Полученную реакционную смесь медленно выливают в ледяную воду (6 л), затем добавляют водный раствор 2,5 н. NaOH (50,0 мл, 125 ммоль). Полученный осадок собирают фильтрованием и перемешивают с холодной водой (3×200 мл). Твердый продукт собирают фильтрованием и сушат до постоянного веса в вакуумном термостате при температуре около 55°C, получая в результате 2-бром-5-тозил-5H-пирроло[2,3-b]пиразин: (134,6 г, 97%) в виде твердого вещества бледно-бежевого цвета: ЖХ/МС (Таблица 2, Способ d) Rt=1,58 мин; МС m/z: 352/354 (M+H)+.
Стадия D: Метил 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбоксилат
К раствору 2-бром-5-тозил-5H-пирроло[2,3-b]пиразина (5,00 г, 14,2 ммоль) в ДМФ (64 мл) добавляют дихлорбис(трифенилфосфин)палладий (0,60 г, 0,86 ммоль), TEA (5,9 мл, 43 ммоль) и MeOH (17 мл, 420 ммоль). К реакционной колбе подключают баллон с окисью углерода. Колбу откачивают и снова заполняют окисью углерода дважды, и полученную смесь нагревают при температуре около 65°C в течение около 3 час. Добавляют дополнительное количество дихлорбис(трифенилфосфин)палладия (0,60 г, 0,86 ммоль) и колбу снова откачивают и снова заполняют окисью углерода дважды. Полученную реакционную смесь нагревают при температуре около 95°C в течение около 16 час в атмосфере окиси углерода. Полученную смесь охлаждают до комнатной температуры и выливают в ледяную воду (350 мл). Полученную суспензию перемешивают в течение около 10 мин и фильтруют. Фильтровальную лепешку промывают водой, и твердый продукт лиофилизируют в течение около 48 час, получая метил 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбоксилат (5,0 г, степень чистоты 90% по данным УФ, 95%) в виде твердого вещества светло-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,21 мин; МС m/z: 332 (M+H)+.
Стадия E: Гидрохлорид 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбоновой кислоты
К раствору метил 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбоксилата (2,5 г, 7,5 ммоль) в 1,4-диоксане (50 мл) добавляют водный раствор 6 н. HCl (50,0 мл, 1650 ммоль), и полученную реакционную смесь перемешивают при температуре около 65°C в течение около 5 час и при комнатной температуре в течение около 72 час. Полученную смесь снова нагревают при около 60°C в течение около 3 час, и перемешивают при комнатной температуре в течение около 48 час. Полученную смесь снова нагревают до около 65°C в течение около 2 час и затем охлаждают до комнатной температуры. нерастворимый ярко желтый остаток удаляют фильтрованием, и органический растворитель удаляют при пониженном давлении, получая осадок, который собирают и сушат, получая гидрохлорид 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбоновой кислоты (1,92 г, 72%) в виде твердого вещества желто-коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,48 мин; МС m/z: 352 (M−H)−.
Стадия F: Трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамат
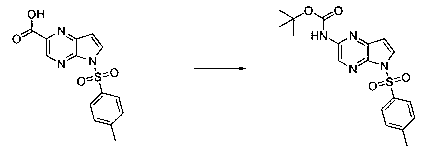
К раствору гидрохлорида 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбоновой кислоты (1,92 г, 5,43 ммоль) в t-BuOH (50 мл) добавляют TEA (1,67 мл, 11,9 ммоль) и дифенилфосфорилазид (1,29 мл, 5,97 ммоль). Полученную реакционную смесь нагревают при температуре около 70°C в течение около 8 час. Полученную смесь охлаждают до комнатной температуры, и нерастворимый остаток удаляют фильтрованием. Полученный фильтрат суспендируют в EtOAc и фильтруют. Полученный фильтрат концентрируют, и сырой материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 17-100% EtOAc/гептан, получая трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамат в виде твердого вещества белого цвета (0,68 г). В результате хроматографической обработки получают также 5-тозил-5H-пирроло[2,3-b]пиразин-2-карбоксамид (0,39 г, 1,23 ммоль) который подвергают взаимодействию с тетраацетатом свинца (0,55 г, 1,2 ммоль) в t-BuOH (25 мл) при комнатной температуре в течение около 72 час, затем выдерживают при кипении с обратным холодильником в течение около 4 часов. Добавляют дополнительное количество тетраацетата свинца (1,36 г, 3,07 ммоль), и полученную смесь нагревают при кипении с обратным холодильником в течение около 2 час. Нерастворимый остаток удаляют фильтрованием, и полученный фильтрат концентрируют при пониженном давлении. Полученный остаток очищают на хроматографической колонке с силикагелем, как раскрыто выше, получая в результате дополнительную порцию искомого продукта (0,18 г). Обе порции объединяют, получая трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамат (0,86 г, 41%): ЖХ/МС (Таблица 2, Способ a) Rt=2,67 мин; МС m/z: 389 (M+H)+.
Стадия G: Бензил 3-(2-(трет-бутоксикарбонил(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)амино)ацетил)-4-метилпиперидин-1-карбоксилат
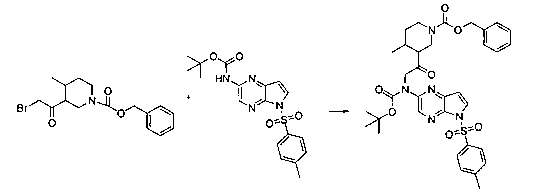
К суспензии NaH (60% дисперсия в минеральном масле, 0,088 г, 2,2 ммоль) в ДМФ при температуре около 0°C (10 мл) добавляют раствор трет-бутил 5-тозил-5H-пирроло[2,3-b]пиразин-2-илкарбамата (0,86 г, 2,2 ммоль, стадия F) в ДМФ (10 мл), и полученную смесь перемешивают при температуре около 0°C в течение около 1 часа. По каплям добавляют раствор бензил 3-(2-бромацетил)-4-метилпиперидин-1-карбоксилата (0,78 г, 2,2 ммоль, стадия B) в ДМФ (5 мл), и полученную смесь перемешивают при комнатной температуре в течение около 16 час. Растворитель удаляют, и полученный остаток разделяют между EtOAc и водой (40 мл каждый). Органическую фазу промывают солевым раствором (20 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении, получая бензил 3-(2-(трет-бутоксикарбонил(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)амино)ацетил)-4-метилпиперидин-1-карбоксилат (1,45 г, 100%): ЖХ/МС (Таблица 2, Способ a) Rt=3,14 мин; МС m/z: 662 (M+H)+.
Стадия H: Бензил 4-метил-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-иламино)ацетил)пиперидин-1-карбоксилат
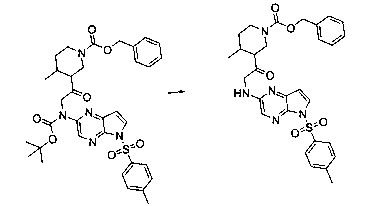
Бензил 3-(2-(трет-бутоксикарбонил(5-тозил-5H-пирроло[2,3-b]пиразин-2-ил)амино)ацетил)-4-метилпиперидин-1-карбоксилат (1,45 г, 2,2 ммоль) перемешивают в HCl (4 н. в 1,4-диоксане, 0,55 мл, 2,2 ммоль) при комнатной температуре в течение около 90 мин. Растворитель удаляют при пониженном давлении, и полученный остаток нейтрализуют, используя насыщенный водный раствор NaHCO3. Водную фазу экстрагируют EtOAc (2×20 мл), и объединенные органические экстракты промывают солевым раствором (16 мл), сушат над безводным MgSO4, фильтруют и концентрируют, получая в результате бензил 4-метил-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-иламино)ацетил)пиперидин-1-карбоксилат (1,23 г, 100%) в виде твердого аморфного вещества коричневого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,74 мин; МС m/z: 562 (M+H)+.
Стадия I: Бензил 4-метил-3-(3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбоксилат
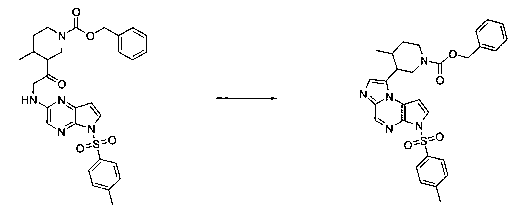
К полученному раствору бензил 4-метил-3-(2-(5-тозил-5H-пирроло[2,3-b]пиразин-2-иламино)ацетил)пиперидин-1-карбоксилата (1,2 г, 2,2 ммоль) в 1,4-диоксане (15 мл) добавляют реагент Лоусона (0,44 г, 1,1 ммоль), и полученную смесь нагревают при температуре около 60°C в течение около 90 мин. Растворитель удаляют при пониженном давлении, и полученный остаток очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-1,5% MeOH/DCM, получая в результате бензил 4-метил-3-(3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбоксилат (0,93 г, 78%) в виде аморфного вещества желтого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=2,49 мин; МС m/z: 544 (M+H)+.
Стадия J: Бензил 3-(3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)-4-метилпиперидин-1-карбоксилат
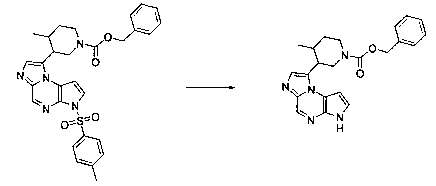
К раствору бензил 4-метил-3-(3-тозил-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)пиперидин-1-карбоксилата (0,93 г, 1,7 ммоль) в 1,4-диоксане (20 мл) добавляют водный раствор NaOH (2 н., 1,0 мл), и полученную смесь нагревают при температуре около 90°C в течение около 80 мин. Растворители удаляют при пониженном давлении, и полученный остаток обрабатывают насыщенным водным раствором NH4Cl (26 мл) и экстрагируют EtOAc (2×30 мл). Объединенные органические экстракты промывают солевым раствором (20 мл), сушат над безводным MgSO4, фильтруют и концентрируют, получая в результате сырой продукт в виде твердого аморфного вещества коричневого цвета. Полученный материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 5-100% MeOH/DCM, получая бензил 3-(3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)-4-метилпиперидин-1-карбоксилат (0,55 г, 83%) в виде твердого вещества желтого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=1,94 мин; МС m/z: 390 (M+H)+.
Стадия K: 8-(4-метилпиперидин-3-ил)-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин
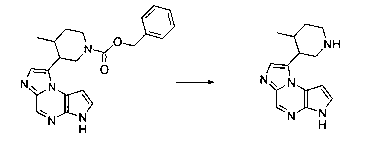
Смесь бензил 3-(3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)-4-метилпиперидин-1-карбоксилата (0,55 г, 1,4 ммоль) и палладия-на-угле (10%, 0,38 г, 0,36 ммоль) в EtOH (25 мл) гидрируют при комнатной температуре при атмосферном давлении водорода в течение около 20 час. Катализатор удаляют фильтрованием через слой Celite®, и полученный фильтрат концентрируют в вакууме, получая 8-(4-метилпиперидин-3-ил)-3H-имидазо[1,2-a]пирроло[2,3-e]пиразин (0,30 г, 83%) в виде аморфного вещества желтого цвета: ЖХ/МС (Таблица 2, Способ a) Rt=0,93 мин; МС m/z: 256 (M+H)+.
Стадия L: 3-((3R,4R)-3-(3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)-4-метилпиперидин-1-ил)-3-оксопропаннитрил

К раствору 8-(4-метилпиперидин-3-ил)-3H-имидазо[1,2-a]пирроло[2,3-e]пиразина (0,30 г, 1,2 ммоль) в ДМФ (10 мл) добавляют DIEA (0,41 мл, 2,4 ммоль) и EDC (0,68 г, 3,5 ммоль). Добавляют 2-цианоуксусную кислоту (0,20 г, 2,4 ммоль), и полученную смесь перемешивают при комнатной температуре в течение около 14 час. Растворитель удаляют при пониженном давлении, и полученный остаток разделяют между DCM и водой (25 мл каждый). Органическую фазу промывают солевым раствором (20 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Материал очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-8% MeOH в DCM, получая продукт в виде твердого вещества белого цвета (0,29 г). В результате хирального разделения (Таблица 3, Способ 10) вещества получают материал (Rt=22,5 мин, опт.вр.=позитив), который далее очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование 0-8% MeOH в DCM, получая 3-((3R,4R)-3-(3H-имидазо[1,2-a]пирроло[2,3-e]пиразин-8-ил)-4-метилпиперидин-1-ил)-3-оксопропаннитрил (0,04 г, 11%): ЖХ/МС (Таблица 2, Способ a) Rt=1,36 мин; МС m/z: 323 (M+H)+.
Пример № 20: 7-(5-метокси-1-метил-1H-индол-3-ил)-1-метил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин
Стадия A: 3-иодо-5-метокси-1-метил-1H-индол
5-метокси-1H-индол (5,00 г, 34,0 ммоль) в ДМФ (100 мл) перемешивают с KOH (2,00 г, 35,7 ммоль) в течение около 15 мин, затем добавляют йод (8,80 г, 34,7 ммоль). Полученную смесь перемешивают в течение около 30 мин, затем порциями добавляют NaH (60% дисперсия в минеральном масле, 1,63 г, 40,8 ммоль). После перемешивания в течение около 15 мин при комнатной температуре, добавляют йодометан (2,34 мл, 37,4 ммоль), и полученную смесь перемешивают в течение около 2 час. Растворители удаляют при пониженном давлении, и полученную смесь перемешивают с водой (300 мл) в течение около 15 мин. Полученную суспензию обрабатывают DCM (100 мл), и слои разделяют. Водный слой экстрагируют DCM (50 мл), и объединенные органические фракции сушат над безводным MgSO4, фильтруют и концентрируют. Полученный материал очищают на хроматографической колонке с силикагелем, элюируя DCM, получая 3-иодо-5-метокси-1-метил-1H-индол (9,48 г, 97%):1H ЯМР (400 МГц, ДМСО-d 6 δ 7,48 (с, 1H), 7,38 (д, 1H), 6,86 (дд, 1H), 6,72 (д, 1H), 3,79 (с, 3H), 3,76 (с, 3H); ЖХ/МС (Таблица 2, Способ a) Rt=2,50 мин.
Стадия B: 5-бром-3-((5-метокси-1-метил-1H-индол-3-ил)этинил)пиразин-2-амин
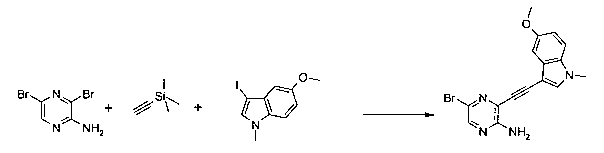
В 500 мл круглодонную колбу помещают NMP (120 мл) и 3,5-дибромпиразин-2-амин (9,00 г, 35,6 ммоль). Полученную смесь дегазируют азотом и добавляют Pd(Ph3P)4 (3,29 г, 2,85 ммоль). Колбу обертывают алюминиевой фольгой для защиты от света, и добавляют иодид меди(I) (0,678 г, 3,56 ммоль), TEA (29,8 мл, 214 ммоль) и (триметилсилил)ацетилен (3,84 г, 39,1 ммоль). Полученную смесь нагревают при около 55°C на масляной бане в течение около 1,5 часов. Полученную смесь охлаждают до комнатной температуры и добавляют 3-иодо-5-метокси-1-метил-1H-индол (9,76 г, 34,0 ммоль), воду (0,256 мл, 14,2 ммоль), NMP (1 мл) и DBU (37,5 мл, 249 ммоль). Полученную смесь перемешивают при комнатной температуре в течение около 16 час. Смесь концентрируют для удаления летучих, и полученную смесь разбавляют водой (800 мл) и экстрагируют EtOAc (4×300 мл). Объединенные органические слои промывают водой (600 мл). Образующуюся эмульсию фильтруют через Celite® для удаления нерастворимого материала. Полученные фильтратные слои разделяют, и органический слой сушат над безводным MgSO4, фильтруют и концентрируют до около 25 мл и очищают на хроматографической колонке с силикагелем, элюируя EtOAc. Содержащие продукт фракции концентрируют, получая материал, который тщательно растирают с Et2O (50 мл), фильтруют и промывают Et2O (2×10 мл). Полученный твердый материал сушат, получая 2,94 г продукта. Полученный выше фильтрат концентрируют до около 6 мл и очищают на хроматографической колонке с силикагелем, элюируя EtOAc, получая вторую порцию обогащенного материала, который тщательно растирают с Et2O (20 мл) и фильтруют, получая дополнительно 0,42 г продукта. Две порции объединяют, получая 5-бром-3-((5-метокси-1-метил-1H-индол-3-ил)этинил)пиразин-2-амин (3,36 г, 26%): ЖХ/МС (Таблица 2, Способ a) Rt=2,46 мин; МС m/z: 357 (M+H)+.
Стадия C: 2-бром-6-(5-метокси-1-метил-1H-индол-3-ил)-5H-пирроло[2,3-b]пиразин

5-бром-3-((5-метокси-1-метил-1H-индол-3-ил)этинил)пиразин-2-амин (3,25 г, 9,10 ммоль) в ДМФ (35 мл) обрабатывают NaH (60% дисперсия в минеральном масле, 0,36 г, 9,1 ммоль). Примерно через 5 час при комнатной температуре, полученную смесь обрабатывают другой порцией NaH (60% дисперсия в минеральном масле, 0,036 г, 0,91 ммоль), и перемешивают в течение около 16 час. Полученную смесь концентрируют и перемешивают с водой (50 мл) и EtOAc (40 мл). Полученную смесь фильтруют, и твердые продукты промывают до тех пор, пока не остается нерастворимая смола. Полученный фильтратные слои разделяют, и органический слой сушат над безводным MgSO4, фильтруют и концентрируют. Материал растворяют в минимальном количестве теплого ДМФ, и очищают на хроматографической колонке с силикагелем (120 г силикагеля колонка), элюируя смесью 95:5 DCM/MeOH. Содержащие продукт фракции объединяют и концентрируют, получая масло, которое очищают на хроматографической колонке с силикагелем (120 г силикагеля колонка), элюируя EtOAc. Содержащие продукт фракции объединяют и концентрируют, получая маслянистый остаток, который тщательно растирают с EtOAc (20 мл), затем фильтруют, получая твердый материал желтого цвета. Этот материал сушат, получая 2-бром-6-(5-метокси-1-метил-1H-индол-3-ил)-5H-пирроло[2,3- b]пиразин (1,48 г, 45%): ЖХ/МС (Таблица 2, Способ a) Rt=2,50 мин; МС m/z: 357 (M+H)+.
Стадия D: 2-бром-6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин
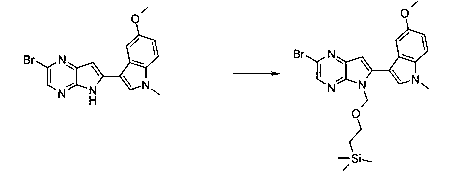
2-бром-6-(5-метокси-1-метил-1H-индол-3-ил)-5H-пирроло[2,3-b]пиразин (0,500 г, 1,40 ммоль) в ДМФ (15 мл) охлаждают до около 0°C, затем обрабатывают NaH (60% дисперсия в минеральном масле, 0,112 г, 2,80 ммоль). Полученную смесь перемешивают в течение около 15 мин, добавляют SEM-Cl (0,372 мл, 2,10 ммоль), и полученную смесь нагревают до комнатной температуры в течение около 15 мин. Полученную смесь концентрируют и очищают на хроматографической колонке с силикагелем (40 г силикагеля колонка), элюируя DCM, получая 2-бром-6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин (0,61 г, 89%): ЖХ/МС (Таблица 2, Способ a) Rt=3,88 мин; МС m/z: 489 (M+H)+.
Стадия E: (6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метанол

2-бром-6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин (0,815 г, 1,67 ммоль), (E)-стирилбороновую кислоту (0,272 г, 1,84 ммоль, Combiblocks), Cs2CO3 (1,36 г, 4,18 ммоль) и PdCl2(PPh3)2 (0,070 г, 0,10 ммоль) в 1,4-диоксане (13 мл) и воде (6,5 мл) нагревают при около 70°C в течение ночи. Полученную смесь охлаждают, и растворители концентрируют при пониженном давлении. Полученный материал разделяют между водой (50 мл) и EtOAc (60 мл) и органический слой сушат над безводным MgSO4, фильтруют и концентрируют до пены (1,01 г). Эту пену растворяют в 1,4-диоксане (15 мл) и воде (3 мл), добавляют 2,5 вес % тетраоксида осмия в t-BuOH (0,84 мл, 0,067 ммоль), и периодат натрия (1,43 г, 6,69 ммоль). Полученную смесь перемешивают в течение около 1 часа при комнатной температуре затем добавляют 2,5 вес % тетраоксида осмия в t-BuOH (0,84 мл, 0,067 ммоль) и воду (3 мл). Полученную смесь перемешивают в течение около 3 час, затем разбавляют водой (50 мл). Полученную смесь экстрагируют EtOAc (50 мл и 25 мл объемных). Объединенные органические растворы промывают солевым раствором (30 мл), сушат над безводным MgSO4, фильтруют и концентрируют, получая масло (0,97 г). Этот материал растворяют в 1,4-диоксане (10 мл) и EtOH (2 мл) затем обрабатывают NaBH4 (0,063 г, 1,672 ммоль) и перемешивают в течение около 30 мин. Растворители выпаривают, и материал разделяют между EtOAc (50 мл), водой (20 мл) и насыщенным водным раствором NaHCO3 (20 мл). Слои разделяют, и водный слой экстрагируют EtOAc (2×20 мл). Объединенные органические растворы промывают солевым раствором (20 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Полученный материал очищают на хроматографической колонке с силикагелем, элюируя EtOAc, получая (6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метанол (0,63 г, 86%): ЖХ/МС (Таблица 2, Способ a) Rt=2,58 мин; МС m/z: 439 (M+H)+.
Стадия F: 2-(азидометил)-6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин
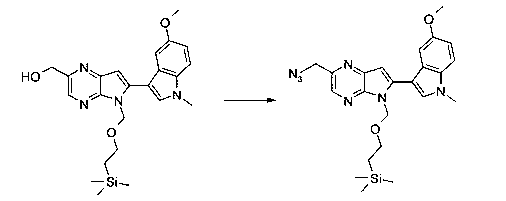
(6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метанол (0,63 г, 1,4 ммоль) в DCM (10 мл) обрабатывают SOCl2 (0,115 мл, 1,58 ммоль) и перемешивают в течение около 15 мин при комнатной температуре. Растворители выпаривают, затем добавляют азид натрия (0,280 г, 4,31 ммоль) и ДМФ (5 мл). Полученную смесь затем перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают, и полученный остаток разделяют между водой (30 мл) и EtOAc (25 мл). Водный слой промывают EtOAc (15 мл), затем объединенные органические растворы сушат над безводным MgSO4, фильтруют и концентрируют, получая 2-(азидометил)-6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин (0,58 г, 87%): ЖХ/МС (Таблица 2, Способ a) Rt=3,42 мин; МС m/z: 464 (M+H)+.
Стадия G: (6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метанамин

2-(азидометил)-6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин (0,58 г, 1,3 ммоль) в ТГФ (15 мл) обрабатывают трифенилфосфином (0,335 г, 1,28 ммоль) и водой (0,150 мл, 8,33 ммоль), затем нагревают при около 70°C в течение около 2 час. Полученную смесь охлаждают, затем концентрируют в вакууме. Полученный материал очищают на хроматографической колонке с силикагелем, элюируя смесью 9:1 DCM/MeOH, содержащий 2,5 об. %, 37 вес %. водный раствор гидроксида аммония, получая (6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метанамин (0,37 г, 68%): ЖХ/МС (Таблица 2, Способ a) Rt=2,11 мин; МС m/z: 438 (M+H)+.
Стадия H: N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)ацетамид
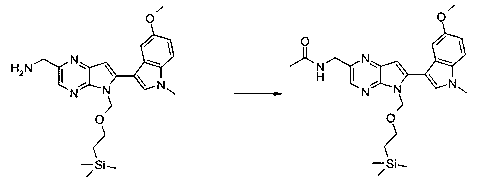
(6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метанамин (0,185 г, 0,423 ммоль) в ТГФ (5 мл) обрабатывают пиридином (0,044 мл, 0,55 ммоль) и уксусным ангидридом (0,044 мл, 0,47 ммоль). Полученную смесь перемешивают в течение около 5 мин при комнатной температуре и обрабатывают AcOH (0,024 мл, 0,42 ммоль). Полученную смесь разбавляют EtOAc (20 мл) и промывают водой (15 мл) и солевым раствором (10 мл). Органический раствор сушат над безводным MgSO4, фильтруют и концентрируют, получая N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пиролло[2,3-b]пиразин-2-ил)метил)ацетамид (0,202 г, 100%): ЖХ/МС (Таблица 2, Способ a) Rt=2,63 мин; МС m/z: 480 (M+H)+.
Стадия I: N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)ацетамид

N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)ацетамид (0,200 г, 0,417 ммоль) в ДМФ (10 мл) обрабатывают этилендиамином (0,90 мл, 13 ммоль) и TBAF (1 M в ТГФ, 1,7 мл, 1,7 ммоль). Полученную смесь нагревают при около 85°C в течение около 90 мин, затем охлаждают и концентрируют при пониженном давлении. Полученный материал перемешивают с водой (20 мл) в течение около 16 час, добавляют Et2O (10 мл), и перемешивание продолжают в течение около 15 мин. Суспензию фильтруют, и твердый продукт собирают и сушат. Полученный фильтрат экстрагируют EtOAc (2×25 мл), затем объединенные органические растворы сушат над безводным MgSO4, фильтруют и концентрируют, получая материал, который объединяют с собранным ранее твердым материалом. Весь материал тщательно растирают с EtOAc (5 мл) и фильтруют, получая твердое вещество. Полученный фильтрат очищают на хроматографической колонке с силикагелем, элюируя DCM/MeOH (9:1), получая дополнительное количество продукта, который объединяют с твердым продуктом, полученным в результате тщательного растирания с EtOAc, получая N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)ацетамид (0,108 г, 74%): ЖХ/МС (Таблица 2, Способ a) Rt=1,91 мин; МС m/z: 350.2 (M+H)+.
Стадия J: 7-(5-метокси-1-метил-1H-индол-3-ил)-1-метил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин
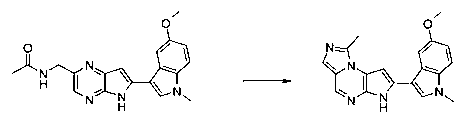
N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)ацетамид (0,108 г, 0,309 ммоль) в 1,4-диоксане (6 мл) обрабатывают реагентом Лоусона (0,075 г, 0,19 ммоль) и нагревают до около 85°C в течение около 30 мин. Полученную смесь быстро охлаждают, затем добавляют другую порцию реагента Лоусона (0,075 г, 0,19 ммоль). Полученную смесь нагревают при около 85°C в течение около 30 мин. Полученную смесь охлаждают до комнатной температуры, затем добавляют ацетат ртути (0,10 г, 0,31 ммоль). Примерно через 15 мин добавляют другую порцию ацетата ртути (0,10 г, 0,31 ммоль). Полученную смесь перемешивают в течение около 15 мин, затем разбавляют EtOAc (50 мл). Полученную смесь фильтруют и фильтровальную лепешку промывают EtOAc (2×25 мл). Полученный фильтрат выпаривают (и полученный остаток отставляют в сторону), и твердые продукты сушат и тщательно растирают с DCM (20 мл). Твердые продукты собирают фильтрованием и промывают DCM (25 мл). Полученный фильтрат концентрируют и объединяют с отставленным в сторону остатком, полученным при фильтровании EtOAc. Фильтровальную лепешку растворяют в ДМФ (1,2 мл) и очищают на хроматографической колонке с силикагелем (10г колонка), элюируя 95:5 DCM/MeOH. Содержащие продукт фракции объединяют с фильтратами, полученными в результате тщательного растирания с EtOAc и DCM, концентрируют, и объединенные материалы очищают на хроматографической колонке с силикагелем (10г колонка), элюируя 95:5 DCM/MeOH. Содержащие продукт фракции объединяют. Колонки с силикагелем промывают ДМФ (40 мл каждая) и все содержащие продукт фракции объединяют с собранными ранее, растворители удаляют при пониженном давлении. Полученный остаток тщательно растирают с MeOH (5 мл) и фильтруют. Фильтровальную лепешку тщательно растирают с водой (40 мл) и 37 вес % гидроксидом аммония (3 мл) и экстрагируют EtOAc (5×50 мл). Органические экстракты объединяют и промывают солевым раствором (25 мл), сушат над безводным MgSO4, фильтруют и концентрируют, получая твердый материал (0,056 г), который тщательно растирают с MeOH (5 мл). Твердый продукт собирают фильтрованием, затем сушат, получая 7-(5-метокси-1-метил-1H-индол-3-ил)-1-метил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин, который содержит 5 вес.% MeOH (0,037 г, 36%): ЖХ/МС (Таблица 2, Способ a) Rt=1,94 мин; МС m/z: 332 (M+H)+. 1H ЯМР (400 МГц, ДМСОd 6) δ 12,19 (с, 1H), 8,50 (с, 1H), 7,81 (с, 1H), 7,66 (с, 1H), 7,45 (дд, J=14,8, 5,52 Гц, 2H), 7,03 (д, J=2,07 Гц, 1H), 6,92 (дд, J=8,88, 2,25 Гц, 1H), 3,87 (с, 3H), 3,83 (с, 3H), 2,95 (с, 3H).
Пример № 21: 7-(5-метокси-1-метил-1H-индол-3-ил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин
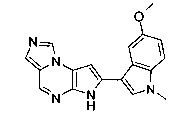
Стадия A: N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)формамид

(6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метанамин (0,095 г, 0,22 ммоль, пример № 20, стадия G) в этилформиате (4,4 мл, 54,0 ммоль) нагревают при температуре около 60°C на масляной бане в течение около 45 мин. Полученную смесь охлаждают и выпаривают, получая N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)формамид (0,10 г, 100%): ЖХ/МС (Таблица 2, Способ a) Rt=2,65 мин; МС m/z: 466 (M+H)+.
Стадия B: 7-(5-метокси-1-метил-1H-индол-3-ил)-6-((2-(триметилсилил)этокси)метил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин
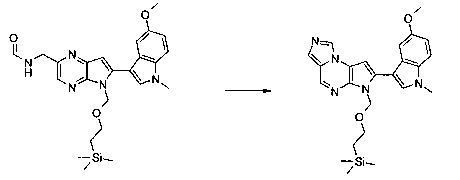
N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)формамид (0,10 г, 0,22 ммоль) в 1,4-диоксане (4 мл) обрабатывают реагентом Лоусона (0,053 г, 0,13 ммоль) и нагревают до около 80°C на масляной бане в течение около 15 мин. Полученную смесь охлаждают и добавляют ацетат ртути (0,073 г, 0,23 ммоль, Fluka). Полученную смесь перемешивают в течение около 30 мин при комнатной температуре и добавляют другую порцию ацетата ртути (0,073 г, 0,228 ммоль, Fluka), и перемешивание продолжают в течение около 2 час при комнатной температуре. Полученную смесь разбавляют EtOAc (20 мл) и фильтруют. Растворитель выпаривают при пониженном давлении, затем материал очищают на хроматографической колонке с силикагелем, элюируя DCM/MeOH (95:5). Затем материал, полученный после концентрирования содержащих продукт фракций, очищают на хроматографической колонке с силикагелем, EtOAc, получая 7-(5-метокси-1-метил-1H-индол-3-ил)-6-((2-(триметилсилил)этокси)метил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин (0,048 г, 49%): ЖХ/МС (Таблица 2, Способ a) Rt=3,16 мин; МС m/z: 448 (M+H)+.
Стадия C: 7-(5-метокси-1-метил-1H-индол-3-ил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин

7-(5-метокси-1-метил-1H-индол-3-ил)-6-((2-(триметилсил)этокси)метил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин (0,048 г, 0,11 ммоль) в ДМФ (4 мл) обрабатывают этилендиамином (0,22 мл, 3,3 ммоль) и нагревают до около 85°C в течение около 5 мин. Полученный раствор охлаждают, и добавляют TBAF (1 M в ТГФ, 0,11 мл, 0,11 ммоль). Полученный раствор снова нагревают при около 85°C в течение около 30 мин. Полученную смесь охлаждают до комнатной температуры и добавляют другую порцию TBAF (1 M в ТГФ, 0,054 мл, 0,054 ммоль) и нагревание продолжают в течение около 1,5 час. Полученный раствор охлаждают, и материал очищают, используя препаративную ВЭЖХ с обращенной фазой (Таблица 2, Способ I). Содержащие продукт фракции концентрируют для удаления MeCN, затем подщелачивают насыщенным водным раствором NaHCO3 и экстрагируют EtOAc (2×10 мл). Объединенные органические растворы сушат над безводным MgSO4, фильтруют и концентрируют. Тщательно растирают твердый продукт с гептаном (5 мл), затем собирают фильтрованием, в результате чего получают 7-(5-метокси-1-метил-1H-индол-3-ил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин (0,028 г, 8%): ЖХ/МС (Таблица 2, Способ a) Rt=1,91 мин; МС m/z: 318,1 (M+H)+. 1H NMR (400 МГц, ДМСО-d 6 δ 12,18 (с, 1H), 8,77 (с, 1H), 8,59 (с, 1H), 7,83 (с, 1H), 7,79 (с, 1H), 7,48 (д, J=2,3 Гц, 1H), 7,43 (д, J=8,9 Гц, 1H), 7,20 (д, J= 2,3 Гц, 1H), 6,92 (дд, J=8,90, 2,36 Гц, 1H), 3,88 (с, 3H), 3,82 (с, 3H).
Пример № 22: 7-(5-метокси-1-метил-1H-индол-3-ил)-1-фенил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин
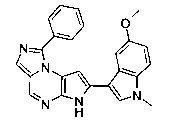
Стадия A: N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)бензамид

(6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метанамин (0,095 г, 0,28 ммоль, пример № 20, стадия G) в ТГФ (5 мл) обрабатывают пиридином (0,026 мл, 0,33 ммоль) и бензоилхлоридом (0,033 мл, 0,28 ммоль). Полученную смесь перемешивают в течение около 20 мин при температуре около 60°C и охлаждают до комнатной температуры, разбавляют водным раствором Na2CO3 (15 мл), и экстрагируют EtOAc (20 мл). Органический раствор сушат над безводным MgSO4, фильтруют и концентрируют, получая N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)бензамид (0,118 г, 100%): ЖХ/МС (Таблица 2, Способ d) Rt=1,64 мин; МС m/z: 542 (M+H)+.
Стадия B: 7-(5-метокси-1-метил-1H-индол-3-ил)-6-((2-(триметилсилил)этокси)метил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин

N-((6-(5-метокси-1-метил-1H-индол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-2-ил)метил)бензамид (0,118 г, 0,218 ммоль) в 1,4-диоксане (3 мл) обрабатывают реагентом Лоусона (0,070 г, 0,17 ммоль) и нагревают до около 80°C на масляной бане в течение около 20 мин. Полученную смесь охлаждают до комнатной температуры и затем добавляют ацетат ртути (0,073 г, 0,23 ммоль). Полученную смесь перемешивают в течение около 60 мин при комнатной температуре, затем добавляют другую порцию ацетата ртути (0,069 г, 0,22 ммоль), и перемешивание продолжают в течение около 20 мин при комнатной температуре. Полученную смесь разбавляют EtOAc (20 мл) и затем фильтруют. Полученный фильтрат концентрируют при пониженном давлении и материал очищают на хроматографической колонке с силикагелем, элюируя EtOAc, получая 7-(5-метокси-1-метил-1H-индол-3-ил)-6-((2-(триметилсилил)этокси)метил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин (0,055 г, 48%): ЖХ/МС (Таблица 2, Способ d) Rt=1,91 мин; МС m/z: 524 (M+H)+.
Стадия C: 7-(5-метокси-1-метил-1H-индол-3-ил)-1-фенил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин
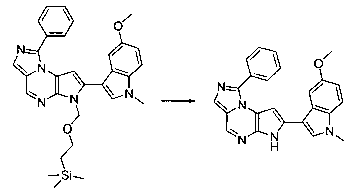
7-(5-метокси-1-метил-1H-индол-3-ил)-1-фенил-6-((2-(триметилсилил)этокси)метил)-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин (0,054 г, 0,103 ммоль) в ДМФ (3 мл) обрабатывают этилендиамином (0,207 мл, 3,09 ммоль) и TBAF (1 M в ТГФ, 0,412 мл, 0,412 ммоль). Полученный раствор нагревают при около 90°C в течение около 70 мин. Полученную смесь охлаждают до комнатной температуры, смесь разбавляют EtOAc (10 мл), промывают водой (6 мл), сушат над безводным MgSO4, фильтруют и концентрируют, получая остаток желтого цвета. Полученный остаток очищают на хроматографической колонке с силикагелем, элюируя 1-6% MeOH/DCM получая твердый продукт желтого цвета, который тщательно растирают с гептаном (2 мл), получая 7-(5-метокси-1-метил-1H-индол-3-ил)-1-фенил-6H-имидазо[1,5-a]пирроло[2,3-e]пиразин (0,004 г, 10%): ЖХ/МС (Таблица 2, Способ a) Rt=2,26 мин; МС m/z: 394 (M+H)+.

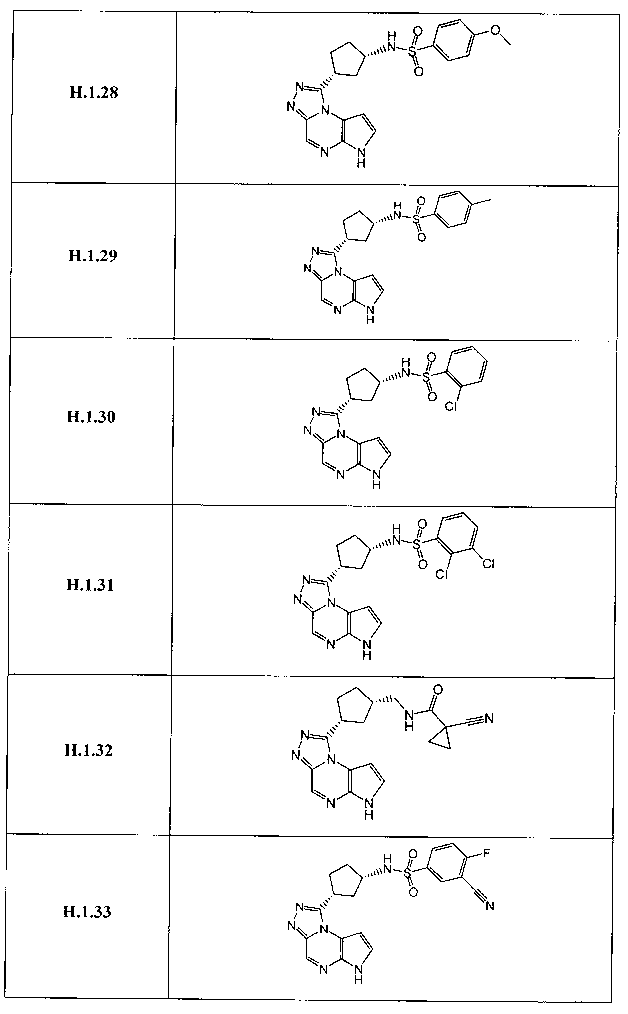


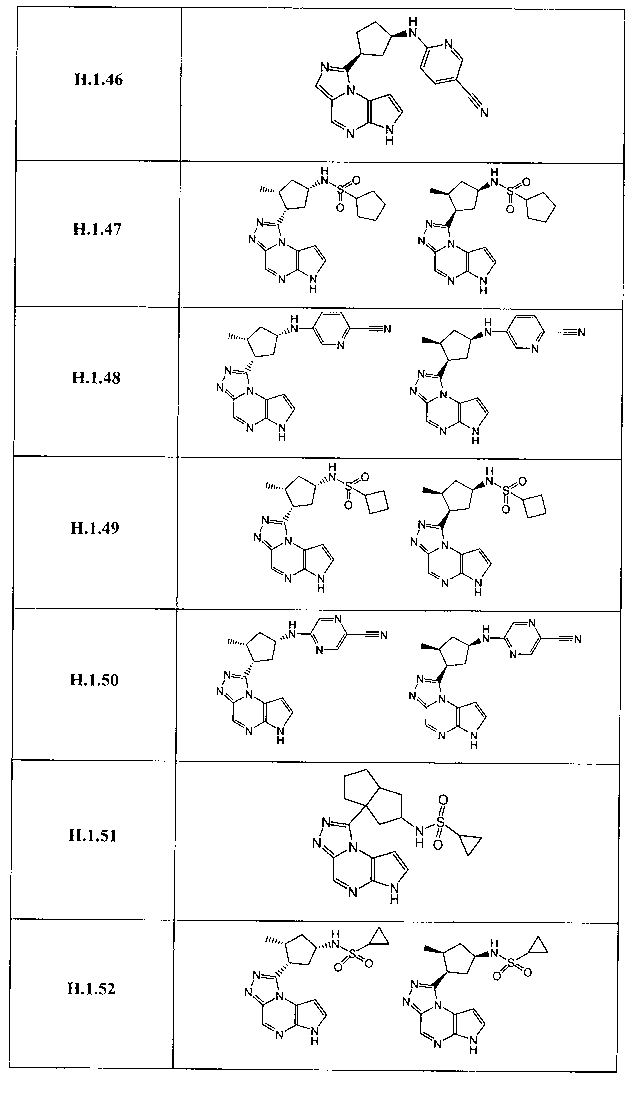
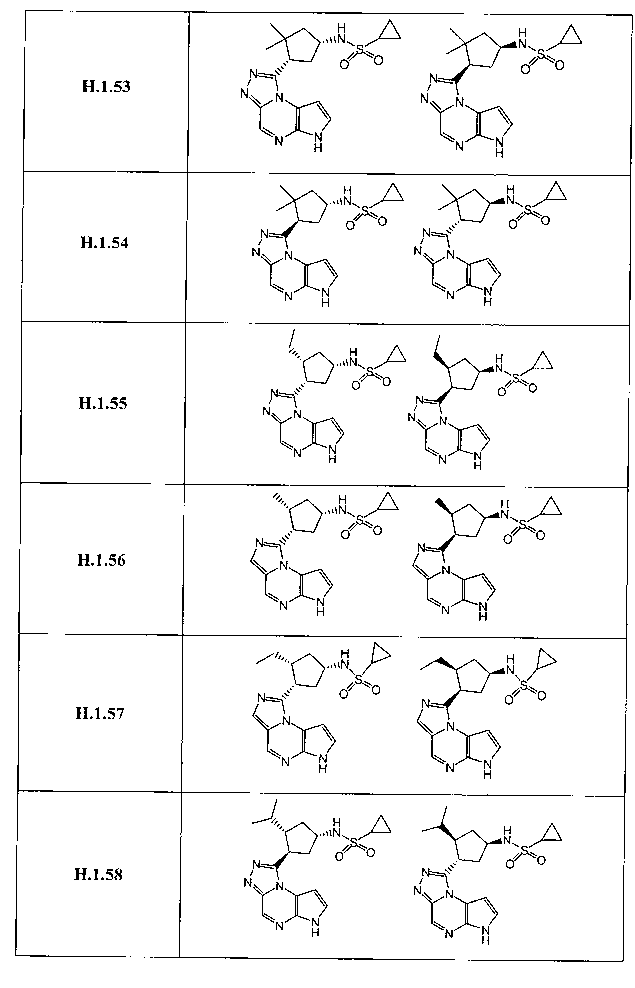
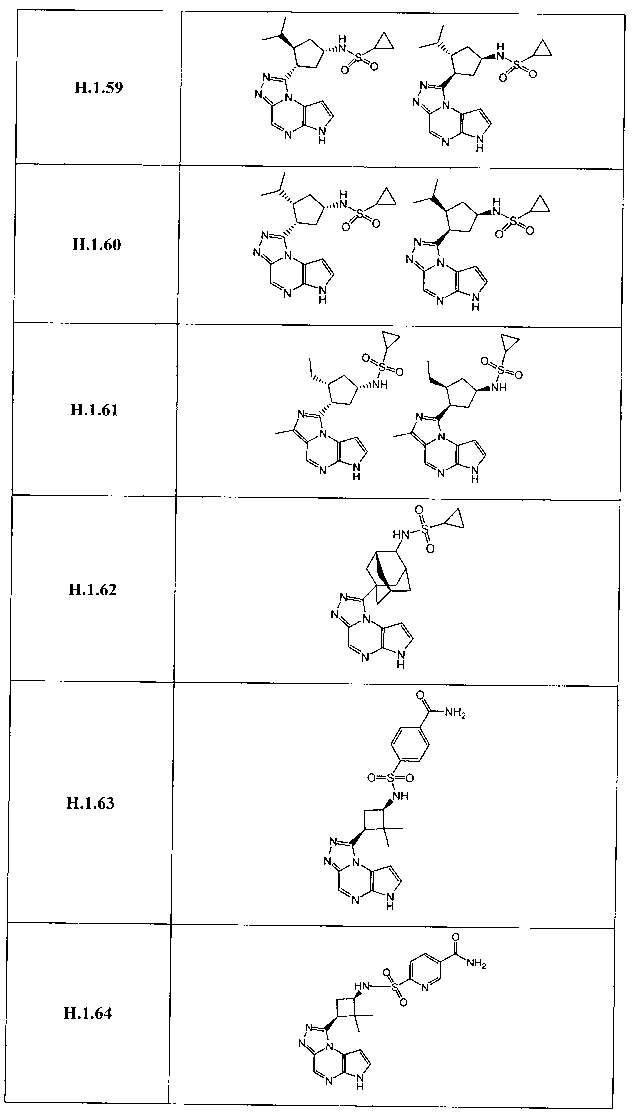


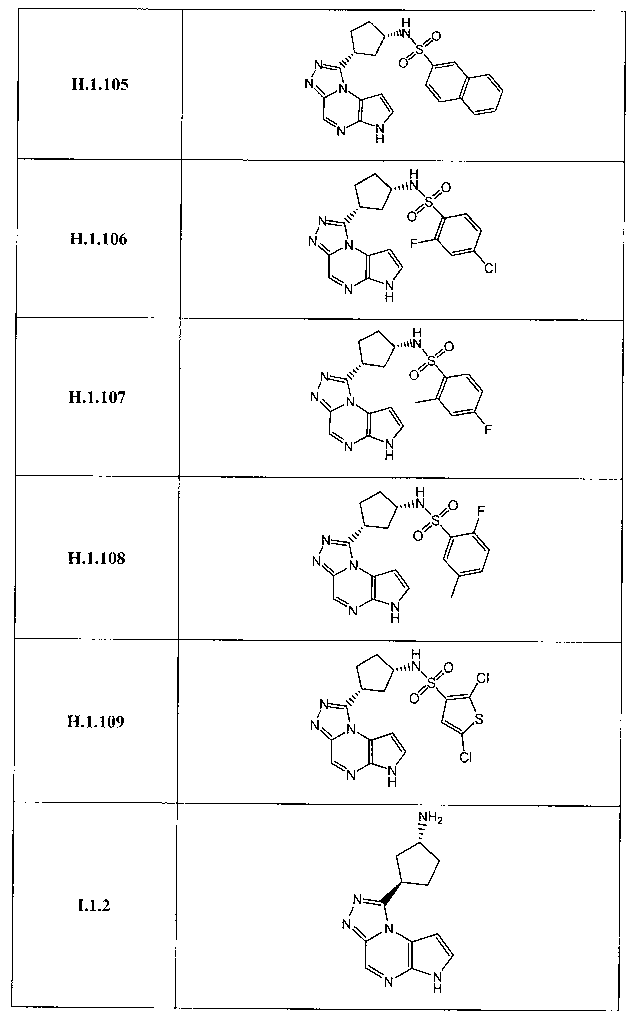
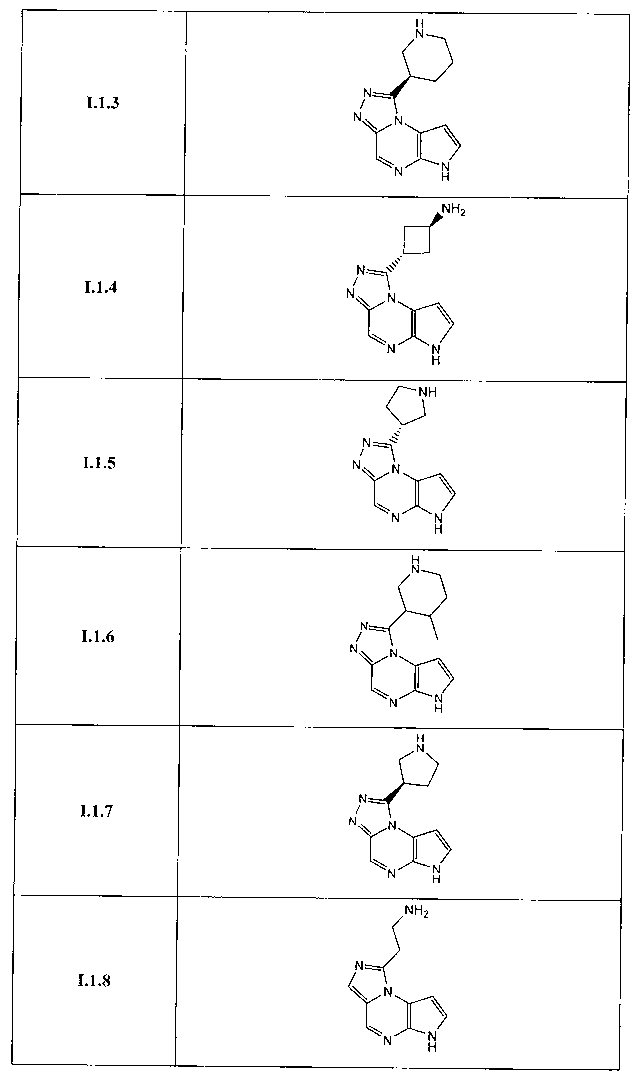
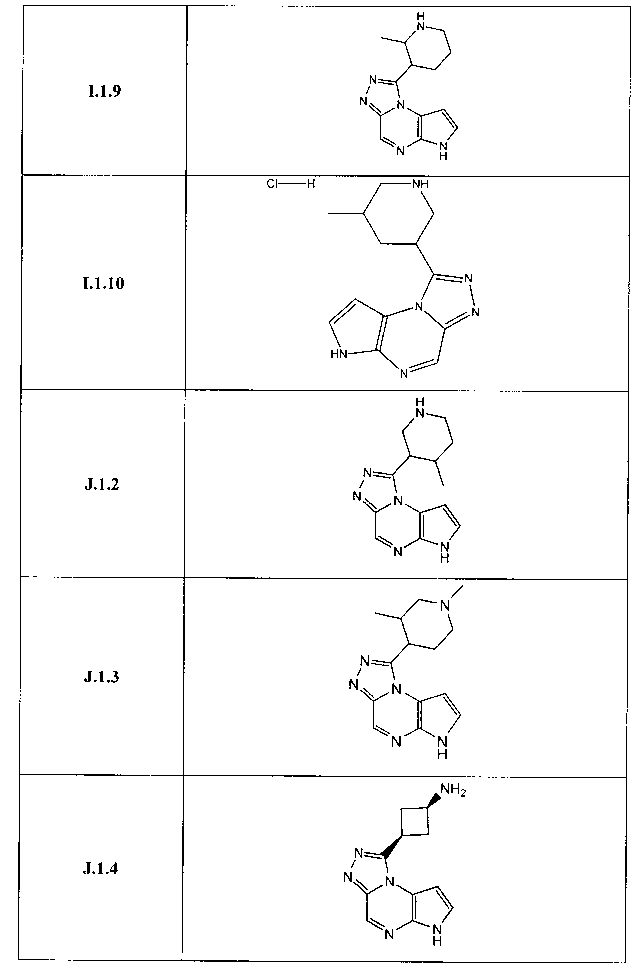
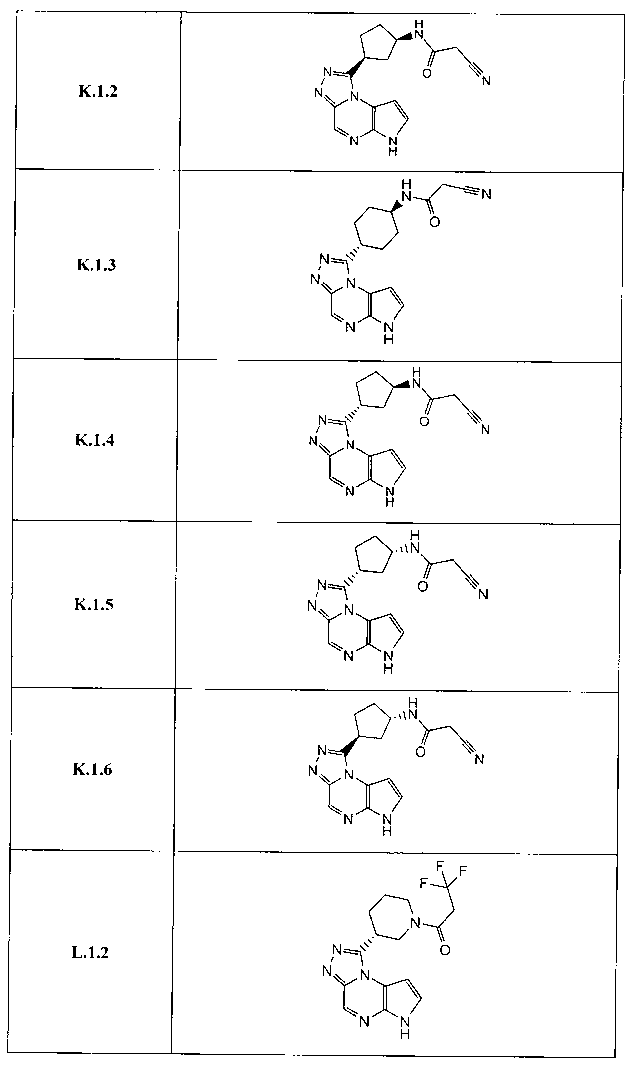
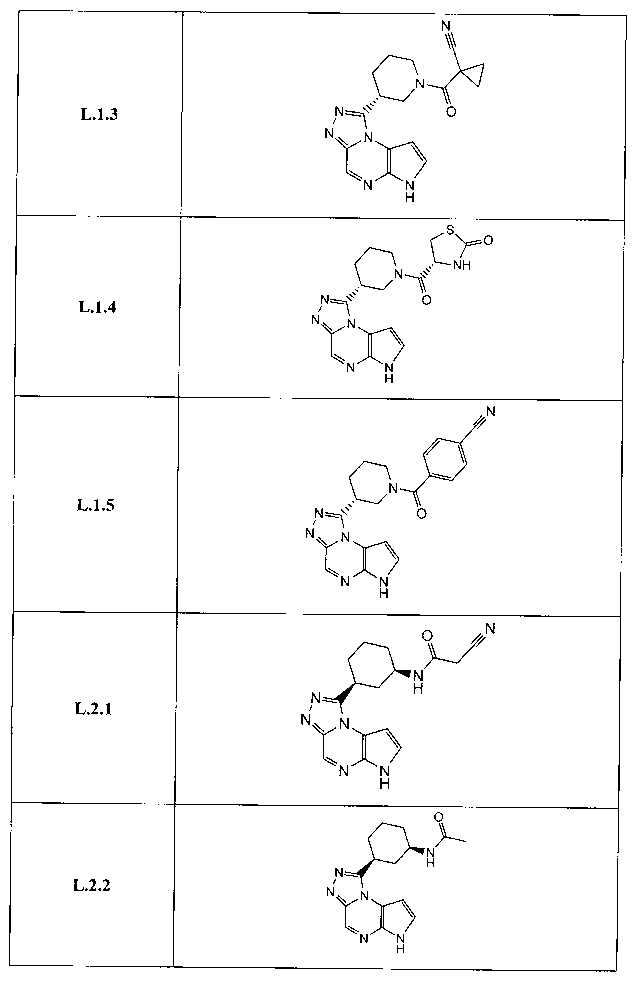

| название | год | авторы | номер документа |
|---|---|---|---|
| ИМИДАЗОПИРРОЛОПИРАЗИНОВЫЕ ПРОИЗВОДНЫЕ, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ АНОМАЛЬНОЙ АКТИВНОСТЬЮ ПРОТЕИНКИНАЗ Jak1, Jak3 ИЛИ Syk | 2010 |
|
RU2570416C2 |
| Имидазопирролопиразиновые производные, полезные для лечения заболеваний, вызванных аномальной активностью протеинкиназ Jak1, Jak3 или Syk | 2010 |
|
RU2711869C2 |
| АНТИВИРУСНЫЕ СОЕДИНЕНИЯ | 2009 |
|
RU2505540C2 |
| ИНГИБИТОРЫ АКТИВНОСТИ АКТ | 2006 |
|
RU2421454C2 |
| СОЕДИНЕНИЯ, ГЕТЕРОБИЦИКЛО-ЗАМЕЩЕННЫЕ-[1,2,4]ТРИАЗОЛО[1,5c]ХИНАЗОЛИН-5-АМИНА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ А2А АНТАГОНИСТОВ | 2013 |
|
RU2671628C2 |
| ТРИАЗОЛОПИРИДИНОВЫЕ СОЕДИНЕНИЯ-ИНГИБИТОРЫ JAK И СПОСОБЫ | 2009 |
|
RU2561104C2 |
| АНТИВИРУСНЫЕ СОЕДИНЕНИЯ | 2009 |
|
RU2505539C2 |
| ТРИЦИКЛИЧЕСКИЕ КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ПИРИДИН-2-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ BRD4 | 2016 |
|
RU2734959C2 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АЛЛОСТЕРИЧЕСКИХ ИНГИБИТОРОВ SHP2 | 2018 |
|
RU2776846C2 |
| ТРИАЗОЛПИРИДИНОВЫЕ СОЕДИНЕНИЯ, ИНГИБИРУЮЩИЕ JAK, И СПОСОБЫ | 2009 |
|
RU2560153C2 |
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы I и к его фармацевтически приемлемым солям, стереоизомерам и изомерам, где Т: N, U: N, X: CR3 и Y: N; или Т: CR6, U: CR4, X: CR3 и Y: N; или Т: CR6, U: N, X: NR3 и Y: C; или Т: O, U: N, X: CR3 и Y: С; или Т: NR6, U: N, X: CR3 и Y: С; и R1, R2 и R5: H, гетероарил, замещенный 1-2 заместителями; или Т: CR6, U: N, X: CR3 и Y: N; или Т: N, U: CR4, X: CR3 и Y: N; и R1 и R2: H, гетероарил, замещенный 1-2 заместителями; R5: гетероарил, замещенный 1-2 заместителями; R3: H, мостиковый (С7-С10)циклоалкил; (С1-C8)алкил, необязательно замещенный 1 заместителем; (С3-С10)циклоалкил, необязательно замещенный 1 заместителем; (С6-С8)циклоалкенил, замещенный двумя (C1-С6)алкилами; (С6)арил, необязательно замещенный 1-2 заместителями; гетероарил, необязательно замещенный (C1-С6)алкилом; гетероциклил, необязательно замещенный (C1-С6)алкилом или гетероарилом; или R3: -A-D-E-G, где: А: связь или (C1-С6)алкилен; D : (C1-C2)алкилен, необязательно замещенный (C1-С6)алкилом, мостиковый (С6-С10)циклоалкилен, необязательно замещенный (C1-С6)алкилом, (С3-С10)циклоалкилен, необязательно замещенный 1-2 заместителями, (С4-С6)циклоалкенилен, необязательно замещенный (C1-С6)алкилом, (С6)арилен, гетероарилен или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом; Е: связь, -Re-, -Re-C(О)-Re-, -Re-C(О)O-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)С(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-N(Ra)C(O)ORe- или -Re-N(Ra)S(О)2-Re-; где во всех случаях E связан или с атомом углерода, или с атомом азота в D; G: Н, -N(Ra)(Rb), галоген, -ORa, S(O)2Ra, -CN, -C(O)N(Ra)(Rb), -N(Ra)С(О)Rb, -C(O)Ra, -CF3, N(Ra)S(O)2Rb, -(C1-C6)алкил, необязательно замещенный 1-3 заместителями; -(С3-С6)циклоалкил, необязательно замещенный CN; -гетероарил, необязательно замещенный 1-2 галогенами, CN, -C(O)NH2 или -CF3; -гетероциклил, необязательно замещенный 1-5 заместителями, -(С6-С10)арил, необязательно замещенный 1-3 заместителями; где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный 1 заместителем (С3-С6)гетероциклил, где указанный (С3-С6)гетероциклил связан через азот; R4 и R6: Н, (C1-С4)алкил, необязательно замещенный -ОН, -СООН; (С3-С8)циклоалкил, фенил, необязательно замещенный -SO2CH3 или -NHSO2CH3, галоген или -J-L-M-Q; где: J: (С2-С6)алкенилен; L: связь; М: связь; Q: -C(O)ORa; Ra и Rb: Н, (С1-С4)алкил, необязательно замещенный циано, -CF3 или циклопропаном; (С6)арил, необязательно замещенный галогеном или -O(С1-С4)алкилом; и Re: связь, (С1-С4)алкилен или (С3)циклоалкилен. Также изобретение относится к конкретным соединениям, фармацевтической композиции на основе соединения формулы I, применению соединения формулы I для лечения и применению соединений формул 2-6 для получения соединения формулы I. Технический результат: получены новые соединения, полезные при лечении состояния, опосредованного активностью Jak1, Jak3 или Syk протеинкиназы. 10 н. и 41 з.п. ф-лы, 34 табл., 44 пр.
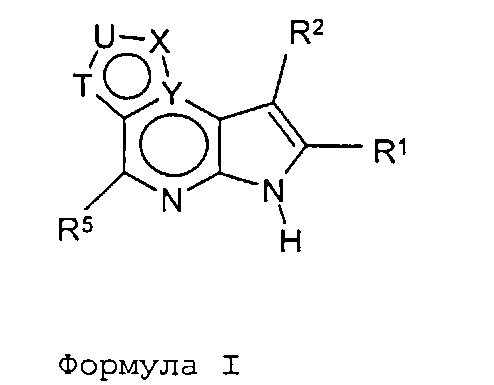
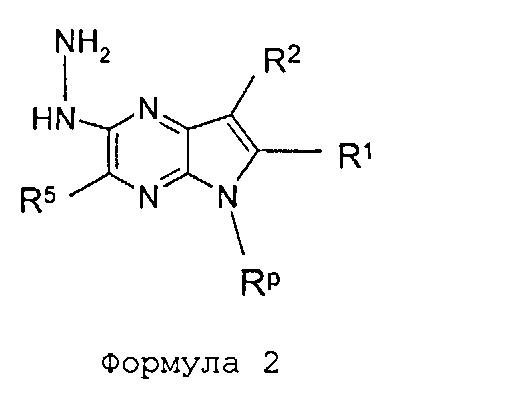
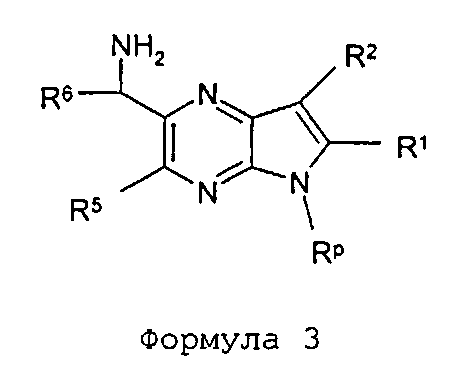

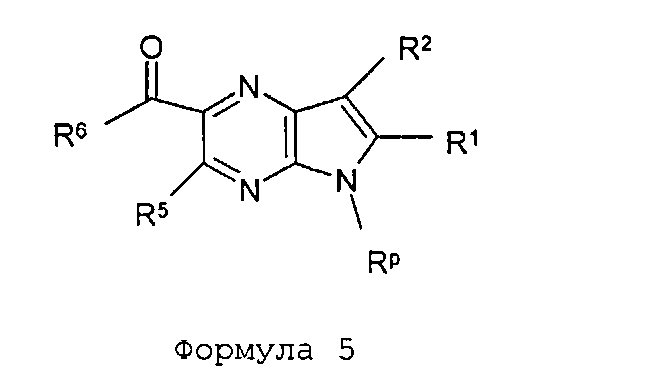
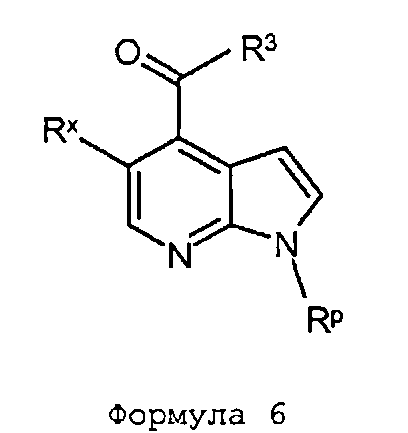
1. Соединение формулы (I)

или его фармацевтически приемлемые соли, стереоизомеры и изомеры, где
Т представляет собой N, U представляет собой N, X представляет собой CR3 и Y представляет собой N; или
Т представляет собой CR6, U представляет собой CR4, X представляет собой CR3 и Y представляет собой N; или
Т представляет собой CR6, U представляет собой N, X представляет собой NR3 и Y представляет собой C; или
Т представляет собой O, U представляет собой N, X представляет собой CR3 и Y представляет собой С; или
Т представляет собой NR6, U представляет собой N, X представляет собой CR3 и Y представляет собой С; и
R1, R2 и R5 каждый независимо представляет собой водород, гетероарил, замещенный 1-2 заместителями, выбранными из (C1-С6)алкила, О(C1-С6)алкила или (С6)арила, необязательно замещенного -SO2Me;
или
Т представляет собой CR6, U представляет собой N, X представляет собой CR3 и Y представляет собой N; или
Т представляет собой N, U представляет собой CR4, X представляет собой CR3 и Y представляет собой N; и
R1 и R2 каждый независимо представляет собой водород, гетероарил, замещенный 1-2 заместителями, выбранными из (С1-С6)алкила, О(C1-С6)алкила или (С6)арила, необязательно замещенного -SO2Me;
R5 представляет собой гетероарил, замещенный 1-2 заместителями, выбранными из (C1-С6)алкила, -О(C1-С6)алкила или (С6)арила, необязательно замещенного -SO2Me;
R3 представляет собой водород, мостиковый (С7-С10)циклоалкил, который является насыщенной или частично ненасыщенной би- или трициклической структурой; (С1-C8)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(С1-С6)алкилом или (C1-С6)алкилом; (С6-С8)циклоалкенил, замещенный двумя заместителями, выбранными из (C1-С6)алкила; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(C1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (C1-С6)алкилом или гетероарилом; или
R3 представляет собой -A-D-E-G, где:
А представляет собой связь или (C1-С6)алкилен;
D представляет собой (C1-C2)алкилен, необязательно замещенный одним (C1-С6)алкилом, мостиковый (С6-С10)циклоалкилен, который является насыщенной би- или трициклической структурой, необязательно замещенной одним (C1-С6)алкилом, (С3-С10)циклоалкилен, необязательно замещенный одним или двумя заместителями, выбранными из (C1-С6)алкила или гетероарила, (С4-С6)циклоалкенилен, необязательно замещенный одним (C1-С6)алкилом, (С6)арилен, гетероарилен или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом;
Е представляет собой связь, -Re-, -Re-C(О)-Re-, -Re-C(О)O-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)С(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-N(Ra)C(O)ORe- или -Re-N(Ra)S(О)2-Re-;
где во всех случаях E связан или с атомом углерода, или с атомом азота в D;
G представляет собой водород, -N(Ra)(Rb), галоген, -ORa, S(O)2Ra, -CN, -C(O)N(Ra)(Rb), -N(Ra)С(О)Rb, -C(O)Ra, -CF3, N(Ra)S(O)2Rb, -(C1-C6)алкил, необязательно замещенный 1-3 заместителями, выбранными из (С1-С6) алкила, ОН или CN; -(С3-С6)циклоалкил, необязательно замещенный одним CN; -гетероарил, необязательно замещенный одним или двумя галогенами, CN, -C(O)NH2 или -CF3; -гетероциклил, необязательно замещенный 1-5 заместителями, выбранными из оксо, (C1-С6)алкила, галогена или -СН2OН, -(С6-С10)арил, необязательно замещенный 1-3 заместителями, выбранными из галогена, -NO2, CN, -C(O)NH2, -COCH3, -OCHF2, (C1-C6)алкила, -N(CH3)2 или -О(C1-С6)алкила;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (С3-С6)гетероциклил, необязательно замещенный одним заместителем, выбранным из галогена, -CF3 или -СН2ОН, где указанный (С3-С6)гетероциклил связан через азот;
R4 и R6 каждый независимо представляет собой водород, (C1-С4)алкил, необязательно замещенный -ОН, -СООН; (С3-С8)циклоалкил, фенил, необязательно замещенный -SO2CH3 или -NHSO2CH3, галоген или -J-L-M-Q;
где:
J представляет собой (С2-С6)алкенилен;
L представляет собой связь;
М представляет собой связь;
Q представляет собой -C(O)ORa;
Ra и Rb каждый независимо представляет собой водород, (С1-С4)алкил, необязательно замещенный циано, -CF3 или циклопропаном; (С6)арил, необязательно замещенный галогеном или -O(С1-С4)алкилом; и
Re в каждом случае независимо представляет собой связь, (С1-С4)алкилен или (С3)циклоалкилен;
где гетероарил, гетероарилен представляют собой моно- или бициклическую ароматическую кольцевую систему, содержащую 5-10 атомов, включая 1-3 гетероатома, выбранных из азота, кислорода или серы;
гетероциклил, гетероциклилен представляют собой насыщенную моноциклическую кольцевую систему, содержащую 5-6 атомов, включая 1-2 гетероатома, выбранных из азота, кислорода или серы.
2. Соединение по п.1, где Т представляет собой N, U представляет собой N, X представляет собой CR3 и Y представляет собой N и образует соединение формулы (Iа)
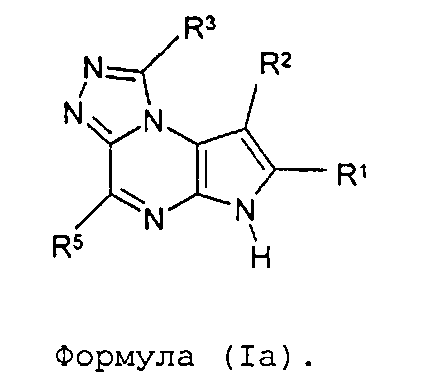
3. Соединение по п.1, где Т представляет собой CR6, U представляет собой N, X представляет собой CR3 и Y представляет собой N и образует соединение формулы (Ib)

4. Соединение по п.1, где Т представляет собой N и U представляет собой CR4, X представляет собой CR3 и Y представляет собой N и образует соединение формулы (Iс)
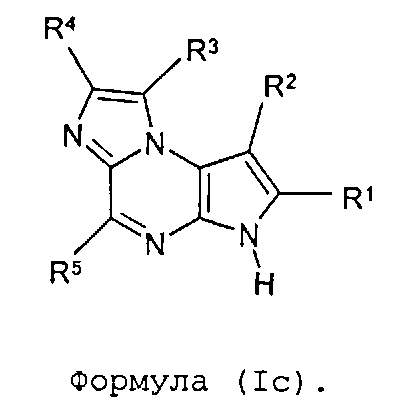
5. Соединение по п.1, где Т представляет собой CR6, U представляет собой CR4, X представляет собой CR3 и Y представляет собой N и образует соединение формулы (Id)

6. Соединение по п.1, где Т представляет собой CR6, U представляет собой N, X представляет собой NR3 и Y представляет собой С и образует соединение формулы (Iе)

7. Соединение по п.1, где Т представляет собой О, U представляет собой N, X представляет собой CR3 и Y представляет собой С и образует соединение формулы (If)
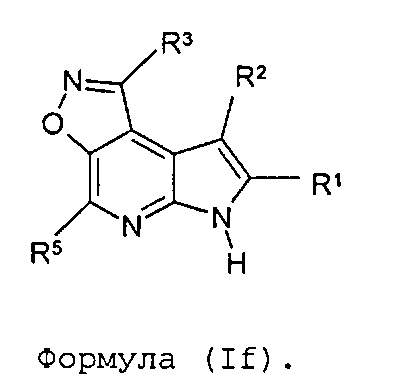
8. Соединение по п.1, где Т представляет собой NR6, U представляет собой N, X представляет собой CR3 и Y представляет собой С и образует соединение формулы (Ig)

9. Соединение по п.1, где R3 представляет собой водород, мостиковый (С7-С10)циклоалкил, который является насыщенной или частично ненасыщенной би- или трициклической структурой; (С1-С6)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной или двумя аминогруппами, -O(С1-С6)алкилом или (C1-С6)алкилом; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -O(С1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (С1-С6)алкилом или гетероарилом.
10. Соединение по п.9, где R3 представляет собой необязательно замещенный циклопропил, необязательно замещенный циклобутил, необязательно замещенный циклопентил, необязательно замещенный циклогексил, необязательно замещенный фенил, необязательно замещенный адамантанил, необязательно замещенный бицикло[2.1.1]гексил, необязательно замещенный бицикло[2.2.1]гептил, необязательно замещенный бицикло[2.2.2]октил, необязательно замещенный бицикло[3.2.1]октил, необязательно замещенный бицикло[3.1.1]гептил, необязательно замещенный пиперидинил, необязательно замещенный пирролидинил или необязательно замещенный тетрагидрофуранил.
11. Соединение по п.1, где R3 представляет собой A-D-E-G и А представляет собой связь или (С1-С6)алкилен.
12. Соединение по п.11, где D представляет собой необязательно замещенный бицикло[2.2.1]гептилен, необязательно замещенный бицикло[2.1.1]гексилен, необязательно замещенный циклобутилен, необязательно замещенный циклопентилен, необязательно замещенный циклогексилен, необязательно замещенный пиперидинил или необязательно замещенный пирролидинил.
13. Соединение по п.12, где Е представляет собой -Re-C(О)-Re-, Re-О-Re-, -Re-S(О)2-Re-, -Re-N(Ra)-Re, -Re-N(Ra)С(О)-Re-, Re-C(О)N(Ra)Re- или -Re-N(Ra)S(О)2-Re-.
14. Соединение по п.13, где G представляет собой ORa, -CN, CF3, -N(Ra)S(О)2Rb, необязательно замещенный (C1-С6)алкил, необязательно замещенный одним CN циклопропил, необязательно замещенный одним CN циклобутил, необязательно замещенный одним CN циклопентил, необязательно замещенный фенил, необязательно замещенный пиридазин, необязательно замещенный пиразин, необязательно замещенный пиримидин, необязательно замещенный пиразол, необязательно замещенный пирролидин, необязательно замещенный хиназолин, необязательно замещенный пиридин, необязательно замещенный тиазолидин или необязательно замещенный триазол.
15. Соединение по п.14, где
А представляет собой связь;
D представляет собой необязательно замещенный циклопентилен или необязательно замещенный пиперидинил;
Е представляет собой -Re-С(О)-Re-, -Re-N(Ra)-Re-, -Re-S(О)2-Re- или -Re-N(Ra)S(О)2-Re-;
где Re в каждом случае независимо представляет собой связь или (С1-С4)алкилен; и
G представляет собой -CN, необязательно замещенный одним CN циклопропил, необязательно замещенный одним CN циклобутил, необязательно замещенный одним CN циклопентил, необязательно замещенный фенил, необязательно замещенный пиразин, необязательно замещенный пиридазин, необязательно замещенный пиразол или необязательно замещенный пиридин.
16. Соединение по п.15, где R1, R2, R4, R5 и R6, если присутствуют, каждый независимо представляет собой водород.
17. Соединение по п.16, где указанное соединение представляет собой соединение формулы (Iа)
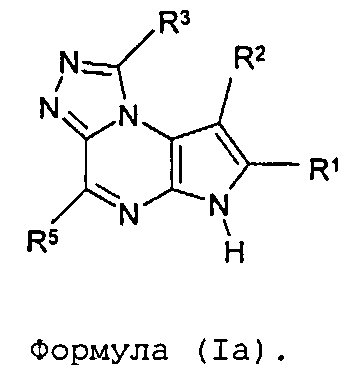
18. Соединение по п.16, где указанное соединение представляет собой соединение формулы (Ib)

19. Соединение по п.16, где указанное соединение представляет собой соединение формулы (Iс)

20. Соединение по п.17, где указанное соединение представляет собой
21. Соединение по п.17, где указанное соединение представляет собой

22. Соединение по п.17, где указанное соединение представляет собой
23. Соединение по п.19, где
А представляет собой связь;
D представляет собой необязательно замещенный циклопентилен или необязательно замещенный пиперидин;
Е представляет собой -Re-N(Ra)-Re-, -Re-С(О)-Re-, -Re-S(O)2-Re- или -Re-N(Ra)S(O)2-Re-; и
G представляет собой -CN, необязательно замещенный фенил, необязательно замещенный пиразин, необязательно замещенный пиридазин, необязательно замещенный пиразол или необязательно замещенный пиридин.
24. Соединение по п.18, где указанное соединение представляет собой
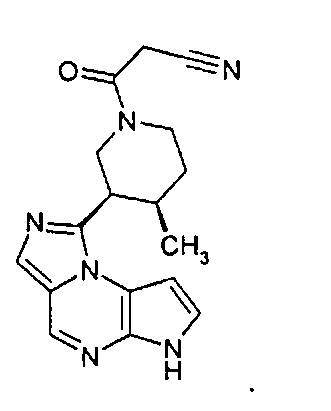
25. Соединение по п.16, где G представляет собой необязательно замещенный фенил, необязательно замещенный пиразин, необязательно замещенный пиразол, необязательно замещенный пиридазин или необязательно замещенный пиридин.
26. Соединение по п.9, где R2 и R5 каждый независимо представляет собой водород.
27. Соединение по п.26, где R1 представляет собой гетероарил, необязательно замещенный 1-2 заместителями, выбранными из (C1-С6)алкила, -О(C1-С6)алкила, (С6)арила, необязательно замещенного -SO2Me.
28. Соединение по п.27, где R1 представляет собой необязательно замещенный азаиндол, необязательно замещенный бензофуран, необязательно замещенный бензотиазол, необязательно замещенный бензоксазол, необязательно замещенный фуран, необязательно замещенный имидазол, необязательно замещенный имидазоксазол, необязательно замещенный имидазопиразин, необязательно замещенный имидазопиридин, необязательно замещенный индазол, необязательно замещенный индол, необязательно замещенный изохинолин, необязательно замещенный изотиазол, необязательно замещенный изоксазол, необязательно замещенный оксадиазол, необязательно замещенный оксазол, необязательно замещенный пиразол, необязательно замещенный пиридин, необязательно замещенный пиримидин, необязательно замещенный пиразолопиридин, необязательно замещенный пиррол, необязательно замещенный хинолин, необязательно замещенный хиназолин, необязательно замещенный тиазол или необязательно замещенный тиофен.
29. Соединение по п.28, где Т представляет собой СН, U представляет собой N, Y представляет собой N и X представляет собой CR3, где R3 представляет собой (C1-С6)алкил, необязательно замещенный одним заместителем, выбранным из (С1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(C1-С6)алкилом или (C1-С6)алкилом; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(С1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (С1-С6)алкилом или гетероарилом.
30. Соединение по п.28, где Т представляет собой СН, U представляет собой N, Y представляет собой С и X представляет собой NR3, где R3 представляет собой (C1-С6)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(С1-С6)алкилом или (C1-С6)алкилом; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(C1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (C1-С6)алкилом или гетероарилом.
31. Соединение по п.28, где Т представляет собой N, U представляет собой N, Y представляет собой N и X представляет собой CR3, где R3 представляет собой (C1-С6)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(C1-С6)алкилом или (С1-С6)алкилом; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(C1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (С1-С6)алкилом или гетероарилом.
32. Применение соединения формулы 2:

для получения соединения формулы (Iа)
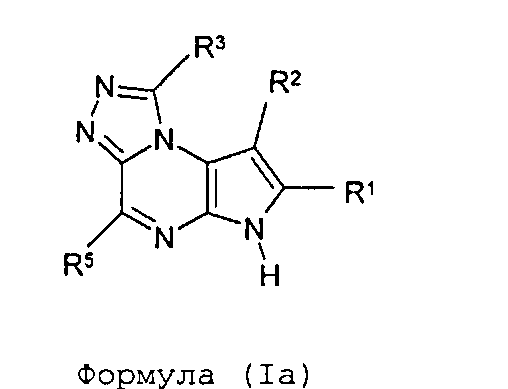
его фармацевтически приемлемых солей, стереоизомеров и изомеров, где
Rp представляет собой -SO2(4-бутилфенил), -SO2(4-метилфенил) или -CH2OCH2CH2Si(СН3)3;
R1, R2 и R5 каждый независимо представляет собой водород, гетероарил, замещенный 1-2 заместителями, выбранными из (С1-С6)алкила, -О(C1-С6)алкила или (С6)арила, необязательно замещенного -SO2Me;
R3 представляет собой водород, мостиковый (С7-С10)циклоалкил, который является насыщенной или частично ненасыщенной би- или трициклической структурой; (С1-C8)алкил, необязательно замещенный одним заместителем, выбранным из (С1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(C1-С6)алкилом или (C1-С6)алкилом; (С6-С8)циклоалкенил, замещенный двумя заместителями, выбранными из (C1-С6)алкила; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(C1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (С1-С6)алкилом или гетероарилом; или
R3 представляет собой -A-D-E-G, где:
А представляет собой связь или (C1-С6)алкилен;
D представляет собой (С1-С2)алкилен, необязательно замещенный одним (C1-С6)алкилом, мостиковый (С6-С10)циклоалкилен, который является насыщенной би- или трициклической структурой, необязательно замещенной одним (C1-С6)алкилом, (С3-С10)циклоалкилен, необязательно замещенный одним или двумя заместителями, выбранными из (C1-С6)алкила или гетероарила, (С4-С6)циклоалкенилен, необязательно замещенный одним (C1-С6)алкилом, (С6)арилен, гетероарилен или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом;
Е представляет собой связь, -Re-, -Re-C(О)-Re-, -Re-C(O)O-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)С(О)-Re- или -ReC(О)N(Ra)Re -;
где во всех случаях E связан или с атомом углерода, или с атомом азота в D;
G представляет собой водород, -N(Ra)(Rb), галоген, -ORa, S(O)2Ra, -CN, -C(O)N(Ra)(Rb), -N(Ra)С(О)Rb, -C(O)Ra, -CF3, N(Ra)S(O)2Rb, -(C1-С6)алкил, необязательно замещенный 1-3 заместителями, выбранными из (C1-С6)алкила, ОН или CN; - (С3-С6)циклоалкил, необязательно замещенный одним CN; -гетероарил, необязательно замещенный одним или двумя галогенами, CN, -C(O)NH2 или -CF3; -гетероциклил, необязательно замещенный 1-5 заместителями, выбранными из оксо, (C1-С6)алкила, галогена или -СН2ОН, -(С6-С10)арил, необязательно замещенный 1-3 заместителями, выбранными из галогена, -NO2, CN, -C(O)NH2, -СОСН3, -OCHF2, (C1-С6)алкила, -N(CH3)2 или -O(C1-С6)алкила;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (С3-С6)гетероциклил, необязательно замещенный одним заместителем, выбранным из галогена, -CF3 или -CН2ОН, где указанный (С3-С6)гетероциклил связан через азот;
Ra и Rb каждый независимо представляет собой водород, (С1-C4)алкил, необязательно замещенный циано, -CF3 или циклопропаном; (С6)арил, необязательно замещенный галогеном или -О(С1-С4)алкилом; и
Re в каждом случае независимо представляет собой связь, (С1-С4)алкилен или (С3)циклоалкилен;
где гетероарил, гетероарилен представляют собой моно- или бициклическую ароматическую кольцевую систему, содержащую 5-10 атомов, включая 1-3 гетероатома, выбранных из азота, кислорода или серы;
гетероциклил, гетероциклилен представляют собой насыщенную моноциклическую кольцевую систему, содержащую 5-6 атомов, включая 1-2 гетероатома, выбранных из азота, кислорода или серы.
33. Применение соединения формулы 3:

для получения соединения формулы (Ib)

его фармацевтически приемлемых солей, стереоизомеров и изомеров, где
Rp представляет собой -SO2(4-метилфенил) или CH2OCH2CH2Si(СН3)3;
R1, R2 и R5 каждый независимо представляет собой водород, гетероарил, замещенный 1-2 заместителями, выбранными из (С1-С6)алкила, -О(C1-С6)алкила или (С6)арила, необязательно замещенного -SO2Me;
R3 представляет собой водород, мостиковый (С7-С10)циклоалкил, который является насыщенной или частично ненасыщенной би- или трициклической структурой; (С1-C8)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(С1-C6)алкилом или (C1-С6)алкилом; (С6-С8)циклоалкенил, замещенный двумя заместителями, выбранными из (C1-С6)алкила; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(C1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (C1-С6)алкилом или гетероарилом; или
R3 представляет собой -A-D-E-G, где:
А представляет собой связь или (C1-С6)алкилен;
D представляет собой (С1-C2)алкилен, необязательно замещенный одним (C1-С6)алкилом, мостиковый (С6-С10)циклоалкилен, который является насыщенной би- или трициклической структурой, необязательно замещенной одним (C1-С6)алкилом, (С3-С10)циклоалкилен, необязательно замещенный одним или двумя заместителями, выбранными из (С1-С6)алкила или гетероарила, (С4-С6)циклоалкенилен, необязательно замещенный одним (C1-С6)алкилом, (С6)арилен, гетероарилен или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом;
Е представляет собой связь, -Re-, -Re-C(О)-Re-, -Re-C(О)O-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)С(О)-Re-, ReC(O)N(Ra)Re-, -Re-N(Ra)C(O)ORe- или -Re-N(Ra)S(O)2-Re-;
где во всех случаях E связан или с атомом углерода, или с атомом азота в D;
G представляет собой водород, -N(Ra)(Rb), галоген, -ORa, S(O)2Ra, -CN, -C(O)N(Ra)(Rb), -N(Ra)С(О)Rb, -C(O)Ra, -CF3, N(Ra)S(O)2Rb, -(C1-С6)алкил, необязательно замещенный 1-3 заместителями, выбранными из (C1-С6)алкила, ОН или CN; -(С3-С6)циклоалкил, необязательно замещенный одним CN; -гетероарил, необязательно замещенный одним или двумя галогенами, CN или -CF3; -гетероциклил, необязательно замещенный 1-5 заместителями, выбранными из оксо, (C1-С6) алкила, галогена или -СН2OН, -(С6-С10)арил, необязательно замещенный 1-3 заместителями, выбранными из галогена, -NO2, CN, -COСН3, -OCHF2, (С1-С6)алкила, -N(CH3)2 или -О(C1-С6)алкила;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (С3-С6)гетероциклил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -CF3 или -CН2OH, где указанный (С3-С6)гетероциклил связан через азот;
R6 представляет собой водород, (С1-C4)алкил, необязательно замещенный -ОН, -СООН; (С3-С8)циклоалкил, фенил, необязательно замещенный -SO2CH3 или -NHSO2CH3, галоген или -J-L-M-Q;
где:
J представляет собой (С2-С6)алкенилен;
L представляет собой связь;
М представляет собой связь;
Q представляет собой -C(O)ORa;
Ra и Rb каждый независимо представляет собой водород, (С1-С4)алкил, необязательно замещенный циано, -CF3 или циклопропаном; (С6)арил, необязательно замещенный галогеном или -O(C1-С4) алкилом; и
Re в каждом случае независимо представляет собой связь, (С1-С4)алкилен или (С3)циклоалкилен;
где гетероарил, гетероарилен представляют собой моно- или бициклическую ароматическую кольцевую систему, содержащую 5-10 атомов, включая 1-3 гетероатома, выбранных из азота, кислорода или серы;
гетероциклил, гетероциклилен представляют собой насыщенную моноциклическую кольцевую систему, содержащую 5-6 атомов, включая 1-2 гетероатома, выбранных из азота, кислорода или серы.
34. Применение соединения формулы 4:

для получения соединения формулы (Iс)

его фармацевтически приемлемых солей, стереоизомеров и изомеров, где
Rp1 представляет собой -SO2(4-метилфенил);
Rp2 представляет собой водород или -С(О)O-С(СН3)3;
R1, R2 и R5 каждый независимо представляет собой водород, гетероарил, необязательно замещенный 1-2 заместителями, выбранными из (C1-С6)алкила, -О(C1-С6) алкила или (С6)арила, необязательно замещенного -SO2Me;
R3 представляет собой водород, мостиковый (С7-С10)циклоалкил, который является насыщенной или частично ненасыщенной би- или трициклической структурой; (С1-C8)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(С1-С6)алкилом или (C1-С6)алкилом; (С6-С8)циклоалкенил, замещенный двумя заместителями, выбранными из (C1-С6)алкила; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(C1-С6) алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (C1-С6)алкилом или гетероарилом; или
R3 представляет собой -A-D-E-G, где:
А представляет собой связь, (C1-С6)алкилен;
D представляет собой (С1-C2)алкилен, необязательно замещенный одним (C1-С6)алкилом, мостиковый (С6-С10)циклоалкилен, который является насыщенной би- или трициклической структурой, необязательно замещенной одним (C1-С6)алкилом, (С3-С10)циклоалкилен, необязательно замещенный одним или двумя заместителями, выбранными из (C1-С6)алкила или гетероарила, (С4-С6)циклоалкенилен, необязательно замещенный одним (C1-С6)алкилом, (С6)арилен, гетероарилен или гетероциклилен, необязательно замещенный одним (C1-C6)алкилом;
Е представляет собой связь, -Re-, -Re-C(О)-Re-, -Re-C(О)O-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)С(О)-Re-, -ReC(O)N(Ra)Re-, -Re-N(Ra)С(О)ORe- или -Re-N(Ra)S(О)2-Re-;
где во всех случаях E связан или с атомом углерода, или с атомом азота в D;
G представляет собой водород, -N(Ra)(Rb), -ORa, -S(O)2Ra, -CN, -C(O)N(Ra)(Rb), -N(Ra)C(O)Rb, -C(O)Ra, -CF3, -N(Ra)S(O)2Rb, -(C1-С6)алкил, необязательно замещенный 1-3 заместителями, выбранными из (C1-С6)алкила, ОН или CN; -(С3-С6)циклоалкил, необязательно замещенный одним CN; -гетероарил, необязательно замещенный одним или двумя галогенами, CN или -CF3; гетероциклил, необязательно замещенный 1-5 заместителями, выбранными из оксо, (C1-С6)алкила, -(С6-С10)арил, необязательно замещенный 1-3 заместителями, выбранными из галогена, -NO2, CN, -СОСН3, -OCHF2, (С1-C6)алкила, -N(CH3)2 или -О(C1-С6)алкила;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (С3-С6)гетероциклил, необязательно замещенный одним заместителем, выбранным из галогена, -CF3 или -СН2ОН, где указанный (С3-С6)гетероциклил связан через азот;
R4 представляет собой водород, (С1-С4)алкил, необязательно замещенный -ОН, -СООН; (С3-С8)циклоалкил, фенил, необязательно замещенный -SO2CH3 или -NHSO2CH3, галоген или -J-L-M-Q;
где:
J представляет собой (С2-С6)алкенилен;
L представляет собой связь;
М представляет собой связь;
Q представляет собой -C(O)ORa;
Ra и Rb каждый независимо представляет собой водород, (С1-С4)алкил, необязательно замещенный циано, -CF3 или циклопропаном; (С6)арил, необязательно замещенный галогеном или -O(С1-С4) алкилом; и
Re в каждом случае независимо представляет собой связь, (С1-С4)алкилен или (С3)циклоалкилен;
где гетероциклил, гетероциклилен представляют собой моно- или бициклическую ароматическую кольцевую систему, содержащую 5-10 атомов, включая 1-3 гетероатома, выбранных из азота, кислорода или серы;
гетероциклил, гетероциклилен представляют собой насыщенную моноциклическую кольцевую систему, содержащую 5-6 атомов, включая 1-2 гетероатома, выбранных из азота, кислорода или серы.
35. Применение соединения формулы 5

для получения соединения формулы (Id)
его фармацевтически приемлемых солей, стереоизомеров и изомеров, где
Rp представляет собой -SO2(4-метилфенил);
R1, R2 и R5 каждый независимо представляет собой водород, гетероарил, замещенный 1-2 заместителями, выбранными из (С1-С6)алкила, О(С1-С6)алкила или (С6)арила, необязательно замещенного -SO2Me;
R3 представляет собой водород, мостиковый (С7-С10)циклоалкил, который является насыщенной или частично ненасыщенной би- или трициклической структурой; (С1-C8)алкил, необязательно замещенный одним заместителем, выбранным из (С1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(C1-С6) алкилом или (C1-С6)алкилом; (С6-С8)циклоалкенил, замещенный двумя заместителями, выбранными из (C1-С6)алкила; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(C1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (С1-C6)алкилом; гетероциклил, необязательно замещенный одним (C1-С6)алкилом или гетероарилом; или
R3 представляет собой -A-D-E-G, где:
А представляет собой связь или (С1-С6)алкилен;
D представляет собой (С1-C2)алкилен, необязательно замещенный одним (C1-С6)алкилом, мостиковый (С6-С10)циклоалкилен, который является насыщенной би- или трициклической структурой, необязательно замещенной одним (C1-С6)алкилом, (С3-С10)циклоалкилен, необязательно замещенный одним или двумя заместителями, выбранными из (C1-C6)алкила или гетероарила, (С4-С6)циклоалкенилен, необязательно замещенный одним (C1-С6)алкилом, (С6)арилен, гетероарилен или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом;
Е представляет собой связь, -Re-, -Re-C(О)-Re-, -Re-C(О)O-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)С(О)-Re-, -Re-C(O)N(Ra)Re-, -Re-N(Ra)C(O)ORe- или -Re-N(Ra)S(О)2-Re-;
где во всех случаях Е связан или с атомом углерода, или с атомом азота в D;
G представляет собой водород, -N(Ra)(Rb), галоген, -ORa, S(O)2Ra, -CN, -C(O)N(Ra)(Rb), -N(Ra)С(О)Rb, -C(O)Ra, -CF3, N(Ra)S(O)2Rb, -(C1-С6)алкил, необязательно замещенный 1-3 заместителями, выбранными из (C1-С6)алкила, ОН или CN; -(С3-С6)циклоалкил, необязательно замещенный одним CN; -гетероарил, необязательно замещенный одним или двумя галогенами, CN, -C(O)NH2 или -CF3; -гетероциклил, необязательно замещенный 1-5 заместителями, выбранными из оксо, (C1-С6)алкила, -(С6-С10)арил, необязательно замещенный 1-3 заместителями, выбранными из галогена, -NO2, CN, -СOСН3, -OCHF2, (C1-С6)алкила, -N(CH3)2 или -О(C1-С6)алкила;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (С3-С6)гетероциклил, необязательно замещенный одним заместителем, выбранным из галогена, -CF3 или -СН2OH, где указанный (С3-С6)гетероциклил связан через азот;
R4 и R6 каждый независимо представляет собой водород, (С1-С4)алкил, необязательно замещенный -ОН, -СOOН; (С3-С8)циклоалкил, фенил, необязательно замещенный -SO2CH3 или -NHSO2CH3, галоген или -J-L-M-Q;
где:
J представляет собой -(С2-С6)алкенилен;
L представляет собой связь;
М представляет собой связь;
Q представляет собой -C(O)ORa;
Ra и Rb каждый независимо представляет собой водород, (С1-С4)алкил, необязательно замещенный циано, -CF3 или циклопропаном; (С6)арил, необязательно замещенный галогеном или -O(С1-С4) алкилом; и
Re в каждом случае независимо представляет собой связь, (С1-С4)алкилен или (С3)циклоалкилен;
где гетероарил, гетероарилен представляют собой моно- или бициклическую ароматическую кольцевую систему, содержащую 5-10 атомов, включая 1-3 гетероатома, выбранных из азота, кислорода или серы;
гетероциклил, гетероциклилен представляют собой насыщенную моноциклическую кольцевую систему, содержащую 5-6 атомов, включая 1-2 гетероатома, выбранных из азота, кислорода или серы.
36. Применение соединения формулы 6

для получения соединение формулы (Ig) или формулы (If)
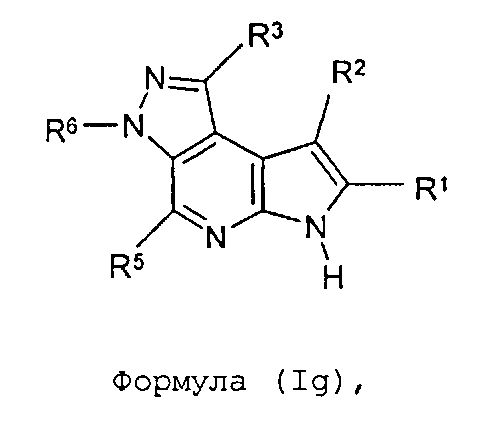
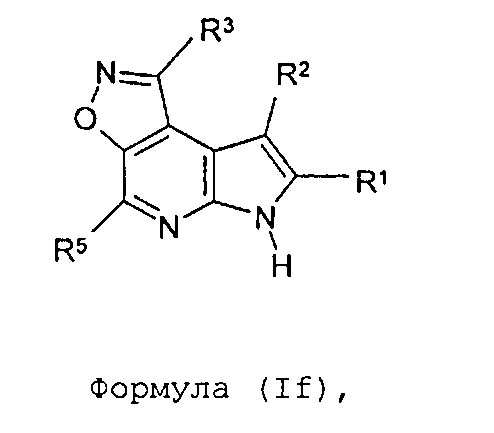
их фармацевтически приемлемых солей, стереоизомеров и изомеров, где
Rp представляет собой водород или -Si(СН(СН3)2)3;
Rx представляет собой водород, фтор, хлор, бром, йод;
R1, R2 и R5 каждый независимо представляет собой водород, гетероарил, замещенный 1-2 заместителями, выбранными из (С1-С6)алкила, -О(C1-С6)алкила или (С6)арила, необязательно замещенного -SO2Me;
R3 представляет собой водород, мостиковый (С7-С10)циклоалкил, который является насыщенной или частично ненасыщенной би- или трициклической структурой; (С1-C8)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(C1-С6)алкилом или (C1-С6)алкилом; (С6-С8)циклоалкенил, замещенный двумя заместителями, выбранными из (C1-С6)алкила; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(C1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (C1-С6)алкилом или гетероарилом; или
R3 представляет собой -A-D-E-G, где:
А представляет собой связь или (C1-С6)алкилен;
D представляет собой (С1-C2)алкилен, необязательно замещенный одним (C1-С6)алкилом, мостиковый (С6-С10)циклоалкилен, который является насыщенной би- или трициклической структурой, необязательно замещенной одним (C1-С6)алкилом, (С3-С10)циклоалкилен, необязательно замещенный одним или двумя заместителями, выбранными из (C1-С6)алкила или гетероарила, (С4-С6)циклоалкенилен, необязательно замещенный одним (C1-С6)алкилом, (С6)арилен, гетероарилен или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом;
Е представляет собой связь, -Re-, -Re-C(О)-Re-, -Re-C(О)O-Re-, -Re-O-Re-, -Re-S(O)2-Re-, -Re-N(Ra)-Re-, -Re-N(Ra)С(O)-Re-, -Re-C(O)N(Ra)Re-, -Re-N(Ra)C(O)ORe- или -Re-N(Ra)S(O)2-Re-;
где во всех случаях E связан или с атомом углерода, или с атомом азота в D;
G представляет собой водород, -N(Ra)(Rb), галоген, -ORa, S(O)2Ra, -CN, -C(O)N(Ra)(Rb), -N(Ra)С(О)Rb, -C(O)Ra, -CF3, N(Ra)S(O)2Rb, -(C1-С6)алкил, необязательно замещенный 1-3 заместителями, выбранными из (C1-С6)алкила, ОН или CN; -(С3-С6)циклоалкил, необязательно замещенный одним CN; -гетероарил, необязательно замещенный одним или двумя галогенами, CN или -CF3; -гетероциклил, необязательно замещенный 1-5 заместителями, выбранными из оксо, (C1-С6)алкила, -(С6-С10)арил, необязательно замещенный 1-3 заместителями, выбранными из галогена, -NO2, CN, -C(O)NH2, -СОСН3, -OCHF2, (C1-С6)алкила, -N(CH3)2 или -O(C1-C6)алкила;
где во фрагменте, содержащем -N(Ra)(Rb), азот, Ra и Rb могут образовывать кольцо так, что -N(Ra)(Rb) представляет собой необязательно замещенный (С3-С6)гетероциклил, необязательно замещенный одним заместителем, выбранным из галогена, -CF3 или -СН2ОН, где указанный (С3-С6)гетероциклил связан через азот;
R6 представляет собой водород, (С1-C4)алкил, необязательно замещенный -ОН, -СООН; (С3-С8)циклоалкил, фенил, необязательно замещенный -SO2CH3 или -NHSO2CH3, галоген или -J-L-M-Q;
где:
J представляет собой (С2-С6)алкенилен;
L представляет собой связь;
М представляет собой связь;
Q представляет собой -C(O)ORa;
Ra и Rb каждый независимо представляет собой водород, (С1-С4)алкил, необязательно замещенный циано, -CF3 или циклопропаном; (С6)арил, необязательно замещенный галогеном или -O(С1-С4) алкилом; и
Re в каждом случае независимо представляет собой связь, (С1-С4)алкилен или (С3)циклоалкилен;
где гетероарил, гетероарилен представляют собой моно- или бициклическую ароматическую кольцевую систему, содержащую 5-10 атомов, включая 1-3 гетероатома, выбранных из азота, кислорода или серы;
гетероциклил, гетероциклилен представляют собой насыщенную моноциклическую кольцевую систему, содержащую 5-6 атомов, включая 1-2 гетероатома, выбранных из азота, кислорода или серы.
37. Фармацевтическая композиция для лечения заболеваний или нарушений, связанных с аномальной или разрегулированной активностью Jak1, Jak3 или Syk киназы, включающая терапевтически эффективное количество соединения

фармацевтически приемлемый носитель и эксципиент.
38. Соединение по п.2, где
R3 представляет собой (С1-C8)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6) алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(C1-С6)алкилом или (C1-С6)алкилом; гетероциклил, необязательно замещенный одним (C1-С6)алкилом или гетероарилом; или
R3 представляет собой -A-D-E-G, где:
А представляет собой связь;
D представляет собой (С3-С10)циклоалкилен, необязательно замещенный одним (C1-С6)алкилом или гетероарилом, мостиковый (С6-С10)циклоалкилен, который является насыщенной би- или трициклической структурой, необязательно замещенной одним (С1-С6)алкилом, или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом;
Е представляет собой -Re-N(Ra)C(О)O-Re-, -Re-N(Ra)S(О)2-Re-, -Re-N(Ra)C(O)-Re-, -Re-C(O)-Re-, -Re-N(Ra)-Re- или -Re-S(O)2-Re-;
где Re представляет собой независимо связь, (С1-C4)алкилен или (С3)циклоалкилен;
G представляет собой водород, -CN, -(C1-С6)алкил, необязательно замещенный 1-3 заместителями, выбранными из (С1-С6)алкила, ОН или CN; -(С3-С6)циклоалкил, необязательно замещенный одним CN; -гетероарил, необязательно замещенный одним или двумя галогенами, CN, -C(O)NH2 или -CF3; -гетероциклил, необязательно замещенный 1-5 заместителями, выбранными из оксо или (С1-С6) алкила; -(С6-С10)арил, необязательно замещенный 1-3 заместителями, выбранными из галогена;
R1 представляет собой водород;
R2 представляет собой водород; и
R5 представляет собой водород.
39. Соединение по п.38, где соединением является 1-(2-метилциклогексил)-6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин;
гидрохлорид цис-4-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклогексанамина;
цис-4-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклогексанамин;
трет-бутил(1S,3R)-3-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентилкарбамат;
N-(4-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)-3-хлорбензолсульфонамид;
N-(((1R,3R)-3-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-a]пиразин-1-ил)циклопентил)метил)-1-цианоциклопропанкарбоксамид;
1-(тетрагидро-2Н-пиран-4-ил)-6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин;
N-((1S,3R,4R)-3-этил-4-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентил)циклобутансульфонамид;
N-((1R,3S,4S)-3-этил-4-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентил)циклобутансульфонамид;
гидрохлорид (R)-1-(пиперидин-3-ил)-6Н-пирроло[2,3-е] [1,2,4]триазоло[4,3-а]пиразина;
1-(пиперидин-4-ил)-6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин;
N-(цис-4-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклогексил)-2-цианоацетамид;
(R)-3-(3-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)пиперидин-1-ил)-3-оксопропаннитрил;
N-((1R,3R)-3-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентил)пирролидин-1-карбоксамид;
N-((1S,3R)-3-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентил)циклопропансульфонамид;
6-((1S,3R)-3-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентиламино)никотинонитрил;
3-(4-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)пиперидин-1-ил)-3-оксопропаннитрил;
N-(цис-3-метил-4-(6H-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентил)циклобутансульфонамид;
1-(1-циклопропилсульфонил)пиперидин-4-ил)-6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин;
N-((1S,3R)-3-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентил)-N-метилциклопропансульфонамид;
N-((1S,3R)-3-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентил)тиофен-2-сульфонамид;
1-циклогексил-6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин;
5-((1S,3R,4S)-3-этил-4-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил; или
5-((1R,3S,4R)-3-этил-4-(6Н-пирроло[2,3-е][1,2,4]триазоло[4,3-а]пиразин-1-ил)циклопентиламино)пиразин-2-карбонитрил.
40. Соединение по п.3, где
R1 представляет собой водород или гетероарил, замещенный 1-2 заместителями, выбранными из (C1-С6)алкила или О(C1-С6)алкила;
R2 представляет собой водород;
R3 представляет собой водород, (С1-C8)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6)алкила или аминогруппы; (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(C1-С6)алкилом или (C1-С6)алкилом; (С6)арил, необязательно замещенный одним или двумя заместителями, выбранными из галогена, -О(C1-С6)алкила, (C1-С6)алкила, -OCF3 или -CF3; гетероарил, необязательно замещенный одним (C1-С6)алкилом; или
R3 представляет собой -A-D-E-G, где А представляет собой связь;
D представляет собой (С1-С2)алкилен, необязательно замещенный одним (C1-С6)алкилом, мостиковый (С6-С10)циклоалкилен, который является насыщенной би- или трициклической структурой, необязательно замещенной одним (C1-С6)алкилом, или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом;
Е представляет собой -Re-С(О)-Re-, -Re-N(Ra)S(О)2-Re-, -Re-N(Ra)С(O)-Re- или -Re-C(O)-Re,
где Re независимо представляет собой связь, (С1-C4)алкилен или (С3)циклоалкилен;
G представляет собой водород, CN или -(С3-С6)циклоалкил, необязательно замещенный 1 CN; и
R5 представляет собой водород.
41. Соединение, выбранное из:
3-((3R,4R)-3-(6Н-имидазо[1,5-а]пирроло[2,3-е]пиразин-1-ил)метилпиперидин-1-ил)-3-оксопропаннитрила;
7-(5-метокси-1-метил-1Н-индол-3-ил)-1-метил-6Н-имидазо[1,5-а]пирроло[2,3-е]пиразина;
7-(5-метокси-1-метил-1Н-индол-3-ил)-6Н-имидазо[1,5-а]пирроло[2,3-е]пиразина;
7-(5-метокси-1-метил-1Н-индол-3-ил)-1-фенил-6Н-имидазо[1,5-а]пирроло[2,3-е]пиразина;
1-циклогексил-6Н-имидазо[1,5-a]пирроло[2,3,e]пиразина;
N-(4-(6Н-имидазо[1,5-а]пирроло[2,3-е]пиразин-1-ил)бицикло[2.2.2]октан-1-ил)циклопропансульфонамида;
(R)-1-(3-(6Н-имидазо[1,5-а]пирроло[2,3-е]пиразин-1-ил)пиперидин-1-карбонил)циклопропанкарбонитрила;
N-(2-(6Н-имидазо[1,5-а]пирроло[2,3-е]пиразин-1-ил)этил)-1-цианоциклопропанкарбоксамида; или
N-((1R,3R,4S)-3-(6Н-имидазо[1,5-а]пирроло[2,3-е]пиразин-1-ил)-4-метилциклопентил) циклопропансульфонамида
или их фармацевтически приемлемых солей, стереоизомеров и изомеров.
42. Соединение по п.4, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой водород или -A-D-E-G, где
А представляет собой связь;
D представляет собой (С3-С10)циклоалкилен, необязательно замещенный одним гетероарилом, или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом;
Е представляет собой -Re- или -Re-C(О)-Re-;
где Re независимо представляет собой связь, (С1-C4)алкилен или (С3)циклоалкилен; и
G представляет собой водород, CN или -(С1-С6)алкил, необязательно замещенный 1-3 заместителями, выбранными из (С1-С6)алкила, ОН или CN.
43. Соединение, выбранное из:
7-циклогексил-3Н-имидазо[1,2-а]пирроло[2,3-е]пиразина;
8-циклогексил-3Н-имидазо[1,2-а]пирроло[2, 3-е]пиразина;
(R)-1-(3-(3Н-имидазо[1,2-а]пирроло[2,3-е]пиразин-8-ил)пиперидин-1-карбонил)циклопропанкарбонитрила;
3-((3S,4S)-3-(3Н-имидазо[1,2-а]пирроло[2,3-е]пиразин-8-ил)-4-метилпиперидин-1-ил)-3-оксопропаннитрила; или
3-((3R,4R)-3-(3Н-имидазо[1,2-а]пирроло[2,3-е]пиразин-8-ил)-4-метилпиперидин-1-ил)-3-оксопропаннитрила
или их фармацевтически приемлемых солей, стереоизомеров и изомеров.
44. Соединение по п.6, где
R1 представляет собой водород, (С6)арил, необязательно замещенный -SO2Me; или гетероарил, замещенный 1-2 заместителями, выбранными из (C1-С6)алкила, О(C1-С6)алкила;
R2 представляет собой водород;
R3 представляет собой (С1-C8)алкил, необязательно замещенный одним заместителем, выбранным из (C1-С6)алкила или аминогруппы; или (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(C1-С6)алкилом или (C1-С6)алкилом;
R5 представляет собой водород; и
R6 представляет собой водород.
45. Соединение по п.44, где соединением является
1-метил-7-(3-(метилсульфонил)фенил)-1,6-дигидропиразоло[3,4-d]пирроло[2,3-b]пиридин;
7-(5-метокси-1-метил-1Н-индол-3-ил)-1-метил)-1,6-дигидропиразоло[3,4-d]пирроло[2,3-b]пиридин; или
1-метил-7-(1-метил-1Н-пиразол-4-ил)-1,6-дигидропиразоло[3,4-d]пирроло[2,3-b]пиридин.
46. Соединение по п.8, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой (С3-С10)циклоалкил, необязательно замещенный одной аминогруппой, -О(C1-С6)алкилом или (С1-С6)алкилом; или
R3 представляет собой -A-D-E-G, где
А представляет собой связь;
D представляет собой (С3-С10)циклоалкилен, необязательно замещенный одним гетероарилом, или гетероциклилен, необязательно замещенный одним (C1-С6)алкилом;
Е представляет собой -Re-, -Re-N(Ra)-Re-, -Re-S(О)2-Re- или -Re-N(Ra)С(O)-Re-;
где Re независимо представляет собой связь или (С1-С4)алкилен;
G представляет собой CF3, CN, -(C1-С6)алкил, необязательно замещенный 1-3 заместителями, выбранными из (C1-C6)алкила, ОН или CN; -(С6-С10)арил, необязательно замещенный 1-3 заместителями, выбранными из галогена, -NO2, CN, -COСН3, -OCHF2, (C1-С6)алкила, -N(CH3)2 или -О(C1-С6)алкила; -(С3-С6)циклоалкил, необязательно замещенный одним CN; или -гетероарил, необязательно замещенный одним или двумя галогенами, CN, -С(O)NH2 или -CF3;
R5 представляет собой Н; и
R6 представляет собой Н или (С1-C4)алкил, необязательно замещенный -ОН, -СOOН.
47. Соединение по п.46, где соединением является
1-циклогексил-3,6-дигидропиразоло[4,3-d]пирроло[2,3-d]пиридин;
1-(1-бензилпиперидин-4-ил)-3,6-дигидропиразоло[4,3-d]пирроло[2,3-b]пиридин;
1-(1-(циклопропилсульфонил)пиперидин-4-ил)-3,6-дигидропиразоло[4,3-d]пирроло[2,3-b]пиридин;
1-(1-(циклопропилсульфонил)пиперидин-3-ил)-3,6-дигидропиразоло[4,3-d]пирроло[2,3-b]пиридин;
1-циклобутил-3,6-дигидропиразоло[4,3-d]пирроло[2,3-b]пиридин;
1-(тетрагидро-2Н-пиран-4-ил)-3,6-дигидропиразоло[4,3-d]пирроло[2,3-b]пиридин;
1-(тетрагидро-2Н-пиран-3-ил)-3,6-дигидропиразоло[4,3-d]пирроло[2,3-b]пиридин;
6-((1S,3S)-3-(3,6-дигидропиразоло[4,3-d]пирроло[2,3-b]пиридин-1-ил)циклопентиламино)никотинонитрил; или
6-((1S,3R)-3-(3,6-дигидропиразоло[4,3-d]пирроло[2,3-b]пиридин-1-ил)циклопентиламино)никотинонитрил.
48. Применение соединения по любому из пп.1-31 и 38-47 или его фармацевтически приемлемой соли, стереоизомера или изомера при получении лекарственного средства для лечения состояния, опосредованного активностью Jak1, Jak3 или Syk протеинкиназы.
49. Применение по п.48, где протеинкиназа представляет собой Jak1 киназу.
50. Применение по п.48 или 49, где состояние выбрано из: ревматоидного артрита, псориаза и болезни Крона.
51. Применение по п.48 или 49, где состояние выбрано из: аутоиммунного заболевания; астмы; атопического дерматита; системной красной волчанки (SLE); рассеянного склероза (MS); рака, такого как рак предстательной железы, толстой кишки, яичников и рак молочной железы, меланома, лейкемия и другие гематопоэтические злокачественные опухоли; классических миелопролиферативных нарушений (MPD); воспаления; воспалительных заболеваний кишечника.
| US 4053474 A1, 11.10.1977 | |||
| WO 2006107771 A2, 12.10.2006 | |||
| WO 2006002051 A1, 05.01.2006 | |||
| Способ изготовления тел накаливания | 1924 |
|
SU7415A1 |
| СПОСОБЫ ИНГИБИРОВАНИЯ ТИРОЗИНКИНАЗЫ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА, АЗОТСОДЕРЖАЩИЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ВВЕДЕНИЯ ИНГИБИТОРА ТИРОЗИНКИНАЗЫ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА, НАПРИМЕР, ERB-B2, ERB-B3 ИЛИ ERB-B4, И ПРОТИВОЗАЧАТОЧНАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2158127C2 |
Авторы
Даты
2015-03-27—Публикация
2009-06-09—Подача