Приоритетный документ
Настоящая заявка заявляет приоритет перед патентной заявкой США №61/254229 и Патентной заявкой Великобритании №0918616.4, поданными 23 октября 2009 г, и раскрываемые сведения которых указаны в настоящем документе во всей их полноте.
Область техники
Настоящее раскрытие относится в способу получения фторированных карбоновых кислот и их солей.
Предпосылки изобретения
Фторированные карбоновые кислоты используются в качестве синтетических промежуточных продуктов при получении промышленных и специальных химических веществ, а также в качестве эмульгаторов или дисперсантов при производстве полимеров (напр., для полимеризации фторированных мономеров). В прошлом, перфорированные низкомолекулярные карбоновые кислоты с общей формулой CF3-(CF2)n-СОО-М+, где М+ является катионом, а n является целым числом от 4 до 8, использовались для полимеризации фторированных мономеров. Тем не менее, по разным причинам, интерес стали представлять альтернативные фторированные эмульгаторы. В качестве альтернативных эмульгаторов были предложены фторированные полиэфирные карбоновые кислоты и, частично, фторированные карбоновые кислоты. В частности, фторированные карбоновые кислоты, описанные в публикации США №2007/0015865 (Hintzer и др.) и патенте США №7671112 (Hintzer и др.). Например, полезными альтернативами были признаны высокофторированные фторалкоксильные карбоновые кислоты с общей формулой [Rf-O-L-COO-]iXi +, где L представляет линейную частично или полностью фторированную алкиленовую группу или алифатическую углеводородную группу, Rf представляет линейную частично или полностью фторированную алифатическую группу, нарушенную одним или несколькими атомами кислорода, Xi + является катионом, имеющим валентность 1, а 1 равно 1, 2 или 3 (как описано в патенте США №7671112).
Для получения фторированных карбоновых кислот были описаны различные способы. Например, патент США №7589234 (Morita и др.) описывает процесс, основанные на реакции раскрытия цикла тетрафторокситанов для создания фторангидридов, которые далее преобразуются в карбоновые кислоты. Однако, данный процесс является трудоемким, и включает в себя различные этапы реакции. Дополнительные способы описывают получение фторированных карбоновых кислот из соответствующих фторированных спиртов. Такие способы включают в себя использование сильных окислителей, как описано в патенте США №7671112 (Hintzer и др.), и включают в себя, например, перманганат калия (Dmowski и др., J. Fluor. Chem., 1990, т.48, 77-84), двухромовокислый калий/серную кислоту (Hudlicky и др., J. Fluor. Chem., 1992, т.59, 9-14), пиридиний бихромат, оксид (VI) хрома с серной кислотой, RuO4 или OsCM, и азотную кислоту, а также некоторые менее известные способы, такой как облучение в присутстви газообразного хлора. Несмотря на то, что данные реакции могут производиться в промышленном масштабе с хорошим выходом, широкое применение этих способы нежелательно в силу проблем с, среди всего прочего, утилизацией тяжелых металлов, низкими объемами получаемой продукции, высокими температурами и использованием дорогих реагентов. Таким образом, имеется потребность в альтернативном процессе получения фторированных карбоновых кислот.
Сущность изобретения
В некоторых примерах, для получения фторированных карбоновых кислот желательно иметь альтернативный процесс окисления, который будет недорогим, эффективным и имеющим легкодоступное исходное сырье, делающим его применимым в промышленном масштабе.
С одной стороны, способ получения фторированных карбоновых кислот и их солей описывается обработкой фторсодержащих спиртов с общей формулой (A):
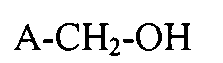
с помощью, как минимум, одного первого и, как минимум, одного второго окислителей для получения высокофторированной карбоновой кислоты или их солей с общей формулой (B):
A-COOM-M+, где M+ является катионом, и где «A» в формулах (A) и (B) является одинаковым фрагментом, и представляющим остаток:

где Rf является фторированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, p, m и n являются независимыми друг от друга эфирами 1 или 0; X, X′, X′′, Y, Y′ и Y′′ являются независимыми друг от друга прочими H, F, CF3, или C2F5, при условии, что не все X, X, X′′, Y, Y′ и Y′′ являются H; или A является остатком:
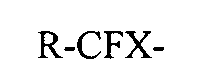
где X и R являются независимо выбранными из водорода, галогена или остатков алкила, алкенила, циклоалкила или арила, которые могут содержать, а могут не содержать один или несколько атомов фтора, и которые могут иметь, а могут и не иметь один или несколько катенарных атомов кислорода, где указанный, как минимум один, первый окислитель является соединением, которое может быть преобразовано действием второго окислителя в активные частицы, способные окислить фторированный спирт.
В одном примере фторированный спирт, как минимум, один первый окислитель и как минимум, один второй окислитель реагируют в смеси, в значительной степени свободной от органического растворителя.
В одном примере как минимум 60% от фторированного спирта преобразуется во фторированную карбоновую кислоту или их соли.
С другой стороны, способ получения фторированных карбоновых кислот и их солей описывается обработкой фторсодержащих спиртов с общей формулой (A):
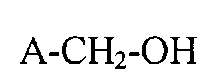
в электрический ток в электрохимическом элементе для получения высокофторированной карбоновой кислоты или их солей с общей формулой (B):
A-COO-M+, где M+ является катионом и где A в формулах (A) и (B) является одинаковым фрагментом, представляющим остаток:
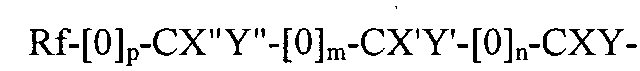
где Rf является фторированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, p, m и n являются независимыми друг от друга эфирами 1 или 0; X, X', X'', Y, Y' и Y'' являются независимыми друг от друга прочими Н, F, CF3, или C2F6, при условии, что не все X, X, X'', Y, Y' и Y'' являются Н.
Приведенные выше сводные данные не ставят целью описать каждый пример. Подробности одного или нескольких примеров изобретения также приведены в данном ниже описании. Прочие свойства, объекты и преимущества будут ясно приведены в описании и заявках.
Подробное описание
Перед подробным описанием любых примеров из настоящего раскрытия, следует понять, что область применения раскрытия не ограничивается приведенными далее, в последующем описании, подробностями структуры и расположением компонентов. Изобретение применимо и в других вариантах, при воплощении или использовании в различными способами. Также следует понять, что фразы и темины, использованные далее, используются в описательных целях, и не должны считаться исчерпывающими. В противоложность использованию слова «состоящее из», использование слов «включающее», «содержащее», «состоящее» или «имеющее» или их форм, применяется для охвата предметов, перечисленных впоследствии (и их эквивалентов), а также дополнительных предметов. Использование неопределенных артиклей применяется для обозначения понятия «один или несколько». Любой числовой диапазон, указанный в настоящем документе, предназначен для включения всех значений, от нижней до верхней границы диапазона. Например, диапазон концентрации от 1 до 50% должен считаться сокращением, и недвусмысленно раскрывать все значения между 1 и 50%, например, 2%, 40%, 10%, 30%, 1,5%, 3,9% и так далее. Использование сочетания «и/или» означает, один или все перечисленные элементы или комбинацию любых двух или более элементов.
При использовании в данном документе термин:
«перфорированный» означает, что все атомы водорода соответствующего остатка замещены атомами фтора. Например, термин «перфторметил» обозначает F3C-группу;
«частично фторированный» означает, что как минимум один, но не все атомы водорода соответствующего остатка замещены атомами фтора. Например, группа -CFH2 или группа -CF2H являются примерами частично фторированного метилового остатка;
«N-оксильные группы» являются группами, в которых кислородный радикал связан с атомом азота. Как правило, атом азота N-оксильной группы связан с одним или двумя атомами органического остатка;
«Р-оксильные группы» являются группами, в которых кислородный радикал связан с атомом фосфора. Как правило, атом фосфора Р-оксильной группы связан с одним или двумя атомами органического остатка;
«оксоаммониевые группы» являются группами, в которых атом кислорода связан с атомом азота, и этот атом азота связан с одним или двумя атомами органического остатка таким образом, что азот имеет положительный заряд;
«оксофосфонитовые группы» являются группами, в которых атом кислорода связан с атомом фосфора, и этот атом фосфора связан с одним или двумя атомами органического остатка таким образом, что фосфор имеет положительный заряд;
«органическое» означает, что соединение имеет и атом углерода и атом водорода, а «неорганическое» означет, что соединение не имеет и атома углерода и атома водорода, но это соединение может иметь атомы углерода или атомы водорода.
Настоящее раскрытие связано с окислением первичных фторированных спиртов до соответствующих фторированных карбоновых кислот или их солей.
Фторированные спирты
Фторированные спирты, подходящие для реакций окисления, описанных в настоящем документе, являются первичными спиртами, такими, как имеющими общую формулу (А):
 ,
,
где А является остатком:
 ; или
; или
 .
.
В формуле A1, Rf является линейным или разветвленным фторированным или перфорированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, р, m и n являются независимыми друг от друга эфирами 1 или 0; X, X', X'', Y, Y' и Y'' являются независимыми друг от друга прочими Н, F, CF3, или C2F5, при условии, что не все X, X, X'', Y, Y' и Y'' являются Н. Предпочтительнее, чтобы как минимум один из р, m и n было равен 1.
Примеры Rf включают в себя, но не ограничиваются, перфорированный алкил, перфорированный алкоксил, перфорированный оксиалкил, перфорированный полиоксиалкил, перфорированный полиоксиалкоксил, частично фторированный алкил, частично фторированный алкоксил, частично фторированный оксиалкил, частично фторированный полиоксиалкил или частично фторированные полиоксиалкоксиловые остатки, которые могут быть линейными, циклическими или разветвленными. Как правило, Rf может содержать от 1 до 14 атомов углерода. Конкретные примеры Rf включают в себя, но не ограничиваются, F3C-, F3CO-, F3CFHC-, F5C2-, F3COF2C-, F3COF2CO-, F7C3-, F9C4-, F11C5-, F2HC-. Предпочтительнее, чтобы как минимум один из Х и Y являся F, CF3 или C2F5, еще более предпочтительно, чтобы оба, Х и Y, были независимы от друг друга, выбранными из F, CF3 или C2F5, так чтобы, например, Х и Y оба были F, или Х было F, а Y было CF3. В некоторых примерах, X, X', X'', Y, Y' и Y'' выбираются таким образом, что ни один или один или больше двух из них были Н, предпочтительнее, чтобы как минимум один из Х и Y не являлся Н, еще более предпочтительно, чтобы оба из Х и Y не являлись Н, а самым предпочтительным, было чтобы Х и Y являлись F.
Примеры подходящих спиртов в соответствии с формулами А и А1 включают перфорированные спирты, являющиеся спиртами, совсем не имеющими атомов водорода, за исключением водородов остатка -CH2OH, или они могут быть частично фторированными спиртами, имеющими, кроме атомов водорода группы -CH2OH, атомы водорода, предпочтительнее, не более двух или не более одного атомов водорода.
В приведенной выше формуле А2, Х и R являются независимо выбранными из водорода, галогена или остатков алкила, алкенила, циклоалкила или арила, которые могут содержать, а могут не содержать один или несколько атомов фтора, и которые могут содержать, а могут не содержать один или несколько катенарных атомов кислорода.
В одном из вариантов формулы A2, Х может быть атомом, таким как атом водорода или галогена (например, фтора, хлора или брома). В другом варианте, X может быть остатком, таким как алкил, циклоалкил или арил. Эти остатки могут иметь, как минимум, 1, 2, 3, 4, 5, 6, 8, или даже 10 атомов углерода; самое большее 4, 6, 8, 10, 14, 16, 18, или даже 20 атомов углерода. Данные остатки могут содержать, а могут не содержать атомы фтора, и могут быть высокофторированными (т.е., как минимум 80%, 90%, 95%, или даже 100% водородов, прикрепленных к углеродам могут быть замещены фтором). Данные остатки могут содержать, а могут не содержать один или несколько катенарных атомов кислорода (напр., простые эфирные связи), и могут быть линейными или разветвленными, насыщенными или ненасыщенными. Эти остатки могут замещаться, а могут не замещаться с другими функциональными группами (например, аминами, сульфидами, эфирами и т.п.), пока данные функциональные группы не подвергаются нежелательному окислению и пространственно не затрудняют реакцию окисления.
В одном из вариантов формулы A2, R может быть атомом, таким как атом водорода или галогена (например, фтора, хлора или брома). В другом варианте R может быть остатком, таким как алкил, циклоалкил или арил. Эти остатки могут иметь как минимум 1, 2, 3, 4, 5, 6, 8, или даже 10 атомов углерода; самое большее 20, 18, 16, 14, 10, 8, 6 или даже 4 атома углерода. Данные остатки могут содержать, а могут не содержать атомы фтора. В одном варианте R является не фторированным, частично фторированным или полностью фторированным. В одном варианте R может быть высокофторированными (т.е., как минимум 80%, 90%, 95%, или даже 100% водородов, прикрепленных к углеродам могут быть замещены фтором). Данные остатки могут содержать, а могут не содержать один или несколько катенарных атомов кислорода (напр., простые эфирные связи). Эти остатки могут быть линейными или разветвленными, насыщенными или ненасыщенными, могут замещаться, а могут не замещаться другими функциональными группами (например, аминами, сульфидами, эфирами и т.п.), пока данные функциональные группы не окисляются, и пространственно не затрудняют реакцию окисления.
Примеры R из формулы А2 включают в себя, перфорированный, частично фторированный или не фторированный алкил, арил, алкоксил, оксиалкил, или полиоксиалкоксиловые остатки, которые могут быть линейными, циклическими или разветвленными. Конкретные примеры R включают в себя:
Н3С-, Н5С6-, F3C-, F3CO-, CHF2(CF2)3-, CHF2(CF2)4-, F3CFHC-, F5C2-, F3COF2C-, CF3CF2OCF2CF2O-, CF3CF2CH2OCF2CH2O-, CF3(CF2)2(OCF2CF2)4O-, CF3O(CF2)3О-, CF3O(CF2)3OFHC-, F3COF2CO-, F7C3-, F9C4-, F11C5-, F13C6-, и F2HC-.
Типичные фторированные спирты с формулой (А) включают в себя:
C6H5CHFCH2OH, CF3CF2OCF2CF2OCF2CH2OH, CHF2(CF2)5CH2OH, CF3(CF2)6CH2OH,
CH3CHFCH2OH, CF3O(CF2)3OCF(CF3)CH2OH, CF3CF2CH2OCF2CH2OCF2CH2OH,
CF3O(CF2)3OCHFCF2CH2OH,
CF3O(CF2)3OCF2CH2OH, CF3(CF2)3(CH2CF2)2CF2CF2CF2CH2OH,
CF3(CF2)2СН2(CF2)2CH2OH, CF3(CF2)2CH2OH,
CF3(CF2)2(OCF(CF3)CF2)OCF(CF3)CH2OH, CF3(CF2)2(OCF2CF2)4OCF(CF3)CH2OH,
CF3CF2O(CF2CF2O)]CF2CH2OH, и Rf-O-CHF-CH2OH, RfO-CHF-CF2CH2OH,
Rf-O-CFf-CFH-CH2OH, RfO-CF2-CHF-CF2-CH2OH, Rf-O-CFf-CF2-CH2OH,
Rf-O-CF2-CF2-CF2-CH2OH, Rf-(O)-CHF-CF2-O-CF2-CH2OH, Rf-CHF-CF2-O-CF2-CH2OH,
Rf-O-(CF2)n-CH2OH, Rf-(CF2)n-CH2OH, Rf-(O-CF2)n-O-(CF2)m-CH2OH,
Rf-(O-CF2-CF2)n-O-(CF2)m-CH2OH, Rf-(O-CF(CF3)-CF2)n-O-(CF2)m-CH2OH, и
Rf-(O-CF2-CF(CF3))n-O-(CF2)m-CH2OH,
где Rf является линейным или разветвленным фторированным или перфорированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, n представляет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, a m представляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10.
Фторированные карбоновые кислоты и их соли
Фторированные спирты могут быть преобразованы в соответствующие фторированные карбоновые кислоты путем окисления остатка -CH2OH в остаток -COO-M+, получая таким образом, карбоновые кислоты или их соли, соответствующие общей формуле (B):

где M+ является катионом, таким как, например, водород, катионы металлов или органические катионы. Примеры катионов металлов включают в себя Na+ и K+. Примеры органических катионов включают в себя: нашатырь 
Как раскрывается в настоящем документе, термин «карбоновая кислота (кислоты)» включает в себя карбоновую кислоту (кислоты) и соль (соли) карбоновой кислоты. Примеры фторированных карбоновых кислот включают в себя перфторированные карбоновые кислоты или частично фторированные карбоновые кислоты. Перфторированные карбоновые кислоты - это карбоновые кислоты в соответствии с формулой (B), не имеющие ни одного атома водорода, кроме водорода в остатке -COOH. Частично фторированные карбоновые кислоты - это карбоновые кислоты в соответствии с формулой (B), кроме водорода в остатке -COOH, имеющие как минимум один атом водорода.
Типичные фторированные карбоновые кислоты с формулой (B) включают в себя:
C6H5CHFCOOH, CF3CF2OCF2CF2OCF2COOH, CHF2(CF2)5COOH, CF3(CF2)6СООН,
CH3CHFCOOH, CF3O(CF2)3OCF(CF3)СООН, CF3CF2CH2OCF2CH2OCF2COOH,
CF3O(CF2)3OCHFCF2COOH, CF3O(CF2)3OCF2COOH,
CF3(CF2)3(CH2CF2)2CF2CF2CF2COOH, CF3(CF2)2CH2(CF2)2СООН, CF3(CF2)2COOH,
CF3(CF2)2(OCF(CF3)CF2)OCF(CF3)СООН, CF3(CF2)2(OCF2CF2)4OCF(CF3)COOH,
CF3CF2O(CF2CF2O)3CF2COOH, и их соли, и Rf-O-CHF-COO-M+, Rf-O-CHF-CF2COO-M+,
Rf-O-CFf-CFHCOO-M+, Rf-O-CF2-CHF-CFf-COO-M+, Rf-O-CHF-CF2-O-CF2-COO-M+,
Rf-O-CF2-CF2-CF2-COO-M+, Rf-(O)-CHF-CF2-O-CF2-COO-M+, Rf-CHF-CF2-O-CF2-COO-M+,
Rf-O-(CF2)n-COO-M+, Rf-(CF2)n-COO-M+, Rf-(O-CF2)n-O-(CF2)m-COO-M+,
Rf-(O-CF2-CF2)n-O-(CF2)m-COO-M+, Rf-(O-CF(CF3))n-O-(CF2)m-COO-M+, и
Rf-(O-CF2-CF(CF3)n-O-(CF2)m-COO-M+,
где Rf является линейным или разветвленным фторированным или перфорированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, n представляет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, a m представляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10, а М+ представляет Н+ или катион, указанный выше.
Получение
В настоящем раскрытии описываются две схемы получения фторированных карбоновых кислот, соответствующих формуле (В) из первичных фторированных спиртов. Первая схема включает в себя использование первого и второго окислителя, в то время как вторая схема включает в себя использование группы свободного нитроксильного радикала и окислителя.
Первая схема
В первой схеме высокофторированные карбоновые кислоты и их соли получаются путем обработки высокофторированных спиртов, имеющих остаток А в сответстви с формулой А1 как минимум одним первым и как минимум одним вторым окислителем для получения высоко фторированной карбоновой кислоты, имеющей формулу (В), где, как минимум, один первый окислитель является соединением, которое может быть преобразовано, действием второго окислителя, в активные частицы, способные окислить фторированный спирт.
Первыми окислителями в использованном выше и ниже смысле являются соединения, которые могут быть окислены в активную форму одним или несколькими вторыми окислителями. Активная форма первых окислителей способна окислять спирт до соответствующих карбоновых кислот.
Первыми окислителями могут быть органические соединения, т.е., соединения, имеющие как атом водорода, так и атом углерода. Предпочтительнее, чтобы первый окислитель не содержал тяжелых металлов. Фактически, он вообще может не содержать металлов.
Первый окислитель может иметь как минимум одну N-оксильную или одну Р-оксильную группу. N-оксильная или Р-оксильная группы могут быть преобразованы в оксоаммониевые или оксофосфонитовые группы путем их окисления как активных частиц. Таким образом, типичными первыми окислителями являются соединения, которые могут быть преобразованы в оксоаммониевые или оксофосфонитовые соединения. Предпочтительными соединениями являются те, в которых преобразование N-оксильных или Р-оксильных групп в их активную «-ониевые» формы является обратимым, в том смысле, что N-оксильная или Р-оксильная группы могут регенерироваться. Таким образом, первый окислитель может использоваться в небольших количествах в силу того, что он может быть регенерирован в процессе реакции окисления.
Первый окислитель может быть циклическим, ациклическим или полициклическим. Предпочтительнее, чтобы первые окислители имели соединения, содержащие N-оксильные и/или P-оксильные группы. Еще более предпочтительнее, чтобы соединения были циклическими. Наиболее предпочтительнее, чтобы атомы N или P N-оксильной, P-оксильной группы являлись частью циклической структуры. Типичные примеры подходящих первых окислителей включают в себя содержащие, как минимум, одну пиперидиновую часть, и могущие иметь пиперидиновый N-оксил. Типичные примеры пиперидиновых N-оксилов соответствуют общей формуле (C):

где каждый из R1, R2, R3 и R4 могут быть идентичными или различными, и независимо друг от друга представлять насыщенные и/или ароматические углеводородные группы, имеющие остаток или их комбинации, R5 и R6 могут быть идентичными или различными, и представлять водород, гидроксил, насыщенные и/или ароматические углеводородные группы, имеющие остаток. Насыщенные алифатические или ароматические группы R1, R2, R3 и R4 могут быть замещены группами, не вмешивающимися в процесс окисления, например, но не ограничиваясь, алкоксигруппы, галогены, галогеновые алкильные группы, амины, аминоалкилы, алкилкарбонилоксиды, алкилкарбониламины, гидроксилы, гидроксилалкилы, кислород, азот и их комбинации. Остатки могут иметь до 12 атомов углерода, или до 8 атомов углерода включительно. Конкретные примеры алкильных остатков включают в себя метил, этил, n-пропил, изопропил, пентил, n-гексил и им подобные. Примеры алкоксильных остатков включают в себя метокси, пропокси, бутокси, изобутокси и им подобные.
Насыщенные алифатические и/или ароматические группы, имеющие остатки R5 и R6 могут быть замещены группами или остатками, не вмешивающимися в процесс окисления. Такие группы или остатки включают в себя, но не ограничиваются алкилы, алкоксилы, амины, аминоалкилы, диаминоалкилы, алкилкарбонилоксиды и алкилкарбониламиновые группы или остатки и их комбинации. Остатки могут иметь до 12 атомов углерода, или до 8 атомов углерода включительно. Примеры пригодных остатков включают в себя, но не ограничиваются, алкилы, алкоксилы, гидроксилалкилы, амины, аминоалкилы, диаминоалкилы, алкилкарбонилоксиды и алкилкарбониламины. Конкретные примеры алкильных остатков включают в себя метил, этил, n-пропил, изопропил, пентил, n-гексил и им подобные. Примеры алкоксильных остатков включают в себя метокси, пропокси, бутокси, изобутокси и им подобные.
Типичные примеры пиперидиновых N-оксилов включают в себя, но не ограничиваются, 2,2,6,6-тетраметил-пиперидин-1-оксил (TEMPO), 4-метокси-2,2,6,6-тетраметил-пиперидин-1-оксил, 4-гидрокси-2,2,6,6-тетраметил-пиперидин-1-оксил и 4-ацетамидо-2,2,6,6-тетраметил-пиперидин-1-оксил.
Другие примеры подходящих первых окислителей включают в себя соединения, имеющие как минимум одну карбонильную группу (формула 2), в частности, как минимум, одну альфа-галогенкарбонильную группу (формула 1), как минимум, одну иминную группу (формула 3), как минимум, одну имминиумную группу (формула 4) или их комбинации.
С помощью вторых окислителей, карбонильные группы могут быть преобразованы в диоксираны (формула II), как их активную форму. Альфа-галогенкарбонильные группы могут быть окислены в пергидраты (формула I), как их активную форму. Имины могут быть окислены в оксизидрины (формула III), а имминиумные соли могут быть окислены в оксизидриновые соли (формула IV), как их активную форму. Соответствующим образом, подходящие первые окислители включают в себя соединения, такие как представленные формулами 1-4, которые могут быть окислены в пергидраты, диоксираны, оксизидрины и оксизидриновые соли (такие, как представленные формулами I-IV):

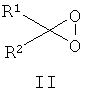
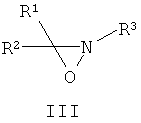
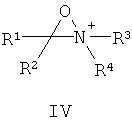

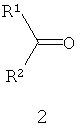

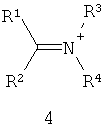
В формулах, соответственно, 1-4 и I-IV, каждый признак из R1, R2, R3 и R4 представляет идентичный или различный остаток, или может быть частью одного и того же остатка, например, в случае циклических или полициклических остатков. X2 представляет два галогена (Br, I, Cl, F), предпочтительнее, Cl и/или F, которые могут быть идентичными или разными. Типичные примеры R1, R2, R3 и R4 включают в себя независимые друг от друга Cl, F, CCl3, CCl2H, ClF2, CF3, CnF2n+i (n=1-20), арил, арилалкил, алкил (CnH2n+i; n=1-20). Типичные противоионы для формул IV и 4 включают в себя, но не ограничиваются, -OSO2CF3, BF4 -, BPh4 -, NO3 -, ClO4 -, PF- 6
Первые окислители могут использоваться в виде чистых веществ или в виде смесей. Они могут использоваться в виде растворов или суспензий. Они также могут использоваться в виде твердых веществ, например, путем их связывания на материале-основе, или твердых подложках, таких как, например, кремниевые или алюминосиликатные материалы или на органических полимерах, например, но не ограничиваясь, полистирол или полиэтиленгликоль. Первые окислители также могут полимерами или полимерными материалами. Например, они могут быть связаны с полимером или находиться в поперечной межмолекулярной связи с полимером, или мономером, имеющим подходящие редокс-активные группы или их исходные вещества, который можно использовать для получения полимера.
Окисление спирта происходит в присутствии как минимум одного второго окислителя. Второй окислитель способен преобразовать первый окислитель в его активную форму. Это можно наблюдать, например, стереоскопически, с помощью способов, используемых в аналитической химии. Например, окисление групп N-оксила или Р-окисламожно отслеживать с использованием методик электронно-спинового резонанса (ЭСР), или с помощью циклической вольтамперометрии. Альтернативные способы включают в себя инфракрасную спектрометрию или измерения ядерно-магнитного резонанса (ЯМР). Например, образование карбоновой кислоты можно наблюдать с помощью 19F-ЯМР спектрометрии. Как правило, преобразование первого окислителя в его активную форму происходит на месте, т.е. в присутствии спирта.
Предпочтительнее, чтобы второй окислитель не содержал атома или иона тяжелого металла. В группу тяжелых металлов включаются все маталлы, кроме Li, Na, К, Rb, Cs, Fr, Be, Mg, Ca, Sr, Ba, Al, Sc, Y и Ti.
Считается, что активная форма первого окислителя окисляет спирт, посредством чего он преобразуется в редуцированную форму. После этого, редуцированная форма может пройти повторное окисление, например, одним или несколькими вторыми окислителями. Для получения хорошего выхода карбоновых кислот может потребоваться только небольшой объем первого окислителя. Следовательно, в конкретном варианте первый окислитель используется в меньших количествах, чем второй окислитель. Как правило, первый окислитель может использоваться в количествах, например, до примерно 10% (молярной массы) от второго окислителя.
Как правило, по сравнению с окисляемым спиртом, вторые окислители используются в меньших эквимолекулярных количествах. Как правило, вторые окислители (отдельно или в общих количествах, например, при использовании комбинации), предпочтительнее использовать в молярных избытках по сравнению с объемом спирта, например, в превышении в 2 моля; 3 моля; 3,5 моля или 10 моль. Оптимальные условия реакции могут изменяться в зависимости от используемых окислителей, но могут быть определены путем стандартными экспериментами.
Второй окислитель может быть органическим, неорганическим, жидким, газообразным или твердым. Как минимум один второй окислитель может быть неорганическим соединением, имеющим, как минимум, один атом кислорода или один атом кислорода и один атом галогена. Типичные примеры включают в себя оксиды галогенов, такие как, например, периодаты, перброматы, перхлораты, гипохлориды, гипоиодиды, гипобромиды, включая их кислоты и соли, и их комбинации. Другие типичные примеры включают в себя органические и неорганические пероксиды, такие как пероксид водорода, персульфаты, такие как, например, персульфаты аммония или калия, гидроперекиси бензоила, гидроперекиси ацетила, пероксиды карбамина, пербораты, пероксикарбонаты, пероксиды бензоила, перекиси ацетона, перекись метилэтилкетона, гидроперекиси трет-бутила и их комбинации. При использовании неорганических или органических перекисей, реакция может быть еще более ускорена путем добавления металлоорганических смесей, например порфиринов железа или марганца.
Примеры газообразных вторых окислителей включают в себя хлор, кислород, озон. Вместо чистого газа можно также использовать смеси, содержащие эти газы. При использовании кислорода в качестве второго окислителя, реакция может быть ускорена путем добавления катализаторов, таких, как обычно используемых для ускорения реакций окисления с помощью кислорода. Типичные примеры включают в себя металлы или соли металлов. Подходящие катализаторы включают в себя, но не ограничиваются, азотнокислые соли металлов (напр., NaNO2), нитраты металлов (напр., Co(NO3)2, Mn(NO3)2) и их комбинации. Как правило, газообразные окислители могут присутствовать при давлениях, превышающих атмосферное давление, например при давлениях выше 1 атмосферы, таких как, например, 1,5; 2; 3 или 5 атмосфер, или могут присутствовать в виде газового потока. Второй окислитель может подходяще иметь стандартный потенциал, превышающий 0,2 В, предпочтительнее, превышающий 0,3 В (электрод Н/Н+ в качестве стандартного электрода, 1 молярный раствор, 25°С). Стандартные потенциалы можно найти в научной литературе, см., например, "Inorganic Chemistry", («Неорганическая химия») D.F.Shriver, P.W.Atkins, C.H.Langfbrd, издательство Oxford Press, второе издание, 1994, Приложение 2).
Вторым окислителем также может быть электрический ток, например электрический ток, вырабатываемый гальваническим элементом. Для этой уели может использоваться стандартный гальванический элемент. Стандартный набор для электрохимического окисления описан в примере 13. Например, могут использоваться электроды из Ni, Ti, Ru, Pb, Pt, оксида/гидроксида олова или электролизер типа «Даймонд» с активированным бором. Последний вариан является предпочтительным.
В определенных условиях, окисление спиртов до карбоновых кислот может происходить при использовании только второго окислителя, например, в случае, когда вторым оксилителем является электрический ток. Тем не менее, реакция может быть ускорена и/или давать больший выход при использовании, также, и первого окислителя.
Как правило, окисление спиртов до карбоновых кислот происходит с использованием комбинации первого и второго окислителей так, что выход карбоновых кислот или их солей составляет, как минимум, 50% в течение 24 часов, предпочтительнее, в течение 12 часов. Спирты и окислители предпочтительнее использовать в количествах, эффективных таким образом, чтобы выход карбоновых кислот или их солей составлял, как минимум, 50% в течение 24 часов, предпочтительнее, в течение 12 часов.
С использованием вторых окислителей, объемы первых окислителей, необходимых для достижения минимального выхода карбоновых кислот в 50% в течение 24 часов, может быть уже около 0,01 молярных % до, примерно, 10 молярных %, или от, примерно, 2,5 молярных % до, примерно, 4 моляных %, исходя из молярного объема окисляемого спирта.
Предпочтительные комбинации первого и второго окислителей включают в себя, но не ограничиваются, N-оксилом- или Р-окислом-, содержащими соединения, в роли первого оксилителя, и галогены, или оксиды галогенов, такие как, например, но не огранчиваясь, NaOCl, NaOBr, NaO2Cl, NaO2Br, кислород, хлор или электричкский ток гальванического элемента в роли вторых окислителей. Следующие предпочтительные комбинации первого и второго окислителей включают в себя, но не ограничиваются, соединения, которые могут быть окислены до пергидратов, диоксиранов, оксизидринов и оксизидриновых солей (например, соответствующие формулам I-IV в роли первых окислителей), и H2O2, KHSO5, APS (персульфат аммония), гидроперекиси бензоила, такие как, например, (m-хлорпероксибензолова якислота), в роли вторых окислителей. Типичные первые окислители данной комбинации включают в себя карбонилы, альфа-галокарбонилы, иммины и имминиумные соли (соответствующие формулам 1-4).
Реакция может проходить в жидкой среде с использованием только жидких фторированных спиртов и/или использованием растворителей. Для ускорения реакции, если реакционная смесь содержит определенные органические и жидкие фазы, могут использоваться катализаторы межфазного переноса. Типичные примеры включают в себя тетраалкил аммонийные соли. Иным способом, может использоваться смесь растворителя из воды и водорастворимых растворителей, например, ацетонитрила, ДМСО и им подобных. Признано подходящим соотношение воды и водорастворимого растворителя (например, Н2О: ацетонитрила) в 1:2-1:4, исходя из объема. Реакция также может проходить с использованием сверхкритической среды (например, жидкого CO2) или ионных жидкостей.
Как правило, реакция происходит при кислотном, нейтральном или щелочном рН, например, при рН от 4 до 7, или от 7 до, примерно, 12. Оптимальный рН зависит от типа используемых окислителей. Например, не газзобразные кислород и галогены, содержащие вторые окислители, предпочтительнее использовать от нейтрального до щелочного рН. Может быть целесообразно уонтролировать рН во время реакции для усиления выхода, контроль рН может производиться, например, с использованием буферов. Типичные примеры буферов включают в себя, но не ограничиваются NaHCO3, КНСО3, К2СО3, Na2CO3, Na2HPO4, NaH2PO4, NaAc и их комбинациями.
Реакции могут проходить при комнатной температуре, или при повышенных температурах, таких как, например, но не ограничиваясь, температурах в диапазоне от, примерно, 30°С до, примерно, 80°С. Как правило, время реакции составляет от 4 до 24 часов.
Вторая схема
Было обнаружено, что обработка первичных фторированных спиртов, таких как, содержащих остаток А по формуле А2 соединением, имеющим группу свободного нитроксильного радикала и одним или несколькими окислителями, может непосредственно привести к окислению фторированного спирта в соответствующие фторированные карбоновые кислоты или их соли. Было обнаружено, что фторированные спирты, имеющие общую структуру Rf(CH2)n-CH2OH, где Rf представляет фторированный остаток, а n является целым числом от 2 до 4 с нитроксильными радикалами, приводят к образованию альдегидов или альдегидгидратов, как описано в статье Pozzi и др., Tetrahedron Letters, 2002, том 43, 6141-6143). Фторированные карбоновые кислоты еще не образовались, или являлись только побочным продуктом с низким выходом.
Как описано в настоящем документе, реакция окисления по второй схеме имеет умеренные условия реакции по сравнению с обычными способами получения, имеет высокую избирательность по образованию фторированных карбоновых кислот, не использует тяжелые металлы и образует минимальные побочные реакции, что приводит к получению реакционной смеси, имеющей минимальное загрязнение побочными продуктами. Данные своства делают реакцию окисления второй схемы, описанной в настоящем документе, экономически эффективной и применимой в промышленном масштабе.
Для окисления фторированных спиртов, содержащих остаток по формуле А2, используется соединение, имеющее группу свободного нитроксильного радикала, такое, как описанное формулой (D):
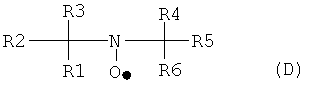
где каждый из R1-R6 могут быть идентичными или различными, и, независимо друг от друга, представлять насыщенные алифатические и/или ароматические остатки или их комбинации. Алифатический или ароматический остаток может иметь, как минимум, 1, 2, 3, 4 или даже 5 атомов углерода; самое большее 4, 6, 7 или даже 8 атомов углерода. Алифатический или ароматический остаток может быть незамещенным или замещенным атомами галогена и/или кислорода. В некоторых примерах, R3 и R4 соединены для образования алифатической кольцевой структуры, такой как кольцо с пятью или шестью элементами, в которой один из кольцевых атомов является атомом азота нитроксильного радикала.
Подходящие соединения, имеющие стабильные нитроксильные радикалы включают в себя, например, соединения, соответствующие общей формуле (Е):

где каждый из R7, R8, R9 и RIO могут быть идентичными или различными, и, независимо друг от друга, представлять насыщенные алифатические и/или ароматические остатки или их комбинации. Алифатические или ароматические остатки могут иметь как минимум 1, 2, 3, 4 или даже 5 атомов углерода; самое большее 4, 6, 7 или даже 8 атомов углерода. Алифатический или ароматический остаток может быть незамещенным или замещенным атомами галогена и/или кислорода.
R11 и R12 могут быть идентичными или различными, и представлять -Н, -ОН, -NH2, -SCN, -ОРО3Н2, -NHCOCH3, -ОСОС6Н5, -CO2H, -СО2СН3, -CN, -OSO2 -СН3, -N+(СН3)3, -CH2NH2, -NHCH2C6H5, -NCH3COCH3, -N+(CH3)2CH2CH2OH или остаток, имеющий атом углерода. Остаток, имеющий атом углерода, может быть насыщенным линейным или разветвленным, циклическим алифатическим или ароматическим остатком, или их комбинацией. В одном варианте остаток, имеющий атом углерода, содержит, как минимум, 1, 2, 3, 4, 5 или даже 6 атомов углерода; самое большее 6, 8, 10 или даже 12 атомов углерода. Примеры подходящих остатков, имеющих атом углерода, включают в себя: алкильные, алкоксильные, гидроксилалкильные, аминные, аминоалкильные, диаминоалкильные, алкилкарбонилоксидные и алкилкарбониламинные остатки. Конкретные примеры алкильных остатков включают в себя: метил, этил, n-пропил, изопропил, пентил, n-гексил и их комбинации. Конкретные примеры алкоксильных остатков включают в себя: метокси, пропокси, бутокси, изобутокси и их комбинации.
Примеры соединений, имеющих группу свободного нитроксильного радикала, включают в себя:
2,2,6,6-тетраметил-пиперидин-1-оксил (TEMPO);
4-метокси-2,2,6,6-тетраметил-пиперидин-1-оксил;
4-гидрокси-2,2,6,6-тетраметил-пиперидин-1-оксил и
4-ацетамидо-2,2,6,6-тетраметил-пиперидин-1-оксил;
2,2,6,6-тетраметил-4-пиперидин-4-один-1-оксил оксим (TEMPOXIME);
RAC-2,2,6,6-тетраметил-пиперидин-N-оксил-4,4-(5-спирогидантоин);
2,2,6,6-тетраметил-пиперидин-1-оксил1-4-амино-4-карбоновая кислота и их комбинации.
Соединения, содержащие нитроксильные радикалы, могут использоваться в виде частых материалов, или в виде растворов или суспензий. Соединения, содержащие нитроксильные радикалы, также могут использоваться в виде материалов-основ или на твердых подложках, на таких как, например, кремниевые или алюминосиликатные материалы или на органических полимерах, например полистирол или полиэтиленгликоль. Соединения, содержащие нитроксильные радикалы, также могут быть полимерными материалами, например, находиться в поперечной межмолекулярной связи с полимером таким образом, что полимер будет иметь одну или несколько молекул, содержащих нитроксильные радикалы.
В одном варианте используются каталитические объемы соединений, имеющих группу свободного нитроксильного радикала. Объем соединения, имеющего группу свободного нитроксильного радикала, необходимый для достижения окисления фторированных спиртов до фторированных карбоновых кислот, низкий. Могут использоваться объемы, как минимум, около 0,01; 0,1; 0,5 или даже 1 молярного % исходя из молярного объема окисляемого фторированного спирта, самое большее, около 2, 5, 8, 10 или даже 15 молярных %, исходя из молярного объема окисляемого фторированного спирта.
Группа свободного нитроксильного радикала соединения, содержащего группу свободного нитроксильного радикала, может быть преобразована путем окисления (например, с помощью окислителя) в оксоаммониевую группу. Это может быть сделано на месте, напр., в присутствии фторированного спирта. Не будучи связанными теорией, считается, что оксоаммониевая соль, окисляющая фторированный спирт до фторированной карбоновой кислоты, одновременно с редуцированием оксоаммониевой соли до гидроксиламина (группа N-OH). Производное гидроксиламина может быть снова окислено до нитроксильного радикала, и далее, до оксоаммониевой соли так, что оксоаммониевая соль действует в роли катализатора окисления, и требуются только небольшие объемы соединения, имеющего нитроксильный радикал.
Подходящие окислители включают в себя такие соединения, которые окисляют группу свободного нитроксильного радикала. Примеры окислителей включают в себя: трихлоризоциануровая кислота, гипобромиты, хлориты, йолисил бензол, йодбензол дихлорид, хлор, кислород/воздух, озон, соли азотистой кислоты и их комбинации. Особенно полезными окислителями являются гипохлориды. Ион гипохлорида может образоваться на месте (например, хлор и щелочь, трихлоризоциануровая кислота и т.п.), или может быть приобретен в виде водного раствора с диапазоном концентрации от 5 до 14 массовой доли.
Как правило, для получения полного превращения фторированного спирта во фторированную карбоновую кислоту, окислители используются в молярном избытке по сравнению со фторированным спиртом. Могут использоваться объемы в, как минимум, 2, 4 или 6 раз выше соответствующего объема фторированного спирта; самое большее, в, примерно, 6, 8, 10 или даже 15 раз выше соответствующего объема фторированного спирта.
Как описано в настоящем документе, органические растворители могут использоваться, а могут не использоваться в реакции окисления. Как известно, органические растворители используются для стабилизации реактивов с целью обеспечения их близкого соседства, давая им возможность вступить в химическую реакцию.
В одном варианте фторированный спирт, соединение, содержащее группу свободного нитроксильного радикала и окислитель, реагируют в присутствии органического растворителя. Примеры органических растворителей включают в себя: ацетонитрил, тетрагидрофуран, диэтиловый эфир, метил-трет-бутиловый эфир, диметокси этан, 2-метоксиэтиловый эфир (простой диметиловый эфир диэтиленгликоля), триэтилен гликоль диметилэфир (сложный диметиловый эфир диэтиленгликоля), толуол, бензол, гексан, пентан, диоксан, дихлорметан, хлороформ, тетрахлорид углерода или их комбинации.
В одном варианте фторированный спирт, соединение, содержащее группу свободного нитроксильного радикала и окислитель, реагируют в присутствии воды и водорастворимого органического растворителя, такого как, например ацетонитрил или диметилсульфоксид. Может использоваться Соотношение воды и водорастворимого органического растворителя в 1:0.5, 1:1, 1:2, 1:3, 1:4, 1:6 или даже 1:10 исходя из объема.
В настоящем раскрытии было открыто, что фторированный спирт, соединение, содержащее группу свободного нитроксильного радикала, и окислитель могут реагировать в смеси при существенное отсутствии органического растворителя, а реакция окисления все-таки доходит до завершения. Существенное отсутствие органического растворителя означает, что отношение молекул органического растворителя к молекулам окисляемого фторированного спирта менее 10%, менее 5%, менее 1%, или даже менее 0,5%. Отсутствие органического растворителя или существенное отсутствие органического растворителя в реакции окисления может быть особенно полезным. Например, может быть устранено загрязнение от органического растворителя в реагирующем растворе, а производственный процесс может быть менее затратным и более экологичным, так как исчезнет необходимость в приобретении или утилизации органических растворителей после их использования. Отсутствие органического растворителя также дает возможность получения более высокого объемный коэффициента полезного действия в реакторе (т.е., так как растворитель не используется, будет больше доступного места для реактивов).
В настоящем раскрытии было обнаружено, что может быть выгодным поддержание щелочной среды во время окисления фторированного спирта. Щелочная среда может увеличить скорость реакции окисления и/или достигнуть высокого выхода. В щелочных условиях фторированный спирт и фторированная карбоновая кислота могут реагировать с образованием эфира. Из-за того, что фторированный спирт образует эфир вместе с уже образованной фторированной карбоновой кислотой, не весь фторированный спирт может быть преобразован во фторированную карбоновую кислоту, и выход продукта реакции может быть низким. Более того, во время дистилляции, эфир выгоняется вместе с фторированной карбоновой кислотой, что приводит к трудностям при очистке фторированной карбоновой кислоты. При использовании щелочной среды эфиры омыливаются (или гидролизируются) с образованием фторированной карбоновой кислоты и фторированного спирта, давая возможность непрерывного окисления фторированного спирта до фторированной карбоновой кислоты. Это приводит к высокому преобразованию фторированного спирта и, таким образом, высокому выходу фторированной карбоновой кислоты.
Показатель рН реакции может превышать 7.5; 8; 9; 10 или даже 12. Для формирования щелочной среды могут добавляться щелочи, такие как, например, гидроксид натрия, гидроксид калия, гидроксид лития или их комбинации. Для поддержания показателя рН смеси могут использоваться различные буферы, такие как, например, фосфатный буфер, карбонатный буфер, бикарбонатный буфер или любые буферы, достаточные для поддержания показателя рН на уровне от, примерно 7.5 до 14, или даже от 10 до 14. Примеры буферов включают в себя: NaH2PO4, KH2PO4, Na2HPO4, K2HPO4, LiHCO3, NaHCO3, КНСО3, Li2CO3, К2СО3, Na2CO3, NaOOCCH3, или их комбинации.
В реакции окисления второй схемы могут использоваться или не использоваться катализаторы межфазного переноса. Как правило, катализатор межфазного переноса используется для содействия реакции водорастворимого реактива с органически растворимым реагентом. Примеры катализаторов межфазного переноса включают в себя: тетра-n-октиламмоний галогениды и тетраметил аммоний галогениды, тетрабутил аммоний галогениды, бензил трифенил галоидный фосфоний, 18-краун-6, полиэтиленгликоль 400 и их комбинации. Отсутствие или существенное отсутствие органических растворителей и отсутствие катализаторов межфазового переноса в реакции окисления может облегчить получение и восстановление фторированной карбоновой кислоты, так как не требуется отделение фторированной карбоновой кислоты от катализатора межфазового переноса и/или органического растворителя, и сделает процесс производства экономически эффективным. Реакция окисления из настоящего раскрытия может проистекать относительно быстро с высоким уровнем преобразования фторированного спирта и отсутствия значительного начального загрязнения фторированным спиртом или эфиром в реагирующем растворе, сыром продукте и/или очищенном продукте. Как раскрыто в настоящем документе, реагирующий раствор относится к продукту, получаемому в результате реакции окисления, сырой продукт относится к продукту, получаемому в результате последующей переработки (напр., экстракции или некоторым другим этапам по отделению необходимого продукта) реагирующего раствора, а очищенный продукт относится к продукту, получаемому в результате рафинации сырого продукта.
Реакция окисления может проходить при комнатной или при слегка повышенной температуре, такой как, например, примерно комнатной, 25°С, 30°С, 35°С, 40°С, или даже 45°С; самое большее 75°С, 80°С, 85°С, 90°С, 95°С, или даже 110°С. Примеры диапазонов включают в себя от примерно комнатной до 90°С и от, примерно, 30°С до 80°С.
Как правило, реакция окисления происходит в течение менее 30 минут, 1 часа, 2 часов, 4 часов, или даже 8 часов; самое большее, примерно 4 часа, 6 часов, 8 часов, 10 часов, или даже 24 часов.
Как обсуждалось выше, путем поддержания щелочной среды во время реакции окисления, можно предотвратить образование эфиров, что приводит к высокому уровню преобразования фторированного спирта в соответствующую фторированную карбоновую кислоту. Как правило, в результате реакции, как минимум 55%, 60% 70%, 75%, 80%, 85%, 90%, 95%, 99%, или даже 100% фторированного спирта преобразуется в соответствующую фторированную карбоновую кислоту или ее соли. Как правило, % выхода продукта (т.е. отношение фактической фторированной карбоновой кислоты к теоретической фторированной карбоновой кислоте) может быть, как минимум, 55%, 60% 70%, 75%, 80%, 85%, 90%, 95%, 99%, или даже 100%. Данные проценты выхода продукта могут быть получены из реагирующего раствора, сырого продукта или даже из рафинированного продукта. Практически весь фторированный спирт преобразуется в соответствующую фторированную карбоновую кислоту, так что при анализе с помощью ЯМР (ядерного магнитного резонанса) не отмечается наличия фторированного спирта. В одном варианте в реагирующем растворе реакции окисления фторированный спирт либо существенно отсутствует (т.е., имеется в количествах менее 1,0 молярного %, менее 0,5 молярного %, менее 0,1 молярного % (по отношению к фторированной карбоновой кислоте), или даже отсутствует совсем (при анализе с помощью ЯМР).
Более того, в реагирующем растворе было отмечено минимальное количество побочных продуктов (т.е. нежелательных продуктов фторированной карбоновой кислоты, получившихся от фторированного спирта). В одном варианте реагирующий раствор имеет минимальное (т.е. менее 1,0 молярного %, менее 0,5 молярного %, менее 0,1 молярного % (по сравнению с молекулами фторированной карбоновой кислоты)) количество побочных продуктов, или не имеет их совсем, как наблюдается путем анализа с использованием ЯМР. Несмотря на нежелание быть связанным теорией, считается, что щелочная среда благоприятствует образованию фторированной карбоновой кислоты и отсутствию побочных реакций. Кроме этого, в описанных в настоящем документе условиях реакции окисления, при использовании второй схемы, в реагирующем растворе наблюдалось малое количество или не наблюдалось совсем соответствующих фторированных альдегидов.
Отделение фторированных карбоновых кислот
Фторированные карбоновые кислоты или их соли могут быть отделены и, в качестве опции, рафинированы с помощью известных методов. В одном варианте сырой продукт отделяется от реагирующего раствора путем добавления концентрированной кислоты, такой как, например, серная кислота, для присоединения протона фторированной карбоновой кислоты, приводящего к расщеплению фаз, при котором фторированная карбоновая кислота является одной из фаз. В другом варианте сырой продукт отделяется путем добавления кислоты, такой как, например, серная кислота, и последующей экстракции с помощью органического растворителя. После этого, фторированная карбоновая кислота отделяется путем удаления органического растворителя.
В силу того, что реакция окисления из настоящего раскрытия может быть относительно чистой, с малым загрязнением от исходных материалов или побочных продуктов реакции, иногда дальнейшее рафинирование сырого продукта не является необходимым. Исключение этапа рафинирования может снизить время и затраты на обработку. При необходимости, реагирующий раствор или сырой продукт могут быть рафинированы, например, путем дистилляции. В рафинировании путем дистилляции, фторированные карбоновые кислоты могут быть преобразованы в более летучий эфир путем добавления, например, спирта (напр., метанола) в присутствии кислоты, содействующей рафинированию. После дистилляции эфир может быть обработан щелочью для выхода соответствующей карбоксилатной соли.
Использование
Фторированные карбоновые кислоты из настоящего раскрытия могут быть полезны в роли синтетических промежуточных продуктов при получении промышленных и специальных химических веществ, таких как, например, инсектицидов, лекарств, красителей и им подобных. Фторированные карбоновые кислоты из настоящего раскрытия также могут быть полезны в роли эмульгаторов при производстве полимеров, особенно фторполимеров путем полимеризации, и в роли дисперсантов в получении водных фторполимерных суспензий, таких, как описаны в патенте США №7589234 (Morita и др.).
Варианты
Ниже приводится краткий обзор конкретных примеров настоящего раскрытия:
1. Способ получения высокофторированных карбоновых кислот и их солей, состоящий из обработки высокофторсодержащих спиртов с общей формулой (A):

с помощью, как минимум, одного первого и, как минимум, одного второго окислителей для получения высокофторированной карбоновой кислоты или их солей с общей формулой (A1):
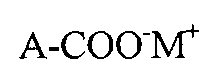
где M+ является катионом, и где «A» в формулах (A) и (B) является одинаковым фрагментом, и представляющим остаток:
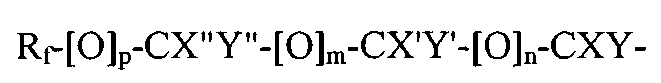 ,где
,где
Rf является фторированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, p, m и n являются независимыми друг от друга эфирами 1 или 0; X, X', X'', Y, Y' и Y'' являются независимыми друг от друга прочими Н, F, CF3, или C2F5, при условии, что не все X, X, X'', Y, Y' и Y'' являются Н; и где указанный выше, как минимум, один окислитель является соединением, которое может быть преобразовано, действием второго окислителя, в активные частицы, способные окислить фторированный спирт.
2. Способ в соответствии с вариантом 1, где только один из X, X', X'', Y, Y' и Y'' явялется Н.
3. Способ в соответствии с любым вариантом, 1 или 2, где Х и Y оба являются F.
4. Способ в соответствии с любым предшествующим вариантом, где все из X, X', X'', Y, Y' и Y'' являются F.
5. Способ в соответствии с любым предшествующим вариантом, где Rf имеет от 1 до 12 атомов углерода.
6. Способ в соответствии с любым предшествующим вариантом, где карбоновые кислоты имеют формулы:
Rf-O-CHF-COO-M+, Rf-O-CHF-CF2COO-M+, Rf-O-CFf-CFHCOO-M+,
Rf-O-CF2-CHF-CFf-COO-M+, Rf-O-CHF-CF2-O-CF2-COO-M+,
Rf-CHF-CF2-O-CF2-COO-M+, Rf-O-(CF2)n-COO-M+, Rf-(CF2)n-
COO-M+, Rf-(O-CF2)n-O-(CF2)m-COO-M+, Rf-(O-CF2CF2)n-O-(CF2)m-
COO-M+, Rf-(O-CF2CF(CF3))n-O-(CF2)m-COO-M+,
Rf(O-CF(CF3)-CF2)n-O-(CF2)m-COO-M+,
где Rf является фторированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, n представляет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, a m представляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10, а М+ определяется как указано выше.
7. Способ в соответствии с любым предшествующим вариантом, где карбоновые кислоты или их соли имеют выход продукта не менее 50% в течение 24 часов.
8. Способ в соответствии с любым предшествующим вариантом, где первый окислитель является соединением, имеющим группу, которая может быть преобразована в одну из следующих групп реактивов: оксоаммониевые соли, оксофосфонитовые соединения, пергидраты, диоксираны, оксизидрины и оксизидриновые соли.
9. Способ в соответствии с вариантом 8, где первые окислители является соединениями, имеющим группы, выбираемые из N-оксилов, Р-оксилов-, альфа-галокарбонилов, кетонов, иминов, солей иминимов и их комбинаций.
10. Способ в соответствии с любым предшествующим вариантом, где первый окислитель является циклическим соединением, имеющим как минимум одну N-оксильную группу и как минимум одну Р-оксильную группу, и где атомы N или Р как минимум, одной N-оксильной или Р-оксильной группы являются частью циклической структуры.
11. Способ в соответствии с любым предшествующим вариантом, где первый окислитель имеет молекулу пиперидин N-оксила.
12. Способ в соответствии с вариантом 11, где молекула пиперидин N-оксила соответствует формуле (С):
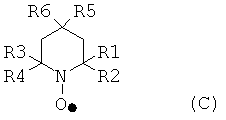
где каждый из R1, R2, R3 и R4 могут быть идентичными или различными, и независимо друг от друга представлять насыщенные и/или ароматические углеводородные группы, имеющие остаток или их комбинации, R5 и R6 могут быть идентичными или различными, и представлять водород, гироксил, насыщенные и/или ароматические углеводородные группы, имеющие остаток.
13. Способ из варианта 11, где каждый из R1, R2, R3 и R4 могут быть идентичными или различными, и представлять алкильный остаток из до 8 атомов углерода включительно, который может быть незамещенным или замещенным атомами галогена, гидроксила, алкоксила и/или кислорода.
14. Способ в соответствии с любым из вариантов 11, 12 и 13, где R5 и R6 могут быть идентичными или различными, и представлять водород, гидроксил, алкил, алкокси, гидрокси алкилы, амины, аминоалкилы, диаминоалкилы, алкилкарбонилоксиды и алкилкарбониламиновые остатки.
15. Способ в соответствии с любым из вариантов 11-14, где пиперидин N-оксил выбирается из 2,2,6,6-тетраметил-пиперидин-1-оксида, 4-метокси-2,2,6,6-тетраметил-пиперидин-1-оксила, 4-гидрокси-2,2,6,6-тетраметил-пиперидин-1-оксила и 4-ацетамидо-2,2,6,6-тетраметил-пиперидин-1-оксила.
16. Способ в соответствии с вариантами 1-8, где первый окислитель имеет как минимум одну кетоновую группу, как минимум одну альфа-галогенкарбонильную группу, как минимум одну группы иминов, как минимум одну группу имининов или их комбинации.
17. Способ в соответствии с любым предшествующим вариантом, где второй окислитель выбирается из электрического тока гальванического элемента, пероксида, оксидов галогенов, хлора, кислорода, озона или их комбинаций.
18. Способ в соответствии с любым из вариантов 1-8, где первый окислитель является соединением, имеющим как минимум одну N-оксильную и/или одну Р-оксильную группу, и где второй окислитель состоит из второго окислителя, выбираемого из электрического тока гальванического элемента, пероксида, оксидов галогенов, хлора, кислорода, озона или их комбинаций.
19. Способ в соответствии с вариантом 18, где второй окислитель состоит из кислорода, озона и/или хлора и где второй окислитель присутствует в виде потока газа или при давлении, превышающем 1,1 атм., или в диапазоне от 1,1 до 20 атм.
20. Способ в соответствии с вариантами 1-8, где первый окислитель является соединением, имеющим как минимум одну кетоновую группу, как минимум одну альфа-галогенкарбонильную группу, как минимум одну группы иминов, как минимум одну группу имининов или их комбинации, а второй окислитель состоит из пероксида, предпочтительнее, из пероксида водорода, персульфата, пероксиарениевой кислоты, предпочтительнее, гидроперекиси бензоила, или их комбинаций.
21. Способ в соответствии с любым из вариантов 1-8, где второй окислитель имеет стандартный потенциал не менее 0,2 В.
22. Способ в соответствии с любым из вариантов 1-8, где второй окислитель является пероксидом или оксидом галогена, таким как, например, гипохлоритом, гипобромитом, гипоиодитом, перброматом, перхлоратом, периодатом или их комбинацией.
23. Способ получения высокофторированных карбоновых кислот и их солей, состоящий из обработки высокофторсодержащих спиртов с общей формулой (А):
A-CH2-OH
электрическим током электрохимического элемента для получения высокофторированной карбоновой кислоты или их солей с общей формулой (А1):
А-СОО-М+,
где М+ является катионом, и где «А» в формулах (А) и (В) является одинаковым веществом, и представляющим остаток:
Rf-[O]p-CX''Y''-[O]m-CX'Y'-[O]n-CXY-, где
Rf является фторированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, р, m и n являются независимыми друг от друга эфирами 1 или 0; X, X', X'', Y, Y' и Y'' являются независимыми друг от друга прочими Н, F, CF3, или C2F6, при условии, что не все X, X, X'', Y, Y' и Y'' являются Н.
24. Способ получения высокофторированных карбоновых кислот и их солей, состоящий из реакции высокофторсодержащих спиртов с общей формулой (G):
R-CFX-CH2-OH
с соединением, содержащим группу нитроксильных радикалов и окислитель для получения реагирующего раствора, состоящего из фторированной карбоновой кислоты или ее солей, где фторированная карбоновая кислота или ее соли соответствуют общей формуле (Н):
R-CFX-COO-M+,
где М+ является катионом, и где Х и R в формулах (G) и (Н) одинаковы, и где Х и R являются независимо выбранными из водорода, галогена или остатков алкила, алкенила, циклоалкила или арила, которые могут содержать, а могут не содержать один или несколько атомов фтора, и которые могут содержать, а могут не содержать один или несколько катенарных атомов кислорода.
25. Способ в соответствии с вариантом 24, где реакция фторированного спирта, соединения, содержащего группу свободного нитроксильного радикала и окислителя поддерживается при показателе рН от, примерно, 7,5 до, примерно, 14.
26. Способ в соответствии с любым из вариантов 24-25, где фторированный спирт, соединение, содержащее группу свободного нитроксильного радикала и окислитель вступают в реакцию в смеси при существенном отсутствии органического растворителя.
27. Способ в соответствии с любым из вариантов 24-25, где фторированный спирт, соединение, содержащее группу свободного нитроксильного радикала и окислитель вступают в реакцию в смеси в присутствии органического растворителя.
28. Способ в соответствии с вариантом 27, где органический растворитель выбирается из: ацетонитрила, тетрагидрофурана, диэтилового эфира, метил-трет-бутилового эфира, диметоксиэтана, 2-метоксиэтилового эфира (простого диметилового эфира диэтиленгликоля), триэтиленгликоль диметилэфира (сложного диметилового эфира диэтиленгликоля), толуола, бензола, гексана, пентана, диоксана, дихлорметана, хлороформа, тетрахлорида углерода и их комбинаций.
29. Способ в соответствии с любым из вариантов 24-28, где, как минимум, 60 молярных % фторированного спирта окисляется до фторированных карбоновых кислот или их солей.
30. Способ в соответствии с любым из вариантов 24-29, где в реагирующем растворе существенно отсутствует фторированный спирт.
31. Способ в соответствии с любым из вариантов 24-30, где соединение, имеющее группу свободного нитроксильного радикала, соответствует общей формуле (D):

где каждый из R1-R6 могут быть идентичными или различными, и, независимо друг от друга, представлять насыщенные алифатические и/или ароматические остатки или их комбинации.
32. Способ в соответствии с любым из вариантов 24-31, где соединение, имеющее группу свободного нитроксильного радикала, соответствует общей формуле (Е):

где каждый из R7, R8, R9 и R10 могут быть идентичными или различными, и, независимо друг от друга, представлять насыщенные алифатические или ароматические остатки или их комбинации, R11 и R12 могут быть идентичными или различными, и представлять водород, гироксил или атомы углерода, имеющие насыщенные линейные или разветвленные или циклические алифатические или ароматические остатки или их комбинации.
33. Способ в соответствии с вариантом 32, где R11 и R12 могут быть идентичными или различными, и выбираются из: Н, ОН, NH2, SCN, ОРО3Н2, NHCOCH3, ОСОС6Н5, СО2Н, СО2СН3, CN, OSO2, СН3, N+(СН3)3, CH2NH2, NHCH2C6H5, NCH3COCH3, N+(СН3)2СН2СН2ОН и их комбинаций.
34. Способ в соответствии с любым из вариантов 24-33, где соединение, имеющее группу свободного нитроксильного радикала, выбирается из: 2,2,6,6-тетраметил-пиперидин-1-оксил (TEMPO);
4-метокси-2,2,6,6-тетраметил-пиперидин-1-оксил;
4-гидрокси-2,2,6,6-тетраметил-пиперидин-1-оксил и
4-ацетамидо-2,2,6,6-тетраметил-пиперидин-1-оксил;
2,2,6,6-тетраметил-4-пиперидин-4-один-1-оксилоксим;
RAC-2,2,6,6-тетраметил-пиперидин-N-оксил-4,4-(5-спирогидантоин); 2,2,6,6-тетраметил-пиперидин-1-оксил1-4-амино-4-карбоновая кислота и их комбинаций.
35. Способ в соответствии с любым из вариантов 24-34, где соединение, имеющее группу свободного нитроксильного радикала, находится в объеме от, примерно, 0,5 до, примерно, 10 молярных % относительно фторированного спирта.
36. Способ в соответствии с любым из вариантов 24-35, где окислитель выбирается из: гипохолоритов, трихлоризоциануровой кислоты, гипобромитов, хлоритов, йолисил бензола, йодбензол дихлорида, кислорода/воздуха, озона, солей азотистой кислоты и их комбинаций.
37. Способ в соответствии с любым из вариантов 24-36, где окислитель находится в объеме от 2 до 10 объемов фторированного спирта.
38. Способ в соответствии с любым из вариантов 24-37, где фторированный спирт, соединение, содержащее группу свободного нитроксильного радикала и окислитель вступают в реакцию в смеси в присутствии катализатора межфазового переноса, выбираемого из: тетра-п-октиламмоний галогениды и тетраметил аммоний галогениды, тетрабутил аммоний галогениды, бензил трифенил галоидный фосфоний, 18-краун-б, полиэтиленгликоль 400 и их комбинаций.
39. Способ в соответствии с любым из вариантов 24-37, где в реагирующем растворе существенно отсутствует катализатор межфазового переноса.
40. Способ в соответствии с любым из вариантов 24-39, где фторированный спирт, соединение, содержащее группу свободного нитроксильного радикала и окислитель вступают в реакцию при температуре в диапазоне от комнатной до, примерно, 90°С.
41. Способ в соответствии с любым из вариантов 24-40, где R является частично или полностью фторированным.
42. Способ в соответствии с любым из вариантов 24-41, где фторированные карбоновые кислоты имеют формулы:
C6H5CHFCOOH, CF3CF2OCF2CF2OCF2COOH, CHF2(CF2)5COOH,
CF3(CF2)6СООН, CH3CHFCOOH, CF3O(CF2)3OCF(CF3)СООН,
CF3CF2CH2OCF2CH2OCF2COOH, CF3O(CF2)3OCHFCF2COOH,
CF3O(CF2)3OCF2COOH, CF3(CF2)3(CH2CF2)2CF2CF2CF2COOH,
CF3(CF2)2CH2(CF2)2COOH, CF3(CF2)2COOH,
CF3(CF2)2(OCF(CF3)CF2)OCF(CF3)COOH, CF3(CF2)2(OCF2CF2)4OCF(CF3)COOH,
CF3CF2O(CF2CF2O)3CF2COOH, и их соли.
43. Способ в соответствии с любым из вариантов 24-42, где время реакции составляет менее 2 часов.
44. Способ в соответствии с любым из вариантов 24-43, имеющий, кроме описанного, как минимум одно из:
(a) добавление концентрированной кислоты для создания расщепления фаз, и:
(b) добавления кислоты и экстракции с помощью органического растворителя.
45. Способ в соответствии с любым из вариантов 24-44, имеющий, кроме описанного, дистилляцию для отделения фторированной карбоновой кислоты.
Примеры
Подготовка составов настоящего раскрытия описана далее, в следующих примерах. Конкретные материалы и их объемы, указанные в данных примерах, а также другие условия и подробности, не должны толковаться как излишне ограничивающие данное раскрытие. Если не указано или не ясно иное, все материалы можно свободно приобрести на рынке, например, у компании Sigma-Aldrich Chemical Company, Milwaukee, Wisconsin, или известны специалистам.
В настоящем руководстве использованы следующие сокращения: эк = эквивалент, г = грамм, М = молярная, мин = минута, ммоль = миллимоль, ч = час, мл = миллилитр, ммРт = миллиметров ртутного столба, л = литр, в = вес, Фурье-ИКС = преобразование Фурье - инфракрасная спектроскопия, ЯМР = ядерный магнитный резонанс и GC-MS = газовая хроматография-масс-спектрометрия.
Если не указано иное, получившийся образец анализировался с использованием протона или ЯМР фтора следующим образом. Пики ЯМР были объединены. Пиковые области, считавшиеся принадлежащими фторированному спирту или его производной, были нормализованы (т.е., учитывалось количество фтора или протонов в конкретном пике), затем суммировались для получения нормализованной общей пиковой области. Нормализованная область конкретного пика делилась на нормализованную общую пиковую область, а затем умножалась на 100% для получения примерного молярного % конкретного пика. Неустановленные побочные продукты считались имеющими одинаковое с фторированной карбоновой кислотой молярное поглощение в ЯМР. Если не указано иное, в приведенных ниже примерах, процентные данные, полученные с помощью анализа ЯМР, указаны в молях.
Сравнительный пример 1
Смесь 1,00 г (2.62 ммоль, 1 эк.)
2,2,3-трифторо-3-(1,1,2,2,3,3-гексафторо-3-трифторметоксипропокси)пропан-1-ол (полученный, как описано в публикации США №2007/0015864, (Hintzer и др.), соединение 11), 7,69 г раствора в 5,25 масс. доли (5,42 ммоль, 2,07 эк) гипохлорита натрия, и 0,362 г (2.62 ммоль, 1 эк) карбоната калия была нагрета до 55°С в течение 20 ч и охлаждена.
Смесь была охлаждена в ледяной бане, и, с бурным выделением газа, было добавлено 0,817 г (7,85 ммол, 3 эк) гидросульфита натрия в 1,00 мл воды. Смесь размешивалась в течение 1 ч, а затем, при охлаждении, было добавлено 5,67 мл 18 молярного раствора (102 ммоль, 38,9 эк) серной кислоты (концентрированной, 96%). Последовало бурное выделение тепла, и были приняты меры для недопущения повышения температуры смеси выше 25°С. Была образована двухфазная смесь, и нижняя фаза была отделена и концентрирована в вакууме для получения 1,0 г сырого продукта.
С помощью ЯМР 19F и 1Н, было определено, что сырой продукт содержит примерно 80% 2,2,3-трифторо-3-(1,1,2,2,3,3-гексафторо-3-трифторометоксипропокси) пропионовой кислоты, и примерно 20% 2,2,3-трифторо-3-(1,1,2,2,3,3-гексафторо-3-трифторометоксипропокси)пропан-1-ол.
Сравнительный пример 2
В 11,3 г 5,25% раствора (7,97 ммоль, 2.9 эк) гипохлорита натрия и 0,493 г (3,570 ммоль, 1,3 эк) карбоната калия, нагретого до 55°С, было добавлено 0,00601 г (0,0384 ммоль, 0,014 эк) TEMPO (2,2,6,6-тетраметил-пиперидин-1-оксил (поставляемого компанией Alfa Aesar, Ward Hill, MA, под торговой маркой «TEMPO FREE RADICAL»). Когда температура реакции достигла 55°С, было порционно добавлено 1,00 г (2,75 ммоль, 1 эк) 3,3,4,4,5,5,6,6,7,7,8,8,8-тридекафтороктан-1-ол в течение 30 мин, а затем смесь перемешивалась при температуре в 55°С в течение 30 мин. Все время смесь оставалась в виде двух жидких фаз. Смесь была охлаждена в водяной бане, и было добавлено 0,8574 г (8,239 ммол, 3 эк) гидросульфита натрия в 1,57 мл воды. Данная смесь перемешивалась в течение 20 мин, после чего в нее было добавлено 0,915 мл (11,0 ммоль, 4 эк) соляной кислоты (концентрированной, 12 молярный раствор, 37% в воде). Измеренный показатель рН составил менее 1. Смесь была экстрактирована с помощью метил-трет-бутилового эфира, а органический слой был смыт водой, и концентрирован в вакууме для получения сырого продукта.
С помощью ЯМР ХН, было определено, что сырой продукт содержит примерно 35% 3,3,4,4,5,5,6,6,7,7,8,8,8-тридекафтороктан-1-ол, примерно 35% одиночного неопределенного продукта, а остальные 30% были комплексной смесью неопределенных продуктов (исходя из химического сдвига, наблюдаемого с помощью ЯМР считалось, что около 8% были эфиром, полученным из начального фторированного спирта и требуемой фторированной карбоновой кислотой). С помощью ЯМР 1Н не наблюдалось видимой фторированной карбоновой кислоты.
Сравнительный пример 2В
Сравнительный пример 2В был создан в соответствии с процедурой, описанной в Сравнительном примере 2А, за исключением того, что смесь была нагрета до 65°С в течение 4 ч, вместо 30 мин при 55°С. Сырой продукт был собран и анализирован с использованием ЯМР 1Н, который показал, что получившийся материал был аналогичен материалу, наблюдавшемуся в Сравнительном примере 2А.
Сравнительный пример 3
К 15,6 г смеси 5,25% водного раствора (11,0 ммоль, 4 эк) гипохлорита натрия, 0,0751 г (0,137 ммоль, 0,05 эк) тетра-n-октиламмоний бромида, 0,491 г (5,85 ммоль, 2,13 эк) бикарбоната натрия, 0,00601 г (0,0385 ммоль, 0,014 эк) TEMPO (pH смеси был 8.5), и 0,0327 г (0,275 ммоль, 0,1 эк) бромида калия было капельно добавлено 1,00 г (2,75 ммоль, 1 эк) 3,3,4,4,5,5,6,6,7,7,8,8,8-тридекафтороктан-1-ола. Смесь была нагрета до 35°С (с начальным выделением тепла до 45°С) и оставалась при 35°С в течение 1 ч. Смесь была оставлена для охлаждения до комнатной температуры, после чего был измерен показатель pH. Значение показателя pH было 8.5. Вместе с охлаждение был добавлен раствор 0,857 г (8,24 ммоль, 3 эк) гидросульфита натрия в 1,50 мл воды. Данная смесь перемешивалась в течение 30 мин, после чего в нее было добавлено 1,49 мл (17,9 ммоль, 6,5 эк) соляной кислоты (концентрированной, 12 молярный раствор, 37% в воде). Это привело к образованию белесоватой смеси с показателем pH менее 1.
Данная смесь была экстрактирована с помощью примерно 30 мл метил-трет-бутилового эфира. Органический слой был отделен и концентрирован для получения сырого продукта.
С помощью ЯМР 1Н, было определено, что сырой продукт содержит примерно 35% 3,3,4,4,5,5,6,6,7,7,8,8,8-тридекафтороктан-1-ола, а остальные 65% были комплексной смесью неопределенных продуктов. С помощью ЯМР Н не наблюдалось видимой фторированной карбоновой кислоты.
Сравнительный пример 4
К 28,5 г 5,25% раствора (20,1 ммоль, 2,9 эк) гипохлорита натрия и 1,24 г (9,01 ммоль, 1,3 эк) карбоната калия, нагретого до 55°С было добавлено 0,0151 г (0,0970 ммоль, 0,014 эк) TEMPO. Когда температура реакции достигла 55°С, было порционно добавлено 1,00 г (6,93 ммоль, 1 эк) спирта, 1-нонанола. В течение 30 мин реакция была нагрета до 55°С, а затем до 65°С в течение 2,5 ч. Смесь была охлаждена до комнатной температуры, и, с бурным выделением газа, было добавлено 2,164 г (20,80 ммол, 3 эк) гидросульфита натрия в 3,97 мл воды. Данная смесь перемешивалась в течение 30 мин, после чего в нее было добавлено 2,31 мл (27,7 ммоль, 4 эк) соляной кислоты (концентрированной, 12 молярный раствор, 37% в воде). К данной смеси было добавлено 20 мл метил-трет-бутилового эфира. Смесь подверглась расщеплению фаз, и органический слой был отделен и концентрирован в вакууме для получения 0,60 грамм сырого продукта.
С помощью ЯМР 1Н, было определено, что сырой продукт содержит примерно 8% 1-нонанола, около 40% нонановой кислоты, а остальные 52% были комплексной смесью неопределенных продуктов.
Сравнительный пример 5
К смеси 10,0 г (26,2 ммоль, 1 эк) 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола, 0,0573 г (0,366 ммоль, 0,014 эк) TEMPO и 0,716 г (1,30 ммоль, 0,05 эк) тетра-n-октиламмоний бромида было добавлено 92,0 г 6,35% раствора (78,5 ммоль, 3 эк) гипохлорита натрия. Смесь выделяла тепло с температурой около 32°С без внешнего охлаждения. Добавление заняло около 30 мин, а затем смесь была нагрета до 35°С в течение 90 минут и оставлена охлаждаться. Водная фаза была удалена, а органическая фаза была перемешана с 62,8 мл гипохлорита натрия (1 молярный, водный) и промыта со смесью из 25 мл метил-трет-бутилового эфира и 25 мл циклогексана. Данная органическая фаза была концентрирована и анализирована с помощью 1Н и 19F ЯМР, и было обнаружено, что органическая фаза состояла, в основном, из фторированного спирта. Удаленная водная фаза была окислена с помощью 6,98 мл соляной кислоты (концентрированной, 12 молярный раствор, 37% в воде), а затем экстрагирована с помощью метил-трет-бутилового эфира. Получившаяся органическая фаза далее была концентрирована до получения выхода в 5,0 г сырого продукта, что дает выход фторированной карбоновой кислоты в 45%.
Как было определено с помощью ЯМР 19F и 1Н, сырой продукт содержал примерно 90%
2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропионовой кислоты, примерно 8% of
2,2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола и примерно 2% тетра-n-октиламмоний бромида.
Сравнительный пример 6
Раствор, содержащий 9,20 г 6,35% раствор (7,85 ммоль, 3 эк) гипохлорита натрия и 5,73 мг (0,0366 ммоль, 14,0 эк) TEMPO, и имеющий показатель рН около 14, был нагрет до 55°С. Затем в него было добавлен 1,00 г (2.62 ммоль, 1 эк) of 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола. Смесь нагревалась при температуре в 55°С в течение 60 мин. Показатель рН водной фазы был около 7. Был добавлен раствор 0,817 г (7,85 ммоль, 3 эк) гидросульфита натрия в 2,00 мл воды. Данная смесь перемешивалась в течение 20 мин, после чего в нее было добавлено 2,0 мл соляной кислоты (концентрированной, 12 молярный раствор, 37% в воде). Смесь была экстрактирована с помощью метил-трет-бутилового эфира, а органический слой был отделен и концентрирован в вакууме для получения 0,4 грамм сырого продукта.
Исследование с помощью ЯМР 19F показало, что сырой продукт содержал примерно 2:5% 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола, примерно 25% 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропановой кислоты, а остальные 50% были сложной смесью неустановленных побочных продуктов.
Пример 1
К смеси из 92,8 г 5,25% раствора (65,4 ммоль, 2,5 эк) гипохлорита натрия и 2,09 г (52,3 ммоль, 2 эк) гидроксида натрия была добавлена смесь из 10,0 г (26,2 ммоль, 1 эк) 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола, 0,0573 г (0,366 ммоль, 0,014 эк) TEMPO и 0,716 г (1,30 ммоль, 0,05 эк) тетра-n-октиламмоний бромида. Смесь перемешивалась и нагревалась до 40°С в течение около 2 ч. В попытке выделить фторированную карбоновую кислоту с одновременным удержанием тетра-n-октиламмоний бромида, была произведена следующая процедура. Реагирующий раствор был охлажден, а затем промыт смесью из метил-трет-бутилового эфира/гексанов в пропорции 50:50. К органической фазе было добавлено 8,0 мл 12 М раствора соляной кислоты. Смесь была экстрактирована с помощью метил-трет-бутилового эфира, а органическая фаза была отфильтрована и концентрирована для получения 8,5 грамм сырого продукта.
По данным ЯМР 1Н и 19F, сырой продукт содержал около 96% of 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропановой кислоты и примерно 4% тетра-n-октиламмоний бромида (исходного материала), без обнаружимых объемов исходного фторированного спирта. Общий выход фторированной карбоновой кислоты в сыром продукте был 81%.
Пример 2
К 108 г 5,25% раствора (75,9 ммоль, 2,9 эк) гипохлорита натрия и 4,70 г (34,0 ммоль, 1,3 эк) карбоната калия, нагретого до 65°С был добавлен раствор из 0,0286 г (0,183 ммоль, 0,007 эк) TEMPO в 0,5 г 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола. Смесь нагревалась в течение 30 мин. Было порционно добавлено еще больше 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола (9,5 г до общего количества добавленного в реакцию фторированного спирта в 10,0 г, 26,2 ммоль, 1 эк) таким образом, что температура реакции оставалась между 55°С и 58°С, что заняло около 40 мин. После этого реакция перемешивалась при температуре в 55°С в течение 30 мин, и охладилась в ледяной бане, после чего было добавлен раствор 8,171 г (78,5 ммоль, 3 эк) гидросульфита натрия в 15,0 мл воды с такой скоростью, чтобы температура не поднималась выше 25°С. Данная смесь перемешивалась в течение 20 мин, после чего, вместе с охлаждением в ледяной бане, было добавлено 56,7 мл 18 М раствора серной кислоты (концентрированной; 96%). Смесь подверглась расщеплению фаз, и нижняя фаза, прозрачная жидкость, была собрана, что дало 10,0 г сырого продукта.
Исследование ЯМР 1Н и 19F показало отсутствие обнаружимого количества 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола в сыром продукте, а преобразование до фторированной карбоновой кислоты явилось квалифицирующимся с поддающимися количественному определению побочными продуктами.
Собранный материал нижней фазы был дистиллирован при давлении в 31 ммРт и температуре в 101,8-102,4°С. Имелся небольшой головной погон при 25°С, который был отброшен. После дистилляции, 9,05 г 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропионовой кислоты, как было определено с помощью анализа ЯМР 1Н и 19F NMR и GC-MS, был собран, что дало выход в 91,5%.
Пример 3
К смеси из 0,0057 г (0,037 ммоль, 0,014 эк) TEMPO и 0,0716 г (0,131 ммоль, 0,05 эк) тетра-n-октиламмоний бромида был добавлен раствор из 11,1 г 5,25% раствора (7,85 ммоль, 3 эк) гипохлорита натрия и 0,468 г (5,57 ммоль, 2,13 эк) бикарбоната натрия, после чего было добавлено 1,00 г (2,62 ммоль, 1 эк) of 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола. Показатель рН раствора был определен на уровне около 8,5. Смесь была перемешана без внешнего охлаждения, и, после продолжительного индукционного периода, смесь нагрелась до 33°С. Смесь была оставлена для охлаждения до комнатной температуры. Показатель рН раствора был определен на уровне 8,5. В смесь был добавлен раствор из 0,817 г (7,85 ммоль, 3 эк) гидросульфит натрия в 5 мл воды, и смесь перемешивалась в течение 30 мин. После этого было добавлено 0,698 мл (8,37 ммоль, 3,2 эк) соляной кислоты (концентрированной, 12М, 37% в воде), что привело к образованию белесоватой смеси с показателем рН менее 1. Данная смесь была экстрактирована с помощью примерно 30 мл метил-трет-бутилового эфира. Органический слой был отделен и концентрирован для получения 1,17 г сырого продукта.
Как было определено с помощью ЯМР 1Н, сырой продукт содержал около 70% 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропановой кислоты, что соответствует примерно 86 массовым % фторированной карбоновой кислоты, указывая на количественное преобразование фторированного спирта во фторированную карбоновую кислоту. Как было определено с помощью ЯМР 1Н, сырой продукт также содержал около 3,5% тетра-n-октиламмоний бромида и, примерно, 26% метил-трет-бутилового эфира. ЯМР анализ 19F сырого продукта показал отсутствие обнаружимого количества 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропан-1-ола.
Пример 4
К 12,4 г 5,25% раствора (8,73 ммоль, 2,9 эк) гипохлорита натрия и 0,541 г (3,91 ммоль, 1,3 эк) карбоната калия, нагретого до 55°С было добавлено 0,007 г (0,0422 ммоль, 0,014 эк) TEMPO. Показатель рН смеси был определен на уровне около 13-14.
Когда температра реакции достигла 55°С, был капельно добавлен 1,00 г (3,01 ммол, 1 эк) 2,2,3,3,4,4,5,5,6,6,7,7-додекафторгептан-1-ол (поставляемый компанией VWR International, West Chester, PA). Реакция увеличила температуру до уровня около 70°С, после чего была оставлена охладиться до 55°С, и смесь была перемешана в течение 30 мин при 55°С, после чего была охлаждена на водяной бане. Показатель рН смеси был определен на уровне около 10.
После этого был добавлен раствор 0,940 г (9,03 ммоль, 3 эк) гидросульфита натрия в 1,73 мл воды. Данная смесь перемешивалась в течение 20 мин, после чего в нее было добавлено 1,00 мл (12,0 ммоль, 4 эк) соляной кислоты (концентрированной, 12 М, 37% в воде). Смесь была экстрактирована с помощью метил-трет-бутилового эфира, а органический слой был смыт водой и концентрирован d dfreevt для получения 1,03 грамм сырого продукта.
Как было определено с помощью ЯМР 1Н, сырой продукт содержал 0,95 г 2,2,3,3,4,4,5,5,6,6,7,7-додекафторгептановой кислоты. Это дает выход фторированной карбоновой кислоты в размере 91% с оставшимся сырым продуктом, в основном, в виде остаточного метил-трет-бутилового эфира.
ЯМР 19F и 1Н сырого продукта выявил примерно 0,5% 2,2,3,3,4,4,5,5,6,6,7,7-додекафторгептан-1-ол.
Пример 5
К 10,3 г 5,25% раствора (7,25 ммоль, 2,9 эк) гипохлорита натрия и 0,449 г (3,25 ммоль, 1,3 эк) карбоната калия, нагретого до 55°С было добавлено 0,00547 г (0,0350 ммоль, 0,014 эк) TEMPO. Показатель рН смеси был определен на уровне около 13-14.
Когда температра реакции достигла 55°С, был порционно добавлен 1,00 г (2,5 ммол, 1 эк) 2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-пентадекафтороктан-1-ол (поставляемый компанией VWR International, West Chester, PA). Выделения тепла не наблюдалось. В течение 30 мин смесь была нагрета при 55°С, а затем при 65°С в течение 1 ч. После этого, смесь была охлаждена до комнатной температуре, а ее показатель рН был установлен на уровне около 10. Реакция была охлаждена в водяной бане, и аккуратно, из-за бурного выделения газа, было добавлено 0,780 г (7,498 ммол, 3 эк) гидросульфита натрия в 1,43 мл воды. После этого смесь была перемешана в течение 30 мин, и было добавлено 0,833 мл (10,0 ммоль, 4 эк) соляной кислоты (концентрированной, 12М, 37% в воде), а показатель рН смеси был был установлен на уровне менее 1. К данной смеси было добавлено 20 мл метил-трет-бутилового эфира, твердые вещества растворились, а смесь стала представлять две жидкие фазы. Смесь подверглась расщеплению фаз, и органический слой был отделен и концентрирован в вакууме для получения 1,0 г сырого продукта.
Как было определено с помощью ЯМР 1Н, сырой продукт содержал 0,93 г 2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-пентадекафторкаприловой кислоты. Это дает выход фторированной карбоновой кислоты в размере 90% с оставшимся сырым продуктом, в основном, в виде остаточного метил-трет-бутилового эфира. ЯМР 19F и 1Н сырого продукта показал отсутствие обнаружимого количества 2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-пентадекафтороктан-1-ола или любых других побочных продуктов.
Пример 6
В 12,4 г 5,25% раствора (8,73 ммоль, 2.9 эк) гипохлорита натрия и 0,541 г (3,91 ммоль, 1,3 эк) карбоната калия, нагретого до 55°С, было добавлено 0,00785 г (0,0422 ммоль, 0,014 эк) радикала 4-метокси-2,2,6,6-тетраметил-1-пиперидиноксила (известного как Methoxy-TEMPO от компании Alfa Aesar, Ward Hill, MA), а показатель pH смеси был определен как, примерно, 13-14.
Когда температура реакции достигла 55°С, было капельно добавлено 1,00 г (3,01 ммоль, 1 эк)2,2,3,3,4,4,5,5,6,6,7,7-додекафторгептан-1-ола.
Реакция нагрелась примерно до 60°С, и перемешивалась при температуре в 55°С в течение 30 мин Затем смесь была нагрета до 65°С в течение 90 мин и охлаждена с помощью водяной бани. Показатель pH смеси был установлен на уровне около 10, и в нее было добавлено 0,940 г (9,03 ммоль, 3 эк) гидросульфита натрия в 1,73 мл воды. Данная смесь перемешивалась в течение 20 минут, после чего в нее было добавлено 1,00 мл (12,0 ммоль, 4 эк) соляной кислоты (концентрированной, 12 М, 37% в воде). Измеренный показатель pH составил менее 1. Смесь была экстрактирована с помощью метил-трет-бутилового эфира, органический слой был смыт водой, и концентрирован в вакууме для получения 1,117 г сырого продукта.
Сырой продукт содержал: 1,00 г of 2,2,3,3,4,4,5,5,6,6,7,7-додекафторгептановой кислоты, как было определено с помощью ЯМР 1Н. Это дает выход фторированной карбоновой кислоты в размере 95,9%. ЯМР 19F и 1Н сырого продукта выявил примерно 98,4% фторированной карбоновой кислоты, примерно 0,6% of 2,2,3,3,4,4,5,5,6,6,7,7-додекафторгептан-1-ола и примерно 0,5% каждого из двух других неопределенных побочных продуктов.
Пример 7
К 26,3 г 5,25% раствора (18,6 ммоль, 2,9 эк) гипохлорита натрия, 1,15 г (8,32 ммоль, 1,3 эк) карбоната калия и 0,0140 г (0,0896 ммоль, 0,014 эк) радикала 2,2,6,6-тетраметил-1-пиперидиноксила, TEMPO, нагретого до 55°С, было добавлено 0,500 г (6,40 ммоль, 1 эк) 2-фторпропан-1-ола (поставляемого SynQuest Laboratories, Inc., Tucson, AZ). Реакция нагрелась до температуры около 65°С и была оставлена охлаждаться до температуры в 55°С, а затем перемешивалась при 55°С в течение 60 мин, а затем охладилась до комнатной температуры. В смесь был добавлен раствор 0,902 г (8,67 ммоль, 3 эк) гидросульфита натрия в 1,66 мл, и произведено перемешивание в течение 20 минут. После этого было произведено добавление 1,00 мл (12,0 ммоль, 4 эк) соляной кислоты (концентрированной, 12 М, 37% в воде).
Часть реагирующего раствора была смешана с равным количеством D20, а ЯМР 19F и 1Н данного раствора показал требуемую фторированную карбоновую кислоту с отсутствием обнаружимого исходного фторированного спирта и отсутствием побочных продуктов, указывая на количественное преобразование фторированного спирта во фторированную карбоновую кислоту. Смесь была экстрактирована с помощью метил-трет-бутилового эфира, органический слой был концентрирован в вакууме для получения 0,32 г сырого продукта, что являлось 54% выходом фторированной карбоновой кислоты. Низкий выход был предсказуем в силу высокой растворимости получающейся фторированной карбоновой кислоты в воде. ЯМР 1Н и 19F сырого продукта указывал на образование требуемой фторированной карбоновой кислоты с отсутствием других обнаруживаемых органических соединений.
Пример 8
К 10,8 г 5,25% раствора (7,59 ммоль, 2,9 эк) гипохлорита натрия, 0,470 г (3,40 ммоль, 1,3 эк) карбоната калия и 0,00572 г (0,03664 ммоль, 0,014 эк) радикала 2,2,6,6-тетраметил-1-пиперидиноксила, TEMPO, нагретого до 55°С, было добавлено 1,0 г (2,62 ммоль, 1 эк) 2,3,3,3-тетрафтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметоксипроксиокси)пропан-1-ола (полученного путем редуцирования NaBH4 фторангидрида, описанного в патенте США №7,176,331). Реакция не выделяла тепла и смесь перемешивалась при 55°С в течение 30 мин; в этот момент аликвота растворилась в D2O. ЯМР анализ 19F показал полное поглощение фторированного спирта, указывая на количественное преобразование. Смесь нагревалась до 55°С в течение дополнительных 2 ч и охладилась до комнатной температуры. К смеси был добавлен раствор из 0,817 г (7,85 ммоль, 3 эк) гидросульфит натрия в 1,50 мл воды, и смесь перемешивалась в течение 20 мин После этого было добавлено 0,872 мл (10,5 ммоль, 4 эк) соляной кислоты (концентрированной, 12М, 37% в воде). Смесь была экстрактирована с помощью метил-трет-бутилового эфира, органический слой был концентрирован в вакууме для получения 0,57 г сырого продукта, что являлось 57% выходом.
ЯМР анализ 1Н и 19F сырого продукта указывал на образование требуемой фторированной карбоновой кислоты при отсутствии 2,3,3,3-тетрафтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметоксипроксиокси)пропан-1-ола.
В предыдущих примерах, ЯМР измерения 1Н производились на оборудовании Bruker DPX 200 MHz (Bruker Corp., Billerica, MA), работавшим с частотой в 200,13 МГц для ЯМР 1Н (триметилсилан) и 188,31 МГц для 19F (CFCl3) с использованием следующих реагентов и химических веществ:
TEMPO на полистироле (загрузка в 2,5 ммоль/г, Fluka, кат. №72601); синоним: (ТЕМРО-4-оксиметил) полистирол;
TEMPO, 2,2,6,6-тетраметил-пиперидин-1-оксил, (Merck, кат. №8146810025);
4-Метокси TEMPO (Alfa Aesar, кат. №15915);
4-Гидрокси TEMPO (Merck, кат. №840130);
ABNO, 9-Аза-бицикло[3.3.1]нонан N-оксил, полученный в соответствии с J. Org. Chem., 74,2009,4619.;
AZADO, 2-Азаадамантан N-оксил (Aldrich, кат. №701718)
2,2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)пропан-1-ол
(Dyneon GmbH, ФРГ);
2,2,3,3,4,4,5,5-октафторо-пентан-1-ol (Acros Organics 98%, кат. №312310250);
MA31 {1,1,2,2,3,3-гексафтор-1-торифторметокси-3-трифторвинилокси-пропан}
(Dyneon GmbH, ФРГ);
2,2,3,4,4-пентафтор-4-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-бутан-1-ол, полученный путем добавления радикала метанола в МА31, в соответствии с Zh. Vses. Khim. O-va, 1979, стр.656;
Кислота 131 (дифтор-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-уксусная кислота,
(Dyneon GmbH, ФРГ);
2,2-дифтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-этанол, полученный путем редуцирования кислоты 131 с использованием L1AIH4, в соответствии с J. Fluorine Chem., 19 (1), 1981,35-42;
HFA, гексафторацетон, (регенерированный из HFA-гидрата, в соответствии с процедурой Ganeshpure, P.A.; Adam, W. Synthesis 1996, 179)
Полуторагидрат HFA (ABCR, кат. № AB 103692);
Трифторэтанол (Merck, кат. №8082590100);
Метилат калия (Alfa Aesar, кат. №014261);
14% гипохлорит натрия (VWR, кат. №27900296);
Нитрит натрия (Fluka, кат. №71760);
Нитрат тетрагидрат марганца (Acros Organics, кат. №193462500)
Нитрат гексагидрат кобальта (Acros Organics, кат. №213091000)
Ацетат натрия (Riedel de Haen, кат. №32319);
Уксусная кислота (VWR, кат. №20104334)
Ацетонитрил (Riedel de Haen, кат. №33019);
Бромид калия (Merck, кат. №1049050500);
Серная кислота 95-97% (Fluka, кат. №84720)
Пример 9:
2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометоксипропокси)пропионовая кислота (CF3-O-F2C-F2C-F2C-O-F2C-F2C-COOH) (1).
В стеклянную колбу объемом 5 л, оснащенную капельной воронкой и мешалкой, было помещено 275 мл воды, 1000 мл MeCN, 18,3 г of KBr, 15,9 г TEMPO на полистироле (2,5 ммоль/г загрузки) и 500 г (1,37 моль) 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)пропан-1-ола. 15% (по массе) водн. NaOCl с созданным рН 8-9 (2400 мл) были добавлены через капельную воронку 3 порциями во время двух дней перемешивания при комнатной температуре. Катализатор был отфильтрован и были добавлены концентрированная серная кислота и вода для придания кислотности реагирующей смеси. Органическая фаза была собрана и испарена с помощью вращающегося испарителя до получения бесцветной жидкости (615,44 г). Жидкость прошла дистилляцию с помощью водяного насоса (15 ммРт, 92°С) до получения на выходе 471,33 г кислоты. Выход: 91%. ЯМР анализ 1Н (CDCl3): 6,2 (dm, J=54,61 Гц, 1Н); 9,1 (s, 1H); ЯМР 19F (CDCl3): -56,3 (t, J=ок. 9 Гц, 3F); -85,2 (система AB, J=142 Гц, 1F); -86,98 (m, 2F); -87,8 (система АВ, J=142 Гц, 1F); -123,6 (m, 2F); -130,4 (m, 2F); -146,5 (dm, J=54 Гц, 1F).
Пример 10:
2,2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)пропионовая кислота (I)
Было использовано оборудование из примера 9. В колбу было помещено 5,5 мл воды, 20 мл MeCN, 0,36 г KBr, 0,12 г TEMPO (0,00077 моль) и 10 г 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)пропан-1-ола. 15% (по массе) водн. NaOCl с созданным рН 8-9 (48 мл) были добавлены через капельную воронку 3 порциями во время 18 часов перемешивания при комнатной температуре. Затем, для придания реагирующей смеси кислотности, была добавлена концентрированная серная кислота (1-2 мл, 95%). После экстракции с помощью диэтилового эфира, органические фазы были собраны и высушены с помощью сульфата магния. Растворитель был испарен до получения бесцветной жидкости (12,24 г), которая была дистиллирована с помощью водяного насоса (15 ммРт, 92°С) до получения 8,54 г чистой кислоты. Выход: 82%.
Сравнительный пример 7:
Был повторен Пример 10, за исключением того, что не использовался TEMPO. После реакции был проведен ЯМР анализ 19F. После 18 часов перемешивания при комнатной температуре, в карбоновую кислоту было преобразовано только 10% спирта.
Пример 11:
2,2,3,3,4,4,5,5-октафтор-пентановая кислота ((CF3-CF2-CF2-CF2-COOH, (2))
В стеклянную колбу объемом 100 мл, оснащенную капельной воронкой и мешалкой, было помещено 5,2 мл воды, 19 мл MeCN, 0,34 г KBr, TEMPO (0,12 г), и 6 г 2,2,3,3,4,4,5,5-октафтор-пентан-1-ола. 45 мл 15% (по массе) водн. NaOCl с созданным рН 8-9 было добавлено через капельную воронку 3 порциями в течение двух дней перемешивания при комнатной температуре. Затем, для придания реагирующей смеси кислотности, была добавлена концентрированная серная кислота (рН 1-2). Реагирующая смесь подверглась трехкратной экстракции с помощью диэтилового эфира, а объединенные органические фазы были высушены с помощью сульфата магния. Растворитель был испарен до получения бесцветной жидкости (8,98 г), которая была дистиллирована с помощью водяного насоса (15 ммРт, 73°С) до получения 5,13 г кислоты. Выход: 80%. ЯМР анализ 1Н (CDCl3): 6.08 (tt, J=52 Гц, J=5,3 Гц, 1Н); 8,6 (s, 1H); ЯМР анализ 19F (CDCl3): -120,6 (t, J=9,2 Гц, 2F); -125,81 (m, 2F); -130,61 (m, 2F); -138,4 (dm,J=52 Гц, 2F).
Пример 12:
2,2,3,4,4-пентафтор-4-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)масляная кислота (CF3-O-CF2CF2CF2-O-CF2CFHCF2-COOH (3))
В стеклянную колбу объемом 50 мл, оснащенную капельной воронкой и мешалкой, было помещено 2,4 мл воды, 8 мл MeCN, 0,16 г KBr, TEMPO (0,06 г) и 5 г 2,2,3,4,4-пентафтор-4-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-бутан-1-ола (полученного в соответствии с Zh. Vses. Khim. Ova, 1979, p 656). 24 мл 15% (по массе) водн. NaOCl с созданным рН 8-9 было добавлено через капельную воронку 3 порциями в течение двух дней перемешивания при комнатной температуре. Затем, для придания реагирующей смеси кислотности, была добавлена концентрированная серная кислота (рН=1-2). Реагирующая смесь подверглась трехкратной экстракции с помощью диэтилового эфира, а объединенные эфирные фазы были высушены с помощью сульфата магния. Растворитель был испарен до получения бесцветной жидкости, которая была дистиллирована с помощью водяного насоса (15 ммРт, 75°С) до получения 4,17 г кислоты.
Выход: 81%. ЯМР анализ 1Н (CDCl3): 5,2 (dm, J=43 Гц, 1Н); 10,2 (s, 1H); ЯМР анализ 19F (CDCl3): -56,3 (t, J=8,3 Гц, 3F); -78,5 (m, 2F); -84,7 (m, 2F); -86,87 (m, 2F); -130,45 (m, 2F); -117,9 (система АВ, J=277 Гц, 1F); -121,6 (система АВ, J=277 Гц, 1F); -130,5 (m, 2F); -214,1 (dm, J=43 Гц, J=ок. 11 Гц, 1F).
Пример 13:
Дифтор-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-уксусная кислота (CF3-O-CF2CF2CF2-O-CF2-COOH (4))
В стеклянную колбу объемом 100 мл, оснащенную капельной воронкой и мешалкой, было помещено 5,5 мл воды, 16 мл MeCN, 0,32 г KBr, TEMPO (0,11 г) и 8 г 2,2-дифтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-этанола. 43 мл 15% (по массе) водн. NaOCl с созданным рН 8-9 было добавлено через капельную воронку 3 порциями в течение двух дней перемешивания при комнатной температуре. Для получения рН около 1-2, были добавлены концентрированная серная кислота и вода.
Реагирующая смесь подверглась трехкратной экстракции с помощью диэтилового эфира, а объединенные эфирные фазы были высушены с помощью сульфата магния. Растворитель был испарен для получения бесцветной жидкости, которая была дистиллирована с помощью водяного насоса (15 ммРт, 70°С) до получения 7,25 г кислоты. Выход: 87%. ЯМР анализ 1Н (CDCl3): 9,39 (s, 1H); ЯМР анализ 19F (CDCl3): -56,28 (t, J=8,7 Гц, 3F); -79,19 (t, J=11,9 Гц, 2F);.84,58 (m, 2F); -86,86 (m, 2F); -130,45 (m, 2F).
Пример 14:
Калиевая соль трифторуксусной кислоты (CF3-COOK (5))
В стеклянную колбу объемом 500 мл, оснащенную капельной воронкой и мешалкой, было помещено 20 мл воды, 73 мл MeCN, 1,33 г KBr, TEMPO (0,46 г), и 10 г трифторэтанола. 175 мл 15% (по массе) водн. NaOCl с созданным рН 8-9 было добавлено через капельную воронку 3 порциями в течение двух дней перемешивания при комнатной температуре. Для придания реагирующей смеси кислотности (рН=1-2), к ней были добавлены концентрированная серная кислота и вода. Реагирующая смесь подверглась трехкратной экстракции с помощью диэтилового эфира. Объединенные эфирные фазы были высушены с помощью сульфата магния, а затем дистиллированы при атмосферном давлении. К дистилляту были добавлены метанол (60 мл) и метилат калия (7 г), после чего, смесь перемешивалась в течение одного часа при комнатной температуре, прошла фильтрацию и испарение до получения бесцветного твердого вещества (13,13 г). Выход: 86%. ЯМР анализ 19F (D2O): -76,82 (s, 3F).
Пример 15:
2,2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси) пропионовая кислота (1)
В стеклянную колбу объемом 50 мл, оснащенную капельной воронкой и мешалкой, было помещено 5,5 мл воды, 20 мл MeCN, 0,36 г KBr, 4-МеОТЕМРО (0,15 г) и 10 г 2,2,3-трифтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-пропан-1-ола. 36 мл 15% (по массе) водн. раствора NaOCl с созданным рН 8-9 было добавлено через капельную воронку 3 порциями в течение двух дней перемешивания при комнатной температуре. Для придания реагирующей смеси кислотности (рН=1-2), к ней были добавлены концентрированная серная кислота и вода. Реагирующая смесь подверглась трехкратной экстракции с помощью диэтилового эфира. Объединенные эфирные фазы были высушены с помощью сульфата магния, а растворитель был удален с помощью вращающегося испарителя. Остаток был дистиллирован до получения 8,4 г кислоты (точка кипения 58 С, 1,6 ммРт). Выход: 81%.
Пример 15а:
В стеклянную колбу объемом 50 мл, оснащенную капельной воронкой и мешалкой, было помещено 0,27 мл воды, 1 мл MeCN, 0,016 г KBr, 2-Азаадамантан N-оксила (AZADO) и 0,5 г 2,2,3-трифтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-пропан-1-ола. 1,6 мл 14% (по массе) водн. раствора NaOCl с созданным рН 8-9 было добавлено через капельную воронку 3 порциями в течение двух часов перемешивания при комнатной температуре. После осаждения был проведен ЯМР анализ 19F. Для придания реагирующей смеси кислотности (рН=1-2), к ней были добавлены концентрированная серная кислота и вода. Реагирующая смесь подверглась трехкратной экстракции с помощью диэтилового эфира. Объединенные эфирные фазы были высушены с помощью сульфата магния. Растворитель был испарен до получения бесцветной жидкости (0,37 г). Выход: 72%.
Пример 15b:
В стеклянную колбу объемом 10 мл, оснащенную капельной воронкой и мешалкой, было помещено 0,27 мл воды, 1 мл MeCN, 0,16 г KBr, 0,0056 г ABNO, (9-Аза-бицикло[3.3.1]нонан N-оксила) и 0,5 г 2,2,3-трифтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-пропан-1-ола. 1,6 мл 14% (по массе) водн. раствора NaOCl с созданным рН 8-9 было добавлено через капельную воронку 3 порциями в течение 3,5 часов перемешивания при комнатной температуре. Для придания реагирующей смеси кислотности (рН=1-2), к ней были добавлены концентрированная серная кислота и вода. Реагирующая смесь подверглась трехкратной экстракции с помощью диэтилового эфира. Объединенные эфирные фазы были высушены с помощью сульфата магния. Растворитель был испарен до получения бесцветной жидкости (0,4 г). Выход: 77%.
Пример 16:
2,2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)пропионовая кислота (1)
В стеклянную колбу объемом 500 мл, оснащенную парциальным конденсатором, мешалкой и кислородным баллоном с подачей в колбу через клапан для проведения реакции в атмосфере кислорода, были помещены 150 мл уксусной кислоты, 0,91 г нитрита натрия, TEMPO (0,68 г), CH3CO2Na (3,78 г) и 20 г 2,2,3-трифтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-пропан-1-ола. Смесь перемешивалась в течение 16 ч при 60°С. Затем смесь была подкислена и подверглась трехкратной экстракции с помощью диэтилового эфира. Объединенные органические фазы были промыты водой и высушены с помощью сульфата магния. Растворитель был удален во вращающемся испарителе, а остаток был дистиллирован до получения 14,15 г кислоты (1,6 ммРт, 58°С). Выход: 68%.
Пример 17:
2,2,3,4,4-пентафтор-4-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)масляная кислота (3)
В стеклянную колбу объемом 200 мл, оснащенную баллоном с молекулярным кислородом, парциальным конденсатором и мешалкой, были помещены 80 мл уксусной кислоты, 0,32 г нитрита натрия, TEMPO (0,24 г), CH3CO2Na (1,13 г) и 8 г 2,2,3,4,4-пентафтор-4-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-бутан-1-ола. Баллон был открыт таким образом, что из него выходил плавный поток кислорода. Смесь перемешивалась в течение 16 ч при 60°С, после чего она была подкислена до рН 1-2, и подверглась трехкратной экстракции с помощью диэтилового эфира. Объединенные органические фазы были промыты водой и высушены с помощью сульфата магния. Растворитель был удален во вращающемся испарителе, а остаток был дистиллирован до получения 5,89 г кислоты (1,6 ммРт, 65°С). Выход: 71%.
Пример 18:
2,2,3,3,4,4,5,5-октафтор-пентановая кислота (2)
В стеклянную колбу объемом 100 мл, оснащенную кислородным баллоном, парциальным конденсатором и мешалкой, были помещены 60 мл уксусной кислоты, 0,46 г нитрита натрия, TEMPO (0,35 г), CH3CO2Na (6,88 г) и 6,5 г 2,2,3,3,4,4,5,5-октафтор-пентан-1-ола. Смесь перемешивалась в течение 16 ч при 60°С, после чего она была подкислена как описывалось в примере 17, и подверглась трехкратной экстракции с помощью диэтилового эфира. Объединенные органические фазы были промыты водой и высушены с помощью сульфата магния. Растворитель был удален во вращающемся испарителе, а остаток был дистиллирован до получения 3,82 г кислоты (20 ммРт, 65°С). Выход: 55%.
Пример 19:
Дифтор-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-уксусная кислота (4)
В реакционный сосуд, описанный в примере 17, были помещены 70 мл уксусной кислоты, 0,24 г нитрита натрия, TEMPO (0,18 г), CH3CO2Na (3,69 г) и 5 г 2,2-дифтор-2-(1, 1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-этанола. Реакция происходила и привела к результатам, описанным в примере 9. Дистилляция остатка дала 4,05 г кислоты (20 ммРт, 65°С). Выход: 78%.
Пример 20:
2,2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)пропионовая кислота (1)
В реакционный сосуд, описанный в примере 17, за исключением того, что была использована колба объемом в 100 мл вместо 200 мл, были помещены 50 мл уксусной кислоты, 0,137 г нитрата тетрагидрат маргнаца, TEMPO (0,42 г), CH3CO2Na (2,24 г) и 10 г 2,2,3-трифтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-пропан-1-ола. Реакция происходила и привела к результатам, описанным в примере 9. Дистилляция дала 7,29 гкислоты (1,6 ммРт, 65°С). Выход: 70%.
Пример 21:
2,2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)пропионовая кислота (1) (CF3-О-F2C-F2C-F2C-О-FHC-F2C-COOH) (1)
К 2,3 мл (22 ммоль) 30% Н2О2 в 20 мл хлороформа, было последовательно добавлены 13,28 г (80 ммоль) гексафторацетона (регенерированного из HFA-гидрата) и 3,64 г (10 ммоль) 2,2,3-трифтор-2-(1,1,2,2,3,3-гексафтор-3-трифторметокси-пропокси)-пропан-1-ола. Смесь перемешивалась в течение 2 дней при комнатной температуре. После расщепления фаз и испарения растворителя, остаток исследовался ЯМР спектроскопией 19F. Выход сырого продукта составил: 52%.
Теоретический пример 22:
В бездиафрагменный электролизер пробирочного типа было помещено 0,36 г (0,001 моль) 2,2,3-трифтор-3-(1,1,2,2,3,3-гексафтор-3-трифторометокси-пропокси)пропан-1-ола, 0,3 ммоль/500 мг TEMPO на силикагеле и 2 мл ацетона. Смесь перемешивалась в течение 3 мин, после чего растворитель был испарен при пониженном давлении. К твердому остатку был добавлен насыщенный водный раствор NaBr, содержащий NaHCCb (20 масс.%, 6 мл). В суспензию были погружены два платиновых электрода (1,5×1,0 см3). Реагирующая смесь подверглась электролизу постоянного тока (30 мА, 2,5 F/моль) при температуре 0°С и интенсивном перемешивании. По завершении электролиза, смесь прошла фильтрацию. Твердые вещества были смыты ацетоном (20 мл). Смывы были объединены, а ацетон испарился.
Специалистам в данной области должно быть очевидно, что в описанном изобретении можно сделать предсказуемые изменения и модификации, без выхода за рамки данного изобретения. Данное изобретение не должно быть ограничено вариантами, приведенными в настоящей заявке для наглядности.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОФТОРИРОВАННЫХ КАРБОНОВЫХ КИСЛОТ И ИХ СОЛЕЙ | 2010 |
|
RU2544855C2 |
| ВОДОЭМУЛЬСИОННАЯ ПОЛИМЕРИЗАЦИЯ ФТОРИРОВАННЫХ МОНОМЕРОВ С ИСПОЛЬЗОВАНИЕМ ФТОРСОДЕРЖАЩЕГО ПОВЕРХНОСТНО-АКТИВНОГО ВЕЩЕСТВА | 2006 |
|
RU2406731C2 |
| ФТОРСОДЕРЖАЩИЕ ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА ДЛЯ ПОЛУЧЕНИЯ ФТОРПОЛИМЕРОВ | 2006 |
|
RU2458041C2 |
| ВОДОЭМУЛЬСИОННАЯ ПОЛИМЕРИЗАЦИЯ ФТОРИРОВАННЫХ МОНОМЕРОВ С ИСПОЛЬЗОВАНИЕМ ПЕРФТОРПОЛИЭФИРНОГО ПОВЕРХНОСТНО-АКТИВНОГО ВЕЩЕСТВА | 2006 |
|
RU2428434C2 |
| ОМЕГА-ГИДРОФТОРАЛКИЛОВЫЕ ЭФИРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИСХОДНЫЕ КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ И СПОСОБЫ С ИСПОЛЬЗОВАНИЕМ ЭФИРОВ (ВАРИАНТЫ) | 1995 |
|
RU2177934C2 |
| СОЕДИНЕНИЯ ФТОРПОЛИМЕРА, СОДЕРЖАЩИЕ МНОГОАТОМНЫЕ СОЕДИНЕНИЯ, И СПОСОБЫ ИЗ ПРОИЗВОДСТВА | 2010 |
|
RU2522749C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРПОЛИМЕРОВ | 2009 |
|
RU2497836C2 |
| НЕПРЕРЫВНЫЙ СПОСОБ ПОЛУЧЕНИЯ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ ПОСРЕДСТВОМ СОДЕРЖАЩЕГО НИТРОКСИЛЬНЫЙ РАДИКАЛ КАТАЛИЗАТОРА | 2011 |
|
RU2579510C2 |
| ФТОРИРОВАННЫЕ ПРОИЗВОДНЫЕ БИСВИНИЛОКСИМЕТАНА (ВАРИАНТЫ), ПОЛИМЕРЫ И СОПОЛИМЕРЫ НА ИХ ОСНОВЕ | 1995 |
|
RU2144044C1 |
| Катализатор селективного окисления первичных спиртов, способ приготовления катализатора и способ селективного окисления первичных спиртов до альдегидов | 2021 |
|
RU2788871C2 |
Изобретение относится к усовершенствованному способу получения фторированных карбоновых кислот и их солей, состоящему из реакции фторсодержащих спиртов с общей формулой (А):A-CH2-OH, с как минимум одним первым и как минимум одним вторым окислителями для получения фторированной карбоновой кислоты или ее солей с общей формулой (В):A-COO-M+, где M+является катионом и где «A» в формулах (А) и (В) является одинаковым фрагментом, представляющим остаток: Rf-[0]p-CX″Y″-[0]m-CX′Y′-[0]n-CXY-, где Rf является фторированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, p, m и n являются независимыми друг от друга или 1, или 0; X, X′, X″, Y, Y′ и Y″ являются независимыми друг от друга прочими H, F, CF3, или C2F5, при условии, что по меньшей мере одно из значений X и Y представляет собой F, CF3, или C2F5; или A является остатком:R-CFX-, где Х и R являются независимо выбранными из водорода, галогена или остатков алкила, алкенила, циклоалкила или арила, которые могут содержать, а могут не содержать один или несколько атомов фтора и которые могут иметь, а могут и не иметь один или несколько катенарных атомов кислорода; где первый окислитель является соединением, имеющим группы, выбираемые из N-оксилов, P-оксилов-, альфа-галокарбонилов, кетонов, иминов, солей иминимов и их комбинаций; и второй окислитель выбирается из электрического тока гальванического элемента, пероксида, оксидов галогенов, хлора, кислорода, озона, солей азотистой кислоты или их комбинаций. Эффективный способ позволяет использовать легкодоступное сырье. 13 з.п. ф-лы, 22 пр.
1. Способ получения фторированных карбоновых кислот и их солей, состоящий из реакции фторсодержащих спиртов с общей формулой (А):
A-CH2-OH
с как минимум одним первым и как минимум одним вторым окислителями для получения фторированной карбоновой кислоты или ее солей с общей формулой (В):
A-COO-M+
где M+является катионом и где «A» в формулах (А) и (В) является одинаковым фрагментом, представляющим остаток:
Rf-[0]p-CX″Y″-[0]m-CX′Y′-[0]n-CXY-,
где Rf является фторированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, p, m и n являются независимыми друг от друга или 1, или 0; X, X′, X″, Y, Y′ и Y″ являются независимыми друг от друга прочими H, F, CF3, или C2F5, при условии, что, по меньшей мере, одно из значений X и Y представляет собой F, CF3, или C2F5; или A является остатком:
R-CFX-,
где Х и R являются независимо выбранными из водорода, галогена или остатков алкила, алкенила, циклоалкила или арила, которые могут содержать, а могут не содержать один или несколько атомов фтора, и которые могут иметь, а могут и не иметь один или несколько катенарных атомов кислорода; где первый окислитель является соединением, имеющим группы, выбираемые из N-оксилов, P-оксилов-, альфа-галокарбонилов, кетонов, иминов, солей иминимов и их комбинаций; и второй окислитель выбирается из электрического тока гальванического элемента, пероксида, оксидов галогенов, хлора, кислорода, озона, солей азотистой кислоты или их комбинаций.
2. Способ в соответствии с п.1, отличающийся тем, что реакция фторированного спирта, как минимум одного первого окислителя и как минимум одного второго окислителя поддерживается при показателе рН от 7,5 до 14.
3. Способ в соответствии с п.1, отличающийся тем, что фторированный спирт, как минимум один первый окислитель и как минимум один второй окислитель вступают в реакцию в смеси при отсутствии органического растворителя.
4. Способ в соответствии с п.1, отличающийся тем, что фторированный спирт, как минимум один первый окислитель и как минимум один второй окислитель вступают в реакцию в смеси в присутствии органического растворителя.
5. Способ в соответствии с п.1, отличающийся тем, что как минимум 60 молярных % фторированного спирта окисляется до фторированных карбоновых кислот или их солей.
6. Способ в соответствии с п.1, отличающийся тем, что в реагирующей смеси отсутствует фторированный спирт.
7. Способ в соответствии с п.1, отличающийся тем, что соединения, имеющие N-оксилы, имеют общую формулу:

где каждый из R1-R6 могут быть идентичными или различными, и, независимо друг от друга, представлять насыщенные алифатические или ароматические остатки или их комбинации.
8. Способ в соответствии с пп.1 или 7, отличающийся тем, что соединения, имеющие N-оксилы, имеют общую формулу:
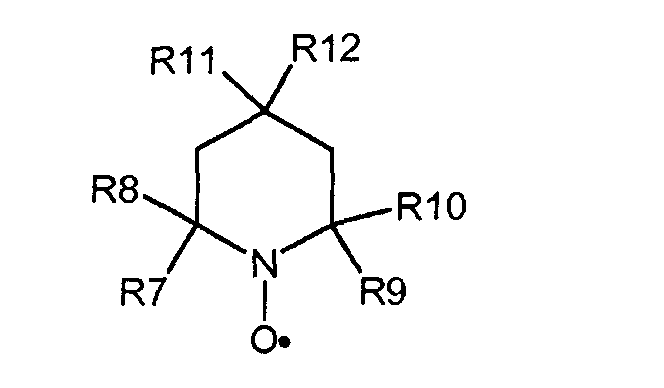
где каждый из R7, R8, R9 и R10 могут быть идентичными или различными, и, независимо друг от друга, представлять насыщенные алифатические или ароматические карбогидратные остатки или их комбинации, R11 и R12 могут быть идентичными или различными, и представлять водород, гироксил или атомы углерода, имеющие насыщенные линейные или разветвленные или циклические алифатические или ароматические остатки или их комбинации.
9. Способ в соответствии с п.8, отличающийся тем, что R11 и R12 могут быть идентичными или различными и выбираются из: H, OH, NH2, SCN, OPO3H2, NHCOCH3, OCOC6H5, CO2H, CO2CH3, CN,
OSO2 CH3, N+(CH3)3, CH2NH2, NHCH2C6H5, NCH3COCH3, N+(CH3)2CH2CH2OH и их комбинаций.
10. Способ в соответствии с п.1, отличающийся тем, что соединения, имеющие N-оксилы, выбираются из: 2,2,6,6-тетраметил-пиперидин-1-оксил (TEMPO); 4-метокси-2,2,6,6-тетраметил-пиперидин-1-оксил;
4-гидрокси-2,2,6,6-тетраметил-пиперидин-1-оксил и 4-ацетамидо-2,2,6,6-тетраметил-пиперидин-1-оксил;
2,2,6,6-тетраметил-4-пиперидин-4-один-1-оксил оксим;
RAC-2,2,6,6-тетраметилпиперидин-N-оксил-4,4-(5-спирогидантоин);
2,2,6,6-тетраметилпиперидин-1-оксил-4-амино-4-карбоновая кислота и их комбинаций.
11. Способ в соответствии с п.1, отличающийся тем, что второй окислитель является оксидом галогена, выбранным из гипохлорита, гипобромита, гипоиодита, пербромата, перхлората, периодата или их комбинации.
12. Способ в соответствии с п.1, отличающийся тем, что только один из X, X′, X″, Y, Y′ и Y″ в остатке Rf из п.1 является H.
13. Способ в соответствии с п.1, отличающийся тем, что Rf в остатке по пункту 1 имеет от 1 до 12 атомов углерода.
14. Способ в соответствии с п.1, отличающийся тем, что фторированные карбоновые кислоты выбраны из:
C6H5CHFCOOH, CF3CF2OCF2CF2OCF2COOH, CHF2(CF2)5COOH,
CF3(CF2)6COOH, CH3CHFCOOH, CF3O(CF2)3OCF(CF3)COOH,
CF3CF2CH2OCF2CH2OCF2COOH, CF3O(CF2)3OCHFCF2COOH,
CF3O(CF2)3OCF2COOH, CF3(CF2)3(CH2CF2)2CF2CF2CF2COOH,
CF3(CF2)2CH2(CF)2COOH, CF3(CF2)2COOH, CF3(CF2)2(OCF(CF3)CF2)OCF(CF3)COOH,
CF3(CF2)2(OCF2CF2)4OCF(CF3)COOH, CF3CF2O(CF2CF2O)3CF2COOH,
Rf-O-CHF-COOH, Rf-O-CHF-CF2COOH, Rf-O-CFf-CFHCOOH,
Rf-O-CF2-CHF-CFf-COOH, Rf-O-CHF-CF2-O-CF2-COOH,
Rf-CHF-CF2-O-CF2-COOH, Rf-O-(CF2)n-COOH, Rf-(CF2)n-COOH,
Rf-(O-CF2)n-O-(CF2)m-COOH, Rf-(O-CF2-CF2)n-O-(CF2)m-COOH,
Rf-(O-CF2CF(CF3))n-O-(CF2)m-COOH, Rf-(O-CF(CF3)-CF2)n-O-(CF2)m-COOH,
и их солей и где Rf является фторированным алкильным остатком, который может содержать, а может не содержать один или несколько катенарных атомов кислорода, n представляет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, a m представляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСШИХ ПЕРФТОРМОНОКАРБОНОВЫХ КИСЛОТ | 1993 |
|
RU2107751C1 |
| JP 10087554 A, 07.04.1998 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПЕРФТОРКАРБОНОВЫХ КИСЛОТ | 2007 |
|
RU2349578C1 |
| JP 8027114 A, 30.01.1996 | |||
| WO 2008113028 A1, 18.09.2008 | |||
| US 6891064 B1, 10.05.2005 | |||
| US 5504246 A1, 02.04.1996 | |||
| US 6127573 A, 03.10.2000 | |||
Авторы
Даты
2015-03-27—Публикация
2010-10-21—Подача