Изобретение относится к области ветеринарии, в частности к птицеводству, а именно, к вакцинным препаратам против инфекционных заболеваний, а именно, против аденовирусного гепатита с включениями - гидроперикардита (АДВГГ) кур.
Имеющиеся научные данные свидетельствуют о том, что аденовивирусная инфекция получила широкое распространение и наносит значительный экономический ущерб птицеводству не только при остром течении заболевания в виде гепатита-гидроперикардита со смертностью от 20 до 70%, но и при субклиническом проявлении болезни, сопровождающемся поражением печени, поджелудочной железы, селезенки и почек.
При заражение птиц возбудителем гепатита с включениями - гидроперикардита происходит внедрение и репликация аденовирусов в иммунокомпетентных клетках лимфоидных органов с последующей их декструкцией. Это отрицательно сказывается на устойчивости инфицированных аденовирусом птиц к возбудителям других заболеваний, на формировании поствакцинального иммунитета, в том числе к ньюкаслской болезни и болезни Гамборо (В.А.Бакулин "Влияние гепатита с включениями - гидроперикардита на вакцинацию цыплят против ньюкаслской болезни." Архив ветеринарных наук, т. 1(48), часть 3).
Вакцинопрофилактика занимает ведущее место в борьбе с этим заболеванием. В последние годы наиболее часто применяют инактивированные вакцины (Afzal M. and Ahmad I. Efficacy of an inactivated vaccine against hydropericardium syndrome. 56//Vet.Rec. - 1990. V.126, p.56).
Известные зарубежные и отечественные средства специфической профилактики гепатита-гидроперикардита, в основном, представляют собой тканевые препараты, изготавливаемые из внутренних органов птиц, зараженных возбудителем гепатита-гидроперикардита. Они достаточно эффективны, но в основном на бройлерах, что связано с особенностями технологии разведения данных кроссов цыплят. На яйценоских птицах их применение часто лишь сдвигает начало проявления болезни на более поздние сроки и изменяет форму ее течения.
Наиболее близкой по технической сущности и достигаемому терапевтическому эффекту к заявляемому вакцинному препарату является инактивированная сорбированная вакцина против синдрома гидроперикардита кур на основе вирусного сырья, полученного из печени инфицированных цыплят после очистки флокулянтом и хлороформом и инактивации димером этиленимина (ДЭИ) в концентрации 0,3% при температуре 35-37°С в течение 24 часов и использовании в качестве адъюванта геля гидрата окиси алюминия (ГОА) в сочетании с сапонином (Борисов В.В., Борисов А.В., Сурнев Д.С. “Разработка и производственные испытания инактивированной сорбированной вакцины против синдрома гидроперикардита кур. Роль ветеринарной науки в развитии животноводства: материалы междунар. научно-производ. конференции, посвященной 75-летию Казахского НИВИ. -Алматы, 2000 г., с. 77-79).
Однако в некоторых случаях, при применении сорбированной вакцины на месте инъекции возможно образование небольшой припухлости, исчезающей через 2-3 недели. В связи с чем, убой птицы на мясо разрешается через 20 суток после введения вакцины. При необходимости убоя птицы ранее этого срока тушки подлежат тщательному осмотру, и при обнаружении на месте введения вакцины признаков воспаления или нерассосавшейся вакцины, тушки выбраковывают и утилизируют.
Это может создавать определенные проблемы при специализации хозяйств на разведении цыплят-бройлеров, когда срок выращивания птицы - 40 дней.
Задачей, решаемой в рамках данного изобретения, является создание профилактического средства против аденовирусного гепатита с включениями -гидроперикардита (АДВГГ) кур, обладающего высокой иммуногенной активностью, стабильностью, в сочетании с безвредностью для птицы и не обладающего остаточной реактогенностью.
Указанная задача решается путем создания вакцинного препарата, содержащего инактивированный теотропином антиген аденовирусного гепатита с включениями - гидроперикардита (АДВГГ) кур штамма "Т-12" с активностью не менее 3,5 0 Lg ИД50/мл в смеси с масляным адъювантом, взятых в равных объемах, причем в качестве масляного адъюванта указанный препарат содержит жировую эмульсию типа масло в воде, включающую продукты переработки сои, например, инфузолипол, либо его аналоги, и содержит теотропин в конечной его концентрации в вируссодержащем материале не менее - 0,2-0,3%.
Инфузолипол - мелкодисперсная жировая эмульсия, применяемая в качестве лекарственного средства для парентерального питания (ФС-42-3955-00 "Инфузолипол для инъекций"). В состав препарата входят масло соевое, лецитин соевый, сорбент и вода для инъекций. Использование инфузолипола в качестве адъюванта дает преимущество быстрого введения вакцинного препарата птицам и точного соблюдения вводимой дозы, повышает иммуногенные и антигенные свойства препарата.
Инактивация вируса теотропином (Препарат А-24) гарантирует полное отсутствие в вакцинном препарате остаточной инфекционности, невозможность репарации генома вирусной ДНК, а при длительном хранении антигена не снижает его активности.
Производственный штамм "Т-12" хранится и поддерживается во Всероссийском научно-исследовательском ветеринарном институте птицеводства (ВНИВИП).
Штамм "Т-12" хранят в лиофилированном состоянии в герметично запаянных ампулах в холодильнике не более 24 месяцев со дня его высушивания.
Производственный штамм "Т-12" должен удовлетворять следующим требованиям
- быть свободным от контаминации посторонними вирусами, бактериальной и грибковой микрофлорой;
- при заражении 25-30 дневных СПФ цыплят вызывать у них клинику и иметь инфекционный титр не ниже, чем 3,5 Lg ИД50/мл. Использование штамма "Т-12" в вакцинном препарате обуславливает его высокую и длительно сохраняющуюся иммуногенную активность.
Вакцинный препарат получают следующим образом. Из матричной расплодки производственного штамма “Т-12” вируса АДВГГ готовят разведение 1:10 на стерильном физиологическом растворе (рН 7,2) с добавлением антибиотиков (100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 50 ед/мл нистатина) и выдерживают для контакта в течение 2 часов при температуре 4-8°С. Разведенный материал готовят в объеме, необходимом для заражения данной партии цыплят 25-30 дневного возраста. Зараженных цыплят убивают через 96 часов после заражения, отбирают пробы печени, гомогенизируют их в 0,01 М фосфатно-буферном растворе рН 7,2 в соотношении 1:1 (вес./объем), трижды замораживают в течение 30 минут, собирают вируссодержащую надосадочную жидкость. В полученный вируссодержащий материал добавляют 500 ед/мл пенициллина, 500 мкг/мл стрептомицина и 200 ед/мл нистатин. После контакта при 4-8°С из каждого флакона берут пробу вируссодержащей жидкости в объеме 1 мл для контроля на стерильность и контаминацию микоплазмами.
Затем из каждого флакона берут пробу в объеме 1 мл вируссодержащего материала и сливают в один стерильный флакон емкостью 100 мл. Эту взвесь проверяют на биологическую активность производственной расплодки. До получения результатов проверки на биологическую активность вся производственная расплодка вируса хранится в замороженном состоянии при температуре 25-30°С. Для приготовления вакцины используют только стерильную в бактериальном отношении вируссодержащую жидкость с титром для вируса АДВГГ не менее 3,5 Lg ИД50 50/мл.
Для инактивации инфекционных свойств вируса АДВГГ используют препарат теотропин (А-24). При проведении инактивации в плоскодонную емкость с вируссодержащей жидкостью кладут магнит в инертной защитной оболочке и ставят емкость на магнитную мешалку. Затем в емкость постепенно при непрерывном помешивании тонкой струей вносят раствор препарата теотропина “А-24” до его конечной концентрации в вируссодержащем материале 0,2-0,3%. Емкости полученной смесью вместе с магнитной мешалкой помещают в термостат с температурой 37,0±0,5°С на 36 часов, устанавливая при этом скорость вращения магнита 50-60 об/мин, чтобы избежать образования пены. Контроль полноты инактивации вируса проводят в течение 3-х последовательных пассажей на 30 цыплятах 10-20 дневного возраста, которым внутримышечно вводится 0,5 мл антигена, с заражением последующей группы гомогенатом печени цыплят предыдущих групп. Отсутствие патологоанатомических изменений во внутренних органах цыплят, характерных для АДВГГ, а также (при гистологическом исследовании) отсутствие внутриядерных включений в гепатоцитах, свидетельствует о полноте инактивации вируса. Данный контроль можно проводить дополнительно на 9-суточных СПФ эмбрионах кур методом трехкратных последовательных “слепых пассажей”. Доза заражения эмбриона - 0,2 мл испытуемого материала. Срок инкубации (наблюдения) при 37°С - 5 дней. После инкубации эмбрионов в указанном режиме экстраэмбриональная жидкость в смеси с гомогенатом ХАО и печенью эмбриона от 1, 2 и 3 пассажей исследуется в РДП с заведомо положительной специфической сывороткой к вирусу АДВГГ. Реакция РДП должна быть отрицательной, что в сочетании с отсутствием патологии у зараженных эмбрионов свидетельствует о полноте инактивации вируса.
Приготовление вакцинного препарата проводится внесением в одну объемную часть готового стерильного масляного адъюванта - инфузолипола (или его аналогов) постепенно - по каплям, при интенсивном перемешивании пропеллерной мешалкой или с помощью гомогенизатора с частотой вращения 4000-5000 об/мин, одной объемной части водного вируссодержащего компонента. После этого перемешивание продолжают еще 5 минут.
Вакцинный препарат расфасовывают по 50, 250 или 450 см3 в стерильные флаконы по ТУ 64-2-100-78, после чего их плотно закрывают стерильными резиновыми пробками по ТУ 38-006-108-84 и закатывают алюминиевыми колпачками по ОСТ 64-009-86.
Механизм действия препарата основан на выработке у привитых цыплят иммунитета к аденовирусу гепатита с включениями - гидроперикардита кур. На 28 сутки после иммунизации специфические антитела в сыворотке крови должны выявляться в РДП не менее, чем у 80% вакцинированных цыплят. Продолжительность поствакцинального иммунитета составляет не менее 6 месяцев. Вакцинации подлежит клинически здоровая птица промышленных стад в возрасте 10-12 суток, при необходимости в более молодом или старшем возрасте, но не позднее, чем за 14 дней до предполагаемого клинического проявления болезни. Метод вакцинации - внутримышечный, в область бедра или груди, а также подкожный - в область нижней трети шеи. Вакцину вводят в объеме 0,3 мл. Место введения препарата обрабатывают 70% спиртом. За 6-9 часов до применения вакцину достают из холодильника и ставят в помещение с температурой от 20 до 28°С. Запрещается нагревание вакцины на водяной бане и на приборах отопления. Вакцину используют в течение 2 часов после вскрытия флакона.
Молодняк родительских стад иммунизируют дважды: первый раз в возрасте 10-12 суток, а второй раз - в возрасте 100-120 суток в удвоенной дозе. Продукты убоя и мясо от вакцинированной птицы реализуют без ограничений независимо от сроков вакцинации.
Сущность и практическая применимость заявленного изобретения характеризуется следующими примерами.
Пример 1.
Вакцина прошла проверку на стерильность, полноту инактивации, безвредность, антигенную и иммуногенную активность на цыплятах, полученных с птицефабрики “Роскар” Ленинградской области, благополучной по инфекционным болезням птиц. Было изготовлено две серии вакцины №5 - (от 15.02.01) и №6 (от 16.02.01.). Для проведения контроля на стерильность пробы испытуемых серий вакцины в объеме 0,2 мл высевали на питательные среды: МПА, МПБ, МППБ под вазелиновым маслом, на среду Сабуро по три пробирки каждой среды. Питательные среды с посевами и контрольные выдерживали в термостате при температуре 37°С в течение 10 дней, а среду Сабуро с посевами - при температуре 20-22°С. В течение указанного срока наблюдения питательные среды оставались стерильными.
Контроль на полноту инактивации вируса проводили в трех последовательных пассажах на 30 цыплятах 17-20 дневного возраста, которым первоначально вводили по 0,5 мл испытуемых серий вакцины, с заражением следующей группы гомогенатом печени цыплят предыдущего пассажа, убитых на 3-и сутки после введения инактивированного антигена. Проводили контроль за клиническим состоянием птицы, гистологические исследования печени цыплят на наличие изменений, характерных для аденовирусной инфекции, а также исследования гомогената печени в РДП с заведомо положительной специфической к аденовирусу гепатита с включениями - гидроперикардита сывороткой птиц.
В течение всех трех пассажей цыплята оставались клинически здоровыми, патологоморфологические изменения в печени, характерные для аденовирусной инфекции не отмечены, результаты исследования гомогената печени в РДП с положительной специфической к аденовирусу гепатита с включениями - гидроперикардита птиц были отрицательными.
Контроль вакцины на безвредность проводили на цыплятах 17-дневного возраста, которым внутримышечно, в область бедра вводили 5-кратную иммунизирующую дозу вакцины в объеме 2,5 мл по 10 голов на каждую серию вакцины. В течение 10-дневного периода наблюдения цыплята оставались живыми и клинически здоровыми, реакция на препарат в месте его введения отсутствовала.
Контроль на иммуногенную активность проводили на цыплятах 17- дневного возраста, введением вакцины в дозе 0,5 мл внутримышечно в область бедра. Через 12 дней после вакцинации проводили контрольное заражение подопытных (вакцинированных) и контрольных (невакцинированных) птиц по 20 голов из каждой группы патогенным штаммом “Т-12” вируса гепатита с включениями - гидроперикардита внутримышечно в объеме 0,5 мл, что соответствовало 1000 ЛД 50.
В обеих подопытных группах птиц, привитых вакциной серии № 5 и № 6 гибель цыплят не наблюдалась, клинические признаки болезни отсутствовали в течение срока наблюдения (10 дней).
Результаты исследований представлены в таблице 1
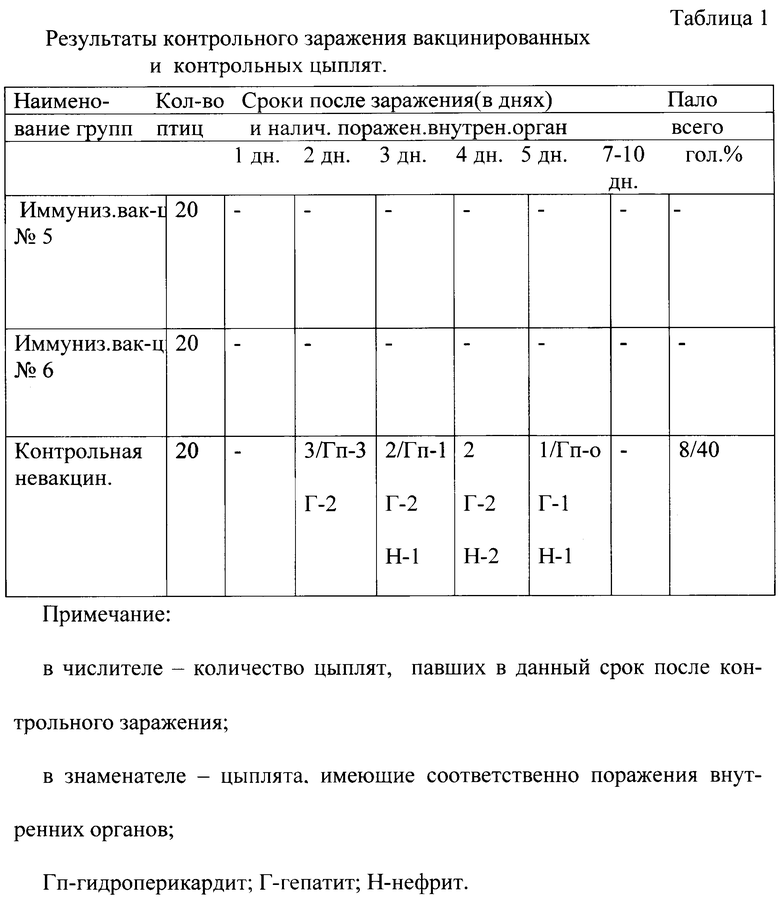
В группе невакцинированных цыплят клинические признаки болезни отмечались у 90% цыплят, зараженных патогенным штаммом аденовируса.
У большинства птиц на 2-3 сутки после заражения наблюдалось угнетение, взъерошенность оперения. Перед гибелью у цыплят крылья были опущены, отсутствовала реакция на внешние раздражители. Птицы стояли, а чаще сидели, уткнувшись клювом.
Антигенную активность проверяли на цыплятах 17-дневного возраста внутримышечно вакцинированных одной иммунизирующей дозой вакцины (по 20 голов на каждую серию вакцины и 20 голов невакцинированных птиц). Через 21 и 28 дней после вакцинации брали кровь, получали сыворотку крови, которую исследовали в РДП с заведомо положительным антигеном гепатита с включениями - гидроперикардита на наличие преципитирующих антител. Преципитирующие антитела в РДП были обнаружены на 21 сутки после вакцинации в 90% исследованных пробах (обе серии вакцины), на 28 сутки - в 100%. Были также проведены исследования на сохранность антигенных свойств штамма “Т-12” аденовирусного гепатита с включениями - гидроперикардита инактивированного теотропином.
Результаты исследований представлены в таблице 2.
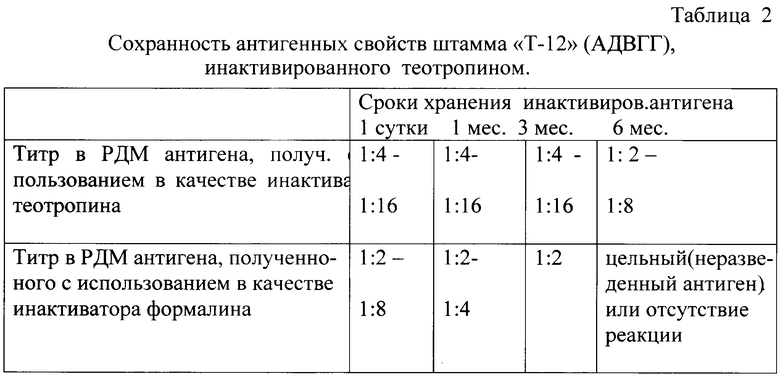
Как следует из приведенных результатов, предлагаемый вакцинный препарат стерилен, безвреден, обладает высокой антигенной и иммуногенной активностью.
Источники информации
1. В.А.Бакулин “Влияние гепатита с включениями - гидроперикардита на вакцинацию цыплят против ньюкаслской болезни”. Архив ветериных наук, т.1 (48), ч. 3.
2. Afzal M. and Ahmad I. Efficacy of an inactivated against hydropericardium syndrome. 56// Vet.Rec. - 1990. V.126, p.56.
3. Борисов В.В., Борисов А.А., Сурнев Д.С. “Разработка и производственные испытания инактивированной сорбированной вакцины против синдрома перикардита кур. Роль ветеринарной науки в развитии животноводства: материалы международной научно-производственной конференции, посвященной 75-летию Казахского НИВИ. -Алматы. 2000 г., с. 77-79.
4. ФС-42-3955-00 “Инфузолипол для инъекций”.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ "Т-12" ВИРУСА АДЕНОВИРУСНОГО ГЕПАТИТА С ВКЛЮЧЕНИЯМИ - ГИДРОПЕРИКАРДИТА КУР (АДВГГ) ДЛЯ ПРОИЗВОДСТВА ДИАГНОСТИКУМОВ И ВАКЦИН И ЭКСПЕРИМЕНТАЛЬНОГО ИЗУЧЕНИЯ БОЛЕЗНИ | 2004 |
|
RU2277584C1 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ СИНДРОМА ГИДРОПЕРИКАРДИТА КУР | 2001 |
|
RU2195959C1 |
| ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ВАКЦИНА ПРОТИВ СИНДРОМА ГИДРОПЕРИКАРДИТА КУР | 2002 |
|
RU2216351C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ СИНДРОМА ГИДРОПЕРИКАРДИТА КУР | 2001 |
|
RU2199342C1 |
| ШТАММ КР 95 № 114 ВИРУСА СИНДРОМА ГИДРОПЕРИКАРДИТА КУР ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ | 2001 |
|
RU2193062C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ЭМУЛЬСИОННОЙ ВАКЦИНЫ ПРОТИВ СИНДРОМА ГИДРОПЕРИКАРДИТА КУР | 2002 |
|
RU2213576C1 |
| ШТАММ "БГ" ВИРУСА ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ И ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 1997 |
|
RU2127602C1 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 1998 |
|
RU2127603C1 |
| ШТАММ "О" ВИРУСА ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2207372C1 |
| ШТАММ "DD1" ВИРУСА ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ КУР СЕМЕЙСТВА BIRNAVIRIDAE, РОДА AVIBIRNAVIRUS, 1 СЕРОТИПА ДЛЯ ПРОИЗВОДСТВА ИНАКТИВИРОВАННЫХ СОРБИРОВАННЫХ И ЭМУЛЬГИРОВАННЫХ ВАКЦИН | 2018 |
|
RU2736888C2 |
Изобретение относится к области ветеринарии. Задачей, решаемой в рамках данного изобретения, являлось создание профилактического средства против аденовирусного гепатита с включениями - гидроперикардита (АДВГГ) кур, обладающего высокой иммуногенной активностью и стабильностью, в сочетании с безвредностью для птицы. Препарат содержит инактивированный теотропином антиген аденовирусного гепатита с включениями - гидроперикардита кур штамма “Т-12” с активностью не менее 3,5 Lg ИД50/мл в смеси с масляным адъювантом, взятые в равных объемах. Препарат обладает высокой иммуногенной активностью и стабильностью, безвреден для птицы, 2 з.п. ф-лы, 2 табл.
| ШТАММ "АДВ" ВИРУСА ГИДРОПЕРИКАРДИТА ПТИЦ СЕМЕЙСТВА ADENOVIRIDAE | 1996 |
|
RU2120993C1 |
| 0 |
|
SU156478A1 | |
| MASHLOOR S., HAMEED A | |||
| et all., Jmmune response of Angara disease (Hydroperecardium syndrome) vaccines in broilers, Veterinarscki Archiv, 1994, v.64, n.4-6, р.103-107. | |||
Авторы
Даты
2004-07-27—Публикация
2002-06-25—Подача