ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет в соответствии с 35 U.S.С.§ 119(е) по патентной заявке США №61/112686, поданной 7 ноября 2008, и по патентной заявке США №61/164870, поданной 30 марта 2009, которые включены при этом в своем полном объеме для любых целей.
УКАЗАНИЕ НА ЗАИНТЕРЕСОВАННОСТЬ ГОСУДАРСТВА
Изобретение, описанное в настоящей заявке, было выполнено частично с использованием средств, предоставленных грантом 5R44 СА101283-03 от Национальных институтов здравоохранения. Правительство США имеет определенные права на это изобретение.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится в основном к комбинации моноклонального антитела (mAb) и технологиям рекомбинантных ДНК для развития новых биологических препаратов, и более конкретно, например, к получению моноклональных антител, которые связываются и нейтрализуют рецептор 2 фактора роста фибробластов.
УРОВЕНЬ ТЕХНИКИ
Существует 22 известных представителя семейства факторов роста фибробластов (FGF), распределяющихся по размеру от 17 до 34 кДа и имеющих общую внутреннюю срединную область сходства, которые могут быть сгруппированы на 7 подсемейств на основании их сходства в активности и последовательности (Omitz et al., Genome Biol. 2:3005.1, 2001). Например, подгруппа FGF1 состоит из прототипных FGF, FGF1 (кислый FGF) и FGF2 (основной FGF); подгруппа FGF4 состоит из FGF4, FGF5 и FGF6; и подсемейство FGF7 состоит из FGF3, FGF7, FGF10 и FGF22 (Zhang et al., J. Biol. Chem. 281:15694, 2006).
Одна форма FGF2 представляет собой негликозилированный полипептид 18 кДа, состоящий из 146 аминокислот, происходящий из предшественника 155 аминокислот (Omitz et al., Genome Biol. 2:3005.1, 2001; Okada-Ban et al., Int. J. Biochem. Cell. Biol. 32:263, 2000). Приводимая в качестве примера последовательность 146 аминокислотного FGF2 человека представлена в последовательности SEQ ID NO:4 в US20020115603. В отличие от большинства других FGF, FGF2 не кодирует сигнальную последовательность для секреции, но форма 18 кДа может быть секретирована нестандартным энергозависимым путем, независимым от ER- комплекса Гольджи. Другой представитель подсемейства FGF1, сам FGF1, имеет размер и структуру, сходную с FGF2, а также лишен сигнальной последовательности, но может быть секретирован. Другим FGF, представляющим здесь интерес, является FGF7, также называемый фактором роста кератиноцитов (KGF), который продуцируется клетками мезенхимального происхождения и стимулирует пролиферацию эпителиальных клеток (Finch et al., Adv. Cancer Res. 91:69, 2004; Finch et al., J. Natl. Cancer Inst. 98:812, 2006). KGF экспрессируется в целом ряде органов, в том числе в легких, предстательной железе, молочной железе, пищеварительном тракте и коже, и вовлечен в развитие органов и репарацию кожных ран (Cho et al., Am. J. Pathol. 170:1964, 2007).
Представители семейства FGF связываются только с четырьмя известными рецепторами тирозинкиназы, рецепторами фактора роста фибробластов 1-4 (FGFR1-4) и их изоформами, с различными FGF, связывающимися с различными FGFR в различной степени (Zhang et al., J. Biol. Chem. 281:15694, 2006). Белковая последовательность FGFR2 человека представлена, например, в GenBank Locus AF487553. Каждый FGFR состоит из внеклеточного домена (ECD), содержащего три иммуноглобулин (Ig)-подобных домена (Dl, D2 и D3), одной трансмембранной спирали и внутриклеточного каталитического киназного домена (Mohammadi et al., Cytokine Growth Factor Revs, 16:107, 2005), как показано на Фиг.1. Существует смежный участок кислых аминокислот в линкере между D1 и D2, называемый «кислым блоком» (АВ). Считается, что область, содержащая D1 и АВ, вовлечена в аутоингибирование рецептора, которое ослабляется связыванием с лигандом. FGFR характеризуются множественным альтернативным сплайсингом их мРНК, приводящим к целому ряду изоформ (Omitz et al., J. Biol. Chem. 271:15292, 1996; смотри также Swiss-Prot P21802 и изоформы с Р21802-1 по -20 для последовательностей FGFR2 и их изоформы). В частности, существуют формы, содержащие все три Ig домена (α изоформа) или только два Ig домена D2 и D3 домены без D1 (β изоформа). Особую важность имеют FGFR1-FGFR3, хотя все формы содержат первую половину D3, обозначенную IIIa, два альтернативных экзона могут быть использованы для второй половины D3, приводя к образованию форм IIIb и IIIс. Для FGFR2, они соответственно обозначены FGFR2IIIb и FGFR2IIIc (или только FGFR2b и FGFR2c); соответствующие бета формы обозначены FGFR2(бета)IIIb и FGFR2(бета)IIIc. Форма FGFR2IIIb у FGFR2 (также обозначенная K-sam-II) является высоко аффинным рецептором как для FGF1, так и для KGF, тогда как FGFR2IIIc (также обозначенный K-sam-I) хорошо связывается как с FGF1, так и с FGF2, но не связывается с KGF (Miki et al., Proc. Natl. Acad. Sci. USA 89:246, 1992). Действительно, FGFR2IIIb является единственным рецептором для KGF (Omitz et al., 1996, ор. cit.) и, следовательно, также обозначен KGFR.
FGFR и их изоформы дифференциально экспрессируются в различных тканях. В частности, FGFR2IIIb (и IIIb формы FGFR1 и FGFR3) экспрессируются в эпителиальных тканях, тогда как FGFRIIIc экспрессируется в мезенхимальных тканях (Duan et al., J. Biol. Chem. 267:16076, 1992; Omitz et al., 1996, ор. cit.). Некоторые из FGF лигандов этих рецепторов имеют противоположный профиль экспрессии. Таким образом, представители подсемейства FGF3, в том числе FGF7 (KGF), связываются только с FGFRIIIb (Zhang et al., ор. cit.) и экспрессируются в мезенхимальных тканях, поэтому могут быть паракринными эффекторами эпителиальных клеток (Omitz et al., 1996, ор. cit.). В отличие от этого, представители подсемейства FGF4, FGF4-6 связываются с FGFR2IIIc и экспрессируются как в эпителиальных, так и в мезенхиальных линиях клеточной дифференцировки, поэтому могут иметь либо аутокринные, либо паракринные функции. Благодаря профилям дифференцировки изоформ FGFR2 и их лигандам, FGFR2 играет роль в эпителиально-мезенхимальных взаимодействиях (Finch et al., Dev. Dyn. 203:223, 1995), поэтому неудивительно, что нокаут FGFR2IIIb у мышей приводит к тяжелым эмбриональным дефектам и летальности (De Moeriooze et al., Development 127:483, 2000).
Помимо связывания с FGFR1-4 с высокой аффинностью, FGF связываются с гепаринсульфатпротеогликанами (HSPG) с более низкой аффинностью. Действительно, связывание FGF с гепарином/гепаринсульфатом (HS) на клеточной поверхности необходимо для передачи сигнала посредством FGFR. Взаимодействие FGF, в особенности FGF2, с FGFR и гепарином было тщательно изучено с помощью рентгеновской кристаллографии и мутационного анализа, и в настоящее время считается, что гепарин/HS принимает участие в формировании асимметричного димера 2:2 FGF-FGFR (Mohammadi et al., 2005), приводящего к активации рецептора, автофосфорилированию и трансдукции сигнала.
FGF опосредуют целый ряд ответных реакций в различных типах клеток, в том числе пролиферацию, миграцию и дифференцировку, особенно во время эмбрионального развития (Omitz et al., op.cit.), а у взрослых они вовлечены в гомеостаз и репарацию тканей. Например, FGF2 стимулирует пролиферацию (т.е. является митогенным) некоторых клеток, в том числе фибробластов и эндотелиальных клеток и является фактором анти-апоптотического сигнала для некоторых клеток, таких как нейроны (Okada-Ban, op.cit.). FGF2 также стимулирует дифференцировку (морфогенез) и миграцию (подвижность) эндотелиальных клеток (Dow et al., Urology 55:800, 2000). Некоторые FGF, особенно FGF1 и FGF2, являются мощными факторами ангиогенеза (Presta et al., Cytokine and Growth Factor Rev. 16:159, 2005).
Важность системы FGF в развитии была особо подчеркнута открытием многочисленных мутаций в FGFR1-3, связанных с врожденными нарушениями скелета человека, включая синдромы краниосиностоза (преждевременное срастание швов черепа) (Wilkie et al., Cytokine Growth Factor Revs 16:187, 2005). Эти генетические заболевания обычно являются доминантными, поскольку ассоциированные мутации приводят к появлению у экспрессируемого белка новых патологических функций, зачастую путем облегчения димеризации рецептора. В частности, тяжелый краниосиностоз Apert синдром (AS) связан с одной из двух мутаций (Ser-252→Trp или Pro-253→Arg) в консервативной D2-D3 линкерной области FGFR2, что повышает аффинность связывания с лигандом (Ibrahimi et al., Proc. Natl. Acad. Sci USA 98:7182, 2001).
Сообщалось, что FGF2 и другие FGF играют роль в злокачественном новообразовании как путем стимуляции ангиогенеза, так и непосредственно опухолевых клеток (Grose et al., Cytokine Growth Factor Revs. 16:179, 2005; Presta et al., op cit.). PHK FGFR2IIIb экспрессируется во многих типах опухолей (Finch et al., J. Natl, Cancer Inst. 98:812, 2006), зачастую как следствие ее экспрессии в соответствующих нормальных тканях (Orr-Urtreger et al., Dev. Biol. 158:475, 1993). KGF (FGF7) и KGFR (FGFR2IIIb) гиперэкспрессируются при многих злокачественных опухолях поджелудочной железы (Ishiwata et al., Am. J. Pathol. 153:213, 1998), и их совместная экспрессия коррелирует с плохим прогнозом (Cho et al., Am. J. Pathol. 170:1964, 2007). Соматические мутации гена FGFR2 найдены у 12% из большого ряда карцином эндометрия (матки), и в нескольких протестированных случаях требовались для выживания опухолевых клеток (Dutt et al., Proc. Natl. Acad. Sci. USA 105:8713, 2008). В двух опухолях было обнаружено, что мутации FGFR2 представляют собой ту же замену S252W, связанную с Apert синдромом. Амплификация и гиперэкспрессия FGFR2 тесно связана с недифференцированным раком желудка диффузного типа, который имеет особенно плохой прогноз, и ингибирование активности FGFR2 под действием соединений с низкой молекулярно массой эффективно ингибировало пролиферацию таких злокачественных клеток (Kunii et al., Cancer Res. 68:2340, 2008; Nakamura et al., Gastroenterol. 131:1530, 2006). FGFR2IIIb РНК экспрессировалась в 16/20 эпителиальных злокачественных опухолях яичников (ЕОС), но не в нормальном поверхностном эпителии яичников (Steele et al., Oncogene 20:5878, 2001); и FGFR2IIIb лиганды FGF1, FGF7 и FGF10 индуцировали пролиферацию, подвижность и защиту от клеточной гибели в клеточных линиях ЕОС (Steele et al., Growth Factors 24:45, 2006), давая возможность предположить, что FGFR2IIIb может вносить вклад в злокачественный фенотип при раке яичников.
Сообщалось только об ограниченном числе моноклональных антител к FGFR2. Fortin et al. (J. Neurosci. 25:7470, 2005) сообщали о блокирующем антителе к FGFR2, a Wei et al. (Hybridoma 25: 115, 2006) разработали два mAb, специфичных к IIIb форме FGFR2 (т.е. KGFR), которые ингибировали KGF-индуцированную пролиферацию клеток. Yayon et al. (WO 2007/144893, 2006) описывали ингибирующее mAb, которое связывается как с FGFR2, так и с FGFR3. R&D Systems с 2005 продавали анти-FGFR2 mAb, которое нейтрализует активность в их исследовании, с предпочтением в отношении формы IIIb. Однако не было сообщений о противоопухолевой активности антител против FGFR2 in vivo.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящее изобретение относится к моноклональному антителу (mAb) к рецептору-2 фактора роста фибробластов (FGFR2), которое ингибирует у мышей рост опухолевого трансплантата человека. mAb может ингибировать по меньшей мере одну и, предпочтительно, несколько или все биологические активности рецептора, в том числе связывание FGF2 с рецептором. mAb может связываться либо с одной, либо с обеими формами FGFR2IIIb и FGFRIIIc рецептора, например с FGFR2IIIb, но не с FGFR2IIIc. Предпочтительно, mAb по настоящему изобретению является генно-инженерным, например химерным, гуманизированным или антителом человека. Антитела, приводимые в качестве примера, представляют собой GAL-FR21, GAL-FR22 и GAL-FR23 и их химерные и гуманизированные формы, и mAb, которые имеют тот же эпитоп или конкурируют за связывание с одним из этих mAb. В другом варианте осуществления предложена фармацевтическая композиция, содержащая генно-инженерное антитело против FGFR2, например химерные или гуманизированные GAL-FR21, GAL-FR22 и GAL-FR23. В третьем варианте осуществления фармацевтическую композицию вводят пациенту для лечения онкологического или другого заболевания, например рака желудка.
Приводимые в качестве примера гуманизированные антитела содержат гуманизированную легкую цепь, содержащую CDR из последовательности на Фиг.13А (GAL-FR21), и гуманизированную тяжелую цепь, содержащую CDR из последовательности Фиг.13В (GAL-FR21), или содержат гуманизированную легкую цепь, содержащую CDR из последовательности на Фиг.16А (GAL-FR22) и гуманизированную тяжелую цепь, содержащую CDR из последовательности Фиг.16В (GAL-FR22). Некоторые гуманизированные антитела содержат CDR легкой цепи, показанные на 13А (GAL-FR21) и три CDR тяжелой цепи, показанные на Фиг.13В (GAL-FR21), или содержат три CDR легкой цепи, показанные на Фиг.16А (GAL-FR22), и три CDR тяжелой цепи, показанные на Фиг.16 В (GAL-FR22). Необязательно, последовательность вариабельной области легкой цепи, по меньшей мере, на 95% идентична последовательности, показанной на Фиг.13А (HuGAL-FR21), и последовательность вариабельной области тяжелой цепи, по меньшей мере, на 95% идентична последовательности, показанной на Фиг.13В (HuGAL-FR21). В некоторых таких антителах остатки Н27, Н28, Н30, Н48 и Н67 по нумерации Кабата заняты остатком, занимающим соответствующее положение в тяжелой цепи, показанной на Фиг.13В (GAL-FR21). Предпочтительное гуманизированное антитело содержит вариабельную область легкой цепи с последовательностью, показанной на Фиг.13А (HuGAL-FR21), и вариабельную область тяжелой цепи с последовательностью, показанной на Фиг.13В (HuGAL-FR21).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Схематическая диаграмма структуры FGFR2, показывающая три Ig-подобных домена (Dl, D2 и D3), трансмембранный домен (черный квадрат) и внутриклеточный киназный домен. Указаны гепаринсвязывающий сайт (HBS), кислый блок (АВ) и альтернативные IIIb/IIIc частичные домены partial. N=амино конец, С=карбокси конец.
Фигура 2. Краткое изложение свойств анти-FGFR2 mAbs GAL-FR21, GAL-FG22, GAL-FR23, как описано в Примерах.
Фигура 3. ELISA связывания mAbs GAL-FR21, GAL-FR22 и GAL-FR23 и отрицательного контроля mIgG с FGFR2IIIb.
Фигура 4. ELISA связывания mAbs GAL-FR21, GAL-FR22 и GAL-FR23 и отрицательного контроля mAb 5G8 мыши с каждой из четырех форм FGFR2 -FGFR2IIIb, FGFR2(бета)IIIb, FGFR2(IIIc) и FGFR2(бета)IIIc - в виде слитых белков с Fc. В этом исследовании использовали фиксированную концентрацию каждого mAb.
Фигура 5. ELISA конкурентного связывания с FGFR2IIIb каждого из mAbs GAL-FR21, GAL-FR22 и GAL-FR23 отрицательного контроля mAb 5G8 мыши против mAbs в биотинилированной форме. Использовали соотношение 100:1 немеченого к биотинилированному mAb.
Фигура 6. Проточная цитометрия связывания mAbs GAL-FR21, GAL-FR22 и GAL-FR23 и mAb отрицательного контроля с FGFR2IIIb на клетках SNU-16 и КАТО III.
Фигура 7. Проточная цитометрия mAbs GAL-FR21, GAL-FR22 и GAL-FR23 и mAb отрицательного контроля, связывающихся с клетками 293F, трасфектированными FGFR2IIIC или FGFR2IIIb(S252W).
Фигуры 8А и 8В. (А) анализ ELISA, измеряющий ингибирование связывания FGF1 (верхняя панель) и FGF2 (нижняя панель) с FGFR2IIIb под действием mAbs GAL-FR21, GAL-FR22 и GAL-FR23. (В) анализ ELISA, измеряющий ингибирование связывания FGF7 (верхняя панель) и FGF10 (нижняя панель) с FGFR2IIIb под действием mAbs GAL-FR21 и GAL-FR22. Для (А) и (В) mIgG является мышиным mAb отрицательного контроля.
Фигура 9. Рост SNU-16 ксенотрансплантатов опухоли желудка человека у мышей, обработанных только PBS, GAL-FR21, GAL-FR23 или FR2bC54.8.11 (верхняя панель) или PBS, GAL-FR22 или FR2bC 54.8.11 (нижняя панель). mAbs вводили в дозе 20 мкг дважды в неделю, примерно 5 мышам на группу. Фигура 10. Рост SNU-16 (А, верхняя панель) или OCUM-2M (В, нижняя панель) трансплантатов опухоли желудка человека у мышей, обработанных только PBS, GAL-FR21 или GAL-FR22.
Фигура 11. ELISA связывания GAL-FR21 (верхняя панель) или GAL-FR22 (нижняя панель) с FGFR2IIIb человека и мыши.
Фигура 12. ELISA связывания GAL-FR21 (верхняя панель) или GAL-FR22 (нижняя панель) с FGFR2IIIb человека и яванского макака.
Фигура 13. Показано выравнивание аминокислотных последовательностей вариабельных областей легкой цепи (А) и тяжелой цепи (В) зрелого HuGAL-FR21 с GAL-FR21 мыши и акцепторными V областями у человека. CDR подчеркнуты в последовательностях GAL-FR21, а аминокислотные последовательности, замещенные аминокислотами мыши, подчеркнуты дважды в последовательностях HuGAL-FR21. 1-буквенный код аминокислот и систему нумерации по Кабат используют как для легкой, так и для тяжелой цепи.
Фигура 14. Аминокислотные последовательности легкой цепи (А) и тяжелой цепи (В) целого зрелого антитела HuGAL-FR21. Первая аминокислота на каждой линии пронумерована; нумерация является последовательной. В легкой цепи первая аминокислота области Сκ подчеркнута, а в тяжелой цепи подчеркнуты первые аминокислоты областей СН1, шарнира, СН2 и СН3.
Фигура 15. Конкурентное связывание гуманизированных HuGAL-FR21 и мышиных GAL-FR21 mAb и контрольного антитела hIgG человека, проводимое, как описано в настоящей заявке.
Фигура 16. Аминокислотные последовательности вариабельных областей легкой цепи (А) и тяжелой цепи (В) зрелого HuGAL-FR22, с подчеркнутыми CDR. 1-буквенный код аминокислот и систему нумерации по Кабат используют как для легкой, так и для тяжелой цепи.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к анти-FGFR2 моноклональным антителам (mAb), которые ингибируют биологические активности FGFR2 и/или ингибируют рост у мышей опухолевого ксенотрансплантата, экспрессирующего FGFR2, фармацевтическим композициям, содержащим эти mAb, и способам их применения для лечения заболевания.
1. Антитела
Антитела представляют собой очень крупные сложные молекулы (молекулярная масса ~150000 или примерно 1320 аминокислот) со сложной внутренней структурой. Природная молекула антитела содержит две идентичные пары полипептидных цепей, каждая пара имеет одну легкую цепь и одну тяжелую цепь. Каждая легкая цепь и каждая тяжелая цепь в свою очередь состоит из двух областей: вариабельная область ("V") вовлечена в связывание с антигеном-мишенью, и константная область ("С"), которая взаимодействует с другими компонентами иммунной системы. Вариабельные области легкой и тяжелой цепей объединяются в 3-мерном пространстве для формирования вариабельной области, которая связывается с антигеном (например, рецептором на поверхности клетки). В пределах каждой вариабельной области легкой и тяжелой цепи существует три коротких сегмента (в среднем 10 аминокислот в длину), называемых областями, определяющими комплементарность ("CDR"). Шесть CDR в вариабельном домене антитела (три из легкой цепи и три из тяжелой цепи) складываются вместе в 3D-пространстве с образованием фактического сайта связывания антитела, который захватывает антиген-мишень. Положение и длина CDR ранее были описаны Kabat, E. et al., Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services, 1983, 1987. Часть вариабельной области, не содержащаяся в CDR, называется каркасом, который образует окружение для CDR.
Гуманизированное антитело представляет собой генно-инженерное антитело, в котором CDR из антитела мыши ("донорского антитела", которое также может быть антителом крысы, хомяка или других видов, не являющихся человеком) трансплантируют на антитело человека ("акцепторное антитело"). Последовательность акцепторного антитела, например, может представлять собой последовательность зрелого антитела человека, консенсусную последовательность последовательностей антитела человека, или последовательность зародышевой линии. Таким образом, гуманизированное антитело представляет собой антитело, имеющее CDR из донорского антитела и каркас вариабельной области и константные области из антитела человека. Кроме того, для сохранения высокой аффинности связывания, может быть использован по меньшей мере один из двух дополнительных структурных элементов. Смотри патент США №5530101 и 5585089, включенные в настоящее описание посредством ссылки, в которых приводятся подробные инструкции конструирования гуманизированных антител. Хотя гуманизированные антитела зачастую включают все шесть CDR (предпочтительно, как определено Кабатом, но зачастую также включают гипервариабельную петлю H1, как определено Чотиа) из антитела мыши, они также могут быть получены менее с чем всеми CDR из антитела мыши (например, Pascalis et al., J. Immunol. 169:3076, 2002; Vajdos et al., Journal of Molecular Biology, 320: 415-428, 2002; Iwahashi et al., Mol. Immunol. 36:1079-1091, 1999; Tamura et al., Journal of Immunology, 164:1432-1441, 2000).
Аналогично может быть необходимым включать только часть CDR, а именно подгруппу остатков CDR, необходимых для связывания, обозначенных SDR, в гуманизированное антитело. Остатки CDR, не контактирующие с антигеном и не находящиеся в SDR, могут быть идентифицированы на основании предыдущих исследований (например, остатки Н60-Н65 в CDR H2 зачастую не требуются), из областей по Кабату CDR, лежащих вне гипервариабельных петель Чотиа (Chothia, J. Mol. Biol. 196:901, 1987), путем молекулярного моделирования и/или эмпирически, как описано у Gonzales et al., Mol. Immunol. 41: 863, 2004. В таких гуманизированных антителах в положениях, в которых один или более донорных остатков CDR отсутствует, аминокислота, занимающая это положение, может быть аминокислотой, занимающей соответствующее положение (по нумерации Кабата) в последовательности акцепторного антитела. Число включений таких замен акцептора на донорские аминокислоты в CDR отражает баланс конкурирующих факторов. Такие замены являются потенциально предпочтительными в снижении числа мышиных аминокислот в гуманизированном антителе и, следовательно, снижении потенциальной иммуногенности. Однако замены также могут вызывать изменения аффинности, и значительные снижения аффинности предпочтительно избегать. Положения для замены в пределах CDR и аминокислот также могут быть выбраны эмпирически.
Таким образом, обычно гуманизированное антитело содержит (i) легкую цепь, содержащую CDR (зачастую три CDR) из антитела мыши, например GAL-FR21, каркас вариабельной области антитела человека и константную область антитела человека; и (ii) тяжелую цепь, содержащую CDR (зачастую три CDR) из антитела мыши, например, GAL-FR21, каркас вариабельной области антитела человека и константную область антитела человека. Каждый каркас вариабельной области легкой и тяжелой цепей может представлять собой последовательность каркаса вариабельной области зрелого антитела человека, последовательность каркаса вариабельной области зародышевой линии (объединенную с последовательностью J области), или консенсусную последовательность последовательностей каркаса вариабельной области антитела человека.
В первом структурном элементе, упомянутом выше, каркас вариабельной области тяжелой цепи гуманизированного антитела выбирают таким образом, чтобы он имел максимальную идентичность последовательности (от 65% до 95%) с каркасом вариабельного домена тяжелой цепи донорского антитела, путем соответствующего выбора акцепторного антитела среди многих известных антител человека. Во втором структурном элементе при конструировании гуманизированного антитела, выбранные аминокислоты в каркасе акцепторного антитела человека (вне CDR) заменены соответствующими аминокислотами из донорского антитела, в соответствии с определенными правилами. В частности, аминокислоты, подлежащие замене в каркасе, выбирают на основании их способности взаимодействовать с CDR. Например, заменяемые аминокислоты должны быть смежными с CDR в последовательности донорского антитела или в пределах 4-6 ангстрем CDR в гуманизированном антителе, измеренных в 3-мерном пространстве.
Химерное антитело представляет собой антитело, в котором вариабельная область антитела мыши (или другого грызуна) объединена с константной областью антитела человека; хорошо известно конструирование такого антитела генно-инженерными способами. Такие антитела сохраняют специфичность связывания мышиного антитела, являясь примерно на две трети антителом человека. Доля последовательности, не являющейся последовательностью человека, в мышиных, химерных и гуманизированных антителах, дает возможность предположить, что иммуногенность химерных антител является промежуточной между мышиными и гуманизированными антителами. Другие типы генно-инженерных антител, которые могут иметь сниженную иммуногенность по сравнению с мышиными антителами, включают антитела человека, полученные с использованием методов фагового дисплея (Dower et al., WO 91/17271; McCafferty et al., WO 92/001047; Winter, WO 92/20791; и Winter, FEBS Lett. 23:92, 1998, каждый из которых включен в настоящее описание посредством ссылки), или с использованием трансгенных животных (Lonberg et al., WO 93/12227; Kucherlapati WO 91/10741, каждый из которых включен в настоящее описание посредством ссылки).
В контексте настоящего изобретения термин «антитело, подобное антителу человека» относится к mAb, в котором значительная часть аминокислотной последовательности одной или обеих цепей (например, около 50% или более) происходит из генов иммуноглобулина человека. Следовательно, антитела, подобные антителам человека, охватывают, но не ограничиваются ими, химерные, гуманизированные антитела и антитела человека. В контексте настоящего изобретения mAb со «сниженной иммуногенностью» представляет собой моноклональное антитело, которое, как ожидается, имеет значительно меньшую иммуногенность, чем антитело мыши при введении пациентам людям. Такие антитела охватывают химерные, гуманизированные mAb и моноклональные антитела человека, а также mAbs, полученные путем замены специфических аминокислот в мышиных антителах, которые могут вносить вклад в В- или Т-клеточные эпитопы, например внешние остатки (Padlan, Mol. Immunol. 28:489, 1991). В контексте настоящего изобретения "генно-инженерное" mAb представляет собой антитело, для которого гены были сконструированы или помещены в неприродное окружение (например, гены человека в мышь или бактериофаг) с помощью технологий рекомбинантных ДНК, и, следовательно, не охватывали бы мышиное mAb, полученное обычной гибридомной технологией.
Другие подходы к созданию гуманизированных антител также могут быть использованы для достижения тех же результатов, как способы в патенте США №5530101 и 5585089, описанные выше, например «супергуманизация» (смотри Tan et al. J. Immunol. 169: 1119,2002, и патент США №6881557) или способ Studnicak et al., Protein Eng. 7:805, 1994. Более того, другие подходы к получению генно-инженерных со сниженной иммуногенностью mAbs включают "структурную перестройку", "гиперхимеризацию" и облицовку/изменение поверхности, как описано, например, у Vaswami et al., Annals of Allergy, Asthma and Immunology 81:105, 1998; Roguska et al. Protein Eng. 9:895, 1996; и патентах США №6072035 и 5639641.
Эпитоп mAb представляет собой область его антигена, с которой связывается это mAb. Два антитела связываются с одним и тем же или перекрывающимся эпитопом, если каждое конкурентно ингибирует (блокирует) связывание другого с этим антигеном. То есть 1х, 5х, 10х, 20х или 100х избыток одного антитела ингибирует связывание другого по меньшей мере на 50%, но, предпочтительно, на 75%, 90% или даже на 99%, как измерено в анализе конкурентного связывания (смотри, например, Junghans et al., Cancer Res. 50:1495, 1990). Альтернативно, два антитела имеют один и тот же эпитоп, если по существу все мутации аминокислот в антигене, которые уменьшают или устраняют связывание одного антитела, уменьшают или устраняют связывание другого. Два антитела имеют перекрывающиеся эпитопы, если некоторые мутации аминокислот, которые снижают или устраняют связывание одного антитела, уменьшают или устраняют связывание другого.
2. Антитела против FGFR2
Говорят, что моноклональное антитело (mAb), которое связывается с FGFR2 (т.е. анти-FGFR2 mAb), нейтрализуют FGFR2, или является нейтрализующим (или ингибирующим или антагонистическим), если связывание частично или полностью ингибирует одну или более биологических активностей FGFR2. Среди биологических активностей FGFR2, которые нейтрализующее антитело может ингибировать или блокировать, является способность FGFR2 связываться с одним или более или со всеми его FGF лигандами, например FGF1 и/или FGF2. Для FGFRIIIb эти лиганды охватывают FGF1, FGF7 (KGF) и других представителей подсемейства FGF7 FGF3, FGF10 и FGF22. Для FGFRIIIc эти лиганды охватывают FGF1 и FGF2; FGF4 и других представителей подсемейства FGF4-FGF5 и FGF6; FGF8 и других представителей подсемейства FGF8-FGF 17 и FGF 18; и FGF9 и других представителей подсемейства FGF9-FGF 16 и FGF20. Другой важной активностью FGFR2, которая может быть ингибирована нейтрализующим анти-FGFR2 mAb, является стимуляцию пролиферации клеток, например эпителиальных или эндотелиальных клеток, фибробластов, таких клеток как клетки Ba/F3, в которые был трансфектирован FGFR2, и различные клетки опухолей человека. Другими активностями, ингибируемыми под действием нейтрализующего анти-FGFR2 mAb, являются стимулирование дифференцировки и миграции таких клеток, как эндотелиальные клетки, и индукция ангиогенеза, например, измеренная путем стимуляции пролиферации сосудистых эндотелиальных клеток человека (HUVEC) или образования трубочек или путем индукции кровеносных сосудов при нанесении на хориоаллантоисную мембрану куриного эмбриона (САМ). Обычно нейтрализующее mAb ингибирует эти активности, когда индуцировано одним или более FGF, перечисленных выше. Аналогично, mAb предпочтительно ингибирует весь путь сигнальной трансдукции, или его часть, стимулированной связыванием FGF лиганда с FGFR2 (Dailey et al., Cytokine Growth Factor Revs 16:233, 2005), например, фосфорилирование FGFR2 и нижележащие MAP киназы.
Нейтрализующее mAb по настоящему изобретению в концентрации, например, 0,01, 0,1, 0,5, 1, 2, 5, 10, 20 или 50 мкг/мл ингибирует биологическую функцию FGFR2 по меньшей мере примерно на 50%, но, предпочтительно, на 75%, более предпочтительно на 90% или 95% или даже на 99%, и наиболее предпочтительно приблизительно на 100% (по существу полностью или неотличимо от отрицательного контроля, лишенного FGFR2), как исследовано способами, описанными в Примерах или известными из уровня техники. Обычно, степень ингибирования измеряют, когда количества используемого FGF лиганда только достаточно для того, чтобы полностью стимулировать биологическую активность, или составляет 1, 2, или 5 нг/мл или 0,01, 0,02, 0,05, 0,1, 0,5, 1, 3 или 10 мкг/мл. Предпочтительно, mAb является нейтрализующим, т.е. ингибирует биологическую активность при использовании в виде отдельного средства, но, необязательно, 2 mAb могут быть использованы вместе для осуществления ингибирования. Наиболее предпочтительно, mAb нейтрализует не только одну, а две, три или несколько биологических функций, перечисленных выше; для целей настоящего изобретения анти-FGFR2 mAb, которое используется в качестве отдельного средства, нейтрализует все биологические активности FGFR2, называется «полностью нейтрализующим», и такие mAb являются наиболее предпочтительными.
Настоящее изобретение относится к нейтрализующим mAb, которые связываются с FGFR2IIIb, но хуже или недетектируемо связываются с FGFRIIIc, или альтернативно связываются с FGFR2IIIc, но хуже или недетектируемо связываются с FGFRIIIb, или в третьей альтернативе связываются как с FGFR2IIIb, так и с FGFR2IIIc, и к применению любого из этих типов антител в фармацевтической композиции, в частности, для лечения злокачественных или других заболеваний. Настоящее изобретение также относится к mAb, либо нейтрализующим, либо не нейтрализующим, которые связываются с FGFR2 в одной или более его формах и ингибируют, предпочтительно полностью, рост опухолевого ксенотрансплантата, который экспрессирует FGFR2, например, SNU-16 или OCUM-2M ксенотрансплантат. Такое mAb может ингибировать опухолевый рост, например, посредством трансмиссии отрицательного сигнала роста или проапоптотического сигнала посредством FGFR2. MAb по настоящему изобретению предпочтительно являются специфичными в отношении FGFR2 или предпочтительно с ним связываются, то есть они не связываются или связываются в гораздо меньшей степени (например, по меньшей мере в 10 раз меньшей), с белками, которые являются родственными FGFR2, например, другими FGF рецепторами FGFR1, FGFR3 и FGFR4, а также другими рецепторными тирозинкиназами. С другой стороны, в некоторых случаях предпочтительными являются mAb, которые связываются с одним или несколькими другими FGF рецепторами помимо FGFR2. MAb по настоящему изобретению обычно имеют аффинность связывания (константа ассоциации Kа) в отношении FGFR2 по меньшей мере 107 М-1, но предпочтительно 108 М-1 или выше, и наиболее предпочтительно 109 М-1 или выше или даже 1010 M-1 или выше. Mab, демонстрирующие дифференциальное или предпочтительное связывание с одной формой FGFR или FGFR2 по сравнению с другой, преимущественно демонстрируют предпочтение по меньшей мере в пять, десять или сто раз между формами, например, по данным Kа. Отсутствие связывания между антителом и антигеном (т.е. антитело не связывается с антигеном) означает любой сигнал от предпринятой реакции связывания между ними двумя, является неотличимым от отрицательного контроля, например, в котором антитело или антиген отсутствует или заменен неактивным агентом.
Некоторые mAb по настоящему изобретению связываются как с FGFR2 человека, так и с FGFR2 мыши, или связываются с FGFR2 человека и одним, двумя или более или всеми из мышиных, крысиных, кроличьих FGFR2, FGFR2 цыпленка, собаки и/или обезьяны (например, яванского макака). В некоторых случаях, mAb связывается с FGFR2 мыши (например, FGFR2IIIb мыши) с аффинностью (т.е. Kа) в пределах 2, 10 или 100 раз большей аффинности в отношении FGFR2 человека; аналогичным образом это mAb может связываться с FGFR2 яванского макака и/или шимпанзе (например, FGFR2IIIb) с аффинностью в пределах 2 или 10 раз большей аффинности в отношении FGFR2 человека или даже по существу такой же или неотличимой от связывания с FGFR2 человека (т.е. в пределах ошибки опыта). Другие mAb являются специфичными только в отношении FGFR2 человека.
MAb по настоящему изобретению включают анти-FGFR2 антитела в их природной тетрамерной форме (2 легкие цепи и 2 тяжелые цепи) и могут быть любого из известных изотипов IgG, IgA, IgM, IgD и IgE и их подтипов, т.е. IgG1, IgG2, IgG3, IgG4 человека и IgG1, IgG2a, IgG2b, и IgG3 мыши. mAb по настоящему изобретению также включают фрагменты антител, такие как Fv, Fab и Р(аb')2; бифункциональные гибридные антитела (например, Lanzavecchia et al., Eur. J. Immunol. 17:105, 1987), одноцепочечные антитела (Huston et al., Proc. Natl. Acad. Sci. USA 85:5879, 1988; Bird et al.. Science 242:423, 1988); антитела с одним плечом (Nguyen et al., Cancer Gene Ther. 10:840, 2003); и антитела с измененными константными областями (например, патент США №5624821). mAb могут быть животного происхождения (например, мыши, крысы, хомяка или цыпленка), или они могут быть генно-инженерными. mAb грызунов получают стандартными способами, включающими множественную иммунизацию с использованием FGFR2 в соответствующем адъюванте внутрибрюшинно (i.p.), внутривенно (i.v.), или в подушечку лап, с последующим извлечением клеток селезенки или лимфатических узлов и слияние с подходящей иммортализованной клеточной линией, а затем селекцию гибридом, которые продуцируют антитело, связывающееся с FGFR2, например, смотри в Примерах. Химерные и гуманизированные mAb, полученные способами, известными из уровня техники, упомянутыми выше, являются предпочтительными вариантам осуществления настоящего изобретения. Антитела человека, полученные, например, методами фагового дисплея или трансгенных мышей, также являются предпочтительными (смотри, например. Dower et al., McCafferty et al., Winter, Lonberg et al., Kucherlapati, supra).
Aнти-FGFR2 mAb GAL-FR21, GAL-FR22 и GAL-FR23, описанные ниже, являются примерами настоящего изобретения. После выделения единичного исходного анти-FGFR2 mAb, например GAL-FR21, которое имеет желаемые свойства, описанные в настоящей заявке, нейтрализующие FGFR2, легко получить другие mAb с аналогичными свойствами, например, имеющие тот же эпитоп, используя способы, известные из уровня техники. Например, мыши могут быть иммунизированы с использованием FGFR2, как описано выше, получены гибридомы и полученные в результате mAb, подвергнуты скринингу на способность конкурировать с исходным mAb за связывание с FGFR2. Мыши также могут быть иммунизированы меньшим фрагментом FGFR2, содержащим эпитоп, с которым связывается исходное mAb. Локализация этого эпитопа может быть установлена, например, путем скрининга на связывание с рядом перекрывающихся пептидов, охватывающих FGFR2. Альтернативно, способ по Jespers et al., Biotechnology 12:899, 1994 может быть использован для направления селекции mAb, имеющих тот же эпитоп и, следовательно, свойства, сходные с исходным mAb, например, GAL-FR21. Используя фаговый дисплей, сначала тяжелую цепь исходного антитела спаривают с репертуаром легких цепей (предпочтительно, человека) для отбора FGFR2-связывающего mAb, а затем новую легкую цепь спаривают с репертуаром тяжелых цепей (предпочтительно, человека) для отбора FGFR2-связывающего mAb (предпочтительно, человека), имеющего тот же эпитоп, как и исходное mAb. Альтернативно, варианты, например, GAL-FR21 могут быть получены путем мутагенеза кДНК, кодирующей тяжелую и легкую цепи GAL-FR21.
MAb с одним и тем же или перекрывающимся эпитопом, что и GAL-FR21, GAL-FG22 или GAL-FR23, например, которые конкурируют за связывание с FGFR2 с соответствующим mAb, представляют другие примеры настоящего изобретения. Химерная или гуманизированная форма GAL-FR21, GAL-FG22 или GAL-FR23 является особенно предпочтительным вариантом осуществления. MAb, которые на 90%, 95% или 99% идентичны GAL-FR21, GAL-FG22 или GAL-FR23 в аминокислотной последовательности вариабельных областей тяжелой и/или легкой цепи (не включая сигнальную последовательность) и сохраняют их функциональные свойства, и/или которые отличаются от соответствующего mAb небольшим числом функционально несущественных аминокислотных замен (например, консервативных замен), делеций или вставок, также включены в настоящее изобретение. Также включены mAb, имеющие по меньшей мере одну или, предпочтительно, все шесть CDR, которые на 90%, 95% или 99% или 100% идентичны соответствующим CDR GAL-FR21, GAL-FG22 или GAL-FR23. Здесь, как и в любом месте в настоящей заявки, процент идентичности последовательностей определяют с последовательностями антител, максимально выровненных в соответствии с конвенцией нумерации Кабата. После выравнивания, если область рассматриваемого антитела (например, полная зрелая вариабельная область тяжелой или легкой цепи) сравнивают с той же областью эталонного антитела, процент идентичности последовательностей между областями рассматриваемого и эталонного антитела представляет собой число положений, занятых той же аминокислотой как в области рассматриваемого, так и эталонного антитела, разделенное на общее число выровненных положений двух областей, не считая разрывов, умноженное на 100, для перевода в проценты.
Для целей классификации аминокислотных замен в качестве консервативных или неконсервативных, аминокислоты могут быть сгруппированы следующим образом:
группа I (гидрофобные боковые цепи); met, ala, val, leu, ile; группа II (нейтральные гидрофильные боковые цепи): cys, ser, thr; группа III (кислые боковые цепи): asp, glu;
группа IV (основные боковые цепи): asn, gln, his, lys, arg; группа V (остатки, влияющие на конформацию цепи): gly, pro; и группа VI (ароматические боковые цепи): trp, tyr, phe. Консервативные замены включают замены между аминокислотами в той же группе. Неконсервативные замены представляют собой замену представителя одной из этих групп на представителя другой.
Нативные mAb по настоящему изобретению могут быть получены из их гибридом. Генно-инженерные mAb, например химерные или гуманизированные mAb, могут быть экспрессированы целым рядом способов, известных из уровня техники. Например, гены, кодирующие их V области легкой и тяжелой цепи, могут быть синтезированы из перекрывающихся олигонуклеотидов и встроены вместе с доступными С областями в векторы экспрессии (например, коммерчески доступные от Invitrogen), которые обеспечивают необходимые регуляторные области, например, промоторы, энхансеры, сайты полиА, и т.д. Предпочтительным является использование CMV промоторов-энхансеров. Векторы экспрессии затем могут быть трансфектированы с использованием различных хорошо известных способов, таких как липофекция или электропорация, в различные клеточные линии млекопитающих, такие как СНО или непродуцирующие миеломы, включающие Sp2/0 и NSO, и клетки, экспрессирующие антитела, отобранные путем соответствующей селекции антибиотиками. Смотри, например, патент США №5530101. Большие количества антитела могут быть получены путем выращивания клеток в коммерчески доступных биореакторах.
После экспрессии mAb или другие антитела по настоящему изобретению могут быть очищены в соответствии со стандартными процедурами из уровня техники, такими как микрофильтрация, ультрафильтрация, аффинная хроматография с белком А или G, гель-фильтрационная хроматография, анион-обменная хроматография, катион-обменная хроматография и/или другие формы аффинной хроматографии, основанных на органических красителях или подобном. Предпочтительными являются по существу чистые антитела, по меньшей мере, примерно 90 или 95% масс/масс гомогенности, и наиболее предпочтительной для фармацевтического применения является 98% или 99% масс/масс или большая гомогенность.
3. Способы лечения
Настоящее изобретение относится к способам лечения, в которых mAb по настоящему изобретению (т.е. анти-FGFR2 MAb) вводят пациентам, имеющим заболевание (терапевтическое лечение) или риск возникновения или рецидива заболевания (профилактическое лечение). Термин «пациент» включает пациентов людей; ветеринарных пациентов, таких как кошки, собаки и лошади; сельскохозяйственных животных, таких как крупный рогатый скот, овцы и свиньи; и лабораторных животных, используемых для целей тестирования, таких как мыши и крысы. Эти способы особенно подходят для лечения пациентов людей. mAb, используемое в способах лечения пациентов людей, связывается с белком FGFR2 человека, последовательность которого представлена GenBank Locus AF487553. Упоминания других FGFR или FGF, на которые дается ссылка в этом описании, представлены в разделе Предпосылки. mAb к белку человека также может быть использовано у других видов, в которых гомолог видов имеет антигенную перекрестную активность с белком человека. У видов, лишенных перекрестной реактивности, антитело используют с соответствующей специфичностью в отношении гомолога видов, присутствующего у этих видов. Однако в экспериментах с ксенотрансплантатами у лабораторных животных обычно используют mAb со специфичностью в отношении белка человека, экспрессируемого этим ксенотрансплантатом.
В предпочтительном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей антитела, описанные в настоящей заявке. Фармацевтические композиции содержат mAb в физиологически приемлемом носителе, необязательно с эксципиентами или стабилизаторами, в форме лиофилизированных или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный или ацетатный при рН обычно от 5,0 до 8,0, чаще всего от 6,0 до 7,0; соли, такие как хлорид натрия, хлорид калия и т.д., для получения изотоничного раствора; антиоксиданты, консерванты, полипептиды с низкой молекулярной массой, белки, гидрофильные полимеры, такие как полисорбат 80, аминокислоты, такие как глицин, углеводы, хелатирующие агенты, сахара и другие стандартные ингредиенты, известные специалистам в данной области (Remington's Pharmaceutical Science 16th edition, Osol, A. Ed. 1980). mAb обычно присутствует в концентрации 0,1-100 мг/мл, например, 1-10 мг/мл или 10-50 мг/мл, например, 5, 10, 20, 30, 40, 50 или 60 мг/мл.
В другом предпочтительном варианте осуществления, настоящее изобретение относится к способу лечения пациента с заболеванием, используя анти-FGFR2 mAb в фармацевтической композиции. mAb, полученное в фармацевтической композиции, может быть введено пациенту любым подходящим путем, в частности парентерально путем внутривенной инфузии или болюсной инъекции, внутримышечно или подкожно. Внутривенная инфузия может быть сделана всего за 15 минут, но чаще в течение 30 минут, или за 1, 2 или даже 3 часа. mAb также могут быть инъецированы непосредственно в патологический очаг (например, опухоль), или инкапсулированы в носители, такие как липосомы. Вводимой дозы достаточно, по меньшей мере, для частичного облегчения патологического состояния, подвергаемого лечению ("терапевтически эффективная доза") и необязательно от 0,1 до 5 мг/кг массы тела, например, 1, 2, 3 или 4 мг/кг, но может составлять вплоть до 0,1 или от 1 до 10 мг/кг или даже от 1 до любой из 15, 20 или 30 мг/кг. Также может быть введена фиксированная единичная доза, например 100, 200, 500, 1000 или 2000 мг, или доза может быть основана на площади поверхности тела пациента, например 1000 мг/м2. Обычно для лечения злокачественного заболевания вводят от 1 до 8 доз (например, 1, 2, 3, 4, 5, 6, 7 или 8), но может быть введено 10, 20 или более доз. mAb можно вводить ежедневно, два раза в неделю, еженедельно, через неделю, ежемесячно или с другим интервалом, в зависимости, например, от периода полужизни mAb, в течение 1 недели, 2 недель, 4 недель, 8 недель, 3-6 месяцев или дольше. Также возможны повторные курсы лечения, которым является длительное применение.
Сочетание дозы, частоты введения и пути введения, эффективное, по меньшей мере, для частичного облегчения заболевания, находящегося у пациента, подвергающегося лечению, называется терапевтически эффективным режимом. Сочетание дозы, частоты введения и пути введения, эффективное для ингибирования или задержки появления заболевания у пациента, называется профилактически эффективным режимом.
Заболевания, поддающиеся лечению с использованием анти-FGFR2 mAb no настоящему изобретению, включают солидные опухоли, особенно те, для которых, как считается, необходим ангиогенез, или связанные с детектируемыми или предпочтительно повышенными уровнями FGFR2 и/или FGF, например, рак яичников, рак эндометрия, рак груди, рак легких (мелкоклеточный или немелкоклеточный), рак толстой кишки, рак предстательной железы, рак шейки матки, рак поджелудочной железы, рак желудка, рак пищевода, печеночноклеточную карциному (рак печени), карциному клеток почек (рак почек), опухоли тканей головы и шеи, мезотелиому, меланому, саркомы и опухоли головного мозга (например, глиомы, такие как глиобластомы). Повышенные уровни могут быть измерены на уровне белка или мРНК в злокачественной ткани относительно сравнимых уровней FGFR2 (например, FGFR2IIIb) или FGF (например, FGF2, FGF7 или FGF10) в нормальных тканях, например родственной незлокачественной ткани, предпочтительно, от того же пациента. Детектируемые уровни могут быть аналогичным образом измерены на уровне белка или мРНК в злокачественной ткани и сравнены с фоновыми уровнями в контрольных образцах, в которых известно, что аналит (например, FGFR2 or FGF) отсутствует, или относительно отрицательных контролей, в которых обнаружение проводят, используя антитело или праймер или зонд, которые, как известно, не связываются с аналитом или нуклеиновой кислотой, кодирующей этот аналит. Лейкозы, лимфомы, множественные миеломы и другие гематологические злокачественные заболевания, в особенности любая из этих злокачественных опухолей, имеющих детектируемую или повышенную экспрессию FGFR2 и/или FGF, также могут поддаваться лечению с использованием анти-FGFR2 mAb. Другие заболевания, связанные с ангиогенезом, для которых подходит лечение с использованием aнти-FGFR2 mAb по настоящему изобретению, включают возрастную дегенерацию желтого пятна (AMD), диабетическую ретинопатию, неоваскулярную глаукому и другие заболевания глаз; псориаз и другие заболевания кожи, ревматоидный артрит; генетические нарушения скелета, связанные с мутациями в FGFR2, например, Apert синдром, как описано выше.
В предпочтительном варианте осуществления, aнти-FGFR2 mAb вводят в сочетании с другим терапевтическим средством (т.е. вместе, а именно до, во время или после) другого терапевтического средства. Например, для лечения злокачественного заболевания анти-FGFR2 mAb можно вводить вместе с любым одним или более из известных химиотерапевтических лекарственных средств, например, алкилирующими агентами, такими как кармустин, хлорамбуцил, цисплатин, карбоплатин, оксалиплатин, прокарбазин и циклофосфамид; антиметаболитами, такими как фторурацил, флоксуридин, флударабин, гемцитабин, метотрексат и гидроксимочевина; природными продуктами, включающими растительные алкалоиды и антибиотики, такие как блеомицин, доксорубицин, даунорубицин, идарубицин, этопозид, митомицин, митоксантрон, винбластин, винкристин и таксол (паклитаксел) или родственные соединения, такие как Taxotere®; ингибитор топоизомеразы 1 иринотекан; средства, специально одобренные для опухолей головного мозга, включающие темозоломид и Gliadel® капсула, содержащая кармустин; и ингибиторы тирозинкиназ, такие как Gleevec®, Sutent® (сунитиниб малат), Nexavar® (сорафениб) и Tarceva® (эрлотиниб) или Iressa® (гефитиниб); ингибиторы ангиогенеза; и все одобренные и экспериментальные противоопухолевые средства, перечисленные в WO 2005/017107 А2 (которая включена в настоящую заявку посредством ссылки). Анти-FGFR2 mAb может быть использовано в комбинации с 1, 2, 3 или более из этих других средств, используемых в стандартном химиотерапевтическом режиме. Обычно другими средствами являются те, которые, как известно, уже являются эффективными для конкретного типа злокачественной опухоли, подвергаемой лечению. Анти-FGFR2 mAb особенно применимо в преодолении резистентности к химиотерапевтическим лекарственным средствам и тем самым повышающее их эффективность.
Другие средства, с которыми анти-FGFR2 mAb может быть введено для лечения злокачественного заболевания, включают биологические продукты, такие как моноклональные антитела, в том числе Herceptin™ против антигена HER2; Avastin® против VEGF; или антитела к рецептору эпидермального фактора роста (EGF), такие как Erbitux® (цетуксимаб) и Vectibix® (панитумумаб). Антитела против фактора роста гепатоцитов (HGF) являются особенно предпочтительными для использования с анти-FGFR2 mAb, в том числе mAb L2G7 (Kim et al., Clin Cancer Res 12:1292, 2006 и патент США №7220410) и, в частности, его химерные и гуманизированные формы, такие как HuL2G7 (WO 07115049 А2); анти-HGF mAb человека, описанные в WO 2005/017107 А2, в частности 2.12.1; и HGF связывающие белки, описанные в WO 07143090 A2 или WO 07143098 A2; и другие нейтрализующие анти-HGF mAb, которые конкурируют за связывание с любым из указанных выше mAb. mAb, которое связывается с cMet рецептором HGF, является особенно предпочтительным, например, анти-cMet mAb OA-5D5 (Martens et al., Clin. Cancer Res. 12:6144, 2006), которое было получено генно-инженерным путем, чтобы оно имело только одно «плечо», т.е. связывающий домен. Антитела против других FGFR рецепторов FGFR1, 3, 4 или против различных FGF, таких как FGF1, FGF2 и FGF7, также являются предпочтительными для использования в комбинации с анти-FGFR2 mAb. Более того, анти-FGFR2 mAb может быть использовано вместе с любым видом хирургического вмешательства и/или лучевой терапией, в том числе наружной дистанционной лучевой терапией, лучевой терапией с модулированной интенсивностью (IMRT) и любым видом радиохирургии, например, такой как гамма-нож.
Лечение (например, стандартная химиотерапия), включающее анти-FGFR2 mAb антитело, может облегчать заболевание путем увеличения средней выживаемости без прогрессирования заболевания или время общей выживаемости пациентов со злокачественной опухолью, по меньшей мере, на 30% или 40%, но, предпочтительно, на 50%, 60%-70% или даже 100% или дольше по сравнению с тем же лечением (например, химиотерапией), но без анти-FGFR2 mAb, или повышения этого времени на 2 недели, 1, 2 или 3 месяца, или, предпочтительно, на 4 или 6 месяцев или даже на 9 месяцев или год. Дополнительно или альтернативно, лечение (например, стандартная химиотерапия), включающее анти-FGFR2 mAb, может увеличивать частоту полной ремиссии, частоту частичного ответа или частоту объективных ответов (полного+частичного) у пациентов с этими опухолями (например, опухолями яичников, желудка, эндометрия, поджелудочной железы, груди, легких, кишечника и глиобластом, в особенности при рецидиве или резистентности) по меньшей мере на 30% или 40%, но, предпочтительно, 50%, 60-70% или даже 100% по сравнению с тем же лечением (например, химиотерапией), но без анти-FGFR2 mAb.
Обычно в клиническом испытании (например, фазе II, фазе II/III или фазе III испытания), указанное выше увеличение средней выживаемости без прогрессирования заболевания и/или частота ответа пациентов, получавших химиотерапевтическое лечение плюс анти-FGFR2 mAb, по сравнению с контрольной группой пациентов, получавших только химиотерапию (или плюс плацебо), является статистически значимым, например, при значении р=0,05 или 0,01 или даже 0,001. Частоту полного и частичного ответа определяют с помощью объективных критериев, обычно используемых в клинических испытаниях для злокачественных заболеваний, например, перечисленных или принятых Национальным институтом злокачественных новообразований и/или Управлением США по надзору за качеством пищевых продуктов и лекарственных средств.
4. Другие способы
Анти-FGFR2 mAb по настоящему изобретению также находят свое применение в способах диагностики, прогнозирования и в лабораторных методах. Эти моноклональные антитела также могут быть использованы для измерения уровня FGFR2 в опухоли или в кровотоке пациента с опухолью, и, следовательно, для наблюдения и направления лечения опухоли. Например, опухоли, связанные с высокими уровнями FGFR2 (например, повышенными, относительно образца незлокачественной родственной ткани от того же пациента) особенно подвержены лечению с использованием анти-FGFR2 mAb. В конкретных вариантах осуществления mAb могут быть использованы в ELISA или радиоиммунном анализе для измерения уровня FGFR2, например, в сыворотке, или в иммуногистохимическом анализе для установления локализации экспрессии FGFR2, например, в образце биопсии опухоли. Использование двух анти-FGFR2 mAb, связывающихся с различными эпитопами (т.е. не конкурирующими за связывание) является особенно применимым в разработке чувствительного «сэндвич» ELISA для обнаружения FGFR2. Для различных анализов mAb может быть мечено флуоресцентными молекулами, спин-меченными молекулами, ферментами или радиоизотопами, и могут быть предоставлены в форме набора со всеми необходимыми реактивами для проведения анализа на FGFR2. В других случаях анти-FGFR2 mAbs используют для очистки FGFR2, например, посредством аффинной хроматографии.
ПРИМЕРЫ
Пример 1: Реактивы и исследования
Получение Flag-FGF1, FLAG-FGF2 и FLAG-FGF7. Синтезировали последовательность ДНК для FGF1 человека (форма со 155 аминокислотами; Chiu et al., Oncogene 5:755-1990) и FGF2 человека (форма со 155 аминокислотами; Sommer et al., Biochem. Biophys. Res. Comm. 144:543, 1987) (GenScript, Inc), затем проводили ПЦР амплификацию для получения N-концевого Flag пептидной метки (tag) и клонировали в производное рЕТ вектора (Invitrogen), используя стандартные методики молекулярной биологии. Эти плазмиды трансформировали в клетки E.coli BL21(DE3) и экспрессию FGF1 или FGF2 индуцировали с использованием 1 мМ IPTG. Уровень экспрессии FGF определяли, используя FGF1 или FGF2 специфичный набор для ELISA (R&D Systems). FGF очищали, используя гепарин-сефарозные бусы CL-6B (Amersham Biosciences), как описано (Wiedlocha et al., Mol. Cell. BioL, 16:270, 1996). Аналогичным образом, ген для FGF7 человека (форма-предшественник из 194 аминокислот; Finch, P.W. et al., Science 245:752, 1989) синтезировали и проводили ПЦР амплификацию для получения N-концевой Flag метки в векторе pCMV (производный от pDrive, Invitrogen), и Flag-FGF10 получали аналогичным образом. Плазмидные ДНК трасфектировали в 293F клетки человека. Культуральный супернатант трансфектированных клеток 293F использовали для анализа лиганд-рецепторного связывания.
Получение FGFR2 слитых белков. Внеклеточный домен (ECD) FGFR2IIIb человека и FGFR2IIIC человека экспрессировали в виде иммуноадгезивны молекул. Для альфа форм, фрагменты ДНК, кодирующие весь ECD FGFR2IIIb (аминокислоты 1-378) или FGFR2IIIC (аминокислоты 1-377) сливали с Fc человека (остатки с 216 по 446) через полипептидный линкер; для бета форм (лишенных D1) аминокислоты 152-378 для FGFR2(бета)IIIb и аминокислоты 152-377 для FGFR2(бета)IIIc были использованы в качестве альтернативы. Эти молекулы FGFR2-Fc экспрессировали путем трансфекции клеток 293F и выбора стабильных трансфектантов в присутствии G418 (1 mg/ml) 293 экспрессионной среде (Invitrogen). FGFR2-Fc секретированный из трансфектированных клеток 293F, очищали, используя колонку с белком A/G. Аналогичным образом, кДНК яванского макака (cyno) FGFR2 ECD клонировали с использованием стандартных методик из мРНК печени cyno, и аминокислоты 1-378 были слиты с Fc человека для создания cyno FGFR2IIIb-Fc для экспрессии. FGFR2IIIb-Fc шимпанзе конструировали, используя мутагенез in vitro для превращения одной аминокислоты в FGFR2IIIb ECD человека, которая отличается от FGFR2IIIb шимпанзе в аминокислоту шимпанзе (остаток 186 метионин в треонин, на основании известных последовательностей в GenBank). Мышиный FGFR2(бета)IIIb-Fc белок приобретали у R&D Systems (Catalog # 708-MF).
Анализ ELISA на mAb, связывающиеся со слитым белком FGFR2. Планшеты для проведения ELISA покрывали антителом козы против IgG-Fc человека (2 мкг/мл) в течение ночи при 4°С. Затем участки неспецифического связывания блокировали с использованием 2% BSA в течение 1 часа при комнатной температуре. Планшеты инкубировали с одним из FGFR2 слитых белков, описанных выше (1 мкг/мл), в течение 1 часа с последующим инкубированием с различными концентрациями mAb или гибридомных культуральных жидкостей в течение 1 часа. Связанное mAb выявляли с использованием HRP-козьего антимышиного антитела с последующим промыванием добавлением ТМВ субстрата (Sigma) и считыванием при 450 нм. Во всех анализах ELISA планшеты промывали 3 раза между каждой стадией.
Проточная цитометрия. После промывания дважды в буфере для сортинга клеток (CSB: PBS/1% FBS/0.02% NaNa), 2×105 клеток ресуспендировали в 50 мкл CSB в лунке микротитровального планшета и инкубировали с 50 мкл тестируемых анти-FGFR2 mAb (1 мкг/50 мкл) в течение 1 часа на льду. Затем клетки промывали дважды в CSB и связанные антитела детектировали путем инкубирования с FITC-козьим антимышиным IgG (Jackson ImmunoResearch Laboratories) в течение 1 часа на льду. После промывания дважды в CSB, клетки анализировали на FACScan (Becton Dickinson).
Пример 2: получение моноклональных антител к FGFR2 Мышей Ba1b/c (самок в возрасте 5-6 недель) иммунизировали путем инъекции в подушечки задних лап с интервалами 1 неделя либо 20, либо 22 раза FGFR2(бета)IIIb-Fc (начальная доза 10 мкг/подушечку лапы, затем 5 мкг/подушечку лапы), или 17 дозами FGFR2IIIc-Fc (начальная доза 10 мкг/подушечку лапы, затем 5 доз по 2 мкг, затем по 5 мкг) с последующими 5 дозами FGFR2(бета)IIIc-Fc (по 5 мкг/подушечку лапы), с антигеном, суспендированным в MPL/TDM (Sigma-Aldrich). Через три дня после последней инъекции подколенные лимфоидные клетки извлекали и сливали с P3/X63-Ag8U1 миеломными клетками мыши в соотношении 1:1, используя систему Hybrimune Electro fusion System (Cyto Pulse Sciences).
Гибридомы отбирали путем добавления 2х HAT (Sigma) спустя 24 часа. Через десять дней после слияния гибридомные культуральные супернатанты подвергали скринингу на их способность связываться с FGFR2IIIb-Fc, но не с IgG человека, используя ELISA. Выбранные mAb затем подвергали скринингу на их способность распознавать FGFR2IIIb на линии опухолевых клеток желудка человека SNU-16 (Shin et al, J. Cancer Res. Clin. Oncol. 126:519, 2000). Выбранные гибридомы затем клонировали дважды, используя метод предельных разведении. Три mAb, выбранных этим способом, представляли собой GAL-FR21 и GAL-FR22 в результате первого режима иммунизации, и GAL-FR23 в результате второго режима иммунизации. Свойства этих mAb показаны на Фиг.2, как дополнительно описано ниже.
Кроме того, ряд других анти-FGFR2 mAb был получен в результате слияний, в том числе FR2bB 100.12.9, FR2bC 54.8.11, FR2bC 100.7.9, FR2bC 101.8.2, FR2bC 115.1.5, FR2bC 149.8.8, FR2bB 11.5.3, и FR2bB 18.1.6.
Пример 3: свойства анти-FGFR2 mAb
Как видно на Фиг.3, все три выбранных mAb GAL-FR21, GAL-FR22 и GAL-FR23 хорошо связываются с FGFR2IIIb в анализе ELISA, описанном в Примере 1. Используя четыре различные формы FGFR2-Fc в ELISA, было определено, что каждое из этих mAb имеет различный профиль связывания, и, следовательно, эпитоп (Фиг.4). GAL-FR21 связывается как с альфа, так и с бета формами FGFR2IIIb (т.е. с D1 и без него), но не с FGFRIIIc. Следовательно, этот эпитоп не может включать D1, а должен включать D3IIIb, поэтому, вероятно заключен в пределах D3IIIb или D3. GAL-FR22 также связывается как с альфа-, так и с бета-формами, но у обоих IIIb и IIIс окружение, поэтому этот эпитоп предположительно заключается в D2-D3IIIa или безусловно в D2-D3. Наконец GAL-FR23 не связывается ни с одной из бета-форм, поэтому его эпитоп должен быть полностью или частично в D1. Следовательно, mAb, которые имеют эпитоп либо в D1, либо D2-D3, либо D3, охватываются настоящим изобретением.
Для подтверждения того, что mAb GAL-FR21, GAL-FR22 и GAL-FR23 связываются с различными эпитопами, проводили эксперимент по конкуренции, в котором каждое mAb было биотинилировано, а затем 0,4 мкг биотинилированного mAb конкурировало с 100:1 избытком каждого из других немеченых mAb (или контрольным мышиным mAb 5G8) за связывание с FGFR2IIIb-Fc в анализе ELISA, описанном выше (но с HRP-стрептавидином в качестве реактива для обнаружения). Как видно на Фиг.5, каждое mAb конкурировало с самим собой за связывание, но не с другими mAb, показывая что они имеют различные эпитопы. Кроме того, другие mAb FR2bB 100.12.9, FR2bC 54.8.11, FR2bC 100.7.9, FR2bC 101.8.2, Fr2bC 115.1.5, FR2bC 149.8.8 конкурировали за связывание с биотинилированным GAL-FR21 в этом исследовании, поэтому имеют тот же самый или перекрывающийся эпитоп, как GAL-FR21, тогда как mAb FR2bB 11.5.3, и FR2bB 18.1.6 конкурировали за связывание с биотинилированным GAL-FR22, поэтому имеют тот же самый или перекрывающийся эпитоп, как GAL-FR22.
Чтобы подтвердить, что выбранные mAb связываются с соответствующими формами FGFR2 на клеточной мембране, использовали проточную цитометрию. Клетки KATO-III (АТСС НТВ-103) и SNU-16 (ATCC CRL-5974), которые гиперэкспрессируют FGFR2IIIb, использовали для тестирования связывания с этой формой рецептора. Как видно на Фиг.6, все три mAb GAL-FR21, GAL-FR22 и GAL-FR23 связываются с обеими клеточными линиями, как ожидалось по их эпитопам, описанным выше. Клетки 293F человека, трансфектированные геном для FGFRIIIc, использовали для тестирования связывания с этой формой, после верификации, что ни одно из mAb само не связывается с 293F клетками-хозяевами. Как видно на Фиг.7, GAL-FR22 и GALFR23, но не GALFR21, связывается с FGFRIIIb-трансфектированными клетками, как ожидалось по их эпитопам. Наконец, поскольку S252W мутация FGFR2 обнаруживается в некоторых злокачественных клетках, было протестировано связывание mAb с клетками 293F, трансфектированными геном FGFR2IIIb, сконструированным таким образом, что содержит эту мутацию (FGFR2IIIb(S252W)). Также, как видно на Фиг.7, все mAb связывались с FGFR2IIIb(S252W)-трансфектированными клетками. Способность связываться с FGFR2IIIb(S252W) является предпочтительным свойством mAb по настоящему изобретению.
Для определения способности mAb ингибировать связывание FGF лигандов с FGFR2, использовали анализ ELISA. Лунки планшетов для ELISA покрывали 2 мкг/мл козьего антитела против IgG-Fc человека в течение ночи при 4°С. После блокирования 2% BSA в течение 1 часа при комнатной температуре, эти лунки инкубировали с 0,5 мкг/мл FGFR2IIIb-Fc в течение 1 часа, с последующим инкубированием с Flag-FGF1 или Flag-FGF2 (0,2 мкг/мл) в присутствии различных концентраций mAb в течение 1 часа. Связанные Flag-FGF детектировали путем добавления HRP-анти-Flag М2 антитела (Sigma), а затем добавления ТМВ субстрата. Как может быть видно из Фиг.8А, mAb GAL-FR21 слабо блокировало связывание FGF1 с FGFR2IIIb в этом исследовании, но GAL-FR22 и GAL-FR23 не блокировали связывание FGF1. В отличие от этого GAL-FR21 сильно блокировало связывание FGF2 с FGFR2IIIb, GAL-FR22 умеренно блокировало FGF2 связывание, и GAL-FR23 не блокировало связывание. В аналогичных анализах, но с использованием Flag-FGF7 и Flag-FGF 10, также было видно (Фиг.8 В), что GAL-FR21 и GAL-FR22 блокируют связывание FGF7 и FGF10 с FGFR2IIIb. Действительно, предпочтительные mAb по настоящему изобретению, наподобие GAL-FR21 и GAL-FR22, блокируют FGF2 и FGF7 и/или FGF10 с FGFR2IIIb, предпочтительно на 80% или 90%, или 95%, или полностью или по существу полностью. Следовательно, было показано, что GAL-FR21 и GAL-FR22, а не GAL-FR23 нейтрализуют по меньшей мере одну биологическую активность FGFR2.
Пример 4: модели ксенотрансплантатов
Эксперименты с ксенотрансплантатом проводили, как описано ранее (Kim et al., Nature 362:841,1993). Опухолевые клетки человека, обычно выращенные в полной среде DMEM, собирают в HBSS. Самкам бестимусных голых мышей или мышам NIH-III Xid/Beige/nud (в возрасте 4-6) вводят подкожно 2-10×106 клеток в 0,1 мл HBSS в область спины. Когда размер опухоли достигает 50-100 мм3, мышей распределяют по группам случайным образом, и 5 мг/кг (всего 100 мкг) или несколько иную дозу mAb вводят внутрибрюшинно (i.p.) дважды в неделю в объеме 0,1 мл. Размеры опухоли определяли дважды в неделю путем измерения по двум параметрам [длина (а) и ширина (b)]. Объем опухоли вычисляют в соответствии с формулой V=аb2/2 и выражают в виде среднего объема опухоли±SEM. Количество мышей в каждой испытуемой группе составляет обычно 5-7 мышей. Может быть проведено статистический анализ, например, используя t-критерий Стьюдента.
На фигурах 9 и 10А показано, что в различных экспериментах GAL-FR21, GAL-FR22 и GAL-FR23, вводимые на уровне дозы 20 мкг (1 мг/кг) дважды в неделю, все сильно ингибировали рост SNU-16 ксенотрансплантатов опухоли желудка, с GAL-FR21, являющимся наиболее эффективным и полностью ингибирующим рост ксенотрансплантата. mAb FR2bC 54.8.11, упомянутое выше, которое конкурирует за связывание с GAL-FR21, также ингибировало рост ксенотрансплантата. На Фиг.10В показано, что GAL-FR21 и GAL-FR22, введенные на уровне дозы 50 мкг (2,5 мг/кг) дважды в неделю также сильно ингибировало рост ксенотрансплантатов OCUM-2M линии клеток опухоли желудка человека (которая описана у Yashiro et al., Jpn J Cancer Res 85:883, 1994). Способность mAb ингибировать ксенотрансплантаты КАТО III или других РСРР2-экспрессирующих клеточных линий показана аналогично. Способность mAb ингибировать рост опухоли суммарно или синергетически с другими противоопухолевыми средствами, описанными выше, показана с помощью испытуемых групп мышей с ксенотрансплантатом с mAb отдельно, отдельным другим средством, и mAb вместе с другим средством, и обращая внимание на то, что лечение обоими средствами имеет большее ингибирующее действие, чем любое из средств в отдельности.
Пример 5: связывание mAb с FGFR2 из других видов
Для определения способности mAb связываться с FGFR2 из других видов, отличных от человека, использовали анализы ELISA. Лунки планшета для проведения ELISA покрывали 2 мкг/мл антитела козы против IgG-Fc человека в течение ночи 4°С. После блокирования с использованием 2% BSA в течение 1 часа при комнатной температуре, лунки инкубировали с 0,2 мкг/мл FGFR2IIIb-Fc в течение 1 часа, где FGFRIIIb в слитом белке был либо FGFRIIIb человека, мыши, яванского макака, либо шимпанзе. Затем лунки инкубировали с различными концентрациями GAL-FR21 или GAL-FR22 mAb. Связанные mAb выявляли путем добавления HRP-конъюгированного козьего антимышиного IgG-Fc, а затем субстрат ТМВ. На Фиг.11 показано, что GAL-FR21 связывается с мышиным FGFR2 почти так же хорошо (в пределах 10 раз), как и с FGFR2 человека, тогда как GAL-FR22 связывается с мышиным FGFR2 довольно хорошо (в пределах примерно 100 раз по сравнению с FGFR2 человека). На Фиг.12 показано, что GAL-FR21 связывается с FGFR2 яванского макака так же хорошо, как (неотличимо от) с FGFR2 человека, тогда как GAL-FR22 связывается с FGFR2 яванского макака довольно хорошо (в пределах примерно 100 раз по сравнению с FGFR2 человека). Аналогичный эксперимент с FGFR2 шимпанзе дал те же результаты, как с FGFR2 яванского макака: GAL-FR21 связывался с FGFR2 шимпанзе также (неотличимо от) FGFR2 человека, тогда как GAL-FR22 связывался с FGFR2 шимпанзе достаточно хорошо (в пределах примерно 100 раз по сравнению с FGFR2 человека). Предпочтительные mAb по настоящему изобретению, как GAL-FR21 и GAL-FR22, связываются со всеми FGFR2 мыши, обезьяны, шимпанзе и человека, и наиболее предпочтительно связываются с мышиным FGFR2 в пределах 2, 10, 100 или 1000 раз как с FGFR2 человека, и/или связываются FGFR2 обезьяны и/или шимпанзе в пределах 2, 10 или 100 раз или неотличимо от (в пределах экспериментального отклонения) FGFR2 человека (по измерениям, например, Kа). Связывание с FGFR2 из таких иных видов делает тестирование mAb у этих животных более легким для проведения.
Пример 6: гуманизация GAL-FR21 и GAL-FR22
Клонирование вариабельных областей легкой и тяжелой цепи GAL-FR21 mAb, конструирование и экспрессия химерного mAb, и создание, конструирование, экспрессия и очистка гуманизированного GAL-FR21 mAb были выполнены с использованием стандартных методов молекулярной биологии, например, как описано в заявке US 20080019974 для L2G7 mAb, которая включена в настоящее описание посредством ссылки для любых целей. Аминокислотные последовательности вариабельных областей (зрелых) легкой и тяжелой цепей (V) GAL-FR21 показаны соответственно на Фиг.13А и 13 В, верхние линии меченные GAL-FR21. Более конкретно, для создания гуманизированного GAL-FR21 mAb, в основном следовали методам Queen et al., и патентов США №№5530101 и 5585089. Vκ последовательность человека CAG27369 и последовательность VH AAB00780, показаны, соответственно на Фиг.13А и 13 В, нижние линии, были соответственно выбраны в качестве акцепторных последовательностей для GAL-FR21 VL и VH последовательностей, поскольку они имеют особенно высокую гомологию каркасных областей (т.е. идентичность последовательностей) с ними. Компьютерную молекулярную модель вариабельного домена GAL-FR21 использовали для локализации аминокислот в каркасной области GAL-FR21, которые достаточно близки к CDR для потенциального взаимодействия с ними. Для создания вариабельных областей легкой и тяжелой цепи гуманизированного GAL-FR21, CDR из мышиного GAL-FR21 mAb сначала были по существу трансплантированы в акцепторные каркасные области. В положениях каркасной области, где компьютерная модель предполагала наличие значительного контакта с CDR, который может быть необходим для поддержания конформации CDR, аминокислоты из мышиного антитела заменяли на аминокислоты каркасной области антитела человека. Для гуманизированного GAL-FR21 mAb создавали HuGAL-FR21, это было сделано по остаткам 27, 28, 30 (в пределах гипервариабельной петли H1 Чотиа) и 48 и 67 тяжелой цепи и не затрагивая остатки легкой цепи, используя нумерацию по Кабату. Последовательности V области легкой и тяжелой цепи HuGAL-FR21 показаны на Фиг.13А и 13В соответственно, средние линии меченные HuGAL-FR21, где они выровнены по сравнению с соответствующим донорским GAL-FR21 и акцепторными V областями человека - CDR (как определено по Кабату) подчеркнуты и замещенные аминокислоты, перечисленные выше, подчеркнуты двойной чертой.
Настоящее изобретение относится не только к гуманизированному GAL-FR21 mAb, HuGAL-FR21, в том числе V областям тяжелым и легкой цепи, показанным на Фиг.13, но также к вариантам гуманизированных mAb, вариабельные области тяжелой и легкой цепи которых отличаются от последовательностей HuGAL-FR21 небольшим числом (например, обычно не более 1, 2, 3, 5 или 10) замен, делеций или вставок, обычно в каркасной области, но возможно в CDR-ax. В частности, только подгруппа замен, описанных выше, может быть сделана в акцепторных каркасных областях, или дополнительная замена (замены) может быть сделана, например, аминокислота 69L GAL-FR21 VH мыши может замещать акцепторную аминокислоту 691, и/или мышиные аминокислоты могут заменять соответствующие аминокислоты в гуманизированной легкой цепи в любом из положений по нумерации Кабата 1, 3 и 60 и 63, которые имеют такую же близость к CDR-ам. Действительно, многие остатки каркасных областей не в контакте с CDR-ами в гуманизированном mAb могут размещать замены аминокислот из соответствующих положений донорского мышиного mAb или других антител мыши или человека, и даже многие потенциальные CDR-контактирующие остатки также подлежат замене и даже аминокислоты в пределах CDR могут быть изменены. Одним примером CDR замены является замена остатка в CDR остатком, занимающим соответствующее положение акцепторной последовательности человека, используемой для предоставления каркасов вариабельных областей.
Чаще всего замены, сделанные в последовательностях варианта гуманизированного GAL-FR21, являются консервативными в отношении замещенных аминокислот HuGAL-FR21. Аминокислоты могут быть сгруппированы следующим образом для определения консервативных замен, т.е. замещений в пределах группы: Группа I (гидрофобные боковые цепи): met, ala, val, leu, ile; Группа II (нейтральные гидрофильные боковые цепи): cys, ser, thr; Группа III (кислые боковые цепи): asp, glu; Группа IV (основные боковые цепи): asn, gln, his, lys, arg; Группа V (остатки, влияющие на ориентацию цепи): gly, pro; и Группа VI (ароматические боковые цепи): trp, tyr, phe.
Предпочтительно, замены в HuGAL-FR21 (консервативные ли, или неконсервативные) не оказывают существенного влияния на аффинность связывания или эффективность гуманизированного антитела mAb, то есть его способность нейтрализовать биологические активности FGFR2 (например, эффективность в некоторых или во всех анализах, описанных в настоящей заявке, варианта гуманизированного GAL-FR21 mAb является по существу такой же, т.е. в пределах экспериментальной ошибки, как у HuGAL-FR21). Предпочтительно, последовательности зрелой V области варианта легкой и тяжелой цепи по меньшей мере на 90%, более предпочтительно, по меньшей мере на 95%, и, наиболее предпочтительно, по меньшей мере на 98% идентичны соответствующим V областям зрелой легкой и тяжелой цепи HuGAL-FR21. Альтернативно, вариабельные области другого антитела человека с высокой идентичностью последовательностей к таковым у GAL-FR21 также являются подходящими для обеспечения каркасной области гуманизированного антитела, особенно областей V каппа из подгруппы I человека и V областей тяжелой цепи из подгруппы I человека, или консенсусных последовательностей этих подгрупп.
В других гуманизированных антителах по меньшей мере 1, 2, 3, 4, или все 5 положений замен акцепторов - доноров, упомянутых выше в связи с антителом, приведенным в качестве примера (т.е. Н27, Н28, Н30, Н48, Н67) предпочтительно заняты остатком, занимающим соответствующее положение в тяжелой цепи донорского антитела мыши. Если акцепторная последовательность тяжелой цепи отличается от ААВ00780, замена акцептор - донор может потребоваться или не требоваться для определенного размещения конкретного положения вариабельной каркасной области в зависимости от того, является ли уже остаток, занимающий конкретное положение тем же между акцептором и донором.
Приводимое в качестве примера mAb HuGAL-FR21, рассмотренное в настоящей заявке, имеет константные области κ и γ1 человека, например, как представлено в US 20080019974, и, следовательно, представляет собой IgG1. Полные последовательности (зрелых) легкой и тяжелой цепей HuGAL-FR21 показаны на Фиг.14. Хотя эти последовательности представляют собой соответственно Km(3) и G1m(3) аллотипы, понятно, что IgG1 mAb любого (IgG1, κ) аллотипа охватываются обозначением HuGAL-FR21. Также будет понятно, что когда HuGAL-FR21 производится посредством общепринятых методов, от одной до нескольких аминокислот на амино или карбокси конце легкой и/или тяжелой цепи, например, С-концевой лизин тяжелой цепи, может отсутствовать или быть производным в части или во всех молекулах, и такой состав все же будет охватываться обозначением HuGAL-FR21 и считаться гуманизированным GAL-FR21 mAb. Гуманизированные mAb других изотипов (например, IgG2, IgG3 и IgG4) могут быть получены путем объединения вариабельных областей HuGAL-FR21 с соответствующими константными областями антитела человека. Замены могут быть сделаны в константных областях HuGAL-FR21 для уменьшения или увеличения эффекторной функции, такой как комплемент-опосредованная цитотоксичность или ADCC (смотри, например, Winter et al., патент США №5624821; Tso et al., патент США №5834597; и Lazar et al., Proc. Natl. Acad. Sci. USA 103:4005, 2006), или для пролонгирования периода полужизни у людей (смотри, например, Hinton et al., J. Biol. Chem. 279:6213, 2004). Более определенно, но без ограничения, HuGAL-FR21, имеющие мутации в константной области IgG на Gln в положении 250 и/или Leu в положении 428, являются вариантами осуществления настоящего изобретения.
Для сравнения аффинности связывания HuGAL-FR21 с аффинностью связывания мышиного mAb GAL-FR21, эксперимент по конкурентному связыванию проводили с использованием стандартной технологии ELISA. В частности, лунки планшетов для проведения ELISA покрывали 2 мкг/мл антитела козы против IgG-Fc человека в течение ночи при 4°С. После блокирования с использованием 2% BSA в течение 1 часа при комнатной температуре, лунки инкубировали с 0,5 мкг/мл FGFR2IIIb-Fc. Затем лунки инкубировали с биотинилированным GAL-FR21 mAb (0,05 мкг/мл) в присутствии возрастающих концентраций немеченого GAL-FR21, HuGAL-FR21 или контрольного антитела человека hIgG. Уровень биотинилированного связанного GAL-FR21 определяли путем добавления HRP-стрептавидина и субстрата. Как показано на Фиг.15, HuGAL-FR21 и GAL-FR21 конкурировали приблизительно одинаково хорошо с HuGAL-FR21 возможно несколько лучше, указывая на то, что аффинность связывания в отношении FGFR2 у HuGAL-FR21 по меньшей мере такая же высокая, как у GAL-FR21 mAb (мышь). Из концентрации HuGAL-FR21 необходимой для ингибирования связывания меченного mAb на 50%, можно оценить, что аффинность связывания Kа у HuGAL-FR21 в отношении FGFR2 по меньшей мере приблизительно составляет 109 М-1. HuGAL-FR21 также может быть протестировано в любом из биологических исследований на активность FGFR2, описанных в настоящей заявке, например, ингибирование связывания FGF2 или FGF7 с FGFR2, и будет ингибировать активность FGFR2 сравнимо с GAL-FR21.
Гуманизированное GAL-FR22 mAb может быть создано, сконструировано, получено и исследовано таким же или аналогичным образом, что и HuGAL-FR22. Аминокислотные последовательности вариабельных областей (зрелой) легкой и тяжелой цепи GAL-FR22 показаны соответственно на Фиг.16А и 16 В, линии меченного GAL-FR22. гуманизированное GAL-FR22 mAb имеет гуманизированную легкую цепь, содержащую CDR из последовательности на Фиг.16А и гуманизированную тяжелую цепь, содержащую CDR из последовательности Фиг.16 В. В некоторых случаях, Гуманизированное GAL-FR22 mAb содержит три CDR легкой цепи, показанных на Фиг.16А и три CDR тяжелой цепи, показанных на Фиг.16 В. Предпочтительно, Гуманизированное GAL-FR22 mAb обладает аффинностью связывания в отношении FGFR2 в пределах 2 или 3 раз больше аффинности мышиного GAL-FR22 mAb, и наиболее предпочтительно имеет аффинность связывания неотличимую или большую, чем аффинность GAL-FR22 mAb, измеренная, например, с помощью конкурентного ELISA, как описано для HuGAL-FR21 и GAL-FR21.
Хотя настоящее изобретение было описано со ссылкой на варианты осуществления, предпочтительные в настоящий момент, должно быть понятно, что различные модификации могут быть сделаны без отклонения от настоящего изобретения. Если иным образом не очевидно из контекста, любая стадия, элемент, вариант осуществления, признак или аспект настоящего изобретения может быть использован с любым другим. Все процитированные публикации, патенты, патентные заявки, регистрационные номера и подобное в настоящее описание включены посредством ссылки в полном объеме для любых целей в той же мере, как если каждая отдельная публикация, патент, патентная заявка или регистрационный номер были конкретно и отдельно указаны включенными посредством ссылки в полном объеме для любых целей. Если последовательность нуклеиновой кислоты или белка, связанная с регистрационным номером, изменена, имеется в виду вариант последовательности, связанный с регистрационным номером как 7 ноября 2008. Гибридомы, продуцирующие моноклональные антитела GAL-FR21, GAL-FR22, и GAL-FR23 были депонированы в Американской коллекции типовых культур, P.O. Box 1549 Manassas, VA 20108, как соответственно АТСС номера РТА-9586 6 ноября 2008, РТА-9587 6 ноября 2008 и РТА-9408 12 августа 2008, в соответствии с будапештским договором. Эти депозиты будут сохраняться в уполномоченном депозитарии в случае мутации, нежизнеспособности или разрушения в течение периода по меньшей мере пять лет после получения депозитарием самого раннего требования выдачи образца, по меньше мере в течение периода три года после даты депонирования, или на протяжении действия отсылочного патента, какой период является наиболее продолжительным. Все ограничения на общедоступность этих клеточных линий будут безвозвратно удалены при выдаче патента по заявке.
| название | год | авторы | номер документа |
|---|---|---|---|
| АФУКОЗИЛИРОВАННЫЕ АНТИТЕЛА К РЕЦЕПТОРУ ФАКТОРА РОСТА ФИБРОБЛАСТОВ FGFR2IIIb | 2014 |
|
RU2698061C2 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2834309C2 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2745707C2 |
| АФУКОЗИЛИРОВАННЫЕ АНТИТЕЛА К РЕЦЕПТОРУ ФАКТОРА РОСТА ФИБРОБЛАСТОВ FGFR2IIIB | 2014 |
|
RU2740714C2 |
| АНТИТЕЛА К FGFR2 В КОМБИНАЦИИ С ХИМИОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ ПРИ ЛЕЧЕНИИ РАКА | 2018 |
|
RU2797560C2 |
| Гуманизированные антитела к LIV-1 и их применение для лечения рака | 2011 |
|
RU2608646C2 |
| ГУМАНИЗИРОВАННЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ФАКТОРУ РОСТА ГЕПАТОЦИТОВ | 2007 |
|
RU2461570C2 |
| Новые антитела против FGFR2b | 2020 |
|
RU2841589C1 |
| НОВЫЕ АНТИТЕЛА ПРОТИВ FGFR2B | 2020 |
|
RU2840537C1 |
| ВНЕКЛЕТОЧНЫЙ ДОМЕН ТИРОЗИНКИНАЗНОГО РЕЦЕПТОРА, СВЯЗЫВАЮЩИЙ АЛЛОСТЕРИЧЕСКИЙ ИНГИБИТОР | 2010 |
|
RU2604805C2 |








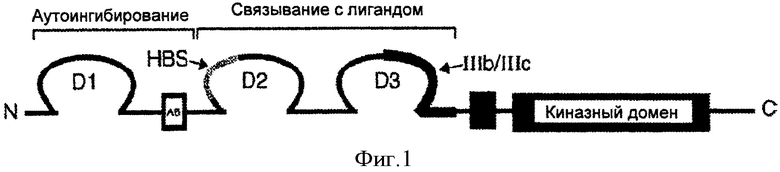

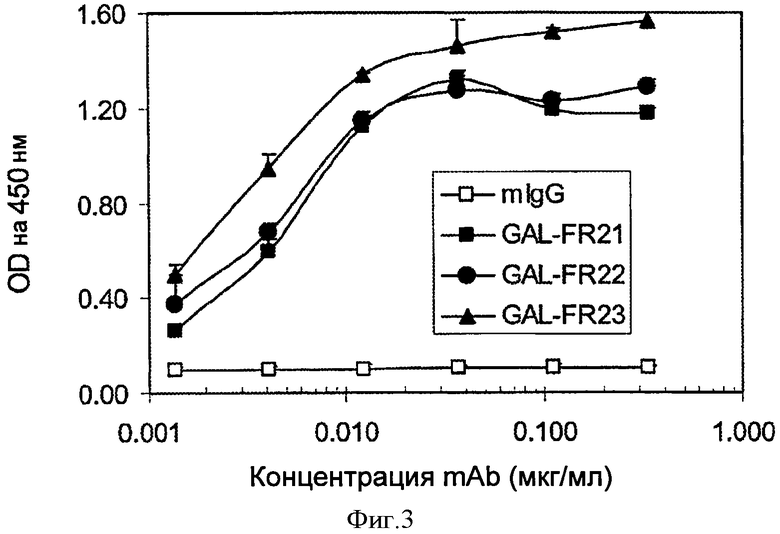
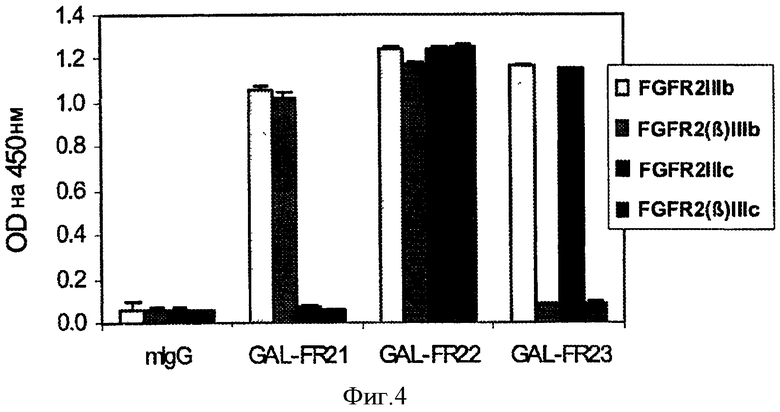
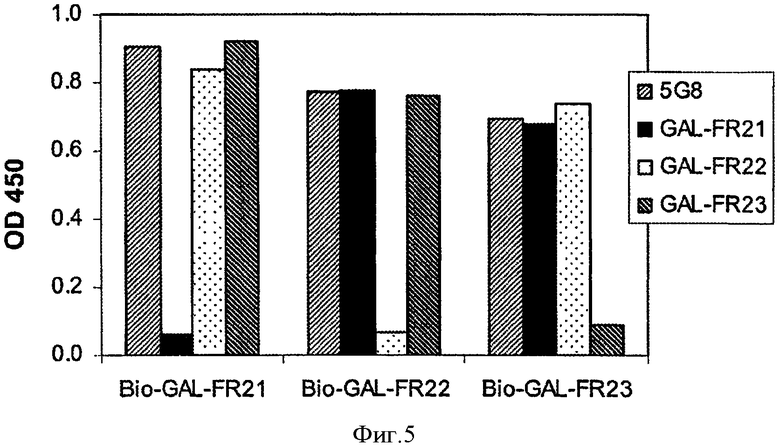
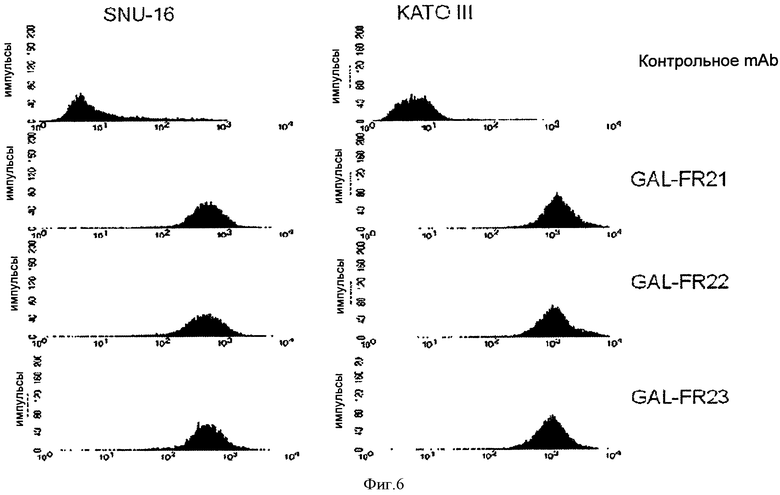
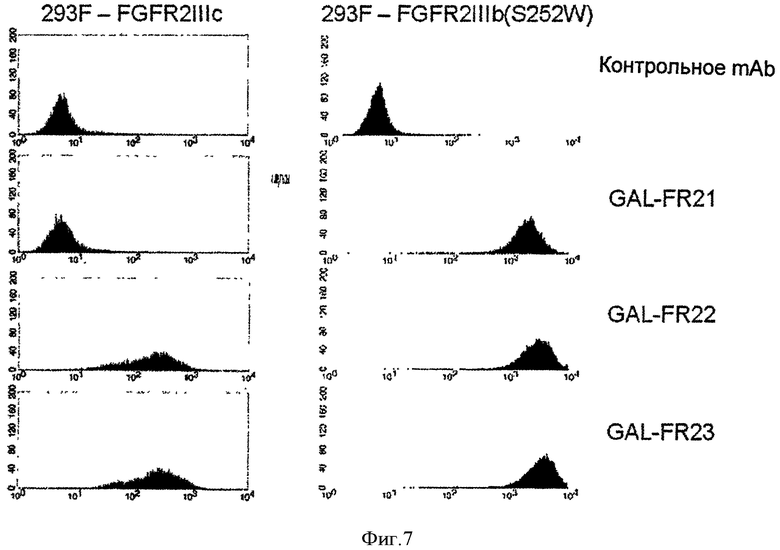
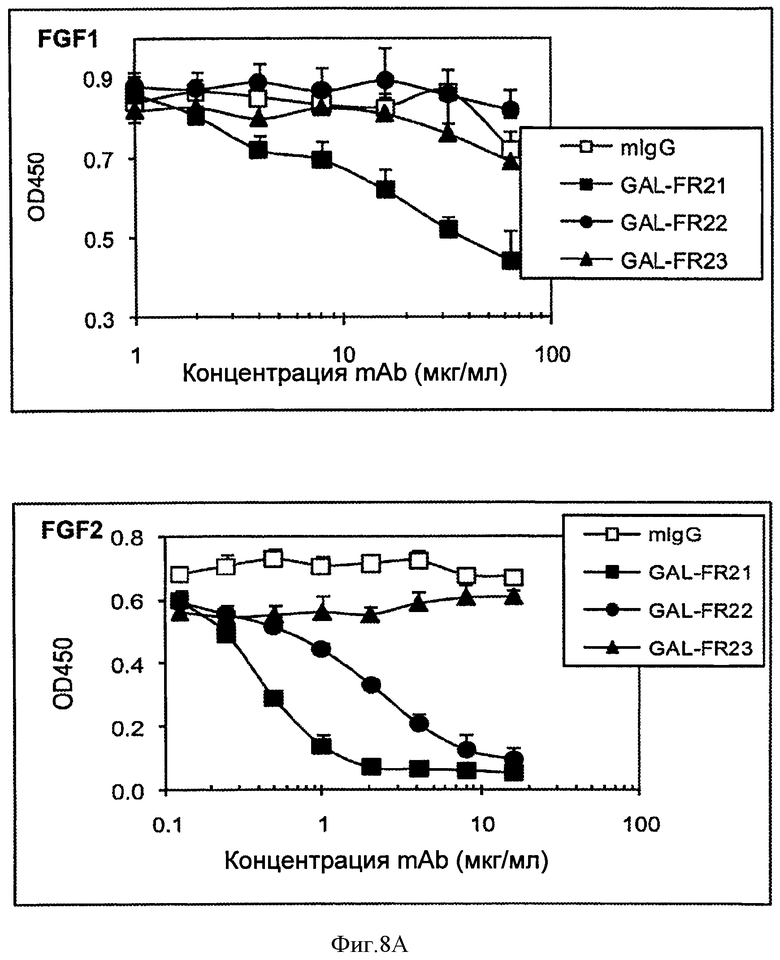
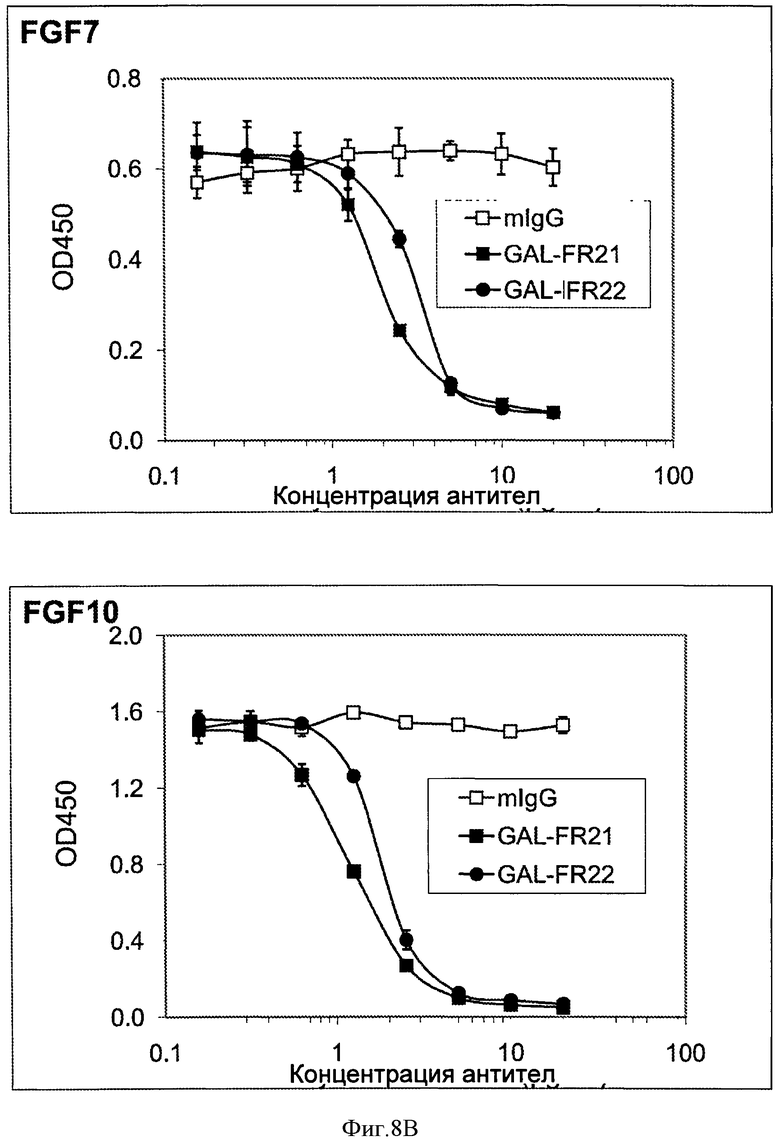
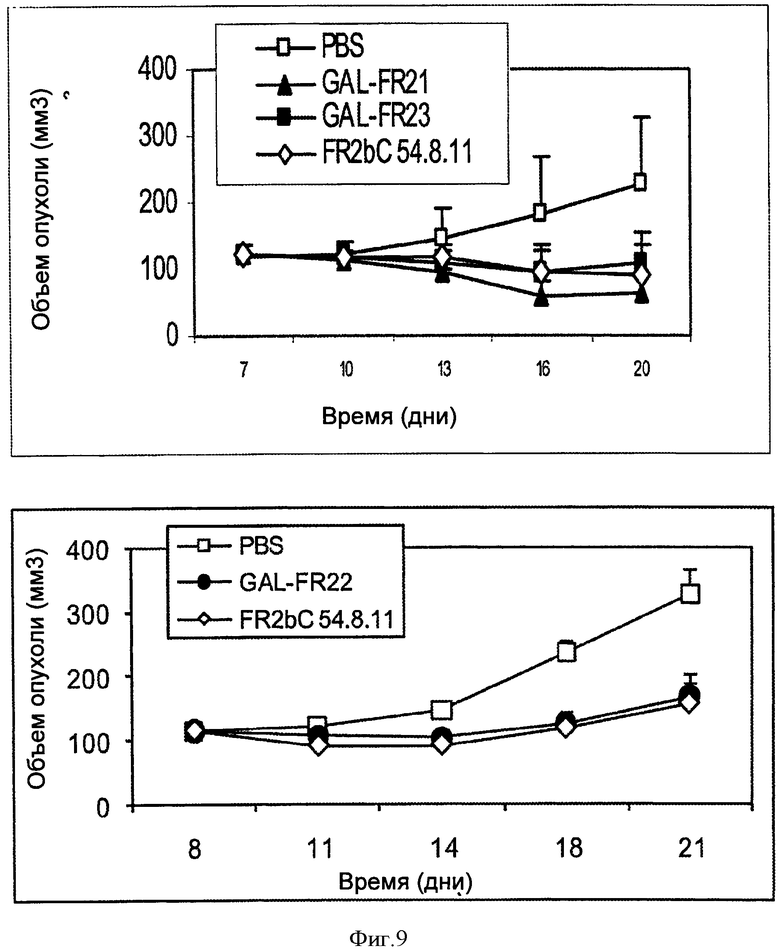
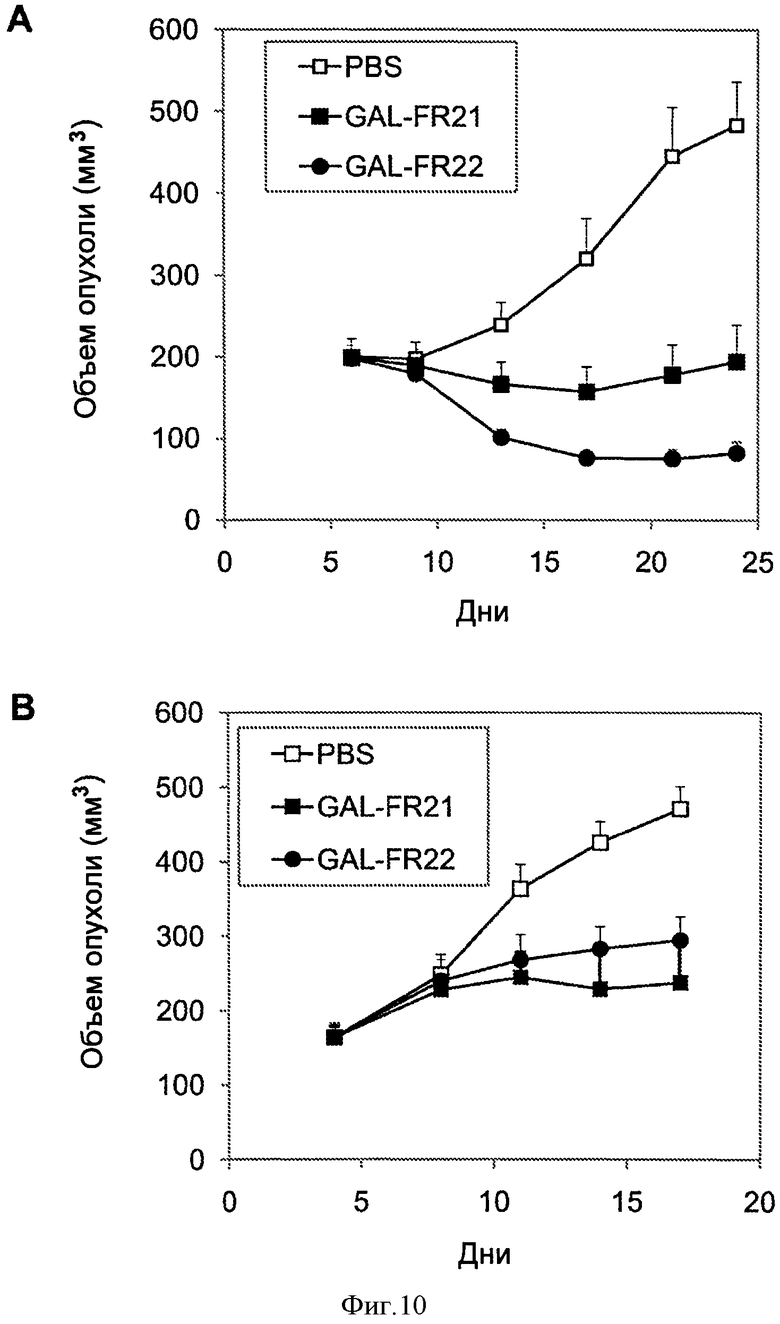
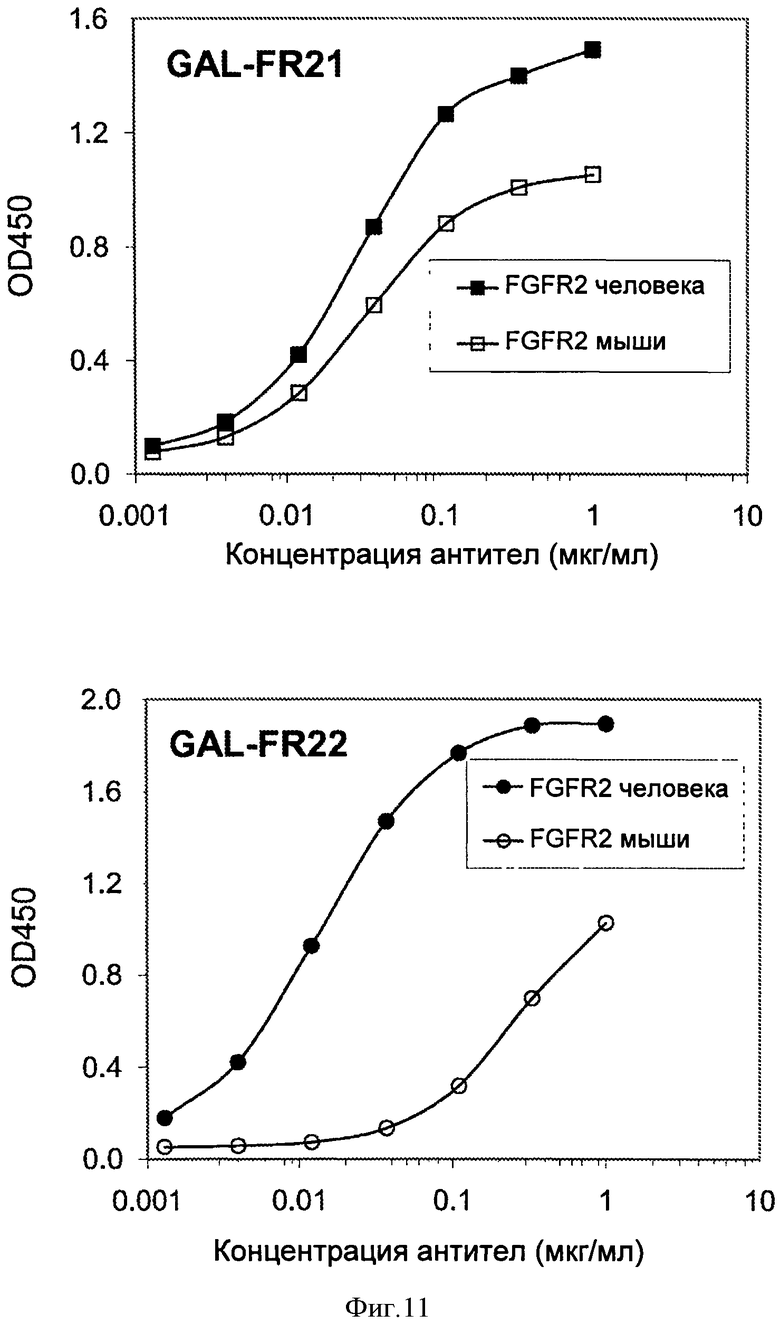
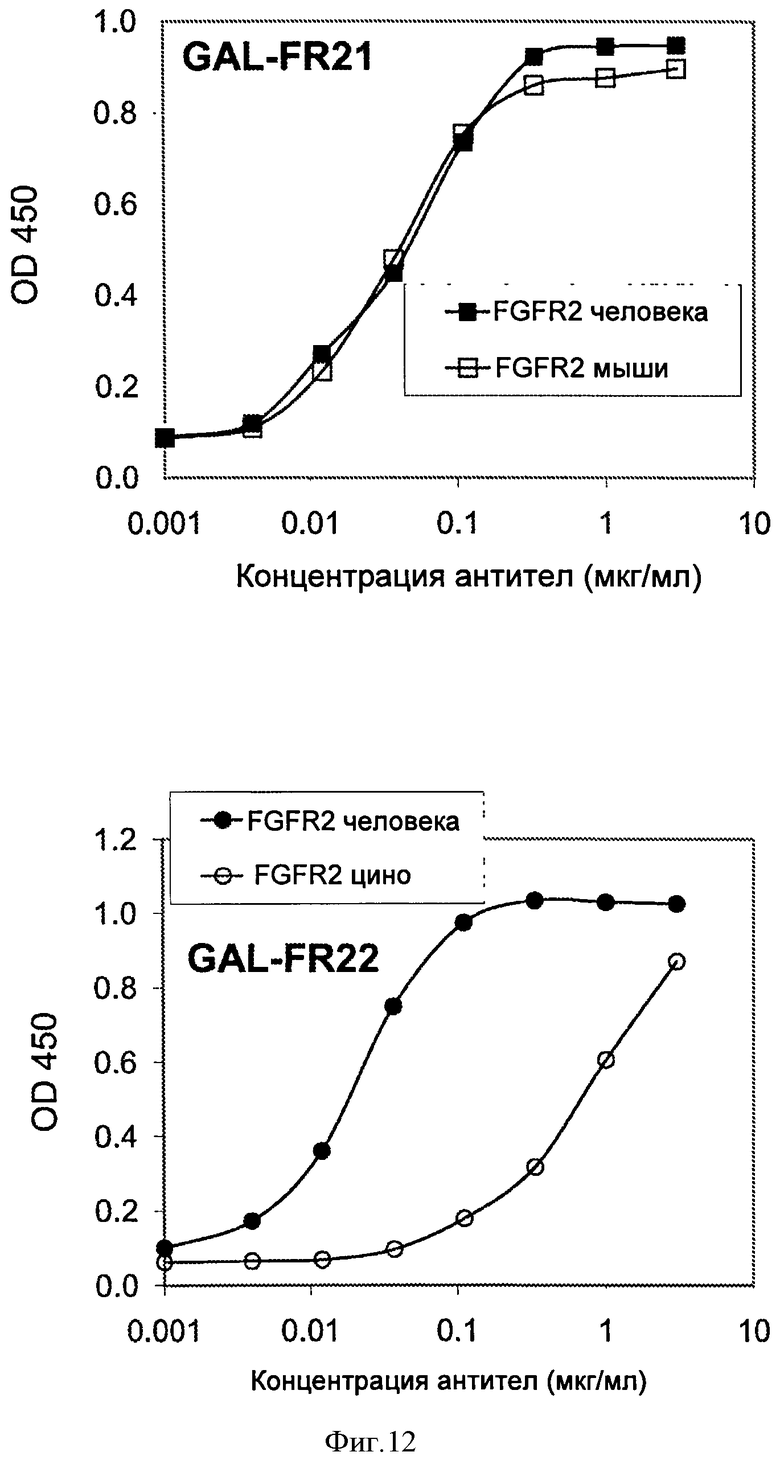


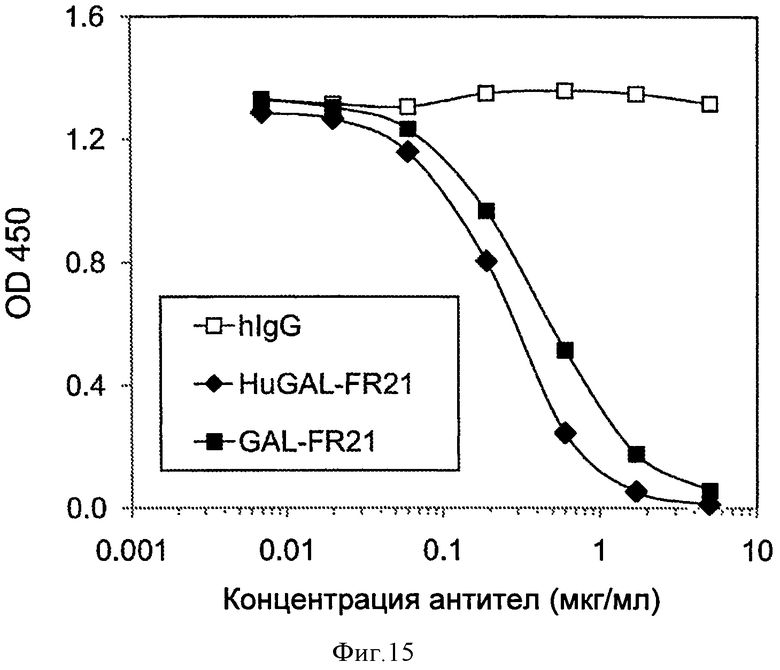

Изобретение относится к области биотехнологии, конкретно к моноклональному антителу (mAb), и может быть использовано в медицине. Указанное антитело связывается с рецептором 2 IIIb фактора роста фибробластов (FGFR2IIIb) и содержит три CDR легкой и три CDR тяжелой цепи, представленные на фиг.13А и 13В, соответственно. Сконструированное антитело или его гуманизированный аналог используется в составе фармацевтической композиции для лечения злокачественного заболевания. Изобретение позволяет получить антитело против FGFR2IIIb, наиболее эффективно и полно ингибирующее рост ксенотрансплантата опухоли человека у мышей. 6 н. и 6 з.п. ф-лы, 16 ил., 6 пр.
1. Моноклональное антитело (mAb), содержащее три CDR легкой цепи, представленные на Фиг. 13А (GAL-FR21), и три CDR тяжелой цепи, представленные на Фиг. 13В (GAL-FR21), которое связывается с рецептором 2 IIIb фактора роста фибробластов (FGFR2IIIb).
2. Моноклональное антитело по п.1, которое представляет собой Fab или F(ab')2 фрагмент или одноцепочечное антитело.
3. Моноклональное антитело по п.1, которое является химерным или гуманизированным.
4. Фармацевтическая композиция для лечения злокачественного заболевания, содержащая терапевтически эффективную дозу моноклонального антитела по п.1 и физиологически приемлемый носитель.
5. Фармацевтическая композиция для лечения злокачественного заболевания, содержащая терапевтически эффективную дозу mAb по п.3 и физиологически приемлемый носитель.
6. Способ лечения злокачественного заболевания у пациента, включающий введение указанному пациенту фармацевтической композиции, содержащей моноклональное антитело по п.1.
7. Способ лечения злокачественного заболевания у пациента, включающий введение указанному пациенту фармацевтической композиции, содержащей mAb по п.3.
8. Способ по п.7, где указанным злокачественным заболеванием является рак желудка.
9. Гуманизированное антитело, содержащее гуманизированную легкую цепь, содержащую три CDR легкой цепи, представленные на Фиг. 13А (GAL-FR21), и гуманизированную тяжелую цепь, содержащую три CDR тяжелой цепи, представленные на Фиг. 13В (GAL-FR21), которое связывается с FGFR2IIIb.
10. Гуманизированное антитело по п.9, в котором последовательность вариабельной области легкой цепи по меньшей мере 95% идентична последовательности, показанной на Фиг. 13А (HuGAL-FR21), и последовательность вариабельной области тяжелой цепи по меньшей мере на 95% идентична последовательности, показанной на Фиг. 13B (HuGAL-FR21).
11. Гуманизированное антитело по п.10, в котором остатки Н27, Н28, Н30, Н48, и Н67 по нумерации Кабата заняты остатком, занимающим соответствующее положение в тяжелой цепи, показанной на Фиг. 13В (GAL-FR21).
12. Гуманизированное антитело по п.11, в котором вариабельная область легкой цепи имеет последовательность, показанную на Фиг. 13А (HuGAL-FR21), и вариабельная область тяжелой цепи имеет последовательность, показанную на Фиг. 13В (HuGAL-FR21).
| US 2007248605 A1, 25.10.2007 | |||
| WO 2008052796 A1, 08.05.2008 | |||
| TAKEDA M | |||
| et al, AZD2171 shows potent antitumor activity against gastric cancer over-expressing fibroblast growth factor receptor 2/keratinocyte growth factor receptor, |
Авторы
Даты
2015-04-10—Публикация
2009-11-06—Подача