[001] Данная заявка испрашивает приоритет по предварительной заявке США № 62/507 053, поданной 16 мая 2017 г., и предварительной заявке США № 62/581 992, поданной 6 ноября 2017 г., содержание которых включено в данный документ в полном объеме посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[002] Данная заявка относится к применению антител к рецептору фактора роста фибробластов 2 (FGFR2), включая антитела к изоформе FGFR2-IIIb FGFR2 (также известной как FGFR2b), при лечении некоторых видов рака в комбинации с химиотерапией по схеме mFOLFOX6.
УРОВЕНЬ ТЕХНИКИ
[003] Члены семейства факторов роста фибробластов (FGF) связываются с четырьмя известными рецепторами тирозинкиназы, рецепторами фактора роста фибробластов 1-4 (FGFR14) и их изоформами, причем различные FGF связывают различные FGFR в разной степени (Zhang et al., J. Biol. Chem. 281:15694, 2006). Белковая последовательность FGFR2 человека представлена, например, в локусе AF487553 базы данных GenBank. Каждый FGFR состоит из внеклеточного домена (ECD), содержащего три иммуноглобулин(Ig)-подобных домена (D1, D2 и D3), одну трансмембранную спираль и внутриклеточный каталитический домен киназы (Mohammadi et al., Cytokine Growth Factor Revs, 16:107, 2005). FGF связываются с рецепторами главным образом через области в доменах D2 и D3 рецепторов. В линкере между доменами D1 и D2 расположен непрерывный участок кислых аминокислот, называемый «кислотным боксом» (AB - "acid box"). Считается, что область, содержащая D1 и AB, участвует в аутоингибировании рецептора, которое ослабляется при связывании с лигандом.
[004] FGFR характеризуются множественным альтернативным сплайсингом их мРНК, что приводит к образованию множества изоформ (Ornitz et al., J. Biol. Chem. 271: 15292, 1996; см. также Swiss-Prot: P21802 и изоформы с P21802-1 по -20 относительно последовательности FGFR2 и его изоформ). Примечательно, что существуют формы, содержащие все три домена Ig (изоформа α) или только два домена Ig D2 и D3 без D1 (изоформа β). У FGFR1, FGFR2 и FGFR3 все формы содержат первую половину D3, обозначаемую IIIa, но два альтернативных экзона могут использоваться для второй половины D3, что приводит к образованию форм IIIb и IIIc. У FGFR2 они соответственно обозначаются как FGFR2-IIIb и FGFR2-IIIc (или просто FGFR2b и FGFR2c); соответствующие бета-формы обозначаются FGFR2(beta)IIIb и FGFR2(beta)IIIc. FGFR2-IIIb форма FGFR2 (также обозначаемая K-sam-II) является высокоаффинным рецептором как для FGF1, так и для членов семейства KGF (FGF7, FGF10 и FGF22), тогда как FGFR2-IIIc (также обозначаемый K-sam-I) хорошо связывает как FGF1, так и FGF2, но не связывает членов семейства KGF (Miki et al., Proc. Natl. Acad. Sci. USA 89:246, 1992). Действительно, FGFR2-IIIb является единственным рецептором членов семейства KGF (Ornitz et al., 1996, op. cit.) и поэтому также обозначается как KGFR.
[005] FGFR и их изоформы по-разному экспрессируются в разных тканях. FGFR2-IIIb (и IIIb-формы FGFR1 и FGFR3) экспрессируется в эпителиальных тканях, в то время как FGFR2-IIIc экспрессируется в мезенхимальных тканях (Duan et al., J. Biol. Chem. 267:16076, 1992; Ornitz et al., 1996, op. cit.). Определенные лиганды FGF данных рецепторов имеют противоположный профиль экспрессии. Так, члены подсемейства KGF, включая FGF7 (KGF), FGF10 и FGF22, связываются только с FGFR2-IIIb (Zhang et al., op. cit.) и экспрессируются в мезенхимальных тканях и могут, таким образом, быть паракринными эффекторами эпителиальных клеток (Ornitz et al., 1996, op. cit.). Напротив, члены подсемейства FGF4, FGF4-6, связываются с FGFR2-IIIc и экспрессируются как в эпителиальных, так и в мезенхимальных линиях и могут, таким образом, выполнять либо аутокринные, либо паракринные функции. Профили экспрессии изоформ FGFR2 и их лигандов обеспечивают участие FGFR2 в эпителиально-мезенхимальных взаимодействиях (Finch et al., Dev. Dyn. 203:223, 1995), поэтому неудивительно, что нокаут FGFR2-IIIb у мышей приводит к развитию тяжелых эмбриональных дефектов и летальности (De Moerlooze et al., Development 127:483, 2000).
[006] KGF (FGF7) и KGFR (FGFR2-IIIb) сверхэкспрессируются при многих видах рака поджелудочной железы (Ishiwata et al., Am. J. Pathol. 153: 213, 1998), а их коэкспрессия коррелирует с плохим прогнозом (Cho et al., Am. J. Pathol. 170:1964, 2007). Соматические мутации гена FGFR2 были обнаружены в 12% большой панели эндометриальных (маточных) карцином, а также в нескольких исследуемых случаях были необходимы для выживания опухолевых клеток (Dutt et al., Proc. Natl. Acad. Sci. USA 105:8713, 2008). В двух опухолях обнаружили, что мутация FGFR2 представляла собой ту же самую замену S252W, как и связанная с синдромом Аперта. Амплификация и сверхэкспрессия FGFR2 ассоциированы с недифференцированным, диффузным типом рака желудка, имеющим особенно плохой прогноз, а ингибирование активности FGFR2 низкомолекулярными соединениями эффективно ингибировало пролиферацию таких раковых клеток (Kunii et al., Cancer Res. 68:2340, 2008; Nakamura et al., Gastroenterol. 131:1530, 2006).
[007] Сообщалось, что ингибирование передачи сигналов FGFR улучшает противоопухолевый иммунитет и снижает вероятность метастазирования при раке молочной железы. (См., например, T. Ye et al., Breast Cancer Res. Treat. 143: 435-446 (2014).) Антитела к FGFR2 также были исследованы, например, на моделях рака желудка. Конкретные антитела к FGFR2 описаны, например, в патенте США № 8 101 723 B2, включая моноклональные антитела, которые связывают FGFR2-IIIb человека, но не так хорошо связываются или вообще не связываются с FGFR2-IIIc, и наоборот. В публикации патента США № 2015-0050273 А1 описаны некоторые афукозилированные антитела, которые связываются с FGFR2-IIIb.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[008] Настоящее изобретение включает, например, способы лечения рака желудочно-кишечного тракта, такого как рак желудка, у субъекта, включающие введение субъекту терапевтически эффективного количества антител к рецептору фактора роста фибробластов 2 (анти-FGFR2) и применение модифицированного режима химиотерапии FOLFOX6 (mFOLFOX6)). В некоторых вариантах осуществления антитело к FGFR2 представляет собой антитело к FGFR2-IIIb. В некоторых вариантах осуществления антитело к FGFR2-IIIb обладает одним или более из следующих свойств: связывается с FGFR2-IIIb с более высокой аффинностью, чем с FGFR2-IIIc, или не связывается с FGFR2-IIIc обнаруживаемым образом; ингибирует связывание FGF2 с FGFR2 человека; ингибирует связывание FGF7 с FGFR2 человека; ингибирует рост опухоли человека в мышиной модели опухоли; индуцирует активность АЗКЦ (ADCC - antibody-dependent cell-mediated cytotoxicity); обладает повышенной активностью АЗКЦ; является афукозилированным; и способно увеличивать количество одной или более положительных по PD-L1 клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани в мышиной модели опухоли по сравнению с контролем.
[009] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит вариабельные области тяжелой цепи и легкой цепи, при этом вариабельная область тяжелой цепи содержит: гипервариабельную область тяжелой цепи H1 (HVR-H1), содержащую аминокислотную последовательность SEQ ID NO: 6; HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8; а вариабельная область легкой цепи содержит: гипервариабельную область легкой цепи L1 (HVR-L1), содержащую аминокислотную последовательность SEQ ID NO: 9; (v) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления вариабельный домен тяжелой цепи антитела к FGFR2-IIIb содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 4. В некоторых вариантах осуществления вариабельный домен легкой цепи антитела к FGFR2-IIIb содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 5. В некоторых вариантах осуществления вариабельный домен тяжелой цепи антитела к FGFR2-IIIb содержит аминокислотную последовательность SEQ ID NO: 4. В некоторых вариантах осуществления вариабельный домен легкой цепи антитела к FGFR2-IIIb содержит аминокислотную последовательность SEQ ID NO: 5. В некоторых вариантах осуществления тяжелая цепь антитела к FGFR2-IIIb содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 2. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 3. В некоторых вариантах осуществления тяжелая цепь антитела к FGFR2-IIIb содержит аминокислотную последовательность SEQ ID NO: 2. В некоторых вариантах осуществления легкая цепь антитела к FGFR2-IIIb содержит аминокислотную последовательность SEQ ID NO: 3. В некоторых вариантах осуществления антитело к FGFR2-IIIb является химерным, гуманизированным или человеческим. В некоторых вариантах осуществления антитело к FGFR2-IIIb выбрано из Fab, Fv, scFv, Fab’ и (Fab’)2.
[0010] В некоторых вариантах осуществления способов, представленных в этом документе, антитело к FGFR2-IIIb обладает одним или более из следующих свойств: отсутствует фукоза в положении Asn297; содержит константную область легкой цепи κ; содержит константную область тяжелой цепи IgG1; обладает повышенной активностью АЗКЦ in vitro по сравнению с антителом, имеющим ту же аминокислотную последовательность, которое фукозилировано в положении Asn297; обладает повышенной аффинностью к Fc-гамма RIIIA по сравнению с антителом, имеющим ту же аминокислотную последовательность, которое фукозилировано в положении Asn297; и способно увеличивать количество одной или более положительных по PD-L1 клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани в мышиной модели опухоли по сравнению с контролем.
[0011] В некоторых вариантах осуществления способов, описанных в настоящем документе, у субъекта имеет место рак желудка, который является локально-распространенным, неоперабельным или метастатическим. В некоторых вариантах осуществления рак желудка представляет собой гастроэзофагеальный рак.
[0012] В некоторых вариантах осуществления способов, описанных в настоящем документе, антитело к FGFR2-IIIb вводят в дозе 6-15 мг/кг, 10-15 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг, 10 мг/кг, 11 мг/кг, 12 мг/кг, 13 мг/кг, 14 мг/кг или 15 мг/кг. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят один раз в 10-21 сутки, один раз в 10-15 суток, один раз в10 суток, один раз в 11 суток, один раз в 12 суток, один раз в 13 суток, один раз в 14 суток, один раз в 15 суток, один раз в 16 суток, один раз в 17 суток, один раз в 18 суток, один раз в 19 суток, один раз в 20 суток или один раз в 21 сутки. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в дозе 6 мг/кг, 10 мг/кг или 15 мг/кг, причем антитело к FGFR2-IIIb вводят один раз в 14 суток.
[0013] В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в следующем режиме дозирования: (a) в дозе 6-15 мг/кг, причем антитело к FGFR2-IIIb вводят один раз в 14 суток; (b) в дозе 6 мг/кг, причем антитело к FGFR2-IIIb вводят один раз в 14 суток; (c) в дозе 10 мг/кг, причем антитело к FGFR2-IIIb вводят один раз в 14 суток; или (d) в дозе 15 мг/кг, причем антитело к FGFR2-IIIb вводят один раз в 14 суток. В некоторых вариантах осуществления (a) антитело к FGFR2-IIIb вводят в дозе 6-15 мг/кг, 10-15 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг, 10 мг/кг, 11 мг/кг, 12 мг/кг, 13 мг/кг, 14 мг/кг или 15 мг/кг один раз в 11-17 суток, в 12-16 суток, в 13-15 суток или в 14 суток и (b) по меньшей мере одну промежуточную дозу 3-8 мг/кг, 5-8 мг/кг, 7-8 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг, 6 мг/кг, 7 мг/кг или 8 мг/кг вводят между двумя дозами (a), и причем доза (b) ниже, чем доза (a). В некоторых вариантах осуществления (i) доза (a) составляет 10-15 мг/кг один раз в 13-15 суток; (ii) доза (a) составляет 15 мг/кг один раз в 13-15 суток; (iii) доза (b) составляет 5-8 мг/кг и вводится через 6-8 суток после по меньшей мере одной дозы (a) и за 6-8 суток до последующей дозы (a); (iv) доза (a) составляет 10-15 мг/кг один раз в 13-15 суток, а доза (b) составляет 7-8 мг/кг и вводится через 6-8 суток после по меньшей мере одной дозы (a) и за 6-8 суток до последующей дозы (a); (v) доза (a) составляет 15 мг/кг один раз в 14 суток, а доза (b) составляет 7-8 мг/кг и вводится через 7 суток после по меньшей мере одной дозы (a) и за 7 суток до последующей дозы (a); (vi) доза (a) составляет 15 мг/кг один раз в 14 суток, а доза (b) составляет 7,5 мг/кг и вводится через 7 суток после по меньшей мере одной дозы (a) и за 7 суток до последующей дозы из (a); и/или (vii) дозу (b) вводят после первого введения дозы (a) в любом из (i)-(vi). В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в дозе 15 мг/кг один раз в 14 суток, а через 6-8 суток после первого введения антитела к FGFR2-IIIb, антитело к FGFR2-IIIb дополнительно вводят в дозе 7,5 мг/кг. В некоторых таких вариантах осуществления антитело к FGFR2-IIIb вводят в дозе 15 мг/кг один раз в 14 суток, в то время как через 7 суток после первого введения антитела к FGFR2-IIIb антитело к FGFR2-IIIb вводят в дозе 7,5 мг/кг. В некоторых таких вариантах осуществления доза 7,5 мг/кг вводится только один раз, то есть между первым и вторым введениями 15 мг/кг.
[0014] В некоторых вариантах осуществления способов по настоящему изобретению mFOLFOX6 включает введение 85 мг/м2 оксалиплатина, 400 мг/м2 лейковорина и 400 мг/м2 5-фторурацила (5-ФУ) путем внутривенной (в/в) инфузии или внутривенной болюсной инъекции. В некоторых вариантах осуществления mFOLFOX6 включает введение 85 мг/м2 оксалиплатина, 400 мг/м2 лейковорина и 400 мг/м2 5-фторурацила (5-ФУ) путем внутривенной (в/в) инфузии или внутривенной болюсной инъекции с последующим введением 2400 мг/м2 5-ФУ путем внутривенной инфузии в течение 44-48 часов. В некоторых вариантах осуществления mFOLFOX6 вводят один раз в 10-21 сутки, один раз в 10-15 суток, один раз в10 суток, один раз в 11 суток, один раз в 12 суток, один раз в 13 суток, один раз в 14 суток, один раз в 15 суток, один раз в 16 суток, один раз в 17 суток, один раз в 18 суток, один раз в 19 суток, один раз в 20 суток или один раз в 21 сутки. В некоторых вариантах осуществления mFOLFOX6 вводят один раз в 14 суток. В некоторых вариантах осуществления mFOLFOX6 включает введение 85 мг/м2 оксалиплатина, 400 мг/м2 лейковорина и 400 мг/м2 5-фторурацила (5-ФУ) путем внутривенной (в/в) инфузии или внутривенной болюсной инъекции с последующим введением 2400 мг/м2 5-ФУ путем внутривенной инфузии в течение 44-48 часов, где mFOLFOX6 вводят один раз в 14 суток.
[0015] В некоторых вариантах осуществления способов по настоящему изобретению антитело к FGFR2-IIIb и mFOLFOX6 вводят одновременно или последовательно. В некоторых вариантах осуществления одно или несколько введений mFOLFOX6 проводят до введения антитела к FGFR2-IIIb. В некоторых вариантах осуществления два введения mFOLFOX6 проводят до введения антитела к FGFR2-IIIb. В некоторых вариантах осуществления антитело к FGFR2-IIIB вводят в те же сутки, что и mFOLFOX6, и до введения mFOLFOX6.
[0016] В некоторых вариантах осуществления ранее было определено, что рак желудка сверхэкспрессировал FGFR2-IIIb, и/или ранее был определено, что рак желудка имеет амплификацию гена FGFR2. В некоторых вариантах осуществления способ дополнительно включает определение того, сверхэкспрессирует ли рак желудка FGFR2-IIIb, и/или определение того, имеет ли рак желудка амплификацию гена FGFR2. В некоторых вариантах осуществления сверхэкспрессию FGFR2-IIIb определяют на уровне белка иммуногистохимическим (ИГХ) методом. В некоторых вариантах осуществления сверхэкспрессия была определена ранее или определяется сигналом ИГХ 3+ по меньшей мере в 10%, 20%, 30%, 40% или 50% опухолевых клеток. В некоторых вариантах осуществления амплификация гена FGFR2 была определена ранее или определяется путем получения отношения FGFR2 к центромере 10 хромосомы (CEN10) с использованием флуоресцентной гибридизации in situ (FISH), где ген FGFR2 считается амплифицированным, если отношение FGFR2/CEN10, определенное посредством FISH, больше или равно 2. В некоторых вариантах осуществления амплификация FGFR2 была ранее обнаружена или обнаруживается в циркулирующей опухолевой ДНК (цоДНК).
[0017] Некоторые варианты осуществления настоящего изобретения охватывают способы лечения локально распространенного, неоперабельного или метастатического рака желудка у субъекта, включающие введение субъекту терапевтически эффективного количества антитела к рецептору фактора роста фибробластов 2 IIIb (антитела к FGFR2-IIIb) и применение модифицированного режима химиотерапии FOLFOX6 (mFOLFOX6), где антитело к FGFR2-IIIb содержит вариабельные области тяжелой цепи и легкой цепи, где вариабельная область тяжелой цепи содержит:
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6;
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8;
а вариабельная область легкой цепи содержит:
(iv) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9;
(v) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и
(vi) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11;
[0018] где антитело к FGFR2-IIIb вводят внутривенно в дозе 10-15 мг/кг с последующим введением mFOLFOX6, включающим введение 85 мг/м2 оксалиплатина, 400 мг/м2 лейковорина и 400 мг/м2 5-фторурацила (5-ФУ) путем внутривенной инфузии или внутривенной болюсной инъекции с последующим введением 2400 мг/м2 5-ФУ путем внутривенной инфузии в течение 44-48 часов; и где антитело к FGFR2-IIIb и mFOLFOX6 вводят раз в 2 недели. Некоторые варианты осуществления настоящего изобретения охватывают способы лечения локально распространенного, неоперабельного или метастатического рака желудка у субъекта, включающие введение субъекту терапевтически эффективного количества антитела к рецептору фактора роста фибробластов 2 IIIb (антитела к FGFR2-IIIb) и применение модифицированного режима химиотерапии FOLFOX6 (mFOLFOX6), где антитело к FGFR2-IIIb содержит вариабельные области тяжелой цепи и легкой цепи, где вариабельная область тяжелой цепи содержит:
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6;
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8;
а вариабельная область легкой цепи содержит:
(iv) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9;
(v) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и
(vi) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11;
где антитело к FGFR2-IIIb и mFOLFOX6 вводят каждые 13-15 суток и, необязательно, где однократную дозу антитела к FGFR2-IIIb 3-8 мг/кг вводят через 6-8 суток после первой дозы 6-15 мг/кг антитела к FGFR2-IIIb и перед второй дозой 6-15 мг/кг антитела к FGFR2-IIIb. В некоторых таких вариантах (a) антитело к FGFR2-IIIb вводят внутривенно в дозе 15 мг/кг, (b) антитело к FGFR2-IIIb и mFOLFOX6 вводят раз в 14 суток в одни и те же сутки, и (c) однократную дозу 7,5 мг/кг антитела к FGFR2-IIIb вводят через 7 суток после первой дозы 15 мг/кг антитела к FGFR2-IIIb и перед второй дозой 15 мг/кг антитела к FGFR2-IIIb.
[0019] В некоторых вариантах осуществления настоящего изобретения ранее было определено, что рак желудка сверхэкспрессирует FGFR2-IIIb, на что указывает сигнал ИГХ 3+ по меньшей мере в 10% опухолевых клеток, и/или ранее было определено, что рак желудка имеет амплификацию гена FGFR2 в цоДНК. В некоторых таких вариантах осуществления субъект получал два введения mFOLFOX6 до первого введения антитела к FGFR2-IIIb.
[0020] Настоящее раскрытие также охватывает композиции, содержащие антитело к FGFR2-IIIb, описанное в данном документе, и каждый из оксалиплатина, лейковорина и 5-ФУ, например, для применения при лечении рака желудочно-кишечного тракта, такого как рак желудка, у пациента в соответствии с любым из вышеперечисленных способов. В некоторых вариантах осуществления композиции содержат комбинацию антитела к FGFR2-IIIb, описанного в данном документе, и по меньшей мере один из таких препаратов как оксалиплатин, лейковорин и 5-ФУ. В некоторых вариантах осуществления антитело к FGFR2-IIIb и по меньшей мере один из таких препаратов как оксалиплатин, лейковорин и 5-ФУ находятся в отдельных контейнерах или отсеках. В некоторых таких вариантах осуществления композиции содержат комбинацию антитела и каждого из оксалиплатина, лейковорина и 5-ФУ в отдельных контейнерах или отсеках. В некоторых вариантах осуществления композиции дополнительно содержат инструкции по применению при раке желудочно-кишечного тракта, например, при лечении рака желудка.
[0021] В некоторых вариантах осуществления способов или композиций настоящего изобретения антитело к FGFR2-IIIb имеет аминокислотные последовательности гипервариабельной области тяжелой и легкой цепи (HVR) H1, H2, H3, L1, L2 и L3 моноклональных антител GAL-FR21, GAL-FR22 или GAL-FR23, описанных в патенте США № 8 101 723 B2. В некоторых вариантах осуществления вариабельная область тяжелой цепи антитела к FGFR2-IIIb содержит: (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и (iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8; а вариабельная область легкой цепи содержит: (iv) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9; (v) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (vi) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11.
[0022] В некоторых вариантах осуществления антитело к FGFR2-IIIb имеет вариабельный домен тяжелой цепи, который идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:4 или содержит аминокислотную последовательность SEQ ID NO: 4. В некоторых вариантах осуществления антитело к FGFR2-IIIb имеет вариабельный домен легкой цепи, который идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:5 или содержит аминокислотную последовательность SEQ ID NO: 5. В некоторых вариантах осуществления вариабельный домен тяжелой цепи идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:4 или содержит аминокислотную последовательность SEQ ID NO: 4, а вариабельный домен легкой цепи идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:5 или содержит аминокислотную последовательность SEQ ID NO: 5. В некоторых вариантах осуществления антитело к FGFR2-IIIb имеет тяжелую цепь, которая идентична на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO: 2; или содержит аминокислотную последовательность SEQ ID NO: 2. В некоторых вариантах осуществления антитело к FGFR2-IIIb имеет легкую цепь, которая идентична на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:3 или содержит аминокислотную последовательность SEQ ID NO: 3. В некоторых вариантах осуществления тяжелая цепь идентична на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:2 или содержит аминокислотную последовательность SEQ ID NO: 2, а легкая цепь идентична на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:3 или содержит аминокислотную последовательность SEQ ID NO: 3.
[0023] В некоторых вариантах осуществления вариабельная область тяжелой цепи антитела к FGFR2-IIIb содержит: (i) CDR1, содержащую аминокислотную последовательность SEQ ID NO: 16; (ii) CDR2, содержащую аминокислотную последовательность SEQ ID NO: 17; и (iii) CDR3, содержащую аминокислотную последовательность SEQ ID NO: 18; а вариабельная область легкой цепи содержит: (iv) CDR1, содержащую аминокислотную последовательность SEQ ID NO: 20; (v) CDR2, содержащую аминокислотную последовательность SEQ ID NO: 21; и (vi) CDR3, содержащую аминокислотную последовательность SEQ ID NO: 22.
[0024] В некоторых вариантах осуществления антитело к FGFR2-IIIb имеет вариабельный домен тяжелой цепи, который идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:15 или содержит аминокислотную последовательность SEQ ID NO: 15. В некоторых вариантах осуществления антитело к FGFR2-IIIb имеет вариабельный домен легкой цепи, который идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:19 или содержит аминокислотную последовательность SEQ ID NO: 19. В некоторых вариантах осуществления вариабельный домен тяжелой цепи идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:15 или содержит аминокислотную последовательность SEQ ID NO: 15, а вариабельный домен легкой цепи идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:19 или содержит аминокислотную последовательность SEQ ID NO: 19.
[0025] В некоторых вариантах осуществления антитело к FGFR2-IIIb является афукозилированным. В некоторых вариантах осуществления в антителе отсутствует фукоза в положении Asn297. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит константную область легкой цепи каппа. В некоторых вариантах осуществления антитело содержит константную область тяжелой цепи IgG1. В некоторых вариантах осуществления афукозилированное антитело обладает повышенной активностью АЗКЦ (антителозависимая клеточная цитотоксичность) in vitro и/или in vivo по сравнению с антителом, имеющим ту же аминокислотную последовательность, которое фукозилировано в Asn297. В некоторых вариантах осуществления афукозилированное антитело обладает повышенной аффинностью к Fc-гамма RIIIA по сравнению с антителом, имеющим ту же аминокислотную последовательность, которое фукозилировано в положении Asn297. В некоторых вариантах осуществления афукозилированное антитело способно увеличивать количество одной или более положительных по PD-L1 клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани в ксенотрансплантате мыши и/или в сингенной опухолевой модели по сравнению с контролем (например, по сравнению с контрольным антителом, которое не нацелено на FGFR2).
[0026] Следует понимать, что как приведенное выше общее описание, так и приведенное ниже подробное описание являются просто иллюстративными и пояснительными и не ограничивают пункты заявленной формулы. Заголовки разделов, используемые в настоящем документе, предназначены только для организационных целей и не должны рассматриваться как ограничивающие заявленный предмет. Все ссылки, приведенные в данном документе, в том числе патентные заявки и публикации, включены в данный документ посредством ссылки в полном объеме для любых целей.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0027] На Фиг. 1 показаны схемы введения для части I клинического испытания с повышением дозы, описанного ниже в примере 1. Начальная когорта находится на уровне дозы 1, а дальнейшие наборы участников будут проводиться на уровнях дозы 1, 2 или -1, как показано на фигуре в соответствии с анализом наличия дозолимитирующей токсичности (ДЛТ), как показано ниже в таблице 1.
[0028] На Фиг. 2 представлена блок-схема, показывающая обследования пациентов, которые должны быть выполнены для части I клинического испытания, описанного ниже в примере 1.
[0029] На Фиг. 3 показаны схемы введения для повышения дозы (фаза 1) клинического испытания, описанного в примере 2. Начальные когорты - это когорты 1 и 2, причем когорта 3 открывается, если необходимо, и еще одна когорта 4 (не показана) также открывается, если это необходимо. Дополнительная подробная информация приведена в Примере 2 ниже.
Описание конкретных вариантов реализации
Определения
[0030] Если не указано иное, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые обычно понятны среднему специалисту в данной области техники. Кроме того, если иное не требуется по контексту, термины в единственном числе включают множественное число, а термины во множественном числе включают единственное число.
[0031] В данной области техники известны примеры методик, используемых в связи с рекомбинантной ДНК, синтезом олигонуклеотидов, культивированием и трансформацией ткани (например, электропорацией, липофекцией), ферментативными реакциями и методик очистки. Многие такие методики и процедуры описаны, помимо других мест, например, в работе Sambrook et al., Molecular Cloning: A Laboratory Manual (2nd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)). Кроме того, в данной области техники также известны типичные методики химического синтеза, химического анализа, фармацевтического приготовления, составления и доставки, а также лечения пациентов.
[0032] В данной заявке применение «или» означает «и/или», если не указано иное. В контексте пункта патентной формулы, зависящего от другого зависимого пункта, использование «или» отсылает к более чем одному предыдущему независимому или зависимому пункту формулы изобретения только в качестве альтернативы. Кроме того, такие термины, как «элемент» или «компонент» охватывают как элементы, так и компоненты, содержащие одну единицу, и элементы и компоненты, которые содержат более одной субъединицы, если конкретно не указано иное.
[0033] Используемые в соответствии с настоящим изобретением следующие термины, если не указано иное, следует понимать как имеющие следующие значения:
[0034] Термины «молекула нуклеиновой кислоты» и «полинуклеотид» могут использоваться взаимозаменяемо и относятся к полимеру нуклеотидов. Такие полимеры нуклеотидов могут включать природные и/или неприродные нуклеотиды и включать, но не ограничиваться ими, ДНК, РНК и ПНК. «Нуклеотидная последовательность» относится к линейной последовательности нуклеотидов, которые составляют молекулу нуклеиновой кислоты или полинуклеотид.
[0035] Термины «полипептид» и «белок» используются взаимозаменяемо для обозначения полимера аминокислотных остатков и не ограничены минимальной длиной. Такие полимеры аминокислотных остатков могут содержать природные или не встречающиеся в природе аминокислотные остатки и включают, но без ограничения этим, пептиды, олигопептиды, димеры, тримеры и мультимеры аминокислотных остатков. В это определение включены как полноразмерные белки, так и их фрагменты. Эти термины также включают пост-экспрессионные модификации полипептида, например, гликозилирование, сиалирование, ацетилирование, фосфорилирование и тому подобное. Кроме того, для целей настоящего изобретения, «полипептид» относится к белку, который содержит модификации, такие как делеции, добавления и замены (обычно консервативные по природе), в нативной последовательности, при условии, что белок сохраняет желаемую активность. Эти модификации могут быть преднамеренными, например, путем сайт-направленного мутагенеза, или могут быть случайными, например, в результате мутаций организмов-хозяев, которые вырабатывают белки, или ошибок вследствие ПЦР-амплификации.
[0036] «FGFR2» относится к рецептору фактора роста фибробластов человека 2, включая любые его альтернативно сплайсированные формы, такие как сплайс-формы IIIa, IIIb и IIIc. Термин FGFR2 охватывает FGFR2 дикого типа и встречающиеся в природе мутантные формы, такие как активирующие FGFR2 мутантные формы, такие как FGFR2-S252W, которая обнаруживается в некоторых раковых клетках. «FGFR2-IIIb» или «FGFR2b» применяют взаимозаменяемо для обозначения сплайс-формы IIIb рецептора фактора роста фибробластов 2 человека. Пример последовательности FGFR2-IIIb человека показан в GenBank с учетным номером NP_075259.4 от 7 июля 2013 г. Неограничивающий пример аминокислотной последовательности зрелого FGFR2-IIIb человека показан в SEQ ID NO: 1. «FGFR2-IIIc» или «FGFR2c» применяют взаимозаменяемо для обозначения сплайс-формы IIIc рецептора фактора роста фибробластов 2 человека. Пример последовательности FGFR2-IIIc человека показан в GenBank с учетным номером NP_000132.3 от 7 июля 2013 г. Неограничивающий пример аминокислотной последовательности зрелого FGFR2-IIIc показан в SEQ ID NO: 12.
[0037] «Внеклеточный домен FGFR2» или «ВКД FGFR2» обозначает внеклеточный домен FGFR2 человека, в том числе его природные и сконструированные варианты. Пример ВКД FGFR2 представлен в SEQ ID NO: 13.
[0038] Термин «антитело» в контексте данного документа относится к молекуле, содержащей по меньшей мере гипервариабельные области (HVR) H1, H2 и H3 тяжелой цепи и L1, L2 и L3 легкой цепи, причем эта молекула способна связываться с антигеном. Термин антитело включает, но без ограничения ими, фрагменты, которые способны связывать антиген, такие как Fv, одноцепочечный Fv (scFv), Fab, Fab’ и (Fab’)2. Термин антитело также включает, но не ограничивается ими, химерные антитела, гуманизированные антитела и антитела различных видов, таких как мышь, человек, яванский макак и т. д. Он также включает антитела, конъюгированные с другими молекулами, такими как низкомолекулярные лекарственные препараты, биспецифичные антитела и мультиспецифичные антитела.
[0039] Антитело «к FGFR2» относится к антителу, которое специфически связывается с FGFR2. Антитело «к FGFR2-IIIb» или антитело «к FGFR2b» относится к антителу, которое специфически связывается с FGFR2-IIIb (также называемым FGFR2b. Такое антитело обладает более высокой аффинностью к FGFR2-IIIb, чем к другим изоформам FGFR2, таким как FGFR2-IIIc. В некоторых вариантах осуществления антитело может не связываться с FGFR2-IIIc обнаруживаемым образом. Термины антитело «к FGFR2», антитело «к FGFR2-IIIb» и антитело «к FGFR2b» явным образом включают афукозилированные формы таких антител.
[0040] Термин «вариабельная область тяжелой цепи» относится к области, содержащей HVR1 тяжелой цепи, каркасную область (FR) 2, HVR2, FR3 и HVR3. В некоторых вариантах реализации вариабельная область тяжелой цепи также содержит по меньшей мере часть FR1 и/или по меньшей мере часть FR4.
[0041] Термин «константная область тяжелой цепи» относится к области, содержащей по меньшей мере три константных домена тяжелой цепи, CH1, CH2 и CH3. Неограничивающие примеры константных областей тяжелой цепи включают γ, δ и α. Неограничивающие примеры константных областей тяжелой цепи также включают ε и μ. Каждая константная область тяжелой цепи соответствует изотипу антитела. Например, антитело, содержащее константную область γ, представляет собой антитело IgG, антитело, содержащее константную область δ, представляет собой антитело IgD и антитело, содержащее константную область α, представляет собой антитело IgA. Кроме того, антитело, содержащее константную область μ, представляет собой антитело IgM, и антитело, содержащее константную область ε, представляет собой антитело IgE. Определенные изотипы могут быть дополнительно подразделены на подклассы. Например, антитела IgG включают, но без ограничения этим, антитела IgG1 (содержащие константную область γ1), IgG2 (содержащие константную область γ2), IgG3 (содержащие константную область γ3) и IgG4 (содержащие константную область γ4); антитела IgA включают, но без ограничения этим, антитела IgA1 (содержащие константную область α1) и антитела IgA2 (содержащие константную область α2); и антитела IgM включают, но без ограничения этим, IgM1 и IgM2.
[0042] Термин «тяжелая цепь» относится к полипептиду, содержащему по меньшей мере вариабельную область тяжелой цепи с лидерной последовательностью или без нее. В некоторых вариантах осуществления тяжелая цепь содержит по меньшей мере часть константной области тяжелой цепи. Термин «полноразмерная тяжелая цепь» относится к полипептиду, содержащему вариабельную область тяжелой цепи и константную область тяжелой цепи, с лидерной последовательностью или без нее.
[0043] Термин «вариабельная область легкой цепи» относится к области, содержащей HVR1 легкой цепи, каркасную область (FR) 2, HVR2, FR3 и HVR3. В некоторых вариантах осуществления вариабельная область легкой цепи также содержит FR1 и/или FR4.
[0044] Термин «константная область легкой цепи» относится к области, содержащей константный домен легкой цепи CL. Неограничивающие примеры константных областей легкой цепи также содержат λ и κ.
[0045] Термин «легкая цепь» относится к полипептиду, содержащему по меньшей мере вариабельную область легкой цепи с лидерной последовательностью или без нее. В некоторых вариантах осуществления легкая цепь содержит по меньшей мере часть константной области легкой цепи. Термин «полноразмерная легкая цепь» относится к полипептиду, содержащему вариабельную область легкой цепи и константную область легкой цепи, с лидерной последовательностью или без нее.
[0046] Термин «гипервариабельная область» или «HVR» обозначает каждую из областей вариабельного домена антитела, являющихся гипервариабельными по последовательности и/или образующих структурно определенные петли («гипервариабельные петли»). Как правило, нативные четырехцепочечные антитела содержат шесть HVR: три в VH (H1, H2, H3) и три в VL (L1, L2, L3). HVR обычно содержат аминокислотные остатки из гипервариабельных петель и/или из «определяющих комплементарность областей» (CDR), причем последние характеризуются высочайшей изменчивостью последовательности и/или участвуют в распознавании антигенов. Примеры гипервариабельных петель соответствуют аминокислотным остаткам 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) и 96-101 (H3). (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987).) Примеры CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) соответствуют аминокислотным остаткам 24-34 L1, 50-56 L2, 89-97 L3, 31-35В Н1, 50-65 Н2 и 95-102 Н3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Термины гипервариабельные области (HVR) и определяющие комплементарность области (CDR) обозначают части вариабельной области, которые образуют антигенсвязывающие области.
[0047] «Аффинность» или «аффинность связывания» относятся к силе суммарного количества нековалентных взаимодействий между одним сайтом связывания молекулы (например, антителом) и ее партнером по связыванию (например, антигеном). В некоторых вариантах осуществления «аффинность связывания» обозначает аффинность собственного связывания, которая отражает взаимодействие 1:1 между членами пары связывания (например, антитело и антиген). Аффинность молекулы X к ее партнеру Y обычно может быть представлена константой диссоциации (Kd).
[0048] «Антителозависимая клеточноопосредованная цитотоксичность» или «АЗКЦ» относится к форме цитотоксичности, при которой секретированный Ig, связанный с Fc-рецепторами (FcR), присутствующими на определенных цитотоксических клетках (например, NK-клетках, нейтрофилах и макрофагах), позволяет этим цитотоксическим эффекторным клеткам специфически связываться с антиген-несущей клеткой-мишенью, а затем уничтожать клетку-мишень цитотоксинами. Первичные клетки для опосредования АЗКЦ, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. данные по экспрессии FcR на гемопоэтических клетках обобщены в таблице 3 на странице 464 публикации Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для оценки активности АЗКЦ представляющей интерес молекулы проводят анализ АЗКЦ in vitro, описанный в патенте США № 5 500 362 или 5 821 337 или патенте США № 6 737 056 (Presta). Пригодные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови и NK-клетки. В качестве альтернативы или дополнения, АЗКЦ-активность молекулы, представляющей интерес, можно оценить in vivo, например, в животной модели, например, согласно описанию в публикации Clynes et al. Proc. Natl. Acad. Sci. (USA) 95:652-656 (1998). Дополнительные антитела с измененными аминокислотными последовательностями Fc-области и повышенной или пониженной активностью АЗКЦ описаны, например, в патенте США № 7,923,538, и патенте США № 7,994,290.
[0049] Антитело, обладающее «повышенной активностью АЗКЦ», относится к антителу, которое более эффективно опосредует АЗКЦ in vitro или in vivo по сравнению с родительским антителом, причем антитело и родительское антитело отличаются по меньшей мере в одном структурном аспекте, а количества такого антитела и родительского антитела, используемого в анализе, по существу, одинаковы. В некоторых вариантах осуществления антитело и родительское антитело имеют одинаковую аминокислотную последовательность, но антитело является афукозилированным, в то время как родительское антитело является фукозилированным. В некоторых вариантах осуществления активность АЗКЦ будет определяться с использованием анализа АЗКЦ in vitro, такого как раскрытый в публикации США № 2015-0050273-A1, однако можно также применять другие анализы или способы определения активности АЗКЦ, например, в животной модели и т. д. В некоторых вариантах осуществления антитело с повышенной активностью АЗКЦ также обладает повышенной аффинностью к Fc-гамма RIIIA. В некоторых вариантах осуществления антитело с повышенной активностью АЗКЦ обладает повышенной аффинностью к Fc-гамма RIIIA (V158). В некоторых вариантах осуществления антитело с повышенной активностью АЗКЦ обладает повышенной аффинностью к Fc-гамма RIIIA (F158).
[0050] «Повышенная аффинность к Fc-гамма RIIIA» относится к антителу, обладающему большей аффинностью к Fc гамма RIIIA (также называемому в некоторых случаях CD16a), чем родительское антитело, где антитело и родительское антитело отличаются по меньшей мере в одном структурном аспекте. В некоторых вариантах осуществления антитело и родительское антитело имеют одинаковую аминокислотную последовательность, но антитело является афукозилированным, в то время как родительское антитело является фукозилированным. Можно применять любой подходящий способ определения аффинности к Fc гамма RIIIA. В некоторых вариантах осуществления аффинность к Fc гамма RIIIA определяют способом, описанным в публикации США № 2015-0050273-A1. В некоторых вариантах осуществления антитело с повышенной аффинностью к Fc гамма RIIIA также обладает повышенной активностью АЗКЦ. В некоторых вариантах осуществления антитело с повышенной аффинностью к Fc гамма RIIIA обладает повышенной аффинностью к Fc гамма RIIIA (V158). В некоторых вариантах осуществления антитело с повышенной аффинностью к Fc гамма RIIIA обладает повышенной аффинностью к Fc гамма RIIIA (F158).
[0051] «Химерное антитело» в контексте данного документа относится к антителу, содержащему по меньшей мере одну вариабельную область первого вида (например, мыши, крысы, яванского макака и т.д.) и по меньшей мере одну константную область второго вида (например, человека, яванского макака и т.д.). В некоторых вариантах осуществления химерное антитело содержит по меньшей мере одну вариабельную область мыши и по меньшей мере одну константную область человека. В некоторых вариантах осуществления химерное антитело содержит по меньшей мере одну вариабельную область яванского макака и по меньшей мере константную область человека. В некоторых вариантах осуществления химерное антитело содержит по меньшей мере одну вариабельную область крысы и по меньшей мере одну константную область мыши. В некоторых вариантах осуществления все вариабельные области химерного антитела относятся к первому виду, а все константные области химерного антитела относятся ко второму виду.
[0052] Термин «гуманизированное антитело» в контексте данного документа относится к антителу, в котором по меньшей мере одна аминокислота в каркасной области нечеловеческой вариабельной области была заменена соответствующей аминокислотой из вариабельной области человека. В некоторых вариантах осуществления гуманизированное антитело содержит по меньшей мере одну человеческую константную область или ее фрагмент. В некоторых вариантах осуществления гуманизированное антитело представляет собой Fab, scFv, (Fab’)2, и т.д.
[0053] «Антитело человека» в контексте данного документа относится к антителам, полученным от людей, антителам, вырабатываемым у отличных от человека животных, которые содержат гены иммуноглобулина человека, таких как XenoMouse®, и антителам, отобранным при помощи in vitro способов, например, фагового дисплея, причем в основе репертуара антител лежат последовательности иммуноглобулина человека.
[0054] «Афукозилированное» антитело или «лишенное фукозы» антитело относится к антителам изотипов IgG1 или IgG3, лишенным фукозы в гликозилировании константной области. Гликозилирование человеческих IgG1 или IgG3 происходит в Asn297 (N297) в виде гликозилирования корового фукозилированного биантенного комплексного олигосахарида с окончанием из вплоть до 2 остатков Gal. В некоторых вариантах осуществления афукозилированное антитело лишено фукозы в положении Asn297. Такие структуры обозначают G0, G1 (α1,6 или α1,3) или G2 гликановыми остатками в зависимости от количества терминальных остатков Gal. См., например, Raju, T. S., BioProcess Int. 1: 44-53 (2003). Гликозилирование CHO-типа Fc-области антител описан, например, в Routier, F. H., Glycoconjugate J. 14: 201-207 (1997). В популяции антител антитела считают афукозилированными, если <5% антител в популяции содержат фукозу в положении Asn297.
[0055] «Эффекторные функции» относятся к биологической активности, относящейся к Fc-области антитела, которая варьируется в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание с Clq и комплементзависимую цитотоксичность (КЗЦ); связывание с Fc-рецептором; антителозависимую клеточноопосредованную цитотоксичность (АЗКЦ); фагоцитоз; отрицательную негативную модуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора); и активацию B-клеток.
[0056] Со ссылкой на антитела к FGFR2, термины «блокирует связывание» или «ингибирует связывание» лиганда относятся к способности ингибировать взаимодействие между FGFR2 и лигандом FGFR2, таким как фактор роста фибробластов человека 1 (FGF1) или FGF2. Подобное ингибирование может происходить при помощи любого механизма, в том числе прямого препятствия связыванию лиганда, например, за счет перекрывающихся сайтов связывания на FGFR2 и/или конформационных изменений в FGFR2, индуцированных антителом, которые изменяют аффинность лиганда или, например, в случае ВКД FGFR2 или слитой молекулы ВКД FGFR2 путем конкурирования за связывание с лигандами FGFR2.
[0057] Термин «выделенный» в контексте данного документа относится к молекуле, которая была отделена по меньшей мере от некоторых компонентов, с которыми она обычно встречается в природе. Например, полипептид называется «выделенным», когда он отделен по меньшей мере от некоторых компонентов клетки, в которой он был получен. В случае, когда полипептид секретируется клеткой после экспрессии, физическое отделение супернатанта, содержащего полипептид, от клетки, которая его вырабатывает, считается «выделением» полипептида. Аналогичным образом, полинуклеотид называется «выделенным», если он не является частью большего полинуклеотида (такого как, например, геномная ДНК или митохондриальная ДНК, в случае полинуклеотида ДНК), в котором он обычно встречается в природе, или если он отделен от по меньшей мере некоторых из компонентов клетки, в которой он был получен, например, в случае полинуклеотида РНК. Таким образом, полинуклеотид ДНК, который содержится в векторе внутри клетки-хозяина, может называться «выделенным» при условии, что полинуклеотид не встречается в этом векторе в природе.
[0058] Термин «повышенный уровень» означает более высокий уровень белка в конкретной ткани субъекта по сравнению с той же тканью в контроле, например, у лица или лиц, которые не страдают от рака или других состояний, описанных в настоящем документе. Повышенный уровень может быть результатом любого механизма, такого как повышенная экспрессия, повышенная стабильность, пониженная деградация, повышенная секреция, пониженный клиренс и т.д. белка.
[0059] Термины «снижать» или «снижает», или «повышать», или «повышает» в отношении белка или типа клеток означают изменение уровня этого белка или типа клеток в конкретной ткани субъекта, такой как опухоль, по меньшей мере на 10%. В некоторых вариантах осуществления средство, такое как антитело к FGFR2, повышает или снижает уровень белка или типа клеток в конкретной ткани субъекта, такой как опухоль, по меньшей мере на 15%, по меньшей мере на 20% по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70% , по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85% или, по меньшей мере, 90% относительно уровня до контакта с антителом.
[0060] Термины «субъект» и «пациент» используют в данном документе взаимозаменяемо для обозначения человека. В некоторых вариантах осуществления также предлагаются способы лечения других млекопитающих, в том числе, но без ограничения этим, грызунов, обезьян, кошачьих, собачьих, лошадиных, крупного рогатого скота, свиных, овечьих, козьих, млекопитающих лабораторных животных, млекопитающих сельскохозяйственных животных, млекопитающих спортивных животных, а также млекопитающих домашних животных.
[0061] Термин «образец» в контексте данного документа относится к композиции, полученной от субъекта, которая содержит клеточный и/или другой молекулярный компонент, который необходимо исследовать, измерить количественно и/или идентифицировать, например, на основе физических, биохимических, химических и/или физиологических характеристик. Пример образца представляет собой образец ткани.
[0062] Термин «рак» относится к злокачественному пролиферативному нарушению, связанному с неконтролируемой пролиферацией клеток, неограниченным ростом клеток и снижением гибели клеток в результате апоптоза. Термин «рак желудочно-кишечного тракта» или «рак ЖКТ» относится к раку желудочно-кишечного тракта, такому как рак желудка, колоректальный рак или аденокарцинома поджелудочной железы. В некоторых вариантах осуществления рак желудочно-кишечного тракта представляет собой «рак желудка» или «РЖ», который в контексте данного документа, включает гастроэзофагеальный рак.
[0063] В некоторых вариантах осуществления рак содержит амплификацию гена FGFR2, тогда как в некоторых вариантах осуществления рак не содержит амплификацию FGFR2. В некоторых вариантах осуществления, где происходит амплификация, амплификация FGFR2 включает соотношение FGFR2:CEN10 (центромера хромосомы 10) > 3. В некоторых вариантах осуществления амплификация FGFR2 включает соотношение FGFR2: CEN10 ≥ 2. Однако в других вариантах осуществления уровень FGFR2 включает соотношение FGFR2:CEN10 от 1 до 2, что указывает на то, что FGFR2 не амплифицирован. В некоторых вариантах осуществления мутации или транслокации могут вызывать амплификацию гена FGFR2.
[0064] Амплификацию гена FGFR2 можно определить при помощи, например, флуоресцентного анализа гибридизации in situ (FISH). Амплификация гена FGFR2 также может быть обнаружена при помощи анализа крови или «жидкой биопсии». В некоторых вариантах осуществления анализа на основе крови амплификация гена FGFR2 может быть обнаружена в ДНК циркулирующих опухолевых клеток или «ЦОК» (CTC - circulating tumor cell). Способы обнаружения и молекулярной характеристики ЦОК описаны, например, в Alix-Panabieres (2013) Clinical Chemistry 59:1 110-118. В некоторых вариантах осуществления анализа на основе крови амплификация гена FGFR2 обнаруживается в цоДНК. Термин «цоДНК» относится к «циркулирующей опухолевой ДНК», которая представляет собой происходящую из опухоли фрагментированную ДНК, циркулирующую в кровотоке, которая не связана с клетками. Способы обнаружения и молекулярной характеристики цоДНК описаны, например, в Han et al. (2017) Genomics, Proteomics & Bioinformatics 15:2 59-72 и включают способы на основе ПЦР и секвенирование нового поколения (NGS).
[0065] В некоторых вариантах осуществления рак сверхэкспрессирует FGFR2-IIIb. В некоторых вариантах осуществления рак сверхэкспрессирует в большей степени FGFR2-IIIb, чем FGFR2-IIIc. В некоторых вариантах осуществления рак экспрессирует FGFR2-IIIb на нормализованном уровне, который более чем в 2, 3, 5 или 10 раз превышает нормализованный уровень экспрессии FGFR2-IIIc. В некоторых вариантах осуществления рак сверхэкспрессирует FGFR2-IIIb, но не содержит амплификацию гена FGFR2, тогда как в других вариантах осуществления рак содержит амплификацию гена FGFR2, а также сверхэкспрессирует FGFR2-IIIb. Экспрессия FGFR2-IIIb может быть определена на уровне белка методом иммуногистохимии (ИГХ), например, образцов опухоли, взятых у пациента, в сравнении со здоровой тканью. Термины «сверхэкспрессия белка FGFR2-IIIb» и «сверхэкспрессия FGFR2-IIIb» и тому подобное означают повышенные уровни белка FGFR2-IIIb независимо от причины таких повышенных уровней (то есть являются ли повышенные уровни результатом повышенной трансляции и/или пониженной деградации белка, другого механизма или комбинации механизмов). В некоторых вариантах осуществления сверхэкспрессия FGFR2-IIIb может быть обнаружена на уровне мРНК с использованием, например, таких методик, как анализ методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), по сравнению с нераковой тканью.
[0066] Уровень экспрессии FGFR2 или FGFR2-IIIb при помощи ИГХ может быть определен путем присвоения образцу опухоли ИГХ показателя по шкале 0-3. В контексте настоящего документа показатель «0» присваивается, если реактивность не наблюдается или мембранная реактивность наблюдается только в <10% опухолевых клеток; показатель «1+» присваивается, если наблюдается слабая или едва заметная мембранная реактивность по меньшей мере в 10% опухолевых клеток или если клетки реактивны только в части своих мембран; показатель «2+» присваивается, если наблюдается слабая или умеренная полная, базолатеральная или латеральная мембранная реактивность по меньшей мере в 10% опухолевых клеток; и показатель «3+» присваивается, если наблюдается сильная полная базолатеральная или латеральная мембранная реактивность по меньшей мере в 10% опухолевых клеток. В некоторых вариантах осуществления ИГХ-окрашивание опухолевых клеток 1+, 2+ или 3+ указывает на сверхэкспрессию FGFR2-IIIb. В некоторых вариантах осуществления ИГХ-окрашивание опухолевых клеток 2+ или 3+ указывает на сверхэкспрессию FGFR2-IIIb. В некоторых вариантах осуществления ИГХ-окрашивание опухолевых клеток 3+ указывает на сверхэкспрессию FGFR2-IIIb.
[0067] Режим химиотерапии «модифицированный FOLFOX6» или «mFOLFOX6» относится к режиму, в котором каждая комбинация оксалиплатина (например, Элоксатина®), лейковорина (например, лейковорина кальция или фолиновой кислоты) и 5-фторурацила (5-ФУ) вводится пациенту при помощи внутривенной инфузии или внутривенной болюсной инъекции в течение приблизительно 2-8 часов, в котором затем вводят дополнительную инфузию 5-ФУ путем внутривенной инфузии в течение приблизительно 2-суточного периода, как предусмотрено в различных вариантах осуществления, описанных в настоящем документе.
[0068] «Лечение» в контексте данного документа обозначает терапевтическое лечение, например, при котором целью является снижение степени тяжести или замедление прогрессирования целевого патологического состояния или расстройства, а также, например, при котором целью является ингибирование рецидива состояния или расстройства. В определенных вариантах реализации термин «лечение» охватывает любое введение или применение терапевтического средства в случае заболевания у пациента и включает ингибирование или замедление заболевания или прогрессирования заболевания; частичное или полное купирование заболевания, например, при помощи инициации регрессии, восстановления или исправления утерянной, отсутствующей или нарушенной функции; стимулирования неэффективного процесса; или выведения заболевания на плато для того, чтобы добиться снижения степени тяжести. Термин «лечение» также включает снижение степени тяжести любой фенотипической характеристики и/или снижение распространенности, степени или вероятности этой характеристики. Те, кто нуждается в лечении, включают тех, кто уже имеет расстройства, а также тех, кто подвержен риску повторного появления расстройства, или тех, у кого необходимо предотвратить или замедлить повторное появление расстройства.
[0069] Термин «эффективное количество» или «терапевтически эффективное количество» относится к количеству лекарственного средства, эффективному для лечения у субъекта заболевания или расстройства. В определенных вариантах реализации эффективное количество относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения желаемого терапевтического или профилактического результата. Терапевтически эффективное количество антитела к FGFR2 или режима химиотерапии в соответствии с настоящим изобретением может отличаться в зависимости от факторов, таких как течение заболевания, возраст, пол и масса индивида, и способности антитела или антител вызывать желаемый ответ у индивидуума. Терапевтически эффективное количество включает количество, при котором любые токсичные или вредные эффекты антитела или антител перевешиваются терапевтически благоприятными эффектами. В некоторых вариантах реализации выражение «эффективное количество» обозначает количество антитела, которое является эффективным для лечения рака.
[0070] Введение «в комбинации с» одним или более дополнительными терапевтические средства, такими как режим химиотерапии включает одновременное (совместное) и поочередное (последовательное) введение в любом порядке.
[0071] «Фармацевтически приемлемый носитель» обозначает нетоксичный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал, вспомогательный состав или носитель, общепринятый в данной области техники для применения с терапевтическим средством, что вместе составляет «фармацевтическую композицию» для введения субъекту. Фармацевтически приемлемый носитель нетоксичен для реципиентов в используемых дозировках и концентрациях и совместим с другими ингредиентами состава. Фармацевтически приемлемый носитель соответствует применяемому составу. Например, если терапевтическое средство должно быть введено перорально, носитель может представлять собой желатиновую капсулу. Если терапевтическое средство должно быть введено подкожно, носитель, в идеале, не раздражает кожу и не вызывает реакции в месте введения препарата.
[0072] Дополнительные определения могут быть приведены в следующих разделах.
Предлагаемые в качестве примера антитела к FGFR2
[0073] Предлагаемые в качестве примера антитела к FGFR2 включают антитела, которые специфически связывают FGFR2-IIIb, то есть антитела к FGFR2-IIIb. В некоторых вариантах осуществления антитела к FGFR2-IIIb связывают FGFR2-IIIc с более низкой аффинностью, чем они связываются с FGFR2-IIIb. В некоторых вариантах осуществления антитела к FGFR2-IIIb не связываются с FGFR2-IIIc обнаруживаемым образом.
[0074] Предлагаемым в качестве примера антителом к FGFR2-IIIb для использования в вариантах осуществления настоящего изобретения является антитело к HuGAL-FR21, описанное в патенте США № 8 101 723 B2, выданном 24 января 2012 г., содержание которого специально включено в данный документ посредством ссылки. На фигурах 13 и 14 патента США № 8 101 723 B2 показаны аминокислотные последовательности вариабельных областей и полноразмерных цепей зрелых антител HuGAL-FR21, и они включены в настоящее описание посредством ссылки. Последовательности вариабельной области тяжелой цепи антитела HuGAL-FR21 подчеркнуты на фигуре 13 патента США № 8 101 723 B2 и специально включены в настоящий документ посредством ссылки. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297. Дополнительные антитела, которые могут быть использованы в вариантах осуществления в настоящем документе, включают антитела, описанные в патентной публикации США № 2015-0050273-А1, в которой описаны определенные афукозилированные антитела к FGFR2-IIIb, и которая включена в настоящее описание посредством ссылки.
[0075] В некоторых вариантах осуществления, антитело к FGFR2-IIIb содержит по меньшей мере одну, две, три, четыре, пять или шесть гипервариабельных областей (HVR; например, CDR), выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0076] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит по меньшей мере одну тяжелую цепь, содержащую вариабельную область тяжелой цепи и по меньшей мере часть константной области тяжелой цепи, и по меньшей мере одну легкую цепь, содержащую вариабельную область легкой цепи и по меньшей мере часть константной области легкой цепи. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит две тяжелые цепи, причем каждая тяжелая цепь содержит вариабельную область тяжелой цепи и по меньшей мере часть константной области тяжелой цепи, и две легкие цепи, причем каждая легкая цепь содержит вариабельную область легкой цепи и по меньшей мере часть константной области легкой цепи. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 5. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 3. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0077] В некоторых вариантах осуществления, антитело к FGFR2-IIIb содержит шесть HVR, содержащих (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления, антитело к FGFR2-IIIb содержит шесть HVR, как описано выше, и связывается с FGFR2-IIIb. В некоторых вариантах осуществления антитело к FGFR-IIIb не связывается с FGFR2-IIIc. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0078] В некоторых вариантах осуществления, антитело к FGFR2-IIIb конкурирует с антителом FGFR2-IIIb, содержащим шесть HVR, содержащих (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0079] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0080] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в Asn297.
[0081] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит (a) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 8; и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0082] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 4. В некоторых вариантах осуществления, последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность избирательно связываться с FGFR2-IIIb без обнаруживаемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления всего от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO: 4. В некоторых вариантах осуществления замены, вставки или делеции происходят в областях за пределами HVR (то есть в FR). Необязательно, антитело к FGFR2-IIIb содержит последовательность VH из SEQ ID NO: 5, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления VH содержит одну, две или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0083] В некоторых вариантах осуществления, антитело к FGFR2-IIIb содержит вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 5. В некоторых вариантах осуществления последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления антитело к FGFR2-IIIb сохраняет способность избирательно связываться с FGFR2-IIIb без связывания с FGFR2-IIIc. В некоторых вариантах осуществления всего от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO: 5. В некоторых вариантах осуществления, замены, вставки или делеции происходят в областях за пределами HVR (то есть в FR). Необязательно, антитело к FGFR2-IIIb содержит последовательность VL из SEQ ID NO: 4, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления VL содержит одну, две или три HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0084] В некоторых вариантах осуществления, антитело к FGFR2-IIIb содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 4, и вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 5. В некоторых вариантах осуществления последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, и последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность избирательно связываться с FGFR2-IIIb без связывания с FGFR2-IIIc. В некоторых вариантах осуществления всего от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO: 4. В некоторых вариантах осуществления всего от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO: 5. В некоторых вариантах осуществления замены, вставки или делеции происходят в областях за пределами HVR (то есть в FR). Необязательно, антитело к FGFR2-IIIb содержит последовательность VH из SEQ ID NO: 4 и последовательность VL SEQ ID NO: 5, включая посттрансляционные модификации одной или обеих последовательностей. В конкретном варианте осуществления VH содержит одну, две или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8; и VL содержит одну, две или три HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0085] В некоторых вариантах осуществления антитело к FGFR2-IIIb имеет VH, как в любом из вариантов осуществления, представленных выше, и VL, как в любом из вариантов осуществления, представленных выше. В одном варианте осуществления антитело содержит последовательности VH и VL из SEQ ID NO: 4 и SEQ ID NO: 5, включая посттрансляционные модификации этих последовательностей. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0086] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит последовательность тяжелой цепи, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 2. В некоторых вариантах осуществления, последовательность тяжелой цепи, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность избирательно связываться с FGFR2-IIIb без обнаруживаемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления всего от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO: 2. В некоторых вариантах осуществления замены, вставки или делеции происходят в областях за пределами HVR (то есть в FR). Необязательно, тяжелая цепь антитела к FGFR2-IIIb содержит последовательность VH из SEQ ID NO: 2, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления тяжелая цепь содержит одну, две или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0087] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит легкую цепь, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 3. В некоторых вариантах осуществления, последовательность легкой цепи, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность избирательно связываться с FGFR2-IIIb без обнаруживаемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления всего от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO: 3. В некоторых вариантах осуществления замены, вставки или делеции происходят в областях за пределами HVR (то есть в FR). Необязательно, антитело к FGFR2-IIIb содержит последовательность VL из SEQ ID NO: 3, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления легкая цепь содержит одну, две или три HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0088] В некоторых вариантах осуществления, антитело к FGFR2-IIIb содержит последовательность тяжелой цепи, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 2, и последовательность легкой цепи, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 3. В некоторых вариантах осуществления, последовательность тяжелой цепи, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность избирательно связываться с FGFR2-IIIb без обнаруживаемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления, последовательность легкой цепи, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность избирательно связываться с FGFR2-IIIb без обнаруживаемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления всего от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO: 2. В некоторых вариантах осуществления всего от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO: 3. В некоторых вариантах осуществления замены, вставки или делеции происходят в областях за пределами HVR (то есть в FR). Необязательно, тяжелая цепь антитела к FGFR2-IIIb содержит последовательность VH из SEQ ID NO: 2, включая посттрансляционные модификации этой последовательности, а легкая цепь антитела к FGFR2-IIIb содержит последовательность VL из SEQ ID NO: 3, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления тяжелая цепь содержит одну, две или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8; а легкая цепь содержит одну, две или три HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0089] Дополнительными предлагаемыми в качестве примеров антителами к FGFR2 являются антитела GAL-FR22 и GAL-FR23, описанные в патенте США № 8 101 723 B2, включенном в настоящий документ посредством ссылки. Вариабельные области легкой и тяжелой цепи GAL-FR22, например, представлены в виде SEQ ID NO: 7 и 8 в патенте № 8 101 723 B2, в то время как CDR по Kabat и вариабельные области легкой и тяжелой цепи также представлены на Фигуре 16 этого патента, которые включены в настоящее описание посредством ссылки. Гибридомы, вырабатывающие GAL-FR21, GAL-FR22 и GAL-FR23, были депонированы в Американской коллекции типовых культур, PO Box 1549, Manassas VA, США, 20108, под номерами ATCC 9586, 9587 и 9408, 6 ноября, 6 ноября и 12 августа 2008 года, соответственно. Таким образом, в некоторых вариантах осуществления антитело к FGFR2 представляет собой антитело, содержащее аминокислотную последовательность антитела, полученного из одного из этих трех штаммов гибридомы.
[0090] Вариабельные области тяжелой и легкой цепи GAL-FR22 также представлены в настоящем документе в виде SEQ ID NO: 39 и 43, в то время как CDR по Kabat представлены в настоящем документе в виде SEQ ID NO: 40-42 и 44-46. Таким образом, в некоторых вариантах осуществления вариабельная область тяжелой цепи антитела к FGFR2-IIIb содержит: (i) CDR1, содержащую аминокислотную последовательность SEQ ID NO: 40; (ii) CDR2, содержащую аминокислотную последовательность SEQ ID NO: 41; и (iii) CDR3, содержащую аминокислотную последовательность SEQ ID NO: 42; вариабельная область легкой цепи содержит: (iv) CDR1, содержащую аминокислотную последовательность SEQ ID NO: 44; (v) CDR2, содержащую аминокислотную последовательность SEQ ID NO: 45; и (vi) CDR3, содержащую аминокислотную последовательность SEQ ID NO: 46.
[0091] В некоторых вариантах осуществления антитело к FGFR2 содержит антитело к FGFR2-IIIb, в котором вариабельный домен тяжелой цепи идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:39 или содержит аминокислотную последовательность SEQ ID NO: 39. В некоторых вариантах осуществления антитело к FGFR2 содержит антитело к FGFR2-IIIb, в котором вариабельный домен легкой цепи идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO: 43; или содержит аминокислотную последовательность SEQ ID NO: 43. В некоторых вариантах осуществления вариабельный домен тяжелой цепи идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:39 или содержит аминокислотную последовательность SEQ ID NO: 39, а вариабельный домен легкой цепи идентичен на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% аминокислотной последовательности SEQ ID NO:43 или содержит аминокислотную последовательность SEQ ID NO: 43. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0092] В любом из способов, описанных в настоящем документе, антитело к FGFR2 может представлять собой гуманизированное антитело, химерное антитело или антитело человека. В любой из композиций или способов, описанных в данном документе, антитело к FGFR2 может быть выбрано из Fab, Fv, scFv, Fab’ и (Fab’)2. В любой из композиций или способов, описанных здесь, антитело к FGFR2 может быть выбрано из IgA, IgG и IgD. В любой из композиций или способов, описанных в настоящем документе, антитело к FGFR2 может представлять собой IgG. В любом из способов, описанных в настоящем документе, антитело может представлять собой IgG1 или IgG3.
Типовые свойства антител
[0093] В некоторых вариантах осуществления антитело к FGFR2-IIIb связывается с FGFR2-IIIb с более высокой аффинностью, чем с FGFR2-IIIc, или не связывается с FGFR2-IIIc обнаруживаемым образом; ингибирует связывание FGF2 с человеческим FGFR2; и/или ингибирует связывание FGF7 с человеческим FGFR2. Связывание антитела с FGFR2 и ингибирование связывания между FGFR2 и FGF можно оценить, например, при помощи анализов ELISA, как описано в патенте США № 8 101 723, или, например, при помощи анализа на основе чипа, как описано в Примере 2 WO 2015/-17600. В некоторых вариантах осуществления антитело индуцирует активность АЗКЦ, а в некоторых вариантах осуществления обладает повышенной активностью АЗКЦ, например, как описано в WO 2015/-17600. Например, активность АЗКЦ может быть определена, как описано в Примере 3 WO 2015/-17600. В некоторых вариантах осуществления антитело может ингибировать рост опухоли человека в мышиной модели, например, как показано в примере 1 международной заявки № PCT/US2016/063332. В некоторых вариантах осуществления антитело к FGFR2-IIIb способно увеличивать количество одной или более PD-L1-положительных клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани в мышиной модели опухоли по сравнению с контролем, например, как описано в примере 2 международной заявки № PCT/US2016/063332.
Афукозилированные антитела к FGFR2
[0094] В некоторых вариантах осуществления антитела к FGFR2, например антитела к FGFR2-IIIb, как описано выше, имеют углеводную структуру, в которой отсутствует фукоза, присоединенная (прямо или непрямо) к Fc-области (т.е. афукозилированные антитела), т. е. антитела являются афукозилированными. В некоторых вариантах осуществления афукозилированное антитело представляет собой антитело IgG1 или IgG3, у которого отсутствует фукоза в положении Asn297.
[0095] В контексте настоящего документа антитела считаются афукозилированными, когда множество таких антител содержит по меньшей мере 95% афукозилированных антител. Количество фукозы может быть определено путем расчета среднего количества фукозы в сахарной цепи в Asn297 относительно суммы всех гликоструктур, присоединенных к Asn 297 (например, сложных, гибридных и высокоманнозных структур). Неограничивающие примеры способов обнаружения фукозы в антителе включают масс-спектрометрию MALDI-TOF (см., например, WO 2008/077546), измерение при помощи ВЭЖХ высвобождаемых флуоресцентно меченных олигосахаридов (см., например, Schneider et al., “N-Glycan analysis of monoclonal antibodies and other glycoproteins using UHPLC with fluorescence detection,” Agilent Technologies, Inc. (2012); Lines, J. Pharm. Biomed. Analysis, 14: 601-608 (1996); Takahasi, J. Chrom., 720: 217-225 (1996)), измерение при помощи капиллярного электрофореза высвобождаемых флуоресцентно меченных олигосахаридов (см., например, Ma et al., Anal. Chem., 71: 5185-5192 (1999)) и ВЭЖХ с импульсным амперометрическим детектированием для измерения состава моносахаридов (см., например, Hardy, et al., Analytical Biochem., 170: 54-62 (1988)).
[0096] Asn297 относится к остатку аспарагина, расположенному приблизительно в положении 297 в Fc-области (нумерация EU остатков в Fc-области); однако в заданной последовательности антитела Asn297 также может быть расположен приблизительно на ± 3 аминокислоты выше или ниже позиции 297, то есть между положениями 294 и 300, из-за незначительных вариаций последовательности в антителах. В антителе к FGFR2-IIIb, описанном в данном документе, Asn297 находится в последовательности QYNST (положения 292-296 SEQ ID NO: 2) и выделен жирным шрифтом и подчеркнут в таблице последовательностей, показанной ниже, SEQ ID NO: 2.
[0097] Варианты фукозилирования могут иметь улучшенную функцию АЗКЦ. См., например, патентные публикации США № US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, относящихся к «афукозилированным» или «фукозодефицитным» антителам, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO2002/031140; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, способных продуцировать афукозилированные антитела, включают клетки Lec13 CHO с недостатком фукозилирования белка (Ripka et al. Arch. Biochem. Biophys. 249: 533-545 (1986); заявка на патент США № US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al. особенно в примере 11), и нокаутные клеточные линии, такие как клеточные линии, лишенные функционального гена альфа-1,6-фукозилтрансферазы, FUT8, например, нокаутные клетки СНО (см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO2003/085107).
[0098] Антитела к FGFR2 в данном документе также могут содержать разделенные пополам олигосахариды, например, в которых двухантенный олигосахарид, присоединенный к Fc-области антитела, делится пополам GlcNAc. Такие антитела могут иметь пониженное фукозилирование и/или улучшенную функцию АЗКЦ. Примеры таких антител описаны, например, в WO 2003/011878 (Jean-Mairet et al.); патенте США № 6 602 684 (Umana et al.); и US 2005/0123546 (Umana et al.). В некоторых вариантах осуществления антитела к FGFR2 имеют по меньшей мере один остаток галактозы в олигосахариде, присоединенном к Fc-области. Такие антитела могут иметь улучшенную функцию КЗЦ. Такие антитела описаны, например, в WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
[0099] В некоторых вариантах осуществления изобретения афукозилированное антитело к FGFR2 опосредует АЗКЦ в присутствии эффекторных клеток человека более эффективно, чем антитело с такой же аминокислотной последовательностью, которое содержит фукозу. Как правило, активность АЗКЦ может быть определена с использованием анализа АЗКЦ in vitro, раскрытого в публикации патента США № 2015-0050273 A1, однако можно также применять другие анализы или способы определения активности АЗКЦ, например, в животной модели и т.д.
[00100] В некоторых вариантах осуществления антитело к FGFR2 содержит последовательности тяжелой и легкой цепей SEQ ID NO: 2 и 3. В некоторых вариантах осуществления антитело, содержащее последовательности тяжелой и легкой цепей SEQ ID NO: 2 и 3, является афукозилированным.
Типовые константные области антител
[00101] В некоторых вариантах осуществления анти-FGFR2, описанное в настоящем документе, содержит одну или несколько константных областей человека. В некоторых вариантах осуществления константная область тяжелой цепи человека имеет изотип, выбранный из IgA, IgG и IgD. В некоторых вариантах осуществления константная область легкой цепи человека имеет изотип, выбранный из κ и λ.
[00102] В некоторых вариантах осуществления антитело, описанное в настоящем документе, содержит константную область человеческого IgG. В некоторых вариантах осуществления, когда желательна эффекторная функция, выбирают антитело, содержащее константную область тяжелой цепи человеческого IgG1 или константную область тяжелой цепи человеческого IgG3. В некоторых вариантах осуществления антитело, описанное в настоящем документе, содержит константную область человеческого IgG1. В некоторых вариантах осуществления антитело, описанное в настоящем документе, содержит константную область человеческого IgG1, где N297 не является фукозилированным. В некоторых вариантах осуществления антитело, описанное в настоящем документе, содержит константную область человеческого IgG1 и легкую цепь κ человека.
[00103] В настоящем описании и формуле изобретения, если явно не указано или не известно специалисту в данной области, нумерация остатков в тяжелой цепи иммуноглобулина соответствует индексу EU в соответствии с номенклатурой Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), содержание которой специально включено в настоящий документ посредством ссылки. «Индекс EU в соответствии с Kabat» относится к нумерации остатков EU человеческого антитела IgG1.
[00104] В определенных вариантах осуществления антитело по изобретению содержит вариант Fc-области, имеющей по меньшей мере одну аминокислотную замену по сравнению с Fc-областью IgG дикого типа или антитела дикого типа. В некоторых вариантах осуществления вариант Fc-области имеет две или более аминокислотных замен в Fc-области антитела дикого типа. В некоторых вариантах осуществления вариантная Fc-область имеет три или более аминокислотных замен в Fc-области антитела дикого типа. В определенных вариантах осуществления вариантная Fc-область имеет по меньшей мере одну, две или три или более аминокислотных замен Fc-области, описанных в настоящем документе. В определенных вариантах осуществления вариантная Fc-область в данном документе будет обладать по меньшей мере приблизительно 80% гомологией с Fc-областью с нативной последовательностью и/или с Fc-областью родительского антитела. В определенных вариантах осуществления вариантная Fc-область в данном документе будет обладать по меньшей мере приблизительно 90% гомологией с Fc-областью с нативной последовательностью и/или с Fc-областью родительского антитела. В определенных вариантах осуществления вариантная Fc-область в данном документе будет обладать по меньшей мере приблизительно 95% гомологией с Fc-областью с нативной последовательностью и/или с Fc-областью родительского антитела.
[00105] В определенных вариантах осуществления антитело, представленное в настоящем документе, изменено для увеличения или уменьшения степени, в которой антитело является гликозилированным. Добавление или удаление сайтов гликозилирования к антителу может быть удобно осуществлено путем изменения аминокислотной последовательности таким образом, что один или несколько сайтов гликозилирования создаются или удаляются.
[00106] Когда антитело содержит Fc-область, углевод, присоединенный к нему, может быть изменен. Нативные антитела, продуцируемые клетками млекопитающих, обычно содержат разветвленный двухантенный олигосахарид, который обычно присоединяется посредством N-связи к Asn297 домена CH2 Fc-области. См., например, Wright et al. TIBTECH 15:26-32 (1997). Олигосахарид может включать в себя различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стволе» двухантенной структуры олигосахаридов. В некоторых вариантах осуществления могут быть сделаны модификации олигосахарида в антителе по изобретению для создания антител с определенными улучшенными свойствами.
[00107] Антитела также могут иметь аминоконцевые лидерные удлинения. Например, один или несколько аминокислотных остатков аминоконцевой лидерной последовательности присутствуют на аминоконце любой одной или нескольких тяжелых или легких цепей антитела. Типичное аминоконцевое лидерное удлинение содержит или состоит из трех аминокислотных остатков VHS, присутствующих в одной или обеих легких цепях антитела.
[00108] In vivo или сывороточный период полувыведения полипептидов, связывающих с высокой аффинностью человеческий FcRn, можно проанализировать, например, у трансгенных мышей, у людей или у отличных от человека приматов, которым вводят полипептиды с вариантной Fc-областью. См. также, например, Petkova et al. International Immunology 18(12):1759-1769 (2006).
Типичные химерные антитела
[00109] В определенных вариантах осуществления антитело к FGFR2, представленное в настоящем документе, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в патенте США № 4 816 567; и Morrison et al., (1984) Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). В одном примере химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область, полученную от мыши, крысы, хомяка, кролика или отличного от человека примата, такого как обезьяна) и константную область человека. В дополнительном примере химерное антитело представляет собой антитело с «переключенным классом», в котором класс или подкласс был изменен по сравнению с родительским антителом. Химерные антитела включают их антигенсвязывающие фрагменты.
[00110] Неограничивающие типичные химерные антитела включают химерные антитела к FGFR2, содержащие последовательности HVR1, HVR2 и HVR3 тяжелой цепи и/или HVR1, HVR2 и HVR3 легкой цепи, описанные в настоящем документе.
[00111] В некоторых вариантах осуществления химерное антитело, описанное в настоящем документе, содержит одну или несколько человеческих константных областей. В некоторых вариантах осуществления константная область тяжелой цепи человека имеет изотип, выбранный из IgA, IgG и IgD. В некоторых вариантах осуществления константная область легкой цепи человека имеет изотип, выбранный из κ и λ. В некоторых вариантах осуществления химерное антитело, описанное в настоящем документе, содержит константную область человеческого IgG. В некоторых вариантах осуществления химерное антитело, описанное в настоящем документе, содержит константную область тяжелой цепи человеческого IgG4. В некоторых вариантах осуществления химерное антитело, описанное в настоящем документе, содержит константную область человеческого IgG4 и легкую цепь κ человека.
[00112] Как отмечено выше, необходима эффекторная функция или нет, может зависеть от конкретного способа лечения, выбранного для антитела. Таким образом, в некоторых вариантах осуществления, когда желательна эффекторная функция, выбирают химерное антитело, содержащее константную область тяжелой цепи человеческого IgG1 или константную область тяжелой цепи человеческого IgG3. В некоторых вариантах осуществления, когда эффекторная функция нежелательна, выбирают химерное антитело, содержащее константную область тяжелой цепи человеческого IgG4 или IgG2. В некоторых вариантах осуществления химерное антитело, описанное в настоящем документе, содержит константную область человеческого IgG1, где N297 не является фукозилированным. В некоторых вариантах осуществления химерное антитело, описанное в настоящем документе, содержит константную область человеческого IgG1 и легкую цепь κ человека.
Типичные гуманизированные антитела
[00113] В некоторых вариантах осуществления используются гуманизированные антитела, которые связывают FGFR2. Гуманизированные антитела полезны в качестве терапевтических молекул, потому что гуманизированные антитела уменьшают или устраняют иммунный ответ человека на нечеловеческие антитела (такие как ответ на человеческое антимышиное антитело (HAMA)), который может приводить к иммунному ответу на терапевтическое средство на основе антитела и снижению эффективности терапевтического средства.
[00114] В определенных вариантах осуществления химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют для снижения иммуногенности для людей, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. Обычно гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR или CDR (или их части) получают из нечеловеческого антитела, а FR (или их части) получают из последовательностей антител человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть человеческой константной области. В некоторых вариантах осуществления некоторые остатки FR в гуманизированном антителе замещены соответствующими остатками нечеловеческого антитела (например, антитела, из которого получены остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
[00115] Гуманизированные антитела и способы их получения рассматриваются, например, в Almagro and Fransson, (2008) Front. Biosci. 13: 1619-1633, и дополнительно описаны, например, в Riechmann et al., (1988) Nature 332:323-329; Queen et al., (1989) Proc. Natl Acad. Sci. USA 86: 10029-10033; патентах США №№ 5 821 337, 7 527 791, 6 982 321 и 7 087 409; Kashmiri et al., (2005) Methods 36:25-34 (описание прививания SDR (a-CDR)); Padlan, (1991) Mol. Immunol. 28:489-498 (описание «изменение поверхности»); Dall'Acqua et al., (2005) Methods 36:43-60 (описание «перестановки FR»); и Osbourn et al., (2005) Methods 36:61-68 и Klimka et al., (2000) Br. J. Cancer, 83:252-260 (описание подхода «управляемого отбора» к перестановке FR).
[00116] Каркасные области человека, которые можно использовать для гуманизации, включают, но не ограничиваются ими: каркасные области, выбранные с использованием метода «наилучшего соответствия» (см., например, Sims et al. (1993) J. Immunol. 151: 2296); каркасные области, полученные из консенсусной последовательности человеческих антител определенной подгруппы вариабельных областей легкой или тяжелой цепи (см., например, Carter et al. (1992) Proc. Natl. Acad. Sci. USA, 89:4285; и Presta et al. (1993) J. Immunol, 151:2623); зрелые каркасные области человека (соматически мутированные) или каркасные области зародышевой линии человека (см., например, Almagro and Fransson, (2008) Front. Biosci. 13:1619-1633); и каркасные области, полученные из скрининга библиотек FR (см., например, Baca et al., (1997) J. Biol. Chem. 272: 10678-10684 и Rosok et al., (1996) J. Biol. Chem. 271: 22611-22618).
[00117] В некоторых вариантах осуществления гуманизированные антитела содержат одну или несколько человеческих константных областей. В некоторых вариантах осуществления константная область тяжелой цепи человека имеет изотип, выбранный из IgA, IgG и IgD. В некоторых вариантах осуществления константная область легкой цепи человека имеет изотип, выбранный из κ и λ.
[00118] В некоторых вариантах осуществления гуманизированное антитело, описанное в настоящем документе, содержит константную область человеческого IgG. В некоторых вариантах осуществления, когда желательна эффекторная функция, антитело содержит константную область тяжелой цепи человеческого IgG1 или константную область тяжелой цепи человеческого IgG3. В некоторых вариантах осуществления гуманизированное антитело, описанное в настоящем документе, содержит константную область человеческого IgG1. В некоторых вариантах осуществления гуманизированное антитело, описанное в настоящем документе, содержит константную область человеческого IgG1, где N297 не является фукозилированным. В некоторых вариантах осуществления гуманизированное антитело, описанное в настоящем документе, содержит константную область человеческого IgG1 и легкую цепь κ человека.
Человеческие антитела
[00119] Человеческие антитела к FGFR2 могут быть получены любым подходящим способом. Неограничивающие типичные способы включают получение человеческих антител у трансгенных мышей, которые содержат локусы человеческого иммуноглобулина. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551-55 (1993); Jakobovits et al., Nature 362: 255-8 (1993); Lonberg et al., Nature 368: 856-9 (1994); и патенты США №№ 5 545 807; 6 713 610; 6 673 986; 6 162 963; 5 545 807; 6 300 129; 6 255 458; 5 877 397; 5 874 299; и 5 545 806.
[00120] Неограничивающие типичные способы включают получение человеческих антител с использованием библиотек фагового дисплея. См., например, Hoogenboom et al., J. Mol. Biol. 227: 381-8 (1992); Marks et al., J. Mol. Biol. 222: 581:-97 (1991) и публикацию PCT № WO 99/10494).
[00121] В некоторых вариантах осуществления человеческое антитело содержит одну или несколько человеческих константных областей. В некоторых вариантах осуществления константная область тяжелой цепи человека имеет изотип, выбранный из IgA, IgG и IgD. В некоторых вариантах осуществления константная область легкой цепи человека имеет изотип, выбранный из κ и λ. В некоторых вариантах осуществления человеческое антитело, описанное в настоящем документе, содержит константную область человеческого IgG. В некоторых вариантах осуществления человеческое антитело, описанное в настоящем документе, содержит константную область тяжелой цепи человеческого IgG4. В некоторых таких вариантах осуществления человеческое антитело, описанное в настоящем документе, содержит мутацию S241P в константной области человеческого IgG4. В некоторых вариантах осуществления человеческое антитело, описанное в настоящем документе, содержит константную область человеческого IgG4 и легкую цепь κ человека.
[00122] В некоторых вариантах осуществления, когда желательна эффекторная функция, выбирают человеческое антитело, содержащее константную область тяжелой цепи человеческого IgG1 или константную область тяжелой цепи человеческого IgG3. В некоторых вариантах осуществления, когда эффекторная функция нежелательна, выбирают человеческое антитело, содержащее константную область тяжелой цепи человеческого IgG4 или IgG2. В некоторых вариантах осуществления гуманизированное антитело, описанное в настоящем документе, содержит константную область человеческого IgG1, где N297 не является фукозилированным. В некоторых вариантах осуществления гуманизированное антитело, описанное в настоящем документе, содержит константную область человеческого IgG1 и легкую цепь κ человека.
Типичные конъюгаты антител
[00123] В некоторых вариантах осуществления антитело к FGFR2 конъюгировано с меткой и/или цитотоксическим агентом. В контексте данного документа метка представляет собой фрагмент, который облегчает обнаружение антитела и/или облегчает обнаружение молекулы, с которой связывается антитело. Неограничивающие примеры меток включают, но не ограничиваются ими, радиоизотопы, флуоресцентные группы, ферментные группы, хемилюминесцентные группы, биотин, эпитопные метки, метки, связывающие металлы, и т.д. Специалист в данной области может выбрать подходящую метку в соответствии с предполагаемым применением.
[00124] В контексте данного документа цитотоксический агент представляет собой фрагмент, который уменьшает пролиферативную способность одной или нескольких клеток. Клетка обладает пониженной пролиферативной способностью, когда клетка становится менее способной к пролиферации, например, потому что клетка подвергается апоптозу или иным образом умирает, клетка не может пройти через клеточный цикл и/или не может делиться, клетка дифференцируется и т.д. Неограничивающие типичные цитотоксические агенты включают, но не ограничиваются ими, радиоизотопы, токсины и химиотерапевтические агенты. Специалист в данной области может выбрать подходящий цитотоксический агент в соответствии с предполагаемым применением.
[00125] В некоторых вариантах осуществления метка и/или цитотоксический агент конъюгированы с антителом при помощи химических методов in vitro. Неограничивающие иллюстративные химические способы конъюгации известны в данной области техники и включают сервисы, методы и/или реагенты, коммерчески доступные, например, от Thermo Scientific Life Science Research Produces (ранее Pierce; г. Рокфорд, штат Иллинойс, США), Prozyme (г. Хэйворд, Калифорния, США), SACRI Antibody Services (г. Калгари, Канада), AbD Serotec (г. Роли, штат Северная Каролина, США) и др. В некоторых вариантах осуществления, когда метка и/или цитотоксический агент представляет собой полипептид, метка и/или цитотоксический агент могут быть экспрессированы из одного вектора экспрессии вместе с по меньшей мере одной цепью антитела для получения полипептида, содержащего метку и/или цитотоксический агент, слитые с цепью антитела. Специалист в данной области может выбрать подходящий способ конъюгирования метки и/или цитотоксического агента с антителом в соответствии с предполагаемым применением.
Молекулы нуклеиновых кислот, кодирующие антитела
[00126] Предложены молекулы нуклеиновой кислоты, содержащие полинуклеотиды, которые кодируют одну или несколько цепей антитела. В некоторых вариантах осуществления молекула нуклеиновой кислоты содержит полинуклеотид, который кодирует тяжелую цепь или легкую цепь антитела. В некоторых вариантах осуществления молекула нуклеиновой кислоты содержит как полинуклеотид, который кодирует тяжелую цепь, так и полинуклеотид, который кодирует легкую цепь антитела. В некоторых вариантах осуществления первая молекула нуклеиновой кислоты содержит первый полинуклеотид, который кодирует тяжелую цепь, а вторая молекула нуклеиновой кислоты содержит второй полинуклеотид, который кодирует легкую цепь.
[00127] В некоторых таких вариантах осуществления тяжелая цепь и легкая цепь экспрессируются из одной молекулы нуклеиновой кислоты или из двух отдельных молекул нуклеиновой кислоты в виде двух отдельных полипептидов. В некоторых вариантах осуществления, например, когда антитело представляет собой scFv, один полинуклеотид кодирует один полипептид, содержащий как тяжелую цепь, так и легкую цепь, связанные вместе.
[00128] В некоторых вариантах осуществления полинуклеотид, кодирующий тяжелую цепь или легкую цепь антитела, содержит нуклеотидную последовательность, которая кодирует лидерную последовательность, которая при трансляции находится на N-конце тяжелой цепи или легкой цепи. Как обсуждалось выше, лидерная последовательность может быть нативной лидерной последовательностью тяжелой или легкой цепи или может быть другой гетерологичной лидерной последовательностью.
[00129] Молекулы нуклеиновой кислоты могут быть сконструированы с использованием методик рекомбинантной ДНК, общепринятых в данной области. В некоторых вариантах осуществления молекула нуклеиновой кислоты представляет собой вектор экспрессии, который подходит для экспрессии в выбранной клетке-хозяине.
Экспрессия и выработка антител
Векторы
[00130] Предложены векторы, содержащие полинуклеотиды, которые кодируют тяжелые цепи и/или легкие цепи антител. Также предложены векторы, содержащие полинуклеотиды, которые кодируют тяжелые цепи и/или легкие цепи антител. Такие векторы включают, но не ограничиваются ими, ДНК-векторы, фаговые векторы, вирусные векторы, ретровирусные векторы и т.д. В некоторых вариантах осуществления вектор содержит первую полинуклеотидную последовательность, кодирующую тяжелую цепь, и вторую полинуклеотидную последовательность, кодирующую легкую цепь. В некоторых вариантах осуществления тяжелая цепь и легкая цепь экспрессируются из вектора в виде двух отдельных полипептидов. В некоторых вариантах осуществления тяжелая цепь и легкая цепь экспрессируются в виде части одного полипептида, например, как в случае, когда антитело представляет собой scFv.
[00131] В некоторых вариантах осуществления первый вектор содержит полинуклеотид, который кодирует тяжелую цепь, а второй вектор содержит полинуклеотид, который кодирует легкую цепь. В некоторых вариантах осуществления первый вектор и второй вектор трансфицируют в клетки-хозяев в сходных количествах (таких как сходные молярные количества или сходные массовые количества). В некоторых вариантах осуществления молярное или массовое соотношение между 5:1 и 1:5 первого вектора и второго вектора трансфицируют в клетки-хозяев. В некоторых вариантах осуществления используется массовое соотношение между 1:1 и 1:5 для вектора, кодирующего тяжелую цепь, и вектора, кодирующего легкую цепь. В некоторых вариантах осуществления используется массовое соотношение 1:2 для вектора, кодирующего тяжелую цепь, и вектора, кодирующего легкую цепь.
[00132] В некоторых вариантах осуществления выбран вектор, который оптимизирован для экспрессии полипептидов в клетках СНО или клетках, полученных из СНО, или в клетках NSO. Примеры таких векторов описаны, например, в Running Deer et al., Biotechnol. Prog. 20:880-889 (2004).
[00133] В некоторых вариантах осуществления вектор выбирают для экспрессии in vivo тяжелых цепей антител и/или легких цепей антител у животных, включая людей. В некоторых таких вариантах осуществления экспрессия полипептида находится под контролем промотора, который функционирует тканеспецифичным образом. Например, специфичные для печени промоторы описаны, например, в публикации РСТ № WO 2006/076288.
Клетки-хозяева
[00134] В различных вариантах осуществления тяжелые цепи и/или легкие цепи антител могут экспрессироваться в прокариотических клетках, таких как бактериальные клетки; или в эукариотических клетках, таких как клетки грибов (таких как дрожжи), клетки растений, клетки насекомых и клетки млекопитающих. Такая экспрессия может проводиться, например, в соответствии с процедурами, известными в данной области техники. Типичные эукариотические клетки, которые можно использовать для экспрессии полипептидов, включают, но не ограничиваются ими, клетки COS, включая клетки COS 7; клетки 293, в том числе клетки 293-6E; клетки CHO, включая клетки CHO-S и DG44; клетки PER.C6® (Crucell); и клетки NSO. В некоторых вариантах осуществления тяжелые цепи и/или легкие цепи антител могут быть экспрессированы в дрожжах. См., например, публикацию США № US 2006/0270045 A1. В некоторых вариантах осуществления конкретную эукариотическую клетку-хозяина выбирают на основании ее способности выполнять желательные посттрансляционные модификации тяжелых цепей и/или легких цепей антитела. Например, в некоторых вариантах осуществления клетки СНО продуцируют полипептиды, которые имеют более высокий уровень сиалирования, чем тот же полипептид, продуцируемый в клетках 293.
[00135] Введение одной или нескольких нуклеиновых кислот в желаемую клетку-хозяина может быть осуществлено любым способом, включая, но не ограничиваясь ими, трансфекцию фосфатом кальция, трансфекцию, опосредованную DEAE-декстраном, трансфекцию, опосредованную катионными липидами, электропорацию, трансдукцию, инфекцию и т. д. Неограничивающие примеры способов описаны, например, в Sambrook et al., Molecular Cloning, A Laboratory Manual, 3rd ed. Cold Spring Harbor Laboratory Press (2001). Нуклеиновые кислоты могут быть временно или стабильно трансфицированы в желаемые клетки-хозяев в соответствии с любым подходящим способом.
[00136] В некоторых вариантах осуществления один или более полипептидов можно продуцировать in vivo у животного, которое было сконструировано или трансфицировано одной или несколькими молекулами нуклеиновой кислоты, кодирующими полипептиды, в соответствии с любым подходящим способом.
Очистка антител
[00137] Антитела могут быть очищены любым подходящим способом. Такие способы включают, но не ограничиваются ими, использование аффинных матриц или хроматографию с гидрофобным взаимодействием. Подходящие аффинные лиганды включают антиген и лиганды, которые связывают константные области антитела. Например, колонку с протеином А, колонку с протеином G, колонку с протеином A/G или колонку с иммобилизованными антителами можно использовать для связывания константной области и для очистки антитела. Хроматография с гидрофобным взаимодействием, например, бутильная или фенильная колонка, также может подходить для очистки некоторых полипептидов. В данной области техники известны многие способы очистки полипептидов.
Бесклеточная продукция антител
[00138] В некоторых вариантах осуществления антитело продуцируется в бесклеточной системе. Неограничивающие примеры бесклеточных систем описаны, например, в Sitaraman et al., Methods Mol. Biol. 498: 229-44 (2009); Spirin, Trends Biotechnol. 22: 538-45 (2004); Endo et al., Biotechnol. Adv. 21: 695-713 (2003).
Модифицированный FOLFOX6
[00139] Модифицированный режим химиотерапии FOLFOX6 (mFOLFOX6) включает режим, в котором комбинацию оксалиплатина (например, Элоксатина®), лейковорина (например, лейковорина кальция или фолиновой кислоты) и 5-фторурацила (5-ФУ) вводят внутривенно поочередно в течение приблизительно 2-суточного периода. Модифицированный FOLFOX6 использовали в качестве терапии первой линии для лечения распространенного рака желудка. Рандомизированное исследование фазы 3, в котором сравнивали mFOLFOX6 с 5FU/LV/цисплатином (FLP) при лечении 220 пациентов с раком желудка, показало статистически незначительное улучшение времени до прогрессирования; однако mFOLFOX6 ассоциировался со значительным снижением нежелательных явлений 3/4 степени, включая нейтропению, анемию и периферическую невропатию. (Al-Batran et al., J. Clin. Oncol. 26: 1435-42 (2008).) Последующие исследования подтвердили безопасность и эффективность mFOLFOX6 при распространенном раке желудка. (B. Keam, BMC Cancer, 8: 148 (2008).)
[00140] В некоторых вариантах осуществления комбинацию оксалиплатина (например, Элоксатина®), лейковорина (например, лейковорина кальция или фолиновой кислоты) и 5-фторурацила (5-ФУ) вводят при помощи внутривенной инфузии или внутривенной болюсной инъекции в течение приблизительно 2-8 часов, а затем проводят дополнительную инфузию 5-ФУ путем внутривенной инфузии в течение приблизительно 44-48 часов. В некоторых вариантах осуществления режим mFOLFOX6 включает: введение оксалиплатина на 1-ые сутки в дозе 50-100 мг/м2 в/в, например, в течение 2 часов, затем введение лейковорина на 1-ые сутки в дозе 100-400 мг/м2 в/в, например, в течение 2 часов, затем введение 5-ФУ в дозе 100-400 мг/м2 при помощи в/в болюсной инъекции или в/в инфузии, все на 1-ые сутки, с последующей дополнительной инфузией 5-ФУ в дозе 2000-2500 мг/м2 в течение 44-48 часов, например 46 часов. В некоторых вариантах осуществления режим mFOLFOX6 включает: введение оксалиплатина на 1-ые сутки в дозе 75-100 мг/м2 в/в, например, в течение 2 часов, затем введение лейковорина на 1-ые сутки в дозе 200-400 мг/м2 в/в, например, в течение 2 часов, затем введение 5-ФУ в дозе 200-400 мг/м2 при помощи в/в болюсной инъекции или в/в инфузии, все на 1-ые сутки, с последующей дополнительной инфузией 5-ФУ в дозе 2200-2400 мг/м2 в течение 44-48 часов, например 46 часов. В некоторых вариантах осуществления режим mFOLFOX6 включает: введение оксалиплатина на 1-ые сутки в дозе 75-90 мг/м2 в/в, например, в течение 2 часов, затем введение лейковорина на 1-ые сутки в дозе 300-400 мг/м2 в/в, например, в течение 2 часов, затем введение 5-ФУ в дозе 300-400 мг/м2 при помощи в/в болюсной инъекции или в/в инфузии, все на 1-ые сутки, с последующей дополнительной инфузией 5-ФУ в дозе 2200-2400 мг/м2 в течение 44-48 часов, например 46 часов.
[00141] В некоторых вариантах осуществления режим mFOLFOX6 включает: введение оксалиплатина на 1-ые сутки в дозе 85 мг/м2 в/в, например, в течение 2 часов, затем введение лейковорина на 1-ые сутки в дозе 400 мг/м2 в/в, например, в течение 2 часов, затем введение 5-ФУ в дозе 400 мг/м2 при помощи в/в болюсной инъекции или в/в инфузии, все на 1-ые сутки, с последующей дополнительной инфузией 5-ФУ в дозе 2400 мг/м2 в течение 44-48 часов, например 46 часов. Например, начальная доза для mFOLFOX6 в качестве терапии первой линии при лечении рака желудка может включать 85 мг/м2 оксалиплатина, 350 мг фолината кальция (фолиновой кислоты), дозы фторурацила 400 мг/м2 с последующей инфузией дозы фторурацила 2400 мг/м2 в течение 46 часов.
[00142] В некоторых вариантах осуществления режим mFOLFOX6 могут вводить один раз в 10-21 сутки, например, один раз в 10-15 суток, один раз в10 суток, один раз в 11 суток, один раз в 12 суток, один раз в 13 суток, один раз в 14 суток, один раз в 15 суток, один раз в 16 суток, один раз в 17 суток, один раз в 18 суток, один раз в 19 суток, один раз в 20 суток или один раз в 21 сутки.
[00143] В некоторых вариантах осуществления mFOLFOX6 может вводиться один раз в «2 недели», что в контексте общего режима дозирования, приведенного в настоящем документе, означает один раз в 14 суток плюс или минус 3 суток или один раз каждые 11-17 суток.
Терапевтические композиции и способы.
Способы лечения рака
[00144] В некоторых вариантах осуществления предлагаются способы лечения рака, включающие введение эффективного количества антитела к FGFR2, такого как антитело к FGFR2-IIIb, как описано здесь, в сочетании с модифицированным режимом химиотерапии FOLFOX6 (mFOLFOX6). В некоторых вариантах осуществления рак представляет собой рак желудочно-кишечного тракта (ЖКТ), такой как рак желудка, колоректальный рак и аденокарцинома поджелудочной железы. В некоторых вариантах осуществления рак представляет собой неоперабельный, локально-распространенный или метастатический рак желудка.
[00145] В некоторых вариантах осуществления способов антитело к FGFR2-IIIb вводят в дозе 6-15 мг/кг, 10-15 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг, 10 мг/кг, 11 мг/кг, 12 мг/кг, 13 мг/кг, 14 мг/кг или 15 мг/кг. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят один раз в 7-21 сутки, один раз в 7-15 суток, один раз в 7-10 суток, один раз в 10-14 суток, один раз в 11-17 суток, один раз в 12-16 суток, один раз в 13-15 суток, один раз в 7 суток, один раз в 8 суток, один раз в 9 суток, один раз в 10 суток, один раз в 11 суток, один раз в 12 суток, один раз в 13 суток, один раз в 14 суток, один раз в 15 суток, один раз в 16 суток, один раз в 17 суток, один раз в 18 суток, один раз в 19 суток, один раз в 20 суток или один раз в 21 сутки. В некоторых вариантах осуществления антитело к FGFR2-IIIb может вводиться один раз в 2 недели, то есть один раз в 14 суток плюс или минус 3 суток или один раз в 11-17 суток.
[00146] В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 6-15 мг/кг каждые 2 недели. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 6-15 мг/кг каждые 13-15 суток. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 6-15 мг/кг каждые 14 суток. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 6, 10 или 15 мг/кг каждые 2 недели. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 6, 10 или 15 мг/кг каждые 13-15 суток. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 6, 10 или 15 мг/кг каждые 14 суток.
[00147] В некоторых вариантах осуществления используется режим дозирования, при котором две дозы вводят с интервалом в 2 недели, а промежуточную бустерную дозу вводят в промежутке времени между этими двумя дозами, причем промежуточная бустерная доза ниже, чем указанные две дозы. Дозирование в таком режиме может помочь поддерживать антитело в кровотоке в разумной или относительно устойчивой концентрации в течение продолжительного периода времени. Например, если концентрация антитела в кровотоке после дозы падает до минимума приблизительно через неделю после введения, то более низкая бустерная доза в этот момент или близкий к нему с последующей регулярной дозой приблизительно через неделю после бустерной дозы, может помочь стабилизировать общую концентрацию антител в кровотоке в течение продолжительного периода времени и не допускать падения концентрации между дозами.
[00148] Соответственно, в некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 6-15 мг/кг каждые 2 недели, а промежуточную бустерную дозу, которая является более низкой дозой, чем доза 6-15 мг/кг, вводят через 1 неделю (то есть 7 плюс или минус 2 суток или 5-9 суток) после первой из двух доз 6-15 мг/кг и за 1 неделю (то есть 5-9 суток) до введения второй из двух доз 6-15 мг/кг. В некоторых таких вариантах осуществления бустерная доза составляет 3-8 мг/кг. В некоторых вариантах осуществления бустерная доза составляет половину непосредственно предшествующей дозы и последующей дозы. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 6-15 мг/кг каждые 2 недели, а промежуточную бустерную дозу 3-8 мг/кг вводят через 6-8 суток после первой из двух доз 6-15 мг/кг и за 6-8 суток до введения второй из двух доз 6-15 мг/кг. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 10-15 мг/кг каждые 2 недели, а промежуточную бустерную дозу 5-8 мг/кг вводят через 6-8 суток после первой из двух доз 10-15 мг/кг и за 6-8 суток до введения второй из двух доз 10-15 мг/кг. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 15 мг/кг каждые 2 недели, а промежуточную бустерную дозу 7-8 мг/кг вводят через 6-8 суток после первых двух доз 15 мг/кг и за 6-8 суток до введения второй из двух доз 15 мг/кг. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 15 мг/кг каждые 13-15 суток, а промежуточную бустерную дозу 7-8 мг/кг вводят через 6-8 суток после первой из двух доз 15 мг/кг и за 6-8 суток до введения второй из двух доз 15 мг/кг. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 15 мг/кг каждые 14 суток, а промежуточную бустерную дозу 7-8 мг/кг вводят через 6-8 суток после первой из двух доз 15 мг/кг и за 6-8 суток до введения второй из двух доз 15 мг/кг. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 15 мг/кг каждые 14 суток, а промежуточную бустерную дозу 7-8 мг/кг вводят через 7 суток после первой из двух доз 15 мг/кг и за 7 суток до введения второй из двух доз 15 мг/кг. В некоторых из приведенных выше вариантов осуществления бустерная доза вводится только один раз, например, только между первым и вторым введениями доз антитела пациенту. В других вариантах осуществления ее вводят только два раза, например между первым и вторым и вторым и третьим введениями дозы антитела.
[00149] В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в режиме дозирования 15 мг/кг каждые 14 суток, а промежуточную бустерную дозу 7,5 мг/кг вводят через 7 суток после первой из двух доз 15 мг/кг и за 7 суток до введения второй из двух доз 15 мг/кг. В некоторых вариантах осуществления антитело к FGFR2-IIIb вводят в дозе 15 мг/кг один раз в 14 суток, начиная с 1-ых и через 7 суток после первого введения антитела к FGFR2-IIIb (т. е. на 8-ые сутки), антитело к FGFR2-IIIb вводят в бустерной дозе 7,5 мг/кг. В некоторых таких вариантах осуществления бустерную дозу 7,5 мг/кг вводят только один раз, например, только между первым и вторым введениями антитела в дозе 15 мг/кг.
[00150] Антитело к FGFR2-IIIb и mFOLFOX6 можно вводить одновременно, например, в одни и те же сутки, например, с введением антитела при помощи внутривенной инфузии до начала режима mFOLFOX6, или их можно вводить последовательно, например, в разные сутки. В некоторых вариантах осуществления mFOLFOX6 вводят, по меньшей мере, один или, по меньшей мере, два раза до начала лечения антителом к FGFR2-IIIb. В некоторых вариантах осуществления как антитело, так и режим mFOLFOX6 вводят один раз в 7-21 сутки, один раз в 7-15 суток, один раз в 7-10 суток, один раз в 10-14 суток, один раз в 11-17 суток, один раз в 12-16 суток, один раз в 13-15 суток, один раз в 7 суток, один раз в 8 суток, один раз в 9 суток, один раз в 10 суток, один раз в 11 суток, один раз в 12 суток, один раз в 13 суток, один раз в 14 суток, один раз в 15 суток, один раз в 16 суток, один раз в 17 суток, один раз в 18 суток, один раз в 19 суток, один раз в 20 суток или один раз в 21 сутки. В некоторых вариантах осуществления антитело к FGFR2-IIIb и режим mFOLFOX6 могут вводить один раз в 2 недели, то есть один раз в 14 суток плюс или минус 3 суток или один раз в 11-17 суток.
[00151] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит вариабельные области тяжелой цепи и легкой цепи, причем вариабельная область тяжелой цепи содержит:
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6;
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8;
а вариабельная область легкой цепи содержит:
(iv) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9;
(v) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и
(vi) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11;
и антитело к FGFR2-IIIb вводят внутривенно в дозе 10-15 мг/кг с последующим введением mFOLFOX6, включающим введение 85 мг/м2 оксалиплатина, 400 мг/м2 лейковорина и 400 мг/м2 5-фторурацила (5-ФУ) путем внутривенной инфузии или внутривенной болюсной инъекции с последующим введением 2400 мг/м2 5-ФУ путем внутривенной инфузии в течение 44-48 часов; и антитело к FGFR2-IIIb и mFOLFOX6 вводят каждые 2 недели.
[00152] В некоторых вариантах осуществления у субъекта имеется рак желудка, содержащий амплификацию гена FGFR2, тогда как в некоторых вариантах осуществления рак не содержит амплификацию FGFR2. В некоторых вариантах осуществления флуоресцентную гибридизацию in situ (FISH) используют для оценки амплификации гена, например, с зондами к локусу гена FGFR2 и центромере хромосомы 10. В некоторых вариантах осуществления, где происходит амплификация, амплификация FGFR2 включает соотношение FGFR2:CEN10 (центромера хромосомы 10) > 3. В некоторых вариантах осуществления амплификация FGFR2 включает соотношение FGFR2: CEN10 ≥2. Однако в других вариантах осуществления уровень FGFR2 включает соотношение FGFR2:CEN10 от 1 до 2, что указывает на то, что FGFR2 не амплифицирован.
[00153] В некоторых вариантах осуществления у субъекта имеется рак желудка со сверхэкспрессией FGFR2 или со сверхэкспрессией FGFR2-IIIb. В некоторых вариантах осуществления рак сверхэкспрессирует в большей степени FGFR2-IIIb, чем FGFR2-IIIc. В некоторых вариантах осуществления рак не включает амплификацию гена, однако FGFR2-IIIb сверхэкспрессируется, тогда как в других вариантах осуществления рак включает как амплификацию гена FGFR2, так и сверхэкспрессию FGFR2-IIIb. В некоторых вариантах осуществления рак, включающий амплификацию FGFR2, экспрессирует FGFR2-IIIb на нормализованном уровне, который более чем в 2, 3, 5 или 10 раз превышает нормализованный уровень экспрессии FGFR2-IIIc. В некоторых вариантах осуществления уровни экспрессии нормализованы относительно GUSB. В некоторых вариантах осуществления сверхэкспрессия представляет собой сверхэкспрессию мРНК. В некоторых вариантах осуществления сверхэкспрессия представляет собой сверхэкспрессию белка. В некоторых вариантах осуществления точечная мутация или транслокация может вызывать сверхэкспрессию FGFR2.
[00154] В некоторых вариантах осуществления сверхэкспрессия FGFR2 или FGFR2-IIIb определяется иммуногистохимией (ИГХ). Например, сверхэкспрессия может быть определена по сигналу ИГХ 1+, 2+ или 3+ по меньшей мере в 10% опухолевых клеток, например, в по меньшей мере 20%, 30%, 40% или 50% опухолевых клеток. Например, в некоторых таких вариантах осуществления пациенты, подлежащие лечению, могут иметь, например, сигнал ИГХ для FGFR2-IIIb 2+ или 3+ по меньшей мере в 10% опухолевых клеток (например, в клеточных мембранах). В некоторых вариантах осуществления пациент может иметь сигнал 3+ по меньшей мере в 10% опухолевых клеток. В некоторых вариантах осуществления пациент может иметь по меньшей мере сигнал 1+ по меньшей мере в 10% опухолевых клеток.
[00155] В некоторых вариантах осуществления на сверхэкспрессию FGFR2 или FGFR2-IIIb может указывать «показатель H». Чтобы определить показатель H, можно определить первую интенсивность окрашивания мембраны для клеток в фиксированном поле, например, через ИГХ, чтобы получить показатели 0, 1+, 2+ или 3+, а показатель H можно рассчитать, используя представленную ниже формулу: 1x (% клеток, визуализированных с интенсивностью ИГХ 1+) + 2x (% клеток, визуализированных с интенсивностью ИГХ 2+) + 3x (% клеток, визуализированных с интенсивностью ИГХ 3+). Теоретически, показатель H может варьироваться от 0 до 300 и быть равным 300, если все клетки в поле зрения имеют окрашивание ИГХ 3+. В некоторых вариантах осуществления пациент, подлежащий лечению, имеет начальный показатель H для FGFR2, такого как FGFR2-IIIb, > 20, такой как > 30, > 40, > 50 или > 100, или в диапазоне 20-300, 20-100, 20-50, 20-40 или 20-30. В некоторых вариантах осуществления пациент имеет показатель H > 10 или он находится в диапазоне 10-20 или 15-20. В других вариантах осуществления пациент имеет показатель Н 0-10, что может указывать на недостаточную сверхэкспрессию.
[00156] В некоторых вариантах осуществления уже было установлено, что рак, например, рак желудка сверхэкспрессирует FGFR2-IIIb и/или несет амплификацию гена FGFR2. В других вариантах осуществления способы, описанные в настоящем документе, оценивают либо экспрессию FGFR2IIIb, либо статус амплификации гена FGFR2, либо и то и другое перед лечением, например, для определения того, является ли оправданным лечение антителом к FGFR2-IIIb. В некоторых вариантах осуществления способы, описанные в настоящем документе, используются для лечения рака желудка, при котором, как было определено, (a) наблюдается сверхэкспрессия FGFR2-IIIb, на что указывает сигнал ИГХ 2+ или 3+ по меньшей мере в 10% опухолевых клеток и/или (b ) наблюдается амплификация гена FGFR2 в цоДНК. В некоторых вариантах осуществления способы, описанные в настоящем документе, используются для лечения рака желудка, при котором, как было определено, (a) наблюдается сверхэкспрессия FGFR2-IIIb, на что указывает сигнал ИГХ 3+ по меньшей мере в 10% опухолевых клеток и/или (b) наблюдается амплификация гена FGFR2 в цоДНК.
Пути введения, носители и дополнительные фармацевтические композиции
[00157] В различных вариантах осуществления антитела можно вводить in vivo различными путями, в том числе, но без ограничения этим, пероральным, внутриартериальным, парентеральным, интраназальным, внутривенным, внутримышечным, внутрисердечным, интравентрикулярным, внутритрахиальным, буккальным, ректальным, внутрибрюшинным, внутрикожным, местным, трансдермальным и интратекальным, или иным путем при помощи имплантации или ингаляции. Рассматриваемые антитела могут быть приготовлены в виде препаратов в твердой, полутвердой, жидкой или газообразной формах; в том числе, но без ограничения этим, таблеток, капсул, порошков, гранул, мазей, растворов, суппозиториев, клизм, инъекций, средств для ингаляции и аэрозолей. Молекула нуклеиновой кислоты, кодирующая антитело, может быть нанесена на микрочастицы золота и доставлена внутрикожно при помощи устройства для бомбардировки частицами или «генной пушки», как описано в литературе (см., например, Tang et al., Nature 356:152-154 (1992)). Соответствующий состав и путь введения могут быть выбраны в соответствии с предполагаемым применением.
[00158] В различных вариантах осуществления композиции, содержащие антитела, предоставлены в составах с широким рядом фармацевтически приемлемых носителей (см., например, Gennaro, Remington: The Science and Practice of Pharmacy with Facts and Comparisons: Drugfacts Plus, 20th ed. (2003); Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th ed., Lippencott Williams and Wilkins (2004); Kibbe et al., Handbook of Pharmaceutical Excipients, 3rd ed., Pharmaceutical Press (2000)). Доступны различные фармацевтически приемлемые носители, в том числе растворители, вспомогательные вещества и разбавители. Кроме того, также доступны различные фармацевтически приемлемые вспомогательные вещества, например, регулирующие рН и буферные средства, средства, регулирующие тоничность, стабилизаторы, смачивающие средства и тому подобные. Неограничивающие примеры носителей включают солевой раствор, забуференный солевой раствор, декстрозу, воду, глицерин, этанол и их комбинации.
[00159] Композиции, содержащие антитело к FGFR2, описанное в настоящем документе, и один или более химиотерапевтических агентов mFOLFOX 6, оксалиплатин, лейковорин и 5-ФУ, описанные в настоящем документе, также представлены в настоящем документе. В некоторых вариантах осуществления ингибитор FGFR2 и химиотерапевтические агенты содержатся, например, в отдельных контейнерах или в отдельных отсеках одного контейнера таким образом, что они не смешиваются друг с другом. В некоторых вариантах осуществления композиции содержат инструкции по применению, такие как инструкции по применению при лечении рака.
ПРИМЕРЫ
[00160] Примеры, обсуждаемые ниже, предназначены только для иллюстрации изобретения и не должны рассматриваться в качестве ограничения изобретения каким-либо образом. Примеры не подразумевают того, что эксперименты, приведенные ниже, представляют собой все или единственные проведенные эксперименты.
Пример 1. Рандомизированное, двойное слепое, плацебо-контролируемое исследование фазы 3 по изучению антитела к FGFR2-IIIb в сочетании с модифицированным FOLFOX6 у пациентов с ранее не леченным распространенным раком желудка или гастроэзофагеальным раком, которому предшествуют фаза 1 по подбору дозы и вводная фаза для оценки безопасности
Краткое изложение содержания протокола
[00161] Следующий протокол будет применяться в до 250 различных исследовательских центрах по всему миру. Исследование будет состоять из двух частей, часть 1: исследование фазы 1 по подбору дозы, вводная фаза для оценки безопасности и часть 2: исследование фазы 3.
[00162] Первичные цели части 1: (a) определить рекомендованную дозу (РД) антитела к FGFR2-IIIb в комбинации с фиксированной дозой инфузионного 5-фторурацила, лейковорина и оксалиплатина (mFOLFOX6) у пациентов с распространенным опухолями желудочно-кишечного тракта (ЖКТ) и (b) оценить профиль безопасности возрастающих доз антитела к FGFR2-IIIb при применении в комбинации с mFOLFOX6 у пациентов с опухолями ЖКТ. Вторичные цели части 1: (a) оценить безопасность и переносимость длительного воздействия антитела к FGFR2-IIIb при применении в комбинации с mFOLFOX6 у пациентов с опухолями ЖКТ, (b) охарактеризовать фармакокинетический (ФК) профиль антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 у пациентов с опухолями ЖКТ и (c) охарактеризовать иммуногенность антитела к FGFR2-IIIb. В рамках части 1 также будут охарактеризовывать фармакодинамический (ФД) профиль антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 посредством оценки поисковых биомаркеров в образцах крови и волосяных фолликулов, взятых у пациентов с опухолями ЖКТ.
[00163] Первична конечная точка для части I: частота возникновения нежелательных явлений (НЯ) 2-й степени или выше, связанных с антителом к FGFR2-IIIb, согласно оценке исследователя и отклонений от нормы в результатах клинико-лабораторных анализов, определяемых как дозолимитирующая токсичность (ДЛТ). Вторичные конечные точки для части 1: (a) частота возникновения НЯ, отклонений от нормы в результатах клинико-лабораторных анализов, результатах исследования роговицы и сетчатки, а также отклонений от нормы на электрокардиограмме (ЭКГ), (b) ФК параметры антитела к FGFR2-IIIb, такие как площадь под кривой зависимости концентрации препарата в сыворотке от времени (AUC), максимальная концентрация в сыворотке крови (Cmax), минимальная концентрация в сыворотке крови (Ctrough), клиренс (CL), конечный период полувыведения (t1/2), объем распределения и коэффициент накопления будут получены из профилей зависимости концентрации препарата в сыворотке от времени, когда это уместно и применимо, а также (c) иммунный ответ на антитела к FGFR2-IIIb по результатам анализа на иммуногенность. В этой части также могут исследовать биомаркеры в образцах крови и волосяных фолликулов.
[00164] Первичная цель части 2 - оценить клиническую пользу антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 посредством анализа выживаемости без прогрессирования (PFS - progression-free survival) у пациентов с FGFR2b-селективным раком желудка или гастроэзофагеальным раком (далее называемым раком желудка или РЖ). Вторичные цели: (a) оценить клиническую пользу антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 посредством анализа общей выживаемости (OS - overall survival) у пациентов с FGFR2b-селективным РЖ, (b) оценить безопасность и переносимость антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 у пациентов с FGFR2b-селективным РЖ, (c) охарактеризовать ФК профиль антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 у пациентов с FGFR2b-селективным РЖ, (d) охарактеризовать иммуногенность антитела к FGFR2-IIIb и (e) охарактеризовать ФД профиль антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 путем анализа инфильтрата иммунных клеток и других поисковых биомаркеров в биоптатах опухолей до и в ходе лечения. В исследовании также могут (a) оценить клиническую пользу антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 путем анализа PFS на основе оценки прогрессирования, проведенного ослепленным независимым наблюдательным комитетом (BIRC - Blinded Independent Review Committee), (b) оценить клиническую пользу антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 при помощи анализа частоты объективных ответов (ORR - objective response rate) у пациентов с FGFR2b-селективным РЖ, (c) оценить клиническую пользу антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 посредством анализа ORR на основании оценки прогрессирования, проведенной BIRC, (d) оценить клиническую пользу антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 путем анализа одногодичной OS у пациентов с FGFR2b-селективным раком ЖКТ, (e) оценить клиническую пользу антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 путем анализа продолжительности ответа (DOR - duration of response) у пациентов с FGFR2b-селективным РЖ, (f) исследовать связь между статусом FGFR2 (в анализе биопсии на основании опухолевой ткани и/или крови [цоДНК], (g) исследовать связь между статусом FGFR2 в опухолевой ткани и амплификацией FGFR2 с использованием анализа биопсии на основе крови (цоДНК), (h) охарактеризовать ФД профиль антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 посредством оценки поисковых биомаркеров в образцы крови пациентов с FGFR2b-селективным РЖ, а также (i) оценить результаты лечения по оценке пациента (PRO - patient reported outcome) и качество жизни (QOL - quality of life) у пациентов с FGFR2b-селективным РЖ, получающих антитело к FGFR2-IIIb в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6.
[00165] Конечные точки для части 2 включают первичную конечную точку PFS, определяемую как время от рандомизации до даты рентгенологического подтверждения прогрессирования заболевания на основе оценки исследователя (согласно RECIST v.1.1) или смерти от любой причины в зависимости от того, что наступит раньше, а также различные вторичные конечные точки. Вторичные конечные точки включают: (a) OS, определяемую как время от даты рандомизации до смерти от любой причины, (b) объективный ответ, основанный на оценке исследователем опухолевых поражений в соответствии с RECIST v1.1, (c) частоту возникновения НЯ, отклонения от нормы в результатах клинико-лабораторных анализов, результаты исследования роговицы и сетчатки, а также отклонения от нормы на электрокардиограмме (ЭКГ), (d) ФК параметры антитела к FGFR2-IIIb в РД при введении в комбинации с mFOLFOX6, такие как AUC, Cmax, Ctrough, CL, t1/2, объем распределения и коэффициент накопления будут получены из профилей зависимости концентрации препарата в сыворотке от времени, когда это уместно и применимо, (e) иммунный ответ по результатам анализа на иммуногенность, а также (f) уровни инфильтрата иммунных клеток и других поисковых биомаркеров в биоптатах опухолей до и в ходе лечения. Исследование также может оценить: (a) одногодичную OS, определяемую как доля пациентов, которые получают по меньшей мере одну дозу антитела к FGFR2-IIIb и живы один год спустя, (b) DOR,ограничиваемую пациентами с ответом, определенным исследователем согласно RECIST v1.1 и определенную как время первого ответа в соответствии с определением исследователя согласно RECIST v1.1 до прогрессирования или смерти в зависимости от того, что наступит раньше, (c) корреляцию между определенным статусом FGFR2 в анализе биопсии на основании опухолевой ткани и/или крови (цоДНК) и объективным ответом согласно RECIST v1.1, (d) корреляцию между определенным статусом FGFR2 в опухолевой ткани и амплификацией FGFR2 в анализе биопсии на основе крови (цоДНК), (e) поисковые биомаркеры на основе крови и (f) изменение от исходного уровня в качестве жизни, измеренном по EQ-5D-5L и EORTC QLQ-C30.
[00166] Дизайн исследования заключается в следующем. Исследование представляет собой многоцентровое исследование, состоящее из двух частей, для оценки безопасности, переносимости, ФК, ФД и эффективности антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6. Исследование будет включать в себя открытое исследование с повышением дозы в части 1, и рандомизированное, двойное слепое, плацебо-контролируемое исследование в части 2 у пациентов с FGFR2b+ раком желудка. Часть 1 состоит как минимум из 2 запланированных когорт дозирования антитела к FGFR2-IIIb в комбинации с mFOLFOX6 у подходящих пациентов с распространенными опухолями ЖКТ для определения РД антитела к FGFR2-IIIb, которое следует вводить в комбинации с mFOLFOX6. Часть 2 состоит из двух групп продления терапии (рандомизация 1:1) с целью оценки безопасности и эффективности антитела к FGFR2-IIIb в РД в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 у пациентов с FGFR2b-селективным распространенным РЖ (определенным при помощи проспективного иммуногистохимического (ИГХ) анализа экспрессии FGFR2b и/или анализа крови, демонстрирующего амплификацию FGFR2). Пациенты будут включены в часть 1 или часть 2 исследования, но не в обе. После начального периода скрининга до 14 суток (2 недели) пациенты будут получать лечение по схеме mFOLFOX6 (с антителом к FGFR2-IIIb или без него) каждые 2 недели в 14-суточных циклах. Пациенты, возможно, начали получать или получали химиотерапию по схеме mFOLFOX6 до включения в часть 1, но согласно критериям приемлемости пациент должен быть кандидатом на получение как минимум 2 дополнительных циклов химиотерапии по схеме mFOLFOX6 (не существует верхнего предела количества циклов лечения по схеме FOLFOX в части 1, которое пациенты могли получить или вовсе могли не получить). Каждого пациента, включенного в часть 1, будут наблюдать в течение 28 суток для оценки безопасности и возникновения дозолимитирующей токсичности (период ДЛТ). По завершении периода ДЛТ пациенты могут продолжить получать антитело к FGFR2-IIIb в комбинации с mFOLFOX6 по усмотрению исследователя. Дополнительные виды лечения могут назначаться каждые 2 недели в 14-суточные циклы до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. Не существует максимального количества доз антитела к FGFR2-IIIb. Продолжающееся применение схемы mFOLFOX6 после периода ДЛТ будет проводиться в соответствии с региональным стандартом лечения. В части 2 пациенты, у которых опухоль положительна в отношении FGFR2b по данным ИГХ (2+ или 3+) или анализа крови, завершили 2 цикла химиотерапии по схеме mFOLFOX6 в качестве стандартной терапии первой линии для лечения рака желудка на поздней стадии и подписали информированное согласие, будут рандомизированы в соотношении 1:1 для лечения антителом к FGFR2-IIIb в комбинации с mFOLFOX6 или плацебо и mFOLFOX6 каждые 2 недели в 14-суточных циклах в РД, выбранной после оценки данных, полученных в части 1. Включенные пациенты могут продолжить лечение каждые 2 недели в 14-суточных циклах до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. Все решения о лечении будут приниматься исследователем с использованием местных оценок. После прекращения исследуемого лечения по причинам, отличным от прогрессирования или отзыва согласия, оценки опухоли будут проводиться до тех пор, пока пациент не начнет проходить дополнительную противораковую терапию. Кроме того, пациенты как в части 1, так и в части 2 будут проходить длительный период последующего наблюдения на предмет выживания путем осуществления визитов в клинику или по телефону приблизительно каждые 3 месяца ± 28 суток после визита EOT, вплоть до 24 месяцев после включения последнего пациента в исследование, или до смерти, потери для последующего наблюдения, отзыва согласия или прекращения исследования спонсором (в зависимости от того, что наступит раньше).
[00167] Часть 1 - это открытое исследование с повышением дозы антитела к FGFR2-IIIb в комбинации с mFOLFOX6. Пациенты, соответствующие критериям участия в части 1, имеют неселективный рак ЖКТ (с или без опухолей, сверхэкспрессирующих FGFR2b) с неоперабельным, локально распространенным или метастатическим заболеванием и являются кандидатами на получение как антител к FGFR2-IIIb, так и химиотерапии по схеме mFOLFOX6. Статус FGFR2 будет определяться ретроспективно при помощи ИГХ и анализа биопсии на основе крови (цоДНК). Пациенты, включенные в Часть 1, будут проходить лечение возрастающими дозами антител к FGFR2-IIIb в комбинации с режимом основной химиотерапии с фиксированной дозой по схеме mFOLFOX6 каждые 2 недели в течение 14-суточных циклов следующим образом:
[00168] Введение антител к FGFR2-IIIb: Антитела к FGFR2-IIIb вводят в/в каждые 2 недели на сутки 1 каждого цикла до введения химиотерапии по схеме mFOLFOX6. Антитела к FGFR2-IIIb будут вводить в виде внутривенной инфузии в течение приблизительно 30 минут через периферическую вену или центральный венозный катетер с встроенным фильтром.
[00169] Режим основной химиотерапии: Введение химиотерапии по схеме mFOLFOX6 начинается на сутки 1 каждого цикла лечения и после введения антител к FGFR2-IIIb (после 30-минутного отдыха). Схему mFOLFOX6 вводят каждые 2 недели следующим образом: в/в инфузия оксалиплатина 85 мг/м2 в течение 120 минут, в/в инфузия лейковорина 400 мг/м2 в течение 120 минут с последующим в/в болюсным введением фторурацила (5 ФУ) 400 мг/м2 с последующим введением 5-ФУ 2400 мг/м2 в виде непрерывной внутривенной инфузии течение 46 часов. При введении оксалиплатина предварительная гидратация не требуется. Премедикация противорвотными средствами, такими как антагонисты серотонина с дексаметазоном или без него может использоваться при наличии клинических показаний по усмотрению исследователя в соответствии с местным стандартом лечения. Уровни доз (часть 1) В части 1 предусмотрены две когорты дозирования антител к FGFR2-IIIb по стандартной схеме повышения дозы 3+3, при этом в каждую когорту включается минимум 3 пациента. Ожидаемые уровни доз: Уровень дозы 1: 10 мг/кг антител к FGFR2-IIIb, уровень дозы 2: 15 мг/кг антител к FGFR2-IIIb, уровень дозы -1: 6 мг/кг антител к FGFR2-IIIb (только если требуется снижение дозы от уровня дозы 1).
[00170] Все решения о повышении дозы будут основаны на оценке ДЛТ, общей безопасности и переносимости, и будут приниматься после завершения последним пациентом, включенный в каждую когорту, 28-суточного периода ДЛТ (завершение 2 циклов лечения). Решения о повышении дозы будут согласованы Наблюдательным комитетом по оценке когорт (CRC - Cohort Review Committee), в состав которого входят спонсор и исследователи. Анализ безопасности и ФК параметров может помочь в принятии решений о добавлении когорт с альтернативными уровнями дозы для достижения оптимального целевого воздействия. Набор пациентов в группу с уровнем дозы -1 будет проводиться только в том случае, если на уровне дозы 1 наблюдается ≥ 2 ДЛТ. ДЛТ определены ниже.
[00171] Решения о повышении дозы будут основаны на следующем алгоритме: если ни один из 3 пациентов в когорте не имеет ДЛТ, может быть открыта следующая когорта; если у 1/3 пациентов в когорте наблюдается ДЛТ, включите еще 3 пациента в ту же когорту; если у 2/3 или 3/3 пациентов в когорте наблюдается ДЛТ, прекратите набор и введите еще 3 пациентов в когорту ниже (т.е. с более низким уровнем дозы), если в предыдущей когорте было только 3, если у 1/6 пациентов в когорте наблюдается ДЛТ, откройте следующую когорту и, если у 2/6 или более пациентов наблюдается ДЛТ, прекратите набор и введите еще 3 пациентов в когорту с более низким уровнем дозы, если только 3 пациента были включены в эту когорту.
[00172] РД антител к FGFR2-IIIb для части 2 будет определена CRC на основе оценки общей безопасности, переносимости и ФК. Следовательно, РД может совпадать или не совпадать с определенной максимально переносимой дозой (MTD - maximum tolerated dose). Например, если MTD не достигнута или если данные из последующих циклов лечения из части 1 дают дополнительное представление о профиле безопасности, тогда РД может быть другой, хотя и не более высокой, чем MTD. MTD определяется как максимальная доза, при которой <33% пациентов испытывают ДЛТ в течение периода ДЛТ. Если ДЛТ наблюдается у 1 из 3 пациентов с заданным уровнем дозы, тогда еще 3 пациента будут включены с тем же уровнем дозы. Повышение дозы может продолжаться до тех пор, пока у 2 из 3-6 пациентов, получающих лечение на уровне дозы, не возникнет ДЛТ (уровень дозы не должен превышать 15 мг/кг). Тогда следующая более низкая доза будет считаться MTD. После достижения MTD или РД будет добавлено до 6 дополнительных пациентов для дальнейшего изучения безопасности и ФК на этом уровне дозы. Таким образом, общий набор для части 1 будет составлять приблизительно от 9 до 12 пациентов. Любой пациент, который не получает 2 дозы антител к FGFR2-IIIb в комбинации с mFOLFOX6 в течение периода ДЛТ, будет считаться не поддающимся оценке, и пациент будет заменен. Замененный пациент может продолжить участие в исследовании после обсуждения со спонсором. В течение 28-суточного периода ДЛТ следует вводить не более 2 доз антител к FGFR2-IIIb или 2 циклов mFOLFOX6. По завершении периода ДЛТ пациенты могут продолжать получать антитела к FGFR2-IIIb в комбинации с mFOLFOX6, вводимые каждые 2 недели в 14-суточных циклах до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. Критерии модификации дозы антител к FGFR2-IIIb и mFOLFOX6 описаны ниже. В случае прекращения применения химиотерапии по схеме mFOLFOX6 по любой причине до прогрессирования заболевания (например, кумулятивная токсичность или завершение химиотерапии по схеме mFOLFOX6 в соответствии с региональной практикой), введение антител к FGFR2-IIIb можно продолжать в виде монотерапии и вводить каждые 2 недели до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. В случае, если проведение цикла по схеме mFOLFOX6 откладывается более чем на 14 суток по причине токсичности, связанной с химиотерапией, введение антител к FGFR2-IIIb не следует откладывать и их можно продолжать вводить каждые 2 недели. Начало нового цикла по схеме mFOLFOX6 после отсрочки дозирования должно быть синхронизировано с проведением инфузии антител к FGFR2-IIIb, если это возможно (но не является требованием исследования).
[00173] В случае отмены антитела к FGFR2-IIIb по любой причине до прогрессирования заболевания (например, кумулятивная токсичность) химиотерапия по схеме mFOLFOX6 может по-прежнему применяться в соответствии с местной региональной практикой или до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения.
[00174] Пациенты будут включены в часть 2 с целью охарактеризовать безопасность и эффективность антитела к FGFR2-IIIb в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 в популяции пациентов с FGFR2b-селективным раком желудка. Набор в часть 2 начнется только после определения CRC в части 1 РД для антитела к FGFR2-IIIb, которая не будет превышать 15 мг/кг. Часть 2 является двойной слепой и будет состоять в общей сложности из приблизительно 360 пациентов с FGFR2b-селективным раком желудка, рандомизированных в соотношении 1:1 для получения лечения в одной из двух групп: группа 1: антитела к FGFR2-IIIb в РД и mFOLFOX6 с введением каждые 2 недели, или группа 2: плацебо и mFOLFOX6 с введением каждые 2 недели. Открытие части 2 для набора будет проводиться на усмотрение спонсора. Пациенты с раком желудка с неоперабельным, локально распространенным или метастатическим заболеванием, которые соответствуют критериям проведения химиотерапии первой линии по схеме mFOLFOX6 и получили 2 цикла mFOLFOX6, будут включены в часть 2 исследования. Пациенты будут отобраны для включения на основе сверхэкспрессии FGFR2b и/или амплификации FGFR2, как определено при помощи валидированной ИГХ или анализа биопсии на основе крови (цоДНК), соответственно. Пациенты, которые не демонстрируют сверхэкспрессию FGFR2b по данным ИГХ или амплификацию по данным анализа биопсии на основе крови (цоДНК), не будут иметь права на включение; однако положительного результата на основе одного или обоих анализов достаточно для удовлетворения требований приемлемости (например, положительный по результатам биопсии на основе крови [цоДНК], но отрицательный по ИГХ). Включенные пациенты могут продолжить лечение каждые 2 недели в 14-суточных циклах до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. Все решения о лечении будут приниматься исследователем с использованием местных оценок.
[00175] Критерии включения следующие. Пациенты, зачисляемые либо в часть 1, либо в часть 2 исследования, должны быть старше 18 лет; иметь неоперабельное, локально распространенное или метастатическое заболевание; показатель общего состояния в соответствии с Восточной кооперативной онкологической группой (ECOG) от 0 до 1; должны предоставить опухолевую ткань для определения статуса FGFR2; предоставить информированное согласие; и удовлетворять всем другим критериям приемлемости, описанным ниже. Пациенты, зачисляемые в часть 1 (вводная фаза для оценки безопасности при повышении дозы) исследования, также должны соответствовать следующим критериям включения: Гистологически или цитологически подтвержденное злокачественное новообразование желудочно-кишечного тракта, для которого схема mFOLFOX6 считается подходящим лечением (например, рак желудка, колоректальный рак, аденокарцинома поджелудочной железы). Не более 2 предыдущих схем химиотерапии для лечения метастатического заболевания (не включая предшествующую адъювантную химиотерапию с применением 5-ФУ и/или оксалиплатином). Пациент должен быть кандидатом как минимум на 2 цикла химиотерапии по схеме mFOLFOX6.
[00176] Пациенты, зачисляемые в часть 2 (фаза продления терапии максимально переносимой дозой) исследования, также должны соответствовать следующим критериям включения: Гистологически подтвержденная аденокарцинома желудка или гастроэзофагеального перехода. Сверхэкспрессия FGFR2b по определению ИГХ и/или амплификация FGFR2 по определению анализа на основе биопсии крови (цоДНК). Предварительная химиотерапия для лечения метастатического или неоперабельного заболевания (за исключением случаев, указанных в критериях включения № 20 для схемы mFOLFOX6) не проводилась. Предварительная химиотерапия на основе платины (за исключением случаев, отмеченных в критериях включения № 20 для схемы mFOLFOX6) не проводилась. Если проводилась предварительная адъювантная или неоадъювантная терапия (химиотерапия и/или химиолучевая терапия), между окончанием адъювантной терапии и набором должно пройти более 6 месяцев.
[00177] Пациент должен быть кандидатом на химиотерапию по схеме mFOLFOX6 и пройти 2 цикла химиотерапии по схеме mFOLFOX6 до включения в исследование (но не превышать 2 цикла). Пациенты, зачисленные в часть 1 или часть 2, будут исключены, если у них имеются нелеченные или симптоматические метастазы в центральную нервную систему (ЦНС); нарушение функции сердца или клинически значимое заболевание сердца; повышенный интервал QTcF; периферическая сенсорная невропатия 2-й степени или выше в соответствии со Стандартными терминологическими критериями нежелательных явлений (CTCAE - Common Terminology Criteria for Adverse Events); положительный статус по HER2; или другое состояние, которое может увеличить риск, связанный с участием в исследовании. Отказ от этих критериев включения или исключения не будет предоставлен.
[00178] В части 1 антитела к FGFR2-IIIb будут поставляться в стерильном флаконе для разведения в пакете для внутривенного введения в исследовательском центре в течение приблизительно 30 минут каждые 14 суток (+/- 3 суток) до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователем, неприемлемой токсичности или другой причины исключения из исследования, указанной в протоколе.
[00179] В части 2 замаскированный ИП (антитела к FGFR2-IIIb/плацебо) будет поставляться и вводиться аналогично незамаскированным антителам к FGFR2-IIIb в части 1.
[00180] Оксалиплатин, 5-ФУ и лейковорин будут поставляться в каждый исследовательский центр в соответствии с установленной практикой учреждения. Схема mFOLFOX6 будет вводиться каждые 14 суток (± 3 суток) до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователем, неприемлемой токсичности или другой причины исключения из исследования, указанной в протоколе. Информацию по приготовлению и полную информации о назначениях смотрите в самой последней региональной инструкции по применению.
[00181] Образцы крови будут собраны для оценки ФК параметров антитела к FGFR2-IIIb, таких как AUC, Cmax, Ctrough, CL, t1/2, объем распределения и коэффициент накопления. В части 1 образцы крови будут собраны в моменты времени, описанные ниже, для измерения сывороточных уровней антител к FGFR2-IIIb у всех зарегистрированных пациентов. Во второй части будут собраны образцы крови первых 60 пациентов, рандомизированных в часть 2 в моменты времени, указанные ниже. Для части 1 и части 2 образцы крови для определения уровней антител к FGFR2-IIIb будут собраны в указанные моменты времени.
[00182] Оценка ответа опухоли будет проводиться как исследователем, так и посредством заслепленной центральной радиологической экспертизы в соответствии с рекомендациями RECIST v.1.1. Полная информация о независимом рассмотрении BIRC будет указана в Хартии независимой экспертизы результатов визуализационных исследований.
[00183] Показатели эффективности будут включать оценки опухолей, состоящие из клинического обследования и исследованиями соответствующими методами визуализации, предпочтительно компьютерной томографии (КТ) органов грудной клетки, брюшной полости и таза с соответствующей толщиной среза в соответствии с рекомендациями RECIST; другие оценки (магнитно-резонансная томография [МРТ], рентгенография, позитронно-эмиссионная томография [ПЭТ] и ультразвуковое исследование) могут быть выполнены при необходимости. Оценки опухолей будут проводиться во время скрининга (в течение 2 недель после цикла 1, сутки 1 в части 1 и части 2), затем каждые 6 недель после первой дозы, в течение 24 недель, а затем приблизительно каждые 12 недель после этого. После того, как будет отмечен первоначальный полный ответ (CR - complete response) или частичный ответ (PR - partial response), подтверждающее сканирование должно быть выполнено через 4-6 недель.
[00184] Показатели безопасности будут включать НЯ, гематологию, биохимический анализ, анализ мочи, показатели жизненно важных функций, массу тела, применение сопутствующих лекарственных препаратов/процедур, показатель общего состояния в соответствии с ECOG, целевые физикальные обследования, ЭКГ и офтальмологические исследования. Независимый комитет по мониторингу данных (DMC - Data Monitoring Committee) будет регулярно оценивать данные исследования в отношении безопасности (НЯ и СНЯ) на протяжении всей фазы лечения в части 2.
[00185] В части 1: Опухолевая ткань, представленная для оценки статуса FGFR2, будет ретроспективно проанализирована на предмет сверхэкспрессии FGFR2b с использованием ИГХ. Образцы для анализа биопсии на основе крови (цоДНК) будут собраны до первой дозы исследуемого препарата (цикл 1 сутки 1) и проанализированы ретроспективно на предмет амплификации FGFR2. Образцы крови для анализа поисковых биомаркеров будут собраны до введения дозы на сутки 1 циклов 1 и 2, через 48 часов после введения доз цикла 1, сутки 1 и цикла 2, сутки 1 (сутки 3), до введения дозы в цикле 3, сутки 1 для пациентов, которые продолжат лечение после 28-суточного периода ДЛТ и во время визита EOT. Образцы волосяных фолликулов будут собраны до введения доз в цикле 1, сутки 1, цикле 3, сутки 1 и цикле 5, сутки 1, а также во время визита EOT у всех пациентов, у которых возможен отбор проб.
[00186] В части 2: Опухолевая ткань будет представлена для оценки статуса FGFR2 и будет проспективно проанализирована на предмет сверхэкспрессии FGFR2b с использованием ИГХ. Образцы крови для оценки цоДНК будут проанализированы проспективно на предмет амплификации FGFR2. Кроме того, анализы биопсии на основе крови (цоДНК) будут собирать в продольном направлении каждые 6 недель от первой дозы в течение 24 недель, а затем приблизительно каждые 12 недель после этого и анализировать ретроспективно на предмет амплификации FGFR2. Образец также будет собран во время визита EOT у всех пациентов части 2. Образец также будет собран во время визита EOT у всех пациентов части 2. Образцы крови для анализа поисковых биомаркеров будут собраны до введения дозы на сутки 1 циклов 1 и 2, через 48 часов после введения доз цикла 1, сутки 1 и цикла 2, сутки 1 (сутки 3), до введения дозы в цикле 3, сутки 1 и во время визита EOT.
[00187] Свежие биопсии опухоли, обязательные, насколько это осуществимо, будут выполнены перед лечением и во время лечения в течение 7 суток до цикла 3, сутки 1 (и не менее чем за 24 часа до введения дозы) у около 30 пациентов, рандомизированных в часть 2. Осуществимость в каждый момент времени будет оцениваться исследователем и должна включать рассмотрение вопроса безопасности пациента. Если исследователь считает, что выполнить биопсию невозможно, то это определение должно быть записано в исходных документах. Для пациентов, которым была выполнена биопсия за 12 недель до регистрации, этот образец может соответствовать требованию для новой биопсии перед лечением при условии наличия адекватного образца для анализа ФД (один парафиновый блок или приблизительно 10 микропрепаратов). Пациентам в части 2 может быть также проведена дополнительная биопсия во время лечения при задокументированном ответе опухоли и/или дополнительная биопсия после лечения при задокументированном прогрессировании опухоли после обсуждения со спонсором.
[00188] Общее число участников, запланированных для этого исследования, составляет приблизительно 372 пациента. В часть 1 будут включены до 12 пациентов, оцениваемые на предмет любой дозолимитирующей токсичности в соответствии со стандартной схемой 3+3. В части 2 эффективность и переносимость будут изучены путем включения приблизительно 360 пациентов с FGFR2b-селективным раком желудка, рандомизированных в соотношении 1:1 для получения антител к FGFR2-IIIb в комбинации с mFOLFOX6 или плацебо и mFOLFOX6. Соответствующие критериям пациенты будут стратифицированы в соответствии с географическим регионом (США и ЕС, Азия, остальной мир), предыдущим статусом лечения (de novo или адъювантное/неоадъювантное) и измеримым статусом заболевания (измеримым или неизмеримым).
[00189] В части 1 все анализы будут описательными и будут представлены по группам доз и в целом по мере необходимости. Описательная статистика будет включать количество наблюдений, среднее значение, стандартное отклонение, медиану, диапазон и интерквартильную широту для непрерывных переменных, а также число и процент для категориальных переменных; 95% доверительные интервалы будут представлены там, где это необходимо. В части 2 первичный анализ эффективности представляет собой сравнение PFS у пациентов, получавших лечение антителами к FGFR2-IIIb в комбинации с mFOLFOX6 или плацебо и mFOLFOX6. Первичная конечная точка, PFS, определяется как время от рандомизации до даты рентгенологического подтверждения прогрессирования заболевания на основе оценки исследователя (согласно RECIST v.1.1) или смерти от любой причины в зависимости от того, что наступит раньше. Вторичные конечные точки эффективности включают OS и ORR. Будет проведен промежуточный анализ и первичный анализ PFS, и оба будут основаны на явлениях. Только промежуточный тест PFS будет проводиться при промежуточном анализе после 48 явлений (50% от целевых 96 явлений PFS для первичного анализа PFS), наблюдаемых у зарегистрированных пациентов для исключения HR>0,806 для комбинации антител к FGFR2-IIIb и mFOLFOX6 по сравнению с плацебо и mFOLFOX6. По оценкам, промежуточный анализ будет проводиться приблизительно через 20 месяцев после включения 1-го пациента. Первичный анализ PFS будет проводиться после того как будет зафиксировано по меньшей мере 96 явлений PFS у первых 156 зарегистрированных пациентов, и будет выполняться с использованием популяции пациентов с назначенным лечением (ITT - intent-to-treat). Первичный анализ будет включать только случаи рентгенологически подтвержденного прогрессирования по определению исследователем согласно RECIST v.1.1, и случаи смерти. Первичный анализ PFS будет проводиться с использованием стратифицированного лог-рангового двухстороннего критерия с уровнем значимости 0,05. Факторы стратификации будут такими же, как и для стратификации графика рандомизации, как описано в интерактивной системе, позволяющей доступ путем телефонного звонка и через Интернет (IXRS). Если значение p для стратифицированного лог-рангового критерия является статистически значимым (<0,05, двусторонний) и HR <1, нулевая гипотеза отсутствия различий в PFS будет отвергнута, и будет сделано заключение о том, что PFS является статистически продленным в группе, получавшей антитела к FGFR2-IIIb в комбинации с mFOLFOX6, по сравнению с группой, получавшей плацебо и mFOLFOX6. Медиана PFS и соответствующий 95% доверительный интервал для каждой группы лечения будут оцениваться с использованием метода Каплана-Мейера. Отношение рисков (HR=λanti-FGFR2-IIIb+mFOLFOX6/λmFOLFOX6) будет оцениваться с использованием регрессионной модели Кокса с группой лечения в качестве единственного основного эффекта и стратификации с использованием тех же факторов стратификации, которые использовались для лог-рангового критерия. Также будет представлено нестратифицированное HR.
[00190] Анализ вторичных конечных точек, включая OS и ORR, будет проводиться, если первичная конечная точка, PFS, является статистически значимой, а формальные гипотезы OS и ORR будут проверяться иерархически на уровне 0,05. Сначала будет проверена OS, и если она будет значимой, то будет проверена ORR. Уровень ошибок типа I при тестировании первичных и вторичных конечных точек будет контролироваться при помощи этой процедуры тестирования с фиксированной последовательностью на уровне 0,05. Планируется промежуточный и окончательный анализ OS, если тест на PFS является статистически значимым. Промежуточный анализ OS будет проводиться во время первичного анализа PFS. В случае проведения анализа OS анализ OS в промежуточный период (т.е., когда наблюдалось по меньшей мере 96 явлений PFS) и в конце (т.е., когда наблюдалось 249 смертей) будет проводиться в популяции ITT. Проверка гипотез OS будет проводиться с использованием стратифицированного лог-рангового двухстороннего критерия с уровнем значимости 0,05. Групповой последовательный метод будет использоваться для распределения частоты ошибок типа I на основании граничных критериев О'Брайена-Флеминга и частоты ошибок типа II на основании семейства гамма-распределений с параметром -4 при промежуточном и окончательном анализе OS. Факторы стратификации будут такими же, как и для стратификации графика рандомизации, как описано в IXRS. Медиана OS и соответствующий 95% доверительный интервал для каждой группы лечения будут оцениваться с использованием метода Каплана-Мейера. HR будет оцениваться с использованием регрессионной модели Кокса с группой лечения в качестве единственного основного эффекта и стратификации с использованием тех же факторов стратификации, которые использовались для лог-рангового критерия. Также будет представлено нестратифицированное HR. ORR определяется как доля пациентов с частичным или полным ответом по определению исследователем согласно RECIST v.1.1. Первичный анализ ORR будет выполнен среди пациентов с измеримым на исходном уровне заболеванием. При анализе ORR пациенты, которые не имеют адекватных оценок опухоли после исходного уровня, будут учитываться как пациенты, у которых не наблюдается ответа. Формальная проверка гипотезы ORR будет проводиться с использованием стратифицированного критерия Кохрана-Мантеля-Хензеля. Факторы стратификации будут такими же, как и для стратификации графика рандомизации, как описано в IXRS.
[00191] Мощность и размер выборки: Данное исследование предназначено для обеспечения адекватной мощности для первичного анализа PFS. Исходя из медианного PFS (mPFS) для пациентов, получавших плацебо и mFOLFOX6 в течение 6 месяцев, приблизительно 156 пациентов (рандомизированных в соотношении 1:1) с целевым показателем 96 явлений PFS должны продемонстрировать отношение рисков (HR) 0,5 для mPFS с мощностью 90% (2-сторонний показатель α=0,05) для комбинации антител к FGFR2-IIIb и mFOLFOX6 по сравнению с плацебо и mFOLFOX6 через 24 месяца после включения и 6 месяцев последующего наблюдения. Предполагая экспоненциальное распределение PFS, это соответствует увеличению показателя mPFS с 6 до 12 месяцев. В текущем дизайне минимальным наблюдаемым эффектом, который привел бы к статистической значимости для PFS, является улучшение на 50% (HR=0,67) с 6 до 9 месяцев. Это исследование также рассчитано на первичный анализ OS. Исходя из медианной OS (mOS) для пациентов, получавших плацебо и mFOLFOX6 в течение 10 месяцев, регистрация в исследовании будет продолжаться до приблизительно 360 пациентов с целевым показателем 249 случаев смерти, чтобы продемонстрировать HR 0,7 для mOS с мощностью 80% при общем уровне ошибок типа I 0,05 для комбинации антител к FGFR2-IIIb и mFOLFOX6 по сравнению с плацебо и mFOLFOX6 через 36 месяцев после включения и 10 месяцев последующего наблюдения после регистрации последнего пациента. Предполагая экспоненциальное распределение OS, это соответствует увеличению на 43% медианной OS с 10 до 14,3 месяцев. В текущем дизайне минимальным наблюдаемым эффектом, который привел бы к статистической значимости для OS в итоговом анализе, является улучшение на 28% (HR=0,78) с 10 до 12,8 месяцев.
[00192] Анализ безопасности: Анализ безопасности будет включать всех пациентов, которые получают любой исследуемый препарат (антитела к FGFR2-IIIb и mFOLFOX6 или плацебо и mFOLFOX6) в течение всего периода исследования, и обеспечивают любую информацию о безопасности после лечения. Все НЯ будут закодированы с использованием Медицинского словаря терминологии для регуляторной деятельности (MedDRA). Исследователь будет классифицировать степень тяжести НЯ, используя CTCAE v 4.03. Нежелательное явление, возникшее в ходе лечения (НЯВЛ), определяется как любое явление с датой возникновения на дату или после даты введения первой дозы исследуемого препарата или как любое явление, присутствующее до лечения, которое ухудшается после лечения. В сводные таблицы будут включены только НЯВЛ с датой возникновения до даты введения последней дозы + 30 суток. Число и процент пациентов, у которых возникают НЯ, будут обобщены по классу системы органов, предпочтительному термину, причинно-следственной связи с исследуемым препаратом и степени тяжести для каждой группы лечения. Список пациентов будет предоставлен для тех пациентов, у которых наблюдаются СНЯ, включая смерть, или НЯ, связанные с досрочным прекращение участия в исследовании или прекращением приема исследуемого препарата. Данные клинико-лабораторных анализов будут обобщены по типу лабораторных исследований. Количество и процент пациентов, у которых обнаруживаются отклонения от нормы (то есть показатели выходят за пределы диапазонов нормальных значений) и/или клинически значимые отклонения после введения исследуемого препарата, будут представлены для каждого показателя клинико-лабораторных анализов. Для каждого показателя клинико-лабораторных анализов будет предоставлена описательная статистика для исходного уровня и всех последующих запланированных визитов после лечения. Также будут предоставлены изменения от исходного уровня до визитов после лечения. Описательная статистика показателей жизненно важных функций также будет предоставлена аналогичным образом. Кроме того, по группе лечения будет представлен сдвиг от исходного уровня по степени CTCAE (где это применимо) и по отметкам высокого/низкого уровня (в случаях, где степени CTCAE не определены). Никаких формальных сравнений конечных точек безопасности не планируется.
[00193] ФК анализ: ФК параметры будут оцениваться с использованием некомпартментного анализа, хотя при необходимости может быть использован компартментный анализ.
Подробное описание протокола
1. Введение
Антитела к FGFR2-IIIb, уровень техники
[00194] Роль пути рецептора фактора роста фибробластов (FGFR) при раке хорошо известна. FGF могут стимулировать трансформацию и пролиферацию опухолевых клеток, а также стимулировать ангиогенез. Существует 22 известных человеческих FGF с экспрессией отдельных FGF, обычно ограниченных определенными тканями, типами клеток и/или стадией развития. Передача сигналов FGF обеспечивается семейством трансмембранных рецепторов тирозинкиназы, кодируемых четырьмя различными генами, продуцирующими подтипы рецептора FGF, называемые FGFR1-4 (Turner and Grose 2010).
[00195] FGFR2 имеет два варианта сплайсинга, b и c. В целом, FGFR2b экспрессируется в тканях эпителиального происхождения (например, желудок, кожа) (Miki 1992). Основными лигандами, передающими сигналы через FGFR2b, являются FGF7, FGF10 и FGF22. Изменения в передаче сигналов в пути FGF/FGFR2 (например, сверхэкспрессия белка FGFR2b или амплификация гена FGFR2) были связаны с раком желудка, молочной железы и другими видами рака и, по-видимому, предвещают худший прогноз (Wu 2013, Turner and Grose 2010). Фактически, уже в 1990 году было отмечено, что подгруппы пациентов с раком желудка (~3-9%) и раком молочной железы (от 1 до 2%) имели амплификацию гена FGFR2, который располагается в хромосоме 10q26. При раке желудка амплификация FGFR2 приводит к высокому уровню экспрессии рецептора FGR2b на поверхности клеток.
FGFR2b-специфическое антитело
[00196] Антитело к FGFR2-IIIb представляет собой гуманизированное моноклональное антитело (изотип IgG1), специфическое к рецептору человеческого FGFR2b (идентификационный номер эталонной последовательности NCBI NP_001138385.1), которое блокирует связывание лиганда FGF с рецептором. Антитело к FGFR2-IIIb направлено против третьей Ig-области изоформы рецептора FGFR2b, области, которая альтернативно сплайсирована и регулирует специфичность лиганда. Данное антитело гликозилировано, но вырабатывается в клеточной линии яичника китайского хомячка (СНО - Chinese hamster ovary), в которой отсутствует ген FUT8 (α1,6фукозилтрансфераза) и, следовательно, отсутствует коровая фукоза в полисахаридной части антитела. Отсутствие коровой фукозы приводит к более высокой аффинности к Fc-рецептору FcγRIIIa по сравнению с фукозилированной молекулой и потенциально усиливает опосредованное иммунными клетками уничтожение опухолевых клеток (Shinkawa 2003). Таким образом, было получено антитело с использованием гликоинженерии для усиления антителозависимой клеточноопосредованной цитотоксичности (АЗКЦ) (Gemo 2014). Антитело к FGFR2-IIIb ингибирует стимулированное лигандом FGF фосфорилирование FGFR2b и пролиферацию клеток в клеточной культуре в FGFR2b со сверхэкспрессией клеточных линий рака желудка и молочной железы. Антитело к FGFR2-IIIb также ингибирует рост опухоли в ксенотрансплантатных моделях желудка и молочной железы со сверхэкспрессией FGFR2b. Таким образом, 3 потенциальных механизма действия антитела к FGFR2-IIIb включают блокирование связывания лиганда и нисходящую передачу сигналов, снижение экспрессии драйверного белка FGFR2b и усиление АЗКЦ.
[00197] Антитело к FGFR2-IIIb может вызывать полное и длительное ингибирование роста опухоли в ксенотрансплантатах рака желудка со сверхэкспрессией FGFR2b и амплификацией гена FGFR2 у мышей с иммунодефицитом, где FGFR2b считается драйвером роста опухоли (Gemo 2014). Кроме того, антитело к FGFR2-IIIb демонстрирует рекрутирование NK-клеток и сопутствующее ингибирование роста опухоли в сингенной опухолевой модели 4T1 с умеренной экспрессией FGFR2b. Эти данные свидетельствуют о том, что АЗКЦ может быть эффективным у пациентов без амплификации гена FGFR2 с умеренной сверхэкспрессией FGFR2b, и что активность АЗКЦ может являться основным фактором, обуславливающим механизм действия у этих пациентов.
[00198] Дополнительно, поскольку антитело к FGFR2-IIIb является специфическим для рецептора FGFR2b, оно не мешает передаче сигналов других FGF/FGFR, включая FGFR2c. В отличие от ингибиторов тирозинкиназы FGFR (ИТК), антитело к FGFR2-IIIb не ингибирует передачу сигналов FGF23. FGF23 является лигандом, задействованном в метаболизме кальция/фосфата. Таким образом, лечение антителами к FGFR2-IIIb, как ожидается, не вызовет значительную дозолимитирующую гиперфосфатемию, ассоциированную с ИТК FGFR (Andre 2013, Brown 2005, Dienstmann 2014, Sequist 2014).
mFOLFOX6
[00199] Инфузионные 5-фторурацил, лейковорин и оксалиплатин (mFOLFOX6) являются одобренным химиотерапевтическим средством и стандартом лечения для терапии первой линии метастатического рака желудка. 5-ФУ является основным химиотерапевтическим средством, используемым для лечения рака желудка во всем мире, и его часто комбинируют с другими видами терапии после того, как исследования показали улучшение клинических исходов по результатам применения комбинированной химиотерапии 5-ФУ (Keam 2008). Стандартный препарат Адруцил®, также известный как 5-фторурацил (5-ФУ), является широко используемым химиотерапевтическим средством, которое в настоящее время показано для лечения колоректального рака, рака молочной железы, рака желудка и рака поджелудочной железы.
Обоснование начальных доз антител к FGFR2-IIIb и mFOLFOX6
[00200] Начальная доза 10 мг/кг антител к FGFR2-IIIb, вводимая в виде внутривенной инфузии каждые 2 недели в 28суточных циклах, запланирована для части 1 этого исследования в рамках вводной фазы для оценки безопасности при повышении дозы.
[00201] В предыдущем клиническом исследовании Фазы I повышение дозы проводилось у пациентов с солидными опухолями (n=19) и пациентов с раком желудка (n=8). Во время повышения дозы не наблюдалось дозолимитирующей токсичности (ДЛТ) при любом уровне дозы, и поэтому не было идентифицировано максимальной переносимой дозы (MTD) антител к FGFR2-IIIb. Доза 15 мг/кг была выбрана в качестве расширенной дозы на основе доклинического моделирования целевых концентраций лекарственного препарата и наблюдаемой переносимости, а также доказательств наблюдаемой эффективности. Ожидается, что при дозировке 15 мг/кг каждые 2 недели для большинства пациентов будет достигнута минимальная концентрация антител к FGFR2-IIIb в равновесном состоянии (Ctrough ss) 60 мкг/мл, которая была получена из исследования эффективности на мышах с использованием OCUM2 FGFR2-амплифицированной ксенотрансплантатной модели рака желудка.
[00202] На основании опубликованных данных популяционных ФК анализов, не было обнаружено клинически значимых различий в ФК по расе для антителосодержащих терапевтических средств, включая бевацизумаб (Genentech Inc.), трастузумаб (Genentech Inc.), пертузумаб (Genentech Inc. 2016) и рамуцирумаб (Eli Lilly and Company). Важно отметить, что клинические данные, полученные из продолжающегося исследования антител к FGFR2-IIIb подтверждают, что доза 10 мг/кг является переносимой для людей. Антитело к FGFR2-IIIb также показало приемлемый профиль безопасности в первом исследовании на человеке с участием 53 пациентов, которых лечили в дозах до 15 мг/кг.
[00203] Начальная доза mFOLFOX6 включает 85 мг/м2 оксалиплатина, 350 мг фолината кальция (фолиновой кислоты), 400 мг/м2 фторурацила и 2400 мг/м2 фторурацила. Оксалиплатин и фолинат кальция вводят одновременно посредством внутривенной инфузии с использованием 3-ходового крана/Y-образного соединителя. Меньшая доза фторурацила вводится при помощи внутривенной болюсной инъекции, а большая доза фторурацила вводится посредством внутривенной инфузии в течение 46 часов. mFOLFOX6 вводится каждые 14 суток.
Обоснование для предварительного скрининга в части 2
[00204] Анти-FGFR2-IIIb представляет собой антитело, предназначенное для распознавания рецептора FGFR2b при экспрессии в опухолях желудка. Настоящая гипотеза заключается в том, что присутствие FGFR2b будет важным прогностическим фактором ответа пациентов с FGFR2b-селективным раком желудка или гастроэзофагеальным раком (в части 2). Это основано на данных доклинического наблюдения о том, что только опухоли, которые сверхэкспрессировали FGFR2b, отвечали на лечение антителами к FGFR2-IIIb в исследованиях ксенотрансплантатов), а также на ранних результатах продолжающегося первого исследования на людях, указывающего на более высокую степень активности антител к FGFR2-IIIb у FGFR2b-положительных пациентов.
[00205] Пациенты в части 2 будут отобраны для включения на основе сверхэкспрессии FGFR2b и/или амплификации FGFR2, как определено при помощи валидированной ИГХ (оценка 2+ или 3+) или анализа биопсии на основе крови, соответственно. Пациенты, которые не демонстрируют сверхэкспрессию FGFR2b по данным ИГХ или амплификацию по данным анализа биопсии на основе крови, не будут иметь права на включение; однако положительного результата на основе одного или обоих анализов достаточно для удовлетворения требований приемлемости (например, положительный по результатам биопсии на основе крови, но отрицательный по ИГХ).
[00206] В части 2 будут участвовать пациенты, ранее не проходившие химиотерапию для лечения метастатического или неоперабельного заболевания; если ранее была получена адъювантная или неоадъювантная терапия (химиотерапия и/или химиолучевая терапия), между окончанием адъювантной терапии и регистрацией должно пройти более 6 месяцев. Эти пациенты должны будут иметь неоперабельное, локально распространенное или метастатическое заболевание, и поэтому, как ожидается, начнут лечение (по схеме mFOLFOX6) вскоре после постановки диагноза.
[00207] Поскольку для получения результатов ИГХ может потребоваться до нескольких недель, пациенты, у которых отрицательный результат анализа крови, столкнутся с отсрочкой начала их химиотерапевтического лечения в ожидании подтверждения их соответствия критериям по результатам ИГХ. По этой причине все пациенты, участвующие в исследовании, должны были получить 2 цикла mFOLFOX6 на момент регистрации. Пациенты не могли получить более 2 циклов или менее 2 циклов, поскольку это может привести к дисбалансу в лечении среди участников исследования и потенциально может затруднить интерпретацию результатов исследования. Ожидается, что результаты ИГХ могут быть получены в течение времени, которое потребуется для применения первых 2 циклов mFOLFOX6. В течение этого периода времени пациенты еще не включены в исследование, поэтому схема mFOLFOX6 будет применяться в соответствии с местной практикой, и нежелательные явления не должны регистрироваться в качестве части исследования. Пациенты перед скринингом должны предоставить информированное согласие на проведение анализов крови и ИГХ. Если результаты ИГХ будут положительными, пациент завершит второй курс mFOLFOX6, войдет в период скрининга, и если удовлетворены все остальные критерии приемлемости, включая предоставление информированного согласия, будет включен в исследование. Если результаты ИГХ отрицательны, а биопсия на основе крови также была отрицательной, пациент не имеет права участвовать в исследовании.
Обоснование для биопсии опухоли и анализов крови
[00208] Пациенты в части 2 этого испытания должны иметь результаты исследования как ткани, так и крови; следовательно, пациент не соответствует критериям участия, если он не может предоставить как ткань, так и плазму крови. Пациенты, которые не демонстрируют сверхэкспрессию FGFR2b по данным ИГХ или амплификацию по данным анализа биопсии на основе крови, не будут иметь права на включение; однако положительного результата на основе одного или обоих анализов достаточно для удовлетворения требований приемлемости (например, положительный по результатам биопсии на основе крови, но отрицательный по ИГХ). Анализ крови покажет амплификацию ДНК FGFR2, в то время как ИГХ покажет степень экспрессии белка. Компания Five Prime разработала антитело к FGFR2b для неклинического применения, чувствительность и специфичность для выявления FGFR2b которого при помощи ИГХ были оптимизированы.
[00209] В исследованиях, оценивающих образцы рака желудка, амплификация FGFR2 была однозначно связана со значительной поверхностной экспрессией FGFR2b, выявленной по результатам ИГХ (Gemo 2014). Противоопухолевый эффект антитела к FGFR2-IIIb, который наблюдался при доклинических исследованиях, был основан на сверхэкспрессии FGFR2b в опухолевых клеточных линиях. Пациенты без сверхэкспрессии FGFR2b вряд ли ощутят значительную пользу от лечения антителами к FGFR2-IIIb и mFOLFOX6. Отбор пациентов с FGFR2b-положительными опухолями для лечения антителами к FGFR2-IIIb поддерживается данными продолжающегося первого исследования фазы 1 антител к FGFR2-IIIb на людях. Цели и конечные точки исследования
Часть 1: Первичные цели
[00210] Определить рекомендованную дозу (РД) антитела к FGFR2-IIIb при введении в комбинации с фиксированной дозой инфузионного 5-фторурацила, лейковорина и оксалиплатина (mFOLFOX6) у пациентов с распространенным опухолями желудочно-кишечного тракта (ЖКТ).
[00211] Оценить профиль безопасности возрастающих доз антител к FGFR2-IIIb при применении в комбинации с mFOLFOX6 у пациентов с опухолями ЖКТ.
Часть 1: Вторичные цели
[00212] Оценить безопасность и переносимость длительного воздействия антител к FGFR2-IIIb при применении в комбинации с mFOLFOX6 у пациентов с опухолями ЖКТ.
[00213] Охарактеризовать фармакокинетический (ФК) профиль антител к FGFR2-IIIb при применении в комбинации с mFOLFOX6 у пациентов с опухолями ЖКТ.
[00214] Охарактеризовать иммуногенность антител к FGFR2-IIIb.
Часть 1: Поисковые цели
[00215] Охарактеризовать фармакодинамический (ФД) профиль антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6, посредством оценки поисковых биомаркеров в образцах крови и волосяных фолликулов, взятых у пациентов с опухолями ЖКТ.
Часть 2: Первичные цели
[00216] Оценить клиническую пользу антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 посредством анализа выживаемости без прогрессирования (PFS) у пациентов FGFR2b-селективным раком желудка или раком желудка и гастроэзофагеальным раком (далее называемым раком желудка или раком ЖКТ).
Часть 2: Вторичные цели
[00217] Оценить клиническую пользу антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6, с помощью анализа общей выживаемости (OS) у пациентов с FGFR2b-селективным раком ЖКТ.
[00218] Оценить безопасность и переносимость антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 у пациентов с FGFR2b-селективным раком ЖКТ.
[00219] Охарактеризовать ФК профиль антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 у пациентов с FGFR2b-селективным РЖ.
[00220] Охарактеризовать иммуногенность антител к FGFR2-IIIb.
[00221] Охарактеризовать ФД профиль антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6, путем анализа инфильтрата иммунных клеток и других поисковых биомаркеров в биопсиях опухолей до и после лечения.
Часть 2: Поисковые цели
[00222] Оценить клиническую пользу антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6, путем анализа PFS на основе оценки прогрессирования, проведенного ослепленным независимым наблюдательным комитетом (BIRC).
[00223] Оценить клиническую пользу антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6, с помощью анализа частоты объективных ответов (ORR) у пациентов с FGFR2b-селективным раком ЖКТ.
[00224] Оценить клиническую пользу антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6, путем анализа ORR на основе оценки прогрессирования, проведенного BIRC.
[00225] Оценить клиническую пользу антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6, с помощью анализа одногодичной OS у пациентов с FGFR2b-селективным раком ЖКТ.
[00226] Оценить клиническую пользу антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6, с помощью анализа продолжительности ответа (DOR) у пациентов с FGFR2b-селективным раком ЖКТ.
[00227] Изучить связь между статусом FGFR2 (в опухолевой ткани и/или биопсии на основе крови) и клиническим исходом.
[00228] Изучить соответствие между статусом FGFR2 в опухолевой ткани и амплификацией FGFR2 с использованием биопсии на основе крови.
[00229] Охарактеризовать ФД профиль антител к FGFR2-IIIb при введении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 путем оценки поисковых биомаркеров в образцах крови пациентов с FGFR2b-селективным РЖ.
[00230] Оценить результаты лечения по оценке пациента (PRO) и качество жизни (QOL) у пациентов с FGFR2b-селективным РЖ, получающих антитело к FGFR2-IIIb в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6.
Часть 1: Первичные конечные точки исследования
[00231] частота возникновения нежелательных явлений (НЯ) 2 степени или выше (AEs), оцениваемых исследователем как связанные с антителом к FGFR2-IIIb, и отклонений от нормы в результатах клинико-лабораторных анализов, определяемых как дозолимитирующая токсичность (ДЛТ).
Часть 1: Вторичные конечные точки
[00232] Частота возникновения НЯ, отклонений от нормы в результатах клинико-лабораторных анализов, результатов исследования роговицы и сетчатки, а также отклонений от нормы на электрокардиограмме (ЭКГ).
[00233] ФК параметры антитела к FGFR2-IIIb, такие как площадь под кривой зависимости концентрации препарата в сыворотке от времени (AUC), максимальная концентрация в сыворотке крови (Cmax), минимальная концентрация в сыворотке крови (Ctrough), клиренс (CL), конечный период полувыведения (t1/2), объем распределения и коэффициент накопления, будут получены из профилей зависимости концентрации препарата в сыворотке от времени, когда это уместно и применимо.
[00234] Оценить иммунный ответ по результатам анализа на иммуногенность.
Часть 1: Поисковые конечные точки
[00235] Поисковые биомаркеры в образцах крови и волосяных фолликулов.
Часть 2: Первичные конечные точки
[00236] PFS, определяемая как время от рандомизации до даты рентгенологического подтверждения прогрессирования заболевания на основе оценки исследователя (согласно RECIST v.1.1) или смерти от любой причины в зависимости от того, что наступит раньше.
Часть 2: Вторичные конечные точки
[00237] OS, определяемая как время от даты рандомизации до смерти по любой причине.
[00238] Частота объективных ответов (ORR), основанная на оценке исследователем опухолевых поражений в соответствии с RECIST v1.1.
[00239] Частота возникновения НЯ, отклонений от нормы в результатах клинико-лабораторных анализов, результатов исследования роговицы и сетчатки, а также отклонений от нормы на электрокардиограмме (ЭКГ).
[00240] ФК параметры антитела к FGFR2-IIIb в РД при введении в комбинации с mFOLFOX6, такие как AUC, Cmax, Ctrough, CL, t1/2, объем распределения и коэффициент накопления, будут получены из профилей зависимости концентрации препарата в сыворотке от времени, когда это уместно и применимо.
[00241] Иммунный ответ по результатам анализа на иммуногенность.
[00242] Уровни инфильтрата иммунных клеток и других поисковых биомаркеров в образцах биопсии опухоли до и после лечения.
Часть 2: Поисковые конечные точки
[00243] Одногодичная OS, определяемая как доля пациентов, которые получают по меньшей мере одну дозу антитела к FGFR2-IIIb и живы один год спустя.
[00244] DOR ограничиваемая пациентами с ответом, определенным исследователем согласно RECIST v1.1, и определяется как время первого ответа в соответствии с определением исследователя согласно RECIST v1.1 до прогрессирования или смерти в зависимости от того, что наступит раньше.
[00245] Корреляция между выявленным статусом FGFR2 в опухолевой ткани и/или биопсией на основе крови и объективным ответом согласно RECIST v1.1.
[00246] Корреляция между выявленным статусом FGFR2 в опухолевой ткани и амплификацией FGFR2 при биопсии на основе крови.
[00247] Поисковые биомаркеры в образцах крови.
[00248] Изменение от исходного уровня в качестве жизни, измеренное по EQ-5D-5L и EORTC QLQ-C30.
Общий дизайн и план исследования
Обзор
[00249] Это многоцентровое исследование, состоящее из двух частей, для оценки безопасности, переносимости, ФК, ФД и эффективности антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6. Исследование будет включать открытую вводную фазу для оценки безопасности при повышении дозы в части 1 и рандомизированное, двойное слепое, плацебо-контролируемое исследование с повышением дозы в части 2.
[00250] Часть 1 состоит как минимум из 2 запланированных когорт дозирования антитела к FGFR2-IIIb в комбинации с mFOLFOX6 у подходящих пациентов с распространенными опухолями ЖКТ для определения РД антитела к FGFR2-IIIb, которое следует вводить в комбинации с mFOLFOX6. Часть 2 состоит из 2 групп продления терапии (рандомизация 1:1) с целью оценки безопасности и эффективности антитела к FGFR2-IIIb в РД в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 у пациентов с FGFR2b-селективным распространенным РЖ (определяемым при помощи проспективного ИГХ анализа экспрессии FGFR2b и/или анализа крови, демонстрирующего амплификацию FGFR2). Пациенты будут включены в часть 1 или часть 2 исследования, но не в обе.
[00251] После начального периода скрининга до 14 суток (2 недели) пациенты будут получать лечение по схеме mFOLFOX6 (с антителом к FGFR2-IIIb или без него) каждые 2 недели в 14-суточных циклах. Пациенты, возможно, начали получать или получали химиотерапию по схеме mFOLFOX6 до включения в часть 1, но согласно критериям приемлемости пациент должен быть кандидатом на получение как минимум 2 дополнительных циклов химиотерапии по схеме mFOLFOX6 (не существует верхнего предела количества циклов лечения по схеме FOLFOX в части 1, которое пациенты могли получить или вовсе могли не получить).
[00252] Каждого пациента, включенного в часть 1, будут наблюдать в течение 28 суток для оценки безопасности и возникновения дозолимитирующей токсичности (период ДЛТ). По завершении периода ДЛТ пациенты могут продолжить получать лечение по усмотрению исследователя. Дополнительное лечение может вводиться каждые 2 недели в 14-суточные циклы после этого при наличии клинических показаний.
[00253] В части 2 пациенты, у которых опухоль положительна в отношении FGFR2b по анализу ИГХ или крови, завершили 2 цикла химиотерапии по схеме mFOLFOX в качестве стандартной терапии первой линии для лечения рака желудка на поздней стадии и подписали информированное согласие, будут рандомизированы в соотношении 1:1 для лечения антителом к FGFR2-IIIb в комбинации с mFOLFOX6 или плацебо в комбинации с mFOLFOX6 каждые 2 недели в 14-суточных циклах в РД, выбранной после оценки данных, полученных в части 1.
Начальный период скрининга
Часть 1
[00254] Период скрининга начинается после подписания пациентами формы информированного согласия (ФИС). Все пациенты будут проходить скрининговые оценки в течение 14 суток (2 недель) до введения первой дозы антител к FGFR2-IIIb. Любые НЯ, не связанные с процедурами в рамках исследования, которые возникают после подписания формы информированного согласия и перед введением первой дозы антитела к FGFR2-IIIb, в течение этого периода не будут собираться. Пациенты, возможно, начали получать или получали химиотерапию по схеме mFOLFOX6 до включения в часть 1, но согласно критериям приемлемости пациент должен быть кандидатом на получение как минимум 2 дополнительных циклов химиотерапии по схеме mFOLFOX6 (не существует верхнего предела количества циклов лечения по схеме FOLFOX в части 1, которое пациенты могли получить или вовсе могли не получить).
Часть 2
[00255] В части 2 будут зарегистрированы пациенты, у которых опухоль положительна в отношении FGFR2b по анализу ИГХ или крови, которые прошли 2 курса химиотерапии по схеме mFOLFOX в качестве стандартной терапии первой линии при раке желудка на поздней стадии, и которые подписали информированное согласие и соответствовали другим критериям приемлемости.
[00256] Право на участие в части 2 будет оцениваться в 2 этапа: период предварительного скрининга, включающий только тестирование на положительность в отношении FGFR2b по анализу ИГХ и крови; и период скрининга, в котором подтверждаются все остальные критерии приемлемости.
Рандомизация
Часть 1
[00257] Часть 1 представляет собой открытое исследование. Пациенты, которые определены как соответствующие критериям, будут последовательно включены.
Часть 2
[00258] Во время предварительного скрининга пациенты будут проверены на положительность в отношении FGFR2b. Пациенты с положительным результатом теста одним или обоими методами (ИГХ и/или кровь) затем начнут период скрининга. (Примечание: если анализ крови положительный, нет необходимости ждать результатов ИГХ, поскольку пациент соответствует критериям в этот момент и должен начать период скрининга).
[00259] Пациенты, которые соответствуют критериям, будут рандомизированы в соотношении 1:1 для приема плацебо в комбинации с mFOLFOX6 или антител к FGFR2-IIIb в комбинации с mFOLFOX6.
Часть 1 (вводная фаза для оценки безопасности при повышении дозы)
[00260] Часть 1 - это открытое исследование с повышением дозы антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6. Пациенты, соответствующие критериям участия в части 1, имеют неселективный рак ЖКТ (с или без опухолей, сверхэкспрессирующих FGFR2b) с неоперабельным, локально распространенным или метастатическим заболеванием и являются кандидатами на получение как антител к FGFR2-IIIb, так и химиотерапии по схеме mFOLFOX6. Статус FGFR2 будет определяться ретроспективно при помощи ИГХ и биопсии на основе крови.
[00261] Пациенты, включенные в Часть 1, будут проходить лечение возрастающими дозами антител к FGFR2-IIIb в комбинации с режимом основной химиотерапии с фиксированной дозой по схеме mFOLFOX6 каждые 2 недели в течение 14-суточных циклов следующим образом:
Введение антител к FGFR2-IIIb:
[00262] Антитела к FGFR2-IIIb вводят в/в каждые 2 недели на сутки 1 каждого цикла до введения химиотерапии по схеме mFOLFOX6. Антитела к FGFR2-IIIb будут вводить в виде внутривенной инфузии в течение приблизительно 30 минут через периферическую вену или центральный венозный катетер с встроенным фильтром.
Режим основной химиотерапии:
[00263] Введение химиотерапии по схеме mFOLFOX6 начинается на сутки 1 каждого цикла лечения и после введения антител к FGFR2-IIIb (после 30-минутного отдыха). Схему mFOLFOX6 вводят каждые 2 недели следующим образом:
[00264] в/в инфузия оксалиплатина 85 мг/м2 в течение 120 минут, в/в инфузия лейковорина 400 мг/м2 в течение 120 минут с последующим в/в болюсным введением фторурацила (5-ФУ) 400 мг/м2 с последующим введением 5-ФУ 2400 мг/м2 в виде непрерывной внутривенной инфузии в течение 46 часов.
[00265] При введении оксалиплатина предварительная гидратация не требуется. Премедикация противорвотными средствами, такими как антагонисты серотонина с дексаметазоном или без него может использоваться при наличии клинических показаний по усмотрению исследователя в соответствии с местным стандартом лечения.
Уровни дозы (часть 1)
[00266] В части 1 предусмотрены две когорты дозирования антител к FGFR2-IIIb по стандартной схеме повышения дозы 3+3, при этом в каждую когорту включается минимум 3 пациента. Ожидаемые уровни доз:
(только если требуется снижение дозы от начального уровня дозы 1).
[00267] Все решения о повышении дозы будут основаны на оценке ДЛТ, общей безопасности и переносимости, и будут приниматься после завершения последним пациентом, включенный в каждую когорту, 28дневного периода ДЛТ (завершение 2 циклов лечения). Решения о повышении дозы будут согласованы Наблюдательным комитетом по оценке когорт (CRC - Cohort Review Committee), в состав которого входят спонсор и исследователи. Анализ безопасности и ФК параметров может помочь в принятии решений о добавлении когорт с альтернативными уровнями дозы для достижения оптимального целевого воздействия. Набор пациентов в группу с уровнем дозы -1 будет проводиться только в том случае, если на уровне дозы 1 наблюдается ≥ 2 ДЛТ.
[00268] Алгоритм, показанный в Таблице 1, будет использоваться для принятия решения о повышении дозы в части 1:
Таблица 1. Повышение дозы
[00269] РД антител к FGFR2-IIIb для части 2 будет определена CRC на основе оценки общей безопасности, переносимости и ФК. Следовательно, РД может совпадать или не совпадать с определенной максимально переносимой дозой (MTD - maximum tolerated dose). Например, если MTD не достигнута или если данные из последующих циклов лечения из части 1 дают дополнительное представление о профиле безопасности, тогда РД может быть другой, хотя и не более высокой, чем MTD.
[00270] MTD определяется как максимальная доза, при которой <33% пациентов испытывают ДЛТ в течение периода ДЛТ. Если ДЛТ наблюдается у 1 из 3 пациентов с заданным уровнем дозы, тогда еще 3 пациента будут включены с тем же уровнем дозы. Повышение дозы может продолжаться до тех пор, пока у 2 из 3-6 пациентов, получающих лечение на уровне дозы, не возникнет ДЛТ (уровень дозы не должен превышать 15 мг/кг). Тогда следующая более низкая доза будет считаться MTD.
[00271] После достижения MTD или РД будет добавлено 3 дополнительных пациента для дальнейшего изучения безопасности и ФК на этом уровне дозы. Таким образом, общий набор для части 1 будет составлять приблизительно от 9 до 12 пациентов.
[00272] Любой пациент, который не получает ровно 2 дозы антител к FGFR2-IIIb в комбинации с mFOLFOX6 в течение периода ДЛТ, будет считаться не поддающимся оценке, и пациент будет заменен. Замененный пациент может продолжить участие в исследовании после обсуждения со спонсором. В течение 28-суточного периода ДЛТ следует вводить не более 2 доз антител к FGFR2-IIIb или 2 циклов mFOLFOX6.
[00273] По завершении периода ДЛТ пациенты могут продолжать получать антитела к FGFR2-IIIb в комбинации с mFOLFOX6, вводимые каждые 2 недели в 14-суточных циклах до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. Не существует максимального количества доз антитела к FGFR2-IIIb. Продолжающееся применение схемы mFOLFOX6 после периода ДЛТ будет проводиться в соответствии с региональным стандартом лечения.
[00274] В случае прекращения применения химиотерапии по схеме mFOLFOX6 по любой причине до прогрессирования заболевания (например, кумулятивная токсичность или завершение химиотерапии по схеме mFOLFOX6 в соответствии с региональной практикой), введение антител к FGFR2-IIIb можно продолжать в виде монотерапии и вводить каждые 2 недели до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. В случае, если проведение цикла по схеме mFOLFOX6 откладывается более чем на 14 суток по причине токсичности, связанной с химиотерапией, введение антител к FGFR2-IIIb не следует откладывать и их можно продолжать вводить каждые 2 недели. Начало нового цикла по схеме mFOLFOX6 после отсрочки дозирования должно быть синхронизировано с проведением инфузии антител к FGFR2-IIIb, если это возможно (но не является требованием исследования).
[00275] В случае отмены антитела к FGFR2-IIIb по любой причине до прогрессирования заболевания (например, кумулятивная токсичность) химиотерапия по схеме mFOLFOX6 может по-прежнему применяться в соответствии с местной региональной практикой или до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения.
Часть 2: Рандомизированное двойное слепое расширение дозы
[00276] Пациенты будут включены в часть 2 с целью охарактеризовать безопасность и эффективность антитела к FGFR2-IIIb в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6 в популяции пациентов с FGFR2b-селективным раком желудка. Набор в часть 2 начнется только после определения CRC в части 1 РД для антитела к FGFR2-IIIb, которая не будет превышать 15 мг/кг.
[00277] Часть 2 является двойной слепой и будет состоять в общей сложности из приблизительно 360 пациентов с FGFR2b-селективным раком желудка, рандомизированных в соотношении 1:1 для получения лечения в одной из двух групп:
[00278] Группа 1: антитела к FGFR2-IIIb в РД и mFOLFOX6 с введением каждые 2 недели, или
[00279] Группа 2: Плацебо и mFOLFOX6 вводят каждые 2 недели
[00280] Открытие части 2 для набора будет проводиться на усмотрение спонсора.
[00281] Пациенты с раком желудка с неоперабельным, локально распространенным или метастатическим заболеванием, которые соответствуют критериям проведения химиотерапии первой линии по схеме mFOLFOX6 и получили 2 цикла mFOLFOX6, будут включены в часть 2 исследования. Пациенты будут отобраны для включения на основе сверхэкспрессии FGFR2b и/или амплификации FGFR2, как определено при помощи валидированной ИГХ или анализа биопсии на основе крови, соответственно.
[00282] Включенные пациенты могут продолжить лечение каждые 2 недели в 14-суточных циклах до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. Все решения о лечении будут приниматься исследователем с использованием местных оценок. После прекращения исследуемого лечения по причинам, отличным от прогрессирования или отзыва согласия, оценки опухоли будут проводиться до тех пор, пока пациент не начнет проходить дополнительную противораковую терапию. Кроме того, пациенты как в части 1, так и в части 2 будут проходить длительный период последующего наблюдения на предмет выживания путем осуществления визитов в клинику или по телефону приблизительно каждые 3 месяца ± 28 суток после визита EOT, вплоть до 24 месяцев после включения последнего пациента в исследование, или до смерти, потери для последующего наблюдения, отзыва согласия или прекращения исследования спонсором (в зависимости от того, что наступит раньше).
[00283] В случае прекращения применения химиотерапии по схеме mFOLFOX6 по любой причине до прогрессирования заболевания (например, кумулятивная токсичность или завершение химиотерапии по схеме mFOLFOX6 в соответствии с региональной практикой), введение ИП можно продолжать в виде монотерапии и вводить каждые 2 недели до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. В случае, если проведение цикла по схеме mFOLFOX6 откладывается более чем на 14 суток по причине токсичности, связанной с химиотерапией, введение ИП не следует откладывать и их можно продолжать вводить каждые 2 недели. Начало нового цикла по схеме mFOLFOX6 после отсрочки дозирования должно быть синхронизировано с проведением инфузии ИП, если это возможно (но не является требованием исследования).
[00284] В случае отмены ИП по любой причине до прогрессирования заболевания (например, кумулятивная токсичность) химиотерапия по схеме mFOLFOX6 может по-прежнему применяться в соответствии с местной региональной практикой или до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения.
Схема исследования
[00285] Схема исследования показана на Фиг. 1 (часть 1) и на Фиг. 2 (часть 2).
Обоснование дизайна исследования
[00286] Это многоцентровое исследование, состоящее из двух частей, для оценки безопасности, переносимости, ФК, ФД и эффективности антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6. Исследование будет включать открытую вводную фазу для оценки безопасности при повышении дозы в части 1 и рандомизированное, двойное слепое, плацебо-контролируемое исследование с повышением дозы в части 2.
[00287] Часть 1 - это вводная фаза исследования для оценки безопасности при повышении дозы антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6. Будет использован стандартный дизайн 3+3. Пациенты, включенные в Часть 1, будут проходить лечение возрастающими дозами антител к FGFR2-IIIb в комбинации с режимом основной химиотерапии с фиксированной дозой по схеме mFOLFOX6 каждые 2 недели в течение 14-суточных циклов. Каждого пациента, включенного в часть 1, будут наблюдать в течение 28 суток для оценки безопасности и возникновения дозолимитирующей токсичности (период ДЛТ) и РД будет выбрана для части 2 после оценки данных.
[00288] Пациенты, соответствующие критериям участия в части 1, имеют неселективный рак ЖКТ (с или без опухолей, сверхэкспрессирующих FGFR2b) с неоперабельным, локально распространенным или метастатическим заболеванием и являются кандидатами на получение как антител к FGFR2-IIIb, так и химиотерапии по схеме mFOLFOX6. Статус FGFR2 будет определяться ретроспективно при помощи ИГХ и биопсии на основе крови.
[00289] Во второй части отобранные пациенты будут рандомизированы в соотношении 1:1 для лечения антителами к FGFR2-IIIb и mFOLFOX6 или плацебо и mFOLFOX6 каждые 2 недели в 14-суточных циклах. Пациенты в части 2 должны пройти ровно 2 цикла mFOLFOX6 (не больше и не меньше).
[00290] Измерение PFS, ORR и OS у пациентов с FGFR2b-селективным раком желудка у рандомизированных пациентов может подчеркнуть клиническую пользу антител к FGFR2-IIIb при применении в комбинации с mFOLFOX6 по сравнению с плацебо и mFOLFOX6.
Критерии приемлемости и исключения из исследования
Запланированное количество пациентов и исследовательских центров
[00291] В части 1 ожидаются 2 когорты дозирования антител к FGFR2-IIIb по стандартной схеме повышения дозы 3+3, при этом в каждую когорту включается минимум 3 пациента. После достижения MTD или РД будет добавлено 3 дополнительных пациента для дальнейшего изучения безопасности и ФК на этом уровне дозы. Таким образом, общий набор для части 1 будет составлять приблизительно от 9 до 12 пациентов.
[00292] Во второй части приблизительно 360 пациентов с FGFR2b-селективным раком желудка будут рандомизированы в соотношении1:1 для лечения антителами к FGFR2-IIIb в комбинации с mFOLFOX6 или плацебо в комбинации с mFOLFOX6 каждые 2 недели в 14-суточных циклах при РД, выбранной после оценки данных, полученных в части 1. Открытие части 2 для набора будет проводиться на усмотрение спонсора.
[00293] Общее число участников, запланированных для этого исследования, составляет приблизительно 372 пациента.
[00294] Исследование будет проводиться в 250 исследовательских центрах по всему миру.
Критерии включения для всех когорт
[00295] Пациенты, зачисляемые в часть 1 или часть 2 исследования, также должны соответствовать всем следующим критериям включения:
1) Неоперабельное, локально распространенное или метастатическое заболевание
2) Понимать и подписать форму информированного согласия (ФИС), одобренную экспертным советом медицинского учреждения (IRB) / независимым комитетом по этике (IEC), перед любой оценкой, проводимой для исследования
3) Ожидаемая продолжительность жизни не менее 3 месяцев
4) Показатель общего состояния в соответствии с Восточной кооперативной онкологической группой (ECOG) от 0 до 1
5) Возраст ≥18 лет на момент подписания ФИС
6) Отрицательный тест на беременность сывороточного β-хорионического гонадотропина человека (β-ХГЧ) за ≤72 часа до регистрации (только женщины с детородным потенциалом)
7) Для сексуально активных пациентов (женщин с детородным потенциалом и мужчин) готовность использовать 2 эффективных метода контрацепции, из которых 1 должен быть барьерным методом (презерватив, диафрагма или колпачок на шейку матки/влагалищный колпачок) в течение 6 месяцев после последней дозы антитела к FGFR2-IIIb. Другие эффективные формы контрацепции включают:
Постоянная стерилизация (гистерэктомия и/или двусторонняя овариэктомия, или двустороннее перевязывание маточных труб хирургическим вмешательством или вазэктомия) по крайней мере за 6 месяцев до скрининга
Женщины с детородным потенциалом, которые находятся на стабильной пероральной терапии контрацептивами, или имеют внутриматочное или имплантируемое устройство в течение не менее 90 суток до начала исследования, или воздерживаются от половых отношений в качестве образа жизни
8) Адекватная гематологическая и биологическая функция, подтвержденная следующими лабораторными показателями:
Функция костного мозга
Абсолютное количество нейтрофилов (АЧН)≥1,5 × 109/л
Тромбоциты >100 × 109/л
Гемоглобин ≥9 г/дл
Функция печени
Аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ) в ≤3 × раза превышают верхний предел нормы (ВПН); в случае метастазов в печень, то ≤5 × ВПН
Билирубин ≤1,5 × ВПН
Функция почек
Расчетный клиренс креатинина ≥ 50 мл/мин
9) Пациенты, получающие полнодозовые антикоагулянты, должны принимать стабильную дозу варфарина и иметь международное нормализованное отношение (МНО) в пределах терапевтического диапазона для лечения состояния пациента или стабильную дозу низкомолекулярного гепарина.
10) Измеримое или неизмеримое заболевание
11) Опухолевая ткань для определения статуса FGFR2
Пациенты, зачисляемые в часть 1 (вводная фаза для оценки безопасности при повышении дозы) исследования, также должны соответствовать следующим критериям включения:
[00296] Гистологически или цитологически подтвержденное злокачественное новообразование желудочно-кишечного тракта, для которого схема mFOLFOX6 считается подходящим лечением (например, рак желудка, колоректальный рак, аденокарцинома поджелудочной железы)
[00297] Не более 2 предыдущих схем химиотерапии для лечения метастатического заболевания (не включая предшествующую адъювантную химиотерапию с применением 5-ФУ и/или оксалиплатином).
[00298] Пациент должен быть кандидатом как минимум на 2 цикла химиотерапии по схеме mFOLFOX6.
Пациенты, зачисляемые в часть 2 (фаза продления терапии максимально переносимой дозой) исследования, также должны соответствовать следующим критериям включения:
1) Гистологически подтвержденная аденокарцинома желудка или гастроэзофагеального перехода.
2) Сверхэкспрессия FGFR2b, определенная при помощи ИГХ и/или амплификация FGFR2, определенная при помощи на основе биопсии крови
3) Предварительная химиотерапия для лечения метастатического или неоперабельного заболевания (за исключением случаев, указанных в критериях включения № 20 для схемы mFOLFOX6) не проводилась
4) Предварительная химиотерапия на основе платины (за исключением случаев, отмеченных в критериях включения № 20 для схемы mFOLFOX6) не проводилась
5) Если проводилась предварительная адъювантная или неоадъювантная терапия (химиотерапия и/или химиолучевая терапия), между окончанием адъювантной терапии и набором должно пройти более 6 месяцев
6) Пациент должен быть кандидатом на химиотерапию по схеме mFOLFOX6 и пройти 2 цикла химиотерапии по схеме mFOLFOX6 до регистрации в исследование (но не более 2 циклов).
Критерии исключения для всех когорт
[00299] Пациенты, зарегистрированные в часть 1 или часть 2, будут исключены, если к ним применим любой из следующих критериев:
[00300] Нелеченные или симптоматические метастазы в центральную нервную систему (ЦНС). Пациенты с бессимптомными метастазами в ЦНС имеют право на участие, при условии, что они были клинически стабильны в течение по крайней мере 4 недель и не нуждаются во вмешательстве, таком как операция, облучение или любая кортикостероидная терапия для лечения симптомов, связанных с заболеванием ЦНС.
[00301] Ослабленная сердечная функция или клинически значимое сердечное заболевание, в том числе любое из следующих:
Нестабильная стенокардия за ≤6 месяцев до регистрации
Острый инфаркт миокарда за ≤6 месяцев до регистрации
Застойная сердечная недостаточность, класс II-IV, по функциональной классификации Нью-Йоркской кардиологической ассоциации
Неконтролируемая артериальная гипертензия (определяется как >160/90, несмотря на оптимальное медицинское лечение)
Сердечная аритмия, требующая антиаритмической терапии, кроме бета-блокаторов или дигоксина
Активная болезнь коронарных артерий
7) QTcF >450 мсек для мужчин или >470 мсек для женщин
8) Периферическая сенсорная невропатия 2-й степени или выше в соответствии со Стандартными терминологическими критериями нежелательных явлений (CTCAE)
9) Активная инфекция, требующая системного лечения или любая неконтролируемая инфекция за ≤14 суток до регистрации
10) Подтвержденный вирус иммунодефицита человека (ВИЧ) или заболевание, связанное с синдромом приобретенного иммунодефицита (СПИД), или хронический гепатит B или C в анамнезе
11) Интерстициальное заболевание легких (например, пневмонит или легочный фиброз) в анамнезе
12) Свидетельство или наличие геморрагического диатеза или коагулопатии в анамнезе
13) Применение любого исследуемого агента или терапии за ≤28 суток до регистрации
14) Лучевая терапия за ≤28 суток до регистрации. Пациенты должны восстановиться после всех токсических эффектов, связанных с лучевой терапией. Радиофармацевтические препараты (стронций, самарий) не должны применяться в течение 8 недель после регистрации
15) Предварительное лечение любым селективным ингибитором (например, AZD4547, BGJ398, JNJ-42756493, BAY1179470) пути FGF-FGFR
16) Текущие побочные эффекты от предшествующего лечения >1 степени по NCI CTCAE (за исключением алопеции 2 степени)
17) Участие в другом терапевтическом клиническом исследовании в течение 28 суток после регистрации или во время этого клинического исследования
18) Дефекты роговицы, изъязвления роговицы, кератит, кератоконус, пересадка роговицы или другие известные аномалии роговицы в анамнезе, которые, по мнению офтальмолога, могут представлять риск при лечении антителами к FGFR2-IIIb
19) Положительный статус HER2 (по определению по положительному ИГХ анализу 3+ или ИГХ 2+ с положительным FISH). Статус HER2 основан на руководстве по оценке рака желудка (HercepTest)
20) Обширные хирургические вмешательства не допустимы за ≤28 суток до регистрации. Операция, требующая местной/эпидуральной анестезии, должна быть завершена как минимум за 72 часа до регистрации. Во всех случаях пациент должен быть достаточно восстановлен и стабилен до начала лечения
21) Женщины, которые беременны или кормят грудью (если пациентка не хочет прервать грудное вскармливание во время введения исследуемого препарата, а затем возобновить через 6 месяцев после прекращения исследования); женщины с детородным потенциалом не должны рассматривать возможность забеременеть во время исследования
22) Наличие любого серьезного или нестабильного сопутствующего системного расстройства, несовместимого с клиническим исследованием (например, злоупотребление психоактивными веществами, психическое расстройство или неконтролируемое интеркуррентное заболевание, включая активную инфекцию, артериальный тромбоз и симптоматическую эмболию легочной артерии)
23) Наличие любого другого состояния, которое может увеличить риск, связанный с участием в исследовании (например, дефицит дигидропиримидина или плевральный выпот), или может помешать интерпретации результатов исследования и, по мнению исследователя, сделает пациента неподходящим для включения в исследование
24) Известная аллергия или гиперчувствительность к компонентам композиции антител к FGFR2-IIIb, включая полисорбат, или к препаратам, содержащим платину, фторурацил или лейковорин
25) Предшествующее злокачественное новообразование в анамнезе, за исключением другого злокачественного новообразования, которое, по мнению исследователя, не повлияет на определение эффекта исследуемого лечения.
Отказ от этих критериев включения или исключения не будет предоставлен.
Исключение из исследования и замена пациента
[00302] Пациент должен прекратить применять предписанную протоколом терапию, если применимо любое из следующего:
Отзыв согласия по требованию пациента или его законного представителя
Прогрессирование заболевания пациента по оценке исследователя.
Любое явление, которое представляет неприемлемый риск для безопасности пациента
Сопутствующее заболевание, которое в значительной степени повлияет на оценку клинического статуса
Положительный тест на беременность в любое время во время исследования
По специальному запросу от спонсора или его уполномоченного представителя (например, если исследование прекращается по соображениям безопасности пациента).
Идентификация и регистрация пациентов
[00303] Пациенты должны иметь возможность предоставить письменное информированное согласие и соответствовать всем критериям включения и ни одному из критериев исключения. Исследователь и спонсор или его уполномоченные лица не смогут отказаться от каких-либо критериев включения или исключения. Перед регистрацией пациента должны быть выполнены все критерии приемлемости. Пациенты, которые имеют право на участие в части 1 исследования, будут включены в первую доступную когорту. Пациент может быть включен в часть 1 или часть 2 исследования, но не в обе.
[00304] В части 2 пациенты сначала проходят предварительный скрининг, при котором требуется как анализ биопсии на основе крови, так и анализ ткани. Пациенты, у которых определен положительный FGFR2, могут немедленно войти в период скрининга (то есть пациентам с положительными результатами анализа крови не нужно ждать результатов ИГХ (см. Таблицу 2). Пациенты в части 2 также должны пройти 2, но не более 2 циклов mFOLFOX6.
Таблица 2: Приемлемость на основе результатов FGFR2b
(с использованием анализа биопсии на основе крови [цоДНК])b
(Исследование ткани на белок FGFR2b)c
a: Оба анализа будут проводиться в центральных лабораториях.
b: Требуется 2 × 10 мл.
c: ИГХ: Требуется минимум 5 микропрепаратов. Оценка 2+ или 3+ будет считаться положительной.
[00305] В обеих частях 1 и 2 исследователь может повторить квалификационные лабораторные анализы и измерение показателей жизненно важных функций/ЭКГ до регистрации, если неквалификационное заключение считается ошибкой или если свежий результат может соответствовать критериям приемлемости при повторном тестировании. Результаты гематологического и биохимического анализа крови должны быть получены в течение 72 часов после введения дозы для подтверждения соответствия критериям.
Исследуемый препарат
Идентичность
[00306] В части 1 антитела к FGFR2-IIIb будет поставляться в стерильном флаконе для разведения в пакете для внутривенного введения в исследовательском центре в течение приблизительно 30 минут каждые 14 суток (± 3 суток) до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователем, неприемлемой токсичности или другой причины исключения из исследования, указанной в протоколе.
[00307] В части 2 плацебо будет поставляться неослепленным фармацевтом исследовательского центра. Участники будут случайным образом распределены в соотношении [1:1] для получения замаскированного ИП (антитела к FGFR2-IIIb/плацебо). Исследователи будут оставаться ослепленными к назначенному каждому участнику лечению в течение всего периода исследования. Для того, чтобы поддерживать ослепленность, неослепленный фармацевт будет нести ответственность за восстановление и распределение всего исследуемого лечения. В случае аудита для обеспечения качества, аудитору(-ам) будет разрешен доступ к незамаскированным записям по исследуемому лечению в исследовательском центре(-ах), чтобы убедиться, что рандомизация/распределение было выполнено точно.
[00308] Оксалиплатин, 5-ФУ и лейковорин будут поставляться в каждый исследовательский центр в соответствии с установленной практикой учреждения. Схема mFOLFOX6 будет вводиться каждые 14 суток (± 3 суток) до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователем, неприемлемой токсичности или другой причины исключения из исследования, указанной в протоколе. Информацию по приготовлению и полную информации о назначениях смотрите в самой последней региональной инструкции по применению.
Введение
1. mFOLFOX6
[00309] Оксалиплатин, 5-ФУ и лейковорин будут поставляться в каждый исследовательский центр в соответствии с установленной практикой учреждения. Схема mFOLFOX6 будет вводиться каждые 14 суток (± 3 суток) до прогрессирования заболевания, неприемлемой токсичности или другой причины исключения из исследования, указанной в протоколе.
[00310] Начальная доза mFOLFOX6 включает 85 мг/м2 оксалиплатина, 350 мг фолината кальция (фолиновой кислоты), 400 мг/м2 фторурацила и 2400 мг/м2 фторурацила. Оксалиплатин и фолинат кальция вводят одновременно посредством внутривенной инфузии с использованием 3-ходового крана/Y-образного соединителя. Меньшая доза фторурацила вводится при помощи внутривенной болюсной инъекции, а большая доза фторурацила вводится посредством внутривенной инфузии в течение 46 часов. mFOLFOX6 может вводиться каждые 14 суток.
[00311] Информацию по приготовлению и полную информации о назначениях смотрите в самой последней инструкции по применению.
2. Открытое введение антител к FGFR2-IIIb (часть 1) и введение замаскированного ИП (часть 2)
[00312] Антитела к FGFR2-IIIb будут вводиться только пациентам в этом исследовании с использованием процедур, описанных в этом протоколе. Доза антител к FGFR2-IIIb основана на массе тела на 1 сутки 1 цикла и корректируется, если вес пациента изменяется на >10% относительно 1 суток 1 цикла.
[00313] Фармацевт (или другое ответственное лицо) подготовит раствор для введения. После расчета количества флаконов, исходя из массы пациента, исследуемый препарат разводят в 0,9% растворе хлорида натрия. Подготовленные антитела к FGFR2-IIIb следует вводить через ≤8 часов после приготовления (при комнатной температуре). Антитела к FGFR2-IIIb будут вводиться под наблюдением врача в течение приблизительно 30 минут внутривенной инфузии с встроенным фильтром через периферическую вену или центральный венозный катетер. Для части 2 фармацевт, который не будет ослеплен к назначению лечения, будет предоставлять плацебо.
[00314] Инфузия антител к FGFR2-IIIb должна быть приостановлена, уменьшена, прервана или прекращена раньше. Если пациент испытывает инфузионную реакцию, показатели жизненно важных функций пациента (температура, артериальное давление, пульс и частота дыхания) должны контролироваться во время инфузии, а также каждые 30 минут после инфузии в течение как минимум 2 часов и до разрешения инфузионной реакции.
[00315] Пациенты получат 2 дозы антител к FGFR2-IIIb с интервалом 2 недели в течение всего периода участия в исследовании. В части 1 по завершении периода ДЛТ, если пациенты переносят лечение без прогрессирования заболевания, пациенты могут продолжать получать антитела к FGFR2-IIIb в комбинации с mFOLFOX6, вводимые каждые 2 недели в 14-суточных циклах до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения.
Начальная доза и модификации дозы
3. Часть 1: Вводная фаза для оценки безопасности при повышении дозы
[00316] Пациенты, включенные в Часть 1, будут проходить лечение возрастающими дозами антител к FGFR2-IIIb в комбинации с режимом основной химиотерапии с фиксированной дозой по схеме mFOLFOX6 каждые 2 недели в течение 14-суточных циклов, как описано выше.
Критерии модификации дозы
4. Открытое введение антител к FGFR2-IIIb (часть 1) и введение замаскированного ИП (часть 2)
[00317] Часть 1 и часть 2: Снижение дозы антител к FGFR2-IIIb может быть разрешено для пациентов, находящихся на лечении после периода ДЛТ в части 1, или для любого пациента в части 2 в соответствии с рекомендациями, изложенными в таблице 3. Если исследователь рассматривает снижение или прерывание дозы, которые не подпадают под эти рекомендации, они потребуют обсуждения и одобрения спонсором или уполномоченным им лицом.
Таблица 3: Рекомендации по модификации дозы антител к FGFR2-IIIb
(первое возникновение)
[00318] Пациенты могут возобновить прием исследуемого препарата, если состояние в связи с явлением возвращается к исходному уровню или ≤1-й степени в соответствии с рекомендациями, изложенными в таблице 3.
[00319] Имеется ± 3-дневное окно для запланированных визитов дозирования. Пациентам не следует вводить 2 последовательных дозы антител к FGFR2-IIIb в течение 7 суток Первая доза каждого цикла считается 1 сутками каждого цикла. Циклы будут повторяться каждые 14 суток, если не будет отсрочки в лечении.
[00320] Повышение дозы для пациента выше начальной дозы для каждого пациента не допускается. Если доза для пациента уменьшается по причине, которая больше не является релевантной, повышение дозы до первоначально назначенной дозы может произойти после обсуждения и одобрения спонсором.
5. mFOLFOX6
[00321] Часть 1 и часть 2: Пациенты должны быть тщательно контролироваться на предмет токсичности mFOLFOX6. Коррекция дозы 5-ФУ и оксалиплатина может быть разрешена для пациентов, находящихся на лечении, но пациенты, которым требуется коррекция дозы или отсрочка применения любого компонента mFOLFOX в течение периода ДЛТ, не будут считаться оцениваемыми, если только коррекция дозы или отсрочка не являются следствием НЯ, связанного с антителом к FGFR2-IIIb, в этом случае НЯ будет считаться ДЛТ (определение ДЛТ см. ниже). Помимо периода ДЛТ в части 1 или любого пациента в части 2, корректировки доз для любого компонента mFOLFOX разрешены в соответствии с рекомендациями, изложенными в протоколе.
[00322] В случае, если введение оксалиплатина прекращено по любой причине до прогрессирования заболевания, терапия 5-ФУ/лейковорином может продолжаться каждые 2 недели до прогрессирования заболевания, неприемлемой токсичности или другой причины для прекращения исследования.
[00323] Корректировки доз при токсичности mFOLFOX6 показаны в таблице 4.
Таблица 4: Снижение дозы и отсрочки для химиотерапии FOLFOX
На основе материалов протокола: Loupakis F, Cremolini C, Masi G, et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 2014;371:1609-18. DOI: 10.1056/NEJMoa1403108.
Дозолимитирующая токсичность
[00324] ДЛТ определяются как любое из следующих явлений, которые происходят в течение первых 28 суток лечения, и оцениваются исследователем как относящиеся к антителам к FGFR2-IIIb. Если применимо, явления будут классифицироваться в соответствии с NCI CTCAE (Версия 4.03).
АЧН <0,5 × 109/л >5 суток или фебрильная нейтропения (т.е. АЧН <1,0 × 109/л с одним случаем повышения температуры >38,3°С или лихорадкой ≥38°С в течение более 1 часа). Использование G-CSF разрешено в соответствии со стандартами учреждения
Тромбоциты <25 × 109/л или тромбоциты <50 × 109/л с кровотечением, требующим медицинского вмешательства
Длительная тромбоцитопения (>7 суток) 3-й степени
Анемия 4-й степени (то есть опасные для жизни последствия; показано срочное вмешательство)
Любое офтальмологическое НЯ 2-й степени или выше, которое не проходит в течение 7 суток
АСТ/АЛТ >3 х ВПН и сопутствующий уровень общего билирубина > 2 х ВПН, не связанные с поражением печени раком
Любое негематологическое НЯ 3-й степени или выше (кроме тошноты, рвоты и диареи, если хорошо контролируются системными препаратами). Лабораторные показатели 3-й или 4-й степени, которые не имеют клинической значимости по согласованию между исследователем и спонсором, не будут считаться ДЛТ.
Любое нежелательное явление, связанное с антителами к FGFR2-IIIb, которое приводит к снижению или отсрочке дозы по меньшей мере на 4 суток любого компонента mFOLFOX6
Рекомендуемая доза (РД) и максимальная переносимая доза (MTD)
Токсичность при самом низком уровне дозы
[00325] Если MTD неожиданно превышена на первом уровне дозы антител к FGFR2-IIIb (10 мг/кг каждые 2 недели), тогда решения о том, как действовать дальше, будут основаны на данных по безопасности, переносимости и ФК; и будут согласованы между исследователями и спонсором.
[00326] Уровень дозы -1 (антитела к FGFR2-IIIb 6 мг/кг каждые 2 недели; от 3 до 6 субъектов) набор будет проводиться только в том случае, если на уровне дозы 1 наблюдается ≥ 2 ДЛТ.
Повышение дозы в когорте
[00327] В части 1 не допускается повышение дозы пациенту.
[00328] В части 2 пациенты будут проходить лечение в РД, определенной в части 1, и повышение дозы не будет разрешено.
Приостановка введения дозы во время инфузии препарата
[00329] Инфузия антитела к FGFR2-IIIb должна быть остановлена, если во время инфузии происходит НЯ ≥3-й степени. Если у пациента во время инфузии возникает бронхоспазм или одышка, инфузию следует прекратить. Симптомы инфузионных реакций могут включать в себя: жар, озноб, мышечную регидность, крапивницу, гипотензию и гипертонию с головной болью, хрипы, одышку, гипоксию и легочные инфильтраты.
[00330] Кроме того, по усмотрению исследователя скорость инфузии может быть уменьшена или инфузия остановлена, если во время инфузии возникает менее тяжелое НЯ (степень 1 или 2). Если НЯ 3-й степени или менее разрешается в течение 4 часов, инфузия может быть возобновлена со скоростью, вполовину меньшей. Если во время возобновленной инфузии снова возникает одно и то же НЯ с той же степенью тяжести, инфузию следует прекратить, и дальнейшая дозировка исследуемого препарата не будет проводиться без консультации со спонсором или уполномоченным спонсором лицом.
[00331] Если пациент испытывает инфузионную реакцию до завершения инфузии, инфузия должна быть остановлена, и пациенту должно быть оперативно предоставлено лечение и осуществляться контроль за пациентом в соответствии с признаками и симптомами, а также местным клиническим протоколом до полного разрешения явления. Для пациентов, у которых явления, связанные с инфузией, были 1-й или 2-й степени и полностью разрешились в сутки инфузии, инфузия может быть возобновлена по усмотрению исследователя с более медленной споростью с премедикацией. Все последующие инфузии для этого пациента должны затем осуществляться с пониженной скоростью инфузии с премедикацией. Премедикация может включать такие лекарственные препараты, как кортикостероиды, дифенгидрамин, ацетаминофен и/или бронходилататоры, в зависимости от показаний. Антитело к FGFR2-IIIb будет окончательно отменено для пациентов, которые испытали нежелательные явления 3-й или выше степени, связанные с инфузией, а также для пациентов, которые имеют рецидивирующие реакции, связанные с инфузией, после возобновления инфузии, несмотря на премедикацию и более медленную скорость инфузии.
[00332] Если пациент испытывает инфузионную реакцию, показатели жизненно важных функций пациента (температура, артериальное давление, пульс и частота дыхания) должны контролироваться во время инфузии, а также каждые 30 минут после инфузии в течение как минимум 2 часов и до разрешения инфузионной реакции.
[00333] Приостановка введения дозы и отсрочки, вызванные токсичностью mFOLFOX6, описаны в таблице 4 (см. маркировку продукта для лейковорина, 5-ФУ и оксалиплатина).
Параметры и методы оценки
Параметры безопасности
[00334] Показатели безопасности будут включать НЯ, гематологию, биохимический анализ, анализ мочи, показатели жизненно важных функций, массу тела, применение сопутствующих лекарственных препаратов/процедур, показатель общего состояния в соответствии с ECOG, целевые физикальные обследования, ЭКГ и офтальмологические исследования.
1.1 Анализ опухолей для отбора пациентов
1.1.1 Часть 1
[00335] Пациенты, соответствующие критериям участия в части 1, имеют неселективный рак ЖКТ (с или без опухолей, сверхэкспрессирующих FGFR2b) с неоперабельным, локально распространенным или метастатическим заболеванием и являются кандидатами на получение как антител к FGFR2-IIIb, так и химиотерапии по схеме mFOLFOX6. Статус FGFR2 будет определяться ретроспективно при помощи ИГХ и биопсии на основе крови.
1.1.2 Часть 2
[00336] Пациенты в части 2 этого исследования должны дать согласие на анализ опухолевой ткани и анализ крови. Пациенты будут отобраны для включения на основе сверхэкспрессии FGFR2b и/или амплификации FGFR2, определенных при помощи валидированной ИГХ или анализа биопсии на основе крови, соответственно. Пациенты, которые не демонстрируют сверхэкспрессию FGFR2b по данным ИГХ или амплификацию по данным анализа биопсии на основе крови, не будут иметь права на включение; однако положительного результата на основе одного или обоих анализов достаточно для удовлетворения требований приемлемости (например, положительный по результатам биопсии на основе крови, но отрицательный по ИГХ). Каждый исследователь обязан получить адекватный образец опухоли для анализа сверхэкспрессии FGFR2b для регистрации. Инструкции по обработке, маркировке и отгрузке образца опухолевого микропрепарата или блока опухоли подробно изложены в лабораторном руководстве, которое будет распространяться вместе с комплектом для сбора образцов.
[00337] Сторонние лаборатории будут выполнять анализ экспрессии FGFR2b и амплификации FGFR2 с использованием валидированной ИГХ и анализа на основе крови, соответственно.
[00338] Для части 2, как только будут получены образцы опухоли и крови, анализ будет проведен максимально эффективно, а результаты будут сообщены исследователю или уполномоченному лицу.
1.2 Свежая биопсия опухоли для фармакодинамического анализа
1.2.1 Только часть 2
[00339] Образцы биопсии опухоли также собирают для оценки фармакодинамического эффекта антител к FGFR2-IIIb на микроокружение опухоли. Эти образцы биопсии будут получены до и после лечения для изучения иммунных инфильтратов и экспрессии выбранных опухолевых маркеров. Дополнительная биопсия также может быть получена из опухолей, которые ответили и/или прогрессировали до или после лечения, чтобы понять механизмы резистентности. Образцы биопсии опухоли могут быть оценены в отношении экспрессии иммунных или связанных с заболеванием генов и/или белков, а также в отношении наличия популяций иммунных клеток с использованием различных методологий, включая, но не ограничиваясь ими, ИГХ, кОТ-ПЦР, обнаружение генетической мутации и флуоресцентную гибридизацию in situ (FISH). Эти образцы могут также подвергаться РНК-секвенированию для определения влияния антитела к FGFR2-IIIb на пути экспрессии генов, а также для выявления сигнатур экспрессии генов, связанных с ответом или резистентностью к ответу. Эти анализы могут помочь предсказать будущую реакцию на лечение. Другие методы экспрессии опухолевых биомаркеров также оцениваются.
[00340] Свежая биопсия первичной опухоли или места метастатической опухоли является обязательной, насколько это возможно, для до 30 пациентов, рандомизированных в часть 2 на этапе скрининга (не менее чем за 24 часа до введения дозы) и во время лечения в течение 7 суток до цикла 3, сутки 1 (и как минимум за 24 часа до введения дозы). Для пациентов, которым была выполнена биопсия за 12 недель до регистрации, этот образец может соответствовать требованию для новой биопсии перед лечением при условии наличия адекватного образца для анализа ФД (один парафиновый блок или приблизительно 10 микропрепаратов).
[00341] Пациентам в части 2 может также проводиться дополнительная биопсия во время лечения после задокументированного ответа опухоли, в течение 28 (±7) суток после оценки опухоли. Пациентам в части 2 может также проводиться дополнительная биопсия после лечения во время визита EOT после задокументированного прогрессирования опухоли. В каждом случае консультация со спонсором должна проводиться до того, как будет проведена биопсия. Обе биопсии являются необязательными.
[00342] Исследователь должен оценить возможность получения свежего образца опухоли в каждый момент времени и это должно включать рассмотрение вопроса безопасности пациента. Если исследователь считает, что выполнить биопсию невозможно, то это определение должно быть записано в исходных документах.
[00343] Поражения, из которых был взят биоптат, могут воспаляться, кровоточить или изменяться в размерах, что может привести к неточным измерениям опухоли. Поэтому настоятельно рекомендуется не использовать поражения, из которых был взят биоптат, в качестве мишени при оценке ответа по критериям RECIST v 1.1. Эти образцы биопсии должны быть взяты методом эксцизионной, инцизионной или пункционной биопсии. Тонкоигольные аспираты или другие цитологические образцы недостаточны для последующего анализа биомаркеров. Образцы опухолевой ткани в виде парафинового блока или неокрашенных микропрепаратов будут представлены для центральной оценки методом ИГХ.
1.3 Оценки опухолей
[00344] Оценка опухолей должна состоять из клинического обследования и соответствующих методов визуализации (предпочтительно компьютерная томография с соответствующей толщиной среза согласно RECIST v1.1); другие оценки (МРТ, рентгенография, ПЭТ и УЗИ) могут быть выполнены при необходимости. Те же самые методы, которые использовались для выявления поражений на исходном уровне, должны использоваться для отслеживания одних и тех же поражений на протяжении всего клинического исследования. Скрининговое сканирование опухоли должно проводиться в течение 2 недель после начала лечения на 1 сутки цикла 1.
[00345] Оценка ответа опухоли будет проводиться как исследователем, так и посредством заслепленной центральной радиологической экспертизы в соответствии с рекомендациями RECIST 1.1.
[00346] Сканирование опухолей будет проводиться во время скрининга (в течение 2 недель цикла 1, сутки 1 в части 1 и 2) и в течение 7 суток до начала суток 1 цикла 4, суток 1 цикла 7, суток 1 цикла 10, суток 1 цикла 13, а затем приблизительно каждые 12 недель. Если отмечается CR или PR, подтверждающее сканирование должно быть выполнено через 4-6 недель.
[00347] После прекращения исследуемого лечения по причинам, отличным от прогрессирования или отзыва согласия, оценки опухоли будут проводиться до тех пор, пока пациент не начнет проходить дополнительную противораковую терапию или до прогрессирования.
1.3.1 Биопсия на основе крови (цоДНК)
[00348] В части 1 образцы для анализа биопсии на основе крови (цоДНК) будут собраны до первой дозы исследуемого препарата (суток 1 цикла 1) и проанализированы ретроспективно на предмет амплификации FGFR2.
[00349] В части 2 будет проведен анализ биопсии на основе крови (цоДНК) перед скринингом. Этот образец будет проанализирован проспективно на предмет амплификации FGFR2. Кроме того, анализы биопсии на основе крови (цоДНК) будут собраны в продольном направлении каждые 6 недель от первой дозы в течение 24 недель, а затем приблизительно каждые 12 недель после этого и анализироваться ретроспективно на предмет амплификации FGFR2. Образец также будет собран во время визита EOT у всех пациентов части 2.
1.4 Фармакодинамический анализ биомаркеров с использованием волосяных фолликулов
[00350] Только в части 1, волосяные фолликулы (приблизительно 10, если имеются) из бровей или кожи головы будут собраны у всех пациентов, у которых возможен забор проб. Известно, что волосяные фолликулы экспрессируют рецептор FGFR2b, и изменения в уровнях FGFR2b и нисходящей передачи сигналов могут использоваться для корреляции дозы антитела к FGFR2-IIIb, необходимой для эффективной блокировки рецепторов FGFR2b и нисходящей передачи сигналов, и могут помочь в подборе РД для части 2 исследования.
1.5 Фармакодинамический анализ биомаркеров с использованием крови
[00351] Образцы сыворотки для анализа поисковых биомаркеров пути FGFR (например: FGF7, FGF10) будут собираться у всех пациентов до введения дозы в моменты времени, указанные в Приложении 3.
1.6 Образец крови для цоДНК
1.7 Фармакодинамический анализ биомаркеров с использованием биопсии опухоли
[00352] Уровни инфильтрата иммунных клеток и других поисковых биомаркеров в образцах биопсии опухоли будут проанализированы до и после лечения у всех пациентов.
1.8 Полиморфизм FCGR
[00353] Образцы крови также собирают для выявления полиморфизмов, которые часто встречаются в Fc-гамма-рецепторах, таких как FCGR2A и FCGR3A. Эти гены экспрессируют Fc-гамма-рецепторы на лейкоцитах, которые являются неотъемлемой частью пути АЗКЦ, который является ожидаемым механизмом действия антитела к FGFR2-IIIb. Данные будут собраны для ретроспективного анализа по завершении исследования для корреляции ответа пациента на антитела к FGFR2-IIIb. Эти анализы биомаркеров считаются поисковыми.
1.9 Шкалы качества жизни
[00354] Опросник качества жизни (QoL) EQ-5D-5L и EORTC QLQ-C30 будут применяться несколько раз до введения дозы (временные точки см. в приложении 1).
[00355] Опросник EQ-5D-5L был разработан компанией EuroQol Group, и является стандартизированной мерой для предоставления вспомогательных средств для клинической и экономической оценки. В нем используется описательная система и визуальная аналоговая шкала (VAS). Описательная система имеет 5 категорий: мобильность, самообслуживание, обычные занятия, боль/дискомфорт и тревога/депрессия, и каждая категория имеет 5 уровней: нет проблем, небольшие проблемы, умеренные проблемы, серьезные проблемы и чрезвычайно серьезные проблемы.
[00356] Респондентов просят указать состояние своего здоровья, проставив галочку напротив наиболее подходящего утверждения в каждой из 5 категорий. Цифры для 5 категорий могут быть объединены в 5-значный номер, описывающий состояние здоровья респондента. Состояния здоровья, определенные описательной системой EQ-5D-5L, преобразуют в одно индексное значение для расчета вспомогательных средств. VAS отображает самооценку здоровья респондента на вертикальной 20-см шкале VAS с конечными точками, помеченными как «лучшее состояние здоровья, которое вы можете себе представить» и «худшее состояние здоровья, которое вы можете себе представить».
[00357] Опросник качества жизни (QLQ) Европейской организации по исследованиям и лечению злокачественных опухолей (EORTC) представляет собой интегрированную систему для оценки связанного со здоровьем качества жизни пациентов с раком, участвующих в международных клинических исследованиях. В EORTC используется модульный подход к оценке качестве жизни, состоящий из основного опросника (EORTC QLQ-C30), который необходимо применять, при необходимости, с модулем, специфичным для месторасположения опухоли, метода лечения или измерения качестве жизни (например, специфичным для рака желудка является модуль QLQ-STO22).
[00358] Пациент дает ответы по пяти функциональным шкалам (физическая, ролевая, эмоциональная, социальная и когнитивная), трем шкалам симптомов (усталость, тошнота и рвота, и боль) и глобальной шкале состояния здоровья/качества жизни и шести единичным показателям (одышка, бессонница, потеря аппетита, запор, диарея и финансовые трудности).
1.10 Показатель общего состояния в соответствии с ECOG
[00359] Показатель общего состояния в соответствии с ECOG будет оцениваться у всех пациентов в сроки, указанные в Приложении 1. Показатель общего состояния в соответствии с ECOG - это шкала, используемая для оценки того, как прогрессирует заболевание пациента, для оценки того, как заболевание влияет на повседневную жизнь пациента, и для определения соответствующего лечения и прогноза. Шкала ECOG показана в Приложении 4.
1.11 Фармакокинетические параметры
[00360] Образцы крови для определения концентрации антител к FGFR2-IIIb в сыворотке крови будут собираться у каждого пациента, как указано в блок-схеме исследования для сбора образцов крови для анализа фармакокинетики, иммуногенности и фармакодинамики (Приложение 3).
2. Проведение исследования
2.1 Обзор оценок пациентов
[00361] График подробных оценок пациентов приведен в Приложении 1. Список лабораторных оценок безопасности приведен в Приложении 2. Инструкции по отбору образцов и обработке ФК, ФД данных и данных по иммуногенности приведены в блок-схеме в Приложении 3.
2.2 Оценки и процедуры в рамках исследования по визиту
2.2.1 Период перед скринингом (только часть 2 - перед исследованием)
[00362] Письменное, подписанное информированное согласие (ФИС перед скринингом) должно быть получено до проведения каких-либо специфических для исследования процедур.
Проспективный ИГХ-анализ экспрессии FGFR2b и анализ крови, демонстрирующий амплификацию FGFR2 (см. выше).
2.2.2 Период скрининга (от суток -14 до суток 0)
[00363] Письменное, подписанное информированное согласие должно быть получено до проведения каких-либо специфических для исследования процедур. Пациенты, которые полностью согласились на участие в исследовании, будут проходить скрининговые оценки в течение 14 суток (2 недель) до проведения первой инфузии антител к FGFR2-IIIb. Будут выполнены следующие процедуры:
Рассмотрение/подтверждение критериев приемлемости
Медицинский анамнез и история болезни, включая лекарственный анамнез
Сбор опухолевой ткани из архива или вновь полученного материала (необходим для регистрации в часть 1 и часть 2)
Демографические и исходные характеристики
Полное физикальное обследование, включая измерение массы и роста
Оценка показателя общего состояния в соответствии с ECOG
Измерение показателей жизненно важных функций (артериальное давление, пульс, дыхание и температура тела [°C])
ЭКГ в 12 отведениях после 5 минут отдыха перед регистрацией
Комплексное офтальмологическое обследование
Анализы крови для оценки безопасности (см. Приложение 2.)
Анализ сыворотки крови на беременность (бета-хорионический гонадотропин человека [β-HCG]), за ≤72 часа для женщин с детородным потенциалом.
Общий анализ мочи (включает тест-полоски для определения белка, глюкозы, крови, рН и кетонов)
Оценки опухолей, выполненные в течение 14 суток до начала лечения, включая клиническое обследование и соответствующие методы визуализации, с другими оценками (МРТ, рентгенография, ПЭТ и УЗИ), выполняемыми при необходимости.
Рандомизация только для пациентов части 2
Для до 30 пациентов, рандомизированных в часть 2: Свежая биопсия ткани в месте первичной или метастатической опухоли не менее чем за 24 часа до введения дозы. Для пациентов, которым была выполнена биопсия за 12 недель до регистрации, этот образец может соответствовать требованию для новой биопсии перед лечением при условии наличия адекватного образца для анализа ФД (один парафиновый блок или приблизительно 10 микропрепаратов).
Сбор образцов биопсии на основе крови (цоДНК), как указано в Приложении 3.
Введение FOLFOX (Для части 1 пациенты могут начать химиотерапию по схеме mFOLFOX6 до включения в исследование, и должны быть кандидатом как минимум на 2 цикла химиотерапии по схеме mFOLFOX6, чтобы соответствовать критериям участия. В части 2 пациенты должны пройти 2 цикла химиотерапии по схеме mFOLFOX6 до рандомизации).
Сообщения о НЯ, если применимо
2.2.3 Период лечения
2.2.3.1 Цикл 1, сутки 1
[00364] Будут выполнены следующие процедуры:
Рассмотрение/подтверждение критериев приемлемости
Обновление медицинского анамнеза, истории болезни и лекарственного анамнеза, чтобы зафиксировать любые изменения от момента скрининга
Ограниченное физикальное обследование, включая измерение массы и обследование ротовой полости
Результаты по оценке пациента (EQ-5D-5L и EORTC QLQ-C30)
Измерение показателей жизненно важных функций (артериальное давление, пульс, дыхание и температура тела [°C]) перед введением дозы и через 0,5, 1, 2 и 4 часа от начала инфузии антител к FGFR2-IIIb
Анализы крови для оценки безопасности, с результатами, полученными в течение 72 часов до введения исследуемого препарата, чтобы подтвердить соответствие критериям участия (см. Приложение 2)
Анализ сыворотки крови на беременность (β-HCG), за≤72 часа до введения дозы для женщин с детородным потенциалом.
Общий анализ мочи (включает тест-полоски для определения белка, глюкозы, крови, рН и кетонов)
Забор крови для анализов ФК, анализа на иммуногенность, FCGR, цоДНК и анализа биомаркеров, как описано в Приложении 3.
Сбор образцов биопсии на основе крови (цоДНК): В части 1 образец биопсии на основе крови (цоДНК) будет собран до введения в цикл 1 сутки 1 для ретроспективного анализа. В данный момент от пациентов части 2 образец не требуется.
Только в части 1 образцы волосяных фолликулов кожи головы или бровей (приблизительно 10, если таковые имеются) будут собраны до введения дозы на первые сутки цикла 1 у всех пациентов, у которых возможен отбор проб.
Сообщения о НЯ
Обзор сопутствующей лекарственной терапии
[00365] Введение исследуемого препарата:
Антитела к FGFR2-IIIb вводят путем внутривенной инфузии в течение 30 минут
Химиотерапия по схеме mFOLFOX6 вводят после 30 минут отдыха
2.2.3.2 Цикл 1, сутки 2
[00366] Будут выполнены следующие процедуры:
Измерение показателей жизненно важных функций (артериальное давление, пульс, дыхание и температура тела [°C]) перед введением дозы и через 0,5, 1 и 2 часа от начала инфузии антител к FGFR2-IIIb
Образцы крови для анализов ФК, анализа поисковых биомаркеров будут собраны, как описано в Приложении 3.
Введение mFOLFOX6 продолжается
Сообщения о НЯ
Обзор сопутствующей лекарственной терапии
2.2.3.3 Цикл 1, день 3
[00367] Будут выполнены следующие процедуры:
Измерение показателей жизненно важных функций (артериальное давление, пульс, дыхание и температура тела [°C]) перед введением дозы и через 0,5, 1 и 2 часа от начала инфузии антител к FGFR2-IIIb
Забор крови для анализа ФК как описано в Приложении 3.
Введение mFOLFOX6 продолжается
Сообщения о НЯ
Обзор сопутствующей лекарственной терапии
2.2.3.4 Цикл 1, сутки 8
[00368] Будут выполнены следующие процедуры:
Ограниченное физикальное обследование, включая измерение массы и обследование ротовой полости
Измерение показателей жизненно важных функций (артериальное давление, пульс, дыхание и температура тела [°C]) перед введением дозы и через 0,5, 1 и 2 часа от начала инфузии антител к FGFR2-IIIb
Анализы крови для оценки безопасности, с результатами, полученными в течение 72 часов до введения исследуемого препарата (см. Приложение 2)
Забор крови для анализа ФК как описано в Приложении 3.
Сообщения о НЯ
Обзор сопутствующей лекарственной терапии
2.2.3.5 Цикл 2, сутки 1
[00369] Будут выполнены следующие процедуры:
Ограниченное физикальное обследование, включая измерение массы и обследование ротовой полости
Измерение показателей жизненно важных функций (артериальное давление, пульс, дыхание и температура тела [°C]) перед введением дозы и через 0,5, 1 и 2 часа от начала инфузии антител к FGFR2-IIIb
Анализы крови для оценки безопасности, с результатами, полученными в течение 72 часов до введения исследуемого препарата (см. Приложение 2)
Образец крови для анализа ФК, анализа на иммуногенность и анализа биомаркеров, как описано в Приложении 3.
Сообщения о НЯ
Обзор сопутствующей лекарственной терапии
[00370] Введение исследуемого препарата:
Антитела к FGFR2-IIIb вводили путем внутривенной инфузии в течение 30 минут
Химиотерапия по схеме mFOLFOX6 вводится после 30 минут отдыха
2.2.3.6 Цикл 3, сутки 1 и сутки 1 последующих нечетных циклов
[00371] По завершении периода ДЛТ пациенты могут продолжать получать антитела к FGFR2-IIIb в комбинации с mFOLFOX6, вводимые каждые 2 недели в 14-суточных циклах до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. Не существует максимального количества доз антитела к FGFR2-IIIb. Продолжающееся введение схемы mFOLFOX6 после периода ДЛТ будет проводиться в соответствии с региональным стандартом лечения.
[00372] Будут выполнены следующие процедуры:
Ограниченное физикальное обследование, включая измерение массы и обследование ротовой полости
Оценка показателя общего состояния в соответствии с ECOG
Результаты по оценке пациента (EQ-5D-5L и EORTC QLQ-C30)
Измерение показателей жизненно важных функций (артериальное давление, пульс, дыхание и температура тела [°C]), выполненное перед введением дозы и через 0,5, 1 и 2 часа от начала инфузии антител к FGFR2-IIIb
Комплексное офтальмологическое обследование
Исследования с использованием щелевой лампы без ОКТ для пациентов в части 1 и для пациентов в части 2, рандомизированных для получения антител к FGFR2-IIIb и FOLFOX 6; каждые 6 недель после цикла 2, сутки 1 (до цикла 3, сутки 15, цикла 5, сутки 1 и цикла 6, сутки 15), а затем каждые 12 недель после цикла 6, сутки 15. Продолжать каждые 6-8 недель, если у пациента есть какие-либо персистирующие заболевания роговицы.
Анализы крови для оценки безопасности, с результатами, полученными в течение 72 часов до введения исследуемого препарата (см. Приложение 2)
Анализ мочи на беременность за ≤72 часа до введения дозы для женщин с детородным потенциалом.
Общий анализ мочи (включает тест-полоски для определения белка, глюкозы, крови, рН и кетонов)
Оценки опухолей, выполненные в пределах 7 суток относительно суток 1 цикла 3 и включающие клиническое обследование и соответствующие методы визуализации, с другими оценками (МРТ, рентгенография, ПЭТ и УЗИ), выполняемыми при необходимости
Свежая биопсия первичной опухоли или места метастатической опухоли является обязательной, насколько это возможно, в течение 7 суток до суток 1 цикла 3 (и не менее чем за 24 часа до введения дозы) у около 30 пациентов, рандомизированных в часть 2.
Забор крови для анализов ФК, анализа на иммуногенность, биопсии на основе крови (цоДНК) и анализа биомаркеров, как описано в Приложении 3.
В части 2 образец биопсии на основе крови (цоДНК) будет собран до начала лечения.
Образцы волосяных фолликулов кожи головы или бровей (~10, если таковые имеются)
Сообщения о НЯ
Обзор сопутствующей лекарственной терапии
[00373] Введение исследуемого препарата:
Антитела к FGFR2-IIIb вводят путем внутривенной инфузии в течение 30 минут на сутки 1 каждого цикла
Химиотерапию по схеме mFOLFOX6 вводят после введения антител к FGFR2-IIIb на сутки 1 каждого цикла после 30 минут отдыха.
2.2.3.7 Цикл 4, сутки 1 и сутки 1 последующих четных циклов
[00374] Будут выполнены следующие процедуры:
Ограниченное физикальное обследование, включая измерение массы и обследование ротовой полости
Результаты по оценке пациента (EQ-5D-5L и EORTC QLQ-C30)
Измерение показателей жизненно важных функций (артериальное давление, пульс, дыхание и температура тела [°C]) перед введением дозы и через 0,5, 1 и 2 часа от начала инфузии антител к FGFR2-IIIb
Исследования с использованием щелевой лампы без ОКТ для пациентов в части 1 и для пациентов в части 2, рандомизированных для получения антител к FGFR2-IIIb и FOLFOX 6; каждые 6 недель после цикла 2, сутки 1 (до цикла 3, сутки 15, цикла 5, сутки 1 и цикла 6, сутки 15), а затем каждые 12 недель после цикла 6, сутки 15. Продолжать каждые 6-8 недель, если у пациента есть какие-либо персестирующие заболевания роговицы.
Анализы крови для оценки безопасности, с результатами, полученными в течение 72 часов до введения исследуемого препарата (см. Приложение 2)
Оценки опухолей, выполненные в течение 7 суток до начала суток 1 цикла 4 и включающие клиническое обследование и соответствующие методы визуализации, с другими оценками (МРТ, рентгенография, ПЭТ и УЗИ), выполняемыми при необходимости
В части 2 образец биопсии на основе крови (цоДНК) будет собран до начала лечения.
В части 1 образец крови для анализа ФК будет взят за ≤4 часа до введения дозы антител к FGFR2-IIIb и через 15 минут (± 10 минут) после окончания инфузии антител к FGFR2-IIIb для последующих циклов. Для части 2 образцы для анализа ФК должны быть собраны (только для пациентов, рандомизированных в группу лечения антителами к FGFR2-IIIb и mFOLFOX6) за ≤4 часа до введения дозы антител к FGFR2-IIIb и через 15 минут (± 10 минут) после окончания подачи отчетности о связанных с введением антител к FGFR2-IIIb НЯ
Сообщения о НЯ
Обзор сопутствующей лекарственной терапии
[00375] Введение исследуемого препарата:
Антитела к FGFR2-IIIb вводят путем внутривенной инфузии в течение 30 минут на сутки 1 каждого цикла
Химиотерапию по схеме mFOLFOX6 вводят после введения антител к FGFR2-IIIb на сутки 1 каждого цикла после 30 минут отдыха
2.2.4 Визит завершения лечения или визит досрочного завершения исследования
[00376] Пациенты вернутся в исследовательский центр примерно через 28 (±3) суток после последнего введения исследуемого лечения или в случае досрочного прекращения участия пациента в исследовании. Следующие оценки будут выполнены во время визита завершения лечения:
Ограниченное физикальное обследование, включая измерение массы и обследование ротовой полости
Оценка показателя общего состояния в соответствии с ECOG
Измерение показателей жизненно важных функций (артериальное давление, пульс, дыхание и температура тела [°C] после 5 минут отдыха)
ЭКГ в 12 отведениях после 5 минут отдыха
Комплексное офтальмологическое обследование
Анализы крови для оценки безопасности (см. Приложение 2)
Анализ мочи на беременность, для женщин с детородным потенциалом
Общий анализ мочи (включает тест-полоски для определения белка, глюкозы, крови, рН и кетонов)
Сканирование опухоли, которое может быть опущено, если последнее сканирование было выполнено менее чем за 6 недель до визита EOT или если ранее было определено прогрессирование опухоли
Образец крови для анализа на иммуногенность
Только в части 2 будет взят образец биопсии на основе крови (цоДНК)
Образцы волосяных фолликулов кожи головы или бровей (~10, если таковые имеются)
Образец крови для анализа ФК для всех пациентов в части 1 и всех пациентов, получающих антитела к FGFR2-IIIb в части 2
Образец крови для оценки биомаркеров
Сообщения о НЯ
Обзор сопутствующей лекарственной терапии
[00377] Примечание: После прекращения исследуемого лечения по причинам, отличным от прогрессирования или отзыва согласия, оценки опухоли будут проводиться до тех пор, пока пациент не начнет проходить дополнительную противораковую терапию или до прогрессирования.
2.2.5 Долгосрочное последующее наблюдение
Пациенты как в части 1, так и в части 2 будут проходить длительный период последующего наблюдения на предмет выживания путем осуществления визитов в клинику или по телефону приблизительно каждые 3 месяца ± 28 суток после визита EOT, вплоть до 24 месяцев после включения последнего пациента в исследование, или до смерти, потери для последующего наблюдения, отзыва согласия или прекращения исследования спонсором (в зависимости от того, что наступит раньше).
В течение периода последующего наблюдения, если пациент проходит противораковую терапию, это должно быть задокументировано.
В течение первых 6 месяцев периода последующего наблюдения следует сообщать спонсору о любом случае беременности.
Пациенты должны находиться под наблюдением до смерти, потери для последующего наблюдения, отзыва согласия или прекращения исследования Спонсором.
О серьезных НЯ, возникающих после визита EOT, исследователь должен сообщить Спонсору, если исследователь считает, что существует причинно-следственная связь с исследуемым препаратом.
3. Статистические методы
[00378] Перед блокировкой базы данных будет составлен отдельный план статистического анализа (SAP) с подробным описанием методов анализов, представленным ниже. Любые отклонения от запланированных анализов будут описаны и обоснованы в заключительном сводном отчете об исследовании.
3.1 Пациенты исследования
3.1.1 Распределение пациентов
[00379] Будет представлено количество и процент пациентов, начинающих и завершающих участие в каждой фазе (например, скрининг, цикл 1 и последующие циклы, если таковые имеются) исследования. Причины отзыва также будут обобщены.
3.1.2 Отклонения от протокола
[00380] Будет предоставленасводная информация о количестве и проценте пациентов с серьезными отклонениями от протокола по типу отклонения. Отклонения будут определены в SAP до блокировки базы данных.
3.1.3 Анализируемые популяции
[00381] Для исследования определены следующие анализируемые популяции:
Популяции оценки безопасности - все пациенты, которые получили какую-либо часть хотя бы одну дозу антител к FGFR2-IIIb.
Оцениваемая популяция ДЛТ - все пациенты, включенные в часть 1 исследования, которые получили по меньшей мере 2 дозы антител к FGFR2-IIIb и завершили цикл 1 лечения, или испытали ДЛТ в цикле 1.
Популяция для оценки ФК - все пациенты, которые получили по меньшей мере одну дозу антител к FGFR2-IIIb и имели адекватные оценки ФК, выполненные для определения профиля ФК. Адекватность будет определяться в каждом конкретном случае и будет оцениваться до анализа образцов крови.
Популяция пациентов с назначенным лечением (ITT) - все зарегистрированные пациенты
Популяция, оцениваемая по эффективности - все пациенты, которые соответствовали критериям приемлемости, получили по меньшей мере 1 дозу антител к FGFR2-IIIb и имели по меньшей мере 1 оценку заболевания после исходного уровня
3.2 Общие соображения
[00382] Общее число участников, запланированных для этого исследования, составляет приблизительно 372 пациента. В часть 1 будут включены до 12 пациентов, оцениваемые на предмет любой ДЛТ в соответствии со стандартной схемой 3+3.
[00383] В части 2 эффективность и переносимость будут изучены путем включения примерно 360 пациентов с FGFR2b-селективным раком желудка, рандомизированных в соотношении 1:1 для получения антител к FGFR2-IIIb в комбинации с mFOLFOX6 или плацебо и в комбинации с mFOLFOX6. Соответствующие критериям пациенты будут стратифицированы в соответствии с географическим регионом (США и ЕС, Азия или остальной мир), предыдущим статусом лечения (de novo или адъювантное/неоадъювантное) и измеримым статусом заболевания (измеримым или неизмеримым).
Мощность и размер выборки
[00384] Данное исследование предназначено для обеспечения адекватной мощности для первичного анализа PFS.
[00385] Исходя из mPFS для пациентов, получавших плацебо и mFOLFOX6 в течение 6 месяцев, приблизительно 156 пациентов (рандомизированных в соотношении 1:1) с целевым показателем 96 явлений PFS должны продемонстрировать отношение рисков (HR) 0,5 для mPFS с мощностью 90% (2-сторонний показатель α=0,05) для комбинации антител к FGFR2-IIIb и mFOLFOX6 по сравнению с плацебо и mFOLFOX6 через 24 месяца после включения и 6 месяцев последующего наблюдения.
[00386] Предполагая экспоненциальное распределение PFS, это соответствует увеличению показателя средней PFS с 6 до 12 месяцев. В текущем дизайне минимальным наблюдаемым эффектом, который привел бы к статистической значимости для PFS, является улучшение на 50% (HR=0,67) с 6 до 9 месяцев.
[00387] Это исследование также рассчитано на первичный анализ OS.
[00388] Исходя из mOS для пациентов, получавших плацебо и mFOLFOX6 в течение 10 месяцев, регистрация в исследовании будет продолжаться до приблизительно 360 пациентов с целевым показателем 249 случаев смерти, чтобы продемонстрировать HR 0,7 для mOS с мощностью 80% при общем уровне ошибок типа I 0,05 для комбинации антител к FGFR2-IIIb и mFOLFOX6 по сравнению с плацебо и mFOLFOX6 через 36 месяцев после включения и 10 месяцев последующего наблюдения после регистрации последнего пациента. Групповой последовательный метод будет использоваться для распределения частоты ошибок типа I на основании граничных критериев О'Брайена-Флеминга и частоты ошибок типа II на основании семейства гамма-распределений с параметром -4 при промежуточном и окончательном анализе OS.
[00389] Предполагая экспоненциальное распределение OS, это соответствует увеличению на 43% медианной OS с 10 до 14,3 месяцев. В текущем дизайне минимальным наблюдаемым эффектом, который привел бы к статистической значимости для OS в итоговом анализе, является улучшение на 28% (HR=0,78) с 10 до 12,8 месяцев.
[00390] Оценки мощности и размера выборки были оценены с использованием EAST®(V6.4).
3.3 Демографические данные, характеристики на исходном уровне и сопутствующая лекарственная терапия
[00391] Демографические данные, история болезни, сопутствующие заболевания и сопутствующая лекарственная терапия будут обобщены по когорте и в целом. Чтобы определить, соблюдаются ли критерии для проведения исследования, будут предоставлены соответствующие таблицы и списки. Они будут включать описание пациентов, которые не соответствовали критериям приемлемости, оценку нарушений протокола, учет исследуемого препарата и другие данные, которые могут повлиять на общее проведение исследования.
[00392] Характеристики на исходном уровне будут обобщены для популяции по оценке безопасности. Пациенты, которые умерли или покинули исследование до начала лечения или не завершили необходимые исследования для оценки безопасности, будут описаны и оценены отдельно.
3.4 Соблюдение режима лечения
[00393] Введение лечения будет обобщено по когорте, включая введение дозы, изменения или отсрочки дозы, кумулятивную дозу, среднюю дозу, количество инфузий и продолжительность терапии.
3.5 Анализы эффективности
[00394] В части 1 все анализы будут описательными и будут представлены по группам доз и в целом по мере необходимости. Описательная статистика будет включать количество наблюдений, среднее значение, стандартное отклонение, медиану, диапазон и интерквартильную широту для непрерывных переменных, а также число и процент для категориальных переменных; 95% доверительные интервалы будут представлены там, где это необходимо.
3.5.1 Анализ первичной эффективности
[00395] В части 2 первичный анализ эффективности представляет собой сравнение PFS у пациентов, получавших лечение антителами к FGFR2-IIIb в комбинации с mFOLFOX6 или плацебо и mFOLFOX6.
[00396] Первичная конечная точка, PFS, определяется как время от рандомизации до даты рентгенологического подтверждения прогрессирования заболевания на основе оценки исследователя (согласно RECIST v.1.1) или смерти от любой причины в зависимости от того, что наступит раньше. Вторичные конечные точки эффективности включают OS и ORR.
[00397] Будет проведен промежуточный анализ и первичный анализ PFS, и оба будут основаны на явлениях. Только промежуточный тест PFS будет проводиться при промежуточном анализе после 48 явлений (50% от целевых 96 явлений PFS для первичного анализа PFS), наблюдаемых у зарегистрированных пациентов для исключения HR > 0,806 для комбинации антител к FGFR2-IIIb и mFOLFOX6 по сравнению с плацебо и mFOLFOX6. По оценкам, промежуточный анализ будет проводиться приблизительно через 20 месяцев после включения первого пациента.
[00398] Первичный анализ PFS будет проводиться после того как будет зафиксировано по меньшей мере 96 явлений PFS у первых 156 зарегистрированных пациентов, и будет выполняться с использованием популяции пациентов с назначенным лечением (ITT - intent-to-treat).
[00399] Первичный анализ будет включать случаи рентгенологически подтвержденного прогрессирования по определению исследователем согласно RECIST v.1.1, и случаи смерти.
[00400] Первичный анализ PFS будет проводиться с использованием стратифицированного лог-рангового двухстороннего критерия с уровнем значимости 0,05. Факторы стратификации будут такими же, как и для стратификации графика рандомизации, как описано в интерактивной системе, позволяющей доступ путем телефонного звонка и через Интернет (IXRS).
[00401] Если значение p для стратифицированного лог-рангового критерия является статистически значимым (<0,05, двусторонний) и HR <1, нулевая гипотеза отсутствия различий в PFS будет отвергнута, и будет сделано заключение о том, что PFS является статистически продленным в группе, получавшей антитела к FGFR2-IIIb в комбинации с mFOLFOX6, по сравнению с группой, получавшей плацебо и mFOLFOX6.
[00402] Медиана PFS и соответствующий 95% доверительный интервал для каждой группы лечения будут оцениваться с использованием метода Каплана-Мейера. Отношение рисков (HR=λanti-FGFR2-IIIb+mFOLFOX6/λmFOLFOX6) будет оцениваться с использованием регрессионной модели Кокса с группой лечения в качестве единственного основного эффекта и стратификации с использованием тех же факторов стратификации, которые использовались для лог-рангового критерия. Также будет представлено нестратифицированное HR. Анализ вторичной конечной точки OS будет проводиться, если первичная конечная точка, PFS, является статистически значимой, а формальная гипотеза OS будет проверяться иерархически на уровне 0,05. Уровень ошибок типа I при тестировании первичных и вторичных конечных точек будет строго контролироваться при помощи этой процедуры тестирования с фиксированной последовательностью на уровне 0,05.
3.5.2 Анализ вторичной эффективности
[00403] Анализ вторичных конечных точек, включая OS и ORR, будет проводиться, если первичная конечная точка, PFS, является статистически значимой, а формальные гипотезы OS и ORR будут проверяться иерархически на уровне 0,05. Сначала будет проверена OS, и если она будет значимой, то будет проверена ORR. Уровень ошибок типа I при тестировании первичных и вторичных конечных точек будет контролироваться при помощи этой процедуры тестирования с фиксированной последовательностью на уровне 0,05.
[00404] Планируется промежуточный и окончательный анализ OS, если тест на PFS является статистически значимым. Промежуточный анализ OS будет проводиться во время первичного анализа PFS. В случае проведения анализа OS анализ OS в промежуточный период (т.е., когда наблюдалось по меньшей мере 96 явлений PFS) и в конце (т.е., когда наблюдалось 249 смертей) будет проводиться в популяции ITT.
[00405] Проверка гипотез OS будет проводиться с использованием стратифицированного лог-рангового двухстороннего критерия с уровнем значимости 0,05. Групповой последовательный метод будет использоваться для распределения частоты ошибок типа I на основании граничных критериев О'Брайена-Флеминга и частоты ошибок типа II на основании семейства гамма-распределений с параметром -4 при промежуточном и окончательном анализе OS. Факторы стратификации будут такими же, как и для стратификации графика рандомизации, как описано в IXRS.
[00406] Медиана OS и соответствующий 95% доверительный интервал для каждой группы лечения будут оцениваться с использованием метода Каплана-Мейера. HR будет оцениваться с использованием регрессионной модели Кокса с группой лечения в качестве единственного основного эффекта и стратификации с использованием тех же факторов стратификации, которые использовались для лог-рангового критерия. Также будет представлен нестратифициорованное HR.
[00407] ORR определяется как доля пациентов с частичным или полным ответом по определению исследователем согласно RECIST v.1.1. Первичный анализ ORR будет выполнен среди пациентов с измеримым на исходном уровне заболеванием. При анализе ORR пациенты, которые не имеют адекватных оценок опухоли после исходного уровня, будут учитываться как пациенты, у которых не наблюдается ответа. Формальная проверка гипотезы ORR будет проводиться с использованием стратифицированного критерия Кохрана-Мантеля-Хензеля. Факторы стратификации будут такими же, как и для стратификации графика рандомизации, как описано в IXRS.
3.5.3 Анализ поисковых показателей эффективности
[00408] Конечные точки эффективности исследования включают продолжительность ответа у пациентов, у которых наблюдается ответ, коэффициент 1-летней OS и изменение качества жизни по сравнению с исходным уровнем, измеренным с помощью EQ-5D-5L и EORTC QLQ-C30 для всех зарегистрированных пациентов.
[00409] Продолжительности ответа определяется для пациентов с объективным ответом как время от первого рентгенографического подтверждения объективного ответа на прогрессирование заболевания по RECIST 1.1 или смерть по любой причине. Средняя продолжительность ответа и связанные с ним 95% ДИ будут оцениваться по группе лечения с использованием методов Каплана-Мейера. Разница между группами лечения будет проанализирована с использованием стратифицированного лог-рангового критерия с использованием той же стратификации, которая использовалась для рандомизации.
[00410] Показатель 1-годичной OS, определяемый как доля пациентов, живых на момент времени 1 год, будет оцениваться при анализе общей выживаемости с использованием метода Каплана-Мейера. Дисперсия пропорций будет оценена по формуле Гринвуда. Общее сравнение разницы в 1-летней выживаемости между двумя группами лечения будет рассчитываться с использованием z-статистики, где t=1 год.
[00411] Для изменения в качестве жизни по сравнению с исходным уровнем уровнем, измеренным с помощью EQ-5D-5L и EORTC QLQ-C30, сводные статистические данные об изменении по сравнению с исходным уровнем будут представлены при каждой последующей оценке после исходного уровня и в конце лечения. Различия между группами лечения будут проанализированы с использованием методов анализа повторных измерений, если это применимо.
Ослепленный независимый наблюдательный комитет (BIRC)
[00412] BIRC будет создан для оценки соответствия между оценкой исследователя и оценкой BIRC. Предварительно определенный план аудита будет включен в воображаемый регламент, в то время как процент пациентов, идентификация подгрупп визуализации, критерии аудита всех изображений и сравнение результатов локального обзора и результатов PFS аудита будут подробно описаны.
3.6 Анализы безопасности
[00413] Анализ безопасности будет включать всех пациентов, которые получают любой исследуемый препарат (антитела к FGFR2-IIIb в комбинации с mFOLFOX6 или плацебо и mFOLFOX6) в течение всего периода исследования, и обеспечивают любую информацию о безопасности после лечения. Все НЯ будут закодированы с использованием Медицинского словаря терминологии для регуляторной деятельности (MedDRA). Исследователь будет классифицировать степень тяжести НЯ, используя CTCAE v 4.03.
[00414] Нежелательное явление, возникшее в ходе лечения (НЯВЛ), определяется как любое явление с датой возникновения на дату или после даты введения первой дозы исследуемого препарата или как любое явление, присутствующее до лечения, которое ухудшается после лечения. В сводные таблицы будут включены только НЯВЛ с датой возникновения до даты введения последней дозы + 30 суток. Число и процент пациентов, у которых возникают НЯ, будут обобщены по классу системы органов, предпочтительному термину, причинно-следственной связи с исследуемым препаратом и степени тяжести для каждой группы лечения. Список пациентов будет предоставлен для тех пациентов, у которых наблюдаются СНЯ, включая смерть, или НЯ, связанные с досрочным прекращение участия в исследовании или прекращением приема исследуемого препарата. Данные клинико-лабораторных анализов будут обобщены по типу лабораторных исследований. Количество и процент пациентов, у которых обнаруживаются отклонения от нормы (то есть показатели выходят за пределы диапазонов нормальных значений) и/или клинически значимые отклонения после введения исследуемого препарата, будут представлены для каждого показателя клинико-лабораторных анализов. Для каждого показателя клинико-лабораторных анализов будет предоставлена описательная статистика для исходного уровня и всех последующих запланированных визитов после лечения. Также будут предоставлены изменения от исходного уровня до визитов после лечения. Описательная статистика показателей жизненно важных функций также будет предоставлена аналогичным образом. Кроме того, по группе лечения будет представлен сдвиг от исходного уровня по степени CTCAE (где это применимо) и по отметкам высокого/низкого уровня (в случаях, где степени CTCAE не определены). Никаких формальных сравнений конечных точек безопасности не планируется.
3.7 Фармакокинетические анализы
[00415] ФК параметры будут оцениваться с использованием некомпартментного анализа, хотя при необходимости может быть использован компартментный анализ. Индивидуальные и средние (± SD) данные зависимости концентрации антител к FGFR2-IIIb в сыворотке от времени будут сведены в таблицу и нанесены на график в зависимости от уровня дозы. ФК параметры антител к FGFR2-IIIb будут оцениваться по данным зависимости концентрации исследуемого препарата в сыворотке от времени с использованием метода некомпартментного анализа (NCA) с вводом внутривенной инфузии. Может рассматриваться примирение альтернативных методов. Оцененные индивидуальные и средние (± SD) ФК параметры будут сведены в таблицу и обобщены по уровню дозы. Другие показатели описательной статистики могут быть представлены для данных зависимости концентрации антител к FGFR2-IIIb в сыворотке от времени и оцененных ФК параметров. Пропорциональность дозы, накопление исследуемого препарата и достижение равновесного состояния будут оцениваться, если позволяют данные.
[00416] Будет оценено влияние иммуногенности на воздействие антител к FGFR2-IIIb.
3.8 Промежуточный анализ
[00417] Будет проведен промежуточный анализ PFS, при котором будет проведен только анализ целесообразности PFS после 48 явлений (50% от целевых 96 явлений PFS для первичного анализа PFS), наблюдаемых у первых 156 зарегистрированных пациентов, чтобы исключить HR> 0,806 в PFS для комбинации антител к FGFR2-IIIb и mFOLFOX6 по сравнению с плацебо и mFOLFOX6. Кроме того, запланирован промежуточный анализ OS, если тест на PFS является статистически значимым. Промежуточный анализ OS будет проводиться во время первичного анализа PFS. Если OS будет проанализирована, анализ OS в промежуточный период будет выполнен для популяции ITT, и частота ошибок типа I при промежуточном анализе определяется путем применения затратной альфа-функции О'Брайена-Флеминга в модификации Лан-ДеМетс в зависимости от доли информация (случаи смерти) на момент анализа.
[00418] Кроме того, данные о безопасности будут регулярно проверяться медицинскими мониторами спонсора и CRO. На этапе повышения дозы медицинские мониторы и исследователи будут проверять данные по безопасности для каждой когорты доз до повышения или снижения дозы. Данные о НЯ из всех циклов будут предоставляться медицинским мониторам, когда они будут доступны.
3.9 Изменения в запланированных анализах
[00419] Если имеются расхождения между текстом статистического анализа, как запланировано в протоколе, и окончательным SAP, поправка к протоколу не будет внедрена, а SAP будет иметь преимущественную силу.
Ссылки
Andre F, Ranson M, Dean E, Varga A, Van der Noll R, Stockman P, et al. Results of a phase I study of AZD4547, an inhibitor of fibroblast growth factor receptor (FGFR), in patients with advanced solid tumors. Proc AACR abstract, 2013:LB-145.
Brown A, Courtney C, King L, Groom S, Graziano M. Cartilage dysplasia and tissue mineralization in the rat following administration of a FGF receptor tyrosine kinase inhibitor. Toxicol Pathol, 2005;33:449-455.
Cunningham D, Starling N, Rao S, et al. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2008 (358): 36-46.
Dienstmann R, Bahleda R, Adamo B et al. First-in-human study of JNJ-42756493, a potent pan fibroblast growth factor receptor (FGFR) inhibitor in patients with advanced solid tumors. Proc AACR 2014: 5446 (abstract).
Fuchs C, Tomasek J, Yong C, et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet Oncol, 2014; 383:31-39.
Garg A, Quartino A, Li J, Jin J, Wada DR, Li H, Cortés J, McNally V, Ross G, Visich J, Lum B. Population pharmacokinetic and covariate analysis of pertuzumab, a HER2-targeted monoclonal antibody, and evaluation of a fixed, non-weight-based dose in patients with a variety of solid tumors. Cancer chemotherapy and pharmacology. 2014 Oct 1;74(4):819-29.
Gemo AT, Deshpande AM, Palencia S, Bellovin DI, Brennan TJ et al. anti-FGFR2-IIIb: A therapeutic antibody for treating patients with gastric cancers bearing FGFR2 amplification. Proc AACR 2014: CT325 (abstract).
Han K, Peyret T, Marchand M, Quartino A, Gosselin NH, Girish S, Allison DE, Jin J. Population pharmacokinetics of bevacizumab in cancer patients with external validation. Cancer Chemotherapy and Pharmacology. 2016 Aug 1;78(2):341-51.
Hecht J, Bang Y, Qin S, et al. Lapatinib in combination with capecitabine plus oxaliplatin in human epidermal growth factor receptor 2-positive advanced or metastatic gastric, esophageal, or gastroesophageal adenocarcinoma: TRIO-013/LOGiC - a randomized phase III trial. J Clin Oncol 2015; 34 (5):443-451.
Inoue M, Tsugane. Epidemiology of gastric cancer in Japan. Postgrad Med J. 2005; 81(957): 419-424.
Li J, Qin S, Xu J, et al. 2016. Randomized, double-blind, placebo-controlled phase III trial of Apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction. J Clin Oncol 2016; 34 (14):1448-1454.
Miki, T, Bottaro, DP, Fleming, TP et al. Determination of ligand-binding specificity by alternative splicing: Two distinct growth factor receptors encoded by a single gene. Proc. Natl. Acad. Sci. USA, 1992;89: 246-250.
National Cancer Institute. SEER Stat Fact Sheets: Esophageal Cancer 2015. Available from http seer (dot) cancer (dog) gov (slash) statfacts (slash) html (slash) esoph (dot) html. Accessed February 25, 2016.
Naylor GM, Gotoda T, Dixon M, et al. Why does Japan have a high incidence of gastric cancer? Comparison of gastritis between UK and Japanese patients. Gut. 2006; 55(11): 1545-1552.
Neugat AI, Hayek H, Howe G. Epidemiology of gastric cancer. Semin Oncol 1996;23:281-91.
Sequist LV, Cassier P, Varga A, et al. Phase I study of BGJ398, a selective pan FGFR inhibitor in genetically preselected advanced solid tumors. Proc AACR 2014: CT326 (abstract).
Shinkawa T, Nakamura k, Yamane N, Shoji-Hosaka E, Kanda Y et al. The absence of fucose but not the presence of galactose or bisecting N-acetylglucosamine of human IgG1 complex-type oligosaccharides shows the critical role of enhancing antibody-dependent cellular cytotoxicity. JBC, 2003; 278:3466-3473.
Takahashi T, Saikawa Y, Kitagawa Y. Gastric cancer: current status of diagnosis and treatment. Cancers 2013; 5(1): 48-63.
Thuss-Patience, P., A. Kretzschmar, D. Bichev, et al. Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer- A randomised phase III study of the Arbeitsgemeinschaft Internistische Onkologie (AIO). Eur J Cancer 2011; 47:2306-2314.
Turner N, Grose R. Fibroblast growth factor signaling: from development to cancer. Nature, 2010;10:116-129.
Ueda S, Hironaka S, Yasui H, et al. Randomized phase III study of irinotecan (CPT-11) versus weekly paclitaxel (wPTX) for advanced gastric cancer (AGC) refractory to combination chemotherapy (CT) of fluoropyrimidine plus platinum (FP): WJOG4007 trial, J Clin Oncol (Meeting Abstracts). 2012, vol. 3
Waddell T, Verheij M, Allum W, Cunningham D, Cervantes A, Arnold D. Gastric cancer: ESMO-ESSO-ESTRO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 2013 Oct 1;24(suppl 6):vi57-63.
Wu, Y-M, Su, F, Kalyana-Sundaram S, Identification of Targetable FGFR Fusions in Diverse Cancers. Cancer Discovery, 2013;3:636-647.
Список аббревиатур и определений
Таблица 5: Оценка фармакокинетических параметров антитела к FGFR2-IIIb (среднее значение ± SD) с использованием некомпартментного анализа для пациентов, включенных в исследование антител к FGFR2-IIIb-001, часть 1, после первой дозы
кг)
(мкг/мл)
(сутки*
мкг/мл)
(сутки*мк/
мл)/мг)
Примечание. Cmax 1=максимальная наблюдаемая концентрация в сыворотке после первой дозы; Cmax 1/доза=Cmax 1, нормализованная по введенной дозе; Ctrough 1=наблюдаемая концентрация в сыворотке в конце первого интервала дозирования; AUClast=площадь под наблюдаемой кривой зависимости концентрация-время от времени дозирования до последней количественно определяемой концентрации после введения первой дозы; AUClast/Dose=AUClast, нормализованная по введенной дозе; и t1/2=конечный период полувыведения.
NC=сводная статистика, которая не может быть представлена как 2 из 3 пациентов с Ctrough 1 ниже LLOQ; ND=ФК параметр, который не может быть точно определен. an=3. Данные от 1 пациента не могут быть представлены, потому что участие пациента было прекращено без получения данных о C1D15 из исследования; bn=2. Характеристики терминальной фазы были получены для менее чем одного периода полувыведения у 1 из 3 пациентов. Таким образом, данные для этого пациента были исключены из сводной статистики для периода полувыведения, как предусмотрено в плане анализа данных; c Один из 6 пациентов в исследовании получил частичную дозу, а параметры были исключены из сводной статистики; и dn=3. Характеристики терминальной фазы были получены для менее чем одного периода полувыведения у 2 из 5 пациентов. Таким образом, эти пациенты были исключены из сводной статистики для периода полувыведения, как предусмотрено в плане анализа данных.
Приложение 1: График оценок - вводная фаза для оценки безопасности при повышении дозы (часть 1) и расширение дозы (часть 2)
Циклы 1 и 2
Цикл 3, цикл 4 и последующие циклы
1-е сутки
1-е сутки
Приложение 2: Лабораторные оценки
Следующие лабораторные параметры будут определены в соответствии с Графиком оценок:
Общий анализ крови (CBC) с лейкоцитарной формулой:
лейкоциты (WBC) тромбоциты
АЧН гемоглобин
нейтрофилы (%) гематокрит
эозинофилы (%) эритроциты (RBC)
базофилы (%) индексы эритроцитов:
лимфоциты (%) средний корпускулярный объем (MCV)
моноциты (%) содержание гемоглобина в одном эритроците (MCH)
средняя концентрация гемоглобина в эритроците (MCHC)
Тест-полоска (внешний вид, цвет, pH, удельный вес, кетоны, белок, глюкоза, билирубин, нитрит, уробилиноген и скрытая кровь)
Если анализ при помощи тест-полоски положительный (2+ или выше) на наличие крови или белка, выполните микроскопическое исследование.
Альбумин глобулин
щелочная фосфатаза глюкоза
АЛТ (СГПТ) лактатдегидрогеназа (ЛДГ)
АСТ (СГОТ) фосфат
азот мочевины в крови (АМК) калий
натрий кальций
хлорид общий билирубин
углекислый газ (CO2 [бикарбонат]) общий холестерин
общий белок креатинин
прямой билирубин мочевая кислота
Приложение 3: Блок-схема сбора образцов крови для анализа фармакокинетики, иммуногенности и фармакодинамики для части 2
Последующее наблюдение
Приложение 4: Показатель общего состояния в соответствии с ECOG
Пример 2. Исследование фазы 1/3 по изучению антитела к FGFR2-IIIb в сочетании с модифицированным FOLFOX6 у пациентов с ранее нелеченным распространенным раком желудка или гастроэзофагеальным раком
Краткое изложение содержания протокола
[00420] Это исследование представляет собой разновидность исследования, описанного в Примере 1, и представляет собой многоцентровое исследование для оценки безопасности, переносимости, эффективности, ФК и ФД антитела к FGFR2-IIIb при введении в комбинации с mFOLFOX6. Исследование будет включать в себя открытую, вводную фазу для оценки безопасности у пациентов с опухолями ЖКТ (не FGFR2-селективными), за которыми следует рандомизированная, открытая фаза 3, у пациентов с FGFR2-селективным РЖ (определяемым при помощи проспективного ИГХ анализа сверхэкспрессии FGFR2b и/или анализа крови цоДНК, демонстрирующего амплификацию гена FGFR2). После начального периода скрининга пациенты будут проходить лечение по схеме mFOLFOX6 в комбинации с антителами к FGFR2-IIIb или только по схеме mFOLFOX6 в течение двухнедельных циклов.
Фаза 1: Вводная фаза для оценки безопасности при повышении дозы
[00421] Фаза 1 - это открытое исследование с повышением дозы антитела к FGFR2-IIIb в комбинации с mFOLFOX6. Соответствующие критерия участия пациенты должны будут иметь неоперабельный, локально распространенный или метастатический рак ЭКТ любого типа и должны быть кандидатами на получение как минимум 2 доз химиотерапии по схеме mFOLFOX6. Статус FGFR2 не является обязательным требованием для регистрации. Статус FGFR2 будет проверяться ретроспективно методом ИГХ (если имеется ткань) и будет получен образец для анализа цоДНК в крови.
[00422] Фаза 1 состоит как минимум из двух когорт дозирования антител к FGFR2-IIIb в комбинации с mFOLFOX6 для определения РД антител к FGFR2-IIIb, которую следует вводить в комбинации с mFOLFOX6 в фазе 3. Пациенты, возможно, начали или еще не начали или ранее получали химиотерапию по схеме mFOLFOX6. Не существует верхнего предела количества предыдущих доз mFOLFOX6, которые могли получать пациенты.
[00423] Каждый зарегистрированный пациент будет наблюдаться в течение 28 суток (период ДЛТ), начиная с первых суток (цикл 1, сутки 1 [сутки исследования 1]) лечения антителами к FGFR2-IIIb для оценки безопасности, ФК и возникновения дозолимитирующей токсичности. Когорты пациентов будут проходить лечение возрастающими дозами антител к FGFR2-IIIb в комбинации со стандартной дозой химиотерапии по схеме mFOLFOX6 в течение 2-недельных циклов.
Введение антител к FGFR2-IIIb
[00424] Антитела к FGFR2-IIIb вводят в/в каждые 2 недели на сутки 1 каждого цикла (2 недели=1 цикл) и до химиотерапии по схеме mFOLFOX6. Пациенты, проходящие лечение в когорте 2, получат только одну дополнительную дозу антител к FGFR2-IIIb на сутки 8 цикла 1 (mFOLFOX6 не будет вводиться в эти сутки). Антитела к FGFR2-IIIb будут вводить в виде внутривенной инфузии в течение приблизительно 30 минут через периферическую вену или центральный венозный катетер. Набор для внутривенного введения для инфузии антител к FGFR2-IIIb должен содержать встроенный фильтр с размером пор 0,22 мкм или шприцевой фильтр с размером пор 0,22 мкм.
Введение mFOLFOX6
[00425] Введение химиотерапии по схеме mFOLFOX6 также начинается на сутки 1 цикла 1 (сутки исследования 1) каждого цикла лечения через 30 минут после окончания инфузии антитела к FGFR2-IIIb. mFOLFOX6 будет вводиться каждые 2 недели следующим образом: - Сутки 1: Оксалиплатин 85 мг/м2 в/в инфузия в течение 120 минут, - Сутки 1: Лейковорин в/в инфузия 400 мг/м2 в течение 120 минут может вводиться одновременно с оксалиплатином при использовании Y-образного соединителя, если не используется Y-образный соединитель, вводить последовательно, - Сутки 1: Сразу после оксалиплатина и лейковорина, 5 ФУ 400 мг/м2 путем болюсной инъекции в течение приблизительно 5 минут, - Сутки 1: Сразу после болюсной инъекции 5-ФУ, 5-ФУ 2400 мг/м2 в виде непрерывной в/в инфузии в течение 46 часов.
[00426] После 28-суточного периода ДЛТ пациенты могут получать дозы или получать уменьшенные дозы mFOLFOX6 или антител к FGFR2-IIIb на основании анализа токсичности. Премедикация может использоваться по усмотрению исследователя в соответствии с местным стандартом лечения.
Когорты фазы 1
[00427] В фазе 1 первая когорта дозирования антител к FGFR2-IIIb, подлежащая анализу составляет 6 мг/кг. Ожидаемые уровни доз: - Когорта 1: 6 мг/кг антител к FGFR2-IIIb каждые 2 недели; - Когорта 2: 15 мг/кг антител к FGFR2-IIIb каждые 2 недели; 1 доза 7,5 мг/кг на сутки 8 (только цикл 1); - Когорта 3 (при необходимости): 15 мг/кг антител к FGFR2-IIIb каждые 2 недели; - Когорта 4 (при необходимости): Уровень дозы ниже, чем в когорте 3, но выше, чем в когорте 1 для достижения переносимости при оптимальном целевом воздействии.
[00428] Если в первой когорте в дозе 6 мг/кг устраняется 28-суточный период ДЛТ, вторая когорта дозирования в дозе 15 мг/кг каждые 2 недели с дозой 7,5 мг/кг на сутки 8 (только цикл 1) будет протестирована в дизайне 6 и будет включено 6 пациентов. Решения о повышении дозы будут основаны на оценке ДЛТ, общей безопасности и переносимости. Решения о повышении дозы будут приниматься после завершения последним пациентом, включенный в каждую когорту, 28-суточного периода ДЛТ (завершение 2 циклов лечения антителами к FGFR2-IIIb и mFOLFOX6). Решения о повышении дозы будут согласованы Наблюдательным комитетом по оценке когорт (CRC), в состав которого входят спонсор и исследователи. Если в когорте 2 наблюдаются ≥ 2 ДЛТ, уровень дозы между когортами 1 и 2 может быть оценен (когорта 3) в дизайне 6 (15 мг/кг каждые 2 недели). Если в когорте 3 наблюдаются ≥ 2 ДЛТ, уровень дозы ниже, чем в когорте 3, но выше, чем в когорте 1, может быть оценен (когорта 4) в дизайне 6. ДЛТ определяются как любое из следующих явлений, которое по мнению исследователя относится к введению антител к FGFR2-IIIb.
АЧН <0,5 × 109/л >5 суток или фебрильная нейтропения (т. е. АЧН <1,0 × 109/л с одним случаем повышения температуры >38,3°С или лихорадкой >38°С в течение более 1 часа). Использование G-CSF разрешено в соответствии со стандартами учреждения
Тромбоциты <25 × 109/л или тромбоциты <50 × 109/л с кровотечением, требующим медицинского вмешательства
Длительная тромбоцитопения (>3 суток) <50 × 109/л тромбоцитов
Анемия 4-й степени (то есть опасные для жизни последствия; показано срочное вмешательство)
Любое офтальмологическое НЯ 2-3-й степени, которое не проходит в течение 7 суток
Офтальмологическое НЯ 4-й степени
АСТ/АЛТ >3x ВПН и сопутствующий уровень общего билирубина >2x ВПН, не связанные с поражением печени раком
Любое негематологическое НЯ 3-й степени или выше (кроме тошноты, рвоты и диареи).
Тошнота, рвота или диарея 3-й степени, которые не проходят при поддерживающей терапии в течение 72 часов.
Лабораторные показатели 3-й степени, которые не имеют клинической значимости по согласованию между исследователем и спонсором, если они не разрешаются в течение 72 часов.
Тошнота, рвота или диарея 4-й степени
Любое отклонение от нормы в лабораторных показателях 4-й степени.
[00429] Следующий алгоритм, представленный в Таблице 6 ниже, будет использоваться для принятия решения о повышении дозы:
Таблица 6: Алгоритм повышения дозы
[00430] РД антител к FGFR2-IIIb для фазы 3 будет определена CRC на основе оценки общей безопасности, переносимости и ФK и не будет превышать 15 мг/кг, будет вводиться внутривенно каждые 2 недели с 1 дозой 7,5 мг/кг только на сутки 8 цикла 1. При определении РД CRC будет учитывать токсичность, наблюдаемую в течение периода оценки ДЛТ, любую токсичность, наблюдаемую после периода оценки ДЛТ, а также снижение дозы и прекращение введения mFOLFOX6 или антител к FGFR2-IIIb по причине токсичности, которая не соответствует критериям ДЛТ. Выбранная на основании совокупности данных РД антител к FGFR2-IIIb будет представлять собой дозу, которая, как ожидается, не приведет к снижению интенсивности лечения по схеме mFOLFOX6, которое подлежит введению. Следовательно, РД может совпадать или не совпадать с определенной максимально переносимой дозой (MTD - maximum tolerated dose). Например, если MTD не достигнута или если данные из последующих циклов лечения из фазы 1 дают дополнительное представление о профиле безопасности, тогда РД может быть другой, хотя и не более высокой, чем MTD.
[00431] MTD определяется как максимальная доза, при которой <33% пациентов испытывают ДЛТ (дозолимитирующую токсичность) в течение периода ДЛТ. Если ДЛТ наблюдается у 1 из 3 пациентов в когорте 1, тогда еще 3 пациента будут включены с тем же уровнем дозы. Повышение дозы может продолжаться до тех пор, пока у 2 из 3-6 пациентов, получающих лечение на уровне дозы, не возникнет ДЛТ (уровень дозы не должен превышать наивысший уровень дозы, переносимый в фазе 1). Тогда следующая более низкая доза будет считаться MTD.
Дизайн исследования
[00432] После начала регистрации в когорте 2 (когорта с дозой 15 мг/кг каждые 2 недели с 1 дозой 7,5 мг/кг на сутки 8 [только цикл 1]), 6 пациентов будут включены в исследование для изучения безопасности и эффективности. Общий набор для фазы 1 будет составлять приблизительно от 9 до 21 пациентов.
[00433] Любой пациент, который не получает полного количества доз антител к FGFR2-IIIb, как определено по когорте, и 2 полных доз mFOLFOX6 в течение периода ДЛТ по причине, которая не является ДЛТ или НЯ, связанной с введением антител к FGFR2-IIIb, будет считаться не поддающимся оценке, и пациент будет заменен. Замененный пациент может продолжить участие в исследовании по усмотрению исследователя и после обсуждения со спонсором. В течение 28-суточного периода ДЛТ не следует вводить дополнительные дозы антител к FGFR2-IIIb или более 2 доз по схеме mFOLFOX6. Нет необходимости синхронизировать дозы антител к FGFR2-IIIb и mFOLFOX6 на сутки 1 цикла 2. Например, если происходит отсрочка введения mFOLFOX6 по причине НЯ, которое считается связанным только с mFOLFOX6, а не с антителом к FGFR2-IIIb, антитело к FGFR2-IIIb следует вводить в соответствии с графиком для циклов 1 и 2 независимо от отсрочек в графике дозирования mFOLFOX6.
[00434] По завершении периода ДЛТ пациенты могут продолжить получать антитело к FGFR2-IIIb в комбинации с mFOLFOX6 по усмотрению исследователя. Дополнительные виды лечения могут назначаться каждые 2 недели (цикл 1) до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения.
[00435] В случае отсрочки применения цикла по схеме mFOLFOX6 более чем на 2 недели по причине токсичности, связанной с химиотерапией в течение первых 3 циклов лечения (42 суток), антитело к FGFR2-IIIb следует вводить по графику (± 3 суток). После первых 3 циклов введение антитела к FGFR2-IIIb может быть отложено до ± 7 суток для синхронизации с введенным mFOLFOX6. Не существует обязательного максимального количества доз антитела к FGFR2-IIIb или mFOLFOX6. Продолжающееся введение схемы mFOLFOX6 после периода ДЛТ будет проводиться в соответствии со следующим графиком:
Начальная доза mFOLFOX6 включает 85 мг/м2 оксалиплатина, 400 мг/м2 фолината кальция (фолиновой кислоты), 400 мг/м2 болюсной дозы 5-ФУ и 2400 мг/м2 инфузионной дозы фторурацила, вводимой в течение 46 часов.
Схема mFOLFOX6 будет вводиться каждые 2 недели (± 3 суток) до подтверждения прогрессирования заболевания, оцененного исследователем посредством радиографического исследования (только фаза 3) или клинического прогрессирования заболевания (только фаза 1), появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения.
Сутки 1: Оксалиплатин 85 мг/м2 в/в инфузия в течение 120 минут
Сутки 1: Лейковорин в/в инфузия 400 мг/м2 в течение 120 минут может вводиться одновременно с оксалиплатином при использовании Y-образного соединителя, если не используется Y-образный соединитель, вводить последовательно
Сутки 1: Сразу после оксалиплатина и лейковорина, 5 ФУ 400 мг/м2 путем болюсной инъекции в течение приблизительно 5 минут
Сутки 1: Сразу после болюсной инъекции 5-ФУ, 5-ФУ 2400 мг/м2 в виде непрерывной в/в инфузии в течение 46 часов.
[00436] Любые изменения текущего введения mFOLFOX6 могут проводиться в соответствии со следующими рекомендациями:
Если изменение массы тела составляет не менее 10%, дозы следует пересчитать.
Порекомендуйте пациентам избегать воздействия холодной погоды во время и в течение примерно 72 часов после каждой инфузии.
Проведите коррекцию гипокалиемии и гипомагниемии до начала введения оксалиплатина.
Тяжелая диарея, мукозит и миелосупрессия после введения 5-ФУ должны стать причиной проведения оценки на предмет дефицита дигидропиримидиндегидрогеназы.
Доза лейковорина вводится в виде d, l-рацемической смеси. Используйте половину дозы для ЛЕВО-лейковорина (l-лейковорин)
В случае, если введение оксалиплатина прекращено по любой причине до прогрессирования заболевания, терапия 5-ФУ/лейковорином может продолжаться каждые 2 недели до прогрессирования заболевания, неприемлемой токсичности или другой причины для прекращения исследования. В случае, если терапия 5ФУ/лейковорином прекращена, тогда следует прекратить введение оксалиплатина.
[00437] Некоторые корректировки доз при токсичности mFOLFOX6 показаны в таблице 7.
Таблица 7: Снижение дозы и отсрочки в случае химиотерапии по схеме mFOLFOX6
*При повторном возникновении токсичности той же степени после снижения дозы; рассмотрите возможность окончательной отмены. Обратите внимание, что если 5-ФУ окончательно отменить, оксалиплатин и лейковорин также следует окончательно отменить. (Адаптировано из Cheeseman 2002, Hochster 2008, Teva Parenteral Medicines Inc. 2016, Teva Parenteral Medicines Inc. 2014, Teva Pharmaceuticals USA 2012.)
[00438] В части фазы 1 исследования, если антитело к FGFR2-IIIb по какой-либо причине будет окончательно отменено, пациент пройдет визит окончания лечения (EOT) в рамках периода последующего наблюдения приблизительно через 28 суток после последней дозы антитела к FGFR2-IIIb. Дальнейшее последующее наблюдение за этими пациентами проводиться не будет, а визит окончания лечения антителами к FGFR2-IIIb в рамках периода последующего наблюдения является окончанием исследования. В случае отмены mFOLFOX6 по какой-либо причине, отличной от прогрессирования по оценке исследователя или по любому из других указанных в протоколе критериев отмены, введение антитела к FGFR2-IIIb может быть продолжено в качестве монотерапии по усмотрению исследователя.
Рандомизированная открытая часть фазы 3
[00439] Регистрация в фазу 3 начнется, когда CRC определит РД для антитела к FGFR2-IIIb, которая не будет превышать самый высокий уровень дозы, оцененный и переносимый в фазе 1. Пациенты могут зарегистрироваться либо в фазу 1, либо в Фазу 3, но могут не участвовать в обеих фазах исследования. Открытие части фазы 3 исследования для набора будет проводиться на усмотрение спонсора.
[00440] Согласно критериям приемлемости необходимо, чтобы пациенты имели неоперабельный локально распространенный или метастатический РЖ, были кандидатами на проведение химиотерапии по схеме mFOLFOX6 в качестве стандартной терапии первой линии и имели опухоль, которая является FGFR2-положительной по результатам централизованного ИГХ исследования ткани и/или анализа цоДНК в крови. Форма информированного согласия (ФИС) перед скринингом должна быть подписана пациентами до предоставления ткани (архивной или свежей) и образца крови для анализа на FGFR2. Поскольку получение результатов централизованного анализа на FGFR2 может занять приблизительно 2 недели, пациентам разрешается получить 1 дозу mFOLFOX6 в течение этого промежуточного периода (периода перед скринингом) по усмотрению исследователя. Эта 1 доза химиотерапии не является обязательной для исследования и не считается частью этого клинического исследования.
[00441] Пациенты, у которых опухоли дали положительный результат на FGFR2b по ИГХ и/или положительный результат на амплификацию гена FGFR2 по анализу цоДНК в крови, могут дать согласие на полное участие в исследовании (подписать ФИС на полное исследование) и войти в период скрининга. Время между подписанием ФИС на полное исследование и регистрацией в исследовании считается периодом скрининга (до 21 суток). В течение периода скрининга пациент будет проходить скрининговые процедуры, указанные в протоколе, чтобы убедиться, что все критерии приемлемости выполнены.
[00442] Часть фазы 3 исследования является рандомизированной, открытой и включает 548 пациентов с FGFR2-селективным РЖ, рандомизированных в соотношении 1:1 для получения РД антитела к FGFR2-IIIb в комбинации с mFOLFOX6 в сравнении с mFOLFOX6 для оценки эффективности комбинации. Пациенты должны получить первое введение исследуемого лечения в течение 3 суток после рандомизации. Группы лечения состоят из: - Группа 1: введение антитела к FGFR2-IIIb в комбинации с mFOLFOX6 каждые 2 недели, или - Группа 2: введение mFOLFOX6 каждые 2 недели.
[00443] Отмена любого компонента исследуемого лечения (mFOLFOX6, компонента mFOLFOX6 или антитела к FGFR2-IIIb) по любой причине, кроме прогрессирования заболевания, не требует отмены других компонентов. Исключением является отмена 5-ФУ по любой причине, которая требует отмены оксалиплатина и лейковорина. Может быть обеспечено продолжающееся введение схемы mFOLFOX6, как обсуждалось выше.
[00444] Для первых 3 циклов лечения антитело к FGFR2-IIIb следует вводить по графику (± 3 суток) независимо от отсрочек в лечении по схеме mFOLFOX6. В случае отсрочки введения mFOLFOX6 после первых 3 циклов антитела к FGFR2-IIIb может быть отсрочка в ведении антитела к FGFR2-IIIb до 7 суток для синхронизации с введением mFOLFOX6. Однако синхронизация введения антитела к FGFR2-IIIb и mFOLFOX6 не является обязательным требованием протокола. Если через 7 суток пациент все еще не может получить mFOLFOX6, следует продолжать введение ИЛП в качестве монотерапии каждые 2 недели (± 3 суток).
[00445] Пациенты, которые прекращают получать все исследуемое лечение (все компоненты антитела к FGFR2-IIIb и mFOLFOX6) по любой причине, кроме отзыва согласия, будут проходить визит EOT с целью оценки безопасности в рамках последующего наблюдения приблизительно через 28 суток после последней дозы последнего введенного компонента лечения (оксалиплатин, лейковорин, 5-ФУ или антитело к FGFR2-IIIb).
[00446] Тем не менее пациенты, которые прекращают исследуемое лечение (антитело к FGFR2-IIIb и/или mFOLFOX6) по причинам, отличным от прогрессирования заболевания или отзыва согласия, будут продолжать проходить оценки опухоли в соответствии с графиком протокола до рентгенологически подтвержденного прогрессирования или начала дополнительной противораковой терапии, после чего они должны были пройти длительное последующее наблюдение для оценки выживаемости.
[00447] Долгосрочное последующее наблюдение для оценки выживаемости будет завершено посредством визита в клинику, телефонного звонка или использования реестров пациентов (в соответствии с национальным законодательством и действующими законами о защите данных) приблизительно каждые 3 месяца (± 1 месяц) после визита EOT, вплоть до 24 месяцев после включения последнего пациента в исследование, или до смерти, потери для последующего наблюдения, отзыва согласия или прекращения исследования спонсором (в зависимости от того, что наступит раньше).
Критерии включения для фазы 1 и фазы 3
[00448] Пациенты, зачисляемые в часть 1 или часть 3 исследования, также должны соответствовать всем следующим критериям включения:
Неоперабельное, локально распространенное или метастатическое заболевание
Понимать и подписать форму информированного согласия (ФИС), ободренную экспертным советом медицинского учреждения (IRB) / независимым комитетом по этике (IEC), перед любой оценкой, проводимой для исследования
Ожидаемая продолжительность жизни не менее 3 месяцев, по мнению исследователя
Показатель общего состояния в соответствии с Восточной кооперативной онкологической группой (ECOG) от 0 до 1
Возраст ≥18 лет на момент подписания ФИС
Отрицательный тест на беременность сывороточного β-хорионического гонадотропина человека (β-ХГЧ) за ≤96 часов до лечения (только женщины с детородным потенциалом) в цикле 1, сутки 1
Для сексуально активных пациентов (женщин с детородным потенциалом и мужчин) готовность использовать 2 эффективных метода контрацепции, из которых 1 должен быть барьерным методом (презерватив, диафрагма или колпачок на шейку матки/влагалищный колпачок) в течение 6 месяцев после последней дозы антитела к FGFR2-IIIb. Другие эффективные формы контрацепции включают в себя:
Постоянная стерилизация (гистерэктомия и/или двусторонняя овариэктомия, или двустороннее перевязывание маточных труб хирургическим вмешательством или вазэктомия) по крайней мере за 6 месяцев до скрининга
Женщины с детородным потенциалом, которые находятся на стабильной пероральной терапии контрацептивами или имеют внутриматочное или имплантируемое устройство в течение не менее 90 суток до начала исследования или воздерживаются от половых отношений в качестве образа жизни
Адекватная гематологическая и биологическая функция, подтвержденная следующими лабораторными показателями в течение 96 часов цикла 1 сутки 1.
Функция костного мозга
Абсолютное количество нейтрофилов (АЧН)≥1,5 × 109/л
Тромбоциты ≥100 × 109/л
Гемоглобин ≥9 г/дл
Функция печени
Аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ) <3 × раза превышают верхний предел нормы (ВПН); в случае метастазов в печень, то <5 ×ВПН
Билирубин <1,5 × ВПН
Функция почек
Расчетный клиренс креатинина с использованием формулы Кокрофта-Голта ≥50 мл/мин.
Пациенты, получающие полнодозовые антикоагулянты, должны принимать стабильную дозу варфарина в течение 6 недель до включения и иметь международное нормализованное отношение (МНО) в пределах терапевтического диапазона для лечения состояния пациента или принимать стабильную дозу низкомолекулярного гепарина.
Измеримое или неизмеримое заболевание
Пациенты, зачисляемые в часть 1 исследования, также должны соответствовать следующим критериям включения:
Гистологически или цитологически подтвержденное злокачественное новообразование ЖКТ, для которых схема mFOLFOX6 считается подходящим лечением (например, РЖ, колоректальный рак, аденокарцинома поджелудочной железы)
Опухолевая ткань (при наличии) для определения сверхэкспрессии FGFR2b методом ИГХ.
Пациент должен быть кандидатом на получение по меньшей мере 2 доз химиотерапии по схеме mFOLFOX6 в указанных ниже дозах и они должны соответствовать указанным выше рекомендациям по токсичности:
Введение химиотерапии по схеме mFOLFOX6 будет начинаться на сутки 1 цикла 1 (сутки исследования 1) каждого цикла лечения через 30 минут после окончания инфузии антитела к FGFR2-IIIb/mFOLFOX6 будет вводиться каждые 2 недели следующим образом:
Сутки 1: Оксалиплатин 85 мг/м2 в/в инфузия в течение 120 минут.
Сутки 1: Лейковорин в/в инфузия 400 мг/м2 в течение 120 минут может вводиться одновременно с оксалиплатином при использовании Y-образного соединителя. Если Y-образный соединитель недоступен, вводить последовательно.
Сутки 1: Сразу после оксалиплатина и лейковорина, 5 ФУ 400 мг/м2 путем болюсной инъекции в течение приблизительно 5 минут.
Сутки 1: Сразу после болюсной инъекции 5-ФУ, 5-ФУ 2400 мг/м2 в виде непрерывной в/в инфузии в течение 46 часов. После первой дозы пациентам может быть проведено снижение доз, могут возникнуть отсрочки или препарат может быть отменен на основе токсичности в соответствии с рекомендациями.
[00449] Пациенты, зачисляемые в часть 3 исследования, также должны соответствовать следующим критериям включения:
Гистологически подтвержденная аденокарцинома желудка или гастроэзофагеального перехода (определяемая как 5 см проксимально и дистально от ГЭП)
Рентгенографическое исследование органов грудной клетки, брюшной полости и таза (предпочтительно компьютерная томография (КТ), приемлемо магнитно-резонансная томография (МРТ)), выполненное в течение 28 суток после C1D1
Опухолевая ткань на предмет сверхэкспрессии FGFR2b, определяемой с помощью централизованно выполненного ИГХ исследования, и/или амплификации гена FGFR2, определяемой с помощью централизованно выполненного анализа ктДНК на основе крови
Пациент должен быть кандидатом на химиотерапию по схеме mFOLFOX6
Предварительная химиотерапия для лечения метастатического или неоперабельного заболевания (за исключением максимально 1 дозы mFOLFOX6, вводимой во время ожидания результатов анализа на FGFR2 в течение предскринингового периода) не проводилась
Предварительная химиотерапия на основе платины (за исключением случаев, отмеченных в критериях включения № 18) не проводилась
Если проводилась предварительная адъювантная или неоадъювантная терапия (химиотерапия и/или химиолучевая терапия), между окончанием адъювантной терапии и набором должно пройти более 6 месяцев
Критерии исключения для фазы 1 и фазы 3
[00450] Пациенты, зарегистрированные в фазу 1 или фазу 3, будут исключены, если применяется любой из следующих критериев:
Нелеченные или симптоматические метастазы в центральную нервную систему (ЦНС) (виазулизационное исследование ЦНС не требуется). Пациенты с бессимптомными метастазами в ЦНС имеют право на участие, при условии, что они были клинически стабильны в течение по крайней мере 4 недель и не нуждаются во вмешательстве, таком как операция, облучение или любая кортикостероидная терапия для лечения симптомов, связанных с заболеванием ЦНС.
Ослабленная сердечная функция или клинически значимое сердечное заболевание, в том числе любое из следующих:
Нестабильная стенокардия за ≤6 месяцев до регистрации
Острый инфаркт миокарда за ≤6 месяцев до регистрации
Застойная сердечная недостаточность, класс II-IV, по функциональной классификации Нью-Йоркской кардиологической ассоциации
Неконтролируемая артериальная гипертензия (определяется как ≥ 160/90, несмотря на оптимальное медицинское лечение)
Неконтролирукмая сердечная аритмия, требующая антиаритмической терапии, кроме бета-блокаторов или дигоксина
Активная болезнь коронарных артерий
QTcF >480
Периферическая сенсорная невропатия 2-й степени или выше в соответствии со ≥ Стандартными терминологическими критериями нежелательных явлений (CTCAE)
Активная инфекция, требующая системного лечения или любая неконтролируемая инфекция за ≤14 суток до регистрации
Подтвержденный вирус иммунодефицита человека (ВИЧ) или заболевание, связанное с синдромом приобретенного иммунодефицита (СПИД), или подтвержденная или хроническая инфекция гепатита B или C в анамнезе
Интерстициальное заболевание легких (например, пневмонит или легочный фиброз) в анамнезе
Свидетельство или наличие геморрагического диатеза или коагулопатии в анамнезе
Лучевая терапия за ≤28 до регистрации. Пациенты должны восстановиться после всех острых токсических эффектов, связанных с радиотерапией. Радиофармацевтические препараты (стронций, самарий) не должны применяться в течение 8 недель после регистрации
Предварительное лечение любым селективным ингибитором (например, AZD4547, BGJ398, JNJ-42756493, BAY1179470) пути FGF-FGFR
Текущие побочные эффекты от предшествующего систематического лечения > 1 степени по NCI CTCAE (за исключением алопеции 2 степени)
Участие в другом терапевтическом клиническом исследовании или получение любого исследуемого препарата в течение 28 суток после регистрации или во время этого клинического исследования
Дефекты роговицы, изъязвления роговицы, кератит, кератоконус, пересадка роговицы или другие известные аномалии роговицы в анамнезе, которые, по мнению офтальмолога, могут представлять повышенный риск развития язвы роговицы
Известный положительный результат в отношении HER2 (определяемый положительным ИГХ анализом 3+ или ИГХ 2+ с положительным FISH).
Обширные хирургические вмешательства не допустимы за ≤28 суток до регистрации. Операция, требующая местной/эпидуральной анестезии, должна быть завершена как минимум за 72 часа до регистрации. Во всех случаях пациент должен быть достаточно восстановлен и стабилен до начала лечения.
Женщины, которые беременны или кормят грудью (если пациентка не хочет прервать грудное вскармливание во время введения исследуемого лечения, а затем возобновить через 6 месяцев после прекращения исследования); женщины с детородным потенциалом не должны рассматривать возможность забеременеть во время исследования
Наличие любого серьезного или нестабильного сопутствующего системного расстройства, несовместимого с клиническим исследованием (например, злоупотребление психоактивными веществами, психическое расстройство или неконтролируемое интеркуррентное заболевание, включая артериальный тромбоз и симптоматическую эмболию легочной артерии)
Наличие любого другого состояния, которое может увеличить риск, связанный с участием в исследовании или может помешать интерпретации результатов исследования и, по мнению исследователя, сделает пациента неподходящим для включения в исследование
Известная аллергия или гиперчувствительность к компонентам композиции антител к FGFR2-IIIb, включая полисорбат или к препаратам, содержащим платину, 5-ФУ или лейковорин
Предшествующее злокачественное новообразование в анамнезе, кроме:
немеланомного злокачественного новообразования кожи, по поводу которого проводилось радикальное лечение
рака шейки матки in situ
протокового или лобулярного рака молочной железы in situ, по поводу которого проводилось радикальное лечение и в настоящее время пациент не получает системной терапии
солидной опухоли, по поводу которой проводилось радикальное лечение более 5 лет назад без признаков рецидива.
[00451] Отказ от этих критериев включения или исключения не будет предоставлен.
Исследуемое лечение
[00452] В фазе 1 антитело к FGFR2-IIIb будет поставляться в стерильном флаконе для разведения в пакете для внутривенного (в/в) введения в исследовательском центре в течение приблизительно 30 минут (± 10 минут) каждые 2 недели (± 3 суток) до введения химиотерапии по схеме mFOLFOX6. Только пациенты, проходящие лечение в когорте 2, получат 1 дополнительную дозу антитела к FGFR2-IIIb на сутки 8 цикла 1. Начиная со второго цикла, все пациенты будут получать антитело к FGFR2-IIIb каждые 2 недели на сутки 1 каждого цикла до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или до соответствия пациентом любому из других указанных в протоколе критериев исключения. Набор для внутривенного введения для инфузии FP144 должен содержать встроенный фильтр с размером пор 0,22 мкм или шприцевой фильтр с размером пор 0,22 мкм.
[00453] В фазе 3 антитело к FGFR2-IIIb будет поставляться и вводиться аналогично антителу к FGFR2-IIIb в фазе 1. Введение антитела к FGFR2-IIIb будет продолжаться до рентгенологического или клинического подтверждения прогрессирования заболевания согласно оценке исследователя, появления неприемлемой токсичности или пока пациент удовлетворяет любому из других указанных в протоколе критериев.
[00454] Оксалиплатин, 5-ФУ и лейковорин (mFOLFOX6) будут вводиться в каждом исследовательском центре (как описано выше) каждые 2 недели (± 7 суток).
Фармакокинетические оценки
[00455] Образцы крови будут собираться в определенные моменты времени для измерения сывороточных уровней антитела к FGFR2-IIIb у всех зарегистрированных пациентов в фазе 1 и фазе 3, соответственно.
[00456] ФК параметры будут оцениваться с использованием некомпартментного анализа, хотя при необходимости может быть использован компартментный анализ. Данные зависимости концентрации в сыворотке от времени из этого клинического испытания будут объединены с данными других исследований для комплексного популяционного ФК анализа и оценки зависимость между воздействием и ответом.
Оценки иммуногенности
[00457] У всех зарегистрированных пациентов в фазе 1 и фазе 3 будут взяты образцы крови для анализа на антитела к FGFR2-IIIb. Иммуногенность, определяемая как иммунный ответ на антитело к FGFR2-IIIb, будет оцениваться путем измерения общего уровня антител к FGFR2-IIIb у всех пациентов. Исследование на иммуногенность будет состоять из скрининга, подтверждения и титрования. Можно рассмотреть возможность дополнительной характеристики подтвержденного ответа на антитело к FGFR2-IIIb.
Оценка эффективности
[00458] В ходе фазы 3, оценка ответа опухоли будет выполняться исследователем в соответствии с рекомендациями RECIST v.1.1. Показатели эффективности будут включать оценки опухоли, состоящие из клинического обследования и соответствующих методов визуализации, предпочтительно компьютерной томографии органов грудной клетки, брюшной полости и таза с соответствующей толщиной среза в соответствии с рекомендациями RECIST v1.1, но МРТ также приемлемо. Сканирование будет проводиться во время скринингового окна (в пределах 21 суток относительно суток 1 цикла 1). Сканирование, выполненное до скрининга в качестве части стандартного лечения, выполненного не позднее, чем за 28 суток до регистрации, является приемлемым. Сканирование будет выполняться каждые 8 недель (±7 суток) от суток 1 цикла 1.
Оценки безопасности
[00459] Показатели безопасности будут включать НЯ, гематологию, биохимический анализ, анализ мочи, показатели жизненно важных функций, массу тела, применение сопутствующих лекарственных препаратов/процедур, показатель общего состояния в соответствии с ECOG, целевые физикальные обследования, ЭКГ и офтальмологические исследования как в фазе 1, так и в фазе 3.
Оценки фармакодинамики
Фаза I
[00460] ФД оценки будут проводиться в определенные моменты времени. Опухолевая ткань, представленная для оценки статуса FGFR2, при наличии, будет ретроспективно проанализирована на предмет сверхэкспрессии FGFR2b с использованием ИГХ. Образцы крови, представленные для оценки статуса FGFR2, будут собраны до первой дозы исследуемого лечения и проанализированы ретроспективно на предмет амплификации гена FGFR2 при помощи анализа цоДНК в крови. Образцы крови для анализа поисковых биомаркеров пути FGFR будут собраны в продольном направлении.
Фаза 3
[00461] Опухолевая ткань будет представлена для оценки статуса FGFR2 и будет проспективно проанализирована на предмет сверхэкспрессии FGFR2b с использованием ИГХ. Образцы крови будут представлены для оценки статуса FGFR2 и будут проспективно проанализированы на предмет амплификации гена FGFR2 с использованием анализа цоДНК в крови. Положительные результаты анализа ткани или крови, но не обоих анализов, должны быть доступны до регистрации.
[00462] Общее число участников, запланированных для этого исследования, составляет приблизительно 569 пациентов. Приблизительно 9-21 пациент, оцениваемый на предмет любой дозолимитирующей токсичности, будет включен в фазу 1. В фазе 3 эффективность и переносимость будут оценены путем включения приблизительно 548 пациентов с FGFR2-селективным РЖ, рандомизированных в соотношении 1:1 для получения антител к FGFR2-IIIb в комбинации с mFOLFOX6 или только mFOLFOX6. Соответствующие критериям участи пациенты будут разделены по географическим регионам (США и ЕС, Япония, остальные страны Азии [включая Китай], остальные страны мира), предшествующему статусу лечения (de novo или адъювантное/неоадъювантное) и введению разовой дозы mFOLFOX6 до регистрации (да или нет).
[00463] В фазе 1 все анализы будут описательными и будут представлены по группам доз и в целом по мере необходимости. Описательная статистика будет включать количество наблюдений, среднее значение, стандартное отклонение, медиану, диапазон и интерквартильную широту для непрерывных переменных, а также число и процент для категориальных переменных; 95% доверительные интервалы будут представлены там, где это необходимо. Дополнительно, частота НЯВЛ, приводящая к снижению дозировки или отмене дозы, будет представлена в виде таблицы и обобщена. В фазе 3 анализ первичной эффективности представляет собой сравнение OS у пациентов, получавших лечение антителами к FGFR2-IIIb в комбинации с mFOLFOX6 или mFOLFOX6.
[00464] Первичная конечная точка OS, определяется как время от рандомизации до смерти по любой причине. Вторичные конечные точки эффективности включают PFS и ORR, где PFS определяется как время от рандомизации до даты рентгенологического подтверждения прогрессирования заболевания на основе оценки исследователя (согласно RECIST v.1.1) или смерти от любой причины в зависимости от того, что наступит раньше, а ORR определяется как доля пациентов с измеряемым на исходном уровне заболеванием с частичным или полным ответом по определению исследователем согласно RECIST v.1.1.
[00465] Это исследование фазы 3 предназначено для оценки соотношения рисков (HR) для общей выживаемости (OS) для комбинации антитела к FGFR2-IIIb и mFOLFOX6 по сравнению только с mFOLFOX6. 374 первичных события смерти могут обеспечить 80% мощности для определения HR 0,75 для OS с использованием регрессионного анализа Кокса, имеющего (односторонний) показатель ложноположительных ошибок 2,5%. Предполагая экспоненциальное распределение OS, это будет соответствовать 33% увеличению средней OS на с 10 до 13,3 месяцев. Статистическая значимость для OS будет иметь место при предполагаемом HR=0,815, что примерно соответствует увеличению средней выживаемости на 22,6% с 10 до 12,26 месяцев.
[00466] Приблизительно 548 пациентов будут рандомизированы (1:1) в течение 44 месяцев регистрации, с последующим наблюдением в течение примерно 24 дополнительных месяцев для достижения целевого числа первичных явлений.
[00467] В первую очередь будет проверена гипотеза OS. Будет проведено у 2 промежуточных анализов и первичный анализ OS, и оба будут анализами, основанными на явлениях.
[00468] Запланировано два промежуточных анализа OS; первый после 50% событий OS (приблизительно 187 событий) и второй после 75% событий OS (приблизительно 281 событий). Граничный критерий мониторинга О'Брайена-Флеминга будет использоваться для сохранения частоты ложноположительных ошибок 2,5%, а применение модификации Лан-ДеМетс позволит обеспечить гибкость в количестве и времени проведения этих промежуточных анализов.
[00469] Первичный анализ OS будет проводиться с использованием популяции пациентов с назначенным лечением (ITT) и будет проводиться с использованием стратифицированного лог-рангового критерия. Факторы стратификации будут такими же, как и для стратификации графика рандомизации, как описано в интерактивной системе, позволяющей доступ путем телефонного звонка и через Интернет (IXRS).
[00470] Медиана OS и соответствующий 95% доверительный интервал для каждой группы лечения будут оцениваться с использованием метода Каплана-Мейера. Отношение рисков (HR= λантитело к FGFR2-IIIB+mFOLFOX6/ λmFOLFOX6)) будет оцениваться с использованием регрессионной модели Кокса с группой лечения в качестве единственного основного эффекта и стратификации с использованием тех же факторов стратификации, которые использовались для стратифицированного лог-рангового критерия. Также будет представлен нестратифициорованное HR.
[00471] Анализ вторичных конечных точек PFS и ORR будет проводиться иерархически, если анализ первичной конечной точки OS является статистически значимым. Формальные гипотезы относительно воздействия на PFS и ORR будут проверены иерархически на уровне 0,05. Сначала будет проверена PFS, и если она будет значимой, то будет проверена ORR. Уровень ошибок типа I с поправкой на эффект множественных сравнений при тестировании первичных и вторичных конечных точек будет контролироваться при помощи этой процедуры тестирования методом поэтапного входного контроля на уровне 0,05.
[00472] Если тестирование на OS является значимым, мы будем тестировать выживаемость без прогрессирования (PFS), с использованием стратифицированного лог-рангового критерия на уровне 0,05 на основе всех событий PFS, наблюдаемых во время выполнения анализа OS. Первичный анализ PFS будет проводиться с использованием стратифицированного лог-рангового критерия (двухстороннего). Факторы стратификации будут такими же, как и для стратификации графика рандомизации, как описано в интерактивной системе, позволяющей доступ путем телефонного звонка и через Интернет (IXRS).
[00473] Медиана PFS и соответствующий 95% доверительный интервал для каждой группы лечения будут оцениваться с использованием метода Каплана-Мейера. HR будет оцениваться с использованием регрессионной модели Кокса с группой лечения в качестве единственного основного эффекта и стратификации с использованием тех же факторов стратификации, которые использовались для стратифицированного лог-рангового критерия. Также будет представлено нестратифицированное HR. Анализ PFS будет проводиться на популяции ITT.
[00474] Если тестирование на PFS является значимым, то анализ ORR будет выполнен среди пациентов с измеримым на исходном уровне заболеванием. При анализе ORR пациенты, которые не имеют адекватных оценок опухоли после исходного уровня, будут учитываться как пациенты, у которых не наблюдается ответа. Формальная проверка гипотезы ORR будет проводиться с использованием стратифицированного критерия Кохрана-Мантеля-Хензеля (двухстороннего) на уровне 0,05. Факторы стратификации будут такими же, как и для стратификации графика рандомизации, как описано в IXRS.
[00475] Анализ безопасности: Все НЯ будут закодированы с использованием Медицинский словарь терминологии для регуляторной деятельности (MedDRA). Исследователь будет классифицировать степень тяжести НЯ, используя CTCAE v 4.03. Нежелательное явление, возникшее в ходе лечения (НЯВЛ), определяется как любое явление с датой возникновения на дату или после даты введения первой дозы исследуемого лечения или как любое явление, присутствующее до лечения, которое ухудшается после лечения. В сводные таблицы будут включены только НЯВЛ с датой возникновения до даты введения последней дозы+28 суток.
[00476] Данные клинико-лабораторных анализов будут обобщены по типу лабораторных исследований. Количество и процент пациентов, у которых обнаруживаются отклонения от нормы (то есть показатели выходят за пределы диапазонов нормальных значений) и/или клинически значимые отклонения после введения исследуемого лечения, будут представлены для каждого показателя клинико-лабораторных анализов. Для каждого показателя клинико-лабораторных анализов будет предоставлена описательная статистика для исходного уровня и всех последующих запланированных визитов после лечения. Также будут предоставлены изменения от исходного уровня до визитов после лечения. Описательная статистика показателей жизненно важных функций также будет предоставлена аналогичным образом. Кроме того, аналогичным образом будет представлен сдвиг от исходного уровня по степени CTCAE (где это применимо) и по отметкам высокого/низкого уровня (в случаях, где степени CTCAE не определены).
[00477] Анализы безопасности для фазы I будут выполняться для пациентов, включенных в популяцию оценки безопасности. Частота ДЛТ, частота TEAE, отклонения от нормы в результатах клинико-лабораторных анализов (например, таблица сдвигов), показатели жизненно важных функций, результаты исследования роговицы и сетчатки и ЭКГ будут представлены в виде таблицы и обобщены по уровню дозы. Дополнительно, частота TEAE, приводящая к снижению дозировки или отмене дозы, будет представлена в виде таблицы и обобщена.
[00478] Анализ безопасности для фазы 3 будет включать всех пациентов, которые получают любое исследуемое лечение (антитела к FGFR2-IIIb в комбинации с mFOLFOX6 или mFOLFOX6) в течение всего периода исследования, и обеспечат любую информацию о безопасности после лечения. Частота TEAE, отклонения от нормы в результатах клинико-лабораторных анализов, показатели жизненно важных функций, результаты исследования роговицы и сетчатки и ЭКГ будут представлены в виде таблицы и обобщены по группе лечения.
[00479] Индивидуальные и средние (± SD) данные зависимости концентрации антител к FGFR2-IIIb в сыворотке от времени будут сведены в таблицу и нанесены на график в зависимости от уровня дозы. ФК параметры будут сведены в таблицу и обобщены по уровню дозы, когда это уместно и применимо. Влияние иммуногенности на воздействие антител к FGFR2-IIIb будет оценено, сведено в таблицу и обобщено по уровню дозы, насколько позволяют данные. Интегрированный популяционный анализ ФК и оценка зависимости ответа от воздействия будут представлены в отдельном отчете.
[00480] Схематическое изображение исследуемых когорт представлено на ФИГ. 3.
Таблица последовательностей
[00481] В приведенной ниже таблице приведен список определенных последовательностей, на которые ссылается данный документ.
TNGRLPVKWM APEALFDRVY THQSDVWSFG VLMWEIFTLG GSPYPGIPVE ELFKLLKEGH RMDKPANCTN ELYMMMRDCW HAVPSQRPTF KQLVEDLDRI LTLTTNEEYL DLSQPLEQYS PSYPDTRSSC SSGDDSVFSP DPMPYEPCLP QYPHINGSVK T
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Five Prime Therapeutics, Inc.
<120> АНТИ-FGFR2 АНТИТЕЛА В КОМБИНАЦИИ С ХИМИОТЕРАПЕВТИЧЕСКИМИ
СРЕДСТВАМИ ПРИ ЛЕЧЕНИИ РАКА
<130> 01134-0054-00PCT
<150> US 62/507 053
<151> 16.05.2017
<150> US 62/581 992
<151> 06.11.2017
<160> 22
<170> PatentIn версия 3.5
<210> 1
<211> 801
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys His Ser Gly Ile Asn Ser Ser Asn Ala Glu Val Leu
290 295 300
Ala Leu Phe Asn Val Thr Glu Ala Asp Ala Gly Glu Tyr Ile Cys Lys
305 310 315 320
Val Ser Asn Tyr Ile Gly Gln Ala Asn Gln Ser Ala Trp Leu Thr Val
325 330 335
Leu Pro Lys Gln Gln Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser
340 345 350
Pro Asp Tyr Leu Glu Ile Ala Ile Tyr Cys Ile Gly Val Phe Leu Ile
355 360 365
Ala Cys Met Val Val Thr Val Ile Leu Cys Arg Met Lys Asn Thr Thr
370 375 380
Lys Lys Pro Asp Phe Ser Ser Gln Pro Ala Val His Lys Leu Thr Lys
385 390 395 400
Arg Ile Pro Leu Arg Arg Gln Val Thr Val Ser Ala Glu Ser Ser Ser
405 410 415
Ser Met Asn Ser Asn Thr Pro Leu Val Arg Ile Thr Thr Arg Leu Ser
420 425 430
Ser Thr Ala Asp Thr Pro Met Leu Ala Gly Val Ser Glu Tyr Glu Leu
435 440 445
Pro Glu Asp Pro Lys Trp Glu Phe Pro Arg Asp Lys Leu Thr Leu Gly
450 455 460
Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val Val Met Ala Glu Ala
465 470 475 480
Val Gly Ile Asp Lys Asp Lys Pro Lys Glu Ala Val Thr Val Ala Val
485 490 495
Lys Met Leu Lys Asp Asp Ala Thr Glu Lys Asp Leu Ser Asp Leu Val
500 505 510
Ser Glu Met Glu Met Met Lys Met Ile Gly Lys His Lys Asn Ile Ile
515 520 525
Asn Leu Leu Gly Ala Cys Thr Gln Asp Gly Pro Leu Tyr Val Ile Val
530 535 540
Glu Tyr Ala Ser Lys Gly Asn Leu Arg Glu Tyr Leu Arg Ala Arg Arg
545 550 555 560
Pro Pro Gly Met Glu Tyr Ser Tyr Asp Ile Asn Arg Val Pro Glu Glu
565 570 575
Gln Met Thr Phe Lys Asp Leu Val Ser Cys Thr Tyr Gln Leu Ala Arg
580 585 590
Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile His Arg Asp Leu Ala
595 600 605
Ala Arg Asn Val Leu Val Thr Glu Asn Asn Val Met Lys Ile Ala Asp
610 615 620
Phe Gly Leu Ala Arg Asp Ile Asn Asn Ile Asp Tyr Tyr Lys Lys Thr
625 630 635 640
Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala Pro Glu Ala Leu Phe
645 650 655
Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp Ser Phe Gly Val Leu
660 665 670
Met Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro Tyr Pro Gly Ile Pro
675 680 685
Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly His Arg Met Asp Lys
690 695 700
Pro Ala Asn Cys Thr Asn Glu Leu Tyr Met Met Met Arg Asp Cys Trp
705 710 715 720
His Ala Val Pro Ser Gln Arg Pro Thr Phe Lys Gln Leu Val Glu Asp
725 730 735
Leu Asp Arg Ile Leu Thr Leu Thr Thr Asn Glu Glu Tyr Leu Asp Leu
740 745 750
Ser Gln Pro Leu Glu Gln Tyr Ser Pro Ser Tyr Pro Asp Thr Arg Ser
755 760 765
Ser Cys Ser Ser Gly Asp Asp Ser Val Phe Ser Pro Asp Pro Met Pro
770 775 780
Tyr Glu Pro Cys Leu Pro Gln Tyr Pro His Ile Asn Gly Ser Val Lys
785 790 795 800
Thr
<210> 2
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> тяжелая цепь альфа-FGFR2b
<220>
<221> ПРИМЕЧАНИЕ
<222> (294)..(294)
<223> Asn297
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Asn Val His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Pro Asp Asn Gly Asp Thr Ser Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 3
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь анти-FGFR2b
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Gly Val Ser Asn Asp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln His Ser Thr Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 4
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи анти-FGFR2b
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Asn Val His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Pro Asp Asn Gly Asp Thr Ser Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 5
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи анти-FGFR2b
<400> 5
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Gly Val Ser Asn Asp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln His Ser Thr Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 6
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HVR1 тяжелой цепи (HC) анти-FGFR2b
<400> 6
Thr Tyr Asn Val His
1 5
<210> 7
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HVR2 HC анти-FGFR2b
<400> 7
Ser Ile Tyr Pro Asp Asn Gly Asp Thr Ser Tyr Asn Gln Asn Phe Lys
1 5 10 15
Gly
<210> 8
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HVR3 HC анти-FGFR2b
<400> 8
Gly Asp Phe Ala Tyr
1 5
<210> 9
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HVR1 легкой цепи (LC) анти-FGFR2b
<400> 9
Lys Ala Ser Gln Gly Val Ser Asn Asp Val Ala
1 5 10
<210> 10
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HVR2 LC анти-FGFR2b
<400> 10
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 11
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HVR3 LC анти-FGFR2b
<400> 11
Gln Gln His Ser Thr Thr Pro Tyr Thr
1 5
<210> 12
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь с N297Q анти-FGFR2b
<220>
<221> ПРИМЕЧАНИЕ
<222> (294)..(294)
<223> N297Q
<400> 12
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Asn Val His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Pro Asp Asn Gly Asp Thr Ser Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 13
<211> 800
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp Tyr Leu Glu Ile Ala Ile Tyr Cys Ile Gly Val Phe Leu Ile Ala
355 360 365
Cys Met Val Val Thr Val Ile Leu Cys Arg Met Lys Asn Thr Thr Lys
370 375 380
Lys Pro Asp Phe Ser Ser Gln Pro Ala Val His Lys Leu Thr Lys Arg
385 390 395 400
Ile Pro Leu Arg Arg Gln Val Thr Val Ser Ala Glu Ser Ser Ser Ser
405 410 415
Met Asn Ser Asn Thr Pro Leu Val Arg Ile Thr Thr Arg Leu Ser Ser
420 425 430
Thr Ala Asp Thr Pro Met Leu Ala Gly Val Ser Glu Tyr Glu Leu Pro
435 440 445
Glu Asp Pro Lys Trp Glu Phe Pro Arg Asp Lys Leu Thr Leu Gly Lys
450 455 460
Pro Leu Gly Glu Gly Cys Phe Gly Gln Val Val Met Ala Glu Ala Val
465 470 475 480
Gly Ile Asp Lys Asp Lys Pro Lys Glu Ala Val Thr Val Ala Val Lys
485 490 495
Met Leu Lys Asp Asp Ala Thr Glu Lys Asp Leu Ser Asp Leu Val Ser
500 505 510
Glu Met Glu Met Met Lys Met Ile Gly Lys His Lys Asn Ile Ile Asn
515 520 525
Leu Leu Gly Ala Cys Thr Gln Asp Gly Pro Leu Tyr Val Ile Val Glu
530 535 540
Tyr Ala Ser Lys Gly Asn Leu Arg Glu Tyr Leu Arg Ala Arg Arg Pro
545 550 555 560
Pro Gly Met Glu Tyr Ser Tyr Asp Ile Asn Arg Val Pro Glu Glu Gln
565 570 575
Met Thr Phe Lys Asp Leu Val Ser Cys Thr Tyr Gln Leu Ala Arg Gly
580 585 590
Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile His Arg Asp Leu Ala Ala
595 600 605
Arg Asn Val Leu Val Thr Glu Asn Asn Val Met Lys Ile Ala Asp Phe
610 615 620
Gly Leu Ala Arg Asp Ile Asn Asn Ile Asp Tyr Tyr Lys Lys Thr Thr
625 630 635 640
Asn Gly Arg Leu Pro Val Lys Trp Met Ala Pro Glu Ala Leu Phe Asp
645 650 655
Arg Val Tyr Thr His Gln Ser Asp Val Trp Ser Phe Gly Val Leu Met
660 665 670
Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro Tyr Pro Gly Ile Pro Val
675 680 685
Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly His Arg Met Asp Lys Pro
690 695 700
Ala Asn Cys Thr Asn Glu Leu Tyr Met Met Met Arg Asp Cys Trp His
705 710 715 720
Ala Val Pro Ser Gln Arg Pro Thr Phe Lys Gln Leu Val Glu Asp Leu
725 730 735
Asp Arg Ile Leu Thr Leu Thr Thr Asn Glu Glu Tyr Leu Asp Leu Ser
740 745 750
Gln Pro Leu Glu Gln Tyr Ser Pro Ser Tyr Pro Asp Thr Arg Ser Ser
755 760 765
Cys Ser Ser Gly Asp Asp Ser Val Phe Ser Pro Asp Pro Met Pro Tyr
770 775 780
Glu Pro Cys Leu Pro Gln Tyr Pro His Ile Asn Gly Ser Val Lys Thr
785 790 795 800
<210> 14
<211> 356
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp Tyr Leu Glu
355
<210> 15
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи Gal-FR22 анти-FGFR2
<400> 15
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Phe
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Asp Phe Arg
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Ile Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Pro Asp Asp Thr Ile Ala Tyr Cys Ala Asn
85 90 95
Phe Tyr Tyr Gly Tyr Asp Asp Tyr Val Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 16
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR1 тяжелой цепи Gal-FR22 анти-FGFR2
<400> 16
Ser Phe Gly Val His
1 5
<210> 17
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR2 тяжелой цепи Gal-FR22 анти-FGFR2
<400> 17
Val Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Asp Phe Arg Ser
1 5 10 15
<210> 18
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR3 тяжелой цепи Gal-FR22 анти-FGFR2
<400> 18
Phe Tyr Tyr Gly Tyr Asp Asp Tyr Val Met Asp Tyr
1 5 10
<210> 19
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи Gal-FR22 анти-FGFR2
<400> 19
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gly Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Lys Asn Tyr
20 25 30
Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Ser Pro Arg Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Gln Pro Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asp Asp Leu Tyr
85 90 95
Met Phe Gly Gly Gly Thr Lys Leu Asp Ile Lys
100 105
<210> 20
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR1 легкой цепи Gal-FR22 анти-FGFR2
<400> 20
Lys Ala Ser Gln Asp Ile Lys Asn Tyr Ile Ala
1 5 10
<210> 21
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR2 легкой цепи Gal-FR22 анти-FGFR2
<400> 21
Tyr Thr Ser Thr Leu Gln Pro
1 5
<210> 22
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR3 легкой цепи Gal-FR22 анти-FGFR2
<400> 22
Leu Gln Tyr Asp Asp Leu Tyr Met
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2745707C2 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2834309C2 |
| АФУКОЗИЛИРОВАННЫЕ АНТИТЕЛА К РЕЦЕПТОРУ ФАКТОРА РОСТА ФИБРОБЛАСТОВ FGFR2IIIB | 2014 |
|
RU2740714C2 |
| НОВЫЕ АНТИТЕЛА ПРОТИВ FGFR2B | 2020 |
|
RU2840537C1 |
| БИСПЕЦИФИЧНЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2800779C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ ИММУНОКОНЪЮГАТОВ, СОДЕРЖАЩИХ АНТИТЕЛО К CD79B, ДЛЯ ЛЕЧЕНИЯ ДИФФУЗНОЙ B-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ | 2020 |
|
RU2827797C1 |
| ДОЗЫ И ВВЕДЕНИЕ АНТИТЕЛ ПРОТИВ C5 ДЛЯ ЛЕЧЕНИЯ АТИПИЧНОГО ГЕМОЛИТИКО-УРЕМИЧЕСКОГО СИНДРОМА (аГУС) | 2020 |
|
RU2822664C2 |
| СПОСОБЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ, СВЯЗАННЫЕ С ИНГИБИРОВАНИЕМ TH2 | 2020 |
|
RU2832013C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА И АНТИТЕЛА С СОЗРЕВШЕЙ АФФИННОСТЬЮ ПРОТИВ FcRH5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2748943C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕСЯ С PD1 И LAG3 | 2018 |
|
RU2778805C2 |
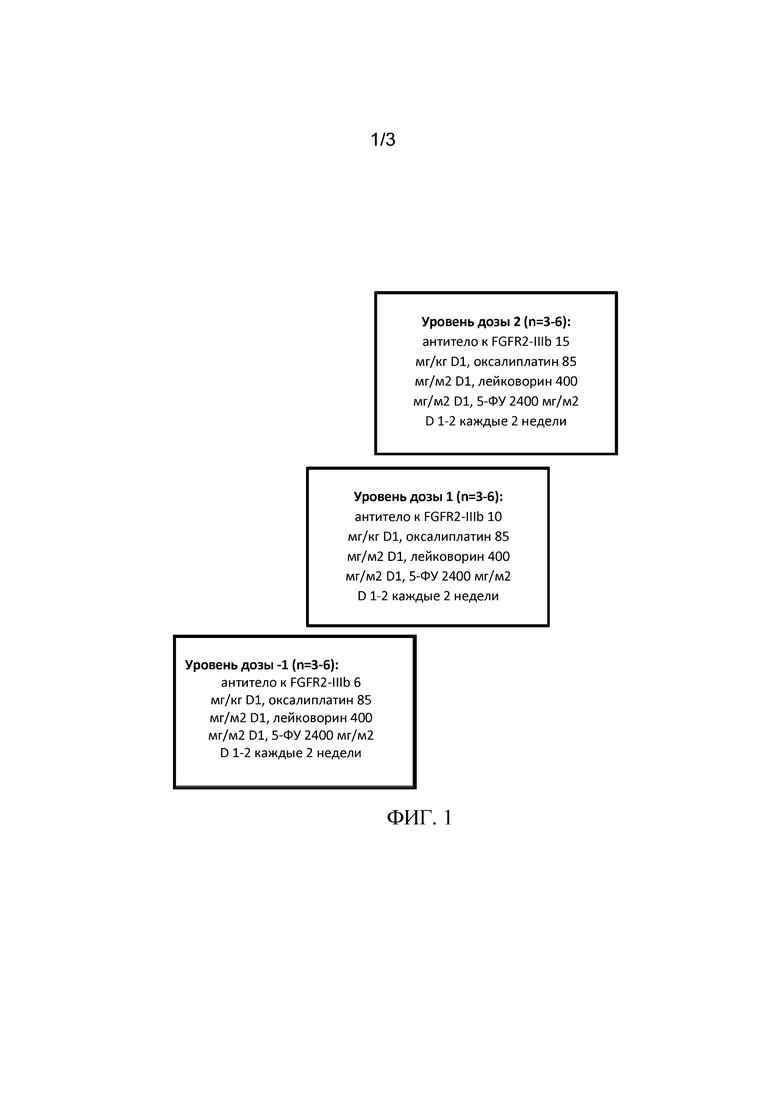
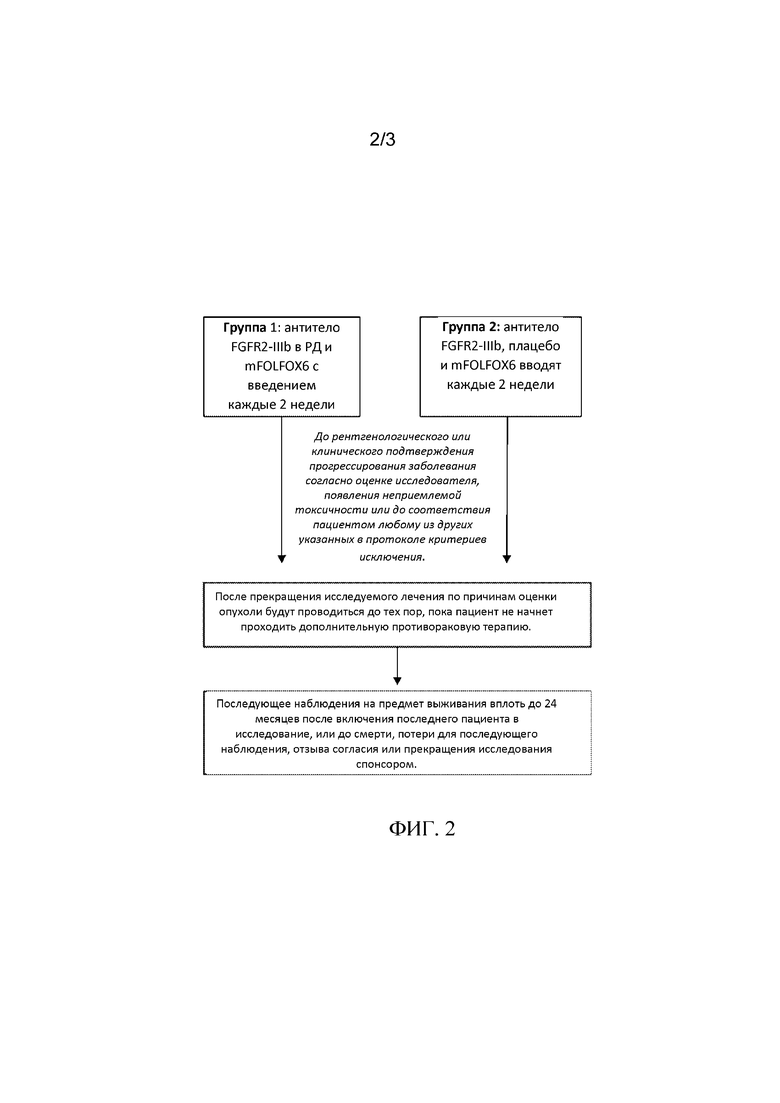
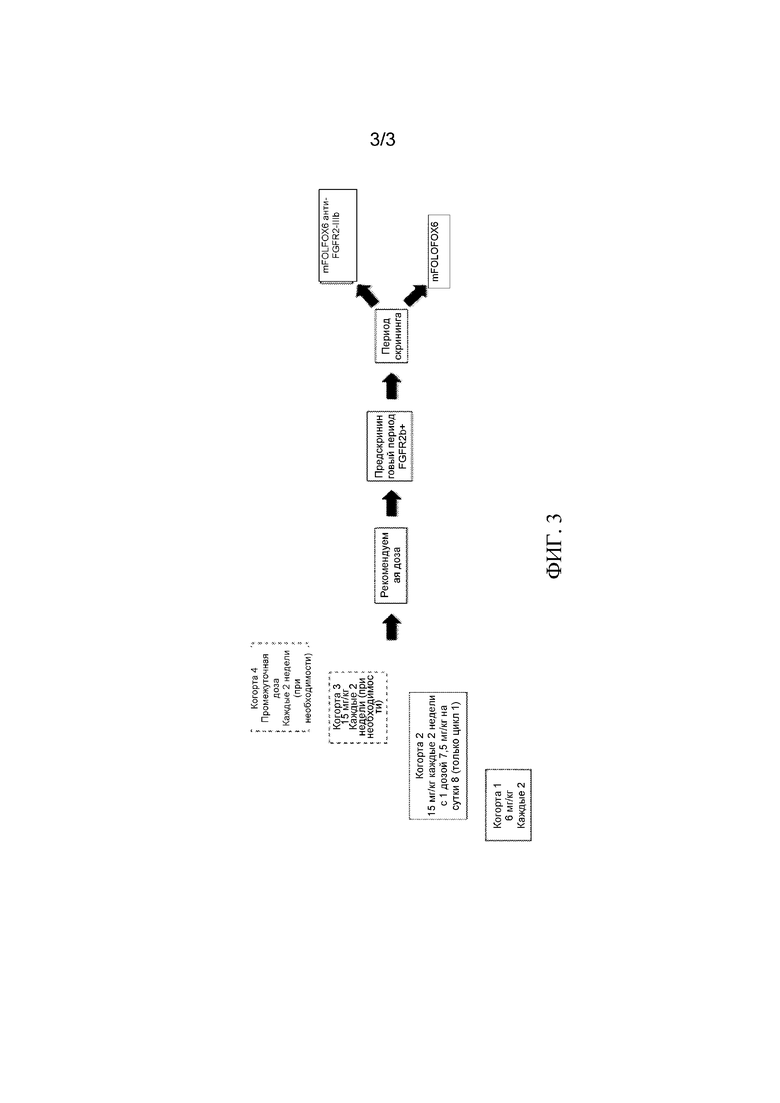
Группа изобретений относится к области фармацевтики и медицины. 1 объект представляет собой способ лечения рака желудка у субъекта-человека, включающий введение субъекту терапевтически эффективного количества антитела к рецептору фактора роста фибробластов 2 IIIb (анти–FGFR2–IIIb) и применение модифицированного режима химиотерапии FOLFOX6 (mFOLFOX6), где антитело к FGFR2–IIIb является афукозилированным, где (1) антитело к FGFR2–IIIb вводят в дозе 6–15 мг/кг, (2) по меньшей мере одну промежуточную дозу антитела к FGFR2-IIIb вводят между двумя дозами (1), (3) химиотерапия mFOLFOX6 включает введение 50-100 мг/м2 оксалиплатина, 100-400 мг/м2 лейковорина и 100-400 мг/м2 5-фторурацила (5-FU) внутривенной инфузией или внутривенной болюсной инъекцией с последующим введением 2200-2400 мг/м2 5-FU в течение 44-48 часов, и (4) введения антитела к FGFR2–IIIb согласно (1) и mFOLFOX6 согласно (3) проводят одновременно или последовательно один раз каждые 13-15 дней. 2 объект – способ лечения локально распространенного, неоперабельного или метастатического рака желудка, который сверхэкспрессирует FGFR2–IIIb, у субъекта-человека. Технический результат заключается в лечении рака желудка с применением заявленного режима введения антитела FGFR2-IIIb в комбинации с химиотерапией по схеме mFOLFOX6. 2 н. и 41 з.п. ф-лы, 3 ил., 8 табл., 2 пр.
1. Способ лечения рака желудка у субъекта-человека, включающий введение субъекту терапевтически эффективного количества антитела к рецептору фактора роста фибробластов 2 IIIb (анти–FGFR2–IIIb) и применение модифицированного режима химиотерапии FOLFOX6 (mFOLFOX6), где антитело к FGFR2–IIIb является афукозилированным и содержит вариабельные области тяжелой цепи и легкой цепи, причем вариабельная область тяжелой цепи содержит:
(i) HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 6;
(ii) HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и
(iii) HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 8;
а вариабельная область легкой цепи содержит:
(iv) HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 9;
(v) HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и
(vi) HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 11;
где (1) антитело к FGFR2–IIIb вводят в дозе 6–15 мг/кг, (2) по меньшей мере одну промежуточную дозу антитела к FGFR2-IIIb вводят между двумя дозами (1), (3) химиотерапия mFOLFOX6 включает введение 50-100 мг/м2 оксалиплатина, 100-400 мг/м2 лейковорина и 100-400 мг/м2 5-фторурацила (5-FU) внутривенной инфузией (IV) или внутривенной болюсной инъекцией с последующим введением 2200-2400 мг/м2 5-FU в течение 44-48 часов, и (4) введения антитела к FGFR2–IIIb согласно (1) и mFOLFOX6 согласно (3) проводят одновременно или последовательно один раз каждые 13-15 дней.
2. Способ по п. 1, отличающийся тем, что антитело к FGFR2–IIIb обладает одним или более из следующих свойств:
a. связывается с FGFR2–IIIb с более высокой аффинностью, чем с FGFR2–IIIc, или не связывается с FGFR2–IIIc обнаруживаемым образом;
b. ингибирует связывание FGF2 с человеческим FGFR2;
c. ингибирует связывание FGF7 с человеческим FGFR2;
d. ингибирует рост опухоли человека в мышиной модели опухоли;
e. индуцирует активность антителозависимой клеточной цитотоксичности (АЗКЦ);
f. обладает повышенной активностью АЗКЦ; и
g. способно увеличивать количество одной или более положительных по PD–L1 клеток, NK–клеток, CD3+ T–клеток, CD4+ T–клеток, CD8+ T–клеток и макрофагов в опухолевой ткани в мышиной модели опухоли по сравнению с контролем.
3. Способ по п. 1, отличающийся тем, что вариабельная область тяжелой цепи антитела к FGFR2–IIIb содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 4.
4. Способ по п. 1, отличающийся тем, что вариабельная область легкой цепи антитела к FGFR2–IIIb содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 5.
5. Способ по п. 1, отличающийся тем, что вариабельная область тяжелой цепи антитела к FGFR2–IIIb содержит аминокислотную последовательность SEQ ID NO: 4.
6. Способ по п. 1, отличающийся тем, что вариабельная область легкой цепи антитела к FGFR2–IIIb содержит аминокислотную последовательность SEQ ID NO: 5.
7. Способ по п. 1, где антитело к FGFR2–IIIb содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 5.
8. Способ по п. 1, отличающийся тем, что тяжелая цепь антитела к FGFR2–IIIb содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 2.
9. Способ по п. 1, отличающийся тем, что легкая цепь антитела к FGFR2–IIIb содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 3.
10. Способ по п. 1, отличающийся тем, что тяжелая цепь антитела к FGFR2–IIIb содержит аминокислотную последовательность SEQ ID NO: 2.
11. Способ по п. 1, отличающийся тем, что легкая цепь антитела к FGFR2–IIIb содержит аминокислотную последовательность SEQ ID NO: 3.
12. Способ по п. 1, где антитело к FGFR2–IIIb содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 3.
13. Способ по п. 1, отличающийся тем, что антитело к FGFR2–IIIb является химерным, гуманизированным или человеческим.
14. Способ по любому из пп. 1–6, отличающийся тем, что антитело к FGFR2–IIIb выбрано из Fab, Fv, scFv, Fab’ и (Fab’)2.
15. Способ по п. 1, отличающийся тем, что антитело к FGFR2–IIIb обладает одним или более из следующих свойств:
а. содержит константную область тяжелой цепи IgG1 или IgG3, в которой отсутствует фукоза в положении Asn297;
b. содержит константную область легкой цепи κ;
c. содержит константную область тяжелой цепи IgG1 или IgG3, в которой отсутствует фукоза в положении Asn297, и обладает повышенной активностью антителозависимой клеточной цитотоксичности (АЗКЦ) in vitro по сравнению с антителом, имеющим ту же аминокислотную последовательность, которое фукозилировано в положении Asn297; и
d. содержит константную область тяжелой цепи IgG1 или IgG3, в которой отсутствует фукоза в положении Asn297, и обладает повышенной аффинностью к Fc–гамма RIIIA по сравнению с антителом, имеющим ту же аминокислотную последовательность, которое фукозилировано в положении Asn297.
16. Способ по любому из пп. 1–15, отличающийся тем, что рак желудка является локально–распространенным, неоперабельным или метастатическим.
17. Способ по любому из пп. 1–15, отличающийся тем, что антитело к FGFR2–IIIb вводят в дозе 10–15 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг, 10 мг/кг, 11 мг/кг, 12 мг/кг, 13 мг/кг, 14 мг/кг или 15 мг/кг.
18. Способ по любому из пп. 1–15, отличающийся тем, что антитело к FGFR2–IIIb вводят один раз в 14 суток.
19. Способ по любому из пп. 1-15, отличающийся тем, что антитело к FGFR2–IIIb вводят в следующем режиме дозирования:
(a) в дозе 6–15 мг/кг, причем антитело к FGFR2–IIIb вводят один раз в 14 суток;
(b) в дозе 6 мг/кг, причем антитело к FGFR2–IIIb вводят один раз в 14 суток;
(c) в дозе 10 мг/кг, причем антитело к FGFR2–IIIb вводят один раз в 14 суток; или
(d) в дозе 15 мг/кг, причем антитело к FGFR2–IIIb вводят один раз в 14 суток.
20. Способ по любому из пп. 1-15, отличающийся тем, что (1) антитело к FGFR2–IIIb вводят в дозе 6–15 мг/кг, 10–15 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг, 10 мг/кг, 11 мг/кг, 12 мг/кг, 13 мг/кг, 14 мг/кг или 15 мг/кг один раз в в 13–15 суток или в 14 суток, и тем, что (2) по меньшей мере одну промежуточную дозу 3–8 мг/кг, 5–8 мг/кг, 7–8 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг, 6 мг/кг, 7 мг/кг или 8 мг/кг антитела к FGFR2-IIIb вводят между двумя дозами (1), и причем доза (2) ниже, чем доза (a).
21. Способ по п. 20, отличающийся тем, что:
(i) доза (1) составляет 10–15 мг/кг один раз в 13–15 суток;
(ii) доза (1) составляет 15 мг/кг один раз в 13–15 суток;
(iii) доза (2) составляет 5–8 мг/кг и вводится через 6–8 суток после по меньшей мере одной дозы (1) и за 6–8 суток до последующей дозы (1);
(iv) доза (1) составляет 10–15 мг/кг один раз в 13–15 суток, а доза (2) составляет 7–8 мг/кг и вводится через 6–8 суток после по меньшей мере одной дозы (1) и за 6–8 суток до последующей дозы (1);
(v) доза (1) составляет 15 мг/кг один раз в 14 суток, а доза (2) составляет 7–8 мг/кг и вводится через 7 суток после по меньшей мере одной дозы (1) и за 7 суток до последующей дозы (1);
(vi) доза (1) составляет 15 мг/кг один раз в 14 суток, а доза (2) составляет 7,5 мг/кг и вводится через 7 суток после по меньшей мере одной дозы (1) и за 7 суток до последующей дозы (1); и/или
(vii) дозу (2) вводят после первого введения дозы (1) в любом из (i)–(vi).
22. Способ по п. 17, отличающийся тем, что антитело к FGFR2–IIIb вводят в дозе 15 мг/кг один раз в 14 суток, и тем, что через 6–8 суток после первого введения антитела к FGFR2–IIIb, промежуточную дозу антитела к FGFR2–IIIb вводят в дозе 7,5 мг/кг.
23. Способ по п. 17, отличающийся тем, что антитело к FGFR2–IIIb вводят в дозе 15 мг/кг один раз в 14 суток, и тем, что через 7 суток после первого введения антитела к FGFR2–IIIb промежуточную дозу антитела к FGFR2–IIIb вводят в дозе 7,5 мг/кг.
24. Способ по любому из пп. 1-15 или 21-23, отличающийся тем, что mFOLFOX6 включает введение 85 мг/м2 оксалиплатина, 400 мг/м2 лейковорина и 400 мг/м2 5–фторурацила (5–ФУ) путем внутривенной (в/в) инфузии или внутривенной болюсной инъекции с последующим введением 2400 мг/м2 5–ФУ путем внутривенной инфузии в течение 44–48 часов.
25. Способ по п. 24, отличающийся тем, что mFOLFOX6 вводят один раз в 14 суток.
26. Способ по любому из пп. 1-15 или 21-23 отличающийся тем, что mFOLFOX6 включает введение 85 мг/м2 оксалиплатина, 400 мг/м2 лейковорина и 400 мг/м2 5–фторурацила (5–ФУ) путем внутривенной (в/в) инфузии или внутривенной болюсной инъекции с последующим введением 2400 мг/м2 5–ФУ путем внутривенной инфузии в течение 44–48 часов, и при этом mFOLFOX6 вводят один раз в 14 суток.
27. Способ по любому из пп. 1-15 или 21-23, отличающийся тем, что одно или несколько введений mFOLFOX6 проводят до введения антитела к FGFR2–IIIb.
28. Способ по п. 27, отличающийся тем, что два введения mFOLFOX6 проводят до введения антитела к FGFR2–IIIb.
29. Способ по п. 26, отличающийся тем, что антитело к FGFR2–IIIb вводят в те же сутки, что и mFOLFOX6, и до введения mFOLFOX6.
30. Способ по любому из пп. 1–15 или 21-23, 25, 28 или 29, отличающийся тем, что ранее было определено, что рак желудка сверхэкспрессирует FGFR2–IIIb, и/или ранее было определено, что рак желудка имеет амплификацию гена FGFR2.
31. Способ по п. 30, где сверхэкспрессия FGFR2–IIIb определяется иммуногистохимией (ИГХ).
32. Способ по любому из пп. 1–15 или 21-23, 25, 28 или 29, отличающийся тем, что способ дополнительно включает определение того, сверхэкспрессирует ли рак желудка FGFR2–IIIb, и/или определение того, имеет ли рак желудка амплификацию гена FGFR2.
33. Способ по п. 32, отличающийся тем, что сверхэкспрессия FGFR2–IIIb определяется иммуногистохимией (ИГХ).
34. Способ по п. 31 или 33, отличающийся тем, что сверхэкспрессия была определена ранее или определяется сигналом ИГХ +2 или 3+ по меньшей мере в 10%, 20%, 30%, 40% или 50% опухолевых клеток.
35. Способ по п. 30, отличающийся тем, что амплификация гена FGFR2 была определена ранее или определяется путем получения отношения FGFR2 к центромере хромосомы 10 (CEN10) с использованием флуоресцентной гибридизации in situ (FISH), где ген FGFR2 считается амплифицированным, если отношение FGFR2/CEN10, определенное посредством FISH, больше или равно 2.
36. Способ по п. 30, отличающийся тем, что амплификация FGFR2 была ранее обнаружена или обнаруживается в циркулирующей опухолевой ДНК (цоДНК).
37. Способ лечения локально распространенного, неоперабельного или метастатического рака желудка, который сверхэкспрессирует FGFR2–IIIb, у субъекта-человека, включающий введение субъекту:
(1) терапевтически эффективного количества афукозилированного антитела к FGFR2–IIIb, где антитело содержит:
(i) HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 6;
(ii) HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и
(iii) HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 8;
(iv) HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 9;
(v) HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и
(vi) HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 11; и
отличающийся тем, что антитело к FGFR2–IIIb вводят внутривенно в дозе 6–15 мг/кг; и
(2) модифицированной FOLFOX6 (mFOLFOX6) химиотерапии после (1), которая включает введение 85 мг/м2 оксалиплатина, 400 мг/м2 лейковорина и 400 мг/м2 5–фторурацила (5–ФУ) путем внутривенной инфузии или внутривенной болюсной инъекции с последующим введением 2400 мг/м2 5–ФУ путем внутривенной инфузии в течение 44–48 часов;
отличающийся тем, что антитело к FGFR2–IIIb и mFOLFOX6 вводят каждые 13–15 суток; и
(3) промежуточной дозы антитела к FGFR2-IIIb между введениями (1), которая ниже, чем доза согласно (1).
38. Способ по п. 37, отличающийся тем, что промежуточная доза содержит 3–8 мг/кг антитела к FGFR2–IIIb и вводится через 6–8 суток после первой дозы 6–15 мг/кг антитела к FGFR2–IIIb и перед второй дозой 6–15 мг/кг антитела к FGFR2–IIIb.
39. Способ по п. 38, отличающийся тем, что (1) антитело к FGFR2–IIIb вводят внутривенно в дозе 15 мг/кг, (2) антитело к FGFR2–IIIb и mFOLFOX6 вводят один раз в 14 суток в одни и те же сутки, и (3) промежуточная доза содержит 7,5 мг/кг антитела к FGFR2–IIIb и вводится через 7 суток после первой дозы 15 мг/кг антитела к FGFR2–IIIb и перед второй дозой 15 мг/кг антитела к FGFR2–IIIb.
40. Способ по п. 38 или 39, отличающийся тем, что ранее было определено, что рак желудка сверхэкспрессирует FGFR2–IIIb, на что указывает сигнал ИГХ 2+ или 3+ по меньшей мере в 10% опухолевых клеток, и/или в котором ранее было определено, что рак желудка имеет амплификацию гена FGFR2 в цоДНК.
41. Способ по п. 38 или п. 39, отличающийся тем, что субъект получал два введения mFOLFOX6 до первого введения антитела к FGFR2–IIIb.
42. Способ по любому из пп. 37-39, где антитело к FGFR2–IIIb содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 5.
43. Способ по любому из пп. 37-39, где антитело к FGFR2–IIIb содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 3.
| WO 2015017600 A1, 05.02.2015 | |||
| US 2014322220 A1, 30.10.2014 | |||
| WO 2016073789 A2, 12.05.2016 | |||
| HACIBEKIROGLU I | |||
| et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| - Vol | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| - No | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| - P | |||
| 1160-1164 | |||
| PEARSON A | |||
| et al | |||
Авторы
Даты
2023-06-07—Публикация
2018-05-15—Подача