Изобретение относится к области фармацевтической химии и касается новых производных индолопирролокарбазолов, обладающих противоопухолевой активностью.
Известны производные N-гликозидов индоло[2,3-а]карбазолов, обладающие высокой противоопухолевой активностью. К их числу относятся природный антибиотик ребеккамицин [патенты США 4487925, 4552842], его модифицированный аналог [патент США 4785085], а также соединение NB-506 [Tomoko Yoshinari, Mami Matsumoto, at al., Cancer Res., 1995, 55, p. 1310-1315; Hiroharu Arakawa, Tomoko Iguchi, at al., Cancer Res., 1995, 55, p. 1316-1320] и эдотекарин [WO 096/04293 и WO 097/09339]. Структура этих соединений представляет собой малеимид индоло[2,3-а]карбазола, в котором один из индольных атомов азота связан с остатком моносахарида гликозидной связью.
Недостатками вышеперечисленных аналогов являются высокая токсичность, низкая растворимость соединений.
Наиболее близкими к заявляемым соединениям являются соединения N-гликозиды индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов [патент РФ №2427585] (прототип).
Недостатками соединений являются высокая токсичность при применении относительно невысоких доз соединений, отсутствие пролонгированного эффекта.
Задачей изобретения является получение новых соединений этого ряда, обладающих противоопухолевой активностью, пролонгированным действием и меньшей токсичностью при применении более высоких доз соединений.
Заявляемые соединения содержат различные заместители по имидному атому азота в сочетании с различными углеводными фрагментами общей формулы I:
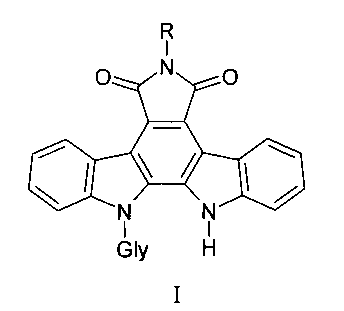
где Gly - остатки пентоз (L-арабинозы, D-рибозы, D-ксилозы) и гексозы (D-галактозы), R - аминогруппа, бензамидогруппа, (пиридин-2-ил) аминогруппа, ацетамидогруппа или карбамидогруппа.
Для получения заявляемых соединений в качестве исходных соединений были использованы N-гликозиды индоло[2,3-а]фурано[3,4-с]карбазол-5,7-дионов [патент РФ №2427585] и 6-амино-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов, полученные при обработке ацетилированных гликозидов индолофуранокарбазолов гидразин-гидратом при температуре 50С в течение 2 часов.
Технический результат заявляемого изобретения состоит в получении новых соединений, обладающих противоопухолевой активностью с пролонгированным эффектом, меньшей токсичностью при применении более высоких доз соединений на более широкой панели опухолей.
Заявляемые соединения охарактеризованы данными спектров 1Н-ЯМР и масс-спектров высокого разрешения. Спектры 1H-ЯМР записаны на приборе Bruker DRX-500 с программным обеспечением, внутренний стандарт - тетраметилсилан, химические сдвиги δ приведены в миллионных долях (м.д.). При описании формы сигналов приведены следующие сокращения: с - синглет, д - дублет, т - триплет, м - мультиплет, дд - дублет дублетов, уш. с. - уширенный синглет; значения констант спин-спинового взаимодействия J приведены в герцах. Масс-спектры зарегистрированы на масс-спектрометре Finnigan МАТ 8430 с системой обработки данных SS-300 при ускоряющем напряжении 3 кВ, энергии ионизирующих электронов 70 эВ, температуре источника ионов 250С, температуре испарения образца 170-250С, с применением системы прямого ввода вещества в область ионизации. Приведены значения m/z (отношение массы частиц к заряду). Аналитическую тонкослойную хроматографию (ТСХ) проводили на силуфоле.
Получение заявляемых соединений иллюстрируется примерами 1-6.
Пример 1.
Получение 6-амино-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (1).
К 0,55 г (0.9 ммоль) 13-формил-12-(2,3,4-три-O-ацетил-α-L-арабинопиранозил)индоло[2,3-а]фурано[3,4-с]карбазол-5,7-диона добавляли 3.2 мл (65.25 ммоль) гидразин-гидрата, смесь выдерживали при температуре 50С в течение двух часов, охлаждали до температуры 22С, выливали в воду. Выпавший осадок отфильтровывали, промывали 10% спиртом. Выход 6-амино-12-(α-L-арабино-пиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона составил 0.37 г (89%). Масс-спектр: М+ 457 m/z.
1H-ЯМР (DMSO-d6, δ м.д.): 12.15 (с, 1H, NH-индол), 9.23 (д, 1Н, Ar), 9.14 (д, 1H, Ar), 7.94 (д, 1H, Ar), 7.70 (д, 1H, Ar), 7.62 (т, 1H, Ar), 7.59 (т, 1H, Ar), 7.41 (т, 1H, Ar), 7,37(т, 1Н, Ar), 6.11 (д, 1H, H1′, J1′2′ 9.1), 6.86, 5.38, 5.24 (3 уш с, 3H, 2′, 3′, 4′-OH), 4.99 (2H, c, NH2), 4.20-4.05 (м, 3H, H2′, Н3′, H5″), 4.25 (м, 1H, H5′), 3.85 (м, 1H, H4′).
Пример 2.
Получение 6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (2).
Пирролокарбазол (2) получали из 13-формил-12-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозил)индоло[2,3-а]фурано[3,4-с]карбазол-5,7-диона аналогично способу получения соединения (1). Выход 6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона 80%. Масс-спектр: М+ 502 m/z.
1Н-ЯМР (DMSO-d6, δ м.д.): 12.17 (с, 1H, NH-индол), 9.23 (д, 1Н, Ar), 9.13 (д, 1H, Ar), 7.96 (д, 1Н, Ar), 7.70 (д, 1Н, Ar), 7.62 (т, 1H, Ar), 7.59 (т, 1H, Ar), 7.40 (м, 1H, Ar), 7,36 (т, 1H, Ar), 6.19 (д, 1H, Н1′, J1′2′. 9.2), 6.84, 5.36, 5.22, 4.85 (4 уш с, 4Н, 2′, 3′, 4′, 6′-OH), 4.99 (2Н, с, NH2), 4.25 (м, 1Н, Н2′), 4.17-4.12 (м, 2Н, Н4′, Н5′), 3.86 (м, 1H, Н3′), 3.73 (м, 1H, Н6″а), 3.66 (м, 1H, Н6″b).
Пример 3.
Получение 6-ацетамидо-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (3).
К смеси, состоящей из 2.5 мл метанола и 5.0 мл тетрагидрофурана, добавляли 56 мг (0.12 ммоль) 6-амино-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона, затем 0.2 мл (0.002 ммоль) уксусного ангидрида. Реакционную массу перемешивали в течение 4 часов при температуре 22°C, затем добавляли 4.0 мл 50% водного метанола. Смесь выдерживали в течение 30 минут, упаривали досуха, добавляли 5.0 мл воды. Образовавшийся осадок отфильтровывали и с помощью препаративной хроматографии на силикагеле в системе бензол-ацетон в соотношении 5:6 из зоны с Rf 0.5 выделяли 31 мг соединения. Выход 6-ацетамидо-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона составил 55%. Масс-спектр: М+ 514 m/z
1Н-ЯМР (DMSO-d6, δ м.д.): 12.24 (д, 1Н, NH-индол), 10.72 (д, 1H, NHAc), 9.12 (д, 1H, Ar), 9.06 (д, 1H, Ar), 8.02 (д, 1H, Ar), 7.74 (д, 1Н, Ar), 7.68 (м, 2Н, Ar), 7.40 (м, 2Н, Ar),7.15, 5.67, 5.55 (уш с, м 3Н, 3-ОН), 6.45 (1Н, д, Н1′ J1′2′ 9.0), 4.2-4.05 (м, 4Н, Н2′, Н3′, Н5′, Н5″), 3.39 (м, 1Н, Н4′).
Пример 4.
Получение 6-(пиридин-2-иламино)-12-(β-D-рибопиранозил)индоло[2,3-а]пирроло[3,4-с] карбазол-5,7-диона (4).
К 1,51 г (2.7 ммоль) 12-(2,3,4-три-О-ацетил-β-D-рибопиранозил)индоло[2,3-а]фурано[3,4-с]карбазол-5,7-диона в 30 мл метанола добавляли 0.58 г (5.3 ммоль) гидразинопиридина. Далее реакционную смесь кипятили 20 минут. Растворитель упаривали, к остатку добавляли 30 мл воды. Выпавший осадок отфильтровывали, высушивали и получали 1,5 г ацетилированного рибозида 6-(пиридин-2-иламино)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона.
Затем к 1,50 г (2.2 ммоль) полученного ацетилированного рибозида в 50 мл абсолютного метанола добавляли 17,2 мл 0,1 н. раствора метилата натрия в метаноле. Реакционную смесь перемешивали при температуре 22°C в течение 15 минут. Выпавший осадок отфильтровывали, промывали горячим ацетоном и высушивали. Выход 6-(пиридин-2-иламино)-12-(β-D-рибопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона составил 1,11 г.(91%). Масс-спектр: М+ 549 m/z.
1Н-ЯМР (DMSO-d6, δ м.д.): 11.72 (c, 1H, NH-индол), 9.36 (с, 1H, NH-Py), 9.14 (д, 1Н, Ar), 9.06 (д, 1H, Ar), 8.08-7.35 (м, 8HAr, Ру), 6,90-6,66 (м, 2Н, Ру), 6,27 (д, 1H, Н′), 5.25-3.85 (м, 5Н, Н2′, Н3′, Н4′, Н5′, Н5″).
Пример 5.
Получение 6-(бензамидо)-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (5).
К 45 мг (0.09 ммоль) 6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона добавляли 0,05 мл (0.43 ммоль) бензоилхлорида. Смесь перемешивали при температуре 22°C в течение двух часов. Раствор упаривали, остаток хроматографировали на силикагеле в системе хлороформ : метанол : тетрагидрофуран в соотношении 4:1:1. Из зоны с Rf 0,53 выделяли 26 мг 6-(бензамидо)-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона. Выход составил 47,7%. Масс-спектр M+ 606 m/z.
1Н-ЯМР (DMSO-d6, δ м.д.): 12.2 (уш. с, 1H, NH-индол), 9.18 (д, 1H, Ar), 9.07 (д, 1H, Ar), 8.06 (д, 1H, Ar), 8.00 (д, 1H, Ar), 7.75 (д, 1H, Ar), 7.70-7.57 (м, 7Н, Ar, NH-Bz), 6.22 (д, 1H, Н′, J1′2′, 7.0), 5.42, 5.28, 4.35, 4.18 (4 уш с, 4Н, 2′, 3′, 4′, 6′-ОН), 4.14 (т, 1Н, Н4′), 3.85 (дд, 1Н, Н2′), 3.76 (м, 1Н, Н5′), 3.67 (дд, 1Н, Н3′), 3.33 (м, 2Н, Н6′, Н6″).
Пример 6.
Получение 6-(карбамидо)-12-(β-D-ксилопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (6).
К 100 мг (0.17 ммоль) 12-(2,3,4-три-O-ацетил-β-D-ксилопиранозил)индоло[2,3-а]фурано[3,4-с]карбазол-5,7-диона в 5 мл метанола добавляли 46,5 мг (0.42 ммоль) семикарбазида гидрохлорида и 58,4 мл (0.42 ммоль) триэтиламина. Смесь кипятили 3 часа, растворитель упаривали. К остатку добавляли воду. Образовавшийся осадок отфильтровывали, высушивали. Выход ацетилированного ксилопиранозида 6-(карбамидо)-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона составил 80 мг.
Далее к 80 мг ацетилированного ксилопиранозида (0.125 ммоль) в 2,5 мл абсолютного метанола добавляли 0,6 мл 0,1 н. раствора метилата натрия в метаноле. Реакционную смесь перемешивали при температуре 22°C в течение 5 минут. Выпавший осадок отфильтровывали, промывали водой, высушивали и получали 45 мг 6-(карбамидо)-12-(β-D-ксилопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона. Выход продукта составил 70%. Масс-спектр M+ 515 m/z.
1Н-ЯМР (DMSO-d6, δ м.д.): 11.87 (с, 1H, NH-индол), 9.20 (д, 1H, Ar), 9.12 (д, 1H, Ar), 8.65 (уш с, 1H, NH), 8.04 (д, 1H, Ar), 7.97(с, 1Н, NH), 7.81(д, 1Н, Ar), 7.62-7.57 (т, 1Н, Ar), 6,42 (2Н, с NH2), 6.40(2Н, д, Н1′), 5.40-3.30 (м, 5Н, Н2′, Н3′, Н4′, Н5′, Н5″).
Исследование цитотоксической активности соединений (1-6) in vitro
Исследование цитотоксической активности соединений (1-6) проводили на клетках рака толстой кишки человека линии НСТ-116:
6-амино-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона, (1);
6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона, (2);
6-(ацетамидо)-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона, (3);
6-(пиридин-2-иламино)-12-(β-D-рибопиранозил)индоло[2,3-а]пирроло-[3,4-с]карбазол-5,7-диона, (4);
6-(бензамидо)-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло-[3,4-с] карбазол-5,7-диона, (5);
6-(карбимидо)-12-(β-ксилопиранозил)индоло[2,3-а]пирроло[3,4-с] карбазол-5,7-диона, (6);
Опухолевые клетки выращивали на среде RPMI 1640, содержащей 10% эмбриональной сыворотки теленка, при 5% содержании CO2 и температуре 37°C. Цитотоксическую активность соединений (1-6) оценивали по выживаемости клеток, которую определяли с помощью стандартного МТТ-теста с использованием МТТ-реагента (3,4,5-диметилтиазол-2-ил-2,5-дифенилтетразолиум бромид), основанного на способности дегидрогеназ живых метаболически активных клеток восстанавливать МТТ-реагент до голубых нерастворимых кристаллов формазана [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, 2005, М., с 649-651].
Исследования выполняли на 96-луночных микропланшетах. Опухолевые клетки рассевали в 180 мкл культуральной среды и выращивали в течение 24 час. Затем добавляли соединения (1-6) в концентрациях от 0,01 до 100 мкМ в объеме 20 мкл. Время инкубации соединений (1-6) с клетками опухолевых линий составляло 48 час. Контролем служили образцы клеток, к которым соединения (1-6) не добавляли. Через 48 час к клеткам добавляли МТТ-реагент в конечной концентрации 0,5 мкг/мл и инкубировали в течение 2 час. Выпавшие кристаллы формазана растворяли в 100 мкл диметилсульфоксида (ДМСО) в течение 20 мин при температуре 37°C. Далее оптическое поглощение окрашенных растворов измеряли на счетчике оптического поглощения при длине волны 540 нм. При этом оптическое поглощение растворенного в ДМСО формазана коррелировало с количеством оставшихся живых клеток в пробе. Выживаемость клеток для каждой концентрации соединений (1-6) определяли по формуле в (%):
(По/Пк)×100,
где По - оптическое поглощение растворенного в ДМСО формазана в опытных образцах, Пк - оптическое поглощение растворенного в ДМСО формазана в контрольных образцах.
На основании полученной кривой «доза-эффект» вычисляли значение ингибирующей концентрации (IC50, мкМ) соединения, при которой поглощение формазана в опытных образцах составляло 50% от контрольных образцов. Соединение считали активным, если IC50 была равна или менее 50 мкМ. Ошибка измерений в экспериментах не превышала 5%.
Наиболее высокой цитотоксической активностью обладало соединение (1), при этом IC50 составило 0,5 мкМ, что послужило основанием изучить цитотоксическую активность соединения (1) на других клеточных линиях рака человека.
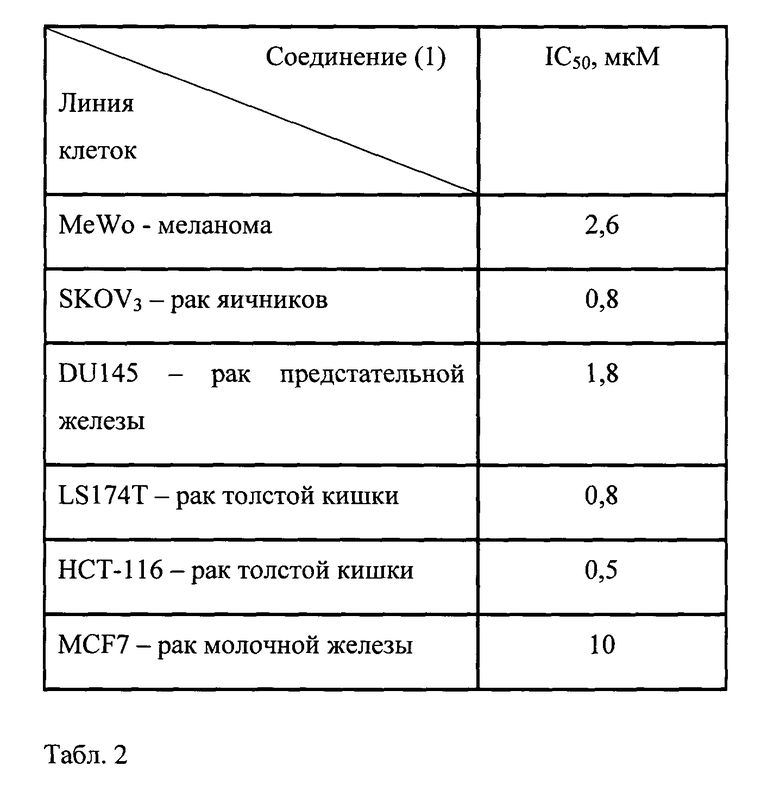
Соединение (1) было изучено на клетках меланомы MeWo, рака яичников SKOV3, рака предстательной железы DU 145, рака толстой кишки LS174T, рака молочной железы MCF-7.
Изобретение иллюстрируется таблицами 1-4.
В табл.1 представлена цитотоксическая активность соединений (1-6) на линии клеток рака толстой кишки человека НСТ-116. Показано, что наибольшей цитотоксической активностью обладало соединение (1), при этом IC50 составило 0,5 мкМ.
В табл.2 представлена цитотоксическая активность соединения (1) на меланоме MeWo, раке яичников SKOV3, раке предстательной железы DU 145, раке толстой кишки LS174T, раке молочной железы MCF-7. Выявлена высокая цитотоксическая активность соединения (1) на клеточных линиях рака толстой кишки LSI74 Т и рака яичников SKOV3; при этом IC50 составила 0,8 мкМ. Цитотоксическая активность на клеточных линиях рака предстательной железы DU 145, меланомы MeWo и рака молочной железы MCF-7 была ниже и показатели IC50 составляли 1,8 мкМ, 2,6 мкМ и 10 мкМ, соответственно.
Соединение (1), обладающее максимально выраженной цитотоксической активностью, было изучено in vivo на перевиваемых опухолях мышей.
Исследование противоопухолевой активности соединения (1) in vivo
Противоопухолевую активность изучали на перевиваемых опухолях мышей линий СВА, BALB/c и мышах гибридах первого поколения BDF1(C57B1/6×DBA/2) массой 18-25 г, которых получали из отдела экспериментальных животных ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН и содержали в виварии на обычном рационе питания.
Противоопухолевую активность изучали на четырех моделях солидных опухолей мышей: эпидермоидной карциноме легкого Льюис (LLC), меланоме (В-16), раке шейки матки РШМ-5 (РШМ-5), аденокарциноме толстой кишки АКАТОЛ (АКАТОЛ) и на трех асцитных опухолях: лимфоцитарной лейкемии Р-388 (Р-388), лимфоидной лейкемии L1210 (L1210), опухоли Эрлиха.
Опухолевые клетки LLC и меланомы В-16 перевивали мышам- гибридам BDF1, РШМ-5 мышам-самкам линии СВА, клетки аденокарциномы толстой кишки АКАТОЛ-мышам линии BALB/c, подкожно в правую подмышечную область по 0,5 мл взвеси опухолевых клеток при разведении 1:10 в среде 199.
Противоопухолевую активность оценивали по торможению роста опухоли (ТРО) и увеличению продолжительности жизни (УПЖ) опытных по сравнению с контрольными мышами.
Опухолевые клетки Р-388, L1210 и опухоли Эрлиха перевивали мышам-гибридам BDF1 внутрибрюшинно по 106 опухолевых клеток в 0,3 мл асцитной жидкости при разведении ее средой 199. Критерием оценки противоопухолевой активности являлось только УПЖ.
Введение соединения (1) начинали через 24 час после перевивки асцитных опухолей и через 48 час после перевивки солидных опухолей, при этом непосредственно перед введением соединение растворяли в ДМСО и разводили физиологическим раствором до 10% концентрации. Соединение (1) вводили ежедневно внутрибрюшинно в течение 5 дней в дозах 10 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг и 100 мг/кг.
Опытные группы при перевивке солидных опухолей состояли из 8 мышей, а при перевивке асцитных опухолей - из 6 мышей. Контрольная группа включала 10-12 мышей.
Для оценки ТРО измеряли три максимальных взаимно перпендикулярных размера опухоли (длина, ширина, высота) у каждой мыши и вычисляли ее объем, а затем определяли средний объем опухолей в группе. Измерение объема опухоли проводили каждые 3 дня, начиная с 1 дня после окончания введения соединения, когда размеры опухолей у мышей контрольной группы были измеримыми.
V (мм3)=L×S×Н
ТРО вычисляли по формуле:
ТРО(%)=(Vк-Vо)/Vк×100, где
Vк - средний объем опухолей в контрольной группе (мм3)
Vо - средний объем опухолей в опытной группе (мм3)
Сравнительную оценку противоопухолевой активности по УПЖ проводили после гибели мышей от опухолевого процесса. Сначала определяли среднюю продолжительность жизни (СПЖ) в днях в опытной и контрольной группах, а затем вычисляли УПЖ по формуле:
УПЖ(%)=(СПЖо-СПЖк)/СПЖк×100, где
СПЖк - средняя продолжительность жизни мышей в контрольной группе (дни)
СПЖо - средняя продолжительность жизни мышей в опытной группе (дни)
Минимальными критериями противоопухолевой активности служили: ТРО≥50% и УПЖ≥25%.
Статистическую значимость результатов оценивали по критерию Стьюдента-Фишера. Статистически значимой противоопухолевую активность считали при р≤0,05.
Токсичность соединения оценивали по срокам ранней гибели мышей в опытной по сравнению контрольной группой, состоянию внутренних органов животных (селезенки, легких, наличию метастазов в легких) и изменению массы тела по сравнению с исходной.
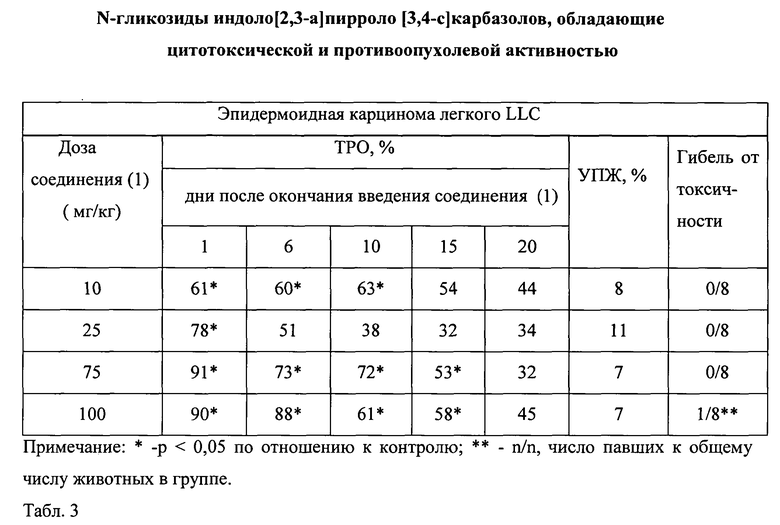
В табл.3 показана зависимость противоопухолевой активности от дозы соединения (1) в диапазоне от 10 мг/кг до 100 мг/кг на LLC. При применении соединения (1) в дозах 75 мг/кг и 100 мг/кг отмечена высокая противоопухолевая активность на следующий день после окончания курса введения: ТРО составило 91% и 90% соответственно. При этом противоопухолевая активность оставалась статистически значимой в течение 15 дней после введения соединения: при значениях ТРО 53% и 58% соответственно. Максимально переносимой дозой соединения (1) была доза 100 мг/кг, которая вызвала гибель одной из 8 мышей.
Таким образом, доза 75 мг/кг соединения (1) являлась терапевтической при ежедневном внутрибрюшинном введении в течение 5 дней.
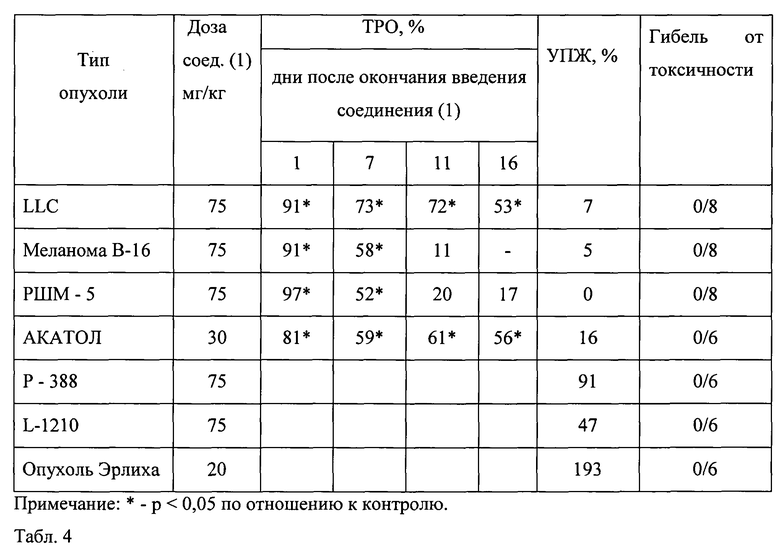
В табл.4 представлена противоопухолевая активность соединения (1) на других опухолях мышей: меланоме В-16, РШМ-5, АКАТОЛе, Р-388, L-1210, опухоли Эрлиха. Противоопухолевую активность соединения (1) в дозе 75 мг/кг наблюдали непосредственно после окончания его введения на меланоме В-16 и РШМ-5, при этом ТРО составило 91% и 97% соответственно. Противоопухолевая активность соединения (1) через неделю после окончания его введения снижалась при значении ТРО 58% и 52% соответственно.
Противоопухолевую активность соединения (1) в дозе 20 мг/кг наблюдали непосредственно после окончания введения на АКАТОЛе. ТРО составило 81% и до 29 дня сохранялось на уровне 56%. При этом УПЖ составило 16%.
Противоопухолевую активность соединения (1) на Р-338, на L-1210 и на опухоли Эрлиха оценивали по УПЖ, которое составило соответственно 91%, 47% и 193%.

| название | год | авторы | номер документа |
|---|---|---|---|
| Производное класса N-гликозидов индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов - N-{ 12-(β-D-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с] карбазол-6-ил} пиридин-2-карбоксамид, обладающее цитотоксической и противоопухолевой активностью | 2017 |
|
RU2667906C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ГЛИКОЗИДОВ ИНДОЛО[2,3-а]ПИРРОЛО[3,4-с]КАРБАЗОЛ-5,7-ДИОНОВ, ОБЛАДАЮЩИХ ЦИТОТОКСИЧЕСКОЙ И ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2427585C9 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2014 |
|
RU2572691C1 |
| ПРОИЗВОДНЫЕ ИНДОЛОКАРБАЗОЛОВ, БЛОКИРУЮЩИЕ ВАСКУЛОГЕННУЮ МИМИКРИЮ В ОПУХОЛИ | 2014 |
|
RU2557554C1 |
| Средство для терапии опухолей | 2019 |
|
RU2726801C1 |
| Способ получения аминокислотных аналогов противоопухолевого антибиотика ребеккамицина | 2020 |
|
RU2755572C1 |
| Способ лечения рака толстой кишки человека SW620 в эксперименте | 2017 |
|
RU2665168C1 |
| ПРОИЗВОДНЫЕ ГЛИКОЗИДОВ ИНДОЛО[2,3-А]ПИРРОЛО[3,4-С]КАРБАЗОЛ-5,7-ДИОНОВ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ И ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2255089C1 |
| ПРОТИВООПУХОЛЕВОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ИНГИБИТОР ТОПОИЗОМЕРАЗЫ I | 2022 |
|
RU2786727C1 |
| ИНДОЛОПИРРОЛОКАРБАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ САХАРОВ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛЕЙ | 1997 |
|
RU2167880C2 |
Изобретение относится к новым производным индолопирролокарбазолов, которые могут использоваться для лечения опухолей, общей формулы I
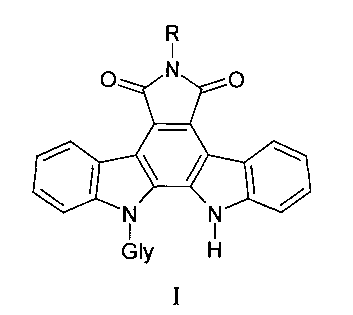
где Gly - остатки пентоз (L-арабинозы, D-рибозы, D-ксилозы) и гексозы (D-галактозы), R - аминогруппа, бензамидогруппа, (пиридин-2-ил) аминогруппа, ацетамидогруппа или карбамидогруппа. Предложены новые соединения, обладающие выраженной цитотоксической активностью. 4 табл., 6 пр.
N-Гликозиды индоло[2,3-а]пирроло[3,4-с]карбазолов, обладающие цитотоксической и противоопухолевой активностью, общей формулы I:
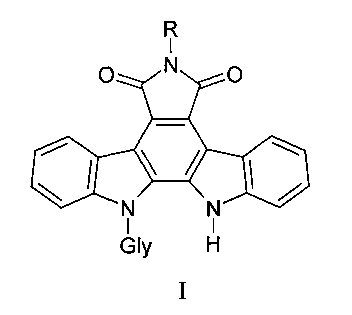
где Gly - остатки пентоз (L-арабинозы, D-рибозы, D-ксилозы) и гексозы (D-галактозы), R - аминогруппа, бензамидогруппа, (пиридин-2-ил) аминогруппа, ацетамидогруппа или карбамидогруппа, из которых 6-амино-12-(α-L-арабинопиранозил)индоло[2,3а]пирроло[3,4-с]карбазол-5,7-дион обладает выраженной цитотоксической активностью на культуре клеток рака толстой кишки человека НСТ-116, LS174T, рака яичников SKOV3 и пролонгированной противоопухолевой активностью при меланоме В-16, эпидермоидной карциноме легкого Льюиса и аденокарциноме толстой кишки АКАТОЛ.
| Gao, Qunjie et al, Chemistry & Biology, 2006, 13(7), 733-743, | |||
| Zhang Changsheng et al, ChemBioChem, 2006, 7(5), 795-804 | |||
| Zhang, Guisheng et al, Journal of Medicinal Chemistry, 2005, 48(7), 2600-2611 | |||
| CN102125578 A, 20.07.2011 | |||
| Facompre Michael et al, ChemBioChem, 2003, 4(5), 386-395 | |||
| Bailly Christian et al, Molecular Pharmacology, 1999, 55(2), |
Авторы
Даты
2015-04-10—Публикация
2014-02-27—Подача