ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка претендует на приоритет по отношению к заявке на патент Китая № CN 201110048505.1, поданной 28 февраля 2011; к заявке на патент Китая № CN 201210026698.5, поданной 7 февраля 2012; и к международной заявке на патент № PCT/CN2012/071079, поданной 13 февраля 2012. Полное содержание каждой из идентифицированных выше заявок включено в настоящее описание посредством ссылки.
Область изобретения
Настоящее изобретение относится по меньшей мере к гуманизированному антителу против фактора некроза опухоли-α (TNFα) или к его фрагментам, включая его специфичные участки или варианты, и к нуклеиновой кислоте, кодирующей гуманизированное антитело против TNFα, и комплементарной ей нуклеиновой кислоте, к векторам, клеткам-хозяевам и к способу их получения, а также к композициям и наборам, содержащим гуманизированное антитело против TNFα, и к их применению.
Предшествующий уровень техники
Фактор некроза опухоли-α (TNFα) человека является провоспалительным цитокином, продуцируемым моноцитами и макрофагами, который исходно продуцируется в виде белка-предшественника, имеющего молекулярную массу 26 кДа, N-конец которого находится внутри клеток, а C-конец находится вне клеток, названного TNFα трансмембранного типа. Авторы Pennica et al. впервые клонировали кДНК гена TNFα в 1984 и вывели, что молекула TNFα человека состоит из 157 аминокислотных остатков и имеет молекулярную массу 17 кДа (Pennica D. et al. Nature 1984; 312:724). TNF человека имеет две молекулярные формы, TNFα и TNFβ. TNFα продуцируется активированными макрофагами или моноцитами и вызывает геморрагический некроз опухолевых тканей, следовательно, его также называют кахектином. TNFβ секретируется, в основном, активными T лимфоцитами. Оба фактора обладают сходным механизмом развития гипертермии. TNFα действует на рецепторы на поверхности онкоцитов и разрушается в лизосоме посредством идентификации клетки, связывающей и поглощающей его посредством эндоцитоза, и, таким образом, активирует лизосомы и протеазы, вызывая гибель клетки. TNFα играет важную роль в иммунном ответе, воспалении и ответе на повреждение, значительно влияет на регуляцию пролиферации клеток и клеточного апоптоза. Кроме воздействий на опухолевую клетку, таких как цитотоксичность, цитолиз, индукция апоптоза и подавление пролиферации клеток, TNFα может также способствовать дифференциации клеток миелоидного лейкоза до макрофагов и улучшать фагоцитарную активность нейтрофильных гранулоцитов.
Соответствующее количество TNFα может активировать иммунную систему, в результате чего усиливается иммунный ответ организма, и играет важную роль в защитной системе сопротивления хозяина инвазии микроорганизмами и ингибирования опухоли. Но при гиперэкспрессии TNFα может вызывать некоторые патологические повреждения другими воспалительными факторами. Таким образом, действия TNFα могут быть подавлены или нейтрализованы на различных уровнях, чтобы блокировать доступность для него соответствующих рецепторов, избегая, в свою очередь, последствий преобразования сигнала.
В целях преодоления релевантных проблем, вызванных применением нечеловеческих антител, относительно эффективной стратегией лечения является конструирование химерного антитела человека и мыши, чтобы уменьшить иммуногенность организма, вызванную НАМА (человеческим антимышиным антителом). Такой вид химерного антитела получают путем включения вариабельной области нечеловеческого антитела в константную область человеческого антитела, сохраняя при этом аминокислотные последовательности исходных вариабельных областей тяжелой и легкой цепей нечеловеческого антитела (см. Daddona, P.E et al. PCT publication WO 92/16553, Le, J. et al., патент US №5919452, Kang, Heui H et al. PCT publication WO 2005/047329, Jin Boquan et al., публикация патента Китая № CN 1544466A). Авторами Jin Yihui et al. в заявке на патент Китая № CN 101177453 предложено химерное антитело, которое может связываться с фактором некроза опухоли человека. По сравнению с нечеловеческим антителом иммуногенность химерного антитела снижается, тем не менее, оно может вызвать ответ HAMA, который в связи с участком химерного антитела мышиного происхождения все же является в различной степени высоким, в частности, включающий реакцию слизистой оболочки и кожи, аллергическую реакцию, аритмию и стенокардию, почечную недостаточность и в тяжелом случае даже кому. Поэтому клинические применения данного вида химерных антител в высокой степени ограничены.
В клинических испытаниях показано, что данный вид химерных антител в виде гетерогенного белка может вызвать иммунологический ответ отторжения этого гетерогенного белка иммунной системой организма (то есть ответ человеческих антимышиных антител, HAMA) при введении человеку. Этот ответ приводит к быстрому клиренсу и короткому периоду полувыведения мышиного антитела в организме человека. Повторное введение может даже привести в результате к анафилактическому шоку. Кроме того, "чужеродное" антитело может быть атаковано иммунным антителом, поэтому оно может быть нейтрализовано до проявления фармацевтических эффектов.
Авторы изобретения на основе упомянутых выше патентов разработали новый метод получения гуманизированного антитела путем применения генетической технологии с целью сокращения до минимума участка мышиного происхождения в химерном антителе. Этот метод включает встраивание в каркасную область (FR) антитела человека участков, определяющих комплементарность (CDR), вариабельной области тяжелой цепи и вариабельной области легкой цепи мышиного антитела по отдельности. Полученное гуманизированное антитело насколько возможно является сходным по структуре с человеческой последовательностью, в то же время, оно может также сохранять конформацию CDR, подобную родительскому нечеловеческому антителу. По сравнению с родительским нечеловеческим антителом и химерным антителом участок родительской нечеловеческой аминокислотной последовательности в сконструированном гуманизированном антителе уменьшен и, с одной стороны, сохраняется способность антитела к распознаванию антигена; с другой стороны, иммуногенность мышиного антитела значительно снижена. Следовательно, повышена безопасность антитела в клинических применениях.
Следовательно, в настоящем изобретении предложено гуманизированное антитело, которое является более безопасным, имеет более длительный период полувыведения, более значительные эффекты в организме человека по сравнению с мышиным химерным антителом предшествующего уровня техники.
Краткое изложение сущности изобретения
В одном аспекте в настоящем изобретении предложено по меньшей мере одно гуманизированное моноклональное антитело против фактора некроза опухоли или его конкретные участки, определяющие комплементарность, вариабельная область тяжелой цепи или легкой цепи, константная область тяжелой цепи или легкой цепи, каркасная область или любые другие произвольные участки. Антитело по настоящему изобретению может быть получено от любых млекопитающих, например, включающих, но не ограниченных ими, человека, мышь, крысу, грызуна, примата или любую их комбинацию.
Антитело по настоящему изобретению специфично связывается по меньшей мере с одним эпитопом белков TNF, их субъединицей, фрагментом, участком или любой их комбинацией. По меньшей мере один эпитоп может включать по меньшей мере одну область связывания антитела. По меньшей мере один эпитоп может необязательно включать по меньшей мере одну область, определяющую комплементарность (CDR) (например, вариабельной области тяжелой цепи или вариабельной области легкой цепи), и/или по меньшей мере одну константную или вариабельную каркасную область (FR) или любой произвольный участок. Аминокислотная последовательность по меньшей мере одного антитела может дополнительно необязательно включать вставку, делецию или консервативную замену по меньшей мере одного аминокислотного остатка.
В другом аспекте в настоящем изобретении предложена по меньшей мере одна молекула нуклеиновой кислоты, включающая полинуклеотид, кодирующий по меньшей мере одно гуманизированное антитело против фактора некроза опухоли по настоящему изобретению, либо комплементарная или гибридизующаяся с полинуклеотидом, кодирующим по меньшей мере одно гуманизированное антитело против фактора некроза опухоли по настоящему изобретению, причем это антитело включает по меньшей мере одну его специфичную последовательность, домен, участок или вариант.
В другом аспекте в настоящем изобретении предложен рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты, кодирующую гуманизированное антитело против фактора некроза опухоли, клетка-хозяин, содержащая нуклеиновую кислоту и/или рекомбинантный вектор, и способ получения и/или применения нуклеиновой кислоты, вектора и/или клетки-хозяина.
По меньшей мере одно антитело по настоящему изобретению обладает по меньшей мере одной активностью, например, но не ограниченной ими, активностью, нейтрализующей токсичность rhTNFα для клетки-мишени L929, подавляющей связывание и/или конкурирующей за связывание TNF с рецептором и/или другим моноклональным антителом, например, но не ограниченным, антителом Хумира.
В другом аспекте в настоящем изобретении предложено применение антитела и/или композиции по настоящему изобретению при ингибировании активностей hTNFα, где заболевание, обусловленное hTNFα, выбрано из группы, состоящей из пиемии, аутоиммунных заболеваний, злокачественной опухоли, расстройства функции легких, отторжения трансплантата, бактериального менингита, церебральной малярии, СПИД и СПИД-ассоциированного комплекса (ARC, AIDS-related complex), вторичной цитомегаловирусной инфекции после трансплантации.
В другом аспекте в настоящем изобретении предложено применение при получении лекарственного средства при диагностическом анализе hTNFα, причем гуманизированное антитело против фактора некроза опухоли также может быть меченным молекулой обнаружения и/или может быть немеченым, и метка включает радиоактивный изотоп; флуоресцентную метку; различные виды меток, представляющих собой субстраты ферментов.
В другом аспекте в настоящем изобретении предложено применение антитела и/или композиции по настоящему изобретению в способе анализа, включающем анализ конкурентного связывания, прямой или непрямой сэндвич-анализ или анализ иммунопреципитации.
В другом аспекте в настоящем изобретении предложена по меньшей мере одна композиция, содержащая гуманизированное антитело против фактора некроза опухоли и/или его кодирующую аминокислоту, одно или более чем одно вспомогательное вещество, выбранное, но не ограниченное ими, из фармацевтически приемлемого носителя, эксципиента, разбавителя или добавки. Композиция может дополнительно необязательно содержать по меньшей мере одно другое антитело, нуклеиновую кислоту, вспомогательные вещества или любую их комбинацию.
В другом аспекте в настоящем изобретении предложен набор, содержащий предопределенное количество реагентов и инструкцию, где реагенты включают антитело, нуклеиновую кислоту и/или композицию по настоящему изобретению. Набор дополнительно включает другие добавки, например, включающие, но не ограниченные ими, стабилизатор и буфер.
Краткое описание графических материалов
Специалистам в данной области техники может быть понятно, что приведенные ниже графические материалы предназначены в целях иллюстрации настоящего изобретения, которая никоим образом не ограничивает объем настоящего изобретения.
На фиг.1 показана кривая нейтрализации антителом киллинг-эффекта TNFα в отношении клеток U937.
На фиг.2 показаны баллы степени отека сустава крысы, индуцированного коллагеном типа II.
На фиг.3A показан балл артрита мышей Tg197, на фиг.3B показана гистологическая оценка группы обработки мышей Tg197, на фиг.3C показано действие обработки группы на балл артрита (AS) и гистологическую оценку (HS) мышей Tg197.
Подробное описание изобретения
Антитело против фактора некроза опухоли
Антитело по настоящему изобретению включает аминокислотную последовательность антитела, кодируемую любым подходящим полинуклеотидом, либо любое выделенное антитело или препарат антитела. Гуманизированное антитело или его антигенсвязывающий фрагмент предпочтительно связывается с фактором некроза опухоли человека и в результате частично, существенно или полностью нейтрализует по меньшей мере одну активность фактора некроза опухоли человека, следовательно, ингибирует процесс преобразования сигнала и физиологический процесс, опосредованный связыванием TNF с рецептором TNF.
Гуманизированное антитело по настоящему изобретению может иметь любой тип (lgG, lgA, lgM, lgE, lgD и т.д.) или изотип и может включать легкие цепи к или λ и тяжелые цепи α, µ, y, ε или δ.
По меньшей мере одно антитело по настоящему изобретению связывается по меньшей мере с одним эпитопом белка TNF, его субъединицей, фрагментом, участком или любой их комбинацией.
По меньшей мере одно моноклональное антитело против фактора некроза опухоли включает приведенную ниже аминокислотную последовательность, где аминокислотная последовательность вариабельной области тяжелой цепи антитела показана в виде SEQ ID NO: 1 и аминокислотная последовательность вариабельной области легкой цепи антитела показана в виде SEQ ID NO: 2.
SEQ ID NO: 1:
QVQLVQSGPELKKPGASVKISCKASGYTFTHYGMHWVKQTPGRGLKWVGWINTYTGEPTYDADFQGRFTFSLETSVSTAFLQINSLKDEDLATYFCARYDFDGFDYWGQGTTLTVSS
SEQ ID NO: 2:
ENVLTQSPPILSASPGERVTMTCRASSSITFNYLHWYQQKSGDSPKVWIYST SNLVSGVPSRFSGSGSGTSYSLTISSLEAEDAATYYCQQYSDYPYTFGGGTKLEIK
где участок, определяющий комплементарность, CDR-H1 вариабельной области тяжелой цепи имеет последовательность SEQ ID NO: 3; CDR-H2 имеет последовательность SEQ ID NO: 4; CDR-H3 имеет последовательность SEQ ID NO: 5; где в пределах каркасной области FR-H1 A может быть заменен E в положении аминокислотного остатка 16, S может быть заменен T в положении 17, I может быть заменен V в положении 20 (например, как показано в SEQ ID NO: 11); в пределах FR-H2 K может быть заменен R в положении 3, G может быть заменен S в положении 9 (например, как показано в SEQ ID NO: 12); в пределах FR-H3 T может быть заменен V в положении 3, E может быть заменен D в положении 7, V может быть заменен T в положении 10, F может быть заменен Y в положении 14, S может быть заменен T в положении 19, T может быть заменен V в положении 27 (например, как показано в SEQ ID NO: 13); и участок, определяющий комплементарность, CDR-L1 имеет последовательность SEQ ID NO: 6; CDR-L2 имеет последовательность SEQ ID NO: 7; CDR-L3 имеет последовательность SEQ ID NO: 8; где в пределах каркасной области FR-L1 L может быть заменен М в положении 11, R может быть заменен E в положении 18, M может быть заменен I в положении 21 (например, как показано в SEQ ID NO: 14); в пределах FR-L2 W может быть заменен L в положении 13 (например, как показано в SEQ ID NO: 15); в пределах FR-L3 S может быть заменен A в положении 4, L может быть заменен V в положении 22, A может быть заменен F в положении 27 (например, как показано в SEQ ID NO: 16).
SEQ ID NO: 3:
HYGMH
SEQ ID NO: 4:
WINTYTGEPTYDADFQG
SEQ ID NO: 5:
YDFDGFDY
SEQ ID NO: 6:
RASSSITFNYLH
SEQ ID NO: 7:
STSNLVS
SEQ ID NO: 8:
QQYSDYPYT
SEQ ID NO: 9:
QVQLVQSGPELKKPG(E/A)(T/S)VK(I/V)SCKASGYTFTHYGMHWV(K/R)QTPGR(S/G)LKVWGWINTYTGEPTYDADFQGRF(T/V)FSL(E/D)TS(T/V)STA(F/Y)LQIN(T/S)LKDEDLA(T/V)YFCARYDFDGFDYWGQGTTLTVSS
SEQ ID NO: 10:
ENVLTQSPPI(M/L)SASPGE(E/R)VT(M/I)TCRASSSITFNYLHWYQQKSGDSPKV(W/L)IYSTSNLVSGVP(A/S)RFSGSGSGTSYSLTISS(V/L)EAED(A/F)ATYYCQQYSDYPYTFGGGTKLEIK
SEQ ID NO: 11:
QVQLVQSGPELKKPG(E/A)(T/S)VK(I/V)SCKASGYTFT
SEQ ID NO: 12:
WV(K/R)QTPGR(S/G)LKWVG
SEQ ID NO: 13:
RF(T/V)FSL(E/D)TS(T/V)STA(F/Y)LQIN(T/S)LKDEDLA(T/V)YFCAR
SEQ ID NO: 14:
ENVLTQSPPI(M/L)SASPGE(E/R)VT(M/I)TC
SEQ ID NO: 15:
WYQQKSGDSPKV(W/L)IY
SEQ ID NO: 16:
GVP(S/A)RFSGSGSGTSYSLTISS(V/L)EAED(A/F)ATYYC
В воплощении настоящего изобретения последовательность константной области тяжелой цепи гуманизированного антитела против фактора некроза опухоли представляет собой константную область тяжелой цепи lgG1 человека.
В воплощении настоящего изобретения последовательность константной области легкой цепи гуманизированного антитела против фактора некроза опухоли представляет собой константную область легкой цепи антитела человека.
В предпочтительном воплощении настоящего изобретения аминокислотная последовательность гуманизированного моноклонального антитела против фактора некроза опухоли человека может быть модифицирована путем инсерции, делеции или консервативной замены одного или более чем одного аминокислотного остатка, предпочтительно 1-5 аминокислотных остатков.
Моноклональное антитело, модифицированное или мутированное путем одной или более чем одной инсерции, делеции или консервативной замены в любых комбинированных формах, может иметь отличия в аминокислотной последовательности. В предпочтительном варианте модификацию получают путем консервативной замены аминокислоты вышеуказанного моноклонального антитела по настоящему изобретению. Консервативная замена означает, что определенная аминокислота заменена другой аминокислотой, обладающей подобными свойствами. Консервативно заменяемыми (обладающими подобными свойствами) считают аминокислоты, перечисленные ниже, но не ограниченные ими: a) аланин, серин и треонин; b) глутаминовую кислоту и аспарагиновую кислоту; c) аспарагин и глутамин; d) аргинин и лизин; e) изолейцин, лейциловую кислоту, метионин и валин; и f) фенилаланин, тирозин и триптофан.
Функционально эквивалентное моноклональное антитело по настоящему изобретению представляет собой вариант, в котором один или более чем один аминокислотный остаток, предпочтительно 1-5 аминокислотных остатков, консервативно заменен. Консервативная замена включает следующие замены: любая из алифатических аминокислот Ala, Val, Leu и Ile может быть заменена другой; гидроксильные остатки Ser и Thr являются заменяемыми; кислотные остатки Asp и Glu являются заменяемыми; амидные остатки Asn и Gln являются заменяемыми; основные остатки Lys и Arg являются заменяемыми; ароматические остатки Phe и Tyr являются заменяемыми.
Кроме того, в настоящем изобретении описаны аминокислотные последовательности, обладающие по меньшей мере 50% идентичностью аминокислотным последовательностям по настоящему изобретению или их фрагментам и аминокислотным последовательностям с эквивалентными функциями. В одном воплощении аминокислотные последовательности обладают по меньшей мере 75% идентичностью, более предпочтительно по меньшей мере 85% идентичностью, даже более предпочтительно по меньшей мере 90% идентичностью, даже более предпочтительно по меньшей мере 95% идентичностью, даже более предпочтительно по меньшей мере 97% идентичностью, и наиболее предпочтительно по меньшей мере 99% идентичностью аминокислотной последовательности SEQ ID NO:1 или 2 согласно настоящему изобретению.
В настоящее изобретение включено несколько видов антител. Например, антитело против hTNFα может представлять собой полноразмерное антитело (например, включающее полноразмерную область Fc человека); или фрагмент антитела (например, Fv, scFv, Fab, Fab' и (Fab')2). Кроме того, антитело может быть меченным обнаружимыми метками, фиксированным на твердофазном носителе и/или связанным с гетерологичными соединениями (такими, как цитотоксические вещества).
Фрагмент Fab получают путем обработки молекулы антитела lgG протеазой/папаином. Этот фрагмент представляет собой фрагмент антитела, имеющий молекулярную массу, составляющую приблизительно 50000, и обладающий антигенсвязывающей активностью, причем во фрагменте, полученном путем обработки папаином (расщепляющим H цепь при аминокислотном остатке 224), примерно половина H цепи от N-конца и полноразмерная L цепь связаны вместе дисульфидными связями. Фрагмент Fab по настоящему изобретению также может быть получен путем вставки ДНК, кодирующей Fab антитела, в прокариотические экспрессионные векторы и/или эукариотические экспрессионные векторы.
Фрагмент Fab' представляет собой фрагмент антитела, обладающий антигенсвязывающей активностью, полученный путем расщепления дисульфидных связей в шарнирной области (Fab')2 и имеющий молекулярную массу, составляющую приблизительно 50000. Фрагмент Fab по настоящему изобретению также может быть получен путем вставки ДНК, кодирующей Fab' антитела, в прокариотические экспрессионные векторы и/или эукариотические экспрессионные векторы и последующего введения этих векторов в прокариоты и/или эукариоты для экспрессии Fab.
Фрагмент (Fab')2 представляет собой фрагмент антитела, обладающий антигенсвязывающей активностью, имеющий молекулярную массу, составляющую приблизительно 50000, где во фрагменте, полученном путем обработки протеазой/пепсином (расщепляющим H цепь при аминокислотном остатке 234) антитела lgG, фрагмент антитела Fab имеет несколько больший размер за счет связывания вместе дисульфидными связями в шарнирной области. Фрагмент (Fab')2 по настоящему изобретению может быть получен путем обработки антитела пепсином. Кроме того, фрагмент (Fab')2 по настоящему изобретению также может быть получен путем сшивания Fab' тиоэфирными связями или дисульфидными связями.
Фрагмент scFv представляет собой фрагмент антитела, обладающий антигенсвязывающей активностью, состоящий из цепи VH и цепи VL, которые соединены соответствующими пептидными связями. Фрагмент scFv по настоящему изобретению может быть получен путем получения кДНК, кодирующих VH и VL антитела, составления ДНК, кодирующей scFv, вставки ДНК, кодирующей scFv, в прокариотические экспрессионные векторы и/или эукариотические экспрессионные векторы и последующего введения этих векторов в прокариоты и/или эукариоты для экспрессии scFv.
Нуклеиновая кислота
Нуклеиновые кислоты по настоящему изобретению представляют собой нуклеотидные последовательности, кодирующие по меньшей мере одну из SEQ ID NO: 1-16, их специфичные фрагменты, варианты или по меньшей мере 70-100% непрерывные аминокислотные последовательности консенсус-последовательностей. Молекулы нуклеиновой кислоты, кодирующие по меньшей мере одно антитело против TNF, могут быть получены способами, описанными в настоящем изобретении или известными в данной области техники.
Молекулы нуклеиновых кислот по настоящему изобретению могут находиться в форме РНК, такой как мРНК, гяРНК (гетерогенная ядерная РНК), тРНК или в любой другой форме, либо в форме ДНК, включающей, но не ограниченной ими, кДНК и геномную ДНК, полученную путем клонирования или полученную синтетическим путем, или любую их комбинацию. ДНК может быть трехнитевой, двунитевой или однонитевой либо представлять собой любую их комбинацию. Любой участок по меньшей мере одной нити ДНК или РНК может представлять собой кодирующую нить, также известную как смысловая нить, или может представлять собой некодирующую нить, также называемую антисмысловой нитью.
Как указано в настоящем описании, молекулы нуклеиновых кислот по настоящему изобретению, включающие нуклеиновую кислоту, кодирующую антитело против TNF, могут включать, но не ограничены ими, следующие молекулы: молекулы, как таковые кодирующие аминокислотную последовательность фрагмента антитела; кодирующие последовательность полноразмерного антитела или его участка; кодирующую последовательность антитела, фрагмента или участка, а также дополнительные последовательности, такие как кодирующая последовательность по меньшей мере одного сигнального лидера слитого пептида, с вышеупомянутыми дополнительными кодирующими последовательностями, такими как по меньшей мере один интрон, или без этих последовательностей, вместе с дополнительными некодирующими последовательностями, включающими, но не ограниченными ими, некодирующие 5' и 3' последовательности, такие как транслируемые, нетранслируемые последовательности, играющие роль в транскрипции, процессинге мРНК, включая сплайсинг и сигналы полиаденилирования (например, связывание рибосомы и стабильность мРНК); дополнительную кодирующую последовательность, которая кодирует дополнительные аминокислоты, например, обеспечивающие дополнительные функции. Таким образом, последовательность, кодирующая антитело, может быть слита с маркерной последовательностью, такой как последовательность, кодирующая пептид, облегчающий очистку слитого антитела, включая фрагмент или участок антитела.
Нуклеиновые кислоты по настоящему изобретению могут быть получены с использованием следующих способов: (a) рекомбинантных способов, (b) синтетических методов, (c) методов очистки или их комбинации, как хорошо известно в данной области техники.
Композиции нуклеиновых кислот по настоящему изобретению, таких как РНК, кДНК, геномная ДНК или любая их комбинация, могут быть получены из биологических источников с использованием любого многообразия методов клонирования, известных специалистам в данной области техники. В некоторых воплощениях для идентификации нужной последовательности в библиотеке кДНК или геномной ДНК используют олигонуклеотидные зонды, которые селективно гибридизуются в жестких условиях с полинуклеотидами по настоящему изобретению. Выделение РНК и конструирование библиотек кДНК и геномных библиотек хорошо известны специалистам в данной области техники.
Скрининг библиотеки кДНК или геномной библиотеки можно осуществлять, используя зонд, основанный на последовательности полинуклеотида по настоящему изобретению, такого как описано в данной работе. Зонды можно использовать для гибридизации с последовательностями геномной ДНК или кДНК, чтобы выделить гомологичные гены в одном или в различных организмах. Специалистам в данной области техники понятно, что в анализе можно использовать гибридизацию различной степени жесткости; и либо среда для гибридизации, либо среда для отмывки может быть жесткой. Если условия гибридизации становятся более жесткими, между зондом и мишенью должна быть более высокая степень комплементарности, чтобы происходило образование дуплекса. Степень жесткости можно регулировать с помощью одного или более чем одного из следующих параметров: температуры, ионной силы, pH и присутствия частично денатурирующего растворителя, такого как формамид. Жесткость гибридизации, например, удобно варьировать с помощью изменения полярности раствора реагента путем, например, манипуляций с концентрацией формамида в диапазоне от 0% до 50%. Степень комплементарности (идентичности последовательности), необходимая для обнаружимого связывания, варьирует в соответствии с жесткостью среды для гибридизации и/или среды для отмывки. Степень комплементарности оптимально составляет 100%, либо 70-100%, либо любой диапазон или значение в пределах данного диапазона. Тем не менее, понятно, что минорные изменения последовательности в зондах и праймерах можно компенсировать путем снижения жесткости среды для гибридизации и/или среды для отмывки.
Способы амплификации РНК или ДНК хорошо известны в данной области техники и могут быть использованы в соответствии с настоящим изобретением без лишнего экспериментирования на основе идеи и руководства, приведенного в настоящей работе.
Изолированные нуклеиновые кислоты по настоящему изобретению могут быть также получены путем прямого химического синтеза известными способами. В результате химического синтеза обычно получают однонитевый олигонуклеотид, который можно преобразовать в двунитевую ДНК путем гибридизации с комплементарной последовательностью или путем полимеризации ДНК полимеразой, использующей одну нить в качестве матрицы.
Конструирование экспрессионного вектора гуманизированного моноклонального антитела
5' фрагмент, включающий ген вариабельной области тяжелой цепи (VH) гуманизированного антитела и 7 аминокислот на 5'-конце константной области тяжелой цепи (Cy1) lgG1 человека, получают путем использования в качестве матрицы плазмиды (pHu-VH), содержащей фрагмент гена вариабельной области тяжелой цепи VH гуманизированного антитела, 5' праймера FVHX (5'-CGCGCAAG-CTTCCTCGAG-3', SEQ ID NO: 17) и 3' праймера RVCG (5'-CGATGGGCCCTTGGTGGA-3', SEQ ID NO: 18). В то же время, ген A, включающий кодирующую последовательность константной области тяжелой цепи (Cy1) lgG1 человека, получают из РНК, выделенной из лейкоцитов человека, путем обратной транскрипции и ПЦР, используя 5' праймер HuCGF (5'-ACCAAGGGCCCATCGGTCTTC-3', SEQ ID NO: 19) и 3' праймер HUCGE (5'-CGGAATTCTCATTTACCCGGAGACAGGGA 3', SEQ ID NO: 20). Наконец, фрагмент, представляющий собой вариабельную область тяжелой цепи гуманизированного антитела, и ген Cy1 человека сшивают с помощью ПЦР, используя 5' праймер (FVHX, SEQ ID NO: 17) и 3' праймер (HUCGE, SEQ ID NO: 20), с получением фрагмента гена, длина которого составляет приблизительно 1400 п.о., включающего кодирующую последовательность тяжелой цепи. Этот фрагмент гена обрабатывают эндонуклеазой Hind III и EcoR1, а затем встраивают в векторы, такие как PUC19 (ссылка: Yanisch-Perron, С, Vieira, J. and Messing, J. (1985) Gene, 33, 103-119).
5' фрагмент, включающий ген вариабельной области легкой цепи (VL) и 7 аминокислот на 5'-конце константной области легкой цепи (CK) человека, получают путем использования в качестве матрицы плазмиды (pHu-VL), содержащей фрагмент гена вариабельной области легкой цепи VL гуманизированного антитела, 5' праймера FVHX (SEQ ID NO: 17) и 3' праймера VKCKO (5'-AGA TGG TGC AGO САС AGT TCG CTT GAT CTO CAG CTT GGT GCC-3', SEQ ID NO: 21). В то же время, ген A, включающий кодирующую последовательность константной области легкой цепи к (CK) человека, получают из РНК, выделенной из лейкоцитов человека, путем обратной транскрипции и ПЦР, используя 5' праймер HuCKF (5'-GTG GCT GCA CCA ТСТ GTC ТТС-3', SEQ ID NO: 22) и 3' праймер HUCKB (5'-TGC GGA ТСС СТА АСА СТС ТСС ССТ GTT GAA-3', SEQ ID NO: 23). Наконец, фрагмент, представляющий собой вариабельную область легкой цепи гуманизированного антитела, и ген CK человека сшивают с помощью ПЦР, используя 5' праймер (FVHX, SEQ ID NO: 17) и 3' праймер (HUCKB, SEQ ID NO: 23), с получением фрагмента гена, длина которого составляет приблизительно 700 п.о., включающего кодирующую последовательность легкой цепи. Этот фрагмент гена обрабатывают эндонуклеазой Hind III и Bam H1, а затем встраивают в векторы, такие как PUC19 (ссылка: Yanisch-Perron, С, Vieira, J. and Messing, J. (1985) Gene, 33, 103-119).
кДНК, кодирующую тяжелую цепь или легкую цепь, или кДНК, кодирующую продукты их модификации, полученные вышеуказанными способами, встраивают в вектор pcDNA3 (Invitrogen USA, Carlsbad, CA, U.S.A.) для конструирования экспрессионного вектора гуманизированного антитела Hu_анти-TNFα. Экспрессионная векторная плазмида содержит промотор-энхансер раннего гена цитомегаловируса, необходимый для высокого уровня экспрессии в клетках млекопитающих. В то же время, векторная плазмида также содержит необязательный маркерный ген, чтобы обладать устойчивостью к ампициллину в бактериях и обладать устойчивостью к G418 в клетках млекопитающих. Кроме того, векторная плазмида содержит ген DHFR. В большинстве клеток-хозяев ген антитела и ген DHFR можно совместно амплифицировать метотрексатом (МТХ, Sigma) (см., например, Axel, R., et al. Патент US 5179017; Kaufman. R. and Sharp. P., J. Mol. Biol. 159:601-621, 1982).
Клетка-хозяин, экспрессирующая антитело
Настоящее изобретение также относится к получению по меньшей мере одного антитела против TNF путем использования клетки-хозяина, сконструированной генно-инженерным способом с помощью рекомбинантного вектора, и рекомбинантного метода в данной области техники.
Полинуклеотиды могут быть необязательно сшиты с вектором, включающим возможные метки для амплификации в клетке-хозяине. Как правило, плазмидный вектор вводят в преципитат, такой как кальцийфосфатный преципитат, либо вводят в комплекс, содержащий заряженный липид.
Подходящие культуральные среды и условия для описанных выше клеток-хозяев известны в данной области техники. Подходящие векторы будут легко очевидными для специалистов в данной области техники. Введение векторной конструкции в клетку-хозяина может быть выполнено с помощью кальцийфосфатной трансфекции, трансфекции, опосредованной ДЭАЭ-декстраном, трансфекции, опосредованной катионным липидом, электропорации, трансдукции, инфекции или других известных способов.
Клетки-хозяева для гуманизированного моноклонального антитела против фактора некроза опухоли по настоящему изобретению, имеющие происхождение от клеток яичника китайского хомячка, получают путем трансфекции плазмидой, содержащей кодирующую последовательность гена анти-TNFα, после чего следует серия жестких специфичных скринингов, включающая скрининг лекарственным препаратом, амплификацию гена и клонирование отдельных клеток с получением конечной линии клеток. Клетка-хозяин по настоящему изобретению, представляющая собой клетку яичника китайского хомячка линии CHO HUAT 132, была депонирована в CCTCC 7 марта 2011 под депозитным номером C201117.
Клетку этой линии клеток можно размножать в суспензии в среде без сыворотки; при культивировании в 2 л ферментере уровень секретируемого антитела против TNFα в среде будет составлять не ниже 1 г/л по окончании цикла культивирования, составляющего 16-20 суток. Антитело против TNFα, продуцируемое этими клеточными линиями, представляет собой гуманизированное моноклональное антитело.
Активность связывания с TNFα
Гуманизированное моноклональное антитело против фактора некроза опухоли по настоящему изобретению обладает только специфичным сродством к рекомбинантному фактору некроза опухоли человека (молекулам-мишеням rhTNFα), но не связывается перекрестно с молекулами какого-либо другого белка. В конкурентном анализе сродства к его молекулам-мишеням определено, что моноклональное антитело против фактора некроза опухоли по настоящему изобретению обладает аналогичным сродством с антителом Хумира.
Гуманизированное моноклональное антитело против фактора некроза опухоли по настоящему изобретению также обладает активностью нейтрализации токсичности rhTNFα для клетки-мишени L929, и ее значение EC50 является сходным со значением для антитела Хумира, составляющим от 20,4 нг/мл до 50 нг/мл.
Терапевтическое применение
Антитело к hTNFα можно применять для лечения и/или предупреждения заболеваний, обусловленных hTNFα, где заболевание, обусловленное hTNFα, может представлять собой, например, пиемию, аутоиммунные заболевания, злокачественную опухоль, расстройство функции легких, отторжение трансплантата, бактериальный менингит, церебральную малярию, СПИД и СПИД-ассоциированный комплекс (ARC, AIDS-related complex), вторичную цитомегаловирусную инфекцию после трансплантации. Применение антитела и компонентов антитела по настоящему изобретению при лечении заболеваний, обусловленных hTNFα, дополнительно обсуждается ниже.
1) Сепсис
Роль фактора некроза опухоли в патологии сепсиса и его биологические эффекты включают гипотензию, угнетение миокарда, синдром транссудации сосудов, некроз органов (см., например, патент US 5231024). Следовательно, гуманизированные антитела по настоящему изобретению и компоненты антител можно применять для лечения любого сепсиса с клиническим фоном, включающего септический шок, эндотоксический шок, грамотрицательный сепсис и синдром токсического шока.
2) Аутоиммунные заболевания
Обнаружено, что фактор некроза опухоли играет роль в патофизиологии ряда аутоиммунных заболеваний, например обнаружено, что TNFα вовлечен в активацию воспаления ткани и приводит к разрушению суставов при ревматоидном артрите (см., например, патент US 5231024; Moeller, A. et al. (1990) Cytokine 2:162-169). Также обнаружено, что TNFα вовлечен в клеточную гибель клеток островков Лангерганса при диабете, а также опосредует цитотоксичность в отношении олигодендроцитов и индуцирует образование воспалительных бляшек.
Гуманизированные антитела и компоненты антител по настоящему изобретению можно применять для лечения аутоиммунных заболеваний, в частности, ассоциированных с воспалением, включающих ревматоидный артрит, ревматоидный миелит, остеоартрит и подагрический артрит, аллергию, рассеянный склероз, аутоиммунный диабет, аутоиммунный глазной увеит и нефротический синдром.
3) Злокачественные опухоли
Обнаружено, что фактор некроза опухоли, находящийся в злокачественных опухолях, вовлечен в индукцию кахексии, стимуляцию роста опухоли, повышение метастатического потенциала и посредничество цитотоксичности. Следовательно, антитела и компоненты антител по настоящему изобретению можно применять для лечения злокачественных опухолей, ингибирования роста и метастазов опухоли и/или уменьшения злокачественной вторичной кахексии. Антитело или компонент антитела можно вводить системно или местно в сайт опухоли.
4) Расстройства функции легких
Известно, что фактор некроза опухоли вовлечен в патофизиологию респираторного дистресс-синдрома взрослых (РДСВ), включающую стимуляцию лейкоцитов и активацию эндотелиальных клеток, цитотоксичность, ориентированную на легочные клетки, и индукцию синдрома транссудации сосудов. Следовательно, антитело и компоненты антитела по настоящему изобретению можно применять для лечения расстройств функции легких, включающих респираторный дистресс-синдром взрослых, хроническую пневмонию, саркоидоз легких, фиброз и силикоз легких.
5) Дисфункция кишечника
Антитела человека и компоненты антитела по настоящему изобретению можно применять для лечения кишечных расстройств, таких как идиопатическое воспалительное кишечное заболевание, включающее два синдрома, болезнь Крона и неспецифический язвенный колит.
6) Трансплантация
Обнаружено, что фактор некроза опухоли может быть ключевым медиатором отторжения аллотрансплантата и реакции "трансплантат против хозяина" (РТПХ), а также опосредует побочные эффекты, наблюдаемые при ингибировании отторжения почечного трансплантата антителом ОКТ3 крысы, которое направлено на рецепторный комплекс T-клеток CD3 (см., например, Suthanthiran, М., and Strom, ТВ (1994) New Engl J. Med. 331:365-375).
Следовательно, антитело и компоненты антитела по настоящему изобретению можно применять для подавления отторжения трансплантата, включая отторжение аллотрансплантата и ксенотрансплантата, и для подавления РТПХ.
7) Инфекционные заболевания
Антитела и компоненты антител по настоящему изобретению можно применять для лечения инфекционных заболеваний, включающих бактериальный менингит, церебральную малярию, СПИД и СПИД-ассоциированный комплекс (ARC) и вторичную цитомегаловирусную инфекцию после трансплантации. Их также можно применять для уменьшения симптомов, обусловленных инфекционными заболеваниями, включающих лихорадку и мышечную боль, вызванную инфекцией (например, вирусом гриппа), и инфекционную вторичную кахексию (такую, как СПИД или вторичный ARC).
Аналитические и диагностические цели
Антитело по настоящему изобретению можно применять при любом известном способе анализа, таком как анализы конкурентного связывания, прямой или непрямой сэндвич-анализ и анализ иммунопреципитации. Zola, Monoclonal Antibodies: Technical Manual "(Monoclone Antibodies; A Manual of Techniques), pp.147-158 (CRC Press, Inc., 1987).
Анализ конкурентного связывания зависит от способности меченого стандартного вещества конкурировать с анализируемым веществом в измеряемом образце за связывание предельного количества антитела. Количество стандартного вещества обратно пропорционально количеству антитела, связанного с hTNFα, в измеряемом образце. С целью облегчения определения количества связанного стандартного вещества антитела обычно нерастворимы до или после конкуренции, поэтому удобно отделять связанное стандартное вещество и анализируемое вещество от несвязанного стандартного вещества и отделенного анализируемого вещества.
Сэндвич-анализ включает использование двух антител, каждое из которых связывается с отличающимся сайтом иммуногенности или эпитопом на белках-мишенях. При сэндвич-анализе измеряемый образец анализируемого вещества связывается с первым антителом, фиксированным на твердофазном носителе, а затем второе антитело связывается с анализируемым веществом, образуя, таким образом, нерастворимый трехкомпонентный комплекс. См. патент US 4376110. Само второе антитело можно метить обнаружимой частью (прямой сэндвич-анализ) либо его можно обнаружить с помощью антител против иммуноглобулина, меченных обнаружимой частью (непрямой сэндвич-анализ). Например, один из сэндвич-анализов представляет собой анализ ELISA (твердофазный иммуноферментный анализ; Enzyme Linked Immuno Sorbent Assay), в котором обнаружимой частью является фермент.
Антитела против hTNFα можно также применять в диагностических анализах hTNFα, например, для обнаружения его экспрессии в определенных клетках, тканях или сыворотке. Этот диагностический способ можно применять для диагностики причин аутоиммунных заболеваний.
Антитело обычно может быть меченным обнаруживаемой молекулой. Можно использовать множество маркеров, и обычно эти маркеры можно классифицировать следующим образом.
(a) Радиоактивные изотопы, такие как 111In, 99Tc, 14C, 131I, 125I, 3H, 32P или 35S. Антитела можно метить радиоактивными изотопами в соответствии со способами, описанными в книге Current Protocols in Immunology, Volume 1 and 2, Coligen eds, Wiley-Interscience, New York, New York, the Pubs (1991), при которых радиоактивность можно определять способом сцинтилляционного счета, и сайты заболевания можно локализовать путем использования иммунной микрофотографии.
(b) Флуоресцентный маркер, такой как редкоземельный хелатирующий агент (хелатор, представляющий собой европий) или люцифераза и ее производные, родамин и его производные, дансил, лиссамин, фикоэритрин и техасский красный. Флуоресцентный маркер можно связывать с антителом, используя способы, описанные, например, в книге Current Protocols in Immunology, упомянутой выше. Флуоресценцию можно определять количественно с помощью флуориметра.
(c) В продаже имеются разнообразные субстратные маркеры, и в патенте US 4275149 описаны некоторые из них. Ферменты обычно катализируют химические изменения разнообразных хромогенных субстратов, которые можно обнаруживать с помощью множества методов. Например, ферменты катализируют изменение цвета субстратов, которое можно измерить с помощью спектрофотометра, либо ферменты изменяют флуоресценцию или хемилюминесценцию субстрата. Выше описана технология определения изменений флуоресценции. Хемилюминесцентные субстраты возбуждаются электричеством в результате химических реакций, а затем светятся. Испускаемый свет можно определить (например, с использованием химического фотометра), либо он передает энергию на флуоресцентные рецепторы. Ферментные маркеры включают такие ферменты, как люцифераза (например, люцифераза светляка и бактериальная флуоресцентная люцифераза; патент US 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназа, уреаза, пероксидаза, такая как пероксидаза хрена (HRPO, horseradish peroxidase), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, оксидаза сахаров (например, фермент глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфатдегидрогеназа), гетероциклические оксидазы (такие, как уриказа и ксантиноксидаза), лактопероксидаза, микропероксидаза. Автором O'Sullivan описана технология конъюгации ферментов с антителами в книге Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay (Methods In Enzym.) (by J. Langone, and H. the Van Vunakis ed.), Academic press, New York, 73:147-166 (1981).
Композиции фермента и субстрата включают, например, следующие композиции:
(i) пероксидаза хрена (HRP) и перекись водорода в качестве субстрата, где перекись водорода окисляет предшественник красителя (например, орто-фенилендиамин (OPD) или соляную кислоту до 3,3',5,5'-тетраметилбензидина (ТМВ));
(ii) щелочная фосфатаза (AP) и паранитрофенилфосфат в качестве хромогенного субстрата;
(iii) ангидраза β-D-галактозидазы (β-D-Gal) и хромогенный субстрат (например, нитрофенил-β-D-галактозидаза) или флуорогенный субстрат и 4-метилумбеллиферон-β-D-галактозидаза.
Специалистам в данной области техники могут быть известны многие другие комбинации фермента и субстрата. Обзор этих комбинаций можно найти в патентах US 4275149 и 4318980. Иногда маркеры и антитела связаны непрямым путем. Специалистам в данной области техники также известны все виды способов получения этих композиций. Например, антитела могут быть связаны с биотином, а любая из вышеупомянутых трех категорий маркеров может быть связана с авидином или наоборот. Биотин селективно связывается с авидином, и маркеры могут быть связаны с антителом непрямым путем, либо для непрямого связывания маркера с антителом это антитело может быть связано с низкомолекулярным гаптеном (например, с дигоксином), тогда как один из маркеров различных типов может быть связан с антителом против гаптенов (например, с антителом против дигоксина). Таким образом, получают непрямое связывание маркеров с антителом.
В другом воплощении настоящего изобретения мечение антител против hTNFα необязательно, и их существование можно обнаружить с помощью меченого антитела, которое связывается с антителом против hTNFα.
Набор для аффинной очистки
Антитела по настоящему изобретению можно применять в качестве реагентов аффинной очистки. При данном способе антитело фиксируют на твердой фазе, например на смоле Sephadex или на фильтровальной бумаге, способами, известными в данной области техники. Фиксированное антитело вступает в контакт с образцами, содержащими hTNFα, подлежащими очистке, а затем носитель промывают подходящими растворителями, в результате чего растворитель может по существу удалить все остальные вещества, кроме hTNFα, связанного с иммобилизованным антителом.
Фармацевтическая композиция и способ введения
Антитело и компоненты антитела по настоящему изобретению могут быть добавлены в фармацевтическую композицию, подходящую для введения субъектам, где эти фармацевтические композиции содержат антитела по настоящему изобретению и фармацевтически приемлемые эксципиенты, а фармацевтические эксципиенты включают любые физиологически приемлемые растворители, дисперсионные среды, антибактериальные агенты, противогрибковые агенты, изотонические агенты, покрытие, агент, замедляющий всасывание. Фармацевтические композиции по настоящему изобретению могут принимать различные формы, такие как жидкие, полутвердые и твердые лекарственные формы.
Антитело против hTNF по настоящему изобретению в фармацевтически приемлемой лекарственной форме можно вводить человеку, используя известные способы. Эти способы включают внутривенный (например, внутривенную инъекцию концентрированного лекарственного средства (болюса) или инфузию в течение периода времени), внутримышечный, интраперитонеальный, введение в цереброспинальную полость, подкожный, внутриартериальный, введение в синовиальную полость, подоболочечную инъекцию, пероральный, местные инъекции или ингаляцию. Антитело можно также целесообразно вводить внутрь опухоли, вокруг опухоли, внутрь сайтов повреждения, вокруг сайтов повреждения для получения местного и системного лечения. Ожидают, что интраперитонеальная инъекция особенно полезна, например, для лечения рака яичника.
В целях предупреждения или лечения заболеваний подходящая доза антитела зависит от типа заболевания, подлежащего лечению, как определено выше, от тяжести заболевания и продолжительности заболевания, антитела, предназначенного для предупреждения или для лечения, предшествующего лечения и от истории болезни пациента и ответа на антитело, а также от независимого мнения лечащего врача. Антитело подходит для разовых или серийных доз для пациентов.
В соответствии с типом и тяжестью заболевания, независимо от однократной дозы, или нескольких отдельных доз, или непрерывной инфузии, исходная доза-кандидат для пациентов составляет от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) антитела. Характерная суточная доза или еженедельная доза составляет приблизительно 1 мг/кг-20 мг/кг или более в зависимости от факторов, упомянутых выше. Что касается повторяющейся дозы в течение нескольких суток или более (в зависимости от состояния), лечение следует продолжать до тех пор, пока желательным образом не ингибированы симптомы заболевания. Тем не менее, можно также применять другую схему лечения. Мониторинг хода лечения можно легко осуществлять, используя традиционные методы и аналитические способы.
Препарат
1) Инъекционный препарат
В другом воплощении настоящего изобретения предложен препарат, содержащий вещество, применяемое для лечения этих заболеваний. Препарат включает контейнер и ярлык. Подходящие контейнеры включают такие контейнеры, как обычные бутылки, медицинские бутылки, шприцы и пробирки. Контейнер может быть изготовлен из различных материалов, таких как стекло или полимер. Контейнер содержит эффективную композицию для лечения заболеваний и имеет стерильный вход (например, контейнер может представлять собой пакет или бутылку для внутривенной инфузии, закупоренную пробкой, которую можно протыкать, используя подкожную иглу). Активным ингредиентом в композиции является антитело против hTNFα. На ярлыке, находящемся на контейнере или связанном с контейнером, указаны конкретные состояния, подлежащие лечению композицией. Препараты могут также включать другой контейнер, содержащий фармацевтически приемлемый буфер, такой как фосфатный буфер, раствор Рингера и раствор глюкозы. В соответствии с потребностями фирмы-изготовителя или с потребностями пользователей он может включать другие вещества, такие как другие буферы, разбавители, фильтры, иглы, шприцы и инструкции.
2) Препараты пролонгированного высвобождения
Гуманизированные моноклональные антитела против фактора некроза опухоли по настоящему изобретению можно применять для получения препаратов пролонгированного высвобождения. Подходящие препараты пролонгированного высвобождения включают такие препараты, как основа из полупроницаемого матрикса, включающего твердые гидрофобные полимеры антител, и основу матрикса составляет материальный объект, такой как пленка или микрокапсулы. Подходящая основа матрикса пролонгированного высвобождения включает такие вещества, как сложные полиэфиры, гидрогели (например, поли(метакриловой кислоты 2-гидроксиэтиловый эфир) или поливиниловый спирт), полилактид (патент US 3773919), сополимер L-глутаминовой кислоты и этилового эфира L-глутаминовой кислоты, неразлагаемый сополимер этилена и винилацетата, разлагаемый сополимер молочной кислоты и этиловой кислоты, такой как Lupron Depot™ (инъекционные микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и лейпролида ацетата), и поли-D-(-)-3-гидроксимасляную кислоту. Молекулы полимеров, таких как сополимер этилена и винилацетата и сополимер молочной кислоты и гликолевой кислоты, обеспечивают высвобождение молекул продолжительностью в течение 100 суток или более, хотя некоторые гидрогели высвобождают белки за более короткий период времени. Когда инкапсулированные антитела удерживаются в организме в течение длительного периода времени, они могут претерпевать денатурацию или когезию при контакте с водой при 37°C, что приводит в результате к снижению биологической активности и может привести к изменению иммуногенности. В соответствии с этим механизмом можно разработать обоснованную стратегию стабильности. Например, если механизмом конденсации является образование межмолекулярной связи S-S в результате реакции обмена дисульфидов, стабилизация может быть достигнута путем модифицирования тиолсодержащих остатков, лиофилизации кислых растворов, контроля содержания влаги, использования подходящих добавок и разработки специальной композиции полимерного матрикса.
Набор
Для удобства антитело по настоящему изобретению может быть предложено в форме наборов, то есть предопределенные количества реагентов и инструкцию для диагностического анализа упаковывают вместе. Если антитело является ферментативно меченным, набор включает субстрат и кофакторы (такие, как предшественники субстрата, образующие обнаружимые хромофоры и флуорофоры), требующиеся для фермента. Кроме того, он может также включать другие добавки, такие как стабилизаторы, буферы (такие, как блокирующий буфер или буфер для лизиса). С той целью чтобы предложенная концентрация реагента могла достигать самой высокой чувствительности анализа, относительные количества различных реагентов значительно меняются. В частности, реагент может представлять собой сухой порошок, обычно в форме лиофилизированного порошка, а также могут быть включены эксципиенты. Эти эксципиенты образуют раствор реагента, имеющий соответствующую концентрацию при растворении.
Далее настоящее изобретение изложено в связи с приведенными ниже конкретными примерами. Должно быть понятно, что эти воплощения предназначены только для иллюстрации настоящего изобретения, но не используются для ограничения объема настоящего изобретения. В описанной ниже форме осуществления экспериментальные методы без указания конкретных условий обычно выполняют в традиционных условиях, например в условиях, описанных в руководстве Sambrook et al. Molecular Cloning: Laboratory Manual (New York; the Cold Spring Harbor Laboratory Press, 1989), или в условиях, рекомендованных изготовителем.
Примеры
Пример 1
Получение мышиного моноклонального антитела против hTNFα
1) Иммунизация
Несколько самок мышей Balb/c в возрасте 7-11 недель иммунизировали IP (интраперитонеально) или ID (внутрикожно) рекомбинантным hTNF (rhTNFα, приобретенный у Pepro Tech Inc.), и рекомбинантный TNFα человека эмульгировали, используя равный объем адъюванта TITERMAX или полного адъюванта Фрейнда, до конечного объема, составляющего 100-400 мкл. Через 1-7, 5-12, 10-18, 17-25 и/или 21-34 суток после этого каждую мышь иммунизировали IP (1-400 мкг) и SC (подкожно) (1400 мкг×2) TNF, который эмульгировали с равным объемом адъюванта TITERMAX или неполного адъюванта Фрейнда. Через 12-25 и 25-40 суток после этого у мышей собирали образцы крови путем пункции бедра в условиях без антикоагулянта, и крови давали возможность свернуться при КТ в течение 1 часа, чтобы собрать сыворотку. Титры определяли, используя ELA (ферментативный анализ) на TNFα в соответствии с известными способами. Когда повторные инъекции не приводили к повышению титров, проводили слияние. С этой целью 1-400 мкг TNFα, разведенного в 100 мкл физиологического раствора, можно инъецировать мышам в течение последних бустер-инъекций. Трое суток спустя мышей умерщвляли путем перелома шейных позвонков, селезенки извлекали в стерильных условиях и погружали в 10 мл холодного физиологического раствора, забуференного фосфатом (ФСБ), содержащего 1000 ед./мл пенициллина, 100 мкг/мл стрептомицина и 0,25 мкг/мл амфотерицина B (ПСА). Клетки селезенки собирали путем стерильной перфузии селезенки ПСА-ФСБ, считали способом исключения трипанового синего и ресуспендировали в среде RPMI 1640, содержащей 25 мМ ГЭПЭС.
2) Сывороточный тест
Планшет покрывали 2 мкг/мл TNFα в ФСБ в течение ночи. После отмывки 0,15 M физиологическим раствором, содержащим 0,02% (об./об.) Твин 20, каждую лунку блокировали в течение 1 часа, используя 1% (масс./об.) БСА (бычьего сывороточного альбумина) в ФСБ, 200 мкл/лунка, при KT. Планшет использовали сразу или замораживали при -20°C для дальнейшего использования. 50 мкл/лунка разведений мышиной сыворотки инкубировали при KT в течение 1 часа на планшете, покрытом TNFα. Планшет промывали, а затем проводили мониторинг при KT в течение 1 часа с 50 мкл/лунка специфичного зонда lgG Fc, меченного HRP (пероксидазой хрена), разведенного 1:30000 в 1% БСА-ФСБ, снова промывали, добавляли 100 мкл/лунка цитратно-фосфатного раствора субстрата (0,1 М лимонная кислота и 0,2 М сульфат натрия, 0,01% H2O2 и 1 мкг/мл OPD) при КТ в течение 15 минут, затем добавляли 25 мкл/лунка останавливающего раствора (4 н. серной кислоты). Значения OD считывали при 490 нм с помощью автоматического фотометрического спектрофотометра для планшетов.
3) Слияние клеток
Живые клетки селезенки, в которых идентифицирован высокий уровень антитела против hTNFα в сыворотке в сывороточном тесте, подвергали слиянию с клетками миеломы мыши в соотношении, составляющем от 1:1 до 10:1. В качестве неограничивающего примера клетки селезенки и клетки миеломы подвергали соосаждению и ресуспендировали в течение 30 секунд или более при 37°C в 1 мл 50% (масс./об.) раствора ПЭГ (полиэтиленгликоля)/ФСБ (молекулярная масса ПЭГ составляла 1450, Sigma). Для остановки слияния добавляли 10,5 мл среды RPMI 1640, содержащей 25 мМ ГЭПЭС (37°C), в течение 1 минуты или более. Слитые клетки центрифугировали при 500-1500 об/мин в течение 5 минут, а затем ресуспендировали в среде ГАТ (среда RPMI 1640, содержащая 25 мМ ГЭПЭС, 10% фетальную сыворотку теленка, клон I (Hyclone), 1 мМ пируват натрия, 4 мМ L-глутамин, 10 мкг/мл факторов Celebration Trappe, 2,5% добавки для культур Origen (Fisher), 10% RPMI 1640, доведенная средой 653/среды ГЭПЭС, 50 мкМ 2-меркаптоэтанол, 100 мкМ гипоксантин и 16 мкМ тимидин) и высевали на 15 отрезков 96-луночных планшетов с плоским дном в количестве 200 мкл/лунка, а затем планшеты помещали в термостат при 37°C, 5% CO2 и влажности 95% на 7-10 суток.
Пример 2
Количественный тест мышиных антител против hTNFα
Для антитела против hTNFα доступно два вида количественных тестов. В одном тесте антитело и Хумира конкурируют за связывание hTNFα, и определяют конкуренцию. В другом тесте определяют способность антитела к нейтрализации hTNFα в анализе определения токсичности для клеток L929. Ниже описаны эти два способа и экспериментальные результаты соответственно.
1) Анализ конкурентного связывания против Хумира
Человеческое антитело против hTNFα, Хумира, меченное пероксидазой хрена (HRP), использовали в качестве реагента. Планшеты для ELISA покрывали rhTNF (50 мкл 0,05 г/мл) и оставляли на ночь при комнатной температуре. Раствор покрытия отбрасывали и каждую лунку блокировали 1% снятым молоком в физиологическом растворе, забуференном фосфатом (ФСБ), в течение приблизительно 0,5 часов и промывали ФСБ, содержащим 0,05% Твин 20, а затем в каждую лунку добавляли смесь 50 мкл среды для роста и 50 мкл меченного HRP Хумира. Немеченое антитело Хумира и среду без антитела использовали в качестве положительного и отрицательного контроля. Этим способом можно подвергать скринингу мышиное моноклональное антитело, которое может в высокой степени ингибировать связывание HRP-меченого Хумира с rhTNFα. Лунки, в которых связывание HRP-меченого Хумира и rhTNFα было ингибировано, амплифицировали и субклонировали с последующим анализом нескольких мышиных моноклональных антител, проявляющих ингибирующие эффекты, и, наконец, клетки гибридомы подвергали скринингу. Клетки гибридомы подвергали промежуточному культивированию, супернатант отбирали для очистки и получили мышиное моноклональное антитело TM2-11-12 и TM2-6-3. Очищенные мышиные моноклональные антитела TM2-11-12 и TM2-6-3 тестировали в анализах конкурентного связывания. Даже при концентрации, составляющей вплоть до 1 мкг/мл, мышиное антитело TM2-6-3 конкурировало только за 50% связывания Хумира с hTNFα. Другое мышиное антитело TM2-11-12 показало такую же хорошую конкурентоспособность, как и немеченое антитело Хумира, поскольку при концентрации, составляющей приблизительно 0,05 мкг/мл (эквивалентной 3×10-10 М), оно может конкурировать приблизительно за 50% связывания Хумира с hTNFα.
2) Количественный тест мышиных антител против hTNFα: определение in vitro активности нейтрализации hTNFα
Биологические активности обоих антител, мышиного антитела против hTNFα и химерного антитела, нейтрализующие биологическую активность hTNFα, можно измерить с использованием анализа цитотоксичности L929, как описано ниже. В каждую лунку 96-луночного культурального планшета вводили 7,5×103 клеток L929 (ATCC) (105/мл, 75 мкл) и помещали в термостат при 37°C, 5% CO2 на 24 часа. Среда для роста клеток L929 представляла собой среду RPMI-1640, содержащую 5% фетальную бычью сыворотку (GIBCO). Используя другой 96-луночный культуральный планшет, раствор, содержащий антитело против hTNFα, серийно разводили 1/2 средой RPMI для роста и добавляли rhTNFα в каждую лунку, содержащую образец, до конечной концентрации rhTNFα, составляющей 5 нг/мл. После помещения планшета, содержащего смеси антитела и rhTNFα, в термостат при 37°C, 5% CO2 на 2 часа смесь антитела и rhTNFα добавляли в лунку, содержащую клетки L929. В каждой строке планшета концентрации антитела в каждой лунке составляли порядок от 0,001 до 2 мкг/мл. Культуральный планшет помещали в термостат при 37°C, 5% CO2. При измерении выживающих клеток спустя 3 суток добавляли 20 мкл ФСБ, содержащего 2,5 мг/мл соли бромид 3-(4,4-диметил-тиазол-2-ил)-2,5-дифенил-тетразола (МТТ; приобретенный у Sigma Biochemicals), и инкубировали при 37°C в течение 4 часов, а затем добавляли 100 мкл 0,01 н. HCl, содержащей 10% додецилсульфат натрия (ДСН), на ночь. Затем для каждой лунки определяли оптическую плотность при 540/690 нм. Строили кривую для степени оптической плотности и концентрации антитела. Значения IC50 были получены с помощью анализа кривой связывания, где IC50 означает концентрацию, при которой может быть нейтрализовано 50% токсичности rhTNFα для клеток L929. Таким образом, значения IC50 можно использовать для сравнения способности антител к ингибированию клеточной токсичности hTNFα. Все значения IC50 нескольких мышиных антител против hTNFα (ТМ2-11-12, ТМ2-10-20, ТМ2-2-2) и антитела Хумира находились в диапазоне от 0,01 до 0,04 мкг/мл, все они обладают сходными способностями к нейтрализации цитотоксичности L929, вызванной rhTNFα. Мышиное антитело против hTNFα ТМ2-11-12 было отобрано для дальнейшего получения химерного антитела.
Пример 3
Клонирование тяжелой цепи и легкой цепи мышиного антитела ТМ2-11-12
1) Клонирование вариабельной области тяжелой цепи мышиного антитела ТМ2-11-12
Для планирования гуманизации мышиного антитела фрагменты ДНК, включающие кодирующие последовательности вариабельной области тяжелой цепи и легкой цепи мышиного антитела ТМ2-11-12, должны быть получены вначале. РНК выделяли из клеток гибридомы мыши ТМ2-11-12 с помощью набора для очистки РНК (Invitrogen Corp.) с целью получения кДНК (GeneRacer kit, Invitrogen, Corp.). Фрагмент ДНК, включающий вариабельную область тяжелой цепи, был выделен из кДНК с помощью полимеразной цепной реакции (ПЦР) с использованием 5' праймера (5'-CGACTGGAGCACGAGGACACTGA-3, SEQ ID NO: 24) и 3' праймера (5'-TCCAGGGGCCAGTGGATAGAGAGA-3', SEQ ID NO: 25). 3' праймер представляет собой антисмысловой гомолог константной области тяжелой цепи lgG1 мыши. Эти полученные фрагменты ДНК были клонированы в векторе TOPO TA (Invitrogen) и секвенированы. Аминокислотная последовательность вариабельной области тяжелой цепи представляет собой SEQ ID NO: 34:
QVQLVQSGPELKKPGEWKISCKASGYTFTHYGMHVVVKQTPGRSLKVVVGWINTYTGEPTYDADFQGRFTFSLETSTSTAFLQINTLKDEDLATYFCARYDFDGFDYWGQGTTLTVSS.
Аминокислотные последовательности в участках, определяющих комплементарность, представляют собой CDR-H1 (SEQ ID NO: 3), CDR-H2 (SEQ ID NO: 4) и CDR-H3 (SEQ ID NO: 5). Определения участков, определяющих комплементарность, можно найти в статье Kabat Е. et al. Sequences of Proteins of Immunological Interest, 5th Edition U.S. Department of Health and Human Services, NIH Publication No. 91-3242.
2) Клонирование вариабельной области легкой цепи мышиного антитела ТМ2-11-12
Фрагмент ДНК, включающий вариабельную область легкой цепи, был выделен из кДНК подобным способом ПЦР, используемым для клонирования вариабельной области тяжелой цепи, с использованием SEQ ID NO: 29 в качестве 5' праймера и другого 3' праймера, представляющего собой антисмысловой гомолог константной области легкой цепи к иммуноглобулина мыши (5'-CACTGGATGGTGGGAAGATGGATA-3', SEQ ID NO: 26). Эти полученные фрагменты ДНК были клонированы в векторе ТОРО ТА (Invitrogen) и секвенированы. Было обнаружено два типа клонов. Приблизительно для 3/4 клонов было показано, что часть нуклеотидной последовательности не может транслироваться в считываемую аминокислотную последовательность (последовательности не показаны). В таких клонах была мутирована мессенджер-РНК легкой цепи, которая не могла кодировать функциональный белок легкой цепи антитела. Приблизительно для 1/4 остальных клонов показана нуклеотидная последовательность, которая может полностью транслироваться в считываемую аминокислотную последовательность. Такие клоны имеют происхождение от функциональной мессенджер-РНК тяжелой цепи. Эти полученные фрагменты ДНК были клонированы в векторе TOPO TA (Invitrogen) и секвенированы. Вариабельная область легкой цепи представляет собой аминокислотную последовательность SEQ ID NO: 35:
ENVLTQSPPIMSASPGEEVTMTCRASSSITFNYLHWYQQKSGDSPKVWIYSTSNLVSGVPARFSGSGSGTSYSLTISSVEAEDAATYYCQQYSDYPYTFGGGTKLEIK.
Аминокислотные последовательности в участках, определяющих комплементарность, представляют собой CDR-L1 (SEQ ID NO: 6), CDR-L2 (SEQ ID NO: 7) и CDR-L3 (SEQ ID NO: 8). Эту аминокислотную последовательность использовали для конструирования гуманизированной легкой цепи.
Пример 4
Схема гуманизации вариабельной области тяжелой цепи и легкой цепи
В целях сохранения антигенсвязывающей активности все аминокислотные последовательности в пределах гипервариабельных участков в пределах легкой цепи и тяжелой цепи в процессе гуманизации остаются аналогичными последовательностям мышиного антитела ТМ2-11-12. Схема гуманизации включает изменение аминокислотных остатков в пределах каркасных областей в соответствии с последовательностями человеческого антитела, конструирование вариабельной области тяжелой цепи и вариабельной области легкой цепи гуманизированного антитела с различными модификациями и сайт-направленный олигонуклеотидный мутагенез последовательности вариабельной области тяжелой цепи и легкой цепи антитела с помощью технологии компьютерного моделирования, чтобы повысить связывающее сродство антитела или снизить иммуногенность антитела.
Для вариабельной области тяжелой цепи гуманизированного антитела (SEQ ID NO: 1) в пределах каркасной области FR-H1 A может быть заменен E в положении аминокислотного остатка 16, S может быть заменен T в положении 17, I может быть заменен V в положении 20; в пределах FR-H2 K может быть заменен R в положении 3, G может быть заменен S в положении 9; в пределах FR-H3 T может быть заменен V в положении 3, Е может быть заменен D в положении 7, V может быть заменен T в положении 10, F может быть заменен Y в положении 14, S может быть заменен T в положении 19, T может быть заменен V в положении 27.
Для вариабельной области легкой цепи гуманизированного антитела (SEQ ID NO: 2) в пределах каркасной области FR-L1 L может быть заменен M в положении 11, R может быть заменен E в положении 18, M может быть заменен I в положении 21; в пределах FR-L2 W может быть заменен L в положении 13; в пределах FR-L3 S может быть заменен A в положении 4, L может быть заменен V в положении 22, A может быть заменен F в положении 27.
Путем введения по меньшей мере одной из вышеуказанных модификаций аминокислот конструируют ряд аминокислотных последовательностей нескольких вариабельных областей тяжелой и легкой цепей гуманизированного антитела. Несколько аминокислотных последовательностей вариабельной области тяжелой и легкой цепей гуманизированного антитела VH и VL представлено в таблице 1:
Пример 5
Конструирование экспрессионного вектора гуманизированного антитела pHu_anti-H1L1-TNFα
1) Конструирование гена легкой цепи гуманизированного антитела
Сначала синтетическим способом был получен фрагмент гена для вариабельной области легкой цепи гуманизированного антитела (F001VL). Методы получения включают: получение нуклеотидных последовательностей путем обратной транскрипции на основании аминокислотной последовательности вариабельной области легкой цепи в соответствии с их генетическими кодонами; присоединение последовательности Козака и лидерной последовательности легкой цепи на 5' конце; получение фрагмента гена вариабельной области легкой цепи синтетическим способом. Этот фрагмент гена был клонирован в соответствующих векторах с получением плазмиды pHu-VL1. Затем получают 5' фрагмент, включающий ген вариабельной области легкой цепи (VL) гуманизированного антитела и 7 аминокислот на 5'-конце константной области легкой цепи к (CK) человека путем использования плазмиды pHu-VL в качестве матрицы, 5' праймера FVHX (SEQ ID NO: 17) и 3' праймера VKCKO (SEQ ID NO: 21). В то же время, ген A, включающий кодирующую последовательность константной области тяжелой цепи (Cy1) человека, получают из РНК, выделенной из лейкоцитов человека, путем обратной транскрипции и ПЦР, используя 5' праймер HuCKF (SEQ ID NO: 22) и 3' праймер HUCKB (SEQ ID NO: 23). Наконец, фрагмент, представляющий собой вариабельную область легкой цепи гуманизированного антитела, и ген CK человека сшивают с помощью ПЦР, используя 5' праймер (FVHX, SEQ ID NO: 17) и 3' праймер (HUCKB, SEQ ID NO: 23), с получением фрагмента гена, длина которого составляет приблизительно 700 п.о., включающего кодирующую последовательность легкой цепи. Этот фрагмент гена обрабатывают эндонуклеазой Hind III и Bam H1, а затем встраивают в векторы, такие как PUC19 (ссылка: Yanisch-Perron, С, Vieira, J. and Messing, J. (1985) Gene, 33, 103-119).
2) Конструирование гена тяжелой цепи гуманизированного антитела
Сначала синтетическим способом был получен фрагмент гена для вариабельной области тяжелой цепи гуманизированного антитела (F001VH). Методы получения включают: получение нуклеотидных последовательностей путем обратной транскрипции на основании аминокислотной последовательности вариабельной области тяжелой цепи в соответствии с их генетическими кодонами; присоединение последовательности Козака и лидерной последовательности тяжелой цепи на 5' конце; получение фрагмента гена вариабельной области тяжелой цепи синтетическим способом. Этот фрагмент гена был клонирован в соответствующих векторах с получением плазмиды pHu-VH1. Затем получают 5' фрагмент, включающий ген вариабельной области тяжелой цепи (VH) гуманизированного антитела и 7 аминокислот на 5'-конце константной области тяжелой цепи (Cy1) lgG1 человека, путем использования в качестве матрицы плазмиды (pHu-VH), содержащей фрагмент гена вариабельной области тяжелой цепи VH гуманизированного антитела, 5' праймера FVHX (SEQ ID NO:17) и 3' праймера RVCG (SEQ ID NO: 18). В то же время, ген A, включающий кодирующую последовательность константной области тяжелой цепи (Cy1) lgG1 человека, получают из РНК, выделенной из лейкоцитов человека, путем обратной транскрипции и ПЦР, используя 5' праймер HuCGF (SEQ ID NO: 19) и 3' праймер HUCGE (SEQ ID NO: 20). Наконец, фрагмент, представляющий собой вариабельную область тяжелой цепи гуманизированного антитела, и ген Cy1 человека сшивают с помощью ПЦР, используя 5' праймер (FVHX, SEQ ID NO: 17) и 3' праймер (HUCGE, SEQ ID NO: 20), с получением фрагмента гена, длина которого составляет приблизительно 1400 п.о., включающего кодирующую последовательность тяжелой цепи. Этот фрагмент гена обрабатывают эндонуклеазой Hind III и EcoR1, а затем встраивают в векторы, такие как PUC19 (ссылка: Yanisch-Perron, С, Vieira, J. and Messing, J. (1985) Gene, 33, 103-119), для экспрессии белка тяжелой цепи гуманизированного антитела. Правильную последовательность фрагмента гена подтверждают с помощью секвенирования ДНК.
3) Одноцепочечный экспрессионный вектор гуманизированного антитела кДНК, кодирующий тяжелую цепь или легкую цепь, полученные вышеуказанными способами, встраивают в вектор pcDNA3 (приобретенный у Invitrogen USA, Carlsbad, CA, USA) для конструирования экспрессионного вектора гуманизированного антитела pHu_anti-H1L1-TNFα. Экспрессионная векторная плазмида содержит промотор-энхансер раннего гена цитомегаловируса, необходимый для высокого уровня экспрессии в клетках млекопитающих. В то же время, векторная плазмида также содержит необязательный маркерный ген, чтобы обладать устойчивостью к ампициллину в бактериях и обладать устойчивостью к G418 в клетках млекопитающих. Кроме того, векторная плазмида содержит ген DHFR. В большинстве клеток-хозяев ген химерного антитела и ген DHFR можно совместно амплифицировать метотрексатом (МТХ, Sigma) (см., например, Axel, R., et al. U.S Patent No. 5,179,017; Kaufman. R. and Sharp. P., J. Mol. Biol. 159:601-621, 1982).
Пример 6
Экспрессия гуманизированных антител
Сконструированную рекомбинантную экспрессионную плазмиду трансфицировали в клетки-хозяева млекопитающих для экспрессии гуманизированного антитела против hTNFα. В целях стабилизации высокого уровня экспрессии предпочтительными хозяевами являются клетки яичника китайского хомячка (СНО) с дефицитом дигидрофолатредуктазы (DHFR) (см., например, Chasind, L, et al., патент US 4818679). Предпочтительным способом трансфекции является электропорация, а также можно использовать другие способы, включающие кальцийфосфатную сопреципитацию, липидную трансфекцию и слияние протопластов. При электропорации используют прибор Gene Pulser (Bio-Rad Laboratories), установленный при электрическом поле, составляющем 250 В, и конденсатор, емкость которого составляет 960 мкФд, 2×107 клеток, ресуспендированных в 0,8 мл ФСБ, добавляют в кювету, которая также содержит 10 мкг ДНК экспрессионной плазмиды, линеаризованной путем использования Pvul (TakaRa). После трансфекции в течение 2 суток добавляют 0,2 мг/мл G418 и 200 нМ метотрексата (метотрексата или МТХ). С целью достижения высокого уровня экспрессии трансфицированный ген гуманизированного антитела совместно амплифицируют путем использования гена DHFR, ингибируемого лекарственными средствами МТХ. Субклонированные трансфектанты разводят и определяют скорости секреции различных клеточных линий для скрининга клеточных линий с высоким уровнем экспрессии гуманизированного антитела.
Пример 7
Исследование на антителах, нейтрализующих киллинг-эффект TNFα в отношении клеток L929
Клетки L929 трипсинизировали, центрифугировали, ресуспендировали в среде 1640 с добавлением 10% ФСТ, считали и добавляли в колонки с 1 по 11 96-луночного планшета при определенной концентрации. Затем добавляли соответствующую концентрацию TNFα в колонки с 1 по 10 в 96-луночные планшеты. Соответственно, 2-кратные градиентные разведения адалимумаба (приобретенного у Abbott Laboratories), химерного антитела с немодифицированными аминокислотами, AT(CE)-1, AT132, AT135, AT143, AT151, AT164, полученных в соответствии с Примерами 5 и 6, добавляли в ряд A, B, C, D, E, F, G и H в сериях концентраций от низкой до высокой (колонки с 1 по 9). Колонка 10 представляет собой контроль TNFα, колонка 11 представляет собой контроль клеток, и колонка 12 представляет собой контроль среды. После добавления планшет помещали в термостат при 37°C с диоксидом углерода для культивирования. После завершения инкубации добавляли цветной реагент и продолжали инкубировать. Затем определяли поглощение с помощью считывающего устройства для микропланшетов. Результаты представлены в таблице 2.
Результаты, приведенные в таблице 2, показывают, что гуманизированные антитела, полученные путем мутирования в каркасной области FR, тем не менее, обладают высокими активностями при нейтрализации TNFα. Значение EC50 AT132, 20,4 нг/мл, подобно значению для Хумира.
Пример 8
Исследование на AT132, нейтрализующем киллинг-эффект TNFα в отношении клеток U937 человека (лимфомы человека)
Клетки U937 в хороших условиях считали и доводили до концентраций, составляющих 3,75×104/лунка, средой 1640, содержащей 10% ФСТ. Затем клетки добавляли в 96-луночный планшет в объеме 75 мкл/лунка. Для соответствующего градиентного разведения стандартного образца AT132 и тестируемых образцов использовали культуральную среду, содержащую 120 нг/мл TNFα. Концентрация в первой лунке составляла 600 нг/мл, и градиент разведения был 1,5-кратным. После разведений образцы добавляли в 96-луночный планшет в объеме 25 мкл/лунка. Планшет инкубировали в течение 40 часов в термостате с диоксидом углерода при 37°C. После завершения инкубации в каждую лунку добавляли 10 мкл цветного реагента ССК8 и инкубировали в течение 3 ч, определяли с помощью считывающего устройства для микропланшетов при двойной длине волны 490 нм/630 нм. Чтобы получить значение ED50 стандартного образца и тестируемых образцов и вычислить специфичную активность (формула: 100% ×ED50 стандартного образца/ED50 тестируемых образцов), проводили соответствие с четырехпараметрической кривой.
На фиг.1 показана кривая нейтрализации антителом киллинг-эффектов TNFα в отношении клеток U937.
Результаты анализа, представленные на фиг.1, показывают, что при крайне низких концентрациях AT132 TNFα уничтожает клетки. При увеличении концентрации AT132 киллинг-эффекты TNFα постепенно антагонизируются. Когда концентрация AT132 достигает приблизительно 80 нг/мл, киллинг-эффекты TNFα полностью антагонизируются. Согласно результатам нескольких экспериментов это действие явным образом является дозозависимым. Среднее значение медианной эффективной концентрации AT132 для нейтрализации 30 нг/мл TNFα составляет 24,1 нг/мл.
Пример 9
Определение сродства AT132
Сродство AT132 определяли с помощью Biacore X100 и анализировали с помощью программного обеспечения анализа Biacore X100 кинетика/сродство. Используя способ непрямой иммобилизации, поликлональное антитело коза против человека lgG Fc подвергали сочетанию с поверхностью микрочипа СМ5 в качестве иммобилизующей молекулы путем использования набора для амидного сочетания. AT132 и Хумира в качестве контроля путем вычисления соответственно разводили до определенной концентрации, чтобы затем использовать в качестве лиганда, a TNFα в качестве анализируемого вещества. Анализируемые вещества разводили до 5 концентраций, и каждую концентрацию в виде цикла. Сначала, используя буфер HBS-EP для пробега в течение трех циклов, устанавливали концентрацию анализируемого вещества, равную 0, для пробега в течение двух циклов и, наконец, устанавливали повторную концентрацию анализируемого вещества для пробега в течение цикла. Весь процесс пробега составлял 11 циклов, и на основании каждого цикла можно построить кривую. Данные динамики/сродства измеряемого антитела и Хумира анализировали с помощью программного обеспечения анализа Biacore Х100 кинетика/сродство.
Результаты: константа диссоциации AT132 (Kd) составляет 1,19×10-11 M, то есть константа сродства (Ka) составляет 8,4×1010 М-1; константа диссоциации Хумира составляет 1,08×10-10 M, то есть константа сродства составляет 9,3×109 M-1.
Пример 10
Связывающая активность АТ132 с TNFα мыши и TNFα обезьяны
На планшет соответственно наносили рекомбинантный TNFα человека 5 нг/лунка, TNFα мыши 25 нг/лунка и TNFα обезьяны 5 нг/лунка при комнатной температуре, блокировали в течение 1 ч и отмывали. Затем добавляли 1,8-кратные градиентные разведения AT132 при исходной концентрации 250 нг/мл и инкубировали при 25°C в течение 2 ч, отмывали, добавляли HRP-меченое антитело Fc против человека, инкубировали при комнатной температуре в течение 1 ч, отмывали и добавляли раствор субстрата в количестве 100 мкл/лунка, помещали в темноту при 37°C на 30 мин. В соответствии с порядком добавленных цветных реагентов добавляли 0,2 М H2SO4, 50 мкл/лунка для остановки реакции. В течение приблизительно 5 минут после остановки измеряли значения OD при 450 нм/630 нм на считывающем устройстве для микропланшетов, и медианные эффективные концентрации были получены путем четырехпараметрического соответствия. Сравнивали связывающие активности AT132 с различными источниками TNFα.
Результаты по связывающей активности с TNFα мыши показали, что AT132 не связывает TNFα мыши. Вычисления, основанные на концентрации нанесения и концентрации образца AT132, позволяют предположить, что связывающая активность AT132 с TNFα мыши по меньшей мере в 1000 раз ниже, чем с TNFα человека.
Результаты по связывающей активности с TNFα обезьяны показали, что связывающая активность AT132 с TNFα обезьяны составляет приблизительно 50% активности связывания с TNFα человека.
Пример 11
Получение инъекционных препаратов
Получение инъекционного препарата AT132, AT135 осуществляют, как описано ниже.
1) Получение 20 л буфера (эквивалентного 20,180 кг раствора, плотность которого составляет 1,009 г/мл)
Взвешивают следующие массы следующих ингредиентов: 240,0 г маннита, 26,1 г моногидрата лимонной кислоты, 6,1 г цитрата натрия, 30,6 г дигидрата двузамещенного фосфата натрия, 17,2 г дигидрата однозамещенного фосфата натрия, 123,3 г хлорида натрия, 20,0 г полиоксиэтилен(20)эфира сорбитана и олеата и от 19715,7 до 19716,1 г воды.
Смешивают 40,0 г гидроксида натрия и 1000,8 г воды для инъекций с получением раствора гидроксида натрия.
Затем растворяют следующие предварительно взвешенные ингредиенты (как описано выше) приблизительно в 90% воды для инъекций с получением буфера: маннит, моногидрат лимонной кислоты, цитрат натрия, дигидрат двузамещенного фосфата натрия, эфир олеата, дигидрофосфат натрия, хлорид натрия и полиоксиэтилен(20)эфир сорбитана и олеата.
После добавления всех описанных выше ингредиентов буфера pH раствора доводят 1 M гидроксидом натрия, полученным описанным выше способом. После добавления гидроксида натрия добавляют конечную массу воды. Затем буфер фильтруют в стерильный контейнер через фильтровальную мембрану (гидрофильный поли(винилиденфторид), размер пор 0,22 мкм). Среда, используемая при фильтровании для дезинфекции фильтра, представляет собой аммиак.
2) Получение 40 л препарата (эквивалентного 40,88 кг)
Фильтрованный буферный раствор добавляли к концентрату антитела (активного ингредиента фармацевтического препарата), оттаянному и растворенному в соответствии с описанными ниже способами. Перед приготовлением фармацевтического препарата антитело (концентрат) помещали в водяную баню для оттаивания. Использовали 34,207 г концентрата антитела, что было эквивалентно 2,0 кг белка в белковом концентрате, концентрация которого составляет 60 мг белка/мл. Плотность концентрата составляла 1,0262 г/мл. Можно использовать любое количество концентрата белка, составляющее от 25,655 до 37,316, что эквивалентно концентрации белка в белковом концентрате, составляющей от 50 до 80 мг/мл. При перемешивании добавляли буфер до достижения конечной массы общего раствора.
Затем препарат, содержащий все его ингредиенты, фильтровали в соответствии с описанным выше способом за исключением того, что препарат фильтровали через два слоя стерильного мембранного фильтра с размером пор 0,22 мкм. После дезинфекции препарат упаковывали для применения во флакон или предварительно заполненный шприц.
Пример 12
Тест острой токсичности AT132
Тестируемые образцы: лиофилизированный порошок AT132, 20 мг/бутылка; контроль адъюванта: буфер AT132 (содержащий гистидин, трегалозу); растворитель: стерильная вода для инъекций. Группы подопытных животных и дозы: количество мышей линии Kunming (KM) 60, возраст 4-6 недель, масса 18-22 г, половина самцов и половина самок, уровень SPF (без патогенов). Животных случайно делили на три группы, по 20 в каждой группе, половина самцов и половина самок. Животных однократно дозировали и наблюдали в течение 14 суток. В таблице 3 показана доза и путь введения:
Оценка исходов: масса тела, прием пищи, психическое состояние, поведение, стул. По окончании испытательного периода наблюдения животным проводили эвтаназию и наблюдали крупные анатомические патологии. Аномальные ткани и органы подвергали гистологическому исследованию.
Результаты
На протяжении испытания ни одно животное не погибло и ни одно не было умирающим; все животные находились в хорошем психическом состоянии, проявляли нормальное поведение, питание, потребление питьевой воды и не проявляли признаков аномалии. Регулярное изменение массы, связанное с введением дозы, в каждой обрабатываемой группе животных не было выявлено. Наблюдение крупных анатомических патологий не показало никаких аномальных изменений, связанных с введением дозы.
Вывод: в условиях настоящего эксперимента при введении порошка AT132 мышам при однократной инъекции дозы, составляющей 500 мг/кг, значительной токсичности не наблюдали, и максимально переносимая доза (МПД) составляет более 500 мг/кг.
Пример 13
Защитный эффект АТ132 от гибели, вызванной rhTNFα, у мышей, сенсибилизированных D-галактозамином
Количество мышей, составляющее 51 мышь C57BL/6 массой 20,0±2,0 г, делили на 6 групп (таблица 4). Для групп со 2 по 5 каждой мыши инъецировали интраперитонеально 0,25 мл раствора AT132, причем на основании количества AT132 каждая мышь получала дозу, составляющую: в группе 2 5,2 мкг/мышь; в группе 3 26 мкг/мышь; в группе 4 52 мкг/мышь; в группе 5 26 мкг/мышь. Для группы 1 каждой мыши инъецировали интраперитонеально 0,25 мл цитратного буфера, pH 5,63. Для группы 6 каждой мыши инъецировали интраперитонеально 0,25 мл lgG1 человека (HulgG1, отрицательный контроль), 26 мкг/мышь на основании количества HulgG1. Спустя 30 минут каждой мыши в каждой группе (за исключением группы 5) инъецировали интраперитонеально 0,25 мл смеси раствора rhTNFα (Primegene, номер партии 1030109021) и D-галактозамина. Для группы 5 каждой мыши инъецировали интраперитонеально 0,25 мл буфера. Наблюдали число погибших мышей в течение 48 часов и вычисляли выживаемость, как показано в таблице 4.
Результаты
Значения выживаемости мышей группы буфера и HulgG1 были равны 0. Но AT132 проявлял дозозависимый защитный эффект у мышей, которым вводили rhTNFα, сенсибилизированных D-галактозамином. Таким образом, AT132 проявлял защитные эффекты от гибели, вызванной rhTNFα, у мышей, сенсибилизированных D-галактозамином.
Пример 14
Исследование эффекта AT132 в отношении артрита, индуцированного коллагеном типа II
Количество самок крыс линии Вистар, составляющее 40, делили случайным образом на 4 группы, по 10 крыс в каждой группе. Группы представляют собой: группу чистого контроля, контрольную группу воспаления (модельную группу), группу AT132 1 мкг/кг и группу AT132 5 мг/кг.
За исключением группы чистого контроля крыс в других группах соответственно иммунизировали путем внутрикожной инъекции на спине коллагеном II и группе провоспалительного контроля инъецировали 0,1 моль/л уксусной кислоты и эмульсию полного или неполного адъюванта Фрейнда (Sigma, номер партии 129K8701).
Группе AT132 1 мг/кг и группе AT132 5 мг/кг начинали инъецировать AT132 интраперитонеально на сутки иммунизации. Через неделю после первой иммунизации мышей снова иммунизировали таким же путем для усиления иммунного ответа и вводили суммарно в течение 28 суток. В различные моменты времени до и после введения измеряли значения опухания суставов крыс с помощью прибора YLS-7B для измерения объема пальца. После экспериментов сустав брали на патологическое исследование. Вычисляли показатель опухания и показатель ингибирования и различия между группами сравнивали с помощью t критерия. Вычисления проводили по следующей формуле:
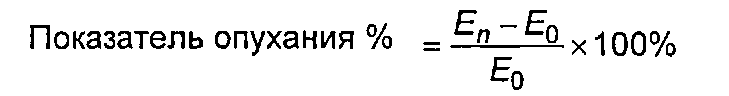
En = значения опухания в различные моменты времени после воспаления
E0 = значения опухания до воспаления
Экспериментальные данные представляли в виде средних значений и стандартного отклонения (s), и для статистического анализа использовали t критерий. Результаты представлены на фиг.2. В группе AT132 1 мг/кг показаны значимые эффекты ингибирования, причем хороший эффект начинается на сутки 19 и лучший эффект составляет 63,10%. С этого момента ингибиторный эффект постепенно снижается. Результат остается хорошим на сутки 28 при показателе ингибирования, составляющем 55,71%. В группе AT132 5 мг/кг показаны значимые эффекты ингибирования, причем значимый лечебный эффект начинается на сутки 19. Опухание сустава лапы крысы постепенно падает, активность суставов становится нормальной и этот эффект длится до 28-х суток. Высший показатель ингибирования, составляющий 47,27%, появлялся на 21-е сутки, а в остальных случаях составлял приблизительно 40%.
Пример 15
Фармакодинамическое исследование AT132 в модели артрита мышей Tg197
В эксперименте использовали трансгенных мышей Tg197 (приобретенных у Cyagen Biosciences) и этих мышей делили на 6 групп по 10 мышей в каждой группе, половина самцов и половина самок, конкретно, как описано ниже: Группа 1: AT132 1 мг/кг; Группа 2: группа растворителя (буфер, содержащий лимонную кислоту и хлорид натрия); Группа 3: AT132 30 мг/кг; Группа 4: AT132 10 мг/кг; Группа 5: Хумира 10 мг/кг; Группа 6: AT132 3 мг/кг. Другие 4 мыши Tg197 были отобраны в качестве группы чистого контроля.
Мышам Tg197 в возрасте 3 недель дважды в неделю инъецировали интраперитонеально AT132 до возраста, составляющего 10 недель. AT132 перед введением разводили до нужной концентрации, и каждая группа получала дозу, составляющую 10 мкл/г массы тела. Наблюдали степень артрита у мышей, оценивали патологические баллы на обнаженном суставе и вычисляли показатель ингибирования на основании баллов артрита и патологических баллов.
1) Исследование AT132 на степень артрита у мышей Tg197
Для оценки степени артрита еженедельно оценивали морфологические изменения суставов мышей, и конкретные критерии определения баллов артрита были следующими:
0,0 = отсутствие артрита (внешний вид нормальный, мыши способны поддерживать массу тела, общая гибкость/способность к уклонению нормальная, максимальная сила захвата лапы);
0,5 = начало артрита (суставы и лапы слегка опухшие, внешний вид нормальный, мыши способны поддерживать массу тела, общая гибкость/способность к уклонению нормальная, максимальная сила захвата лапы);
1,0 = артрит легкой степени (суставы опухшие и деформированные, лапы опухшие, внешний вид нормальный, мыши способны поддерживать массу тела, общая гибкость/способность к уклонению нормальная, максимальная сила захвата лапы);
1,5 = артрит от легкой до средней степени (суставы и лапы опухшие, деформированные, последние пальцы деформированы внутрь, слабая способность к поддержанию массы тела, общая гибкость снижена, сила захвата лапы снижена);
2,0 = артрит средней степени (тяжелое опухание суставов, лап и пальцев, деформация суставов стопы, не могут поддерживать массу тела вверх и падают, исчезновение общей гибкости, сила захвата лапы исчезает, изменение лазания/питания);
2,5 = артрит от средней до тяжелой степени (тяжелое опухание суставов, лап и пальцев, деформация суставов стопы, не могут поддерживать массу тела вверх и падают, исчезновение общей гибкости, сила захвата лапы исчезает, изменение лазания/питания, деформация пальцев лап, активность мыши ухудшается);
3,0 = артрит тяжелой степени (скованность суставов, обнаруживается изгиб и тяжелое нарушение активности, мыши погибают).
Баллы артрита мышей Tg197 представлены ниже на фиг.3A.
2) Гистопатологическое исследование голеностопного сустава мышей Tg197
Для мониторинга болезненного состояния четырех мышей Tg197 из того же помета, что и испытуемые мыши (пронумерованы как Con1-Con4), умерщвляли в возрасте 3 недель в качестве образцов суставов в начале обработки. Подопытных мышей умерщвляли в возрасте 10 недель и образцы срезов брали из голеностопных суставов. После окрашивания гематоксилином/эозином микроскопические гистопатологические баллы артрита оценивали слепым методом, и балл 0-4 представлял собой следующее:
0 = отсутствие обнаружимой патологии
1 = синовиальная пролиферация, инфильтрация полиморфоядерных лейкоцитов
2 = образование паннуса и фиброзной ткани и эрозия субхондральной кости в месте очага
3 = деструкция хряща и эрозия кости
4 = обширная деструкция хряща и эрозия кости
Гистопатологический анализ мышей Tg197 представлен на фиг.3B и 3C.
3) Вычисление показателей ингибирования в соответствии с баллами артрита и патологическими баллами
Показатели ингибирования в соответствии с баллами артрита вычисляли по следующей формуле:
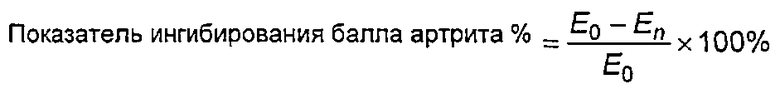
En = балл артрита каждой группы
E0 = балл артрита группы растворителя
Показатели ингибирования в соответствии с патологическими баллами вычисляли по следующей формуле:
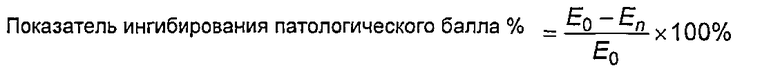
En = патологический балл каждой группы
E0 = патологические баллы группы растворителя
Результаты представлены в таблице 5 ниже.
балла (%)
Результаты
При введении различных доз AT132 (группа 1, группа 3, группа 4, группа 6) показаны значительные ингибиторные эффекты в отношении ревматоидного артрита, которые в характерном случае дозозависимы. В частности, можно сделать значительное различие между показателями ингибирования от группы 1 (1 мг/кг) до группы 6 (3 мг/кг). От группы 6 (3 мг/кг) до группы 4 (10 мг/кг) показатели ингибирования также значительно различаются. Только между группой 4 (10 мг/кг) и группой 3 самой высокой дозы (30 мг/кг) показатели ингибирования не различаются. Важно, что при одинаковом уровне дозы, составляющем 10 мг/кг, группа обработки AT132 не имеет значительных различий с группой 5 Хумира и характеризуется значительным эффектом улучшения в отношении гистопатологии артрита по сравнению с группой 2 растворителя.
Пример 16
Перекрестная реакция тканей на моноклональное антитело AT132
1) Перекрестная реакция тканей человека на моноклональное антитело AT132
Парафиновые срезы полипов носа и парафиновые срезы нормальной ткани от четырех человек (доноров A, B, C, D, предоставленных государственными институтами контроля пищевых продуктов и лекарственных средств и государственным центром оценки безопасности лекарственных средств) делили на три группы, а именно на экспериментальную группу (AT132 с биотиновым маркером), группу положительного контроля (антитело Хумира, меченное биотином), группу отрицательного контроля (буфер ФСБ). Наблюдали окрашивание тканевых срезов после перекрестной реакции ткани.
Результаты эксперимента показали, что группа отрицательного контроля полипов носа человека и нормальных тканей человека не окрашивается. Группа положительного контроля биотин-Хумира, включающая макрофаги полипов носа человека, макрофаги нормальных лимфатических узлов человека и легочные альвеолярные макрофаги, проявляет окрашивание от слабого до среднего, тогда как другие ткани не окрашиваются. Экспериментальная группа Биотин-AT132, включающая макрофаги полипов носа человека, проявляла окрашивание от слабого до среднего. Перекрестные реакции нормальных тканей человека были сходными с реакциями на Хумира.
2) Перекрестная реакция тканей яванского макака на моноклональное антитело AT132
Парафиновые срезы полипов носа и парафиновые срезы трех групп тканей яванского макака (доноров A, B, C, предоставленных государственными институтами контроля пищевых продуктов и лекарственных средств и государственным центром оценки безопасности лекарственных средств) делили на три группы, а именно на экспериментальную группу (AT132 с биотиновым маркером), группу положительного контроля (антитело Хумира, меченное биотином), группу отрицательного контроля (буфер ФСБ). Наблюдали окрашивание тканевых срезов после перекрестной реакции ткани.
Результаты эксперимента показали, что группа отрицательного контроля полипов носа человека и нормальных тканей яванского макака не окрашивается. Группа положительного контроля биотин-Хумира, включающая макрофаги полипов носа человека, проявляет окрашивание от слабого до среднего, тогда как нормальные ткани яванского макака не окрашиваются. Экспериментальная группа Биотин-AT132, включающая макрофаги полипов носа человека, проявляла окрашивание от слабого до среднего. Перекрестные реакции нормальных тканей яванского макака были сходными с реакциями Хумира.



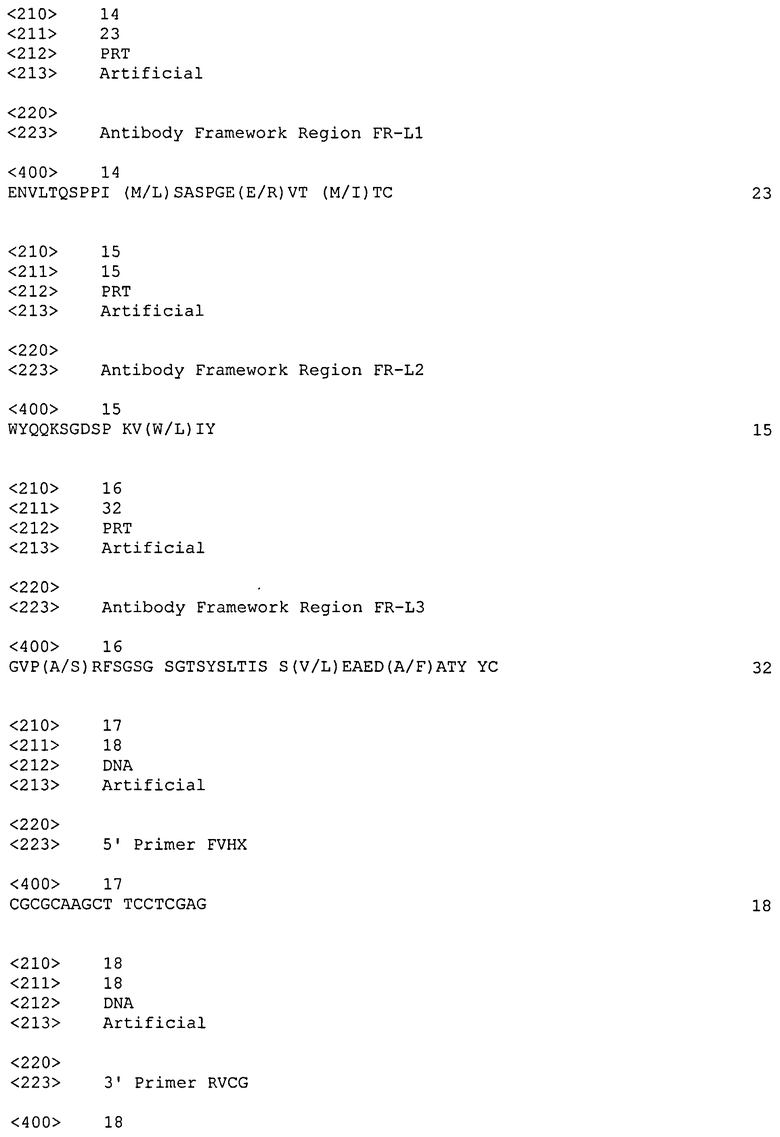





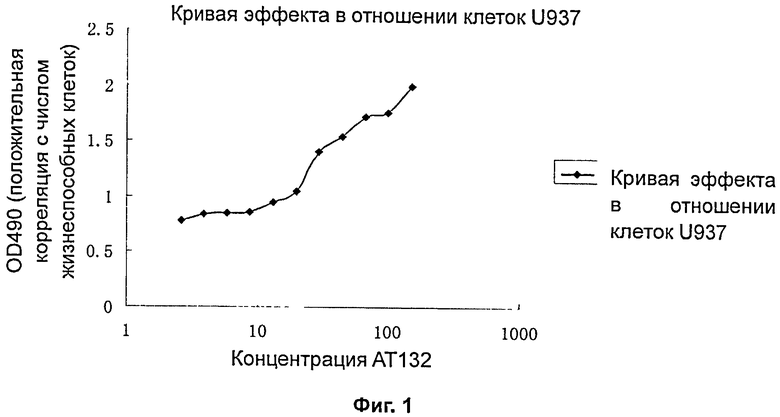
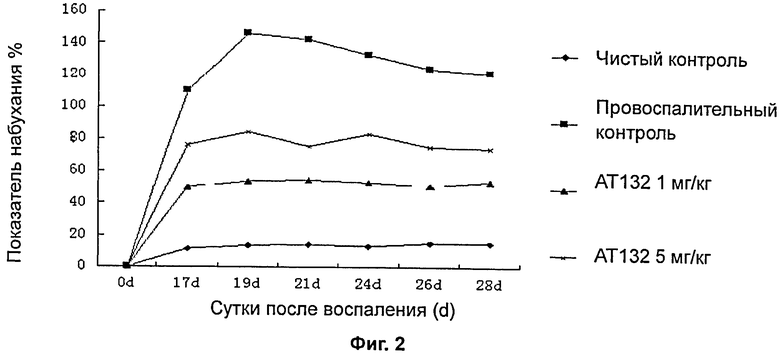
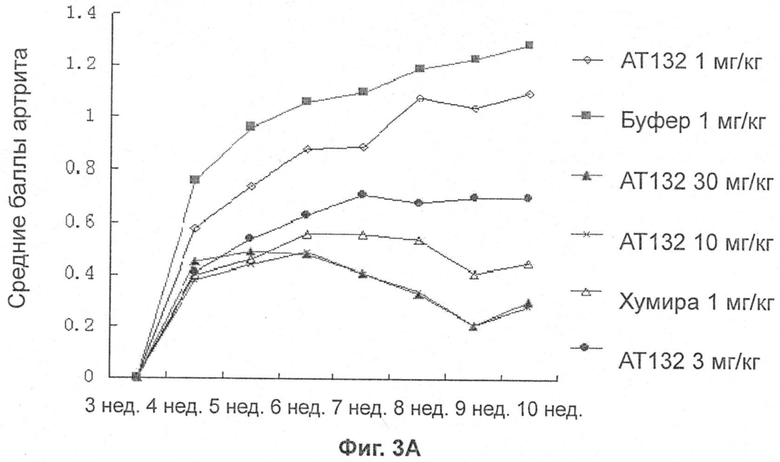

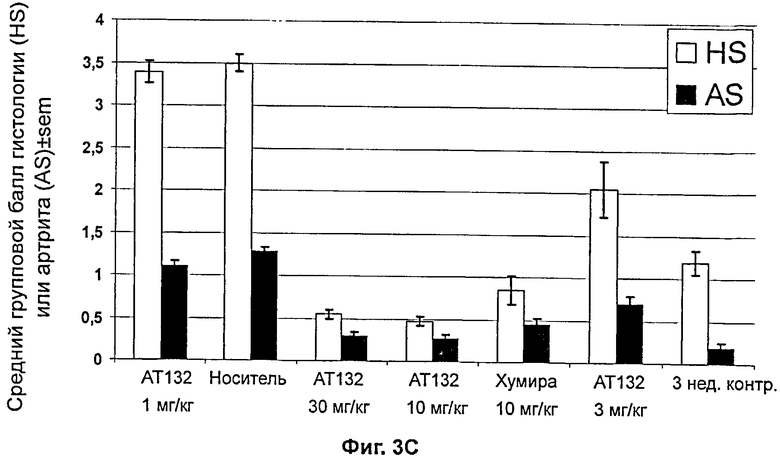
Изобретение относится к биохимии. Описано гуманизированное моноклональное антитело против TNF и его применение. Изобретение позволяет значительно снизить иммуногенность мышиного антитела при сохранении способности антитела распознавать антиген по сравнению с консервативным химерным мышиным антителом. Таким образом, повышена безопасность антитела в клинических применениях. 8 н. и 3 з.п. ф-лы, 3 ил., 5 табл., 16 пр.
1. Гуманизированное моноклональное антитело против TNF, включающее тяжелую цепь и легкую цепь, в котором тяжелая цепь включает последовательность SEQ ID NO:1 или последовательность, обладающую по меньшей мере 75% гомологией с SEQ ID NO:1, и легкая цепь включает последовательность SEQ ID NO:2 или последовательность, обладающую по меньшей мере 75% гомологией с SEQ ID NO:2; и в котором тяжелая цепь и/или легкая цепь модифицирована путем замены аминокислотного остатка в последовательности SEQ ID NO:1 или последовательности SEQ ID NO:2 только в пределах каркасных областей.
2. Гуманизированное моноклональное антитело против TNF, включающее тяжелую цепь и легкую цепь, в котором тяжелая цепь содержит последовательность SEQ ID NO:1 или последовательность, обладающую по меньшей мере 75% гомологией с SEQ ID NO:1, и легкая цепь включает последовательность SEQ ID NO:2 или последовательность, обладающую по меньшей мере 75% гомологией с SEQ ID NO:2, в котором тяжелая цепь и/или легкая цепь модифицирована путем консервативной замены 1-5 аминокислотных остатков в последовательности SEQ ID NO:1 или последовательности SEQ ID NO:2 только в пределах каркасных областей.
3. Гуманизированное моноклональное антитело против TNF по п.1, в котором участок, определяющий комплементарность, CDR-H1 вариабельной области тяжелой цепи включает последовательность SEQ ID NO:3; CDR-H2 включает последовательность SEQ ID NO:4; CDR-H3 включает последовательность SEQ ID NO:5; в котором в пределах каркасной области FR-H1 А возможно заменен Е в положении аминокислотного остатка 16, S возможно заменен Т в положении 17 и I возможно заменен V в положении 20 (SEQ ID NO:11); в пределах FR-H2 К возможно заменен R в положении 3 и G возможно заменен S в положении 9 (SEQ ID NO:12); в пределах FR-Н3 Т возможно заменен V в положении 3, Е возможно заменен D в положении 7, V возможно заменен Т в положении 10, F возможно заменен Y в положении 14, S возможно заменен Т в положении 19 и Т возможно заменен V в положении 27 (SEQ ID NO:13); и участок, определяющий комплементарность, CDR-L1 включает последовательность SEQ ID NO:6; CDR-L2 включает последовательность SEQ ID NO:7; CDR-L3 включает последовательность SEQ ID NO:8; в котором в пределах каркасной области FR-L1 L возможно заменен М в положении 11, R возможно заменен Е в положении 18 и М возможно заменен I в положении 21 (SEQ ID NO:14); в пределах FR-L2 W возможно заменен L в положении 13 (SEQ ID NO:15); в пределах FR-L3 S возможно заменен А в положении 4, L возможно заменен V в положении 22 и А возможно заменен F в положении 27 (SEQ ID NO:16).
4. Молекула нуклеиновой кислоты, кодирующая гуманизированное моноклональное антитело против TNF по любому из пп.1-3.
5. Вектор, включающий нуклеиново-кислотную молекулу по п.4 для экспрессии гуманизированного моноклонального антитела против TNF по любому из пп.1-3.
6. Вектор по п.5, дополнительно включающий промотор, который функционально связан с нуклеиново-кислотной последовательностью для стимуляции ее экспрессии.
7. Клетка-хозяин, содержащая вектор по п.5 для экспрессии гуманизированного моноклонального антитела против TNF по любому из пп.1-3, где клетка-хозяин является клеткой млекопитающего.
8. Способ получения лекарственного средства, применяемого при диагностическом анализе hTNFα, при котором в лекарственное средство включают эффективное количество гуманизированного моноклонального антитела против TNF по любому из пп.1-3.
9. Способ лечения заболевания, обусловленного hTNF, при котором пациенту, нуждающемуся в этом, вводят эффективное количество гуманизированного моноклонального антитела против TNF по любому из пп.1-3.
10. Способ по п.9, при котором заболевание, обусловленное hTNFα, выбрано из аутоиммунных заболеваний и злокачественной опухоли.
11. Применение гуманизированного моноклонального антитела против TNF по любому из пп.1-3 для получения фармацевтической композиции.
| ПОЛИПЕПТИДНЫЕ ВАРИАНТЫ С ИЗМЕНЕННОЙ ЭФФЕКТОРНОЙ ФУНКЦИЕЙ | 2005 |
|
RU2367667C2 |
| KR 20030022367 A, 15.03.2003 | |||
Авторы
Даты
2015-04-27—Публикация
2012-02-13—Подача