ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет согласно международной заявке №PCT/CN2014/082721, поданной 22 июля 2014 года, которая полностью включена в настоящий документ посредством ссылки для всех целей.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к антителам и их антиген-связывающим фрагментам, связывающимся с PD-1, а также способам применения таких антител и антиген-связывающих фрагментов.
ОПИСАНИЕ ТЕКСТОВОГО ФАЙЛА, ПРЕДСТАВЛЕННОГО В ЭЛЕКТРОННОМ ВИДЕ
[0003] Содержание текстового файла, представленного в электронном виде вместе с данной заявкой, полностью включено в настоящий документ посредством ссылки: Копия перечня последовательностей в машиночитаемом формате (название файла: CRBI_006_01WO_SeqList_ST25); дата записи: 14 июля 2015 года; размер файла 147 кБ).
УРОВЕНЬ ТЕХНИКИ
[0004] Рецептор запрограммированной гибели клеток-1 (PD-1) экспрессируется главным образом на лимфоцитах и характеризуется двумя лигандами, PD-L1 и PD L2. PD-1 представляет собой белок с молекулярной массой 55 кДа, кодируемый геном Pdcd1; показано, что он подавляет передачу сигнала от антигена к рецептору при вовлечении своего лиганда (Freeman et al.(2000) J Exp Med 192:1027-34; Latchman, et. al.(2001) Nat Immunol 2:261-8; Carter et al.(2002) Eur J Immunol 32:634-43). PD-1 относится к надсемейству иммуноглобулинов, которое включает такие члены, как CD28, CTLA-4, ICOS и BTLA. PD-1 представляет собой трансмембранный гликопротеин I типа, содержащий домен Ig вариабельного типа (V-типа) для связывания лиганда и цитоплазматический хвост для связывания сигнальных молекул. PD-1 содержит два цитоплазматических сигнальных мотива на основе тирозина, иммунорецепторный тирозиновый ингибирующий мотив (ITIM) и иммунорецепторный тирозиновый переключающий мотив (ITSM). После стимуляции Т-клеток PD-1 рекрутирует тирозинфосфатазу SHP-2 в ITSM-мотив в составе своего цитоплазматического хвоста, что приводит к дефосфорилированию эффекторных молекул, например, CD3-дзета, PKC-тета и ZAP70, участвующих в CD3-сигнальном каскаде Т-клеток. В отличие от вышеописанного, лиганды PD-1 (PD-L1 и PD L2) содержат две коротких цитоплазматических области с неизвестными функциями. Указанные лиганды содержат внеклеточную область, содержащую IgV- и IgC-подобные домены, и конститутивно экспрессируются или могут индуцироваться в клетках различного типа, в том числе в некроветворных тканях, а также в опухолях различного типа. PD-L1 экспрессируется не только на B-, T-, миелоидных и дендритных клетках (DC), но и на периферических клетках, например, клетках эндотелия микрососудов и нелимфоидных органов, например, сердца, легких и т.д. В противоположность этому, PD-L2 встречается только на макрофагах и DC. Картина экспрессии лигандов PD-1 указывает на роль PD-1 в поддержании периферического иммунитета и может регулировать аутореакцию T - и B-клеток на периферии. На сегодняшний день многочисленные исследования показали, что взаимодействие PD-1 с его лигандами приводит к ингибированию пролиферации лимфоцитов in vitro и in vivo. Показано, что нарушение взаимодействия PD-1/PDL1 увеличивает пролиферацию Т-клеток и стимулирует продукцию цитокинов.
[0005] Таким образом, PD-1/PD-L1-путь играет важную роль в контроле иммунного ответа. Дисфункция сигнального пути PD-1/PD-L1, по-видимому, коррелирует с началом и развитием таких заболеваний, как рак и вирусная инфекция. Анализ животных с нокаутом соответствующих генов позволил установить, что функция PD-1 заключается главным образом в индукции и регуляции периферического иммунитета. Таким образом, терапевтическая блокада пути PD-1 может быть полезна при преодолении иммунной толерантности и при лечении рака или инфекции, а также усилении иммунитета во время вакцинации (профилактической или терапевтической). В данной области техники существует необходимость совершенствования способов блокады PD-1-пути.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] В одном аспекте настоящего изобретения предложены антитела и их антиген-связывающие фрагменты, связывающиеся с рецептором запрограммированной гибели клеток-1 (PD-1). В некоторых вариантах реализации антитела или их антиген-связывающие фрагменты связываются с PD-1 человека. В некоторых вариантах реализации антитела или их антиген-связывающие фрагменты связываются с PD-1 и блокируют связывание PD-L1 и/или PD-L2 с PD-1. В дополнительных вариантах реализации антитела или их антиген-связывающие фрагменты связываются с PD-1 и нарушают путь PD-1/PD-L1 или PD1/PD-L2. В одном варианте реализации антитело или его фрагмент является антителом мыши, химерным антителом, антителом человека или гуманизированным антителом. В одном варианте реализации антитело против PD-1 или его фрагмент являются моноклональным антителом, scFv, Fab-фрагментом, Fab'-фрагментом, F(ab)'-фрагментом, биспецифическим антителом, иммуноконъюгатом или их комбинацией.
[0007] В одном варианте реализации настоящего изобретения предложено выделенное антитело или его фрагмент, содержащие один или более из CDR, выбранных из группы, состоящей из SEQ ID NO: 19-21, 24-26, 29-31, 34-36, 40-42, 45-47, 50-52, 55-57, 60-62, 65-67, 70-72, 75-77, 80-82, 85-87, 90-92, 95-97, 100-102, 105-107, 110-112 и 115-117.
[0008] В одном варианте реализации антитело или его фрагмент содержит последовательность CDR1 легкой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 81% гомологией, по меньшей мере 82% гомологией, по меньшей мере 83% гомологией, по меньшей мере 84% гомологией, по меньшей мере 85% гомологией, по меньшей мере 86% гомологией, по меньшей мере 87% гомологией, по меньшей мере 88% гомологией, по меньшей мере 89% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 24, 34, 45, 55, 65, 75, 85, 95, 105, и 115.
[0009] В одном варианте реализации антитело или его фрагмент содержит последовательность CDR2 легкой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 81% гомологией, по меньшей мере 82% гомологией, по меньшей мере 83% гомологией, по меньшей мере 84% гомологией, по меньшей мере 85% гомологией, по меньшей мере 86% гомологией, по меньшей мере 87% гомологией, по меньшей мере 88% гомологией, по меньшей мере 89% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 25, 35, 46, 56, 66, 76, 86, 96, 106 и 116.
[0010] В одном варианте реализации антитело или его фрагмент содержит последовательность CDR3 легкой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 81% гомологией, по меньшей мере 82% гомологией, по меньшей мере 83% гомологией, по меньшей мере 84% гомологией, по меньшей мере 85% гомологией, по меньшей мере 86% гомологией, по меньшей мере 87% гомологией, по меньшей мере 88% гомологией, по меньшей мере 89% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 26, 36, 47, 57, 67, 77, 87, 97, 107 и 117.
[0011] В одном варианте реализации антитело или его фрагмент содержит последовательность CDR1 тяжелой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 81% гомологией, по меньшей мере 82% гомологией, по меньшей мере 83% гомологией, по меньшей мере 84% гомологией, по меньшей мере 85% гомологией, по меньшей мере 86% гомологией, по меньшей мере 87% гомологией, по меньшей мере 88% гомологией, по меньшей мере 89% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 19, 29, 40, 50, 60, 70, 80, 90, 100 и 110.
[0012] В одном варианте реализации антитело или его фрагмент содержит последовательность CDR2 тяжелой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 81% гомологией, по меньшей мере 82% гомологией, по меньшей мере 83% гомологией, по меньшей мере 84% гомологией, по меньшей мере 85% гомологией, по меньшей мере 86% гомологией, по меньшей мере 87% гомологией, по меньшей мере 88% гомологией, по меньшей мере 89% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 20, 30, 41, 51, 61, 71, 81, 91, 101 и 111.
[0013] В одном варианте реализации антитело или его фрагмент содержит последовательность CDR3 тяжелой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 81% гомологией, по меньшей мере 82% гомологией, по меньшей мере 83% гомологией, по меньшей мере 84% гомологией, по меньшей мере 85% гомологией, по меньшей мере 86% гомологией, по меньшей мере 87% гомологией, по меньшей мере 88% гомологией, по меньшей мере 89% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 21, 31, 42, 52, 62, 72, 82, 92, 102 и 112. В одном варианте реализации антитело или его фрагмент содержат CDR1 легкой цепи, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 24, 34, 45, 55, 65, 75, 85, 95, 105 и 115; CDR2 легкой цепи, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 25, 35, 46, 56, 66, 76, 86, 96, 106 и 116; CDR3 легкой цепи, состоящий из аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 26, 36, 47, 57, 67, 77, 87, 97, 107 и 117; CDR1 тяжелой цепи, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 19, 29, 40, 50, 60, 70, 80, 90, 100 и 110; CDR2 тяжелой цепи, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 20, 30, 41, 51, 61, 71, 81, 91, 101 и 111; и CDR3 тяжелой цепи, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 21, 31, 42, 52, 62, 72, 82, 92, 102 и 112.
[0014] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 24, 25 и 26, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 19, 20 и 21, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 24, 25 и 26, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 19, 20 и 21, соответственно.
[0015] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 34, 35 и 36, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 29, 30 и 31, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 34, 35 и 36, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 29, 30 и 31, соответственно.
[0016] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 45, 46 и 47, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 40, 41 и 42, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 45, 46 и 47, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 40, 41 и 42, соответственно.
[0017] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 55, 56 и 57, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 50, 51 и 52, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 55, 56 и 57, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 50, 51 и 52, соответственно.
[0018] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 65, 66 и 67, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 60, 61 и 62, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 65, 66 и 67, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 60, 61 и 62, соответственно.
[0019] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 75, 76 и 77, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 70, 71 и 72, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 75, 76 и 77, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 70, 71 и 72, соответственно.
[0020] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 85, 86 и 87, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 80, 81 и 82, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 85, 86 и 87, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 80, 81 и 82, соответственно.
[0021] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 95, 96 и 97, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 90, 91 и 92, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 95, 96 и 97, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 90, 91 и 92, соответственно.
[0022] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 105, 106 и 107, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 100, 101 и 102, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 105, 106 и 107, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 100, 101 и 102, соответственно.
[0023] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 115, 116 и 117, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности согласно SEQ ID NO: 110, 111 и 112, соответственно. В дополнительном варианте реализации антитело или фрагмент антитела содержит CDR1, CDR2 и CDR3 легкой цепи согласно SEQ ID NO: 115, 116, 117, соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи согласно SEQ ID NO: 110, 111 и 112, соответственно.
[0024] В одном варианте реализации антитело или его фрагмент связывает PD-1 и содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 23, 33, 44, 54, 64, 74, 84, 94, 104, 114, 133, 143 и 152; и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 18, 28, 39, 49, 59, 69, 79, 89, 99, 109, 131 и 141. В дополнительном варианте реализации выделенное антитело или его фрагмент связывается с PD-1 и содержит вариабельную область легкой цепи, содержащую, состоящую главным образом из или состоящую из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 23, 33, 44, 54, 64, 74, 84, 94, 104, 114, 133, 143 и 152; и вариабельную область тяжелой цепи, содержащую, состоящую главным образом из или состоящую из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 18, 28, 39, 49, 59, 69, 79, 89, 99, 109, 131 и 141.
[0025] В одном варианте реализации настоящего изобретения предложены антитела против PD-1, содержащие вариабельную область легкой цепи антитела, выбранного из группы, состоящей из 10D1, 4C10, 7D3, 13F1, 15H5, 14A6, 22A5, 6E1, 5A8, 7A4 и 7A4D и вариабельную область тяжелой цепи антитела, выбранного из группы, состоящей из 10D1, 4C10, 7D3, 13F1, 15H5, 14A6, 22A5, 6E1, 5A8 и 7A4. Так, в одном варианте реализации настоящего изобретения предложено антитело или его фрагмент, содержащие вариабельную область легкой цепи, содержащую SEQ ID NO: 23, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 18; вариабельную область легкой цепи, содержащую SEQ ID NO: 33, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 28; вариабельную область легкой цепи, содержащую SEQ ID NO: 44, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 39; вариабельную область легкой цепи, содержащую SEQ ID NO: 54, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 49; вариабельную область легкой цепи, содержащую SEQ ID NO: 64, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 59; вариабельную область легкой цепи, содержащую SEQ ID NO: 74, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 69; вариабельную область легкой цепи, содержащую SEQ ID NO: 84, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 79; вариабельную область легкой цепи, содержащую SEQ ID NO: 94, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 89; вариабельную область легкой цепи, содержащую SEQ ID NO: 104, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 99; вариабельную область легкой цепи, содержащую SEQ ID NO: 114, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 109; вариабельную область легкой цепи, содержащую SEQ ID NO: 133, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 131; вариабельную область легкой цепи, содержащую SEQ ID NO: 143, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 141; вариабельную область легкой цепи, содержащую SEQ ID NO: 152, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 131.
[0026] В одном варианте реализации настоящего изобретения предложено химерное антитело против PD-1, причем указанное антитело содержит тяжелую цепь, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией, или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 119, 121, 125 и 127; и легкую цепь, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 123 и 129.
[0027] В одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 131 и 141. В еще одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 133, 143 и 152.
[0028] В еще одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит вариабельную область тяжелой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к SEQ ID NO: 131, и вариабельную область легкой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к SEQ ID NO: 133 или 152. В еще одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит вариабельную область тяжелой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к SEQ ID NO: 141, и вариабельную область легкой цепи, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к SEQ ID NO: 143.
[0029] В одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит полную тяжелую цепь, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 135, 137, 145 и 147. В еще одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит полную легкую цепь, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% гомологией, по меньшей мере 85% гомологией, по меньшей мере 90% гомологией, по меньшей мере 91% гомологией, по меньшей мере 92% гомологией, по меньшей мере 93% гомологией, по меньшей мере 94% гомологией, по меньшей мере 95% гомологией, по меньшей мере 96% гомологией, по меньшей мере 97% гомологией, по меньшей мере 98% гомологией или по меньшей мере 99% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 139, 149 и 153.
[0030] В одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит тяжелую цепь согласно SEQ ID NO: 135 и легкую цепь согласно SEQ ID NO: 139. В еще одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит тяжелую цепь согласно SEQ ID NO: 137 и легкую цепь согласно SEQ ID NO: 139. В еще одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит тяжелую цепь согласно SEQ ID NO: 135 и легкую цепь согласно SEQ ID NO: 153. В еще одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит тяжелую цепь согласно SEQ ID NO: 137 и легкую цепь согласно SEQ ID NO: 153. В еще одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит тяжелую цепь согласно SEQ ID NO: 145 и легкую цепь согласно SEQ ID NO: 149. В еще одном варианте реализации настоящего изобретения предложено гуманизированное антитело против PD-1, причем указанное антитело содержит тяжелую цепь согласно SEQ ID NO: 147 и легкую цепь согласно SEQ ID NO: 149. В одном варианте реализации настоящего изобретения предложены антитела против PD-1 или их фрагменты, связывающиеся с тем же эпитопом PD-1, что и любое из антител, приведенных в качестве примера в настоящем документе. В одном варианте реализации антитела или их фрагменты конкурируют за связывание с PD-1 с любым из антител, приведенных в качестве примера в настоящем документе. Связывание с PD-1 можно измерить с помощью анализа на основе твердофазного ИФА, проточной цитометрии, поверхностного плазмонного резонанса (ППР), или любым другим способом, известным в данной области техники.
[0031] В одном варианте реализации настоящего изобретения предложены антитела против PD-1 и их фрагменты, связывающиеся с PD-1 со сродством от приблизительно 1 нМ до приблизительно 0,01 нМ. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством от приблизительно 0,5 нМ до приблизительно 0,1 нМ. В еще одном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 1 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,75 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,5 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,25 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,2 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,15 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,1 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,075 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,05 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,025 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,02 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,015 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,01 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,0075 нМ или менее. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, связываются с PD-1 со сродством приблизительно 0,005 нМ или менее.
[0032] В одном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, обладают EC50 связывания по отношению к PD-1, равной от приблизительно 1 нг/мл до приблизительно 2000 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, обладают EC50 связывания по отношению к PD-1, равной от приблизительно 1 нг/мл до приблизительно 1500 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, обладают EC50 связывания по отношению к PD-1, равной от приблизительно 1 нг/мл до приблизительно 1000 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, обладают EC50 связывания по отношению к PD-1, равной от приблизительно 2 нг/мл до приблизительно 500 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, обладают EC50 связывания по отношению к PD-1, равной от приблизительно 2 нг/мл до приблизительно 200 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, обладают EC50 связывания по отношению к PD-1, равной от приблизительно 5 нг/мл до приблизительно 100 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, обладают EC50 связывания по отношению к PD-1, равной от приблизительно 5 нг/мл до приблизительно 50 нг/мл. В одном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, обладают ЕС50 связывания по отношению к PD-1, равной приблизительно 500 нг/мл или менее, приблизительно 400 нг/мл или менее, приблизительно 300 нг/мл или менее, приблизительно 250 нг/мл или менее, приблизительно 200 нг/мл или менее, приблизительно 150 нг/мл или менее, приблизительно 100 нг/мл или менее, приблизительно 75 нг/мл или менее, приблизительно 60 нг/мл или менее, приблизительно 50 нг/мл или менее, приблизительно 40 нг/мл или менее, или приблизительно 30 нг/мл или менее.
[0033] В одном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, ингибируют связывание PD-L1 с IC50, равной от приблизительно 1 нг/мл до приблизительно 1000 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, ингибируют связывание PD-L1 с IC50, равной от приблизительно 2 нг/мл до приблизительно 800 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, ингибируют связывание PD-L1 с IC50, равной от приблизительно 5 нг/мл до приблизительно 500 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, ингибируют связывание PD-L1 с IC50, равной от приблизительно 5 нг/мл до приблизительно 100 нг/мл. В дополнительном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, ингибируют связывание PD-L1 с IC50, равной от приблизительно 10 нг/мл до приблизительно 50 нг/мл. В одном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, ингибируют связывание с PD-L1 с IC50, равной приблизительно 800 нг/мл или менее, приблизительно 400 нг/мл или менее, приблизительно 300 нг/мл или менее, приблизительно 250 нг/мл или менее, приблизительно 200 нг/мл или менее, приблизительно 150 нг/мл или менее, приблизительно 100 нг/мл или менее, приблизительно 75 нг/мл или менее, приблизительно 60 нг/мл или менее, приблизительно 50 нг/мл или менее, приблизительно 40 нг/мл или менее, или приблизительно 30 нг/мл или менее.
[0034] В одном варианте реализации антитело против PD-1, представленное в настоящем документе, представляет собой гуманизированное антитело, содержащее аминокислотную последовательность вариабельной области легкой цепи согласно SEQ ID NO: 133 и аминокислотную последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 131; или содержащее аминокислотную последовательность вариабельной области легкой цепи согласно SEQ ID NO: 143 и аминокислотную последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 141; или содержащее аминокислотную последовательность вариабельной области легкой цепи согласно SEQ ID NO: 152 и аминокислотную последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 131; причем указанное антитело против PD-1 обладает ЕС50 связывания по отношению к PD-1, равной приблизительно 200 нг/мл или менее или приблизительно 150 нг/мл или менее или приблизительно 100 нг/мл или менее или приблизительно 80 нг/мл или менее или приблизительно 60 нг/мл или менее, согласно измерению с помощью твердофазного ИФА или FACS. В еще одном варианте реализации антитело против PD-1, представленное в настоящем документе, представляет собой гуманизированное антитело, содержащее аминокислотную последовательность вариабельной области легкой цепи согласно SEQ ID NO: 133 и аминокислотную последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 131; или содержащее аминокислотную последовательность вариабельной области легкой цепи согласно SEQ ID NO: 143 и аминокислотную последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 141; или содержащее аминокислотную последовательность вариабельной области легкой цепи согласно SEQ ID NO: 152 и аминокислотную последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 131; причем указанное антитело против PD-1 обладает IC50 по отношению к блокаде PD-L1, равной приблизительно 1000 нг/мл или менее, или приблизительно 800 нг/мл или менее, или приблизительно 600 нг/мл или менее, или приблизительно 500 нг/мл или менее, или приблизительно 400 нг/мл или менее, или приблизительно 300 нг/мл или менее, или приблизительно 200 нг/мл или менее, или приблизительно 100 нг/мл или менее, или приблизительно 60 нг/мл или менее, или приблизительно 30 нг/мл или менее, или приблизительно 25 нг/мл или менее, или приблизительно 20 нг/мл или менее, или приблизительно 10 нг/мл или менее, согласно измерению с помощью твердофазного ИФА или FACS. В еще одном варианте реализации антитело против PD-1, представленное в настоящем документе, представляет собой гуманизированное антитело, содержащее аминокислотную последовательность вариабельной области легкой цепи согласно SEQ ID NO: 133 и аминокислотную последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 131; или содержащее аминокислотную последовательность вариабельной области легкой цепи согласно SEQ ID NO: 143 и аминокислотную последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 141; или содержащее аминокислотную последовательность вариабельной области легкой цепи согласно SEQ ID NO: 152 и аминокислотную последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 131; причем указанное антитело против PD-1 обладает сродством по отношению к PD-1, равным приблизительно 1 нМ или менее, или приблизительно 0,5 нМ или менее, или приблизительно 0,1 нМ или менее, или приблизительно 0,05 нМ или менее. В конкретном варианте реализации гуманизированное антитело против PD-1 обладает сродством по отношению к PD-1, приблизительно равным 0,1 нМ.
[0035] В одном варианте реализации антитела против PD-1 или их фрагменты, представленные в настоящем документе, связываются с PD-1 на Т-клетках, нарушая взаимодействие PD-1/PD-L1 и приводя к усилению активации Т-клеток. В дополнительном варианте реализации антитела и их фрагменты связывают PD-1 и приводят к усилению пролиферации Т-клеток и/или продукции цитокинов. В еще одном дополнительном варианте реализации антитела и их фрагменты связывают PD-1 и приводят к увеличению уровня одного или более из цитокинов, выбранных из группы, состоящей из ИЛ-2, ИФНγ, ФНО, ИЛ-1, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-12, ИЛ-13, ИЛ-17 и ГМКСФ. Таким образом, в одном аспекте настоящего изобретения предложены способы модуляции иммунного ответа, включающие контакт Т-клеток с антителом против PD-1 или его фрагментом. В одном варианте реализации модуляцию иммунного ответа посредством антител против PD-1 и их фрагментов, представленных в настоящем документе, можно измерить с помощью реакции смешанной культуры лимфоцитов (СКЛ). В одном варианте реализации антитела против PD-1, представленные в настоящем документе, повышают уровень продукции цитокинов лимфоцитами в реакции СКЛ. В дополнительном варианте реализации антитела против PD-1 повышают уровень продукции ИЛ-2 и/или ИФНγ в реакции СКЛ. В еще одном дополнительном варианте реализации антитела против PD-1 повышают уровень продукции ИЛ-2 и ИФНγ в реакции СКЛ. В одном варианте реализации антитела против PD-1 усиливают ответ Т-клеток памяти. В дополнительном варианте реализации антитела против PD-1 усиливают ответ Т-клеток памяти, измеряемый по усилению продукции ИФНγ Т-клетками памяти.
[0036] В одном варианте реализации антитела против PD-1 и их фрагменты, представленные в настоящем документе, ингибируют функцию регуляторных Т-клеток. В дополнительном варианте реализации антитела против PD-1 и их фрагменты ингибируют суппрессию эффекторных Т-клеток регуляторными Т-клетками. В еще одном варианте реализации антитела против PD-1 и их фрагменты восстанавливают эффекторные функции Т-клеток в присутствии регуляторных Т-клеток. В дополнительном варианте реализации антитела против PD-1 и их фрагменты восстанавливают способность эффекторных Т-клеток к пролиферации и/или продукции цитокинов в присутствии регуляторных Т-клеток. Таким образом, в одном варианте реализации настоящего изобретения предложен способ ингибирования суппрессорной функции регуляторных Т-клеток in vitro или в организме субъекта, нуждающегося в этом.
[0037] В одном из аспектов предложены выделенное антитело или его фрагмент, связывающиеся с PD-1, причем указанное антитело продуцирует гибридома, выбранная из группы, состоящей из гибридом, называемых в настоящем документе 10D1, 4C10, 7D3, 13F1, 15H5, 14A6, 22A5, 6E1, 5A8, 7A4 и 7A4D. Таким образом, настоящее изобретение также охватывает гибридомы 10D1, 4C10, 7D3, 13F1, 15H5, 14A6, 22A5, 6E1, 5A8, 7A4 и 7A4D, а также любую гибридому, продуцирующую антитело, описанное в настоящем документе. В настоящем изобретении также предложены выделенные полинуклеотиды, кодирующие антитела или их фрагменты, представленные в настоящем документе. Настоящее изобретение также охватывает экспрессирующие векторы, содержащие выделенные полинуклеотиды, и клетки-хозяева, содержащие такие экспрессирующие векторы.
[0038] В одном варианте реализации настоящего изобретения предложены иммуноконъюгаты антитела против PD-1. Таким образом, в настоящем изобретении предложены антитело против PD-1 или его фрагмент, связывающиеся с PD-1 и присоединенные к или конъюгированные с терапевтическим агентом. Терапевтические агенты, которые можно присоединить к или конъюгировать с антителом против PD-1, могут включать цитостатические препараты, радиоактивные изотопы, иммуномодуляторы или антитела, но не ограничиваются ими.
[0039] В одном аспекте настоящего изобретения предложены композиции, содержащие одно или более из антител против PD-1 или его фрагмент, представленные в настоящем документе, и фармацевтически приемлемый носитель.
[0040] В одном аспекте настоящего изобретения также предложены способы модуляции иммунного ответа у субъекта, причем указанный способ включает введение субъекту терапевтически эффективного количества антитела против PD-1 или его фрагмента, представленных в настоящем документе. В одном варианте реализации настоящего изобретения также предложены способы лечения или профилактики заболевания или расстройства у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества антитела против PD-1 или его фрагмента, представленных в настоящем документе.
[0041] В одном варианте реализации настоящего изобретения также предложен способ усиления противоопухолевого ответа у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества антитела против PD-1 или фрагмента согласно настоящему изобретению. В еще одном варианте реализации настоящего изобретения также предложен способ уменьшения опухоли или ингибирования роста опухолевых клеток у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества антитела против PD-1 или его фрагмента согласно настоящему изобретению. В еще одном варианте реализации настоящего изобретения также предложен способ лечения рака у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества антитела против PD-1 или фрагмента согласно настоящему изобретению. В дополнительном варианте реализации рак выбирают из группы, состоящей из лимфомы, лейкоза, меланомы, глиомы, рака молочной железы, рака легких, рака толстой кишки, рака костей, рака яичников, рака мочевого пузыря, рак почек, рака печени, рака желудка, рака прямой кишки, рака яичка, рака слюнных желез, рака щитовидной железы, рака тимуса, эпителиального рака, рака головы или шеи, рака желудка, рака поджелудочной железы или их комбинации.
[0042] В одном варианте реализации настоящего изобретения также предложен способ лечения инфекционного заболевания у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества антитела против PD-1 или фрагмента согласно настоящему изобретению. В дополнительном варианте реализации инфекционное заболевание выбирают из группы, состоящей из кандидоза, кандидемии, аспергиллеза, стрептококковой пневмонии, стрептококковых заболеваний кожи и ротоглотки, сепсиса, вызванного грамотрицательными бактериями, туберкулеза, мононуклеоза, гриппа, респираторных заболеваний, вызванных респираторно-синцитиальным вирусом, малярии, шистосомоза и трипаносомоза.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0043] Фигуры 1A и 1B представляют собой графики, на которых показана блокада связывания лигандов PD-L1 и PD L2 с PD-1 антителами мыши против PD-1, измеренная с помощью FACS. На фигуре 1A показана блокада связывания PD-L1 антителами мыши против PD-1, а на фигуре 1B показана блокада связывания PD-L2 антителами мыши против PD-1. На верхнем графике фигуры 1A и фигуры 1B показана MFI в диапазоне концентраций антитела.IC50 блокады для антител против PD-1 показаны в нижней панели фигуры 1A и фигуры 1B.
[0044] Фигура 2 представляет собой график, на котором показана продукция ИЛ-2 (пг/мл) в реакции СКЛ в ответ на различные концентрации антител мыши против PD-1. Протестированные антитела против PD-1 представляли собой (слева направо): контрольное mIgG1, 22A5-mIgG1, 6E1-mIgG1, 10D1-mIgG1, 4C10-mIgG1, 7D3-mIgG1, 13F1-mIgG1, 14A6-mIgG1, 15H5-mIgG1, 5A8-mIgG1 и 7A4-mIgG1. Как показано на оси X, каждое антитело тестировали в концентрации 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0045] Фигура 3 представляет собой график, на котором показана продукция ИФН-γ (пг/мл) в реакции СКЛ в ответ на различные концентрации антител мыши против PD-1. Протестированные антитела против PD-1 представляли собой (слева направо): контрольное mIgG1, 22A5-mIgG1, 6E1-mIgG1, 10D1-mIgG1, 4C10-mIgG1, 7D3-mIgG1, 13F1-mIgG1, 14A6-mIgG1, 15H5-mIgG1, 5A8-mIgG1 и 7A4-mIgG1. Как показано на оси X, каждое антитело тестировали в концентрации 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0046] Фигура 4 представляет собой график, на котором показана продукция ИЛ-2 (пг/мл) в реакции СКЛ в ответ на различные концентрации химерных антител против PD-1. Протестированные химерные антитела против PD-1 представляли собой (слева направо): контрольное hIgG4, химерное 4C10-hIgG4, химерное 6E1-hIgG4, химерное 7A4-hIgG4, химерное 13F1-hIgG4, химерное 15H5-hIgG4, химерное 22A5-hIgG4 и химерное 7D3-hIgG4. Как показано на оси X, каждое антитело тестировали в концентрации 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0047] Фигура 5 представляет собой график, на котором показана продукция ИФН-γ (пг/мл) в реакции СКЛ в ответ на различные концентрации химерных антител против PD-1. Протестированные химерные антитела против PD-1 представляли собой (слева направо): контрольное hIgG4, химерное 4C10-hIgG4, химерное 6E1-hIgG4, химерное 7A4-hIgG4, химерное 13F1-hIgG4, химерное 15H5-hIgG4, химерное 22A5-hIgG4 и химерное 7D3-hIgG4. Как показано на оси X, каждое антитело тестировали в концентрации 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0048] На фигуре 6 показаны EC50 связывания гуманизированных антител 13F1 (фигура 6A) и 7A4 против PD-1 (фигура 6B), измеренные с помощью твердофазного ИФА. На верхнем графике фигуры 6A показана оптическая плотность в диапазоне концентраций химерного антитела 13F1, гуманизированного антитела 13F1-hIgG1 (h13F1-IgG1), гуманизированного антитела 13F1-hIgG4 (h13F1-IgG4) или контрольного антитела hIgG4. На нижнем графике фигуры 6A показаны рассчитанные EC50 каждого из протестированных антител. На верхнем графике фигуры 6 В показана оптическая плотность в диапазоне концентраций химерного антитела 7A4- hIgG1, химерного антитела 7A4-hIgG4, гуманизированного антитела 784 -hIgG1 (h7A4hIgG1), гуманизированного антитела 7A4-hIgG4 (h7A4hIgG4) или контрольного антитела hIgG4. На нижнем графике фигуры 6 В показаны рассчитанные EC50 каждого из протестированных антител.
[0049] На фигуре 7 показаны EC50 связывания гуманизированных антител 13F1 (фигура 7A) и 7A4 против PD-1 (фигура 7B), измеренные с помощью FACS. На верхнем графике фигуры 7A показана средняя интенсивность флуоресценции (MFI) в диапазоне концентраций контрольного антитела hIgG4, химерного антитела 13F1-hIgG4, гуманизированного антитела 13F1-hIgG1 (h13F1-hIgG1) или гуманизированного антитела 13F1-hIgG4 (h13F1-hIgG4). На нижнем графике фигуры 7A показаны рассчитанные EC50 каждого из протестированных антител. На верхнем графике фигуры 7 В показана MFI в диапазоне концентраций контрольного антитела hIgG4, химерного антитела 7A4- hIgG4, химерного антитела 7A4- hIgG1, гуманизированного антитела 7A4-IgG4 (h7A4-hIgG4) или гуманизированного антитела 7A4- IgG1 (h7A4-hIgG1). На нижнем графике фигуры 7 В показаны рассчитанные EC50 каждого из протестированных антител.
[0050] На фигуре 8 показана блокада связывания PD-L1 гуманизированными антителами против PD-1 13F1 (фигура 8A) и 7A4 (фигура 8B), измеренная с помощью твердофазного ИФА. На фигуре 8A показана оптическая плотность в диапазоне концентраций контрольного антитела hIgG4, химерного антитела 13F1, гуманизированного антитела 13F1-hIgG1 или гуманизированного антитела 13F1-hIgG4. На фигуре 8 В показана оптическая плотность в диапазоне концентраций контрольного антитела hIgG4, химерного антитела 7A4 -hIgG1, химерного антитела 7A4- hIgG4, гуманизированного антитела 784 -hIgG1 или гуманизированного антитела 7A4-hIgG4. На фигуре 8С показаны рассчитанные IC50 блокады PD-L1 химерным и гуманизированным антителами 13F1 и 7A4.
[0051] На фигуре 9 показана блокада связывания PD-L1 гуманизированными антителами 13F1 и 7A4, измеренная с помощью FACS. На верхнем графике фигуры 9 показана MFI в диапазоне концентраций антител.IC50 блокады для гуманизированных антител показаны в нижней панели фигуры 9.
[0052] На фигуре 10 показаны данные связывания гуманизированных моноклональных антител h13F1(верхний левый график) и h7A4 (верхний правый график) с PD-1 при измерении с помощью анализа на основе Biacore. На нижней панели представлены количественные данные о связывании, измеренные с помощью анализа на основе Biacore.
[0053] Фигура 11 представляет собой график, на котором показана продукция ИЛ-2 (пг/мл) в реакции СКЛ в присутствии контрольного антитела hIgG4, антитела мыши 13F1-mIgG1 (13F1-mIgG1), гуманизированного антитела 13F1-hIgG1, гуманизированного антитела 13F1-hIgG4 или химерного антитела 7A4-hIgG4 в следующих концентрациях: 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0054] Фигура 12 представляет собой график, на котором показана продукция ИФН-γ (пг/мл) в реакции СКЛ в присутствии контрольного антитела hIgG4, антитела мыши 13F1-mIgG1 (13F1-mIgG1), гуманизированного антитела 13F1-hIgG1, гуманизированного антитела 13F1-hIgG4 или химерного антитела 7A4-hIgG4 в следующих концентрациях: 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0055] Фигура 13 представляет собой график, на котором показана продукция ИЛ-2 (пг/мл) в реакции СКЛ в присутствии контрольного антитела hIgG4, химерного антитела 7A4-hIgG1, химерного антитела 7A4-hIgG4, гуманизированного антитела 7A4-hIgG1 или гуманизированного антитела 7A4-hIgG4 в следующих концентрациях: 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0056] Фигура 14 представляет собой график, на котором показана продукция ИФН-γ (пг/мл) в реакции СКЛ в присутствии контрольного антитела hIgG4, химерного антитела 7A4-hIgG1, химерного антитела 7A4-hIgG4, гуманизированного антитела 7A4-hIgG1 или гуманизированного антитела 7A4-hIgG4 в следующих концентрациях: 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0057] На фигуре 15 показано действие гуманизированных антител против PD-1 на ответ Т-клеток памяти, вызванный столбнячным токсином, измеренное по продукции ИФН-γ (пг/мл). Отрицательное контрольное антитело hIgG4, гуманизированное антитело 13F1-hIgG1, гуманизированное антитело 13F1-hIgG4, гуманизированное антитело 7A4-hIgG1 и гуманизированное антитело 7A4-hIgG4 протестировали в следующих концентрациях: 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0058] На фигуре 16 показана продукция ИФН-γ (пг/мл) T-клетками в ответ на совместную стимуляцию аутологичными DC и антителом против CD3 в присутствии 10 мкг/мл гуманизированных антител против PD-1 (h13F1-hIgG1, h13F1-hIgG4, h7A4-hIgG1 или h7A4-hIgG4), изотипического контрольного (hIgG4) антитела или в отсутствие антитела.
[0059] На фигурах 17A и 17B показаны данные связывания на основе Biacore (фигура 17A) и блокады на основе FACS (фигура 17B) гуманизированных моноклональных антител h7A4 и h7A4D по отношению к PD-1. На фигуре 17A сверху слева показаны данные для h7A4, сверху справа - для 7A4D, на на нижнем графике фигуры 17A приведены количественные данные связывания, измеренные с помощью анализа на основе Biacore. На фигуре 17B показана IC50 блокады связывания PD-L1 с клетками 293T-PD1 за счет антитела 7A4D-hIgG4.
[0060] Фигура 18 представляет собой график, на котором показана продукция ИЛ-2 (пг/мл) в реакции СКЛ в присутствии контрольного антитела hIgG4, гуманизированного антитела 7A4-hIgG4 или гуманизированного антитела 7A4D-hIgG4 в следующих концентрациях: 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
[0061] Фигура 19 представляет собой график, на котором показана продукция ИФН-γ (пг/мл) в реакции СКЛ в присутствии контрольного антитела hIgG4, гуманизированного антитела 7A4-hIgG4 или гуманизированного антитела 7A4D-hIgG4 в следующих концентрациях: 20 мкг/мл, 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл и 0,002 мкг/мл.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0062] Рецептор запрограммированной гибели клеток 1 (PD-1) представляет собой контрольный рецептор иммунной системы. Он экспрессируется главным образом на активированных T- и B-клетках, однако встречается и на моноцитах и двойных отрицательных CD4-CD8-Т-клетках и NK-Т-клетках при развитии тимуса (Agata et al., supra; Okazaki et al.(2002) Curr.Opin.Immunol.14:391779-82; Bennett et al.(2003) J Immunol 170:711-8). У PD-1 есть два лиганда - PD-L1 и PD-L2. Показано, что взаимодействие PD-1 с любым из этих двух лигандов ослабляет T-клеточный ответ in vitro и in vivo, что, однако, можно купировать путем ингибирования локального взаимодействия PD-1 с PD-L1, и данный эффект является аддитивным при дополнительной блокаде взаимодействии PD-1 и PD-L2 (Iwai et al.(2002) Proc.Nat'l.Acad Sci.USA 99:12293-7; Brown et al.(2003) J.Immunol.170:1257-66).
[0063] Установлено, что PD-1 коррелирует с ростом и развитием рака из-за его роли в защите опухолевых клеток от эффективного разрушения иммунной системой. Выявлено, что его лиганд, PD-L1, в значительной степени экспрессируется в ряде опухолей мыши и человека; считается, что это опосредует ускользанию от иммунологического надзора (Iwai, Y. et al.,Proc.Natl.Acad.Sci.USA.99:12293-12297 (2002); Strome S.E. et al.,Cancer Res.,63:6501-6505 (2003); Dong et al.(2002) Nat.Med.8:787-9). В организме человека экспрессия PD-1 (на лимфоцитах, проникающих в опухоли) и/или PD-L1 (на опухолевых клетках) обнаруживается в ряде биоптатов первичных опухолей при иммуногистохимическом анализе. Такие ткани включают раковые опухоли легких, печени, яичников, шейки матки, кожи, толстой кишки, глиому, рак мочевого пузыря, молочной железы, почек, пищевода, желудка, плоскоклеточный рак ротовой полости, уротелиальную карциному и рак поджелудочной железы, а также опухоли головы и шеи (Brown J.A.et al.,J.Immunol.170:1257-1266 (2003); Dong H. et al.,Nat.Med.8:793-800 (2002); Wintterle et al.,Cancer Res.63:7462-7467 (2003); Strome S.E. et al.,Cancer Res.,63:6501 -6505 (2003); Thompson R.H. et al., Cancer Res.66:3381-5(2006); Thompson et al.,Clin.Cancer Res.13:1757-61(2007); Nomi T. et al.,Clin.Cancer Res.13:2151-7.(2007)). Что еще более примечательно, экспрессия лиганда PD-1 на опухолевых клетках коррелирует с плохим прогнозом у онкологических пациентов с опухолями различного типа (см. обзор OkaZaki and Honjo, Int.Immunol.19:813-824 (2007)).
[0064] Хотя взаимодействие между PD-1 и PD-L1 приводит к сокращению количества лимфоцитов, проникающих в опухоль, снижению пролиферации, опосредованной Т-клеточным рецептором, и ускользанию раковых клеток от иммунологического надзора (Dong et al.(2003) J.Mol.Med.81:281-7; Blank et al.(2005) Cancer Immunol.Immunother.54:3 07-3 14; Konishi et al.(2004) Clin.Cancer Res.10:5094-100), показано, что блокада взаимодействия PD-1/PD-L1 усиливает опухолеспецифический Т-клеточный иммунитет и полезна при уничтожении опухолевых клеток иммунной системой. На модели агрессивного рака поджелудочной железы у мыши, например, Nomi T., et al.(Clin.Cancer Res.13:2151-2157, 2007) продемонстрировали терапевтическую эффективность блокады PD-1/PD-L1. Введение антитела против PD-1 или PD-L1 значимо ингибировало рост опухоли. Блокада с помощью антитела эффективно стимулировала инфильтрацию реакционноспособных CD8+ T-клеток в опухоль, что приводило к активации противоопухолевых эффекторов, в том числе ИФН-γ, гранзима B и перфорина. Кроме того, авторы показали, что блокаду PD-1 можно эффективно комбинировать с химиотерапией, получая синергетический эффект.В еще одном исследовании с использованием модели плоскоклеточной карциномы у мышей блокада PD-1 или PD-L1 с помощью антитела значительно ингибировала рост опухоли (Tsushima F. et al., Oral Oncol.42:268-274 (2006)).
[0065] Более того, трансфекция линии мастоцитомы мыши PD-L1 привела к ослаблению лизиса опухолевых клеток при совместном культивировании с опухолеспецифическим клоном CTL. Лизис восстанавливался при добавлении мАт против PD-L1 (Iwai Y. et al., Proc. Natl. Acad. Sci. USA. 99:12293-12297 (2002)). Показано, что блокада взаимодействия PDl/PD-L1 in vivo повышала эффективность адоптивной клеточной терапии посредством переноса T-клеток в модели опухоли у мыши (Strome S.E. et al., Cancer Res. E. et al.,Cancer Res.63:6501-6505 (2003)). Еще одно доказательство роли PD-1 в лечении рака получено в экспериментах, выполненных с использованием мышей с нокаутом PD-1. Миеломные клетки, экспрессирующие PD-L1, росли только в организме животных дикого типа (что приводило к росту опухоли и смерти животного), но не в организме мышей с дефектом PD-1 (Iwai Y., et al., Proc. Natl. Acad. Sci. USA. 99:12293-12297(2002)). В исследованиях с участием людей R.M. Wong et al. (Int. Immunol. 19:1223-1234 (2007)) показали, что блокада PD-1 с помощью полностью человеческого антитела против PD-1 повышала абсолютное количество опухолеспецифических CD8+ T-клеток (CTL) при анализах стимуляции ex vivo с использованием вакцинных антигенов и клеток вакцинированных лиц. В аналогичном исследовании блокада PD-L1 с помощью антитела привела к усиленной цитолитической активности опухолеассоциированных антиген-специфических цитотоксических Т-клеток и повышенной продукции цитокинов клетками опухолеспецифическими TH-клетками (Blank C. et al., Int. J. Cancer 119:317-327 (2006)). Те же авторы показали, что блокада PD-L1 усиливает ответ опухолеспецифических Т-клеток in vitro при использовании в комбинации с блокадой с помощью антитела против CTLA-4. В целом, путь PD-1/PD-L1 является мишенью для разработки терапевтических средств для лечения рака на основе антител. Антитела против PD-1 также можно применять при хронической вирусной инфекции.CD8+ Т-клетки памяти, возникающие после острой вирусной инфекции, являются высокофункциональными и составляют важный компонент защитного иммунитета. В противоположность этому, хронические инфекции часто характеризуются различной степенью функциональных нарушений (истощения) вирус-специфического Т-клеточного ответа, и этот дефект является основной причиной неспособности хозяина устранить патоген, присутствующий в организме. Хотя функциональные эффекторные Т-клетки первоначально возникают на ранних стадиях инфекции, они постепенно теряют функцию в ходе хронической инфекции. Barber et al. (Barber et al., Nature 439:682-687 (2006)) показали, что у мышей, инфицированных лабораторным штаммом LCMV, развивалась хроническая инфекция, приводящая к высокому уровню вируса в крови и других тканях. У этих мышей изначально развивался эффективный Т-клеточный ответ, однако в конечном итоге они поддались инфекции после истощения Т-клеток. Авторы обнаружили, что снижение количества и функции эффекторных T-клеток у хронически инфицированных мышей можно купировать путем инъекции антитела, блокировавшего взаимодействие между PD-1 и PD-L1.
[0066] В одном аспекте настоящего изобретения предложены антитела или их антиген-связывающие фрагменты, связывающиеся с рецептором запрограммированной гибели клеток-1 (PD-1). PD-1. В одном варианте реализации антитела или их фрагменты связываются с PD-1 человека. В еще одном варианте реализации антитела или их фрагменты связываются с PD-1 человека и яванского макака. В еще одном варианте реализации антитела или их фрагменты блокируют взаимодействие PD-1 на Т-клетках с его лигандом PD-L1. В одном аспекте настоящего изобретения предложены способы изготовления и применения антител против PD-1 или их фрагментов и композиций, содержащих антитела против PD-1 или их фрагменты, в том числе фармацевтических композиций.
[0067] В настоящем документе термин «антитело» относится к связывающему белку, содержащему по меньшей мере один антиген-связывающий домен. Антитела и их фрагменты согласно настоящему изобретению могут представлять собой целые антитела или любые фрагменты антител. Таким образом, антитела и фрагменты согласно изобретению включают моноклональные антитела или их фрагменты и варианты антител или их фрагментов, а также иммуноконъюгаты. Примеры фрагментов антител включают Fab-фрагменты, Fab'-фрагменты, F(аb)'-фрагменты, Fv-фрагменты; выделенные CDR-области, одноцепочечные Fv-молекулы (scFv); и другие фрагменты антител, известные в данной области техники. Антитела и их фрагменты также могут включать рекомбинантные полипептиды, гибридные белки и биспецифические антитела. Антитела против PD-1 и их фрагменты, описанные в настоящем документе, могут относиться к изотипу IgG1, IgG2, IgG3 или IgG4. Термин «изотип» относится к классу антитела, кодируемого генами константной области тяжелой цепи. В одном варианте реализации антитела против PD-1 и их фрагменты, описанные в настоящем документе, относятся к изотипу IgG1 или IgG4. Антитела против PD-1 и их фрагменты согласно настоящему изобретению можно получить из любого вида животных, включая мышь, крысу, кролика, примата, ламу и человека, но не ограничиваясь ими. Антитела против PD-1 и их фрагменты могут являться химерными, гуманизированными или полностью человеческими антителами. В одном варианте реализации антитела против PD-1 являются антителами мыши. В еще одном варианте реализации антитела против PD1 являются химерными антителами. В дополнительном варианте реализации химерные антитела являются химерными антителами мыши-человека. В еще одном варианте реализации антитела получают из организма мыши и гуманизируют.
[0068] «Химерное антитело» представляет собой антитело, содержащее по меньшей мере часть вариабельной области тяжелой цепи и по меньшей мере часть вариабельной области легкой цепи, происходящие от одного вида животных; и по меньшей мере часть константной области, происходящей от другого вида. Например, в одном варианте реализации химерное антитело может содержать вариабельные области мыши и константные области человека.
[0069] «Гуманизированное антитело» представляет собой антитело, содержащие области, определяющие комплементарность (CDR), происходящие от антитела, не являющегося антителом человека; и каркасные области, а также константные области, происходящие от антитела человека. Например, антитело против PD-1, представленное в настоящем документе, может содержать CDR, происходящие от одного или нескольких антител мыши, и каркасные и константные области человека. Так, в одном варианте реализации гуманизированное антитело, представленное в настоящем документе, связывается с тем же эпитопом PD-1, что и антитело мыши, из которого получены CDR указанного антитела. Типичные гуманизированные антитела представлены в настоящем документе. Дополнительные антитела против PD-1, содержащие CDR тяжелой и легкой цепи, представленные в настоящем документе, или их варианты можно получить с использованием любой каркасной последовательности человека; такие антитела также входят в настоящее изобретение. В одном варианте реализации каркасные последовательности, подходящие для применения в настоящем изобретении, включают каркасные последовательности, структурно аналогичные каркасным последовательностям, представленным в настоящем документе. Можно выполнить дополнительные модификации каркасных областей с целью улучшения свойств антител, представленных в настоящем документе. Такие дополнительные модификации каркасной области могут включать химические модификации; точечные мутации с целью снижения иммуногенности или удаления Т-клеточных эпитопов; или обратные мутации остатков до исходной последовательности эмбрионального типа.
[0070] В некоторых вариантах реализации такие модификации каркасной области включают модификации, соответствующие мутациям, приведенным в настоящем документе в качестве примеров, включая обратные мутации до последовательности эмбрионального типа. Например в одном варианте реализации одна или более аминокислот в каркасных областях человека VH и/или VL гуманизированных антител, представленных в настоящем документе, подвергли обратной мутации до соответствующей аминокислоты в исходном антителе мыши. В качестве примера для VH и VL 7A4 и 13F1, несколько сайтов аминокислотной последовательности каркасной области вышеупомянутого матричного антитела человека, подвергли обратной мутации до соответствующих аминокислотных последовательностей антитела мыши 7A4 и 13F1. В одном варианте реализации аминокислоты в положениях 40 и/или 45 и/или 70 и/или 72 вариабельной области легкой цепи подвергли обратной мутации в соответствующие аминокислоты, находящиеся в этих положениях вариабельной области легкой цепи антител мыши 7A4 или 13F1. В еще одном варианте реализации аминокислоты в положениях 2 и/или 26 и/или 46 и/или 48 и/или 49 и/или 67 и/или 70 и/или 71 вариабельной области тяжелой цепи подвергли обратной мутации в соответствующие аминокислоты, находящиеся в этих положениях вариабельной области тяжелой цепи антител мыши 7A4 или 13F1. В одном варианте реализации гуманизированное антитело 7A4 содержит вариабельную область легкой цепи, в которой аминокислота в положении 40 мутирована из Tyr (Y) в Phe (F), а аминокислота в положении 72 мутирована из Gly (G) в Arg (Р); и вариабельную область тяжелой цепи, в которой аминокислота в положении 2 мутирована из Val (V) в Ile (I), аминокислота в положении 46 мутирована из Glu (Е) в Lys (К), а аминокислота в положении 70 мутирована из Phe (F) в Ile (I). В одном варианте реализации гуманизированное антитело 13F1 содержит вариабельную область легкой цепи, в которой аминокислота в положении 45 мутирована из Leu (L) в Pro (P), а аминокислота в положении 70 мутирована из Phe (F) в Tyr (Y); и вариабельную область тяжелой цепи, в которой аминокислота в положении 26 мутирована из Gly (G) в Tyr (Y), аминокислота в положении 48 мутирована из Ile (I) в Met (M), аминокислота в положении 49 мутирована из Gly (G) в Ala (A), а аминокислота в положении 67 мутирована из Val (V) в Ile (I), а аминокислота в положении 71 мутирована из Val (V) в Arg (R). В каркасных областях гуманизированных антител, представленных в настоящем документе, можно внести дополнительные или альтернативные обратные мутации с целью улучшения свойств антител.
[0071] Настоящее изобретение также охватывает гуманизированные антитела, связывающиеся с PD-1 и содержащие модификации каркасной области, соответствующие типичным модификациям, описанным в настоящем документе по отношению к любой подходящей каркасной последовательности, а также другие модификации каркасной области, которые в прочих случаях улучшают свойства антител. Например, в некоторых вариантах реализации антитела, представленные в настоящем документе, содержат одну или более из мутаций, удаляющих один или более из сайтов деамидирования или один или более из сайтов окисления. Например, в одном варианте реализации антитела, представленные в настоящем документе, содержат мутацию одного или более из остатков аспарагина, удаляющую один или более из сайтов деамидирования, и/или мутацию одного или более из остатков метионина, удаляющую один или более из сайтов окисления.
[0072] В других вариантах реализации антитела, представленные в настоящем документе, содержат одну или более из мутаций, улучшающих стабильность, растворимость, влияющих на гликозилирование и/или снижающих иммуногенность, например, путем адресных аминокислотных замен, снижающих деамидирование или окисление, снижающих изомеризацию, оптимизирующих гидрофобные остатки ядра и/или зарядового кластера, удаляющих гидрофобные остатки с поверхности, оптимизирующих остатки, участвующие во взаимодействии между вариабельными областями тяжелой и легкой цепей и/или изменяющих значение изоэлектрической точки.
[0073] В настоящем документе термин "происходящий» по отношению к молекуле или полипептиду, имеющим отношение к эталонному антителу или другому связывающему белку, означает молекулу или полипептид, способные специфически связываться с тем же эпитопом, что и эталонное антитело или другой связывающий белок.
[0074] Антитела и их антиген-связывающие фрагменты, описанные в настоящем документе, специфичны по отношению к PD-1. В некоторых вариантах реализации антитела и их фрагменты специфичны по отношению к PD-1 человека. В одном варианте реализации антитела и фрагменты, представленные в настоящем документе, связываются с PD-1 человека или примата, но не с PD-1 любого другого млекопитающего. В одном варианте реализации антитела или их фрагменты не связываются с PD-1 мыши. Термины "PD-1 человека", "HPD-1", и "huPD-1" и т.п. используются в настоящем документе взаимозаменяемо и относятся к PD-1 человека и вариантам или изоформам PD-1 человека. Под термином "специфичен по отношению к" подразумевают, что антитела и их фрагменты связываются с рецептором PD-1 с большим сродством, чем с любой другой мишенью. В одном варианте реализации антитела против PD-1 и фрагменты, представленные в настоящем документе, специфичны по отношению к PD-1 и не обладают способностью к перекрестному взаимодействию с CTLA4, ICOS или CD28. В настоящем документе термин “EC50” относится к эффективной концентрации, обеспечивающей 50% от максимального ответа антитела. В настоящем документе термин “IC50” относится к ингибирующей концентрации, обеспечивающей 50% от максимального ответа антитела. Как EC50, так и IC50 можно измерить с помощью анализа на основе твердофазного ИФА или FACS или любым другим способом, известным в данной области техники.
[0075] В одном из вариантов реализации антитела против PD1 и их фрагменты или их варианты обладают сродством (KD) по отношению к PD-1 в диапазоне от приблизительно 0,001 нМ до приблизительно 100 нМ, от приблизительно 0,002 нМ до приблизительно 50 нМ, от приблизительно 0,005 нМ до приблизительно 5 нМ, от приблизительно 0,01 нМ до приблизительно 1 нМ, или от приблизительно 0,05 нМ до приблизительно 0,1 нМ. В одном варианте реализации антитела или их фрагменты обладают сродством (KD) по отношению к PD-1, составляющим приблизительно 50 нМ или менее, приблизительно 25 нМ или менее, приблизительно 20 нМ или менее, приблизительно 15 нМ или менее, приблизительно 10 нМ или менее, приблизительно 8 нМ или менее, приблизительно 6 нМ или менее, приблизительно 4 нМ или менее, приблизительно 2 нМ или менее, приблизительно 1 нМ или менее, приблизительно 0,9 нМ или менее, приблизительно 0,8 нМ или менее, приблизительно 0,7 нМ или менее, приблизительно 0,6 нМ или менее, приблизительно 0,5 нМ или менее, приблизительно 0,4 нМ или менее, приблизительно 0,3 нМ или менее, приблизительно 0,2 нМ или менее, приблизительно 0,1 нМ или менее, приблизительно 0,09 нМ или менее, приблизительно 0,08 нМ или менее, приблизительно 0,07 нМ или менее, приблизительно 0,06 нМ или менее, приблизительно 0,05 нМ или менее, приблизительно 0,04 нМ или менее, приблизительно 0,03 нМ или менее, приблизительно 0,02 нМ или менее, приблизительно 0,01 нМ или менее, приблизительно 0,009 нМ или менее, приблизительно 0,008 нМ или менее, приблизительно 0,007 нМ или менее, приблизительно 0,006 нМ или менее, приблизительно 0,005 нМ или менее, приблизительно 0,004 нМ или менее, приблизительно 0,003 нМ или менее, приблизительно 0,002 нМ или менее, или приблизительно 0,001 нМ или менее. В одном варианте реализации антитела или их фрагменты обладают сродством (KD) по отношению к PD-1, составляющим приблизительно 10 нМ, приблизительно 9 нМ, приблизительно 8 нМ, приблизительно 7 нМ, приблизительно 6 нМ, приблизительно 5 нМ, приблизительно 4 нМ, приблизительно 3 нМ, приблизительно 2 нМ, приблизительно 1 нМ, приблизительно 0,9 нМ, приблизительно 0,8 нМ, приблизительно 0,7 нМ, приблизительно 0,6 нМ, приблизительно 0,5 нМ, приблизительно 0,4 нМ, приблизительно 0,3 нМ, приблизительно 0,2 нМ, приблизительно 0,1 нМ, приблизительно 0,09 нМ, приблизительно 0,08 нМ, приблизительно 0,07 нМ, приблизительно 0,06 нМ, приблизительно 0,05 нМ, приблизительно 0,04 нМ, приблизительно 0,03 нМ, приблизительно 0,02 нМ, приблизительно 0,01 нМ, приблизительно 0,009 нМ, приблизительно 0,008 нМ, приблизительно 0,007 нМ, приблизительно 0,006 нМ, приблизительно 0,005 нМ, приблизительно 0,004 нМ, приблизительно 0,003 нМ, приблизительно 0,002 нМ или приблизительно 0,001.
[0076] В одном варианте реализации антитела и фрагменты, представленные в настоящем документе, содержат легкую цепь и тяжелую цепь, каждая из которых содержит три CDR-области. Типичные CDR-последовательности легкой цепи (LCDR1, LCDR2 и LCDR3) антител против PD-1 согласно настоящему изобретению представлены ниже в таблице 1. Типичные CDR-последовательности тяжелой цепи (HCDR1, HCDR2 и HCDR3) антител против PD-1 согласно настоящему изобретению представлены ниже в таблице 2. Типичные последовательности вариабельных областей и полных антител против PD-1 согласно настоящему изобретению представлены ниже в таблице 3.
Таблица 1.CDR-последовательности легкой цепи
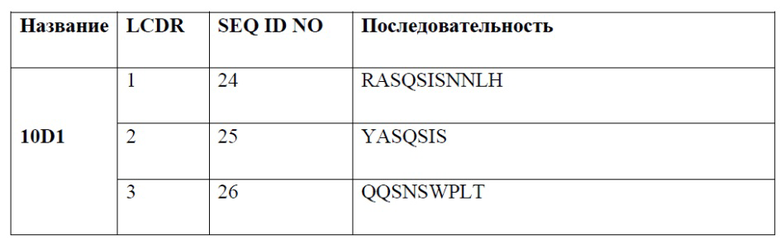
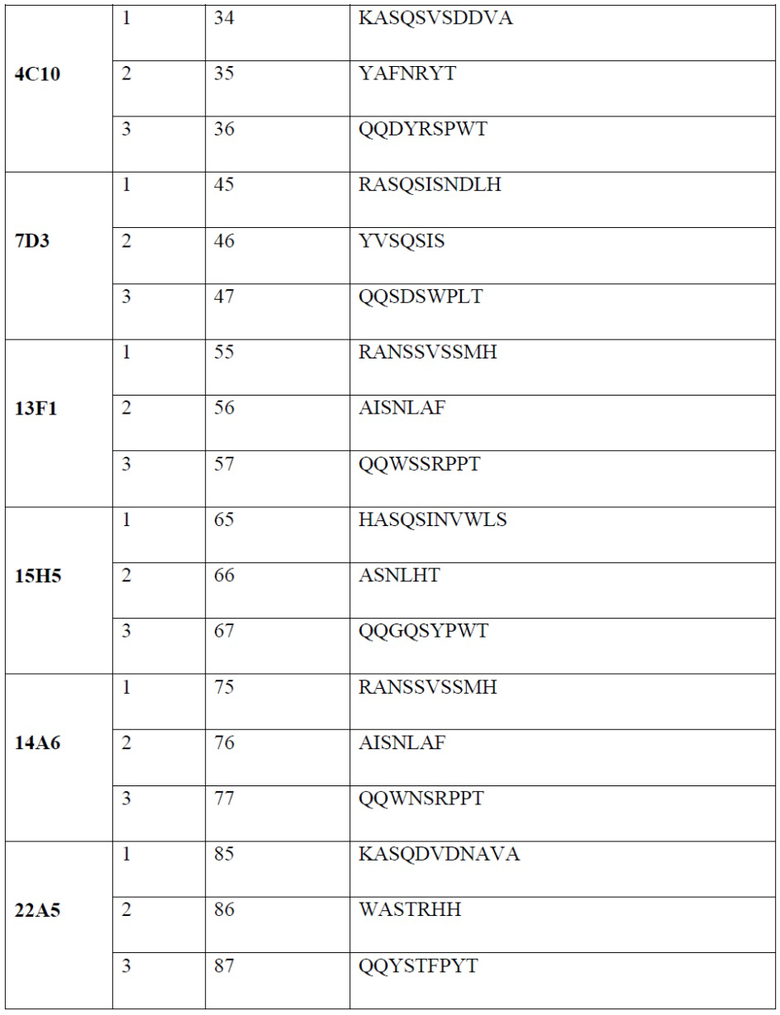
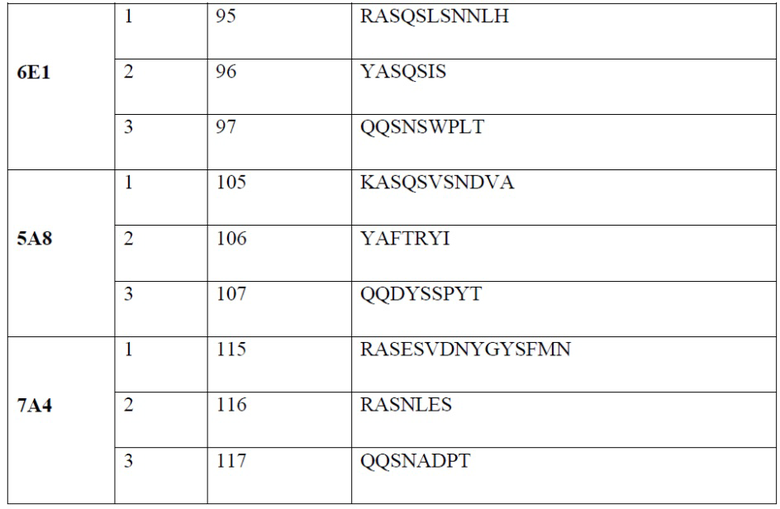
Таблица 2.CDR-последовательности тяжелой цепи
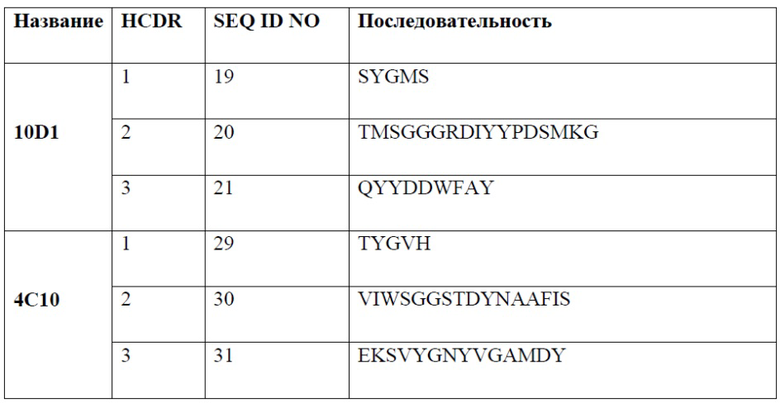
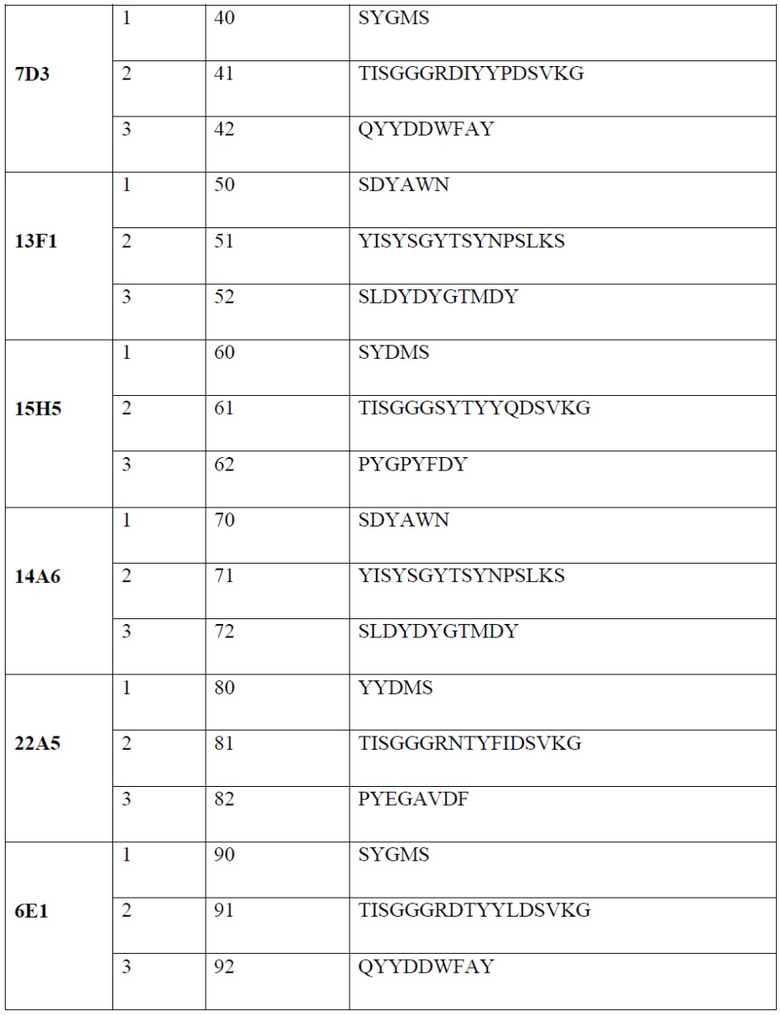
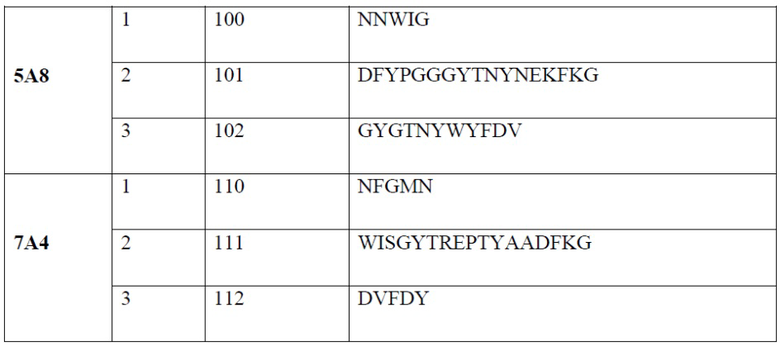
Таблица 3. Последовательности вариабельной области легкой цепи и тяжелой цепи и последовательности полных антител
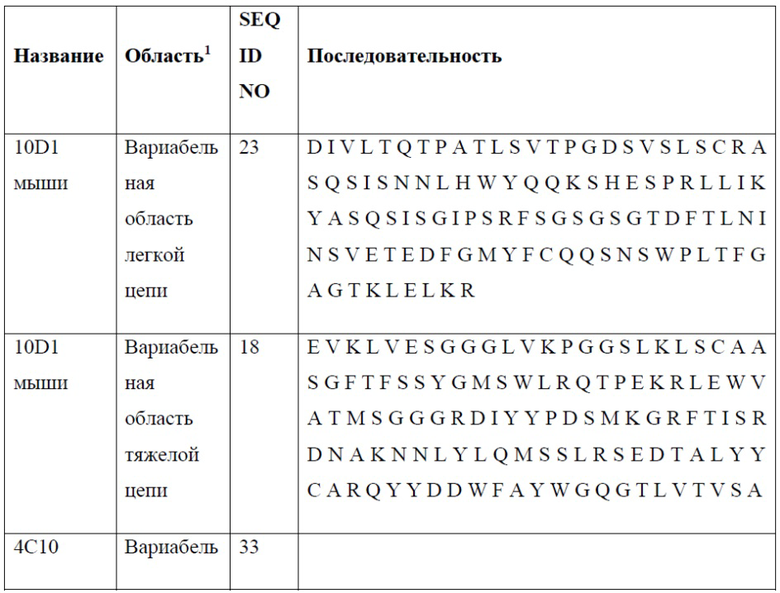

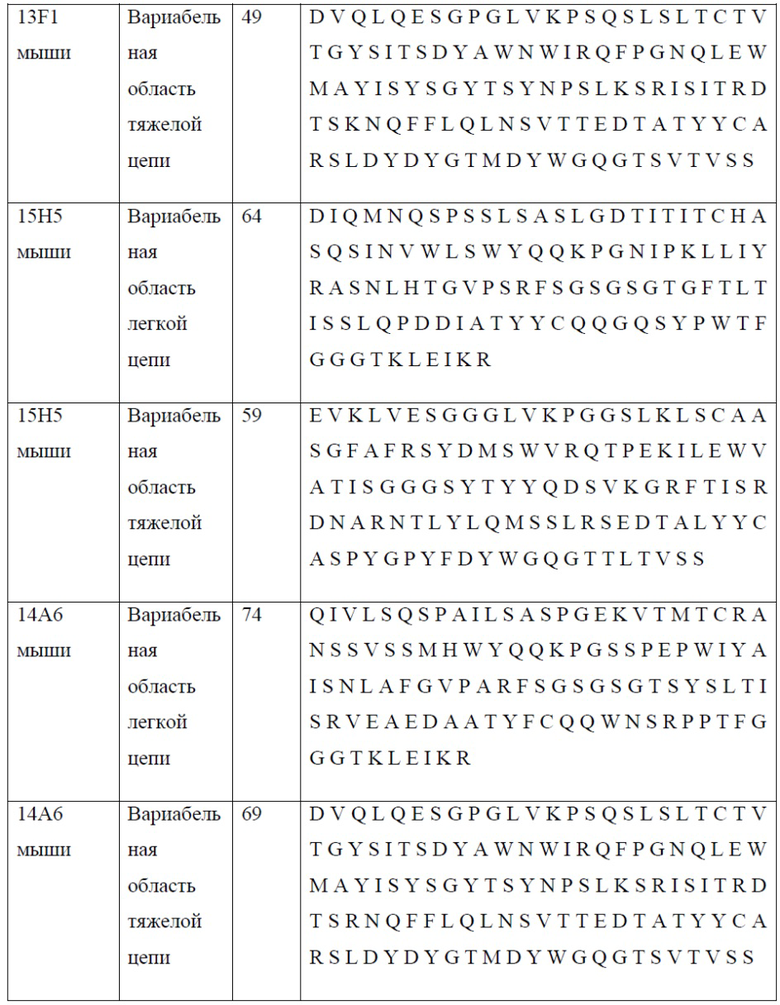
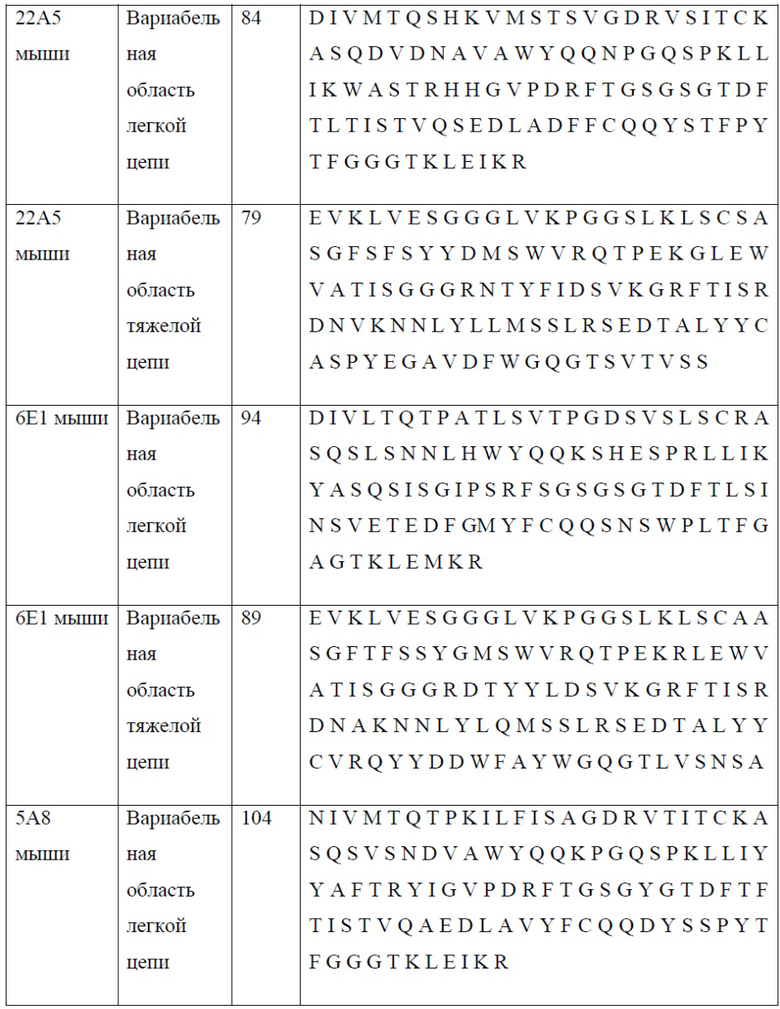

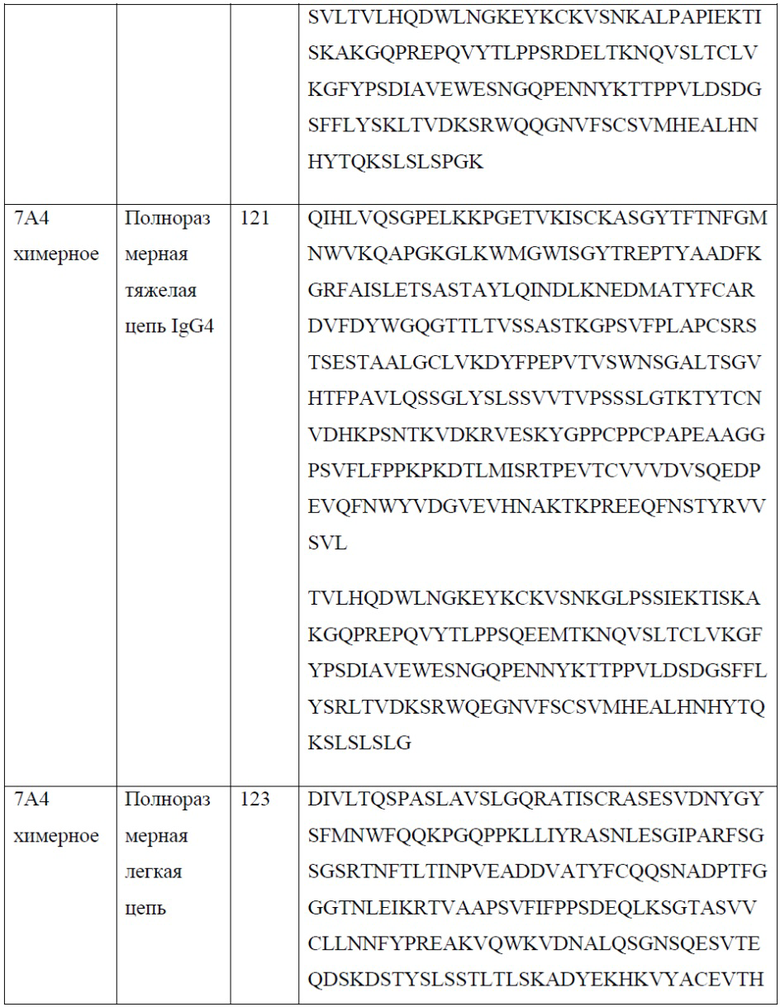
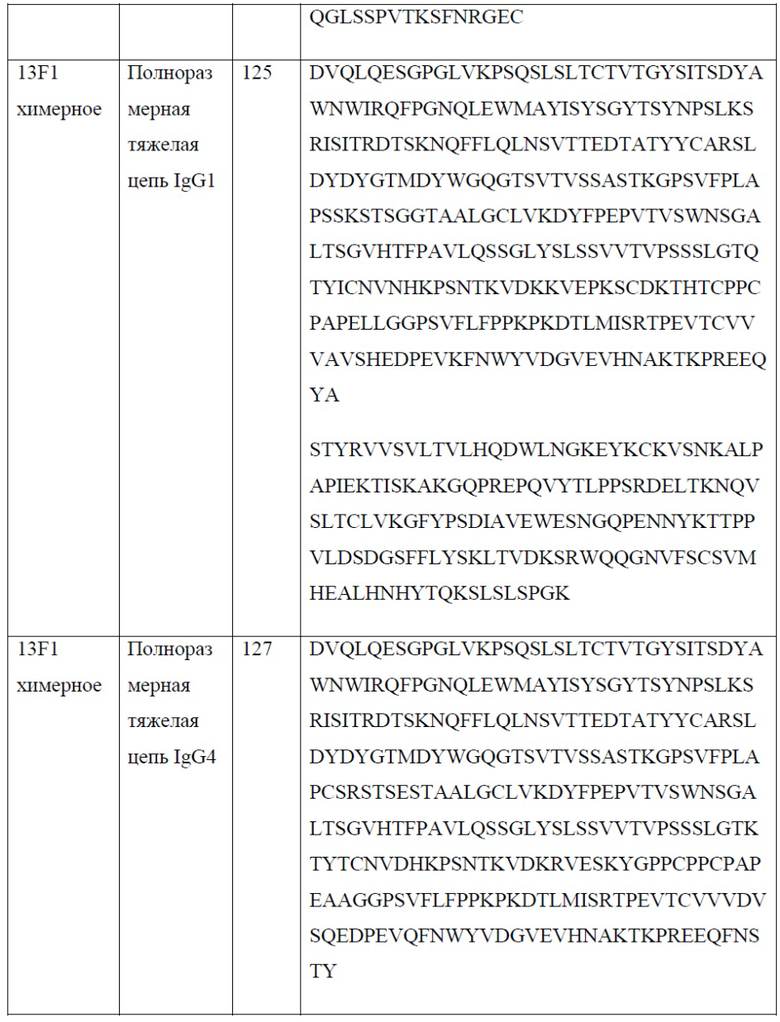
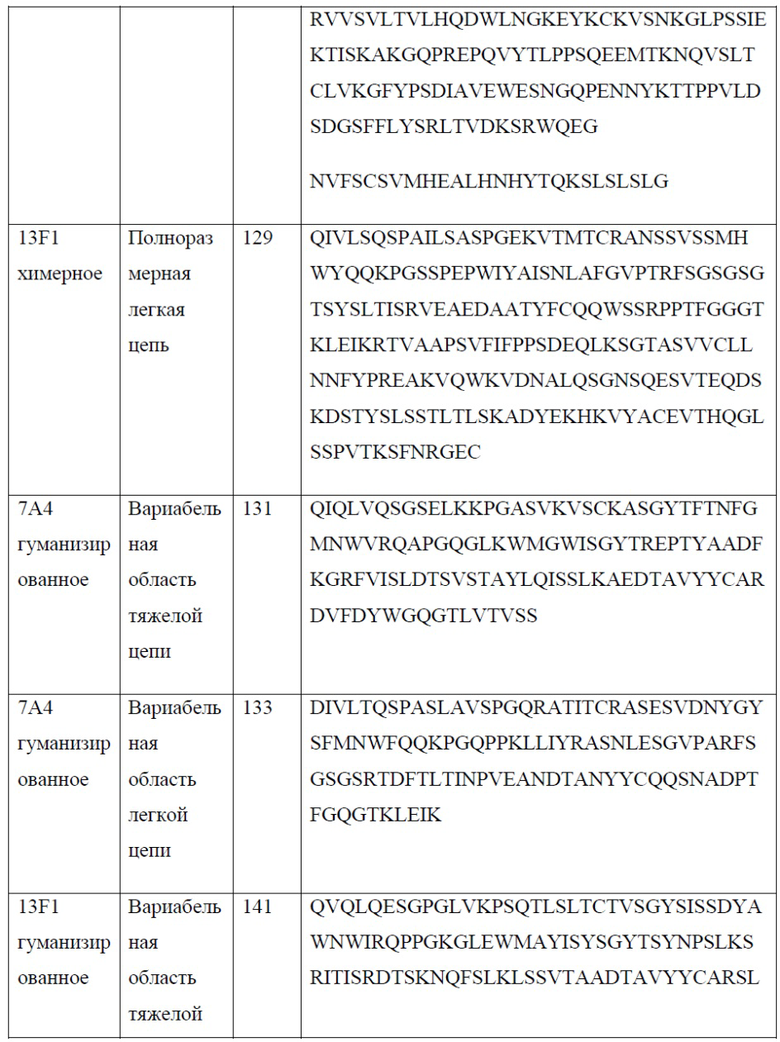
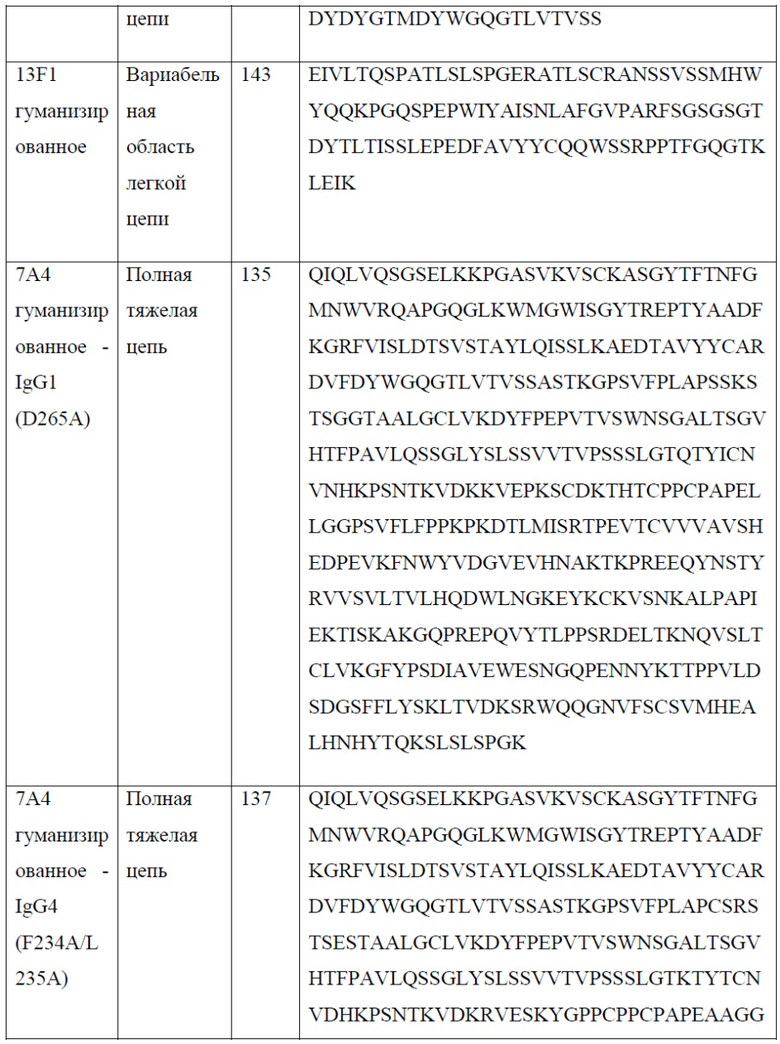
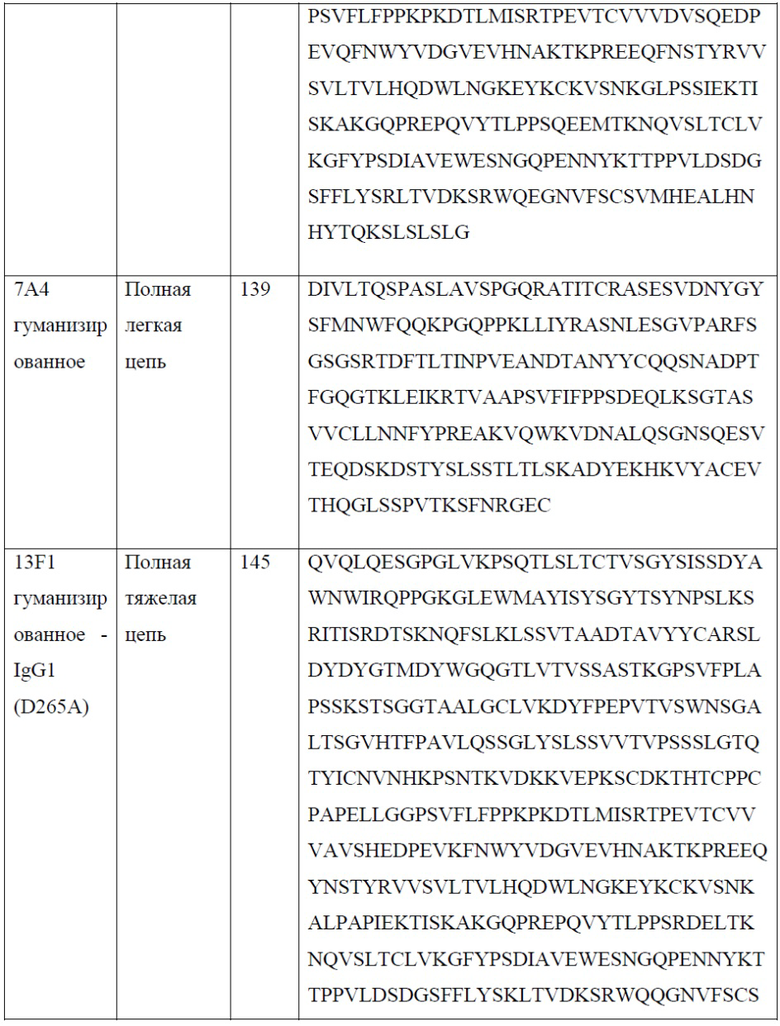
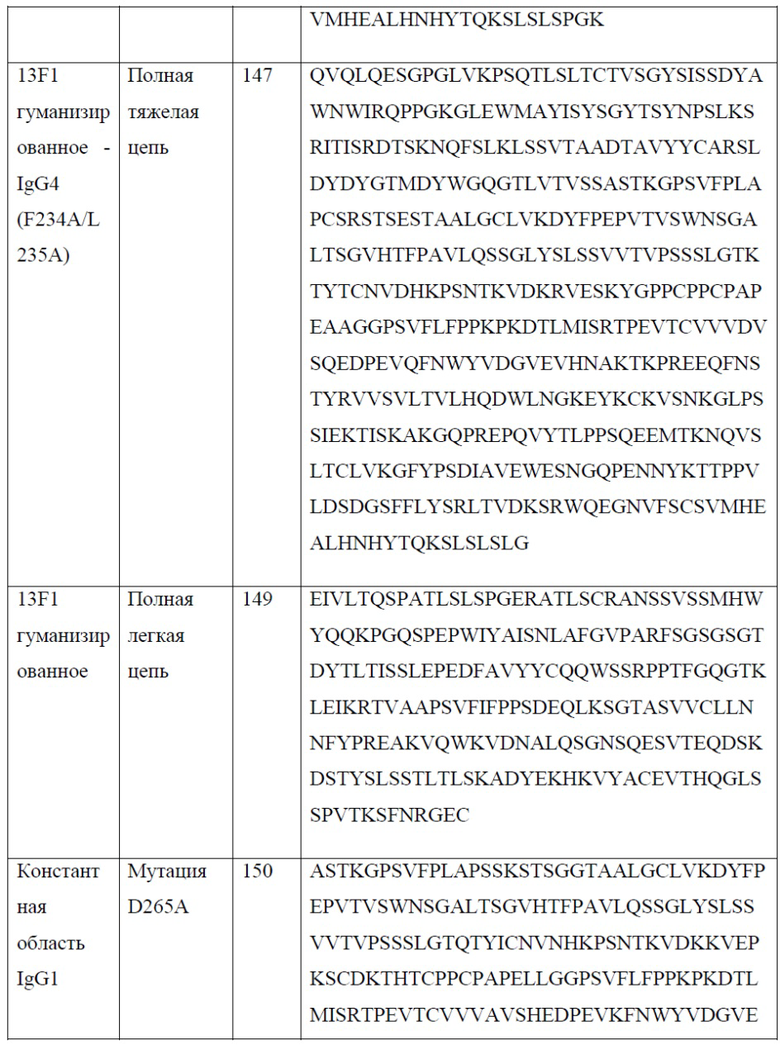
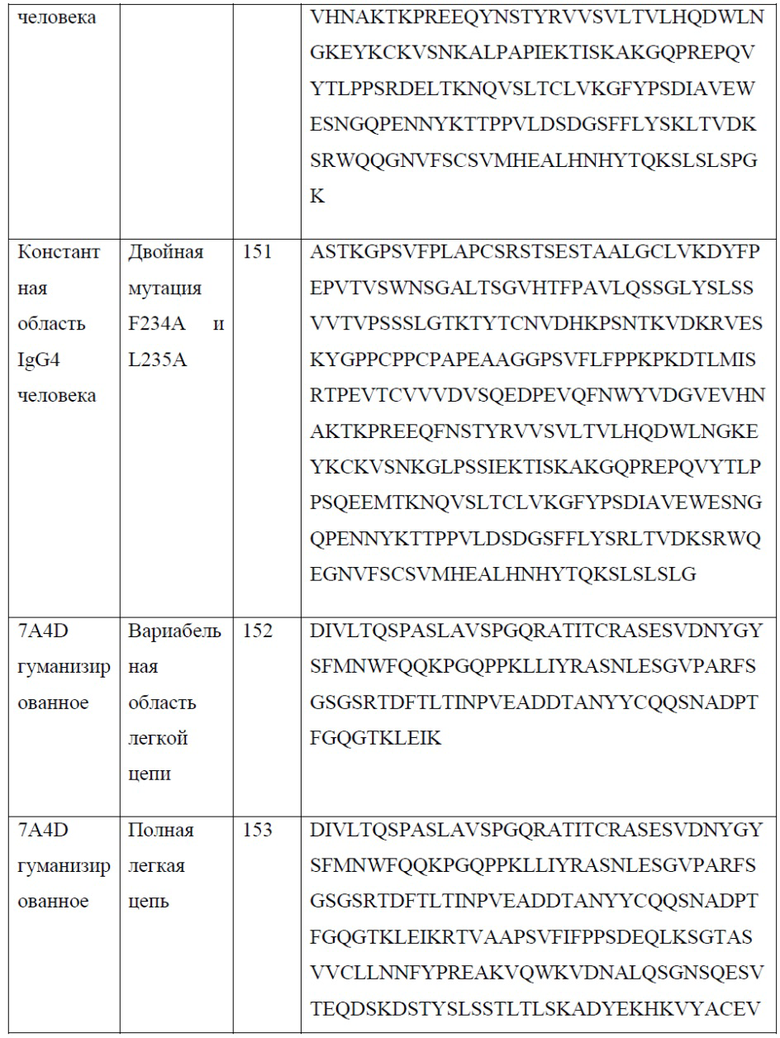

[0077] В одном варианте реализации настоящего изобретения предложены антитела против PD-1, содержащие CDR легкой цепи и CDR тяжелой цепи антител 10D1, 4C10, 7D3, 13F1, 15H5, 14A6, 22A5, 6E1, 5A8 и/или 7A4. Специалист в данной области техники должен понимать, что CDR тяжелой и легкой цепи антител, представленных в настоящем документе, можно независимо друг от друга выбрать, скомбинировать или подобрать с целью формирования антитела или его связывающего фрагмента, содержащего любую CDR1, CDR2 и CDR3 легкой цепи; и любую CDR1, CDR2 и CDR3 тяжелой цепи антител, представленных в настоящем документе. Таким образом, в настоящем изобретении предложены антитела против PD-1, содержащие CDR1 легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 24, 34, 45, 55, 65, 75, 85, 95, 105 и 115; CDR2 легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 25, 35, 46, 56, 66, 76, 86, 96, 106 и 116; CDR3 легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 26, 36, 47, 57, 67, 77, 87, 97, 107 и 117; CDR1 тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 19, 29, 40, 50, 60, 70, 80, 90, 100 и 110; CDR2 тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 20, 30, 41, 51, 61, 71, 81, 91, 101 и 111; и CDR3 тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 21, 31, 42, 52, 62, 72, 82, 92, 102 и 112. В одном варианте реализации настоящего изобретения предложены антитела против PD-1, содержащие CDR области тяжелой и легкой цепи, содержащие аминокислотные последовательности, обладающие по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% гомологией по отношению к соответствующей CDR1, CDR2 или CDR3 легкой или тяжелой цепи, представленной в настоящем документе. В одном варианте реализации настоящего изобретения предложены антитела против PD-1, содержащие CDR-области тяжелой и легкой цепи, содержащие аминокислотные последовательности, содержащие 1, 2, 3, 4, 5 или 6 аминокислотных замен, делеций или инсерций по сравнению с соответствующими CDR1, CDR2 или CDR3 легкой или тяжелой цепи, представленными в настоящем документе.
[0078] В одном варианте реализации настоящего изобретения предложены антитела против PD-1, содержащие вариабельную область легкой цепи антитела, выбранного из группы, состоящей из 10D1, 4C10, 7D3, 13F1, 15H5, 14A6, 22A5, 6E1, 5A8, 7A4 и 7A4D и вариабельную область тяжелой цепи антитела, выбранного из группы, состоящей из 10D1, 4C10, 7D3, 13F1, 15H5, 14A6, 22A5, 6E1, 5A8 и 7A4. В одном варианте реализации антитела и их фрагменты, представленные в настоящем документе, содержат вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% гомологией по отношению к вариабельной области легкой цепи согласно SEQ ID NO: 23, 33, 44, 54, 64, 74, 84, 94, 104, 114, 133, 143 и 152. В одном варианте реализации антитела и их фрагменты, представленные в настоящем документе, содержат вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 23, 33, 44, 54, 64, 74, 84, 94, 104, 114, 133, 143, 152 или ее вариант, причем указанный вариант содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен или делеций, или их комбинацию. В дополнительном варианте реализации аминокислотные замены являются консервативными заменами. В еще одном варианте реализации аминокислотные замены улучшают свойства антител, как предложено в настоящем документе, например, путем удаления сайта дезамидирования. Например, в одном варианте реализации мутируют остаток аспарагина (Asn, N). В дополнительном варианте реализации Asn мутируют в аспарагиновую кислоту (Asp; D). В еще одном дополнительном варианте реализации Asn в положении 85 каркасной области 3 вариабельной области легкой цепи мутируют в Asp.В одном варианте реализации настоящего изобретения предложено гуманизированное антитело 7A4D, содержащее ту же аминокислотную последовательность, что и гуманизированное антитело 7A4, за исключением мутации в каркасной области 3 (положении 85) легкой цепи, удаляющей сайт дезамидирования.
[0079] В одном варианте реализации антитела и их фрагменты, представленные в настоящем документе, содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% гомологией по отношению к вариабельной области легкой цепи согласно SEQ ID NO: 18, 28, 39, 49, 59, 69, 79, 89, 99, 109, 131 и 141 или 84. В одном варианте реализации антитела и их фрагменты, представленные в настоящем документе, содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 18, 28, 39, 49, 59, 69, 79, 89, 99, 109, 131, 141 или ее вариант, причем указанный вариант содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более аминокислотных замен или делеций, или их комбинацию. В дополнительном варианте реализации аминокислотные замены являются консервативными заменами. В еще одном варианте реализации аминокислотные замены улучшают свойства антител, как предложено в настоящем документе, например, путем удаления сайта дезамидирования. Например, в одном варианте реализации мутируют остаток аспарагина (Asn, N). В дополнительном варианте реализации Asn мутируют в аспарагиновую кислоту (Asp; D).
[0080] Антитела против PD-1, описанные в настоящем документе, содержащие одну или более из аминокислотных замен, инсерций, делеций или их комбинацию в CDR или вариабельной области легкой или тяжелой цепи, сохраняют биологическую активность соответствующего антитела против PD-1, не содержащей аминокислотной замены, инсерции или делеции. Таким образом, варианты антител против PD-1, представленные в настоящем документе, сохраняют способность к связыванию с PD-1. В настоящем документе процент гомологии относится к количеству идентичных аминокислотных последовательностей, совместно присутствующих в двух эталонных последовательностях, разделенному на общее количество положений аминокислот и умноженному на 100.
[0081] В некоторых вариантах реализации антитела против PD-1, представленные в настоящем документе, содержат консервативные аминокислотные замены. Специалист в данной области техники должен понимать, что консервативная аминокислотная замена представляет собой замену одной аминокислоты другой аминокислотой, обладающей аналогичными структурными или химическими свойствами, например, аналогичной боковой цепью. Типичные консервативные замены описаны в данной области техники, например, в Watson et al. Molecular Biology of the Gene, The Bengamin/Cummings Publication Company, 4th Ed.(1987).
[0082] Специалист должен понимать, что вариабельную область легкой цепи и вариабельную область тяжелой цепи можно независимо выбрать или скомбинировать и подобрать из антител, представленных а настоящем документе. Таким образом, в настоящем изобретении предложены антитела против PD-1, содержащие вариабельную область легкой цепи, обладающую по меньшей мере 80% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 23, 33, 44, 54, 64, 74, 84, 94, 104, 114, 133, 143 и 152; и вариабельную область тяжелой цепи, обладающую по меньшей мере 80% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 18, 28, 39, 49, 59, 69, 79, 89, 99, 109, 131 и 141.
[0083] В одном варианте реализации настоящего изобретения предложены антитела, связывающиеся с тем же эпитопом, что и любое из антител, приведенных в качестве примера в настоящем документе. Так, в одном варианте реализации настоящего изобретения предложены антитела, конкурирующие за связывание с PD-1 с антителами, приведенными в качестве примера в настоящем документе.
[0084] Антитела против PD-1 и их фрагменты, представленные в настоящем документе, могут содержать модификации Fc-области, влияющие на эффекторные функции. Модификации Fc-области могут представлять собой аминокислотные инсерции, делеции или замены, или могут представлять собой химические модификации. Например, модификации Fc-области можно вносить с целью увеличения или снижения связывания комплемента, увеличения или снижения антитело-зависимой клеточной цитотоксичности, или для увеличения или снижения времени полужизни антитела. Некоторые модификации Fc-области увеличивают или уменьшают сродство антитела по отношению к рецептору Fcγ, например, FcγRI, FcγRII, FcγRIII или FcRn. Различные модификации Fc-области описаны в данной области техники, например, в Shields et al.,J Biol.Chem 276; 6591 (2001); Tai et al.Blood 119; 2074 (2012); Spiekermann et al.J Exp.Med 196; 303 (2002); Moore et al. mAbs 2:2; 181 (2010); Medzihradsky Methods in Molecular Biology 446; 293 (2008); Mannan et al. Drug Metabolism and Disposition 35; 86 (2007); и Idusogie et al. J Immunol 164; 4178 (2000). В некоторых вариантах реализации модифицирована картина гликозилирования Fc-области. В других вариантах реализации Fc-область модифицируют путем ПЭГилирования (например, посредством реакции антитела или его фрагмента с полиэтиленгликолем (ПЭГ).
[0085] В одном варианте реализации антитела или их фрагменты, представленные в настоящем документе, являются иммуноконъюгатами, содержащими антитело против PD-1 или его фрагмент, и дополнительно содержащими агент, выбранный из группы, включающей дополнительный терапевтический агент, цитотоксический агент, молекулу иммуноадгезии и агент для визуализации. В некоторых вариантах реализации агент для визуализации выбирают из группы, состоящей из радиоактивной метки, фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки и биотина. В некоторых вариантах реализации агент для визуализации содержит радиоактивную метку, выбранную из группы, состоящей из: 3H, 14C, 35S, 62, 64Cu, 89Zr, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm. В некоторых вариантах реализации терапевтический агент или цитотоксический агент выбирают из группы, включающей химиотерапевтический агент, иммунодепрессант, иммуностимулятор, антиметаболит, алкилирующий агент, антибиотик, фактор роста, цитокин, антиангиогенный агент, антимитотический агент, антрациклин, токсин и апоптотический агент.В некоторых вариантах реализации связывающий белок конъюгируют непосредственно с агентом. В других вариантах реализации связывающий белок конъюгируют с агентом через линкер. Подходящие линкеры включают аминокислотные и полипептидные линкеры, описанные в настоящем документе, но не ограничиваются ими. Линкеры могут быть расщепляемыми или нерасщепляемыми.
[0086] В одном варианте реализации настоящего изобретения предложены биспецифические или полиспецифические антитела, специфические по отношению к PD-1 и по меньшей мере одному из других антигенов или эпитопов. Антитела против PD-1 и их фрагменты, представленные в настоящем документе, можно тестировать на предмет связывания с PD-1 с использованием анализов связывания, представленных в настоящем документе, или любого другого анализа связывания, известного в данной области техники.
[0087] Если не указано иное, то при практической реализации настоящего изобретения используют обычные методики молекулярной биологии, клеточной биологии, биохимии и иммунологии, хорошо известные в данной области техники и описанные, например, в Methods in Molecular Biology, Humana Press; Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al.,1989), Current Protocols in Immunology (J.E.Coliganet al., eds.,1991); Immunobiology (C.A.Janeway and P.Travers, 1997); Antibodies (P.Finch, 1997); Antibodies: a practical approach (D.Catty., ed.,IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P.Shepherd and C.Dean, eds.,Oxford University Press, 2000); Phage display: a laboratory manual (C.Barbas III et al, Cold Spring Harbor Laboratory Press, 2001); и Using antibodies: a laboratory manual (E.Harlow and D.Lane (Cold Spring Harbor Laboratory Press, 1999).
[0088] В одном из аспектов настоящего изобретения предложены способы лечения субъекта от заболевания или состояния, реагирующего на усиление, стимуляцию или индукцию иммунного ответа. В настоящем документе термин "лечение" относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. Субъекты, нуждающиеся в лечении, включают субъектов, у которых уже есть данное заболевание или состояние, а также субъектов, у которых может развиться данное заболевание или состояние, и у которых необходимо предотвратить, задержать или ослабить данное заболевание или состояние. В настоящем документе термин "субъект" означает млекопитающее, например, относящееся к грызунам, кошачьим, собачьим и приматам. Предпочтительно, субъект согласно настоящему изобретению является человеком.
[0089] Термин «терапевтически эффективное количество» в настоящем документе относится к количеству соединения или композиции, необходимому для получения терапевтического и/или профилактического благоприятного эффекта у субъекта.
[0090] В одном аспекте антитела и их антиген-связывающие фрагменты можно применять при лечении солидных или несолидных опухолей. Так, в одном аспекте настоящего изобретения предложены способы лечения рака. Термин "рак" в настоящем документе относится к физиологическому состоянию у млекопитающих, обычно характеризующемуся нерегулируемым ростом клеток. Примеры рака включают карциному, лимфому, бластому, саркому (включая липосаркому, остеогенную саркому ангиосаркому, эндотелиосаркому, лейомиосаркому, хордому, лимфангиосаркому, лимфангиоэндотелиомаркому, рабдомиосаркому, фибросаркому, миксосаркому, хондросаркому), нейроэндокринные опухоли, мезотелиому, синовиому, невриному, менингиому, аденокарциному, меланому и лейкоз или лимфоидные злокачественные новообразования, но не ограничиваются ими. Более конкретные примеры таких видов рака включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), лимфому Ходжкина; неходжкинские лимфомы (лимфому Беркитта, мелкоклеточную лимфоцитарную лимфому/ хронический лимфолейкоз, фунгоидную гранулему, лимфому из клеток мантии, фолликулярную лимфому, диффузную крупноклеточную В-клеточную лимфому, лимфому из клеток маргинальной зоны, волосатоклеточный лейкоз и лимфоплазмоцитарный лейкоз), опухоли из клеток-предшественников лимфоцитов, в том числе B-клеточный острый лимфобластный лейкоз/лимфому и Т-клеточный острый лимфобластный лейкоз/лимфому, тимому, опухоли из зрелых Т- и NK-клеток, в том числе периферические Т-клеточные лейкозы, Т-клеточный лейкоз взрослых/Т-клеточную лимфому и крупноклеточный гранулярно-лимфоцитарный лейкоз, лангергансоклеточный гистиоцитоз, миелоидные новообразования, например, острые миелобластные лейкозы, в том числе ОМЛ с созреванием, ОМЛ без дифференцировки, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз и острый моноцитарный лейкоз, миелодиспластические синдромы и хронические миелопролиферативные заболевания, в том числе хронический миелобластный лейкоз, В-клеточный острый лимфобластный лейкоз/лимфому, Т-клеточный острый лимфобластный лейкоз/лимфому, рак легких, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого, мелкоклеточную карциному легкого, перитонеальный рак, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, рак ободочной и прямой кишки, карциному эндометрия или матки, карциному слюнных желез, рак почек, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, карциному зднего прохода, карциному полового члена, рак яичка, рак пищевода, опухоли желчевыводящих путей, опухоль Юинга, базальноклеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечноклеточную карциному, гепатому, карциному желчных протоков, хориокарциному, семиному, эмбриональный рак, опухоль Вильмса, опухоль яичек, карциному легкого, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиомц, эпендимому, пинеалому, гемангиобластому, невриному слухового нерва, олигодендроглиому, менингиому, меланому, нейробластому, ретинобластому, лейкоз, лимфому, множественную миелому, макроглобулинемию Вальденстрема, миелодиспластическое заболевание, болезнь тяжелых цепей, нейроэндокринные опухоли, шванному и другие карциномы, а также рак головы и шеи.
[0091] В одном варианте реализации антитела и их фрагменты, представленные в настоящем документе, можно применять при лечении заболеваний, вызванных инфекционными агентами. Инфекционные агенты включают бактериальные, микологические, паразитарные и вирусные агенты, но не ограничиваются ими. Примеры таких инфекционных агентов включают: Staphylococcus, метициллин-устойчивый Staphylococcus aureus, Escherichia coli, Streptococcaceae, Neisseriaaceae, кокки, Enterobacteriaceae, Enterococcus, ванкомицин-устойчивый Enterococcus, Cryptococcus, гистоплазмоз, Aspergillus, Pseudomonadaceae, Vibrionaceae, Campylobacter, Pasteurellaceae, Bordetella, Francisella, Brucella, Legionellaceae, Bacteroidaceae, грамотрицательные палочки, Clostridium, Corynebacterium, Propionibacterium, грамположительные палочки, возбудитель сибирской язвы, Actinomyces, Nocardia, Mycobacterium, Treponema, Borrelia, Leptospira, Mycoplasma, Ureaplasma, Rickettsia, Chlamydiae, Candida, системные микозы, оппортунистические микозы, Protozoa, нематод, трематод, цестод, аденовирусы, герпесвирусы (включая, например, вирус простого герпеса, вирус Эпштейна-Барр и вирус опоясывающего герпеса), поксвирусы, паповавирусы, вирусы гепатита, (включая, например, вирус гепатита В и вирус гепатита С), папилломавирусы, ортомиксовирусы (включая, например, вирусы гриппа А, гриппа B и гриппа C), парамиксовирусы, коронавирусы, пикорнавирусы, реовирусы, тогавирусы, флавивирусы, буньявирусы, рабдовирусы, ротавирус, респираторный синцитиальный вирус, вирус иммунодефицита человека и ретровирусы. Типичные инфекционные заболевания включают кандидоз, кандидемию, аспергиллез, стрептококковую пневмонию, стрептококковые заболевания кожи и ротоглотки, сепсис, вызванный грамотрицательными бактериями, туберкулез, мононуклеоз, грипп, респираторное заболевание, вызванное респираторно-синцитиальным вирусом, малярию, шистосомоз и трипаносомоз, но не ограничиваются ими.
[0092] В одном варианте реализации антитела и их фрагменты, представленные в настоящем документе, можно применять при лечении заболеваний, опосредованных Т-хелперами 2 типа (Th2), например, астмы, аллергии или реакции трансплантат против хозяина.
[0093] В одном варианте реализации антитела и их фрагменты, представленные в настоящем документе, можно применять для стимуляции иммунного ответа у субъекта, нуждающегося в этом. Например, в одном варианте реализации, антитела против PD-1 и их фрагменты можно вводить в комбинации с исследуемым антигеном для получения иммунного ответа на указанный антиген. Исследуемый антиген может представлять собой антиген, ассоциированный с возбудителем, например, вирусом или бактерией. Таким образом, в одном варианте реализации настоящего изобретения предложены вакцины, содержащие антитело против PD-1 и антиген, причем указанная вакцина вызывает антиген-специфический иммунный ответ.
[0094] В одном варианте реализации антитела против PD-1, представленные в настоящем документе, модулируют функцию регуляторных Т-клеток. CD4+ CD25+ регуляторные T-клетки представляют собой лимфоциты, подавляющие или снижающие функцию эффекторных T-клеток. Термины "регуляторные Т-клетки" и "Treg" в настоящем документе используются взаимозаменяемо. В одном варианте реализации антитела против PD-1, представленные в настоящем документе, предотвращают или купируют ингибиторное действие регуляторных Т-клеток на продукцию цитокинов эффекторными Т-клетками. Например, в одном варианте реализации антитела против PD-1, представленные в настоящем документе, восстанавливают способность эффекторных Т-клеток к продукции ИФН-γ в контакте с регуляторными Т-клетками.
[0095] В одном варианте реализации антитела и их фрагменты, описанные в настоящем документе, можно вводить субъекту с использованием по меньшей мере одного пути, выбранного из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, внутрикапсульного, внутрихрящевого, внутриполостного, интрацелиального, внутримозжечкового, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, внутрисердечного, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, внутриплеврального, интрапростатического, внутрилегочного, интраректального, внутрипочечного, интраретинального, интраспинального, интрасиновиального, интраторакального, интратимпанального, внутриматочного, внутрипузырного, интравитреального, болюсного, субконъюнктивального, вагинального, ректального, буккального, сублингвального, интраназального, внутриопухолевого и трансдермального.
[0096] В одном варианте реализации антитела и их фрагменты, описанные в настоящем документе, можно вводить субъекту, нуждающемуся в этом, в комбинации с одним или более из дополнительных терапевтических агентов. В одном варианте реализации антитела и их фрагменты можно вводить субъекту до, во время или после введения субъекту дополнительного терапевтического агента. В одном варианте реализации дополнительный терапевтический агент представляет собой химиотерапевтический агент, радиотерапевтический агент, цитокин, антитело или их фрагмент или любое другое дополнительное терапевтическое средство, показанное при заболевании, подлежащем лечению. В одном варианте реализации антитело против PD-1 и дополнительный терапевтический агент демонстрируют терапевтическую синергию при совместном одновременном или последовательном введении. В одном варианте реализации антитело против PD-1 и дополнительный терапевтический агент вводят в раздельных составах. В еще одном варианте реализации антитело против PD-1 и дополнительный терапевтический агент вводят в одном и том же составе. В одном варианте реализации антитела против PD-1 и фрагменты, представленные в настоящем документе, усиливают иммуномодулирующее действие одного или более из дополнительных терапевтических агентов. В еще одном варианте реализации один или более из дополнительных терапевтических агентов усиливает действие антитела против PD-1 или его фрагмента.
[0097] В настоящем изобретении предложены выделенные антитела и их антиген-связывающие фрагменты, нуклеиновые кислоты, кодирующие такие антитела и фрагменты, а также композиции, содержащие такие выделенные антитела, фрагменты и нуклеиновые кислоты. Термин «выделенный» относится к исследуемому соединению (например, антителу или нуклеиновой кислоте), отделенному от своего естественного окружения. В настоящем изобретении также предложены фармацевтические композиции, содержащие выделенные антитела или их фрагменты или нуклеиновые кислоты, кодирующие такие антитела или фрагменты, и дополнительно содержащие один или более из фармацевтически приемлемых носителей. Фармацевтически приемлемые носители включают, например, вспомогательные вещества, разбавители, инкапсулирующие материалы, наполнители, буферы или другие агенты.
[0098] Использование форм единственного числа включает использование форм множественного числа и наоборот, если не указано иное. Подразумевают, что термин «один» и существительные в единственном числе, применяемые в настоящей заявке, включают «по меньшей мере один», если не указано иное. Использование союза «или» означает «и/или», если не указано иное. Смысл фразы «по меньшей мере один» эквивалентен смыслу фразы «один или более». Кроме того, использование термина «включая», а также других форм этого слова, например, «включает» и «включал», не является ограничивающим. Кроме того, такие термины, как «элемент» или «компонент» охватывают как элементы или компоненты, содержащие одну единицу, так и элементы или компоненты, содержащие более одной единицы, если иное не указано специально.
[0099] Хотя настоящее изобретение подробно описано посредством иллюстрации и примера для целей ясности понимания, для специалиста в данной области техники в свете идей настоящего изобретения очевидно, что в него можно внести определенные изменения и модификации без отступления от сущности или области прилагаемой формулы изобретения. Следующие примеры представлены исключительно для целей иллюстрации и не предназначены для ограничения. Специалисты в данной области техники могут легко назвать различные некритичные параметры, которые можно менять или модифицировать, получая практически аналогичные результаты.
ПРИМЕРЫ
Пример 1 - иммунизация мыши и продукция антител мыши против PD-1 человека
[00100] Для получения антител против PD-1 человека с помощью ПЦР получили кДНК, кодирующие открытую рамку считывания внеклеточного домена hPD-1, объединенного с гистидиновым маркером (hPD-1-HisTag, SEQ ID NO: 1), Fc мыши (hPD-L1-mFc, SEQ ID NO: 13) и Fc-маркером человека (hPD-1-hFc, SEQ ID NO: 5), и субклонировали их в экспрессирующий вектор pcDNA3.1 (Invitrogen, №по каталогу V-790), соответственно. После временной экспрессии в клетках freestyle 293 hPD-1-HisTag очищали на колонке с NTA (GE healthcare), hPD-1-mFc и hPD-1-hFc очищали на колонке с белком G (GE healthcare).
[00101] Для иммунизации мышей, необходимой для получения гибридомных клеточных линий, смешивали 100 мкг гибридного белка PD-1 человека-Fc мыши и полного адъюванта Фрейнда в одинаковых количествах, и указанную смесь вводили посредством подкожной инъекции каждой из пяти 6-7-недельных мышей BALB/c. Через две недели антиген (половину от ранее введенного количества) смешивали с неполным адъювантом Фрейнда, как описано выше, и указанную смесь вводили каждой мыши посредством подкожной инъекции. Через одну неделю выполняли окончательную стимуляцию, и через три дня собирали кровь из хвоста каждой мыши для получения сыворотки. Затем сыворотку разбавляли PBS в соотношении 1/1000 и выполняли твердофазный ИФА для оценки увеличения титра антител, распознающих PD-1 человека-mFc. После этого отбирали мышей с достаточным количеством антител, и на отобранных мышах выполняли слияние клеток.
[00102] За три дня до эксперимента по слиянию клеток каждой мыши вводили смесь 50 мкг PBS и гибридного белка PD-1 человека -mFc посредством внутрибрюшинной инъекции. Каждую иммунизированную мышь наркотизировали, извлекали селезенку, расположенную с левой стороны тела, и измельчали ее с помощью сетки для выделения клеток, которые смешивали с культуральной средой (RPMI1640), получая суспензию клеток селезенки. Суспензию центрифугировали, собирая слой клеток. Полученные 1×108 клеток селезенки смешивали с 1,5×107 клеток миеломы (Sp2/0), и центрифугировали смесь для осаждения клеток. Осадок медленно диспергировали и обрабатывали ПЭГ Hybri-Max (Sigma Inc.,№по каталогу 7181). Смешанные клетки распределяли в 96-луночные планшеты из расчета 0,1 мл на лунку и инкубировали при 37°C в инкубаторе с 5% CO2. В день 1 клетки подкармливали, добавляя дополнительные 0,1 мл среды, содержащей сыворотку, HAT и 2×метотрексат в каждую лунку. В день 3 и день 7 0,1 мл среды из каждой лунки заменяли 0,1 мл свежей среды HT. Скрининг обычно выполняли между 9-14 днями.
Пример 2 - Отбор гибридомных клеток, продуцирующих моноклональные антитела против белка PD-1 человека, на основании твердофазного ИФА и FACS-анализа.
[00103] Твердофазный ИФА связывания выполняли на основе белка PD-1 человека-hFc. На 96-луночные планшеты (Costar, № по каталогу 9018) иммобилизовали 100 мкл 2 мкг/мл PD1-hFc (CrownBio) в буфере для иммоилизации (PBS, Hyclone, №по каталогу SH30256.01B) в течение ночи при температуре 4°C. Лунки аспирировали и блокировали сайты неспецифического связывания, добавляя 200 мкл блокирующего буфера с 1% (масс/об) бычьего сывороточного альбумина (БСА, Roche, №по каталогу 738328) и инкубируя в течение 1 часа при температуре 37°C. После трехкратной промывки планшетов буфером для промывки (PBS с 0,05% (об/об) Tween20 (Sigma, № по каталогу P1379) добавляли 100 мкл/лунку соответствующих разведений супернатанта гибридомы в блокирующем буфере и инкубировали при комнатной температуре в течение 1 часа. Планшеты промывали и инкубировали со 100 мкл/лунку антитела козы против IgG мыши (H+L) (Thermo, № по каталогу 31432) в блокирующем буфере в течение 60 мин. После промывки планшетов добавляли 100 мкл/лунку раствора субстрата (ТМБ (eBioscience, № по каталогу 00-4201-56), и планшеты инкубировали в течение 2 мин при комнатной температуре. Для остановки реакции добавляли 100 мкл/лунку стоп-раствора (2 н. H2SO4). Развивался колориметрический сигнал, который считывали при длине волны 450 нм с помощью Auto Plate SpectraMax Plus (поставщик: Molecular Devices; модель: MNR0643; программное обеспечение: SoftMax Pro вер. 5.4). С помощью этого способа повторно отбирали гибридомные клеточные линии, продуцировавшие антитела, обладавшие высокой специфичностью связывания с белком PD-1 человека.
[00104] Анализ блокады лиганда на основе твердофазного ИФА выполняли путем блокирования связывания биотинилированного PD-L1 человека-mFc с PD-1 человека-hFc. Антиген PD-1-mFc (CrownBio) суспендировали в PBS (Hyclone, №по каталогу SH30256.01B) (2 мкг/мл, 100 мкл/лунку) и иммобилизовали на 96-луночных планшетах (costar, № по по каталогу 9018) при температуре 4°С в течение ночи. Планшеты 3 раза промывали буфером для промывки: PBS+0,05% Tween 20 (Sigma, №по каталогу Р1379). 200 мкл блокирующего буфера (PBS+1% БСА (Roche, №по каталогу 738328)) добавляли в каждую лунку, инкубировали при 37°С в течение 1 часа и промывали 3 раза. Различные концентрации (подходящие разведения супернатанта гибридом в PBS) Ат против PD-1 добавляли в лунки (100 мкл/лунку) и инкубировали при 37°С в течение 1 часа. Добавляли лиганд (0,1 мкг/мп PDL-1-mFc-биотин, 100 мкл/лунку), инкубировали при 37°С в течение 2 ч и промывали 3 раза. Добавляли вторичное антитело (Авидин-ПХ eBioscience №по каталогу Е07418-1632, 1:500, 100 мкл/лунку), инкубировали при 37°С в течение 0,5 часа и промывали 3 раза. Добавляли ТМБ (Sigma, № по каталогу Т0440, 100 мкл/лунку) и инкубировали в течение 3 мин при КГ. Для остановки реакции добавляли 100 мкл/лунку стоп-раствора (2 н. H2SO4). Развивался колориметрический сигнал, который считывали при длине волны 450 нм с помощью Auto Plate SpectraMax Plus (поставщик: Molecular Devices; модель: MNR0643; программное обеспечение: SoftMax Pro вер. 5.4).
[00105] Анализ связывания клеток и антител выполняли с использованием линии клеток hPD-1-293T. 2×105 клеток 293T-PD-1 использовали для каждой реакции, помещая их в каждую лунку 96-луночных культуральных планшетов. Клетки инкубировали с указанным антителом (20 мкг/мл при разбавлении в соотношении 1/5) при 4°С в течение 1 ч. Клетки трижды промывали буфером для EACS. Вторичное антитело (РЕ-антитело козы против антител мыши: 1:200; РЕ-антитело мыши против антитела человека: 1:10) добавляли к клеткам в количестве 100 мкл/лунку и инкубировали при 4°С в течение 40 мин. Клетки трижды промывали буфером для FACS и анализировали на EACS Array.
[00106] Анализ блокады лиганда на основе EACS выполняли для определения гибридомных антител против PD-1 при блокаде связывания биотинилированного PD-L1 и PD-L2 человека с клетками hPD-1-293T, используя проточно-цитометрический анализ. Клетки 293Т, экспрессирукшие PD-1, суспендировали в буфере для FACS (PBS с 3% эмбриональной телячьей сывороткой). Различные концентрации тестируемых гибридомных антител добавляли к суспензии клеток и инкубировали при 4°С в течение 60 минут в 96-луночных планшетах. Меченый биотином белок PD-L1 или меченый биотином белок PD-L2 добавляли в лунки и инкубировали при 4°С в течение 60 минут.Планшеты промывали 3 раза и добавляли РЕ антитело мыши против биотина (Biolgend, №по каталогу 409004). Проточно-цитометрический анализ выполняли с помощью FACS Array. Результаты исследования изображены на фигуре 1А (PD-L1) и фигуре IB (PD-L2). Моноклональные антитела против PD-1 блокировали связывание PD-L1 или PD-L2 с клетками 293Т, трансфицированными PD-1 человека при измерении средней интенсивности флуоресценции (MFI) окрашивания. Эти данные продемонстрировали, что антитела против PD-1 блокировали связывание лигандов PD-L1 и PD-L2 с PD-1 на поверхности клеток.
Пример 3 - Субклонирование с целью получения клонов моноклональных антител и очистка антител против hPD-1
[00107] Субклонирование основано на процедуре ограниченного разбавления и предназначено для получения отдельных гибридомных клонов, продуцирующих моноклональные антитела. Каждую из гибридом подвергали нескольким циклам (4 циклам) ограниченного разбавления. Для каждого цикла субклонирования клоны тестировали посредством анализов блокады на основе твердофазного ИФА и FACS.
[00108] Очистку выполняли в общей сложности для двадцати двух гибридомных антител против hPD-1. Клетки гибридом культивировали в среде Игла, модифицированной по Дульбекко (GIBCO; Invitrogen Corporation, Карлсбад, штат Калифорния, США), содержащей 10% эмбриональной телячьей сыворотки, 1% пенициллина/стрептомицина, 2% L-глутамина и 1% титрованного раствора NaHCO3. Затем выбранные гибридомные клетки адаптировали в бессывороточной культуральной среде; антитела очищали от супернатанта на колонке с белком G (GE healthcare). После промывки PBS связанные антитела элюировали, используя 0,1 М глицина, pH 3,0, с последующей нейтрализацией рН с помощью 2,0 М триса. Центробежные концентраторы Ultra-15 (Amicon) использовали для замены буфера и концентрирования антител.
Пример 4 - исследование характеристик очищенных антител мыши против hPD-1 по отношению к активности связывания и блокады лиганда на основе твердофазного ИФА и FACS-анализа
[00109] Дальнейшее исследование характеристик очищенных гибридомных антител выполняли на основе твердофазного ИФА и FACS-анализа. Используемые способы были аналогичны способам, описанным выше в примере 2, за исключением того, что в этих случаях измеряли количество и концентрацию очищенных антител, и результаты использовали для расчета значений EC50 и IC50. В следующих таблицах 1-5 показаны результаты для 10 антител.
Таблица 1. EC50 связывания 10 антител мыши против PD-1 на основе твердофазного ИФА
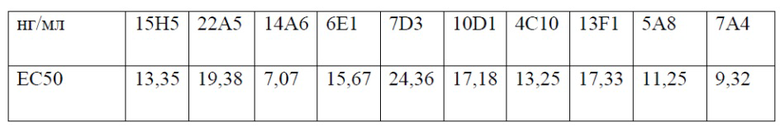
Таблица 2. IC50 блокады 10 антител мыши против PD-1 на основе твердофазного ИФА
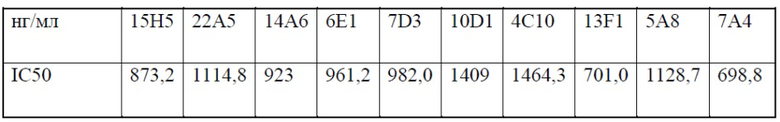
Таблица 3. EC50 связывания 10 антител мыши против PD-1 на основе FACS
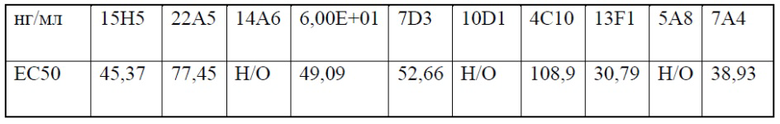
Таблица 4.IC50 блокады PD-L1 10 выбранных антител мыши против PD-1 на основе FACS.
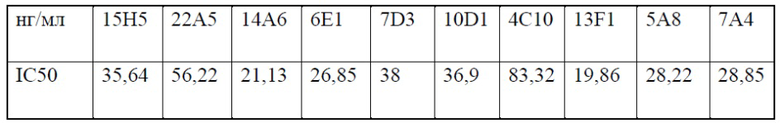
Таблица 5.IC50 блокады PD-L2 10 выбранных антител мыши против PD-1 на основе FACS
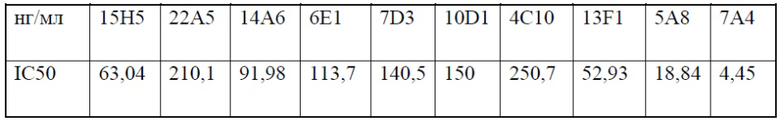
Пример 5: Анализ антител мыши против PD-1 на основе Biacore
[00110] Для дальнейшего исследования характеристик связывания антител выполнили оценку профиля 10 гибридомных антител с помощью Biacore (Biacore 3000, GE) с целью выявления кинетики связывания и расчета равновесных констант связывания. Данный анализ выполняли с использованием методики захвата, используя набор для захвата антитела мыши (BR-1008-38, GE). После разбавления мАт против Fc мыши до концентрации 25 мкг/мл в буфере для иммобилизации (рН 5,0) выполнили иммобилизацию с параметрами, показанными в таблице 6, при скорости потока 5 мкл/мин. Анализ кинетики выполняли посредством: 1) введения лиганда, обычно в течение 0,5-1 мин, при скорости потока 10 мкл/мин; 2) введения выбранных анализируемых соединений, обычно в течение 3 мин, с последующей диссоциацией в подвижном буфере (1X PBS-P20), обычно в течение 5-10 мин, при скорости потока 30 мкл/мин; и 3) введения регенерирующего раствора 10 мМ глицина (pH 1,7), обычно в течение 1-2 мин, при скорости потока 10 мкл/мин.
Таблица 6. Параметры Biacore.
[00111] Результаты исследования показаны в таблице 7. Каждое из антител против PD1 человека демонстрировало скорость ассоциации (ka) в диапазоне от 1,11E+05 1/Мс до 8,40E+05 1/Мс; скорость диссоциации (kd) в диапазоне от 2,83E-05 1/с до 7,55E-05 1/с; равновесную константу ассоциации (KA) в диапазоне от 1,60E+10 1/М до 5,44E+10 1/М; и сродство (KD) в диапазоне от 1,84E-11 M до 6,23E-11 M (от 0,0184 нМ до 0,0623 нМ).
Таблица 7. Значения KD гибридомных антител против PD-1.
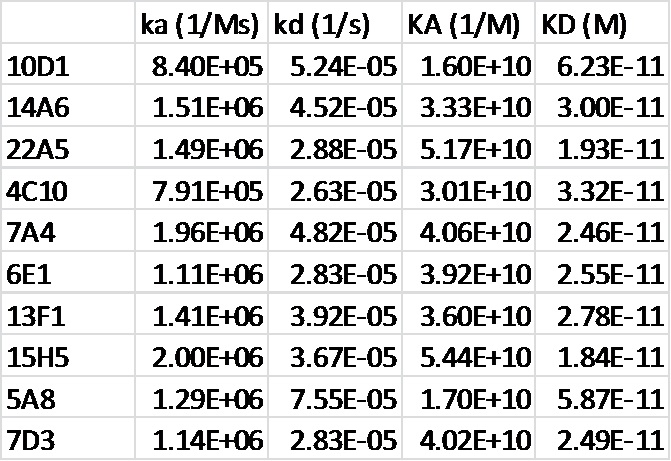
Пример 6: Перекрестная реакционная способность между видами и аналогичными молекулами
[00112] Для оценки межвидовой перекрестной реакционной способности антител рецепторы PD-1 мыши и яванского макака клонировали с помощью ПЦР и получали стабильно трансфицированные клетки 293T-PD-1. Антитела тестировали на предмет связывания с рецепторами яванского макака, используя твердофазный ИФА на основе белка. Результаты исследования показали, что антитела связываются с PD-1 человека и яванского макака с равным сродством и блокируют связывание hPD-L1/Fc и hPD-L2/Fc к PD-1 яванского макака с аналогичной эффективностью по сравнению с PD -1. Ни одно из выбранных антител не связывало PD-1 мыши с обнаруживаемым сродством при любом из использованных анализов. Ни одно из антител не проявляло перекрестной реакционной способности по отношению к CTLA4, ICOS и CD28 человека (см. таблицу 8).
Пример 7: Действие гибридомных антител против PD-1 на продукцию цитокинов в реакции смешанной культуры лимфоцитов.
[00113] Реакцию смешанной культуры лимфоцитов использовали для демонстрации действия блокады пути PD-1 в эффекторных лимфоцитах. В данном анализе тестировали Т-клетки на предмет пролиферации, секреции ИФН-γ и секреции ИЛ-2 в присутствии или в отсутствие моноклональных антител мыши против PD-1 человека. В данном анализе CD4+ Т-клетки человека очищали от МПК с помощью отбора CD4+-отрицательных клеток (Miltenyi Biotech, № по каталогу 130-091-155). Зрелые дендритные клетки (DC) получали из культуры очищенных моноцитов (Miltenyi, Mo-DC Generation Toolbox, №по каталогу 130-093-568) со средой для дифференцировки Mo-DC в течение 7 дней; затем индуцировали созревание DC с помощью реагента для созревания Mo-Dc в течение 2 дней. Каждая культура содержала 105 очищенных Т-клеток и 104 аллогенных дендритных клеток в общем объеме 200 мкл. Моноклональное антитело 4C10, 5A8, 6E1, 7D3, 7A4, 10D1, 13F1, 14A6, 15H5 или 22A5 против PD-1 добавляли в каждую культуру при различных концентрациях антитела. Отсутствие антитела или изотипическое контрольное антитело использовали в качестве отрицательного контроля. Клетки культивировали в течение 5 дней при температуре 37°C. На 5 день собирали 50 мкл среды для измерения ИЛ-2 и ИФН-γ. Уровни ИФН-γ и ИЛ-2 в культуральной жидкости измеряли с помощью набора для твердофазного ИФА hIFN-γ (R&D, №по каталогу DY285) и набора для твердофазного ИФА ИЛ-2 (eBioscience). Результаты исследования представлены на фигуре 2 (секреция ИЛ-2) и фигуре 3 (секреция ИФН-γ) и показывают, что моноклональные антитела против PD-1 человека стимулировали пролиферацию Т-клеток, секрецию ИФН-γ и секрецию ИЛ-2 в зависимости от концентрации. В противоположность этому, культуры, содержащие изотипическое контрольное антитело, не демонстрировали увеличения пролиферации Т-клеток, секреции ИФН-γ или ИЛ-2.
Пример 8: Свойства 10 антител мыши против hPD-1
[00114] Сводные характеристики 10 очищенных и исследованных моноклональных антител против PD1 приведены в таблице 8. Эти антитела прочно связывались с PD-1 (с константами диссоциации в диапазоне от 20 мкм до 3 нм) и могли блокировать взаимодействие с PD-L1 и PD L2 с различными значениями IC50. Каждое из антител индуцировало продукцию ИЛ-2 и ИФН-γ. Ни одно из 10 антител не проявляло перекрестной реакционной способности по отношению к CTLA4, ICOS или CD28. Каждое из антител связывало PD-1 яванского макака. Каждое из антител при добавлении в раствор действовало как антагонист рецептора, в конечном счете усиливая Т-клеточный ответ (см. пример 5).
Таблица 8. Сводка характерных свойств 10 антител мыши против PD-1.


Пример 9: Клонирование и гуманизация последовательностей кДНК антитела против PD-1
[00115] Клонирование кДНК иммуноглобулинов
[00116] Общую РНК, выделенную из клеток гибридомной линии, продуцирующей антитело против hPD-1, с помощью набора RNeasy Mini Kit (Qiagen, №по каталогу 74104), использовали в качестве матрицы для синтеза первой цепи кДНК с помощью обратной транскриптазы SuperScript® II (Life Technology, №по каталогу 18064-14) согласно инструкциям производителя. Затем продукт кДНК подвергали ПЦР в 50 мкл объеме реакционной смеси с использованием вырожденных праймеров IgG мыши (Kettleborough CA, et al, European Journal of Immunology 23:206-211 (1993), Strebe N, et al, Antibody Engineering 1:3-14 (2010)). Реакцию проводили в термоциклере С1000((Bio-Rad, №по каталогу 184-2000) в течение 30 циклов: 94°C, 1,5 минут для денатурации; 50°C, 1 минута для отжига; и 72°C, 1 минута для синтеза. В конце 30 цикла реакционную смесь инкубировали в течение дополнительных 7 минут при 72°C для размножения.
[00117] Смесь ПЦР подвергали электрофорезу в 1% агарозно/трис-боратном геле, содержащем 0,5 мкг/мл бромида этидия. Фрагменты ДНК ожидаемого размера (приблизительно 400 п.о. для тяжелой цепи и легкой цепи) вырезали из геля и очищали. 3 мкл очищенного продукта ПЦР клонировали в вектор pMD 18Т (Takara, №по каталогу D101A) и трансформировали в химически компетентные по отношению к One Shot(TOP10 клетки E.coli (Invitrogen, №по каталогу C4040-03). Клоны подвергали скринингу с помощью ПЦР колоний с использованием универсальных прямого и обратного праймеров M13, 10 положительных клонов из каждой реакции отбирали для секвенирования ДНК в обоих направлениях, используя прямой и обратный праймеры M13.
[00118] Последовательности вариабельных областей антител 4C10 (SEQ ID NO: 28, 33), 5A8 (SEQ ID NO: 99, 104), 6E1 (SEQ ID NO: 89, 94), 7D3 (SEQ ID NO: 39, 44), 7A4 (SEQ ID NO: 109, 114), 10D1 (SEQ ID NO: 18, 23), 13F1 (SEQ ID NO: 49, 54), 14A6 (SEQ ID NO: 69, 74), 15H5 (SEQ ID NO: 59, 64) и 22A5 (SEQ ID NO: 79, 84) амплифицировали из соответствующих гибридомных клонов. Эти антитела демонстрировали желательные функции, например, блокирование связывания PD-1 с PD-L1 и усиленную активацию Т-клеток и высвобождение цитокинов.
[00119] Конструирование и экспрессия химерных антител 7A4 и 13F1
[00120] Легкие цепи химерных антител 7A4 и 13F1 (SEQ ID NO: 123 и 129, соответственно) конструировали, связывая ПЦР-клонированные кДНК VL-областей мыши с каппа-цепью и IgG1 человека, соответственно. Тяжелые цепи химерных IgG1-антител 7A4 и 13F1 (SEQ ID NO: 119 и 125, соответственно) конструировали, связывая ПЦР-клонированные кДНК VH-областей мыши с константной областью IgG1 человека. Тяжелые цепи химерных IgG4-антител 7A4 и 13F1 (SEQ ID NO: 121 и 127, соответственно) конструировали, связывая ПЦР-клонированные кДНК VH-областей мыши с константной областью IgG4 человека. 5'-Концы последовательностей кДНК мыши модифицировали с использованием ПЦР-праймеров, предназначенных для добавления лидерной последовательности к легкой и тяжелой цепи.
[00121] Клетки Freestyle 293 (200 мл из расчета 106/мл) трансфицировали 100 мкг каждой из плазмид, экспрессирующих химерные тяжелые и легкие цепи, и культивировали в течение 6 дней. Затем химерные антитела очищали от супернатанта на колонке с белком G (GE healthcare). Связывание химерных антител с PD-1 измеряли с использованием твердофазного ИФА и Biacore, как описано выше в примерах 2 и 5; показано, что они связывались с PD-1 со сродством, сопоставимым со сродством исходного антитела мыши. В таблице 9 показаны EC50 связывания каждого из химерных антител против PD-1, измеренные с помощью твердофазного ИФА. В таблице 10 показаны IC50 блокады PD-L1 каждого из химерных антител против PD-1, измеренные с помощью твердофазного ИФА. В таблице 11 показаны EC50 связывания каждого из химерных антител против PD-1, измеренные с помощью FACS. В таблице 12 показаны IC50 блокады PD-L1 каждого из химерных антител против PD-1, измеренные с помощью FACS.
Таблица 9. EC50 связывания химерных антител против PD-1 на основе твердофазного ИФА
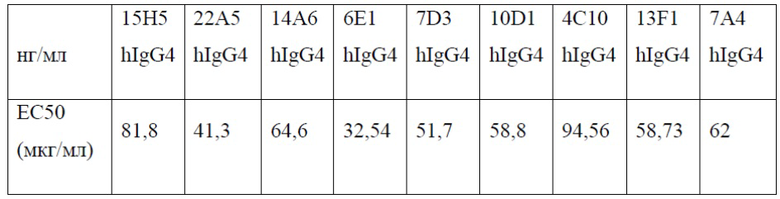
Таблица 10. IC50 блокады химерных антител против PD-1 на основе твердофазного ИФА
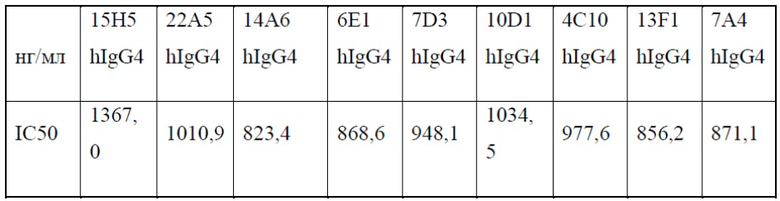
Таблица 11. EC50 связывания химерных антител против PD-1 на основе FACS
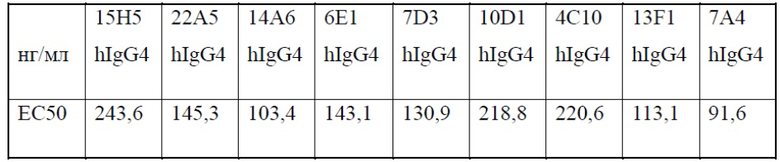
Таблица 12. IC50 блокады PD-L1 химерных антител против PD-1 на основе FACS
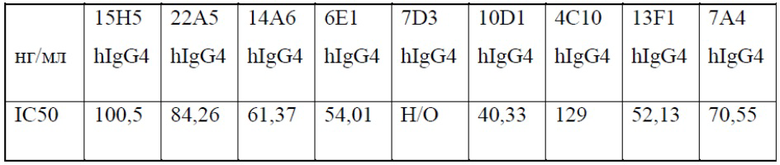
[00122] Реакции смешанной культуры лимфоцитов, описанные выше в примере 7, использовали для определения влияния химерных антител против PD-1 на секрецию ИЛ-2 (фигура 4) и ИФН-γ (фигура 5) Т-клетками. Каждое из химерных моноклональных антител против PD-1 стимулировало секрецию ИЛ-2 и ИФН-γ в СКЛ-анализе в зависимости от концентрации. В противоположность этому, изотипическое контрольное антитело (hIgG4) не вызывало секреции ИЛ-2 или ИФН-γ в любой протестированной концентрации.
[00123] Схема гуманизации антител
[00124] Антитела 7A4 и 13F1 гуманизировали с использованием способа пересадки CDR (патентСША№5225539, полностью включенный в настоящий документ посредством ссылки). Последовательности вариабельной области легкой и тяжелой цепи антител 7A4 и 13F1 мыши сравнивали с последовательностями, доступными в банке данных белковых последовательностей Research Collaboratory for Structural Bioinformatics (RCSB) путем поиска по базе данных NCBI http://www.ncbi.nlm.nih.gov/igblast/igblast.cgi. Соответственно, на основании структуры VH и VL с максимальной гомологией последовательности создали модели 7A4 и 13F1.
[00125] Матрицы антител человека для пересадки областей, определяющих комплементарность, (CDR) в VH и VL антител 7A4 и 13F1 мыши отбирали из эмбриональных антител человека, содержащих аминокислотную последовательность с высокой степенью гомологии по отношению к антителам 7A4 и 13F1 мыши путем поиска в базе данных структур IMGT/Domain Gap Align 3D, http://www.imgt.org/3Dstructure-DB/cgi/DomainGapAlign.cgi. Выбранная для 7A4 матрица VH человека представляла собой комбинацию IGHV2-5*10 и IGHJ4*01, а выбранная матрица VL человека представляла собой комбинацию IGKV1-33*01 и IGKJ2*01. Выбранная для 13F1 матрица VH человека представляла собой комбинацию IGHV3-21*04 и IGHJ4*01, а выбранная матрица VL человека представляла собой комбинацию IGKV7-3*01 и IGKJ2*01.
[00126] Аминокислотные последовательности CDR вышеупомянутых матриц антител человека заменили аминокислотными последовательностями CDR антител 7A4 и 13F1 мыши. Кроме того, в каркасы вышеупомянутых матриц VH и VL антител человека пересадили необходимые аминокислотные последовательности из VH и VL антител 7A4 и 13F1 мыши, получая функциональное гуманизированное антитело. Для VH и VL 7A4 и 13F1 несколько сайтов аминокислотной последовательности каркасной области вышеупомянутого матричного антитела человека подвергли обратной мутации до соответствующих аминокислотных последовательностей антитела мыши 7A4 и 13F1. Для вариабельной области легкой цепи гуманизированного антитела 7A4 аминокислоту в положении 40 мутировали из Tyr (Y) в Phe (F), а аминокислоту в положении 72 мутировали из Gly (G) в Arg (R); а для вариабельной области тяжелой цепи гуманизированного антитела 7A4 аминокислоту в положении 2 мутировали из Val (V) в Ile (I), аминокислоту в положении 46 мутировали из Glu (Е) в Lys (К), а аминокислоту в положении 70 мутировали из Phe (F) в Ile (I). Для вариабельной области легкой цепи гуманизированного антитела 13F1 аминокислота в положении 45 мутировали из Leu (L) в Pro (P), а аминокислоту в положении 70 мутировали из Phe (F) в Tyr (Y); а для вариабельной области тяжелой цепи гуманизированного антитела 13F1 аминокислоту в положении 26 мутировали из Gly (G) в Tyr (Y), аминокислоту в положении 48 мутировали из Ile (I) в Met (M), аминокислоту в положении 49 мутировали из Gly (G) в Ala (A), а аминокислоту в положении 67 мутировали из Val (V) в Ile (I), а аминокислоту в положении 71 мутировали из Val (V) в Arg (R).
[00127] Аминокислотным последовательностям вариабельной области легкой и тяжелой цепей гуманизированного антитела 13F1 присвоили SEQ ID NO: 143 и 141, соответственно. Сконструировали последовательности оснований ДНК, кодирующие указанные аминокислотные последовательности (SEQ ID NO: 140 и 142, соответственно). Аминокислотным последовательностям вариабельной области легкой и тяжелой цепей гуманизированного антитела 7A4 присвоили SEQ ID NO: 133 и 131, соответственно. Сконструировали последовательности оснований ДНК, кодирующие указанные аминокислотные последовательности (SEQ ID NO: 130 и 132, соответственно).
[00128] Получили IgG1- и IgG4-версии гуманизированных антител 7A4 и 13F1 (h13F1-IgG1, h13F1-IgG4, h7A4-IgG1 и h7A4-IgG4). Константная область IgG1 несет мутацию D265A (Clynes R, et al, Nature Medicine 6:443-446 (2000)), в то время как константная область IgG4 несет двойную мутацию F234A и L235A (Xu D, et al, Cellular Immunology 200:16-26 (2000)). Последовательности константных областей описаны в SEQ ID NO: 150 и 151. Полные аминокислотные последовательности легких и тяжелых цепей h13F1-IgG1 (SEQ ID NO: 149 и 145), h13F1-IgG4 (SEQ ID NO: 149 и 147), h7A4-IgG1 (SEQ ID NO: 139 и 135) и h7A4-IgG4 (SEQ ID NO: 139 и 137) приведены выше в таблице 3. Для удаления потенциального сайта дезамидирования в легкой цепи 7A4 Asn85 мутировали в Asp (h7A4D). Аминокислотные последовательности вариабельной области легкой цепи (SEQ ID NO: 152) и полной легкой цепи (SEQ ID NO: 153) также приведены выше в таблице 3.
[00129] Конструирование и экспрессия гуманизированных антител 7A4, 7A4D и 13F1
[00130] ДНК, кодировавшие легкие цепи и тяжелые цепи гуманизированных антител 7A4, 7A4D и 13F1, синтезировали и клонировали в экспрессирующем векторе pcDNA3.1 (Invitrogen, №по каталогу V-790). Клетки Freestyle 293 (200 мл из расчета 106/мл) трансфицировали 100 мкг каждой из плазмид, экспрессирующих гуманизированные тяжелые и легкие цепи, и культивировали в течение 6 дней. Затем гуманизированные антитела очищали от супернатанта на колонке с белком G (GE healthcare).
Пример 10: Исследование характеристик гуманизированных антител против PD-1 по отношению к активности и специфичности связывания и активности блокады лиганда (PD-L1)
[00131] После получения и очистки гуманизированных антител 13F1-hIgG1, 13F1-hIgG4, 7A4-IgG1 и 7A4-hIgG4 определяли связывание и специфичность антител посредством анализов связывания и блокады PD-1 на основе твердофазного ИФА, а также анализов связывания и блокады PD-L1 на основе FACS. Используемые способы были аналогичны способам, описанным выше в примерах 2 и 4.
[00132] При анализе связывания на основе твердофазного ИФА гуманизированные антитела 13F1 hu-13F1-hIgG1 и hu-13F1-hIgG4 демонстрировали связывание с PD-1, аналогичное связыванию химерного антитела 13F1 (фигура 6A, верхний график); а гуманизированные антитела 7A4 hu-7A4-D265A-hIgG1 и 7A4-huIgG4 демонстрировали связывание с PD-1, аналогичное связыванию химерного антитела 7A4 (фигура 6B, верхний график). В противоположность этому, изотипическое контрольное антитело hIgG4 не демонстрировало связывания с PD-1. На нижних графиках фигуры 6A и фигуры 6B показаны EC50 для каждого из протестированных антител, рассчитанные на основе данных твердофазного ИФА связывания, и продемонстрировано, что гуманизированные антитела 13F1 и 7A4 обладали связыванием с PD-1.
[00133] Аналогично, при анализе связывания на основе FACS гуманизированные антитела 13F1 hu-13F1-hIgG1 и hu-13F1-hIgG4 (фигура 7A, верхний график) и гуманизированные антитела 7A4 hu-7A4-D265A-hIgG1 и 7A4-huIgG4 (фигура 7B, верхний график) демонстрировали связывание с PD-1.EC50, рассчитанные на основе данных FACS-анализа связывания для гуманизированных антител 13F1 и 7A4, показаны на фигуре 7А и фигуре 7B, соответственно.
[00134] На фигуре 8 показаны результаты анализов блокирования лиганда на основе твердофазного ИФА для гуманизированных антител 13F1 и 7A4. Как показано на фигуре 8А и фигуре 8B, гуманизированные антитела 13F1 и 7A4, соответственно, демонстрировали активность блокады лиганда, аналогичную активности соответствующих химерных антител. Количественное определение IC50 для каждого гуманизированного и химерного антитела показано на фигуре 8C.
[00135] На фигуре 9 показано, что каждое из гуманизированных антител 13F1 и 7A4 блокировало связывание PD-L1, измеряемое при анализе блокады лиганда на основе FACS. На нижнем графике фигуры 9 представлены IC50 каждого из гуманизированных антител.
Пример 11: Анализ кинетики гуманизированных антител 13F1, 7A4 и 7A4D против PD-1 с помощью Biacore
[00136] Для исследования характеристик связывания гуманизированных антител кинетику связывания PD-1 и антител против PD-1 измеряли с помощью Biacore3000 и регистрировали при частоте сбора данных 1 Гц. Поликлональное антитело кролика против IgG мыши (GE, BR-1008-38) разбавляли 10 mM (pH 5,0) ацетатом натрия и иммобилизовали на эталонную и экспериментальную проточные ячейки биосенсорного чипа CM5 до приблизительно 15000 ЕО с использованием набора для связывания аминогрупп (GE, BR10050). В начале каждого цикла разбавленное тестируемое антитело (1,5 мкг/мл) вводили в экспериментальную проточную ячейку в течение 1 минуты для захвата. Серии анализируемого соединения PD-1 получали путем разбавления исходного раствора проточным буфером до 100 нМ с последующим 2X последовательным разбавлением этим же буфером до 0,78 нМ. Анализируемые соединения последовательно вводили в эталонную и экспериментальную проточные ячейки в течение 3 минут при скорости потока 30 мкл/минуту. Затем пропускали проточный буфер (PBS с 0,05% P20) в течение 10 минут при скорости потока 30 мкл/минуту. В конце каждого цикла поверхность биосенсора регенерировали в течение 3 минут посредством введения 10 мМ (pH 1,7) глицин-HCl-буфера при скорости потока 10 мкл/минуту. Для каждого введения образца анализируемого соединения (т.е. каждого цикла) ответы связывания, полученные с поверхности экспериментального биосенсора, дважды корректировали, вычитая одновременно записанные ответы с эталонной поверхности с последующим дополнительным вычитанием ответов однократно скорректированного образца проточного буфера. Константы скорости ассоциации и диссоциации (ka и kd) определяли одновременно путем аппроксимации дважды скорректированных сенсограмм всей серии титрования моделью Ленгмюра (1:1) с помощью программного обеспечения Biaevaluation 4,0. Константу диссоциации KD рассчитывали на основе определенных констант скорости по формуле KD=kd/ka. Как показано на фигурах 10 и 17A, гуманизированные антитела 13F1, 7A4 и 7A4D против PD-1 связывали PD-1 человека с высоким сродством. Кривые связывания Biacore приведены на фигурах 10 и 17A (верхние графики), а сводные количественные данные связывания приведены на фигурах 10 и 17A (нижние графики). На фигуре 17B показана IC50 блокады связывания PD-L1 с клетками 293T-PD1 за счет антитела 7A4D-hIgG4.
Пример 12: Действие гуманизированных антител против PD-1 на продукцию цитокинов в реакции смешанной культуры лимфоцитов (СКЛ).
[00137] Реакцию смешанной культуры лимфоцитов (СКЛ) использовали для демонстрации способности гуманизированных антител блокировать путь PD-1 в эффекторных лимфоцитах. В данном анализе тестировали Т-клетки на предмет секреции ИФН-γ и ИЛ-2 в присутствии или в отсутствие антител против PD-1. CD4+ Т-клетки человека очищали от МПК человека с помощью набора для выделения и отбора CD4 отрицательных клеток (Miltenyi Biotech, № по каталогу 130-091-155). Незрелые дендритные клетки (DC) получали из моноцитов, выделенных из МПК человека с помощью Mo-DC Generation Toolbox (Miltenyi, №по каталогу 130-093-568). Клетки культивировали со средой для дифференцировки Mo-DC в течение 7 дней, а затем индуцировали созревание DC с помощью среды для созревания Mo-Dc в течение 2 дней. Для настройки СКЛ в каждую лунку добавляли 105 очищенных Т-клеток и 104 аллогенных зрелых дендритных клеток в общем объеме 200 мкл. Тестируемое антитело анализировали в диапазоне концентраций от 20 мкг/мл до 0,002 мкг/мл. Отсутствие антитела или изотипическое контрольное антитело (hIgG4) использовали в качестве отрицательного контроля. Клетки культивировали в течение 5 дней при 37°C. На 6-й день измеряли уровни ИФН-γ и ИЛ-2 в культуральной среде с помощью набора для твердофазного ИФА ИЛ-2 (eBioscience) и набора для твердофазного ИФА hIFN-γ (R&D, №по каталогу DY285). Результаты для гуманизированных антител 13F1 показаны на фигуре 11 (продукция ИЛ-2) и фигуре 12 (продукция ИФН-γ). Каждое из гуманизированных антител 13F1 стимулировало продукцию ИЛ-2 и ИФН-γ в зависимости от концентрации. Аналогичным образом, гуманизированные антитела 7A4 и 7A4D стимулировали продукцию ИЛ-2 (фигуры 13 и 18) и ИФН-γ (фигуры 14 и 19) в зависимости от концентрации. Культуры, содержащие изотипическое контрольное антитело, не демонстрировали увеличения секреции ИФН-γ и ИЛ-2. Таким образом, результаты исследования показали, что гуманизированные антитела против PD-1 блокируют путь PD-1, стимулируя Т-клеточный иммунный ответ.
Пример 13: Гуманизированное антитело против PD-1 усиливает вторичный Т-клеточный ответ у человека на стимуляцию столбнячным анатоксином
[00138] Для исследования возможности модуляции антиген-специфического Т-клеточного рецептора за счет блокирования пути PD-1/PD-L1 с помощью антител против PD-1 использовали анализ вторичного Т-клеточного ответа у человека на антиген столбнячного анатоксина (TT) с целью стимуляции уже существующих Т-клеток памяти в крови здоровых доноров, иммунизированных TT. С этой целью свежесобранные МПК (образцы, собранные в течение менее 1 года) доноров, иммунизированных TT, высевали в 96-луночные круглодонные планшеты (costar, №по каталогу 3799) из расчета 4×105 клеток/лунку с использованием RPMI1640 (Invitrogen, №по каталогу A10491-01) с добавлением 80 ед/мл пенициллина, 80 г/мл стрептомицина и 30% аутологичной сыворотки. Гуманизированные антитела 13F1 или 7A4 добавляли в различных концентрациях и выполняли стимуляцию 0,1 мкг/мл SEB и 1 мкг/мл TT (Astarte Biologies). После совместного культивирования в течение 7 дней при 37°C и 5% CO2 собирали супернатант и измеряли концентрацию ИФН-γ. Результаты исследования приведены на фигуре 15 и демонстрируют, что, по сравнению с использованием только антигена TT, блокада PD-L1 антителами против PD-1 приводила к усилению секреции ИФН-γ T-клетками памяти.
Пример 14: Влияние гуманизированного антитела против PD-1 на активацию аутологичных Т-клеток.
[00139] В этом примере исследовали влияние блокирования пути PD-/PD-L1 гуманизированным антителом против PD-1 на активацию Т-клеток. Очищенные CD4+ T-клетки человека (Mitenyi Biotech, № по каталогу 130-091-155) активировали 1 мкг/мл растворимого антитела против CD3 (R&D, № по каталогу MAB100) в присутствии аутологичных дендритных клеток (DC) моноцитарного происхождения. Через три дня с момента активации в присутствии или отсутствии титруемого антитела против PD-1 собирали культуральную среду и измеряли концентрацию ИФН-γ посредством твердофазного ИФА. Результаты приведены на фигуре 16 и показывают, что блокада PD-L1 антителами против PD-1 усиливала секрецию ИФН-γ T-клетками.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-PD-L1 АНТИТЕЛА | 2015 |
|
RU2722212C2 |
| КОМБИНИРОВАННЫЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ РАКА ПОЧЕК | 2021 |
|
RU2830590C2 |
| КОМБИНИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ОПУХОЛИ | 2020 |
|
RU2829637C2 |
| АНТИТЕЛА ПРОТИВ ЛИГАНДА ПРОГРАММИРУЕМОЙ СМЕРТИ (PD-L1) И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2761638C1 |
| НОВЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1(PD-1) | 2016 |
|
RU2757316C2 |
| СПОСОБЫ И АНТИТЕЛА ДЛЯ МОДУЛЯЦИИ ИММУННОГО ОТВЕТА | 2016 |
|
RU2757489C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2013 |
|
RU2599417C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2006 |
|
RU2494107C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩИЕ СВЯЗЫВАЮЩИЕ TIGIT АГЕНТЫ | 2017 |
|
RU2765410C2 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |



















































































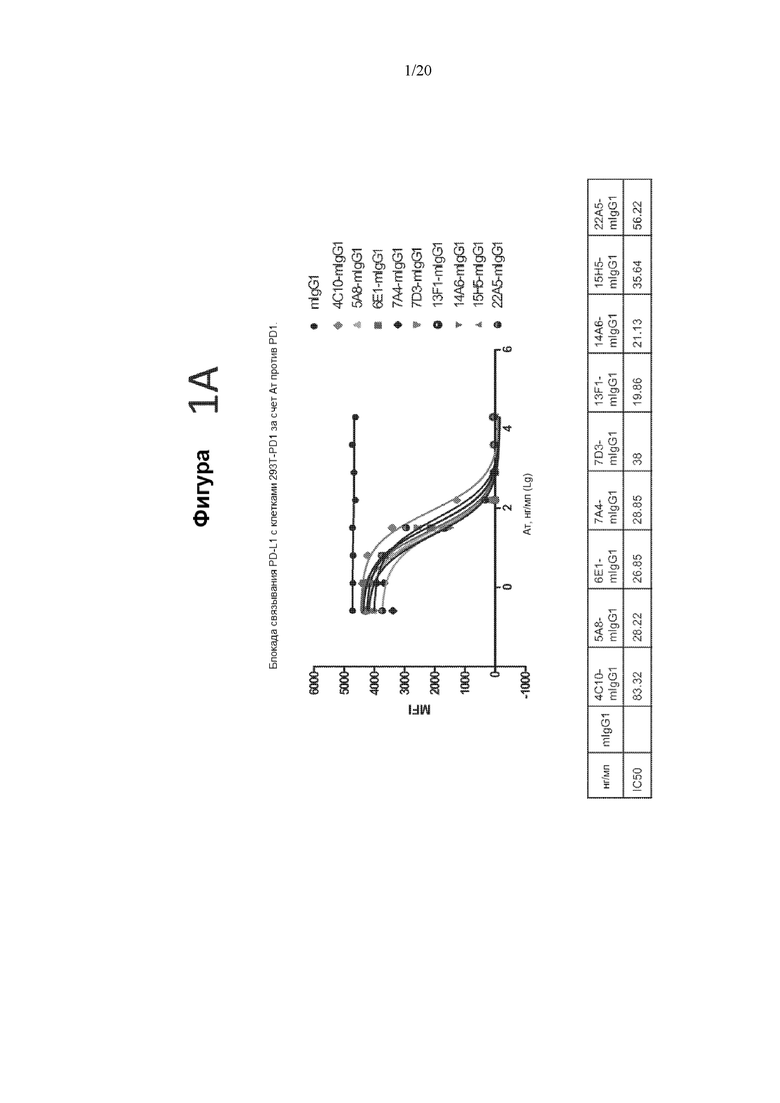
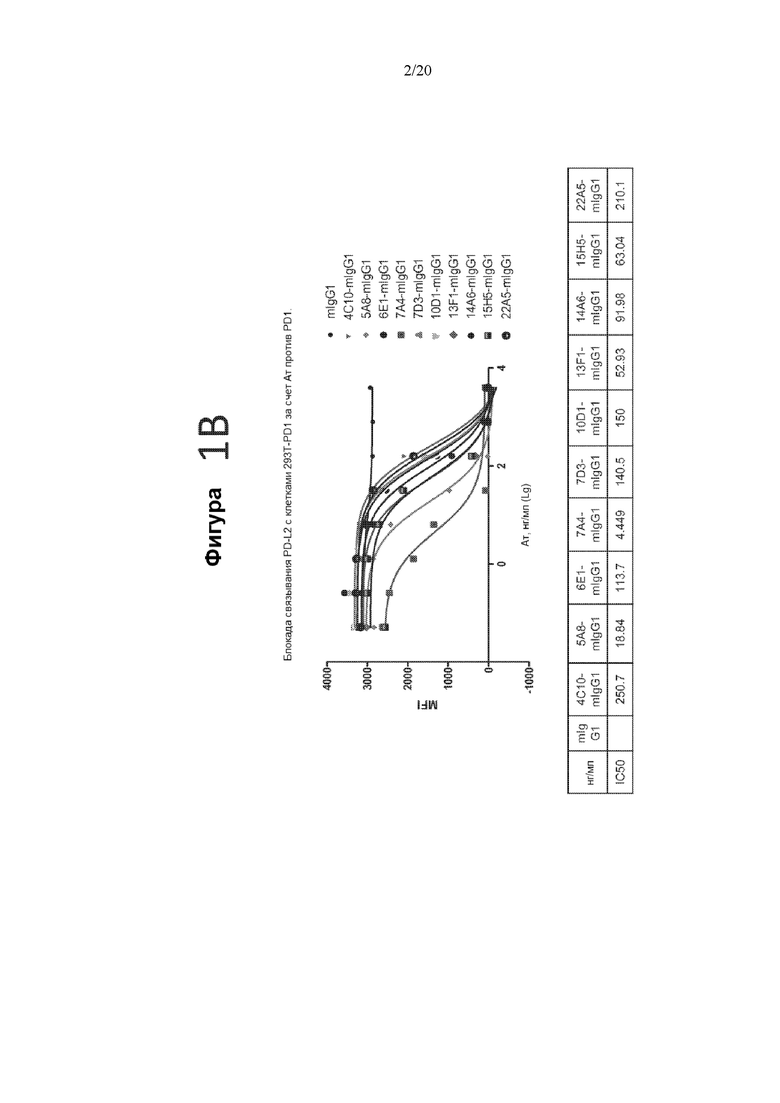
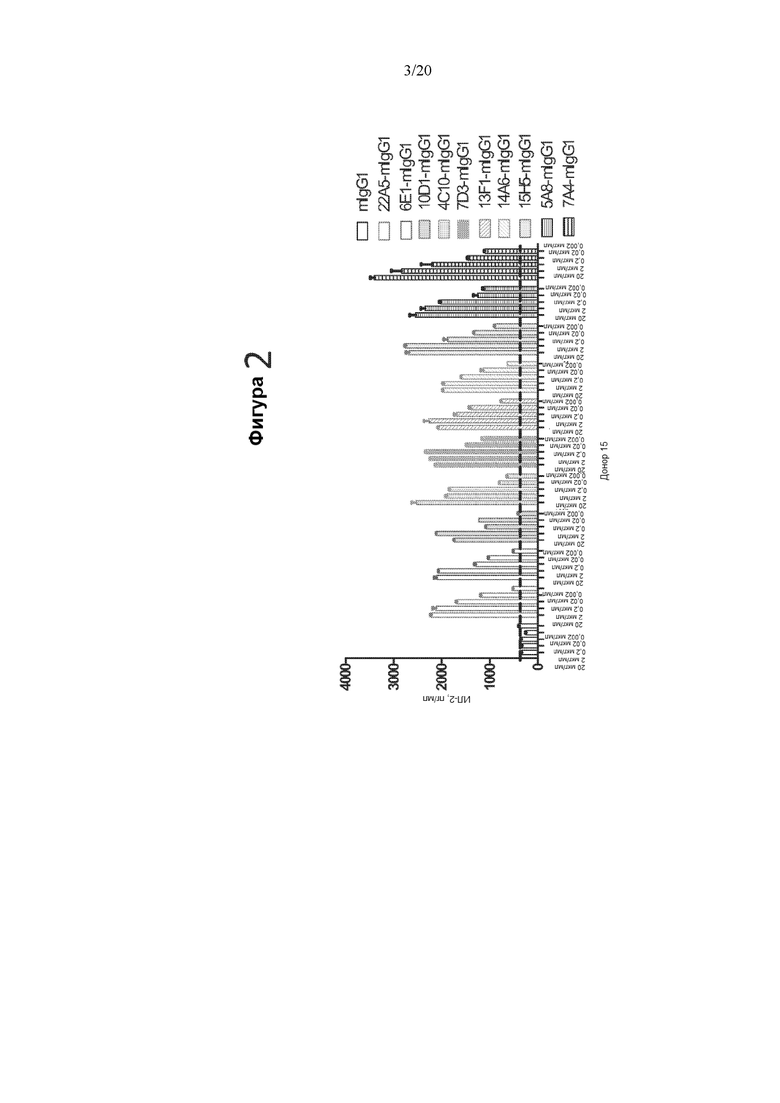

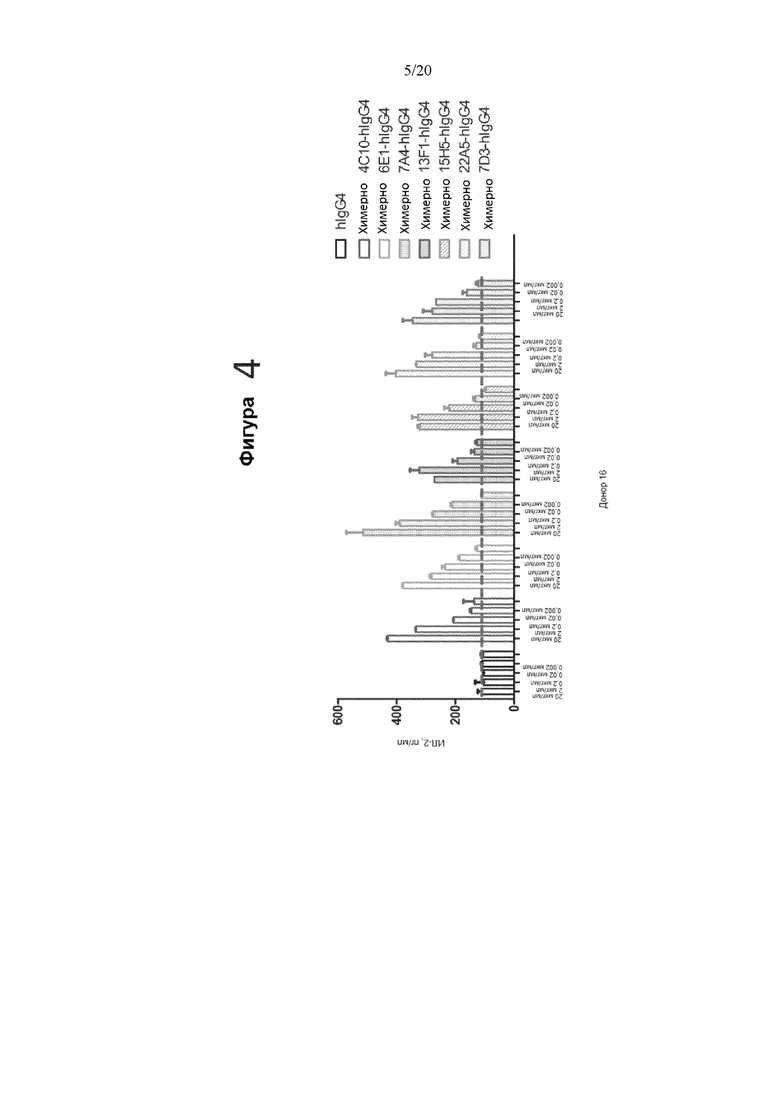

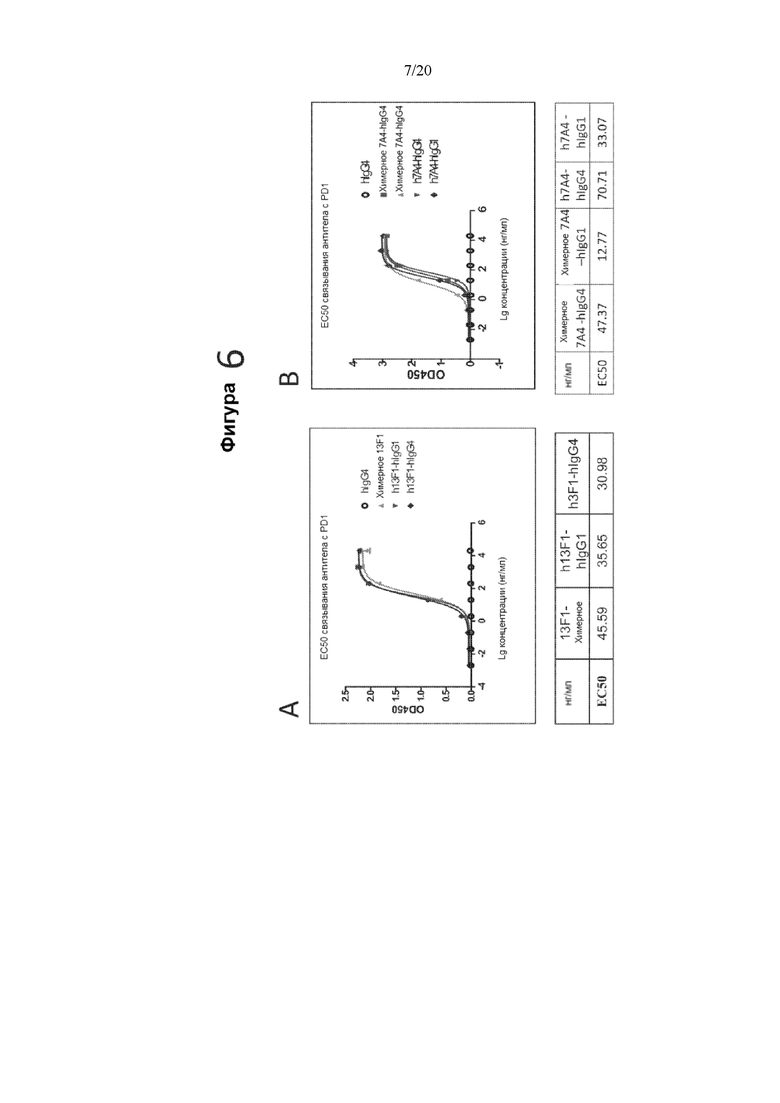
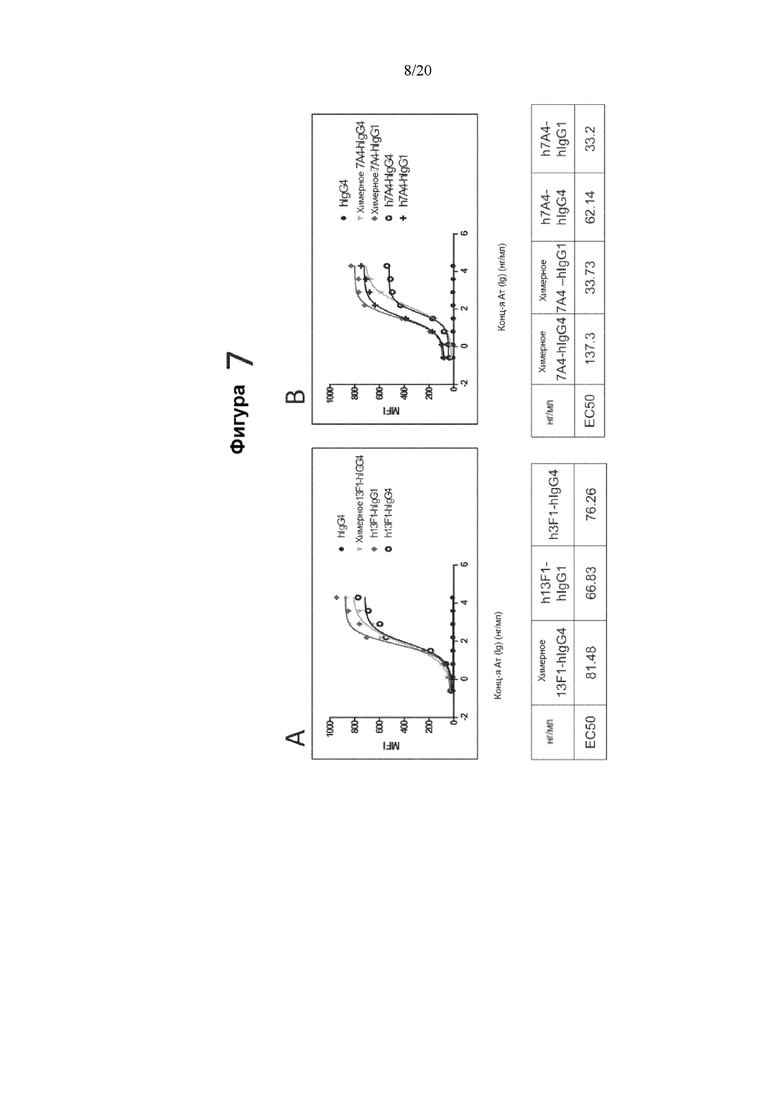
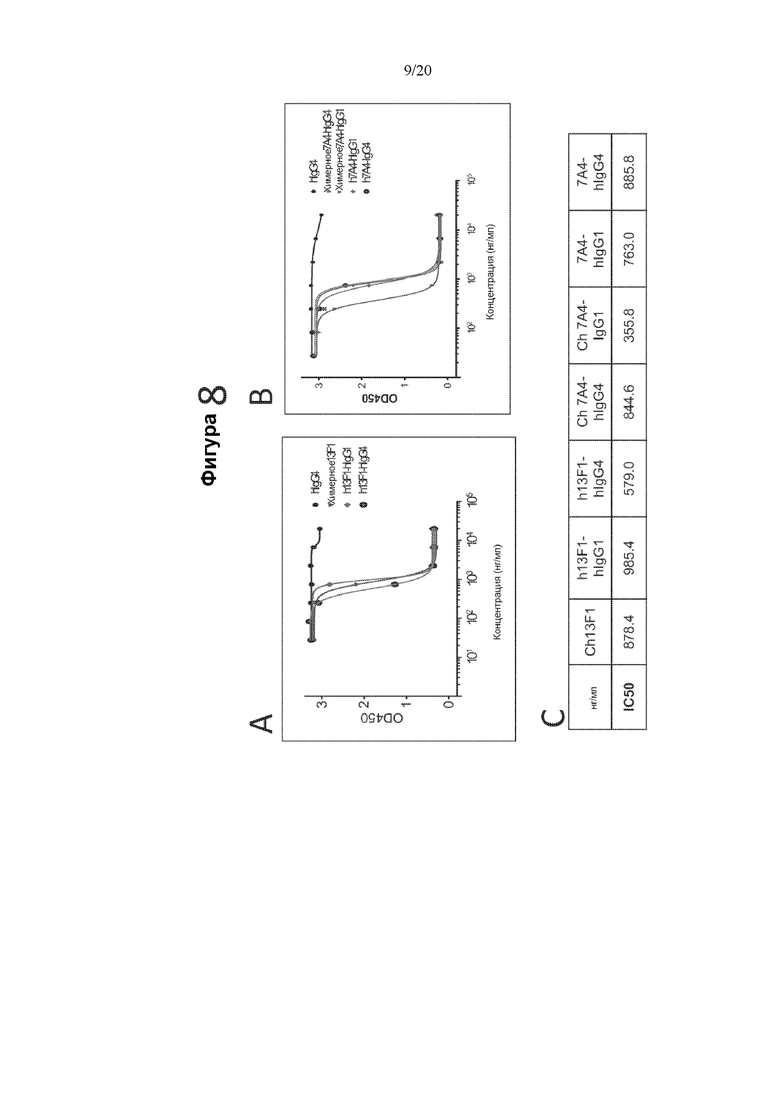
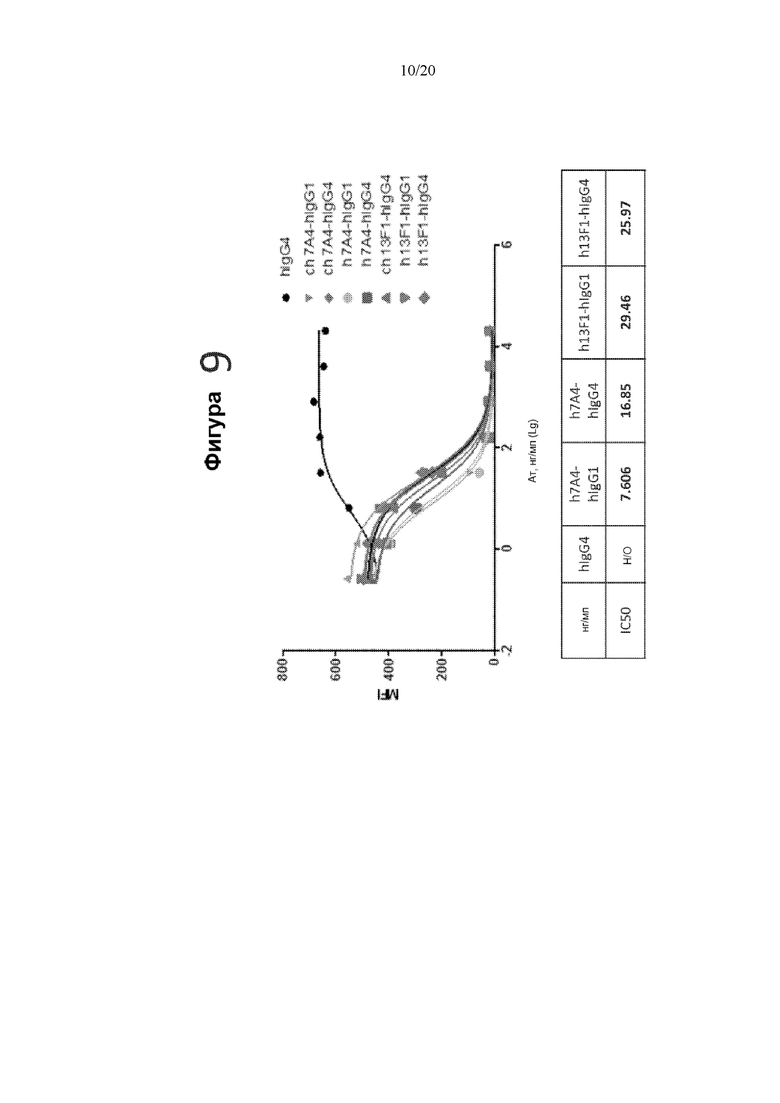
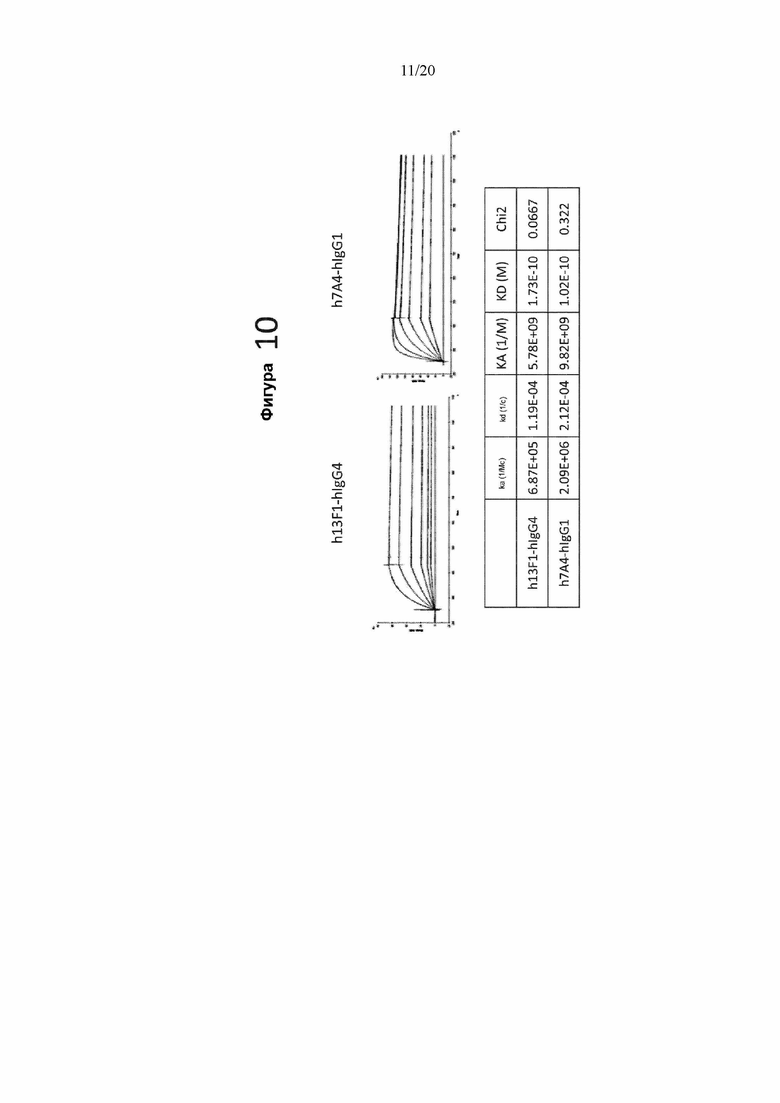
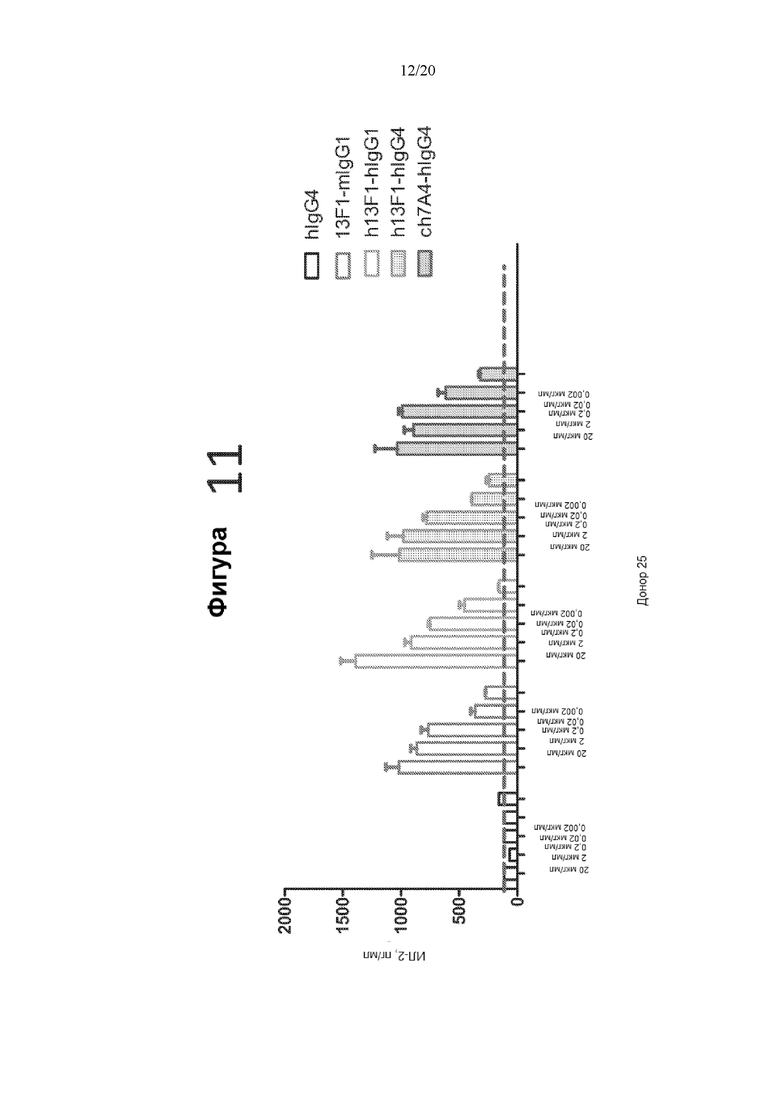
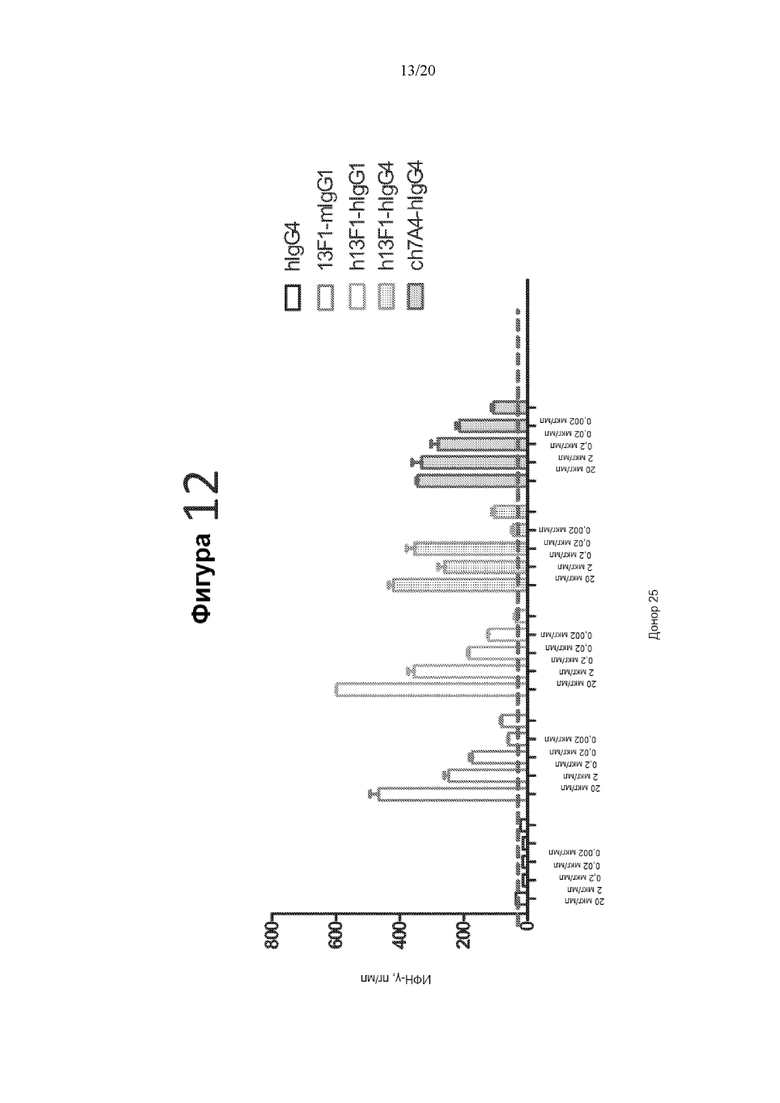


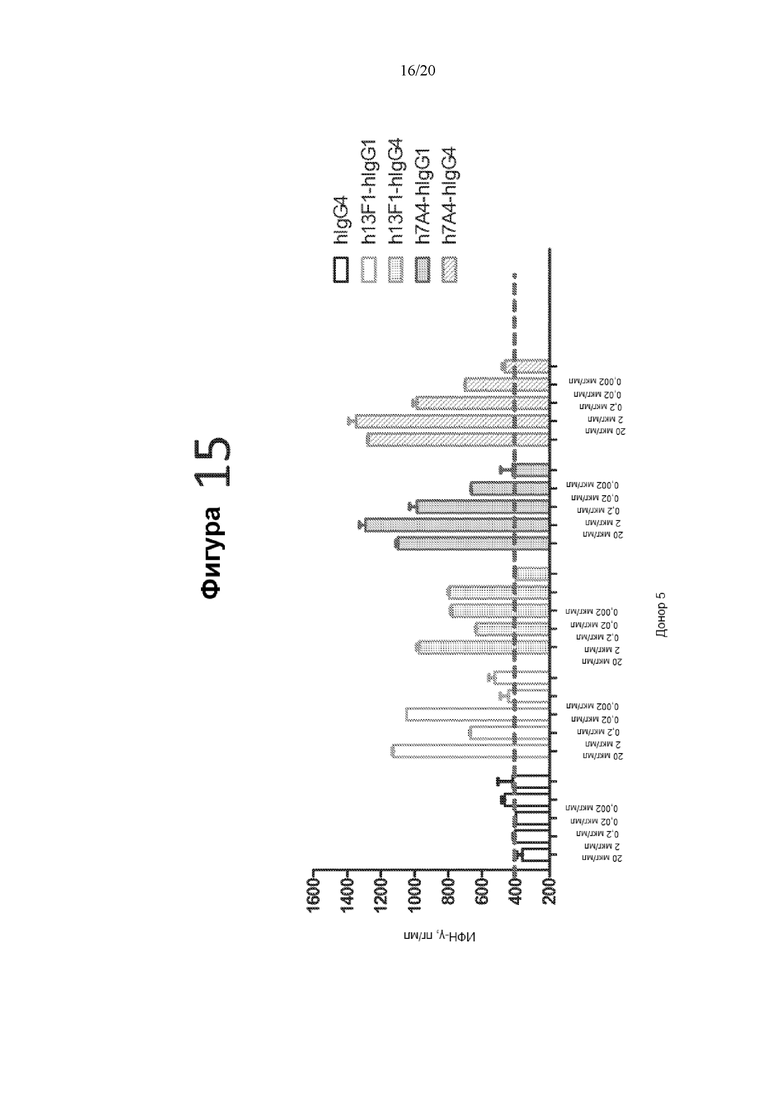
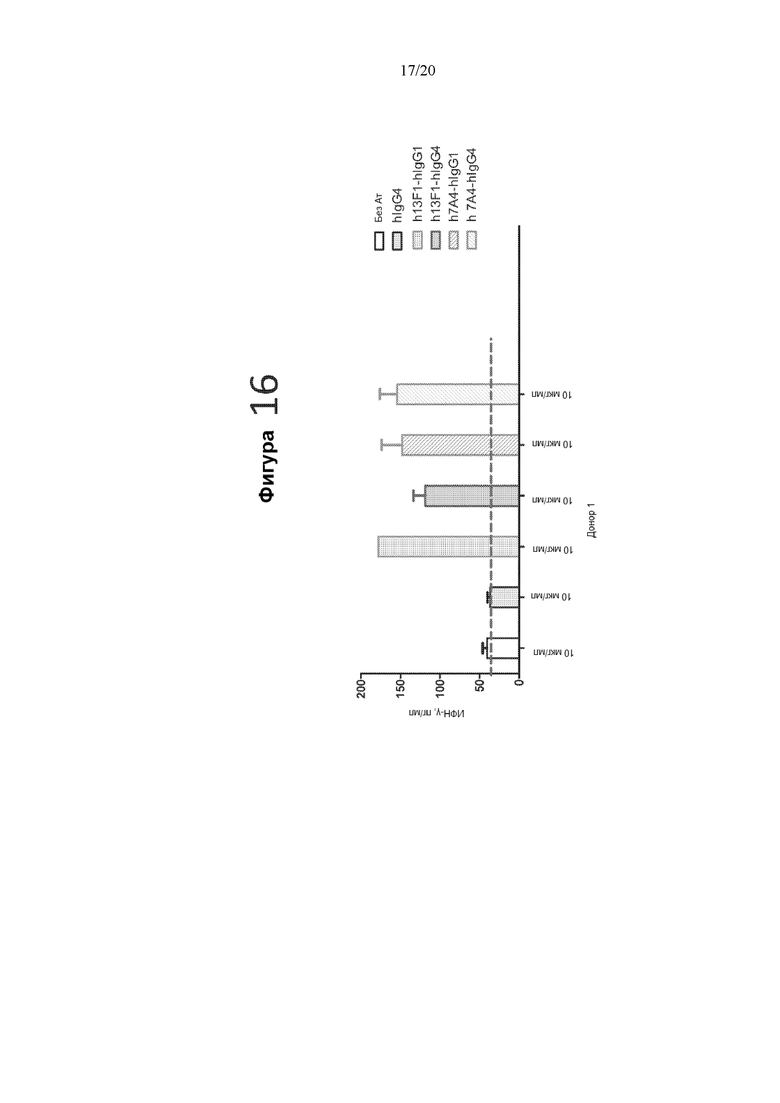
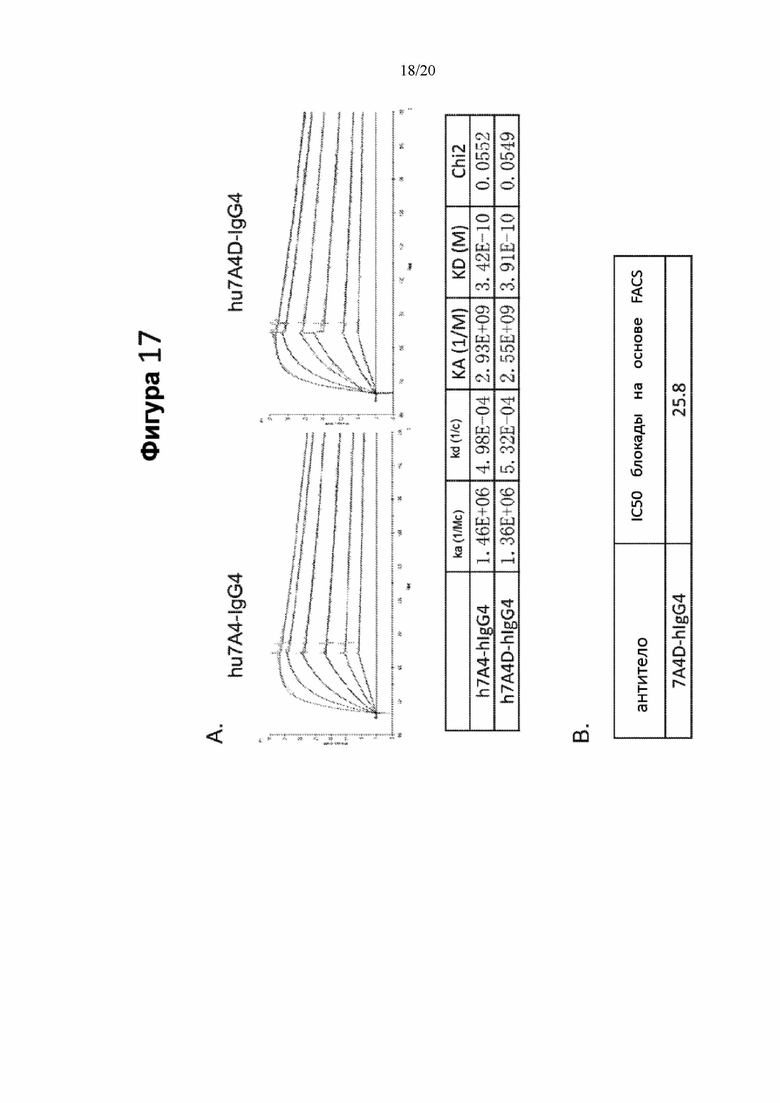
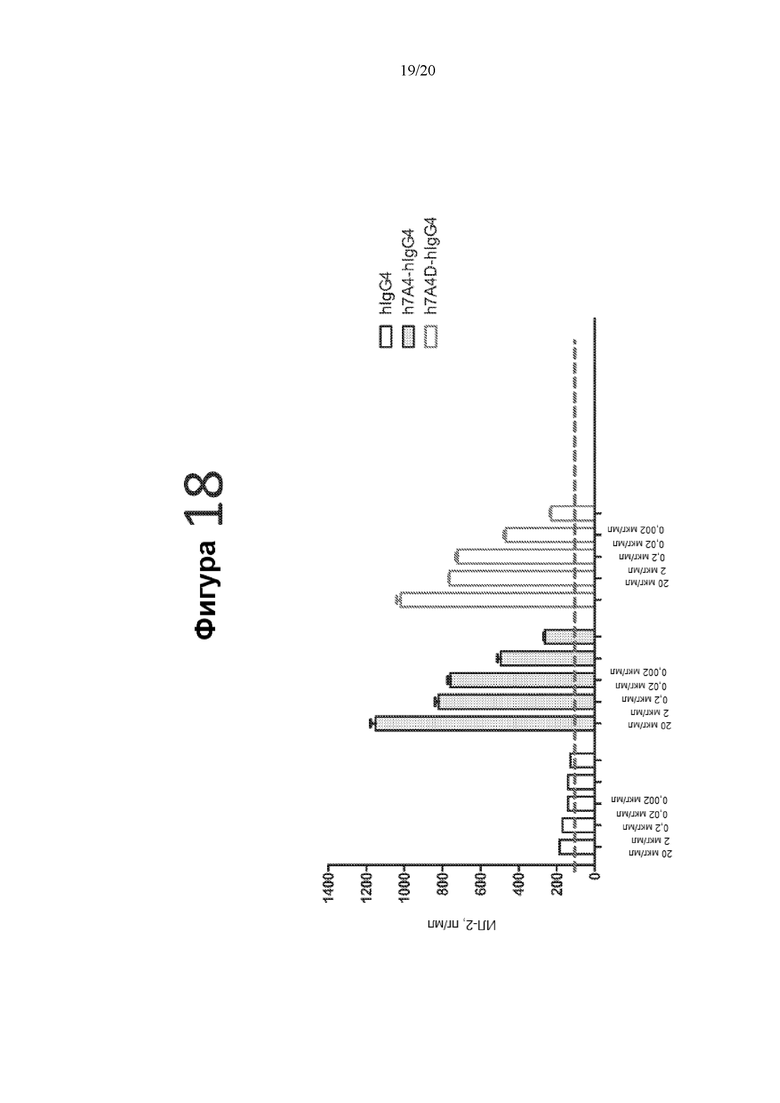
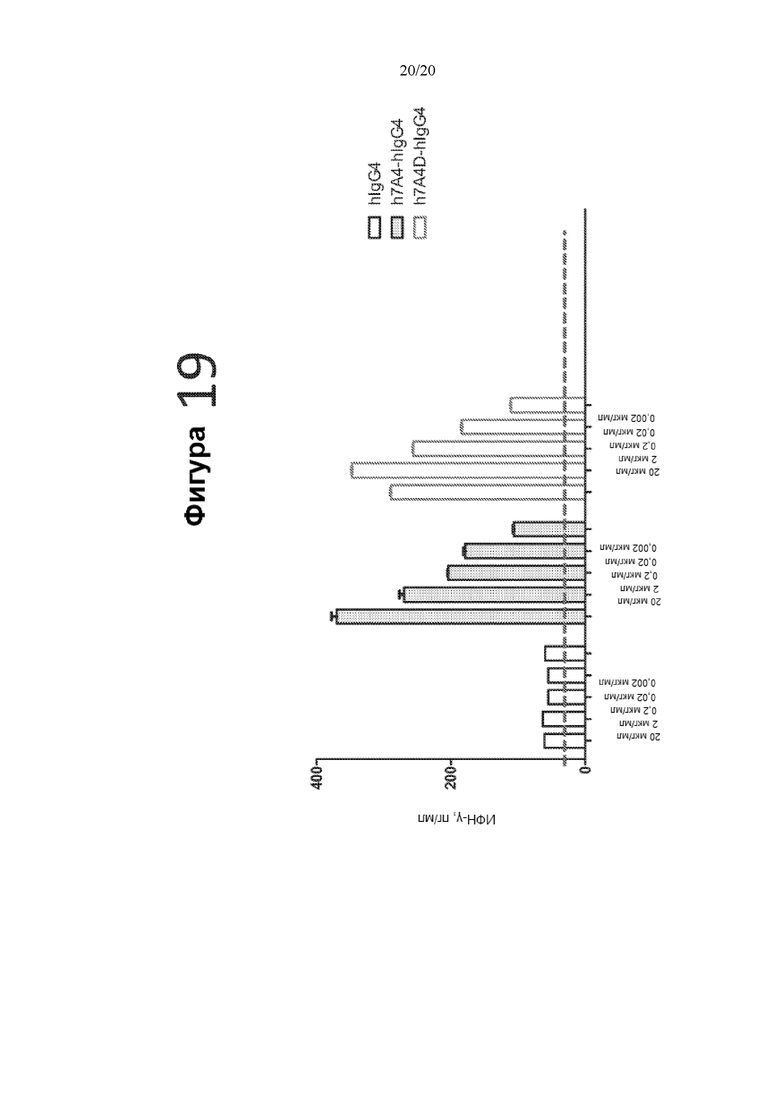
Группа изобретений относится к иммунологии, в частности к антителам и их антиген-связывающим фрагментам, специфически связывающимся с PD-1, а также к способам применения таких антител и антиген-связывающих фрагментов, в частности, для лечения рака и инфекционного заболевания, ассоциированных с экспрессией PD-1. Предложенные антитела против PD-1 блокируют путь PD-1, стимулируя Т-клеточный иммунный ответ, приводят к усилению секреции ИЛ-2 и/или ИФНγ и усиливают ответ Т-клеток памяти. 16 н. и 24 з.п. ф-лы, 19 ил., 12 табл., 14 пр.
1. Выделенное антитело или его антиген-связывающий фрагмент, специфически связывающиеся с PD-1, причем указанное антитело или его фрагмент содержат:
(i) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 24, 25 и 26 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 19, 20 и 21 соответственно;
(ii) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 34, 35 и 36 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 29, 30 и 31 соответственно;
(iii) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 45, 46 и 47 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 40, 41 и 42 соответственно;
(iv) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 55, 56 и 57 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 50, 51 и 52 соответственно;
(v) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 65, 66 и 67 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 60, 61 и 62 соответственно;
(vi) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 75, 76 и 77 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 70, 71 и 72 соответственно;
(vii) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 85, 86 и 87 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 80, 81 и 82 соответственно;
(viii) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 95, 96 и 97 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 90, 91 и 92 соответственно;
(ix) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 105, 106 и 107 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 100, 101 и 102 соответственно; или
(x) последовательности CDR1, CDR2 и CDR3 легкой цепи, содержащие SEQ ID NO: 115, 116 и 117 соответственно, и последовательности CDR1, CDR2 и CDR3 тяжелой цепи, содержащие SEQ ID NO: 110, 111 и 112 соответственно.
2. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 24, 25 и 26 соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 19, 20 и 21 соответственно.
3. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 34, 35 и 36 соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 29, 30 и 31 соответственно.
4. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 45, 46 и 47,соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 40, 41 и 42 соответственно.
5. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 55, 56 и 57 соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 50, 51 и 52 соответственно.
6. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 65, 66 и 67 соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 60, 61 и 62 соответственно.
7. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 75, 76 и 77 соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 70, 71 и 72 соответственно.
8. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 85, 86 и 87 соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 80, 81 и 82 соответственно.
9. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 95, 96 и 97 соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 90, 91 и 92 соответственно.
10. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 105, 106 и 107 соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 100, 101 и 102 соответственно.
11. Антитело или фрагмент по п. 1, отличающиеся тем, что антитело или его фрагмент содержат CDR1, CDR2 и CDR3 легкой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 115, 116 и 117 соответственно; и CDR1, CDR2 и CDR3 тяжелой цепи, содержащие аминокислотную последовательность согласно SEQ ID NO: 110, 111 и 112 соответственно.
12. Выделенное антитело или его фрагмент по любому из пп. 1-11, отличающиеся тем, что антитело или его фрагмент являются химерными или гуманизированными.
13. Выделенное антитело или его фрагмент по п.1, специфически связывающиеся с PD-1, причем указанное антитело или его фрагмент содержат:
(i) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 23, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 18;
(ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 33, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 28;
(iii) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 44, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 39;
(iv) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 54, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 49;
(v) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 64, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 59;
(vi) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 74, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 69;
(vii) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 84, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 79;
(viii) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 94, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 89;
(ix) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 104, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 99;
(x) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 114, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 109;
(xi) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 133, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 131;
(xii) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 143, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 141; или
(xiii) вариабельную область легкой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO: 152, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, обладающую по меньшей мере 90% гомологией с SEQ ID NO:131.
14. Выделенное антитело или его фрагмент по п. 13, отличающиеся тем, что антитело или его фрагмент содержат:
(i) вариабельную область легкой цепи, содержащую SEQ ID NO: 23, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 18;
(ii) вариабельную область легкой цепи, содержащую SEQ ID NO: 33, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 28;
(iii) вариабельную область легкой цепи, содержащую SEQ ID NO: 44, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 39;
(iv) вариабельную область легкой цепи, содержащую SEQ ID NO: 54, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 49;
(v) вариабельную область легкой цепи, содержащую SEQ ID NO: 64, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 59;
(vi) вариабельную область легкой цепи, содержащую SEQ ID NO: 74, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 69;
(vii) вариабельную область легкой цепи, содержащую SEQ ID NO: 84, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 79;
(viii) вариабельную область легкой цепи, содержащую SEQ ID NO: 94, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 89;
(ix) вариабельную область легкой цепи, содержащую SEQ ID NO: 104, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 99;
(x) вариабельную область легкой цепи, содержащую SEQ ID NO: 114, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 109;
(xi) вариабельную область легкой цепи, содержащую SEQ ID NO: 133, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 131;
(xii) вариабельную область легкой цепи, содержащую SEQ ID NO: 143, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 141; или
(xiii) вариабельную область легкой цепи, содержащую SEQ ID NO: 152, и вариабельную область тяжелой цепи, содержащую SEQ ID NO: 131.
15. Выделенное антитело или его фрагмент, специфически связывающиеся с PD-1, причем указанные антитело или его фрагмент содержат вариабельную область легкой цепи согласно SEQ ID NO: 133 или 152 и вариабельную область тяжелой цепи согласно SEQ ID NO: 131.
16. Выделенное антитело или его фрагмент, специфически связывающиеся с PD-1, причем указанные антитело или его фрагмент содержат вариабельную область легкой цепи согласно SEQ ID NO: 143 и вариабельную область тяжелой цепи согласно SEQ ID NO: 141.
17. Выделенное антитело или его фрагмент, специфически связывающиеся с PD-1, причем указанные антитело или его фрагмент содержат легкую цепь согласно SEQ ID NO: 139 или 153 и тяжелую цепь согласно SEQ ID NO: 135.
18. Выделенное антитело или его фрагмент, специфически связывающиеся с PD-1, причем указанные антитело или его фрагмент содержат легкую цепь согласно SEQ ID NO: 139 или 153 и тяжелую цепь согласно SEQ ID NO: 137.
19. Выделенное антитело или его фрагмент, специфически связывающиеся с PD-1, причем указанные антитело или его фрагмент содержат легкую цепь согласно SEQ ID NO: 149 и тяжелую цепь согласно SEQ ID NO: 145.
20. Выделенное антитело или его фрагмент, специфически связывающиеся с PD-1, причем указанные антитело или его фрагмент содержат легкую цепь согласно SEQ ID NO: 149 и тяжелую цепь согласно SEQ ID NO: 147.
21. Выделенное антитело или его фрагмент по любому из пп. 1-11, 13-20, отличающиеся тем, что указанное антитело представляет собой моноклональное антитело, а антиген-связывающий фрагмент выбран из группы, состоящей из scFv, Fab-фрагмента, Fab'-фрагмента или F(ab)’-фрагмента.
22. Выделенное антитело или его фрагмент по п. 1, специфически связывающиеся с PD-1, причем указанные антитело или его фрагмент обладают сродством по отношению к PD-1, составляющим от приблизительно 1 нМ до приблизительно 0,01 нМ.
23. Выделенное антитело или его фрагмент по п. 22, отличающиеся тем, что указанные антитело или его фрагмент обладают сродством по отношению к PD-1, составляющим приблизительно 1 нМ или менее.
24. Выделенное антитело или его фрагмент по п. 22, отличающиеся тем, что указанные антитело или его фрагмент обладают сродством по отношению к PD-1, составляющим приблизительно 0,1 нМ или менее.
25. Выделенное антитело или его фрагмент по п. 1, специфически связывающиеся с PD-1, причем указанное антитело обладает EC50 связывания, составляющей от приблизительно 5 нг/мл до приблизительно 1000 нг/мл.
26. Выделенное антитело или его фрагмент по п. 1, специфически связывающиеся с PD-1, причем указанное антитело блокирует связывание PD-1 с PD-L1.
27. Выделенное антитело или его фрагмент по п. 26, отличающиеся тем, что указанное антитело блокирует связывание PD-1 с PD-L1 или PD-L2 с IC50, составляющей от приблизительно 5 нг/мл до приблизительно 1000 нг/мл.
28. Выделенное антитело или его фрагмент по п. 1, специфически связывающиеся с PD-1, причем указанные антитело или его фрагмент усиливают активацию Т-клеток, измеряемую по продукции воспалительных цитокинов.
29. Выделенное антитело или его фрагмент по п. 28, отличающиеся тем, что указанные антитело или его фрагмент усиливают продукцию ИЛ-2 и ИФН-γ Т-клетками.
30. Композиция для лечения расстройства, ассоциированного с экспрессией PD-L1, содержащая эффективное количество антитела или его фрагмента по любому из пп. 1-29 и фармацевтически приемлемый носитель.
31. Выделенный полинуклеотид, кодирующий антитело или его фрагмент по любому из пп. 1-29.
32. Экспрессирующий вектор, содержащий выделенный полинуклеотид по п. 31.
33. Клетка-хозяин для продуцирования антитела или его фрагмента по любому из пп. 1-29, содержащая экспрессирующий вектор по п. 32.
34. Способ усиления активации Т-клеток, причем указанный способ включает контакт Т-клеток с антителом или его фрагментом по любому из пп. 1-29.
35. Способ уменьшения опухолей, ассоциированных с экспрессией PD-L1, у субъекта, причем указанный способ включает введение субъекту терапевтически эффективного количества выделенного антитела или его фрагмента по любому из пп. 1-29.
36. Способ лечения рака, ассоциированного с экспрессией PD-L1, у субъекта, нуждающегося в этом, причем указанный способ включает введение терапевтически эффективного количества выделенного антитела или его фрагмента по любому из пп. 1-29 субъекту.
37. Способ по п. 36, отличающийся тем, что рак выбран из группы, состоящей из лимфомы, лейкоза, меланомы, глиомы, рака молочной железы, рака легких, рака толстой кишки, рака костей, рака яичников, рака мочевого пузыря, рака почек, рака печени, рака желудка, рака прямой кишки, рака яичка, рака слюнных желез, рака щитовидной железы, рака тимуса, эпителиального рака, рака головы или шеи, рака желудка, рака поджелудочной железы или их комбинации.
38. Способ лечения инфекционного заболевания, ассоциированного с экспрессией PD-L1, у субъекта, нуждающегося в этом, причем указанный способ включает введение терапевтически эффективного количества выделенного антитела или его фрагмента по любому из пп. 1-29 субъекту.
39. Способ по п. 38, отличающийся тем, что инфекционное заболевание выбрано из группы, состоящей из кандидоза, кандидемии, аспергиллеза, стрептококковой пневмонии, стрептококковых заболеваний кожи и ротоглотки, сепсиса, вызванного грамотрицательными бактериями, туберкулеза, мононуклеоза, гриппа, респираторных заболеваний, вызванных респираторно-синцитиальным вирусом, малярии, шистосомоза и трипаносомоза.
40. Способ ингибирования роста опухолевых клеток, ассоциированных с экспрессией PD-L1, у субъекта, причем указанный способ включает введение субъекту терапевтически эффективного количества выделенного антитела или его фрагмента по любому из пп. 1-29.
| US 2013133091 A1, 23.05.2013 | |||
| US 2011008369 A1, 13.01.2011 | |||
| WO 2011110604 A1, 15.09.2011 | |||
| US 8735553 B1, 27.05.2014 | |||
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ИНФЕКЦИЙ И ОПУХОЛЕЙ | 2007 |
|
RU2478400C2 |
| US 6808710 B1, 26.10.2004. | |||
Авторы
Даты
2020-01-15—Публикация
2015-07-22—Подача