Область изобретения
Настоящее изобретение относится к областям органической химии и медицинской химии, в частности к замещенному фосфорсодержащей группой хинолину, способу его получения, фармацевтической композиции, содержащей это соединение, и применению.
Предшествующий уровень техники
Протеинкиназа представляет собой вид фосфотрансферазы и обладает функцией переноса γ-фосфатной группы АТФ на специфический аминокислотный остаток субстрата, способствуя фосфорилированию белка и проявлению им своих физиологических и биохимических функций. Протеинкиназа играет важную роль и обладает, в основном, следующими двумя функциями в сигнальной трансдукции: с одной стороны она регулирует активность белков посредством фосфорилирования; с другой стороны она шаг за шагом усиливает сигналы путем последовательного фосфорилирования белков, вызывая тем самым клеточный ответ.
Аномальная активность протеинкиназ не только тесно связана с аномальным состоянием на определенном этапе в последовательности внутри- и внеклеточных путей сигнальной трансдукции, таким как пролиферация опухолевых клеток, апоптоз, метастазирование, но также является основной причиной возникновения ряда других заболеваний человека, ассоциированных с воспалительным или пролиферативным ответом, например ревматоидного артрита, заболеваний сердечно-сосудистой или нервной системы, астмы, псориаза. На данный момент известно о существовании свыше 400 видов заболеваний человека, непосредственно или косвенно связанных с протеинкиназой, что делает протеинкиназу другой важной мишенью для лекарственных средств после сопряженного с G-белком рецептора.
Большое семейство протеинкиназ состоит из более чем 500 членов и в основном подразделяется на два типа, т.е. протеинтирозинкиназы (РТК) и серин-треонинкиназы. По расположению киназ в клетке их классифицируют на рецепторные киназы и нерецепторные киназы, также называемые внутриклеточными киназами. Рецепторные киназы главным образом принадлежат к тирозинкиназам, также называемым рецепторными тирозинкиназами (RTK); такие рецепторные киназы состоят из части, находящейся с внешней стороны клеточной мембраны, трансмембранного домена и части, находящейся в цитоплазме; каталитическая часть киназы находится в цитоплазме. Большинство серин-треонинкиназ находится внутри клетки и принадлежит к нерецепторным киназам, иначе называемым цитозольными киназами.
Рецепторы факторов роста являются типичными представителями семейства RTK, имеющего по меньшей мере 19 подсемейств; основными подсемействами являются следующие:
(а) рецепторные тирозинкиназы семейства HER, которые включают EGFR (рецептор эпителиального фактора роста), HER2, HER3 и HER4. EGFR является мишенью синтетических низкомолекулярных лекарственных средств, таких как Tarceva®, Tykerb® и моноклонального антитела Erbitux® для лечения немелкоклеточного рака легкого;
(б) семейство инсулина состоит из рецептора инсулина (IR), рецептора инсулиноподобного фактора роста 1 (IGF-1R) и рецептора, родственного инсулиновому рецептору (IRR); где IGF-1R является хорошо известной мишенью противораковой терапии; поскольку он чрезвычайно похож на IR, в частности находящаяся внутри клетки часть киназы, их аминокислотные последовательности являются на 100% идентичными, то при ингибировании активности IGF-1R обычно также ингибируется активность IR. Доказано, что IR также является эффективной мишенью противораковой терапии, хотя при ингибировании IR может появляться риск повышения уровня сахара в крови, и необходимо найти баланс между эффективностью и допускаемым риском при использовании ингибитора IR в качестве противоракового агента;
(в) семейство рецепторов тромбоцитарного фактора роста (PDGFR), которое включает PDGFR-α, PDGFR-β, CSF1R, c-KIT и c-fms; где c-KIT служит молекулярной мишенью лекарственных средств для лечения лейкоза, таких как Gleevec®, а также при лечении стромальных опухолей желудочно-кишечного тракта;
(г) семейство рецепторов фактора роста эндотелия сосудов (VEGFR), которое включает FLT1 (Fms-подобная тирозинкиназа 1 или VEGFR1), KDR (или VEGFR-2) и FLT4 (или VEGFR3). Члены этого семейства являются молекулярной мишенью Sutent® и Naxavar®;
(д) семейство рецепторов фактора роста фибробластов (FGFR), которое включает FGFR1, FGFR2, FGFR3 и FGFR4 и 7 лигандов, FGF1, FGF2, FGF3, FGF4, FGF5, FGF6 и FGF7. Члены этого семейства являются молекулярными мишенями лекарственных средств, в настоящее время проходящих клинические испытания;
(е) семейство МЕТ, которое включает c-Met, иначе называемый рецептором фактора роста гепатоцитов человека (hHGFR), и RON; где c-Met играет важную роль в росте и метастазировании первичной опухоли; лекарственные средства, нацеленные на членов семейства МЕТ в настоящее время проходят клинические испытания;
(ж) семейство RET; RET являются рецепторами членов семейства GDNF и имеют изоформы RET51, RET43 и RET9; лекарственные средства, нацеленные на членов семейства RET в настоящее время проходят клинические испытания;
(з) семейство Eph, которое является самым большим семейством рецепторных тирозинкиназ, состоит из 16 рецепторов (EPHA1, EPHA2, EPHA3, EPHA4, EPHA5, EPHA6, EPHA7, EPHA8, EPHA9, EPHA10, EPHB1, EPHB2, ЕРНВ3, ЕРНВ4, ЕРНВ5, ЕРНВ6) и 9 лигандов (EFNA1, EFNA2, EFNA3, EFNA4, EFNA5, EFNB1, EFNB2, EFNB3). Члены этого семейства играют важные роли в развитии животных, и некоторые из них играют роль в опухолевых процессах.
Нерецепторные киназы не имеют части, находящейся с внешней стороны клеточной мембраны, и трансмембранного домена, и вся киназа находится в цитоплазме. К настоящему моменту известно, что существуют по меньшей мере 24 нерецепторные киназы, которые подразделяют на 11 подсемейств, т.е. подсемейства Src, Frk, Btk, CsK, AbI, Zap70, Fes, Fps, Fak, Jak и AcK; где подсемейство Src является самым большим и включает Src, Yes, Fyn, Lyn, Lck, BIk, Hck, Fgr, AUR1, AUR2 и Yrk киназы. Для более подробной информации см.: Neet, К.; Hunter, Т. Genes to Cells 1996, 1, 147-169 и документы, упомянутые там. Хотя некоторые нерецепторные киназы принадлежат к тирозинкиназам, большинство нерецепторных киназ принадлежит к серин-треонинкиназам; где некоторые их члены являются молекулярными мишенями лекарственных средств для лечения лейкоза, таких как Gleevec® и Sprycel®.
Как указано выше, при клиническом и практическом применении было полностью доказано, что рецепторные киназы и нерецепторные киназы являются мишенями противоопухолевой терапии, и некоторые противоопухолевые лекарственные средства разрешены к продаже на рынке для использования пациентами. Кроме лечения опухолей ингибирование аномальной активности рецепторных киназ и нерецепторных киназ также может быть использовано для лечения следующих заболеваний, которые включают: псориаз, цирроз печени, диабет, связанные с ангиогенезом заболевания, связанные с рестенозом заболевания, заболевания глаза, возрастную макулярную дегенерацию, ревматоидный артрит и другие воспалительные заболевания, заболевания иммунной системы, такие как аутоиммунное заболевание, сердечно-сосудистые заболевания, такие как атеросклероз, или почечное заболевание и т.д., но не ограничиваются ими. Таким образом, нужно продолжать разработки требуемых ингибиторов этих киназ.
Сущность изобретения
Одна задача настоящего изобретения состоит в том, чтобы предложить замещенный фосфорсодержащей группой хинолин, обладающий ингибирующей активностью в отношении протеинкиназы, и способ его получения.
Другая задача настоящего изобретения состоит в том, чтобы предложить применение указанного выше замещенного фосфорсодержащей группой хинолина в изготовлении лекарственных средств для лечения заболеваний, ассоциированных с аномальной активностью протеинкиназы.
Еще одна задача настоящего изобретения состоит в том, чтобы предложить фармацевтическую композицию, содержащую указанный выше замещенный фосфорсодержащей группой хинолин, для лечения заболеваний, ассоциированных с аномальной активностью протеинкиназы.
Техническое решение изобретения
Замещенный фосфорсодержащей группой хинолин, имеющий молекулярную структуру, представленную следующей формулой (I):
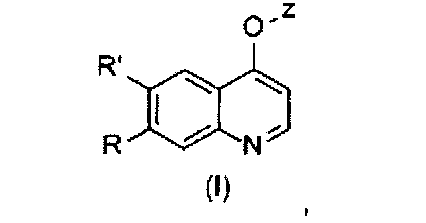
в которой
Z представляет собой 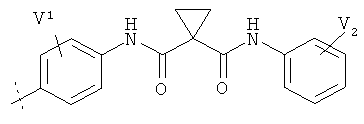 , каждый из V1 и V2 независимо выбран из водорода, галогена, -OCF3, -CF3, -NO2, -CN, -ОН, -NH2, -NMe2, C1-6алкила, C3-6циклоалкила, C3-6гетероциклоалкила, С6алкокси, C3-6циклоалкокси или C3-6гетероциклоалкокси;
, каждый из V1 и V2 независимо выбран из водорода, галогена, -OCF3, -CF3, -NO2, -CN, -ОН, -NH2, -NMe2, C1-6алкила, C3-6циклоалкила, C3-6гетероциклоалкила, С6алкокси, C3-6циклоалкокси или C3-6гетероциклоалкокси;
один из R и R′ представляет собой фосфорсодержащий заместитель Q, другой выбран из водорода, метоксила, метоксиэтоксила или фосфорсодержащего заместителя Q;
где фосфорсодержащий заместитель Q представляет собой 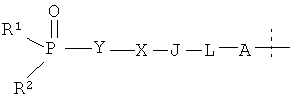 ,
,
A отсутствует или представляет собой O, NH, S(=O)m или C1-6алкил, и A возможно замещен G1;
L отсутствует или представляет собой C1-6алкил, C3-6циклоалкил, С6арил, C5-6гетероарил или C3-6гетероциклоалкил, и L возможно замещен G2;
J отсутствует или представляет собой O, NH, S(=O)m, C1-6алкил, C3-6циклоалкил, С6арил, C5-6гетероарил или C3-6гетероциклоалкил, и J возможно замещен G3;
X отсутствует или представляет собой -С(=O)-, -S(O)m-, C1-6алкил, C3-6циклоалкил, С6арил, C5-6гетероарил или C3-6гетероциклоалкил, и X возможно замещен G4;
Y отсутствует или представляет собой C1-6алкил, C3-6циклоалкил, С6арил, C5-6гетероарил или C3-6гетероциклоалкил, и Y возможно замещен G5;
каждый из R1 и R2 независимо выбран из -OH, C1-6алкила, C3-6циклоалкила, С6арила, C5-6гетероарила, C3-6гетероциклоалкила, С6алкокси, C3-6циклоалкокси, С6арилокси, C5-6гетероарилокси или C3-6гетероциклоалкокси, и каждый из R1 и R2 возможно замещен G6; R1 и R2 вместе с атомом фосфора, к которому они присоединены, могут образовывать C3-6гетероциклоалкильное кольцо, которое может дополнительно содержать гетероатом(ы), выбранный(ые) из O, N или S(=O)m;
где
каждый из G1, G2, G3, G4, G5 и G6 независимо выбран из H, -CN, -CF3, -СО2Н, галогена, C1-6алкила, C3-6циклоалкила, C2-6алкенила, C2-6алкинила, С6арила, C5-6гетероарила, C3-6гетероциклоалкила, R3O-, R3R4N-, R3S(=O)m-, R3R4NS(=O)m-, R5C(=O)-, R3R4NC(=O)-, R3OC(=O)-, R5C(=O)O-, R3R4NC(=O)O-, R5C(=O)NR3-, R3R4NC(=O)NR6-, R3OC(=O)NR6-, R3S(=O)mNR6-, R3R4NS(=O)mNR6-, R3R4NC(=NR7)NR6-, R3R4NC(=CHNO2)NR6-, R3R4NC(=N-CN)NR6-, R3R4NC(=NR7)-, R3S(=O)(=NR7)NR6- или R3R4NS(=O)(=NR7)-;
каждый из R3, R4, R5, R6 и R7 независимо выбран из H, C1-6алкила, C3-6циклоалкила, С6арила, C5-6гетероарила или C1-6гетероциклоалкила; когда R3 и R4 присоединены к одному и тому же атому азота, тогда R3 и R4 вместе с азотом, к которому они присоединены, могут образовывать C3-6гетероциклоалкильное кольцо, которое может дополнительно содержать гетероатом(ы), выбранный(ые) из O, N или S(=O)m; и R3, R4, R5, R6 и R7 могут быть возможно замещены галогеном, CN, C1-6алкилом или C3-6циклоалкилом;
m равен 0-2.
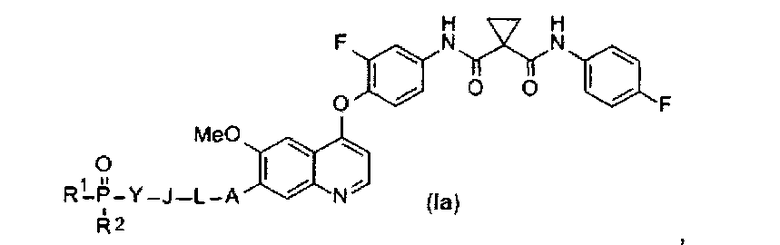
В данной заявке предложен замещенный фосфорсодержащей группой хинолин, представленный приведенной ниже формулой (Ia):
где в приведенной выше формуле
A представляет собой O, NH или S(=O)m, и A возможно замещен G1;
L представляет собой C1-6алкил или C3-6циклоалкил, и L возможно замещен G2;
J представляет собой O, NH или S(=O)m, и J возможно замещен G3;
Y представляет собой C1-6алкил или C3-6циклоалкил, и Y возможно замещен G5;
каждый из R1 и R2 независимо выбран из -OH, C1-6алкила, C3-6циклоалкила, С6арила, C5-6гетероарила, C3-6гетероциклоалкила, C1-6алкокси, C3-6циклоалкокси, С6арилокси, C5-6гетероарилокси или C3-6гетероциклоалкокси, и каждый из R1 и R2 возможно замещен G6;
m равен 0-2.
Замещенный фосфорсодержащей группой хинолин представлен приведенной ниже формулой (Ib):
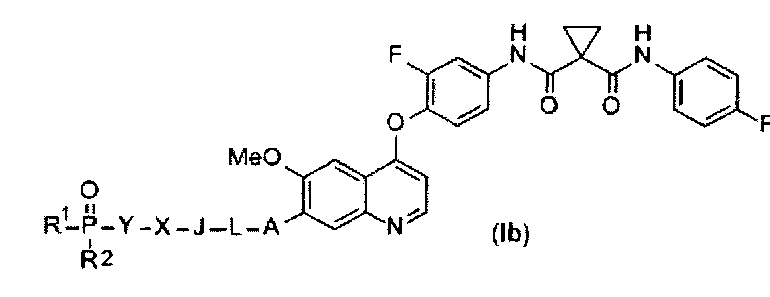 ,
,
где в приведенной выше формуле
A представляет собой O, NH или S(=O)m, и A возможно замещен G1;
L представляет собой C1-6алкил, и L возможно замещен G2;
J представляет собой C3-6циклоалкил или C3-6гетероциклоалкил, и J возможно замещен G3;
X отсутствует или представляет собой -C(=O)- или -S(O)m-;
Y представляет собой C1-6алкил или C3-6циклоалкил, и Y возможно замещен G5;
каждый из R1 и R2 независимо выбран из -OH, C1-6алкила, C3-6циклоалкила, С6арила, C5-6гетероарила, C3-6гетероциклоалкила, C1-6алкокси, C3-6циклоалкокси, С6арилокси, C5-6гетероарилокси или C3-6гетероциклоалкокси, и каждый из R1 и R2 возможно замещен G6;
m равен 0-2.
Замещенный фосфорсодержащей группой хинолин представлен приведенной ниже формулой (Ic):
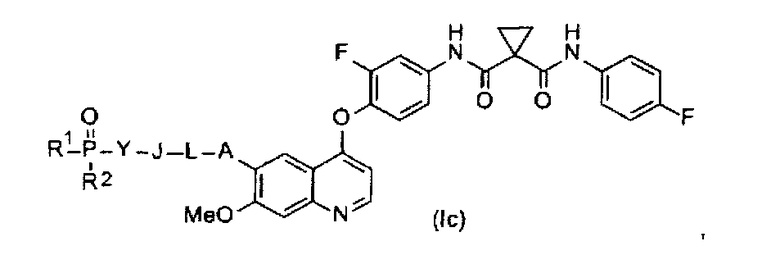
где в приведенной выше формуле
А представляет собой O, NH или S(=O)m, и A возможно замещен G1;
L представляет собой C1-6алкил или C3-6циклоалкил, и L возможно замещен G2;
J представляет собой O, NH или S(=O)m, и J возможно замещен G3;
Y представляет собой C1-6алкил или C3-6циклоалкил, и Y возможно замещен G5;
каждый из R1 и R2 независимо выбран из -OH, C1-6алкила, C3-6циклоалкила, С6арила, C5-6гетероарила, C3-6гетероциклоалкила, C1-6алкокси, C3-6циклоалкокси, С6арилокси, C5-6гетероарилокси или C3-6гетероциклоалкокси, и каждый из R1 и R2 возможно замещен G6;
m равен 0-2.
В данной заявке предложен замещенный фосфорсодержащей группой хинолин, представленный приведенной ниже формулой (Id):
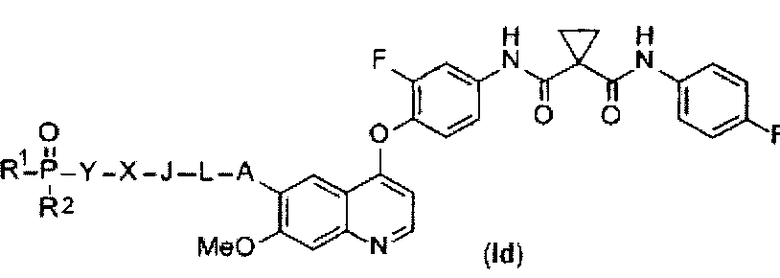 ,
,
где в приведенной выше формуле
А представляет собой O, NH или S(=O)m, и A возможно замещен G1;
L представляет собой C1-6алкил, и L возможно замещен G2;
J представляет собой C3-6циклоалкил или C3-6гетероциклоалкил, и J возможно замещен G3;
X отсутствует или представляет собой -C(=O)- или -S(O)m-;
Y представляет собой C1-6элкил или C3-6циклоалкил, и Y возможно замещен G5;
каждый из R1 и R2 независимо выбран из -OH, C1-6алкила, C3-6циклоалкила, С6арила, C5-6гетероарила, C3-6гетероциклоалкила, C1-6алкокси, C3-6циклоалкокси, С6арилокси, C5-6гетероарилокси или C3-6гетероциклоалкокси, и каждый из R1 и R2 возможно замещен G6;
m равен 0-2.
В данной заявке предложен замещенный фосфорсодержащей группой хинолин, представленный приведенной ниже формулой (Ie):
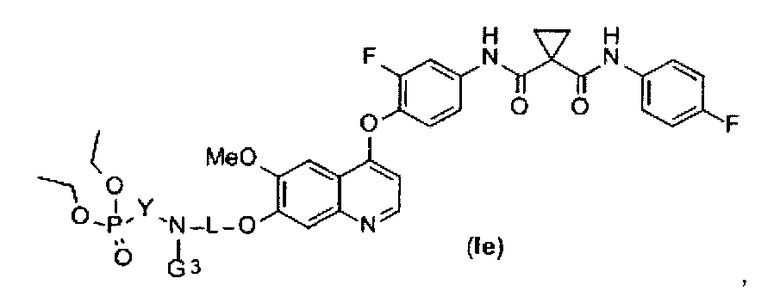
где в приведенной выше формуле
L представляет собой C1-6алкил или C3-6циклоалкил, и L возможно замещен G2;
Y представляет собой C1-6алкил или C3-6циклоалкил, и Y возможно замещен G5.
Замещенный фосфорсодержащей группой хинолин представлен приведенной ниже формулой (If):
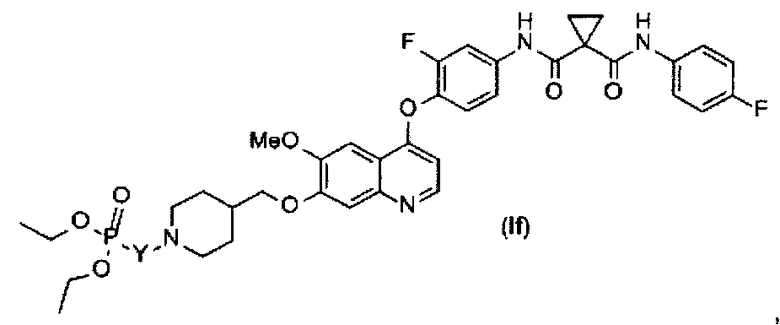
где в приведенной выше формуле
Y представляет собой C1-6алкил или C3-6циклоалкил, и Y возможно замещен G5.
Замещенный фосфорсодержащей группой хинолин выбран из группы, состоящей из одного или более чем одного из следующих соединений:
N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметиламино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметил)(метил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметил)(этил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметил)(н-пропил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметил)(этил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)цикпопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметил)(метил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметил)(этил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметил)(н-пропил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметил)(этил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(ацетил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-Фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(формил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(пропионил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(изопропионил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(циклопропилформил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(ацетил(диэтоксифосфорилметил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(формил(диэтоксифосфорилметил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(пропионил(диэтоксифосфорилметил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(изопропионил(диэтоксифосфорилметил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(циклопропилформил(диэтоксифосфорилметил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(аминокарбонил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(этиламинокарбонил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(метиламинокарбонил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(N,N′-диметиламинокарбонил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(аминокарбонил(диэтоксифосфорилметил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(этиламинокарбонил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(метиламинокарбонил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(N,N′-диметиламинокарбонил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(метилсульфонил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(этилсульфонил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметиламино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметиламино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметил)(метил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметил)(этил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметил)(н-пропил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметил)(этил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметил)(метил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметил)(этил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметил)(н-пропил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметил)(этил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)цикпопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(ацетил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(формил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(пропионил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(изопропионил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(цикпопропилформил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(ацетил(диэтоксифосфорилметил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(формил(диэтоксифосфорилметил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(пропионил(диэтоксифосфорилметил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(изопропионил(диэтоксифосфорилметил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(циклопропилформил(диэтоксифосфорилметил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(аминокарбонил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(этиламинокарбонил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(метиламинокарбонил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(N,N′-диметиламинокарбонил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(аминокарбонил(диэтоксифосфорилметил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(этиламинокарбонил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(метиламинокарбонил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(N,N′-диметиламинокарбонил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(метилсульфонил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(этилсульфонил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[[1-(диэтоксифосфорилметил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[[1-(2-диэтоксифосфорилацетил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[[1-(диэтоксифосфорилметил)-4-пиперидинил]метоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[[1-(2-диэтоксифосфорилацетил)-4-пиперидинил]метоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид.
Замещенный фосфорсодержащей группой хинолин, выбранный из группы, состоящей из одного или более чем одного из следующих соединений:
N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорил(N-метил)метиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(ацетил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[[1-(2-диэтоксифосфорилацетил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[[1-(диэтоксифосфорилметил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид.
Рацемат или энантиомер замещенного фосфорсодержащей группой хинолина.
В данной заявке предложен способ получения замещенного фосфорсодержащей группой хинолина, состоящий из стадий, представленных на следующей схеме 1:
Схема 1
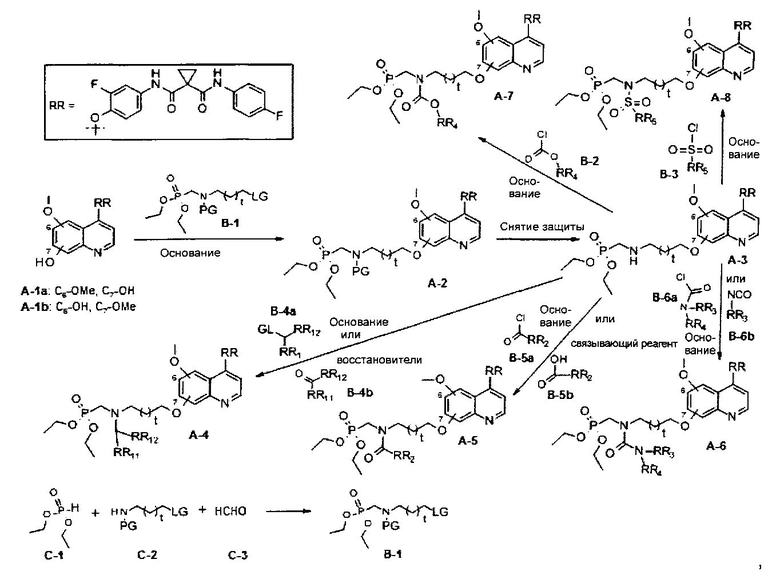
где
t равен 0-4;
LG или GL представляют собой общепринятые в области органической химии уходящие группы;
PG представляет собой общепринятые в области органической химии защитные группы;
каждый из RR1, RR11, RR12, RR2, RR3, RR4 или RR5 выбран из Н, C1-6алкила, C3-6циклоалкила, С6арила, C5-6гетероарила или C3-6гетероциклоалкила и возможно замещен Н, -CN, -CF3, -СО2Н, галогеном, C1-6алкилом, C1-6циклоалкилом, C2-6алкенилом, C2-6алкинилом, С6арилом, C5-6гетероарилом, C3-6гетероциклоалкилом, R3O-, R3R4N-, R3S(=O)m-, R3R4NS(=O)m-, R5C(=O)-, R3R4NC(=O)-, R3OC(=O)-, R5C(=O)O-, R3R4NC(=O)O-, R5C(=O)NR3-, R3R4NC(=O)NR6-, R3OC(=O)NR6-, R3S(=O)mNR6-, R3R4NS(=O)mNR6-, R3R4NC(=NR7)NR6-, R3R4NC(=CHNO2)NR6-, R3R4NC(=N-CN)NR6-, R3R4NC(=NR7)-, R3S(=O)(=NR7)NR6- или R3R4NS(=O)(=NR7), где каждый из R3, R4, R5, R6 и R7 независимо выбран из водорода, C1-6алкила, C3-6циклоалкила, С6арила, C5-6гетероарила или C3-6героциклоалкила; когда R3 и R4 присоединены к одному и тому же атому азота, тогда R3 и R4 вместе с азотом, к которому они присоединены, могут образовывать C3-6гетероциклоалкильное кольцо, которое может дополнительно содержать гетероатом(ы), выбранный(ые) из O, N, S(=O)m; и каждый из R3, R4, R5, R6 и R7 возможно замещен галогеном, CN, C1-6алкилом или C3-6Циклоалкилом; m равен 0-2.
В данной заявке предложен способ получения замещенного фосфорсодержащей группой хинолина, состоящий из стадий, представленных на следующей схеме 2:
Схема 2
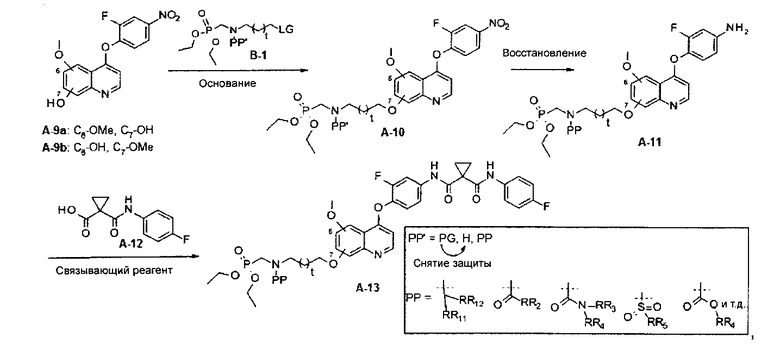
где
РР′ может представлять собой любую из PG, H и PP; и PG может быть превращена в H посредством снятия защиты.
В настоящей заявке предложен способ получения замещенного фосфорсодержащей группой хинолина, состоящий из стадий, представленных на следующей схеме 3:
Схема 3
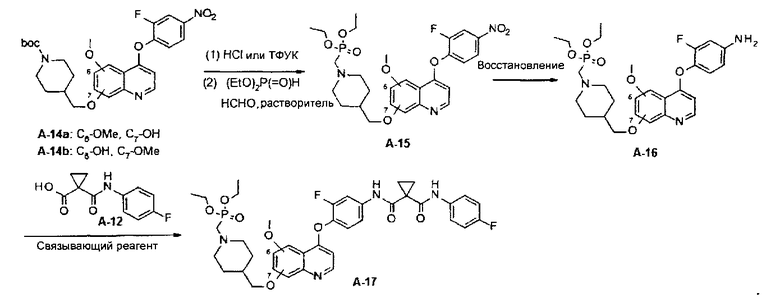
В настоящей заявке предложен способ получения замещенного фосфорсодержащей группой хинолина, состоящий из стадий, представленных на следующей схеме 4:
Схема 4
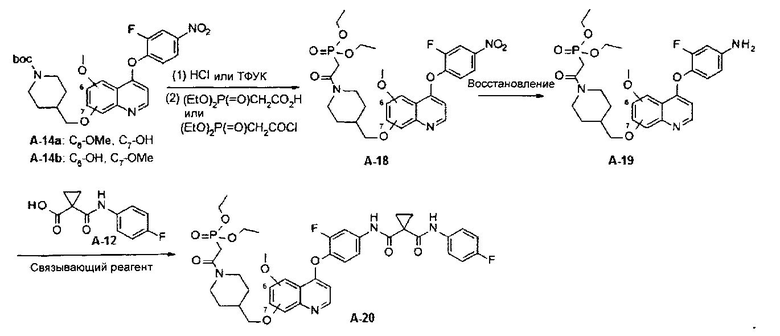
В настоящей заявке предложен способ получения замещенного фосфорсодержащей группой хинолина, состоящий из стадий, представленных на следующей схеме 5:
Схема 5
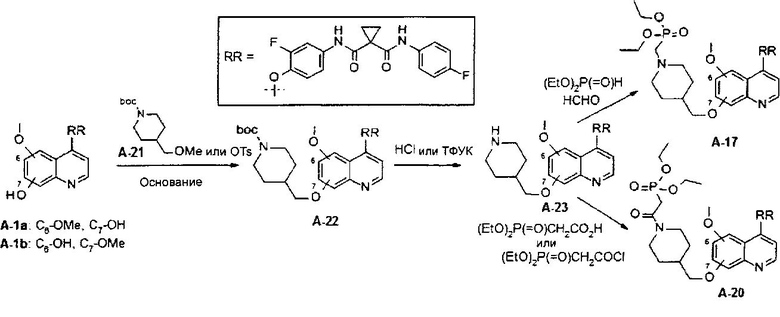
В данной заявке предложено применение фармацевтической композиции, содержащей замещенный фосфорсодержащей группой хинолин, где композицию применяют для лечения заболеваний, ассоциированных с аномальной активностью протеинкиназы.
В данной заявке предложено применение фармацевтической композиции, содержащей замещенный фосфорсодержащей группой хинолин, где протеинкиназа представляет собой c-Met, KDR или VEGFR2, RET, PDGFR-β, c-KIT, FIt3, MEK5, DDR1, LOK, CSF1R, EPHA7, EPHA8, EPHB6, MKNK2, BLK, HIPK4, HCK или FIt4.
В данной заявке предложено применение фармацевтической композиции, содержащей замещенный фосфорсодержащей группой хинолин, где протеинкиназа представляет собой RON, ALK (или киназу анапластической лимфомы), EGF1R, HER2, HER3, HER4, PDGFR-α, c-fms, FLT1, Src, Frk, Btk, CsK, Abl, Fes, Fps, Fak, AcK, Yes, Fyn, Lyn, Lck, Hck, Fgr, Yrk, PDK1, TAK1, Tie-2, Tie-1, YSK4, TRKA, TRK B, TRK C, SLK, PKN2, PLK4, MST1R, MAP4K или DDR2.
В данной заявке предложено применение фармацевтической композиции, содержащей замещенный фосфорсодержащей группой хинолин, где заболевание, которое лечат с помощью этой композиции, представляет собой псориаз, цирроз печени, диабет, опосредованные ангиогенезом заболевания, заболевания глаза, заболевания иммунной системы или сердечно-сосудистые заболевания.
В данной заявке предложено применение фармацевтической композиции, содержащей замещенный фосфорсодержащей группой хинолин, где заболевание, которое лечат с помощью этой композиции, представляет собой опухоль, включая солидные и жидкие опухоли.
В данной заявке предложено применение фармацевтической композиции, содержащей замещенный фосфорсодержащей группой хинолин, где заболевание, которое лечат с помощью этой композиции, представляет собой опухоль, включая рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы и шеи, меланому кожи или внутриглазную меланому, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак ободочной кишки, рак молочной железы, рак фаллопиевой трубы, рак эндометрия, рак шейки матки, рак влагалища, рак вульвы, болезнь Ходжкина, рак пищевода, рак кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, саркому мягкой ткани, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, рак мочевого пузыря, рак почки или мочеточника, почечный рак, опухоли центральной нервной системы (ЦНС), опухоли спинного мозга, аденомы гипофиза, желудочно-кишечные стромальные опухоли, колоректальный рак, немелкоклеточный рак легкого, мелкоклеточный рак легкого, мастоцитоз, глиому, саркому, лимфому.
В данной заявке предложено лекарственное средство для лечения заболеваний, ассоциированных с аномальной активностью протеинкиназы, которое содержит любое из указанных выше соединений или его фармацевтически приемлемые соль, сольват, пролекарство или рацемат или энантиомер любого из указанных выше соединений или его фармацевтически приемлемых соли, сольвата, пролекарства.
Указанное выше лекарственное средство дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель.
Указанное выше лекарственное средство находится в форме следующих композиций: (1) пероральной композиции; (2) инъекционной композиции; (3) ректального суппозитория; (4) композиции для назальной ингаляции; (5) глазных капель; (6) кожного пластыря.
Ряд экспериментов подтверждает, что замещенные фосфорсодержащей группой хинолины по настоящему изобретению обладают следующими преимуществами: (1) скрининговые тесты ингибирования киназы показывают, что соединение по настоящему изобретению оказывает сильное ингибирующее действие на ряд протеинкиназ и их мутантов; (2) тесты по ингибированию опухоли показывают, что такой замещенный фосфорсодержащей группой хинолин значительно ингибирует рост опухолей без видимой токсичности; (3) соединение по настоящему изобретению может быть использовано в комбинации с другими противоопухолевыми лекарственными средствами и таким образом оказывать синергетический или аддитивный эффект; (4) соединение по настоящему изобретению может быть использовано совместно с другими видами терапии опухолей, например радиотерапией, интервенционной терапией и т.д. Это показывает, что замещенный фосфорсодержащей группой хинолин по изобретению может быть использован в качестве лекарственного средства для эффективного лечения заболеваний, ассоциированных с аномальной активностью протеинкиназы.
Среди заболеваний, ассоциированных с аномальной активностью протеинкиназы, которые лечат соединением по изобретению, виды рака почки представляют собой рак надпочечника, почечно-клеточную карциному или карциному почечной лоханки; глиомы представляют собой нейроглиому ствола головного мозга, нейроэндокринную глиому и нейроглиому.
Помимо опухоли, заболевания, ассоциированные с аномальной активностью протеинкиназы, для лечения которых используют соединение по изобретению, дополнительно включают псориаз, цирроз печени, диабет, связанные с ангиогенезом заболевания, связанные с рестенозом заболевания, заболевания глаза, такие как AMD (возрастная макулярная дегенерация), ревматоидный артрит и другие воспалительные заболевания, заболевания иммунной системы, такие как аутоиммунное заболевание (например СПИД), сердечно-сосудистые заболевания, такие как атеросклероз, или почечное заболевание и т.д.
Фармацевтическая композиция, содержащая соединение по настоящему изобретению, может быть использована для лечения заболеваний, ассоциированных с аномальной активностью протеинкиназы, у млекопитающих, таких как пациенты-люди.
Посредством способа изготовления (приготовления) соединение по изобретению (включая рацемат, энантиомер и другой стереоизомер) или его фармацевтически приемлемые соль, гидрат, сольват или пролекарство совместно с подходящими фармацевтически приемлемыми носителями и обычно используемыми в медицине вспомогательными веществами может быть приготовлено в виде фармацевтической композиции, которая является благоприятной для введения.
Пути введения лекарственного средства, содержащего соединение по изобретению, могут представлять собой: (1) пероральное введение, например таблетка, капсула и т.д.; (2) инъекция, например внутривенная, подкожная, внутримышечная, глазная инъекция, внутрибрюшинная инъекция и т.д.; (3) ректальная закупоривающая масса, например суппозиторий, гели и т.д.; (4) назальная ингаляция, например спрей, аэрозоль и т.д.; (5) глазные капли; (6) кожный пластырь. Система высвобождения лекарственного средства, например липосома, технология медленного высвобождения и т.д. также могут быть применены там, где предпочтительно применять пероральное введение и инъекцию, в частности более предпочтительно применять пероральное введение.
Различные лекарственные формы фармацевтической композиции, содержащей соединение по настоящему изобретению, могут быть приготовлены с помощью обычных в медицинской промышленности способов, например смешивания, растворения, гранулирования, измельчения, эмульгирования, инкапсулирования, нанесения сахарного покрытия, сублимационной сушки, лиофильной сушки и т.д.
Содержание соединения по настоящему изобретению в фармацевтической композиции находится в диапазоне 0,001-100%. Эффективное количество фармацевтической композиции для введения млекопитающим, включая людей, составляет 0,1-500 мг на килограмм массы тела в сутки, предпочтительно в количестве 1-100 мг на килограмм массы тела в сутки. В таком диапазоне эффективного количества соединение по настоящему изобретению проявляет фармацевтические действия по ингибированию активности протеинкиназы и лечению заболеваний, ассоциированных с аномальной активностью протеинкиназы (например рака).
Частота введения лекарственного средства по настоящему изобретению может варьировать в зависимости от используемого соединения или его фармацевтической композиции и заболеваний, которые нужно лечить; фармацевтическую композицию по настоящему изобретению обычно вводят 1-6 раз в сутки, оптимальная частота введения составляет 1-3 раза в сутки.
Упаковка и хранение лекарственного средства по настоящему изобретению сходны с упаковкой и хранением обычных западных лекарственных средств, например лекарственное средство в форме твердого препарата может быть непосредственно помещено во флакон из стекла, пластика, бумаги или металла; во флаконе предпочтительно содержится десиккант для поддержания качества лекарственного средства; обычно лекарственное средство в форме жидкой композиции помещают во флакон из стекла, пластика или металла или гибкую трубку; а лекарственное средство в форме композиции в виде тумана обычно помещают в устойчивый к повышенному давлению контейнер из пластика или металла и оснащают редукционным клапаном и т.д.
Определение терминов
Далее представлены определения терминов, упомянутых в настоящем изобретении. Переменные группы, используемые в настоящем изобретении, например Ra, Rb, m и т.д., применяются только к этому разделу (т.е. к разделу "Определение терминов").
В соответствии с общими знаниями специалиста в данной области большинство химических реакций необходимо проводить в растворителе; обычно используемые растворители для получения соединения по изобретению включают воду, метанол, этанол, изопропанол, н-пропанол, н-бутанол, изобутанол, трет-бутанол, 2-метоксилэтанол, 2,2,2-трифторэтанол, дихлорметан, 1,2-дихлорэтан, хлороформ, ТГФ, диоксан, DME, этилацетат, диэтиловый эфир, метил-трет-бутиловый эфир, гексан, циклогексан, толуол, ацетонитрил, ДМФА (диметилформамид), ДМСО или смесь любых двух или более перечисленных выше растворителей, но не ограничиваются ими. В некоторых случаях химические взаимодействия необходимо проводить в присутствии кислоты или основания; обычно используемые основания для получения соединения по изобретению включают Et3N, Me3N, i-Pr2NEt, пиридин, DBU (1,8-диазабицикло[5.4.0]ундец-7-ен), DABCO (1,4-диазабицикло[2.2.2]октан), тетраметилгуанидин, NaOH, KOH, Cs2CO3, Na2CO3, K2CO3, NaHCO3, KF, CsF, K3PO3, K2HPO4, KH2PO4, NaH, н-BuLi, втор-BuLi, трет-BuLi, NaN(SiMe3)2, LiN(SiMe3)2, KN(SiMe3)2 или смесь любых двух или более перечисленных выше оснований, но не ограничиваются ими; и обычно используемые кислоты включают HCO2H, АсОН, ТФУК (трифторуксусная кислота), HCl (соляная кислота), H2SO4, HNO3, H3PO4, п-TsOH (п-толуолсульфоновая кислота), PhSO3H, CSA (камфорсульфокислота), MsOH (метансульфоновая кислота) или кислоту Льюиса, такую как ZnCl2, AlCl3, BF3·OEt2, но не ограничиваются ими. В некоторых случаях химические реакции необходимо проводить в присутствии связывающего реагента; обычно используемые связывающие реагенты для получения соединения по изобретению включают DCC (N,N′-дициклогексилкарбодиимид), EDC, HATU, TBTU (тетрафторборат O-бензотриазол-1-ил-N,N,N′,N′-тетраметилурония), PyBOP (гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония), HCTU (гексафторфосфат O-(1Н-6-хлорбензотриазол-1-ил)-N,N,N′,N′-тетраметилурония), BOP (гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония), DIC N,N′-диизопропилкарбодиимид, HOBt (1-гидроксибензотриазол), HOAt (1-гидроксиазабензотриазол), CDI (1,1′-карбонилдиимидазол), DEPBT (3-(диэтоксифосфорилокси)-1,2,3-бензотриазин-4(3Н)-он) и т.д., но не ограничиваются ими. На некоторых стадиях получения соединения по изобретению необходимы восстановительная реакция и восстановители; восстановители включают H2+Pd/C, H2+Pd(OH)2, Н2+PtO2, H2+Ni Ренея, H2NNH2+Ni Ренея, Mg+MeOH, Fe+AcOH, Fe+HCl, Zn+AcOH, Zn+HCl, Zn+NH4OAc, SnCl2, LiAIH4, NaBH4, NaBH3(CN), NaB(OAc)3H, BH3 и т.д., но не ограничиваются ими. На некоторых стадиях получения соединения по изобретению необходимы снятия защиты; когда защитная группа представляет собой Boc (трет-бутоксикарбонил), обычно используемые реагенты для снятия защиты включают HCl, ТФУК, H2SO4 и т.д., но не ограничиваются ими; когда защитная группа представляет собой CBZ (бензилоксикарбонил), обычно используемые реагенты для снятия защиты включают сильную HCl, H2+Pd/C и т.д., но не ограничиваются ими; когда защитная группа представляет собой Bn (бензил), обычно используемые реагенты для снятия защиты включают H2+Pd/C, H2+Pd(OH)2, H2+Pd/C+HCl и т.д., но не ограничиваются ими. Реакцию получения соединения по изобретению обычно проводят при комнатной температуре, однако иногда температуру необходимо понизить до -78°C или повысить до 200°C; типично реакцию проводят в условиях указанных выше растворителей и температур обычно при перемешивании, однако иногда ее необходимо проводить в микроволновой печи; когда основание, реагент, катализатор являются чувствительными к воде или кислороду, реакцию необходимо проводить в безводных и бескислородных условиях; в таком случае не могут быть использованы протонные растворители.
Термин "фармацевтически приемлемая соль" означает соль, образованную посредством взаимодействия соединения по изобретению с неорганической кислотой, органической кислотой, неорганическим основанием или органическим основанием; соль обладает такой же или сходной биологической активностью и эффективностью, что и соединение по изобретению. Неорганическая кислота или органическая кислота может представлять собой соляную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, азотную кислоту, угольную кислоту, фосфорную кислоту, хлорную кислоту, уксусную кислоту, лимонную кислоту, щавелевую кислоту, молочную кислоту, яблочную кислоту, салициловую кислоту, винную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту, замещенную бензолсульфоновую кислоту (например п-толуолсульфоновую кислоту), изоникотиновую кислоту, олеиновую кислоту, дубильную кислоту, пантотеновую кислоту, аскорбиновую кислоту, янтарную кислоту, малеиновую кислоту, гентизиновую кислоту, фумаровую кислоту, глюконовую кислоту, уроновую кислоту, глюкаровую кислоту или сахарную кислоту, муравьиную кислоту, бензойную кислоту, глутаминовую кислоту, памовую кислоту, сорбиновую кислоту и т.д.; неорганическое основание или органическое основание может представлять собой гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид железа, гидроксид кальция, гидроксид бария, гидроксид алюминия, гидроксид магния, гидроксид цинка, аммиак, гидроксид органического четвертичного аммония, карбонат натрия, карбонат калия, карбонат лития, карбонат кальция, карбонат бария, карбонат магния, карбонатные четвертичные органические аммониевые соли, гидрокарбонат натрия, гидрокарбонат калия, гидрокарбонат лития, гидрокарбонат кальция, гидрокарбонат бария, гидрокарбонат магния, гидрокарбонатную четвертичную органическую аммониевую соль и т.д.
Термин "сольват" означает стабильное вещество, образованное соединением по изобретению и обычно используемым в химических реакциях растворителем посредством ковалентной связи, водородной связи, ионной связи, ван-дер-ваальсовых сил, комплексообразования, включения и т.д.; растворитель может представлять собой метанол, этанол, пропанол, бутанол, этиленгликоль, пропандиол, полиэтиленгликоль, ацетон, ацетонитрил, диэтиловый эфир, метил-трет-бутиловый эфир и т.д.
Термин "гидрат" означает сольват, в котором растворитель представляет собой воду.
Термин "пролекарство" означает соединение, которое получают посредством превращения соединения по настоящему изобретению с помощью химического синтеза или физического метода и которое превращается обратно в соединение по настоящему изобретению в организме млекопитающего после его введения млекопитающему. Обычно методику "пролекарства" используют, чтобы преодолеть недостаточное или неподходящее физико-химическое свойство или способность проявлять лекарственные свойства самого лекарственного соединения.
Термин "рацемат, энантиомер и другой стереоизомер" означает соединения, имеющие одинаковую молекулярную формулу и молекулярную массу, но они отличаются вследствие различных типов связывания между атомами и различных пространственных расположений, такие соединения называют изомером или стереоизомером. Когда эти стереоизомеры являются зеркальным отражением друг друга, т.е. выглядят сходно, но не могут быть полностью наложены друг на друга, как левая рука и правая рука, эти соединения называют энантиомерами. Абсолютные конфигурации энантиомеров обычно представляют как (R)- и (S)- или R- и S-. Подробно правила для определения абсолютных конфигураций смотри в главе 4 "Advanced Organic Chemistry", издание 4-е (J. March, John Wiley и Sons, New York, 1992). (R)- и (S)-энантиомеры вращают плоскость поляризованного света в противоположные стороны, т.е. вращение влево и вращение вправо. Когда (R)- и (S)-энантиомеры смешаны или находятся в соотношении 1:1, смесь не обладает вращающим действием на поляризованный свет, такую смесь называют рацематом.
Соединение по изобретению может иметь таутомеры, ротамеры, цис-транс-изомеры и т.д., эти понятия можно найти и изучить в "Advanced Organic Chemistry", издание 4-е, J. March. Поскольку эти изомеры обладают такой же функцией ингибирования активности протеинкиназы, что и соединение по изобретению, то эти изомеры охватываются настоящим изобретением.
В соответствии с общими знаниями в данной области техники, после введения соединения по настоящему изобретению млекопитающим (например людям), оно, вероятно, метаболизируется в различные метаболиты в организме млекопитающего при помощи различных ферментов; поскольку эти метаболиты обладают функцией ингибирования активности протеинкиназы, сходной с функцией соединения по изобретению, они также охватываются настоящим изобретением.
Термин "фармацевтическая композиция" означает смесь, полученную посредством смешивания одного или более чем одного соединения по изобретению, его фармацевтически приемлемых соли, или сольвата, или гидрата, или пролекарства с другим химическим ингредиентом (например фармацевтически приемлемым носителем). Цель приготовления фармацевтической композиции состоит в том, чтобы облегчить введение животным. Указанные выше фармацевтические композиции помимо фармацевтически приемлемого носителя могут дополнительно содержать обычно используемые фармацевтические вспомогательные вещества, например антибактериальный агент, противогрибковый агент, антимикробный агент, консервант, тонирующее вещество, солюбилизатор, загуститель, поверхностно-активное вещество, комплексообразующий агент, белок, аминокислоту, жир, углевод, витамины, минеральные вещества, микроэлементы, подсластитель, краситель, ароматизатор или их комбинации.
Термин "фармацевтически приемлемый носитель" относится к неактивным ингредиентам в фармацевтической композиции; он может представлять собой карбонат кальция, фосфат кальция, различные сахара (например лактозу, маннит и т.д.), крахмал, циклодекстрин, стеарат магния, целлюлозу, карбонат магния, полиакрилат, полиметилакрилат, желатин, воду, полиэтиленгликоль, пропандиол, этиленгликоль, касторовое масло, гидрогенизированное касторовое масло, полиэтоксилированное гидрогенизированное касторовое масло, кунжутное масло, кукурузное масло, арахисовое масло и т.д.
Термин "алкил" означает линейную или разветвленную насыщенную углеводородную группу, имеющую определенное число атомов углерода, например C1-12алкил означает линейные или разветвленные группы, имеющие 1-12 атомов углерода. С0алкил означает одну одинарную ковалентную связь. Использованный в настоящем изобретении термин "алкил" включает метил, этил, пропил, бутил, изопропил, неопентил, 2-метил-1-гексил и т.д., но не ограничивается ими. Один или все атомы водорода алкила могут быть замещены следующими группами: циклоалкил, арил, гетероарил, гетероциклоалкильное кольцо, галоген, амино, гидроксил, циано, нитро, карбоксил, тио, оксо, алкокси, арилокси, алкилтио, арилтио, карбонил, тиокарбонил, C-амид, N-амид, O-аминокарбонилокси, N-аминокарбонилокси, O-тиоаминокарбонилокси, N-тиоаминокарбонилокси, C-сложный эфир, O-сложный эфир и -NRaRb, где Ra и Rb соответственно выбраны из водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила и трифторметилсульфонила, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероциклоалкильное кольцо.
Термин "циклоалкил" или "циклический алкил" означает одно-, двух- или многокольцевую углеводородную группу, имеющую определенное число атомов углерода; в случае двух- или многокольцевой группы, они могут быть соединены вместе до конденсированной (два смежных атома углерода являются общими для двух или более колец) или спиро группы (один атом углерода является общим для двух или более колец), например C1-12циклоалкил означает группы одно-, двух- или многокольцевого углеводородного соединения, имеющие 1-12 атомов углерода. С0циклоалкил означает одну одинарную ковалентную связь. Циклоалкил может содержать ненасыщенную двойную или тройную связь, но не имеет полностью сопряженной π-электронной системы. Использованный в настоящем изобретении термин "циклоалкил" включает циклопропил, циклобутил, циклогексил, циклопентенил, циклогептатриенил, адамантин, но не ограничивается ими (примеры показаны в таблице 1):
 и т.д.
и т.д.
Один или все атомы водорода циклоалкила или циклоалкана могут быть замещены следующими группами: алкил, арил, гетероарил, гетероциклоалкильное кольцо, галоген, амино, гидроксил, циано, нитро, карбоксил, тио, оксо, алкокси, арилокси, алкилтио, арилтио, карбонил, тиокарбонил, С-амид, N-амид, O-аминокарбонилокси, N-аминокарбонилокси, O-тиоаминокарбонилокси, N-тиоаминокарбонилокси, C-сложный эфир, O-сложный эфир и -NRaRb, где Ra и Rb соответственно выбраны из водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила, трифторметилсульфонила, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероциклоалкильное кольцо.
Термин "галоген" означает фтор, хлор, бром или йод.
Термин "алкокси" или "алкоксил" означает, что алкил, имеющий определенное число атомов углерода присоединен к другой группе через атом кислорода. Использованный в настоящем изобретении термин "алкокси" включает метоксил, этоксил, пропокси, бутоксил, циклопентилокси, циклогексилокси, изопропокси, неопентилокси, 2-метил-1-гексилокси и т.д., но не ограничивается ими.
Термин "циклоалкокси" или "циклоалкоксил" означает, что циклоалкил, имеющий определенное число атомов углерода присоединен к другой группе через атом кислорода. Использованный в настоящем изобретении термин "циклоалкокси" включает циклопропокси, циклобутокси, циклогексокси и тому подобное, но не ограничивается ими.
Термин "арил" означает одно-, двух- или многокольцевую группу, состоящую из 6-12 атомов углерода, где по меньшей мере одно кольцо имеет полностью сопряженную π-электронную систему и отвечает правилу N+2, т.е. обладает ароматичностью; но вся группа не обязательно должна быть полностью сопряженной. Арил может также находиться в форме арилена, т.е. в структуре арила присутствуют два или более чем два атома, присоединенных к другим группам. Использованный в настоящем изобретении термин "арил" включает фенил, нафтил, инденил, инданил, тетрагидронафталин и т.д., но не ограничивается ими. Один или все атомы водорода арила могут быть замещены следующими группами: алкил, циклоалкил, гетероарил, гетероциклоалкильное кольцо, галоген, амино, гидроксил, циано, нитро, карбоксил, тио, оксо, алкокси, арилокси, алкилтио, арилтио, карбонил, тиокарбонил, C-амид, N-амид, O-аминокарбонилокси, N-аминокарбонилокси, O-тиоаминокарбонилокси, N-тиоаминокарбонилокси, C-сложный эфир, O-сложный эфир и -NRaRb, где Ra и Rb соответственно выбраны из группы, состоящей из водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила, трифторметилсульфонила, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероциклоалкильное кольцо.
Термин "гетероарил" означает одно-, двух- или многокольцевую группу, состоящую из 5-12 кольцевых атомов, отличных от атомов водорода, где по меньшей мере один атом представляет собой O, N или S(=O)m (где m равен 0-2) и где по меньшей мере одно кольцо имеет полностью сопряженную π-электронную систему и отвечает правилу N+2, т.е. обладает ароматичностью; но вся группа не обязательно должна быть полностью сопряженной; например, С5гетероарил означает ароматическую кольцевую группу, состоящую из 5 кольцевых атомов, где по меньшей мере один кольцевой атом выбран из O, N или S(=O)m (где m равен 0-2). Гетероарил может также находиться в форме гетероарилена, т.е. в структуре гетероарила присутствуют два или более чем два атома, присоединенных к другим группам. Использованный в настоящем изобретении термин "гетероарил" включает пиридинил, пиридинонил, тетрагидропиридинонил, пиримидинил, пиразинил, пиридазинил, имидазолил, тиазолил, тиофенил, фуранил, индолил, азаиндолил, бензимидазолил, индолинил, индолонил, хинолинил и т.д., но не ограничивается ими (примеры показаны в таблице 2):
Один или все атомы водорода гетероарила могут быть замещены следующими группами: алкил, циклоалкил, арил, гетероциклоалкильное кольцо, галоген, амино, гидроксил, циано, нитро, карбоксил, тио, оксо, алкокси, арилокси, алкилтио, арилтио, карбонил, тиокарбонил, C-амид, N-амид, O-аминокарбонилокси, N-аминокарбонилокси, O-тиоаминокарбонилокси, N-тиоаминокарбонилокси, C-сложный эфир, O-сложный эфир и -NRaRb, где Ra и Rb соответственно выбраны из группы, состоящей из водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила и трифторметилсульфонила, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероциклоалкильное кольцо.
Термин "гетероциклоалкил или гетероциклоалкильное кольцо" означает одно-, двух- или многокольцевой алкил или алкан, состоящий из 3-12 кольцевых атомов, отличных от атомов водорода, где по меньшей мере один атом представляет собой O, N или S(=O)m (где m равен 0-2), например С6гетероциклоалкил означает однокольцевую группу, состоящую из 6 кольцевых атомов, где по меньшей мере один кольцевой атом выбран из O, N или S(=O)m (где m равен 0-2). Такое кольцо может дополнительно содержать двойные или тройные связи, отличные от одинарных связей, но эти двойные или тройные связи не образуют ароматической структуры. Такие одно-, двух- или многокольцевые алкилы или алканы могут находиться в форме конденсированного кольца, мостикового кольца или спиро кольца. Использованный в настоящем изобретении термин "гетероциклоалкил" или "гетероциклоалкильное кольцо" включает пиперидинил, морфолинил, пиперазинил, пирролидинил, индолинил, тетрагидропиридинил, тетрагидрофуранил, тропинил и т.д., но не ограничивается ими (примеры показаны в таблице 3):
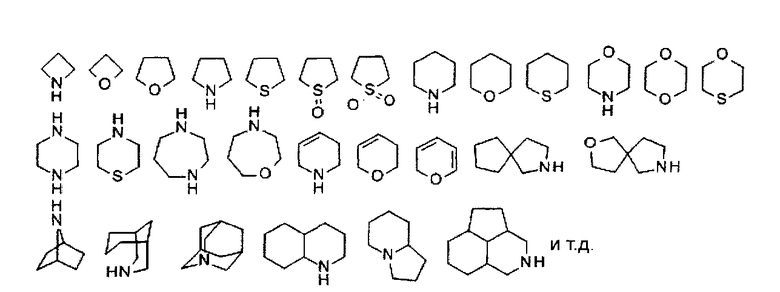
Один или все атомы водорода гетероциклоалкила или гетероциклоалкильного кольца могут быть замещены следующими группами: алкил, циклоалкил, арил, гетероарил, гетероциклоалкильное кольцо, галоген, амино, гидроксил, циано, нитро, карбоксил, тио, оксо, алкокси, арилокси, алкилтио, арилтио, карбонил, тиокарбонил, C-амид, N-амид, O-аминокарбонилокси, N-аминокарбонилокси, O-тиоаминокарбонилокси, N-тиоаминокарбонилокси, C-сложный эфир, O-сложный эфир и -NRaRb, где Ra и Rb соответственно выбраны из группы, состоящей из: водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила, трифторметилсульфонила, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероциклоалкильное кольцо.
Термин "арилокси" означает, что арил присоединен к другой группе через атом кислорода. Использованный в настоящем изобретении термин "арилокси" включает фенокси, нафтилокси и т.д., но не ограничивается ими.
Термин "гетероарилокси" означает, что гетероарил присоединен к другой группе через атом кислорода. Использованный в настоящем изобретении термин "гетероарилокси" включает 4-пиридинилокси, 2-тиенилокси и т.д., но не ограничивается ими.
Термин "амино" означает H2N- или H2N-, в котором атомы водорода замещены, т.е. RaHN- и RaRbN-.
Термин "оксо" или "оксил" означает =O, т.е. кислород присоединен к углероду или гетероатомам, включающим N, S, P, посредством двойной связи. Примеры веществ, замещенных оксилом, включают вещества, показанные в таблице 4, но не ограничиваются ими:
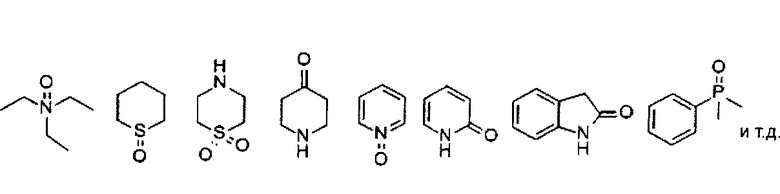
"Гидроксил" означает -OH.
"Нитро" означает -NO2.
"Карбоксил" означает -CO2H.
"Тио" означает -SH.
"Алкилтио" означает алкил-S-.
"Арилтио" означает арил-S-.
"Карбонил" означает -C(=O)-.
"Тиокарбонил" означает -C(=S)-.
"С-амид" означает -C(=O)NRaRb.
"N-амид" означает C(=O)NRa-.
"O-аминокарбонилокси" означает -O-C(=O)NRaRb.
"N-аминокарбонилокси" означает O-C(=O)NRa-.
"О-тиоаминокарбонилокси" означает -O-C(=S)NRaRb.
"N-тиоаминокарбонилокси" означает O-C(=S)NRa-.
"C-сложный эфир" означает -C(=O)ORa.
"N-сложный эфир" означает С(=O)O-.
"Ацетил" означает СН3С(=O)-.
"Сульфонил" означает -SO2Ra.
"Трифторметилсульфонил" означает CF3SO2-.
Краткое описание графических материалов
Фиг.1 представляет собой изображение опухолей в моделях мышиных ксенотрансплантатов GTL-16.
Фиг.2 представляет собой кривую изменения размеров опухоли в моделях мышиных ксенотрансплантатов GTL-16.
Фиг.3 представляет собой кривую, показывающую изменения массы тела в моделях мышиных ксенотрансплантатов GTL-16.
Фиг.4 представляет собой молекулярную структуру соединения по изобретению.
Конкретные воплощения
Настоящее изобретение дополнительно описано в следующих примерах, так что широкому кругу лиц будет далее понятен способ получения соединения по изобретению и их полезный эффект. Но примеры не следует толковать, как ограничивающие объем настоящей заявки.
Далее представлены аббревиатуры, использованные в примерах, и их соответствующие значения. Если какая-либо аббревиатура, не включенная в следующий список, появляется в примерах, она имеет общепринятое значение.
ДМСО: диметилсульфоксид
ТМС: тетраметилсилан
DCM: дихлорметан
CDCl3: дейтеротрихлорметан
CD3OD: дейтерометанол
DME: 1,2-диметоксиэтан
ТГФ: тетрагидрофуран
водн.: водный раствор
ТСХ: тонкослойная хроматография
ЖХ-МС: жидкостная хроматография-масс-спектрометрия
г: грамм
мг: миллиграмм
ммоль: миллимоль
мкМ: микромоль
мкл: микролитр
нМ: наномоль
M: молярность
N: нормальность (эквивалентная концентрация)
m/z: отношение массы к заряду
δ: химический сдвиг
DMAP: 4-диметиламинопиридин
DIPEA: диизопропилэтиламин
HATU: гексафторфосфат 2-(7-азабензотриазол)-N,N,N′,N′-тетраметилурония
EDC.HCl: гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида.
Общие условия эксперимента:
Водородные и углеродные спектры ядерного магнитного резонанса получают при использовании оборудования Varian INOVA 500 NB, или Varian 400 МГц, или Bruker 400 МГц (растворителем является дейтеро-ДМСО, дейтеротрихлорметан или дейтерометанол и т.д., а внутренним стандартом является ТМС). Масс-спектр получают при использовании жидкостного хроматографа-масс-спектрометра (источник ионизации ESI (электрораспылительная ионизация) или APCI (химическая ионизация при атмосферном давлении) ZQ4000, Waters Corporation, США). Ультрафиолетовый спектр измеряют с помощью ультрафиолетового спектрофотометра UV-3010, Hitachi Corporation, Япония. Инфракрасный спектр измеряют с помощью инфракрасного спектрометра NICOLET 6700 (диски KBr). Высокоэффективную жидкостную хроматографию проводят на высокоэффективном жидкостном хроматографе Waters 2695 ZORBAX (колонка Вх-С8, 5 мкм, 150×4,6 мм). Точку плавления измеряют с помощью прибора для определения точки плавления Electrothermal IA9100, без коррекции.
Исходные вещества, реагенты и растворители имеются в продаже у: Beta-Pharma, Шанхай; Shanghai PI Chemicals; AndaChem, Тайюань; Shanghai FWD Chemicals; Sigma-Aldrich, Милуоки, Висконсин (WI), США; Acros, Моррис Плейнс, Нью-Джерси (NJ), США; Frontier Scientific, Логан, Юта, США; Alfa Aesar, Уорд Хилл, Массачусетс (MA), США и т.д., или синтезированы посредством способов, описанных в литературе. Если не указано иного, обычно растворитель от поставщика используют непосредственно без осушения или осушают с помощью молекулярных сит.
Способы получения различных промежуточных соединений (включая промежуточное соединение A, промежуточное соединение B, промежуточное соединение C, промежуточное соединение D, промежуточное соединение F, промежуточное соединение G, промежуточное соединение H, промежуточное соединение I, промежуточное соединение J, промежуточное соединение K), необходимых для получения соединения по изобретению являются следующими.
Способ получения промежуточного соединения A: 4-(2-фтор-4-нитрофенокси)-6-метоксилхинолил-7-ола:
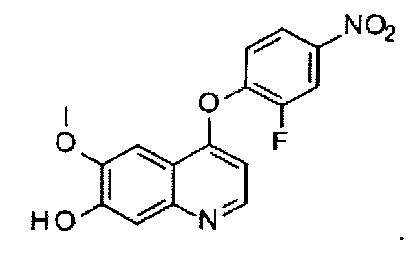
Промежуточное соединение A получают согласно способу, описанному в WO 2008/035209, и аналитические данные полученного продукта являются следующими: 1Н ЯМР (400 МГц, ДМСО-d6): δ=11.74 (s, ушир., 1Н), 8.76 (d, J=6.8 Гц, 1Н), 8.47 (dd, J=2.8 Гц, J=10.4 Гц, 1Н), 8.23 (dd, J=1.2 Гц, J=8.8 Гц, 1Н), 7.81 (m, 1Н), 7.65 (s, 1Н), 7.49 (s, 1Н), 7.04 (d, J=6.4 Гц, 1Н), 3.94 (s, 3Н).
Способ получения промежуточного соединения B: 4-(2-фтор-4-нитрофенокси)-7-метоксилхинолил-6-ола:
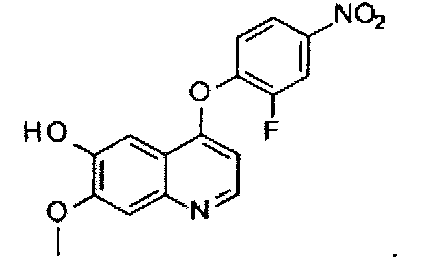
Промежуточное соединение B получают согласно способам, описанным в документах WO 2003/033472 и WO 2004/039782, и аналитические данные полученного продукта являются следующими: масс-спектр m/z: 331.12 [М+Н].
Способ получения промежуточного соединения C: трет-бутил-4-[[4-(4-амино-2-фторфенокси)-6-метоксил-7-хинолил]оксиметил]пиперидин-1-карбоксилата:
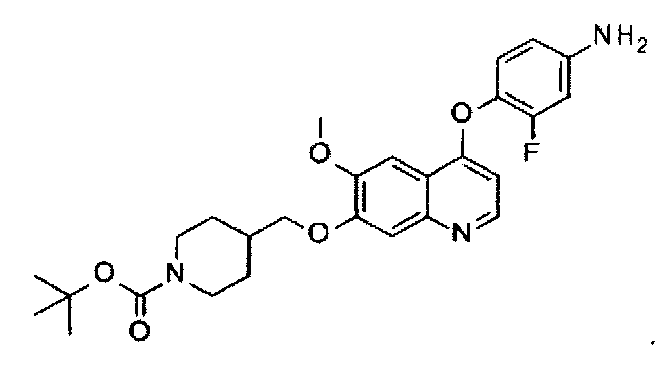
Промежуточное соединение C получают согласно способу, описанному в документе WO 2008/076415, и аналитические данные полученного продукта являются следующими: масс-спектр m/z: 498.21 [М+Н].
Способ получения промежуточного соединения D: 1-[(4-фторфенил)карбамоил]циклопропанкарбоновой кислоты:
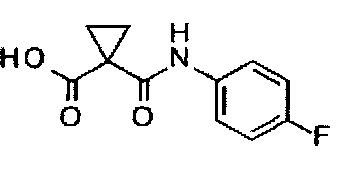
Промежуточное соединение C получают согласно способу, описанному в документе WO 2005/030140, и аналитические данные полученного продукта являются следующими: 1Н ЯМР (400 МГц, ДМСО-d6): δ=13.0 (s, 1Н), 10.6 (s, 1Н), 7.62-7.57 (m, 2Н), 7.15-7.09 (m, 2Н), 1.39 (s, 4Н).
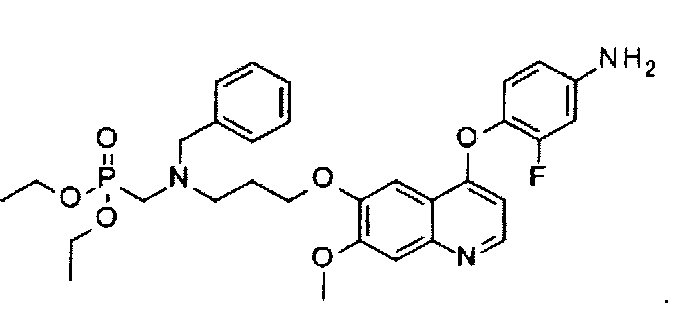
Способ получения промежуточного соединения E: N-бензил-3-хлор-N-(диэтоксифосфорилметил)пропан-1-амина:
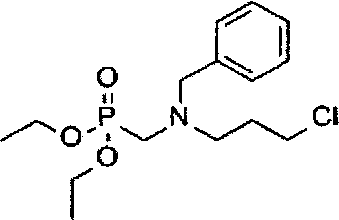
1,6 мл 37%-ного водного раствора формальдегида добавляют к суспензии гидрохлорида N-бензил-3-хлорпропан-1-амина (7,9 г или 35,9 ммоль) в диоксане (60 мл), полученную смесь слегка нагревают до превращения ее в раствор. Раствор охлаждают до комнатной температуры, в него добавляют 3,2 мл диэтилфосфата, перемешивая при комнатной температуре в течение 30 минут, и затем перемешивания при 90-100°C в течение 3 часов, реакцию прекращают. Растворитель удаляют при пониженном давлении, и остаток очищают посредством колоночной хроматографии (элюент: 1-4% MeOH в DCM) с получением 7,6 г целевого соединения (выход: 63%). Аналитические данные полученного продукта являются следующими: 1Н ЯМР (400 МГц, ДМСО-d6): δ=7.30-7.21 (m, 5Н), 4.01-3.93 (m, 4Н), 3.69 (s, 2Н), 3.59 (t, J=6.8 Гц, 2Н), 2.83 (d, J=10.0 Гц, 2Н), 2.61 (t, J=6.8 Гц, 2Н), 1.85-1.82 (m, 2Н), 1.2 (t, J=7.2 Гц, 6Н).
Способ получения промежуточного соединения F: 4-[[7-[3-(бензил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфениламина:
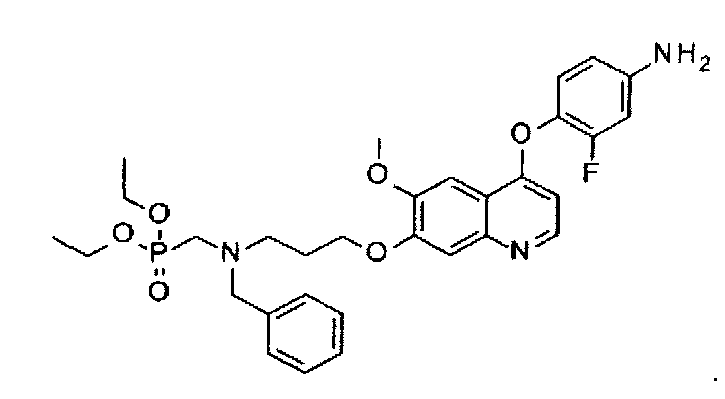
Стадия 1: получение N-бензил-N-(диэтоксифосфорилметил)-3-[[4-(2-фтор-4-нитрофенокси)-6-метоксил-7-хинолил]оксил]пропан-1-амина: карбонат калия (7,3 г или 53,2 ммоль) добавляют в раствор промежуточного соединения E (7,6 г или 22,8 ммоль) и промежуточного соединения A (5,0 г или 15,2 ммоль) в ДМФА (100 мл). Полученную смесь перемешивают при 110°C в течение 2 часов. Реакционную смесь разбавляют 500 мл этилацетата, неорганическую соль удаляют посредством фильтрации, фильтрат концентрируют, и остаток очищают посредством колоночной хроматографии (элюент: 1-4% MeOH в DCM) с получением 3,6 г целевого соединения (выход: 38%). Аналитические данные полученного продукта являются следующими: 1Н ЯМР (400 МГц, ДМСО-d6): δ=8.57 (d, J=5.2 Гц, 1Н), 8.47 (dd, J=2.4, 10.4 Гц, 1Н), 8.21-8.18 (m, 1Н), 7.63 (t, J=8.8 Гц, 1Н), 7.41-7.18 (m, 8Н), 6.78 (d, J=5.2 Гц, 1Н), 4.17 (t, J=6.4 Гц, 2Н), 4.04-3.96 (m, 4Н), 3.86 (s, 3Н), 3.78 (s, 2Н), 2.91 (d, J=10.0 Гц, 2Н), 2.73 (t, J=6.4 Гц, 2Н), 2.00 (t, J=6.4 Гц, 2Н), 1.24-1.19 (m, 6Н).
Стадия 2: получение 4-[[7-[3-(бензил(диэтоксифосфорилметил)амино) пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфениламина:
N-бензил-N-(диэтоксифосфорилметил)-3-[[4-(2-фтор-4-нитрофенокси)-6-метоксил-7-хинолил]оксил]пропан-1-амин (3,6 г или 28,7 ммоль), полученный на стадии 1, растворяют в 300 мл ТГФ, туда добавляют 5 г никеля Ренея, полученную смесь перемешивают при 30°C под давлением водорода 30 ф./кв. дюйм (примерно 206,8 кПа) в течение 2 часов. В конце реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением 2,9 г целевого соединения (выход: 83%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 598.01 [М+Н].
Способ получения промежуточного соединения G: 4-[[6-[3-(бензил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфениламина:
Беря за основу промежуточное соединение E и промежуточное соединение B, промежуточное соединение G получают способом, аналогичным способу получения промежуточного соединения F. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 598.08 [М+Н].
Способ получения промежуточного соединения Н: 3-хлор-N-(диэтоксифосфорилметил)-N-метилпропан-1-амина:
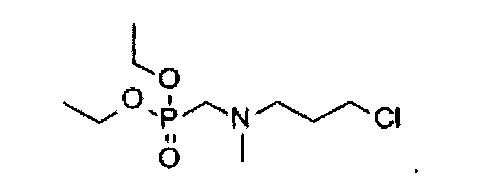
0,8 мл 37%-ного водного раствора формальдегида добавляют к суспензии 3-хлор-N-метилпропан-1-амина (1,4 г или 1,3 ммоль) в диоксане (30 мл), полученную смесь слегка нагревают до превращения ее в раствор. Раствор охлаждают до комнатной температуры, в него добавляют 1,6 мл диэтилфосфата, перемешивая при комнатной температуре в течение 30 минут, и затем перемешивая при 90-100°C в течение 3 часов, реакцию прекращают. Растворитель удаляют при пониженном давлении, и остаток очищают посредством колоночной хроматографии (элюент: 1-4% МеОН в DCM) с получением 2,3 г целевого соединения (выход: 81%). Аналитические данные полученного продукта являются следующими: 1Н ЯМР (400 МГц, CDCl3): δ=4.17-4.10 (m, 4Н), 3.74-3.53 (m, 4Н), 3.28-3.08 (m, 2Н), 2.80 (s, 3Н), 2.25-2.09 (m, 2Н), 1.29 (t, J=6.8 Гц, 6Н).
Способ получения промежуточного соединения I: 4-[[7-[3-(диэтоксифосфорилметил(метил))амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфениламина:
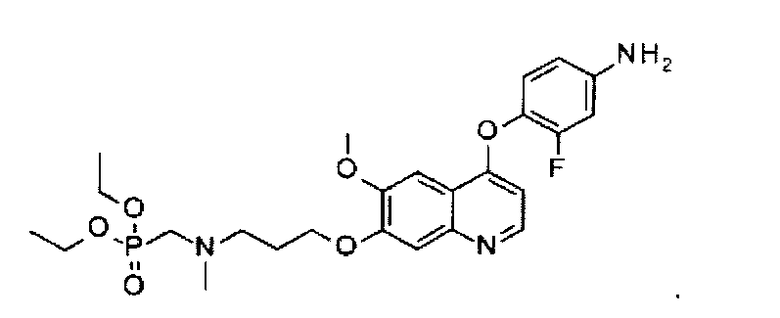
Стадия 1: получение N-(диэтоксифосфорилметил)-3-[[4-(2-фтор-4-нитрофенокси)-6-метоксил-7-хинолил]оксил]-N-метил-пропан-1-амина: карбонат калия (2,9 г или 21,0 ммоль) добавляют в раствор промежуточного соединения Н (2,0 г или 6,0 ммоль) и промежуточного соединения A (2,3 г или 9,0 ммоль) в ДМФА (45 мл). Полученную смесь перемешивают при 110°C в течение 2 часов. Реакционную смесь разбавляют 100 мл этилацетата, неорганическую соль удаляют посредством фильтрации, фильтрат концентрируют, и остаток очищают посредством колоночной хроматографии (элюент: 1-5% MeOH в DCM) с получением 1,8 г целевого соединения (выход: 55%). Аналитические данные полученного продукта являются следующими: 1Н ЯМР (400 МГц, ДМСО-d6): δ=8.55 (d, J=5.2 Гц, 1Н), 8.46 (dd, J=2.4, 10.8 Гц, 1Н), 8.22-8.15 (m, 1Н), 7.62 (t, J=8.4 Гц, 1Н), 7.43 (d, J=12.8 Гц, 2Н), 6.76 (d, J=5.2 Гц, 1Н), 4.20 (t, J=8.4 Гц, 2Н), 4.01-3.95 (m, 4Н), 3.91 (s, 3Н), 2.82 (d, J=10.8 Гц, 2Н), 2.64 (t, J=6.8 Гц, 2Н), 2.34 (s, 3Н), 1.96-1.93 (m, 3Н), 1.21 (t, J=4.4 Гц, 6Н).
Стадия 2: получение 4-[[7-[3-(диэтоксифосфорилметил(метил))амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфениламина:
N-(диэтоксифосфорилметил)-3-[[4-(2-фтор-4-нитрофенокси)-6-метоксил-7-хинолил]оксил]-N-метил-пропан-1-амин (1,8 г или 3,3 ммоль), полученный на стадии 1, растворяют в 170 мл ТГФ, туда добавляют 5 г никеля Ренея, полученную смесь перемешивают при 30°C под давлением водорода 30 ф./кв. дюйм (примерно 206,8 кПа) в течение 2 часов. В конце реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением 1,6 г целевого соединения (выход: 97%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 522.10 [М+Н].
Способ получения промежуточного соединения J: 4-[[6-[3-(диэтоксифосфорилметил)(метил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфениламина:

Беря за основу промежуточное соединение Н и промежуточное соединение B, промежуточное соединение J получают способом, аналогичным способу получения промежуточного соединения I. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 522.12 [М+Н].
Способ получения промежуточного соединения K: дигидрохлорида N1-[3-фтор-4-[[6-метоксил-7-(4-пиперидинилметоксил)-4-хинолил]оксил]фенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
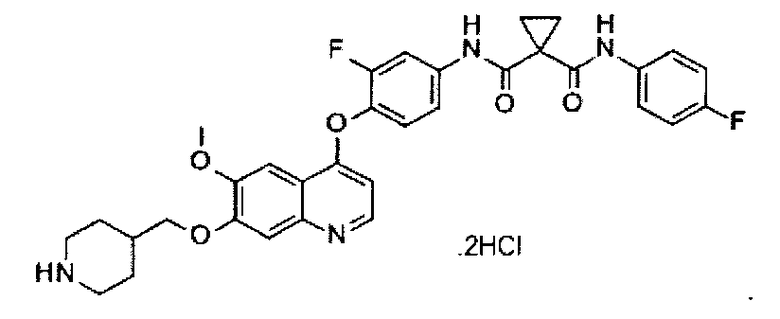
Стадия 1: получение трет-бутил-4-[[4-[2-фтор-4-[[1-[(4-фторфенил)аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метоксил-7-хинолил]оксиметил]пиперидин-1-карбоксилата: смесь промежуточного соединения C (1,5 г или 3,0 ммоль), промежуточного соединения D (1,7 г или 7,6 ммоль), DIPEA (1,55 г или 12,0 ммоль), HATU (2,3 г или 6,0 ммоль), DMAP (0,183 г или 1,5 ммоль) в ДМФА (60 мл) перемешивают при 30-40°C в течение ночи. Смесь концентрируют при пониженном давлении, и остаток очищают посредством колоночной хроматографии (элюент: 1-5% МеОН в DCM) с получением 1,9 г целевого соединения (выход: 90%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 703.30 [М+Н].
Стадия 2: получение дигидрохлорида трет-бутил-N1-[3-фтор-4-[[6-метоксил-7-(4-пиперидинилметоксил)-4-хинолил]оксил]фенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида: при 0°C насыщенный раствор (40 мл) HCl в EtOAc добавляют к раствору трет-бутил-4-[[4-[2-фтор-4-[[1-[(4-фторфенил)аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метоксил-7-хинолил]оксиметил]пиперидин-1-карбоксилата (1,6 г или 2,3 ммоль), полученному на стадии 1, в EtOAc (40 мл), полученную смесь перемешивают при комнатной температуре в течение 4 часов. Смесь фильтруют для сбора осадка с последующей промывкой EtOAc с получением 1,0 г целевого соединения (выход: 69%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 603.10 [М+Н].
Пример 1
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[7-[3-(бензил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
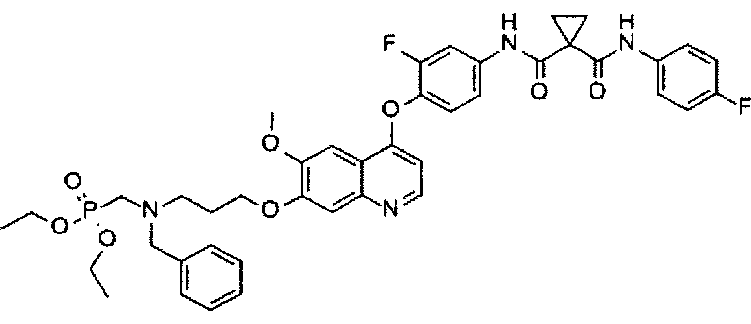
Смесь промежуточного соединения F (3,3 г или 5,5 ммоль), промежуточного соединения D (3,1 г или 13,8 ммоль), DIPEA (3,8 г или 22,1 ммоль), HATU (4,2 г или 11,0 ммоль), DMAP (0,337 г или 2,8 ммоль), растворенную в ДМФА (150 мл), перемешивают при 30-40°C в течение ночи. Смесь концентрируют при пониженном давлении, и остаток очищают посредством колоночной хроматографии (элюент: 1-4% МеОН в DCM) с получением 3,0 г соединения по изобретению (выход: 68%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 803.10 [М+Н].
Пример 2
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[6-[3-(бензил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)цикпопропан-1,1-дикарбоксамида:
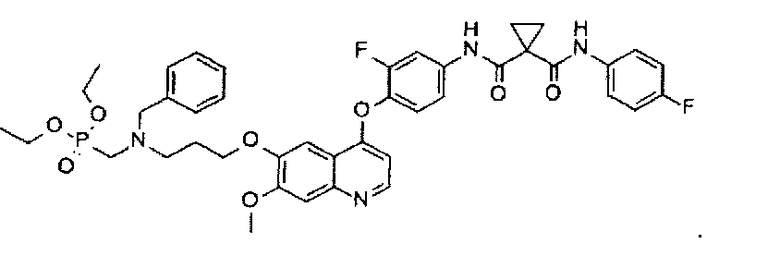
Используя промежуточное соединение G и промежуточное соединение D, указанное выше соединение получают таким же образом, как в примере 1. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 803.13 [М+Н].
Пример 3
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
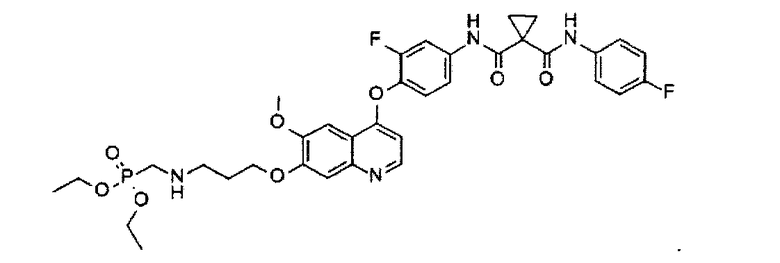
N1-[4-[[7-[3-(бензил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид, полученный по примеру 1 (1,0 г или 1,2 ммоль), растворяют в EtOH/ТГФ (1:1, 250 мл), туда добавляют Pd(OH)2 (1 г), и полученную смесь перемешивают при 45°C под давлением водорода 50 ф./кв. дюйм (примерно 344,7 кПа) в течение 18 часов. В конце реакционную смесь фильтруют, фильтрат концентрируют при пониженном давлении, и остаток очищают посредством колоночной хроматографии (элюент: 1-4% MeOH в DCM) с получением 0,368 г соединения по изобретению (выход: 43%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 713.20 [М+Н].
Пример 4
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[6-[3-(диэтоксифосфорилметиламино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
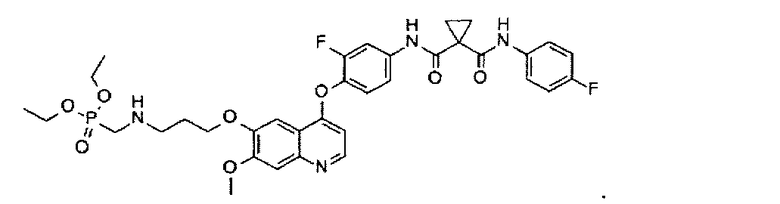
Используя N1-[4-[[6-[3-(бензил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид, полученный по примеру 2, указанное выше соединение получают таким же образом, как в примере 3. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 713.21 [М+Н].
Пример 5
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[7-[3-(ацетил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)цикпопропан-1,1-дикарбоксамида:
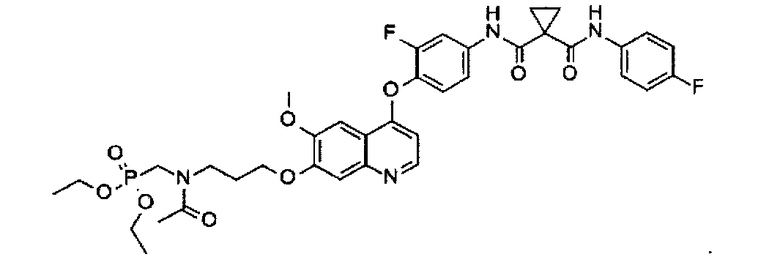
N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)цикпопропан-1,1-дикарбоксамид, полученный по примеру 3 (1,0 г или 1,4 ммоль), и DIPEA (0,544 г или 4,2 ммоль) растворяют в DCM (50 мл), туда добавляют уксусный ангидрид (0,428 г или 4,2 ммоль), и полученную смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь разбавляют DCM с последующим промыванием рассолом и затем концентрированием, и остаток очищают посредством колоночной хроматографии (элюент: 1-3% MeOH в DCM) с получением 0,856 г соединения по изобретению (выход: 81%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 755.18 [М+Н].
Пример 6
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[6-[3-(ацетил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинол ил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
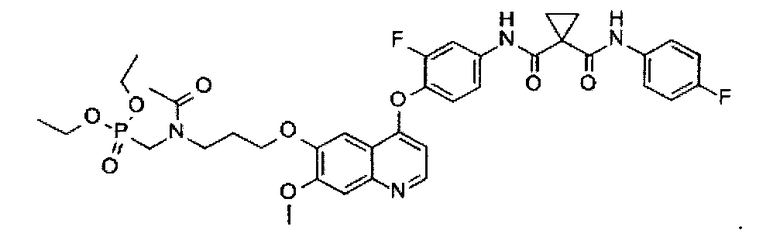
Используя N1-[4-[[6-[3-(диэтоксифосфорилметиламино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид, полученный по примеру 4, указанное выше соединение синтезируют таким же образом, как в примере 5. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 755.18 [М+Н].
Пример 7
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[7-[3-(диэтоксифосфорилметил)(метил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
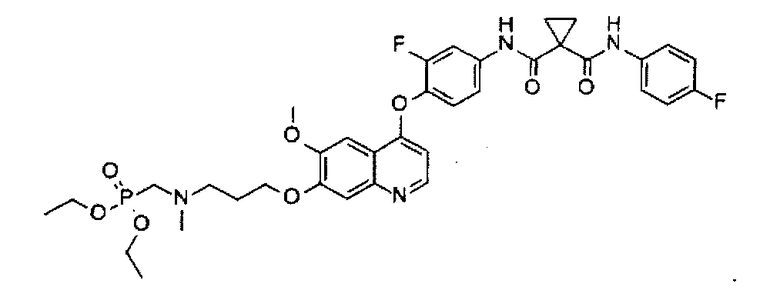
Смесь промежуточного соединения I (0,8 г или 1,5 ммоль), промежуточного соединения D (0,856 г или 7,6 ммоль), DIPEA (1,1 мл или 6,1 ммоль), HATU (1,2 г или 3,1 ммоль), DMAP (0,093 г или 0,8 ммоль) в ДМФА (60 мл) перемешивают при 30-40°C в течение ночи. Смесь концентрируют при пониженном давлении, и остаток очищают посредством колоночной хроматографии (элюент: 1-5% MeOH в DCM) с получением 0,352 г соединения по изобретению (выход: 31%). Аналитические данные полученного продукта являются следующими: 1Н ЯМР (400 МГц, ДМСО-d6): δ=10.37 (s, 1Н), 9.99 (s, 1Н), 8.46 (d, J=5.2 Гц, 1Н), 7.90 (dd, J=2.4, 13.2 Гц, 1Н), 7.64-7.60 (m, 2Н), 7.64-7.60 (m, 2Н), 7.51-7.49 (m, 2Н), 7.16-7.11 (m, 2Н), 6.41 (t, J=4.4 Гц, 1Н), 4.19 (t, J=6.0 Гц, 1Н), 4.04-3.96 (m, 4Н), 3.93 (s, 3Н), 2.90-2.81 (m, 2Н), 2.71-2.61 (m, 2Н), 2.06 (s, 3Н), 1.98-1.90 (m, 2Н), 1.46-1.42 (m, 4Н), 1.21 (t, J=7.2 Гц, 6Н).
Пример 8
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[6-[3-(диэтоксифосфорилметил)(метил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
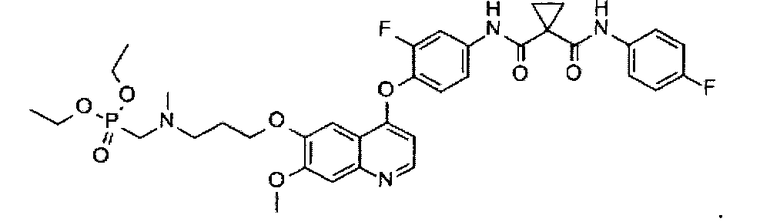
Используя промежуточное соединение J и промежуточное соединение D, указанное выше соединение получают таким же образом, как в примере 7. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 727.20 [М+Н].
Пример 9
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[7-[[1-(2-диэтоксифосфорилацетил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
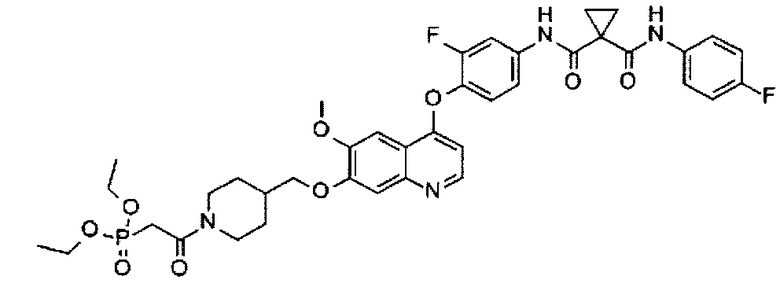
Смесь промежуточного соединения K (0,5 г или 0,8 ммоль), 2-диэтоксифосфорилуксусной кислоты (0,307 г или 1,6 ммоль), DIPEA (0,404 г или 3,1 ммоль), HATU (0,597 г или 1,6 ммоль) в ДМФА (15 мл) перемешивают при комнатной температуре в течение 2 часов. Смесь концентрируют при пониженном давлении, и остаток очищают посредством колоночной хроматографии (элюент: 1-5% МеОН в DCM) с получением 0,237 г соединения по изобретению (выход: 39%). Аналитические данные полученного продукта являются следующими: 1Н ЯМР (400 МГц, ДМСО-d6): δ=10.37 (s, 1Н), 9.99 (s, 1Н), 8.45 (d, J=5.2 Гц, 1Н), 7.90 (dd, J=2.0, 13.2 Гц, 1Н), 7.64-7.60 (m, 2Н), 7.50-7.48 (m, 2Н), 7.42-7.37 (m, 2Н), 7.16-7.11 (m, 2Н), 6.40 (dd, J=1.2, 5.2 Гц, 1Н), 4.45-4.35 (m, 1Н), 4.05-3.98 (m, 7Н), 3.93 (s, 3Н), 3.20-3.00 (m, 3Н), 2.65-2.55 (m, 1Н), 2.20-2.00 (m, 1Н), 1.88-1.78 (m, 2Н), 1.45-1.44 (m, 4Н), 1.42-1.28 (m, 1Н), 1.23 (t, J=6.8 Гц, 6Н), 1.18-1.08 (m, 1Н).
Пример 10
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1-[4-[[7-[[1-(диэтоксифосфорилметил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)цикпопропан-1,1-дикарбоксамида:
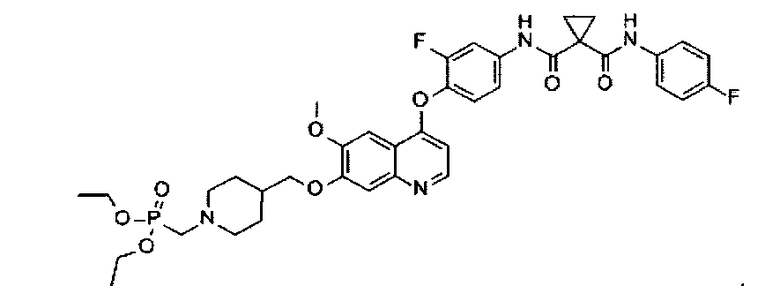
0,11 мл 37%-ного водного раствора формальдегида добавляют к суспензии промежуточного соединения K (0,8 г или 1,3 ммоль) в диоксане (10 мл), полученную смесь слегка нагревают до превращения ее в раствор. Раствор охлаждают до комнатной температуры, добавляют в него 0,21 мл диэтилфосфата при перемешивании при комнатной температуре в течение 30 минут, и затем перемешивая при 90-100°C в течение 3 часов, реакцию прекращают. Растворитель удаляют при пониженном давлении, и остаток очищают посредством колоночной хроматографии (элюент: 1-4% MeOH в DCM) с получением 0,354 г соединения по изобретению (выход: 35%). Аналитические данные полученного продукта являются следующими: 1Н ЯМР (400 МГц, ДМСО-d6): δ=10.37 (s, 1Н), 10.00 (s, 1Н), 8.45 (d, J=5.2 Гц, 1Н), 7.90 (dd, J=2.0, 13.2 Гц, 1Н), 7.64-7.60 (m, 2Н), 7.51-7.49 (m, 2Н), 7.42-7.36 (m, 2Н), 7.16-7.11 (m, 2Н), 6.39 (d, J=5.2 Гц, 1Н), 4.05-3.97 (m, 6Н), 3.93 (s, 3Н), 3.06-3.03 (m, 2Н), 2.76-2.74 (m, 2Н), 2.15-2.09 (m, 2Н), 1.88-1.74 (n, 3Н), 1.45-1.33 (m, 6Н), 1.24 (t, J=6.8 Гц, 6Н).
Пример 11
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1′-[4-[[7-[3-(аминокарбонил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинол ил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
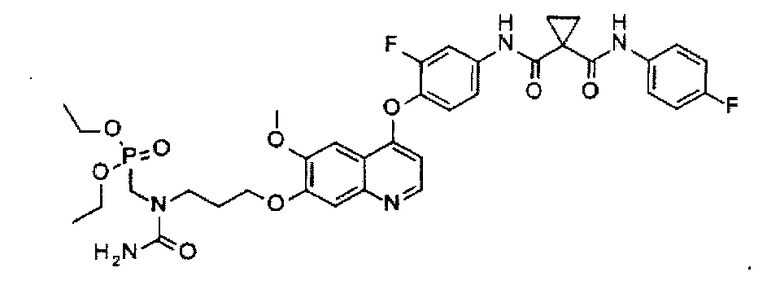
N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинол ил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид, полученный по примеру 3 (71,2 мг или 0,1 ммоль), растворяют в DCM (5 мл), затем туда добавляют Me3Si-NCO (23,0 мг или 0,20 ммоль) и диизопропилэтиламин (38,5 мг или 0,3 ммоль), полученную смесь перемешивают при комнатной температуре в течение 16 часов, растворитель удаляют при пониженном давлении, и неочищенный продукт очищают посредством колоночной хроматографии на силикагеле (элюент: 1-4% MeOH в DCM) с получением 57,5 мг соединения по изобретению (выход: 76%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 756.12 [М+Н].
Пример 12
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1′-[4-[[6-[3-(аминокарбонил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
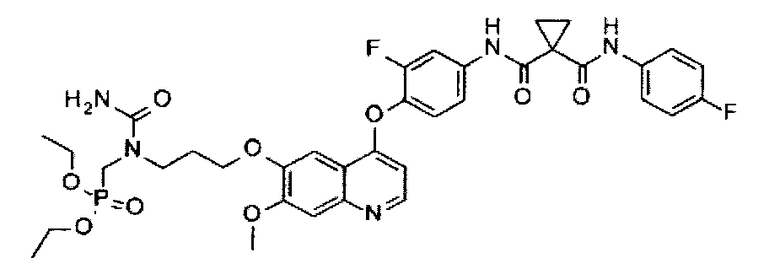
Используя N1-[4-[[6-[3-(диэтоксифосфорилметиламино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид, полученный по примеру 4, указанное выше соединение получают таким же образом, как в примере 11. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 756.18 [М+Н].
Пример 13
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1′-[4-[[7-[3-(диэтоксифосфорилметил)(этиламинокарбонил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
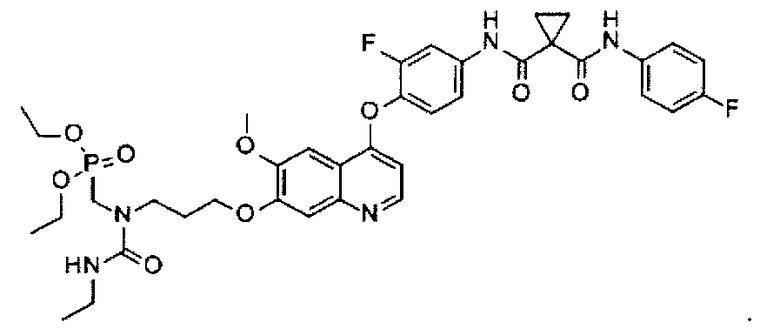
N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид, полученный по примеру 3 (71,2 мг или 0,1 ммоль), растворяют в DCM (5 мл), затем туда добавляют EtNCO (14,2 мг или 0,20 ммоль) и диизопропилэтиламин (38,5 мг или 0,3 ммоль), полученную смесь перемешивают при комнатной температуре в течение 16 часов, растворитель удаляют при пониженном давлении, и неочищенный продукт очищают посредством колоночной хроматографии на силикагеле (элюент: 1-4% MeOH в DCM) с получением 64,3 мг соединения по изобретению (выход: 82%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 784.22 [М+Н].
Пример 14
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1′-[4-[[7-[3-(диэтоксифосфорилметил)(пропионил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)цикпопропан-1,1-дикарбоксамида:
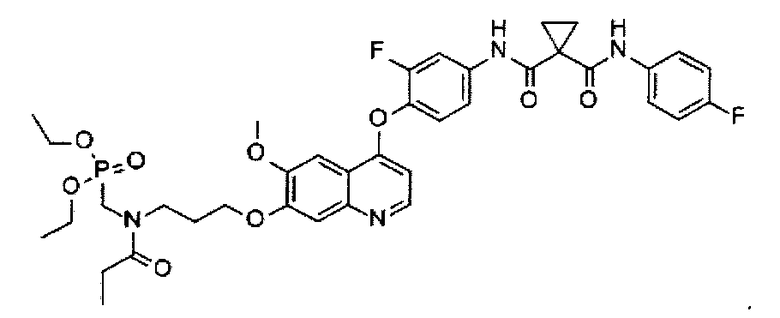
N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид (71,2 мг или 0,1 ммоль), полученный по примеру 3, растворяют в DCM (5 мл), затем туда добавляют пропионовую кислоту (14,8 мг или 0,20 ммоль), EDC.HCl (38,4 мг или 0,2 ммоль) и диизопропилэтиламин (64,2 мг или 0,5 ммоль), полученную смесь перемешивают при комнатной температуре в течение 16 часов, растворитель удаляют при пониженном давлении, и неочищенный продукт очищают посредством колоночной хроматографии на силикагеле (элюент: 1-4% MeOH в DCM) с получением 50,7 мг соединения по изобретению (выход: 66%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 769.15 [М+Н].
Пример 15
Получение одного из замещенных фосфорсодержащей группой хинолинов по настоящему изобретению, N1′-[4-[[7-[3-(диэтоксифосфорилметил)(метилсульфонил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
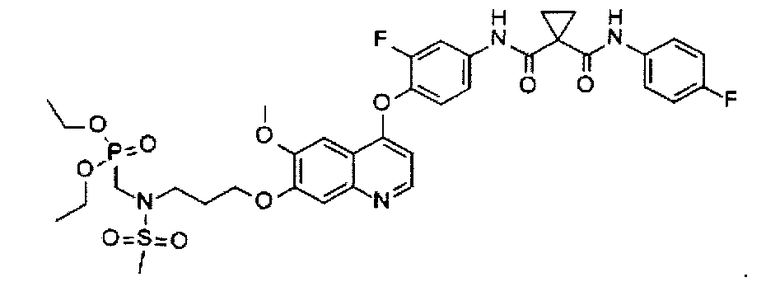
N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид, полученный по примеру 3 (71,2 мг или 0,1 ммоль) растворяют в DCM (5 мл) и затем туда добавляют метилсульфонилхлорид (22,9 мг или 0,20 ммоль), EDC.HCl (38,4 мг или 0,2 ммоль) и диизопропилэтиламин (64,2 мг или 0,5 ммоль), полученную смесь перемешивают при комнатной температуре в течение 16 часов, растворитель удаляют при пониженном давлении, и неочищенный продукт очищают посредством колоночной хроматографии на силикагеле (элюент: 1-4% MeOH в DCM) с получением 44,3 мг соединения по изобретению (выход: 56%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 791.28 [М+Н].
Пример 16
Скрининговый тест ингибирования киназы:
В этом примере соединение, полученное в примере 10, N1-[4-[[7-[[1-(диэтоксифосфорилметил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид, тестируют на ингибирующее действие на 442-киназной панели KinomeScan™ (http://www.kinomescan.com) от DiscoveRx Corporation (4215 Sorrento Valley Blvd, Сан-Диего, Калифорния (CA) 92121), при концентрации соединения 1000 нМ, результаты показаны в следующей таблице 5.
Для подробной информации по методике скрининга см. Fabian, М. A. et al, Nat, Biotechnol. 2005, 23, 329 и Karaman, M.W. et al, Nat, Biotechnol. 2008, 26, 127. По следующим характерным результатам можно видеть, что соединение по настоящему изобретению обладает значительным ингибирующим действием на киназы, включая c-Met, KDR или VEGFR2, RET, PDGFR-β, c-KIT, Flt3, MEK5, DDR1, LOK, CSF1R, EPHA7, EPHA8, EPHB6, MKNK2, BLK, HIPK4, HCK, FIt4 и их мутанты.
Пример 17
Ингибиторная активность в отношении киназ в опухолевых клетках.
В этом примере соединение, полученное в примере 10, N1-[4-[[7-[[1-(диэтоксифосфорилметил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)цикпопропан-1,1-дикарбоксамид, тестируют на опухолевых клетках от корпорации ProQinase GmbH (Breisacher Str. 117, D-79106 Фрайбург, Германия, http://www.proqinase.com) на ингибиторную активность в отношении следующих киназ: c-KIT, c-MET, VEGFR2 и PDGFR-β. Исследование включает следующие стадии.
Сначала соединение по настоящему изобретению растворяют в диметилсульфоксиде (ДМСО) для получения 10 мМ исходного раствора, который серийно разводят согласно диапазонам концентрации, показанным в таблице 6:
Культура клеток
Киназа c-KIT: в исследовательском эксперименте по фосфорилированию киназы KIT в клетках используют линию клеток острого мегакариоцитарного лейкоза человека М07е, имеющих эндогенную высокоэкспрессируемую c-KIT дикого типа. Когда эти клетки стимулируют человеческим фактором стволовых клеток (SCF), происходит аутофосфорилирование тирозина рецепторных киназ KIT. Клетки M07e инокулируют в RPMI, содержащую 20% фетальной телячьей сыворотки (FCS) и 10 нг/мл ГМ-КСФ (гранулоцитарно-макрофагальный колониестимулирующий фактор), в многолуночный планшет для культур клеток. Соединение по изобретению добавляют к клеткам после истощения в течение ночи сыворотки и ростового фактора, затем клетки культивируют в среде без сыворотки.
Киназа c-MET: в исследовательском эксперименте по фосфорилированию киназы c-MET в клетках используют линию клеток рака желудка человека MKN45, имеющих эндогенную высокоэкспрессируемую c-MET дикого типа (c-MET дикого типа). Такая высокая экспрессия c-MET приводит к непрерывному аутофосфорилированию тирозина рецепторных киназ c-MET без лигандов. Клетки MKN45 инокулируют в культуральный среду DMEM (среда Игла, модифицированная по Дульбекко), содержащую 10% FCS, в многолуночный планшет для культур клеток. Соединение по изобретению добавляют к клеткам после истощения в течение ночи сыворотки, затем клетки культивируют в среде без сыворотки.
Киназа VEGFR2: в исследовательском эксперименте по фосфорилированию киназы VEGFR2 в клетках используют спонтанно иммортализованную линию эндотелиальных клеток пупочной вены человека HUE, имеющих эндогенный высокоэкспрессируемый R (рецептор) фактора роста эндотелия сосудов-2 (VEGFR2). Когда эти клетки стимулируют фактором роста эндотелия сосудов-A (VEGF-A) человека, это приводит к аутофосфорилированию тирозина рецепторных киназ VEGFR2. Клетки HUE инокулируют в среду для выращивания эндотелиальных клеток (ECGM), содержащую 10% FCS, в многолуночный планшет для культур клеток. Соединение по изобретению добавляют к клеткам после истощения в среде для выращивания эндотелиальных клеток (ECGM) в течение ночи сыворотки, затем клетки культивируют в культуральной среде ECGM без сыворотки.
Киназа PDGFR-β: в исследовательском эксперименте по фосфорилированию киназы PDGFR-бета в клетках используют линию клеток эмбриональных фибробластов мыши NIH3T3, имеющих эндогенную высокоэкспрессируемую PDGFR-β дикого типа (PDGFR-β дикого типа). Когда эти клетки стимулируют мышиным тромбоцитарным фактором роста BB (PDGF-ВВ), это приводит к аутофосфорилированию тирозина рецепторных киназ PDGFR-бета. Клетки NIH3T3 инокулируют в культуральную среду DMEM, содержащую 10% FCS, в многолуночный планшет для культур клеток. Соединение по изобретению добавляют к клеткам после истощения в течение ночи сыворотки, затем клетки культивируют в среде без сыворотки.
Способ исследования
Образец разведенного исходного раствора соединения по изобретению добавляют к раствору культуры клеток в соотношении 1:100, до тех пор пока не будет достигнута конечная концентрация ДМСО 1%. После культивирования при 37°C в течение 90 минут клетки стимулируют согласно таблице 7 (количественный способ: сэндвич-ELISA (твердофазный иммуноферментный анализ): количественный анализ субстратного фосфорилирования проводят при помощи способа сэндвич-ELISA в 96-луночном планшете при использовании антитела для захвата специфического субстрата и антитела для детекции дефосфорилированного тирозина. Величины IC50 определяют при использовании программного обеспечения GraphPad Prism 5.01):
Результаты исследования
При построении кривой титрования N1-[4-[[7-[[1-(диэтоксифосфорилметил)-4-пиперидинил]метоксил]-6-метоксил-4-хинол ил]оксил]-3-фторфенил]-N1′-(4-фторфенил)цикпопропан-1,1-дикарбоксамида, ингибирующего c-KIT, c-MET, VEGFR2 и PDGFR-β в клетках, получают величины IC50 соединения, ингибирующего четыре указанные выше киназы; показаны в таблице 8.
Из указанных выше данных можно видеть, что соединение по настоящему изобретению обладает значительным ингибирующим действием на некоторые киназы, т.е. c-Met, c-KIT, VEGFR2 и PDGFR-β в опухолевых клетках, их величины Ю5о находятся в диапазоне 0,43-27 нМ.
Пример 18
Противоопухолевые эксперименты: в этом примере N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид, полученный по примеру 3, используют в противоопухолевых экспериментах ксенотрансплантата клеток рака желудка человека GTL-16 на животной модели бестимусных мышей с мутацией nude, способы и результаты являются следующими.
Материалы
7-8-недельных самок мышей BALB/c-nu/nu, имеющих статус SPF (свободных от специфических патогенов), с массой тела 16-20 г приобретают в Центре экспериментальных животных в провинции Гуандун (Experimental Animal Center of Guangdong Province), номер контрольного сертификата: NO: 0072659. Клетки рака желудка GTL-16 приобретают в Центре источника клеток Шанхайского института биологических наук (Cell Source Center of Shanghai Institutes for Biological Sciences). Культуральную среду RPMI-1640, фетальную телячью сыворотку (FBS) и трипсин пищеварительного сока получают от Gibco Corporation. Все антибиотики приобретают у Sigma Company.
Способы
Первоначальное культивирование клеток рака желудка GTL-16: линию клеток GTL-16 инокулируют в культуральную среду RPMI-1640, содержащую 10% FBS, 100 ед/мл пенициллина, 100 ед/мл стрептомицина, и культивируют при 37°C, 5% CO2, 100% влажности в углекислотном инкубаторе клеток, клетки входят в логарифмическую фазу роста через 24 часа, через 48 часов после инокуляции клетки растут, покрывая дно культурального сосуда. Затем клетки GTL-16, покрывающие 80% дна культурального сосуда, разрушаются, через 5 минут после центрифугирования при 1000 об/мин клетки разводят до 2×107 клеток/мл и подкожно имплантируют в передний край правой подмышечной ямки в количестве 0,1 мл на мышь. Через 12 суток после имплантации опухолевых клеток взвешивают бестимусных мышей с мутацией nude, несущих опухоли, размеры опухолей измеряют, и мышей с размерами опухолей в диапазоне 40-160 мм3 случайным образом разделяют на группу носителя (носитель, 0,2% водный раствор метилсульфоновой кислоты) и подвергаемую обработке группу, в которой применяют соединение, полученное в примере 3, N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид (который растворяют в 0,2%-ном водном растворе метилсульфоновой кислоты до концентрации 5 мг/мл), 8 мышей на группу; после этого бестимусных мышей с мутацией nude взвешивают каждые сутки и перорально вводят в количестве 0,1 мл/10 г массы тела с помощью зонда (50 мг/кг ежедневно перорально), размеры опухолей у каждого животного измеряют раз в двое суток, через 14 суток мышей-опухоленосителей умерщвляют путем дислокации шейного отдела позвоночника, и опухоли извлекают для взвешивания. Способ подсчета ингибирования опухолевого роста (TGI): экспериментальные данные выражают в виде среднего значения ±SD (стандартное отклонение), TGI=[(Vгруппа носителя-Vподвергаемая обработке группа)÷Vгруппа носителя]×100%.
Vгруппа носителя означает объем опухоли у мышей в группе носителя;
V подвергаемая обработке группа означает объем опухоли у мышей в подвергаемой обработке группе.
Результаты
Эффект опухолевого ингибирования соединения по настоящему изобретению, полученного в примере 3, на опухоль мышей в подвергаемой обработке группе: группе носителя и подвергаемой обработке группе дают соответственно носитель и раствор лекарственного средства, через 14 суток средние объемы опухоли у животных в группе носителя и подвергаемой обработке группе составляют 377,1±244,5 мм3 (n=7) и 57,1±61,2 (n=8), соответственно; таким образом, TGI в подвергаемой обработке группе составляет 85%. По сравнению с первоначальными объемами опухоли размеры опухоли в подвергаемой обработке группе значительно уменьшаются. Сравнение опухолевых тканей представлено на Фиг.1, а сравнение экспериментальных кривых представлено на Фиг.2.
Изменение массы тела мышей в группе носителя и подвергаемой обработке группе представлено на Фиг.3: после лечения в течение 14 суток масса тела мышей в подвергаемой обработке группе, в которой применяют соединение по примеру 3, изменилась незначительно (менее 5%).
Из результатов приведенных выше противоопухолевых экспериментов можно видеть, что в животных моделях ксенотрансплантатов бестимусных мышей с мутацией nude типичное соединение по настоящему изобретению проявляет значительное противоопухолевое действие при пероральном введении в дозе 50 мг/кг один раз в сутки; через 14 суток TGI достигает 85%. Масса тела животных в подвергаемой обработке группе по существу не уменьшается, это показывает, что лекарственное средство не обладает значительной токсичностью.
Пример 19:
Ингредиенты и композиция лекарственного средства
Таблетка (мг/таблетка)
Соединение, полученное в примере 1: 100;
Лактоза, Ph EUR (Европейская Фармакопея): 182,75;
Карбоксиметилцеллюлоза натрия: 12,0;
Суспензия кукурузного крахмала (5 мас./об.%): 2,25;
Стеарат магния: 3,0.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 20:
Ингредиенты и композиция лекарственного средства
Таблетка (мг/таблетка)
Соединение, полученное в примере 5: 100; содержание других веществ является таким же, как в примере 19.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 21:
Ингредиенты и композиция лекарственного средства
Таблетка (мг/таблетка)
Соединение, полученное в примере 1: 50;
Лактоза, Ph EUR: 223,75;
Карбоксиметилцеллюлоза натрия: 6,0;
Кукурузный крахмал: 15,0;
Поливинилпирролидон (5 масс./об.%): 2,25;
Стеарат магния: 3,0.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 22:
Ингредиенты и композиция лекарственного средства
Таблетка (мг/таблетка)
Соединение, полученное в примере 3: 50; содержание других веществ является таким же, как в примере 21.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 23:
Ингредиенты и композиция лекарственного средства
Таблетка (мг/таблетка)
Соединение, полученное в примере 7: 1,0;
Лактоза, Ph EUR: 93,25,
Карбоксиметилцеллюлоза натрия: 4,0;
Суспензия кукурузного крахмала (5 мас./об.%): 0,75;
Стеарат магния: 76.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 24:
Ингредиенты и композиция лекарственного средства
Таблетка (мг/таблетка)
Соединение, полученное в примере 5: 1,0; содержание других веществ является таким же, как в примере 23.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 25:
Ингредиенты и композиция лекарственного средства
Капсула (мг/капсула)
Соединение, полученное в примере 7: 10,0;
Лактоза, Ph EUR: 488,5;
Магний: 1,5.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 26:
Ингредиенты и композиция лекарственного средства
Капсула (мг/капсула)
Соединение, полученное в примере 2: 10,0; содержание других веществ является таким же, как в примере 25.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 27:
Ингредиенты и композиция лекарственного средства
Инъекция (50 мг/мл)
Соединение, полученное в примере 6: 5%;
1 М раствор гидроксида натрия: 15%;
0,1 М раствор соляной кислоты (pH доводят до 7,6);
Полиэтиленгликоль 400: 5%;
Доведение до 100% водой для инъекций:
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 28:
Ингредиенты и композиция лекарственного средства
Инъекция (50 мг/мл)
Соединение, полученное в примере 12: 5%; содержание других веществ является таким же, как в примере 27; в конце доведение до 100% водой для инъекций.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 29:
Ингредиенты и композиция лекарственного средства
Инъекция (10 мг/мл)
Соединение, полученное в примере 11: 1%;
Гидрофосфат динатрия BP (Британская Фармакопея): 3,6%;
0,1 М раствор гидроксида натрия: 15%;
Доведение до 100% водой для инъекций.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 30:
Ингредиенты и композиция лекарственного средства
Инъекция (10 мг/мл)
Соединение, полученное в примере 9: 1%; содержание других веществ является таким же, как в примере 29; доведение до 100% водой для инъекций.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 31:
Ингредиенты и композиция лекарственного средства
Инъекция (1 мг/мл) (pH доводят до 6)
Соединение, полученное в примере 6: 0,1%;
Гидрофосфат динатрия BP: 2,26%;
Лимонная кислота: 0,38%;
Полиэтиленгликоль 400: 3,5%;
Вода для инъекций (для доведения до 100%).
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 32:
Ингредиенты и композиция лекарственного средства
Инъекция (1 мг/мл) (pH доводят до 6)
Соединение, полученное в примере 10: 0,1%; содержание других веществ является таким же, как в примере 31; в конце используют воду для инъекций для доведения содержимого до 100%.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 33:
Ингредиенты и композиция лекарственного средства
Аэрозоль (мг/мл)
Соединение, полученное в примере 1:10;
Сорбитан олеат: 13,5;
Трихлорфторметан: 910,0;
Дихлордифторметан: 490,0.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 34:
Ингредиенты и композиция лекарственного средства
Аэрозоль (мг/мл)
Соединение, полученное в примере 3: 10; содержание других веществ является таким же, как в примере 33.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 35:
Ингредиенты и композиция лекарственного средства
Аэрозоль (мг/мл)
Соединение, полученное в примере 4: 0,2;
Сорбитан олеат: 0,27;
Трихлорфторметан: 70,0;
Дихлордифторметан: 280,0;
Дихлортетрафторэтан: 1094,0.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 36:
Ингредиенты и композиция лекарственного средства
Аэрозоль (мг/мл)
Соединение, полученное в примере 7: 0,2; содержание других веществ является таким же, как в примере 35.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 37:
Ингредиенты и композиция лекарственного средства
Аэрозоль (мг/мл)
Соединение, полученное в примере 8: 2,5;
Сорбитан олеат: 3,38;
Трихлорфторметан: 67,5;
Дихлордифторметан: 1086,0;
Дихлортетрафторэтан: 191,60.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 38:
Ингредиенты и композиция лекарственного средства
Аэрозоль (мг/мл)
Соединение, полученное в примере 11: 2,5; содержание других веществ является таким же, как в примере 37.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 39:
Ингредиенты и композиция лекарственного средства
Аэрозоль (мг/мл)
Соединение, полученное в примере 4: 2,5;
Соевый лецитин: 2,7;
Трихлорфторметан: 67,5;
Дихлордифторметан: 1086,0;
Дихлортетрафторэтан: 191,60;
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 40:
Ингредиенты и композиция лекарственного средства
Аэрозоль (мг/мл)
Соединение, полученное в примере 13: 2,5; содержание других веществ является таким же, как в примере 39.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 41:
Ингредиенты и композиция лекарственного средства
Мазь (/мл)
Соединение, полученное в примере 1: 40 мг;
Этанол: 300 мкл;
Вода: 300 мкл;
1-додецилазациклогептанон: 50 мкл;
Пропандиол: до 1 мл.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
Пример 42:
Ингредиенты и композиция лекарственного средства
Мазь (/мл)
Соединение, полученное в примере 7: 40 мг; содержание других веществ является таким же, как в примере 41.
Применение для людей
Применим для пациентов, страдающих заболеваниями, ассоциированными с аномальной активностью протеинкиназы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИНОЛИЛ-СОДЕРЖАЩЕЕ СОЕДИНЕНИЕ ГИДРОКСАМОВОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, А ТАКЖЕ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ АНОМАЛЬНОЙ АКТИВНОСТЬЮ ПРОТЕИНКИНАЗЫ И/ИЛИ ГИСТОНДЕАЦЕТИЛАЗЫ | 2011 |
|
RU2573633C2 |
| ХИНОЛИНИЛ-СОДЕРЖАЩЕЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2803116C2 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО, ЗАДЕЙСТВУЮЩЕЕ СОЕДИНЕНИЯ С ИНГИБИРУЮЩИМ ЭФФЕКТОМ К КИНАЗАМ В КОМБИНАЦИИ | 2011 |
|
RU2560683C2 |
| ФАРМАЦЕВТИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ Axl | 2011 |
|
RU2573834C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИРИДИНА И ПРОИЗВОДНОЕ ПИРИМИДИНА (3) | 2006 |
|
RU2362771C1 |
| НОВЫЕ КОНДЕНСИРОВАННЫЕ ПИРИДИНОВЫЕ ПРОИЗВОДНЫЕ, ПРИМЕНИМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗЫ с-MET | 2013 |
|
RU2619130C2 |
| Соединения, активные по отношению к бромодоменам | 2015 |
|
RU2743074C2 |
| АЗОТСОДЕРЖАЩИЕ АРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ, ИХ ПРИМЕНЕНИЕ, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2264389C2 |
| Регулятор на основе азотсодержащего гетероциклического производного, способ его получения и его применение | 2020 |
|
RU2829553C2 |
| КЛАСС КОНДЕНСИРОВАННЫХ КОЛЬЦЕВЫХ СОЕДИНЕНИЙ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2831125C1 |
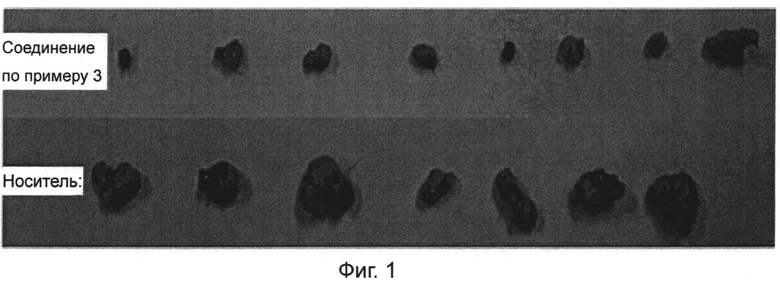
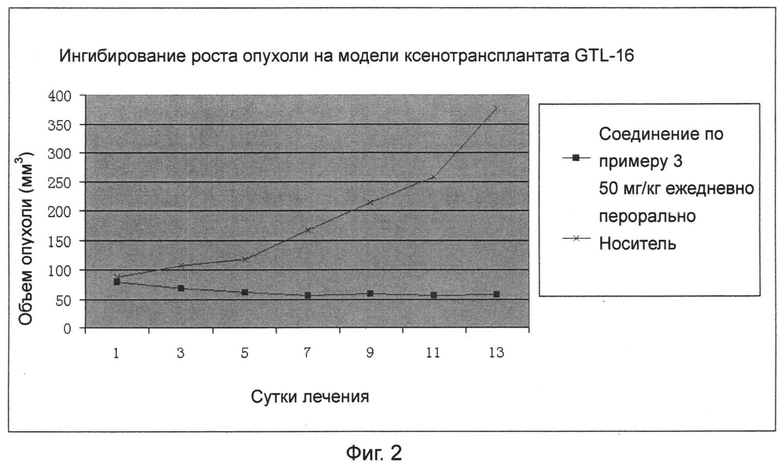
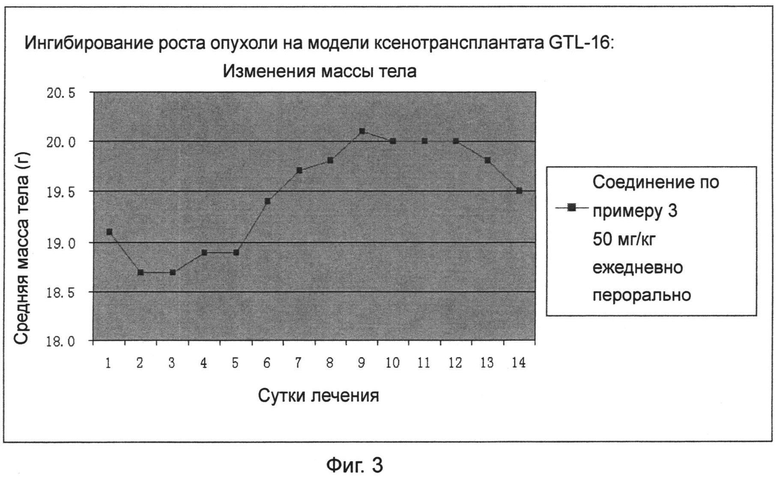
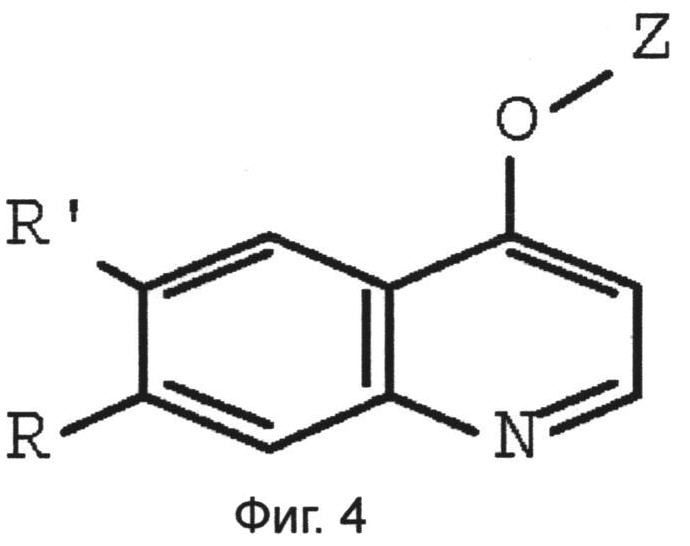
Изобретение относится к замещенным фосфорсодержащей группой хинолинам формулы (I), которые могут использоваться в медицине
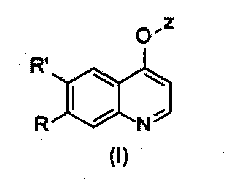 ,
,
где Ζ представляет собой 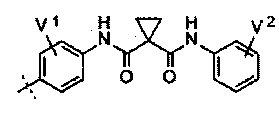 , V1 и V2 независимо выбраны из водорода или галогена; один из R и R` представляет собой фосфорсодержащий заместитель Q, другой выбран из водорода или метоксила; где фосфорсодержащий заместитель Q представляет собой
, V1 и V2 независимо выбраны из водорода или галогена; один из R и R` представляет собой фосфорсодержащий заместитель Q, другой выбран из водорода или метоксила; где фосфорсодержащий заместитель Q представляет собой 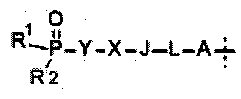 , А представляет собой О; L представляет собой С1-6алкил; J представляет собой NH или С3-6гетероциклоалкил и J возможно замещен G3; X отсутствует или представляет собой -С(=O)-; Υ отсутствует или представляет собой C1-6алкил; каждый из R1 и R2 независимо выбран из С1-6алкила или С1-6алкокси; G3 представляет собой С1-6алкил, R3S(=O)m-, R5C(=O)- или R3R4NC(=O)-; R3, R4 и R5 независимо выбраны из Η или С1-6алкила; m равен 0-2. Предложены новые ингибиторы протеинкиназы, эффективные для лечения заболеваний, ассоциированных с аномальной активностью протеинкиназы. 6 н. и 14 з.п. ф-лы, 42 пр., 8 табл., 3 ил.
, А представляет собой О; L представляет собой С1-6алкил; J представляет собой NH или С3-6гетероциклоалкил и J возможно замещен G3; X отсутствует или представляет собой -С(=O)-; Υ отсутствует или представляет собой C1-6алкил; каждый из R1 и R2 независимо выбран из С1-6алкила или С1-6алкокси; G3 представляет собой С1-6алкил, R3S(=O)m-, R5C(=O)- или R3R4NC(=O)-; R3, R4 и R5 независимо выбраны из Η или С1-6алкила; m равен 0-2. Предложены новые ингибиторы протеинкиназы, эффективные для лечения заболеваний, ассоциированных с аномальной активностью протеинкиназы. 6 н. и 14 з.п. ф-лы, 42 пр., 8 табл., 3 ил.
1. Замещенный фосфорсодержащей группой хинолин, представленный приведенной ниже формулой (I):
 ,
,
где в формуле (I)
Ζ представляет собой  , каждый из V1 и V2
независимо выбран из водорода или галогена;
, каждый из V1 и V2
независимо выбран из водорода или галогена;
один из R и R′ представляет собой фосфорсодержащий заместитель Q, другой выбран из водорода или метоксила;
где фосфорсодержащий заместитель Q представляет собой 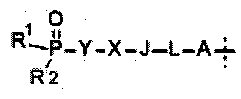 ,
,
А представляет собой О;
L представляет собой С1-6алкил;
J представляет собой NH или С3-6гетероциклоалкил и J возможно замещен G3;
X отсутствует или представляет собой -С(=O)-;
Υ отсутствует или представляет собой C1-6алкил;
каждый из R1 и R2 независимо выбран из С1-6алкила или С1-6алкокси;
G3 представляет собой С1-6алкил, R3S(=O)m-, R5C(=O)- или R3R4NC(=O)-;
каждый из R3, R4 и R5 независимо выбран из Η или С1-6алкила;
m равен 0-2.
2. Замещенный фосфорсодержащей группой хинолин по п. 1, где соединение представлено приведенной ниже формулой (Ia):
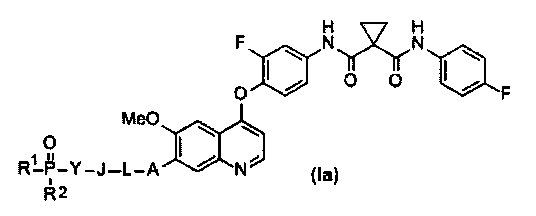 ,
,
где в приведенной выше формуле
А представляет собой О;
L представляет собой C1-6алкил;
J представляет собой NH и J возможно замещен G3;
Υ представляет собой C1-6алкил.
3. Замещенный фосфорсодержащей группой хинолин по п. 1, где соединение представлено приведенной ниже формулой (Ib):
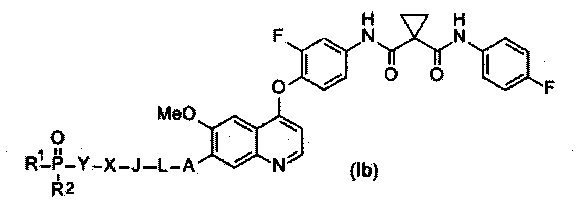 ,
,
где в приведенной выше формуле
А представляет собой О;
L представляет собой С1-6алкил;
J представляет собой С3-6гетероциклоалкил;
X отсутствует или представляет собой -С(=O)-;
Υ представляет собой С1-6алкил.
4. Замещенный фосфорсодержащей группой хинолин по п. 1, где соединение представлено приведенной ниже формулой (Ic):
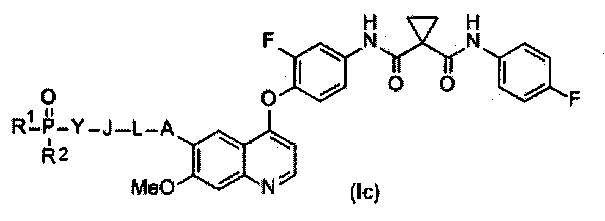 ,
,
где в приведенной выше формуле
А представляет собой О;
L представляет собой С1-6алкил;
J представляет собой NH и J возможно замещен G3;
Υ представляет собой С1-6алкил.
5. Замещенный фосфорсодержащей группой хинолин по п. 1, где соединение представлено приведенной ниже формулой (Id):
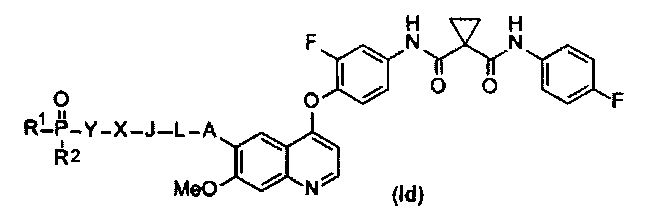 ,
,
где в приведенной выше формуле
А представляет собой О;
L представляет собой С1-6алкил;
J представляет собой С3-6гетероциклоалкил;
X отсутствует или представляет собой -С(=O)-;
Υ представляет собой С1-6алкил.
6. Замещенный фосфорсодержащей группой хинолин по п. 1, где соединение представлено приведенной ниже формулой (Ie):
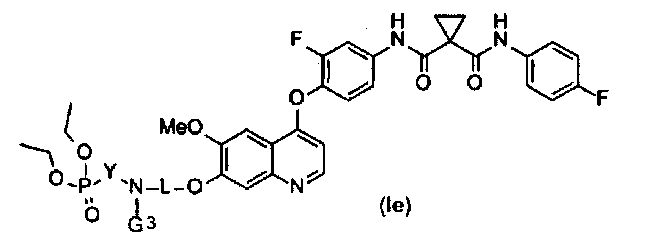 ,
,
где в приведенной выше формуле
L представляет собой С1-6алкил;
Υ представляет собой С1-6алкил.
7. Замещенный фосфорсодержащей группой хинолин по п. 1, где соединение представлено приведенной ниже формулой (If):
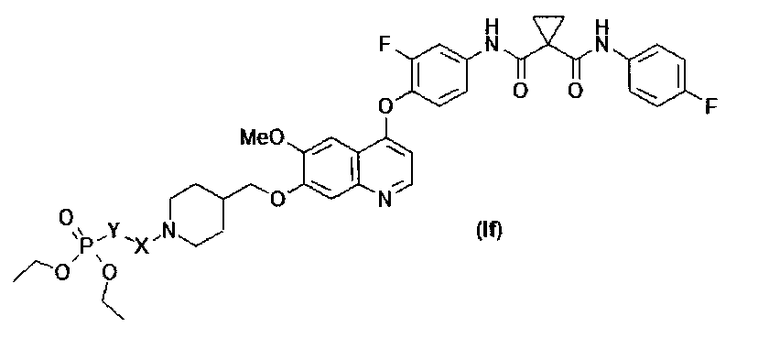 ,
,
где в приведенной выше формуле
X отсутствует или представляет собой -С(=O)-;
Υ представляет собой С1-6алкил.
8. Замещенный фосфорсодержащей группой хинолин по п. 1, где соединение выбрано из группы, состоящей из одного или более чем одного из следующих соединений:
N1-[4-[[7-[3-(диэтоксифосфорилметиламино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(диэтоксифосфорилметил)(метил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(ацетил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[3-(пропионил(диэтоксифосфорилметил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(аминокарбонил(диэтоксифосфорилметил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(этиламинокарбонил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(этиламинокарбонил)амино)этоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[7-[3-(диэтоксифосфорилметил)(метилсульфонил)амино)пропоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметиламино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(диэтоксифосфорилметил)(метил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(ацетил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[3-(пропионил(диэтоксифосфорилметил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(аминокарбонил(диэтоксифосфорилметил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(этиламинокарбонил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(аминокарбонил(диэтоксифосфорилметил)амино)этоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[4-[[6-[3-(диэтоксифосфорилметил)(метилсульфонил)амино)пропоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[[1-(диэтоксифосфорилметил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[7-[[1-(2-диэтоксифосфорилацетил)-4-пиперидинил]метоксил]-6-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1-[4-[[6-[[1-(диэтоксифосфорилметил)-4-пиперидинил]метоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид или
N1-[4-[[6-[[1-(2-диэтоксифосфорилацетил)-4-пиперидинил]метоксил]-7-метоксил-4-хинолил]оксил]-3-фторфенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамид.
9. Способ получения замещенных фосфорсодержащей группой хинолинов по любому из пп. 1-8, состоящий из стадий, представленных на следующей схеме 1:
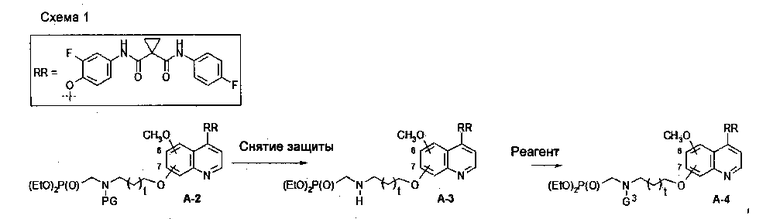
где способ содержит следующие стадии:
первая стадия: удаление защитной группы PG атома N соединения А-2 с получением соединения А-3;
вторая стадия: взаимодействие соединения А-3 с реагентом с получением продукта А-4, где когда реагент представляет собой:
(а) R3S(=O)mCl вместе с основанием, тогда G3 в А-4 представляет собой R3S(=O)m-;
(б) R5C(=O)Cl вместе с основанием или R5C(=O)OH вместе со связывающим реагентом, тогда G3 в А-4 представляет собой R5C(=O)-;
(в) R3R4NCO вместе с основанием или R3R4NC(=O)Cl вместе с основанием, тогда G3 в А-4 представляет собой R3R4NC(=O)-; или
(г) С1-6алкил-LG вместе с основанием или C1-6альдегид либо кетон вместе с восстановителем, тогда G3 в А-4 представляет собой С1-6алкил;
где
t равен 0-4;
LG представляет собой общепринятые в области органической химии уходящие группы;
PG представляет собой общепринятые в области органической химии защитные группы;
определения G3, R3, R4, R5 и m такие же, как указано в п. 1.
10. Способ получения замещенных фосфорсодержащей группой хинолинов по любому из пп. 1-8, состоящий из стадий, представленных на следующей схеме 2:
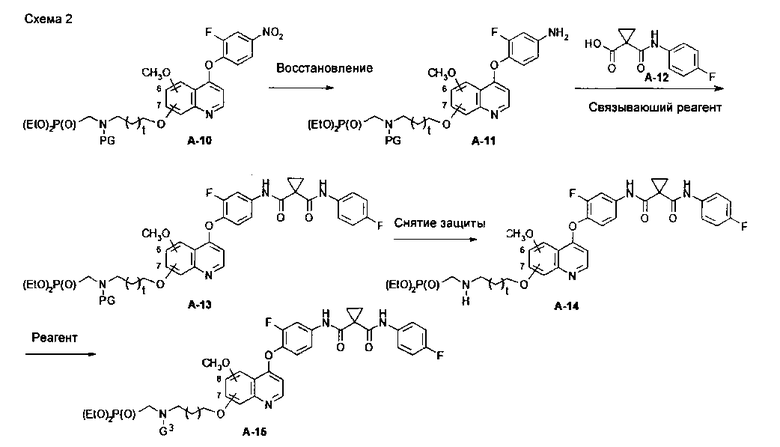
где способ содержит следующие стадии:
первая стадия: восстановление нитрогруппы соединения А-10 с получением амина А-11;
вторая стадия: подвергание соединения А-11 и соединения А-12 реакции сочетания с получением соединения А-13;
третья стадия: удаление защитной группы атома N соединения А-13 с получением соединения А-14;
четвертая стадия: взаимодействие соединения А-14 с реагентом с получением продукта А-15,
где когда реагент представляет собой:
(а) R3S(=O)mCl вместе с основанием, тогда G3 в А-15 представляет собой R3S(=O)m-;
(б) R5C(=O)Cl вместе с основанием или R5C(=O)OH вместе со связывающим реагентом, тогда G3 в А-15 представляет собой R5C(=O)-;
(в) R3R4NCO вместе с основанием или R3R4NC(=O)Cl вместе с основанием, тогда G3 в А-15 представляет собой R3R4NC(=O)-; или
(г) С1-6алкил-LG вместе с основанием или С1-6альдегид либо кетон вместе с восстановителем, тогда G3 в А-15 представляет собой C1-6алкил;
где
t=0-4;
PG представляет собой общепринятые в области органической химии защитные группы;
определения G3, R3, R4, R5 и m такие же, как в п. 1.
11. Способ получения замещенных фосфорсодержащей группой хинолинов по любому из пп. 1-8, состоящий из стадий, представленных на следующей схеме 5:
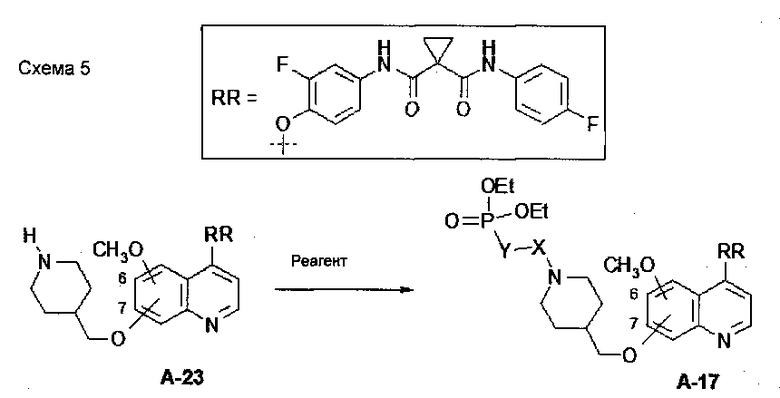
где способ содержит следующие стадии:
взаимодействие соединения А-23 с реагентом с получением продукта А-17, где когда реагент представляет собой:
(а) диэтилфосфат и формальдегид, тогда X в А-17 отсутствует и Υ представляет собой С1-6алкил; или
(б) 2-диэтоксилфосфорилуксусную кислоту вместе со связывающим реагентом или 2-диэтоксилфосфорилацетилхлорид вместе с основанием, тогда X в А-17 представляет собой -С(=O)- и Υ представляет собой С1-6алкил.
12. Применение фармацевтической композиции, содержащей замещенные фосфорсодержащей группой хинолины по любому из пп. 1-8, где композицию применяют для лечения заболеваний, ассоциированных с аномальными активностями протеинкиназ.
13. Применение по п. 12, где протеинкиназа представляет собой c-Met, KDR или VEGFR2, RET, PDGFR-β, c-KIT, Flt3, МЕК5, DDR1, LOK, CSF1R, EPHA7, EPHA8, EPHB6, MKNK2, BLK, HIPK4, HCK или Flt4.
14. Применение по п. 12, где протеинкиназа представляет собой ALK (или киназу анапластической лимфомы), EGFR, PDGFR-α, FLT1, Src, Frk, Btk, Abl, Fes, Fak, Yes, Fyn, Lyn, Lck, Hck, Fgr, TAK1, Tie-2, Tie-1, YSK4, TRK B, TRK C, SLK, PKN2, PLK4, MST1R, MAP4K или DDR2.
15. Применение по п. 12, где заболевание представляет собой псориаз, цирроз печени, диабет, опосредованные ангиогенезом заболевания, заболевания глаза, заболевания иммунной системы или сердечно-сосудистые заболевания.
16. Применение по п. 12, где заболевание представляет собой опухоль, включая солидные и жидкие опухоли.
17. Применение по п. 12, где опухоль включает: рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы и шеи, меланому кожи или внутриглазную меланому, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак ободочной кишки, рак молочной железы, рак фаллопиевой трубы, рак эндометрия, рак шейки матки, рак влагалища, рак вульвы, болезнь Ходжкина, рак пищевода, рак кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, саркому мягкой ткани, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, рак мочевого пузыря, рак почки или мочеточника, почечный рак, опухоли центральной нервной системы (ЦНС), опухоли спинного мозга, аденомы гипофиза, желудочно-кишечные стромальные опухоли, колоректальный рак, немелкоклеточный рак легкого, мелкоклеточный рак легкого, мастоцитоз, глиому, саркому, лимфому или любую их комбинацию.
18. Лекарственное средство для лечения заболеваний, ассоциированных с аномальной активностью протеинкиназы, содержащее соединение по любому из пп. 1-8 или фармацевтически приемлемую соль.
19. Лекарственное средство по п. 18, дополнительно содержащее по меньшей мере один фармацевтически приемлемый носитель.
20. Лекарственное средство по п. 18, находящееся в форме следующих композиций:
(1) пероральной композиции; (2) инъекционной композиции; (3) композиции для назальной ингаляции; (4) глазных капель.
| НОВОЕ ПРОИЗВОДНОЕ ПИРИДИНА И ПРОИЗВОДНОЕ ПИРИМИДИНА (3) | 2006 |
|
RU2362771C1 |
| US 20100239576 A1, 23.09.2010. | |||
Авторы
Даты
2015-05-20—Публикация
2011-04-06—Подача