Изобретение относится к новому ряду химических соединений, а именно к производным тиакаликсарена общей формулы I, которые могут находиться в конфигурациях конус и 1,3-альтернат:
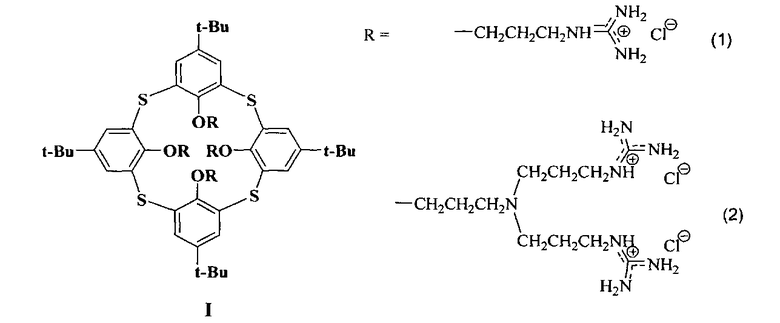
обеспечивающих эффективную доставку плазмидной ДНК в эукариотические клетки, которые могут найти применение в области медицины в качестве препаратов для генной терапии, а также в качестве трансфекционных реагентов для проведения лабораторных исследований.
В научной литературе и патентах, на дату представления настоящей заявки, отсутствуют примеры использования производных тиакаликсаренов, содержащих гуанидиниевые группы на нижнем ободе макроцикла, для переноса ДНК в клетки.
Из исследованного уровня техники заявителем выявлены наиболее близкие по структуре и назначению аналоги заявляемых соединений, представляющие собой производные каликс[4]арена и каликс[6]арена, содержащие фрагменты аргинина и гуанидиния, соединенные с макроциклической платформой через соответствующий углеводородный мостик (называемый в зарубежной литературе термином «спейсер») [WO 2013021355].
Недостатком данных соединений является использование в качестве основы молекулярной платформы каликсарена, что значительно ограничивает число возможных конфигурационных изомеров полученных соединений [N. Morohashi, F. Narumi, N. Iki, Т. Hattori, S. Miyano, Chem. Rev., 2006, 106, 5291-5316.], отсутствие данных по возможности проведения трансфекции ими культур клеток человека НЕК293Т, а также более высокая цитотоксичность, по сравнению с заявляемыми соединениями (по данным из указанного источника концентрация соединения, при которой погибает 50% клеток составила 20 мкмоль/л, что на 23% ниже, чем для заявляемого соединения (2)).
Заявителем выявлены структурные аналоги соединений (I) - алкилированные каликсарены и тиакаликсарены общей формулы II, где D-S, СН2, SO, SO2 группы,
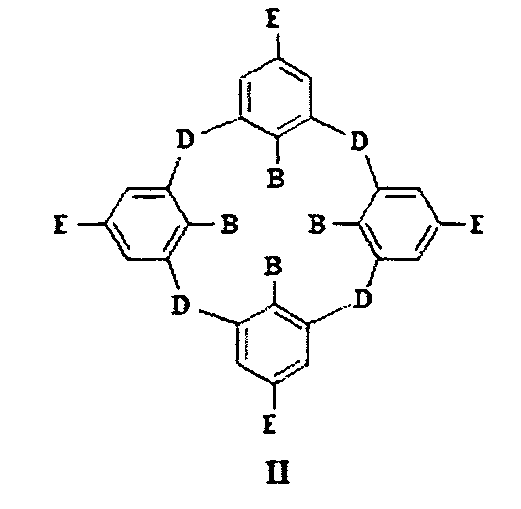
Е-Н, алкильный, арильный, NO2, NH2, NR2, гуанидиниевая группа, R-C=O, а В - группа OR, где R - углеводородный радикал от С1 до С10, содержащий также фрагмент триазола, соединенный с углеводным остатком. Данные соединения препятствуют развитию бактериальных инфекций, однако для них не изучены их трансфекционные свойства [US 2013252910 (А1)].
Недостатком известных соединений является то, что гуанидиниевые группы в соединениях общей формулы II находятся на «верхнем» ободе макроцикла в сопряжении с ароматическими фрагментами, что повышает кислотность гуанидиниевого фрагмента [Albert, A. The strength of heterocyclic bases / A. Albert, R. Goldacre, J. Phillips // J. Chem. Soc. - 1948. - P. 2240-2249], уменьшая тем самым эффективность взаимодействия с полианионными субстратами ДНК. Из исследованного уровня техники не выявлено наличие свойств их трансфекционной активности по отношению к эукариотическим клеткам.
Из исследованного уровня техники также известен аналог заявляемых соединений по назначению, представляющий собой полимер полиэтиленимин (PEI), обеспечивающий эффективную доставку ДНК в различные типы клеток [US 2012052574 (А1)].
Недостатком известного из уровня техники полимера полиэтиленимина является его высокая цитотоксичность [Neu, М. Recent advances in rational gene transfer vector design based on poly(ethylene imine) and its derivatives / M. Neu, D. Fischer, Th. Kissel // J Gene Med. - 2005. - V.7. - P. 992-1009] (0.009 мг/мл против 0.013 мг/мл и 0.050 мг/мл для заявляемых соединений (1) и (2)).
Таким образом, из исследованного заявителем уровня техники на дату подачи заявочных материалов, не установлено наличие близких аналогов как по составу, так и по достигаемому заявляемым техническим решением техническому(им) результату(ам).
Задачей заявляемого технического решения является создание новых эффективных, низкотоксичных препаратов, обеспечивающих эффективную доставку ДНК в эукариотические клетки.
Техническим результатом являются новые производные тиакаликсарена формулы (I), обладающие трансфекционной активностью по отношению к эукариотическим клеткам.
Заявленный технический результат достигается посредством получения производных тиакаликсарена формулы (I), обладающих трансфекционной активностью по отношению к эукариотическим клеткам.
Поставленная задача решается синтезом новых соединений - производных тиакаликсаренов, содержащих гуанидиниевые группы на «нижнем» ободе макроцикла в конфигурациях конус и 1,3-альтернат формулы 1 и 2, которые могут использоваться в качестве средств доставки ДНК в эукариотические клетки.
Заявляемые соединения получены взаимодействием соответствующих аминов на основе тиакаликсарена с различными гуанидирующими реагентами.
Способ иллюстрируется следующими примерами, но не исчерпывается ими.
Пример 1. Двухстадийный способ получения 5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис-[3′-гуанидинийпропокси]тетратиакаликс[4]арена тетрахлорида (1) путем взаимодействия исходного амина с N,N′-ди(трет-бутоксикарбонил)-N′′-трифлилгуанидина с последующим снятием защитных трет-бутоксикарбонильных групп сильной кислотой.
Стадия 1. К раствору 1.00 г 5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис-(3-аминопропокси)тетратиакаликс[4]арена в конфигурации конус, полученного по литературной методике [Galukhin, A.V. Mono-, 1,3-Di- and Tetrasubstituted p-tert-Butylthiacalix[4]arenes Containing Phthalimide Groups: Synthesis and Functionalization with Ester, Amide, Hydrazide and Amino Groups [Text] / A.V. Galukhin, E.N. Zaikov, I.S. Antipin, A.I. Konovalov, I.I. Stoikov // Macroheterocycles. - 2012. V. 5(3). - P. 266-274] в 40 мл хлористого метилена по каплям прибавляли раствор эквимолярного количества N,N′-ди(трет-бутоксикарбонил)-N′′-трифлилгуанидина в 10 мл хлористого метилена. Реакционная масса выдерживалась в течение 24 часов. Далее реакционная масса дважды перемешивалась с 30 мл 2М водного раствора дигидросульфата натрия и 50 мл насыщенного водного раствора гидрокарбоната натрия, органическая фаза отделялась и высушивалась над молекулярными ситами 3Å. Далее раствор упаривали на роторном испарителе, сухой остаток высушивали в вакууме над оксидом фосфора. Выход 5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис[3-(бис-трет-бутоксикарбонил-гуанидин)пропокси]тетратиакаликс[4]арена (конус) составил 1.98 г (98%).
Т.пл. 248-250°C. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц):1.10 (36Н, с, (СН3)3С), 1.48 (36Н, с, Boc), 1.48 (36Н, с, Boc), 2.25 (6Н, м, 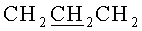
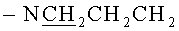
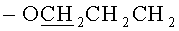
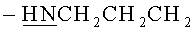
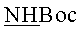
Стадия 2. К раствору 0.50 г 5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис[3-(бис-трет-бутоксикарбонил-гуанидин)пропокси]тетратиакаликс[4]арена (конус) в ТГФ добавляли 2 мл концентрированной соляной кислоты. Реакционная масса выдерживалась в течение 24 часов. Далее, реакционную массу максимально упаривали на роторном испарителе, добавляли 50 мл диэтилового эфира. Выпавший белый осадок отфильтровывали, промывали двумя порциями диэтилового эфира по 30 мл затем сушили в эксикаторе над оксидом фосфора. Выход целевого соединения (1) составил 83%.
Разл.>238°С. Спектр ЯМР 1H (D2O, δ, м.д., J/Гц): 0.98 (36Н, уш.с, (СН3)3С), 2.15 (6Н, уш.м, 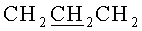
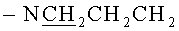
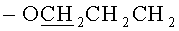
Пример 2. Трехстадийный способ получения 5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис(3′-N,N-бис[3′′-аминопропил]гуанидинийпропокси) тетратиакаликс[4]арена октахлорида (2).
Стадия 1. В круглодонной колбе, снабженной магнитной мешалкой и обратным холодильником с хлоркальциевой трубкой, смесь 0.50 г (0.53 ммоль) 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетракис(3-аминопропокси)-тетратиакаликс[4]-арена 1,3-альтернат, полученного по литературной методике [Galukhin, A.V. Mono-, 1,3-Di- and Tetrasubstituted p-tert-Butylthiacalix[4]arenes Containing Phthalimide Groups: Synthesis and Functionalization with Ester, Amide, Hydrazide and Amino Groups [Text] / A.V. Galukhin, E.N. Zaikov, I.S. Antipin, A.I. Konovalov, I.I. Stoikov // Macroheterocycles. - 2012. V. 5(3). - P. 266-274], 1.41 г (5.27 ммоль) N-(3-бромпропил)фталимида, 0.72 г (5.27 ммоль) свежепрокаленного карбоната калия и 40 мл свежеперегнанного ацетонитрила кипятили в течение 40 часов. После охлаждения реакционной смеси карбонат калия отфильтровали, промывали хлороформом 2×20 мл. Полученный раствор упаривали при пониженном давлении, остаток перекристаллизовывали из метилового спирта. Выход 5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис-(3-N,N-ди[3-фталимидопропил]аминопропокси)тетратиакаликс[4]арена составил 0.95 г (74%).
Т.пл. 254°C. Спектр ЯМР 1H (CDCl3, δ, м.д., J/Гц): 1.22 (36Н, с, (СН3)3С), 1.82 (24Н, м, 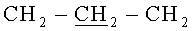
Стадия 2. В круглодонной колбе, снабженной магнитной мешалкой и обратным холодильником с хлоркальциевой трубкой, 1.00 г 5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис-(3-N,N-ди[3-фталимидопропил]аминопропокси) тетратиакаликс[4]арена и 2 мл гидразингидрата (40 ммоль) в смеси 30 мл этанола и 20 мл тетрагидрофурана кипятили в течение 5 часов. После охлаждения реакционной смеси растворитель упаривали в вакууме, заливали 50 мл CHCl3 и промывали органический слой 20 мл 20% NH4OH. Органическую фазу отделяли и сушили над молекулярными ситами 3Å. Растворитель отгоняли при пониженном давлении. Выход 5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис(3′-N,N-бис-[3′′-аминопропил]аминопропокси) тетратиакаликс[4]арена составил 89%.
Т.пл. 137-139°C. Спектр ЯМР 1H (CDCl3, δ, м.д., J/Гц): 1.23 (36Н, с, (СН3)3С), 1.38 (16Н, уш.с, NH2), 1.59 (8Н, м, 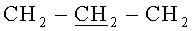
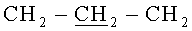
Стадия 3. В круглодонной колбе, снабженной магнитной мешалкой, 0.30 г (0.21 ммоль) 5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис(3′-N,N-ди-[3′′-аминопропил]аминопропокси)тетратиакаликс[4]арен и 0.30 г (2 ммоль) S-аллилизотиомочевины хлорида в 20 мл тетрагидрофурана кипятили в течение 20 часов. После охлаждения реакционной смеси отфильтровали выпавший осадок и промыли его 3×20 мл тетрагидрофурана. Осадок сушили в эксикаторе над оксидом фосфора. Целевое соединение (2) было получено с выходом 93%.
5,11,17,23-Тетра-трет-бутил-25,26,27,28-тетракис(3′-N,N-бис[3′′-гуанидинийпропил]аминопропокси)тетратиакаликс[4]арен октахлорид (2). Разл.>208°С. Спектр ЯМР 1H (D2O, δ, м.д., J/Гц): 1.19 (36Н, с, (СН3)3С), 1.79 (24Н, м, 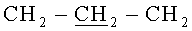
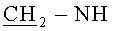
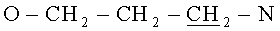
Для описания свойств тиакаликсаренов, являющихся предметом изобретения, получены репрезентативные данные для соединений (1) и (2), различающихся длиной спейсерного фрагмента, соединяющего гуанидиниевую группу с макроциклической платформой, количеством катионных групп и конфигурацией макроциклической платформы (конус (1) и 1,3-альтернат (2)).
Сокращения
ФСБ - фосфатно-солевой буфер
eGFP - зеленый флуоресцентный белок
DMEM - модифицированная Дульбеко среда Игла. Питательная среда для культур клеток
Среда с сывороткой - DMEM и 10% объема сыворотки крови эмбрионов крупного рогатого скота (HyClone)
МТТ-3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолия бромид
CD50 - концентрация, при которой гибнет 50% клеток в культуре.
Пример 3. Методика проведения экспериментальной трансфекции с помощью новых соединений (1) и (2)
Монослойную культуру клеток человека линии НЕК293Т рассаживают по 40 тыс клеток на лунку за день до трансфекции из расчета получить на следующий день конфлуэнтность 50-70%. Для трансфекции НЕК293Т используют концентрацию 50-100 тыс клеток на лунку 96-луночного планшета. За час перед трансфекцией клеткам дают свежую среду DMEM без сыворотки и антибиотика. Трансфекции проводят также в 96-луночном планшете, эксперименты проводят в тройном повторе. Сначала делают серию последовательных разведений потенциальных трансфектантов в воде Milli-Q с конечной концентрацией 10-3, 10-2, 0,1 и 1 мг/мл, добавляют к раствору ДНК и аккуратно пипетируют один раз. По истечении 10-15 минут инкубирования липокомплексы с 0,6 мкг плазмидной ДНК peGFP-N1 (Clontech) в суммарном объеме 20 мкл добавляют к клеткам без значительного перемешивания. На следующие сутки флуоресценцию популяции клеток в планшете наблюдают на флуоресцентном микроскопе с обращенной оптикой. Через 48 часов после трансфекции проводят анализ методом проточной цитометрии, как описано далее. Получив результаты о предварительной функциональности новых соединений как трансфектантов, далее проводим оптимизацию соотношения количества трансфектанта к количеству плазмидной ДНК вблизи значений, при которых наблюдается максимальная трансфекционная эффективность. Используемый шаг в выбранном диапазоне составляет последовательное двукратное увеличение концентрации. Также оптимизируем продолжительность инкубации клеток с трансфекционной смесью и возможность комбинирования трансфекции/электропорации. Проведение электропорации после трансфекции оказывается нецелесообразным, поскольку вызывает гибель клеток, значительно не влияя на процент трансфецированных клеток. Оптимальное время инкубации с трансфектантом составляет 4 часа, по истечении которых среду в клетках меняем на полную среду DMEM с сывороткой и антибиотиком.
Пример 4. Методика анализа трансфекции клеток методом проточной цитометрии
В исследовании степени трансфекции клеток используем метод проточной цитометрии. Каждую лунку планшета с клетками после инкубации с экспериментальными препаратами в течение 48 часов отмываем 200 мкл ФСБ (x1), обрабатываем трипсином и фиксируем в 0,5% формалине. В полученной таким образом клеточной суспензии определяем методом проточной цитометрии процент клеток, экспрессирующих eGFP. Эта величина является мерой эффективности трансфекции. Клетки, инкубируемые без экспериментальных препаратов при тех же условиях, используем в качестве отрицательного контроля. Для сравнения проводится измерение процента eGFP положительных клеток, трансфецированных с помощью коммерческого препарата Metafectene easy по протоколу, предлагаемому производителем (Biontex, EU). Далее из полученных данных рассчитываем процент флуоресцентных клеток с использованием программы FACS Diva («Becton Dickinson», США), средние значения и стандартные отклонения для популяций.
Пример 5. Методика определения цитотоксичности соединений к клеткам линии НЕК293Т
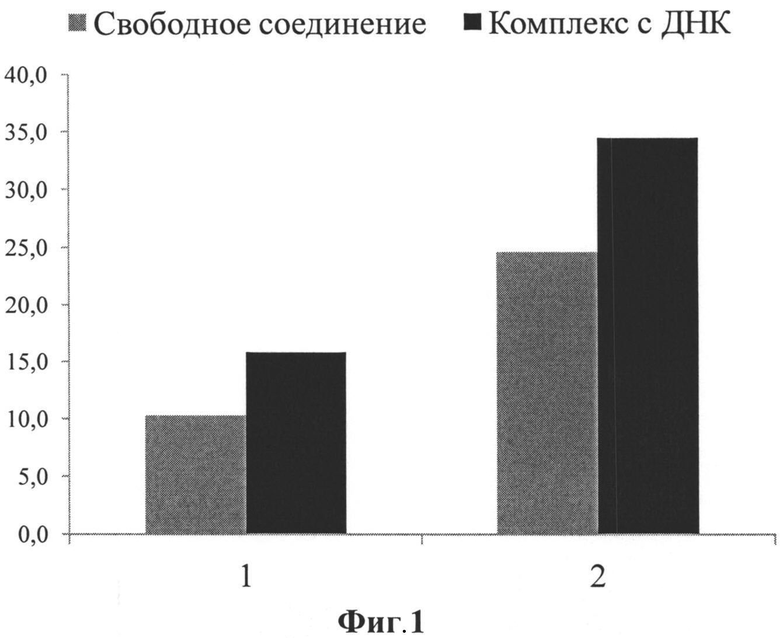
Цитотоксичность определялась с помощью МТТ реагента. В качестве критерия цитотоксичности использовался параметр CD50 (концентрация, при которой гибнет 50% клеток в культуре). Культуру клеток человека линии НЕК293Т рассаживают по 40 тыс клеток на лунку 96-луночного планшета за день до определения цитотоксичности из расчета получить на следующий день 50-70% монослоя. За час до добавления экспериментальных соединений либо их комплексов с ДНК клеткам дают свежую среду DMEM без сыворотки и антибиотика. Делают серию последовательных разведений потенциальных трансфектантов в воде Milli-Q с конечной концентрацией 10-3, 10-2, 0,1 и 1 мг/мл, добавляют к раствору плазмидной ДНК и аккуратно пипетируют один раз. По истечении 15 минут инкубирования липокомплексы с 0,6 мкг плазмидной ДНК в суммарном объеме 20 мкл добавляют к клеткам без значительного перемешивания. Параллельно к клеткам добавляют индивидуальные вещества без ДНК в соответствующем количестве. По истечении 48 часов инкубации с соединениями к пробам добавляли по 20 мкл р-ра МТТ (5 мг/мл). После 2-4 часов инкубации с МТТ удаляют среду из лунок, стараясь не затрагивать кристаллы, растворяют кристаллы формазана в 200 мкл ДМСО. Далее определяют оптическую плотность на приборе Tecan Sunrise Basic при длине волны 492 нм с вычитанием фона. По полученным данным определялся параметр CD50 для соединений формулы 1 и 2, которые представлены на диаграмме Фиг.1, где показана цитотоксичность (CD50, мкмоль/л) соединений (1) и (2) к клеткам линии НЕК293Т.
Из указанной диаграммы следует, что значение цитотоксичности (CD50) исследуемых соединений (1) и (2) уменьшается при их комплексообразовании с плазмидной ДНК, а также видно, что концентрационный диапазон значений CD50 для соединений (1) и (2) и их комплексов с плазмидной ДНК выше, чем эффективные концентрации этих соединений, при которых наблюдается наибольший процент трансфецированных клеток (см. Пример 7 и 8), что позволяет применять данные соединения по заявленному назначению.
Пример 6. Формирование комплексов исследуемых соединений с ДНК
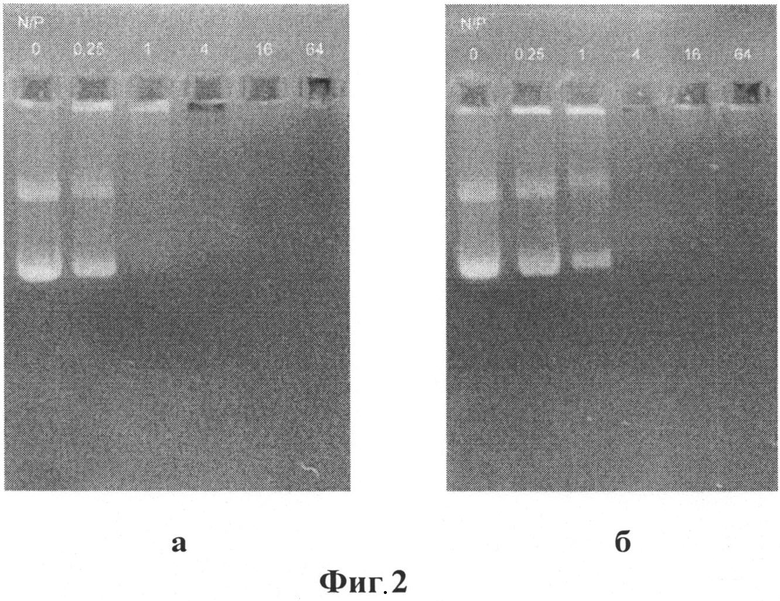
При росте концентрации потенциальных трансфектантов вплоть до достижения N/P (отношение количества положительно заряженных атомов азота трансфектанта к количеству остатков фосфатов в плазмидной ДНК) около 1 (для соединения (1)) и 4 (для соединения (2)) наблюдается практически полное исчезновение свободной плазмидной ДНК, что является показателем формирования комплексов. На фотографиях а и б (Фиг. 2) представлены результаты электрофореза, плазмидной ДНК (4700 пн) в присутствии возрастающих концентраций тиакаликсаренов (1) и (2) от N/P=0 до N/P=64, демонстрирующие уменьшение доли свободной плазмидной ДНК при увеличении соотношения N/P от 0 до 64.
Таким образом, из приведенных данных на фото 1 и 2 следует, что доля свободной плазмидной ДНК при увеличении соотношения N/P от 0 до 64 уменьшается.
Пример 7. Проведение трансфекции с помощью соединения (1)
По указанному выше протоколу проводим тестирование трансфекционной эффективности соединения (1). Для соединения (1) наибольший процент трансфецированных клеток составляет 42% (в среднем 30±10%) при концентрации 11.1 мкмоль/л.
Пример 8. Проведение трансфекции с помощью соединения (2)
По указанному выше протоколу проводим тестирование трансфекционной эффективности соединения 2. Наибольший процент трансфецированных клеток составляет 28% (в среднем 20±8%) при концентрации 6.9 мкмоль/л.
Таким образом, заявляемые производные тиакаликсарена 1 и 2 обладают способностью эффективно доставлять ДНК в эукариотические клетки, а также обладают низкой токсичностью. Полученные результаты являются первым примером успешного проведения трансфекции эукариотических клеток производными тиакаликсарена.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, т.к. из исследованного уровня техники не выявлены технические решения, характеризующиеся указанными признаками, приводящими к реализации заявленных технических результатов заявленного технического решения.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемый к изобретениям, т.к. не является очевидным для специалистов в данной области техники, вследствие того, что заявленное техническое решение обеспечивает реализацию объективно существующих на практике противоречий, не разрешимых посредством обычного проектирования, а именно из исследованного уровня техники известно, что существующие системы доставки ДНК в клетки на основе немакроциклических производных обладают достаточно высокой цитотоксичностью, что препятствует их применению по указанному назначению, при этом указанная цитотоксичность была значительно снижена за счет использования макроциклической платформы тиакаликсарена, также обеспечивающей пространственную организацию связывающих гуанидиниевых фрагментов, что позволило создать эффективные трансфекционные агенты. Заявленные макроциклические соединения демонстрируют низкую цитотоксичность, а также способность осуществлять трансфекцию клеток линии НЕК293Т, таким образом можно сделать вывод о том, что полученные результаты не является очевидными для специалиста в данной области техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», т.к. может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных материалов и технологий.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АЛКИЛАММОНИЙНОГО ГЕМИНАЛЬНОГО ПОВЕРХНОСТНО-АКТИВНОГО ВЕЩЕСТВА, ОБЕСПЕЧИВАЮЩИЕ ЭФФЕКТИВНУЮ ДОСТАВКУ ДНК В КЛЕТКИ | 2012 |
|
RU2513726C2 |
| КОМПОЗИТНЫЙ МАТЕРИАЛ С ВЫСОКОЙ ТЕМПЕРАТУРОЙ РАЗЛОЖЕНИЯ | 2014 |
|
RU2571979C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ ИЗ ВОДНЫХ РАСТВОРОВ СОЛЕЙ ЩЕЛОЧНЫХ МЕТАЛЛОВ И СЕРЕБРА | 2008 |
|
RU2389812C2 |
| ЛИОТРОПНАЯ ЖИДКОКРИСТАЛЛИЧЕСКАЯ КОМПОЗИЦИЯ | 2007 |
|
RU2371465C2 |
| НАНОРАЗМЕРНЫЕ АГРЕГАТЫ НА ОСНОВЕ ПРОИЗВОДНЫХ СТЕРЕОИЗОМЕРОВ П-ТРЕТ-БУТИЛТИАКАЛИКС[4]АРЕНА И КАТИОНОВ СЕРЕБРА | 2008 |
|
RU2381222C2 |
| ТЕРМОСТОЙКИЙ ГИБРИДНЫЙ КОМПОЗИЦИОННЫЙ МАТЕРИАЛ | 2015 |
|
RU2611518C1 |
| МОДУЛЬНЫЙ МОЛЕКУЛЯРНЫЙ КОНЪЮГАТ ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ ГЕНЕТИЧЕСКИХ КОНСТРУКЦИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2529034C2 |
| МОЛЕКУЛЯРНЫЙ КОНЪЮГАТ НА ОСНОВЕ СИНТЕТИЧЕСКИХ АНАЛОГОВ ЛЮЛИБЕРИНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВА ДОСТАВКИ ДНК В КЛЕТКИ ГОРМОН-ЧУВСТВИТЕЛЬНЫХ ОПУХОЛЕЙ (ВАРИАНТЫ) | 2007 |
|
RU2377247C2 |
| ЛИПОТЕТРАПЕПТИДЫ НА ОСНОВЕ ДИЭФИРОВ L-ГЛУТАМИНОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2533554C1 |
| СРЕДСТВО ДЛЯ ВНУТРИКЛЕТОЧНОЙ ДОСТАВКИ НУКЛЕИНОВЫХ КИСЛОТ В КЛЕТКИ МЛЕКОПИТАЮЩИХ | 2014 |
|
RU2572575C1 |
Изобретение относится к области органической химии, а именно к производным тиакаликсарена общей формулы I, которые могут быть использованы как средства доставки ДНК в эукариотические клетки. Технический результат: получены новые гетероциклические соединения, обладающие полезными биологическими свойствами. 2 ил., 8 пр.
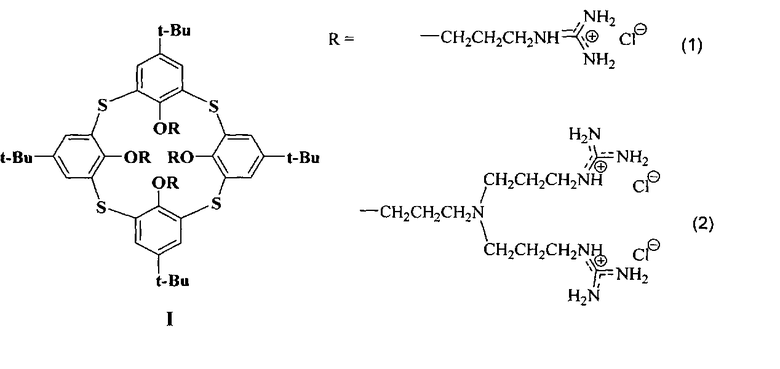
Производные тиакаликсаренов формулы (1) и (2),
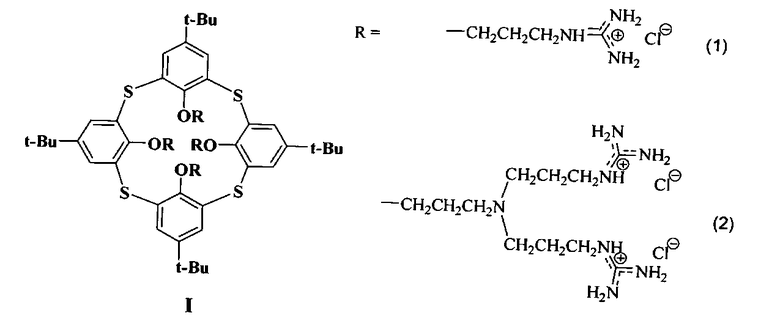
как средства доставки ДНК в эукариотические клетки.
| WO2011029528 A1, 17.03.2011 | |||
| Листовальные вальцы | 1955 |
|
SU103704A1 |
| НАНОРАЗМЕРНЫЕ АГРЕГАТЫ НА ОСНОВЕ ПРОИЗВОДНЫХ СТЕРЕОИЗОМЕРОВ П-ТРЕТ-БУТИЛТИАКАЛИКС[4]АРЕНА И КАТИОНОВ СЕРЕБРА | 2008 |
|
RU2381222C2 |
Авторы
Даты
2015-05-20—Публикация
2014-01-20—Подача