Изобретение относится к медицине, а именно к травматологии и ортопедии, онкоортопедии, и может быть использовано для лечения метастатического поражения проксимального отдела бедренной кости.
Метастатическое поражение проксимального отдела бедренной кости занимает достаточно высокое место среди опухолевой патологии опорно-двигательного аппарата [1, 2, 8-11]. При угрозе патологического перелома проксимального отдела бедренной кости наиболее часто используется лучевая терапия [4], в то время как большинство зарубежных авторов, рекомендует применять профилактическую ортопедическую фиксацию [1, 3, 5, 6]. Для лечения пациентов с данной патологией необходимо противоопухолевое воздействие и восполнение дефекта механически прочным материалом. Известны способы пластики метастатического очага костным цементом и радиочастотной абляцией [2, 4, 10]. Также описана методика профилактической фиксации патологического очага при помощи конструкций для внутрикостного остеосинтеза [6]. Наиболее широко с целью сохранения опороспособности нижней конечности при метастатическом поражении проксимального отдела бедренной кости применяется эндопротезирование тазобедренного сустава с резекцией проксимального отдела бедренной кости [8]. Эндопротезирование отличается достаточно длительным опытом применения его в клинической практике во многих странах мира. Хорошо изучены положительные стороны эндопротезирования, такие как практически полное исключение патологического перелома, снижение интенсивности болевого синдрома и восстановление опороспособности конечности. Также хорошо изучены и осложнения данного правления хирургического лечения. К недостаткам эндопротезирования относятся:
- большое количество противопоказаний, связанных с соматическим статусом больного;
- повышенная кровопотеря и ослабление ресурсов организма во время операции и в послеоперационном периоде;
- длительный и сложный период реабилитации;
- высокий риск гнойно-воспалительный осложнений со стороны операционной раны, развитие которых может надолго прервать проведение лекарственной и лучевой терапии онкологических больных;
- высокий риск развития нестабильности эндопротеза вследствие резорбции костной ткани на фоне проводимого комбинированного лечения.
Известны способы пластики метастатического очага костным цементом [2, 3]. Однако основным недостатком данных методов является противопоказание их использования при расположении метастатического очага в нагружаемых опорных зонах костей нижних конечностей.
Идея использования центрального канала канюлированного винта для введения цемента подробно описана для хирургии позвоночника. Успешно применяется способ введения костного цемента в тела позвонков перед установкой транспедикулярных винтов [7]. Описаний подобной техники для других локализаций нами не найдено.
Найдено сообщение о клиническом случае применения радиочастотной абляции в сочетании с профилактической фиксацией проксимального отдела бедренной кости при метастатическом поражении на фоне гепаток-леточной карциномы [6]. Недостатком данной методики является установка металлоконструкции без удаления ткани метастатического очага, что в случае продленного роста может спровоцировать литический процесс в области точек фиксации конструкции и послужить причиной развития ее нестабильности.
Наиболее близким к предлагаемому способу можно считать способ открытой профилактической фиксации с криодеструкцией метастатического очага [5]. Однако данный способ отличается большой травматичностью. Также, при использовании описанного варианта оперативного пособия неизбежны трудности, связанные расчетом времени воздействия отрицательной температуры на кость и окружающие мягкие ткани, что может явиться причиной замедленного заживления послеоперационной раны и отсрочки комплексной терапии основного заболевания.
Предлагаемый способ позволяет предотвратить развитие патологического перелома на фоне метастатического (литического или смешанного) поражения проксимального отдела бедренной кости, замедлить или остановить рост метастатического очага, отсрочить или избежать эндопротезирования с резекцией проксимального отдела бедренной кости и, в итоге, продолжить пациенту лечение основной онкологической патологии, не утяжеляя его соматический статус.
Результат изобретения достигается за счет того, что предварительно изготавливают переходник для возможности сопоставления инструмента для введения костного цемента с гамма-винтом. Переходник изготавливают заранее из металлической трубки, например, диаметром 8 мм и длиной от 250 до 300 мм, с внутренним диаметром, соответствующим диаметру центрального канала гамма-винта. На одном конце трубки нарезают наружную резьбу для сопоставления с внутренней резьбой гамма-винта, которая изначально служит для закрепления отвертки и установки заглушки. Шаг наружной резьбы нарезают соответствующим шагу внутренней резьбы гамма-винта, а количество витков резьбы выбирают достаточным для плотной посадки и закрепления гамма-винта и переходника. На другом конце трубки нарезают наружную резьбу, аналогичную резьбе на трепанах для вертебропластики и используемой для присоединения инжектора костного цемента. В ином варианте исполнения на проксимальном конце переходника фрезеруют фланец, аналогичный таковому на куполе иглы для вертебропластики. Также, отступая 5 мм от резьбы для инжектора (или 10 мм от фланца), фрезеруют монтажные проточки (лыски) под инструмент для монтажа (например, под гаечный ключ 6 мм) шириной, равной двойной толщине рабочей части используемого при монтаже инструмента. Переходник необходим для соединения гамма-винта с инжектором костного цемента и используется для введения костного цемента в полость, сформированную путем кюретажа и аспирации опухолевых масс, предварительно подвергнутых радиочастотной абляции и после проведения армирования проксимального отдела бедренной кости, пораженного метастатическим процессом, конструкцией PFN. Через трепанационные отверстия по трепану вводят электрод в область метастатического очага и выполняют радиочастотную абляцию в шеечном и диафизарном направлениях. После проведения радиочастотной абляции производят перфорацию вертельной области для введения стержня и через полученное отверстие осуществляют кюретаж вертельной области и аспирацию опухолевых масс. Далее по общепринятой методике формируют канал и вводят гамма-стержень конструкции PFN. Затем производят перфорацию в шеечном направлении и через полученное отверстие при необходимости осуществляют кюретаж шеечной области и аспирацию опухолевых масс, подвергнутых радиочастотной абляции, после чего по общепринятой методике формируют канал и вводят основной гамма-винт. После полной установки гамма-винт частично выкручивают таким образом, чтобы выходное отверстие его центрального канала находилось на уровне центра полости. Затем посредством соответствующей резьбы соединяют и закрепляют заранее подготовленный переходник сначала с гамма-винтом, а затем с инжектором для введения цемента. Далее с использованием собранной конструкции в полость вводят костный цемент, после чего удаляют переходник с инжектором костного цемента, а в центральный канал гамма-винта вводят направляющую спицу и осуществляют окончательную установку гамма-винта с импакцией полимеризующегося костного цемента.
Сущность изобретения поясняется чертежами, где изображены:
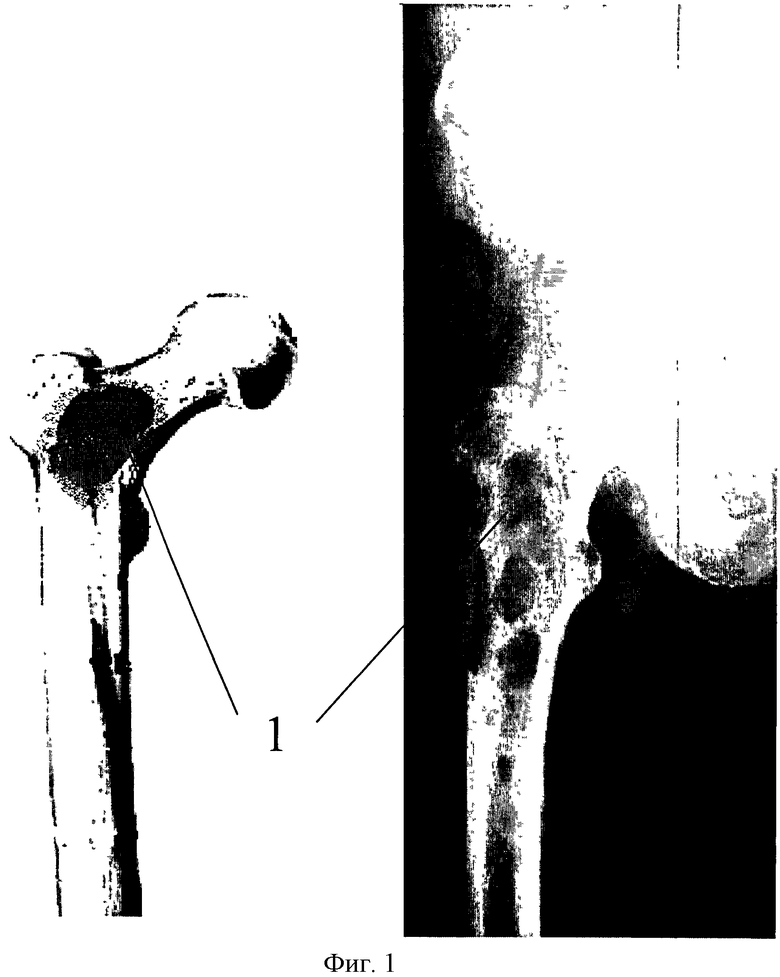
Фиг. 1 - рентгенограмма и схема расположения метастатического очага в проксимальном отделе бедренной кости, где 1 - метастатический очаг.
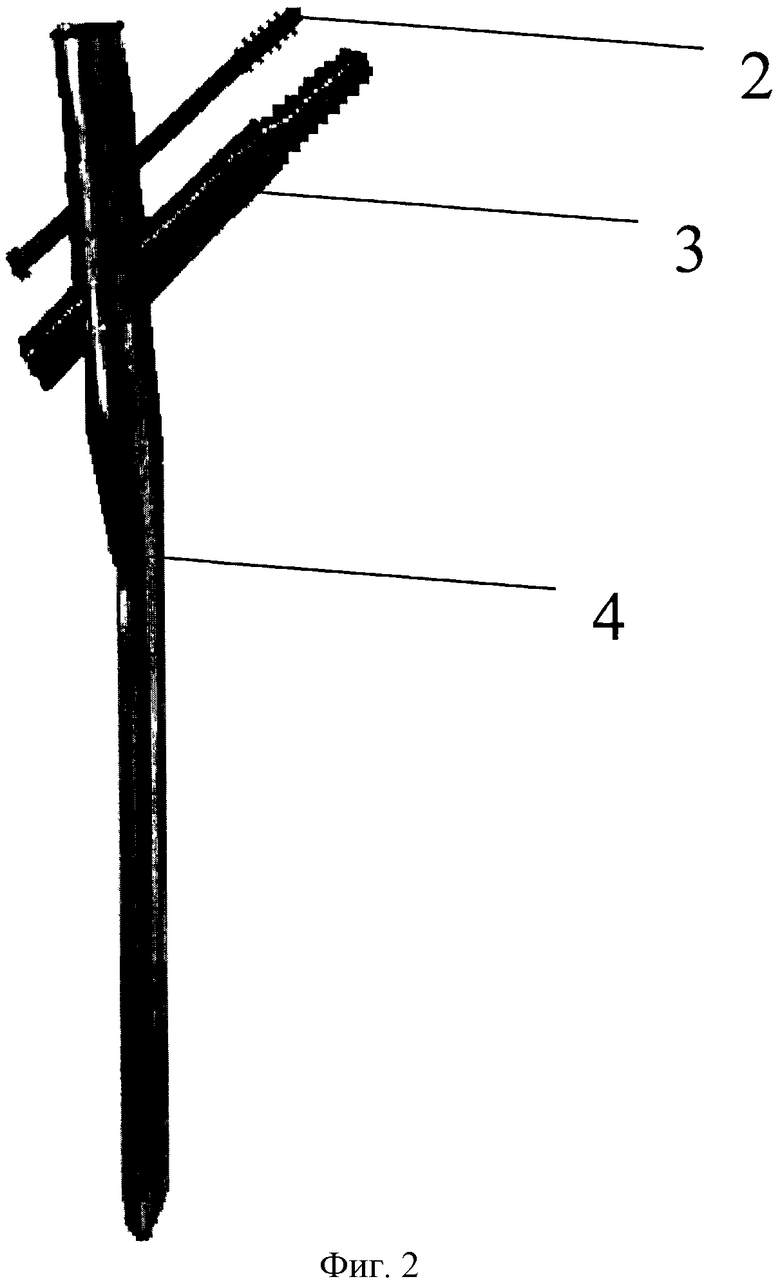
Фиг. 2 - общий вид основных элементов имплантируемой конструкции, 2 - деротационный винт, 3 - гамма-винт, 4 - гамма-стержень PFN.
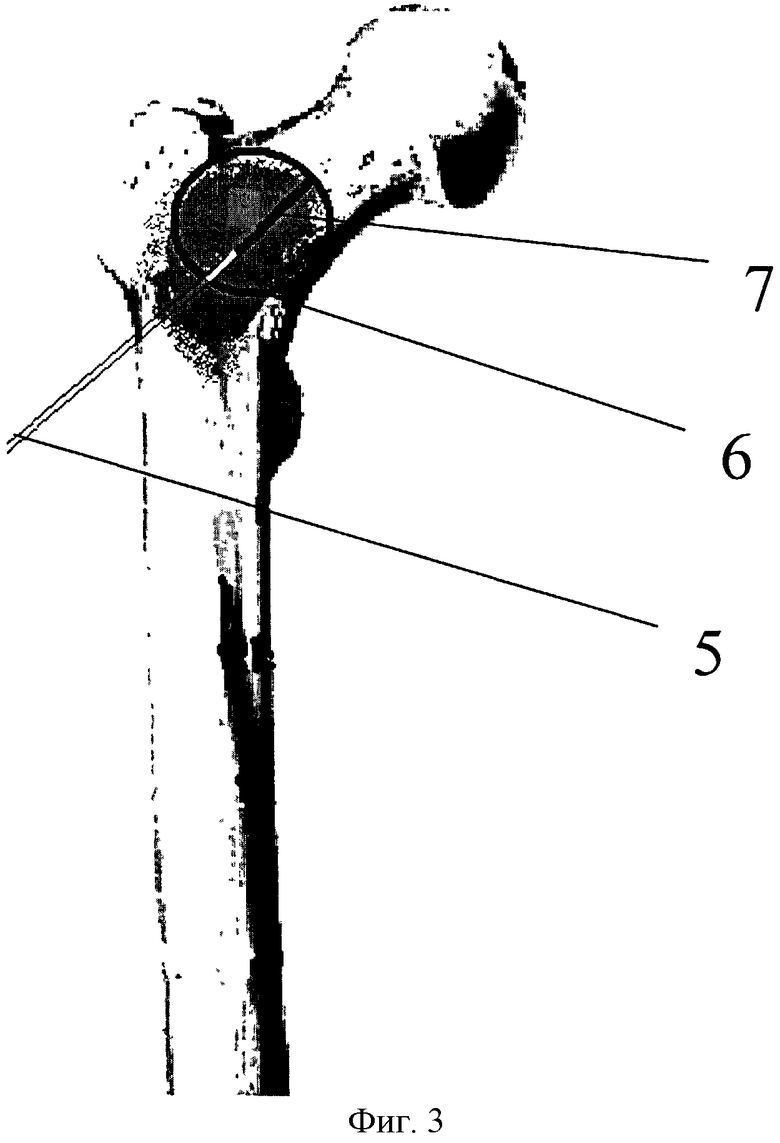
Фиг. 3 - этап введения иглы аблятора в направление шейки бедренной кости, где 5 - трепан, 6 - электрод аблятора, 7 - зона действия аблятора.
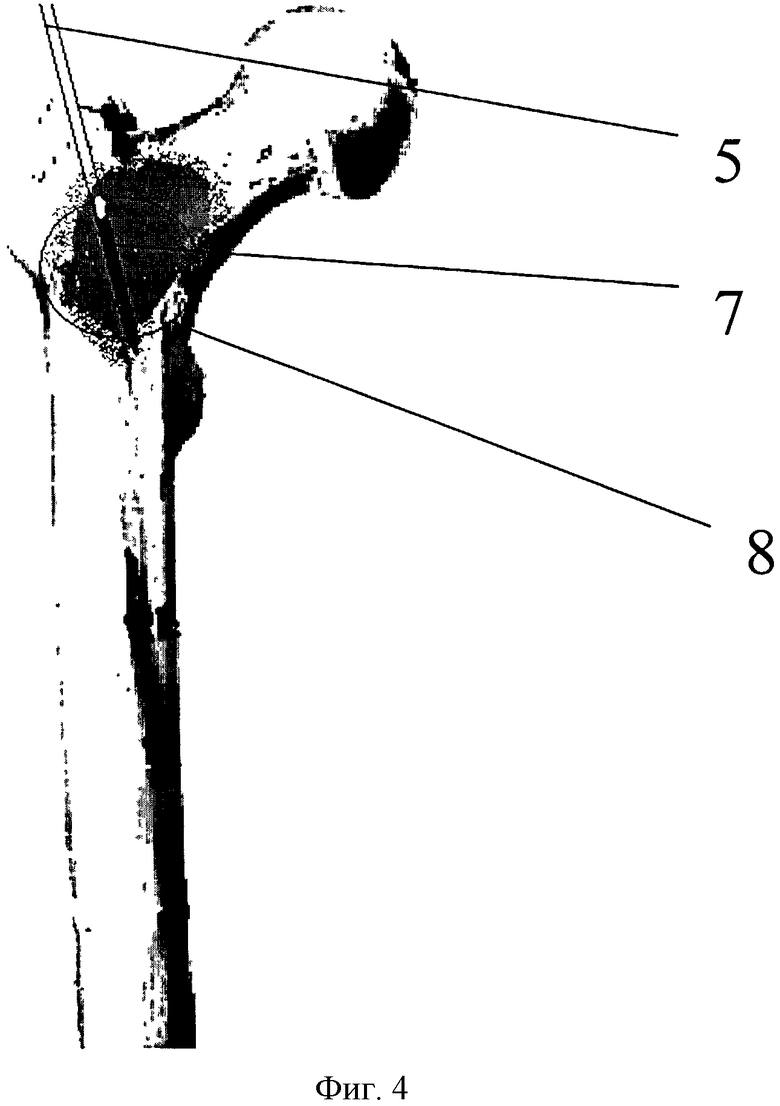
Фиг. 4 - этап введения электрода аблятора при помощи трепана в диафизарном направлении, где 5 - трепан, 6 - электрод аблятора, 8 - зона действия радиочастотного аблятора.
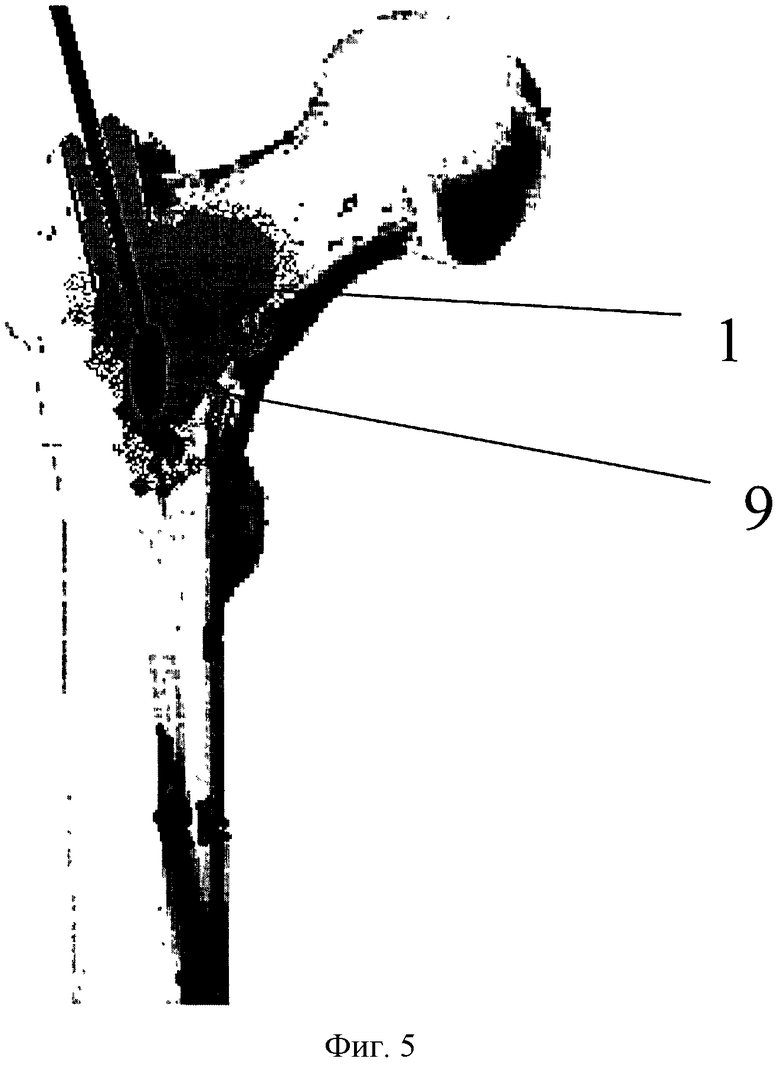
Фиг. 5 - этап кюретажа метастатического очага в диафизарном направлении, где 9 - костная ложка, 1 - метастатический очаг.
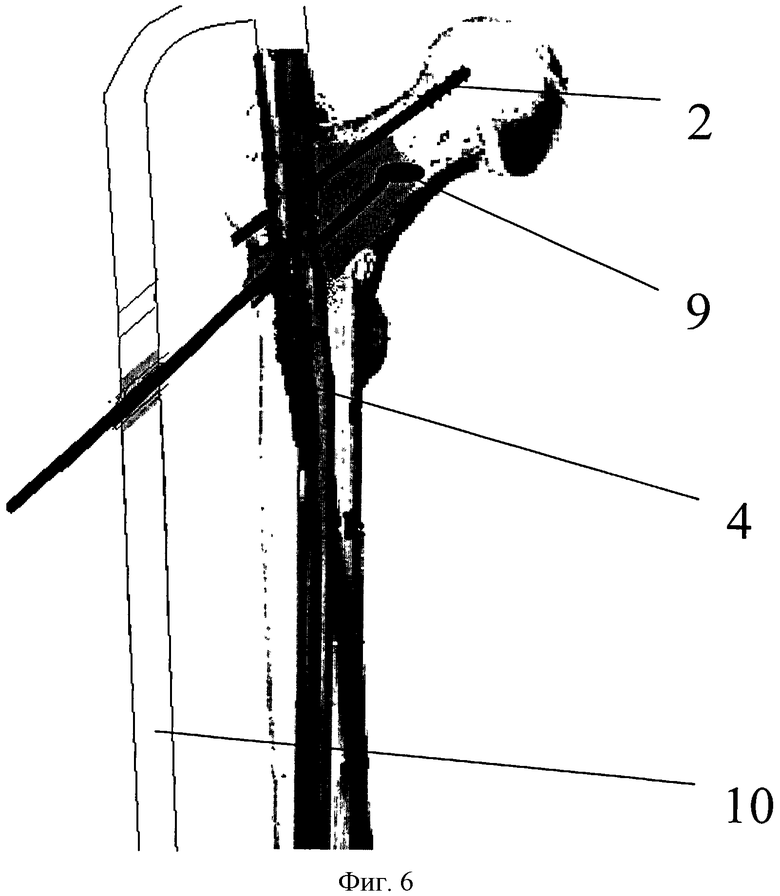
Фиг. 6 - этап кюретажа шеечной части полости метастатического очага, где 4 - гамма-стержень PFN, 9 - костная ложка, 10 - визир, 2 - деротационный винт.
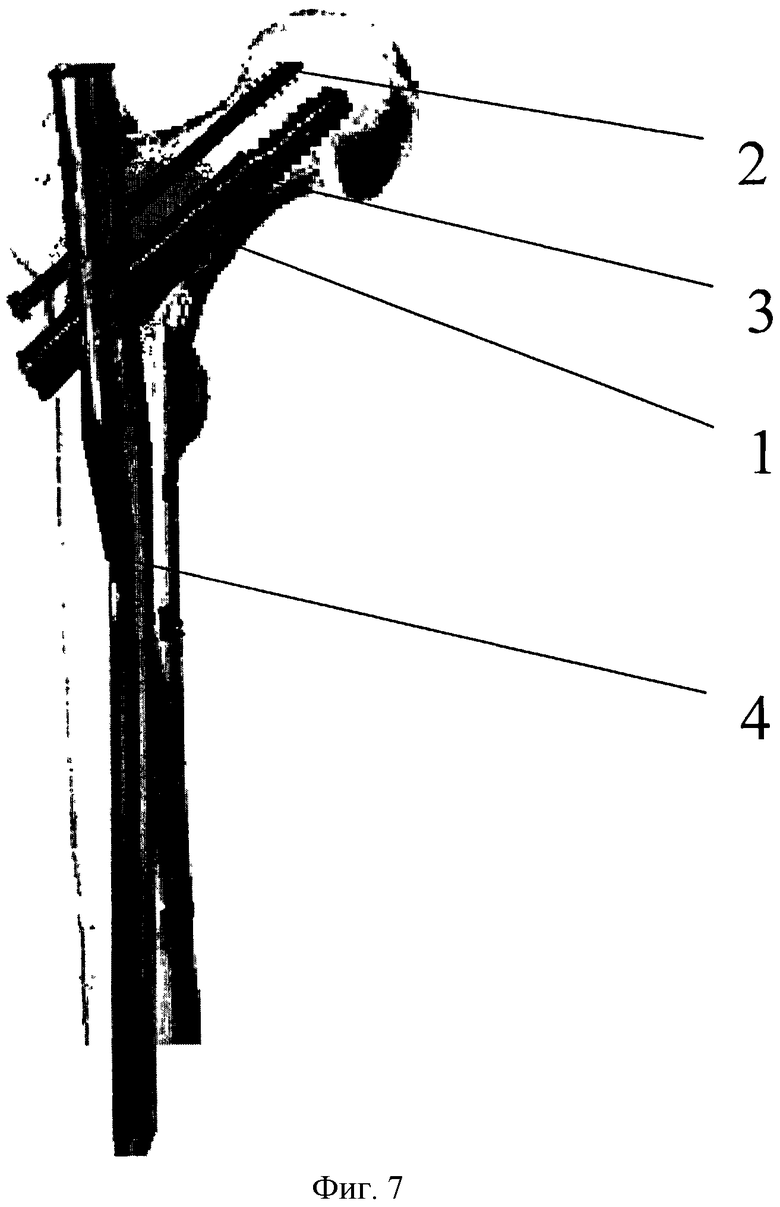
Фиг. 7 - схема установленной конструкции PFN после экскохлеации метастатического очага, где 2 - деротационный винт, 3 - гамма-винт, 4 - гамма-стержень.
Фиг. 8 - схема установленной конструкции PFN с частично выкрученным гамма-винтом в полость после кюретажа метастатического очага, где 2 - дератационный винт, 3 - гамма-винт, 4 - гамма-стержень, 17 - выход центрального канала гамма-винта на уровне центра дефектной полости метастатического очага.
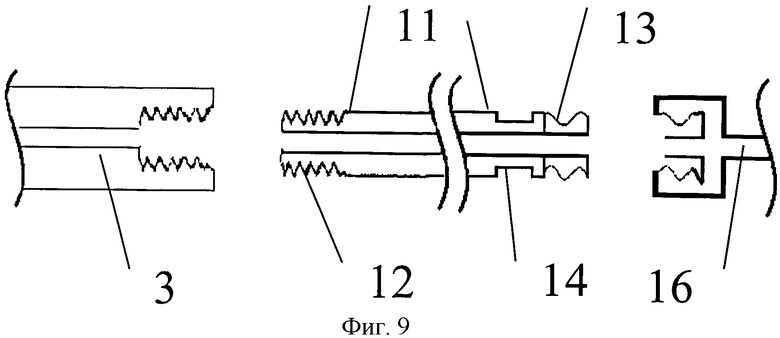
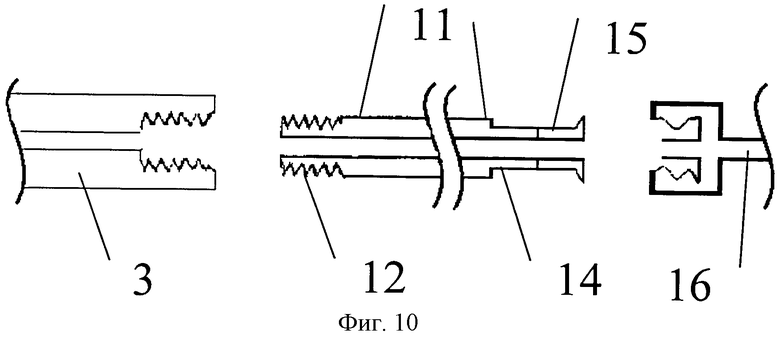
Фиг. 9 - общий вид резьбового переходника, где 11 - резьбовой переходник, 12 - резьба для соединения с винтом, 13 - резьба для соединения с инжектором костного цемента, 14 - монтажные проточки (лыски).
Фиг. 10 - общий вид резьбового переходника с вариантом резьбы для соединения с инжектором костного цемента, где 14 - монтажные проточки, 15 - фланец.
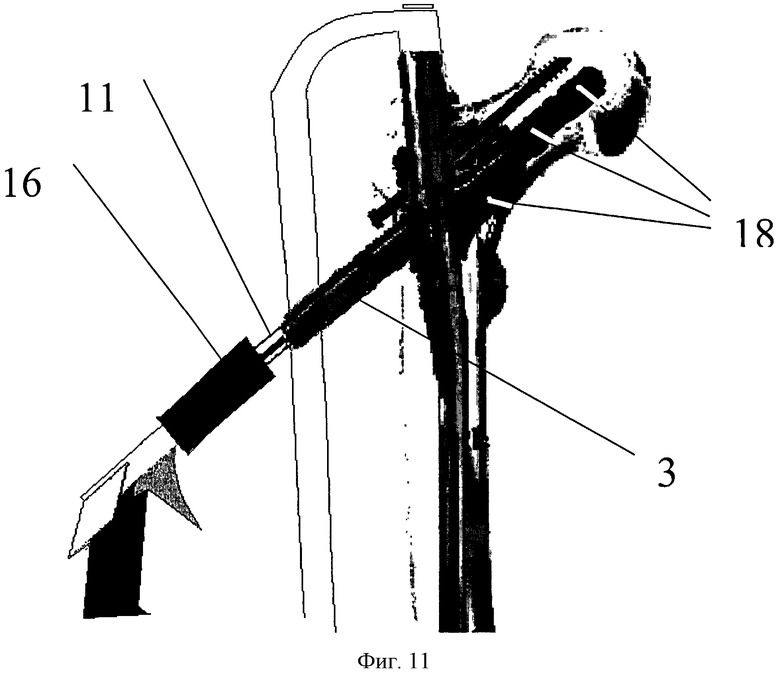
Фиг. 11 - этап сборки системы канюлированный гамма-винт - резьбовой переходник-инжектор, где 3 - гамма-винт, 11 - резьбовой переходник, 16 - инжектор костного цемента, 17 - выход центрального канала гамма-винта на уровне центра дефектной полости метастатического очага.
Фиг. 12 - этап проведения направляющей спицы перед окончательной установкой гамма-винта в полость, заполненную костным цементом, где 3 - гамма-винт, 18 - костный цемент, 19 - направляющая спица.
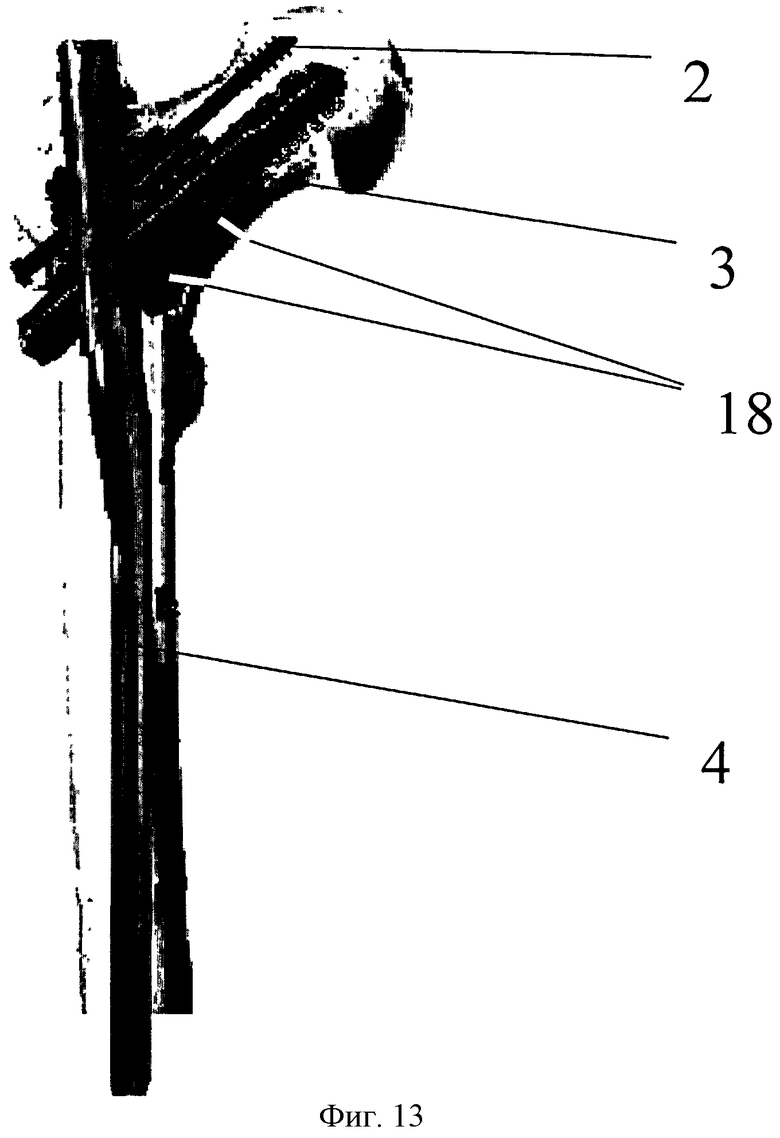
Фиг. 13 - схема окончательно установленной конструкции в проксимальном отделе бедренной кости, где 2 - деротационный винт, 3 - гамма-винт, 4 - гамма-стержень, 18 - костный цемент.
Фиг. 14 - рентгенограмма проксимального отдела бедренной кости пациентки И. через 3 месяца после операции по предложенному способу.
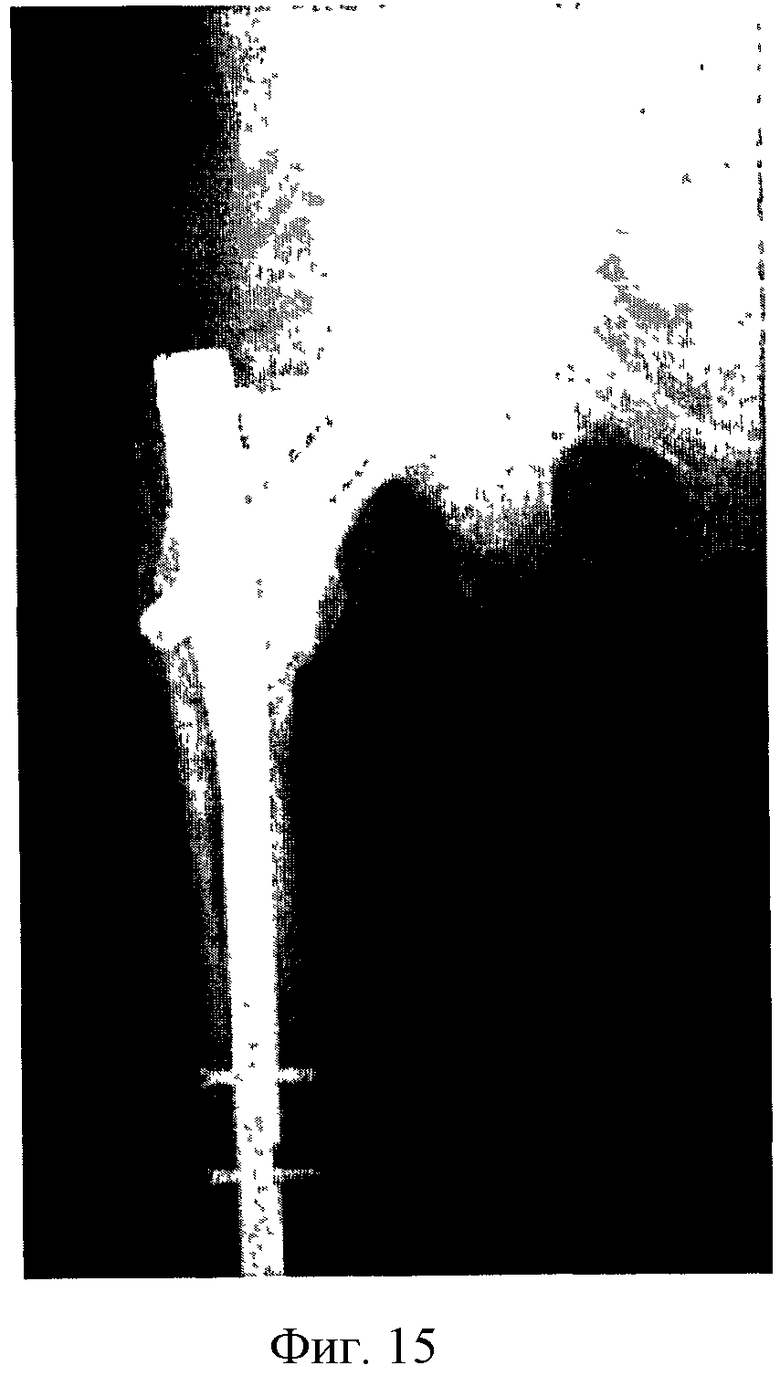
Фиг. 15 - рентгенограммы проксимального отдела бедренной кости пациентки И. через 12 месяцев после операции по предложенному способу.
Отличие от существующих методик профилактической фиксации или цементной пластики метастатического очага заключается в предварительной абляции с удалением опухолевых масс без нанесения дополнительных отверстий в кости и операционных ран, а также заполнении образованной полости костным цементом с помощью переходника через технологическое отверстие винта непосредственно перед его окончательным введением.
Предлагаемый способ осуществляют следующим образом.
Предварительно изготавливают резьбовой переходник 11 из металлической трубки длиной от 250 до 300 мм с внутренним диаметром, соответствующим диаметру центрального канала гамма-винта 3. Такая длина трубки обусловлена необходимостью монтажа переходника через визир 10 для установки элементов конструкции (PFN) (фиг.2). На одном конце трубки нарезают наружную резьбу 12 для сопоставления с внутренней резьбой гамма-винта, которая изначально служит для закрепления отвертки и установки заглушки. Шаг наружной резьбы 13 нарезают соответствующим шагу внутренней резьбы гамма-винта 3, а количество витков резьбы выбирают достаточным для плотной посадки и закрепления гамма-винта и переходника. С другой стороны трубки нарезают наружную резьбу, аналогичную той, которая есть на трепанах для вертебропластики и используемой для присоединения инжектора костного цемента (фиг.9). В другом варианте исполнения на проксимальном конце переходника нарезают фланец 15, аналогичный таковому на куполе иглы для вертебропластики (фиг.10). Также, отступая 5 мм от резьбы для соединения с инжектором 13 (или 10 мм от фланца 15), фрезеруют две плоские монтажные проточки (лыски) 14, протяженность которых равна двойной толщине рабочей части используемого при монтаже инструмента (фиг.9 и 10), например, рожкового гаечного ключа с расстоянием между его рожками равным 6 мм. Если по какой либо причине гаечный ключ отсутствует, для монтажа можно использовать пассатижи или разводной гаечный ключ.
Для окончательного определения диагноза метастатического поражения до возникновения патологического перелома необходимо проведение скринингового рентгенологического исследования, остеосцинтиграфии и морфологической верификации первичной опухоли. Гистологический материал получают методом трепанбиопсии, так как при осуществлении открытой биопсии достаточно велик риск обсеменения опухолевыми клетками окружающих мягких тканей. Кроме того, всегда после биопсии, рост опухолевых клеток усиливается. Следовательно, промежуток времени между установлением морфологического диагноза и началом лечения должен быть как можно короче. Результат патоморфологического исследования, полученного при трепанбиопсии материала, становится известным в течение 10-21 суток. После получения результата в ближайшие сроки проводится оперативное лечение.
В зону метастатического очага 1 (фиг.1) под рентгенологическим контролем вводят трепан 5 (фиг.3), по которому проводят электрод радиочастотного аблятора 6 с рабочей длиной иглы от 30 до 40 мм. На мощности 100-120 Вт в течение 2×8 мин производят радиочастотную абляцию метастатического очага в межвертельном пространстве в шеечном 7 (фиг.3) и диафизарном 8 (фиг.4) направлениях. Наружным доступом по стандартной методике выделяют верхушку большого вертела. Через верхушку большого вертела в костномозговой канал под рентгенологическим контролем проводят спицу. По спице костномозговой канал вскрывают канюлированным шилом. Далее канал бедренной кости разрабатывают канюлированным сверлом 17 мм по общепринятой методике. Через полученное отверстие для введения гамма-стержня 4 стабилизирующей конструкции (PFN), без нанесения дополнительных отверстий, костной ложкой 9, под рентгенологическим контролем, выполняют кюретаж (фиг.5) и аспирацию содержимого полости метастатического очага подвергнутого абляции. Все удаленные ткани подвергают патоморфологическому исследованию с использованием электронной микроскопии, так как оценить результаты радиочастотного воздействия на опухолевые клетки при стандартном окрашивании материала затруднительно. Вводят гамма-стержень 4 для проксимального отдела бедренной кости.
В головку и шейку через проксимальное отверстие по визиру 10 под рентгенологическим контролем проводят направляющую спицу и формируют канал диаметром 6,5 мм, в который вводят деротационный гамма-винт 2. Направляющую спицу удаляют. Далее по ходу дистального отверстия диаметром 11 мм устанавливают следующую направляющую спицу и при помощи штатного сверла производят перфорацию кости до зоны метастатического очага. Направляющую спицу удаляют. Через полученное отверстие, при необходимости, используя костную ложку 9 и аспиратор, под рентгенологическим контролем проводят дополнительный кюретаж и аспирацию фрагментов метастатического очага из шейки бедренной кости (фиг.6) (данная манипуляция проводится при распространении метастатического очага на базисцервикальную область). Затем по стандартной методике через данное отверстие формируют канал диаметром 11 мм. Далее производят установку гамма-винта (фиг.7) необходимой длины и градусом шеечно-диафизарного угла по стандартной методике. Данный этап выполняется с целью формирования резьбового хода в головке бедренной кости и упрощения последующих действий. После формирования резьбового хода гамма-винт частично выкручивают (фиг.8) таким образом, чтобы выход его центрального канала 17 находился на уровне центра полости 1, оставшейся после экскохлеации метастатического очага. Посредством соответствующей резьбы соединяют и закрепляют заранее подготовленный переходник 11 сначала с гамма-винтом 3, а затем с инжектором для введения костного цемента 16. Для соединения резьбового переходника 11 с гамма-винтом 3 используется внутренняя резьба гамма-винта, которая предназначена для закрепления в нем установочного инструмента и заглушки. Инжектор костного цемента 16 присоединяют к переходнику 11 посредством заранее подготовленного соединения. При помощи набора для цементной пластики и резьбового переходника 11, установленного между гамма-винтом и инжектором костного цемента 16, под рентгенологическим контролем выполняют заполнение полости метастатического очага 1 костным цементом 18 (фиг.11). Далее сразу после введения цемента и до его застывания (фиг.12) удаляют переходник с инжектором костного цемента и вводят направляющую спицу 19 до конца сформированного канала в шейке и головке бедренной кости, после чего производят окончательное введение гамма-винта 3. Этим достигается импакция костного цемента в неровности стенок полости. Полимеризующийся костный цемент посредством экзотермической реакции оказывает дополнительное цитолитическое воздействие на те клетки метастатической ткани, которые могут оставаться жизнеспособными после проведения радиочастотной термоабляции. Устанавливают заглушки на гамма-винт 3 и гамма-стержень 4 и удаляют спицу 19 (фиг.13).
По визиру 10 через проколы кожи по стандартной методике под рентгенологическим контролем проводят два дистальных блокирующих кортикальных винта. Выполняют промывание ран растворами антисептиков (при необходимости активное дренирование), раны послойно ушивают и накладывают асептическую повязку.
Применение заявляемого способа позволяет достигать максимально возможного стабилизирующего эффекта профилактического остеосинтеза с минимальной травматизацией тканей. Таким образом, способ может быть применен при лечении пациентов с угрозой патологического перелома на фоне метастатического поражения проксимального отдела бедренной кости. Благодаря использованию радиочастотной термоабляции значительно уменьшается уровень болевого синдрома и замедляется или прекращается рост метастатического очага. Применение метода позволяет отсрочить или избежать эндопротезирования с резекцией проксимального отдела бедренной кости.
В послеоперационном периоде больным рекомендована ходьба с дополнительной опорой до снятия швов (12-14 суток). Продолжение комплексного лечения основной онкологической патологии возможно сразу после выписки больного.
Клинический пример:
Пациент женщина И., 52 года. Диагноз: Рак молочной железы в течение 6 месяцев. Первичный очаг не удален. Получила 4 курса полихимиотерапии и гормонотерапию. Метастатическое поражение проксимального отдела бедренной кости в течение 3 месяцев. Болевой синдром и рентгенологические признаки активного роста с угрозой патологического перелома кости с момента отмены химиотерапии в течение 2 месяцев. При первом обращении была выполнена трепанбиопсия. Результат патоморфологического исследования был получен на 10-е сутки после биопсии. Заключение - метастаз рака молочной железы с лечебным патоморфозом. На 11-е сутки пациентке проведена операция по предложенному способу. После проведения оперативного лечения получала гормонотерапию и бисфосфонаты. Контрольные осмотры рентгенограммами 1 раз в 3 месяца. На момент первого осмотра (3 месяца после операции) ходит с дополнительной опорой на трость без болевого синдрома, при рентгенологическом контроле признаков продленного роста метастатического очага нет (фиг.14). При осмотре через 12 месяцев ходьба без дополнительной опоры, на контрольных рентгенограммах признаки продленного роста также не выявлены (фиг.15). Пациентка продолжает получение комплексной терапии. Применение способа в данном клиническом случае позволило предотвратить развитие патологического перелома на фоне метастатического поражения проксимального отдела бедренной кости, остановить рост метастатического очага, значительно снизить уровень болевого синдрома и продолжить лечение основной онкологической патологии, без утяжеления соматического статуса пациентки. Наблюдение продолжается.
Список литературы
1. Hattori H. Surgical management of metastatic disease of the proximal femur / H.Hattori, J.Mibe, H.Matsuoka, S.Nagai, K.Yamamoto // J. Orthop. Surg. (Hong Kong). - 2007. - Vol.15, N 3. - P.295-298.
2. Hoffmann R.T. Radiofrequency ablation in combination with osteoplasty in the treatment of painful metastatic bone disease / R.T. Hoffmann, T.F. Jakobs, C.J. Trumm // Vase. Interv. Radiol. - 2008. - Vol.19, N 3. - P.419-425.
3. Harrington K.D. Methylmethacrylate as an adjunct in internal fixation of pathological fractures. Experience with three hundred and seventy-five cases / K.D. Harrington, F.H. Sim, J.E. Enis [et al.] / J. Bone Joint Surg. - 1976. - Vol.58-A. - P.1047-1055.
4. Kurup A.N. Ablation of skeletal metastases: Current status / A.N. Kurup, Callstrom M.R. // J. Vase Interv Radiol - 2010. - Vol.21 - P.5242-5250.
5. V. Ippolito (ссылка из интернета Open Intramedullary Nailing Of Femo ral Metastases http://www.coobs.it/?page_id=209/).
6. Ogura K. Bone radiofrequency ablation combined with prophylactic in ternal fixation for metastatic bone tumor of the femur from hepatocellular carcinoma / K. Ogura, R. Miyake, S. Shiina [et al] // Int. J. Clin. Oncol. - 2012. - Vol.17, N4. - P.417-421.
7. Ptashnikov D.A. Percutaneous transpedicular fixation with cement vertebroplasty in patients with osteoporosis and widespread metastasis / D.A. Ptashnikov, V.D. Usikov, O.A. Smecalenkov, D.A. Mikhailov // Acta Neurochir. - 2011. - Vol 153, N9. - P.1889-1890.
8. Sokolovski V.A. Total hip replacement for proxial femoral tumours Our midterm results / V.A. Sokolovski, V.P. Voloshin, M.D. Aliev, V.S Zubikov, S.A. Saravanan, D.V. Martynenko, D.V. Nisichenko, K.N.Strelmkov // Int. Orthop. - 2006 - Vol 30, N 5. - P.399-402.
9. Бухаров А.В. Радиочастотная термоаблация в лечении пациентов с опухолевым поражением костей / А.В. Бухаров, В.В. Тепляков, В.Ю. Карпенко, Г.А. Франк, С.О. Степанов, С.А. Седых // Российский онкологический журнал. - 2008. - №5. - С.15-21.
10. Жуков Н.В. Метастатическое поражение костей. / Н.В. Жуков // Практическая онкология. - 2009. - Т.10, №3. - С.125-130.
11. Зоря В.И. Патологические переломы костей конечностей метастатического происхождения (диагностика и лечение) / В.И. Зоря, Ю.С. Злобина // Травматология и ортопедия России. - 2008. - №1 (47). - С.27-33.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оперативного лечения при гигантоклеточной опухоли костей, образующих коленный сустав | 2024 |
|
RU2822230C1 |
| СПОСОБ ЭНДОПРОТЕЗИРОВАНИЯ ТАЗОБЕДРЕННОГО СУСТАВА ПРИ ОПУХОЛЕВОМ ПОРАЖЕНИИ ПРОКСИМАЛЬНОГО ОТДЕЛА БЕДРЕННОЙ КОСТИ | 2018 |
|
RU2682510C1 |
| СПОСОБ ПЕРКУТАННОЙ ТРАНСПЕДИКУЛЯРНОЙ ФИКСАЦИИ ПОЗВОНОЧНИКА С ПУНКЦИОННОЙ ВЕРТЕБРОПЛАСТИКОЙ В ЛЕЧЕНИИ ПАЦИЕНТОВ С РАСПРОСТРАНЕННЫМ ОСТЕОПОРОЗОМ И МНОЖЕСТВЕННЫМИ МЕТАСТАТИЧЕСКИМИ ПОРАЖЕНИЯМИ ПОЗВОНОЧНИКА | 2011 |
|
RU2479274C1 |
| СПОСОБ ВЕРТЕБРОПЛАСТИКИ | 2004 |
|
RU2262318C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРЕЛОМОВ ПРОКСИМАЛЬНОГО ОТДЕЛА БЕДРА В УСЛОВИЯХ ОСТЕОПОРОЗА | 2011 |
|
RU2473317C1 |
| СПОСОБ ОСТЕОСИНТЕЗА ШЕЙКИ БЕДРЕННОЙ КОСТИ С НЕСВОБОДНОЙ КОСТНОЙ АУТОПЛАСТИКОЙ | 2011 |
|
RU2463988C1 |
| СПОСОБ РЕЭНДОПРОТЕЗИРОВАНИЯ ТАЗОБЕДРЕННОГО СУСТАВА | 2003 |
|
RU2230513C1 |
| СПОСОБ ЗАМЕЩЕНИЯ ДЕФЕКТА ТЕЛА L5 ПОЗВОНКА ИЗ ЗАДНЕГО ОПЕРАТИВНОГО ДОСТУПА ПОСЛЕ КОРПОРЭКТОМИИ | 2015 |
|
RU2594445C1 |
| СПОСОБ АРТРОДЕЗА КОЛЕННОГО СУСТАВА ПРИ ОБШИРНЫХ ДЕФЕКТАХ ДИСТАЛЬНОЙ ЧАСТИ БЕДРЕННОЙ КОСТИ | 2019 |
|
RU2700383C1 |
| СПОСОБ ДВУХЭТАПНОЙ ПЛАСТИКИ ТАЗОБЕДРЕННОГО СУСТАВА ПРИ КОКСАРТРОЗЕ ПОЗДНИХ СТАДИЙ С ДЕФЕКТОМ И ДЕФОРМАЦИЕЙ ГОЛОВКИ БЕДРЕННОЙ КОСТИ | 1997 |
|
RU2154429C2 |



Изобретение относится к медицине, а именно к травматологии, ортопедии и онкоортопедии. Проводят радиочастотную абляцию, кюретаж метастатической полости, цементную пластику с использованием дополнительных инструментов и фиксирующей внутрикостной конструкции PFN. При этом предварительно изготавливают переходник из металлической трубки длиной от 250 до 300 мм, с внутренним диаметром, соответствующим диаметру канала гамма-винта, на которой с одного конца нарезают резьбу с шагом, соответствующим шагу внутренней резьбы гамма-винта, с количеством витков, достаточным для плотной посадки и закрепления переходника и гамма-винта между собой. С другого конца трубки нарезают резьбу с шагом, соответствующим шагу внутренней резьбы инжектора костного цемента, с количеством витков, достаточным для плотного скрепления переходника с инжектором костного цемента, после чего, отступя 5 мм от последнего витка резьбы для соединения переходника с инжектором костного цемента конца трубки, фрезеруют плоские монтажные проточки под инструмент для монтажа шириной, равной двойной толщине его рабочей части. Через трепанационные отверстия по трепану вводят электрод в область метастатического очага и выполняют радиочастотную абляцию в шеечном и диафизарном направлениях. Далее производят перфорацию вертельной области для введения стержня и через полученное отверстие осуществляют кюретаж вертельной области и аспирацию опухолевых масс, подвергнутых радиочастотной абляции. Формируют канал и вводят стержень, затем производят перфорацию в шеечном направлении и через полученное отверстие при необходимости осуществляют кюретаж шеечной области и аспирацию опухолевых масс, подвергнутых радиочастотной абляции. Далее формируют канал и вводят гамма-винт, который после полной установки частично выкручивают таким образом, чтобы выходное отверстие его центрального канала находилось на уровне центра полости, после чего посредством соответствующей резьбы соединяют и закрепляют заранее подготовленный переходник сначала с гамма-винтом, а затем с инжектором для введения цемента. Затем с использованием собранной конструкции в полость вводят костный цемент, после чего удаляют переходник и инжектор, а в центральный канал гамма-винта вводят направляющую спицу и осуществляют окончательную установку гамма-винта с импакцией полимеризующегося костного цемента. Способ позволяет предотвратить развитие патологического перелома на фоне метастатического поражения проксимального отдела бедренной кости, замедлить или остановить рост метастатического очага, отсрочить или избежать эндопротезирования с резекцией проксимального отдела бедренной кости. 15 ил., 1 пр.
Способ профилактической фиксации проксимального отдела бедренной кости с цементной пластикой после радиочастотной абляции при метастатическом поражении и угрозе патологического перелома, включающий проведение радиочастотной абляции, кюретаж метастатической полости, цементную пластику, использование дополнительных инструментов и фиксирующей внутрикостной конструкции PFN, отличающийся тем, что предварительно изготавливают переходник из металлической трубки длиной от 250 до 300 мм, с внутренним диаметром, соответствующим диаметру канала гамма-винта, на которой с одного конца нарезают резьбу с шагом, соответствующим шагу внутренней резьбы гамма-винта, с количеством витков, достаточным для плотной посадки и закрепления переходника и гамма-винта между собой, а с другого конца трубки нарезают резьбу с шагом, соответствующим шагу внутренней резьбы инжектора костного цемента, с количеством витков, достаточным для плотного скрепления переходника с инжектором костного цемента, после чего, отступя 5 мм от последнего витка резьбы для соединения переходника с инжектором костного цемента конца трубки, фрезеруют плоские монтажные проточки под инструмент для монтажа, шириной, равной двойной толщине его рабочей части; через трепанационные отверстия по трепану вводят электрод в область метастатического очага и выполняют радиочастотную абляцию в шеечном и диафизарном направлениях, после чего производят перфорацию вертельной области для введения стержня и через полученное отверстие осуществляют кюретаж вертельной области и аспирацию опухолевых масс, подвергнутых радиочастотной абляции, далее формируют канал и вводят стержень, затем производят перфорацию в шеечном направлении и через полученное отверстие при необходимости осуществляют кюретаж шеечной области и аспирацию опухолевых масс, подвергнутых радиочастотной абляции, далее формируют канал и вводят гамма-винт, который после полной установки частично выкручивают таким образом, чтобы выходное отверстие его центрального канала находилось на уровне центра полости, после чего посредством соответствующей резьбы соединяют и закрепляют заранее подготовленный переходник сначала с гамма-винтом, а затем с инжектором для введения цемента, далее с использованием собранной конструкции в полость вводят костный цемент, после чего удаляют переходник и инжектор, а в центральный канал гамма-винта вводят направляющую спицу и осуществляют окончательную установку гамма-винта с импакцией полимеризующегося костного цемента.
| OGURA K | |||
| et al | |||
| Bone radiofrequency ablation combined with prophylactic internal fixation for metastatic bone tumor of the femur from hepatocellular carcinoma | |||
| Int | |||
| J | |||
| Clin | |||
| Oncol | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| СПОСОБ ЛЕЧЕНИЯ РАКА КОСТЕЙ | 2007 |
|
RU2468796C2 |
| СПОСОБ ПЕРКУТАННОЙ ТРАНСПЕДИКУЛЯРНОЙ ФИКСАЦИИ ПОЗВОНОЧНИКА С ПУНКЦИОННОЙ ВЕРТЕБРОПЛАСТИКОЙ В ЛЕЧЕНИИ ПАЦИЕНТОВ С РАСПРОСТРАНЕННЫМ ОСТЕОПОРОЗОМ И МНОЖЕСТВЕННЫМИ МЕТАСТАТИЧЕСКИМИ ПОРАЖЕНИЯМИ ПОЗВОНОЧНИКА | 2011 |
|
RU2479274C1 |
| БУХАРОВ А.В | |||
| и др | |||
| Радиочастотная термоаблация в лечении пициентов с опухолевым поражением | |||
Авторы
Даты
2015-06-20—Публикация
2013-11-22—Подача