Предлагаемое изобретение относится к органической химии, а точнее к способам получения адамантилированных фуранов, являющихся полупродуктами для тонкого органического синтеза.
Одним из первых примеров получения фуранов, содержащих 1-адамантильный фрагмент, является способ получения 2,5-ди(1-адамантил)фурана в котором исходными соединениями служат 1-адамантоилхлорид и малоновый эфир (Н. Stetter, Е. Rauscher. Zur kenntnis des β-[adamantyl-(1)]-)-β-oxo-propionsaure-athylesters. Chem. Ber., 1960, 93, 2054-2057). В соответствии со схемой:
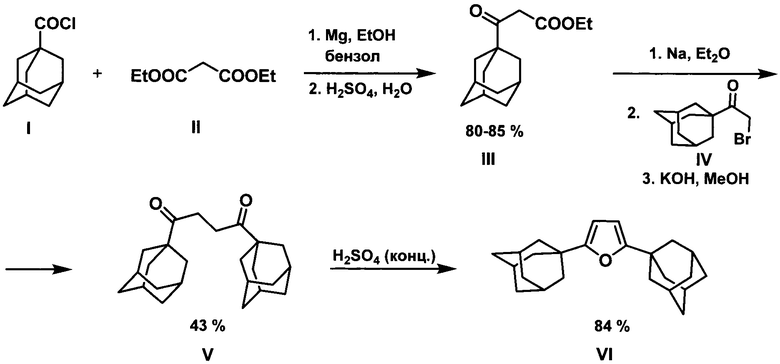
на первой стадии проводят ацилирование 1-адамантоилхлоридом I диэтилмалоната II, образующийся при этом этиловый эфир 3-(1-адамантил)-3-оксопропионовой кислоты III на второй стадии алкилируют 1-(1-адамантил)-2-бромэтаноном IV. Циклизация образующегося 1,4-ди(1-адамантил)бутандиона-1,4 V в концентрированной серной кислоте приводит к целевому продукту VI с выходом 84% (30% на все стадии).
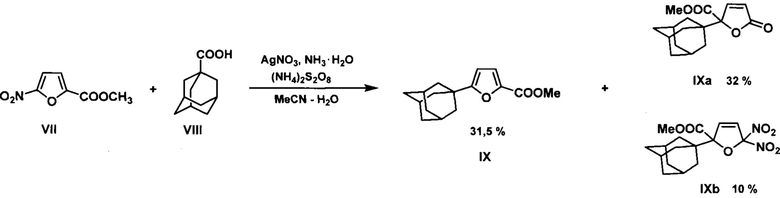
Описан способ получения 1-адамантилированных фуранов, заключающийся в радикальном адамантилировании метилового эфира 5-нитрофуран-2-карбоновой кислоты VII или 5-нитрофурфурола. Для генерирования адамантильного радикала использовалось Ag(I) - катализируемое окислительное декарбоксилирование 1-адамантанкарбоновой кислоты VIII. (P. Cogolli, L. Tastaferri, М. Tiecco, М. Tingoli. Factors controlling the fate of radical ipso intermediates. Homolytic alkylation of furan derivatives. J. Chem. Soc. Chem. Comm., 1979, 800-801).
Предложен трехстадийный способ получения 1-адамантилфурана, в котором стартовым соединением служит 1-адамантилкарбальдегид X. В соответствии со схемой:
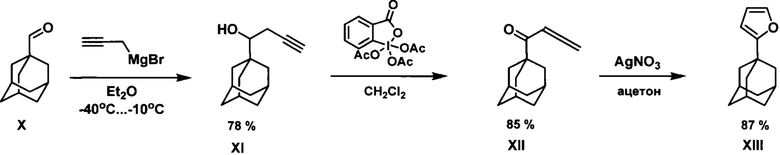
на первой стадии из 1-адамантилкарбальдегида и пропаргилмагний бромида получают соответствующий гомопропаргиловый спирт XI, который далее окисляют реактивом Десса-Мартина в алленилкетон XII, последующая гетероциклизация которого под действием нитрата серебра приводит к целевому 1-адамантилфурану XIII с общим выходом 58% на три стадии. (A.S.K. Hashmi, R. Salathe, W. Frey. Gold catalysis: no steric limitations in the phenol synthesis. Chem. Eur. J., 2006, 12, 6991-6996.).
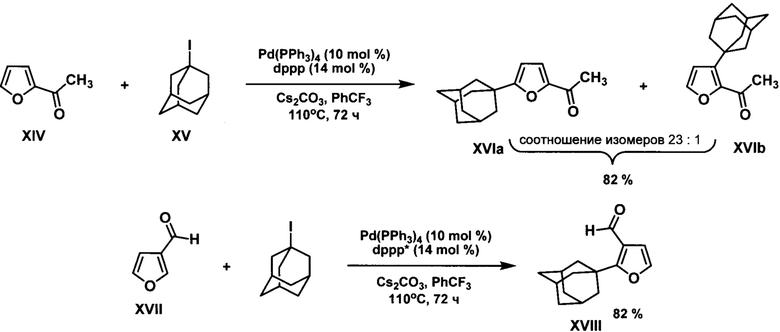
Известен способ 1-адамантилирования фуранов с электроноакцепторными заместителями в кольце (2-ацетилфуран XIV, фуран-3-карбоксальдегид XVII) действием 1-иодадамантана XV в присутствии 10 мольных % тетракис(трифенилфосфин)палладия, 14 мольных % 1,3-бис(дифенилфосфино)пропана (dppp) и 200 мольных % карбоната цезия в среде трифторметилбензола. (Xiaojin Wu, Jessica Wei Ting See, Kai Xu, Hajime Hirao, Julien Roger, Jaen-Cyrille Hierso, Jianrong (Steve) Zhou. A general palladium-catalyzed method for alkylation of heteroarenes using secondary and tertiary alkyl halides. Angew. Chem. Int. Ed. 2014, 53, 49, p. 13573-13577.)
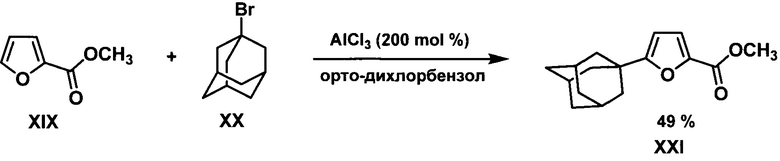
Способ адамантилирования 1-бромадамантаном в присутствии кислоты Льюиса использовался в заявке (PCT/WO2005/080367 A1, МПК (7) C07D 307/68, C07D 405/04, опубл. 01.09.2005): метиловый эфир фуран-2-карбоновой кислоты XIX обрабатывали 1-бромадамантаном XX в орто-дихлорбензоле в присутствии 200 мольных % хлорида алюминия. Выход целевого продукта XXI составил 49%.
Недостатками приведенных способов синтеза 1-адамантилированных фуранов является многостадийность схем синтезов, применение в ряде случаев дорогостоящих палладиевых катализаторов и специфических реакционных сред или образование смеси продуктов реакции. Кроме того, не один из примеров не реализован на широком спектре фурановых субстратов, что позволило бы говорить об универсальности способа.
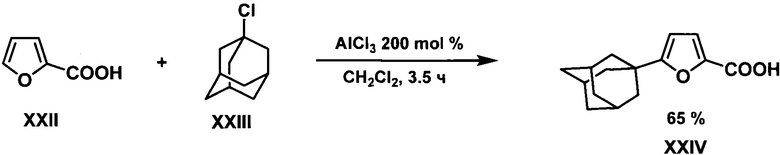
Наиболее близким к предлагаемому является способ 1-адамантилирования фуранов, реализованный на 2-фуранкарбоновой кислоте XXII, который заключается в адамантилировании 1-хлорадамантаном XXIII в среде дихлорметана в присутствии 200 мольных % трихлорида алюминия. Выход целевого продукта XIV составляет 65%. (Haruo Aikawa, Yusuke Takahira, Masahiko Yamaguchi. Synthesis of 1,8-di(1-adamantyl)naphthalenes as single enantiomers stable at ambient temperatures. Chem. Commun., 2011, 47, 1479-1481).
По сравнению с известными данный способ проще, не используются палладиевые катализаторы, специфические растворители, однако необходимо двукратное мольное количество кислоты Льюиса - хлорида алюминия.
Техническим результатом является создание простого способа получения (1-адамантил)фуранов с использованием меньшего количества катализатора, обеспечивающего более высокий выход целевых продуктов, а также возможность варьирования заместителей в фурановом кольце.
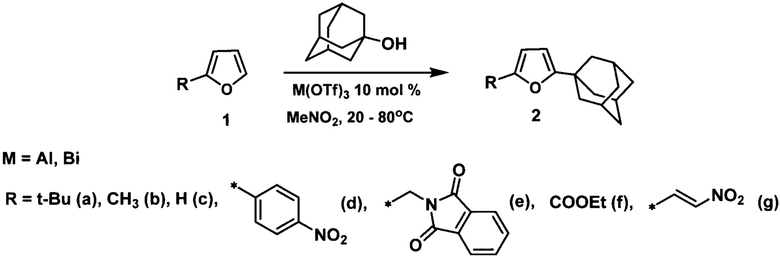
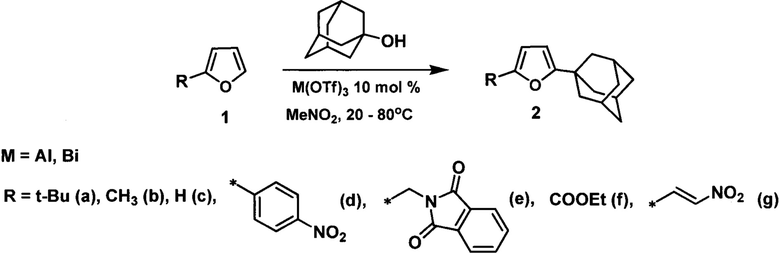
Технический результат достигается адамантилированием фуранов 1-адамантанолом в среде нитрометана в присутствии кислоты Льюиса, в качестве которой использовались трифлат алюминия или висмута в количестве 10 мольных %, в соответствии со схемой:
Выбор оптимальных условий получения адамантилированных фуранов проводили на модельной реакции 2-трет-бутилфурана с 1-адамантанолом, ход которой контролировали с использованием хромато-масс-спектрометрии.
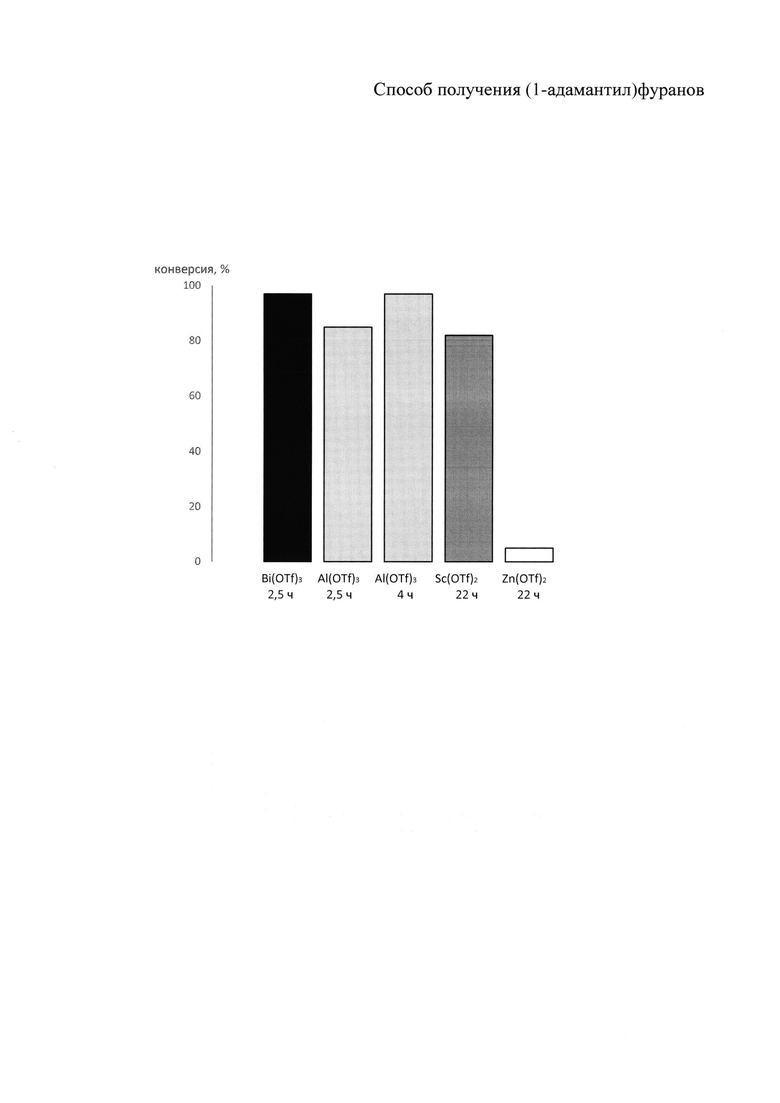
Зависимость конверсии 1-адамантанола в 2-(1-адамантил)-5-(трет-бутил)фуран от используемой кислоты Льюиса представлена на рисунке.
На чертеже представлено сравнение эффективности кислот Льюиса в реакции адамантилирования 2-трет-бутилфурана.
Как видно из чертежа, быстрее всего расходование 1-адамантанола и накопление продукта адамантилирования наблюдается в случае использования 10 мольных % трифлата висмута (97% конверсия через 2,5 ч при комнатной температуре), в то время как аналогичное количество трифлата алюминия за это же время вызывает конверсию 85%. Тем не менее, трифлат алюминия способен обеспечить конверсию 97% при перемешивании реактантов в течение 4 ч. В случае трифлата скандия конверсия 82% достигается только через 22 ч, а в случае трифлата цинка за это же время конверсия составляет всего 5%.
В отличие от прототипа в предлагаемом способе применяют катализаторы, которые используют в меньших количествах (10 мольных % по сравнению с 200 мольных % в прототипе), что делает способ более экономичным и экологичным, т.к. сокращается количество стоков, содержащих катализатор. Для снижения удельного веса катализатора целесообразней использовать трифлат алюминия, т.к. в этом случае выигрыш составляет порядка 38% за счет разницы молекулярных масс алюминия и висмута.
В зависимости от природы заместителя в фурановом кольце адамантилирование осуществляют при комнатной температуре или нагревании при 50-80°C.
Способ применим к ряду алкил-, арилфуранов, а также к фуранам содержащим функциональные группы, такие как карбэтокси, β-нитровинильная, которые наиболее перспективны для использования в синтезе биологически активных веществ.
Пример получения 2-(1-адамантил)-5-(трет-бутил)фурана 2а.
В 7 мл нитрометана вносят 0,25 г (0,00164 моль) 1-адамантанола и 0,0789 г (0,000164 моль) трифлата алюминия. В раствор прибавляют 0,2 г (0,00164 моль) 2-(трет-бутил)фурана и перемешивают при комнатной температуре 4 часа. Затем реакционную массу переносят в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяют, водный экстрагируют хлороформом (3 раза по 5 мл), объединенные хлороформные экстракты упаривают на ротационном испарителе. Остаток очищают флеш-хроматографией (элюент гексан : этилацетат 20 : 1). Выход 83%. Бесцветные кристаллы. Тпл 60-61°C.
ИК-спектр (KBr), ν/см-1: 3103 (Csp2-H), 2964, 2927, 2906, 2848 (Csp3-H), 1604, 1556 (Csp2-Csp2), 1452.
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 258 (15, М+), 243 (100).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 1.25 (с, 9Н, СН3), 1.72-1.78 (м, 6Н, СН2), 1.88-1.91 (м, 6Н, СН2), 2.01-2.06 (м., 3Н, СН), 5.76 (д, 3.2 Гц, 1H, СН), 5.81 (д, 3.2 Гц, 1H, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 28.2 (СН), 29.0 (СН3), 32.6 (С), 34.5 (С), 36.9 (СН2), 41.2 (СН2), 101.0 (СН), 101.4 (СН), 161.7 (С), 162.6 (С).
Пример получения 2-(1-адамантил)-5-метилфурана 2b.
В 7 мл нитрометана вносят 0,25 г (0,00164 моль) 1-адамантанола и 0,0789 г (0,000164 моль) трифлата алюминия. В раствор прибавляют 0,54 г (0,00656 моль) сильвана и перемешивают при комнатной температуре 4 часа. Затем реакционную массу переносят в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяют, водный экстрагируют хлороформом (3 раза по 5 мл), объединенные хлороформные экстракты упаривают на ротационном испарителе. Остаток очищают флеш-хроматографией (элюент гексан : этилацетат 20 : 1). Выход 79%.
ИК-спектр (KBr), ν/см-1: 3103 (Csp2-H), 2964, 2927, 2906, 2848 (Csp3-H), 1604, 1556 (Csp2-Csp2), 1452.
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 216 (75, М+), 159 (100), 131 (15), 122 (34).
Пример получения 2-(1-адамантил)фурана 2 с.
В 7 мл нитрометана вносят 0,25 г (0,00164 моль) 1-адамантанола и 0,0789 г (0,000164 моль) трифлата алюминия. В раствор прибавляют 0,45 г (0,00656 моль) фурана и перемешивают при комнатной температуре 4 часа. Затем реакционную массу переносят в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяют, водный экстрагируют хлороформом (3 раза по 5 мл), объединенные хлороформные экстракты упаривают на ротационном испарителе. Остаток очищают флеш-хроматографией (элюент гексан : этилацетат 20 : 1). Выход 79%. Бесцветное масло.
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 202 (71, М+), 159 (10), 145 (100), 117 (28), 108 (33).
Пример получения 2-(1-адамантил)-5-(4-нитрофенил)фурана 2d.
В 5 мл нитрометана вносят 0,1 г (0,00066 моль) 1-адамантанола и 0,031 г (0,00006 моль) трифлата алюминия. В раствор прибавляют 0,125 г (0,00066 моль) 2-(4-нитрофенил)фурана и перемешивают при 50°C 2 часа. Затем реакционную массу переносят в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 10 мл этилацетата. Органический слой отделяют, водный экстрагируют этилацетатом (3 раза по 5 мл), объединенные экстракты упаривают на ротационном испарителе. Остаток очищают флеш-хроматографией (элюент гексан : этилацетат 10 : 2). Выход 83%. Желтые кристаллы. Тпл 169-170°C.
ИК-спектр (KBr), ν/см-1: 3012 (Csp2-H), 2920, 2904, 2893, 2852 (Csp3-H), 1602, 1508 (Csp2-Csp2), 1535 (NO2 as), 1332 (NO2 sy).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 323 (100, M+), 266 (68), 229 (24), 150(14).
Спектр ЯМР 1H (399.78 МГц, CDCl3, δ, м.д.): 1.75-1.82 (м, 6Н, СН2), 1.96-1.99 (м, 6Н, СН2), 2.06-2.10 (м., 3Н, СН), 2.07-2.12 (м., 6Н, СН2), 6.08 (д, 3.2 Гц, 1Н, СН), 6.77 (д, 3.2 Гц, 1H, СН), 7.72 (м, 2Н, СН), 8.20 (м, 2Н, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 28.2 (СН), 34.9 (С), 36.7 (СН2), 41.2 (СН2), 104.8 (СН), 109.9 (СН), 123.3 (СН), 124.3 (СН), 137.0 (С), 145.8 (С), 149.4 (С), 167.0 (С).
Пример получения 2-(5-(1-адамантил)-2-фурил)метил-1Н-изоиндол-1,3-диона 2е.
В 5 мл нитрометана вносят 0,1 г (0,00066 моль) 1-адамантанола и 0,031 г (0,00006 моль) трифлата алюминия. В раствор прибавляют 0,15 г (0,00066 моль) 2-(2-фурилметил)-1Н-изоиндол-1,3-диона и перемешивают при 40°C 3 часа. Затем реакционную массу переносят в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 10 мл этилацетата. Органический слой отделяют, водный экстрагируют этилацетатом (3 раза по 5 мл), объединенные экстракты упаривают на ротационном испарителе. Остаток очищают флеш-хроматографией (элюент гексан : этилацетат 10 : 2). Выход 77%.
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 361 (96, М+), 333 (21), 267 (10), 226 (44), 157 (92), 135 (100).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 1.70-1.78 (м, 6Н, СН2), 1.85 (уш.с, 6Н, СН2), 2.00 (уш.с, 3Н, СН), 4.81 (с, 2Н, СН2), 5.81 (д, 3.2 Гц, 1H, СН), 6.21 (д, 3.2 Гц, 1H, СН), 7.67-7.73 (м, 2Н, СН), 7.82-7.88 (м, 2Н, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 28.2 (СН), 34.6 (СН2), 36.7 (СН2), 41.1 (СН2), 43.2 (С), 102,3 (СН), 108.9 (СН), 123.4 (СН), 132.2 (С), 134.0 (СН), 147.0 (С), 164.6 (С), 167.7 (С=O).
Пример получения этил 5-(1-адамантил)-2-фуроата 2f.
В 7 мл нитрометана вносят 0,25 г (0,00164 моль) 1-адамантанола и 0,0789 г (0,000164 моль) трифлата алюминия. В раствор прибавляют 0,23 г (0,00164 моль) этил 2-фуроата и перемешивают при 80°C 4 часа. Затем реакционную массу переносят в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяют, водный экстрагируют хлороформом (3 раза по 5 мл), объединенные хлороформные экстракты упаривают на ротационном испарителе. Остаток очищают флеш-хроматографией (элюент гексан : этилацетат 10 : 2). Выход 72%. Бесцветные кристаллы. Тпл 84°C.
ИК-спектр (KBr), ν/см-1: 3169, 3128 Csp2-H), 2981, 2941, 2900, 2850 (Csp3-H), 1720 (С=O).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 274 (100, М+), 229 (19), 217 (63), 180 (23).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 1.36 (т, 7 Гц, СН3, 3Н), 1.73-1.80 (м, 6Н, СН2), 1.91 (с, 3Н,), 1.93-1.98 (м., 6Н, СН2), 2.03-2.09 (м., 3Н, СН), 4.33 (кв, 7 Гц, 2Н, СН2), 6.04 (д, 3.4 Гц, 1Н, СН), 7.06 (д, 3.5 Гц, 1H, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 14.4 (СН3), 28.1 (СН), 35.0 (С), 36.5 (СН2), 41.8 (СН2), 60.5 (СН2), 104.2 (СН), 118.7 (СН), 142.7 (С), 159.0 (С), 169.0 (С=O).
Пример получения 2-(1-адамантил)-5-(2-нитровинил)фурана 2g.
В 5 мл нитрометана вносят 0,1 г (0,00066 моль) 1-адамантанола и 0,031 г (0,00006 моль) трифлата алюминия. В раствор прибавляют 0,092 г (0,00066 моль) 2-(4-нитрофенил)фурана и перемешивают при 50°C 3 часа. Затем реакционную массу переносят в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 10 мл этилацетата. Органический слой отделяют, водный экстрагируют этилацетатом (3 раза по 5 мл), объединенные экстракты упаривают на ротационном испарителе. Остаток очищают флеш-хроматографией (элюент гексан : этилацетат 10 : 2). Выход 37%. Лимонно-желтые кристаллы.
ИК-спектр (KBr), ν/см-1: 3147, 3103, 3066 (Csp2-H), 2908, 2848 (Csp3-H), 1627, 1492 (Csp2-Csp2), 1523 (NO2 as), 1330 (NO2 sy).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 273 (15, M+), 230 (37), 145 (15), 135 (100).
Спектр ЯМР 1H (399.78 МГц, CDCl3, δ, м.д.): 1.73-1.81 (м, 6Н, СН2), 1.91-1.93 (м., 6Н, СН2), 2.07 (уш.с., 3Н, СН), 6.13 (д, 3.7 Гц, 1H, СН), 6.80 (д, 3.7 Гц, 1Н, СН), 7.47 (д, 12.8 Гц, 1Н, СН), 7.70 (д, 13.2 Гц, 1H, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 28.0 (СН), 35.2 (С), 36.5 (СН2), 40.8 (СН2), 106.3 (СН), 121.9 (СН), 125.7 (СН), 133.2 (С), 144.7 (С), 170.4 (С).
Таким образом, взаимодействие 1-адамантанола с фуранами в присутствии 10 мольных % трифлата алюминия или висмута в среде нитрометана обеспечивает получение целевых (1-адамантил)фуранов с хорошим выходом, при этом используют экологичные, коммерчески доступные реагенты, что делает способ промышленно применимым.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ N-АДАМАНТИЛИРОВАННЫХ АМИДОВ | 2013 |
|
RU2549901C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ БЕТА-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ | 2012 |
|
RU2496766C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-(1-АДАМАНТИЛ)АНИЛИНА | 2014 |
|
RU2549902C1 |
| Способ получения 5-(1-адамантил)салициловой кислоты | 2023 |
|
RU2822485C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ДИБЕНЗОСУБЕРЕНИЛЬНЫЙ ФРАГМЕНТ | 2014 |
|
RU2560727C1 |
| Способ получения 1-адамантилферроцена | 2018 |
|
RU2691998C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(1-АДАМАНТИЛКАРБОНИЛ)-1,2-ДИГИДРОНАФТО[2,1-b]ФУРАНОВ | 2011 |
|
RU2495033C2 |
| Способ получения 2-гидрокси-2-((5-метилфуран-2-ил)метил)-3,3,3-трифторпропановой кислоты | 2023 |
|
RU2813205C1 |
| Способ получения тетраалкинилсиланов | 2019 |
|
RU2724877C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЛКИНИЛАДАМАНТАНОВ | 2012 |
|
RU2507189C1 |
Настоящее изобретение относится к способу получения адамантилированных фуранов, которые являются полупродуктами для тонкого органического синтеза. Способ заключается в адамантилировании фуранов 1-адамантанолом в среде нитрометана в присутствии кислоты Льюиса, в качестве которой использовались трифлат алюминия или висмута в количестве 10 мольных %, при температуре 25-80°С в течение 2-4 часов в соответствии со схемой:
Технический результат - упрощение способа за счет уменьшения количества использованного катализатора, обеспечивающего более высокий выход целевых продуктов, а также возможность варьирования заместителей в фурановом кольце. 1 ил., 7 пр.
Способ получения (1-адамантил)фуранов, включающий взаимодействие фуранов и адамантилирующего реагента в присутствии кислоты Льюиса в среде органического растворителя, отличающийся тем, что в качестве адамантилирующего реагента используют 1-адамантанол, а в качестве кислоты Льюиса берут трифлат алюминия или висмута, в количестве 10 мольных %, а реакционной средой служит нитрометан, процесс ведут при температуре 25-80°C в течение 2-4 часов.
| WO 2005080367 A1, 01.09.2005 | |||
| P.Cogolli et al., "Factors Controlling The Fate of Radical ipso Internmediates.Homolytic Alkylation of Furan Dervatives", J.Chem.Soc | |||
| Comm | |||
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
| Xiaojin Wu | |||
| et al., " A General Palladium-Catalyzed Method for Alkylation of Heteroarenes Using Secondary and Tertiary Alkyl Halides", Angew | |||
| Chem | |||
| Int.Ed., 2014, 53,49, p.13573-13577 | |||
| RU 2012144245 A, 27.04.2014 | |||
| СПОСОБ ПОЛУЧЕНИЯ 1-АЛКИНИЛАДАМАНТАНОВ | 2012 |
|
RU2507189C1 |
Авторы
Даты
2018-07-17—Публикация
2017-12-04—Подача