Предлагаемое изобретение относится к органической химии, а точнее к способам получения N-адамантилированных амидов, являющихся полупродуктами для органического синтеза.
Известные способы получения N-адамантилированных амидов основаны на реакции адамантилирующих реагентов, в качестве которых могут выступать адамантан, 1-галогенадамантаны или 1-адамантанол, с азотсодержащими соединениями - первичными амидами или нитрилами, в присутствии кислот Льюиса или Бренстеда, т.е. условиях, обеспечивающих генерирование 1-адамантильного катиона.
Известен способ получения N-(1-адамантил)ацетамида взаимодействием 1-хлорадамантана с ацетонитрилом в водной среде в присутствии марганецсодержащих катализаторов, выбранных из ряда: MnCl2, MnBr2, Mn(acac)2, Mn2(CO)10, при температуре 130°C в течение 2-3 ч, при мольном соотношении реагентов [Ad-Cl]:[CH3CN]:[H2O]:[Mn]=100:300-400:100: 3, выход целевого продукта 100% [Патент РФ 2455280, МПК C07C 231/06 (2006.01), C07C 233/06 (2006.01). Способ получения N-(1-адамантил)ацетамида / Джемилев У.М., Хуснутдинов Р.И., Щаднева Н.А., Маякова Ю.Ю., Ошнякова Т.М.; патентообладатель Учреждение Российской академии наук Институт нефтехимии и катализа РАН (RU) - №2011101002/04 заявл. 12.01.2011; опубл. 10.07.2012, Бюл. №19].
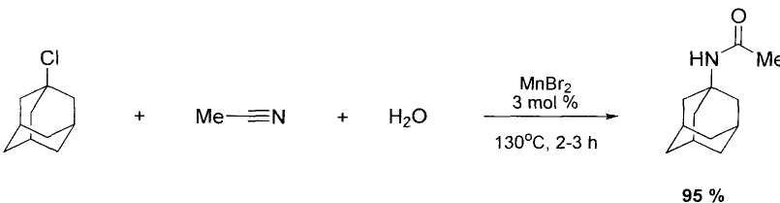
Способ является небезопасным из-за применения автоклавной техники для осуществления реакции нагревания водного раствора выше 100°C.
Известен способ получения N-адамантилированных амидов общей формулы ANHCOR (А - 1-адамантил; R - алкил, замещенный арил) в присутствии кислоты и растворителя с последующим гидролизом полученного продукта, согласно которому процесс ведут в присутствии трифторуксусной кислоты, являющейся растворителем. Отгонку непрореагировавшего нитрила и трифторуксусной кислоты осуществляют до стадии гидролиза. Процесс проводится при 50-150°C при атмосферном или избыточном давлении. Выход целевых продуктов составляет 38-88% [А.с. 914549 СССР. Способ получения вторичных амидов / Ковтун В.Ю., Плахотник В.М., Яшунский В.Г., Пенке И.Х., Ковалев В.В, Шокова Э.А МПК3 C07C 102/08. - №2648239/23-04; заявл. 18.07.78; опубл. 23.03.82. Бюл. №11].
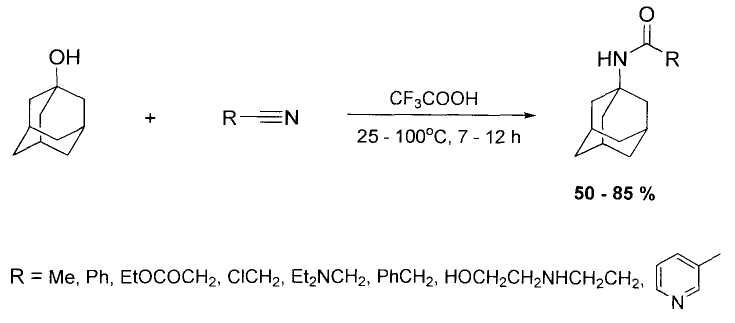
Известен способ получения различных N-адамантилированных амидов карбоновых кислот адамантилированием соответствующих первичных амидов 1-адамантанолом при кипячении в среде трифторуксусной кислоты [Е. Shokova, Tasoulla Mousoulou, Y. Luzikov, V. Kovalev. Adamantylation and Adamantylalkylation of amides, nitriles and ureas in trifluoroacetic acid. Synthesis, 1997, vol.9, p.1034-1040; Э.А. Шокова, Тусула Мусулу, Ю.Н. Лузиков, В.В. Ковалев. Адамантилирование и адамантилалкилирование амидов, нитрилов и мочевин в трифторуксусной кислоте. Журн. Орган. химии 1999, том 35, вып.6, с.869-881.]

Недостатком описанных способов является использование в качестве реакционной среды агрессивной трифторуксусной кислоты.
Известен способ получения N-адамантилированных формамида и ацетамида по реакции адамантана с синильной кислотой или ацетонитрилом соответственно в среде трифторуксусной кислоты в присутствии окислителя, в качестве которого используется тетраацетат свинца [S.R. Jones, J.M. Mellor. Introduction of bridgehed functionality via lead (IV) oxidation of hydrocarbons. Synthesis 1976, p.32-33.]
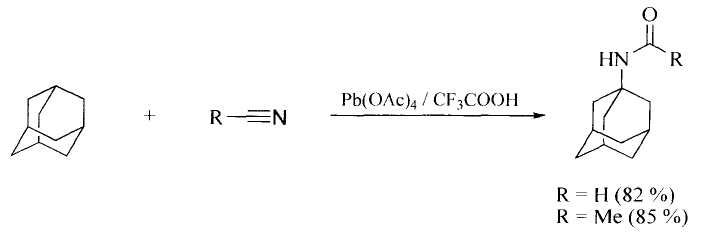
Для реализации способа требуется применение высокотоксичного реагента - тетраацетата свинца.
Наиболее близким к заявляемому способу является способ получения N-(1-адамантил)бензамида с выходом 91% посредством адамантилирования бензонитрила 1-адамантанолом в водной среде в течение 17 ч при 100°C в присутствии 20 мольных процентов кислоты Льюиса - трифлата висмута (III), взятого в качестве катализатора [Е. Callens, A.J. Burton, A.G.M. Barrett, Synthesis of amides using the Ritter reaction with bismuth triflate catalysis, Tetrahedron Letters 47 (2006) 8699-8701.], в соответствии со схемой:
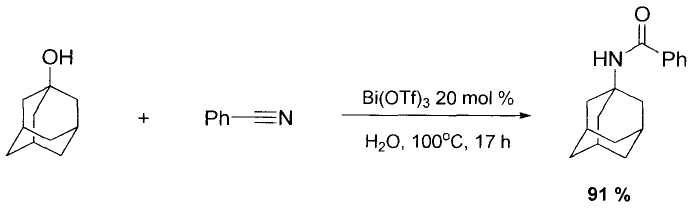
Недостатком описанного способа является использование в качестве катализатора значительных количеств - 20 мольных % трифлата висмута (III). Большая молекулярная масса катализатора - 656.19 г/моль, обуславливает неудобства, связанные со значительным удельным весом катализатора в реакционной массе. Кроме того, для достижения максимального выхода целевого продукта требуется применение сверхстехиометрческих количеств исходного азотсодержащего соединения - бензонитрила, его берут 3.8 моль на 1 моль 1-адамантанола. Способ адамантилирования описан только на одном примере, что не позволяет судить о его применимости к другим субстратам.
Техническим результатом является создание экологически безопасного и безвредного способа получения ряда N-адамантилированных амидов с использованием коммерчески доступных исходных соединений с хорошим выходом целевых продуктов при стехиометрических соотношениях реактантов.
Технический результат достигается адамантилированием 1-адамантанолом азотсодержащих соединений, в качестве которых используют первичные амиды карбоновых или сульфокислот, в присутствии кислоты Льюиса, в качестве которой использован трифлат алюминия, в количестве 5 мольных процентов, реакцию ведут в среде кипящего нитрометана при стехиометрическом соотношении реактантов, в соответствии со схемой:

Время завершения реакции определяется в каждом случае с использованием хромато-масс-спектрометрии. Выход целевых N-адамантилированных амидов составляет 48-88%.
В отличие от прототипа в предлагаемом способе применяют более удобный катализатор - трифлат алюминия, который используется в меньших количествах. Трифлат алюминия имеет молекулярную массу 474.18 г/моль и эффективен в количестве 5 мольных %, это позволяет снизить удельный вес катализатора в реакционной массе более чем на 80%, что делает способ более экономичным.
Пример получения N-(1-адамантил)формамида 3a
В 5 мл нитрометана при перемешивании и нагревании растворяли 0.250 г (0.00164 моль) 1-адамантанола. В раствор вносили 0.074 г (0.00164 моль) формамида и 0.039 г (0.000082 моль) трифлата алюминия. Реакционную массу перемешивали при кипении растворителя в течение 8 часов. После окончания реакции смесь переносили в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяли, растворитель отгоняли на ротационном испарителе. Остаток очищали флеш-хроматографией на силикагеле, проводя элюирование хлороформом. Выход 68%. Т.пл. 139-141°C.
ИК-спектр (KBr), ν/см-1: 3186, 3089 (N-H), 2914, 2899, 2850 (Csp3-H), 1693 (C=O), 1604, 1514 (C=C), 1541 (NH).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 179 (33, M+), 122 (100), 92 (21), 79(12), 67(8).
Пример получения N-(1-адамантил)ацетамида 3b
В 5 мл нитрометана при перемешивании и нагревании растворяли 0.250 г (0.00164 моль) 1-адамантанола. В раствор вносили 0.097 г (0.00164 моль) ацетамида, растворенного в 2 мл нитрометана и 0.039 г (0.000082 моль) трифлата алюминия. Реакционную массу перемешивали при кипении растворителя в течение 6 часов. После окончания реакции смесь переносили в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяли, упаривали на ротационном испарителе. Остаток кристаллизовали из водного этанола (5:3 по объему). Выход 72%. Т.пл. 146.7-147.5°C.
ИК-спектр (KBr), ν/см-1: 3315, 3061 (N-H), 2974, 2941, 2899, 2848(Csp3-Н), 1674, 1649 (C=O), 1627 (C-N), 1541 (NH).
Спектр ЯМР 1H (399.78 МГц, CDCl3, δ, м.д.): 1.61-1.68 (м, 6Н, СН2), 1.91 (с, 3Н, СН3), 1.98-2.01 (м., 6Н, СН2), 2.04-2.09 (м., 3H, СН), 5.26 (уш.с, 1Н, NH).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.72 (СН3), 29.42 (СН), 36.36 (СН2), 41.61 (СН2), 51.83 (С), 169.29 (С=О).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 193 (45, М+), 136 (100), 94 (43).
Пример получения N-(1-адамантил)акриламида 3c
В 5 мл нитрометана при перемешивании и нагревании растворяли 0.250 г (0.00164 моль) 1-адамантанола. В раствор вносили 0.116 г (0.00164 моль) акриламида, растворенного в 2 мл нитрометана, и 0.039 г (0.000082 моль) трифлата алюминия. Реакционную массу перемешивали при кипении растворителя в течение 6 часов. После окончания реакции смесь переносили в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяли, упаривали, на ротационном испарителе. Остаток очищали флеш-хроматографией на силикагеле, проводя элюирование смесью гексан: этилацетат (10:2 по объему). Выход 73%. Т.пл. 143-146°C.
ИК-спектр (KBr), ν/см-1: 3251, 3068 (N-H), 3028 (Csp2-H), 2962, 2904, 2893, 2854 (Csp3-H), 1655 (C=O+C=C), 1616 (C-N), 1558 (NH).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 1.64-1.69 (м, 6H, СН2), 2.00-2.09 (м, 9H, CH2+CH), 5.30 (уш.с, 1H, NH), 5.52 (д, 1.6 Гц, 0.5Н), 5.54 (д, 1.6 Гц, 0.5Н), 5.97-6.04 (м, 1Н), 6.17 (1.6 Гц, 0.5Н), 6.21 (1.6 Гц, 0.5Н).
Спектр ЯМР 13C (CDCl3), δ, м.д.: 29.36 (СН), 36.28 (СН2), 41.52 (СН2), 52.00 (С), 125.45 (СН2), 132.14 (СН), 164.47 (C=O).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 205 (26, М+), 148 (100), 94 (32).
Пример получения N-(1-адамантил)бензамида 3d
В 5 мл нитрометана при перемешивании и нагревании растворяли 0.250 г (0.00164 моль) 1-адамантанола. В раствор вносили 0.199 г (0.00164 моль) бензамида, растворенного в 2 мл нитрометана, и 0.039 г (0.000082 моль) трифлата алюминия. Реакционную массу перемешивали при кипении растворителя в течение 6 часов. После окончания реакции смесь переносили в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяли, растворитель отгоняли на ротационном испарителе. Остаток очищали флеш-хроматографией на силикагеле, проводя элюирование хлороформом. Выход 88%. Т.пл. 148-150°C.
ИК-спектр (KBr), ν/см-1: 3327 (N-H), 3078, 3057, 3026 (Csp2-H), 2916, 2904, 2848, (Csp3-H), 1635 (C=O), 1598, 1577 (C=C), 1531 (NH), 1253 (C-N).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 1.55-1.64 (уш.м, 6H, СН2), 1.96-2.05 (уш.м, 3H, CH+6H, CH2), 5.83 (уш.с, 1H, NH) 7.23-7.35 (м, 3H), 7.55-7.61 (м, 2Н).
Спектр ЯМР 13C (CDCl3), δ, м.д.: 29.42 (CH), 36.30 (CH2), 41.58 (CH2), 52.18 (C), 126.63 (CH), 128.33 (CH), 130.91 (CH), 135.93 (C), 166.53 (C=O).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 225 (39, М+), 198 (100), 105 (94), 77 (50).
Пример получения N-(1-адамантил)-4-нитробензамида 3e
В 5 мл нитрометана при перемешивании и нагревании растворяли 0.250 г (0.00164 моль) 1-адамантанола. В раствор вносили 0.272 г (0.00164 моль) 4-нитробензамида, растворенного в 2 мл нитрометана, и 0.039 г (0.000082 моль) трифлата алюминия. Реакционную массу перемешивали при нагревании (110°C) в течение 6 часов. После окончания реакции смесь переносили в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяли, растворитель отгоняли на роторном испарителе. Остаток растворяли в хлороформе. Кристаллизовали из водного этанола (4:5 по объему). Выход 48%. Т.пл. 190-192°C.
ИК-спектр (KBr), ν/см-1: 3340 (N-H), 3104, 3075, 3049 (Csp2-H), 2950, 2911, 2850, (Csp3-H), 1635 (C=O), 1598, 1577 (C=C), 1531 (NH), 1253 (C-N).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 1.74 (уш.м, 6H, CH2), 2.14 (уш.м, 3H, CH+6H, CH2), 5.88 (уш.с, 1H, NH) 7.85-7.89 (м, 2H), 7.24-7.27 (м, 2H).
Спектр ЯМР 13C (CDCl3), δ, м.д.: 29.45 (CH), 36.26 (CH2), 41.54 (CH2), 53.01 (C), 123.720, 127.95 (CH), 141.65 (C), 149.29 (C), 164.60 (C=O).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 300 (31, М+), 243 (100), 207 (8), 150 (38), 120 (14), 92 (24).
Пример получения этил 1-адамантилкарбамата 3f
В 5 мл нитрометана при перемешивании и нагревании растворяли 0.250 г (0.00164 моль) 1-адамантанола. В раствор вносили 0.146 г (0.00164 моль) уретана, растворенного в 2 мл нитрометана, и 0.039 г (0.000082 моль) трифлата алюминия. Реакционную массу перемешивали при нагревании (110°C) в течение 6 часов. После окончания реакции растворитель отгоняли на роторном испарителе. Остаток растворяли в хлороформе. Разделение смеси проводили с помощью флеш-хроматографии, элюент гексан : этилацетат (10:2 по объему). Выход 74%. Т.пл. - 90,2-90,8°C.
ИК-спектр (KBr), ν/см-1: 3336, 3305 (N-H), 2981, 2904, 2848, (Csp3-H), 1635 (С=О), 1598, 1577 (С=С), 1531 (NH), 1253 (C-N).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.):1.20 (m, 7 Гц, 3H, СН3), 1.63-1.65 (м, 6Н, СН2), 1.89-1.92 (м, 6Н, CH2), 2.03-2.05 (м, 3H, CH), 4.05 (кв, 13.6 Гц, 2H, CH2), 4.49 (уш.с, 1H, NH).
Спектр ЯМР 13C (CDCl3), δ, м.д.: 14.57 (CH3), 29.39 (CH), 36.27 (CH2), 41.83 (CH2), 50.52 (CH2), 59.90 (C), 154.53 (C=O).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 223 (80, М+), 166 (100), 138 (75), 135 (22), 120 (47), 94 (16).
Пример получения N-(1-адамантил)-4-толилсульфамида 3g
В 5 мл нитрометана при перемешивании и нагревании растворяли 0.250 г (0,00082 моль) адамантанола. В раствор вносили 0.281 г (0.00164 моль) 4-толилсульфамида, растворенного в 2 мл нитрометана, и 0.039 г (0.000082 моль) трифлата алюминия. Реакционную массу перемешивали при нагревании (110°C) в течение 4 часов. После окончания реакции смесь переносили в делительную воронку, содержащую 20 мл 2 М соляной кислоты и 5 мл хлороформа. Органический слой отделяли, растворитель отгоняли на роторном испарителе. Остаток растворяли в хлороформе. Разделение смеси проводили с помощью флеш-хроматографии, элюент гексан: этилацетат (10:2 по объему). Выход 70%. Т.пл. 166-167°C.
ИК-спектр (KBr), ν/см-1: 3292 (N-H), 3068, 3057, 3030 (Csp2-H), 2910, 2887, 2848, (Csp3-H), 1597, 1492 (C=C), 1531 (NH), 1363, 1153 (S=O), 1255 (C-N).
Спектр ЯМР 1H (399.78 МГц, ((CD3)2SO), δ, м.д.): 1.40-1.53 (уш.м, 6H, CH2), 1.65-1.67 (уш.м, 6Н, СН2), 1.86-1.91 (уш.м, 3H, CH), 2.35 (с, 3H, CH3), 7.32-7.34 (м, 2H), 7.42 (уш.с, 1H, NH), 7.69-7.71 (м, 2Н).
Спектр ЯМР 13C ((CD3)2SO), δ, м.д.: 20.92 (CH3), 28.84 (CH2), 35.52 (CH), 42.41 (CH2), 53.60 (C), 126.12 (CH), 129.33 (CH), 141.79 (C), 142.23 (C).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 305 (36, М+), 248 (48), 155 (31), 94 (33), 93 (100), 91 (80), 41 (31).
Таким образом, взаимодействие 1-адамантанола с первичными амидами карбоновых или сульфокислот в присутствии 5 мольных % трифлата алюминия в среде нитрометана обеспечивает получение целевых N-адамантилированных амидов с хорошим выходом, при этом применяют экологичные, практически безвредные, коммерчески доступные реагенты, что делает способ промышленно применимым.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения (1-адамантил)фуранов | 2017 |
|
RU2661482C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-(1-АДАМАНТИЛ)АНИЛИНА | 2014 |
|
RU2549902C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ БЕТА-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ | 2012 |
|
RU2496766C1 |
| Способ получения 5-(1-адамантил)салициловой кислоты | 2023 |
|
RU2822485C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЛКИНИЛАДАМАНТАНОВ | 2012 |
|
RU2507189C1 |
| Способ получения 1-адамантилферроцена | 2018 |
|
RU2691998C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ДИБЕНЗОСУБЕРЕНИЛЬНЫЙ ФРАГМЕНТ | 2014 |
|
RU2560727C1 |
| Способ получения тетраалкинилсиланов | 2019 |
|
RU2724877C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АМИНОЗАМЕЩЕННЫХ 1-(1-АДАМАНТИЛ)-3,4-ДИНИТРО-1Н-ПИРАЗОЛОВ | 2013 |
|
RU2533557C1 |
| Способ получения 1-адамантилацетальдегида | 2015 |
|
RU2612956C1 |
Предлагаемое изобретение относится к органической химии, а точнее к способам получения N-адамантилированных амидов, являющихся полупродуктами для органического синтеза. Способ осуществляют путем адамантилирования 1-адамантанолом азотсодержащих соединений в присутствии кислоты Льюиса, в качестве которой берут трифлат алюминия, в количестве 5 мольных %, в среде кипящего нитрометана при стехиометрическом соотношении реактантов. В качестве азотсодержащих соединений используют первичные амиды карбоновых кислот или первичные амиды сульфокислот. Технический результат - получение целевых соединений с хорошим выходом, применяя экологичные и коммерчески доступные реагенты. 2 з.п. ф-лы, 7 пр.
1. Способ получения N-адамантилированных амидов путем адамантилирования 1-адамантанолом азотсодержащих соединений в присутствии катализатора - кислоты Льюиса, отличающийся тем, что в качестве исходных азотсодержащих соединений используют первичные амиды кислот, процесс осуществляют при стехиометрическом соотношении реактантов в присутствии кислоты Льюиса - трифлата алюминия, взятой в количестве 5 мольных %.
2. Способ по п.1 отличающийся тем, что в качестве азотсодержащих соединений используют первичные амиды карбоновых кислот.
3. Способ по п.1 отличающийся тем, что в качестве азотсодержащих соединений используют первичные амиды сульфокислот.
| EMMANUEL CALLENS et al.: "Synthesis of amides using the Ritter reaction with bismuth triflate catalysis", TETRAHEDRON LETTERS, 2006, vol.47, p.8699-8701 | |||
| ШОКОВА Э.А | |||
| и др.: "Адамантилирование и адамантилалкилирование амидов, нитрилов и мочевин в трифторуксусной кислоте", Журнал Органической Химии, 1999, т.35, вып.6, стр.869-881 | |||
| СПОСОБ ПОЛУЧЕНИЯ 1-ФОРМАМИДО-3,5-ДИМЕТИЛАДАМАНТАНА | 2007 |
|
RU2455281C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕМАНТИНА И ПРОМЕЖУТОЧНОГО ПРОДУКТА | 2009 |
|
RU2478611C2 |
| Шланговое соединение | 0 |
|
SU88A1 |
Авторы
Даты
2015-05-10—Публикация
2013-12-30—Подача