Область, к которой относится изобретение
Настоящее изобретение относится к области иммуноанализов, а более конкретно к способам увеличения чувствительности иммуноанализа, проводимого в целях определения амилоидных бета-пептидов в биологических жидкостях.
Предшествующий уровень техники
Болезнь Альцгеймера (БА) представляет собой прогрессирующее денегеративное заболевание центральной нервной системы, характеризующееся прогрессирующей и нарастающей потерей памяти с последующим нарушением функционирования двигательных функций конечностей и всего организма и, в конечном счете, летальным исходом. Это заболевание, очевидно, является наиболее распространенной причиной развития деменции, которая наблюдается у 1-6% населения в возрасте от 65 лет и выше и у 10-20% населения в возрасте свыше 80 лет.
БА отличается от деменции других типов несколькими патологическими признаками, включая прогрессирующее образование сенильных бляшек во внеклеточном пространстве между нейронами головного мозга пациентов. В сердцевине бляшек образуются амилоидные отложения, образованные, главным образом, пептидными фибриллами, состоящими из 40-42 аминокислот и называемыми амилоидным β-пептидом (Αβ), который окружен дегенерированными нейритами и глиальными клетками. Такой пептид образуется в результате протеолитического процессинга белка-предшественника, называемого белком-предшественником β-амилоида (βΑΡΡ).
БА может быть классифицирована в соответствии с возрастным проявлением этого заболевания, то есть, в более раннем возрасте (до 60 лет) и в более позднем возрасте (в возрасте более 60 лет) и с аутосомно-доминантным наследованием, то есть, как наследственная или спорадическая БА. Рано проявляющиеся наследственные формы БА могут быть ассоциированы с известной мутацией в генах, кодирующих βΑΡΡ, пресенилин 1 и пресенилин 2 (и расположенных, соответственно, на хромосомах 21, 14 и 1). Эти классификации не являются взаимно исключающими. Наиболее часто встречающимися формами являются спорадические формы, проявляющиеся в более позднем возрасте.
В клинической практике, диагноз БА ставят по клиническим критериям, исходя из присутствия типичных клинических признаков и исключения деменции других типов с применением методов нейровизуализации и анализов крови. Достоверность диагноза, поставленного на основе этих критериев, является приемлемой, хотя в соответствии с исследованиями, проводимыми после аутопсии головного мозга, было установлено, что 10-20% пациентов с диагностированной БА страдали и другим заболеванием. Кроме того, современные методы диагностики могут быть осуществлены лишь в том случае, когда нейродегенеративный процесс является уже настолько запущенным, что пациент страдает несколькими формами деменции, а поражение головного мозга является настолько обширным, что это ограничивает выбор терапевтических мер. Для окончательного диагноза необходимо патолого-анатомическое исследование ткани головного мозга.
Принимая во внимание тот факт, что Αβ аккумулируется в головном мозге пациентов с БА и является центральным элементом в патогенезе БА, следует отметить, что этот белок рассматривается как наиболее подходящий кандидат на его использование в качестве биомаркера БА. Однако использование Αβ в качестве биомаркера БА, присутствующего в плазме, связано с проблемой, заключающейся в том, что концентрации пептидов Αβ (Αβ(1-40) и Αβ(1-42)) в сыворотке являются крайне низкими, а поэтому пока не существует анализов, которые обладали бы чувствительностью, достаточной для осуществления надежного детектирования указанных пептидных молекул.
Для определения уровней амилоидных бета-пептидов в биологических образцах было проведено множество различных анализов (см., например, методы, описанные Scheuner et al. (Nature Med., 1996, 2:864-870); Tamaoka A et al. (J. Neurol. Sci., 1996, 141, 65-68); Suzuki, N. et al. (Science, 1994, 264: 1336-1340); WO200722015, Vanderstichele H et al. (Amyloid, 2000, 7, 245-258); Fukomoto y col. (Arch. Neurol. 2003, 60, 958-964); Mehta et al. (Arch. Neurol. 57, 2000, 100-105); Mayeux, R. et al. (Ann Neurol. 1999, 46, 412-416); Lanz, T.A. and Schacthter, J.B. (J. Neuroscience Methods, 2006, 157:71-81), и в WO200750359, WO0162801, WO0315617, WO0246237, WO0413172. Однако все ELISA-анализы, известные в настоящее время, имеют низкий предел детектирования, по всей вероятности, не входящий в интервал однозначных значений пг/мл, который является достаточным для детектирования Αβ40 и Αβ42 в CSF, а также для детектирования указанных молекул в плазме пациентов, страдающих наследственной БА, и являются непригодными для детектирования Αβ42 в плазме пациентов, страдающих спорадической БА, при которой концентрация Αβ42 в плазме является гораздо более низкой.
До настоящего времени, анализы, проводимые, лишь на один пептид Αβ, имеют предел детектирования ниже однозначных значений в интервале пг/мл, как описано в WO200646644 и WO2009015696.
В WO200646644 описан электрохемилюминесцентный (ЭХЛ) «сэндвич»-анализ, где mAb 21F12 (распознающее аминокислоты 33-42 Αβ42) связывают с магнитными сферами, которые затем используются для захвата пептида Αβ42 в образце, содержащем Αβ42, и подвергают контактированию с mAb 3D6, связанным с комплексом рутения. Затем количество связанного антитела 3D6 детектируют по люминесцентному излучению, испускаемому комплексом рутения при сообщении ему электрической энергии. Применение такого анализа позволяет авторам настоящего изобретения детектировать по меньшей мере 0,5 пг/мл стандартного Αβ42. Однако если тот же самый анализ применить для сравнения Αβ42 в пробах плазмы у пациентов с БА и у здоровых пациентов, то какого-либо значимого различия между пациентами этих двух групп может не наблюдаться, в результате чего авторы настоящего изобретения пришли к выводу, что количество интактного Αβ42 в сыворотке является очень низким, из-за его деградации, и вернулись к конкурентному ELISA-анализу с использованием mAb 21F12, который дает меньший уровень чувствительности в диапазоне значений порядка нг/мл.
В WO2009015696 описан высокочувствительный ELISA-«сэндвич»-анализ, в котором детектируемое антитело подвергают контактированию с меченным биотином реагентом, специфичным к указанному антителу. Этот реагент подвергают контактированию со стрептавидином, связанным с пероксидазой. Затем детектируют пероксидазную активность колориметрическим методом с использованием реагента TMB или флуоресцентным методом с использованием QuantaBlue.
В WO2006053251 описан метод определения молекул амилоидного бета-пептида в образце, где указанный метод включает контактирование образца с денатурирующим агентом, экстрагирование пептидного пула из смеси «образец-денатурирующий агент», отделение молекул амилоидного бета-пептида от указанного пула и определение количества молекул амилоидного бета-пептида. Этот метод требует проведения стадии разделения пептидов до их определения, что увеличивает время осуществления этого метода и затраты на его проведение.
Поэтому необходимо разработать усовершенствованные иммунологические анализы и получить наборы для детектирования пептидов, происходящих от Αβ, что позволит решить проблемы, связанные с применением известных методов и наборов, а в частности разработать анализы и наборы с чувствительностью, достаточной для надежного детектирования Αβ-пептидов в плазме пациентов, страдающих спорадической БА.
Описание сущности изобретения
В своем первом аспекте, настоящее изобретение относится к способу диагностики нейродегенеративного заболевания у индивидуума, детектирования состояния, предшествующего нейродегенеративному заболеванию, или дифференциации нейродегенеративного заболевания от состояния, предшествующего указанному нейродегенеративному заболеванию, где указанный способ включает стадии:
(i) определения одного или нескольких параметров, выбранных из группы, состоящей из:
(a) уровня одного или нескольких свободных амилоидных бета-пептидов в биологическом образце указанного индивидуума;
(b) уровней агрегатов одного или нескольких свободных амилоидных пептидов в биологическом образце указанного индивидуума и указанных одного или нескольких амилоидных бета-пептидов, ассоциированных с макромолекулярными компонентами, присутствующими в указанном биологическом образце, где указанные уровни агрегатов определяют путем оценки количества указанных одного или нескольких амилоидных бета-пептидов в бесклеточной фракции указанного образца после контактирования указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидного бета-пептида или амилоидных бета-пептидов из компонентов, присутствующих в биологическом образце,
(c) уровня одного или нескольких амилоидных бета-пептидов, ассоциированных с клетками в биологическом образце указанного индивидуума, где указанный уровень определяют путем выделения клеточной фракции указанного биологического образца, контактирования указанной клеточной фракции указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидного бета-пептида или амилоидных бета-пептидов из клеток, присутствующих в указанном образце;
(ii) сравнения величины по меньшей мере одного из параметров (b) или (c), или величины параметра, вычисленного путем арифметического комбинирования по меньшей мере двух параметров (a)-(c) с эталонной величиной, соответствующей величине указанных параметров (b) или (c) или указанного вычисленного параметра в эталонном образце; и
(iii) диагностики нейродегенеративного заболевания; детектирования состояния, предшествующего нейродегенеративному заболеванию; или дифференциации нейродегенеративного заболевания от состояния, предшествующего указанному нейродегенеративному заболеванию, в случае, если наблюдается изменение величины параметра или величины вычисленного параметра по сравнению с эталонной величиной.
В своем втором аспекте, настоящее изобретение относится к набору для определения амилоидных бета-пептидов в биологическом образце, где указанный набор включает:
(i) белок-солюбилизирующий агент и
(ii) по меньшей мере антитело против амилоидного бета-пептида.
Краткое описание графического материала
Фигура 1: A-F. Построенные по точкам кривые измерений для (A) UP Αβ1-40, (B) DP Αβ1-40, (C) CBAβ1-40, (D) UP Αβ1-42, (E) DP Αβ1-42 и (F) CB Αβ1-42, полученных в двух независимых лабораториях (Lab1 и Lab2). Большинство точек находится близко от линии конкордации, что указывает на значимую и почти точную степень соответствия измерений. На каждом графике во вставке внизу справа указан коэффициент корреляции и конкордации (ССС) и 95% доверительные интервалы.
Фигура 2: Прямые маркеры Αβ1-40 (A), Αβ1-42 (B) и вычисленные маркеры Αβ1-40 и Αβ1-42 (C). A. Концентрации (пг/мл) свободного Αβ1-40 в сыворотке (FP), уровни общих Αβ1-40 в плазме (включая свободные Αβ1-40 и Αβ1-40, связанные с компонентами плазмы) (TP) и Αβ1-40, связанного с клетками (CB) у здоровых контрольных индивидуумов (HC), у пациентов, страдающих слабым нарушением познавательных способностей (MCI), и у пациентов, страдающих болезнью Альцгеймера (БА). В. Концентрации (пг/мл) свободного Αβ1-42 в сыворотке (FP), общих уровней Αβ1-42 в плазме (включая свободные Αβ1-42 и Αβ1-42, связанные с компонентами плазмы) (TP) и Αβ1-42, связанного с клетками (CB) у здоровых контрольных индивидуумов (HC), у пациентов, страдающих слабым нарушением познавательных способностей (MCI), и у пациентов, страдающих болезнью Альцгеймера (БА). C. Величины, пг/мл, для агрегированного общего Αβ1-40 в плазме (полученного при контактировании пробы плазмы с белок-солюбилизирующим агентом) плюс связанного с клетками Αβ1-40 (TP+CB Αβ1-40), общего Αβ1-42 в плазме (полученного при контактировании пробы плазмы с белок-солюбилизирующим агентом) плюс связанного с клетками Αβ1-42 (TP+CB Αβ1-42), или величины агрегированных TP+CB Αβ1-40 и Αβ1-42 (TP+CB Αβ1-42). H, M и A означают значимые величины (p<0,05) для здоровых контрольных (ЗК) индивидуумов, для пациентов со слабым нарушением познавательных способностей (MCI) и для пациентов с БА, соответственно. * означает p<0,01.
Фигура 3: A-F. Построенные по точкам кривые величин (A) DP Αβ1-40, (B) CB Αβ1-40, (C) UP Αβ1-42, (D) DP Αβ1-42, (E) T40 и (F) Τ-βΑΡΒ для ЗК-индивидуумов, пациентов с MCI и пациентов с БА. Цифры со * означают величины, полученные для отдельных пациентов в группах MCI и БА, которые, для точности представления, не даны в том же масштабе на оси ординат. Горизонтальная линия представляет граничные величины, полученные для пациентов с MCI и ЗК-индивидуумов.
Фигура 4: ROC-кривая для маркера lab40 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,510.
Фигура 5: ROC-кривая для маркера 2ab40 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,778.
Фигура 6: ROC-кривая для маркера 3ab40 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,458.
Фигура 7: ROC-кривая для маркера lab42 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,576.
Фигура 8: ROC-кривая для маркера 2ab42 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,667.
Фигура 9: ROC-кривая для маркера 3ab42 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,744.
Фигура 10: ROC-кривая для маркера 3ab42 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,508.
Фигура 11: ROC-кривая для маркеров 2ab40+3ab40 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,830.
Фигура 12: ROC-кривая для маркеров 2ab42+3ab42 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,713.
Фигура 13: ROC-кривая для маркеров 2ab42+3ab42 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,777.
Фигура 14: ROC-кривая для маркеров 2ab40+3ab40+2ab42+3ab42 у пациентов с MCI/HC. Площадь под ROC-кривой = 0,848.
Подробное описание изобретения
Авторами настоящего изобретения было неожиданно обнаружено, что разведение плазмы буфером для образцов приводит к увеличению детектируемых уровней Αβ1-40 и Αβ1-42. Не ограничиваясь какой-либо теорией, можно отметить, что такое разведение плазмы приводит к изменению ионной силы и молекулярных взаимодействий с образцом с последующим высвобождением Αβ1-40 и Αβ1-42, связанных с белками и другими компонентами плазмы.
Таким образом, увеличение значений, измеренных после разведения плазмы, может быть обусловлено детектированием Αβ-пептидов, высвобождаемых из белков и других компонентов плазмы, и может быть истолковано как величина общего уровня Αβ в плазме.
В любом случае, эти результаты показывают, что уровни Αβ-пептида в крови гораздо выше, чем уровни, которые могли бы быть получены путем простого анализа в неразведенной плазме. Полное определение общих уровней βΑΡΒ в крови должно включать количественную оценку свободных пептидов в плазме, пептидов, связанных с белками плазмы, и пептидов, связанных с клетками крови. Такая исчерпывающая количественная оценка различных компонентов βΑΡΒ позволит более точно измерить уровни Αβ в крови и дает возможность лучше понять сложный механизм регуляции Αβ-пептидов у здорового и больного человека. Кроме того, уровни указанных пулов амилоидных бета-пептидов, а также величина некоторых вычисленных параметров, полученных в результате арифметического сложения концентраций различных пулов и концентраций свободных амилоидных бета-пептидов, могут быть использованы для того, чтобы определить, страдает ли пациент нейродегенеративным заболеванием или состоянием, предшествующим нейродегенеративному заболеванию, и для того, чтобы дифференцировать нейродегенеративное заболевание от состояния, предшествующего указанному нейродегенеративному заболеванию.
Диагностический способ согласно изобретению
Таким образом, в своем первом аспекте, настоящее изобретение относится к способу диагностики нейродегенеративного заболевания у индивидуума, детектирования состояния, предшествующего нейродегенеративному заболеванию, или дифференциации нейродегенеративного заболевания от состояния, предшествующего указанному нейродегенеративному заболеванию, где указанный способ включает стадии:
(i) определения одного или нескольких параметров, выбранных из группы, состоящей из:
(a) уровня одного или нескольких свободных амилоидных бета-пептидов в биологическом образце указанного индивидуума;
(b) уровней агрегатов одного или нескольких свободных амилоидных пептидов в биологическом образце указанного индивидуума и указанных одного или нескольких амилоидных бета-пептидов, ассоциированных с макромолекулярными компонентами, присутствующими в биологическом образце, где указанные уровни агрегатов определяют путем оценки количества указанных одного или нескольких амилоидных бета-пептидов в бесклеточной фракции указанного образца после контактирования указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидного бета-пептида или амилоидных бета-пептидов из компонентов, присутствующих в биологическом образце;
(c) уровня одного или нескольких амилоидных бета-пептидов, ассоциированных с клетками в биологическом образце указанного индивидуума, где указанный уровень определяют путем выделения клеточной фракции указанного биологического образца, контактирования указанной клеточной фракции указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидного бета-пептида или амилоидных бета-пептидов из клеток, присутствующих в указанном образце; и
(ii) сравнения величины по меньшей мере одного из параметров (b) или (c), или величины параметра, вычисленного путем арифметического комбинирования по меньшей мере двух параметров (a)-(c), с эталонной величиной, соответствующей величине указанных параметров (b) или (c), или указанного вычисленного параметра в эталонном образце; и
(iii) диагностики нейродегенеративного заболевания, детектирования состояния, предшествующего нейродегенеративному заболеванию, или дифференциации нейродегенеративного заболевания от состояния, предшествующего указанному нейродегенеративному заболеванию, в случае, если наблюдается изменение величины параметра или величины вычисленного параметра по сравнению с эталонной величиной.
Используемый здесь термин «диагноз» включает оценку предрасположенности индивидуума к развитию заболевания, определения наличия заболевания у индивидуума, а также прогноз исхода заболевания у индивидуума, страдающего этим заболеванием. Как известно специалистам в данной области, установление такого диагноза у индивидуума обычно не может быть точным на 100%, хотя, предпочтительно, чтобы он был точным. Однако под этим термином подразумевается, что статистически значимая группа индивидуумов может быть идентифицирована как индивидуумы, страдающие данным заболеванием или имеющие предрасположенность к данному заболеванию. Если эта группа является статистически значимой, то она может быть легко определена специалистом с применением нескольких хорошо известных методов статистической оценки, например путем определения доверительных интервалов и р-величин, применения т-критерия Стьюдента, критерия Манна-Уитни и т.п. Подробное описание приводится в публикациях Dowdy and Wearden, Statistics for Research, John Wiley & Sons, New York 1983. Предпочтительные доверительные интервалы составляют по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%. Величины p, предпочтительно, составляют 0,2, 0,1 или 0,05.
Используемый здесь термин «индивидуум» относится ко всем животным, классифицированным как млекопитающие, включая, но не ограничиваясь ими, домашних и сельскохозяйственных животных, приматов и человека, например людей, приматов, за исключением человека, коров, лошадей, свиней, овец, коз, собак, кошек или грызунов. Предпочтительным индивидуумом является человек, то есть, мужчина или женщина любого возраста или расы.
Используемый здесь термин «нейродегенеративное заболевание» означает состояние или расстройство, при котором происходит потеря нейронных клеток в результате их гибели, что приводит к ухудшению когнитивной функции или к поражению, или дисфункции нервной системы, или к осложнениям, которые могут характеризоваться как неврологические, нейродегенеративные, физиологические, психические или поведенческие расстройства. Подходящими нейродегенеративными заболеваниями, которые могут быть диагностированы способами согласно изобретению, являются, но не ограничиваются ими, возрастная дегенерация желтого пятна; болезнь Крейцфельда-Якоба; болезнь Альцгеймера; деменция, вызываемая лучевой терапией; повреждение аксонов; острая диссеминированная депрессия, вызываемая дисфункцией коры головного мозга, альфа-синуклеинопатия, ишемия головного мозга, болезнь Гентингтона, перманентная фокальная ишемия коры головного мозга, регенерация периферических нервов, модель постэпилептического статуса, повреждение спинного мозга, спорадический боковой амиотрофический склероз и трансмиссивная губчатая энцефалопатия.
В предпочтительном варианте изобретения, нейродегенеративным заболеванием является болезнь Альцгеймера. Термин «болезнь Альцгеймера» (или «сенильная деменция») означает психическое заболевание, ассоциированное со специфическим дегенеративным заболеванием головного мозга, которое характеризуется наличием сенильных бляшек, нейритных клубков и прогрессирующей потерей нейронов и клинически проявляется прогрессирующей потерей памяти, спутанностью сознания, поведенческими расстройствами, недееспособностью, постепенным ухудшением физического состояния и в конечном счете приводит к летальному исходу. Пациенты, страдающие болезнью Альцгеймера, были идентифицированы с применением критерия NINCDS-ADRDA (по шкале CDR = 1, по шкале MMSE от 16 до 24 баллов и атрофия медиального участка височной области (как было определено по МРТ) >3 баллов по шкале Шелтена).
Используемый здесь термин «стадия, предшествующая нейродегенеративному заболеванию» означает состояние, которое может быть определено как переходное от состояния, наблюдающееся у нормального индивидуума, к состоянию, определяемому как нейродегенеративное расстройство, и которое характеризуется наличием некоторых признаков и симптомов нейродегенеративных расстройств или подгруппы признаков и симптомов, наблюдаемых у пациентов, страдающих нейродегенеративным расстройством. В предпочтительном варианте изобретения, стадией, предшествующей указанному нейродегенеративному заболеванию, является слабое нарушение познавательных способностей (далее обозначаемое MCI), которое означает переходную стадию от нарушения познавательной способности при естественном старении к ранней стадии болезни Альцгеймера. Пациентов обычно идентифицируют, как пациентов, страдающих MCI, если они удовлетворяют клиническому критерию Майо (CDR = 0,5, что указывает на атрофию медиального участка височной области (определяемой по МРТ), и эта оценка на 3 пункта выше оценки по шкале Шелтена, что указывает на картину гипометаболизма в теменной и/или в височной области, определяемой с помощью позитронно-эмиссионной томографии, проводимой с использованием 18-фтордезоксиглюкозы (PET-FDG)) (предположительно, БА).
Термин «дифференциация нейродегенеративного заболевания от стадии, предшествующей нейродегенеративному заболеванию» означает возможность отличить пациента, имеющего состояние, предшествующее нейродегенеративному заболеванию, или состояние в продромальном периоде указанного заболевания, от пациента, уже страдающего этим заболеванием. В конкретном случае, где нейродегенеративным заболеванием является болезнь Альцгеймера, способ согласно изобретению позволяет дифференцировать болезнь Альцгеймера от продромальной стадии указанного заболевания, известного как слабое нарушение познавательных способностей (MCI).
В своей первой стадии, способ согласно изобретению включает определение по меньшей мере одного параметра, выбранного из группы, состоящей из:
(a) уровня одного или нескольких свободных амилоидных бета-пептидов в биологическом образце указанного индивидуума;
(b) уровней агрегатов одного или нескольких свободных амилоидных пептидов в биологическом образце указанного индивидуума и указанных одного или нескольких амилоидных бета-пептидов, ассоциированных с макромолекулярными компонентами, присутствующими в указанном биологическом образце, где указанные уровни агрегатов определяют путем оценки количества указанных одного или нескольких амилоидных бета-пептидов в бесклеточной фракции указанного образца после контактирования указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидного бета-пептида или амилоидных бета-пептидов из компонентов, присутствующих в биологическом образце;
(c) уровня одного или нескольких амилоидных бета-пептидов, ассоциированных с клетками в биологическом образце указанного индивидуума, где указанный уровень определяют путем выделения клеточной фракции указанного биологического образца, контактирования указанной клеточной фракции указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидного бета-пептида или амилоидных бета-пептидов из клеток, присутствующих в указанном образце.
Используемый здесь термин «амилоидный бета-пептид» является синонимом термина «A-бета», «Абета», «бета-AP», «A-бета-пептид» или «Αβ-пептид» и означает семейство пептидов, которые являются основными химическими составляющими сенильных бляшек и сосудистых амилоидных отложений (амилоидная ангиопатия), присутствующих в головном мозге пациентов с болезнью Альцгеймера (БА), пациентов с синдромом Дауна и пациентов, страдающих наследственным кровоизлиянием в головной мозг, ассоциированным с амилоидозом голландского типа (HCHWA-D). Амилоидные бета-пептиды представляют собой фрагменты белка-предшественника бета-амилоида (APP), который содержит различное число аминокислот, обычно 38-43 аминокислот.
Амилоидные бета-пептиды обычно обозначают как «Αβ (x-y)», где x означает число аминокислот у амино-конца амилоидного бета-пептида, а y означает число аминокислот у карбокси-конца. Так, например, Αβ(1-40) представляет собой амилоидный бета-пептид, амино-конец которого начинается в положении 1 аминокислотной последовательности, а карбокси-конец заканчивается в положении 40 аминокислотной последовательности, где указанная последовательность представлена SEQ ID NO:l. Примерами амилоидных бета-пептидов, которые могут быть определены способом согласно изобретению, являются, но не ограничиваются ими, Αβ(1-38) (SEQ ID NO:2), Αβ(1-39) (SEQ ID NO:3), Αβ(1-40) (SEQ ID ΝΟ:1), Αβ(1-41) (SEQ ID NO:4), Αβ(1-42) (SEQ ID NO:5), Αβ(1-43) (SEQ ID NO:6), Αβ(11-42) (SEQ ID NO:7), Αβ(3-40) (SEQ ID NO:8), Αβ(3-42) (SEQ ID NO:9), Αβ (4-42) (SEQ ID NO:10), Αβ(6-42) (SEQ ID NO:11), Αβ(7-42) (SEQ ID NO:12), A13(8-42) (SEQ ID NO:13), Αβ(9-42) (SEQ ID NO:14), Αβ(x-40), Αβ(x-42) и Αβ (x-38), a также все амилоидные бета-пептиды, которые относятся ко множеству видов амилоидных бета-пептидов, где отдельные виды являются неидентифицированными. В предпочтительных вариантах изобретения, амилоидными бета-пептидами, которые могут быть детектированы способом согласно изобретению, являются Αβ(1-40) и Αβ(1-42).
Используемый здесь термин «Αβ(1-42)» означает пептид, который состоит из 42 аминокислот, соответствующих аминокислотам 672-713 (SEQ ID NO:5) APP, и который получают путем последовательного протеолитического расщепления белка-предшественника амилоида (SEQ ID NO:15) под действием β- и γ-секретаз.
Используемый здесь термин «Αβ(1-40)» означает пептид, который состоит из 40 аминокислот, соответствующих аминокислотам 672-711 (SEQ ID NO:1), и который получают путем последовательного протеолитического расщепления белка-предшественника амилоида (SEQ ID NO:15) под действием β- и γ-секретаз.
Используемый в настоящем изобретении термин «биологический образец» включает (1) биологические жидкости, такие как цельная кровь, сыворотка, плазма, моча, лимфа, слюна, сперма, мокрота, слезы, слизь, пот, молоко, экстракты головного мозга и цереброспинальная жидкость; (2) компоненты крови, такие как плазма, сыворотка, клетки крови и тромбоциты; (3) экстракты, полученные из твердых тканей или органов, таких как головной мозг; и (4) экстракты, полученные из культур клеточных линий или первичных клеток человека или животного, таких как первичные нейроны человека и первичные нейроны, выделенные у трансгенных мышей, несущих гены APP человека, например клетки PDAPP, выделенные у трансгенного животного (например, мыши), а также клеточная линия почек человека 293, клеточная линия нейроглиомы человека, клеточная линия HeLa человека, первичная эндотелиальная клеточная линия (например, клетки HUVEC), первичная линия фибробластов человека или первичная линия лимфобластов (включая эндогенные клетки, происходящие от пациентов с APP-мутациями), первичная смешанная клеточная культура головного мозга человека (включая нейроны, астроциты и нейроглиальные клетки) или клеточная линия яичника китайского хомячка (CHO). Способы согласно изобретению являются особенно подходящими для измерения Αβ в пробе крови человека или животного, не являющегося человеком, такой как цельная кровь, плазма или образец, содержащий любые компоненты крови в любых количествах.
Термин «цельная кровь» означает кровь, взятую у человека или животного и содержащую клеточные компоненты и жидкий компонент. Цельная кровь может храниться в свернувшемся состоянии или в не свернувшемся состоянии. Термин «цельная кровь» также включает кровь, в которой часть клеточных компонентов или все клеточные компоненты, такие как лейкоциты или эритроциты, были подвергнуты лизису.
Термин «плазма» означает жидкий компонент цельной крови. В зависимости от применяемого метода разделения в плазме могут полностью отсутствовать клеточные компоненты, либо плазма может содержать различное количество тромбоцитов и/или небольшое количество других клеточных компонентов.
Термин «сыворотка» означает плазму, в которой отсутствует фактор свертывания крови, такой как белок фибриноген, и другие факторы свертывания крови.
Используемый здесь термин «свободный амилоидный бета-пептид» означает амилоидные бета-пептиды, которые не ассоциируются с любым компонентом биологического образца и которые являются легкодоступными для связывания со специфическим антителом. Этот пептид может быть определен стандартными иммунологическими методами путем контактирования биологического образца с антителом, специфичным к указанному пептиду. В предпочтительном варианте изобретения, уровень свободного амилоидного пептида определяют в плазме.
Используемый здесь термин «амилоидный бета-пептид, ассоциированный с макромолекулярными компонентами» означает амилоидный бета-пептид, который нековалентно связан с молекулами или присоединен к молекулам, присутствующим в исследуемом биологическом образце. Этот пептид обычно является труднодоступным для иммунологического детектирования, а поэтому для отделения этого пептида от компонентов требуется предварительная обработка такого биологического образца. В этих условиях, амилоидный бета-пептид, связанный с макромолекулярными компонентами, будет высвобождаться из указанных компонентов и будет доступным для иммунологического детектирования специфическими антителами. Поскольку биологический образец уже содержит некоторое количество свободного амилоидного бета-пептида, то общее количество свободного амилоидного пептида после контактирования образца с белок-солюбилизирующим агентом будет включать определенный уровень агрегатов такого обычно присутствующего свободного амилоидного бета-пептида и амилоидного бета-пептида, высвобождаемого после обработки белок-солюбилизирующим агентом. В случае, если необходимо определить уровень амилоидного бета-пептида, ассоциированного с макромолекулярными компонентами в биологическом образце, то это может быть осуществлено путем определения уровня свободного амилоидного бета-пептида до обработки белок-солюбилизирующм агентом и уровня свободного амилоидного бета-пептида после обработки белок-солюбилизирующм агентом и вычитания первой величины из второй величины. В целях осуществления настоящего изобретения обычно определяют уровень агрегированных свободных амилоидных бета-пептидов, который включает уровень обычно присутствующих свободных амилоидных бета-пептидов, а также уровень амилоидных бета-пептидов, высвобождаемых из макромолекулярных компонентов после обработки белок-солюбилизирующим агентом. Поэтому параметр, который обычно определяют в случае обработки образца в целях диссоциации амилоидного пептида из макромолекулярных компонентов, представляет собой сумму количества свободного пептида, присутствующего в образце, и пептида, ассоциированного с макромолекулярными компонентами.
Макромолекулярные компоненты образца, которые могут связываться с амилоидными бета-пептидами и которые могут составлять пул амилоидных бета-пептидов, ассоциированных с макромолекулярными компонентами, включают оба белка, а также пептиды. В конкретном случае осуществления этого способа на пробах крови или плазмы, макромолекулярными компонентами являются, но не ограничиваются ими, белки и липиды крови. Репрезентативными белками крови являются альбумин, иммуноглобулин G, иммуноглобулин E, иммуноглобулин M, иммуноглобулин A, фибриноген (фибрин и продукты их разложения), антитрипсин альфа-1, преальбумин, кислотный гликопротеин альфа-1, фетопротеин альфа-1, гаптоглобин альфа-2, макроглобулин, церулоплазмин, трансферрин, C3/C4-бета-2-микроглобулин, бета-липопротеин, альфа-, бета- и гамма-глобулины, C-реактивный белок (CRP), протромбин, тироксин-связывающий белок, транстиретин и т.п. Репрезентативными липидами крови являются свободные жирные кислоты, холестерин, триглицериды, фосфолипиды, сфинголипиды и т.п. Количество амилоидного бета-пептида, ассоциированного с макромолекулярными компонентами, может быть определено посредством контактирования бесклеточного биологического образца с белок-солюбилизирующим агентом в условиях, подходящих для индуцирования высвобождения указанных амилоидных бета-пептидов из макромолекулярных компонентов.
В настоящем описании, под термином «контактирование» подразумевается добавление к данному образцу достаточного количества раствора, содержащего белок-солюбилизирующий агент, такого, чтобы концентрация белок-солюбилизирующего агента в полученной смеси была достаточной для эффективной солюбилизации амилоидного бета-пептида, который связывается с белками и клетками в данном образце. При этом, предпочтительно, чтобы указанный белок-солюбилизирующий агент присутствовал в буферном растворе в количестве, которое не вызывало бы значительного изменения рН образца.
Используемый здесь термин «белок-солюбилизирующий агент» означает любое соединение определенного состава, способное изменять вторичную, третичную и/или четвертичную структуру полипептидов при сохранении их первичной структуры. Что касается свойств указанных белок-солюбилизирующих агентов, то эти агенты обладают способностью повышать растворимость белков в данном образце, а также предотвращать межмолекулярную и внутримолекулярную агрегацию белков. Белок-солюбилизирующими агентами, подходящими для использования в настоящем изобретении, являются, но не ограничиваются ими, детергенты, хаотропные агенты, восстановители или их смеси.
Используемый здесь термин «детергент», в основном, является синонимом термина «поверхностно-активное вещество» и означает амфипатические поверхностно-активные вещества, которые, при их добавлении в жидкость, снижают поверхностное натяжение в жидкости по сравнению с поверхностным натяжением той же самой жидкости, в которой данный детергент отсутствует. Детергенты также могут предотвращать агрегацию белков и неспецифическое взаимодействие или связывание с примесями, загрязняющими представляющей интерес белок. Детергентами, подходящими для использования в настоящем изобретении, являются, но не ограничиваются ими, неионогенные (нейтральные), анионогенные, катионогенные или цвиттерионные детергенты.
Примерами неионогенных или нейтральных детергентов являются, но не ограничиваются ими, детергенты серии Твин, такие как твин® 20, твин® 21, твин® 40, твин® 60, твин® 61, твин® 65, твин® 80, твин® 81, твин® 85, детергенты серии Span®, такие как Span® 20; детергенты серии тергитолов, такие как тергитол типа 15-S-12; детергенты серии Brij®, такие как Brij® 35, Brij® 56, Brij® 72, Brij® 76, Brij® 92V, Brij® 97, Brij® 58P; детергенты серии твин, такие как твин® 20, твин® 21, твин® 40, твин® 60, твин® 61, твин® 65, твин® 80, твин® 81, твин® 85; детергенты серии тритон®, такие как тритон® X-100, тритон® X-114, тритон® CF-21, тритон® CF-32, тритон® DF-12, тритон® DF-16, тритон® GR-5M, тритон® X-102, тритон® X-l5, тритон® X-151, тритон® X-207, тритон® X-165, тритон® X-305, тритон® X-405, тритон® X-45, тритон® X-705-70 или неионогенный консервативный вариант по меньшей мере одного из указанных детергентов.
Примерами анионогенных детергентов являются, но не ограничиваются ими, холевая кислота и ее производные, таурохолевая кислота, тритон X-200, тритон W-30, тритон-30, тритон-770, диоктилсульфосукцинат, N-оксид N5N-диметилдодециламина, 1-алкилсульфонаты натрия, N-лауроилсаркозин или соли жирных кислот.
Примерами катионогенных детергентов являются, но не ограничиваются ими, моно- и диметиламины жирных кислот, соли алкилтриметиламмония, соли диалкилдиметиламмония, ацетаты алкиламина, ацетаты триалкиламмония, соли алкилдиметилбензиламмония, соли диалкилметилбензиламмония, галогенид алкилпиридиния и соли алкил(алкил-замещенного)пиридиния, соли алкилтиометилпиридиния, соли алкиламидометилпиридиния, соли алкилхинолиния, соли алкилизохинолиния, соли N,N-алкилметилпирролидиния, соли 1,1-диалкилпиперидиния, соли 4,4-диалкилтиаморфолиния, соли 1-оксида 4,4-диалкилтиаморфолиния, метилсульфат метил-бис(алкилэтил)-2-алкилимидазолиния (и другие соли), метилсульфат метилбис(алкиламидоэтил)-2-гидроксиэтиламмония (и другие соли), соли алкиламидопропил-диметилбензиламмония, соли карбоксиалкил-алкилдиметиламмония, оксиды алкиламина, оксиды алкилдиметиламина, соли поли(винилметилпиридиния), соли поли(винилпиридина), полиэтиленимины, бикарбонаты триалкилфосфония (и другие соли), соли триалкилметилфосфония, соли алкилэтилметилсульфония и соли алкилдиметилсульфоксония.
Примерами цвиттерионных детергентов являются, но не ограничиваются ими, 3-[(3-холамидопропил)диметиламмиак]-1-пропансульфонат (CHAPS); 3-[(3-холамидопропил)диметиламмиак]-2-гидрокси-1-пропансульфонат (CHAPSO); N-(алкил-C10-C16)-N,N-диметилглицин-бетаин (EMPIGEN BB); каприлилсульфобетаин (SB3- 10); 3-[N,N-диметил(3-миристоиламинопропил)аммиак]пропансульфонат (амидосульфобетаин-14; ASB-14); N-тетрадецил-N,N-диметил-3-аммиак-1-пропансульфонат (3-14-детергент; ZWITTERGENT); N-додецил-N,N'-диметил-3-аммиак-1-пропансульфонат; N-октадецил-N,N-диметил-3-аммиак-1-пропансульфонат; N-децил-N,N-диметил-3-аммоний-1-пропансульфонат; миратаин CB; миратаин BB; миратаин CBR; миратаин ACS; миракар 2MHT и миракар 2MCA.
В предпочтительном варианте изобретения, белок-солюбилизирующим реагентом является детергент. В еще более предпочтительном варианте изобретения, указанным детергентом является Твин 20. В еще более предпочтительном варианте изобретения, Твин 20 используют в концентрации 0,5%.
Используемый здесь термин «хаотропный агент» означает соединение или смесь соединений, которые расщепляют водородные связи и нарушают гидрофобные взаимодействия между белками и внутри белков. Хаотропные агенты, используемые в высоких концентрациях, разрушают вторичную структуру белка и образуют белки в растворе, которые сами не являются растворимыми. Подходящими хаотропными агентами являются, но не ограничиваются ими, мочевина, изотиоцианат гуанидиния, тиоцианат натрия (NaSCN), гуанидин-HCl, хлорид гуанидиния, тиоцианат гуанидиния, тетрахлорацетат лития, перхлорат натрия, тетрахлорацетат рубидия, иодид калия или трифторацетат цезия.
Используемый здесь термин «восстановитель» означает любое соединение или вещество, которое сохраняет сульфгидрильные группы в восстановленном состоянии и восстанавливает внутримолекулярные или межмолекулярные дисульфидные связи. Так, например, восстановителями, подходящими для их применения в способе согласно изобретению, являются сульфгидрильные или фосфиновые восстановители. Примерами сульфгидрильных восстановителей являются дитиотреитол (DTT), дитиоэритрит (DTE) и β-меркаптоэтанол. Примерами фосфиновых восстановителей являются трибутилфосфин (TBP) и трис-карбоксиэтилфосфин (TCEP).
Обычно биологический образец сначала подвергают обработке для удаления клеточной фракции. Затем бесклеточный образец подвергают контактированию с белок-солюбилизирующим агентом. В предпочтительном варианте изобретения, образец разводят буфером, содержащим белок-солюбилизирующий агент. Обычно образец 5-кратно разводят в буферном растворе, содержащем Твин 20.
Используемый здесь термин «буферный раствор» означает любое вещество или смесь соединений в растворе, которые обладают способностью нейтрализовать кислоты и основания, но при этом не оказывают значительного влияния на исходную кислотность или основность раствора. Подходящими буферными растворами, используемыми в способе согласно изобретению, являются, но не ограничиваются ими, буферный раствор триса, фосфатно-буферный раствор, боратно-буферный раствор, карбонатно-буферный раствор, буферный раствор, содержащий глицин-гидроксид натрия, или т.п. Предпочтительным буферным раствором является фосфатно-буферный раствор, такой как забуференный фосфатом физиологический раствор или PBS.
Количество раствора, содержащего белок-солюбилизирующий агент, который добавляют к биологическому образцу, не имеет решающего значения при условии, что будет достигаться достаточный уровень диссоциации амилоидного бета-пептида. Так, например, биологическая жидкость может быть разведена в растворе, содержащем белок-солюбилизирующий агент при разведении по меньшей мере 1/2 (об./об.), 1/3 (об./об.), 1/4 (об./об.), 1/5 (об./об.), 1/6 (об./об.), 1/7 (об./об.), 1/8 (об./об.), 1/9 (об./об.), 1/10 (об./об.), 1/20 (об./об.), 1/50 (об./об.), 1/60 (об./об.), 1/80 (об./об.), 1/90 (об./об.), 1/100 (об./об.) или более. Специалистам известно, что может быть использована любая комбинация указанных белок-солюбилизирующих агентов в указанной степени разведения при условии, что конечная концентрация белок-солюбилизирующего агента будет адекватной для достижения нужного эффекта. Так, например, раствор, содержащий белок-солюбилизирующий агент, может включать указанный(е) выбранный(е) белок-солюбилизирующий(е) агент(ы) в концентрации от 0,001% до 0,5% (мас./об.). После разведения в указанном растворе, содержащем белок-солюбилизирующий агент, указанная биологическая жидкость обычно содержит указанное(ые) поверхностно-активное(ые) вещество(а) в концентрации менее чем 0,1% (мас./об.), предпочтительно, менее чем 0,6% (мас./об.), более предпочтительно, не более чем 0,5% (мас./об.), наиболее предпочтительно, не более чем 0,45% (мас./об.) и еще более предпочтительно, 0,5%.
Буферными системами, подходящими для использования в настоящем изобретении, являются трис-HCl-буферы, включая соль, такую как NaCl или KCl, и необязательно, BSA. Конкретными буферными системами являются, но не ограничиваются ими:
50 мМ трис-HCl, pH 8, 0,5M NaCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 0,5M NaCl, 0,05%; BSA, 0,05% твин-20, 1M GuHCl;
50 мМ трис-HCl, pH 8, 0,5M KCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 0,5M KCl, 0,05%; BSA, 0,05% твин-20, 1M GuHCl;
50 мМ трис-HCl, pH 8, 0,5M NaCl, 0,05%; BSA, 0,05% твин-80;
50 мМ трис-HCl, pH 8, 0,5M KCl, 0,05%; BSA, 0,05% твин-80;
50 мМ трис-HCl, pH 8, 0,5M NaCl; 0,05%; BSA, 0,05% тритон X-100
50 мМ трис-HCl, pH 8, 0,5M KCl, 0,05%; BSA, 0,05% тритон X-100;
50 мМ трис-HCl, pH 8; 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 0,5M NaCl, 0,1%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 0,5M NaCl, 0,05%; BSA, 0,1% твин-20;
50 мМ трис-HCl, pH 8, 0,5M NaCl, 0,1%; BSA, 0,1% твин-20;
50 мМ трис-HCl, pH 8, 1M NaCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 1,5M NaCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 2M NaCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 2,5M NaCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 3M NaCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 0,5M NaCl, 0,05%; BSA, 0,05% твин-20, 10% ДМСО;
50 мМ трис-HCl, pH 8, 0,5M NaCl, 0,05%; BSA, 0,05% твин-20, 0,5 M GuHCl;
50 мМ трис-HCl, pH 6, 0,5M NaCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 7, 0,5M NaCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 9, 0,5M NaCl, 0,05%; BSA, 0,05% твин-20;
50 мМ трис-HCl, pH 8, 0,5M NaCl, 0,05%; BSA.
Так, например, если в качестве белок-солюбилизирующего агента используется твин 20, то, предпочтительно, его концентрация составляет 0,004-0,02%, а более предпочтительно, 0,005-0,01% (мас./об.).
Стадию контактирования, предпочтительно, осуществляют при низкой температуре для ингибирования активности протеолитических ферментов, присутствующих в образце. Подходящими температурами являются температуры примерно 0-10°C, предпочтительно, примерно 3-5°C, например, примерно, 4°C.
После контактирования биологической жидкости с раствором, содержащим белок-солюбилизирующий агент, обе жидкости могут быть смешаны. Смешивание может быть осуществлено путем перемешивания, предпочтительно, встряхивания, более предпочтительно, высокоскоростного встряхивания, а наиболее предпочтительно, вихревого встряхивания, в течение по меньшей мере 5 секунд, предпочтительно, по меньшей мере в течение 10 секунд, а более предпочтительно, по меньшей мере в течение 15 секунд (например, 15-50 секунд). Предпочтительная скорость указанного смешивания, перемешивания, встряхивания, высокоскоростного встряхивания или вихревого встряхивания составляет по меньшей мере 250 об/мин, предпочтительно, по меньшей мере 500 об/мин, более предпочтительно, по меньшей мере 1000 об/мин, а наиболее предпочтительно, примерно 2000-2500 об/мин.
Стадию контактирования осуществляют в условиях, подходящих для достижения частичной или, предпочтительно, полной диссоциации амилоидного бета-пептида из белка и липидов, присутствующих в биологическом образце. Такие условия могут быть адекватно определены средним специалистом в данной области путем мониторинга количества амилоидного бета-пептида, которое может быть детектировано до проведения стадии контактирования, и которое может постепенно увеличиваться в различные периоды времени после стадии контактирования. Время проведения эксперимента может быть определено, как описано в примере, представленном в экспериментальной части.
Специалисту в данной области известно, что если уровень амилоидного бета-пептида определяют путем разведения биологического образца буфером, содержащим белок-солюбилизирующий агент, то уровень свободного амилоидного бета-пептида, определенный иммунологическим методом, корректируют с учетом коэффициента, применяемого ранее разведения биологического образца.
Таким образом, в предпочтительном варианте изобретения, параметром, определяемым на стадии (i) способа согласно изобретению, являются один или несколько параметров, выбранных из группы, состоящей из уровня свободного пептида ABETA40 в биологическом образце, взятом у указанного индивидуума (обозначаемом далее 1ab40 или UP Αβ(1-40)), уровня агрегатов свободного пептида ABETA40 в биологическом образце, и пептида ABETA40, ассоциированного с компонентами указанного биологического образца, полученного как описано выше (далее обозначаемого 2ab40 или DP Αβ(1-40)), уровня свободного пептида ABETA42 в биологическом образце (далее обозначаемого 1ab42 или UP Αβ(1-42)), и уровней агрегатов свободного пептида ABETA42 в биологическом образце, и пептида ABETA42, ассоциированного с компонентами указанного биологического образца, полученного, как описано выше (далее обозначаемого 2ab42 или DP Αβ(1-42)).
Используемый здесь термин «амилоидный бета-пептид, ассоциированный с клетками» означает амилоидный бета-пептид, который нековалентно связан с поверхностью клеток, присутствующих в биологическом образце, и который не способен связываться с антителами, добавляемыми в образец, а поэтому он является иммунологически недетектируемым. Обычно, если биологическим образцом является кровь, то амилоидный бета-пептид ассоциирован с эритроцитами, лейкоцитами, включая нейтрофилы, эозинофилы, базофилы, лимфоциты и моноциты, и с тромбоцитами.
Может быть определено количество амилоидного бета-пептида, ассоциированного с клетками в данном образце, и эта величина может быть использована отдельно или в комбинации с другими параметрами, относящимися к амилоидным бета-пептидам, применяемым в способах согласно изобретению. Для этой цели сначала необходимо выделить клеточную фракцию из биологического образца. Это может быть осуществлено с применением любого метода, известного специалистам, такого как центрифугирование, седиментация, фильтрация и т.п. После выделения клеточной фракции из биологического образца клетки подвергают контактированию с белок-солюбилизирующим агентом.
Подходящими белок-солюбилизирующими агентами являются детергенты, хаотропные агенты и восстановители, определенные выше, и обычно используемые в буферном растворе в соответствующей концентрации. Подходящие агенты, буферные растворы и концентрации агентов в буферном растворе описаны выше. Стадию контактирования осуществляют, в основном, как описано выше в способе высвобождения амилоидного пептида, связанного с компонентами (белками и липидами) биологического образца. В предпочтительном варианте изобретения, указанным белок-солюбилизирующим агентом является детергент. В еще более предпочтительном варианте изобретения, указанным детергентом является твин 20. Подходящие концентрации твина 20, используемого в качестве белок-солюбилизирующего агента, определены выше и составляют 0,004-0,02%, а более предпочтительно, 0,005-0,01% (мас./об.).
Стадию контактирования, предпочтительно, осуществляют при низкой температуре для ингибирования активности протеолитических ферментов, присутствующих в образце. Подходящие температуры составляют примерно 0-10°C, предпочтительно, примерно 3-5°C, например примерно 4°C.
Обычно, стадию контактирования осуществляют путем ресуспендирования клеточной фракции в биологическом образце с раствором, содержащим белок-солюбилизирующий агент. Указанное ресуспендирование может быть осуществлено путем осторожного пипетирования путем забора и выпуска, путем перемешивания, предпочтительно, встряхивания, более предпочтительно, высокоскоростного встряхивания, а наиболее предпочтительно, вихревого встряхивания, в течение по меньшей мере 5 секунд, предпочтительно, по меньшей мере в течение 10 секунд, а более предпочтительно, по меньшей мере в течение 15 секунд (например, 15-50 секунд). Предпочтительная скорость указанного смешивания, перемешивания, встряхивания, высокоскоростного встряхивания или вихревого встряхивания составляет по меньшей мере 250 об/мин, предпочтительно, по меньшей мере 500 об/мин, более предпочтительно, по меньшей мере 1000 об/мин, а наиболее предпочтительно, примерно 2000-2500 об/мин.
Стадию контактирования осуществляют в условиях, подходящих для достижения частичной или, предпочтительно, полной диссоциации амилоидного бета-пептида из клеток, присутствующих в биологическом образце. Такие условия могут быть адекватно определены средним специалистом в данной области путем мониторинга количества амилоидного бета-пептида, которое может быть детектировано до проведения стадии контактирования, и которое может постепенно увеличиваться в различные периоды времени после стадии контактирования. Время проведения эксперимента может быть определено, как описано в примере в экспериментальной части.
Таким образом, в предпочтительном варианте изобретения, параметром, определяемым на стадии (i) способа согласно изобретению, являются один или несколько параметров, выбранных из группы, состоящей из уровня ABETA40, ассоциированного с клетками, присутствующими в биологическом образце (обозначаемом далее 3ab40 или СВ Αβ(1-40)), и уровня ABETA40, ассоциированного с клетками, присутствующими в биологическом образце (далее обозначаемого 3ab42 или СВ Αβ(1-42)).
Нижеследующая стадия способа согласно изобретению включает сравнение величины по меньшей мере одного из параметров (b) или (c) или величины параметра, вычисленного путем арифметического комбинирования одного или нескольких параметров (a)-(c) с эталонной величиной, соответствующей величине указанных параметров (b) или (c) или указанного вычисленного параметра в эталонном образце, где (a), (b) и (c) определены, как подробно описано выше, и соответствуют уровню свободного амилоидного бета-пептида в биологическом образце указанного индивидуума, соответственно (a), уровням агрегатов свободного амилоидного пептида в биологическом образце, взятом у указанного индивидуума, и уровням указанного амилоидного бета-пептида, ассоциированного с макромолекулярными компонентами, присутствующими в указанном биологическом образце (b), а также уровню амилоидного бета-пептида, ассоциированного с клетками в биологическом образце, взятом у указанного индивидуума (c).
Параметрами, используемыми на стадии (ii) способа согласно изобретению, являются любые прямые параметры, то есть, параметры, которые могут быть определены прямым способом, описанным выше, и которые соответствуют параметрам, ранее определенным как 2ab40, 3ab40, 2ab42 и 3ab42. Альтернативно, вычисленный параметр может быть также получен с помощью арифметической комбинации одного или нескольких прямых параметров. Практически, вычисленные параметры с диагностическим значением могут быть получены путем любого арифметического комбинирования двух или более параметров, включая сложение, вычитание, умножение, деление и их комбинации. Конкретными вычисленными маркерами, используемыми в способе согласно изобретению, являются, но не ограничиваются ими, 2ab40/2ab42, 3ab40/3ab42, 2ab40/3ab40, 2ab42/3ab42, 1ab40+2ab40, 1ab40+3ab40, 2ab40+3ab40, 1ab40+2ab40+3ab40, 1ab42+2ab42, 1ab42+3ab42, 2ab42+3ab42, 1ab42+2ab42+3ab42, 1ab40+2ab40+1ab42+2ab42, 1ab40+3ab40+1ab42+3ab42, 2ab40+3ab40+2ab42+3ab42, 1ab40+2ab40+3ab40+1ab42+2ab42+3ab42, (1ab40+2ab40)/(1ab42+2ab42), (1ab40+3ab40)/(1ab42+3ab42), (2ab40+3ab40)/(2ab42+3ab42), (1ab40+2ab40+3ab40)/(1ab42+2ab42+3ab42), (1ab42+2ab42)/(1ab40+2ab40), (1ab42+3ab42)/(1ab40+3ab40), (2ab42+3ab42)/(2ab40+3ab40), (1ab42+2ab42+3ab42)/(1ab40+2ab40+3ab40), 2ab40-1ab40, 2ab42-1ab42 и (2ab40-1ab40)/(2ab42-1ab42). В предпочтительном варианте изобретения, вычисленный параметр получают путем сложения параметров 2ab40 и 3ab40 (далее обозначаемых T40). В другом предпочтительном варианте изобретения, вычисленный параметр получают путем сложения параметров 2ab42 и 3ab42 (далее обозначаемых T42). В еще одном предпочтительном варианте изобретения, вычисленный параметр получают путем сложения параметров 2ab40, 3ab40, 2ab42 и 3ab42 (далее обозначаемых Τ-βΑΡΒ).
Используемый здесь термин «эталонная величина» означает величину параметра, который используется для сравнения и который был определен у индивидуума, не страдающего нейродегенеративным заболеванием, или у индивидуума, у которого в анамнезе отсутствует какое-либо нейродегенеративное заболевание. Предпочтительно, индивидуумами, от которых были получены эталонные величины для различных параметров и вычисленных параметров, являются пациенты, у которых отсутствовали жалобы на потерю памяти, наблюдалось нормальное поведение, на что указывали нейропсихологические тесты, и отсутствовали структурные изменения по МРТ.
В частности, были выбраны эталонные величины, которые соответствовали чувствительности выше 85% и специфичности выше 75%. В другом предпочтительном варианте изобретения, эталонные величины отбирают так, чтобы они соответствовали чувствительности выше 70% и специфичности выше 70%. Предпочтительно, эталонные величины позволяют сделать прогноз с точностью по меньшей мере 80%.
На стадии (iii) способа согласно изобретению, диагноз нейродегенеративного заболевания, определение стадии, предшествующей нейродегенеративному заболеванию, или дифференциация нейродегенеративного заболевания от стадии, предшествующей нейродегенеративному заболеванию, осуществляют с использованием конкретной серии маркеров или вычисленных маркеров, которые дают достаточно адекватные уровни специфичности и чувствительности. Таким образом, в конкретном примере, диагноз нейродегенеративного заболевания ставят путем сравнения величины параметра, выбранного из группы, состоящей из 3ab40 и 2ab42, или величины вычисленного параметра, выбранного из группы, состоящей из 2ab40+3ab40 и 2ab40+3ab40+2ab42+3ab42.
В другом конкретном варианте изобретения, детектирование стадии заболевания, предшествующей нейродегенеративному заболеванию, осуществляют путем сравнения величины параметра, выбранного из группы, состоящей из 2ab40, 3ab40 и 2ab42, или величины вычисленного параметра, выбранного из группы, состоящей из 2ab40+3ab40, 2ab40+3ab40+2ab42+3ab42, 1ab40+2ab40+3ab40+1ab42+2ab42+3ab42, 1ab40+2ab40+3ab40, 1ab42+2ab42+3ab42, 1ab40+1ab42+2ab42+3ab42, 1ab40+2ab40+1ab42+2ab42 и 1ab40+3ab40+1ab42+3ab42.
В другом варианте изобретения, дифференциацию нейродегенеративного заболевания от стадии заболевания, предшествующего указанному нейродегенеративному заболеванию, осуществляют путем сравнения величины параметра, выбранного из группы, состоящей из 3ab40 и 2ab42, или путем сравнения величины вычисленного параметра, выбранного из группы, состоящей из 2ab40+3ab40, 2ab40+3ab40+2ab42+3ab42 и 1ab40+2ab40+1ab42+2ab42.
Адекватные эталонные величины, используемые в различных диагностических способах согласно изобретению, систематизированы в таблице 1.
Систематизированные параметры и пороговые величины для предпочтительных способов согласно изобретению
После определения величины параметра или вычисленного параметра диагностика нейродегенеративного заболевания, детектирование стадии, предшествующей нейродегенеративному заболеванию, или дифференциация нейродегенеративного заболевания от стадии, предшествующей указанному нейродегенеративному заболеванию согласно изобретению, могут быть достигнуты в том случае, если наблюдается изменение величины параметра или величины вычисленного параметра по сравнению с эталонной величиной.
Термин «изменение» означает статистически значимое увеличение или снижение величины рассматриваемого параметра по сравнению с эталонной величиной.
Используемый здесь термин «статистически значимый» относится к статистическому анализу вероятности, которая представляет собой неслучайную комбинацию двух или более результатов, конечных точек или исходов заболевания, то есть, определенную степень математической достоверности того, что величина параметра, ассоциирующаяся с конкретной группой пациентов, соответствует эталонной величине.
Статистически значимое изменение величин может быть определено с использованием p-величины. Так, например, при использовании p-величины параметр идентифицируют как статистически значимое изменение, если р-величина составляет менее чем 0,1, предпочтительно, менее чем 0,05, более предпочтительно, менее чем 0,01, еще более предпочтительно, менее чем 0,005, а наиболее предпочтительно, менее чем 0,001.
Обычно, величина рассматриваемого параметра может считаться «повышенной», если указанная величина по меньшей мере в 1,1 раза, в 1,5 раза, в 5 раз, в 10 раз, в 20 раз, в 30 раз, в 40 раз, в 50 раз, в 60 раз, в 70 раз, в 80 раз, в 90 раз, в 100 раз или более превышает эталонную величину. С другой стороны, величина параметра может считаться «пониженной», если указанная величина по меньшей мере в 0,9 раза, в 0,75 раза, в 0,2 раза, в 0,1 раза, в 0,05 раза, в 0,025 раза, в 0,02 раза, в 0,01 раза, в 0,005 раза или менее ниже эталонной величины. В конкретном варианте изобретения, изменением величины параметра или величины вычисленного параметра по сравнению с эталонной величиной является увеличение указанной величины.
В настоящем изобретении может быть применен любой способ, подходящий для определения пептидов. Так, например, концентрация амилоидного бета-пептида может быть определена с применением одного или нескольких методов, выбранных из вестерн-блот-анализа, иммунопреципитации, твердофазного иммуноферментного анализа (ELISA), анализа методом поверхностного плазмонного резонанса, реакции с преципитином, иммунодиффузного анализа методом диффузии в геле, радиоиммуноанализа (РИА), клеточного сортинга с активацией флуоресценции (FACS), двухмерного гель-электрофореза, капиллярного электрофореза, масс-спектроскопии (MC), матричной лазерной десорбции/времяпролетной ионизирующей МС (MALDI-TOF), лазерной десорбции с времяпролетной ионизацией на активированной поверхности (SELDI-TOF), высокоэффективной жидкостной хроматографии (ВЭЖХ), жидкостной экспресс-хроматографии белков (ЖЭХБ), многомерной жидкостной хроматографии (МЖХ), тандемной масс-спектрометрии (МС/MC), тонкослойной хроматографии, анализа методом экспрессии на белковом чипе и лазерной денситометрии.
В предпочтительном варианте изобретения определение по меньшей мере одного или нескольких 1ab40, 1ab42, 2ab40, 2ab42, 3ab40 и 3ab42 осуществляют иммунологическим методом. Используемый здесь термин «иммунологический метод», если он относится к определению, означает любой метод, который включает использование одного или нескольких антител, специфичных к веществу-мишени, для определения количества/концентрации указанного вещества-мишени, исключая другие вещества, присутствующие в образце. Подходящими иммунологическими методами являются, но не ограничиваются ими, вестерн-блот-анализ, иммунопреципитация, твердофазный иммуноферментный анализ (ELISA), анализ методом поверхностного плазмонного резонанса, радиоиммуноанализ (РИА).
Специалистам в данной области очевидно, что для осуществления способов иммунологического детектирования согласно изобретению может быть использовано антитело любого типа при условии, что такое антитело будет обладать специфичностью, достаточной для эффективной дифференциации молекул амилоидного бета-пептида в образце от других веществ. Молекулами антител, подходящих для их использования в иммунологических способах согласно изобретению, являются, но не ограничиваются ими:
(i) «интактные» антитела, содержащие антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи CHl, CH2 и CH3,
(ii) «Fab»-фрагменты, полученные в результате гидролиза интактного антитела папаином и содержащие один антигенсвязывающий сайт и область CL и CH1,
(iii) «F(ab')2»-фрагменты, полученные в результате гидролиза интактного антитела пепсином и содержащие два антигенсвязывающих сайта,
(iv) «Fab»-фрагменты, содержащие константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи и только один антигенсвязывающий сайт. Fab'-фрагменты отличаются от Fab-фрагментов тем, что к ним присоединено несколько остатков у карбокси-конца домена СН1 тяжелой цепи, включая один или несколько цистеинов, происходящих от шарнирной области антитела.
(v) «Fv», который представляет собой минимальный фрагмент антитела, содержащий полноразмерный сайт распознавания антигена и антигенсвязывающий сайт. Эта область состоит из димера, состоящего из одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, прочно связанных друг с другом нековалентной связью. Эта конфигурация представляет собой три гипервариабельные области (CDR) каждого вариабельного домена, которые составляют определенный антигенсвязывающий сайт на поверхности димера VH-VL. В целом, шесть гипервариабельных областей сообщают антителу специфичность связывания с антигеном. Однако даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельных области, специфичных к антигену) обладает способностью распознавать антиген и связываться с антигеном, хотя и с меньшей аффинностью, чем полноразмерный сайт связывания.
(vi) Одноцепочечные фрагменты Fv или «scFv» антитела, содержащие домены VL и VH антитела, где указанные домены присутствуют на одной полипептидной цепи. Предпочтительно, области VL и VH соединены полипептидным линкером, что позволяет фрагменту scFv образовывать нужную структуру, подходящую для связывания с антигеном.
(vii) «Диантитела», содержащие вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) на той же самой полипептидной цепи (VH-VL) посредством пептидного линкера, который является слишком коротким для того, чтобы образовывать пары между двумя доменами на одной и той же цепи. Это обеспечивает спаривание с комплементарными доменами другой цепи и стимулирует сборку димерной молекулы с двумя функциональными антигенсвязывающими сайтами.
(viii) «Биспецифические антитела» (BAb), которые представляют собой одноцепочечные двухвалентные антитела (или их иммунотерапевтически эффективные фрагменты), имеющие два антигенсвязывающих сайта с различной специфичностью. Эти два антигенсвязывающих сайта могут быть связаны друг с другом химическим методом или методами генной инженерии, известными специалистам.
Все эти фрагменты антител могут быть также модифицированы стандартными методами, известными специалистам, например, с использованием аминокислотной(ых) делеции(й), инсерции(й), замены (замен), добавления(й) и/или рекомбинации (и/или любой(ых) другой(их) модификации(й) (например, известных посттрансляционных и химических модификаций, таких как гликозилирование и фосфорилирование), как отдельно, так и в комбинации. Методы введения таких модификаций в последовательность ДНК, кодирующую соответствующую аминокислотную последовательность иммуноглобулиновой цепи, хорошо известны специалистам; см., например, руководство Sambrook et al.; Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory Press, 2nd edition 1989 and 3rd edition 2001.
Антителами могут быть как поликлональные, так и моноклональные антитела. Для получения поликлональных антител различные хозяева, включая коз, кроликов, крыс, мышей, верблюдов, одногорбых верблюдов, лам, человека, птиц и т.п., могут быть иммунизованы путем инъекции пептида, соответствующего фрагменту Αβ40 или Αβ42, обладающему иммуногенными свойствами. В зависимости от вида хозяина для повышения иммунного ответа могут быть использованы различные адъюванты. Такими адъювантами являются, но не ограничиваются ими, адъювант Фрейнда, минеральные гели, такие как гидроксид алюминия, и поверхностно-активные вещества, такие как лизолецитин, полианионы, пептиды, масляные эмульсии, KLH и динитрофенол. Среди адъювантов, используемых для введения человеку, особенно предпочтительными являются БЦГ (бацилла Кальметта-Герена) и Corynebacterium parvum. Если антигеном является пептид, то он может быть использован для конъюгирования с белком, который является иммуногенным для иммунизованных видов. Так, например, антиген может быть конъюгирован с гемоцианином лимфы улитки (KLH), Blue Carrier (гемоцианином, выделенным из Concholepas concholepas), бычьим тироглобулином или соевым ингибитором трипсина посредством бифункционального или дериватизирующего агента, например малеимидобензоилсульфосукцинимидоэфира (конъюгирование, осуществляемое посредством цистеиновых остатков), N-гидроксисукцинимида (посредством лизиновых остатков), глутаральдегида, ангидрида янтарной кислоты или SOCl2.
Для продуцирования моноклональных антител могут быть применены стандартные методы. Так, например, моноклональные антитела могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature, 256:495 (1975), в соответствии с процедурой, подробно описанной в разделах 11.4-11.11 руководства Ausubel, F.M. et al. (Current Protocols in Molecular Biology, John Wiley & Sons Inc; ring-bound edition, 2003). Альтернативно, моноклональные антитела могут быть выделены методами рекомбинантных ДНК из фаговых библиотек антител, полученных методами, описанными в руководстве McCafferty et al., Nature, 348:552-554 (1990). В работах Clacksoii et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol, 222:581-597 (1991) описано выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В других публикациях описано продуцирование высокоаффинных (в нМ-диапазоне) человеческих антител путем перестановки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторное инфицирование и in vivo рекомбинация, применяемые в качестве стратегии для конструирования очень крупных фаговых библиотек (Waterhouse et al., Nucl. Acids. Res., 21:2265-2266 (1993)). Таким образом, эти методы являются реальной альтернативой традиционной гибридомной технологии продуцирования моноклональных антител.
Поликлональные антитела могут быть использованы непосредственно в качестве антисыворотки, полученной от иммунизованных хозяев после забора крови и удаления фибринового сгустка. Моноклональные антитела могут быть использованы непосредственно в качестве супернатанта гибридомной культуры или в качестве асцитной жидкости после имплантации гибридомы в брюшную полость подходящего хозяина. Альтернативно, молекулы иммуноглобулина как поликлональные, так и моноклональные перед их применением, могут быть очищены стандартными методами, такими как аффинная очистка с использованием пептидов, происходящих от амилоидных бета-пептидов, очистка в неденатурирующем геле, очистка методами ВЭЖХ или ОФ-ВЭЖХ, очистка методом эксклюзионной хроматографии, очистка на колонке с белком А или любая комбинация этих методов.
Подходящими антителами, которые могут быть получены иммунологическими методами согласно изобретению, являются, но не ограничиваются ими:
(i) Антитела, которые распознают область, начинающуюся от N-концевой области амилоидных бета-пептидов, такие как антитела, специфичные к эпитопам, локализованным в положениях аминокислот 1-16, 1-17, 13-28, 15-24, 1-5 и 1-11 пептидов Αβ40 или Αβ42; и антитела, продуцируемые против пептида, соответствующего С-концевой области пептида Αβ42, которые специфически связываются с Αβ42 и не вступают в какую-либо явную перекрестную реакцию с Αβ40 или Αβ43,
(ii) Антитела, продуцируемые против пептида, соответствующего С-концевой области пептида Αβ40, которые специфически связываются с Αβ40 и не вступают в какую-либо явную перекрестную реакцию с Αβ42, Αβ39, Αβ38, Αβ41 или Αβ43,
(iii) Антитела, которые одновременно распознают C-концевую область Αβ40 и Αβ42,
(iv) Антитела, которые являются специфичными к области стыка амилоидных бета-пептидов, и которые могут быть использованы для идентификации амилоидных бета-пептидов от других APP-фрагментов, и локализованы в положениях аминокислот 16 и 17 аминокислотной последовательности, обычно простирающейся от аминокислотного остатка 13 до аминокислотного остатка 28,
(v) Комбинация двух или более антител, упомянутых в пунктах (i)-(iv).
В предпочтительном варианте изобретения, определение количества амилоидного бета-пептида осуществляют с помощью ELISA.
Используемый здесь термин «ELISA» означает твердофазный иммуноферментный анализ и анализ, в котором неизвестное количество вещества-мишени (амилоидного бета-пептида) фиксируют на поверхности, а затем на эту поверхность наносят специфическое антитело для того, чтобы оно связывалось с антигеном. Это антитело связывается с ферментом, и в конечной стадии добавляют вещество, которое фермент может превратить в определенный детектирумый сигнал. Различные типы ELISA-анализов известны специалистам и могут быть использованы в способе согласно изобретению, включая прямой ELISA, «сэндвич»-ELISA, конкурентный ELISA и способ и устройство для обратного ELISA (ELISA-R m&d).
Прямой ELISA-анализ осуществляют путем контактирования тест-образца, содержащего амилоидный бета-пептид, с твердым носителем, который был предварительно покрыт концентрированным раствором инертного белка или реагента (альбумина бычьей сыворотки, казеина). После абсорбирования амилоидного бета-пептида, присутствующего в тест-образце, на носителе, добавляют антитело, специфичное к амилоидному бета-пептиду в условиях, подходящих для связывания с амилоидным бета-пептидом. Затем связанное антитело детектируют с использованием «второго» антитела, которое связывается с детектируемой меткой или с субстрат-модифицирующим ферментом. Сигнал, продуцируемый детектируемой меткой или субстратом, пропорционален количеству антитела, связанного с носителем, которое, в свою очередь, непосредственно коррелирует с количеством амилоидного бета-пептида в образце.
Конкурентный ELISA-анализ включает первую стадию, на которой тест-образец, содержащий неизвестное количество амилоидного бета-пептида, подвергают контактированию с «первым» антителом, определенным выше. В лунку, покрытую антигеном, добавляют комплексы «антитело-антиген». После промывки носителя для удаления любых не специфически связанных комплексов количество «первого» антитела детектируют с использованием «второго» антитела, связанного с детектируемой молекулой. В анализах этого типа, чем выше исходная концентрация антигена, тем слабее выходной сигнал. Альтернативным конкурентным ELISA-анализом является ELISA, в котором используется не антитело, связанное с ферментом, а антиген, связанный с ферментом. Меченый антиген конкурирует с антигеном (немеченым) образца за сайты связывания с «первым» антителом. В анализах этого типа концентрация антигена в образце обратно пропорциональна количеству меченого антигена, оставшегося в лунке, и соответственно, чем больше концентрация, тем слабее сигнал.
В способе и устройстве для обратного ELISA (ELISA-R m&d) применяется твердая фаза нового типа, изготовленная из иммуноферментного полистиролового стержня с 4-12 выступающими заостренными концами, причем, все устройство может быть введено в тест-пробирку, содержащую собранный образец, и последующие стадии (промывка, инкубирование в виде конъюгата и инкубирование в хромогенном растворе) могут быть легко осуществлены путем погружения заостренных концов устройства в микролунки в стандартных микропланшетах, предварительно заполненных реагентами и хранящихся в герметично закрытом виде вплоть до их применения.
В предпочтительном варианте изобретения, ELISA-анализом является «сэндвич»-ELISA. Анализ «сэндвич»-ELISA включает нанесение на носитель «первого» антитела, специфичного к амилоидному бета-пептиду, нанесение образца, содержащего амилоидный бета-пептид, что приводит к связыванию амилоидного бета-пептида с «первым» антителом, и нанесение «второго» антитела, которое также является специфичным к амилоидному бета-пептиду, где указанное «второе» антитело обычно связывается с детектируемой меткой или с субстрат-модифицирующим ферментом. Сигнал, генерируемый меткой или превращенным субстратом, пропорционален количеству антигена в образце.
В контексте описания настоящего изобретения, «первое» антитело называется «антителом для захвата», что означает, что это антитело используется для выделения из образца молекул всех видов, с которыми специфически связывается данное антитело. Тип антитела, которое может быть использовано в качестве антитела для захвата, не имеет конкретных ограничений при условии, что оно содержит по меньшей мере один антигенсвязывающий сайт, специфичный к Αβ40 и/или Αβ42. Таким образом, в качестве антитела для захвата может быть использовано любое из вышеупомянутых антител.
В контексте описания настоящего изобретения, «второе» антитело называется «детектирующим антителом», поскольку это антитело может быть использовано для детектирования количества антигена, который удерживается антителом для захвата. Аналогично антителу для захвата, тип антитела, которое может быть использовано в качестве детектирующего антитела, практически не имеет ограничений. Однако в этой связи следует отметить, что детектирующее антитело (i) должно связываться с областью антигена, который не был сенсибилизирован антителом для захвата, и (ii) должно содержать не только антигенсвязывающий сайт, но также и детектируемую метку, субстрат-модифицирующий фермент или дополнительную(ые) область(и), которая(ые) может (могут) специфически детектироваться реагентом, обнаруживающим высокую аффинность связывания с указанным антителом, что позволит детектировать антитело, которое связывается с антигеном, захваченным антителом для захвата. Предпочтительно, указанные дополнительные области, которые могут специфически связываться с указанным реагентом, соответствуют константной области молекулы иммуноглобулина.
В предпочтительном варианте изобретения, антителом для захвата является антитело, специфичное к N-концевой области амилоидных бета-пептидов. В более предпочтительном варианте изобретения, указанным антителом для захвата является антитело, специфичное к эпитопу, локализованному в положениях аминокислот 1-16 Abeta40 или Abeta42. Особенно предпочтительным антителом для захвата является моноклональное антитело 6E10, описанное Kim, K.S. (Neuroscience Res. Comm. 1988, 2:121-130).
В другом предпочтительном варианте изобретения, детектирующим антителом является антитело, специфичное к эпитопу, локализованному в С-концевой области амилоидного бета-пептида. Как объяснялось выше, тип детектирующего антитела может быть адекватно выбран средним специалистом в данной области в зависимости от числа детектируемых амилоидных бета-пептидов.
Для детектирования или для определения одного Αβ40 антителом для захвата может служить антитело, которое распознает N-концевую область Αβ40 (а также Αβ42, поскольку оба эти пептида имеют идентичные N-концевые области), а детектирующим антителом может служить антитело, которое специфически распознает С-концевую область Αβ40, но при этом не вступает в какую-либо перекрестную реакцию с Αβ42. Альтернативно, Αβ40 может быть специфически детектирован с использованием антитела для захвата, которое распознает С-концевую область Αβ40, но при этом не вступает в какую-либо перекрестную реакцию с Αβ42, и детектирующего антитела, распознающего область Αβ40, которая является общей для Αβ40 и Αβ42, а предпочтительно, N-концевую область Αβ42/Αβ40.
Для детектирования или для определения одного Αβ42 антителом для захвата может служить антитело, которое распознает N-концевую область Αβ42 (а также Αβ42, поскольку оба эти пептида имеют идентичные N-концевые области), а детектирующим антителом может служить антитело, которое специфически распознает С-концевую область Αβ42, но при этом не вступает в какую-либо перекрестную реакцию с Αβ40. Альтернативно, Αβ42 может быть специфически детектирован с использованием антитела для захвата, которое распознает С-концевую область Αβ42, и детектирующего антитела, распознающего область Αβ42, которая является общей для Αβ42 и Αβ40.
Для одновременного детектирования или определения Αβ42 и Αβ40 антителом для захвата может служить антитело, которое распознает N-концевую область, общую для Αβ42 и Αβ40, а детектирующим антителом может служить комбинация по меньшей мере двух антител, где первое антитело специфически распознает С-концевую область Αβ42, но при этом не вступает в какую-либо перекрестную реакцию с Αβ40, а второе антитело специфически распознает С-концевую область Αβ40, но при этом не вступает в какую-либо перекрестную реакцию с Αβ42. Альтернативно, антителом для захвата может служить антитело, которое распознает N-концевую область, общую для Αβ42 и Αβ40, а детектирующим антителом может служить антитело, которое распознает С-концевую область Αβ40 и Αβ42. Альтернативно, Αβ40 и Αβ42 могут быть одновременно детектированы с использованием в качестве антитела для захвата смеси по меньшей мере двух антител, содержащей первое антитело, которое специфически распознает С-концевую область Αβ42, но при этом не вступает в какую-либо перекрестную реакцию с Αβ40, и второе антитело, которое специфически распознает С-концевую область Αβ40, но при этом не вступает в какую-либо перекрестную реакцию с Αβ42, и детектирующее антитело, которое распознает N-концевую область, общую для Αβ42 и Αβ40. Альтернативно, Αβ42 и Αβ40 могут быть одновременно детектированы с использованием в качестве антитела для захвата антитела, которое распознает С-концевую область Αβ40 и Αβ42, и детектирующего антитела, которое распознает N-концевую область, общую для Αβ42 и Αβ40.
Антитела, специфичные к Αβ40 и Αβ42, и методы их получения были подробно описаны в заявках WO2004024770 и WO2004098631, содержание которых вводится в настоящее описание посредством ссылки.
Детектирующие антитела и/или антитела для захвата могут быть аффинно очищены с использованием полипептида, содержащего последовательность полипептида, используемого для получения этих антител.
Как упоминалось выше, детектирующее антитело может быть непосредственно связано с детектируемой меткой или с субстрат-модифицирующим ферментом. Предпочтительно, может быть использован реагент, обладающий аффинностью к детектирующему антителу, и в этом случае указанный реагент метят не детектирующим антителом, а детектируемой меткой или субстрат-модифицирующим ферментом. Кроме того, антитело-связывающий реагент может быть связан с первым членом связывающей пары, и в этом случае, он является вторым членом связывающей пары, которая может быть связана с детектируемой меткой или с субстрат-модифицирующим ферментом.
Антитело-связывающий реагент может быть нековалентно связан с антителом конкретного(ных) типа(ов), конкретного(ых) класса(ов) и/или конкретного(ных) подкласса(ов) и/или с фрагментами таких антител. Альтернативно, антитело-связывающий реагент может быть нековалентно связан с антителом, специфичным к конкретному антигену. В конкретных вариантах изобретения, антитело-связывающий реагент может быть нековалентно связан с Fc-областью или с F(ab)-областью детектирующего антитела. Предпочтительными антитело-связывающими реагентами являются белок A, G-белок, белок V, белок L, анти-Fc антитело или антитело-связывающий фрагмент и Fc-рецептор (FcR) или его антитело-связывающий фрагмент. Неограничивающими примерами антител, которые могут нековалентно связываться с детектирующим антителом, являются моноклональные антитела, поликлональные антитела, мультиспецифические антитела, человеческие антитела, гуманизованные антитела, химерные антитела, однодоменные антитела, одноцепочечные Fv (scFv) одноцепочечных антител, Fab-фрагменты, F(ab')-фрагменты, Fv (sdFv), связанные дисульфидной связью, интратела и антиидиотипические (анти- Id) антитела, и эпитоп-связывающие фрагменты любых из вышеуказанных антител. Неограничивающими примерами Fc-рецепторов являются FcγRI, FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIAα, FcγRIIIB, FcεRIα, FcεRIξ и FcγRIIIAξ.
Подходящими связывающими парами, используемыми для детектирования, являются:
- гаптен или антиген/антитело, например дигоксин и антитела против дигоксина
- биотин или аналоги биотина (например, аминобиотин, иминобиотин или дезтиобиотин)/авидин или стрептавидин,
- сахар/лектин,
- фермент и кофактор,
- фолиевая кислота/фолат,
- двухцепочечные олигонуклеотиды, которые селективно связываются с белками/факторами транскрипции,
- нуклеиновая кислота или аналог нуклеиновой кислоты/комплементарная нуклеиновая кислота,
- рецептор/лиганд, например рецептор стероидного гормона/стероидный гормон.
Следует отметить, что термин «первый» и «второй» член связывающей пары является относительным, и что каждый из вышеупомянутых членов может рассматриваться как первый или второй члены связывающей пары. В предпочтительном варианте изобретения, первым членом связывающей пары является биотин или его функционально эквивалентный вариант, а вторым членом связывающей пары является авидин, стрептавидин или его функционально эквивалентный вариант.
В предпочтительном варианте изобретения, вторым членом связывающей пары является стрептавидин.
Подходящими детектирующими метками являются, но не ограничиваются ими, флуоресцентные молекулы (например, флуоресцеин, родамин, фикоэритрин, кумарин, оксазин, резоруфин, цианин и их производные), люминесцентные молекулы (например, наночастицы Qdot™, поставляемые Quantum Dot Corporation, Palo Alto, CA).
Подходящими субстрат-модифицирующими ферментами являются ферменты, обладающие способностью вырабатывать детектируемый сигнал, например, после добавления активатора, субстрата, усилителя и т.п. Ферментами, подходящими для использования в настоящем изобретении в качестве детектируемых меток, и их соответствующими субстратами являются:
- Щелочная фосфатаза:
- Хромогенные субстраты: субстраты на основе п-нитрофенилфосфата (p-NPP), 5-бром-4-хлор-3-индолилфосфата/голубого нитротетразолия (BCIP/NPT), быстрого красного/нафтол-AS-TS-фосфата.
- Флуорогенные субстраты: 4-метилумбеллиферилфосфат (4-MUP), 2-(5'-хлор-2'-фосфорилоксифенил)-6-хлор-4-(3H)-хиназолинон (CPPCQ), 3,6-флуоресцеиндифосфат (3,6-FDP), быстрый голубой BB, быстрый красный TR или диазониевые соли быстрого красно-фиолетового LB.
- Пероксидазы:
- Хромогенные субстраты на основе 2,2-азинобис(3-этилбензотиазолин-6-сульфоновой кислоты) (ABTS), o-фенилендиамина (OPT), 3,3',5,5'-тетраметилбензидина (TMB), o-дианизидина, 5-аминосалициловой кислоты, 3- диметиламинобензойной кислоты (DMAB) и 3-метил-2- бензотиазолингидразона (MBTH), тетрагидрохлорида 3-амино-9-этилкарбазола (AEC) и 3,3'-диаминобензидина (DAB).
- Флуорогенные субстраты: 4-гидрокси-3-метоксифенилуксусная кислота, восстановленные феноксазины и восстановленные бензотиазины, включая реагент красный Amplex®, ярко-красный Amplex и восстановленные дигидроксантины.
- Гликозидазы:
- Хромогенные субстраты: o-нитрофенил-β-D-галактозид (o-NPG), п-нитрофенил-β-D-галактозид и 4-метилумбеллиферил-β-D-галактозид (MUG) для β-D-галактозидазы.
- Флуорогенные субстраты: β-D-галактопиранозид резоруфина, дигалактозид флуоресцеина (FDG), диглюкуронид флуоресцеина, 4-метилумбеллиферил-β-D-галактопиранозид, карбоксиумбеллиферил-β-D-галактопиранозид и фторированные β-D-галактопиранозиды кумарина.
- Оксидоредуктазы (люцифераза):
- Люминесцентные субстраты: люциферин.
Наборы согласно изобретению
Настоящее изобретение также относится к наборам, которые являются подходящими для осуществления способа согласно изобретению. Таким образом, в другом своем аспекте, настоящее изобретение относится к набору для определения амилоидных бета-пептидов в биологическом образце, где указанный набор содержит:
(i) белок-солюбилизирующий агент и
(ii) по меньшей мере одно антитело против амилоидного бета-пептида.
Компоненты (i) и (ii) данного набора, по существу, описаны в способе согласно изобретению. В предпочтительном варианте изобретения, белок-солюбилизирующим агентом является детергент. В еще более предпочтительном варианте изобретения указанным детергентом является твин 20.
В другом предпочтительном варианте изобретения по меньшей мере одно антитело против амилоидного бета-пептида выбрано из группы, состоящей из:
(i) антитела против N-концевой области амилоидного бета-пептида,
(ii) антитела против С-концевой области амилоидного бета-пептида, и
(iii) комбинации антитела против N-концевой области амилоидного бета-пептида и антитела против С-концевой области амилоидного бета-пептида.
В еще более предпочтительном варианте изобретения, набор согласно изобретению содержит антитело против N-концевой области амилоидного бета-пептида, которое направлено против эпитопа, локализованного в положениях аминокислот 1-16 ABETA40 и ABETA42. В другом предпочтительном варианте изобретения, набор согласно изобретению содержит антитело против С-концевой области амилоидного бета-пептида, которое направлено против пептида и выбрано из группы, состоящей из:
(i) поликлонального антитела против пептида, соответствующего C-концевой области пептида ABETA42, где указанное антитело специфически связывается с ABETA42, но, по существу, не вступает в какую-либо перекрестную реакцию с ABETA40,
(ii) поликлонального антитела против пептида, соответствующего C-концевой области пептида ABETA40, где указанное антитело специфически связывается с ABETA40, но, по существу, не вступает в какую-либо перекрестную реакцию с ABETA42, и
(iii) антитела, которое одновременно распознает C-концевую область ABETA40 и ABETA42 и
(iv) комбинации антител по пунктам (i) и (ii).
В предпочтительном варианте изобретения, набор согласно изобретению также содержит твердый носитель. Используемый здесь термин «носитель» или «поверхность» означает твердую фазу, представляющую собой не растворимый в воде пористый или непористый материал, который может быть изготовлен в различных формах, таких как полоски, палочки, частицы, включая латексные частицы, магнитные частицы, микрочастицы, сферы, мембраны, лунки микротитрационных планшетов и пластиковые трубки. В принципе, в качестве твердого носителя может быть использован любой материал при условии, что он будет обладать способностью связываться с достаточным количеством антитела для захвата. Таким образом, выбор твердофазного материала может быть сделан исходя из желательных рабочих параметров анализа данного формата. Материалами, подходящими для изготовления твердого носителя, являются полимерные материалы, а в частности целлюлозные материалы и материалы, происходящие от целлюлозы, такие как бумага из волокна, например фильтровальная бумага, хроматографическая бумага, бумага из стекловолокна и т.п.; синтетические или модифицированные природные полимеры, такие как нитроцеллюлоза, ацетат целлюлозы, поливинилхлорид, полиакриламид, декстран с перекрестными связями, агароза, полиакрилат, полиэтилен, полипропилен, поли(4-метилбутен), полистирол, полиметакрилат, полиэтилентерефталат, найлон, поливинилбутират и т.п., которые могут быть использованы отдельно или в комбинации с другими материалами; стекло такое, как, например, стекло, применяемое в качестве биологического стекла, керамика, металлы и т.п. Предпочтительными являются не связанные перекрестными связями полимеры стирола и карбоксилированного стирола, или стирола с другими активными функциональными группами, такими как амино, гидроксил, галоген и т.п. В некоторых случаях могут быть использованы сополимеры замещенных стиролов и диенов, таких как бутадиен.
Твердый носитель и антитело могут поставляться в наборе по отдельности, либо, альтернативно, носитель может быть предварительно покрыт антителом для захвата. В этом случае носитель может быть обработан блокирующим раствором после связывания с антителом для захвата.
Дополнительными компонентами данного набора могут быть:
- Средства для взятия у пациента образца для анализа,
- Буферы и растворы, необходимые для построения стандартных кривых для амилоидных бета-пептидов,
- Буферы и растворы для промывки и блокирования твердого носителя во время анализа,
- Буферы и растворы для нанесения антитела на твердый носитель,
- Реагенты для обнаружения цветного или флуорогенного сигнала, продуцируемого детектируемой меткой,
- Реагенты для прекращения образования цветного или флуорогенного продукта, продуцируемого детектируемой меткой (например, 1н H2SO4),
- Образец, содержащий маточный раствор пептидов Αβ40 или Αβ42 или их комбинации.
В предпочтительном варианте изобретения, набор согласно изобретению содержит два антитела, которые могут быть использованы в «сэндвич»-ELISA-анализе. В этом случае одно из антител, то есть, антитело для захвата, иммобилизуют на твердом носителе. Иммобилизация может быть осуществлена перед связыванием детектируемого полипептида-мишени или после связывания пептида/белка с антителом для захвата. В любом случае, если используется твердый носитель, то удобнее блокировать избыток белок-связывающих сайтов на носителе перед добавлением образца, содержащего определяемый полипептид-мишень. Предпочтительно, блокирование или нейтрализацию пептид-связывающих сайтов на носителе осуществляют с использованием того же самого буфера, который был использован для промывки комплексов после каждой реакции связывания (например, 50 мМ трис-HCl, pH 8, PBS или TBS, содержащий, но необязательно, твин 20) и в который было добавлено макромолекулярное соединение (например, альбумин бычьей сыворотки, обезжиренное сухое молоко, блокирующий реагент, используемый в вестерн-блот-анализе, казеин, лактоальбумин, овальбумин) в концентрациях примерно 0,05%-10%, предпочтительно, 1-5%, а более предпочтительно, примерно 3%.
Настоящее изобретение описано в нижеследующих примерах, которые носят лишь иллюстративный характер и не должны рассматриваться как ограничение объема изобретения.
Примеры
Пример 1
Группы, участвующие в исследовании
В исследование было включено 40 участников, из них - 16 здоровых индивидуумов, отобранных в качестве контроля (HC), 8 пациентов со слабым нарушением познавательных способностей, страдающих потерей памяти (MCI), и 16 пациентов, страдающих болезнью Альцгеймера (БА). Все участники имели возраст свыше 65 лет, и каждая группа наполовину состояла из мужчин и женщин. Демографические характеристики участников систематизированы в таблице 2.
Демографические характеристики
Здоровых индивидуумов тщательно отбирали из живущих в коммунах социально активных добровольцев, у которых отсутствовали жалобы на потерю памяти, наблюдалось нормальное поведение, на что указывали нейропсихологические тесты, и отсутствовали структурные изменения, на что указывала количественная магнитно-резонансная томография (МРТ).
Участники с MCI удовлетворяли клиническому критерию Майо. Кроме того, для отбора участников с MCI необходимо, чтобы CDR=0,5, и более чем 3 балла по шкале Шелтена (J. Neurol. Neurosurg Psychiatry. 1992; 55:967-972), что указывает на атрофию медиального участка височной области и на картину гипометаболизма в теменной и/или в височной области, определенную по позитронно-эмиссионной томографии, проводимую с использованием 18-фтордезоксиглюкозы (PET-FDG), предположительно, на БА. Были исключены пациенты с любой психической или системной патологией, которая, предположительно, не является нейродегенеративным заболеванием, и которая может вызывать MCI.
Конкретными критериями включения в БА-группу является предварительный диагноз БА (критерии NINCDS-ADRDA), CDR=1, MMSE от 16 от 24 баллов и оценка более чем 3 балла по шкале Шелтена для атрофии медиального участка височной области.
Обследование на познавательные способности для установления диагноза для MCI-группы и БА-группы осуществляли в соответствии с рутинной клинической оценкой потери памяти по ACE, описанной в литературе.
От каждого участника в исследованиях было получено письменное информированное согласие (или, в случае некоторых пациентов с БА, согласие их близких родственников). Протоколы исследования были проверены и одобрены Комитетом по этике (Ethical Committee of the Hospital Clinic i Provincial (Barcelona, Spain).
Пример 2
Получение образцов
У индивидуумов брали кровь и добавляли гранулы Roche CompleteMini (ингибиторы протеазы) по 10 мл каждую. Кровь либо сразу центрифугировали, либо хранили при 4°C и центрифугировали в день проведения анализа.
Плазму отделяли от клеточной фракции, и эту плазму собирали, разделяли на 0,5 мл-аликвоты и помещали в пробирки Эппендорфа. Аликвоты могут храниться при -80°C.
Уровень свободного амилоида в плазме (1ab40 и 1ab42) определяли непосредственно в неразведенной осветленной плазме, полученной, как описано ниже. Эти параметры далее обозначаются 1ab40 или UP (неразведенная плазма) Αβ(1-40) для Αβ(1-40) и 1ab42 или UP Αβ(1-42) для Aβ(1-42).
Общий амилоид плазмы, соответствующий свободному амилоиду в плазме плюс амилоид, ассоциированный с компонентами плазмы, определяли в образцах, полученных путем разведения 150 мкл плазмы в 300 мкл буфера для разведения (PBS, содержащего 0,5% твин-20). Эти параметры далее обозначаются 2ab40 или DP (разведенная плазма) Αβ(1-40) для Αβ(1-40) и 2ab42 или DP Αβ(1-42) для Αβ(1-42).
Связанный с клетками амилоид бета определяли путем разведения клеточной фракции плазмы (об/об) 1/5 в образце для разведения (PBS, содержащем 0,5% твин-20). Эти параметры обозначаются далее 3ab40 или CB (связанный с клетками) Αβ(1-40) для Αβ(1-40) и 3ab42 или CB Αβ(1-42) для Αβ(1-42).
Пример 3
Условия обработки образца
Разведение образца
Для идентификации разведения образца, имеющего наивысшую оптическую плотность, как показал ELISA-анализ, были протестированы различные разведения и буферные растворы.
Образцы разводили 1/2, 1/3, 1/4, 1/5 и 1/10. Было обнаружено, что при разведении 1/4 и выше, оптическая плотность образца снижалась. Наилучшими разведениями являются разведения 1/2 и 1/3.
Центрифугирование образца
Образцы могут быть осветлены путем центрифугирования в течение 1 минуты при 13000 об/мин для удаления компонентов в виде крупных частиц, которые могут оказывать негативное влияние на иммунологическое детектирование. Супернатант может быть собран и протестирован сразу или после разведения, описанного выше.
Обработка образца ультразвуком
Образцы могут быть обработаны ультразвуком в течение 5-10 минут. Обработанные ультразвуком образцы могут быть использованы непосредственно в ELISA-анализах, либо они могут быть центрифугированы в течение 1 минуты при 13000 об/мин, и этот супернатант может быть использован непосредственно в ELISA-анализах. Обработанные ультразвуком образцы могут быть также разведены с использованием подходящих буферов, определенных в предыдущих примерах.
Предварительное осветление образца
Образцы пропускали через колонку с сефарозой 4B-IgGK для удаления возможных примесей, в основном как описано Fuckumoto et al., (Arch. Neurol, 2003, 60: 958-964). Колонку с сефарозой 4B-IgGK получали путем реакции взаимодействия CNBr-активированной сефарозы с IgGlk в соответствии с нижеследующей процедурой:
- IgGlk (молекулярная масса (MW)=150000) растворяли в буфере для связывания (0,1M NaHCO3, pH 8,3 и NaCl, 0,5M (1,5 мл для 300 мг агарозы)) с использованием 500 мкл IgG1k (0,6 мг) и 1,5 мл буфера для связывания.
- Смолу промывали 1 мМ HCl (60 мл для каждых 300 мг смолы).
- Лиганд смешивали со смолой, промытой кислотой, и инкубировали в течение ночи при 4°С при постоянном встряхивании (альтернативно, инкубирование может быть осуществлено в течение 2 часов при комнатной температуре).
- Затем избыток лиганда отмывали 5 объемами буфера для связывания. После этого, непрореагировавшие активные группы в смоле блокировали с использованием 0,1 M трис-HCl, pH 8, в течение 2 часов при комнатной температуре со встряхиванием.
- Смолу промывали в три цикла с использованием, альтернативно, 0,1M трис-HCl, pH 8, + 0,5M NaCl/0,1M ацетата натрия, pH 4, +0,5M NaCl.
После получения сефарозы 4B-IgGK проводили следующие стадии обработки образца:
- 300 мкл плазмы подвергали контактированию с 525 мкл буфера для образцов и 75 мкл агарозы-IgGlk и инкубировали в течение 2 часов при 4°C при постоянном перемешивании.
- Агарозу удаляли путем центрифугирования (5 минут при 1000 об/мин).
- 100 мкл обработанного образца добавляли в лунки микротитрационных планшетов, на которых было адсорбировано антитело для захвата, специфичное к N-концу амилоидных бета-пептидов, и инкубировали в течение ночи при 4°C.
- Количество амилоидного бета-пептида, присутствующего в осветленном образце, определяли с помощью ELISA-анализа путем добавления в лунки анти-Αβ40 или анти-Αβ42 специфической антисыворотки (1/4000) в течение 1 часа при комнатной температуре и при постоянном встряхивании.
- Затем образцы инкубировали с 1/5000-разведением биотинилированного антикроличьего антитела в течение 1 часа при комнатной температуре при постоянном встряхивании.
- Затем образцы инкубировали с 1/4000-разведением стрептавидина, связанного с пероксидазой, в течение 1 часа при комнатной температуре и при встряхивании.
- Затем реакцию проявляли реагентом TMB в течение 30 минут в темноте.
- Проявление реакции прекращали добавлением блокирующего раствора, и оптическую плотность считывали на 450 нм.
Удаление альбумина и IgG
Образцы пропускали через колонки, с которыми связываются альбумин и IgG. Проходящий поток анализировали для идентификации фракции, в которой присутствуют амилоидные пептиды. Альбумин удаляли с использованием набора «ProteoExtract Albumin Removal, Kit» (CALBIOCHEM) в соответствии с инструкциями производителей.
IgG удаляли на колонке с белком A (на белке А-сефарозе 4 Fast Flow, Amersham Biosciences) в соответствии с инструкциями производителей.
Концентрирование образца
Образцы концентрировали на микроконцентраторе с отсечкой 10000. Амилоидные пептиды улавливались в проходящем потоке, а высокомолекулярные белки улавливались в ретентате.
Эффекты, полученные в результате обработки в соответствии с различными протоколами, могут быть систематизированы следующим образом:
- Детергенты: твин-20 представляет собой детергент, обеспечивающий значительное увеличение величин оптической плотности. Такого эффекта не наблюдалось, если концентрация твина-20 увеличивалась с 0,05% до 0,1%.
- pH: Величины pH, при которых достигались лучшие результаты, составляли 7 и 8. При определении Aβ40 адекватные величины оптической плотности также наблюдались при pH=9. При определении Aβ42 адекватные величины оптической плотности были получены при pH 9 и 5.
- Условия денатурации: Добавление 0,5M или 1 M GuHCl или 10% ДМСО не приводило к увеличению оптической плотности.
- Соли: Более высокие величины оптической плотности были получены с использованием NaCl, а не KCl.
- BSA: Каких-либо различий в уровнях оптической плотности не наблюдалось в случае увеличения концентрации BSA с 0,05% до 0,5%.
- Обработка ультразвуком: Каких-либо различий не наблюдалось в случае обработки образцов ультразвуком до определения оптической плотности.
- Предварительное осветление: Какого-либо эффекта не наблюдалось в случае предварительной обработки образцов сефарозой 4B-IgGk.
- Удаление альбумина и IgG: Амилоидные пептиды, очевидно, связываются с IgG, а не с альбумином.
- Концентрирование: Амилоидные пептиды присутствуют, главным образом, в ретентате.
Пример 4
Колориметрический «сэндвич»-ELISA-анализ с усилением сигнала под действием биотина-стрептавидина
Для повышения чувствительности сигнал может быть усилен с использованием биотина-стрептавидина. Планшет покрывали антителом (mAb) 6E10 для захвата, которое распознает аминокислоты 1-17 в амилоидном пептиде Aβ40 и в амилоидном пептиде Aβ42. Покрытие осуществляли при концентрации 5 мкг/мл в 100 мМ карбонатного/бикарбонатного буфера, pH=9,6, в течение ночи при 4°C. Затем планшет блокировали 300 мкл блокирующего раствора (50 мМ трис-HCl, pH 8, 0,2% твин-20, 0,5% BSA) в течение 3 часов при комнатной температуре со встряхиванием или в течение 2 часов при 37°C. При необходимости, после блокирования, планшет может быть обработан 100 мкл 50 мМ раствора трис-HCl, pH 8, содержащего 20 мг/мл трегалозы. Планшеты оставляли для выпаривания до тех пор, пока не образовывалось белое гало, указывающее на присутствие трегалозы. Обработанные таким образом планшеты, обернутые алюминиевой фольгой, могут храниться при 4°C и сохраняют свою стабильность в течение двух лет.
Образцы стандартных кривых были построены по данным, полученным для 200 пг/мл маточного раствора пептидов Aβ40 и Аβ42 на планшетах, покрытых mAb 6E10 и обработанных трегалозой. Из этих растворов приготавливали серийные разведения 1:2 в SDB так, чтобы концентрации составляли 200, 100, 50, 25, 12,5, 6,25 и 3,125 пг/мл. 100 мкл каждого разведенного или неразведенного образца добавляли в SDB (1/1000000) и инкубировали в течение ночи при 4°C (или в течение 2 часов при 37°C). Образцы для определения свободного амилоида плазмы, общего амилоида плазмы и амилоида, связанного с клетками, в тест-образцах, получали, как описано в примере 1 и добавляли в лунки ELISA-планшетов в условиях, аналогичных условиям приготовления стандартного образца. После этого добавляли детектирующее антитело (поликлональное антитело против пептида, соответствующего C-концевой области пептида Αβ42 или поликлональное антитело против пептида, соответствующего C-концевой области пептида Αβ40, в зависимости от конкретно детектируемого пептида, то есть, Αβ42 или Αβ40), разведенное в SDB. В каждую лунку добавляли 100 мкл антитела и инкубировали в течение 1 часа при комнатной температуре. После этого добавляли 100 мкл меченного биотином антитела против кроличьих IgG (SIGMA) при разведении 1/5000 в SDB и инкубировали в течение 1 часа при комнатной температуре со встряхиванием. Затем в каждую лунку добавляли 100 мкл ПХ-конъюгированного стрептавидина (от SIGMA) при разведении 1/4000 в SDB и инкубировали в течение 1 часа при комнатной температуре.
Планшет проявляли с использованием 100 мкл хромогенного субстрата TMB (ZEU Inmunotec). Для этого добавляли TMB и инкубировали в темноте в течение 15-30 минут. Затем в каждую лунку добавляли 50 мкл 1н H2SO4, используемой в качестве блокирующего раствора. Оптическую плотность на 450 нм считывали на планшет-ридере Synergy HT (BioTek Instruments).
Величины концентраций (пг/мл), полученные для образцов, используемых для определения общего амилоида плазмы (свободного амилоида плазмы вместе с амилоидом, связанным с компонентами плазмы), корректировали для внесения поправки на разведение, осуществляемое во время проведения стадии приготовления образца. Поскольку разведение обычно составляло 1:3 (см. пример 1), то величину пг/мл, полученную после считывания оптической плотности, умножали на 3 для определения реальной концентрации агрегатов свободного амилоида в плазме и амилоида, связанного с компонентами плазмы. Аналогичным образом, величины пг/мл, полученные из величин оптической плотности для образцов, используемых для определения связанного с клетками амилоида, также корректировали для внесения поправки на разведение, осуществляемое во время проведения стадии приготовления образца. Поскольку разведение обычно составляло 1:5 (см. пример 1), то величину пг/мл, полученную после считывания оптической плотности, умножали на 5 для определения реальной концентрации амилоида, связанного с клетками.
В промежутке между стадиями планшет промывали в автоматическом устройстве для мойки планшетов (Elx50 Bio Tek Instruments), запрограммированном на 5 ополаскиваний через каждый промежуток времени. Промывочный раствор содержал 50 мМ трис-HCl, pH 8, 0,05% твин-20 и 150 мМ NaCl (отфильтрованный перед его применением).
Пример 5
Флуоресцентный «сэндвич»-ELISA-анализ
Планшет покрывали антителом 6E10 в бикарбонатном буфере (5 мкг/мл) в течение ночи при 4°C. Затем планшет блокировали в течение 3 часов при комнатной температуре со встряхиванием (300 мкл/лунку). Затем тест-образцы и образцы для построения стандартной кривой добавляли в планшеты и инкубировали в течение ночи при 4°C. В каждую лунку добавляли 1/4000-разведение детектирующего антитела (анти-Aβ40 или анти-Aβ42 антисыворотки) и инкубировали в течение 1 часа при комнатной температуре со встряхиванием. После этого добавляли серийные разведения ФИТЦ-конъюгированного антитела (разведения 1/1000, 1/5000, 1/10000) и инкубировали в течение 1 часа при комнатной температуре в темноте. Флуоресценцию считывали на длине волны возбуждения 485 нм и на длине волны излучения 528 нм.
Альтернативно, анализ проводили с использованием флуоресцентного субстрата Quanta-Blu (PIERCE), который повышает чувствительность ELISA-анализа. Максимальное возбуждение наблюдалось на 325 нм, а максимальное излучение наблюдалось на 420 нм. Такое возбуждение может быть детектировано в диапазоне длин волн 315-340 нм, а излучение может быть детектировано в диапазоне длин волн 370-470 нм. Рабочий раствор QuantaBlu получали путем смешивания 9 частей раствора субстрата QuantaBlu с одной частью стабильного пероксидазного раствора QuantaBlu (раствора, который является стабильным в течение 24 часов при комнатной температуре). Инкубирование может быть осуществлено в течение периода времени от 1,5 минут до 90 минут при комнатной температуре, а считывание может быть осуществлено после завершения реакции или в процессе реакции без ее завершения (появляется голубая окраска).
Планшет покрывали антителом (mAb) 6E10 в бикарбонатном буфере (5 мкг/мл) в течение ночи при 4°C, а затем блокировали в течение 3 часов при комнатной температуре со встряхиванием (300 мкл/лунку). Затем получали различные стандартные кривые с использованием следующих концентраций пептидов Αβ42 и Αβ40:
- 1000, 500, 250, 125, 62,5, 31, 25 и 15,65 пг/мл
- 200, 100, 50, 25, 12,5, 6,25 и 3,125 пг/мл
- 25, 12,5, 6,25, 3,125, 1,56, 0,78 и 0,39 пг/мл
- 10, 5, 2,5, 1,25, 0,625, 0,3125 и 0,156 пг/мл
- 5, 2,5, 1,25, 0,625, 0,3125, 0,156 и 0,078 пг/мл
- 1, 0,5, 0,25, 0,125, 0,0625, 0,03125 и 0,0156 пг/мл.
Детектирующее антитело (анти-Aβ40 или анти-Aβ42 антисыворотку) добавляли (при разведении 1/4000) в течение 1 часа при комнатной температуре со встряхиванием. Затем добавляли ПХ-конъюгированное антитело против кроличьих IgG при разведении 1/1000 и инкубировали в течение 1 часа при комнатной температуре со встряхиванием. Для проявления окраски реакционной смеси добавляли 100 мкл рабочего раствора Quanta-Blue и инкубировали в течение 30 минут, 60 минут и 90 минут при комнатной температуре в темноте. Затем считывали флуоресценцию (возбуждение: 360/40 нм; излучение: 460/40 нм) в течение 30 минут, 60 минут и 90 минут, не завершая при этом реакцию, или после завершения реакции блокирующим раствором.
Пример 6
Построение стандартных кривых по данным для Αβ40 и Αβ42
В целях построения стандартной кривой для Αβ40, лиофилизованный образец человеческого Аβ40 разводили до 10 мкг/мл. Из маточного раствора получали образцы, содержащие следующие концентрации (в пг/мл): 25000 пг/мл, 2500 пг/мл, 25 пг/мл, 12,5 пг/мл, 6,25 пг/мл, 3,125 пг/мл, 1,56 пг/мл, 0,78 пг/мл. Образцы получали в присутствии 1 мМ ингибитора протеазы AEBSF. Затем образцы обрабатывали методом, описанным в предыдущих примерах.
В целях построения стандартной кривой для Αβ42, лиофилизованный образец Аβ42 человека разводили до 10 мкг/мл. Из маточного раствора получали образцы, содержащие следующие концентрации (в пг/мл): 25000 пг/мл, 2500 пг/мл, 25 пг/мл, 12,5 пг/мл, 6,25 пг/мл, 3,125 пг/мл, 1,56 пг/мл, 0,78 пг/мл. Образцы получали в присутствии 1 мМ ингибитора протеазы AEBSF. Затем образцы обрабатывали методом, описанным в предыдущих примерах.
Пример 7
Статистический анализ
Воспроизводимость результатов измерений в различных лабораториях оценивали для 16 произвольно выбранных образцов по коэффициенту корреляции и конкордации (CCC), который позволял оценивать соответствие между тремя считываниями, то есть, считыванием, проводимым авторами в своей лаборатории, и считыванием того же самого образца, проводимым в двух других лабораториях путем измерения отклонения на 45° от линии, проходящей через начало координат (линии конкордации)27. Степень сходства образцов, полученных от одного и того же индивидуума в различные дни (воспроизводимость для одного и того же индивидуума), оценивали по коэффициенту внутригрупповой корреляции (ICC). Степень сходства, оцениваемая по этим коэффициентам корреляции, была определена как низкая (0,21-0,40), умеренная (0,41-0,60), высокая (0,61-0,80) и почти абсолютная (0,81-1,00). Уровни Αβ для различных диагностических групп сравнивали с помощью U-критерия Манна-Уитни. Для оценки корреляций между непрерывными переменными применяли анализ Спирмана. Для отклонения нулевой гипотезы необходимо, чтобы p<0,05. Все статистические анализы, включая оценку диагностической точности, осуществляли с использованием компьютерной программы SAS 9.1. Графики, представленные на фиг. 1-3, строили с использованием статистической компьютерной программы PASW.
Нижеследующие показатели достоверности и надежности маркеров амилоидных бета-пептидов были оценены в скрининг-тесте для пациентов с БА, MCI и HC.
Для каждого указанного и определенного маркера проводили анализ, конкретно описанный ниже, а участников разделяли на группы: здоровые индивидуумы (контроль) - пациенты с БА; здоровые индивидуумы (контроль) - пациенты с MCI и пациенты с MCI-БА:
Классификация пациентов на группы: пациенты с БА и здоровые индивидуумы (контроль) (TP: истинно положительный; FP: ложноположительный; TN: истинно отрицательный; FN: ложноотрицательный)
Классификация пациентов на группы: пациенты с MCI и здоровые индивидуумы (контроль) (TP: истинно положительный; FP: ложноположительный; TN: истинно отрицательный; FN: ложноотрицательный)
Классификация пациентов на группы: пациенты с БА и пациенты с MCI (TP: истинно положительный; FP: ложноположительный; TN: истинно отрицательный; FN: ложноотрицательный)
Критерии достоверности:
Чувствительность: означает вероятность правильной классификации больных индивидуумов, то есть, вероятность получения положительного результата для больного индивидуума в данном тесте. Поэтому, чувствительность означает способность данного теста диагностировать данное заболевание.
-――――
Специфичность: означает вероятность правильной классификации здоровых индивидуумов, то есть, вероятность получения отрицательного результата для здорового индивидуума. Другими словами, специфичность может быть определена как способность идентифицировать здорового индивидуума.
-――――
Критерии надежности:
Положительное прогностическое значение: означает вероятность наличия заболевания, если данный тест дает положительный результат. Поэтому предсказанное положительное значение может быть определено исходя из числа пациентов с положительным результатом теста, которые, в конечном счете, заболевали данным заболеванием:
-――――
Отрицательное прогностическое значение: означает вероятность того, что индивидуум с отрицательным результатом теста является фактически здоровым. Это значение может быть определено путем деления числа истинно отрицательных результатов на общее число пациентов с отрицательным результатом теста:
-――――
Помимо таких понятий, как чувствительность, специфичность и прогностические значения, могут быть рассмотрены еще и такие понятия, как отношение правдоподобия, отношение вероятностей или отношение шансов. Последний параметр означает более вероятный конкретный (положительный или отрицательный) результат с точки зрения наличия или отсутствия заболевания.
Положительное отношение правдоподобия или положительное отношение шансов: это отношение вычисляют путем деления вероятности положительного результата у больных пациентов на вероятность положительного результата у здоровых индивидуумов. Короче говоря, это отношение представляет собой отношение числа истинно положительных результатов (чувствительность) к числу ложноположительных результатов (1-специфичность):

Отрицательное отношение правдоподобия или отрицательное отношение шансов: это отношение вычисляют путем деления вероятности отрицательного результата в отношении наличия заболевания на вероятность отрицательного результата в отношении отсутствия заболевания. Поэтому, это отношение вычисляют как отношение числа ложноотрицательных результатов (1-чувствительность) к числу истинно отрицательных результатов (специфичность):
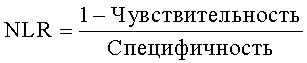
Кривая ROC представлена в виде графика, а площадь под кривой ROC с 95% ДИ, реальная классификация в соответствии с параметром (больных/здоровых) пациентов, величины чувствительности, величины специфичности, положительное прогностическое значение и отрицательное прогностическое значение с 95% ДИ представлены в таблицах.
Все статистические тесты были проведены с уровнем значимости 0,05.
Пример 8
Воспроизводимость результатов измерений Αβ, полученных в различных лабораториях
Шестнадцать произвольно отобранных образцов, взятых от любого участника, и их экстракты посылали в две независимые лаборатории для оценки воспроизводимости результатов измерений, полученных в различных лабораториях. Все маркеры действовали аналогичным образом в соответствии с CCC, который варьировался от 0,84 до 0,99 (общий 95% IC составлял от 0,73 до 0,99), что соответствовало, во всех случаях, степени сходства, оцениваемой как высокая степень сходства или почти абсолютное сходство (фиг. 1).
Средняя внутрианалитическая воспроизводимость результатов измерений для шести маркеров, проводимых в каждой лаборатории, выражаемая как коэффициент вариабельности для лунок с тремя повторностями, составляла 4,31, 5,83 и 8,34 (таблица 6). Предел детектирования в данных анализах, проводимых в трех лабораториях, составлял 5,31, 3,63 и 1,91 пг/мл для Αβ1-40 и 2,37, 2,04 и 2,45 пг/мл для Αβ1-42.
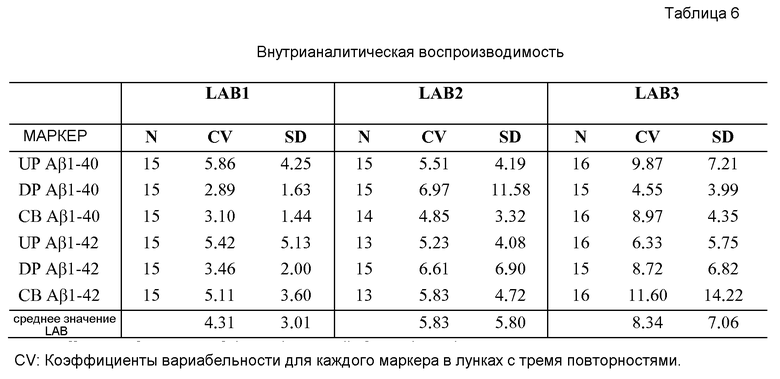
Пример 9
Внутрииндивидуальная воспроизводимость результатов измерений Αβ
Воспроизводимость результатов измерений Αβ при четырех еженедельных заборах крови (BS1-BS4), измеренная по ICC, варьировалась от высокой до почти абсолютной для всех прямых маркеров в трех группах (таблица 7). В среднем, для трех диагностических групп, более высокий ICC соответствовал результатам измерений Αβ1-40 и Αβ1-42 в DP (0,93, 95% ДИ = 0,98-0,80 и 0,93, 95% ДИ = 0,98-0,78; соответственно).
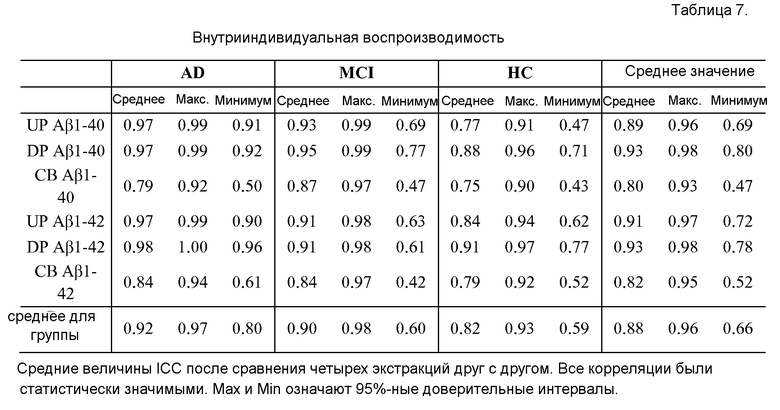
Пример 10
Сравнение диагностических групп
В соответствии с высокой внутрииндивидуальной воспроизводимостью результатов измерений сравнение между группами участников давало одну и ту же картину для четырех проб крови, взятых в различные дни (BS1-BS4), хотя некоторые p-величины для этих проб крови (BS) варьировались очень незначительно. Нижеследующее описание дано на основе измерений BS4.
Первый неожиданный результат заключался в том, что концентрация Αβ1-40 и Αβ1-42, измеренная в неразведенной плазме (UP), составляла примерно лишь 1/3 и 1/4, соответственно, от уровней в разведенной плазме (DP) для всех диагностических групп (таблица 8).
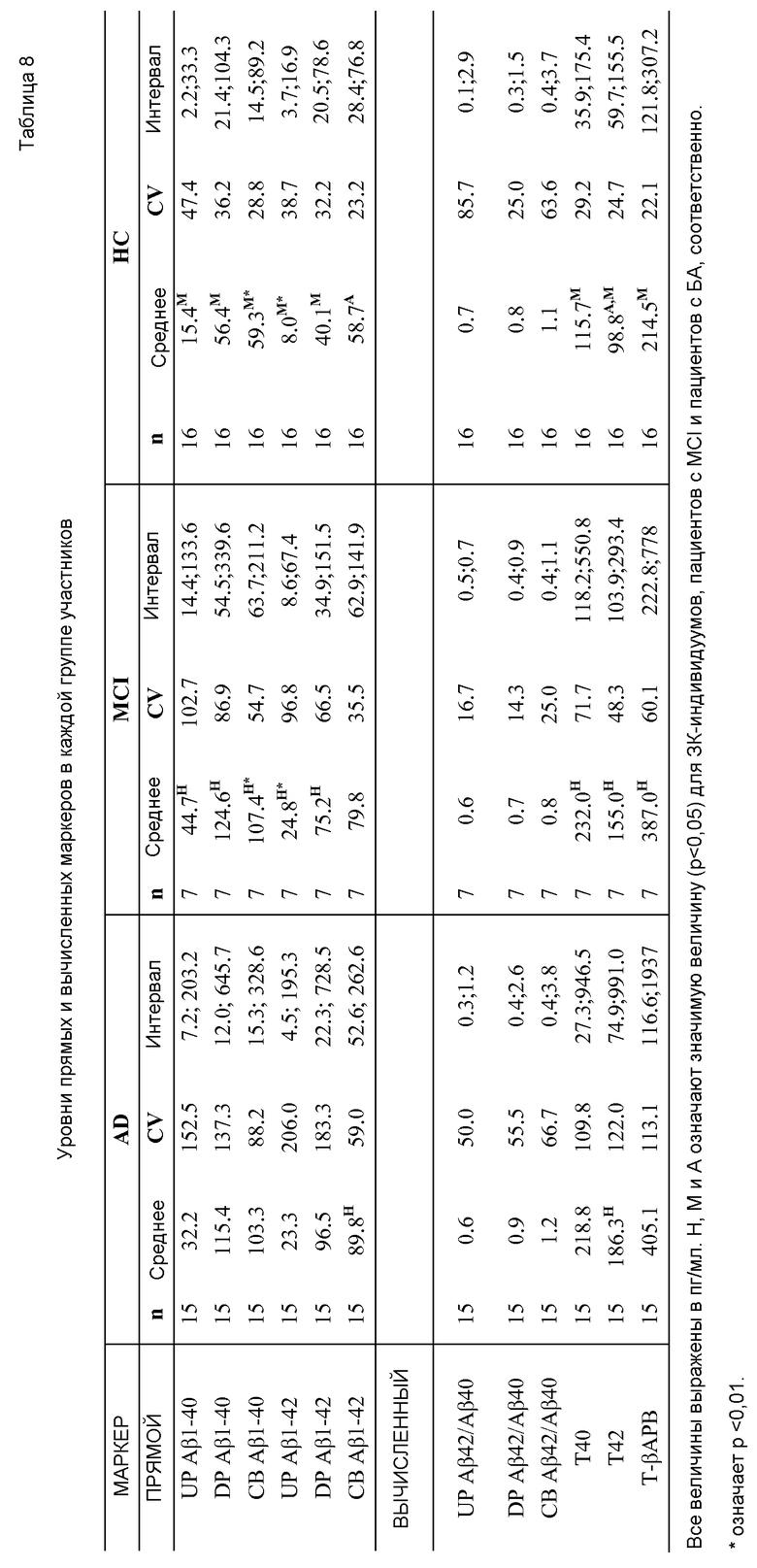
Во-вторых, было обнаружено, что уровни пептида, связанного с клетками (CB), непосредственно измеренные в клеточной фракции пробы крови, были аналогичны уровням, измеренным в DP. Кроме того, уровни Αβ1-40 и Αβ1-42 четко коррелировали с уровнями, измеренными в UP, DP или в CB-фракции (r = 0,58, 0,71 и 0,71, соответственно; p<0,001). Значимые корреляции были также обнаружены между любыми парами из шести маркеров, непосредственно проанализированных в образцах (Αβ1-40 и Aβ1-42 в UP, DP, CB; ( таблица 9)).
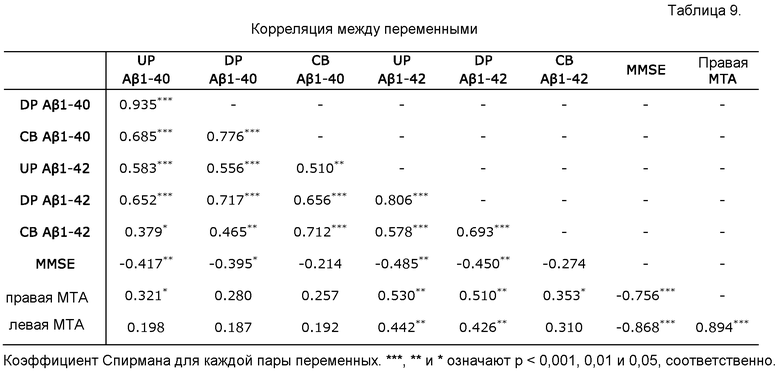
Кроме того, авторами настоящего изобретения было обнаружено, что у пациентов с MCI и БА уровни каждого маркера выше, чем у здоровых индивидуумов контрольной группы (фиг.2, таблица 8). Такое увеличение достигало статистической значимости у группы пациентов с MCI и у НС-группы для трех маркеров Αβ1-40 (UP, DP и CB, уровни которых увеличивались в 2,9, 2,2 и 1,8 раз, соответственно) и для двух маркеров Αβ1-42 плазмы (UP и DP, уровни которых увеличивались в 3,1 и 1,8 раз, соответственно). Средний уровень каждого маркера в группе с БА был почти аналогичен его среднему уровню в группе с MCI, и каких-либо значимых различий между этими двумя группами пациентов не наблюдалось. Аналогичным образом, каких-либо статистических различий между группой пациентов с БА и группой здоровых контрольных пациентов не наблюдалось, за исключением уровней CB-Αβ1-42 (фиг. 2). Такое отсутствие значимости, по всей вероятности, обусловлено широким диапазоном отдельных измерений внутри группы с БА (n=16), что давало коэффициенты вариабельности (CV) в 1,5-2,7 раз больше, чем в группе с MCI (n=8), и в 2,5-5,7 раз больше, чем в группе HC (n=16), для каждого маркера (таблица 8).
Маркеры плазмы Αβ1-40 и Αβ1-42 (UP и DP), но не CB, значимо коррелировали с MMSE (таблица 9), хотя их уровень может быть отчасти завышен, поскольку кластеризация HC имеет тенденцию к увеличению пунктуации. Действительно, при исключении участников с MMSE ≥ 26, уровни Αβ1-40 и Αβ1-42 у некоторых пациентов с тяжелыми патологиями (MMSE ≤ 21, n=5) были ниже, чем у пациентов с умеренной патологией (MMSE 22-25, n=12), хотя это различие не достигало статистической значимости (данные не приводятся). Кроме того, три маркера Αβ1-42, но не Αβ1-40, обнаруживали значимую корреляцию со степенью атрофии медиальной части височной области в правом и левом полушарии (таблица 9).
Авторами настоящего изобретения также рассматривалось несколько маркеров, вычисленных из маркеров, непосредственно проанализированных в образцах. Помимо обычных отношений Αβ1-42/Αβ1-40, наибольший интерес представляет сумма DP+CB-Αβ1-40 и сумма DP+CB-Αβ1-42, которые были обозначены авторами как общий Αβ1-40 (T40) и общий Αβ1-42 (T42), соответственно, и сумма этих двух величин, которые были обозначены авторами как общий βΑΡΒ (Τ-βΑΡΒ). Отношения Αβ1-42/Αβ1-40, измеренные для UP, DP или CB, не обнаруживали значимых различий между группами. Однако в MCI-группе, уровни T40, T42 и T-βΑΡΒ возрастали в 2,0, 1,5 и 1,8 раз по сравнению с уровнями в группе здоровых контрольных индивидуумов (p≤0,03) (таблица 4). Аналогичное среднее увеличение этих уровней наблюдалось у здоровых контрольных индивидуумов (HC) и у пациентов с БА, но в этом случае статистическую значимость давал только T42 (фиг. 2).
Пример 11
Диагностические признаки прямых и вычисленных маркеров
Прямые и вычисленные параметры, упомянутые в таблице 10, были определены методами, описанными в предыдущих примерах.
Список прямых и вычисленных параметров, которые были проанализированы во время исследования
Прогностическое значение вышеуказанных параметров было протестировано для:
(i) установления диагноза болезни Альцгеймера (путем сравнения образцов, взятых у здоровых индивидуумов, с образцами, взятыми у пациентов с болезнью Альцгеймера, БА/HC),
(ii) установления диагноза слабого нарушения познавательных способностей и стадии, предшествующей болезни Альцгеймера (путем сравнения образцов, взятых у здоровых индивидуумов, с образцами, взятыми у пациентов, страдающих слабым нарушением познавательных способностей, MCI/HC), и
(iii) дифференциации слабого нарушения познавательных способностей от болезни Альцгеймера (путем сравнения образцов, взятых у пациентов, страдающих слабым нарушением познавательных способностей, с образцами, взятыми у пациентов с болезнью Альцгеймера, MCI/БА).
Диагностические свойства этих анализов оценивали путем логистического анализа результатов измерений Αβ и клинического диагноза, рассматриваемого как «золотой стандарт». Результаты, относящиеся к чувствительности, специфичности, положительному прогностическому значению (PPV), отрицательному прогностическому значению (NPV), точности и к площади под кривой рабочей характеристики приемника (кривой ROC), систематизированы в таблице 11.
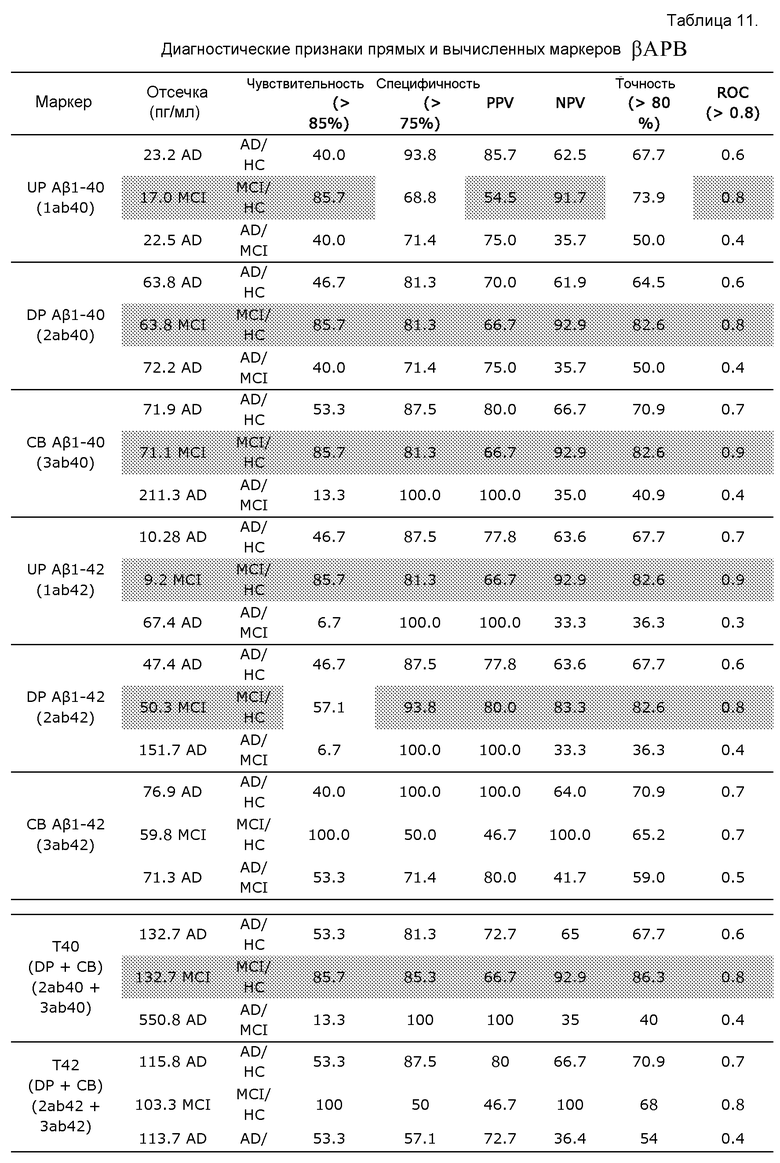
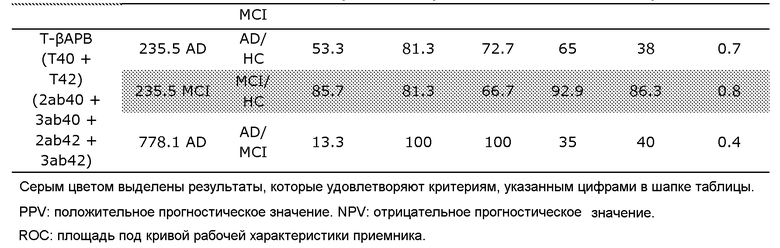
Большинство прямых маркеров и два вычисленных маркера (T40 и Τ-βΑΡΒ) удовлетворяют критериям, рассматриваемым как подходящие для дифференциации пациентов с MCI от здоровых контрольных индивидуумов (ЗК), и эти маркеры представляют наибольший интерес с любой практической точки зрения, особенно когда необходимо установить более точный диагноз. Таким образом, все прямые маркеры, за исключением CB Αβ1-42, представленного на кривой ROC ≥ 0,8, и четыре из этих маркеров (DP Αβ1-40, CB Αβ1-40, UP Αβ1-42 и DP Αβ1-42) дают точность >80%, что означает, что 80% от всех результатов теста являются правильными по сравнению с клиническим «золотым стандартом» (фиг. 3). Вычисленные маркеры T40 и Τ-βΑΡΒ давали одинаковую точность в случае дифференциации группы с MCI от группы HC, в отличие от прямых маркеров, а маркер T42 давал менее надежный результат (фиг. 3). Из-за высокой вариабельности результатов измерений Αβ между индивидуумами в группе с БА не было обнаружено какой-либо критической точки, при которой эти маркеры могли бы дифференцировать пациентов с БА от индивидуумов двух других групп с приемлемой чувствительностью и специфичностью (фиг. 3).
Пример 12
Другими параметрами, указывающими на самую высокую чувствительность и специфичность, и подходящими для их применения в настоящем изобретении, являются параметры, представленные в таблице 12.

Были разработаны способы, которые являются особенно подходящими для дифференциации индивидуумов со слабым нарушением познавательной способности от здоровых индивидуумов, и в которых используются: маркер 1ab40 (фигура 4), маркер 2ab40 (фигура 5), маркер 3ab40 (Фигура 6), маркер 1ab42 (фигура 7), маркер 2ab42 (фигура 8), маркер 3ab42 (фигуры 9 и 10), маркер 2ab40+3ab40 (фигура 11), маркер 2ab42+3ab42 (фигура 12), 2ab42+3ab42 (фигура 13) и 2ab40+3ab40+2ab42+3ab42 (фигура 14).








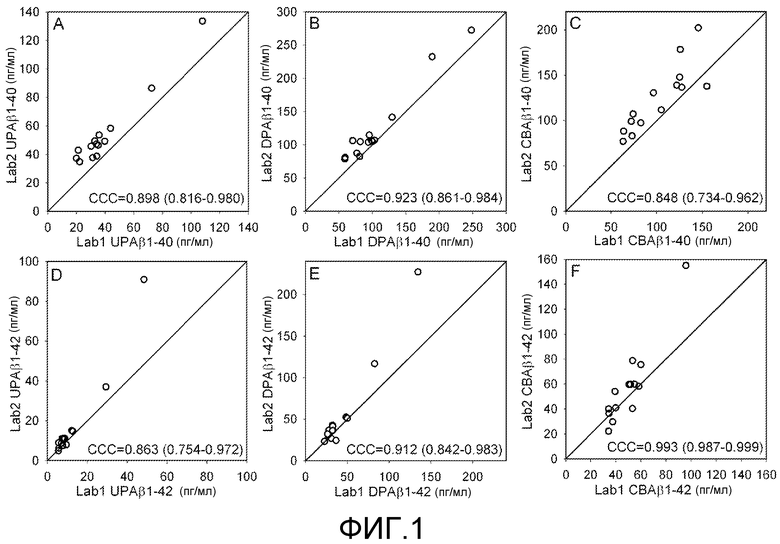
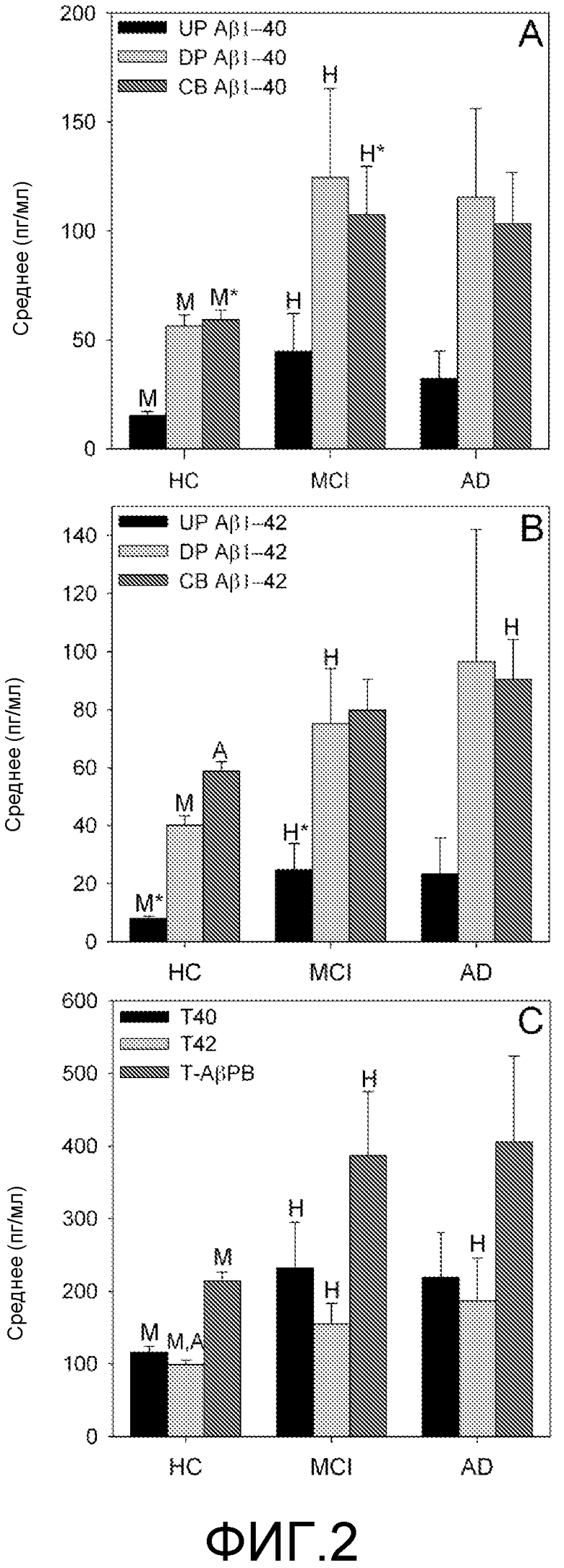
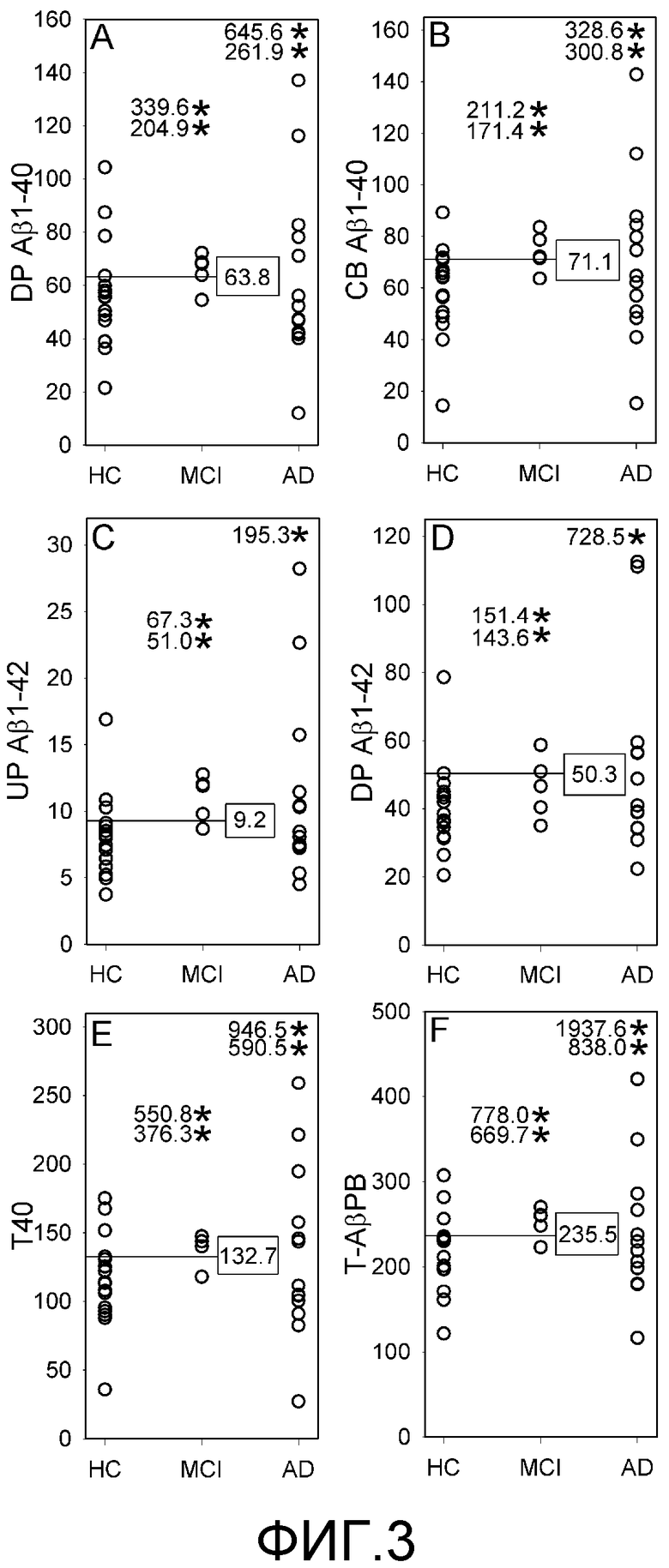
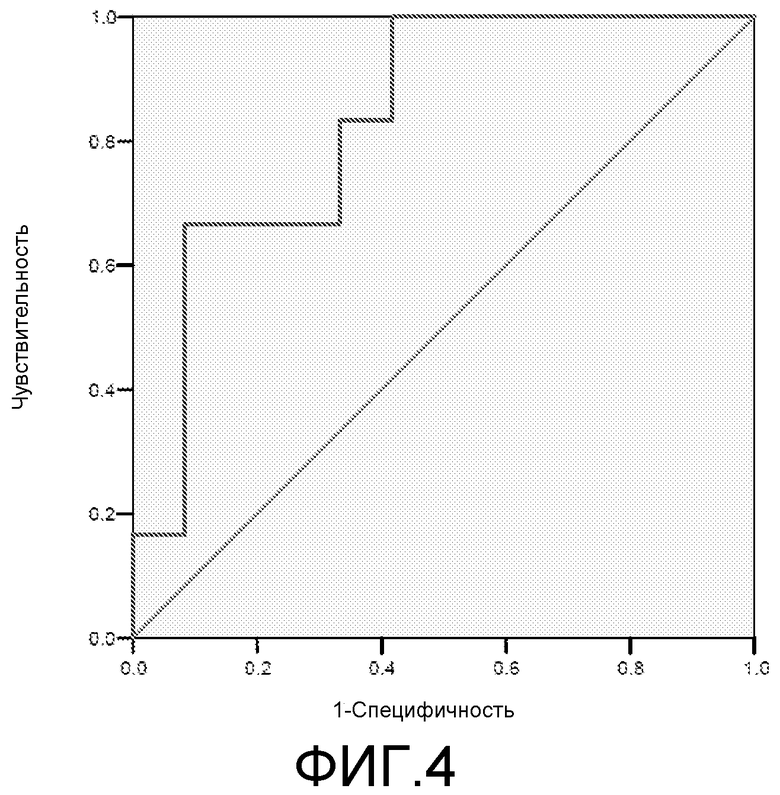
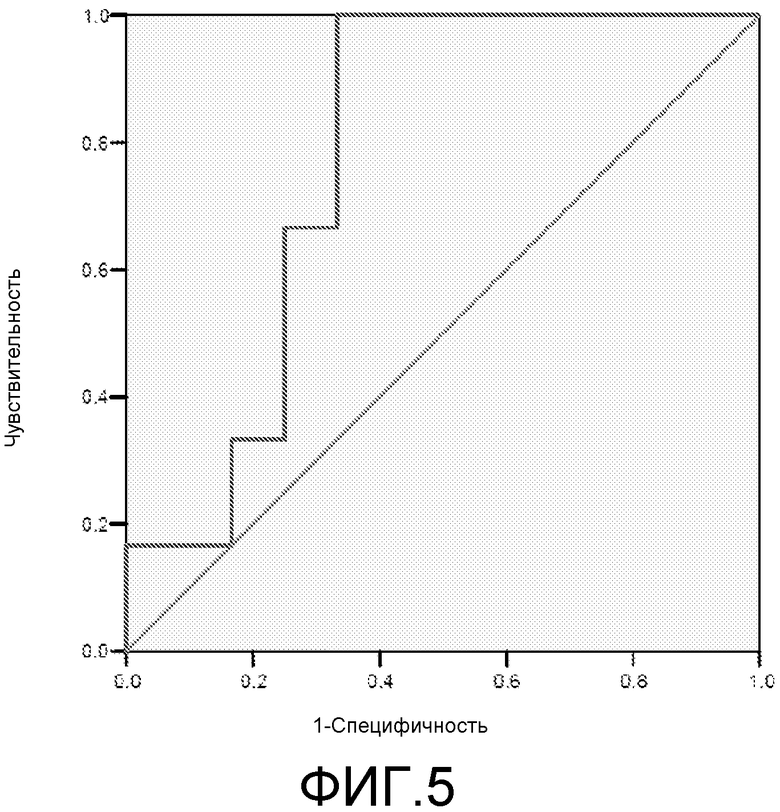

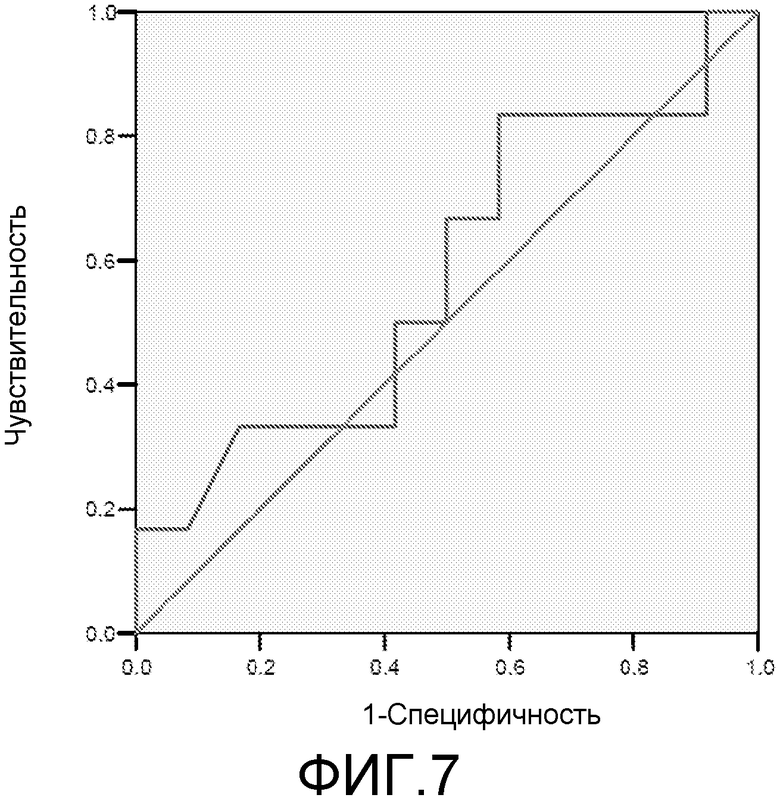
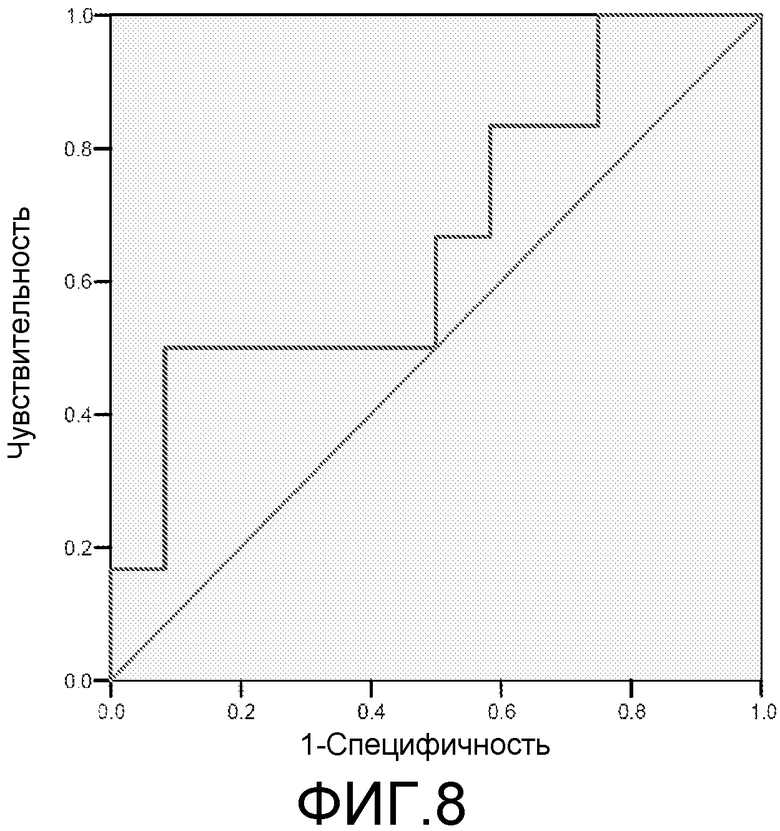
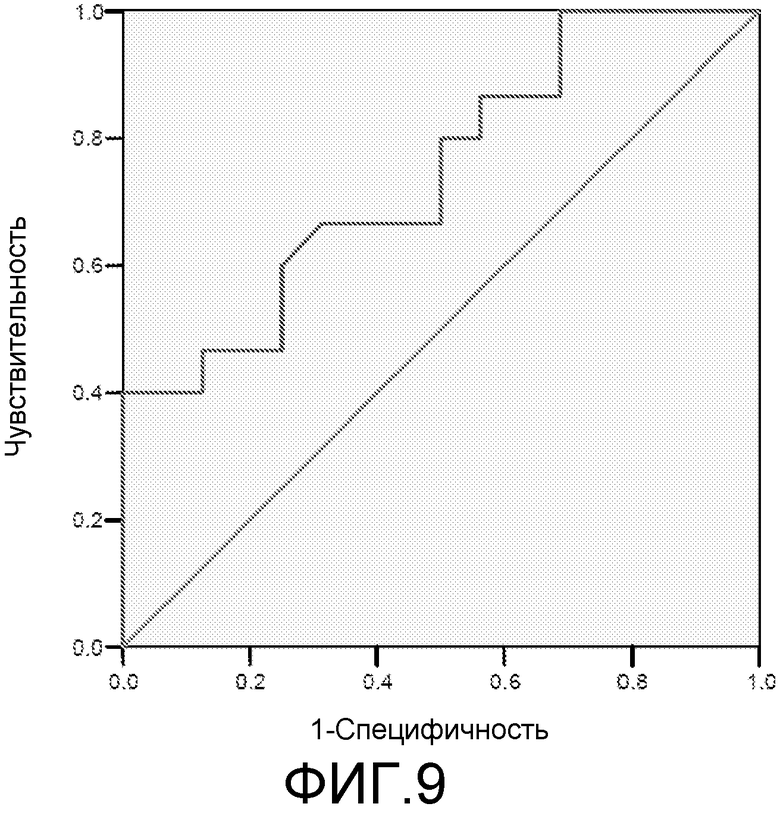
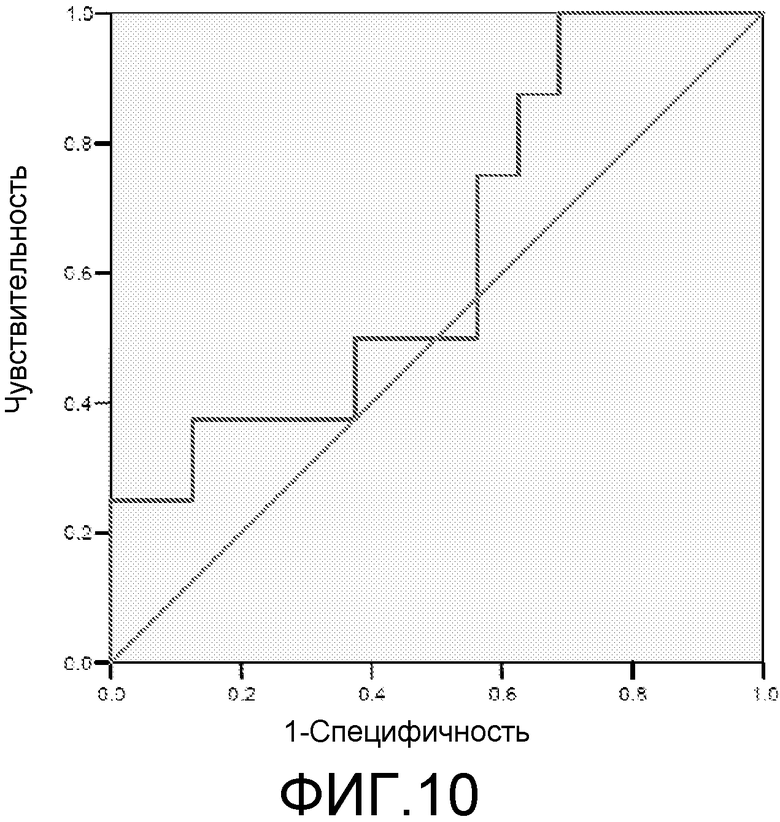

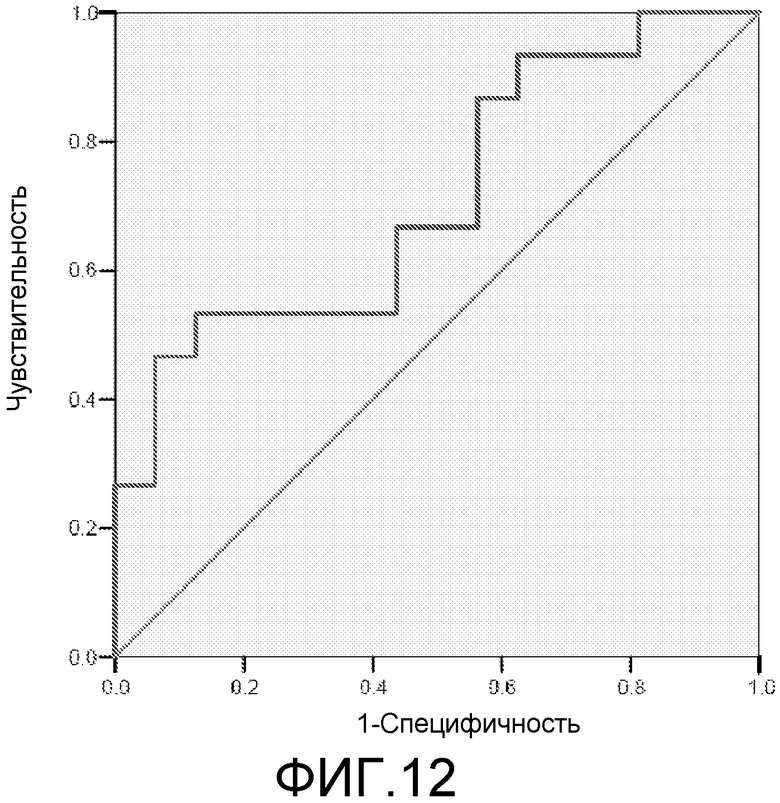
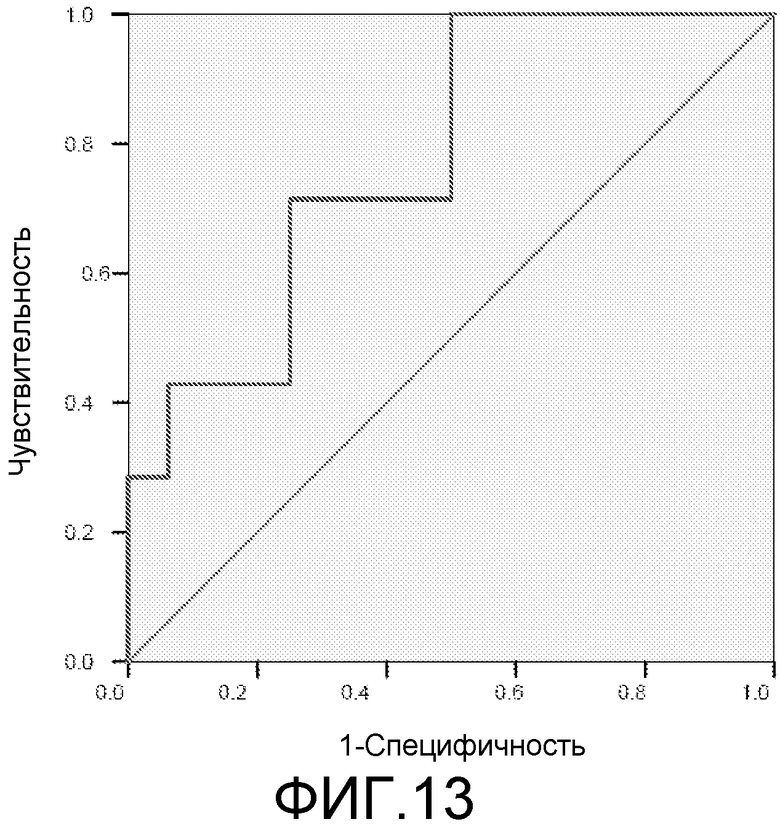
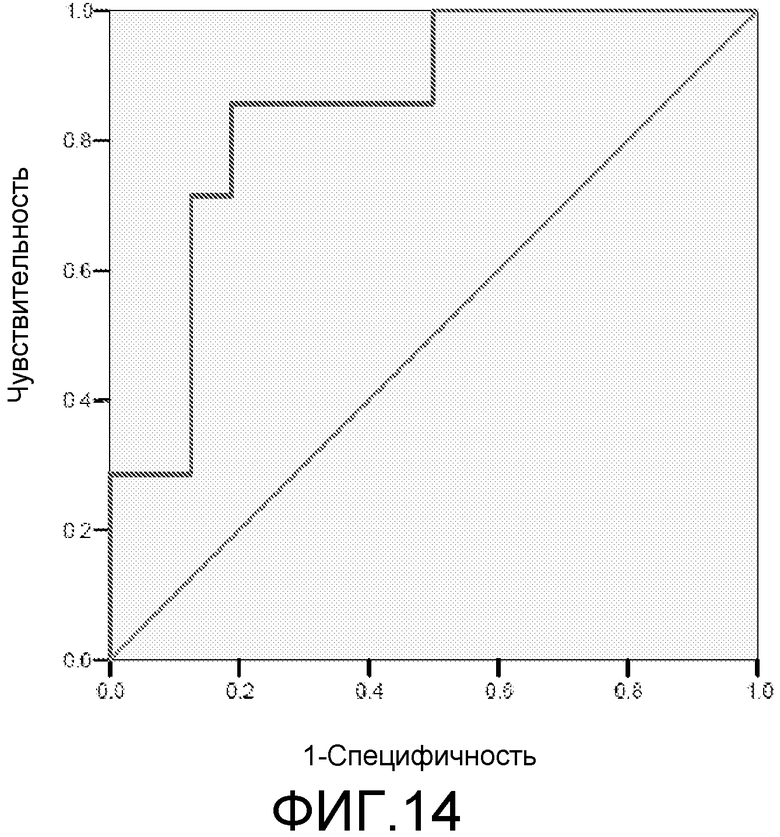
Группа изобретений относится к медицине и касается способа диагностики нейродегенеративного заболевания у индивидуума, включающего стадии (i) определения одного или нескольких параметров, выбранных из группы, состоящей из 3ab40 или величины вычисленного параметра, выбранного из группы, состоящей из 2ab40+3ab40, 2ab40+3ab40+2ab42+3ab42 и 1ab40+2ab40+1ab42+2ab42; (ii) сравнения величины параметра с эталонной величиной, соответствующей величине указанного параметра в эталонном образце; и (iii) диагностики нейродегенеративного заболевания, в случае, если наблюдается увеличение величины параметра по сравнению с эталонной величиной. Группа изобретений также касается способа детектирования стадии, предшествующей нейродегенеративному заболеванию; способа дифференциации нейродегенеративного заболевания от стадии, предшествующей указанному нейродегенеративному заболеванию. Группа изобретений обеспечивает высокую чувствительность и специфичность способов детектирования. 3 н. и 10 з.п. ф-лы, 12 пр., 14 ил., 12 табл.
1. Способ диагностики нейродегенеративного заболевания у индивидуума, включающий следующие стадии:
(i) определения одного или нескольких параметров, выбранных из группы, состоящей из:
(a) 3ab40 или
(b) величины вычисленного параметра, выбранного из группы, состоящей из 2ab40+3ab40, 2ab40+3ab40+2ab42+3ab42 и 1ab40+2ab40+1ab42+2ab42;
(ii) сравнения величины параметра (а) или величины вычисленного параметра (b) с эталонной величиной, соответствующей величине указанного параметра (а) или указанного вычисленного параметра (b) в эталонном образце,
где эталонная величина, используемая на стадии (ii) для сравнения величины параметра или величины вычисленного параметра, выбрана из группы, состоящей из:
(i) 71,9 пг/мл для параметра 3ab40,
(ii) 132,7 пг/мл для параметра 2ab40+3ab40,
(iii) 235,5 пг/мл для параметра 2ab40+3ab40+2ab42+3ab42,
(iv) 158,3 пг/мл для параметра 1ab40+2ab40+1ab42+2ab42; и
(iii) диагностики нейродегенеративного заболевания, в случае, если наблюдается увеличение величины параметра или величины вычисленного параметра по сравнению с эталонной величиной,
где указанным биологическим образцом является плазма или кровь,
где нейродегенеративным заболеванием является болезнь Альцгеймера и
где
1ab40 соответствует уровню свободного пептида АВЕТА40 в биологическом образце указанного индивидуума;
1ab42 соответствует уровню свободного пептида АВЕТА42 в биологическом образце указанного индивидуума;
2ab40 соответствует уровню агрегатов свободного пептида АВЕТА40 в биологическом образце указанного индивидуума и пептида АВЕТА40, ассоциированного с компонентами указанного биологического образца, где 2ab40 определяют путем вычисления количества пептида АВЕТА40 в указанном образце после контактирования указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации пептида АВЕТА40 из компонентов, присутствующих в биологическом образце;
2ab42 соответствует уровню агрегатов свободного пептида АВЕТА42 в биологическом образце указанного индивидуума и пептида АВЕТА42, ассоциированного с компонентами указанного биологического образца, где 2ab42 определяют путем вычисления количества пептида АВЕТА42 в указанном образце после контактирования указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации пептида АВЕТА42 из компонентов, присутствующих в биологическом образце;
3ab40 соответствует уровню пептида АВЕТА40, ассоциированного с клетками в биологическом образце указанного индивидуума, где 3ab40 определяют путем вычисления количества пептида АВЕТА40 после контактирования клеточной фракции указанного биологического образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидных бета-пептидов из клеток, присутствующих в указанном образце; и
3ab42 соответствует уровню пептида АВЕТА42, ассоциированного с клетками в биологическом образце указанного индивидуума, где 3ab42 определяют путем вычисления количества пептида АВЕТА42 после контактирования клеточной фракции указанного биологического образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидных бета-пептидов из клеток, присутствующих в указанном образце.
2. Способ детектирования стадии, предшествующей нейродегенеративному заболеванию, где указанный способ включает стадии:
(i) определения одного или нескольких параметров, выбранных из группы, состоящей из:
(a) 3ab40 или
(b) величины вычисленного параметра, выбранного из группы, состоящей из 2ab40+3ab40, 2ab40+3ab40+2ab42+3ab42 и 1ab40+2ab40+lab42+2ab42;
(ii) сравнения величины параметра (а) или величины вычисленного параметра (b) с эталонной величиной, соответствующей величине указанного параметра (а) или указанного вычисленного параметра (b) в эталонном образце,
где эталонная величина, используемая на стадии (ii) для сравнения величины параметра или величины вычисленного параметра, выбрана из группы, состоящей из:
(i) 71,1 пг/мл для параметра 3ab40,
(ii) 132,7 пг/мл для параметра 2ab40+3ab40,
(iii) 235,5 пг/мл для параметра 2ab40+3ab40+2ab42+3ab42,
(iv) 142,4 пг/мл для параметра 1ab40+2ab40+lab42+2ab42;
и
(iii) детектирования стадии заболевания, предшествующей нейродегенеративному заболеванию, в случае, если наблюдается увеличение величины параметра или величины вычисленного параметра по сравнению с эталонной величиной,
где указанным биологическим образцом является плазма или кровь,
где стадией, предшествующей нейродегенеративному заболеванию, является слабое нарушение познавательных способностей, и
где
1ab40 соответствует уровню свободного пептида АВЕТА40 в биологическом образце указанного индивидуума;
1ab42 соответствует уровню свободного пептида АВЕТА42 в биологическом образце указанного индивидуума;
2ab40 соответствует уровню агрегатов свободного пептида АВЕТА40 в биологическом образце указанного индивидуума и пептида АВЕТА40, ассоциированного с компонентами указанного биологического образца, где 2ab40 определяют путем вычисления количества пептида АВЕТА40 в указанном образце после контактирования указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации пептида АВЕТА40 из компонентов, присутствующих в биологическом образце;
2ab42 соответствует уровню агрегатов свободного пептида АВЕТА42 в биологическом образце указанного индивидуума и пептида АВЕТА42, ассоциированного с компонентами указанного биологического образца, где 2ab42 определяют путем вычисления количества пептида АВЕТА42 в указанном образце после контактирования указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации пептида АВЕТА42 из компонентов, присутствующих в биологическом образце;
3ab40 соответствует уровню пептида АВЕТА40, ассоциированного с клетками в биологическом образце указанного индивидуума, где 3ab40 определяют путем вычисления количества пептида АВЕТА40 после контактирования клеточной фракции указанного биологического образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидных бета-пептидов из клеток, присутствующих в указанном образце; и
3ab42 соответствует уровню пептида АВЕТА42, ассоциированного с клетками в биологическом образце указанного индивидуума, где 3ab42 определяют путем вычисления количества пептида АВЕТА42 после контактирования клеточной фракции указанного биологического образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидных бета-пептидов из клеток, присутствующих в указанном образце.
3. Способ дифференциации нейродегенеративного заболевания от стадии, предшествующей указанному нейродегенеративному заболеванию, где указанный способ включает стадии:
(i) определения одного или нескольких параметров, выбранных из группы, состоящей из:
(a) 3ab40 или
(b) величины вычисленного параметра, выбранного из группы, состоящей из 2ab40+3ab40, 2ab40+3ab40+2ab42+3ab42 и 1ab40+2ab40+1ab42+2ab42;
(ii) сравнения величины параметра (а) или величины вычисленного параметра (b) с эталонной величиной, соответствующей величине указанного параметра (а) или указанного вычисленного параметра (b) в эталонном образце,
где эталонная величина, используемая на стадии (ii) для сравнения величины параметра или величины вычисленного параметра, выбрана из группы, состоящей из:
(i) 211,3 пг/мл для параметра 3ab40,
(ii) 550,8 пг/мл для параметра 2ab40+3ab40,
(iii) 778,1 пг/мл для параметра 2ab40+3ab40+2ab42+3ab42,
(iv) 161,2 пг/мл для параметра 1ab40+2ab40+lab42+2ab42;
и
(iii) дифференциации нейродегенеративного заболевания от стадии, предшествующей указанному нейродегенеративному заболеванию, в случае, если наблюдается увеличение величины параметра или величины вычисленного параметра по сравнению с эталонной величиной,
где указанным биологическим образцом является плазма или кровь,
где нейродегенеративным заболеванием является болезнь Альцгеймера, и стадией, предшествующей нейродегенеративному заболеванию, является слабое нарушение познавательных способностей, и
где
1ab40 соответствует уровню свободного пептида АВЕТА40 в биологическом образце указанного индивидуума;
1ab42 соответствует уровню свободного пептида АВЕТА42 в биологическом образце указанного индивидуума;
2ab40 соответствует уровню агрегатов свободного пептида АВЕТА40 в биологическом образце указанного индивидуума и пептида АВЕТА40, ассоциированного с компонентами указанного биологического образца, где 2ab40 определяют путем вычисления количества пептида АВЕТА40 в указанном образце после контактирования указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации пептида АВЕТА40 из компонентов, присутствующих в биологическом образце;
2ab42 соответствует уровню агрегатов свободного пептида АВЕТА42 в биологическом образце указанного индивидуума и пептида АВЕТА42, ассоциированного с компонентами указанного биологического образца, где 2ab42 определяют путем вычисления количества пептида АВЕТА42 в указанном образце после контактирования указанного образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации пептида АВЕТА42 из компонентов, присутствующих в биологическом образце;
3ab40 соответствует уровню пептида АВЕТА40, ассоциированного с клетками в биологическом образце указанного индивидуума, где 3ab40 определяют путем вычисления количества пептида АВЕТА40 после контактирования клеточной фракции указанного биологического образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидных бета-пептидов из клеток, присутствующих в указанном образце; и
3ab42 соответствует уровню пептида АВЕТА42, ассоциированного с клетками в биологическом образце указанного индивидуума, где 3ab42 определяют путем вычисления количества пептида АВЕТА42 после контактирования клеточной фракции указанного биологического образца с белок-солюбилизирующим агентом в условиях, подходящих для стимуляции диссоциации амилоидных бета-пептидов из клеток, присутствующих в указанном образце.
4. Способ по любому из пп. 1-3, где указанным белок-солюбилизирующим агентом является детергент.
5. Способ по любому из пп. 1-3, где стадию определения по меньшей мере одного или нескольких 1ab40, 1ab42, 2ab40, 2ab42, 3ab40 и 3ab42 осуществляют иммунологическим методом.
6. Способ по п. 5, где указанным иммунологическим методом является ELISA-анализ.
7. Способ по п. 6, где указанным ELISA-анализом является «сэндвич»-ELISA-анализ.
8. Способ по п. 7, где антителом для захвата в «сэндвич»-ELISA-анализе является антитело против N-концевой области амилоидного бета-пептида.
9. Способ по п. 8, где антитело против N-концевой области амилоидного бета-пептида направлено против эпитопа, локализованного в положениях аминокислот 1-7 АВЕТА40 и АВЕТА42.
10. Способ по любому из пп. 6-9, где детектирующим антителом в «сэндвич»-ELISA-анализе является антитело, специфичное к эпитопу, локализованному в C-концевой области амилоидного бета-пептида.
11. Способ по п. 10, где антитело, специфичное к C-концевой области амилоидного бета-пептида, выбрано из группы, состоящей из:
(i) поликлонального антитела против пептида, соответствующего C-концевой области пептида АВЕТА42, где указанное антитело специфически связывается с АВЕТА42, но, по существу, не вступает в какую-либо перекрестную реакцию с АВЕТА40,
(ii) поликлонального антитела против пептида, соответствующего C-концевой области пептида АВЕТА40, где указанное антитело специфически связывается с АВЕТА40, но, по существу, не вступает в какую-либо перекрестную реакцию с АВЕТА42,
(iii) антитела, которое распознает одновременно C-концевую область АВЕТА40 и АВЕТА42, и
(iv) комбинации антител по (i) и (ii).
12. Способ по любому из пп. 7-9, где указанное детектирующее антитело также детектируют с использованием реагента, обладающего аффинностью к указанному антителу, которое связывается с первым членом связывающей пары.
13. Способ по п. 12, где детектирование осуществляют с использованием второго члена связывающей пары, связанной с детектируемой меткой.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| LEVINE H., Thioflavine T interaction with synthetic Alzheimer's disease beta-amyloid peptides: detection of amyloid aggregation in solution | |||
| Protein Sci | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
Авторы
Даты
2015-06-27—Публикация
2010-12-13—Подача