Данное изобретение относится к применению эстриола в изготовлении фармацевтического состава для вагинального введения с возможностью самоограничения абсорбции эстриола. Этот состав используется в профилактике и/или лечении урогенитальной атрофии у женщин, которые имеют высокую вероятность развития или которые страдают или страдали от сердечно-сосудистой патологии.
Уровень техники
Эстрогены и другие женские половые гормоны в основном продуцируются в яичниках и действуют на протяжении всей жизни в различных тканях и органах. Клетки этих органов, среди которых выделяются молочные железы и матка, имеют рецепторы для эстрогенов и других гормонов. Эстрогеновые гормоны оказывают свое действие, связываясь с указанными рецепторами и инициируя различные физиологические или патологические процессы. Среди других физиологических функций они отвечают за развитие и изменения, возникающие в грудных железах и матке в различные периоды жизни (половое созревание, беременность, лактация, менопауза). Но эстрогены также могут принимать участие в патологических процессах, вызывая, например, ишемическую болезнь сердца, нарушения мозгового кровообращения или тромбоэмболические заболевания.
Во время женского климакса происходит прогрессивное уменьшение продукции эстрогенов в яичниках, которое обычно сопровождается серией признаков, симптомов и патологий. Главным признаком является исчезновение менструаций (менопауза) и возникновение множественных гормональных и психических симптомов, наиболее распространенными среди которых являются вазомоторные расстройства (приливы и потливость) и мочеполовая атрофия.
Когда продукция эстрогенов снижается, происходит постепенное сокращение вагинальной, уретральной слизистой оболочки и слизистой оболочки мочевого пузыря. Когда атрофия становится более выраженной, возникают генитальные симптомы - зуд и вагинальное жжение, атрофический вагинит, диспареуния и кровоточивость - и урологические симптомы - повторные инфекции, дизурия и недержание мочи. Кроме того, дефицит гормона вызывает сокращение поддерживающей ткани, что может стать причиной выпадения и стрессового недержания мочи.
Хотя урогенитальная атрофия является естественным следствием климакса и менопаузы, связанные расстройства часто влияют на качество жизни женщины, поэтому важно, чтобы врачи рано обнаруживали их присутствие и прописывали лечение.
Следует учитывать, что симптомы вагинальной атрофии и необходимость лечения тем больше, чем дольше женщина находится в постменопаузе. Тем не менее, чем больше возраст, тем больше вероятность развития сердечно-сосудистой патологии, так что риск возникновения тромбоэмболии, коронарных и цереброваскулярных заболеваний увеличивается с возрастом.
Несмотря на то, что эстрогеновая терапия, как правило, очень эффективна в обратном развитии урогенитальной атрофии, вызванной гормональным дефицитом, его применение у женщин с вагинальной атрофией, которые в анамнезе имеют венозную тромбоэмболическую патологию (например, тромбоз глубоких вен или легочную тромбоэмболию) или коронарное или цереброваскулярное заболевание (такое как инфаркт миокарда или инсульт), не рекомендуется из-за рисков, которые оно влечет за собой. По этой же причине также не рекомендуется его применение у женщин, которые имеют высокую вероятность развития сердечно-сосудистых заболеваний, а также у пожилых женщин в постменопаузе.
Хотя урогенитальная атрофия из-за дефицита эстрогена не всегда требует системного лечения с помощью пероральной заместительной гормональной терапии, а скорее предпочтительным является вагинальный путь введения эстрогенов, но нужно принимать во внимание, что этот путь не безопасен. Местно введенные эстрогеновые гормоны могут абсорбироваться и переходить на системный уровень, увеличивая риск возникновения ишемической болезни сердца, нарушений мозгового кровообращения (инсультов) и/или тромбоэмболических заболеваний.
Эстриол является одним из эстрогенов, используемых в лечении урогенитальной атрофии, особенно при вагинальном пути введения. В настоящее время предложенные на рынке вагинальные составы с эстриолом, как правило, назначают в дозе 0,5 мг/сут (500 мкг/сут) в течение первых 2-3 недель лечения, а затем в дозе 0,5 мг 2 или 3 раза/нед, но в связи с риском, который они влекут за собой, их введение не рекомендуется женщинам, страдающим сердечно-сосудистыми заболеваниями или с высокой вероятностью их развития.
Следовательно, помощь при урогенитальной атрофии из-за дефицита эстрогенов у женщин, страдающих ишемической болезнью сердца, инсультом или венозным тромбоэмболическим заболеванием, или у женщин с высокой вероятностью развития сердечно-сосудистых заболеваний, является вопросом, который до сих пор не решен. В частности, это нерешенная проблема для тех женщин в постменопаузе, у которых давно наступила менопауза, т.е. у пожилых женщин.
Краткое описание изобретения
Изобретатели данного изобретения неожиданно обнаружили, что некоторые вагинальные составы с эстриолом образуют систему, способную к самоограничению абсорбции эстриола.
Они обнаружили, что после начала лечения составами данного изобретения, когда вагинальный эпителий атрофирован, наблюдается низкая абсорбция эстриола, что показано площадью под кривой (AUC) плазменной концентрации эстриола в зависимости от времени 1000 пг/мл × час, предпочтительно менее 750 пг/мл х час. После повторного введения этих составов наблюдалось обратное развитие вагинальной атрофии, что неожиданно происходило через несколько дней (от 2 до 15 дней, в частности от 2 до 10 дней, более конкретно от 2 до 7 дней, еще более конкретно от 2 до 5 дней) после начала лечения, абсорбция эстриола была незначительной и площадь под кривой значительно снижалась по сравнению с исходной, становясь менее 500 пг/мл × час, предпочтительно менее 250 пг/мл × час. Таким образом, составы данного изобретения могут быть использованы без риска или со значительно сниженным риском для лечения или профилактики урогенитальной атрофии у женщин с высокой вероятностью развития сердечно-сосудистого заболевания или у женщин, которые страдают или страдали от сердечно-сосудистого заболевания.
Изобретатели данного изобретения также неожиданно обнаружили, что при лечении вагинальной атрофии с помощью коммерчески доступных составов системное воздействие эстриола не вызывает значительных изменений на протяжении всего лечения (хотя в конце эпителий становился эутрофным), в то время как при лечении составами данного изобретения, как уже упоминалось, системное воздействие значительно снижается во время лечения.
Следовательно, введение вагинальным путем составов данного изобретения с эстриолом позволяет предотвращать и/или лечить урогенитальную атрофию из-за дефицита эстрогенов, в то же время оно предотвращает или очень существенно снижает риск, связанный с эстрогеновой терапией, вызывающей сердечно-сосудистые заболевания.
Таким образом, первым аспектом изобретения является применение эстриола в изготовлении фармацевтического состава для вагинального введения с возможностью самоограничения абсорбции эстриола для профилактики и/или лечении урогенитальной атрофии у женщин с высокой вероятностью развития сердечно-сосудистой патологии или страдающих или страдавших от сердечно-сосудистой патологии.
Другими словами, данное изобретение относится к фармацевтическому составу, содержащему эстриол, для вагинального введения с возможностью самоограничения абсорбции эстриола, который будет использоваться для профилактики и/или лечении урогенитальной атрофии у женщин с высокой вероятностью развития сердечно-сосудистой патологии или страдающих или страдавших от сердечно-сосудистой патологии.
Второй аспект данного изобретения относится к способу профилактики или лечения урогенитальной атрофии у женщин, который включает вагинальное введение состава с эстриолом с возможностью самоограничения абсорбции этого гормона, при этом указанные женщины имеют высокую вероятность развития сердечно-сосудистой патологии, либо они страдают или страдали от сердечно-сосудистой патологии.
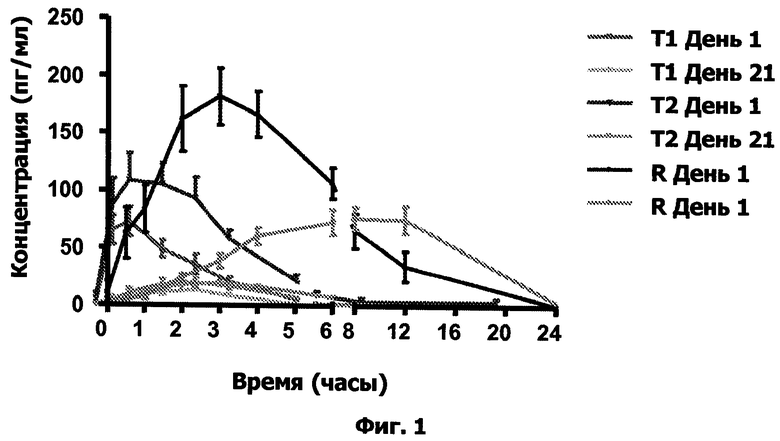
Краткое описание графических материалов Фиг.1. Плазменные концентрации эстриола в зависимости от времени.
Подробное описание изобретения
В контексте данного изобретения женщины, которые имеют в анамнезе сердечно-сосудистое заболевание и/или по меньшей мере один из известных факторов риска, а именно: увеличение возраста (например, женщины старше 50 лет или старше 60 лет), генетическую предрасположенность (например, сердечно-сосудистые заболевания в семейном анамнезе, генетические мутации, связанные с сердечно-сосудистыми заболеваниями), сопутствующие патологии (тяжелые мигрени с аурой, высокое артериальное давление, гиперхолестеринемия, гипертриглицеридемия, инсулин-зависимый диабет, кардиопатия, клапанные пороки сердца и др.) и образ жизни (курение, сидячий образ жизни, ожирение, диета, богатая жирами, и т.д.), считаются женщинами с высокой вероятностью развития сердечно-сосудистых заболеваний (СС3).
В частности, в контексте данного изобретения сердечно-сосудистые патологии включают любые заболевания или расстройства сердечно-сосудистой системы, которые связаны с действием эстрогенов или которые могут рассматриваться как противопоказание к эстрогеновой терапии. Например, ишемическая болезнь сердца (или коронарная кардиопатия), нарушение мозгового кровообращения (сердечно-сосудистое заболевание или инсульт), венозная тромбоэмболия (включая тромбоз глубоких вен и эмболию легочной артерии), поверхностные тромбофлебиты или тромбофилия.
В частности, женщины в постменопаузе, предпочтительно старше 55 лет, более предпочтительно старше 60 лет, еще более предпочтительно старше 65 лет, составляют группу с повышенной вероятностью развития сердечно-сосудистых заболеваний, связанных с эстрогеновой терапией, и могут извлечь пользу из лечения составами данного изобретения с самоограничением абсорбции эстриола.
С другой стороны, женщины, которые имеют в анамнезе венозную тромбоэмболическую патологию (например, тромбоз глубоких вен, тромбоэмболию легочной артерии, поверхностные тромбофлебиты или тромбофилию), коронарные и цереброваскулярные заболевания (такие как инфаркт миокарда или инсульт) или мигрень с аурой, также могут извлечь пользу из лечения составами данного изобретения с самоограничением абсорбции эстриола.
Необходимо четко понимать, что когда говорится об «абсорбции эстриола», это означает абсорбцию эстриола в плазму крови.
Воплощение данного изобретения относится к применению указанного состава с самоограничением абсорбции эстриола для профилактики и/или лечения урогенитальной атрофии у женщин с высокой вероятностью развития сердечно-сосудистой патологии.
Оно также относится к способу профилактики и/или лечения урогенитальной атрофии у женщин с высокой вероятностью развития сердечно-сосудистого заболевания с использованием составов данного изобретения с самоограничением абсорбции эстриола.
Предпочтительное воплощение относится к применению указанных составов у женщин, давно находящихся в постменопаузе (пожилых женщин). В частных воплощениях у указанных женщин менопауза начиналась по меньшей мере за 5 лет, предпочтительно за 10, более предпочтительно за 15, еще более предпочтительно за 20 лет назад и более до начала лечения.
Другое воплощение относится к применению указанных составов с самоограничением абсорбции эстриола для профилактики и/или лечения урогенитальной атрофии у женщин, которые страдают или страдали от сердечно-сосудистой патологии.
Оно также относится к способу профилактики и/или лечения урогенитальной атрофии у женщин, которые страдают или страдали от сердечно-сосудистых заболеваний, с применением составов данного изобретения с самоограничением абсорбции эстриола.
Предпочтительное воплощение относится к применению указанных составов у женщин, предпочтительно у женщин в постменопаузе, которые страдают или страдали от ишемической болезни сердца, инсульта, тромбоза глубоких вен, тромбоэмболии легочной артерии, поверхностных тромбофлебитов, тромбофилии и/или тяжелой мигрени с аурой.
Другое воплощение также относится к способу профилактики сердечно-сосудистых заболеваний на системном уровне, связанном с эстрогеновой терапией, который включает вагинальное введение состава с эстриолом с возможностью самоограничения абсорбции данного гормона.
Как уже упоминалось, фармацевтические составы, используемые в способе лечения данного изобретения, представляют собой такие составы, которые образуют систему с самоограничением абсорбции эстриола. В контексте данного изобретения состав с возможностью самоограничения абсорбции эстриола является таким, что он обеспечивает низкую абсорбцию гормона (пики эстриола в плазме менее 150 пг/мл, предпочтительно менее 125 пг/мл), когда слизистая оболочка влагалища является атрофированной, и незначительную абсорбцию (которая показана пиками плазменного эстриола, близкими к базальным физиологическим значениям у женщин в постменопаузе), когда атрофия обратно развивается из-за местного действия эстриола.
В частности, фармацевтический состав может быть любым, который при его вагинальном введении обеспечивает плазменные пики эстриола менее 50 пг/мл, предпочтительно менее 30 пг/мл, более предпочтительно менее 25 пг/мл, еще более предпочтительно менее или равно 20 пг/мл, после повторного введения один раз в день в течение времени от 1 до 4 недель, в частности от 2 до 3 недель, и после этого срока, если введение продолжается.
В соответствии с предпочтительным воплощением фармацевтический состав данного изобретения может быть любым, который позволяет значительно снизить системное воздействие эстриола (количественно оценивается с помощью AUC плазменной концентрации эстриола в зависимости от времени) после повторного ежедневного введения в течение нескольких дней, когда вагинальная атрофия подвергается обратному развитию. В частности, он может быть любым составом, который обеспечивает AUC менее 1000 пг/мл·час, предпочтительно менее 750 пг/мл·час, более предпочтительно менее 600 пг/мл·час, в начале лечения, более конкретно в первый день лечения, и AUC менее 750 пг/мл·час, предпочтительно менее 500 пг/мл·час, более предпочтительно менее 300 пг/мл·час, еще более предпочтительно менее 250 пг/мл·час, после повторного введения один раз в день в течение времени от 1 до 4 недель, в частности от 2 до 3 недель, и после этого срока, если введение продолжается.
В особенно предпочтительном воплощении фармацевтический состав данного изобретения может быть любым, который делает возможным почти незначительное системное воздействие и одновременно обратное развитие урогенитальной атрофии. В частности, он может быть таким, который обеспечивает AUC меньше или равно 150 пг/мл·час после повторного введения один раз в день в течение времени от 1 до 4 недель, особенно от 2 до 3 недель, и после этого срока, если введение продолжается.
Фармацевтический состав может быть, например, в твердой (свечи, таблетки и т.д.), полутвердой (гели, кремы и т.д.), жидкой форме или в виде пены. Также он может содержать любой из эксципиентов, известных специалистам в данной области.
В соответствии с предпочтительным воплощением фармацевтические композиции данного изобретения являются полутвердыми составами, например, гелями, крем-гелями или кремами.
В предпочтительном воплощении они являются мукоадгезивными гелями, крем-гелями или кремами, содержащими по меньшей мере один биоадгезивный полимер (гелеобразующий агент и/или загуститель) и такое количество эстриола, которое позволяет вводить менее 0,5 мг/сут.
В более предпочтительном воплощении мукоадгезивные составы данного изобретения содержат по меньшей мере два биоадгезивных полимера и такое количество эстриола, которое позволяет вводить менее 0,3 мг/сут, предпочтительно менее 0,1 мг/сут, еще более предпочтительно от 0,07 до 0,002 мг/сут. Например, составы могут содержать эстриол в количестве меньше или равном 0,03% от веса, предпочтительно меньше или равном 0,01% от веса, более предпочтительно от 0007 до 0,0002% от веса, еще более предпочтительно от 0005 до 0001% от веса состава.
Биоадгезивные полимеры, используемые для составов данного изобретения, выбирают среди целлюлозных полимеров, природных смол, альгината натрия, полиоксиэтиленов, акриловых гомо- или сополимеров и их смесей.
Целлюлозные полимеры могут быть выбраны среди метилцеллюлозы, карбоксиметилцеллюлозы натрия (CMC), гидроксиэтилцеллюлозы (НЕС), гидроксипропилцеллюлозы (НРС) и гидроксипропилметилцеллюлозы (НРМС). Природные смолы могут быть выбраны, например, среди гуаровой камеди, камеди карайи, ксантановой смолы и препарата Veegum. Акриловые полимеры предпочтительно выбирают среди полимеров типа акриловой кислоты, поперечно сшитой с дивинилгликолем (поставляется под торговой маркой Noveon® AA-1 Polycarbophil), и полимеров, полученных из акриловой кислоты, поперечно сшитой с аллилсахарозой или аллилпентаэритритом, обозначаемых как полимеры карбомерного типа (поставляются под торговой маркой Carbopol®).
Карбомер является общим названием, принятым рядом учреждений, в том числе Фармакопеей и Национальным формуляром США (USP-NF), Советом США по присвоенным названиям (USAN) и Европейской Фармакопеей, для определения различных типов высоко молекулярных поперечно сшитых полимеров на основе акриловой кислоты, которые представлены на рынке как полимеры Carbopol®. Патенты США №№2798053, 4267103, 5349030, 4996274, 4509949, 5373044 описывают эти полимеры полиакриловой кислоты, в том числе типа Carbopol®, которые включены в данный документ посредством ссылки. Handbook of Pharmaceutical Excipients, 2006, также описывает полимеры типа Carbopol® под заголовком «Carbomer», при этом данная монография также включена в данный документ посредством ссылки.
Полимеры карбомерного типа и поликарбофильный полимер производят путем процесса поперечного сшивания. В зависимости от степени сшивки и условий изготовления существуют различные классы карбопола. Carbopol® 934 Р поперечно сшит с аллилсахарозой и полимеризован в растворителе бензоле. Carbopol 5984 ЕР поперечно сшит с аллилсахарозой и полимеризован в этилацетате и цикпогексане. Carbopol® 71 G, 971 Р, 974 Р поперечно сшиты с аллилпентаэритритом и полимеризованы в этилацетате. Carbopol® 980 и 981 поперечно сшиты с аллилпентаэритритом и полимеризованы в смеси растворителей этилацетата и циклогексана. Поликарбофил является поперечно сшитым полимером в дивинилгликоле и полимеризован в растворителе бензоле или этилацетате. Все полимеры, изготовленные в этилацетате, нейтрализованы 1-3% гидроксидом калия.
Хотя Carbopol® 971 Р и Carbopol® 974 Р производятся в одном и том же процессе в аналогичных условиях, разница между ними заключается в том, что Carbopol® 971 Р (USP29/NF24 карбомер гомополимер типа А) имеет несколько более низкий уровень сшивающего агента, чем Carbopol® 974 Р (USP29/NF24 карбомер гомополимер типа В). В результате Carbopol® 971 NF Р имеет вязкость от 4000 до 11000 сР (измеряется в вискозиметре Brookfield RTV при 20 оборотах в минуту, 25°С, в 0,5% (по весу) слизи, нейтрализованной до рН 7,3-7,8), в то время как Carbopol® 974 NF Р имеет вязкость между 29400 и 39400 сР (измеряется в вискозиметре Brookfield RTV при 20 оборотах в минуту, 25°С, в 0,5% (по весу) слизи, нейтрализованной до рН 7,3-7,8). По тем же причинам Carbopol® 981 NF имеет вязкость между 4000 и 10000 сР (измеряется в вискозиметре Brookfield RTV при 20 оборотах в минуту, 25°С, в 0,5% (по весу) слизи, нейтрализованной до рН 7,3-7,8), тогда как Carbopol® 980 NF имеет вязкость между 40000 и 60000 сР (измеряется в вискозиметре Brookfield RTV при 20 оборотах в минуту, 25°С, в 0,5% (по весу) слизи, нейтрализованной до рН 7,3-7,8).
В еще более предпочтительном воплощении мукоадгезивные составы, используемые в способах данного изобретения, содержат по меньшей мере один полимер карбомерного типа, выбранный среди полимеров акриловой кислоты, поперечно сшитой с аллиловыми эфирами пентаэритрита, по меньшей мере одну полиакриловую кислоту, поперечно сшитую с дивинилгликолем, и эстриол в таком количестве, что оно позволяет вводить менее или равно 0,1 мг/сут.
Полимер карбомерного типа предпочтительно выбирают среди таких полимеров, синтез которых не требует использования бензола в качестве растворителя, например, Carbopol® 71 G NF, Carbopol® 971 Р NF, Carbopol® 974 P NF, Carbopol® 980 NF, Carbopol® 981 NF и Carbopol® 5984 EP. Более предпочтительно полимер карбомерного типа выбирают среди полимеризованных в этилацетате или в смеси этилацетата и циклогексана. Еще более предпочтительно полимер карбомерного типа выбирают среди полимеризованных в этилацетате или в смеси этилацетата и циклогексана и с вязкостью между 4000 и 11000 сР.
В особенно предпочтительном воплощении составы содержат по меньшей мере два биоадгезивных полимера, один является гомополимером карбомерного типа, выбранным среди Carbopol® 971 Р NF и Carbopol® 981 NF, а другой является Noveon® AA-1 Polycarbophil, и количество эстриола, меньшее или равное 0,03% от веса состава.
В более предпочтительном воплощении составы содержат по меньшей мере поликарбофил Noveon® AA-1 и Carbopol® 971 Р NF и количество эстриола, меньшее или равное 0,03% от веса состава.
Каждый полимер включен в количестве, необходимом для создания состава с физико-химическими и органолептическими свойствами, подходящими для вагинального введения. В случае акриловых полимеров количество будет составлять от 0,05 до 5% от веса препарата, предпочтительно от 0,1 до 2%, более предпочтительно от 0,25 до 1,5%.
Состав также может содержать другие фармацевтически приемлемые эксципиенты, такие как увлажняющие агенты, смачивающие агенты, солюбилизирующие агенты, эмульгаторы, консерванты, жирные или липофильные вещества и т.д., в количествах, известных специалистам в данной области.
Указанные составы могут быть изготовлены в процессах, известных специалистам в данной области.
Составы, используемые в способах данного изобретения, предпочтительно вводят в количестве, достаточном для формирования слоя по всей вагинальной поверхности и для получения эффективного и безопасного режима дозирования. Например, в случае полутвердых составов, как правило, от 1 до 5 граммов.
Приспособления, которые могут быть использованы для введения полутвердых составов, используемые в способе данного изобретения, представляют собой любые из аппликаторов для введения одной дозы, известные в данной области, например аппликаторы с поршнем или с мембраной.
Доза эстриола для введения пациентам, получающим лечение по способам данного изобретения, будет составлять менее 0,5 мг/сут, предпочтительно менее 0,3 мг/сут, более предпочтительно менее 0,1 мг/сут.
В частном воплощении данного изобретения эстриол вводят в дозах от 0,002 до 0,07 мг/сут (от 2 до 70 мкг/сут), предпочтительно от 0,002 до 0,05 мг/сут (от 2 до 50 мкг/сут), более предпочтительно от 0,01 до 0,05 мг/сут (от 10 до 50 мкг/сут), особенно предпочтительно от 0,02 до 0,05 мг/сут (от 20 до 50 мкг/сут), для профилактики и/или лечения урогенитальной атрофии из-за дефицита эстрогенов у женщин с высокой вероятностью развития сердечно-сосудистой патологии, предпочтительно у женщин, давно находящихся в постменопаузе.
В другом частном воплощении эстриол вводят в дозах от 0,002 до 0,07 мг/сут (от 2 до 70 мкг/сут), предпочтительно от 0,002 до 0,05 мг/сут (от 2 до 50 мкг/сут), более предпочтительно от 0,01 до 0,05 мг/сут (от 10 до 50 мкг/сут), особенно предпочтительно от 0,02 до 0,05 мг/сут (от 20 до 50 мкг/сут), для лечения урогенитальной атрофии из-за дефицита эстрогенов у женщин, которые страдали или страдают от сердечно-сосудистой патологии, предпочтительно у женщин, страдавших или страдающих от ишемической болезни сердца, нарушения мозгового кровообращения и венозной тромбоэмболии.
Учитывая высокую безопасность составов, используемых в способах данного изобретения, лечение и/или профилактика вагинальной атрофии могут быть выполнены одновременно с лечением сердечно-сосудистого заболевания.
Длительность лечения и/или профилактики урогенитальной атрофии и режим введения данных составов будут зависеть от состояния пациента, ответа на лечение и сопутствующей терапии. Например, доза от 0,002 до 0,07 мг, предпочтительно от 0,01 до 0,05 мг, будет вводиться каждый день в течение 2 или 3 недель, и будет продолжаться дозой от 0,002 до 0,07 мг, предпочтительно от 0,01 до 0,05 мг, два раза в неделю в течение времени, необходимого для поддержания трофического состояния вагинальной слизистой оболочки, без перерыва в лечении. Альтернативно будет вводиться доза от 0,002 до 0,07 мг в сутки, предпочтительно от 0,01 до 0,05 мг, в течение 2 или 3 недель, и будет продолжаться дозой от 0,002 до 0,07 мг, предпочтительно от 0,01 до 0,05 мг, два раза в неделю в течение нескольких недель, например от 6 до 10 недель, таким образом с перерывом в лечении до тех пор, пока симптомы не появятся вновь. Альтернативно, учитывая высокую безопасность составов, используемых в способах данного изобретения, их введение может продолжаться ежедневно или два раза в неделю дозой от 0,002 до 0,07 мг, предпочтительно от 0,01 до 0,05 мг, в течение более 3 недель или более 10 недель, соответственно.
Наглядный пример изобретения описан ниже. Ни в каком случае он не должен рассматриваться как ограничивающий трактовку формулы изобретения.
Анализ
Сравнительная фармакокинетика и эффективность двух эстриоловых составов изобретения в сравнении с коммерческим эстриоловым составом (крем Ovestinon®, Organon) у женщин в постменопаузе.
Описание
Анализируемыми составами были два вагинальных геля на основе эстриола Т1 (0,002% ITFE) и Т2 (0,005% ITFE) со следующей композицией:
Эти составы сравнивали с составом плацебо без эстриола и коммерчески доступным составом (крем Ovestinon® с 0,1% эстриола).
В анализе принимали участие семьдесят женщин в постменопаузе с вагинальной атрофией, которые были случайным образом разделены на четыре группы, три с 20 пациентками в каждой и одну с 10 пациентками:
Женщины получали лечение ежедневно и непрерывно в течение 21 дня. 1 г геля в сутки вагинальным путем вводили каждой пациентке из групп В, С и D, и 0,5 г крема в сутки вагинальным путем вводили каждой пациентке из группы А.
Группа А: леченные Ovestinon (обозначены «R») (n=20)
Группа В: леченные 0,005% ITFE (n=20)
Группа С: леченные 0,002% ITFE (n=20)
Группа D: леченные 0% ITFE (обозначены «Р») (n=10)
Фармакокинетическое исследование проводили в подгруппе из 42 женщин, образованной 12 пациентками из каждой группы, которые получали активное лечение (n=12 группа А, n=12 В, n=12 С).
За день до начала лечения у пациенток проводили гинекологическое обследование и шейно-влагалищный цитологический анализ.
В первый день лечения состав, соответствующий назначенной группе, вагинально вводили всем пациенткам, а образцы крови забирали в моменты времени 0 (перед введением), 0, 5, 1, 2, 3, 4, 6, 8, 12 и 24 ч (после введения) только у 42 добровольцев фармакокинетического исследования.
На второй день всем пациенткам повторяли введение и только у 42 добровольцев забирали образцы крови.
С 3-го по 20-й дни лечения ежедневно всем пациенткам вагинально вводили соответствующие составы. На 7-й и 14-й дни непосредственно перед введением оценивали субъективную эффективность и переносимость.
На 21-й день всем пациентам вводили последнюю дозу лечения и только от 42 добровольцев фармакокинетического исследования получали образцы крови в момент времени 0 (перед введением), 0, 5, 1, 2, 3, 4, 6, 8, 12 и 24 ч (после введения). Местную переносимость оценивали через 12 часов после введения.
На 22-й день у всех пациенток проводили гинекологическое обследование и шейно-влагалищный цитологический анализ, и только от 42 добровольцев получали образцы крови в описанные выше моменты времени.
Оценка влияния на вагинальную атрофию
Вагинальные мазки, полученные во время гинекологического обследования в 0-й и 22-й дни, фиксировали с водном растворе для цитодиагностики (этанол/метанол ЭДТА) и окрашивали по методике Папаниколау для качественной оценки цитологического статуса и количества поверхностных клеток (SC, superficial cells), промежуточных клеток (1C, intermediate cells) и парабазальных клеток (PC, parabasal cells), что используется в последующем определении индекса созревания (Ml, maturation index) и значения созревания (MV, maturation value).
Значение созревания (MV) рассчитывается на основе индекса созревания (Ml) следующим образом: = 0,2·% парабазальных клеток +0,6·% промежуточных клеток +1,0·% поверхностных клеток.
Данные качественной и количественной оценки (Ml и MV) приведены в таблицах I, II и III.
Таким образом, можно сделать вывод, что способ лечения данного изобретения является эффективным в обратном развитии вагинальной атрофии.
Оценка плазменных уровней эстриола
Концентрацию эстриола в плазме крови определяли с помощью жидкостной хроматографии/масс-спектрометрии (LC-MS/MS) в образцах крови, полученных от 42 добровольных пациентов в моменты времени 0 (до введения), 0, 5, 1, 2, 3, 4, 6, 8, 12 и 24 ч (после введения) в 0-й, 1-й, 21-й и 22-й дни.
Плазменные уровни, полученные в первый день и в 21-й день лечения, приведены в таблицах IV и VI и на графике 1.
Фармакокинетические параметры, рассчитанные из этих значений, приведены в таблицах V и VII.
Таким образом, можно сделать вывод, что безопасный профиль составов данного изобретения весьма благоприятен, поскольку системное воздействие эстриола после повторного введения является весьма незначительным (очень слабым). Кроме того, системное воздействие значительно ниже, чем воздействие, возникающее после введения контрольного препарата.
Кроме того, хотя системное воздействие эстриола значительно ниже, составы данного изобретения вызывают такое же увеличение значения созревания на 22-й день по сравнению с днем 0, что указывает на эффект, сходный с эффектом контрольного препарата на вагинальную слизистую.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ ВАГИНАЛЬНОЙ АТРОФИИ У ЖЕНЩИН С РИСКОМ ОПУХОЛЕВОЙ ПАТОЛОГИИ | 2009 |
|
RU2504381C2 |
| ПРИМЕНЕНИЕ ЭСТРИОЛА В НИЗКОЙ ДОЗЕ | 2008 |
|
RU2483734C2 |
| ДРОСПИРЕНОН ДЛЯ ГОРМОНАЛЬНОЙ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ | 2001 |
|
RU2275198C2 |
| ДРОСПИРЕНОН ДЛЯ ГОРМОНАЛЬНОЙ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ | 2005 |
|
RU2402331C2 |
| СПОСОБ ПОВЫШЕНИЯ КОНЦЕНТРАЦИИ ТЕСТОСТЕРОНА И РОДСТВЕННЫХ СТЕРОИДОВ У ЖЕНЩИН | 2001 |
|
RU2286787C2 |
| ПРИМЕНЕНИЕ ИНСУЛИН-СЕНСИБИЛИЗИРУЮЩИХ АГЕНТОВ, ВВОДИМЫХ ИНТРАВАГИНАЛЬНО | 2010 |
|
RU2567334C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ И СПОСОБЫ НА ОСНОВЕ ЭСТРАДИОЛА ДЛЯ ИНТРАВАГИНАЛЬНОГО ВВЕДЕНИЯ | 2014 |
|
RU2713888C2 |
| СПОСОБ ПОДДЕРЖАНИЯ АМЕНОРЕИ У ЖЕНЩИН, ПОДВЕРГАЮЩИХСЯ ПОСТОЯННОМУ ВВЕДЕНИЮ ПРОГЕСТИНА, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1998 |
|
RU2261099C2 |
| Способ лечения вагинальной атрофии у женщин в постменопаузе с учетом состояния эпителия и микробиоценоза влагалища | 2017 |
|
RU2636619C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ УРОГЕНИТАЛЬНЫХ ОРГАНОВ | 2008 |
|
RU2375064C1 |
Группа изобретений относится к медицине, а именно к гинекологии, и может быть использована для способа профилактики и/или лечения урогенитальной атрофии у женщин, включающей вагинальное введение фармацевтических составов с эстриолом. А также для применения эстриола в получении фармацевтического состава с возможностью самоограничения абсорбции эстриола. Указанные женщины имеют высокую вероятность развития сердечно-сосудистой патологии, либо страдают или страдали от сердечно-сосудистой патологии. При этом эстриол вводят в дозе, меньшей или равной 0,1 мг/сут. Площадь под кривой плазменной концентрации эстриола в зависимости от времени менее 500 пг/мл·ч после введения повторных доз один раз в день в течение времени от 1 до 4 недель. Группа изобретений обеспечивает эффективное и безопасное лечение. 2 н. и 22 з.п. ф-лы, 7 табл., 1 фиг.
1. Применение эстриола в получении фармацевтического состава для вагинального введения в дозе, меньшей или равной 0,1 мг/сут, где фармацевтический состав обеспечивает площадь под кривой плазменной концентрации эстриола в зависимости от времени менее 500 пг/мл·ч после введения повторных доз один раз в день в течение времени от 1 до 4 недель, для профилактики и/или лечения урогенитальной атрофии у женщин, где указанные женщины имеют высокую вероятность развития сердечно-сосудистой патологии, либо страдали или страдают от сердечно-сосудистой патологии.
2. Применение по п.1, где фармацевтический состав обеспечивает площадь под кривой менее 300 пг/мл·ч.
3. Применение по п.2, где фармацевтический состав обеспечивает площадь под кривой менее 250 пг/мл·ч.
4. Применение по п.3, где фармацевтический состав обеспечивает площадь под кривой, меньшую или равную 150 пг/мл·ч, после введения повторных доз один раз в день в течение времени от 2 до 3 недель.
5. Применение по п.1, где фармацевтический состав обеспечивает плазменные уровни эстриола менее 50 пг/мл после повторного введения один раз в день в течение времени от 1 до 4 недель.
6. Применение по п.5, где фармацевтический состав обеспечивает плазменные уровни эстриола менее 25 пг/мл после повторного введения один раз в день в течение времени от 2 до 3 недель.
7. Применение по п.6, где фармацевтический состав обеспечивает плазменные уровни эстриола, меньшие или равные 20 пг/мл.
8. Применение по п.1, где абсорбция эстриола является низкой, когда вагинальный эпителий атрофичен, и абсорбция эстриола становится незначительной, когда повторное введение состава вызывает обратное развитие вагинальной атрофии.
9. Применение эстриола по п.8, где площадь под кривой плазменной концентрации эстриола в зависимости от времени составляет менее 1000 пг/мл·ч, когда вагинальный эпителий атрофичен, и менее 500 пг/мл·ч, когда вагинальная атрофия подвергается обратному развитию.
10. Применение эстриола по п.9, где площадь под кривой плазменной концентрации эстриола в зависимости от времени составляет менее 750 пг/мл·ч, когда вагинальный эпителий атрофичен, и менее 250 пг/мл·ч, когда вагинальная атрофия подвергается обратному развитию.
11. Применение по п.8, где вагинальная атрофия подвергается обратному развитию в течение 2-10 дней, более конкретно в течение 2-7 дней, еще более конкретно в течение 2-5 дней после начала лечения.
12. Применение эстриола по п.1, где женщины, имеющие высокую вероятность наличия сердечно-сосудистой патологии, являются женщинами в постменопаузе в возрасте старше 55 лет и/или женщинами, имеющими в семейном анамнезе ишемическую болезнь сердца, инсульт, тромбоз глубоких вен, тромбоэмболию легочной артерии, поверхностные тромбофлебиты, тромбофилии и/или тяжелую мигрень с аурой.
13. Применение эстриола по п.1, где женщины страдают или страдали от ишемической болезни сердца, инсульта, тромбоза глубоких вен, тромбоэмболии легочной артерии, поверхностного тромбофлебита, тромбофилии и/или тяжелой мигрени с аурой.
14. Применение по п.1, где доза эстриола составляет от 0,002 до 0,07 мг/сут.
15. Применение по п.14, где доза эстриола составляет от 0,01 до 0,05 мг/сут.
16. Применение эстриола по п.1, где фармацевтический состав представляет собой мукоадгезивный гель, крем-гель или крем, содержащий по меньшей мере один биоадгезивный полимер.
17. Применение по п.16, где указанный биоадгезивный полимер выбран из группы, состоящей из целлюлозных полимеров, природных смол, альгината натрия, полиоксиэтиленов, акриловых полимеров и их смесей.
18. Применение по п.17, где указанный биоадгезивный полимер выбран из группы, состоящей из метилцеллюлозы, карбоксиметилцеллюлозы натрия (CMC), гидроксиэтилцеллюлозы (НЕС), гидроксипропилцеллюлозы (НРС) и гидроксипропилметилцеллюлозы (НРМС).
19. Применение по п.17, где указанный биоадгезивный полимер выбран из группы, состоящей из полимеров типа акриловой кислоты, поперечно сшитой с дивинилгликолем, и полимеров, полученных из акриловой кислоты, поперечно сшитой с аллилсахарозой или аллилпентаэритритом.
20. Применение по п.16, где фармацевтический состав содержит по меньшей мере одну полиакриловую кислоту, поперечно сшитую с дивинилгликолем, и по меньшей мере один полимер акриловой кислоты, поперечно сшитой с аллиловыми эфирами пентаэритрита.
21. Применение по п.20, где акриловая кислота, поперечно сшитая с аллиловыми эфирами пентаэритрита, полимеризована в этилацетате или в смеси этилацетата и циклогексана.
22. Применение по п.21, где акриловая кислота, поперечно сшитая с аллиловыми эфирами пентаэритрита и полимеризованная в этилацетате или в смеси этилацетата и циклогексана, имеет вязкость от 4,000 до 11,000 сР.
23. Применение по п.19, где количества указанного акрилового полимера, поперечно сшитого с дивинилгликолем, и/или указанных полимеров, полученных из акриловой кислоты, поперечно сшитой с аллиловыми эфирами сахарозы или аллиловыми эфирами пентаэритрита, по отдельности составляют от 0,05 до 5% от веса состава, предпочтительно от 0,1 до 2%, более предпочтительно от 0,25 до 1,5%.
24. Способ профилактики и/или лечения урогенитальной атрофии у женщин, включающий вагинальное введение фармацевтических составов с эстриолом с возможностью самоограничения абсорбции эстриола, где указанные женщины имеют высокую вероятность развития сердечно-сосудистой патологии, либо страдают или страдали от сердечно-сосудистой патологии и где эстриол вводят в дозе, меньшей или равной 0,1 мг/сут, и где фармацевтический состав обеспечивает площадь под кривой плазменной концентрации эстриола в зависимости от времени менее 500 пг/мл·ч после введения повторных доз один раз в день в течение времени от 1 до 4 недель.
| Погружной пневмоударник | 1989 |
|
SU1652535A1 |
| ДРОСПИРЕНОН ДЛЯ ГОРМОНАЛЬНОЙ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ | 2001 |
|
RU2275198C2 |
| МАЛИЧЕНКО С.Б | |||
| и др | |||
| Первичный остеопороз: взаимосвязь патологии костной и сердечно-сосудистой системы у пожилых | |||
| РМАПО, Москва | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| КОБРИН В | |||
| И | |||
| и др. | |||
Авторы
Даты
2015-07-10—Публикация
2009-08-07—Подача