Уровень техники, предшествующий изобретению
1. Область техники, к которой относится изобретение
Настоящее изобретение относится к полипептиду, который является модифицированный так, что обладает гомосеринацетилтрансферазной активностью, кодирующему его полинуклеотиду, рекомбинантному вектору, содержащему полинуклеотид, микроорганизму, который является трансформированным рекомбинантным вектором, и способу получения O-ацетилгомосерина с использованием микроорганизма.
2. Описание связанной области
Метионин представляет собой одну из незаменимых аминокислот в организме, и широко используется в качестве корма для животных и пищевой добавки, а также компонента медицинских водных растворов и других исходных веществ для лекарственных средств. Метионин действует как предшественник холина (лецитина) и креатинина, и его также используют в качестве исходного вещества для синтеза цистеина и таурина. Кроме того, он функционирует как донор серы.
S-аденозилметионин получают из L-метионина, он служит в качестве донора метила в организме, и он участвует в синтезе различных нейромедиаторов в головном мозге. Также выявлено, что метионин и/или S-аденозил-L-метионин (SAM) предотвращают накопление липидов в печени и артериях и является эффективным при лечении депрессии, воспаления, заболеваний печени и мышечной боли.
Метионин можно синтезировать химически или биологически для использования в кормах для животных, пище и лекарственных препаратах.
При химическом синтезе L-метионин преимущественно получают гидролизом 5-(β-метилмеркаптоэтил)гидантоин. Однако химически синтезированный метионин имеет недостаток, его получают только в смешанной форме L-типа и D-типа.
В отношении биологического синтеза L-метионина в патентной публикации США № US2005/0054060A1 описан способ синтеза гомоцистеина или метионина непосредственно с использованием H2S или CH3SH, при этом без использования цистеина, посредством модификации цистатионин синтазы для получения микроорганизмов. В этом способе модифицированную цистатионин синтезу непосредственно вводят в клетки для синтеза метионина по способу внутриклеточного синтеза метионина. Однако существуют конкретные проблемы в этом, этим способом получают только небольшое количество метионина вследствие ингибирующих активностей синтезируемого метионина, обусловленных использованием внутриклеточных метаболических путей метионина, и H2S или CH3SH также вызывают цитотоксичность.
Для решения этих проблем авторы настоящего изобретения разработали двухстадийный способ конверсии предшественника L-метионина в L-метионин посредством ферментативной реакции (PCT/KR2007/003650). Этот двухстадийный способ может решать указанные выше проблемы цитотоксичности H2S или CH3SH и ингибирования метаболического процесса получаемым L-метионином. Кроме того, этот способ характеризуется тем, что он является очень эффективным для получения избирательно только L-метионина, а не смешанной формы D-метионина и L-метионина.
В этом двухстадийном способе O-сукцинилгомосерин и O-ацетилгомосерин можно использовать в качестве предшественника метионина. В ходе реакции конверсии метионина O-ацетилгомосерин является предпочтительным O-сукцинилгомосерину в отношении выхода продукта соотношения предшественника к метионину. Конкретно можно получать 0,91 моль метионина из 1 моль O-ацетилгомосерина, тогда как из 1 моль O-сукцинилгомосерина можно получать только 0,67 моль метионина. Таким образом, затраты на получение конечного продукта метионина можно снижать посредством использования O-ацетилгомосерина в качестве предшественника метионина, и высокий выход продукта O-ацетилгомосерина является определяющим фактором для массового получения метионина.
При этом использование O-ацетилгомосерина или O-сукцинилгомосерина в качестве предшественника метионина зависит от типа микроорганизмов. В подробном изложении, микроорганизмы, принадлежащие к роду Escherichia, Enterobacteria, Salmonella и Bacillus, продуцируют O-сукцинилгомосерин из гомосерина и сукцинил-КоА посредством L-гомосерин O-сукцинилтрансферазы (Biochemistry, 1999 Oct. 26, 38(43): 14416-23), и микроорганизмы, принадлежащие к роду Corynebacterium, Leptospira, Deinococcus, Pseudomonas и Mycobacterium, продуцируют O-ацетилгомосерин из гомосерина и ацетил-КоА посредством L-гомосерин O-ацетилтрансферазы (Journal of Bacteriology, Mar. 2002, p. 1277-1286).
Таким образом, экспрессия O-ацетилгомосеринтрансферазы, опосредованная введением metX, чужеродным геном, необходима для биосинтеза O-ацетилгомосерина с использованием микроорганизмов рода Escherichia, которых используют для получения рекомбинантных белков для экспериментальных и промышленных целей. Однако существуют проблемы, связанные с отрицательным отношением потребителей к введению чужеродных генов в микроорганизмы, используемые для получения пищевых продуктов, и доказательством безопасности введения чужеродных генов.
Таким образом, авторы настоящего изобретения приложили усилия для получения штамма рода Escherichia, который продуцирует O-ацетилгомосерин, предпочтительный в отношении выхода продукта, без введения чужеродных генов. В результате авторы настоящего изобретения обнаружили, что гомосеринсукцинилтрансферазную активность можно конвертировать в гомосеринацетилтрансферазную активность с использованием модифицированного полипептида, получаемого заменой глутаминовой кислоты на аминокислоту в положении 111 O-сукцинилгомосеринтрансферазы, которая происходит из E.coli, таким образом, осуществляя настоящее изобретение.
Сущность изобретения
Целью настоящего изобретения является предоставление модифицированного полипептида, в котором полипептид, обладающий гомосерин-O-сукцинилтрансферазной активностью, является конвертированным, чтобы обладать гомосеринацетилтрансферазной активностью.
Другой целью настоящего изобретения является предоставление полинуклеотида, кодирующего указанный выше модифицированный полипептид.
Другой целью настоящего изобретения является предоставление рекомбинантного вектора, содержащего полинуклеотидные последовательности, функционально связанные с указанным выше полинуклеотидом.
Другой целью настоящего изобретения является предоставление микроорганизма, содержащего указанный выше полинуклеотид.
Другой целью настоящего изобретения является предоставление микроорганизма, который трансформируют в рекомбинантный вектор, функционально связанный с указанным выше полинуклеотидом.
Другой целью настоящего изобретения является предоставление способа получения O-ацетилгомосерина с использованием микроорганизма, который экспрессирует модифицированный полипептид, обладающий гомосеринацетилтрансферазной активностью.
Краткое описание чертежей
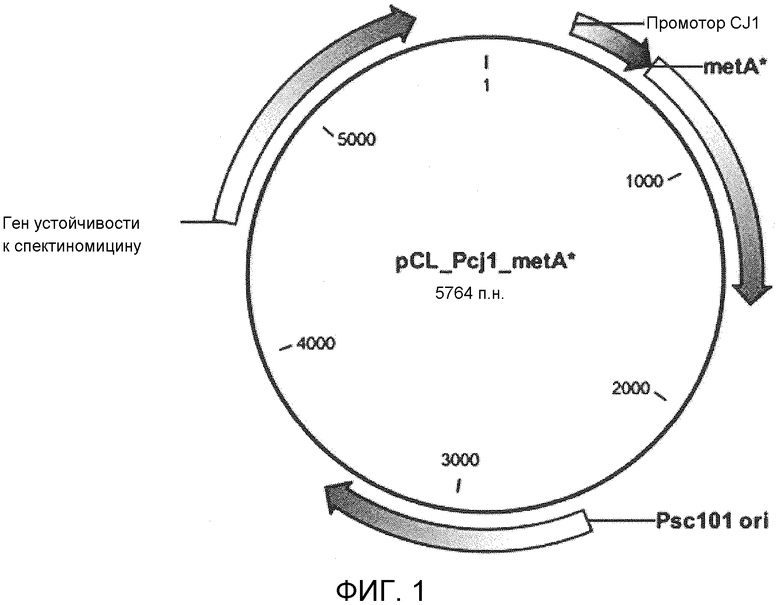
Фиг. 1 представляет собой диаграмму, демонстрирующую рекомбинантный вектор, который является функционально связанным с полинуклеотидом, кодирующим модифицированный полипептид по настоящему изобретению.
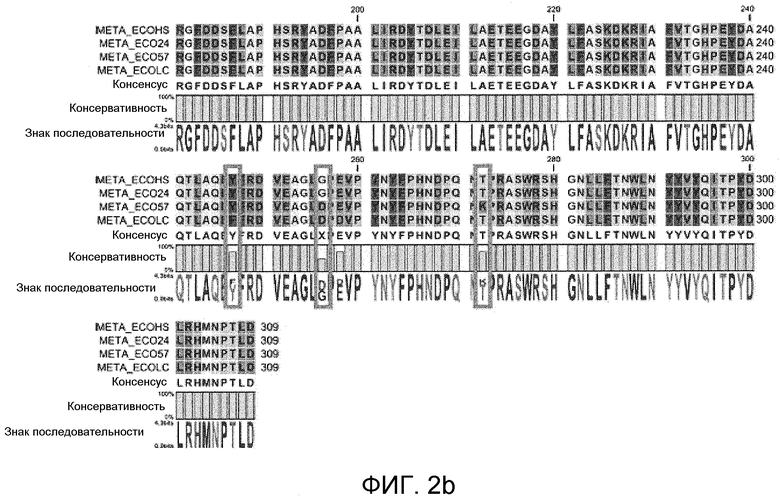
На фиг. 2 представлено сравнение гомологии первичных аминокислотных последовательностей гомосерин-O-сукцинилтрансферазы между вариантами E.coli.
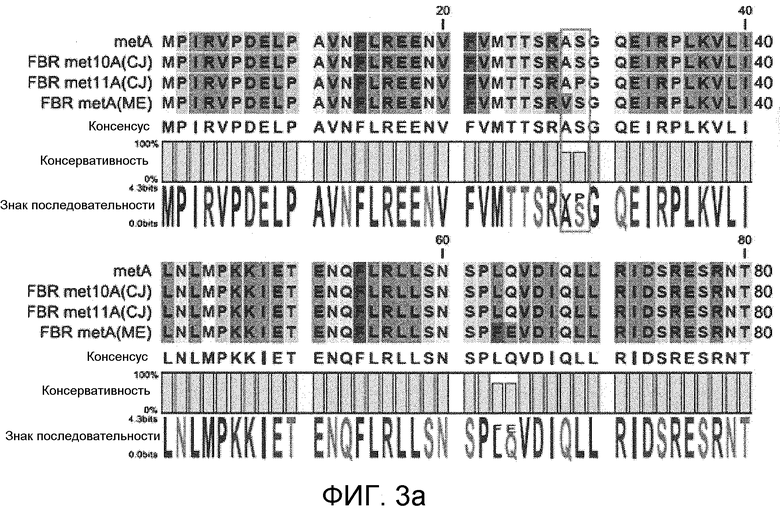
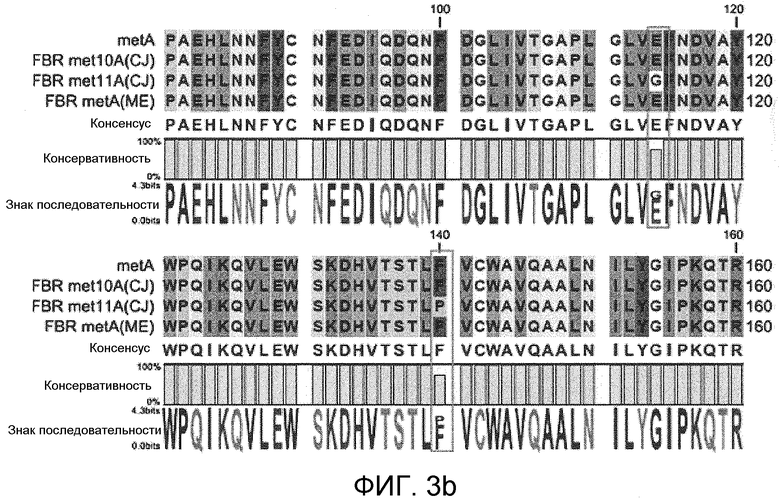
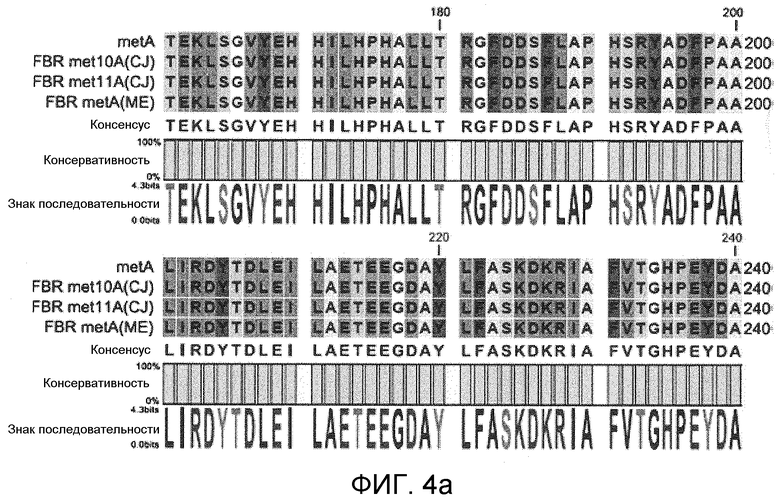
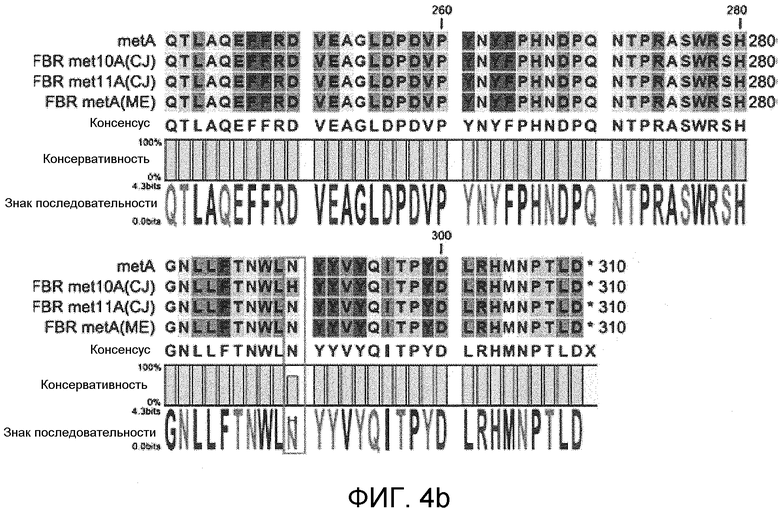
На фиг. 3 и 4 представлены сравнения гомологии первичных аминокислотных последовательностей мутантной гомосерин-O-сукцинилтрансферазы, устойчивой к регуляции с обратной связью метионином, в которых для сравнения использовали первичные аминокислотные последовательности гомосерин-O-сукцинилтрансферазы дикого типа, устойчивой к регуляции с обратной связью мутантной гомосерин-O-сукцинилтрансферазы met10A и met11A, описанных в публикации PCT № WO 2008/127240, и устойчивую к регуляции с обратной связью мутантную гомосерин-O-сукцинилтрансферазу, описанную в публикации PCT № WO 2005/108561, и
Фиг. 5 представляет собой диаграмму, демонстрирующую получение FRT-одностадиной делеционной кассеты посредством ПЦР по методу перекрывающегося сплайсинг-расширения для замены промотора pro на промотор acs в хромосоме.
Подробное описание предпочтительных вариантов осуществления
В одном из аспектов для достижения указанных выше целей настоящее изобретение относится к модифицированному полипептиду, обладающему гомосерин-O-ацетилтрансферазной активностью, содержащему аминокислотную последовательность SEQ OD No:17 или по меньшей мере на 95% гомологичную ей, в которой аминокислота в положении 111 от начальной аминокислоты, метионина, последовательности замещена глутаминовой кислотой.
В рамках изобретения полипептид, обладающий гомосерин-O-сукцинилтрансферазной активностью, означает полипептид, обладающий активностью синтезировать O-сукцинилгомосерин из гомосерина и сукцинил-КоА, представленных в путях биосинтеза метионина, как показано в следующей ниже схеме реакции.
гомосерин + сукцинил-КоА -> O-сукцинилгомосерин
Полипептид, обладающий гомосерин-O-сукцинилтрансферазной активностью, может представлять собой рекомбинантный полипептид, который происходит от микроорганизма рода Enterobacteria, Salmonella, Pseudomonas, Bacillus или Escherichia, предпочтительно рекомбинантный полипептид, обладающий гомосеринсукцинилтрансферазной активностью, который происходит от микроорганизма рода Escherichia, и более предпочтительно рекомбинант полипептид, обладающий гомосерин-O-сукцинилтрансферазной активностью, который происходит из E. coli.
В настоящем изобретении полипептид, обладающий гомосерин-O-сукцинилтрансферазной активностью, может включать полипептид, обладающий гомосеринсукцинилтрансферазной активностью, который состоит из аминокислотной последовательности SEQ ID NO:17 или по меньшей мере на 95% гомологичной ей при условии, что он обладает активностью, указанной в приведенной выше схеме реакции.
В примерах настоящего изобретения сравнивали гомологию аминокислотных последовательностей гомосерин-O-сукцинилтрансферазы между различными видами E.coli. В результате существовало менее 5% вариаций в полипептидах гомосерин-O-сукцинилтрансферазы между различными видами E.coli (таким образом, они обладают по меньшей мере 95% гомологией), но не существовало значимого отличия в гомосерин-O-сукцинилтрансферазной активности (фиг. 2). Эти результаты свидетельствуют о том, что полипептиды, обладающие 95% или более гомологией по отношению к полипептиду SEQ ID NO:17 по настоящему изобретению, также обладают идентичной гомосерин-O-сукцинилтрансферазной активностью, которая понятна специалистам в данной области, и которую авторы настоящего изобретения продемонстрировали.
В рамках изобретения термин "модифицированный полипептид" означает полипептид, обладающий гомосерин-O-ацетилтрансферазной активностью, получаемый посредством замены части аминокислотных последовательностей полипептида, обладающего гомосерин-O-сукцинилтрансферазной активностью, отличной от дикого типа. Таким образом, модифицированный полипептид по настоящему изобретению означает модифицированный полипептид, обладающий аналогичной активностью, как в следующей ниже схеме реакции, который обладает субстратной специфичностью к ацетил-КоА в отличие от сукцинил-КоА, получаемый заменой части аминокислотных последовательностей полипептида, обладающего гомосерин-O-сукцинилтрансферазной активностью.
гомосерин + ацетил-КоА -> O-ацетилгомосерин
В настоящем изобретении указанный выше модифицированный полипептид может представлять собой модифицированный полипептид, в котором аминокислоту в положении 111 полипептида, обладающую аминокислотной последовательностью SEQ ID NO:17, или полипептид, обладающий 95% или более гомологией ее последовательности, заменяют глутаминовой кислота(SEQ ID NO:18), и аминокислоту в положении 112 полипептида дополнительно заменяют треонином (SEQ ID NO:19) или гистидином (SEQ ID NO:20).
Выявлено, что дополнительная замена треонина или гистидина в аминокислоте лейцина в положении 112 усиливает гомосеринацетилтрансферазную активность (таблицы 2 и 3).
Согласно одному предпочтительному варианту осуществления указанный выше модифицированный полипептид может представлять собой полипептид, содержащий любую из аминокислотных последовательностей SEQ ID NO:18-20.
В примерах по настоящему изобретению получают плазмиду, способную экспрессировать полипептид, где аминокислота глицин в положении 111 гомосеринсукцинилтрансферазы, кодированной геном metA E.coli, состоящим из нуклеотидных последовательностей, предоставленных SEQ ID NO:39, заменена глутаминовой кислотой, и плазмиду, способную экспрессировать полипептид, где аминокислота в положении 112 в дополнение к указанной выше замене, заменена треонином или гистидином (пример 2).
Кроме того, в экспериментальных примерах по настоящему изобретению продемонстрировано, что только O-сукцинилгомосерин продуцировался CJM2 pCL_Pcj1_metA(wt) и CJM3 pCL_Pcj1_metA(wt), трансформированными плазмидой, содержащей ген metA дикого типа (SEQ ID NO:39). В отличие от этого, только O-ацетилгомосерин накапливался штаммом, который трансформировали плазмидой, содержащей ген, кодирующий модифицированный полипептид по настоящему изобретению (экспериментальный пример 2, таблицы 2 и 3).
Таким образом, микроорганизм, экспрессирующий модифицированный полипептид по настоящему изобретению, является предпочтительным в том, что он способен продуцировать O-ацетилгомосерин в качестве предшественника метионина с высоким выходом продукта без введения чужеродных генов для гомосеринацетилтрансферазной активности.
В настоящем изобретении указанный выше модифицированный полипептид может являться устойчивым к регуляции с обратной связью метионином вследствие замены части аминокислот полипептида, обладающего гомосеринсукцинилтрансферазной активностью. Таким образом, наиболее активная гомосеринсукцинилтрансфераза регулируется ингибированием по типу обратной связи небольшим количеством метионина в среде, и, таким образом, модифицированный полипептид по настоящему изобретению может являться устойчивым к регуляции с обратной связью метионином для массового получения O-ацетилгомосерина.
В настоящем изобретении можно проводить замену аминокислоты для устранения регуляции с обратной связью метионином способом, описанным в публикации PCT № WO 2008/127240. В более подробном изложении, регуляцию с обратной связью метионином можно устранять заменой пролина для аминокислоты в положении 29, заменой глицина для аминокислоты в положении 114, заменой серина для аминокислоты в положении 140 полипептида, обладающего гомосеринсукцинилтрансферазной активностью, или одной или более комбинациями трех замен аминокислот. Предпочтительно можно заменять две или более и наиболее предпочтительно три аминокислоты.
Согласно одному предпочтительному варианту осуществления модифицированный полипептид, устойчивый к регуляции с обратной связью метионином, может представлять собой модифицированный полипептид, содержащий любую аминокислотную последовательность, выбранную из аминокислотных последовательностей SEQ ID NO:21-23.
В примерах по настоящему изобретению аминокислоты в положении 29, 114 и 140 рекомбинантного полипептида, обладающего гомосеринсукцинилтрансферазной активностью, который кодирует ген metA E.coli, заменяли пролином, глицином и серином соответственно так, чтобы устранить регуляцию с обратной связью метионином. Кроме того, конструировали плазмиды, содержащие полинуклеотиды, кодирующие модифицированные полипептиды, обладающие гомосеринацетилтрансферазной активностью, которые представляют собой [pCL_Pcj1_metA#11(EL)], получаемый заменой глутаминовой кислоты для аминокислоты в положении 111, [pCL_Pcj1_metA#11(ET)], получаемый заменой глутаминовой кислоты и треонина для аминокислот в положении 111 и 112, и [pCL_Pcj1_metA#11(EH)], получаемый заменой глутаминовой кислоты и гистидина для аминокислот в положении 111 и 112 (пример 3).
Кроме того, в экспериментальных примерах по настоящему изобретению продемонстрировано, что среди штаммов, экспрессирующих модифицированные полипептиды, устойчивые к регуляции с обратной связью метионином, для штаммов CJM2 pCL_Pcj1_metA(#11)EH и CJM3 pCL_Pcj1_metA(#11)EH, получаемых заменой глутаминовой кислоты и гистидина для аминокислот в положении 111 и 112, продемонстрированы высокие продукции O-ацетилгомосерина 11,1 г/л и 24,8 г/л соответственно, и эти накопления O-ацетилгомосерина являются аналогичными таким, как получаемые введением чужеродного гена гомосеринацетилтрансферазы (экспериментальный пример 2, таблицы 2 и 3).
В другом аспекте настоящее изобретение относится к полинуклеотиду, кодирующему модифицированный полипептид или рекомбинантный вектор, содержащий полинуклеотидные последовательности, функционально связанные с полинуклеотидом.
В настоящем изобретении указанный выше полинуклеотид представляет собой нуклеотидный полимер, состоящий из нуклеотидных мономеров, ковалентно связанных в цепи, и его примеры представляют собой цепи ДНК или РНК с предопределенной или большей длинной, и он представляет собой полинуклеотид, кодирующий указанный выше модифицированный полипептид.
В настоящем изобретении указанный выше полинуклеотид может представлять собой полинуклеотид, содержащий любые нуклеотидные последовательности SEQ ID NO:24-29.
В рамках изобретения указанный выше термин "рекомбинантный вектор" представляет собой средство для экспрессии модифицированного полипептида посредством введения ДНК в клетку-хозяина для получения микроорганизма, экспрессирующего модифицированный полипептид по настоящему изобретению, и можно использовать известные экспрессирующие векторы, такие как плазмидный вектор, космидный вектор и вектор на основе бактериофага. Специалисты в данной области могут легко получать вектор любым известным способом с использованием технологии рекомбинантных ДНК.
В настоящем изобретении рекомбинантный вектор может представлять собой вектор pACYC177, pACYC184, pCL1920, pECCG117, pUC19, pBR322 или pMW118 и предпочтительно вектор pCL1920.
Термин "функционально связанный" означает, что регуляторная последовательность экспрессии является связанной таким образом, что регулирует транскрипцию и трансляцию полинуклеотидной последовательности, кодирующей модифицированный полипептид, и включает поддержание конкретной рамки трансляции таким образом, что модифицированный полипептид, кодированный полинуклеотидной последовательностью, продуцируется, когда полинуклеотидная последовательность экспрессируется под контролем регуляторных последовательностей (включая промотор).
В другом аспекте настоящее изобретение относится к микроорганизму, содержащему полинуклеотид, кодирующий указанный выше модифицированный полипептид, и микроорганизму, который трансформируют рекомбинантным вектором, функционально связанным с полинуклеотидом, кодирующим указанный выше модифицированный полипептид.
В рамках изобретения термин "трансформация" означает способ, в котором ген вводят в клетку-хозяина для того, чтобы он экспрессировался в клетке-хозяине. Трансформированный ген, если он находится в состоянии экспрессии в клетке-хозяине, может быть встроенным в хромосому клетки-хозяина или может существовать независимо от хромосомы.
Кроме того, ген содержит ДНК и РНК в качестве полинуклеотида, способного кодировать полипептид. Ген можно вводит в любом виде при условии, что его можно вводить в клетку-хозяина, и он может экспрессироваться в ней. Например, ген можно вводить в клетку-хозяина в виде экспрессирующей кассеты, которая представляет собой полинуклеотидную конструкцию, содержащую все элементы для экспрессии гена самого по себе. Как правило, экспрессирующая кассета содержит промотор, сигнал терминации транскрипции, участок связывания рибосомы и сигнал терминации трансляции, которые являются функционально связанными с геном. Экспрессирующая кассета может находиться в виде экспрессирующего вектора, способного к саморепликации. Указанный выше ген можно также вводить в клетку-хозяина как сам по себе или в виде полинуклеотидной конструкции таким образом, чтобы он являлся функционально связанным с последовательностью, необходимой для экспрессии в клетке-хозяине.
Указанный выше микроорганизм представляет собой прокариотический или эукариотический микроорганизм, который способен экспрессировать модифицированный полипептид посредством содержания полинуклеотида, кодирующего модифицированный полипептид, или посредством трансформации рекомбинантным вектором, функционально связанным с полинуклеотидом, кодирующим модифицированный полипептид, и, например, он может представлять собой микроорганизм, принадлежащий к роду Escherichia, Bacillus, Aerobacter, Serratia, Providencia, Erwinia, Schizosaccharomyces, Enterobacteria, Zygosaccharomyces, Leptospira, Deinococcus, Pichia, Kluyveromyces, Candida, Hansenula, Debaryomyces, Mucor, Torulopsis, Methylobacter, Salmonella, Streptomyces, Pseudomonas, Brevibacterium или Corynebacterium.
В настоящем изобретении микроорганизм экспрессирует полипептид, обладающий гомосерин-O-сукцинилтрансферазной активностью. Например, он может представлять собой микроорганизм, принадлежащий к роду Bacillus, Escherichia, Enterobacteria или Salmonella, предпочтительно микроорганизм, принадлежащий к роду Escherichia и более предпочтительно E.coli.
В примерах по настоящему изобретению получают штаммы CJM2 pCL_Pcj1_metAEL, CJM2 pCL_Pcj1_metAET и CJM2 pCL_Pcj1_metAEH E.coli, трансформированные рекомбинантным вектором, содержащим полинуклеотид, кодирующий модифицированный полипептид по настоящему изобретению (пример 2 и экспериментальный пример 2), и штаммы CJM2 pCL_Pcj1_metA(#11)EL, CJM2 pCL_Pcj1_metA(#11)ET, и CJM2 pCL_Pcj1_metA(#11)EH E.coli, трансформированные рекомбинантным вектором, содержащим полинуклеотид, кодирующий модифицированный полипептид, устойчивый к регуляции с обратной связью метионином и обладающий гомосерин-O-ацетилтрансферазной активностью по настоящему изобретению (пример 3 и экспериментальный пример 2). Среди указанных выше штаммов штаммы CJM2 pCL_Pcj1_metA(#11)EL, CJM2 pCL_Pcj1_metA(#11)ET и CJM2 pCL_Pcj1_metA(#11)EH обозначали как CA05-0546, CA05-0547 и CA05-0548 соответственно, и они депонированы в Корейском центре культур микроорганизмов по состоянию на 14 декабря 2010 года, и им присвоены номера доступа KCCM11145P, KCCM11146P и KCCM11147P соответственно.
Настоящее изобретение относится к модифицированному полипептиду, обладающему гомосерин-O-ацетилтрансферазной активностью, в котором заменена часть аминокислотных последовательностей полипептида, обладающего гомосерин-O-сукцинилтрансферазной активностью. Таким образом, предпочтительным является то, что когда модифицированный полипептид по настоящему изобретению экспрессируется в микроорганизме, экспрессирующем полипептид, обладающий только гомосерин-O-сукцинилтрансферазной активностью, полипептид, обладающий гомосерин-O-ацетилтрансферазной активностью, может экспрессироваться без введения чужеродного гена, такого как metX, кодирующего гомосерин-O-ацетилтрансфераза.
В настоящем изобретении указанный выше микроорганизм может представлять собой микроорганизм, который дополнительно модифицируют так, чтобы он обладал повышенной ацетил-КоА-синтетазной активностью, или дополнительно модифицируют так, чтобы он обладал пантотенаткиназной активностью, устойчивой к регуляции с обратной связью накоплением КоА, для получения большого количества O-ацетилгомосерина.
В настоящем изобретении ацетил-КоА-синтетаза и пантотенаткиназа, которые происходят от различных микроорганизмов, и гены, кодирующие белки, обладающие такими активностями, как правило, называют acs и coaA соответственно.
В настоящем изобретении повышение ацетил-КоА-синтетазной активности можно получать повышением экспрессии гена посредством модификации нуклеотидных последовательностей области промотора и области 5'-UTR гена acs, кодирующего ацетил-КоА-синтетазу, и можно увеличивать активность белка введением мутации в область ORF соответствующего гена, и можно увеличивать уровень экспрессии белка введением дополнительной копии соответствующего гена в хромосоме или введением соответствующего гена с собственным промотором или усиленным другим промотором в штамме.
Более конкретно ацетил-КоА-синтетазную активность можно увеличивать посредством замены промотора с увеличенной активностью, введением мутации промотора для увеличения активности или увеличения числа копий гена, и, таким образом, настоящее изобретение относится к способу улучшения продукции O-ацетилгомосерина и получаемой способом E.coli. Для замены промотора с увеличенной активностью можно использовать pTac, pTrc, pPro, pR и pL, для которых известно, что они обладают увеличенной активностью.
Согласно одному предпочтительному варианту осуществления настоящее изобретение относится к продуцирующему O-ацетилгомосерин штамму, в котором ген acs, участвующий в биосинтезе ацетил-КоА является сверхэкспрессированным посредством замены конституционного промотора экспрессии, промотора pro, на его промотор. Промотор pro может представлять собой часть или полную SEQ ID NO:30.
Настоящее изобретение дополнительно относится к микроорганизму, в который вводят модифицированную пантотенаткиназу, устойчивую к регуляции ингибирования по типу обратной связи накоплением КоА в путях биосинтеза КоА. Более конкретно аминокислоту аргинин в положении 106 в аминокислотной последовательности пантотенаткиназы заменяют аланином (SEQ ID NO:40), таким образом, что она становится устойчивой к регуляции ингибирования по типу обратной связи накоплением КоА, приводящей к улучшению продукции O-ацетилгомосерина.
В настоящем изобретении указанный выше микроорганизм может представлять собой микроорганизм, в котором увеличено число копий одного или более генов, выбранных из группы, состоящей из гена, кодирующего фосфоенолпируваткарбоксилаза (ppc), гена, кодирующего аспартатаминотрансферазу (aspC), и гена, кодирующего аспартатполуальдегидегидрогеназу (asd), или промотор гена заменяют промотором с увеличенной активностью или вводят мутацию для того, чтобы он обладал повышенной активностью.
В настоящем изобретении серии ферментов обладают активностью для синтеза O-ацетилгомосерина из фосфоенолпирувата, как продемонстрировано в следующих ниже схемах реакций. Таким образом, можно индуцировать накопление O-ацетилгомосерина в клетке увеличением экспрессии генов, обладающих такими активностями.
Фосфоенолпируваткарбоксилаза (ppc)
Фосфоенолпируват + H2O + CO2 <-> оксалоацетат + фосфат
Аспартатаминотрансфераза (aspC)
Оксалоацетат + глутаминат <-> аспартат + α-кетоглутарат
Аспартаткиназа (thrA)
Аспартат + АТФ <-> аспартил-4-фосфат + АДФ
Аспартатполуальдегиддегидрогеназа (asd)
Аспартил-4-фосфат + NADPH <-> аспартатполуальдегид + фосфат + NADP+
Гомосериндегидрогеназа (thrA)
Аспартатполуальдегид + NADPH <-> гомосерин
В схемах реакций ген thrA, кодирующий бифункциональный фермент аспартаткиназу/гомосериндегидрогеназу, предварительно усиливают посредством ослабления регуляции ингибирования по типу обратной связи в штамме CJM2 в экспериментальном примере 2, и оставшиеся три фермента можно усиливать посредством увеличения числа копий гена, заменой промотора указанного выше гена на промотор с увеличенной активностью или введением мутации промотора для увеличения активности.
В рамках изобретения термин "увеличение числа копий" означает дополнительное введение желаемого гена в хромосому или посредством введения плазмиды, содержащей кодирующий соответствующий фермент ген.
В примерах по настоящему изобретению штамм CJM2-AP получали посредством делеции промотора acs metA и штамма CJM2 с делецией metB и заменой его промотора pro, а затем трансформировали, чтобы он обладал устойчивостью к регуляции с обратной связью coaA таким образом, чтобы получать штамм CJM2-AP/CO, обладающий повышенным пулом ацетил-КоА, с последующим получением штамма CJM3, содержащего две копии трех генов ppc, aspC и asd. В дальнейшем конструировали штаммы CJM3 с введенными pCL_Pcj1_metA#11(EL), pCL_Pcj1_metA#11(EH) и pCL_Pcj1_metA#11(ET) в виде CA05-0578, CA05-0579 и CA05-0580 соответственно и депонировали в Корейском центре культур микроорганизмов по состоянию на 12 декабря 2011 года, и присваивали номера доступа KCCM11228P, KCCM11229P и KCCM11230P соответственно (экспериментальный пример 2).
В другом аспекте настоящее изобретение относится к способу получения O-ацетилгомосерина, включающему этапы культивирования микроорганизма, содержащего полинуклеотид, кодирующий модифицированный полипептид, или микроорганизма, который трансформируют рекомбинантным вектором, функционально связанным с полинуклеотидом, кодирующим модифицированный полипептид, и получения O-ацетилгомосерина, который продуцируется в ходе указанной выше культивации микроорганизма.
В настоящем изобретении получение O-ацетилгомосерина с использованием микроорганизма, экспрессирующего модифицированный полипептид, можно проводить в соответствующей среде и условиях, известных в данной области. Специалистам в данной области хорошо понятно, что способ культивирования можно легко корректировать в соответствии с выбираемым штаммом.
Примеры способа культивирования включают, но не ограничиваются ими, периодическую, непрерывную и подпитываемую культуру. Используемая в культивировании среда должна соответствовать условиям культивирования конкретного штамма.
Используемая в настоящем изобретении среда может содержать любой углеродный источник сахарозы, глюкозы, глицерина и уксусной кислоты или их сочетаний, и примером источника азота, который необходимо использовать, являются органические источники азота, такие как пептон, экстракт дрожжей, мясной экстракт, экстракт солода, жидкий кукурузный экстракт и соевую муку, и неорганические источники азота, такие как мочевина, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония, или их сочетания.
В качестве источника фосфата среда может содержать первичный кислый фосфат калия, вторичный кислый фосфат калия и соответствующие содержащие натрий соли. Среда также может содержать соль металла, такую как сульфат магния или сульфат железа. Кроме того, также можно добавлять аминокислоты, витамины и соответствующие предшественники. Среду или предшественники можно добавлять в культуру периодического типа или непрерывного типа. При культивировании можно регулировать pH культуры добавлением соответствующим образом соединения, такого как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота, и при культивировании можно подавлять образование пены использованием противовспенивателя, такого как сложный эфир полигликоля и жирной кислоты.
Для поддержания аэробных условий культуры можно вводить кислород или содержащий кислород газ в культуру. Для поддержания анаэробных условия и микроаэробных условий можно не вводить газ или можно вводить азот, водород или диоксид углерода. Температура культуры может составлять от 27°C до 37°C и предпочтительно от 30°C до 35°C. Период культивирования может быть длительным при условии, что продуцируется желаемое вещество, и предпочтительно составляет от 10 до 100 часов.
Далее в настоящем описании настоящее изобретении более подробно описано в отношении примеров и экспериментальных примеров. Однако эти примеры приведены исключительно с иллюстративными целями, и не предполагают, что изобретение ограничено этими примерами.
Пример 1: Конструкция плазмиды, содержащей гомосерин-O-сукцинилтрансферазу и гомосерин-O-ацетилтрансферазу
Для амплификации гена metA, кодирующего гомосерин-O-сукцинилтрансферазу, проводили ПЦР с использованием хромосомы штамма W3110 E.coli (номер доступа ATCC9637), приобретаемой от Американской коллекции типовых культур, в качестве матрицы и праймеров SEQ ID NO:1 и SEQ ID NO:2.
Применяемые в ПЦР праймеры получали на основании последовательности хромосомы E.coli NC_000913, зарегистрированной в банке генов Национального института здоровья (NIH), и праймеры SEQ ID NO:1 и SEQ ID NO:2 содержали участки рестрикции EcoRV и HindIII соответственно.
SEQ ID NO:1
5' AATTGATATCATGCCGATTCGTGTGCCGG 3'
SEQ ID NO:2
5' AATTAAGCTTTTAATCCAGCGTTGGATTCATGTG 3'
Для амплификации гена metX, кодирующего гомосерин-O-ацетилтрансферазу (SEQ ID NO:44) проводили ПЦР с использованием в качестве матрицы хромосомы Deinococcus radiodurans и праймеров SEQ ID NO:3 и SEQ ID NO:4. Праймеры SEQ ID NO:3 и SEQ ID NO:4 содержали участки рестрикции EcoRV и HindIII соответственно.
SEQ ID NO:3
5' AATTGATATCATGACCGCCGTGCTCGC 3'
SEQ ID NO:4
5' AATTAAGCTTTCAACTCCTGAGAAACGCCCC 3'
ПЦР проводили в следующих условиях: денатурация при 94°C в течение 3 минут, 25 циклов, состоящих из денатурации при 94°C в течение 30 секунд, отжига при 56°C в течение 30 секунд и полимеризации при 72°C в течение 5 минут, и полимеризации при 72°C в течение 7 минут.
Получаемые продукты ПЦР клонировали в плазмиду pCL1920, содержащую промотор cj1 (KR 2006-0068505), после обработки ферментами рестрикции EcoRV и HindIII соответственно. DH5α E.coli трансформировали клонированными плазмидами и отбирали трансформированные DH5α E.coli в среде LB для чашек Петри, содержащей 50 мкг/мл спектиномицина, таким образом, чтобы получать плазмиды. Получаемые плазмиды обозначали как pCL_Pcj1_metA и pCL_Pcj1_metXdr соответственно.
Пример 2: Конструкция модифицированного полипептида, обладающего гомосерин-O-ацетилтрансферазной активностью
Аминокислоту глицин (Gly) в положении 111 O-сукцинилтрансферазы заменяли глутаминовой кислотой (Glu) с использованием плазмиды pCL_Pcj1_metA, получаемой в примере 1, в качестве матрицы и набора для сайт-направленного мутагенеза (Stratagene, USA) (G111E). Последовательности используемых праймеров представляли собой такие, как указано ниже:
SEQ ID NO:5
5' ttgtaactggtgcgccgctggaactggtggggtttaatgatgtc 3'
SEQ ID NO:6
5' gacatcattaaaccccaccagttccagcggcgcaccagttacaa 3'
Конструируемую плазмиду, содержащую мутантный ген G111E metA, обозначали как pCL_Pcj1_metA(EL).
Кроме того, аминокислоту глицин (Gly) в положении 111 O-сукцинилтрансферазы заменяли глутаминовой кислотой (Glu) и аминокислоту лейцин в положении 112 O-сукцинилтрансферазы заменяли треонином (L112T) или гистидином (L112H). На этот раз последовательности используемых праймеров представляли собой такие, как указано ниже:
Замена треонина на лейцин
SEQ ID NO:7
5' tgtaactggtgcgccgctggaaaccgtggggtttaatgatgtcg 3'
SEQ ID NO:8
5' cgacatcattaaaccccacggtttccagcggcgcaccagttaca 3'
Замена гистидина на лейцин
SEQ ID NO:9
5' tgtaactggtgcgccgctggaacatgtggggtttaatgatgtcg 3'
SEQ ID NO:10
5' cgacatcattaaaccccacatgttccagcggcgcaccagttaca 3'
В числе конструируемых плазмид содержащую ген metA плазмиду, в которой аминокислоту глицин в положении 111 заменяли глутаминовой кислотой и аминокислоту лейцин в положении 112 заменяли треонином, обозначали как pCL_Pcj1_metA(ET). А также плазмиду, содержащую ген metA, в которой аминокислоту глицин в положении 111 заменяли глутаминовой кислотой и аминокислоту лейцин в положении 112 заменяли гистидином, обозначали как pCL_Pcj1_metA(EH).
Пример 3: Конструкция устойчивого к регуляции с обратной связью модифицированного полипептида, обладающего гомосерин-O-ацетилтрансферазной активностью
Ген metA с устойчивостью к регуляции с обратной связью метионином (metA#11) конструировали с использованием плазмиды pCL_Pcj1_metA, получаемой в примере 1, в качестве матрицы, таким же образом, как в примере 2. Конкретно способом, описанным в публикации PCT № WO 2008/127240, заменяли серин, глутаминовую кислоту и фенилаланин в положении 29, 114 и 140 O-сукцинилтрансферазы на пролин (S29P), глицин (E114G) и серин (F140S) соответственно. Последовательности используемых праймеров представляют собой такие, как указано ниже.
Замена пролина на серин
SEQ ID NO:11
5' ATGACAACTTCTCGTGCGCCTGGTCAGGAAATTCG 3
SEQ ID NO:12
5' CGAATTTCCTGACCAGGCGCACGAGAAGTTGTCAT 3'
Замена глицина на глутаминовую кислоту
SEQ ID NO:13
5' CGCCGCTGGGCCTGGTGGGGTTTAATGATGTCGCT 3'
SEQ ID NO:14
5' AGCGACATCATTAAACCCCACCAGGCCCAGCGGCG 3'
Замена серина на фенилаланин
SEQ ID NO:15
5' CACGTCACCTCGACGCTGAGTGTCTGCTGGGCGGT 3'
SEQ ID NO:16
5' ACCGCCCAGCAGACACTCAGCGTCGAGGTGACGTG 3'
Каждую из мутаций последовательно вводили в конструкцию плазмиды, содержащей ген metA(#11) с тремя мутациями, которую обозначали как pCL_Pcj1_metA#11.
Затем конструировали плазмиды для экспрессии полипептидов, содержащих мутации идентичные мутациям, модифицированных полипептидов, обладающих гомосерин-O-ацетилтрансферазной активностью из примера 2, с использованием в качестве матрицы получаемой плазмиды pCL_Pcj1_metA#11.
В числе конструируемых плазмид содержащую ген metA#11 плазмиду, в которой аминокислоту глицин в положении 111 заменяли глутаминовой кислотой, обозначали как pCL_Pcj1_metA#11(EL), содержащую ген metA#11 плазмиду, в которой аминокислоту глицин в положении 111 заменяли глутаминовой кислотой и аминокислотой лейцин в положении 112 заменяли треонином, обозначали как pCL_Pcj1_metA#11(ET), и содержащую ген metA#11 плазмиду, в которой аминокислоту глицин в положении 111 заменяли глутаминовой кислотой и аминокислоту лейцин в положении 112 заменяли гистидином, обозначали как pCL_Pcj1_metA#11(EH).
Экспериментальный пример 1: Сравнение гомологии между гомосеринсукцинилтрансферазой E.coli и устойчивой к регуляции с обратной связью гомосеринсукцинилтрансферазой E.coli
Сравнивали первичные аминокислотные последовательности [SEQ ID NO:41, SEQ ID NO:42 и SEQ ID NO:43 по порядку] вариантов гомосерин-O-сукцинилтрансферазы 09:H4 E. coli (штамм HS), 0139:H28 E. coli (штамм E24377A) и 0157:H7 E. coli (штамм ATCC8739) с использованием программы CLC Main Workbench (CLC bio, Denmark).
Как продемонстрировано на фиг. 2, наблюдали менее 5% вариаций в первичных аминокислотных последовательностях гомосерин-O-сукцинилтрансферазы вариантов E. coli (фиг. 2).
Также сравнивали первичные аминокислотные последовательности мутантной гомосерин-O-сукцинилтрансферазы, устойчивой к регуляции с обратной связью метионином, с использованием казанной выше программы. Для сравнения использовали первичные аминокислотные последовательности гомосерин-O-сукцинилтрансферазы дикого типа, устойчивой к регуляции с обратной связью мутантной гомосерин-O-сукцинилтрансферазы met10A и met11A, описанной в публикация PCT № WO 2008/127240, и устойчивой к регуляции с обратной связью мутантной гомосерин-O-сукцинилтрансферазы, описанной в публикация PCT № WO 2005/108561.
Как продемонстрировано на фиг. 3 и 4, наблюдали менее 5% вариаций в первичных аминокислотных последовательностях мутантной гомосерин-O-сукцинилтрансферазы, устойчивой к регуляции с обратной связью метионином (фиг. 3 и 4).
Эти результаты свидетельствуют о том, что полипептиды гомосерин-O-сукцинилтрансферазы, содержащиеся в E.coli, обладали 95% или более высокой гомологией между ними, и не существовало большого различия гомосеринсукцинилтрансферазной активности даже при различии последовательностей менее 5%.
Экспериментальный пример 2: Сравнение субстратной специфичности и активности модифицированных полипептидов, обладающих гомосеринацетилтрансферазной активностью
2-1: Получение тестируемых штаммов
2-1-1. Делеция генов metA и metB
Для сравнения активностей модифицированных полипептидов, продуцирующих избыточные количества O-ацетилгомосерина, получали штамм, накапливающий гомосерин и содержащий делецию утилизации O-ацетилгомосерина. Штамм с делецией генов metA и metB получали способами из примеров от 1-1 до 1-4, описанных в публикации патента EP2108693A2, на основе продуцирующего треонин штамма FTR2533 (KCCM 10541), описанного в PCT/KR2005/00344. Штамм обозначали как CJM2. CJM2 представляет собой штамм, который накапливает большое количество гомосерина и продуцирует O-ацетилгомосерин или O-сукцинилгомосерин в зависимости от введенного гена.
2-1-2. Замена промотора acs
Для получения избыточного количества O-ацетилгомосерина необходимо обеспечивать продукцию гомосерина и ацетил-КоА. Во-первых, для обеспечения предоставления ацетил-КоА промотор гена acs (ацетил-КоА-синтетазы) заменяли конститутивным промотором pro SEQ ID NO:30 таким образом, чтобы индуцировать конститутивную сверхэкспрессию желаемого гена. Для замены промотора проводили модифицированную FRT-одностадийную ПЦР (PNAS (2000) vol.97: 6640-6645). Для получения кассеты, как показано на фиг. 5, получаемую из pKD3 (PNAS (2000) vol.97: 6640-6645) устойчивую к хлорамфениколу FRT-кассету подвергали ПЦР с использованием SEQ ID NO:31 и SEQ ID NO:33, и область промотора pro подвергали ПЦР с использованием SEQ ID NO:32 и SEQ ID NO:34. Два продукта ПЦР подвергали ПЦР по методу перекрывающегося сплайсинг-расширения для получения отдельной кассеты (кассета с удаленным промотором acs-замененным промотором pro) (Nucleic Acids Res. 1988 August 11, 16(15): 7351-7367). ПЦР проводили в следующих условиях: 30 циклов, состоящих из денатурации при 94°C в течение 30 секунд, отжига при 55°C в течение 30 секунд и полимеризации при 72°C в течение 1 минуты.
SEQ ID NO:31
5' AGGGGCTTCATCCGAATTGCGCCATTGTTGCAATGGCGGTGCTGGAGCTGCTTCGAAGTTC 3'
SEQ ID NO:32
5' GATATTCATATGGACCATGGCTCGAGCATAGCATTTTTATCC 3'
SEQ ID NO:33
5' GGATAAAAATGCTATGCTCGAGCCATGGTCCATATGAATATC 3'
SEQ ID NO:34
5' CGATGTTGGCAGGAATGGTGTGTTTGTGAATTTGGCTCATATGTACCTTTCTCCTCTTTA 3'
Получаемый продукт ПЦР подвергали электрофорезу на 1,0% агарозном геле, а затем очищали ДНК из полосы приблизительно 1,2 т.п.н. Получаемый фрагмент ДНК электропорировали в штамм CJM2 предварительно трансформированный вектором pKD46 (PNAS (2000) vol.97: 6640-6645). Перед электропорацией штамм CJM2, трансформированный pKD46, культивировали при 30°C в среде LB, содержащей 100 мкг/л ампициллина и 5 мМ L-арабинозы до тех пор, пока OD600 не достигала 0,6. Затем культивируемый штамм однократно отмывали стерилизованной дистиллированной водой и дважды 10% глицерином. Электропорацию проводили при 2500 В. Получаемый штамм сеяли штрихом в среду LB для чашек Петри, содержащую 25 мкг/л хлорамфеникола, с последующим культивированием при 37°C в течение ночи. Затем, таким образом, отбирали штамм, проявляющий устойчивость к хлорамфениколу.
ПЦР проводили с использованием отобранного штамма в качестве матрицы и аналогичных праймеров в тех же условиях. Делецию промотора acs и замену промотора pro устанавливали подтверждением гена размером 1,2 т.п.н. на 1,0% агарозном геле. Затем штамм трансформировали вектором pCP20 (PNAS (2000) vol.97: 6640-6645) и культивировали в среде LB. Конструировали конечный штамм с удаленным промотором acs и замененным промотором pro, в котором размер гена уменьшали до 150 п.н. на 1,0% агарозном геле, посредством ПЦР в тех же самых экспериментальных условиях, и подтверждали, что маркерный ген хлорамфеникола удаляли. Конструированный штамм обозначали как CJM2-AP.
2-1-3. Замена устойчивого к регуляции с обратной связью coaA
Для получения штамма CJM2-AP с устойчивостью к регуляции с обратной связью coaA проводили ПЦР с использованием гДНК w3110 в качестве матрицы и праймеров SEQ ID NO:35 и SEQ ID NO:36, содержащих участок рестрикции EcoRI так, чтобы получать ген coaA, кодирующий пантотенаткиназу. В качестве полимеразы использовали ДНК-полимеразу высокой точности PfuUltra™ (Stratagene) и проводили ПЦР в условиях 30 циклов, состоящих из денатурации denaturation при 96°C в течение 30 секунд, отжига при 50°C в течение 30 секунд и полимеризации при 72°C в течение 2 минут.
После обработки получаемого гена coaA и плазмиды pSG76C (Journal of Bacteriology, July 1997, 4426-4428) ферментом рестрикции EcoRI, их лигировали друг с другом. DH5α E.coli трансформировали конструированной плазмидой, а затем отбирали трансформированный DH5α E.coli на среде LB для чашек Петри, содержащей 25 мкг/мл хлорамфеникола, так, чтобы получать pSG-76C-coaA.
SEQ ID NO:35
5' ATGAGTATAAAAGAGCAAAC 3'
SEQ ID NO:36
5' TTATTTGCGTAGTCTGACC 3'
pSG-76C-coaA (R106A) конструировали с использованием получаемого pSG-76C-coaA и праймеров SEQ ID NO:37 и SEQ ID NO:38 сайт-направленным мутагенезом (Stratagene, USA).
SEQ ID NO:37
5' GGAAAAGTACAACCGCCgccGTATTGCAGGCGCTATT 3'
SEQ ID NO:38
5' AATAGCGCCTGCAATACggcGGCGGTTGTACTTTTCC 3'
Штамм CJM2-AP трансформировали плазмидой pSG76C-coaA (R106A) и культивировали в среде LB-Cm (10 г/л дрожжевого экстракта, 5 г/л NaCl, 10 г/л триптона, 25 мкг/л хлорамфеникола) для отбора колоний, устойчивых к хлорамфениколу. Отбираемый трансформант представлял собой штамм, в котором pSG76c-coaA (R106A) преимущественно встроен в область coaA генома.
Штамм с встроенным геном coaA (R106A) трансформировали вектором pASceP (Journal of Bacteriology, July 1997, 4426-4428), экспрессирующим фермент рестрикции I-SceI, который расщепляет участок I-SceI, содержащийся в pSG76c, с последующим отбором штаммов на среде LB-Ap (10 г/л дрожжевого экстракта, 5 г/л NaCl, 10 г/л триптона, 100 мкг/л ампициллина). Ген coaA амплифицировали из отбираемого штамма с использованием праймеров SEQ ID NO:35 и SEQ ID NO:36 и замену coaA (R106) в амплифицируемом гене подтверждали секвенированием в компании Macrogen (Корея) (Nucleic Acids Research, 1999, Vol.27, No.22 4409-4415). Получаемый штамм обозначали как CJM2-AP/CO. Штамм CJM2-AP/CO представляет собой штамм, обладающий повышенным пулом гомосерина и ацетил-КоА.
2-1-4. Увеличение числа копий ключевых генов путей биосинтеза гомосерина
Даже несмотря на то, что штамм CJM2 или CJM2-AP/CO представляет собой штамм, продуцирующий избыточное количество гомосерина, увеличивали число копий трех генов ppc, aspC и asd, чтобы еще дополнительно улучшать продукцию гомосерина. Плазмиды pSG7 6c-2ppc, pSG76c-2aspC и pSG76c-2asd конструировали способами, описанными в примерах от <1-1> до <1-3> публикации патента № KR2011-0023703, и вводили плазмиды в штамм CJM2-AP/CO для получения штамма, содержащего две копии трех генов, способом из примера <1-5>. Получаемый штамм обозначали как CJM3. CJM3 представляет собой штамм, который накапливает большое количество гомосерина по сравнению со штаммом CJM2 и продуцирует O-ацетилгомосерин или O-сукцинилгомосерин в зависимости от вводимой плазмиды.
2-2: Экспериментальные способы и экспериментальные результаты
Получала два штамма CJM2 и CJM3 получали в качестве компетентных клеток и вводили 9 плазмид pCL_Pcj1_metX, pCL_Pcj1_metA, pCL_Pcj1_metA(EL), pCL_Pcj1_metA(EH), pCL_Pcj1_metA(ET), pCL_Pcj1_metA#11, pCL_Pcj1_metA#11(EL), pCL_Pcj1_metA#11(EH) и pCL_Pcj1_metA#11(ET) в компетентные клетки посредством электропорации соответственно.
В их числе штаммы CJM2, в которые вводили pCL_Pcj1_metA#11(EL), pCL_Pcj1_metA#11(EH) и pCL_Pcj1_metA#11(ET), обозначали как CA05-0546, CA05-0547 и CA05-0548 соответственно. Их депонировали в Корейском центре культур микроорганизмов по состоянию на 14 декабря 2010 года и присваивали номера доступа KCCM11145P, KCCM11146P и KCCM11147P соответственно.
Кроме того, штаммы CJM3, в которые вводили pCL_Pcj1_metA#11(EL), pCL_Pcj1_metA#11(EH) и pCL_Pcj1_metA#11(ET), обозначали как CA05-0578, CA05-0579 и CA05-0580 соответственно. Их депонировали в Корейском центре культур микроорганизмов по состоянию на 12 декабря 2011 года и присваивали номера доступа KCCM11228P, KCCM11229P и KCCM11230P соответственно.
В дальнейшем проводили тест в колбе для сравнения типов и продукции предшественников метионина, которые продуцировались каждым штаммом, в которые вводили 9 типов плазмид. В тесте в колбе после штриховой разводки каждого штамма на среде LB для чашек Петри и культивировании их в инкубаторе при 31°C в течение 16 часов отдельные колонии инокулировали в 3 мл среды LB, а затем культивировали в инкубаторе при 200 об/мин/31°C в течение 16 часов.
25 мл среды для продукции предшественника метионина из таблицы 1 помещали в 250 мл колбы и добавляли к ней каждые 500 мкл из культуральных бульонов. Затем колбы инкубировали в инкубаторе при 200 об/мин/31°C в течение 40 часов и сравнивали ВЭЖХ тип и продукцию предшественника метионина, продуцируемого каждым из штаммов, в которые вводили плазмиды. Результаты представлены в таблице 2 (результаты штаммов типа CJM2) и в таблице 3 (результаты штаммов типа CJM3).
Как показано в таблицах 2 и 3, только O-сукцинилгомосерин продуцировался pCL_Pcj1_metA (дикого типа), содержащим ген metA дикого типа, но только O-ацетилгомосерин накапливался штаммами, содержащими три мутантных гена metA по настоящему изобретению. Таим образом, гомосеринсукцинилтрансферазная активность полипептида модифицировали в гомосеринацетилтрансферазную активность заменой его аминокислот.
Кроме того, в числе трех мутантов штаммов типа CJM3 штамм (EL), получаемый заменой глутаминовой кислоты для аминокислоты в положении 111, продуцировал 2,1 г/л O-ацетилгомосерина, тогда как штамм (EH), получаемый дополнительной заменой гистидина для аминокислоты в положении 112, продуцировал 3,2 г/л O-ацетилгомосерина, что является самым высоким выходом продукта O-ацетилгомосерина.
Для штаммов, экспрессирующих модифицированные полипептиды, обладающие гомосеринацетилтрансферазной активностью, устойчивые к регуляции с обратной связью метионином, также продемонстрированы аналогичные результаты. Конкретно штамм с введенным геном metA#11(EH), который обладал устойчивостью к регуляции с обратной связью метионином и содержал замены глутаминовой кислоты и гистидина для аминокислот в положении 111 и 112, продуцировал самое большое количество O-ацетилгомосерина (24,8 г/л), указывая на то, что он накапливает O-ацетилгомосерин на уровне, аналогичном уровню при введении чужеродного гена гомосеринацетилтрансферазы (CJM3 pCL_Pcj1_metX, 23,7 г/л).
Эффект изобретения
По настоящему изобретению O-ацетилгомосерин можно получать из гомосерина без введения чужеродного гена в микроорганизм, который экспрессирует фермент, который конвертируют гомосерин в O-сукцинилгомосерин, и указанный выше O-ацетилгомосерин можно использовать в качестве предшественника для получения метионина. Таким образом, когда применяют настоящее изобретение для получения метионин для применения в пищевых продуктах, оно является предпочтительным тем, что можно разрешать проблемы тревожности и отрицательного отношения потребителей в отношении введения чужеродных генов и предоставления доказательства безопасности введения чужеродных генов.


























Изобретение относится к биотехнологии и представляет собой модифицированный полипептид c гомосерин-O-ацетилтрансферазной активностью с аминокислотной последовательностью SEQ ID NO:17 или с по меньшей мере 95% гомологией с ней, в котором аминокислоту в положении 111 от начальной аминокислоты метионина последовательности заменяют глутаминовой кислотой. Изобретение относится также к способу получения о-ацетилгомосерина, который включает культивирование микроорганизма рода Escherichia, трансформированного полинуклеотидом, кодирующим заявленный полипептид. Изобретение позволяет получать о-ацетилгомосерин с высокой степенью эффективности. 6 н. и 12 з.п. ф-лы, 5 ил., 3 табл., 5 пр.
1. Модифицированный полипептид c гомосерин-O-ацетилтрансферазной активностью с аминокислотной последовательностью SEQ ID NO:17 или с по меньшей мере 95% гомологией с ней, в котором аминокислоту в положении 111 от начальной аминокислоты метионина последовательности заменяют глутаминовой кислотой.
2. Модифицированный полипептид по п. 1, где аминокислоту в положении 112 полипептида дополнительно заменяют треонином или гистидином.
3. Модифицированный полипептид по п. 1 или 2, где модифицированный полипептид имеет любую из аминокислотных последовательностей SEQ ID NO:18-20.
4. Модифицированный полипептид по п. 1, где модифицированный полипептид проявляет устойчивость к регуляции с обратной связью метионином при замене аминокислот.
5. Модифицированный полипептид по п. 4, где аминокислоту в положении 29 заменяют пролином, в положении 114 заменяют глицином, в положении 140 заменяют серином, или одной или более их комбинаций.
6. Модифицированный полипептид по п. 5, где аминокислоту в положении 112 полипептида дополнительно заменяют треонином или гистидином.
7. Модифицированный полипептид по п. 5 или 6, где модифицированный полипептид имеет любую из аминокислотных последовательностей SEQ ID NO:21-23.
8. Полинуклеотид, кодирующий модифицированный полипептид по п. 1.
9. Полинуклеотид по п. 8, где полинуклеотид имеет любую из нуклеотидных последовательностей SEQ ID NO:24-29.
10. Рекомбинантный вектор экспрессии, содержащий полинуклеотидные последовательности, функционально связанные с полинуклеотидом по п. 8.
11. Микроорганизм рода Escherichia для продукции о-ацетилгомосерина, содержащий полинуклеотид по п. 8.
12. Микроорганизм по п. 11, где микроорганизм дополнительно модифицируют, чтобы он обладал повышенной ацетил-КоА-синтетазной активностью по сравнению с эндогенной ацетил-КоА-синтетазной активностью, или дополнительно модифицируют, чтобы он обладал пантотенаткиназной активностью, устойчивой к регуляции ингибирования по типу обратной связи накоплением КоА.
13. Микроорганизм по п. 11, где увеличивают число копий одного или более генов, выбранных из группы, состоящей из гена, кодирующего фосфоенолпируваткарбоксилазу (ppc), гена, кодирующего аспартатаминотрансферазу (aspC), и гена, кодирующего аспартатполуальдегиддегидрогеназу (asd), или промотор гена заменяют промотором с увеличенной активностью или в него вводят мутацию, чтобы он обладал повышенной активностью.
14. Микроорганизм рода Escherichia для продукции о-ацетилгомосерина, трансформированный рекомбинантным вектором по п. 10.
15. Микроорганизм по п. 14, где микроорганизм принадлежит к роду Escherichia.
16. Микроорганизм по п. 15, где микроорганизм представляет собой E.coli.
17. Микроорганизм по п. 16, где микроорганизм депонирован под номером доступа KCCM11145P, KCCM11146P, KCCM11147P, KCCM11228P, KCCM11229P или KCCM11230P.
18. Способ получения O-ацетилгомосерина, включающий культивирование микроорганизма по любому из пп. 11-17, и получение O-ацетилгомосерина, который продуцируется при культивации микроорганизма.
| RU 2008105480 A, 27.08.2009 | |||
| US 7195897 B2, 27.03.2007 | |||
| ШКАФ РАДИОЭЛЕКТРОННОЙ АППАРАТУРЫ | 1995 |
|
RU2108693C1 |
| HWANG BJ Corynebacterium glutamicum utilizes both transsulfuration and direct sulfhydrylation pathways for methionine biosynthesis, J Bacteriol | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| КОВАЛЕВА Г.Ю | |||
| Регуляция биосинтеза метионина/цистеина в Corynebacterium glutamicum и родственных организмах, Молекулярная биология, т.41, N1, стр.139-150 | |||
Авторы
Даты
2015-07-20—Публикация
2011-12-21—Подача