Ссылка на родственные заявки
Настоящая заявка не является предварительной заявкой и имеет заявленный приоритет в соответствии с предварительной заявкой США с серийным номером 61/134264, поданной 8 июля 2008, а также в соответствии с предварительной заявкой США с серийным номером 61/197258, поданной 23 октября 2008, содержание которых полностью включено в настоящее описание в виде ссылок.
Область изобретения
Настоящее изобретение связано со связывающими белками и их композициями, например, антителами и их антиген-связывающими частями, специфичными в отношении метаболитов липидов, таких как простагландин E2 (PGE2), а также со способами их получения, определения их характеристических свойств и применения в профилактике, диагностике и лечении заболеваний.
Предшествующий уровень техники
Биологически активные липиды, такие как простагландин (PG), тромбоксан (TX), лейкотриен (LT) и сфингозин-1-фосфат, играют критическую физиологическую роль в этиологии различных расстройств. (Wymann, MP and Schneiter R, Nat. Rev. Mol. Cell. Biol. 9(2): 162-76 (2008)). В процессе воспаления клеточные фосфолипазы, в особенности фосфолипазы A2 и C, активируются и вызывают деградацию фосфолипидов клеточной мембраны до арахидоновой кислоты (АК). АК метаболизируется двумя основными путями обмена, циклооксигеназным (COX) и липоксигеназным (LO). Путь COX продуцирует простагландины (PGD2, PGE2, PGF2α, простациклин или PGI2, а также тромбоксан A2 или TXA2). Путь LO имеет два ответвления; путь 5-LO продуцирует лейкотриены (например, LTA4, LTB4, LTC4, LTD4, LTE4 и LTF4), а путь 15-LO продуцирует липоксины (например, LXA4, LXB4). Простаноиды, такие как простагландин (PG), тромбоксан (TX) и лейкотриен (LT), имеют различные физиологические активности для установления локального гомеостаза в организме (The Pharmacological Basis of Therapeutics, Gilman, et al., eds., 7th Ed., p. 660, Macmillan Publishing Co., New York (1985)). Продукты путей обмена COX, PG G2/PG H2 превращаются в специфические простагландины под действием тканевых специфических изомераз, с получением PGI2, TXA2, PGD2, PGE2 и PGF2α. Биологические функции простагландинов опосредованы тканеспецифическими родопсиноподобными семиспиральными трансмембранными рецепторами клеточной поверхности, сопряженными с G-белком (GPCR). Точную физиологическую/патологическую роль каждого простагландина определяют в клеточном контексте, по профилю экспрессии рецептора, по аффинности лиганда и по дифференциальному сопряжению с тем или иным путям сигнальной трансдукции (Haluska et al., Annu. Rev. Pharm. Tox. 10: 213 (1989); Prostanoids and their Receptors. In Comprehensive Medicinal Chemistry, p. 643, Pergamon Press, Oxford (1990)). Простагландины играют весьма разнообразные физиологические роли в регуляции изменения двигательности сосудов, в циклах сна/бодрствования, в кишечной секреции, липолизе, клубочковой фильтрации, дегрануляции тучных клеток, нейротрансмиссии, агрегации тромбоцитов, в лютеолизе желтого тела, в сокращении миометрия и родоразрешении, в развитии воспаления и артритов, в незаращении артериального протока, в росте и дифференцировке клеток и в целом в иммунном ответе. В патофизиологическом отношении простагландины причастны ко множеству различных заболеваний, включая проявления боли и воспаления, злокачественные опухоли, неврологические заболевания, сердечно-сосудистые заболевания и гипертонию.
Простагландин E2 (PGE2) является членом семейства простаноидов. PGE2 принимает обширное участие в процессах сокращения и расслабления желудочно-кишечного тракта, секреции желудочного сока, релаксации гладкой мускулатуры и высвобождении нейротрансмиттеров. Было идентифицировано четыре подтипа рецепторов для PGE2, включая EP1, EP2, EP3 и EP4 (Negishi, M. et al., J. Lipid Mediators Cell Signalling, 12: 379-391 (1995)), каждый из которых участвует в различных путях сигнальной трансдукции.
PGE2 является основным продуктом метаболизма АК пути обмена COX. Он является главным простагландином, синтезируемым в суставах и играющим важную роль в процессе воспаления и в патогенезе артрита. Было идентифицировано пять PGE2-синтаз. (Smith WL, Am. J. Physiol. 263 (2 Pt 2): F181-91 (1992)). Из указанных пяти мембранная PGE-синтаза (mPGES)-1 представляется ключевым PGE2-превращающим ферментом, ответственным за продукцию PGE2. MPGES-1 проявляет наиболее высокую каталитическую активность, по сравнению с другими PGE-синтазами, и функцию, в сочетании с COX-1 и/или COX-2, по превращению PGH2 в PGE2. Исследования с использованием мышей KO с mPGES-1 (Kamei, D., et al., J. Biol. Chem., 279(32): 33684-95 (2004); Trebino, C.E., et al., Proc. Natl. Acad. Sci. USA 100(15): 9044-9 (2003) специфической изоформы рецептора PGE2 у мышей KO (McCoy, J.M., et al. J. Clin. Invest., 110(5): 651-8 (2002); Majima, M., et al. Trends Pharmacol. Sci., 24(10): 524-9 (2003); а также Amano, H., et al., J. Exp. Med., 197(2): 221-32 (2003); и специфических антител против PGE2 (Portanova, J.P., et al., J. Exp. Med., 184(3): 883-91 (1996); Zhang, Y., et al., J. Pharmacol. Exp. Ther., 283(3): 1069-75(1997) выявили, что у животных моделей PGE2 играет, по-видимому, основную роль в развитии ревматоидного артрита (RA), боли и воспаления, а также злокачественной опухоли. В отсутствие mPGES-1 уровни COX-1, COX-2 и других PGE2-синтаз остаются относительно неизменными. Мыши mPGES-1 KO являются жизнеспособными, фертильными и нормально развиваются по сравнению с мышами дикого типа. Однако у них возникает резкое снижение как базальных уровней продуцирования PGE2, так и продуцирования PGE2 из макрофагов после сенсибилизации различными воспалительными стимулами. Кроме того, повышается продукция TXA2. У мышей mPGES-1 KO снижена частота встречаемости и степень тяжести развития артрита, к тому же указанные животные в различных моделях проявляли резистентность к боли и воспалению. В нескольких лабораториях независимо были получены различные изоформы рецепторов для EP у мышей KO. Указанные мыши являются жизнеспособными, фертильными и нормально развиваются. Исследование с использованием мышей KO со специфической изоформой EP показало, что различные функции PGE2 опосредованы специфическими изоформами EP. Например, отсутствие у мышей изоформы EP4 четко отражается на тяжести развития артрита, тогда как отсутствие EP3 влияет на развитие и прогрессирование опухолей через модуляцию продуцирования VEGF стромальными клетками и ангиогенез.
В настоящее время считается, что дефекты в биосинтезе и метаболизме простагландинов играют важную роль в этиологии аутоиммунных расстройств и воспаления. Например, синовиальные ткани пациентов, страдающих от ревматоидного артрита, продуцируют в большем количестве PGE2 и простагландин F2α (PGF2α) по сравнению с синовиальными тканями, полученными у субъектов, у которых они не затронуты патологическим процессом (Blotman, F., et al., Rev. Rhum. Mal. Osteoartic, 46(4): 243-7 (1979)). Сходным образом, повышенный синтез PGE2 и PGF2α имеет место у пациентов, у которых проявляются системные и желудочно-кишечные симптомы на фоне нарушения переносимости пиши. Таким образом, головные боли, носящие характер мигрени, проявляющиеся вследствие принятия определенной пищи, могут быть результатом повышенного синтеза простагландинов второго ряда. Множественный склероз также ассоциируется с дисбалансом нормальных уровней простагландинов PGE1 и PGE2. Многие аспекты репродукции, например, фертильность, беременность и роды, могут регулироваться простагландинами. Простагландины играют также ведущую роль в физиологии репродукции. Избыточный синтез простагландинов вызывает дисменорею и родовую деятельность, которые могут быть индуцированы путем внутривенного введения простагландинов или путем установки маточного кольца. (Wang L. et al., Occup. Environ. Med. 61(12): 1021-1026 (2004)). Избыточный синтез PGE2 играет ведущую роль также в расстройствах процессов репродукции, таких как бесплодие, повторные выкидыши, преэклампсия и эклампсия. Следовательно, есть потребность в антителах, специфичных в отношении PGE2, которые блокируют или модулируют его биологические функции, которые могут быть использованы для профилактики и лечения заболеваний, ассоциированных с избыточной продукцией PGE2, а также в диагностических целях.
Имеется сообщение о получении высокоаффинного (с KD, приблизительно составляющим 300 пкМ) моноклонального антитела (mAb) против PGE2, 2B5. (Mnich SJ, et al. J. Immunol. 155(9): 4437-44 (1995)). Эффективность 2B5 по сравнению с индометацином, ингибитором COX-1,2, была определена на животных моделях боли и воспаления у мышей и индуцированного адъювантом артрита у крыс. (Portanova JP et al., J. Exp. Med. 184(3): 883-91 (1996)). Указанные исследования четко показали, что 2B5 было столь же эффективно, сколь и индометацин, в ослаблении боли и воспаления, давая основания предполагать, что PGE2 является ключевым звеном в реализации пути COX-1,2 метаболизма АК у указанных животных моделей.
В течение десятилетий ингибирование пан-PG-продуцирования под действием ингибиторов COX считается хорошо установленной терапевтической стратегией. Известны две изоформы COX, COX-1 и COX-2, каждая из которых кодируется индивидуальным геном. Указанные две изоформы выполняют, по существу, одну и ту же каталитическую реакцию и имеют сходные третичные структуры (Garavito RM, et al., Annu. Rev. Biophys. Biomol. Struct. 32: 183-206 (2003)). COX-1 конститутивно экспрессируется почти во всех тканях и считается в значительной степени ответственным за нормальные функции "домашнего хозяйства", такие как защита клеток и гомеостаз желудка. В отличие от этого, COX-2 конститутивно экспрессируется в особых тканях и является высокоиндуцибельным в местах локализации воспаления и злокачественной опухоли. Таким образом, считается, что COX-2-опосредованная продукция PG играет важную роль в местах локализации воспаления и злокачественной опухоли. Традиционные нестероидные противовоспалительные лекарственные средства (NSAID), например, аспирин, индометацин, ибупрофен) ингибируют обе изоформы COX. Указанные соединения являются наиболее широко применимыми лекарственными средствами в случае боли, ревматоидного артрита (RA), остеоартрита (OA), а также сердечно-сосудистых заболеваний, и в настоящее время они проходят испытания на предмет возможной профилактики злокачественной опухоли толстой кишки и AD. Основными возражениями в связи с традиционными NSAID являются нежелательные явления в популяциях высокого риска, связанные с желудком и почками, и, по-видимому, указанные явления происходят в связи с ингибированием COX-1. Соответственно, второе поколение NSAID, селективные ингибиторы COX-2 (например, целекоксиб, целебрекс; рофекоксиб, виокс; вальдекоксиб, бекстра), имеют, как полагают, улучшенный терапевтический профиль. Это предположение привело к тому, что их стали широко применять против боли, RA и OA. Начиная с момента утверждения первого ингибитора COX-2 в 1999 году, суммарные продажи ингибиторов COX-2 в 2004 году приблизительно составили сумму в 5 биллионов долларов США. Однако к настоящему времени некоторые селективные ингибиторы COX-2 были изъяты с рынка, и они находятся в стадии пересмотра на уровне FDA, в силу их побочных эффектов в отношении сердечно-сосудистых заболеваний в популяции пациентов высокого риска при использовании ими ингибиторов COX-2. Ответственность, ассоциированная с ингибиторами COX, возможно, возрастает в силу того, что они способны ингибировать все простагландины, и, в частности, в силу их способности дифференциально препятствовать продуцированию PGI2 и TXA2, каждый из которых играет важную роль в поддержании сердечно-сосудистого гомеостаза (Martinez-Gonzalez J. et al., Curr. Pharm. Des. 13(22): 2215-2227 (2007)). Ингибирование COX может способствовать тому, что АК становится более доступна для ее метаболизирования липоксигеназным (LO) путем, и, таким образом, увеличивается продукция лейкотриенов и липоксинов, которые могут вносить свой вклад в возникновение побочных эффектов, ассоциированных с ингибированием COX. Современные исследования с использованием мышей, нокаутных в отношении COX-1 и/или COX-2, и специфических ингибиторов COX-1 и COX-2 дают основание допустить, что предположения относительно физиологических ролей двух указанных COX-изоформ могут быть неверными. (Loftin, CD., et al. Prostaglandins Other Lipid Mediat. 68-69: 177-85 (2002)). Указанные исследования свидетельствуют о том, что как COX-1, так и COX-2 играют важную роль в обеспечении простагландинов для поддержания тканевого гомеостаза, и что обе эти изоформы могут участвовать в развитии заболеваний, таких как боль, воспаление и злокачественная опухоль. Следовательно, блокирование пагубного PGE2 ниже путей COX-1 и COX-2 специфическим антителом представляется привлекательным подходом к лечению определенных заболеваний человека.
Другим примером важного биологически активного простагландина является PGD2. PGD2 представляет собой основной циклооксигеназный продукт арахидоновой кислоты, происходящий из тучных клеток при иммунологической сенсибилизации (Lewis, et al., J. Immunol. 129: 1627-1631 (1982)). Активированные тучные клетки, основной источник PGD2, играют одну из ключевых ролей на пути, приводящем к аллергическому ответу при таких состояниях как астма, аллергический ринит, аллергический конъюнктивит, аллергический дерматит и другие заболевания (Brightling, et al., Clin. Exp. Allergy 33: 550-556 (2003)). Современные исследования показывают, что свои эффекты PGD2 оказывает посредством двух различных связанных с G-белком рецепторов (GPCR), D-простаноидным рецептором (DP) и молекулой, гомологичной хемотактическому рецептору и экспрессируемой на Т-хелперных клетках типа 2 (CRTH2, chemoattractant receptor-homologous molecule expressed on T helper type-2), экспрессируемых в различных тканях человека. Системой PGD2/CRTH2 опосредован хемотаксис эозинофилов, базофилов и Th2-клеток, которые участвуют в индукции аллергического воспаления (Ulven T et al., Curr. Top. Med. Chem. 6(13): 1427-1444 (2006)). Многие из воздействий PGD2 опосредованы его действием на рецептор простагландина D-типа ("DP"), G-белок-связанный рецептор, экспрессируемый на клетках эпителия и гладкой мускулатуры. В течение длительного периода считалось, что при астме дыхательный эпителий является ключевым источником воспалительных цитокинов и хемокинов, которые способствуют прогрессированию заболевания (Holgate, et al., Am. J. Respir. Crit. Care Med. 162: 113-117 (2000)). В экспериментальной мышиной модели астмы уровень DP-рецептора на дыхательном эпителии резко увеличивается при сенсибилизации антигеном (Matsuoka, et al., Science 287: 2013-2017 (2000)). DP-рецептор участвует в аллергическом рините у человека, частом аллергическом заболевании, которое характеризуется симптомами чихания, зуда, ринореи и заложенности носа. Было показано, что антагонисты DP эффективны в плане облегчения симптомов аллергического ринита у многих видов, и, более конкретно, было показано, что они ингибируют вызванную антигеном заложенность носа, наиболее ярко выраженный симптом аллергического ринита (Jones, et al., Am. J. Resp. Crit. Care Med. 167: A218 (2003); Arimura, et al., S-5751. J. Pharmacol. Exp. Ther. 298(2): 411-9 (2001)). DP-антагонисты эффективны также в экспериментальных моделях аллергического конъюнктивита и аллергического дерматита (Arimura et al., S-5751. J. Pharmacol. Exp. Ther. 298(2): 411-9 (2001); Torisu, et al., Bioorg. & Med. Chem. 12: 5361-5378 (2004)). Таким образом, есть потребность также и в антителах, специфичных в отношении PGD2, и, следовательно, блокирование или модуляция его биологических функций могут быть использованы для профилактики и лечения заболеваний, которые ассоциированы с избыточной продукцией PGD2.
Сфингозин-1-фосфат (S1P) является другим примером биологически активного липида, который индуцирует многие клеточные эффекты, включая и те, которые приводят к агрегации тромбоцитов, к клеточной пролиферации, а также те, которыми обусловлены клеточная морфология, инвазия опухолевых клеток, хемотаксис эндотелиальных клеток и ангиогенез эндотелиальных клеток in vitro. Следовательно, S1P-рецепторы являются подходящими мишенями для терапевтических воздействий, таких как ранозаживление и ингибирование опухолевого роста. S1P-сигналы передаются клеткам отчасти через группы связанных с G-белком рецепторов, обозначаемых S1P1, S1P2, S1P3, S1P4 и S1P5 (раньше называемых, соответственно, EDG-1, EDG-5, EDG-3, EDG-6 и EDG-8). Указанные рецепторы имеют 50-55% аминокислотную и кластерную идентичность трем остальным рецепторам (LPA1, LPA2 и LPA3 (раньше называемым EDG-2, EDG-4 и EDG-7)) для родственной по структуре лизофосфатидиловой кислоты (LPA). (Ishii, I. et al., Mol. Pharmacol. 58(5): 895-902 (2000)). Когда лиганд связывается с рецептором, в связанном с G-белком рецепторе (GPCR) индуцируется конформационный сдвиг, являющийся причиной того, что ГДФ на α-субъединице ассоциированных G-белков заменяется на ГТФ, с последующим высвобождением G-белков в цитоплазму. Затем α-субъединица и βγ-субъединица диссоциируют, после чего каждая из субъединиц может ассоциировать с эффекторными белками, что активирует вторичные посредники, приводя к реализации клеточного ответа. В конечном итоге ГТФ на G-белках гидролизуется до ГДФ, и происходит реассоциация субъединиц G-белков друг с другом, а затем с рецептором. Амплификация играет основную роль в общем пути метаболизма GPCR. Связывание одного лиганда с одним рецептором приводит к активации многих G-белков, каждый из которых способен к ассоциации со многими эффекторными белками, что приводит к усиленному клеточному ответу. S1P-рецепторы служат хорошими мишенями для лекарственных средств, поскольку индивидуальные рецепторы являются как тканеспецифичными, так и специфичными в отношении конкретного ответа. Тканеспецифичность S1P-рецепторов важна, поскольку создание агониста или антагониста, селективного в отношении одного рецептора, локализует клеточный ответ на тканях, содержащих данный рецептор, ограничивая появление нежелательных побочных эффектов. Специфичность ответа S1P-рецепторов также важна, поскольку дает возможность создания агонистов или антагонистов, которые вызывают инициацию или супрессию определенных клеточных ответов, не воздействуя на другие ответы. Например, специфичность ответа S1P-рецепторов может допустить создание S1P-миметика, который инициирует агрегацию тромбоцитов, не влияя на морфологию клеток.
S1P образуется в качестве метаболита сфингозина и его реакции с сфингозинкиназой, и он в избытке хранится в агрегатах тромбоцитов, когда имеются высокие уровни сфингозинкиназы и отсутствует сфингозинлиаза. S1P высвобождается в процессе агрегации тромбоцитов, накапливается в сыворотке и обнаруживается также в злокачественных асцитах. Биодеградация S1P, наиболее вероятно, происходит путем гидролиза под действием фосфогидролаз, в частности, эктофосфогидролаз сфингозин-1-фосфата. Следовательно, существует потребность в антителах, специфичных в отношении S1P, для модуляции его биологических функций либо путем блокирования его взаимодействия с рецепторами, либо путем стабилизации S1P и усиления его биологических эффектов, для применения в профилактике или лечении аутоиммунных заболеваний, воспалительных заболеваний и злокачественных опухолей.
С учетом роли PGE2 в развитии различных расстройств человеческого организма, созданы терапевтические стратегии для ингибирования или противодействия активности PGE2. В частности, нет никаких публикаций относительно терапевтических антител, подходящих для доставки в организм человека, которые бы связывали и нейтрализовали PGE2. В данной области есть потребность в создании улучшенных антител, способных к связыванию и нейтрализации PGE2.
Краткое описание изобретения
Настоящее изобретение относится к связывающим белкам, специфичным в отношении метаболитов липидов, таких как простагландин E2 (PGE2). Связывающие PGE2 белки согласно изобретению включают в себя, но не ограничиваются перечисленным, антитела, антиген-связывающие фрагменты, а также антиген-связывающие фрагменты с различными каркасными структурами, которые способны к связыванию с PGE2.
Один из аспектов настоящего изобретения относится к связывающим белкам, способным к связыванию PGE2. В одном из аспектов связывающие белки согласно изобретению обладают нейтрализующей, стабилизирующей активностью, активностью антагониста и/или агониста. В другом аспекте связывающие белки способны к модуляции биологической функции PGE2. Например, связывающие белки способны, по меньшей мере, к нейтрализации PGE2.
В одном из аспектов настоящего изобретения связывающие белки способны к связыванию PGE2 и предотвращению связывания PGE2 с одним или несколькими рецепторами PGE2 (например, EP1, EP2, EP3 и EP4). В одном из аспектов настоящего изобретения связывающие белки способны к связыванию PGE2 и предотвращению связывания PGE2 с рецепторами EP1, EP2, EP3 и EP4.
Настоящее изобретение связано со способами получения, определения свойств и применения PGE2-связывающих белков в качестве монотерапии или в качестве комбинированной терапии наряду с другими терапевтическими средствами; а также со способами профилактики и/или лечения заболеваний, опосредованных PGE2, например, аутоиммунных и воспалительных заболеваний, таких, например, как ревматоидный артрит, болезнь Крона, остеоартрит, AMD [возрастная макулярная дистрофия], лимфаденопатии, гемолитические анемии, пурпура, анкилозирующий спондилит, множественный склероз, сахарный диабет, злокачественная опухоль, боль, потеря/восстановление кости, атеросклеротические заболевания, репродуктивные расстройства и другие заболевания. Связывающие белки согласно изобретению могут быть использованы в диагностике таких заболеваний.
В одном из воплощений настоящего изобретения связывающий белок является выделенным белком или его антиген-связывающим фрагментом, которые связываются с PGE2. Такое связывание может быть продемонстрировано путем анализа биотинилированного PGE2 на основе ELISA, с EC50, выбранной из группы, составляющей приблизительно из интервалов от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M. В другом воплощении связывание белков, связывающихся с PGE2, может быть продемонстрировано радиоиммуноанализом на основе 3H-меченного PGE2, с KD, выбранным из группы, состоящей из интервалов приблизительно от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M. В другом воплощении связывание белков, связывающихся с PGE2, может быть продемонстрировано методом FLIPR, где PGE2-индуцированный приток кальция, опосредованный его рецептором EP4, ингибируется путем связывания белков, связывающихся с PGE2, с IC50, выбранной из группы, состоящей из интервалов приблизительно от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M.
В одном из воплощений антитело ингибирует связывание биотинилированного PGE2 с рецептором EP1, EP2, EP3 и/или EP4 на клеточной поверхности на основе FACS-анализа связывания рецептора, или же антитело ингибирует связывание биотинилированного PGE2 с рецептором EP1, EP2, EP3 и/или EP4 на препарате мембран, полученном с помощью рецептор-экспрессирующих клеток, в анализе связывания рецептора на основе ELISA, с IC50, выбранной из группы, состоящей из интервалов приблизительно от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M, или антитело ингибирует связывание 3H-PGE2 с рецептором EP1, EP2, EP3 и/или EP4 на клеточной поверхности или на препарате мембран, в радиоиммуноанализе на основе 3H-меченного PGE2, с IC50, приблизительно составляющей от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M, с IC50, и/или антитело ингибирует PGE2-индуцированный приток кальция в EP4-опосредованном FLIPR-анализе, с IC50, приблизительно составляющей от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M. В одном из воплощений антитело или его антиген-связывающий фрагмент связываются с PGE2 и ингибируют связывание PGE2, по меньшей мере, с одним из его рецепторов в анализе связывания рецептора на основе клеточной поверхности или в анализе связывания рецептора на основе радиоиммуноанализа приблизительно на 70-100% при концентрации 100 нМ.
В одном из воплощений указанным антителом является антитело 19C9, 4F10, 15F10, K1B, K7H, K3A, L11, L21, 2B5-7.0, 2B5-8.0 или 2B5-9.0, или его вариант. В одном из воплощений указанным вариантом является гуманизированный вариант, такой как Hu2B5.P1 или Hu2B5.P2.
В другом аспекте настоящее изобретение связано с выделенным антителом или его антиген-связывающим фрагментом, которые связываются с PGE2 и ингибируют отек лапы приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% на модели индуцированного каррагинаном отека лапы у грызунов. В особом воплощении указанное антитело ингибирует отек лапы более чем приблизительно на 10% на модели индуцированного каррагинаном отека лапы у грызунов.
В другом аспекте настоящее изобретение связано с выделенным антителом или его антиген-связывающим фрагментом, которые связываются с PGE2 и ингибируют припухлость лапы или артрит среднего масштаба приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% на модели индуцированного коллагеном артрита у грызунов. В особом воплощении указанное антитело ингибирует припухлость лапы или артрит среднего масштаба приблизительно более чем приблизительно на 10% на модели индуцированного коллагеном артрита у грызунов.
В другом аспекте настоящее изобретение связано с выделенным антителом или с его антиген-связывающим фрагментом, которые связываются с PGE2 и ингибируют отек лапы приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% на модели индуцированного каррагинаном отека подушечки стопы у грызунов. В особом воплощении указанное антитело ингибирует отек подушечки стопы более чем приблизительно на 10% на модели индуцированного каррагинаном отека подушечки стопы у грызунов.
В другом аспекте настоящее изобретение связано с выделенным антителом или его антиген-связывающим фрагментом, которые связываются с PGE2 и ингибируют припухлость лапы или артрит среднего масштаба приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% на модели индуцированного коллагеном артрита у грызунов. В особом воплощении указанное антитело ингибирует припухлость лапы или артрит среднего масштаба приблизительно более чем приблизительно на 10% на модели индуцированного коллагеном артрита у грызунов.
В другом воплощении связывающий белок согласно изобретению имеет константу скорости диссоциации (koff) от PGE2, составляющую самое большее приблизительно 10-3 сек-1; самое большее приблизительно 10-4 сек-1; самое большее приблизительно 10-5 сек-1; или самое большее приблизительно 10-6 сек-1, измеряемую методом радиоиммуноанализа. Предпочтительно, чтобы связывающий белок согласно изобретению имел константу скорости диссоциации (koff) от PGE2, приблизительно составляющую от 10-3 сек-1 приблизительно до 10-4 сек-1; приблизительно от 10-4 сек-1 приблизительно до 10-5 сек-1; или приблизительно от 10-5 сек-1 приблизительно до 10-6 сек-1, определяемую методом радиоиммуноанализа.
В другом воплощении связывающий белок согласно изобретению имеет константу диссоциации (KD) от PGE2, определяемую методом радиоиммуноанализа, составляющую самое большее приблизительно 10-6 M; самое большее приблизительно 10-7 M; самое большее приблизительно 10-8 M; самое большее приблизительно 10-9 M; самое большее приблизительно 10-10 M; самое большее приблизительно 10-11 M; самое большее приблизительно 10-12 M; или самое большее приблизительно 10-13 M. Предпочтительно, чтобы связывающий белок согласно изобретению имел константу диссоциации (KD) от PGE2, приблизительно составляющую от 10-7 приблизительно до 10-8 M; приблизительно от 10-8 приблизительно до 10-9 M; приблизительно от 10-9 приблизительно до 10-10 M; приблизительно от 10-10 приблизительно до 10-11 M; приблизительно от 10-11 приблизительно до 10-12 M; или приблизительно от 10-12 приблизительно до 10-13 M. Один из аспектов настоящего изобретения связан, по меньшей мере, с одним анти-PGE2-идиотипическим антителом, по меньшей мере, к одному связывающему PGE2 белку согласно изобретению. Антиидиотипическое антитело включает в себя любой белок или пептид, содержащий молекулу, которая содержит, по меньшей мере, часть молекулы иммуноглобулина, такую, без ограничения, как, по меньшей мере, одну определяющую комплементарность область (CDR) тяжелой или легкой цепи или их лиганд-связывающую область, вариабельную область тяжелой цепи или вариабельную область легкой цепи, константную область тяжелой цепи или легкой цепи, каркасную область; или любую их часть, которая может быть встроена в связывающий белок согласно изобретению.
В другом аспекте настоящее изобретение связано с выделенным антителом или его антиген-связывающим фрагментом, которые связываются с простагландином E2 и ингибируют связывание простагландина E2, по меньшей мере, с одним из рецепторов E1, E2, E3 и E4 в анализе связывания рецептора на основе рецепторов клеточной поверхности, с IC50, выбранной из группы, состоящей приблизительно из интервалов от 1×10-6 до 1×10-7 M, от 1×10-7 до 1×10-8 M, от 1×10-8 до 1×10-9 M, от 1×10-9 до 1×10-10 M, от 1×10-10 приблизительно до 1×10-11 M и от 1×10-11 до 1×10-12 M, или в анализе связывания рецептора на основе метода ELISA, с IC50, выбранной из группы, приблизительно состоящей из интервалов от 1×10-6 до 1×10-7 M, от 1×10-7 до 1×10-8 M, от 1×10-8 до 1×10-9 M, от 1×10-9 до 1×10-10 M, от 1×10-10 до 1×10-11 M и от 1×10-11 до 1×10-12 M.
В другом аспекте антитело или его антиген-связывающий фрагмент связываются с простагландином E2 и ингибируют связывание простагландина E2, по меньшей мере, с одним из рецепторов E1, E2, E3 и E4 в анализе связывания с рецептором клеточной поверхности или в радиоиммуноанализе на основе 3H-PGE2 с использованием экспрессирующих клеток или препаратов клеточных мембран, экспрессирующих, по меньшей мере, один из рецепторов E1, E2, E3 и E4, приблизительно на 70-100%, в концентрации приблизительно в 100 нМ. В одном из воплощений антитело выбрано из группы, состоящей из антител 19C9, 4F10, 15F10, K1B, K7H, K3A, L11, L21, 2B5-7.0, 2B5-8.0 и 2B5-9.0. В другом воплощении антитело или его антиген-связывающий фрагмент способны модулировать биологическую функцию простагландина E2, такую как нейтрализация простагландина E2. Указанное антитело или его антиген-связывающий фрагмент выбраны из группы, состоящей из молекулы иммуноглобулина, моноклонального антитела, химерного антитела, CDR-привитого антитела, гуманизированного антитела, Fab-, Fab'-, F(ab')2-, Fv-, дисульфидным мостиком связанного Fv-, scFv-, антитела, содержащего один домен, диатела, мультиспецифического антитела, антитела с двойной специфичностью и биспецифического антитела. В одном из воплощений указанное антитело или его антиген-связывающий фрагмент представляют собой гуманизированное антитело. В другом воплощении указанное антитело или его антиген-связывающий фрагмент выбраны из группы, состоящей из Hu2B5.P1 и Hu2B5.P2. Данное изобретение связано также с фармацевтической композицией, содержащей указанное антитело или его антиген-связывающий фрагмент и фармацевтически приемлемый носитель. В одном из воплощений указанная фармацевтическая композиция дополнительно содержит, по меньшей мере, одно дополнительное терапевтическое средство для лечения расстройства, при котором активность простагландина E2 является неблагоприятной.
В другом аспекте настоящее изобретение связано со способом получения антитела или его фрагмента, который связывается с простагландином E2, предусматривающим проведение стадий иммунизации животного, отличного от человека, простагландин-E2-тиреоглобулином, сбора из организма жидкости или органа, содержащих антитело против простагландина E2, и выделения антитела против простагландина E2.
В другом аспекте настоящее изобретение связано с гуманизированным антителом, содержащим антиген-связывающий домен, способный связываться с простагландином E2, содержащим, по меньшей мере, одну CDR-область, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 54-59. В другом воплощении настоящее изобретение связано с гуманизированным антителом, содержащим антиген-связывающий домен, содержащий, по меньшей мере, одну CDR-область, содержащую аминокислотную последовательность, по меньшей мере, приблизительно на 60%, по меньшей мере, приблизительно на 65%, по меньшей мере, приблизительно на 70%, по меньшей мере, приблизительно на 75%, по меньшей мере, приблизительно на 80%, по меньшей мере, приблизительно на 85%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно на 95% или, по меньшей мере, приблизительно на 98% гомологичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 54-59. В одном из аспектов указанное гуманизированное антитело содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 78, 79, 80 и 81.
В одном из аспектов связывающий белок согласно изобретению способен связываться с PGE2, домен, связывающий указанный антиген, содержит, по меньшей мере, одну область CDR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из CDR-H1: GYTFTKYWLG (SEQ ID NO: 54), CDR-H2: DIYPGYDYTHYNEKFKD (SEQ ID NO: 55), CDR-H3: SDGSSTY (SEQ ID NO: 56), CDR-L1: TSSQNIVHSNGNTYLE (SEQ ID NO: 57), CDR-L2: KVSNRFSG (SEQ ID NO: 58), CDR-L3: FQVSHVPYT (SEQ ID NO: 59).
В другом воплощении настоящее изобретение связано со связывающим белком или его фрагментом, содержащими антиген-связывающий домен, содержащий, по меньшей мере, одну область CDR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, 7, 8, 10, 11, 12, 14, 15, 16, 18, 19, 20, 22, 23, 26, 27, 28, 30, 31, 32, 34, 35, 37, 38 и 39. В другом воплощении связывающий белок или его фрагмент содержит антиген-связывающий домен, содержащий, по меньшей мере, одну VH- область, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, 13, 21, 25, 33, 40, 42 и 44. Еще в одном воплощении связывающий белок или его фрагмент содержат антиген-связывающий домен, содержащий, по меньшей мере, одну VL-область, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, 17, 24, 29, 36, 41, 43 и 45. Еще в одном воплощении связывающий белок или его фрагмент содержат антиген-связывающий домен, содержащий, по меньшей мере, одну область CDR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 54-59.
В одном из воплощений связывающий белок содержит, по меньшей мере, 3 области CDR, выбранные, например, из набора VH-CDR, выбранных из группы, состоящей из SEQ ID NO: 6, 7 и 8; SEQ ID NO: 14, 15 и 16; SEQ ID NO: 14, 22 и 23, SEQ ID NO: 26, 27, 28 и 32; SEQ ID NO: 26, 34 и 35; а также SEQ ID NO: 54, 55 и 56. В другом воплощении, по меньшей мере, 3 области CDR выбраны из набора VL-CDR, выбранных из группы, состоящей из SEQ ID NO: 10, 11 и 12; SEQ ID NO: 17, 18 и 19; SEQ ID NO: 30, 31 и 32; SEQ ID NO: 37, 38 и 39; SEQ ID NO: 42, 43 и 44; а также SEQ ID NO: 57, 58 и 59. Еще в одном воплощении, по меньшей мере, 3 области CDR содержат набор аминокислотных последовательностей VH-CDR: SEQ ID NO: 54, 55 и 56, и/или набор аминокислотных последовательностей VL-CDR: SEQ ID NO: 57, 58 и 59.
В другом воплощении связывающий белок содержит, по меньшей мере, два набора CDR вариабельных доменов, выбранных, например, из группы, состоящей из SEQ ID NO: 6, 7, 8 и SEQ ID NO: 10, 11, 12; SEQ ID NO: 14, 15, 16 и SEQ ID NO: 18, 19, 20; SEQ ID NO: 14, 22, 23 и SEQ ID NO: 10, 11, 12; SEQ ID NO: 26, 27, 28 и SEQ ID NOs: 30, 31, 32; а также SEQ ID NO: 26, 34, 35 и SEQ ID NO: 37, 38, 39.
В другом воплощении связывающий белок согласно изобретению содержит два вариабельных домена, которые имеют аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 5 и SEQ ID NO: 9; SEQ ID NO: 13 и SEQ ID NO: 17; SEQ ID NO: 21 и SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 29; SEQ ID NO: 33 и SEQ ID NO: 36; SEQ ID NO: 40 и SEQ ID NO: 41; SEQ ID NO: 42 и SEQ ID NO: 43; а также SEQ ID NO: 44 и SEQ ID NO: 45. В другом воплощении указанные два вариабельных домена имеют аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 60 и SEQ ID NO: 61; SEQ ID NO: 62 и SEQ ID NO: 63; SEQ ID NO: 64 и SEQ ID NO: 65; SEQ ID NO: 66 и SEQ ID NO: 67; SEQ ID NO: 68 и SEQ ID NO: 69; SEQ ID NO: 70 и SEQ ID NO: 71; SEQ ID NO: 72 и SEQ ID NO: 73; SEQ ID NO: 74 и SEQ ID NO: 75; а также SEQ ID NO: 76 и SEQ ID NO: 77. В другом воплощении указанные два вариабельных домена имеют аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 78 и SEQ ID NO: 79; и SEQ ID NO: 80 и SEQ ID NO: 81.
В другом аспекте настоящее изобретение связано с гуманизированным антителом или его фрагментом, которые связываются с простагландином E2, при этом указанное гуманизированное антитело содержит, по меньшей мере, одну VH-область, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60, 62, 64, 66, 68, 70, 72, 74, 76, 78 и 80. В другом воплощении указанное гуманизированное антитело или его фрагмент содержит, по меньшей мере, одну VL-область, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 61 63, 65, 67, 69, 71, 73, 75, 77, 79 и 81. Еще в одном воплощении, по меньшей мере, одна из указанных VH-областей или, по меньшей мере, одна из VL-областей содержит акцепторные последовательности человеческой каркасной области, которые содержат, по меньшей мере, одну аминокислотную замену, при этом указанная аминокислотная последовательность каркасной области, по меньшей мере, на 65% идентична последовательности акцепторной последовательности человеческой каркасной области. Например, акцепторная человеческая каркасная область может содержать, по меньшей мере, одну аминокислотную замену ключевого остатка каркасной области, где ключевой остаток выбран из группы, состоящей из остатка, прилегающего к области CDR, из остатка на участке гликозилирования, из редкого остатка, из остатка, способного взаимодействовать с простагландином E2; из остатка, способного взаимодействовать с областью CDR, из канонического остатка, из остатка, расположенного на границе контакта вариабельной области тяжелой цепи и вариабельной области легкой цепи, из остатка внутри зоны Верньера, а также из остатка в области перекрывания между определяемой Чотиа CDR1 вариабельной области тяжелой цепи и определяемой Кабатом первой каркасной области тяжелой цепи.
В другом воплощении связывающий белок дополнительно содержит акцепторную человеческую каркасную область.
В одном из воплощений настоящего изобретения акцепторные человеческие последовательности тяжелой цепи и легкой цепи выбраны из последовательностей, описанных в таблице 7 и в таблице 8 (Пример 4.2.1). Другие акцепторные человеческие последовательности тяжелой цепи и легкой цепи хорошо известны в данной области и являются подходящими для применения в настоящем изобретении. В одном из воплощений связывающим белком является CDR-привитое антитело или его антиген-связывающая часть, способные связываться с PGE2. В другом воплощении связывающим белком является гуманизированное антитело или его антиген-связывающая часть, способные связываться с простагландином PGE2. В одном из воплощений CDR-привитое антитело или гуманизированное антитело, или его антиген-связывающая часть содержат одну или несколько описанных здесь областей CDR, например, три или более, четыре или более, пять или более, или же шесть или более областей CDR. В другом воплощении CDR-привитое антитело или гуманизированное антитело, или его антиген-связывающая часть содержат акцепторную человеческую каркасную область. Указанная акцепторная человеческая каркасная область может быть любой акцепторной каркасной областью человеческого иммуноглобулина. В особом воплощении акцепторная человеческая каркасная область представляет собой любую одну из описанных здесь акцепторных человеческих рамок считывания. В одном из воплощений области CDR встроены в вариабельный домен человеческого антитела акцепторной человеческой каркасной области. В одном из воплощений указанный вариабельный домен человеческого антитела представляет собой консенсусный человеческий вариабельный домен. В другом воплощении указанная акцепторная человеческая каркасная область содержит, по меньшей мере, одну аминокислотную замену ключевого остатка в последовательности каркасной области, где ключевой остаток выбран из группы, состоящей из остатка, прилегающего к области CDR, из остатка на участке гликозилирования, из редкого остатка, из остатка, способного взаимодействовать с простагландином E2; из остатка, способного взаимодействовать с областью CDR, из канонического остатка, из остатка, расположенного на границе контакта вариабельной области тяжелой цепи и вариабельной области легкой цепи, из остатка внутри зоны Верньера, а также из остатка в области перекрывания между определяемой Чотиа CDR1 вариабельной области тяжелой цепи и определяемой Кабатом первой каркасной области тяжелой цепи. В одном из воплощений акцепторная человеческая каркасная области содержит, по меньшей мере, одну аминокислотную замену каркасной области, при этом аминокислотная последовательность каркасной области, по меньшей мере, на 65% идентична последовательности указанной акцепторной человеческой каркасной области и содержит, по меньшей мере, 70 аминокислотных остатков, идентичных указанной акцепторной человеческой каркасной области. В одном из воплощений указанная аминокислотная замена ключевого остатка в каркасной области выбрана из группы, состоящей из замены M (человек) в положении 48 на I (мышь), замены V (человек) в положении 68 на A (мышь), замены M (человек) в положении 70 на L (мышь), и замены T (человек) в положении 72 на V (мышь) в вариабельной области тяжелой цепи; и замены I (человек) в положении 2 на V (мышь) и замены V (человек) в положении 3 на L (мышь) в вариабельной области легкой цепи.
В другом аспекте настоящее изобретение связано с антительной конструкцией, содержащей любой один из связывающих белков и линкерный полипептид и/или константный домен иммуноглобулина. В одном из воплощений указанная антительная конструкция выбрана из группы, состоящей из молекулы иммуноглобулина, моноклонального антитела, химерного антитела, CDR-привитого антитела, гуманизированного антитела, Fab, Fab', F(ab')2, Fv, дисульфидным мостиком связанного Fv, scFv, антитела, содержащего один домен, диатела, мультиспецифического антитела, антитела с двойной специфичностью и биспецифического антитела. В одном из воплощений указанная антительная конструкция содержит константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из константного домена человеческого IgM, константного домена человеческого IgG1, константного домена человеческого IgG2, константного домена человеческого IgG3, константного домена человеческого IgG4, константного домена человеческого IgE и константного домена человеческого IgA. В одном из воплощений указанная антительная конструкция содержит константный домен иммуноглобулина, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1; SEQ ID NO: 2; SEQ ID NO: 3; SEQ ID NO: 4; и SEQ ID NO: 5.
В другом воплощении настоящее изобретение связано с конъюгатом антитела против PGE2, содержащим анти-PGE2-антительную конструкцию и средство, выбранное из группы, состоящей из иммуноадгезивной молекулы, визуализирующего средства и цитотоксического средства. В одном из воплощений указанным средством является визуализирующее средство, выбранное из группы, состоящей из радиоактивной метки, фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки и биотина. В другом воплощении указанным визуализирующим средством является радиоактивная метка, выбранная из группы, состоящей, например, из 3H, 14С, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm. В другом воплощении указанным средством является терапевтическое или цитотоксическое средство, выбранное из группы, состоящей из антиметаболита, алкилирующего средства, антибиотика, фактора роста, цитокина, антиангиогенного средства, антимитотического средства, антрациклина, токсина и апоптотического средства.
В другом воплощении связывающий белок является гликозилированным. В особом воплощении белок, связывающийся с PGE2, имеет характер гликозилирования, свойственный человеку.
В другом воплощении белок, связывающийся с PGE2, антительная конструкция или конъюгат антитела являются кристаллизованными (например, существуют в виде кристалла). В одном из воплощений указанный кристалл представляет собой свободный от носителя фармацевтический кристалл с контролируемым высвобождением. В другом воплощении кристаллизованный связывающий белок, кристаллизованная антительная конструкция или кристаллизованный конъюгат антитела имеют большее время полужизни in vivo, нежели их растворимый аналог. В другом воплощении указанные кристаллизованный связывающий белок, кристаллизованная антительная конструкция или кристаллизованный конъюгат антитела после кристаллизации сохраняют свою биологическую активность.
Один из аспектов настоящего изобретения касается DVD-связывающего белка [то есть связывающего белка с двойным вариабельным доменом], содержащего белки, способные связываться с PGE2. Предпочтительно, чтобы DVD-связывающий белок способен был связываться с двумя участками связывания PGE2 или связываться с PGE2 и второй мишенью. Указанная вторая мишень выбрана из группы, состоящей из CSF1 (MCSF), CSF2 (GM-CSF), CSF3 (GCSF), FGF2, IFNα1, IFNβ, IFNγ, гистамина и гистаминовых рецепторов, IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12α, IL-12β, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, KITLG, PDGFB, IL-2Rβ, IL-4R, IL-5Rα, IL-8Rα, IL-8Rβ, IL-12Rβ, IL- 12Rβ2, IL-13Rα1, IL-13Rα2, IL-18R1, TSLP, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, CCL17, CCL18, CCL19, CCL20, CCL22, CCL24, CX3CL1, CXCL1, CXCL2, CXCL3, XCL1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CX3CR1, GPR2, XCR1, FOS, GATA3, JAK1, JAK3, STAT6, TBX21, TGFB1, TNFSF6, YY1, CYSLTR1, FCER1A, FCER2, LTB4R, TB4R2, LTBR и хитиназы. В одном из воплощений DVD-связывающий белок способен распознавать PGE2 и IL-1β, PGE2 и IL-9; PGE2 и IL-4; PGE2 и IL-5; PGE2 и IL-25; PGE2 и TARC; PGE2 и MDC; PGE2 и MIF; PGE2 и TGFβ; агонист PGE2 и LHR; PGE2 и CL25; PGE2 и SPRR2a; PGE2 и SPRR2b; или PGE2 и ADAM8. В одном из воплощений DVD-связывающий белок способен связываться с PGE2 и TNFα.
В другом аспекте настоящее изобретение связано с выделенной нуклеиновой кислотой, кодирующей PGE2-связывающий белок, антительную конструкцию или конъюгат антитела. Дополнительное воплощение связано с векторами, содержащими выделенные нуклеиновые кислоты согласно изобретению, при этом вектор выбран из группы, состоящей из плазмидных кДНК; pTT (Durocher et al., Nucleic Acids Research 2002, Vol. 30, No.2); pTT3 (pTT с дополнительным сайтом множественного клонирования); pEFBOS (Mizushima, S. and Nagata, S., (1990) Nucleic Acids Research Vol. 18, No. 17); pBV; pJV; pA2; и pBJ.
В другом аспекте настоящее изобретение связано с клетками-хозяевами, трансформированными векторами согласно изобретению. В одном из воплощений указанная клетка-хозяин является прокариотической клеткой (например, E. coli). В другом воплощении клетка-хозяин является эукариотической клеткой, например, одноклеточным организмом, клеткой животного, клеткой птицы, растительной клеткой, грибной клеткой (например, дрожжевой клеткой, такой, например, как Saccharomyces cerevisiae), клеткой млекопитающих (например, CHO, COS и HEK293), клеткой насекомых (например, Sf9).
В другом аспекте настоящее изобретение связано со способом продуцирования белка, который связывается с PGE2, предусматривающим культивирование любой какой-нибудь клетки-хозяина согласно изобретению в культуральной среде в условиях, подходящих для продуцирования связывающего белка, который связывается с PGE2. Другое воплощение связано со связывающим белком, продуцируемым в соответствии со способами согласно изобретению.
В другом аспекте настоящее изобретение связано с композицией, которая содержит кристаллизованный PGE2-связывающий белок, кристаллизованную антительную конструкцию или кристаллизованный конъюгат антитела, ингредиент и/или, по меньшей мере, один полимерный носитель. В одном из аспектов указанным полимерным носителем является полимер, выбранный из группы, состоящей из поли(акриловой кислоты), поли (цианоакрилатов), поли (аминокислот), поли (ангидридов), поли (депсипептида), поли (сложных эфиров), поли (молочной кислоты), поли (сополимера молочной и гликолевой кислот) или PLGA, поли (b-гидроксибутирата), поли (капролактона), поли (диоксанона); поли (этиленгликоля), поли ((гидроксипропил) метакриламида, поли [(органо)фосфазена], поли (сложных ортоэфиров), поли (винилового спирта), поли (винилпирролидона), сополимеров малеинового ангидрида и алкилвинилового эфира, плюроновых полиолов, альбумина, альгината, целлюлозы и производных целлюлозы, коллагена, фибрина, желатина, гиалуроновой кислоты, олигосахаридов, гликаминогликанов, сульфатированных полисахаридов и их смеси и/или их сополимеров. В другом воплощении указанный ингредиент выбран из группы, состоящей из альбумина, сахарозы, трегалозы, лактитола, желатина, гидроксипропил-β-циклодекстрина, метоксиполиэтиленгликоля и полиэтиленгликоля.
В другом аспекте настоящее изобретение связано со способом лечения субъекта, предусматривающим стадию введения указанному субъекту эффективного количества PGE2-связывающего белка, антительной конструкции, конъюгата или композиции. В одном из воплощений указанным субъектом является млекопитающее, такое как человек, страдающий от воспалительного заболевания или другого описанного здесь расстройства. В одном из воплощений настоящее изобретение связано со способом ослабления, улучшения или предотвращения одного или нескольких симптомов такого заболевания или расстройства, например, симптома (a) ревматоидного артрита, аллергического артрита, ювенильного артрита, анкилозирующего спондилита и остеоартрита; (b) определенных расстройств, индуцированных вирусами, таких как синдром Гийена-Барре, инфекционный мононуклеоз, других вирусных лимфаденопатий и инфекций, вызванных вирусом герпеса; (c) множественного склероза и других демиелинизирующих заболеваний; (d) гематологических заболеваний, таких как гемолитическая анемия и тромбоцитопения; (e) эндокринных расстройств, таких как сахарный диабет, болезнь Аддисона, идиопатический гипопаратироидизм и хронический лимфоцитарный тиреоидит; (f) коллагеновых расстройств, таких как системная красная волчанка; и (g) репродуктивных расстройств, таких как аменорея, бесплодие, привычные выкидыши и эклампсия; и (h) опухолей, таких как опухоль головы и шеи, рак легкого, рак желудка, рак предстательной железы, рак поджелудочной железы и т.д.; и (i) воспалительных заболеваний кишечника, которые включают в себя болезнь Крона и язвенный колит; и (j) болей, ассоциированных с остеоартритом и другими расстройствами; и (k) глазных расстройств, таких как возрастная макулярная дистрофия (AMD).
В другом аспекте настоящее изобретение связано с фармацевтической композицией, содержащей PGE2-связывающий белок, антитело, конструкцию, конъюгат или композицию и фармацевтически приемлемый носитель. В одном из воплощений указанный фармацевтически приемлемый носитель функционирует в качестве адъюванта, используемого для усиления абсорбции или дисперсии связывающего белка. В одном из аспектов указанным адъювантом является гиалуронидаза. Фармацевтическая композиция может дополнительно включать в себя, по меньшей мере, одно дополнительное средство для диагностики или лечения расстройства, при котором активность PGE2 является неблагоприятной, например, средство, выбранное из группы, состоящей из терапевтического средства, визуализирующего средства; цитотоксического средства; ингибитора ангиогенеза (например, анти-VEGF-антитела или VEGF-фильтра); киназного ингибитора (например, ингибитора KDR или TIE-2); блокатора костимулирующей молекулы (например, анти-B7.1, анти-B7.2, CTLA4-Ig или анти-CD20); блокатора адгезивной молекулы (например, анти-LFA-1, анти-E/L-селектина или ингибитора малой молекулы); антицитокинового антитела или его функционального фрагмента (например, антитела против IL-18, антитела против TNF или антитела против IL-6/цитокинового рецептора); метотрексата; циклоспорина; рапамицина; FK506; детектируемой метки или репортера; антагониста TNF; антиревматического средства; мышечного релаксанта; наркотика; нестероидного противовоспалительного средства (NSAID); аналгетика; анестезирующего средства; седативного средства; локального анестезирующего средства; нейро-мышечного блокатора; противомикробного средства; антипсориатического средства; кортикостероида; анаболического стероида; эритропоэтина; иммунизирующего средства; иммуноглобулина; иммуносупрессивного средства; гормона роста; лекарственного средства-заменителя гормона; радиофармацевтического средства; антидепрессанта; антипсихотического средства; стимулирующего средства; противоастматического лекарственного средства; бета-агониста; ингалируемого стероида; перорального стероида; эпинефрина или его аналога; цитокина; и антагониста цитокина.
В другом аспекте настоящее изобретение связано со способом ингибирования и/или уменьшения активности PGE2, предусматривающим приведение PGE2 в контакт с PGE2-связывающим белком, таким образом, чтобы ингибировать и/или уменьшить активность PGE2. В одном из воплощений настоящее изобретение связано со способом ингибирования и/или уменьшения активности PGE2 у субъекта, страдающего от расстройства, при котором активность PGE2 является неблагоприятной, предусматривающим введение указанному субъекту связывающего белка, такого, чтобы ингибировать и/или уменьшить у субъекта активность PGE2. В другом воплощении указанный способ предусматривает введение субъекту PGE2-связывающего белка согласно изобретению, с тем, чтобы было достигнуто излечение.
В другом аспекте настоящее изобретение связано со способом лечения (например, излечения, супрессии, улучшения, отсрочивания или предотвращения запуска, или предотвращения рецидива, или обострения) или предотвращения PGE2-ассоциированного расстройства у субъекта. Указанный способ включает в себя введение субъекту PGE2-связывающего белка (в частности, антагониста), например, анти-PGE2-антитела или его фрагмента, в количестве, достаточном для лечения или профилактики PGE2-ассоциированного расстройства. Антагонист PGE2, например, анти-PGE2-антитело или его фрагмент, может быть введен субъекту, отдельно или в сочетании с другими терапевтическими способами воздействия.
В одном из воплощений указанным субъектом является млекопитающее, например, человек, страдающий от одного или нескольких PGE2-ассоциированных расстройств (например, характеризующихся избыточными уровнями или биосинтезом PGE2). В одном из воплощений настоящее изобретение связано со способами лечения воспалительных расстройств и расстройств иммунитета у субъекта, причем указанные расстройства могут быть охарактеризованы избыточным биосинтезом PGE2, при этом указанные способы включают в себя введение субъекту эффективного количества антитела, специфичного в отношении PGE2. Расстройства, которые можно лечить способом согласно изобретению, включают в себя аутоиммунные и воспалительные заболевания и опухоли, при которых имеет место избыточный синтез PGE2. Такие расстройства включают в себя (a) ревматоидный артрит, аллергический артрит, ювенильный артрит, анкилозирующий спондилит и остеоартрит; (b) определенные расстройства, индуцированные вирусами, такие как синдром Гийена-Барре, инфекционный мононуклеоз, другие вирусные лимфаденопатии и инфекции, вызванные вирусом герпеса; (c) множественный склероз и другие демиелинизирующие заболевания; (d) гематологические заболевания, такие как гемолитическая анемия и тромбоцитопения; (e) эндокринные расстройства, такие как сахарный диабет, болезнь Аддисона, идиопатический гипопаратироидизм и хронический лимфоцитарный тиреоидит; (f) коллагеновые расстройства, такие как системная красная волчанка; и (g) репродуктивные расстройства, такие как аменорея, бесплодие, привычные выкидыши и эклампсия; и (h) опухоли, такие как опухоль головы и шеи, рак легкого, рак желудка, рак предстательной железы, рак поджелудочной железы и т.д.; и (i) воспалительные заболевания кишечника, которые включают в себя болезнь Крона и язвенный колит; и (j) боль, ассоциированную с остеоартритом и другими расстройствами; и (k) глазные расстройства, такие как возрастная макулярная дистрофия (AMD). В другом аспекте настоящая заявка связана со способом детектирования наличия PGE2 в образце in vitro (например, в биологическом образце, таком как сыворотка, плазма, ткань, биопсия). Указанный способ может быть использован для диагностики расстройства, например, расстройства, ассоциированного с иммунными клетками. Указанный способ включает в себя (i) приведение, как здесь описано, указанного образца или контрольного образца в контакт с анти-PGE2-антителом или его фрагментом; и (ii) детектирование образования комплекса между указанным анти-PGE2-антителом или его фрагментом и указанным образцом или контрольным образцом, при этом статистически значимое изменение в образовании комплекса в указанном образце по сравнению с контрольным образцом является свидетельством наличия PGE2 в данном образце.
Еще в одном аспекте настоящая заявка связана со способом детектирования присутствия PGE2 в образце in vivo (например, визуализации in vivo у субъекта). Указанный способ может быть использован для диагностики расстройства, например, PGE2- ассоциированного расстройства. Указанный способ включает в себя (i) введение, как здесь описано, анти-PGE2-антитела или его фрагмента субъекту или контрольному субъекту в условиях, которые допускают связывание антитела или его фрагмента с PGE2; и (ii) детектирование образования комплекса между указанным антителом или его фрагментом и PGE2, при этом статистически значимое изменение в образовании комплекса у указанного субъекта по сравнению с контрольным субъектом является свидетельством наличия PGE2.
В другом аспекте связывающие белки согласно изобретению применимы для лечения расстройства, выбранного из группы, состоящей из артрита, остеоартрита, хронического ювенильного артрита, септического артрита, артрита Лайма, псориатического артрита, реактивного артрита, спондиллоартропатии, системной красной волчанки, болезни Крона, язвенного колита, воспалительного заболевания кишечника, инсулин-зависимого сахарного диабета, тиреоидита, астмы, аллергических заболеваний, псориаза, кожной склеродермии, заболевания трансплантат против хозяина, отторжения органного трансплантата, острого или хронического иммунного заболевания, ассоциированного с трансплантацией органа, саркоидоза, атеросклероза, диссеминированного внутрисосудистого свертывания, болезни Кавазаки, болезни Грава, нефротического синдрома, синдрома хронической усталости, гранулематоз Вегенера, пурпуры Геноха-Шонлейна, микроскопического васкулита почек, активного хронического гепатита, увеита, септического шока, синдрома токсического шока, септического синдрома, кахексии, инфекционных заболеваний, паразитарных заболеваний, синдрома приобретенного иммунодефицита, острого поперечного миелита, хореи Гентингтона, болезни Паркинсона, болезни Альцгеймера, инсульта, первичного билиарного цирроза печени, гемолитической анемии, злокачественных заболеваний, сердечной недостаточности, инфаркта миокарда, болезни Аддисона, спорадического полигландулярного дефицита типа I и полигландулярного дефицита типа II, синдрома Шмидта, (острого) респираторного дистресс-синдрома у взрослых, алопеции, гнездной алопеции, серонегативной артропатии, артропатии, болезни Рейтера, псориатической артропатии, артропатии при язвенном колите, энтеропатическом синовите, артропатии, ассоциированной с хламидией, иерсинией и сальмонеллой, спондилоартропатии, атероматозного заболевания/артериосклероза, атопической аллергии, аутоиммунного буллезного заболевания, обыкновенной пузырчатки, эксфолиативной пузырчатки, пемфигоида, IgA-зависимого линейного дерматоза, аутоиммунной гемолитической анемии, гемолитической анемии с положительным тестом Кумбса, приобретенной пернициозной анемии, ювенильной пернициозной анемии, миалгического энцефалита/синдрома хронической усталости, хронического кандидоза кожи и слизистых, гигантоклеточного артериита, первичного склерозирующего гепатита, криптогенного аутоиммунного гепатита, синдрома болезни приобретенного иммунодефицита, заболеваний, связанных с приобретенным иммунодефицитом, гепатита B, гепатита C, общего пестрого иммунодефицита (общей вариабельной гипогаммаглобулинемии), дилатационной кардиомиопатии, женского бесплодия, недостаточности яичника, преждевременного угасания функции яичников, легочного фиброза, криптогенного фиброзирующего альвеолита, поствоспалительной интерстициальной болезни легких, интерстициального пневмонита, интерстициальной болезни легких, ассоциированной с болезнью соединительной ткани, болезни легких, ассоциированной со смешанной болезнью соединительной ткани, интерстициальной болезни легких, ассоциированной с системным склерозом, интерстициальной болезни легких, ассоциированной с ревматоидным артритом, болезни легких, ассоциированной с системной красной волчанкой, болезни легких, ассоциированной с дерматомиозитом/полимиозитом, болезни легких, ассоциированной с болезнью Шегрена, болезни легких, ассоциированной с анкилозирующим спондилитом, связанного с васкулитом диффузного заболевания легких, болезни легких, ассоциированной с гемосидерозом, лекарственной интерстициальной болезни легких, фиброза, радиационного фиброза, облитерирующего бронхиолита, хронической эозинофильной пневмонии, лимфоцитарной инфильтрирующей болезни легких, постинфекционной интерстициальной болезни легких, подагрического артрита, аутоиммунного гепатита, аутоиммунного гепатита типа 1 (классический аутоиммунный или волчаночный гепатит), аутоиммунного гепатита типа 2 (анти-LKM-антительный гепатит), опосредованной аутоиммунным заболеванием гипогликемии, инсулинорезистентности типа B с акантокератодермией, гипопаратироидизма, острого иммунного заболевания, ассоциированного с трансплантацией органа, хронического иммунного заболевания, ассоциированного с трансплантацией органа, остеоартроза, первичного склерозирующего холангита, псориаза типа 1, псориаза типа 2, идиопатической лейкопении, аутоиммунной нейтропении, почечного заболевания NOS (БДУ), гломерулонефрита, микроскопического васкулита почек, болезни Лайма, дискоидной красной волчанки, мужского бесплодия, идиопатического или NOS (БДУ), аутоиммунности спермы, рассеянного склероза (всех подтипов), симпатической офтальмии, легочной гипертензии, вторичной относительно заболевания соединительной ткани, синдрома Гудпасчера, легочной манифестации нодозного полиартериита, острой ревматической лихорадки, ревматоидного спондилита, болезни Стилла, системного склероза, синдрома Шегрена, болезни Такаясу/артериита, аутоиммунной тромбоцитопении, идиопатической тромбоцитопении, аутоиммунного заболевания щитовидной железы, гипертиреоза, зобного аутоиммунного гипотиреоза (болезнь Хашимото), атрофического аутоиммунного гипотиреоза, первичной микседемы, факогенного увеита, первичного васкулита, витилиго, острого заболевания печени, хронического заболевания печени, алкогольного цирроза, индуцированного алкоголем повреждения печени, холестаза, идиосинкратической болезни печени, индуцированного лекарственным средством гепатита, неалкогольного стеатогепатита, аллергии и астмы, стрептококковой инфекции группы В (GBS), психических расстройств (например, депрессии и шизофрении), заболеваний, опосредованных Th2-типом и Th1-типом, острой и хронической боли (различные формы боли) и раковых заболеваний, таких как рак легкого, молочной железы, желудка, мочевого пузыря, ободочной кишки, поджелудочной железы, яичников, предстательной железы и прямой кишки, и гемопоэтических злокачественных заболеваний (лейкоз и лимфома), абеталипопротеинемии, акроцианоза, острых и хронических паразитарных или инфекционных процессов, острого лейкоза, острого лимфобластного лейкоза (ALL), острого миелоидного лейкоза (AML), острой или хронической бактериальной инфекции, острого панкреатита, острой почечной недостаточности, аденокарцином, предсердных эктопических систол, комплекса СПИД-деменция, индуцированного алкоголем гепатита, аллергического конъюнктивита, аллергического контактного дерматита, аллергического ринита, отторжения аллотрансплантата, недостаточности альфа-1-антитрипсина, амиотрофического бокового склероза, анемии, стенокардии, дегенерации клеток переднего рога спинного мозга, анти-cd3-терапии, антифосфолипидного синдрома, аллергических реакций на противорецепторные антитела, аневризмы аорты и периферических сосудов, рассечения аорты, артериальной гипертензии, артериосклероза, атриовентрикулярной фистулы, атаксии, предсердной фибрилляции (стойкой или пароксизмальной), трепетания предсердий, атриовентрикулярной блокады, В-клеточной лимфомы, отторжения костного трансплантата, отторжения трансплантата костного мозга (BMT), межжелудочковой блокады, лимфомы Беркитта, ожогов, сердечных аритмий, синдрома временной остановки сердца, опухоли сердца, кардиомиопатии, воспалительной реакции при искусственном кровообращении, отторжения трансплантата хряща, церебеллярных кортикальных дегенераций, церебеллярных нарушений, хаотической или мультиочаговой предсердной тахикардии, ассоциированных с химиотерапией нарушений, хронического миелоцитарного лейкоза (CML), хронического алкоголизма, хронических воспалительных патологий, хронического лимфоцитарного лейкоза (CLL), хронической обструктивной болезни легких (COPD), хронической интоксикации салицилатом, рака ободочной кишки, застойной сердечной недостаточности, конъюнктивита, контактного дерматита, легочного сердца, болезни коронарных артерий, болезни Крейтцфельдта-Якоба, отрицательного в культуре сепсиса, муковисцидоза, ассоциированных с терапией цитокинами нарушений, боксерской деменции, демиелинизирующих заболеванияй, геморрагической лихорадки Денге, дерматита, дерматологических состояний, диабета, сахарного диабета, диабетического артериосклеротического заболевания, заболевания с диффузными тельцами Леви, дилатационной застойной кардиомиопатии, нарушений базальных (подкорковых) ядер головного мозга, синдрома Дауна в среднем возрасте, индуцированных лекарственными средствами нарушений движения, нарушений, индуцированных лекарственными средствами, блокирующими рецепторы допамина ЦНС, чувствительности к лекарственным средствам, экземы, энцефаломиелита, эндокардита, эндокринопатии, эпиглоттита, инфекции вирусом Эпштейна-Барр, эритромелалгии, экстрапирамидальных и церебеллярных расстройств, семейного гематофагоцитарного лимфоцитарного гистиоцитоза, отторжения имплантата фетальной вилочковой железы, атаксии Фридрейха, функциональных периферических артериальных нарушений, грибкового сепсиса, газовой (анаэробной) гангрены, язвы желудка, гломерулонефрита, отторжения трансплантата любого органа или любой ткани, грамотрицательного сепсиса, грамположительного сепсиса, гранулем, вызываемых внутриклеточными организмами, волосатоклеточного лейкоза, болезни Халлеррордена-Шпатца, тиреоидита Хашимото, сенной лихорадки, отторжения трансплантата сердца, гемохроматоза, гемодиализа, гемолитического уремического синдрома/тромболитической тромбоцитопенической пурпуры, кровотечения, гепатита (A), аритмии пучка Гиса, ВИЧ-инфекции/ВИЧ-невропатии, болезни Ходжкина, гиперкинетических нарушений движения, реакций гиперчувствительности, гиперчувствительного пневмонита, гипертензии, гипокинетических нарушений движения, диагностики системы гипоталамус-гипофиз-надпочечники, идиопатической болезни Аддисона, идиопатического легочного фиброза, опосредованной антителами цитотоксичности, астении, детской спинально-мышечной атрофии, воспаления аорты, гриппа А, воздействия ионизирующей радиации, иридоциклита/увеита/неврита зрительного нерва, ишемического-реперфузионного повреждения, ишемического инсульта, ювенильного ревматоидного артрита, ювенильной спинально-мышечной атрофии, саркомы Капоши, отторжения трансплантата почки, инфекции микобактерией Legionella, лейшманиоза, проказы, повреждений кортико-спинальной системы, жирового отека, отторжения трансплантата печени, лимфатического отека, малярии, злокачественной лимфомы, злокачественного гистиоцитоза, злокачественной меланомы, менингита, менингококкемии, метаболической/идиопатической мигренеподобной головной боли, митохондриального мультисистемного нарушения, заболевания смешанной соединительной ткани, моноклональной гаммопатии, множественной миеломы, дегенераций множественных систем (Mencel Dejerine- Thomas Shi-Drager и Machado-Joseph), тяжелой псевдопаралитической миастении, комплекса Mycobacterium avium, туберкулезной бациллы, синдрома миелодисплазии, инфаркта миокарда, ишемических нарушений миокарда, рака носоглотки, хронического заболевания легких новорожденных, нефрита, нефроза, нейродегенеративных заболеваний, нейрогенных мышечных атрофий I, нейрогенной лихорадки, неходжкинской лимфомы, закупорки брюшной аорты и ее ответвлений, окклюзивных артериальных нарушений, okt3-терапии, орхита/эпидидимита, процедуры после лечения орхита/вазэктомии, органомегалии, остеопороза, отторжения трансплантата поджелудочной железы, рака поджелудочной железы, паранеопластического синдрома/гиперкальциемии при злокачественных заболеваниях, отторжения трансплантата паращитовидной железы, воспалительного заболевания почечных лоханок, круглогодичного ринита, заболевания перикарда, периферического атеросклеротического заболевания, периферических васкулярных нарушений, перитонита, пернициозной анемии, пневмонии, вызываемой Pneumocystis carinii, пневмонии, синдрома POEMS (полиневропатии, органомегалии, эндокринопатии, моноклональной гаммопатии и синдрома изменений кожи), постперфузионного синдрома, постгемодиализного синдрома, синдрома пост-MI-кардиотомии, преэклампсии, прогрессирующего супрануклеарного паралича, первичной легочной гипертензии, лучевой терапии, феномена и болезни Рейно, болезни Рейно, болезни Рефсума, тахикардии с регулярными узкими QRS, реноваскулярной (почечно-сосудистой) гипертензии, реперфузионного повреждения, рестриктивной кардиомиопатии, сарком, склеродермии, сенильной хореи, сенильной деменции, ассоциированной с тельцами Леви, сероотрицательных артропатий, шока, серповидно-клеточной анемии, отторжения аллотрансплантата кожи, синдрома изменений кожи, отторжения трансплантата тонкой кишки, солидных опухолей, специфических аритмий, спинальной атаксии, спинально-церебеллярных дегенераций, стрептококкового миозита, структурных повреждений мозжечка, подострого склерозирующего панэнцефалита, обморока (синкопе), сердечно-сосудистого сифилиса, системной анафилаксии, синдрома системной воспалительной реакции, системного ювенильного ревматоидного артрита, T-клеточного или FAB ALL (острый лимфобластный лейкоз), телангиэктазии, облитерирующего тромбоангиита, тромбоцитопении, токсичности, трансплантатов, травмы/кровотечения, аллергических реакций типа III, аллергии типа IV, нестабильной стенокардии, уремии, уросепсиса, крапивницы, вальвулярных сердечных заболеваний, варикозных вен, васкулита, венозных заболеваний, венозного тромбоза, фибрилляции (мерцание) желудочков, вирусных и грибковых инфекций, острого энцефалита с высоким риском смертельного исхода/асептического менингита, гемафагоцитарного синдрома, ассоциированного с высоким риском смертельного исхода, синдрома Вернике-Корсакова, заболевания Вильсона, отторжения ксенотрансплантата любого органа или любой ткани, острых коронарных синдромов, острого идиопатического полиневрита, острой воспалительной демиелинизирующей полирадикулоневропатии, острой ишемии, болезни Стилла-Шоффара у взрослых, гнездной алопеции, анафилаксии, синдрома антифосфолипидного антитела, апластической анемии, атеросклероза, атопической экземы, атопического дерматита, аутоиммунного дерматита, аутоиммунного заболевания, ассоциированного со стрептококковой инфекцией, аутоиммунной энтеропатии, аутоиммунной тугоухости, аутоиммунного лимфопролиферативного синдрома (ALPS), аутоиммунного миокардита, аутоиммунной преждевременной недостаточности функции яичников, блефарита, бронхоэктаза, буллезного пемфигоида, сердечно-сосудистого заболевания, катастрофического антифосфолипидного синдрома, глютеиновой болезни, шейного спондилеза, хронической ишемии, рубцового пемфигоида, клинически выделенного синдрома (CIS) с риском развития множественного склероза, конъюнктивита, психического расстройства, начинающегося в детском возрасте, хронического обструктивного легочного заболевания (COPD), дакриоцистита, дерматомиозита, диабетической ретинопатии, сахарного диабета, грыжи межпозвонкового диска, выпадения диска, лекарственной иммунной гемолитической анемии, эндокардита, эндометриоза, эндофтальмита, эписклерита, многоформной эритемы, большой (major) многоформной эритемы, пемфигоида беременных, синдрома Гийена-Барре (GBS), сенной лихорадки, синдрома Хьюза, идиопатической болезни Паркинсона, идиопатической интерстициальной пневмонии, IgE-опосредованной аллергии, иммунной гемолитической анемии, миозита с включенными тельцами, инфекционного воспалительного заболевания глаз, воспалительного демиелинизирующего заболевания, воспалительного заболевания сердца, воспалительного заболевания почек, IPF/UIP, ирита, кератита, сухого кератоконъюнктивита, болезни Куссмауля или болезни Куссмауля-Мейера, паралича Ландри, гистиоцитоза клеток Лангерганса, сетчатой мраморной кожи, дегенерации желтого пятна, микроскопической ангиопатии, болезни Бехтерева, расстройство двигательных клеток переднего рога спинного мозга, пемфигоида мембран слизистой оболочки, полиорганной недостаточности, большой миастении, миелодиспластического синдрома, миокардита, расстройств нервного корешка, невропатий, гепатита ни-А, ни-В, неврита зрительного нерва, остеолиза, пауциартикулярного юношеского артрита, окклюзивного заболевания периферических артерий (PAOD), болезни периферических сосудов (PVD), болезни периферических артерий (PAD), флебитов, узелкового полиартериита (или нодозного полиартериита), полихондрита, ревматической полимиалгии, полиоза, многосуставного юношеского артрита, аутоиммунного полиэндокринного синдрома, полиомиозита, ревматической полимиалгии (PMR), постперфузионного синдрома, первичного паркинсонизма, простатита, истинной эритроцитарной аплазии, первичной недостаточности надпочечников, рекуррентного оптикомиелита, рестеноза, ревматического порока сердца, SAPHO (синовит, акне, пустулез, гиперостоз и остеит), склеродермии, вторичного амилоидоза, инфаркта легкого, воспаления склеры, ишиалгии, вторичной недостаточности надпочечников, связанной с силиконом диффузной болезни соединительной ткани, дерматоза Снеддона-Уилкинсона, анкилозирующего спондилита, синдрома Стивенса-Джинсона (SJS), синдрома системной воспалительной реакции, темпорального артериита, токсоплазмозного ретинита, токсического эпидермального некролиза, поперечного миелита, TRAPS (рецептор фактора некроза опухоли, аллергическая реакция типа 1), диабета II типа, крапивницы, обычной интерстициальной пневмонии (UIP), васкулита, весеннего конъюнктивита, вирусного ретинита, синдрома Фогта-Коянага-Харада (синдром VKH), влажной макулодистрофии и заживления ран.
В одном из аспектов заболевания, которые можно лечить или диагностировать с помощью композиций и способов согласно изобретению, включают в себя, но не ограничиваются перечисленным, первичные и метастазирующие злокачественные опухоли, включая карциномы молочной железы, толстой кишки, прямой кишки, легких, ротоглотки, гортаноглотки, пищевода, желудка, поджелудочной железы, печени, желчного пузыря и желчевыводящих путей, тонкого кишечника, мочевых путей (включая почки, мочевой пузырь и уротелий), женских половых путей (включая (шейку матки, матку и яичники, а также хориокарциному и трофобластическую болезнь беременных), мужских половых путей (включая опухоли предстательной железы, семенных пузырьков, яичек и герминому), эндокринных желез (включая щитовидную железу, надпочечники и мозговые придатки (гипофиз), а также те, которые возникают из мозговых и мягких тканей, также как и саркома Капоши), опухоли мозга, нервов, глаз и мягких мозговых оболочек (включая астроцитомы, глиомы, глиобластомы, ретинобластомы, невромы, нейробластомы, шванномы и менингиомы), солидные опухоли, возникающие из гематопоэтических злокачественных опухолей, такие как лейкемии и лимфомы (как Ходжкинская, так и неходжкинская лимфомы).
Указанный способ включает в себя введение субъекту антагониста PGE2, например, антитела против PGE2 или фрагмента такого антитела, в количестве, достаточном для лечения (например, ослабления, улучшения) или предотвращения одного или нескольких симптомов. Антитело против PGE2 может быть введено либо с терапевтической, либо с профилактической целью, или же с обеими целями. Антагонист PGE2, например, антитело против PGE2 или фрагмент такого антитела, как описано выше, может быть введен субъекту отдельно или в сочетании с другими терапевтическими средствами. Предпочтительно, чтобы указанным субъектом было млекопитающее, например, человек, страдающий, как описано выше, от PGE2-ассоциированного расстройства.
В другом аспекте связывающие белки согласно изобретению применимы для лечения расстройств, выбранных из группы, состоящей из острой лимфобластной лейкемии, острого миелолейкоза, карциномы надпочечников, рака анального канала, рака слепой кишки, астроцитомы мозжечка, астроцитомы головного мозга, базальноклеточной карциномы, рака желчевыводящих путей, внепеченочных желчевыводящих путей, рака мочевого пузыря, рака кости, остеосаркомы/глиомы злокачественной фиброзной гистиоцитоксантомы ствола головного мозга, опухоли головного мозга, глиомы ствола головного мозга, церебральной астроцитомы/злокачественной глиомы, эпендимомы, медуллобластомы, супратенториальных примитивных нейроэктодермальных опухолей, глиомы зрительного проводящего пути и гипоталамической глиомы, рака головного мозга, аденомы/карциноидной опухоли бронхов, карциноидной опухоли, карциноидной опухоли, желудочно-кишечной карциномы неизвестного происхождения, лимфомы центральной нервной системы, первичной астроцитомы мозжечка, рака шейки матки, хронического лимфоцитарного лейкоза, хронического миелоцитарного лейкоза, хронических миелопролиферативных расстройств, рака толстой кишки, рака ободочной и прямой кишки, кожной T-клеточной лимфомы, рака эндометрия, эпендимомы, рака пищевода, семейства опухолей Юинга, внечерепной герминомы, внегонадной гомоцитомы, рака внепеченочных желчевыводящих путей, злокачественной опухоли глаза, внутриглазной меланомы/ретинобластомы, злокачественной опухоли желчного пузыря, рака желудка (желудочно-кишечного тракта), карциноидной опухоли, желудочно-кишечного тракта, желудочно-кишечной стромальной опухоли (GIST), внечерепной герминомы, внегонадной гомоцитомы, гомоцитомы яичника, обусловленной беременностью трофобластической болезни, глиомы, глиомы ствола головного мозга, церебральной астроцитомы/глиомы, глиомы зрительного проводящего пути и гипоталамической глиомы у детей, волосатоклеточного лейкоза, рака головы и шеи, гепатоклеточного (печеночного) рака, лимфомы Ходжкина, гипофарингеального рака, внутриглазной меланомы, рака островковых клеток (эндокринных зон поджелудочной железы), саркомы Капоши, рака почки (ренальных клеток), ларингеального рака, острого лимфобластного лейкоза, острого миелолейкоза, хронического лимфолейкоза, хронического миелолейкоза, волосатоклеточного лейкоза, рака губы и ротовой полости, рака печени, немелкоклеточного рака легких, мелкоклеточного рака легких, СПИД-ассоциированной лимфомы, лимфомы Беркитта, кожной T-клеточной лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, первичной лимфомы центральной нервной системы, макроглобулинемии Вальденстрема, остеосаркомы/злокачественной фиброзной гистиоцитомы кости, медуллобластомы, меланомы, внутриглазной (глазной) меланомы, карциномы клеток Меркеля, злокачественной мезотелиомы, метастазирующего сквамозного рака шеи неизвестной этиологии, рака полости рта, синдрома множественных эндокринных неоплазий, множественной миеломы/новообразования плазматических клеток, грибовидного микоза, миелодиспластических синдромов, миелодиспластических/миелопролиферативных заболеваний, миелогенной лейкемии, хронического миелолейкоза, множественной миеломы, миелопролиферативных расстройств, рака носовой полости и придаточной пазухи носа, назофарингеального рака, нейробластомы, рака полости рта, рака ротовой полости, рака губы и ротоглоточного рака, остеосаркомы/злокачественной фиброзной гистиоцитомы кости, рака яичника, эпителиального рака яичника, гомоцитомы яичника, пограничной опухоли яичника, рака поджелудочной железы, рака островковых клеток поджелудочной железы, рака носовой полости и придаточной пазухи носа, рака паращитовидной железы, рака полового члена, фарингеального рака, феохромацитомы, пинеобластомы и супратенториальных примитивных нейроэктодермальных опухолей, опухоли гипофиза, новообразования плазматических клеток /множественной миеломы, плевролегочной бластомы, рака предстательной железы, рака прямой кишки, рака клеток почечного эпителия (почки), рака почечной лоханки и мочеточника, рака «переходной» клетки, ретинобластомы, рака слюнной железы, саркомы, семейства опухолей Юинга, саркомы Капоши, саркомы мягких тканей, саркомы матки, синдрома Сезари, рака кожи (немеланомного типа), рака кожи (меланома), кожной карциномы клеток Меркеля, рака тонкой кишки, карциномы сквамозных клеток, метастазирующего сквамозного рака шеи неизвестной этиологии, рака желудка (желудочно-кишечного тракта), супратенториальных примитивных нейроэктодермальных опухолей, кожной T-клеточной лимфомы, рака яичка, рака горла, тимомы, тимомы и карциномы тимуса, рака щитовидной железы, рака «переходной» клетки почечной лоханки и мочеточника, обусловленной беременностью трофобластической болезни, рака «переходной» клетки почечной лоханки и мочеточника, рака мочеточника, рака матки, эндометриальной саркомы матки, рака влагалища, глиомы зрительного проводящего пути и гипоталамической глиомы, рака наружных женских половых органов, макроглобулинемии Вальденстрёма, опухоли Вильмса.
В другом аспекте настоящее изобретение связано со способом лечения пациента, страдающего от расстройства, при котором PGE2 оказывает нежелательное воздействие, включающим в себя стадию введения любых каких бы то ни было описанных здесь связывающих белков, одновременно или после введения второго средства, как описано выше. В одном из воплощений указанное второе терапевтическое средство, которое может быть введено совместно и/или составлено в композицию совместно с одним или несколькими антагонистами PGE2 (например, анти-PGE2-антителами или их фрагментами), включают в себя, не ограничиваясь перечисленным, один или несколько из следующих компонентов: ингалируемые стероиды; пероральные стероиды; бета-агонисты, например, бета-агонисты кратковременного действия или длительного действия; антагонисты лейкотриенов или лейкотриеновые рецепторы; комбинированные лекарственные средства, такие как ADVAIR; ингибиторы IgE, например, анти-IgE-антитела (например, XOLAIR); ингибиторы фосфодиэстеразы (например, ингибиторы PDE4); ксантины; антихолинергические средства; вещества, стабилизирующие тучные клетки, такие как кромолин; ингибиторы IL-4; ингибиторы IL-5; ингибиторы эотаксина/ингибиторы CCR3; антагонисты гистамина или его рецепторов, включая H1, H2, H3 и H4, а также антагонисты простагландина D или его рецепторов (DP1 и CRTH2). Такие комбинации могут быть использованы для лечения астмы и других респираторных расстройств. Дополнительные примеры терапевтических средств, которые могут быть совместно введены и/или составлены в композицию совместно с одним или несколькими анти-PGE2-антителами или их фрагментами, включают в себя, помимо прочего, одно или несколько из следующих веществ: антагонисты TNF (например, растворимый фрагмент рецептора TNF, например, человеческий TNF-рецептор p55 или p75 или его производные, например, TNFR-IgG в 75 кДа (слитый белок в 75 кДа из рецептора TNF и IgG, ENBREL)); ферментативные антагонисты TNF, например, ингибиторы TNF-превращающего фермента (TACE); антагонисты мускаринового рецептора; антагонисты TGF-бета; интерферон-гамма; перфенидон; химиотерапевтические средства, например, метотрексат, лефлуномид или сиролимус (рапамицин) или его аналог, например, CCI-779; ингибиторы COX2 и cPLA2; разнообразные NSAID; иммуномодуляторы; ингибиторы p38, ингибиторы TPL-2, MK-2 и NFkB. Дополнительное второе средство выбрано из группы, состоящей из буденозида, эпидермального фактора роста, кортикостероидов, циклоспорина, сульфазалазина, аминосалицилатов, 6-меркаптопурина, азатиоприна, метронидазола, ингибиторов липоксигеназы, мезаламина, олзалазина, балзалазида, антиоксидантов, ингибиторов тромбоксана, антагонистов рецептора IL-I, анти-IL-1β, моноклональных антител, моноклональных антител против IL-6, факторов роста, ингибиторов эластазы, соединений пиридинил-имидазольных соединений, агонистов или антител против TNF, LT, IL-I, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF, антител против CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лигандов, метотрексата, циклоспорина, FK506, рапамицина, микофенолята мофетила, лефлуномида, разнообразных NSAID, ибупрофена, кортикостероидов, преднизолона, ингибиторов фосфодиэстеразы, агонистов аденозина, антитромботических средств, ингибиторов комплемента, адренергических средств, IRAK, NIK, IKK, p38, ингибиторов MAP-киназы, ингибиторов IL-1β-превращающего фермента, ингибиторов TNFα-превращающего фермента, ингибиторов передачи T-клеточных сигналов, металлопротеиназных ингибиторов, сульфазалазина, азатиоприна, 6-меркаптопуринов, ингибиторов ангиотензин-превращающего фермента, растворимых цитокиновых рецепторов, растворимого TNF-рецептора p55, растворимого TNF-рецептора p75, sIL-1RI, sIL-1RII, sIL-6R, противовоспалительных цитокинов, IL-4, IL-10, IL-11 и TGFβ.
В особом аспекте настоящее изобретение связано со способом лечения пациента, страдающего от расстройства, при котором PGE2 оказывает нежелательное воздействие, включающим в себя стадию введения связывающего белка согласно изобретению перед, одновременно или после введения второго средства, при этом указанное второе средство выбрано из группы, состоящей из лекарственных средств, которые одновременно используются для лечения различных заболеваний или расстройств у человека. Список таких лекарственных средств доступен из Интернета по следующему адресу: www.drugs.com. Указанный список часто обновляется, отражая положение на данный момент в области лечения различных заболеваний человека. Список таких лекарственных средств доступен также из наиболее обновленного справочника (Complete Guide to Prescription & Nonpresciption Drugs 2008, by H. Winter Griffith, Stephen Moore, ISBN-13: 978-0399533723). Белок-антагонист, связывающийся с PGE2, можно комбинировать с любой терапией из приведенного выше списка в условиях конкретного заболевания. Например, белок-антагонист, связывающийся с PGE2, можно комбинировать с одним или несколькими средствами для лечения ревматоидного артрита и ювенильного ревматоидного артрита. Примеры таких средств включают в себя, не ограничиваясь перечисленным, метотрексат, лефлуномид, низкие дозы кортикостероидов, таких как преднизон или кортизон, противомалярийные лекарственных средств, такие как гидроксихлорохин, золото, сульфазалазин, пеницилламин, циклофосфамид, циклоспорин, миноциклин, ацетаминофен, аспирин, ибупрофен, напроксен, целекоксиб, инфликсимаб, этанерцепт, адалимумаб, абатацепт, ритуксимаб, анакинра и другие новые биологические средства и перорально доставляемые средства, нацеленные на IL-6, IL-6R, IL-17, IL-18, IL-23, B7.1/B7.2. Белок-антагонист, связывающийся с PGE2, можно комбинировать с одним или несколькими средствами для лечения остеоартрита. Примеры таких средств включают в себя, не ограничиваясь перечисленным, ацетаминофен, аспирин, ибупрофен, напроксен, целекоксиб, стероиды, искусственные суставные жидкости, такие как синвиск и гиалган. Белок-антагонист, связывающийся с PGE2, можно комбинировать с одним или несколькими средствами для лечения болезни Крона. Примеры таких средств включают в себя, не ограничиваясь перечисленным, адалимумаб, азасан, азакол, азатиоприн, азульфидин, будесонид, энтокорт, флагил, имуран, инфликсимаб, меркаптопурин, метронидазол, протостат, пуринетол, ремикад и сульфазалазин. Белок-антагонист, связывающийся с PGE2, можно комбинировать с одним или несколькими средствами для лечения анкилозирующего спондилита. Примеры таких средств включают в себя, не ограничиваясь перечисленным, ацетокот, ацетилсалициловую кислоту, акуприн-81, адалимумаб, алев, амкорт, анапрокс, аристокорт, аспирин, аспиртаб, азмакорт, буфферин, буффекс, катафлам, целебрекс, клинорил, кортизон, диклофенак, дипентум, эасприн, этанерцепт, индоцин, индометацин, инфликсимаб, напроксен, ремикад, триамцинолон и вольтарен. Белок-антагонист, связывающийся с PGE2, можно комбинировать с одним или несколькими средствами для лечения множественного склероза. Примеры таких средств включают в себя, не ограничиваясь перечисленным, авонекс, азасан, азатиоприн, бетасерон, Bubbli-Pred, копаксон, котолон, глатирамер, имкран, интерферон-бета-1a, раствор интерферона-бета-1b, Key-Pred, Key-Pred SP, митоксантрон, натализумаб, новантрон, орапред, орапред ODT, педиапред, Pred-Ject-50, предакорд 50, предалон 50, предат-50, преднизолон, прелон, ребиф и тизабри. Белок-антагонист, связывающийся с PGE2, можно комбинировать с одним или несколькими средствами или, с одной или несколькими процедурами для лечения различных видов рака и злокачественных новообразований у человека. Помимо списка, доступного на вэб-сайте Интернета http://www.drugs.com и из самого обновленного справочного издания (Complete Guide to Prescription & Nonpresciption Drugs 2008, by H. Winter Griffith, Stephen Moore, ISBN-13: 978-0399533723), NCI также поддерживает информацию об опреденных лекарственных средствах, которые одобрены Управлением по контролю за продуктами и лекарствами США (FDA) для лечения злокачественных опухолей или состояний, связанных со злокачественными опухолями. Примеры таких средств включают в себя, не ограничиваясь перечисленным, абраксан, адриамицин, адруцил, алдара, алемтузумаб, алимта, аминолевулиновую кислоту, анастрозол, апрепитант, аримидекс, аромазин, арранон, триоксид мышьяка, авастин (бевацизумаб), азацитидин, бевацизумаб, бексаротен, бортезомиб, кэмпас (алемтузумаб), камптосар (иринотекана гидрохлорид), капецитабин, карбоплатин, цетуксимаб, цисплатин, клафен (циклофосфамид), клофарабин, клофарекс (клофарабин), клолар (клофарабин), циклофосфамид, цитарабин, цитозар-U (цитарабин), цитоксан (циклофосфамид), дакоген (децитабин), дазатиниб, децитабин, DepoCyt (липосомный цитарабин), DepoFoam (липосомный цитарабин), дексразоксана гидрохлорид, доцетаксел, доксил (липосомный доксорубицина гидрозлорид), доксорубицина гидрохлорид, доксорубицина гидрохлорид липосомный, Dox-SL (доксорубицина гидрохлорид липосомный), эфудекс (фторурацил), элленс (эпирубицина гидрохлорид), элоксатин (оксалиплатин), эменд (апрепитант), эпирубицина гидрохлорид, эрбитукс (цетуксимаб), эрлотиниба гидрохлорид, эвацет (доксорубицина гидрохлорид липосомный), эвиста (ралоксифена гидрохлорид), эксеместан, фаслодекс (фульвестрант), фемара (летрозол), фтороплекс (фторурацил), фторурацил, фульвестрант, гефитиниб, гемцитабина гидрохлорид, гемтузумаб озогамицин, гемзар (гемцитабина гидрохлорид), гливек (иматиниб мезилат), герцептин (трастузумаб), гицамтин (топотекан гидрохлорид), иматиниб мезилат, имихимод, иресса (гефитиниб), иринотекана гидрохлорид, иксабепилон, иксемпра (иксабепилон), кеоксифен (ралоксифена гидрохлорид), кепиванс (палифермин), лапатиниб дитозилат, леналидомид, летрозол, левулан (аминолевулиновая кислота), липодокс (доксорубицина гидрохлорид липосомный), липосомный цитарабин, метазоластон (темозоломид), милозар (азацитидин), милотарг (гемтузумаб озогамицин), паклитаксел из наночастиц (композиция стабилизированного альбумином паклитаксела из наночастиц), неларабин, неозар (циклофосфамид), нексавар (сорафениба тозилат), нилотиниб, нолвадекс (тамоксифена цитрат), онкаспар (пегаспаргаза), оксалиплатин, паклитаксел, композиция стабилизированного альбумином паклитаксела из наночастиц, палифермин, панитумумаб, параплат (карбоплатин), параплатин (карбоплатин), пегаспаргаза, пеметрексед динатрий, платинол-AQ (цисплатин), платинол (цисплатин), ралоксифена гидрохлорид, ревлимид (леналидомид), ритуксан (ритуксимаб), ритуксимаб, склерозол внутриплевральный аэрозольный (тальковый), сорафениб тозилат, сприцел (дазатиниб), стерильный тальковый порошок (тальк), стеритальк (тальк), сунитиниб малат, сутент (сунитиниб малат), синовир (талидомид), тальк, тамоксифена цитрат, тарабин PFS (цитарабин), тарцева (эрлотиниба гидрохлорид), таргретин (бексаротен), тасигна (нилотиниб), таксол (паклитаксел), таксотер (доцетаксел), темодар (темозоломид), темозоломид, темсиролимус, таломид (талидомид), талидомид, тотект (дексразоксана гидрохлорид), топотекана гидрохлорид, торизел (темсиролимус), трастузумаб, тризенокс (триоксид мышьяка), тикерб (лапатиниб дитозилат), вектибикс (панитумумаб), велкад (бортезомиб), видаза (азацитидин), вориностат, кселода (капецитабин), зинекард (дексразоксана гидрохлорид), золедроновая кислота, золинза (вориностат) и зомета (золедроновая кислота).
В предпочтительном воплощении описанные выше фармацевтические композиции связывающегося с PGE2 белка вводят субъекту, по меньшей мере, одним из способов, выбранных из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, интракапсулярного, внутрихрящевого, внутриполостного, интрацелиального, интрацеребеллярного, интрацеребровентрикулярного, введения внутрь толстой/ободочной кишки, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинального, интрасиновиального, внутригрудного, внутриматочного, интравезикулярного, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и трансдермального способов введения.
Краткое описание чертежей
Указанные выше и прочие объекты, признаки и преимущества настоящего изобретения, также как и само изобретение как таковое, будут более полноценно восприняты из нижеследующего описания предпочтительных воплощений, в совокупности с сопроводительными фигурами, среди которых
На фигуре 1 представлены результаты измерений связывания двух полученных из гибридом моноклональных антител, mAb 15F10.3C9 и mAb 1F7.1D5, с биотин-PGE2 в тесте ELISA, описанном в примере 1.1.A.
На фигуре 2 представлены результаты измерений связывания двух полученных из гибридом моноклональных антител, mAb 19C9.4B10 и mAb 4F10.3B9, с биотин-PGE2 в тесте ELISA, описанном в примере 1.1.A.
На фигуре 3 представлены результаты измерений связывания полученных из PROfusion(TM) моноклональных антител mAb K1B, K7H, K3A, L11 и L21 с биотин-PGE2 в тесте ELISA, описанном в примере 1.1.A.
На фигуре 4 приведены результаты измерений связывания рекомбинантных моноклональных антител против PGE2, mAb 2B5-7.0, 2B5-8.0 и 2B5-9.0, с биотин-PGE2 в тесте ELISA, описанном в примере 1.1.A. В данном анализе полученное из гибридомы антитело 2B5 служит положительным контролем.
На фигуре 5 показана нейтрализация PGE2-индуцируемого притока Ca++ в EP4-трансфицированные клетки стабильной клеточной линии HEK293 Gα16, под действием моноклональных антител против PGE2, mAb 2B5-8.0, измеряемая методом FLIPR, как описано в примере 1.1.C 1. В данном анализе полученное из гибридомы антитело 2B5 служит положительным контролем.
На фигуре 6 показана нейтрализация PGE2-индуцируемого притока Ca++ в EP4-трансфицированные клетки стабильной клеточной линии HEK293 Gα16, под действием гуманизированных моноклональных антител против PGE2, mAb 2B5.5, 2B5.6, 2B5.7 и 2B5.8, измеряемая методом FLIPR, как описано в примере 1.1.C 1.
На фигуре 7 показана нейтрализация PGE2-индуцируемого притока Ca++ в EP4-трансфицированные клетки стабильной клеточной линии HEK293 Gα16, под действием гуманизированных моноклональных антител против PGE2, mAb 2B5.1, 2B5.2, 2B5.3 и 2B5.4, измеряемая методом FLIPR, как описано в примере 1.1.C 1.
На фигуре 8 показано выравнивание VH-областей и VL-областей анти-PGE2-антител 2B5.7, 2B5.8 и 2B5.9, как описано в примере 3.
На фигуре 9 продемонстрирована эффективность анти-PGE2-антитела, антитела против мышиного TNF и их сочетание на модели коллаген-индуцированного артрита, измеряемая посредством MAS (mean arthritis score, или средняя оценка артрита в баллах).
Подробное описание изобретения
Настоящее изобретение связано с простагландин E2 (PGE2)-связывающими белками, в частности, с анти-PGE2-антителами или их антиген-связывающими фрагментами, которые связываются с PGE2. Различные аспекты данного изобретения связаны с антителами и фрагментами антител, а также с содержащими их фармацевтическими композициями, а также с нуклеиновыми кислотами, рекомбинантными экспрессирующими векторами и клетками-хозяевами, используемыми для получения таких антител и фрагментов. Способы применения антител согласно изобретению для детектирования PGE2, для ингибирования одной или нескольких активностей PGE2, будь то in vitro или in vivo, а также с целью регуляции экспрессии генов также входят в объем, охватываемый настоящим изобретением.
Если не указано иначе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые являются общеизвестными специалистам в данной области. Значение и область применения указанных терминов должны быть ясны, однако в случае какой бы то ни было неясности приведенные здесь определения являются приоритетными по отношению к словарным переводам или каким бы то ни было общепринятым определениям. Более того, если из контекста не следует иного, термины, употребляемые в единственном числе, включают в себя также и множественное число, также как и термины во множественном числе включают в себя также и единственное число. В настоящей заявке использование слова "или", если не указано иначе, означает "и/или". Кроме того, если специально не указано иначе, использование термина "включающий в себя", также как и другие формы, такие как "включает" и "включено", не имеют ограничения. Также и такие термины как "элемент" или "компонент" охватывают оба варианта, то есть как элементы и компоненты, включающие в себя одну единицу, так и элементы и компоненты, включающие в себя более чем одну субъединицу.
Обычно номенклатуры и технологии, используемые в связи с описанными здесь клеточной и тканевой культурами, молекулярной биологией, иммунологией, микробиологией, генетикой и белковой химией и химией нуклеиновых кислот, а также гибридизацией, хорошо известны и общеприменимы в данной области. Способы и технологии согласно изобретению, как правило, если специально не указано иначе, реализуются в соответствии с общепринятыми приемами, хорошо знакомыми специалистам в данной области, и так, как описано в разных источниках общего характера и более конкретных ссылках, которые повсеместно цитируются и обсуждаются в настоящем описании. Ферментативные реакции и технологии очистки выполняются в соответствии с инструкциями производителей, в соответствии с общепринятыми в данной области приемами, или же так, как описано в настоящей заявке. Используемые здесь номенклатуры и лабораторные процедуры и технологии аналитической химии, синтетической органической химии и медицинской и фармацевтической химии соответствуют таковым, общепринятым и обычно используемым в данной области. Стандартные технологии используются в химическом синтезе, химическом анализе, при изготовлении, составлении фармацевтических композиций, их доставке, а также при лечении пациентов.
Для облегчения понимания настоящего изобретения некоторые термины дополнительно определены ниже.
Используемый здесь термин "полипептид" относится к любой полимерной цепи аминокислот. Термины "пептид" и "белок" используются взаимозаменяемым образом с термином полипептид и также относятся к полимерной цепи аминокислот. Термин "полипептид" охватывает нативные или искусственные белки, белковые фрагменты и полипептидные аналоги белковой последовательности. Полипептид может быть мономерным или полимерным.
Термины "выделенный белок" или "выделенный полипептид" относятся к белку или полипептиду, который, в силу своего происхождения или источника получения, не ассоциирован с природно ассоциированными компонентами, которые сопровождают его в нативном состоянии; по существу, свободен от других белков из того же самого биологического вида; экспрессируется клеткой из различных биологических видов; или не встречается в природе. Таким образом, полипептид, который синтезирован химически или синтезирован в клеточной системе, отличной от клетки, из которой он происходит в природе, будет считаться "выделенным" от компонентов, с которыми он ассоциирован в природе. Белок также может быть получен по существу в свободном от природно ассоциированных с ним компонентов путем выделения, с применением технологий очистки белков, хорошо известных в данной области.
Используемый здесь термин "извлечение, или получение" относится к процессу переработки химического вещества, такого как полипептид, по существу свободный от природно ассоциированных с ним компонентов, путем выделения, например, с применением технологий очистки белков, хорошо известной в данной области. Термин "простагландин E2" (используемый здесь в сокращенном виде как PGE2), относится к простагландину, имеющему следующую структуру, или его варианту, который сохраняет некоторые или же все активности PGE2:
"Биологическая активность" относится здесь к биологическим свойствам, присущим указанному цитокину. Биологические свойства PGE2 включают в себя, но не ограничены связыванием с рецептором PGE2.
Термины "специфическое связывание" или "удельное связывание", используемые здесь в отношении взаимодействия антитела, белка или пептида с химическим веществом второго вида, означают, что указанное взаимодействие зависит от наличия на химическом веществе конкретной структуры (например, антигенной детерминанты или эпитопа); например, антитело распознает специфическую белковую структуру и связывается именно с нею, а не вообще с белками. Если антитело является специфичным в отношении эпитопа "A", то присутствие молекулы, содержащей эпитоп A (или свободный, немеченный эпитоп A) в реакции, содержащей меченый эпитоп "A" и антитело, будет уменьшать количество меченого эпитопа A, связанного с данным антителом.
Используемый здесь термин "антитело" в широком смысле относится к молекуле иммуноглобулина (Ig), состоящей из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, или любому его функциональному фрагменту, мутанту, варианту или производному, которые сохраняют основные свойства связывания эпитопа молекулы Ig. Такие форматы антитела как мутант, вариант или производное, известны в данной области. Неограничивающие воплощения указанных форматов обсуждаются ниже.
В полноразмерном антителе каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (обозначаемой принятыми здесь аббревиатурами HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (обозначаемой принятыми здесь аббревиатурами LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, которые называются определяющими комплементарность областями (CDR), которые перемежаются более консервативными областями, называемыми каркасными областями (FR). Каждая область VH и VL состоит из трех областей CDR и четырех областей FR, расположенных, от амино-конца к карбокси-концу, в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Иммуноглобулиновые молекулы бывают разного типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgAl и IgA2) или подкласса.
Используемый здесь термин "антиген-связывающая часть", или "антиген-связывающий фрагмент", антитела (или же просто "часть антитела") относится к одному или нескольким фрагментам антитела, которые сохраняют способность к специфическому связыванию с антигеном (например, с PGE2). Антиген-связывающая функция антитела может быть осуществлена фрагментами полноразмерного антитела. В таких воплощениях антитело может быть представлено в биспецифическом, мультиспецифическом форматах, а также в формате двойной специфичности, при этом специфически связываясь с двумя или несколькими различными антигенами. Примеры связывающих фрагментов, охватываемых термином "антиген-связывающая часть" антитела, включает в себя (i) Fab-фрагмент, моновалентный фрагмент, состоящий из VL-, VH-, CL- и CH1-доменов; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, состоящий из двух Fab-фрагментов, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из VH- и CH1-доменов; (iv) Fv-фрагмент, состоящий из VL- и VH-доменов антитела с одним плечом, (v) dAb-фрагмент (Ward et al., (1989) Nature 341: 544-546, Winter et al., публикация PCT международной заявки WO 90/05144 Al), который содержит единственный вариабельный домен; а также (vi) выделенную определяющую комплементарность область (CDR). Кроме того, хотя указанные два домена Fv-фрагмента, VL- и VH-, кодируются отдельными генами, они могут быть объединены, с использованием рекомбинантных методов, синтетическим линкером, который позволяет им выступать в виде единственной белковой цепи, в которой VL- и VH- области спарены, с образованием моновалентных молекул (известны как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242: 423-426; а также Huston et al. (1988) Proc. Natl Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также охватываются термином "антиген-связывающая часть" антитела. Другие формы одноцепочечных молекул, такие как диатела, также входят в это понятие. Диатела являются двухваленьными, биспецифическими антителами, в которых VL- и VH-домены экспрессированы в единственной полипептидной цепи, но с использованием линкера, который слишком короток, чтобы допустить спаривание между указанными двумя доменами на одной и той же цепи, вынуждая, таким образом, указанные домены спариваться с комплементарными доменами другой цепи образуя два антиген-связывающий участка (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R.J., et al. (1994) Structure 2: 1121-1123). Такие связывающие участки антител известны в данной области (Kontermann and Dubel eds., Antibody Engineering (2001) Springer-Verlag, New York, pp. 790 (ISBN 3-540-41354-5).
Термин "антительная конструкция", используемый в настоящем описании, относится к полипептиду, содержащему одну или несколько антиген-связывающих частей согласно изобретению, связанных с линкерным полипептидом или с константным доменом иммуноглобулина. Линкерные полипептиды включают в себя две или более аминокислотных остатков, соединенных пептидными связями, и используются для соединения одного или нескольких антиген-связывающих частей. Такие линкерные полипептиды хорошо известны в данной области (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R. J., et al. (1994) Structure 2: 1121-1123). Константный домен иммуноглобулина относится к константному домену тяжелой цепи или легкой цепи. Аминокислотные последовательности константного домена тяжелой цепи и легкой цепи человеческого IgG известны в данной области и представлены в таблице 1.
Последовательность константного домена тяжелой цепи и константного домена легкой цепи человеческого IgG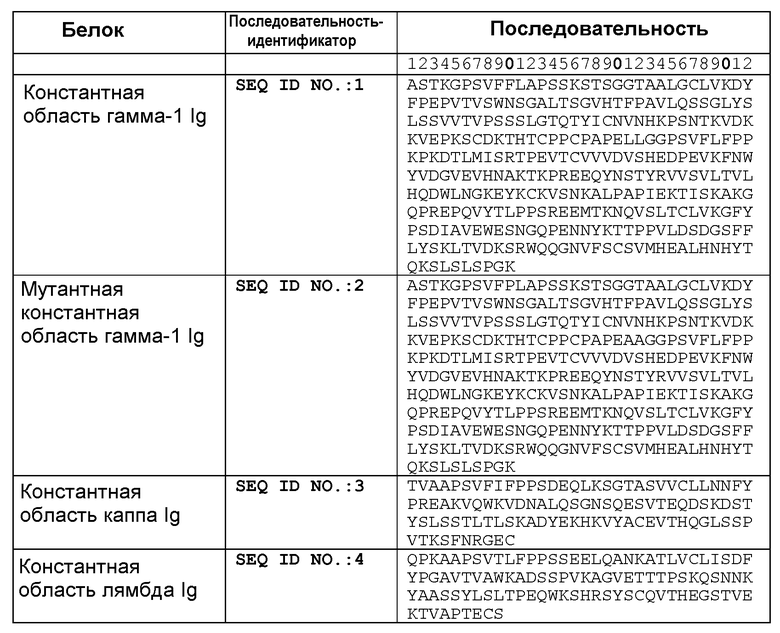
Кроме того, антитело или его антиген-связывающий участок могут быть частью более крупной иммуноадгезивной молекулы, образованной путем ковалентной или нековалентной ассоциации антитела или части антитела с одним или несколькими другими белками или пептидами. Примеры таких иммуноадгезивных молекул включают в себя молекулы, полученные с использованием области стрептавидинового ядра для получения тетрамерной молекулы scFv (Kipriyanov, S.M., et al. (1995) Human Antibodies and Hybridomas 6: 93-101) и с использованием цистеинового остатка, маркерного пептида и C-концевой полигистидиновой метки для получения бивалентных и биотинилированных молекул scFv (Kipriyanov, S.M., et al. (1994) Mol. Immunol. 31: 1047-1058). Части антител, такие как Fab- и F(ab')2-фрагменты, могут быть получены из целых антител с использованием общепринятых технологий, таких, соответственно, как папаиновое или пепсиновое переваривание целых антигенов. Кроме того, как здесь описано, антитела, части антител и иммуноадгезивные молекулы могут быть получены с помощью стандартных технологий рекомбинантной ДНК.
Используемый здесь термин "выделенное антитело" относится к антителу, которое по существу свободно от других антител, имеющих отличную антигенную специфичность (например, выделенное антитело, которое специфически связывается с PGE2, является по существу свободным от других антител, которые специфически связываются с антигенами, отличными от PGE2). Выделенное антитело, которое специфически связывается с PGE2, может, однако, иметь перекрестную реактивность с другими антигенами, такими как молекулы простагландина E1 (PGE1). Кроме того, выделенное антитело может быть по существу свободно от другого клеточного материала и/или других химических веществ.
Используемый здесь термин "человеческое антитело" относится к антителам, имеющим вариабельную и константную области, полученные из последовательностей человеческих иммуноглобулинов эмбрионального типа. Человеческие антитела согласно изобретению могут включать в себя аминокислотные остатки, не кодируемые последовательностями человеческих иммуноглобулинов эмбрионального типа (например, мутации, включаемые путем случайного или сайт-направленного мутагенеза in vitro или путем соматических мутаций in vivo), например, в областях CDR и в конкретной области CDR3. Однако используемый здесь термин "человеческое антитело" не включает в себя антитела, в которых последовательности CDR, полученные из последовательностей эмбрионального типа другого вида млекопитающих, таких как мышь, прививали на последовательности человеческой каркасной области.
Подразумевается, что используемый здесь термин "рекомбинантное человеческое антитело" включает в себя все человеческие антитела, которые получены, экспрессированы, созданы или выделены рекомбинантным путем, такие как антитела, экспрессируемые с помощью рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяин (дополнительно описано в разделе II C, ниже), антитела, выделенные из рекомбинантной комбинаторной библиотеки антител человека (Hoogenboom H.R., (1997) TIB Tech. 15: 62-70; Azzazy H., and Highsmith W.E., (2002) Clin. Biochem. 35: 425-445; Gavilondo J.V., and Larrick J. W. (2002) BioTechniques 29: 128-145; Hoogenboom H., and Chames P. (2000) Immunology Today 21: 371-378), антитела, выделенные из организма животного (например, мыши), которое является трансгенным в отношении человеческих иммуноглобулиновых генов (см., например, Taylor, L.D., et al. (1992) Nucl. Acids Res. 20: 6287-6295; Kellermann S-A., а также Green L.L. (2002) Current Opinion in Biotechnology 13: 593-597; Little M. et al. (2000) Immunology Today 21: 364-370), или же антитела, которые получены, экспрессированы, созданы или выделены любым другим способом, который включает в себя сплайсинг последовательностей человеческих иммуноглобулиновых генов с другими последовательностями ДНК. Такие рекомбинантные человеческие антитела имеют вариабельные области и константные области, полученные из последовательностей человеческих иммуноглобулинов эмбрионального типа. Однако в определенных воплощениях такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или же, когда используют животных, трансгенных в отношении последовательностей человеческих Ig, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител являются последовательностями, которые, хоть и получены из последовательностей VH и VL, родственных человеческой зародышевой линии, в природе могут и не существовать в репертуаре человеческих антител зародышевой линии in vivo. Одно из воплощений связано с полностью человеческими антителами, способными связываться с PGE2, которые могут быть получены с помощью технологий, хорошо известных в данной области, таких, например, но не ограничиваясь перечисленным, как технологии с применением человеческих фаговых библиотек иммуноглобулинов, например, таких, которые описаны у Jermutus et al., публикация PCT No. WO 2005/007699 A2.
Термин "химерное антитело" относится к антителам, которые содержат последовательности вариабельной области тяжелой и/или легкой цепи от одного вида, а последовательности константных областей из другого вида, таким как антитела, имеющие мышиные вариабельные области тяжелой и легкой цепи, соединенные с человеческими константными областями.
Термин "CDR-привитое антитело" относится к антителам, которые содержат последовательности вариабельной области тяжелой и/или легкой цепи от одного вида, но в которых последовательности одной или более VH- и/или VL-областей CDR заменены последовательностями CDR другого вида, таким как антитела, имеющие вариабельные области мышиной тяжелой и легких цепей, в которых одна или несколько мышиных областей CDR (например, CDR3) заменены человеческими CDR-последовательностями.
Термин "гуманизированное антитело" относится к антителам, которые содержат последовательности вариабельной области тяжелой цепи и легкой цепи, присущие виду, отличному от человека (например, мыши), но в которых, по меньшей мере, часть VH- и/или VL-последовательности изменена в сторону "очеловечивания", то есть изменена, с тем, чтобы стать более сходной с вариабельными последовательностями человеческой зародышевой линии. Гуманизированным антителом одного типа является CDR-привитое антитело, в котором человеческие CDR-последовательности введены в не являющиеся человеческими VH- и VL-последовательности, чтобы заменить соответствующие не-человеческие CDR-последовательности. В одном из воплощений получены гуманизированные анти-PGE2-антитела и их антиген-связывающие части. Такие антитела были выработаны путем получения мышиных моноклональных анти-PGE2-антител с использованием традиционной гибридомной технологии, с последующей гуманизацией с использованием генно-инженерных методов in vitro, таких как методы, описанные у Kasaian et al. в публикации PCT No. WO 2005/123126 A2.
Термины "нумерация по Кабат", "определения согласно Кабат " и "мечение по Кабат" используются здесь взаимозаменяемым образом. Указанные термины, известные в данной одласти, относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (то есть гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепей антитела или его антиген-связывающей области (Kabat et al. (1971) Ann. NY Acad, ScL 190: 382-391 and, Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). В случае вариабельной области тяжелой цепи гипервариабельная область находится в положениях аминокислот от 31 до 35 в области CDR1, в положениях аминокислот от 50 до 65 в области CDR2 и в положениях аминокислот от 95 до 102 в области CDR3. В случае вариабельной области легкой цепи гипервариабельная область находится в положениях аминокислот 24 до 34 в области CDR1, в положениях аминокислот от 50 до 56 в области CDR2 и в положениях аминокислот от 89 до 97 в области CDR3.
Здесь термины "акцептор" и "акцепторное антитело" относятся к последовательности антитела или нуклеиновой кислоты, соответствующей или кодирующей, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или 100% аминокислотных последовательностей одной или более рамок считывания. В некоторых воплощениях термин "акцептор" относится к аминокислотной последовательности антитела, соответствующей константной области (областям) или последовательности нуклеиновой кислоты антитела, кодирующей ее(их). Еще в одном воплощении термин "акцептор" относится к аминокислотной последовательности или последовательности нуклеиновой кислоты антитела, соответствующей одной или нескольким каркасным областям и константной области (областям) или кодирующей их. В специфическом воплощении термин "акцептор" относится к человеческой аминокислотной последовательности или последовательности нуклеиновой кислоты антитела, которая соответствует, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или 100% аминокислотных последовательностей одной или более рамок считывания или кодирует их. В соответствии с указанным воплощением, акцептор может содержать, по меньшей мере, 1, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 10 аминокислотных остатков, которые не встречаются в одном или нескольких специфических положениях человеческого антитела. Акцепторная каркасная область и/или акцепторная константная область (области) может быть, например, произведена или получена из гена антитела зародышевой линии, зрелого гена антитела, функционального антитела (например, антител, хорошо известных в данной области, антител в процессе развития или коммерчески доступных антител).
Здесь термин "CDR" относится к определяющей комплементарность области внутри вариабельных последовательностей антитела. В каждой из вариабельных областей тяжелой цепи и легкой цепи находится три области CDR, которые для каждой из вариабельных областей обозначаются как CDR1, CDR2 и CDR3. Термин "набор CDR" относится здесь к группе из трех областей CDR, которые находятся в единственной вариабельной области, способной связываться с антигеном. Точные границы указанных областей CDR в разных системах определяются по-разному. Система, описанная Кабатом (Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987) и (1991)), обеспечивает не только однозначную систему нумерации остатка, приложимую к любой вариабельной области антитела, но дает также и точное определение пограничных остатков, определяющих три указанные области CDR. Эти три области CDR можно называть областями CDR Кабата. Чотиа и сотрудники (Chothia & Lesk, J. Mol. Biol. 196: 901-917 (1987), а также Chothia et al., Nature 342: 877-883 (1989)) обнаружили, что определенные субчасти внутри областей CDR по Кабату принимают почти идентичные конформации пептидного остова, несмотря на то, что обладают значительно большим разнообразием на уровне аминокислотной последовательности. Указанные субчасти были обозначены как L1, L2 и L3 или H1, H2 и H3, где "L" и "H" означают, соответственно, области легких и тяжелых цепей. Указанные субчасти могут быть названы областями CDR по Чотиа, и они имеют границы, которые перекрываются с областями CDR по Кабату. Другие границы, определяющие области CDR, перекрывающиеся с областями CDR по Кабату, были описаны Padlan (FASEB J. 9: 133-139 (1995)), а также MacCallum (J. Mol. Biol. 262(5): 732-45 (1996)). Из одной из описанных выше систем могут следовать и другие не очень точные определения границ областей CDR, но все равно они перекрываются с областями CDR по Кабату, несмотря на то, что они могут быть укорочены или удлинены в свете предсказаний или экспериментальных находок, связанных с тем, что конкретные остатки или группы остатков или даже полные участки CDR не оказывают значительного влияния на связывание антигена. В применяемых здесь способах можно использовать CDR, определяемые в соответствии с одной из указанных систем, хотя и в предпочтительных воплощениях используются определения областей CDR по Кабату или по Чотиа.
Используемый здесь термин "канонический" остаток относится к остатку в области CDR или каркасной области, который определяет конкретную каноническую структуру CDR согласно Chothia et al., J. Mol. Biol. 196: 901-907 (1987); Chothia et al., J. Mol. Biol. 227: 799 (1992). Согласно Чотиа с соавторами, критические части областей CDR многих антител имеют почти идентичные конформации пептидного остова, несмотря на большое разнообразие на уровне аминокислотных последовательностей. Каждая каноническая структура в первую очередь устанавливает набор торсионных углов внутреннего вращения для смежного сегмента аминокислотных остатков, образующих петлю.
Используемые здесь термины "донор" и "донорное антитело" относятся к антителу, имеющему одну или более областей CDR. В предпочтительном воплощении донорное антитело является антителом из видов, отличных от тех видов, из которых получены или произведены каркасные области. В контексте гуманизированного антитела термин "донорное антитело" относится к антителу, не являющемуся человеческим антителом, имеющим одну или более областей CDR.
Здесь термин "каркасная область" или "последовательность каркасной области" относится к остальным последовательностям вариабельной области минус области CDR. Поскольку точное определение последовательности CDR может быть сформулировано с применением различных систем, смысл последовательности каркасной области является, соответственно, предметом разных интерпретаций. Шесть областей CDR (CDR-L1, CDR-L2 и CDR-L3 легкой цепи и CDR-H1, CDR-H2 и CDR-H3 тяжелой цепи) также разделяют каркасные области на легкой цепи и на тяжелой цепи на четыре суб-области (FR1, FR2, FR3 и FR4) на каждой цепи, причем CDR1 располагается между FR1 и FR2, CDR2 между FR2 и FR3, а CDR3 между FR3 и FR4. Не ставя задачу конкретизировать суб-области как FR1, FR2, FR3 или FR4, каркасная область, как полагают другие, представляет собой комбинированные каркасные области FR внутри вариабельной области единственной природно возникающей иммуноглобулиновой цепи. Здесь область FR представляет собой одну из четырех суб-областей, а области FR представляют собой две или более из четырех суб-областей, состоящих из каркасной области. См. таблицы 5 и 6 в качестве примеров FR-последовательностей.
Здесь термин "ген антитела зародышевой линии" или "фрагмент гена антитела зародышевой линии" относится к иммуноглобулиновой последовательности, кодируемой нелимфоидными клетками, которые не подвергаются процессу созревания, который приводит к генетической реаранжировке и созреванию экспрессии конкретного иммуноглобулина. (См., например, Shapiro et al., Crit. Rev. Immunol. 22(3): 183-200 (2002); Marchalonis et al., Adv Exp Med Biol. 484: 13-30 (2001)). Одно из преимуществ, обеспечиваемых различными воплощениями настоящего изобретения, происходит из осознания того факта, что гены антитела зародышевой линии являются более предпочтительными, чем гены зрелого антитела, для сохранения главных структурных характеристик аминокислотной последовательности индивидов данного вида, и следовательно, наименее вероятно, что они будут распознаны как чужеродные при их терапевтическом применении у данного вида.
Здесь термин "ключевой" относится к определенным остаткам внутри вариабельной области, которые оказывают наиболее существенное воздействие на специфичность связывания и/или аффинность антитела, в частности, гуманизированного антитела. Ключевой остаток включает в себя, не ограничиваясь перечисленным, один или несколько из следующих остатков: остаток, смежный с областью CDR, включает в себя потенциальный участок гликозилирования (может быть участок либо N-, либо O-гликозилирования), редкий остаток, остаток, способный взаимодействовать с антигеном, остаток, способный взаимодействовать с областью CDR, канонический остаток, остаток, расположенный на границе контакта вариабельной области тяжелой цепи и вариабельной области легкой цепи, остаток внутри зоны Верньера, а также остаток в области перекрывания между определяемой Чотиа CDR1 вариабельной области тяжелой цепи и определяемой Кабатом первой каркасной области тяжелой цепи.
Здесь термин "гуманизированное антитело" представляет собой антитело или его вариант, производное, аналог или фрагмент, который иммуноспецифически связывается с представляющим интерес антигеном и который содержит каркасную область (FR), имеющую по существу аминокислотную последовательность человеческого антитела и определяющую комплементарность область (CDR), имеющую по существу аминокислотную последовательность антитела, не являющегося человеческим антителом. Здесь термин "по существу" в контексте CDR относится к области CDR, имеющей аминокислотную последовательность, по меньшей мере, на 80%, предпочтительно, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентичную аминокислотной последовательности области CDR антитела, не являющегося человеческим антителом. Гуманизированное антитело содержит по существу все, по меньшей мере, из одного, а обычно двух, вариабельных доменов (например, Fab, Fab', F(ab')2, FabC, Fv), в которых все или по существу все из областей CDR соответствуют таковым не-человеческого иммуноглобулина (то есть донорного антитела) и все или по существу все из каркасных областей соответствуют таковым консенсусной последовательности человеческого иммуноглобулина. Предпочтительно, чтобы гуманизированное антитело также содержало, по меньшей мере, часть константной области иммуноглобулина (Fc), типичную для таковой человеческого иммуноглобулина. В некоторых воплощениях гуманизированное антитело содержит как легкую цепь, так и, по меньшей мере, вариабельный домен тяжелой цепи. Указанное антитело может включать в себя также область CH1, шарнирную область, области CH2, CH3 и CH4 тяжелой цепи. В некоторых воплощениях гуманизированное антитело содержит только гуманизированную легкую цепь. В некоторых воплощениях гуманизированное антитело содержит только гуманизированную тяжелую цепь. В специфических воплощениях гуманизированное антитело содержит только гуманизированный вариабельный домен легкой цепи и/или гуманизированную тяжелую цепь.
Гуманизированное антитело может быть выбрано из любого класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE, и из любого изотипа, включая, без ограничения, IgG1, IgG2, IgG3 и IgG4. Гуманизированное антитело может содержать последовательности более чем из одного класса или изотипа, и для оптимизации требуемых эффекторных функций могут быть выбраны конкретные константные домены с помощью хорошо известных в данной области технологий.
Каркасные области и CDR гуманизированного антитела не обязательно должны в точности соответствовать родительским последовательностям, например, область CDR или консенсусная каркасная область донорного антитела могут быть подвергнуты мутагенезу посредством замены, вставки и/или делеции, по меньшей мере, одного аминокислотного остатка, так, чтобы указанный остаток CDR или каркасной области на указанном участке не соответствовали ни таковому донорного антитела, ни таковому консенсусной каркасной области. Однако в предпочтительном воплощении такие мутации не должны быть экстенсивными. Обычно, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 90%, и наиболее предпочтительно, по меньшей мере, 95% остатков гуманизированного антитела будут соответствовать таковым родительских последовательностей FR и CDR. Здесь термин "консенсусная каркасная область" относится к каркасной области в консенсусной последовательности иммуноглобулина. Здесь термин "консенсусная последовательность иммуноглобулина" относится к последовательности, образованной из наиболее часто встречающихся аминокислот (или нуклеотидов) в семействе родственных иммуноглобулиновых последовательностей (см., например, Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, Germany 1987). В семействе иммуноглобулинов каждое положение в консенсусной последовательности занято аминокислотой, наиболее часто встречающейся в этом положении в указанном семействе. Если две аминокислоты встречаются одинаково часто, любая из них может быть включена в консенсусную последовательность.
Здесь термин зона "Верньера" относится к субпопуляции остатков каркасной области, которые могут подогнать структуру CDR и тонко ее подстроить для соответствия с антигеном, как описано Foote and Winter (1992) J. Mol. Biol. 224: 487-499). Остатки зоны Верньера образуют слой, лежащий в основе областей CDR, и могут влиять на структуру областей CDR и аффинность антитела.
Термин "мультивалентный связывающий белок" используется в настоящем описании для обозначения связывающего белка, содержащего два или несколько антиген-связывающих участка. Мультивалентный связывающий белок предпочтительно конструируется таким образом, чтобы он содержал три или более антиген-связывающих участка, и обычно он является антителом, не встречающимся в природе. Термин "мультиспецифический связывающий белок" относится к связыванию белка, способного связываться с двумя или более родственными или неродственными мишенями. Используемые здесь связывающие белки с двойным вариабельным доменом (DVD) связываются с белками, которые содержат два или более антиген-связывающих участка, и являются тетравалентными или мультивалентными связывающими белками. Такие связывающие белки DVD могут быть моноспецифическими, то есть способными связываться с одним антигеном, или мультиспецифическими, то есть способными связываться с двумя или несколькими антигенами. Связывающие белки DVD, содержащие два полипептида DVD тяжелой цепи и два полипептида DVD легкой цепи, называются DVD-Ig(TM). Каждая половина DVD-Ig содержит полипептид DVD тяжелой цепи и полипептид DVD легкой цепи, а также два антиген-связывающих участка. Каждый участок связывания содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, а в сумме 6 областей CDR, участвующих в связывании антигена, на антиген-связывающий участок.
Здесь термин "нейтрализующий" относится к нейтрализации биологической активности цитокинового или липидного метаболита, когда связывающий белок специфически связывается с цитокиновым или липидным метаболитом. Предпочтительно, чтобы нейтрализующий связывающий белок представлял собой нейтрализующее антитело, связывание которого с PGE2 приводило бы к ингибированию биологической активности PGE2. Предпочтительно, чтобы нейтрализующий связывающий белок связывался с PGE2 и уменьшал биологическую активность PGE2, по меньшей мере, приблизительно на 10%, 20%, 40%, 60%, 80%, 85% или более. Ингибирование биологической активности PGE2 под действием нейтрализующего связывающего белка может быть установлено путем измерения одного или нескольких показателей биологической активности PGE2, хорошо известных в данной области. Например, анализ ингибирования PGE2-индуцированного притока кальция под действием EP4 с использованием клеток HEK293, в избыточном количестве экспрессирующих рецептор EP4 (см. пример 1.1.C 1).
Термин "активность" включает в себя такие активности как специфичность/аффинность связывания антитела с антигеном, например, анти-PGE2-антитела, которое связывается с антигеном PGE2, и/или нейтрализующая способность антитела, например, анти-PGE2-антитела, связывание которого с PGE2 ингибирует биологическую активность PGE2, например, анализ ингибирования PGE2-индуцированного притока кальция под действием EP4 с использованием клеток HEK293, в избыточном количестве экспрессирующих рецептор EP4 (см. пример 1.1.C 1).
Термин "эпиоп" включает в себя любую полипептидную детерминанту, способную к специфическому связыванию с иммуноглобулином или T-клеточным рецептором. В определенных воплощениях эпитопные детерминанты включают в себя скопления химически активных поверхностных групп молекул, таких как аминокислоты, сахара, боковые цепи, фосфорил или сульфорил, а кроме того, в определенных воплощениях, могут иметь трехмерные структурные характеристики и/или специфические характеристики по заряду. Эпитопом является область антигена, которая связывается с антителом. В определенных воплощениях антитело специфически связывается с антигеном, когда оно предпочтительно распознает свой антиген-мишень в сложной смеси белков и/или макромолекул.
Используемый здесь термин "поверхностный плазмонный резонанс" относится к оптическому феномену, который позволяет изучать специфические биологические взаимодействия в реальном времени путем детектирования изменений в концентрации белка внутри биочувствительного матрикса, например, с помощью системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, NJ). Для ознакомления с дальнейшими подробностями см. Jönsson, U., et al. (1993). Ann. Biol. Clin. 51: 19-26; Jönsson, U., et al. (1991) Biotechniques 11: 620-627; Johnsson, B., et al. (1995) J. Mol. Recognit. 8: 125-131; and Johnnson, B., et al. (1991) Anal. Biochem. 198: 268-277.
Используемый здесь термин "kon" относится к константе скорости ассоциации антитела с антигеном с образованием комплекса антиген/антитело, что является общеизвестным в данной области.
Используемый здесь термин "koff" относится к константе скорости диссоциации антитела из комплекса антиген/антитело, что является общеизвестным в данной области.
Используемый здесь термин "KD" относится к константе диссоциации конкретного взаимодействия антиген/антитело, что является общеизвестным в данной области.
Используемый здесь термин "меченый связывающий белок" относится к белку с включенной меткой, который обеспечивает идентификацию связывающего белка. Предпочтительно, чтобы метка была детектируемым маркером, например, встроенной радиоактивной аминокислотой или прикрепленными к полипептиду биотинилированными фрагментами, которые могут быть детектированы по меченыму авидину (например, по стрептавидин содержащей флуоресцентной метке или по ферментативной активности, которая может быть детектирована с помощью оптических или колориметрических методов). Примеры меток для полипептидов включают в себя, но не ограничиваются перечисленными, следующие метки: радиоизотопы или радионуклиды (например, 3H, 14С, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm); флуоресцентные метки (например, FITC, родамин, лантанидные фосфоры); ферментативные метки (например, пероксидаза хрена, люцифераза, щелочная фосфатаза); хемилюминесцентные метки; биотиновые группы; предопределенные полипептидные эпитопы, распознаваемые вторичным репортером (например, парные последовательности лейциновой молнии, связывающие участки для вторичных антител, металл-связывающие домены, эпитопные метки); а также магнитные вещества, такие как хелаты гадолиния.
Термин "конъюгат антитела" относится к связывающему белку, такому как антитело, химически связанное со вторым химическим фрагментом, таким как терапевтическое или цитотоксическое средство. Термин "средство" используется здесь для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, полученного из биологических материалов. Предпочтительно, чтобы терапевтическое или цитотоксическое средства включали в себя, не ограничиваясь перечисленным, коклюшный токсин, таксол, цитохалазин B, грамицидин D, бромистый этидий, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин, а также их аналоги и гомологи.
Используемые здесь термины "кристалл" и "кристаллизованный" относятся к антителу или его антиген-связывающей части, которая существует в виде кристалла. Кристаллы существуют в виде вещества в твердом состоянии, которое отлично от других форм, таких как аморфное твердое состояние или жидко-кристаллическое состояние. Кристаллы состоят из регулярных, повторяющихся трехмерных решеток из атомов, ионов, молекул (например, белки, такие как антитела), или молекулярных ансамблей (например, комплексы антиген-антитело). Указанные трехмерные решетки расположены в строго специфических математических соотношениях. Фундаментальная ячейка, или строительный блок, который повторяется в кристалле, называется единицей асимметрии. Повторение единиц асимметрии в расположении, которое соответствует данной, отчетливо выраженной, кристаллографической симметрии, определяет "единичную (элементарную) ячейку" кристалла. Повторение единичной ячейки путем регулярных переносов во всех трех направлениях дает кристалл. См. Giege, R. and Ducruix, A. Barrett, Crystallization of Nucleic Acids and Proteins, a Practical Approach, 2nd ed., pp. 20 1-16, Oxford University Press, New York, New York, (1999).
Одно из воплощений связано с композицией для высвобождения связывающего белка, при этом композиция включает в себя состав, который, в свою очередь, включает в себя кристаллизованный связывающий белок, кристаллизованную антительную конструкцию или кристаллизованный конъюгат антитела, как описано выше, и ингредиент; и, по меньшей мере, один полимерный носитель. Предпочтительно, чтобы указанный полимерный носитель являлся полимером, выбранным из одной или нескольких групп, состоящих из поли(акриловой кислоты), поли (цианоакрилатов), поли (аминокислот), поли (ангидридов), поли (депсипептида), поли (сложных эфиров), поли (молочной кислоты), поли (сополимера молочной и гликолевой кислот) или PLGA, поли (b-гидроксибутирата), поли (капролактона), поли (диоксанона); поли (этиленгликоля), поли ((гидроксипропил) метакриламида, поли [(органо)фосфазена], поли (сложных ортоэфиров), поли (винилового спирта), поли (винилпирролидона), сополимеров малеинового ангидрида и алкилвинилового эфира, плюроновых полиолов, альбумина, альгината, целлюлозы и производных целлюлозы, коллагена, фибрина, желатина, гиалуроновой кислоты, олигосахаридов, гликаминогликанов, сульфатированных полисахаридов, их смесей и сополимеров. Предпочтительно, чтобы указанный ингредиент был выбран из группы, состоящей из альбумина, сахарозы, трегалозы, лактитола, желатина, гидроксипропил-β-циклодекстрина, метоксиполиэтиленгликоля и полиэтиленгликоля. Другое воплощение связано с лечением млекопитающего, включающим в себя стадию введения млекопитающему эффективного количества описанной выше композиции.
Используемый здесь термин "полинуклеотид" означает полимерную форму двух или более нуклеотидов, будь то рибонуклеотиды или дезоксирибонуклеотиды, или модифицированную форму одного из указанных типов нуклеотидов. Указанный термин включает в себя одно- и двухцепочечные формы ДНК, но предпочтительной является двухцепочечная ДНК.
Используемый здесь термин "выделенный полинуклеотид" означает полинуклеотид (например, геномный полинуклеотид, кДНК или полинуклеотид искусственной природы, или же любая их комбинация), который, по определению, не ассоциирован с полноразмерным полинуклеотидом или с частью полинуклеотида, с которым указанный "выделенный полинуклеотид" обнаруживается в природе; оперативно связан с полинуклеотидом, который в природе с ним не связан, или не выступает в природе как часть более крупной последовательности.
Используемый здесь термин "вектор" относится к молекуле нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, с которой он связан. Одним из типов векторов является "плазмида", которая относится к петле кольцевой двухспиральной ДНК, внутри которой могут быть лигированы дополнительные сегменты ДНК. Другим типом векторов является вирусный вектор, в котором дополнительные сегменты ДНК могут быть лигированы в вирусный геном. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальную природу репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при их введении в клетку-хозяин и, таким образом, могут реплицироваться вместе с геномом хозяина. Кроме того, определенные векторы способны направлять экспрессию генов, с которыми они оперативно связаны. Такие векторы называются здесь "рекомбинантными экспрессирующими векторами" (или же просто "экспрессирующими векторами"). Обычно экспрессирующие векторы для применения в технологиях рекомбинантных ДНК часто представлены в виде плазмид. В настоящем описании "плазмида" и "вектор" могут быть использованы взаимозаменяемым образом, поскольку плазмида является наиболее часто используемой формой вектора. Однако подразумевается, что настоящее изобретение включает в себя также и другие формы экспрессирующих векторов, такие как вирусные векторы (например, дефективные в отношении репликации ретровирусы, аденовирусы и адено-ассоциированные вирусы), которые выполняют эквивалентные функции.
Термин "оперативно связанный" относится к смежному положению, где описанные компоненты находятся в такой взаимосвязи, которая позволяет им функционировать предусмотренным образом. Контрольную последовательность, "оперативно связанную" с кодирующей последовательностью, лигируют таким образом, чтобы достигалась экспрессия кодирующей последовательности в условиях, сравнимых с контрольными последовательностями.
"Оперативно связанные" последовательности включают в себя как экспрессирующиеся контрольные последовательности, которые являются смежными с представляющими интерес генами, так и экспрессирующиеся контрольные последовательности, которые действуют в транс-положении или на расстоянии, обеспечивая контроль представляющего интерес гена. Используемый здесь термин "экспрессирующаяся контрольная последовательность" относится к полинуклеотидным последовательностям, которые необходимы для воздействия на экспрессию и процессинг кодирующих последовательностей, с которыми они лигированы. Экспрессирующиеся контрольные последовательности включают в себя соответствующие последовательности инициации транскрипции, терминации, промотора и энхансера; эффективные сигналы процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые усиливают эффективность трансляции, то есть консенсусные последовательности Козака); последовательности, которые повышают белковую стабильность; а также, если это желательно, последовательности, которые усиливают секрецию белка. Природа таких контрольных последовательностей отличается, в зависимости от организма-хозяина; у прокариот такие контрольные последовательности обычно включают в себя промотор, участок связывания с рибосомами и последовательность терминации транскрипции; у эукариот такие контрольные последовательности обычно включают в себя промоторы и последовательность терминации транскрипции. Термин "контрольные последовательности" включает в себя компоненты, присутствие которых существенно для экспрессии и процессинга, и он может включать в себя также дополнительные компоненты, присутствие которых желательно, например, лидерные последовательности и последовательности партнеров слияния. Белковые структуры согласно изобретению могут быть экспрессированы и очищены с использованием экспрессирующих векторов и клеток-хозяев, известных в данной области, включая экспрессирующие кассеты, векторы, рекомбинантные клетки-хозяева, а также способы рекомбинантной экспрессии и протеолитического процессинга рекомбинантных полипротеинов и пре-протеинов с единственной открытой рамки считывания (например, WO 2007/014162).
Используемый здесь термин "трансформация" относится к любому процессу, посредством которого экзогенная ДНК входит в клетку-хозяин. Трансформация может происходить в природных или в искусственных условиях с помощью различных способов, хорошо известных в данной области. Трансформация может быть основана на любом известном способе включения чужеродных последовательностей нуклеиновой кислоты в прокариотическую или эукариотическую клетку-хозяин. Такой способ выбирают на основе клетки-хозяина, которую предстоит трансформировать, и он может включать в себя, не ограничиваясь перечисленным, вирусную инфекцию, электропорацию, липофекцию, а также бомбардировку частицами. Такие "трансформированные" клетки включают в себя стабильно трансформированные клетки, в которых включенная ДНК способна к репликации либо в качестве автономно реплицирующейся плазмиды, либо как часть хромосомы клетки-хозяина. Они включают в себя также клетки, которые транзиторно экспрессируют включенную ДНК или РНК в течение ограниченных временных периодов.
Используемый здесь термин "рекомбинантная" клетка (или же просто "клетка-хозяин") относится к клетке, в которую введена экзогенная ДНК. Следует иметь в виду, что такие термины относятся не только к конкретной клетке как таковой, но также и к потомству такой клетки. Поскольку в последующих поколениях могут возникать определенные модификации, в результате либо мутаций, либо под влиянием окружающей среды, фактически такой потомок может быть не идентичен родительской клетке, однако здесь он, тем не менее, включен в объем понятий, определяемых термином "клетка-хозяин". Предпочтительно, чтобы клетка-хозяин включала в себя прокариотические клетки, эукариотические клетки, клетки насекомых или клетки, выбранные из любого царства природы. Предпочтительные эукариотические клетки включают в себя одноклеточные организмы, клетки грибов, растений и животные клетки. Наиболее предпочтительно, если клетка-хозяин включает в себя, не ограничиваясь перечисленным, линию прокариотических клеток E. coli; линии клеток млекопитающих CHO, HEK 293 и COS; линию клеток насекомых Sf9; а также клетки грибов S. cerevisiae.
В реализации методик рекомбинантной ДНК, синтеза олигонуклеотидов, а также культуры тканей и трансформации (например, электропорации, липофекции) могут быть использованы стандартные технологии. Технологии проведения ферментативных реакций и очистки могут быть предприняты согласно инструкциям производителей или же так, как является общепринятым в данной области, или в соответствии с тем, как здесь описано. Указанные выше технологии и процедуры в целом могут быть выполнены согласно общепринятым способам, хорошо известным в данной области, а также так, как описано в различных общих и более конкретных ссылках, которые здесь приводятся и которые обсуждаются в тексте настоящей заявки. См., например, Sambrook et al. Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)).
Используемый здесь и известный в данной области термин "трансгенный организм" относится к организму, в котором имеются клетки, которые содержат трансген, причем указанный трансген, внесенный в данный организм (или в организм его прародителя), экспрессирует полипептид, природным образом в данном организме не экспрессируемый. "Трансгеном" является конструкция ДНК, которая стабильно и оперативно интегрирована в геном клетки, из которой развивается трансгенный организм, направляя экспрессию кодируемого продукта в клетках одного или более типов или в тканях трансгенного организма.
Используемые здесь термины "регулировать" и "модулировать" являются взаимозаменяемыми и относятся к изменению или отклонению в активности представляющей интерес молекулы (например, в биологической активности PGE2). Модуляцией может быть повышение или снижение величины определенной активности или функции представляющей интерес молекулы. Примеры активностей и функций молекулы включают в себя, не ограничиваясь перечисленным, характеристики связывания, ферментативную активность, активацию клеточного рецептора и передачу сигнала.
Соответственно, используемый здесь термин "модулятор" относится к соединению, способному вызывать изменения или отклонения в активности или функции представляющей интерес молекулы (например, в биологической активности PGE2). Например, модулятор может вызвать повышение или снижение величины определенной активности или функции молекулы по сравнению с величиной активности или функции, наблюдаемых в отсутствие модулятора. В определенных воплощениях модулятором является ингибитор, который уменьшает величину, по меньшей мере, одной активности или функции молекулы. Примеры ингибиторов включают в себя, не ограничиваясь перечисленным, белки, пептиды, антитела, пептитела, углеводы или малые органические молекулы. Пептитела описаны например, в документе WO 01/83525.
Используемый здесь термин "агонист" относится к модулятору, который при контакте с представляющей интерес молекулой вызывает повышение величины определенной активности или функции молекулы по сравнению с величиной активности или функции, наблюдаемыми в отсутствие указанного агониста. Конкретные представляющие интерес агонисты могут включать в себя, не ограничиваясь перечисленным, PGE2 или полипептиды, нуклеиновые кислоты, углеводы или любые другие молекулы, которые связываются с PGE2.
Используемые здесь термины "антагонист" или "ингибитор" относятся к модулятору, который при контакте с представляющей интерес молекулой вызывает снижение величины определенной активности или функции молекулы по сравнению с величиной активности или функции, наблюдаемых в отсутствие указанного антагониста. Конкретные представляющие интерес антагонисты включают в себя таковые, которые блокируют или модулируют биологическую или иммунологическую активность PGE2. Антагонисты и ингибиторы PGE2 могут включать в себя, не ограничиваясь перечисленным, белки, нуклеиновые кислоты, углеводы или любые другие молекулы, которые связываются с PGE2.
Термин "ингибировать связывание с рецептором" относится к способности связывания белка для предотвращения связывания PGE2 с одним или более из его рецепторов. Такое ингибирование связывания с рецептором приведет к снижению или упразднению биологической активности, опосредованной связыванием PGE2 с его рецептором или рецепторами.
Используемый здесь термин "эффективное количество" относится к количеству терапевтического средства, которого достаточно для снижения или облегчения степени тяжести и/или продолжительности течения расстройства или же одного или нескольких его симптомов, предотвращения распространения расстройства, с тем, чтобы вызвать регрессию расстройства, предотвратить возврат, развитие, запуск или прогрессирование одного или нескольких симптомов, ассоциированных с расстройством, для детектирования расстройства или повышения или улучшения профилактического или терапевтического эффекта (эффектов) другого лечения (например, профилактическим или терапевтическим средством).
Используемый здесь термин "образец" применяется в самом широком смысле. Используемый здесь термин "биологический образец" включает в себя, не ограничиваясь перечисленным, любое количество вещества из всего живого или из всего некогда живого. Такой объект из всего живого включает в себя, не ограничиваясь перечисленным, человека, мышей, крыс, обезьян, собак, кроликов и других животных. Указанные вещества включают в себя, не ограничиваясь перечисленным, кровь, сыворотку, мочу, синовиальную жидкость, клетки, органы, ткани, костный мозг, лимфатические узлы и селезенку.
В предпочтительном воплощении связывающим белком является CDR-привитое антитело или его антиген-связывающая часть, способная связываться с PGE2. Предпочтительно, чтобы CDR-привитое антитело или его антиген-связывающая часть содержали одну или несколько областей CDR из описанных выше 2B5-7.0 или 2B5-8.0, или 2B5-9.0. Предпочтительно, чтобы CDR-привитое антитело или его антиген-связывающая часть содержали человеческую акцепторную каркасную область. Более предпочтительно, чтобы человеческая акцепторная каркасная область представляла собой любую из человеческих акцепторных рамок считывания, имеющих более чем 60% гомологию с каркасными областями мышиного антитела 2B5-7.0 или 2B5-8.0, или 2B5-9.0.
В предпочтительном воплощении связывающий белок представляет собой гуманизированное антитело или его антиген-связывающая часть, способную связываться с PGE2. Предпочтительно, чтобы гуманизированное антитело или его антиген-связывающая часть содержали одну или несколько описанных выше областей CDR, встроенных в вариабельный домен человеческого антитела человеческой акцепторной каркасной области. Предпочтительно, чтобы вариабельный домен человеческого антитела был консенсусным человеческим вариабельным доменом. Более предпочтительно, чтобы человеческая акцепторная каркасная область содержала, по меньшей мере, одну аминокислотную замену ключевого остатка в каркасной области, при этом, чтобы ключевой остаток был выбран из группы, состоящей из остатка, прилегающего к области CDR; из остатка на участке гликозилирования; из редкого остатка; из остатка, способного взаимодействовать с PGE2; из остатка, способного взаимодействовать с областью CDR; из канонического остатка; из остатка, расположенного на границе контакта вариабельной области тяжелой цепи и вариабельной области легкой цепи; из остатка внутри зоны Верньера; а также из остатка в области перекрывания между определяемой Чотиа CDR1 вариабельной области тяжелой цепи и определяемой Кабатом первой каркасной области тяжелой цепи. Предпочтительно, чтобы человеческая акцепторная каркасная область содержала, по меньшей мере, одну аминокислотную замену в каркасной области, при этом, чтобы аминокислотная последовательность каркасной области была, по меньшей мере, на 65% идентична последовательности человеческой акцепторной каркасной области и содержала, по меньшей мере, 70 аминокислотных остатков, идентичных остаткам человеческой акцепторной каркасной области.
В одном из воплощений гуманизированное антитело или его антиген-связывающая часть содержит три или более описанных выше областей CDR. В определенном воплощении гуманизированное антитело или его антиген-связывающая часть содержит шесть описанных выше областей CDR.
Одно из воплощений настоящего изобретения связано с антительной конструкцией, содержащей любой из описанных выше связывающих белков и линкерный полипептид или иммуноглобулин. В предпочтительном воплощении антительная конструкция выбрана из группы, состоящей из молекулы иммуноглобулина, моноклонального антитела, химерного антитела, CDR-привитого антитела, гуманизированного антитела, Fab, Fab', F(ab')2, Fv, связанного дисульфидным мостиком Fv, scFv, антитела, содержащего один домен, диатела, мультиспецифического антитела, антитела с двойной специфичностью, DVD-Ig(TM) и биспецифического антитела. В предпочтительном воплощении указанная антительная конструкция содержит константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из константного домена человеческого IgM, константного домена человеческого IgG1, константного домена человеческого IgG2, константного домена человеческого IgG3, константного домена человеческого IgG4, константного домена человеческого IgE и константного домена человеческого IgA. В другом воплощении настоящее изобретение связано с конъюгатом антитела, содержащим описанную выше антительную конструкцию и средство, при этом средство выбрано из группы, состоящей из иммуноадгезивной молекулы, визуализирующего средства, терапевтического средства и цитотоксического средства. В предпочтительном воплощении визуализирующее средство выбрано из группы, состоящей из радиоактивной метки, фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки и биотина. Более предпочтительно, чтобы визуализирующее средство являлось радиоактивной меткой, выбранной из группы, состоящей из 3H, 14С, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm. В предпочтительном воплощении терапевтическое или цитотоксическое средство выбрано из группы, состоящей из антиметаболита, алкилирующего средства, антибиотика, фактора роста, цитокина, антиангиогенного средства, антимитотического средства, антрациклина, токсина и апоптотического средства.
В другом воплощении указанная антительная конструкция является гликозилированной. Предпочтительно, чтобы указанное гликозилирование имело характер гликозилирования, свойственный человеку.
В другом воплощении указанные связывающий белок, антительная конструкция или конъюгат антитела, описанные выше, представляли собой кристалл. Предпочтительно, чтобы указанный кристалл представлял собой свободный от носителя фармацевтический кристалл с контролируемым высвобождением. В предпочтительном воплощении указанные кристаллизованный связывающий белок, кристаллизованная антительная конструкция или кристаллизованный конъюгат антитела имеют большее время полужизни in vivo, чем их растворимый аналог. В другом предпочтительном воплощении указанные кристаллизованный связывающий белок, кристаллизованная антительная конструкция или кристаллизованный конъюгат антитела сохраняют свою биологическую активность после кристаллизации.
В одном из аспектов настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей любой один из описанных выше объектов, включая связывающий белок, антительную конструкцию или конъюгаты антитела. Дополнительное воплощение связано с вектором, содержащим описанную выше выделенную нуклеиновую кислоту, при этом вектор выбран из группы, состоящей из плазмидной кДНК; pTT (Durocher et al, Nucleic Acids Research 2002, Vol. 30, No.2); pTT3 (pTT с дополнительным множественным сайтом клонирования); pEFBOS (Mizushima, S. and Nagata, S. (1990) Nucleic acids Research Vol. 18, No. 17); pBV; pJV; pA2; и pBJ.
В другом аспекте клетка-хозяин трансформирована описанным выше вектором. Предпочтительно, чтобы клетка-хозяин была прокариотической клеткой. Более предпочтительно, чтобы клетка-хозяин являлась клеткой E. coli. В другом воплощении клетка-хозяин является эукариотической клеткой. Предпочтительно, чтобы указанная эукариотическая клетка была выбрана из группы, состоящей из одноклеточного организма, животной клетки, растительной клетки и грибной клетки. Более предпочтительно, чтобы клетка-хозяин была клеткой млекопитающего, включая, но не ограничиваясь перечисленным, клетки CHO, HEK293 и COS; или грибной клеткой, такой как Saccharomyces cerevisiae; или клеткой насекомого, такой как Sf9.
Другой аспект настоящего изобретения связан со способом получения связывающего белка, который связывается с PGE2, включающим в себя культивирование любой из описанных выше клеток-хозяев в культуральной среде в условиях, подходящих для продуцирования связывающего белка, который связывается с PGE2. Другое воплощение относится к связывающему белку, продуцируемому в соответствии с описанным выше способом.
Настоящее изобретение связано также с фармацевтической композицией, содержащей описанные выше связывающий белок, антительную конструкцию или конъюгат антитела, а также фармацевтически приемлемый носитель. В дополнительном воплощении указанная фармацевтическая композиция содержит, по меньшей мере, одно дополнительное терапевтическое средство для лечения расстройства, при котором активность PGE2 является неблагоприятной. Предпочтительно, чтобы дополнительное средство было выбрано из группы, состоящей из терапевтического средства, визуализирующего средства, цитотоксического средства, ингибитора ангиогенеза (включая, но не ограничиваясь ими, анти-VEGF-антитела или VEGF-фильтр); киназного ингибитора (включая, но не ограничиваясь ими, ингибиторы KDR и TIE-2); блокатора костимулирующей молекулы (включая, но не ограничиваясь ими, анти-B7.1, анти-B7.2, CTLA4-Ig, анти-CD20); блокатора адгезивной молекулы (включая, но не ограничиваясь ими, антитела против LFA-1, антитела против E/L-селектина, ингибиторы малой молекулы); антицитокинового антитела или его функционального фрагмента (включая, но не ограничиваясь ими, антитела против IL-18, антитела против TNF, антитела против IL-6/цитокинового рецептора); метотрексата; циклоспорина; рапамицина; FK506; детектируемой метки или репортера; антагониста TNF; противоревматического средства; мышечного релаксанта; наркотика; нестероидного противовоспалительного средства (NSAID); аналгетика; анестезирующего средства; седативного средства; локального анестезирующего средства; нейро-мышечного блокатора; противомикробного средства; антипсориатического средства; кортикостероида; анаболического стероида; эритропоэтина; иммунизирующего средства; иммуноглобулина; иммуносупрессивного средства; гормона роста; лекарственного средства-заменителя гормона; радиофармацевтического средства; антидепрессанта; антипсихотического средства; стимулирующего средства; противоастматического лекарственного средства; бета-агониста; ингалируемого стероида; эпинефрина или его аналога; цитокина и антагониста цитокина.
В другом аспекте настоящее изобретение связано со способом ингибирования активности PGE2, включающим в себя стадию приведения PGE2 в контакт с описанным выше связывающим белком, таким образом, чтобы достичь ингибирования активности PGE2. В подобном аспекте настоящее изобретение связано со способом ингибирования активности PGE2 у человека, страдающего от расстройства, при котором активность PGE2 является неблагоприятной, где указанный способ включает в себя стадию введения указанному человеку описанного выше связывающего белка, таким образом, чтобы было достигнуто ингибирование активности PGE2 и излечение.
В другом аспекте настоящее изобретение связано со способом лечения (например, излечения, супрессии, улучшения, отсрочивания или предотвращения запуска, или предотвращения рецидива, или обострения) или предотвращения PGE2-ассоциированного расстройства у субъекта. Указанный способ включает в себя введение субъекту PGE2-связывающего средства (в частности, антагониста), например, анти-PGE2-антитела или его фрагмента, как описано выше, в количестве, достаточном для лечения или профилактики PGE2-ассоциированного расстройства. Антагонист PGE2, например, анти-PGE2-антитело или его фрагмент, может быть введен субъекту, отдельно или в сочетании с другими терапевтическими способами воздействия, как описано выше.
В одном из воплощений настоящее изобретение связано со способами и композициями для лечения (например, ослабления или улучшения) одного или нескольких симптомов у млекопитающего субъекта, например, человека, страдающего от одного или нескольких PGE2-ассоциированных расстройств, включая, например, аутоиммунные и воспалительные заболевания и опухоли, при которых имеет место избыточный синтез PGE2. Такие расстройства включают в себя (a) ревматоидный артрит и аллергический артрит; (b) определенные расстройства, индуцированные вирусами, такие как синдром Гийена-Барре, инфекционный мононуклеоз, другие вирусные лимфаденопатии и инфекции, вызванные вирусом герпеса; (c) множественный склероз и другие демиелинизирующие заболевания; (d) гематологические расстройства, такие как гемолитическая анемия и тромбоцитопения; (e) эндокринные расстройства, такие как сахарный диабет, болезнь Аддисона, идиопатический гипопаратироидизм и хронический лимфоцитарный тиреоидит; (f) коллагеновые расстройства, такие как системная красная волчанка; и (g) репродуктивные расстройства, такие как аменорея, бесплодие, привычные выкидыши и эклампсия; и (h) опухоли, такие как опухоль головы и шеи, рак легкого, рак желудка, рак предстательной железы, рак поджелудочной железы и т.д.; и (i) расстройства органов желудочно-кишечного тракта (например, воспалительные заболевания кишечника (IBD), такие как язвенный колит и/или болезнь Крона); и (j) болевые расстройства, такие как боль, ассоциированные с остеоартритом и другими расстройствами; и (k) глазные расстройства, такие как возрастная макулярная дистрофия (AMD). Соответственно, настоящее описание включает в себя применение PGE2-связывающего средства (такого как анти-PGE2-антитело или его фрагмент) для лечения и применение PGE2-связывающего средства (такого как анти-PGE2-антитело или его фрагмент) для получения лекарственного средства для лечения.
Указанный способ включает в себя введение субъекту антагониста PGE2, например, антитела против PGE2 или фрагмента антитела, в количестве, достаточном для лечения (например, ослабления, улучшения) или профилактики одного или нескольких симптомов. Антитело против PGE2 может быть введено с терапевтической или профилактической целью, или же и с той, и с другой целями. Антагонист PGE2, например, анти-PGE2-антитело или его фрагмент, может быть введен субъекту, как здесь описано, отдельно или в сочетании с другими терапевтическими способами воздействия. Предпочтительно, чтобы указанным субъектом являлось млекопитающее, например, человек, страдающий от PGE2-ассоциированного расстройства, как описано в настоящей заявке.
В другом аспекте настоящая заявка связана со способом детектирования наличия PGE2 в образце in vitro (например, в биологическом образце, таком как сыворотка, плазма, ткань, биопсия). Указанный способ может быть использован для диагностики расстройства, например, расстройства, ассоциированного с иммунными клетками. Указанный способ включает в себя (i) приведение, как здесь описано, указанного образца или контрольного образца в контакт с анти-PGE2-антителом или его фрагментом; и (ii) детектирование образования комплекса между указанным анти-PGE2-антителом или его фрагментом и указанным образцом или контрольным образцом, при этом статистически значимое изменение в образовании комплекса в указанном образце по сравнению с контрольным образцом является свидетельством наличия PGE2 в данном образце.
В другом аспекте настоящее изобретение связано со способом лечения пациента, страдающего от расстройства, при котором PGE2 оказывает нежелательное воздействие, включающим в себя стадию введения любого одного из описанных выше связывающих белков перед, одновременно или после введения второго средства, как описано выше. В предпочтительном воплощении указанное дополнительное терапевтическое средство, которое может быть введено совместно и/или составлено в композицию совместно с одним или несколькими антагонистами PGE2 (например, анти-PGE2-антителами или их фрагментами), включает в себя, не ограничиваясь перечисленным, один или несколько из следующих компонентов: MTX; пероральных стероидов; ингибиторов металлопротеиназ, сульфазалазина, азатиоприна, 6-меркаптопуринов, ингибиторов ангиотензин-превращающего фермента, растворимых цитокиновых рецепторов, растворимого TNF-рецептора p55, растворимого TNF-рецептора p75, sIL-1RI, sIL-1RII, sIL-6R, противовоспалительных цитокинов, IL-4, IL-10, IL-11 и TGFβ.
В предпочтительном воплощении описанные выше фармацевтические композиции вводят субъекту, по меньшей мере, одним из способов, выбранных из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, интракапсулярного, внутрихрящевого, внутриполостного, интрацелиального, интрацеребеллярного, интрацеребровентрикулярного, введения внутрь толстой/ободочной кишки, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинального, интрасиновиального, внутригрудного, внутриматочного, интравезикулярного, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и трансдермального способов введения.
Один из аспектов настоящего изобретения связан, по меньшей мере, с одним анти-PGE2-идиотипическим антителом, по меньшей мере, к одному связывающему PGE2 белку согласно изобретению. Антиидиотипическое антитело включает в себя любой белок или пептид, содержащий молекулу, которая содержит, по меньшей мере, часть молекулы иммуноглобулина, такую, без ограничения, как, по меньшей мере, одну определяющую комплементарность область (CDR) тяжелой или легкой цепи или их лиганд-связывающую область, вариабельную область тяжелой цепи или вариабельную область легкой цепи, константную область тяжелой цепи или легкой цепи, каркасную область; или любую их часть, которая может быть встроена в связывающий белок согласно изобретению.
I. Антитела, которые связываются с простагландином E2
Настоящее изобретение связано с мышиными моноклональными антителами или их антиген-связывающими частями, которые связываются с PGE2 с высокой аффинностью, с низкой скоростью диссоциации и высокой нейтрализующей способностью. Изобретение связано также с химерными антителами, которые связываются с PGE2. Изобретение связано также с гуманизированными антителами или их антиген-связывающими частями, которые связываются с PGE2. Предпочтительно, чтобы указанные антитела или их части были выделенными антителами. Предпочтительно, чтобы антитела согласно изобретению были нейтрализующими человеческими анти-PGE2-антителами и/или человеческими анти-PGE2-антителами.
A. Способ получения антител против простагландина E2
Антитела и фрагменты антител согласно изобретению могут быть получены любым из известных в данной области методов, таким, например, как методы гибридомного, микробного (например, фагового, бактериального, дрожжевого), рекомбинантного, рибосомного дисплеев, мРНК- и ДНК-дисплеев или их комбинации. Многие методы могут быть использованы для манипулирования антителами с целью модификации свойств антител, включая улучшение их гуманизации, созревания их аффинности, переключения изотипов антител, физико-химических свойств и фармакокинетического профиля и т.д., которые хорошо известны в данной области.
1. Моноклональные антитела против простагландина E 2 , полученные с помощью гибридомной технологии
Моноклональные антитела могут быть получены с использованием разнообразных технологий, известных в данной области, включая применение технологий гибридомного, рекомбинантного, фагового и дрожжевого дисплеев или их сочетаний. Моноклональные антитела могут быть получены, например, с помощью гибридомных технологий, включая известные в данной области технологии, а также описанные, например, у Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling, et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981). Используемый здесь термин "моноклональное антитело" не ограничено антителами, полученными с использованием гибридомной техники. Термин "моноклональное антитело" относится к антителу, которое получено из одного клона, включая любой эукариотический, прокариотический или фаговый клон, и не относится к тому, каким способом оно получено.
Способы получения и скрининга специфических антител с использованием гибридомной техники являются рутинными и хорошо известны в данной области. В одном из воплощений настоящее изобретение связано со способами получения моноклональных антител, а также антител, продуцируемых способом, включающим в себя культивирование гибридомных клеток, секретирующих антитело согласно изобретению, при этом предпочтительно, чтобы гибридома была получена путем слияния спленоцитов, выделенных из организма мыши, иммунизированной антигеном согласно изобретению, с клетками миеломы, и последующего скрининга гибридом, полученных в результате слияния гибридомных клонов, которые секретируют антитело, способное связываться с полипептидом согласно изобретению (см. пример 1.2). Вкратце, мышей можно иммунизировать белком-носителем, конъюгированным с PGE2, что известно под названием конъюгатов гаптена с белком-носителем. Здесь указанным гаптеном является PGE2, а белок-носитель может быть любым белком, например, из бычьих тиреоглобулинов, гемоцианина лимфы улитки, бычьего сывороточного альбумина, овальбумина и т.д. В предпочтительном воплощении конъюгат PGE2-тиреоглобулин вводят вместе с адъювантом для стимуляции иммунного ответа. Такие адъюванты включают в себя полный или неполный адъювант Фрейнда, RIBI (мурамил-дипептид) или ISCOM (иммуностимулирующие комплексы). Такие адъюванты могут защитить полипептид от быстрой дисперсии путем секвестрирования его в локальный депозит, или же они могут содержать вещества, которые стимулируют хозяина к секреции факторов, которые являются хемотаксическими для макрофагов и других компонентов иммунной системы. Предпочтительно, чтобы в случае, если вводят полипептид, схема иммунизации включала в себя два или более введений полипептида, разнесенных в течение периода в несколько недель.
После иммунизации животного конъюгатом PGE2-тиреоглобулин из организма животного могут быть получены антитела и/или антитело-продуцирующие клетки. Сыворотку, содержащую антитела против PGE2, получают из организма животного путем кровопускания или путем умерщвления животного. Полученная сыворотка может быть использована как таковая, полученная из организма животного, из сыворотки может быть получена иммуноглобулиновая фракция, или же из сыворотки могут быть получены и очищены антитела против PGE2. Полученные таким образом сыворотка или иммуноглобулины являются поликлональными, которые, таким образом, имеют гетерогенный набор свойств.
Сразу после детектирования реализации иммунного ответа, например, обнаружения в мышиной сыворотке антител, специфичных в отношении антигена PGE2, извлекали мышиную селезенку и выделяли из нее спленоциты. Затем полученные спленоциты с помощью хорошо известных технологий сливали с любыми подходящими для этого миеломными клетками, например, с клетками из клеточной линии SP20, доступной из ATCC. Гибридомы выделяли и клонировали путем ограниченных разведений. Затем гибридомные клоны изучали, используя методы, хорошо известные в данной области для клеток, которые секретируют антитела, способные связываться с PGE2. Асцитную жидкость, которая обычно содержит высокие уровни антител, можно получить путем иммунизации мышей позитивными гибридомными клонами.
В другом аспекте из иммунизированных животных могут быть получены продуцирующие антитело иммортализованные гибридомы. После иммунизации животное умерщвляют, и, как хорошо известно в данной области, B-клетки селезенки сливают с иммортализованными миеломными клетками. См., например, Harlow and Lane, выше. В предпочтительном воплощении миеломные клетки не секретируют иммуноглобулиновых полипептидов (несекретирующие линии клеток). После слияния и антибиотической селекции гибридомы подвергают скринингу с использованием PGE2 или его части, или же клетки, экспрессирующей PGE2. В предпочтительном воплощении первоначальный скрининг предпринимают с использованием иммуноферментного анализа (ELISA) или радиоиммунного анализа (RIA), предпочтительно, с помощью ELISA. Пример скрининга с использованием ELISA описан в заявке WO 00/37504.
Гибридомы, продуцирующие антитело против PGE2, отбирают, клонируют и подвергают дополнительному скринингу на предмет обнаружения требуемых характеристик, включая хороший рост гибридомы, высокий уровень продукции антитела и наличие требуемых характеристик, как будет обсуждаться ниже. Гибридомы могут быть культивированы и наработаны in vivo у сингенных животных, у животных с отсутствием иммунной системы, например, у голых мышей, или же в клеточной культуре in vitro. Способы селекции, клонирования и наработки гибридом хорошо известны специалистам в данной области.
В предпочтительном воплощении гибридомы являются мышиными гибридомами, как описано выше. В другом предпочтительном воплощении гибридомы продуцируются в организме животных, отличных от человека и мыши, таких как крысы, овцы, свиньи, козы, крупный рогатый скот или лошади. В другом воплощении гибридомы являются человеческими гибридомами, в которых клетки человеческой несекретирующей миеломы слиты с человеческой клеткой, экспрессирующей анти-PGE2-антитело.
Фрагменты антитела, которые распознают специфические эпитопы, могут быть получены с помощью известных технологий. Например, Fab- и F(ab')2-фрагменты согласно изобретению могут быть получены путем протеолитического расщепления иммуноглобулиновых молекул под действием таких ферментов как папаин (для получения Fab-фрагментов) или пепсин (для получения F(ab')2-фрагментов). F(ab')2-фрагменты содержат вариабельную область, константную область легкой цепи и CH1-домен тяжелой цепи.
2. Моноклональные антитела против простагландина E 2 , полученные с помощью технологии SLAM
В другом аспекте настоящего изобретения рекомбинантные антитела вырабатываются из отдельных выделенных лимфоцитов с помощью процедуры, известной в данной области как метод селекции антител лимфоцитов (SLAM), описанный в патенте США No. 5627052, публикации PCT номер WO 92/02551, а также Babcock, J.S. et al. (1996) Proc. Natl. Acad. Sci. USA 93: 7843-7848. В указанном методе отдельные клетки, секретирующие представляющие интерес антитела, например, лимфоциты, полученные из организма любого из описанных в разделе 1 животных, подвергают скринингу, используя анализ антиген-специфического бляшкообразования, при котором антиген PGE2, субъединица PGE2 или его фрагмент соединяются с эритроцитами барана с помощью линкера, такого как биотин, и используются для идентификации отдельных клеток, которые секретируют антитела, специфичные в отношении PGE2. Последующая идентификация представляющих интерес антитело-секретирующих клеток, кДНК вариабельной области тяжелой и легкой цепей получали из клеток методом ПЦР с обратной транскрипцией, и затем указанные вариабельные области можно было экспрессировать, в контексте подходящих для этого константных областей иммуноглобулинов (например, человеческих константных областей), в клетках-хозяевах млекопитающих, таких как клетки COS, HEK293 или CHO. Клетки-хозяева, трансфицированные амплифицированными иммуноглобулиновыми последовательностями, полученными из лимфоцитов, подвергнутых селекции in vivo, можно затем подвергнуть дополнительному анализу и селекции in vitro, например, путем пэннинга трансфицированных клеток на выделенных клетках, экспрессирующих антитела против PGE2. Амплифицированные иммуноглобулиновые последовательности можно подвергнуть дополнительным манипуляциям in vitro, таким как методы созревания аффинности in vitro, такие как методы, описанные в публикации PCT номер WO 97/29131 и публикации PCT номер WO 00/56772.
3. Моноклональные антитела против простагландина E 2 , полученные с помощью трансгенных животных
В другом аспекте настоящего изобретения антитела получают путем иммунизации животного, отличного от человека, содержащего некоторые или все локусы иммуноглобулина человека, с конъюгатом PGE2-белок-носитель. В предпочтительном воплощении животным, отличным от человека, является трансгенная мышь XENOMOUSE, сконструированный генно-инженерным путем штамм мышей, содержащий крупные фрагменты локусов человеческих иммуноглобулинов и дефицитный по продукции мышиных антител. См., например, Green et al. Nature Genetics 7: 13-21 (1994), а также патенты США 5916771, 5939598, 5985615, 5998209, 6075181, 6091001, 6114598 и 6130364. См. также международную заявку WO 91/10741, опубликованную 25 июля 1991, WO 94/02602, опубликованную 3 февраля 1994, WO 96/34096 и WO 96/33735, одновременно опубликованные 31 октября 1996, WO 98/16654, опубликованную 23 апреля 1998, WO 98/24893, опубликованную 11 июня 1998, WO 98/50433, опубликованную 12 ноября 1998, WO 99/45031, опубликованную 10 сентября 1999, WO 99/53049, опубликованную 21 октября 1999, WO 00 09560, опубликованную 24 февраля 2000, а также заявку WO 00/037504, опубликованную 29 июня 2000. Трансгенная мышь XENOMOUSE продуцирует репертуар полностью человеческих антител, сходный с таковым у взрослого человека, и у нее вырабатываются антиген-специфические человеческие моноклональные антитела. Трансгенная мышь XENOMOUSE содержит приблизительно 80% репертуара человеческих антител при введении в мегабазу YAC-фрагментов локусов человеческой тяжелой цепи и легкой цепи, с указанием их размеров и зародышевой конфигурации. См. Mendez et al., Nature Genetics 15: 146-156 (1997), Green and Jakobovits J. Exp. Med. 188: 483-495 (1998).
4. Моноклональные антитела против простагландина E 2 , полученные с помощью библиотек рекомбинантных антител
Для получения антител согласно изобретению могут быть использованы также методы in vitro, в которых библиотеку антител подвергают скринингу с целью идентификации антитела, имеющего требуемую специфичность связывания. Способы такого скрининга библиотек рекомбинантных антител хорошо известны в данной области и включают в себя способы, описанные, например, Ladner et al. в патенте США No. 5223409; Kang et al. в публикации PCT No. WO 92/18619; Dower et al. в публикации PCT No. WO 91/17271; Winter et al. в публикации PCT No. WO 92/20791; Markland et al. в публикации PCT No. WO 92/15679; Breitling et al. в публикации PCT No. WO 93/01288; McCafferty et al. в публикации PCT No. WO 92/01047; Garrard et al. в публикации PCT No. WO 92/09690; Fuchs et al. (1991) Bio/Technology 9: 1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3: 81-85; Huse et al. (1989) Science 246: 1275-1281; McCafferty et al., Nature (1990) 348: 552-554; Griffiths et al. (1993) EMBO J 12: 725-734; Hawkins et al. (1992) J Mol. Biol. 226: 889-896; Clackson et al. (1991) Nature 352: 624-628; Gram et al. (1992) PNAS 89: 3576-3580; Garrad et al. (1991) Bio/Technology 9: 1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19: 4133-4137; и Barbas et al. (1991) PNAS 88: 7978-7982, в публикации патентной заявки США 20030186374, а также в публикации PCT No. WO 97/29131.
Библиотеку рекомбинантных антител можно получить у субъекта, иммунизированного конъюгатом PGE2-белок-носитель. Альтернативно, библиотеку рекомбинантных антител можно получить у интактного субъекта, то есть такого, который не был иммунизирован конъюгатом PGE2-белок-носитель. Антитела согласно изобретению отбирают путем скрининга библиотеки рекомбинантных антител с использованием средства, содержащего PGE2, с тем, чтобы таким образом отобрать те антитела, которые распознают PGE2. Способы проведения такого скрининга и селекции хорошо известны в данной области, такие, например, как описанные в ссылках в предыдущем абзаце. Для селекции антител согласно изобретению, имеющих конкретные величины аффинности связывания PGE2, такие как антитела, которые диссоциируют из комплекса с PGE2 с конкретной желаемой константой скорости koff, может быть использован известный в данной области метод поверхностного плазмонного резонанса. Для селекции антител согласно изобретению, имеющих конкретные величины нейтрализующей активности в отношении PGE2, таких как антитела с конкретной IC50, могут быть использованы известные в данной области стандартные методы, с помощью которых устанавливают ингибирование активности PGE2.
Например, антитела согласно изобретению могут быть получены также с помощью различных известных в данной области методов фагового дисплея. В методах фагового дисплея функциональные домены антитела расположены на поверхности фаговых частиц, которые несут кодирующие их полинуклеотидные последовательности. В частности, такие фаги могут быть использованы для дисплея антиген-связывающих доменов, экспрессируемых из репертуара или библиотеки комбинаторных антител (например, человеческих или мышиных). Фаг, экспрессирующий антиген-связывающий домен, который связывается с представляющим интерес антигеном, может быть отобран или идентифицирован с помощью антигена, например, с помощью меченого антигена или антигена, связанного или фиксированного на твердой поверхности или шарике. Фаг, используемый в указанных способах, является типичным нитевидным фагом, включающим в себя связывающие домены fd и M13, экспрессируемые из фага в составе Fab, Fv или стабилизированных дисульфидным мостиком антительных доменов Fv, рекомбинантным образом слитых либо с геном III фага, либо с белковым геном VIII. Примеры методов фагового дисплея, которые могут быть использованы для получения антител согласно изобретению, включают в себя методы, описанные Brinkman et al., J. Immunol. Methods 182: 41-50 (1995); Ames et al., J. Immunol. Methods 184: 177-186 (1995); Kettleborough et al., Eur. J. Immunol. 24: 952-958 (1994); Persic et al., Gene 187 9-18 (1997); Burton et al., Advances in Immunology 57: 191-280 (1994); в заявке PCT номер PCT/GB91/01134; в публикации PCT No. WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; а также в патентах США No. 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108.
Как описано в приведенных выше ссылках, после отбора фага антитело, кодирующее области из фага, могут быть выделены и использованы для получения полных антител, включая человеческие антитела или любой другой требуемый антиген-связывающий фрагмент, а также экспрессированы в клетке любого требуемого хозяина, включая клетки млекопитающего, клетки насекомого, клетки растения, дрожжевые клетки и бактерии, например, так, как подробно описано ниже. Например, технологии рекомбинантного продуцирования фрагментов Fab, Fab' и F(ab')2 могут быть использованы также с применением способов, известных в данной области, таких как способы, описанные в публикации PCT номер WO 92/22324; Mullinax et al., BioTechniques 12(6): 864-869 (1992); Sawai et al., AJRI 34: 26-34 (1995); Better et al., Science 240: 1041-1043 (1988). Примеры технологий, которые могут быть использованы для продукции одноцепочечных Fv и антител, включают в себя технологии, описанные в патентах США 4946778 и 5258498; Huston et al., Methods in Enzymology 203: 46-88 (1991); Shu et al., PNAS 90: 7995-7999 (1993); а также Skerra et al., Science 240: 1038-1040 (1988).
Альтернативно скринингу библиотек рекомбинантных антител методом фагового дисплея, можно воспользоваться и другими известными в данной области методологиями для скрининга обширных комбинаторных библиотек с целью идентификации антител согласно изобретению с двойной специфичностью. Одним из типов систем с альтернативной экспрессией является система, в которой библиотека рекомбинантных антител экспрессируется в виде слияний РНК-белок, как описано в публикации PCT No. WO 98/31700 авторами Szostak и Roberts, а также у Roberts, R. W. and Szostak, J. W. (1997) Proc. Natl. Acad. Sci USA 94: 12297-12302. В этой системе создано ковалентное слияние между мРНК и пептидом или белком, которое кодируется путем in vitro трансляции искусственных мРНК, несущих на своем 3'-конце пуромицин, пептидильный акцепторный антибиотик. Таким образом, специфическая мРНК может быть обогащена из сложной смеси мРНК (например, комбинаторной библиотеки) на основе свойств кодируемого пептида или белка, например, антитела или его части, таких как связывание антитела или его части с антигеном с двойной специфичностью. Последовательности нуклеиновых кислот, кодирующие антитела или их части, восстановленные в результате скрининга таких библиотек, могут быть экспрессированы рекомбинантным способом, как описано выше (например, в клетках-хозяевах млекопитающих), а кроме того, могут быть подвергнуты дополнительному созреванию аффинности либо в результате дополнительных циклов скрининга слияний мРНК-пептид, при которых в исходно отобранную последовательность (последовательности) вносят мутации, либо другими способами созревания аффинности рекомбинантных антител in vitro, как описано выше.
При другом подходе антитела согласно изобретению могут быть получены также с помощью известных в данной области методов дрожжевого дисплея. В методах дрожжевого дисплея используются генетические методы для связывания доменов антитела со стенкой дрожжевой клетки и распределения их на поверхности дрожжей. В частности, такие дрожжи могут быть использованы для дисплея антиген-связывающих доменов, экспрессируемых из репертуара или библиотеки комбинаторных антител (например, человеческих или мышиных). Примеры методов дрожжевого дисплея, которые могут быть использованы для получения антител согласно изобретению, включают в себя методы, описанные Wittrup, et al. в патенте США No. 6699658.
5. Моноклональные антитела против простагландина E 2 , полученные с помощью технологии PROfusion дисплея мРНК
Технология PROfusion(TM) является одной из описанных выше технологий дисплея мРНК. Технология PROfusion(TM) может быть использована для дисплея фрагментов (VH или VL или scFv) человеческих антител, спаренных с кодирующими их последовательностями ДНК, с целью отделения от разных других антигенов. Примеры методов дисплея мРНК, которые могут быть использованы для получения антител согласно изобретению, включают в себя методы, описанные Szostak et al. в патентах США No. 6207446; 6214553; и Gold, et al. в патенте США No. 6194550, а также у Roberts, R. W. и Szostak, J. W. (1997) Proc. Natl. Acad. Sci USA 94: 12297-12302. В указанной системе создано ковалентное слияние между мРНК и пептидом или белком, которое кодируется путем in vitro трансляции искусственных мРНК, несущих пуромицин, пептидильный акцепторный антибиотик, на их 3'-конце. Таким образом, специфическая мРНК может быть обогащена из сложной смеси мРНК (например, комбинаторной библиотеки) на основе свойств кодируемого пептида или белка, например, антитела или его части, например, связывание антитела или его части с антигеном с двойной специфичностью. Последовательности нуклеиновых кислот, кодирующие антитела или их части, восстановленные в результате скрининга таких библиотек, могут быть экспрессированы рекомбинантным способом, как описано выше (например, в клетках-хозяевах млекопитающего), а кроме того, они могут быть подвергнуты дополнительному созреванию аффинности либо в результате дополнительных циклов скрининга слияний мРНК-пептид, при котором в исходно отобранную последовательность (последовательности) вносят мутации, либо другими способами созревания аффинности рекомбинантных антител in vitro, как описано выше.
6. Созревание аффинности моноклональных антител против простагландина E 2
Методы in vitro также могут быть использованы для созревания аффинности антител согласно изобретению, мутагенез в библиотеке антител вызывают путем внесения точковой мутации (мутаций) в области CDR и/или каркасной области одного из первоначальных антител с помощью ошибочно направленной ПЦР или искусственных олигонуклеотидов, или же олигонуклеотид-направленного мутагенеза. Затем мутагенную библиотеку можно подвергнуть скринингу с целью идентификации антитела, имеющего улучшенную специфичность связывания. Способы такого скрининга библиотек рекомбинантных антител хорошо известны в данной области и включают в себя методы, описанные, например, Ladner et al. в патенте США No. 5223409; Kang et al. в публикации PCT No. WO 92/18619; Dower et al. в публикации PCT No. WO 91/17271; Winter et al. в публикации PCT No. WO 92/20791; Markland et al. в публикации PCT No. WO 92/15679; Breitling et al. в публикации PCT No. WO 93/01288; McCafferty et al. в публикации PCT No. WO 92/01047; Garrard et al. в публикации PCT No. WO 92/09690; Fuchs et al. (1991) Bio/Technology 9: 1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3: 81-85; Huse et al. (1989) Science 246: 1275-1281: McCafferty et al, Nature (1990) 348: 552-554; Griffiths et al. (1993) EMBO J 12: 725-734; Hawkins et al. (1992) J Mol Biol 226: 889-896; Clackson et al. (1991) Nature 352: 624-628; Gram et al. (1992) PNAS 89: 3576-3580; Garrad et al. (1991) Bio/Technology 9: 1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19: 4133-4137; и Barbas et al. (1991) PNAS 88: 7978-7982, в публикации патентной заявки США 20030186374, а также в публикации PCT No. WO 97/29131.
Способы проведения такого скрининга и селекции хорошо известны в данной области, например, такие, которые описаны в ссылках в предыдущем абзаце. Для отбора антител согласно изобретению, имеющих конкретные уровни аффинности связывания с PGE2, такие как антитела, которые диссоциируют от PGE2 с конкретным значением константы скорости koff, может быть использован известный в данной области метод поверхностного плазмонного резонанса, с помощью которого могут быть отобраны антитела с требуемой специфичностью, имеющие требуемое значение константы скорости koff. Для селекции антител согласно изобретению, имеющих конкретное значение величины нейтрализующей активности в отношении PGE2, таких как антитела с конкретной IC50, могут быть использованы известные в данной области стандартные методы, с помощью которых устанавливают ингибирование активности PGE2.
Например, антитела согласно изобретению могут также пройти стадию созревания аффинности с помощью различных известных в данной области методов дисплея. В методах фагового дисплея функциональные домены антитела расположены на поверхности фаговых частиц, которые несут кодирующие их полинуклеотидные последовательности. В частности, такие фаги могут быть использованы для дисплея антиген-связывающих доменов, экспрессируемых из репертуара или библиотеки комбинаторных антител (например, человеческих или мышиных). Фаг, экспрессирующий антиген-связывающий домен, который связывается с представляющим интерес антигеном, может быть отобран или идентифицирован с помощью антигена, например, с помощью меченого антигена или антигена, связанного или фиксированного на твердой поверхности или шарике. Фаг, используемый в указанных способах, является типичным нитевидным фагом, включающим в себя связывающие домены fd и M13, экспрессируемые из фага в составе Fab, Fv или стабилизированных дисульфидным мостиком антительных доменов Fv, рекомбинантным образом слитых либо с геном III фага, либо с белковым геном VIII. Примеры методов фагового дисплея, которые могут быть использованы для получения антител согласно изобретению, включают в себя методы, описанные Brinkman et al., J. Immunol. Methods 182: 41-50 (1995); Ames et al., J. Immunol. Methods 184: 177-186 (1995); Kettleborough et al., Eur. J. Immunol. 24: 952-958 (1994); Persic et al., Gene 187 9-18 (1997); Burton et al., Advances in Immunology 57: 191-280 (1994); в заявке PCT номер PCT/GB91/01134; в публикации PCT No. WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; а также в патентах США No. 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108.
Как описано в приведенных выше ссылках, после отбора фага антитело, кодирующее области из фага, могут быть выделены и использованы для получения полных антител, включая человеческие антитела или любой другой требуемый антиген-связывающий фрагмент, а также экспрессированы в клетке любого требуемого хозяина, включая клетки млекопитающего, клетки насекомого, клетки растения, дрожжевые клетки и бактерии, например, так, как подробно описано ниже. Например, технологии рекомбинантного продуцирования фрагментов Fab, Fab' и F(ab')2 могут быть использованы также с применением способов, известных в данной области, таких как способы, описанные в публикации PCT номер WO 92/22324; Mullinax et al., BioTechniques 12(6): 864-869 (1992); Sawai et al., AJRI 34: 26-34 (1995); Better et al., Science 240: 1041-1043 (1988). Примеры технологий, которые могут быть использованы для продукции одноцепочечных Fv и антител, включают в себя технологии, описанные в патентах США 4946778 и 5258498; Huston et al., Methods in Enzymology 203: 46-88 (1991); Shu et al., PNAS 90: 7995-7999 (1993); а также Skerra et al., Science 240: 1038-1040 (1988).
Альтернативно скринингу библиотек рекомбинантных антител методом фагового дисплея, можно воспользоваться и другими известными в данной области методологиями для скрининга обширных комбинаторных библиотек с целью идентификации антител согласно изобретению с двойной специфичностью. Одним из типов систем с альтернативной экспрессией является система, в которой библиотека рекомбинантных антител экспрессируется в виде слияний РНК-белок, как описано в публикации PCT No. WO 98/31700 авторами Szostak и Roberts, а также у Roberts, R. W. and Szostak, J. W. (1997) Proc. Natl. Acad. Sci USA 94: 12297-12302. В этой системе создано ковалентное слияние между мРНК и пептидом или белком, которое кодируется путем in vitro трансляции искусственных мРНК, несущих на своем 3'-конце пуромицин, пептидильный акцепторный антибиотик. Таким образом, специфическая мРНК может быть обогащена из сложной смеси мРНК (например, комбинаторной библиотеки) на основе свойств кодируемого пептида или белка, например, антитела или его части, таких как связывание антитела или его части с антигеном с двойной специфичностью. Последовательности нуклеиновых кислот, кодирующие антитела или их части, восстановленные в результате скрининга таких библиотек, могут быть экспрессированы рекомбинантным способом, как описано выше (например, в клетках-хозяевах млекопитающих), а кроме того, могут быть подвергнуты дополнительному созреванию аффинности либо в результате дополнительных циклов скрининга слияний мРНК-пептид, при которых в исходно отобранную последовательность (последовательности) вносят мутации, либо другими способами созревания аффинности рекомбинантных антител in vitro, как описано выше.
При другом подходе антитела согласно изобретению могут быть получены также с помощью известных в данной области методов дрожжевого дисплея. В методах дрожжевого дисплея используются генетические методы для связывания доменов антитела со стенкой дрожжевой клетки и распределения их на поверхности дрожжей. В частности, такие дрожжи могут быть использованы для дисплея антиген-связывающих доменов, экспрессируемых из репертуара или библиотеки комбинаторных антител (например, человеческих или мышиных). Примеры методов дрожжевого дисплея, которые могут быть использованы для получения антител согласно изобретению, включают в себя методы, описанные Wittrup, et al. в патенте США No. 6699658.
B. Получение рекомбинантных антител против простагландина E 2
Антитела согласно изобретению могут быть получены с применением любой из целого ряда технологий, известных в данной области. Например, путем экспрессии из клетки-хозяина, при этом экспрессирующий вектор (векторы), кодирующий тяжелую и легкую цепи, трансфицируют в клетку-хозяин, используя стандартные технологии. Различные формы термина "трансфекция" подразумевают обширное разнообразие технологий, обычно используемых для включения экзогенной ДНК в прокариотические или эукариотические клетки-хозяева, например, электропорация, кальций-фосфатное осаждение, DEAE-декстрановая трансфекция и т.п. Несмотря на то, что антитела согласно изобретению можно экспрессировать либо в прокариотических, либо в эукариотических клетках-хозяевах, экспрессия в эукариотических клетках является предпочтительной, причем наиболее предпочтительными являются клетки-хозяева млекопитающих, поскольку более вероятно, что в таких эукариотических клетках (и, в частности, в клетках млекопитающих), а не в прокариотических, происходит правильная сборка и секреция, а также правильная пространственная упаковка и приобретается иммунологическая активность антитела.
Предпочтительные для экспрессии рекомбинантных антител согласно изобретению клетки-хозяева млекопитающих включают в себя клетки яичника китайского хомячка (клетки CHO) (включая dhfr-CHO-клетки, описанные Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci USA 77: 4216-4220, в которых используется селективный маркер DHFR, например, как описано у RJ. Kaufman and P.A. Sharp (1982) Mol. Biol. 159: 601-621), клетки миеломы NSO, клетки COS и клетки SP2. Когда рекомбинантные экспрессирующие векторы, кодирующие гены антитела, вводят в клетки-хозяева млекопитающего, антитела продуцируют путем культивирования клеток-хозяев в течение периода, достаточного для реализации экспрессии антитела в клетках-хозяевах, или, более предпочтительно, секреции антитела в культуральную среду, в которой выращивают указанные клетки-хозяева. Антитела могут быть получены из культуральной среды с помощью стандартных методов очистки белков.
Клетки-хозяева могут быть использованы также для получения функциональных фрагментов антител, таких как Fab-фрагменты или молекулы scFv. Следует понимать, что вариации указанных выше процедур полностью включены в объем, охватываемый настоящим изобретением. Например, может быть желательно трансфицировать клетку-хозяина молекулой ДНК, кодирующей функциональные фрагменты или легкой цепи, и/или тяжелой цепи антитела согласно изобретению. Технология рекомбинантных ДНК также может быть использована для устранения некоторых или же всех молекул ДНК, кодирующих либо одну, либо обе, легкую и тяжелую, цепи, которые не являются необходимыми для связывания с представляющими интерес антигенами. Молекулы, экспрессируемые с таких усеченных молекул ДНК, также входят в объем, охватываемый настоящим изобретением. Кроме того, могут быть получены бифункциональные антитела, в которых тяжелая и одна легкая цепь образуют антитело согласно изобретению, а другая тяжелая и легкая цепи являются специфичными в отношении антигена, отличного от представляющих интерес антигенов, путем перекрестного связывания антитела согласно изобретению со вторым антителом с использованием стандартных химических методов образования поперечного связывания.
В предпочтительной системе рекомбинантной экспрессии антитела или его антиген-связывающей части согласно изобретению рекомбинантный экспрессирующий вектор, кодирующий и тяжелую цепь антитела, и легкую цепь антитела, вводят в клетки dhfr-CHO путем кальций-фосфат-опосредованной трансфекции. Внутри рекомбинантного экспрессирующего вектора каждый из генов, ген тяжелой цепи и ген легкой цепи антитела, оперативно связан с регуляторными элементами энхансером CMV/промотором AdMLP для проведения высоких уровней транскрипции указанных генов. Рекомбинантный экспрессирующий вектор несет также ген DHFR, который позволяет осуществлять селекцию клеток CHO, которые трансфицированы вектором с помощью селекции/амплификации на фоне метотрексата. Отобранные клетки-хозяева-трансформанты культивируют, добиваясь экспрессии тяжелой и легкой цепей антитела, и затем из культуральной среды получают интактное антитело. Стандартные технологии молекулярной биологии используются для получения рекомбинантного экспрессирующего вектора, трансфекции клеток-хозяев, селекции трансформантов, культивирования клеток-хозяев и получения антитела из культуральной среды. Кроме того, настоящее изобретение связано со способом синтезирования рекомбинантного антитела согласно изобретению путем культивирования клетки-хозяина согласно изобретению в соответствующей культуральной среде до тех пор, пока не начнет синтезироваться рекомбинантное антитело согласно изобретению. Указанный способ может дополнительно включать в себя выделение рекомбинантного антитела из культуральной среды.
Продуцирование химерных антител против простагландина E 2
Химерное антитело представляет собой молекулу, в которой разные части антитела получены из разных видов животных, например, антитела, имеющие вариабельную область, полученную из мышиного моноклонального антитела, и константную область человеческого иммуноглобулина. Способы получения химерных антител известны в данной области и подробно описаны в примере 2.1. См., например, Morrison, Science 229: 1202 (1985); Oi et al., BioTechniques 4: 214 (1986); Gillies et al., (1989) J. Immunol. Methods 125: 191-202; патенты США No. 5807715; 4816567; и 4816397. Кроме того, могут быть использованы технологии, развитые для продуцирования "химерных антител" (Morrison et al., 1984, Proc. Natl. Acad. Sci. 81: 851-855; Neuberger et al., 1984, Nature 312: 604-608; Takeda et al., 1985, Nature 314: 452-454) путем сплайсинга генов из молекулы мышиного антитела соответствующей антигенной специфичности с генами из молекулы человеческого антитела с соответствующей биологической активностью.
В одном из воплощений химерные антитела согласно изобретению продуцируют путем замены константной области тяжелой цепи мышиных моноклональных антител против PGE2, описанных в разделе 1, константной областью человеческого IgG1. В специфическом воплощении химерное антитело согласно изобретению содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность SEQ ID 60, 62, 64, 66, 68, 70, 72, 74, 76, 78 и 80, и вариабельную область легкой цепи (VL), SEQ ID 61, 63, 65, 67, 69, 71, 73, 75, 77, 79 и 81.
Гуманизированные антитела против простагландина E 2
Гуманизированными антителами являются молекулы антитела, полученные от видов, не являющихся человеком, которые связываются с требуемым антителом, имеющим одну или несколько определяющих комплементарность областей (CDR) из отличных от человека видов и каркасной области из человеческой молекулы иммуноглобулина. Известные последовательности иммуноглобулина человека описаны, например, в Интернете по следующим адресам: www.ncbi.nlm.nih.gov/entrez-/query.fcgi; www.atcc.org/phage/hdb.html; www.sciquest.com/; www.abcam.com/; www.antibodyresource.com/onlinecomp.html; www.public.iastate.edu/.about.pedro/research_tools.html; www.mgen.uniheidelberg.de/SD/IT/IT.html; www.whfreeman.com/immunology/CH-05/kuby05.htm; www.library.thinkquest.org/12429/Immune/Antibody.html; www.hhmi.org/grants/lectures/1996/vlab/; www.path.cam.ac.uk/.about.mrc7/m-ikeimages.html; www.antibodyresource.com/;
mcb.harvard.edu/BioLinks/Immuno-logy.html.
http://www.immunologylink.com/;
pathbox.wustl.edu/.about.hcenter/index.-html; www.biotech.ufl.edu/.about.hcl/; www.pebio.com/pa/340913/340913.html-; www.nal.usda.gov/awic/pubs/antibody/;
www.m.ehime-u.acjp/.about.yasuhito-/Elisa.html; www.biodesign.com/table.asp;
www.icnet.uk/axp/facs/davies/lin-ks.html;
www.biotech.ufl.edu/.about.fccl/protocol.html;
www.isac-net.org/sites_geo.html;
aximtl.imt.uni-marburg.de/.about.rek/AEP-Start.html; baserv.uci.kun.nl/.about.jraats/linksl.html;
www.recab.uni-hd.de/immuno.bme.nwu.edu/;
www.mrc-cpe.cam.ac.uk/imt-doc/pu-blic/INTRO.html; www.ibt.unam.mx/vir/V_mice.html; imgt.cnusc.fr: 8104/; www.biochem.ucl.ac.uk/.about.martin/abs/index.html; antibody.bath.ac.uk/; abgen.cvm.tamu.edu/lab/wwwabgen.html; www.unizh.ch/.about.honegger/AHOseminar/SlideOl.html; www.cryst.bbk.ac.uk/.about.ubcg07s/; www.nimr.mrc.ac.uk/CC/ccaewg/ccaewg.htm;
www.path.cam.ac.uk/.about.mrc7/humanisation/TAHHP.html; www.ibt.unam.mx/vir/structure/stat_aim.html; www.biosci.missouri.edu/smithgp/index.html;
www.cryst.bioc.cam.ac.uk/.about.fmolina/Web-pages/Pept/spottech.html; http://www.jerini.de/fr roducts.htm; www.patents.ibm.com/ibm.html.; Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983). Такие привнесенные последовательности, как известно в данной области, могут быть использованы для уменьшения иммуногенности или же для уменьшения, повышения или модификации связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, времени полужизни или любой другой подходящей характеристики.
Остатки в каркасной области в человеческих каркасных областях могут быть заменены соответствующим остатком из области CDR донорного антитела с целью изменения, предпочтительно, улучшения связывания антигена. Такие замены в каркасной области идентифицируют методами, хорошо известными в данной области, например, путем моделирования взаимодействий остатков области CDR и каркасной области для идентификации остатков каркасной области, играющих важную роль в связывании антигена, и сравнение последовательностей для идентификации необычных остатков каркасной области в определенных положениях. (См., например, Queen et al., патент США No. 5585089; Riechmann et al., Nature 332: 323 (1988)). Трехмерные модели иммуноглобулина обычно доступны и знакомы специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и воспроизводят возможные трехмерные конформационные структуры отобранных иммуноглобулиновых последовательностей-кандидатов. Изучение таких изображений позволяет анализировать вероятную роль остатков в функционировании иммуноглобулиновой последовательности-кандидата, то есть анализировать остатки, которые влияют на способность иммуноглобулина-кандидата связывать свой антиген. Таким образом, остатки FR могут быть отобраны и скомбинированы из консенсусной и привнесенной последовательностей, так, чтобы были достигнуты требуемые характеристики антитела, такие как повышенная аффинность в отношении антигена (антигенов)-мишени. Обычно остатки области CDR вовлечены непосредственно и наиболее существенным образом и оказывают влияние на связывание антигена. Антитела могут быть гуманизированы путем применения различных технологий, известных в данной области, таких, без ограничения, как те, которые описаны в публикациях Jones et al., Nature 321: 522 (1986); Verhoeyen et al., Science 239: 1534 (1988)), Sims et al., J. Immunol. 151: 2296 (1993); Chothia and Lesk, J. Mol. Biol. 196: 901 (1987), Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89: 4285 (1992); Presta et al., J. Immunol. 151: 2623 (1993), Padlan, Molecular Immunology 28(4/5): 489-498 (1991); Studnicka et al., Protein Engineering 7(6): 805-814 (1994); Roguska. et al., PNAS 91: 969-973 (1994); в публикации PCT WO 91/09967, PCT/: US98/16280, US96/18978, US91/09630, US91/05939, US94/01234, GB89/01334, GB91/01134, GB92/01755; WO90/14443, WO90/14424, WO90/14430, EP 229246, EP 592106; EP 519596, EP 239400, в патентах США No. 5565332, 5723323, 5976862, 5824514, 5817483, 5814476, 5763192, 5723323, 5766886, 5714352, 6204023, 6180370, 5693762, 5530101, 5585089, 5225539; и 4816567.
C. Продуцирование антител и антитело-продуцирующих клеточных линий
Предпочтительно, чтобы анти-PGE2-антитела согласно изобретению обладали высокой способностью снижать или нейтрализовать активность PGE2, что можно установить, например, одним из целого ряда известных в данной области анализов in vitro и in vivo (например, см. пример 1.1.C). Например, такие антитела нейтрализуют PGE2-индуцируемый приток кальция в анализе рецептора EP4 со значениями IC50 в области, по меньшей мере, приблизительно 10-6 M, приблизительно 10-7 M, приблизительно 10-8 M, приблизительно 10-9 M, приблизительно 10-10 M, приблизительно 10-11 M или приблизительно 10-12 M.
В предпочтительных воплощениях выделенное антитело или его антиген-связывающая часть связывается с PGE2, при этом указанное антитело или его антиген-связывающая часть диссоциирует от PGE2 с константой скорости koff, приблизительно составляющей 0,1 сек-1 или менее, что определяется методом радиоиммуноанализа, или же ингибирует активность PGE2 с IC50, приблизительно составляющей 1×10-6 M или менее. Альтернативно, антитело или его антиген-связывающая часть может диссоциировать от PGE2 с константой скорости koff, приблизительно составляющей 1×10-2 сек-1 или менее, как определяется методом радиоиммуноанализа, или же может ингибировать активность PGE2 с IC50, приблизительно составляющей 1×10-7 M или менее. Альтернативно, антитело или его антиген-связывающая часть может диссоциировать от PGE2 с константой скорости koff, приблизительно составляющей 1×10-3 сек-1 или менее, как определяется методом радиоиммуноанализа, или может ингибировать активность PGE2 с IC50, приблизительно составляющей 1×10-8 M или менее. Альтернативно, антитело или его антиген-связывающая часть может диссоциировать от PGE2 с константой скорости koff, приблизительно составляющей 1×10-4 сек-1 или менее, как определяется методом радиоиммуноанализа, или может ингибировать активность PGE2 с IC50, приблизительно составляющей 1×10-9 M или менее. Альтернативно, антитело или его антиген-связывающая часть может диссоциировать от PGE2 с константой скорости koff, приблизительно составляющей 1×10-5 сек-1 или менее, как определяется методом радиоиммуноанализа, или может ингибировать активность PGE2 с IC50, приблизительно составляющей 1×10-10 M или менее. Альтернативно, антитело или его антиген-связывающая часть может диссоциировать от PGE2 с константой скорости koff, приблизительно составляющей 1×10-6 сек-1 или менее, как определяется методом радиоиммуноанализа, или может ингибировать активность PGE2 с IC50, приблизительно составляющей 1×10-11 M или менее.
Моноклональные антитела согласно изобретению блокируют связывание PGE2, по меньшей мере, с одним из рецепторов EP1, EP2, EP3 и EP4. Было показано как на основе FACS-анализа связывания рецептора, так и на основе анализа связывания 3H-меченного PGE2 на клеточной поверхности, что как мышиная версия, так и гуманизированная версия анти-PGE2 способны эффективно блокировать связывание PGE2 с его рецепторами. Кристаллическая структура PGE2, образующая комплексы с Fab-областью гуманизированного анти-PGE2-антитела Hu2B5.7, предусмотрена настоящим изобретением.
В определенных воплощениях антитело содержит константную область тяжелой цепи, такую как константная область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. Предпочтительно, чтобы константная область тяжелой цепи представляла собой константную область тяжелой цепи IgG1 или константную область тяжелой цепи IgG4. Кроме того, антитело может содержать константную область легкой цепи либо константную область легкой каппа-цепи, либо константную область легкой лямбда-цепи. Предпочтительно, чтобы антитело содержало константную область легкой каппа-цепи. Альтернативно, часть антитела может представлять собой, например, Fab-фрагмент или одноцепочечный Fv-фрагмент.
Замены аминокислотных остатков Fc-части с целью изменения эффекторной функции антитела известны в данной области (Winter, et al., патенты США NO. 5648260; 5624821). Fc-частью антитела опосредовано несколько важных эффекторных функций, например, индукция цитокина, ADCC, фагоцитоз, комплемент-зависимая цитотоксичность (CDC) и время полужизни/скорость клиренса антитела и комплексов антиген-антитело. В некоторых случаях указанные эффекторные функции являются желательными для терапевтического антитела, но в других случаях они могут быть необязательны или даже нежелательны, в зависимости от терапевтической задачи. Определенные изотипы человеческого IgG, в частности, IgG1 и IgG3, опосредуют ADCC и CDC через связывание, соответственно, с FcγRs и комплементом C1q. Неонатальные Fc-рецепторы (FcRn) являются критическими компонентами, определяющими время полужизни циркулирующих антител. В другом воплощении, по меньшей мере, один аминокислотный остаток заменен в константной области антитела, например, Fc-области антитела, так, чтобы изменились эффекторные функции антитела. В другом аспекте активность Fc-фрагмента может быть весьма усилена сиалилированием N-связанного гликана Fc-части (например, 2,6-связью с предпоследней галактозой комплекса, двухантенного гликана, обнаруживаемого в положении Asn 297 в иммуноглобулине G (IgG)) (Anthony, RM (2008) Science 320: 373-376).
Одно из воплощений связано с мечеными связывающимися белками, где антитело или часть антитела согласно изобретению являются производными или связаны с другой функциональной молекулой (например, другим пептидом или белком). Например, меченый связывающийся белок согласно изобретению может быть получен путем функционального связывания антитела или части антитела согласно изобретению (например, путем химического связывания, генетического слияния, нековалентной ассоциации или пр.) с одной или несколькими другими молекулярными структурами, такими как другое антитело (например, биспецифическое антитело или диатело), детектируемым средством, цитотоксическим средством, фармацевтическим средством и/или белком или пептидом, которым может быть опосредована ассоциация антитела или части антитела с другой молекулой (например, такой как область стрептавидинового ядра или полигистидиновая метка).
Полезные детектируемые средства, с помощью которых могут быть дериватизированы антитело или часть антитела согласно изобретению, включают в себя флуоресцентные соединения. Примеры флуоресцентных детектируемых средств включают в себя флуоресцеин, флуоресцеинизотиоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и т.п. Антитело может быть дериватизировано также с помощью детектируемых ферментов, таких как щелочная фосфатаза, пероксидаза хрена, глюкозооксидаза и т.п. Когда антитело дериватизировано с помощью детектируемого фермента, процесс его детектирования связан с добавлением дополнительных реагентов, которые используются ферментом для продуцирования детектируемого продукта реакции. Например, когда присутствует детектируемое средство пероксидаза хрена, добавление перекиси водорода и диаминобензидина приводит к образованию продукта цветной реакции, которая детектируется. Антитело может быть дериватизировано также с помощью биотина и детектировано путем непрямого измерения связывания авидина или стрептавидина.
Другое воплощение настоящего изобретения связано с кристаллизованным связывающим белком. В предпочтительном случае изобретение, как описано выше, связано с кристаллами цельных анти-PGE2-антител и их фрагментов, а также с составами и композициями, содержащими такие кристаллы. В одном из воплощений кристаллизованный связывающий белок имеет большее время полужизни in vivo, чем растворимый аналог связывающего белка. В другом воплощении связывающий белок сохраняет свою биологическую активность после кристаллизации.
Кристаллизованный связывающий белок согласно изобретению может быть продуцирован согласно методам, известным в данной области и описанным в документе WO 02072636.
Другое воплощение настоящего изобретения связано с гликозилированным связывающим белком, где антитело или его антиген-связывающая часть содержит один или несколько углеводных остатков. Возникающая in vivo белковая продукция может подвергаться дальнейшему процессингу, известному под названием посттрансляционной модификации. В частности, сахарные (гликозильные) остатки могут быть добавлены энзиматически - процесс, называемый гликозилированием. Полученные в результате белки, ковалентно связанные олигосахаридными боковыми цепями, известны под названием гликозилированные белки или гликопротеины. Антитела являются гликопротеинами с одним или несколькими углеводными остатками в Fc-домене, а также в вариабельном домене. Углеводные остатки в Fc-домене оказывают существенное влияние на эффекторную функцию Fc-домена, при этом минимально воздействуя на связывание антигена или время полужизни антитела (R. Jefferis, Biotechnol. Prog. 21 (2005), pp. 11-16). В противоположность этому, гликозилирование вариабельного домена может влиять на антиген-связывающую активность антитела. Гликозилирование в вариабельном домене может отрицательным образом сказаться на аффинности связывания антитела, по всей вероятности, в силу стерических несоответствий (Co, M.S., et al., Mol. Immunol. (1993) 30: 1361-1367), или вызвать повышенную аффинность в отношении антигена (Wallick, S.C., et al., Exp. Med. (1988) 168: 1099-1109; Wright, A., et al., EMBO J. (1991) 10: 2717 2723).
Один из аспектов настоящего изобретения направлен на выработку мутантных сайтов гликозилирования, в которых O- или N-связанный участок гликозилирования связывающего белка подвергся мутации. Специалист в данной области может получать такие мутанты с использованием стандартных хорошо известных технологий. Мутанты по участкам гликозилирования, которые сохраняют свою биологическую активность, но при этом имеют повышенную или пониженную активность связывания, являются другими объектами настоящего изобретения.
Еще в одном воплощении гликозилирование антитела или его антиген-связывающей части согласно изобретению модифицировано. Например, может быть получено агликозилированное антитело (то есть антитело, которое лишено гликозилирования). Гликозилирование может быть изменено, например, с целью повышения аффинности антитела в отношении антигена. Такие углеводные модификации могут быть выполнены, например, путем изменения одного или нескольких участков гликозилирования внутри последовательности антитела. Например, могут быть произведены одна или несколько аминокислотных замен, которые приведут к элиминации одного или нескольких участков гликозилирования вариабельной области, с тем, чтобы устранить гликозилирование на этом участке. Такое агликозилирование может повысить аффинность антитела в отношении антигена. Такой подход более подробно описан в публикации PCT WO 2003016466A2 и в патентах США No. 5714350 и 6350861.
Дополнительно или альтернативно, может быть получено модифицированное антитело согласно изобретению, которое имеет измененный тип гликозилирования, например, гипофукозилированное антитело, имеющее уменьшенное количество фукозильных остатков, или антитело, имеющее повышенное количество рассеченных структур GlcNAc. Было показано, что такой измененный характер гликозилирования повышает ADCC-способность антител. Такие углеводные модификации могут быть выполнены, например, путем экспрессии антитела в клетках-хозяевах с другим механизмом гликозилирования. Клетки с другим механизмом гликозилирования описаны в данной области и могут быть использованы в качестве клеток-хозяев для экспрессии рекомбинантных антител согласно изобретению, чтобы таким образом продуцировать антитело с измененным характером гликозилирования. См., например, Shields, R. L. et al. (2002) J. Biol. Chem. 277: 26733-26740; Umana et al. (1999) Nat. Biotech. 17: 176-1, а также Европейский патент No: EP 1176195; публикации PCT WO 03/035835; WO 99/5434280.
Гликозилирование белков зависит от аминокислотной последовательности представляющих интерес белков, а также от клетки-хозяина, в которой экспрессируется указанный белок. Разные организмы могут продуцировать различные ферменты гликозилирования, (например, гликозилтрансферазы и гликозидазы) и у них имеются в наличии разные субстраты (нуклеотидные сахара). Благодаря таким факторам характер гликозилирования белков и состав гликозильных остатков может отличаться, в зависимости от системы хозяина, в которой экспрессируется конкретный белок. Гликозильные остатки, пригодные для данного изобретения, могут включать в себя, не ограничиваясь перечисленным, глюкозу, галактозу, маннозу, фукозу, н-ацетилглюкозамин и сиаловую кислоту. Предпочтительно, чтобы гликозилированный связывающий белок содержал такие гликозильные остатки, чтобы характер гликозилирования был таким, какой свойственен человеку.
Специалистам в данной области известно, что различное гликозилирование белков может придавать белку разные характеристики. Например, эффективность терапевтического белка, продуцируемого в микроорганизме-хозяине, таком как дрожжи, и гликозилирование с использованием дрожжевых эндогенных путей может быть снижено по сравнению с таковыми у того же самого белка, экспрессируемого в клетках млекопитающих, таких как линия клеток CHO. Такие гликопротеины могут также быть иммуногенными для человека и обнаруживать более короткое время полужизни in vivo после их введения. Специфические рецепторы у человека и других животных могут распознавать специфические гликозильные остатки и стимулировать быстрый клиренс из кровяного русла. Другие побочные эффекты могут включать в себя изменения в пространственной упаковке белка, в его растворимости, в подверженности действию протеиназ, в его обороте, транспорте, компартментализации, секреции, в его распознавании другими белками или факторами, в его антигенности или аллергенности. Соответственно, практикующий клиницист может предпочесть терапевтический белок со специфическим составом и характером гликозилирования, например, специфическим составом и характером гликозилирования, идентичным или, по меньшей мере, схожим с таковыми, продуцируемыми в человеческих клетках или видоспецифических клетках подразумеваемого вида животного.
Экспрессии гликозилированных белков, отличных от таковых клетки-хозяина, можно достичь путем генетической модификации клеток-хозяев, чтобы они экспрессировали гетерологичные ферменты гликозилирования. Используя известные в данной области технологии, практикующий клиницист может получить антитела или их антиген-связывающие части, имеющие характер гликозилирования, свойственный человеческим белкам. Например, дрожжевые штаммы генетически модифицируют с тем, чтобы они экспрессировали ферменты гликозилирования, не свойственные их природе, так, чтобы гликозилированные белки (то есть гликопротеины), продуцируемые в этих штаммах дрожжей, имели характер гликозилирования, идентичный таковому в животных клетках, в частности, в клетках человека (патентные заявки США 20040018590 и 20020137134, а также публикация PCT WO 2005100584 A2).
Помимо связывающих белков, настоящее изобретение направлено также и на антиидиотипическое (анти-Id) антитело, специфичное в отношении указанных связывающих белков согласно изобретению. Анти-Id-антитело является антителом, которое распознает уникальные детерминанты, обычно ассоциированные с антиген-связывающей областью другого антитела. Анти-Id-антитело может быть получено путем иммунизации животного связывающим белком или его CDR-содержащей областью. Иммунизированное животное будет распознавать и отвечать на идиотипические детерминанты иммунизирующего антитела и продуцировать анти-Id-антитела. Анти-Id-антитело может быть использовано также и в качестве "иммуногена" для получения иммунного ответа еще у какого-нибудь другого животного, продуцирующего анти-анти-Id-антитело.
Кроме того, специалисту в данной области должно быть очевидно, что представляющий интерес белок может быть экспрессирован с помощью библиотеки клеток-хозяев, генетически измененных с тем, чтобы они экспрессировали различные ферменты гликозилирования, такие, чтобы клетка-хозяин, входящая в состав библиотеки, продуцировала представляющий интерес белок с различными вариантами гликозилирования. Затем практикующий клиницист сможет отобрать и выделить представляющий интерес белок с особенным, новым характером гликозилирования. Предпочтительно, чтобы белок, имеющий специально отобранный, новый характер гликозилирования, проявлял улучшенные или измененные биологические свойства.
D. Применение антител против простагландина E 2
Если принять во внимание способность связываться с PGE2, анти-PGE2-антитела или их части согласно изобретению можно использовать для детектирования PGE2 (например, в биологическом образце, таком как сыворотка или плазма), используя обычно применяемый иммуноанализ, такой как твердофазные иммуноферментные анализы (ELISA), радиоиммуноанализ (RIA) или тканевый иммуногистохимический анализ. Изобретение связано со способом детектирования PGE2 в биологическом образце, включающим в себя приведение биологического образца в контакт с антителом или его фрагментом согласно изобретению и детектирование либо указанного антитела (или части антитела), связанного с PGE2, либо несвязанного антитела (или части антитела), с тем, чтобы таким образом определить PGE2 в биологическом образце. Для того, чтобы облегчить детектирование связанного или несвязанного антитела, данное антитело прямым или непрямым образом метят детектируемым веществом. Подходящие для этого детектируемые вещества включают в себя различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры подходящих для этого ферментов включают в себя пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих для этого комплексов простетических групп включают в себя стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают в себя умбеллиферон, флуоресцеин, флуоресцеинизотиоцианат, родамин, дихлоротриазиниламинфлуоресцеин, дансилхлорид или фикоэритрин; примером люминесцентного материала может быть люминол; и примеры подходящих радиоактивных материалов включают в себя 3H, 14С, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho или 153Sm.
Альтернативно мечению антитела, PGE2 может быть исследован в биологических жидкостях путем конкурентного иммуноанализа с использованием стандартов PGE2, меченных детектируемым веществом и немеченным анти-PGE2-антителом. В таком анализе биологический образец, меченые стандарты PGE2 и анти-PGE2-антитело объединяют, и определяют количество меченого стандарта PGE2, связанного с немеченным антителом. Количество PGE2 в биологическом образце обратно пропорционально количеству меченого стандарта PGE2, связанного с анти-PGE2-антителом. Сходным образом, PGE2 можно изучать также и в биологических жидкостях путем конкурентного иммуноанализа с использованием стандартов PGE2, меченных детектируемым веществом и немеченным анти-PGE2-антителом.
Антитела и части антител согласно изобретению предпочтительно способны к нейтрализации активности PGE2 как in vitro, так и in vivo. Соответственно, такие антитела и части антител могут быть использованы для ингибирования активности PGE2, например, в клеточной культуре, содержащей PGE2, у человека или у другого млекопитающего, имеющего PGE2, с которым антитело согласно изобретению перекрестно реагирует. В одном из воплощений настоящее изобретение связано со способом ингибирования активности PGE2, включающим в себя приведение PGE2 в контакт с антителом или фрагментом антитела согласно изобретению, с тем, чтобы таким образом добиться ингибирования активности PGE2 в биологическом образце. Например, в клеточную культуру, содержащую или прдположительно содержащую PGE2, можно добавить антитело и часть антитела согласно изобретению к культуральной среде для ингибирования активности PGE2 в такой культуре.
В другом воплощении настоящее изобретение связано со способом уменьшения активности PGE2 у субъекта, предпочтительно, у субъекта, страдающего от заболевания или расстройства, при котором активность PGE2 является нежелательной. Данное изобретение связано со способом снижения активности PGE2 у субъекта, страдающего от такого заболевания или расстройства, при этом указанный способ включает в себя введение субъекту антитела и части антитела согласно изобретению, так, чтобы у указанного субъекта снизилась активность PGE2. Предпочтительно, чтобы указанным субъектом был человек. Альтернативно, таким субъектом может быть млекопитающее, экспрессирующее PGE2, с которым способно было бы связываться антитело согласно изобретению. Кроме того, таким субъектом может быть млекопитающее, которому введен PGE2 (например, путем введения PGE2 или путем экспрессии трансгена PGE2-синтетазы). Антитело согласно изобретению может быть введено человеку в терапевтических целях. Кроме того, антитело согласно изобретению может быть введено млекопитающему, не являющемуся человеком, экспрессирующему PGE2, с которым способно связываться указанное антитело, в ветеринарных целях или же в качестве животной модели человеческого заболевания. Что касается последнего, то такие животные модели могут быть использованы для оценки терапевтической эффективности антитела согласно изобретению (например, при тестировании дозировок и режимов введения).
Используемый здесь термин "расстройство, при котором активность PGE2 является нежелательной" включает в себя заболевания и другие расстройства, при которых показано или предполагается, что наличие PGE2 у субъекта, страдающего от такого расстройства, ответственно за патофизиологию указанного расстройства или же является фактором, который способствует ухудшению состояния при данном расстройстве. Соответственно, расстройство, при котором активность PGE2 является нежелательной, является расстройством, при котором можно ожидать, что снижение активности PGE2 приведет к облегчению симптомов и/или затормозит прогрессирование расстройства. Такие расстройства могут быть подтверждены, например, повышенным содержанием PGE2 в биологической жидкости субъекта, страдающего от такого расстройства (например, повышенной концентрацией PGE2 у субъекта в сыворотке, плазме, синовиальной жидкости и т.д.), что можно детектировать, например, с помощью анти-PGE2-антитела, как описано выше. Неограничивающие примеры расстройств, которые можно лечить с помощью антител согласно изобретению, включают в себя расстройства, которые обсуждаются ниже в разделе, относящемся к фармацевтическим композициям, содержащим антитела согласно изобретению.
Считается, что участие PGE2 связано с его кардинальной ролью в инициации патофизиологических ответов, ассоциированных с ревматоидным артритом. Однако другие медиаторы различных иммунологических путей метаболизма также участвуют в развитии артрита, и блокирование таких медиаторов, вдобавок к PGE2, может дать дополнительный терапевтический эффект. Таким образом, связывающие белки согласно изобретению могут быть включены в белки DVD-Ig(TM), где DVD-Ig(TM) способны связывать пары-мишени, включая, без ограничения, PGE2 и провоспалительный цитокин, такой как фактор некроза опухоли α (TNF-α). Блокирование обоих указанных медиаторов, PGE2 и TNF-α, может оказывать благотворные эффекты, при которых эффект DMARD от TNF-α сочетается с облегчением боли за счет блокирования PGE2. В предпочтительном воплощении DVD-Ig(TM) согласно изобретению связывается с PGE2- и TNF-α-мишенями и используется для лечения ревматоидного артрита.
Один из аспектов настоящего изобретения связан со связывающим белком DVD-Ig(TM), содержащим связывающие белки, способные связываться с PGE2. Предпочтительно, чтобы связывающий белок DVD-Ig(TM) был способен связываться с PGE2 и второй мишенью. Указанная вторая мишень выбрана из группы, состоящей из TNF, EGF, EGFR, IGF1, IGF2, IGF1/2, IGFR Erb2, Erb3, VEGF, VEGFR, Muc-1, CSF1 (MCSF), CSF2 (GM-CSF), CSF3 (GCSF), FGF2, IFNγ1, IFNγ1, IFNγ, гистамина и гистаминовых рецепторов, IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12α, IL-12β, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, KITLG, PDGFB, IL-2Rα, IL-4R, IL-5Rα, IL-8Rα, IL-8Rβ, IL-12Rβ,, IL-12Rβ, 1, IL-12Rβ, IL-12Rβ 2, IL-18R1, TSLP, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, CCL17, CCL18, CCL19, CCL20, CCL22, CCL24, CX3CL1, CXCL1, CXCL2, CXCL3, XCL1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CX3CR1, GPR2, XCR1, FOS, GATA3, JAK1, JAK3, STAT6, TBX21, TGFB1, TNFSF6, YY1, CYSLTR1, FCER1A, FCER2, LTB4R, TB4R2, LTBR и хитиназы. Более предпочтительно, чтобы DVD-связывающий белок был способен распознавать PGE2 и TNF-α, PGE2 и IL-6, PGE2 и IL-1β, PGE2 и IL-6R, PGE2 и CTLA-4, PGE2 и EGF; PGE2 и IGF-1/2, PGE2 и Erb2, PGE2 и Erb3, PGE2 и VEGF. Более предпочтительно, чтобы DVD-связывающий белок был способен связываться с PGE2 и TNF-α. Предпочтительные DVD-Ig для лечения аутоиммунных заболеваний включают в себя, не ограничиваясь перечисленным, DVD-Ig, содержащие анти-PGE2-антитело и мишени, выбранные из группы, состоящей из TNFα, IL-1α, IL-1β, IL-6 или IL-6R, CTLA-4Ig, BAFF, TACI, RANKL, или DKK1 или SOCT, MMP 13, или MMPl или MMP4. Пары-мишени, предпочтительные для терапии злокачественных опухолей, включают в себя PGE2+ EGF или EGFR, PGE2 + IGF1 или IGFlR, PGE2 + IGF2 или IGF2R, PGE2 + IGF1/2, PGE2 + VEGF или VEGFR, PGE2 + Erb2, PGE2 + Erb3 и PGE2 + S1P.
Считается, что участие PGE2 связано с его кардинальной ролью в инициации патофизиологических ответов, ассоциированных с ревматоидным артритом или злокачественными опухолями. Однако другие медиаторы различных иммунологических путей метаболизма также участвуют в развитии артрита или рака, и блокирование таких медиаторов, вдобавок к PGE2, может дать дополнительный терапевтический эффект. Список лекарственных средств, которые обычно используются для лечения различных заболеваний и расстройств человека, доступен в Интернете на сайте at www.drugs.com. Этот список часто обновляется, отражая состояние в данной области на данный момент относительно лечения различных заболеваний человека. Антагонисты PGE2 можно комбинировать с любой из терапий из этого списка для лечения конкретных болезненных состояний. Ниже приведено несколько примеров. Антагонисты PGE2 можно комбинировать с одним или несколькими средствами для лечения ревматоидного артрита и ювенильного ревматоидного артрита. Примеры таких средств включают в себя, но не ограничиваются средствами, перечисленными ниже, например, средства, которые уменьшают боль и воспаление, уменьшая при этом рост аномальной синовиальной ткани (ткань, которая выстилает сустав изнутри). Такие лекарственных средства включают в себя метотрексат и низкие дозы кортикостероидов (таких как преднизон или кортизон). У некоторых людей указанные лекарственные средства уменьшают также деструкцию суставов. Другие лекарственные препараты, используемые для лечения ревматоидного артрита, включают в себя следующие: противомалярийные препараты (такие как гидроксихлорохин), препараты золота, сульфазалазин, пеницилламин, циклофосфамид, циклоспорин и миноциклин. Кроме того, можно прописывать более чем одно лекарственное средство. В настоящее время доступны более новые биологические средства, которые блокируют эффекты специфических воспалительных факторов (цитокинов). Инфликсимаб, этанерцепт и адалимумаб блокируют цитокин TNFα, абатацепт блокирует T-клеточную костимуляцию, ритуксимаб истощает B-клетки, анакинкра блокирует цитокин интерлейкин-1, а другие новые биологические средства нацелены на IL-6, IL-6R, IL- 17, IL-18, IL-23, B7.1/B7.2. Антагонисты PGE2 можно комбинировать с одним или несколькими средствами для лечения анкилозирующего спондилита. Примеры таких средств включают в себя, не ограничиваясь перечисленным, кортикостероиды, цитотоксические лекарственные средства, а также большинство современных средств-антагонистов TNFα. Антагонисты PGE2 можно комбинировать с одним или несколькими средствами для лечения множественного склероза. Примеры таких средств включают в себя, не ограничиваясь перечисленным, авонекс, азасан, азатиоприн, бетасерон, Bubbli-Pred, копаксон, котолон, глатирамер, имуран, интерферон бета-1a, раствор интерферона бета-1b, Key-Pred, Key-Pred SP, митоксантрон, натализумаб, новантрон, орапред, орапред ODT, педиапред, Pred-Ject-50, предакорт 50, предалон 50, предат-50, преднизолон, прелон, ребиф и тизабри. Антагонисты PGE2 можно комбинировать с одним или несколькими средствами или лечебными процедурами, перечисленными по адресу в Интернете www.drugs.com, для лечения боли. Антагонисты PGE2 можно комбинировать с одним или несколькими средствами или лечебными процедурами, перечисленными по адресу в Интернете www.drugs.com, для лечения болезни Крона. Антагонисты PGE2 можно комбинировать с одним или несколькими средствами или лечебными процедурами, перечисленными по адресу в Интернете www.drugs.com, для лечения различных форм злокачественных опухолей и злокачественных заболеваний.
E. Фармацевтическая композиция
Настоящее изобретение связано также с фармацевтическими композициями, содержащими антитело или его антиген-связывающую часть согласно изобретению и фармацевтически приемлемый носитель. Фармацевтические композиции, содержащие антитела согласно изобретению, предназначены, не ограничиваясь перечисленным, для диагностики, детектирования или мониторинга расстройства, в предотвращении, лечении, контролировании или улучшении состояния при расстройстве или улучшении одного или нескольких его симптомов, и/или для проведения научных исследований. В специфическом воплощении фармацевтическая композиция содержит одно или несколько антител согласно изобретению. В другом воплощении фармацевтическая композиция содержит одно или несколько антител согласно изобретению, а также одно или несколько профилактических или терапевтических средств, отличных от антител согласно изобретению, для лечения расстройств, при которых активность PGE2 является неблагоприятной. Предпочтительно, чтобы профилактические или терапевтические средства, известные тем, что они могут быть полезны или в настоящее время используются для предотвращения, лечения, контролирования или улучшения состояния при расстройстве или улучшения одного или нескольких его симптомов. В соответствии с указанными воплощениями, композиция может дополнительно содержать носитель, разбавитель или наполнитель.
Антитела и части антител согласно изобретению могут быть включены в состав фармацевтических композиций, подходящих для введения субъекту. Обычно фармацевтическая композиция включает в себя антитело или часть антитела согласно изобретению и фармацевтически приемлемый носитель. Используемый здесь термин "фармацевтически приемлемый носитель" включает в себя любой или все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и пролонгирующие абсорбцию и прочие средства, которые являются физиологически приемлемыми. Примеры фармацевтически приемлемых носителей включают в себя один или несколько из перечисленных далее: воду, физиологический раствор, забуференный фосфатом физиологический раствор, декстрозу, глицерин, этанол и т.п., а также их сочетания. Во многих случаях предпочтительно, чтобы в композицию были включены изотонические средства, например, сахара, полиспирты, такие как маннит, сорбит или хлорид натрия. Фармацевтически приемлемые носители могут дополнительно включать в себя минорные количества вспомогательных средств, таких как увлажняющие или эмульгирующие средства, консерванты или буферы, которые увеличивают срок годности или эффективность антитела или части антитела.
Известны различные системы доставки, которые могут быть использованы для введения одного или нескольких антител согласно изобретению или комбинации одного или нескольких антител согласно изобретению и профилактического средства или терапевтического средства, применимого для предотвращения, контролирования, лечения или улучшения состояния при расстройстве или улучшения одного или нескольких его симптомов, например, инкапсулирование в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать антитело или фрагмент антитела, рецептор-опосредованный эндоцитоз (см., например, Wu and Wu, J. Biol. Chem. 262: 4429-4432 (1987)), конструкция нуклеиновой кислоты как часть ретровирусного или другого вектора, и пр. Способы введения профилактического или терапевтического средства включают в себя, не ограничиваясь перечисленным, парентеральное введение (например, внутрикожное, внутримышечное, внутрибрюшинное, внутривенное подкожное), эпидуральное введение, внутриопухолевое введение и введение через слизистую оболочку (например, интраназальным и пероральным путями). Кроме того, можно воспользоваться легочным введением, например, с помощью ингалятора или небулайзера, а также использовать композицию со средством, переводящим композицию в аэрозольное состояние. См., например, патенты США No. 6019968; 5985320; 5985309; 5934272; 5874064; 5855913; 5290540; и 4880078; а также публикации PCT No. WO 92/19244; WO 97/32572; WO 97/44013; WO 98/31346; и WO 99/66903. В одном из воплощений антитело согласно изобретению, комбинированная терапия или композиция согласно изобретению вводятся с использованием технологии доставки легочных лекарственных средств Alkermes AIR(R) (Alkermes, Inc., Cambridge, Mass.). В специфическом воплощении профилактические или терапевтические средства согласно изобретению вводят внутримышечно, внутривенно, внутриопухолевым путем, перорально, интраназально, пульмонально или подкожно. Профилактические или терапевтические средства могут быть введены любым из удобных путей, например, путем инфузии или болюсной инъекции, посредством абсорбции через эпителиальные или кожно-слизистые оболочки (например, слизистую рта, слизистую прямой кишки и слизистую кишечника, и т.п.) и могут быть введены вместе с другими биологически активными средствами. Введение может быть системным или локальным.
В специфическом воплощении может потребоваться локальное введение профилактического или терапевтического средства согласно изобретению в область, нуждающуюся в лечении. Это может быть достигнуто, например, путем локальной инфузии, путем инъекции или с помощью имплантата, такого как имплантат, созданный из пористого или непористого материала, включая мембраны и матриксы, такие как силиконовые мембраны, полимеры, волокнистые матриксы (например, Tissuel(R)) или коллагеновые матриксы. В одном из воплощений эффективное количество одного или нескольких антител согласно изобретению вводят субъекту локально в пораженный участок для профилактики, лечения, контролирования и/или улучшения состояния при расстройстве или облегчения его симптомов. В другом аспекте эффективное количество одного или нескольких антител согласно изобретению вводят субъекту в пораженный участок локально в сочетании с эффективным количеством одного или нескольких терапевтических средств (например, одного или нескольких профилактических или терапевтических средств), отличных от антитела согласно изобретению, для предотвращения, лечения, контролирования и/или улучшения состояния при расстройстве или облегчения одного или нескольких его симптомов.
В другом воплощении профилактическиое или терапевтическое средство согласно изобретению может быть доставлено в составе системы с контролируемым или непрерывным высвобождением. В одном из воплощений для достижения контролируемого или непрерывного высвобождения может быть использован насос (см. Langer, выше; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14: 20; Buchwald et al., 1980, Surgery 88: 507; Saudek et al., 1989, N. Engl. J. Med. 321: 574). В другом воплощении для достижения контролируемого или непрерывного высвобождения терапевтических средств согласно изобретению могут быть использованы полимерные материалы (см., например, Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, FIa. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J. Macromol. Sci. Rev. Macromol. Chem. 23: 61; см. также Levy et al., 1985, Science 228: 190; During et al., 1989, Ann. Neurol. 25: 351; Howard et al., 1989, J. Neurosurg. 71: 105); патент США No. 5679377; патент США No. 5916597; патент США No. 5912015; патент США No. 5989463; патент США No. 5128326; публикацию PCT No. WO 99/15154; а также публикацию PCT No. WO 99/20253. Примеры полимеров, используемых в композициях непрерывного высвобождения, включают в себя, но не ограничиваются перечисленным, поли(2-гидроксиэтилметакрилат), поли(метилметакрилат), поли(акриловую кислоту), сополимеры этилена и винилацетата, поли(метакриловую кислоту), полигликолиды (PLG), полиангидриды, поли(N-винилпирролидон), поли(виниловый спирт), полиакриламид, поли(этиленгликоль), полилактиды (PLA), поли(сополимер молочной кислоты и гликолидов) (PLGA) и сложные полиортоэфиры. В предпочтительном воплощении полимер, используемый в композициях непрерывного высвобождения, является инертным, свободным от вымываемых примесей, стабильным при хранении, стерильным и биодеградируемым. Еще в одном воплощении систему с контролируемым или непрерывным высвобождением можно поместить в непосредственной близости от профилактической или терапевтической мишени, таким образом, в этом случае требуется только часть системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, выше, vol. 2, pp. 115-138 (1984)).
Системы с контролируемым высвобождением обсуждаются в обзорах Langer (1990, Science 249: 1527-1533). Любая технология, известная специалистам в данной области, может быть использована для получения композиций с непрерывным высвобождением одного или нескольких терапевтических средств согласно изобретению. См., например, патент США No. 4526938, PCT WO 91/05548, публикацию PCT WO 96/20698, Ning et al., 1996, "Intratumoral Radioimmunotheraphy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel," Radiotherapy &Oncology 39: 179-189, Song et al., 1995, "Antibody Mediated Lung Targeting of Long-Circulating Emulsions," PDA Journal of Pharmaceutical Science & Technology 50: 372-397, Cleek et al., 1997, "Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application," Pro. Int'l. Symp. Control. Rel. Bioact. Mater. 24: 853-854, а также Lam et al., 1997, "Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery," Proc. Int'l. Symp. Control Rel. Bioact. Mater. 24: 759-760.
В специфическом воплощении, когда композиция согласно изобретению является нуклеиновой кислотой, кодирующей профилактическое или терапевтическое средство, нуклеиновая кислота может быть введена in vivo для стимуляции экспрессии кодируемого ею профилактического или терапевтического средства путем конструирования ее в виде части соответствующего экспрессирующего вектора нуклеиновой кислоты и введения ее таким образом, чтобы она стала внутриклеточной, например, с использованием ретровирусного вектора (см. патент США No. 4980286), или путем прямой инъекции, или путем бомбардировки микрочастицами (например, генной пушкой; Biolistic, Dupont), или покрытием липидами, или рецепторами клеточной поверхности, или трансфицирующими средствами, или путем введения ее в сочетании с гомеобоксоподобным пептидом, который, как известно, проникает в ядро (см., например, Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88: 1864-1868). Альтернативно, нуклеиновая кислота может быть введена внутриклеточно и встроена в ДНК клетки-хозяина для экспрессии путем гомологической рекомбинации.
Фармацевтическая композиция согласно изобретению составлена в соответствии с предполагаемым путем введения. Примеры путей введения включают в себя, не ограничиваясь перечисленным, парентеральный, например, внутривенный, внутрикожный, подкожный, пероральный, интраназальный (например, путем ингаляции), чрескожный (например, местный), чресслизистый и ректальный пути введения. В специфическом воплощении композицию составляют, используя рутинные методы, в виде фармацевтической композиции, адаптированной для внутривенного, подкожного, внутримышечного, перорального, интраназального или местного введения человеку. Обычно композиции для местного введения представляют собой растворы в изотоническом стерильном водном буфере. Когда это необходимо, композиция может включать в себя также солюбилизирующее средство и локальный анестетик, такой как лигнокаин, для облегчения боли на месте инъекции.
Если композиции согласно изобретению предназначены для местного введения, такие композиции могут быть составлены в виде мази, крема, трансдермального пластыря, лосьона, геля, шампуня, спрея, аэрозоля, раствора, эмульсии или другой формы, известной специалистам в данной области. См., например, Remington's Pharmaceutical Sciences and Introduction to Pharmaceutical Dosage Forms, 19th ed., Mack Pub. Co., Easton, Pa. (1995). Для нераспыляемых местных дозируемых форм обычно используют от вязких до полутвердых или твердых форм, содержащих носитель или один или несколько эксципиентов, совместимых с местным нанесением и имеющих динамическую вязкость, предпочтительно, более высокую, чем вода. Подходящие для этого составы включают в себя, не ограничиваясь перечисленным, растворы, суспензии, эмульсии, кремы, мази, порошки, линименты, бальзамы и пр., которые, в случае необходимости, являются стерилизованными или смешанными с добавочными средствами (например, консервантами, стабилизаторами, увлажняющими средствами, буферами или солями) для приобретения ими различных свойств, таких, например, как осмотическое давление. Другие подходящие для этого местные дозированные формы включают в себя распыляемые аэрозольные препараты, в которых активный ингредиент, предпочтительно, в сочетании с твердым или жидким инертным носителем, упакован в смеси со спрессованным летучим веществом (например, газообразным пропеллентом, таким как фреон) в пластиковую бутылку. В случае необходимости к фармацевтическим композициям и дозированным формам могут быть добавлены также увлажнители или смачивающие вещества. Примеры таких дополнительных ингредиентов хорошо известны в данной области.
Если способ согласно изобретению включает в себя интраназальное введение композиции, указанная композиция может быть составлена в аэрозольной форме, в виде спрея, распылителя или в виде капель. В частности, профилактические или терапевтические средства для применения согласно изобретению может быть обычным образом доставлены в виде аэрозольного спрея, подаваемого из спрессованных упаковок или небулайзера с использованием соответствующего пропеллента (например, дихлордифторметана, трихлорфторметана дихлоротетрафторэтана, диоксида углерода или другого подходящего для этого газа). В случае спрессованного аэрозоля дозированное одноразовое количество может определяться клапаном для доставки отмеренного количества. Капсулы и картриджи (составленные, например, из желатина) для применения в ингаляторе или инсуффляторе могут быть составлены таким образом, чтобы они содержали порошковую смесь соединения и соответствующую порошковую основу, такую как лактоза или крахмал.
Если способ согласно изобретению включает в себя пероральное введение, композиции могут быть составлены в виде таблеток, капсул, облаток, желатиновых капсул, растворов, суспензий и пр. Таблетки и капсулы могут быть получены обычным путем с применением фармацевтически приемлемых эксципиентов, таких как связующие средства (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон, или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазочные вещества (например, стеарат магния, тальк или диоксид кремния); разрыхлители (например, картофельный крахмал или натрия гликолят крахмала); или смачивающие средства (например, лаурилсульфат натрия). Таблетки могут быть покрыты способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут принимать форму растворов, сиропов или суспензий, не ограничиваясь перечисленным, или же они могут быть представлены в виде сухого продукта для его составления с водой или другими подходящими наполнителями перед применением. Такие жидкие препараты могут быть получены обычным путем с применением фармацевтически приемлемых добавок, таких как суспендирующие средства (например, сироп сорбита, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгирующие средства (например, лецитин или акация); неводные наполнители (например, миндальное масло, сложные эфиры жирных кислот, этиловый спирт или фракционированные растительные масла); а также консерванты (например, метил или пропил-пара-гидроксибензоаты или сорбиновая кислота). Такие препараты, если требуется, могут также содержать буферные соли, ароматизирующие средства, красители и подсластители. Препараты для перорального введения могут быть составлены соответствующим образом для медленного высвобождения, контролируемого высвобождения или непрерывного высвобождения профилактического или терапевтического средства (средств).
Способ согласно изобретению может включать в себя пульмональное введение композиции, составленной с использованием средства, переводящего в аэрозольное состояние, например, с помощью ингалятора или небулайзера. См., например, патенты США No. 6019968; 5985320; 5985309; 5934272; 5874064; 5855913; 5290540; и 4880078; а также публикации PCT No. WO 92/19244; WO 97/32572; WO 97/44013; WO 98/31346; и WO 99/66903. В специфическом воплощении антитело согласно изобретению, комбинированную терапию и/или композицию согласно изобретению вводят с использованием технологии доставки легочных лекарственных средств Alkermes AIR(R) (Alkermes, Inc., Cambridge, Mass.).
Способ согласно изобретению может включать в себя введение композиции, составленной для парентерального введения путем инъекции (например, болюсной инъекции или непрерывной инъекции). Составы для инъекций могут быть представлены в единичной дозированной форме (например, в ампулах или в контейнерах с многократными дозами) с добавлением консерванта. Такие композиции могут принимать такие формы как суспензии, растворы или эмульсии в составе масляного или водного наполнителей и могут содержать составляющие композицию средства, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Альтернативно, активный ингредиент может быть представлен в виде порошка, который перед употреблением восстанавливают соответствующим наполнителем (например, стерильной апирогенной водой).
Способы согласно изобретению могут включать в себя композиции, составленные в виде препаратов пролонгированного действия. Такие составы длительного действия могут быть введены путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Таким образом, такие композиции могут быть составлены, например, с использованием соответствующих полимерных или гидрофобных материалов (например, в виде эмульсии в приемлемом масле) или ионообменных смол, или же медленно растворимых производных (например, таких как медленно растворимая соль).
Способы согласно изобретению охватывают случаи введения композиций, составленных в виде нейтральных или солевых форм. Фармацевтически приемлемые соли включают в себя соли, образованные такими анионами, которые получены из соляной, фосфорной, уксусной, щавелевой, виннокаменной и пр. кислот, а также соли, образованные такими катионами, которые получены из натрия, калия, аммония, кальция, гидроокисей железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.п.
Обычно ингредиенты композиций поставляются либо отдельно, либо в смеси друг с другом в дозированной лекарственной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметически запечатанном контейнере, таком как ампула или саше, с указанным на них количеством активного ингредиента. Когда способом введения является инфузия, композицию можно растворить в инфузионном флаконе, содержащем стерильную фармацевтически чистую воду или физиологический раствор. Когда способом введения является инъекция, можно использовать ампулу со стерильной водой для инъекций или физиологическим раствором таким образом, чтобы смешивать ингредиенты в содержимом ампулы перед введением.
В частности, настоящим изобретением предусмотрено также и то, что одно или несколько профилактических или терапевтических средств или фармацевтических композиций согласно изобретению упаковано в герметически запечатанном контейнере, таком как ампула или саше, с указанным на них количеством средства. В одном из воплощений одно или несколько профилактических или терапевтических средств или фармацевтических композиций согласно изобретению поставляется в виде сухого стерильного лиофилизированного порошка или безводного концентрата в герметически запечатанном контейнере и может быть восстановлено (например, водой или физиологическим раствором) до соответствующей композиции для введения субъекту. Предпочтительно, чтобы одно или несколько профилактических или терапевтических средств или фармацевтических композиций согласно изобретению поставлялось в виде сухого стерильного лиофилизированного порошка в герметически запечатанном контейнере в единичной лекарственной форме в дозе, по меньшей мере, в 5 мг, более предпочтительно, по меньшей мере, в 10 мг, по меньшей мере, в 15 мг, по меньшей мере, в 25 мг, по меньшей мере, в 35 мг, по меньшей мере, в 45 мг, по меньшей мере, в 50 мг, по меньшей мере, в 75 мг или, по меньшей мере, в 100 мг. Лиофилизированные профилактические или терапевтические средства или фармацевтические композиции согласно изобретению должны храниться при температуре от 2°C до 8°C в своем исходном контейнере, и, кроме того, указанные профилактические или терапевтические средства или фармацевтические композиции согласно изобретению должны быть введены в течение 1 недели, предпочтительно, в течение 5 дней, в течение 72 часов, в течение 48 часов, в течение 24 часов, в течение 12 часов, в течение 6 часов, в течение 5 часов, в течение 3 часов или в течение 1 часа после их восстановления. В альтернативном воплощении одно или несколько профилактических или терапевтических средств или фармацевтических композиций согласно изобретению должно поставляться в жидкой форме в герметически запечатанном контейнере, с указанием на нем количества и концентрации указанного средства. Предпочтительно, чтобы жидкая форма вводимой композиции поставлялась в герметически запечатанном контейнере с содержанием, по меньшей мере, 0,25 мг/мл, более предпочтительно, по меньшей мере, 0,5 мг/мл, по меньшей мере, 1 мг/мл, по меньшей мере, 2,5 мг/мл, по меньшей мере, 5 мг/мл, по меньшей мере, 8 мг/мл, по меньшей мере, 10 мг/мл, по меньшей мере, 15 мг/мл, по меньшей мере, 25 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл или, по меньшей мере, 100 мг/мл. Указанная жидкая форма должна храниться при температуре от 2°C до 8°C в своем исходном контейнере.
Антитела и части антител согласно изобретению могут быть встроены в фармацевтическую композицию, подходящую для парентерального введения. Предпочтительно, чтобы антитело или части антитела были изготовлены в виде инъецируемого раствора, содержащего 0,1-250 мг/мл антитела. Инъецируемый раствор может быть составлен либо из жидкой, либо из лиофилизированной дозированной формы в глянцевой оберточной бумаге или в пузырьке, ампуле янтарного цвета или в предварительно заполненном шприце. Буфер может быть L-гистидиновым (1-50 мМ), оптимально, 5-10 мМ, с pH от 5,0 до 7,0 (оптимально, pH 6,0). Другие подходящие буферы включают в себя, не ограничиваясь перечисленным, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Хлорид калия может быть использован для модификации токсичности раствора при концентрации 0-300 мМ (для жидкой дозированной формы оптимально 150 мМ). В случае лиофилизированной дозированной формы могут быть включены криоконсерванты, преимущественно, 0-10% сахарозы (оптимально, 0,5-1,0%). Другие подходящие для такого случая криоконсерванты включают в себя трегалозу и лактозу. В лиофилизированную дозированную форму могут быть включены наполнители, преимущественно, 1-10% маннита (оптимально, 2-4%). Как в жидкой, так и в лиофилизированной дозированной форме могут быть использованы стабилизаторы, преимущественно, 1-50 мМ L-метионина (оптимально, 5-10 мМ). Другие подходящие для такого случая наполнители включают в себя глицин, аргинин, может быть включено 0-0,05% полисорбата-80 (оптимально, 0,005-0,01%). Дополнительные поверхностно-активные вещества включают в себя, не ограничиваясь перечисленным, полисорбат-20 и сурфактанты BRIJ. Фармацевтическая композиция, содержащая антитела и части антител согласно изобретению, изготовленная в виде раствора для инъекций для парентерального введения, может дополнительно включать в себя средство, используемое в качестве адъюванта, такое как средства, используемые для повышения абсорбции или дисперсии терапевтического белка (например, антитела). Фармацевтически приемлемым адъювантом является гиалуронидаза, такая как Hylenex(R) (рекомбинантная человеческая гиалуронидаза). Добавление гиалуронидазы к раствору для инъекций улучшает биодоступность в организме человека после парентерального введения, в частности, подкожного введения. Оно помогает также увеличить объем местной инъекции (например, более чем до 1 мл), вызывая меньше боли и дискомфорта и минимизируя количество случаев проявления реакции на месте инъекции (см. WO2004078140 и US2006104968).
Композиции согласно изобретению могут быть представлены в различных формах. Они включают в себя, например, жидкие, полу-жидкие и твердые дозированные формы, такие как жидкие растворы (например, инъецируемые и инфузируемые растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительность формы зависит от предполагаемого характера введения и применяемой терапии. Обычно предпочтительными композициями являются композиции в виде инъецируемых или инфузируемых растворов, таких как композиции, сходные с теми, которые используются для пассивной иммунизации человека другими антителами. Предпочтительным способом введения является парентеральный (например, внутривенный, подкожный, внктрибрюшинный, внутримышечный). В предпочтительном воплощении антитело вводят путем внутривенной инфузии или инъекции. В другом предпочтительным воплощении антитело вводят путем внутримышечной или подкожной инъекции.
Обычно терапевтические композиции должны быть стерильными и стабильными в условиях производства и хранения. Композиция может быть составлена в виде раствора, микроэмульсии, дисперсии, липосомы или других предписанных форм, подходящих для высоких концентраций лекарственного средства. Стерильные растворы для инъекций могут быть получены путем включения активного соединения (например, антитела или части антитела) в требуемом количестве в соответствующий растворитель с одним или несколькими, в зависимости от потребностей, перечисленными выше ингредиентами, с последующей стерилизацией путем фильтрования. Обычно дисперсии изготавливают путем включения активного соединения в стерильный наполнитель, который содержит основную дисперсионную среду и другие требуемые ингредиенты из перечисленных выше. В случае стерильных лиофилизированных порошков для получения стерильных растворов для инъекций предпочтительными способами изготовления являются вакуумная сушка и лиофильная сушка, которые дают в результате порошок активного ингредиента плюс любой дополнительный требуемый ингредиент из перечисленных выше стерилизованных путем фильтрования растворов. Свойственная раствору текучесть может быть сохранена, например, с помощью покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и с использованием поверхностно-активных веществ. Пролонгированного поглощения инъецируемых композиций можно добиться путем включения в такую композицию средства, которое задерживает абсорбцию, например, соли моностеарата и желатин.
Антитела и части антител согласно изобретению могут быть введены разными известными в данной области способами, хотя для многих терапевтических применений предпочтительным путем/способом введения является подкожная инъекция, внутривенная инъекция или инфузия. Для специалистов в данной области будет очевидно, что путь и/или способ введения будет варьировать, в зависимости от требуемых результатов. В определенных воплощениях активное соединение может быть изготовлено в составе с носителем, который будет препятствовать быстрому высвобождению указанного соединения, таких, например, как композиции с контролируемым высвобождением, включая имплантаты, чрескожные пластыри и микроинкапсулированные системы доставки. Могут быть использованы биодеградируемые биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Многие способы получения таких композиций запатентованы или в общем известны специалистам в данной области. См., например, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
В определенных воплощениях антитело или часть антитела согласно изобретению могут быть введены перорально, например, с инертным разбавителем или ассимилируемым пищевым носителем. Указанное соединение (а также, если это необходимо, и другие ингредиенты) может быть также заключено в твердую или мягкую оболочку желатиновой капсулы, спрессованной в таблетки, или же непосредственно включено в диету субъекта. Для перорального терапевтического введения указанные соединения могут быть включены в состав с эксципиентами и применимы в виде таблеток для проглатывания, защечных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, вафель и т.п. Для введения соединения согласно изобретению иным путем, отличным от парентерального, необходимо покрыть соединение материалом, препятствующим его инактивации, или же ввести такой материал совместно с указанным соединением.
Вспомогательные активные соединения могут также быть включены в композиции. В определенных воплощениях антитело или часть антитела согласно изобретению совместно составляются и/или вводятся совместно с одним или несколькими добавочными терапевтическими средствами, которые используются для лечения расстройств, при которых активность PGE2 является неблагоприятной. Например, анти-PGE2-антитело или часть антитела согласно изобретению могут быть составлены и/или введены совместно с одним или несколькими добавочными антителами, которые связываются с другими мишенями (например, с антителами, которые связываются с другими цитокинами или которые связываются с другими молекулами клеточной поверхности). Кроме того, одно или несколько антител согласно изобретению могут быть использованы в сочетании с двумя или более из указанных выше терапевтических средств. При такой комбинированной терапии можно успешно использовать более низкие дозы вводимых терапевтических средств, таким образом обходя возможную токсичность или сложности, ассоциированные с различными видами монотерапии.
В определенных воплощениях антитело против PGE2 или его фрагмент связаны с известным в данной области носителем, увеличивающим время его полужизни. Такие носители включают в себя, не ограничиваясь перечисленным, Fc-домен, полиэтиленгликоль и декстран. Такие носители описаны, например, в патентной заявке США с серийным No. 09/428082 и в опубликованной заявке PCT No. WO 99/25044.
В специфическом воплощении последовательности нуклеиновой кислоты, содержащие нуклеотидные последовательности, кодирующие антитело согласно изобретению или же другое профилактическое или терапевтическое средство согласно изобретению, вводят для лечения, предотвращения, контролирования или улучшения состояния или одного или нескольких его симптомов с помощью генной терапии. Генная терапия относится к терапии, предпринимаемой путем введения субъекту экспрессируемой или поддающейся экспрессии нуклеиновые кислоты. В таком воплощении настоящего изобретения нуклеиновые кислоты продуцируют кодируемое ими антитело или профилактическое или терапевтическое средство согласно изобретению, которым опосредован профилактический или терапевтический эффект.
В данной области для генной терапии может быть использован любой из способов согласно изобретению. В целом для обзора способов генной терапии см. Goldspiel et al, 1993, Clinical Pharmacy 12: 488-505; Wu and Wu, 1991, Biotherapy 3: 87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol. 32: 573-596; Mulligan, Science 260: 926-932 (1993); а также Morgan and Anderson, 1993, Ann. Rev. Biochem. 62: 191-217; May, 1993, TIBTECH 11(5): 155-215. Способы, общеизвестные в области технологии рекомбинантых ДНК, могут быть использованы, как описано Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); and Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990). Подробные описания различных способов генной терапии описаны в документе US20050042664 A1.
В другом аспекте в настоящем изобретении описан способ лечения (например, излечения, супрессии, улучшения, задержки или предотвращения запуска или предупреждения рецидива) или профилактики PGE2-ассоциированного расстройства у субъекта. Указанный способ включает в себя введение субъекту PGE2-связывающего средства (в частности, антагониста), например, анти-PGE2-антитела или, как здесь описано, его фрагмента, в количестве, достаточном для лечения или профилактики PGE2-ассоциированного расстройства. Антагонист PGE2, например, анти-PGE2-антитело или его фрагмент, могут быть введены субъекту, как здесь описано, отдельно или в сочетании с другими терапевтическими способами воздействия.
Настоящее изобретение связано со способами лечения воспалительных расстройств и расстройств иммунитета у субъекта, где указанные расстройства характеризуются избыточным биосинтезом PGE2, при этом указанные способы включают в себя введение субъекту эффективного количества антитела, специфичного в отношении PGE2. Расстройства, которые можно лечить способами согласно изобретению, включают в себя аутоиммунные и воспалительные заболевания и опухоли, при которых важную роль играет избыточный синтез PGE2. Такие расстройства включают в себя: (a) ревматоидный артрит и аллергический артрит; (b) определенные расстройства, индуцированные вирусами, такие как синдром Гийена-Барре, инфекционный мононуклеоз, другие вирусные лимфаденопатии и инфекции, вызванные вирусом герпеса; (c) множественный склероз и другие демиелинизирующие заболевания; (d) гематологические заболевания, такие как гемолитическая анемия и тромбоцитопения; (e) эндокринные расстройства, такие как сахарный диабет, болезнь Аддисона, идиопатический гипопаратироидизм и хронический лимфоцитарный тиреоидит; (f) коллагеновые расстройства, такие как системная красная волчанка; и (g) репродуктивные расстройства, такие как аменорея, бесплодие, привычные выкидыши и эклампсия; и (h) опухоли, такие как опухоли головы и шеи, рак легкого, рак желудка, рак предстательной железы, рак поджелудочной железы и т.д.; и (i) воспалительные и/или аутоиммунные состояния кожи, органов желудочно-кишечного тракта (например, воспалительные заболевания кишечника (IBD), такие как язвенный колит и/или болезнь Крона); и (j) боль, ассоциированную с остеоартритом и другими расстройствами; и (k) глазные расстройства, такие как возрастная макулярная дистрофия (AMD). Соответственно, настоящее описание включает в себя применение PGE2-связывающего средства (такого как анти-PGE2-антитело или его описанный здесь фрагмент) для описанного здесь лечения и применение PGE2-связывающего средства (такого как анти-PGE2-антитело или его описанный здесь фрагмент) для изготовления лекарственного средства для описанного здесь лечения.
Примеры PGE2-ассоциированных расстройств включают в себя, но не ограничены перечисленным, расстройства, выбранные из группы, состоящей из артрита, ревматоидного артрита, остеоартрита, хронического ювенильного артрита, септического артрита, артрита Лайма, псориатического артрита, реактивного артрита, спондиллоартропатии, системной красной волчанки, болезни Крона, язвенного колита, воспалительного заболевания кишечника, инсулин-зависимого сахарного диабета, тиреоидита, астмы, аллергических заболеваний, псориаза, кожной склеродермии, атопического дерматита, заболевания трансплантат против хозяина, отторжения органного трансплантата, острого или хронического иммунного заболевания, ассоциированного с трансплантацией органа, саркоидоза, атеросклероза, диссеминированного внутрисосудистого свертывания, болезни Кавазаки, болезни Грава, нефротического синдрома, синдрома хронической усталости, гранулематоза Вегенера, пурпуры Геноха-Шонлейна, микроскопического васкулита почек, активного хронического гепатита, увеита, септического шока, синдрома токсического шока, септического синдрома, кахексии, инфекционных заболеваний, паразитарных заболеваний, синдрома приобретенного иммунодефицита, острого поперечного миелита, хореи Гентингтона, болезни Паркинсона, болезни Альцгеймера, инсульта, первичного билиарного цирроза печени, гемолитической анемии, злокачественных заболеваний, сердечной недостаточности, инфаркта миокарда, болезни Аддисона, спорадического полигландулярного дефицита типа I и полигландулярного дефицита типа II, синдрома Шмидта, (острого) респираторного дистресс-синдрома у взрослых, алопеции, гнездной алопеции, серонегативной артропатии, артропатии, болезни Рейтера, псориатической артропатии, артропатии при язвенном колите, энтеропатическом синовите, артропатии, ассоциированной с хламидией, иерсинией и сальмонеллой, спондилоартропатии, атероматозного заболевания/артериосклероза, атопической аллергии, аутоиммунного буллезного заболевания, обыкновенной пузырчатки, эксфолиативной пузырчатки, пемфигоида, IgA-зависимого линейного дерматоза, аутоиммунной гемолитической анемии, гемолитической анемии с положительным тестом Кумбса, приобретенной пернициозной анемии, ювенильной пернициозной анемии, миалгического энцефалита/синдрома хронической усталости, хронического кандидоза кожи и слизистых, гигантоклеточного артериита, первичного склерозирующего гепатита, криптогенного аутоиммунного гепатита, синдрома болезни приобретенного иммунодефицита, заболеваний, связанных с приобретенным иммунодефицитом, гепатита B, гепатита C, общего пестрого иммунодефицита (общей вариабельной гипогаммаглобулинемии), дилатационной кардиомиопатии, женского бесплодия, недостаточности яичника, преждевременного угасания функции яичников, легочного фиброза, криптогенного фиброзирующего альвеолита, поствоспалительной интерстициальной болезни легких, интерстициального пневмонита, интерстициальной болезни легких, ассоциированной с болезнью соединительной ткани, болезни легких, ассоциированной со смешанной болезнью соединительной ткани, интерстициальной болезни легких, ассоциированной с системным склерозом, интерстициальной болезни легких, ассоциированной с ревматоидным артритом, болезни легких, ассоциированной с системной красной волчанкой, болезни легких, ассоциированной с дерматомиозитом/полимиозитом, болезни легких, ассоциированной с болезнью Шегрена, болезни легких, ассоциированной с анкилозирующим спондилитом, связанного с васкулитом диффузного заболевания легких, болезни легких, ассоциированной с гемосидерозом, лекарственной интерстициальной болезни легких, фиброза, радиационного фиброза, облитерирующего бронхиолита, хронической эозинофильной пневмонии, лимфоцитарной инфильтрирующей болезни легких, постинфекционной интерстициальной болезни легких, подагрического артрита, аутоиммунного гепатита, аутоиммунного гепатита типа 1 (классический аутоиммунный или волчаночный гепатит), аутоиммунного гепатита типа 2 (анти-LKM-антительный гепатит), опосредованной аутоиммунным заболеванием гипогликемии, инсулинорезистентности типа B с акантокератодермией, гипопаратироидизма, острого иммунного заболевания, ассоциированного с трансплантацией органа, хронического иммунного заболевания, ассоциированного с трансплантацией органа, остеоартроза, первичного склерозирующего холангита, псориаза типа 1, псориаза типа 2, идиопатической лейкопении, аутоиммунной нейтропении, почечного заболевания NOS (БДУ), гломерулонефрита, микроскопического васкулита почек, болезни Лайма, дискоидной красной волчанки, мужского бесплодия, идиопатического или NOS (БДУ), аутоиммунности спермы, рассеянного склероза (всех подтипов), симпатической офтальмии, легочной гипертензии, вторичной относительно заболевания соединительной ткани, синдрома Гудпасчера, легочной манифестации нодозного полиартериита, острой ревматической лихорадки, ревматоидного спондилита, болезни Стилла, системного склероза, синдрома Шегрена, болезни Такаясу/артериита, аутоиммунной тромбоцитопении, идиопатической тромбоцитопении, аутоиммунного заболевания щитовидной железы, гипертиреоза, зобного аутоиммунного гипотиреоза (болезнь Хашимото), атрофического аутоиммунного гипотиреоза, первичной микседемы, факогенного увеита, первичного васкулита, витилиго, острого заболевания печени, хронического заболевания печени, алкогольного цирроза, индуцированного алкоголем повреждения печени, холестаза, идиосинкратической болезни печени, индуцированного лекарственным средством гепатита, неалкогольного стеатогепатита, аллергии и астмы, стрептококковой инфекции группы В (GBS), психических расстройств (например, депрессии и шизофрении), заболеваний, опосредованных Th2-типом и Th1-типом, острой и хронической боли (различные формы боли) и раковых заболеваний, таких как рак легкого, молочной железы, желудка, мочевого пузыря, ободочной кишки, поджелудочной железы, яичников, предстательной железы и прямой кишки, и гемопоэтических злокачественных заболеваний (лейкоз и лимфома), абеталипопротеинемии, акроцианоза, острых и хронических паразитарных или инфекционных процессов, острого лейкоза, острого лимфобластного лейкоза (ALL), острый миелоидный лейкоз (AML), острой или хронической бактериальной инфекции, острого панкреатита, острой почечной недостаточности, аденокарцином, предсердных эктопических систол, комплекса СПИД-деменция, индуцированного алкоголем гепатита, аллергического конъюнктивита, аллергического контактного дерматита, аллергического ринита, отторжения аллотрансплантата, недостаточности альфа-1-антитрипсина, амиотрофического бокового склероза, анемии, стенокардии, дегенерации клеток переднего рога спинного мозга, анти-cd3-терапии, антифосфолипидного синдрома, аллергических реакций на противорецепторные антитела, аневризмы аорты и периферических сосудов, рассечения аорты, артериальной гипертензии, артериосклероза, атриовентрикулярной фистулы, атаксии, предсердной фибрилляции (стойкой или пароксизмальной), трепетания предсердий, атриовентрикулярной блокады, В-клеточной лимфомы, отторжения костного трансплантата, отторжения трансплантата костного мозга (BMT), межжелудочковой блокады, лимфомы Беркитта, ожогов, сердечных аритмий, синдрома временной остановки сердца, опухоли сердца, кардиомиопатии, воспалительной реакции при искусственном кровообращении, отторжения трансплантата хряща, церебеллярных кортикальных дегенераций, церебеллярных нарушений, хаотической или мультиочаговой предсердной тахикардии, ассоциированных с химиотерапией нарушений, хронического миелоцитарного лейкоза (CML), хронического алкоголизма, хронических воспалительных патологий, хронического лимфоцитарного лейкоза (CLL), хронической обструктивной болезни легких (COPD), хронической интоксикации салицилатом, рака ободочной кишки, застойной сердечной недостаточности, конъюнктивита, контактного дерматита, легочного сердца, болезни коронарных артерий, болезни Крейтцфельдта-Якоба, отрицательного в культуре сепсиса, муковисцидоза, ассоциированных с терапией цитокинами нарушений, боксерской деменции, демиелинизирующих заболеваних, геморрагической лихорадки Денге, дерматита, дерматологических состояний, диабета, сахарного диабета, диабетического артериосклеротического заболевания, заболевания с диффузными тельцами Леви, дилатационной застойной кардиомиопатии, нарушений базальных (подкорковых) ядер головного мозга, синдрома Дауна в среднем возрасте, индуцированных лекарственными средствами нарушений движения, нарушений, индуцированных лекарственными средствами, блокирующими рецепторы допамина ЦНС, чувствительности к лекарственным средствам, экземы, энцефаломиелита, эндокардита, эндокринопатии, эпиглоттита, инфекции вирусом Эпштейна-Барр, эритромелалгии, экстрапирамидальных и церебеллярных расстройств, семейного гематофагоцитарного лимфоцитарного гистиоцитоза, отторжения имплантата фетальной вилочковой железы, атаксии Фридрейха, функциональных периферических артериальных нарушений, грибкового сепсиса, газовой (анаэробной) гангрены, язвы желудка, гломерулонефрита, отторжения трансплантата любого органа или любой ткани, грамотрицательного сепсиса, грамположительного сепсиса, гранулем, вызываемых внутриклеточными организмами, волосатоклеточного лейкоза, болезни Халлеррордена-Шпатца, тиреоидита Хашимото, сенной лихорадки, отторжения трансплантата сердца, гемохроматоза, гемодиализа, гемолитического уремического синдрома/тромболитической тромбоцитопенической пурпуры, кровотечения, гепатита (A), аритмии пучка Гиса, ВИЧ-инфекции/ВИЧ-невропатии, болезни Ходжкина, гиперкинетических нарушений движения, реакций гиперчувствительности, гиперчувствительного пневмонита, гипертензии, гипокинетических нарушений движения, диагностики системы гипоталамус-гипофиз-надпочечники, идиопатической болезни Аддисона, идиопатического легочного фиброза, опосредованной антителами цитотоксичности, астении, детской спинально-мышечной атрофии, воспаления аорты, гриппа А, воздействия ионизирующей радиации, иридоциклита/увеита/неврита зрительного нерва, ишемического-реперфузионного повреждения, ишемического инсульта, ювенильного ревматоидного артрита, ювенильной спинально-мышечной атрофии, саркомы Капоши, отторжения трансплантата почки, инфекции микобактерией Legionella, лейшманиоза, проказы, повреждений кортико-спинальной системы, жирового отека, отторжения трансплантата печени, лимфатического отека, малярии, злокачественной лимфомы, злокачественного гистиоцитоза, злокачественной меланомы, менингита, менингококкемии, метаболической/идиопатической мигренеподобной головной боли, митохондриального мультисистемного нарушения, заболевания смешанной соединительной ткани, моноклональной гаммопатии, множественной миеломы, дегенераций множественных систем (Mencel Dejerine-Thomas Shi-Drager и Machado-Joseph), тяжелой псевдопаралитической миастении, комплекса Mycobacterium avium, туберкулезной бациллы, синдрома миелодисплазии, инфаркта миокарда, ишемических нарушений миокарда, рака носоглотки, хронического заболевания легких новорожденных, нефрита, нефроза, нейродегенеративных заболеваний, нейрогенных мышечных атрофий I, нейрогенной лихорадки, неходжкинской лимфомы, закупорки брюшной аорты и ее ответвлений, окклюзивных артериальных нарушений, okt3-терапии, орхита/эпидидимита, процедуры после лечения орхита/вазэктомии, органомегалии, остеопороза, отторжения трансплантата поджелудочной железы, рака поджелудочной железы, паранеопластического синдрома/гиперкальциемии при злокачественных заболеваниях, отторжения трансплантата паращитовидной железы, воспалительного заболевания почечных лоханок, круглогодичного ринита, заболевания перикарда, периферического атеросклеротического заболевания, периферических васкулярных нарушений, перитонита, пернициозной анемии, пневмонии, вызываемой Pneumocystis carinii, пневмонии, синдрома POEMS (полиневропатии, органомегалии, эндокринопатии, моноклональной гаммопатии и синдрома изменений кожи), постперфузионного синдрома, постгемодиализного синдрома, синдрома пост-MI-кардиотомии, преэклампсии, прогрессирующего супрануклеарного паралича, первичной легочной гипертензии, лучевой терапии, феномена и болезни Рейно, болезни Рейно, болезни Рефсума, тахикардии с регулярными узкими QRS, реноваскулярной (почечно-сосудистой) гипертензии, реперфузионного повреждения, рестриктивной кардиомиопатии, сарком, склеродермии, сенильной хореи, сенильной деменции, ассоциированной с тельцами Леви, сероотрицательных артропатий, шока, серповидно-клеточной анемии, отторжения аллотрансплантата кожи, синдрома изменений кожи, отторжения трансплантата тонкой кишки, солидных опухолей, специфических аритмий, спинальной атаксии, спинально-церебеллярных дегенераций, стрептококкового миозита, структурных повреждений мозжечка, подострого склерозирующего панэнцефалита, обморока (синкопе), сердечно-сосудистого сифилиса, системной анафилаксии, синдрома системной воспалительной реакции, системного ювенильного ревматоидного артрита, T-клеточного или FAB ALL (острый лимфобластный лейкоз), телангиэктазии, облитерирующего тромбоангиита, тромбоцитопении, токсичности, трансплантатов, травмы/кровотечения, аллергических реакций типа III, аллергии типа IV, нестабильной стенокардии, уремии, уросепсиса, крапивницы, вальвулярных сердечных заболеваний, варикозных вен, васкулита, венозных заболеваний, венозного тромбоза, фибрилляции (мерцание) желудочков, вирусных и грибковых инфекций, острого энцефалита с высоким риском смертельного исхода/асептического менингита, гемафагоцитарного синдрома, ассоциированного с высоким риском смертельного исхода, синдрома Вернике-Корсакова, заболевания Вильсона, отторжения ксенотрансплантата любого органа или любой ткани, острых коронарных синдромов, острого идиопатического полиневрита, острой воспалительной демиелинизирующей полирадикулоневропатии, острой ишемии, болезни Стилла-Шоффара у взрослых, гнездной алопеции, анафилаксии, синдрома антифосфолипидного антитела, апластической анемии, атеросклероза, атопической экземы, атопического дерматита, аутоиммунного дерматита, аутоиммунного заболевания, ассоциированного со стрептококковой инфекцией, аутоиммунной энтеропатии, аутоиммунной тугоухости, аутоиммунного лимфопролиферативного синдрома (ALPS), аутоиммунного миокардита, аутоиммунного преждевременной недостаточности функции яичников, блефарита, бронхоэктаза, буллезного пемфигоида, сердечно-сосудистого заболевания, катастрофического антифосфолипидного синдрома, глютеиновой болезни, шейного спондилеза, хронической ишемии, рубцового пемфигоида, клинически выделенного синдрома (CIS) с риском развития множественного склероза, конъюнктивита, психического расстройства начинающегося в детском возрасте, хронического обструктивного легочного заболевания (COPD), дакриоцистита, дерматомиозита, диабетической ретинопатии, сахарного диабета, грыжи межпозвонкового диска, выпадения диска, лекарственной иммунной гемолитической анемии, эндокардита, эндометриоза, эндофтальмита, эписклерита, многоформной эритемы, большой (major) многоформной эритемы, пемфигоида беременных, синдрома Гийена-Барре (GBS), сенной лихорадки, синдрома Хьюза, идиопатической болезни Паркинсона, идиопатической интерстициальной пневмонии, IgE-опосредованной аллергии, иммунной гемолитической анемии, миозита с включенными тельцами, инфекционного воспалительного заболевания глаз, воспалительного демиелинизирующего заболевания, воспалительного заболевания сердца, воспалительного заболевания почек, IPF/UIP, ирита, кератита, сухого кератоконъюнктивита, болезни Куссмауля или болезни Куссмауля-Мейера, паралича Ландри, гистиоцитоза клеток Лангерганса, сетчатой мраморной кожи, дегенерации желтого пятна, микроскопической ангиопатии, болезни Бехтерева, расстройство двигательных клеток переднего рога спинного мозга, пемфигоида мембран слизистой оболочки, полиорганной недостаточности, большой миастении, миелодиспластического синдрома, миокардита, расстройств нервного корешка, невропатий, гепатита ни-А, ни-В, неврита зрительного нерва, остеолиза, пауциартикулярного юношеского артрита, окклюзивного заболевания периферических артерий (PAOD), болезни периферических сосудов (PVD), болезни периферических артерий (PAD), флебитов, узелкового полиартериита (или нодозного полиартериита), полихондрита, ревматической полимиалгии, полиоза, многосуставного юношеского артрита, аутоиммунного полиэндокринного синдрома, полиомиозита, ревматической полимиалгии (PMR), постперфузионного синдрома, первичного паркинсонизма, простатита, истинной эритроцитарной аплазии, первичной недостаточности надпочечников, рекуррентного оптикомиелита, рестеноза, ревматического порока сердца, SAPHO (синовит, акне, пустулез, гиперостоз и остеит), склеродермии, вторичного амилоидоза, инфаркта легкого, воспаления склеры, ишиалгии, вторичной недостаточности надпочечников, связанной с силиконом диффузной болезни соединительной ткани, дерматоза Снеддона-Уилкинсона, анкилозирующего спондилита, синдрома Стивенса-Джинсона (SJS), синдрома системной воспалительной реакции, темпорального артериита, токсоплазмозного ретинита, токсического эпидермального некролиза, поперечного миелита, TRAPS (рецептор фактора некроза опухоли, аллергическая реакция типа 1), диабета II типа, крапивницы, обычной интерстициальной пневмонии (UIP), васкулита, весеннего конъюнктивита, вирусного ретинита, синдрома Фогта-Коянага-Харада (синдром VKH), влажной макулодистрофии и заживления ран.
В другом аспекте связывающие белки согласно изобретению применимы для лечения расстройств, выбранных из группы, состоящей из острой лимфобластной лейкемии, острого миелолейкоза, карциномы надпочечников, рака анального канала, рака слепой кишки, астроцитомы мозжечка, астроцитомы головного мозга, базальноклеточной карциномы, рака желчевыводящих путей, внепеченочных желчевыводящих путей, рака мочевого пузыря, рака кости, остеосаркомы/глиомы злокачественной фиброзной гистиоцитоксантомы ствола головного мозга, опухоли головного мозга, глиомы ствола головного мозга, церебральной астроцитомы/злокачественной глиомы, эпендимомы, медуллобластомы, супратенториальных примитивных нейроэктодермальных опухолей, глиомы зрительного проводящего пути и гипоталамической глиомы, рака головного мозга, аденомы/карциноидной опухоли бронхов, карциноидной опухоли, желудочно-кишечной карциномы неизвестного происхождения, лимфомы центральной нервной системы, первичной астроцитомы мозжечка, рака шейки матки, хронического лимфоцитарного лейкоза, хронического миелоцитарного лейкоза, хронических миелопролиферативных расстройств, рака толстой кишки, рака ободочной и прямой кишки, кожной T-клеточной лимфомы, рака эндометрия, эпендимомы, рака пищевода, семейства опухолей Юинга, внечерепной герминомы, внегонадной гомоцитомы, рака внепеченочных желчевыводящих путей, злокачественной опухоли глаза, внутриглазной меланомы/ретинобластомы, злокачественной опухоли желчного пузыря, рака желудка (желудочно-кишечного тракта), карциноидной опухоли, желудочно-кишечного тракта, желудочно-кишечной стромальной опухоли (GIST), внечерепной герминомы, внегонадной гомоцитомы, гомоцитомы яичника, обусловленной беременностью трофобластической болезни, глиомы, глиомы ствола головного мозга, церебральной астроцитомы/глиомы, глиомы зрительного проводящего пути и гипоталамической глиомы у детей, волосатоклеточного лейкоза, рака головы и шеи, гепатоклеточного (печеночного) рака, лимфомы Ходжкина, гипофарингеального рака, внутриглазной меланомы, рака островковых клеток (эндокринных зон поджелудочной железы), саркомы Капоши, рака почки (ренальных клеток), ларингеального рака, острого лимфобластного лейкоза, острого миелолейкоза, хронического лимфолейкоза, хронического миелолейкоза, волосатоклеточного лейкоза, рака губы и ротовой полости, рака печени, немелкоклеточного рака легких, мелкоклеточного рака легких, СПИД-ассоциированной лимфомы, лимфомы Беркитта, кожной T-клеточной лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, первичной лимфомы центральной нервной системы, макроглобулинемии Вальденстрёма, остеосаркомы/злокачественной фиброзной гистиоцитомы кости, медуллобластомы, меланомы, внутриглазной (глазной) меланомы, карциномы клеток Меркеля, злокачественной мезотелиомы, метастазирующего сквамозного рака шеи неизвестной этиологии, рака полости рта, синдрома множественных эндокринных неоплазий, множественной миеломы/новообразования плазматических клеток, грибовидного микоза, миелодиспластических синдромов, миелодиспластических/миелопролиферативных заболеваний, миелогенной лейкемии, хронического миелолейкоза, множественной миеломы, миелопролиферативных расстройств, рака носовой полости и придаточной пазухи носа, назофарингеального рака, нейробластомы, рака полости рта, рака ротовой полости, рака губы и ротоглоточного рака, остеосаркомы/злокачественной фиброзной гистиоцитомы кости, рака яичника, эпителиального рака яичника, гомоцитомы яичника, пограничной опухоли яичника, рака поджелудочной железы, рака островковых клеток поджелудочной железы, рака носовой полости и придаточной пазухи носа, рака паращитовидной железы, рака полового члена, фарингеального рака, феохромацитомы, пинеобластомы и супратенториальных примитивных нейроэктодермальных опухолей, опухоли гипофиза, новообразования плазматических клеток /множественной миеломы, плевролегочной бластомы, рака предстательной железы, рака прямой кишки, рака клеток почечного эпителия (почки), рака почечной лоханки и мочеточника, рака «переходной» клетки, ретинобластомы, рака слюнной железы, саркомы, семейства опухолей Юинга, саркомы Капоши, саркомы мягких тканей, саркомы матки, синдрома Сезари, рака кожи (немеланомного типа), рака кожи (меланома), кожной карциномы клеток Меркеля, рака тонкой кишки, карциномы сквамозных клеток, метастазирующего сквамозного рака шеи неизвестной этиологии, рака желудка (желудочно-кишечного тракта), супратенториальных примитивных нейроэктодермальных опухолей, кожной T-клеточной лимфомы, рака яичка, рака горла, тимомы, тимомы и карциномы тимуса, рака щитовидной железы, рака «переходной» клетки почечной лоханки и мочеточника, обусловленной беременностью трофобластической болезни, рака «переходной» клетки почечной лоханки и мочеточника, рака мочеточника, рака матки, эндометриальной саркомы матки, рака влагалища, глиомы зрительного проводящего пути и гипоталамической глиомы, рака наружных женских половых органов, макроглобулинемии Вальденстрема, опухоли Вильмса.
В другом аспекте настоящее изобретение связано со способом детектирования наличия PGE2 в образце in vitro (например, в биологическом образце, таком как сыворотка, плазма, ткань, биопсия). Указанный способ может быть использован для диагностики расстройства, например, расстройства, ассоциированного с иммунными клетками. Указанный способ включает в себя (i) приведение, как здесь описано, указанного образца или контрольного образца в контакт с анти-PGE2-антителом или его фрагментом; и (ii) детектирование образования комплекса между указанным анти-PGE2-антителом или его фрагментом и указанным образцом или контрольным образцом, при этом статистически значимое изменение в образовании комплекса в указанном образце по сравнению с контрольным образцом является свидетельством наличия PGE2 в данном образце.
Еще в одном аспекте настоящее изобретение связано со способом детектирования наличия PGE2 в образце in vivo (например, визуализации in vivo у субъекта). Указанный способ может быть использован для диагностики расстройства, например, PGE2- ассоциированного расстройства. Указанный способ включает в себя (i) введение, как здесь описано, анти-PGE2-антитела или его фрагмента субъекту или контрольному субъекту в условиях, которые допускают связывание антитела или его фрагмента с PGE2; и (ii) детектирование образования комплекса между указанным антителом или его фрагментом и PGE2, при этом статистически значимое изменение в образовании комплекса у указанного субъекта по сравнению с контрольным субъектом является свидетельством наличия PGE2.
Антитела согласно изобретению или их антиген-связывающие области могут быть использованы отдельно или в сочетании для лечения таких заболеваний. Следует иметь в виду, что антитела согласно изобретению или их антиген-связывающие области могут быть использованы отдельно или в сочетании с дополнительным средством, например, с терапевтическим средством, при этом указанное дополнительное средство выбирает специалист в данной области в соответствии с теми целями, которые перед ним стоят. Например, дополнительным средством может быть терапевтическое средство, известное в данной области своим благотворным влиянием при лечении заболевания или состояния, которое поддается лечению под действием антитела согласно изобретению. Дополнительное средство может быть также средством, которое придает благоприятное свойство терапевтической композиции, например, средство, которое действует на вязкость композиции.
Кроме того, следует иметь в виду, что сочетания, которые следует считать входящими в объем, охватываемый настоящим изобретением, являются такими сочетаниями, которые оказывают благоприятное воздействие при их применении по указанному здесь назначению. Средства, указанные ниже, приведены здесь лишь с целью иллюстрации и вовсе не предназначены для ограничения объема изобретения. В сочетания, которые являются частью настоящего изобретения, могут входить антитела согласно изобретению и, по меньшей мере, одно дополнительное средство, выбранное из приведенных ниже списков. Указанное сочетание может включать в себя также и более чем одно дополнительное средство, например, два или три дополнительных средства, если указанная комбинация такова, что образованная композиция сохраняет способность выполнять предназначенную функцию.
Комбинированная терапия может включать в себя один или несколько антагонистов PGE2, например, анти-PGE2-антитела или их фрагменты, составленные совместно и/или вводимые совместно с одним или несколькими дополнительными терапевтическими средствами, например, с одним или несколькими ингибиторами цитокинов и факторов роста, иммуносупрессорными средствами, противовоспалительными средствами (например, системными противовоспалительными средствами), антифибротическими средствами, ингибиторами метаболизма, ингибиторами ферментов и/или цитотоксическими или цитостатическими средствами, более подробно описанными ниже. Примеры предпочтительных дополнительных терапевтических средств, которые могут быть совместно составлены и/или могут быть введены совместно с одним или несколькими антагонистами PGE2, например, анти-PGE2-антителами или их фрагментами, включают в себя, не ограничиваясь перечисленным, один или несколько из следующих средств: ингалируемые стероиды; бета-агонисты, например, быстродействующие бета-агонисты или бета-агонисты длительного действия; антагонисты лейкотриенов или рецепторов лейкотриенов; комбинированные лекарственные средства, такие как ADVAIR; ингибиторы IgE, например, анти-IgE-антитела (например, XOLAIR); ингибиторы фосфодиэстеразы (например, ингибиторы PDE4); ксантины; антихолинергические лекарственные средства; средства, стабилизирующие тучные клетки, такие как кромолин; ингибиторы IL-4; ингибиторы IL-5; ингибиторы эотаксина/CCR3; антагонисты гистамина или его рецепторов, включая H1, H2, H3 и H4, а также антагонисты простагландина D или его рецепторов (DP1 и CRTH2). Такие комбинации могут быть использованы для лечения астмы и других респираторных расстройств. Дополнительные примеры терапевтических средств, которые могут быть совместно составлены и/или введены совместно с одним или несколькими анти-PGE2-антителами или их фрагментами, включают в себя, не ограничиваясь перечисленным, одно или несколько из следующих средств: антагонисты TNF (например, растворимый фрагмент рецептора TNF, например, человеческого рецептора TNF p55 или p75 или их производных, например, TNFR-IgG в 75 кДа (слитый белок IgG-рецептор TNF в 75 кДа, ENBREL)); ферментативные антагонисты TNF, например, ингибиторы TNF-превращающего фермента (TACE); антагонисты мускариновых рецепторов; антагонисты TGF-бета; интерферон гамма; перфенидон; химиотерапевтические средства, например, метотрексат, лефлуномид или сиролимус (рапамицин) или их аналог, например, CCI-779; иммуноглобулины COX2 и cPLA2; средства NSAID; иммуномодуляторы; ингибиторы p38, ингибиторы TPL-2, MK-2 и NFkB. Другие комбинации являются цитокин-супрессивными противовоспалительными средствами (средством) (CSAID); антагонистами других человеческих цитокинов или факторов роста или антителами против них, например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, IL-21, IL-31, интерфероны, EMAP-II, GM-CSF, FGF, EGF, PDGF и эндотелин-1, а также рецепторы указанных цитокинов и факторов роста. Антитела согласно изобретению или их антиген-связывающие части можно комбинировать с антителами против молекул клеточной поверхности, таких как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, CTLA или их лигандов, включая CD154 (gp39 или CD40L).
Предпочтительные комбинации терапевтических средств могут вмешиваться в различные процессы воспалительного каскада реакций. Предпочтительные примеры включают в себя антагонисты TNF, такие как гуманизированные или человеческие антитела против TNF, D2E7, (публикация PCT No. WO 97/29131), CA2 (ремикадTM), CDP 571, и растворимые рецепторы TNF, p55 или p75, их производные (p75TNFR1gG (энбрел) или p55TNFR1gG (ленерцепт), а также ингибиторы TNF-превращающего фермента (TACE); сходным образом, по той же самой причине могут быть эффективны и ингибиторы IL-1 (ингибиторы интерлейкин-1-превращающего фермента, IL-1RA и т.п.).
Фармацевтические композиции согласно изобретению могут включать в себя "терапевтически эффективное количество" или "профилактически эффективное количество" антитела или части антитела согласно изобретению. Термин "терапевтически эффективное количество" относится к количеству, эффективному в дозах и в течение периода, необходимых для достижения требуемого терапевтического результата. Терапевтически эффективное количество антитела или части антитела может быть определено специалистом в данной области и может варьироваться в зависимости от таких факторов как состояние болезни, возраст, пол и вес индивида, а также способности антитела или части антитела вызывать требуемую реакцию в организме указанного индивида. Терапевтически эффективное количество является также таким количеством, при котором любые токсические или неблагоприятные эффекты антитела или части антитела компенсируются терапевтически благоприятными эффектами. "Профилактически эффективное количество" относится к количеству, эффективному в дозах и в течение периода, необходимых для достижения требуемого профилактического результата. Обычно, поскольку профилактическая доза используется субъектом до наступления или на ранней стадии заболевания, профилактически эффективное количество будет меньше терапевтически эффективного количества.
Схемы приема дозировок могут быть подкорректированы для обеспечения оптимально требуемого ответа (например, терапевтической или профилактической реакции). Например, можно ввести единственный болюс, несколько раздельных доз в течение временного интервала, или же доза может пропорционально снижаться или повышаться, в зависимости от того, как продиктовано терапевтической ситуацией. Особенно благотворными являются парентеральные композиции, составляемые в единичной дозированной форме для облегченного введения и однородностью дозированных форм. Используемая здесь единичная дозированная форма относится к физически дискретным единицам, подходящим в качестве однократных доз для лечения млекопитающих субъектов; каждая единица содержит предопределенное количество активного соединения, рассчитанного с учетом продуцирования требуемого терапевтического эффекта в ассоциации с требуемым фармацевтическим носителем. Технические характеристики единичных дозированных форм согласно изобретению диктуются и напрямую зависят от (a) присущих им характеристик активного соединения и конкретного терапевтического или профилактического эффекта, которого предполагается достичь, и (b) ограничений, существующих в данной области при составлении смеси таких активных соединений для лечения индивидуальной чувствительности.
Примерным, неограничивающим интервалом терапевтически или профилактически эффективного количества антитела или части антитела согласно изобретению является интервал от 0,1 до 20 мг/кг, более предпочтительно, от 1 до 10 мг/кг. Следует отметить, что объемы доз могут варьировать, в зависимости от типа и тяжести состояния, подвергаемого лечению. Кроме того, следует иметь в виду, что для того или иного конкретного субъекта специфические режимы дозировок должны быть со временем скорректированы в соответствии с индивидуальными потребностями и профессиональным решением специалиста, назначающего или контролирующего назначение композиций, а также то, что указанные здесь интервалы доз приведены только в качестве примера, для ориентации, и вовсе не предназначены для ограничения объема изобретения или применения заявленной композиции.
Специалистам в данной области должно быть понятно, что соответствующие модификации и адаптации описанных здесь способов согласно изобретению очевидны, и они могут быть произведены с использованием соответствующих эквивалентов в рамках объема настоящего изобретения или описанных здесь его воплощений. После приведенного выше подробного описания настоящего изобретения оно, для лучшего понимания, будет проиллюстрировано нижеследующими примерами, которые приведены лишь с целью илюстрации изобретения, но ни в коем случае не для ограничения объема изобретения.
Пояснение на примерах
Пример 1: Получение и выделение моноклональных антител против простагландина E 2
Пример 1.1: Анализы по идентификации человеческих антител против простагландина E 2
Если не указано иначе, для идентификации и характеристики антител против простагландина E2 были использованы следующие анализы.
Пример 1.1.A: ELISA
Твердофазные иммуноферментные анализы для скрининга антител, которые связываются с простагландином E2, были предприняты, по меньшей мере, в соответствии с одним из двух следующих способов.
Способ 1
Планшеты ELISA (Costar 3369, Corning, NY) покрывали 50 мкл анти-Fc-антителами против IgG хозяина (Sigma, St. Louis, MO) в концентрации 2 мкг/мл в PBS (Invitrogen Carlsbad, CA). Затем в течение ночи их инкубировали при 4°C, промывали PBS, после чего планшеты блокировали 200 мкл реактива Superblock (Pierce #37535, Rockford, IL). Образцы, содержащие IgG, разбавляли до 1 мкг/мл буфером для анализа (10% реактива Superblock в PBS, содержащем 0,05% Surfactamps (Pierce #37535, Rockford, IL), и по 50 мкл/лунку добавляли к каждой лунке и инкубировали в течение 1 часа при комнатной температуре. Планшеты четыре раза промывали раствором, забуференным Tween-Tris (TTBS). PGE2-биотинамид (Cayman Chemicals, Ann Arbor, MI) разбавляли до 30 нМ, и делали серийные разведения 1:3 в буфере для анализа. Образцы для титрационной кривой добавляли к каждому образцу IgG в концентрации по 50 мкл/лунку и инкубировали в течение 1 часа при комнатной температуре. Планшеты промывали, как было описано выше, и к каждой лунке добавляли по 50 мкл разведенного 1:5000 стрептавидина polyhrp40 (Fitzgerald Industries, Concord, MA) в буфере для анализа и инкубировали в течение 45 минут при комнатной температуре. Предпринимали конечную стадию промывания, и планшеты вырабатывали с использованием одностадийной системы TMB (Sigma #T8665, St. Louis, MO) и 100 мкл/лунку 2 н. H2SO4. Планшеты считывали при 450 нм с помощью устройства для считывания планшетов, Molecular Devices Spectramax plate reader (Sunnyvale, CA). EC50 определяли с помощью GraphPad Prism 5 (GraphPad Software, La Jolla, CA).
Способ 2
Альтернативно, связывание с простагландином определяли с помощью 3H-PGE2 ELISA. Планшеты покрывали 50 мкл/лунку козьими антителами против человеческого IgG (Fc) (Thermo Scientific # 31170, Hudson, NH) или козьими антителами против мышиного IgG (Fc) (Thermo Scientific # 31125, Hudson, NH) в PBS и инкубировали в течение ночи при температуре 4°C. На следующий день планшеты отряхивали и получали реплику сухим промоканием. Планшеты блокировали посредством 200 мкл/лунку реактива Superblock (Thermo Scientific # 37515, Hudson, NH) в течение 1 часа при комнатной температуре. Планшеты отряхивали и получали реплику сухим промоканием. Моноклональные антитела разбавляли до 0,04 мкг/мл в растворе фосфатного буфера с Tween 20 (PBST) (Abbott Bioresearch Center, Worcester, MA) и 10% Superblock, и по 50 мкл каждого антитела добавляли к каждой лунке такого предварительно блокированного планшета ELISA, в концентрации 2 нг/лунку, и инкубировали в течение 1 часа при комнатной температуре. Затем лунки 3 раза промывали PBS + 0,1% Tween-20. Проводили серийное 3-кратное титрование 3H-PGE2 (Perkin Elmer # NET-428, Waltham, MA) в PBST/10% Superblock. Пятьдесят микролитров раствора 3H-PGE2 добавляли к каждой лунке планшета и инкубировали в течение 1 часа при комнатной температуре. Лунки вручную промывали 6 раз PBST/10% Superblock, и к каждой лунке добавляли по 50 мкл сцинтилляционной жидкости (Perkin Elmer # 6013621, Waltham, MA). Планшеты считывали с помощью устройства TopCount reader (Perkin Elmer, Waltham, MA) с 5-минутным временем счета. Значения EC50 определяли с помощью GraphPad Prism 5 (GraphPad Software, La Jolla, CA).
Пример l.l.B: Конкурентный ELISA-анализ PGE 2
Конкурентные твердофазные иммуноферментные анализы были предприняты для определения специфичности связывания простагландина с антителами, которые связываются с простагландином E2, по меньшей мере, в соответствии с одним из двух из следующих способов.
Способ 1
Планшеты ELISA (Costar 3369, Corning, NY) покрывали 50 мкл анти-Fc-антителами против IgG хозяина (Sigma, St. Louis, MO) в концентрации 2 мкг/мл в PBS (Invitrogen Carlsbad, CA). После инкубирования в течение ночи при 4°C планшеты блокировали 200 мкл реактива Superblock (Pierce #37535, Rockford, IL). Образцы IgG разбавляли до 6 мкг/мл буфером для анализа (10% реактива Superblock в PBS, содержащем 0,05% Surfactamps (Pierce #37535, Rockford, IL). PGE2-биотинамид разбавляли до 3 нМ в буфере для анализа. Образцы для титрационной кривой в буфере для анализа готовили для простагландина PGA 2 (Cayman Chemicals, Ann Arbor, MI), PGD2 (Cayman Chemicals, Ann Arbor, MI) и PGE2 (Cayman Chemicals, Ann Arbor, MI), начиная с 300 нМ путем серийных разведений 1:10. Реагенты добавляли к пробиркам в объеме 50 мкл каждого/пробирку преинкубировали в течение 1 часа при комнатной температуре. После преинкубации смесь переносили в заблокированные планшеты и инкубировали в течение 1 часа при комнатной температуре. Далее планшеты четыре раза промывали раствором, забуференным Tween-20-Tris (TTBS). Затем стрептавидин polyhrp40 (Fitzgerald Industries, Concord, MA) в буфере для анализа (Fitzgerald Industries, Concord, MA) добавляли к каждой лунке при разведении 1:5000 и инкубировали в течение 45 минут при комнатной температуре. Предпринимали конечную стадию промывания, и планшеты вырабатывали с использованием одностадийной системы TMB (Sigma #T8665, St. Louis, MO) и 100 мкл/лунку 2 н. H2SO4. Планшеты считывали при 450 нм с помощью устройства для считывания планшетов, Molecular Devices Spectramax plate reader (Sunnyvale, CA). В лунках, в которых немеченые простагландины конкурировали за связывание с PGE2-биотинамидом, сигнал уменьшался. Значение IC50 определяли с помощью GraphPad Prism 5 (GraphPad Software, La Jolla, CA). Затем по IC50 рассчитывали индекс перекрестной реактивности PGE2/IC50 другого простагландина (простагландинов).
Способ 2
Альтернативно, селективность простагландина определяли с помощью конкурентного 3H-PGE2 ELISA-анализа. Планшеты покрывали 50 мкл/лунку козьими антителами против человеческого IgG (Fc) (Thermo Scientific # 31170, Hudson, NH) или козьими антителами против мышиного IgG (Fc) (Thermo Scientific # 31125, Hudson, NH) в концентрации 5 мкг/мл, в PBS, и инкубировали в течение ночи при температуре 4°C. На следующий день планшеты отряхивали и получали реплику сухим промоканием. Планшеты блокировали посредством 200 мкл/лунку реактива Superblock (Thermo Scientific # 37515, Hudson, NH) в течение 1 часа при комнатной температуре. Планшеты отряхивали и получали реплику сухим промоканием. Моноклональные антитела разбавляли до 0,04 мкг/мл в PBST (Abbott Bioresearch Center, Worcester, MA) и 10% Superblock, и по 50 мкл каждого добавляли к каждой лунке (2 нг/лунку) такого предварительно блокированного планшета ELISA, и инкубировали в течение 1 часа при комнатной температуре. Затем лунки 3 раза промывали PBS/0,1% Tween-20. 3H-PGE2 (Perkin Elmer # NET-428, Waltham, MA) разбавляли в PBST/10% Superblock до 6 нМ (2Х сток-раствор). Каждый простагландин (Cayman Chemicals, Ann Arbor, MI) готовили в PBST+10% Superblock при различных концентрациях, варьирующих от 2000 мкМ (2X сток-раствор) до 0,00004 мкМ (2X). Смешивали равные объемы раствора 3H-PGE2 и каждого разведения простагландина. Затем пятьдесят микролитров такой смеси добавляли к каждой лунке планшета и инкубировали в течение 1 часа при комнатной температуре. Лунки вручную промывали 6 раз PBST/10% Superblock, и к каждой лунке добавляли по 50 мкл сцинтилляционной жидкости (Perkin Elmer # 6013621, Waltham, MA). Планшеты считывали с помощью устройства TopCount reader (Perkin Elmer, Waltham, MA) с 5-минутным временем счета. Значения IC50 определяли с помощью GraphPad Prism 5 (GraphPad Software, La Jolla, CA). Затем по IC50 рассчитывали индекс перекрестной реактивности PGE2/IC50 другого простагландина (простагландинов).
Пример 1.1.C: Измерение функциональной активности антител против простагландина E 2
Для изучения функциональной активности анти-PGE2-антител согласно изобретению использовали антитела в следующих анализах in vitro и in vivo, в которых измеряется способность антитела ингибировать активность PGE2.
Пример 1.1.C.1: Определение биологической активности EP4
Способность анти-PGE2-антитела ингибировать клеточный ответ PGE2 in vitro определяли в анализе по притоку Ca++ в клетки HEK293 Gα16 (Abbott Bioresearch Center, Worcester, MA), стабильно трансфицированных человеческим рецептором EP4. Вкратце, экспрессирующую плазмиду, кодирующую один из четырех человеческих рецепторов PGE2, EP4, и экспрессирующую плазмиду, кодирующую Gα16, котрансфицировали в клетки 293 линии клеток эмбриональной почки человека (ATCC# CRL1573, Manassas, Virginia). Стабильные клоны, коэкспрессирующие как человеческий EP4, так и белок Gα 16, отбирали с использованием стандартных методов (Joseph Sambrook and David W. Russell. Molecular Cloning: A Laboratory Manual Publisher. Published by Cold Spring Harbor Laboratory Press, 2001) и использовали для анализа биологической активности EP4.
Клетки HEK293 Gα 16 высевали в черные/прозрачные поли-D-лизиновые планшеты (Corning #3667, Corning, NY) и инкубировали в присутствии Ca++-чувствительной краски (Molecular Devices, Sunnyvale, CA) в течение 90 минут. Сток-раствор PGE2 (в 200 этанола с установленным градусом крепости) растворяли в буфере FLIPR [содержащем 1X HBSS (Invitrogen Carlsbad, CA), 20 мМ HEPES (Invitrogen Carlsbad, CA), 0,1% BSA (Sigma, St. Louis, MO) и 2,5 мМ пробенецида (Sigma, St. Louis, MO)]. Анти-PGE2-антитела или подходящие по изотипу контрольные антитела также предварительно растворяли в буфере FLIPR. 25 мкл PGE2 или преинкубированной смеси PGE2/антитело добавляли к лункам с предварительно внесенными в них клетками. Определяли реакцию доза-ответ PGE2 при серийном титровании PGE2 и с помощью FLIPR1 или Tetra (Molecular Devices, Sunnyvale, CA), а EC50 определяли, используя GraphPad Prism 5 (GraphPad Software, La Jolla, CA). Для тестирования антител, PGE2 при концентрации EC50 инкубировали с различными концентрациями тестируемых антител или подходящих по изотипу антител (отрицательный контроль) (ABC) в течение 20 минут, и добавляли к меченым человеческим EP4 в клетках HEK293 Ga 16. Осуществляли мониторинг притока Ca++ с помощью FLIPR1, и данные анализировали с использованием GraphPad Prism 5 (GraphPad Software, La Jolla, CA).
Пример 1.1.C.2: Конкурентное ингибирование связывания PGE 2 с рецепторами PGE 2 под действием антител против простагландина E 2 с помощью 3 H-PGE 2
Конкурентное ингибирование связывания PGE2 с рецепторами PGE2, например, EP4 или EP3, анти-PGE2-антитела определяли путем анализа связывания рецептора на основе клеток или клеточной мембраны, с использованием 3H-PGE2 (простагландин E2, [5,6,8,11,12,14,15-3H(N)], Perkin Elmer, Waltham, MA. Cat# NET428250UC).
Клетки, эндогенно или стабильно сверхэкспрессирующие рецептор EP4 (то есть клетки HEK293-EP4 или клетки HEK293-EP4-Gα16, используемые для определения биологической активности EP4) (105 клеток/мл), выращивали в течение ночи в 24-луночном планшете в среде DMEM (Invitrogen, Carlsbad, CA)/10% FCS (Sigma #T8665, Sigma, St. Louis, MO). Среду удаляли, и добавляли 100 мкл связывающего буфера (среда без ЭБС). Планшет на 10 минут помещали на лед. Добавляли нерадиоактивный PGE2 (0-1 мкМ) вместе с радиоактивным маркером (40 пкМ 3H-PGE2) в объеме 100 мкл. Равновесное связывание рецептора поддерживали в течение 90 минут при 4°C. Среду удаляли, и клетки четыре раза промывали 200 мкл холодной среды. Клетки собирали, добавляя 20 мкл 0,5 M NaOH. Лизат переносили в планшет с жидким сцинтиллятором. К каждой лунке добавляли 100 мкл Aquasafe 500 (Zinsser Analytic, Frankfurt, Germany) плюс коктейль LSC (Lumac LSC, Groningen, The Netherlands) и перемешивали. Связанную с клетками радиоактивность определяли путем определения метки в жидком сцинтилляторе. Для большинства взаимодействий агонист-рецептор считается, что ингибирование связывания рецептора под действием агониста (PGE2) следует однопараметрической модели (one-site model). Значения EC50, Ki и Kd вычисляют с помощью GraphPad Prism 5 (GraphPad Software, La Jolla, CA).
Ингибирование анти-PGE2-антитела по связыванию 3H-PGE2 (простагландин E2, [5,6,8,11,12,14,15-3H(N)], Perkin Elmer, Waltham, MA. Cat# NET428250UC) с рецептором EP3 было предпринято с использованием мембранных препаратов, полученных из клеток, в избыточном количестве экспрессирующих рецептор EP3 (Millipore, Billerica, MA). Перед анализом связывания к фильтровальному планшету Unifilter-96 GF/B (Perkin Elmer, Waltham, MA) добавляли по 50 мкл/лунку 0,3% полиэтиленимина (PEI) (Sigma, St. Louis, MO) и перед употреблением выдерживали 1 час при температуре 4°C. Разведение антитела 1:3 производили при 2X концентрации в связывающем буфере (50 мМ HEPES, pH 7,0, 10 мМ MgCl2, 1 мМ ЭДТА, 0,2% БСА). 3H-PGE2 получали при 2X концентрации в связывающем буфере. Затем к каждой лунке, содержащей 50 микролитров 200 пкМ 3H-PGE2, добавляли по 50 мкл антитела, полученного в результате трехкратного серийного разведения, как следует перемешивали и в течение 10 минут выдерживали при комнатной температуре. Замороженные мембраны подвергали оттаиванию и ресуспендировали в связывающем буфере. К каждой лунке добавляли по 5 мкг мембран. Смеси инкубировали в течение 60 минут при комнатной температуре перед нанесением, с использованием 96-луночного харвестера производства Packard, на фильтры фильтрационного планшета, предварительно обработанного GF/B. Затем планшеты сушили в течение часа перед добавлением Microscint(TM)20 (Perkin Elmer, Waltham, MA). После этого планшеты запечатывали и просчитывали на устройстве TopCount reader (Perkin Elmer, Waltham, MA). Неспецифическое связывание определяли в присутствии 100 мкл холодного PGE2. Измерение радиоактивности (cpm) производили для определения значений IC50 с использованием Graphpad Prism (GraphPad Software, La Jolla, CA).
Пример 1.1.C.3: Конкурентное ингибирование связывания PGE 2 с рецепторами PGE 2 под действием антител против простагландина E 2 с помощью FACS-анализа на основе клеток
Конкурентное ингибирование связывания PGE2 с рецепторами PGE2, например, EP4, под действием анти-PGE2-антитела, может быть определено с помощью FACS-анализа на основе клеток с использованием PGE2-биотинимида (Cayman Chemical, Ann Arbor, Michigan. Cat# 10006987) и стрептавидин-R-фикоэритрина (SA-RPE; Invitrogen, Carlsbad, CA, Cat# 15-4301). Клетки (1×106), эндогенно экспрессирующие или стабильно сверхэкспрессирующие рецептор EP4 (то есть клетки HEK293-EP4 или клетки HEK293-EP4-Gα16, используемые для определения биологической активности EP4), культивировали в среде DMEM (Invitrogen, Carlsbad, CA)/10% ЭБС (Sigma #T8665, Sigma, St. Louis, MO). Клетки собирали и несколько раз промывали 500 мкл промывочного буфера (PBS/1% БСА). Клетки ресуспендировали в 500 мкл связывающего буфера FACS (среда без ЭБС). 20 мкл PGE2-биотинимида добавляли к клеточной суспензии и инкубировали в течение 1 часа при температуре 4°C. Клетки три раза промывали промывочным буфером. Клетки суспендировали в 500 мкл связывающего буфера FACS, и к клеткам добавляли 20 мкл SA-RPE и в течение 30 минут инкубировали при 4°C. Затем клетки ресуспендировали в 500 мкл связывающего буфера FACS и методом проточной цитометрии исследовали связывание PGE2 на клеточной поверхности. Ингибирование анти-PGE2-антитела может быть определено путем преинкубации клеток с титрованием анти-PGE2-антитела перед инкубацией с PGE2-биотинимидом и SA-RPE.
Пример 1.2: Получение моноклональных антител против простагландина E 2 гибридомным методом
Мышиные моноклональные антитела против простагландина E2 получали следующим образом:
Пример 1.2.A: Иммунизация мышей конъюгатом простагландин E 2 -тиреоглобулин
Двадцать микрограммов конъюгата PGE2/тиреоглобулин, смешанного с неполным адъювантом Фрейнда (Pierce, Rockford, IL) или адъювантом Immunoeasy (Qiagen, Valencia, CA), инъецировали подкожно пяти 6-8-недельным мышам Balb/C, пяти мышам C57B/6 и пяти мышам AJ на день 1-й. На 24, 38 и 49-й дни тем же самым мышам подкожно инъецировали 25 мкг конъюгата PGE2/тиреоглобулин, смешанного с неполным адъювантом Фрейнда или адъювантом Immunoeasy. На 84, 112 или 144-й дни мышам внутривенно инъецировали 1 мкг конъюгата PGE2/тиреоглобулин.
Пример 1.2.B: Получение гибридом
Для получения гибридом спленоциты, полученные из организма иммунизированных мышей, описанных в примере 1.2.A, были слиты с клетками SP2/O-Ag-14 в соотношении 5:1, согласно учрежденному методу, описанному Kohler, G. and Milstein, Nature, 256: 495 (1975). Слитые продукты помещали в селективную среду, содержащую азасерин (Pierce, Rockford, IL) и гипоксантин (Pierce, Rockford, IL), в 96-луночных планшетах при плотности 2,5×106 клеток селезенки на лунку. Через семь - десять дней после слияния стали наблюдаться макроскопические гибридомные колонии. Супернатанты из каждой клетки, содержащей гибридомные колонии, тестировали методом ELISA (как описано в примере 1.1.A) на предмет наличия антитела против PGE2.
PGE2 конъюгировали с несколькими различными белками-носителями, включая бычий тиреоглобулины, гемоцианин лимфы улитки, бычий сывороточный альбумин и овальбумин. (Amiram, et al. Eur. J. Biochem. 53: 145-150 (1975)). Мышей иммунизировали одним из указанных конъюгированных PGE2-белковых комплексов, как описано в примере 1.2.A. Затем клетки селезенки из организма иммунизированных мышей сливали для получения гибридом, как описано в примере 1.2.B. Те гибридомы, которые продуцировали антитела, специфичные в отношении PGE2, выделили, и полученные антитела характеризовали, используя биотинилированный PGE2 в методе ELISA, как описано в примере 1.1.A.
Пример 1.2.C: Идентификация и характеристика моноклональных антител против простагландина E 2
Гибридомы, продуцирующие антитела, которые связываются с PGE2, и полученные согласно примеру 1.2.B, наращивали и клонировали методом ограниченного разведения.
Было выделено несколько антител, обозначенных 19C9, 4F10 и 15F10, специфичных в отношении PGE2. Аффинности указанных антител определяи методом ELISA с помощью биотинилированного PGE2, как описано в примере 1.1.A (фигуры 1 и 2). Специфичость указанных антител в отношении PGE2 была дополнительно определена в конкурентном анализе ELISA с использованием различных простагландинов, как описано в примере 1.1.B (таблица 2).
Аффинность и перекрестная реактивность антител 19C9, 4F10, 15F10 и 2B5
Пример 2: Человеческие антитела против простагландина E 2 , полученные с использованием технологии дисплея in Vitro
Пример 2.1: Человеческие антитела против простагландина E 2 , отобранные из библиотек неиммунных человеческих антител с использованием технологии дисплея in Vitro
С помощью технологии PROfusion(TM) дисплея мРНК осуществляли селекцию человеческих анти-PGE2-антител из библиотек неиммунных человеческих антител с помощью технологии дисплея in Vitro в формате одноцепочечного Fv (scFv). Аминокислотные последовательности антитела, которые кодируются биотинилированными PGE2-связывающими scFv-белками, собирали с помощью стрептавидиновых или нейтравидиновых магнитных бусинок и дополнительно обогащали из библиотек многократными циклами селекции. Полный выход последовательностей нуклеиновых кислот scFv субклонировали в плазмидную ДНК для размножения бактерий, и индивидуальные бактериальные колонии выбирали для анализа последовательности scFv и подтверждения их связывания с PGE2 тем же самым анализом связывания антигена, который использовался и при селекции библиотек. Затем VH- и VL-ДНК PGE2-связывающих клонов scFv отдельно субклонировали в соответствующие векторы, экспрессирующие тяжелую цепь и легкую цепь IgG человека, и трансфицировали в клетки COS7 для экспрессии IgG. Затем среды IgG-содержащих COS7 использовали для подтверждения PGE2-связывания методом ELISA, как описано в примере 1.1.A (таблица 3).
Связывание анти-PGE7-антител, полученных из библиотеки PROfusion, с PGE7-биотинамидом (OD450)
В таблице 4 приведен список аминокислотных последовательностей областей VH и VL человеческих анти-PGE2-антител, полученных из библиотеки PROfusionTM дисплея мРНК.
Список аминокислотных последовательностей областей VH и VL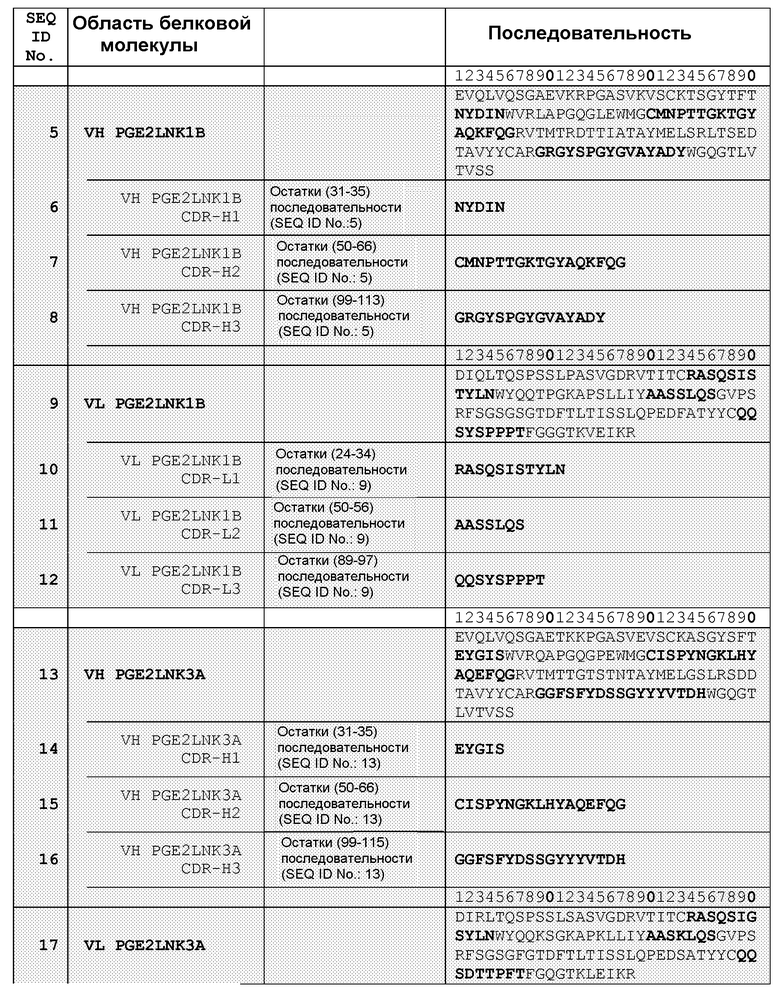
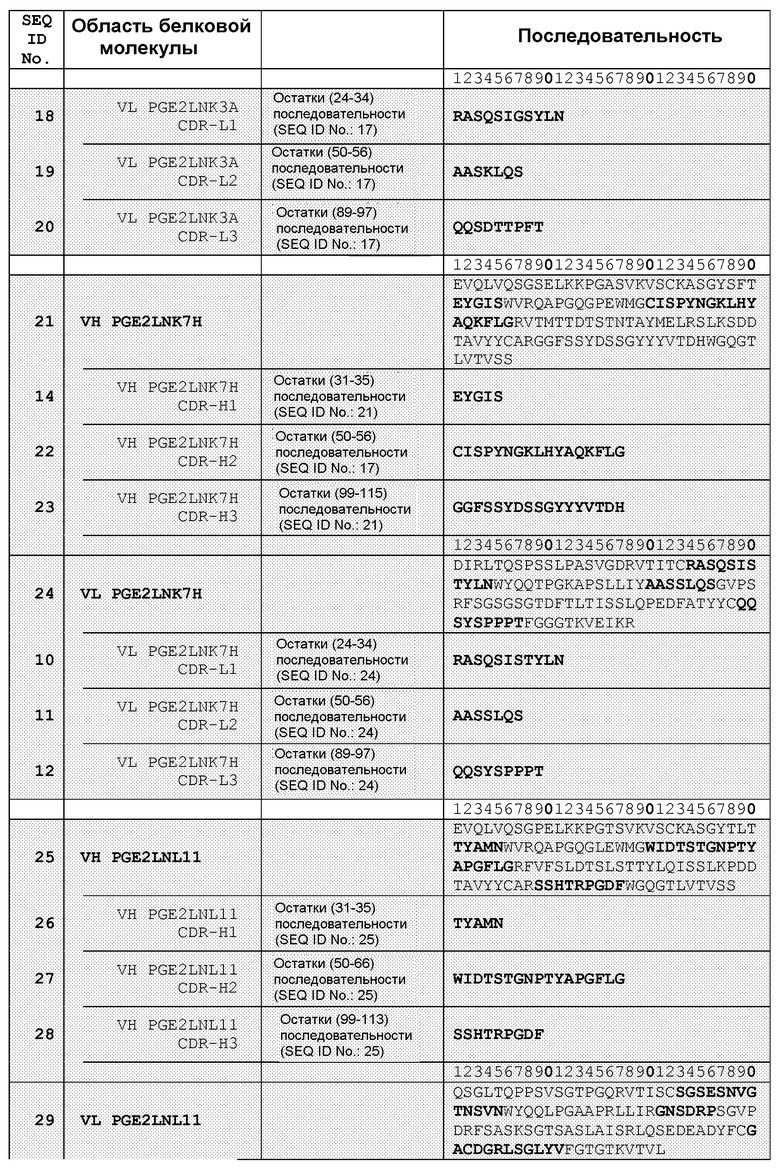
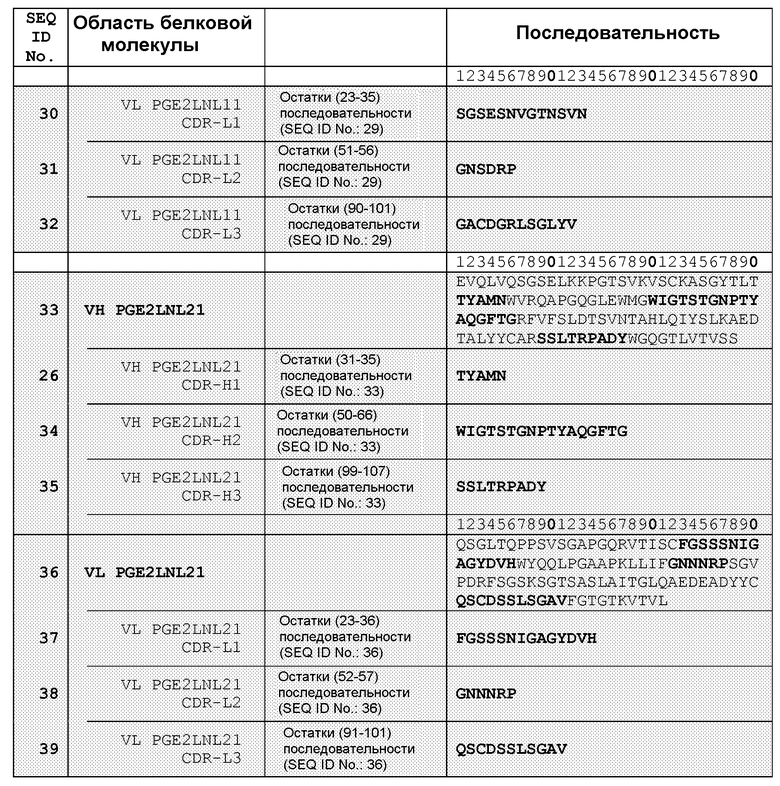
Пример 3: Получение и характеристика рекомбинантных антител против простагландина E 2 в соответствии с последовательностями растворенного белка путем комбинирования последовательности Эдмана, анализа масс-спектра и BLAST
Белковую последовательность полученных из гибридомы мышиных антител, специфичных в отношении PGE2, получали путем анализа аминокислотных последовательностей, используя комбинацию деградации Эдмана, анализа масс-спектра и BLAST (Basic Local Alignment Search Tool, NCBI, NIH, Bethesda, MD), как было описано ранее (Pham, V. et al. Analyt. Biochem. 352: 77-86 (2006)). 0,45 мг анти-PGE2-антитела восстанавливали с помощью 100 мМ DTT (Invitrogen, Carlsbad, CA) до легкой цепи и тяжелой цепи. Легкие цепи и тяжелые цепи анти-PGE2-антител разделяли методом ВЭЖХ с обращенной фазой, используя систему Shimadzu HPLC (Shimadzu Scientifc Instruments, Columbia, MD) с колонкой Vydac C-18 с обращенной фазой (H-P Separations Group, Hesperia, CA). Молекулярные веса легкой и тяжелой цепей измеряли масс-спектрометре Applied Biosystems API QSTAR Pulsar i (Applied Biosystems, Foster City, CA) и масс-спектрометре Agilent Q-TOF (Agilent, Palo Alto, CA). N-концевое секвенирование легких цепей производили в растворе на белково-пептидном секвенаторе PE Applied Biosystems 494/785A/140C/610A (Applied Biosystems, Foster City, CA). 45 мкл легкой цепи анти-PGE2-антитела 2B5 наносили в центр фильтра, и выполняли 42 цикла. N-конец тяжелой цепи анти-PGE2-антитела блокировали пироглутаминовой кислотой, и он не иог быть секвенирован напрямую путем деградации Эдмана. Перед N-концевым секвенированием тяжелой цепи по Эдману снимали блокировку с N-конца тяжелой цепи, используя для этого пироглутамат-аминопептидазу (Sigma, St. Louis, MO). 80 мкг анти-PGE2-антитела восстанавливали с помощью 50 мМ DTT при 37°C в течение 30 минут. 0,42 мкл 0,5 M ЭДТА, pH 7,5 (Invitrogen, Carlsbad, CA), добавляли для восстановления образца до конечной концентрации ЭДТА 1 мМ. К этому образцу добавляли 50 мкл восстановленной рекомбинантной пироглутамат-аминопептидазы pyrococcus furiosus (Sigma, St. Louis, MO). После инкубации раствора образца при 40°C в течение 15 часов температуру повышали до 60°C на дополнительных два часа. Дополнительно добавляли 10 мкл восстановленной пироглутамат-аминопептидазы pyrococcus furiosus, и образец инкубировали при 60°C в течение еще одного часа. Для мониторинга и определения длительности процесса деблокирования 4 мкл образца использовали для анализа LC/MS 15-часовой, 17-часовой и 18-часовой временных точек. Когда реакция деблокирования была завершена, раствор концентрировали в вакууме (метод speed-vacuum) (Eppendorf, Westbury, NY) приблизительно до 100 мкл. Деблокированную тяжелую цепь отделяли от легкой цепи на ДСН-ПААГ, а затем переносили на мембрану PVDF (Invitrogen, Carlsbad, CA) для секвенирования по Эдману (Mall, HD, Methods Enzymol. 27: 942-1010 (1973)).
Для получения внутренней пептидной последовательности анти-PGE2-антитела, указанное антитело расщепляли под действием множественных протеиназ при щелочной обработке или без нее. Сначала образец восстанавливали с помощью DTT. Перед расщеплением восстановленный образец либо подвергали прямому воздействию претеиназы, либо алкилировали йодацетамидом (Sigma, St. Louis, MO). Используемые в данном исследовании протеиназы включают в себя трипсин, glu-C, asp-N и химотрипсин (Sigma, St. Louis, MO). Фракции пептидов, расщепленных под действием протеиназ, разделяли методом ВЭЖХ, и каждую фракцию собирали в отдельной эппендорфовской пробирке либо для проведения MS, либо для секвенирования по Эдману. Для анализа LC/MS/MS использовали MALDI-MS (Applied Biosystems, Foster City, CA), нано-LC/ESI-MS/MS (Applied Biosystems, Foster City, CA) с применением либо LCQ-deca, либо API QStar Pulsar (Applied Biosystems, Foster City, CA), либо Agilent Q-TOF (Agilent, Palo Alto, CA). Условия ВЭЖХ мобильной фазе A=0,1% муравьиной кислоты; мобильной фазе B=80% ACN/20% 0,1% муравьиной кислоты. Применяли 1-3-часовой градиент (5-50% B). Для секвенирования по Эдману фракции, содержащие пептиды, расщепленные под действием протеиназ, переносили на мембрану PVDF посредством картриджа ProSorb (Applied Biosystems, Foster City, CA). Каждую фракцию разбавляли до 100 мкл 0,1% раствора ТФУ (Sigma, St. Louis, MO). После увлажнения мембраны PVDF (Invitrogen, Carlsbad, CA) в резервуаре с 10 мкл метанола (Sigma, St. Louis, MO) образец вносили в указанный резервуар. Образец извлекали из указанного резервуара, и мембрану PVDF сушили на воздухе. Мембрану PVDF встряхивали, добавляли 5 мкл 10% разбавленного раствора Biobrene (Sigma, St. Louis, MO), и мембрану PVDF полностью высушивали. После промывки мембраны PVDF 15 микролитрами 0,1% ТФУ в течение 15 секунд, ее поверхность протирали фильтровальной бумагой. К мембране PVDF добавляли 4 мкл метанола, и давали ей полностью высохнуть. Высушенную мембрану PVDF использовали для секвенирования по Эдману.
Последовательности зародышевой линии областей VH и VL анти-PGE2-антитела определяли путем выравнивания растворенных вариабельных областей тяжелой цепи и легкой цепи согласно указанным выше способам с использованием базы данных областей VH и VL мышиных последовательностей зародышевой линии (Ig-BLAST, NCBI, NIH, Bethesda, MD). Для областей, не определяемых путем MS секвенирования по Эдману, была определена наиболее близкая последовательность зародышевой линии. Возможные мутации активных участков определяли вручную, сличая, соответственно, с молекулярным весом тяжелой цепи и легкой цепи анти-PGE2-антитела, экспериментально определяемым путем MS. Белковая последовательность анти-PGE2-антитела была определена с помощью указанного выше способа.
Несколько версий рекомбинантных анти-PGE2-антител (2B5-7.0, 2B5-8.0 и 2B5-9.0) было сконструировано на основе таких определяемых белковых последовательностей, каждая из которых имела разные остатки в нескольких неопределяемых положениях (таблица 5). Тестирование таких рекомбинантных антител описано в примере 4. Хотя аминокислотная последовательность областей CDR антитела и является критичной для специфичности связывания, эффективность и аффинность антитела, замены, перестройки, делеции и добавления нескольких остатков в каркасных областях и даже в областях CDR могут все еще в большой степени поддерживать специфичность связывания, эффективность и аффинность антитела. Версия антитела, по меньшей мере, с одной или несколькими такими заменой (заменами), перестройками, делециями или добавлениями считается входящей в объем, охватываемый настоящим изобретением. Выравнивание областей VH и VL анти-PGE2-антител (2B5-7.0, 2B5-8.0 и 2B5-9.0) представлено на фигуре 8.
Несколько версий определяемых белковых последовательностей для мышиного анти-PGE2-антитела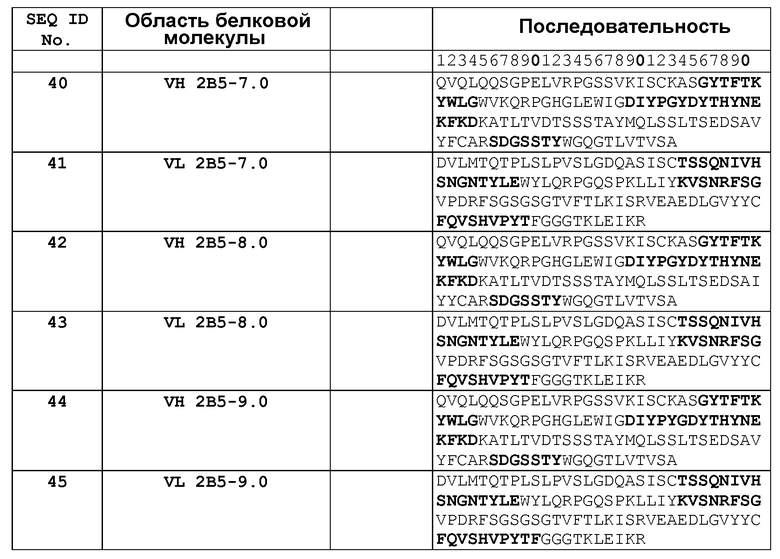
Пример 4: Рекомбинантные антитела против простагландина E 2
Приме 4.1: Конструирование и экспрессия рекомбинантных антител против простагландина E 2
ДНК, кодирующую вариабельные области тяжелой цепи мыщиных анти-PGE2-антител, 2B5-7.0, 2B5-8.0 или 2B5-9.0, сливали с фрагментом кДНК, кодирующим либо константную область человеческого IgG1, либо константную область мышиного IgG1, либо константную область мышиного IgG2a посредством гомологической рекомбинации в бактериях. (Zhang, Y et al. Nature Biotechnol. 18(12): 1314-7 (2000)). ДНК, кодирующую вариабельные области легкой цепи, 2B5-7.0, 2B5-8.0 или 2B5-9.0, сливали с человеческой константной каппа-областью или мышиной константной каппа-областью. Там же.
Полноразмерные антитела транзитно экспрессировали в клетках 293 путем котрансфекции кДНК тяжелой и легкой цепей, лигированных в экспрессирующие плазмиды pTT3. (Durocher, Y et al. Nucleic Acids Res. 30(2): E9 (2002)). Клеточные супернатанты, содержащие рекомбинантное химерное антитело, были очищены в результате хроматографии на протеин А-сефарозе, и связавшееся антитело элюировали посредством добавления кислотного буфера. Антитела нейтрализовывали и диализовали против PBS. (Making and Using Antibodies: A Practical Handbook. Edited by Gary C. Howard and Matthew R. Kaser. Published by CRC (2006)).
Затем очищенные химерные моноклональные антитела против PGE2, 2B5-7.0, 2B5-8.0 и 2B5-9.0, тестировали на предмет определения их способности связываться с PGE2 в анализе ELISA, как описано в примере 1.1.A (таблица 6), а также их селективности в конкурентном анализе ELISA, как описано в примере 1.1.B (таблица 6). Все три рекомбинантных моноклональных антитела против PGE2, 2B5-7.0, 2B5-8.0 и 2B5-9.0, эффективно связывались с PGE2 со сходной специфичностью в отношении PGE2. Моноклональное антитело 2B5-8.0 проявляло самую высокую способность связывания с PGE2 и было выбрано для дальнейшего определения его свойств в EP4-биоанализе с целью охарактеризовать его способность нейтрализовать биологическую активность PGE2, а также в конкурентном 3H-PGE2-анализе ELISA с целью охарактеризовать его селективность в отношении простагландина с использованием полной панели простагландинов. Моноклональное антитело 2B5-8.0 эффективно ингибировало вызываемый PGE2 приток кальция в EP4-биоанализе, как описано в примерах 1.1.C (таблица 6).
Получение характеристик связывания PGE2, селективности связывания простагландинов и эффективности нейтрализации PGE2 сконструированными моноклональными антителами против PGE2
Пример 4.2: Конструирование и экспрессия гуманизированных антител против простагландина E 2
Пример 4.2.1: Селекция рамок считывания человеческих антител
Гуманизация была основана на гомологии аминокислотных последовательностей, кластерном CDR-анализе, частоте использования среди экспрессируемых человеческих антител и доступной информации по кристаллическим структурам человеческих антител. Принимая во внимание возможные эффекты по связыванию антител, VH-VL-спариваниию, а также другие факторы, мышиные остатки, за некоторым исключением, заменяли человеческими остатками там, где мышиные и человеческие остатки в каркасной области были различными. Дополнительные стратегии гуманизации были созданы на основе анализа последовательностей человеческих антител зародышевой линии или их подгрупп, которые имеют высокую степень гомологии, то есть подобие последовательностей, истинной аминокислотной последовательности вариабельных областей мышиного антитела.
Для идентификации остатков, уникальных для последовательностей мышиных антител, которые, согласно предсказаниям, являются критичными для структуры областей CDR антитела, использовали гомологическое моделирование. Ссылочный белок, имеющий последовательность, сходную с последовательностью представляющего интерес белка-мишени, для которых известны трехмерные координаты, использовали для получения исходных координат и в качестве ориентира для их дальнейшей очистки. Первичные последовательности ссылочных белков и белков-мишеней выравнивали таким образом, чтобы координаты идентичных частей указанных двух белков были выровнены. Координаты не совпадающих частей указанных двух белков, например, из остатков, полученных в результате мутаций, вставок или делеций, конструируются из видовых структурных матриц, чтобы убедиться в непротиворечивости с координатами уже выровненных моделей. Такая компьютерная структура белка может быть дополнительно уточнена или непосредственно использована в исследованиях по моделированию.
Мышиную последовательность генов вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела 2B5-8.0 отдельно выравнивали с 44 последовательностями вариабельных областей тяжелой цепи человеческого иммуноглобулина зародышевой линии или с 46 последовательностями вариабельных областей легкой цепи человеческого иммуноглобулина зародышевой линии (полученных из вэб-сайта NCBI Ig BlAST по адресу: http://www.ncbi.nlm.nih.gov/igblast/retrieveig.html.) с использованием программного обеспечения Vector NTI. Сочетание изучения с помощью BLAST и визуальной проверки осуществляли для идентификации соответствующих ссылочных структур. 25%-ая идентичность последовательностей между ссылочной последовательностью и аминокислотной последовательностью-мишенью считается минимально необходимой для осуществления попыток гомологического моделирования. Выравнивание последовательностей производили вручную, а координаты модели описывали с помощью программы Jackal (Petrey, D., et al. Proteins 53 (Suppl. 6): 430-435 (2003)). Для гуманизации антитела 2B5-8.0, исходя из изучения гомологии с последовательностями человеческих сегментов V и J, для получения рамок считывания гуманизированной вариабельной области тяжелой цепи антитела 2B5-8.0 были отобраны сегмент VH1-18 области VH и сегмент JH4 области J. Для вариабельной области легкой цепи антитела 2B5-8.0 были использованы сегмент 01 области VL и сегмент JK4 области J (см. таблицы 7 и 8). Степень идентичности аминокислот каркасной области между областью VH антитела 2B5-8.0 и акцепторными человеческими сегментами VH1-18 и JH4 составляла 80,2%, тогда как степень идентичности между областью VL антитела 2B5-8.0 и акцепторными человеческими сегментами 01 и JK4 составила 90,3%. Несмотря на то, что в качестве акцепторов для гуманизации антитела 2B5-8.0 были отобраны специфические пары предпочтительных человеческих акцепторных рамок считывания VH/JH и VL/JK, в данной области известно, что и другие человеческие акцепторные каркасные области с последовательностью, минимально на 25% идентичной мышиной каркасной области, также могут быть использованы для гуманизации антитела 2B5-8.0, а следовательно, они также входят в объем, охватываемый настоящим изобретением.
Акцепторные последовательности тяжелой цепи для гуманизации антитела 2B5-8.0
Акцепторные последовательности легкой цепи для гуманизации антитела 2B5-8.0
Первичные последовательности мышиной и человеческой рамок считывания отобранных антител в значительной степени идентичны. Положения остатков, которые отличались, были кандидатами на включение мышиного остатка в гуманизированную последовательность в порядке сохранения наблюдаемой эффективности связывания у мышиного антитела. Такие аминокислотные замены в каркасной области (человеческие остатки, которые были подвергнуты обратной мутации для восстановления мышиных остатков) на месте ключевого остатка называются обратными мутациями каркасной области, при этом ключевой остаток выбран из группы, состоящей из остатка, прилегающего к области CDR, из остатка на участке гликозилирования, из редкого остатка, из остатка, способного взаимодействовать с PGE2; из остатка, способного взаимодействовать с областью CDR, из канонического остатка, из остатка, расположенного на границе контакта вариабельной области тяжелой цепи и вариабельной области легкой цепи, из остатка внутри зоны Верньера, а также из остатка в области перекрывания между определяемой Чотиа CDR1 вариабельной области тяжелой цепи и определяемой Кабатом первой каркасной области тяжелой цепи. В одном из аспектов человеческая акцепторная каркасная область содержит, по меньшей мере, одну замену аминокислотного остатка в каркасной области, при этом аминокислотная последовательность каркасной области, по меньшей мере, на 65% идентична последовательности человеческой акцепторной каркасной области и содержит, по меньшей мере, 70 аминокислотных остатков, идентичных таковым человеческой акцепторной каркасной области. Для гуманизации антитела 2B5-8.0 аминокислотная замена в положении ключевого остатка каркасной области выбрана из группы, состоящей из замены M (человек) в положении 48 на I (мышь), V (человек) в положении 68 на A (мышь), M (человек) в положении 70 на L (мышь), и T (человек) в положении 72 на V (мышь) в вариабельной области тяжелой цепи; и I (человек) в положении 2 на V (мышь) и V (человек) в положении 3 на L (мышь) в вариабельной области легкой цепи.
Вероятность того, что данный остаток каркасной области будет влиять на связывающие свойства антитела, зависит от его близости к остаткам CDR. Следовательно, с помощью модельных структур остатки, которые отличаются в мышиных и человеческих последовательностях, были ранжированы в соответствии с их отдаленностью от любого атома в CDR, который может с определенной вероятностью контактировать с PGE2. Те остатки, которые находятся в пределах 4,5 Å от любого атома CDR, были идентифицированы как наиболее важные и считались кандидатами на сохранение мышиного остатка в гуманизированном антителе (то есть на обратную мутацию каркасной области).
Для гуманизации вариабельных областей антитела 2B5-8.0 общим подходом, обеспечивающим настоящим изобретением, является следующий. Прежде всего, молекулярная модель вариабельных областей антитела 2B5-8.0 была сконструирована с помощью компьютерных программ ABMOD и ENCAD (Levitt, M., J. Mol. Biol. 168: 595-620 (1983)). Далее, исходя из изучения гомологии с последовательностями человеческих сегментов V и J, сегмент VH1-18 области VH (The Immunoglobulin Facts Book. 2001, authored by Marie-Paule Lefranc and Gerald Lefranc, published byAcademic Press) и сегмент JH4 области J (там же) были отобраны для получения рамок считывания для гуманизации вариабельной области тяжелой цепи для антитела 2B5-8.0. Для вариабельной области легкой цепи антитела 2B5-8.0 были использованы сегмент 01 области VL (там же) и сегмент JK4 области J (там же). Степень идентичности аминокислот каркасной области между областью VH антитела 2B5-8.0 и акцепторными человеческими сегментами VH1-18 и JH4 составляла 80,2%, тогда как степень идентичности между областью VL антитела 2B5-8.0 и акцепторными человеческими сегментами 01 и JK4 составляла 90,3%. Компьютерная модель не давала возможности идентифицировать любые значимые остатки, контактирующие с областями CDR, которые необходимо подвергнуть обратной мутации. Никаких дополнительных замен сделано не было.
Было сконструировано девять различных версий антитела 2B5-8.0, названных HU2B5.1, HU2B5.2, HU2B5.3, HU2B5.4, HU2B5.5, HU2B5.6, HU2B5.7, HU2B5.8 и HU2B5.9. Указанные девять антител отличались, как было описано выше, обратными мутациями в каркасной области в положениях 48, 68, 70, и 72 вариабельной области тяжелой цепи и в положениях 2 и 3 вариабельной области легкой цепи.
CDR мышиного анти-PGE2-антитела 2B5-8.0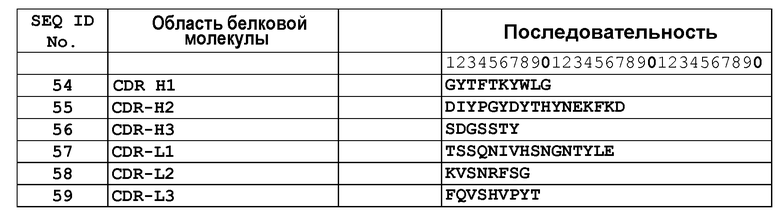
Девять гуманизированных анти-PGE2-антител с CDR антитела 2B5-8.0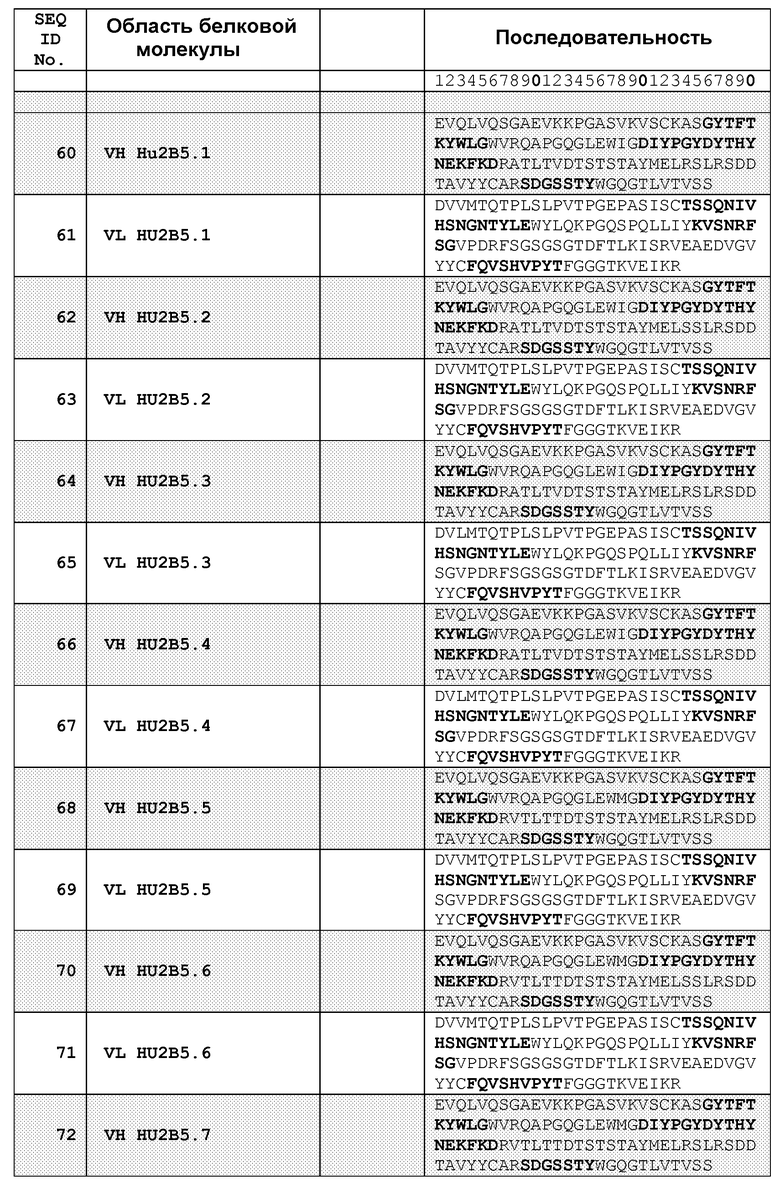
Пример 4.2.2: Конструирование гуманизированных антител
Сконструированные путем компьютерного моделирования гуманизированные антитела, описанные в примере 4.2.1, были сконструированы de novo с помощью олигонуклеотидов. Для кДНК каждой вариабельной области было сконструировано 6 олигонуклеотидов из 60-80 нуклеотидов каждый с перекрыванием друг друга по 20 нуклеотидам на 5'- и/или 3'-конце каждого олигонуклеотида. В реакции отжига все 6 олигонуклеотидов комбинировали, кипятили и отжигали в присутствии дезоксинуклеозидтрифосфата dNTP (дНТФ). ДНК-полимеразу I, большой фрагмент (Кленова) (New England Biolabs #M0210, Beverley, MA.) добавляли для заполнения пробелов приблизительно в 40 п.н. между перекрывающимися олигонуклеотидами. Затем проводили ПЦР для амплификации гена полной вариабельной области с использованием двух наиболее удаленных праймеров, содержащих выступающие последовательности, комплементарные множественному участку клонирования в модифицированных векторах pTT3. Продукты ПЦР, полученные с каждого ансамбля кДНК, разделяли на агарозном геле, и полосу, соответствующую по размеру кДНК предсказанной вариабельной области, извлекали и очищали. Вариабельную область тяжелой цепи встраивали внутри рамки в фрагмент кДНК, кодирующий константную область человеческого IgG1 дикого типа или константную область человеческого IgG1, содержащую 2 аминокислотные мутации в шарнирной области путем гомологической рекомбинации у бактерий. (Zhang, Y et al. Nature Biotechnol. 18(12): 1314-7 (2000)). Указанными мутациями были замена лейцина на аланин в положении 234 (EU-нумерация) и замена лейцина на аланин в положении 235 (Lund et al. J. Immunol., 147: 2657 (1991)). Вариабельную область легкой цепи встраивали внутри рамки в человеческую константную каппа-область путем гомологической рекомбинации. Бактериальные колонии выделили, плазмидную ДНК экстрагировали, и вставки кДНК секвенировали в всей их полноте. Векторы pTT3, содержащие правильные гуманизированные тяжелую и легкую цепи, соответствующие каждому антителу, котрансфицировали в клетки HEK293 для транзиторного продуцирования полноразмерных гуманизированных анти-PGE2-антител. Клеточные супернатанты, содержащие рекомбинантное химерное антитело, очищали хроматографически на протеин А-сефарозе, и связанное антитело элюировали путем добавления 0,1 н. уксусной кислоты/0,15 M NaCl (pH 3,0). Антитела нейтрализовывали и диализовали против PBS.
Пример 4.2.3: Альтернативное конструирование гуманизированных анти-PGE 2 -антител
В данном примере описана гуманизация анти-PGE2-антитела. Гуманизацию мышиного моноклонального антитела 2B5-8.0 проводили в основном в соответствии с методикой Queen, C, et al., Proc. Natl. Acad. Sci USA 86: 10029-10033 (1989). Прежде всего, были идентифицированы человеческие V-сегменты с высокой степенью гомологии с аминокислотными последовательностями VH или VL антитела 2B5-8.0. Далее, последовательности определяющей комплементарность области (CDR), вместе с аминокислотами каркасной области, имеющими важное значение для поддержания структур областей CDR, пересаживали в отобранные последовательности человеческой каркасной области. Кроме того, аминокислоты человеческой каркасной области, которые были обнаружены в качестве редких в соответствующей подгруппе области V, были заменены консенсусными аминокислотами с целью снижения потенциальной иммуногенности.
Для гуманизации вариабельных областей антитела 2B5-8.0 общим подходом, предложенным в настоящем изобретении, был следующий. Во-первых, молекулярная модель вариабельных областей антитела 2B5-8.0 была сконструирована с помощью компьютерных программ ABMOD и ENCAD (Levitt, M., J. Mol. Biol. 168: 595-620 (1983)). Далее, исходя из изучения гомологии с последовательностями человеческих сегментов V и J, сегмент MUC1-1'CL области VH (Griffiths, A.D., et al., EMBO J. 12: 725-734 (1993)) и сегмент JH4 области J (Ravetch, J.V., et al., Cell 27: 583-591 (1981)) были отобраны для получения рамок считывания для вариабельной области тяжелой цепи антитела 2B5-8.0. Для вариабельной области легкой цепи антитела Hu2B5-8.0 были использованы сегмент TR1.37'CL области VL (Portolano, S., et al., J. Immunol. 151: 2839-2851 (1993)) и сегмент JK2 области J (Hieter, P. A., et al., J. Biol. Chem. 257: 1516-1522 (1982)). Степень идентичности аминокислот каркасной области между областью VH антитела 2B5-8.0 и акцепторными человеческими сегментами MUC1-1'CL и JH4 составляла 76%, тогда как степень идентичности между областью VL антитела 2B5-8.0 и акцепторными человеческими сегментами TR1.37'CL и JK2 составляла 84%.
В положениях каркасной области, в которых компьютерная модель предполагала значительный контакт с областями CDR, аминокислоты из мышиных V-областей были заменены аминокислотами исходной человеческой каркасной области. Для гуманизации антитела 2B5-8.0 аминокислотная замена в положении ключевого остатка каркасной области выбрана из группы, состоящей из замены M (человек) в положении 48 на I (мышь), R (человек) в положении 67 на K (мышь), V (человек) в положении 68 на А (мышь), I (человек) в положении 70 на L (мышь), и R (человек) в положении 72 на V (мышь) в вариабельной области тяжелой цепи; и D (человек) в положении 75 на V (мышь) в вариабельной области легкой цепи. Кроме того, несколько аминокислот было заменено консенсусными аминокислотами в тех же самых подгруппах человеческого вариабельного домена с целью снижения потенциальной иммуногенности, где указанные аминокислоты включают в себя замену A на T в положении 76 в вариабельной области тяжелой цепи, а также замену E на D в положении 1 и замену L на I в положении 2 в вариабельной области легкой цепи.
Белковые последовательности пересаженных CDR вариабельных доменов (VH и VL из Hu2B5.P1) и вариабельных доменов, в которые были включены все обратные мутации и консенсусные замены (VH и VL из Hu2B5.P2) на основе указанного анализа гуманизации, приведены ниже. В целом понятно, что любая гуманизированная версия с одной или несколькими такими обратными мутациями и консенсусными заменами входид в объем, охватываемый настоящим изобретением. Антитело E содержало VH Hu2B5.P2 и VL Hu2B5.P2; Антитело F содержало VH Hu2B5.P2 и VL Hu2B5.P1; Антитело G содержало VH Hu2B5.P1 и VL Hu2B5.P2; и антитело I содержало VH Hu2B5.P1 и VL Hu2B5.P1.
Гуманизированные анти-PGE2-антитела с областями CDR антитела 2B5-8.0
Пример 4.2.4: Характеристические свойства гуманизированных анти-PGE 2 -антител
Способность очищенных гуманизированных анти-PGE2-антител связываться с PGE2 определяли методом биотин-PGE2 ELISA или методом 3H-PGE2-радиоиммуноанализа, как описано в примере 1.1.A, перекрестную реактивность гуманизированных анти-PGE2-антител определяли путем конкурентных анализов биотин-PGE2 ELISA или 3H-PGE2-радиоиммуноанализов, как описано в примере 1.1.B. Ингибирование активности PGE2 путем гуманизации анти-PGE2-антител определяли с помощью биоанализа EP4, как описано в примерах 1.1.C.
Все гуманизированные анти-PGE2-антитела способны были связываться с PGE2 в анализе биотин-PGE2 ELISA (фигуры 6 и 7; таблица 12). Гуманизированные анти-PGE2-антитела были способны к нейтрализации и блокированию PGE2-опосредованного притока кальция в EP4-FLIPR-анализе. Альтернативным образом сконструированные гуманизированные анти-PGE2-антитела E, F, G и I также способны были связываться с PGE2 в анализе 3H-PGE2-ELISA (таблица 13). Hu2B5.7 был выбран для дальнейшего определения характеристик специфичности связывания простагландина в конкурентных анализах 3H-PGE2 ELISA и продемонстрировал свою специфичность в отношении PGE2 (таблица 13).
Характеристические свойства гуманизированных антител
Характеристические свойства гуманизированных анти-PGE2-антител (продолжение)
Характеристические свойства селективности гуманизированных анти-PGE2-антител Hu2B5.7 в отношении простагландина
(CRI %)
Пример 4.2.4.A: Гуманизированные анти-PGE 2 -антитела блокируют связывание PGE 2 с рецептором PGE 2
Конкурентное ингибирование связывания PGE2 с рецепторами PGE2, например, EP4, под действием анти-PGE2-антитела, может быть определено в анализе связывания рецептора, на основе клеток или на основе мембран, с помощью 3H-PGE2, как описано в примере 1.1.D, а также в FACS-анализе на основе клеток, как описано в примере 1.1.E.
Для терапевтического моноклонального антитела со временем полужизни в сыворотке, составляющим от 10 до 20 дней в мужском организме, концентрация в сыворотке обычно составляет от 5 до 15 мкг/мл, с еженедельным режимом внутривенного или подкожного введения по 3 mpk/кг или же с режимом введения один раз в две недели или реже. Исходя из такого расчета, полагают, что hu2B5.1-Hu2B5.9 в качестве терапевтического моноклонального антитела, вероятнее всего, будут полностью (100%) блокировать связывание PGE2 с EP4 in vivo при концентрации в сыворотке в 100 нМ (или 15 мкг/мл), в условиях обычного режима дозирования моноклонального антитела.
Пример 4.2.5: Био-физико-химическая характеристика гуманизированных анти-PGE 2 -антител
Тестируемые критерии определяли в ряду от обычных параметров, определяющих свойства лекарственных или подобных им средств, такие как параметры, включающие в себя внутреннюю стабильность (дифференциальная сканирующая калориметрия, или DSC), и общей физической и химической стабильности (например, чистота, включая мониторинг фрагментации и агрегации путем SEC).
Аналитические методы, используемые для получения био-физико-химической характеристики:
Пример 4.2.5.1: Эксклюзионная хроматография по размеру (SEC)
Эксклюзионную хроматографию по размеру использовали для разделения белков на основе размера их молекул. Белки переносили в мобильную водную фазу, пропускали через набитую смолой колонку с пористой стационарной фазой. Время удерживания на колонке является функцией гидродинамического размера белка и размера пор в набитой смолой колонке. Молекулы меньшего размера могут проникать через более мелкие поры в смоле и удерживаются в ней дольше, чем более крупные молекулы. При элюции с колонки производят детектирование указанных белков по УФ-поглощению. В методе SEC, или гель-фильтрации, использовали системы защиты TSK gel guard (TOSOH Biosciences, Montgomeryville, PA, cat. no. 08543) и TSK gel G3000SWxL (TOSOH Biosciences, Montgomeryville, PA, cat. no. 08541). Мобильная фаза соответствовала 100 мМ Na2HPO4, 200 мМ Na2SO4, pH 7,0. Скорость тока составляла 0,3 мл/минуту. Вводимый объем составлял 20 мкл образца с концентрацией 1 мг/мл. Температура колонки соответствовала комнатной температуре. Температура автосэмплера составляла 2-8°C. Полное время прогона составляло 50 минут. Детектирование было основано на УФ-поглощении при длине волны 214 нм, с шириной полосы в 8 нм, против поглощения при длине волны 360 нм, с шириной полосы в 100 нм.
Пример 4.2.5.1: Дифференциальная сканирующая калориметрия (DSC)
Теплостабильность анти-PGE2-антител устанавливали с помощью инструментария DSC. Использованным инструментарием DSC служил автоматизированное оснащение VP-DSC с капиллярной ячейкой (Microcal, GE Healthcare Ltd./Microcal, Buckinghamshire, UK). Развертку белков изучали путем сканирования со скоростью 1°C/минуту в интервале температур от 25°C до 95°C в образцах с концентрацией 1 мг/мл. Дополнительно предпринятыми измеряемыми параметрами являлись подгоняемый период в 16 секунд, время предварительного сканирования в 10 минут, и измерения были предприняты в режиме без обратной связи. Для индивидуального измерения штатив для проб для проведения измерений DSC заполняли 420 мкл образца/холостой пробы, при этом планшет заполняли по указанной ниже схеме. Полученные термограммы подгоняли к недвухуровневой модели для получения срединных значений температур и энтальпий различных переходов.
Дополнительным требованием для успешного исследования биологического препарата-кандидата является то, что белок должен сохранять свое нативное состояние и конформацию. Белок в водном растворе находится в равновесии между своей нативной (пространственно упакованной) конформацией денатурированной (неупакованной) конформацией. Стабильность нативного состояния основана на величине свободной энергии Гиббса (DG) системы, а термодинамическое соотношение между энтальпией (DH) и энтропией (DS) изменяется. Положительная величина DG указывает на то, что нативное состояние является более стабильным, чем денатурированное состояние - чем больше положительная величина DG, тем больше стабильность. Для того чтобы белковая молекула развернулась, необходимо разрушить стабилизирующие силы. Конформационная энтропия превосходит стабилизирующие силы, позволяя белку развернуться при температурах, при которых энтропия становится доминирующей. При DSC измеряют DH белка, разворачивающегося в результате тепловой денатурации. В качестве общего правила можно утверждать, что чем выше срединная точка перехода (Tm), тем более стабилен белок при низких температурах. В процессе того же самого эксперимента метод DSC позволяет измерить также изменение в теплоемкости (DCp) при денатурации белка. Изменения теплоемкости, ассоциированные с неупакованной конформацией белка, происходят в первую очередь за счет изменений в гидратации боковых цепей, которые в нативном состоянии были спрятаны, но становятся доступными для растворителя в денатурированном состоянии. Было показано, что метод DSC позволяет делать оценочные предсказания относительно стабильности белков и других биологических макромолекул в жидкой композиции (Remmele, R.L. Jr., Gombotz, W.R., BioPharm 13, 36-46, 2000; а также Remmele, R.L. Jr., Nightlinger, N.S., Srinivasen, S., Gombotz, W.R., Pharm. Res. 15, 200-208, 1998).
Пример 4.2.6: Стабильность гуманизированного анти-PGE 2 -антитела Hu2B5.7 в процессе клональной селекции
Пример 4.2.6.A: Стабильность гуманизированного анти-PGE 2 -антитела Hu2B5.7, определяемая с помощью методов DSC и SEC
Стабильность серий клонов (то есть анти-PGE2-антител) родительского анти-PGE2-антитела устанавливали путем определения внутренней термодинамической стабильности клона с помощью метода DSC (концентрация клона 0,79 мг/мл, при этом клон образован в условиях при pH 6 в 10 мМ цитратном буфере, 10 мМ фосфатном буфере) и с применением ускоренного скрининга стабильности (концентрация клона 0,79 мг/мл, клон образован при pH 6 в 10 мМ цитратном буфере, 10 мМ фосфатном буфере, в течение 7 дней при 50°С), при этом мониторинг стабильности клона осуществляли методом SEC (таблица 15).
Образование агрегатов и фрагментов в вариантах Hu2B5.1 - Hu2B5.9 образцов клонов гуманизированного антитела Hu2B5, определяемое методом SEC (начало исследования стабильности)
Образование агрегатов и фрагментов в вариантах Hu2B5.1 - Hu2B5.9 образцов клонов гуманизированного антитела Hu2B5, определяемое методом SEC (7 дней хранения при 50°С)
В таблицах 15 и 16 представлены полученные методом SEC результаты тестирования гуманизированных анти-PGE2-антител после их хранения вплоть до 7 дней, которые демонстрируют уровень мономеров вначале и в конце ускоренного скрининга стабильности. У Hu2B5.7 и Hu2B5.9 выявлены наиболее высокие уровни мономеров через 7 дней ускоренного скрининга стабильности. Результаты, приведенные в таблице 17, показывают, что клон hu2B5.7 также имеет очень благоприятный профиль внутренней стабильности (данные DSC) по сравнению с другими клонами данной панели (например, Hu2B5.4).
Антителу IgG обычно присуще три конформационных перехода (Tm): конформационный переход интактного антитела ассоциирован с плавлением CH2-домена в Fc-фрагменте, плавлением CH3-домена в Fc-фрагменте и с плавлением Fab-фрагмента. Чтобы выбрать анти-PGE2-антитела с требуемыми свойствами, подобными свойствам лекарственных средств, были отобраны клоны с высокими значениями Tm и высокой внутренней стабильностью, такие как Hu2B5.7 (таблица 17).
Определение внутренней клональной термодинамической стабильности клонов гуманизированных анти-PGE2-антител путем DSC (концентрация клонального антитела 0,79 мг/мл, составленного при pH 6 в 10 мМ цитратном буфере, 10 мМ фосфатном буфере)
Пример 4.2.6.B: Капиллярно-зональный электрофорез клонов Hu2B5.1-Hu2B5.9
Капиллярно-зональным электрофорезом является метод капиллярного электрофореза, при котором капилляр заполнен буфером, и механизм разделения молекул основан на различиях в электрофоретической подвижности анализируемого вещества внутри буфера. Электрофоретическая подвижность молекулы связана с соотношением заряда и размера. Для анализа методом капиллярно-зонального электрофореза (CZE) была использована система Beckman-Coulter ProteomeLab PA 800 (Beckman Coulter, Fullerton, CA). Использовали нейтральный капилляр (eCAP neutral, с общей длиной 56 см, 50 мкм I. D. Beckman-Coulter, P/N 477441, Fullerton, CA). В данном методе использовали капилляр в 30,2 см с окошком для детектирования в 20,2 см из входного отверстия для ввода образца. Подвижный буфер представлял собой 100 мМ EACA (6-аминокапроновая кислота, Sigma A7824- 100 G, St. Louis, MO) с 0,1% MC (из 1%-го раствора метилцеллюлозы, Convergent Bioscience, cat# 101876, Toronto, ON, Canada), pH 5,5.
Полученные результаты показали, что движение Hu2B5.1, Hu2B5.3, Hu2B5.5, Hu2B5.7, Hu2B5.9 свидетельствовало об их более щелочном характере (например, время их миграции было короче), чем Hu2B5.2, Hu2B5.4, Hu2B5.6, Hu2B5.8. Это можно отнести за счет того факта, что все из клонов Hu2B5.1, Hu2B5.3, Hu2B5.5, Hu2B5.7, Hu2B5.9 имеют аминокислоту R в тяжелой цепи в положении аминокислоты 84, тогда как остальные четыре образца в том же самом положении имеют аминокислоту S. Во всех этих девяти образцах были обнаружены главный пик, а также минорные кислотные и основные компоненты, и никаких особых различий между указанными образцами в их распределении обнаружено не было.
Пример 4.3: Кристаллизация Hu2B5.7, находящегося в комплексе с PGE 2
Fab-фрагмент Hu2B5.7 образует комплекс с PGE2, и кристаллы указанного комплекса получают следующим образом.
Пример 4.3.1: Получение и очистка Fab-фрагмента Hu2B5.7
Для получения Fab-фрагмента сначала IgG Hu2B5.7 концентрировали в 0,15 M буфере до 2 мг/мл с помощью устройства корзиночной центрифуги с фильтрующей поверхностью Ultrafree-15 Biomax (Millipore) с номинальным отсечением по молекулярной массе в 10 кДа (MWCO). Пастообразную смесь папаинового геля (Pierce) предварительно промывали и вносили в 2-3X буфер A (20 мМ Na2HPO4, 10 мМ ЭДТА, 20 мМ цистеина) в объемном соотношении 1:1. Затем концентрированное антитело смешивали с 50%-ой смеси папинового геля и инкубировали при 37°C в течение 24 часов при энергичном встряхивании. Смесь антитело/пастообразный гель центрифугировали (Beckman 6KR), и супернатант наносили на предварительно уравновешенную буфером PBS колонку сефадекс-75. Основной пик элюировали, и собирали белок. 25 мл протеин A-сефарозы на хроматографической колонке 4 Fast Flow (Amersham Pharmacia) получали путем промывания 100 мл буфера PBS. Собранные фрагменты антитела наносили на колонку аффинной хроматографии (скорость потока 2 мл/мин). В потоке собирали фракции, содержащие Fab-фрагменты Hu2B5.7 (мониторинг осуществляли путем УФ-поглощения при 280 нм). Фракции, содержащие Fab-фрагменты Hu2B5.7 в концентрации выше чем 0,3 мг/мл (определяемой УФ-поглощением при 280 нм), собирали и замораживали при -80°C. Степень чистоты образцов устанавливали методом ДСН-ЭФ на ПААГ.
Пример 4.3.2: Получение комплекса PGE 2 /Fab-фрагмент Hu2B5.7
PGE2 и белок Fab-Hu2b5.7 смешивали в молярном соотношении 1 : 1 и инкубировали в течение 1 часа при 4°C. Комплексный образец наносили на предварительно уравновешенную (20 мМ трис, pH 7,5, 150 мМ NaCl) колонку с сефадексом-200 при скорости 0,5 мл/минуту. Указанный комплекс собирали и концентрировали до 24 мг/мл с помощью устройства корзиночной центрифуги с фильтрующей поверхностью Ultrafree-15 Biomax (Millipore) с номинальным отсечением по молекулярной массе в 10 кДа (MWCO) и замораживали при -80°C. Степень чистоты образца устанавливали методом ДСН-ЭФ на ПААГ.
Пример 4.3.3: Кристаллизация комплекса PGE 2 /Fab-фрагмент Hu2B5.7
Замороженный маточный раствор комплекса PGE2/Hu2B5.7 (≈ 24 мг/мл) подвергали оттаиванию на льду. Указанный комплекс (1,0 мкл) смешивали с 1,0 мкл коллекторного раствора (1,75 M сульфата аммония, 100 мМ MES, pH 6,5, 10 мМ CaCl2). Полученную каплю смешивали в резервуаре с лункой сидячей капли (CrysChem sitting-drop plate) приблизительно при 18°C. Не позднее чем через неделю обычно появлялись бриллиантообразные кристаллы.
Пример 4.3.4: Криозащита и мгновенное замораживание кристаллического комплекса PGE 2 /Fab-фрагмент Hu2B5.7
Кристаллы комплекса PGE2/Fab-фрагмент Hu2B5.7 собирали, используя для этого оптическое волокно по способу петли в маточном растворе + 20% глицерина. Затем указанные кристаллы мгновенно замораживали путем их погружения в жидкий азот.
Пример 4.3.5: Сбор данных по дифракции рентгеновских лучей комплексом PGE 2 /Fab-фрагмент Hu2B5.7
Данные по дифракции рентгеновских лучей на кристаллах PGE2/Fab-фрагмент Hu2B5.7 получали при IMCA-отводе частиц из накопительного кольца на мишень на установке Advanced Photon Source in Argonne, IL. В процессе сбора данных кристаллы поддерживали при температуре 100°K с помощью криосистемы охлаждения Oxford Cryosystems Cryostream. Всего получено 180 кадров при диапазоне колебаний в 1,0°. Полученные данные обрабатывали с помощью пакета программ HKL2000 (Otwinowski and Minor, 1997). После определения ориентации кристаллов полученные данные интегрировали с помощью DENZO и переводили в определенный масштаб и объединяли с помощью SCALEPACK, после чего наносили на абсолютную шкалу и пересчитывали с учетом амплитуды коэффициента устойчивости структуры с помощью TRUNCATE (French and Wilson, 1978). Было зафиксировано пять процентов уникальных рефлексов в произвольной последовательности для "свободного" набора для вычисления свободного R-фактора (Rfree) (Brunger, 1992); остальные 95% рефлексов составляли "рабочий" набор для вычисления R-фактора (R).
Пример 4.3.6: Расчет молекулярного замещения и обработка кристаллической структуры комплекса PGE 2 /Fab-фрагмент Hu2B5.7
Расчет молекулярного замещения с максимальной вероятностью определяли с помощью программы PHASER (Read, 2001). Всего шесть мономеров PGE2/Hu2B5.7 было допустимо в соответствующей пространственной группе при разрешении в 3,0 Å. Исследуемой моделью являлась кристаллическая структура Fab-фрагмента, обсуждаемая выше (Protein Data Bank entry 1BJ1; Muller et al. 1998). Координаты получены на основе расчета молекулярного замещения.
Обработку кристаллической структуры комплекса PGE2/Fab-фрагмент Hu2B5.7 начинали с расчета координат молекулярного замещения, описанного выше, в соответствующей пространственной группе. Обработка начинается с обработки твердого тела с помощью программы REFMAC, доступной в пакете программ CCP4 (Murshudov et al., 1997, Collaborative Computational Project, 1994). Наблюдали электронную плотность PGE2 de novo. При построении вручную PGE2 из шести мономеров ориентировались на общедоступную ЯМР-структуру IUZ PGE2 (Moy et al., 2001), пользуясь молекулярной графической программой O (Jones et al., 1991) и просмотром карт электронной плотности 2Fo-Fc и Fo-Fc. Программа обработки REFMAC (Murshudov et al., 1997) использовалась для повторных циклов ограничительной обработки, дающей следующую статистику: R порядка 25,8% (Rfree 30,5%).
Пример 5.0: Анализ фармакокинетики
Пример 5.1: Анализ фармакокинетики рекомбинантных мышиных анти-PGE 2 -антител
Фармакокинетические исследования с использованием мышиного антитела mAb 2B5.8.0 проводили на крысах Sprague Dawley и мышах Balb/C. Самцам и самкам крыс и мышей вводили внутривенно или внутрибрюшинно (только мышам) однократную дозу в 4 мг/кг антитела 2B5.8.0, и образцы сыворотки подвергали анализу с помощью антигенной ловушки на основе метода хемилюминесценции MSD (Meso Scale Discovery), (Meso Scale Discovery, Gaithersburg, Maryland). Фармакокинетические параметры рассчитывали путем некомпартментного анализа с использованием WinNonlin.
Пример 5.1.1: Анализ, используемый для количественного определения 2B5.8.0 при фармакокинетических исследованиях на образцах сыворотки
Для измерения концентрации антитела в сыворотке крыс и мышей использовали следующий анализ MSD. MSD-стрептавидиновые планшеты (Meso Scale Discovery, Gaithersburg, MD) промывали забуференным фосфатом физиологическим раствором, содержащим 0,05% Tween-20 (Sigma, St. Louis, MO). Планшеты блокировали 250 мкл/лунку блокирующего раствора (MSD Block, Meso Scale Discovery, разбавленного до конечной концентрации 3% в PBS) в течение 1 часа, закрывали и встряхивали (600 об/мин) при комнатной температуре. После промывания к каждой лунке добавляли по 70 мкл биотинилированного PGE2 (простагландин E2-биотинамид, Cayman Chemical, Ann Arbor, Michigan, cat# 10006987, lot# 190831-191028, 0,01 мкг/мл в буфере для анализа). Планшеты закрывали и инкубировали в течение 1 часа, при встряхивании (600 об/мин), при комнатной температуре.
Перед анализом образцы сывороток крыс и мышей подвергали оттаиванию на льду, осторожно перемешивали и центрифугировали при 14,000 об/мин в течение 3 минут при 4°C в эппендорфовской центрифуге. Стандартная кривая и контрольные образцы были получены на крысиной и мышиной сыворотках. Автоматизированная жидкостная платформа для обработи вручную, Tecan Evo automated liquid handling station, была использована для разбавления стандартной кривой, высоких, средних и низких контролей, а также образцов сыворотки, в буфере для анализа, при поддержании постоянной 1% конечной концентрации сыворотки. Планшеты MSD вновь промывали, и к ним добавляли (по 70 мкг/лунку) исследуемые образцы, образцы стандартных кривых и холостые контроли, а также высокие, средние и низкие контроли. Планшеты закрывали и инкубировали в течение 1 часа, при встряхивании (600 об/мин), при комнатной температуре.
После инкубации планшеты MSD промывали, и к каждой лунке добавляли по 70 мкл меченного сульфогруппой козьего антитела против мышиного IgG (Meso Scale Discovery; разбавленного до 1 мкг/мл буфером для анализа). Планшеты MSD закрывали и инкубировали в течение 1 часа, при встряхивании (600 об/мин), при комнатной температуре, затем планшеты промывали и обрабатывали 2x буфером для считывания (Meso Scale Discovery). Хемилюминесценцию измеряли в течение десяти минут на визуализирующей установке MSD Sector Imager 6000.
Стандартные кривые анализировали с помощью четырехпараметрической логистической приставки, и концентрации образцов вычисляли, используя программное обеспечение XLfit4 версии 2.2.1 Build 16 (Microsoft Corporation, Redmond, WA). Фармакокинетические параметры рассчитывали для каждого животного с помощью программного обеспечения Winonlin версии 5.0.1 (Pharsight Corporation, Mountain View, CA) путем некомпартментного анализа.
Пример 5.1.2: Фармакокинетические исследования 2B5.8.0, проведенные на крысах SD и мышах Balb/C
Хирургически измененных (с канюлированной яремной веной, JVC) и нормальных самцов и самок крыс Sprague-Dawley (приблизительно семинедельного возраста, весящих 240-390 граммов) закупали в компании Charles River Laboratories (Wilmington, MA). Животных размещали в помещениях, в которых поддерживалась постоянная температура и влажность, а также 12-часовой цикл света/темноты, им давали обычный корм для грызунов, и они имели неограниченный доступ к пище и воде. Проводили ежедневный мониторинг уровня гидратации и клинического состояния животных.
Самцов и самок мышей Balb/c (весящих приблизительно 0,025 кг) закупали в компании Charles River Laboratories (Wilmington, MA). Животные имели неограниченный доступ к пище и воде. Образцы крови (по 0,2 мл у крыс через хвостовую вену и путем пункции сердца у мышей) собирали в разных временных точках (по 5 мышей на каждую временную точку), в течение 30 минут при комнатной температуре дожидались образования сгустка, центрифугировали в течение 3 минут при 13,200 об/мин, сыворотку переносили в эппендорфовские пробирки и замораживали при -80°C.
После внутривенного введения крысам антитело 2B5.8.0 проявляло двойной распад по экспоненциальному закону, типичный для антител. Клиренс 2B5.8.0 и объемы распределения в организме были низки (таблица 18), а время полужизни было длительным, T1/2: 9,1 и 8,9 дней (соответственно, для самцов и самок). В отличие от самцов, среди самок наблюдали большую вариабельность между животными.
После внутривенного введения мышам Balb/C антитело 2B5.8.0 обнаружило очень длительное время полужизни (26,3 и 16,2 дня, соответственно, у самцов и самок), с низким клиренсом и объемами распределения (таблица 18). После внутрибрюшинного введения у мышей в ранних временных точках наблюдали большую вариабельность между животными среди самок. Поглощение было медленным, с высоким показателем Cmax порядка 37-49 нг/мл, достигаемым за 1-2 дня. Время полужизни было длительным (13,8-16,1 дней), и биодоступность была хорошей (65,8-72,0%).
Основные параметры фармакокинетики антитела 2B5.8.0 у крыс Sprague-Dawlev и мышей Balb/C
Пример 5.1.3: Фармакокинетический анализ рекомбинантных гуманизированных анти-PGE 2 -антител hu2B5.7 и hu2B5.4
Фармакокинетические исследования с антителами hu2B5.7 и hu2B5.4 проводили на крсах Sprague Dawley. Самцам крыс внутривенно вводили однократную дозу в 4 мг/кг hu2B5.7 и hu2B5.4, и образцы сыворотки подвергали анализу с помощью антигенной ловушки на основе метода хемилюминесценции MSD (Meso Scale Discovery). Фармакокинетические параметры рассчитывали путем некомпартментного анализа с использованием WinNonlin.
Пример 5.1.3.1: Анализ, используемый для количественного определения Hu2b5.7 при фармакокинетических исследованиях на образцах сыворотки
Для измерения концентраций hu2B5.7 и hu2B5.4 в сыворотке крыс использовали следующий анализ MSD.
MSD-стрептавидиновые планшеты (Meso Scale Discovery) промывали забуференным фосфатом физиологическим раствором, содержащим 0,05% Tween-20 (разведенным из 10X PBS, Abbott Bioresearch Center, Media Room, Worcester, MA, и Tween-20, Sigma, St. Louis, MO). Планшеты блокировали 250 мкл/лунку блокирующего раствора (MSD Block, Meso Scale Discovery, разбавленного до конечной концентрации 3% в PBS) в течение 1 часа, закрывали и встряхивали (600 об/мин) при комнатной температуре. После промывания к каждой лунке добавляли по 70 мкл биотинилированного PGE2 (простагландин E2-биотинамид, Cayman Chemical, Ann Arbor, Michigan, cat# 10006987, lot# 190831-191028, 0,01 мкг/мл в буфере для анализа). Планшеты закрывали и инкубировали в течение 1 часа, при встряхивании (600 об/мин), при комнатной температуре.
Перед анализом образцы сывороток крыс подвергали оттаиванию на льду, осторожно перемешивали и центрифугировали при 14,000 об/мин в течение 3 минут при 4°C в эппендорфовской центрифуге. Стандартная кривая и контрольные образцы были получены на крысиной сыворотках. Автоматизированная жидкостная платформа для обработи вручную, Tecan Evo automated liquid handling station, была использована для разбавления стандартной кривой, высоких, средних и низких контролей, а также образцов сыворотки, в буфере для анализа, при поддержании постоянной 1% конечной концентрации сыворотки. Планшеты MSD вновь промывали, и к ним добавляли (по 70 мкг/лунку) исследуемые образцы, образцы стандартных кривых и холостые контроли, а также высокие, средние и низкие контроли. Планшеты закрывали и инкубировали в течение 1 часа, при встряхивании (600 об/мин), при комнатной температуре.
После инкубации планшеты MSD промывали, и к каждой лунке добавляли по 70 мкл меченного сульфогруппой козьего антитела против человеческого IgG (Meso Scale Discovery; разбавленного до 1 мкг/мл буфером для анализа). Планшеты MSD закрывали и инкубировали в течение 1 часа, при встряхивании (600 об/мин), при комнатной температуре, затем планшеты промывали и обрабатывали 2x буфером для считывания (Meso Scale Discovery). Хемилюминесценцию измеряли в течение десяти минут на визуализирующей установке MSD Sector Imager 6000.
Стандартные кривые анализировали с помощью четырехпараметрической логистической приставки, и концентрации образцов вычисляли, используя программное обеспечение XLfit4 версии 2.2.1 Build 16 (Microsoft Corporation, Redmond, WA). Фармакокинетические параметры рассчитывали для каждого животного с помощью программного обеспечения Winonlin версии 5.0.1 (Pharsight Corporation, Mountain View, CA) путем некомпартментного анализа.
Пример 5.1.3.2: Фармакокинетические исследования, проведенные на крысах Sprague-Dawley
Хирургически измененных (с канюлированной яремной веной, JVC) самцов крыс Sprague-Dawley (приблизительно семинедельного возраста, весящих 240-390 граммов) закупали в компании Charles River Laboratories (Wilmington, MA). Животных размещали в помещениях, в которых поддерживались постоянная температура и влажность, а также 12-часовой цикл света/темноты, им давали обычный корм для грызунов, и они имели неограниченный доступ к пище и воде. Проводили ежедневный мониторинг уровня гидратации и клинического состояния животных.
По 0,2 мл бразцов крови брали у крыс в разных временных точках, в течение 30 минут при комнатной температуре дожидались образования сгустка, центрифугировали в течение 3 минут при 13,200 об/мин, сыворотку переносили в эппендорфовские пробирки и замораживали при -80°C.
После внутривенного введения в концентрациях hu2B5.7 и hu2B5.4 в сыворотке проявлялся двойной распад по экспоненциальному закону, типичный для антител. Клиренсы hu2B5.7 и hu2B5.4 и объемы распределения были низки (таблица 18), а время полужизни было длительным, T1/2: 12,4 дней для обоих антител (таблица 19). Приблизительно через 10-14 дней у нескольких животных было обнаружено необъяснимое падение концентраций hu2B5.7 в сыворотке. Возможно, такие неожиданные падения концентрации можно объяснить развитием антительной реакции против лекарственных антител (ADA); однако эта версия не подтвердилась. Животные с возможными ADA-ответами были изъяты при окончательных расчетах фармакокинетики.
Основные фармакокинетические параметры hu2B5.7 и hu2B5.4 у самцов крыс Sprague-Dawlev после введения внутривенной дозы в 4 мг/кг
Пример 4.4: In vivo эффективность рекомбинантного мышиного и гуманизированного антител против PGE 2
Эффективность in vivo антител против PGE2 устанавливали следующим образом.
Пример 4.4.1: In vivo эффективность мышиного и гуманизированного антител против PGE 2 на модели каррагинан-индуцированного отека подушечки стопы
Индуцированный каррагинаном отек подушечки стопы является острой моделью врожденной функции иммунитета у грызунов. Эффективность in vivo мышиного антитела против PGE2, 2B5-8.0, устанавливали на модели каррагинан-индуцированного отека подушечки стопы. Индукцию воспаления лапы под действием каррагинана предпринимали подобно тому, как было описано ранее (Joseph P. Portanova, et al. J. Exp. Med. 184: 883-891 (1996)). Внутрикожная (в/к) инъекция воспалительного средства вызывала быстрый приток нейтрофилов и водянки, с наступлением пика приблизительно через 4 часа, с последующим притоком макрофагов и моноцитов, пик которых приходился приблизительно на 48 часов. Мышей C57.BL/6 (8-10-недельного возраста, Jackson Laboratories, Bar Harbor, ME) внутрикожно инъецировали в тыльную часть подушечки стопы 30 микролитрами либо PBS (слева), либо λ-каррагинаном (Sigma Aldrich, St. Louis, MO) в PBS (справа) в концентрации 5,0 мг/мл (150 мкг/мышь). Утолщение тыльной части подушечки стопы измеряли с поощью красящего пружинного штангенциркуля модели #310-119 исходно (время=0) и через 4 часа после сенсибилизации каррагинаном. Значительные различия в толщине лапы были обнаружены при сравнении среднего отека лапы для каждой из обрабатываемых групп по сравнению с наполнителем, согласно двустороннему t-тесту Стьюдента. Мышей титровали дозами анти-PGE2-антитела (2B5-8.0) внутрибрюшинно (в/б) за 18 часов до сенсибилизации каррагинаном или индометацином, перорально, за 2 часов до сенсибилизации. Измеренной конечной точкой было измерение разницы в распухании (отеке) лапы между правой и левой лапами через 4 часа после обработки. Анти-PGE2-антитело ингибировало отек лапы дозо-зависимым образом, и максимальное ингибирование отека лапы на 40-50% достигалось при 10 мг/кг, по сравнению с максимальным ингибированием, достигаемым под действием индометацина (таблица 20).
Распухание лапы в мышиной модели индуцированного каррагинаном отека подушечки стопы после обработки антителом
(10 мг/кг, в/б)
Пример 4.4.2: Эффективность in vivo мышиных и гуманизированных анти-PGE 2 -антител на модели индуцированной каррагинаном гипералгезии
Эффективность in vivo мышиного анти-PGE2-антитела 2B5-8.0 и гуманизированного анти-PGE2-антитела Hu2B5.7 устанавливали путем определения индуцированной каррагинаном гипералгезии. Индукцию воспаления лапы под действием каррагинана вызывали так, как было описано ранее (Joseph P. Portanova, et al. J. Exp. Med. 184: 883-891 (1996)). Гипералгезию индуцировали путем инъецирования 0,1 мл 0,1% раствора каррагинана в стерильном физиологическом растворе (FMC Corp., Rockland, ME) в подушечку задней лапы 200-граммового самца крысы Sprague Dawley (Charles River Laboratories, Portage, ME). У тех же животных вызывали ответ в виде гипералгезии путем тепловой стимуляции по методу Hargreaves et al. Pain. 32: 77-88 (1988)). Задние лапы подвергали действию теплового излучения, испускаемого проекционной электрической лампой высокой интенсивности через выбранные промежутки времени после инъекции. Количество времени, в течение которого каждую заднюю лапу подвергали воздействию указанного источника тепла, измеряли с точностью до 0,1 сек. Ответ в виде гипералгезии выражали в виде разницы между латентным периодом ожидания в случае инъецированных каррагинаном и инъецированных физиологическим раствором лап каждого животного. В некоторых экспериментах крысам через ротовой зонд вводили индометацин в 0,5% метилцеллюлозе/0,025% твин-80 (Sigma Chemical Co., St. Louis, MO) за 1 час до введения каррагинана. Другим крысам внутрибрюшинно инъецировали мышиное моноклональное анти-PGE2-антитело, 2B5-8.0, или гуманизированное анти-PGE2-антитело, Hu2B5.7, или же подобранное соответствующее по изотипу антитело за 18 часов до инъекции каррагинана.
Пример 4.4.2: Эффективность in vivo мышиных анти-PGE 2 -антител при индуцированном коллагеном артрите
Бычий коллаген II типа (лиофилизированный) был получен из Университета штата Юта (Salt Lake City, UT). Самцов мышей DBA/J (8-10-недельного возраста, Jackson Laboratories, Bar Harbor, ME) иммунизировали внутрикожно у основания хвоста 100 микролитрами эмульсии, содержащей 100 мкг бычьего коллагена II типа, растворенного в 0,1 н. уксусной кислоте и 100 мкг инактивированной нагреванием Mycobacterium tuberculosis H37Ra (полный адъювант Фрейнда, Difco, Laurence, KS). Через двадцать один день после иммунизации коллагеном мышей в/б стимулировали 1 миллиграммом зимозана A (Sigma, St. Louis, MO). После стимуляции проводили ежедневный мониторинг мышей на предмет обнаружения артрита. Каждую лапу оценивали в соответствии со следующими критериями: 0 = норма; 1 = распухание с одной стороны, подошвы или лодыжки; 2 = распухание и подошвы, и лодыжки; и 3 = анкилоз. Оценочные баллы суммировали для каждого животного, и полученное в итоге среднее значение по всем животным в каждой группе выражали в виде показателя MAS (mean arthritic score). Помимо клинической оценки, мышей оценивали также в отношении наличия отека лапы, определяемого с помощью штангенциркуля Dyer spring calipers model #310-119. Мышей вносили в список исследуемых животных между 24 и 28 днями при появлении первых клинических признаках заболевания. В конце эксперимента отбирали по 6 лап из каждой группы и хранили в 10% нейтральном забуференном формалине для компьютерной микро-томографии и гистологии.
Компьютерную микро-томографию осуществляли на установке Scanco µCT-40 unit (Scanco Medical AG) при пиковом напряжении в 60 киловольт и при 160 мкA. Задние лапы (которые хранились в 70% этаноле) закрепляли в трубках для визуализации, и измеряли объем кости предплюсны в 1,8-миллиметровом сечении мышиной лодыжки от основания большеберцовой кости к суставу предплюсны/метатарзальному суставу, при разрешении в 18 мкм. Затем необработанную картину компьютерной микротомографии анализировали с помощью оценочной программы Scanco AG µCT Evaluation program.
Для гистопалогических анализов делали срезы фиксированных в формалине лап и окрашивали их гематоксилином Gills 3 (Richard-Allan Scientific, Kalamazoo, MI) и эозином с флоксином (Newcomer Supply, Middleton, MI). Тяжесть заболевания оценивали гистологически, пользуясь следующими критериями: 0 = норма; 1 = минимальные изменения; 2 = слабые изменения; 3 = умеренные изменения; и 4 = значительные изменения. Оценочные баллы суммировали для каждого животного, и итог выражали в виде среднего значение по всем животным в каждой группе.
Терапевтический эффект отдельно анти-PGE2-антитела оценивали на индуцированных коллагеном артритах у мышей (самцы DBA/1J), стандартной модели человеческого ревматоидного артрита. Обработку лекарственным средством начинали после того как у мышей развились признаки заболевания артритом после иммунизации бычьим коллагеном II типа. Клинические признаки артрита оценивали у мышей визуально, и результаты выражали в виде средней оценки артрита в баллах (MAS). Отечность лапы и показатель MAS, в отношении которых проводили мониторинг, также были представлены в виде площади под кривой (AUC, area under the curve) (Таблица 21). После запуска заболевания обрабортка моноклональным анти-PGE2-антителом 2B5 уменьшала показатель AUC по MAS на 22%.
Оценка заболевания, распухание и объем кости у мышей после обработки анти-PGE2-антителом 2B5-8.0
Пример 4.4.2: Эффективность in vivo мышиных анти-PGE 2 -антител при индуцированном адъювантом артрите
Эффективность in vivo мышиного анти-PGE2-антитела 2B5-8.0 устанавливали на модели индуцированного адъювантом артрита. Артрит индуцировали у самцов крыс Lewis (Harlan, Indianapolis, IN) путем инъекции в подушечку лапы Mycobacterium butyricum в минеральном масле (Difco Laboratories, Detroit, MI), как было описано ранее. Дексаметазон и индометацин (Sigma Chemical Co.) суспендировали в метилцеллюлозе/твине и вводили дважды в день через зонд в дозах 0,1 и 2 мг/кг, соответственно. Антитело 2B5-8.0 и изотипическое контрольное антитело вводили ежедневно в дозе 10 мг/кг путем внутрибрюшинной инъекции. Обработку начинали на день 15-й после инъекции адъюванта и продолжали до последнего измерения объема не подвергнутых инъецированию контралатеральных лап на день 21-й. Мышей тщательно проверяли два раза в неделю на предмет визуального обнаружения признаков артрита в периферических суставах и определяли оценочные баллы в отношении активности заболевания.
Включение посредством ссылки
Содержание всех цитируемых ссылок (включая литературные ссылки, патенты, патентные заявки и вэб-сайты), которые указаны в настоящей заявке, однозначно является включенным в настоящее описание посредством ссылок во всей их полноте, поскольку они являются цитируемыми здесь ссылками. Применение настоящего изобретения будет связано с использованием, если специально не оговорено иначе, общепринятых технологий иммунологии, молекулярной биологии и клеточной биологии, известных в данной области.
Эквиваленты
Настоящее изобретение может быть воплощено в других специфических формах в рамках его концепции или основных характеристик. Таким образом, вышеизложенные воплощения следует во всех отношениях считать иллюстративными, а не ограничивающими объем, охватываемый описанным здесь изобретением. Объем изобретения определяется, таким образом, прилагаемой формулой изобретения, а не приведенным выше описанием, и следовательно, все внесенные изменения, которые не выходят за рамки концепции и являются эквивалентами в рамках заявленной формулы изобретения, считаются входящими в объем настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ CSF-1R | 2009 |
|
RU2547586C2 |
| Антигены, ассоциированные с воспалительным заболеванием кишечника | 2012 |
|
RU2612878C2 |
| IL-17A-СВЯЗЫВАЮЩИЙ АГЕНТ И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2014 |
|
RU2682046C1 |
| ANTI-CXCR4 АНТИТЕЛА И КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВО | 2014 |
|
RU2675516C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ БОЛИ | 2009 |
|
RU2522493C2 |
| АНТИТЕЛА ПРОТИВ TNF-α И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2595379C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2016 |
|
RU2650767C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ УМЕНЬШЕНИЯ АГРЕГАЦИИ МАКРОМОЛЕКУЛ ПРИ ФИЗИОЛОГИЧЕСКИХ УСЛОВИЯХ | 2009 |
|
RU2563823C2 |
| НОВЫЕ МОДУЛЯТОРЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2592672C9 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2010 |
|
RU2570639C2 |





































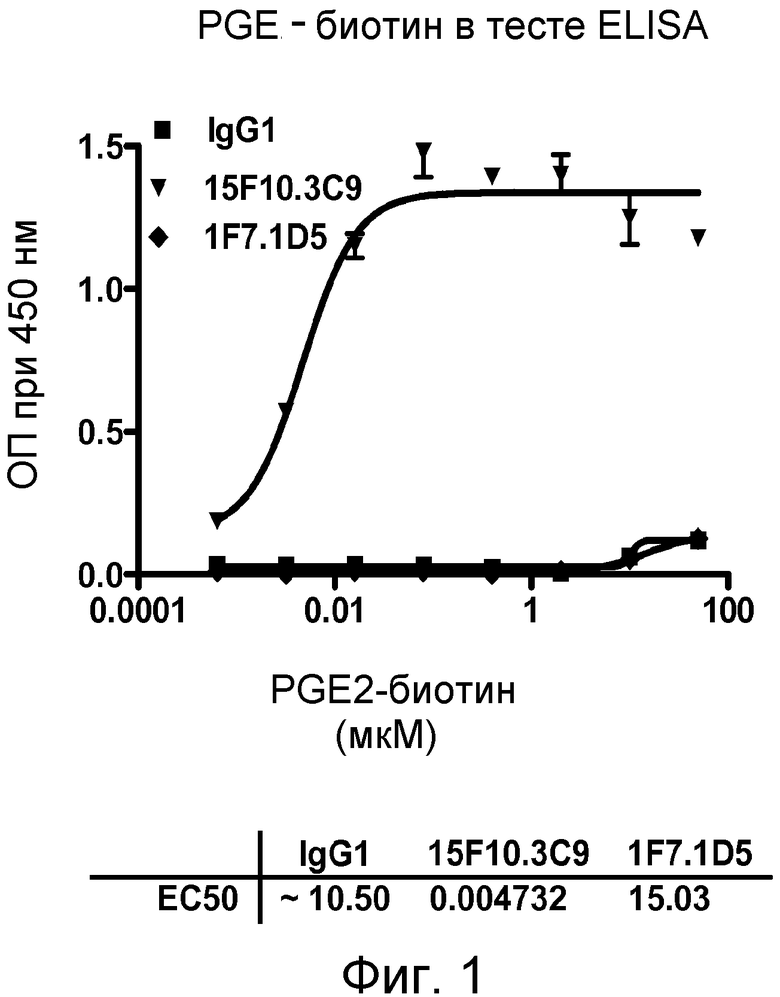
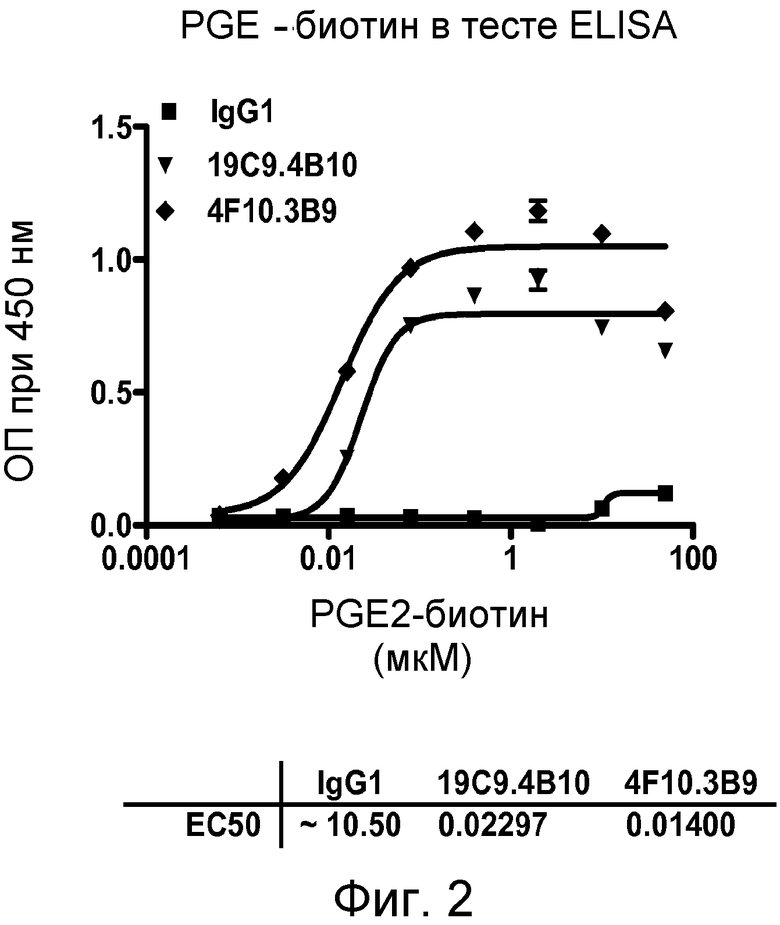
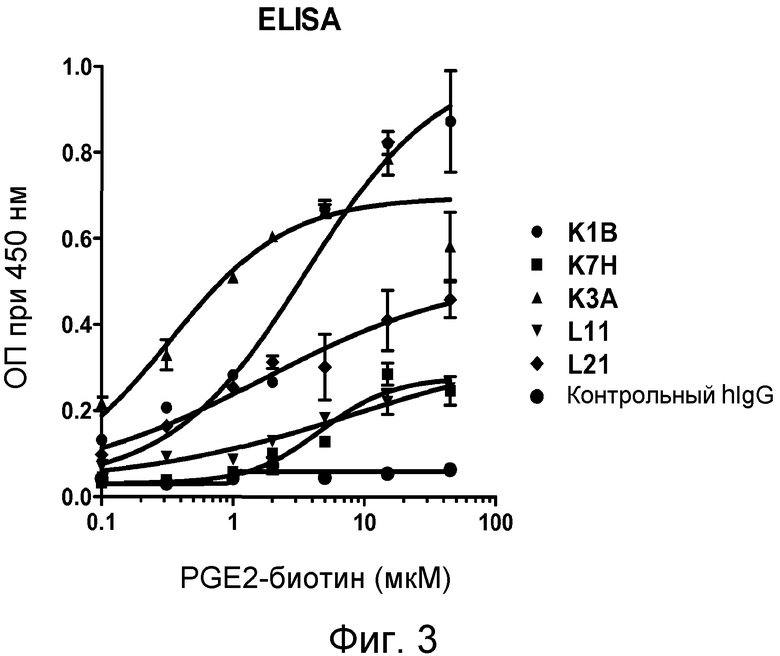
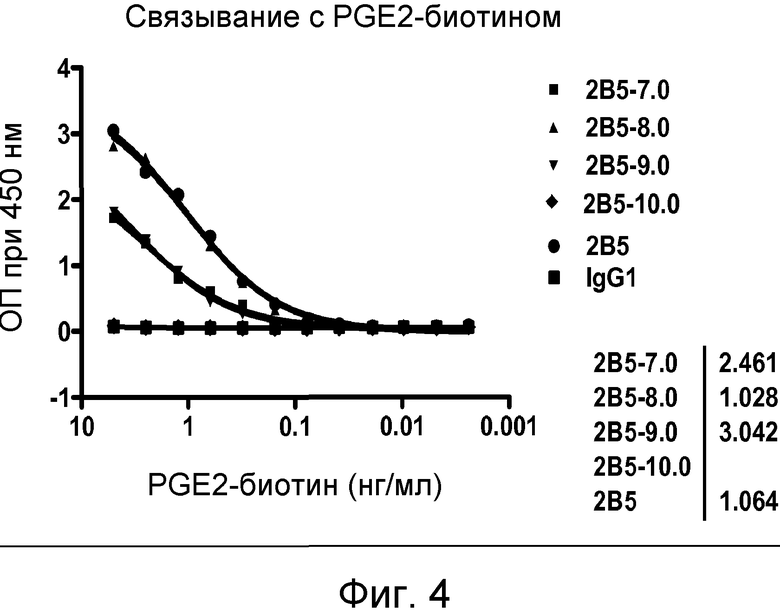
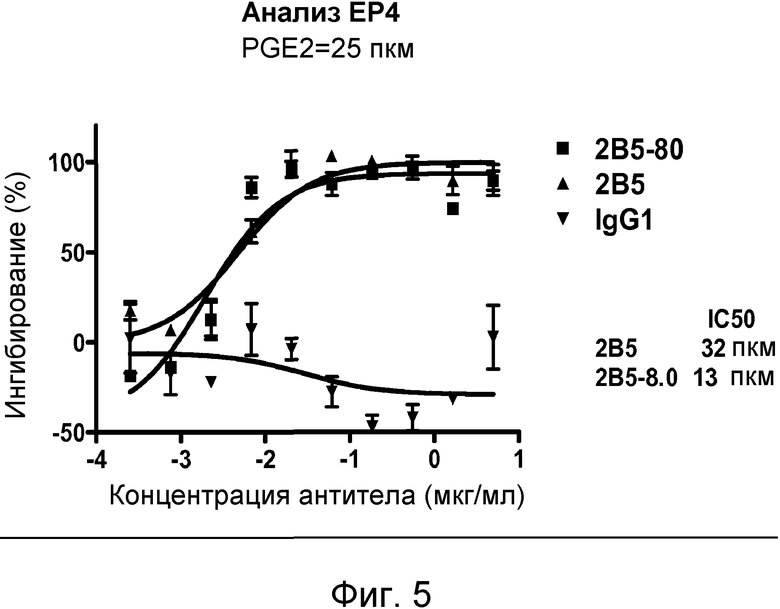
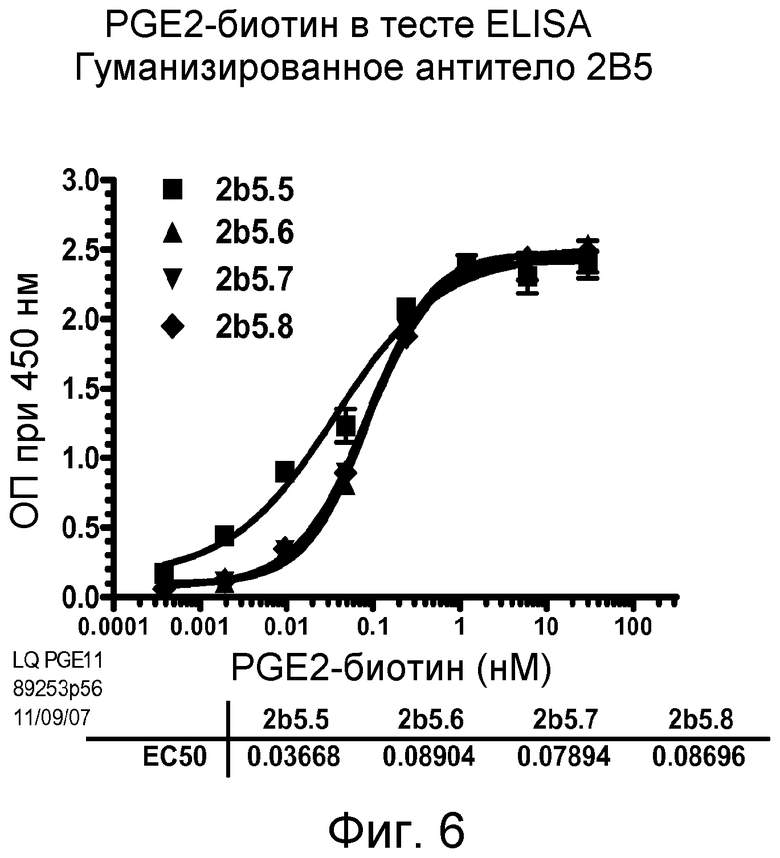
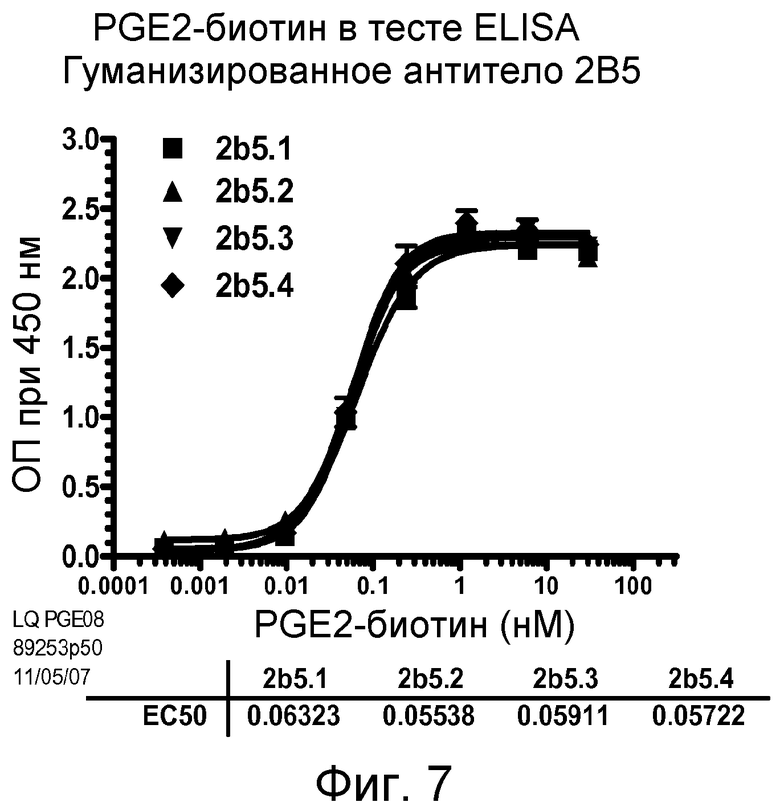
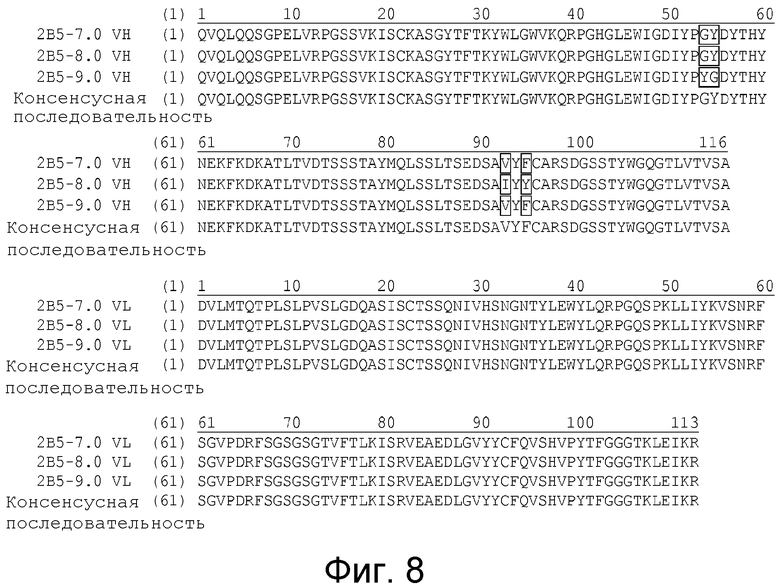
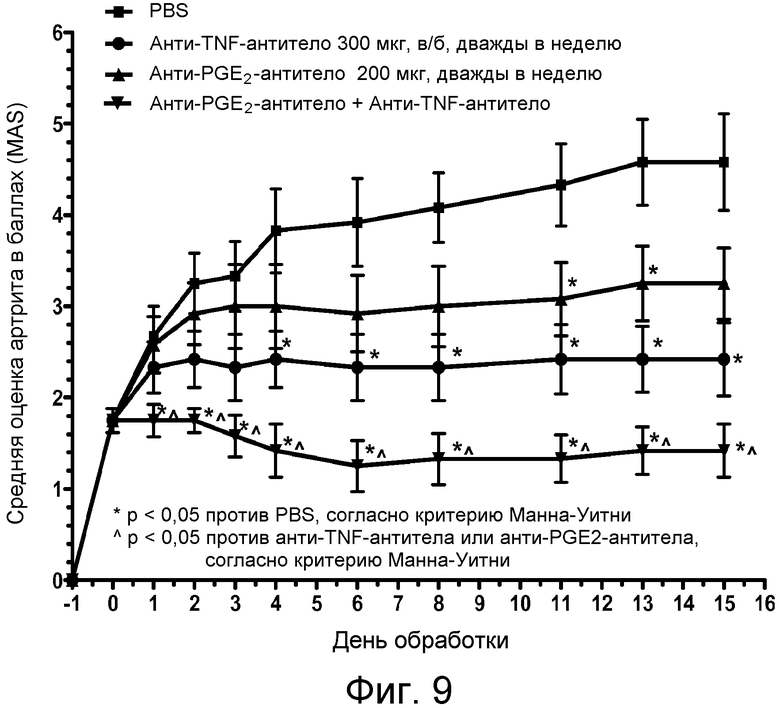
Настоящее изобретение относится к области иммунологии. Предложено антитело и его антиген-связывающий фрагмент, способные связывать простагландин Е2 (PGE2) и охарактеризованные последовательностями CDR. Также рассмотрены: кодирующая антитело или его антиген-связывающий фрагмент выделенная нуклеиновая кислота, вектор экспрессии, клетка-хозяин, способ продуцирования антитела или его антиген-связывающего фрагмента по изобретению, композиции, содержащие антитело или антиген-связывающий фрагмент антитела по изобретению, применение антитела или антиген-связывающего фрагмента по изобретению в производстве лекарственного средства для понижения активности PGE2 у субъекта-человека и для лечения субъекта, а также способ определения присутствия PGE2 или его фрагмента в тестируемом образце посредством иммуноанализа. Данное изобретение может найти дальнейшее применение в терапии и диагностике заболеваний, связанных с повышенной активностью или экспрессией PGE2. 10 н. и 15 з.п. ф-лы, 9 ил., 21 табл., 4 пр.
1. Антитело или его антиген-связывающий фрагмент, способные связывать простагландин Е2, где указанные антитело или антиген-связывающий фрагмент содержат последовательности определяющих комплементарность областей (CDR): GYTFTKYWLG (SEQ ID NO:54), DIYPGYDYTHYNEKFKD (SEQ ID NO:55), SDGSSTY (SEQ ID NO:56), TSSQNIVHSNGNTYLE (SEQ ID NO:57), KVSNRFSG (SEQ ID NO 58) и FQVSHVPYT (SEQ ID NO:59), где указанное антитело или его антиген-связывающий фрагмент не являются антителом 2В5.
2. Антитело или антиген-связывающий фрагмент по п.1, дополнительно содержащие последовательности человеческого акцепторного каркаса.
3. Антитело или антиген-связывающий фрагмент по п.1, где указанные антитело или антиген-связывающий фрагмент
(a) способны модулировать биологическую функцию простагландина Е2;
(b) способны нейтрализовать простагландин Е2;
(c) способны предотвратить связывание простагландина Е2 с одним или более рецепторов простагландина Е2, выбранных из группы, состоящей из ЕР1, ЕР2, ЕР3 и ЕР4;
(d) способны предотвратить связывание простагландина Е2 с рецепторами простагландина Е2 ЕР1, ЕР2, ЕР3 и ЕР4;
(e) представляют собой антитело или антиген-связывающий фрагмент, которые связывают простагландин Е2 с EC50, выбранной из группы, состоящей интервалов от приблизительно 1×10-6 до приблизительно 1×10-7 M, от приблизительно 1×10-7 до приблизительно 1×10-8 M, от приблизительно 1×10-8 до приблизительно 1×10-9 M, от приблизительно 1×10-9 до приблизительно 1×10-10 М, от приблизительно 1×10-10 до приблизительно 1×10-11 М и от приблизительно 1×10-11 до приблизительно 1×10-12 М, определяемых в анализе с использованием метода ELISA; и/или
(f) представляют собой антитело или антиген-связывающий фрагмент, которые ингибируют приток кальция, индуцируемый связыванием простагландина Е2 с рецептором простагландина Е2, ЕР4, в опосредованном рецептором ЕР4 FLIPR-анализе, с IC50, выбранной из группы, состоящей из интервалов от приблизительно 1×10-6 до приблизительно 1×10-7 М, от приблизительно 1×10-7 до приблизительно 1×10-8 М, от приблизительно 1×10-8 до приблизительно 1×10-9 М, от приблизительно 1×10-9 до приблизительно 1×10-10 М, от приблизительно 1×10-10 до приблизительно 1×10-11 М и от приблизительно 1×10-11 до приблизительно 1×10-12 М.
4. Антитело или антиген-связывающий фрагмент по п.1, где указанные антитело или антиген-связывающий фрагмент имеют зрелую аффинность.
5. Антитело или антиген-связывающий фрагмент по п.1, где указанные антитело или антиген-связывающий фрагмент содержат:
SEQ ID NO: 60 и SEQ ID NO: 61;
SEQ ID NO: 62 и SEQ ID NO: 63;
SEQ ID NO: 64 и SEQ ID NO: 65;
SEQ ID NO: 66 и SEQ ID NO: 67;
SEQ ID NO: 68 и SEQ ID NO: 69;
SEQ ID NO: 70 и SEQ ID NO: 71;
SEQ ID NO: 72 и SEQ ID NO: 73;
SEQ ID NO: 74 и SEQ ID NO: 75;
SEQ ID NO: 76 и SEQ ID NO: 77;
SEQ ID NO: 78 и SEQ ID NO: 79; или
SEQ ID NO: 80 и SEQ ID NO:81.
6. Антитело или антиген-связывающий фрагмент по п.1, где указанные антитело или антиген-связывающий фрагмент представляют собой молекулу иммуноглобулина, связанного дисульфидным мостиком Fv, моноклональное антитело, scFv, химерное антитело, CDR-привитое антитело, диатело, гуманизированное антитело, мультиспецифическое антитело, Fab, антитело с двойной специфичностью, Fab', биспецифическое антитело, F(ab')2 или Fv.
7. Антитело или антиген-связывающий фрагмент по п.1, дополнительно содержащие константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из константного домена человеческого IgM, константного домена человеческого IgG4, константного домена человеческого IgG1, константного домена человеческого IgE, константного домена человеческого IgG2, константного домена человеческого IgG3 и константного домена человеческого IgA.
8. Антитело или антиген-связывающий фрагмент по п.7, где указанные константные домены иммуноглобулина имеют аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4.
9. Антитело или антиген-связывающий фрагмент по п.1, где
(a) указанные антитело или антиген-связывающий фрагмент имеют характер гликозилирования, свойственный человеку;
(b) указанные антитело или антиген-связывающий фрагмент являются кристаллизованными;
(с) указанные антитело или антиген-связывающий фрагмент представляют собой часть свободного от носителя фармацевтического кристаллизованного антитела с контролируемым высвобождением;
(d) указанные антитело или антиген-связывающий фрагмент представляют собой часть антительной конструкции, которая имеет большее время полужизни in vivo, чем растворимый аналог указанной антительной конструкции; и/или
(е) антитело или антиген-связывающий фрагмент из подпунктов (а)-(d) сохраняют биологическую активность после кристаллизации.
10. Антитело или антиген-связывающий фрагмент по п.1 для модуляции связанных с простагландином Е2 состояний, где указанные антитело или антиген-связывающий фрагмент конъюгированы со средством, выбранным из группы, состоящей из иммуноадгезивной молекулы, визуализирующего средства, терапевтического средства и цитотоксического средства, где указанное средство представляет собой
(a) визуализирующее средство, выбранное из группы, состоящей из радиоактивной метки, необязательно выбранной из группы, состоящей из 3H, 14С, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm, фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки или биотина; и/или
(b) терапевтическое или цитотоксическое средство, выбранное из группы, состоящей из антиметаболита, алкилирующего средства, антибиотика, фактора роста, цитокина, антиангиогенного средства, антимитотического средства, антрациклина, токсина и апоптотического средства.
11. Выделенная нуклеиновая кислота, кодирующая антитело или антиген-связывающий фрагмент по любому из пп.1-9.
12. Вектор экспрессии, содержащий выделенную нуклеиновую кислоту по п.11.
13. Вектор экспрессии по п.12, где указанный вектор экспрессии представляет собой плазмидную кДНК, рТТ, рТТ3, pEFBOS, pBV, pJV, pBJ или рА2.
14. Клетка-хозяин для экспрессии нуклеиновой кислоты, кодирующей антитело или его антиген-связывающий фрагмент по любому из пп.1-9, содержащая вектор по п.12, где указанная клетка-хозяин выбрана из группы, состоящей из прокариотической клетки, клетки Escherichia coli, эукариотической клетки, клетки одноклеточного организма, клетки животного, клетки растения, клетки гриба, клетки млекопитающего, клетки птицы, клетки насекомого, клетки СНО, клетки COS, клетки НЕК293, дрожжевой клетки, клетки Saccharomyces cerevisiae и клетки насекомого Sf9.
15. Способ продуцирования антитела или его антиген-связывающего фрагмента, способных связываться с простагландином Е2, где указанный способ включает стадию культивирования клетки-хозяина по п.14 в условиях, подходящих для продуцирования указанных антитела или антиген-связывающего фрагмента.
16. Композиция для модуляции связанных с простагландином Е2 состояний, где указанная композиция включает терапевтически эффективное количество кристаллизованных антитела или антиген-связывающего фрагмента по п.9; и
(a) ингредиент, выбранный из группы, состоящей из альбумина, сахарозы, трегалозы, лактитола, желатина, гидроксипропил-β-циклодекстрина, метоксиполиэтиленгликоля и полиэтиленгликоля; и/или
(b) по меньшей мере, один полимерный носитель, который представляет собой поли(акриловую кислоту), поли(цианоакрилаты), поли(аминокислоты), поли(ангидриды), поли(депсипептид), поли(сложные эфиры), поли(молочную кислоту), поли(сополимер молочной и гликолевой кислот) или PLGA, поли(b-гидроксибутират), поли(капролактон), поли(диоксанон); поли(этиленгликол), поли((гидроксипропил)метакриламид), поли[(органе)фосфазен], поли(сложные ортоэфиры), поли(виниловый спирт), поли(винилпирролидон), сополимеры малеинового ангидрида и алкилвинилового эфира, плюроновые полиолы, альбумин, альгинат, целлюлозу и производные целлюлозы, коллаген, фибрин, желатин, гиалуроновую кислоту, олигосахариды, гликаминогликаны, сульфатированные полисахариды, или их смеси, и/или их сополимер.
17. Фармацевтическая композиция для модуляции связанных с простагландином Е2 состояний, содержащая эффективное количество антитела или антиген-связывающего фрагмента по любому из пп.1-9 и фармацевтически приемлемый носитель.
18. Фармацевтическая композиция по п.17, где фармацевтически приемлемый носитель функционирует в качестве адъюванта, используемого для повышения абсорбции или дисперсии указанных антитела или антиген-связывающего фрагмента, где указанный адъювант представляет собой гиалуронидазу; и где указанная композиция необязательно дополнительно включает дополнительное терапевтическое средство, которое представляет собой визуализирующее средство, цитотоксическое средство, ингибитор ангиогенеза, киназный ингибитор, блокатор костимулирующей молекулы, блокатор адгезивной молекулы, антицитокиновое антитело или его функциональный фрагмент, метотрексат, циклоспорин, рапамицин, FK506, детектируемую метку или репортер, антагонист TNF; противоревматическое средство, мышечный релаксант, наркотическое средство, нестероидное противовоспалительное средство (NSAID), аналгетик, анестезирующее средство, седативное средство, локальное анестезирующее средство, нейро-мышечный блокатор, противомикробное средство, антипсориатическое средство, кортикостероид, анаболический стероид, эритропоэтин, иммунизирующее средство, иммуноглобулин, иммуносупрессивное средство, гормон роста, лекарственное средство-заменитель гормона, радиофармацевтическое средство, антидепрессант, антипсихотическое средство, стимулирующее средство, противоастматическое лекарственное средство, бета-агонист, ингалируемый стероид, пероральный стероид, эпинефрин или его аналог, цитокин или антагонист цитокина.
19. Применение антитела или антиген-связывающего фрагмента по любому из пп.1-9 в производстве лекарственного средства для понижения активности простагландина E2 у субъекта-человека.
20. Применение по п.19, где указанный субъект-человек страдает заболеванием, выбранным из группы, состоящей из аутоиммунного заболевания, воспалительного заболевания, опухоли, ревматоидного артрита, аллергического артрита, синдрома Гийена-Барре, инфекционного мононуклеоза, вирусной лимфаденопатии, инфекции, вызванной вирусом герпеса, множественного склероза, демиелинизирующего заболевания, гематологического расстройства, гемолитической анемии, тромбоцитопении, эндокринного расстройства, сахарного диабета, болезни Аддисона, идиопатического гипопаратироидизма, хронического лимфоцитарного тиреоидита, коллагенового расстройства, системной красной волчанки, репродуктивного расстройства, аменореи, бесплодия, привычных выкидышей, эклампсии, опухоли головы и шеи, рака легкого, рака желудка, рака предстательной железы, рака поджелудочной железы, болезни органа желудочно-кишечного тракта, воспалительного заболевания кишечника, язвенного колита, болезни Крона, боли, боли, ассоциированной с остеоартритом, глазного расстройства, возрастной макулярной дистрофии, ревматоидного артрита, остеоартрита, хронического ювенильного артрита, септического артрита, артрита Лайма, псориатического артрита, реактивного артрита, спондиллоартропатии, системной красной волчанки, болезни Крона, язвенного колита, воспалительного заболевания кишечника, инсулин-зависимого сахарного диабета, тиреоидита, астмы, аллергических заболеваний, псориаза, кожной склеродермии, заболевания трансплантат против хозяина, отторжения органного трансплантата, острого или хронического иммунного заболевания, ассоциированного с трансплантацией органа, саркоидоза, атеросклероза, диссеминированного внутрисосудистого свертывания, болезни Кавазаки, болезни Грава, нефротического синдрома, синдрома хронической усталости, гранулематоза Вегенера, пурпуры Геноха-Шонлейна, микроскопического васкулита почек, активного хронического гепатита, увеита, септического шока, синдрома токсического шока, септического синдрома, кахексии, инфекционных заболеваний, паразитарных заболеваний, синдрома приобретенного иммунодефицита, острого поперечного миелита, хореи Гентингтона, болезни Паркинсона, болезни Альцгеймера, инсульта, первичного билиарного цирроза, гемолитической анемии, злокачественных заболеваний, сердечной недостаточности, инфаркта миокарда, болезни Аддисона, спорадического полигландулярного дефицита типа I и полигландулярного дефицита типа II, синдрома Шмидта, (острого) респираторного дистресс-синдрома у взрослых, алопеции, гнездной алопеции, серонегативной артропатии, артропатии, болезни Рейтера, псориатической артропатии, артропатии при язвенном колите, энтеропатического синовита, артропатии, ассоциированной с хламидией, иерсинией и сальмонеллой, спондилоартропатии, атероматозного заболевания/артериосклероза, атопической аллергии, аутоиммунного буллезного заболевания, обыкновенной пузырчатки, эксфолиативной пузырчатки, пемфигоида, IgA-зависимого линейного дерматоза, аутоиммунной гемолитической анемии, гемолитической анемии с положительным тестом Кумбса, приобретенной пернициозной анемии, ювенильной пернициозной анемии, миалгического энцефалита/синдрома хронической усталости, хронического кандидоза кожи и слизистых, гигантоклеточного артериита, первичного склерозирующего гепатита, криптогенного аутоиммунного гепатита, синдрома болезни приобретенного иммунодефицита, заболеваний, связанных с приобретенным иммунодефицитом, гепатита В, гепатита С, общего пестрого иммунодефицита (общей вариабельной гипогаммаглобулинемии), дилатационной кардиомиопатии, женского бесплодия, недостаточности яичников, преждевременного угасания функции яичников, легочного фиброза, криптогенного фиброзирующего альвеолита, поствоспалительной интерстициальной болезни легких, интерстициального пневмонита, интерстициальной болезни легких, ассоциированной с болезнью соединительной ткани, болезни легких, ассоциированной со смешанной болезнью соединительной ткани, интерстициальной болезни легких, ассоциированной с системным склерозом, интерстициальной болезни легких, ассоциированной с ревматоидным артритом, болезни легких, ассоциированной с системной красной волчанкой, болезни легких, ассоциированной с дерматомиозитом/полимиозитом, болезни легких, ассоциированной с болезнью Шегрена, болезни легких, ассоциированной с анкилозирующим спондилитом, связанного с васкулитом диффузного заболевания легких, болезни легких, ассоциированной с гемосидерозом, лекарственной интерстициальной болезни легких, фиброза, радиационного фиброза, облитерирующего бронхиолита, хронической эозинофильной пневмонии, лимфоцитарной инфильтрирующей болезни легких, постинфекционной интерстициальной болезни легких, подагрического артрита, аутоиммунного гепатита, аутоиммунного гепатита типа 1 (классический аутоиммунный или волчаночный гепатит), аутоиммунного гепатита типа 2 (анти-LKM-антительный гепатит), опосредованной аутоиммунным заболеванием гипогликемии, инсулинорезистентности типа В с акантокератодермией, гипопаратироидизма, острого иммунного заболевания, ассоциированного с трансплантацией органа, хронического иммунного заболевания, ассоциированного с трансплантацией органа, остеоартроза, первичного склерозирующего холангита, псориаза типа 1, псориаза типа 2, идиопатической лейкопении, аутоиммунной нейтропении, почечного заболевания NOS (БДУ), гломерулонефрита, микроскопического васкулита почек, болезни Лайма, дискоидной красной волчанки, мужского бесплодия, идиопатического или NOS (БДУ), аутоиммунности спермы, рассеянного склероза (всех подтипов), симпатической офтальмии, легочной гипертензии, вторичной относительно заболевания соединительной ткани, синдрома Гудпасчера, легочной манифестации нодозного полиартериита, острой ревматической лихорадки, ревматоидного спондилита, болезни Стилла, системного склероза, синдрома Шегрена, болезни Такаясу/артериита, аутоиммунной тромбоцитопении, идиопатической тромбоцитопении, аутоиммунного заболевания щитовидной железы, гипертиреоза, зобного аутоиммунного гипотиреоза (болезнь Хашимото), атрофического аутоиммунного гипотиреоза, первичной микседемы, факогенного увеита, первичного васкулита, витилиго, острого заболевания печени, хронического заболевания печени, алкогольного цирроза, индуцированного алкоголем повреждения печени, холестаза, идиосинкратической болезни печени, индуцированного лекарственным средством гепатита, неалкогольного стеатогепатита, аллергии и астмы, стрептококковой инфекции группы В (GBS), психических расстройств, депрессии, шизофрении, заболеваний, опосредованных Th2-типом и Th1-типом, острой боли, хронической боли, раковых заболеваний, таких как рак легкого, рак молочной железы, рак желудка, рак мочевого пузыря, рак ободочной кишки, рак поджелудочной железы, рак яичника, рак предстательной железы, рак прямой кишки, гемопоэтических злокачественных заболеваний, лейкоза, лимфомы, абеталипопротеинемии, акроцианоза, острых и хронических паразитарных или инфекционных процессов, острого лейкоза, острого лимфобластного лейкоза (ALL), острого миелоидного лейкоза (AML), острой или хронической бактериальной инфекции, острого панкреатита, острой почечной недостаточности, аденокарцином, предсердных эктопических систол, комплекса СПИД-деменция, индуцированного алкоголем гепатита, аллергического конъюнктивита, аллергического контактного дерматита, аллергического ринита, отторжения аллотрансплантата, недостаточности альфа-1-антитрипсина, амиотрофического бокового склероза, анемии, стенокардии, дегенерации клеток переднего рога спинного мозга, анти-cd3-терапии, антифосфолипидного синдрома, аллергических реакций на противорецепторные антитела, аневризмы аорты и периферических сосудов, рассечения аорты, артериальной гипертензии, артериосклероза, атриовентрикулярной фистулы, атаксии, фибрилляции предсердий (стойкой или пароксизмальной), трепетания предсердий, атриовентрикулярной блокады, В-клеточной лимфомы, отторжения костного трансплантата, отторжения трансплантата костного мозга (ВМТ), межжелудочковой блокады, лимфомы Беркитта, ожогов, сердечных аритмий, синдрома временной остановки сердца, опухоли сердца, кардиомиопатии, воспалительной реакции при искусственном кровообращении, отторжения трансплантата хряща, церебеллярных кортикальных дегенераций, церебеллярных нарушений, хаотической или мультиочаговой предсердной тахикардии, ассоциированных с химиотерапией нарушений, хронического миелоцитарного лейкоза (CML), хронического алкоголизма, хронических воспалительных патологий, хронического лимфоцитарного лейкоза (CLL), хронической обструктивной болезни легких (COPD), хронической интоксикации салицилатом, рака ободочной кишки, застойной сердечной недостаточности, конъюнктивита, контактного дерматита, легочного сердца, болезни коронарных артерий, болезни Крейтцфельдта-Якоба, отрицательного в культуре сепсиса, муковисцидоза, ассоциированных с терапией цитокинами нарушений, боксерской деменции, демиелинизирующих заболеваних, геморрагической лихорадки Денге, дерматита, дерматологических состояний, диабета, сахарного диабета, диабетического артериосклеротического заболевания, заболевания с диффузными тельцами Леви, дилатационной застойной кардиомиопатии, нарушений базальных (подкорковых) ядер головного мозга, синдрома Дауна в среднем возрасте, индуцированных лекарственными средствами нарушений движения, нарушений, индуцированных лекарственными средствами, блокирующими рецепторы допамина ЦНС, чувствительности к лекарственным средствам, экземы, энцефаломиелита, эндокардита, эндокринопатии, эпиглоттита, инфекции вирусом Эпштейна-Барр, эритромелалгии, экстрапирамидальных и церебеллярных расстройств, семейного гематофагоцитарного лимфоцитарного гистиоцитоза, отторжения имплантата фетальной вилочковой железы, атаксии Фридрейха, функциональных периферических артериальных нарушений, грибкового сепсиса, газовой (анаэробной) гангрены, язвы желудка, гломерулонефрита, отторжения трансплантата любого органа или любой ткани, грамотрицательного сепсиса, грамположительного сепсиса, гранулем, вызываемых внутриклеточными организмами, волосатоклеточного лейкоза, болезни Халлеррордена-Шпатца, тиреоидита Хашимото, сенной лихорадки, отторжения трансплантата сердца, гемохроматоза, гемодиализа, гемолитического уремического синдрома/тромболитической тромбоцитопенической пурпуры, кровотечения, гепатита (А), аритмии пучка Гиса, ВИЧ-инфекции/ВИЧ-невропатии, болезни Ходжкина, гиперкинетических нарушений движения, реакций гиперчувствительности, гиперчувствительного пневмонита, гипертензии, гипокинетических нарушений движения, диагностики системы гипоталамус-гипофиз-надпочечники, идиопатической болезни Аддисона, идиопатического легочного фиброза, опосредованной антителами цитотоксичности, астении, детской спинально-мышечной атрофии, воспаления аорты, гриппа А, воздействия ионизирующей радиации, иридоциклита/увеита/неврита зрительного нерва, ишемического-реперфузионного повреждения, ишемического инсульта, ювенильного ревматоидного артрита, ювенильной спинально-мышечной атрофии, саркомы Капоши, отторжения трансплантата почки, инфекции микобактерией Legionella, лейшманиоза, проказы, повреждений кортико-спинальной системы, жирового отека, отторжения трансплантата печени, лимфатического отека, малярии, злокачественной лимфомы, злокачественного гистиоцитоза, злокачественной меланомы, менингита, менингококкемии, метаболической/идиопатической мигренеподобной головной боли, митохондриального мультисистемного нарушения, заболевания смешанной соединительной ткани, моноклональной гаммопатии, множественной миеломы, дегенерации множественных систем (Mencel Dejerine- Thomas Shi-Drager и Machado-Joseph), тяжелой псевдопаралитической миастении, комплекса Mycobacterium. avium, туберкулезной бациллы, синдрома миелодисплазии, инфаркта миокарда, ишемических нарушений миокарда, рака носоглотки, хронического заболевания легких новорожденных, нефрита, нефроза, нейродегенеративных заболеваний, нейрогенных мышечных атрофии I, нейрогенной лихорадки, неходжкинской лимфомы, закупорки брюшной аорты и ее ответвлений, окклюзивных артериальных нарушений, okt3-терапии, орхита/эпидидимита, процедуры после лечения орхита/вазэктомии, органомегалии, остеопороза, отторжения трансплантата поджелудочной железы, рака поджелудочной железы, паранеопластического синдрома/гиперкальциемии при злокачественных заболеваниях, отторжения трансплантата паращитовидной железы, воспалительного заболевания почечных лоханок, круглогодичного ринита, заболевания перикарда, периферического атеросклеротического заболевания, периферических васкулярных нарушений, перитонита, пернициозной анемии, пневмонии, вызываемой Pneumocystis carinii, пневмонии, синдрома POEMS (полиневропатии, органомегалии, эндокринопатии, моноклональной гаммопатии и синдрома изменений кожи), постперфузионного синдрома, постгемодиализного синдрома, синдрома пост-MI-кардиотомии, преэклампсии, прогрессирующего супрануклеарного паралича, первичной легочной гипертензии, лучевой терапии, феномена и болезни Рейно, болезни Рейно, болезни Рефсума, тахикардии с регулярными узкими QRS, реноваскулярной гипертензии, реперфузионного повреждения, рестриктивной кардиомиопатии, сарком, склеродермии, сенильной хореи, сенильной деменции, ассоциированной с тельцами Леви, сероотрицательных артропатий, шока, серповидно-клеточной анемии, отторжения аллотрансплантата кожи, синдрома изменений кожи, отторжения трансплантата тонкой кишки, солидных опухолей, специфических аритмий, спинальной атаксии, спинально-церебеллярных дегенераций, стрептококкового миозита, структурных повреждений мозжечка, подострого склерозирующего панэнцефалита, обморока (синкопе), сердечно-сосудистого сифилиса, системной анафилаксии, синдрома системной воспалительной реакции, системного ювенильного ревматоидного артрита, Т-клеточного или FAB-ALL (острый лимфобластный лейкоз), телангиэктазии, облитерирующего тромбоангиита, тромбоцитопении, токсичности, трансплантатов, травмы/кровотечения, аллергических реакций типа III, аллергии типа IV, нестабильной стенокардии, уремии, уросепсиса, крапивницы, вальвулярных сердечных заболеваний, варикозных вен, васкулита, венозных заболеваний, венозного тромбоза, фибрилляции (мерцание) желудочков, вирусных и грибковых инфекций, острого энцефалита с высоким риском смертельного исхода/асептического менингита, гемафагоцитарного синдрома, ассоциированного с высоким риском смертельного исхода, синдрома Вернике-Корсакова, заболевания Вильсона, отторжения ксенотрансплантата любого органа или любой ткани, острых коронарных синдромов, острого идиопатического полиневрита, острой воспалительной демиелинизирующей полирадикулоневропатии, острой ишемии, болезни Стилла-Шоффара у взрослых, гнездной алопеции, анафилаксии, синдрома антифосфолипидного антитела, апластической анемии, атеросклероза, атопической экземы, атопического дерматита, аутоиммунного дерматита, аутоиммунного заболевания, ассоциированного со стрептококковой инфекцией, аутоиммунной энтеропатии, аутоиммунной тугоухости, аутоиммунного лимфопролиферативного синдрома (ALPS), аутоиммунного миокардита, аутоиммунной преждевременной недостаточности функции яичников, блефарита, бронхоэктаза, буллезного пемфигоида, сердечно-сосудистого заболевания, катастрофического антифосфолипидного синдрома, глютеиновой болезни, шейного спондилеза, хронической ишемии, рубцового пемфигоида, клинически выделенного синдрома (CIS) с риском развития множественного склероза, конъюнктивита, психического расстройства, начинающегося в детском возрасте, хронического обструктивного легочного заболевания (COPD), дакриоцистита, дерматомиозита, диабетической ретинопатии, сахарного диабета, грыжи межпозвонкового диска, выпадения диска, лекарственной иммунной гемолитической анемии, эндокардита, эндометриоза, эндофтальмита, эписклерита, многоформной эритемы, большой (major) многоформной эритемы, пемфигоида беременных, синдрома Гийена-Барре (GBS), сенной лихорадки, синдрома Хьюза, идиопатической болезни Паркинсона, идиопатической интерстициальной пневмонии, IgE-опосредованной аллергии, иммунной гемолитической анемии, миозита с включенными тельцами, инфекционного воспалительного заболевания глаз, воспалительного демиелинизирующего заболевания, воспалительного заболевания сердца, воспалительного заболевания почек, IPF/UIP, ирита, кератита, сухого кератоконъюнктивита, болезни Куссмауля или болезни Куссмауля-Мейера, паралича Ландри, гистиоцитоза клеток Лангерганса, сетчатой мраморной кожи, дегенерации желтого пятна, микроскопической ангиопатии, болезни Бехтерева, расстройства двигательных клеток переднего рога спинного мозга, пемфигоида мембран слизистой оболочки, полиорганной недостаточности, большой миастении, миелодиспластического синдрома, миокардита, расстройств нервного корешка, невропатий, гепатита ни-А, ни-В, неврита зрительного нерва, остеолиза, пауциартикулярного юношеского артрита, окклюзивного заболевания периферических артерий (PAOD), болезни периферических сосудов (PVD), болезни периферических артерий (PAD), флебитов, узелкового полиартериита (или нодозного полиартериита), полихондрита, ревматической полимиалгии, полиоза, многосуставного юношеского артрита, аутоиммунного полиэндокринного синдрома, полиомиозита, ревматической полимиалгии (PMR), постперфузионного синдрома, первичного паркинсонизма, простатита, истинной эритроцитарной аплазии, первичной недостаточности надпочечников, рекуррентного оптикомиелита, рестеноза, ревматического порока сердца, SAPHO (синовит, акне, пустулез, гиперостоз и остеит), склеродермии, вторичного амилоидоза, инфаркта легкого, воспаления склеры, ишиалгии, вторичной недостаточности надпочечников, связанной с силиконом диффузной болезни соединительной ткани, дерматоза Снеддона-Уилкинсона, анкилозирующего спондилита, синдрома Стивенса-Джинсона (SJS), синдрома системной воспалительной реакции, темпорального артериита, токсоплазмозного ретинита, токсического эпидермального некролиза, поперечного миелита, TRAPS (рецептор фактора некроза опухоли, аллергическая реакция типа 1), диабета II типа, крапивницы, обычной интерстициальной пневмонии (UIP), васкулита, весеннего конъюнктивита, вирусного ретинита, синдрома Фогта-Коянага-Харада (синдром VKH), влажной макулодистрофии и заживления ран.
21. Применение антитела или антиген-связывающего фрагмента по любому из пп.1-9 в производстве лекарственного средства для лечения субъекта, страдающего расстройством, при котором простагландин Е2 оказывает неблагоприятное воздействие, причем лекарственное средство предназначено для введения перед, одновременно или после введения второго средства, где указанное второе средство выбрано из группы, состоящей из лекарственных средств, которые используются для лечения ревматоидного артрита или ювенильного ревматоидного артрита, выбранных из группы, состоящей из метотрексата, лефлуномида, низких доз кортикостероидов, преднизона, кортизона, противомалярийных лекарственных средств, гидроксихлорохина, золота, сульфазалазина, пеницилламина, циклофосфамида, циклоспорина, миноциклина, ацетаминофена, аспирина, ибупрофена, напроксена, целекоксиба, инфликсимаба, этанерцепта, адалимумаба, абатацепта, ритуксимаба, анакинра, биологических средств и перорально доставляемых средств, нацеленных на IL-6, IL-6R, IL-17, IL-18, IL-23 или В7.1/В7.2; лекарственных средств, выбранных из группы, состоящей из ацетаминофена, аспирина, ибупрофена, напроксена, целекоксиба, стероидов, искусственной суставной жидкости, синвиска, гиалгана; адалимумаба, азасана, азакола, азатиоприна, азульфидина, будесонида, энтокорта, флагила, имурана, инфликсимаба, меркаптопурина, метронидазола, протостата, пуринетола, ремикада, сульфазалазина; ацетокота, ацетилсалициловой кислоты, акуприна-81, адалимумаба, алева, амкорта, анапрокса, аристокорта, аспирина, аспиртаба, азмакорта, буфферина, буффекса, катафлама, целебрекса, клинорила, кортизона, диклофенака, дипентума, эасприна, этанерцепта, индоцина, индометацина, инфликсимаба, напроксена, ремикада, триамцинолона, вольтарена; авонекса, азасана, азатиоприна, бетасерона, Bubbli-Pred, копаксона котолона, глатирамера, имурана, интерферона-бета-1a, раствора интерферона-бета-lb, Кеу-Pred, Key-Pred SP, митоксантрона, натализумаба, новантрона, орапреда, орапреда ODT, педиапреда, Pred-Ject-50, предакорда 50, предалона 50, предат-50, преднизолона, прелона, ребифа, тизабри; абраксана, адриамицина, адруцила, алдара, алемтузумаба, алимта, аминолевулиновой кислоты, анастрозола, апрепитанта, аримидекса, аромазина, арранона, триоксида мышьяка, авастина (бевацизумаб), азацитидина, бевацизумаба, бексаротена, бортезомиба, кэмпаса (алемтузумаб), камптосара (иринотекана гидрохлорид), капецитабина, карбоплатина, цетуксимаба, цисплатина, клафена (циклофосфамид), клофарабина, клофарекса (клофарабин), клолара (клофарабин), циклофосфамида, цитарабина, цитозара-U (цитарабин), цитоксана (циклофосфамид), дакогена (децитабин), дазатиниба, децитабина, DepoCyt (липосомный цитарабин), DepoFoam (липосомный цитарабин), дексразоксана гидрохлорида, доцетаксела, доксила (липосомный доксорубицина гидрохлорид), доксорубицина гидрохлорида, доксорубицина гидрохлорида липосомного, Dox-SL (доксорубицина гидрохлорид липосомный), эфудекса (фторурацил), элленса (эпирубицина гидрохлорид), элоксатина (оксалиплатин), эменда (апрепитант), эпирубицина гидрохлорида, эрбитукса (цетуксимаб), эрлотиниба гидрохлорида, эвацета (доксорубицина гидрохлорид липосомный), эвиста (ралоксифена гидрохлорид), эксеместана, фаслодекса (фульвестрант), фемара (летрозол), фтороплекса (фторурацил), фторурацила, фульвестранта, гефитиниба, гемцитабина гидрохлорида, гемтузумаба озогамицина, гемзара (гемцитабина гидрохлорид), гливека (иматиниб мезилат), герцептина (трастузумаб), гицамтина (топотекан гидрохлорид), иматиниба мезилата, имихимода, иресса (гефитиниб), иринотекана гидрохлорида, иксабепилона, иксемпра (иксабепилон), кеоксифена (ралоксифена гидрохлорид), кепиванса (палифермин), лапатиниба дитозилата, леналидомида, летрозола, левулана (аминолевулиновая кислота), липодокса (доксорубицина гидрохлорид липосомный), липосомного цитарабина, метазоластона (темозоломид), милозара (азацитидин), милотарга (гемтузумаб озогамицин), паклитаксела из наночастиц (композиция стабилизированного альбумином паклитаксела из наночастиц), неларабина, неозара (циклофосфамид), нексавар (сорафениба тозилат), нилотиниба, нолвадекса (тамоксифена цитрат), онкаспара (пегаспаргаза), оксалиплатина, паклитаксела, композиции стабилизированного альбумином паклитаксела из наночастиц, палифермина, панитумумаба, параплата (карбоплатин), параплатина (карбоплатин), пегаспаргазы, пеметрекседы динатрия, платинола-AQ (цисплатин), платинола (цисплатин), ралоксифена гидрохлорида, ревлимида (леналидомид), ритуксана (ритуксимаб), ритуксимаба, склерозола внутриплеврального аэрозольного (тальковый), сорафениба тозилата, сприцела (дазатиниб), стерильного талькового порошка (тальк), стериталька (тальк), сунитиниба малата, сутента (сунитиниб малат), синовира (талидомид), талька, тамоксифена цитрата, тарабина PFS (цитарабин), тарцева (эрлотиниба гидрохлорид), таргретина (бексаротен), тасигна (нилотиниб), таксола (паклитаксел), таксотера (доцетаксел), темодара (темозоломид), темозоломида, темсиролимуса, таломида (талидомид), талидомида, тотекта (дексразоксана гидрохлорид), топотекана гидрохлорида, торизела (темсиролимус), трастузумаба, тризенокса (триоксид мышьяка), тикерба (лапатиниб дитозилат), вектибикса (панитумумаб), велкада (бортезомиб), видаза (азацитидин), вориностата, кселода (капецитабин), зинекарда (дексразоксана гидрохлорид), золедроновой кислоты, золинзы (вориностат) и зометы (золедроновая кислота).
22. Применение по п.21, где введение указанному субъекту производят способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, интракапсулярного, внутрихрящевого, внутриполостного, интрацелиального, интрацеребеллярного, интрацеребровентрикулярного, введения внутрь толстой/ободочной кишки, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинального, интрасиновиального, внутригрудного, внутриматочного, интравезикулярного, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и трансдермального способов введения.
23. Способ определения присутствия простагландина Е2 (PGE2) или его фрагмента в тестируемом образце посредством иммуноанализа, где указанный иммуноанализ включает приведение указанного тестируемого образца в контакт с, по меньшей мере, одним антителом или антиген-связывающим фрагментом по любому из пп.1-9 и, по меньшей мере, одной детектируемой меткой.
24. Способ по п.23, дополнительно включающий:
(a) приведение тестируемого образца в контакт с указанными, по меньшей мере, одним антителом или антиген-связывающим фрагментом, где указанные антитело или антиген-связывающий фрагмент связываются с эпитопом на PGE2 или его фрагменте с образованием первого комплекса;
(b) приведение указанного комплекса в контакт с, по меньшей мере, одной детектируемой меткой, где указанная детектируемая метка связывается с указанными антителом или антиген-связывающим фрагментом или эпитопом на PGE2 или его фрагменте, который не связан указанными антителом или антиген-связывающим фрагментом, с образованием второго комплекса; и
(c) определение присутствия PGE2 или его фрагмента в тестируемом образце, исходя из сигнала, генерируемого детектируемой меткой во втором комплексе, где присутствие PGE2 или его фрагмента напрямую коррелирует с сигналом, генерируемым указанной детектируемой меткой.
25. Способ по п.23, дополнительно включающий
(a) приведение тестируемого образца в контакт с, по меньшей мере, одним антителом или антиген-связывающим фрагментом, где указанные антитело или антиген-связывающий фрагмент связываются с эпитопом на PGE2 или его фрагменте с образованием первого комплекса;
(b) приведение указанного комплекса в контакт с указанной, по меньшей мере, одной детектируемой меткой, где указанная детектируемая метка конкурирует с PGE2 или его фрагментом за связывание с указанными антителом или антиген-связывающим фрагментом с образованием второго комплекса; и
(c) определение присутствия PGE2 или его фрагмента в тестируемом образце, исходя из сигнала, генерируемого детектируемой меткой во втором комплексе, где присутствие PGE2 или его фрагмента опосредованно коррелирует с сигналом, генерируемым указанной детектируемой меткой.
| MNICH S | |||
| J | |||
| et al., "Characterization of a monoclonal antibody that neutralizes the activity of prostaglandin E2", J | |||
| Immunology, 1995; 155(9): 4437-4444 | |||
| PORTANOVA J | |||
| P | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| EP 0 148 075 | |||
Авторы
Даты
2015-08-10—Публикация
2009-07-08—Подача