Данное изобретение относится к антителам и молекулам, связывающим рецептор хемокина 4 (CXCR4). Данное изобретение так же относится к молекулам содержащим, или альтернативно, состоящим из непроцессированных антител, фрагментов антитела или их вариантов. Данное изобретение так же относится к аминокислотным последовательностям и последовательностям нуклеиновых кислот, кодирующим такие антитела. Данное изобретение так же относится к конъюгатам антител (например, конъюгатам антитело-лекарство), содержащим анти-CXCR4 антитела, композициям, содержащим анти-CXCR4 антитела, и способам применения анти-CXCR4 антител и их коъюгатов для лечения состояний, ассоциированных с экспрессией CXCR4 (например, рак). Изобретение так же включает применение указанных антител, их антиген-связывающего фрагмента, или конъюгатов антитело-лекарство и соответствующих способов обнаружения и диагностики патологических расстройств, ассоциированных с экспрессией CXCR4. В определенных аспектах, расстройства означают онкогенные расстройства, связанные с повышенной экспрессией CXCR4, относительно нормы или любой другой патологии, связанной с надэкспрессией CXCR4. В других аспектах, расстройства означают воспалительные и иммунные расстройства, аллергические расстройства, инфекции (ВИЧ инфекция, и т.д.), аутоиммунные расстройства (например, ревматоидный артрит), фиброзные расстройства (например, легочные), и сердечнососудистые расстройства. Изобретение так же включает продукты и/или композиции или наборы, содержащие как минимум такое антитело или конъюгат антитело-лекарство для прогнозирования или диагностики или мониторинга терапии таких расстройств.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Хемокины являются маленькими секретируемыми пептидами, контролирующими миграцию лейкоцитов по химическому градиенту лиганда, известного как градиент хемокина, особенно во время иммунных реакций (Zlotnik et al., 2000, Immunity, 12:121-127). Их подразделяют на 4 класса согласно расположению Cys остатков на N-конце. Класс СХС состоит из хемокинов с парой Cys, разделенной одним остатком. Самыми известными ленами этого класса являются интерлейкин-8 (IL-8, CXCL8), стромальный фактор-1 (SDF-I, CXCL12), протеин-10, вызываемый гамма-интерфероном (IP-10, CXCLIO), фактор-4 тромбоцитов (PF-4, CXCL4), нейтрофил активирующий протеин-2 (NAP-2, CXCL7) и стимулирующий активность роста меланомы (MGSA, CXCLI). Класс СС хемокинов имеет два смежных Cys на N-конце и включает макрофаг воспалительный протеин-1 (MIP-1α, CCL3; MIP-IjSa, CCL4), регулируемый активацией экспрессией и секрецией нормальных Т клеток (RANTES, CCL5), моноцит хемоаттрактант протеин-1 (MCP-I, CCL2). Класс СХ3С хемокинов включает два Cys, разделенных тремя остатками на N-конце, и представлен фракталкином/нейротактином (CX3CL1). Класс С хемокинов включает один Cys на N-конце и представлен лимфотактином/ATAC/SCM (CLI). Рецепторы хемокинов сгруппированы согласно их связывающей селективности к хемокинам. Например, CXCR4 связывает SDF-I, CXCR5 связывает привлекающий В-клетки хемокин 1 (BCAI). Взаимодействие CXCR4 и SDF-1 играет важную роль в многочисленных фазах опухолеобразования, включая рост опухоли, инвазию, ангиогенез и метастазирование.
CXCR4 является рецептором, сопряженным с седьмым трансмембранным G протеином (GPCR) (Herzog et al. ДНК Cell Biol. 12: 465 (1993); Rimland et al. Mol. Pharmacol. 40: 869 (1991); WO 03014153, WO 02061087). Многие значимые в медицине биологические процессы опосредованы путями сигнальной трансдукции, включающей G-протеины (Lefkowitz, Nature, 351:353-354, (1991)). Рецепторы, сопряженные с G-протеином (GPCR) являются встроенными протеинами мембраны, содержащими 7 предполагаемых трансмембранных доменов (ТМ). Эти протеины передают сигналы на поверхность клетки посредством активации гетеротримерных G протеинов, которые в свою очередь активируют различные эффекторные протеины, в конечном итоге приводящие к физиологическому ответу.
CXCR4 принимает участие в эмбриогенезе, гомеостазе и воспалении. Более того, CXCR4 функционирует в качестве сорецептора для Т лимфотрофных HIV-I изолятов (Feng, Y. et al. Science 272:872(1996)). CXCR4 так же принимает плейотропное участие в человеческом раке. Его экспрессия апрегулируется во многих типах опухолей, включая рак молочной железы, легких, толстого кишечника, поджелудочной железы, мозга, простаты, яичников, а также гематопоэтический рак. Некоторые литературные источники предполагают, что SDF-1 может действовать посредством CXCR4 в качестве фактора роста и/или выживания для некоторых опухолей. CXCR4 экспрессируется в стволовые клетки-подобных или опухоль-инициирующих субпопуляциях многих опухолей, и может опосредовать способность этих клеток поддерживать рецедивирование и метастазное распространение рака. Кроме этого, CXCR4 экспрессируется в эндотелиальных клетках предшественниках (ЕРС), и его активность необходима для включения ЕРС в функциональные сосуды на протяжении ангиогенеза. Это может играть существенную роль в васкуляризации и выживании опухолей. Сигнализирование CXCR4 так же может приводить к индуцированию про-ангиогенных цитокинов (например, VEGF), а так же интегринов, адгезивных молекул и ферментов, разлагающих матрицу, которые могут опосредовать инвазию опухолевыми клетками. Более того, экспрессия CXCR4 выявлена в лимфоцитах и фибробластах, инфильтрующих опухоли, а так же в макрофагах, ассоциированных с опухолями. Эти клетки пытаются подавлять иммунное распознавание и атаку на опухоли, и перестраивают микроокружение опухоли с целью стимулирования роста опухоли и метастазирования.
Многочисленные функции CXCR4 в росте опухолей и метастазировании, и его широкая экспрессия во многих типах опухолей, делает его привлекательной мишенью для терапевтического вмешательства с использованием ингибиторов. Хотя пептидные и низкомолекулярные ингибиторы CXCR4 и анти-CXCR антител были идентифицированы или введены в клинические исследования, их использование ограничено фармакокинетическими свойствами и токсикологией. Агент, такой как антитело или конъюгат антитело-лекарство, являющийся селективным, имеющий длительный период полураспада, улучшенную эффективность и профиль безопасности, является желательным агентом для применения в лечении рака
Хотя разрабатываются различные агенты, мишенью которых является CXCR4, существует потребность в дополнительных терапевтических агентах, нацеленных на CXCR4 (таких как антитела или конъюгаты антитело-лекарство), имеющих улучшенную эффективность и профиль безопасности, и являющихся приемлемыми для применения людям. Антитела и конъюгаты антитело-лекарство данного изобретения являются терапевтически приемлемыми анти-CXCR4 антителами, обладающими желательными свойствами, такими как пониженное опухолеобразование, рост опухоли, ангиогенез та метастазирование. Кроме этого, антитела и конъюгаты антитело-лекарство данного изобретения вызывают апоптоз опухолевых клеток.
РЕЗЮМЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к выделенным антителам, антиген-связывающим фрагментам и их производным, и конъюгатам антитело-лекарство, которые связывают рецепторы хемокина 4 (CXCR4). Изобретение включает аминокислотные последовательности вариабельных тяжелой и легкой цепи антитела и их соответствующие последовательности нуклеиновых кислот.
В одном аспекте, данное изобретение включает последовательности участков определения комплементарности (CDR) антитела с целью получения связывающих молекул, содержащих один или больше CDR участков, или CDR-производных участков, которые сохраняют CXCR4-связывающую способность родительской молекулы, из которой получали CDR.
В другом аспекте, изобретение касается конъюгата антитело-лекарство, содержащего анти-CXCR4 антитела, описанные в данном документе.
В другом аспекте, изобретение включает применение анти-CXCR4 антител, их антиген-связывающих фрагментов и конъюгатов антитело-лекарство, и соответствующих способов выявления и диагностирования расстройств, ассоциированных с экспрессией или функцией CXCR4. В одном аспекте, расстройства включают раковые расстройства, ассоциированные с повышенной экспрессией CXCR4, по сравнению с нормой или любой патологией, связанной с надэкспрессией CXCR4.
В другом аспекте, изобретение включает продукты и/или композиции или наборы, содержащие как минимум такое антитело, антиген-связывающий фрагмент или конъюгаты антитело-лекарство для прогнозирования или диагностики или мониторинга терапии определенных видов рака.
В одном аспекте, изобретение касается изолированного антитела или его антиген-связывающего фрагмента, которое связывается с рецептором хемокина 4 (CXCR4) и содержит: а) вариабельный участок тяжелой цепи (VH), содержащий (i) VH CDR1, выбранный из группы, состоящей из SEQ ID NO: 107, 113, 114, 108, 109, 115, 116, 117, 121 и 122; (ii) VH CDR2, выбранный из группы, состоящей из SEQ ID NO: 162, 128, 110, 111, 118, 119, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156, и 130, и (iii) VH CDR3, выбранный из группы, состоящей из SEQ ID NO: 112 и 120; и/или; b) вариабельный участок легкой цепи (VL), содержащий (i) VL CDR1, выбранный из группы, состоящей из SEQ ID NO: 144, 131, 135, 138, 141, 142, 143, 146, 147, 148, 149, 150 и 151; (ii) VL CDR2, выбранный из группы, состоящей из 145, 132, 136 и 152; и (iii) VL CDR3, выбранный из группы, состоящей из SEQ ID NO: 139, 133, 137, 140 и 153.
В другом аспекте, изобретение касается изолированного антитела или его антиген-связывающего фрагмента, которое связывается с рецептором хемокина 4 (CXCR4) и содержит: а) вариабельный участок тяжелой цепи (VH), содержащий участки определения комплементарности, выбранный из группы, состоящей из (i) VH CDR1 содержащий последовательность SEQ ID NO: 107, 113, 114, 108, 109, 115, 116, 117, 121 или 122; (ii) VH CDR2 содержащий последовательность SEQ ID NO: 162, 128, 110, 111, 118, 119, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156, или 130, и; (iii) VH CDR3 содержащий последовательность SEQ ID NO: 112, или 120; и/или b) вариабельный участок легкой цепи (VL), содержащий участки определения комплементарности, выбранный из группы, состоящей из (i) VL CDR1 содержащий последовательность SEQ ID NO: 144, 131, 135, 138, 141, 142, 143, 146, 147, 148, 149, 150, или 151; (ii) VL CDR2 содержащий последовательность SEQ ID NO 145, 132, 136, или 152; и (iii) VL CDR3 содержащий последовательность SEQ ID NO: 139, 133, 137, 140, или 153.
В другом аспекте, изобретение касается изолированного антитела, или его антиген-связывающего фрагмента, которое связывается с рецептором хемокина 4 (CXCR4) и содержит: а) вариабельный участок легкой цепи (VL), содержащий (i) VL CDR1, содержащий последовательность X1SX2X3SLFNSX4X5RKNYLX6 где X1 означает R или K; Х2 означает S или А; Х3 означает W, N или Q; X4 означает Н или R; Х5 означает Т или F; и/или Х6 означает A, L, N или М (SEQ ID NO: 151); (ii) VL CDR2, содержащий последовательность WASARX1S, где Х1 означает G или Е (SEQ ID NO: 152), и (iii) VL CDR3, содержащий последовательность KQSFX1LRT, где X1 означает N или R (SEQ ID NO: 153); и/или b) вариабельный участок тяжелой цепи (VH), содержащий (i) VH CDR1 содержащий последовательность SEQ ID NO: 107, 108, 109, 113 или 114; (ii) VH CDR2, содержащий последовательность SEQ ID NO: 157, и (iii) VH CDR3, содержащий последовательность SEQ ID NO: 112.
В одном аспекте, изобретение касается изолированного антитела или его антиген-связывающего фрагмента, которое связывается с CXCR4 и содержит: последовательность вариабельного участка тяжелой цепи (VH), содержащую: EVQLVESGGGLVQPGGSLRLSCAASGFTFSDYYMSWVRQAPGKGLEWVX1FIRHKX2NX3X4TX5EYSTX6X7X8GRFTISRDX9SKNX10LYLQMNSLX11X12EDTAVYYCAX13DLPGFAYWGQGTLVTVSS (SEQ ID NO: 106), где X1 означает G или S; X2 означает V или A; X3 означает G, F, K, V, T, L, или I; X4 означает E или Y; X5 означает T или R; X6 означает W или S; X7 означает D или V; X8 означает K, T, или R; Х9 означает D или N; Х10 означает Т или S; Х11 означает R or K; Х12 означает А или Т; и/или Х13 означает K или R.
В одном аспекте, изобретение касается изолированного антитела или его антиген-связывающего фрагмента, которое связывается с рецептором хемокина 4 (CXCR4), выбранного из группы, состоящей из: а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1 с последовательностью SEQ ID NO: 107, 113 или 114; VH CDR2 с последовательностью SEQ ID NO: 162 или 128, и VH CDR3 с последовательностью SEQ ID NO: 112, и вариабельный участок легкой цепи (VL), содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; b) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 115, 116, 117, 121 или 122; VH CDR2 с последовательностью SEQ ID NO: 118 или 119 и VH CDR3 с последовательностью SEQ ID NO: 120, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 135; VL CDR2 с последовательностью SEQ ID NO: 136 и VL CDR3 с последовательностью SEQ ID NO: 137; с) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107, 108, 109, 113 или 114; VH CDR2 с последовательностью SEQ ID NO: 110 или 111 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 131; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 133; d) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107, 108, 109, 113 или 114; VH CDR2 с последовательностью SEQ ID NO: 154 или 123, и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO:138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 139; и e) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107, 108, 109, 113 или 114; VH CDR2 с последовательностью SEQ ID NO: 157 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 151; VL CDR2 с последовательностью SEQ ID NO: 152 и VL CDR3 с последовательностью SEQ ID NO: 153.
В одном аспекте, изобретение касается изолированного антитела или его антиген-связывающего фрагмента, выбранного из группы, состоящей из: а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112 и вариабельный участок легкой цепи (VL), содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; b) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 115; VH CDR2 с последовательностью SEQ ID NO: 118 и VH CDR3 с последовательностью SEQ ID NO: 120, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 135; VL CDR2 с последовательностью SEQ ID NO: 136 и VL CDR3 с последовательностью SEQ ID NO: 137; с) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 110 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 131; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 133; d) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 154 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 139; и е) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 157 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 151; VL CDR2 с последовательностью SEQ ID NO: 152 и VL CDR3 с последовательностью SEQ ID NO: 153.
В одном аспекте, изобретение касается изолированного антитела или его антиген-связывающего фрагмента, выбранного из группы, состоящей из: а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112 и вариабельный участок легкой цепи (VL), содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 139; b) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; с) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 150; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; d) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 141; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; e) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140; f) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 147; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; g) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 159 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; h) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 160 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; i) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 161 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; j) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; k) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; l) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 164 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; m) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 165 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; o) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 166 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; p) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 167 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; q) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 168 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; r) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 168 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; s) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140; t) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; u) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; v) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; и w) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140.
В определенных аспектах изобретения, антитело или его антиген-связывающий фрагмент содержат: вариабельный участок тяжелой цепи (VH), содержащий три CDR с последовательностями SEQ ID NO: 107, 162 и 112. В некоторых аспектах, антитело или его антиген-связывающий фрагмент содержит: вариабельный участок легкой цепи (VL), содержащий три CDR с последовательностями SEQ ID NO: 144, 145 и 139. В некоторых аспектах, антитело или его антиген-связывающий фрагмент содержит: вариабельный участок тяжелой цепи (VH), содержащий три CDR с последовательностями SEQ ID NO: 107, 162 и 112; и вариабельный участок легкой цепи (VL), содержащий три CDR с последовательностями SEQ ID NO: 144, 145 и 139.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент содержит: вариабельный участок тяжелой цепи (VH), содержащий VH CDR1, VH CDR2 и VH CDR3 из VH участка последовательности SEQ ID NO: 33. В других аспектах, антитело или его антиген-связывающий фрагмент содержит: вариабельный участок легкой цепи (VL), содержащий VL CDR1, VL CDR2 и VL CDR3 из VL участка последовательности SEQ ID NO: 73. В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент содержит: вариабельный участок тяжелой цепи (VH), содержащий VH CDR1, VH CDR2 и VH CDR3 из VH участка последовательности SEQ ID NO: 33; и вариабельный участок легкой цепи (VL), содержащий VL CDR1, VL CDR2 и VL CDR3 из VL участка последовательности SEQ ID NO: 73.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент выбраны из группы, состоящей из: а) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 33 и VL участок последовательности SEQ ID NO: 73; b) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 13 и VL участок последовательности SEQ ID NO: 15; с) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 5 и VL участок последовательности SEQ ID NO: 7; d) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 21 и VL участок последовательности SEQ ID NO: 47; и е) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 106 и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132; и VL CDR3 с последовательностью SEQ ID NO: 139.
В некоторых аспектах изобретения, изолированное антитело или его антигенный фрагмент содержит вариабельный участок тяжелой цепи с аминокислотной последовательностью, которая на как минимум 95% идентична последовательности SEQ ID NO: 33, и вариабельный участок легкой цепи с аминокислотной последовательностью, которая на как минимум 95% идентична последовательности SEQ ID NO: 73.
В определенных аспектах изобретения, антитело или его антиген-связывающий фрагмент содержит: а) вариабельный участок тяжелой цепи (VH) с последовательностью SEQ ID NO: 33; и/или b) вариабельный участок легкой цепи (VL) с последовательностью SEQ ID NO: 73.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент содержит вариабельный участок тяжелой цепи (VH) полученный с помощью вектора экспрессии с АТСС номером доступа РТА-121353. В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент содержит вариабельный участок легкой цепи (VL), полученный с помощью вектора экспрессии с АТСС номером доступа РТА-121354.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент выбраны из группы, состоящей из:
а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и вариабельный участок легкой цепи (VL), содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 139;
b) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
c) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 150; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
d) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 141; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
e) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140;
f) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 147; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
g) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 159 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
h) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 160 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
i) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 161 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
j) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
k) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
l) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 164 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
m) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 165 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
n) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 166 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
o) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 167 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
p) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 168 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
q) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 168 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140;
r) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140;
s) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139;
t) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139;
u) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; и v) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, которые связывают CXCR4, конкурируют за связывание с CXCR4 и/или связываются с тем же эпитопом CXCR4, что и антитело или его антиген-связывающий фрагмент, описанные в данном документе.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент содержат VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент является гуманизированным, гибридным, CDR-привитым или рекомбинантным человеческим антителом. В других аспектах изобретения, антитело или его антиген-связывающий фрагмент не являются собачим или фелинизированным.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент содержат метку, содержащую глутамин донор ацила, сконструированную в определенном месте.
В некоторых аспектах изобретения, оно касается конъюгатов анти-CXCR4 антитело-лекарство. Конъюгат антитело-лекарство изобретения имеет формулу: Ab-(T-L-D), где: Ab означает антитело или его антиген-связывающий фрагмент, которое связывается с рецептором хемокина 4 (СХС4); Т означает метку, содержащую глутамин донор ацила, которую включают необязательно; L означает линкер; и D означает лекарство.
В определенных аспектах, конъюгат антитело-лекарство изобретения, выбран из группы, состоящей из: а) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 107, 162 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 144, 145 и 139; b) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 115, 118 и 120, и VL участок, включающий последовательности CDR SEQ ID NO: 135, 136 и 137; с) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 107, 110 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 131, 132 и 133; d) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 107, 154 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 138, 132 и 139; е) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 107, 157 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 151, 152 и 153; f) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 33 и VL участок последовательности SEQ ID NO: 73; g) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 13 и VL участок последовательности SEQ ID NO: 15; h) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 5 и VL участок последовательности SEQ ID NO: 7; и i) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 21 и VL участок последовательности SEQ ID NO: 47.
В некоторых конъюгатах антитело-лекарство изобретения, Ab означает гуманизированное, гибридное, CDR-привитое или рекомбинантное человеческое антитело или его антиген-связывающий фрагмент. В некоторых конъюгатах антитело-лекарство изобретения, Т выбирают из группы, состоящей из SEQ ID NO: 171, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 172, 173, 102, 103 и LLQ. В некоторых конъюгатах антитело-лекарство изобретения, L выбирают из группы, состоящей из ацетил-лизин-валин-цитруллин-р-аминобензилоксикарбонил (AcLys-VC-PABC), амино PEG6-пропионил, малеимидокапроновый-валин-цитруллин-р-аминобензилоксикарбонил (vc) и малеимидокапроил (mc). В некоторых конъюгатах антитело-лекарство изобретения, D выбирают из группы, состоящей из а цитотоксический агент, иммуномодулирующий агент, визуализирующее средство, терапевтический протеин, биополимер и олигонуклеотид.
Любой конъюгат антитело-лекарство изобретения может быть получен вместе с лекарством, являющимся цитотоксическим агентом. Цитотоксический агент означает антрациклин, ауристатин, камптотецин, комбрестатин, доластатин, дуокармицин, энедиин, гелданамицин, димер индолино-бензодиазепин, маутанзин, пуромицин, пирролобензодиазепиновый димер, таксан, алкалоид барвинка, тубулизин, гемиастерлин, сплайсеостатин, пладиенолид и каличеамицин. Любой конъюгат антитело-лекарство изобретения может быть получен вместе с лекарством, являющимся ауристатин. В одном аспекте, ауристатин означает 0101 (2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-{[(1S)-2-фенил-1-(1,3-тиазол-2-ил)этил]амино}пропил] пирролидин-1-ил}-5-метил-1-oкcoгeптaн-4-ил]-N-мeтил-L-вaлинaмид), MMAD (Монометил Ауристатин D или монометил доластатин 10 и 8261 (2-Метилаланил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбокси-2-фенилэтил]амино}-1-метокси-2-метил-3-oкcoпpoпил]пиppoлидин-1-ил}-3-мeтoкcи-5-мeтил-1-oкcoгeптaн-4-ил]-N-мeтил-L-валинамид).
В определенных аспектах, конъюгат антитело-лекарство изобретения выбран из группы, состоящей из: a) Ab-LLQGA (SEQ ID NO: 91)-(ацетил-лизин-валин-цитруллин-р-аминобензилоксикарбонил (AcLys-VC-PABC))-0101; Ab-LLQGA (SEQ ID NO: 91)-(AcLys-VC-PABC)-MMAD; c) Ab-LLQX1X2X3X4X5 (SEQ ID NO: 102)-(AcLys-VC-PABC)-0101; d) Ab-LLQX1X2X3X4X5 (SEQ ID NO: 102)-(AcLys-VC-PABC)-MMAD; e) Ab-GGLLQGA (SEQ ID NO: 92)-(AcLys-VC-PABC)-0101; и f) Ab-GGLLQGA (SEQ ID NO: 92)-(AcLys-VC-PABC)-MMAD.
В некоторых аспектах изобретения, CXCR4 конъюгат антитело-лекарство содержит любое их антител или их антиген-связывающих фрагментов, описанных в данном документе, В определенном аспекте изобретения, конъюгат антитело-лекарство изобретения содержит антитело, где антитело содержит VH участок, включающий последовательности CDR SEQ ID NO: 107, 162 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 144, 145 и 139.
Изобретение также относится к фармацевтическим композициям, содержащим CXCR4 антитело, его антиген-связывающий фрагмент или конъюгат антитело-лекарство, описанные в данном документе, и фармацевтически приемлемый носитель.
В некоторых аспектах изобретения, обеспечивают изолированный полинуклеотид, содержащий нуклеотидную последовательность, кодирующую любое анти-CXCR4 антитело или его антиген-связывающий фрагмент, описанные в данном документе. В некоторых аспектах, обеспечивают клетки хозяева, рекомбинантно продуцирующие антитело или его антиген-связывающий фрагмент, описанные в данном документе.
В других аспектах, обеспечивают способы лечения расстройства, ассоциированные с функцией или экспрессией CXCR4 у субъекта, включающие введение субъекту эффективного количества фармацевтической композиции данного изобретения. В определенных аспектах изобретения, расстройством является рак.
В других аспектах, обеспечивают способы снижения метастазирования раковых клеток, экспрессирующих CXCR4, у субъекта, включающие введение субъекту, который в этом нуждается, эффективного количества фармацевтической композиции, описанной в данном документе. В других аспектах, обеспечивают способы вызывания регрессии опухоли у субъекта, имеющего опухоль, экспрессирующую CXCR4, включающие введение субъекту, который в этом нуждается, эффективного количества фармацевтической композиции, описанной в данном документе.
Эти и другие аспекты изобретения являются описанием заявки в целом.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1 показывает выравнивание h3G10 вариабельного участка тяжелой цепи (VH).
Фигура 2 показывает выравнивание h3G10 вариабельного участка легкой цепи (VL).
Фигура 3А показывает кросс-реактивность анти-человеческого CXCR4 Ab h3G10.1,91.A58B с CXCR4 яванской макаки с помощью проточной цитометрии в серии разведений (0,007-267 нМ) на HPB-ALL (Т-клеточная лейкемия человека) и циано-СХСР4 трансфецированных СНО клетках.
Фигура 3В показывает кросс-реактивность анти-человеческого CXCR4 Ab h3G10.1,91.A58B с CXCR4 яванской макаки с помощью проточной цитометрии в серии разведений (0,007-267 нМ) на Raji (NHL; неходжкинская лимфома человека) и HSC-F (Т-клеточная линия яванской макаки).
Фигура 4 показывает ADCC(A-C) и CDC(D-F) активности анти-человеческого CXCR4 антитела на человеческих клеточных линиях, экспрессирующих CXCR4.
Фигура 4А показывает ADCC активности 12А11, 6В6 и 3G10 анти-человеческого CXCR4 антитела на клетках Ramos (NHL).
Фигура 4В показывает сравнение ADCC активности m3G10-hlgG1 и m3G10-hlgG4 анти-человеческого CXCR4 антитела на клетках MOLT-4 (Т-острая лимфобластическая лейкемия).
Фигура 4С показывает ADCC активности мышиного (m3G10-) и гуманизированного (h3G10-) анти-человеческого CXCR4 антитела на клетках MOLT-4 (Т-острая лимфобластическая лейкемия).
Фигура 4D показывает CDC активности 12А11, 6В6 и 3G10 анти-человеческого CXCR4 антитела на клетках Ramos (NHL).
Фигура 4Е показывает сравнение ADCC активности m3G10-hlgG1 и m3G10-hlgG4 анти-человеческого CXCR4 антитела на клетках Daudi (NHL).
Фигура 4F показывает CDC активности мышиного (m3G10-) и гуманизированное (h3G10-) анти-человеческого CXCR4 антитела на клетках Daudi (NHL).
Фигура 5 показывает ингибирование потока кальция с помощью 3G10, 6В6 и 12А11 анти-человеческого CXCR4 антитела.
Фигура 6А показывает, что 3G10, 6В6 и 12А11 анти-человеческие CXCR4 антитела способны вызвать гибель клеток на клетках Ramos дозо-зависимым образом.
Фигура 6В показывает, что способность анти-человеческого CXCR4 антитела 3G10's вызывать гибель клеток, является бивалентно зависимой.
Фигура 7 показывает, что 3G10, 6В6 и 12А11 анти-человеческие CXCR4 антитела значительно ингибируют рост опухоли в модели неходжскинской лимфомы (NHL) (Ramos), по сравнению с изотипом контрольного антитела.
Фигура 8А показывает, что анти-человеческие CXCR4 антитела 3G10, 6В6 и 12А11 имеют значительный эффект, по сравнению с изотипом контрольного антитела, на опухолевую массу животных, системно имплатированных клетками Raji-LUC.
Фигура 8В показывает, что лечение анти-человеческими CXCR4 антителами 3G10, 6В6 и 12А11, имело значительное ингибирующее влияние на рост опухоли (TGI), по сравнению с изотипом контрольного антитела в этой модели.
Фигура 8С представляет кривую выживания, которая показывает значительный эффект анти-человеческого CXCR4 антитела 3G10, 6В6 и 12А11, по сравнению с изотипом контрольного антитела, в выживании животных, системно имплантированных клетками Raji-LUC.
Фигура 9А показывает эффект CXCR4 Ab 6В6 на опухолевую массу в модели острой миелогенной лейкемии (AML) (MV4-11-LUC). Показано образцовую биолюминесцентную визуализацию 5 животных/на группу обработки с 20 по 41 день.
Фигура 9В показывает значительный эффект анти-СХСR4 антитела 6В6, по сравнению с изотипом контрольного антитела, в выживании животных, системно имплантированных клетками MV4-11-LUC AML.
Фигура 9С показывает значительное снижение человеческой AML опухолевой массы в периферической крови (РВ) животных, обработанных анти-CXCR4 6В6 антителом, сравнению с изотипом контрольно обработанных животных на 35 день исследования.
Фигура 10А показывает образцовую визуализацию люциферазы в мышах с системной хронической лимфоцитарной лейкемией, обработанных CXCR4 3G10 антителом.
Фигура 10В представляет кривую выживания, показывающую значительный эффект анти-человеческого CXCR4 антитела 3G10, по сравнению с изотипом контрольного антитела, в выживании животных, системно имплантированных клетками хронической димфоцитарной лейкемии.
Фигура 11 показывает, что гуманизированное анти-человеческое CXCR4 антитело значительно ингибирует рост опухоли в модели неходжскинской лимфомы (NHL) (Ramos), по сравнению с изотипом контрольного антитела.
Фигура 12А показывает эффект CXCR4 Ab h3G10.1,91.A58B на опухолевую массу в модели множественной миеломы (ММ) (ОПМ-2-LUC). Показано образцовую биолюминесцентную визуализацию 5 животных/на группу обработки с 8 по 30 день.
Фигура 12В показывает количественную оценку биолюминсценции (активности люциферазы) в мышиной модели системной множественной миеломы (ММ), обработанной анти-человеческим CXCR4 антителом h3G10.1,91.A58B, по сравнению с животными, обработанными изотипом контрольного антитела и мелфаланом.
Фигура 12С представляет кривую выживания, показывающую значительный эффект анти-CXCR4 антитела h3G10.1,91.A58B, по сравнению с изотипом контрольного антитела и мелфаланом, у мышей, системно имплантированных клетками ОПМ-2-Luc ММ.
Фигура 13А показывает значительный противоопухолевый эффект CXCR4 ADCs 3G10-TG6-vc0101 и 6B6-TG6-vc0101 в опухолевой модели Ramos (NHL).
Фигура 13В показывает значительный противоопухолевый эффект CXCR4 ADC 3G10-TG6-vc0101 в опухолевой модели HPB-ALL (T-ALL).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение, описанное в данном документе, относится к антителам и конъюгатам антител (например, конъюгаты антитело-лекарство), которые связываются с CXCR4 (например, человеческий CXCR4). Изобретение так же относится к полинуклеотидам, кодирующим такие антитела, композициям, содержащим такие антитела, и способам получения и использования таких антител. В определенных аспектах, антитела данного описания происходят от определенных зародышевых последовательностей тяжелой и легкой цепи и/или содержат конкретные структурные признаки, такие как участки CDR, содержащие определенные аминокислотные последовательности. Данное описание касается выделенных антител, способов получения таких антител, их антиген-связывающих фрагментов, конъюгатов антитело-лекарство и биспецифических молекул, содержащих такие антитела, и фармацевтических композиций, содержащих антитела, их антиген-связывающие фрагменты, конъюгаты антитело-лекарство или биспецифические молекулы описания. Данное описание так же относится к способам использования антител, например, для выявления CXCR4, модулирования активности CXCR4 и/или для направления в клетки, экспрессирующие CXCR4 для разрушения (например, ADCC, CDC, токсин), при расстройствах, ассоциированных с функцией или экспрессией CXCR4, таких как рак. Изобретение так же относится к способам превентивного и/или терапевтического лечения расстройства, ассоциированного с функцией или экспресией CXCR4 у субъекта, такого как рак (например, плотная опухоль или гематологический рак). Наконец, изобретение включает композиции, содержащие такие антитела в конъюгате (например, конъюгаты антитело-лекарство) или в комбинации с другими противораковыми соединениями, такими как антитела, токсины, цитотоксические/цитостатические соединения, и применение таких композиций для превентивного и/или терапевтического лечения расстройства, ассоциированного с функцией или экспресией CXCR4, такого как рак.
Общие техники
Практика данного изобретения использует, пока не указано обратное, традиционные техники молекулярной биологии (включая рекомбинантные техники), микробиологии, клеточной биологии, биохимии и иммунологии, известные специалистам в отрасли. Такие техники полностью описаны в литературе, например, Molecular Cloning: А Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Векторы for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Моноклональное антитела: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); and, The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Определения и аббревиатуры
Термины "Хемокиновый (С-Х-С мотив) рецептор 4'' и "CXCR4", как указано в данном документе, относится к G протеин-сопряженному, 7-трансмембранного домена хемокиновому рецептору, в норме погруженному в мембрану клетки. Термины также включают варианты, изоформы, гомологи, ортологи и паралоги. Последовательности нуклеиновых кислот и полипептидов humanCXCR4 описаны под номерами доступа в GenBank НМ_003467 и NP_003458, соответственно. Дальнейшее описание человеческого CXCR4 можно найти в Federsppiel, В. et al. Genomics 16(3):707-712 (1993); Herzog, Н. et al. DNA Cell Biol. 12(6): 465-471 (1993); Jazin, E.E. et ai Regul. Pept 47(3): 247-258 (1993); Nomura, H. et al. Int. Immunol. 5(10): 1239-1249 (1993); Loetscher, M. et al J. Biol. Chem. 269(1): 232-237 (1994); Moriuchi, M. et al: J. Immunol. 159(9): 4322-4329 (1997); Caruz, A. et al. FEBS Lett. 426(2): 271-278 (1998); and Wegner, S.A. et al. J. Biol. Chem. 273(8): 4754-4760 (1998).
CXCR4 так же известен в отрасли в качестве, например, LESTR, CD 184, CD184 антигена, С-Х-С хемокинового рецептора типа 4, CXCR-4, CXCL-12, CXCR-R4, D2S201E, FB22, гибридного фузина, НМ89, HSY3RR, LAP3, LCR1, рецептора седьмого трансмембранного домена лейкоцитарного происхождения, NPY3R, NPYR, NPYRL, NPYY3R, SDF-1 рецептора, или рецептор стромального клеточного фактора 1.
Для целей данного изобретения, термин "CXCR4 антиген" включает любой CXCR4, включая человеческий CXCR4, CXCR4 других млекопитающих (например, мышиный CXCR4, крысиный CXCR4, собачий CXCR4, кошачий CXCR4 протеин или CXCR4 приматов), а также различные формы CXCR4 (например, гликозилированный CXCR4).
Термины "антитело" и "Ab", как указано в данном документе, относятся к молекуле иммуноглобулина, способной распознавать и связываться с специфической мишенью или антигеном, такой как углевод, полинуклеотид, липид, полипептид, и т.д., по средством как минимум одного сайта распознавания антигена, расположенного в вариабельном участке молекулы иммуноглобулина. Как указано в данном документе, термин "антитело" может включать любой вид антитела, включая, но не ограничиваясь следующими: моноклональные антитела, поликлональные антитела и антиген-связывающие фрагменты интактного антитела, сохраняющие способность специфически связывать определенный антиген (например, CXCR4), биспецифические антитела, гетероконъюгат антитела, их мутанты, сопряженные протеины, включающие антитело, одно-цепочечные (ScFv) и одно-доменные антитела (например, антитела акулы и верблюда), макситела, минитела, интратела, диатела, триатела, тетратела, v-NAR и bis-scFv (смотреть, например, Hollinger and Hudson, 2005, Nature Biotechnology 23(9): 1126-1136), гуманизированное антитела, гибридное антитела и любая другая модифицированная конфигурация молекулы иммуноглобулина, включающая сайт распознавания антигена нужной специфичности, включая гликозилированные варианты антитела, варианты аминокислотной последовательности антитела, и ковалентно модифицированные антитела. Антитела могут иметь мышиное, крысиное, человеческое или любое другое происхождение (включая гибридные или гуманизированные антитела). В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент для применения способов изобретения представляет собой гибридное, гуманизированное или рекомбинантное человеческое антитело, или его CXCR4-антиген-связывающий фрагмент.
Существует 5 главных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и несколько этих классов могут быть поделены на подклассы (изотипы), например, lgG1, lgG2, lgG3, lgG4, lgA1 и lgA2. Константные участки тяжелой цепи, соответствующие различным классам иммуноглобулинов называются альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерных конфигураций различных классов иммуноглобулинов хорошо известны в отрасли.
Нативные или природные антитела обычно являются гетеротетрамерными гликопротеинами массой приблизительно 150,000 дальтон, состоящими из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связанна с тяжелой цепью одной ковалентной дисульфидной связью, хотя количество дисульфидных связей тяжелых цепей различается в различных изотипах иммуноглобулинов. Каждая тяжелая и легкая цепь так же имеет равномерно распределенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), с последующими константными доменами. Каждая легкая цепь имеет на одном конце вариабельный домен (VL) и константный домен на другом конце; константный домен легкой цепи находится на одной линии с первым константным доменом тяжелой цепи, и вариабельный участок домена легкой цепи находится на одной линии с вариабельным доменом тяжелой цепи. Определенные аминокислотные остатки образовывают поверхность взаимодействия между вариабельными доменами легкой и тяжелой цепей. Термин "вариабельный" касается факта, что определенные части вариабельных доменов существенно различаются по последовательности среди антител.
Термины "антиген-связывающий фрагмент", "антиген-связывающая часть" и "часть антитела", как указано в данном документе, относятся к одному или нескольким фрагментам интактного антитела, сохраняющим способность связываться с опеределенным антигеном (например, CXCR4). Антиген-связывающие функции антитела могут осуществляться фрагментами интакного антитела. Примеры антиген-связывающих фрагментов включают Fab; Fab'; F(ab')2; фрагмент Fd состоит из VH и СН1 доменов; фрагмент Fv состоит из VL и VH доменов одного плеча антитела; фрагмент одно-доменного антитела (dAb) (Ward et al., Nature 341: 544-546, 1989), выделенный участок определения комплементарности (CDR), нанотело и вариабельный участок тяжелой цепи, содержащий один вариабельный домен и два константных домена. Более того, хотя два домена фрагмента Fv, VL и VH, кодируются отдельными генами, они могут буть объединены, используя рекомбинантные способы, с помощью синтетического линкера, что позволяет им создать единую протеиновую цепь, где пары VL и VH участков формируют моновалентные молекулы (известные как одноцепочечный Fv (scFv), смотреть, например, Bird et al., Science 242: 423-426 (1988), and Huston el al., PNAS 85: 5879-5883 (1988). Такие одноцепочечные антитела так же включены в термин "антиген-связывающая часть" антитела. Эти фрагменты антитела получают, используя стандартные техники, известные в отрасли, и скрининг фрагментов на пригодность проводят таким же образом, как и интактные антитела.
Термин "CDR", как указано в данном документе, относится к участку вариабельного домена антитела, который обеспечивает его связывающую специфичность. Имеется 3 CDR на каждой тяжелой и легкой цепи антитела. Аминокислотные остатки внутри вариабельного участка, составляющие CDR, могут быть идентифицированы, используя известные в отрасли способы, включая, но не ограничиваясь Kabat (Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington D.C.), Chothia (Chothia et al., 1989, Nature 342:877-883), объединение Kabat и Chothia, определение AbM (являющееся компромиссом между Kabat и Chothia, и использует программное обеспечение для моделирования Oxford Molecular's AbM антитела (сейчас Accelrys®), определение контакта (MacCallum et al., 1996, J. Mol. Biol., 262:732-745), и/или определение конформации (Makabe et al., 2008, Journal of Biological Chemistry, 283: 1156-1166). Как указано в данном документе, CDR может относится к CDR, определенной любым известным способом, включая комбинации подходов. Способы, использованные в данном документе, могут использовать CDR, определенные любым из указанных подходов.
Термин "Fc участок", как указано в данном документе, относится к С-терминальному участку тяжелой цепи иммуноглобулина. "Fc участок" может быть Fc участком с нативной последовательностью или вариантом Fc участка. Хотя границы участка Fc тяжелой цепи иммуноглобулина могут разниться, Fc участок тяжелой цепи человеческого IgG обычно располагается от аминокислотного остатка в положении Cys226, или от Pro230, до его карбоксильного-конца. Количество остатков участка Fc соответствует индексу EU в Kabat (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991).
Термины "моноклональное антитело" и "mAb", как указано в данном документе, относятся к антителу, полученному из популяции по сути гомогенного антитела, то есть, индивидуальные антитела, составляющие популяцию, являются идентичными, кроме возможных природных мутаций, присутствующих в незначительном количестве. Моноклональные антитела являются высоко специфичными, направленными против одного антигенного сайта. Более того, в отличии от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. "Моноклональное" указывает на характер антитела как полученного из по сути гомогенной популяции антитела, и не подразумевает получение антитела каким либо определенным способом. Например, моноклональные антитела, для использования в данном изобретении, могут быть получены способом гибридомы, впервые описанным Kohler and Milstein, Nature 256: 495, 1975, или способами рекомбинантной ДНК, описанными в патенте США №4,816,567. Моноклональные антитела так же могут быть выделены из библиотек фагов, образованных техниками, описанными в McCafferty et al., Nature 348: 552-554, 1990.
Термин "изолированное антитело", как указано в данном документе, касается антитела, по сути не содержащего других антител з отличной антигенной специфичностью (например, изолированное антитело, специфически связывающее CXCR4, по сути не содержит антитела, специфически связывающего антигены, отличные от CXCR4). Изолированное антитело специфически связывающее CXCR4 может, однако, иметь кросс-реактивность к другим антигенам, таким как молекулы CXCR4 других видов. Более того, изолированное антитело может, по сути, не содержать клеточного материала и/или химических соединений.
Термины "гуманизированное антитело" и "CDR-привитое антитело", как указано в данном документе, касается форм нечеловеческого (например, мышиного) антитела, представленного гибридными иммуноглобулинами, цепями иммуноглобулина или их фрагментами (такими как Fv, Fab, Fab', F(ab')2 или другими антиген-связывающими последовательностями антитела), содержащими минимальное количество последовательностей, происходящих от нечеловеческого иммуноглобулина. Желательно, гуманизированные антитела являются человеческими иммуноглобулинами (реципиентное антитело), где остатки из участка определения комплементарности (CDR) реципиента замещены остатками из CDR нечеловеческих видов (донорное антитело), таких как мышиное, крысиное или кроличье с желательной специфичностью, аффинностью и активностью.
В некоторых случаях, остатки Fv каркасного участка (FR) человеческого иммуноглобулина замещены соответствующими нечеловеческими остатками. Более того, гуманизированное антитело может содержать остатки, которые отсутствуют как в реципиентном антителе, так и в импортированном CDR или каркасных последовательностях, но включенные для улучшения и оптимизации активности антитела. В целом, гуманизированное антитело содержит по сути все из как минимум одного, и обычно двух вариабельных доменов, где все или по сути все участки CDR соответствуют участкам нечеловеческого иммуноглобулина, и все или по сути все участки FR представлены участками консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело оптимально содержит как минимум часть константного участка или домена иммуноглобулина (Fc), обычно человеческого иммуноглобулина. Предпочтительными являются антитела, имеющие участки Fc, модифицированные как описано в WO 99/58572. Другие формы гуманизированного антитела имеют один или больше CDR (CDR L1, CDR L2, CDR L3, CDR Н1, CDR Н2 или CDR Н3), измененные соответственно оригинальному антителу, которые так же называют одним или больше CDR "происходящими из" одного или больше CDR оригинального антитела.
Гуманизация по сути производится согласно способу Винтера и сотрудников (Jones et al. Nature 321: 522-525 (1986); Riechmann et al. Nature 332: 323-327 (1988); Verhoeyen et al. Science 239: 1534-1536 (1988)), путем замещения CDR или последовательностей CDR грызунов или мутантных CDR или последовательностей CDR грызунов соответствующими последовательностями человеческого антитела. Смотреть так же патенты США №5,225,539; 5,585,089; 5,693,761; 5,693,762; 5,859,205; включенные с помощью ссылок. В некоторых случаях, остатки внутри каркасных участков одного или больше вариабельных участков человеческого иммуноглобулина, замещены соответствующими нечеловеческими остатками (смотреть, например, патенты США №5,585,089; 5,693,761; 5,693,762; и 6,180,370). Более того, гуманизированные антитела могут содержать остатки, не присутствующие в реципиентном антителе или донорном антителе. Эти модификации осуществляют для улучшения активности антитела (например, для получения желателной активности). В целом, гуманизированное антитело содержит по сути все из как минимум одного, и обычно двух вариабельных доменов, где все или по сути все гипервариабельные участки соответствуют участкам нечеловеческого иммуноглобулина, и все или по сути все каркасные участки являются участками последовательности человеческого иммуноглобулина. Гуманизированное антитело так же необязательно содержит как минимум часть константного участка иммуноглобулина (Fc), обычно человеческого иммуноглобулина. Более детально смотреть Jones et al. Nature 331: 522-525 (1986); Riechmann et al. Nature 332: 323-329 (1988); and Presta Curr. Op. Struct. Biol. 2: 593-596 (1992); включенные с помощью ссылок. Соответственно, такие "гуманизированные" антитела могут включать антитела, где по сути менее чем интактный человеческий вариабельный домен замещен соответствующей последовательностью нечеловеческих видов. Практически, гуманизированные антитела обычно являются человеческими антителами, где некоторые остатки CDR и возможно некоторые каркасные остатки, замещены остатками из аналогичных сайтов антитела грызунов. Смотреть, например, Патенты США №5,225,539; 5,585,089; 5,693,761; 5,693,762; 5,859,205. Смотреть так же патент США №6,180,370, и международную публикацию WO 01/27160, где описаны гуманизированные антитела и техники получения гуманизированных антител с улучшенной аффинностью к определенному антигену.
Термин "человеческое антитело", как указано в данном документе, относится к антителу с аминокислотной последовательностью, соответствующей последовательности антитела продуцированного человеком и/или полученного любым способом получения человеческого антитела, известным в отрасли, или описанным в данном документе. Такое определение человеческого антитела включает антитела, содержащие как минимум один человеческий полипептид тяжелой цепи или как минимум один человеческий легкой цепи. Примером является антитело, содержащее мышиные полипептиды легкой цепи и человеческие полипептиды тяжелой цепи. Человеческие антитела могут быть получены, используя известные в отрасли техники. В одном варианте осуществления, человеческое антитело выбирают из библиотеки фагов, где библиотека фагов экспрессирует человеческие антитела (Vaughan et al., Nature Biotechnology, 14: 309-314, (1996); Sheets et al., Proc. Natl. Acad. Sci. (USA) 95: 6157-6162, (1998); Hoogenboom and Winter, J. Mol. Biol., 227:381, (1991); Marks et al., J. Mol. Biol., 222:581, (1991)). Человеческие антитела так же получают иммунизацией животных, которым трансгенно ввели локусы человеческого иммуноглобулина вместо эндогенных локусов, например, мыши в которых эндогенные гены иммуноглобулина частично или полностью инактивированы. Такой подход описан в патентах США №5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; и 5,661,016. Альтернативно, человеческое антитело может быть получено омервщлением человеческих В лимфоцитов, продуцирующих антитело, направленное против антигена мишени (такие В лимфоциты могут быть восстановлены у индивидуума или клонированием кДНК одноклеточных, или могут быть иммунизированы in vitro). Смотреть, например, Cole et al. Моноклональное Antibodies and Cancer Therapy, Alan R. Liss, p. 77, (1985); Boerner et al., J. Immunol., 147 (1): 86-95, (1991); и Патент США №5,750,373.
Термин "гибридное антитело", как указано в данном документе, относится к антителу, где последовательности вариабельного участка происходят из одного вида, а последовательности константного участка происходят из других видов, например, антитело, где последовательности вариабельного участка происходят измышиного антитела, последовательности константного участка происходят из человеческого антитела. Для применения в ветеринарии, константные домены гибридного антитела могут происходить от доменов других видов, таких как котов и собак.
Термины "канинизированное антитело" и "фелинизированное антитело", как указано в данном документе, относится к гибридноому антителу, приемлемому в качестве терапевтического средства для собак и кошек, соответственно. В обоих случаях, антиген-связывающий домен донорного антитела гетерологичных видов, объединяют с неантиген-связывающим доменом реципиентного антитела тех же видов.
Термины "предпочтительно связывает" или "специфически связывает", как указано в данном документе, при использовании в контексте связывания антитела с мишенью (например, CXCR4 протеином), являются известными в отрасли. Способы определения такого специфичного или предпочтительного связывания так же известны в отрасли. Считается, что молекула проявляет "специфическое связывание" или "предпочтительно связывание", если она реагирует или ассоциирует более быстро, более часто, с большей продолжительностью и/или с большей аффинностью с определенной клеткой или соединением, чем с другими клетками или соединениями. Антитело "специфически связывает" или "предпочтительно связывает" мишень, если оно связывается с большей аффинностью, авидностью, более быстро и/или с большей продолжительностью, чем с другими соединениями. Например, антитело специфично или предпочтительно связывающее эпитоп CXCR4 является антителом, связывающим этот эпитоп с большей аффинностью, авидностью, более быстро и/или с большей продолжительностью, чем с другими CXCR4 эпитопами или не -CXCR4 эпитопами.
Термин "аффинность связывания" и "KD", как указано в данном документе, относится к равновесной константе диссоциации конкретного взаимодействия антиген-антитело. KD является соотношением скорости диссоциации, так же называемой "off-скорость" или "kd", к скорости ассоциации, или "on-скорость" или "ka". Таким образом, KD равняется kd/ka и выражается в молярной концентрации (М). Из этого следует, что чем меньше KD, тем сильнее аффинность связывания. Поэтому, KD=1 мкМ указывает на слабую аффинность связывания, по сравнению с KD=1 нМ. Значения KD для антител определяют, используя известные в отрасли способы. Одним из способов определения KD антитела является поверхностный плазмонный резонанс, обычно использующий систему биосенсора, такую как система BIACORE®.
Термин "конкурировать", как указано в данном документе относительно антитела, означает, что первое антитело связывается с эпитопом аналогичным способом, что и второе антитело, так что результат связывания первого антитела с родственным эпитопом, значительно снижается в присутствии второго антитела, по сравнению со связыванием первого антитела при отсутствии второго антитела. Антитела, конкурирующие за связывание с эпитопом с антителом изобретения, включены в данное изобретение. Специалисту в отрасли понятно, что на основе приведенных методик, такие конкурирующие антитела могут быть приемлемыми для способов, описанных в данном документе.
Термин "лекарство", как указано в данном документе, относится к любому соединению, имеющему биологическую или выявляемую активность. Термин лекарство включает цитотоксические агенты, терапевтические агенты, иммуномодулирующие агенты, выявляемые метки, радиоактивные агенты, связывающие агенты, пролекарства (которые метаболизируются в активный агент in vivo), факторы роста, гормоны, цитокины, анти-гормоны, ксантины, интерлейкины, интерфероны, и цитотоксические лекарства. Лекарство может находиться в форме маленьких молекул, полипептидов, олигонуклеотидов или биополимеров. Лекарство может быть конъюгировано с антителом изобретения по средством линкера с образованием конъюгата антитело-лекарство.
Термин "эффекторная функция", как указано в данном документе, относится к биологической активности присущей участку Fc антитела. Примеры эффекторной функции антитела включают, но не ограничиваются следующими: антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC), связывание Fc рецептора, комплемент-зависимая цитотоксичность (CDC), фагоцитоз, C1q связывание, и даун-регуляция рецепторов поверхности клетки (например, В-клеточный рецептор; BCR). Смотреть, например, Патент США №6,737,056. Такая эффекторная функция обычно требует объединения участка Fc со связывающим доменом (например, вариабельный домен антитела) и может быть оценена, используя известные в отрасли способы оценки такой эффекторной функции антитела. Примером измерения эффекторной функции является связывание Fcγ3 и/или C1q.
Термин "эпитоп", как указано в данном документе, включает любую детерминанту протеина, способную связываться с иммуноглобулином или Т-клеточным рецептором, или другим образом взаимодействовать с молекулой. Эпитопные детерминанты обычно состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или углеводородные или сахарные цепи, и обычно имеют специфические трехмерные структуры, а так же специфические характеристики заряда. Эпитоп может быть «линейным" или "конформационным". В линейном эпитопе все точки взаимодействия между протеином и реагирующей молекулой (такой как антитело) находятся линейно вдоль первичной аминокислотной последовательности протеина. В конформационном эпитопе, точки взаимодействия находятся поперек аминокислотных остатков протеина, отделенных друг от друга. После выявления желаемого эпитопа на антигене, возможно вырабатывать антитела к этому эпитопу, например, используя описанные выше техники в данном изобретении. Альтернативно, на протяжении процесса исследования, выработка и характеристика антител может прояснить информацию о желательных эпитопах. Из такой информации затем возможно провести конкурентный скрининг антител на связывание с одинаковым эпитопом. Для этой цели осуществляют конкурентные исследования с целью обнаружения антител, конкурентно связывающих одно другое, то есть, антитела конкурируют за связывание с эпитопом. Высокопроизводительный процесс 'связывания антитела на основе их конкуренции описан в международной публикации WO 03/48731. Как указано в данном документе, термин 'связывание' относится к способу группирования антител на основе их антиген-связывающих характеристик.
Термины "полинуклеотид," "нуклеиновая кислота /нуклеотид" и "олигонуклеотид», как указано в данном документе, относятся у полимерным формам нуклеотидов любой длины, к дезоксирибонуклеотидам или рибонуклеотидам, их аналогам, или любому субстрату, который может быть включен в цепь с помощью ДНК- или РНК-полимеразы. Полинуклеотиды могут иметь трехмерную структуру и могут выполнять любую функцию, известную или нет. Далее приведены не исчерпывающие примеры полинуклеотидов: ген или фрагмент гена, экзоны, интроны, матричная РНК (мРНК), трансферная РНК, рибосомальная РНК, рибозимы, ДНК, кДНК, геномная ДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК любой последовательности, выделенная РНК любой последовательности, зонды нуклеиновых кислот и праймеры. Полинуклеотиды могут иметь природное, искусственное, рекомбинантное или комбинированное происхождение. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. В случае присутствия, модификацию структуры нуклеотида обеспечивают перед или после сборки цепи. Последовательность нуклеотидов может быть прервана не-нуклеотидными компонентами. Полинуклеотид также модет быть модифицирован после полимеризации, например, конъюгацией с меткой. Другие виды модификаций включают, например, "кэпы", замещение одного или более природных нуклеотидов аналогом, внутринуклеотидные модификации, такие как, например, с незаряженными связями (например, метил фосфонаты, фосфотриэстеры, фосфоамидаты, карбаматы, и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты, и т.д.), модификации, имеющие подвешенные остатки, такие как, например, протеины (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин, и т.д.), модификации с интеркаляторами (например, акридин, псорален, и т.д.), модификации содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы, и т.д.), модификации содержащие алкиляторы, с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты, и т.д.), а так же не модифицированные формы полинуклеотида(ов). Более того, любая гидроксильная группа, обычно присутствующая в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами, или активирована для получения дополнительных связей с дополнительными нуклеотидами, или конъюгирована с твердыми подложками. 5' и 3' терминальная ОН может быть фосфорилированна или замещена аминами или остатками органических кепирующих групп, содержащими 1-20 атомов углерода. Другие гидроксилы так же дериватезированы от стандартных защитных групп. Полинуклеотиды так же могут содержать аналогичные формы рибозы или дезоксирибозы, известных в отрасли, включая, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидо-рибоза, аналоги карбоциклического сахара, альфа- или бета-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозы, фуранозы, седогептулозы, циклические аналоги и абазические аналоги нуклеозидов, такие как метил рибозид. Один или более фосфодиэстерных связей могут быть замещены альтернативными связями. Такие альтернативные группы связи включают, но не ограничиваются следующими: варианты осуществления, где фосфат замещен Р(O)S("тиоатом"), P(S)S ("дитиоатом"), (O)NR2 ("амидатом"), P(O)R, P(O)OR', СО или СН2 ("формацеталем"), где каждый R или R' независимо означает Н, или замещенный или незамещенный алкил (1-20 С), который необязательно содержит эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде должны быть идентичными. Вышеприведенное описание относится ко всем полинуклеотидам, указанным в данном документе, включая РНК и ДНК.
Термины "полипептид", "олигопептид", "пептид" и "протеин", как указано в данном документе, относятся к цепям аминокислот любой длины, желательно, относительно коротким (например, 10-100 аминокислот). Цепь может юыть линейной или разветвленной, она может содержать модифицированные аминокислоты и/или может быть прервана не-аминокислотами. Термины так же включают аминокислотную цепь, модифицированную природно или путем вмешательства; например, образованием дисульфидной связи, гликозилированием, липидизацией, ацетилированием, фосфорилированием или любым другим вмешательством или модификацией, такой как конъюгация с меткой. Так же термины включают, например, полипептиды, содержащие один или больше аналогов аминокислот (включая, например, неприродные аминокислоты, и т.д.), а так же другие известные модификации. Понятно, что полипептиды могут существовать как единичные цепи или ассоциированные цепи.
Аминокислоты могут обозначаться в данном документе как общеизвестные трехбуквенные сокращения, рекомендованные IUPAC-IUB Biochemical.
Термины "аминокислота" и "природная аминокислота", как указано в данном документе, относятся к следующим: аргинин, глутамин, фенилаланин, тирозин, триптофан, лизин, глицин, аланин, гистидин, серин, пролин, глутаминовая кислота, аспарагиновая кислота, треонин, цистеин, метионин, лейцин, аспарагин, изолейцин и валин.
Термин "производная аминокислоты", как указано в данном документе, относится к аминокислоте с замещениями или модификациями, произведенными ковалентным присоединением родительской аминокислоты, например, путем алкилирования, гликозилирования, ацетилирования, фосфорилирования, и т.д. Так же термин "производная" включает, например, один или более аналогов аминокислоты с замещенными связями, а так же другие модификации, известные в отрасли.
Термин "вектор», как указано в данном документе, относится к конструкту способному доставить, и желательно экспрессировать, один или больше нужных генов или последовательностей в клетке хозяине. Примеры векторов включают, но не ограничиваются следующими: вирусные векторы, голые векторы экспрессии ДНК или РНК, плазмида, космида или фаговые векторы, векторы экспрессии ДНК или РНК, ассоциированные с катионными конденсирующими агентами, векторы экспрессии ДНК или РНК, инкапсулированные в липосомах, и определенные эукариотические клетки, такие как клетки продуценты.
Термин "процент идентичности последовательности», как указано в данном документе, относится к степени похожести двух последовательностей. В контексте последовательности нуклеиновых кислот, он означает одинаковые остатки в двух последовательностях при выравнивании на максимальное соответствие. Длина сравнения идентичности последовательностей может равняться как минимум приблизительно 9 нуклеотидов, обычно как минимум приблизительно 18 нуклеотидов, обычно как минимум приблизительно 24 нуклеотида, типично как минимум приблизительно 28 нуклеотидов, более типично как минимум приблизительно 32 нуклеотида, и желательно как минимум приблизительно 36, 48 или больше нуклеотидов. Существует большое количество различных алгоритмов, известных в отрасли, которые используют для определения идентичности последовательности нуклеотидов. Например, полинуклеотидные последовательности можно сравнить, используя FASTA, Gap или Bestfit, которые представляют программы в Wisconsin Package Version 10,0, Genetics Computer Group (GCG), Madison, Wisconsin. FASTA, которая включает, например, программы FASTA2 и FASTA3, обеспечивает выравнивание и процент идентичности последовательности участков наилучшего перекрывания между нужной и исследуемой последовательностями (Pearson, Methods Enzymol. 183:63-98 (1990); Pearson, Methods Mol. Biol. 132:185-219 (2000); Pearson, Methods Enzymol. 266:227-258 (1996); Pearson, J. Mol. Biol. 276:71-84 (1998); включенной с помощью ссылки). Пока не указано обратное, используют параметры по умолчанию для определенной программы или алгоритма. Например, процент идентичности последовательности между последовательностями нуклеиновых кислот определяют, используя FASTA с ее параметрами по умолчанию (размер слова 6 и NOPAM фактор для оценочной матрицы), или используя Gap с ее параметрами по умолчанию, приведенными в GCG Version 6.1, включенной с помощью ссылки.
Ссылка на нуклеотидную последовательность включает ее комплемент, пока не указано обратное. Таким образом, ссылка на нуклеиновую кислоту с определенной последовательностью включает комплементарную ей цепь, с комплементарной последовательностью.
В контексте аминокислотных последовательностей, это означает, что две аминокислотные последовательности, при оптимальном выравнивании, с помощью программ GAP или BESTFIT, используя штрафы за открытие гэпа по умолчанию, разделяют как минимум 70%, 75% или 80% идентичности последовательности, желательно как минимум 90% или 95% идентичности последовательности, и более желательно как минимум 97%, 98% или 99% идентичности последовательности. В некоторых по сути одинаковых аминокислотных последовательностях, не идентичные положения остатков отличаются консервативными аминокислотными замещениями.
По сути одинаковые полипептиды так же включают консервативно замещенные варианты, где один или больше остатков консервативно замещены функционально одинаковым остатком. Примеры консервативных замещений включают замещение одного неполярного (гидрофобного) остатка, такого как изолейцин, валин, лейцин или метионин, на другой; замещение одного полярного (гидрофильного) остатка на другой, например, между аргинином и лизином, между глутамином и аспарагином, между глицином и серином; замещение одного основного остатка, такого как лизин, аргинин или гистидин, на другой; или замещение одного кислотного остатка, такого как аспарагиновая кислота или глутаминовая кислота, на другой.
Указание на то, что два протеина являются идентичными, означает, что они разделяют общую трехмерную структуру, или являются биологически функциональными эквивалентами.
Термин "цитотоксическая активность», как указано в данном документе, относится у клетко-разрушительному, цитостатическому или антипролиферативному эффекту антитела, ADC или внутриклеточного метаболита указанного ADC. Цитотоксическая активность может быть выражена через значение IС50, являющееся концентрацией (молярной или массовой) на единицу объема, при которой половина клеток выживает.
Термин "контактирование», как указано в данном документе, относится к объединению антитела или антиген-связывающей части данного изобретения и мишени CXCR4, или его эпитопа, таким образом, что антитело может влиять на биологическую активность CXCR4. Такое "контактирование" может осуществляться "in vitro," тоесть, в пробирке, чашке Петри, и т.д. В пробирке контактирование может включать только антитело или его антиген-связывающую часть и CXCR4 или его эпитоп, или может включать целые клетки. Клетки так же могут поддерживаться или расти у чашках с культуральной средой и контактировать с антителами или их антиген-связывающими частями в этой середе. В этом контексте, способность определенного антитела или антиген-связывающей части влиять на CXCR4-ассоциированное расстройство, то есть, IС50 антитела, может быть определена перед применением антитела in vivo на более сложных живых организмах. Для клеток вне организма, существует множество способов, известных специалистам в отрасли, контактирования CXCR4 с антителами или их антиген-связывающими фрагментами. В другом варианте осуществления, значительная часть эффективности генерируется эффекторной функцией. Иммунные эффекторные функции, принимающие участие в антитело-опосредованной цитотоксичности, включают, но не ограничиваются следующими: антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC), антитело-зависимый клеточно-опосредованный фагоцитоз (ADCP), и комплемент-зависимая цитотоксичность (CDC).
Термин "донор ацила глутамин-содержащая метка" и "глутаминовая метка», как указано в данном документе, относится к полипептиду или протеину, содержащему один или больше Gln остатков, действующему как акцептор амин трансглутаминазы. Смотреть, например, WO 2012059882.
Термин "фармацевтически приемлемый носитель" и "фармацевтически приемлемый вспомогательный агент», как указано в данном документе, относится к любому материалу, который при объединении с активным ингредиентом, позволяет ингредиенту сохранить биологическую активность, и не взаимодействует с иммунной системой субъекта. Примеры включают любые и все растворители, дисперсную среду, покрытия, антибактериальные и противогрибковые агенты, изотоничные агенты и агенты, отсрочивающие абсорбцию, и т.д., являющиеся физиологически совместимыми. Стандартные фармацевтические носители включают, но не ограничиваются следующими: фосфатный забуференый солевой раствор, вода, эмульсии, такие как эмульсия масло/вода, и различные виды смачивающих агентов. Предпочтительными растворителями для аэрозоля и парентерального введения являются фосфатный забуференный солевой раствор (PBS) или нормальный (0,9%) солевой раствор. Композиции, содержащие такие носители, формируют согласно известным способам (смотреть, например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy 21st Ed. Mack Publishing, 2005). Желательно, носитель является приемлемым для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, путем инъекции или инфузии). В зависимости от пути введения, активное соединение (например, моноклональное антитело, его антиген-связывающий фрагмент, конъюгат антитело-лекарство) может быть покрыто материалом для защиты соединения от действия кислот и других природных условий, которые могут его инактивировать.
Данное изобретение так же относится к композициям, содержащим, или альтернативно состоящим из 1, 2, 3, 4, 5, 10, 15, 20 или больше антител данного изобретения (включая молекулы, содержащие или альтернативно состоящие из фрагментов антитела или его вариантов). Композиция изобретения может содержать или альтернативно состоять из 1, 2, 3, 4, 5, 10, 15, 20 или больше аминокислотных последовательностей одного или больше антител или их фрагментов или их вариантов. Альтернативно, композиция изобретения может содержать или альтернативно состоять из молекул нуклеиновых кислот, кодирующих одно или больше антител изобретения.
Термин "СХСR4-ассоциированное расстройство" означает любое расстройство, где патология является следствием, как минимум частично, повышения экспрессии или недопустимой экспрессии CXCR4 или недопустимой функции CXCR4. Примеры таких расстройств включают, но не ограничиваются следующими: рак, ассоциированный с повышенной экспрессией CXCR4, по сравнению с нормой, воспалительные и иммунные расстройства, аллергические расстройства, инфекции (ВИЧ инфекция, и т.д.), аутоиммунные расстройства (например, ревматоидный артрит), фиброзные расстройства (например, легочные), и сердечнососудистые расстройства.
Термин "рак" относится к физиологическому состоянию или расстройству у млекопитающих, обычно характеризующемуся нерегулируемым клеточным ростом. Гематологический рак относится к раку крови включая, но не ограничиваясь следующими: лейкемия, лимфома и миелома. Солидный рак относится к раку тканей тела, за исключением крови, включая, но не ограничиваясь следующими: рак мочевого пузыря, рак молочной железы, рак шейки матки, хориокарцинома, рак толстого кишечника, рак пищевода, рак желудка, глиобластома, рак головы и шеи, рак почек, рак легких, оральный рак, рак яичников, рак поджелудочной железы, рак простаты, рак кожи, рак печени и гепатокарцинома, и т.д.
Термин "пациент», как указано в данном документе, относится к субъекту, страдающему от СХСR4-ассоциированного расстройства. Пациенты включают, но не ограничиваются следующими: люди, нечеловекообразные приматы (например, обезьяны), крысы, мыши, морские свинки, свиньи, козы, коровы, кони, собаки, кошки, птицы и дичь. В предпочтительных вариантах осуществления, пациентом которому вводят антитело или конъюгат антитело-лекарство изобретения, является человек.
Термины "эффективное количество" или "эффективная доза», как указано в данном документе, относятся к количеству лекарства, соединения или фармацевтической композиции необходимому для достижения одного или более благоприятных или желательных терапевтических результатов. Для профилактического применения, благоприятные или желательные результаты включают исключение или снижения риска, облегчение тяжести или отсрочка начала расстройства, включая биохимические, гистологические и/или поведенческие симптомы расстройства, его осложнений и промежуточных патологических фенотипов, проявляющихся на протяжении развития расстройства. Для терапевтического применения, благоприятные или желательные результаты включают клинические результаты, такие как снижение частоты возникновения или снижение интенсивности одного или более симптомов расстройства, способность снижать дозу других медикаментов, необходимых для лечения расстройства, улучшение эффекта другого медикамента, использованного для лечения расстройства, и/или замедление прогрессирования расстройства.
Для целей данного изобретения, благоприятные или желательные клинические результаты включают, но не ограничиваются следующими: снижение пролиферации (или разрушение) неопластических или раковых клеток при СХСR4-ассоциированном расстройстве, снижение или ингибирование метастазирования неопластических клеток при СХСR4-ассоциированном расстройстве, сокращение или уменьшение размера СХСR4-экспрессирующей опухоли, ремиссия СХСR4-ассоциированного расстройства, увеличение продолжительности жизни пациента с СХСR4-ассоциированным расстройством, снижение симптомов СХСR4-ассоциированного расстройства, повышение качества жизни пациента с СХСR4-ассоциированным расстройством, способность снижения дозы других медикаментов, необходимых для лечения CXCR4-ассоциированного расстройства без побочных эффектов, отсрочка прогрессирования СХСR4-ассоциированного расстройства, вылечивание СХСR4-ассоциированного расстройства и/или пролонгирование выживания пациентов с СХСR4-ассоциированным расстройством.
Пока не указано обратное, научные и технические термины, использованные в данном изобретении, имеют общеизвестный специалистам в отрасли смысл. Например, термины "содержит," "включает" и "имеет" и тд., могут иметь смысл, указанный в патентном праве США, и означать "содержит" и т.д.; "состоит по сути из" так же имеет смысл, указанный в патентном праве США, и термин является не ограниченным, позволяя включать значения, выходящие за рамки основных характеристик.
Так же, пока обратное не ясно из контекста, термины в единственном числе включают множественные формы, а термины во множественном числе включают единственное число.
Ссылка на "приблизительное" значение или параметр включает (и описывает) варианты осуществления, направленные на это значение или параметр per se. Например, описание "приблизительно X" включает описание "X." Многочисленные диапазоны включают числа, включенные в диапазон. Когда аспекты или варианты осуществления изобретения описаны с помощью групп Маркуша или другими альтернативными группами, данное изобретение включает не только всю группу, а и каждого члена группы индивидуально, и все возможные подгруппы главной группы, а так же главную группу, в которой отсутствует один или больше членов группы. Данное изобретение так же предусматривает исключение одного или больше заявленных членов группы.
В данном описании и формуле изобретения, термин "содержит," или его варианты, такие как "включает" означает включение указанной переменной или группы переменных, но не означает исключения любой другой переменной или группы переменных. Пока обратное не ясно из контекста, термины в единственном числе включают множественные формы и наоборот.
Пока не указано обратное, научные и технические термины, использованные в данном изобретении, имеют общеизвестный специалистам в отрасли смысл. Примеры способов и материалов описаны в данном документе, хотя способы и материалы, подобные или эквивалентные описанным, так же могут быть использованы в практике данного изобретения. Материалы, способы и Примеры являются иллюстративными и не воспринимаются как ограничительные.
Aнти-CXCR4 антитела и способы их получения
Данное изобретение относится к анти-CXCR4 антителам или их антиген-связывающим фрагментам, которые присоединяются к человеческим CXCR4. В этом разделе описания детально описаны функциональные и структурные характеристики образцового анти-CXCR4 антитела или антиген-связывающих фрагментов описания. Понятно, что антитела или антиген-связывающие фрагменты описания могут быть описаны на основе любой одной или более (2, 3, 4, 5, 6, 7, 8, 9, и т.д.) структурных и/или функциональных характеристик, описанных в данном документе. В этой части описания, когда функциональные или структурные характеристики описывают в отношении антитела описания, нужно понимать, что кроме тех мест где контекст четко указывает на обратное, такие функциональные или структурные характеристики могут быть использованы для описания антиген-связывающего фрагмента описания.
Последовательность нуклеотидов человеческой CXCR4 кДНК и предполагаемая аминокислотная последовательность человеческого CXCR4 протеина показаны в SEQ ID NO: 104 и 105, соответственно (Таблица 1). Человеческий CXCR4 ген, имеющий длину приблизительно 1679 нуклеотидов, кодирует непроцессированный протеин с молекулярной массой приблизительно 38,7 кДа, и имеющий длину приблизительно 352 аминокислотных остатка. Дальнейшее описание последовательностей нуклеиновых кислот и полипептидов человеческого CXCR4 можно найти в GenBankAccession под номерами НМ_003467 и NP_003458, соответственно; а так же в Federsppiel, В. et а/. Genomics 16(3): 707-712 (1993); Herzog, Н. et al. ДНК Cell Biol. 12(6): 465-471 (1993); Jazin, Е. Е. et al. Regul. Pept 47(3): 247-258 (1993); Nomura, H. et al. Int. Immunol. 5(10): 1239-1249 (1993); Loetscher, M. et al. J. Biol. Chem. 269(1): 232-237 (1994); Moriuchi, M. et al. J. Immunol. 159(9): 4322-4329 (1997); Caruz, A. et al. FEBS Lett. 426(2): 271-278 (1998); and Wegner, S.A. et al. J. Biol. Chem. 273(8): 4754-4760 (1998).


Человеческая CXCR4 последовательность, как указано в данном документе, может отличаться от человеческой CXCR4 SEQ ID NO: 105, наличием, например, консервативных мутаций или мутаций в неконсервативных участках, и CXCR4 имеет по сути одинаковую биологическую функцию, что и человеческая CXCR4 SEQ ID NO: 105. Например, биологическая функция человеческой CXCR4 представлена наличием эпитопа в внеклеточном домене CXCR4, связываемого антителом данного описания, или биологическая функция человеческой CXCR4 представлена связыванием хемокина или участием в процессе метастазирования.
Конкретная последовательность человеческой CXCR4 имеет как минимум 90% идентичности аминокислотной последовательности с SEQ ID NO: 105 человеческой CXCR4, и содержит аминокислотные остатки, идентифицирующие аминокислотную последовательность как человеческую, по сравнению с аминокислотными последовательностями CXCR4 других видов (например, мышей). В определенных случаях, человеческая CXCR4 может иметь как минимум 95%, или как минимум 96%, 97%, 98%, или 99% идентичности аминокислотной последовательности с аминокислотной последовательности с SEQ ID NO: 105 CXCR4. В некоторых аспектах изобретения, последовательность человеческой CXCR4 имеет не более 10 аминокислотных отличий от CXCR4 с последовательностью SEQ ID NO: 105. В определенных аспектах изобретения, человеческая CXCR4 имеет не более 5, или не более 4, 3, 2 или 1 аминокислотного отличия от CXCR4 с последовательностью SEQ ID NO: 105. Процент идентичности может быть определен, как описано в данном документе.
Антитела, их антиген-связывающие фрагменты и конъюгаты антитело-лекарство изобретения характеризуют по одной или больее следующим характеристикам: (а) связывание с CXCR4; (b) снижение или даун-регуляция экспрессии протеина CXCR4; (с) лечение, предупреждение, улучшение одного или более симптомов расстройства, ассоциированного с функцией или экспрессией CXCR4 у субъекта (например, рак, такой как NHL, AML, MM, CLL, T-ALL, рак желудка, рак головы и шеи, рак легких, рак яичников или рак поджелудочной железы); (d) снижение или ингибирование роста или прогрессирования опухоли у субъекта (имеющего опухоль, экспрессирующую CXCR4); (е) снижение или ингибирование метатстазирования раковых клеток, экспрессирующих CXCR4, у субъекта (имеющего одну или больше раковых клеток, экспрессирующих CXCR4); (f) вызывание регрессии (например, длительной регрессии) опухоли, экспрессирующей CXCR4; (g) проявление цитотоксической активности в клетках, экспрессирующих CXCR4; (h) деактивация или даун-регуляция пути CXCR4; и (i) блокирование взаимодейтвия CXCR4 с внеклеточными партнерами связывания CXCR4.
Например, антитело, его антиген-связывающий фрагмент и конъюгат антитело-лекарство изобретения блокируют функцию SDF-I.
Антитела, приемлемые в данном изобретении, включают моноклональные антитела, поликлональные антитела, фрагменты антитела (например, Fab, Fab', F(ab')2, Fv, Fc, и т.д.), гибридные антитела, биспецифические антитела, гетероконъюгат антител, отдельные цепи (ScFv), их мутанты, гибридные протеины, содержащие часть антитела (например, домен антитела), гуманизированное антитела, и любая другая модифицировання конфигурация молекулы иммуноглобулина, содержащая сайт распознавания антигена нужной специфичности, включая гликозиллированные варианты антитела, варианты аминокислотной последовательности антитела, и ковалентно модифицированные антитела. Антитела могут иметь мышиное, крысиное, человеческое или любое другое происхождение (включая гибридные или гуманизированные антитела).
В некоторых аспектах изобретения, анти-CXCFM антитело как описано в данном документе, является моноклональным антителом. Например, анти-СХСR4 антитело является гуманизированным моноклональным антителом или гибридным моноклональным антителом.
В некоторых аспектах изобретения, антитела данного изобретения кросс-реагируют с CXCR4 нечеловеческих видов, таких как CXCR4 мышей, крыс, собак, кошек или приматов, а так же различными формами CXCR4 (например, гликозилированный CXCR4). В некоторых аспектах изобретения, антитела, специфические к человеческим CXCR4, могут быть полностью специфическими к человеческому CXCR4, и могут не проявлять видовую или другую кросс-реактивность.
В некоторых аспектах изобретения, анти-CXCR4 антитело, как описано в данном документе, является канинизированным антителом, или фелинизированным антителом. Антитела данного изобретения, канинизированные или фелинизированные, способны связываться с как минимум одним собачим CXCR4 протеином или фелинизированным CXCR4 протеином. В одном аспекте, моноклональное антитело данного изобретения связывается с собачим CXCR4 протеином или кошачим CXCR4 протеином, и предупреждает его связывание с стромальным клеточным фактором-1 (SDF-1).
В некоторых аспектах изобретения, антитело содержит модифицированный константный участок, такой как, например, константный участок с увеличенным потенциалом вызывания иммунного ответа. Например, константный участок может быть модифицирован с целью увеличения аффинности к Fc гамма рецептору, такому как, например, FcγRI, FcγRIIA или Fcγlll.
В некоторых аспектах изобретения, антитело содержит модифицированный константный участок, такой как константный участок с повышенной аффинностью к человеческому Fc гамма рецептору, являющийся иммунологически инертным, то есть, имеет пониженный потенциал вызывания иммунного ответа. В некоторых аспектах изобретения, константный участок модифицируют, как описано в Eur. J. Immunol., 29:2613-2624, 1999; РСТ заявке PCT/GB 99/01441; и/или патентной заявке Великобритании №98099518. Fc может быть человеческим lgG1, человеческим lgG2, человеческим lgG3 или человеческим lgG4. Fc может быть человеческим lgG2, содержащим мутацию А330Р331 -S330S331 (lgG2Δa), в котором аминокислотные остатки пронумерованные со ссылкой на последовательность lgG2 дикого типа. Eur. J. Immunol., 29:2613-2624, 1999. В некоторых аспектах изобретения, антитело содержит константный участок lgG4, содержащий следующие мутации (Armour et al., Molecular Immunology 40 585-593, 2003): E233F234L235 - P233V234A235 (lgG4Δc), нумерация идет со ссылкой на lgG4 дикого типа. В других аспектах изобретения, Fc является человеческим lgG4 E233F234L235 - P233V234A235 с делецией G236 (lgG4Δb). В другом аспекте изобретения, Fc является любым человеческим lgG4 Fc (lgG4, lgG4Δb или lgG4Δc), содержащим мутацию S228 - Р228 стабилизирующую петлю (Aalberse et al., Immunology 105, 9-19, 2002). В определенном аспекте изобретения, Fc может быть гликозилированным Fc.
В некоторых аспектах изобретения, константный участок агликозилирован путем мутации присоединенного остатка олигосахарида (такого как Asn297) и/или фланкирующих остатков, являющихся частью последовательности распознавания гликозилирования в константном участке. В некоторых аспектах изобретения, константный участок является агликозилированным для N-связанного гликозилирования ферментативно. Константный участок может быть агликозилированным для N-связанного гликозилирования ферментативно или путем экспрессии в клетках хозяевах, дефицитных к гликозилированию.
Одним из путей определения аффинности связывания антитела с CXCR4 является определение аффинности связывания монофункциолнальных Fab фрагментов антитела. Для получения монофункциональных Fab фрагментов, антитело (например, IgG) может быть расщеплено папаином или рекомбинантно экспрессировано. Аффинность CXCR4 Fab фрагмента антитела может быть определена поверхностным плазмонным резонансом (Biacore™3000™ система поверхностного плазмонного резонанса (SPR), Biacore™, INC, Piscataway NJ), оснащенного предварительно иммобилизированными сенсорными чипами стрептавидина (SA) или анти-мышиного Fc или анти-человеческого Fc, используя подвижный буфер HBS-EP (0,01М HEPES, рН 7,4, 0,15 NaCI, 3 мМ EDTA, 0,005% о/о Поверхностно-активное вещество Р20). Биотинилированный WGA может быть нанесен на SA чип для улучшения захвата липочастиц, содержащих CXCR4 протеины. Серии разведений (5-членный, 3Х разведения фактор с наибольшей концентрацией 10 или 30 нМ) Fab инъектировали от низкой до высокой концентрации (с временем ассоциации 3 минуты для каждой концентрации) для осуществления кинетического анализа данных, используя методику "кинетического титрования" как описано в Karlsson, et al. (Karlsson, R., Katsamba, P.S., Nordin, H., Pol, E. & Myszka, D.G. Analyzing a kinetic titration series using affinity biosensors. Anal. Biochem. 349, 136-147 (2006). Для некоторых циклов анализа буфер инъектировали поверх захваченных частиц вместо Fab для обеспечения холостых циклов с целью двойного посылания (двойную ссылку осуществляли как описано Myszka et al.), (Myszka, D.G. Improving biosensor analysis. J. Mol. Recognit.12, 279-284 (1999).
Концентрации Fab протеинов определяли с помощью ELISA и/или SDS-PAGE электрофореза, используя Fab известной концентрации (определенной с помощью аминокислотного анализа) в качестве стандарта. Скорости кинетической ассоциации (kon) и диссоциации (koff) получали одновременно, подставляя данные 1:1 в модель связывания Лангмура 1:1 (Karlsson, R. Roos, Н. Fagerstam, L. Petersson, В. (1994). Methods Enzymology 6. 99-110), используя программу подсчета BIA. Равновесную константу диссоциации (KD) рассчитывали как koff/kon. Этот протокол является приемлемым для определения аффинности связывания антитела с любым CXCR4, включая человеческую CXCR4, CXCR4 другого млекопитающего (таким как мышиный CXCR4, крысиный CXCR4, собачий CXCR4 или CXCR4 приматов), а так же с различными формами CXCR4 (например, гликозилированный CXCR4). Аффинность связывания антитела обычно измеряют при 25°С, но могут и при 37°С.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент, который связывает CXCR4, имеет MFI менее чем 10,000 мкг/мл. В определенных аспектах изобретения, антитело или его антиген-связывающий фрагмент, связывающийся с CXCR4, имеет MFI менее чем 6000 мкг/мл. В определенных аспектах изобретения, антитело или его антиген-связывающий фрагмент, связывающийся с CXCR4, имеет MFI менее чем 5000 мкг/мл. В определенных аспектах изобретения, антитело или его антиген-связывающий фрагмент, связывающийся с CXCR4 имеет MFI в диапазоне от 2000 мкг/мл до 5000 мкг/мл.
Как указано в данном документе, "MFI" означает интенсивность флуоресценции или среднюю интенсивность флуоресценции.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент, связывающийся с CXCR4, имеет ЕС50 менее чем 3.00Е-09 М. В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент, связывающийся с CXCR4, имеет ЕС50 в диапазоне от приблизительно 1.00Е-09 М до приблизительно 3.00Е-09 М. Например, антитело или его антиген-связывающий фрагмент, связывающийся с CXCR4, имеет ЕС50 на уровне 2.00Е-09 М.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент, связывающийся с CXCR4, ингибирует SDF-1 вызванный кальциевый поток. Например, антитело или его антиген-связывающий фрагмент, ингибирует SDF-1 альфа вызванный кальциевый поток, с IC50 для ингибирования в диапазоне от приблизительно 1 нМ до 50 нМ. В одном аспекте, антитело или его антиген-связывающий фрагмент, ингибирует SDF-1 альфа вызванный кальциевый поток, с IC50 для ингибирования менее чем 30 нМ. В одном аспекте, антитело или его антиген-связывающий фрагмент, ингибирует SDF-1 альфа вызванный кальциевый поток, с IC50 для ингибирования менее чем 2 нМ.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент, значительно снижает количество клеток AML в клеточных моделях AML. Например, количество человеческих клеток значительно снижалось у животных, которых лечили анти-CXCR4 6В6 антителом. Так же, выживание животных, которых лечили анти-CXCR4 антителом данного изобретения, значительно увеличивалось.
В некоторых аспектах, антитела данного изобретения увеличивают длительность выживания и снижают опухолевую массу в клеточных мышиных моделях системной неходжкинской лимфомы (NHL) и острой миелоидной лейкемии (AML). В одном аспекте, антитела данного изобретения увеличивают длительность выживания в модели мышиной системной хронической опухоли (CLL). В одном аспекте, антитела данного изобретения ингибируют NHL рост опухоли in vivo. В некоторых аспектах, антитела данного изобретения увеличивают длительность выживания и снижают опухолевую массу в мышиной модели системной множественной миеломы (ММ).
Антитела изобретения могут быть получены, используя техники известные в отрасли, например, рекомбинантные техники, техники фагового отображения, технологии синтеза или комбинации таких технологий, или другие известные в отрасли технологии (смотреть, например, Jayasena, S.D., Clin. Chem., 45: 1628-50 (1999) and Fellouse, F.A., et al, J. Mol. Biol., 373(4): 924-40 (2007)).
Aнти-CXCR4 антитела или их антиген-связывающие фрагменты, как описано в данном документе, могут быть получены любым известным в отрасли способом. Например, для получения клеточных линий гибридомы, путь и схема иммунизации животного хозяина производится согласно известным техникам стимулирования и продуцирования антитела, как далее описано в данном документе. Общие техники получения человеческих и мышиных антител известны в отрасли и/или описаны в данном документе.
Понятно, что любой субъект млекопитающее, включая людей или клетки, продуцирующие антитело, могут служить основой для получения линий клеток гибридом млекопитающих, включая человеческие. Обычно, животное хозяина инокулируют интраперитонеально, внутримышечно, орально, подкожно, внутриподошвенно и/или интрадермально, определенным количеством иммуногена, как описано в данном документе.
Гибридомы могут быть получены из лимфоцитов и иммортализированных клеток миеломы, используя общие техники гирбридизации соматических клеток Kohler, В. and Milstein, С., Nature 256:495-497 (1975), или модифицирование Buck, D.W., et al., In Vitro, 18:377-381 (1982). Доступные линии миеломы, включая, но не ограничиваясь Х63-Ag8.653 и линиями из института Салка, Центра Клеточного Распределения, Сан-Диего, Калифорния, США, могут быть использованы для гибридизации. Обычно, техники включают слияние клеток миеломы и лимфоидных клеток, используя фузоген, такой как полиэтиленгликоль, или электрические средства, известные в отрасли. После слияния, клетки отделяют от среды слияния и выращивают на селективной ростовой среде, такой как среда гипоксантин-аминоптерин-тимидин (HAT), с целью удаления непрогибридизировавших родительских клеток. Любую среду, описанную в данном документе, дополненную сывороткой или нет, можно использовать для культивирования гибридом, секретирующих моноклональные антитела. Альтернативой техники клеточной гибридизации, является EBV иммортализированные В клетки, для получения CXCR4 моноклональных антител данного изобретения. Гибридомы выращивают и субклонируют, по желанию, и супернатанты анализируют на анти-иммуногенную активность с помощью иммуноанализа (например, радиоиммуноанализ, ферментный иммуноанализ или флуоресцентный иммуноанализ).
Гибридомы, которые можно использовать в качестве источника антител, включают все производные, потомство клеток родительских гибридом, которые продуцируют моноклональное антитела, специфичные к CXCR4, или его части.
Гибридомы, продуцирующие такие антитела, могут быть выращены in vitro или in vivo, используя известные процедуры. Моноклональное антитела могут быть выделены из культуральной среды или жидкостей тела, с помощью обычных процедур очистки иммуноглобулина, таких как осаждение с сульфатом аммония, гель-электрофорез, диализ, хроматография и ультрафильтрация, по желанию. В случае присутствия нежелательной активности, ее можно убрать, например, путем прогонки препарата через адсорбенты, расположенные на иммуногене, присоединенном на твердую фазу, и эллюируя или высвобождая желаемые антитела от иммуногена. Иммунизация животного хозяина человеческим CXCR4 или его фрагментом, содержащим целевую аминокислотную последовательность, конъюгированную с протеином, являющимся иммуногенным у видов, которые иммуниируют, например, гемоцианин лимфы улитки, сывороточный альбумин, коровий тироглобулин, илиингибитор трипсина сои, используя бифункциональный или дериватезирующий агент, например, сложный эфир малеимидобензоила и сульфосукцинимида (конъюгация по средством остатков цистеина), N-гидроксисукцинимид (по средством остатков лизина), глутаральдегид, янтарный ангидрид, SOCl2, или R1N=C=NR, где R и R1 являются разными алкильными группами, может дать популяцию антитела (например, моноклонального антитела).
По желанию, желательное анти-CXCR4 антитело (моноклональное или поликлональное) может быть секвенировано, и полинуклеотидная последовательность затем может быть клонирована в вектор для экспрессии или размножения. Последовательность, кодирующая желаемое антитело, может поддерживаться в векторе в клетке хозяине, и затем клетка хозяин может быть размножена или заморожена для последующего применения. Получение рекомбинантного моноклонального антитела в клеточной культуре может осуществляться клонированием генов антитела из В клеток известными в отрасли техниками. Смотреть, например, Tiller et al., J. Immunol. Methods 329, 112 (2008); патент США №7,314,622.
Альтернативно, полинуклеотидная последовательность может быть использована для генетической манипуляции с целью "гуманизации" антитела или улучшения аффинности или других характеристик антитела. Например, константный участок может быть спроектирован так, чтобы походить на человеческие константные участки для избежания иммунного ответа, если антитело используют в клинических испытаниях и лечении людей. Желательно провести генетические манипуляции с последовательностью антитела для получения большей аффинности к CXCR4 и/или большей эффективности ингибирования CXCR4.
Существует 4 общие стадии гуманизации моноклонального антитела. Они включают: (1) определение нуклеотидной и предсказанной аминокислотной последовательности легкого и тяжелого вариабельны доменов исходного антитела; (2) проектирование гуманизированного антитела, то есть, выбор каркасного участка антитела для использования на протяжении процесса гуманизации; (3) методики/техники непосредственно гуманизирования; и (4) трансфекция и экспрессия гуманизированного антитела. Смотреть, например, патенты США №4,816,567; 5,807,715; 5,866,692; 6,331,415; 5,530,101; 5,693,761; 5,693,762; 5,585,089; и 6,180,370.
Было описано количество молекул "гуманизированного" антитела, содержащих сайт связывания антигена, происходящий от нечеловеческого иммуноглобулина, включая гибридные антитела, имеющие V участки грызунов или модифицированные V участки грызунов, и их ассоциированные CDR, конденсированные с человеческими константными участками. Смотреть, например, Winter et al. Nature 349:293-299 (1991), Lobuglio et al. Proc. Nat. Acad. Sci. USA 86:4220-4224 (1989), Shaw et al. J Immunol. 138:4534-4538 (19870, and Brown et al. Cancer Res. 47:3577-3583 (1987). Другие ссылки описывают CDR грызунов, привитые на человеческий поддерживающий каркасный участок (FR) перед гибридизацией с соответствующим константным участком человеческого антитела. Смотреть, например, Riechmann et al. Nature 332:323-327 (1988), Verhoeyen et al. Science 239:1534-1536 (1988), and Jones et al. Nature 321:522-525 (1986). Другая ссылка описывает CDR грызунов, поддерживаемые рекомбинантно сконструированными каркасными участками грызунов. Смотреть, например, Европейская патентная публикация №0519596. Эти "гуманизированные" молекулы сконструированы с целью минимизирования нежелательного иммунного ответа на молекулы анти-человеческого антитела грызунов, что ограничивает продолжительность и эффективность терапевтического применения этих остатков у людей. Например, константный участок антитела может быть сконструирован так, чтобы быть иммунологически инертным (например, не вызывает лизис комплемента). Смотреть, например, РСТ публикацию PCT/GB99/01441; патентная заявка Великобритании №9809951.8. Другие способы гуманизации антитела, которые так же могут быть использованы, описаны в Daugherty et al., Nucl. Acids Res. 19:2471-2476, 1991, и в патентах США №6,180,377; 6,054,297; 5,997,867; 5,866,692; 6,210,671; и 6,350,861; и в РСТ публикации № WO 01/27160.
Общие принципы, относящиеся к гуманизированным антителам, описанные выше, так же применимы к обычным антителам для применения, например, у собак, кошек, приматов, лошадей и коров. Более того, один или больше аспектов гуманизации антитела, описанных в данном документе, могут быть скомбинированы, например, CDR графтинг, каркасная мутация и мутация CDR.
В некоторых аспектах изобретения, полностью человеческие антитела могут быть получены, используя коммерчески доступных мышей, сконструированных с экспрессией специфических протеинов человеческого иммуноглобулина. Трансгенные животные, спроектированные для продуцирования более желательного (например, полностью человеческие антитела) или более сильного иммунного ответа, так же могут быть использованы для генерирования гуманизированных или человеческих антител. Способы получения человеческих антител из трансгенных мышей описаны в Green et at, Nature Genet. 7: 13 (1994), Lonberg et at, Nature 368:856 (1994), and Taylor et at, Int. Immun. 6:519 (1994). Примером такой системы является XenoMouse® (например, Green et al., J. Immunol. Methods 231:11-23 (1999), включенной с помощью ссылки) производства Abgenix (Fremont, СА). В XenoMouse® и подобных животных, гены мышиного антитела инактивировали и заменяли функциональными генами человеческого антитела, в то время как остальная часть иммунной системы оставалась интактной.
XenoMouse® трансформировали зародышевыми YAC (искусственные хромосомы дрожжей), содержащими части человеческого IgH и локусы Igkappa, включая большую часть последовательностей вариабельного участка, вместе с добавочными генами и регуляторными последовательностями. Репертуар человеческого вариабельного участка может быть использован для генерирования В-клеток, продуцирующих антитело, которое может быть процессировано в гибридомы с помощью известных техник. XenoMouse®, иммунизированные антигеном мишенью, продуцируют человеческие антитела по средством нормального иммунного ответа, которые могут быть собраны и/или продуцированы с помощью вышеописанных техник. Доступны различные виды XenoMouse®, каждый из которых способен продуцировать различные классы антител. Трансгенно продуцированные человеческие антитела имеют терапевтический потенциал, при этом сберегая фармакокинетические свойства нормальных человеческих антител (Green et al., J. Immunol. Methods 231: 11-23 (1999)). Специалисту в отрасли очевидно, что заявленные композиции и способы не ограничены применением системы XenoMouse®, а могут использовать любых трансгенных животных, генетически спроектированных для продуцирования человеческих антител.
В некоторых аспектах изобретения, антитело может быть получено, используя антитело, имеющее одну или больше VH и/или VL последовательностей, описанных в данном документе, в качестве исходного материала для конструирования модифицированного антитела, при этом модифицированное антитело может иметь измененные свойства, по сравнению с исходным. Антитело может быть сконструировано путем модифицирования одного или больше остатков в одном или обоих вариабельных участках (VH и/или VL), например в одном или больше CDR участках и/или в одном или больше каркасных участках. Кроме этого или альтернативно, антитело может быть сконструировано путем модифицирования остатков в константном участке(ах), например, для изменения эффекторной функции антитела. В определенных аспектах, CDR трансплантация может быть использована для проектирования вариабельных участков антитела. Антитела взаимодействуют с целевыми антигенами преимущественно по средством аминокислотных остатков, расположенных в шести участков определения комплементарности (CDR) тяжелой и легкой цепи. По этой причине, аминокислотные последовательности в CDR более отличаются между индивидуальными антителами, чем последовательности извне CDR. В следствии того, что последовательности CDR отвечают за большинство взаимодействий антитело-антиген, возможно экспрессировать рекомбинантные антитела, повторяющие свойства специфических природных антител путем конструирования векторов экспрессии, включающих последовательности CDR из специфических природных антител, привитых на каркасные участки из других антител с другими свойствами (смотреть, например, Riechmann, L et al., Nature 332 323-327 (1995), Jones, P et al., Nature 32J. 522-525 (1986), Queen, С et al.,Proc Natl Acad See U.S.A 86 10029-10033 (1989), U.S. Patent Nos. 5,225,539; 5,530,101; 5,585,089; 5,693,762; and 6,180,370).
Такие каркасные последовательности могут быть получены из публичных баз данных ДНК или опубликованных ссылках, включающих последовательности генов антител эмбрионального типа. Например, зародышевые ДНК последовательности вариабельных участков тяжелой и легкой цепи человеческих генов можно найти в "VBase", базе данных человеческих зародышевых последовательностей (доступна в Internet по адресу www mrc-cpe cam ас uk/vbase), а так же в Kabat, Е А, et. al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, US. Department of Health and Human Services, NIH Publication No 91-3242, Tomlinson, I M, et al. (1992) "The Repertoire of Human Germline VH Sequences Reveals about Fifty Groups of VH Segments with Different Hypervariable Loops"Cox, J P L et al.,J Mol. Biol TTL 776-798 (1994) "A Directory of Human Germ-line VH Segments Reveals a Strong Bias in their Usage" Ew. J. Immunol 2A 827-836, содержание которых включено с помощью ссылки. Другой пример, зародышевые ДНК последовательности вариабельных участков тяжелой и легкой цепи человеческих генов можно найти в базе данных Genbank. Например, следующие зародышевые последовательности тяжелой цепи, находящиеся в НСо7 HuMAb мышах, доступны в Genbank под номерами доступа 1-69 (NG_0010109, NT_024637 и ВС070333), 3-33 (NG_0010109 и NT_024637) и 3-7 (NG_0010109 и NT_024637). Например, следующие зародышевые последовательности тяжелой цепи, находящиеся в HCol 2 HuMAb мышах, доступны в Genbank под номерами доступа 1-69 (NG_0010109, NT_024637 и ВС070333), 5-51 (NG_0010109 и NT_024637), 4-34 (NG_0010109 и NT_024637), 3-30 3 (CAJ556644) и 3-23 (AJ406678). Другим источником человеческих зародышевых последовательностей тяжелой и легкой цепи является база данных генов человеческого иммуноглобулина, доступная от IMGT (http://imgt.cines.fr).
Желательные каркасные участки для применения в антителах данного описания, являются структурно подобными каркасным участкам, используемым выбранными антителами данного описания. Последовательности VH CDR1, CDR2 и CDR3, и последовательности VL CDR1, CDR2 и CDR3, могут быть привиты на каркасные участки, имеющие идентичную последовательность, с зародышевой последовательностью гена иммуноглобулина, из которой происходит каркасная последовательность, или CDR последовательности могут быть привиты на каркасные участки, содержащие одну или больше мутаций, по сравнению с зародышевыми последовательностями. Другой вид каркасной модификации включает мутирование одного или нескольких остатков в каркасном участке, или даже в одном или больше CDR участках, с целью удаления эпитопов Т-клеток, таким образом снижая потенциальную иммуногенность антитела. Этот подход так же называется "деиммунизация" и описан детально в патентной публикации США №20030153043.
Кроме или альтернативно модификациям, осуществленным внутри каркасных или CDR участках, антитела данного описания могут быть спроектированы как содержащие модификации внутри участка Fc, обычно для изменения одного или больше функциональных свойств антитела, таких как период полураспада в сыворотке, фиксация комплемента, связывание рецептора Fc и/или антиген-зависимая клеточная цитотоксичность. Более того, антитело данного описания может быть химически модифицировано (например, один или больше химических остатков могут быть присоединены к антителу) или модифицировано с целью изменения его гликозилирования, для изменения одного или больше функциональных свойств антитела. Каждое из этих вариантов осуществления описано более детально далее. Нумерация остатков в участке Fc отвечает EU индексу Kabat и/или Chothia. Например, было обнаружено, что в определенных случаях предпочтительнее мутировать остатки внутри каркасных участков для поддержания или улучшения антиген0связывающей способности антитела (смотреть, например, патенты США №5,530,101; 5,585,089; 5,693,762). В некоторых аспектах изобретения, шарнирный участок CHI модифицирован таким образом, что изменено количество остатков цистеина в шарнирном участке, например, увеличено или уменьшено. Такой подход описан в патенте СШ №5,677,425 Bodmer el al. Количество остатков цистеина в шарнирном участке CHI изменено с целью, например, улучшить сборку легких и тяжелых цепей, или повышения или понижения стабильности антитела. В некоторых аспектах изобретения, шарнирный участок Fc антитела мутирован для уменьшения биологического периода полураспада антитела. Более конкретно, одну или больше аминокислотных мутаций вводят в домен СН2-СН3 граничной области Fc-шарнирного фрагмента, так что антитело имеет ухудшенное связывание Протеина А стафилококка (SpA), по сравнению со связыванием нативного Fc-шарнирного домена SpA. Этот подход описан детально в патентной заявке США №6,165,745, Вардом и др.
В некоторых аспектах изобретения, антитело модифицируют для увеличения биологического периода полураспада. Возможны различные подходы. Например, одна или больше следующих мутаций могут быть введены T252L, T254S, T256F, как описано в патенте США №6,277,375. Альтернативно, для увеличения биологического периода полураспада, антитело может быть изменено внутри CHl или CL участка, так чтобы содержать эпитоп связывания рецептора реутилизации, взятого из двух петель СН2 домена Fc участка IgG, как описано в патентах США №5,869,046 и 6,121,022, Presta el al.
В некоторых аспектах изобретения, антитела могут быть получены рекомбинантно и экспрессированы, используя любой известный способ. Альтернативно, антитела могут быть получены рекомбинантно фаговым отображением. Смотреть, например, патенты США 5,565,332; 5,580,717; 5,733,743 и 6,265,150; и Winter et al., Annu. Rev. Immunol. 12:433-455 (1994). Альтернативно, технология фагового отображения (McCafferty et al., Nature 348:552-553 (1990)) может быть использована для продуцирования человеческих антител и фрагментов антитела in vitro, из набора генов вариабельного домена (V) иммуноглобулина из иммунизированных доноров. Согласно данной технологии, гены V домена антитела клонируют внутри рамки в ген большего или меньшего поверхностного протеина нитевидного бактериофага, такого как М13 или fd, и отображают в качестве функциональных фрагментов антитела на поверхности частицы фага. В следствии того, что нитевидная частица содержит одно-спиральную ДНК копию генома фага, отбор на основе функциональных свойств антитела так же приводит в отбору гена, кодирующего антитело, которое проявляет эти свойства. Таким образом, фаг повторяет некоторые свойства В-клетки. Отображение фага можно осуществить в различных форматах; смотреть, например, Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Несколько источников сегментов V-гена может быть использовано для отображения фага. Кларксон и др., Nature 352:624-628 (1991), выделили широкий набор анти-оксазолон антител из небольшой рандомичной комбинаторной библиотеки V генов, происходящих из селезенки иммунизированных мышей. Может быть сконструирован набор V генов из иммунизированных человеческих доноров и могут быть выделены антитела к различным наборам антигенов (включая аутоантигены) согласно технологиям, описанным Mark et al., J. Mol. Biol. 222:581-597 (1991), or Griffith et al., EMBO J. 12:725-734 (1993). При природном иммунном ответе, гены антитела в высокой степени аккумулируют мутации (соматическая гипермутация). Некоторые из внесенных изменений будут обеспечивать большую аффинность, и В-клетки отображающие поверхность иммуноглобулина высокой аффинности, преимущественно реплицируют и дифференцируют на протяжении последующей сенсибилизации антигеном. Этот природный процесс можно скопировать, используя технику, известную как "перемешивание в цепи" (Marks et al., Bio/Technol. 10:779-783 (1992)). В этом способе, аффиннность "первичных" человеческих антител, полученных отображением фага, может быть улучшена последовательной заменой генов V участка тяжелой и легкой цепи набором природных вариантов (репертуара) генов V домена, полученных от иммунизированных доноров. Эта техника позволяет продуцировать антитело и фрагменты антитела с аффинностью в диапазоне пМ-нМ. Стратегия получения очень большого фагового набора антител (так же известного как "мать всех библиотек") была описана Waterhouse et al., Nucl. Acids Res. 21:2265-2266 (1993). Перетасовка генов так же модет быть использована для дериватизации человеческих антител из антител грызунов, где человеческое антитело имеет такую же аффинность и специфичность что и исходное антитело грызуна. Согласно этому способу, который так же называют "импринтинг эпитопа", ген V домена легкой и тяжелой цепи антитела грызуна, полученного отображением фага, заменяют набором человеческих генов V домена, образуя грызун-человеческие гибриды. Выбор антигена приводит к выделению человеческих вариабельных участков, способных восстановить сайт связывания функционального антигена, то есть, эпитоп обуславливает (отпечатывает) выбор партнера. При повторении процесса с целью замены оставшегося V домена грызуна, получают человеческое антитело (смотреть РСТ публикацию WO 93/06213). В отличие от традиционной гуманизации антитела грызуна графтингом CDR, эта техника обеспечивает полностью человеческими антителами, не содержащими каркасных или CDR остатков грызуна.
Антитела могут быть получены рекомбинантно сначала выделением антитела и клеток, продуцирующих антитело, из животных хозяев, получением последовательности гена, и использованием последовательности гена для рекомбинантной экспрессии антитела в клетках хозяевах (например, СНО клетках). Другой способ представлен экспрессией последовательности антитела в растениях (например, табаке) или трансгенном молоке. Были описаны способы рекомбинантной экспрессии антител в растениях или молоке. Смотреть, например, Peeters, et al., Vaccine 19:2756, (2001); Lonberg, N. and D. Huszar lnt. Rev. Immunol 13:65 (1995); и Pollock, et al., J Immunol Methods 231:147 (1999). Способы получения производных антител, например, гуманизированных, одноцепочечных, и т.д., известны в отрасли.
Техники отбора иммуноанализом и цитометрией в потоке, такие как флуоресцентно активированный отбор клеток (FACS), так же могут быть использованы для выделения антител, специфичных к CXCR4.
Антитела, как описано в данном документе, могут быть привязаны на различные носители. Носители могут быть активными и/или инертными. Примеры хорошо известных носителей включают полипропилен, полистирол, полиэтилен, декстран, нейлон, амилазы, стекло, природные и модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. Природа носителя может быть растворимой или нерастворимой в зависимости от цели изобретения. Специалистам в отрасли известны другие приемлемые носители для связывания антител, или они могут их подобрать путем обычных экспериментов. В некоторых аспектах изобретения, носитель содержит остаток, направленный в миокард.
ДНК, кодирующая моноклональное антитела, легко выделяется и секвенируется, используя стандартные техники (например, используя олигонуклеотидные зонды, способные специфично связываться с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Клетки гибридомы служат предпочтительным источником такой ДНК. После выделения, ДНК может быть помещена в векторы экспрессии (такие как векторы экспрессии, описанные в РСТ публикации WO 87/04462), которые затем трансфецируют в клетки хозяева, такие как клетки Е. coli, COS клетки обезьяны, клетки яичников китайского хомячка (СНО) или клетки миеломы, которые другим образом не продуцируют протеин иммуноглобулина, с получением синтеза моноклонального антитела в рекомбинантных клетках хозяевах. Смотреть, например, РСТ публикацию WO 87/04462. ДНК так же может быть модифицирована, например, путем замещения кодирующей последовательности константных участков человеческих тяжелой и легкой цепи на место гомологичных мышиных последовательностей, Morrison et al., Proc. Nat. Acad. Sci. 81:6851, 1984, или путем ковалентного присоединения к кодирующей последовательности иммуноглобулина всей или части кодирующей последовательности полипептида не-иммуноглобулина. Таким образом, получают "гибридные" или "химерные" антитела, имеющие специфичность связывания CXCR4 моноклонального антитела.
Способы определения специфичности связывания анти-CXCR4 антитела хорошо известны в отрасли. Общие способы описаны, например, Mole, "Epitope Mapping," in METHODS IN MOLECULAR BIOLOGY, VOLUME 10: IMMUNOCHEMICAL PROTOCOLS, Manson (ed.), pages 105-116 (The Humana Press, Inc. 1992).
Анти-CXCR4 антитела или их антиген-связывающие фрагменты, как описано в данном документе, могут быть идентифицированы или охарактеризованы, используя изветсные в отрасли способы, таким образом, определяя и/или измеряя снижение экспрессии CXCR4. В некоторых аспектах изобретения, анти-CXCR4 антитело или его антиген-связывающий фрагмент идентифицируют путем инкубирования агента кандидата с CXCR4, и мониторинга связывания и/или снижения экспрессии CXCR4. Анализ связывания осуществляют с очищенными CXCR4 полипептидами, или с клетками, природно экспрессирующими, или траснфецированными для экспрессии, CXCR4 полипептидов. В одном аспекте, анализ связывания является конкурентным анализом связывания, где оценивают способность антитела кандидата конкурировать с известным анти-CXCR4 антителом или его антиген-связывающим фрагментом за связывание CXCR4. анализ может быть осуществлен в различных форматах, включая ELISA.
Следуя первоначальному определению, активность кандидата анти-CXCR4 антитела или его антиген-связывающего фрагмента так же может быть подтверждена и оптимизирована с помощью биоанализа, тестирующего направленную биологическую активность. Альтернативно, биоанализ может быть использован для прямого скрининга кандидатов. Некоторые способы идентификации и характеризации анти-СХСR4 антитела или его антиген-связывающего фрагмента детально описаны в Примерах.
Анти-CXCR4 антитела или их антиген-связывающие фрагменты могут быть охарактеризованы, используя известные в отрасли способы. Например, одним способом является идентификация эпитопа, с которым оно связывается, или "картирование эпитопа". В отрасли известно много способов картирования и характеризации расположения эпитопов на протеинах, включая растворение кристаллической структуры комплекса антитело-антиген, конкурентный анализ, анализ экспрессии фрагмента гена, и анализ искусственных пептидов, как описано, например, в Chapter 11 of Harlow and Lane, Using Antibodies, a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1999. В дополнительном примере, картирование эпитопа может быть использовано для определения последовательности, с которой связывается анти-СХСR4 антитело или его антиген-связывающий фрагмент. Картирование эпитопа является коммерчески доступным из различных источников, например, Pepscan Systems (Эдельхертвег 15, 8219 РН Лелистад, Голландия). Эпитоп может быть линейным эпитопом, то есть, содержаться в одной цепи аминокислоты, или конфармационным эпитопом, образованным трехмерным взаимодействием аминокислоты, которая не обязательно содержится в одной цепи. Пептиды различной длины (например, как минимум 4-6 аминокислот) могут быть выделены или синтезированы (например, рекомбинантно) и использованы для анализов связывания с анти-СХСR4 антителом или его антиген-связывающими фрагментами. В другом Примере, эпитоп с которым связывается анти-СХСR4 антитело или его антиген-связывающие фрагменты, может быть определен систематическим скринингом, используя перекрывающиеся пептиды, происходящие от последовательности CXCR4, и определением связывания анти-CXCR4 антителом или антиген-связывающими фрагментами. Согласно анализу экспрессии фрагмента гена, открытая рамка считывания, кодирующая CXCR4, фрагментирована рандомично или специфическими генетическими конструкциями, и определяют реактивность экспрессированных фрагментов CXCR4 с тестируемым антителом. Фрагменты гена могут, например, быть получены с помощью ПЦР, а потом транскрибированы и транслированы в протеин in vitro, в присутствии радиоактивных аминокислот. Связывание антитела с радиоактивно меченными CXCR4 фрагментами затем определяют иммуноосаждением и гель-электрофорезом. Определенные эпитопы так же могут быть идентифицированы, используя большие библиотеки рандомичных пептидных последовательностей, отображаемых на поверхности частиц фага (библиотеки фага). Альтернативно, определенная библиотека перекрывающихся пептидных фрагментов может быть исследована на связывание с тест антителом в простом анализе связывания. В дополнительном Примере, мутагенез антиген-связывающего домена, эксперименты по обмену доменами и аланин сканирующий мутагенез могут быть осуществлены для идентификации нужных остатков, достаточных и/или необходимых для связывания эпитоп. Например, эксперименты по обмену доменами могут быть осуществлены, используя мутантный CXCR4, в котором различные фрагменты CXCR4 Протеина, были замещены (обменены) последовательностями из CXCR4 других видов (например, мышей), или близкородственны, но антигенно отличающимся протеином (например, CXCR4). При оценке связывания антитела с мутантным CXCR4, может быть оценена важность конкретного CXCR4 фрагмента для связывания антитела.
Еще одним способом характеризации анти-CXCR4 антитела является использование конкурентного анализа с другими антителами, связывающими тот же антиген, то есть, различные фрагменты CXCR4, для определения того или анти-CXCR4 антитело конкурирует с и/или связывается с тем же эпитопом, что и другие антитела. Конкурентные анализы хорошо известны в отрасли.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, связывающееся с CXCR4, конкурирует за связывание с CXCR4 с и/или связывается с тем же эпитопом CXCR4. Антитела, конкурирующие за связывание с CXCR4 и/или связывающиеся с тем же эпитопом CXCR4, включают антитела, содержащие как минимум вариабельный участок тяжелой цепи (VH), содержащий (i) VH CDR1, выбранный из группы, состоящей из SEQ ID NO: 107, 113, 114, 108, 109, 115, 116, 117, 121 и 122; (ii) VH CDR2, выбранный из группы, состоящей из SEQ ID NO: 162, 128, 110, 111, 118, 119, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156 и 130, и (iii) VH CDR3, выбранный из группы, состоящей из SEQ ID NO: 112 и 120; и/или; как минимум вариабельный участок легкой цепи (VL), содержащий (i) VL CDR1, выбранный из группы, состоящей из SEQ ID NO: 144, 131, 135, 138, 141, 142, 143, 146, 147, 148, 149, 150 и 151; (ii) VL CDR2, выбранный из группы, состоящей из 145, 132, 136 и 152; и (iii) VL CDR3, выбранный из группы, состоящей из SEQ ID NO: 139, 133, 137, 140 и 153.
В некоторых аспектах изобретения, антитело конкурирует за связывание с CXCR4 с антителом или его антиген-связывающим фрагментом, содержащим вариабельный участок тяжелой цепи (VH), содержащий три CDR с последовательностями SEQ ID NO: 107, 162 и 112.
В некоторых аспектах изобретения, антитело конкурирует за связывание с CXCR4 с антителом или его антиген-связывающим фрагментом, содержащим вариабельный участок легкой цепи (VL), содержащий три CDR с последовательностями SEQ ID NO: 144, 145 и 139.
В некоторых аспектах изобретения, антитело конкурирует за связывание с CXCR4 с антителом или его антиген-связывающим фрагментом, содержащим а) вариабельный участок тяжелой цепи (VH), содержащий три CDR с последовательностями SEQ ID NO: 107, 162 и 112; и b) вариабельный участок легкой цепи (VL), содержащий три CDR с последовательностями SEQ ID NO: 144, 145 и 139.
В некоторых аспектах изобретения, и антитело конкурирует за связывание с CXCR4 с антителом или его антиген-связывающим фрагментом, содержащим а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1, VH CDR2 и VH CDR3 из VH участка последовательности SEQ ID NO: 33; и/или b) вариабельный участок легкой цепи (VL), содержащий VL CDR1, VL CDR2 и VL CDR3 из VL участка последовательности SEQ ID NO: 73.
В некоторых аспектах изобретения, антитело конкурирует за связывание с CXCR4 с антителом или его антиген-связывающим фрагментом, содержащим а) вариабельный участок тяжелой цепи (VH) с последовательностью SEQ ID NO: 33; и/или b) вариабельный участок легкой цепи (VL) с последовательностью SEQ ID NO: 73.
Вектор экспрессии может быть использован для направления экспрессии анти-CXCR4 антитела или его антиген-связывающих фрагментов. Специалистам в отрасли известно о введении векторов экспрессии с целью получения экспрессии экзогенного протеина in vivo. Смотреть, например, патенты США №6,436,908; 6,413,942 и 6,376,471. Введение векторов экспрессии включает локальное или системное введение, включая инъекцию, оральное введение, генная пушка или катетерное введение, и местное введение. В другом аспекте изобретения, вектор экспрессии вводят непосредственно в симпатический ствол или ганглий, или в коронарную артерию, предсердие, желудочек сердца или перикард.
Так же может быть использована направленная доставка терапевтической композиции, содержащей вектор экспрессии или субгеномные полинуклеотиды. Техники рецептор-опосредованной ДНК доставки описаны в, например, Findeis et al., Trends Biotechnol. 11:202(1993),; Chiou et al., Gene Therapeutics: Methods And Applications Of Direct Gene Transfer, J.A. Wolff, ed, 1994; Wu et al., J. Biol. Chem., 263:621 (1988); Wu et al., J. Biol. Chem., 269:542 (1994); Zenke et al., Proc. Natl. Acad. Sci. USA, 87:3655 (1990); и Wu et al., J. Biol. Chem., 266:338 (1991). Терапевтические композиции, содержащие полинуклеотид, вводят в диапазоне от приблизительно 100 нг до приблизительно 200 мг ДНК при локальном введении, в протоколе генной терапии. На протяжении генной терапии так же могут быть использованы диапазоны концентраций от приблизительно 500 нг до приблизительно 50 мг, от приблизительно 1 мкг до приблизительно 2 мг, от приблизительно 5 мкг до приблизительно 500 мкг, и от приблизительно 20 мкг до приблизительно 100 мкг ДНК. Терапевтические полинуклеотиды и полипептиды могут быть доставлены, используя средства доставки генов. Устройство доставки генов может иметь вирусное или невирусное происхождение (смотреть, Jolly et al., Cancer Gene Therapy, 1:51 (1994); Kimura, Human Gene Therapy, 5:845 (1994); Connelly et al., Human Gene Therapy, 1:185(1995),; and Kaplitt, Nature Genetics, 6:148 (1994)). Экспрессия таких кодирующих последовательностей может быть вызвана, используя эндогенные промотеры млекопитающих или гетерологичные промоторы. Экспрессия кодирующей последовательности может быть конститутивной или регулируемой.
Вирусные векторы для доставки желаемого полинуклеотида и экспрессии в желаемой клетке хорошо известны в отрасли. Примеры вирусных средств включают, но не ограничиваются следующими: рекомбинантные ретровирусы (смотреть, например, РСТ публикации WO 90/07936; WO 94/03622; WO 93/25698; WO 93/25234; WO 93/11230; WO 93/10218; WO 91/02805; патенты США №5,219,740 И 4,777,127; патент Великобритании №2,200,651; и европейский патент №0345242), векторы на основе альфавирусов (например, векторы вируса Синдбис, вируса леса Симлики (АТСС VR-67; АТСС VR-1247), вируса реки Росс (АТСС VR-373; АТСС VR-1246) и векторы вируса венесуэського энцефалита лошадей (АТСС VR-923; АТСС VR-1250; АТСС VR 1249; АТСС VR-532)), и векторы адено-ассоциированного вируса (AAV) (смотреть, например, РСТ публикации WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 и WO 95/00655). Так же может быть использовано введение ДНК, присоединенной на убитый аденовирус, как описано в Curiel, Hum. Gene Ther., 1992, 3:147.
Также может быть использована невирусная доставка средств и способов, включая, но не ограничиваясь следующими: поликатионная конденсированная ДНК, присоединенная или нет к убитому аденовирусу (смотреть, например, Curiel et al., Hum. Gene Ther., 3:147 (1992)); лиганд-связанная ДНК (смотреть, например, Wu, J. et al., Biol. Chem., 264:16985 (1989)); средства доставки эукариотических клеток (смотреть, например, патент США №5,814,482; РСТ публикации WO 95/07994; WO 96/17072; WO 95/30763 и WO 97/42338) и нейтрализация заряда ядра или гибридизация с клеточной мембраной. Так же могут быть использованы голые ДНК. Примеры способов введения голых ДНК описаны в РСТ публикации WO 90/11092 и патенте США №5,580,859. Липосомы, действующие как средства доставки генов, описаны в патенте США №5,422,120; РСТ публикациях WO 95/13796; WO 94/23697; WO 91/14445; и EP 0524968. Дополнительные подходы описаны в Philip et al., Mol. Cell Biol., 14:2411 (1994) and in Woffendin et al., Proc. Natl. Acad. Sci., 91:1581 (1994).
В некоторых аспектах изобретения, изобретение включает композиции, включая фармацевтические композиции, содержащие антитела, описанные в данном документе, или полученные с помощью способов и имеющие характеристики, описанные в данном документе. Как указано в данном документе, композиции содержат одно или больше антител, связывающихся с CXCR4, и/или один или больше полинуклеотидов, содержащих последовательности, кодирующие одно или больше таких антител. Эти композиции так же могут содержать приемлемые вспомогательные вещества, такие как фармацевтически приемлемые вспомогательные вещества, включая буферы, хорошо известные в отрасли.
Соответственно, изобретение касается любой из следующих последовательностей, или композиций (включая фармацевтические композиции), содержащих любую из следующих последовательностей:

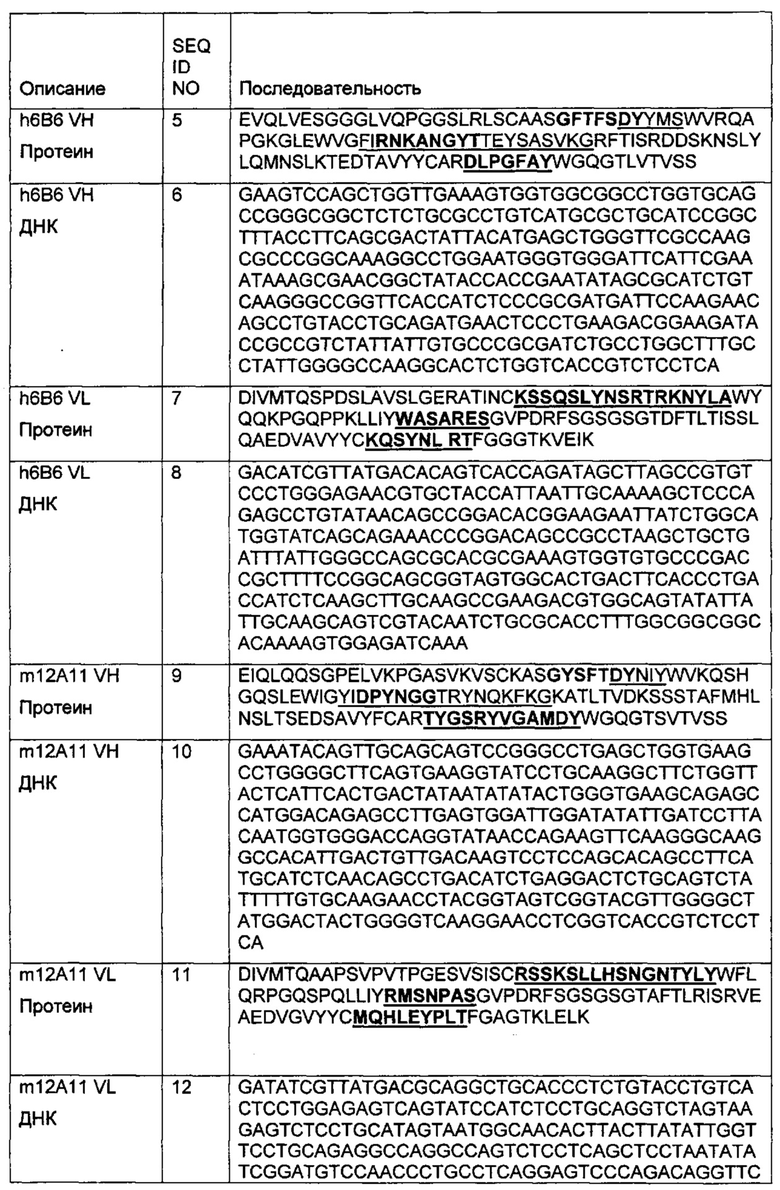






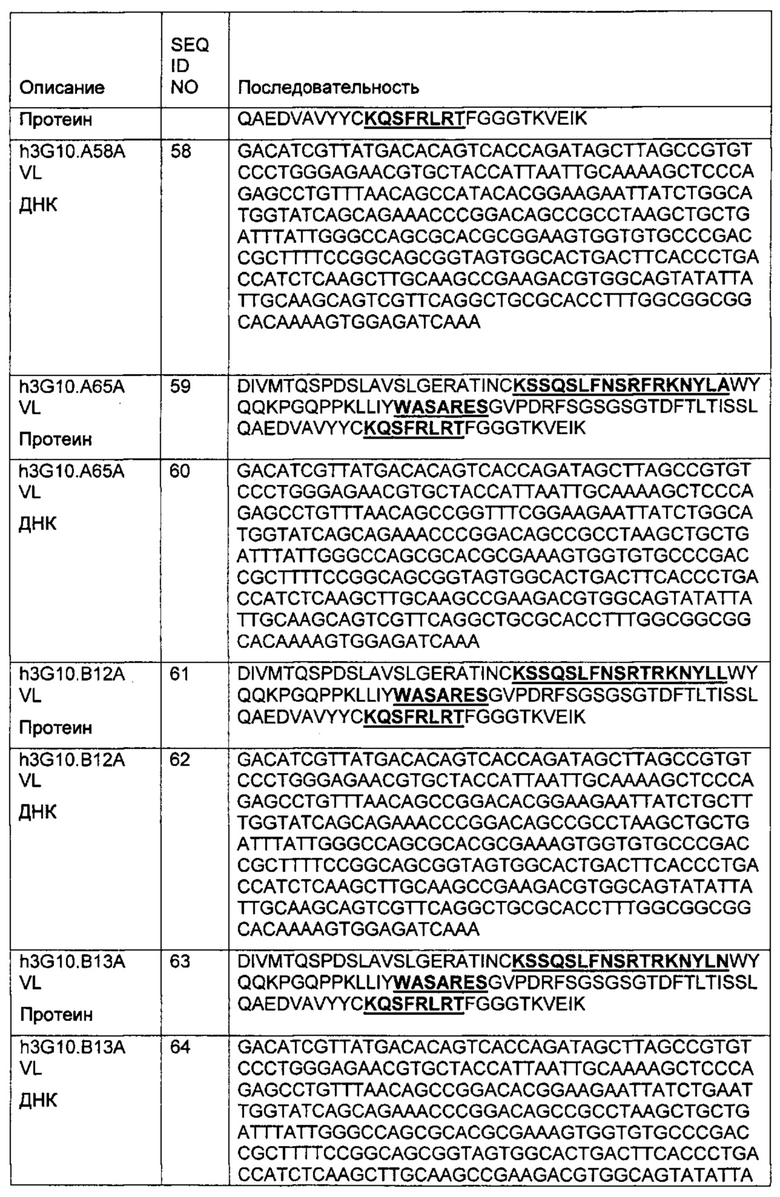
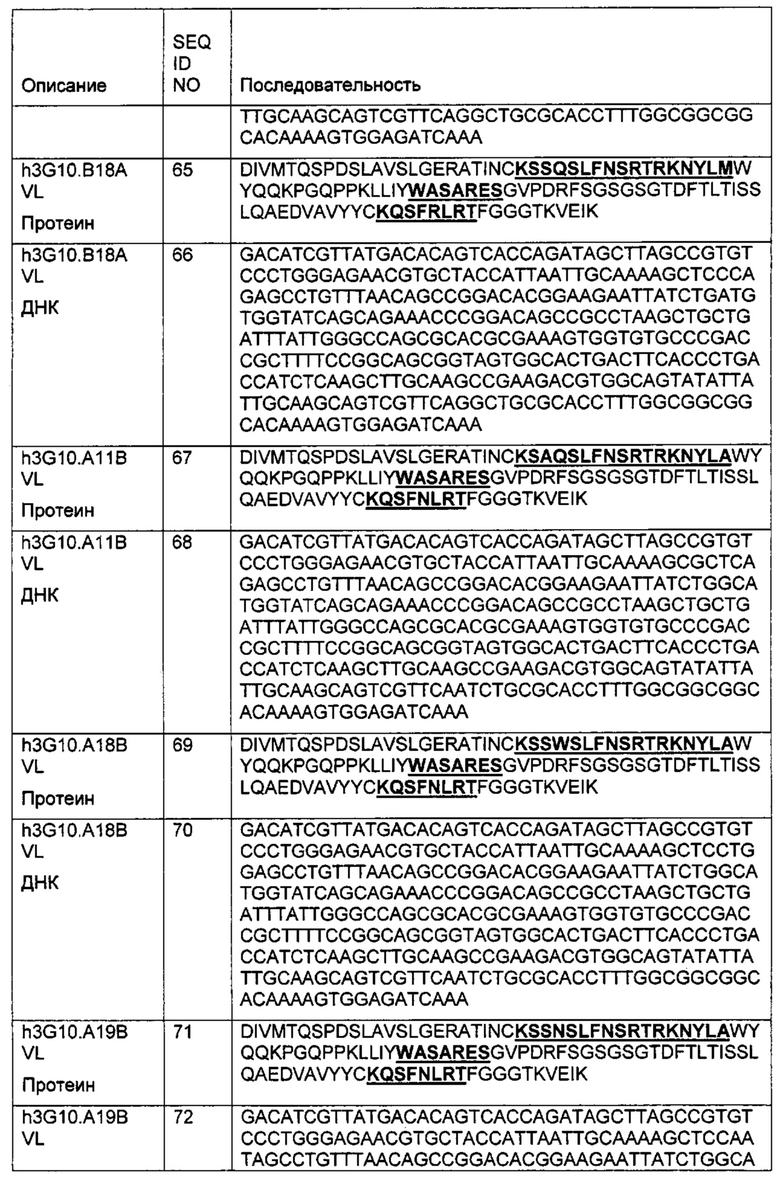
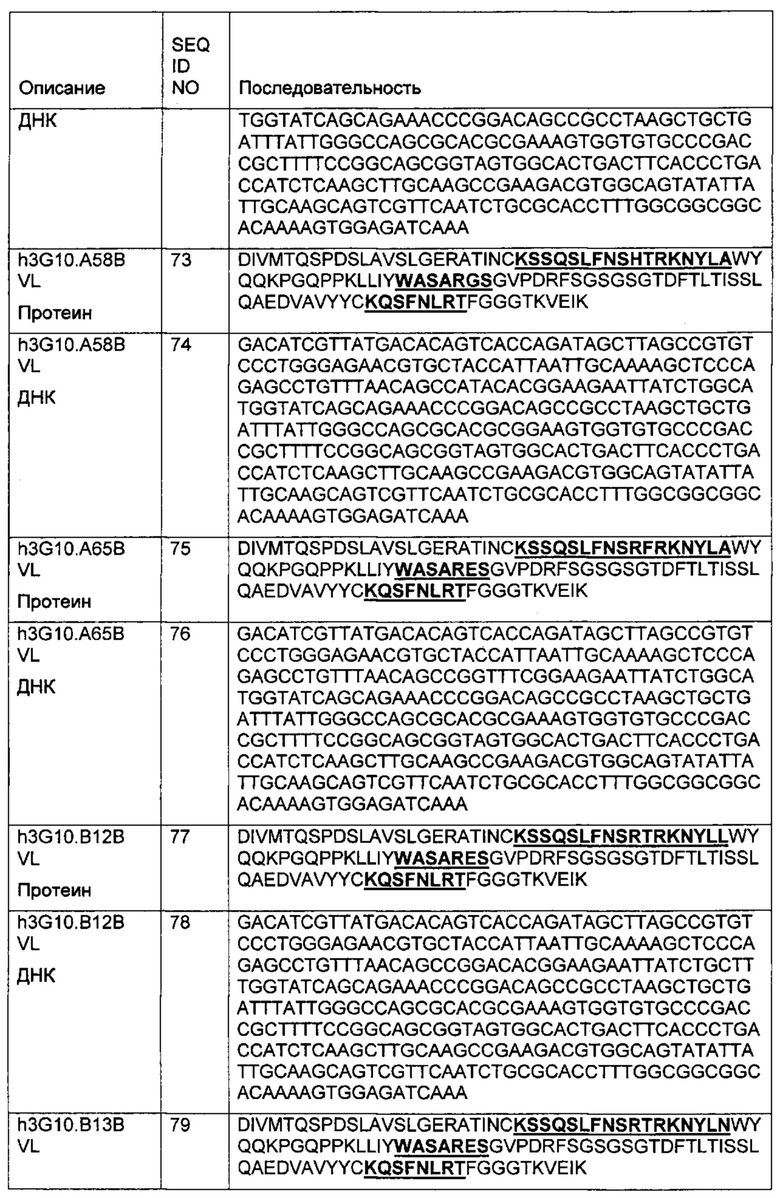
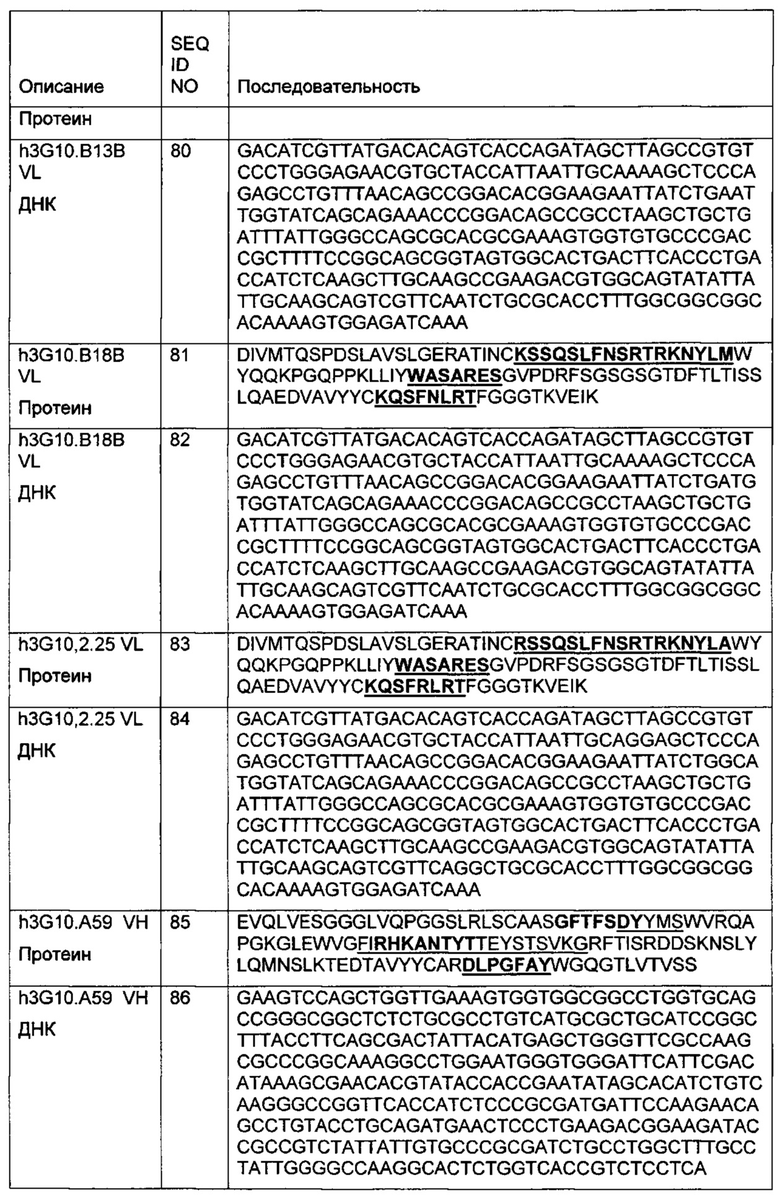

В Таблице 2, подчеркнутые последовательности являются CDR последовательностями согласно Kabat, а выделенные жирным согласно Chothia.
Изобретение так же относится к CDR частям антитела к CXCR4 (включая Chothia, Kabat CDR, и CDR контактные участки). Определение участков CDR известно в отрасли. Понятно, что в некоторых аспектах изобретения, CDR могут представлять комбинацию Kabat и Chothia CDR (так же называют "комбинированные CR" или "удлиненные CDR"). В некоторых вариантах осуществления, CDR являются Kabat CDR. В других вариантах осуществления, CDR являются Chothia CDR. Другими словами, в вариантах осуществления с более чем одной CDR, CDR может представлять Kabat, Chothia, комбинацию CDR, или их комбинации. Таблицы 3 и 4 приводят Примеры CDR последовательностей, приведенных в данном документе.
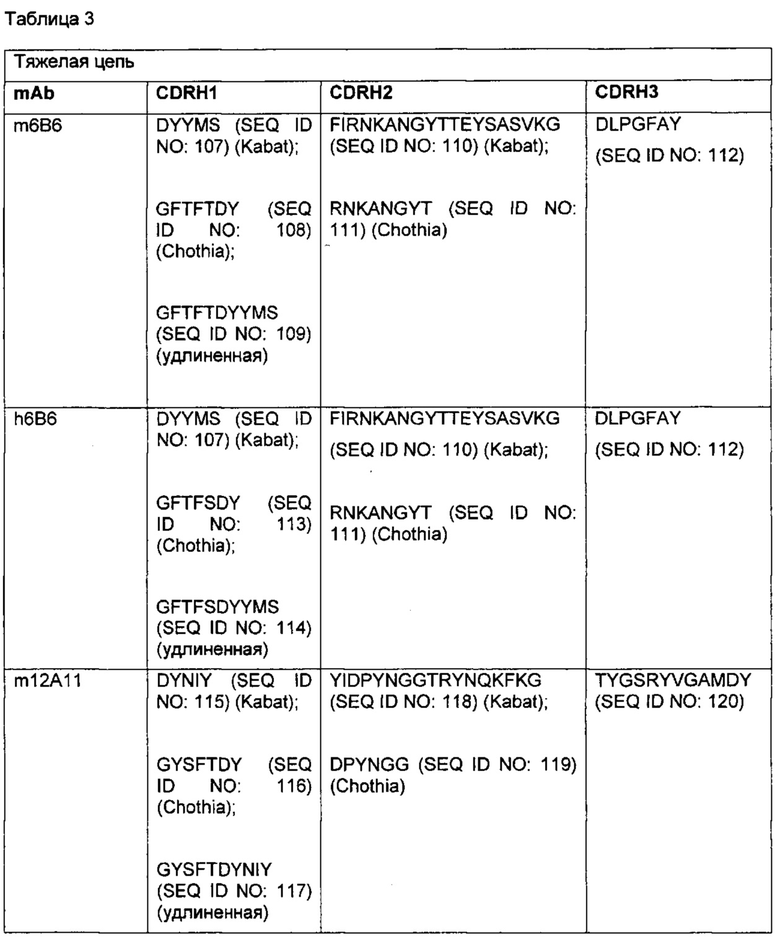
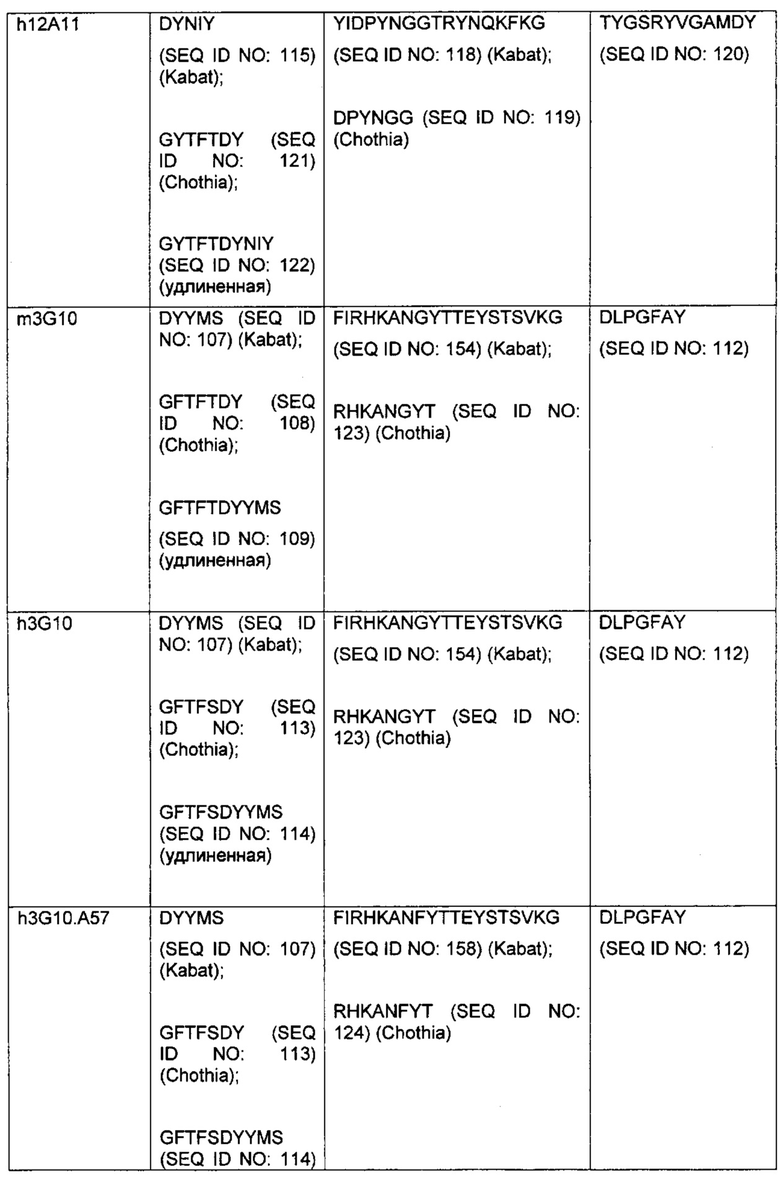



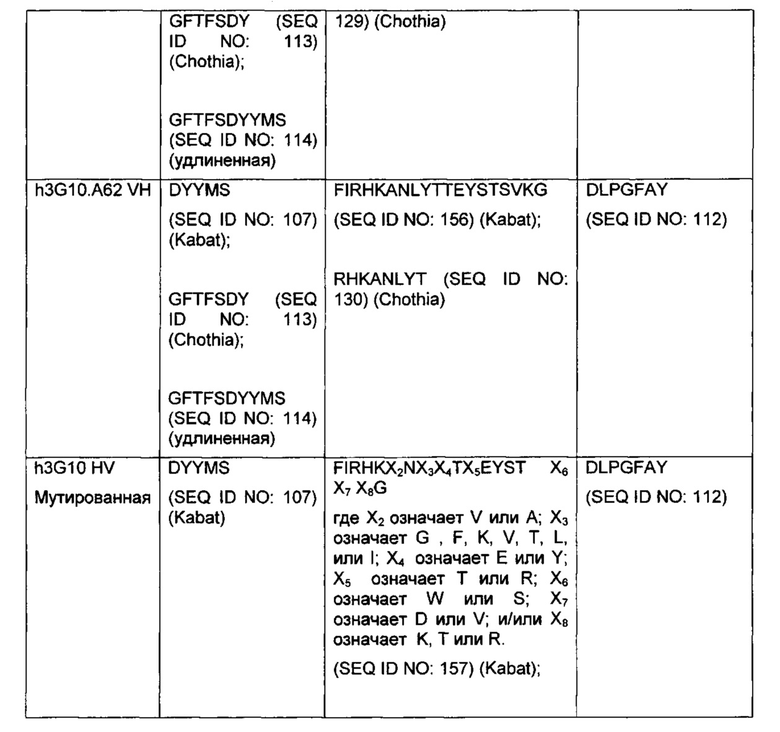

В одном аспекте, данное изобретение касается антитела, которое связывается с CXCR4 и/или конкурирует с антителом, как описано в данном документе, таким как m6B6, h6B6, m12A11, h2A11, m3G10, h3G10, h3G10.A57, h3G10.B44, h3G10.1.7, h3G10.1.60, h3G10,2,5, h3G10.1,91, h3G10,2.37, h3G10,2.45, h3G10,2.42, h3G10.1.33, h3G10,3.25, h3G10, h3G10,2.72, h3G10.A11A, h3G10.A18A, h3G10.A19A, h3G10.A58A, h3G10.A65A, и h3G10.B12A, h3G10.B13A, h3G10.B18A, h3G10.A11B, h3G10.A18B, h3G10.A19B, h3G10.A58B, h3G10.A65B, h3G10.B12B, h3G10.B13B, h3G10.B18B, h3G10,2.25, h3G10.A59, h3G10.A62, или h3G10.L94D.
В другом аспекте, антитело конкурирует за связывание с CXCR4 с антителом m6B6, h6B6, m12A11, h12A11, m3G10, h3G10, h3G10.A57, h3G10.B44, h3G10.1.7, h3G10.1.60, h3G10,2,5, h3G10.1,91, h3G10,2.37, h3G10,2.45, h3G10,2.42, h3G10.1.33, h3G10,3.25, h3G10, h3G10,2.72, h3G10.A11A, h3G10.A18A, h3G10.A19A, h3G10.A58A, h3G10.A65A, и h3G10.B12A, h3G10.B13A, h3G10.B18A, H3G10.A11B, h3G10.A18B, h3G10.A19B, h3G10.A58B, h3G10.A65B, h3G10.B12B, h3G10.B13B, h3G10.B18B, h3G10,2.25, h3G10.A59, h3G10.A62 или h3G10.L94D.
В некоторых аспектах изобретения, антитело конкурирует за связывание с CXCR4 с антителом данного изобретения, и имеет аффинность связывания (KD) моновалентного антитела приблизительно менее чем 6,5 нМ, 6,0 нМ, 5,5 нМ, 5,0 нМ, 4,5 нМ, 4,0 нМ, 3,5 нМ, 3,0 нМ, 2,5 нМ, 2,0 нМ, 1,5 нМ, 1,0 нМ, 0,5 нМ или 0,25 нМ, измеренную с помощью поверхностного плазмонного резонанса. В некоторых аспектах изобретения, антитело конкурирует за связывание с CXCR4 с антителом h3G10, и имеет аффинность связывания (KD) моновалентного антитела приблизительно менее чем 30 нМ, 25 нМ, 22 нМ, 20 нМ, 15 нМ или 10 нМ.
В некоторых аспектах, изобретение так же относится к CDR частям антитела, анти-CXCR4 антителу на основе CDR контактных участков. CDR контактные участки являются участками антитела, наделяющими антитело специфичностью к антигену. В целом, CDR контактные участки включают положения остатков в CDR и вспомогательных зонах, которые стеснены с целью поддержания нужной структуры петли антитело для связывания специфического антигена. Смотреть, например, Makabe et al., J. Biol. Chem., 283:1156-1166, 2007. Определение CDR контактных участков известно в отрасли.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, которое связывается с рецептором хемокина 4 (CXCR4), включает: вариабельный участок тяжелой цепи (VH), содержащий (i) VH CDR1, выбранный из группы, состоящей из SEQ ID NO: 107, 113, 114, 108, 109, 115, 116, 117, 121 и 122; (ii) VH CDR2, выбранный из группы, состоящей из SEQ ID NO: 162, 128, 110, 111, 118, 119, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156 и 130, и (iii) VH CDR3, выбранный из группы, состоящей из SEQ ID NO: 112; и 120; и/или; b) вариабельный участок легкой цепи (VL), содержащий (i) VL CDR1, выбранный из группы, состоящей из SEQ ID NO: 144, 131, 135, 138, 141, 142, 143, 146, 147, 148, 149, 150 и 151; (ii) VL CDR2, выбранный из группы, состоящей из 145, 132, 136 и 152; и (iii) VL CDR3, выбранный из группы, состоящей из SEQ ID NO: 139, 133, 137, 140 и 153.
В одном аспекте, антитело или его антиген-связывающий фрагмент, которое связывается с CXCR4, включает вариабельные CDR участки тяжелой цепи (VH), содержащие аминокислотную последовательность, как минимум на 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO: 107, 113, 114, 108, 109, 115, 116, 117, 121, 122; 162, 128, 110, 111, 118, 119, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156, 130, 112 и 120. В одном аспекте, антитело или его антиген-связывающий фрагмент, которое связывается с CXCR4, включает вариабельные CDR участки тяжелой цепи (VH), содержащие аминокислотную последовательность, как минимум на 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO: 144, 131, 135, 138, 141, 142, 143, 146, 147, 148, 149, 150, 151, 145, 132, 136, and 152, 139, 133, 137, 140 и 153.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, которое связывается с CXCR4, включает: а) вариабельный участок тяжелой цепи (VH), содержащий участки определения комплементарности, выбранный из группы, состоящей из (i) VH CDR1, содержащий последовательность SEQ ID NO: 107, 113, 114, 108, 109, 115, 116, 117, 121 и 122; (ii) VH CDR2, содержащий последовательность SEQ ID NO: 162, 128, 110, 111, 118, 119, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156, и 130, и (iii) VH CDR3 содержащий последовательность SEQ ID NO: 112; или 120; и/или b) вариабельный участок легкой цепи (VL), содержащий участки определения комплементарности, выбранный из группы, состоящей из (i) VL CDR1, содержащий последовательность SEQ ID NO: 144, 131, 135, 138, 141, 142, 143, 146, 147, 148, 149, 150 или 151; (ii) VL CDR2, содержащий последовательность SEQ ID NO 145, 132, 136 или 152; и (iii) VL CDR3 содержащий последовательность SEQ ID NO: 139, 133, 137, 140 или 153. В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, которое связывается с CXCR4, включает: а) вариабельный участок легкой цепи (VL), содержащий (i) VL CDR1, содержащий последовательность X1SX2X3SLFNSX4X5RKNYLX6 где X1 означает R или K; Х2 означает S или А; Х3 означает W, N или Q; X4 означает Н или R; Х5 означает Т или F; и/или Х6 означает A, L, N, или М (SEQ ID NO: 151); (ii) VL CDR2, содержащий последовательность WASARX1S, где X1 означает G или Е (SEQ ID NO: 152), и (iii) VL CDR3, содержащий последовательность KQSFX1LRT, где X1 означает N или R (SEQ ID NO: 153); и/или b) вариабельный участок тяжелой цепи (VH), содержащий (i) VH CDR1, содержащий последовательность SEQ ID NO: 107, 108, 109, 113, или 114; (ii) VH CDR2, содержащий последовательность SEQ ID NO: 157 и (iii) VH CDR3, содержащий последовательность SEQ ID NO: 112.
В другом аспекте, изобретение касается изолированного антитела или его антиген-связывающего фрагмента, которое связывается с рецептором хемокина 4 (CXCR4), и содержит: последовательность вариабельного участка тяжелой цепи (VH), содержащую: EVQLVESGGGLVQPGGSLRLSCAASGFTFSDYYMSWVRQAPGKGLEWVX1FIRHKX2NX3X4TX5EYSTX6X7X8GRFTISRDX9SKNX10LYLQMNSLX11X12EDTAVYYCAX13DLPGFAYWGQGTLVTV SS (SEQ ID NO: 106), где X1 означает G или S; X2 означает V или A; X3 означает G, F, K, V, T, L, или I; X4 означает E или Y; X5 означает T или R; X6 означает W или S; X7 означает D или V; X8 означает K, T или R; Х9 означает D или N; Х10 означает Т или S; Х11 означает R или K; Х12 означает А или Т; и Х13 означает K или R.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, которое связывается с рецептором хемокина 4 (CXCR4), выбрано из группы, состоящей из: а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1 с последовательностью SEQ ID NO: 107, 113 или 114; VH CDR2 с последовательностью SEQ ID NO: 162 или 128, и VH CDR3 с последовательностью SEQ ID NO: 112, и вариабельный участок легкой цепи (VL), содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; b) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 115, 116, 117, 121 или 122; VH CDR2 с последовательностью SEQ ID NO: 118 или 119 и VH CDR3 с последовательностью SEQ ID NO: 120 и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 135; VL CDR2 с последовательностью SEQ ID NO: 136 и VL CDR3 с последовательностью SEQ ID NO: 137; с) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107, 108, 109, 113 или 114; VH CDR2 с последовательностью SEQ ID NO: 110 или 111, и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 131; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 133; d) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107, 108, 109, 113 или 114; VH CDR2 с последовательностью SEQ ID NO: 154 или 123 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 139; и е) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107, 108, 109, 113 или 114; VH CDR2 с последовательностью SEQ ID NO: 157 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 151; VL CDR2 с последовательностью SEQ ID NO: 152 и VL CDR3 с последовательностью SEQ ID NO: 153.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, которое связывается с рецептором хемокина 4 (CXCR4), выбрано из группы, состоящей из: а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112 и вариабельный участок легкой цепи (VL), содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; b) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 115; VH CDR2 с последовательностью SEQ ID NO: 118 и VH CDR3 с последовательностью SEQ ID NO: 120 и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 135; VL CDR2 с последовательностью SEQ ID NO: 136 и VL CDR3 с последовательностью SEQ ID NO: 137; c) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 110 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 131; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 133; d) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 154 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 139; и e) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 157 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 151; VL CDR2 с последовательностью SEQ ID NO: 152 и VL CDR3 с последовательностью SEQ ID NO: 153.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, которое связывается с рецептором хемокина 4 (CXCR4), выбрано из группы, состоящей из: а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112 и вариабельный участок легкой цепи (VL), содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 139; b) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; c) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 150; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; d) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 141; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; e) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140; f) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 147; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; g) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 159 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; h) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 160 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; i) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 161 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; j) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; k) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; l) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 164 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; m) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 165 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; o) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 166 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; p) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 167 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; q) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 168 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; r) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 168 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; s) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140; t) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO:145 и VL CDR3 с последовательностью SEQ ID NO: 139; u) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; v) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; и w) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, содержит: вариабельный участок тяжелой цепи (VH), содержащий три CDR с последовательностями SEQ ID NO: 107, 162 и 112. В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, содержит: вариабельный участок легкой цепи (VL), содержащий три CDR с последовательностями SEQ ID NO: 144, 145 и 139. В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, содержит: а) вариабельный участок тяжелой цепи (VH), содержащий три CDR с последовательностями SEQ ID NO: 107, 162 и 112; и b) вариабельный участок легкой цепи (VL), содержащий три CDR с последовательностями SEQ ID NO: 144, 145 и 139.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, содержит: вариабельный участок тяжелой цепи (VH), содержащий VH CDR1, VH CDR2 и VH CDR3 из VH участка последовательности SEQ ID NO: 33. В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, содержит: вариабельный участок легкой цепи (VL), содержащий VL CDR1, VL CDR2 и VL CDR3 из VL участка последовательности SEQ ID NO: 73. В других аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, содержит: а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1, VH CDR2 и VH CDR3 из VH участка последовательности SEQ ID NO: 33; и b) вариабельный участок легкой цепи (VL), содержащий VL CDR1, VL CDR2 и VL CDR3 из VL участка последовательности SEQ ID NO: 73.
В некоторых аспектах изобретения, изолированное антитело или его антиген-связывающий фрагмент, выбрано из группы, состоящей из: а) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 33 и VL участок последовательности SEQ ID NO: 73; b) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 13 и VL участок последовательности SEQ ID NO: 15; с) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 5 и VL участок последовательности SEQ ID NO: 7; d) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 21 и VL участок последовательности SEQ ID NO: 47; и е) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 106 и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 139.
В одном аспекте изобретения, изолированное антитело или его антиген-связывающий фрагмент, содержит: а) вариабельный участок тяжелой цепи (VH) с последовательностью SEQ ID NO: 33; и/или b) вариабельный участок легкой цепи (VL) с последовательностью SEQ ID NO: 73.
В одном аспекте, данное изобретение касается антитела или его антиген-связывающего фрагмента, которое связывается с CXCR4, где антитело содержит вариабельный участок тяжелой цепи (VH), содержащий последовательность SEQ ID NO: 1, 5, 9, 13, 17, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 85, 87 или 106; и/или вариабельный участок легкой цепи (VL), содержащий последовательность SEQ ID NO: 3, 7, 11, 15, 19, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, или 169. В одном аспекте, антитело или его антиген-связывающий фрагмент, которое связывается с CXCR4, содержит вариабельный участок тяжелой цепи (VH), содержащий аминокислотную последовательность на как минимум 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO: 1, 5, 9, 13, 17, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 85, 87 или 106. В одном аспекте, антитело или его антиген-связывающий фрагмент, которое связывается с CXCR4, содержит вариабельный участок легкой цепи (VL), содержащий аминокислотную последовательность на как минимум 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO: 3, 7, 11, 15, 19, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83 или 169.
В некоторых аспектах изобретения, оно касается изолированного антитела или его антиген-связывающего фрагмента по п. 6, выбранного из группы, состоящей из: а) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 33 и VL участок последовательности SEQ ID NO: 73; b) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 13 и VL участок последовательности SEQ ID NO: 15; с) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 5 и VL участок последовательности SEQ ID NO: 7; d) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO:21 и VL участок последовательности SEQ ID NO: 47; и е) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 106, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132; и VL CDR3 с последовательностью SEQ ID NO: 139.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент включает а) вариабельный участок тяжелой цепи (VH) с последовательностью SEQ ID NO: 33; и/или b) вариабельный участок легкой цепи (VL) с последовательностью SEQ ID NO: 73. В определенных аспектах, антитело или его антиген-связывающий фрагмент включает вариабельный участок тяжелой цепи (VH), полученный с помощью вектора экспрессии с АТСС номером доступа РТА-121353. В других аспектах, антитело или его антиген-связывающий фрагмент содержит вариабельный участок легкой цепи (VL), полученный с помощью вектора экспрессии с АТСС номером доступа РТА-121354.
В некоторых аспектах изобретения, антитело или его антиген-связывающий фрагмент, которое связывается с рецептором хемокина 4 (CXCR4), выбрано из группы, состоящей из следующих: а) вариабельный участок тяжелой цепи (VH), содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и вариабельный участок легкой цепи (VL), содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 139; b) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; с) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 150; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; d) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 141; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; е) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140; f) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 147; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; g) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 159 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; h) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 160 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; i) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 161 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; j) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; k) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; l) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 164 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; m) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 165 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; n) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 166 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; o) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 167 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; p) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 168 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; q) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 168 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 138; VL CDR2 с последовательностью SEQ ID NO: 132 и VL CDR3 с последовательностью SEQ ID NO: 140; r) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140; s) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 158 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; t) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; u) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 163 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139; и v) VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 140.
В определенных аспектах изобретения, антитело или его антиген-связывающий фрагмент содержит VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139.
Аффинность связывания (KD) анти-CXCR4 антител или их антиген-связывающих фрагментов, как описано в данном документе, с CXCR4 (такими как человеческие CXCR4) составляет приблизительно 0,002 до приблизительно 200 нМ. В некоторых аспектах изобретения, аффинность связывания составляет приблизительно 200 нМ, приблизительно 100 нМ, приблизительно 50 нМ, приблизительно 45 нМ, приблизительно 40 нМ, приблизительно 35 нМ, приблизительно 30 нМ, приблизительно 25 нМ, приблизительно 20 нМ, приблизительно 15 нМ, приблизительно 10 нМ, приблизительно 8 нМ, приблизительно 7.5 нМ, приблизительно 7 нМ, приблизительно 6,5 нМ, приблизительно 6 нМ, приблизительно 5,5 нМ, приблизительно 5 нМ, приблизительно 4 нМ, приблизительно 3 нМ, приблизительно 2 нМ, приблизительно 1 нМ, приблизительно 500 пМ, приблизительно 100 пМ, приблизительно 60 пМ, приблизительно 50 пМ, приблизительно 20 пМ, приблизительно 15 пМ, приблизительно 10 пМ, приблизительно 5 пМ, или приблизительно 2 пМ. В некоторых аспектах изобретения, аффинность связывания составляет мнее приблизительно 250 нМ, приблизительно 200 нМ, приблизительно 100 нМ, приблизительно 50 нМ, приблизительно 30 нМ, приблизительно 20 нМ, приблизительно 10 нМ, приблизительно 7.5 нМ, приблизительно 7 нМ, приблизительно 6.5 нМ, приблизительно 6 нМ, приблизительно 5 нМ, приблизительно 4.5 нМ, приблизительно 4 нМ, приблизительно 3,5 нМ, приблизительно 3 нМ, приблизительно 2,5 нМ, приблизительно 2 нМ, приблизительно 1,5 нМ, приблизительно 1 нМ, приблизительно 500 пМ, приблизительно 100 пМ, приблизительно 50 пМ, приблизительно 20 пМ, приблизительно 10 пМ, приблизительно 5 пМ, или приблизительно 2 пМ.
В некоторых аспектах изобретения, аффинность связывания (например, связывания моноваленьного антитела) антитела, как описано в данном документе, составляет приблизительно 35 нМ или меньше, что измерено поверхностным плазмонным резонансом. В некоторых аспектах изобретения, аффинность связывания (например, связывания моноваленьного антитела) антитела, как описано в данном документе, составляет приблизительно 6,5 нМ или меньше, что измерено поверхностным плазмонным резонансом.
Изобретение так же относится к способам получения любого из этих антител. Антитела данного изобретения могут быть получены согласно известным в отрасли способам. Полипептиды могут быть получены протеолитическим или другим расщеплением антитела, с помощью рекомбинантных способов (то есть, отдельные или гибридные полипептиды), как описано выше, или с помощью химического синтеза. Полипептиды антител, особенно короткие полипептиды длиной до приблизительно 50 аминокислот, легко получить химическим синтезом. Способы химического синтеза известны в отрасли, и являются коммерчески доступными. Например, антитело может быть получено автоматическим синтезатором полипептидов, используя твердофазный способ. Смотреть так же, патенты США №5,807,715; 4,816,567 и 6,331,415.
В другом аспекте изобретения, антитела могут быть получены рекомбинантно, используя известные в отрасли процедуры. В другом аспекте, полинуклеотид содержит последовательность, кодирующую вариабельные участки тяжелой и/или легкой цепи антитела m6B6, h6B6, m12A11, М2А11, m3G10, h3G10(VH), h3G10.A57, h3G10.B44, h3G10.1.7, h3G10.1.60, h3G10,2,5, h3G10.1,91, h3G10,2.37, h3G10,2.45, h3G10,2.42, h3G10.1.33, h3G10,3.25, h3G10,2,54, h3G10.A59, h3G10.A62, h3G10 (VL), h3G10,2.72, h3G10.A11A, h3G10.A18A, h3G10.A19A, h3G10.A58A, h3G10.A65A, и h3G10.B12A, h3G10.B13A, h3G10.B18A, h3G10.A11B, h3G10.A18B, h3G10.A19B, h3G10.A58B, h3G10.A65B, h3G10.B12B, h3G10.B13B, h3G10.B18B, h3G10,2.25 или h3G10.L94D. последовательность, кодирующую нужное антитело, поддерживают в векторе в клетке хозяине, и затем клетку хозяина можно размножить или заморозить для последующего использования. Векторы (включая векторы экспрессии) и клетки хозяева описаны далее.
Изобретение так же включает scFv антитела данного изобретения. Одноцепочечные фрагменты вариабельного участка получают путем связывания вариабельного участка легкой и/или тяжелой цепи, используя короткий связывающий пептид (Bird et al., Science 242:423-426, 1988). Примером связывающего пептида является (GGGGS)3 (SEQ ID NO: 89), образующий мостик в приблизительно 3,5 нм между карбокси-концом одной вариабельной области и амино-концом другой вариабельной области. Линкеры других последовательностей были созданы и использованы, Bird et al. (1988). Линкеры должны представлять собой короткие гибкие полипептиды, и желательно содержать менее чем приблизительно 20 аминокислотных остатков. Линкеры в свою очередь могут быть модифицированы с целью дополнительных функций, таких как присоединение лекарств или твердых подложек. Одноцепочечные варианты могут быть получены рекомбинантно или искусственно. Для искусственного производства scFv, используют автоматический синтезатор. Для рекомбинантного производства scFv, приемлемый полинуклеотид, содержащий плазмиду, который кодирует scFv, может быть введен в приемлемую клетку хозяина, например, эукариотическую, такую как дрожжевые, растительные клетки, клетки насекомых или млекопитающих, или прокариотическую, амино-конец другого вариабельного участка. Линкеры других последовательностей были разработаны и использованы, Bird et al. (1988). В свою очередь, линкеры могут быть модифицированы для дополнительных функций, таких как присоединение лекарственных средств или присоединение к твердым подложкам. Одноцепочечные варианты могут быть получены либо рекомбинантно, либо синтетически. Для синтетического производства scFv может использоваться автоматизированный синтезатор. Для рекомбинантного продуцирования scFv подходящая плазмида, содержащая полинуклеотид, который кодирует scFv, может быть введена в подходящую клетку-хозяина, либо эукариотическую, такую как дрожжи, растения, насекомые или клетки млекопитающих, или прокариотические, такие как Е. coli. Полинуклеотиды, кодирующие интересующий scFv, могут быть получены путем стандартных манипуляций, таких как лигирование полинуклеотидов. Полученный scFv может быть выделен, используя стандартные техники очистки протеинов.
Другие формы одноцепочечных антител, такие как диатела или минитела так же включены в изобретение. Диатела являются бивалентеными биспецифичными антителами, где домены вариабельного участка тяжелой цепи (VH) и вариабельного участка легкой цепи (VL) экспрессированы в единой полипептидной цепи, но используя линкер, являющийся слишком коротким для образования пар между двумя доменами одной цепи, таким образом, заставляя домены образовывать пары с комплементарными доменами другой цепи, и образуя два сайта связывания антигена (смотреть, например, Holliger, P., et al., Proc. Natl. Acad Sci. USA 90:6444-6448 (1993); Poljak, R.J., et al., Structure 2:1121-1123 (1994)). Минитело включает VL и VH домены нативного антитела, приконденсированные к шарнирному участку и СН3 домену молекулы иммуноглобулина. Смотреть, например, патент США №5,837,821.
Биспецифичное антитело является антителом способным одновременно связываться с двумя разными целями. Биспецифичные антитела (bsAb) и биспецифичные фрагменты антитела (bsFab) могут иметь как минимум одно плечо, которое связывается, например, с опухоль-ассоциированным антигеном, и как минимум одно другое плечо, которое связывается с целевым конъюгатом, несущим терапевтический или диагностический агент. Различные биспецифические гибридные протеины могут быть получены, используя молекулярную инженерию.
Например, биспецифичные антитела, моноклональное антитела, имеющие специфичность связывания с как минимум двумя различными антигенами, могут быть получены, используя антитела, описанные в данном документе. Способы получения биспецифичных антител известны в отрасли (смотреть, например, Suresh et al., Methods in Enzymology 121:210 (1986)). Обычно, рекомбинантное получение биспецифичных антител, основано соэкспрессией двух пар тяжелой-легкой цепей иммуноглобулина с двумя тяжелыми цепями с различной специфичностью (Millstein and Cuello, Nature 305, 537-539 (1983)).
Согласно одному подходу получения биспецифичных антител, вариабельные домены антитела с желаемыми характеристиками связывания (сайты объединения антитело-антиген) приконденсируют к последовательностям константного участка иммуноглобулина. Конденсирование желательно производят с константным участком тяжелой цепи иммуноглобулина, содержащим как минимум часть петли, СН2 и СН3 участки. Желательно чтобы первый константный участок (СН1) тяжелой цепи, содержащий сайт, необходимый для присоединения легкой цепи, присутствовал при как минимум одном конденсировании. ДНК, кодирующие гибридизацию тяжелой цепи иммуноглобулина и, в случае необходимости, легкой цепи иммуноглобулина, вставляют в отдельные векторы экспрессии, и сотрансфецируют в приемлемый организм хозяина. Это делают для большей пластичности при установлении взаимных пропорций трех полипептидных фрагментов в вариантах осуществления, где неравные соотношения трех полипептидных цепей, использованных в конструкции, обеспечивают оптимальный результат. Однако, так же возможно вставить кодирующие последовательности для двух или всех трех полипептидных цепей в один вектор экспрессии, когда экспрессия как минимум двух полипептидных цепей в равном соотношении приводит к высокому выходу, или когда соотношение не имеет особого значения.
В некоторых аспектах изобретения, биспецифические антитела состоят из тяжелой цепи гибридного иммуноглобулина с первой специфичностью связывания в одном плече, и парой легкой-тяжелой цепи гибридного иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Такая ассимметричная структура, с легкой цепью иммуноглобулина только в одной половине биспецифичной молекулы, способствует отделению желаемого биспецифичного соединения от нежелательной комбинации цепей иммуноглобулина. Этот подход описан в РСТ публикации WO 1994/004690.
В другом аспекте, биспецифичные антитела состоят из модификации аминокислоты в первой шарнирной области в одном плече, и замещенная/замененная аминокислота в первой шарнирной области имеет заряд противоположный соответствующей аминокислоте во второй шарнирной области в другом плече. Этот подход описан в РСТ публикации WO 2011/143545.
В другом аспекте, биспецифичные антитела могут быть получены, используя глутамин-содержащий пептидный маркер, сконструированный для антитела, направленного на эпитоп (например, CXCR4) в одном плече, и другой пептидный маркер (например, Lys-содержащий пептидный маркер или реактивный эндогенный Lys), сконструированный для второго антитела, направленного во второй эпитоп в другом плече, в присутствии трансглутаминазы. Этот подход описан в РСТ публикации WO 2012/059882.
Гетероконъюгаты антител, содержащие два ковалентно связанных антитела, так же включены в рамки изобретения. Такие антитела использовали для направления клеток иммунной системы на нежелательные клетки (Патент США №4,676,980), и для лечения ВИЧ инфекции (РСТ публикация WO 1991/000360). Гетероконъюгат антитела может быть получен, используя любые подходящие способы кросс-связывания. Приемлемые агенты кросс-связывания и техники хорошо известны в отрасли, и описаны в патенте США №4,676,980.
Химерные или гибридные антитела так же могут быть получены in vitro, используя известные способы синтеза протеинов, включая способы, использующие кросс-связывающие агенты. Например, иммунотоксины могут быть сконструированы, используя реакцию дисульфидного обмена или путем образования тиоэфрной связи. Примеры приемлемых реагентов для этой цели включают иминотиолат и метил-4-меркаптобутиримидат.
Изобретение включает модификации вариантов антител и полипептидов изобретения, показанные на Таблице 2, включая функционально эквивалентные антитела, значительно не влияющие на их свойства, и варианты с повышенной или сниженной активностью и/или аффинностью. Например, аминокислотную последовательность можно мутировать с получением антитела с желаемой аффинностью связывания с CXCR4. Модифицирование полипептидов является рутинной практикой в отрасли, поэтому нет необходимости детально описывать ее в данном документе. Примеры модифицированных полипептидов включают полипептиды с модификациями консервативных последовательностей. Как указано в данном документе, термин "модификации консервативных последовательностей" относится к модификациям аминокислот, значительно не влияющим или не изменяющим характеристики связывания антитела, содержащего аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замещения, добавления и делеции, значительно не меняющие функциональную активность, или которые развивают (улучшают) аффинность полипептида к его лиганду, или применение химических аналогов.
Модификации могут быть введены в антитело данного описания согласно стандартным способам известным в отрасли, таким как сайт-направленный мутагенез и ПЛР-опосредованный мутагенез. Консервативные аминокислотные замещения являются замещениями, где аминокислотный остаток заменяют аминокислотным остатком с одинаковой боковой цепью. Семейства аминокислотных остатков с одинаковыми боковыми цепями известны в отрасли. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или больше аминокислотных остатков участках CDR антитела данного описания могут быть заменены другими аминокислотными остатками из одного семейства боковых цепей, и измененное антитело можно протестировать на сохранение функции (то есть, функций описанных выше), используя функциональный анализ, описанный в данном документе.
Вставки в аминокислотную последовательность включают амино- и/или карбоксил-терминальные конденсирования длиной в диапазоне от одного остатка до полипептидов, содержащих 100 и более остатков, а так же вставки одного или больше аминокислотных остатков внутри последовательности. Примеры терминальных вставок включают антитело с N-терминальным остатком метионила или антитело, приконденсированное к метке эпитопа. Другие варианты вставок в молекулу антитела включают приконденсирование к N- или С-концу антитела фермента или полипептида, увеличивающего период полураспада антитела в кровяном русле.
Замещенные варианты имеют удаление как минимум одного аминокислотного остатка в молекуле антитела и вставку другого остатка на его место. Сайты для заместительного мутагенеза, представляющие наибольший интерес, включают гипервариабельные участки, но так же включают и FR замены. Консервативные замещения показаны в Таблице 5 под заголовком "консервативные замещения". Если такие замещения приводят к изменению биологической активности, тогда могут быть введены более существенные изменения, под названием "образцовые замещения" в Таблице 5, или как детально описано далее со ссылкой на классы аминокислот, и произведен скрининг продуктов.

Существенные модификации биологических свойств антитела сопровождаются селективными замещениями, значительно отличающимися по их влиянию на поддержание (а) структуры основной цепи полипептида в месте замещения, например, в виде листовой или спиральной конформации, (b) заряда или гидрофобности молекулы в целевом сайте, или (с) размера боковой цепи. Природные аминокислотные остатки делят на группы на основании общих свойств боковой цепи:
(1) Неполярные: Норлейцин, Met, Ala, Val, Leu, Ile;
(2) Полярные без заряда: Cys, Ser, Thr, Asn, Gin;
(3) Кислотные (негативно заряженные): Asp, Glu;
(4) Основные (позитивно заряженные): Lys, Arg;
(5) Остатки, влияющие на пространственное расположение цепи: Gly, Pro; и
(6) Ароматические: Trp, Tyr, Phe, His.
Неконсервативные замещения осуществляют заменой члена одного из указанных классов на члена другого класса.
Любой остаток цистеина, который не принимает участие в поддержании надлежащей конформации антитела, так же может быть замещен, в основном серином, с целью улучшения окислительной стабильности молекулы и предупреждения аномального кросс-связывания. В свою очередь, цистеиновую связь(и) можно добавить в антитело с целью улучшения его стабильности, а именно, когда антитело представлено фрагментом антитела, таким как Fv фрагмент.
Аминокислотные модификации могут варьировать от замены или модификации одной или больше аминокислоты до полного перепроектирования участка, такого как вариабельный участок. Изменения в вариабельном участке могут изменить аффинность связывания и/или специфичность. В некоторых аспектах изобретения, в CDR домене осуществляют не более 1-5 консервативных аминокислотных замещений. В других аспектах изобретения, в CDR домене осуществляют не более 1-3 консервативных аминокислотных замещений.
Модификации так же могут включать гликозилированные и негликозилированные полипептиды, а так же полипептиды с другими пост-трансляционными модификациями, такими как, например, гликозиллирование с различными сахарами, ацетилирование и фосфорилирование. Антитела гликозилируют в консервативных положениях в константных участках (Jefferis and Lund, Chem. Immunol. 65:111-128 (1997); Wright and Morrison, TibTECH 15:26-32 (1997)). Олигосахариды боковых цепей иммуноглобулинов негативно влияют на функцию протеинов (Boyd et al., Mol. Immunol. 32:1311-1318 (1996); Wittwe and Howard, Biochem. 29:4175-4180 (1990)) и внутримолекулярное взаимодействие между частями гликопротеина, что может повредить конформацию и трехмерную поверхность гликопротеина (Jefferis and Lund, supra; Wyss and Wagner, Current Opin. Biotech. 7:409-416 (1996)). Олигосахариды так же могут направлять конкретный гликопротеин к определенным молекулам на основании специфичных структур распознавания. Гликозилирование антитела так же негативно влияет на антитело-зависимую клеточную цитотоксичность (ADCC). А именно, СНО клетки с тетрациклин-регулируемой экспрессией β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), гликозилтрансфераза, катализирующая образование GlcNAc в точках ветвления, имеют улучшенную активность ADCC (Umana et al., Mature Biotech. 17:176-180 (1999)).
Гликозилирование антитела обычно является N-связанным или О-связанным. N-связанное относится к присоединению углеводородного остатка к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин, аспарагин-Х-треонин, и аспарагин-Х-цистеин, где X является любой аминокислотой кроме пролина, являются последоватеьностями распознавания для ферментативного присоединения углеводородного остатка к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, обычно серину или треонину, хотя так же используют 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу сопровождается заменой в аминокислотной последовательности, так что она содержит одну или больше из вышеописанных трипептидных последовательностей (для N-связанных сайтов гликозилирования). Замена может так же осуществляться добавлением или замещением одного или больше остатков серина или треонина к последовательности исходного антитела (для O-связанных сайтов гликозилирования).
Схема гликозилирования антитела так же может быть изменена без изменения основной нуклеотидной последовательности. Гликозилирование сильно зависит от клетки хозяина, используемой для экспрессии антитела. В виду того, что тип клетки, используемой для экпрессии рекомбинантных гликопротеинов, например, антител в качестве потенциальных терапевтических средств, редко является нативным, можно ожидать вариаций в схеме гликозилирования антитела (смотреть, например, Hse et al., J. Biol. Chem. 272:9062-9070 (1997)).
Кроме выбора клеток хозяев, факторы, влияющие на гликозилирование на протяжении рекомбинантного получения антитела, включают вид роста, композиция среды, плотность культуры, насыщение кислородом, pH, схемы очистки и т.д. Были предложены различные способы изменения схемы гликозилирования в конкретном организме хозяине, включая введение или надэкспрессию определенных ферментов, которые принимают участие в выработке олигосахарида (Патенты США №5,047,335; 5,510,261 и 5,278,299). Гликозилирование или определенные виды гликозилирования могут быть ферментативно удалены из гликопротеина, например, используя эндогликозидазу Н (Эндо Н), N-гликозидазу F, эндогликозидазу F1, эндогликозидазу F2, эндогликозидазу F3. Кроме того, рекомбинантную клетку хозяина можно генетически сконструировать так, чтобы она не могла процессировать определенные виды полисахаридов. Эти и подобные техники хорошо известны в отрасли.
Другой модификацией антитела, включенной в данное описание, является пегилирование, например, с целью увеличения биологического (например, сывороточного) периода полураспада антитела. Для пегилирования антитела, антитело или его фрагмент обычно поддают взаимодействию с полиэтиленгликолем (PEG), например, реактивным сложным эфиром или альдегидной производной PEG, в условиях где одна или больше групп PEG присоединяются к антителу или его фрагменту. Желательно, пегилирование осуществляют с помощью реакции ацилирования или алкилирования с реактивной молекулой PEG (или аналогичным реактивным водорастворимым полимером). Как указано в данном документе, термин "полиэтиленгликоль" включает любые формы PEG, использованный для дериватизации других протеинов, таких как моно (CI-CIO) алкокси- или арилокси-полиэтиленгликоль или полиэтиленгликоль-малеимид. В определенных аспектах изобретения, антитело, которое пегилируют, является агликозилированным антителом. Способы пегилирования протеинов известны в отрасли и могут применяться к антителам данного описания. Смотреть, например, ЕР 0154316 by Nishimura et al., и EP 0401384 by Ishikawa el al.
Данное изобретение не ограничено традиционными антителами и включает применение фрашментов антител и миметиков антител. Были разработаны различные технологии фрагментов антител и миметиков антител, и они известны в отрасли. В то время как эти технологии, такие как доменные антитела, нанотела и унитела используют фрагменты или другие модификации традиционных структур антител, так же существуют и альтернативные технологии, такие как аффитела, DARРины, авимеры, антикалины и версатела, применяющие связывающие структуры, которые хотя иммитируют традиционное связывание антитела, генерируются и функционируют согласно друх механизмов.
Доменные антитела (dAbs) являются наименьшими функциональными единицами связывания антитела, которые соответствуют вариабельным участкам тяжелой (VH) или легкой (VL) цепи человеческих антител. Компания Domantis разработала серии больших и высокофункциональных библиотек полностью человеческих VH и VL dAbs (более 10 миллиардов различных последовательностей в каждой библиотеке), и использует эти библиотеки для отбора dAbs, специфичных к терапевтическим мишеням. В отличии от многочисленных обычных антител, доменные антитела хорошо экспрессируются в бактериальных, дрожжевых клеточных системах и клеточных системах млекопитающих. Детали доменных антител и способы их получения модно найти в патентах США №6,291,158, 6,582,915, 6,593,081, 6,172,197 и 6,696,245, патентной заявке США №2004/0110941, европейской патентной заявке №1433846 и европейских патентах №0368684 и 0616640, WO 05/035572, WO 04/101790, WO 04/081026, WO 04/058821, WO 04/003019 и WO 03/002609, включенных с помощью ссылок.
Нанотела представляют собой терапевтические протеины, происходящие от антител, которые имеют уникальные структурные и функциональные свойства цепи антител, состоящих из тяжелых цепей. Эти антитела, состоящие из тяжелых цепей, содержат один вариабельный домен (VHH) и два константных домена (СН2 и СН3). Клонированный и выделенный VHH домен является идеально подходящим полипептидом, имеющим антигенсвязывающую способность исходного антитела, состоящего из тяжелых цепей. Нанотела имеют высокую гомологию с VH доменами человеческих антител, и может быть гуманизировано без потери активности. Более того, нанотела объединяют преимущества обычных антител с важными свойствами низкомолекулярных лекарств. Нанотела показывают высокую специфичность к мишени, высокую аффинность к мишени и низкую присущую токсичность. Нанотела кодируются моногенами и эффективно продуцируются в большинстве прокариотических и эукариотических хозяев, например, Е. coli (смотреть, например, Патент США №6,765,087, включенный с помощью ссылок), плесневые грибы (например, Aspergillus или  ) и дрожжи (например, Saccharomyces, Kluyveromyces, Hansenula или Pichia) (смотреть, например, Патент США №6,838,254, включенный с помощью ссылок).
) и дрожжи (например, Saccharomyces, Kluyveromyces, Hansenula или Pichia) (смотреть, например, Патент США №6,838,254, включенный с помощью ссылок).
В некоторых аспектах, данное изобретение касается применения унител. Унитела являются другой технологий фрагментов антител, основанной на удалении шарнирной области IgG4 антитела. Удаление шарнирной области приводит к получению молекулы, имеющей половину размера обычного IgG4 антитела, и имеющей одновалентный связывающий участок, в отличии от бивалентного связывающего участка IgG4 антитела. Так же известно, что IgG4 антитела являются инертными, и таким образом не взаимодействуют с иммунной системой, что может иметь преимущества для лечения заболеваний, при которых иммунный ответ не желателен. Например, унитела могут ингибировать или заглушать, но не убивать клетки, с которыми они связаны. Кроме этого, унитело, связанное с раковыми клетками, не стимулирует их пролиферацию. Более того, благодаря тому, что унитела имеют половину размера обычного IgG4 антитела, они проявляют лучшее распределение в больших солидных опухолях с потенциально лучшей эффективностью. Унитела выводяться из организма с такой же скоростью, что и IgG4 антитела, и могут связываться с одинаковой аффинностью с такими же антигенами, что и целые антитела. Более детальное описание унител можно найти в РСТ публикации WO 2007/059782, включенной с помощью ссылок.
В некоторых аспектах, данное изобретение включает молекулы афител. Молекулы афител являются новым классом аффинных протеинов, основанных на домене протеина из 58-аминокислотных остатков, имеющих происхождение от одного из IgG-связывающих доменов стафиллококового Протеина А. Этот трех-спиральный свернутый домен использовали в качестве каркаса для конструирования комбинаторных фагмидных библиотек, из которых выбирают аффитела, направленные на желаемые молекулы, с использованием технологии отображения фага (Nord K, Gunnettsson Е, Ringdahl J, Stahl S, Uhlen M, Nygren PA, Binding Proteins selected from combinatorial libraries of an α-helical bacterial receptor domain, Nat Biotechnol 15 772-7 (1997), RonMark J, Gronlund H, Uhlen M, Nygren PA, Human Immunoglobuline A (IgA)-specific ligands from combinatorial engineering of Protein A, Eur J Biochem., 269 2647-55 (2002)). Простая устойчивая структура молекул аффитела в комбинации с маленькой молекулярной массой (6 кДа), делает их приемлемыми для многочисленных применений, например, в качестве выявляемых реагентов (RoHMark J, Hansson М, Nguyen Т, et al, Construction and characterization of affibody-Fc chimeras produced in Escherichia coli, J Immunol Methods, 261 199-211 (2002)) и для ингибирования рецепторных взаимодействий (Sandstorm K, Xu Z, Forsberg G, Nygren PA, Inhibition of the CD28-CD80 со- stimulation signal by a CD28-binding Affibody ligand developed by combinatorial Protein engineering, Protein Eng., 16 691-7 (2003)). Детальное описание аффител и способов их получения можно найти в патенте США №5,831,012, включенном с помощью ссылок.
Другой технологией копирования антител, приемлемой в контексте данного изобретения, являются авимеры. Авимеры выделяют из большого семейства человеческих внеклеточных рецепторных доменов путем перемешивания экзонов in vitro и фагового отображения, образуя многодоменные протеины со связывающими и ингибирующими свойствами. Связывание многочисленных независимых доменов связывания создает авидность и приводит к улучшенной аффинности и специфичности, по сравнению с обычными одно-эпитоп связывающими протеинами. Другие потенциальные преимущества включают простую и эффективную выработку многоцелевых специфичных молекул в Escherichia coli, улучшенную термостабильность и резистентность к протеазам. Были получены авимеры с суб-наномолярной аффинностью к многичесленным мишеням. Дополнительную информацию касательно авимеров можно найти в патентных заявках США №2006/0286603, 2006/0234299, 2006/02231 14, 2006/0177831, 2006/0008844, 2005/0221384, 2005/0164301, 2005/0089932, 2005/0053973, 2005/0048512, 2004/0175756, включенных с помощью ссылок.
Версатела являются другим видом технологии копирования антител, которую можно использовать в контексте данного изобретения. Версатела являются маленькими протеинами массой 3-5 кДа с>15% цистеина, образующими каркас с высокой плотностью дисульфидов, заменяющий гидрофобное ядро, которое обычно содержат протеины. Замена большого количества гидрофобных аминокислот, содержащих гидрофобное ядро, небольшим количеством дисульфидов приводит к получению протеина меньшего размера и более гидрофильного (меньше агрегации и неспецифическое связывание), более резистентного к протеазам и теплу, и имеющего меньшую плотность Т-клеточных эпитопов, благодаря тому, что остатки, принимающие наибольшее участие в презентации МНС, являются гидрофобными. Известно, что все эти свойства влияют на иммуногенность, и вместе они вызывают значительное снижение иммуногенности. Дополнительную информацию касательно версател можно найти в патентной заявке РСТ 2007/0191272, включенной с помощью ссылок.
Детальное описание технологий фрагментов антитела и копирования антитела, приведенное выше, не является исчерпывающим перечнем технологий, которые можно использовать в контексте данного описания. Например, и так же не ограничиваясь указанным, множество дополнительных технологий, включая альтернативные полипептидные технологии, такие как гибридизация участков определения комплементарности, описано в Qui et al., Nature Biotechnology, 25(8) 921-929 (2007), включенной с помощью ссылки, а так же технологии на основе нуклеиновых кислот, такие как технология РНК аптамера, описанная в патентах США №5,789,157; 5,864,026; 5,712,375; 5,763,566; 6,013,443; 6,376,474; 6,613,526; 6,114,120; 6,261,774 и 6,387,620, включенных с помощью ссылок, могут быть использованы в контексте данного изобретения.
Другие способы модифицтрования включают использование известных в отрасли техник сопряжения, включая, но не ограничиваясь следующими: ферментативные средства, окислительное замещение и хелатирование. Модификации могут быть использованы, например, для присоединения меток для иммуноанализа. Модифицированные полипептиды получают, используя установленные процедуры, и поддают скринингу, используя стандартные анализы, некоторые из которых описаны ниже в Примерах.
В некоторых аспектах изобретения, антитело содержащее модифицированный константный участок, такой как константный участок с повышенной аффинностью к человеческому Fc гамма рецептору, является иммунологически инертным или частично инертным, например, не вызывает комплемент-опосредованного лизиса, не стимулирует антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC), или не активирует макрофаги; или имеет сниженную активность (по сравнению с немодифицированным антителом) в одном из следующих действий: вызывание комплемент-опосредованного лизиса, стимулирование антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC), или активирование микроглии. Различные модификации константного участка могут быть использованы для достижения оптимального уровня и/или комбинации эффекторных функций. Смотреть, например, Morgan et al., Immunology 86:319-324 (1995); Lund et al., J. Immunology 157:4963-9 157:4963-4969 (1996); Idusogie et al., J. Immunology 164:4178-4184, (2000); Tao et al., J. Immunology 143: 2595-2601 (1989); and Jefferis et al., Immunological Reviews 163:59-76 (1998). В некоторых аспектах изобретения, константный участок модифицируют как описано в Eur. J. Immunol., 29:2613-2624(1999); РСТ публикации WO 1999/058572. В других аспектах изобретения, антитело содержит константный участок тяжелой цепи человеческого IgG2, содержащий следующие мутации: А330Р331 - S330S331 (нумерация аминокислот со ссылкой на последовательность дикого типа IgG2). Eur. J. Immunol., 29:2613-2624 (1999). В других аспектах изобретения, константный участок является агликозилированным для N-связанного гликозилирования. В некоторых аспектах изобретения, константный участок агликозилирован для N-связанного гликозилирования с помощью мутирования гликозилированного аминокислотного остатка или фланкирующих остатков, являющихся частью последовательности распознавания N-гликозилирования в константном участке. Например, сайт N-гликозилирования N297 может быть мутирован на A, Q, K или Н. Смотреть, Tao et al., J. Immunology 143: 2595-2601 (1989); and Jefferis et al., Immunological Reviews 163:59-76 (1998). В некоторых аспектах изобретения, константный участок агликозилирован для N-связанного гликозилирования. Константный участок агликозилирован для N-связанного гликозилирования ферментативно (например, удалением углевода ферментом PNGазой), или экспрессией в клетке хозяине, дефицитной к гликозилированию.
Другие модификации антитела включают антитела модифицированные как описано в РСТ публикации WO 99/58572. Эти антитела включают, кроме домена связывания, направленного на молекулу мишень, эффекторный домен с аминокислотной последовательностью по сути гомологичной всему или части константного участка тяжелой цепи человеческого иммуноглобулина. Эти антитела способны связывать молекулу мишень не вызывая комплемент-зависимого лизиса или клеточно-опосредованного разрушения мишени. В некоторых аспектах изобретения, эффекторный домен способен специфично связывать FcRn и/или FcyRIIb. Эти рецепторы обычно основаны на гибридных доменах, происходящих от двух или больше CH2 доменов тяжелой цепи человеческого иммуноглобулина. Антитела, модифицированные таким образом являются приемлемыми для применения в хронической терапии антителами, с целью избежания воспалительных и других побочных реакций на терапию обычными антителами.
Изобретение включает антитела с созревшей аффинностью. Например, антитела с созревшей аффинностью могут быть получены согласно известным в отрасли способам (Marks et al., Bio/Technology, 10:779-783 (1992); Barbas et al., Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al., Gene, 169:147-155 (1995); Yelton et al., J. Immunol., 155:1994-2004 (1995); Jackson etal., J. Immunol., 154(7):3310-9 (1995), Hawkins et al., J. Mol. Biol., 226:889-896 (1992); и PCT публикации WO 2004/058184).
Следующие способы могут быть использованы для установления аффинности антитела и для характеристики CDR. Одним из способов характеристики CDR антитела и/или изменения (например, улучшения) аффинности связывания полипептида, такого как антитело, является "мутагенез сканирующий библиотеку". Обычно, мутагенез сканирующий библиотеку работает следующим образом. Одно или больше аминокислотных положений в CDR заменяют двумя или больше (например, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20) аминокислотами, используя известные в отрасли техники. Это дает маленькие библиотеки клонов (в некоторых аспектах изобретения, одну для каждого анализируемого аминокислотного положения), каждую с комплектацией в два или больше членов (если замещено две или больше аминокислоты в каждом положении). Обычно, библиотека так же включает клона, содержащего нативную (незамещенную) аминокислоту. Небольшое количество клонов, например, приблизительно 20-80 клонов (в зависимости от сложности библиотеки), из каждой библиотеки поддают скринингу на аффинность связывания с целевым полипептидом (или другой мишенью связывания), и идентифицируют кандидатов с повышенным, неизменным, пониженным связыванием или с отсутствием связывания. Способы определения аффинности связывания хорошо известны в отрасли. Аффинность связывания может быть определена, используя анализ поверхностного плазмонного резонанса Biacore™, который выявляет различия в аффинности связывания в приблизительно 2-раза или больше. Biacore™ особенно приемлем, когда исходное антитело уже связывается с относительно высокой аффинностью, например, KD приблизительно 10 нМ или меньше. Скрининг с применением поверхностного плазмонного резонанса Biacore™ описан в Примерах.
В другом аспекте, изобретение относится к антителу или его антиген-связывающиему фрагменту, которое связывает CXCR4, где антитело или его антиген-связывающий фрагмент имеет ЕС50 менее чем 100 нМ. В другом аспекте, изобретение относится к антителу или его антиген-связывающему фрагменту, которое связывает CXCR4, где антитело или его антиген-связывающий фрагмент имеет ЕС50 менее чем 50 нМ. В другом аспекте, изобретение относится к антителу или его антиген-связывающему фрагменту, которое связывает CXCR4, где антитело или его антиген-связывающий фрагмент имеет ЕС50 менее чем 1 нМ. Термин "ЕС50" означает концентрацию исследуемого антитела, его антиген-связывающего фрагмента или конъюгата антитело-лекарство, необходимую для 50% ингибирования его максимального эффекта in vitro. Термин "IC50" означает "ингибирующую концентрацию в 50%"
Аффинность связывания может быть определена, используя Kinexa Biocensor, сцинтилляционный анализ сближения, ELISA, ORIGEN иммуноанализ (IGEN), гашение флуоресценции, трансфер флуоресценции и/или отображение дрожжей. Аффинность связывания так же может поддаваться скринингу, используя приемлемый биоанализ.
В некоторых аспектах изобретения, каждое аминокислотное положение в CDR заменено (в некоторых вариантах осуществления, по очереди) всеми 20 природными аминокислотами, используя известные способы мутагенеза (некоторые из которых описаны в данном документе). Это дает маленькие библиотеки клонов (в некоторых аспектах изобретения, одну для каждого анализируемого аминокислотного положения), каждую комплектностью в 20 членов (при замещении всех 20 аминокислот в каждом положении).
В некоторых аспектах изобретения, библиотека, которую поддают скринингу, содержит замещения в двух или больше положениях, которые могут находиться в одном CDR или в двух или больше CDR. Таким образом, библиотека может содержать замещения в двух или больше положениях в одном CDR. Библиотека может содержать замещения в двух или больше положениях в двух или больше CDR. Библиотека может содержать замещения в 3, 4, 5 или больше положениях, где указанные положения находятся в двух, трех, четырех, пяти или шести CDR. Замещение осуществляют, используя кодоны с низкой избыточностью. Смотреть, например, Таблицу 2 в Balint et al., Gene 137(1):109-18(1993).
CDR может быть представлена CDRH3 и/или CDRL3. CDR может означать одну или больше CDRL1, CDRL2, CDRL3, CDRH1, CDRH2 и/или CDRH3. CDR может означать Kabat CDR, Chothia CDR или удлиненную CDR.
Кандидаты с улучшенным связыванием могут быть секвенированы, таким образом, идентифицируя заместительного мутанта CDR, который приводит к улучшенной аффинности (так же называют "улучшенное" замещение). Так же могут быть секвенированы кандидаты, которые связываются, таким образом, идентифицируя замещение CDR, которое сохраняет связывание.
Могут быть осуществлены многочисленные циклы скрининга. Например, кандидаты (каждый содержит аминокислотное замещение в одном или больше положениях одной или больше CDR) с улучшенным связыванием так же приемлемы для конструирования второй библиотеки, содержащей как минимум исходную и замещенную аминокислоту в каждом улучшенном положении CDR (то есть, аминокислотном положении в CDR, в котором заместительный мутант показал улучшенное связывание). Получение и скрининг или отбор такой библиотеки описаны далее.
Сканирующий мутагенез библиотеки также обеспечивает средствами для характеризации CDR, в виду того что частота клонов с улучшенным связыванием, одинаковым связыванием, пониженным связыванием или отсутствием связывания, так же предоставляет информацию касательно важности каждого аминокислотного положения для стабильности комплекса антитело-антиген. Например, если положение в CDR сохраняет связывание при замене на все 20 аминокислот, то положение идентифицируют как положение, которое навряд ли необходимо для связывания антигена. Наоборот, если положение в CDR сохраняет связывание только при небольшом проценте замещений, то положение идентифицируют как положение, которое важно для функционирования CDR. Таким образом, сканирующий мутагенез библиотеки дает информацию касательно положений в CDR, которые могут быть заменены на много различных аминокислот (включая все 20 аминокислот), и положений в CDR, которые не могут быть заменены, или которые могут быть заменены только несколькими аминокислотами.
Кандидаты с улучшенной аффинностью могут быть объединены во вторую библиотеку, которая содержит улучшенную аминокислоту, исходную аминокислоту в положении, и также может содержать дополнительные замещения в положении, в зависимости от сложности желаемой библиотеки, или позволяет использовать желаемый метод скрининга или отбора. Кроме того, по желанию, прилегающее аминокислотное положение может быть рандомизировано до как минимум двух или больше аминокислот. Рандомизация прилежащей аминокислоты может дать дополнительную конформационную пластичность в мутантной CDR, которая в свою очередь, позволяет или способствует введению большого количества улучшенных мутаций. Библиотека так же может включать замещение в положениях, которые не показали улучшенную аффинность в первом круге скрининга.
Вторую библиотеку поддают скринингу или отбору на членов библиотеки с улучшенной и/или измененной аффинностью связывания, используя любой известный в отрасли способ, включая скрининг с использованием поверхностного плазмонного резонанса Biacore™, и отбор с использованием любого известного в отрасли способа, включая фаговое отображение, дрожжевое отображение и рибосомное отображение.
Изобретение так же включает гибридные протеины, содержащие один или больше фрагментов или участков антител данного изобретения. В некоторых аспектах изобретения, получают гибридный полипептид, содержащий как минимум 10 смежных аминокислот участка VH цепи с последовательностью SEQ ID NO: 1, 5, 9, 13, 17, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 85, 87 и 106; и/или как минимум 10 аминокислот участка VL с последовательностью SEQ ID NO: 3, 7, 11, 15, 19, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83 и 169. В разных аспектах изобретения, получают гибридный полипептид, содержащий как минимум приблизительно 10, как минимум приблизительно 15, как минимум приблизительно 20, как минимум приблизительно 25, или как минимум приблизительно 30 смежных аминокислот вариабельного участка легкой цепи и/или как минимум приблизительно 10, как минимум приблизительно 15, как минимум приблизительно 20, как минимум приблизительно 25, или как минимум приблизительно 30 смежных аминокислот вариабельного участка тяжелой цепи. В другом аспекте, гибридный полипептид содержит вариабельный участок легкой цепи и/или вариабельный участок тяжелой цепи, как показано в любой из пар последовательностей в Таблице 2. Например, SEQ ID NO: 3 и 5; 3 и 9; 7 и 5; 11 и 13; 15 и 13; 19 и 17; 69 и 31; 49 и 37; и, 33 и 73. В некоторых аспектах, гибридный полипептид содержит одну или больше CDR. В других аспектах, гибридный полипептид содержит CDR Н3 (VH CDR3) и/или CDR L3 (VL CDR3). Для целей данного изобретения, гибридный протеин одно или больше антител и другую аминокислотную последовательность, к которой он не присоединен в нативной молекуле, например, гетерологичную последовательность или гомологичную последовательность из другого участка. Примеры гетерологичных последовательностей включают, но не ограничиваются следующими: "метка" такая как FLAG метка или 6His метка. Метки хорошо известны в отрасли.
Гибридный полипептид может быть получен любыми известными способами, например, искусственно или рекомбинантно. Обычно, гибридные протеины данного изобретения получают путем экспрессирования полинуклеотида, кодирующего их, используя рекомбинантные способы, описанные в данном документе, хотя они так же могут быть получены другими известными способами, включая, например, химический синтез.
Данное изобретение так же касается композиций, содержащих антитела, конъюгированные (например, связанные) с агентом, способствующим сцеплению с твердой подложкой (например, биотин или авидин). Для упрощения, ссылаются обычно на антитела понимая то, что эти способы применяют к любым анти-CXCR4 антителам или их антиген-связывающим фрагментам, описанным в вариантах осуществления. Конъюгация в целом относится к связыванию этих компонентов, как описано в данном документе. Связывание (которое обычно подразумевает закрепление этих компонентов в тесной ассоциации как минимум для введения) осуществляют любым способом. Например, прямая реакция между агентом и антителом возможна, когда каждый имеет заместитель, способный реагировать с другим. Например, нуклеофильная группа, такая как амино или сульфгидрильная группа, на одном может реагировать с карбонил-содержащей группой, такой как ангидрид или кислотный галид, или с алкильной группой, содержащей отходящую группу (например, галид) на другом.
Изобретение так же относится к изолированным полинуклеотидам, кодирующим антитела изобретения, и векторам и клеткам хозяевам, содержащим полинуклеотид.
Соответственно, изобретение касается полинуклеотидов (или композиций, включая фармацевтические композиции), содержащих полинуклеотиды, кодирующие любую из следующих: m6B6, h6B6, m12A11, h12A11, m3G10, h3G10, h3G10.A57, h3G10.B44, h3G10.1.7, h3G10.1.60, h3G10,2,5, h3G10.1,91, h3G10,2.37, h3G10,2.45, h3G10,2.42, h3G10.1.33, h3G10,3.25, h3G10, h3G10,2.72, h3G10.A11A, h3G10.A18A, h3G10.A19A, h3G10.A58A, h3G10.A65A, и h3G10.B12A, h3G10.B13A, h3G10.B18A, h3G10.A11B, h3G10.A18B, h3G10.A19B, h3G10.A58B, h3G10.A65B, h3G10.B12B, h3G10.B13B, h3G10.B18B, h3G10,2.25, h3G10.A59 h3G10.A62, h3G10.L94D, или любой их фрагмент или часть, имеющих способность связывать CXCR4.
В некоторых аспектах, изобретение касается полинуклеотидов, кодирующих любое антитело (включая фрагменты антитела) и полипептиды, описанные в данном документе, например, антитела и полипептиды с ухудшенной или улучшенной эффекторной функцией. Полинуклеотиды могут быть получены и экспрессированы с помощью известных техник.
В других аспектах, изобретение касается композиций (таких как фармацевтические композиции), содержащих любые полинуклеотиды изобретения. В некоторых аспектах, композиция содержит вектор экспрессии, содержащий полинуклеотид, кодирующий любое антитело, описанное в данном документе. Например, композиция содержит один из или оба полинуклеотидов с последовательность SEQ ID NO: 2 и 4, или SEQ ID NO: 6 и 8, или SEQ ID NO: 86 и 68.
Векторы экспрессии и введение полинуклеотидных композиций описано далее.
В других аспектах, изобретение касается способа получения любых полинуклеотидов, описанных в данном документе.
Полинуклеотиды комплементарные любой такой последовательности, так же включены в данное изобретение. Полинуклеотиды могут быть односпиральными (кодирующие или антисмысловые) или двухспиральными, и могут быть представлены ДНК (геномной, кДНК или искусственной) или молекулами РНК. Молекулы РНК включают молекулы HnPHK, содержащие интроны и соответствующие молекуле ДНК один к одному, и молекулы мРНК, не содержащие интроны. Дополнительные кодирующие или некодирующие последовательности могут, но не обязательно, присутствовать в полинуклеотиде данного изобретения, и полинуклеотид может, но не обязательно, быть связан с другими молекулами и/или вспомогательными материалами.
Полинуклеотиды могут содержать нативную последовательность (то есть, эндогенную последовательность, кодирующую антитело или его часть) или может содержать вариант такой последовательности. Варианты полинуклеотида содержат одно или больше замещений, добавлений, делеций и/или вставок, так что не ослабляется иммунореактивность кодируемого полипептида, по сравнению с нативной иммунореактивной молекулой. Влияние на иммунореактивность кодируемого полипептида обычно оценивают, как описано в данном документе. Варианты желательно проявляют как минимум приблизительно 70% идентичности, более желательно как минимум приблизительно 80% идентичности, более желательно как минимум приблизительно 90% идентичности, и наиболее желательно как минимум приблизительно 95% идентичности к полинуклеотидной последовательности, кодирующей нативное антитело или его часть.
Два полинуклеотида или полипептидных последовательности являются "идентичными", если последовательность нуклеотидов или аминокислот в двух последовательностях является одинаковой, при выравнивании на максимальное соответствие, как описано ниже. Сравнение двух последовательностей обычно осуществляют путем сравнения последовательностей в окне сравнения, с целью идентификации и сравнения локальных участков схожести последовательности. "Окно сравнения», как указано в данном документе, относится к сегменту, состоящему из как минимум приблизительно 20 смежных положений, обычно от 30 до приблизительно 75, или от 40 до приблизительно 50, где последовательность, по сравнению со сравниваемой последовательностью, может иметь одинаковое количество смежных положений, после оптимального выравнивания двух последовательностей.
Оптимальное выравнивание последовательностей для сравнения осуществляют, используя программу Megalign в программном обеспечении Lasergene suite of bioinformatics software (DNASTAR, Inc., Madison, WI), используя параметры по умолчанию. Эта программа включает несколько схем выравнивания, описанных в следующих ссылках: Dayhoff, М.О., 1978, A model of evolutionary change in Proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to AlignMent and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., CABIOS 5:151-153 (1989); Myers, E.W. and Muller W., CABIOS 4:11-17 (1988); Robinson, E.D., Comb. Theor. 11:105 (1971); Santou, N, Nes, M., Mol. Biol. Evol. 4:406-425 (1987); Sneath, P.H.A. and Sokal, R.R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and LipMan, D.J., Proc. Natl. Acad. Sci. USA 80:726-730 (1983).
Желательно, "процент идентичности последовательности" определяют путем сравнения двух оптимально выравненных последовательностей в окне сравнения из как минимум 20 положений, где часть полинуклеотидной или полипептидной последовательности в окне сравнения могут содержать добавления или делеции (то есть, гэпы) составляющие 20% или меньше, обычно 5-15%, или 10-12%, по сравнению со сравниваемыми последовательностями (которые не содержат добавлений или делеций), для оптимального выравнивания двух последовательностей. Процент рассчитывают путем определения количества положений, в которых идентичные основы нуклеиновых кислот или остатки аминокислот выявляются в обоих последовательностях, получая количество совпадающих положений, затем количество совпадающих положений делят на общее количество положений в сравниваемой последовательности (то есть, размер окна) и умножают результат на 100, получая процент идентичности последовательности.
Варианты так же могут, или альтернативно, быть по сути гомологичными нативному гену или его части или комплементу. Такие полинуклеотидные варианты способны к гибридизации в умеренно жестких условиях с природной последовательностью ДНК, кодирующей нативное антитело (или комплементарной последовательностью).
Приемлемые "умеренно жесткие условия" включают предварительное промывание в растворе 5 X SSC, 0,5% SDS, 1,0 мМ EDTA (pH 8,0); гибридизацию при 50°C-65°C, 5 X SSC, на протяжении ночи; затем двойное промывание при 65°C на протяжении 20 мин. каждым из 2Х, 0,5Х и 0,2Х SSC, содержащим 0,1% SDS.
Как указано в данном документе, "сильно жесткие условия" или "условия сильной жесткости" включают: (1) применение промывания низкой ионной силы и высокой температуры, например, 0,015 М хлорид натрия / 0,0015 М цитрат натрия / 0,1% додецилсульфат натрия при 50°C; (2) применение на протяжении гибридизации денатурирующего агента, такого как формамид, например, 50% (о/о) формамид с 0,1% альбумином сыворотки быка /0,1% Ficoll/ 0,1% поливинилпирролидон / 50 мМ буфер фосфата натрия при pH 6,5 с 750 мМ хлоридом натрия, 75 мМ цитратом натрия при 42°C; или (3) применение 50% формамида, 5 x SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфата натрия (pH 6,8), 0,1% пирофосфата натрия, 5 x раствор Денхардта, подвергнутая действию ультразвука ДНК спермы лосося (50 мкг/мл), 0,1% SDS, и 10% сульфата декстрана при 42°C, с промываниями при 42°C в 0,2 x SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55°C, затем промывание в сильно жестких условиях, содержащее 0,1 x SSC, включающий EDTA, при 55°C. Специалисту в отрасли понятно кА подобрать температуру, ионную силу и т.д., необходимые для удовлетворения факторам, таким как длина измерительного сенсора и т.д.
Специалистам в отрасли понятно, что в результате дегенеративности генетического кода, существует множество нуклеотидных последовательностей, кодирующих полипептид, как описано в данном документе. Некоторые из этих полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью любого нативного гена. Тем не менее, полинуклеотиды, отличающиеся в следствии различий в использовании кодона, отдельно рассматриваются в данном изобретении. Так же, аллели генов, содержащих полинуклеотидные последовательности, приведенные в данном документе, включены в объем данного изобретения. Аллели являются эндогенными генами, измененными в результате одной или больше мутаций, таких как делеции, добавления и/или замещения нуклеотидов. Полученная мРНК и протеин могут, но не обязательно, иметь измененную структуру или функцию. Аллели могут быть идентифицированы с использованием стандартных техник (таких как гибридизация, амплификация и/или сравнение последовательностей базы данных).
Полинуклеотиды данного изобретения могут быть получены с использованием химического синтеза, рекомбинантных способов или ПЦР. Способы химического синтеза полинуклеотидов хорошо известны в отрасли, и нет необходимости в их детальном описании. Специалист в отрасли может использовать последовательности, описанные в данном документе, и коммерческий синтезатор ДНК для получения желаемой последовательности ДНК.
Для получения полинуклеотидов с использованием рекомбинантных способов, полинуклеотид, содержащий желаемую последовательность, может быть вставлен в приемлемый вектор, и вектор в свою очередь может быть введен в приемлемую клетку хозяина для репликации и амплификации, как далее описано в данном документе. Полинуклеотиды могут быть введены в клетки хозяева любым известным способом. Клетки трансформируют введением экзогенного полинуклеотида путем прямого захвата, эндоцитоза, трансфекции, F-спаривания или электропорации. После введения, экзогенный полинуклеотид может поддерживаться в клетке в виде неинтегрированного вектора (например, плазмиды) или интегрирует в геном клетки хозяина. Таким образом амплифицированный полинуклеотид может быть выделен из клетки хозяина с помощью известныхспособов. Смотреть, например, Sambrook et al., 1989.
Альтернативно, воспроизводить последовательности ДНК можно с помощью ПЦР. Технология ПЦР хорошо известна в отрасли и описана в патентах США №4,683,195, 4,800,159, 4,754,065 и 4,683,202, а так же: The Polymerase Chain Reaction, Mullis et al. eds., Birkauswer Press, Boston, 1994.
РНК может быть получена, используя выделенную ДНК в подходящем векторе и вводя ее в приемлемую клетку хозяина. После репликации клетки и транскрибирования ДНК в РНК, затем РНК может быть выделена, используя известны в отрасли способы, как описано Sambrook et al., 1989, выше.
Приемлемые векторы клонирования могут быть сконструированы согласно стандартных техникам, или могут быть выбраны из большого числа клонирующих векторов, доступных в отрасли. Хотя клонирующий вектор может отличаться в зависимости от клетки хозяина, приемлемые клонирующие векторы обычно имеют способность к саморепликации, могут иметь одну мишень для конкретной рекстрикционной эндонуклеазы и/или может иметь гены для маркера, используемого при отборе клонов, содержащих вектор. Приемлемые примеры включают плазмиды и бактериальные вирусы, например, pUC18, pUC19, Bluescript (например, pBS SK+) и их производные, mp18, mp19, pBR322, пМВ9, ColE1, pCR1, RP4, ДНК фага, и шаттл векторы, такие как pSA3 и рАТ28. эти и многие другие клонирующие векторы доступны из коммерческих источников, таких как BioRad, Strategene и Invitrogen.
Векторы экспрессии обычно являются реплицируемыми полинуклеотидными конструктами, содержащими полинуклеотид изобретения. Подразумевается, что вектор экспрессии должен реплицироваться в клетке хозяине в виде эписом или интегрированной части хромосомной ДНК. Приемлемые векторы экспрессии включают, но не ограничиваются следующими: плазмиды, вирусные векторы, включая аденовирусы, адено-ассоциированные вирусы, ретровирусы, косм иды и векторы экспрессии, описанные в РСТ публикации WO 87/04462. Компоненты векторов обычно включают, но не ограничиваются одним или больше из следующих: сигнальная последовательность; точка начала репликации; один или больше маркерных генов; приемлемые элементы контроля транскрипции (такие как промоторы, энхансеры и терминатор). Для экспрессии (то есть, трансляции), могут потребоваться так же один или больше элементов контроля трансляции, таких как сайты связывания рибосом, сайты инициирования рибосом и стоп кодоны.
Векторы, содержащие желаемые полинуклеотиды, могут быть введены в клетку хозяина многочисленными способами, включая электропорацию, трансфекицю с применением хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других соединений; бомбардировку микрочастицами; липофекцию; и инфицирование (например, когда вектор представлен инфекционным агентом, таким как вирус оспавакцины). Выбор введения векторов или полинуклеотидов обычно зависит от свойств клетки хозяина.
Изобретение так же относится к клеткам хозяевам, содержащим любой из описанных полинуклеотидов. Любые клетки хозяева, способные над-экспрессировать гетерологичные ДНК, могут быть использованы для выделения генов, кодирующих интересующее антитело, полипептид или протеин. Не исчерпывающие примеры клеток хозяев млекопитающих включают, но не ограничиваются следующими: COS, HeLa и СНО клетки. Смотреть так же РСТ публикацию WO 87/04462. Приемлемые клетки хозяева млекопитающих включают прокариоты (такие как Е. coli или В. subtillis) и дрожжи (такие как S. cerevisae, S. pombe; или K. lactis). Желательно, клетки хозяева экспрессируют кДНК на уровне приблизительно в 5 раз выше, более желательно в 10 раз выше, еще более желательно, 20 раз выше, чем уровень характерный эндогенному антителу или протеину, в случае присутствия в клетке хозяине. Скрининг клеток хозяев на специфичное связывание с CXCR4 или CXCR4 доменом (например, домены 1-4), осуществляют иммуноанализом или FACS. Таким образом, может быть идентифицирована клетка, надэкспрессирующая желаемое антитело или протеин.
Анти-CXCR4 конъюгаты антитело-лекарство
Данное изобретение относится к конъюгату антитело-лекарство формулы Ab-(T-L-D), где а) Ab означает антитело или его антиген-связывающий фрагмент, которое связывается с CXCR4, b) Т означает метку, содержащую глутамин донор ацила, которая может быть необязательно включена; с) L означает линкер; и d) D означает лекарство. Так же изобретение относится к способам получения и производства таких конъюгатов антитело-лекарство, и применения в медицине. "Конъюгат антитело-лекарство" или "ADC" относится к антителам или их антиген-связывающим фрагментам, включая производные антител, связывающиеся с CXCR4, и конъюгатам лекарств.
В некоторых аспектах изобретения, Ab выбран из группы, состоящей из: а) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 107, 162 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 144, 145 и 139; b) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 115, 118 и 120, и VL участок, включающий последовательности CDR SEQ ID NO: 135, 136 и 137; с) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 107, 110 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 131, 132 и 133; d) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 107, 154 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 138, 132 и 139; е) антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 107, 157 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 151, 152 и 153; f) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 33 и VL участок последовательности SEQ ID NO: 73; g) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 13 и VL участок последовательности SEQ ID NO: 15; h) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 5 и VL участок последовательности SEQ ID NO: 7; и i) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 21 и VL участок последовательности SEQ ID NO: 47.
Способы конъюгирования цитотоксического агента или других терапевтических агентов с антителами описаны в различных публикациях. Например, химическую модификацию осуществляют в антителах по средством аминов боковой цепи лизина или сульфгидрильных групп цистеина, активированных восстановлением внутрицепочечных дисульфидных связей для реакции конъюгации. Смотреть, например, Tanaka et al., FEBS Letters 579:2092-2096, (2005), and Gentle et al., Bioconjug. Chem. 15:658-663, (2004). Также были описаны реактивные остатки цистеина, сконструированные в специфичных сайтах антител для специфичной конъюгации с лекарством с определенной стехиометрией. Смотреть, например, Junutula et al., Nature Biotechnology, 26:925-932, (2008). Конъюгация с использованием метки, содержащей глутамин донор ацила и/или эндогенный глутамин, делают реактивной (то есть, способность образовывать ковалентную связь в качестве донора ацила) путем конструирования полипептида в присутствии трансглутаминазы и амина (например, цитотоксический агент, содержащий или присоединенный к реактивному амину), что так же описано в мужденародной патентной заявке PCT/IB 2011/054899 (WO 2012/059882), Strop et al., Chem. Biol. 20(2):161-167 (2013), и Farias et al., Bioconjug. Chem. 25(2):245-250 (2014).
Примером приемлемой конъюгации является конъюгация гидразидов и других нуклеофилов с альдегидами, образованными окислением углеводов, природно присутствующих в антителах. Гидразон-содержащие конъютаты могут быть получены с введенными карбонильными группами, обеспечивающими желаемые свойства высвобождения лекарства. Конъюгаты так же можно получать с линкерами, имеющими дисульфид на одном конце, алкильную цепь по середине, и производную гидразина на другом конце. Антрациклины являются примером цитотоксинов, которые можно конъюгировать с антителами, использую данную технологию.
В других аспектах изобретения, анти-CXCR4 антитело или его антиген-связывающий фрагмент, или конъюгат, как описано в данном документе, содержит метку, содержащую глутамин донор ацила (Т), сконструированную в определенном месте антитела (например, карбоксильном конце, амино конце или другом месте в анти-CXCR4 антителе). В некоторых аспектах изобретения, метка содержит аминокислоту глутамин (Q) или аминокислотную последовательность LLQGG (SEQ ID NO: 171), GGLLQGG (SEQ ID NO: 90), LLQGA (SEQ ID NO: 91), GGLLQGA (SEQ ID NO: 92), LLQ, LLQGPGK (SEQ ID NO: 93), LLQGPG (SEQ ID NO: 94), LLQGPA (SEQ ID NO: 95), LLQGP (SEQ ID NO: 96), LLQP (SEQ ID NO: 97), LLQPGK (SEQ ID NO: 98), LLQGAPGK (SEQ ID NO: 99), LLQGAPG (SEQ ID NO: 100), LLQGAP (SEQ ID NO: 101), GGLLQGPP (SEQ ID NO: 172), LLQGPP (SEQ ID NO: 173), LLQX1X2X3X4X5, где X1 означает G или P, где X2 означает A, G, P, или отсутствует, где X3 означает A, G, K, P, или отсутствует, где Х4 означает K, G или отсутствует, и где Х5 означает K или отсутствует (SEQ ID NO: 102), или LLQX1X2X3X4X5, где Х1, означает природную аминокислоту, и где Х2, Х3, Х4, Х5 означают любые природные аминокислоты или отсутствуют (SEQ ID NO: 103). В определенном аспекте изобретения, Т выбирают из группы, состоящей из любой из SEQ ID NO: 91, 92 и 102.
В других аспектах изобретения, изобретение касается изолированного антитела, содержащего метку, содержащую глутамин донор ацила и аминокислотную модификацию в положении 222, 340 или 370 антитела (схема нумерации EU), где модификация означает делецию, замещение, вставку, мутацию аминокислоты или любую их комбинацию. Например, модификация аминокислоты представлена K222R, K340R и K370R.
В некоторых аспектах изобретения, конъюгат антитела или его антиген-связывающего фрагмента конъюгировано с лекарством, где лекарство выбирают из группы, состоящей из следующих: цитотоксический агент, иммуномодулирующий агент, визуализирующее средство, терапевтический агент (например, терапевтический протеин), биополимер и олигонуклеотид.
В некоторых аспектах изобретения, лекарство может быть связано или конъюгировано с анти-CXCR4 антителом или его антиген-связывающим фрагментом, как описано в данном документе, для направленной локальной доставки лекарства к опухолям (например, СХСР4-экспрессирующая опухоль). В определенных аспектах изобретения, лекарство означает цитотоксический агент. Примеры цитотоксического агента включают, но не ограничиваются следующими: антрациклин, ауристатин, камптотецин, комбретастаин, доластатин, дуокармицин, энедиин, гелданамицин, димер индолино-бензодиазепин, маутанзин, пуромицин, пирролобензодиазепиновый димер, таксан, алкалоид барвинка, тубулизин, гемиастерлин, сплайсеостатин, пладиенолид, каличеамицин, и стереоизомеры, изостеры, их аналоги или производные. В некоторых аспектах изобретения, антрациклины происходят из бактерий Strepomyces и используют для лечения широкого диапазона раковых заболеваний, таких как лейкемия, лимфомы, рак молочной железы, рак матки, рак яичников и рак легких. Примеры антрациклинов включают, но не ограничиваются следующими: даунорубицин, доксорубицин (то есть, адриамицин), эпирубицин, идарубицин, валрубицин и митоксантрон.
Доластатины и их пептидные аналоги и производные, ауристатины, являются потенциальными антимитотическими агентами, имеющими противораковую и противогрибковую активность. Смотреть, например, патент США №5,663,149 и Pettit et al., Antimicrob. Agents Chemother. 42:2961-2965 (1998). Примеры доластатинов и ауристатинов включают, но не ограничиваются следующими: доластатин 10, ауристатин Е, ауристатин ЕВ (АЕВ), ауристатин EFP (AEFP), MMAD (Монометил Ауристатин D или монометил доластатин 10), MMAF (Монометил Ауристатин F или N-метилвалин-валин-долаизолейцин-долапроин-фенилаланин), ММАЕ (Монометил Ауристатин Е или N-метилвалин-валин-долаизолейцин-долапроин-норфедрин), сложный эфир 5-бензоилвалериановая кислота-АЕ (AEVB), и другие новые ауристатины (такие как описанные в публикации США №20130129753).
В определенных аспектах изобретения, ауристатин выбирают из группы, состоящей из 0101 (2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-{[(1S)-2-фенил-1-(1,3-тиазол-2-ил)этил]амино}пропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид), MMAD (Монометил Ауристатин D или монометил доластатин 10 и 8261 (2-Метилаланил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбокси-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид).
В некоторых аспектах данного изобретения, ауристатин означает 0101 (2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-{[(1S)-2-фенил-1-(1,3-тиазол-2-ил)этил]амино}пропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид) со следующей структурой:
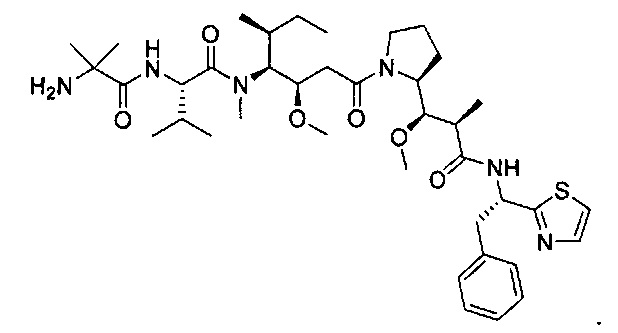
В других аспектах, ауристатин означает 3377 (N,2-диметилаланил-N-{(1S,2R)-4-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбоксил-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-2-метокси-1-[(1S)-1-метилпропил]-4-оксобутил}-N-метил-L-валинамид) со следующей структурой:
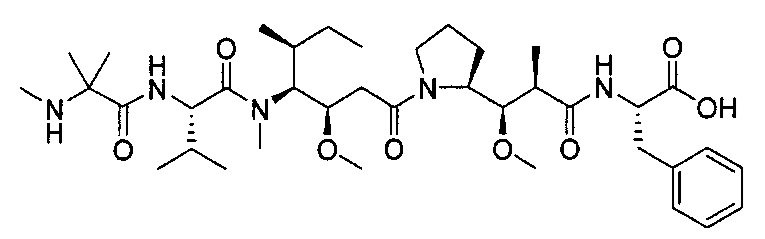
В других аспектах изобретения, ауристатин означает 0131 (2-метил-L-проли-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбокси-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пиppoлидин-1-ил}-3-мeтoкcи-5-мeтил-1-oкcoгeптaн-4-ил]-N-мeтил-L-валинамид) со следующей структурой:
В некоторых аспектах, ауристатин означает 0121 (2-метил-L-проли-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид) со следующей структурой:
В других аспектах, ауристатин означает 8261, (8261 2-Метилаланил-N-[3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-кapбoкcи-2-фeнилэтил]aминo}-1-мeтoкcи-2-мeтил-3- оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид), со следующей структурой:
Камптотецин является цитотоксическим хинолиновым алкалоидом, ингибирующим фермент топоизомеразу I. Примеры камптотецина и его производных включают, но не ограничиваются следующими: топотекан и иринотекан, и их метаболиты, такие как SN-38.
Комбретастатины являются природными фенолами, разрушающими сосуды в опухоли. Примеры комбретастатинов и их производных включают, но не ограничиваются следующими: комбретастатин А-4 (СА-4) и обмрабулин.
Дуокармицины представляют собой ДНК алкилирующие агенты с потенциальной цитотоксичностью. Смотреть Boger and Johnson, PNAS 92:3642-3649 (1995). Примеры дуокармицинов включают, но не ограничиваются следующими: дуокармицин А, дуокармицин В1, дуокармицин В2, дуокармицин С1, дуокармицин С2, дуокармицин D, дуокармицин SA и СС-1065. Энедиины являются классом противоопухолевых бактериальных продуктов, которые характеризуются наличием 9- и 10-членных колец или циклической системы конъюгированных связей тройная-двойная-тройная. Примеры энедиинов включают, но не ограничиваются следующими: каличеамицин, эсперамицин и динемицин.
Гелданамицины представлены бензохинон анзамициновым антибиотиком, связывающимся с Hsp90 (белок теплового шока 90), и используемым в качестве противоопухолевого лекарства. Примеры гелданамицинов включают, но не ограничиваются следующими: 17-AAG (17-N-аллиламино-17-деметоксигелданамицин) и 17-DMAG (17-диметилминоэтиламино-17-деметоксигелданамицин).
Маутанзины или их производные маутанзиноиды ингибируют пролиферацию клетки путем ингибирования образования микротрубочек на протяжении митоза, посредством ингибирования полимеризации тубулина. Смотреть Remillard et al., Science 189:1002-1005 (1975). Примеры маутанзинов и маутанзиноидов включают, но не ограничиваются следующими: мертанзин (DM1) и его производные, а также ансамитоцин.
Пирролобензодиазепиновые димеры (PBD) и индолино-бензодиазепиновые димеры (IGN) являются противоопухолевыми агентами, содержащими одну или больше функциональных групп или их эквивалентов, связывающихся с двухспиральной ДНК. Молекулы PBD и IGN основаны на природном продукте атрамицине, и взаимодействуют с ДНК последовательность-селективным образом, с предпочтением последовательностям пурин-гуанин-пурин. Примеры PBD и их аналогов включают, но не ограничиваются SJG-136.
Сплайсеостатины и пладиенолиды являются противоопухолевыми соединениями, ингибирующими сплайсинг и взаимодействующими с сплайсингосомой, SF3b. Примеры сплайсеостатинов включают, но не ограничиваются следующими: сплайсеостатин А, FR901464. Примеры пладиенолидов включают, но не ограничиваются следующими: пладиенолид В, пладиенолид D, и Е7107.
Таксаны являются дитерпенами, действующими как анти-тубулиновые агенты или ингибиторы митоза. Примеры таксанов включают, но не ограничиваются следующими: паклитаксель (например, TAXOL®) и доцетаксель (TAXOTERE®).
Алкилоиды барвинка являются анти-тубулиновыми агентами. Примеры алкилоидов барвинка включают, но не ограничиваются следующими: винкристин, винбластин, виндезин и винорелбин.
В некоторых аспектах изобретения, лекарство означает иммуномодулирующий агент. Примеры иммуномодулирующего агента включают, но не ограничиваются следующими: ганцикловир, этанерцепт, такролимус, сиролимус, воклоспорин, циклоспорин, рапамицин, циклофосфамид, азатиоприн, микофенолгат мофетил, метотрексат, глюкокортикоид и его аналоги, цитокины, факторы роста стволовых клеток, лимфотоксины, фактор некроза опухоли (TNF), гематопоэтические факторы, интерлейкины (например, интерлейкин-1 (IL-1), IL-2, IL-3, IL-6, IL-10, IL-12, IL-18 и IL-21), факторы, стимулирующие толстый кишечник (например, фактор, стимулирующий гранулоциты толстого кишечника (G-CSF) и фактор, стимулирующий гранулоциты макрофаги толстого кишечника (GM-CSF)), интерфероны (например, интерфероны-α, -β и -γ), фактор роста стволовых клеток, обозначенный как "S 1 фактор," эритропоэтин и тромбопоэтин, или их комбинация.
В некоторых аспектах изобретения, лекарство означает визуализирующее средство (например, флуорофор или хелатор), например, флуоресцеин, родамин, лантанид фосфора, и их производные. Примеры флуорофоров включают, но не ограничиваются следующими: флуоросцеин изотиоцианат (FITC) (например, 5-FITC), флуоресцеин амидит (FAM) (например, 5-FAM), эозин, карбоксифлуоресцеин, эритрозин, Alexa Fluor® (например, Alexa 350, 405, 430, 488, 500, 514, 532, 546, 555, 568, 594, 610, 633, 647, 660, 680, 700 или 750), карбокситетраметилродамин (TAMRA) (например, 5,-TAMRA), тетраметилродамин (TMR) и сульфородамин (SR) (например, SR101). Примеры хелаторов включают, но не ограничиваются следующими: 1,4,7,10-тетраазациклододекан-N,N',N'',N'''-тетрауксусной кислоты (DOTA), 1,4,7-триазациклононан-1,4,7-триуксусной кислоты (NOTA), 1,4,7-триазациклононан, 1-глетаровая кислота-4,7-уксусной кислоты (NODAGA), диэтилентриаминпентауксусная кислота (DTPA), и 1,2-бис(о-аминофенокси)этан-N,N,N',N'-тетрауксусная кислота) (ВАРТА).
В некоторых аспектах изобретения, терапевтические или диагностические радиоизотопы или другие метки (например, метки PET или SPECT) могут быть введены в лекарство для конъюгации с анти-CXCR4 антителами или их антиген-связывающими фрагментами, как описано в данном документе. Примеры радиоизотопов или других меток включают, но не ограничиваются следующими: 3Н, 11С, 13N, 14С, 15N, 15O, 35S, 18F, 32Р, 33Р, 47Sc, 51Cr, 57Со, 58Со, 59Fe, 62Cu, 64Cu, 67Cu, 67Ga, 68Ga, 75Se, 76Br, 77Br, 86Y, 89Zr, 90Y, 94Tc, 95Ru, 97Ru, 99Tc, 103Ru, 105Rh, 105Ru, 107Hg, 109Pd, 111Ag, 111In, 113In, 121Te, 122Te, 123I, 124I, 125I, 125Te, 126I, 131I, 131In, 133I, 142Pr, 143Pr, 153Pb, 153Sm, 161Tb, 165Tm, 166Dy, 166H, 167Tm, 168Tm, 169Yb, 177Lu, 186Re, 188Re, 189Re, 197Pt, 198Au, 199Au, 201TI, 203Hg, 211At, 212Bi, 212Pb, 213Bi, 223Ra, 224Ac, и 225Ac.
В некоторых аспектах изобретения, лекарство означает терапевтический протеин включая, но не ограничиваясь следующими: токсин, гормон, фермент и фактор роста.
Примеры протеинов токсинов (или полипептидов) включают, но не ограничиваются следующими: дифтерия (например, А цепь дифтерии), экзотоксин или эндотоксин Pseudomonas, рицин (например, А цепь рицина), абрин (например, А цепь абрина), модецин (например, А цепь модецина), альфа-сарцин, протеины Aleurites fordii, протеины диантина, рибонуклеаза (РНаза), ДНКаза I, энтеротоксин-А стафиллокока, антивирусный протеин фитолакки, гелонин, токсин дифтерии, протеины Phytolaca americana (PAPI, PAPII, и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, митогеллин, рестриктоцин, феномицин, эномицин, трикотецены, пептиды ингибитора цистинового узла (ICK) (например, кератотоксины), и конотоксин (например, KIIIA или SmIIIa).
В некоторых аспектах изобретения, лекарство является биосовместимым полимером. Анти-CXCR4 антитела или их антиген-связывающие фрагменты как описано в данном документе, могут быть конъюгированы с биосовместимым полимером для увеличения периода полураспада в сыворотке и биоактивности и/или увеличения периода полураспада in vivo. Примеры биосовместимых полимеров включают водорастворимый полимер, такой как полиэтиленгликоль (PEG) или его производные и цвитеррион-содержащие биосовместимые полимеры (например, полимер, содержащий фосфорилхолин).
В некоторых аспектах изобретения, лекарство является олигонуклеотидом, таким как антисмысловые олигонуклеотиды.
В другом аспекте, изобретение касается конъюгата антитела или его антиген-связывающего фрагмента, как описано в данном документе, где конъюгат антитело-лекарство имеет формулу: антитело-(донор ацила глутамин-содержащая метка)-(линкер)-(лекарство), где донор ацила глутамин-содержащая метка сконструирован в определенном месте антитела или его антиген-связывающего фрагмента (например, на карбоксильном конце тяжелой или легкой цепи или в другом месте), где метка конъюгирована с линкером (например, линкером, содержащим один или больше реактивных аминов (например, первичный амин NH2)), и где линкер конъюгирован с цитотоксическим агентом (например, MMAD или другие ауристатины, как описано в данном документе). В некоторых аспектах изобретения, конъюгат антитело-лекарство не содержит донор ацила глутамин-содержащей метки.
Примеры линкера, содержащего один или больше реактивных аминов, включают, но не ограничиваются следующими: ацетил-лизин-валин-цитруллин-р-аминобензилоксикарбонил (AcLys-VC-PABC) или амино PEG6-пропионил. Смотреть, например, WO 2012/059882.
В некоторых аспектах изобретения, линкер может быть дипептидным линкером, таким как валин-цитруллин (val-cit), фенилаланин-лизин (phe-lys) линкер, или малеимидокапроновый-валин-цитруллин-р-аминобензилоксикарбонил (vc) линкер. В другом аспекте, линкер может означать сульфосукцинимидил-4-[Нмалеимидометил] циклогексан-1-карбоксилат (smcc). Сульфо-smcc конъюгация осуществляется по средством малеимидной группы, взаимодейтвующей с сульфгидрилами (тиолы, -SH), в то время как его сульфо-NHS сложный эфир реагирует с первичными аминами (имеющимися в лизине и протеине или пептиде-конца). Так же, линкер может означать малеимидокапроил (mc). В некоторых аспектах изобретения, донор ацила глутамин-содержащая метка включает LLQGG (SEQ ID NO: 171), GGLLQGG (SEQ ID NO: 90), LLQGA (SEQ ID NO: 91), GGLLQGA (SEQ ID NO: 92), LLQ, LLQGPGK (SEQ ID NO: 93), LLQGPG (SEQ ID NO: 94), LLQGPA (SEQ ID NO: 95), LLQGP (SEQ ID NO: 96), LLQP (SEQ ID NO: 97), LLQPGK (SEQ ID NO: 98), LLQGAPGK (SEQ ID NO: 99), LLQGAPG (SEQ ID NO: 100), LLQGAP (SEQ ID NO: 101), GGLLQGPP (SEQ ID NO: 172), LLQGPP (SEQ ID NO: 173), LLQX1X2X3X4X5, где X1 означает G или P, где X2 означает A, G, P, или отсутствует, где X3 означает A, G, K, P, или отсутствует, где Х4 означает K, G или отсутствует, и где Х5 означает K или отсутствует (SEQ ID NO: 102), или LLQX1X2X3X4X5, где X1 означает любую природную аминокислоту, и где Х2, Х3, X4, и Х5 означают любые природные аминокислоты или отсутствуют (SEQ ID NO: 103).
В некоторых аспектах изобретения, анти-CXCR4 антитело или конъюгат, как описано в данном документе, содержит аминокислотное замещение аспарагина (N) на глутамин (Q) или N на аланин (А) в положении 297 анти-CXCR4 антитела.
В некоторых аспектах изобретения, донор ацила глутамин-содержащая метка включает, например, LLQ, SEQ ID NO: 91, 90, 94, 95, 95, 97, 98, 99, 100, 171, 101, 172 или 173, сконструирована на С-конце тяжелой цепи антитела, где остаток лизина на С-конце удален. В других аспектах, донор ацила глутамин-содержащая метка (например, GGLLQGA (SEQ ID NO: 92)) сконструирована на С-конце легкой цепи антитела. Примеры антитела включают, но не ограничиваются следующими: m6B6, h6B6, m12A11, h12A11, m3G10, h3G10, h3G10.A57, h3G10.B44, h3G10.1.7, h3G10.1.60, h3G10,2,5, h3G10.1,91, h3G10,2.37, h3G10,2.45, h3G10,2.42, h3G10.1.33, h3G10,3.25, h3G10, h3G10,2.72, h3G10.A11A, h3G10.A18A, h3G10.A19A, h3G10.A58A, h3G10.A65A, и h3G10.B12A, h3G10.B13A, h3G10.B18A, h3G10.A11B, h3G10.A18B, h3G10.A19B, h3G10.A58B, h3G10.A65B, h3G10.B12B, h3G10.B13B, h3G10.B18B, h3G10,2.25, h3G10.A59, h3G10.A62 или h3G10.L94D.
В других аспектах изобретения, конъюгат имеет формулу: антитело-(донор ацила глутамин-содержащая метка)-(L)-(цитотоксический агент). В некоторых аспектах изобретения, конъюгат означает a) Ab-LLQGA (SEQ ID NO: 91)-(ацетил-лизин-валин-цитруллин-р-аминобензилоксикарбонил (AcLys-VC-PABC))-0101; b) Ab-LLQGA (SEQ ID NO: 91)-(AcLys-VC-PABC)-MMAD; c) Ab-LLQX1X2X3X4X5 (SEQ ID NO: 102)-(AcLys-VC-PABC)-0101; d) Ab-LLQX1X2X3X4X5 (SEQ ID NO: 102)-(AcLys-VC-PABC)-MMAD; e) Ab-GGLLQGA (SEQ ID NO: 92)- (AcLys-VC-PABC)-0101; и f) Ab-GGLLQGA (SEQ ID NO: 92)-(AcLys-VC-PABC)-MMAD.
Примеры антитела включают, но не ограничиваются следующими: m6B6, h6B6, m12A11, h12A11, m3G10, h3G10, h3G10.A57, h3G10.B44, h3G10.1.7, h3G10.1.60, h3G10,2,5, h3G10.1,91, h3G10,2.37, h3G10,2.45, h3G10,2.42, h3G10.1.33, h3G10,3.25, h3G10, h3G10,2.72, h3G10.A11A, h3Gl0.A18A, h3G10.A19A, h3G10.A58A, h3G10.A65A, и h3G10.B12A, h3G10.B13A, h3G10.B18A, h3G10.A11B, h3G10.A18B, h3G10.A19B, h3G10.A58B, h3G10.A65B, h3G10.B12B, h3G10.B13B, h3G10.B18B, h3G10,2.25, h3G10.L94D, h3G10.A59, h3G10.A62 или h3G10.L94D.
В некоторых аспектах изобретения, Ab означает антитело или его антиген-связывающий фрагмент, содержащий VH участок, включающий последовательности CDR SEQ ID NO: 107, 162 и 112, и VL участок, включающий последовательности CDR SEQ ID NO: 144, 145 и 139.
В некоторых аспектах изобретения, анти-CXCR4 конъюгат антитело-лекарство вызывает регрессию опухоли.
Способы использования анти-CXCR4 антител, их антиген-связывающих фрагментов, конъюгатов антитело-лекарство
Антитела и конъюгаты антитело-лекарство данного изобретения применимы в различных применениях, включая, но не ограничиваясь, терапевтическими способами лечения и диагностическими способами.
В некоторых аспектах изобретения, при введении пациенту, антитело или конъюгат и фармацевтически приемлемые носители являются стерильными. Вода является примером носителя, когда соединение или конъюгат вводят внутривенно. Солевые растворы и водные растворы декстрозы и глицерина так же могут использоваться в качестве жидких носителей, а именно для инъектируемых растворов. Данные композиции, по желанию, так же могут содержать небольшое количество увлажнителей или эмульгаторов или рН буферных агентов.
Данные композиции могут иметь форму растворов, пеллет, порошков, композиций с пролонгированным высвобождением или любую другую форму, приемлемую для использования. Другие примеры приемлемых фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" by E.W. Martin.
В некоторых аспектах, антитело изобретения и/или конъюгат антитело-лекарство сформулированы согласно стандартных правил для фармацевтических композиций, адаптированных для внутривенного введения животным, а именно, человеку. Обычно, носители или наполнители для внутривенного введения представлены стерильными изотоничными водными буферными растворами. В случае необходимости, композиции так же могут включать солюбилизаторы. Композиции для внутривенного введения могут необязательно включать местный анестетик, такой как лигнокаин для облегчения боли в месте введения инъекции. Обычно, ингредиенты поставляют отдельно или смешанными в единой дозированной форме, например, в виде сухого лиофиллизированного порошка или безводного концентрата в герметичном контейнере, таком как ампула или саше, с указанием количества активного агента. Когда соединение изобретения и/или конъюгат антитело-лекарство вводят путем инфузии, оно может быть распределено, например, в инфузийном флаконе, содержащем стерильную фармацевтическую воду или солевой раствор. Когда соединение изобретения и/или конъюгат антитело-лекарство вводят путем инъекции, обеспечивают ампулу со стерильной водой для инъекции или солевым раствором, так чтобы ингредиенты модно было смешать перед введением.
Композиция может включать различные материалы, модифицирующие физическую форму твердой или жидкой дозированной формы. Например, композиция может включать материалы, образующие поверхностное покрытие вокруг активных ингредиентов. Материалы, образующие поверхностное покрытие, обычно инертные, и могут быть выбраны из, например, сахара, шеллака и других кишечных покрытий. Альтернативно, активные ингредиенты могут быть заключены в желатиновую капсулу.
В твердой или жидкой форме, данные композиции могут включать фармакологический агент, используемый для лечения рака. В одном аспекте, изобретение касается способа лечения состояния, ассоциированного с экспрессией CXCR4 у субъекта. В некоторых аспектах изобретения, способ лечения расстройства, ассоциированного с функцией или экспрессией CXCR4 у субъекта, включает введение субъекту, который в этом нуждается, эффективного количества композиции (например, фармацевтическая композиция), содержащей анти-CXCR4 антитела, их антиген-связывающие фрагменты или анти-CXCR4 конъюгаты антитело-лекарство, как описано в данном документе. Расстройства, ассоциированные с экспрессией CXCR4, включают, но не ограничиваются следующими: анормальная экспрессия CXCR4, измененная или аберрантная экспрессия CXCR4, надэкспрессия CXCR4 и пролиферативное расстройство (например, рак).
Соответственно, в некоторых аспектах обеспечивается способ лечения рака у субъекта, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей анти-CXCR4 антитело, их антиген-связывающие фрагменты или анти-СХСР4 конъюгат антитело-лекарство, как описано в данном документе. Как указано в данном документе, рак включает, но не ограничивается следующими: рак мочевого пузыря, рак молочной железы, рак шейки матки, хориокарцинома, рак толстого кишечника, рак пищевода, желудка, глиобластома, рак головы и шеи, рак почек, рак легких, рак рта, рак яичников, рак поджелудочной железы, рак простаты, рак кожи и гематологический рак. В некоторых аспектах изобретения, обеспечивается способ снижения роста или прогрессирования опухоли у субъекта с опухолью, экспрессирующей CXCR4, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей анти-CXCR4 антитело или антиген-связывающие фрагменты, или анти-CXCR4 конъюгат антитело-лекарство, как описано в данном документе. В других аспектах, обеспечивается способ снижения количества метастазов раковых клеток, экспрессируюзщих CXCR4, у субъекта, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей анти-CXCR4 антитело, его антиген-связывающие фрагменты или анти-CXCR4 конъюгат антитело-лекарство, как описано в данном документе. В других аспектах, обеспечивается способ вызывания регрессии опухоли, экспрессирующей CXCR4, у субъекта, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей анти-CXCR4 антитело или его антиген-связывающие фрагменты, или анти-CXCR4 конъюгат антитело-лекарство, как описано в данном документе.
В некоторых аспектах, изобретение касается изолированного антитела, его антиген-связывающего фрагмента или конъюгата антитело-лекарство любого антитела, как описано в данном документе, для применения в выявлении, диагностировании и лечении патологических расстройств, ассоциированных с функцией или экспрессией CXCR4. В одном аспекте, расстройства включают онкогенные расстройства, связанные с повышенной экспрессией CXCR4, по сравнению с нормальной или любой другой патологией, связанной с надэкспрессией CXCR4.
В некоторых аспектах изобретения, обеспечивается способ лечения рака у субъекта, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей вариабельный участок тяжелой цепи (VH), включающий (i) VH CDR1, выбранный из группы, состоящей из SEQ ID NO: 107, 113, 114, 108, 109, 115, 116, 117, 121 и 122; (ii) VH CDR2, выбранный из группы, состоящей из SEQ ID NO: 162, 128, 110, 111, 118, 119, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156, и 130, и, (iii) VH CDR3, выбранный из группы, состоящей из SEQ ID NO: 112 т 120; и/или; b) вариабельный участок легкой цепи (VL), содержащий (i) VL CDR1, выбранный из группы, состоящей из SEQ ID NO: 144, 131, 135, 138, 141, 142, 143, 146, 147, 148, 149, 150 и 151; (ii) VL CDR2, выбранный из группы, состоящей из 145, 132, 136 и 152; и (iii) VL CDR3, выбранный из группы, состоящей из SEQ ID NO: 139, 133, 137, 140 и 153.
В некоторых аспектах изобретения, обеспечивается способ лечения рака у субъекта, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей антитело или его антиген-связывающий фрагмент, где антитело содержит: вариабельный участок тяжелой цепи (VH), содержащий три CDR с последовательностями SEQ ID NO: 107, 162 и 112. В некоторых аспектах изобретения, обеспечивается способ лечения рака у субъекта, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей антитело или его антиген-связывающий фрагмент, где антитело содержит: вариабельный участок легкой цепи (VL), содержащий три CDR с последовательностями SEQ ID NO: 144, 145 и 139.
В некоторых аспектах изобретения, обеспечивается способ лечения рака у субъекта, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей антитело или его антиген-связывающий фрагмент по любому из предыдущих пунктов, где антитело содержит: вариабельный участок тяжелой цепи (VH), содержащий три CDR с последовательностями SEQ ID NO: 107, 162 и 112; и вариабельный участок легкой цепи (VL), содержащий три CDR с последовательностями SEQ ID NO: 144, 145 и 139.
В некоторых аспектах, данное изобретение обеспечивает способ лечения рака у субъекта, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей изолированное антитело или его антиген-связывающий фрагмент, которое связывается с CXCR4 и содержит: вариабельный участок тяжелой цепи (VH), содержащий VH CDR1, VH CDR2 и VH CDR3 из VH участка последовательности SEQ ID NO: 33; и вариабельный участок легкой цепи (VL), содержащий VL CDR1, VL CDR2 и VL CDR3 из VL участка последовательности SEQ ID NO: 73.
В других аспектах, данное изобретение обеспечивает способ лечения рака у субъекта, включающий введение субъекту, который в этом нуждается, эффективного количества композиции, содержащей антитело или его антиген-связывающий фрагмент по любому из предыдущих пунктов, где антитело содержит: а) вариабельный участок тяжелой цепи (VH) с последовательностью SEQ ID NO: 33; и b) вариабельный участок легкой цепи (VL) с последовательностью SEQ ID NO: 73.
В некоторых аспектах, изобретение касается применения изолированного антитела, его антиген-связывающего фрагмента или конъюгата антитело-лекарство любого антитела, как описано в данном документе, в производстве лекарства для лечения расстройства, ассоциированного с функцией или экспрессией CXCR4. В одном аспекте, расстройства включают онкогенные расстройства, связанные с повышенной экспрессией CXCR4, по сравнению с нормальной или любой другой патологией, связанной с надэкспрессией CXCR4.
В других аспектах изобретения, анти-CXCR4 конъюгат антитело-лекарство включат антитело или его антиген-связывающий фрагмент, имеющий как минимум один вариабельный участок тяжелой цепи, и как минимум один вариабельный участок легкой цепи, где как минимум один вариабельный участок тяжелой цепи включает три CDR с последовательностями SEQ ID NO: 107, 113, 114, 162, 128 и 112. В некоторых аспектах изобретения, анти-СХСR4 конъюгат антитело-лекарство включает антитело или его антиген-связывающий фрагмент, имеющий как минимум один вариабельный участок тяжелой цепи, и как минимум один вариабельный участок легкой цепи, где как минимум один вариабельный участок легкой цепи включает три CDR с последовательностями SEQ ID NO: 144, 145 и 139.
В некоторых аспектах изобретения, конъюгат антитело-лекарство, который связывается с CXCR4, содержит антитело или его антиген-связывающий фрагмент, содержащий вариабельный участок тяжелой цепи с последовательностью SEQ ID NO: 33, 5, 9, 13, 17, 21, 23, 25, 27, 29, 31, 35, 37, 39, 41, 43, 45, 85 или 87, и/или вариабельный участок легкой цепи с последовательностью SEQ ID NO: 73, 3, 7, 11, 15, 19, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 75, 77, 79, 81, 83 или 169. Например, анти-CXCR4 конъюгат антитело-лекарство изобретения может включать антитело или его антиген-связывающий фрагмент, содержащий вариабельный участок тяжелой цепи с аминокислотной последовательностью на как минимум 90% идентичной последовательности SEQ ID NO: 33, и вариабельный участок легкой цепи с аминокислотной последовательностью на как минимум 90% идентичной последовательности SEQ ID NO: 73; или антитело или его антиген-связывающий фрагмент, содержащий вариабельный участок тяжелой цепи с последовательностью SEQ ID NO: 33, и вариабельный участок легкой цепи с аминокислотной последовательностью SEQ ID NO: 73.
В определенных аспектах изобретения, антитело не канинизировано или фелинизированно.
Антитела так же могут быть модифицированы, например, в вариабельных доменах тяжелой и/или легкой цепи, например, для изменения связывающих свойств антитела. Например, мутацию можно осуществить в одном или больше CDR участках для повышения или снижения KD анти-CXCR4 антитела, для повышения или снижения koff, или для изменения специфичности связывания антитела. Технологии сайт-направленного мутагенеза хорошо известны в отрасли. Смотреть, например, Sambrook et al. and Ausubel et al., выше.
В некоторых аспектах изобретения, обеспечивается способ выявления, диагностирования и/или мониторинга расстройства, ассоциированного с функцией или экспрессией CXCR4. Например, анти-CXCR4 антитела, как описано в данном документе, могут быть помечены выявляемым остатком, таким как визуализирующее средство и метка фермент-субстрат. Антитела, как описано в данном документе, так же могут быть использованы для диагностирования in vivo, например, отображение in vivo (например, PET или SPECT), или как окрашивающий агент.
В одном аспекте изобретения, обеспечивается способ выявления, диагностирования и/или мониторинга расстройства, ассоциированного с функцией или экспрессией, включающий стадии: (i) получение биологического образца пациента, у которого подозревают расстройство, ассоциированное с функцией или экспрессией CXCR4; (ii) взаимодействие тестируемого образца с антителом или его антиген-связывающей частью в условиях, позволяющих образование комплекса антитела и антигена протеина CXCR4 (iii) выявление указанного комплекса антитело-антиген протеина, где присутствие указанного комплекса антитело-антиген протеина указывает на то, что данный пациент имеет расстройство, ассоциированное с функцией или экспрессией CXCR4. В определенном аспекте изобретения, способ так же включает введение пациенту терапевтически эффективного количества изолированного антитела, его антиген-связывающего фрагмента или конъюгата антитело-лекарство любого антитела, как описано в данном документе.
В некоторых аспектах изобретения, ADC может быть использован для направления соединений (например, терапевтических агентов, меток, цитотоксинов, радиотоксинов, иммуносупрессантов, и т.д.) в клетки, имеющие рецепторы CXCR4 на своей поверхности, путем связывания таких соединений с антителом или его фрагментом. Таким образом, в некоторых аспектах изобретения, обеспечивают способы локализирования ex-vivo или in vivo клеток, экспрессирующих CXCR4 (например, выявляемая метка, такая как радиоизотоп, флуоресцентное соединение как фермент). Альтернативно, ADC могут быть использованы для уничтожения клеток, имеющих рецепторы CXCR4 на своей поверхности, направлением цитотоксинов или радиотоксинов к CXCR4.
В некоторых аспектах изобретения, способы, описанные в данном документе, так же включают стадию лечения субъекта дополнительным видом терапии. В некоторых аспектах, дополнительный вид терапии представлен дополнительной противораковой терапией, включая, но не ограничиваясь следующими: химиотерапия, облучение, хирургическое вмешательство, гормональная терапия и/или дополнительная иммунотерапия.
В некоторых аспектах изобретения, дополнительный вид терапии включает введение одного или больше терапевтических агентов, в дополнение к анти-CXCR4 антителу, его антиген-связывающему фрагменту или анти-CXCR4 конъюгату антитело-лекарство, как описано в данном документе. Терапевтические агенты включают, но не ограничиваются следующими: второе антитело (например, анти-VEGF антитело, анти-HER2 антитело, анти-CD25 антитело, и/или анти-CD20 антитело), ингибитор ангиогнеза, цитотоксический агент, противовоспалительный гент (например, паклитаксель, доцетаксель, цисплатин, доксорубицин, преднизон, митомицин, прогестерон, тамоксифен или фторурацил). В одном аспекте, дополнительные виды терапии могут вводиться одновременно или последовательно или параллельно с анти-CXCR4 антителом, его антиген-связывающим фрагментом или анти-CXCR4 конъюгатом антитело-лекарство, как описано в данном документе.
Анти-CXCR4 антитело, его антиген-связывающие фрагменты, или анти-CXCR4 конъюгат антитело-лекарство данного изобретения могут быть введены индивидууму любым приемлемым путем. Специалист в отрасли дожжен понимать, что Примеры, описанные в данном документе, не являются ограничивающими, а иллюстрируют имеющиеся техники. Соответственно, в некоторых аспектах изобретения, анти-CXCR4 антитело, его антиген-связывающие фрагменты или анти-CXCR4 конъюгат антитело-лекарство, вводят индивидууму согласно известным способам, таким как внутривенное введение, например, в виде болюсного введения или непрерывной инфузии на протяжении определенного периода времени, с помощью внутримышечного, интраперитонеального, интрацереброспинального, интракраниального, трансдермального, подкожного, интраартикулярного, подъязычного, интрасиновиального введений, с помощью инсуффляции, интратекального, ротового введения, ингаляции или местных путей. Введение может быть системным, например, внутривенное введение, или локальным. Коммерчески доступные распылители для жидких композиций, включая струйные и ультразвуковые распылители, являются приемлемыми для введения. Жидкие композиции могут быть распылены напрямую, лиофиллизированные порошок может быть распылен после восстановления. Альтернативно, анти-CXCR4 антитело, его антиген-связывающие фрагменты или анти-CXCR4 конъюгат антитело-лекарство, могут быть распылены, используя фторуглеродную компоизцию и дозирующий аэрозольный ингалятор, или ингалированы в виде лиофиллизированного и измельченного порошка. В некоторых аспектах изобретения, анти-CXCR4 антитело, его антиген-связывающие фрагменты, или анти-CXCR4 конъюгат антитело-лекарство, могут быть введены с помощью ингаляции, как описано в данном документе. В других аспектах, анти-CXCR4 антитело, его антиген-связывающие фрагменты, или анти-CXCR4 конъюгаты антитело-лекарство данного изобретения, могут комбинироваться с другими фармацевтически приемлемыми наполнителями, такими как солевой раствор, раствор Рингера, раствор декстрозы, и т.д. Конкретный режим дозирования, то есть, доза, время и повторы, зависит от конкретного индивидуума и его медицинской истории.
В одном аспекте, анти-CXCR4 антитело, его антиген-связывающие фрагменты или анти-CXCR4 конъюгат антитело-лекарство, вводят сайт-специфичным или направленным локальным введением. Примеры сайт-специфичного или направленного локального введения включают различные имплантируемые депо анти-CXCR4 антител, их антиген-связывающих фрагментов или анти-CXCR4 конъюгата антитело-лекарство, или катетеры локальной доставки, такие как инфузийные катетеры, постоянные катетеры, или иголочные катеетры, искусственные имплантаты, адвентициальные бинты, шунты и стенты, или другие приемлемые устройства, сайт-специфичные носители, направленная инъекция или прямое нанесение. Смотреть, например, РСТ публикация WO 00/53211 и патент США №5,981,568.
Различные композиции анти-CXCR4 антитела, его антиген-связывающих фрагментов или анти-CXCR4 конъюгата антитело-лекарство, могут быть использованы для введения. В некоторых аспектах изобретения, анти-CXCR4 антитело (его антиген-связывающие фрагменты или анти-CXCR4 конъюгат антитело-лекарство) и фармацевтически приемлемое вспомогательное вещество могут находиться в различных композициях. Некоторые композиции данного изобретения содержат фармацевтически приемлемые вспомогательные вещества. Фармацевтически приемлемые вспомогательные вещества известны в отрасли, и являются относительно инертными соединениями, улучшающими введение фармакологически эффективного соединения. Например, вспомогательное вещество может быть представлено или действовать как разбавитель. Приемлемые вспомогательные вещества включают, но не ограничиваются следующими: стабилизаторы, увлажнители и эмульгаторы, соли для регулирования осмолярности, капсулирующие агенты, буферы и улучшители проникновения через кожу. Вспомогательные вещества, а так же композиции для парентерального и непарентерального введения лекарства описаны в Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000.
Обычно, для введения анти-CXCR4 антитела, его антиген-связывающего фрагмента и/или анти-CXCR4 конъюгата антитело-лекарство, первоначальная доза может составлять приблизительно 2 мг/кг. Для целей данного изобретения, типичная дневная доза находится в диапазоне от приблизительно 3 мкг/кг до 30 мкг/кг, до 300 мкг/кг, до 3 мг/кг, до 30 мг/кг, до 100 мг/кг или больше, в зависимости от вышеприведенных факторов. Например, может быть использована доза приблизительно 1 мг/кг, приблизительно 2,5 мг/кг, приблизительно 5 мг/кг, приблизительно 10 мг/кг, и приблизительно 25 мг/кг. Для повторного введения на протяжении нескольких дней или дольше, в зависимости от состояния, лечение продолжают до получения делаемое угнетения симптомов или до достижения достаточного терапевтического уровня, например, ингибирование или задержка роста/прогрессирования опухоли или метастазирования раковых клеток. Типичный режим дозировки включает введение дозы приблизительно 2 мг/кг, затем недельной дозы в приблизительно 1 мг/кг анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, или затем дозы в приблизительно 1 мг/кг каждую следующую неделю. Другой типичный режим дозировки включает введение повышенных доз (например, исходная доза 1 мг/кг и постепенное увеличение до одной или больше более высоких доз каждую неделю или дольше). Так же применяют другие режимы дозировок, в зависимости от модели фармакокинетического распада, которую желают получить. Например, в некоторых аспектах, дозировку рассчитывают от одного до четырех раз в неделю. В других аспектах, дозировку рассчитывают один раз в месяц или один раз через месяц, или каждые три месяца. Прогресс такой терапии легко отлеживать с помощью стандартных техник и анализов. Режим дозирования (включая использованные анти-CXCR4 антитело, его антиген-связывающие фрагменты, или анти-CXCR4 конъюгат антитело-лекарство) можно изменять со временем.
Для целей данного изобретения, подходящая доза анти-CXCR4 антитела, его антиген-связывающего фрагмента, или конъюгата анти-CXCR4 антитела, зависит от примененного анти-CXCR4 антитела, его антиген-связывающего фрагмента, или CXCR4 конъюгата антитело-лекарство (или их композиции), типа и тяжести симптомов, которые лечат, вводят ли агент с терапевтической целью, предыдущего лечения, клинической истории пациента и ответа на агент, скорости клиренса введенного агента у пациента, и предписания лечащего врача. Обычно врач вводит анти-CXCR4 антитело, его антиген-связывающий фрагмент или анти-CXCR4 конъюгат антитело-лекарство до достижения дозы, обеспечивающей желаемый результат. Доза и/или частота могут изменять в течении курса лечения. Эмпирические факторы, такие как период полураспада, обычно имеют значение при определении дозы. Например, антитела, совместимые с человеческой иммунной системой, такие как гуманизированные антитела или полностью человеческие антитела, могут быть использованы для пролонгирования периода полураспада антитела и предотвращения атаки на антитело иммунной системой хозяина. Частота введения определяется и устанавливается на протяжении лечения и обычно, но не обязательно, основана на лечении и/или угнетении и/или улучшении и/или задержке симптомов, например, ингибировании или задержки роста опухоли и т.д. Альтернативно, композиции с постоянным непрерывным высвобождением анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство, могут быть желаемыми. В отрасли известны различные композиции с непрерывным высвобождением.
В некоторых аспектах изобретения, дозировки анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство могут быть установлены эмпирически для индивидуума, которому один раз или больше вводили анти-CXCR4 антитела, их антиген-связывающие фрагменты или анти-CXCR4 конъюгат антитело-лекарство. Индивидуумы получают постепенно увеличиваемые дозы анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство. Для оценки эффективности, следят за показателями заболевания.
Введение анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство согласно способу данного изобретения может быть непрерывным или периодичным, в зависимости от, например, физиологического состояния пациента, того или целью введения является лечение или профилактика, и других факторов, известных специалистам. Введение анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство может быть по сути непрерывным на протяжении выбранного периода времени или может проходить в виде серии поделенных доз.
В некоторых аспектах изобретения, может присутствовать более чем одно анти-CXCR4 антитело, его антиген-связывающий фрагмент или анти-CXCR4 конъюгат антитело-лекарство. Может присутствовать как минимум одно, как минимум два, как минимум три, как минимум четыре, как минимум пять разных или более анти-CXCR4 антител, их антиген-связывающих фрагментов или анти-CXCR4 конъюгатов антитело-лекарство. В целом, эти анти-CXCR4 антитела, их антиген-связывающие фрагменты или анти-CXCR4 конъюгаты антитело-лекарство могут иметь комплементарную активность, негативно не влияющую друг на друга. Например, может использоваться одно или больше следующих анти-CXCR4 антител: первое анти-CXCR4 антитело, направленное на один эпитоп на CXCR4, и второе анти-CXCR4 антитело, направленное на другой эпитоп на CXCR4.
Терапевтические композиции анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство, используемые согласно данного изобретения, получают для хранения путем смешивания антитела с желаемым уровнем чистоты с необязательными фармацевтически приемлемыми носителями, вспомогательными веществами или стабилизаторами (Remington, The Science and Practice of Pharmacy 21st Ed. Mack Publishing, 2005), в виде лиофиллизованных композиций или водных растворов. Приемлемые носители, вспомогательные вещества или стабилизаторы не являются токсичными для реципиента в применяемых дозах и концентрациях, и могут содержать буферы, такие как фосфорная, лимонная и другие органические кислоты; соли, такие как хлорид натрия; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензол аммония хлорид; гексаметония хлорид; бензалкония хлорид, бензетония хлорид; фнол, бутил или бензиловый спирт; алкил парабены, такие как метил или пропил парабен; катехол; резорцинол; циклогексанол; 3-пентанол; и m-крезол); низкомолекулярные (менее 10 остатков) полипептиды; протеины, такие как сывороточный альбумин, желатин, или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды, и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как цукроза, маннит, трегалоза или сорбитол; соль-образующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-протеин); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Липосомы, содержащие анти-CXCR4 антитело, его антиген-связывающий фрагмент или анти-CXCR4 конъюгат антитело-лекарство, получают с помощью известных в отрасли способов, таких как описаны в Epstein, et al., Proc. Natl. Acad. Sci. USA 82:3688 (1985); Hwang, et al., Proc. Natl Acad. Sci. USA 77:4030 (1980); и патнтах США №4,485,045 и 4,544,545. Липосомы с улучшенным временем циркуляции описаны в Патенте США №5,013,556. Особенно приемлемые липосомы могут быть получены способом обращено-фазового выпаривания с жировой композицией, содержащей фосфатидилхолин, холестерин и PEG-дериватизированный фосфатидилэтаноламин (PEG-РЕ). Липосомы продавливают через фильтры с установленным размером пор с получением липосом желаемого диаметра.
Активные ингредиенты так же могут быть заключены в микрокапсулы, полученные, например, с помощью техник коацервации или межфазной полимеризации, например, гидроксиметилцеллюлоза или желатин-микрокапсулы и поли-(метилметакрилат) микрокапсулы, соответственно, в коллоидные системы доставки лекарств (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие техники описаны в Remington, The Science and Practice of Pharmacy 21st Ed. Mack Publishing, 2005.
Могут быть получены препараты с непрерывным высвобождением. Приемлемые примеры препаратов с непрерывным высвобождением включают полунепроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, где матрицы имеют вид оформленных частиц, например, пленки или микрокапсулы. Примеры матриц с непрерывным высвобождением включают полиэстеры, гидрогели (например, поли(2-гидроксиэтил-метакрилат), или поливиниловый спирт)), полилактиды (патент США №3,773,919), сополимеры L-глутаминовой кислоты и 7 этил-L-глутамата, неразлагаемый этилен-винил ацетат, разлагамые сополимеры молочная кислота-гликолевая кислота, такие как LUPRON DEPOT ™ (инъектируемые микросферы, состоящие из сополимера молочная кислота-гликолевая кислота и лейпролид ацетата), цукрозы ацетат изобутират, и поли-D-(-)-3-гидроксимасляная кислота.
Композиции для введения in vivo должны быть стерильными. Стерильность достигается, например, фильтрованием через сетрильный фильтровальные мембраны. Терапветические композиции анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство обычно помещают в контейнер со стерильным входом, например, пакет с внутривенным раствором или сосуд с пробкой, поддающейся прокалыванию подкожной инъекционной иглой.
Композиции данного изобретения могут находится в отдельных дозированных формах, таких как таблетки, пилюли, капсулы, порошки, гранулы, растворы или суспензии, или суппозитории для орального, парентерального или ректального введения, или введения путем ингаляции или инсуффляции.
Для получения твердых композиций, таких как таблетки, главный активный ингредиент смешивают с фармацевтическим носителем, например, стандартные ингредиенты для таблетирования, такие как кукурузный крахмал, лактоза, цукроза, сорбитол, тальк, стеариновая кислота, стеарат магния, фосфат кальция или смолы, и другие фармацевтические разбавители, например, вода для формирования твердой предварительной композиции, содержащей гомогенную смесь соединения данного изобретения или его нетоксичную фармацевтически приемлемую соль. Когда такие предварительные композиции являются гомогенными, это означает, что активный ингредиент равномерно распределен в композиции, так что композиция может быть легко поделена на равные по эффективности дозированные формы, такие как таблетки, пилюли и капсулы. Такая твердая предварительная композиция затем делится на дозированные формы, содержащие от 0,1 до приблизительно 500 мг активного ингредиента данного изобретения. Таблетки или пиллюли новой композиции могут быть покрыты или другим образом компаундированы для получения дозированной формы с пролонгированным действием. Например, таблетка или пилюля может содержать внешний и внутренний компонент дозированной формы, где внешний компонент имеет вид оболочки поверх внутреннего. Два компонента могут быть разделены кишечным слоем, которые предупреждает разложение в желудке и позволяет внутреннему компоненту попасть невредимым в 12-перстную кишку или иметь отсроченное высвобождение. Различные материалы используют для таких кишечных покрытий, такие материалы включают большое количество полимерных кислот и смесей полимерных кислот с такими материалами как шеллак, цетиловый спирт или ацетат целлюлозы.
Приемлемые поверхностно-активные агенты включают, например, неионные агенты, такие как полиоксиэтиленсорбитаны (например, Tween™ 20, 40, 60, 80 или 85) и другие сорбитаны (например, Span™ 20, 40, 60, 80 или 85). Композиции с поверхностно-активным агентом обычно содержат 0,05-5% поверхностно-активного агента, или 0,1-2,5%. Понятно, что в случае необходимости, так же могут быть добавлены другие ингредиенты, например, манит, или другие фармацевтически приемлемые наполнители.
Приемлемые эмульсии могут быть получены, используя коммерчески доступные жировые эмульсии, такие как Intralipid™, Liposyn™, Infonutrol™, Lipofundin™ и Lipiphysan™. Активный ингредиент может быть растворен в предварительно смешанной эмульсионной композиции, или альтернативно может быть растворен в масле (например, соевое масло, масло сафлора, масло хлопчатника, кунжутное масло, кукурузное масло или миндальное масло) и эмульсии, образованной смешиванием с фосфолипидом (например, фосфолипиды яйца, фосфолипиды сои или соевый лецитин) и водой. Понятно, что так же могут быть добавлены другие ингредиенты, например, глицерин или глюкоза, для регулирования тоничности эмульсии. Приемлемые эмульсии обычно содержат до 20% масла, например, 5-20%. Жирная эмульсия может включать капли жира от 0,1 до 1,0 мкМ, а именно, 0,1-0,5 мкМ, и иметь рН в диапазоне 5,5-8,0.
Эмульсионные композиции могут быть получены смешиванием анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство с Intralipid™ или его компонентами (соевое масло, фосфолипиды яйца, глицерин и вода).
Композиции для ингаляций и инсуффляций включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смесях, и порошки. Жидкие или твердые композиции могут содержать приемлемые фармацевтически приемлемые вспомогательные вещества, как описано выше. В некоторых аспектах изобретения, композиции вводят орально или назально для получение локального или системного эффекта. Композиции в желательно стерильных фармацевтически приемлемых растворителях могут быть распылены с использованием газов. Распыляемые растворы могут вдыхаться непосредственно из распылителя, или распылитель может быть прикреплен к лицевой маске, тампону или дыхательному устройству позитивного давления с периодичным действием. Растворенные, суспензионные или порошковые композиции могут быть введены, желательно орально или назально, из устройств, доставляющих композицию нужным образом.
Композиции
Композиции, использованные в способах изобретения, содержат эффективное количества анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство, как описано в данном документе. Примеры таких композиций, а так же того как их получать, описаны ранее и далее. В некоторых аспектах изобретения, композиция содержит одно или больше анти-CXCR4 антител, их антиген-связывающих фрагментов или анти-CXCR4 конъюгатов антитело-лекарство. Например, анти-CXCR4 антитело распознает человеческие CXCR4. В некоторых аспектах, CXCR4 антитело является человеческим антителом, CDR-привитым, гуманизированным антителом, или гибридным антителом. В других аспектах, анти-CXCR4 антитело содержит константный участок, способный вызывать желаемый иммунный ответ, например, антитело-опосредованный лизис или ADCC. В других аспектах, анти-CXCR4 антитело содержит константный участок, не вызывающий нежелательный или неблагоприятный иммунный ответ, например, антитело-опосредованный лизис или ADCC. В некоторых аспектах изобретения, анти-CXCR4 антитело содержит один или больше CDR анти-CXCR4 антитела или анти-CXCR4 или его антиген-связывающего фрагмента, как описано в данном документе (например, один, два, три, четыре, пять или, в некоторых вариантах осуществления, все шесть CDR).
Понятно, что композиции могут содержать более одного анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство (например, смесь анти-CXCR4 антител, распознающих разные эпитопы CXCR4). Другие композиции содержат более одного анти-CXCR4 антитело, антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство, распознающих один и тот же эпитоп(ы), или разные виды анти-CXCR4 антител, их антиген-связывающих фрагментов или анти-CXCR4 конъюгатов антитело-лекарство, связывающих разные эпитопы CXCR4 (например, человеческие CXCR4).
Композиция, использованная в данном изобретении, так же может содержать фармацевтически приемлемые носители, вспомогательные вещества или стабилизаторы (Remington: The Science and practice of Pharmacy 21st Ed., 2005, Lippincott Williams and Wilkins, Ed. K.E. Hoover), в виде лиофиллизированных композиций или водных растворов. Приемлемые носители, вспомогательные вещества, или стабилизаторы являются нетоксичными для рецепиента в дозах и концентрациях, и могут содержать буферы, такие как такие как фосфорная, лимонная и другие органические кислоты; соли, такие как хлорид натрия; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензол аммония хлорид; гексаметония хлорид; бензалкония хлорид, бензетония хлорид; фнол, бутил или бензиловый спирт; алкил парабены, такие как метил или пропил парабен; катехол; резорцинол; циклогексанол; 3-пентанол; и m-крезол); низкомолекулярные (менее 10 остатков) полипептиды; протеины, такиекак сывароточный альбумин, желатин, или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды, и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как цукроза, маннит, трегалоза или сорбитол; соль-образующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-протеин); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG). Фармацевтически приемлемые вспомогательные вещества описаны далее.
Наборы
Изобретение так же относится к наборам, применяемым в данных способах. Наборы изобретения включают один или больше контейнеров, содержащих анти-CXCR4 антитело, его антиген-связывающий фрагмент или анти-CXCR4 конъюгат антитело-лекарство, как описано в данном документе, и инструкции для применения согласно с любым из способов изобретения, описанных в данном документе. Обычно, эти инструкции содержат описание введения анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство для вышеуказанного терапевтического лечения.
Инструкции, относящиеся к применению анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство, как описано в данном документе, обычно включают информацию о дозировке, графике доизрования и пути введения для предназначенного лечения. Контейнеры могут содержать одну дозу, упаковки россыпью (например, много-дозовые пакеты) или субъединичные дозы. Инструкции, поставляющиеся с наборами изобретения обычно написаны на упаковке или вставлены внутрь упаковки (например, бумажный лист, включенный в набор), но так же применимы машиночитаемые инструкции (например, инструкции, нанесенные на магнитный или оптический диск).
Наборы данного изобретения находятся в приемлемой упаковке. Приемлемые упаковки включают, но не ограничиваются следующими: склянки, бутылочки, банки, гибкая упаковка (например, герметичный майлар или пластиковые пакеты), и т.д. Также используют упаковки для применения в комбинации с определенным устройством, таким как ингалятор, устройство для назального введения (например, распылитель) или устройство для инфузий, такое как минипомпа. Набор может иметь стерильный вход (например, контейнером может быть пакет с внутривенным раствором или сосуд с пробкой, прокалываемой подкожной инъективной иглой). Как минимум один активный агент в композиции является анти-CXCR4 антителом. Контейнер так же может содержать второй фармацевтически активный агент.
Наборы так же могут необязательно включать дополнительные компоненты, такие как буферы и интерпретируемую информацию. В норме, набор содержит контейнер и этикетку поверх или вкладыш внутри контейнера.
Мутации и модификации
Для экспрессии анти-CXCR4 антител их антиген-связывающих фрагментов данного изобретения, сначала получают фрагменты ДНК, кодирующие VH и VL участки, используя любые описаны выше способы. Различные модификации, например, мутации, замещения, делеции и/или добавления так же могут быть введены в последовательности ДНК, используя стандартные в отрасли способы. Например, мутагенез может быть осуществлен согласно стандартным способам, таким как ПЦР-опосредованный мутагенез, где мутированные нуклеотиды встраивают в ПЦР праймеры, так чтобы ПЦР продукт содержал желаемые мутации, или сайт-направленный мутагенез.
Одним из видов замещения, который может быть осуществлен, является замена одного или больше цистеинов в антителе, которое может быть химически реактивным, на другой остаток, такой как, аланин или серин, но не ограничиваясь ими. Например, возможно замещение не усредненного цистеина. Замещение можно осуществить в CDR или каркасном участке вариабельного домена, или в константном участке антитела. В некоторых аспектах изобретения, цистеин является усредненным.
Антитела так же могут быть модифицированы, например, в вариабельных доменах тяжелой и/или легкой цепи, например, для изменения связывающих свойств антитела. Например, мутацию можно сделать в одном или больше CDR участках для повышения или снижения KD антитела к CXCR4, для повышения или снижения koff, или для изменения специфичности связывания антитела. Техники сайт-направленного мутагенеза хорошо известны в отрасли. Смотреть, например, Sambrook et al. and Ausubel et al., выше.
Модификация или мутация так же может быть осуществлена в каркасном участке или константном участке для увеличения периода полураспада анти-CXCR4 антитела. Смотреть, например, РСТ публикация WO 00/09560. Мутация в каркасном или константном участке так же может быть осуществлена для изменения иммуногенности антитела, с целью обеспечения сайта для ковалентного или нековалентного связывания с другой молекулой или для изменения таких свойств как фиксация комплемента, FcR связывание и антитело-зависимая клеточно-опосредованная цитотоксичность. Согласно изобретению, отдельное антитело может иметь мутации в одном или больше CDR или каркасных участках вариабельного домена или в константном участке.
В процессе, известном как "гуманизирование", определенные аминокислоты в последовательностях VH и VL могут быть мутированы для соответствия природным аминокислотам, имеющимся в человеческих VH и VL последовательностях. А именно, аминокислотные последовательности каркасных участков в VH и VL последовательностях могут быть мутированы для соответствия человеческим последовательностям, с целью снижения риска иммуногенности при введении антитела. ДНК последовательности зародышевой линии для человеческих VH и VL генов известны в отрасли (смотреть, например, "Vbase" база данных человечески последовательностей зародышевой линии; так же смотреть Kabat, Е.A., et al. (1991), Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Tomlinson et al., J. Mol. Biol. 227:776-798 (1992); and Cox et al., Eur. J. Immunol. 24:827-836 (1994).
Другим типом аминокислотного замещения является удаление потенциальных протеолитических сайтов в антителе. Такие сайты могут возникать в CDR или каркасном участке вариабельного домена или в константном участке антитела. Замещение остатков цистеина и удаление протеолитических сайтов может снизить риск гетерогенности в продукте антитела, и таким образом, повысить его гомогенность. Другим типом аминокислотного замещения является удаление пар аспарагин-глицин, образующих потенциальные сайты деамидирования, путем замены одного или обоих остатков. В другом примере, может быть расщеплен С-терминальный лизин тяжелой цепи анти-CXCR4 антитела изобретения. В различных аспектах изобретения, тяжелая и легкая цепь анти-CXCR4 антитела может необязательно включать сигнальную последовательность.
После получения ДНК фрагментов, кодирующих VH и VL сегменты данного изобретения, эти фрагменты ДНК могут использоваться в стандартных техниках рекомбинантной ДНК, например, для превращения генов вариабельного участка в гены непроцессированной цепи антитела, в гены Fab фрагмента, или в ген scFv. В таких манипуляциях, VL- или VH-кодирующий фрагмент ДНК является операбельно связанным с другим фрагментом ДНК, кодирующим другой протеин, таким как константный участок антитела или пластичный линкер. Термин "операбельно связанный", как использовано в данном контексте, означает, что два фрагмента ДНК соединены так, что аминокислотные последовательности, кодируемые двумя фрагментами ДНК, остаются в рамке.
Выделенная ДНК, кодирующая VH участок, может быть преобразована в ген непроцессированной тяжелой цепи путем операбельного связывания VH-кодирующей ДНК с другой молекулой ДНК, кодирующей константные участки тяжелой цепи (СН1, СН2 и СН3). Последовательности генов константных участков человеческой тяжелой цепи известны в отрасли (смотреть, например, Kabat, Е.A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, включающие эти участки, могут быть получены ПЦР-амплификацией. Константный участок тяжелой цепи может быть константным участком IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее желательно является константным участком IgG1 или IgG2. Последовательность константного участка IgG может быть представлена любым из многочисленных аллелей или аллотипов, существующих у разных индивидуумов, например, Gm(1), Gm(2), Gm(3) и Gm(17). Эти аллотипы представляют собой природное аминокислотное замещение в константном участке IgG1. Для Fab фрагмента гена тяжелой цепи, VH-кодирующая ДНК может быть операбельно связана с другой молекулой ДНК, кодирующей только СН1 константный участок тяжелой цепи. СН1 константный участок тяжелой цепи может происходить от любого гена тяжелой цепи.
Выделенная ДНК, кодирующая VL участок, может быть преобразована в ген непроцессированной легкой цепи (а так же ген Fab легкой цепи) путем операбельного связывания VL-кодирующей ДНК с другой молекулой ДНК, кодирующей константный участок, CL, легкой цепи. Последовательности генов константных участков человеческой легкой цепи известны в отрасли (смотреть, например, Kabat, Е.A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242) и фрагменты ДНК, включающие эти участки, могут быть получены ПЦР-амплификацией. Константный участок легкой цепи может быть каппа или лямбда константным участком. Каппа константный участок может быть представлен любым из многочисленных аллелей или аллотипов, существующих у разных индивидуумов, например Inv(1), Inv(2) и Inv(3). Лямбда константный участок может происходить из любого из трех лямбда генов.
Для получения гена scFv, фрагменты ДНК, кодирующие VH и VL, являются операбельно связанными с другим фрагментом, кодирующим пластичный линкер, например, кодирующим аминокислотную последовательность (Gly4 -Ser)3, (SEQ ID NO: 80), так что VH и VL последовательности могут быть экспрессированы в виде непрерывного одноцепочечного протеина, с VL и VH участками, присоединенными пластичным линкером (смотреть, например, Bird et al., Science 242:423-426 (1988); Huston et al., Proc. Natl. Acad. Sci. USA 85:5879-5883 (1988); McCafferty et al., Nature 348:552-554 (1990). Одноцепочечное антитело может быть моновалентным, при использовании только одной VH и VL, бивалентным, при использовании двух VH и VL, или поливалентным, при использовании более двух VH и VL. Могут быть получены биспецифичные или поливалентные антитела, связывающиеся с CXCR4 и другой молекулой.
В некоторых аспектах изобретения, может быть получено гибридное антитело или иммуноадгезин, содержащие все или часть анти-CXCR4 антитела изобретения, связанную с другим полипептидом. В других аспектах, только вариабельные домены анти-CXCR4 антитела связаны с полипептидом. В некоторых аспектах изобретения, VH домен анти-CXCR4 антитела связан с первым полипептидом, в то время как VL домен анти-CXCR4 антитела связан со вторым полипептидом, который взаимодействует с первым полипептидом таким образом, что VH и VL домены могут взаимодействовать один с другим с образованием сайта связывания антигена. В других аспектах, VH домен отделен от VL домена линкером, так что VH и VL домены могут взаимодействовать один с другим. VH-линкер- VL антитело затем связывается с желаемым полипептидом. Более того, могут быть образованы гибридные антитела, где два (или больше) одноцепочечных антитела связаны друг с другом. Это необходимо, если нужно создать дивалетное или поливалентное антитело на одной полипептидной цепи, или если нужно создать биспецифичное антитело.
В некоторых аспектах изобретения, другие модифицированные антитела могут быть получены, используя анти-CXCR4 антитело, кодируемое молекулами нуклеиновой кислоы. Например, "каппа тела" (Ill et al., Protein Eng. 10:949-57 (1997)), "Minibodies" (Martin et al., EMBO J., 13:5303-9 (1994)), "диатела" (Holliger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993)), или "Janusins" (Traunecker et al., EMBO J. 10:3655-3659 (1991) and Traunecker et al., Int. J. Cancer (Suppl.) 7:51-52 (1992)) могут быть получены, используя стандартные техники молекулярной биологии, следуя инструкциям описания.
Биспецифичные антитела или их антиген-связывающие фрагменты могут быть получены, используя различные способы, включая слитие гибридом или связывание Fab' фрагментов. Смотреть, например, Songsivilai & Lachmann, Clin. Exp.Immunol. 79:315-321 (1990), Kostelny et al., J. Immunol. 148:1547-1553 (1992). Кроме того, биспецифичные антитела могут быть формированы как "диатела" или "Janusins." В некоторых аспектах изобретения, биспецифичное антитело связывается с двумя разными эпитопами CXCR4. В некоторых аспектах, описанные выше модифицированные антитела получают, используя один или больше вариабельных доменов или CDR участков из анти-CXCR4 антитела данного документа.
В одном аспекте, данное изобретение включает применение многоспецифичных антител. Многоспецифичное антитело является антителом, которое может одновременно связываться с как минимум двумя целями, имеющими различную структуру, например, двумя разными антгенами, двумя разными эпитопами на одном антигене, или гаптеном и/или антигеном или эпитопом. Многоспецифичные, поливалентные антитела являются конструктами, имеющими более одного сайта связывания, и сайты связывания имеют разную специфичность.
Репрезентативные материалы данного изобретения депонированы в Американской Коллекции Культур (АТСС) 19 июня 2014 года. Вектор с АТСС номером доступа РТА-121353 является полинуклеотидом, кодирующим вариабельный участок тяжелой цепи гуманизированного анти-CXCR4 антитела, и вектор с АТСС номером доступа РТА-121354 является полинуклеотидом, кодирующим вариабельный участок легкой цепи гуманизированного анти-CXCR4 антитела. Депонирование осуществляли согласно Будапештскому Соглашению о международном признании депонированных микроорганизмов с целью патентной процедуры (Будапештское Соглашение). Это обеспечивает жизнеспособными культурами на 30 лет от даты депонирования. Депозит доступен под номером АТСС в термины определенные Будапештским Соглашением, и является объектом соглашения между Pfizer, Inc. и АТСС, что обеспечивает постоянный и неограниченный доступ к потомству культуры депозита после выдачи патента США или после публикации патентной заявки США или международной патентной заявки, в зависимости от того, что будет первым, и обеспечивает доступ к потомству представителю, определенному Уполномоченным США по патентам и товарным знакам, указанному в заглавии согласно 35 U.S.С. Секция 122 и правилам Уполномоченных (включая 37 C.F.R. Секция 1,14 со ссылкой на 886 OG 638).
Правопреемник данной заявки согласился с тем, что если культура материалов в депозитарии погибнет или утратится или разрушится, при культивировании в приемлемых условиях, то материалы будут быстро заменены другими. Доступность депонированного материала не рассматривается как лицензия для использования изобретения, в нарушение прав, данных владельцу правительством согласно патентного права.
Изобретение так же относится к применению этих анти-CXCR4 антител, например, непроцессированных антител, их антиген-связывающих фрагментов, или анти-CXCR4 конъюгатов антитело-лекарство, и фармацевтических композиций, содержащих CXCR4 рецептор антитела, например, непроцессированного антитела или его антиген-связывающих фрагментов, в лечении заболеваний и состояний, ассоциированных с модуляцией CXCR4, таких как трансплантация костного мозга, химиосенсибилизация, рак, метазстазы (например, рак), аутоиммунное заболевание (например, ревматоидный артрит), фиброз (например, легочный), ВИЧ инфекция, сердечно-сосудистые заболевания, увеит, воспалительные заболевания, глютеновая болезнь, и восстанавливающая медицина на основе стволовых клеток.
Рак
CXCR4 рецептор надэкспрессируется при большинстве видов рака, включая, но не ограничиваясь раком молочной железы (Muller, A. et al. Nature 410:50-56(2001)); яичников (Scotton, С. et al. Br. J. Cancer 85:891-897 (2001); простаты (Taichman, R.S. et al. Cancer Res. 62:1832-1837(2002); немелкоклеточным раком легких (Spano J.P. et al. Ann. Oncol. 15:613-617 (2004)); раком поджелудочной железы (Koshiba, Т. et al. Clin. Cancer Res. 6:3530-3535 (2000)); раком щитовидной железы (Hwang, J.H. et al. J. Clin. Endocrinol. Metab. 88:408-416(2003)); носоглоточной карциномой (Wang, N. et al. J. Transl. Med. 3:26-33 (2005)); меланомой (Scala, S. et al. Clin. Cancer Res. 11:1835-1841 (2005)); почечной карциномой (Staller, P. et al. Nature 425:307-311 (2003)); лимфомой (Bertolini, F. et al. Cancer Res. 62:3530-3535 (2002)); нейробластомой (Geminder, H. et al. J. Immunol. 167:4747-4757 (2001)); глиобластомой (Rempel, S.A. et al. Clin. Cancer Res. 6:102-111 (2000)); рабдомиосаркомой (Libura, J. et al. Blood 100:2597-2606 (2002)); раком толстой и прямой кишки (Zeelenberg, I.S. et al. Cancer Res. 63:3833-3839 (2003)); раком почек (Schrader, A.J. et al. Br. J. Cancer 86:1250-1256(2002)); остеосаркомой (Laverdiere, C. et al. Clin. Cancer Res. 11:2561-2567 (2005)); острой лимфобластической лейкемией (Crazzolara, R. et al. Br. J. Haematol. 115:545-553 (2001)); и острой миелоидной лейкемией (Rombouts, E.J.C. et al. Blood 104:550-557 (2004)).
В виду вышеуказанного, анти-CXCR4 антитело, его антиген-связывающие фрагменты, или анти-CXCR4 конъюгат антитело-лекарство данного описания может быть использовано для лечения рака, включая, но не ограничиваясь средующими: рак молочной железы, рак яичников, рак простаты, немелкоклеточный рак легких, рак поджелудочной железы, рак щитовидной железы, носоглоточная карцинома, меланома, почечноклеточная карцинома, лимфома, нейробластома, глиобластома, рабдомиосаркома, рак толстой и прямой кишки, рак почек, остеосаркома, острая лимфоцитарная лейкемия (ALL), острая миелоидная лейкемия (AML), хроническая (CLL), мелкоклеточная лимфоцитарная лимфома (SLL), множественная миелома (ММ), неходжкинская лимфома (NHL), Ходжкинская лимфома, мантийноклеточная лимфома (MCL), фолликулярная лимфома, макроглобулинемия Вальденстрема (WM), и В-клеточная лимфома и диффузная В-крупноклеточная лимфома (DLBCL). Антитело может быть использовано отдельно или в комбинации с другим лечением рака, таким как хирургия и/или облучение, и/или с другими противоопухолевыми средствами, такими как вышеописанные противоопухолевые средства, включая химиотерапевтические лекарства и другие противоопухолевые антиген антитела, такие как связывающиеся с CD20, Her2, PSMA, Campath-1, EGFR и т.д.
В некоторых аспектах, анти-CXCR4 антитела данного изобретения могут быть использованы в комбинации с анти CD22 или анти CD33 антителами, конъюгатами антитело-лекарство или композициями, содержащими такие антитела. Например, анти-CXCR4 антитела данного изобретения могут быть скомбинированы с инотузумаб озогамицином или гемтузумаб озогомицином (Mylotarg®).
"Комбинированная терапия" или введение "в комбинации с" одним или больше дополнительными терапевтическими агентами, включает одновременное, конкуретное и последовательное введение в любом порядке. Введение компонентов комбинированных препаратов данного изобретения может осуществляться одновременно, по отдельности или последовательно.
Согласно данному изобретению обеспечивается способ лечения рака, включающий одновременное, конкурентное и последовательное введение анти-CXCR4 антитела данного изобретения и инотузумаб озогамицина. Например, анти-CXCR4 антитело может быть введено перед или после или одновременно с инотузумаб озогамицином. Кроме этого, данное изобретение обеспечивается способ лечения рака, такого как AML, включающий одновременное, конкурентное и последовательное введение анти-CXCR4 антитела данного изобретения и Mylotarg. Например, анти-CXCR4 антитело могут быть введены перед или после или одновременно с Mylotarg.
Анти-CXCR4 антитело или его фрагмент может быть конъюгировано с терапевтическим остатком и/или диагностичным агентом, таким как цитотоксин, лекарство (например, иммуносупрессант) или ралиотоксином. Такие конъюгаты называются в данном документе конъюгаты антитело-лекарство. Конъюгат антитело-лекарство может содержать один или больше цитотоксинов.
В некоторых аспектах изобретения, лечение включает введение анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство данного изобретения с одним или больше биоактивными агентами, выбранными из следующих: антитела, факторы роста, гормоны, цитокины, анти-гормоны, ксантины, интерлейкины, интерфероны, и цитотоксичные лекарства. В определенных аспектах изобретения, биоактивный агент означает антитело, и направлен против антигена поверхности клетки, экспрессируемого на злокачественных В-клетках.
В некоторых аспектах изобретения, антитело, направленное против поверхностных антигенов, экспрессируемых на злокачественных В-клетках, выбирают из группы, состоящей из анти-CD19, анти-CD20 и анти-CD33 антител. Такие антитела включают анти-CD20 антитело, ритуксимаб (Rituxan™).
В некоторых аспектах изобретения, биоактивные агенты означают цитокины или факторы роста, и включают, но не ограничиваются следующими: интерлейкин 2 (IL-2), TNF, CSF, GM-CSF и G-CSF. В определенных аспектах изобретения, биоактивные агенты означают гормоны, и включают эстрогены, андрогены, прогетины и кортикостероиды.
В некоторых аспектах изобретения, лекарство означает лекарство, выбранное из следующих: доксорубицин, даунорубицин, идарубицин, акларубицин, зорубицин, митоксантрон, эпирубицин, карубицин, бендамустин, бейяцизумаб, бортесомиб, леналидомид, мелфалан, ногаламицин, меногарил, питарубицин, валрубицин, цитарабин, гемцитабин, трифлуридин, анцитабин, еноцитабин, азацитидин, доксифлуридин, пентостатин, броксуридин, капецитабин, кладрибин, децитабин, флоксуридин, флударабин, доугеротин, пуромицин, тегафур, тиазофурин, адриамицин, цисплатин, карбоплатин, циклофосфамид, дакарбазин, винбластин, винкристин, митоксантрон, блеомицин, меклоретамин, преднизон, прокарбазин метотрексат, фторурацилы, этопозид, таксол, аналоги таксола и митомицин.
В некоторых аспектах изобретения, терапевтически эффективную дозу анти-CXCR4 антитела, его фрагмента или анти-CXCR4 конъюгата антитело-лекарство данного изобретения вводят вместе с одной или больше комбинациями ингибиторов тирозинкиназы. Ингибиторы тирозинкиназы включают как протеиновые, так и непротеиновые остатки. Ингибитором тирозинкиназы может быть, например, антитело, рецепторный лиганд или низкомолекулярный ингибитор. Примеры ингибиторов тирозинкиназы, приемлемых для применения в способах данного изобретения включают, но не ограничиваются следующими: гефитиниб, сунитиниб, эрлотиниб, лапатиниб, канертиниб, семаксиниб, ваталаниб, сорафениб, иматиниб, дасатиниб, лефлуномид, вандетаниб, их производные, аналоги и комбинации. Дополнительные ингибиторы тирозинкиназы, приемлемые для применения в данном изобретении описаны, например, в патентах США №5,618,829; 5,639,757; 5,728,868; 5,804,396; 6,100,254; 6,127,374; 6,245,759; 6,306,874; 6,313,138; 6,316,444, 6,329,380; 6,344,459; 6,420,382; 6,479,512; 6,498,165; 6,544,988; 6,562,818; 6,586,423; 6,586,424; 6,740,665; 6,794,393; 6,875,767, 6,927,293 и 6,958,340.
В некоторых аспектах, терапевтически эффективную дозу анти-CXCR4 антитела, его фрагмента или анти-CXCR4 конъюгата антитело-лекарство данного изобретения вводят вместе с одной или больше комбинацией лекарств, как часть режима лечения, где комбинацию цитотоксических агентов выбираю из: СНОРР (циклофосфамид, доксорубицин, винкристин, преднизон, и прокарбазин); CHOP (циклофосфамид, доксорубицин, винкристин, и преднизон); СОР (циклофосфамид, винкристин, и преднизон); CAP-ВОР (циклофосфамид, доксорубицин, прокарбазин, блеомицин, винкристин, и преднизон); m-BACOD (метотрексат, блеомицин, доксорубицин, циклофосфамид, винкристин, дексаметазон, и лейковорин); ProMACE-МОРР (преднизон, метотрексат, доксорубицин, циклофосфамид, этопозид, лейковорин, мехлоэтамин, винкристин, преднизон, и прокарбазин); ProMACE-CytaBOM (преднизон, метотрексат, доксорубицин, циклофосфамид, этопозид, лейковорин, цитарабин, блеомицин, и винкристин); МАСОР-В (метотрексат, доксорубицин, циклофосфамид, винкристин, преднизон, блеомицин, и лейковорин); МОРР (мехлоэтамин, винкристин, преднизон, и прокарбазин); ABVD (адриамицин/доксорубицин, блеомицин, винбластин, и дакарбазин); МОРР (мехлоэтамин, винкристин, преднизон и прокарбазин) чередующийся с ABV (адриамицин/доксорубицин, блеомицин, и винбластин); МОРР (мехлоэтамин, винкристин, преднизон, и прокарбазин) чередующийся с ABVD (адриамицин/доксорубицин, блеомицин, винбластин, и дакарбазин); ChlVPP (хлорамбуцил, винбластин, прокарбазин, и преднизон); IMVP-16 (ифосфамид, метотрексат, и этопозид); MIME (метил-gag, ифосфамид, метотрексат, и этопозид); DHAP (дексаметазон, высокая доза цитарабина, и цисплатин); ESHAP (этопозид, метилпредизолон, высокая доза цитарабина, и цисплатин); СЕРР(В) (циклофосфамид, этопозид, прокарбазин, преднизон, и блеомицин); CAMP (ломустин, митоксантрон, цитарабин, и преднизон); CVP-1 (циклофосфамид, винкристин, и преднизон), ESHOP (этопозид, метилпредизолон, высокая доза цитарабина, винкристин and цисплатин); EPOCH (этопозид, винкристин, и доксорубицин на протяжении 96 часов с болюсными дозами циклофосфамида и орально преднизона), ICE (ифосфамид, циклофосфамид, и этопозид), СЕРР(В) (циклофосфамид, этопозид, прокарбазин, преднизон, и блеомицин), СНОР-В. (циклофосфамид, доксорубицин, винкристин, преднизон, и блеомицин), СЕРР-В (циклофосфамид, этопозид, прокарбазин, и блеомицин), и P/DOCE (эпирубицин или доксорубицин, винкристин, циклофосфамид, и преднизон).
В некоторых аспектах изобретения, лекарство может быть введено одновременно или последовательно или конкурентно с анти-CXCR4 антителом, его антиген-связывающим фрагментом или анти-CXCR4 конъюгатом антитело-лекарство, как описано в данном документе. Например, анти-CXCR4 антитело, его антиген-связывающий фрагмент или анти-CXCR4 конъюгат антитело-лекарство могут быть введены перед введением одной или больше комбинаций цитотоксических агентов, как часть режима лечения. В некоторых аспектах изобретения, терапевтически эффективную дозу анти-CXCR4 антитела, его антиген-связывающего фрагмента или анти-CXCR4 конъюгата антитело-лекарство вводят вслед за введением одной или больше комбинаций цитотоксических агентов, как часть режима лечения.
В некоторых аспектах изобретения, анти-CXCR4 антитело, его антиген-связывающий фрагмент или анти-CXCR4 конъюгат антитело-лекарство вводят в месте с одной или больше комбинаций цитотоксических агентов, как часть режима лечения.
Анти-CXCR4 антитело, его антиген-связывающий фрагмент или анти-CXCR4 конъюгат антитело-лекарстводанного изобретения так же вводят параллельно с нелекарственным лечением, таким как операция, облучение, химиотерапия, иммунотерапия и режим диета/упражнения. Другое лечение может проводиться конкурентно с, или после лечения анти-CXCR4 антителом, его антиген-связывающим фрагментом или анти-CXCR4 конъюгатом антитело-лекарство данного изобретения. Также может присутствовать задержка в несколько часов, дней и, в некоторых случаях, недель между проведением разных видов лечения, так что анти-CXCR4 антитело, его антиген-связывающий фрагмент или анти-CXCR4 конъюгат антитело-лекарство данного изобретения могут быть введены перед или после другого лечения.
Терапевтическое применение CXCR4
Согласно разным аспектам изобретения, анти-CXCR4 антитела, их антиген-связывающие фрагменты, или анти-CXCR4 конъюгаты антитело-лекарство могут быть использованы для лечения или получения лекарств для лечения различных расстройств, включая разные виды рака, воспалительные расстройства, аллергические расстройства, инфекции (ВИЧ инфекция, и т.д.), аутоиммунные расстройства (например, ревматоидный артрит), фиброзные расстройства (например, легочные), и сердечнососудистые расстройства. Рак включает солидные раковые опухоли (например, рак желудка, головы и шеи, легких, яичников, и поджелудочной железы) и гематологический рак (например, миелодиспластический синдром, миелопролиферативное расстройство и острая лейкемия). Примеры гематопоэтического расстройства включают не-В дифференцированного происхождения, например, острая миелоидная лейкемия (AML), хроническая миелоидная лейкемия (CML), не-В клеточная острая лимфоцитарная лейкемия (ALL), миелодиспластические расстройства, миелопролиферативные расстройства, эритроцитоз, тромбоцитемия или не-В атипичная иммунная лимфопролиферация. Примеры В-клеточного или В клеточного дифференцированного происхождения расстройства включают хроническая лимфоцитарная лейкемия (CLL), В лимфоцитарная лейкемия, множественная миелома, острая лимфобластическая лейкемия (ALL), В-клеточная пролимфоцитарная лейкемия, лимфобластическая лейкемия В-клеток предшественников, волосатоклеточная лейкемия или расстройства клеток плазмы, например, амилоидоз или макроглобулинемия Вальденстрема.
Гематологические Расстройства
Гематологические расстройства включают заболевания крови и всех ее составляющих, а так же заболевания органов и тканей, принимающих участие в выработке или разложении составляющих крови. В некоторых аспектах изобретения, гематологические расстройства включают, но не ограничиваются следующими: острая лимфоцитарная лейкемия (ALL), острая миелоидная лейкемия (AML), хроническая (CLL), мелкоклеточная лимфоцитарная лимфома (SLL), множественная миелома (ММ), неходжкинская лимфома (NHL), Ходжкинская лимфома, мантийноклеточная лимфома (MCL), фолликулярная лимфома, макроглобулинемия Вальденстрема (WM), В-клеточная лимфома и диффузная В-крупноклеточная лимфома (DLBCL). NHL может включать хроническую неходжкинскую лимфому (iNHL) или агрессивную неходжкинскую лимфому (aNHL). В определенных аспектах, субъекты снова заболевают или не поддаются другому лечению. В определенных аспектах, снова заболевают или не поддаются как минимум двум или больше другим лечениям. В некоторых аспектах изобретения, снова заболевают или не поддаются как минимум трем или больше другим лечениям. В некоторых аспектах изобретения, снова заболевают или не поддаются как минимум пяти или больше другим лечениям.
Данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR антитела, в качестве первичной терапевтической композиции для лечения гематологического расстройства. Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела. Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклинального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
Хроничесакя лимфоцитарная лейкемия
CLL клетки экспрессируют высокие уровни CXCR4 (Burger JA, Burger М, Kipps TJ. Chronic lymphocytic leukemia В cells express functional CXCR4 chemokine receptors that mediate spontaneous migration beneath bone marrow stromal cells. Blood. 94:3658-3667 (1999)). Данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR антитело, в качестве первичной терапевтической композиции для лечения В-клеточной хронической лейкемии (CLL). Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела, или смесь поликлональных анти-CXCR4 или моноклональных анти-CXCR4 антител. Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
Другие В-клеточные лимфомы
Экспрессию CXCR4 продемонстрировали в В-клетках (Burger et. al., Chronic lymphocytic leukemia В cells express functional CXCR4 chemokine receptors that mediate spontaneous migration beneath bone marrow stromal cells. Blood. 94:3658-3667 (1999)) и T-клетках (Trentin L, Agostini С, Facco M, et al. The chemokine receptor CXCR4 expressed on malignant В cells and mediates chemotaxis. J Clin Invest. 104:115-121 (1999)) неходскинской лимфомы (NHL). Злокачественные В клетки пациентов с B-NHL экспрессируют функциональные рецепторы CXCR4. Считается, что четкая модель экспрессии хемокинового рецептора принимает участие в направленной миграции и хоуминге клеток лимфомы и позволяет отличить разные подгруппы NHL (Jones D, Benjamin RJ, Shahsafaei A, Dorfman DM. The chemokine receptor CXCR4 expressed in a subset of B-cell lymphomas and is a marker of B-cell chronic lymphoma. Blood. 95:627-632 (2000)). В животной моделе, мышей стимулировали клетками Т-клеточной гибридомы, сконструированными для удержания CXCR4 в цитоплазме. В другой мышиной модели человеческой NHL с высокой степенью дифференцировки, нейтрализация CXCR4 моноклональными антителами ингибирует хоуминг циркулирующих NHL клеток и улучшает выживание (Bertolini F, Dell'Agnola С, Mancuso Р, et al. CXCR4 neutralization, a novel therapeutic approach for NHL. Cancer Res. 62:3106-3112 (2002)). Таким образом, нейтрализация CXCR4 является новым терапевтическим подходом в лечении NHL. Данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR4 антитела, в качестве первичной терапевтической композиции для лечения В-клеточной хронической лимфомы. Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела. Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
CXCR4 при множественной миеломе
Множественная миелома (ММ) является крупным неизлечимым новообразованием клеток плазмы. Хемокиновый рецептор CXCR4 экспрессируется ММ клетках большинства пациентов. Он стимулирует миграцию клеток и хоуминг в костном мозге (ВМ), поддерживает выживание опухолевых клеток и защищает клетки миеломы от апоптоза, вызываемого химиотерапией. Соответственно, анти-CXCR4 антитело, его антиген-связывающий фрагмент или анти-CXCR4 конъюгат антитело-лекарство, содержащий анти-CXCR антитело данного изобретения, которое ингибирует активность CXCR4 (например, антагонист антитела), могут быть использованы для лечения гематологического расстройства, такого как множественная миелома. Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-СХСR4 конъюгатов антитело-лекарство.
CXCR4 при острой лейкемии
Вследствие того, что CXCR4 играет ключевую роль в удержании гематопоэтических клеток-предшественников в костном мозге, несколько групп исследовали роль, которую играет CXCR4 в лейкемии клеток-предшественников. Предшественники В-клеточной острой лимфобластической лейкемии (ALL) экспрессируют функциональные CXCR4 рецепторы (Bradstock KF, Makrynikola V, Bianchi A, Shen W, Hewson J, Gottlieb DJ. Effects of the chemokine stromal cell-derived фактор-1 on the migration and localization of precursor-B acute lymphoblastic leukemia cells within bone marrow stromal layers.Leukemia. 14:882-888 (2000)), которые принимают участие в хоуминге клеток лейкемии в костном мозге комбинированных иммунодефицитных остро диабетических мышей без ожирения (NOD/SCID)(Shen W, Bendall LJ, Gottlieb DJ, Bradstock KF. The chemokine receptor CXCR4 enhances integrin- mediated in vitro adhesion and facilitates engraftment of leukemic precursor-B cells in the bone marrow. Exp Hematol. 29:1439-1447 (2001)). В животной модели Спринкинса и др. (Sipkins DA, Wei X, Wu JW, et al. In vivo imaging of specialized bone marrow endothelial microdomains for tumour engraftment. Nature. 435: 969-973 (2005)) предоставляются четкие данные о том, что функциональный CXCR4 является необходимым для хоуминга клеток ALL в костном мозге. Данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR4 антитела, в качестве первичной терапевтической композиции для лечения острой лимфобластической лейкемии (ALL). Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела.
Более того, терапевтическая композиция данного изобретения может содержать смесь моноклинальных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
CXCR4 при острой миелогенной лейкемии (AML)
Несмотря на общую чувствительность к химиотерапии, длительная выживаемость без болезни при AML остается низкой, в связи с тем, что у большинства пациентов происходит обострение минимальной остаточной болезни (MRD). CXCR4 являются центральными регуляторами сигналов выживания, лежащих в основе резистентности у противораковым лекарствам. Эта концепция поддерживается данными о том, что высокий уровень экспрессии CXCR4 в клетках лейкемии является негативным прогностическим индикатором при AML. Spoo AC, Wierda WG, Burger JA. The CXCR4 score: a new prognostic marker in acute myelogenous leukemia [abstract]. Blood. 104:304a (2004). Данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR4 антитела, в качестве первичной терапевтической композиции для лечения острой миелогенной лейкемия (AML). Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела.
Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
CXCR4 при негематопоэтическом раке
Одной из наиболее интригующих и важных ролей, которую играют хемокины и хемокиновые рецепторы, является регулирование метастазирования солидных опухолей. CXCR4 является одним из наиболее изученных хемокиновых рецепторов, который селективно связывает СХС хемокиновый стромальный клеточный фактор 1 (SDF-1), так же известный как CXCL12 (Fredriksson et. al., Mol Pharmacol. 63:1256-72 (2003)). До сегодняшнего времени было пиродемоснтрировано, что CXCR4 надэкспрессируется в более 20 человеческих злокачественных опухолях, включая рак молочной железы, рак простаты, рак почек, рак толстого кишечника, рак щитовидной железы и рак поджелудочной железы ( et al., Nature 410: 50-6 (2001); Akashi et al. Cancer Sci. 99(3):539-542 (2008);
et al., Nature 410: 50-6 (2001); Akashi et al. Cancer Sci. 99(3):539-542 (2008);  et al. Br J Cancer, 100, 1444-51 (2009); Wang et al., Clin Exp Metastasis, 26, 1049-54.(2009); He X et al., Pathol Res Pract, 206, 712-5. (2010)).
et al. Br J Cancer, 100, 1444-51 (2009); Wang et al., Clin Exp Metastasis, 26, 1049-54.(2009); He X et al., Pathol Res Pract, 206, 712-5. (2010)).
Данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR4 антитела, в качестве первичной терапевтической композиции для лечения негематопоэтического рака. Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела. Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
CXCR4 при раке молочной железы
Высокий уровень экспрессии CXCR4 в неопластичких клетках ассоциирован с относительно незначительной общей выживаемостью пациентов с раком молочной железы (Li YM, Pan Y, Wei Y, et at. Up-regulation of CXCR4 is essential for HER2-mediated tumor metastasis. Cancer Cell. 6:459-469 (2004)). Высокий уровень экспрессии HER2/neu, который наблюдают в приблизительно 30% всех случаев рака молочной железы, так же связан с относительно неутешительными прогнозами. Ли и др. недавно продемонстрировали, что HER2/neu улучшает экспрессии и функцию CXCR4 путем ингибирования разложения CXCR4. (Li YM, Pan Y, Wei Y, et al. Up-regulation of CXCR4 is essential for HER2-mediated tumor metastasis. Cancer Cell. 6:459-469 (2004)). Таким образом, данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR4 антитела, в качестве первичной терапевтической композиции для лечения рака молочной железы. Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела. Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
CXCR4 при раке легких
Мелкоклеточный рак легких (SCLC) является агрессивным быстро метастазирующим новообразованием с высокой склонностью к вовлечению костного мозга. Даже при комбинировании химиотерапии и радиотерапии, 5-летний период выживания составляет только около 5%, вследствие быстро развивающейся резистентности к лекарствам. В клетках SCLC, активация CXCR4 вызывает миграционные и инвазивные ответы и адгезию к стромальным клеткам костного мозга CXCR4- и интегрин-зависимым образом. CXCR4 может направлять схему метастазирования, наблюдаемую у пациентов с SCLC. Таким образом, данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR4 антитела, в качестве первичной терапевтической композиции для лечения рака легких. Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела. Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
CXCR4 при почечно-клеточной карциноме (RCC)
Недавно была изучена роль CXCR4 в mRCC. Результаты продемонстрировали, что сильная экспрессия CXCR4 была связана с плохой выживаемостью пациентов с mRCC (Wang et al., Clin Exp Metastasis, 26, 1049-54(2009); Zhao et al., Mol Biol Rep, 38, 1039-45 (2011)). Более того, результаты в мышиной модели аа, указывали на сильную взаимосвязь между способностью CXCR4-экспрессирующих RCC клеток метастазироваться и уровнем протеина CXCR4 в раковых клетках и экспрессией SDF-1α в органах мишенях. (Motzer et. Al. The New England Journal of Medicine, vol. 335, no. 12, pp. 865-875 (1996)) Соответственно, CXCR4 может быть интересной терапевтической мишенью в комбинированной терапии почечно-клеточной карциномы.
Данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR4 антитела, в качестве первичной терапевтической композиции для лечения почечно-клеточной карциномы (RCC). Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела.
Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
CXCR4 при неонкологических показаниях
Хемокиновые рецепторы экспрессируются во многих специфичных клетках и в определенное время. Они сильно связаны с контролем воспальтельногои иммунного ответа, по средством механизма, с помощью которого их эффекторные клетки аккумулируются в месте, где продуцируется хемокин. Например, было показано, что SDF-1 специфично ингибирует инфекцию Т клетки-направленного (Х4) ВИЧ in vitro (Bleul et al. Nature, 382:829-833(1996), Oberlin et al. Nature, 833-835(1996)). Это означает, что SDF-1 связывается с CXCR4 перед ВИЧ, таким образом, забирая инициативу инфицирования клетки ВИЧ, что приводит к ингибированию ВИЧ инфекции. Более того, ингибитор ВИЧ инфекции является антагонистом CXCR4 (Nat. Med., 4, 72 (1998)).
Соответственно, данное изобретение включает применение анти-CXCR4 антитела, его антиген-связывающего фрагмента, или анти-CXCR4 конъюгата антитело-лекарство, содержащего анти-CXCR4 антитела, в качестве первичной терапевтической композиции для лечения воспалительных и иммунных заболеваний, аллергических заболеваний, инфекции (ВИЧ инфекция, и т.д.), заболеваний ассоциированных с ВИЧ инфекцией (синдром приобретенного иммунодефицита, и т.д.). Такая композиция может содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела. Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство.
WHIM синдром
WHIM синдром является редким наследственным иммунодефицитным расстройством, характеризующимся основными клиническими проявлениями: бородавки, гипогаммаглобулинемия, присутствующие бактериальные инфекции и миелокатексис [McDermott, DH et al. Blood 118 (18): 4957-4962 (2011); Mcermott DH et al. J. Cell. Mol. Med. 15(10): 2071-2081 (2011)]. Миелокатексис также характеризуется как необычное гематологическое расстройство, при котором зрелые нейтрофилы не могут выйти из костного мозга, и количество В- и Т- клеток или функции является дефицитным (Zueler WW et al. N. Engl. J. Med. 270: 699-704 (1964)). Хернандез П.А. и др. Впервые описали, что мутации в CXCR4 связаны с WHIM синдромом, где CXCR4R334X является наиболее частым и изученным вариантом (Hernandez PA et al. Nature Genetics 34: 70-74 (2003)). CXCR4R334X, как мутация с приобретением функции, проявляет улучшенную сигнальную способность к энодгенному лиганду CXCL12. Таким образом, CXCR4R334X повышенная сигнальная способность может быть использована для лечения синдрома WHIM.
В некоторых аспектах изобретения, данное изобретение включает применение конъюгата антитела-лекарство, содержащего анти-CXCR4 антитела, в качестве первичной терапевтической композиции для лечения синдрома WHIM, где указанная композиция моет содержать поликлональные анти-CXCR4 или моноклональные анти-CXCR4 антитела. Более того, терапевтическая композиция данного изобретения может содержать смесь моноклональных анти-CXCR4 антител, направленных на разные неблокируемые CXCR4 эпитопы, или смесь конъюгатов анти-CXCR4 антитело-лекарство из моноклонального анти-CXCR4 и анти-CXCR4 конъюгатов антитело-лекарство. Кроме этого, в некоторых аспектах, терапевтическая композиция, описанная в данном изобретении, может быть введена сама по себе или в комбинации с некоторыми современными лекарствами для лечениями синдрома WHIM, такими как G-CSF (филграстим (Neupogen; Amgen Inc.)), внутривенный иммуноглобулин, и низкомолекулярный CXCR4 антагонист AMD3100 (плериксафор, торговая марка Mozobil (Genyzme Corporation)).
Следующие Примеры приведены с иллюстративной целью, и не ограничивает объем данного изобретения. Более того, различные модификации изобретения, кроме описанных в данном описании, являются очевидными специалистам в отрасли и включены в рамки приложенной формулы изобретения.
Пример 1
Определение аффинности связывания антитела для гибридных анти-CXCR4 мышиных антител
Связывание гибридных мышиных анти-CXCR4 антител 12А11, 6В6 и 3G10 (выраженных как подтип hIgG1) оценивали на CXCR4-экспрессирующих человеческих клетках неходжскинской лимфомы (NHL) Ramos методом проточной цитометрии. 100,000 клеток инкубировали со серийно разведенными анти-CXCR4 антителами в 100 мкл буфера для связывания (PBS + 0,5% BSA), после чего инкубировали с Dylight488-конъюгированным козлиным анти-человеческим Fc вторичным антителом производства Jackson Immunoresearch Laboratories. Получали % путем нормализации значений MFI для каждого разведения к максимальному значению. ЕС50 рассчитывали с помощью программного обеспечения PRISM.
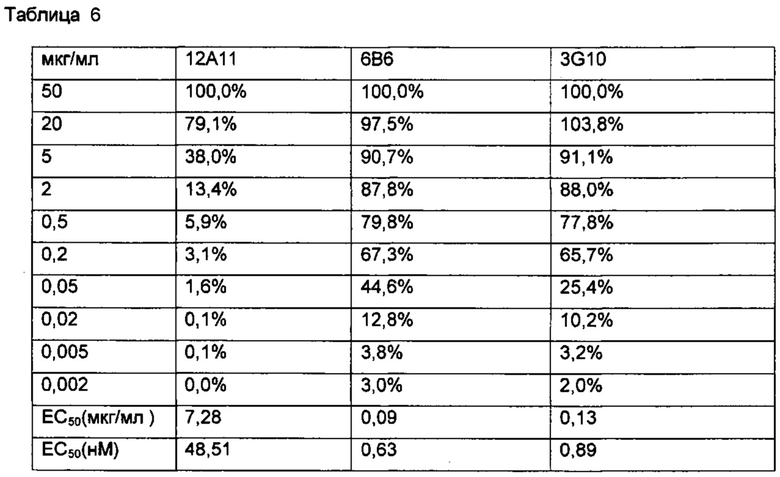
Пример 2
Связывание гуманизированного 3G10 Fab с CXCR4-экспрессирующими HPB-ALL клетками
Связывание гуманизированных 3G10 Fab оценивали на CXCR4-экспрессирующих HPB-ALL клетках проточной цитометрией. 150,000 клеток инкубировали с разными h3G10 Fabs при 2,5 или 0,25 мкг/мл в 100 мкл буфера для связывания (PBS + 0,5% BSA), после чего инкубировали с АРС-конъюгированным козлиным анти-человеческим Fab-специфичным вторичным антителом производства R&D systems.
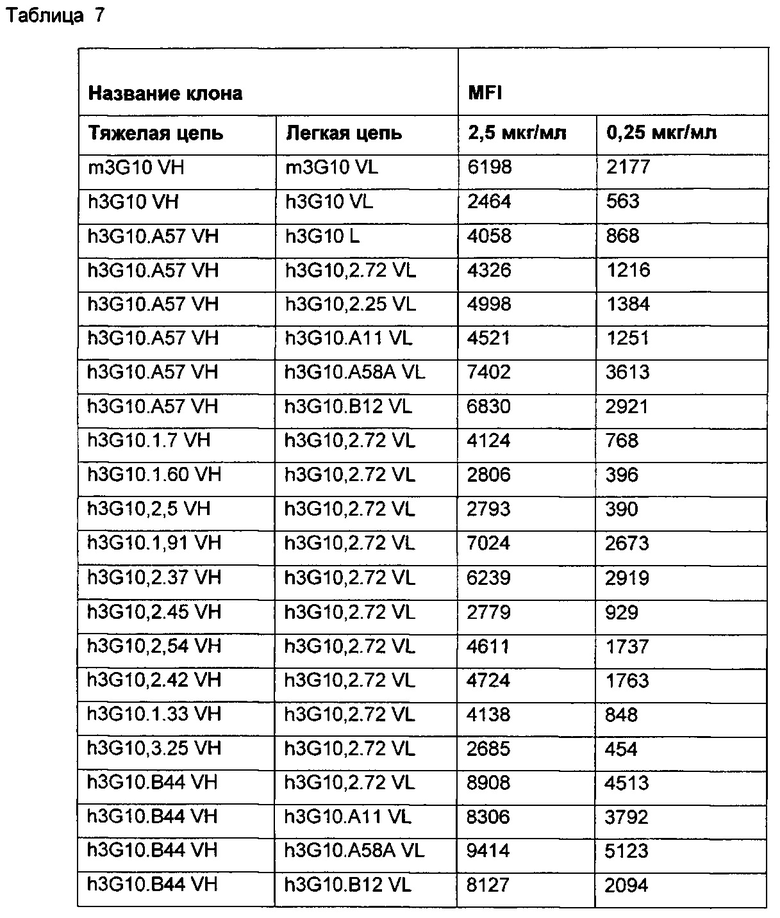
Пример 3
Связывание CXCR4 антитело:клетка и измерение аффинности CXCR4 Ab Fab
Связывание CXCR4 Fab с CXCR4-экспрессирующими клетками определяли проточной цитометрией на клетках HPB-ALL (человеческие Т клетки лейкемии). 150,000 HPB-ALL клеток ресуспендировали в 100 мкл FACS буфера (1xPBS + 0,5% BSA) на 96-леночных планшетах. Анти-CXCR4 Fab добавляли в каждую лунку до конечной концентрации 0,25 мкг/мл и инкубировали при 4 градусах Цельсия на протяжении 30 мин. После удаления первичных антител, клетки промывали дважды буфером FACS и затем ресуспендировали в буфере FACS, и затем в каждую лунку добавляли 2 мкл (3 мкл) 2го Ab (Alexa Fluor 647-конъюгированный козлиный анти-человеческий IgG, F(ab')2 специфичный, Jackson ImmunoResearch Laboratories, West Grove PA). Планшеты инкубировали при 4 градусах Цельсия на протяжении еще 30 мин. Сигналы флуоресценции получали с помощью клеточного анализатора LSRII (BD Biosciences, San Jose СА). На Таблице показаны MFI (средняя интенсивность флуоресценции) каждого образца.
Аффинность связывания каждого Fab определяли, используя человеческие CXCR4-обогащенные липочастицы (LEV101, Integral Molecular, Philadelphia PA). Биотинилированные WGA (Sigma Aldrich, St. Louis МО)) могут быть нанесены на SA чип для улучшения схватывания липочастиц, содержащих CXCR4 протеины. Серии разведений (5-членный, 3Х фактор разведения с максимальной концентрацией 10 или 30 нМ) Fab инъектировали от низкой к высокой концентрации (со временем ассоциации в 3-минуты для каждой концентрации), для осуществления кинетического анализа данных, используя методологию "кинетического титрования", как описано в Karlsson, et al. (Karlsson, R., Katsamba, P.S., Nordin, H., Pol, E. & Myszka, D.G. Analyzing a kinetic titration series using affinity biosensors. Anal. Biochem. 349, 136-147 (2006). Для некоторых циклов анализа буфер инъектировали поверх захваченных частиц, вместо Fab, для обеспечения нулевых циклов с целью двойной ссылки (двойную ссылку осуществляли, как описано в Myszka et al. Improving biosensor analysis. J. Mol. Recognit. 12, 279-284 (1999).
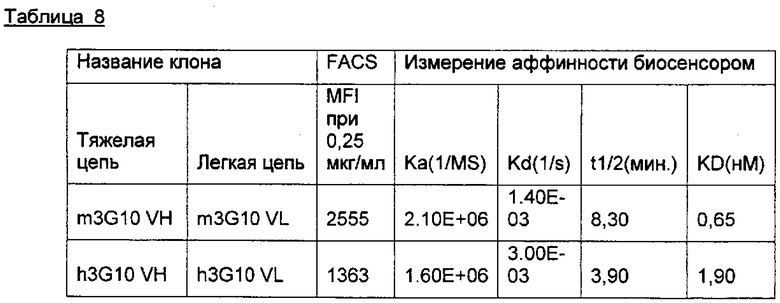
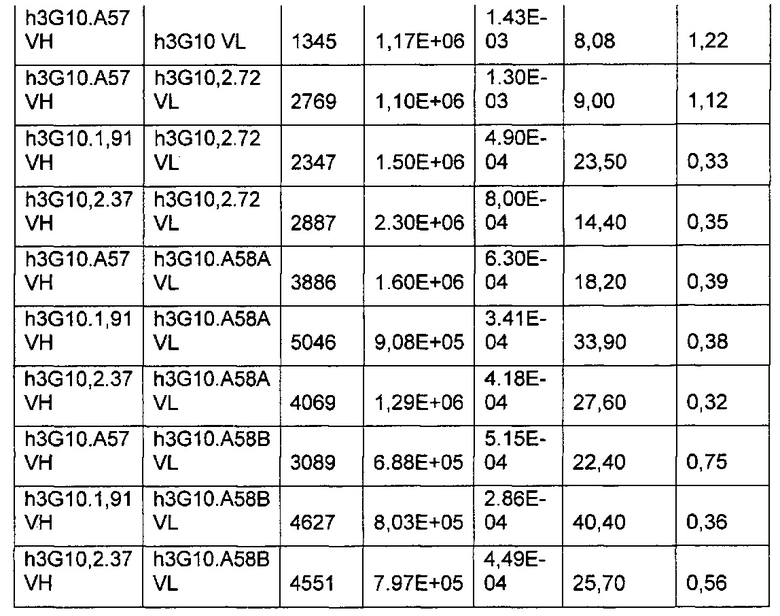
Пример 4
Связывание CXCR4 Ab с человеческими CXCR4 и Cyno-CXCR4
Анти-человеческие CXCR4 Ab h3G10.1,91.A58B тестировали на кросс-реактивность с CXCR4 яванских макак проточной цитометрией в серии разведений (0,007-267нМ) на 1) HPB-ALL (Человеческие Т-клетки лейкемии) и Cyno-CXCR4 трансфецированных СНО клетках и 2) Raji (человеческая неходскинская лимфома) и HSC-F (Т-клеточная линия яванских макак). Связывание выявляли с помощью 2-го Ab (Alexa Fluor 647-конъюгированного козлиного анти-человеческого IgG, Fcgamma специфичного, Jackson ImmunoResearch Laboratories, West Grove PA) и получали данные с помощью клеточного анализатора LSRFortessa (BD Biosciences, San Jose CA). Построение кривой и расчет ЕС50 осуществляли с помощью программного обеспечения Prism (GraphPad Software, La Jolla CA). Таблицы 9A и 9B и Фигуры 3А и 3В.
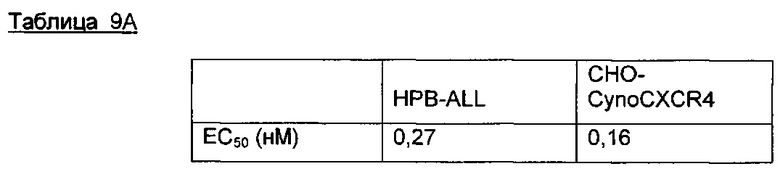

Пример 5
Эффекторная функция CXCR4 антитела
Терапевтические голые антитела основаны на двух видах функциональности для получения клинической эффективности: мишень-специфическое связывание с помощью Fab (антиген-связывающий фрагмент) домена и иммунно-опосредованные эффекторные функции - такие как антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC) и комплемент зависимая цитотоксичность (CDC) - через взаимодействие Fc домена антитела с Fc рецепторами разных типов клеток. В ADCC, Fc участок антитела связывается с Fc рецепторами (FcγRs) на поверхности иммунных эффекторных клеток, таких как природные киллеры и макрофаги, приводя к фагоцитозу или лизису намеченных клеток. В CDC, антитела убивают намеченные клетки путем вызывания каскада комплемента на поверхности клетки. Fc часть терапевтического антитела таким образом играет важную роль в его механизме действия, посредством влияния на ADCC или CDC.
Каждый подкласс человеческих IgG (IgG1, IgG2, IgG3 и IgG4) имеет четкий профиль эффекторной функции, обусловленный дифференциальным связыванием с каждым из FcγRs и комплексом протеинов комплемента. В то время как IgG1 и IgG3 связываются относительно сильно, IgG2 и IgG4 имеют намного меньшую аффинность к рецепторам Fc, и не вызывают высоких уровней ADCC. IgG1 так же имеет более высокую аффинность к комплексу протеинов комплемента, с намного меньшим CDC вызванным IgG2, IgG3 и IgG4.
Активность ADCC (антитело-зависимая цитотоксичность) анти-CXCR4 антитела определяли нерадиактивным набором для анализа цитотоксичности cytoTox96 (Promega, Madison WI). CXCR4-экспрессирующие человеческие опухолевые клетки высевали с плотностью 10,000 клеток за день до анализа. Донорные РВМС клетки отделяли с помощью градиента Ficoll и культивировали на протяжении ночи при 37°С в x-vivo среде. На следующий день 10 или 20 мкг/мл антитела добавляли в лунки с или без добавления 1000,000 РВМС клеток (Е:Т=100:1) в RПMI+5% FBS. Затем планшеты инкубировали при 37°С на протяжении 4 часов. Через 3,5 часа добавляли 20 мкл раствора для лизиса в лунки, содержащие только клетки мишени. После вращения планшеты при 8000 об.\мин. на протяжении 3 минут, 50 мкл супернатанта переносили в другой планшет. Затем добавляли 50 мкл субстрата в каждую лунку, и планшет инкубировали при комнатной температуре на протяжении 30 минут в темноте. Реакцию останавливали добавлением 50 мкл стоп раствора в каждую лунку. Затем планшеты считывали при 490 нМ на спектрометре (Molecular Devices). Процент (%) специфичного лизиса рассчитывали по следующей формуле:
% специфичного лизиса = (высвобождение LDH после лечения - спонтанное высвобождение LDH клеткой мишенью - спонтанное высвобождение LDH эффекторной клеткой) / (максимальное высвобождение LDH клеткой мишенью - спонтанное высвобождение LDH эффекторной клеткой)×100
Активность CDC (комплемент-зависимая цитотоксичность) анти-CXCR4 антитела определяли нерадиактивным набором для анализа цитотоксичности cytoTox 96 (Promega, Madison WI). CXCR4-экспрессирующие человеческие опухолевые клетки высевали с плотностью 10,000 клеток за день до анализа. На следующий день добавляли к клеткам только 5-20 мкг/мл каждого Ab или вместе с 2,5%, 10% или 20% донора комплемента АВ (производства Innovative Biotech или Sigma). Планшеты проявляли и специфический лизис анализировали аналогично анализу ADCC.
Анализ ADCC осуществляли в CXCR4 экспрессирующих Ramos (NHL) или MOLT-4 (человеческие Т-клетки лейкемии) клетках, используя 20 мкг/мл (Фигура 4А) или 10 мкг/мл (Фигура 4С) антитела + соотношение 100:1 (Эффектор:Мишень) клеток РВМС нормального донора. Через 4 часа инкубирования, активность ADCC была выражена в анти-человеческих CXCR4 Мишиных Abs 12А11, 6В6 и 3G10, полученных как гибридные hIgG1 на клетках Ramos (NHL) (Фигура 4А) или гуманизированные 3G10 антитела на клетках MOLT-4 (Фигура 4С). Приблизительно 80% клеточного лизиса получали после обработки m3G10-hIgG1, по сравнению с ~20% клеточного лизиса от подтипа m3G10-hIgG4 на клетках MOLT-4 (Фигура 4В).
Активность CDC наблюдали после обработки с 20 мкг/мл гибридного мышиного 12А11-, 6В6- и 3G10-hIgG1 антитела в CXCR4 экспрессирующих клетках Ramos (Фигура 4D) и с 5 мкг/мл гуманизированного антитела на клетках Daudi (NHL) (Фигура 4F). Максимальный 20-30% специфичного лизиса выявляли при 5 мкг/мл анти-CXCR4 3G10 антитела на основной цепи IgG1, подобно позитивному контролю антитело Rituxan на клетках Daudi, в то время как формат 3G10 на hIgG4 показал отсутствие активности CDC (Фигура 4Е)
Пример 6
Ингибирование SDF-1 вызванного анти-CXCR4 антителами кальциевого потока
При связывании SDF-1 (лиганд) с рецептором CXCR4 вызывали реакцию кальциевого потока. В качестве подтверждения функционирующей анагонистической активности CXCR4 Abs, способность анти-человеческого CXCR4 антитела ингибировать SDF-1 вызванный поток кальция, человеческие клетки Т-клеточной лейкемии (Jurkat) использовали вместе с набором для анализа Fluo-NW Calcium assay kit (Molecular Probes/life technologies). Клетки культивировали до суб-конфлюенции в среде RПMI 1640, содержащей 10% сыворотки эмбриона быка, 1% глутамин, при 37°С в CO2 инкубаторе. В день анализа, клетки помещали в 384-луночный планшет с черным прозрачный дном в количестве 70,000 клеток на лунку в 25 мкл буфера для анализа. Затем в планшеты добавляли краситель, 25 мкл/лунку на протяжении 110 минут при комнатной температуре, защищали от света. 11 серийных разведений 1:3 готовили в буфере Fluo-NW Са для каждого анти-человеческого CXCR4 антитела, получая диапазон концентраций от 500 нМ до 8 пМ. Клетки инкубировали с антителами при комнатной температуре на протяжении 20 мин. Затем клетки стимулировали SDF-1 alpha (Invitrogen) при конечной концентрации 8 нМ. Затем измеряли кальциевый поток на протяжении 95 сек., используя FLIPR Tetra (Molecular Devices). Позитивный контроль состоял из клеток в присутствии SDF-1 alpha и отсутствии обработки антитела. Базовую линию измеряли по клеткам не имеющим SDF-1 alpha и отсутствии обработки антитела. SDF-1 alpha вызывание кальция измеряли по выработке флуоресцентного сигнала со временем. Данные экспортировали и составляли графи, используя програмное обеспечение GraphPad Prism и использовали нелинейную кривую с сигмоидальной формулой доза-ответ для расчета значений ЕС50. Полученное ингибирование кальциевого потока анти-человеческого CXCR4 антителами показано на Фигуре 5. Антитела 3G10, 6В6 и 12А11 ингибировали SDF-1 alpha вызванный кальциевый поток, со значениями IC50 для ингибирования 1,555 нМ, 1,418 нМ и 27,07 нМ, соответственно (Таблица 10). Значения IC50 для гуманизированного CXCR4 антитела, полученные в функциональном анализе кальциевого потока, сведены в Таблице 11 (среднее n=3 независимые эксперименты/антитело). В таблице, активность гуманизированного CXCR4 антитела равна активности гибридного m3G10 антитела в данном анализе.


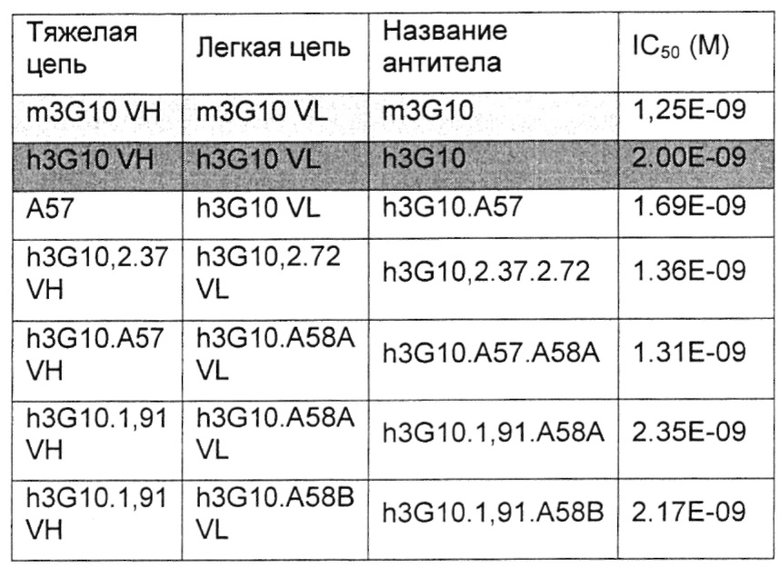
Пример 7
Активность CXCR4 антител в функциональном клеточном анализе циклической АМФ (цАМФ)
Известно, что при связывании CXCL12 (лиганд) с CXCR4 рецептором, ингибируется цАМФ. В качестве подтверждения антагонистичной активности CXCR4 Abs, осуществляли анализ цАМФ, используя СНО-K1 клетки, трансфецированные человеческим CXCR4, производства DiscoveRx, Fremont, СА. Набор для анализа цАМФ Hunter eXpress GPCR assay kit (DiscoveRx) использовали для анализа. При отсутствии CXCR4 антитела, обработка лигандом CXCR4, CXCL12, ингибировала выработку цАМФ. При обработке CXCR4 антителом, такое ингибирование нейтрализовалось, и увеличивалась выработка цАМФ. Значения ЕС50 для этого ответа приведено в Таблице 12. В таблице, все протестированные CXCR4 антитела имели одинаковую активность в этом анализе, в диапазоне от 24,3 до 45,6 нМ. Данное исследование подтверждает, что мышиное (гибридное) 3G10 и гуманизированное 3G10 CXCR4 антитело могут конкурировать и блокировать активность лиганда CXCR4 в функциональном анализе цАМФ.


Пример8
Вызывание клеточной смерти анти-CXCR4 антителами
Анти-CXCR4 антитела исследовали на способность вызывать гибель клеток на клеточной линии Ramos человеческой неходжскинской лимфомы. Клетки культивировали до субконфлюэнции в RПMI 1640 среде, содержащей 10% сыворотку эмбриона быка и 2нМ глутамин, при 37°С в CO2 инкубаторе. Клетки высеивали на ростовую среду в 48-луночные планшеты плотностью 2,5×106 клеток/мл. Анти-CXCR4 антитела, разведенные в PBS до указанных концентраций, добавляли к клеткам и инкубировали на протяжении 24 часов при 37°С. Гибель клеток измеряли а помощью флуоресцентного сигнала Annexin V-РЕ и пропидиум йодида (PI), измеренного на проточном цитометре LSRII (BD Biosciences). Общую гибель клеток определяли добавлением популяции Annexin V+/PI+ (поздняя) с популяцией Annexin V+/PI- (ранняя).
Результаты на Фигуре 6А демонстрируют, что 6В6 и 3G10 анти-CXCR4 антитела способны вызывать гибель клеток Ramos в дозо-зависимой манере. При наибольшей тестируемой концентрации, 100 нМ, 3G10 и 6В6, гибель клеток составила >70%. Этот результат был выше чем у позитивного контроля с стауроспорином (STS), известным индуктором гибели клеток (приблизительно 60%). Необработанные клетки показали приблизительно 30% гибель клеток. Анти-CXCR4 12А11 антитело не вызывало гибель клеток в условиях тестирования. Похожие результаты наблюдали при тестировании активности этих антител на клетках Raji не-ходжкинской лимфомы.
В аналогичном исследовании, одноцепочечный (Fab) и бивалентный F(ab)2' получали из 3G10 антитела. Fab является одноцепочечным антителом (моновалентным) и содержит вариабельные участки иммуноглобулина, являющиеся частью сацта связывания антигена, и первый константный участок иммуноглобулина. Этот фрагмент получали путем расщепления 3G10 антитела протеолитическим ферментом папаином. F(ab')2 получали расщеплением с помощью пепсина с целью удаления большей части участка Fc, при этом оставляя интактным шарнирный участок. Фрагменты F(ab')2 имеют две антиген-связывающие Fab части, связанные вместе дисульфидными связями, и таким образом являющиеся бивалентными. Fab и F(ab')2 тестировали одновременно с бивалентным непроцессированным 3G10 антителом на способность вызывать гибель клеток Ramos. Результаты, показанные на Фигуре 6В, указывают на то, что способность вызывать гибель клеток является бивалентно зависимой для интактного антитела (3G10) и F(ab')2 антитела, способного вызывать гибель клеток, в то время как 3G10 Fab имел очень ограниченное влияние на гибель клеток.
Пример 9
Ингибирование роста солидной опухоли неходжскинкой лимфомы in Vivo анти-CXCR4 антителами
Считается, что SDF-1/CXCR4 сигнализирование играет важную роль в многочисленных стадиях развития опухоли, включая рост опухоли, ангиогенез, инвазию, и метастазирование. Для оценки способности анти-человеческого CXCR4 Abs ингибировать рост опухоли, использовали человеческую модель ксенотрансплантата, с применением мышей женского пола возрастом 4-6 недель СВ17 SCID Beige (Jackson Laboratories) и клетки Ramos человеческой неходскинской лимфомы, имплантированные подкожно. Клетки культивировали при 37°С в 5% CO2 инкубаторе в RПMI 1640 среде, содержащей 10% сыворотку эмбриона быка. В этом исследовании, 5×106 клеток имплантировали в правую ягодицу каждой мыши и оставляли расти в виде солидных опухолей до среднего объема приблизительно 175 мм3, рассчитывали по формуле (объем = длина × ширина2)/2. Мышей затем рандомизировали на 4 разные группы обработки, n=10 животных на группу. Группы мышей обрабатывали внутривенными инъекциями антител в растворе стерильного PBS: (i) изотип контрольное Ab (15 мг/кг); (ii) 3G10 (15 мг/кг); (iii) 6В6 (15 мг/кг); и (iv) 12А11 (15 мг/кг). Животным давали дозы антител один раз в неделю на протяжении 3 недель, всего 3 дозы. Объемы опухолей измеряли циркулем 1-3 раза в неделю на протяжении исследования. Результаты эксперимента представлены на Фигуре 7. Результаты указывают, что все 3 протестированные анти-CXCR4 антитела значительно ингибируют рост опухоли, по сравнению с изотипом контрольного антитела. Результаты указывают, что анти-CXCR4 антитела способные ингибировать рост стабильной солидной опухоли in vivo. Такой ингибиторный эффект поддерживался в течении длительного периода времени (42 дня) после прекращения дозирования антитела. Активность всех трех протестированных анти-CXCR4 антител была сопоставима в данной модели солидной опухоли. Фигура 7.
Пример 10
Увеличение периода выживания и снижение опухолевой нагрузки анти-CXCR4 антителами в мышиной клеточной модели системной неходскинской лимфомы
Противоопухолевую активность анти-CXCR4 антител исследовали на модели гематологической лимфомы, используя Raji клетки неходскинской лимфомы. Клетки Raji, использованные в данном исследовании, трансфецировали геном люциферазы (LUC) для обеспечения "на живых клетках" мониторинга опухолевой массы со временем. Клетки культивировали при 37°С в 5% CO2 инкубаторе в RПMI 1640 среде, содержащей 10% сыворотку эмбриона быка. Модель осуществляли инъекцией 1×106 клеток Raji-LUC мышам женского пола возрастом 6-8 недель SCID Beige (производства Charles River Laoratories) через хвостовую вену. На день 0 (день имплантации) клетки Raji-LUC попадали в легкие, что свидетельствовало о точной внутривенной инъекции опухолевых клеток у всех животных. На следующий день после имплантации клеток, мышей поделили на группы обработки (10 животных на группу) на основе биолюминесценции в легких. Мышей обрабатывали изотипом контрольного антитела, 3G10, 6В6 и 12А11 при 10 мг/кг в растворе стерильного PBS один раз в неделю внутрибрюшинно (i.p.), до 67-го дня. Опухолевую массу мониторили биолюминесцентной визуализацией, используя систему визуализации Xenogen IVIS 200. Получали изображения мышей каждые 5 дней в вентральном положении, вводили люциферин внутрибрюшинно в количестве 15 мг/мл, инъекцию 200 мкл, и биолюминесценцию всего тела определяли, используя Xenogen Living Image. Когда у мышей начал проявляться паралич задней конечности или другие человеческие ожидаемые результаты, их эвтанизировали. Как опухолевую массу (с помощью люминесценции), так и выживание оценивали как ожидаемые результаты.
Фигуры 8А и В показывают результаты биолюминесции этого исследования. Снижение опухолевой массы показано снижением уровня биолюминесции с течением времени. Фигура 8А показывает репрезентативное изображение 4-5 животных каждой группы в день 0 (базовая линия имплантации), 15 и 25 исследования. Все три анти-CXCR4 антитела значительно снижали опухолевую массу, согласно уровню люминесценции. Фигура 8В показывает, что обработка 3G10, 6В6 и 12А11 антителами давала сопоставимую TGI активность, по отношению к изотипу контрольного антитела в этой модели.
Кривая выживания, показанная на Фигуре 8С, демонстрирует значительный эффект анти-CXCR4 антитела 3G10, 6В6 и 12А11, по сравнению с изотипом контрольного антитела на выживание животных, системно имплантированных клетками Raji-LUC. В то время как животные, обработанные изотипом контрольного антитела показали среднюю выживаемость составляющую 18 дней, животные, обработанные анти-CXCR4 антителами, не достигали средней выживаемости до окончания исследования. Влияние всех трех анти-CXCR4 антител было сопоставимо, без статистической разницы между ними. Выживание животных, обработанных анти-CXCR4 антителами, поддерживалось до 67-го дня, когда вводили последнюю дозу антитела.
Пример 11
Увеличение периода выживания и снижение опухолевой нагрузки анти-CXCR4 антителами в мышиной системной клеточной модели острой миелогенной лейкемии (AML)
Анти-CXCR4 антитело 6В6 исследовали на способность увеличивать выживание и снижать опухолевую массу у мышей NSG, используя генерализованную/системную внутривенную модель AML. Человеческая раковая линия AML MV4-11 трансфектировали геном люциферазы (MV4-11-LUC) для "живого" мониторинга опухолевой массы со временем. Клетки культивировали при 37°С в 5% CO2 инкубаторе в IMDM среде, содержащей 10% сыворотку эмбриона быка с 1 мкг/мл пуромицина для отбора экспрессии люциферазы. Мышей женского пола NSG в возрасте 4-6 недель (производства Jackson Laboratories) инъектировали внутривенно клетками MV4-11-LUC AML (1×106/животное).
На 13-й день после имплантации клеток, мышей рандомизировали на три группы обработки (10 животных на группу) на основе общей интенсивности биолюминесценции тела. Еженедельное подкожное введение антитела в количестве 10 мг/кг в растворе стерильного PBS осуществляли на 13-й день (изотип контрольного и анти-CXCR4 6В6 антитело) и 20-й день (анти-CXCR4 6В6 антитело), как показано на Фигуре (день 13; день 20). Опухолевую массу оценивали, используя систему отображения Xenogen IVIS 200. производили отображение мышей каждые 7 дней в вентральном положении, и биолюминесценцию тела определяли, используя программное обеспечение Xenogen Living Image. Когда у мышей начал проявляться паралич задней конечности или другие человеческие ожидаемые результаты, их эвтанизировали. Как опухолевую массу (с помощью люминесценции), так и выживание оценивали как ожидаемые результаты. Количество человеческих клеток AML циркулирующих в периферической крови (РВ) мышей (n=10 на группу) мониторили по образцам крови, собранным на 35-й день исследования. AML CD45 и CD33 маркеры использовали для определения процента человеческих AML клеток в кровяном русле с помощью протоковой цитометрии, окрашивая анти-человеческие CD45 и анти-человеческие CD33 антитела (производства BD Biosciences).
Фигура 9А показывает репрезентативное изображение биолюминесценции 5 животных/группу обработки для данного исследования (с 20-го по 41-й день). Снижение опухолевой массы показано снижением уровня биолюминесценции с течением времени. Ингибирование опухолевой массы анти-CXCR4 6В6 антителом, начавшееся ранее (день 13), было более выраженным, чем инициированное через неделю (день 20). 6В6 анти-CXCR4 антитело значительно снижало опухолевую массу в обоих группах обработки, по сравнению с изотипом контрольного антитела, указывая на то, что анти-CXCR4 антитело эффективно ингибирует опухолевую массу в разбитой по стадиям мышиной модели человеческой AML.
Кривая выживания, показанная на Фигуре 9В, демонстрирует значительный эффект анти-CXCR4 антитела 6В6, по сравнению с изотипом контрольного антитела, на выживание животных, системно имплантированных клетками MV4-11-LUC AML. В то время как животные, обработанные изотипом контрольного антитела показали среднюю выживаемость составляющую 40 дней, животные, обработанные анти-CXCR4 6В6 антителом в день 13 и 20, показали среднюю выживаемость составляющую 53 и 61 день, соответственно. Эти разница являются статистически значимыми (р<0,05) по тесту Мантеля-Кокса.
Фигура 9С показывает значительное снижение количества человеческих AML клеток у животных, обработанных анти-CXCR4 6В6 антителом, по сравнению с животными, обработанными изотипом контрольного антитела на 35-й день исследования.
Пример 12
Повышение выживаемости анти-CXCR4 антителом в мышиной системной модели хронической лимофцитарной лейкемии
Противоопухолевую активность CXCR4 антитела исследовали на генерализованной внутривенной модели хронической лимфоцитарной лейкемии (CLL). Человеческую линию опухолевых клеток JVM-13, стабильно трансфецированную для экспрессии гена люциферазы, культивировали при 37°С в 5% CO2 инкубаторе в RПMI 1640 среде, содержащей 10% сыворотку эмбриона быка и 0,25 мг/мл пуромицина. Модель инициировали инъекцией 1×106 JVM-13-Luc клеток мышам женского пола SCID Beige возрастом 6-8 недель через хвостовую вену. Через 21 день после имплантирования мышей делили на группы обработки (10 животных на группу) на основе считывания биолюминесценции (BLI). Мышей обрабатывали изотипом контрольного антитела и 3G10 в дозе 10 мг/кг в растворе стерильного PBS, один раз в неделю подкожно. Ритуксимаб, анти-CD20 Ab, утвержденный для лечения пациентов с CLL, использовали как позитивный контроль. Ритуксимаб дозировали в количестве 10 мг/кг в растворе стерильного PBS один раз в неделю, подкожно. Опухолевую массу оценивали, используя систему отображения Xenogen IVIS 200. Изображения мышей получали каждые 7 дней в вентральном положении и биолюминесценцию тела определяли, используя программное обеспечение Xenogen Living Image. Когда у мышей начал проявляться паралич задней конечности или другие человеческие ожидаемые результаты, их эвтанизировали. Как опухолевую массу (с помощью люминесценции), так и выживание оценивали как ожидаемые результаты.
Фигура 10А показывает репрезентативную активность люциферазы у мышей в каждой группе обработки в дни исследования 28, 35, 42, 49 и 56. Обработка 3G10 значительно снижала JVM-13-Luc опухолевую массу в больших костях, показано уровнем биолюминесценции с течением времени, по сравнению с изотипом контрольного антитела. Обработка ритуксимабом также значительно снизила опухолевую массу, по сравнению с изотипом контрольного антитела.
Фигура 10В показывает кривую выживаемости Каплана-Мейера для данного исследования. Значительное увеличение выживаемости наблюдали для 3G10 и ритуксимаб антител, по сравнению с изотипом контрольного Ab (р<0,0001). В то время как животные, обработанные изотипом контрольного антитела показали среднюю выживаемость составляющую 32,5 дней, животные, обработанные ритуксаном, показали среднюю выживаемость 45 дней, а животные, обработанные 3G10, не достигли средней выживаемости к 60-му дню. Результаты данного исследования указывают на то, что анти-CXCR4 антитело является эффективным ингибитором опухолевой массы в постадийной мышиной модели человеческой CLL.
Пример 13:
Ингибирование роста опухоли неходжскинской лимфомы Ramos in vivo с помощью гуманизированных анти-CXCR4 антител
Для оценки способности гуманизированных CXCR4 Ab ингибировать рост опухоли, использовали модель ксенотрансплантата опухоли, используя мышей женского пола в возрасте 4-6 недель CB17 cg-Prkdc SCID Beige (Charles River) и человеческие клетки Ramos неходжскинской лимфомы, имплантированные подкожно. Клетки культивировали при 37°С в 5% CO2 инкубаторе в RПMI 1640 среде, содержащей 10% сыворотку эмбриона быка. В этом исследовании, 5×106 клеток имплантировали в правую заднюю часть каждой мыши и оставляли расти в виде солидной опухоли до среднего объема приблизительно 350 мм3, рассчитанного по формуле (объем = длина × ширина2)/2. Затем мышей рандомизировали на 7 разных групп обработки, n=10 животных на группу. Группы мышее обрабатывали подкожно 10 мг/кг каждого антитела в растворе стерильного PBS: (изотип контрольного антитела; m3G10; h3G10.A57.WT; h3G10,2.37.2.72; h3G10.A57.A58; h3G10.1,91.A58A; h3G10.1,91.A58B). Животных дозировали антителом один раз в неделю на протяжении 2 недель, всего 2 дозы. Объемы опухолей измеряли циркулем дважды в неделю на протяжении исследования. Результаты эксперимента показаны на Фигуре 11. Результаты указывают на то, что все тестированные анти-CXCR4 антитела значительно ингибируют рост опухоли, по сравнению с изотипом контрольного антитела. Результаты указывают на то, что гуманизированные CXCR4 антитела имеют одинаковую эффективность с гибридным m3G10 антителом. Эффект ингибирования роста опухоли поддерживался несколько дней после прекращения дозирования антитела (день 7).
Пример 14
Увеличение периода выживания и снижение опухолевой нагрузки гуманизированными анти-CXCR4 антителами в мышиной системной модели множественной миеломы (ММ)
Гуманизированное анти-CXCR4 антитело h3G10.1,91.A58B тестировали на способность увеличивать выживаемость и снижать опухолевую массу на мышах NSG, используя генерализованную/системную внутривенную модель ММ. Человеческую раковую линию ММ ОПМ-2 трансфецировали геном люциферазы (ОПМ-2-LUC) для "живого" мониторинга опухолевой массы со временем. Клетки культивировали при 37°С в 5% CO2 инкубаторе в RПMI 1640 среде, содержащей 10% сыворотку эмбриона быка с 0,5 мкг/мл пуромицина для селективной экспрессии люциферазы. Мышей женского пола NSG в возрасте 4-6 недель инъектировали внутривенно клетками ОПМ-2-Luc (5×106/животное).
На 8-й день после имплантации клеток, мышей рандомизировали на три группы обработки (10 животных на группу) на основании интенсивности биолюминесценции всего тела. Инициировали еженедельные подкожные введения антитела в количестве 10 мг/кг в растворе стерильного PBS проводили на протяжении 5 недель. Мелфалан, одно из одобренных лекарств для лечения пациентов с множественной миеломой, вводили в дозе 1 мг/кг, дважды в неделю на протяжении 3 недель. Опухолевую массу оценивали, используя систему визуализации Xenogen IVIS 200. Мышей визуализировали каждые 7 дней в вентральном положении и биолюминесценцию тела определяли, используя программное обеспечение Xenogen Living Image software. Когда у мышей начал проявляться паралич задней конечности или другие человеческие ожидаемые результаты, их эвтанизировали. Как опухолевую массу (с помощью люминесценции), так и выживание оценивали как ожидаемые результаты.
Фигуры 12А и В показывают результаты биолюминесценции (активности люциферазы) данного исследования. Снижение опухолевой массы показано снижением уровня биолюминесценции со временем. Фигура 12А показывает репрезентативное изображение биолюминесценции 5 животных/группу обработки для данного исследования. Фигура 12В показывает, что обработка CXCR4 антителом h3G10.1,91.A58B значительно ингибирует рост опухоли, по сравнению с изотипом контрольного антитела со временем (р<0,0001 на 30-й день), указывая на то, что анти-CXCR4 антитело эффективно ингибирует опухолевую массу в разбитой по стадиям мышиной модели ксенотрансплантата человеческой множественной миеломы. Кривая выживаемости для этого исследования, показанная на Фигуре 12С, демонстрирует значительный эффект анти-CXCR4 антитела h3G10.1,91.A58B, по сравнению с изотипом контрольного антитела в выживаемости животных, системно имплантированных клетками ОПМ-2-Luc ММ. В то время как животные, обработанные изотипом контрольного антитела и мелфаланом, показали среднюю выживаемость на уровне 33,5 и 36 дней соответственно, животные, обработанные h3G10.1,91.A58B CXCR4 антителом, не имели определенного среднего уровня выживаемости, при этом не наблюдали смертей к 50-му дню исследования. Таблица 13. эти разницы были статистически значимыми (р<0,0001) согласно тесту Мантеля-Кокса.

Пример 15
Цитотоксичность анти-CXCR4-ADC в CXCR4-позитивных клетках
Анти-CXCR4 антитела (например, 3G10) экспрессировали как человеческие IgG1 подтипы и конструировали с глутамин-содержащим трансглутаминазным ("Q") маркером TG6(SEQ ID NO: 91 (LLQGA)) и конъюгировали с AcLys-vc-PABC-MMAD (ацетил-лизин-валин-цитруллин-р-аминобензилоксикарбонил-MMAD), и AcLys-vc-PABC-0101 ((2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-{[(1S)-2-фенил-1-(1,3-тиазол-2-ил)этил]амино}пропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид). Трансглутаминазные маркеры конструировали у тяжелой цепи С-конца антитела. Затем осуществляли коньюгацию анти-CXCR4 антитела с цитотоксическим агентом MMAD или 0101 с помощью микробиологической реакции трансамидации, катализируемой трансглутаминазой, между анти-CXCR4 антителом, несущим глутамин-содержащий маркер в специфичном сайте (например, карбоксильном конце тяжелой цепи антитела) и амин-содержащей производной payload (например, MMAD или 0101). В некоторых случаях, аминокислоту лизин дикого типа на карбоксильном конце (положение 447 согласно нумерации EU) удаляли и заменяли Q-tag. В других случаях, аминокислоту лизин дикого типа в положении 222 (согласно нумерации EU) заменяли аминокислотой аргинином ("K222R"). K222R замещение обеспечивало значительное влияние приводя к более гомогенному антителу и payload конъюгату, и/или лучшей внутримолекулярной кросссвязи между антителом и payload. В реакции трансамидирования, глутамин на глутамин-содервщем маркере являлся донором ацила, а амин-содержащее соединение было акцептором ацила (донор амина). Очищенное анти-CXCR4 антитело инкубировали с излишком акцептора ацила в присутствии трансглутаминазы Streptoverticillium mobaraense (ACTIVA™, Ajinomoto, Japan) в 150-900 мМ NaCl, и 25 мМ MES, HEPES [4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоти] или Tris HCl буфере при рН в диапазоне 6,2-8,8. Условия реакции устанавливали для индивидуальных производных акцептора ацила. После инкубации при комнатной температуре на протяжении 2,5 часов, конъюгат антитело-лекарство очищали на смоле MabSelect (GE Healthcare, Waukesha, WI), используя стандартные способы аффинной хроматографии известные в отрасли, такие как коммерческая аффинная хроматография от GE Healthcare.
Клетки, экспрессирующие CXCR4, затем высевали в белые планшеты с прозрачным дном плотностью 4000-8,000 клеток/лунку на 24 часа перед обработкой. Затем клетки обрабатывали сериями разведенных в 4 раза конъюгатов антитело-лекарство в трех повторах. Жизнеспособность клеток определяли с помощью анализа жизнеспособности CellTiter-Glo® Luminescent Cell Viability Assay 96 (Promega, Madison WI) через 96 часов после обработки. Относительную жизнеспособность клеток определяли как процент необработанного контроля. Затем рассчитывали значения IC50. Анти-CXCR4 антитела, конъюгированные с MMAD или 0101, по средством трансаминазного маркера, показали значительную активность по уничтожению клеток на клетках, экспрессирующих CXCR4.
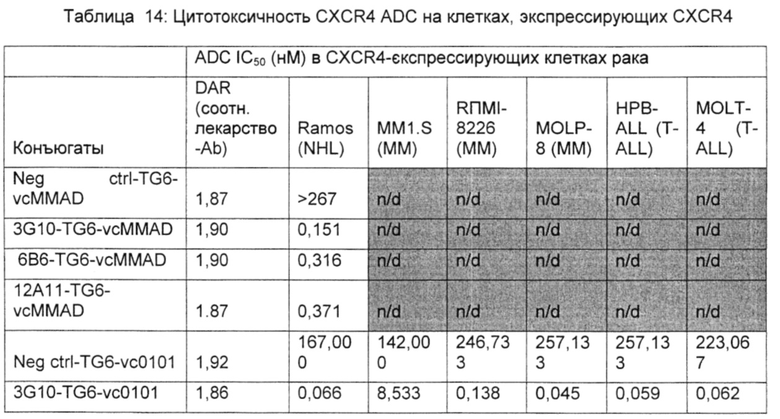

Пример 16
In vivo противоопухолевая активность CXCR4-ADC
Противоопухолевую эффективность CXCR4 ADC in vivo оценивали на модели ксенотрансплантата Ramos (NHL) и HPB-ALL (T-ALL). Мышей женского пола СВ17 SCID в возрасте 4-6 недель (Jackson Laboratories) имплантировали подкожно клетками 5×106 Ramos (NHL) как описано в Примере 9, до среднего объема опухоли приблизительно 500 мм3, рассчитанного по формуле (объем = длина × ширина2)/2. Клетки 10×106HPB-ALL имплантировали мышам женского пола СВ17 SCID в возрасте 4-6 недель до среднего объема опухоли ~500 мм3. В модели Ramos, группы мышей обрабатывали одной внутривенной дозой инъекции негативного контроля ADC (neg ctrl-TG6-vc0101) в количестве 6,0 мг/кг, или CXCR4 ADC (3G10-TG6-vc0101 и 6B6-TG6-vc0101) в количестве 1,5, 3,0 или 6,0 мг/кг. Объемы опухолей измеряли циркулем один раз в неделю на протяжении исследования. Результаты эксперимента представлены на Фигуре 13А. Результаты указывают на то, что оба CXCR4 ADC вызывают регрессию опухоли при дозировке ≥3 мг/кг. Контрольный ADC не влиял на рост опухоли. В модели HPB-ALL, инъекция с дозой 1,5 мг/кг of 3G10-TG6-vc0101 оказалась достаточной для регрессии опухоли (Фигура 13В).
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫДЕЛЕННОЕ АНТИТЕЛО ПРОТИВ СПЕЦИФИЧЕСКОГО МЕМБРАННОГО АНТИГЕНА ПРОСТАТЫ (PSMA) И СПОСОБ ИНГИБИРОВАНИЯ РОСТА КЛЕТОК, ЭКСПРЕССИРУЮЩИХ PSMA | 2006 |
|
RU2421466C2 |
| АНТИТЕЛА РЕЦЕПТОРА 1 ИНТЕРФЕРОНА АЛЬФА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2600884C2 |
| Терапевтические антитела и их применения | 2016 |
|
RU2722381C2 |
| ВЫДЕЛЕННОЕ АНТИ-CD30 АНТИТЕЛО (ВАРИАНТЫ), ХОЗЯЙСКАЯ КЛЕТКА, СПОСОБ ПОЛУЧЕНИЯ ХИМЕРНОГО ИЛИ ГУМАНИЗИРОВАННОГО ВАРИАНТА АНТИ-CD30 АНТИТЕЛ (ВАРИАНТЫ), СПОСОБ ИНГИБИРОВАНИЯ РОСТА КЛЕТОК CD30+ И СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛЕВЫХ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ CD30 | 2006 |
|
RU2492186C2 |
| АНТИТЕЛА РЕЦЕПТОРА 1 ИНТЕРФЕРОНА АЛЬФА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2412202C2 |
| Анти-LAG-3 антитела | 2016 |
|
RU2760582C2 |
| АНТИ-С4.4А АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2577977C2 |
| АНТИТЕЛО К ПРОТИВООПУХОЛЕВОМУ АНТИГЕНУ И СПОСОБЫ ПРИМЕНЕНИЯ | 2011 |
|
RU2598711C2 |
| АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ NKG2D И ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2563343C2 |
| АНТИТЕЛА К ФАКТОРУ XI И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2739946C2 |







































































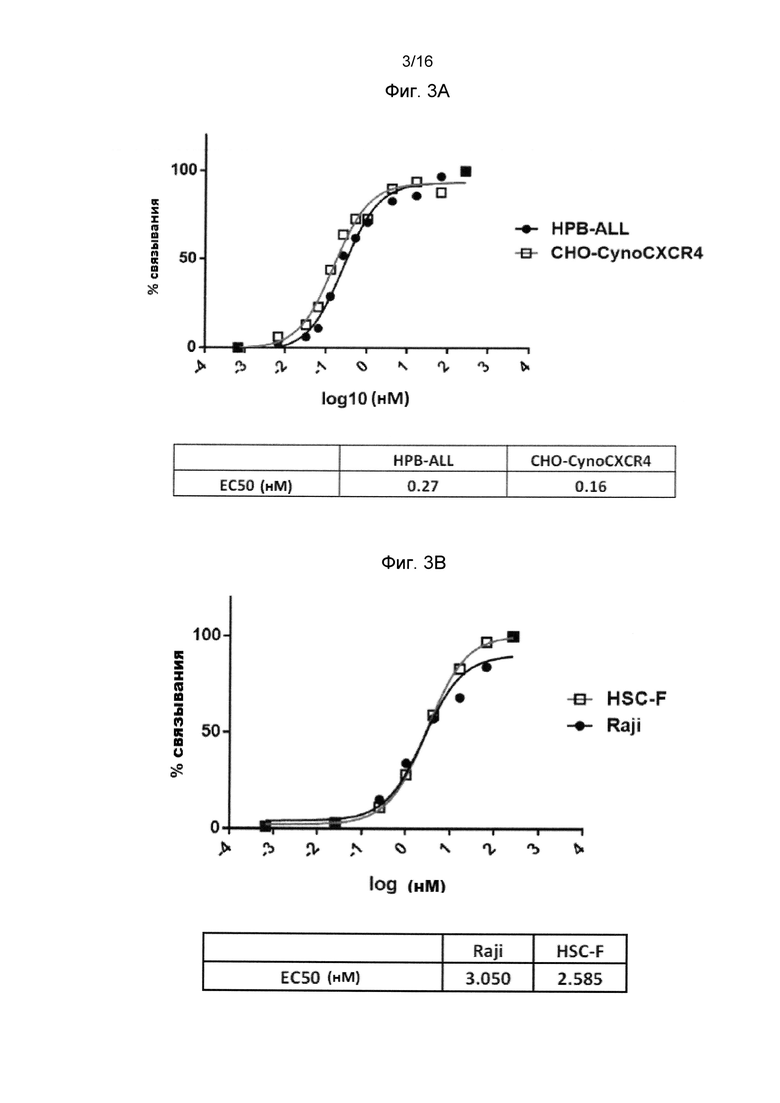
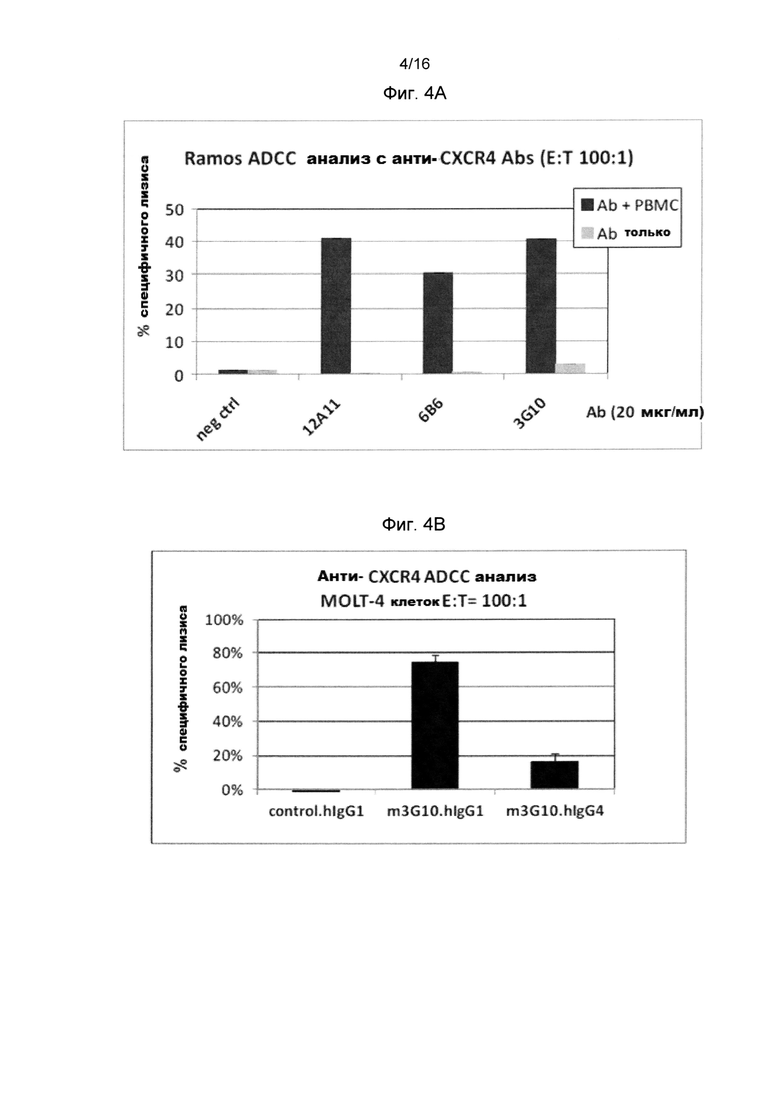
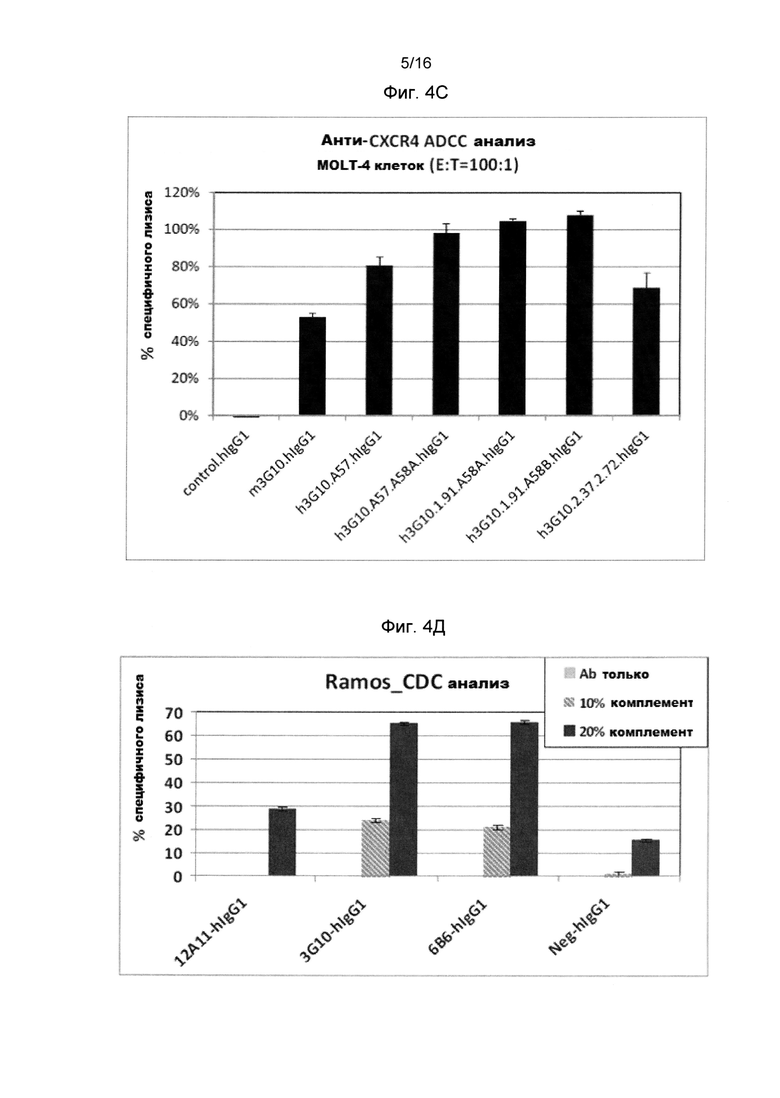
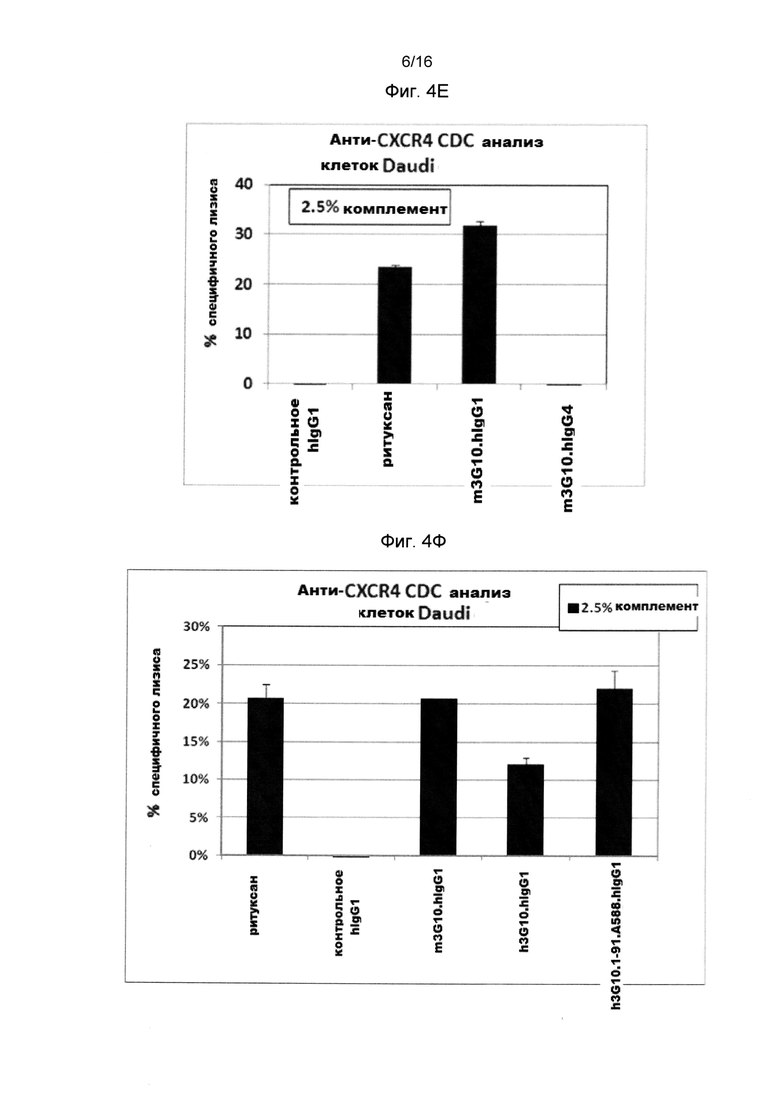

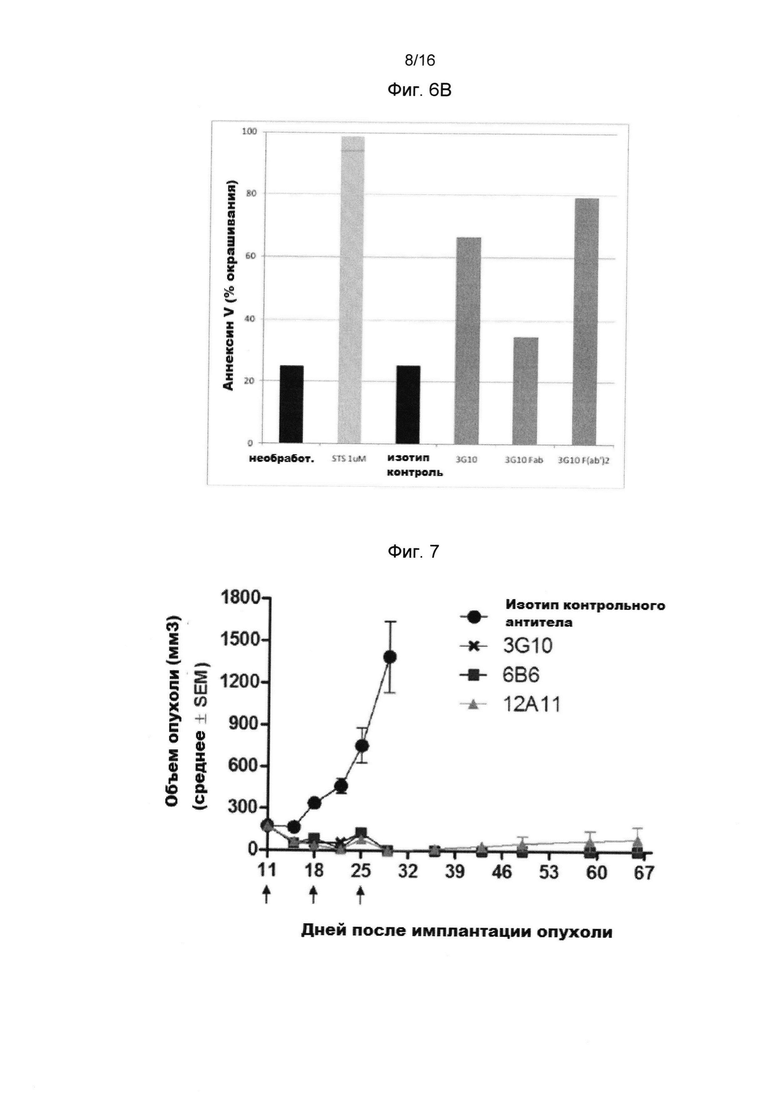
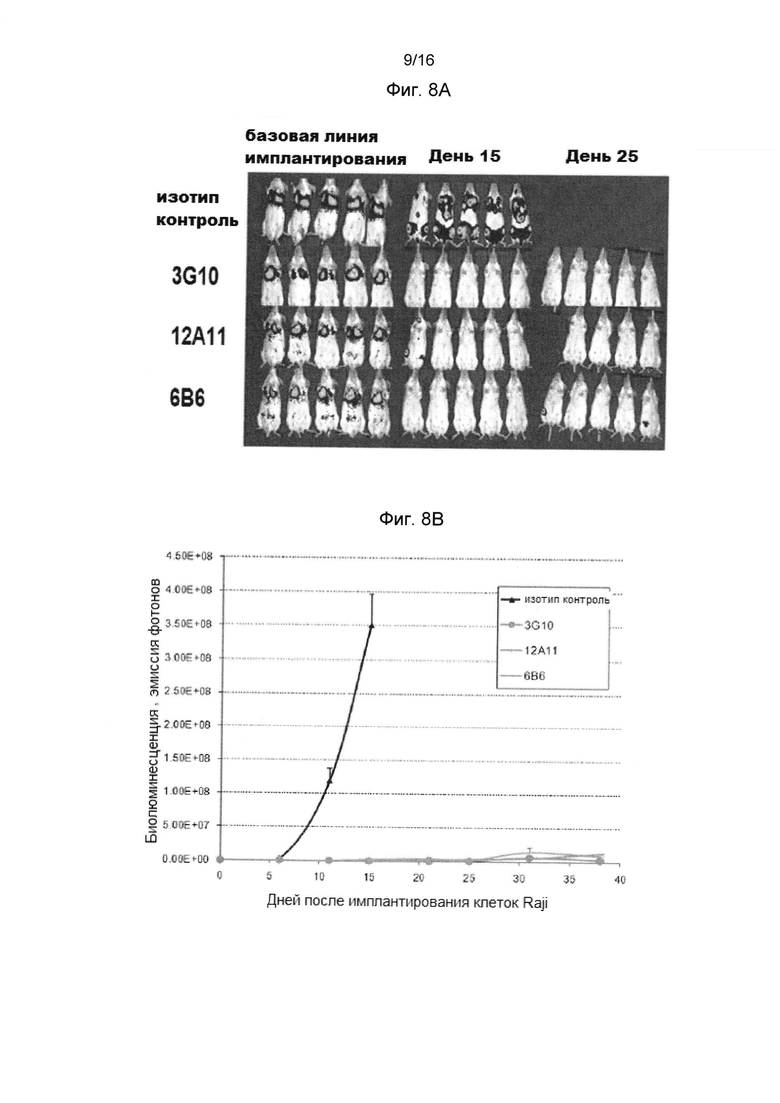
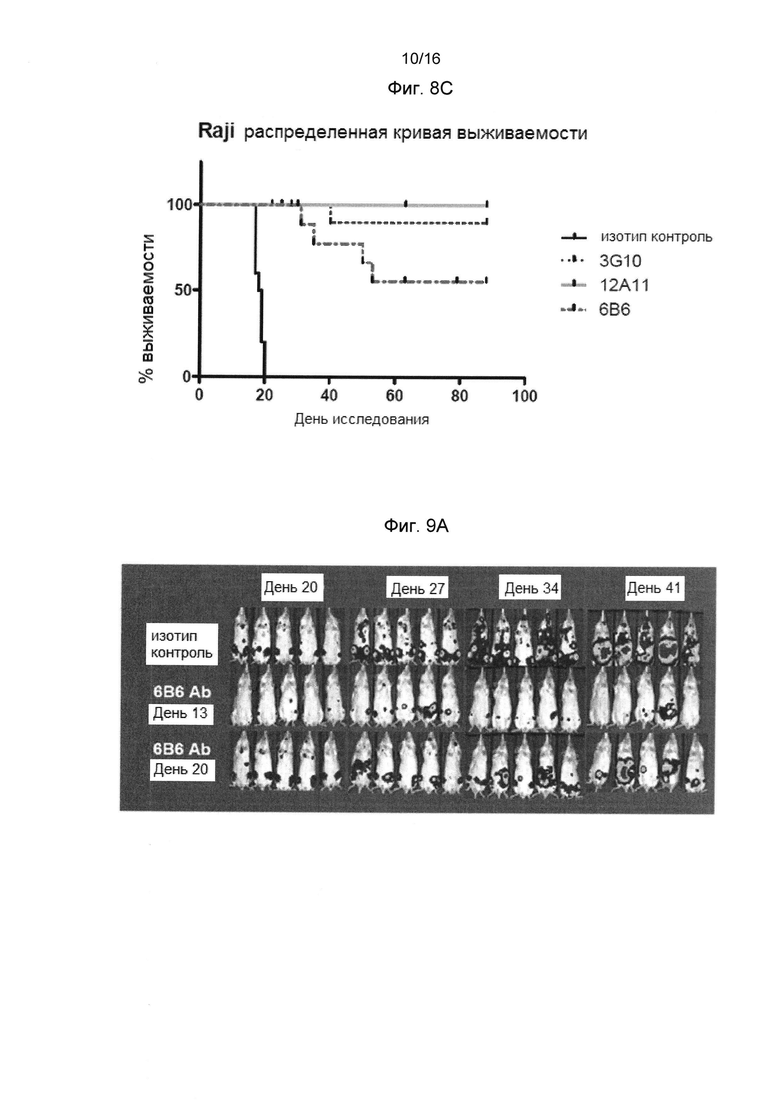


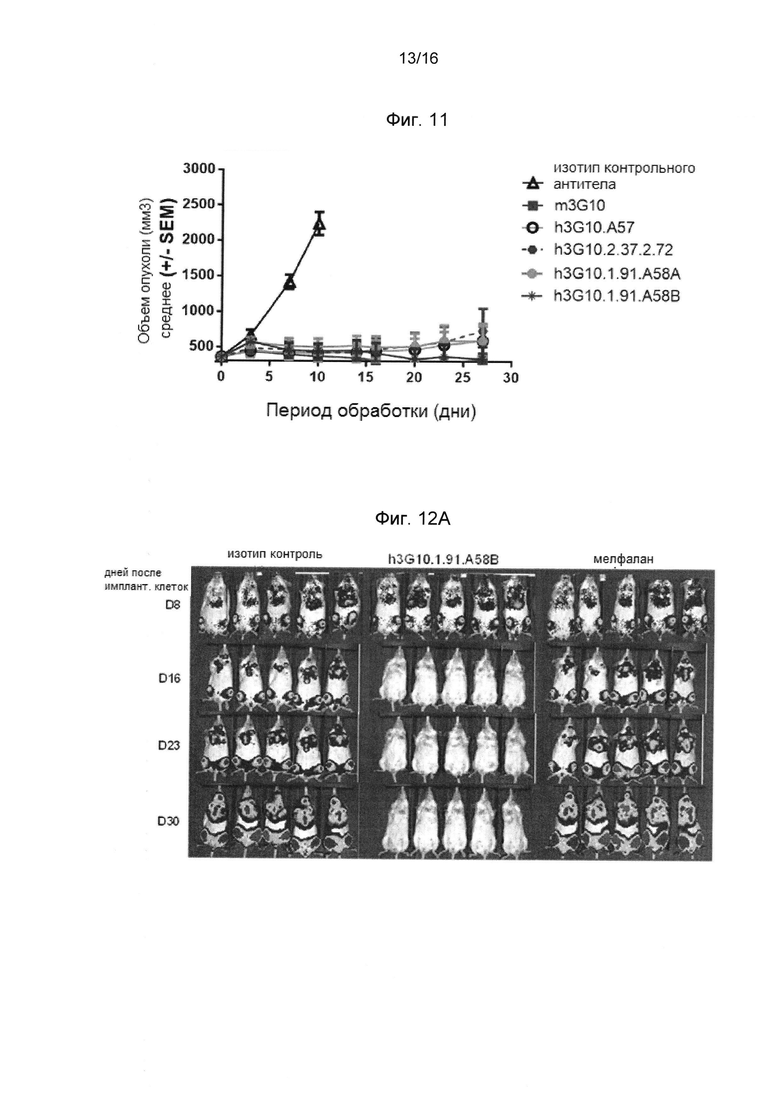
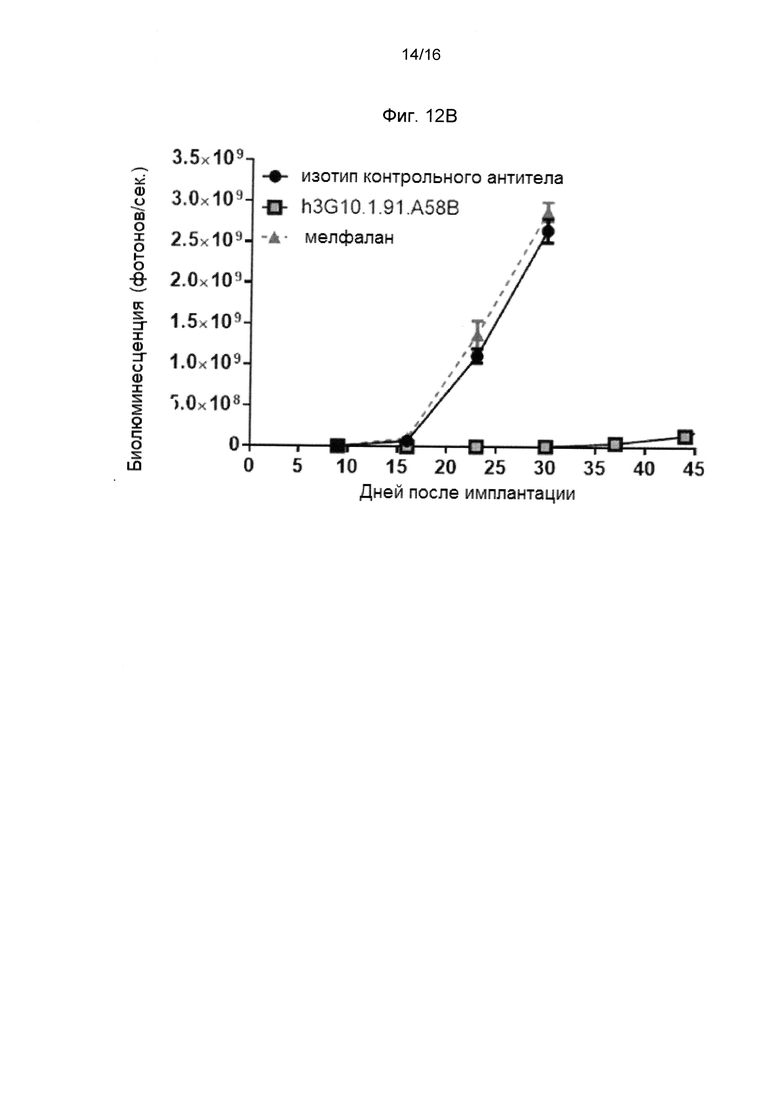
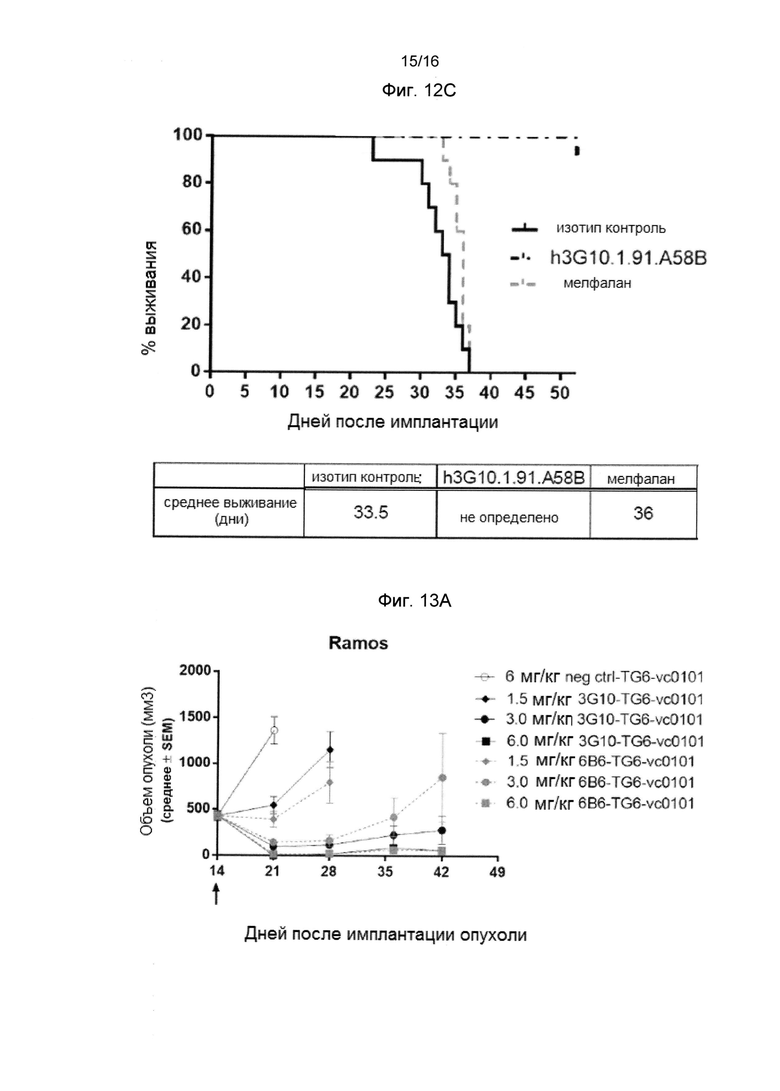
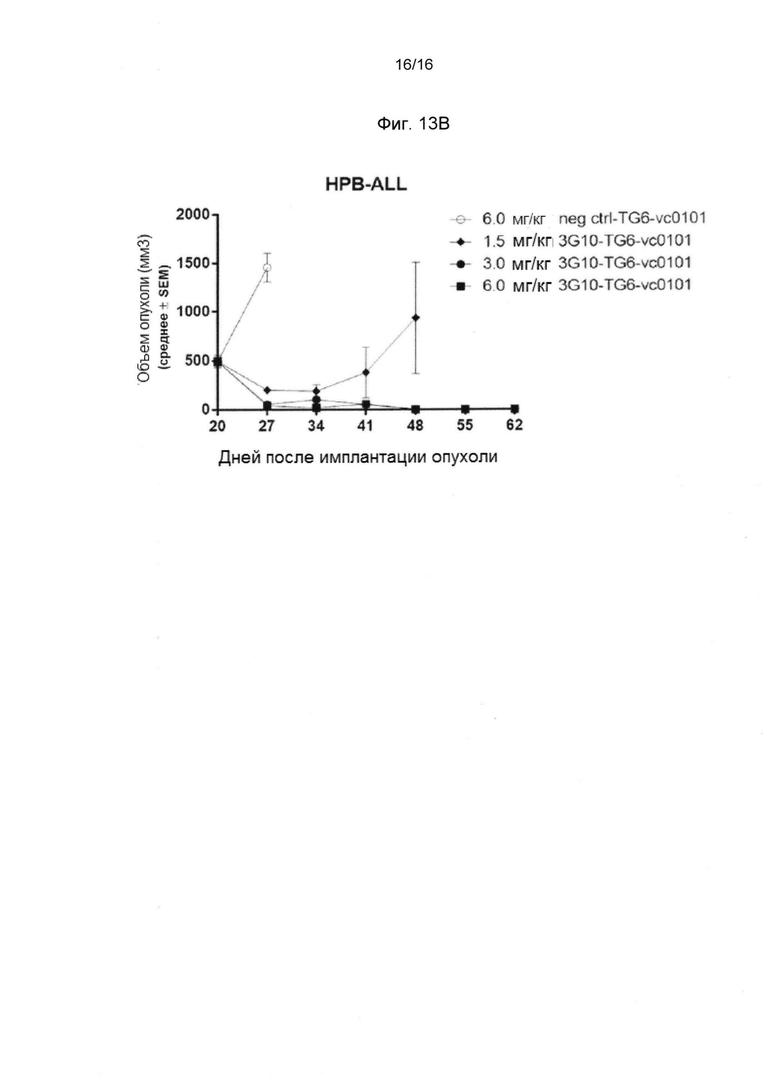
Изобретение относится к биотехнологии. Описано изолированное антитело или его антиген-связывающий фрагмент, которое связывается с рецептором хемокина 4 (CXCR4) и содержит:
a) вариабельный участок тяжелой цепи (VH), содержащий (i) VH CDR1, выбранный из группы, состоящей из SEQ ID NO: 107, 113, 114; (ii) VH CDR2, выбранный из группы, состоящей из SEQ ID NO: 162, 128, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156 и 130, и (iii) VH CDR3, выбранный из группы, состоящей из SEQ ID NO: 112; и;
b) вариабельный участок легкой цепи (VL), содержащий (i) VL CDR1, выбранный из группы, состоящей из SEQ ID NO: 144, 138, 141, 142, 143, 146, 147, 148, 149 и 150; (ii) VL CDR2, выбранный из группы, состоящей из SEQ ID NO: 145, 132; и (iii) VL CDR3, выбранный из группы, состоящей из SEQ ID NO: 139, 140 и 170. Изобретение также относится к конъюгатам антитело-лекарство, содержащим такое антитело, нуклеиновые кислоты, кодирующие антитело, и способам получения такого антитела. Изобретение также относится к терапевтическим способам применения указанного антитела и анти-CXCR4 конъюгатов антитело-лекарство для лечения расстройства, ассоциированного с функцией или экспрессией CXCR4 (например, рака), такого как рак толстого кишечника, RCC, рак пищевода, рак желудка, рак головы и шеи, рак легких, рак яичников, рак поджелудочной железы или гематологический рак. Изобретение расширяет арсенал средств для лечения рака. 13 н. и 11 з.п. ф-лы, 13 ил., 14 табл., 16 пр.
1. Изолированное антитело или его антиген-связывающий фрагмент, которое связывается с рецептором хемокина 4 (CXCR4) и содержит:
a) вариабельный участок тяжелой цепи (VH), содержащий (i) VH CDR1, выбранный из группы, состоящей из SEQ ID NO: 107, 113, 114; (ii) VH CDR2, выбранный из группы, состоящей из SEQ ID NO: 162, 128, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156 и 130, и (iii) VH CDR3, выбранный из группы, состоящей из SEQ ID NO: 112; и;
b) вариабельный участок легкой цепи (VL), содержащий (i) VL CDR1, выбранный из группы, состоящей из SEQ ID NO: 144, 138, 141, 142, 143, 146, 147, 148, 149 и 150; (ii) VL CDR2, выбранный из группы, состоящей из SEQ ID NO: 145, 132; и (iii) VL CDR3, выбранный из группы, состоящей из SEQ ID NO: 139, 140 и 170.
2. Изолированное антитело или его антиген-связывающий фрагмент, которое связывается с CXCR4 и содержит:
a) VH участок, содержащий участки определения комплементарности, выбранный из группы, состоящей из (i) VH CDR1, содержащего последовательность SEQ ID NO:107, 113, 114; (ii) VH CDR2, содержащего последовательность SEQ ID NO: 162, 128, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156 или 130; и (iii) VH CDR3, содержащего последовательность SEQ ID NO: 112; и
b) VL участок, содержащий участки определения комплементарности, выбранный из группы, состоящей из (i) VL CDR1, выбранного из группы, состоящей из SEQ ID NO: 144, 138, 141, 142, 143, 146, 147, 148, 149 или 150; (ii) VL CDR2, содержащего последовательность SEQ ID NO 145; и (iii) VL CDR3, содержащего последовательность SEQ ID NO: 139, 140 или 170.
3. Изолированное антитело или его антиген-связывающий фрагмент по п. 1, которое связывается с рецептором хемокина 4 (CXCR4), содержащее VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107, 113 или 114; VH CDR2 с последовательностью SEQ ID NO: 162 или 128; и VH CDR3 с последовательностью SEQ ID NO: 112; и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145; и VL CDR3 с последовательностью SEQ ID NO: 139.
4. Антитело или его антиген-связывающий фрагмент по п. 1, где антитело содержит:
a) VH участок, содержащий три CDR с последовательностями SEQ ID NO: 107, 162 и 112; и
b) VL участок, содержащий три CDR с последовательностями SEQ ID NO: 144, 145 и 139.
5. Изолированное антитело или его антиген-связывающий фрагмент по п. 1 или 2, где антитело содержит:
a) VH участок, содержащий VH CDR1, VH CDR2 и VH CDR3 из VH участка последовательности SEQ ID NO: 33; и
b) VL участок, содержащий VL CDR1, VL CDR2 и VL CDR3 из VL участка последовательности SEQ ID NO: 73.
6. Изолированное антитело или его антиген-связывающий фрагмент по п. 1, выбранное из группы, состоящей из следующих:
a) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 33 и VL участок последовательности SEQ ID NO: 73; и
b) антитело или его антиген-связывающий фрагмент, содержащий VH участок последовательности SEQ ID NO: 21 и VL участок последовательности SEQ ID NO: 47.
7. Антитело или его антиген-связывающий фрагмент по п. 4, где антитело содержит VH участок, полученный с помощью вектора экспрессии с АТСС номером доступа РТА-121353.
8. Антитело или его антиген-связывающий фрагмент по п. 4, где антитело содержит VL участок, полученный с помощью вектора экспрессии с АТСС номером доступа РТА-121354.
9. Изолированное антитело или его антиген-связывающий фрагмент, которое связывает CXCR4, где антитело или его антиген-связывающий фрагмент конкурирует за связывание с CXCR4, и где антитело или его антиген-связывающий фрагмент содержит VH участок, содержащий VH CDR1 с последовательностью SEQ ID NO: 107; VH CDR2 с последовательностью SEQ ID NO: 162 и VH CDR3 с последовательностью SEQ ID NO: 112, и VL участок, содержащий VL CDR1 с последовательностью SEQ ID NO: 144; VL CDR2 с последовательностью SEQ ID NO: 145 и VL CDR3 с последовательностью SEQ ID NO: 139.
10. Фармацевтическая композиция для лечения состояния, ассоциированного с функцией или экспрессией CXCR4, содержащая терапевтически эффективное количество антитела или его антиген-связывающего фрагмента по какому-либо одному из пп. 1-9 и фармацевтически приемлемый носитель.
11. Изолированный полинуклеотид, кодирующий VH участок антитела или его антиген-связывающий фрагмент по п. 1, содержащий нуклеотидную последовательность, кодирующую (а) VH участок, включающий (i) VH CDR1, выбранный из группы, состоящей из SEQ ID NO: 107, 113, 114; (ii) VH CDR2, выбранный из группы, состоящей из SEQ ID NO: 162, 128, 154, 123, 158, 124, 159, 125, 160, 126, 161, 127, 163, 164, 165, 166, 167, 168, 155, 129, 156, и 130; и (iii) VH CDR3, выбранный из группы, состоящей из SEQ ID NO: 112; и
b) VL участок, содержащий (i) VL CDR1, выбранный из группы, состоящей из SEQ ID NO: 144, 138, 141, 142, 143, 146, 147, 148, 149 и 150; (ii) VL CDR2, выбранный из группы, состоящей из SEQ ID NO: 145, 132; и (iii) VL CDR3, выбранный из группы, состоящей из SEQ ID NO: 139, 140 и 170; где антитело связывается с CXCR4.
12. Вектор экспрессии, содержащий полинуклеотид по п. 11.
13. Изолированная клетка-хозяин рекомбинантно продуцирующая антитело или его антиген-связывающий фрагмент по какому-либо одному из пп. 1-9, где антитело связывается с CXCR4, содержащая вектор по п. 12.
14. Способ получения антитела или его антиген-связывающего фрагмента, включающий культивирование клетки-хозяина по п. 13 в культуральной среде в условиях, приводящих к продуцированию антитела или его антиген-связывающего фрагмента, и изолирование антитела или его антиген-связывающего фрагмента из клетки-хозяина или культуральной среды.
15. Применение фармацевтической композиции по п. 10 в лечении расстройства, ассоциированного с функцией или экспрессией CXCR4 у субъекта.
16. Применение по п. 15, где расстройство означает рак.
17. Применение по п. 16, где рак означает гематологический рак.
18. Применение по п. 16, где рак означает В-клеточный или Т-клеточный лейкоз.
19. Применение по п. 16, где рак выбирают из группы, состоящей из следующих: острая лимфоцитарная лейкемия (ALL), острая миелоидная лейкемия (AML), хроническая лимфоцитарная лейкемия (CLL), мелкоклеточная лимфоцитарная лимфома (SLL), множественная миелома (ММ), неходжкинская лимфома (NHL), Ходжкинская лимфома, мантийноклеточная лимфома (MCL), фолликулярная лимфома, макроглобулинемия Вальденстрема (WM), В-клеточная лимфома и диффузная В-крупноклеточная лимфома (DLBCL).
20. Применение по п. 16, где рак выбирают из группы, состоящей из следующих: рак мочевого пузыря, молочной железы, шейки матки, хориокарцинома, толстого кишечника, пищевода, желудка, глиобластома, головы и шеи, почек, легких, рта, яичников, поджелудочной железы, простаты и кожи.
21. Применение фармацевтической композиции по п. 10 для снижения роста или прогрессирования опухоли у субъекта, который имеет опухоль, экспрессирующую CXCR4.
22. Применение фармацевтической композиции по п. 10 для снижения количества метастазов раковых клеток, экспрессирующих CXCR4 у субъекта.
23. Применение фармацевтической композиции по п. 11 для индуцирования регрессии опухоли у субъекта, который имеет опухоль, экспрессирующую CXCR4.
24. Применение изолированного антитела по какому-либо одному из пп. 1-9 в производстве лекарственного средства для лечения расстройства, ассоциированного с экспрессией CXCR4.
| WO2010037831 A1, 08.04.2010 | |||
| МЕХАНИЗМ ОТВЕТА ПРИ ВОССТАНОВЛЕНИИ ДАННЫХ В РЕЖИМЕ "ТОЧКА-ТОЧКА" ДЛЯ СИСТЕМ ПЕРЕДАЧИ "ТОЧКА - МНОГО ТОЧЕК" | 2005 |
|
RU2371863C2 |
| EA 200900424 А1, 28.08.2009. | |||
Авторы
Даты
2018-12-19—Публикация
2014-07-28—Подача