Область техники
Изобретение относится к анти-CGRP антителу для применения в предотвращении и/или лечении хронической боли и/или симптомов хронической боли и к способу лечения и/или предотвращения хронической боли и/или симптомов хронической боли с применением анти-CGRP антитела.
Уровень техники
Хроническая боль представляет собой продолжительную боль, которая сохраняется продолжительнее, чем временное естественное заживление исходного поражения или заболевания, вызывающего боль. Она не содействует полезной или защитной функции, и по оценкам 2,7 миллионов людей в Великобритании становятся нетрудоспособными из-за патологического состояния хронической боли.
Боль, вызванная раковым заболеванием, является одной из наиболее распространенных типов хронической боли и демонстрирует ноцицептивные компоненты благодаря опухолевому росту и невропатические компоненты благодаря нервному поражению, индуцированному опухолью. Она дополнительно включает структурное поражение, ущемление и поражение нерва, воспалительные процессы, которые ведут к нарушению нормального метаболизма ткани, продуцированию простагландинов и цитокинов воспаления и к поражению ткани.
К настоящему времени, основная часть анальгетиков, применяемых для лечения хронической боли, представляет собой опиаты и нестероидные противовоспалительные средства (НПВС). Оба класса лекарственных средств могут производить тяжелые побочные эффекты. НПВС могут вызывать язву желудка и поражение почек, опиаты могут вызывать тошноту, констипацию, спутанность сознания и проблемы зависимости. Опиоиды не способны даже при высоких дозах производить ослабление боли у всех индивидуумов, страдающих хронической болью, и, кроме того, развитие анальгетической устойчивости к опиоидам затрудняет их применимость в течение длительного курса терапии. В частности, лечение боли, связанной с раковым заболеванием, требует использования неприемлемо высокого уровня опиатов с сопутствующими этому побочными эффектами, и при этом, по меньшей мере, 20% подвергнутых лечению пациентов все еще имеют неконтролируемую боль.
Соответственно, существует медицинская необходимость идентификации новых фармацевтически активных соединений, которые препятствуют ключевым стадиям процесса хронической боли, и, в частности, это необходимо для лечения и/или предотвращения хронической ноцицептивной боли и/или симптомов хронической ноцицептивной боли.
К удивлению, авторы обнаружили, что введение анти-CGRP антитела в периферическом месте приложения действия является эффективным для предотвращения и/или лечения хронической боли и, в частности, хронической ноцицептивной боли, такой как боль, связанная с раковым заболеванием.
CGRP (пептид, связанный с геном кальцитонина) представляет собой нейропептид из 37 аминокислот, который действует в качестве нейромедиатора в центральной нервной системе. Он связывается с высокой степенью аффинности с CGRP-рецептором, с рецептором подобным рецептору кальцитонина (CRLR), активируя продуцирование аденилатциклазы и протеинкиназы A.
Было продемонстрировано, что при спинальном введении с центральным проникновением, низкомолекулярные селективные CGRP-антагонисты применимы в лечении патологических состояний невропатической и ноцицептивной боли (Adwanikar et al, Pain 2007), предполагая, что удаление эндогенного CGRP в спинном мозге обладает антиноцицептивным эффектом. Было продемонстрировано, что дополнительное интратекальное введение иммунной сыворотки против CGRP уменьшает ноцицептивное поведение в моделях артрита у грызунов (Kuraishi, Y., et al. Neurosci. Lett (1998) 92, 325-329).
К удивлению, авторы обнаружили, что введение анти-CGRP антитела в периферическом месте приложения действия является эффективным в предотвращении и/или лечении хронической боли и, в частности, хронической ноцицептивной боли, при введении периферически. Этот периферический путь введения обеспечивает явное преимущество по сравнению с требованием интратекального или спинального введения антител, с более высоким риском и затруднительной процедурой.
Краткое описание изобретения
В настоящем изобретении предлагается применение анти-CGRP антогонистического антитела для производства лекарственного средства для предотвращения и/или лечения хронической боли и/или симптомов хронической боли, где лекарственное средство готовят для введения периферически.
В настоящем изобретении дополнительно предлагается способ предотвращения и/или лечения хронической боли и/или симптомов хронической боли у индивидуума, способ, который включает периферическое введение указанному индивидууму терапевтически эффективного количества анти-CGRP антагонистического антитела.
В одном воплощении, анти-CGRP антагонистическое антитело при введении действует периферически.
Описание фигур
Фигура 1. Эффект антитела G2, оказываемый на механическую гиперчувствительность к 8 граммам стимулов von Frey в модели боли, связанной с раком кости. Крысы с инъецированным MRMT-1 получали антитело G2 или пустой носитель (PBS+0,01% Tween20) на 9 день после операции. Группы были здоровы все время на протяжении послеоперационного периода, что демонстрировалось послеоперационным увеличением прибавки веса (данные не показаны). Данные представляют собой среднее значение ± стандартная погрешность среднего для 7-9 крыс на группу. *p<0,05 против группы, получавшей пустой носитель в каждый момент времени.
Фигура 2. Эффект антитела G2, оказываемый на механическую гиперчувствительность к 15 граммам стимулов von Frey в модели боли, связанной с раком кости. Крысы с инъецированным MRMT-1 получали G2 или пустой носитель (PBS+0,01% Tween20) на 9 день после операции. Данные представляют собой среднее значение ± стандартная погрешность среднего для 7-9 крыс на группу. *p<0,05 против группы, получавшей пустой носитель в каждый момент времени.
Фигура 3. Эффект антитела G2, оказываемый на способность передвигаться, измеренную с помощью вращающегося стержня. Исследовали две пограничные точки. Латентный период для ослабления по измерениям ухудшений двигательной координации, индуцированных соединением (A), и балльная оценка согласно тесту вращающегося стержня по измерениям боли, вызванной способностью передвигаться (B) в модели боли, связанной с раком кости. Крысы с инъецированным MRMT-1 получали антитело G2 или пустой носитель (PBS+0,01% Tween20) на 9 день после операции. Данные представляют собой среднее значение ± стандартная погрешность среднего для 7-9 крыс на группу. *p<0,05 против группы, получавшей пустой носитель в каждый момент времени.
Фигура 4: Данные анализа связывания, демонстрирующие, что антитело G1 ингибирует связывание α-CGRP с CGRP1-рецептором.
Фигура 5a: Уровень концентрации анти-CGRP антитела (мкг/мл) в сыворотке против времени после внутривенного введения 10 мг/кг, измеренный с помощью анти-IgG-ELISA.
Фигура 5b: Уровень концентрации анти-CGRP антитела (мкг/мл) в сыворотке против времени после внутривенного введения 10, 30, 100 мг/кг, измеренный с помощью анти-IgG-ELISA.
Фигура 6: Сканирующий аланином мутагенез с использованием C-концевого фрагмента CGRP (CGRP 25-37). Изменение аффинности выражается в кратной потере аффинности и демонстрирует, что анти-CGRP антитело G1 связывается с C-концевым участком человеческого белка α-CGRP.
Фигура 7: Конкурирование в растворе с помощью Biacore: CGRP, фрагменты CGRP или пептиды, с последовательностью, родственной CGRP, использовали для определения специфичности антитела G1.
Фигура 8: CGRP-последовательности человека, макаки-крабоеда, крысы, собаки и кролика. Подчеркнуты неконсервативные остатки между видами, эпитоп антитела G1 выделен жирным шрифтом.
Фигура 9: Данные демонстрируют, что G1 ингибирует неврогенное воспаление кожи, начиная с 90 мин после обработки. G1 вводили с помощью внутривенного введения (1 мл/кг). Данные собраны от 6-8 или 13 крыс на группу. *p=0,05, **p=0,01 против группы, получавшей пустой носитель (фосфатно-буферный солевой раствор) в каждый момент времени (AVOVA).
Таблица 1: Kd и IC50 анти-CGRP антител, измеренные при 25ºC против человеческого α-CGRP [muMab7E9 = мышиный предшественник G1. Его KD для крысиного β-CGRP=1 нМ. RN4901 = мышиное средство, распознающее тот же эпитоп, что и G1, но демонстрирующее такую же аффинность и селективность у крыс (β-CGRP KD=17 нМ); G1=антитело, гуманизированное из muMab7E9 (KD для крысиного β-CGRP=0,1 нМ).]
Таблица 2: Аффинности связывания G1, определенные с помощью Biacore.
Описание изобретения
Общие методы
При практическом применении настоящего изобретения до тех пор, пока не указано иначе, будут применяться стандартные методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в компетенции специалиста в данной области. Такие методы в полном объеме объяснены в литературе, такой как Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (MJ. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. CeIMs, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J. P. Mather and P. E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths, and D. G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D. M. Weir and CC. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987); Current Protocols in Molecular Biology (F. M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J. E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (CA. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty, ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); and Cancer: Principles and Practice of Oncology (VT. DeVita et al., eds., J. B. Lippincott Company, 1993).
Определения
"Антитело" представляет собой молекулу иммуноглобулина, способную к специфичному связыванию с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., посредством, по меньшей мере, одного сайта распознавания антигена, локализованного в вариабельном участке молекулы иммуноглобулина. При использовании в настоящем документе, термин охватывает не только интактные поликлональные или моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2, Fv, dAb), одноцепочечные антитела (ScFv), их мутанты, химерные антитела, диатела, сшитые белки, включающие участок антитела, и охватывает любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая включает сайт распознавания антигена. Антитело включает антитело любого класса, такое как IgG, IgA или IgM (или их подклассы), и антитело необязательно должно принадлежать к какому-то конкретному классу. В зависимости от аминокислотной последовательности константного домена тяжелых цепей антитела, иммуноглобулины могут быть отнесены к различным классам. Существует пять главных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут дополнительно подразделяться на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, которые соответствуют различным классам иммуноглобулинов, называют альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
"Fv" представляет собой фрагмент антитела, который содержит полный сайт распознавания и связывания антигена. В двухцепочечных вариантах Fv, этот участок состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в тесной нековалентной ассоциации. В одноцепочечном варианте Fv, один вариабельный домен тяжелой цепи и один вариабельный домен могут быть ковалентно связаны с помощью гибкого пептидного линкера, так что легкая и тяжелая цепи могут быть ассоциированы в димерной структуре, аналогичной структуре двухцепочечных вариантов Fv. В этой конфигурации три CDR каждого вариабельного домена взаимодействуют для определения антиген-связывающей специфичности на поверхности димера VH-VL. Однако даже один вариабельный домен (или половина Fv, включающего только 3 CDR, специфичных к антигену) обладает способностью распознавать и связываться с антигеном, хотя, как правило, с более низкой активностью, по сравнению с полным сайтом связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов вставкой нескольких остатков в карбокси-конец CH1-домена тяжелой цепи, включающих один или более цистеинов из шарнирных участков антитела. F(ab)2-фрагмент представляет собой двухвалентный фрагмент, включающий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирном участке.
Антитело может содержать один или более сайтов связывания (для соединения с антигеном). Если существует более одного сайта связывания, то сайты связывания могут быть идентичны друг другу или могут отличаться. Например, встречающийся в естественной среде иммуноглобулин содержит два идентичных сайта связывания, одноцепочечное антитело или Fab-фрагмент содержат один сайт связывания, в то время как "биспецифичное" или "бифункциональное" антитело (диатело) содержит два различных сайта связывания в отношении последовательности распознавания антигена и/или эпитопа.
"Изолированное антитело" представляет собой антитело, которое (1) не ассоциировано с естественно-ассоциированными компонентами, включающими другие естественно-ассоциированные антитела, которые сопровождают его в нативном состоянии, (2) свободно от других белков из того же вида, (3) экспрессируется клеткой из другого вида, или (4) не встречается в естественной среде.
"Моноклональное антитело" обозначает гомогенную популяцию антител, где моноклональное антитело состоит из аминокислот (встречающихся в естественной среде или не встречающихся в естественной среде), которые вовлечены в селективное связывание с антигеном. Популяция моноклональных антител является высоко специфичной, будучи направленной против одного антигенного сайта. Термин "моноклональное антитело" охватывает не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные антитела (ScFv), их мутанты, сшитые белки, включающие участок антитела, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая включает сайт распознавания антигена требуемой специфичности и способности связывания с антигеном. В изобретении не предусмотрено ограничение, касающееся источника антитела или способа его получения (например, с помощью гибридомы, фаговой селекции, рекомбинатной экспрессии, трансгенных животных и т.д.).
При использовании в настоящем документе, "гуманизированные" антитела обозначают формы антител из источников, отличных от человека (например, мышиные), которые представляют собой специфические химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антиген-связывающие фрагменты последовательностей антител), которые содержат минимальную последовательность, произошедшую из иммуноглобулина, полученного из источника, отличного от человека. По большей части, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из участка, определяющего комплементарность (CDR), реципиента заменены остатками CDR из вида, отличного от человека (донорное антитело), такого как мышь, крыса или кролик, где гуманизированные антитела имеют целевую специфичность, аффинность и биологическую активность. В некоторых случаях, остатки каркасного участка Fv (FR) человеческого иммуноглобулина заменяют соответствующими остатками вида, отличного от человека. Кроме того, гуманизированное антитело может включать остатки, которые не обнаружены ни в реципиентном антителе, ни в импортируемых CDR или каркасных последовательностях, но они включены для дополнительной коррекции и оптимизации функции антитела. Вообще, гуманизированное антитело будет включать, по существу, все из, по меньшей мере, одного и, как правило, двух вариабельных доменов, в которых все или по существу все из участков CDR соответствуют последовательностям иммуноглобулина из вида, отличного от человека, и все или по существу все FR-участки представляют собой консенсусные последовательности из человеческого иммуноглобулина. Гуманизированное антитело оптимально также будет включать, по меньшей мере, часть константного участка или домена (Fc) иммуноглобулина, как правило, человеческого иммуноглобулина. Антитела могут содержать Fc-участки, описанные в WO 99/58572. Другие формы гуманизированных антител содержат один или более участков CDR (один, два, три, четыре, пять, шесть), которые изменены по отношению к исходному антителу, которые также обозначаются как один или более CDR "произошедших из" одного или более CDR из исходного антитела.
При использовании в настоящем документе, "человеческое антитело" обозначает антитело, имеющее аминокислотную последовательность, соответствующую последовательности антитела, продуцированного клетками человека, и/или полученную с использованием любого из методов получения человеческих антител, известного из уровня техники или раскрытого в настоящем документе. Это определение человеческого антитела включает антитела, включающие, по меньшей мере, один человеческий полипептид тяжелой цепи или, по меньшей мере, один человеческий полипептид легкой цепи. Один такой пример представляет собой антитело, включающее мышиный полипептид легкой цепи и человеческий полипептид тяжелой цепи. Человеческие антитела могут быть получены с использованием различных методов, известных из уровня техники. В одном воплощении, человеческое антитело выбирают из фаговой библиотеки, которая экспрессирует человеческие антитела (Vaughan et al., 1996, Nature Biotechnology, 14:309-314; Sheets et al., 1998, PNAS, (USA) 95:6157-6162; Hoogenboom and Winter, 1991, J. Mol. Biol., 227:381; Marks et al., 1991, J. Mol. Biol., 222:581). Человеческие антитела также могут быть получены путем введения человеческих иммуноглобулиновых локусов трансгенным животным, например мышам, у которых эндогенные иммуноглобулиновые гены частично или полностью инактивированы. Этот способ описан в Патентах США No. 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016. Альтернативно, человеческое антитело может быть получено с помощью иммортализации человеческих В-лимфоцитов, которые продуцируют антитело против антигена-мишени (такие B-лимфоциты могут быть получены от индивидуума или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., 1991, J. Immunol., 147 (1):86-95; и Патент США No. 5750373.
Одноцепочечное антитело (scFc) представляет собой антитело, в котором участки VL и VH спарены с образованием одновалентной молекулы посредством синтетического линкера, который дает им возможность существовать в виде одной белковой цепи (Bird et al Science, 242: 423-426 (1988) and Huston et al., Proc. Natl. Acad. Sci. USA, 85:5879-5883 (1988)).
Диатела представляют собой двухвалентные биспецифичные антитела, в которых домены VH и VL экспрессируются на одной полипептидной цепи, но с использованием линкера, который слишком короткий, чтобы позволить спаривание между двумя доменами на одной цепи, заставляя, таким образом, домены спариваться с комплементарными доменами другой цепи и создавая два антиген-связывающих сайта.
"Химерные антитела" обозначают такие антитела, где одна часть каждой из аминокислотных последовательностей тяжелой и легкой цепей гомологична соответствующим последовательностям, произошедшим из конкретного вида или принадлежащих к конкретному классу, в то время как оставшийся сегмент цепей гомологичен последовательностям другого вида или класса. Как правило, в этих химерных антителах вариабельный участок обеих, легкой и тяжелой, цепей имитирует вариабельные участки антител, произошедших из одного вида млекопитающих, в то время как константные участки гомологичны последовательностям антител, произошедших из другого вида. Одно очевидное преимущество таких химерных форм заключается, например, в том, что вариабельные участки могут быть выделены удобным способом из известных в настоящее время источников с использованием легкодоступных гибридом или В-клеток из организмов-хозяев, отличных от человека, в комбинации с константными участками, выделенными, например, из препаратов человеческих клеток. В то время как вариабельный участок имеет преимущество легкого получения, и источник не влияет на специфичность, константный участок, будучи человеческим, с меньшей вероятностью будет вызывать иммунный ответ человека при инъекции антител по сравнению с константным участком из источника, отличного от человека. Однако определение не ограничено этим частным примером.
"Функциональный Fc-участок" обладает, по меньшей мере, одной эффекторной функцией нативной последовательности Fc-участка. В качестве примера "эффекторные функции" включают C1q-связывание; комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; даун-регуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора; BCR) и т.д. Такие эффекторные функции, как правило, требуют, чтобы Fc-участок был объединен с доменом связывания (например, вариабельным доменом антитела), и могут оцениваться с использованием различных известных из уровня техники анализов для оценки таких эффекторных функций антитела.
"Fc-участок нативной последовательности" включает аминокислотную последовательность, идентичную аминокислотной последовательности Fc-участка, обнаруженного в естественной среде. "Вариантный Fc-участка" включает аминокислотную последовательность, которая отличается от нативной аминокислотной последовательности Fc-участка посредством, по меньшей мере, одной аминокислотной модификации, сохраняя при этом, по меньшей мере, одну эффекторную функцию Fc-участка нативной последовательности. Предпочтительно, вариантный Fc-участок содержит, по меньшей мере, одну аминокислотную замену по сравнению с Fc-участком нативной последовательности или с Fc-участком родительского полипептида, например, содержит примерно до десяти аминокислотных замен, и предпочтительно, примерно от одной примерно до пяти аминокислотных замен в Fc-участке нативной последовательности или в Fc-участке родительского полипептида. Вариантный Fc-участок согласно настоящему документу предпочтительно будет обладать, по меньшей мере, примерно 80% идентичности последовательности с Fc-участком нативной последовательности и/или с Fc-участком родительского полипептида и, наиболее предпочтительно, по меньшей мере, примерно 90% идентичности последовательности с указанными последовательностями, более предпочтительно, по меньшей мере, примерно 95% идентичности последовательности с указанными последовательностями.
При использовании в настоящем документе, "антителозависимая клеточноопосредованная цитотоксичность" и "ADCC" обозначают клеточноопосредованную реакцию, в которой неспецифичные цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcR) (например, естественные киллерные клетки (NK), нейтрофилы и макрофаги), распознают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. ADCC-активность молекулы, представляющей интерес, может оцениваться с использованием in vitro ADCC-анализа, такого как описанный в Патенте США No. 5500362 или 5821337. Эффекторные клетки, применяемые для таких анализов, включают мононуклеарные клетки периферической крови (PBMC) и NK-клетки. Альтернативно или дополнительно, ADCC-активность молекулы, представляющей интерес, может оцениваться in vivo, например, в животных моделях, таких как раскрытые у Clynes et al., 1998, PNAS (USA), 95:652- 656.
При использовании в настоящем документе, "Fc-рецептор" и "FcR" описывают рецептор, который связывается с Fc-участком антитела. Предпочтительный FcR представляет собой нативную последовательность человеческого FcR. Кроме того, предпочтительный FcR представляет собой последовательность, которая связывается с антителом IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы альтернативного сплайсинга этих рецепторов. FcγRII-рецепторы включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые обладают похожими аминокислотными последовательностями, которые отличаются, главным образом, их цитоплазматическими доменами. FcR рассмотрены у Ravetch and Kinet, 1991, Ann. Rev. Immunol., 9:457-92; Capel et al., 1994, Immunomethods, 4:25-34; и de Haas et al., 1995, J. Lab. Clin. Med., 126:330-41. "FcR" также включает неонатальный рецептор, FcRn, который ответственен за передачу плоду материнских IgG (Guyer et al., 1976, J. Immunol., 117:587; and Kim et al., 1994, J. Immunol., 24:249).
"Комплементзависимая цитотоксичность" и "CDC" обозначают лизирование мишени в присутствии комплемента. Путь активации комплемента инициируется посредством связывания первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе с распознанным антигеном. Для оценки активации комплемента может быть осуществлен CDC-анализ, описанный у Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996).
При использовании в настоящем документе, термины "G1" и "антитело G1" взаимозаменяемо используются для обозначения антитела, продуцируемого экспрессирующими векторами, имеющими депозитные номера ATCC-PTA-6867 и ATCC-PTA-6866. Аминокислотная последовательность вариабельных участков тяжелой и легкой цепи представлены в SEQ ID No. 1 и 2. CDR-части антитела G1 (включая CDR по Chothia и Kabat) изображены в виде диаграммы на Фигуре 5 WO 2007/054809, содержание которого включено в настоящий документ ссылкой в полном объеме. Полинуклеотиды, кодирующие вариабельные участки тяжелой и легкой цепи, представлены в SEQ ID No. 9 и 10. Характеристика антитела G1 описана в Примерах WO 2007/054809, содержание которого включено в настоящий документ ссылкой в полном объеме. G1 представляет собой гуманизированное моноклональное блокирующее антитело (IgG2), которое блокирует связывание и активность нейропептида CGRP (a и b) и его эффект нейрогенной вазодилатации, вызванной высвобождением CGRP. G1 представляет собой IgG2Δa моноклональное анти-CGRP антагонистическое антитело, произошедшее из мышиного анти-CGRP антагонистического антитела-предшественника, обозначенного muMAb7E9, которое было идентифицировано в скрининге с использованием клеток селезенки, полученных от мыши, иммунизированной человеческим и крысиным CGRP, которые были слиты с клетками плазмоцитомы мыши. G1 было создано путем графтинга CDR легкой и тяжелой цепи, произошедших из muMAb7E9, в непосредственной близости к человеческой зародышевой последовательности с последующим введением, по меньшей мере, 1 мутации в каждый CDR и 2 каркасных мутаций в VH. Две мутации вводили в Fc-домен G1 для подавления активации человеческого Fc-рецептора. Было продемонстрировано, что G1 и muMab7E9 распознают один и тот же эпитоп.
При использовании в настоящем документе, термины "G2" и "антитело G2" взаимозаменяемо используются для обозначения мышиного моноклонального антитела к крысиному CGRP, описанного у Wong HC et al. Hybridoma 12:93-106 (1993). Аминокислотная последовательность вариабельных участков тяжелой и легкой цепи представлена в SEQ ID No. 19 и 20. Полинуклеотиды, кодирующие вариабельные участки тяжелой и легкой цепи, представлены в SEQ ID No. 27 и 28. CDR-участки антитела G2 представлены в SEQ ID No. 21-26. Было продемонстрировано, что G2 распознает тот же эпитоп, что и G1.
При использовании в настоящем документе, "иммуноспецифичное" связывание антител обозначает антиген-специфичное связывающее взаимодействие, которое происходит между антиген-связывающим сайтом антитела и специфичным антигеном, распознаваемым антителом (т.e. антитело вступает в реакцию с белком в ELISA или в другом иммуноанализе и не вступает в реакцию на детектируемом уровне с посторонними белками).
Эпитоп, который "специфично связывается" или "предпочтительно связывается" (используются взаимозаменяемо) с антителом или полипептидом, представляет собой термин, хорошо известный из уровня техники, и методы определения такого специфичного или предпочтительного связывания также хорошо известны из уровня техники. Говорят, что молекула демонстрирует "специфичное связывание" или "предпочтительное связывание", если она вступает в реакцию или ассоциирует с конкретной клеткой или веществом более часто, более быстро, более продолжительно и/или с большей аффинностью по сравнению с другими клетками или веществами. Антитело "специфично связывается" или "предпочтительно связывается" с мишенью, если оно связывается с мишенью с большей аффинностью, авидностью, более легко и/или более продолжительно по сравнению с другими веществами. Также из настоящего определения понятно, что, например, антитело (или компонент или эпитоп), которое специфично или предпочтительно связывается с первой мишенью, может или не может специфично или предпочтительно связываться со второй мишенью. "Специфичное связывание" или "предпочтительное связывание" как таковое не является обязательным требованием (хотя оно может им быть) особого связывания. Как правило, но необязательно, ссылка на связывание обозначает предпочтительное связывание.
Термины "полипептид", "олигопептид", "пептид" и "белок" взаимозаменяемо используются в настоящем документе для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может включать модифицированные аминокислоты и он может прерываться компонентами, отличными от аминокислот. Термины также охватывают аминокислотный полимер, который был модифицирован естественным образом или путем воздействия; например, путем образования дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или путем любой другой манипуляции или модификации, такой как конъюгирование с компонентом мечения. Также в определение включены, например, полипептиды, содержащие один или более аналогов аминокислот (включающих, например, синтетические аминокислоты и т.д.), а также другие модификации, известные из уровня техники. Понятно, что поскольку полипептиды по настоящему изобретению базируются на основе антител, то полипептиды могут встречаться в виде одиночных цепей или ассоциированных цепей.
"Полинуклеотид" или "нуклеиновая кислота" при взаимозаменяемом использовании в настоящем документе обозначают полимеры нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги или любой субстрат, который может быть включен в полимер с помощью ДНК- или РНК-полимеразы. Полинуклеотид может включать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Модификация в нуклеотидной структуре, если она присутствует, может быть привнесена перед или после сборки полимера. Последовательность нуклеотидов может прерываться компонентами, отличными от нуклеотидных. Полинуклеотид может быть дополнительно модифицирован после полимеризации, как например, с помощью конъюгирования с компонентом мечения. Другие типы модификаций включают, например, "кэпы", замену одного или более из встречающихся в естественной среде нуклеотидов на аналог, межнуклеотидные модификации, такие как, например, нуклеотиды, с образованием незаряженных связей (например, метилфосфонатной, фосфотриэфирной, фосфорамидатной, карбаматной, и т.д.) и с образованием заряженных связей (например, фосфоротиоатной, фосфородитиоатной и т.д.), модификации включают нуклеотиды, содержащие компоненты боковой цепи, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации с использованием интеркалирующих агентов (например, акридина, псоралена и т.д.), модификации с использованием хелаторов (например, металлов, радиоактивных металлов, бора, окисляющих металлов и т.д.), модификации с использованием алкилирующих агентов, модификации включают нуклеотиды с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также включают не модифицированные формы полинуклеотида(ов). Кроме того, любые из гидроксильных групп, обычно присутствующих в сахарах, могут быть замещены, например, фосфатными группами, защищенными стандартными защитными группами или активированными для создания дополнительных связей с дополнительными нуклеотидами, или они могут быть конъюгированы с твердой подложкой. 5'- и 3'-концевая OH-группа может быть фосфорилирована или замещена аминами или компонентами органических кэпирующих групп, содержащих от 1 до 20 атомов углерода. Другие гидроксилы также могут быть модифицированы с использованием стандартных защитных групп. Полинуклеотиды также могут содержать аналогичные формы рибозных или дезоксирибозных сахаров, которые, как правило, известны из уровня техники, включая, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилоза или ликсоза, пиранозные сахара, фуранозные сахара, седогептулоза, ациклические аналоги и нуклеозидные аналоги без основания, такие как метилрибозид. Одна или более фосфодиэфирных связей могут быть замещены альтернативными связывающими группами. Эти альтернативные связывающие группы включают, в частности, воплощения, где фосфат замещен P(O)S("тиоатом"), P(S)S ("дитиоатом"), "(O)NR2 ("амидатом"), P(O)R, P(O)OR', CO или CH2 ("формацеталем"), в которых каждый R или R' независимо представляет собой H или замещенный или незамещенный алкил (1-20 C), необязательно содержащий эфирную связь (-O-), арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде обязательно идентичны. Предыдущее описание применимо ко всем полинуклеотидам, обозначенным в настоящем документе, включая РНК и ДНК.
"Вариабельный участок" антитела обозначает вариабельный участок легкой цепи антитела или вариабельный участок тяжелой цепи антитела или индивидуально, или в комбинации. Каждый из вариабельных участков тяжелой и легкой цепи состоит из четырех каркасных участков (FR), связанных тремя участками, определяющими комплементарность (CDR), также известными как гипервариабельные участки. CDR в каждой цепи находятся вместе в непосредственной близости от FR и с CDR из другой цепи, способствуя образованию антиген-связывающего сайта антител. Существует, по меньшей мере, два метода для определения CDR: (1) способ на основе межвидовой вариабельности последовательности (т.e. Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda MD)); и (2) способ на основе кристаллографических исследований комплексов антиген-антитело (Chothia et al. (1989) Nature 342:877; Al-lazikani et al (1997) J. Molec. Biol. 273:927-948)). При использовании в настоящем документе, CDR может обозначать CDR, определенные любым из этих способов или комбинацией обоих способов.
"Константный участок" антитела обозначает константный участок легкой цепи антитела или константный участок тяжелой цепи антитела или индивидуально или в комбинации.
При использовании в настоящем документе, "анти-CGRP антагонистическое антитело" (взаимозаменяемо используется с термином "анти-CGRP антитело") обозначает антитело, которое способно связываться с CGRP и ингибировать биологическую активность CGRP и/или последующий сигнальный каскад(ы). Анти-CGRP антагонистическое антитело охватывает антитела, которые блокируют, противодействуют, подавляют или уменьшают (включая значительное уменьшение) биологическую активность CGRP. Для целей настоящего изобретения совершенно понятно, что термин "анти-CGRP антагонистическое антитело" охватывает все ранее идентифицированные термины, названия и функциональные состояния и характеристики, с помощью которых сам CGRP, биологическая активность CGRP или следствия биологической активности, по существу, исчезают, уменьшаются или нейтрализуются в любой значимой степени. В настоящем документе представлены примеры анти-CGRP антагонистических антител.
При использовании в настоящем документе, "по существу чистый" обозначает материал, который является чистым, по меньшей мере, на 50% (т.e. свободен от примесей), более предпочтительно, является чистым, по меньшей мере, на 90%, более предпочтительно, является чистым, по меньшей мере, на 95%, более предпочтительно, является чистым, по меньшей мере, на 98%, более предпочтительно, является чистым, по меньшей мере, на 99%.
"Клетка-хозяин" включает индивидуальную клетку или клеточную культуру, которая может быть или является реципиентом для вектора(ов) для включения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина, и потомство необязательно может быть полностью идентичным (по морфологии или по набору геномной ДНК) с исходной родительской клеткой благодаря естественным, случайным или преднамеренным мутациям. Клетка-хозяин включает клетки, трансфецированные in vivo полинуклеотидом(ами) по изобретению.
При использовании в настоящем документе, "лечение" представляет собой способ для получения благоприятных или целевых клинических результатов. Для целей настоящего изобретения, благоприятные или целевые клинические результаты включают, в частности, один или более из следующих результатов: улучшение или ослабление любого аспекта хронической боли и/или симптома хронической боли.
Для целей настоящего изобретения, благоприятные или целевые клинические результаты включают, в частности, один или более из следующих результатов: уменьшение тяжести, ослабление боли и/или симптома, ассоциированного с хронической болью. "Эффективное количество" лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для эффективных, благоприятных или целевых результатов, включающих клинические результаты, такие как ослабление или уменьшение болевой чувствительности. Эффективное количество может вводиться посредством одного или более введений. Для целей настоящего изобретения, эффективное количество лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для лечения, ослабления, уменьшения интенсивности хронической боли или симптома, ассоциированного с хронической болью, и/или для их предотвращения. Из клинического контекста понятно, что эффективное количество лекарственного средства, соединения или фармацевтической композиции может или не может быть достигнуто совместно с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, "эффективное количество" может предполагаться в контексте введения одного или более терапевтических агентов, и может предполагаться, что один агент дается в эффективном количестве, если совместно с другими агентами, одним или более, может быть достигнут или достигается целевой результат.
В одном воплощении, "приготовленное для" в настоящем документе обозначает лекарственное средство в единой дозированной форме или подобным образом удобно упакованное и/или маркированное для использования для периферического введения.
"Уменьшение частоты возникновения" хронической боли и/или симптома, ассоциированного с хронической болью, обозначает любое уменьшение их тяжести (которое может включать уменьшение потребности и/или количества (например, воздействия) других лекарственных средств и/или терапий, используемых, как правило, для этих патологических состояний), продолжительности и/или частоты.
"Ослабление" хронической боли и/или симптома, ассоциированного с хронической болью, обозначает уменьшение или улучшение одного или более симптомов хронической боли и/или симптомов, ассоциированных с хронической болью, по сравнению с отсутствием введения анти-CGRP антагонистического антитела. "Ослабление" также включает сокращение или уменьшение продолжительности симптома.
"Временное ослабление" хронической боли и/или симптома, ассоциированного с хронической болью, обозначает уменьшение степени одного или более нежелательных клинических проявлений хронической боли у индивидуума или в популяции индивидуумов, получавших анти-CGRP антагонистическое антитело согласно изобретению.
При использовании в настоящем документе, "замедление" развития хронической боли обозначает отсрочку, запаздывание, задержку, стабилизацию и/или отсроченную прогрессию хронической боли и/или симптома, ассоциированного с хронической болью. Это замедление может варьироваться по продолжительности в зависимости от истории болезни и/или от индивидуумов, получавших лечение. Специалисту в данной области очевидно, что достаточное или значительное замедление может по существу охватывать предотвращение, в случае которого у индивидуума не развивается хроническая боль. Метод, который "замедляет" развитие симптома представляет собой метод, который уменьшает вероятность развития симптома в данных временных рамках и/или уменьшает степень симптомов в данных временных рамках по сравнению с неиспользованием метода. Такие сравнения, как правило, основаны на клинических исследованиях, использующих статистически значимое количество объектов.
"Биологический образец" охватывает разнообразные типы образцов, полученные от индивидуума, и может использоваться в анализах диагностики и мониторинга. Определение охватывает образцы крови и других жидкостей биологического происхождения, образцы твердой ткани, такие как биоптат, или культуры ткани или клеток, полученных из нее, а также их потомство. Определение также включает образцы, которые были использованы каким-либо образом после их приобретения, как например, были обработаны реагентами, солюбилизированы или обогащены определенными компонентами, такими как белки или полинуклеотиды, или залиты в полутвердый или в твердый матрикс для целей секционирования. Термин "биологический образец" охватывает клинический образец, а также включает клетки в культуре, клеточные супернатанты, клеточные лизаты, сыворотку, плазму, биологическую жидкость и образцы ткани.
"Индивидуум" или "объект" представляет собой позвоночное, предпочтительно, млекопитающее, более предпочтительно, человека. Млекопитающие включают, в частности, сельскохозяйственных животных (таких как коровы), спортивных животных, домашних питомцев (таких как кошки, собаки и лошади), приматов, мышей и крыс.
При использовании в настоящем документе, "вектор" обозначает конструкцию, которая способна к доставке и, предпочтительно, к экспрессии одного или более генов или последовательностей, представляющих интерес, в клетке-хозяине. Примеры векторов включают, в частности, вирусные векторы, депротеинизированная ДНК- или РНК-экспрессирующие векторы, плазмидные, космидные или фаговые векторы, ДНК- или РНК-экспрессирующие векторы, ассоциированные с катионными конденсирующими агентами, ДНК- или РНК-экспрессирующие векторы, инкапсулированные в липосомы, и определенные эукариотические клетки, такие как клетки-продуценты.
При использовании в настоящем документе, "последовательность контроля экспрессии" обозначает последовательность нуклеиновой кислоты, которая направляет транскрипцию нуклеиновой кислоты. Последовательность контроля экспрессии может представлять собой промотор, такой как конститутивный или индуцируемый промотор, или энхансер. Последовательность контроля экспрессии функционально связана с транскрибируемой последовательностью нуклеиновой кислоты.
При использовании в настоящем документе, "фармацевтически приемлемый носитель" включает любой материал, который при объединении с активным ингредиентом позволяет ингредиенту сохранить биологическую активность и не реагирует с иммунной системой объекта. Примеры в частности включают любой из стандартных фармацевтических носителей, таких как фосфатно-буферный солевой раствор, вода, эмульсии, такие как масло/вода, и различные типы увлажняющих агентов. Предпочтительные разбавители для аэрозольного или парентерального введения представляют собой фосфатно-буферный солевой раствор или нормальный (0,9%) солевой раствор. Композиции, включающие такие носители, составляют с помощью хорошо известных стандартных методов (См., например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000).
При использовании в настоящем документе термин "вводили периферически" обозначает путь, через который происходит доставка вещества, лекарственного средства и/или анти-CGRP антагонистического антитела, конкретно, он обозначает введение не центрально, не спинально, не интратекально, не посредством доставки непосредственно в ЦНС. Термин обозначает пути введения, отличные от только что упомянутых, и включает введение через путь, который представляет собой пероральный путь введения, подъязычный, трансбукальный, локальный, ректальный, посредством ингаляции, чрескожный, подкожный, внутривенный, внутриартериальный, внутримышечный, внутрисердечный, внутрикостный, внутрикожный, внутрибрюшинный, чресслизистый, вагинальный, в стекловидное тело, внутриартикулярный, периартикулярный, местный или накожный.
При использовании в настоящем документе термин "действует периферически" обозначает место приложения действия вещества, соединения, лекарственного средства и/или анти-CGRP антагонистического антитела, причем указанное место находится внутри периферической нервной системы в отличие от центральной нервной системы, причем указанное соединение, лекарственное средство и/или анти-CGRP антагонистическое антитело ограничено неспособностью пересекать барьер в ЦНС и в мозг при введении периферически. Термин "с центральным проникновением" обозначает способность вещества пересекать барьер в мозг или ЦНС.
При использовании в настоящем документе, термин "Koff" предназначен для обозначения константы скорости диссоциации антитела из комплекса антитело/антиген.
При использовании в настоящем документе, термин "Kd" предназначен для обозначения константы диссоциации взаимодействия антитело-антиген.
Настоящее изобретение относится к лекарственному средству для предотвращения и/или лечения хронической боли и/или симптомов хронической боли и к способам предотвращения и/или лечения хронической боли и/или симптомов хронической боли у индивидуума.
В первом аспекте, в изобретении предлагается применение анти-CGRP антагонистического антитела для производства лекарственного средства для предотвращения и/или лечения хронической боли и/или симптомов хронической боли, где лекарственное средство готовят для периферического введения или где лекарственное средство вводят периферически.
Во втором аспекте, в изобретении предлагается анти-CGRP антагонистическое антитело для применения в предотвращении и/или лечении хронической боли и/или симптомов хронической боли, где антитело готовят для периферического введения или где антитело вводят периферически.
В третьем аспекте, в изобретении предлагается применение анти-CGRP антагонистического антитела для производства лекарственного средства для ослабления, контролирования, уменьшения частоты возникновения или замедления развития или прогрессии хронической боли и/или симптомов хронической боли, где лекарственное средство готовят для периферического введения или где лекарственное средство вводят периферически. Альтернативно этому аспекту в изобретении предлагается анти-CGRP антагонистическое антитело для применения для ослабления, контролирования, уменьшения частоты возникновения или замедления развития или прогрессии хронической боли и/или симптомов хронической боли, где антитело готовят для периферического введения или где антитело вводят периферически.
В четвертом аспекте, в изобретении предлагается способ предотвращения и/или лечения хронической боли и/или симптомов хронической боли у индивидуума, включающий периферическое введение индивидууму эффективного количества анти-CGRP антагонистического антитела.
В пятом аспекте, в изобретении предлагается способ ослабления, контролирования, уменьшения частоты возникновения или замедления развития или прогрессии хронической боли и/или симптомов хронической боли у индивидуума, включающий периферическое введение индивидууму эффективного количества анти-CGRP антагонистического антитела.
Согласно предпочтительному воплощению настоящего изобретения, индивидуумом предпочтительно является млекопитающее, например домашнее животное, такое как лошадь, кошка или собака, или сельскохозяйственное животное, такое как овца, корова или свинья. Наиболее предпочтительным млекопитающим является человек.
Согласно предпочтительному воплощению настоящего изобретения, лекарственное средство и/или анти-CGRP антагонистическое антитело готовят для перорального, подъязычного, трансбукального, локального, ректального, посредством ингаляции, чрескожного, подкожного, внутривенного, внутриартериального, внутримышечного, внутрисердечного, внутрикостного, внутрикожного, внутрибрюшинного, чресслизистого, вагинального, в стекловидное тело, внутриартикулярного, периартикулярного, местного или накожного введения.
Согласно следующему предпочтительному воплощению, лекарственное средство готовят для периферического введения перед и/или во время и/или после развития хронической боли.
В одном воплощении, анти-CGRP антагонистическое антитело при введении действует периферически. В одном воплощении, анти-CGRP антагонистическое антитело не вводится центрально, спинально или интратекально.
Согласно предпочтительному воплощению настоящего изобретения хроническая боль включает одну или более из хронической ноцицептивной боли, хронической невропатической боли, хронической воспалительной боли, фибромиалгии, периодической боли и постоянной боли. Хроническая боль может включать одну или более из гиперплазии, аллодинии, центральной сенсибилизации, периферической сенсибилизации, расторможенности и усиленной передачи сигналов.
Согласно следующему предпочтительному воплощению настоящего изобретения, хроническая боль представляет собой боль, связанную с раковым заболеванием, предпочтительно боль, связанная с раковым заболеванием, возникает из-за злокачественной опухоли или рака, предпочтительно выбранных из одного или более из следующих заболеваний: аденокарциномы в железистой ткани, бластомы в эмбриональной ткани органов, карциномы в эпителиальной ткани, лейкоза в ткани, которая образует кровяные клетки, лимфомы в лимфатической ткани, миеломы в костном мозге, саркомы в соединительной или опорной ткани, рака надпочечника, лимфомы, ассоциированной со СПИДом, анемии, рака мочевого пузыря, рака кости, рака мозга, рака груди, карциноидных опухолей, рака шейки матки, химиотерапии, рака толстой кишки, цитопении, рака эндометрия, рака пищевода, рака желудочно-кишечного тракта, рака головы, рака шеи, гепатобилиарного рака, рака почки, лейкоза, рака печени, рака легкого, лимфомы, болезни Ходжкина, неходжкинской лимфомы, опухолей нервной системы, рака ротовой полости, рака яичников, рака поджелудочной железы, рака простаты, ректального рака, рака кожи, рака желудка, рака яичка, рака щитовидной железы, уретрального рака, рака кости, рака в виде сарком соединительной ткани, рака костной ткани, рака кроветворных клеток, рака костного мозга, множественной миеломы, лейкоза, первичного или вторичного рака кости, опухолей, которые метастазируют в кость, опухолей, инфильтрующих нервную ткань и полости внутренних органов, и опухолей, близких к структурам нервной ткани. Еще предпочтительнее, боль, связанная с раковым заболеванием, включает висцеральную боль, предпочтительно, возникающую из-за рака поджелудочной железы и/или метастаз в брюшную полость. Еще предпочтительнее, боль, связанная с раковым заболеванием, включает соматическую боль, предпочтительно возникающую из-за одного или более из следующих состояний - рака кости, метастазирования в кость, послеоперационной боли, рака в виде сарком соединительной ткани, рака костной ткани, рака кроветворных клеток костного мозга, множественной миеломы, лейкоза, первичного или вторичного рака кости.
Согласно предпочтительному воплощению настоящего изобретения, анти-CGRP антагонистическое антитело связывается с CGRP, более предпочтительно, связывается с CGRP и ингибирует способность CGRP связываться с рецептором CGRP. Предпочтительно, анти-CGRP антагонистическое антитело связывается с обоими CGRP, человеческим и грызунов, предпочтительно с человеческим и крысиным CGRP. Более предпочтительно, антитело связывается с человеческим CGRP, еще предпочтительнее, анти-CGRP антагонистическое антитело связывается с человеческим α-CGRP или с человеческим α-CGRP и/или β-CGRP. Наиболее предпочтительно, анти-CGRP антагонистическое антитело представляет собой антитело, которое демонстрирует любую одну или более из следующих функциональных характеристик: (a) связывается с CGRP; (b) блокирует CGRP от его связывания с его рецептором(ами); (c) блокирует или уменьшает активацию рецептора CGRP, включая активацию cAMP; (d) ингибирует, блокирует, подавляет или уменьшает биологическую активность CGRP, включая последующие сигнальные пути, опосредованные сигнальным каскадом CGRP, такие как связывание рецептора и/или вызов клеточного ответа на CGRP; (e) предотвращает, ослабляет или подвергает лечению любой аспект хронической боли; (f) увеличивает выведение CGRP; и (g) ингибирует (уменьшает) синтез, продуцирование или высвобождение CGRP.
Известно, что антитела по изобретению, включающие G1 и G2, связываются с CGRP и ликвидируют его биологическую доступность, например, в сыворотке, предотвращая таким образом, доступ CGRP к своему рецептору и к последующим клеточным ответам и биологическим эффектам CGRP, таким как воспалительная гиперемия и вазодилатация.
В следующем предпочтительном воплощении изобретения, анти-CGRP антагонистическое антитело связывается с фрагментом CGRP, более предпочтительно, с фрагментом CGRP, а также с полноразмерным CGRP. Предпочтительно, анти-CGRP антагонистическое антитело связывается с C-концевым участком или фрагментом CRGP. C-концевой участок или фрагмент CRGP предпочтительно включает аминокислоты 19-37 или 25-37 или 29-37 или альтернативно 30-37, или альтернативно аминокислоты 31-37 последовательности CGRP. В следующем воплощении, C-концевой участок или фрагмент CRGP предпочтительно включает аминокислоты 32-37, наиболее предпочтительно, аминокислоты 33-37 последовательности CGRP. Предпочтительно, CGRP представляет собой или α-CGRP или β-CGRP, еще предпочтительнее, человеческий или грызуна, еще предпочтительнее, человеческий или крысиный, более предпочтительно, человеческий, еще предпочтительнее, человеческий α-CGRP или β-CGRP, наиболее предпочтительно, человеческий α-CGRP.
В следующем предпочтительном воплощении изобретения, анти-CGRP антагонистическое антитело специфично связывается с аминокислотной последовательностью GSKAF. Предпочтительно, последовательность GSKAF из CGRP представляет собой эпитоп, с которым связывается анти-CGRP антагонистическое антитело, предпочтительно, в положении 33-37, наиболее предпочтительно, последовательность представляет собой GXXXF, где X может быть любой аминокислотой, предпочтительно в положениях 33-37 в CGRP, концы определяются аминокислотами G33 и F37 в CGRP.
В одном воплощении, в настоящем изобретении предлагается анти-CGRP антагонистическое антитело, которое специфично связывается с эпитопом, определяемым аминокислотами G33-F37 в CGRP. Анти-CGRP антагонистическое антитело может специфично связываться с эпитопом, определяемым аминокислотной последовательностью GSKAF. В одном воплощении, в настоящем изобретении предлагается применение такого антитела в применениях и способах, определяемых различными аспектами настоящего изобретения.
В одном воплощении, анти-CGRP антагонистическое антитело ингибирует или предотвращает активацию рецептора CGRP. Предпочтительно анти-CGRP антитело имеет IC50 от 0,0001 (0,1 нМ) до 500 мкМ. В некоторых предпочтительных воплощениях IC50 составляет от 0,0001 мкМ до 250 мкМ, 100 мкМ, 50 мкМ, 10 мкМ, 1 мкМ, 500 нМ, 250 нМ, 100 нМ, 50 нМ, 20 нМ, 15 нМ, 10 нМ, 5 нМ, 1 нМ, или 0,5 нМ, или IC50 примерно равна любому из этих значений, измеренных в in vitro-анализе связывания. В некоторых предпочтительных воплощениях, IC50 составляет менее чем 500 пМ, или 100 пМ, или 50 пМ, по измерениям в in vitro-анализе связывания. В следующем предпочтительном воплощении, IC50 составляет 1,2 нМ или 31 нМ. В следующем предпочтительном воплощении, используемое анти-CGRP антагонистическое антитело способно конкурировать с антителом, описанным выше в настоящем документе, за связывание с CGRP или с фрагментом CGRP, или с фрагментом CGRP, а также с полноразмерным CGRP, предпочтительно, с C-концевым участком или фрагментом CRGP, предпочтительно, C-концевой участок или фрагмент CRGP включает аминокислоты 19-37 или 25-37 или 29-37 или альтернативно 30-37, или альтернативно аминокислоты 31-37 CGRP. В следующем воплощении, C-концевой участок или фрагмент CRGP предпочтительно включает аминокислоты 32-37, наиболее предпочтительно, аминокислоты 33-37 CGRP.
В следующем предпочтительном воплощении, анти-CGRP антагонистическое антитело или его антиген-связывающая часть, используемая по изобретению, представляет собой антитело, способное конкурировать с анти-CGRP антагонистическим антителом, описанным выше в настоящем документе, конкретно, с описанными в настоящем документе G1 или G2 за:
(a) связывание с CGRP или с фрагментом CGRP, или с фрагментом CGRP а также с полноразмерным CGRP, предпочтительно, с C-концевым участком или фрагментом CRGP, предпочтительно, с C-концевым участком или фрагментом CRGP, включающими аминокислоты 19-37 или 25-37 или 29-37 или альтернативно 30-37, или альтернативно 31-37, предпочтительно аминокислоты 32-37, наиболее предпочтительно, аминокислоты 33-37 CGRP, предпочтительно, CGRP представляет собой альфа- или бета-форму, предпочтительно бета, более предпочтительно он является белком грызуна или человеческим, наиболее предпочтительно, человеческим,
(b) связывание с последовательностью эпитопа GSKAF, предпочтительно в положениях аминокислот 33-37 CGRP, определенных в (a), более предпочтительно, с последовательностью GXXXF, где X представляет собой любую аминокислоту, предпочтительно, GXXXF находится в положениях аминокислот 33-37 CGRP, определенных в (a),
(c) связывание, описанное в (a) или (b) по существу с одинаковыми Kd и/или по существу с одинаковыми Koff, и/или
(d) связывание с CGRP и ингибирование/противодействие биологической активности CGRP и/или последующим сигнальным путям, предпочтительно CGRP представляет собой альфа- или бета-форму, предпочтительно бета, более предпочтительно он является белком грызуна или человеческим, наиболее предпочтительно, человеческим.
Анти-CGRP антагонистическое антитело предпочтительно связывается с CGRP, участком CGRP или фрагментом CGRP с аффинностью связывания (Kd) от 0,000001 мкМ (0,001 нМ) или 0,00001 мкМ (0,01 нМ) до 500 мкМ. В некоторых предпочтительных воплощениях, аффинность связывания (Kd) находится между 0,000001 мкМ или 0,00001 мкМ и 250 мкМ, 100 мкМ, 50 мкМ, 10 мкМ, 1 мкМ, 500 нМ, 250 нМ, 100 нМ, 50 нМ, 20 нМ, 15 нМ, 10 нМ, 5 нМ, 1 нМ, 0,5 нМ, 1 нМ, 0,05 нМ, или 0,01 нМ, 0,005 нМ, 0,001 нМ, или она примерно равна любому из этих значений, измеренных в in vitro-анализе связывания. В некоторых следующих предпочтительных воплощениях, аффинность связывания (Kd) составляет менее, чем любая из 500 пМ, или 100 пМ, 50 пМ, или 10 пМ, 5 пМ, 1 пМ, измеренных в in vitro-анализе связывания. В следующем более предпочтительном воплощении, аффинность связывания (Kd) составляет 0,04 нМ или 16 нМ.
Анти-CGRP антагонистическое антитело, используемое по настоящему изобретению, может быть выбрано из группы: моноклональных антител, поликлональных антител, фрагментов антител (например, Fab, Fab', F(ab')2, Fv, Fc, ScFv и т.д.), химерных антител, биспецифичных антител, гетероконъюгированных антител, одноцепочечных антител (ScFv), их мутантов, сшитых белков, включающих часть антитела (например, домен антитела), гуманизированных антител и любой другой модифицированной конфигурации иммуноглобулиновой молекулы, которая включает сайт распознавания антигена требуемой специфичности, включая гликозилированные варианты антител, варианты аминокислотных последовательностей антител и ковалентно модифицированные антитела. Анти-CGRP антагонистическое антитело может быть мышиным, крысиным, человеческим или любого другого происхождения (включая химерные или гуманизированные антитела). В некоторых воплощениях, анти-CGRP антагонистическое антитело может быть гуманизированным, но более предпочтительно, является человеческим. Предпочтительно, анти-CGRP антагонистическое антитело является изолированным, еще предпочтительнее, оно является, по существу чистым. В случае, где анти-CGRP антагонистическое антитело представляет собой фрагмент антитела, то фрагмент предпочтительно сохраняет функциональные характеристики исходного антитела, т.е. связывание с CGRP и/или антагонистическую активность, описанные в функциональных характристиках.
Примеры анти-CGRP антагонистических антител известны из уровня техники. Следовательно, согласно предпочтительному воплощению настоящего изобретения анти-CGRP антагонистическое антитело, используемое по настоящему изобретению, предпочтительно представляет собой анти-CGRP антитело, которое в целом или в частности раскрыто в любом из документов (i) WO 2007/054809, (ii) WO 2007/076336, (iii) Tan et al., Clin. Sci. (Lond). 89:565-73, 1995, (iv) Sigma (Missouri, US), продукт под номером C7113 (клон #4901), (v) Plourde et al., Peptides 14:1225-1229, 1993, или которое включает или состоит из:
(a) фрагмента указанного антитела (например, Fab, Fab', F(ab')2, Fv, Fc, ScFv и т.д.),
(b) легкой цепи указанного антитела,
(c) тяжелой цепи указанного антитела,
(d) одного или более вариабельных участков из легкой цепи и/или тяжелой цепи указанного антитела,
(e) одного или более CDR (одного, двух, трех, четырех, пяти или шести CDR) указанного антитела,
(f) CDR H3 из тяжелой цепи указанного антитела,
(g) CDR L3 из легкой цепи указанного антитела,
(h) трех CDR из легкой цепи указанного антитела,
(i) трех CDR из тяжелой цепи указанного антитела,
(j) трех CDR из легкой цепи и трех CDR из тяжелой цепи указанного антитела,
(k) любого одного компонента или более из (a) до (j).
Согласно предпочтительному воплощению настоящего изобретения, анти-CGRP антагонистическое антитело представляет собой антитело G2 или антитело G1. Согласно наиболее предпочтительному воплощению настоящего изобретения, используемое анти-CGRP антагонистическое антитело представляет собой анти-CGRP антитело G1, раскрытое, в частности, в патентной заявке WO 2007/054809, или включающее его варианты, представленные в Таблице 6 WO 2007/054809, также включая антитела, функционально эквивалентные G1, т.e. включающие консервативные замены аминокислотных остатков или одну или более делеций или вставок аминокислот, которые не оказывают значительного влияния на функциональные характеристики антител, например на связывание с CRGP или на антагонистическую активность, а также варианты, которые обладают повышенной или пониженной активностью и/или связыванием. При использовании в настоящем документе термины "G1" и "антитело G1" используются взаимозаменяемо для обозначения антитела, продуцируемого экспрессирующими векторами, имеющими депозитные номера ATCC PTA-6867 и ATCC PTA-6866, раскрытыми в заявке WO 2007/054809.
Согласно следующему воплощению настоящего изобретения, анти-CGRP антагонистическое антитело включает или состоит из полипептида, выбранного из: (a) антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (b) фрагмента или участка антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (c) легкой цепи антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (d) тяжелой цепи антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (e) одного или более вариабельных участков из легкой цепи и/или тяжелой цепи антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (f) одного или более CDR (одного, двух, трех, четырех, пяти или шести CDR) антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (g) CDR H3 из тяжелой цепи антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (h) CDR L3 из легкой цепи антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (i) трех CDR из легкой цепи антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (j) трех CDR из тяжелой цепи антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; (k) трех CDR из легкой цепи и/или трех CDR из тяжелой цепи антитела G1 или его вариантов, представленных в Таблице 6 WO 2007/054809; и (l) антитела, включающего любой компонент от (b) до (k). В изобретении также предлагаются полипептиды, включающие любой один или более из вышеописанных. В некоторых воплощениях, по меньшей мере, один, два, три, четыре, пять или шесть CDR идентичны, по меньшей мере, примерно на 85%, 86%, 87%, 88%, 89%, 90%, 95%, 96%, 97%, 98% или 99%, по меньшей мере, одному, двум, трем, четырем, пяти или шести CDR из G1 или его вариантов, представленных в Таблице 6 WO 2007/054809.
Определение CDR-участков находится в компетенции специалиста в данной области. Понятно, что в некоторых воплощениях, CDR могут представлять собой комбинацию CDR по Kabat и по Chothia. В некоторых воплощениях, CDR представляют собой CDR по Kabat. В некоторых воплощениях, CDR представляют собой CDR по Chothia.
Анти-CGRP антагонистическое антитело предпочтительно включает или состоит из фрагмента или участка антитела G1 (например, Fab, Fab', F(ab')2, Fv, Fc, ScFv и т.д.) или его вариантов, представленных в Таблице 6 WO 2007/054809. Предпочтительно, указанный фрагмент или участок обладает функциональными характеристиками анти-CGRP антагонистического антитела, например активностью связывания CGRP и/или антагонистической активностью, и включает или состоит из одного или более компонентов в виде легкой цепи, тяжелой цепи, фрагмента, содержащего один или более вариабельных участков из легкой цепи и/или тяжелой цепи, или один или более CDR из легкой цепи и/или тяжелой цепи антитела G1.
Согласно следующему предпочтительному воплощению изобретения, анти-CGRP антагонистическое антитело включает вариабельный участок легкой цепи, LCVR, включающий пептид с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 28-32, и/или вариабельный участок тяжелой цепи, HCVR, включающий пептид с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 34-38 патентной заявки WO 2007/076336.
Еще предпочтительнее, анти-CGRP антагонистическое антитело включает LCVR-полипептид из патентной заявки WO 2007/076336 с SEQ ID NO, представленной в Таблице 1, и дополнительно включает HCVR-полипептид из патентной заявки WO 2007/076336 с SEQ ID NO, представленной в Таблице 1.
Согласно следующему воплощению изобретения, используемое анти-CGRP антагонистическое антитело включает CDR легкой цепи (CDRL), выбранный из группы, состоящей из SEQ ID NO: 8-13, и/или CDR тяжелой цепи (CDRH), выбранный из группы, состоящей из SEQ ID NO: 14-22 из патентной заявки WO 2007/076336.
Способы получения и изолирования анти-CGRP антагонистических антител заявки WO 2007/076336 и данные, демонстрирующие связывание CGRP и антагонистические характеристики антител, описаны в заявке WO 2007/076336.
Предпочтительно, анти-CGRP антагонистическое антитело для применения в настоящем изобретении включает VH-домен, аминокислотная последовательность которого идентична, по меньшей мере, на 85%, по меньшей мере, на 86%, по меньшей мере, на 87%, по меньшей мере, на 88%, по меньшей мере, на 89%, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97% по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% последовательности SEQ ID NO: 1 или SEQ ID NO: 19, представленным в настоящем документе.
Предпочтительно, анти-CGRP антагонистическое антитело включает VL-домен, аминокислотная последовательность которого идентична, по меньшей мере, на 85%, по меньшей мере, на 86%, по меньшей мере, на 87%, по меньшей мере, на 88%, по меньшей мере, на 89%, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% последовательности SEQ ID NO: 2 или SEQ ID NO: 20, представленным в настоящем документе.
Анти-CGRP антагонистическое антитело предпочтительно включает VH-домен и VL-домен, аминокислотная последовательность которых идентична, по меньшей мере, на 85%, по меньшей мере, на 86%, по меньшей мере, на 87%, по меньшей мере, на 88%, по меньшей мере, на 89%, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97% по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% последовательности SEQ ID NO: 1 и 2, соответственно, или SEQ ID NO: 19 и 20, соответственно, представленным в настоящем документе.
Предпочтительно, анти-CGRP антагонистическое антитело включает VH-домен, аминокислотная последовательность которого идентична, по меньшей мере, на 90% последовательности SEQ ID NO: 1, и VL-домен, аминокислотная последовательность которого идентична, по меньшей мере, на 90% последовательности SEQ ID NO: 2, представленной в настоящем документе.
Альтернативно, анти-CGRP антагонистическое антитело предпочтительно включает VH-домен, аминокислотная последовательность которого идентична, по меньшей мере, на 90% последовательности SEQ ID NO: 19, и VL-домен, аминокислотная последовательность которого идентична, по меньшей мере, на 90% последовательности SEQ ID NO: 20, представленной в настоящем документе. Анти-CGRP антагонистическое антитело предпочтительно включает, по меньшей мере, один CDR, выбранный из группы, состоящей из: (a) CDR H1, представленный в SEQ ID NO: 3 или 21; (b) CDR H2, представленный в SEQ ID NO: 4 или 22; (c) CDR H3, представленный в SEQ ID NO: 5 или 23; (d) CDR L1, представленный в SEQ ID NO: 6 или 24; (e) CDR L2, представленный в SEQ ID NO: 7 или 25; (f) CDR L3, представленный в SEQ ID NO: 8 или 26; и (g) варианты CDR L1, CDR L2 и CDR H2, представленные в Таблице 6 из WO 2007/054809.
Согласно предпочтительному воплощению настоящего изобретения, константный участок тяжелой цепи анти-CGRP антагонистического антитела может представлять собой любой тип константных участков, таких как IgG, IgM, IgD, IgA, и IgE; и любых изотипов, таких как IgG1, IgG2, IgG3 и IgG4.
Еще предпочтительнее, анти-CGRP антагонистическое антитело включает тяжелую цепь, продуцированную экспрессирующим вектором с Регистрационным номером ATCC No. PTA-6867. Еще предпочтительнее, анти-CGRP антагонистическое антитело включает легкую цепь, продуцированную экспрессирующим вектором с Регистрационным номером ATCC No. PTA-6866. Еще предпочтительнее, анти-CGRP антагонистическое антитело продуцируется экспрессирующими векторами с Регистрационными номерами ATCC No. PTA-6867 и PTA-6866.
Предпочтительно, анти-CGRP антагонистическое антитело для применения по настоящему изобретению представляет собой антитело G1 или антитело G2, определенные в настоящем документе.
Согласно следующему воплощению изобретения, анти-CGRP антагонистическое антитело включает модифицированный константный участок, описанный, например, в WO 2007/054809. Предпочтительно, модифицированный константный участок является иммунологически инертным, включая частично иммунологически инертный вариант, так что он не запускает опосредованный комплементом лизис, не стимулирует антителозависимую клеточно-опосредованную цитотоксичность (ADCC), не активирует микроглию. Предпочтительно, модифицированный константный участок обеднен одной или более из этих активностей. Более предпочтительно, константный участок модифицирован, как описано в Eur. J. Immunol. (1999) 29:2613-2624; в заявке PCT No. PCT/GB99/01441; и/или патентной заявке UK No. 9809951.8. Согласно предпочтительному воплощению изобретения, анти-CGRP антагонистическое антитело включает константный участок тяжелой цепи человеческого IgG2, включающий следующие мутации: A330, P331 на S330, S331 (аминокислотная нумерация по отношению к последовательности IgG2 дикого типа). Eur. J. Immunol. (1999) 29:2613-2624. Способы получения и изолирования анти-CGRP антагонистических антител заявки WO 2007/054809 и данные, демонстрирующие связывание CGRP и антагонистическую характеристику антител, описаны в заявке WO 2007/054809. Последовательности SEQ ID No. 1-14 указанной заявки представлены в настоящем документе как SEQ ID No. 1-14, соответственно.
Согласно следующему воплощению настоящего изобретения, лекарственное средство готовят для периферического введения от 1 до 7 раз в неделю, еще предпочтительнее, от одного до четырех раз в месяц, еще предпочтительнее, от одного до шести раз в течение шестимесячного периода, еще предпочтительнее, от одного до двенадцати раз в год. Предпочтительно, лекарственное средство готовят для введения периферически в течение периода, выбранного из: один раз ежедневно, один раз каждые два, три, четыре, пять или шесть дней, еженедельно, один раз каждые две недели, один раз каждые три недели, ежемесячно, один раз каждые два месяца, один раз каждые три месяца, один раз каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев, один раз каждые семь месяцев, один раз каждые восемь месяцев, один раз каждые девять месяцев, один раз каждые десять месяцев, один раз каждые одиннадцать месяцев или ежегодно. Согласно предпочтительным воплощениям, лекарственное средство готовят для введения периферически через путь, выбранный из одного или более из следующих: перорального пути введения, подъязычного, трансбукального, локального, ректального, посредством ингаляции, чрескожного, подкожного, внутривенного, внутриартериального или внутримышечного, внутрисердечного введения, внутрикостного, внутрикожного, внутрибрюшинного, чресслизистого, вагинального, в стекловидное тело, накожного, внутриартикулярного, периартикулярного или местного.
Согласно следующему воплощению настоящего изобретения, лекарственное средство готовят для периферического введения с концентрацией антитела от 0,1 до 200 мг/мл; предпочтительно, с концентрацией примерно от 0,1 и примерно до любой из 0,5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мг/мл +/-10% ошибка или с концентрацией, примерно равной этим значениям, наиболее предпочтительно, с концентрацией 50 мг/мл.
Согласно следующему воплощению настоящего изобретения, лекарственное средство готовят для периферического введения с концентрацией антитела от 0,1 до 200 мг/кг массы тела; предпочтительно от 0,1 и примерно до любой из 0,5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мг/кг массы тела +/-10% ошибка или с концентрацией, примерно равной этим значениям, наиболее предпочтительно, с концентрацией 10 мг/кг. Согласно предпочтительному воплощению настоящего изобретения, анти-CGRP антагонистическое антитело имеет период полужизни in vivo, составляющий более чем любой из следующих: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, 154, 156, 158, 160, 162, 164, 166, 168, 170, 172, 174, 176, 178, 180, 182, 184, 186, 188, 190, 192, 194, 196, 198, 200, 202, 204, 206, 208 или 210 дней +/- 1 день, еще предпочтительнее, более чем любой из следующих: 7, 8, 9, 10, 11 или 12 месяцев.
Предпочтительно, анти-CGRP антагонистическое антитело имеет период полужизни in vivo, составляющий более чем 6 дней.
Согласно следующему предпочтительному воплощению настоящего изобретения, лекарственное средство и/или анти-CGRP антагонистическое антитело не производят эффекта на центральную нервную систему и/или не вызывают интеллектуального расстройства. Предпочтительно, лекарственное средство и/или анти-CGRP антагонистическое антитело не индуцируют одного или более из следующих состояний: амнезии, спутанности сознания, деперсонализации, гипестезии, аномального мышления, тризма, головокружения, акатизии, апатии, атаксии, околоротовой парестезии, стимулирования ЦНС, эмоциональной неустойчивости, эйфории, галлюцинаций, враждебного поведения, гиперестезии, гиперкинезии, гипотонии, нарушения координации, повышения полового влечения, маниакальной реакции, миоклонии, невралгии, невропатии, психоза, пароксизма, спутанной речи, ступора, суицидальных мыслей; головокружений, сонливости, бессонницы, тревожности, тремора, депрессии или парестезии. Наиболее предпочтительно, лекарственное средство и/или анти-CGRP антагонистическое антитело не индуцирует расстройства двигательной координации или внимания.
Согласно следующему воплощению настоящего изобретения, лекарственное средство и/или анти-CGRP антагонистическое антитело не производит респираторного, почечного или желудочно-кишечного расстройства.
Согласно следующему воплощению настоящего изобретения, лекарственное средство и/или анти-CGRP антагонистическое антитело не производит эффектов психической и/или психологической зависимости. Предпочтительно, лекарственное средство и/или анти-CGRP антагонистическое антитело не демонстрирует аффинности к опиату, бензодиазепину, фенциклидину (PCP), или к рецепторам N-метил-D-аспарагиновой кислоты (NMDA), или к стимуляторам ЦНС и не производит никакого седативного или эйфорического эффекта. В одном воплощении, анти-CGRP антагонистическое антитело, при введении ослабляет, контролирует, уменьшает частоту возникновения или замедляет развитие или прогрессию ощущения центральной боли.
В другом воплощении, эффект анти-CGRP антагонистического антитела равен и/или превосходит эффекты НПВС и/или опиатов в одинаковых моделях хронической боли. В одном воплощении, анти-CGRP антагонистическое антитело является эффективным в лечении популяций с болью, неподдающейся лечению.
Согласно следующему аспекту настоящего изобретения, предлагается применение или способ согласно любому другому аспекту изобретения, где анти-CGRP антагонистическое антитело вводится отдельно, последовательно или одновременно с одним или более дополнительными фармакологически активными соединениями или агентами, предпочтительно, соединениями или агентами, применяемыми для лечения хронической боли. Предпочтительно, дополнительный(е) агент(ы) выбран/выбраны из одного или более из следующих:
(i) опиоидного анальгетика, например морфина, героина, гидроморфона, оксиморфона, леворфанола, леваллорфана, метадона, меперидина, фентанила, кокаина, кодеина, дигидрокодеина, оксикодона, гидрокодона, пропоксифена, налмефена, налорфина, налоксона, налтрексона, бупренорфина, буторфанола, налбуфина или пентазоцина;
(ii) нестероидного противовоспалительного средства (НПВС), например аспирина, диклофенака, дифлусинала, этодолака, фенбуфена, фенопрофена, флуфенисала, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, меклофенамовой кислоты, мефенамовой кислоты, набуметона, напроксена, оксапрозина, фенилбутазона, пироксикама, сулиндака, толметина или зомепирака, ингибиторов циклооксигеназы-2 (COX-2), целекоксиба; рофекоксиба; мелоксикама; JTE-522; L-745,337; NS398; или их фармацевтически приемлемых солей;
(iii) барбитуратного седативного средства, например амобарбитала, апробарбитала, бутобарбитала, бутабитала, мефобарбитала, метарбитала, метогекситала, пентобарбитала, секобарбитала, талбутала, теамилала или тиопентала или их фармацевтически приемлемых солей;
(iv) бензодиазепина, обладающего седативным действием, например хлордиазепоксида, хлоразепата, диазепама, флуразепама, лоразепама, оксазепама, темазепама или триазолама или их фармацевтически приемлемых солей;
(v) H1-антагониста, обладающего седативным действием, например дифенгидрамина, пириламина, прометазина, хлорфенирамина или хлорциклизина или их фармацевтически приемлемых солей;
(vi) седативного средства, такого как глутетимид, мепробамат, метаквалон или дихлоралфеназон или их фармацевтически приемлемые соли;
(vii) миорелаксанта скелетной мышцы, например баклофенона, каризопродола, хлорзоксазона, циклобензапина, метокарбамола или орфренадина или их фармацевтически приемлемых солей;
(viii) антагониста рецептора NMDA, например декстрометорфана ((+)-3-гидрокси-N-метилморфинан) или его метаболита декстрорфана ((+)-3-гидрокси-N-метилморфинан), кетамина, мемантина, пирроло-хинолин хинона или цис-4-(фосфонометил)-2-пиперидинкарбоновой кислоты или их фармацевтически приемлемых солей;
(ix) альфа-адренергического средства, например доксазозина, тамсулозина, клонидина или 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолина;
(x) трициклического антидепрессанта, например дезипрамина, имипрамина, амитриптилина или нортриптилина;
(xi) антиконвульсанта, например карбамазепина или валпроата;
(xii) антагониста тахикинина (NK), конкретно, антагониста NK-3, NK-2 или NK-1, например, (αR,9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4- метилфенил)-7H-[1,4]диазоцино[2,1-g][1,7]нафтридин-6-13-диона (TAK-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3-(4-фторфенил)-4- морфолинил]метил]-1,2-дигидро-3H-1,2,4-триазол-3-она (MK-869), ланепитанта, дапитанта или 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенил-пиперидина (2S,3S);
(xiii) мускаринового антагониста, например оксибутина, толтеродина, пропиверина, хлорида тропсия или дарифенацина;
(xiv) ингибитора COX-2, например целекоксиба, рофекоксиба или вальдекоксиба;
(xv) неселективного ингибитора COX (предпочтительно с G1-защитой), например, нитрофлурбипрфена (HCT-1026);
(xvi) анальгетика, конкретно, парацетамола, с происхождением из каменноугольной смолы;
(xvii) нейролептика, такого как дроперидол;
(xviii) агониста ваниллоидного рецептора (например, ресинифератоксина) или антагониста (например, капсазепина);
(xix) бета-адренергического средства, такого как пропранолол;
(xx) местного анестетика, такого как мексилетин;
(xxi) кортикостероида, такого как дексометазон;
(xxii) агониста или антагониста рецептора серотонина;
(xxiii) холинергического (никотинового) анальгетика;
(xxiv) Трамадола (торговая марка);
(xxv) ингибитора PDEV, такого как силденафил, варденафил или таладафил;
(xxvi) альфа-2-дельта лиганда, такого как габапентин или прегабалин;
(xxvii) каннабиноида и
(xxviii) антидепрессанта, такого как амитриптилин (Elavil), тразодон (Desyrel) и имипрамин (Tofranil) или антиконвульсанта, такого как фенитоин (Dilantin) или карбамазепин (Tegretol).
Согласно следующему аспекту настоящего изобретения предлагается фармацевтическая композиция для предотвращения и/или лечения хронической боли и/или симптомов хронической боли или для ослабления, контролирования, уменьшения частоты возникновения или замедления развития или прогрессии хронической боли и/или симптомов хронической боли у индивидуума, причем фармацевтическая композиция включает анти-CGRP антагонистическое антитело и фармацевтически приемлемый носитель и/или вспомогательное вещество, где композицию готовят для введения периферически.
Согласно следующему аспекту настоящего изобретения, предлагается набор реагентов, включающий:
(a) фармацевтическую композицию, определенную выше; и
(b) инструкции по периферическому введению эффективного количества указанной фармацевтической композиции индивидууму для предотвращения и/или лечения хронической боли и/или симптомов хронической боли или для ослабления, контролирования, уменьшения частоты возникновения или замедления развития или прогрессии хронической боли и/или симптомов хронической боли.
Набор реагентов может включать один или более контейнеров, содержащих анти-CGRP антагонистическое антитело или полипептид, описанный в настоящем документе, и инструкции по применению согласно любому из способов и применений по изобретению. Набор реагентов может дополнительно включать описание выбора индивидуума, подходящего для лечения, на основе идентификации того, имеет ли индивидуум хроническую боль или имеет риск возникновения хронической боли. Инструкции для периферического введения фармацевтической композиции могут включать информацию о дозировке, график дозирования и пути введения для предназначенного лечения.
Предпочтительные характерные черты каждого аспекта изобретения применяются равноценно друг другу с учетом соответствующих различий.
Примеры
Настоящее изобретение теперь описывается со ссылкой на следующие Примеры, которые предназначены для иллюстрации, а не для ограничения изобретения.
Следующие примеры и фигуры приведены по отношению к антителу G1, человеческому моноклональному антителу к человеческому CGRP; и по отношению к антителу G2, мышиному моноклональному антителу к крысиному CGRP (Wong HC et al. Hybridoma 12:93-106 (1993)).
Пример 1: Схема механизма модели боли, связанной с раковым заболеванием, у грызунов
Используемые опухолевые клетки представляют собой сингенные крысиные MRMT-1 клетки карциномы молочной железы, переданные из Института Novartis (Лондон). Клетки культивируют в RPMI 1640 (Gibco), содержащей 10% фетальной бычьей сыворотки (FCS), 1% L-глутамин, 2% пенициллин/стрептомицин (Gibco). Две краткие промывки проводят с помощью 0,1% масс./об. Трипсина для высвобождения тех клеток, которые прикреплены к флакону, и затем блокируют с помощью равного объема 10% FCS, с последующим центрифугированием раствора в течение 3 минут при 1200 об/мин. Осадок промывают и ресуспендируют в среде Хэнкса (Hanks) и концентрацию клеток рассчитывают с использованием гемоцитометра, с помощью окрашивания трипановым синим определяют количество мертвых клеток MRMT-1. Затем получают конечную концентрацию клеток 3×103 с помощью разведения раствора согласно количеству видимых клеток. Конечный раствор поддерживают на льду до момента инъекции.
Самцов крыс Sprague-Dawley с массой, близкой к 170 г, в момент операции используют для создания модели рака. У крыс индуцируют анестезию с использованием галотана или изофлурана (1,5-2%) 66% N2O и 33% O2, ногу бреют вокруг подходящей области и дезинфицируют с помощью хлоргексидина (Animalcare Ltd, UK). Производят небольшой надрез с целью экспонирования передней медиальной поверхности дистального конца большой берцовой кости. В надкостнице просверливают отверстие с использованием 0,7 мм стоматологической бормашины, сквозь которое вводят 2-см полиэтиленовую трубку на 1 см во внутримедуллярную полость большой берцовой кости. С помощью шприца Hamilton предварительно приготовленные 10 мкл 3×103 MRMT-1-клеток инъецируют через трубку в полость. Трубку затем удаляют и отверстие закрывают с использованием материала костной репарации (IRM, Dentsply, USA). Разрез затем промывают 0,9% солевым раствором и закрывают металлическими скобками. Контрольных животных оперируют с использованием такой же процедуры, но инъецируя им только 10 мкл раствора Хэнкса. Животных помещают в терморегулируемые восстановительные боксы, пока не придет время, когда их можно будет поместить обратно в клетки их обычного содержания.
Пример 2: Оценка анти-CGRP антитела G2 грызунов в модели боли, связанной с раковым заболеванием
В тесте поведения по отношению к механическим стимулам используют нити von Frey (North Coast Medical Inc., USA) к подошвенной поверхности задних лап с обеих сторон, ипсилатеральной и контралатеральной. Крыс помещают в бокс из оргстекла с сетчатым полом и дают акклиматизироваться в течение 10 минут. Каждый стимул von Frey применяют 10 раз к каждой задней лапе попеременно между ипсилатеральной и контралатеральной с продолжительностью 2-3 секунды каждый раз. Используемые нити Von Frey обладают изгибающими усилиями, составляющими 1, 5, 9 и 15 г, и период между возрастающими усилиями von Frey составляет 5 минут. Защитная реакция (подъем) определяется в виде быстрого отдергивания задней лапы, и количество подъемов для каждой лапы при каждой усилии von Frey записывают (максимум 10) и выражают в виде процента реакции.
Проводят оценку эффективности анти-CGRP антитела G2 грызунов в смягчении гиперчувствительности на широкий спектр статических, механических, охлаждающих и комплексных стимулов, а также исходных базальных реакций на боль с помощью этой обоснованной модели костной боли, индуцированной раком. Измеренные реакции смягчаются с помощью стандартного лечения анальгетиками, такими как морфин и габапентин. Все измерения проводятся одним исследователем слепым методом - слепым по идентичности соединения/контроля и по обработке животного.
G2 вводили внутривенно в количестве 10 мг/кг на 9 день и крыс тестировали через 2 часа и затем на 10, 11, 12 день, затем через 14-18 дней после обработки (Фигура 1 ).
G2 оказывало заметный эффект на поведенческие реакции на механические стимулы более высокой интенсивности. Частота отдергиваний в ответ на 8 г von Frey уменьшалась через два часа после инъекции и значительно уменьшалась по сравнению с группой, получавшей пустой носитель, на 11 и 12 дни (через 2 и 3 дня после инъекции, p=0,0164 и 0,0311, соответственно). Фактически животные, получавшие G2, имели балльную оценку боли, подобную исходным значениям. К 14 дню (5 день после инъекции G2) не было видимых различий между группами, получавшими G2 и пустой носитель. Обе группы достигали одинакового уровня гиперчувствительности к 8 г von Frey на 18 день после MRMT-1-инъекции (9 день после обработки). Также наблюдалось подобное полное изменение гиперчувствительности к 15 г von Frey. Уменьшение гиперчувствительности к 15 г von Frey в группе обработки пустым носителем было очевидно через 2 часа после инъекции, значительное уменьшение наблюдали на 2 и 3 дни после введения лекарственного средства (p=0,02 и 0,03, соответственно). Уменьшение гиперчувствительности пропадало на 6 день после введения G2, и обе группы достигали одинаковой максимальной частоты отдергивания на 18 день после MRMT-1-инъекции (Фигура 2).
Результаты выявляют, что G2 уменьшает тяжелую боль, испытываемую при метастазирующем раке кости на крысиной модели.
Пример 3: Тест вращающегося стержня для определения двигательной недостаточности
Следующее тестированное пограничное состояние представляет собой способность передвигаться (с помощью вращающегося стержня). Тест проводится для измерения двигательной недостаточности по сравнению с контрольными животными, получавшими антитело, каждое из которых подвергалось одинаковому тесту при одинаковых условиях. Тест вращающегося стержня состоит из 4 вращающихся цилиндров, разделенных на границах ускоряющимся цилиндром с электроприводом (Ugo Basile, Comerio, VA, Italy). Для данного испытания крысу помещают на вращающийся стержень, и скорость вращения ускоряется от 4 до 16 об/мин в течение 2 минут. Время максимальной работы, как правило, устанавливается на 120 секундах. Каждое животное, как правило, получает три испытания в день с 1-часовым перерывом в течение нескольких последующих дней после операции. Латентное падение со стержня представлено в виде среднего значения результатов трех испытаний. Никаких различий не обнаружено между группой, получавшей антитело G2, и группой, получавшей пустой носитель, в латентном падении с вращающегося стержня во время принудительного передвижения (Фигура 3). Это предполагает, что G2 не нарушает сигнальных путей, вовлеченных в двигательную координацию или внимание, и указывает на отсутствие производимых антителом побочных эффектов для ЦНС.
Пример 4: Анализ связывания
Анализ связывания проводят для измерения IC50 анти-CGRP антитела G1 и G2 при блокировании связывания человеческого α-CGRP с CGRP1-рецептором в клетках SK-N-MC. Кривые дозовой зависимости наносили на график и Ki-значения определяли с использованием уравнения: Ki=IC50/(1+([лиганд]/KD); Фигура 4, где константа диссоциации равновесия KD=8 пМ для человеческого α-CGRP с CGRP1-рецептором, как представлено в клетках SK-N-MC. Подтвержденное значение IC50 (по отношению к IgG-молекулам) преобразовывали по отношению к сайтам связывания так, чтобы его можно было сравнивать с аффинностями (KD), определенными с помощью Biacore, N-биотинилированные α-CGRP, человеческий и крысиный, захватывались индивидуальными неприкрепленными клетками на низком уровне (как правило, 100 реактивных единиц) с получением реакционных поверхностей, в то время как немодифицированные неприкрепленные клетки служили в качестве эталонного канала. G1 титровали на поверхности чипа. Аффинности связывания выводили из соотношения констант скорости кинетической реакции (KD=koff/kon), см. Таблицу 1.
Аффинность связывания G1 для человеческого α- и β-CGRP была эквивалентной (Kd=0,155 и 0,152 нМ, соответственно). Аффинность связывания G2 для крысиного α- и β-CGRP была эквивалентной (16 и 17 нМ, соответственно). Кроме того, аффинность связывания G1 была в 40 раз более сильной у человеческого белка, чем у крысиного для α-CGRP (Kd=0,042 и 1,22 нМ, соответственно), и эквивалентной для β-CGRP (Kd=0,155 и 0,152 нМ, соответственно). Антитело G1 также демонстрировало удовлетворительную межвидовую селективность и связывалось с крысиным α-CGRP с такой же аффинностью, как антитело G2 (около 1,2 нМ), Таблица 2.
G1 связывается с человеческими белками α- и β-CGRP и с этими белками макаки-крабоеда с высокой аффинностью (KD=63 и 155 пМ, соответственно). G1 демонстрирует видовую селективность для человеческого/обезьяньего CGRP и связывается с α- и β-CGRP из других видов, например с крысиным белком с более низкой аффинностью (KD=2,57 нМ и 152 пМ, соответственно).
Пример 5: Период полужизни анти-CGRP антитела in vivo
Измерения уровня анти-CGRP антитела у крыс, Фигура 5, выявили, что период полужизни составляет порядка 7 дней. Антитело ограничено периферически, имея молекулярную массу около 150000, Фигуры 5a, 5b, т.e. оно не пересекает барьер в центральную нервную систему или не пересекает гематоэнцефалический барьер.
Пример 6: Селективность анти-CGRP антитела
Авторы определяли специфичность антитела G1 к человеческому или крысиному CGRP с помощью использования чипа Biacore для "зондирования" свободной концентрации предварительно смешанного комплекса mAb + пептид. Как ожидалось, когда авторы преинкубировали антитело G1 с человеческим или крысиным CGRP, реакция полностью блокировалась. Напротив, предварительная инкубация G1 с избытком амилина, кальцитонина или адреномедуллина была сравнима с контрольной реакцией (G1 вместе с буфером), демонстрируя, что G1 не образует комплекса с этими пептидами (Фигура 7).
Пример 7: Идентификация эпитопа связывания с антителом G1
Анализ взаимодействия проводили при 25ºC на системе Biacore 3000TM, оборудованной сенсорными чипами со стрептовидиновым покрытием (SA) (Biacore AB, Упсала, Швеция), с использованием стандартного рабочего буфера Biacore (HBS-P). Сначала авторы подтвердили, что N-биотинилированный 25-37-фрагмент человеческого α-CGRP связывается с антителом G1 с такой же аффинностью, что и полноразмерный, N-биотинилированный человеческий α-CGRP. Каждую аминокислоту между положениями 27-37 затем подвергали мутации с получением аланина и представляли кратную потерю аффинности по сравнению с фрагментом дикого типа. N-биотинилированные фрагменты захватывались индивидуальными неприкрепленными клетками на низком уровне (как правило, 100 реактивных единиц) с получением реакционных поверхностей, в то время как немодифицированные неприкрепленные клетки служили в качестве эталонного канала. Получали очищенные Fab-фрагменты антитела G1. Fab-фрагменты титровали на чипе с использованием 1 мкМ в качестве верхней концентрации двухкратных последовательных разведений. Осуществляли мониторинг фаз ассоциации и диссоциации при 100 мкл/мин в течение 1 минуты и 5 минут, соответственно. Поверхности регенерировались с помощью смеси 35% этанол + 25мМ NaOH + 0,5M NaCl.
Результаты сканирующего аланином мутагенеза демонстрируют, что антитело G1 связывается с C-концевым участком человеческого α-CGRP, конкретно, с остатками 25-37, и демонстрирует специфичное связывание с участком (т.e. потеря аффинности заметно увеличивается при мутации участка специфичного связывания), который может быть определен как эпитоп и который располагается внутри последних 5 C-концевых аминокислот, т.е. от G33A до F37A. Наиболее основательные изменения аффинности вызываются посредством мутации G33A и F37A (Фигура 6). C-концевой Phe является важным для селективности антитела G1 по отношению к CGRP по сравнению с родственными пептидами и членами семейства генов (Фигура 8).
Таким образом, в одном воплощении, в настоящем изобретении предлагается анти-CGRP антагонистическое антитело, которое специфично связывается с эпитопом, определенным аминокислотами G33-F37 из CGRP. Анти-CGRP антагонистическое антитело может специфично связываться с эпитопом, определенным аминокислотной последовательностью GSKAF, более специфично с эпитопом CGRP, определенным как GXXXF, где X может представлять собой любую аминокислоту, причем G33 и F37 являются наиболее важными остатками эпитопа для определения высокой аффинности связывания анти-CGRP антагонистического антитела.
Пример 8: Анализ индикаторов физической или психологической зависимости
Ни антитело G1, ни антитело G2 не демонстрируют проникновения в ЦНС. Кроме того, продолжительное наблюдение за животными (крысами), которым вводили каждое антитело на уровне, использованном в предыдущих экспериментах, не обнаружило по сравнению с контрольными животными побочных эффектов для ЦНС, таких как седативный эффект или возбуждение/эйфорическое поведение. Эти наблюдения выявляют отсутствие риска зависимости для антител и, следовательно, значительно повышают безопасность антител по сравнению с опиатами, используемыми в настоящее время в терапии боли.
Пример 9: Анализ индикаторов желудочно-кишечных побочных эффектов
1-месячное in vivo-исследование крыс с антителом G2 и 1-недельное сравнительное исследование с антителом G1 демонстрируют, что не наблюдается никаких побочных желудочно-кишечных эффектов, влияющих на поведение, прием пищи, работу кишечника или гистопатологию по сравнению с контрольными животными. Эти наблюдения выявляют отсутствие желудочно-кишечного риска по отношению к антителам и, следовательно, значительно повышают безопасность антител по сравнению с используемыми в настоящее время НПВС для терапий боли.
Пример 10: G1 и G2 как анти-CGRP антагонистические антитела
Известное следствие биологической активности CGRP при его доставке in vivo представляет собой неврогенную воспалительную гиперемию. Было продемонстрировано, что G1 и G2 представляют собой анти-CGRP антагонистические антитела, так как они предотвращают развитие неврогенной воспалительной гиперемии in vivo. Используя крысиную модель неврогенной воспалительной гиперимии кожи, тестировали эффективность G1 по части его способности блокировать эффект CGRP in vivo. Подкожный нерв у крыс электрически стимулировали, вызывая высвобождение CGRP из нервных окончаний и приводя к вазолидатации, полученные в результате изменения в кровотоке можно было измерить с использованием лазерных допплеровских методов.
Изменения параметров кровотока выражали в виде площади под кривой (AUC, изменение произвольных допплеровских флоуметрических единиц, умноженное на время). Антагонист CGRP-рецептора, CGRPs-37 (400 нмоль/кг, внутривенно) использовали в качестве положительного контроля для подтверждения специфичности модели (данные не показаны). Для определения эффекта G1 для каждого животного перед дозированием устанавливали исходную реакцию кровотока на стимулирование с помощью двух стимулирований подкожного нерва, по 30 минут каждое. Крысы получали G1 после того, как реакция кровотока на второе стимулирование возвращалась к исходному уровню (приблизительно через 10 минут после стимулирования), и проводили дополнительные четыре стимулирования с 30-минутным интервалом.
Результаты (Фигура 9) демонстрируют, что у животных, получавших пустой носитель, не было значительного изменения реакции кровотока, а крысы, получавшие G1, демонстрировали значительное уменьшение реакции кровотока, начиная с 90 и 120 минут после дозирования 10 мг/кг и 1 мг/кг, соответственно. Подобной активности достигали с использованием G2. Кроме того, в следующих тестах модели неврогенной воспалительной гиперемии и вазодилатации G1 демонстрировало заметный эффект на 7 день после внутривенного дозирования (прогнозированная ED50=6 мкг/мл в модели стимулирования подкожного нерва). Заключительная форма проведенных тестов состоит в том, что G1 и G2 демонстрируют анти-CGRP антагонистическую активность. Подобная способность антител блокировать функцию CGRP также представлена в публикации Zeller J, et. al. Br J Pharmacol. 2008 Dec;155(7): 1093-103. Epub 2008 Sep 8.
Ниже приведены последовательности антител, применяемые для практического осуществления настоящего изобретения.
Последовательности антител
Аминокислотная последовательность вариабельного участка тяжелой цепи антитела G1 (SEQ ID NO:1)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWISWVRQAPGKGLEWVAEIRSESDA SATHYAEAVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCLAYFDYGLAIQNYWGQG TLVTVSS
Аминокислотная последовательность вариабельного участка легкой цепи антитела (SEQ ID NO:2)
EIVLTQSPATLSLSPGERATLSCKASKRVTTYVSWYQQKPGQAPRLLIYGASNRYLGIP ARFSGSGSGTDFTLTISSLEPEDFAVYYCSQSYNYPYTFGQGTKLEIK
CDR H1 антитела G1 (удлиненный CDR) (SEQ ID NO:3)
GFTFSNYWIS
CDR H2 антитела G1 (удлиненный CDR) (SEQ ID NO:4)
EIRSESDASATHYAEAVKG
CDR H3 антитела G1 (SEQ ID NO:5)
YFDYGLAIQNY
CDR L1 антитела G1 (SEQ ID NO:6)
KASKRVTTYVS
CDR L2 антитела G1 (SEQ ID NO:7)
GASNRYL
CDR L3 антитела G1 (SEQ ID NO:8)
SQSYNYPYT
Нуклеотидная последовательность вариабельного участка тяжелой цепи антитела G1 (SEQ ID NO:9)
GAAGTTCAGCTGGTTGAATCCGGTGGTGGTCTGGTTCAGCCAGGTGGTTCCCTGC GTCTGTCCTGCGCTGCTTCCGGTTTCACCTTCTCCAACTACTGGATCTCCTGGGTT CGTCAGGCTCCTGGTAAAGGTCTGGAATGGGTTGCTGAAATCCGTTCCGAATCCG ACGCGTCCGCTACCCATTACGCTGAAGCTGTTAAAGGTCGTTTCACCATCTCCCGT GACAACGCTAAGAACTCCCTGTACCTGCAGATGAACTCCCTGCGTGCTGAAGACA CCGCTGTTTACTACTGCCTGGCTTACTTTGACTACGGTCTGGCTATCCAGAACTAC TGGGGTCAGGGTACCCTGGTTACCGTTTCCTCC
Нуклеотидная последовательность вариабельного участка легкой цепи антитела G1 (SEQ ID NO:10)
GAAATCGTTCTGACCCAGTCCCCGGCTACCCTGTCCCTGTCCCCAGGTGAACGTGCT ACCCTGTCCTGCAAAGCTTCCAAACGGGTTACCACCTACGTTTCCTGGTACCAGCAGA AACCCGGTCAGGCTCCTCGTCTGCTGATCTACGGTGCTTCCAACCGTTACCTCGGTAT CCCAGCTCGTTTCTCCGGTTCCGGTTCCGGTACCGACTTCACCCTGACCATCTCCTCC CTGGAACCCGAAGACTTCGCTGTTTACTACTGCAGTCAGTCCTACAACTACCCCTACA CCTTCGGTCAGGGTACCAAACTGGAAATCAAA
Аминокислотная последовательность тяжелой цепи полноразмерного антитела G1 (включая модифицированный IgG2, описанный в настоящем документе) (SEQ ID NO:11)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWISWVRQAPGKGLEWVAEIRSESDA SATHYAEAVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCLAYFDYGLAIQNYWGQG TLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVH TFPAVLQSSGLYSLSSWTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPC PAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVWDVSHEDPEVQFNWYVDGVEVHNAK TKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPSSIEKTISKTKGQPREP QVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGS FFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Аминокислотная последовательность легкой цепи полноразмерного антитела G1 (SEQ ID NO:12)
EIVLTQSPATLSLSPGERATLSCKASKRVTTYVSWYQQKPGQAPRLLIYGASNRYLGIP ARFSGSGSGTDFTLTISSLEPEDFAVYYCSQSYNYPYTFGQGTKLEIKRTVAAPSVFIF PPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYS LSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
Нуклеотидная последовательность тяжелой цепи полноразмерного антитела G1 (включая модифицированный IgG2, описанный в настоящем документе) (SEQ ID NO:13)
GAAGTTCAGCTGGTTGAATCCGGTGGTGGTCTGGTTCAGCCAGGTGGTTCCCTGC GTCTGTCCTGCGCTGCTTCCGGTTTCACCTTCTCCAACTACTGGATCTCCTGGGTT CGTCAGGCTCCTGGTAAAGGTCTGGAATGGGTTGCTGAAATCCGTTCCGAATCCG ACGCGTCCGCTACCCATTACGCTGAAGCTGTTAAAGGTCGTTTCACCATCTCCCGT GACAACGCTAAGAACTCCCTGTACCTGCAGATGAACTCCCTGCGTGCTGAAGACA CCGCTGTTTACTACTGCCTGGCTTACTTTGACTACGGTCTGGCTATCCAGAACTAC TGGGGTCAGGGTACCCTGGTTACCGTTTCCTCCGCCTCCACCAAGGGCCCATCTG TCTTCCCACTGGCCCCATGCTCCCGCAGCACCTCCGAGAGCACAGCCGCCCTGG GCTGCCTGGTCAAGGACTACTTCCCAGAACCTGTGACCGTGTCCTGGAACTCTGG CGCTCTGACCAGCGGCGTGCACACCTTCCCAGCTGTCCTGCAGTCCTCAGGTCTC TACTCCCTCAGCAGCGTGGTGACCGTGCCATCCAGCAACTTCGGCACCCAGACCT ACACCTGCAACGTAGATCACAAGCCAAGCAACACCAAGGTCGACAAGACCGTGGA GAGAAAGTGTTGTGTGGAGTGTCCACCTTGTCCAGCCCCTCCAGTGGCCGGACCA TCCGTGTTCCTGTTCCCTCCAAAGCCAAAGGACACCCTGATGATCTCCAGAACCCC AGAGGTGACCTGTGTGGTGGTGGACGTGTCCCACGAGGACCCAGAGGTGCAGTT CAACTGGTATGTGGACGGAGTGGAGGTGCACAACGCCAAGACCAAGCCAAGAGA GGAGCAGTTCAACTCCACCTTCAGAGTGGTGAGCGTGCTGACCGTGGTGCACCAG GACTGGCTGAACGGAAAGGAGTATAAGTGTAAGGTGTCCAACAAGGGACTGCCAT CCAGCATCGAGAAGACCATCTCCAAGACCAAGGGACAGCCAAGAGAGCCACAGGT GTATACCCTGCCCCCATCCAGAGAGGAGATGACCAAGAACCAGGTGTCCCTGACC TGTCTGGTGAAGGGATTCTATCCATCCGACATCGCCGTGGAGTGGGAGTCCAACG GACAGCCAGAGAACAACTATAAGACCACCCCTCCAATGCTGGACTCCGACGGATC CTTCTTCCTGTATTCCAAGCTGACCGTGGACAAGTCCAGATGGCAGCAGGGAAAC GTGTTCTCTTGTTCCGTGATGCACGAGGCCCTGCACAACCACTATACCCAGAAGAG CCTGTCCCTGTCTCCAGGAAAGTAA
Нуклеотидная последовательность легкой цепи полноразмерного антитела G1 (SEQ ID NO:14)
GAAATCGTTCTGACCCAGTCCCCGGCTACCCTGTCCCTGTCCCCAGGTGAACGTG CTACCCTGTCCTGCAAAGCTTCCAAACGGGTTACCACCTACGTTTCCTGGTACCAG CAGAAACCCGGTCAGGCTCCTCGTCTGCTGATCTACGGTGCTTCCAACCGTTACC TCGGTATCCCAGCTCGTTTCTCCGGTTCCGGTTCCGGTACCGACTTCACCCTGAC CATCTCCTCCCTGGAACCCGAAGACTTCGCTGTTTACTACTGCAGTCAGTCCTACA ACTACCCCTACACCTTCGGTCAGGGTACCAAACTGGAAATCAAACGCACTGTGGCT GCACCATCTGTCTTCATCTTCCCTCCATCTGATGAGCAGTTGAAATCCGGAACTGC CTCTGTTGTGTGCCTGCTGAATAACTTCTATCCGCGCGAGGCCAAAGTACAGTGGA AGGTGGATAACGCCCTCCAATCCGGTAACTCCCAGGAGAGTGTCACAGAGCAGGA CAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACCCTGAGCAAAGCAGAC TACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGTTCTC CAGTCACAAAGAGCTTCAACCGCGGTGAGTGCTAA
Сравнение аминокислотной последовательности человеческого и крысиного CGRP (человеческий α-CGRP (SEQ ID NO:15); человеческий β-CGRP (SEQ ID NO:16); крысиный α-CGRP (SEQ ID NO:17); и крысиный β-CGRP (SEQ ID NO:18)):
NH2-ACDTATCVTHRLAGLLSRSGGVVKNNFVPTNVGSKAF-CONH2 (SEQ ID NO:15) NH2-ACNTATCVTHRLAGLLSRSGGMVKSNFVPTNVGSKAF-CONH2 (SEQ ID NO:16) NH2-SCNTATCVTHRLAGLLSRSGGVVKDNFVPTNVGSEAF-CONH2 (SEQ ID NO:17) NH2-SCNTATCVTHRLAGLLSRSGGVVKDNFVPTNVGSKAF-CONH2 (SEQ ID NO:18)
Аминокислотная последовательность вариабельного участка тяжелой цепи антитела G2 (SEQ ID NO:19)
EVQLQQSGPELVKPGASVKMSCKASGYTFTSSVMHWVKQKPGQGLEWIGYINPYND
GTKYNEKFKGKATLTSDKSSSTAYMELSSLTSEDSAVYYCAKGGNDGYWGQGTTLTV
SS
Аминокислотная последовательность вариабельного участка легкой цепи антитела G2 (SEQ ID NO:20)
EIVLTQSPTTMAASPGEKITITCSASSSISSIYLHWYQQKPGFSPKVLIYRASNLASGVPA RFSGSGSGTSYSLTIGTMEAEDVATYYCQQGSTIPFTFGSGTKLEIK
CDR H1 антитела G2 (удлиненный CDR) (SEQ ID NO:21)
SSVMH
CDR H2 антитела G2 (удлиненный CDR) (SEQ ID NO:22)
YINPYNDGTKYNEKFKG
CDR H3 антитела G2 (SEQ ID NO:23)
GGNDGY
CDR L1 антитела G2 (SEQ ID NO:24)
SASSSISSIYLH
CDR L2 антитела G2 (SEQ ID NO:25)
RASNLAS
CDR L3 антитела G2 (SEQ ID NO:26)
QQGSTIPFT
Нуклеотидная последовательность вариабельного участка тяжелой цепи антитела G2 (SEQ ID NO:27)
GAGGTCCAGCTGCAGCAGTCTGGACCTGAGCTGGTAAAGCCTGGGGCTTCAGTGAAG ATGTCCTGCAAGGCTTCTGGATACACATTCACTAGCTCTGTTATGCACTGGGTGAAGC AGAAGCCTGGGCAGGGCCTTGAGTGGATTGGATATATTAATCCTTACAATGATGGTAC TAAGTACAATGAGAAGTTCAAAGGCAAGGCCACACTGACTTCAGACAAATCCTCCAGC ACAGCCTACATGGAACTCAGCAGCCTGACCTCTGAGGACTCTGCGGTCTATTACTGTG CAAAAGGGGGTAACGATGGCTACTGGGGCCAAGGCACTACTCTCACAGTCTCCTCA
Нуклеотидная последовательность вариабельного участка легкой цепи антитела G2 (SEQ ID NO:28)
GAAATTGTGCTCACCCAGTCTCCAACCACCATGGCTGCATCTCCCGGGGAGAAGATC ACTATCACCTGTAGTGCCAGCTCAAGTATAAGTTCCATTTACTTGCATTGGTATCAGCA GAAGCCAGGATTCTCCCCTAAAGTCTTGATTTATAGGGCATCCAATCTGGCTTCTGGA GTCCCAGCTCGCTTCAGTGGCAGTGGGTCTGGGACCTCTTACTCTCTCACAATTGGCA CCATGGAGGCTGAAGATGTTGCCACTTACTACTGCCAGCAGGGTAGTACTATACCATT CACGTTCGGCTCGGGGACAAAGTTGGAAATAAAA
Аминокислотная последовательность тяжелой цепи полноразмерного антитела G2 (не включая Fc-домен) (SEQ ID NO:29)
EVQLQQSGPELVKPGASVKMSCKASGYTFTSSVMHWVKQKPGQGLEWIGYINPYNDGT KYNEKFKGKATLTSDKSSSTAYMELSSLTSEDSAVYYCAKGGNDGYWGQGTTLTVSSAK TTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLY TLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRD
Аминокислотная последовательность легкой цепи полноразмерного антитела G2 (SEQ ID NO:30)
EIVLTQSPTTMAASPGEKITITCSASSSISSIYLHWYQQKPGFSPKVLIYRASNLASGVPARF SGSGSGTSYSLTIGTMEAEDVATYYCQQGSTIPFTFGSGTKLEIKRADAAPTVSIFPPSSEQ LTSGGASWCFLNNFYPRDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKD EYERHNSYTCEATHKTSTSPIVKSFNRNEC
Нуклеотидная последовательность тяжелой цепи полноразмерного антитела G2 (не включая Fc-домен) (SEQ ID NO:31)
GAGGTCCAGCTGCAGCAGTCTGGACCTGAGCTGGTAAAGCCTGGGGCTTCAGTGAAG ATGTCCTGCAAGGCTTCTGGATACACATTCACTAGCTCTGTTATGCACTGGGTGAAGC AGAAGCCTGGGCAGGGCCTTGAGTGGATTGGATATATTAATCCTTACAATGATGGTAC TAAGTACAATGAGAAGTTCAAAGGCAAGGCCACACTGACTTCAGACAAATCCTCCAGC ACAGCCTACATGGAACTCAGCAGCCTGACCTCTGAGGACTCTGCGGTCTATTACTGTG CAAAAGGGGGTAACGATGGCTACTGGGGCCAAGGCACTACTCTCACAGTCTCCTCAG CCAAAACGACACCCCCATCTGTCTATCCACTGGCCCCTGGATCTGCTGCCCAAACTAA CTCCATGGTGACCCTGGGATGCCTGGTCAAGGGCTATTTCCCTGAGCCAGTGACAGT GACCTGGAACTCTGGATCCCTGTCCAGCGGTGTGCACACCTTCCCAGCTGTCCTGCA GTCTGACCTCTACACTCTGAGCAGCTCAGTGACTGTCCCCTCCAGCACCTGGCCCAG CGAGACCGTCACCTGCAACGTTGCCCACCCGGCCAGCAGCACCAAGGTGGACAAGA AAATTGTGCCCAGGGAT
Нуклеотидная последовательность легкой цепи полноразмерного антитела G2 (SEQ ID NO:32)
GAAATTGTGCTCACCCAGTCTCCAACCACCATGGCTGCATCTCCCGGGGAGAAGA TCACTATCACCTGTAGTGCCAGCTCAAGTATAAGTTCCATTTACTTGCATTGGTATC AGCAGAAGCCAGGATTCTCCCCTAAAGTCTTGATTTATAGGGCATCCAATCTGGCT TCTGGAGTCCCAGCTCGCTTCAGTGGCAGTGGGTCTGGGACCTCTTACTCTCTCA CAATTGGCACCATGGAGGCTGAAGATGTTGCCACTTACTACTGCCAGCAGGGTAG TACTATACCATTCACGTTCGGCTCGGGGACAAAGTTGGAAATAAAACGGGCTGATG CTGCACCAACTGTATCCATCTTCCCACCATCCAGTGAGCAGTTAACATCTGGAGGT GCCTCAGTCGTGTGCTTCTTGAACAACTTCTACCCCAGAGACATCAATGTCAAGTG GAAGATTGATGGCAGTGAACGACAAAATGGTGTCCTGAACAGTTGGACTGATCAG GACAGCAAAGACAGCACCTACAGCATGAGCAGCACCCTCACATTGACCAAGGACG AGTATGAACGACATAACAGCTATACCTGTGAGGCCACTCACAAGACATCAACTTCA CCCATCGTCAAGAGCTTCAACAGGAATGAGTGTTAA
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ВИСЦЕРАЛЬНОЙ БОЛИ ПУТЕМ ВВЕДЕНИЯ АНТИТЕЛ-АНТАГОНИСТОВ, НАПРАВЛЕННЫХ ПРОТИВ ПЕПТИДА, СВЯЗАННОГО С ГЕНОМ КАЛЬЦИТОНИНА | 2010 |
|
RU2535074C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНОЙ БОЛИ | 2009 |
|
RU2467765C2 |
| ЛЕЧЕНИЕ ИНТЕРСТИЦИАЛЬНОГО ЦИСТИТА | 2008 |
|
RU2570559C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ПРОСТАГЛАНДИН Е2, И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2559525C2 |
| AXL-АНТИТЕЛА | 2008 |
|
RU2506276C2 |
| Стабильная водная композиция антитела против фактора роста эндотелия сосудов (VEGF) | 2016 |
|
RU2699544C2 |
| Антитела к PD-1 и способы их применения | 2015 |
|
RU2701797C2 |
| СПОСОБЫ ЛЕЧЕНИЯ БОЛИ, ВЫЗВАННОЙ ОСТЕОАРТРИТОМ, ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА ФАКТОРА РОСТА НЕРВОВ И СОДЕРЖАЩИХ ЕГО КОМПОЗИЦИЙ | 2006 |
|
RU2429013C2 |
| ОТБОР ПАЦИЕНТОВ С ГОЛОВНОЙ БОЛЬЮ, ВОСПРИИМЧИВЫХ К АНТИТЕЛАМ, НАПРАВЛЕННЫМ ПРОТИВ КАЛЬЦИТОНИН ГЕН-РОДСТВЕННОГО ПЕПТИДА | 2018 |
|
RU2770066C2 |
| Антитело против PD-1 и его применение | 2017 |
|
RU2739610C1 |
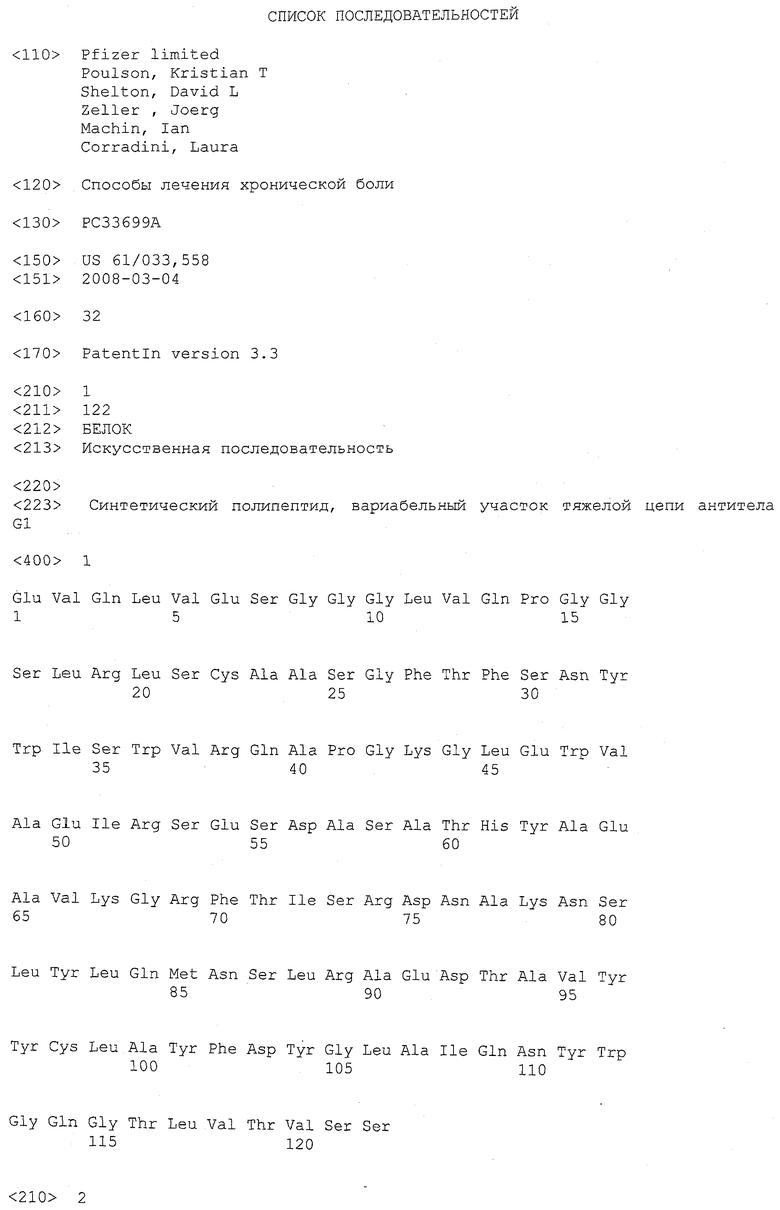















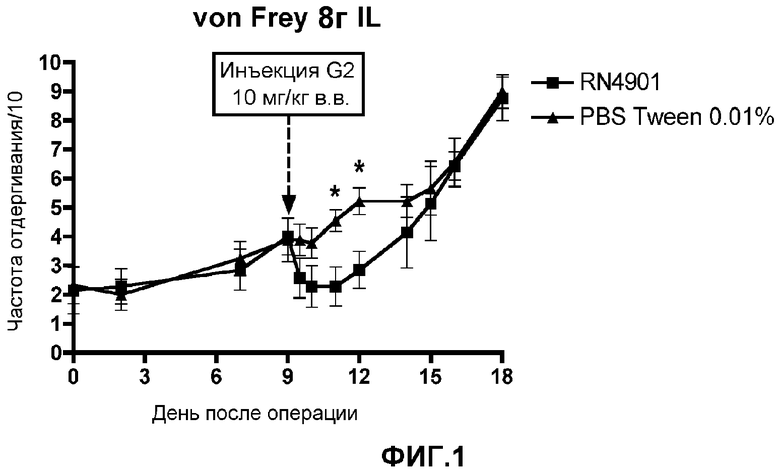
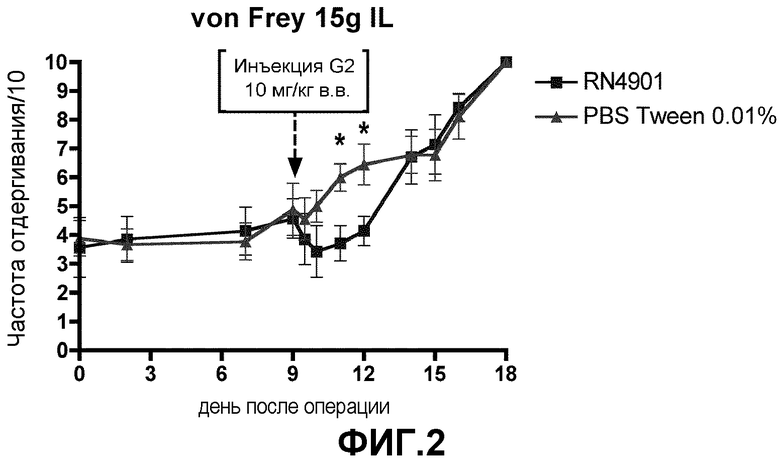
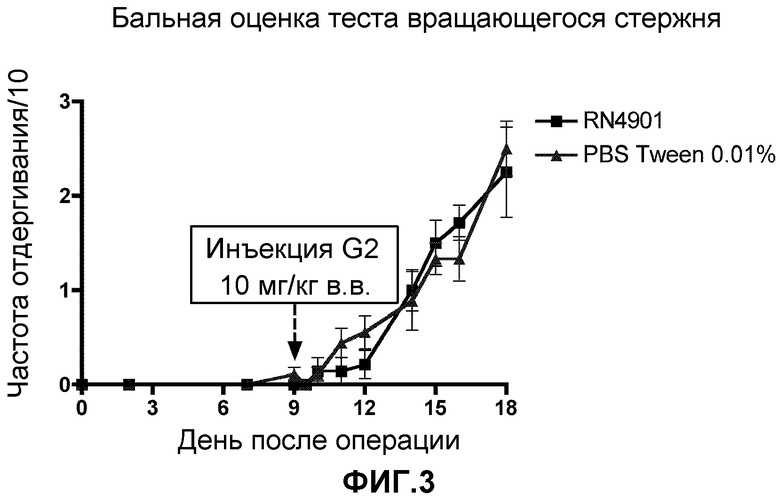
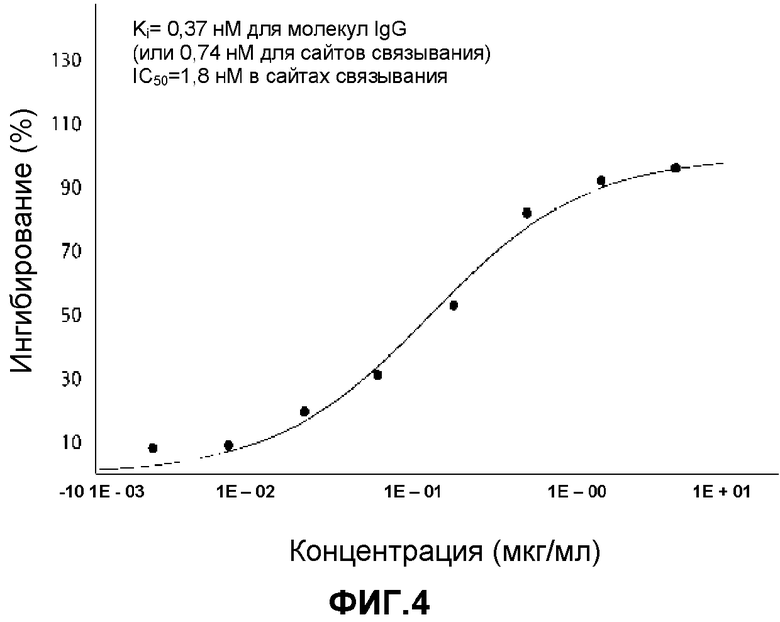

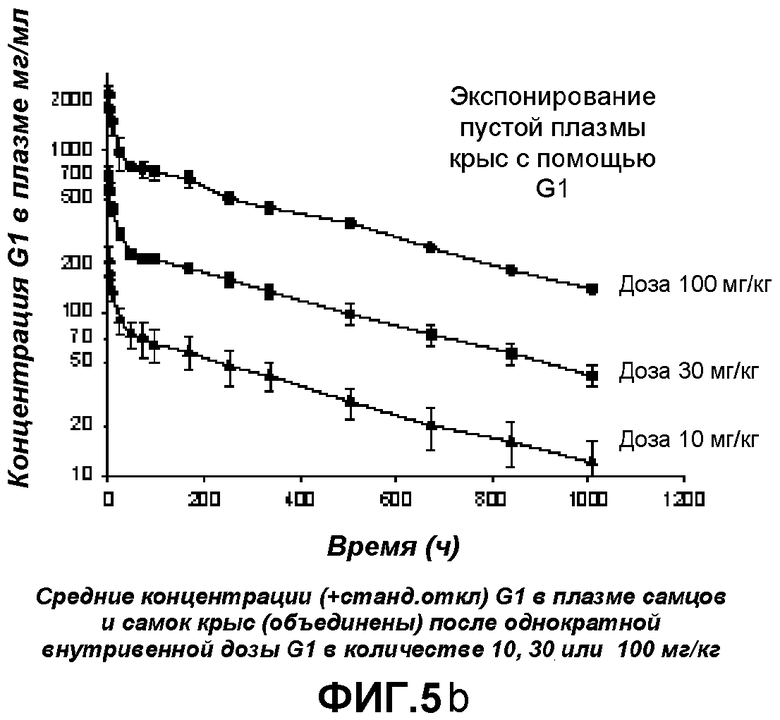
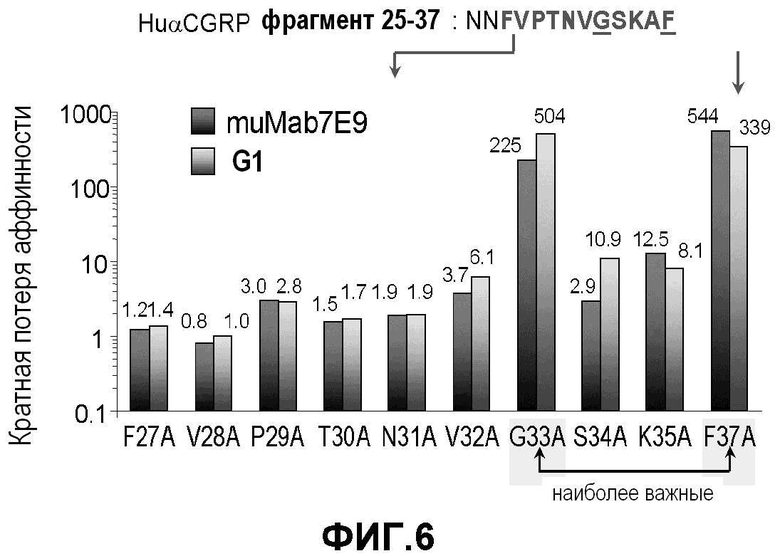
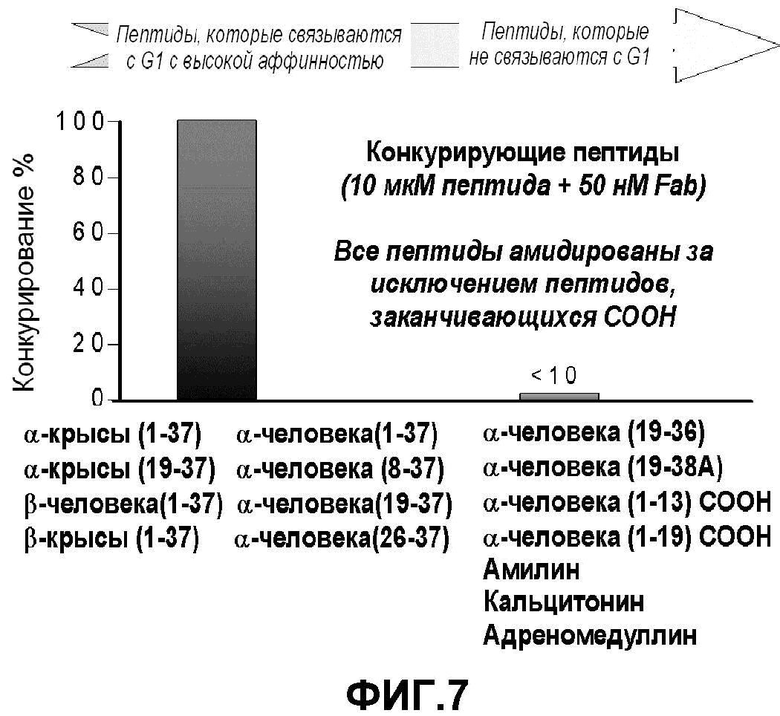

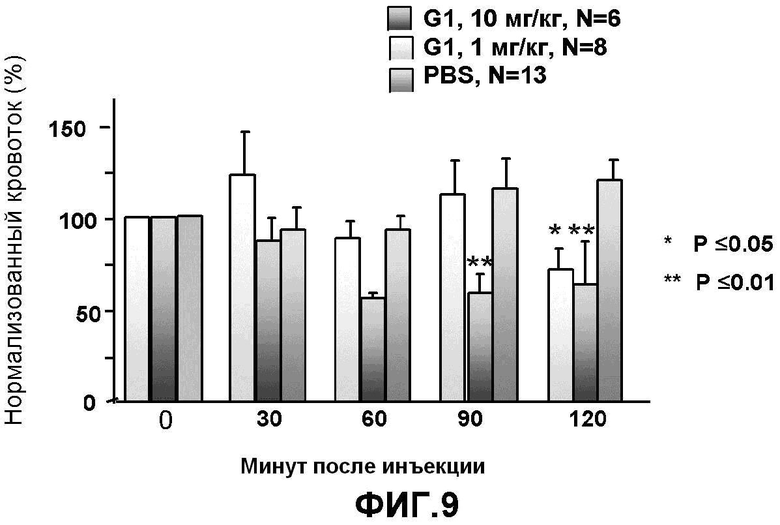
Изобретение относится к области биохимии, в частности к применению анти-CGRP антагонистического антитела для производства лекарственного средства для предотвращения и/или лечения хронической боли и/или симптомов хронической боли и где лекарственное средство получено для периферического введения. Применение указанного лекарственного средства для периферического введения является эффективным для предотвращения и/или лечения хронической боли. 2 з.п. ф-лы, 9 ил., 2 табл., 10 пр.
1. Применение анти-CGRP антагонистического антитела для производства лекарственного средства для предотвращения и/или лечения хронической боли и/или симптомов хронической боли, где хроническая боль возникает из-за одного или нескольких следующих заболеваний: аденокарциномы железистой ткани, бластомы эмбриональной ткани органов, карциномы эпителиальной ткани, лейкоза в ткани, которая образует кровяные клетки, лимфомы в лимфатической ткани, миеломы костного мозга, саркомы соединительной или опорной ткани, рака надпочечника, лимфомы, ассоциированной со СПИДом, анемии, рака мочевого пузыря, рака кости, рака молочной железы, карциноидных опухолей, рака шейки матки, химиотерапии, рака толстой кишки, цитопении, рака эндометрия, рака пищевода, рака желудочно-кишечного тракта, рака шеи, гепатобилиарного рака, рака почки, лейкоза, рака печени, рака легкого, лимфомы, болезни Ходжкина, неходжкинской лимфомы, опухолей нервной системы, рака ротовой полости, рака яичников, рака поджелудочной железы, рака простаты, ректального рака, рака кожи, рака желудка, рака яичка, рака щитовидной железы, уретрального рака, рака костной ткани, рака кроветворных клеток, рака костного мозга, множественной миеломы, лейкоза, первичного или вторичного рака кости, опухолей, которые метастазируют в кость, опухолей, инфильтрующих нервную ткань и полости внутренних органов, и опухолей, близких к структурам нервной ткани, и где лекарственное средство получено для периферического введения.
2. Применение по п.1, где лекарственное средство содержит анти-CGRP антитело и фармацевтически приемлемый носитель.
3. Применение по п.1, где лекарственное средство представлено в наборе, который дополнительно содержит инструкции по периферическому введению индивидууму терапевтически эффективного количества указанного лекарственного средства для лечения и/или предотвращения указанной хронической боли и/или симптомов указанной хронической боли.
4. Применение по п.1, где лекарственное средство вводят периферически.
5. Применение по п.1, где лекарственное средство готовят для введения перорально, подьязычно, для введения посредством ингаляции, чрескожно, подкожно, внутривенно, внутриартериально, внутриартикулярно, периартикулярно, местно и/или внутримышечно.
6. Применение по п.4 где лекарственное средство готовят для введения подкожно или внутривенно.
7. Применение по п.1, где анти-CGRP антагонистическое антитело при введении действует периферически.
8. Применение по п.1, где хроническая боль включает одну или более из хронической ноцицептивной боли, хронической невропатической боли, хронической воспалительной боли, фибромиалгии, периодической боли и постоянной боли.
9. Применение по п.8, где хроническая боль дополнительно включает одну или более из гиперплазии, аллодинии, центральной сенсибилизации, периферической сенсибилизации, расторможенности и усиленной передачи сигналов.
10. Применение по п.1, где хроническая боль представляет собой боль, связанную с раком кости.
11. Применение по п.1, где анти-CGRP антагонистическое антитело:
(a) связывается с CGRP;
(b) блокирует CGRP от связывания с его рецептором;
(c) блокирует или уменьшает активацию рецептора CGRP;
(d) ингибирует, блокирует, подавляет или уменьшает биологическую активность CGRP;
(e) увеличивает выведение CGRP; и/или
(g) ингибирует синтез, продуцирование или высвобождение CGRP.
12. Применение по п.1, где анти-CGRP антагонистическое антитело:
(i) представляет собой человеческое антитело,
(ii) представляет собой гуманизированное антитело,
(iii) представляет собой моноклональное антитело,
(iv) связывается с CGRP с Kd 50 нМ или менее (по измерениям с помощью поверхностного плазмонного резонанса при 37°C); и/или
(v) in-vivo имеет период полужизни, составляющий, по меньшей мере, 7 дней.
13. Применение по п.1, где анти-CGRP антагонистическое антитело специфично связывается с C-концевым участком CGRP.
14. Применение по п.12, где анти-CGRP антагонистическое антитело специфично распознает эпитоп, характеризующийся последовательностью GSKAF.
15. Применение по п.1, где анти-CGRP антагонистическое антитело включает VH-домен, аминокислотная последовательность которого, по меньшей мере, на 90% идентична SEQ ID NO: 1 или 19.
16. Применение по п.1, где анти-CGRP антагонистическое антитело включает VL-домен, аминокислотная последовательность которого, по меньшей мере, на 90% идентична SEQ ID NO: 2 или 20.
17. Применение по п.16, где анти-CGRP антитело дополнительно включает VH-домен, аминокислотная последовательность которого, по меньшей мере, на 90% идентична SEQ ID NO: 1 или 19.
18. Применение по любому из пп.1-14, где анти-CGRP антитело включает, по меньшей мере, один участок CDR, выбранный из группы, состоящей из:
(a). CDR H1, представленного в SEQ ID NO: 3 или 21;
(b). CDR H2, представленного в SEQ ID NO: 4 или 22;
(c). CDR H3, представленного в SEQ ID NO: 5 или 23;
(d). CDR L1, представленного в SEQ ID NO: 6 или 24;
(e). CDR L2, представленного в SEQ ID NO: 7 или 25;
(f). CDR L3, представленного в SEQ ID NO: 8 или 26; и
(g). вариантов L1, L2 и H2.
19. Применение по любому из пп.1-14, где анти-CGRP антитело включает VH-домен, аминокислотная последовательность которого, по меньшей мере, на 90% идентична SEQ ID NO: 1, и включает VL-домен, аминокислотная последовательность которого, по меньшей мере, на 90% идентична SEQ ID NO: 2.
20. Применение по любому из пп.1-14, где анти-CGRP антитело включает тяжелую цепь, получаемую с помощью экспрессирующего вектора с регистрационным номером ATCC No. PTA-6867.
21. Применение по любому из пп.1-14, где анти-CGRP антитело включает легкую цепь, получаемую с помощью экспрессирующего вектора с регистрационным номером ATCC No. PTA-6866.
22. Применение по любому из пп.1-14, где анти-CGRP антитело получают с помощью экспрессирующих векторов с регистрационными номерами ATCC No. PTA-6867 и PTA-6866.
23. Применение по любому из пп.1-14, где лекарственное средство готовят для периферического введения с помощью подкожной или внутривенной инъекции от одного, двух, трех до четырех раз в месяц.
24. Применение по п.23, где лекарственное средство готовят для периферического введения с концентрацией антитела от 5 до 100 мг/мл.
25. Применение по п.23, где лекарственное средство готовят для периферического введения с концентрацией антитела от 1 до 100 мг/кг массы тела.
26. Применение по любому из пп.1-14, где лекарственное средство не производит CNS-расстройства моторной координации или внимания.
27. Применение по любому из пп.1-14, где анти-CGRP антагонистическое антитело не вводят центрально, спинально или интратекально.
28. Применение по любому из пп.1-14, где анти-CGRP антитело вводится отдельно, последовательно или одновременно в комбинации с одним или более из дополнительных фармакологически активных соединений.
29. Применение по п.28, где одно или более из дополнительных фармакологически активных соединений выбрано/выбраны из:
(i) опиоидного анальгетика, например, морфина, героина, гидроморфона, оксиморфона, леворфанола, леваллорфана, метадона, меперидина, фентанила, кокаина, кодеина, дигидрокодеина, оксикодона, гидрокодона, пропоксифена, налмефена, налорфина, налоксона, налтрексона, бупренорфина, буторфанола, налбуфина или пентазоцина;
(ii) нестероидного противовоспалительного средства (НПВС), например, аспирина, диклофенака, дифлусинала, этодолака, фенбуфена, фенопрофена, флуфенисала, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, меклофенамовой кислоты, мефенамовой кислоты, набуметона, напроксена, оксапрозина, фенилбутазона, пироксикама, сулиндака, толметина или зомепирака, или их фармацевтически приемлемых солей;
(iii) барбитуратного седативного средства, например, амобарбитала, апробарбитала, бутобарбитала, бутабитала, мефобарбитала, метарбитала, метогекситала, пентобарбитала, секобарбитала, талбутала, теамилала или тиопентала или их фармацевтически приемлемых солей;
(iv) бензодиазепина, обладающего седативным действием, например, хлордиазепоксида, хлоразепата, диазепама, флуразепама, лоразепама, оксазепама, темазепама или триазолама или их фармацевтически приемлемых солей;
(v) H1-антагониста, обладающего седативным действием, например, дифенгидрамина, пириламина, прометазина, хлорфенирамина или хлорциклизина или их фармацевтически приемлемых солей;
(vi) седативного средства, такого как глутетимид, мепробамат, метаквалон или дихлоралфеназон или их фармацевтически приемлемых солей;
(vii) миорелаксанта скелетной мышцы, например, баклофенона, каризопродола, хлорзоксазона, циклобензапина, метокарбамола или орфренадина или их фармацевтически приемлемых солей;
(viii) антагониста рецептора NMDA, например, декстрометорфана ((+)-3-гидрокси-N-метилморфинан) или его метаболита декстрорфана ((+)-3-гидрокси-N-метилморфинан), кетамина, мемантина, пирроло-хинолин хинона или цис-4-(фосфонометил)-2-пиперидинкарбоновой кислоты или их фармацевтически приемлемых солей;
(ix) альфа-адренергического средства, например, доксазозина, тамсулозина, клонидина или 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолина;
(x) трициклического антидепрессанта, например, дезипрамина, имипрамина, амитриптилина или нортриптилина;
(xi) антиконвульсанта, например, карбамазепина или валпроата;
(xii) антагониста тахикинина (NK), конкретно, антагониста NK-3, NK-2 или NK-1, например, (αR,9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7H-[1,4]диазоцино[2,1-g][1,7]нафтридин-6-13-диона (TAK-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]-1,2-дигидро-3H-1,2,4-триазол-3-она (MK-869), ланепитанта, дапитанта или 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенил-пиперидина (2S,3S);
(xiii) мускаринового антагониста, например, оксибутина, толтеродина, пропиверина, хлорида тропсия или дарифенацина;
(xiv) ингибитора COX-2, например, целекоксиба, рофекоксиба или вальдекоксиба;
(xv) неселективного ингибитора COX (предпочтительно с G1-защитой), например, нитрофлурбипрофена (HCT-1026);
(xvi) анальгетика, конкретно, парацетамола, с происхождением из каменноугольной смолы;
(xvii) нейролептика, такого как дроперидол;
(xviii) агониста ваниллоидного рецептора (например, ресинифератоксина) или антагониста (например, капсазепина);
(xix) бета-адренергического средства, такого как пропранолол;
(xx) местного анестетика, такого как мексилетин;
(xxi) кортикостероида, такого как дексометазон;
(xxii) агониста или антагониста рецептора серотонина;
(xxiii) холинергического (никотинового) анальгетика;
(xxiv) Трамадола (торговая марка);
(xxv) ингибитора PDEV, такого как силденафил, варденафил или таладафил;
(xxvi) альфа-2-дельта лиганда, такого как габапентин или прегабалин; и
(xxvii) каннабиноида.
| KAWAMURa M | |||
| et al., Antinociceptive effect of intrathecally administered antiserum against calcitonin gene-related peptide on thermal and mechanical noxious stimuli in experimental hyperalgesic rats | |||
| Brain Research, 1989, Vol | |||
| Врезной замок с секретным устройством для застопоривания в крайних положениях сдвоенных ригелей | 1923 |
|
SU497A1 |
| ПЕЧНОЙ ЖЕЛЕЗНЫЙ РУКАВ (ТРУБА) | 1920 |
|
SU199A1 |
| KURAISHI Y | |||
| et al., Antinociception induced in rats by intrathecal administration of antiserum against | |||
Авторы
Даты
2014-07-20—Публикация
2009-03-03—Подача