Изобретение относится к лечению и обнаружению воспалительного заболевания кишечника (IBD). Изобретение включает применение агента специфического связывания, который связывает изоформу ED-Α фибронектина, в частности агента специфического связывания, связывающего домен ED-Α фибронектина. Например, агент специфического связывания может быть конъюгирован с иммуносупрессивной или противовоспалительной молекулой, такой как интерлейкин-10.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Воспалительное заболевание кишечника (IBD) представляет собой группу воспалительных состояний, поражающих ободочную кишку и тонкий кишечник. Основными типами IBD являются болезнь Крона (CD) и неспецифический язвенный колит (UK). Патогенез IBD характеризуется различной ангиогенной регуляцией, вносящей вклад в хроническое воспалительное состояние кишечника и закрепление этого состояния (Chidlow et al., 2006, Am J Physiol. Gastrointest. Liver Physiol., 29, G5-G18). Болезнь Крона может поражать любую часть желудочно-кишечного тракта, тогда как неспецифический язвенный колит обычно ограничен ободочной и прямой кишкой (Summers RW, Elliott DE, Qadir K, Urban JF, Thompson R, Weinstock JV (2003) Am. J. Gastroentol., 98: 2034-2041). В зависимости от его тяжести для лечения неспецифического язвенного колита может требоваться иммуносупрессия, чтобы контролировать его симптомы, и лечение обычно включает введение противовоспалительных молекул.
Известно, что IBD характеризуется повышающей регуляцией провоспалительных цитокинов, таких как IFN(интерферон)-γ, IL(интерлейкин)-6 и IL-12 (например IL-12р70). Например, известно, что болезнь Крона ассоциирована с избыточным продуцированием IL-12/IL-23 и IFN-γ/IL-17 (Strober et al. (2007), The Journal of Clinical Investigation, 117(3), 514-521). Описан также синтез IL-12p70 и IL-23 во время активной болезни Крона (Fuss et al. 2006, Inflamm. Bowel Dis. 12: 9-15).
Фибронектин (FN) представляет собой гликопротеин и широко экспрессируется в ряде нормальных тканей и жидкостей организма. Он является компонентом внеклеточного матрикса (ЕСМ) и играет роль во многих биологических процессах, включая клеточную адгезию, клеточную миграцию, гемостаз, тромбоз, заживление раны, дифференцировку тканей и онкогенную трансформацию.
Различные изоформы FN образуются в результате альтернативного сплайсинга трех областей (ED-Α, ED-B, IIICS) первичного транскрипта пре-мРНК FN, где данный процесс модулируется цитокинами и внеклеточным рН (Balza (1988) FEBS Lett., 228, 42-44; Carnemolla (1989) J. Cell Biol., 106, 1139-1148; Borsi (1990) FEBS Lett. 261, 175-178). Фибронектин содержит два глобулярных экстра-домена типа III, которые могут подвергаться альтернативному сплайсингу: ED-Α и ED-B (ffrench-Constant (1995) Exp. Cell Res., 22, 261-271, Kaspar et al. (2006) Int. J. Cancer, 118, 1331-1339). ED-A мышиного фибронектина мыши и человеческого фибронектина идентичны на 96,7% (только 3 аминокислоты различаются между 90-аминокислотными последовательностями).
Описана экспрессия ED-Α фибронектина в опухолевых клетках и в солидных опухолях на уровне мРНК при раке молочной железы (Jacobs et al. (2002) Human Pathol, 33, 29-38, Matsumoto et al. (1999) Jpn. J. Cancer Res., 90, 320-325) и раке печени (Oyama et al. (1989) JBC, 264, 10331-10334, Tavian et al. (1994) Int. J. Cancer, 56, 820-825) и на уровне выделенного белка при фибросаркоме, рабдомиосаркоме и меланоме (Borsi et al. (1987) J. Cell Biol., 104, 595-560). Помимо рака, экспрессия ED-Α фибронектина описана при ревматоидном артрите (WO 2009/056268). В WO 2010/078950 также описана экспрессия ED-Α фибронектина при эндометриозе, псориазе и псориатическом артрите, тем не менее, гистохимический анализ выявил, что при рассеянном склерозе и при неспецифическом язвенном колите экспрессия ED-Α является от очень слабой до почти отсутствующей. Иммуногистохимические анализы, описанные авторами Brenmoehl et al. (Int. J. Colorectal Dis. (2007) 22: 611-623), показывают, что экспрессия ED-A снижается в воспаленной слизистой оболочке кишечника пациентов с CD по сравнению с контрольной слизистой оболочкой и повышается при неспецифическом язвенном колите. В статье Brenmoehl et al. (2007) также описана повышенная экспрессия изоформ ED-Α и ED-B в фибротической слизистой оболочке пациентов с CD. Экспрессия изоформ ED-A и ED-B в фибротической слизистой оболочке ожидается, поскольку известно, что эти изоформы фибронектина вовлечены в заживление ран. В статье Brenmoehl et al. (2007) отсутствует предположение, что ED-Α экспрессируется во время (активной) CD, с учетом сниженной экспрессии ED-Α в воспаленной слизистой оболочке кишечника пациентов с CD по сравнению со слизистой оболочкой, имеющей происхождение от контрольных пациентов. Применение агентов связывания, связывающих изоформу ED-Α фибронектина, для лечения или диагностики IBD также не раскрыто в данном документе.
Интерлейкин-10 (IL-10) представляет собой противовоспалительный цитокин, функционирующий как важный регулятор иммунной системы. Хотя известно, что IL-10 играет множество различных ролей в иммунной системе, его две основные активности включают ингибирование продуцирования цитокинов макрофагами и ингибирование вспомогательных функций макрофагов в процессе активации Т-клеток (Abbas A, Lichtman A, Pober J., 1994, Cellular and Molecular Immunology. 2nd Ed. Philadelphia: W.B. Saunders Company). Эффекты этих действий заставляют IL-10 играть, в основном, противовоспалительную роль в иммунной системе. IL-10 первоначально был известен как ингибирующий фактор синтеза цитокина (CSIF), и открытие этого белка было основано на его биологической активности (Delves Ρ, Roitt I (eds), 1998, Encyclopedia of Immunology, 2nd Ed. San Diego: Academic Press). В связи с его хорошо известными противовоспалительными свойствами терапия IL-10 была внедрена как потенциально новая противовоспалительная терапия при болезни Крона (CD) (Fedorak et al., Gastroenterology (2000) 119, 1473-1482.; Schreiber et al., Gastroenterology (2000) 119, 1461-1472; Colombel et al., Gut (2001) 49, 42-46).
Авторами Asadullah et al. (Pharmacology Reviews, (2003), 55, 245-269) сделан обзор уровня техники относительно терапии интерлейкином-10 при ряде воспалительных заболеваний. При обзоре хронического воспалительного заболевания кишечника Asadullah et al. сообщают о проведении нескольких обширных многоцентровых испытаний, тестирующих множественные дозировки IL-10 у пациентов со слабой/умеренной или устойчивой к терапии CD, а также у пациентов, проходящих лечебную резекцию подвздошной кишки или тонкотолстокишечную резекцию, чтобы предотвратить эндоскопическую послеоперационную встречаемость, путем системного введения (Fedorak et al., Gastroenterology (2000) 119, 1473-1482.; Schreiber et al., Gastroenterology (2000) 119, 1461-1472; Colombel et al., Gut (2001) 49, 42-46.). Эти данные указывают на то, что терапия IL-10 безопасна и хорошо переносится. Тем не менее, лечение IL-10 не приводило в результате к значительно более высоким скоростям ремиссии или к клиническому улучшению по сравнению с введением плацебо.
Было обнаружено, что клинические результаты в целом неудовлетворительны, и Herfarth и Scholmerich обсуждали несколько объяснений неудач данной терапевтической стратегии (Gut (2002) 50, 146-147).
Таким образом, существует необходимость в эффективных терапиях различных состояний IBD.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения неожиданно обнаружили, что анти-EDA антитело, слитое с IL-10, обладало следующей способностью (1) селективно локализоваться в участках воспаленной ободочной кишки in vivo у мышей с заболеванием IBD и (2) снижать сывороточные уровни некоторых провоспалительных цитокинов у мышей с заболеванием IBD, в частности интерферона-гамма, IL-6 и IL-12р70.
Понижающая регуляция провоспалительных цитокинов посредством введения анти-EDA антитела, слитого с IL-10, была особенно неожиданной, поскольку авторы Tilg et al. (Gut (2002), 50, 191-195) сообщают, что лечение пациентов с болезнью Крона рекомбинантным человеческим IL-10 индуцирует интерферон-гамма. Авторы Shibata et al. (J. Immunol., (1998) 161, 4283-4288) также сообщают, что IL-10 усиливает продуцирование NK-клетками IFN-гамма, но ингибирует продуцирование макрофагами факторов, индуцирующих IFN-гамма.
Таким образом, в первом аспекте изобретения предложен агент специфического связывания, например молекула антитела, связывающий изоформу экстра-домен А (ED-Α) фибронектина (A-FN), для применения в способе лечения IBD. В изобретении также предложено применение агента специфического связывания, например молекулы антитела, связывающего изоформу экстра-домен А (ED-Α) фибронектина, для изготовления лекарственного средства для лечения IBD. В изобретении также предложен способ лечения IBD у пациента, включающий введение пациенту терапевтически эффективного количества лекарственного средства, содержащего агент специфического связывания, связывающий изоформу ED-A фибронектина. Предпочтительно агент специфического связывания связывает изоформу ED-Α человеческого фибронектина.
Агент специфического связывания, например молекула антитела, для применения в этом первом аспекте изобретения может связывать ED-A фибронектина.
Агент специфического связывания, например молекула антитела, для применения в этом первом аспекте изобретения, может быть конъюгирован с молекулой, обладающей иммуносупрессивной или противовоспалительной активностью, с выявляемой меткой, с радиоактивным изотопом или с биоактивной молекулой, такой как цитокин, гормон, терапевтический радиоактивный изотоп, цитотоксическое лекарственное средство. Агент специфического связывания может быть конъюгирован с биоактивной молекулой посредством расщепляемого линкера.
В предпочтительном воплощении агент специфического связывания, например молекула антитела, конъюгирован с молекулой, обладающей иммуносупрессивной или противовоспалительной активностью, такой как IL-10.
IBD по отношению к данному изобретению может представлять собой активную IBD. В частности, IBD может представлять собой болезнь Крона (CD), неспецифический язвенный колит (UK), коллагенозный колит, лимфоцитарный колит, ишемический колит, диверсионный колит, болезнь Бехчета или неопределенный колит. IBD может представлять собой CD или UK. IBD может представлять собой CD, коллагенозный колит, лимфоцитарный колит, ишемический колит, диверсионный колит, болезнь Бехчета или неопределенный колит. В одном воплощении изобретения IBD не представляет собой UK. IBD может представлять собой IBD, обычно не ограниченное воспалением в ободочной и прямой кишке, такое как CD. IBD может представлять собой IBD, поражающее не только выстилающую поверхность кишечника. Предпочтительно IBD представляет собой CD. Термины CD, UK, коллагенозный колит, лимфоцитарный колит, ишемический колит, диверсионный колит, болезнь Бехчета и неопределенный колит, как используют в данном описании, могут относиться к активной CD, активному UK, активному коллагенозному колиту, активному лимфоцитарному колиту, активному ишемическому колиту, активному диверсионному колиту, активной болезни Бехчета и активному неопределенному колиту, соответственно.
Во втором аспекте изобретения предложен агент специфического связывания, например молекула антитела, связывающий изоформу ED-A фибронектина, для применения в доставке молекулы, конъюгированной с агентом специфического связывания, к IBD-ткани. В изобретении также предложено применение агента специфического связывания, например молекулы антитела, связывающего изоформу ED-Α фибронектина, для изготовления лекарственного средства для доставки молекулы, конъюгированной с агентом специфического связывания, к IBD-ткани. В изобретении также предложен способ доставки молекулы к IBD-ткани у человека или животного, где эта молекула конъюгирована с агентом специфического связывания, связывающим изоформу ED-Α фибронектина, с образованием конъюгата, и данный способ включает введение конъюгата человеку или животному. Предпочтительно агент специфического связывания связывает изоформу ED-Α человеческого фибронектина.
Агент специфического связывания, например молекула антитела, для применения в этом втором аспекте изобретения, может связывать ED-A фибронектина.
Агент специфического связывания, например молекула антитела, для применения в этом втором аспекте изобретения может быть конъюгирован с выявляемой меткой, радиоактивным изотопом или биоактивной молекулой, такой как цитокин, гормон, терапевтический радиоактивный изотоп или цитотоксическое лекарственное средство. Агент специфического связывания может быть конъюгирован с биоактивной молекулой посредством расщепляемого линкера.
Агент специфического связывания, например молекула антитела, предпочтительно конъюгирован с IL-10.
В третьем аспекте изобретения предложен агент специфического связывания, например молекула антитела, связывающий изоформу ED-A фибронектина, для применения в способе диагностики IBD. В изобретении также предложено применение агента специфического связывания, связывающего изоформу ED-Α фибронектина, для изготовления диагностического продукта для диагностики IBD. В изобретении также предложен способ обнаружения или диагностики IBD у человека или животного, включающий стадии:
а) введения человеку или животному агента специфического связывания, связывающего домен ED-Α фибронектина, и
б) определения присутствия или отсутствия агента специфического связывания в участках IBD организма человека или животного,
где локализация агента специфического связывания в участке IBD указывает на наличие IBD.
Предпочтительно агент специфического связывания связывает изоформу ED-Α человеческого фибронектина.
Агент специфического связывания, например молекула антитела, для применения в этом третьем аспекте изобретения может связывать ED-A фибронектина.
Агент специфического связывания, например молекула антитела, для применения в этом третьем аспекте изобретения может быть конъюгирован с выявляемой меткой или радиоактивным изотопом.
В четвертом аспекте изобретения предложен агент специфического связывания, связывающий изоформу ED-Α фибронектина, для применения в способе визуализации IBD-ткани. В изобретении также предложено применение агента специфического связывания, связывающего изоформу ED-A фибронектина, для изготовления визуализирующего агента для визуализации IBD-ткани. В изобретении также предложен способ обнаружения или визуализации IBD-ткани у человека или животного, включающий стадии:
а) введения человеку или животному агента специфического связывания, связывающего домен ED-Α фибронектина, и
б) обнаружения связывания агента специфического связывания с IBD-тканью в организме человека или животного.
Предпочтительно агент специфического связывания связывает изоформу ED-Α человеческого фибронектина.
Агент специфического связывания, например молекула антитела, для применения в этом четвертом аспекте изобретения, может связывать ED-A фибронектина.
Агент специфического связывания, например молекула антитела, для применения в этом четвертом аспекте изобретения, может быть конъюгирован с выявляемой меткой или радиоактивным изотопом.
В пятом аспекте в изобретении предложен конъюгат, содержащий связывающий агент, который связывает изоформу ED-Α, например ED-A, фибронектина, конъюгированный с IL-10, где конъюгат имеет последовательность, представленную в SEQ ID NO: 13. Данный конъюгат в настоящем описании обозначен как F8-IL10. Поскольку вариабельный домен тяжелой цепи (VH) и/или вариабельный домен легкой цепи (VL) данного конъюгата связаны посредством аминокислотного линкера из 5 аминокислот (см. Фиг. 1В), ожидают, что конъюгат образует нековалентные гомодимеры в растворе.
Агент специфического связывания, для применения в изобретении может представлять собой молекулу антитела, связывающую ED-A-изоформу фибронектина и/или ED-Α фибронектина, где антитело содержит одну или более чем одну определяющую комплементарность область (CDR) антитела F8, описанного в данном изобретении. Эти последовательности приведены ниже (см. SEQ ID NO: 1-6). Последовательности CDR антитела F8 также показаны на Фиг. 1.
Агент специфического связывания для применения в изобретении может содержать одну или более чем одну CDR, как описано в изобретении, например CDR3, и возможно также CDR1 и CDR2 с образованием набора CDR.
Предпочтительно агент специфического связывания для применения в изобретении содержит набор CDR H (тяжелой цепи) и/или L (легкой цепи) антитела F8, описанного в изобретении, имеющих десять или менее, например одну, две, три, четыре или пять, аминокислотных замен в пределах раскрытого набора CDR H и/или L.
Замены могут быть потенциально осуществлены в любом остатке в пределах набора CDR и могут в пределах CDR1, CDR2 и/или CDR3.
Агент специфического связывания для применения в изобретении, может включать молекулу антитела, например молекулу человеческого антитела. Агент специфического связывания обычно содержит VH- и/или VL-домен антитела. VH-домены агентов специфического связывания также предложены для применения в изобретении. В пределах каждого из доменов VH и VL находятся определяющие комплементарность области (CDR) и каркасные области (FR). Домен VH содержит набор HCDR, а домен VL содержит набор LCDR. Молекула антитела может содержать домен VH, содержащий VH CDR1, CDR2 и CDR3 и каркасную область. Альтернативно или также она может содержать домен VL, содержащий VL CDR1, CDR2 и CDR3 и каркасную область. Все последовательности VH и VL, последовательности CDR, наборы CDR и наборы HCDR и наборы LCDR, раскрытые в данном изобретении, представляют собой воплощения агента специфического связывания для применения в изобретении. Как описано в данном изобретении, "набор CDR" включает CDR1, CDR2 и CDR3. Таким образом, набор HCDR относится к HCDR1, HCDR2 и HCDR3, а набор LCDR относится к LCDR1, LCDR2 и LCDR3. Если не указано иное, "набор CDR" включает HCDR и LCDR.
Агент специфического связывания для применения в изобретении может содержать VH-домен антитела, содержащий определяющие комплементарность области HCDR1, HCDR2 и HCDR3 и каркасную область, где HCDR1 представляет собой SEQ ID NO: 1, и где, возможно, HCDR2 представляет собой SEQ ID NO: 2, и/или HCDR3 представляет собой SEQ ID NO: 3.
В типичном случае домен VH спарен с доменом VL с обеспечением антигенсвязывающего сайта антитела, хотя, как дополнительно обсуждается ниже, для связывания антигена можно использовать только один домен VH или домен VL. Таким образом, агент специфического связывания для применения в изобретении может дополнительно содержать домен VL антитела, содержащий определяющие комплементарность области LCDR1, LCDR2 и LCDR3 и каркасную область, где LCDR1 представляет собой SEQ ID NO: 4, и где, возможно, LCDR2 представляет собой SEQ ID NO: 5 и/или LCDR3 представляет собой SEQ ID NO: 6.
Агент специфического связывания для применения в изобретении может предпочтительно содержать молекулу антитела к ED-Α фибронектина, содержащую домен VH и домен VL, где домен VH содержит каркасную область и набор определяющих комплементарность областей HCDR1, HCDR2 и HCDR3, и где домен VL содержит определяющие комплементарность области LCDR1, LCDR2 и LCDR3 и каркасную область, и где:
HCDR1 имеет аминокислотную последовательность SEQ ID NO: 1;
HCDR2 имеет аминокислотную последовательность SEQ ID NO: 2;
HCDR3 имеет аминокислотную последовательность SEQ ID NO: 3;
LCDR1 имеет аминокислотную последовательность SEQ ID NO: 4;
LCDR2 имеет аминокислотную последовательность SEQ ID NO: 5; и
LCDR3 имеет аминокислотную последовательность SEQ ID NO: 6.
Одна или более чем одна CDR или набор CDR антитела можно прививать на каркасную область (например человеческую каркасную область) с получением молекулы антитела для применения в изобретении. Каркасные области могут содержать человеческие последовательности генного сегмента эмбрионального типа. Таким образом, каркасной области может быть возвращена последовательность эмбриональной линии, в силу чего один или более чем один остаток в пределах каркасной области изменяют для совпадения с остатками в эквивалентном положении в наиболее подобной человеческой каркасной области эмбрионального типа. Агент специфического связывания для применения в изобретении может представлять собой выделенную молекулу антитела, имеющую домен VH, содержащий набор HCDR в человеческой каркасной области эмбрионального типа, например DP47. Обычно агент специфического связывания также имеет домен VL, содержащий набор LCDR, например, в человеческой каркасной области эмбрионального типа. Человеческая каркасная область эмбрионального типа домена VL может представлять собой DPK22.
Домен VH для применения в изобретении может предпочтительно иметь аминокислотную последовательность SEQ ID NO: 7, представляющую собой домен VH антитела F8. Домен VL для применения в изобретении может предпочтительно иметь аминокислотную последовательность SEQ ID NO: 8, представляющую собой домен VL антитела F8 дикого типа.
Агент специфического связывания для применения в изобретении может представлять собой или содержать одноцепочечный Fv (scFv), содержащий домен VH и домен VL, соединенные через пептидный линкер. Специалист в данной области техники может выбрать соответствующую длину и последовательность линкера, например, по меньшей мере 5 или по меньшей мере 10 аминокислот в длину, вплоть до примерно 15, вплоть до примерно 20 или вплоть до примерно 25 аминокислот в длину. Линкер может иметь аминокислотную последовательность GGSGG (SEQ ID NO: 9).
Агент специфического связывания может представлять собой диатело, представляющее собой поливалентный или мультиспецифический фрагмент, сконструированный путем слияния генов (WO 94/13804; Holliger et al. (1993а), Proc. Natl. Acad. Sci. USA 90 6444-6448).
Предпочтительно агент специфического связывания представляет собой scFv, образующий (стабильные) нековалентные гомодимеры в растворе. Например, как антитело F8, так и конъюгат F8-IL10, раскрытые в данном изобретении, включают scFv, который, как ожидают, образует (стабильные) нековалентные гомодимеры в растворе.
Одноцепочечный Fv (scFv) может содержаться внутри мини-иммуноглобулина или малого иммунопротеина (SIP), например, как описано в Li et al., (1997), Protein Engineering, 10: 731-736. SIP может содержать молекулу scFv, слитую с доменом СН4 секреторной изоформы IgE человека IgE-S2 (εS2-СН4; Batista et al., (1996), J. Exp. Med., 184: 2197-205), образуя гомодимерную мини-иммуноглобулиновую молекулу антитела.
Альтернативно агент специфического связывания для применения в изобретении может содержать антигенсвязывающий сайт внутри молекулы, не являющейся антителом, обычно обеспечиваемый одной или более чем одной CDR, например, набор CDR в белковом остове, не являющемся антителом. Агенты специфического связывания, включающие молекулы, не являющиеся антителом, и молекулы антитела, раскрыты более подробно в другом разделе данного изобретения.
Агент специфического связывания для применения в настоящем изобретении может представлять собой молекулу антитела, содержащую домен VH антитела F8, представленный в SEQ ID NO: 7, и/или домен VL антитела F8, представленный в SEQ ID NO: 8. Агент специфического связывания для применения в настоящем изобретении может представлять собой молекулу антитела, содержащую последовательность, представленную в SEQ ID NO: 11. Агент специфического связывания, конъюгированный с IL-10, по настоящему изобретению может содержать последовательность, представленную в SEQ ID NO: 13.
Агент специфического связывания для применения в настоящем изобретении может также содержать одну или более чем одну, например все шесть, CDR анти-ED-A антител Н1, В2, С5, D5, Е5, С8, F1, В7, Е8 или G9 или их варианты либо домены VH и/или VL анти-ED-A антител Н1, В2, С5, D5, Е5, С8, F1, В7, Е8 или G9 или их варианты. Последовательности CDR и последовательности доменов VH и VL этих антител раскрыты в WO 2010/078950.
Подходящий вариант для применения в настоящем изобретении содержит антигенсвязывающий сайт антитела, содержащий домен VH и домен VL антитела F8, описанного в данном изобретении, где остаток лейцина (L) в положении 5 домена VH, представленного как SEQ ID NO: 7, заменен остатком валина (V) и/или остаток аргинина (R) в положении 18 домена VL, представленного как SEQ ID NO: 8, заменен остатком лизина (K).
Эти и другие аспекты изобретения более подробно раскрыты ниже.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1А показана аминокислотная последовательность тяжелой цепи (VH) анти-ED-A антитела F8 (SEQ ID NO: 7). Аминокислотная последовательность CDR1 тяжелой цепи (SEQ ID NO: 1) анти-ED-A антитела F8 подчеркнута. Аминокислотная последовательность CDR2 тяжелой цепи (SEQ ID NO: 2) анти-ED-A антитела F8 показана курсивом и подчеркнута. Аминокислотная последовательность CDR3 тяжелой цепи (SEQ ID NO: 3) анти-ED-A антитела F8 показана полужирным шрифтом и подчеркнута. На Фиг. 1В показана аминокислотная последовательность линкерной последовательности анти-ED-A антитела F8 между доменами VH и VL (SEQ ID NO: 9). На Фиг. 1С показаны аминокислотные последовательности легкой цепи (VL) (SEQ ID NO: 8) анти-ED-A антитела F8. Аминокислотная последовательность CDR1 легкой цепи (SEQ ID NO: 4) анти-ED-A антитела F8 подчеркнута. Аминокислотная последовательность CDR2 легкой цепи (SEQ ID NO: 5) анти-ED-A антитела F8 показана курсивом и подчеркнута. Аминокислотная последовательность CDR3 легкой цепи (SEQ ID NO: 6) анти-ED-A антитела F8 показана жирным шрифтом и подчеркнута. На Фиг. 1D показана аминокислотная последовательность линкера между антителом F8 и IL-10, когда антитело конъюгировано с IL-10. На Фиг. 1Е показана аминокислотная последовательность человеческого IL-10.
На Фиг. 2 показаны результаты авторадиографии ободочной кишки от мышей с IBD и от здоровых мышей. Ободочные кишки собирали и экспонировали с помощью системы скрининга изображений на люминесцентном фосфорном покрытии (Molecular Dynamics) в течение 24 часов и визуализировали с помощью прибора Storm 860. Дорожка 1: ободочная кишка, взятая через 6 ч после инъекции от группы 0 (здоровая мышь); Дорожка 2: ободочная кишка, взятая через 6 ч после инъекции от группы 2 (мышь с IBD); Дорожка 3: ободочная кишка, взятая через 24 ч после инъекции от группы 0 (здоровая мышь); Дорожка 4: ободочная кишка, взятая через 24 ч после инъекции от группы 2 (мышь с IBD).
На Фиг. 3 показано биораспределение 125I-F8-IL10 у здоровых или больных мышей. Диаграммы показывают биораспределение 125I-F8-IL10 у здоровых и больных мышей через 6 часов после инъекции (А), через 24 часа после инъекции (В) и через 96 часов после инъекции (С). Через 96 часов видно преимущественное накопление 125I-F8-IL10 в ободочной кишке и в мезентериальных лимфатических узлах (L.N.) больных мышей по сравнению со здоровыми мышами. Последовательность конъюгата F8-IL10, используемого в этих экспериментах, представлена в SEQ ID NO: 13.
На Фиг. 4 показаны уровни цитокинов у мышей, которым вводили F8-IL10. На верхней диаграмме представлены уровни цитокинов в сыворотке здоровых мышей (вода), больных мышей, которые не получали препарат (3% декстрансульфат натрия (DSS)), больных мышей, которые получали антитело F8 в формате малого иммунопротеина (F8SIP), больных мышей, которые получали F8-IL10 (F8-IL10). Приведены уровни следующих цитокинов (выраженные в пикограммах (пг) белка на мл сыворотки): интерлейкина 1β (IL1-b), интерлейкина 12 (IL-12p70), интерферона γ (IFNγ) и интерлейкина 6 (IL6).
На Фиг. 5 показаны уровни цитокинов у мышей, которым вводили F8-IL10. На верхней диаграмме представлены уровни цитокинов в сыворотке здоровых мышей (вода), больных мышей, которые не получали препарат (3% DSS), больных мышей, которые получали антитело F8 в формате малого иммунопротеина (F8SIP), больных мышей, которые получали F8-IL10 (F8-IL10). Приведены уровни следующих цитокинов (выраженные в пикограммах (пг) белка на мл сыворотки): кератиноцитарного хемокина (KC), интерлейкина 10 (IL10) и фактора некроза опухоли альфа (TNFa).
На Фиг. 6 показан гистохимический анализ образцов ткани ободочной кишки пациентов, пораженной неспецифическим язвенным колитом и болезнью Крона, идентифицированных с антителом F8 в формате SIP и с фактором фон Виллебранда. Рисунок окрашивания, наблюдаемый с антителом F8 и с фактором фон Виллебранда показывает, что F8 окрашивает вновь образованные кровеносные сосуды, но не окрашивает нормальные сосуды у пациентов, страдающих неспецифическим язвенным колитом и болезнью Крона. Фактор фон Виллебранда обычно используют в качестве маркера нормальных кровеносных сосудов.
На Фиг. 7 показан гистохимический анализ образцов ткани ободочной кишки пациентов, пораженной неспецифическим язвенным колитом и болезнью Крона (справа), и непораженных ободочных кишок (слева). Рисунок окрашивания, наблюдаемый с антителом F8, показывает, что F8 более интенсивно окрашивает вновь образованные кровеносные сосуды в ободочной кишке, пораженной заболеванием.
ТЕРМИНОЛОГИЯ
Фибронектин
Фибронектин представляет собой антиген, подвергаемый альтернативному сплайсингу, и известен ряд альтернативных изоформ фибронектина, описанных в другом разделе настоящего изобретения. Экстра-домен A (EDA или ED-Α) также известен как ED, повтор А экстра-типа III (EIIIA) или EDI. Последовательность человеческого ED-Α опубликована Kornblihtt et al. (1984), Nucleic Acids Res. 12, 5853-5868 и Paolella et al. (1988), Nucleic Acids Res. 16, 3545-3557. Последовательность ED-A человека также доступна в базе данных SwissProt как аминокислоты 1631-1720 (фибронектин типа III 12; экстра-домен 2) аминокислотной последовательности, депонированной под номером доступа Р02751. Последовательность мышиного ED-Α доступна в базе данных SwissProt как аминокислоты 1721-1810 (фибронектин типа III 13; экстра-домен 2) аминокислотной последовательности, депонированной под номером доступа Р11276.
Изоформа ED-Α фибронектина (A-FN) содержит экстра-домен A (ED-A). Последовательность человеческого A-FN может быть выведена из соответствующей последовательности предшественника человеческого фибронектина, доступной в базе данных SwissProt под номером доступа Р02751. Последовательность мышиного A-FN может быть выведена из соответствующей последовательности предшественника мышиного фибронектина, доступной в базе данных SwissProt под номером доступа Р11276. A-FN может представлять собой человеческую изоформу ED-A фибронектина. ED-Α может представлять собой экстра-домен А человеческого фибронектина.
ED-Α представляет собой последовательность из 90 аминокислот, встроенную в фибронектин (FN) в результате альтернативного сплайсинга, и локализована между доменом 11 и 12 FN (Borsi et al., 1987, J. Cell Biol., 104, 595-600). В основном ED-A отсутствует в плазматической форме FN, но присутствует в большом количестве в процессе эмбриогенеза, ремоделирования ткани, фиброза, трансплантации сердца и роста солидной опухоли.
Альтернативный сплайсинг
Альтернативный сплайсинг относится к встречаемости различных паттернов сплайсинга первичного РНК-транскрипта ДНК с образованием различных мРНК. После эксцизии интронов отбор может определить, какие из экзонов сплайсируются вместе с образованием мРНК. Альтернативный сплайсинг приводит к образованию различных изоформ, содержащих различные экзоны и/или различное число экзонов. Например, одна изоформа может включать дополнительную аминокислотную последовательность, соответствующую одному или более чем одному экзону, которая может содержать один или более чем один домен. Агент специфического связывания
Данный термин описывает один агент из пары молекул, специфически связывающихся друг с другом. Агенты пары специфического связывания могут иметь природное происхождение, либо могут быть полностью или частично получены синтетическим путем. Один агент из пары молекул имеет область на его поверхности, либо полость, связывающуюся с определенной пространственной и полярной организацией другого агента из пары молекул, и, следовательно, комплементарной этому агенту. Примерами являются следующие типы пар связывания: антиген-антитело, биотин-авидин, гормон-рецептор гормона, рецептор-лиганд, фермент-субстрат. Настоящее изобретение относится к реакциям типа антиген-антитело.
Агент специфического связывания обычно содержит молекулу, имеющую антигенсвязывающий сайт. Например, агент специфического связывания может представлять собой молекулу антитела или белок, не являющийся антителом, который содержит антигенсвязывающий сайт. Агент специфического связывания, относящийся к данному изобретению, предпочтительно представляет собой молекулу антитела.
Антигенсвязывающий сайт может обеспечиваться за счет расположения определяющих комплементарность областей (CDR) на остове белка, не являющегося антителом, такого как фибронектин или цитохром В и т.д. (Haan & Maggos, (2004), BioCentury, 12(5): А1-А6; Koide et al., (1998), Journal of Molecular Biology, 284: 1141-1151; Nygren et al., (1997), Current Opinion in Structural Biology, 7: 463-469), либо за счет рандомизации или мутирования аминокислотных остатков петли в пределах белкового остова для придания связывающей специфичности к желаемой мишени. Подробный обзор остовов для конструирования новых связывающих сайтов в белках приведен в статье Nygren et al. (1997) (Current Opinion in Structural Biology, 7: 463-469). Миметики белкового остова антитела раскрыты в документе WO/0034784, в котором авторами изобретения раскрыты белки (миметики антител), содержащие домен фибронектина типа III, имеющий по меньшей мере одну рандомизированную петлю. Подходящий остов, в который можно прививать одну или более чем одну CDR, например набор HCDR, может обеспечивать любой доменный элемент суперсемейства иммуноглобулиновых генов. Остов может представлять собой человеческий или нечеловеческий белок человека. Преимущество остова белка, не являющегося антителом, состоит в том, что он может обеспечивать антигенсвязывающий сайт в молекуле остова, являющейся меньшей по размеру и/или более простой в получении, чем по меньшей мере некоторые молекулы антител. Малый размер связывающего агента может придавать полезные физиологические свойства, такие как способность к проникновению в клетки, к глубокому проникновению в ткани или к достижению мишени внутри других структур, либо к связыванию внутри полостей белка антигена-мишени. Обзор применения антигенсвязывающих сайтов в остовах белка, не являющегося антителом, приведен в статье Wess, 2004, In: BioCentury, The Bernstein Report on BioBusiness, 12(42), A1-A7. Типичными являются белки, имеющие стабильный скелет и одну или более чем одну вариабельную петлю, в которых аминокислотную последовательность этой петли или петель подвергают специфичному или случайному мутированию для создания антигенсвязывающего сайта, который связывает антиген-мишень. Такие белки включают IgG-связывающие домены белка А из S. aureus, трансферрин, тетранектин, фибронектин (например 10-й домен фибронектина типа III) и липокалины. Другие подходы включают синтетические "микротела" (Selecore GmbH), основанные на циклотидах, представляющих собой малые белки, имеющие внутримолекулярные дисульфидные связи.
Кроме последовательностей антитела и/или антигенсвязывающего сайта, агент специфического связывания для применения в настоящем изобретении может содержать другие аминокислоты, например, образующие пептид или полипептид, такой как свернутый домен, или для придания молекуле другой функциональной характеристики в дополнение к способности связывать антиген. Связывающие агенты для применения в изобретении могут нести выявляемую метку или могут быть конъюгированы с токсином, молекулой, проявляющей иммуносупрессивное или противовоспалительное действие, либо с нацеливающей группировкой или ферментом (например, посредством пептидильной связи или линкера). Предпочтительно связывающие агенты для применения в изобретении конъюгированы с интерлейкином 10.
Например, связывающий агент может содержать каталитический сайт (например, в ферментативном домене), а также антигенсвязывающий сайт, связывающийся с антигеном и, следовательно, нацеливающий каталитический сайт на антиген. Каталитический сайт может ингибировать биологическую функцию антигена, например, посредством расщепления.
Хотя, как было отмечено, CDR могут находиться на остовах, не являющихся антителом, структура, предназначенная для того, чтобы нести CDR или набор CDR, как правило, представляет собой последовательность тяжелой или легкой цепи антитела либо ее существенный участок, в котором CDR или набор CDR расположены в положении, соответствующем CDR или набору CDR встречающихся в природе вариабельных доменов VH и VL антитела, кодируемых перегруппированными иммуноглобулиновыми генами. Структуры и локализации вариабельных доменов иммуноглобулина могут быть определены со ссылкой на книгу Kabat et al. (1987) (Sequences of Proteins of Immunological Interest. 4th Edition. US Department of Health and Human Services) и ее переиздания, доступную в настоящее время в Интернете (на сайте immuno.bme.nwu.edu или в поиске "Kabat" с использованием любой поисковой системы).
Подразумевают, что область CDR или CDR указывает на гипервариабельные области тяжелых и легких цепей иммуноглобулина, как определено Kabat et al. (1987) Sequences of Proteins of Immunological Interest, 4th Edition, US Department of Health and Human Services (Kabat et al., (1991a), Sequences of Proteins of Immunological Interest, 5th Edition, US Department of Health and Human Services, Public Service, NIH, Washington, и последующие издания). Антитело обычно содержит 3 CDR тяжелой цепи и 3 CDR легкой цепи. Термин "CDR" или "области CDR" используют в данном изобретении для указания соответственно случаю одной или нескольких из этих областей или даже всех этих областей, которые содержат большую часть аминокислотных остатков, ответственных за связывание по сродству антитела к антигену или к эпитопу, который он распознает.
Среди шести коротких последовательностей CDR третий CDR тяжелой цепи (HCDR3) имеет более высокую вариабельность по размеру (более высокое разнообразие по существу вследствие механизмов группировки генов, которые вызывают его). Он может быть настолько коротким, как 2 аминокислоты, хотя самый длинный известный размер составляет 26. Функционально HCDR3 отчасти играет роль в определении специфичности антитела (Segal et al., (1974), PNAS, 71: 4298-4302; Amit et al., (1986), Science, 233: 747-753; Chothia et al., (1987), J. Mol. Biol., 196: 901-917; Chothia et al., (1989), Nature, 342: 877-883; Caton et al., (1990), J. Immunol., 144: 1965-1968; Sharon et al., (1990a), PNAS, 87: 4814-4817; Sharon et al., (1990b), J. Immunol., 144: 4863-4869; Kabatetal., (1991b), J. Immunol., 147: 1709-1719).
Молекула антитела
Данный термин описывает иммуноглобулин, либо природный, либо полученный частично или полностью синтетическим путем. Этот термин также относится к любому полипептиду или белку, содержащему антигенсвязывающий сайт антитела. Должно быть понятно, что изобретение не относится к антителам в природной форме, то есть они не находятся в их природном окружении, но их можно выделить или получить путем очистки из природных источников, либо получить иначе путем генетической рекомбинации или путем химического синтеза, и они могут, таким образом, содержать неприродные аминокислоты, как описано ниже. Фрагменты антител, содержащие антигенсвязывающий сайт антитела, включают, но не ограничены ими, такие молекулы антитела, как Fab, Fab', Fab'-SH, scFv, Fv, dAb, Fd; и диатела.
Чтобы получить другие антитела или химерные молекулы, связывающие антиген-мишень, можно брать моноклональные и другие антитела и применять методы технологии рекомбинантных ДНК. Такие методы могут включать введение ДНК, кодирующей вариабельную область иммуноглобулина или CDR антитела, в константные области или константные области плюс каркасные области другого иммуноглобулина. См., например, ЕР-А-184187, GB 2188638 А или ЕР-А-239400, а также большое количество более поздней литературы. Гибридому или другую клетку, продуцирующую антитело, можно подвергать генетической мутации или другим изменениям, которые могут изменять или не изменять связывающую специфичность полученных антител.
Поскольку антитела могут быть модифицированы разнообразными путями, термин "молекула антитела" следует истолковывать как охватывающий любые связывающие агент или вещество, имеющие антигенсвязывающий сайт антитела необходимой специфичности и/или связывающееся с антигеном. Таким образом, данный термин включает фрагменты и производные антител, включающие любой полипептид, содержащий антигенсвязывающий сайт антитела, либо природный, либо полностью или частично синтетический. Таким образом, в этот термин включены химерные молекулы, содержащие антигенсвязывающий сайт антитела или его эквивалент, слитый с другим полипептидом (например, имеющим происхождение из другого вида или принадлежащим к другому классу или подклассу антител). Клонирование и экспрессия химерных антител раскрыты в документах ЕР-А-0120694 и ЕР-А-0125023, а также в большом количестве более поздней литературы.
Дополнительные методы, доступные в области инженерии антител, дали возможность выделить человеческие и гуманизированные антитела. Например, человеческие гибридомы могут быть получены, как описано в книге Kontermann & Dubel (2001), S, Antibody Engineering, Springer-Verlag New York, LLC; ISBN: 3540413545. Фаговый дисплей, являющийся другим разработанным методом получения связывающих агентов, подробно описан во многих публикациях, таких как документ WO 92/01047 (дополнительно обсуждаемый ниже) и следующие патенты США: US 5969108, US 5565332, US 5733743, US 5858657, US 5871907, US 5872215, US 5885793, US 5962255, US 6140471, US 6172197, US 6225447, US 6291650, US 6492160, US 6521404 и Kontermann & Dubel (2001), S, Antibody Engineering, Springer-Verlag New York, LLC; ISBN: 3540413545. Для выделения человеческих антител можно использовать трансгенных мышей, у которых гены мышиного антитела инактивированы и функционально заменены генами человеческого антитела, при этом другие агенты иммунной системы мыши остаются интактными (Mendez et al., (1997), Nature Genet, 15(2): 146-156).
Синтетические молекулы антитела могут быть созданы путем экспрессии с генов, образованных с помощью олигонуклеотидов, синтезированных и собранных внутри подходящих экспрессионных векторов, например, как описано Knappik et al. (2000) J. Mol. Biol. 296, 57-86 или Krebs et al. (2001) Journal of Immunological Methods, 254 67-84.
Показано, что фрагменты полноразмерного антитела могут выполнять функцию связывания антигенов. Примерами связывающих фрагментов являются следующие фрагменты: (1) Fab-фрагмент, состоящий из доменов VL, VH, CL и СН1; (2) Fd-фрагмент, состоящий из доменов VH и СН1; (3) Fv-фрагмент, состоящий из доменов VL и VH одного антитела; (4) dAb-фрагмент (Ward et al. (1989) Nature 341, 544-546; McCafferty et al. (1990) Nature, 348, 552-554; Holt et al. (2003) Trends in Biotechnology 21, 484-490), состоящий из домена VH или домена VL; (5) выделенные области CDR; (6) F(ab')2-Фрагменты, представляющие собой бивалентный фрагмент, содержащий два связанных Fab-фрагмента; (7) одноцепочечные молекулы Fv (scFv), где домен VH и домен VL связаны посредством пептидного линкера, который дает возможность для ассоциации этих двух доменов с образованием антигенсвязывающего сайта (Bird et al. (1988) Science, 242, 423-426; Huston et al. (1988) PNAS USA, 85, 5879-5883); (8) биспецифических димеров одноцепочечного Fv (PCT/US 92/09965) и (9) "диател", представляющих собой поливалентные или мультиспецифические фрагменты, конструируемые путем слияния генов (WO 94/13804; Holliger et al. (1993а), Proc. Natl. Acad. Sci. USA 90 6444-6448). Молекулы Fv, scFv или диатела могут быть стабилизированы путем включения дисульфидных мостиков, связывающих домены VH и VL (Reiter et al. (1996), Nature Biotech, 14, 1239-1245). Могут быть также получены минитела, содержащие scFv, соединенный с доменом СНЗ (Ни et al. (1996), Cancer Res., 56(13):3055-61). Другими примерами связывающих фрагментов являются Fab', отличающиеся от Fab-фрагментов присоединением на карбоксильном конце домена СН1 тяжелой цепи нескольких остатков, включая один или более чем один остаток цистеина из шарнирной области антитела, и Fab'-SH, представляющий собой Fab'-фрагмент, в котором остаток(тки) цистеина константных доменов несет(ут) свободную тиольную группу.
Фрагменты антитела для применения в изобретении могут быть получены, начиная с любой из молекул антитела, описанных в данном изобретении, например, с молекул антитела, содержащих домены VH и/или VL или CDR любого из антител, описанных в данном изобретении, такими способами, как расщепление ферментами, такими как пепсин или папаин, и/или путем расщепления дисульфидных мостиков путем химического восстановления. Иным образом, фрагменты антитела по настоящему изобретению могут быть получены методами генетической рекомбинации, подобными методам, известным специалистам в данной области техники, или иначе путем пептидного синтеза с помощью, например, автоматических пептидных синтезаторов, таких как синтезаторы, поставляемые фирмой Applied Biosystems, и т.д., или путем синтеза и экспрессии нуклеиновых кислот.
Функциональные фрагменты антитела согласно настоящему изобретению включают любой функциональный фрагмент, время полувыведения которого увеличивается в результате химической модификации, в частности, путем пэгилирования или путем включения в липосому.
dAb (доменное антитело) представляет собой малый мономерный антигенсвязывающий фрагмент антитела, а именно вариабельную область тяжелой или легкой цепи антитела (Holt et al. (2003) Trends in Biotechnology 21, 484-490). VH dAb встречается в природе у семейства верблюдовых (например верблюда, ламы) и могут быть получены путем иммунизации животного семейства верблюдовых целевым антигеном, выделения антигенспецифичных В-клеток и прямого клонирования генов dAb из индивидуальных В клеток. dAb также могут быть получены в культуре клеток. Их малый размер, хорошая растворимость и температурная стабильность делает их особенно физиологически полезными и подходящими для селекции и созревания аффинности. Связывающий агент по настоящему изобретению может представлять собой dAb, содержащее домен VH или VL, по существу как изложено в данном описании, либо домен VH или VL, содержащий набор CDR, по существу как изложено в данном описании.
Как используют в данном описании, "по существу как изложено" относится к тому, что характеристика(и) релевантных CDR домена VH или VL связывающих агентов, описанных в данном изобретении, либо идентична, либо в высокой степени подобна указанным областям, последовательность которых представлена в данном изобретении. Как описано в данном изобретении, выражение "в высокой степени подобна" по отношению к указанной(ым) области(ям) одного или более чем одного вариабельного домена подразумевает, что в CDR и/или в домене VH или VL могут быть получены аминокислотные замены в количестве от 1 до примерно 5, например от 1 до 4, включая 1-3, либо 1, либо 2, либо 3, либо 4.
Биспецифические или бифункциональные антитела образуют второе поколение моноклональных антител, в которых две различные вариабельные области объединены в одной и той же молекуле (Holliger and Bohlen 1999 Cancer and metastasis rev. 18: 411-419). Их применение продемонстрировано как в области диагностики, так и в области терапии благодаря их способности к рекрутированию новых эффекторных функций или к нацеливанию нескольких молекул на поверхность опухолевых клеток. Если нужно использовать биспецифические антитела, они могут представлять собой традиционные биспецифические антитела, которые могут быть получены разнообразными путями (Holliger et al. (1993b), Current Opinion Biotechnol 4, 446-449), например, получены химическим путем или из гибридных гибридом, либо могут представлять собой любой из биспецифических фрагментов антитела, упомянутых выше. Эти антитела могут быть получены химическими способами (Glennie et al., (1987) J. Immunol. 139, 2367-2375; Repp et al., (1995) J. Hemat. 377-382) или соматическими способами (Staerz U.D. and Bevan M.J. (1986) PNAS 83; Suresh et al. (1986) Method. Enzymol. 121: 210-228), но также методами генной инженерии, которые дают возможность усилить гетеродимеризацию и, таким образом, облегчают процесс очистки искомого антитела (Merchand et al., 1998 Nature Biotech. 16: 677-681). Примеры биспецифических антител включают биспецифические антитела технологии BiTE™, при которой можно использовать связывающие домены двух антител с различной специфичностью и непосредственно сшивать их посредством коротких гибких пептидов. Это объединяет два антитела на одной короткой полипептидной цепи. Диатела и scFv можно конструировать без Fc-области, используя только вариабельные домены, потенциально уменьшая эффекты антиидиотипической реакции.
Биспецифические антитела можно конструировать в виде полноразмерных IgG, в виде биспецифических Fab'2, в виде Fab'ПЭГ(полиэтиленгликоль), в виде диател или также в виде биспецифических scFv. Кроме того, два биспецифических антитела могут быть сшиты с использованием стандартных способов, известных в данной области техники, с образованием тетравалентных антител.
Биспецифические диатела, в противоположность биспецифическим полноразмерным антителам, могут быть также особенно полезны, поскольку их можно легко конструировать и экспрессировать в Е.coli. Диатела (и многие другие полипептиды, такие как фрагменты антител), обладающие соответствующими связывающими специфичностями, можно легко отбирать, используя фаговый дисплей (WO 94/13804) из библиотек. Если одно плечо диатела следует сохранять постоянным, например, со специфичностью, направленной против антигена-мишени, то может быть получена библиотека, где другое плечо варьирует, и отобрано антитело, обладающее соответствующей специфичностью. Биспецифические полноразмерные антитела могут быть получены альтернативными способами инженерии, как описано в статье Ridgeway et al. (1996), Protein Eng., 9, 616-621.
В данной области техники доступны различные способы получения антител против антигена-мишени. Антитела могут представлять собой моноклональные антитела, в частности, человеческого, мышиного, химерного или гуманизированного происхождения, которые могут быть получены в соответствии со стандартными способами, хорошо известными специалистам в данной области техники.
Как правило, для получения моноклональных антител или их функциональных фрагментов, в частности, мышиного происхождения, можно ссылаться на методы, описанные, в частности, в руководстве "Antibodies" (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor N.Y., pp. 726, 1988), или на метод получения из гибридом, описанный в статье Kohler and Milstein, 1975, Nature, 256: 495-497.
Моноклональные антитела могут быть получены, например, из клетки животного, иммунизированного против A-FN или любого из его фрагментов, содержащих эпитоп, распознаваемый этими моноклональными антителами, например фрагмента, содержащего ED-Α или состоящего из него, или пептидного фрагмента ED-A. A-FN или любой из его фрагментов может быть, в частности, получен в соответствии с обычными рабочими методами, путем генетической рекомбинации, начиная с нуклеиново-кислотной последовательности, содержащейся в последовательности кДНК, кодирующей A-FN или его фрагмент, путем пептидного синтеза, начиная с последовательности аминокислот, содержащейся в пептидной последовательности A-FN и/или его фрагмента.
Моноклональные антитела могут быть очищены, например, на аффинной колонке, на которой предварительно иммобилизован A-FN или любой из его фрагментов, содержащий эпитоп, распознаваемый данными моноклональными антителами, например фрагмент, содержащий ED-Α или состоящий из него, или пептидный фрагмент ED-Α. Моноклональные антитела могут быть очищены с помощью хроматографии на белке А и/или G, за которой следует или не следует ионообменная хроматография, как таковая нацеленная на устранение остаточных примесей белка, а также ДНК и липополисахарида (ЛПС), за которой следует или не следует эксклюзионная хроматография на сефарозном геле с целью устранения потенциальных агрегатов вследствие присутствия димеров или других мультимеров. Все эти способы можно использовать одновременно или последовательно.
Антигенсвязывающий сайт
Этот термин описывает часть молекулы, связывающуюся с полноразмерным антигеном-мишенью или с его частью и комплементарную им. В молекуле антитела этот термин относится к антигенсвязывающему сайту антитела и содержит часть антитела, связывающуюся с полноразмерным антигеном-мишенью или с его частью и комплементарную им. В случае, когда антиген имеет большой размер, антитело может связываться только с определенной частью антигена, называемой эпитопом. Антигенсвязывающий сайт антитела может обеспечиваться одним или более чем одним вариабельным доменом антитела. Антигенсвязывающий сайт антитела может содержать вариабельную область легкой цепи (VL) антитела и вариабельную область тяжелой цепи (VH) антитела.
Выделенный
Этот термин относится к состоянию, в котором агенты специфического связывания для применения в изобретении или нуклеиновая кислота, кодирующая такие агенты специфического связывания, в целом соответствуют настоящему изобретению. Таким образом, агенты специфического связывания, домены VH и/или VL по настоящему изобретению могут быть предложены в выделенном и/или очищенном виде, например, от их естественной окружающей среды, по существу в чистой или гомогенной форме, или, в случае нуклеиновой кислоты, свободны или по существу свободны от нуклеиновой кислоты или генов, имеющих иное происхождение, чем последовательность, кодирующая полипептид, обладающий необходимой функцией. Выделенные агенты и выделенная нуклеиновая кислота свободны или по существу свободны от вещества, с которыми они ассоциированы в природе, такого как другие полипептиды или нуклеиновые кислоты, с которыми они находятся в их естественной окружающей среде или в окружающей среде, в которой их получают (например в культуре клеток), если такое получение осуществляют с помощью технологии рекомбинантных ДНК, осуществляемой in vitro или in vivo. Агенты специфического связывания и нуклеиновую кислоту можно получать в виде композиции с разбавителями или адъювантами, и, кроме того, их выделяют для практических целей, например, эти агенты обычно смешивают с желатином или с другими носителями, если их используют для покрытия микротитрационных планшетов для применения в иммунологических анализах, или смешивают с фармацевтически приемлемыми носителями или разбавителями при применении в диагностике или в терапии. Агенты специфического связывания могут быть гликозилированы либо в их природном состоянии, либо системами гетерологичных эукариотических клеток (например СНО или NS0 (ЕСАСС 85110503)), или они могут быть (например, если они получены путем экспрессии в прокариотической клетке) негликозилированными.
В изобретении можно также применять гетерогенные препараты, содержащие молекулы антитела. Например, такие препараты могут представлять собой смеси антител с полноразмерными тяжелыми цепями и с тяжелыми цепями, в которых отсутствует С-концевой лизин, имеющими различные степени гликозилирования и/или дериватизированные аминокислоты, например, путем замыкания цикла N-концевой глутаминовой кислоты с образованием остатка пироглутаминовой кислоты.
Один или более чем один агент специфического связывания к антигену, например A-FN, ED-Α фибронектина, может быть получен путем библиотеки агентов специфического связывания в соответствии с изобретением приведения в контакт с антигеном или его фрагментом, например фрагментом, содержащим ED-Α или пептидный фрагмент ED-Α либо состоящим из него, и отбора одного или более чем одного агента специфического связывания из библиотеки, способного к связыванию антигена.
Библиотеку антител можно подвергать скринингу, используя итеративный скрининг колоний на фильтре (ICFS). При ICFS бактерии, содержащие ДНК, кодирующую несколько связывающих специфичностей, выращивают в жидкой среде, и, как только достигнута стадия экспоненциального роста, несколько млрд из них распределяют на подложке для выращивания, состоящей из мембранного фильтра, предварительно обработанного соответствующим образом, который инкубируют до появления полностью конфлюэнтных колоний бактерий. Второй улавливающий субстрат состоит из другого мембранного фильтра, предварительно увлажненного и покрытого желаемым антигеном.
Затем улавливающий мембранный фильтр помещают на поверхность чашки, содержащей подходящую культуральную среду, и покрывают фильтром для выращивания, поверхность которого покрыта колониями бактерий, расположенными сверху. Полученный таким образом сэндвич инкубируют при комнатной температуре в течение приблизительно 16 ч. Таким образом, можно получить экспрессию генов, кодирующих фрагменты антитела scFv, обладающие способностью к растеканию, поэтому эти фрагменты улавливаются при специфичном связывании с антигеном, находящимся на улавливающей мембране. Затем улавливающую мембрану обрабатывают таким образом, чтобы выявить связанные фрагменты антитела scFv с помощью колориметрических методов, обычно применяемых для этой цели.
Положение цветовых пятен на улавливающем фильтре дают возможность вернуться к соответствующим колониям бактерий, присутствующих на мембране для выращивания, и продуцировать уловленные фрагменты антитела. Такие колонии собирают и выращивают, и несколько миллионов из этих бактерий распределяют на новой культуральной мембране, повторяя описанные выше методы. Затем аналогичные циклы проводят до тех пор, пока положительные сигналы на улавливающей мембране не будет соответствовать отдельным положительным колониям, каждая из которых представляет потенциальный источник фрагментов моноклонального антитела, направленного против антигена, использованного при отборе. Метод ICFS раскрыт, например, в документе WO 0246455.
Библиотеку можно также выявлять на частицах или молекулярных комплексах, например воспроизводимых генетических упаковках, таких как частицы бактериофага (например, Т7), или других системах дисплея in vitro, где каждая частица или молекулярный комплекс содержит нуклеиновую кислоту, кодирующую вариабельный домен VH антитела, выявляемый на этой частице или молекулярном комплексе, и, возможно, также выявленный домен VL, если он присутствует. Фаговый дисплей раскрыт в WO 92/01047 и, например, в патентах US: US 5969108, US 5565332, US 5733743, US 5858657, US 5871907, US 5872215, US 5885793, US 5962255, US 6140471, US 6172197, US 6225447, US 6291650, US 6492160 и US 6521404.
После отбора связывающих агентов, способных к связыванию антигена и выявленных на бактериофаге или другой библиотеке частиц или молекулярных комплексов, нуклеиновую кислоту можно отобрать из бактериофага или из другой частицы или молекулярного комплекса, на которых выявлен данный отобранный связывающий агент. Такую нуклеиновую кислоту можно использовать при последующем продуцировании связывающего агента или вариабельного домена VH или VL антитела путем экспрессии с нуклеиновой кислоты, имеющей последовательность, взятую из бактериофага или другой частицы или молекулярного комплекса, на которых выявлен данный отобранный связывающий агент.
Вариабельный домен VH антитела, имеющий аминокислотную последовательность вариабельного домена VH антитела данного отобранного связывающего агента, может быть получен в выделенной форме, как и связывающий агент, содержащий такой домен VH.
Способность к связыванию A-FN или ED-Α фибронектина, либо другого антигена-мишени или изоформы можно дополнительно тестировать, например способность к конкурированию с анти-ED-A антителом F8 за связывание с A-FN или фрагментом A-FN, например ED-Α фибронектина.
Агент специфического связывания для применения в изобретении может специфично связывать A-FN и/или ED-Α фибронектина. Агент специфического связывания по настоящему изобретению может связывать A-FN и/или ED-A фибронектина с таким же сродством, как анти-ED-A антитело F8, например, в формате scFv, или с лучшим сродством. Агент специфического связывания для применения в изобретении может связывать A-FN и/или ED-Α фибронектина с KD 3⋅10-8 M или с более высоким сродством. Предпочтительно агент специфического связывания для применения в изобретении связывает A-FN и/или ED-Α фибронектина с KD 2⋅10-8 M или с более высоким сродством. Более предпочтительно агент специфического связывания для применения в изобретении связывает A-FN и/или ED-Α фибронектина с KD 1,7⋅10-8 M или с более высоким сродством. Еще более предпочтительно агент специфического связывания для применения в изобретении связывает A-FN и/или ED-A фибронектина с KD 1,4⋅10-8 M или с более высоким сродством. Наиболее предпочтительно агент специфического связывания для применения в изобретении связывает A-FN и/или ED-Α фибронектина с KD 3⋅10-9 M или с более высоким сродством.
Агент специфического связывания по настоящему изобретению может связываться с тем же эпитопом на A-FN и/или ED-Α фибронектина, что и анти-ED-A антитело F8.
Агент специфического связывания для применения в изобретении может не проявлять какого-либо значимого связывания с молекулами, отличными от A-FN и/или ED-Α фибронектина. В частности, агент специфического связывания может не связывать другие изоформы фибронектина, например изоформу ED-B и/или изоформу IIICS фибронектина.
Варианты молекул антитела, раскрытых в данном изобретении, можно продуцировать и использовать в настоящем изобретении. Методы, необходимые для получения замен в пределах аминокислотных последовательностей CDR доменов VH или VL антитела, в частности каркасных областей доменов VH и VL, и связывающих агентов, в целом доступны в данной области техники. Можно получать варианты последовательностей, содержащие замены, для которых может быть или не может быть предсказано минимальное или полезное воздействие на активность, и тестировать их на способность к связыванию A-FN и/или ED-A фибронектина и/или на любое другое желаемое свойство.
Варианты аминокислотной последовательности вариабельного домена любого из доменов VH и VL, последовательности которых конкретно раскрыты в данном изобретении, можно использовать в соответствии с настоящим изобретением, как обсуждалось. Конкретные варианты могут включать одно или более чем одно изменение аминокислотной последовательности (добавление, делецию, замену и/или инсерцию аминокислотного остатка), возможно менее чем примерно 20 изменений, менее чем примерно 15 изменений, менее чем примерно 10 изменений или менее чем примерно 5 изменений, возможно 5, 4, 3, 2 или 1. Изменения могут быть получены в одной или более чем одной каркасной области и/или в одной или более чем одной CDR. Эти изменения обычно не приводят в результате к утрате функции, поэтому агент специфического связывания, содержащий измененную таким образом аминокислотную последовательность, может сохранять способность к связыванию A-FN и/или ED-Α фибронектина. Например, он может сохранить такое же связывание в количественном выражении, что и агент специфического связывания, в котором изменение не сделано, например, как измерено в анализе, описанном в данном изобретении. Агент специфического связывания, содержащий измененную таким образом аминокислотную последовательность, может обладать улучшенной способностью к связыванию A-FN и/или ED-A фибронектина. Например, агент специфического связывания, связывающий изоформу ED-Α или ED-Α фибронектина, относящийся к данному изобретению, может содержать домен VH, представленный в SEQ ID NO: 7, и домен VL, представленный в SEQ ID NO: 8, имеющий 10 или менее, например 5, 4, 3, 2 или 1, аминокислотных замен в пределах каркасной области домена VH и/или VL. Такой агент специфического связывания может связывать изоформу ED-A или ED-Α фибронектина с таким же или по существу таким же сродством, что и агент специфического связывания, содержащий домен VH, представленный в SEQ ID NO: 7, и домен VL, представленный в SEQ ID NO: 8, или может связывать изоформу ED-Α или ED-Α фибронектина с более высоким сродством, чем агент специфического связывания, содержащий домен VH, представленный в SEQ ID NO: 7, и домен VL, представленный в SEQ ID NO: 8.
Новые области VH или VL, несущие последовательности, имеющие происхождение из CDR, для применения в изобретении могут быть созданы с использованием случайного мутагенеза одного или более чем одного выбранного гена VH и/или VL для создания мутаций в пределах полноразмерного вариабельного домена. В некоторых воплощениях изобретения получают одну или две аминокислотные замены в пределах полноразмерного вариабельного домена или набора CDR. Другим способом, который можно использовать, является направленный мутагенез областей CDR генов VH или VL.
Как отмечено выше, аминокислотная последовательность CDR, по существу как представлено в данном изобретении, может быть перенесена в качестве CDR в вариабельный домен антитела человека или его существенный участок. Последовательности HCDR3, по существу как представлено в данном изобретении, представляют собой воплощения настоящего изобретения, и, например, каждая из этих последовательностей может быть перенесена в качестве HCDR3 в вариабельный домен тяжелой цепи человека или его существенный участок.
Вариабельные домены, применяемые в изобретении, могут быть получены или иметь происхождение из любого вариабельного домена эмбрионального типа или перегруппированного вариабельного домена, либо могут представлять собой синтетический вариабельный домен, основанный на консенсусных или действительных последовательностях известных человеческих вариабельных доменов. Вариабельный домен может иметь происхождение из нечеловеческого антитела. Последовательность CDR для применения в изобретении (например CDR3) может быть введена в репертуар вариабельных доменов, не содержащих CDR (например CDR3), с использованием технологии рекомбинантных ДНК. Например, авторами Marks et al. (1992) описаны способы получения репертуаров вариабельных доменов антител, в которых используют консенсусные праймеры, направленные на 5-конец области вариабельного домена или смежные с ним, в сочетании с консенсусными праймерами на третью каркасную область генов VH человека с получением репертуара вариабельных доменов VH, не содержащих CDR3. Авторами Marks et al., кроме того, описано, как этот репертуар можно комбинировать с CDR3 конкретного антитела. Используя аналогичные методы, последовательности, имеющие происхождение из CDR3, по настоящему изобретению можно перетасовывать с репертуарами доменов VH или VL, не содержащих CDR3, и перетасованные полноразмерные домены VH или VL объединять с родственным доменом VL или VH с получением связывающих агентов для применения в изобретении. Затем этот репертуар может быть выявлен на подходящей системе-хозяине, такой как система фагового дисплея из WO 92/01047 или любого источника из огромного массива последующей литературы, включая Kay, Winter & McCafferty (1996), и, таким образом, отобраны подходящие связывающие агенты. Репертуар может состоять из любого числа индивидуальных членов, составляющего 104 и выше, например по меньшей мере из 105, по меньшей мере из 106, по меньшей мере из 107, по меньшей мере из 108, по меньшей мере из 109 или по меньшей мере из 1010 членов.
Аналогично, один или более чем один или все три CDR можно прививать в репертуар доменов VH или VL, который затем подвергают скринингу на связывающий агент или связывающие агенты к A-FN и/или ED-Α фибронектина.
Можно использовать одну или более чем одну из HCDR1, HCDR2 и HCDR3 антитела F8 или набор HCDR антитела F8, и/или можно использовать одну или более чем одну из LCDR1, LCDR2 и LCDR3 антитела F8 или набор LCDR антитела F8.
Аналогично можно использовать другие домены VH и VL, наборы CDR и наборы HCDR и/или наборы LCDR, раскрытые в данном изобретении.
A-FN и/или ED-Α фибронектина можно использовать в скрининге на агенты специфического связывания, например, молекулы антитела, для применения в приготовлении лекарственного средства для лечения IBD. Этот скрининг может представлять собой скрининг репертуара, как раскрыто в данном изобретении в другом разделе.
Существенный участок вариабельного домена иммуноглобулина может содержать по меньшей мере три области CDR вместе с находящимися между ними каркасными областями. Этот участок может также содержать по меньшей мере примерно 50% любой из первой и четвертой каркасных областей или их обоих, где эти 50% составляют 50% первой каркасной области с С-конца и 50% четвертой каркасной области с N-конца. Дополнительные остатки на N-конце или на С-конце существенной части вариабельного домена могут представлять собой остатки, в норме не связанные с природными областями вариабельных доменов. Например, конструирование агентов специфического связывания по настоящему изобретению, выполненное методами рекомбинантных ДНК, может привести в результате к введению N- или С-концевых остатков, кодируемых линкерами, введенными для облегчения клонирования или других стадий манипуляций. Другие стадии манипуляций включают введение линкеров для соединения вариабельных доменов, раскрытых в других разделах данного изобретения, с дополнительными белковыми последовательностями, включающими константные области антитела, другие вариабельные домены (например, при получении диател) или выявляемыми/функциональными метками, как более подробно обсуждается в других разделах данного изобретения.
Хотя агенты специфического связывания могут содержать пару доменов VH и VL, в изобретении можно также применять отдельные связывающие домены, основанные на последовательностях либо домена VH, либо домена VL. Известно, что отдельные домены иммуноглобулина, особенно домены VH, способны связывать антигены-мишени определенным образом. Например, см. обсуждение dAb выше.
В случае любых из отдельных связывающих доменов эти домены можно использовать для скрининга на комплементарные домены, способные к образованию двухдоменного связывающего агента, способного к связыванию A-FN и/или ED-Α фибронектина. Это может быть достигнуто способами скрининга фагового дисплея с использованием так называемого иерархического двойного комбинаторного подхода, как раскрыто в WO 92/01047, при котором индивидуальную колонию, содержащую клон Н- или L-цепи, используют для инфицирования полноразмерной библиотеки клонов, кодирующих другую цепь (L или Н), и полученный в результате двухцепочечный связывающий агент отбирают в соответствии с методами фагового дисплея, такими как описано в данной ссылке. Этот метод также раскрыт в Marks, 1992.
Агенты специфического связывания для применения в настоящем изобретении могут дополнительно содержать константные области антитела или их части, например, константные области антитела человека или их части. Например, домен VL может быть присоединен на его С-конце к константным доменам легкой цепи антитела, включая человеческие цепи Сκ или Сλ, например Сλ. Аналогично агент специфического связывания, основанный на домене VH, может быть присоединен на его С-конце к полноразмерной тяжелой цепи иммуноглобулина или к ее части (например к домену СН1), имеющей происхождение из антитела любого изотипа, например, IgG, IgA, IgE и IgM, и любого из подклассов изотипа, в частности IgG1 и IgG4. Любой синтетический или другой вариант константной области, обладающий данными свойствами и стабилизирующий вариабельные области, также полезен в воплощениях настоящего изобретения.
Агенты специфического связывания для применения в изобретении могут быть меченными выявляемой или функциональной меткой. Метка может представлять собой любую молекулу, которая продуцирует сигнал или может быть индуцирована для продуцирования сигнала, включая флуорофоры, радиоактивные метки, ферменты, хемилюминесцентные метки или фотосенсибилизаторы, но не ограничиваясь ими. Таким образом, связывание может быть обнаружено и/или измерено путем обнаружения флуоресценции или люминесценции, радиоактивности, ферментативной активности или поглощения света. Выявляемые метки могут быть присоединены к антителам для применения в изобретении с использованием методов традиционной химии, известных в данной области техники.
Существуют многочисленные способы, с помощью которых метка может продуцировать сигнал, обнаружимый внешними средствами, например, с помощью визуального осмотра, электромагнитного излучения, нагревания и химических реагентов. Эта метка может быть также связана с другим агентом специфического связывания, связывающим антитело для применения в изобретении, или с носителем.
Меченые агенты специфического связывания, например scFv, меченные выявляемой меткой, можно применять в диагностике in vivo, ex vivo или in vitro и/или в терапии.
Например, радиоактивно меченые связывающие агенты (например связывающие агенты, конъюгированные с радиоактивным изотопом), могут применяться в радиодиагностике и радиотерапии. Радиоактивные изотопы, которые можно конъюгировать со связывающим агентом для применения в изобретении, включают такие изотопы, как 94mTc, 99mTc, 186Re, 188Re, 203Pb, 67Ga, 68Ga, 47Sc, 111In, 97Ru, 62Cu, 64Cu, 86Y, 88Y, 90Y, 121Sn, 161Tb, 153Sm, 166Ho, 105Rh, 177Lu, 123I, 124I, 125I, 131I, 18F, 211At и 225Ac. Предпочтительно для диагностических применений (например для ПЭТ (позитронно-эмиссионной томографии)) используют излучатели позитронов, такие как 18F и 124I, или гамма-излучатели, такие как 99mTc, 111In и 123I, тогда как для терапевтических применений предпочтительно используют бета-излучатели, такие как 131I, 90Y и 177Lu. Для терапии можно также применять альфа-излучатели, такие как 211At и 225Ас.
Например, агент специфического связывания для применения в изобретении, меченный выявляемой меткой, можно применять для обнаружения, диагностики или мониторинга IBD у человека или животного.
Агент специфического связывания по настоящему изобретению можно применять для получения диагностического продукта для применения в диагностике IBD.
В настоящем изобретении можно применять конъюгат или продукт слияния связывающего агента для применения в изобретении и молекулы, оказывающей биоцидное, цитотоксическое, иммуносупрессивное или противовоспалительное действие на клетки-мишени в повреждениях, и антитела, направленного против компонента внеклеточного матрикса, присутствующего в таких повреждениях. Например, конъюгированная молекула может представлять собой интерлейкин-10. Такие конъюгаты можно применять терапевтически, например, для лечения IBD, относящегося к настоящему изобретению.
Получение и применение продуктов слияния или конъюгатов агентов специфического связывания с биоцидными или цитотоксическими молекулами описано, например, в документе WO 01/62298.
Агент специфического связывания для применения в изобретении может представлять собой конъюгат (1) молекулы, оказывающей противовоспалительное действие на клетки-мишени посредством клеточного взаимодействия, противовоспалительной молекулы, цитокина, например IL-10, и (2) агента специфического связывания изоформы ED-Α фибронектина и/или ED-Α фибронектина.
Агент специфического связывания для применения в изобретении может представлять собой конъюгат (1) молекулы, оказывающей иммуносупрессивное или противовоспалительное действие, и (2) агента специфического связывания изоформы ED-Α фибронектина и/или ED-Α фибронектина.
Агент специфического связывания для применения в изобретении предпочтительно представляет собой конъюгат (1) интерлейкина-10 (IL10) и (2) агента специфического связывания изоформы ED-Α фибронектина и/или ED-Α фибронектина. Такой агент специфического связывания полезен в аспектах изобретения, раскрытых в данном изобретении в отношении лечения IBD.
В данном изобретении также раскрыт конъюгат (1) молекулы, оказывающей биоцидное или цитотоксическое действие на клетки-мишени посредством клеточного взаимодействия, либо иммуносупрессивное или противовоспалительное действие, и (2) связывающего агента изоформы ED-A фибронектина и/или ED-Α фибронектина. Такой конъюгат предпочтительно включает слитый белок, содержащий биоцидную, цитотоксическую, иммуносупрессивную или противовоспалительную молекулу, и указанный связывающий агент, или, где связывающий агент является двухцепочечным или многоцепочечным, слитый белок, содержащий биоцидную, цитотоксическую, иммуносупрессивную или противовоспалительную молекулу и компонент полипептидной цепи указанного связывающего агента. Предпочтительно связывающий агент представляет собой одноцепочечный полипептид, например одноцепочечную молекулу антитела, такую как scFv.
Конъюгат, относящийся к данному изобретению, может экспрессироваться в виде слитого белка. Таким образом, в изобретении можно применять слитый белок, содержащий иммуносупрессивную или противовоспалительную молекулу и одноцепочечную молекулу антитела Fv.
Иммуносупрессивная или противовоспалительная молекула, оказывающая свое действие на клетки-мишени посредством клеточного взаимодействия, может взаимодействовать непосредственно с клетками-мишенями, может взаимодействовать с мембраносвязанным рецептором на клетке-мишени или возбуждать электрохимический потенциал клеточной мембраны. Предпочтительно молекула представляет собой IL-10.
Предпочтительно молекула, конъюгированная с агентом специфического связывания, представляет собой IL-10.
Как обсуждается ниже, агент специфического связывания для применения в изобретении предпочтительно представляет собой молекулу антитела или содержит антигенсвязывающий сайт антитела. Для удобства агент специфического связывания может представлять собой одноцепочечный полипептид, такой как одноцепочечное антитело. Это дает возможность удобного продуцирования слитого белка, содержащего одноцепочечное антитело и, например, иммуносупрессивную или противовоспалительную молекулу (например интерлейкин-10 или TGF(трансформирующий фактор роста)-бета). Антигенсвязывающий сайт антитела может быть получен путем ассоциации домена VH антитела и домена VL антитела в отдельных полипептидах, например в полноразмерном антителе или во фрагменте антитела, таком как Fab или диатело. Когда агент специфического связывания представляет собой двухцепочечную или многоцепочечную молекулу (например Fab или полноразмерное антитело, соответственно), иммуносупрессивная или противовоспалительная молекула, например, может быть конъюгирована в виде слитого полипептида с одной или более чем одной полипептидной цепью в агенте специфического связывания.
Агент специфического связывания может быть конъюгирован с иммуносупрессивной или противовоспалительной молекулой посредством пептидной связи, то есть в пределах слитого полипептида, содержащего указанную молекулу и агент специфического связывания или компонент его полипептидной цепи (см., например, Trachsel et al.). Другие способы конъюгации включают химическую конъюгацию, в частности, сшивание с применением бифункционального реагента (например, используя руководство DOUBLE-REAGENTS™ Cross-linking Reagents Selection Guide, Pierce).
Предложена также выделенная нуклеиновая кислота, кодирующая агент специфического связывания для применения в настоящем изобретении. Нуклеиновая кислота может содержать ДНК и/или РНК. Нуклеиновая кислота может кодировать CDR или набор CDR, либо домен VH или домен VL, либо антигенсвязывающий сайт антитела, либо молекулу антитела, например scFv или IgG, например IgG1, как определено выше. Нуклеотидные последовательности могут кодировать домены VH и/или VL, раскрытые в данном изобретении.
Кроме того, в данном изобретении описаны конструкции в форме плазмид, векторов, транскрипционных или экспрессионных кассет, содержащих по меньшей мере один полинуклеотид, как описано выше.
Предложена также рекомбинантная клетка-хозяин, содержащая одну или более чем одну конструкцию, как предложено выше. Описана нуклеиновая кислота, кодирующая CDR или набор CDR, либо домен VH или домен VL, либо антигенсвязывающий сайт антитела, либо молекулу антитела, например scFv, или IgG1, или IgG4, как предложено, а также способ получения кодируемого продукта, включающий экспрессию с кодирующей нуклеиновой кислоты. Экспрессия для удобства может быть достигнута путем культивирования в соответствующих условиях рекомбинантных клеток-хозяев, содержащих эту нуклеиновую кислоту. После продуцирования путем экспрессии домен VH или VL, либо агент специфического связывания может быть выделен и/или очищен, используя любой подходящий метод, а затем использован, как целесообразно.
Нуклеиновая кислота может содержать ДНК или РНК и может быть полностью или частично синтетической. Ссылка на нуклеотидную последовательность, представленную в данном изобретении, включает молекулу ДНК с указанной последовательностью, а также включает молекулу РНК с указанной последовательностью, в которой U замещен на Т, если контекст не требует иного.
Описан также способ получения вариабельного домена VH антитела, включающий индукцию экспрессии с кодирующей нуклеиновой кислоты. Такой способ может включать культивирование клетки-хозяина в условиях продуцирования данного вариабельного домена VH антитела.
Способ получения может включать стадию выделения и/или очистки продукта. Способ получения может включать включение приготовление продукта в виде композиции, содержащей по меньшей мере один дополнительный компонент, такой как фармацевтически приемлемый эксципиент.
Системы клонирования и экспрессии полипептида в ряде различных клеток-хозяев хорошо известны. Подходящие клетки-хозяева включают бактерий, клетки млекопитающих, растительные клетки, мицелиальные грибы, дрожжевые и бакуловирусные системы и трансгенные растения и животных. Экспрессия антител и фрагментов антител в прокариотических клетках хорошо разработана в данной области техники. В качестве обзора см., например, Plückthun (1991), Bio/Technology 9: 545-551. Обычным бактериальным хозяином является Е.coli.
Экспрессия в эукариотических клетках в культуре также доступна специалистам в данной области техники в качестве возможного варианта получения агента специфического связывания, например, Chadd et al. (2001), Current Opinion in Biotechnology 12: 188-194); Andersen et al. (2002) Current Opinion in Biotechnology 13: 117; Larrick & Thomas (2001) Current Opinion in Biotechnology 12: 411-418. Линии клеток млекопитающих, доступные в данной области техники для экспрессии гетерологичного полипептида, включают клетки китайского хомячка (СНО), клетки HeLa, клетки почки новорожденного хомяка, клетки меланомы мыши NS0, клетки миеломы крысы YB2/0, клетки эмбриональных почек человека, клетки эмбриональной сетчатки человека и многие другие.
Могут быть выбраны или сконструированы подходящие векторы, содержащие соответствующие регуляторные последовательности, включающие промоторные последовательности, терминирующие последовательности, последовательности полиаденилирования, энхансерные последовательности, маркерные гены и другие последовательности, являющиеся целесообразными. Векторы могут представлять собой плазмиды, например фагмиду, или быть вирусными, например фаговыми, как целесообразно. Дополнительные подробности см., например, в руководстве Sambrook & Russell (2001) Molecular Cloning: a Laboratory Manual: 3rd edition, Cold Spring Harbor Laboratory Press. Многие известные методы и протоколы манипуляций с нуклеиновыми кислотами, например, при получении нуклеиново-кислотных конструкций, мутагенезе, секвенировании, введении ДНК в клетки и экспрессии генов, а также анализ белков, подробно описаны в руководстве Ausubel et al. (1999) 4th eds., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, John Wiley & Sons.
Клетка-хозяин может содержать нуклеиновую кислоту, как описано в данном изобретении. Такая клетка-хозяин может находиться in vitro и может находиться в культуре. Такая клетка-хозяин может находиться in vivo. Присутствие клетки-хозяина in vivo может дать возможность внутриклеточной экспрессии связывающего агента для применения в настоящем изобретении в виде "интрател" или внутриклеточных антител. Интратела можно применять для генотерапии.
Описан также способ, включающий введение нуклеиновой кислоты, описанной в данном изобретении, в клетку-хозяина. При этом введении можно применять любой подходящий метод. Для эукариотических клеток подходящие методы могут включать кальцийфосфатную трансфекцию, ДЭАЭ(диэтиламиноэтил)-декстран, электропорацию, трансфекцию, опосредованную липосомами, и трансдукцию с использованием ретровируса или другого вируса, например осповакцины, или бакуловируса для клеток насекомых. При введении нуклеиновой кислоты в клетку-хозяина, в частности в эукариотическую клетку, можно использовать систему на основе вируса или плазмиды. Плазмидную систему можно поддерживать в эписомном состоянии, либо встраивать в клетку-хозяина или в искусственную хромосому. Это встраивание может происходить посредством либо случайной, либо направленной интеграции одной или более чем одной копии в один локус или во множественные локусы. Для бактериальных клеток подходящие методы могут включать трансформацию с помощью хлорида кальция, электропорацию и трансфекцию с использованием бактериофага.
За введением может следовать индукция или предоставление возможности для экспрессии с нуклеиновой кислоты, например, путем культивирования клеток-хозяев в условиях экспрессии генов. Очистка экспрессированного продукта может быть достигнута способами, известными специалистам в данной области техники.
Нуклеиновая кислота может быть интегрирована в геном (например в хромосому) клетки-хозяева. Интеграции может способствовать включение последовательностей, стимулирующих рекомбинацию с геномом, в соответствии со стандартными методами.
Описан также способ, включающий использование конструкции, как указано выше, в экспрессионную систему для экспрессии агента специфического связывания или полипептида, как описано выше.
Агенты специфического связывания для применения в настоящем изобретении предназначены для применения в способах диагностики или лечения субъектов-людей или животных, например человека. Агенты специфического связывания для применения в изобретении можно применять в диагностике или лечении IBD.
Соответственно, в изобретении предложены способы лечения, включающие введение агента специфического связывания, как он описан, фармацевтические композиции, содержащие такой агент специфического связывания, и применение такого агента специфического связывания в изготовлении лекарственного средства для введения, например, в способе получения лекарственного средства или фармацевтической композиции, включающем приготовление агента специфического связывания в виде композиции с фармацевтически приемлемым эксципиентом. Фармацевтически приемлемые носители хорошо известны и адаптированы специалистом в данной области техники в зависимости от природе и от способа введения выбранного(ых) активного(ых) соединения(й).
Агенты специфического связывания для применения в настоящем изобретении обычно вводят в форме фармацевтической композиции, которая может содержать по меньшей мере один ингредиент в дополнение к агенту специфического связывания. Таким образом, фармацевтическая композиция, описанная в данном изобретении и предназначенная для применения в соответствии с настоящим изобретением, может содержать в дополнение к активному ингредиенту фармацевтически приемлемый эксципиент, носитель, буфер, стабилизатор или другие вещества, известные специалистам в данной области техники. Такие вещества должны быть нетоксичными и не должны препятствовать эффективности активного ингредиента. Точная природа носителя или другого вещества зависит от пути введения, который может быть пероральным, ингаляционным или путем инъекции, например внутривенным.
Фармацевтические композиции для перорального введения, такие как, например, нанотела и т.д., также рассматриваются в настоящем изобретении. Такие пероральные композиции могут находиться в форме таблетки, капсулы, порошка, в жидкой или полутвердой форме. Таблетка может содержать твердый носитель, такой как желатин, или адъювант. Жидкие фармацевтические композиции, как правило, содержат жидкий носитель, такой как вода, нефтепродукты, животные или растительные масла, минеральное масло или синтетическое масло. Можно включать физиологический солевой раствор, декстрозу или раствор другого сахарида или гликоли, такие как этилен гликоль, пропиленгликоль или полиэтиленгликоль.
Для внутривенной инъекции или инъекции в участок поражения активный ингредиент находится в форме парентерально приемлемого водного раствора, который является апирогенным и имеет подходящее значение рН, подходящую изотоничность и стабильность. Специалисты в данной области техники способны приготовить подходящие растворы, используя, например, такие изотонические растворители, как хлорид натрия для инъекций, раствор Рингера для инъекций, раствор Рингера для инъекций с лактатом. Консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки можно использовать по необходимости. Многие способы приготовления фармацевтических композиций известны специалистам в данной области техники. См., например, Robinson ed., Sustained and Controlled Release Drug Delivery Systems, Marcel Dekker, Inc., New York, 1978.
Композицию можно вводить отдельно или в комбинации с другими терапиями, одновременно или последовательно или в виде комбинированного препарата с другим терапевтическим агентом или агентами в зависимости от состояния, подлежащего лечению.
Агент специфического связывания для применения в настоящем изобретении можно применять в виде части комбинированной терапии или в сочетании с дополнительным лекарственным компонентом. Комбинированные терапии можно применять для получения значимых синергетических эффектов, в частности, комбинацию агента специфического связывания для применения в настоящем изобретении с одним или более чем одним другим лекарственным средством. Агент специфического связывания для применения в настоящем изобретении можно вводить одновременно или последовательно, либо в виде комбинированного препарата с другим терапевтическим агентом или агентами для лечения одного или более состояний, перечисленных в данном изобретении.
Например, агент специфического связывания для применения в изобретении можно применять в комбинации с существующим терапевтическим агентом для лечения IBD.
Агент специфического связывания для применения в изобретении и один или более чем один дополнительный лекарственный компонент можно применять в изготовлении лекарственного средства. Это лекарственное средство может быть предназначено для отдельного или комбинированного введения индивидууму и, соответственно, может содержать агент специфического связывания и дополнительный компонент в виде комбинированного препарата или в виде раздельных препаратов. Можно применять раздельные препараты, чтобы обеспечивать раздельное и последовательное или одновременное введение, и обеспечивать возможность введения компонентов различными путями, например перорального и парентерального введения.
В соответствии с настоящим изобретением предложенные композиции можно вводить млекопитающим. Введение можно выполнять в "терапевтически эффективном количестве", достаточном, чтобы оказывать полезное действие на пациента. Такая польза может состоять по меньшей мере в ослаблении по меньшей мере одного симптома. Таким образом, "лечение IBD" относится к ослаблению по меньшей мере одного симптома. Действительное вводимое количество, а также частота и режим введения зависят от природы и тяжести того, что подлежит лечению, от конкретного млекопитающего, подлежащего лечению, от клинического состояния индивидуального пациента, от причины расстройства, от участка доставки композиции, от типа агента специфического связывания, от способа введения, режима введения и от других факторов, известных практикующим врачам. Назначение лечения, например, решения по дозировке и т.д., находится в пределах ответственности специалистов общей практики и других врачей и может зависеть от тяжести симптомов и/или прогрессирования заболевания, подлежащего лечению. Подходящие дозы антитела хорошо известны в данной области техники (Ledermann et al. (1991) Int. J. Cancer 47: 659-664; и Bagshawe et al. (1991) Antibody, Immunoconjugates and Radiopharmaceuticals 4: 915-922). Можно применять конкретные дозировки, указанные в данном изобретении или в документе Physician's Desk Reference (2003) как целесообразные для типа вводимого лекарственного средства. Терапевтически эффективное количество или подходящую дозу агента специфического связывания для применения в изобретении можно определить путем сравнения его активности in vitro и активности in vivo в животной модели. Известны способы экстраполяции эффективных доз у мышей и других подопытных животных на людей. Точная доза зависит от ряда факторов, включая следующие факторы: предназначено ли антитело для диагностики, предупреждения или лечения, размер и локализация области, подлежащей лечению, точная природа антитела (например полноразмерное антитело, фрагмент или диатело) и природа какой-либо выявляемой метки или другой молекулы, присоединенной к антителу. Характерная доза антитела находится в диапазоне от 100 мкг до 1 г для системных применений и от 1 мкг до 1 мг для местных применений. Можно вводить начальную более высокую насыщающую дозу, а затем одну или большее количество более низких доз. Антитело может представлять собой полноразмерное антитело, например, изотипа IgG1 или IgG4. Эта доза представляет собой дозу для отдельного лечения взрослого пациента, которая может быть пропорционально отрегулирована для детей и детей младшего возраста, а также отрегулирована для других форматов антитела в соотношении с молекулярной массой. Терапии можно повторять через интервалы, составляющие сутки, две недели, неделю или месяц, по решению врача. Терапии можно осуществлять каждые 2-4 недели для подкожного введения и каждые 4-8 недель для внутривенного введения. В некоторых воплощениях настоящего изобретения лечение является периодическим, и период между введениями составляет примерно две недели или более, например примерно три недели или более, примерно четыре недели или более, либо примерно один раз в месяц. В других воплощениях изобретения лечение можно проводить до и/или после операции, и можно вводить или наносить непосредственно в анатомическом участке хирургического лечения.
Воспалительное заболевание кишечника (IBD)
Воспалительное заболевание кишечника представляет собой группу воспалительных состояний, поражающих ободочную и тонкую кишку. Основными типами IBD являются болезнь Крона (CD) и неспецифический язвенный колит (UK), тогда как другие типы IBD включают коллагенозный колит, лимфоцитарный колит, ишемический колит, диверсионный колит, болезнь Бехчета и неопределенный колит. CD может поражать любую часть желудочно-кишечного тракта, тогда как UK обычно ограничен ободочной и прямой кишкой.
IBD по отношению к данному изобретению может представлять собой CD, UK, коллагенозный колит, лимфоцитарный колит, ишемический колит, диверсионный колит, болезнь Бехчета и неопределенный колит. В частности, термины CD, UK, коллагенозный колит, лимфоцитарный колит, ишемический колит, диверсионный колит, болезнь Бехчета и неопределенный колит, как используют в данном описании, могут относиться к активной CD, активному UK, активному коллагенозному колиту, активному лимфоцитарному колиту, активному ишемическому колиту, активному диверсионному колиту, активной болезни Бехчета и активному неопределенному колиту, соответственно. В одном воплощении изобретения IBD может представлять собой CD или UK. В другом воплощении изобретения IBD может представлять собой CD, коллагенозный колит, лимфоцитарный колит, ишемический колит, диверсионный колит, болезнь Бехчета или неопределенный колит. В следующем воплощении изобретения IBD не представляет собой UK. IBD может представлять собой IBD, обычно не ограниченное воспалением в ободочной и прямой кишке, такое как CD. IBD может представлять собой IBD, поражающее не только выстилающую поверхность ободочной кишки. В предпочтительном воплощении изобретения IBD представляет собой CD. Наиболее предпочтительно IBD представляет собой активную CD.
Дополнительные аспекты и воплощения изобретения станут очевидными специалистам в данной области техники с учетом настоящего описания, включая приведенные ниже пояснения в виде экспериментальных примеров.
Все документы, упоминаемые в данном описании, полностью включены в него посредством ссылки.
"И/или" при использовании в данном изобретении следует понимать как конкретное раскрытие каждого из двух указанных признаков или компонентов с другим или без другого. Например, "А и/или В" следует понимать как конкретное раскрытие каждого из (1) А, (2) В и (3) А и В, как если бы каждый из них был представлен индивидуально.
Если контекстом не продиктовано иное, описания и определения признаков, указанных выше, не ограничено каким-либо конкретным аспектом или воплощением изобретения и в равной степени применимо ко всем описанным аспектам и воплощениям изобретения.
Некоторые аспекты и воплощения изобретения теперь будут проиллюстрированы с помощью примера и со ссылкой на описанные выше графические материалы.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
МАТЕРИАЛЫ И МЕТОДЫ
Мышиная модель IBD
Мышиные модели IBD, включающие введение декстрансульфата натрия (DSS), известны в данной области техники. Подходящая мышиная модель также описана, например, в статье Okayasu et al. (1990), Gastroenterology, 98, 694-702.
Для экспериментов, описанных в данном разделе, колит индуцировали у мышей C57BL/6 (Jackson Laboratories, Bar Harbor, ME) путем включения 3% декстрансульфата натрия (DSS) (MP BioMedicals) в питьевую воду на протяжении 7 суток, после чего в течение 3-5 суток давали обычную питьевую воду. Контрольным мышам давали стандартную воду на протяжении всего хода исследования. Проводили мониторинг мышей на индукцию/прогрессирование заболевания, о чем свидетельствовал гемоккульт-тест на сутки 3-5, а также на основании суточного изменения массы. Мышей подвергали эвтаназии в различные моменты времени на сутки 3-5 после прекращения введения DSS в воду для оценки направленности, локализации и фармакологических эффектов F8-IL-10.
Радиойодирование, очистка, характеризация и приготовление раствора для дозирования 125I-F8/IL10
125I-F8/IL10 было получено, используя сукцинимидил-йодбензоат (SIB) (Zalutsky & Narula (1988) Cancer Research, 48, 1446-1450; Zalutsky & Narula (1987) Appl. Radiat. Isot. 38, 1051-1055; Cheng, et al. (2002) J. Med. Chem. 45, 3048-3056). Кратко, аликвоту йода-125 (20 мкл, примерно 2,0 мкКи) (Perkin Elmer, Waltham, MA) подвергали взаимодействию с 2,5 мкг N-сукцинимидил-3-(три-н-бутилстаннил)бензоата (C23H35NO4Sn; MW (молекулярная масса) равна 508,23, синтезирован Texas Biochemicals, Inc. College Station, TX) вместе с 10 мкг NCS (N-хлорсукцинимид) (Sigma-Aldrich, St. Louis, МО) в качестве окислителя в 50 мкл метанола, содержащего 1,5% уксусную кислоту (об.:об.) (оба реагента от фирмы Sigma-Aldrich). После 15 мин инкубации при температуре окружающей среды остаточный окислитель в реакционном растворе гасили добавлением 10 мкг бисульфата натрия (восстанавливающий агент) (Sigma-Aldrich) и инкубацией при температуре окружающей среды дополнительно в течение 5 мин. 1251-меченый SIB конъюгировали с антителом F8-IL10 (примерно 0,2 мг при исходном молярном отношении промежуточного соединения к антителу приблизительно 2,5:1) путем инкубации при температуре окружающей среды в течение 20 мин при рН 8,0. Радиоактивно меченый продукт (125I-F8/IL10) очищали, используя предварительно уравновешенную колонку PD-10 (GE Healthcare, Little Chalfont, Buckinghamshire, UK) (потенциально неспецифические сайты связывания белка на колонке насыщали, используя бычий сывороточный альбумин, с последующим промыванием колонки по меньшей мере тремя объемами колонки PBS (фосфатно-солевого буфера)), элюируя PBS. Был получен радиохимический выход приблизительно 30%.
Радиохимическую чистоту (RCP) и биологическую активность 125I-F8/IL10 характеризовали с помощью эксклюзионной хроматографии (SEC) и EDA-аффинной колонки, соответственно. Для анализа SEC приблизительно 1 мкКи раствора продукта 125I-F8/IL10 впрыскивали на колонку для высокоэффективной жидкостной хроматографии (HPLC) (Agilent 1100, оборудованной встроенным детектором радиоактивности), оборудованную эксклюзионной колонкой (G3000SWxl, TOSOH Biosciences, Tokyo, Japan), и элюировали при скорости тока 1 мл в минуту подвижного растворителя, представляющего собой 25 мМ фосфатный буфер, 0,15 M NaCl, рН 6,8. Идентичность 125I-F8/IL10 подтверждали путем сравнения его времени удерживания на радиометрической хроматограмме с хроматограммой референсного F8/IL10 в УФ свете (280 нм). Для 125I-F8/IL10 была получена RCP выше 99% при удельной радиоактивности приблизительно 4,5 мКи/мг.
Биологическую активность 125I-F8-IL10 определяли путем анализа на аффинной колонке с EDA. Кратко, аликвоту (приблизительно 1 мкКи) 125I-F8/IL10 наносили на предварительно уравновешенную аффинную колонку с EDA (содержащую 250 мкл EDA-смолы; предварительное уравновешивание проводили путем блокирования сайтов неспецифического связывания 2 мл бычьего сывороточного альбумина (BSA), 2 мг/мл в PBS, а затем путем промывания колонки 8 мл PBS). Аффинную колонку промывали 6 мл BSA (2 мг/мл в PBS), и элюат собирали фракциями. Радиоактивность в собранном элюате и остаточную радиоактивность на аффинной колонке измеряли в гамма-счетчике. Вычисляли процент радиоактивности, удержанной на колонке с EDA-смолой, от суммарной нанесенной радиоактивности. Для 125I-F8/IL10 было получено процентное содержание радиоактивности, удержанной на аффинной колонке, равное 64%.
Дозируемые растворы, используемые в исследованиях фармакокинетики (PK) и тканевого распределения, готовили путем смешивания 125I-F8/IL10 с немеченым F8/IL10 (исходный раствор F8/IL10) и буфером для композиции до необходимой конечной концентрации. Раствор тестируемого продукта готовили на сутки дозирования и доводили до температуры окружающей среды перед введением животным.
Биораспределение и локализация в ободочной кишке 125I-F8/IL10 в мышиной модели IBD
Необработанных или обработанных DSS мышей обрабатывали йодидом калия (KI) в воде (20 мМ) приблизительно за 2-4 суток до дозирования (сутки 5-7 после инициации DSS), чтобы блокировать захват щитовидной железой какого-либо потенциально несвязанного свободного I-125, образующегося in vivo. На сутки 9 после инициации обработки DSS вводили однократную дозу 125I-F8/IL10 внутривенно (IV). Доза и радиоактивность на группу указана ниже.
1) Группа 0 - приблизительная доза на мышь: 5 мг/кг.
Группа 0 - приблизительная доза радиоактивности на мышь: 7,5 мкКи (удельная активность 75 мкКи/мг).
2) Группа 1 - приблизительная доза на мышь: 5 мг/кг.
Группа 1 - приблизительная доза радиоактивности на мышь: 10 мкКи (удельная активность 100 мкКи/мг).
3) Группа 2 - приблизительная доза на мышь: 0,15 мг/кг.
Группа 2 - приблизительная доза радиоактивности на мышь: 12 мкКи (удельная активность 4490 мкКи/мг).
Подгруппы мышей обескровливали через 5 минут, 1, 3, 6, 24, 48 и 96 часов, а затем собирали различные ткани. Образцы крови собирали либо путем пункции сердца, либо путем ретроорбитального кровоизвлечения в пробирки для сбора с отделением сыворотки. Образцы сыворотки собирали путем центрифугирования образцов крови при 10000 g в течение 5 мин. Для сбора тканей животное умерщвляли, а представляющие интерес ткани собирали сразу после взятия образцов крови и перфузии всего тела. Перфузию крови всего тела проводили путем введения приблизительно 20 мл гепарина-ФСБ (25 единиц на мл) в течение приблизительно 10 мин. Представляющие интерес ткани, включающие головной мозг, мезентериальные лимфатические узлы, кожу, жировую ткань, скелетную мышцу бедра, легкое, сердце, селезенку, печень, желудок, тонкий кишечник, толстый кишечник и почку, собирали и взвешивали. Содержимое из желудочно-кишечного тракта (ЖКТ) удаляли. Радиоактивность (суммарный счет в импульсах в минуту (имп./мин)) образцов тканей измеряли непосредственно с помощью гамма-счетчика.
Авторадиография ободочной кишки больных и здоровых мышей
Авторадиографию ободочной кишки проводили на образцах ободочной кишки от мышей группы 0 и группы 2. Ободочные кишки собирали, их содержимое удаляли, и ткань экспонировали на системе формирования изображения на люминесцентном фосфорном покрытии (Molecular Dynamics) в течение 24 часов и визуализировали с помощью прибора Storm 860. Результаты представлены на Фиг. 2. Дорожка 1: ободочная кишка, взятая через 6 ч после инъекции от группы 0 (здоровая мышь); Дорожка 2: ободочная кишка, взятая через 6 ч после инъекции от группы 2 (мышь, которой вводили DSS); Дорожка 3: ободочная кишка, взятая через 24 ч после инъекции от группы 0 (здоровая мышь); Дорожка 4: ободочная кишка, взятая через 24 ч после инъекции от группы 2 (мышь, которой вводили DSS). Очаговую локализацию 125I-F8/IL10 наблюдали вдоль ободочной кишки у мышей, обработанных DSS, и не наблюдали у нормальных мышей, что согласуется с нерегулярным воспалением ободочной кишки и ассоциированным профилем экспрессии EDA-мишени в данной модели.
Определение эквивалентных концентраций радиоактивности в сыворотке и тканях и срармакокинетические вычисления
Эквивалентную концентрацию в сыворотке (нг-экв./г) 125I-F8/IL10 оценивали на основании измеренной радиоактивности, осаждаемой ТСА (трихлоруксусной кислотой) (ассоциированной с белком). Для осаждения ТСА аликвоту (50 мкл) образца сыворотки смешивали с 50 мкл сыворотки мыши с последующим добавлением 100 мкл 20% раствора ТСА. Смесь образца центрифугировали при 10000 g в течение 5 минут для осаждения белка. Определяли суммарную и ТСА-растворимую радиоактивность в супернатанте. Измерения ТСА-осаждаемой радиоактивности (имп./мин) в данном образце, удельной активности дозируемого раствора (ТСА-осаждаемый счет в имп./мин на мг белка), а также данные образца (tS) и дозируемого раствора (tD) использовали для вычисления эквивалентной концентрации тестируемого препарата (нг-экв./мл) в данном образце, используя формулу: [ТСА-осаждаемый счет в имп./мин/EXP(-0,693/60,2⋅(tS - td)]/[удельная активность (в имп./мин/мг)⋅объем образца (в мл)].
Количественное определение эквивалентной концентрации (нг-экв./г) 125I-F8/IL10 в тканях вычисляли на основании измеренной суммарной радиоактивности в образце и удельной активности дозируемого раствора после поправки на физический период полураспада 1251, используя формулу: [имп./мин образца/EXP(-0,693/60,2⋅(tS - td))]/[удельная активность (в имп./мин/мг)⋅масса образца (в мг)]. Ни гомогенизацию, ни осаждение ТСА не проводили для образцов ткани. Кроме эквивалентной концентрации радиоактивности (нг-экв./мл для сыворотки, нг-экв./г для ткани), также вычисляли процент инъецированной дозы на грамм (%ID/г) и/или процент инъецированной дозы (%ID) для сыворотки и представляющих интерес тканей.
Биораспределение 125I-F8/IL10 у нормальных (группа 0) и DSS-обработанных (группа 1) мышей определяли через 6 часов (на Фиг. 3А), 24 часа (на Фиг. 3В) и 96 часов после инъекции (на Фиг. 3С).
РК-параметры вычисляли при средних сывороточных или тканевых концентрациях в измеряемые моменты времени. Использовали модуль фармакокинетического анализа без компартментализации фармакокинетического пакета программ WinNonlin (версия 5.1, Pharsight). Площадь под кривой концентрации против времени (AUC) вычисляли, используя линейный метод трапеций.
Действие терапевтического лечения F8-IL10 в мышиной модели IBD на сывороточные уровни цитокинов
Поскольку известно, что IL-10 снижает провоспалительные цитокины, авторы изобретения исследовали, повлияет ли введение F8-IL10 в мышиные модели IBD на ответы сывороточных цитокинов в данной модели. Мышам вводили 200 мкг/мышь F8-IL10 или контрольного малого иммунного белка (F8-SIP) IV на сутки 3, 6 и 9 после инициации обработки DSS (n=10 мышей/группа). Этот режим дозы был таким же, как эффективные режимы в моделях артрита, индуцированного коллагеном (Schwager K, et al. Arthritis Research and Therapy, (2009) 11: R142). Контрольные группы включали не больных (обыкновенная вода) и необработанных больных (n=10 мышей/группа) мышей. На сутки 10 после инициации DSS собирали кровь и получали сыворотку, как описано выше для исследований локализации. Сыворотку оценивали на уровни IL-1b, IL-12p40, IFNg, IL-6, KC, IL-10 и TNFa, используя технологическую платформу MSD и 7-плексный набор для мышей MSD согласно инструкциям изготовителя (Mesoscale Discovery, Gaithersburg, MD). Уровни цитокинов выражены в пикограммах (пг) белка на мл сыворотки на Фиг. 4 и 5.
Окрашивание ткани человека на экспрессию ЕРА
Иммуногистохимический анализ замороженных образцов ткани ободочной кишки, заключенных в ОСТ, от 60-летней пациентки, пораженной неспецифическим язвенным колитом и 42-летнего пациента, пораженного болезнью Крона. Оба образца идентифицировали антителом F8 в формате SIP и фактором фон Виллебранда.
Кроме того, замороженные парные образцы биопсии пораженной и непораженной ткани от тех же пациентов с болезнью Крона и неспецифическим язвенным колитом (n=3 пациентов с болезнью Крона и n=5 пациентов UK) были получены из Analytical Biological Services (Wilmington, DE). Замороженные образцы ориентировали на сухом льду для предотвращения оттаивания, заключали в стандартные криоформы (Tissue-Tek 4557), заполненные соединением О.С.Т. (Tissue-Tek #4583) и подвергали быстрой заморозке в изопентане, охлажденном сухим льдом. Получали срезы тканевых блоков толщиной 4 микрона на криостате Leica СМ1850, помещали их на предметные стекла и хранили при -80°С до проведения иммуногистохимии (ИГХ). При инициации ИГХ ткани погружали в холодный (-20°F) метанол (Fisher Scientific А412Р-4), чтобы удалить какую-либо влагу, которая может образоваться при хранении, и высушивали на воздухе 20 мин при комнатной температуре. Затем ткани погружали в холодный (-20°F) ацетон (ACROS CAS # 67-64-1) на 10 мин и высушивали на воздухе 10 мин при комнатной температуре.
Стекла с тканями метили подходящим полосковым кодом Ventana и помещали в прибор для ИГХ Ventana Discovery XT на фибронектин F8 SIP или KSF SIP (контрольное антитело). Эндогенный биотин блокировали обоими реагентами: 5% нормальной сывороткой мыши (Jackson Immuno Research 015-000-120) в блоке Ventana S (Ventana 760-4212) в течение 20 минут и набором для блокирования биотина Ventana (Ventana 760-050) в течение 8 минут. Фибронектин-F8SIP или KSF разводили в разбавителе для антител Dako (S0908) (Dako North America, Carpinteria, СА) при концентрации 1:200 (100 мкл на стекло) и инкубировали в течение 40 минут. Стекла окрашивали контрастным красителем гематоксилином и реагентом, окрашивающим в голубой цвет (4 минуты каждый), перед завершением опыта. Стекла извлекали и помещали в Ventana Symphony для последующего обезвоживания и покрытия покровным стеклом. Репрезентативные изображения ИГХ представлены на Фиг. 7. ИГХ образцов непораженной (слева) и пораженной (справа) ткани от пациента с неспецифическим язвенным колитом UH0501-34 (сверху) и пациента с болезнью Крона UH0405-09 (снизу).
РЕЗУЛЬТАТЫ
Авторадиография ободочной кишки
На Фиг. 2 показана авторадиография ободочных кишок или не больных мышей (вода) (дорожки 1 и 3), или больных мышей (DSS-обработанных) (дорожки 2 и 4) либо через 6 (дорожки 1 и 2), либо через 24 (дорожки 3 и 4) часа после введения радиоактивно меченного F8-IL10. Это демонстрирует, что F8-IL10 накапливается в воспаленной ободочной кишке в большем количестве, чем в нормальной ободочной кишке. Очаговый внешний вид локализации F8-IL10 в больной ободочной кишке согласуется с вариабельными уровнями воспаления и экспрессии EDA, наблюдаемыми вдоль длины ободочной кишки в данной модели, что дополнительно подтверждает локализацию F8-IL10 при воспалении.
Биораспределение 125I-F8-IL10 у больных и здоровых мышей На Фиг. 3 показано накопление 125I-F8-IL10 в моменты времени через 6, 24 и 96 часов в ободочной кишке и мезентериальных лимфатических узлах (L.N.) у больных (DSS) мышей по сравнению с нормальными (вода) мышами.
Подобно Фиг. 2, эти данные демонстрируют направленность F8-IL10 на ободочную кишку и связанные с ней лимфатические узлы у DSS-обработанных мышей. Из этих исследований также определили, что время полувыведения в сыворотке составляет приблизительно 3,5 часа, тогда как время полувыведения F8-IL10 в ободочной кишке составляет приблизительно 35 часов; 10-кратное повышение позволяет предположить усиленную персистенцию в ткани. Это указывает на то, что F8-IL10 не только направлено на ободочную кишку и мезентериальные лимфатические узлы во время хронического воспаления, но также персистирует в ней в течение более длительных периодов времени, чем в кровообращении. Все вместе эти данные позволяют предположить, что в таких условиях воспаления в ободочной кишке, как при болезни Крона и неспецифическом язвенном колите, у людей F8-IL10 преимущественно направлено на эти участки и персистирует в них. Уровни цитокинов в сыворотке от больных и здоровых мышей На Фиг. 4 показано, что по сравнению с контрольными группами введение F8-IL10 в терапевтическом режиме приводит в результате к значимому снижению сывороточных уровней воспалительных цитокинов, IL-1β, IL12p40, IFNγ и IL-6.
На Фиг. 5 показано, что по сравнению с контрольными группами введение F8-IL10 в терапевтическом режиме не приводит в результате к повышению TNF-альфа и кератиноцитарного хемокина (KC) и приводит в результате к повышенным уровням IL-10. Повышенные уровни этих цитокинов на Фиг. 4 в модели DSS ассоциированы с индукцией заболевания в ободочной кишке. Снижения этих воспалительных цитокинов на Фиг. 4 и повышения IL-10 согласуются с известными биологическими эффектами IL-10 (Abbas A, Lichtman A, Pober J., 1994, Cellular and Molecular Immunology. 2nd Ed. Philadelphia: W.B. Saunders Company; Delves P, Roitt I (eds), 1998, Encyclopedia of Immunology, 2nd Ed. San Diego: Academic Press). Таким образом, F8-IL10 демонстрирует фармакологическую активность в данной модели IBD на основании снижения цитокинов, ассоциированных с воспалением и патологией в условиях IBD. Поскольку известно, что эти провоспалительные цитокины претерпевают повышающую регуляцию у пациентов с IBD, понижающая регуляция этих цитокинов в результате введения F8-IL10 позволяет предположить, что F8-IL10, вероятно, полезно при лечении IBD in vivo. В частности, известно, что интерферон γ и IL-12р70 претерпевают повышающую регуляцию у пациентов с CD, и данные, раскрытые в изобретении, позволяют предположить, что введение F8-IL10, таким образом, вероятно, особенно полезно для лечения CD in vivo.
Иммуногистохимия
На Фиг. 6 показано, что антитело F8 SIP окрашивает вновь образованные кровеносные сосуды, но не окрашивает нормальные кровеносные сосуды у пациента, пораженного неспецифическим язвенным колитом. (Фактор фон Виллебранда стандартным образом используют в качестве маркера нормальной сосудистой сети.)
На Фиг. 7 показаны репрезентативные изображения парных образцов биопсии болезни Крона или UK, окрашенные с помощью иммуногистохимии на EDA. Стрелками указаны сосуды в пределах каждого изображения. Интенсивность окрашивания вокруг сосудов в пораженных сосудах увеличена по сравнению с непораженными образцами от тех же пациентов. Это позволяет предположить, что повышенная экспрессия EDA может привести в результате к усиленной направленности на воспаленные области ободочной кишки в данных условиях заболевания человека. В итоге, все взятые вместе данные, как направленное распределение в ободочной кишке и сниженные уровни цитокинов, наблюдаемые под действием F8-IL10 в мышиной модели IBD, так и повышенная экспрессия EDA вокруг сосудов пораженной ткани человека при болезни Крона и неспецифическом язвенном колите, свидетельствуют о том, что предположительно введение F8-IL10 может оказывать направленное и положительное воздействие на пациентов с IBD. 


| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИГЕН, АССОЦИИРОВАННЫЙ С РЕВМАТОИДНЫМ АРТРИТОМ | 2013 |
|
RU2649368C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ИММУНОЦИТОКИНАМИ | 2012 |
|
RU2628089C2 |
| ЛЕЧЕНИЕ ИНФАРКТА МИОКАРДА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ TGF-БЕТА | 2011 |
|
RU2637088C2 |
| ПАРТНЕРЫ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ С NGF | 2006 |
|
RU2406728C2 |
| АНТИТЕЛА ПРОТИВ АЛЬФА5-БЕТА 1 И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2528736C2 |
| ИММУНОКОНЪЮГАТЫ IL2 И МУТАНТНОГО TNF | 2017 |
|
RU2758139C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ АНТИТЕЛА К СЕМАФОРИНУ 4D В КОМБИНАЦИИ С ЭПИГЕНЕТИЧЕСКИМ МОДУЛИРУЮЩИМ АГЕНТОМ | 2018 |
|
RU2783535C2 |
| АНТИТЕЛА К HER3 И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2560583C2 |
| КОМПОЗИЦИИ IL-12, НАЦЕЛЕННЫЕ НА EDB | 2019 |
|
RU2758143C1 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2016 |
|
RU2648152C2 |






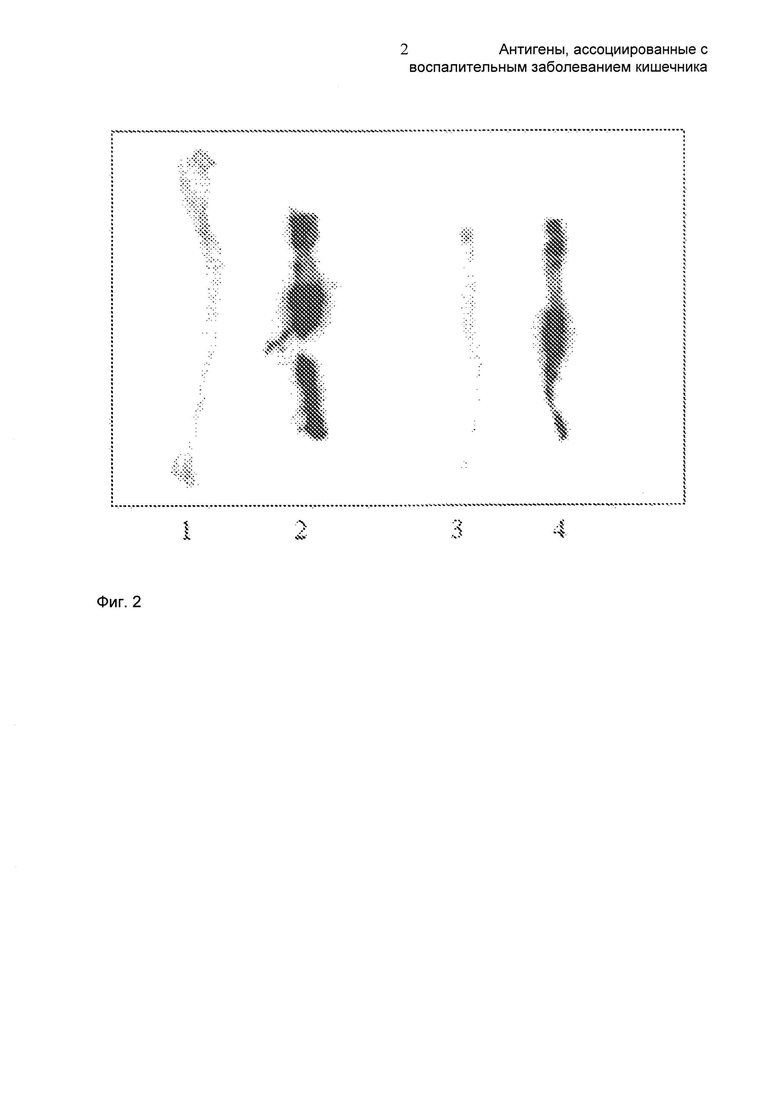
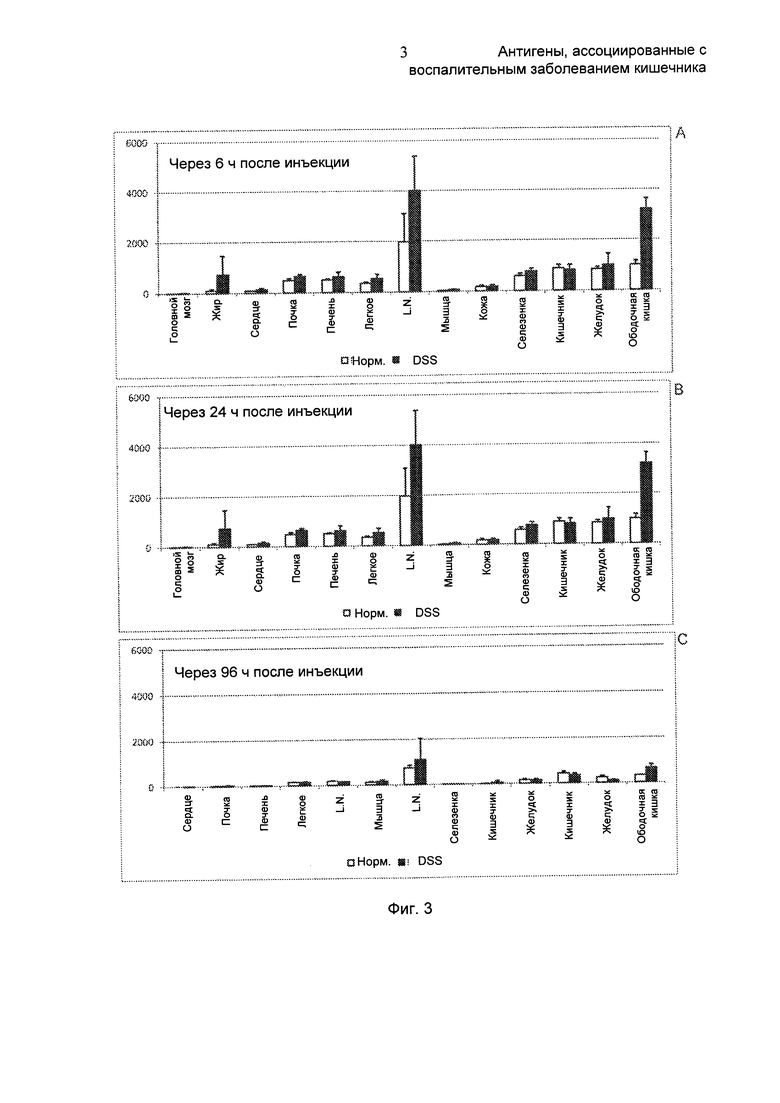
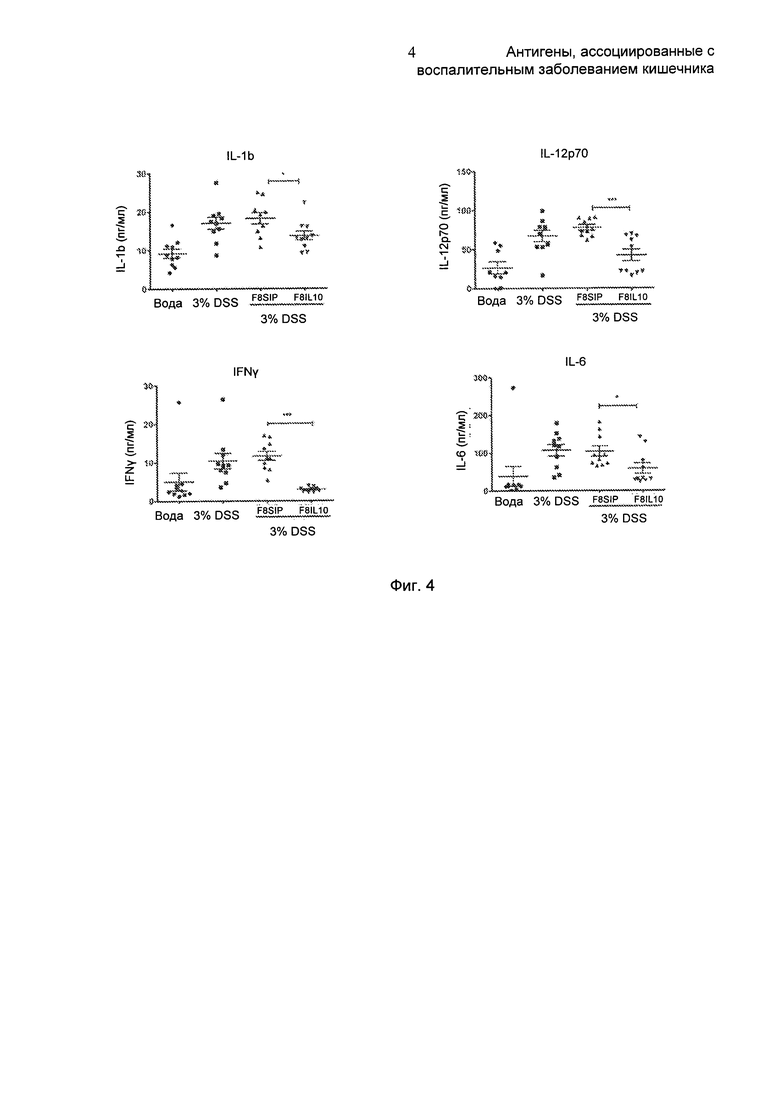



Изобретение относится к биохимии. Описано применение антитела или его антигенсвязывающего фрагмента, связывающих экстра-домен A (ED-A) фибронектина, конъюгированных с иммуносупрессивной или противовоспалительной молекулой, причем указанное антитело содержит VH-домен (вариабельный домен тяжелой цепи) и VL-домен (вариабельный домен легкой цепи), где VH-домен содержит аминокислотные последовательности CDR1 (определяющей комплементарность области 1), CDR2 и CDR3 тяжелой цепи в SEQ ID NO: 7 и VL-домен содержит аминокислотные последовательности CDR1, CDR2 и CDR3 легкой цепи в SEQ ID NO: 8 для лечения воспалительного заболевания кишечника (IBD). Изобретение расширяет арсенал средств для лечения воспалительного заболевания кишечника (IBD). 2 н. и 23 з.п. ф-лы, 7 ил.
1. Применение конъюгата антитела для приготовления лекарственного средства для лечения воспалительного заболевания кишечника (IBD), где конъюгат антитела содержит антитело или его антигенсвязывающий фрагмент, связывающие экстра-домен A (ED-A) фибронектина и конъюгированные с иммуносупрессивной или противовоспалительной молекулой, причем указанное антитело содержит VH-домен (вариабельный домен тяжелой цепи) и VL-домен (вариабельный домен легкой цепи), где
VH-домен содержит аминокислотные последовательности CDR1 (определяющей комплементарность области 1), CDR2 и CDR3 тяжелой цепи в SEQ ID NO: 7; и
VL-домен содержит аминокислотные последовательности CDR1, CDR2 и CDR3 легкой цепи в SEQ ID NO: 8.
2. Применение конъюгата антитела в качестве лекарственного средства для лечения воспалительного заболевания кишечника (IBD), где конъюгат антитела содержит антитело или его антигенсвязывающий фрагмент, связывающие экстра-домен A (ED-A) фибронектина и конъюгированные с иммуносупрессивной или противовоспалительной молекулой, причем указанное антитело содержит VH-домен и VL-домен, где
VH-домен содержит аминокислотные последовательности CDR1, CDR2 и CDR3 тяжелой цепи в SEQ ID NO: 7; и
VL-домен содержит аминокислотные последовательности CDR1, CDR2 и CDR3 легкой цепи в SEQ ID NO: 8.
3. Применение по п. 1 или 2, где VH-домен и/или VL-домен содержит человеческую каркасную область эмбрионального типа.
4. Применение по п. 3, где человеческая каркасная область эмбрионального типа в VH-домене имеет происхождение из гена DP47 и/или человеческая каркасная область эмбрионального типа в VL-домене имеет происхождение из гена DPK22.
5. Применение по п. 1 или 2, где VH-домен содержит аминокислотную последовательность SEQ ID NO: 7 и VL-домен содержит аминокислотную последовательность SEQ ID NO: 8.
6. Применение по п. 1 или 2, где указанные антитело или антигенсвязывающий фрагмент конъюгированы с выявляемой меткой.
7. Применение по п. 6, где выявляемая метка представляет собой радиоактивный изотоп.
8. Применение по п. 1 или 2, где указанная противовоспалительная молекула представляет собой цитокин.
9. Применение по п. 8, где указанный цитокин представляет собой человеческий интерлейкин-10 (IL-10).
10. Применение по п. 1 или 2, где указанные антитело или антигенсвязывающий фрагмент конъюгированы с указанной иммуносупрессивной или противовоспалительной молекулой посредством расщепляемого линкера.
11. Применение по п. 1 или 2, где указанные антитело или антигенсвязывающий фрагмент конъюгированы с указанной иммуносупрессивной или противовоспалительной молекулой через пептидный линкер.
12. Применение по п. 11, где указанный пептидный линкер содержит 15 аминокислот.
13. Применение по п. 12, где указанный пептидный линкер состоит из аминокислотных остатков (SSSSG)3 (SEQ ID NO: 10).
14. Применение по п. 1 или 2, где указанный конъюгат антитела содержит антигенсвязывающий фрагмент указанного антитела.
15. Применение по п. 14, где указанный антигенсвязывающий фрагмент содержит малый иммунопротеин (SIP).
16. Применение по п. 14, где указанный антигенсвязывающий фрагмент содержит одноцепочечный Fv (scFv).
17. Применение по п. 16, где VH-домен и VL-домен в scFv конъюгированы друг с другом через аминокислотный линкер.
18. Применение по п. 17, где указанный аминокислотный линкер содержит 5-25 аминокислот.
19. Применение по п. 14, где указанный антигенсвязывающий фрагмент представляет собой диатело, содержащее полипептид, содержащий VH- и VL-домены, где VH- и VL-домены в полипептиде конъюгированы друг с другом через аминокислотный линкер, содержащий 1-5 аминокислот.
20. Применение по п. 19, где указанный аминокислотный линкер состоит из аминокислотных остатков GGSGG (SEQ ID NO: 9).
21. Применение по п. 20, где указанный конъюгат антитела содержит (1) диатело и (2) человеческий интерлейкин-10 (IL-10), конъюгированный с VL-доменом диатела через пептидный линкер, содержащий аминокислотные остатки (SSSSG)3 (SEQ ID NO: 10).
22. Применение по п. 20, где указанный конъюгат антитела состоит из (1) диатела и (2) человеческого интерлейкина-10 (IL-10), конъюгированного с VL-доменом диатела через пептидный линкер, состоящий из аминокислотных остатков (SSSSG)3 (SEQ ID NO: 10).
23. Применение по п. 1 или 2, где указанный конъюгат антитела содержит аминокислотную последовательность SEQ ID NO: 13.
24. Применение по п. 1 или 2, где указанный конъюгат антитела состоит из аминокислотной последовательности SEQ ID NO: 13.
25. Применение по п. 1 или 2, где указанное IBD выбрано из группы, состоящей из: неспецифического язвенного колита (UC), коллагенозного колита, лимфоцитарного колита, ишемического колита, диверсионного колита, болезни Бехчета, неопределенного колита и болезни Крона (CD).
| US 20110250131 A1, 13.10.2011 | |||
| RU 2008103312 A, 10.08.2009. |
Авторы
Даты
2017-03-13—Публикация
2012-10-03—Подача