РОДСТВЕННАЯ ЗАЯВКА
Эта заявка притязает на приоритет по дате подачи предварительной заявки на патент США № 60/856592, поданной 2 ноября 2006 и озаглавленной «ALK1 Receptor and Ligand Antagonist and Uses Thereof». Взятые в целом учения упомянутой предварительной заявки специально включены сюда посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Развитие кровеносных сосудов, процесс образования новых кровеносных сосудов, является критическим во многих нормальных и патологических физиологических состояниях. В нормальных физиологических состояниях у людей и животных развитие кровеносных сосудов наблюдается в специфических и ограниченных ситуациях. Например, развитие кровеносных сосудов в нормальном состоянии наблюдается при заживлении ран, зародышевом и эмбриональном развитии и образовании желтого тела, эндометрия и плаценты.
Нежелательное или не соответствующим образом регулируемое развитие кровеносных сосудов встречается при многих нарушениях, при которых аномальный рост эндотелия может вызвать патологический процесс или принимать участие в этом процессе. Например, развитие кровеносных сосудов принимает участие в росте многих опухолей. Нерегулируемое развитие кровеносных сосудов подразумевалось в таких патологических процессах как ревматоидный артрит, ретинопатии, гемангиомы и псориаз. Разнообразные патологические болезненные состояния, при которых присутствует нерегулируемое развитие кровеносных сосудов, были классифицированы как связанные с развитием кровеносных сосудов заболевания.
Полагают, что и контролируемое, и не контролируемое развитие кровеносных сосудов протекает схожим образом. Капиллярные кровеносные сосуды состоят главным образом из эндотелиальных клеток и перицитов, окруженных базальной мембранной. Развитие кровеносных сосудов начинается с эрозии базальной мембраны под действием ферментов, высвобождаемых эндотелиальными клетками и лейкоцитами. Эндотелиальные клетки, которые выстилают просвет кровеносных сосудов, затем выступают наружу через базальную мембрану. Факторы развития кровеносных сосудов индуцируют миграцию эндотелиальных клеток через подвергнутую эрозии базальную мембрану. Мигрирующие клетки образуют «отросток», выступающий из исходного кровеносного сосуда, в котором эндотелиальные клетки подвергаются митозу и пролиферируют. Эндотелиальные отростки объединяются друг с другом, с образованием капиллярных петель, создавая новые кровеносные сосуды.
Было установлено, что агенты, ингибирующие развитие кровеносных сосудов, являются эффективными для лечения множества нарушений. Было установлено, что AvastinTM (бевацизумаб), моноклональное антитело, которое связывается с фактором роста эндотелия сосудов (VEGF), является эффективным для лечения множества раков. Было установлено, что MacugenTM, аптамер, который связывается с VEGF, является эффективным для лечения неоваскулярной (мокнущей) возрастной дегенерации желтого пятна. Антагонисты пути передачи сигнала, опосредуемой SDF/CXCR4, ингибируют неоваскуляризацию опухолей и эффективны против рака в моделях на мышах (Guleng et al. Cancer Res. 2005 Jul 1; 65(13): 5864-71). Завершено клиническое испытание фазы I изокумарина 2-(8-гидрокси-6-метокси-1-оксо-1Н-2-бензопиран-3-ил)пропионовой кислоты (NM-3) в качестве перорально биодоступного ингибитора развития кровеносных сосудов. NM-3 непосредственно уничтожает как эндотелиальные, так и опухолевые клетки in vitro и эффективен для лечения ксенотрансплантатов разнообразных опухолей человека в мышах (Agata et al. Cancer Chemother Pharmacol. 2005 Dec; 56(6): 610-4). Талидомид и родственные соединения продемонстрировали благоприятные эффекты при лечении рака, и хотя молекулярный механизм действия не ясен, ингибирование развития кровеносных сосудов, по-видимому, является важным компонентом противоопухолевого эффекта (см., например, Dredge et al. Microvasc. Res. 2005 Jan; 69(1-2): 56-63). Успех антагонистов TNF-альфа при лечении ревматоидного артрита отчасти объясняется антиангиогенными эффектами на воспаленную ткань сустава (Feldmann et al. Annu. Rev. Immunol. 2001; 19: 163-96). Очень вероятно, что антиангиогенные терапии будут иметь благоприятные эффекты на другие воспалительные заболевания, в частности, псориаз. Несмотря на то, что многие антиангиогенные агенты оказывают эффект на развитие кровеносных сосудов независимо от пораженной ткани, другие антиангиогенные агенты могут иметь тенденцию к оказанию избирательного в отношении ткани эффекта.
Желательно иметь дополнительные композиции и способы для ингибирования развития кровеносных сосудов. Они включают способы и композиции, которые могут ингибировать нежелательный рост кровеносных сосудов, или вообще, или в определенных тканях и/или при определенных болезненных состояниях.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Отчасти настоящее описание представляет характеристику опосредуемой подобной рецептору активина киназой I (ALK1) регуляторной системы и роли этой системы в развитии кровеносных сосудов in vivo. В некоторых аспектах настоящим описанием предоставляются антагонисты лигандов ALK1 и применение таких антагонистов в качестве антиангиогенных агентов. Кроме того, настоящим описанием предоставляются антагонисты самой ALK1 и применение таких антагонистов в качестве антиангиогенных агентов. Описываемая здесь ALK1 представляет собой рецептор для группы лигандов GDF5, которая включает GDF6 и GDF7, а также для группы лигандов BMP9, которая включает ВМР10. В этом описании демонстрируется, что передача сигнала, опосредуемая ALK1 и описываемыми здесь лигандами, вовлечена в развитие кровеносных сосудов in vivo, и что ингибирование этой регуляторной системы оказывает сильный антиангиогенный эффект. Таким образом, в некоторых аспектах настоящим описанием предоставляются антагонисты опосредуемой ALK1 регуляторной системы, включающие антагонисты рецептора и одного или нескольких лигандов, для применения для ингибирования развития кровеносных сосудов. В некоторых аспектах настоящим описанием предоставляются антагонисты лигандов ALK1 для лечения раков, в частности, множественной миеломы, ревматоидного артрита, и нарушений, связанных с патологическим развитием кровеносных сосудов внутри глаза.
В некоторых аспектах настоящим описанием предоставляются полипептиды, включающие лигандсвязывающую часть внеклеточного домена ALK1 («содержащие ECD ALK1 полипептиды») для применения для ингибирования развития кровеносных сосудов. Несмотря на нежелание быть связанными с каким-либо конкретным механизмом действия, предполагают, что такие полипептиды действуют путем связывания с лигандами ALK1 и ингибирования способности этих лигандов взаимодействовать с ALK1, а также другими рецепторами. В некоторых вариантах осуществления содержащие ECD ALK1 полипептиды включают аминокислотную последовательность, которая по меньшей мере на 70%, 80%, 90%, 95%, 97%, 99% или 100% идентична последовательности аминокислот 22-118 последовательности ALK1 человека SEQ ID NO: 1. Содержащие ECD ALK1 полипептиды могут использоваться в виде небольшого мономерного белка или в подвергнутой димеризации форме (например, представленной в виде слитого белка), в частности, для местного введения в ткани, такие как глаз. Содержащие ECD ALK1 полипептиды могут быть также слиты со второй полипептидной частью для обеспечения улучшенных свойств, таких как увеличенный полупериод существования или большая легкость продукции или очистки. Слияния с Fc-областью иммуноглобулина или соединение с полиоксиэтиленовой составляющей (например, полиэтиленгликолем) могут быть особенно полезными для увеличения полупериода существования в сыворотке содержащего ECD ALK1 полипептида при системном введении (например, внутривенном, внутриартериальном и внутрибрюшинном введении). Как здесь продемонстрировано, системное введение полипептида ALK1-Fc оказывает сильный антиангиогенный эффект внутри глаза, а также обеспечивает положительные эффекты в моделях ревматоидного артрита и множественной миеломы на мышах. В некоторых вариантах осуществления слитый белок ALK1-Fc включает в себя полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 70%, 80%, 90%, 95%, 97%, 99% или 100% идентична последовательности аминокислот 22-118 SEQ ID NO: 1, и слитый, или с использованием промежуточного линкера, или без него, с Fc-областью иммуноглобулина, причем слитый белок ALK1-Fc связывается с GDF5, GDF7 и BMP9 с KD, составляющей менее 1×10-7 М, и связывается с TGFβ-1 с KD, превышающей 1×10-6 М. Fc-область можно выбрать, чтобы она была подходящей для организма. Необязательно, Fc-областью является Fc-область IgG1 человека. В предпочтительном варианте осуществления слитый белок ALK1-Fc включает аминокислоты 22-118 SEQ ID NO: 1. Необязательно слитый белок ALK1-Fc включает аминокислотную последовательность SEQ ID NO: 3. Необязательно слитый белок ALK1-Fc является белком, продуцируемым при экспрессии нуклеиновой кислоты SEQ ID NO: 4 в линии клеток млекопитающего, в частности, в линии клеток яичника китайского хомячка (СНО). Содержащие ECD ALK1 полипептиды можно приготовить в виде фармацевтической композиции, которая по существу не содержит пирогенов. Фармацевтическую композицию можно приготовить для системной доставки (например, внутривенной, внутриартериальной или подкожной доставки) или для местной доставки (например, в глаз).
В некоторых аспектах настоящим описанием предоставляются способы ингибирования развития кровеносных сосудов у млекопитающего путем введения любого из содержащих ECD ALK1 полипептидов, описанных здесь в общем или в частности. В одном варианте осуществления способ включает введение млекопитающему эффективного количества слитого белка ALK1-Fc, причем слитый белок ALK1-Fc содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности аминокислот 22-118 SEQ ID NO: 1, и слитый с Fc-областью иммуноглобулина, причем слитый белок ALK1-Fc связывается с TGFβ-1 с KD, превышающей 1×10-6 М. Необязательно слитый белок ALK1-Fc связывается с одним или несколькими лигандами ALK1, выбранными из группы, состоящей из GDF5, GDF6, GDF7, BMP9 и ВМР10. Необязательно слитый белок ALK1-Fc имеет последовательность SEQ ID NO: 3. Содержащий ECD ALK1 полипептид может доставляться местно (например, в глаз) или системно (например, внутривенно, внутриартериально или подкожно). В конкретном варианте осуществления настоящим описанием предоставляется способ ингибирования развития кровеносных сосудов внутри глаза млекопитающего путем введения белка ALK1-Fc млекопитающему в месте, удаленном от глаза, например, с помощью системного введения.
В некоторых аспектах настоящим описанием предоставляются антитела, которые связываются с ALK1, в частности, с эпитопом, расположенным во внеклеточном домене, аминокислоты 22-118 SEQ ID NO: 1, и ингибируют связывание ALK1 с по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6, GDF7, BMP9 и ВМР10. На основании аффинностей этих лигандов в отношении ALK1 антитело может связываться с KD, составляющей менее 1×10-8 М и необязательно находящейся между 5×10-8 и 1×10-10. Можно было бы ожидать, что антитело с аффинностью в пределах этого диапазона ингибирует передачу сигнала, опосредуемую одним или более из GDF5, 6 и 7, несмотря на то, что оно оказывает меньший эффект на передачу сигнала, опосредуемую BMP9 и ВМР10. Такое антитело предпочтительно ингибирует развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. Несмотря на нежелание быть связанными с каким-либо конкретным механизмом, предполагают, что такие антитела будут действовать путем ингибирования непосредственно активности ALK1, которая должна быть противоположностью активности слитого белка ALK1-Fc, который, как предполагают, ингибирует активность лигандов ALK1. Не предполагают, что антитело против ALK1 будет создавать помехи способности GDF5, GDF6, GDF7, ВМР9 или ВМР10 передавать сигнал через альтернативные рецепторные системы, такие как комплексы BMPR1a, BMPR1b или BMPRII. Однако, предполагают, что антитело против ALK1 будет создавать помехи способности лигандов с низкой аффинностью в отношении ALK1 (например, TGF-β, который, как обычно признается, инициирует существенные события передачи сигналов через ALK1, даже несмотря на то, что связывание является относительно слабым) передавать сигнал через ALK1, даже несмотря на то, что ECD ALK1 может не связываться с такими лигандами с низкой аффинностью или не ингибировать такие лиганды. Антитело может связываться с полипептидом ALK1 с KD, составляющей менее 1×10-10 М. Можно было бы ожидать, что антитело с аффинностью в пределах этого диапазона будет ингибировать передачу сигнала, опосредуемую ВМР9 или 10. Такое антитело предпочтительно ингибирует связывание ВМР9 и ВМР10 с ALK1. Примечательно, на основе раскрытых здесь данных, что антитело, которое относительно плохо связывается с ALK1, может ингибировать связывание TGF-β с ALK1, несмотря на то, что оно не ингибирует сильнее связывающиеся лиганды, такие как GDF5 или ВМР9. Описываемые здесь антитела являются предпочтительно рекомбинантными антителами, означающими антитела, экспрессируемые с нуклеиновой кислоты, которая была сконструированы с использованием методов молекулярной биологии, такими как гуманизированные антитела или полностью человеческие антитела, разработанные на основе одноцепочечного антитела. В термин «рекомбинантное антитело» также включены Fv, Fab и одноцепочечные антитела. Антитела могут также быть поликлональными или нерекомбинантными моноклональными антителами (включающими человеческие или мышиные формы, а также антитела человека, получаемые из трансгенных мышей). Антитела и содержащие ECD ALK1 полипептиды можно приготовить в виде фармацевтической композиции, которая по существу не содержит пирогенов. Фармацевтическую композицию можно приготовить для системной доставки (например, внутривенной, внутриартериальной или подкожной доставки) или для местной доставки (например, в глаз).
В некоторых аспектах настоящим описанием предоставляются способы ингибирования развития кровеносных сосудов у млекопитающего путем введения млекопитающему эффективного количества антитела, которое связывается с полипептидом ALK1, описанного здесь в общем или в частности. Применимое для этой цели антитело может связываться с внеклеточным доменом ALK1 (например, связываться с полипептидом, состоящим из аминокислот 22-118 SEQ ID NO: 1) или другой частью ALK1. Антитело может связываться с полипептидом, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, BMP9 и ВМР10. Антитело может связываться с полипептидом ALK1 с KD, составляющей менее 5×10-8 М и необязательно находящейся между 5×10-8 и 1×10-10. Антитело может ингибировать развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. Антитело, которое избирательно ингибирует передачу сигнала, опосредуемую GDF5, 6 и 7, относительно передачи сигнала, опосредуемой ВМР9 или 10, может использоваться в качестве избирательного ингибитора развития кровеносных сосудов, которое происходит в тканях, в которых обнаруживаются GDF5, 6 или 7, главным образом, в кости или суставах. Антитело может связываться с полипептидом ALK1 с KD, составляющей менее 1×10-10 М. Антитело может ингибировать связывание ALK1 с лигандом ALK1, причем лиганд ALK1 выбран из группы, состоящей из ВМР9 и ВМР10. Антитело против ALK1 может доставляться местно (например, в глаз) или системно (например, внутривенно, внутриартериально или подкожно). В конкретном варианте осуществления настоящим описанием предоставляется способ ингибирования развития кровеносных сосудов внутри глаза млекопитающего путем введения антитела против ALK1. В другом конкретном варианте осуществления настоящим описанием предоставляется способ лечения пациентов с множественной миеломой. В конкретном варианте осуществления настоящим описанием предоставляется способ ингибирования развития кровеносных сосудов при нарушениях, которые связаны с патологическим развитием кровеносных сосудов в качестве результата действия множества проангиогенных факторов, таких как VEGF, PDGF и/или FGF.
В некоторых аспектах настоящим описанием предоставляются антитела, которые связываются с описанным здесь лигандом ALK1 и ингибируют связывание лиганда ALK1 с ALK1. Несмотря на нежелание быть связанными с каким-либо конкретным механизмом, предполагают, что антитела, которые связываются с лигандами ALK1, будут оказывать эффекты, которые схожи по природе с эффектами содержащих ECD ALK1 полипептидов, поскольку оба типа агентов связываются с лигандами, а не с самим рецептором. В некоторых вариантах осуществления антитело связывается с лигандом, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. Антитело может связываться с лигандом ALK1 с KD, составляющей менее 5×10-8 М. Антитело может быть выбрано для ингибирования развития кровеносных сосудов, стимулируемого лигандом ALK1. Анализ с использованием САМ является подходящей для отбора желаемых антител системой анализа. Такие антитела являются предпочтительно рекомбинантными антителами и могут быть приготовлены в виде фармацевтической композиции, которая по существу не содержит пирогенов. Фармацевтическую композицию можно приготовить для системной доставки (например, внутривенной, внутриартериальной или подкожной доставки) или для местной доставки (например, в глаз).
В некоторых аспектах настоящим описанием предоставляются антитела, которые связываются с лигандом ALK1 и ингибируют связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из ВМР9 и ВМР10. Антитело может связываться с лигандом ALK1 с KD, составляющей менее 1×10-10 М. Такие антитела являются предпочтительно рекомбинантными антителами и могут быть приготовлены в виде фармацевтической композиции, которая по существу не содержит пирогенов. Фармацевтическую композицию можно приготовить для системной доставки (например, внутривенной, внутриартериальной или подкожной доставки) или для местной доставки (например, в глаз).
В некоторых аспектах настоящим описанием предоставляются способы ингибирования развития кровеносных сосудов у млекопитающего, включающие введения млекопитающему эффективного количества антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10. Антитело может ингибировать развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7.
Члены семейства BMP/GDF, включающие ВМР9, ВМР10, GDF5, GDF6 и GDF7, связываются с рецептором типа I и типа II для того, чтобы образовать функциональный передающий сигнал комплекс. Сайты связывания для этих рецепторов различны. Соответственно, в некоторых вариантах осуществления антитело, которое связывается с лигандом ALK1 и ингибирует связывание лиганда с ALK1, является антителом, которое связывается в сайте связывания с рецептором лиганда типа I или вблизи этого сайта.
В некоторых аспектах настоящим описанием предоставляются способы ингибирования развития кровеносных сосудов у млекопитающего путем введения других ингибиторов описываемой здесь системы передачи сигнала, опосредуемой ALK1. Такие ингибиторы могут включать нуклеиновые кислоты (например, конструкции антисмысловых НК или интерферирующих РНК), которые уменьшают продукцию ALK1, GDF5, GDF6, GDF7, ВМР9 или ВМР10. Можно также использовать множество реагентов для аффинного связывания, таких как аптамеры, произвольные пептиды, каркасные структуры белков, которые можно модифицировать для того, чтобы сделать возможным связывание с выбранными мишенями (примеры таких каркасных структур включают антикалины и домены FNIII), в каждом случае реагенты для аффинного связывания можно было бы выбирать по способности нарушать опосредуемую ALK1 регуляторную систему, описанную здесь, или путем нарушения взаимодействия ALK1-лиганд, или путем ингибирования передачи сигнала, которая происходит после связывания.
В дополнительном варианте осуществления в настоящем описании очерчена роль DAN в качестве регулятора опосредуемой ALK1 регуляторной системы. Как здесь показано, DAN связывается с группой лигандов GDF5, но не связывается с группой лигандов ВМР9. Таким образом, предполагают, что DAN ингибирует развитие кровеносных сосудов, опосредуемое GDF5, GDF6 или GDF7, но не развитие кровеносных сосудов, опосредуемое ВМР9 или ВМР10. Следовательно, DAN можно использовать в качестве избирательного агента для ингибирования развития кровеносных сосудов в кости или суставах, в которых главным образом экспрессируется группа белков GDF5. Таким образом, в некоторых вариантах осуществления настоящим описанием предоставляются белки DAN для применения в качестве антиангиогенных агентов в контексте развития кровеносных сосудов в кости или суставах, в том числе ревматоидного артрита и раков, при которых поражены болезнью кость или суставы (например, множественной миеломы или метастазирования в кость). Белок DAN будет, как правило, связываться с одним или несколькими лигандами ALK1, выбранными из группы, состоящей из GDF5, GDF6 и GDF7, несмотря на то, что он относительно плохо связывается с ВМР9 или ВМР10. Белок DAN может включать аминокислотную последовательность, которая по меньшей мере на 70%, 80%, 90%, 95%, 97%, 99% или 100% идентична последовательности аминокислот, соответствующих аминокислотам 17-180 SEQ ID NO: 10 (зрелого DAN человека) или аминокислотам 21-125 SEQ ID NO: 10 (домена DAN с группой консервативных цистеинов). Белок DAN может также кодироваться нуклеиновой кислотой, включающей последовательность, комплемент которой гибридизуется в жестких условиях гибридизации с нуклеотидами 153-467 SEQ ID NO: 11 и вариантом нуклеотидов 153-467 SEQ ID NO: 11, который имеет такую же кодирующую последовательность («молчащим» вариантом, таким как вариант, содержащий одно или несколько изменений в неоднозначном положении в коде - триплете), или с нуклеотидами 93-635 SEQ ID NO: 11 или его молчащим вариантом. В некоторых аспектах белок DAN является слитым белком, таким как слитый с Fc белок. Несмотря на то, что DAN, как предполагается, особенно полезен для ингибирования развития кровеносных сосудов в кости и суставах (в том числе опухолях, находящихся в кости или суставах, таких как множественная миелома и метастазирование в кость), он может также быть полезен в других контекстах, например, для опухоли, находящейся в другом месте, или для глаза.
В некоторых аспектах настоящим описанием предоставляются способы лечения ревматоидного артрита у млекопитающего, включающие введения млекопитающему, страдающему ревматоидным артритом, эффективного количества агента, выбранного из группы, состоящей из содержащего ECD ALK1 белка; антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; антитела, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; и полипептида DAN.
В некоторых аспектах настоящим описанием предоставляются способы лечения опухоли у млекопитающего. Такой способ может включать введения млекопитающему, имеющему опухоль, эффективного количества агента, выбранного из группы, состоящей из содержащего ECD ALK1 белка; антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; антитела, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; и полипептида DAN. Способ может, кроме того, включать введение второго агента, ингибирующего развитие кровеносных сосудов. Опухолью может быть опухоль, которая связана с костью, такой как лейкоз, опухоль костного мозга, множественная миелома или метастазы в кость, такие как метастазы, обычно сопровождающие рак молочной железы или предстательной железы. Опухолью может также быть опухоль, которая использует множество проангиогенных факторов, такая как опухоль, которая устойчива к анти-VEGF-терапии.
В некоторых аспектах настоящим описанием предоставляются композиции для глаз. Такие композиции могут включать агент, выбранный из группы, состоящей из содержащего ECD ALK1 белка; антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; антитела, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; и полипептида DAN.
В некоторых аспектах настоящим описанием предоставляются способы лечения заболевания глаз, связанного с развитием кровеносных сосудов. Такие способы могут включать введения системно или в указанный глаз фармацевтической композиции, содержащей эффективное количество агента, выбранного из группы, состоящей из содержащего ECD ALK1 белка; антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; антитела, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; и полипептида DAN.
В каждом случае описываемый здесь агент может вводиться в соединении со вторым агентом, ингибирующим развитие кровеносных сосудов. Если желательно ингибировать развитие кровеносных сосудов в опухоли, агент может вводиться в соединении со вторым агентом, который оказывает противораковый эффект, таким как химиотерапевтический агент или биологический противораковый агент.
Настоящим описанием также предоставляется фармацевтическая композиция для глаз, содержащая слитый белок ALK1-Fc, содержащий полипептид, имеющий аминокислотную последовательность, которая идентична последовательности аминокислот 22-118 SEQ ID NO: 1 по меньшей мере на 97%, и слитый с Fc-областью иммуноглобулина, причем слитый белок ALK1-Fc связывается с GDF5, GDF7 и BMP9 с KD, составляющей менее 1×10-7 М, и связывается с TGFβ-1 с KD, превышающей 1×10-6 М. В одном варианте осуществления слитый белок имеет последовательность SEQ ID NO: 3. В одном варианте осуществления Fc-область происходит из IgG1 человека. В одном варианте осуществления слитый белок продуцируется при экспрессии нуклеиновой кислоты SEQ ID NO: 4 в линии клеток млекопитающего. В одном варианте осуществления линией клеток является линия клеток яичника китайского хомячка. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
Настоящей заявкой также предоставляется фармацевтическая композиция для глаз, содержащая антитело, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10. В одном варианте осуществления антитело ингибирует развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. В одном варианте осуществления антитело связывается с полипептидом ALK1 с KD, составляющей менее 5×10-8 М. В другом варианте осуществления антитело связывается с полипептидом ALK1 с KD, составляющей менее 1×10-10 М. В одном варианте осуществления антитело ингибирует развитие кровеносных сосудов, стимулируемое GDF5, GDF6, GDF7, ВМР9 или ВМР10. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
В некоторых аспектах настоящим описанием предоставляется фармацевтическая композиция для глаз, содержащая антитело, которое связывается с лигандом ALK1, описанным здесь, и ингибирует связывание лиганда ALK1 с ALK1. В некоторых вариантах осуществления антитело связывается с лигандом, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. Антитело может связываться с лигандом ALK1 с KD, составляющей менее 5×10-8 М. Антитело может быть выбрано для ингибирования развития кровеносных сосудов, стимулируемого лигандом ALK1. Анализ с использованием САМ является подходящей для отбора желаемых антител системой анализа. Такие антитела являются предпочтительно рекомбинантными антителами. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
Настоящей заявкой также предоставляется способы лечения заболевания глаз, связанного с развитием кровеносных сосудов, включающие введение в указанный глаз фармацевтической композиции для глаз, содержащей слитый белок ALK1-Fc, включающий в себя полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 97% идентична последовательности аминокислот 22-118 SEQ ID NO: 1, и слитый с Fc-областью иммуноглобулина, причем слитый белок ALK1-Fc связывается с GDF5, GDF7 и BMP9 с KD, составляющей менее 1×10-7 М, и связывается с TGFβ-1 с KD, превышающей 1×10-6 М. В одном варианте осуществления слитый белок имеет последовательность SEQ ID NO: 3. В одном варианте осуществления Fc-область происходит из IgG1 человека. В одном варианте осуществления слитый белок продуцируется при экспрессии нуклеиновой кислоты SEQ ID NO: 4 в линии клеток млекопитающего. В одном варианте осуществления линией клеток является линия клеток яичника китайского хомячка. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
Настоящей заявкой также предоставляются способы лечения заболевания глаз, связанного с развитием кровеносных сосудов, включающие введение в указанный глаз фармацевтической композиции для глаз, содержащей антитело, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10. В одном варианте осуществления антитело ингибирует развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. В одном варианте осуществления антитело связывается с полипептидом ALK1 с KD, составляющей менее 5×10-8 М. В другом варианте осуществления антитело связывается с полипептидом ALK1 с KD, составляющей менее 1×10-10 М. В одном варианте осуществления антитело ингибирует развитие кровеносных сосудов, стимулируемое GDF5, GDF6, GDF7, ВМР9 или ВМР10. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
В одном варианте осуществления раскрытых способов заболевание глаз, связанное с развитием кровеносных сосудов, выбран из группы, состоящей из опухоли, устойчивой к анти-VEGF-терапии опухоли, опухоли в виде множественной миеломы, опухоли, которая метастазировала в кость, воспаления сустава или кости, ревматоидного артрита, диабетической ретинопатии, синдрома Терри, дегенерации желтого пятна, отторжения трансплантированной ткани роговицы, неоваскулярной глаукомы и ретролентальных фиброплазий.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 приведена аминокислотная последовательность подобной рецептору активина киназы I (ALK1) человека (SEQ ID NO: 1). Однократное подчеркивание показывает предсказываемый внеклеточный домен. Двойное подчеркивание показывает внутриклеточный домен. Сигнальный пептид и трансмембранный домен не подчеркнуты.
На фиг. 2 приведена последовательность нуклеиновой кислоты ALK1 человека кДНК (SEQ ID NO: 2). Кодирующая последовательность подчеркнута. Часть, кодирующая внеклеточный домен, подчеркнута дважды.
На фиг. 3 приведен пример слияния внеклеточного домена ALK1 человека с Fc-областью (SEQ ID NO: 3). Белок hALK1-Fc включает аминокислоты 22-120 ALK1 человека, слитые на С-конце с линкером (не подчеркнут) и Fc-областью IgG1.
На фиг. 4 приведена последовательность нуклеиновой кислоты для экспрессии полипептида hALK1-Fc SEQ ID NO: 3. Также показана кодируемая аминокислотная последовательность. Лидерная последовательность отщепляется таким образом, что Asp22 является N-концевой аминокислотой секретируемого белка.
На фиг. 5 показан антиангиогенный эффект mALK1-Fc («RAP») и hALK1-Fc («ACE») при анализе образования трубок из эндотелиальных клеток. Все концентрации RAP и ACE снижали уровень образования трубок в ответ на вспомогательное средство для роста эндотелиальных клеток (ECGS) в большей степени, чем положительный контроль, эндостатин.
На фиг. 6 показан ангиогенный эффект GDF7 в анализе с использованием хориоаллантоисной оболочки цыпленка (САМ). Эффект GDF7 сравним с эффектом VEGF.
На фиг. 7 продемонстрирован антиангиогенный эффект слитого белка hALK1-Fc в анализе с использованием САМ. hALK1-Fc ингибирует развитие кровеносных сосудов, стимулируемое VEGF, FGF и GDF7.
На фиг. 8 продемонстрированы сравнительные антиангиогенные эффекты mALK1-Fc, hALK1-Fc имеющегося в продаже моноклонального антитела против ALK1 (мАт против ALK1) и имеющегося в продаже нейтрализующего моноклонального антитела против VEGF. Антиангиогенный эффект конструкций ALK1-Fc сравним с эффектами антитела против VEGF.
На фиг. 9 продемонстрированы антиангиогенные эффекты hALK1-Fc и антитела против VEGF in vivo. hALK1-Fc и антитела против VEGF оказывали сравнимые эффекты на развитие кровеносных сосудов внутри глаза, определяемое с помощью анализа с использованием микрокармана в роговице мыши.
На фиг. 10 продемонстрированы эффекты mALK1-Fc в модели ревматоидного артрита в виде индуцируемого коллагеном артрита на мышах. Диаграмма показывает средние групповые показатели артрита, определяемые в течение 42-дневного периода наблюдения у самцов мышей с индуцированным коллагеном артритом DBA/1. RAP-041 представляет собой mALK1-Fc. AvastinTM представляет собой антитело против VEGF бевацизумаб.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. Обзор
ALK1 является рецептором клеточной поверхности типа I для надсемейства лигандов TGF-β и также известен как ACVRL1 или ACVRLK1. Под ALK1 подразумевали рецептор для TGF-β1, TGF-β3 и ВМР9 (Marchuk et al., Hum. Mol. Genet. 2003; Brown et al., J. Biol. Chem. 2005 Jul. 1; 280(26): 25111-8).
У мышей мутации в ALK1, приводящие к утрате его функции, приводят к множеству патологий в развивающейся сосудистой сети (Oh et al., Proc. Natl. Acad. Sci. USA 2000, 97, 2626-2631; Urness et al., Nat. Genet. 2000, 26, 328-331).
У людей мутации в ALK1, приводящие к утрате его функции, сопровождаются наследственной геморрагической телеангиэктазией (ННТ или болезнью Ослера-Рендю-Вебера), при которой у пациентов развиваются артериовенозные мальформации, которые создают прямой поток (связь) из артерии в вену (артериовенозный шунт) без промежуточного капиллярного русла. Типичные симптомы пациентов с ННТ включают повторяющееся носовое кровотечение, желудочно-кишечное кровотечение, кожные и слизисто-кожные телеангиэктазии и артериовенозные мальформации (AVM) в легочной, мозговой или печеночной сосудистой сети.
В недавних публикациях David et al. (Blood. 2007 Mar 1; 109(5): 1953-61) и Scharpfenecker et al. (J. Cell Sci. 2007 Mar. 15l 120(Pt 6); 964-72) делается вывод, что ВМР9 и ВМР10 активируют ALK1 в эндотелиальных клетках, и что результатом такой активации является ингибирование пролиферации и миграции эндотелиальных клеток. Эти эффекты прямо противоположны эффектам проангиогенных факторов, таких как VEGF. Таким образом, в этих публикациях делается вывод, что ВМР9 и ВМР10 являются сами антиангиогенными факторами, и, кроме того, что активация ALK1 оказывает антиангиогенный эффект. Напротив, в настоящем описании демонстрируется, что антагонисты, а не агонисты, ВМР9 и ВМР10 оказывают антиангиогенный эффект.
Настоящее описание относится к обнаружению того, что полипептиды, включающие часть внеклеточного домена ALK1, («содержащие ECD ALK1 полипептиды») могут использоваться для ингибирования развития кровеносных сосудов in vivo, в том числе VEGF-независимого развития кровеносных сосудов и развития кровеносных сосудов, которое опосредуется множеством ангиогенных факторов, включающих VEGF, FGF и PDGF. Частично в настоящем описании опознаются физиологические лиганды с высокими аффинностями для ALK1, и демонстрируется, что содержащие ECD ALK1 полипептиды ингибируют развития кровеносных сосудов. Данные демонстрируют, что содержащий ECD ALK1 полипептид может оказывать антиангиогенный эффект даже в случае, когда содержащий ECD ALK1 полипептид не демонстрирует значимое связывание с TGF-β1. Более того, содержащие ECD ALK1 полипептиды ингибируют развитие кровеносных сосудов, стимулируемое многими различными проангиогенными факторами, включающими VEGF, FGF и PDGF. Таким образом, настоящим описанием обеспечивается описание опосредуемой ALK1 регуляторной системы, в которой ALK1 является рецептором для группы лигандов GDF5, которая включает GDF6 и GDF7, а также для группы лигандов ВМР9, которая включает ВМР10, с различными аффинностями для двух групп лигандов. Кроме того, в настоящем описании демонстрируется, что опосредуемая ALK1 и описанными здесь лигандами передача сигналов является проангиогенной in vivo, и что ингибирование этой регуляторной системы оказывает сильный антиангиогенный эффект in vivo. Таким образом, в некоторых аспектах настоящим описанием предоставляются антагонисты опосредуемой ALK1 регуляторной системы, включающие антагонисты рецептора или одного или нескольких лигандов, для применения для ингибирования развития кровеносных сосудов, в том числе VEGF-зависимого развития кровеносных сосудов и VEGF-независимого развития кровеносных сосудов. Однако следует отметить, что антитела, направленные против самого ALK1, как предполагают, оказывают эффекты, отличные от эффектов содержащего ECD ALK1 полипептида. Можно было бы ожидать, что пан-нейтрализующее антитело против ALK1 (антитело, ингибирующее связывание всех сильных и слабых лигандов) будет ингибировать передачу сигнала от таких лигандов через ALK1, но нельзя было бы ожидать, что оно будет ингибировать способность таких лигандов передать сигнал через другие рецепторы (например, BMPR1a, BMPR1b, BMPRII в случае GDF5-7 и BMP9-10 и TBRI и TBRII в случае TGF-β). С другой стороны можно было бы ожидать, что содержащий ECD ALK1 полипептид будет ингибировать все лиганды, с которыми он сильно связывается, включающие, например, такую конструкцию, которая продемонстрирована в примерах, GDF5-7 и BMP9-10, но он не мог бы оказывать влияние на лиганды, с которыми он связывается слабо, такие как TGF-β. Значит, несмотря на то, что пан-нейтрализующее антитело против ALK1 могло бы блокировать передачу сигнала от ВМР9 и TGF-β через ALK1, оно не могло бы блокировать передачу сигнала от ВМР9 и TGF-β через другой рецептор, и, несмотря на то, что содержащий ECD ALK1 полипептид может ингибировать передачу сигнала от ВМР9 через все рецепторы (даже рецепторы, отличные от ALK1), нельзя было бы ожидать, что он будет ингибировать передачу сигнала от TGF-β через любой рецептор, даже ALK1.
Описываемые здесь белки являются человеческими формами, если не указано иное. Номерами белков в Genbank являются следующие номера: GDF5 человека, CAA56874; GDF6 человека, AAH43222; GDF7 человека, NP_878248; BMP9 человека, Q9UK05; BMP10 человека, O95393; DAN человека, BAA92265. Последовательности ALK1 представлены на фиг. 1-5.
Аминокислотная последовательность DAN человека (SEQ ID NO: 10) (GenBank BAA92265):

Предполагается, что зрелый белок DAN соответствует аминокислотам 17-180. Домен с группой консервативных цистеинов DAN соответствует аминокислотам 21-125 (подчеркнутым).
Последовательность кДНК DAN человека (SEQ ID NO: 11) (GenBank BC012037):


Кодирующая предшественник DAN последовательность соответствует нуклеотидам 93-635. Кодирующая зрелый белок DAN последовательность соответствует нуклеотидам 141-632. Кодирующая домен с группой консервативных цистеинов DAN последовательность соответствует нуклеотидам 153-467.
Используемые в этом описании термины, как правило, имеют значения, обычные в данной области техники, в контексте этого описания и в конкретном контексте, в которых используется этот термин. Некоторые термины обсуждаются в настоящем описании для предоставления специалисту-практику дополнительного руководства к описанию раскрытых здесь композиций и способов и к тому, каким образом их изготовить и применять. Объем или значение любого использования термина будет очевиден из конкретного контекста, в котором используется термин.
2. Растворимые полипептиды ALK1
Встречающиеся в природе белки ALK1 являются трансмембранными белками, при этом часть белка локализуется вне клетки (внеклеточная часть), а часть белка локализуется внутри клетки (внутриклеточная часть). Аспекты настоящего описания охватывают полипептиды, включающие часть внеклеточного домена ALK1.
В некоторых вариантах осуществления настоящим описанием предоставляются «содержащие ECD ALK1 полипептиды». Подразумевается, что термин «содержащий ECD ALK1 полипептид» относится к полипептиду, состоящему из или включающему аминокислотную последовательность внеклеточного домена встречающегося в природе полипептида ALK1, или с, или без какой-либо сигнальной последовательности и последовательности, N-концевой относительно сигнальной последовательности, или аминокислотную последовательность, которая по меньшей мере на 33 процента идентична последовательности внеклеточного домена встречающегося в природе полипептида ALK1, и необязательно по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или на 100% идентична последовательности внеклеточного домена встречающегося в природе полипептида ALK1, иллюстрируемой участком с группой цистеинов, состоящим из аминокислот 34-95 SEQ ID: 1, или участком с группой цистеинов плюс дополнительные аминокислоты на N- или С-конце внеклеточного домена, таким как аминокислоты 22-118 SEQ ID: 1. Подобным образом, содержащий ECD ALK1 полипептид может включать полипептид, который кодируется нуклеотидами 100-285 SEQ ID: 2 или их молчащими вариантами, или нуклеиновыми кислотами, которые гибридизуются с их комплементом в жестких условиях гибридизации (как правило, такие условия известны в данной области техники, но могут, например, включать гибридизацию в 50% (в объемном отношении) формамиде, 5× SSC, 2% (в отношении веса к объему) блокирующем агенте, 0,1% N-лауроилсаркозине, 0,3% SDS при 65ºС в течение ночи и отмывку, например, в 5× SSC при приблизительно 65ºС). Кроме того, содержащий ECD ALK1 полипептид может включать полипептид, который кодируется нуклеотидами 64-384 SEQ ID: 2 или их молчащими вариантами, или нуклеиновыми кислотами, которые гибридизуются с их комплементом в жестких условиях гибридизации (как правило, такие условия известны в данной области техники, но могут, например, включать гибридизацию в 50% (в объемном отношении) формамиде, 5× SSC, 2% (в отношении веса к объему) блокирующем агенте, 0,1% N-лауроилсаркозине, 0,3% SDS при 65ºС в течение ночи и отмывку, например, в 5× SSC при приблизительно 65οС). Соответственно, термином «содержащий ECD ALK1 полипептид» охватываются выделенные внеклеточные части полипептидов ALK1, их варианты (включающие варианты, которые включают, например, не более 2, 3, 4, 5 или 10 замен, добавлений или делеций аминокислот в последовательности, соответствующей аминокислотам 22-118 SEQ ID: 1, и включающие варианты, которые включают не более 2, 3, 4, 5 или 10 замен, добавлений или делеций аминокислот в последовательности, соответствующей аминокислотам 34-95 SEQ ID: 1), их фрагменты и слитые белки, включающие любую из частей, вариантов или фрагментов предшествующего описания, но в каждом случае предпочтительно, чтобы любой из вышеприведенных содержащих ECD ALK1 полипептидов сохранял значительную аффинность в отношении одного или нескольких следующих лигандов: GDF5, GDF6, GDF7, BMP9 или BMP10. Однозначно подразумевается, что термин «содержащий ECD ALK1 полипептид» исключает любой полноразмерный, встречающийся в природе полипептид ALK1. Как правило, содержащий ECD ALK1 полипептид будет конструироваться так, чтобы он был растворим в водных растворах при биологически релевантных температурах, уровнях рН и осмотической концентрации раствора.
Как описано выше, настоящим описанием предоставляются содержащие ECD ALK1 полипептиды, последовательность которых имеет определенную степень идентичности или схожести с последовательностью встречающегося в природе полипептида ALK1. Для определения идентичности в процентах двух аминокислотных последовательностей последовательности совмещают с целью оптимального сравнения (например, для оптимального совмещения в одну или обе из первой и второй аминокислотных последовательностей или последовательностей нуклеиновых кислот могут быть введены пропуски, а не являющиеся гомологичными последовательности могут не приниматься во внимание для целей сравнения). Затем сравнивают аминокислотные остатки в соответствующих положениях аминокислот. Когда положение в первой последовательности занято аминокислотным остатком, одинаковым с аминокислотным остатком в соответствующем положении во второй последовательности, тогда молекулы являются идентичными в этом положении (как здесь используется, «идентичность» аминокислот эквивалента «гомологии» аминокислот). Идентичность в процентах двух последовательностей является функцией числа идентичных положений, разделяемых последовательностями, принимая во внимание число пропусков и длину каждого пропуска, который необходимо ввести для получения оптимального совмещения двух последовательностей.
Сравнение последовательностей и определение идентичности и схожести в процентах двух последовательностей можно выполнить, используя математический алгоритм (Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; and Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds, M. Stockton Press, New York, 1991).
В одном варианте осуществления идентичность в процентах двух аминокислотных последовательностей определяют, используя алгоритм Needleman и Wunsch (J. Mol. Biol. (48): 444-453 (1970)), который включен в программу GAP в пакете программ GCG (доступном на сайте http://www.gcg.com). В конкретном варианте осуществления в программе GAP используются следующие параметры: или матрицу Blosum 62, или матрицу PAM250 и весовой показатель пропуска, составляющий 16, 14, 12, 10, 8, 6 или 4, и весовой показатель длины, составляющий 1, 2, 3, 4, 5 или 6. В еще одном варианте осуществления идентичность в процентах двух нуклеотидных последовательностей определяют, используя программу GAP в пакете программ GCG (Devereux, J., et al., Nucleic Acids Res. 12(1): 387 (1994) (доступном на сайте http://www.gcg.com). Примерные параметры включают использование матрицы NWSgapdna.CMP и весового показателя пропуска, составляющего 40, 50, 60, 70 или 80, и весового показателя длины, составляющего 1, 2, 3, 4, 5 или 6. Если не задано иное, идентичность в процентах двух аминокислотных последовательность должна определяться с использованием программы GAP, используя матрицу Blosum 62, весовой показатель пропуска, составляющий 10, и весовой показатель длины, составляющий 3, и, если такой алгоритм не может вычислить желаемый процент идентичности, следует выбрать подходящий альтернативный алгоритм, описанный здесь.
В другом варианте осуществления идентичность в процентах двух аминокислотных последовательностей определяют, используя алгоритм E. Myers и W. Miller (CABIOS, 4: 11-17 (1989)), который включен в программу ALIGN (версии 2,0), используя таблицу остатков по весовым показателям РАМ120, штраф за длину пропуска - 12 и штраф на пропуск - 4.
Другой вариант для определения наилучшего общего совмещения двух аминокислотных последовательный можно определить, используя компьютерную программу FASTDB, основанную на алгоритме Brutlag et al. (Comp. App. Biosci., 6: 237-245 (1990)). При совмещении последовательностей и последовательность запроса, и рассматриваемая здесь последовательность являются аминокислотными последовательностями. Результат указанного общего совмещения последовательностей представляют в виде идентичности в процентах. В одном варианте осуществления идентичность аминокислотных последовательностей определяют, используя компьютерную программу FASTDB, основанную на алгоритме Brutlag et al. (Comp. App. Biosci., 6: 237-245 (1990)). В конкретном варианте осуществления параметры, используемые для расчета идентичности и схожести в процентах при совмещении аминокислотных последовательностей, включают: матрицу = РАМ 150, k-кортеж = 2, штраф за несоответствие = 1, штраф за соединение = 20, число элементов в группе рандомизации = 0, граница отсечения = 1, штраф за пропуск = 5 и штраф за размер пропуска = 0,05.
В некоторых вариантах осуществления содержащие ECD ALK1 полипептиды включают внеклеточную часть встречающегося в природе белка ALK1, такого как последовательность SEQ ID NO: 1, и предпочтительно лигандсвязывающую часть внеклеточного домена ALK1. В некоторых вариантах осуществления растворимый полипептид ALK1 включает аминокислотную последовательность, которая по меньшей мере на 60%, 70%, 80%, 85%, 90%, 95%, 97% или 99% идентична последовательности аминокислот 22-118 SEQ ID NO: 1. В некоторых вариантах осуществления усеченный внеклеточный полипептид ALK1 включает по меньшей мере 30, 40 или 50 следующих одна за другой аминокислот аминокислотной последовательности внеклеточной части SEQ ID NO: 1.
В предпочтительных вариантах осуществления содержащий ECD ALK1 полипептид связывается с одним или несколькими лигандами: GDF5, GDF6, GDF7, BMP9 и BMP10. Необязательно полипептид ALK1 не демонстрирует значительное связывание с TGF-β1 или TGF-β3. Связывание можно определить, используя очищенные белки в растворе или в системе поверхностного плазмонного резонанса, такой как система BiacoreTM. Предпочтительные растворимые полипептиды ALK1 будут проявлять антиангиогенную активность. Количественные определения ингибиторной в отношении развития кровеносных сосудов активности включают анализ с использованием хориоаллантоисной оболочки цыпленка (САМ), анализ с использованием микрокармана в роговице мыши, анализ для измерения эффекта введения выделенных или синтезированных белков на имплантированные опухоли. Анализ с использованием САМ описан O'Reilly et al. в “Angiogenic Regulation of Metastatic Growth” Cell, vol. 79 (2), Oct. 1, 1994, pp. 315-328. Вкратце, трехдневные куриные эмбрионы с неповрежденными желтками выделяют из яиц и помещают в чашку Петри. Через 3 дня инкубации метилцеллюлозный диск, содержащий проверяемый белок, накладывают на САМ отдельных эмбрионов. Через 48 часов инкубации проводят исследование эмбрионов и САМ для определения того, произошло ли ингибирование эндотелиального роста. Анализ с использованием микрокармана в роговице мыши включает имплантацию содержащего факторы роста шарика вместе с другим шариком, содержащим предполагаемый ингибитор эндотелиального роста, в роговицу мыши и проведение исследования рисунка капилляров, которые создаются в роговице. Другие анализы описываются в примерах.
Содержащие ECD ALK1 полипептиды можно получить удалением цитоплазматического хвоста и трансмембранного участка полипептида ALK1. В альтернативном случае трансмембранный домен можно подвергнуть инактивации с помощью делеции или замены гидрофобных в нормальных условиях аминокислотных остатков, которые включает трансмембранный домен, гидрофильными остатками. В любом из двух случаев создается в значительной степени гидрофильный профиль гидрофобности, который будет уменьшать сродство к липидам и увеличивать растворимость в воде. Делеция трансмембранного домена предпочтительнее замены гидрофильными аминокислотными остатками, поскольку при ней исключается введение потенциально иммуногенных эпитопов.
Содержащие ECD ALK1 полипептиды могут дополнительно включать любое число широко известных лидерных последовательностей на N-конце. Такая последовательность могла бы сделать возможным то, что пептиды будут экспрессироваться и направляться по пути секреции в эукариотической системе. См., например, Ernst et al., патент США № 5082783 (1992). В альтернативном случае можно использовать природную сигнальную последовательность ALK1 для осуществления экструзии из клетки. Возможные лидерные последовательности включают природную сигнальную последовательность ALK1, tPa и лидерные последовательности меллитина медоносных пчел (SEQ ID NO: 7-9, соответственно). Процессирование сигнальных пептидов может варьировать в зависимости от выбранной лидерной последовательности, используемого типа клеток и условий культивирования, среди прочих переменных, и поэтому действительные N-концевые стартовые места для зрелых содержащих ECD ALK1 полипептидов, включающих полипептид SEQ ID NO: 5, могут быть сдвинуты на 1-5 аминокислот в N-концевом или С-концевом направлении.
В некоторых вариантах осуществления настоящим описанием предусматриваются специфические мутации полипептидов ALK1 для того, чтобы изменить гликозилирование полипептида. Такие мутации можно выбрать, чтобы ввести или исключить один или несколько сайтов гликозирования, таких как сайты гликозилирования с О-присоединением или N-присоединением. Узнаваемые сайты при гликозилировании с присоединением к аспарагинам обычно включают трипептидную последовательность, аспарагин-Х-треонин (или аспарагин-Х-серин) (где «Х» является любой аминокислотой), которая специфически узнается соответствующими клеточными ферментами гликозилирования. Изменение можно также осуществить путем добавления одного или нескольких остатков серинов или треонинов, или путем замены ими, в последовательность полипептида ALK1 дикого типа (для сайтов гликозилирования с О-присоединением). Множество аминокислотных замен или делеций в одном или обоих из первого или третьего положения узнаваемого при гликозилировании сайта (и/или делеции аминокислоты во втором положении) приводят к негликозилированию в модифицированной трипептидной последовательности. Другим способом увеличения числа углеводных составляющих в полипептиде ALK1 является способ с использованием химического или фермантативного соединения гликозидов с полипептидом ALK1. В зависимости от используемого способа соединения сахар(а) можно присоединить к (а) аргинину и гистидину; (b) свободным карбоксильным группам; (с) свободным сульфгидрильным группам, таким как сульфгидрильные группы цистеина, (d) свободным гидроксильным группам, таким как гидроксильные группы серина, треонина или гидроксипролина, (е) ароматическим остаткам, таким как ароматические остатки фенилаланина, тирозина или триптофана, или (f) амидной группе глютамина. Эти способы описываются в заявке WO 87/05330, опубликованной 11 сентября 1987, и в Aplin and Wriston (1981) CRC Crit. Rev. Biochem., pp. 259-306, которые включены сюда посредством ссылки. Удаление одной или нескольких углеводных составляющих, присутствующих на полипептиде ALK1, можно выполнить химически и/или ферментативно. Химическое дегликолизирование может включать, например, подвергание полипептида ALK1 воздействию соединения трифторметансульфокислоты или эквивалентного соединения. Эта обработка приводит к отщеплению большинства или всех сахаров, кроме соединительного сахара (N-ацетилглюкозамина или N-ацетилгалактозамина) без повреждения аминокислотной последовательности. Химическое дегликозилирование дополнительно описывается Hakimuddin et al. (1987) Arch. Biochem. Biophys. 259: 52 и Edge et al. (1981) Anal. Biochem. 118: 131. Ферментативное отщепление углеводных составляющих на полипептиде ALK1 можно успешно выполнить с помощью использования ряда эндо- и экзогликозидаз, как описано Thotakura et al. (1987) Meth. Enzymol. 138: 350. Последовательность полипептида ALK1 можно привести, соответствующим образом, в соответствие с используемым типом экспрессионной системы, поскольку клетки млекопитающих, дрожжей, насекомых и растений могут представлять отличающиеся типы гликозилирования, на которые может оказывать влияние аминокислотная последовательность пептида. Как правило, белки ALK1 для применения для людей будут экспрессировать в линии клеток млекопитающего, которая обеспечивает соответствующее гликозилирование, такой как линии клеток НЕК293 или СНО, хотя предполагают, что другие линии клеток млекопитающих для экспрессии, линии дрожжевых клеток с сконструированными ферментами гликозилирования и клетки насекомых будут также пригодны.
Этим описанием, кроме того, предусматривается способ создания мутантов, в частности, множества комбинаторных мутантов полипептида ALK1, а также мутантов с усечениями; пулы комбинаторных мутантов особенно полезны для идентификации функциональных вариантных последовательностей. Целью скринирования таких комбинаторных библиотек может быть создание, например, вариантов полипептида ALK1, которые могут действовать или в качестве агонистов, или в качестве антагонистов, или, в альтернативном случае, которые все одновременно обладают новыми активностями. Множество скрининговых исследований предоставлено ниже, и такие исследования могут использоваться для оценки вариантов. Например, вариант полипептида ALK1 можно проскринировать на способность связываться с лигандом ALK1, предотвращать связывание лиганда ALK1 с полипептидом ALK1 или мешать передаче сигнала, вызываемой лигандом ALK1. Активность полипептида ALK1 или его вариантов можно также проверить в анализе на основе клеток или in vivo анализе, в частности, в любом из анализов, описанных в примерах.
Можно создать комбинаторно получаемые варианты, которые обладают избирательной или обычно увеличенной активностью относительно содержащего ECD ALK1 полипептида, включающего внеклеточный домен встречающегося в природе полипептида ALK1. Подобным образом, мутагенез может дать начало вариантам, которые имеют полупериоды существования в сыворотке, значительно отличающиеся от соответствующих полупериодов содержащего ECD ALK1 полипептида дикого типа. Например, измененный белок может оказаться или более устойчивым, или менее устойчивым к протеолитической деградации или другим процессам, которые приводят к деструкции, или иначе элиминации, или инактивации природного содержащего ECD ALK1 полипептида. Такие варианты и кодирующие их гены можно использовать для изменения уровней содержащих ECD ALK1 полипептидов путем модулирования полупериода существования полипептидов ALK1. Например, короткий полупериод существования может вызывать более кратковременные биологические эффекты и может сделать возможным более сильный контроль уровней рекомбинантных содержащих ECD ALK1 полипептидов у пациента. В слитом с Fc белке мутации могут быть осуществлены в линкере (если он имеется) и/или в Fc-области для изменения полупериода существования белка.
Комбинаторную библиотеку можно получить в виде вырожденной библиотеки генов, кодирующей библиотеку полипептидов, каждый из которых включает по меньшей мере часть последовательностей возможных полипептидов ALK1. Например, смесь синтетических олигонуклеотидов можно ферментативно лигировать в последовательности генов из условия, чтобы вырожденное множество нуклеотидных последовательностей для возможных полипептидов ALK1 можно было экспрессировать в виде отдельных полипептидов, или, альтернативно, в виде множества более больших слитых белков (например, для фагового дисплея).
Существует много способов, с помощью которых можно создать библиотеку возможных содержащих ECD ALK1 вариантов на основе вырожденной последовательности олигонуклеотида. Химический синтез вырожденной последовательности гена можно выполнить в автоматизированном ДНК-синтезаторе, и синтетические гены затем можно лигировать в соответствующий вектор для экспрессии. Синтез вырожденных олигонуклеотидов широко известен в данной области техники (см., например, Narang, SA (1983) Tetrahedron 39: 3; Itakura et al., (1981) Recombinant DNA, Proc 3rd Cleveland Sympos. Macromolecules, ed. AG Walton, Amsterdam: Elsevier pp273-289; Itakura et al., (1984) Annu. Rev. Biochem. 53: 323; Itakura et al., (1984) Science 198: 1056; Ike et al., (1983) Nucleic Acid Res. 11: 477). Такие методы использовались в направленной эволюции других белков (см., например, Scott et al., (1990) Science 249: 386-390; Roberts et al., (1992) PNAS USA 89: 2429-2433; Devlin et al., (1990) Science 249: 404-406; Cwirla et al., (1990) PNAS USA 87: 6378-6382, а также в патентах США № 5223409, 5198346 и 5096815).
В альтернативном случае можно использовать другие формы мутагенеза для создания комбинаторной библиотеки. Например, варианты полипептида ALK1 можно создать и выделить из библиотеки путем скринирования, например, с использованием сканирующего аланином мутагенеза и т.п. (Ruf et al., (1994) Biochemistry 33: 1565-1572; Wang et al., (1994) J. Biol. Chem. 269: 3095-3099; Balint et al., (1993) Gene 137: 109-118; Grodberg et al., (1993) Eur. J. Biochem. 218: 597-601; Nagashima et al., (1993) J. Biol. Chem. 268: 2888-2892; Lowman et al., (1991) Biochemistry 30: 10832-10838; Cunningham et al., (1989) Science 244: 1081-1085), сканирующего линкером мутагенеза (Gustin et al., (1993) Virology 192: 653-660; Brown et al., (1992) Mol. Cell Biol. 12: 2644-2652; McKnight et al., (1982) Science 232: 316), насыщающего мутагенеза (Meyers et al., (1986) Science 232: 613), мутагенеза с использованием ПЦР (Leung et al., (1989) Method Cell Mol. Biol. 1: 11-19) или неспецифического мутагенеза, в том числе химического мутагенеза, и т.п. (Miller et al., (1992) A Short Course in Bacterial Genetics, CSHL Press, Cold Spring Harbor, NY, Greener et al., (1994) Strategies in Mol. Biol. 7: 32-34). Сканирующий линкером мутагенез, в частности, в комбинаторной установке, является привлекательным способом идентификации усеченных (биоактивных) форм полипептидов ALK1.
Широкий ряд методов известен в данной области техники для скринирования продуктов генов комбинаторных библиотек, созданных путем точечных мутаций или усечений, и, в этом отношении, для скринирования библиотек кДНК на продукты генов, имеющие определенное свойство. Такие методы можно, как правило, адаптировать для быстрого скрининга библиотек генов, созданных с помощью комбинаторного мутагенеза полипептидов ALK1. Наиболее широко используемые методы скринирования больших библиотек генов обычно включают клонирование библиотеки генов в реплицируемые экспрессионные векторы, трансформацию соответствующих клеток результирующей библиотекой векторов и экспрессию комбинаторных генов в условиях, при которых обнаружение желаемой активности способствует относительно нетрудному выделению вектора, кодирующего ген, продукт которого обнаружен. Предпочтительные анализы включают анализы связывания с лигандом ALK1 и анализы передачи сигнала в клетке, опосредуемой лигандом.
В некоторых вариантах осуществления содержащие ECD ALK1 полипептиды настоящего описания могут, кроме того, включать посттрансляционные модификации, помимо любой из тех модификаций, которые природно присутствуют в полипептидах ALK1. Такие модификации включают, но без ограничения, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидизацию и ацилирование. В результате модифицированные содержащие ECD ALK1 полипептиды могут содержать не являющиеся аминокислотами элементы, такие как полиэтиленгликоли, липиды, поли- или моносахарид и фосфаты. Эффекты таких не являющихся аминокислотами элементов на функцию содержащего ECD ALK1 полипептида можно проверить, как здесь описывается для других вариантов содержащего ECD ALK1 полипептида. Когда содержащий ECD ALK1 полипептид продуцируется в клетках путем расщепления находящейся в процессе образования формы полипептида ALK1, посттрансляционный процессинг может также быть важен для правильной укладки и/или функции белка. Различные клетки (такие как CHO, HeLa, MDCK, 293, WI38, NIH-3T3 или HEK293) имеют специфический клеточный аппарат и характерные механизмы для таких посттрансляционных активностей, и их можно выбрать для обеспечения правильной модификации и процессирования полипептидов ALK1.
В некоторых аспектах функциональные варианты или модифицированные формы содержащих ECD ALK1 полипептидов включают слитые белки, имеющие по меньшей мере часть содержащих ECD ALK1 полипептидов и один или несколько составных доменов. Широко известные примеры таких составных доменов включают, но без ограничения, полигистидин, Glu-Glu, глютатион-S-трансферазу (GST), тиоредоксин, белок А, белок G, константную область тяжелой цепи иммуноглобулина (Fc), мальтозосвязывающий белок (МВР) или сывороточный альбумин человека. Составной домен можно выбрать с тем, чтобы придать желаемое свойство. Например, некоторые составные домены особенно полезны для выделения слитых белков с помощью аффинной хроматографии. С целью аффинной очистки используют релевантные матрицы для аффинной хроматографии, такие как соединенные с глютатионом, амилазой и никелем или кобальтом смолы. Многие из таких матриц имеются в продаже в форме «набора», такой как система для GST-очистки Pharmacia и система QIAexpressTM (Qiagen), применимая со слитыми с (HIS6) элементами процесса очистки. В качестве другого примера составной домен можно выбрать с тем, чтобы облегчить обнаружение содержащих ECD ALK1 полипептидов. Примеры таких детектируемых доменов включают различные флуоресцентные белки (например, GFP), а также «эпитопные метки», которые обычно представляют собой короткие пептидные последовательности, для которых имеется специфическое антитело. Широко известные эпитопные метки, для которых легко доступны специфические моноклональные антитела, включают метки FLAG, гемагглютинин вируса гриппа (НА) и c-myc. В некоторых случаях составные домены имеют сайты расщепления протеазами, такими как фактор Ха или тромбин, которые делают возможным частичный гидролиз релевантной протеазой слитых белков и, таким образом, высвобождение рекомбинантных белков от них. Высвободившиеся белки можно затем отделить от составного домена с помощью последующего хроматографического разделения. В некоторых предпочтительных вариантах осуществления содержащий ECD ALK1 полипептид сливают с доменом, который стабилизирует полипептид ALK1 in vivo (доменом-«стабилизатором»). Под стабилизацией подразумевается все, что увеличивает полупериод существования в сыворотке, независимо от того, является ли это результатом уменьшения деструкции, уменьшения клиренса почками или другого фармакокинетического эффекта. Известно, что слияния с Fc-областью иммуноглобулина придают желаемые фармакокинетические свойства широкому ряду белков. Подобным образом, слияния с сывороточным альбумином человека могут придать желаемые свойства. Другие типы составных доменов, которые могут быть выбраны, включают приводящие к мультимеризации (например, димеризации, тетрамеризации) домены и функциональные домены.
В качестве конкретного примера настоящим описанием предоставляется слитый белок, включающий растворимый внеклеточный домен ALK1, слитый с Fc-доменом, (например, SEQ ID NO: 6).


Необязательно в Fc-домене имеется одна или несколько мутаций в таких остатках, как Asp-265, лизин 322 и Asn-434. В некоторых случаях мутантный Fc-домен, в котором имеется одна или несколько из этих мутаций (например, мутация Asp-265), имеет уменьшенную способность связываться с рецептором Fcγ относительно Fc-домена дикого типа. В других случаях мутантный Fc-домен, в котором имеется одна или несколько из этих мутаций (например, мутация Asn-434), имеет увеличенную способность связываться с относящимся к МНС класса I рецептором Fc (FcRN) относительно Fc-домена дикого типа.
Понятно, что различные элементы слитых белков могут быть расположены любым образом, который совместим с желаемой функцией. Например, содержащий ECD ALK1 полипептид может быть размещен на С-конце гетерологичного домена или, альтернативно, гетерологичный домен может быть размещен на С-конце содержащего ECD ALK1 полипептида. Не требуется, чтобы домен содержащего ECD ALK1 полипептида и гетерологичный домен были граничащими в слитом белке, и дополнительные домены или аминокислотные последовательности могут быть включены так, чтобы они были С- или N-концевыми относительно любого их двух доменов или между доменами.
Предполагается, что используемый здесь термин «Fc-область иммуноглобулина» или просто «Fc» означает карбоксиконцевую часть константной области цепи иммуноглобулина, предпочтительно константной области тяжелой цепи иммуноглобулина, или ее часть. Например, Fc-область иммуноглобулина может включать 1) СН1-домен, СН2-домен и СН3-домен, 2) СН1-домен и СН2-домен, 3) СН1-домен и СН3-домен, 4) СН2-домен и СН3-домен или 5) комбинацию двух или более доменов и шарнирную область иммуноглобулина. В предпочтительном варианте осуществления Fc-область иммуноглобулина включает по меньшей мере шарнирную область иммуноглобулина, СН2-домен и СН3-домен и предпочтительно не включает СН1-домен.
В одном варианте осуществления классом иммуноглобулина, из которого происходит константная область тяжелой цепи, является IgG (Igγ) (γ-подклассы 1, 2, 3 или 4). Могут использоваться другие классы иммуноглобулина: IgA (Igα), IgD (Igδ), IgE (Igε) и IgM (Igµ). Выбор подходящей константной области тяжелой цепи иммуноглобулина обсуждается подробно в патентах США № 5541087 и 5726044. Считается, что выбор конкретных последовательностей константных областей тяжелых цепей иммуноглобулинов из некоторых классов и подклассов иммуноглобулинов для достижения конкретного результата находится в пределах уровня знаний в данной области техники. Часть ДНК-конструкции, кодирующая Fc-область иммуноглобулина, предпочтительно включает по меньшей мере часть шарнирного домена и предпочтительно по меньшей мере часть СН3-домена Fcγ или гомологичных доменов в любом из IgA, IgD, IgE или IgM.
Кроме того, подразумевается, что замена или делеция аминокислот в пределах константных областей тяжелых цепей иммуноглобулинов может быть полезна при осуществлении на практике раскрытых здесь способов и композиций. Одним примером могло бы быть введение аминокислотных замен в верхней части СН2-области для создания варианта Fc с уменьшенной аффинностью для рецепторов Fc (Cole et al. (1997) J. Immunol. 159: 3613).
В некоторых вариантах осуществления настоящее изобретение делает доступными выделенные и/или очищенные формы содержащих ECD ALK1 полипептидов, которые отделены, или иначе по существу свободны (например, по меньшей мере на 80%, 90%, 95%, 97% или 99%) от других белков и/или других разновидностей содержащих ECD ALK1 полипептидов. Полипептиды ALK1 будут, как правило, продуцировать экспрессией с рекомбинантных нуклеиновых кислот.
В некоторых вариантах осуществления настоящее описание включает нуклеиновые кислоты, кодирующие растворимые полипептиды ALK1, включающие кодирующие внеклеточную часть белков ALK1 последовательность. В дополнительных вариантах осуществления это описание также относится к клетке-хозяину, включающей такие нуклеиновые кислоты. Клеткой-хозяином может быть любая прокариотическая или эукариотическая клетка. Например, полипептид настоящего описания можно экспрессировать в бактериальных клетках, таких как E.coli, клетках насекомых (например, используя бакуловирусную экспрессионную систему), дрожжах или клетках млекопитающих. Квалифицированным в данной области техники специалистам известны другие подходящие клетки-хозяева. Соответственно, некоторые варианты осуществления настоящего описания, кроме того, относятся к способам продуцирования содержащих ECD ALK1 полипептидов. Было установлено, что слитый белок ALK1-Fc, определенный в SEQ ID NO: 3 и экспрессированный в клетках СНО, обладает сильной антиангиогенной активностью.
Полипептиды DAN, включающие варианты DAN дикого типа, и слитые белки, содержащие белки DAN, могут быть получены и охарактеризованы, как описано выше в отношении содержащих ECD ALK1 белков.
3. Нуклеиновые кислоты, кодирующие полипептиды ALK1
В некоторых аспектах настоящим описанием предоставляются выделенные и/или рекомбинантные нуклеиновые кислоты, кодирующие любой из полипептидов ALK1 (например, содержащие ECD ALK1 полипептиды), в том числе фрагменты, функциональные варианты и слитые белки, описанные здесь. Например, SEQ ID NO: 2 кодирует полипептид-предшественник встречающегося в природе ALK1 человека, в то время как SEQ ID NO: 4 кодирует предшественник внеклеточного домена ALK1, слитого с Fc-доменом IgG1. Рассматриваемые здесь нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными. Такие нуклеиновые кислоты могут быть молекулами ДНК или РНК. Эти нуклеиновые кислоты могут использоваться, например, в способах получения полипептидов ALK1 или в качестве непосредственных терапевтических агентов (например, в методе терапии с использованием антисмысловых НК, интерферирующих РНК или генной терапии).
В некоторых аспектах, кроме того, предполагается, что рассматриваемые здесь нуклеиновые кислоты, кодирующие полипептиды ALK1, включают нуклеиновые кислоты, которые являются вариантами SEQ ID NO: 2 или 4. Варианты нуклеотидных последовательностей включают последовательности, которые отличаются одной или несколькими заменами, добавлениями или делециями нуклеотидов, такие как аллельные варианты.
В некоторых вариантах настоящим описанием предоставляются выделенные или рекомбинантные последовательности нуклеиновых кислот, которые по меньшей мере на 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 2 или 4. Специалисту со средним уровнем компетентности в данной области техники будет понятно, что последовательности нуклеиновых кислот, комплементарные SEQ ID NO: 2 или 4, и варианты SEQ ID NO: 2 или 4 также находятся в пределах объема этого описания. В дополнительных вариантах осуществления последовательности нуклеиновых кислот настоящего описания могут быть выделенными, рекомбинантными и/или слитыми с гетерологичной нуклеотидной последовательностью или находится в ДНК-библиотеке.
В других вариантах осуществления нуклеиновые кислоты настоящего описания также включают нуклеотидные последовательности, которые гибридизуются в высокой степени жестких условиях с нуклеотидной последовательностью, указанной в SEQ ID NO: 2 или 4, последовательностью, комплементарной SEQ ID NO: 2 или 4, или их фрагментами. Как обсуждалось выше, специалист со средним уровнем компетентности в данной области техники без труда поймет, что соответствующие условия жесткости, которые поддерживают гибридизацию ДНК, могут варьировать. Например, гибридизацию можно было бы выполнить в 6,0 × натрия хлориде/натрия цитрате (SSC) при приблизительно 45ºС с последующей отмывкой 2,0 × SSC при 50ºС. Например, концентрацию соли на стадии отмывки можно выбрать из условий пониженной жесткости - приблизительно 2,0 × SSC при 50ºС до условий высокой жесткости - приблизительно 0,2 × SSC при 50ºС. Кроме того, температура на стадии отмывки может быть увеличена от условий пониженной жесткости при комнатной температуре, приблизительно 22ºС, до условий высокой жесткости при приблизительно 65ºС. Можно варьировать и температурой, и концентрацией соли, или температуру или концентрацию соли можно держать постоянными, в то время как меняют другую переменную. В одном варианте осуществления настоящим описанием предоставляются нуклеиновые кислоты, которые гибридизуются в условиях пониженной жесткости - 6 × SSC при комнатной температуре с последующей отмывкой 2,0 × SSC при комнатной температуре.
Выделенные нуклеиновые кислоты, которые отличаются от нуклеиновых кислот, определенных в SEQ ID NO: 2 или 4, вследствие вырожденности генетического кода, также находятся в пределах объема настоящего описания. Например, для ряда аминокислот предназначено более одного триплета. Кодоны, которые определяют одну и ту же аминокислоту, или синонимы (например, CAU и CAC являются синонимами для гистидина) могут приводить к «молчащим» мутациям, которые не изменяют аминокислотную последовательность белка. Однако предполагается, что полиморфизмы последовательностей ДНК, которые приводят к изменениям аминокислотных последовательностей рассматриваемых здесь белков, будут присутствовать в группе клеток млекопитающих. Квалифицированному в данной области техники специалисту будет понятно, что эти вариации в одном или нескольких нуклеотидах (вплоть до приблизительно 3-5% нуклеотидов) нуклеиновых кислот, кодирующих конкретный белок, могут присутствовать в группе индивидуумов данного вида вследствие природной аллельной вариации. Любые и все такие вариации нуклеотидов и результирующие полиморфизмы аминокислот находятся в пределах объема настоящего описания.
В некоторых вариантах осуществления рекомбинантные нуклеиновые кислоты настоящего описания могут быть функционально связаны с одной или несколькими регуляторными нуклеотидными последовательностями в экспрессионной конструкции. Регуляторные нуклеотидные последовательности будут, как правило, соответствующими для клетки-хозяина, используемой для экспрессии. Многочисленные типы соответствующих экспрессионных векторов и подходящие регуляторные последовательности известны в данной области техники для множества клеток-хозяев. Как правило, указанные одна или несколько регуляторных нуклеотидных последовательностей могут включать, но без ограничения, промоторные последовательности, лидерные или сигнальные последовательности, сайты связывания рибосом, последовательности начала и терминации транскрипции, последовательности начала и терминации трансляции и последовательности-энхансеры или активаторы. Конститутивные или индуцибельные промоторы, известные в данной области техники, предусматриваются настоящим описанием. Промоторы могут быть или встречающими в природе промоторами, или гибридными промоторами, в которых объединены элементы более одного промотора. Экспрессионная конструкция может присутствовать в клетке на эписоме, такой как плазмида, или экспрессионная конструкция может быть вставлена в хромосому. В предпочтительном варианте осуществления экспрессионный вектор содержит ген селектируемого маркера для того, чтобы сделать возможным отбор трансформированных клеток-хозяев. Гены селектируемых маркеров широко известны в данной области техники и будут варьировать в зависимости от используемой клетки-хозяина.
В некоторых аспектах, раскрываемых здесь, рассматриваемая здесь нуклеиновая кислота предоставляется в экспрессионном векторе, включающем нуклеотидную последовательность, кодирующую полипептид ALK1 и функционально связанную с по меньшей мере одной регуляторной последовательностью. Регуляторные последовательности идентифицированы в данной области техники и выбираются для управления экспрессией полипептида ALK1. Соответственно, термин «регуляторная последовательность» включает промоторы, энхансеры и другие контролирующие экспрессию элементы. Примерные регуляторные последовательности описаны в Goeddel, Gene Expression Technology: Methods in Enzymology, Academic Press, San Diego, CA (1990). Например, любую из широкого ряда контролирующих экспрессию последовательностей, которые контролируют экспрессию последовательности ДНК при функциональной связи с нею, можно использовать в этих векторах для экспрессии последовательностей ДНК, кодирующих полипептид ALK1. Такие применимые контролирующие экспрессию последовательности включают, например, ранний и поздний промоторы SV40, промотор tet, немедленно ранний промотор аденовируса или цитомегаловируса, промоторы RSV, lac-систему, trp-систему, систему TAC или TRC, промотор Т7, экспрессией которого управляет Т7 РНК-полимераза, основной оператор и промоторные области фага лямбда, контролирующие области для покровного белка fd, промотор для 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислой фосфатазы, например, Pho5, промоторы факторов α-спаривания дрожжей, полиэдровый промотор бакуловирусной системы и другие последовательности, о которых известно, что они контролируют экспрессию генов прокариотических или эукариотических клеток или их вирусов, и различные их комбинации. Следует понимать, что разработка экспрессионного вектора может зависеть от таких факторов, как выбор клетки-хозяина, подвергаемой трансформации, и/или типа белка, который желательно экспрессировать. Кроме того, следует также принимать во внимание число копий вектора, способность контролировать это число копий и экспрессию любого другого белка, кодируемого вектором, такого как маркеры в виде антибиотиков.
Рекомбинантную нуклеиновую кислоту, включенную в настоящее описание, можно получить лигированием клонируемого гена или его части, в вектор, подходящий для экспрессии или в прокариотических клетках, эукариотических клетках (дрожжей, птиц, насекомых или млекопитающих), или в обоих типах клеток. Экспрессионные носители для продукции рекомбинантного полипептида ALK1 включают плазмиды и другие векторы. Например, подходящие векторы включают плазмиды типов: получаемые из pBR322 плазмиды, получаемые из pEMBL плазмиды, получаемые из pEX плазмиды, получаемые из pBTac плазмиды и получаемые из pUC плазмиды для экспрессии в прокариотических клетках, таких как E.coli.
Некоторые векторы для экспрессии в клетках млекопитающих содержат и прокариотические последовательности для содействия репродукции вектора в бактерии, и один или несколько эукариотических компонентов транскрипции, которые экспрессируются в эукариотических клетках. Получаемые из pcDNAI/amp, pcDNAI/neo, pRc/CMV, pSV2gpt, pSV2neo, pSV2-dhfr, pTk2, pRSVneo, pMSG, pSVT7, pko-neo и pHyg векторы являются примерами векторов для экспрессии в клетках млекопитающих, подходящими для трансфекции эукариотических клеток. Некоторые из этих векторов модифицированы последовательностями из бактериальных плазмид, таких как pBR322, для содействия репликации и отбора по устойчивости к лекарственному средству как в прокариотических, так и в эукариотических клетках. В альтернативном случае производные вирусов, таких как бычий папилломавирус (BPV-1) или вирус Эпштейна-Барра (pHEBo, pREP-происходящий и p205), можно использовать для транзиторной экспрессии белков в эукариотических клетках. Примеры других вирусных (в том числе ретровирусных) экспрессионных систем можно найти ниже в описании систем доставки для генной терапии. Различные способы, используемые для приготовления плазмид и трансформации организмов хозяев, широко известны в данной области техники. Что касается других систем, подходящих для экспрессии и в прокариотических, и в эукариотических клетках, а также общих рекомбинантных способов см. Molecular Cloning A Laboratory Manual, 3rd Ed., ed. By Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press, 2001). В некоторых случаях может быть желательно экспрессировать рекомбинантные полипептиды с помощью использования бакуловирусной экспрессионной системы. Примеры таких бакуловирусных экспрессионных систем включают получаемые из pVL векторы (такие как pVL1392, pVL1393 и pVL941), получаемые из pAcUW векторы (такие как pAcUW1) и получаемые из pBlueBac векторы (такие как pBluBacIII, содержащий β-gal).
В предпочтительном варианте осуществления вектор, такой как вектор Pcmv-Script (Stratagene, La Jolla, Calif.), векторы pcDNA4 (Invitrogen, Carlsbad, Calif.) и векторы pCI-neo (Promega Madison, Wisc), конструируют для продукции рассматриваемых здесь полипептидов ALK1 в клетках СНО. Как это будет видно, рассматриваемые здесь конструкции генов можно использовать для вызова экспрессии рассматриваемых здесь полипептидов ALK1 в клетках, размножающихся в культуре, например, для продуцирования белков, в том числе слитых белков или вариантов белков, для очистки.
Это описание также относится к клетке-хозяину, трансфицированной рекомбинантным геном, включающим кодирующую последовательность (например, SEQ ID NO: 2 или 4) для одного или нескольких рассматриваемых здесь полипептидов ALK1. Клетка-хозяин может быть любой прокариотической или эукариотической клеткой. Например, описываемый здесь полипептид ALK1 может быть экспрессирован в бактериальных клетках, таких как E.coli, клетках насекомых (например, используя бакуловирусную экспрессионную систему), дрожжах или клетках млекопитающих. Другие подходящие клетки-хозяева известны квалифицированным в данной области техники специалистам.
Соответственно, настоящее описание, кроме того, относится к способам продуцирования рассматриваемых здесь полипептидов ALK1, в том числе содержащих ECD ALK1 полипептидов. Например, клетку-хозяина, трансфицированную экспрессионным вектором, кодирующим полипептид ALK1, можно культивировать при соответствующих условиях для того, чтобы позволить происходить экспрессии полипептида ALK1. Полипептид ALK1 можно секретировать и выделить из смеси клеток и среды для культивирования, содержащей полипептид ALK1. В альтернативном случае полипептид ALK1 может удерживаться цитоплазматически или в мембранной фракции, и клетки можно собрать, лизировать и выделить белок. Клеточная культура включает клетки-хозяева, среду для культивирования и другие побочные продукты. Подходящие среды для культивирования клеток широко известны в данной области техники. Рассматриваемые здесь полипептиды ALK1 можно выделить из среды для культивирования клеток, клеток-хозяев или как из среды, так и из клеток, используя методы, известные в данной области техники для очистки белков, включающие ионообменную хроматографию, гель-фильтрацию, ультрафильтрацию, электрофорез, иммуноаффинную очистку с использованием антител, специфичных в отношении конкретных эпитопов полипептидов ALK1, и аффинную очистку с использованием агента, который связывается с доменом, слитым с полипептидом ALK1, (например, колонку с белком А можно использовать для очистки слияния ALK1-Fc). В предпочтительном варианте осуществления полипептид ALK1 представляет собой слитый белок, содержащий домен, который способствует его очистке. В предпочтительном варианте осуществления очистку успешно выполняют с использованием ряда стадий хроматографий на колонках, включающих, например, три или более следующие хроматографии, в любом порядке: хроматографию на колонке с белком А, хроматографию на колонке с Q-сефарозой, хроматографию на колонке с фенилсефарозой, гель-фильтрацию и катионообменную хроматографию. Очистку можно было бы завершить фильтрацией от вирусов и обменом буфера.
В другом варианте осуществления слитый ген, кодирующий лидерную последовательность для очистки, такую как поли-(His)/последовательность сайта расщепления энтерокиназой на N-конце желаемой части рекомбинантного полипептида ALK1, может сделать возможной очистку экспрессированного слитого белка с помощью аффинной хроматографии с использованием смолы с металлом Ni2+. Лидерную последовательность для очистки можно затем впоследствии удалить обработкой энтерокиназой для обеспечения очищенного полипептида ALK1 (см., например, Hochuli et al., (1987) J. Chromatography 411: 177; Janknecht et al., PNAS USA 88: 8972).
Методы получения слитых генов широко известны. По существу, соединение различных фрагментов ДНК, кодирующих различные полипептидные последовательности, выполняют в соответствии с общепринятыми методами, используя тупые или выступающие концы для лигирования, расщепление рестрикционными ферментами для обеспечения соответствующих концов, заполнение липких концов в соответствующем случае, обработку щелочной фосфатазой для исключения нежелательного соединения и ферментативное лигирование. В другом варианте осуществления слитый ген можно синтезировать с помощью общепринятых методов, включающих автоматизированные ДНК-синтезаторы. В альтернативном случае амплификацию фрагментов гена с использованием ПЦР можно выполнить, используя анкерные праймеры, которые дают начало комплементарным избыточностям между двумя последовательными фрагментами гена, которые можно впоследствии подвергнуть отжигу для получения последовательности химерного гена (см., например, Current Protocols in Molecular Biology, eds. Ausubel et al., John Wiley & Sons: 1992).
Примеры классов соединений в виде нуклеиновых кислот, которые являются антагонистами ALK1, ВМР9, ВМР10, GDG5, GDF6 или GDF7, включают антисмысловые нуклеиновые кислоты, конструкции интерферирующих РНК и конструкции каталитических нуклеиновых кислот. Соединение в виде нуклеиновой кислоты может быть одноцепочечным или двухцепочечным. Двухцепочечное соединение может также включать области избыточности или некомлементарности, в которых одна или другая из цепей является одноцепочечной. Одноцепочечное соединение может включать области самокомплементарности, означая, что соединение образует так называемую структуру «шпильки», с областью двойной спиральной структуры. Соединение в виде нуклеиновой кислоты может включать нуклеотидную последовательность, которая комплементарна области, состоящей из не более 1000, не более 5000, не более 250, не более 100 или не более 50, 35, 30, 25, 22, 20 или 18 нуклеотидов последовательности нуклеиновой кислоты полноразмерного ALK1 или последовательности нуклеиновой кислоты лиганда. Область комплементарности будет предпочтительно представлять собой по меньшей мере 8 нуклеотидов и необязательно по меньшей мере 10 или по меньшей мере 15 нуклеотидов, и необязательно 15-25 нуклеотидов. Область комплементарности может находиться в пределах интрона, кодирующей последовательности или некодирующей последовательности транскрипта-мишени, например, части кодирующей последовательности. Как правило, размер соединения в виде нуклеиновой кислоты будет составлять от приблизительно 8 до приблизительно 500 нуклеотидов или пар оснований, и необязательно размер будет составлять от приблизительно 14 до приблизительно 50 нуклеотидов. Нуклеиновая кислота может быть ДНК (в частности, для использования в качестве антисмысловой), РНК или гибридом РНК:ДНК. Любая одна цепь может включать смесь ДНК и РНК, а также модифицированные формы, которые невозможно классифицировать ни как ДНК, ни как РНК. Подобным образом двухцепочечное соединение может быть ДНК:ДНК, ДНК:РНК или РНК:РНК, и любая одна цепь может также включать смесь ДНК и РНК, а также модифицированные формы, которые невозможно классифицировать ни как ДНК, ни как РНК. Соединение в виде нуклеиновой кислоты может включать любой ряд модификаций, в том числе одну или несколько модификаций в остове (сахарофосфатной части в природной нуклеиновой кислоте, в том числе межнуклеотидных связях) или части оснований (части пуриновых или пиримидиновых оснований природной нуклеиновой кислоты). Соединение в виде антисмысловой нуклеиновой кислоты будет предпочтительно иметь размер, составляющий от приблизительно 15 до приблизительно 30 нуклеотидов, и будет часто содержать одну или несколько модификаций для улучшения характеристик, таких как стабильность в сыворотке, в клетке или в месте, в которое соединение, по-видимому, доставляется, например, в желудке в случае перорально доставляемых соединений и в легком для ингаляционно доставляемых соединений. В случае конструкции интерферирующей РНК цепь, комплементарная транскрипту-мишени, будет представлять собой, как правило, РНК или ее модификации, Другая цепь может быть РНК, ДНК или любым другим вариантом. Дуплексная часть конструкции двухцепочечной или одноцепочечной «шпилечной» интерферирующей РНК будет предпочтительно иметь размер, составляющий 18-40 нуклеотидов и необязательно от приблизительно 21 до 23 нуклеотидов, при условии, что она служит в качестве субстрата для разрезания. Каталитические или ферментативные нуклеиновые кислоты могут быть рибозимами или ДНК-ферментами и могут также содержать модифицированные формы. Соединения в виде нуклеиновых кислот могут ингибировать экспрессию мишени на приблизительно 50%, 75%, 90% или более при приведении в контакт с клетками в физиологических условиях и в концентрации, в которой несмысловой или смысловой контроль не оказывает эффект или оказывает незначительный эффект. Предпочтительные концентрации для проверки эффекта соединений в виде нуклеиновых кислот составляют 1, 5 и 10 микромоль. Соединения в виде нуклеиновых кислот можно также проверить в отношении эффектов, например, на развитие кровеносных сосудов.
Нуклеиновые кислоты, кодирующие полипептиды DAN, в том числе варианты DAN дикого типа, и нуклеиновые кислоты, кодирующие слитые белки, содержащие белки DAN, могут быть получены и охарактеризованы, как описано выше в отношении нуклеиновых кислот, кодирующих содержащие ECD ALK1 белки.
4. Антитела
Другой аспект настоящего описания относится к антителу, способному реагировать с внеклеточной частью полипептида ALK1, предпочтительно антителами, которые способны специфически взаимодействовать с полипептидом ALK1. В предпочтительном варианте осуществления такое антитело может мешать связыванию ALK1 с лигандом, таким как GDG5, GDF6, GDF7, ВМР9 или ВМР10 - понятно, что антитело против лиганда ALK1 должно связываться со зрелой, процессированной формой релевантного белка. Настоящим описанием также предоставляются антитела, которые связываются с GDG5, GDF6, GDF7, ВМР9 и/или ВМР10 и ингибируют связывание ALK1 с такими лигандами. Предпочтительные антитела будут проявлять антиангиогенную активность в биологическом анализе, таком как анализ с использованием САМ или анализ с использованием микрокармана в роговице (см. выше).
Используемый здесь термин «антитело», как подразумевается, включает целые антитела, например, любого изотипа (IgG, IgA, IgM, IgE и т.п.), и включает фрагменты или домены иммуноглобулинов, которые способны реагировать с выбранным антигеном. Антитела могут быть фрагментированы с использованием общепринятых методов, и такие фрагменты можно скринировать на применимость и/или взаимодействие со специфическим представляющим интерес эпитопом. Таким образом, термин включает сегменты протеолически расщепленных или рекомбинантно полученных частей молекулы антитела, которые способны избирательно реагировать с определенным белком. Неограничивающие примеры таких протеолических и/или рекомбинантных фрагментов включают Fab, F(ab')2, Fab', Fv и одноцепочечные антитела (scFv), содержащие V[L]- и/или V[H]-домены, соединенные с помощью пептидного линкера. scFv могут быть ковалентно или нековалентно связаны с образованием антител, имеющих два или более сайтов связывания. Термин «антитело» также включает поликлональные, моноклональные или другие очищенные препараты антител и рекомбинантных антител. Термин «рекомбинантное антитело» означает антитело, или антигенсвязывающий домен иммуноглобулина, экспрессированное с нуклеиновой кислоты, которая была сконструирована с использованием методов молекулярной биологии, такое как гуманизированное антитело или полностью человеческое антитело, разработанное на основе одноцепочечного антитела. В термин «рекомбинантное антитело» также включаются однодоменные и одноцепочечные антитела.
Антитела можно создать с помощью любого из различных способов, известных в данной области техники, включающих введение антигена животному, введение антигена животному, которое несет гены иммуноглобулинов человека, или скринирование с использованием антигена библиотеки антител (часто одноцепочечных антител или доменов антител). После того, как антигенсвязывающая активность выявлена, релевантные части белка могут быть пересажены в каркасные области других антител, в том числе каркасные области полноразмерных IgG. Например, используя иммуногены, происходящие из полипептида ALK1 или лиганда ALK1, антисыворотку или моноклональные антитела против белка/пептида можно получить стандартными способами (см., например, Antibodies: A Laboratory Manual ed. by Harlow and Lane (Cold Spring Harbor Press: 1988)). Млекопитающее, такое как мышь, хомяк или кролик, можно иммунизировать иммуногенной формой пептида (например, полипептидом ALK1 или антигенным фрагментом, которой способен вызывать гуморальный иммунный ответ, или слитым белком). Методы предоставления иммуногенности белку или пептиду включают конъюгирование с носителями или другие методы, широко известные в данной области техники. Иммуногенную часть (предпочтительно внеклеточную часть) полипептида ALK1 можно вводить в присутствии адъюванта. Развитие иммунизации можно контролировать путем детектирования титров антител в плазме или сыворотке. Стандартную ELISA или другие иммунологические анализы можно использовать с иммуногеном в качестве антигена для оценки уровней антител.
После иммунизации животного антигенным препаратом полипептида ALK1 можно получить антисыворотку против ALK1, и, если желательно, из сыворотки можно выделить поликлональные антитела против ALK1. Для продуцирования моноклональных антител продуцирующие антитела клетки (лимфоциты) можно получить из иммунизированного животного и слить с использованием стандартных способов слияния соматических клеток с подвергнутыми иммортализации клетками, такими как миеломные клетки, для получения гибридомных клеток. Такие методы широко известны в данной области техники и включают, например, гибридомную технологию (впервые разработанную Kohler и Milstein (1975) Nature, 256: 495-497), гибридомную технологию с использованием В-клеток человека (Kozbar et al., (1983) Immunology Today, 4: 72) и EBV-гибридомную технологию для продуцирования моноклональных антител человека (Cole et al., (1985) Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc. pp. 77-96). Гибридомные клетки можно скринировать иммунохимически на продукции антител, способных специфически реагировать с полипептидом ALK1 млекопитающего настоящего описания, а моноклональные антитела можно выделить из культуры, содержащей такие гибридомные клетки.
Подразумевается, что используемый здесь термин «антитело» включает его фрагменты, которые также способны специфически реагировать с одним из рассматриваемых здесь полипептидов ALK1. Антитела можно фрагментировать, используя общепринятые методы, а фрагменты можно скринировать на применимость таким же образом, как описано выше для полноразмерных антител. Например, фрагменты F(ab)2 можно создать обработкой антитела пепсином. Результирующий фрагмент F(ab)2 можно обработать для того, чтобы уменьшить количество дисульфидных мостиков для получения фрагментов Fab. Кроме того, подразумевается, что антитело настоящего описания включает биспецифические, одноцепочечные, и химерные, и гуманизированные молекулы, имеющие аффинность для полипептида ALK1, обеспечиваемую по меньшей мере одной CDR-областью антитела. В предпочтительном варианте осуществления антитело, кроме того, включает метку, которая присоединена к нему и может быть обнаружена (например, меткой может быть радиоактивный изотоп, флуоресцентный компонент, фермент или кофактор фермента).
В некоторых предпочтительных вариантах осуществления антитело настоящего описания является рекомбинантным антителом, в частности, гуманизированным моноклональным антителом или полностью человеческим рекомбинантным антителом.
Подразумевается, что определение «способное специфически реагировать с», используемое при упоминании антитела, означает, как оно обычно понимается в данной области техники, что антитело является довольно избирательным между представляющим интерес антигеном (например, полипептидом ALK1 или лигандом ALK1) и другими, не представляющими интерес антигенами, т.е. антитело применимо, как минимум, для установления присутствия представляющего интерес антигена в конкретном типе биологического образца. В некоторых способах, в которых используется антитело, может быть желательной более высокая степень специфичности связывания. Например, антитело для применения для обнаружения представляющего интерес белка, характеризующегося низким относительным содержанием, в присутствии не представляющих интерес одного или нескольких белков, характеризующихся высоким относительным содержанием, может действовать лучше, если оно имеет большую степень избирательности между представляющим интерес антигеном и другими перекрестно реагирующими веществами. Моноклональные антитела, как правило, больше склонны (по сравнению с поликлональными антителами) к эффективному проведению различия между желаемыми антигенами и перекрестно реагирующими полипептидами. Кроме того, антитело, которое является эффективным для распознавания избирательно представляющего интерес антигена в одном типе биологического образца (например, пробе фекалий), может не быть настолько же эффективным для распознавания избирательно того же антигена в отличном типе биологического образца (например, пробе крови). Подобным образом, антитело, которое является эффективным для распознавания представляющего интерес антигена в препарате очищенного белка, который лишен других биологических примесей, может не быть настолько же эффективным для распознавания представляющего интерес антигена в неочищенном биологическом образце, таком как образец крови или мочи. Соответственно, в предпочтительных вариантах осуществления заявкой предоставляются антитела, которые продемонстрировали специфичность в отношении представляющего интерес антигена в типе образцов, который, вероятно, является типом образцов, предпочтительным для использования антитела.
Одной из характеристик, влияющих на специфичность взаимодействия антитело:антиген, является аффинность антитела в отношении антигена. Хотя желаемой специфичности можно достигнуть при использовании ряда различных аффинностей, как правило, предпочтительные антитела будут иметь аффинность (константу диссоциации), составляющую приблизительно 10-6, 10-7, 10-8, 10-9 или меньше. При условии явно низкой аффинности связывания TGFβ в отношении ALK1 предполагается, что многие антитела против ALK1 будут ингибировать связывание TGFβ. Однако, группа лигандов GDF5,6,7 связывается с KD, составляющей приблизительно 5×10-8 М, а лиганды ВМР9,10 связываются с KD, составляющей приблизительно 5×10-10 М. Следовательно, можно отобрать антитела соответствующей аффинности для того, чтобы вносить помехи в связанные с передачей сигналов активности этих лигандов.
Кроме того, методы, используемые для скрининга антител для того, что идентифицировать желаемое антитело, могут оказывать влияние на свойства получаемого антитела. Например, антитело, используемое для некоторых лечебных целей, будет предпочтительно способно поражать конкретный тип клеток. Соответственно, для получения антител этого типа может быть желательным скринирование на антитела, которые связываются с клетками, экспрессирующими представляющий интерес антиген (например, с помощью клеточного сортинга с активацией флуоресценции). Подобным образом, если антитело используется для связывания антигена в растворе, может быть желательной проверка связывания в растворе. Имеется множество различных методов для проверки взаимодействий антитело:антиген для того, чтобы идентифицировать конкретно желаемые антитела. Такие методы включают ELISA, анализы связывания с использованием поверхностного плазмонного резонанса (например, анализ связывания Biacore, Bia-core AB, Uppsala, Швеция), сэндвич-анализы (например, система с использованием парамагнитных бусинок IGEN International, Inc., Gaithersburg, Maryland), Вестерн-блоттинг, анализы иммунопреципитациии и иммуногистохимию.
5. Изменения в антителах и слитые с Fc белки
Настоящей заявкой, кроме того, предоставляются антитела, слитые белки ALK1-Fc и слитые белки DAN-Fc с сконструированными или вариантными Fc-областями. Такие антитела и слитые с Fc белки могут быть полезны, например, при модулировании эффекторных функций, таких как антителозависимая клеточноопосредованная цитотоксичность (ADCC) или комплементзависимая цитотоксичность (CDC). Кроме того, модификации могут увеличить стабильность антител и слитых с Fc белков. Варианты аминокислотных последовательностей антител и слитых с Fc белков получают путем введения соответствующих изменений в ДНК или путем синтеза пептидов. Такие варианты включают, например, делеции и/или вставки и/или замены остатков внутри аминокислотных последовательностей антител и слитых с Fc белков, описываемых здесь. Для прихода к желаемой конструкции осуществляют любую комбинацию делеций, вставок и замен при условии, что конечная конструкция обладает желаемыми характеристиками. Изменения аминокислот также могут изменить посттрансляционный процессинг антител и слитых с Fc белков, например, изменить число или положение сайтов гликозилирования.
Антитела и слитые с Fc белки с уменьшенной эффекторной функцией можно получить путем введения изменений в аминокислотную последовательность, включающих, но без ограничения, мутацию Ala-Ala, описанную Bluestone et al. (см. WO 94/28027 и WO 98/47531, также см. Xu et al. 2000 Cell Immunol. 200: 16-26). Таким образом, в некоторых вариантах осуществления антитела и слитые с Fc белки настоящего описания с мутациями в пределах константной области, включающими мутацию Ala-Ala, могут использоваться для уменьшения или отмены эффекторной функции. В соответствии с этими вариантами осуществления антитела и слитые с Fc белки могут включать мутацию в аланин в положении 234 или мутацию в аланин в положении 235, или их комбинацию. В одном варианте осуществления антитело или слитый с Fc белок включает каркасную область IgG4, причем мутация Ala-Ala могла бы описывать мутацию(и) фенилаланина в аланин в положении 234 и/или мутацию лейцина в аланин в положении 235. В другом варианте осуществления антитело или слитый с Fc белок включает каркасную область IgG1, причем мутация Ala-Ala могла бы описывать мутацию(и) лейцина в аланин в положении 234 и/или мутацию лейцина в аланин в положении 235. Антитело или слитый с Fc белок может альтернативно или дополнительно нести другие мутации, включающие точечную мутацию К322А в СН2-домене (Hezareh et al. 2001 J. Virol. 75: 12161-8).
В конкретных вариантах осуществления антитело или слитый с Fc белок могут быть модифицированы или для увеличения, или для ингибирования комплементзависимой цитотоксичности (CDC). Модулированную CDC-активность можно успешно получить путем введения одной или нескольких замен, вставок или делеций аминокислот в Fc-области (см., например, патент США № 6194551). Альтернативно или дополнительно, в Fc-область можно ввести остаток(остатки) цистеина, делая, таким образом, возможным образованием дисульфидной связи в этой области. Гомодимерное антитело, получаемое таким образом, может иметь увеличенную или уменьшенную способность к интернализации и/или увеличенное или уменьшенное опосредуемое комплементом уничтожение клетками. См. Caron et al., J. Exp. Med. 176: 1191-1195 (1992); Shopes, B.J. Immunol. 148: 2918-2922 (1992), WO 99/51642, Duncan & Winter Nature 322: 738-40 (1988); патент США № 5648260, патент США № 5624821 и WO 94/29351.
6. Способы и композиции для модулирования развития кровеносных сосудов и некоторых нарушений
Настоящим описанием предоставляются способы ингибирования развития кровеносных сосудов у млекопитающего путем введения субъекту эффективного количества содержащего ECD ALK1 полипептида, такого как слитый белок ALK1-Fc, белка DAN, такого как слитый белок DAN-Fc, или описываемого здесь антитела, такого как антитело против GDF5, GDF6, GDF7, BMP9, MMP10 или ECD ALK1, или антагонистов в виде нуклеиновых кислот (например, антисмысловых НК или малых интерферирующих РНК) любого из вышеизложенных агентов, которые в дальнейшем собирательно упоминаются как «терапевтические агенты». Представленные данные указывают, в частности, на то, антиангиогенные терапевтические агенты, описываемые здесь, могут использоваться для ингибирования развития кровеносных сосудов внутри глаза млекопитающего. Предполагается, что эти терапевтические агенты будут также полезны для ингибирования развития кровеносных сосудов в костях и суставах, и в опухолях, в частности, опухолях, связанных с костями и суставами.
Связанные с развитием кровеносных сосудов заболевания включают, но без ограничения, зависимый от развития кровеносных сосудов рак, например, солидные опухоли, опухоли крови, такие как лейкозы, и метастазы опухолей, доброкачественные опухоли, например, гемангиомы, невриомы слухового нерва, нейрофибромы, трахомы и пиогенные гранулемы, ревматоидный артрит, псориаз, покраснение радужки, болезнь Ослера-Вебера, развитие кровеносных сосудов в сердечной мышце, бляшковую неоваскуляризацию, телеангиэкстазию, суставы больных гемофилией и ангиофиброму.
В частности, терапевтические агенты в виде полипептидов настоящего описания применимы для лечения или предупреждения рака (опухоли) и, в частности, таких раков, которые, как известно, основаны на процессах развития кровеносных сосудов для поддержки роста. В отличие от большинства антиангиогенных агентов содержащие ECD ALK1 полипептиды оказывают воздействие на развитие кровеносных сосудов, которое стимулируется множеством факторов. Это в большой степени имеет отношение к ракам, для которых часто требуется множество факторов, поддерживающих развитие кровеносных сосудов в опухоли. Таким образом, описываемые здесь терапевтические агенты будут особенно эффективны для лечения опухолей, которые устойчивы к лечению лекарственным средством, направленным на один ангиогенный фактор (например, бевацизумабом, который направлен против VEGF). Как здесь показано, слитый белок ALK1-Fc эффективен в уменьшении патологических последствий множественной миеломы. Множественную миелому широко идентифицируют как рак, который включает значительный ангиогенный компонент. Соответственно, предполагается, что слитые белки ALK1-Fc и другие терапевтические агенты, описываемые здесь, будут применимы для лечения множественной миеломы и других опухолей, связанных с костью. Как здесь показано, описываемые здесь терапевтические агенты могут использоваться для уменьшения повреждения костей, связанного с множественной миеломой, и, следовательно, могут использоваться для уменьшения повреждения костей, связанного с метастазированием в кости других опухолей, таких как опухоли молочной железы или предстательной железы. Как здесь отмечено, лиганды GDF5-7 в высокой степени экспрессируются в кости, и, несмотря на нежелание ограничиваться каким-либо конкретным механизмом, предполагают, что препятствованием этим лигандам можно нарушить процессы, которые требуются для развития опухоли в кости.
В некоторых вариантах осуществления таких способов один или несколько терапевтических агентов в виде полипептидов можно вводить вместе (одновременно) или в различное время (последовательно). Кроме того, терапевтические агенты в виде полипептидов можно вводить с другим типом соединений для лечения рака или для ингибирования развития кровеносных сосудов.
В некоторых вариантах осуществления рассматриваемые способы настоящего описания можно использовать отдельно. В альтернативном случае рассматриваемые здесь способы можно использовать в комбинации с другими общепринятыми противораковыми терапевтическими подходами, направленными на лечение или предупреждение пролиферативных нарушений (например, опухоли). Например, такие способы можно использовать для профилактики рака, предупреждения рецидива рака и метастазов после оперативного вмешательства и в качестве адъюванта другой общепринятой противораковой терапии. В настоящем описании признается, что эффективность общепринятых противораковых терапий (например, химиотерапии, лучевой терапии, фототерапии, иммунотерапии и оперативного вмешательства) можно усилить благодаря использованию терапевтического агента в виде рассматриваемого здесь полипептида.
Было показано, что широкий ряд общепринятых соединений обладает антинеопластическими активностями. Эти соединения использовали в качестве фармацевтических агентов при химиотерапии для уменьшения солидных опухолей, предотвращения метастазирования и дальнейшего роста или уменьшения числа злокачественных клеток при лейкозах или злокачественностях костного мозга. Хотя химиотерапия была эффективной для лечения различных типов злокачественностей, многие антинеопластические соединения вызывают нежелательные побочные эффекты. Было показано, что, при объединении двух или более различных терапий, терапии могут действовать синергически и позволяют уменьшить дозу каждой из терапии, уменьшая, тем самым, вредные побочные эффекты, вызываемые каждым соединением в больших дозах. В других случаях злокачественности, которые являются не поддающимися лечению, могут реагировать на комбинированную терапию из двух или более различных лечений.
Когда описываемый здесь терапевтический агент в виде полипептида вводят в комбинации с другим общепринятым антинеопластическим агентом, или сопутствующим образом, или последовательно, такой терапевтический агент может усиливать терапевтический эффект антинеопластического агента или преодолевать устойчивость клеток к такому неопластическому агенту. Это позволяет уменьшить дозу антинеопластического агента, уменьшая, тем самым, нежелательные побочные эффекты, или восстанавливает эффективность антинеопластического агента в устойчивых клетках.
В соответствии с настоящим описанием антиангиогенные агенты, описываемые здесь, могут использоваться в комбинации с другими композициями и способами для лечения заболеваний. Например, опухоль можно лечить обычно с использованием оперативного вмешательства, облучения или химиотерапии в комбинации с антагонистом ALK1 или лиганда ALK1, и затем антагонист можно впоследствии вводить пациенту для продления неактивного состояния микрометастазирования и для стабилизации любой остаточной первичной опухоли.
Ингибирующие развитие кровеносных сосудов агенты можно также предоставлять профилактически индивидуумам, о которых известно, что они подвержены высокому риску развития новых или рецидивирующих раков. Соответственно, аспект настоящего описания охватывает способы профилактики рака у субъекта, включающие введение субъекту эффективного количества антагониста ALK1 или лиганда ALK1, и/или их производного, или другого ингибирующего развитие кровеносных сосудов агента настоящего описания.
Как здесь продемонстрировано, ALK1-Fc эффективен для ослабления фенотипа модели ревматоидного артрита на мышах. Соответственно, терапевтические агенты, описываемые здесь, могут использоваться для лечения ревматоидного артрита и других типов воспаления костей или суставов.
Некоторые нормальные физиологические процессы также связаны с развитием кровеносных сосудов, например, овуляция, менструация и плацентация. Ингибирующие развитие кровеносных сосудов белки настоящего описания применимы для лечения заболевания чрезмерной или аномальной стимуляции эндотелиальных клеток. Эти заболевания включают, но без ограничения, спайки кишечника, атеросклероз, склеродерму и гипертрофические рубцы, т.е. келоиды. Они также применимы для лечения заболеваний, при которых развитие кровеносных сосудов является патологическим последствием, таких как лихорадка, вызванная кошачьими царапинами (Rochele minalia quintosa) и язвы (Helicobacter pylori).
Обычные ингибирующие развитие кровеносных сосудов белки можно использовать в качестве ограничивающего рождаемость агента путем уменьшения или предупреждения васкуляризации матки, требуемой для имплантации эмбриона. Таким образом, настоящим описанием предоставляется эффективный способ ограничения рождаемости, когда женщине вводится количество ингибиторного белка, достаточное для предотвращения имплантации эмбриона. В одном аспекте способа ограничения рождаемости количество ингибирующего белка, достаточное для блокирования имплантации эмбриона, вводится до или после половой связи и оплодотворения, обеспечивая, таким образом, эффективный способ ограничения рождаемости, возможно способ контрацепции после половой связи. Несмотря на нежелание быть связанными этим утверждением, полагают, что ингибирование васкуляризации эндометрия матки препятствует имплантации бластоцисты. Схожее ингибирование васкуляризации слизистой оболочки маточной трубы препятствует имплантации бластоцисты, предотвращая случай трубной внематочной беременности. Способы введения могут включать, но без ограничения, пилюли, инъекции (внутривенные, подкожные, внутримышечные), суппозитории, влагалищные тампоны и внутриматочные устройства. Также полагают, что введение ингибирующих развитие кровеносных сосудов агентов настоящего описания будет препятствовать нормальной усиленной васкуляризации плаценты, а также развитию сосудов внутри успешно имплантированной бластоцисты и развитию эмбриона и плода.
Внутри глаза развитие кровеносных сосудов связано, например, с диабетической ретинопатией, синдромом Терри, дегенерацией желтого пятна, отторжением трансплантированной ткани роговицы, неоваскулярной глаукомой и ретролентальными фиброплазиями. Терапевтические агенты, описываемые здесь, могут вводиться внутрь глаза или путем местного применения к глазу. Кроме того, как показано в примерах, ALK1-Fc можно вводить системно и все еще иметь желаемый эффект на развитие кровеносных сосудов внутри глаза.
Другие заболевания, связанные с развитием кровеносных сосудов внутри глаза, включают, но без ограничения, эпидемический кератоконъюнктивит, недостаток витамина А, износ контактных линз, атопический кератит, верхний лимбический кератит, сухой нитчатый кератит, сухой кератоконъюнктивит, красные угри, пузырчатку глаз, сифилис, микобактериальные инфекции, липидную дистрофию, химические ожоги, бактериальные язвы, грибковые язвы, инфекции Herpes simplex, инфекции Herpes zoster, протозойные инфекции, саркому Капоши, разъедающую язву роговицы, краевую дегенерацию Терриена, маргинальный кератолизис, ревматоидный артрит, системную красную волчанку, полиартериит, травму, саркоидоз Вегенера, склерит, синдром Стивена-Джонсона, переднюю радиальную кератотомию и отторжение трансплантированной ткани роговицы, серповидноклеточную анемию, саркоид, эластическую псевдоксантому, болезнь Педжета, окклюзию вен, окклюзию артерий, заболевание, вызываемое обструкцией сонных артерий, хронический увеит/витрит, микобактериальные инфекции, болезнь Лима, системную красную волчанку, синдром Терри, болезнь Илза, болезнь Беше, инфекции, вызывающие ретинит или хориоидит, предполагаемый гистоплазмоз глаз, болезнь Беста, близорукость, врожденные ямки в диске зрительного нерва, болезнь Штаргардта, промежуточный увеит, хроническое отслоение сетчатки, синдром повышенной вязкости, токсоплазмоз, повреждение и послелазерные осложнения. Другие заболевания включают, но без ограничения, заболевания, связанные с покраснением (неоваскуляризацией угла глазной щели), и заболевания, вызванные патологической пролиферацией фиброваскулярной или фиброзной ткани, включающие все формы пролиферативной витреоретинопатии.
Заболевания глаза можно лечить и предупреждать с помощью, например, системной, местной, внутриглазной инъекции терапевтического агента или путем ввода устройства для непрерывного высвобождения, которое высвобождает терапевтический агент. Терапевтический агент может доставляться в фармацевтически приемлемом для глаз носителе из условия, чтобы соединение оставалось в контакте с поверхностью глаза в течение достаточного периода времени для того, чтобы сделать возможным проникновение соединения в роговичные и внутренние участки глаза, например, переднюю камеру, заднюю камеру, стекловидное тело, внутриглазную жидкость, жидкость стекловидного тела, роговицу, радужную оболочку/реснитчатое тело, хрусталик глаза, собственно сосудистую оболочку глаза/сетчатку и склеру. Фармацевтически примелемый для глаз носитель может, например, быть мазью, растительным маслом или материалом для инкапсуляции. В альтернативном случае терапевтические агенты настоящего описания могут вводиться непосредственно в жидкость стекловидно тела и внутриглазную жидкость. В дополнительном альтернативном случае соединения могут вводиться системно, например, путем внутривенной инфузии или инъекции, для лечения глаза.
Может вводиться один или несколько терапевтических агентов. Способы настоящего описания также включает совместное введение с другими лекарственными средствами, которые используются для лечения заболеваний глаза. При введении более одного агента или комбинации агентов и лекарственных средств введение может происходить одновременно или последовательно во времени. Терапевтические агенты и/или лекарственные средства можно вводить различными путями введения или одним и тем же путем введения. В одном варианте осуществления терапевтический агент и лекарственное средство вводят вместе в фармацевтической композиции для глаз.
В одном варианте осуществления терапевтический агент используют для лечения заболевания, связанного с развитием кровеносных сосудов внутри глаза, путем введения, пересекающегося с введением других лекарственных средств, которые функционируют с блокированием развития кровеносных сосудов согласно фармакологическим механизмам. Лекарственные средства, которые можно использовать для введения, пересекающегося с введением терапевтического агента настоящего описания, включают, но без ограничения, пегаптаниб (MacugenTM), ранибизумаб (LucentisTM), скваламина лактат (EvizonTM), гепариназу и глюкокортикоиды (например, триамцинолон). В одном варианте осуществления предоставляется способ лечения заболевания, связанного с развитием кровеносных сосудов, путем введения фармацевтической композиции для глаз, содержащей по меньшей мере один терапевтический агент, описанный здесь, и по меньшей мере одно из следующих лекарственных средств: пегаптаниб (MacugenTM), ранибизумаб (LucentisTM), скваламина лактат (EvizonTM), гепариназу и глюкокортикоиды (например, триамцинолон).
7. Композиции и эффективные дозы
Терапевтические агенты, описываемые здесь, можно включить в состав фармацевтических композиций. Фармацевтические композиции для применения в соответствии с настоящим описанием можно приготовить общепринятым способом, используя один или несколько физиологически приемлемых носителей или наполнителей. Такие композиции будут, как правило, по существу не содержать пирогенов, в соответствии с большинством обязательных требований.
В некоторых вариантах осуществления терапевтический способ настоящего описания включает введение композиции системно или место в виде имплантата или устройства. При введении терапевтическая композиция для использования в этом описании находится в свободной от пирогенов, физиологически приемлемой форме. Терапевтически применимые агенты, отличные от антагонистов опосредуемой ALK1 передачи сигналов, которые могут также необязательно быть включены в композицию, описываемую здесь, можно вводить одновременно или последовательно с рассматриваемыми здесь соединениями (например, содержащими ECD ALK1 полипептидами или любым из антител, описываемых здесь) в описываемых здесь способах.
Как правило, белковые терапевтические агенты, описываемые здесь, будут вводить парентерально и, в частности, внутривенно или подкожно. Фармацевтические композиции, подходящие для парентерального введения, могут содержать один или несколько содержащих ECD ALK1 полипептидов или других антител в комбинации с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями или стерильными порошками, которые можно воссоздать в стерильные инъецируемые растворы или дисперсии прямо перед использованием, которые могут содержать антиоксиданты, буферы, бактериостатические факторы, растворенные вещества, которые делают композицию изотонической с кровью намеченного реципиента, или суспендирующие агенты или загустители. Примеры подходящих водных и неводных носителей, которые могут использоваться в фармацевтических композициях настоящего описания, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, такие оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Соответствующую текучесть можно поддерживать, например, путем использования материалов покрытия, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий и путем использования поверхностно-активных веществ.
В одном варианте осуществления антитела и содержащие ECD ALK1 полипептиды, описываемые здесь, вводят в фармацевтической композиции для глаз. В некоторых вариантах осуществления фармацевтическая композиция для глаз представляет собой стерильный водный раствор, предпочтительно подходящей концентрации для инъекции, или целебную мазь или мазь. Такие целебные мази или мази обычно содержат одно или несколько антител или содержащих ECD ALK1 полипептидов, описываемых здесь, растворенных или суспендированных в стерильной фармацевтически приемлемой основе лечебной мази или мази, такой как основа минеральное масло - медицинский вазелин. В случае композиций в виде целебной мази или мази безводный ланолин может быть также включен в композицию. К таким композициям в виде мазей также предпочтительно добавляют тимеросал или хлорбутанол в качестве противомикробных агентов. В одном варианте осуществления стерильным водным раствором является раствор, описанный в патенте США № 6071958.
Настоящим описанием предоставляются композиции, которые могут различаться с включением кислот и основанием для доведения рН и буферных агентов для сохранения рН в узком диапазоне. К композиции могут быть добавлены дополнительные лекарственные средства. Такие средства включают, но без ограничения, пегаптаниб, гепариназу, ранибизумаб или глюкокортикоиды. Фармацевтическую композицию для глаз в соответствии с настоящим описанием готовят согласно асептическому манипулированию, или на подходящей стадии приготовления проводят стерилизацию.
Композиции могут, если желательно, быть представлены в упаковке или устройстве для распыления, которые могут содержать одну или несколько форм стандартных доз, содержащих активный ингредиент. Упаковка может, например, включать металлическую фольгу или полимерную пленку, такую как прозрачная упаковка. Упаковка или устройство для распыления может сопровождаться инструкциями в отношении введения.
ПРИМЕРЫ
Пример 1: Экспрессия слитых белков ALK1-Fc
Заявители сконструировали растворимый слитый с ALK1 белок, который имеет внеклеточный домен ALK1 человека, слитый с Fc человека, или ALK1 мыши, слитый с Fc-доменом мыши, с использованием минимального линкера между ними. Конструкции упоминаются как hALK1-Fc и mALK1-Fc, соответственно.
hALK1-Fc показан на фиг. 3 как очищенный из линий клеток СНО белок (SEQ ID NO: 3). Примечательно, что хотя обычный С-конец внеклеточного домена белка ALK1 человека является аминокислотой 118 SEQ ID NO: 1, авторы настоящего изобретения установили, что желательно избегать наличия домена, который заканчивается на остатке глютамина. Соответственно, часть SEQ ID NO: 3, происходящая из ALK1 человека, включает два остатка, С-концевых относительно Q118, лейцин и аланин. Таким образом, настоящим описанием предоставляются содержащие ECD ALK1 полипептиды (в том числе слитые с Fc белки, имеющие С-конец ALK1-происходящей последовательности, который находится где-либо на 1-5 аминокислот левее (113-117 относительно SEQ ID NO: 1) или правее (119-123) Q118.
Белки hALK1-Fc и mALK1-Fc экспрессировали в линиях клеток СНО.
Рассматривались три различные лидерные последовательности:
(i) меллитина медоносных пчел (HBML): MKFLVNVALVFMVVYISYIYA (SEQ ID: 7),
(ii) тканевого активатора плазминогена (TPA): MDAMKRGLCCVLLLCGAVFVSP (SEQ ID: 8),
(iii) природная: MTLGSPRKGLLMLLMALVTQG (SEQ ID NO: 9).
В выбранной форме используется лидерная последовательность ТРА, и она имеет непроцессированную аминокислотную последовательность, показанную на фиг. 4 (SEQ ID NO: 5).
Полипептид кодируется последовательностью нуклеиновой кислоты, показанной на фиг. 4 (SEQ ID NO: 4).
Очистку успешно выполняли с помощью ряда стадий хроматографий на колонках, включающих, например три или более следующие хроматографии, в любом порядке: хроматографию на колонке с белком А, хроматографию на колонке с Q-сефарозой, хроматографию на колонке с фенилсефарозой, гель-фильтрацию и катионообменную хроматографию. Очистку можно завершить фильтрацией от вирусов и обменом буфера. Белок hALK1-Fc очищали до чистоты >98%, как определено с помощью гель-фильтрации, и >95%, как определено с помощью электрофореза в SDS-PAGE.
Пример 2: Идентификация лигандов ALK1-Fc
ALK1 представляет собой рецепторы типа 1 для членов семейства TGFβ. Ряд членов семейства TGFβ проверили на связывание со слитым белком ALK1-Fc, используя систему BiacoreTM. Ни сам TGFβ, ни GDF8, ни GDF11, ни ВМР2, ни ВМР4 не продемонстрировали значительное связывание с белком hALK1-Fc. ВМР2 и ВМР4 продемонстрировали ограниченное связывание. GDF5, GDF7 и ВМР9 продемонстрировали связывание со значениями KD, составляющими приблизительно 5×10-8 М, 5×10-8 М и 1×10-10 М, соответственно. На основе схожести GDF5 и GDF7 с GDF6 предполагают, что GDF6 будет связываться со схожей аффинностью. ВМР10 является близко родственным с ВМР9 и, как предполагается, также будет связываться со схожей аффинностью.
Пример 3: Характеристика эффектов ALK1-Fc и антитела против ALK1 на эндотелиальные клетки.
Используя люциферазную репотерную конструкцию под контролем четырех последовательных консенсусных сайтов SBE (SBE4-luc), которые реагируют на Smad1/5/8-опосредуемую передачу сигналов, авторы настоящего изобретения измеряли опосредуемую ВМР9 активность в присутствии и в отсутствие лекарственного средства ALK1-Fc или нейтрализующего, специфичного в отношении ALK1 моноклонального антитела в клетках HMVEC. Клетки HMVEC стимулировали rhBMP-9 (50 нг/мл), который вызывал Smad1/5/8-опосредуемую активацию транскрипции, подтверждаемую здесь по увеличению модулируемого увеличении транскрипции SBE4-luc. Соединение hALK1-Fc (10 мкг/мл) или антитело (10 мкг/мл), при их добавлении, ослабляли эту транскрипционную реакцию, при этом каждый на почти 60%, что указывает на то, что присутствие ALK1-Fc значительно снижает передачу сигнала от ВМР9, и, кроме того, что опосредуемая ВМР9 передача сигнала связана с активностью ALK1.
Активация фосфорилирования SMAD обычно используется для анализа активации рецепторов активина, находящихся относительно SMAD в противоположном направлении передачи сигнала. Известно, что ALK1 модулирует фосфорилирование белков SMAD 1, 5 и 8 при активации его лигандом. Здесь авторы настоящего изобретения добавляли rhBMP-9 (50 нг/мл) для инициирования фосфорилирования SMAD в клетках HUVEC, линии эндотелиальных клеток человека, которая природно экспрессирует рецептор ALK1, в течение периода, составляющего 30 минут. Фосфорилирование SMAD 1/5/8 было видно через 5 минут после обработки клеток лигандом, и фосфорилирование сохранялось в течение всего 30-минутного периода. В присутствии относительно низких концентраций hALK1-Fc (250 нг/мл) фосфорилирование SMAD 1/5/8 уменьшалось, подтверждая, что этот агент ингибирует опосредуемую Smad1/5/8 активацию в эндотелиальных клетках.
Для оценки ангиогенного эффекта ALK1-Fc в in vitro системе авторы настоящего изобретения исследовали эффективность соединения в уменьшении образования трубок из эндотелиальных клеток на субстрате матригеле. Этот метод, дающий как быстрые, так в высокой степени воспроизводимые результаты, обычно используют для оценки неоваскуляризации. Вспомогательное средство для роста эндотелиальных клеток (ECGS) используют для индукции образования микрососудов из эндотелиальных клеток на матригеле, и эффективность антиангиогенных соединений затем измеряют в виде уменьшения образования тяжей в присутствии как лекарственного средства, так и ECGS в течение 18-часового периода. Как и ожидалось, добавление ECGS (200 нг/мл) вызывало значительное образование тяжей по сравнению с отрицательным контролем (без обработки), который показывает базальные уровни образования тяжей эндотелиальными клетками, получаемые на субстрате матригеле (фиг. 5). При добавлении или hALK1-Fc (100 нг/мл), или mALK1-Fc (100 нг/мл) образование тяжей явно уменьшалось. Конечный количественный анализ длины сосудов во всех образцах показал, что каждая концентрация hALK1-Fc или mALK1-Fc уменьшала неоваскуляризацию до базальных уровней. Кроме того, hALK1-Fc и mALK1-Fc в присутствии сильно проангиогенного фактора ECGS сохраняли сильное ингибирование неоваскуляризации, демонстрируя даже более сильную антиангиогенную активность, чем эндостатин положительного контроля (100 нг/мл).
Пример 4: Анализы с использованием САМ
Широко известно, что VEGF и FGF стимулируют развитие кровеносных сосудов. Систему анализа с использованием САМ (хориоаллантоисной оболочки цыпленка) использовали для оценки ангиогенных эффектов GDF7. Как показано на фиг. 6, GDF7 стимулирует развитие кровеносных сосудов с эффективностью, схожей с эффективностью VEGF. Схожие результаты наблюдали при использовании GDF5 и GDF6.
Слитые белки ALK1-Fc проверяли на антиангиогенную активность в анализе с использованием САМ. Эти слитые белки продемонстрировали сильный антиангиогенный эффект на развитие кровеносных сосудов, стимулируемое VEGF, FGF и GDF7. См. фиг. 7. ВМР9 и PDFG продемонстрировали относительно слабую способность индуцировать развитие кровеносных сосудов в этом анализе, но такой ангиогенный эффект этих факторов тем не менее ингибировался ALK1-Fc.
Белки ALK1-Fc и имеющееся в продаже антиангиогенное моноклональное антитело против VEGF сравнивали в анализе с использованием САМ. Белки ALK1-Fc имели эффективность, схожую с эффективностью антитела против VEGF. Бевацизумаб, антитело против VEGF, используют в настоящее время для лечения рака и дегенерации желтого пятна у людей. См. фиг. 8.
Интересно, что антитело против ALK1 (R&D Systems) не ингибировало значительно развитие кровеносных сосудов в этой системе анализа. Авторы настоящего изобретения предполагают, что это может отображать различие в последовательности ALK1 в различных видах.
Пример 5: Анализ с использованием микрокармана в роговице мыши
Анализ с использованием микрокармана в роговице мыши использовали для оценки эффектов ALK1-Fc на развитие кровеносных сосудов внутри глаза мыши. hALK1-Fc, вводимый внутрибрюшинно, значительно ингибировал развитие кровеносных сосудов внутри глаза. Как показано на фиг. 9, hALK1-Fc ингибировал развитие кровеносных сосудов внутри глаза в той же степени, что и антитело против VEGF. hALK1-Fc и антитело против VEGF использовали в одинаковых в весовом отношении дозах. Схожие данные были получены, когда матригелевую массу, пропитанную VEGF, имплантировали в место, не являющееся глазом.
Эти данные демонстрируют, что лиганды ALK1 с высокими аффинностями стимулируют развитие кровеносных сосудов, и что слитый белок ALK1-Fc обладает сильной антиангиогенной активностью. Лиганды ALK1 распадаются на два класса, при этом группа GDF5,6,7 имеет среднюю аффинность в отношении ALK1, а группа ВМР9,10 имеет высокую аффинность в отношении ALK1.
GDF5, 6 и 7 обнаруживаются, главным образом, в кости и суставах, в то время как ВМР9 циркулирует в крови. Таким образом, по-видимому, существует проангиогенная система костей и суставов, которая включает ALK1, GDF5, 6 и 7, и системная ангиогенная система, которая включает ALK1 и ВМР9 (и возможно ВМР10).
Пример 6: Модель ревматоидного артрита на мышах
Модель индуцируемого коллагеном артрита на мышах является широко принятой моделью ревматоидного артрита. В этом исследовании группы из 10 мышей подвергали лечению носителем, антителом против VEGF (бевацизумабом - в качестве отрицательного контроля, поскольку бевацизумаб не ингибируют VEGF мыши) или mALK1-Fc (“RAP-041”) в дозах 1 мг/мл, 10 мг/мл или 25 мг/мл. После повторного введения коллагена в день 21 показатели артрита (см. фиг. 10) и опухание лап неуклонно возрастали во всех группах, при этом пик приходится приблизительно на 38 день. Мыши, подвергнутые лечению mALK1-Fc (“RAP-041”), продемонстрировали уменьшенные показатели для обеих характеристик, в частности при использовании наибольшей дозы (25 мг/кг), хотя уменьшение не достигало статистической значимости. Тем не менее, связанная с дозой тенденция является видимой.
К концу исследования в день 42 частота артрита достигала 10/10 у контрольных мышей, подвергнутых лечению носителем, 9/10 у мышей, подвергнутых лечению бевацизумабом, 8/10 в группе, подвергнутой лечению mALK1-Fc в дозе 1 мг/кг, и 9/10 в группе, подвергнутой лечению mALK1-Fc в дозе 10 мг/кг. В группе, подвергнутой лечению mALK1-Fc в дозе 25 мг/кг, частота заболевания была ниже, составляя 6/10.
Пример 7: Модель множественной миеломы на мышах
Множественная миелома представляет собой рак, главным образом, кости, который сопровождается значительной потерей костной массы. Модель 5Т2ММ миеломы на мышах основана на использовании опухолевых клеток (клеток 5Т2ММ) из типа спонтанной опухоли, которая развивается у старых мышей и вызывает у мышей явления, которые схожи с явлениями, наблюдаемыми у людей, страдающих множественной миеломой. См., например, Vanderkerken et al., Methods Mol. Med. 2005; 113: 191-205. mALK1-Fc проверяли на эффекты в этой модели.
Клетки 5Т2ММ, инъецированные мышам C57BL/KaLwRij, стимулировали увеличение покрытия остеокластами, образование остеолитических повреждений и вызвали уменьшение объема кости. Заболевание кости сопровождается уменьшением числа остеобластов, площади остеобластов и снижением минерализации.
Мышей, поддерживающих клетки 5Т2ММ, лечили mALK1-Fc (RAP-041) (в дозе 10 мг/мл, внутрибрюшинно, дважды в неделю) или носителем, от момента инъекции клеток 5Т2ММ, в течение в целом 12 недель. МикроСТ-анализ проксимальной большеберцовой кости и поясничных позвонков продемонстрировал статистически значимое уменьшение объема губчатой кости и числа трабекул у 5Т2ММ-поддерживающих мышей по сравнению с мышами без опухолей (объем кости уменьшался на 40% относительно контролей; число трабекул уменьшалось на 40%). RAP-041 полностью предотвращал вызываемое клетками 5Т2ММ уменьшение объема кости и числа трабекул по сравнению с мышами, подвергнутыми лечению носителем (подвергнутые лечению мыши имели объем кости, составляющий 120% относительно контролей без опухолей, и число трабекул, составляющее 115% относительно контролей без опухолей). Кроме того, у подвергнутых лечению носителем мышей с опухолями развивались литические костные повреждения, которые выявлялись с помощью микроСТ. Лечение mALK1-Fc приводило к уменьшению числа литических костных повреждений на 50% относительно мышей, подвергнутых лечению носителем.
Основываясь на антиангиогенных эффектах ALK1-Fc, авторы настоящего изобретения делают вывод, что защитный эффект для кости, обеспечиваемый этим агентом, является последствием уменьшенного роста опухоли.
Следовательно, ALK1-Fc может использоваться для лечения множественной миеломы и для уменьшения явлений заболевания кости, являющихся результатом этого типа опухоли.
Пример 8: Свойства DAN, касающиеся связывания с лигандами
DAN является членом семейства секретируемых белков с группой цистеинов, который ингибирует активность ВМР. Известно, что DAN связывается с GDF5 и служит в качестве его антагониста. Авторы настоящего изобретения определили, что DAN также сильно связывается с GDF7, но не связывается с ВМР9. Поэтому авторы настоящего изобретения делают вывод, что DAN ингибирует ряд обнаруживаемых в кости и суставах лигандов ALK1, и DAN, как предполагается, является сильным антагонистом связанного с костью и суставами развития кровеносных сосудов. Таким образом, DAN может быть полезен для лечения раков кости, например, множественной миеломы и метастазирования в кость, а также ревматоидного артрита и остеоартрита.
Вместе взятые факты, приведенные в этих примерах, обеспечивают многочисленные реагенты, описанные здесь, для ингибирования развития кровеносных сосудов in vivo и, в частности, развития кровеносных сосудов внутри глаза. Эти факты также указывают на то, что агенты, направленные на GDF5, 6 и 7, могут использоваться для избирательного ингибирования развития кровеносных сосудов в кости и суставов. Эти факты, кроме того, указывают, на то, что такие агенты могут использоваться для лечения раков и ревматоидного артрита.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Все публикации и патенты, упоминаемые здесь, полностью включены таким образом посредством ссылки, как если бы для каждой отдельной публикации или патента было специально и отдельно указано, что она(он) включена посредством ссылки. В случае конфликта настоящая заявка, в том числе любые приведенные здесь определения, будет господствовать.
ЭКВИВАЛЕНТЫ
Несмотря на то, что здесь явно раскрыты конкретные варианты осуществления рассматриваемых здесь изобретений, вышеприведенное описание является иллюстративным, а не ограничивающим. Многие варианты изобретений станут очевидными квалифицированным в данной области техники специалистам при обзоре этого описания и формулы изобретения, приведенной ниже. Полный объем изобретений должен определяться по ссылке на формулу изобретения, вместе с полным объемом их эквивалентов, и описанием, вместе с такими вариантами.


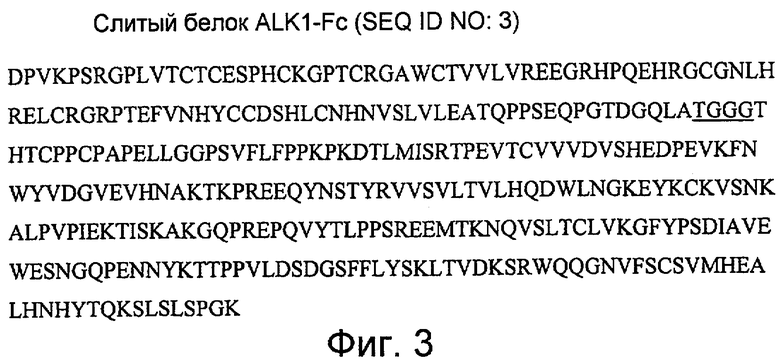

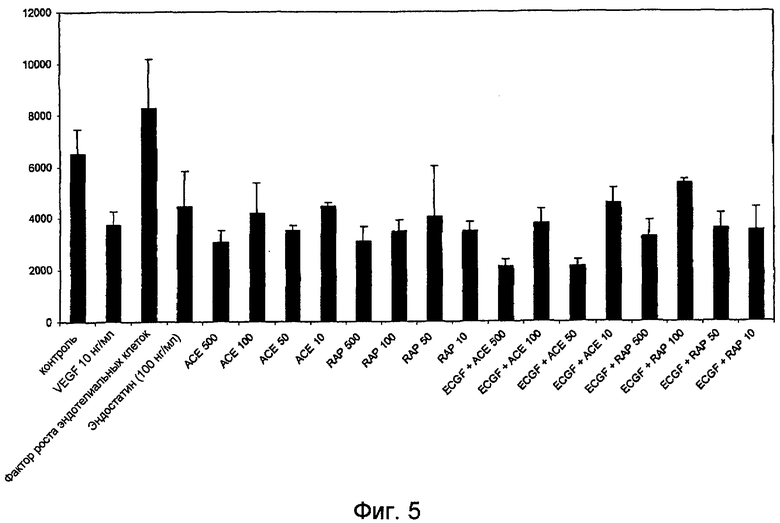
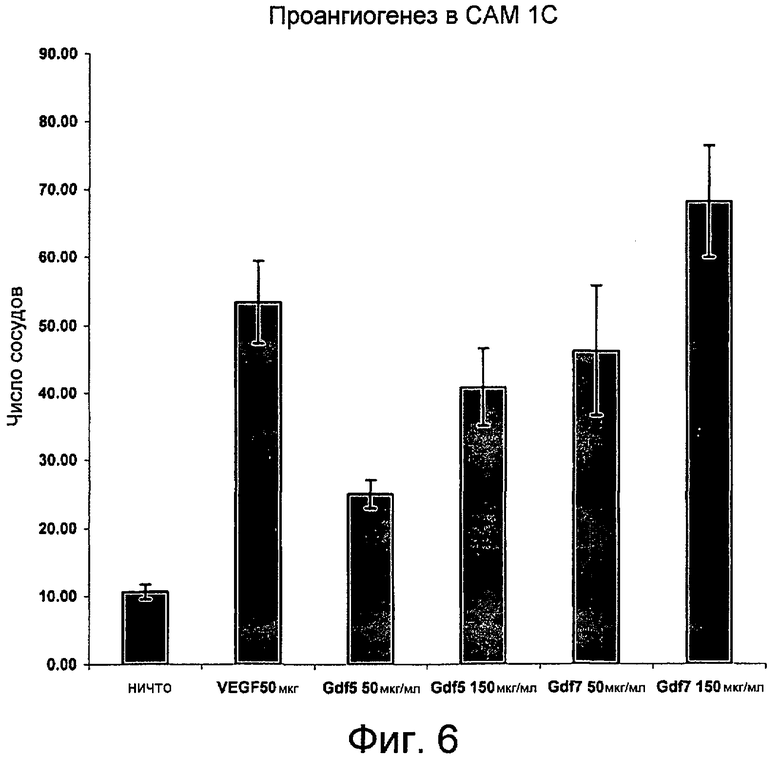
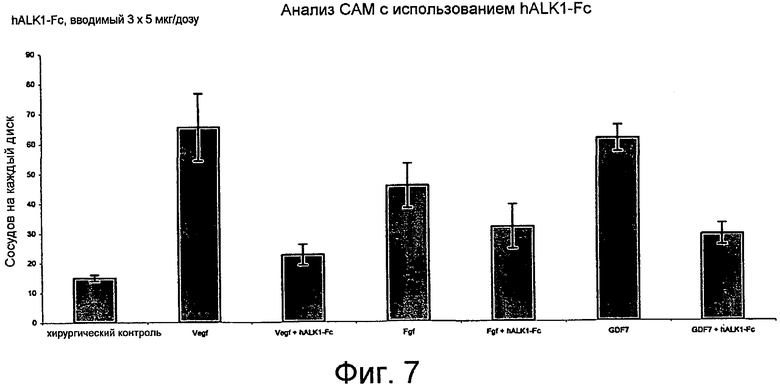
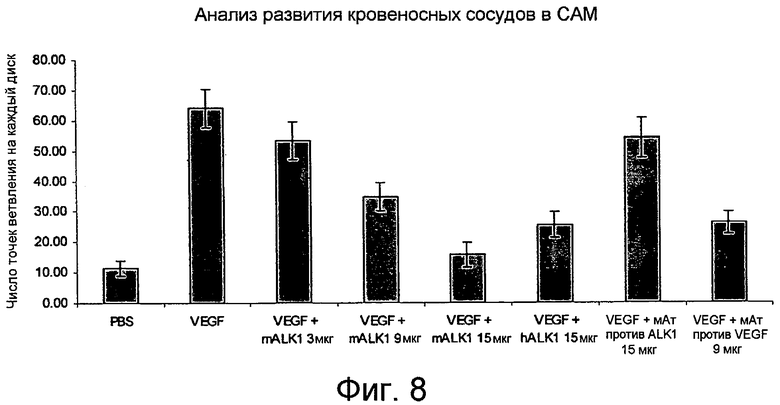
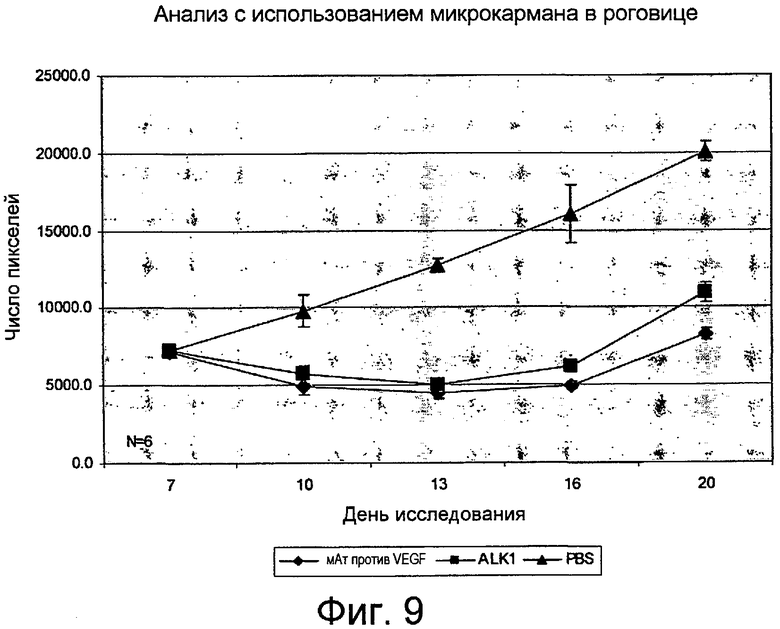
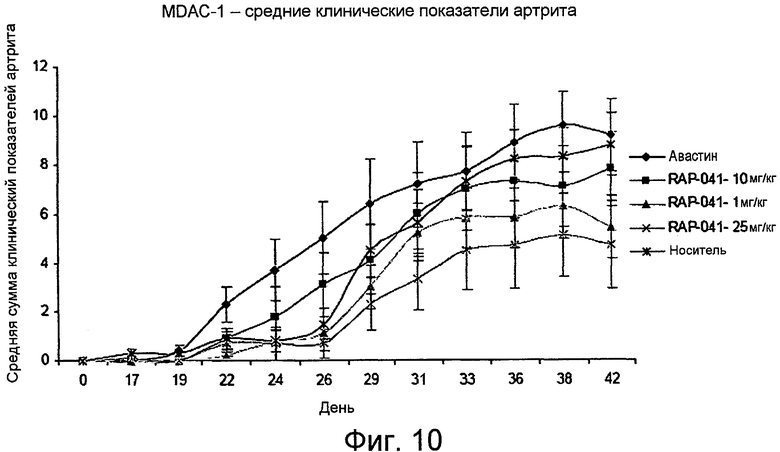
Настоящее изобретение относится к области биотехнологии. Предложен способ лечения опухоли у млекопитающего, предусматривающий введение эффективного количества слитого белка ALK1-Fc, где слитый белок ALK1-Fc содержит внеклеточный домен (ECD) подобной рецептору активина киназы I (ALK1 или ACVRL1), слитый на C-конце с Fc-областью иммуноглобулина. Слитый белок ALK1-Fc по настоящему изобретению способен связывать GDF5, GDF7 и BMP9, обеспечивая ингибирование развития кровеносных сосудов. 15 з.п. ф-лы, 10 ил., 8 пр.
1. Способ лечения опухоли у млекопитающего, предусматривающий введение млекопитающему, имеющему опухоль, эффективного количества слитого белка ALK1-Fc, где слитый белок ALK1-Fc содержит полипептид ECD ALK1, слитый на C-конце с Fc-областью иммуноглобулина, причем слитый белок ALK-1 не содержит полноразмерную полипептидную последовательность ALK1.
2. Способ по п.1, в котором слитый белок ALK1-Fc связывается с TGFбета-1 с KD больше 1×10-8 М.
3. Способ по п.1, в котором слитый белок ALK1-Fc связывается с BMP9.
4. Способ по п.1, в котором аминокислотная последовательность слитого белка ALK1-Fc представляет собой последовательность SEQ ID NO: 3.
5. Способ по п.1, в котором содержащий ECD ALK1 полипептид включает аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, соответствующей аминокислотам 34-95 последовательности SEQ ID NO: 1.
6. Способ по п.1, в котором полипептид ECD ALK1 содержит аминокислотную последовательность, кодируемую нуклеиновой кислотой, которая гибридизуется в жестких условиях гибридизации с нуклеотидами 100-285 последовательности SEQ ID NO: 2 или вариантом нуклеотидов 100-285 последовательности SEQ ID NO: 2, который имеет такую же кодирующую последовательность.
7. Способ по п.1, в котором слитый белок ALK1-Fc доставляется внутривенно.
8. Способ по п.1, который дополнительно предусматривает введение второго агента, который ингибирует ангиогенез.
9. Способ по п.1, в котором опухоль ассоциирована с костью.
10. Способ по п.1, в котором опухолью является миелома или опухоль, которая метастазировала в кость.
11. Способ по п.1, в котором опухоль устойчива к анти-VEGF-терапии.
12. Способ по п.1, в котором аминокислотная последовательность белка ALK1-ECD содержит аминокислоты 22-120 последовательности SEQ ID NO: 1.
13. Способ по п.1, в котором аминокислотная последовательность слитого белка ALK1-Fc содержит аминокислотную последовательность SEQ ID NO: 3.
14. Способ по п.1, где полипептид ECD ALK1 состоит из полипептида с аминокислотной последовательностью, которая по меньшей мере на 95% идентична последовательности аминокислот 22-118 последовательности SEQ ID NO:1.
15. Способ по п.1, где полипептид ECD ALK1 состоит из полипептида с аминокислотной последовательностью, которая по меньшей мере на 97% идентична последовательности аминокислот 22-118 последовательности SEQ ID NO:1.
16. Способ по п.1, где полипептид ECD ALK1 состоит из полипептида с аминокислотной последовательностью, которая по меньшей мере на 99% идентична последовательности аминокислот 22-118 последовательности SEQ ID NO: ID NO:1.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| DAVID L | |||
| et al., "Identification of BMP9 and BMP10 as functional activators of the orphan activin receptor-like kinase 1 (ALK1) in endothelial cells", Blood, 1 March 2007 (prepublished online October 26, 2006), 109(5): 1953-1961 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| HOFFMANN A | |||
| et al., "Perspectives in the biological | |||
Авторы
Даты
2015-08-10—Публикация
2007-11-02—Подача