УРОВЕНЬ ТЕХНИКИ
[0001] На почечно-клеточную карциному (ПКК) приходится более 90% всех случаев злокачественных опухолей почек. Данный тип рака занимает восьмое место среди наиболее часто диагностируемых типов рака у мужчин и женщин в США. По оценке Национального института рака США в 2012 году в США будет диагностировано приблизительно 65000 новых случаев рака почек, и рак почек станет причиной приблизительно 13600 смертей. По всему миру каждый год диагностируют более 200000 новых случаев и более 100000 смертей по причине ПКК. По всему миру увеличиваются как частота возникновения, так и смертность от ПКК.
[0002] ПКК часто может быть вылечен путем хирургического удаления опухоли или почки, если рак диагностировали и приступили к его лечению, когда он еще локализован в почке или в непосредственно прилежащей ткани. Однако по мере того как рак становится васкуляризованным и метастазирует в отдаленные области тела вероятность выживания без болезни значительно снижается. Треть случаев ПКК представляет собой метастазирующее заболевание со значением пятилетней выживаемости менее 10%.
[0003] Метастазирующий ПКК (мПКК) исторически нечувствителен к химиотерапии и гормональной терапии, и до очень недавнего времени его системное лечение было ограничено неспецифической иммунной цитокиновой терапией интерлейкином-2 (ИЛ-2) или интерфероном альфа (ИФН α). Данные варианты терапии сопровождаются низкой степенью ответа и высокой степенью токсичности.
[0004] Исследования, проведенные в течение последнего десятилетия, позволили выявить генетические факторы, связанные с онкогенезом ПКК и прогрессированием заболевания. В частности, было установлено, что нарушение передачи сигналов в путях передачи сигналов с участием фактора роста эндотелия сосудов (VEGF), фактора роста тромбоцитов (PDGF) и AKT/mTOR (мишень рапамицина у млекопитающих) как внутри опухолевых клеток, так и между опухолевыми клетками и окружающей тканью (например, резидентными эндотелиальными клетками и перицитами), играет решающую роль в поддержании васкуляризации ПКК, жизнестойкости клеток и пролиферации опухоли. Обнаружение связи нарушений в данных путях передачи сигналов и ПКК в свою очередь привело к разработке целого ряда вариантов терапии, направленных на ключевые этапы путей передачи сигналов с участием VEGF, PDGF и mTOR. В частности, с 2005 года FDA были одобрены пять агентов, нацеленных на пути передачи сигналов с участием VEGF и PDGF (т.е. сорафениб, сунитиниб, бевацизумаб, пазопаниб и акситиниб), и два варианта терапии, направленной на путь передачи сигналов с участием mTOR (т.е. темсиролимус и эверолимус), для применения в прогрессирующей ПКК.
[0005] За исключением бевацизумаба (который представляет собой гуманизированное антитело, связывающееся с VEGF, общеизвестное как АВАСТИН®), одобренные варианты терапии ПКК, мишенями которых являются пути передачи сигналов с участием VEGF, представляют собой низкомолекулярные ингибирующие соединения-миметики АТФ. Данные низкомолекулярные ингибиторы действуют путем связывания с высококонсервативным АТФ-связывающим каталитическим участком рецепторных тирозинкиназ, таких как VEGFR1, VEGFR2 и VEGFR3, и за счет этого блокируют внутриклеточную передачу сигналов от связанного рецептора. Однако отчасти вследствие высококонсервативной структуры АТФ-связывающего каталитического участка протеинкиназ большинство низкомолекулярных ингибиторов рецепторных киназ также связывается и ингибирует отличные нецелевые рецепторные тирозинкиназы, а иногда и киназы, относящиеся к другим семействам. Подобное «нецелевое» действие ингибиторов рецепторной тирозинкиназы часто приводит к возникновению побочных действий и токсичности, что ограничивает терапевтическое применение и/или эффективность лекарственного препарата.
[0006] Сунитиниб (общеизвестный как СУТЕНТ®) представляет собой ингибитор рецепторных тирозинкиназ, имеющий много мишеней, который первоначально был разработан как низкомолекулярный ингибитор рецепторной тирозинкиназы c-Met. Помимо c-Met, сунитиниб конкурентно ингибирует активность рецепторных тирозинкиназ VEGFR1, VEGFR2, VEGFR3, PDGFRa, PDGFRb, flt-3, с KIT (CD117), RET и CSF-1R. Сунитиниб был одобрен в качестве терапии первой линии для лечения прогрессирующей ПКК после завершения базовых клинических исследований, продемонстрировавших, что сунитиниб вызывает увеличение общей выживаемости у пациентов с прогрессирующим заболеванием приблизительно на пять месяцев по сравнению с интерфероном альфа (26,4 месяцев по сравнению с 21,8 месяцев). Благодаря данному, хотя и небольшому, улучшению выживаемости пациента сунитиниб стал новым стандартом лечения для пациентов с прогрессирующим ПКК, не получавших лекарственной терапии. Терапия сунитинибом связана со значительными побочными действиями, что подтверждается необходимостью уменьшения размера дозы у 50% пациентов с ПКК для уменьшения значительного токсического действия, связанного с сунитинибом.
[0007] Несмотря на недавние достижения в терапии ПКК, остается значительная неудовлетворенная потребность в эффективных вариантах терапии. Доступные в настоящий момент варианты терапии дают пациентам менее одного года выживаемости без прогрессирования заболевания и связаны со значительным токсическим действием. Более того, адаптация опухоли к лечению часто приводит к прерыванию лечения и к ускоренному росту опухоли.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] В настоящем изобретении предложены антагонисты регуляторной системы активинподобной киназы I (ALK1) и применение таких антагонистов для лечения почечно-клеточной карциномы (ПКК). Согласно конкретным аспектам настоящего изобретения ПКК представляет собой светлоклеточную почечно-клеточную карциному. Согласно следующим аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM (классификация по принципу Опухоль/Лимфатический узел/Метастазы, Tumor/Mode/Metastasis). Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно другим аспектам настоящего изобретения ПКК инвазировал почечный синус. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0009] Как описано в настоящей заявке, ALK1 представляет собой рецептор для группы лигандов GDF5 (фактор роста и дифференцировки 5), которая включает GDF6 и GDF7, а также для группы лигандов ВМР9 (морфогенетический белок кости 5), которая включает BMP10. В настоящем тексте продемонстрировано, что передача сигналов, опосредуемая ALK1 и лигандами, описанными выше, вовлечена в ангиогенез in vivo, и что ингибирование данной регуляторной системы обладает потенциальным антиангиогенным действием.
[0010] В настоящем тексте также продемонстрировано, что применение антагонистов регуляторной системы ALK1, таких как слитые белки ALK1-Fc, ингибирует рост опухоли в моделях на животных с ксенотрансплантатами ПКК человека. В настоящем тексте также продемонстрировано, что слитый белок ALK1-Fc, антагонист ALK1, при введении в комбинации с сунитинибом вызывает значительное увеличение активности сунитиниба (ингибитора рецепторной тирозинкиназы VEGF) по ингибированию роста опухоли в моделях на животных с ксенотрансплантатами ПКК человека. Таким образом, согласно некоторым аспектам в настоящем изобретении предложены антагонисты регуляторной системы ALK1, в том числе антагонисты рецептора ALK1 или одного или нескольких лигандов ALK1, для применения в лечении почечно-клеточной карциномы. Согласно конкретным аспектам настоящего изобретения антагонист ALK1 представляет собой слитый белок ALK1-Fc (например, слитый белок ALK1-Fc, описанный в настоящей заявке). Согласно некоторым аспектам в настоящем изобретении предложены антагонисты регуляторной системы ALK1, в том числе антагонисты рецептора ALK1 или одного или нескольких лигандов ALK1, для применения в лечении почечно-клеточной карциномы. Согласно конкретным аспектам настоящего изобретения почечно-клеточная карцинома представляет собой светлоклеточную почечно-клеточную карциному. Согласно дополнительным аспектам настоящего изобретения почечно-клеточная карцинома, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно другим аспектам настоящего изобретения ПКК инвазировала почечный синус. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0011] Согласно некоторым аспектам в настоящем изобретении предложены полипептиды, содержащие лиганд-связывающий участок внеклеточного домена ALK1 («полипептиды ALK1 ECD»), для применения в ингибировании ангиогенеза. Согласно дополнительным аспектам в настоящем изобретении предложены полипептиды, включающие полипептиды ALK1 ECD, для применения в лечении ПКК (например, прозрачноклеточной почечно-клеточной карциномы). Без намерения ограничения каким-либо конкретным механизмом действия, предполагают, что данные полипептиды действуют путем связывания с лигандами ALK1 и ингибирования способности данных лигандов взаимодействовать с ALK1, а также с другими рецепторами. Согласно некоторым вариантам реализации настоящего изобретения полипептид ALK1 ECD содержит аминокислотную последовательность, которая по меньшей мере на 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности аминокислот 22-118 последовательности ALK1 человека, SEQ ID NO: 1. Согласно некоторым вариантам реализации настоящего изобретения полипептид ALK1 ECD содержит аминокислотную последовательность, которая по меньшей мере на 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности аминокислот 22-120 последовательности ALK1 человека SEQ ID NO: 1. Полипептид ALK1 ECD можно применять в виде небольшого мономерного белка или в димеризованной форме (например, его можно экспрессировать в форме Fc-слитого белка). ALK1 ECD может также быть слитым со второй частью полипептида для получения улучшенных или желаемых свойств, таких как улучшенная аффинность связывания с лигандом, увеличенный период полужизни или значительное облегчение процесса получения или очистки. Слияние с Fc-фрагментом иммуноглобулина или связывание с группой полиоксиэтилена (например, с полиэтиленгликолем) может быть особенно полезно для увеличения периода полужизни полипептида ALK1 ECD в сыворотке при системном введении (например, при внутривенном, внутриартериальном и внутрибрюшинном введении).
[0012] Как продемонстрировано в настоящей заявке, системно введенный слитый белок ALK1-Fc обладает потенциальным действием по ингибированию роста опухоли при введении отдельно в моделях на мышах с ксенотрансплантатами ПКК человека и вызывает значительное увеличение ингибирования роста опухоли ПКК сунитинибом при системном введении вместе с сунитинибом в исследованных моделях на мышах с ксенотрансплантатами ПКК человека. Согласно некоторым вариантам реализации настоящего изобретения слитый белок ALK1-Fc содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или на 100% идентична последовательности аминокислот 22-118 или 22-120 из SEQ ID NO: 1, причем указанный полипептид слит (гибридизован), через промежуточный линкер или без него, с Fc-фрагментом иммуноглобулина и при этом слитый белок ALK1-Fc связывается с лигандом ALK1, который выбирают из GDF5 (например, имеющего последовательность, приведенную в базе данных Genbank под учетным № САА56874), GDF6 (например, имеющего последовательность, приведенную в базе данных Genbank под учетным № ААН43222), GDF7 (например, имеющего последовательность, приведенную в базе данных Genbank под учетным № NP 878248), BMP9 (например, имеющего последовательность, приведенную в базе данных Genbank под учетным № AF156891, AF188285, АК314956, ВС069643 или ВС074921) и BMP 10 (например, имеющего последовательность, приведенную в базе данных Genbank под учетным № 095393). Согласно следующим аспектам настоящего изобретения слитый белок ALK1-Fc связывается с лигандом ALK1, который выбирают из GDF5, GDF7 и ВМР9, со значением KD, составляющим менее 1×10-7 М, и связывается с TGFP-1 со значением KD, составляющим более 1×10-6 М. Fc-фрагменты Fc-слитого белка выбирают таким образом, чтобы они соответствовали организму, который лечат, и таким образом, чтобы белок демонстрировал желаемые фармакокинетические и фармакодинамические свойства. В некоторых случаях Fc-фрагмент представляет собой Fc-фрагмент IgGl человека. Согласно предпочтительным вариантам реализации настоящего изобретения слитый белок ALK1-Fc включает аминокислоты 22-118 или 22-120 из SEQ ID NO: 1. В некоторых случаях слитый белок ALK1-Fc включает аминокислотную последовательность SEQ ID NO: 3. В некоторых случаях слитый белок ALK1-Fc включает аминокислотную последовательность SEQ ID NO: 14. В некоторых случаях слитый белок ALK1-Fc представляет собой белок, полученный в результате экспрессии нуклеиновой кислоты SEQ ID NO: 4 в лини клеток млекопитающих, в частности, в линии клеток яичников китайского хомячка (СНО). Полипептиды ALK1-ECD готовят в форме фармацевтических препаратов, которые являются по существу апирогенными. Фармацевтический препарат можно приготовить для системной доставки (например, внутривенная, внутриартериальная или подкожная доставка) или для местной доставки.
[0013] Согласно некоторым аспектам настоящее изобретение направлено на преодоление сложностей при разработке относительно гомогенных препаратов слитого белка ALK1-Fc для их терапевтического применения. Как описано в настоящей заявке, слитые белки ALK1-Fc имеют тенденцию агрегировать с образованием мультимеров более высокого порядка. В настоящем изобретении предложены подходы для решения данных сложностей, а также, на основании этого, предложены фармацевтические препараты, содержащие слитые белки ALK1-Fc, причем такие препараты состоят по меньшей мере на 85%, 90%, 95%, 96%, 97%, 98% или на 99% из димерного слитого белка ALK1-Fc. Соответственно, согласно некоторым аспектам в настоящем изобретении предложены фармацевтические препараты, содержащие слитый белок ALK1-Fc, включающие: полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96% или на 97% идентична последовательности аминокислот 22-118 или 22-120 из SEQ ID NO: 1, причем указанный полипептид слит с Fc-фрагментом иммуноглобулина и при этом слитый белок ALK1-Fc связывается с лигандом, который выбирают из GDF5, GDF6, GDF7, ВМР9 и BMP 10. Согласно следующим аспектам настоящего изобретения слитый белок ALK1-Fc связывается с GDF5, GDF7 и ВМР9 со значением KD, составляющим менее 1×10-7 М, и связывается с TGFP-1 со значением KD, составляющим более 1×10-6 М, и при этом по меньшей мере 85%, 90%, 95%, 96%, 97%, 98% или 99% слитого белка ALK1-Fc присутствует в форме димера.
[0014] Fc-фрагмент слитого белка ALK1-Fc может представлять собой Fc-фрагмент IgGl человека или иммуноглобулинов человека другого подкласса, таких как IgG2 или IgG3. Согласно некоторым аспектам настоящего изобретения слитый белок ALK1-Fc включает аминокислотную последовательность SEQ ID NO:3. Согласно другим аспектам настоящего изобретения слитый белок ALK1-Fc включает аминокислотную последовательность SEQ ID NO: 14. Согласно следующим аспектам настоящего изобретения слитый белок ALK1-Fc получают в результате экспрессии нуклеиновой кислоты SEQ ID NO: 4 в линии клеток млекопитающих, такой как линия клеток яичников китайского хомячка (СНО). Такие фармацевтические препараты можно приготовить в составы с целью оптимизации желаемых свойств слитого белка ALK1-Fc с применением известных методик и реактивов.
[0015] Фармацевтические препараты согласно настоящему изобретению можно применять для различных терапевтических целей, описанных в настоящей заявке, в том числе для ингибирования ангиогенеза и лечения ПКК. Согласно конкретному аспекту настоящего изобретения фармацевтические препараты используют для лечения почечно-клеточной карциномы. Согласно следующему аспекту настоящего изобретения фармацевтические препараты используют для лечения ПКК у млекопитающего, который ранее получал терапевтический агент для лечения ПКК. Согласно другому аспекту настоящего изобретения фармацевтические препараты используют для лечения млекопитающего с ПКК, которое проходит медицинские процедуры или которое готовят к прохождению медицинских процедур для лечения ПКК. Согласно следующему аспекту настоящего изобретения фармацевтические препараты согласно настоящему изобретению используют для лечения прогрессирующей (метастазирующей) ПКК. Согласно дополнительным аспектам настоящего изобретения фармацевтические препараты согласно настоящему изобретению используют для ингибирования ангиогенеза и/или для лечения заболевания или нарушения, при котором ингибирование ангиогенеза является желательным.
[0016] Согласно некоторым вариантам реализации настоящего изобретения фармацевтические препараты ALK1-Fc и препараты, включающие антитела, направленные против ALK1 или против одного или нескольких лигандов ALK1 (например, ВМР9 и/или BMP 10), используются в сочетании с агентом, который ингибирует ангиогенез. Согласно некоторым вариантам реализации настоящего изобретения фармацевтические препараты ALK1-Fc и препараты, включающие антитела, направленные против ALK1 или против одного или нескольких лигандов ALK1 (например, ВМР9 и/или BMP10), используют в сочетании с антагонистом пути передачи сигналов с участием VEGF (например, с антителом, которое связывается с VEGF (например, АВАСТИН®), с рецептором VEGF (например, VEGFR1, VEGFR2 и VEGFR3) и с рецептором-ловушкой VEGF). Согласно конкретным аспектам настоящего изобретения фармацевтические препараты содержат ингибитор рецепторной тирозинкиназы VEGF. Согласно следующим аспектам настоящего изобретения ингибитор рецепторной тирозинкиназы VEGF представляет собой агент, выбранный из сунитиниба (СУТЕНТ®), сорафениба (НЕКСАВАР®), пазопаниба (ВОТРИЕНТ®), акситиниба (ИНЛИТА®), тивозаниба и вандетаниба.
[0017] Согласно некоторым аспектам в настоящем изобретении предложены способы лечения почечно-клеточной карциномы у млекопитающего путем введения млекопитающему с ПКК, полипептида ALK1 ECD. Согласно следующему аспекту в настоящем изобретении предложен способ лечения ПКК у млекопитающего, включающий введение млекопитающему с ПКК, эффективного количества слитого белка активинподобная киназа I (ALK1)-Fc и ингибитора рецепторной тирозинкиназы VEGF. Согласно одному аспекту настоящего изобретения ПКК, которую лечат, представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0018] Согласно некоторым аспектам настоящего изобретения слитый белок ALK1-Fc, который вводят в соответствии со способом согласно настоящему изобретению, содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 80%, 90%, 95%, 96%, 97%, 98%, 99% или на 100% идентична последовательности аминокислот 22-118 или 22-120 из SEQ ID NO: 1, причем указанный полипептид слит с Fc-фрагментом иммуноглобулина, и при этом слитый белок ALK1-Fc связывается с лигандом ALK, который выбирают из GDF5, GDF6, GDF7, ВМР9 и ВМР10. Согласно следующим аспектам настоящего изобретения слитый белок ALK1-Fc связывается с TGFpM со значением KD, составляющим более 1×10-6 М. В некоторых случаях слитый белок ALK1-Fc имеет последовательность согласно SEQ ID NO: 3. В альтернативном варианте слитый белок ALK1-Fc имеет последовательность согласно SEQ ID NO: 14. Полипептид ALK1 ECD можно доставлять местно или системно (например, внутривенно, внутриартериально или подкожно).
[0019] Согласно следующему аспекту настоящего изобретения ингибитор рецепторной тирозинкиназы VEGF, который вводят вместе со слитым белком ALK1-Fc, представляет собой агент, выбранный из сунитиниба (СУТЕНТ®), сорафениба (НЕКСАВАР®), пазопаниба (ВОТРИЕНТ®), акситиниба (ИНЛИТА®), тивозаниба и вандетаниба.
[0020] Согласно другому аспекту в настоящем изобретении предложен способ лечения ПКК у млекопитающего, включающий введение млекопитающему с ПКК, эффективного количества активинподобной киназы I (ALK1)-Fc, ингибитора рецепторной тирозинкиназы VEGF и ингибитора мишени рапамицина у млекопитающих (mTOR). Согласно следующему аспекту настоящего изобретения слитый белок ALK1-Fc и ингибитор рецепторной тирозинкиназы VEGF вводят вместе с ингибитором, мишенью которого является mTOR, - эверолимусом или темсиролимусом. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384.
[0021] Согласно одному аспекту настоящего изобретения ПКК, которую лечат, представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0022] Согласно другому аспекту в настоящем изобретении предложен способ лечения почечно-клеточной карциномы у млекопитающего, которое ранее получало терапевтический агент для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества слитого белка активинподобная киназа I (ALK1)-Fc. Согласно одному аспекту настоящего изобретения терапевтический агент, получаемый ранее, представляет собой ингибитор рецепторной тирозинкиназы VEGF. Согласно следующему аспекту настоящего изобретения ингибитор рецепторной тирозинкиназы VEGF представляет собой агент, выбранный из: сунитиниба, сорафениба, пазопаниба, акситиниба, тивозаниба и вандетаниба. Согласно другому аспекту настоящего изобретения терапевтический агент, получаемый ранее, представляет собой ингибитор, мишенью которого является мишень рапамицина у млекопитающих (mTOR). Согласно следующему аспекту настоящего изобретения ингибитор, мишенью которого является mTOR, представляет собой агент, выбранный из эверолимуса и темсиролимуса. Согласно другим аспектам настоящего изобретения ингибитор, мишенью которого является mTOR, представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384. Согласно дополнительному аспекту настоящего изобретения терапевтический агент, получаемый ранее, представляет собой системную цитокиновую терапию. Согласно следующему аспекту настоящего изобретения системная цитокиновая терапия представляет собой терапию интерфероном альфа (ИФН α) или интерлейкином-2 (ИЛ-2). Согласно одному аспекту настоящего изобретения ПКК, которую лечат, представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0023] Согласно дополнительным аспектам в настоящем изобретении предложен способ лечения почечно-клеточной карциномы у млекопитающего, которое ранее получало терапевтический агент для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества слитого белка активинподобная киназа I (ALK1)-Fc и ингибитора рецепторной тирозинкиназы VEGF. Согласно следующему варианту реализации настоящего изобретения ингибитор рецепторной тирозинкиназы VEGF представляет собой агент, выбранный из: сунитиниба, сорафениба, пазопаниба, акситиниба, тивозаниба и вандетаниба. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно одному аспекту настоящего изобретения ПКК представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0024] Согласно дополнительным аспектам в настоящем изобретении предложен способ лечения почечно-клеточной карциномы у млекопитающего, которое ранее получало терапевтический агент для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества слитого белка активинподобная киназа I (ALK1)-Fc и антитела, которое связывается с рецепторной тирозинкиназой. Согласно следующему аспекту настоящего изобретения антитело связывается с рецепторной тирозинкиназой, которую выбирают из: VEGF, VEGFR1, VEGFR2, VEGFR3, PDGFRa, PDGFRb, c-KIT, MET FAK, RET, FGF бета, TiE-1, Tie-2 и EGFR. Согласно дополнительному аспекту настоящего изобретения антитело, которое вводят, представляет собой бевацизумаб. Согласно одному аспекту настоящего изобретения ПКК представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0025] Согласно дополнительным аспектам в настоящем изобретении предложен способ лечения почечно-клеточной карциномы у млекопитающего, которое ранее получало терапевтический агент для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества слитого белка активинподобная киназа I (ALK1)-Fc и ингибитора, мишенью которого является mTOR. Согласно следующему аспекту настоящего изобретения ингибитор, мишенью которого является mTOR, представляет собой агент, выбранный из эверолимуса и темсиролимуса. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384. Согласно одному аспекту настоящего изобретения ПКК представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0026] Согласно дополнительным аспектам в настоящем изобретении предложен способ лечения почечно-клеточной карциномы у млекопитающего, которое ранее получало терапевтический агент для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества слитого белка активинподобная киназа I (ALK1)-Fc и иммуностимулирующего цитокина. Согласно дополнительному варианту реализации настоящего изобретения иммуностимулирующий цитокин, который вводят, представляет собой ИФН α или ИЛ-2. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0027] Согласно дополнительному аспекту в настоящем изобретении предложен способ лечения ПКК у млекопитающего, который включает введение млекопитающему с ПКК, которое проходит медицинские процедуры или которое готовят к прохождению медицинских процедур для лечения ПКК, эффективного количества слитого белка активинподобная киназа I (ALK1)-Fc. Согласно одному аспекту настоящего изобретения медицинская процедура выбрана из: нефронсберегающей хирургии, частичной нефрэктомии, полной нефрэктомии и термоаблации. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно дополнительным аспектам настоящего изобретения ПКК инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0028] Согласно одному аспекту настоящего изобретения слитый белок ALK1-Fc, который вводят млекопитающему с ПКК, которое проходит медицинские процедуры или которое готовят к прохождению медицинских процедур для лечения ПКК, содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 85%, 90%, 95%, 96%, 97%, 98%, 99% или на 100% идентична последовательности аминокислот 22-118 или 22-120 из SEQ ID NO: 1, причем слитый белок ALK1-Fc связывается с лигандом ALK1, который выбирают из GDF5, GDF6, GDF7, ВМР9 и BMP10. Согласно дополнительному аспекту настоящего изобретения Fc-фрагмент слитого белка ALK1-Fc представляет собой Fc-фрагмент иммуноглобулина человека IgGl. Согласно следующему аспекту настоящего изобретения слитый белок ALK1-Fc включает аминокислотную последовательность SEQ ID NO: 3 или SEQ ID NO: 14.
[0029] Согласно следующему аспекту в настоящем изобретении предложен способ лечения ПКК у млекопитающего, которое проходит медицинские процедуры или которое готовят к прохождению медицинских процедур для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества слитого белка активинподобная киназа I (ALK1)-Fc и ингибитора рецепторной тирозинкиназы VEGF. Согласно одному аспекту настоящего изобретения ингибитор рецепторной тирозинкиназы VEGF представляет собой агент, выбранный из сунитиниба, сорафениба, пазопаниба, акситиниба, тивозаниба и вандетаниба.
[0030] Согласно другому аспекту в настоящем изобретении предложен способ лечения ПКК у млекопитающего, которое проходит медицинские процедуры или которое готовят к прохождению медицинских процедур для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества слитого белка ALK1-Fc, ингибитора рецепторной тирозинкиназы VEGF и ингибитора, мишенью которого является mTOR. Согласно одному аспекту настоящего изобретения ингибитор, мишенью которого является mTOR, представляет собой агент, выбранный из эверолимуса и темсиролимуса. Согласно другому аспекту настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384.
[0031] Согласно другому аспекту в настоящем изобретении предложен способ лечения ПКК у млекопитающего, которое проходит медицинские процедуры или которое готовят к прохождению медицинских процедур для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества слитого белка ALK1-Fc, ингибитора рецепторной тирозинкиназы VEGF и иммуностимулирующего цитокина. Согласно одному аспекту настоящего изобретения иммуностимулирующий цитокин, который вводят, представляет собой ИФН альфа или ИЛ-2.
[0032] Согласно некоторым аспектам в настоящем изобретении предложен способ лечения ПКК у млекопитающего, которое проходит медицинские процедуры или которое готовят к прохождению медицинских процедур для лечения ПКК, причем указанный способ включает введение млекопитающему антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1. Согласно некоторым вариантам реализации настоящего изобретения антитело связывается с лигандом ALK1 со значением KD, составляющим менее 5×10-8 М. Согласно некоторым вариантам реализации настоящего изобретения антитело ингибирует ангиогенез, стимулируемый лигандом ALK1. Согласно некоторым аспектам настоящего изобретения антитело связывается с ALK1 во внеклеточном домене, который представляет собой аминокислоты 22-118 или 22-120 из SEQ ID NO: 1, и ингибирует связывание ALK1 с по меньшей мере одним лигандом ALK1, который выбирают из группы, состоящей из: GDF5, GDF6, GDF7, ВМР9 и BMP 10. Исходя из аффинности данных лигандов к ALK1, антитело может связываться со значением KD, составляющим менее 5×10-8 М, а в некоторых случаях от 5×10-8 М до 1×10-10 М. Предполагают, что антитело с аффинностью, находящейся в данном диапазоне, ингибирует передачу сигналов с участием одного или нескольких из GDF5, GFD6 и GFD7 и при этом оказывает меньшее действие на передачу сигналов с участием ВМР9 и BMP10. Такое антитело предпочтительно ингибирует ангиогенез, стимулируемый по меньшей мере одним лигандом ALK1, который выбирают из группы, состоящей из: GDF5, GDF6 и GDF7. Не вдаваясь в конкретный механизм, предполагают, что такие антитела будут действовать напрямую путем ингибирования активности ALK1, что отличается от действия слитого белка ALK1-Fc, который, как предполагают, ингибирует активность лигандов ALK1. Можно предположить, что антитело против ALK1 не препятствует способности GDF5, GDF6, GDF7, ВМР9 или BMP10 передавать сигнал посредством альтернативных рецепторных систем, таких как комплексы BMPRla, BMPRlb и BMPRII. Однако предполагают, что антитело против ALK1 препятствует способности низкоаффинных лигандов ALK1 (например, TGF-β, который, как обычно считают, запускает значительные события передачи сигналов через ALK1 даже в том случае, если связывание является относительно слабым) передавать сигналы посредством ALK1, даже в том случае, если ALK1 ECD может не связываться с такими низкоаффинными лигандами или может не ингибировать их. Согласно некоторым вариантам реализации настоящего изобретения [антитело] связывается с полипептидом ALK1 со значением KD, составляющим менее 1×10-10 М. Предполагают, что антитело с аффинностью, находящейся в данном диапазоне, ингибирует передачу сигналов с участием ВМР9 или BMP10. Такое антитело предпочтительно ингибирует связывание ВМР9 и ВМР10 с ALK1.
[0033] Для образования функционального сигнального комплекса члены семейства BMP/GDF, в том числе ВМР9, ВМР10, GDF5, GDF6 и GDF7, связываются с рецептором типа I и типа II. Участки связывания для данных двух типов рецепторов являются различными. Соответственно, согласно определенным вариантам реализации настоящего изобретения антитело, которое связывается с лигандом ALK1 и ингибирует лиганд ALK1, представляет собой антитело, которое связывается в участке или поблизости от участка лиганда, связывающего рецептор типа I.
[0034] В частности, на основании данных, раскрытых в настоящей заявке, антитело, которое связывается с ALK1 относительно более слабо, может ингибировать связывание TGFP с ALK1 и при этом может не ингибировать лиганды, которые связываются более сильно, такие как GDF5 или ВМР9. Антитела, описанные в настоящей заявке, предпочтительно представляют собой рекомбинантные антитела, что означает антитело, экспрессированное с нуклеиновой кислоты, которая была сконструирована с применением методик молекулярной биологии, такое как гуманизированное антитело или полностью человеческое антитело, полученное из одноцепочечного антитела. Fv, Fab и одноцепочечные антитела также включены в термин «рекомбинантное антитело». Также антитела могут представлять собой поликлональные или нерекомбинантные моноклональные антитела (в том числе человеческие и мышиные формы, а также человеческие антитела, полученные из трансгенных мышей). Антитела и полипептиды ALK1-ECD можно легко приготовить в форме фармацевтического препарата, который является по существу апирогенными. Может быть приготовлен фармацевтический препарат для системной доставки (например, внутривенная, внутриартериальная или подкожная доставка) или для местной доставки. В различных способах, описанных в настоящей заявке, можно применять антитела, описанные в опубликованной международной заявке на патент № WO 2007/040912.
[0035] Согласно некоторым аспектам в настоящем изобретении предложены способы лечения почечно-клеточной карциномы у млекопитающего путем введения млекопитающему эффективного количества антитела, которое связывается с полипептидом ALK1, описанным в настоящей заявке в общем виде либо конкретно. Согласно одному аспекту настоящего изобретения почечно-клеточная карцинома представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0036] Антитело, которое можно применять для данной цели, связывается с внеклеточным доменом ALK1 (например, связывается с полипептидом, состоящим из аминокислот 22-118 из SEQ ID NO: 1) или с другим фрагментом ALK1. Согласно одному варианту реализации настоящего изобретения антитело связывается с полипептидом, состоящим из аминокислот 22-118 из SEQ ID NO:l, и ингибирует связывание по меньшей мере одного лиганда ALK1, который выбирают из группы, состоящей из: GDF5, GDF6, GDF7, ВМР9 и BMP10. Согласно другому варианту реализации настоящего изобретения антитело связывается с полипептидом ALK1 со значением KD, составляющим менее 5×10-8 М, а в некоторых случаях от 5×10-8 М до 1×10-10 М. Согласно дополнительному варианту реализации настоящего изобретения антитело ингибирует ангиогенез, стимулируемый по меньшей мере одним лигандом ALK1, который выбирают из группы, состоящей из: GDF5, GDF6 и GDF7. Согласно некоторым вариантам реализации настоящего изобретения антитело, которое селективно ингибирует передачу сигналов, опосредованную GDF5, GDF6 или GDF7, по сравнению с передачей сигналов с участием ВМР9 или BMP10, применяют в качестве селективного ингибитора ангиогенеза, происходящего в тканях, в которых локализуются GDF5, GDF6 или GDF7: преимущественно в костях и суставах. Согласно некоторым вариантам реализации настоящего изобретения антитело связывается с полипептидом ALK1 со значением KD, составляющим менее 1×10-10 М. Согласно дополнительным вариантам реализации настоящего изобретения антитело ингибирует связывание ALK1 с лигандом ALK1, причем лиганд ALK1 выбирают из группы, состоящей из: ВМР9 и ВМР10. Антитело против ALK1 можно вводить местно или системно (например, внутривенно, внутриартериально или подкожно). Согласно конкретному варианту реализации в настоящем изобретении предложен способ лечения прогрессирующего почечно-клеточной карциномы млекопитающего путем введения антитела против ALK1.
[0037] Согласно другому конкретному варианту реализации в настоящем изобретении предложен способ лечения млекопитающего, страдающего от почечно-клеточной карциномы, путем введения антитела против ALK1 и ингибитора рецепторной тирозинкиназы VEGF, описанных в настоящей заявке. Согласно конкретному варианту реализации в настоящем изобретении предложен способ лечения млекопитающего, страдающего от прозрачноклеточного почечно-клеточной карциномы, путем введения антитела против ALK1 и ингибитора рецепторной тирозинкиназы VEGF млекопитающему с ПКК. Согласно одному аспекту настоящего изобретения ПКК представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0038] Согласно некоторым аспектам в настоящем изобретении предложены композиции, содержащие ингибиторы рецепторной тирозинкиназы VEGF, и антитела, которые связываются с лигандом ALK1 и ингибируют связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из ВМР9 и BMP10. В частности, как продемонстрировано в настоящей заявке, нейтрализующее антитело против ВМР9 ингибирует ангиогенез in vivo. Кроме того, как продемонстрировано в настоящей заявке, BMP10 стимулирует ангиогенез, тогда как антагонист BMP10 ингибирует ангиогенез. Антитело может связываться с лигандом ALK1 со значением KD, составляющим менее 1×10-10 М. Такие антитела предпочтительно представляют собой рекомбинантные антитела, и их можно легко приготовить в форме фармацевтического препарата, который является по существу апирогенным. Может быть приготовлен фармацевтический препарат для системной доставки (например, внутривенная, внутриартериальная или подкожная доставка) или для местной доставки.
[0039] Согласно некоторым аспектам в настоящем изобретении предложены способы лечения почечно-клеточной карциномы у млекопитающего, причем указанные способы включают введение млекопитающему эффективного количества ингибитора рецепторной тирозинкиназы (ИРТК) и антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и BMP10. Антитело может ингибировать ангиогенез, стимулируемый по меньшей мере одним лигандом ALK1, который выбирают из группы, состоящей из: GDF5, GDF6 и GDF7. Согласно следующим аспектам настоящего изобретения почечно-клеточная карцинома, которую лечат, метастазировала в лимфатический узел. Согласно дополнительным аспектам настоящего изобретения почечно-клеточная карцинома, которую лечат, представляет собой светлоклеточную почечно-клеточную карциному.
[0040] Согласно некоторым аспектам в настоящем изобретении предложены способы лечения почечно-клеточной карциномы у млекопитающего путем введения млекопитающему с ПКК эффективного количества ингибитора рецепторной тирозинкиназы VEGF и ингибитора системы передачи сигналов через ALK1, включая, но не ограничиваясь ими: нуклеиновые кислоты (например, антисмысловые конструкции или конструкции на основе РНКи), которые вызывают уменьшение продукции ALK1, GDF5, GDF6, GDF7, ВМР9 или BMP10. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень. Такие ингибиторы передачи сигналов через ALK1 включают, но не ограничиваются ими, аффинные связывающиеся тела, такие как аптамеры, случайные пептиды и белки-скаффолды, которые можно модифицировать для обеспечения связывания с конкретными мишенями (примеры таких белков-скаффолдов включают антикалины и домены FNIII). Данные связывающиеся вещества можно применять для обнаружения и отбора аффинно связывающихся веществ, которые препятствуют функционированию регуляторной системы ALK1 либо за счет нарушения взаимодействия ALK1 -лиганд, либо за счет ингибирования передачи сигналов, которая возникает после связывания. Согласно одному аспекту настоящего изобретения ПКК, которую лечат согласно данному способу, представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно другому аспекту настоящего изобретения ПКК, которую лечат, инвазировала почечный синус. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0041] Согласно следующему аспекту настоящего изобретения предложен способ лечения почечно-клеточной карциномы у млекопитающего, включающий введение млекопитающему с ПКК эффективного количества антагониста ВМР9 и/или BMP10 и ингибитора рецепторной тирозинкиназы VEGF. Согласно некоторым вариантам реализации настоящего изобретения антагонист представляет собой антитело, которое связывается с ВМР9 и/или BMP10. Антитело может представлять собой поликлональное, моноклональное и химерное или гуманизированное антитело. Антагонист может представлять собой Fd, Fv, Fab, F(ab’), F(ab)2 или Р(ab’)2-фрагмент, одноцепочечный Fv (scFv), диатело, триотело, тетратело, миниантитело или пептидное антитело. Согласно некоторым вариантам реализации настоящего изобретения антагонист представляет собой аптамер (пептид или нуклеиновую кислоту). Принимая во внимание перекрывающиеся эффекты антагонистов ВМР9 и BMP10, продемонстрированные в настоящей заявке, в настоящем изобретении предложены антагонисты как для ВМР9, так и для BMP10, такие как антитела, которые способны перекрестно взаимодействовать и, таким образом, действуют как антагонисты обоих белков (например, обладают аффинностью менее 10 нМ или менее 1 нМ и к ВМР9, и к ВМР10). Другим примером антагониста ALK1, который связывается как с ВМР9, так и с BMP10, является слитый белок ALK1-Fc, который связывается как с ВМР9, так и с BMP10 и ингибирует активность обоих лигандов. Согласно следующему аспекту настоящего изобретения способ дополнительно включает введение млекопитающему эффективного количества ингибитора, мишенью которого является mTOR. Согласно следующим аспектам настоящего изобретения антагонист ингибирует экспрессию ВМР9 и/или BMP10. Согласно некоторым вариантам реализации настоящего изобретения антагонист представляет собой нуклеиновую кислоту, которая ингибирует экспрессию ВМР9 и/или BMP10. Например, согласно одному аспекту настоящего изобретения нуклеиновая кислота представляет собой антисмысловую нуклеиновую кислоту или РНКи. Согласно другим аспектам настоящего изобретения антагонист представляет собой белок, отличный от антитела, который связывается с ВМР9 и/или BMP10. Согласно одному аспекту настоящего изобретения антагонист является членом семейства GDF Trap. Примеры членов семейства GDF Trap включают, но не ограничиваются ими, фоллистатин, FLRG, ноггин и гремлин. Согласно некоторым вариантам реализации настоящего изобретения антагонист представляет собой полипептид, содержащий аминокислотную последовательность, которую выбирают из библиотеки аминокислотных последовательностей способом, включающим этап обнаружения аминокислотных последовательностей, которые связываются с ВМР9 и ВМР10.
[0042] Согласно некоторым аспектам в настоящем изобретении предложен способ лечения метастазирующей почечно-клеточной карциномы у млекопитающего. Например, такой способ может включать введение млекопитающему с метастазирующей почечно-клеточной карциномой, эффективного количества ИРТК и агента, выбранного из группы, состоящей из: белка ALK1 ECD; антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и BMP10; антитела, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 из SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, который выбирают из группы, состоящей из: GDF5, GDF6, GDF7, ВМР9 и BMP10.
[0043] В каждом отдельном случае агент, описанный в настоящей заявке, может быть введен в сочетании с дополнительным агентом, который ингибирует ангиогенез.
[0044] Согласно некоторым вариантам реализации в настоящем изобретении предложены способы для ингибирования ангиогенеза у млекопитающего, включающие введение млекопитающему, нуждающемуся в этом, эффективного количества ингибитора системы передачи сигналов через ALK1 (например, ALK1-Fc). В случае если необходимо ингибировать ангиогенез опухоли, агент в некоторых случаях вводят в сочетании со вторым агентом, обладающим противораковым действием, таким как химиотерапевтический агент или биологический противораковый агент. Согласно следующим аспектам настоящего изобретения агент вводят с ингибитором mTOR (мишени рапамицина у млекопитающих). Согласно некоторым вариантам реализации настоящего изобретения способы согласно настоящему изобретению применяют для лечения и [профилактики] заболевания, связанного с ангиогенезом, которое выбирают из группы, состоящей из опухоли, опухоли, которая является резистентной к терапии, направленной против VEGF, множественной миеломы и опухоли, метастазировавшей в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0045] На фигуре 1 представлена аминокислотная последовательность активинподобной киназы 1 человека, ALK1 (SEQ ID NO: 1). Одинарным подчеркиванием выделен предполагаемый внеклеточный домен. Двойным подчеркиванием выделен внутриклеточный домен. Сигнальный пептид и трансмембранный домен не подчеркнуты.
[0046] На фигуре 2 представлена последовательность нуклеиновой кислоты кДНК ALK1 человека (SEQ ID NO:2). Кодирующая последовательность подчеркнута. Часть, кодирующая внеклеточный домен, подчеркнута двумя линиями.
[0047] На фигурах 3А и 3В представлены примеры слияния внеклеточных доменов ALK1 человека с Fc-доменом (SEQ ID NO: 3) и (SEQ ID NO: 14). Белок hALK1-Fc включает аминокислоты 22-120 белка ALK1 человека, слитые на С-конце с линкером (подчеркнут) и Fc-областью IgG1.
[0048] На фигуре 4 представлена последовательность нуклеиновой кислоты для экспрессии полипептида hALK1-Fc согласно SEQ ID NO: 3. Также представлена кодируемая аминокислотная последовательность. После отщепления лидерной последовательности Asp 22 становится N-концевой аминокислотой секретируемого белка.
[0049] На фигуре 5 продемонстрировано антиангиогенное действие ALK1-Fc мыши («RAP») и ALK1-Fc человека («АСЕ») в анализе образования трубочек в эндотелиальных клетках. Внесение всех концентраций RAP и АСЕ вызывало уменьшение образования трубочек в ответ на внесение добавки для роста эндотелиальных клеток (ECGF) в большей степени, чем положительный контроль - эндостатин.
[0050] На фигуре 6 показано антиангиогенное действие GDF7 в анализе на хориоаллантоисной оболочке цыпленка (ХАО). Действие GDF7 сравнивали с действием VEGF.
[0051] На фигуре 7 показано антиангиогенное действие слитого белка ALK1-Fc человека в анализе на ХАО. hALK1-Fc ингибирует ангиогенез, стимулируемый VEGF, FGF и GDF7.
[0052] На фигуре 8 показано сравнение антиангиогенного действия ALK1-Fc мыши (mALK1-Fc), hALK1-Fc, коммерчески доступного моноклонального антитела против ALK1 (МАТ против ALK1, анти-ALK1 МАТ) и коммерчески доступного нейтрализующего моноклонального антитела против VEGF. Антиангиогенное действие конструкций ALK1-Fc сравнимо с действием антитела против VEGF.
[0053] На фигуре 9 показано антиангиогенное действие hALK1-Fc и антитела против VEGF in vivo. hALK1-Fc и антитело против VEGF обладают сравнимым действием на ангиогенез в глазу, что было подтверждено в анализе на микрокармане роговицы мыши.
[0054] На фигуре 10 показано действие mALK1-Fc на модели ревматоидного артрита - коллаген-индуцированном артрите мыши (КИА). На графике представлены средние групповые артритные показатели, определенные в течение 42-дневного периода наблюдения у самцов мышей DBA/1 с коллаген-индуцированным артритом. RAP-041 представляет собой mALK1-Fc. АвастинТМ представляет собой антитело против VEGF - бевацизумаб.
[0055] На фигуре 11 показаны результаты разделения hALK1-Fc (SEQ ID NO: 3) и слитого белка hALK1-Fc от R&D Systems (Миннеаполис, Миннесота, США) на колонке для эксклюзионной хроматографии Superose 12 10/300 GL (Amersham Biosciences, Пискатауэй, Нью-Джерси). Материал производства R&D Systems содержит приблизительно 13% агрегированного белка, что подтверждается наличием пиков в левой части графика, а также некоторое количество фракции с меньшей молекулярной массой. Материал cSEQ ID NO: 3 более чем на 99% состоит из димеров соответствующего молекулярного размера.
[0056] На фигуре 12 представлен флуоресцентный сигнал от экспрессирующих люциферазу клеток рака легких Льюиса (LL/2-luc) у мышей, которые получали ФБР (круги) и mALK1-Fc (квадраты). Клетки опухоли вводили инъекцией в хвостовую вену и начинали введение исследуемых веществ (ФБР или 10 мг/кг mALK1-Fc интраперитонеально, два раза в неделю) в день введения клеток. Мышей, которые получали ФБР, умерщвляли в день 22, поскольку они находились в агонии. Каждая из групп лечения и контроля состояла из семи животных (n=7).
[0057] На фигуре 13 показано влияние рекомбинантных ВМР9 человека («rhB9») и коммерчески доступного моноклонального антитела против ВМР9 («mabB9») на VEGF-опосредованный ангиогенез в анализе на ХАО. Примечательно, что как введение ВМР9, так и введение антитела против ВМР9 ингибируют опосредуемый VEGF ангиогенез.
[0058] На фигуре 14 представлено действие mALK1-Fc на модели ортотопического ксенотрансплантата с применением клеточной линии MDA-MB-231, клеточной линии, происходящей от ER- клеток рака молочной железы. В дозе 30 мг/кг mALK1-Fc обладает значительным действием, замедляющим рост ксенотрансплантантной опухоли.
[0059] На фигуре 15 показано действие hALK1-Fc на модели ортотопического ксенотрансплантата с применением клеточной линии MCF7, клеточной линии, происходящей от эстроген-рецептор положительных (ER+) клеток рака молочной железы. В дозе 10 или 30 мг/кг hALK1-Fc обладает значительным действием, замедляющим рост ксенотрансплантантной опухоли.
[0060] На фигуре 16 показана способность hALK1-Fc ингибировать более чем на 80% транскрипционную репортерную активность, индуцированную BMP10, в клеточном анализе.
[0061] На фигуре 17 представлено выравнивание зрелых частей белков ВМР9 (SEQ ID NO: 12) и BMP 10 (SEQ ID NO: 13) человека. Области идентичности показаны звездочками.
[0062] На фигуре 18 продемонстрирована способность hALK1-Fc усиливать ингибирование роста опухоли сунитинибом на ксенотрансплантантной модели 786-0 ПКК человека. hALK1-Fc дополнительно имеет тенденцию к ингибированию роста опухоли в качестве агента для монотерапии.
[0063] На фигуре 19 показана способность hALK1-Fc ингибировать рост опухоли в качестве агента для монотерапии на ксенотрансплантантной модели А498 ПКК человека.
[0064] На фигуре 20 показана способность hALK1-Fc усиливать ингибирование роста опухоли сунитинибом на ксенотрансплантантной модели А498 ПКК человека.
ПОДРОБНОЕ ОПИСАНИЕ
1. Обзор
Почечно-клеточная карцинома
[0065] Всемирная Организация Здравоохранения выделяет более 50 различных типов рака почек. Почечно-клеточная карцинома (ПКК) представляет собой наиболее распространенный тип рака почек. Он возникает, когда раковые клетки образуются в клетках, выстилающих почечные канальцы. ПКК характеризуется отсутствием ранних предупреждающих признаков, разнообразными клиническими проявлениями, а также резистентностью к химиотерапии и ионизирующему излучению. Большинство опухолей ПКК выявляют у пациентов 50-70-летнего возраста; частота возникновения данного заболевания у мужчин в два-три раза выше, чем у женщин. Увеличенная частота возникновения ПКК ассоциирована с определенными генетическими состояниями, в том числе с синдромом фон Гиппеля-Линдау (VHL), наследственным папиллярным раком почки, семейной почечной онкоцитомой, ассоциированной с синдромом Бирта-Хогга-Дюба, и наследственным раком почки. 30% пациентов находятся на прогрессирующих стадиях ПКК и страдают либо от метастазирующего, либо от неоперабельного заболевания; 2-летняя общая выживаемость данной когорты составляет <10% (Reeves et al, Cancer Chemotherapy and Pharmacology 2009; 64(1): 11-25).
[0066] В настоящий момент выделяют пять основных подтипов ПКК, в том числе прозрачноклеточную, являющуюся наиболее распространенным подтипом ПКК, папиллярную (типа I и типа II), хромофобную, рак собирающего протока и неклассифицированную ПКК. Более того, для различения стадий ПКК традиционно применяют анатомический критерий. Система классификации по принципу опухоли, лимфатическго узла и метастазов (TMN) для различения стадий ПКК основана на размере первичной опухоли, степени распространения опухоли в лимфатические узлы и наличии метастазов. Стадия опухоли представляет собой наиболее важный фактор, позволяющий прогнозировать выживаемость при ПКК (Koul et al., Am. J. Cancer Research 2011; 1(2): 240-254). Более 50% пациентов на ранних стадиях ПКК излечиваются. При определенных условиях для лечения местнораспространенного ПКК и метастазирующего ПКК также показана радикальная нефрэктомия. У 23% пациентов с клинически локализованным заболеванием после нефрэктомии развивалось метастазирующее заболевание (Koul et al., Am. J. Cancer Research 2011; 1(2): 240-254). Однако в случае заболеваний стадии III и стадии IV по классификации TNM, которые характеризуются, например, присутствием опухоли в главных венах или в надпочечниках или поражением лимфатических узлов (стадия III) и присутствием заболевания за пределами почки (IV), результат был неудовлетворительным.
[0067] Светлоклеточный почечно-клеточный рак, как правило, возникает в корковом веществе почек из эпителиальных клеток проксимальных извитых канальцев нефрона и имеет тенденцию распространятся за счет инвазии в кровеносные сосуды, причем злокачественные клетки обнаруживают во внутрипочечных венах в 18-29% опухолей, локализованных в пределах одного органа (Delahunt et al., Clin. Lab. Med. 2005; 25(2):231-46; и Bonsib et al., Mod. Pathol. 2006; 19(5):746-53). В результате экстенсивного патологического исследования 120 образцов прозрачноклеточной почечно-клеточной карциномы инвазия в почечный синус была обнаружена приблизительно в половине из исследованных опухолей. ПКК наиболее часто метастазирует в легкие (33-72%), внутрибрюшные лимфатические узлы (3-35%), кость (21 25%), головной мозг (7-13%) и печень (5-10%). См., например, публикацию Klatte et al., Urol. Oncol. 2008; 26(6): 604-9.
[0068] Небольшие опухоли, локализованные на почке или внутри почки, зачастую удаляют с помощью частичной нефрэктомии (также известной как «нефронсберегающая хирургия»). Дополнительные хирургические процедуры для локализованных опухолей включают лечение путем абляции тканей (например, криохирургии и радиочастотной абляции (РЧА). В тех случаях, когда увеличиваются размер и/или распространение карциномы в пределах или за пределами почки, хирургическое вмешательство, как правило, включает полную нефрэктомию (т.е., удаление целой почки с прилегающим надпочечником и жировой тканью вокруг почки или без них). Такое оперативное вмешательство представляет собой традиционное стандартное вмешательство при раке почек. При определенных условиях радикальная нефрэктомия также показана для лечения местнораспространенноой ПКК и метастазирующей ПКК. У 23% пациентов с клинически локализованным заболеванием после нефрэктомии развивалось метастазирующее заболевание (Koul et al., Am J Cancer Research 2011; 1(2): 240-254).
[0069] Иммунотерапия иммуностимулирующими цитокинами, такими как интерлейкин-2 (ИЛ-2) и интерферон α (ИФН α), представляет собой основной вариант системной терапии при ПКК. Сообщалось, что при внутривенном введении высоких доз ИЛ-2 степень ответа составляет 15-20%, степень полной ремиссии составляет 6-8% и показатель эффективности лечения составляет приблизительно 5% (Koul et al., Am J Cancer Research 2011; 1(2): 240-254). Однако данный режим лечения является довольно токсичным. Введение ИФН α дает более скромное улучшение выживаемости, но обладает более благоприятным профилем токсичности.
ALK1
[0070] ALK1 представляет собой рецептор клеточной поверхности типа I для лигандов суперсемейства TGF-β и известен как ACVRL1 и ACVRLK1. ALK1 выступает в качестве рецептора для TGF-β1, TGF-β3 и ВМР-9 (Marchuk et al., 2003; Hum. Mol. Genet. 12:R97-Rl 12 и Brown et al., 2005; J. Biol. Chem. 280(26): 25111-8).
[0071] У мышей мутации в ALK1 с потерей функции приводят к различным аномалиям развивающейся сосудистой системы (Oh et al., 2000; Proc. Natl. Acad. Sci. USA 97: 2626-31 и Urness et al., 2000; Nat. Genet. 26: 328-31).
[0072] У людей мутации в ALK1 с потерей функции ассоциированы с наследственной геморрагической телеангиэктазией (НГТ, или синдром Ослера-Рандю-Вебера), при которой у пациентов развивается артериовенозная мальформация, то есть образуется прямой поток (соединение) из артерии в вену (артериовенозный шунт) без посредничества капиллярного русла. Типичные симптомы, наблюдаемые у пациентов с НГТ, включают периодическое носовое кровотечение, желудочно-кишечное кровотечение, кожные и слизисто-кожные телеангиоэктазии и артериовенозные мальформации (АВМ) в сосудистой системе легких, головного мозга или печени.
[0073] В недавних публикациях David с соавт. (Blood 2007; 109(5): 1953-61) и Scharpfenecker с соавт. (J. Cell Sci. 2007 120(6): 964-72) пришли к выводу, что ВМР9 и BMP 10 активируют ALK1 в эндотелиальных клетках и что следствием данной активации является ингибирование пролиферации и миграции эндотелиальных клеток. Данные предполагаемые эффекты активации ALK1 прямо противоположны действиям проангиогенных факторов, таких как VEGF. Таким образом, на основании указанных публикаций можно сделать вывод, что ВМР9 и BMP 10 являются сами по себе антиангиогенными факторами, а также что активация ALK1 обладает антиангиогенным действием. В противоположность этому в настоящем изобретении было продемонстрировано, что антиангиогенным действием обладают скорее антагонисты, чем агонисты ВМР9 и BMP10 .
[0074] Настоящее изобретение относится к обнаружению того, что полипептиды, содержащие часть внеклеточного домена ALK1 («полипептиды ALK1 ECD»), способны ингибировать рост опухоли ПКК in vivo. В частности, как обсуждается ниже, в настоящем изобретении описано применение антагонистов ALK1 ECD для демонстрации вовлеченности ALK1 в воздействие как на VEGF-независимый ангиогенез, так и на ангиогенез, опосредуемый множеством ангиогенных факторов, в том числе VEGF, FGF и PDGF. Настоящее изобретение также относится к неожиданному обнаружению того, что антагонисты ALK1 ECD, такие как ALK1-Fc, способны ингибировать рост опухоли ПКК в модели с ксенотрансплантатами ПКК человека in vivo, а также способны значительно улучшать активность сунитиниба по ингибированию опухоли в моделях с ксенотрансплантатами ПКК человека.
[0075] Настоящее изобретение дополнительно относится к открытию того, что полипептиды, содержащие часть внеклеточного домена ALK1 («полипептиды ALK1 ECD»), можно применять для ингибирования ангиогенеза in vivo, включая как VEGF-независимый ангиогенез, так и ангиогенез, опосредованный множеством ангиогенных факторов, в том числе VEGF, FGF и PDGF.
[0076] Настоящее изобретение также относится к открытию того, что полипептиды, содержащие часть внеклеточного домена ALK1 («полипептиды ALK1 ECD»), можно применять для ингибирования ангиогенеза in vivo, в том числе VEGF-независимого ангиогенеза и ангиогенеза, опосредованного множеством ангиогенных факторов, в том числе VEGF, FGF и PDGF. В частности, в настоящем изобретении предложены физиологические высокоаффинные лиганды для ALK1 и продемонстрировано, что полипептиды ALK1 ECD ингибируют ангиогенез.
[0077] В частности, в настоящем изобретении предложены физиологические высокоаффинные лиганды для ALK1 и продемонстрировано, что полипептиды ALK1 ECD ингибируют ангиогенез. Данные, представленные в настоящей заявке, демонстрируют, что полипептид ALK1 ECD может проявлять антиангиогенное действие даже в тех ситуациях, когда полипептид ALK1 ECD не демонстрирует значительного связывания с TGF-β1. Более того, полипептиды ALK1 ECD ингибируют ангиогенез, стимулируемый множеством различных проангиогенных факторов, в том числе VEGF, FGF и GDF7. Таким образом, в настоящем изобретении предложено описание регуляторной системы ALK1, в которой ALK1 представляет собой рецептор для группы лигандов GDF5, включающей GDF6 и GDF7, а также для группы лигандов ВМР9, включающей BMP10, с различными аффинностями для данных двух групп лигандов. Кроме того, в настоящем тексте продемонстрировано, что передача сигналов, опосредуемая ALK1 и лигандами, описанными выше, является проангиогенной in vivo и что ингибирование данной регуляторной системы обладает потенциальным антиангиогенным действием in vivo.
[0078] Таким образом, согласно некоторым аспектам в настоящем изобретении предложены антагонисты регуляторной системы ALK1, в том числе антагонисты рецептора ALK1 или одного или нескольких лигандов ALK1, для применения в ингибировании ангиогенеза, включая как VEGF-зависимый ангиогенез, так и VEGF-независимый ангиогенез. Однако необходимо отметить, что ожидается, что антитела, нацеленные на ALK1 сам по себе, обладают действием, отличным от действия полипептида ALK1 ECD. Ожидается, что универсальное нейтрализующее антитело против ALK1 (антитело, которое ингибирует связывание как сильных, так и слабых лигандов) будет ингибировать передачу сигналов от таких лигандов через ALK1, но не будет ингибировать способность данных лигандов передавать сигнал через другие рецепторы (например, BMPR1a, BMPR1b, BMPRII в случае GDF5-7 и ВМР9-10, TBRI и TBRII в случае TGFP). С другой стороны, ожидается, что полипептид ALK1 ECD ингибирует все лиганды, с которыми он связывается сильнее, в том числе, например, такую конструкцию, как показана в примерах, GDF5-7 и ВМР9-10, и не оказывает действия на лиганды, с которыми он связывается слабее, такие как TGF-β. Таким образом, несмотря на то, что универсально нейтрализующее антитело против ALK1 будет блокировать передачу сигналов от ВМР9 и TGF-β через ALK1, данное антитело не будет блокировать передачу сигналов от ВМР9 и TGF-β через другой рецептор, и, несмотря на то, что полипептид ALK1 ECD может ингибировать передачу сигналов от ВМР9 посредством всех рецепторов (даже рецепторы, отличные от ALK1), нельзя ожидать, что он будет ингибировать передачу сигналов от TGF-β через любой рецептор, даже ALK1.
[0079] Термины, используемые в настоящей спецификации, как правило, имеют свои обычные значения в данной области техники, в контексте настоящего изобретения и в конкретном контексте, в котором используется каждый термин. Определенные термины обсуждаются в настоящей спецификации, чтобы предоставить дополнительное руководство специалисту-практику в описании композиции и способов, раскрытых в настоящей заявке, и того, как получать и применять их. Объем и значение любого применения термина будут очевидными из конкретного контекста, в котором используется данный термин.
2. Растворимые полипептиды ALK1
[0080] Природные белки ALK1 представляют собой трансмембранные белки; часть данного белка расположена за пределами клетки (внеклеточная часть) и часть данного белка расположена внутри клетки (внутриклеточная часть). Аспекты настоящего изобретения охватывают полипептиды, содержащие часть внеклеточного домена ALK1.
[0081] Согласно некоторым вариантам реализации в настоящем изобретении предложены «полипептиды ALK1 ECD». Термин «полипептид ALK1 ECD» призван обозначить полипептид, состоящий из (или содержащий ее) аминокислотной последовательности внеклеточного домена существующего в природе полипептида ALK1, включая либо же не включая любую сигнальную последовательность и последовательность, являющуюся N-концевой по отношению к сигнальной последовательности, или из аминокислотной последовательности, которая по меньшей мере на 33 процента идентична внеклеточному домену существующего в природе полипептида ALK1 и в некоторых случаях по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична последовательности внеклеточного домена существующего в природе полипептида ALK1, примером которой является область цистеинового узла, состоящая из аминокислот 34-95 из SEQ ID NO: 1, или цистеиновый узел вместе с дополнительными аминокислотами на N- и С-концах внеклеточного домена, такими как аминокислоты 22-118 или 22-120 из SEQ ID NO. 1.
[0082] Подобным образом полипептид ALK1 ECD может включать полипептид, который кодируется нуклеотидами 100-285 из SEQ ID NO: 2 или их молчащими вариантами или нуклеиновыми кислотами, которые гибридизуются с комплементарной им последовательностью в жестких условиях гибридизации (как правило, такие условия известны в данной области техники, но могут, например, включать гибридизацию в 50% (объем/объем) формамиде, 5х SSC (натрия хлорид/натрия цитрат), 2% (масса/объем) блокирующем агенте, 0,1% N-лауроилсаркозине, 0,3% ДСН (додецилсульфат натрия) при 65°С в течение ночи и отмывку, например, в 5х SSC при температуре приблизительно 65°С). Кроме того, полипептид ALK1 ECD может включать полипептид, который кодируется нуклеотидами 64-384 из SEQ ID NO: 2 или их молчащими вариантами или нуклеиновыми кислотами, которые гибридизуются с комплементарной им последовательностью (как правило, такие условия известны в данной области техники, но могут, например, включать гибридизацию в 50% (объем/объем) формамиде, 5х SSC, 2% (масса/объем) блокирующем агенте, 0,1% N-лауроилсаркозине, 0,3% ДСН при температуре 65°С в течение ночи и отмывку, например, в 5х SSC при температуре приблизительно 65°С). Соответственно, термин «полипептид ALK1 ECD» охватывает выделенные внеклеточные части полипептидов ALK1, их варианты (в том числе варианты, которые содержат, например, не более 2, 3, 4, 5 или 10 аминокислотных замен, вставок или делеций в последовательности, соответствующей аминокислотам 22-118 или 22-120 из SEQ ID NO: 1, и в том числе варианты, которые содержат не более 2, 3, 4, 5 или 10 аминокислотных замен, вставок или делеций в последовательности, соответствующей аминокислотам 34-95 из SEQ ID NO: 1), их фрагменты и слитые белки, содержащие любой из вышеперечисленных элементов, но в каждом случае предпочтительно любой из вышеперечисленных полипептидов ALK1 ECD сохраняет значительную аффинность к одному или нескольким из GDF5, GDF6, GDF7, ВМР9 или BMP 10. Термин «полипептид ALK1 ECD» однозначно призван исключить любой полноразмерный существующий в природе полипептид ALK1. Как правило, полипептид ALK1 ECD разрабатывают так, чтобы он был растворимым в водных растворах при биологически соответствующих температурах, значениях рН и осмолярности.
[0083] Как описано выше, в настоящем изобретении предложены полипептиды ALK1 ECD, которые обладают определенной степенью идентичности или подобия последовательности существующему в природе полипептиду ALK1. Для определения процента идентичности двух аминокислотных последовательностей последовательности выравнивают для их оптимального сравнения (например, в одну или в обе из последовательностей аминокислот или нуклеиновых кислот могут быть введены пробелы (гэпы) для оптимального выравнивания, а негомологичными последовательностями для целей сравнения можно пренебречь). Затем сравнивают аминокислотные остатки в соответствующих положениях аминокислот. Если положение в первой последовательности занято тем же аминокислотным остатком, что и соответствующее положение во второй последовательности, это означает, что молекулы являются идентичными по данному положению (в настоящей заявке термин «идентичность» аминокислот эквивалентен термину «гомология» аминокислот). Процент идентичности между двумя последовательностями является функцией количества идентичных положений, которые содержат последовательности, принимая во внимание количество пробелов и длину каждого пробела, который необходимо ввести для оптимального выравнивания двух последовательностей.
[0084] Сравнение последовательностей и определение процента идентичности и подобия между двумя последовательностями можно осуществить с помощью математического алгоритма (Computational Molecular Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991).
[0085] Согласно одному варианту реализации настоящего изобретения процент идентичности между двумя аминокислотными последовательностями определяют с помощью алгоритма Ниделмана-Вунша (Needleman and Wunsch, J. Mol. Biol. 1970; (48): 444-453), который был включен в программу GAP в пакете программного обеспечения GCG (доступно на сайте http://www.gcg.com). Согласно конкретному варианту реализации настоящего изобретения в программе GAP используются следующие параметры: матрица Blosum 62 или РАМ250, штраф за открытый пробел 16, 14, 12, 10, 8, 6 или 4, штраф за удлинение пробела 1, 2, 3, 4, 5 или 6. Согласно еще одному варианту реализации настоящего изобретения процент идентичности между двумя нуклеотидными последовательностями определяют с применением программы GAP в пакете программного обеспечения GCG (Devereux et al, Nucleic Acids Res. 1984; 12(1): 387) (доступно на сайте http://www.gcg.com). Типичные параметры включают применение матрицы NWSgapdna.CMP, штраф за открытый пробел 40, 50, 60, 70 или 80 и штраф за удлинение пробела 1, 2, 3, 4, 5 или 6. Если не указано обратное, процент идентичности между двумя аминокислотными последовательностями определяют с помощью программы GAP с применением матрицы Blosum 62, штраф за открытый пробел 10 и штраф за удлинение пробела 3, и, если такой алгоритм не может рассчитать желаемый процент идентичности, следует выбрать соответствующие альтернативы, раскрытые в настоящей заявке.
[0086] Согласно другому варианту реализации настоящего изобретения процент идентичности между двумя аминокислотными последовательностями определяют с помощью алгоритма Майерса-Миллера (Е. Myers и W. Miller, CABIOS, 1989; 4: 11-17) который был включен в программу ALIGN (версия 2.0), с применением таблицы веса остатков РАМ 120, штрафа за удлинение пробела 12 и штраф за пробел 4.
[0087] Другой вариант реализации для определения наилучшего общего выравнивания между двумя аминокислотными последовательностями можно определить с применением компьютерной программы FASTDB на основе алгоритма Brutlag с соавт. (Сотр. Арр. Biosci., 1990; 6:237-245). При выравнивании последовательности как референсная, так и исследуемая последовательность представляют собой аминокислотные последовательности. Результат указанного глобального выравнивания последовательности представляют в форме процента идентичности. Согласно одному варианту реализации настоящего изобретения идентичность аминокислотных последовательностей определяют с помощью компьютерной программы FASTDB на основе алгоритма Brutlag с соавт. (Сотр. Арр. Biosci., 1990; 6:237-245). Согласно конкретному варианту реализации настоящего изобретения параметры, которые применяют для подсчета процента идентичности и подобия выравнивания аминокислот, включают: матрица = РАМ 150, k-tuple (идентичный участок) = 2, штраф за нарушение комплементарности = 1, штраф за связывание = 20, длина рандомизационной группы = 0, балл отбрасывания = 1, штраф за введение пробела = 5 и штраф за размер пробела = 0,05.
[0088] Согласно некоторым вариантам реализации настоящего изобретения полипептиды ALK1 ECD содержат внеклеточную часть существующего в природе белка ALK1, такую как последовательность SEQ ID NO: 1, и предпочтительно лиганд-связывающую часть внеклеточного домена ALK1. Согласно вариантам реализации настоящего изобретения растворимый полипептид ALK1 ECD содержит аминокислотную последовательность, которая по меньшей мере на 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или на 99% идентична аминокислотной последовательности аминокислот 22-118 или 22-120 из SEQ ID NO: 1. Согласно некоторым вариантам реализации настоящего изобретения усеченный внеклеточный полипептид ALK1 включает по меньшей мере 30, 40 или 50 последовательных аминокислот из аминокислотной последовательности внеклеточной части SEQ ID NO: 1.
[0089] Согласно предпочтительным вариантам реализации полипептид ALK1 ECD связывается с одним или несколькими из GDF5, GDF6, GDF7, ВМР9 и BMP10. В некоторых случаях полипептид ALK1 не демонстрирует существенного связывания с TGF-βi или TGF-β3. Связывания можно достичь с применением очищенных белков в растворе или в системе поверхностного плазмонного резонанса, такой как система BiacoreTM. Предпочтительные растворимые полипептиды ALK1 будут демонстрировать антиангиогенное действие. Биологические анализы для определения активности по ингибированию ангиогенеза включают анализ на хориоаллантоисной оболочке цыпленка (ХАО), анализ микрокармана роговицы мыши или анализ для измерения эффекта введения выделенных или изолированных белков на имплантированную опухоль, известный в данной области техники. Анализ на ХАО описан O'Reilly с соавторами в публикации "Angiogenic Regulation of Metastatic Growth" Cell, 1994; 79 (2): 315-328. Вкратце, куриные эмбрионы в возрасте 3 дней с интактными желтками отделяют от яйца и помещают в чашку Петри. Через 3 дня инкубации на ХАО отдельные эмбрионы помещают метилцеллюлозный диск, содержащий исследуемый белок. Через 48 часов инкубации эмбрионы и ХАО изучают для определения ингибирования роста эндотелия. Анализ микрокармана роговицы мыши включает имплантацию гранулы, содержащей фактор роста, вместе с другой гранулой, содержащей потенциальный ингибитор роста эндотелия, в роговицу мыши и наблюдение за паттерном капилляров, развивающихся в роговице. Другие варианты анализа описаны в примерах.
[0090] Полипептиды ALK1 ECD могут быть получены в результате удаления цитоплазматического «хвоста» и трансмембранной области полипептида ALK1 ECD. В качестве альтернативы трансмембранный домен может быть инактивирован в результате делеций или в результате замены в норме гидрофобных аминокислотных остатков, входящих в состав трансмембранного домена, на гидрофильные остатки. В любом случае создается по существу гидрофильный профиль гидрофобности, который вызывает уменьшение аффинности к жирам и улучшает растворимость в воде. Делеция трансмембранного домена более предпочтительна, чем замена на гидрофильные аминокислотные остатки, поскольку она позволяет избежать введения потенциально иммуногенных эпитопов.
[0091] Полипептиды ALK1 ECD могут дополнительно содержать любую из различных лидерных последовательностей на N-конце. Такая последовательность позволяет экспрессировать пептиды и направлять их на секреторный путь в эукариотической системе. См., например, Ernst et al., патент США № 5,082,783. В качестве альтернативы для эффективного выделения из клетки можно применять природную сигнальную последовательность ALK1. Возможные лидерные последовательности включают природные лидерные последовательности АТП (активатора тканевого плазминогена) и мелитина пчелы (SEQ ID №№.7-9, соответственно). Процессинг сигнальных пептидов может варьировать, среди прочих переменных, в зависимости от выбранных лидерных последовательностей, применяемого типа клеток и условий культивирования, и вследствие этого фактические N-концевые стартовые участки для зрелых полипептидов ALK1 ECD, в том числе полипептида, представленного в SEQ ID NO:5, могут быть сдвинуты на 1-5 аминокислоты в N-концевом или в С-концевом направлении.
[0092] Согласно некоторым вариантам реализации в настоящем изобретении рассматриваются конкретные мутации полипептидов ALK1 для изменения гликозилирования полипептида. Такие мутации могут быть отобраны для введения или удаления одного или нескольких участков гликозилирования, таких как участки О-гликозилирования или N-гликозилирования. Участки распознавания аспарагин-связанного гликозилирования, как правило, содержат трипептидную последовательность аспарагин-Х-треонин (или аспарагин-Х-серин) (где «X» представляет собой любую аминокислоту), которая специфически распознается соответствующими ферментами клеточного гликозилирования. Изменение можно также осуществить с помощью добавления одного или нескольких остатков серина или треонина или введением замены на них в последовательности полипептида ALK1 дикого типа (для участков О-гликозилирования). Множество аминокислотных замен или делеций в одном или обоих первом или третьем положении аминокислот в участке распознавания гликозилирования (и/или деления аминокислоты во втором положении) приводит к отсутствию гликозилирования в модифицированной трипептидной последовательности. Другим способом увеличения количества углеводных групп в полипептиде ALK1 является химическое или ферментативное присоединение гликозидов к полипептиду ALK1. В зависимости от применяемого вида связи, сахар (а) можно присоединять к (а) аргинину и гистидину; (b) свободным карбоксильным группам; (с) свободным сульфгидрильным группам, таким как группы цистеина; (d) свободным гидроксильным группам, таким как группы серина, треонина или гидроксипролина; (е) ароматическим остаткам, таким как остатки фенилаланина, тирозина или триптофана; или (f) к амидной группе глутамина. Данные способы описаны в международной заявке на патент WO 87/05330, опубликованной 11 сентября 1987, и в публикации Aplin and Wriston, (1981) CRC Crit. Rev. Biochem., pp. 259-306, включенных в настоящую заявку посредством ссылки. Удаление одной или нескольких углеводных групп, присутствующих в полипептиде ALK1, можно осуществить химическим и/или ферментативным способом. Химическое дегликозилирование может включать, например, воздействие на полипептид ALK1 соединением трифторметансульфоновой кислоты или эквивалентным соединением. Данная обработка приводит к отщеплению большинства или всех Сахаров, за исключением присоединенных Сахаров (N-ацетилглюкозамин или N-ацетилгалактозамин), при этом оставляет аминокислотную последовательность интактной. Химическое дегликозилирование также описано в публикациях Hakimuddin et al., (1987) Arch. Biochem. Biophys. 259: 52 и Edge et al., Anal. Biochem. 1981; 118: 131. Ферментативное отщепление углеводных групп от полипептидов ALK1 достигается в результате применения ряда эндо- и экзогликозидаз, как описано в публикации Thotakura et al., (1987) Meth. Enzymol. 138: 350. Последовательность полипептида ALK1, по мере необходимости, можно изменить в зависимости от типа применяемой системы экспрессии, поскольку клетки млекопитающих, дрожжей, насекомых и растений могут вводить различные паттерны гликозилирования, способные влиять на аминокислотную последовательность пептида. Как правило, белки ALK1 для применения у человека экспрессируют в клеточной линии млекопитающих, которая обеспечивает соответствующее гликозилирование, таких как клеточные линии НЕК293 или СНО, хотя предполагают, что, помимо них, можно применять и другие клеточные линии экспрессии млекопитающих, клеточные линии дрожжей с генно-инженерными ферментами гликозилирования, а также клетки насекомых.
[0093] В настоящем изобретении также рассматривается способ получения мутантов, в частности, серии комбинаторных мутантов полипептида ALK1, а также усеченных мутантов; применение пулов комбинаторных мутантов в особенности эффективно для обнаружения функциональных вариантов последовательностей. Целью скрининга таких комбинаторных библиотек может быть создание, например, вариантов полипептида ALK1, которые могут выступать в качестве агонистов или антагонистов, или, в качестве альтернативы, которые в совокупности обладают новыми активностями. Ниже предложен ряд разновидностей скринингового анализа, которые можно применять для оценки вариантов. Например, вариант полипептида ALK1 можно подвергнуть скринингу для определения его способности связываться с лигандом ALK1, предотвращать связывание лиганда ALK1 с полипептидом ALK1 или препятствовать передаче сигналов, вызванной лигандом ALK1. Активность полипептида ALK1 или его вариантов можно также исследовать в клеточном анализе или анализе in vivo, в частности, в любом из анализов, раскрытых в примерах.
[0094] Могут быть созданы варианты, происходящие от комбинаторной изменчивости, обладающие селективной или, как правило, увеличенной активностью относительно полипептида ALK1 ECD, содержащего внеклеточный домен существующего в природе полипептида ALK1. Подобным образом мутагенез может привести к появлению вариантов, период полужизни в сыворотке которых существенно отличается от периода полужизни соответствующего полипептида ALK1 ECD дикого типа. Например, измененный белок может оказаться более стабильным или менее стабильным по отношению к протеолитической деградации или к другим процессам, что приводит к разрушению природного полипептида ALK1 ECD или к его удалению каким-либо другим способом или к инактивации. Такие варианты и гены, которые их кодируют, можно применять для изменения концентрации полипептида ALK1 ECD путем модулирования периода полужизни полипептидов ALK1. Например, короткий период полужизни может привести к менее продолжительному биологическому действию и может позволить осуществлять более сильный контроль концентрации рекомбинантного полипептида ALK1 ECD у пациента. В Fc-слитом белке мутации для изменения периода полужизни белка могут быть введены в линкер (если таковой имеется) и/или в Fc-фрагмент.
[0095] Комбинаторная библиотека может быть получена в форме вырожденной библиотеки генов, кодирующих библиотеку полипептидов, каждый из которых содержит по меньшей мере часть последовательности потенциального полипептида ALK1. Например, смесь синтетических олигонуклеотидов можно лигировать ферментативным способом в такие последовательности генов, в которых вырожденный набор потенциальных нуклеотидных последовательностей полипептида ALK1 способен экспрессироваться в виде отдельных полипептидов или, в качестве альтернативы, в виде набора слитых белков более большого размера (например, для фагового дисплея).
[0096] Существует ряд путей, с помощью которых можно создать библиотеку потенциальных вариантов ALK1 ECD из вырожденной олигонуклеотидной последовательности. Химический синтез вырожденной последовательности генов можно осуществить на автоматическом ДНК-синтезаторе, а затем лигировать синтетические гены в соответствующий вектор для экспрессии. Синтез вырожденных нуклеотидов хорошо известен в данной области техники (см., например, публикации Narang, SA Tetrahedron 1983;39:3; Itakura et al., Recombinant DNA, Proc. 3rd Cleveland Sympos. Macromolecules, ed. AG Walton, Amsterdam: Elsevier pp273-289; Itakura et al.,(1984) Annu. Rev. Biochem. 1981; 53: 323; Itakura et al., (1984) Science 1984;198:1056; Ike et al., Nucleic Acid Res. 1983: 1983; 11: 477). Такие методики применяли для направленной эволюции других белков (см., например, Scott et al., Science 1990;249:386-390; Roberts et al.,(1992) PNAS USA 89: 2429-2433; Devlin et al.,; Science 1990;249: 404-406; Cwirla et al., (1990) PNAS USA 87: 6378-6382; а также патенты США №№: 5,223,409, 5,198,346 и 5,096,815).
[0097] В качестве альтернативы для создания комбинаторной библиотеки можно применять другие формы мутагенеза. Например, варианты полипептида ALK1 могут быть созданы и выделены из библиотеки с помощью скрининга с применением, например, сканирующего аланином мутагенеза и тому подобное (Ruf et al., Biochemistry 1994; 33:1565-1572; Wang et al., J. Biol. Chem. 1994; 269: 3095-3099; Balint et al., Gene 1993; 137: 109-118; Grodberg et al., (1993) Eur. J. Biochem. 218:597-601; Nagashima et al., J. Biol. Chem. 1993; 268: 2888-2892; Lowman et al., Biochemistry 1991;30:10832-10838; и Cunningham et al., (1989) Science 244:1081-1085), сканирующего линкером мутагенеза (Gustin et al., Virology 1993; 193: 653-660; Brown et al., Mol. Cell Biol. 1992; 12: 2644-2652; McKnight et al., Science 1982; 232: 316); насыщающего мутагенеза (Meyers et al., Science 1986; 232:613); ПЦР-опосредованного мутагенеза (Leung et al., Method Cell Mol. Biol., 1989; 1: 11-19); или неспецифического мутагенеза, в том числе химического мутагенеза и т.д. (Miller et al., (1992) A Short Course in Bacterial Genetics, CSHL Press, Cold Spring Harbor, NY; и Greener et al., Strategies in Mol Biol 1994; 7: 32-34). Сканирующий линкером мутагенез, в частности, в комбинаторных вариантах, представляет собой перспективный способ для обнаружения усеченных (биологически активных) форм полипептидов ALK1.
[0098] В данной области техники известен большой диапазон методик для скрининга продуктов генов из комбинаторных библиотек, созданных в результате точечных мутаций и усечений, и, собственно, для скрининга кДНК библиотек для продуктов генов, обладающих определенными признаками. Такие методики являются, как правило, легко адаптируемыми для быстрого скрининга библиотек генов, созданных в результате комбинаторного мутагенеза полипептидов ALK1. Наиболее широко используемые методики для скрининга больших библиотек генов, как правило, включают клонирование библиотеки генов в репликативные векторы экспрессии, трансформирование соответствующих клеток полученной в результате библиотекой векторов и экспрессию комбинаторных генов в условиях, при которых обнаружение желаемой активности способствует относительно простому выделению вектора, кодирующего ген, продукт которого был обнаружен. Предпочтительные варианты анализа включают анализ связывания лиганда ALK1 и анализ лиганд-опосредуемой клеточной передачи сигналов.
[0099] Согласно некоторым вариантам реализации настоящего изобретения полипептиды ALK1 ECD могут дополнительно содержать посттрансляционные модификации в дополнение к любым мутациям, которые в природе присутствуют в полипептидах ALK1. Такие модификации включают, но не ограничиваются ими, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидизацию и ацилирование. В результате модифицированные полипептиды ALK1 ECD могут содержать элементы, отличные от аминокислот, такие как полиэтиленгликоли, липиды, поли- или моносахариды и фосфаты. Действие таких элементов, отличных от аминокислот, на функциональные возможности полипептида ALK1 ECD можно исследовать, как описано в настоящей заявке для других вариантов полипептида ALK1 ECD. Когда полипептид ALK1 ECD получают в клетках путем отщепления образующейся формы полипептида ALK1, посттрансляционный процессинг может также быть важным для надлежащего фолдинга и/или функционирования белка. Различные клетки (такие как СНО, HeLa, MDCK, 293, WI38, NIH-3T3 или НЕК293) обладают специфическими клеточными органеллами и характерными механизмами для осуществления таких посттрансляционных активностей; их можно выбрать, чтобы убедиться в надлежащей модификации и процессинге полипептидов ALK1.
[0100] Согласно некоторым аспектам настоящего изобретения функциональные варианты или модифицированные формы полипептидов ALK1 ECD включают слитые белки, содержащие по меньшей мере часть полипептидов ALK1 ECD и один или несколько доменов слияния. Хорошо известные примеры таких доменов слияния включают, но не ограничиваются ими, полигистидин, Glu-Glu, глутатион-S-трансферазу (ГСТ), тиоредоксин, белок А, белок G, константную область тяжелой цепи иммуноглобулина (Fc), мальтоза-связывающий белок (МСБ) или сывороточный альбумин человека. Домен слияния может быть выбран таким образом, чтобы обеспечит желаемое свойство. Например, некоторые домены слияния особенно полезны для выделения слитых белков методом аффинной хроматографии. Для аффинной очистки применяют соответствующие матрицы для аффинной хроматографии, такие как глутатион-, амилаза-, никель- или кобальт- конъюгированные смолы. Многие из таких матриц доступны в форме «наборов», таких как система очистки Pharmacia GST и система QIAexpressTM (Qiagen), применимые с партнерами слияния (HIS6).
[0101] В качестве другого примера домен слияния может быть выбран таким образом, чтобы облегчить обнаружение полипептидов ALK1 ECD. Примеры таких доменов обнаружения включают различные флуоресцентные белки (например, GFP), а также «эпитопные метки», которые, как правило, представляют собой короткие пептидные последовательности, для которых доступно специфическое антитело. Хорошо известные эпитопные метки, для которых широко доступны специфические моноклональные антитела, включают метки FLAG, гемагглютинин вируса гриппа (НА) и с-myc. В некоторых случаях домены слияния содержат участок расщепления протеазой, такой как фактор Ха или тромбин, которые позволяют соответствующей протеазе частично расщеплять слитые белки и посредством этого высвобождать из них рекомбинантные белки. Высвободившиеся белки могут затем быть выделены из домена слияния с помощью последующего хроматографического разделения. Согласно определенным предпочтительным вариантам реализации настоящего изобретения полипептид ALK1 ECD слит с доменом, который стабилизирует полипептид ALK1 in vivo («стабилизирующий» домен). Под «стабилизацией» подразумевается любое действие, которое увеличивает период полужизни в сыворотке, независимо от того, произошло ли данное увеличение в результате уменьшения разрушения, уменьшения клиренса в почке или другого фармакокинетического эффекта. Известно, что слияние белка с Fc-фрагментом иммуноглобулина применяли для предоставления желаемых фармакокинетических свойств широкому диапазону белков. Подобным образом слияние с сывороточным альбумином человека может предоставить желаемые свойства. Другие типы доменов слияния, которые могут быть выбраны, включают домены мультимеризации (например, димеризации, тетрамеризации) и функциональные домены.
[0102] В качестве конкретного примера в настоящем изобретении предложен слитый белок, содержащий растворимый внеклеточный домен ALK1, слитый с Fc-доменом (например, SEQ ID NO: 6).
THTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVD(A)VSHEDPEVKFNWYVD GVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCK(A)VSNKALPVPIEKTI SKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTP PVLDSDGPFFLYSKLTVDKSRWQQGNVFSCSVMHEALHN(A)HYTQKSLSLSPGK*
[0103] В некоторых случаях Fc-домен содержит одну или несколько мутаций в остатках, таких как Asp-265, лизин-322 и Asn-434. В определенных случаях мутантный Fc-домен, содержащий одну или несколько данных мутаций (например, мутацию Asp-265), обладает уменьшенной способностью связываться с Fcγ-рецептором по сравнению с Fc-доменом дикого типа. В других случаях мутантный Fc-домен, содержащий одну или несколько данных мутаций (например, мутацию Asn-434), обладает увеличенной способностью связываться с МНС класса 1-связанным Fc-рецептором (FcRN) по сравнению с Fc-доменом дикого типа.
[0104] Известно, что различные элементы слитых белков могут быть организованы любым образом, который согласуется с желаемыми функциональными возможностями. Например, полипептид ALK1 ECD может быть размещен с С-конца от гетерологичного домена или, в качестве альтернативы, гетерологичный домен может быть размещен на С-конце полипептида ALK1 ECD. Необходимо, чтобы домен полипептида ALK1 ECD и гетерологичный домен не были смежными в слитом белке; также с С- или N-конца любого домена или между доменами могут быть включены дополнительные домены или аминокислотные последовательности.
[0105] В настоящей заявке термин «Fc-область иммуноглобулина» или просто «Fc» используется для обозначения карбоксильной концевой части константной области цепи иммуноглобулина, предпочтительно константной области тяжелой цепи иммуноглобулина или ее части. Например, Fc-область иммуноглобулина может содержать 1) домен СН1, домен СН2 и домен СН3, 2) домен СН1 и домен СН2, 3) домен СН1 и домен СН3, 4) домен СН2 и СН3, или 5) комбинацию двух или нескольких доменов и шарнирной области иммуноглобулина. Согласно предпочтительным вариантам реализации настоящего изобретения Fc-область иммуноглобулина содержит по меньшей мере шарнирную область иммуноглобулина, домен СН2 и домен СН3 и предпочтительно в ней отсутствует домен СН1.
[0106] Согласно одному варианту реализации настоящего изобретения класс иммуноглобулина, от которого происходит константная область тяжелой цепи, представляет собой IgG (Igy) (у подклассы 1, 2, 3 или 4). Можно применять и другие классы иммуноглобулинов: IgA (Igy), IgD (Ig5), IgE (Ige) и IgM (Igu). Выбор соответствующей константной области тяжелой цепи иммуноглобулина подробно обсуждается в патентах США №№ 5,541,087 и 5,726,044. Выбор конкретной последовательности константной области тяжелой цепи иммуноглобулина от определенных классов и подклассов иммуноглобулинов для достижения конкретного результата находится в рамках компетенции специалиста в данной области техники. Часть конструкции ДНК, кодирующей Fc-область иммуноглобулина, предпочтительно содержит по меньшей мере часть шарнирного домена и предпочтительно по меньшей мере часть домена СН3 Fc гамма или гомологичных доменов любого из IgA, IgD, IgE или IgM.
[0107] Более того, предполагают, что замену или делецию аминокислот в константных областях тяжелой цепи иммуноглобулина можно применять при реализации на практике способов и композиций, раскрытых в настоящей заявке. Одним из примеров является введение аминокислотных замен в верхнюю СН2-область для создания Fc-варианта с уменьшенной аффинностью к Fc-рецепторам (Cole et al., (1997) J. Immunol. 159: 3613).
[0108] Согласно некоторым вариантам реализации настоящее изобретение делает доступными выделенные и/или очищенные формы полипептидов ALK1 ECD, которые были выделены из других белков и/или других видов полипептидов ALK1 ECD или были иным способом по существу очищены от других белков и/или других видов полипептидов ALK1 ECD (например, очищены по меньшей мере на 80%, 90%, 95%, 96%, 97%, 98% или на 99%). Полипептиды ALK1 ECD, как правило, получают в результате экспрессии рекомбинантных нуклеиновых кислот.
[0109] Согласно некоторым вариантам реализации настоящее изобретение включает нуклеиновые кислоты, кодирующие растворимые полипептиды ALK1, содержащие кодирующую последовательность для внеклеточной части белков ALK1. Согласно следующим вариантам реализации настоящее изобретение также относится к клетке хозяина, содержащей такие нуклеиновые кислоты. Клетка-хозяин может представлять собой любую прокариотическую или эукариотическую клетку. Например, полипептид согласно настоящему изобретению можно экспрессировать в бактериальных клетках, таких как Е. coli, клетках насекомых (например, с применением бакуловирусной системы экспрессии), клетках дрожжей или млекопитающих. Другие подходящие клетки-хозяева известны специалисту в данной области техники. Соответственно, некоторые варианты реализации настоящего изобретения также имеют отношение к способам получения полипептидов ALK1 ECD. Как продемонстрировано в настоящей заявке, слитый белок ALK1-Fc, изложенный в SEQ ID NO: 14, экспрессированный в клетках СНО, обладает потенциальной антиангиогенной активностью.
3. Нуклеиновые кислоты, кодирующие полипептиды ALK1
[0110] Согласно некоторым аспектам в настоящем изобретении предложены выделенные и/или рекомбинантные нуклеиновые кислоты, кодирующие любой из полипептидов ALK1 (например, полипептиды ALK1 ECD), в том числе фрагменты, функциональные варианты и слитые белки, раскрытые в настоящей заявке. Например, SEQ ID NO: 2 кодирует существующий в природе предшественник полипептида ALK1 человека, тогда как SEQ ID NO: 4 кодирует предшественник внеклеточного домена ALK1, слитого с Fc-доменом IgGl. Рассматриваемые нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными. Такие нуклеиновые кислоты могут представлять собой молекулы ДНК или РНК. Данные нуклеиновые кислоты можно применять, например, в способах для производства полипептидов ALK1 или в качестве прямых терапевтических агентов (например, в подходах терапии на основе антисмысловой РНК, РНКи или генной терапии).
[0111] Согласно некоторым аспектам настоящего изобретения рассматриваемые нуклеиновые кислоты, кодирующие полипептиды ALK1, также понимают как нуклеиновые кислоты, которые представляют собой варианты SEQ ID NO: 2 или 4. Нуклеотидные последовательности - варианты включают последовательности, которые отличаются на одну или несколько нуклеотидных замен, вставок или делеций, такие как аллельные варианты.
[0112] Согласно некоторым вариантам реализации в настоящем изобретении предложены выделенные или рекомбинантные последовательности нуклеиновых кислот, которые по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или на 100% идентичны SEQ ID NO: 2 или 4. Среднему специалисту в данной области техники очевидно, что последовательности нуклеиновой кислоты комплементарны SEQ ID NO: 2 или 4, и варианты SEQ ID NO: 2 или 4 также включены в объем настоящего изобретения. Согласно следующим вариантам реализации настоящего изобретения последовательности нуклеиновых кислот согласно настоящему изобретению могут представлять собой выделенные, рекомбинантные последовательности и/или последовательности, слитые с гетерологичной нуклеотидной последовательностью, или могут находиться в ДНК-библиотеке.
[0113] Согласно другим вариантам реализации настоящего изобретения нуклеиновые кислоты согласно настоящему изобретению также включают нуклеотидные последовательности, которые гибридизуются в условиях высокой жесткости с нуклеотидной последовательностью, представленной в SEQ ID NO: 2 или 4, с последовательностью, комплементарной SEQ ID NO: 2 или 4, или с их фрагментами. Как обсуждалось выше, средний специалист в данной области техники легко поймет, что соответствующие жесткие условия, которые способствуют гибридизации ДНК, могут варьировать. Средний специалист в данной области техники легко поймет, что соответствующие жесткие условия, которые способствуют гибридизации ДНК, можно варьировать. Например, гибридизация может осуществляться в 6,0х натрия хлориде/натрия цитрате (SSC) при температуре приблизительно 45°С с последующей отмывкой 2,0х SSC при температуре 50°С. Например, концентрация соли на этапе отмывки может быть выбрана от гибридизации в условиях пониженной жесткости, для которой концентрация составляет приблизительно 2,Ox SSC при температуре 50°С, до гибридизации в условиях повышенной жесткости, для которой концентрация составляет приблизительно 0,2х SSC при температуре 50°С. Кроме того, температура на этапе отмывки может быть увеличена от условий пониженной жесткости при комнатной температуре, приблизительно 22°С, до условий повышенной жесткости при температуре приблизительно 65°С. Как величину температуры, так и концентрацию соли можно варьировать либо же температуру или концентрацию соли можно поддерживать на постоянном уровне, тогда как другая переменная будет изменяться. Согласно одному варианту реализации в настоящем изобретении предложены нуклеиновые кислоты, которые гибридизуются в условиях пониженной жесткости в 6х SSC при комнатной температуре с последующей отмывкой в 2х SSC при комнатной температуре.
[0114] Выделенные нуклеиновые кислоты, которые отличаются от нуклеиновых кислот, представленных в SEQ ID NO: 2 или 4, вследствие вырожденности генетического кода, также включены в рамки объема настоящего изобретения. Например, ряд аминокислот обозначаются более чем одним триплетом. Наличие кодонов, которые обозначают одну и ту же аминокислоту, или синонимов (например, CAU и САС являются синонимами для гистидина), может приводить к появлению «молчащих» мутаций, которые не влияют на аминокислотную последовательность белка. Однако предполагают, что в клетках млекопитающих существуют полиморфизмы последовательности ДНК, которые приводят к изменениям в аминокислотных последовательностях рассматриваемых белков. Специалисту в данной области техники очевидно, что данные изменения в одном или нескольких нуклеотидах (приблизительно в более 3-5% нуклеотидов) в нуклеиновых кислотах, кодирующих конкретный белок, могут существовать среди индивидуумов данного вида вследствие природной аллельной вариативности. Любая и все такие изменения нуклеотидов и образующихся в результаты полиморфизмов аминокислот находятся в рамках объема настоящего изобретения.
[0115] Согласно некоторым вариантам реализации настоящего изобретения рекомбинантные нуклеиновые кислоты согласно настоящему изобретению могут быть функционально связаны одной или несколькими регуляторными нуклеотидными последовательностями в экспрессирующую конструкцию. Регуляторные нуклеотидные последовательности, как правило, соответствуют клетке хозяина, используемого для экспрессии. Многочисленные типы соответствующих векторов экспрессии и подходящих регуляторных последовательностей известны в данной области техники для ряда клеток хозяев. Как правило, указанные одна или несколько регуляторных нуклеотидных последовательностей могут включать, но не ограничиваются ими, последовательности промотора, лидерные или сигнальные последовательности, участки связывания рибосомы, последовательности начала и окончания транскрипции, последовательности начала и окончания трансляции и последовательности энхансера или активатора. В настоящей заявке рассматриваются конститутивные или индуцибельные промоторы, известные в данной области техники. Промоторы могут представлять собой либо существующие в природе промоторы, либо гибридные промоторы, которые объединяют элементы более чем одного промотора. Экспрессирующая конструкция может присутствовать в клетке в эписоме, такой как плазмида, либо же экспрессирующая конструкция может быть встроена в хромосому. Согласно предпочтительным вариантам реализации настоящего изобретения экспрессирующий вектор содержит выбираемый маркерный ген, позволяющий проводить селекцию трансформированных клеток хозяина. Выбираемые маркерные гены хорошо известны в данной области техники и будут варьировать в зависимости от применяемой клетки-хозяева.
[0116] Согласно некоторым аспектам настоящего изобретения, раскрытым в настоящей заявке, рассматриваемая нуклеиновая кислота находится в векторе экспрессии, содержащем нуклеотидную последовательность, кодирующую полипептид ALK1 ECD, и функционально связанную с по меньшей мере одной регуляторной последовательностью. Регуляторные последовательности представляют собой последовательности, принятые в данной области техники; их выбирают так, чтобы направлять экспрессию полипептида ALK1. Соответственно, термин «регуляторная последовательность» включают промоторы, энхансеры и другие элементы, контролирующие экспрессию. Типичные регуляторные последовательности описаны в руководстве Goeddel; Gene Expression Technology: Methods in Enzymology, Academic Press, San Diego, С A (1990). Например, любую из целого ряда последовательностей, контролирующих экспрессию, которые контролируют экспрессию последовательности ДНК в том случае, если функционально связаны с ней, можно применять в данных векторах для экспрессии последовательностей ДНК, кодирующих полипептид ALK1. Такие применимые последовательности, контролирующие экспрессию, включают, например, ранние и поздние промоторы SV40, промотор tet, немедленно ранний промотор аденовируса или цитомегаловируса, промоторы RSV, систему lac, систему trp, систему ТАС или TRC, промотор Т7, чью экспрессию направляют с помощью РНК-полимеразы Т7, главные операторные и промоторные участки фага лямбда, контрольные области белка оболочки fd, промотор 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислой фосфатазы, например, Pho5, промоторы системы α-спаривания дрожжей, промотор polyhedron бакуловируса и другие последовательности, контролирующие экспрессию генов прокариотических и эукариотических клеток или их вирусов, и их различные комбинации. Следует понимать, что дизайн вектора экспрессии может зависеть от таких факторов как выбор клетки-хозяева, которая будет трансформирована, и/или тип желаемого белка, который планируется экспрессировать. Более того, также следует принимать во внимание число копий вектора, способность контролировать данное число копий и экспрессию любого другого белка, кодируемого вектором, таких как антибиотики-маркеры.
[0117] Рекомбинантную нуклеиновую кислоту, включенную в настоящее изобретение, можно получить путем лигирования клонированного гена или его фрагмента в вектор, подходящий для экспрессии либо в прокариотических клетках, либо в эукариотических клетках (клетках дрожжей, птиц, насекомых или млекопитающих), либо и в тех, и в других. Экспрессирующие носители для получения рекомбинантного полипептида ALK1 включают плазмиды и другие векторы. Например, векторы, подходящие для экспрессии в прокариотических клетках, таких как Е. coli, включают плазмиды следующих типов: плазмиды, полученные из pBR322, плазмиды, полученные из pEMBL, плазмиды, полученные из рЕХ, плазмиды, полученные из рВТас, и плазмиды, полученные из pUC.
[0118] Некоторые экспрессирующие векторы млекопитающих содержат как прокариотические последовательности, которые облегчают размножение вектора в бактерии, так и один или несколько эукариотических транскрипционных элементов, экспрессирующихся в эукариотических клетках. Векторы, полученные из pcDNAI/amp, pcDNAI/neo, pRc/CMV, pSV2gpt, pSV2neo, pSV2-dhfr, pTk2, pRSVneo, pMSG, pSVT7, pko-neo и pHyg, являются примерами векторов экспрессии млекопитающих, подходящих для трансфекции эукариотических клеток. Некоторые из данных векторов модифицируют последовательностями бактериальных плазмид, таких как pBR322, для облегчения репликации и селекции по устойчивости к лекарственному препарату как в прокариотических, так и в эукариотических клетках. В качестве альтернативы для временной экспрессии белков в эукариотических клетках можно применять производные вирусов, такие как производные вируса папилломы крупного рогатого скота (BPV-1) или вируса Эппштейна-Барр (pHEBo, pREP и р205). Примеры других вирусных (включая ретровирусные) систем экспрессии можно найти ниже в описании систем доставки генной терапии. В данной области техники хорошо известны различные способы, применяемые для приготовления плазмид и для трансформации организмов хозяина. Информацию о других подходящих системах экспрессии как для прокариотических, так и для эукариотических клеток, а также об общих рекомбинантных методиках можно найти в руководстве Molecular Cloning A Laboratory Manual, 3rd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press, 2001). В некоторых случаях для экспрессии рекомбинантных полипептидов желательно применять бакуловирусную систему экспрессии. Примеры таких бакуловирусных систем экспрессии включают векторы, полученные из pVL (такие как pVL1392, pVL1393 и pVL941), векторы, полученные из pAcUW (такие как pAcUWl), и векторы, полученные из pBlueBac (такие как pBlueBac III, содержащий B-gal).
[0119] Согласно предпочтительным вариантам реализации настоящего изобретения для получения рассматриваемых полипептидов ALK1 в клетках СНО конструируют вектор, такой как вектор Pcmv-Script (Stratagene, Ла-Хойя, Калифорния), векторы pcDNA4 (Invitrogen, Карлсбад, Калифорния) и векторы pCI-neo (Promega, Мэдисон, Висконсин). Очевидно, что рассматриваемые генетические конструкции можно применять для индукции экспрессии рассматриваемых полипептидов ALK1 в клетках, выращиваемых в культуре, например, с получением белков, в том числе слитых или вариантных, которые затем можно подвергнуть очистке.
[0120] Настоящее изобретение также относится к клетке хозяина, трансфицированной рекомбинантным геном, содержащим кодирующую последовательность (например, SEQ ID NO: 2 или 4) одного или нескольких рассматриваемых полипептидов ALK1 ACD. Клетка хозяина может представлять собой любую прокариотическую или эукариотическую клетку. Например, полипептид ALK1, раскрытый в настоящей заявке, можно экспрессировать в бактериальных клетках, таких как Е. coli, в клетках насекомых (например, с применением бакуловирусной системы экспрессии), дрожжей или в клетках млекопитающих. Другие подходящие клетки-хозяева известны специалисту в данной области техники.
[0121] Соответственно, настоящее изобретение также относится к способам получения рассматриваемых полипептидов ALK1, в том числе полипептидов ALK1 ECD. Например, клетку хозяина, трансфицированную экспрессирующим вектором, кодирующим полипептид ALK1, можно культивировать в соответствующих условиях для обеспечения экспрессии полипептида ALK1. Полипептид ALK1 может секретироваться из клеток и его можно выделить из смеси клеток и среды, содержащей полипептид ALK1. В качестве альтернативы полипептид ALK1 может накапливаться в цитоплазме или в мембранной фракции, и белок можно выделить после сбора и лизиса клеток. Культура клеток включает клетки-хозяева, среду и другие субпродукты. Подходящая среда для культивирования клеток хорошо известна в данной области техники.
[0122] Рассматриваемые полипептиды ALK1 можно выделить из среды культивирования клеток, из клеток хозяина или и из того, и из другого, с применением методик для очистки белков, известных в данной области техники, в том числе ионообменной хроматографии, гель-фильтрационной хроматографии, ультрафильтрации, электрофореза, иммуноаффинной очистки с применением антител, специфичных к конкретным эпитопам полипептидов ALK1, и аффинной очистки с применением агента, который связывается с доменом, слитым с полипептидом ALK1 (например, для очистки слитого белка ALK1-Fc можно применять колонки с белком А). Согласно предпочтительным вариантам реализации настоящего изобретения полипептид ALK1 представляет собой слитый белок, содержащий домен, который облегчает его очистку. Согласно предпочтительному варианту реализации настоящего изобретения пептид очищают в результате серии этапов колоночной хроматографии, включая, например, три или более следующих этапов, в любом порядке: хроматографию с белком А, хроматографию на Q-сефарозе, хроматографию на фенилсефарозе, эксклюзионную хроматографию и катионообменную хроматографию. Очистку можно завершить вирусной фильтрацией и сменой буфера.
[0123] Согласно другому варианту реализации настоящего изобретения слитый ген, кодирующий лидерную последовательность для очистки, такую как последовательность участка расщепления поли-(Нis)/энтерокиназы на N-конце целевого фрагмента рекомбинантного полипептида ALK1, может облегчать очистку экспрессируемого слитого белка методом аффинной хроматографии с применением Ni2+-металлосодержащей смолы. Впоследствии лидерную последовательность для очистки можно удалить путем обработки энтерокиназой с получением очищенного полипептида ALK1 (например, см. публикации Hochuli et al., (1987) J. Chromatography 411: 177; и Janknecht et al., PNAS USA 88: 8972).
[0124] Способы получения слитых генов хорошо известны. В основном присоединение различных фрагментов ДНК, кодирующих различные полипептидные последовательности, проводят с помощью традиционных методов с использованием для лигирования «тупых» или «липких» концов, которые получают путем соответствующего расщепления рестриктазой; «липкие» концы дополняют соответствующим образом, после чего, чтобы избежать нежелательного присоединения, проводят обработку щелочной фосфатазой и затем ферментативное лигирование. Согласно другому варианту реализации настоящего изобретения слитый ген можно синтезировать стандартными способами, включая использование автоматических ДНК-синтезаторов. В качестве альтернативы можно проводить ПЦР-амплификацию фрагментов гена с применением якорных праймеров, которые обеспечивают комплементарное соединение «липких» концов двух последовательных фрагментов гена, после чего можно провести отжиг с получением химерной генной последовательности (См., например, руководство Current Protocols in Molecular Biology, eds. Ausubel et al., John Wiley & Sons: 1992).
[0125] Примеры категорий соединений нуклеиновой кислоты, которые являются антагонистами ALK1, ВМР9, ВМР10, GDF5, GDF6 или GDF7, включают антисмысловые нуклеиновые кислоты, конструкции РНКи и конструкции каталитической нуклеиновой кислоты. Нуклеиновая кислота может быть одно- или двухцепочечной. Двухцепочечное соединение может также содержать области «липких» концов или некомплементарности, в которых одна из цепей является одноцепочечной. Одноцепочечное соединение может содержать области самокомплементарности, то есть соединение может образовывать структуру, которую называют «шпилька» или «стебель-петля» с участком двуспиральной структуры. Соединение нуклеиновой кислоты может содержать нуклеотидную последовательность, которая является комплементарной области, состоящей из не более 1000, не более 500, не более 250, не более 100 или не более 50, 35, 30, 25, 22, 20 или 18 нуклеотидов полноразмерной последовательности нуклеиновой кислоты ALK1 или последовательности нуклеиновой кислоты лиганда. Область комплементарности предпочтительно будет состоять из по меньшей мере 8 нуклеотидов, в некоторых случаях из по меньшей мере 10 или из по меньшей мере 15 нуклеотидов и в некоторых случаях от 15 до 25 нуклеотидов. Область комплементарности может находиться в интроне, кодирующей последовательности или некодирующей последовательности целевого транскрипта, такой как фрагмент кодирующей последовательности. Как правило, длина соединения нуклеиновой кислоты составляет от приблизительно 8 до приблизительно 500 нуклеотидов или пар нуклеотидов, в некоторых случаях длина составляет от приблизительно 14 до приблизительно 50 нуклеотидов. Нуклеиновая кислота может представлять собой ДНК (в частности, для применения в качестве антисмысловой), РНК или гибрид РНК/ДНК. Одна цепь может содержать смесь ДНК и РНК, а также модифицированные формы, которые невозможно однозначно классифицировать как ДНК или РНК. Подобным образом двухцепочечное соединение может представлять собой ДНК/ДНК, ДНК/РНК или РНК/РНК, и любая цепь может также содержать смесь ДНК и РНК, а также модифицированные формы, которые невозможно однозначно классифицировать как ДНК или РНК. Соединение нуклеиновой кислоты может содержать любую из ряда модификаций, в том числе одну или [несколько] модификаций остова (сахаро-фосфатной части природной нуклеиновой кислоты, включающей межнуклеотидные связи) или оснований (пуриновая или пиримидиновая часть природной нуклеиновой кислоты). Антисмысловое соединение нуклеиновой кислоты предпочтительно имеет длину от приблизительно 15 до приблизительно 30 нуклеотидов и зачастую содержит одну или несколько модификаций для улучшения таких характеристик, как стабильность в сыворотке, в клетке или в участке возможной доставки соединения, в таком как желудок в случае пероральной доставки соединений и легкие в случае доставки соединений путем ингаляции. В случае конструкции РНКи цепь, комплементарная целевому транскрипту, как правило, представляет собой РНК или ее модификации. Другая цепь может представлять собой РНК, ДНК или любую другую вариацию. Дуплексная часть двухцепочечной или одноцепочечной «шпильки» конструкции РНКи предпочтительно составляет в длину от 18 до 40 нуклеотидов и в некоторых случаях приблизительно от 21 до 23 нуклеотидов при условии, что она служит субстратом Дайсера. Каталитические или ферментативные нуклеиновые кислоты могут представлять собой рибозимы или ферменты ДНК и также могут содержать модифицированные формы. Соединения нуклеиновой кислоты могут ингибировать экспрессию мишени приблизительно на 50%, 75%, 90% или более при контакте с клетками в физиологических условиях и в концентрации, в которой несмысловой или смысловой контроль оказывает небольшое действие или не оказывает действия. Предпочтительные концентрации соединений нуклеиновой кислоты для исследования составляют 1, 5 и 10 микромолей. Также можно исследовать влияние соединений нуклеиновой кислоты, например, на ангиогенез.
4. Антитела
[0126] Другой аспект настоящего изобретения относится к антителу, способному взаимодействовать с внеклеточной частью полипептида ALK1, предпочтительно к антителам, которые специфически взаимодействуют с полипептидом ALK1. Согласно предпочтительным вариантам реализации настоящего изобретения такое антитело может препятствовать связыванию ALK1 с лигандом, таким как GDF5, GDF6, GDF7 ВМР-9 или BMP-10 - следует понимать, что антитело против лиганда ALK1 должно связываться со зрелой, прошедшей процессинг формой соответствующего белка. В настоящем изобретении также предложены антитела, которые связываются с GDF5, GDF6, GDF7, ВМР9 и/или BMP10 и ингибируют связывание ALK1 с данными лигандами. Предпочтительные антитела демонстрируют антиангиогенную активность в биологическом анализе, таком как анализ на ХАО или анализ микрокармана роговицы (см. выше). Предпочтительное антитело против ВМР9 описано в примере 10 ниже. Согласно некоторым вариантам реализации настоящего изобретения может быть желательным антитело, которое ингибирует как ВМР9, так и BMP10; такое антитело может ингибировать оба лиганда в анализе связывания ALK1, в анализе ангиогенеза (например, в анализе образования микротрубочек на клетках HUVEC, в анализе на ХАО, в анализе с применением Matrigel или в других анализах, таких как в анализы, описанные в настоящей заявке).
[0127] Предполагается, что термин «антитело» в настоящей заявке включает целые антитела, например, любой изотипа (IgG, IgA, IgM, IgE, и т.д.), и включает фрагменты или домены иммуноглобулинов, способные взаимодействовать с конкретным антигеном. Фрагменты антител можно получить с применением общепринятых методик, после чего фрагменты можно подвергнуть скринингу на пригодность и/или способность взаимодействовать с конкретным целевым эпитопом. Таким образом, данный термин включает сегменты фрагментов молекулы антитела, полученных в результате протеолитического расщепления или рекомбинантным способом, которые способны селективно взаимодействовать с определенным белком. Неограничивающие примеры таких фрагментов, полученных протеолитическими и/или рекомбинантными способами, включают Fab, F(ab')2, Fab', Fv и одноцепочечные антитела (scFv), содержащие домены V[L] и/или V[H], соединенные пептидным линкером. scFv можно соединить ковалентным или нековалентным способом для получения антител, содержащих два или более участков связывания. Термин «антитело» также включает поликлональные, моноклональные или другие очищенные препараты антител, а также рекомбинантные антитела. Термин «рекомбинантное антитело» относится к антителу или антиген связывающему домену иммуноглобулина, экспрессированному с применением нуклеиновой кислоты, сконструированной методами молекулярной биологии, и включает гуманизированное антитело или полностью человеческое антитело, полученное из одноцепочечного антитела. Термин «рекомбинантное антитело» также охватывает однодоменные и одноцепочечные антитела.
[0128] Антитела можно получить с помощью любых из различных способов, известных в данной области техники, включая введение антигена животному, введение антигена животному, несущему гены иммуноглобулина человека, или скрининг антигеном библиотеки антител (часто одноцепочечных антител или доменов антител). После того, как обнаружена антигенсвязывающая активность, соответствующие части белка могут быть перенесены в рамки считывания другого антитела, в том числе рамки считывания полноразмерного IgG. Например, с применением иммуногенов, производных полипептида ALK1 или лиганда ALK1 (например, ВМР9 или BMP10 или иммуногена, общего для ВМР9 и BMP10), можно получить антисыворотку против белка/против пептида или моноклональные антитела с применением стандартных протоколов (См., например, руководство Antibodies: A Laboratory Manual ed. by Harlow and Lane (Cold Spring Harbor Press: 1988)). Как показано на фигуре 19, ВМР9 и BMP10 обладают значительной идентичностью аминокислот и вследствие этого каждый белок можно применять в качестве иммуногена для создания антитела, которое может перекрестно реагировать как с ВМР9, так и с BMP10. Фрагменты последовательностей с высокой степенью подобия также могут применяться в качестве иммуногенов. Млекопитающее, такое как мышь, хомяк или кролик, может быть иммунизировано иммуногенной формой пептида (например, полипептидом ALK1 или антигенным фрагментом, способным вызывать ответ антитела, или слитым белком). Методики обеспечения иммуногености белка или пептида включают конъюгацию с носителями или другие методики, хорошо известные в данной области техники. Иммуногенная часть (предпочтительно внеклеточная часть) полипептида ALK1 или лиганда ALK1, такого как ВМР9 или BMP10, может быть введена в присутствии адъюванта. Развитие иммунизации можно отслеживать посредством определения титров антитела в плазме или сыворотке. Стандартный анализ методом твердофазного ИФА (ELISA) или другие варианты иммуноанализа можно применять с иммуногеном в качестве антигена для достижения необходимых концентраций антитела.
[0129] После иммунизации животного антигенным препаратом полипептида ALK1 или полипептида лиганда (например, ВМР9 или BMP10) можно получить антисыворотку против ALK1 или против лиганда и, при необходимости, из сыворотки можно выделить поликлональные антитела. Для получения моноклональных антител продуцирующие антитела клетки (лимфоциты) могут быть выделены из иммунизированного животного и слиты с помощью стандартных процедур слияния соматических клеток с иммортализованными клетками, такими как клетки миеломы, для получения клеток гибридомы. Такие методики хорошо известны в данной области техники и включают, например, гибридомную технологию (первоначально разработанную авторами Kohler и Milstein, Nature, 1975; 256: 495-497), технологию гибридом В-клеток человека (Kozbar et al., Immunology Today, (1983; 4: 72), и технологию гибридом EBV-гибридом для получения моноклональных антител человека (Cole et al., (1985) Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc. pp. 77-96). Клетки гибридомы можно подвергнуть скринингу иммунохимическим методом для получения антител, специфически взаимодействующих с полипептидом ALK1 млекопитающих согласно настоящему изобретению или с лигандами, такими как ВМР9 или BMP10; моноклональные антитела затем могут быть выделены из культуры, содержащей такие клетки гибридомы. Антитела со специфичностью как к ВМР9, так и к BMP10, могут быть отобраны из гибридом, полученных от животных, которым вводили либо ВМР9, либо BMP10 по отдельности.
[0130] Термин «антитело» в настоящей заявке включает фрагменты антитела, которые также способны специфически взаимодействовать с одним из рассматриваемых полипептидов ALK1 или с полипептидами лиганда ALK1, или с комбинацией антигенов-мишеней (например, ВМР9 и BMP10). Фрагменты антител можно получить с применением общепринятых методик, после чего фрагменты можно подвергнуть скринингу на пригодность тем же образом, как описано выше для целых антител. Например, F(ab)2-фрагменты можно создать путем обработки антитела пепсином. Полученный в результате F(ab)2-фрагмент можно обработать для восстановления дисульфидных мостиков с получением Fab-фрагментов. «Антитело» согласно настоящему изобретению также включает биспецифичные, одноцепочечные и химерные и гуманизированные молекулы, обладающие аффинностью к полипептиду ALK1, подтвержденной по меньшей мере одной CDR-областью антитела. Согласно предпочтительным вариантам реализации антитело дополнительно содержит метку, присоединенную к нему, и может детектироваться (например, метка может представлять собой радиоактивный изотоп, флуоресцирующее соединение, фермент или кофактор фермента).
[0131] Согласно некоторым предпочтительным вариантам реализации настоящего изобретения антитело согласно настоящему изобретению представляет собой рекомбинантное антитело, в частности, гуманизированное моноклональное антитело или полностью человеческое рекомбинантное антитело.
[0132] Определение «способное специфически взаимодействовать с» применительно к антителу означает, в соответствии с принятым в данной области техники значением, что антитело является достаточно селективным в отношении целевого антигена (например, полипептида ALK1 или лиганда ALK1) по сравнению с другими антигенами, которые не являются целевыми, чтобы антитело можно было применять как минимум для обнаружения присутствия целевого антигена в биологическом образце конкретного типа. Для определенных способов применения антитела может потребоваться более высокая степень специфичности связывания. Например, антитело для применения для обнаружения малораспространенного целевого белка в присутствии одного или нескольких очень высоко распространенных белков, которые не являются целевыми, может функционировать лучше, если оно обладает более высокой степенью селективности в отношении целевого антигена, чем другие перекрестно реагирующие антигена. Моноклональные антитела, как правило, обладают более высокой способностью (по сравнению с поликлональными антителами) эффективно различать целевые антигены и перекрестно-взаимодействующие полипептиды. Кроме того, антитело, которое является эффективным в селективном обнаружении целевого антигена в одном типе биологического образца (например, в образце стула), может быть не таким эффективным для селективного обнаружения того же антигена в другом типе биологического образца (например, в образце крови). Аналогично, антитело, которое является эффективным в обнаружении целевого антигена в препарате очищенного белка, который не содержит других биологических примесей, может быть не таким эффективным в обнаружении целевого антигена в неочищенном биологическом образце, таком как образец крови или мочи. Соответственно, согласно предпочтительным вариантам реализации в настоящем изобретении предложены антитела, которые продемонстрировали специфичность к целевому антигену в том типе образца, который предположительно будет выбран для применения антитела.
[0133] Характеристикой, которая влияет на специфичность взаимодействия антитело-антиген, является аффинность антитела к антигену. Хотя желаемой специфичности можно достичь при различных значениях аффинности, как правило, предпочтительные антитела обладают аффинностью (константой диссоциации), составляющей приблизительно 10-6, 10-7, 10-8, 10-9 или менее. Принимая во внимание кажущуюся низкой аффинность связывания TGFβ с ALK1, предполагают, что многие антитела против ALK1 будут ингибировать связывание TGFβ. Однако группа лигандов GDF5, 6, 7 связывается со значением KD, составляющим приблизительно 5×10-8 М, а лиганды ВМР9, 10 связываются со значением KD, составляющим приблизительно 1×10-8 М. Таким образом, антитела соответствующей аффинности могут быть выбраны таким образом, чтобы они препятствовали активностям данных лигандов по передаче сигналов.
[0134] Кроме того, методики, применяемые для скрининга антител с целью обнаружения желаемого антитела, могут оказывать влияние на свойства полученного антитела. Например, антитело, которое будет применяться для определенных терапевтических целей, предпочтительно способно нацеливаться на конкретный тип клеток. Соответственно, для получения антител данного типа, может быть желательно провести скрининг на наличие антител, которые связываются с клетками, экспрессирующими целевой антиген (например, методом сортировки клеток с активированной флуоресценцией). Подобным образом если антитело будет применяться для связывания антигена в растворе, может быть желательно исследовать связывание в растворе. Существует ряд различных методик для исследования взаимодействия антитело-антиген для обнаружения особенно желательных антител. Такие методики включают варианты анализа ELISA, анализ связывания методом поверхностного плазмонного резонанса (например, анализ связывания на приборе Biacore, Bia-core АВ, Уппсала, Швеция), «сэндвич»-варианты анализа (например, система на основе парамагнитных бусин IGEN International, Inc., Гейтерсберг, Мэриленд), вестерн-блоттинг, анализ иммунопреципитации и иммуногистохимия.
[0135] Согласно предпочтительным вариантам реализации настоящего изобретения антитело, раскрытое в настоящей заявке, представляет собой антитело, которое связывается со зрелой частью ВМР9 человека, аминокислотная последовательность которой представлена ниже:
RS AGAGSHCQKT SLRVNFEDIG WDSWIIAPKE YEAYECKGGC FFPLADDVTP TKHAIVQTLV HLKFPTKVGK ACCVPTKLSP ISVLYKDDMG VPTLKYHYEG MSVAECGCR (SEQ ID NO: 12)
[0136] Согласно дополнительному варианту реализации настоящего изобретения антитело, раскрытое в настоящей заявке, представляет собой антитело, которое связывается со зрелой частью BMP10 человека, аминокислотная последовательность которой представлена ниже:
NAKG NYCKRTPLYI DFKEIGWDSWIIAPPGYEAY ECRGVCNYPL
AEHLTPTKHA IIQALVHLKN SQKASKACCV PTKLEPISIL YLDKGVVTYK FKYEGMAVSE CGCR (SEQ ID NO: 13)
[0137] Кроме того, белки, которые связываются с ВМР9 или BMP10, отличные от антител, могут быть образованы в результате селекции из библиотек. Целый ряд методик доступен для скрининга случайных пептидов, а также белков на основе рамки считывания, которые связываются с конкретным лигандом. Как правило, подход для обнаружения применимого белка, отличного от антитела, включает скрининг или селекцию из библиотеки тех белков, которые связываются с ВМР9 и/или BMP10 или ингибируют активность ВМР9 или ВМР10, такую как связывание рецепторов (например, ALK1) или клеточную передачу сигналов (например, передачу сигналов с участием SMAD 1/5).
5. Изменения в антителах и Fc-слитых белках
[0138] В настоящей заявке также предложены антитела и слитые белки ALK1-Fc, которые содержат генно-инженерные или вариативные Fc-области. Такие антитела и Fc-слитые белки можно применять, например, для модулирования эффекторных функций, таких как антиген-зависимая цитотоксичность (ADCC) и комплемент-зависимая цитотоксичность (CDC). Кроме того, модифицикации могут улучшать стабильность антител и Fc-слитых белков. Варианты аминокислотной последовательности антител и Fc-слитых белков готовят введением соответствующих замен нуклеотидов в ДНК или с помощью пептидного синтеза. Такие варианты включают, например, делеций и/или вставки и/или замены в остатках аминокислотных последовательностей антител и Fc-слитых белков, раскрытых в настоящей заявке. Любую комбинацию делеций, вставки и замены используют для получения финальной конструкции и обеспечения того, чтобы финальная конструкция обладала желаемыми характеристиками. Аминокислотные замены также могут изменять посттрансляционный процессинг антител и Fc-слитых белков, например, изменять количество или положение участков гликозилирования.
[0139] Антитела и Fc-слитые белки с уменьшенной эффекторной функцией можно получить путем введения изменений в аминокислотную последовательность, включая, но не ограничиваясь ими, мутацию Ala-Ala, описанную Bluestone et al., (см. международные заявки на патент WO 94/28027 и WO 98/47531; также см. публикацию Xu et al., 2000 Cell Immunol 200; 16-26). Таким образом, согласно определенным вариантам реализации настоящего изобретения антитела и Fc-слитые белки согласно настоящему изобретению, содержащие мутации в константной области, в том числе мутацию Ala-Ala, можно применять для снижения либо устранения эффекторной функции. Согласно данным вариантам реализации настоящего изобретения антитела и Fc-слитые белки могут содержать мутацию аланина в положении 234 или мутацию аланина в положении 235 или их комбинацию. Согласно одному варианту реализации настоящего изобретения антитело или Fc-слитый белок содержит рамку считывания IgG4, причем мутация Ala-Ala описывает мутацию (мутации) фенилаланина на аланин в положении 234 и/или мутацию лейцина на аланин в положении 235. Согласно другому варианту реализации настоящего изобретения антитело или Fc-слитый белок содержит рамку считывания IgGl, причем мутация Ala-Ala описывает мутацию (мутации) лейцина на аланин в положении 234 и/или мутацию лейцина на аланин в положении 235. Антитело или Fc-слитый белок может в качестве альтернативы или дополнительно содержать другие мутации, в том числе точечную мутацию К322А в домене СН2 (Hezareh et al., 2001; J. Virol. 75: 12161-8).
[0140] Согласно конкретным вариантам реализации настоящего изобретения антитело или Fc-слитый белок модифицированы для увеличения либо ингибирования комплемент-зависимой цитотоксичности (CDC). Модулировать активность CDC можно с помощью введения в Fc-область одной или нескольких аминокислотных замен, вставок или делеций (см., например, патент США №6,194,551). В качестве альтернативы или дополнительно в Fc-область можно ввести остаток (остатки) цистеина, что позволяет образовать в данной области межцепочечные дисульфидные связи. Гомодимерное антитело, образованное таким образом, может обладать улучшенной или уменьшенной способностью к интернализации и/или увеличенной или уменьшенной способностью к комплемент-опосредованному уничтожению клеток. См. публикации Caron et al.; J. Exp Med. 1992; 176: 1191-1195 и Shopes, В. (1992); J. Immunol. 148: 2918-2922, международную заявку на патент WO 99/51642, Duncan & Winter Natureb, 1988; 322: 738-40; патент США №5,648,260; патент США №5,624,821; и международную заявку на патент WO 94/29351.
6. Способы и композиции для лечения почечно-клеточной карциномы, модулирования ангиогенеза и лечения других нарушений
[0141] В настоящем изобретении предложены способы лечения почечно-клеточной карциномы у млекопитающего путем введения млекопитающему эффективного количества полипептида ALK1 ECD, такого как слитый белок ALK1-Fc, или антитела, раскрытого в настоящей заявке, такого как антитело против GDF5, GDF6, GDF7, ВМР9, BMP10 или ECD ALK1, или антагонистов нуклеиновой кислоты (например, антисмысловой или сиРНК) любого из вышеперечисленных соединений, далее в совокупности именуемых «терапевтические агенты» или «антагонист(ы) ALK1». Полагают, что данные терапевтические агенты можно применять для лечения почечно-клеточной карциномы в форме агентов для монотерапии или в комбинации с другими терапевтическими агентами для лечения ПКК.
[0142] В частности, терапевтические агенты - полипептиды согласно настоящему изобретению обладают несколькими свойствами, которые делают их особенно привлекательными в качестве терапевтических агентов для лечения ПКК. Например, в отличие от большинства биологических агентов, полипептиды ALK1 ECD влияют на рост клеток почек путем модулирования ряда факторов, способствующих и поддерживающих рост опухоли, пролиферацию и ангиогенез опухоли. Это в значительной степени относится к тем типам рака, при которых рак часто содержит мутации, ассоциированные с множеством различных путей передачи сигналов, которые поддерживают, например, рост опухоли, пролиферацию, ангиогенез и метастазирование. Таким образом, терапевтические агенты, раскрытые в настоящей заявке, являются особенно эффективными для лечения опухолей, таких как почечно-клеточный рак, устойчивых к лечению препаратами, нацеленными на отдельные ангиогенные факторы (например, бевацизумабом, нацеленным на VEGF), и в то же самое время представляют собой потенциальные антагонисты активности ALK1, который селективно экспрессируется на активированных эндотелиальных клетках и, как предполагают, играет важную роль в регулировании ответа данных клеток на ряд факторов, таких как ВМР9, VEGF и FGF, которые поддерживают ангиогенез опухоли и пролиферацию клеток.
[0143] Как продемонстрировано в настоящей заявке, слитые белки ALK1-Fc эффективно вызывают уменьшение роста опухоли in vivo в моделях с ксенотрансплантатами ПКК человека. Соответственно, предполагают, что полипептиды ALK1 ECD, такие как слитые белки ALK1-Fc и другие терапевтические агенты, раскрытые в настоящей заявке, можно применять в самостоятельной терапии (т.е., монотерапии) для лечения почечно-клеточной карциномы. Кроме того, что также раскрыто в настоящей заявке, слитый белок ALK1-Fc вызывает значительное увеличение активности по ингибированию роста опухоли сунитиниба, который на сегодняшний день является стандартом для лечения прогрессирующего ПКК, на каждой из исследованных моделей с ксенотрансплантатами ПКК человека. Соответственно, предполагают, что полипептиды ALK1 ECD, такие как слитые белки ALK1-Fc и другие терапевтические агенты, раскрытые в настоящей заявке, можно применять для лечения почечно-клеточной карциномы в комбинированной терапии вместе с другими агентами, такими как ингибиторы рецепторной тирозинкиназы.
[0144] В настоящей заявке термин «лечить» или «лечение» относится к контакту или введению экзогенного терапевтического агента, диагностического агента или композиции млекопитающему (например, человеку), субъекту, клетке, ткани, органу или биологической жидкости и может относиться, например, к терапевтическим, фармакокинетическим, диагностическим, исследовательским и экспериментальным способам. «Лечение» включает введение полипептида ALK1 ECD, такого как слитый белок ALK1-Fc или другой антагонист ALK, для предотвращения или задержки манифестации симптомов и осложнений или для биохимической индикации заболевания, состояния или нарушения, для облегчения симптомов или для задержки или ингибирования дальнейшего развития заболевания, состояния или нарушения. Лечение может являться профилактическим (для предотвращения или задержки манифестации заболевания или для предотвращения манифестации его клинических или субклинических симптомов) или терапевтическим - для подавления или облегчения симптомов после манифестации заболевания, состояния или нарушения. Лечение можно осуществлять полипептидом ALK1 ECD (например, слитым белком ALK1-Fc) или другим антагонистом ALK1 в отдельности или в комбинации с одним или несколькими дополнительными терапевтическими агентами. В настоящей заявке термин «млекопитающее» или «субъект» относится к млекопитающему животному (включая, но не ограничиваясь ими, млекопитающих, отличных от приматов, таких как коров, свиней, лошадей, овец, коров, собак, котов, крыс и мышей), более конкретно к примату (включая, но не ограничиваясь ими, обезьян, не являющихся человекообразными, человекообразных обезьян и людей) и еще более конкретно к человеку.
[0145] В настоящей заявке термин «эффективное количество» (например, для лечения и т.д.) относится к такому количеству терапевтического агента, например, полипептида ALK1 ECD, такого как слитый белок ALK1-Fc, которое является достаточным для достижения желаемого действия, такого как облегчение одного или нескольких симптомов или эффектов заболевания у субъекта или популяции, которых лечат, за счет индукции регрессии или ингибирования прогрессирования такого симптома (симптомов) или эффектов в любой клинически измеримой степени. Количество терапевтического агента, которое является эффективным для облегчения любого конкретного симптома заболевания или эффекта (также обозначается в настоящей заявке как «терапевтически эффективное количество») или для предотвращения конкретного симптома или эффекта заболевания (также обозначается в настоящей заявке как «профилактически эффективное количество»), может варьировать в зависимости от определенных факторов, таких как состояние заболевания, возраст и вес пациента и способность лекарственного препарата вызывать желаемый ответ у пациента. Оценить, было ли достигнуто облегчение симптома или эффекта заболевания, можно с помощью любого клинического измерения обычно применяемого для оценки серьезности или статуса прогрессии данного симптома или эффекта (например, лечащими врачами или лабораторными клиницистами).
[0146] В настоящей заявке аббревиатура «ИРТК» относится к низкомолекулярному ингибитору рецепторной тирозинкиназы, который связывается с VEGFR1, VEGFR2 или VEGFR3 и ингибирует передачу сигналов через них. ИРТК может связываться и ингибировать другие рецепторные тирозинкиназы, помимо VEGFR, такие как PDGFRa, PDGFRb, RET и c-Met. Подобным образом ИРТК может ингибировать различные классы киназ и киназы, которые не являются рецепторами клеточной поверхности, такие как сериновые киназы B-raf и c-raf.
[0147] Таким образом, согласно одному аспекту настоящее изобретение относится к способу лечения почечно-клеточной карциномы (ПКК) у млекопитающего, включающему введение млекопитающему с ПКК эффективного количества ИРТК и полипептида ALK1 ECD, такого как слитый белок ALK1-Fc или другой антагонист ALK, раскрытый в настоящей заявке. Согласно одному аспекту настоящего изобретения антагонист ALK представляет собой агент, выбранный из (а) полипептида ALK1, содержащего лиганд-связывающую часть внеклеточного домена ALK1; (b) антитела, которое связывается с внеклеточным доменом ALK1 человека; (с) антитела, которое связывается с ВМР9 человека; и (d) антитела, которое связывается с BMP 10 человека. Согласно некоторым аспектам настоящего изобретения полипептид ALK1, который применяют согласно указанному способу, содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности аминокислот 22-120 из SEQ ID NO: 1. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит константный домен иммуноглобулина. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит Fc-фрагмент иммуноглобулина и согласно дополнительным аспектам настоящего изобретения Fc-фрагмент представляет собой Fc-фрагмент IgGl человека. Согласно другим аспектам настоящего изобретения полипептид ALK1 содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 3 или SEQ ID NO: 14.
[0148] Согласно дополнительному аспекту настоящее изобретение охватывает способ лечения почечно-клеточной карциномы у млекопитающего с ПКК, которое подвергалось медицинской процедуре для лечения ПКК. Согласно конкретным вариантам реализации настоящего изобретения медицинскую процедуру выбирают из нефронсберегающей хирургии, нефрэктомии, полной нефрэктомии и абляции ткани. Согласно следующим аспектам настоящего изобретения введение терапевтического препарата млекопитающему осуществляют в пределах 1, 2, 3, 4, 5, 6 или одного месяца после прохождения медицинской процедуры.
[0149] Согласно некоторым аспектам настоящего изобретения антитело, применяемое в способах согласно настоящему изобретению, связывается с эпитопом в последовательности аминокислот 22-118 из SEQ ID NO: 1 и ингибирует связывание лиганда, выбранного из GDF5, GDF6, GDF7, ВМР9 и BMP10. Согласно дополнительным аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-111 из SEQ ID NO: 12 и ингибирует связывание ВМР9 с рецептором. Согласно следующим аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-108 из SEQ ID NO: 13 и ингибирует связывание BMP10 с рецептором.
[0150] Согласно некоторым аспектам настоящего изобретения ИРТК, который применяют в способах согласно настоящему изобретению, представляет собой сунитиниб.
[0151] Согласно другим вариантам реализации настоящего изобретения ИРТК, который применяют в способах согласно настоящему изобретению, представляет собой не сунитиниб.
[0152] Согласно некоторым аспектам настоящего изобретения ИРТК, который применяют в способах согласно настоящему изобретению, представляет собой сорафениб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой пазопаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой акситиниб. Согласно другому аспекту настоящего изобретения ИРТК представляет собой тивозаниб или вандетаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК, который применяют в способе, представляет собой агент, выбранный из: мотезаниба (AMG-706), ваталиниба (PTK787/ZK), самаксаниба (SU5416), SU6668, AZD2171, XL184, XL880/GSK1363089, PF-2351066, MGCD265, ZD6474, АЕЕ788, AG-013736, AG-013737, GW786034 и АВТ-869. Согласно следующим аспектам настоящего изобретения фармацевтические препараты содержат агент - ингибитор рецепторной тирозинкиназы VEGF, раскрытый в опубликованных международных заявках на патент №№ WO97/22596, WO 97/30035, WO 97/32856 или WO 98/13354. Согласно дополнительным аспектам настоящее изобретение относится к способу лечения почечно-клеточной карциномы (ПКК) у млекопитающего, включающему введение млекопитающему с ПКК, (1) эффективного количества (1) ИРТК, (2) полипептида ALK1 ECD, такого как слитый белок ALK1-Fc или другой раскрытый антагонист ALK, и (3) ингибитора ингибитора, мишенью которого является мишень рапамицина у млекопитающих (mTOR) рапамицина у млекопитающих (mTOR). В настоящей заявке термин «ингибитор, мишенью которого является mTOR» относится к низкомолекулярному ингибитору, который связывается и ингибирует передачу сигналов с участием сигнального пути AKT/mTOR. Ингибиторы, мишенью которых является mTOR, и варианты анализа для обнаружения ингибиторов, мишенью которых является mTOR, которые можно применять в способах согласно настоящему изобретению, известны в данной области техники. Согласно некоторым аспектам настоящего изобретения ингибитор mTOR, который применяют в способах согласно настоящему изобретению, представляет собой эверолимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой темсиролимус. Согласно дополнительным аспектам настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384.
[0153] Согласно дополнительным аспектам настоящего изобретения почечно-клеточная карцинома (ПКК), которую лечат способами согласно настоящему изобретению, представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно другим аспектам настоящего изобретения ПКК инвазировала почечный синус. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0154] Таким образом, согласно одному аспекту настоящее изобретение относится к способу лечения метастазирующего почечно-клеточной карциномы (ПКК) у млекопитающего, включающему введение млекопитающему, страдающему от метастазирующего ПКК, эффективного количества ИРТК и полипептида ALK1 ECD, такого как слитый белок ALK1-Fc, или другого антагониста ALK, раскрытого в настоящей заявке. Согласно одному аспекту настоящее изобретение охватывает способ лечения почечно-клеточной карциномы у млекопитающего с ПКК, которое подвергалось медицинской процедуре для лечения ПКК. Согласно конкретным вариантам реализации настоящего изобретения медицинскую процедуру выбирают из нефронсберегающей хирургии, нефрэктомии, полной нефрэктомии и абляции ткани. Согласно следующим аспектам настоящего изобретения введение терапевтического препарата млекопитающему осуществляют в пределах 1, 2, 3, 4, 5, 6 или месяца после прохождения медицинской процедуры.
[0155] Согласно следующим аспектам настоящее изобретение направлено на способы лечения млекопитающего, которое ранее получало лечение терапевтическим агентом против ПКК. Согласно следующему аспекту настоящее изобретение охватывает способ лечения почечно-клеточной карциномы у млекопитающего, который ранее получал терапевтический агент для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества агента, выбранного из: (а) полипептида ALK1, содержащего лиганд-связывающую часть внеклеточного домена ALK1; (b) антитела, которое связывается с внеклеточным доменом ALK1 человека; (с) антитела, которое связывается с ВМР9 человека; и (d) антитела, которое связывается с BMP10 человека. Согласно некоторым аспектам настоящего изобретения полипептид ALK1, который применяют в способе, содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности аминокислот 22-120 из SEQ ID NO: 1. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит константный домен иммуноглобулина. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит Fc-фрагмент иммуноглобулина и согласно дополнительным аспектам настоящего изобретения Fc-фрагмент представляет собой Fc-фрагмент IgGl человека. Согласно другим аспектам настоящего изобретения полипептид ALK1 содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 3 или SEQ ID NO: 14.
[0156] Согласно некоторым аспектам настоящего изобретения антитело, применяемое в способах согласно настоящему изобретению, связывается с эпитопом в последовательности аминокислот 22-118 из SEQ ID NO: 1 и ингибирует связывание лиганда, выбранного из GDF5, GDF6, GDF7, ВМР9 и BMP10. Согласно дополнительным аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-111 из SEQ ID NO: 12 и ингибирует связывание ВМР9 с рецептором. Согласно следующим аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-108 из SEQ ID NO: 13 и ингибирует связывание BMP10 с рецептором.
[0157] Согласно одному аспекту настоящего изобретения терапевтический агент для лечения ПКК, получаемый ранее, представляет собой ИРТК. Согласно следующему аспекту настоящего изобретения ИРТК представляет собой агент, выбранный из: сунитиниба, сорафениба, пазопаниба, акситиниба, тивозаниба и вандетаниба. Согласно другому аспекту настоящего изобретения терапевтический агент для лечения ПКК, получаемый ранее, представляет собой ингибитор, мишенью которого является мишень рапамицина у млекопитающих (mTOR). Согласно следующему аспекту настоящего изобретения ингибитор, мишенью которого является mTOR, представляет собой агент, выбранный из эверолимуса и темсиролимуса. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384.
[0158] Согласно дополнительному аспекту настоящего изобретения терапевтический агент для лечения ПКК, получаемый ранее, представляет собой системную цитокиновую терапию. Согласно следующему аспекту настоящего изобретения терапевтический агент для лечения ПКК, получаемый ранее, представляет собой интерферон альфа (ИФН α) или интерлейкин-2 (ИЛ-2).
[0159] Согласно некоторым аспектам настоящего изобретения ИРТК, который применяют в способах лечения млекопитающего, которое ранее получало лечение терапевтическим агентом для лечения ПКК, представляет собой сунитиниб.
[0160] Согласно другим вариантам реализации настоящего изобретения ИРТК, который применяют в способах лечения млекопитающего, которое ранее получало лечение терапевтическим агентом для лечения ПКК, представляет собой не сунитиниб.
[0161] Согласно некоторым аспектам настоящего изобретения ИРТК, который применяют в способах лечения млекопитающего, которое ранее получало лечение терапевтическим агентом для лечения ПКК, представляет собой сорафениб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой пазопаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой акситиниб. Согласно другому варианту реализации настоящего изобретения ИРТК представляет собой тивозаниб или вандетаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК, который применяют в способе, представляет собой агент, выбранный из: мотезаниба (AMG-706), ваталиниба (PTK787/ZK), самаксаниба (SU5416), SU6668, AZD2171, XL184, XL880/GSK1363089, PF-2351066, MGCD265, ZD6474, АЕЕ788, AG-013736, AG-013737, GW786034 и АВТ-869. Согласно следующим аспектам настоящего изобретения фармацевтические препараты содержат агент - ингибитор рецепторной тирозинкиназы VEGF, раскрытый в опубликованных международных заявках на патент №№ WO97/22596, WO 97/30035, WO 97/32856 или WO 98/13354.
[0162] Согласно дополнительным аспектам настоящее изобретение относится к способу лечения почечно-клеточной карциномы (ПКК) у млекопитающего, которое ранее получало терапевтический агент для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества (1) ИРТК, (2) полипептида ALK1 ECD, такого как слитый белок ALK1-Fc или другой раскрытый антагонист ALK, и (3) ингибитора, мишенью которого является мишень рапамицина у млекопитающих (mTOR) рапамицина у млекопитающих (mTOR). Ингибитор, нацеленный на mTOR, и варианты анализа для обнаружения ингибитора, мишенью которого является mTOR, которые можно применять в способах согласно настоящему изобретению, известны в данной области техники. Согласно некоторым аспектам настоящего изобретения ингибитор mTOR, который применяют в способах согласно настоящему изобретению, представляет собой эверолимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой темсиролимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384.
[0163] Согласно дополнительным аспектам настоящее изобретение относится к способу лечения почечно-клеточной карциномы (ПКК) у млекопитающего, которое ранее получало терапевтический агент для лечения ПКК, причем почечно-клеточная карцинома (ПКК), которую лечат способами согласно настоящему изобретению, представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно другим аспектам настоящего изобретения ПКК инвазировала почечный синус. Согласно следующим аспектам настоящего изобретения ПКК представляет собой метастазирующий почечно-клеточный рак. Согласно дополнительным аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0164] Согласно следующим аспектам настоящее изобретение направлено на способы лечения млекопитающего с ПКК, которое готовят к прохождению медицинской процедуры для лечения ПКК. Согласно одному аспекту настоящее изобретение включает способ лечения почечно-клеточной карциномы у млекопитающего с ПКК и которое готовят к прохождению медицинской процедуры для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества агента, выбранного из: (а) полипептида ALK1, содержащего лиганд-связывающую часть внеклеточного домена ALK1; (b) антитела, которое связывается с внеклеточным доменом ALK1 человека; (с) антитела, которое связывается с ВМР9 человека; и (d) антитела, которое связывается с BMP10 человека. Согласно некоторым аспектам настоящего изобретения полипептид ALK1, который применяют согласно указанному способу, содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности аминокислот 22-120 из SEQ ID NO: 1. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит константный домен иммуноглобулина. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит Fc-фрагмент иммуноглобулина и согласно дополнительным аспектам настоящего изобретения Fc-фрагмент представляет собой Fc-фрагмент IgGl человека. Согласно другим аспектам настоящего изобретения полипептид ALK1 содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 3 или SEQ ID NO: 14. Согласно одному аспекту настоящего изобретения агент вводят по меньшей мере за 1, 2, 3, 4, 5, 6 или 7 дней до прохождения медицинской процедуры. Согласно другому аспекту настоящего изобретения млекопитающее получало серию из по меньшей мере 1, 2, 3 или 4 введений агента до оперативного вмешательства. Согласно другому аспекту настоящего изобретения агент вводят перед прохождением медицинской процедуры, которую выбирают из: нефронсберегающей хирургии, нефрэктомии, полной нефрэктомии и абляции ткани.
[0165] Согласно некоторым вариантам реализации настоящего изобретения антитело вводят для лечения млекопитающего с ПКК, которое готовят к прохождению медицинской процедуры для лечения ПКК. Согласно дополнительным вариантам реализации настоящего изобретения введенное антитело связывается с эпитопом в последовательности аминокислот 22-118 из SEQ ID NO: 1 и ингибирует связывание лиганда, выбранного из GDF5, GDF6, GDF7, ВМР9 и BMP10. Согласно дополнительным аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-111 из SEQ ID NO: 12 и ингибирует связывание ВМР9 с рецептором. Согласно следующим аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-108 из SEQ ID NO: 13 и ингибирует связывание BMP10 с рецептором.
[0166] Согласно некоторым аспектам настоящего изобретения ИРТК вводят вместе с антагонистом ALK1, раскрытым в настоящей заявке, для лечения млекопитающего перед прохождением медицинской процедуры. Согласно некоторым аспектам настоящего изобретения ИРТК, который применяют в способах лечения млекопитающего перед прохождением медицинской процедуры для лечения ПКК, представляет собой сунитиниб. Согласно другим вариантам реализации настоящего изобретения ИРТК, который применяют в способах лечения млекопитающего перед прохождением медицинской процедуры для лечения ПКК, представляет собой не сунитиниб.
[0167] Согласно некоторым аспектам настоящего изобретения ИРТК, который применяют в способах лечения млекопитающего перед прохождением медицинской процедуры для лечения ПКК, представляет собой сорафениб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой пазопаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой акситиниб. Согласно другому варианту реализации настоящего изобретения ИРТК представляет собой тивозаниб или вандетаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК, который применяют в способе, представляет собой агент, выбранный из: мотезаниба (AMG-706), ваталиниба (PTK787/ZK), самаксаниба (SU5416), SU6668, AZD2171, XL184, XL880/GSK1363089, PF-2351066, MGCD265, ZD6474, АЕЕ788, AG-013736, AG-013737, GW786034 и АВТ-869. Согласно следующим аспектам настоящего изобретения агент включает ИРТК, раскрытый в опубликованных заявках на международный патент №№ WO 97/22596, WO 97/30035, WO 97/32856 или WO 98/13354.
[0168] Согласно некоторым аспектам настоящее изобретение направлено на способы лечения млекопитающего с ПКК и которое готовят к прохождению медицинской процедуры для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества (1) ИРТК, (2) полипептида ALK1 ECD, такого как слитый белок ALK1-Fc или другой раскрытый антагонист ALK, и (3) ингибитора ингибитора, мишенью которого является мишень рапамицина у млекопитающих (mTOR) рапамицина у млекопитающих (mTOR). Согласно некоторым аспектам настоящего изобретения ингибитор mTOR, который применяют в способах согласно настоящему изобретению, представляет собой эверолимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой темсиролимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384.
[0169] Согласно дополнительным аспектам настоящее изобретение относится к способу лечения почечно-клеточной карциномы (ПКК) у млекопитающего с ПКК перед прохождением медицинской процедуры для лечения ПКК, причем почечно-клеточная карцинома (ПКК) представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно другим аспектам настоящего изобретения ПКК инвазировала почечный синус. Согласно следующим аспектам настоящего изобретения ПКК представляет собой метастазирующую почечно-клеточную карциному. Согласно дополнительным аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0170] Согласно следующему аспекту настоящее изобретение направлено на способы лечения млекопитающего с ПКК, которое прошло медицинскую процедуру для лечения ПКК. Согласно одному аспекту настоящее изобретение охватывает способ лечения почечно-клеточной карциномы у млекопитающего с ПКК, которое прошло медицинскую процедуру для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества агента, выбранного из: (а) полипептида ALK1, содержащего лиганд-связывающую часть внеклеточного домена ALK1; (b) антитела, которое связывается с внеклеточным доменом ALK1 человека; (с) антитела, которое связывается с ВМР9 человека; и (d) антитела, которое связывается с BMP10 человека. Согласно некоторым аспектам настоящего изобретения полипептид ALK1, который применяют в способе, содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности аминокислот 22-120 из SEQ ID NO: 1. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит константный домен иммуноглобулина. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит Fc-фрагмент иммуноглобулина и согласно дополнительным аспектам настоящего изобретения Fc-фрагмент представляет собой Fc-фрагмент IgGl человека. Согласно другим аспектам настоящего изобретения полипептид ALK1 содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 3 или SEQ ID NO: 14. Согласно одному аспекту настоящего изобретения агент вводят по меньшей мере через 1, 2, 3, 4, 5, 6 или 7 дней после прохождения медицинской процедуры. Согласно другому аспекту настоящего изобретения агент вводят в пределах одной недели, одного месяца или трех месяцев прохождения медицинской процедуры. Согласно другому аспекту настоящего изобретения агент вводят по меньшей мере через 1, 2, 3, 4, 5, 6 или 7 дней после. Согласно другому аспекту настоящего изобретения после оперативного вмешательства млекопитающее получает серию из по меньшей мере 1, 2, 3 или 4 введений агента. Согласно другому аспекту настоящего изобретения агент вводят после прохождения медицинской процедуры, которую выбирают из: нефронсберегающей хирургии, нефрэктомии, полной нефрэктомии и абляции ткани.
[0171] Согласно некоторым вариантам реализации настоящего изобретения антитело вводят для лечения млекопитающего с ПКК, которое прошло медицинскую процедурудля лечения ПКК. Согласно некоторым аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 22-118 из SEQ ID NO: 1 и ингибирует связывание лиганда, выбранного из GDF5, GDF6, GDF7, ВМР9 и BMP10. Согласно дополнительным аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-111 из SEQ ID NO: 12 и ингибирует связывание ВМР9 с рецептором. Согласно следующим аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-108 из SEQ ID NO: 13 и ингибирует связывание BMP10 с рецептором.
[0172] Согласно некоторым аспектам настоящего изобретения ИРТК вводят вместе с антагонистом ALK1, раскрытым в настоящей заявке, для лечения млекопитающего с ПКК, которое прошло медицинскую процедуру для лечения ПКК. Согласно некоторым аспектам настоящего изобретения ИРТК, который применяют в способах лечения млекопитающего после прохождения медицинской процедуры, представляет собой сунитиниб. Согласно другим вариантам реализации настоящего изобретения ИРТК, который применяют в способах лечения млекопитающего после прохождения медицинской процедуры для лечения ПКК, представляет собой не сунитиниб. Согласно некоторым аспектам настоящего изобретения ИРТК, который применяют в способах лечения млекопитающего после прохождения медицинской процедуры для лечения ПКК, представляет собой сорафениб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой пазопаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой акситиниб. Согласно другому варианту реализации настоящего изобретения ИРТК представляет собой тивозаниб или вандетаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК, который применяют в способе, представляет собой агент, выбранный из: мотезаниба (AMG-706), ваталиниба (PTK787/ZK), самаксаниба (SU5416), SU6668, AZD 2171, XL 184, XL880/GSK1363089, PF-2351066, MGCD265, ZD6474, AEE788, AG-013736, AG-013737, GW786034 и ABT-869. Согласно следующим аспектам настоящего изобретения агент включает ИРТК, раскрытые в опубликованных заявках на международный патент №№ WO97/22596, WO 97/30035, WO 97/32856 или WO 98/13354.
[0173] Согласно дополнительным аспектам настоящее изобретение относится к способу лечения почечно-клеточной карциномы (ПКК) у млекопитающего после прохождения медицинской процедуры для лечения ПКК, причем указанный способ включает введение млекопитающему эффективного количества (1) ИРТК, (2) полипептида ALK1 ECD, такого как слитый белок ALK1-Fc или другой раскрытый антагонист ALK, и (3) ингибитора, мишенью которого является мишень рапамицина у млекопитающих (mTOR) рапамицина у млекопитающих (mTOR). Согласно некоторым аспектам настоящего изобретения ингибитор mTOR, который применяют в способах согласно настоящему изобретению, представляет собой эверолимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой темсиролимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384.
[0174] Согласно дополнительным аспектам настоящее изобретение относится к способу лечения ПКК у млекопитающего с ПКК после прохождения медицинской процедуры для лечения ПКК, причем почечно-клеточная карцинома (ПКК) представляет собой прозрачноклеточную почечно-клеточную карциному. Согласно некоторым аспектам настоящего изобретения ПКК представляет собой заболевание стадии III по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК представляет собой заболевание стадии IV по классификации TNM. Согласно дополнительным аспектам настоящего изобретения ПКК обнаружена во внутрипочечных венах. Согласно другим аспектам настоящего изобретения ПКК инвазировала почечный синус. Согласно следующим аспектам настоящего изобретения ПКК представляет собой метастазирующий почечно-клеточный рак. Согласно дополнительным аспектам настоящего изобретения ПКК метастазировала в надпочечники или в лимфатический узел. Согласно следующим аспектам настоящего изобретения ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
[0175] Согласно следующим аспектам настоящее изобретение направлено на способы лечения млекопитающего с метастазирующего ПКК. Согласно одному аспекту настоящее изобретение охватывает способ лечения метастазирующего ПКК, причем указанный способ включает введение млекопитающему эффективного количества агента, выбранного из: (а) полипептида ALK1, содержащего лиганд-связывающую часть внеклеточного домена ALK1; (Ь) антитела, которое связывается с внеклеточным доменом ALK1 человека; (с) антитела, которое связывается с ВМР9 человека; и (d) антитела, которое связывается с BMP10 человека. Согласно некоторым аспектам настоящего изобретения полипептид ALK1, который применяют в способе, содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности аминокислот 22-120 из SEQ ID NO: 1. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит константный домен иммуноглобулина. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит Fc-фрагмент иммуноглобулина и согласно дополнительным аспектам настоящего изобретения Fc-фрагмент представляет собой Fc-фрагмент IgGl человека. Согласно другим аспектам настоящего изобретения полипептид ALK1 содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 3 или SEQ ID NO: 14.
[0176] Согласно некоторым вариантам реализации настоящего изобретения антитело вводят для лечения млекопитающего с метастазирующей ПКК. Согласно дополнительным вариантам реализации настоящего изобретения введенное антитело связывается с эпитопом в последовательности аминокислот 22-118 из SEQ ID NO: 1 и ингибирует связывание лиганда, выбранного из GDF5, GDF6, GDF7, ВМР9 и BMP10. Согласно дополнительным аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-111 из SEQ ID NO: 12 и ингибирует связывание ВМР9 с рецептором. Согласно следующим аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-108 из SEQ ID NO: 13 и ингибирует связывание BMP10 с рецептором.
[0177] Согласно одному аспекту настоящее изобретение относится к способу лечения метастазирующего почечно-клеточной карциномы (ПКК) у млекопитающего, включающему введение млекопитающему, страдающему от метастазирующего ПКК, эффективного количества ИРТК и полипептида ALK1 ECD, такого как слитый белок ALK1-Fc или другой антагонист ALK, раскрытый в настоящей заявке. Согласно некоторым аспектам настоящего изобретения ИРТК представляет собой сунитиниб. Согласно другим вариантам реализации настоящего изобретения ИРТК представляет собой не сунитиниб. Согласно некоторым аспектам настоящего изобретения ИРТК представляет собой сорафениб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой пазопаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой акситиниб. Согласно другому варианту реализации настоящего изобретения ИРТК представляет собой тивозаниб или вандетаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой агент, выбранный из: мотезаниба (AMG-706), ваталиниба (PTK787/ZK), самаксаниба (SU5416), SU6668, AZD2171, XL184, XL880/GSK1363089, PF-2351066, MGCD265, ZD6474, АЕЕ788, AG-013736, AG-013737, GW786034 и АВТ-869. Согласно следующим аспектам настоящего изобретения агент включает ИРТК, раскрытые в опубликованных заявках на международный патент №№ WO 97/22596, WO 97/30035, WO 97/32856 или WO 98/13354.
[0178] Согласно некоторым аспектам настоящее изобретение направлено на способы лечения млекопитающего с метастазирующей ПКК, причем указанный способ включает введение млекопитающему эффективного количества (1) ИРТК, (2) полипептида ALK1 ECD, такого как слитый белок ALK1-Fc или другой раскрытый антагонист ALK, и (3) ингибитора ингибитора, мишенью которого является мишень рапамицина у млекопитающих (mTOR) рапамицина у млекопитающих (mTOR). Согласно некоторым аспектам настоящего изобретения ингибитор mTOR, который применяют в способах согласно настоящему изобретению, представляет собой эверолимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой темсиролимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384.
[0179] В настоящем изобретении также предложены способы ингибирования ангиогенеза у млекопитающего путем введения млекопитающему эффективного количества полипептида ALK1 ECD, такого как слитый белок ALK1-Fc, или другого «терапевтического агента» или «антагониста ALK1», раскрытого в настоящей заявке. Полагают, что данные терапевтические агенты можно также применять для ингибирования ангиогенеза в костях и суставах, а также в опухолях, в частности, в опухолях, ассоциированных с костями и суставами.
[0180] Заболевания, ассоциированные с ангиогенезом, включают, но не ограничиваются ими, ангиогенез-зависимый рак, в том числе, например, солидные опухоли, опухоли кровеносной системы, такие как лейкозы, и метастазы опухолей; доброкачественные опухоли, например, гемангиомы, нейромы слухового нерва, нейрофибромы, трахомы и пиогенные гранулемы; ревматоидный артрит; псориаз; рубеоз; синдром Ослера-Вебера; миокардиальный ангиогенез; неоваскуляризацию тромбоцитов; телеангиэктазию; гемофилические соединения и ангиофиброму.
[0181] В частности, терапевтические агенты - полипептиды согласно настоящему изобретению можно применять для лечения или предотвращения рака (опухоли) и, в частности, тех видов рака, о которых известно, что их рост поддерживается процессами ангиогенеза. В отличие от большинства антиангиогенных агентов полипептиды ALK1 ECD воздействуют на ангиогенез, стимулируемый множественными факторами. Это в высокой степени относится к тем видам рака, при которых рак часто сопровождается множественными факторами, которые поддерживают ангиогенез опухоли. Таким образом, терапевтические агенты, раскрытые в настоящей заявке, будут, в частности, эффективны для лечения опухолей, которые являются резистентными к лечению лекарственными препаратами, нацеленными на отдельные ангиогенные факторы (например, к лечению бевацизумабом, нацеленным на VEGF). Как продемонстрировано в настоящей заявке, слитый белок ALK1-Fc является эффективным для уменьшения патологических эффектов меланомы, рака легких и множественной миеломы. Множественная миелома широко известна в качестве рака, который включает значительный ангиогенную составляющую. Соответственно, предполагают, что слитые белки ALK1-Fc и другие терапевтические агенты, раскрытые в настоящей заявке, можно применять для лечения множественной миеломы и других опухолей, ассоциированных с костной тканью. Как продемонстрировано в настоящей заявке, терапевтические агенты, раскрытые в настоящей заявке, можно применять для устранения последствий повреждения кости, ассоциированного с множественной миеломой, и вследствие этого можно применять для устранения последствий повреждения кости, ассоциированного с костными метастазами других опухолей, таких как опухоли молочной железы и предстательной железы. Как отмечается в настоящей заявке, лиганды GDF5-7 интенсивно экспрессируются в кости, и, не желая ограничиваться каким-либо конкретным механизмом, можно предположить, что препятствование действию данных лигандов может нарушить процессы, необходимые для развития опухоли в кости.
[0182] Согласно некоторым аспектам настоящее изобретение направлено на способы ингибирования ангиогенеза у млекопитающего, находящегося в состоянии, при котором ингибирование ангиогенеза является желательным, причем указанный способ включает введение млекопитающему эффективного количества агента, выбранного из: (а) полипептида ALK1, содержащего лиганд-связывающую часть внеклеточного домена ALK1; (b) антитела, которое связывается с внеклеточным доменом ALK1 человека; (с) антитела, которое связывается с ВМР9 человека; и (d) антитела, которое связывается с BMP10 человека. Согласно некоторым аспектам настоящего изобретения полипептид ALK1, который применяют в способе, содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности аминокислот 22-120 из SEQ ID NO: 1. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит константный домен иммуноглобулина. Согласно следующим аспектам настоящего изобретения полипептид ALK1 дополнительно содержит Fc-фрагмент иммуноглобулина и согласно дополнительным аспектам настоящего изобретения Fc-фрагмент представляет собой Fc-фрагмент IgGl человека. Согласно другим аспектам настоящего изобретения полипептид ALK1 содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 3 или SEQ ID NO: 14.
[0183] Согласно некоторым вариантам реализации настоящего изобретения антитело вводят для ингибирования ангиогенеза у млекопитающего. Согласно дополнительным вариантам реализации настоящего изобретения введенное антитело связывается с эпитопом в последовательности аминокислот 22-118 из SEQ ID NO: 1 и ингибирует связывание лиганда, выбранного из GDF5, GDF6, GDF7, ВМР9 и BMP10. Согласно дополнительным аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-111 из SEQ ID NO: 12 и ингибирует связывание ВМР9 с рецептором. Согласно следующим аспектам настоящего изобретения антитело связывается с эпитопом в последовательности аминокислот 1-108 из SEQ ID NO: 13 и ингибирует связывание BMP10 с рецептором.
[0184] Согласно некоторым аспектам настоящего изобретения ИРТК вводят вместе с антагонистом ALK1, раскрытым в настоящей заявке, для ингибирования ангиогенеза у млекопитающего. Согласно некоторым аспектам настоящего изобретения ИРТК представляет собой сунитиниб. Согласно другим вариантам реализации настоящего изобретения ИРТК представляет собой не сунитиниб. Согласно некоторым аспектам настоящего изобретения ИРТК представляет собой сорафениб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой пазопаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК представляет собой акситиниб. Согласно другому варианту реализации настоящего изобретения ИРТК представляет собой тивозаниб или вандетаниб. Согласно дополнительным аспектам настоящего изобретения ИРТК выбирают из: мотезаниба (AMG-706), ваталиниба (PTK787/ZK), самаксаниба (SU5416), SU6668, AZD2171, XL 184, XL880/GSK1363089, PF-2351066, MGCD265, ZD6474, AEE788, AG-013736, AG-013737, GW786034 и ABT-869. Согласно следующим аспектам настоящего изобретения ИРТК раскрыт в опубликованных заявках на международный патент №№ WO 97/22596, WO 97/30035, WO 97/32856 или WO 98/13354.
[0185] Согласно некоторым аспектам настоящее изобретение направлено на способы ингибирования ангиогенеза, причем указанный способ включает введение млекопитающему эффективного количества (1) ИРТК, (2) полипептида ALK1 ECD, такого как слитый белок ALK1-Fc или другой раскрытый антагонист ALK, и (3) ингибитора ингибитора, мишенью которого является мишень рапамицина у млекопитающих (mTOR) рапамицина у млекопитающих (mTOR). Согласно некоторым аспектам настоящего изобретения ингибитор mTOR, который применяют в способах согласно настоящему изобретению, представляет собой эверолимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой темсиролимус. Согласно другим аспектам настоящего изобретения ингибитор mTOR представляет собой агент, выбранный из: WYE354, YE132 (Pfizer), РР30 и РР242, AZD8055, OSI-027, Torinl, BEZ235, XL765, GDC-0980, PF-04691502 и PF-05212384.
[0186] Согласно настоящему изобретению антиангиогенные агенты, описанные в настоящей заявке, можно применять в комбинации с другими композициями и процедурами для лечения заболеваний. Например, опухоль могут подвергать лечению общепринятым способом с помощью оперативного вмешательства, ионизирующего излучения или химиотерапии, объединенных с антагонистом ALK1 или лиганда ALK1, а в дальнейшем антагонист может быть введен пациенту для того, чтобы продлить состояние покоя микрометастазов и стабилизировать любую остаточную первичную опухоль.
[0187] Агенты, ингибирующие ангиогенез, можно также вводить профилактически тем индивидуумам, о которых известно, что они подвержены риску развития новых или рецидивирующих случаев рака. Соответственно, аспект настоящего изобретения охватывает способы для профилактического предотвращения рака у субъекта, включающие введение субъекту эффективного количества антагониста ALK1 или лиганда ALK1 и/или их производного, или другого агента согласно настоящему изобретению, ингибирующего ангиогенез.
[0188] Как продемонстрировано в настоящей заявке, ALK1-Fc эффективно ослабляет фенотип ревматоидного артрита на мышиной модели. Соответственно, терапевтические агенты, раскрытые в настоящей заявке, можно применять для лечения ревматоидного артрита и других типов воспаления костей и суставов.
[0189] С ангиогенезом также связан ряд нормальных физиологических процессов, например, овуляция, менструация и планцентация. Белки согласно настоящему изобретению, ингибирующие ангиогенез, можно применять для лечения заболевания, связанного с чрезмерной или аномальной стимуляцией эндотелиальных клеток. Данные заболевания включают, но не ограничиваются ими, спайки кишечника, атеросклероз, склеродерму и гипертрофические рубцы, т.е. келоиды. Их также можно применять для лечения заболеваний, при которых ангиогенез является патологическим последствием, таких как заболевание кошачьих царапин (Rochele minalia quintosa) и язва (Helicobacter pylori).
[0190] В общем виде белки, ингибирующие ангиогенез, можно применять в качестве агентов для контроля рождаемости путем уменьшения или предотвращения васкуляризации матки, необходимой для имплантации эмбриона. Таким образом, в настоящем изобретении предложен эффективный способ контроля рождаемости, при котором женщине вводят ингибирующий белок в количестве, достаточном для предотвращения имплантации эмбриона. Согласно одному аспекту способа контроля рождаемости количество ингибирующего белка, достаточное для блокирования имплантации эмбриона, вводят до или после полового контакта и оплодотворения; соответственно, предложен эффективный способ контроля рождаемости, возможно, способ, который можно применять «на следующее утро». Без желания связывать себя данным утверждением, считают, что ингибирование васкуляризации эндометрия матки препятствует имплантации бластоцисты. Подобное ингибирование васкуляризации слизистой оболочки фаллопиевых труб препятствует имплантации бластоцисты и предотвращает возникновение трубной беременности. Также считают, что введение агентов согласно настоящему изобретению, ингибирующих ангиогенез, будет препятствовать увеличению васкуляризации плаценты, наблюдаемому в норме, а также развитию кровеносных сосудов в успешно имплантированной бластоцисте и развитию эмбриона и плода.
[0191] Способы введения могут включать, но не ограничиваются ими, таблетки, инъекции (внутривенные, подкожные, внутримышечные), суппозитории, вагинальные губки, вагинальные тампоны и внутриматочные средства. Согласно некоторым вариантам реализации настоящего изобретения один или несколько терапевтических агентов могут быть введены вместе (одновременно) или в разное время (последовательно). Кроме того, терапевтические агенты могут быть введены вместе с другим типом соединения для лечения рака или для ингибирования ангиогенеза. Согласно некоторым вариантам реализации настоящего изобретения рассматриваемые способы согласно настоящему изобретению можно применять в отдельности. В качестве альтернативы рассматриваемые способы можно применять в комбинации с другим общепринятым противораковым терапевтическим подходом, направленным на лечение или предотвращение пролиферативных нарушений (например, опухоли). Например, такие способы можно применять для профилактического предупреждения рака, профилактики рецидивов рака и метастазов после хирургического вмешательства или в качестве вспомогательного средства другой общепринятой терапии рака. В настоящем тексте считается, что эффективность общепринятых вариантов терапии рака (например, химиотерапии, терапии на основе ионизирующего излучения, фототерапии, иммунотерапии и оперативного вмешательства) может быть увеличена за счет применения рассматриваемого терапевтического агента - полипептида.
[0192] Было показано, что широкий спектр обычных соединений обладает противоопухолевой активностью. Данные соединения применяют в качестве фармацевтических агентов в химиотерапии для уменьшения размера солидных опухолей, предотвращения образования метастазов и предотвращения дальнейшего роста или уменьшения количества злокачественных клеток в злокачественных образованиях при лейкозе или при возникновении злокачественных образований в костном мозге. Хотя химиотерапия эффективна для лечения различных типов злокачественных новообразований, многие противоопухолевые соединения вызывают нежелательные побочные действия. Было показано, что при комбинировании двух или более различных вариантов лечения средства лечения могут действовать синергитическим образом, что позволяет уменьшить дозу каждого варианта лечения и посредством этого уменьшить пагубные побочные действия, проявляемые каждым соединением в более высоких дозах. В других случаях злокачественные новообразования, которые не поддаются лечению, могут отвечать на комбинированную терапию двумя или более различными вариантами лечения.
[0193] Когда терапевтический агент - полипептид, раскрытый в настоящей заявке, вводят в комбинации с другим общепринятым противоопухолевым агентом параллельно либо последовательно, такой терапевтический агент может увеличить терапевтический эффект противоопухолевого агента или преодолеть клеточную резистентность к такому противоопухолевому агенту. Это позволяет уменьшить дозу противоопухолевого агента и посредством этого уменьшить нежелательные побочные действия или восстановить эффективность противоопухолевого агента в резистентных клетках.
[0194] Способы согласно настоящему изобретению также включают совместное введение с другими медицинскими средствами, которые применяют для лечения состояний в глазу. В случае введения более чем одного агента или комбинации агентов и медицинских средств введение можно осуществлять одновременно или последовательно во времени. Терапевтические агенты и/или медицинские средства могут быть введены различными путями введения или одним и тем же путем введения.
7. Лекарственные формы и эффективные дозы
[0195] Терапевтические агенты, описанные в настоящей заявке, могут быть приготовлены в виде фармацевтических композиций. Фармацевтические композиции для применения согласно настоящему изобретению могут быть приготовлены обычным способом с применением одного или нескольких физиологически приемлемых носителей или вспомогательных веществ. Такие лекарственные формы обычно по существу апирогенны, в соответствии с большинством регуляторных требований.
[0196] Согласно некоторым вариантам реализации настоящего изобретения терапевтический способ согласно настоящему изобретению включает введение композиции системно или местно в виде имплантата или устройства. При введении терапевтическая композиция для применения согласно настоящему изобретению находится в апирогенной физиологически приемлемой форме. Терапевтически применимые агенты, отличные от антагонистов передачи сигналов ALK1, которые в некоторых случаях также могут быть включены в композиции, описанные выше, могут вводиться одновременно или последовательно с рассматриваемыми соединениями (например, с полипептидами ALK1 ECD или любым антителом, раскрытым в настоящей заявке) согласно способам, раскрытым в настоящей заявке.
[0197] Как правило, терапевтические агенты - белки, раскрытые в настоящей заявке, вводят парентерально и, в частности, внутривенно или подкожно. Фармацевтические композиции, подходящие для парентерального введения, могут содержать один или несколько полипептидов ALK1 ECD или другие антитела в комбинации с одним или несколькими фармацевтически приемлемым стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями или стерильными порошками, которые можно восстановить в стерильных растворах или дисперсиях для инъекций непосредственно перед применением; указанные композиции также могут содержать антиоксиданты, буферы, бактериостатические средства, растворенные вещества, придающие композиции изотонические свойства по отношению к крови предполагаемого реципиента, или суспендирующие агенты или загустители. Примеры подходящих водных и неводных носителей, которые можно применять в фармацевтических композициях согласно настоящему изобретению, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное), а также их подходящие смеси, растительные масла, такие как оливковое масло, и органические сложные эфиры для инъекций, такие как этилолеат. Надлежащую текучесть можно обеспечивать, например, путем применения веществ, образующих покрытие, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий и путем применения поверхностно-активных веществ.
[0198] Композиции и составы могут, при необходимости, поставляться в пачке или в дозирующем устройстве, которые могут включать одну или несколько единиц дозированной формы, содержащих активный компонент. Пачка может, например, включать металлизированную или полимерную фольгу, такую как блистерная упаковка. Пачка или дозирующее устройство могут быть укомплектованы инструкциями по введению.
ПРИМЕРЫ
Пример 1. Экспрессия слитого белка ALK1-Fc
[0199] Авторами настоящего изобретения был сконструирован растворимый слитый белок ALK1, содержащий внеклеточный домен ALK1 человека, слитый с Fc человека, или содержащий ALK1 мыши, слитый с Fc-доменом мыши, между которыми был введен линкер минимального размера. Указанные конструкции обозначаются hALK1-Fc и mALK1-Fc, соответственно.
[0200] hALK1-Fc представлен на фигуре 3В в виде очищенного из клеточной линии СНО белка (SEQ ID NO: 14). В частности, хотя, как правило, С-концевой аминокислотой внеклеточного домена белка ALK1 человека является аминокислота 118 из SEQ ID NO: 1, авторами настоящего изобретения было установлено, что желательно избежать присутствия домена, который оканчивается остатком глутамина. Соответственно в часть SEQ ID NO: 14, которая происходит от ALK1 человека, были встроены два остатка с С-конца от Q118, лейцин и аланин. В настоящем изобретении вследствие этого предложены полипептиды ALK1 ECD (в том числе Fc-слитые белки), содержащие на С-конце последовательность, происходящую от ALK1, которая отличается от последней в пределах от 1 до 5 аминокислот выше (upstream) (113-117 по отношению к SEQ ID NO: 1) или ниже (downstream) (119-123) относительно Q118.
[0201] Белки hALK1-Fc и mALK1-Fc экспрессировали в клеточных линиях СНО. Использовали три различные лидерные последовательности:
(i) Мелитина пчелы (МЛП): MKFLVNVALVFMVVYISYIYA (SEQ ID NO: 7)
(ii) Активатора тканевого плазминогена (АТП): MDAMKRGLCCVLLLCGAVFVSP (SEQ ID NO: 8)
(iii) Нативную: MTLGSPRKGLLMLLMALVTQG (SEQ ID NO: 9).
[0202] Выбранная форма, полученная с использованием лидерной последовательности АТП, до осуществления процессинга имеет аминокислотную последовательность, представленную на фигуре 4 (SEQ ID NO: 5).
[0203] Данный полипептид кодируется последовательностью нуклеиновой кислоты, представленной на фигуре 4 (SEQ ID NO: 4).
[0204] Пептид очищают серией этапов колоночной хроматографии, включая, например, три или более следующих этапов, в любом порядке: хроматографию с белком А, хроматографию на Q-сефарозе, хроматографию на фенилсефарозе, эксклюзионную хроматографию и катионообменную хроматографию. Очистку можно завершить вирусной фильтрацией и сменой буфера. Белок hALK1-Fc очищали до степени чистоты более 98%, установленной методом эксклюзионной хроматографии, и до степени чистоты более 95%, установленной методом ДСН-ПААГ (электрофорез в полиакриламидном геле с додецилсульфатом натрия).
[0205] В ходе наработки и очистки белка авторы настоящего изобретения отметили, что hALK1-Fc имеет тенденцию экспрессироваться в форме смеси димеров и агрегатов более высокого порядка, введение которых пациенту является затруднительным, хотя они и кажутся чистыми по результатам анализа в денатурирующих восстанавливающих условиях (например, анализа методом ДСН-ПААГ в редуцирующих условиях). Агрегаты могут быть иммуногенными или иметь низкую биодоступность; вследствие своей гетерогенности агрегаты затрудняют характеризацию фармацевтических препаратов на том уровне, который необходим для разработки лекарственных препаратов. Соответственно, были исследованы различные подходы для уменьшения количества агрегатов в конечных препаратах.
[0206] В одном подходе исследовали различные среды для культивирования клеток. Применение среды IS CHO-CD (кат. № 91119, Irvine Scientific, Санта-Ана, Калифорния) привело к заметному уменьшению образования агрегигованных продуктов, при этом поддерживался высокий уровень образования hALK1-Fc. Кроме того, элюирование материала с колонки для хроматографии на основе гидрофобного взаимодействия (например, фенилсефарозной) при рН 8,0 приводило к дополнительному разделению агрегированного продукта. Полученный в результате материал содержал более 99% димеров. Сравнение со слитым белком ALK1-Fc, продаваемым R&D Systems (кат. № 370-AL, Миннеаполис, Миннесота), показало, что данный белок, продуцируемый в клетках NSO, содержит 84% димеров, а в остальном состоит из белка, который, согласно результатам анализа методом эксклюзионной хроматографии, представляет собой высокомолекулярную фракцию. Сравнение хроматограмм препаратов представлено на фигуре 11. После обнаружения того, что образование агрегатов представляет собой значительную проблему при продукции ALK1-Fc, предполагают, что можно разработать другие подходы, в том числе подходы, включающие дополнительные этапы очистки (хотя такие подходы могут приводить к меньшему выходу очищенного белка).
Пример 2. Обнаружение лигандов ALK1-Fc
[0207] ALK1 представляет собой рецептор типа 1 для лигандов семейства TGF|3. Связывание со слитым белком человека ALK1-Fc многочисленных членов семейства TGFP исследовали с применением системы BiacoreTM. TGFP сам по себе, а также GDF8, GDF11, ВМР2 и ВМР4 не продемонстрировали существенного связывания с белком hALK1-Fc, тогда как ВМР2 и ВМР4 продемонстрировали только ограниченное связывание. Напротив, GDF5 и GDF7 демонстрировали значительное связывание со значениями KD, составляющими в обоих случаях приблизительно 5 х 10-8 М. На основании структурного подобия GDF5 и GDF7 с GDF6 предполагают, что GDF6 будет связываться со слитым белком с подобным значением аффинности. Наибольшая аффинность связывания с hALK1-Fc наблюдалась для ВМР9 - со значениями KD, составляющими от 1 х 10-10 до 2 х 10-9, и для BMP10 со значением KD, составляющим приблизительно 3 х 10-9.
Пример 3. Характеристика влияния ALK1-Fc и антитела против ALK1 на эндотелиальные клетки
[0208] С применением люциферазной репортерной конструкции под контролем четырех последовательных консенсусных участков SBE (SBE4-luc), которые отвечают на Smad 1, 5, 8 -опосредованную передачу сигналов, авторы настоящего изобретения измеряли величину активности, опосредованной ВМР-9, в присутствии и в отсутствии препарата hALK1-Fc или нейтрализующего ALK1 специфического моноклонального антитела, на клетках HMVEC. Клетки HMVEC стимулировали rhBMP-9 (50 нг/мл), который вызывал индукцию Smad 1, 5, 8-опосредованной активации транскрипции, что в данном случае доказывали увеличением положительной регуляции транскрипции, модулированной SBE4-luc. Прибавление соединения hALK1-Fc (10 мкг/мл) или антитела (10 мкг/мл) вызывало уменьшение данного транскрипционного ответа на приблизительно 60% каждое; это свидетельствует, что присутствие ALK1-Fc вызывает значительное уменьшение передачи сигналов с участием ВМР9 и, более того, что передача сигналов с участием ВМР9 связана с активностью ALK1.
[0209] Активация фосфорилирования SMAD широко используется для анализа активации вышестоящих рецепторов активина. Известно, что ALK1 после активации лигандом модулирует фосфорилирование белков SMAD 1, 5 и 8. В данном случае авторы настоящего изобретения прибавляли rhBMP-9 (50 нг/мл) для инициации фосфорилирования SMAD в клетках HUVEC, клеточной линии эндотелия человека, которая в норме экспрессирует рецептор ALK1, в течение периода воздействия 30 минут. Фосфорилирование SMAD 1, 5, 8 наблюдалось через 5 минут после обработки клеток лигандом; фосфорилирование поддерживалось в течение всей протяженности 30-минутного периода воздействия. В присутствии относительно низких концентраций hALK1-Fc (250 нг/мл) фосфорилирование SMAD 1, 5, 8 было снижено; это подтверждает, что данный агент ингибирует активацию Smad 1, 5, 8 в эндотелиальных клетках.
[0210] С целью оценки ангиогенного действия ALK1-Fc в системе in vitro авторы настоящего изобретения исследовали эффективность соединения для уменьшения образования трубочек в эндотелиальных клетках на субстрате Matrigel. Данная методика широко применяется для достижения неоваскуляризации и позволяет быстро получать хорошо воспроизводимые результаты. Добавку для роста эндотелиальных клеток (ECGS) используют для индукции образования микрососудов из эндотелиальных клеток на субстрате Matrigel, после чего рассчитывают эффективность антиангиогенных соединений, исходя из уменьшения образования трубочек в присутствии как препарата, так и ECGS, в течение 18-часового периода воздействия. Как и ожидалось, добавление ECGS (200 нг/мл) вызывало значительное образование трубочек по сравнению с отрицательным контролем (без добавления соединения), который иллюстрирует базальный уровень образования трубочек эндотелиальных клеток на субстрате Matrigel (Фиг. 5). В результате прибавления hALK1-Fc (100 нг/мл) или mALK1-Fc (100 нг/мл) образование трубочек заметно уменьшалось. Итоговый подсчет длины кровеносных сосудов во всех образцах показал, что каждая концентрация hALK1-fc или mALK1-Fc приводила к уменьшению неоваскуляризации до базального уровня. Кроме того, hALK1-Fc и mALK1-Fc в присутствии мощного проангиогенного фактора ECGS поддерживали существенное ингибирование неоваскуляризации и демонстрировали даже более сильную антиангиогенную активность, чем положительный контроль - эндостатин (100 нг/мл).
Пример 4. Анализы на ХАО
[0211] VEGF и FGF являются хорошо известными стимуляторами ангиогенеза. Систему анализа на ХАО (хориоаллантоисная оболочка цыпленка) использовали для оценки ангиогенного действия GDF7. Как показано на фигуре 6, GDF7 стимулирует ангиогенез в той же степени, что и VEGF. Подобные результаты наблюдали для GDF5 и GDF6.
[0212] Антиангиогенную активность слитых белков ALK1-Fc изучали в анализе на ХАО. Данные слитые белки продемонстрировали мощное антиангиогенное действие на ангиогенез, стимулируемый VEGF, FGF и GDF7, см. фигуру 7. ВМР9 и PDGF в данном анализе продемонстрировали относительно низкую способность индуцировать ангиогенез, однако, несмотря на это, ALK1 ингибировал такое ангиогенное действие данных факторов.
[0213] Проводили сравнение белков ALK1-Fc и коммерчески доступного антиангиогенного моноклонального антитела против VEGF в анализе на ХАО. Белки ALK1-Fc продемонстрировали эффективность, близкую к эффективности антитела против VEGF. Антитело против VEGF - бевацизумаб в настоящий момент применяется для лечения рака и макулярной дистрофии у людей. См. фигуру 8.
[0214] Примечательно, что антитело против ALK1 (R&D Systems) в данной системе анализа не вызывало значительного ингибирования ангиогенеза. Авторы настоящего изобретения предполагают, что это может отражать различия в последовательности ALK1 разных видов.
Пример 5. Анализ микрокармана роговицы мыши
[0215] Анализ микрокармана роговицы мыши применяли для оценки влияния ALK1-Fc на ангиогенез в глазу мыши. hALK1-Fc при интраперитонеальном введении вызывал значительное ингибирование окулярного ангиогенеза. Как показано на фигуре 9, hALK1-Fc вызывал ингибирование окулярного ангиогенеза в той же степени, что и антитело против VEGF. hALK1-Fc и антитело против VEGF применяли в идентичных дозах (по массе). Подобные данные были получены и при имплантации пробки из субстрата Matrigel, пропитанной VEGF, в область тела животного, отличную от глаза.
[0216] Указанные данные свидетельствуют, что высокоаффинные лиганды для ALK1 способствуют ангиогенезу и что слитый белок ALK1-Fc обладает мощной антиангиогенной активностью. Лиганды ALK1 подразделяют на две категории, группу GDF 5, 6, 7, которая обладает средней аффинностью к ALK1, и группу ВМР9, 10, которая обладает высокой аффинностью к ALK1.
[0217] GDF 5, 6 и 7 преимущественно локализованы в костях и суставах, тогда как ВМР9 циркулирует в крови. Таким образом, по-видимому, существует проангиогенная система костей и суставов, которая включает ALK1, GDF5, 6 и 7, и системная ангиогенная система, которая включает ALK1 и ВМР9 (и возможно BMP10).
Пример 6. Модель ревматоидного артрита на мышах
[0218] Мышиная модель коллаген-индуцированного артрита является хорошо зарекомендовавшей себя моделью ревматоидного артрита. В данном исследовании группам из 10 мышей вводили наполнитель, антитело против VEGF (бевацизумаб в качестве отрицательного контроля, поскольку бевацизумаб не ингибирует VEGF мыши) или дозы mALK1-Fc («RAP-041»), составляющие 1 мг/кг, 10 мг/кг или 25 мг/кг. На день 21 после введения коллагена как артритные показатели (см. фигуру 10), так и степень припухлости лап были устойчиво увеличены во всех группах; их максимальное значение наблюдалось приблизительно в день 38. У мышей, которые получали терапию mALK1-Fc («RAP-041»), величина данных показателей по обеим характеристикам была меньшей, в частности, при наиболее высокой дозе (25 мг/кг), хотя уменьшение не достигало уровня статистической значимости. Тем не менее, дозозависимая тенденция является очевидной.
[0219] После окончания исследования в день 42 частота возникновения заболевания артритом достигла 10/10 в группе мышей, которые получали контроль (наполнитель), 9/10 в группе мышей, которые получали бевацизумаб, 8/10 в группе мышей, которые получали mALK1-Fc в дозе 1 мг/кг, и 9/10 в группе мышей, которые получали mALK1-Fc в дозе 10 мг/кг. В группе мышей, которые получали mALK1-Fc в дозе 25 мг/кг, частота возникновения заболевания была менее 6/10.
Пример 7. ALK1-Fc уменьшает ангиогенез опухоли в анализе на ХАО
[0220] Опухоли, как и любая другая ткань, обладают основной потребностью в питательных веществах и кислороде. Хотя небольшие опухоли способны получать необходимые количества данных веществ за счет диффузии из соседних кровеносных сосудов, по мере того как опухоль увеличивается в размере, ей необходимо обеспечивать себя питательными веществами путем привлечения и поддержания существующих капилляров. Для изучения способности белков ALK1-Fc ограничивать рост опухоли за счет ингибирования роста кровеносных сосудов авторы настоящего изобретения исследовали различные концентрации mALK1-Fc в анализе эксплантатов меланомы на ХАО. Как и при вариантах анализа на ХАО, описанных выше, в поверхности каждого яйца были проделаны небольшие отверстия, сквозь которые имплантировали 5 х 105 клеток меланомы В16. Затем яйца ежедневно в течение недели обрабатывали 0,02 мг/мл mALK1-Fc, 0,2 мг/мл mALK1-Fc или оставляли необработанными. По окончании эксперимента опухоли осторожно удаляли, взвешивали и фотографировали, получая их цифровые изображения. Было продемонстрировано, что размер опухолей, происходящих из ХАО, которые обрабатывали mALK1-Fc, был значительно меньше размера необработанных опухолей ХАО. Подсчет массы опухоли продемонстрировал, что масса опухоли, которую обрабатывали ежедневно 0,02 мг/мл или 0,2 мг/мл mALK1-Fc, была меньше на 65% и 85% по сравнению с опухолями их необработанных ХАО (Фиг. 6Е). В заключение, введение ALK1-Fc вызывало значительное ингибирование неоваскуляризации и роста опухоли дозозависимым образом; это свидетельствует, что ALK1-Fc представляет собой мощный антиангиогенный агент.
Пример 8. Экспериментальная модель рака легких
[0221] Чтобы дополнительно подтвердить влияние ALK1-Fc на прогрессию опухоли, изучали модель рака легких на мышах. Флуоресцентно меченные мышиные клетки рака легких Льюиса (LL/2-luc) вводили в хвостовую вену мышам albino Black 6. В тот же день начинали интраперитонеальное введение мышам либо ФБР (фосфатного буферного раствора) в качестве контроля (n=7), либо 10 мг/кг mALK1-Fc (n=7). С помощью прижизненной флуоресцентной визуализации было продемонстрировано существенное развитие опухолей, локализованных в легких, у контрольных мышей, до момента, когда у мышей началась агония, и исследователи были вынуждены их умертвить на день 22 после имплантации. В противоположность этому у мышей, которым вводили ALK1-Fc, наблюдался существенно замедленный рост опухолей легких и 100% выживаемость по данным на день 22. См. фигуру 12.
[0222] Данные результаты указывают на то, что ALK1-Fc оказывает существенное действие на рост опухоли на мышиной модели рака легких и позволяет получить преимущество выживаемости.
Пример 9. ВМР9 и антитела против ВМР9: влияние на ангиогенез
[0223] Систему анализа на ХАО (хориоаллантоисная оболочка цыпленка) применяли для оценки ангиогенного действия рекомбинантного ВМР9 человека (rhB9) и моноклонального антитела против ВМР9 (mabB9) (R&D Systems, Миннеаполис, Миннесота, кат. № МАВ3209). Известно, что данное антитело нейтрализует передачу сигналов с участием BMP9/ALK1. См., например, Scharpfenecker et al., J Cell Sci. 2007 Mar 15; 120(Pt 6): 964-72; David et al., (2007); Blood Mar 1; 109(5): 1953-61; David et al., Circ. Res. 2008 Apr 25; 102(8): 914-22.
[0224] Ни BMP9, ни антитело против ВМР9 не оказывали существенного влияния на ангиогенез при отсутствии экзогенного VEGF, вероятно, поскольку недостаточность ангиогенеза при отсутствии экзогенного VEGF вызывает увеличение чувствительности анализа. См. фигуру 13, колонки справа. При отсутствии VEGF оба белка применяли в дозе 50 нг 1 раз в день в дни 1 и 3 в течение 5-дневного цикла. Однако в присутствии VEGF как ВМР9, так и антитело против него оказывали существенное антиангиогенное действие, см. фигуру 13. Эти результаты согласуются с данными Scharpfenecker с соавт. в отношении ВМР9 и VEGF в комбинации, а также согласуются с заключениями Scharpfenecker с соавт. и David с соавт. в отношении антиангиогенного действия ВМР9 отдельно. Однако действие антитела против ВМР9 заметно отличается от результатов, описанных в литературе. На основании этих данных авторы настоящего изобретения высказали гипотезу, что оптимальные, или физиологические концентрации ВМР9 могут быть необходимы для надлежащего протекания ангиогенеза, и что избыток либо недостаток ВМР9 1 ингибируют ангиогенез.
[0225] Примечательно, что имеющиеся данные относительно действия антитела против ВМР9 хорошо согласуются с результатами, представленными в настоящей заявке, демонстрирующими, что ALK1-Fc (который является альтернативным агонистом ВМР9) также ингибирует ангиогенез. Таким образом, эти данные демонстрируют, что как ALK1-Fc, так и антитело против ВМР9 обладает антиангиогенным действием и что антитело против ВМР9, вероятно, можно применять для лечения нарушений ангиогенеза, таких как опухоли, ревматоидный артрит и окулярные нарушения, тем же образом, что и ALK1-Fc.
[0226] Принимая во внимание антиангиогенную активность антитела МАВ3209, авторы настоящего изобретения высказали предположение, что данное мышиное моноклональное антитело можно гуманизировать для получения терапевтического агента для применения у людей. Антитело можно гуманизировать с помощью ряда принятых в данной области техники методик, в том числе химеризации, трансплантации CDR, ремоделирования поверхности, обратных мутаций, супергуманизации, оптимизации содержания участков последовательности человека (human string content) и эмпирических способов, таких как создание и селекция FR-библиотек (библиотек каркасной области), перетасовка каркасных областей и использование способа Humaneering. См., например, публикацию Almagro and Fransson, Frontiers in Biosciences, 13: 1619-1633, 2008.
Пример 10. Влияние слитого белка ALK1-Fc на опухолевые модели рака молочной железы
[0227] mALK1-Fc эффективно замедлял рост опухолевых клеточных линий рака молочной железы, происходящих как от эстроген-рецептор положительных (ER+), так и от эстроген-рецептор отрицательных опухолевых клеток (ER-).
[0228] Клеточную линию рака молочной железы MDA-MB-231 (происходящую из ER-клеток) стабильно трансфицировали геном люциферазы для обнаружения роста опухоли и потенциального образования метастазов in vivo. В данном исследовании 1 х 106 клеток MDA-MB-231-Luc были имплантированы ортопикально в жировое тело молочной железы бестимусных мышей, мутантных по гену nude (Harlan). Прогрессию опухоли отслеживали с помощью биолюминисцентной визуализации с применением системы визуализации IVIS Spectrum (Caliper Life Sciences). Степень увеличения люминисценции (количество зарегистрированных фотонов) соответствует степени увеличения массы опухоли.
[0229] Тридцати самкам мышей nude в жировое тело молочной железы вводили 1 х 106 клеток опухоли. Через три дня после имплантации опухоли мышам вводили наполнитель в качестве контроля либо mALK1-Fc (30 мг/кг) дважды в неделю путем подкожной (ПК) инъекции. Продолжали лечение и отслеживали прогрессию опухоли методом биолюминисцентной визуализации в течение 10 недель. Введение mALK1-Fc в дозе 30 мг/кг вызывало замедление прогрессии опухоли, что определяли методом биолюминисцентной визуализации, по сравнению с контролями, которые подвергали обработке наполнителем (фигура 14). Обработка mALK1-Fc вызывала замедление, но не вызывала обратного развития роста опухоли в данной модели. Можно предположить, что данные опухоли после введения антиангиогенного соединения способны выживать и достигать определенного размера до того момента, когда им будет необходимо образование новых кровеносных сосудов для поддержания продолжающегося роста. В подобном эксперименте hALK1-Fc оказывал подобное либо слегка меньшее действие в дозах менее 3 мг/кг.
[0230] Эстроген-рецептор положительную (ER+) клеточную линию MCF-7, экспрессирующую люциферазу, также исследовали на модели ортотопической имплантации. В данной модели самкам мышей nude имплантировали подкожно гранулу 17β-эстрадиола с 60-дневным замедленным высвобождением. Через два дня после имплантации гранулы в жировое тело молочной железы имплантировали 5 х 106 опухолевых клеток MCF-7. Мышей подвергали терапии hALK1-Fc два раза в неделю в дозах 3, 10 и 30 мг/кг или наполнителем в качестве контроля, интраперитонеальным путем. Прогрессию опухоли отслеживали еженедельно методом биолюминисцентной визуализации с помощью аппарата для визуализации IVIS-Spectrum imager (Caliper Life Sciences). Опухоли у мышей, которые получали наполнитель, быстро прогрессировали до дня исследования 26 (фигура 15). После дня 26 наблюдались колебания в люминесценции опухоли до окончания исследования в день 60 (когда гранулы эстрадиола были исчерпаны). Данные колебания были обусловлены особенностью данной модели, заключающейся в том, что быстрый рост опухоли может увеличить ангиогенный ответ животного хозяина и привести к некрозу опухоли и сопутствующему «возврату» люминисцентного сигнала. Оставшиеся клетки продолжают расти, что приводит к увеличению сигнала. Размер опухоли у мышей, которые получали 10 или 30 мг/кг hALK1-Fc, в течение исследования поддерживался на постоянном уровне по сравнению с контрольными мышами, которым вводили наполнитель, что свидетельствует о мощном действии данной молекулы на рост опухоли.
Пример И. Ингибирование hALK1-Fc передачи сигналов с участием BMP10 в клеточном анализе
[0231] Влияние hALK-Fc на передачу сигналов с участием BMP10 определяли в клеточном анализе, в котором клетки глиобластомы T98G человека трансфицировали тремя плазмидами: 1) экспрессирующей конструкцией, кодирующей полноразмерные ALK1; 2) репортерной конструкцией люциферазы светлячка, отвечающей на Smad 1, 5, 8-посредованную передачу сигналов (см. пример 3), и 3) конструкцией люциферазы Renilla в качестве контроля. Обработка трансфицированных клеток рекомбинантным BMP10 человека (1 нг/мл) эффективно стимулировала активность люциферазы светлячка по сравнению с активностью люциферазы Renilla (фигура 16). Устранение ALK1-экспрессирующей конструкции вызывало уменьшение активности, стимулированной BMP10, приблизительно на две трети (данные не показаны), что указывает на ALK1 как на основной медиатор передачи сигналов с участием BMP10. Обработка полностью трансфицированных клеток hALK1-Fc (65 нг/мл) и BMP10 (1 нг/мл) вызывала уменьшение транскрипционного ответа по сравнению с обработкой одним BMP 10 на более чем 80% (фигура 16). Взятые в совокупности, данные результаты свидетельствуют, что ALK1 является главным медиатором передачи сигналов с участием BMP10 и что ALK1-Fc может значительно ингибировать такую передачу сигналов.
Пример 13. ALK-Fc увеличивает активность сунитиниба в модели с ксенотрансплантатом опухоли 786-O
[0232] Клетки 786-О, клеточная линия фон Гиппеля-Линдау (УНЕ)-дефицитного почечно-клеточной карциномы человека (ПКК) (см. публикацию Iliopoulos et al, Nature Medicine 1995; 1: 822-6), были получены в Американской коллекции типовых культур. Клетки культивировали в среде RPMI 1640 (Cellgro). В среду прибавляли 2 ммоль/л L-глутамина, 10% ЭТС (эмбриональная телячья сыворотка) и 1% стрептомицин (50 мкг/мл). Клетки культивировали при температуре 37°С в атмосфере, содержащей 5% CO2. Клетки 786-О собирали от субконфлюэнтных культур путем кратковременного воздействия 0,25% трипсином и 0,02% EDTA. Трипсинизацию останавливали внесением среды, содержащей 10% эмбриональную телячью сыворотку; клетки промывали один раз в бессывороточной среде и суспендировали в ФБР. Для инъекций использовали исключительно суспензии, состоящие из отдельных клеток, жизнеспособность которых составляла более 90%.
[0233] Чтобы получит ксенотрансплантанты ПКК человека, клетки опухоли 786-О вводили подкожной инъекцией (1 х 107 клеток) в подвздошную область самок бестимусных мышей мутантных по гену nude/beige, в возрасте 6-8-недель (Charles River Laboratories), средняя масса тела которых составляла 20 г. Опухоли развивались у более 80% мышей и были, как правило, визуально заметны через несколько дней после имплантации. Мышей подвергали лечению наполнителем вместе с Fc, сунитинибом вместе с Fc, наполнителем вместе с ALK-Fc или сунитинибом вместе с ALK-Fc, когда опухоли достигали диаметра 12 мм. Сунитиниб (53,6 мг/кг; Pfizer) вводили 6 из 7 дней в неделю вместе с принудительным питанием. ALK1-Fc (10 мг/кг) вводили 3 раза в неделю интраперитонеально. Размер опухоли измеряли через день на протяжении лечения мышей.
[0234] Как показано на фигуре 18, лечение сунитинибом вместе с Fc вызывало замедление роста опухоли на ксенотрансплантантной модели мыши-человека 786-О. Данное действие было даже усилено, когда опухоли подвергали лечению сунитинибом вместе с ALK-Fc, что свидетельствует о том, что ALK-Fc вызывает усиление активности сунитиниба по ингибированию роста опухоли на модели прозрачноклеточного почечно-клеточной карциномы.
Пример 14. ALK-Fc обладает активностью агента для монотерапии на ксенотрансплантантной модели опухоли А498
[0235] Клетки А498, клеточная линия VHL-дефицитного ПКК человека (см. публикацию Iliopoulos et al., Nature Medicine 1995; 1: 822-6), были получены в Американской коллекции типовых культур. Клетки культивировали в минимальной поддерживающей среде Игла. В среду прибавляли 2 ммоль/л L-глутамина, 10% ЭТС и 1% стрептомицин (50 мкг/мл). Клетки культивировали при температуре 37°С в атмосфере, содержащей 5% CO2. Клетки А498 собирали от субконфлюэнтных культур путем кратковременного воздействия 0,25% трипсином и 0,02% EDTA. Трипсинизацию останавливали внесением среды, содержащей 10% эмбриональную телячью сыворотку; клетки промывали один раз в бессывороточной среде и суспендировали в ФБР. Для инъекций использовали исключительно суспензии, состоящие из отдельных клеток, жизнеспособность которых составляла более 90%.
[0236] Для создания ксенотрансплантантов ПКК человека клетки опухоли А498 вводили подкожной инъекцией (1 х 107 клеток) в подвздошье самок бестимусных мышей, мутантных по гену nude/beige, возрастом 6-8-недель (Charles River Laboratories), средняя масса тела которых составляла 20 г. Опухоли развивались у более 80% мышей и были, как правило, визуально заметными через несколько дней после имплантации. Мышей подвергали лечению Fc или ALK-Fc, когда опухоли достигали диаметра 12 мм. ALK1-Fc (10 мг/кг) вводили 3 раза в неделю интраперитонеально. Размер опухоли измеряли через день, пока мышей подвергали лечению.
[0237] Как показано на фигуре 19, ALK-Fc обладает активностью агента для монотерапии при лечении ALK-Fc в отдельности и вызывает существенное замедление роста опухоли на клетках А498 на ксенотрансплантантной модели мыши-человека.
Пример 15. ALK-Fc также вызывает увеличение активности сунитиниба на ксенотрансплантантной модели опухоли А498
[0238] Культуру клеток А498 и ксенотрансплантант получали, как описано в примере 14. Мышей подвергали лечению наполнителем вместе с Fc, сунитинибом вместе с Fc, наполнителем вместе с ALK-Fc или сунитинибом вместе с ALK-Fc, когда опухоли достигали диаметра 12 мм. Сунитиниб (53,6 мг/кг; Pfizer) вводили 6 из 7 дней в неделю вместе с принудительным питанием. ALK1-Fc (10 мг/кг) вводили 3 раза в неделю интраперитонеально. Размер опухоли измеряли ежедневно, пока мышей подвергали лечению.
[0239] Как показано на фигуре 20, лечение сунитинибом вместе с Fc или наполнителем вместе с ALK-Fc вызывало замедление роста опухоли на ксенотрансплантантной модели опухоли А498. Однако при введении в комбинации слитый белок ALK-Fc по существу увеличивал активность сунитиниба по ингибированию роста опухоли в отношении роста опухоли А498.
ВКЛЮЧЕНИЕ СВЕДЕНИЙ ПОСРЕДСТВОМ ССЫЛКИ
[0240] Все публикации и патенты, упоминаемые в настоящем тексте, включены в него посредством ссылки во всей своей полноте так, как если бы каждая отдельная публикация или патент были конкретно и отдельно указаны как включенные посредством ссылки. В случае несоответствия настоящий текст, включая любые приведенные в нем определения, является приоритетным.
ЭКВИВАЛЕНТЫ
[0241] Хотя конкретные варианты реализации рассматриваемых изобретений в явном виде раскрыты выше в настоящем тексте, данное описание является иллюстративным, а не ограничительным. Ряд вариаций настоящего изобретения будет очевидным специалисту в данной области техники после ознакомления с данным описанием и формулой изобретения, представленной ниже. Полный объем настоящего изобретения определяется формулой изобретения, вместе с полным объемом ее эквивалентов, и описанием, вместе с такими изменениями.




















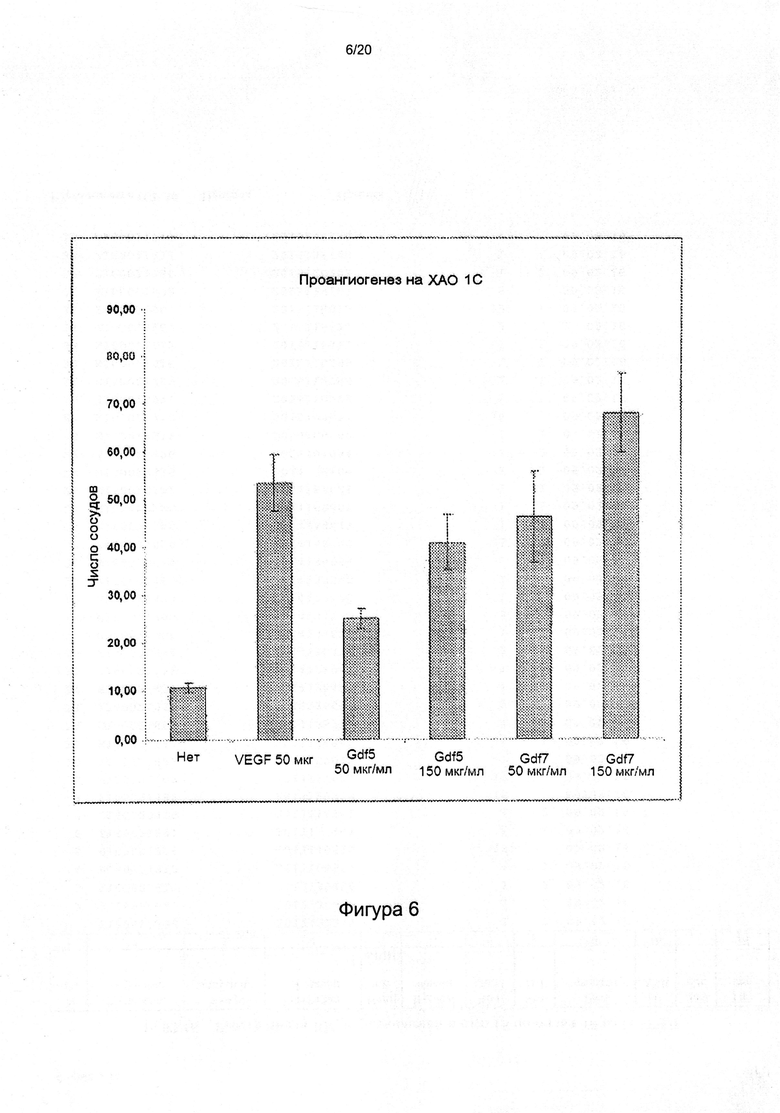
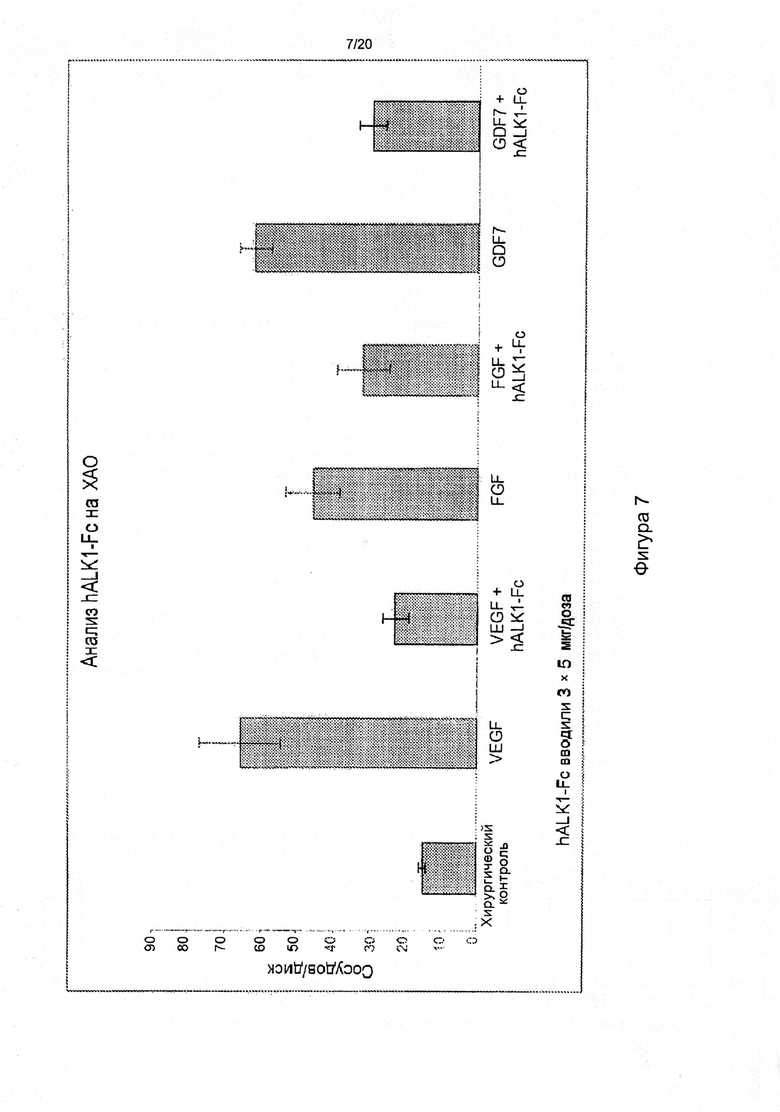

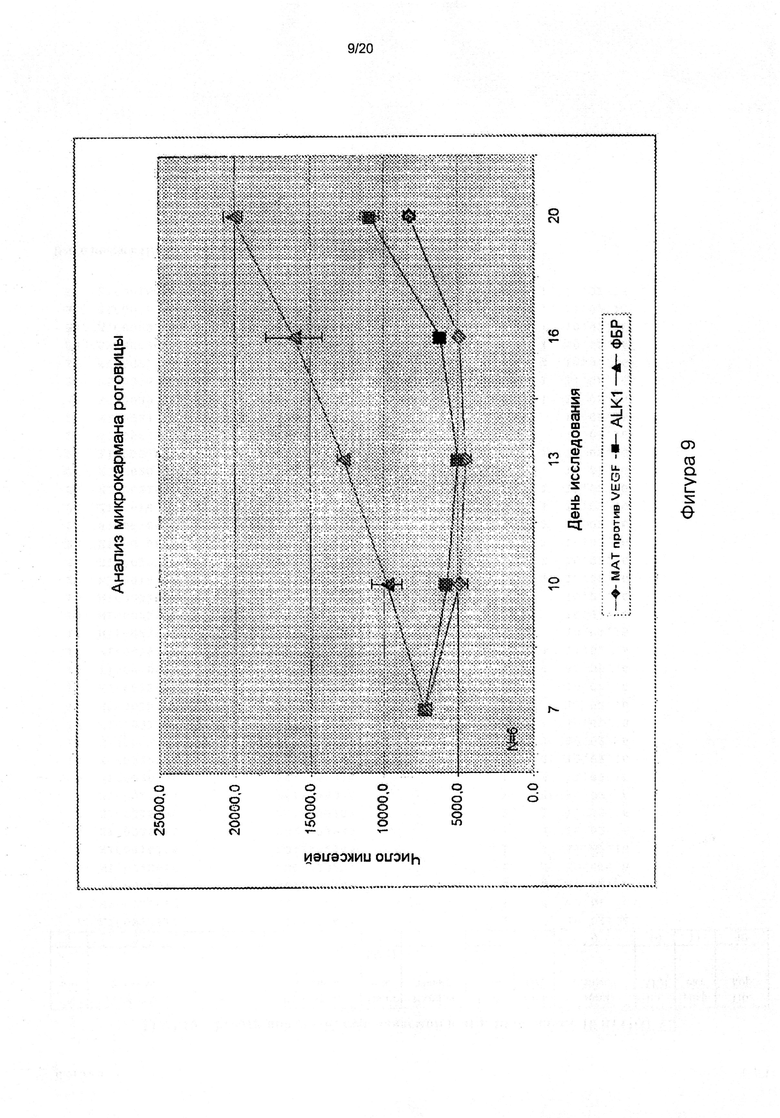


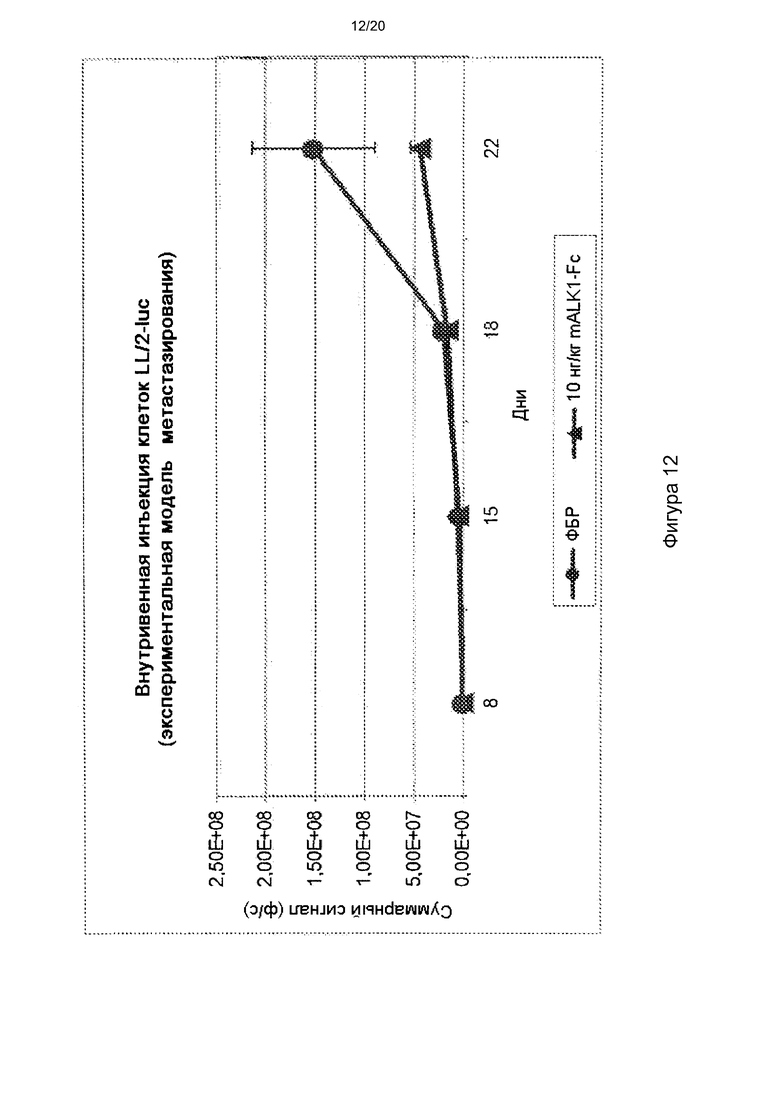
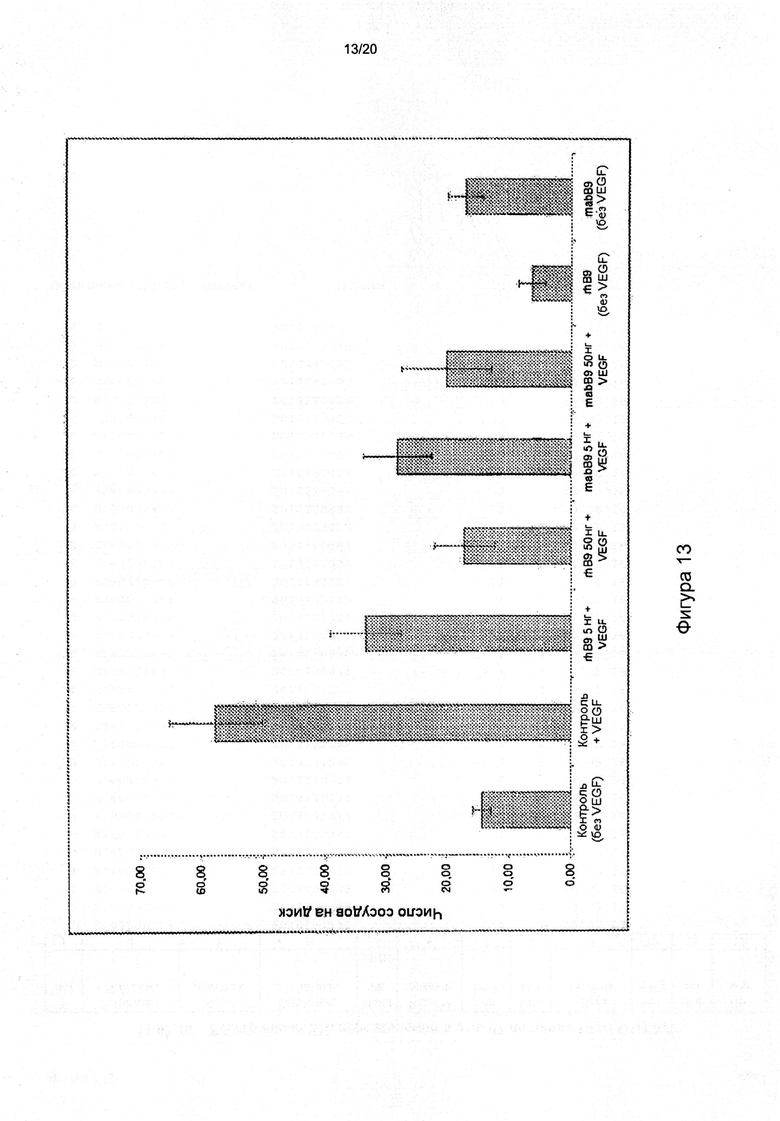
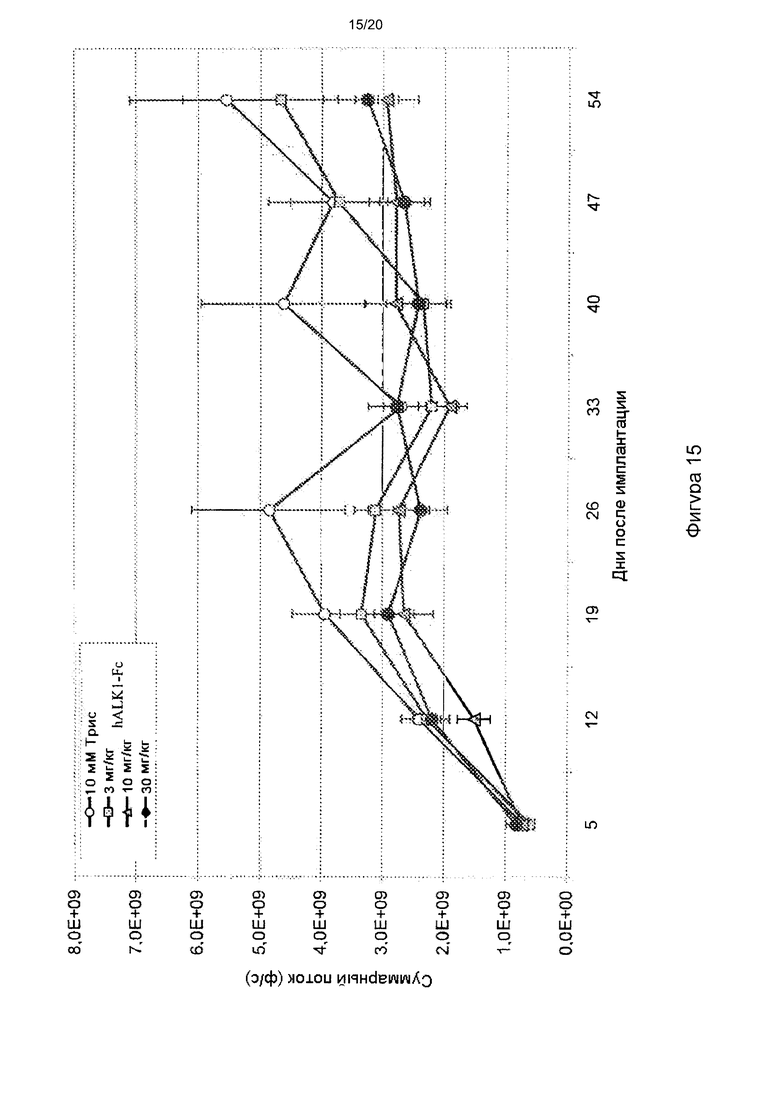
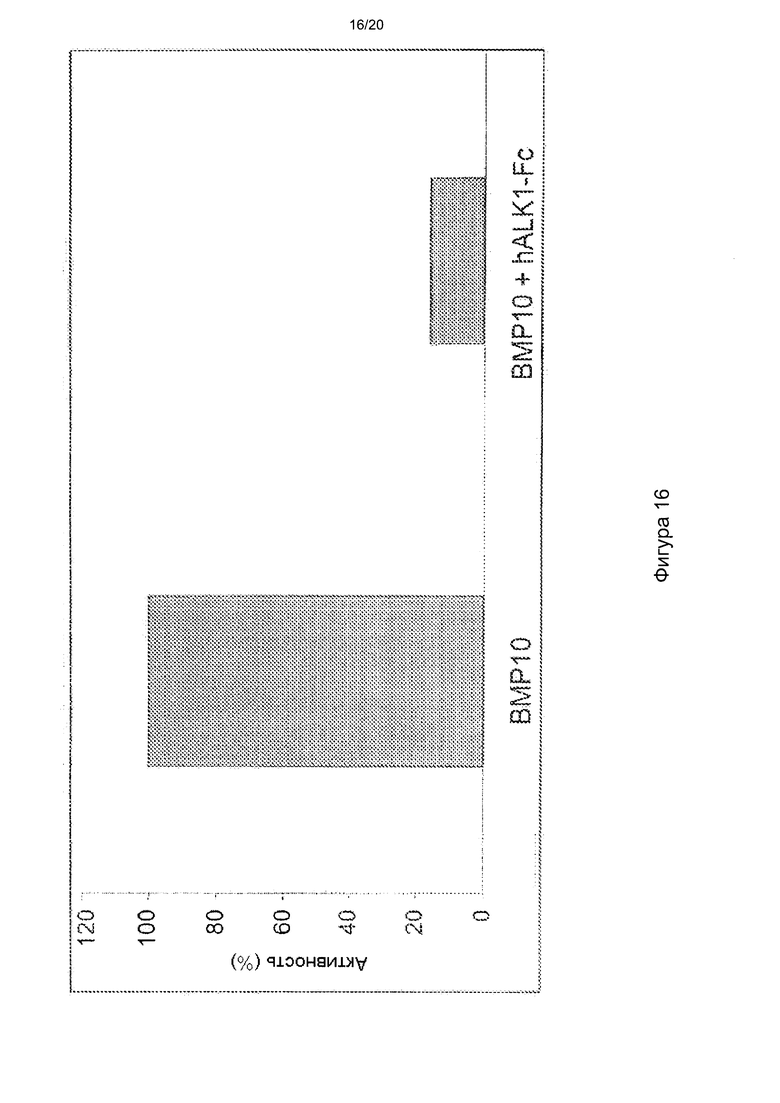

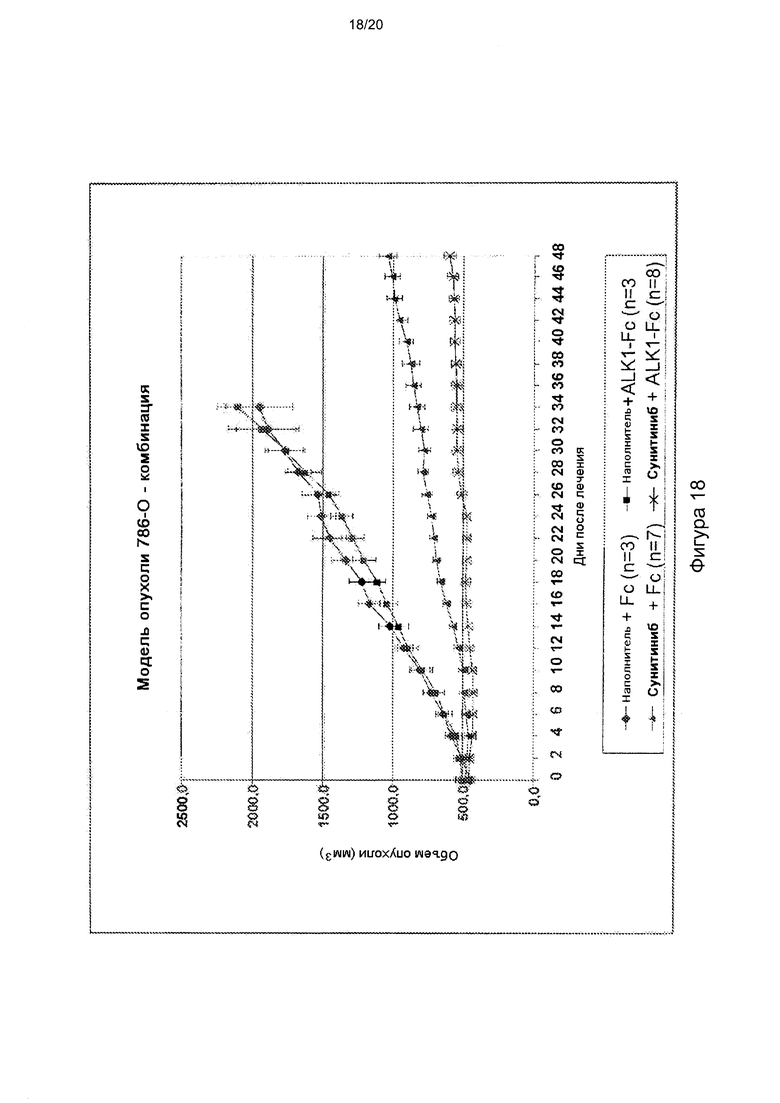
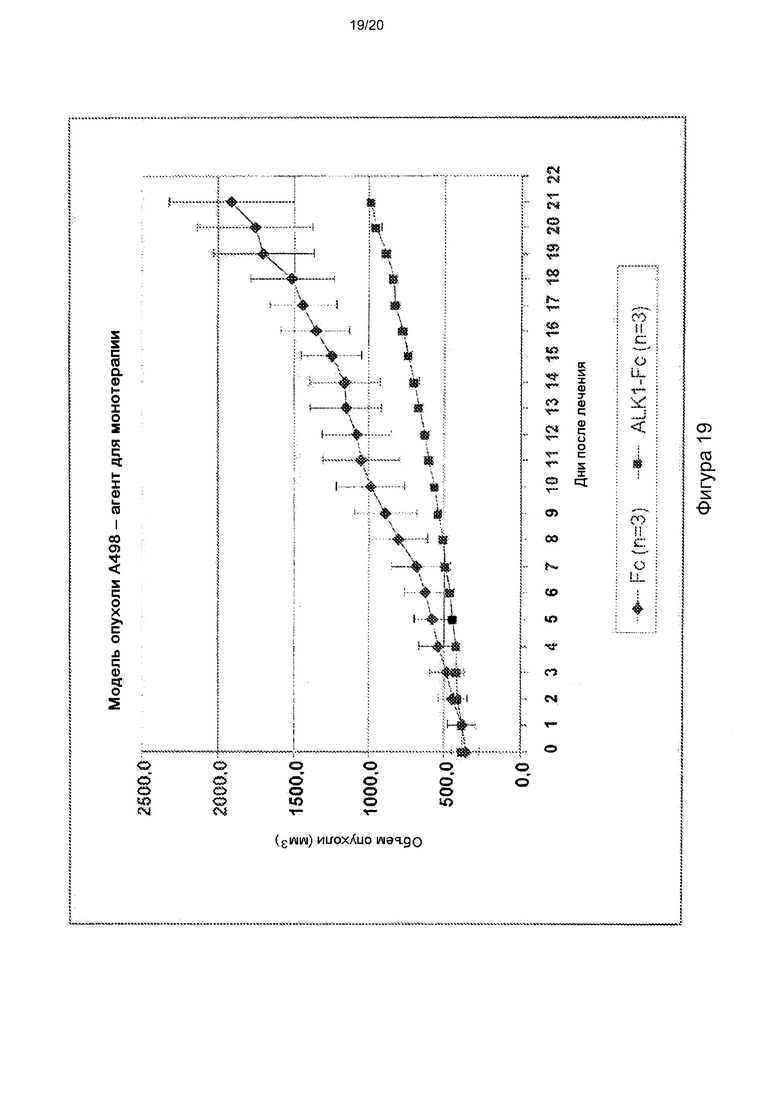
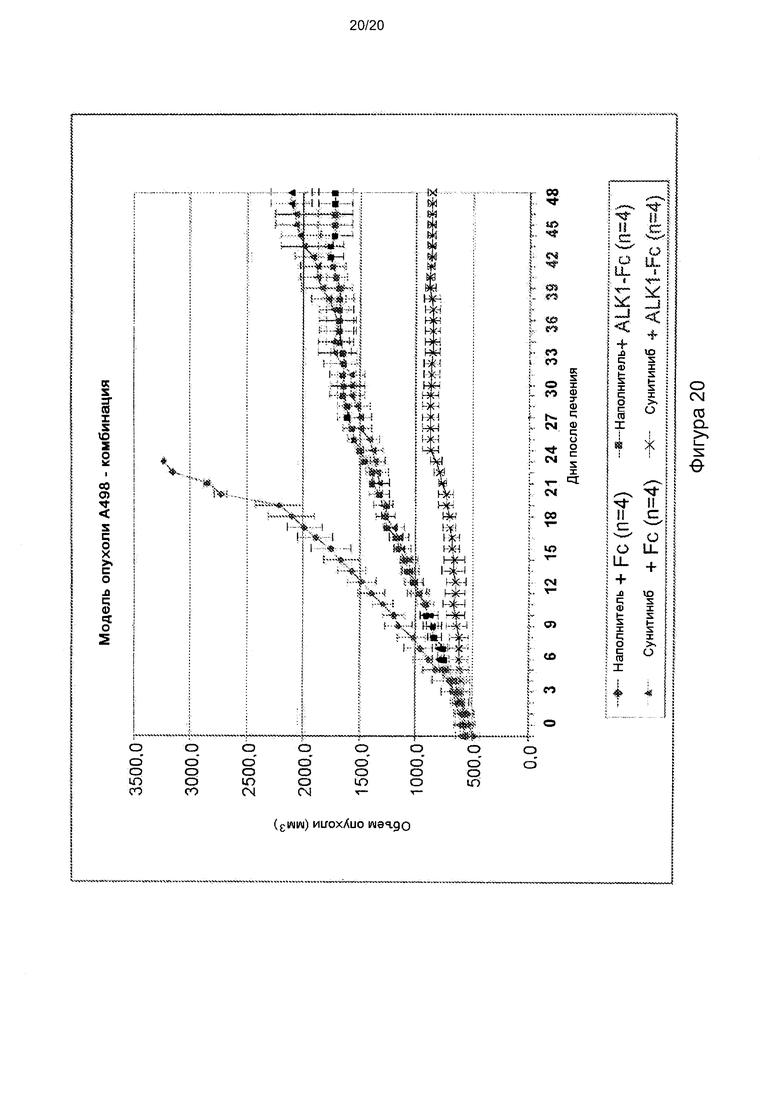
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения почечно-клеточной карциномы (ПКК). Способ по изобретению включает введение млекопитающему с ПКК эффективного количества сунитиниба и полипептида ALK1, содержащего лиганд-связывающую часть внеклеточного домена ALK1. Использование изобретения позволяет замедлить рост опухоли и усилить активность сунитиниба. 9 з.п. ф-лы, 20 ил., 15 пр.
1. Способ лечения почечно-клеточной карциномы (ПКК) у млекопитающего, включающий введение млекопитающему с ПКК эффективного количества сунитиниба и полипептида ALK1, содержащего лиганд-связывающую часть внеклеточного домена ALK1, причем полипептид ALK1 необязательно содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности аминокислот 22-120 из SEQ ID NO: 1, и при этом полипептид ALK1 связывается с лигандом ALK1, выбранным из GDF5, GDF6, GDF7, ВМР9 и BMP10.
2. Способ по п. 1, отличающийся тем, что полипептид ALK1 имеет последовательность аминокислот SEQ ID NO: 3 или SEQ ID NO: 14 или последовательность аминокислот, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности аминокислот 22-120 из SEQ ID NO: 1.
3. Способ по п. 1, дополнительно включающий введение ингибитора, мишенью которого является мишень рапамицина у млекопитающих (mTOR), и при этом ингибитор, мишенью которого является mTOR, представляет собой эверолимус или темсиролимус.
4. Способ по п. 1, отличающийся тем, что ПКК представляет собой прозрачноклеточную почечно-клеточную карциному.
5. Способ по п. 1, отличающийся тем, что ПКК инвазировала почечный синус, ПКК представляет собой метастазирующую ПКК или ПКК метастазировала в легкие, внутрибрюшные лимфатические узлы, кость, головной мозг или печень.
6. Способ по п. 1, отличающийся тем, что млекопитающее ранее получало терапевтический агент для лечения ПКК.
7. Способ по п. 6, в котором терапевтический агент для лечения ПКК, получаемый ранее, представляет собой ингибитор, мишенью которого является мишень рапамицина в клетках млекопитающих (mTOR), выбранный из эверолимуса и темсиролимуса.
8. Способ по п. 6, в котором терапевтический агент для лечения ПКК, получаемый ранее, представляет собой интерферон альфа (ИФН альфа) или интерлейкин-2 (ИЛ-2).
9. Способ по п. 1, в котором полипептид ALK1 дополнительно содержит Fc-фрагмент IgG1 человека.
10. Способ по п. 6, в котором терапевтический агент для лечения ПКК, получаемый ранее, представляет собой ИРТК (ингибитор рецепторной тирозинкиназы), выбранный из сунитиниба, сорафениба, пазопаниба, акситиниба, тивозаниба и вандетаниба.
| US 20080175844 A1, 24.07.2008 | |||
| БЕЛИКОВ В.Г., Фармацевтическая химия, М., Высшая школа, 1993, с | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| MOTZER RJ et al | |||
| Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma//J Clin Oncol | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| BERNARD ESCUDIER et al | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| CUNHA S | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2017-10-16—Публикация
2013-02-01—Подача