Задачей данного изобретения является получение препарата из in vitro культуры дедифференцированных, неактивированных клеток железного дерева, косметическая или дерматологическая композиция, содержащая указанный препарат, и ее применения для лечения старения кожи, воспаления и заживления кожи.
Железное дерево представляет собой дерево, которое принадлежит к ботаническому семейству Sapotacea, и его научным названием является Argania spinosa (L.) Scelles.
Габитус этого дерева подобен оливковому дереву; оно имеет короткий и скрученный ствол. Древесина является очень твердой и плотной. Ветви являются очень колючими и имеют мелкие, ланцетовидные, очередные, короткие (примерно 2 см в длину) и узкие листья, которые часто сгруппированы в грозди. Листья являются вечнозелеными, но они часто отмирают и опадают всегда, когда стоит сильная засуха. Цветки являются обоеполыми и пятимерными. Они сгруппированы в плотные кистеобразные соцветия и распускаются в мае и в июне. Цветки имеют зеленовато-желтый цвет.
Железное дерево может давать плод, начиная с возраста 5 лет. Плод представляет собой желтую, овальную сидячую ягоду, примерно от 4 до 5 см в длину. Он состоит из мякоти, окружающей ядро, содержащее от 2 до 3 плоских семян, сложенных вместе, где каждое заключает в себе миндаль с высоким содержанием масла.
Железное дерево является эндемиком для Марокко и расположено, в основном, на юго-западе Марокко между Эссуэйрой и Агадиром. Леса железного дерева покрывают примерно 830000 га.
Марокканское население сначала использовало железное дерево в связи с его особо твердой древесиной в качестве источника топлива. Другим основным традиционным использованием является масло, первоначально экстрагируемое вручную, но, в настоящее время, экстрагируемое с использованием пресса. Первоначальное применение этого масла составляют пищевые продукты; другим важным применением в настоящее время является косметика.
Мякоть и остаточный жмых, полученный из данного производства масла, обычно используют для корма животных.
Многие косметологические продукты разработаны на основе железного дерева. Выдано несколько патентов на изобретения для масла, полученного из семян, например, масла, полученного с помощью растворителя (французский патент №2553788), масла железного дерева, обогащенного не омыляемым веществом (французский патент №2724663).
Вещества, иные, чем масло, также запатентованы, например, пептиды, выделенные из жмыха семян, полученного после экстракции масла; комбинация масла и пептидов из жмыха для лечения проблем, связанных со старением кожи (французский патент №2756183). Также существует патент на изобретение для листьев железного дерева, белков и сапонинов из жмыха, экстрактов из листьев (Патент ЕР 1213025), белков жмыха (Патент ЕР 1213024), сапонинов жмыха (Патент ЕР 1430900). В более недавнее время была депонирована заявка на патент ЕР 1968536, в которой раскрыто применение экстракта из мякоти плода железного дерева в косметических изделиях против старения кожи.
Следовательно, композиция из целого железного дерева представляет интерес для дерматологического и/или косметического применения.
Железное дерево является важным растительным ресурсом, прежде всего, для экологии, поскольку оно является ″экосистемным″ растением. Оно прекрасно приспособлено к засушливым областям, оно защищает почву от эрозии водой и ветром и, следовательно, предотвращает распространение пустыни в Марокко. Но также оно важно для экономики, поскольку является деревом с многочисленными применениями.
Это дерево является ведущей культурой Марокко. Таким образом, леса железного дерева были защищены дахиром (декретом), изданным в 1925 г., постановляющим, что данная страна обладает первоочередными правами на леса железного дерева, но что местное население имеет право пользования (плоды, мертвая древесина, культурные растения под деревьями железного дерева). ЮНЕСКО недавно классифицировала железное дерево как резерв биосферы.
Именно поэтому использование его древесины или листьев для косметического применения может иметь серьезные последствия для данного защищенного растения.
Другими средствами получения молекул, представляющих интерес, из растения является получение тотипотентных дедифференцированных клеточных культур. Использование дедифференцированных растительных клеток может также позволить избежать некоторых проблем индустриализации, встречающихся в процессе разработки косметических средств. При использовании клеточной культуры различие в концентрации интересующих веществ между различными партиями или сборами растений исчезает. Этот метод также является недеструктивным, относительно простым и не дорогостоящим для технологии. Наконец, он устраняет необходимость в экстракции, поскольку клетки находятся в культуральной среде, и активные соединения находятся либо в культуральной среде, либо в межклеточной жидкости. Таким образом, простое измельчение делает эти соединения доступными.
В заявке на патент WO 03077881 раскрыта композиция для местного применения, содержащая по меньшей мере один гомогенат дедифференцированных и активированных растительных клеток в in vitro культуре, для синтеза по меньшей мере одного фитоалексина. Растительный материал предпочтительно выделяют из вина.
Таким образом, в данном документе раскрыто косметическое применение растительных клеток, которые могут быть дедифференцированными и активированными, где активация приводит к достаточному количеству вторичных метаболитов, чтобы обеспечить биологическую активность при местном применении.
Удивительно и неожиданно автор изобретения продемонстрировал, что препарат, полученный из in vitro культуры дедифференцированных, но не активированных клеток железного дерева, обладает хорошими косметическими и/или дерматологическими активностями в областях применения против старения кожи, воспаления и заживления кожи.
Полученные результаты показывают, что в конкретном случае железного дерева возможно другое применение клеточных культур железного дерева (в данном случае неактивированных клеток) в вышеупомянутом контексте.
Кроме того, получение препарата, как описано в данном изобретении, может устранить необходимость в стадии активации, которая является промышленно трудной и дорогостоящей стадией; активация приводит к значительно большему выходу биомассы за счет замедления клеточного роста.
В заявке WO 03077881 упомянуты различные пути осуществления этой активации, например, облучение УФ светом в течение 3 суток; диоксид углерода в течение от 24 часов до 2 суток; облучение УФ светом и диоксид углерода в течение 5 суток.
Способ, осуществляемый в рамках данного изобретения, состоящий в дедифференциации клеток из растительного материала, выделенного из железного дерева, а затем культивировании клеток в суспензии, может быстро привести в результате к получению тонкоизмельченной, обильной, гомогенной и стерильной биомассы данного растения. Клеточная культура дает возможность применять биохимические пути для биосинтеза данного растения непосредственно на клеточном уровне.
Таким образом, данное изобретение нацелено на препарат, полученный из in vitro культуры дедифференцированных, неактивированных клеток железного дерева, на косметическую или дерматологическую композицию, включающую указанный препарат, и на ее применения в косметологии и/или дерматологии, и предпочтительно для лечения старения кожи, воспаления и заживления кожи.
В более общем смысле in vitro культуры растительных тканей в суспензии обеспечивают средство продуцирования активных органических соединений, имеющих происхождение непосредственно из первичного или вторичного метаболизма клеток.
Растительные клетки в суспензии находятся в дедифференцированном состоянии, подобном состоянию стволовых клеток для культур клеток животных. Следовательно, эти растительные клетки теоретически способны продуцировать все метаболиты, наблюдаемые в целом растении. Дедифференциация вызывает генетическое или эпигенетическое нарушение путей биосинтеза, так что химические профили количественно и качественно различаются между целым растением и полученными в результате клеточными линиями. Таким образом, теоретически реакционные промежуточные соединения, не наблюдаемые в целом растении, могут появиться в клеточной суспензии. Это обеспечивает новые возможности, так что, может быть достигнуто ″спящее″ химическое биологическое разнообразие.
На современном уровне техники, как правило, активации (химическая, физическая, биологическая) клеточной культуры могут стимулировать и продуцировать большее количество метаболитов. В способе авторов изобретения в соответствии с изобретением авторы изобретения покажут, что, в отличие от большинства случаев, и неожиданно, активация не является необходимой, но является вредной для роста биомассы и для требующихся биологических активностей.
Одна из целей данного изобретения относится к препарату, полученному из in vitro культуры дедифференцированных, неактивированных клеток железного дерева.
″Дедифференцированные растительные клетки″ относятся к любой растительной клетке без какой-либо специализации ее природы, иными словами, в физиологическом состоянии, подобном меристематическим тканям растения в природном состоянии. Эти клетки способны жить сами по себе и не зависят от других клеток.
Дедифференцированные клетки Argania spinosa получают из живого растительного материала, собранного из дерева или молодого побега, состоящего из листьев, черешков листьев, стебля, коры, корня, плода, семени, цветка и органов цветка или почки, и более конкретно из листьев.
Способ получения культур дедифференцированных клеток осуществляют in vitro любым способом, известным специалистам в данной области техники, например, со ссылкой на Murashige, Т., Skoog, F. 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiol. Plant 15: 473-496. / Plant Culture Media, Vol-1 Formulations and Uses E.F. George, D. J. M. Puttock, and H.J. George (1987) Exegetics Ltd. Edington, Westbury, Wilts, BA134QG England.
Препарат в соответствии с данным изобретением может быть получен путем осуществления приведенных ниже стадий в последовательности:
a) Стерилизации растительного материала,
b) Дедифференциации клеток,
c) Помещения в клеточную культуру с культуральной средой без активатора,
d) Размножения и продуцирования биомассы культуры с культуральной средой без активатора, и
получение препарата.
Препарат может быть получен в колбе Эрленмейера, если цель состоит в продуцировании малых количеств биомассы, или в биореакторе для больших количеств. Например, среднее количество, собранное в колбе Эрленмейера с 500 мл клеточной суспензии составляет 100 г сухой биомассы (а именно 200 г биомассы/л клеточной суспензии), тогда как средняя сухая биомасса, собранная в 10 л биореакторе, составляет 3000 г (300 г/л биомассы).
Встречается три основных режима для культуры растительных клеток в биореакторе:
1. прерывистая или периодическая культура,
2. повторная загрузка/сбор или культура с подпиткой и
3. непрерывная культура.
а. Стадия стерилизации растительного материала:
Эксплантаты Argania spinosa, и более конкретно эксплантаты листьев, отбирают и обеззараживают растворами гипохлорита натрия или кальция ли растворами хлорида ртути при температуре окружающей среды в течение нескольких минут. Ткани промывают стерильной дистиллированной водой, а затем промывают по меньшей мере один раз стерильной дистиллированной водой по окончании обеззараживания.
b. Стадия дедифференциации клеток
Обеззараженные эксплантаты помещают в ламинарном боксе в контакт с агаровой питательной средой Мурасиге и Скуга, в которую добавлена сахароза и факторы роста (или гормоны). Эти гормоны роста контролируют клеточный механизм эксплантатов таким образом, чтобы вызвать деления клеток и вызвать образование клеточных кластеров или дедифференцированных каллусов (каллусообразование). Полученные каллусы переносят в новую питательную среду дедифференциации каждые 3-4 недели. Некоторые компоненты этой среды, обогащенные агаром, могут претерпевать метаболизм за счет каллусов или разрушаться под действием воздуха.
Как правило, гормональная композиция на основе ауксина (2,4-дихлорфеноксиуксусной кислоты) и цитокинина (кинетина) была успешно протестирована для получения быстрой и полной дедифференциации тканей в форме рыхлых каллусов (каллусообразования) и для облегчения переноса в жидкую среду. Стерильные эксплантаты листьев можно укладывать на сторону верхней поверхности листа в контакте с агаровой средой, состоящей из среды Мурасиге и Скуга (Murashige, Т., Skoog, F. 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiol. Plant 15: 473-496) с 30 г/л сахарозы, 8 г/л агара, с добавками 0,5 мг/л кинетина и 0,75 мг/л 2,4-дихлорфеноксиуксусной кислоты (24D), и доведенной до pH 6 с последующей обработкой в автоклаве в течение 20 минут при 121°C (1 бар). Чашки Петри, содержащие эксплантаты, оставляют для инкубации в темноте при 28°C. Первые каллусы появляются через 2 недели. Полученные каллусы переносят на новую среду каждые 3-4 недели путем деления каллусов скальпелем с выдерживанием размера от 2 до 3 см. Эти переносы продолжают в течение от 2 до 6 месяцев до получения рыхлых каллусов.
с. Стадия получения клеточной суспензии в культуральной среде без активатора
Дедифференциация клеток с успешными переносами каллусов на агаровую среду приводит к образованию рыхлых каллусов. Это падение когезии между клетками является следствием дедифференциации, которая может происходить между двумя и шестью месяцами в зависимости от растения. Данное состояние благоприятно для переноса в жидкую среду, поскольку оно гарантирует дезинтеграцию каллусов в клеточной суспензии, сводя, в то же время, к минимуму индуцированные механические стрессы. Таким образом, коллекцию жидких каллусов вносят (10-20% об/об) в жидкую питательную среду, приготовленную с использованием такой же композиции, как и агаровая среда дедифференциации, но без гелеобразующего агента.
Рыхлые каллусы, таким образом, дезинтегрируют в жидкой среде под действием качающегося стола в течение 2-3 суток, и полученную клеточную суспензию освобождают от не дезинтегрированных частей каллуса, образуя, таким образом, гомогенную клеточную суспензию. Эту суспензию поддерживают в культуре до получения достаточно плотной клеточной популяции. На этой стадии суспензию (субкультивируют) или разводят в новой питательной среде, и культивирование начинают таким же путем.
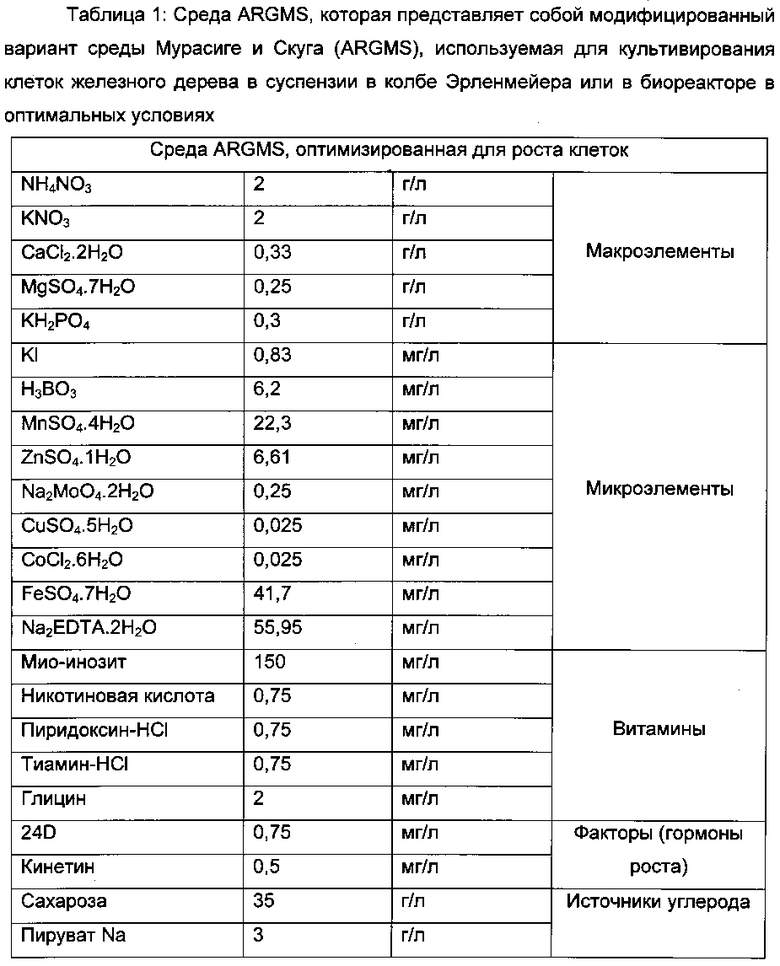
Первоначальную клеточную суспензию можно начать культивировать путем помещения примерно от 20 до 40 г рыхлых каллусов в 500 мл колбе Эрленмейера, содержащей 200 мл среды. Рыхлые каллусы, таким образом, дезинтегрируют в жидкой среде под действием качающегося стола в течение 2-3 суток при 115 об/мин в темноте при 29°C. Затем надосадочную жидкость клеток собирают с использованием пипетки, оставляя не дезинтегрированные остаточные каллусные кластеры в стороне. Надосадочная жидкость клеток, таким образом, образует гомогенную клеточную суспензию. Эту суспензию поддерживают в культуре до получения ″достаточно″ плотной клеточной популяции. Полученную клеточную суспензию культивируют в течение 15 суток, а затем размножают путем разведения 1:5 в новой среде в течение такого же периода времени. Проведено регулирование композиции культуральной среды (питательных веществ, факторов роста и т.д.), чтобы увеличить до максимума продуктивность биомассы. Результатом является среда для выращивания биомассы ARGMS (см. таблицу 1), оптимизированная дли жидкой клеточной суспензии. Эта среда представляет собой модифицированный вариант среды Мурасиге и Скуга для каллусообразования. Эту среду доводят до pH 6 добавлением КОН с последующей обработкой в автоклаве в течение 20 минут при 121°C (p=1 бар) или стерилизацией фильтрованием при 0,2 мкм.
d. Выращивание биомассы и продуцирование культуры с культуральной средой без активатора
После взятия нескольких таких субкультур клеточную суспензию стабилизируют, когда плотность клеток, полученная за период, является постоянной. Таким образом, возможно регулирование композиции культуральной среды (питательные вещества, факторы роста и т.д.) с целью увеличения до максимума продуктивности биомассы. В одной конкретной форме осуществления изобретения оптимизированная среда, используемая в качестве средства продуцирования биомассы, представляет собой среду, описанную в таблице 1.
Клеточную суспензию фильтруют, чтобы отделить ее от внеклеточной среды или надосадочной жидкости культуры, и собранную биомассу помещают обратно в суспензию в дистиллированной воде и измельчают при 0°C. Полученный гомогенат лиофилизируют или центрифугируют таким образом, чтобы осветлить его перед лиофилизацией.
Клеточную культуру в ″оптимальных″ условиях, созданную таким образом, стабилизируют и поддерживают в колбе Эрленмейера (культура для разведения) при разведении 1:5 клеточной суспензии каждые 15 суток. Это эквивалентно инокулированной клеточной культуре с 60 г/л свежей биомассы, которая образует клеточную суспензию примерно 300 г/л после 15 суток культивирования, либо ее инокулируют в биореактор в зависимости от необходимости.
Препарат, полученный либо в колбе Эрленмейера, либо в биореакторе, может состоять из:
- клеточной суспензии (для целей изобретения "клеточная суспензия" относится к клеткам (а именно к биомассе) в данной культуральной среде);
- биомассы (для целей данного изобретения "биомасса" означает клеточный кластер, отделенный от культуральной среды, а именно от клеточной суспензии, после фильтрования);
- измельченной биомассы после помещения обратно (или без помещения обратно) в суспензию в дистиллированной воде;
- осветленного экстракта биомассы или надосадочной жидкости биомассы, измельченной с помощью центрифугирования или с помощью фильтрования;
- надосадочной жидкости культуры (для целей данного изобретения ″надосадочная жидкость культуры″ представляет собой культуральную среду, в которой клетки находились в культуре во время культивирования, либо внеклеточную среду).
Независимо от того, рассматривают ли клеточную суспензию, биомассу или надосадочную жидкость измельченной биомассы, их можно поддерживать без изменения в замороженном виде или путем добавления консервирующих веществ, таких как фенокси-2-этанол, бензиловый спирт или любой другой консервирующий препарат, присутствующий в Приложении VI в директиве EU по косметическим средствам, озаглавленном ″Перечень консервирующих агентов, которые могут присутствовать в косметических средствах″. Они могут быть также разведены на косметологически приемлемой среде, такой как гликоль (пропиленгликоль, бутиленгликоль, полиэтиленгликоли и т.д.), в соотношениях, варьирующих от 10 до 60%. Клеточную суспензию или биомассу можно также измельчать, а затем консервировать как таковую в замороженном виде или путем добавления консервирующих веществ или среды, как описано выше.
Измельченную или не измельченную, клеточную суспензию, биомассу или надосадочную жидкость биомассы можно также высушивать путем лиофилизации или распыления и хранить как таковые, либо высушивать на мальтодекстрине, лактозе или среде типа силикагеля, либо любой другой косметологически приемлемой среде.
Наконец, клеточную суспензию можно обогащать полезными соединениями путем аффинной хроматографии: абсорбции на смоле (полистироловых сополимерах типа Амберлит® XAD®-2la и т.д.) и элюирования подходящим растворителем, таким как этанол.
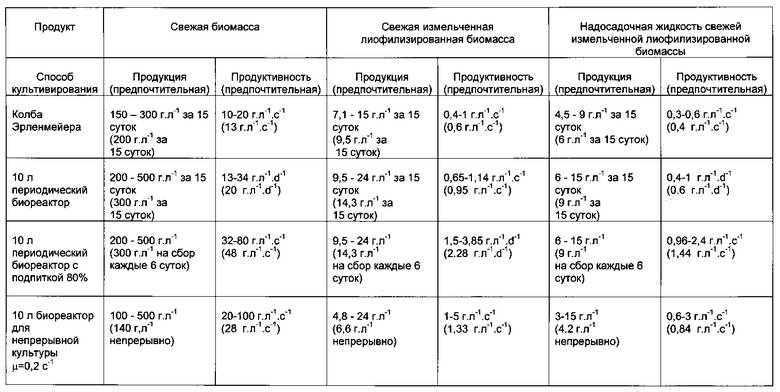
Свежая биомасса, полученная способом в соответствии с данным изобретением, составляет примерно от 100 до 500 г на литр суспензии, и более предпочтительно от 200 до 350 г на литр суспензии на оптимальную дату сбора (а именно примерно 15 суток в среднем).
В приведенной ниже таблице выражены полученные выходы (выход полученного продукта в граммах/л клеточной суспензии):
Данное изобретение также относится к косметической или дерматологической композиции, содержащей препарат, полученный из культуры неактивированных, дедифференцированных клеток железного дерева, в качестве активного ингредиента, как описано выше.
Предпочтительно количество указанного препарата составляет от 0,1 до 10% суммарной массы композиции. Даже более предпочтительно количество экстракта составляет от 0,2% до 5%.
Косметическая композиция в соответствии с данным изобретением может преимущественно находиться в любой галеновой форме, обычно используемой в косметике для местного или перорального применения, и преимущественно для местного применения. Для введения местным путем галенова форма может представлять собой крем, гель, мазь или спрей. Пероральный препарат выбран из группы, включающей таблетки, капсулы и порошки для питьевых суспензий.
Косметическая композиция в соответствии с изобретением также содержит обычные косметически совместимые эксципиенты.
Обычные эксципиенты, совместимые с косметической композицией, могут представлять собой любой эксципиент среди известных специалистам в данной области техники, чтобы получить косметическую композицию для местного применения в формах, подобных описанным выше.
Косметическая и/или дерматологическая композиция в соответствии с изобретением может, в частности, содержать добавки и вспомогательные вещества для препаратов, такие как сурфактанты эмульгирующего, очищающего, пенообразующего типа и т.д., комплексообразующие агенты, загустители, гелеобразующие агенты, стабилизаторы, консервирующие агенты, включая антибактериальные средства и антиоксиданты, кондиционеры, подкисляющие агенты, подщелачивающие агенты, смягчающие средства, растворители, красящие агенты и ароматические вещества.
Авторы изобретения также показали, что препараты, полученные из дедифференцированных, неактивированных клеток железного дерева могут обладать перечисленными ниже активностями:
- антиокислительной активностью, активностью против свободных радикалов для ограничения процесса окисления, связанного с внутренним и внешним старением и воспалительными процессами.
- активностью в отношении внеклеточного матрикса для улучшения механических свойств зрелой кожи (устойчивости, эластичности, тонуса) посредством ингибирования металлопротеаз, разрушающих коллаген.
Наконец, данное изобретение относится к композиции, раскрытой в данной заявке, для лечения старения кожи, воспаления и заживления кожи.
Приведенные ниже примеры приведены в качестве не ограничивающих примеров.
Примеры получения препарата в соответствии с данным изобретением
Пример 1: Свежая биомасса/способ, осуществляемый в колбе Эрленмейера
Листья железного дерева, предпочтительно возраста от 3 до 4 месяцев, стерилизуют с помощью нескольких погружений в последовательности: 70% спирт в течение 1 минуты, 2% гипохлорит натрия в течение 3 минут, а затем промывания двумя последовательными погружениями в деминерализованную воду продолжительностью 8 минут и 10 минут.
Стерилизованные эксплантаты листьев укладывают на сторону верхней поверхности в контакте с агаровой средой, состоящей из среды Мурасиге и Скуга (Murashige, Т., Skoog, F. 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiol. Plant 15: 473-496) с 30 г/л сахарозы, 8 г/л агара, дополненной 0,5 мг/л кинетина и 0,75 мг/л 2,4-дихлорфеноксиуксусной кислоты (2.4-D) и доведенной до pH 6, с последующим автоклавированием в течение 20 минут при 121°C (1 бар). Чашки Петри, содержащие эксплантаты, оставляют для инкубации в темноте при 28°C и выращивают до получения рыхлых и стабилизированных каллусов.
Исходную клеточную суспензию создают путем помещения примерно 40 г рыхлых каллусов в 500 мл колбу Эрленмейера, содержащую 200 мл автоклавированной среды, композиция которой описана в таблице 1, упомянутой выше.
Культуру оставляют на одну неделю на качающемся столе при 115 об/мин в темноте при 29°C. Затем всплывающие клетки собирают пипеткой, оставляя остаточные кластеры каллусов. Полученную клеточную суспензию культивируют в течение 15 суток, а затем выращивают путем разведения 1:5 в новой среде в течение такого же периода времени.
Затем суспензию фильтруют в вакууме и выделяют биомассу. Полученный выход свежей биомассы составляет 168 г/л.
Биомассу хранят при -20°C.
Пример 2: Сухая биомасса
Пример 2а: Сухая биомасса/способ, осуществляемый в биореакторе в периодической культуре
Четыре 500 мл колбы Эрленмейера с клеточной суспензией, полученной, как описано в примере 1, помещают вместе в устройство для инокуляции и получают 2 л инокулята, который стерильно заливают в 10 л биореактор. Этот биореактор заполняют 8 л оптимальной среды (см. таблицу 1), дополненной 30 мг/л предварительно стерилизованного пеногасителя, затем охлаждают и держат при 29,5°C с помощью контролируемой термостатом циркуляции воды в замкнутом контуре в кожухе биореактора.
Датчик кислорода калибруют путем насыщения и вводят данные в компьютеризированное устройство регуляции pO2 в реальном времени. Это устройство поддерживает pO2 при 80% путем впрыскивания стерильного чистого кислорода в систему аэрации. Этот биореактор также оборудован устройством для измерения CO2 в реальном времени в отходящих газах (в свободном пространстве над жидкостью), которое одновременно вводит данные в компьютеризированное устройство регуляции pCO2 для поддержания pCO2 при 6%. Это осуществляют путем впрыска в устройство аэрации стерильного атмосферного воздуха, смешиваемого с кислородом. Биореактор также оборудован системой перемешивания пропеллерного типа, вращающейся при 75 об/мин, для перемешивания клеточной суспензии и предотвращения ее осаждения. На выходной стороне биореактора устанавливают автоматическое устройство, чтобы обеспечить стерильный отбор образцов и мониторинг биомассы.
Периодическую культуру поддерживают при этих постоянных условиях температуры и растворенного газа в течение от 15 до 17 суток до достижения плотности клеток от 280 до 320 г/л свежей биомассы. Биореактор опорожняют после завершения этой периодической культуры, и биомассу собирают фильтрованием на фильтре, используя воронку Бюхнера.
Собранную свежую биомассу, растворенную в равном объеме дистиллированной воды, измельчают в холодном виде, используя ″ультразвуковой очиститель″, а затем лиофилизируют.
Пример 2b: Сухая биомасса/способ, осуществляемый в биореакторе в периодической культуре с подпиткой 10.0.0.1
Четыре 500 мл колбы Эрленмейера с клеточной суспензией использовали в качестве инокулята, как описано в примере 2а. Биореактор готовят, как указано в примере 2а. Системы регуляции растворенного газа, температуры и перемешивания готовят, как указано в примере 2а.
Исходную культуру поддерживают при этих постоянных условиях температуры и растворенного газа в течение от 15 до 17 суток до достижения плотности клеток от 280 до 320 г/л свежей биомассы. 80% содержимого 10 л биореактора отбирают после завершения этой исходной культуры. Таким образом, собирают 8 л клеточной суспензии. Биомассу в этой суспензии собирают фильтрованием на фильтре, используя воронку Бюхнера. Собирают от 2240 г до 2560 г свежей биомассы. Собранную свежую биомассу, растворенную в равном объеме дистиллированной воды, измельчают в холодном виде, используя ультразвуковой очиститель, а затем лиофилизируют. Получают от 100 до 130 г лиофилизированной биомассы.
В то же время, как только осуществлен 80% частичный сбор, 8 л предварительно автоклавированной и охлажденной среды ARGMS заливают в биореактор, таким образом, содержащий 2 л клеточной суспензии, чтобы восстановить объем культуры до 10 л. Культуру с подпиткой поддерживают при тех же постоянных условиях температуры и растворенного газа в течение от 15 до 17 суток до достижения плотности клеток от 280 до 320 г/л свежей биомассы. Эта культура является более быстрой (большей продуктивности), чем исходная культура, поскольку биомасса находится в пролонгированном физиологическом состоянии клеточного деления, так что заливка новой питательной среды характеризуется фазой латентности, меньшей чем 24 часа, и немедленным нарастанием биомассы. По окончании этого культивирования с подпиткой 80% 10 л биореактора извлекают. Таким образом, собирают 8 л клеточной суспензии. Биомассу этой суспензии собирают фильтрованием на фильтре, используя воронку Бюхнера. Затем культивирование возобновляют, как описано выше.
Пример 2 с: Сухая биомасса/способ, осуществляемый в биореакторе непрерывной культуры
Четыре 500 мл колбы Эрленмейера с клеточной суспензией использовали в качестве инокулята, как описано в примере 2а. Биореактор готовят, как указано в примере 2а. Системы регуляции растворенного газа, температуры и перемешивания готовят, как описано в примере 2а.
Исходную культуру поддерживают при этих постоянных условиях температуры и растворенного газа в течение 10 суток до достижения плотности клеток 150 г/л и скорости роста биомассы в этот момент 0,2 с-1. На этой стадии 1,2% содержимого 10 л биореактора извлекают каждый 1 час и 20 минут. Эти образцы автоматически восполняются заливанием такого же объема новой среды ARGMS в биореактор. Этот способ позволяет поддерживать клетки в постоянном физиологическом состоянии и при постоянной плотности клеток.
Таким образом, собирают от 100 до 120 мл клеточной суспензии. Биомассу в этой суспензии собирают фильтрованием на фильтре, используя воронку Бюхнера. Для каждого образца собирают от 15 г до 18 г свежей биомассы. Собранную свежую биомассу, растворенную в равном объеме дистиллированной воды, измельчают в холодном виде, используя ультразвуковой очиститель, а затем лиофилизируют. Полученный результат составляет от 0,71 до 0,85 г свежей высушенной биомассы на каждый отбор. Культуру, таким образом, поддерживают в течение по меньшей мере 60 суток. Теоретически возможно поддерживать ее неограниченное время.
Преимущество непрерывной культуры по сравнению с предшествующими режимами состоит в отсутствии необходимости снова готовить биореактор, требующий очистки и стерилизации, и отсутствует фаза латентности клеток. Отбор от 1 до 1,5% клеточной суспензии автоматически с последующей компенсацией новой средой в биореакторе вызывает минимальные вариации в композиции культуральной среды в ходе работы биореактора. Таким образом, клеточная популяция не требует какого-либо повторного метаболического регулирования для фазы латентности, ответственного за потерю объемной продуктивности биомассы, наблюдаемую при других режимах культивирования.
Пример 3: Надосадочная жидкость свежей биомассы, где биомасса получена, как описано в примере 2а
20 г свежей измельченной биомассы, полученной, как описано в примере 2а, центрифугируют при 10000 г в течение 15 минут, и надосадочную жидкость собирают. Затем ее лиофилизируют.
Средний выход составляет 30 мг лиофилизированной надосадочной жидкости на г свежей биомассы.
Примеры косметической композиции:
Пример 4: Препарат Н/Е
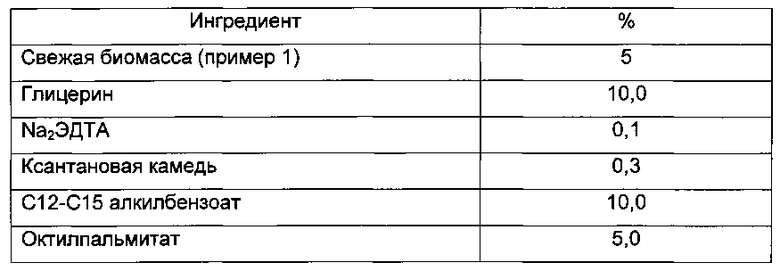
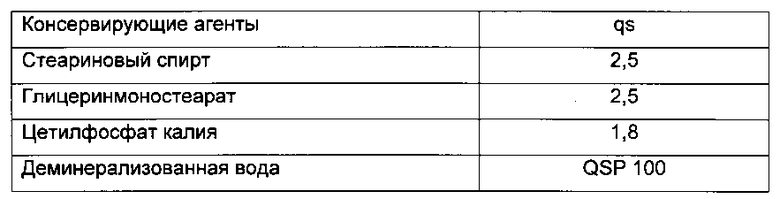
Пример 5: Препарат Е/Н
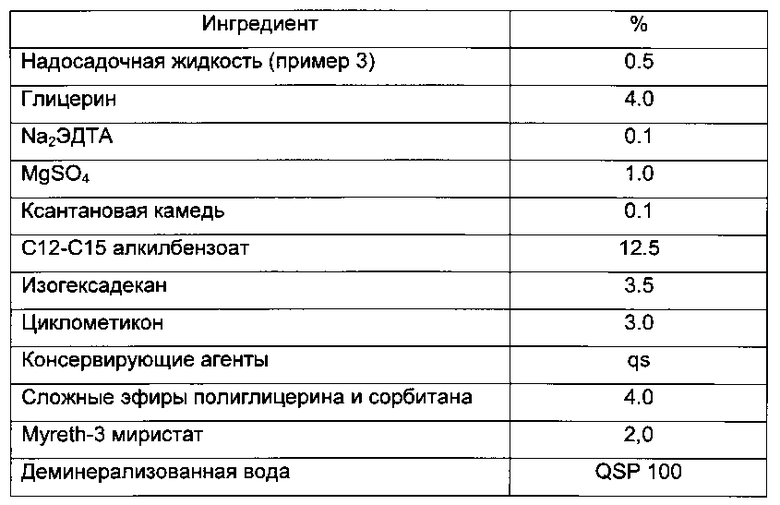
Пример 6: ОЦЕНКА АНТИОКИСЛИТЕЛЬНОЙ АКТИВНОСТИ
Хемилюминесценция
Данный способ генерирует свободные радикалы (супероксидный радикал O2°-) посредством фотохимического сигнала. Интенсивность окисления в 1000 раз выше, чем интенсивность, полученная в нормальных условиях. Обнаружение проводят с помощью хемилюминесценции и используют для оценки жиро- или водорастворимых антиокислительных экстрактов или молекул. Результаты выражают в виде эквивалентного количества витамина С или Тролокса (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты). Чувствительность составляет порядка одного наномоль.
Анализ результатов зависит от двух критериев, а именно формы кривой (интегрирования) и численного значения, данного программным обеспечением, в наномоль. (Igor Popov and Gudrun Lewin. Methods in enzymology [44] vol 300. 437-456; Maibach I Howard and coll. Journal of Cosmetic Dermatology Vol 7(2) 96-100 (2008)).
Результаты выражены в количестве мкг образца, необходимом для получения активности, эквивалентной активности, обнаруженной для 1 мкг стандарта (= тролокса). (Набор ACL).
Результаты
Антиокислительная активности, исследованная в данном тесте, представляет собой способность к специфичному улавливанию свободных радикалов супероксидных анионов с помощью хемилюминесценции.

Лиофилизированная биомасса, полученная в соответствии с примером 2а, и надосадочная жидкость измельченной лиофилизированной биомассы, полученная в соответствии с примером 3, в целом обладает эквивалентной антирадикальной улавливающей активностью.
278 мкг лиофилизированной биомассы необходимо для получения активности, эквивалентной активности, обнаруженной для 1 мкг тролокса: активность эквивалента коэнзиму Q10, сравнительной антиокислительной молекулы.
171 мкг надосадочной жидкости измельченной лиофилизированной биомассы необходимо для получения активности, эквивалентной активности, обнаруженной для 1 мкг тролокса.
Свободные радикалы, образование которых возрастает в результате агрессивных внешних воздействий (холода, загрязнения, табака, ультрафиолетового света), ответственны за повреждение ДНК клеток кожи, а также ДНК клеточной и митохондриальной мембраны. Эти свободные радикалы также играют очень важную роль в процессе воспаления. Эти весьма реактивные метаболиты являются вторыми мессенджерами передачи сигнала клеточного окислительного стресса и, следовательно, ранними медиаторами воспаления (А. Van Der Vliet and coll, Chem Biol Interaction 85: 95-116, 1992).
Антирадикальная активность препаратов, описанных в примерах 2а и 3, помогает противостоять внутреннему и внешнему старению кожи и воспалению.
Пример 7: ОЦЕНКА ИНГИБИРОВАНИЯ МЕТАЛЛОПРОТЕАЗНОЙ АКТИВНОСТИ В ОТНОШЕНИИ КОЛЛАГЕНА, ОБРАЗУЮЩЕГО ВНЕКЛЕТОЧНЫЙ МАТРИКС
Внеклеточный матрикс (ВКМ) представляет собой динамичную структуру со структурной и регуляторной ролью для тканей. Он придает коже ее тургесценцию и механические свойства. В эпидермисе он занимает межклеточное пространство, и оно обеспечивает поддержку структуры эпидермиса. Он также контролирует обмены между клетками эпидермиса и играет роль в клеточной активности. Он состоит из волокон, в частности, коллагена, и основных веществ (воды, солей, гликопротеинов, гликозаминогликанов). Коллагены являются волокнистыми белками, образованными из трех полипептидных цепей, которые могут быть идентичными или разными, соединенных ковалентными водородными связями. Коллагены составляют незаменимый компонент волокнистой сети и играют механическую роль, обеспечивающую упругость и эластичность кожи.
Когда клетка стареет, большинство компонентов ВКМ расщепляется ферментами эндопептидазного типа, богатыми цинком, называемыми матриксными металлопротеиназами (ММР) (Hideaki Nagase § and J. Frederick Woessner. J Biol Chem, Vol.274, Issue 31, 21491-21494, July 30, 1999). Они являются мембранными или секретируемыми. Все ММР обладают сильной гомологией структуры и последовательности, но различаются по субстратной специфичности. ММР1 или ″интерстициальная коллагеназа″ преимущественно расщепляет коллаген типа I (80% содержания в дерме нормальной кожи), а также расщепляет коллагены типа II, VII, VIII и X.
На модели рекомбинантного фермента человека, используя специфичный пептидный субстрат Mca-Lys-Pro-Leu-Gly-Leu-DPA-Ala-Arg-NH2, авторы изобретения проанализировали эффект экстрактов на прямую ферментативную активность с помощью флуориметрического количественного определения (David Leppertd and coll, Analytical Biochemistry 328 (2004) 166-17).
Активированный фермент предварительно инкубируют с различными препаратами, а затем его помещают в присутствии субстрата. Фермент расщепляет пептид, отделяющий флуорофор Мса (7-метоксикумарин-4-ил)ацетил) от гасителя Dpa (N-3-(2,4-динитрофенил)-1-2,3-диаминопропионила). Затем этот пептид испускает флуоресценцию с длиной волны 405 нм, когда его возбуждают при 320 нм. Таким образом, измеряют ферментативную активность ММР-1, и она пропорциональна испускаемой флуоресценции.
С помощью данного теста in tubo авторы изобретения смогли определить потенциальные ингибиторы активности ММР1, фермента с критической ролью в инициации расщепления коллагенов. Авторы изобретения измерили проценты ингибирования активности ММР1.
Вычисление процента ингибирования фермента относительно ингибитора или продукта:

Результаты
Надосадочная жидкость, полученная в соответствии с примером 3, значимо ингибирует активность ММР1 и зависима от дозы от 60 до 500 мкг/мл.
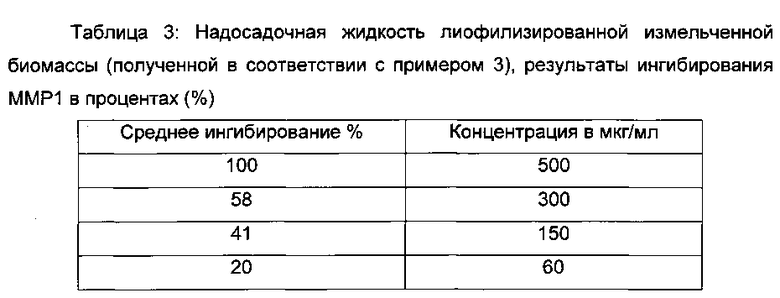
Лиофилизированная биомасса, полученная в соответствии с примером 2а, была протестирована от 60 до 1000 мкг/мл. За счет физико-химической интерференции биомассы в целом авторы изобретения не смогли измерить активность ингибирования. Однако очень сходный экстракт был протестирован и показал значимое ингибирование от 60 мкг/мл до 1000 мкг/мл.
Экстракт, полученный в соответствии с примером 3, может выдерживать возрастающую активность ММР, когда происходит старение, и может вносить вклад в поддержание механической роли коллагена, обеспечивая, таким образом, упругость и эластичность кожи.
Пример 8: Измерение синтеза TGF-β1 в кератиноцитах НаСаТ
TGF-β1 (трансформирующий фактор роста бета 1) принадлежит к надсемейству TGF-β, секретируемого различными типами клеток, который играет важную роль в контроле клеточного роста и регуляции множественных клеточных ответов и биологических процессов. Основные активности цитокинов в данном семействе состоят в том, что они модулируют пролиферацию большинства клеток, стимулируют пролиферацию фибробластов и увеличивают формирование внеклеточного матрикса (Lawrence, 1996). TGF-β1 также вовлечен в репарацию повреждений, процессы заживления (Cullen et al., 1997), в частности, посредством индукции реорганизации клеточного цитоскелета (актина) и стимуляции миграции эпителиальных клеток (Boland et al., 1996). Клеточной популяцией, больше всего представленной в ткани кожи, является популяция кератиноцитов. Они образуют важный источник факторов роста, которые могли бы контролировать и оказывать влияние на поведение клеток кожи, в частности, фибробластов (Ghahary et al., 2001).
Прибор и способы
Получение неактивированной биомассы: в соответствии с примером 2а
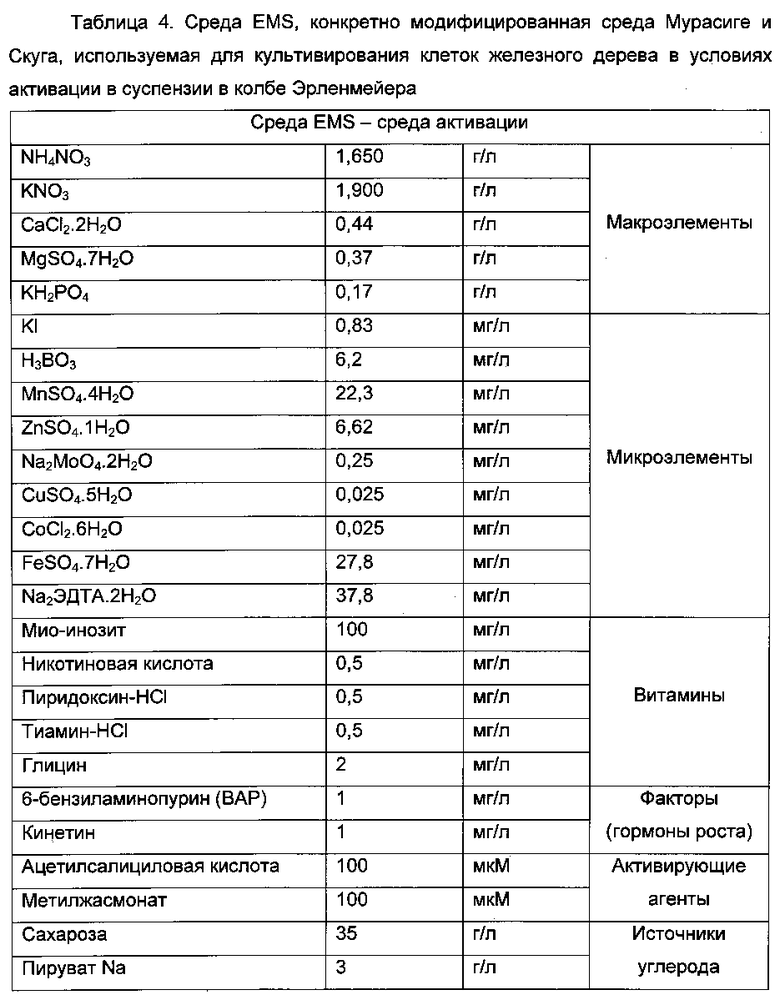
Получение активированной биомассы
Среду Мурасиге и Скуга готовят без факторов роста (кинетина и 24D). Эту среду доводят до pH 6 добавлением КОН с последующим автоклавированием в течение 20 минут при 121°C (p=1 бар). Затем эту среду инокулируют при 1:5 по объему, используя клеточную суспензию, полученную из выращиваемой культуры. Условия активации создают сразу после стерильного добавления концентрированного раствора 6-бензиламинопурина (ВАР или (N-(фенилметил-7Н-пурин-6-амин) и агентов активации (ацетилсалициловой кислоты и метилжасмоната) в кинетине и ДМСО. Результатом является среда активации EMS (см. таблицу 4). Затем активированную культуру поддерживают в течение 15 суток на качающемся столе в темноте при 115 об/мин и при 29°C. Затем свежую биомассу собирают и высушивают на воронке Бюхнера, после чего измельчают и центрифугируют, и надосадочную жидкость стабилизируют путем лиофилизации.
Кератиноциты НаСаТ обрабатывают в течение 5 ч различными экстрактами, а затем клетки инкубируют в течение 24 ч в среде DMEM при 37°C. TGF-β1 дозируют в супернатанты культуры с набором для ELISA.
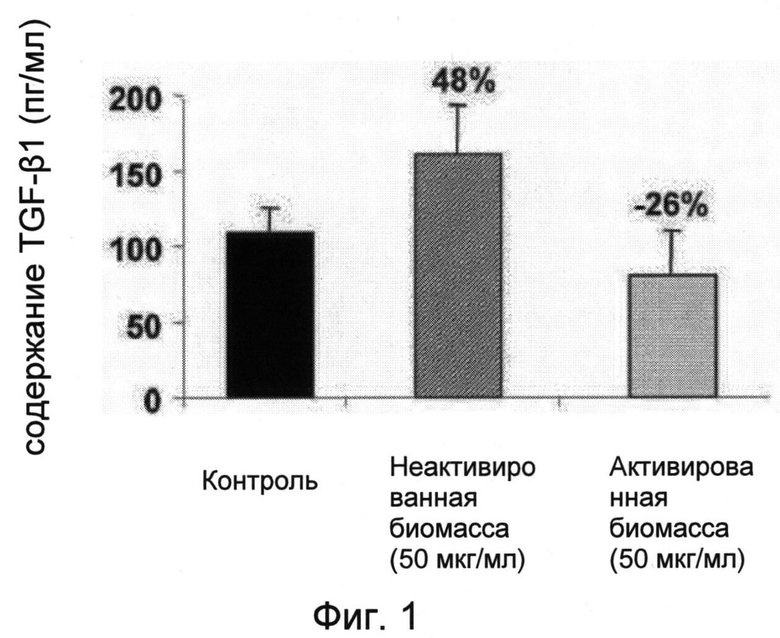
Эффекты неактивированной биомассы железного дерева, полученной в соответствии с примером 2а, и биомассы железного дерева, полученной после активации, на синтез TGF-β1 в кератиноцитах человека НаСаТ показаны на прилагаемой фиг. 1. Они показывают, что в кератиноцитах НаСаТ неактивированная биомасса железного дерева, полученная в соответствии с примером 2а (50 мкг/мл), стимулирует синтез TGF-β1 на 48%, тогда как активированная биомасса железного дерева ингибирует синтез TGF-β1 на 26%.
Пример 9: Измерение пролиферации и клеточной миграции кератиноцитов человека
Пример 9а: Измерение клеточной пролиферации кератиноцитов человека
Заживление повреждений является сложным и динамичным биологическим процессом, в который вовлечено взаимодействие многих локальных и системных факторов при нормальной репарации тканей. Процесс заживления включает четыре независимые фазы: гемостаз, воспаление, пролиферацию и ремоделирование. В пролиферацию вовлечены три четко наблюдаемых процесса, а именно грануляция, сокращение и повторная эпителизация.
В процессе грануляции наблюдают пролиферацию клеток, которые будут вовлечены в остальную часть процесса репарации, с миграцией этих клеток в направлении ложа повреждения. Эти клетки включают макрофаги, фибробласты и эпителиальные клетки. Макрофаги непрерывно высвобождают хемотаксические факторы и факторы роста. Фибробласты конструируют новый клеточный матрикс, необходимый для роста клеток на дне повреждения. Эта подложка облегчает миграцию клеток.
Сокращение повреждения является механизмом для восстановления размера повреждения, и фибробласты играют ведущую роль в этом сокращении.
Повторная эпителизация состоит в регенерации эпидермиса, который покрывает повреждение, чтобы снова сформировать эффективный барьер против внешней среды, способный к пигментации и восстановлению сенсорных и иммунных функций. Поэтому в нее вовлечена клеточная миграция кератиноцитов и процессы пролиферации, но также дифференциация этого вновь образованного эпителия и восстановление базальной мембраны, вновь соединяющей дерму с эпидермисом. Когда миграция базальных клеток в направлении центра повреждения обеспечивает соединение двух сторон повреждения вместе, происходит волна клеточного митоза, чтобы заполнить пространства, оставленные за счет миграции, и поставлять клетки для эпителиальной ткани при трехмерной регенерации.
Стадии пролиферации клеток кератиноцитов, фибробластов и эпителиальных клеток можно рассматривать как одно из функциональных явлений, подтверждающих заживляющую активность активного компонента. Увеличение пролиферации фибробластов или эндотелиальных клеток должно участвовать в заживлении кожи, тогда как увеличение пролиферации кератиноцитов должно участвовать в повторной эпителизации.
Прибор и способы: клеточная пролиферация
В данном методе используют измерение включения нуклеотида, 5-бром-2′-дезоксиуридина (BrdU), аналога тимидина, в ДНК клеток в фазе S.
Кератиноциты, выделенные из кожи, удаленной после операции, культивируют в полной среде KSFM (ВРЕ 25 мкг/мл; EGF 1,5 мг/мл). Клетки инкубируют в присутствии молекул, подлежащих оцениванию, в течение 48 ч при 37°C в атмосфере с 5% CO2.
Включение BrdU, пропорциональное скорости клеточной пролиферации, оценивают с помощью системы антител anti-BrdU, связанных с пероксидазой. Добавление субстрата пероксидазы проявляет цветную реакцию (Biotrak Elisa System). Соответствующее поглощение (DO) измеряют при 450 нм. Таким образом, эти данные пропорциональны скорости клеточной пролиферации.
Затем процент пролиферации определяют, используя приведенную ниже формулу:
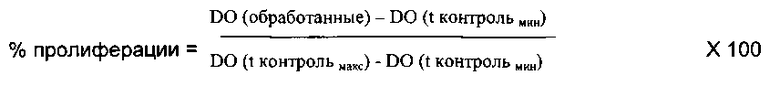
Примечание:
Контрольмин = клетки, инкубируемые с минимальной средой
Контрольмакс = клетки, инкубируемые с полной средой
Таким образом, контрольмин соответствует 0% пролиферации, а контроль макс соответствует 100% пролиферации.
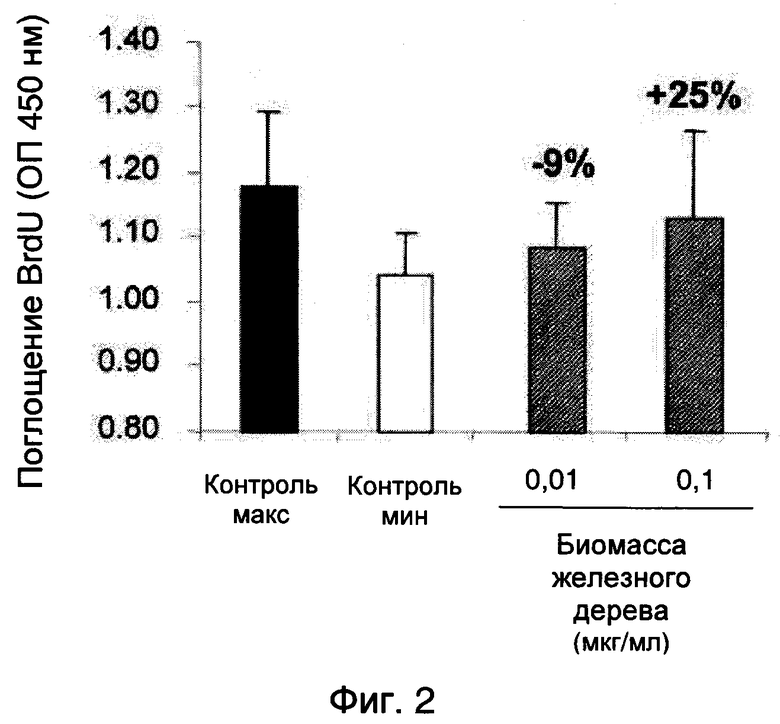
Результаты в отношении клеточной пролиферации представлены на фиг. 2, которая иллюстрирует эффект биомассы железного дерева, полученной в соответствии с примером 2а, на пролиферацию кератиноцитов человека.
Эти результаты показывают, что биомасса железного дерева, полученная в соответствии с примером 2а, при 0,1 мкг/мл стимулирует пролиферацию кератиноцитов человека на 25%. Эффект неизмерим, когда биомассу тестируют при 0,01 мкг/мл.
Пример 9.b: Измерение клеточной миграции кератиноцитов человека
Прибор и способы: клеточная миграция кератиноцитов НаСаТ
Протокол, используемый для исследования клеточной миграции, основан на использовании 96-луночного набора. Принцип этого теста состоит в исследовании миграции клеток в направлении центра лунки (96-луночного планшета). Для достижения этого в центр каждой лунки помещают ограничитель, чтобы создать 2 мм зону обнаружения. Затем клетки НаСаТ высевают вокруг этого ограничителя. Ограничители вынимают, когда клетки хорошо связаны с поверхностью вокруг ограничителей, и, таким образом, клетки могут мигрировать в зону обнаружения. Планшеты без ограничителей и с активными ингредиентами инкубируют при 37°C в течение 24 часов в DMEM 0% SVF. Затем анализируют количество клеток, локализованных в зоне, в которой был расположен ограничитель, чтобы оценить миграцию клеток. Клетки маркируют красителем Хехст 33342, и используют кэш для визуализации и подсчета только клеток, локализованных в этой зоне. Для каждого условия получают среднее значение для восьми лунок. Результаты выражают
- в виде интенсивности флуоресценции (IF - пропорциональна количеству клеток, которые мигрировали).
- в виде процента активности относительно контроля 0% SVF:
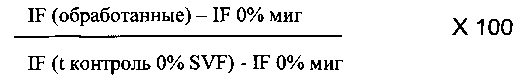
Примечание:
IF (0% миг) соответствует IF (интенсивности флуоресценции) лунок, содержащих ограничители, и, следовательно, фона.
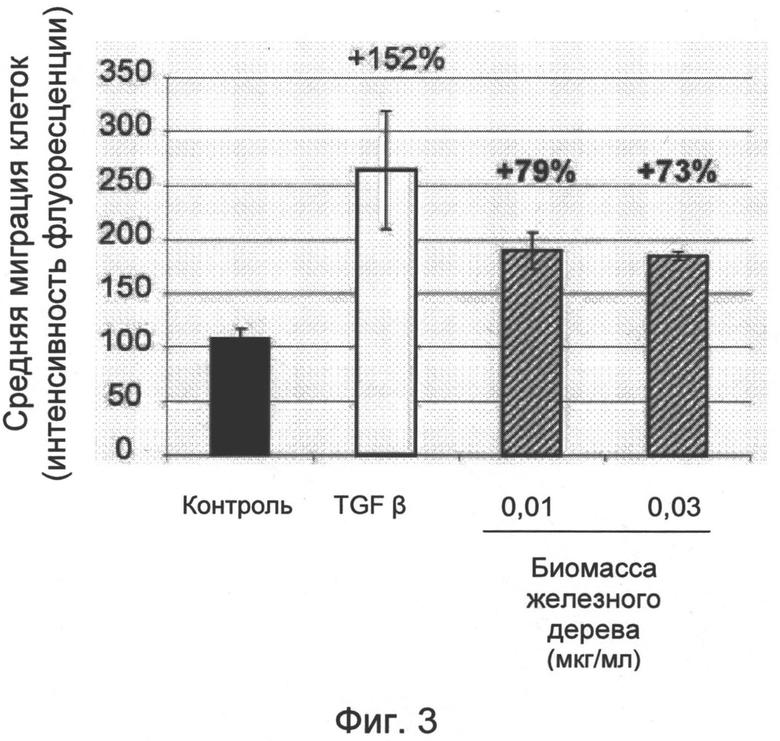
На фиг. 3 показаны результаты клеточной миграции и проиллюстрирован эффект биомассы железного дерева, полученной в соответствии с примером 2а, на миграцию кератиноцитов НаСаТ.
Эти результаты показывают, что биомасса железного дерева, полученная в соответствии с примером 2а, при 0,01 или 0,03 мкг/мл стимулирует миграцию кератиноцитов НаСаТ на 79% и 73% соответственно.
Изобретение относится к фармацевтической промышленности и представляет собой препарат для применения при лечении старения кожи и воспаления и при заживлении кожи в форме клеточной суспензии, биомассы, измельченной биомассы, надосадочной жидкости измельченной биомассы или надосадочной жидкости культуры, полученный из in vitro культуры дедифференцированных, неактивированных клеток железного дерева согласно способу, который включает следующие стадии: стерилизацию растительного материала, дедифференциацию клеток, помещение в клеточную суспензию с культуральной средой без активатора, размножение и продуцирование биомассы культуры с культуральной средой без активатора. Изобретение обеспечивает расширение арсенала средств, применяемых при лечении старения кожи и воспалении и при заживлении кожи. 2 н. и 1 з.п. ф-лы, 9 пр., 5 табл., 3 ил.
1. Препарат в форме клеточной суспензии, биомассы, измельченной биомассы, надосадочной жидкости измельченной биомассы или надосадочной жидкости культуры, полученный из in vitro культуры дедифференцированных, неактивированных клеток железного дерева согласно способу, который включает приведенные ниже стадии:
a) стерилизацию растительного материала,
b) дедифференциацию клеток,
c) помещение в клеточную суспензию с культуральной средой без активатора,
d) размножение и продуцирование биомассы культуры с культуральной средой без активатора,
для применения при лечении старения кожи и воспаления и при заживлении кожи.
2. Композиция для лечения старения кожи, воспаления и заживления кожи, содержащая препарат по п. 1 в качестве активного ингредиента в сочетании с приемлемым эксципиентом.
3. Композиция по п. 2, характеризующаяся тем, что количество препарата составляет от 0,1 до 10% суммарной массы композиции.
| WO 2003077880 A1, 25.09.2003 | |||
| Способ получения 2-тионафтола | 1984 |
|
SU1213025A1 |
| СРЕДСТВО ДЛЯ УХОДА ЗА КОЖЕЙ ТЕЛА И ЛИЦА "МИЧЛУН" | 2001 |
|
RU2195259C1 |
| В.И | |||
| Покровский | |||
| Энциклопедический словарь медицинских терминов | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2015-08-10—Публикация
2011-03-30—Подача