1. ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет 35 U.S.C. § 119(e) предварительной заявки № 61/243616, поданной 18 сентября 2009, содержание которой включено в настоящее описание в виде ссылки.
2. УРОВЕНЬ ТЕХНИКИ
Боль является наиболее частой причиной, по которой люди обращаются за медицинской помощью. Боль от легкой до умеренной обычно лечат ацетаминофеном и нестероидными противовоспалительными средствами. Опиоидные анальгетики, агонисты эндогенных μ-(мю), δ-(дельта) и/или κ-(каппа) опиоидных рецепторов главным образом в центральной нервной системе ("ЦНС") назначают при умеренной до сильной острой и хронической боли. Длительное применение опиоидных анальгетиков может приводить к физической зависимости и обладает побочными эффектами, такими как седативный эффект, помутнение сознания, тошнота, рвота, запор и зуд.
Опиоид-индуцированный запор, (ОИЗ ("OIC")) и ассоциированные состояния, называемые опиоид-индуцированной дисфункцией кишечника (ОДК ("OBD")), являются частыми побочными эффектами у пациентов, которые принимают опиоиды в течение более чем нескольких дней. Агонисты μ-опиоидных рецепторов в кишке и ЦНС ингибируют пропульсивную перистальтику в кишечнике, что приводит к запору. Другие симптомы ОИЗ или ОДК могут включать неполное опорожнение, тяжесть в животе, вздутие, дискомфорт в животе и желудочно-пищеводный рефлюкс. Вторичные осложнения включают псевдообструкцию кишечника, анорексию, тошноту, рвоту и влияние на введение и абсорбцию пероральных лекарственных средств. См. P. Holzer (2009) Regulatory Peptides 155: 11-17.
ОИЗ и ОДК можно лечить с помощью совместного назначения слабительных препаратов, но такой подход часто имеет ограниченную эффективность и требует частой коррекции дозы и смены слабительных. Другие варианты лечения включают совместное введение селективных антагонистов опиоидных рецепторов, таких как налоксон, налтрексон и N-метилналтрексон. С целью эффективного лечения опиоид-индуцированных заболеваний желудочно-кишечного тракта без снижения обезболивающего эффекта или развития неприятных и потенциально опасных центральных симптомов отмены опиоидов критично, чтобы в ЦНС не устанавливались пороговые фармакологически значимые концентрации опиоидных антагонистов. Суб-фармакологические пороговые концентрации опиоидных антагонистов в ЦНС на сегодняшний день были достигнуты или тщательным титрованием низких доз центрально-активных антагонистов (например, налоксона), или созданием антагониста с низкой системной биодоступностью (например, налоксон с контролируемым высвобождением), или путем использования опиоидных антагонистов, которые ограничены периферией, т.е. имеют ограниченный доступ в ЦНС (например, N-метилналтрексон).
Комбинированная композиция с фиксированным соотношением налоксона с контролируемым высвобождением и оксикодона с контролируемым высвобождением (TARGIN®) была одобрена в Европе в качестве пути снижения тяжести ОИЗ.
ENTEREG® (алвимопан) был одобрен для продажи в Соединенных Штатах и показан для ускорения времени до восстановления верхнего и нижнего желудочно-кишечного тракта после операции по частичной резекции толстой или тонкой кишки с первичным анастомозом. Такое применение ограничено кратковременным лечением послеоперационной непроходимости кишечника после резекции кишечника у госпитализированных пациентов в возрасте 18 лет или старше. Считают, что послеоперационная непроходимость кишечника, по меньшей мере, частично вызывается или ухудшается экзогенными опиоидными анальгетиками.
RELISTOR® (н-метилналтрексон), продукт, который вводят путем подкожной инъекции, был одобрен в Соединенных Штатах для лечения ОИЗ у пациентов с запущенными заболеваниями, которые получают паллиативный уход, когда ответ на терапию слабительными средствами недостаточен.
Так что, следовательно, существует необходимость в более эффективном пероральном лечении ОИЗ или ОДК, которые не влияют на обезболивание и не вызывают центральной отмены опиоидов у пациентов.
3. СУЩНОСТЬ
Настоящее описание обеспечивает способ лечения или профилактики ОИЗ или ОДК у пациента, которым может быть животное или человек, путем введения пациенту некоторого количества 5-(2-метокси-4-{[2-(тетрагидропиран-4-ил)этиламино]метил}фенокси)пиразин-2-карбоксамида (Соединение I) и/или его фармацевтически приемлемой соли, эффективных для облегчения симптомов ОИЗ или ОДК без снижения опиоидного обезболивания или формирования центральной отмены опиоидов. Настоящее описание дополнительно обеспечивает применение 5-(2-метокси-4-{[2-(тетрагидропиран-4-ил)этиламино]метил}фенокси)пиразин-2-карбоксамида (Соединение I) и/или его фармацевтически приемлемой соли для получения лекарственного средства для облегчения симптомов ОИЗ или ОДК без снижения опиоидного обезболивания или развития центральной отмены опиоидов. Изобретение, описанное в настоящем описании, частично основано на неожиданном открытии авторов, что соединение I, антагонист опиоидных рецепторов с эффективностью, сравнимой с известными антагонистами опиоидов налтрексоном и алвимопаном, достаточно распределяется у пациентов на периферии, так что им можно эффективно лечить ОИЗ или ОДК, не влияя на обезболивание или развитие центральной отмены опиоидов.
Авторы изобретения изучали результаты экспериментов в известных моделях на животных, созданных для определения эффективности и фармакокинетических свойств антагонистов опиоидных рецепторов, и определили, что данные для Соединения I согласовывались с сильным антагонистом опиоидных рецепторов, который в низких дозах значительно распределяется по периферии. В частности авторы изобретения получили из данных, что Соединение I является, по меньшей мере, в 100 раз менее сильным антагонистом опиоидных рецепторов в центральной нервной системе, чем налтрексон (Пример 1, Фиг. 1). Авторы изобретения также отметили, что Соединение I было приблизительно в 20 раз более сильным в обратном развитии морфин-индуцированного замедления моторики кишечника у мышей, когда морфин вводили системно (т.е., он действовал периферически), чем когда морфин вводили непосредственно в ЦНС. (Пример 1, фиг. 2)
Авторы изобретения дополнительно исследовали данные по распределению Соединения I в организме крыс и мышей и отметили, что имела место гораздо более высокая концентрация (в 17 раз больше) в плазме крови, чем в головном мозге. Исследование распределения у мышей, нокаутированных по переносчику P-гликопротеина ("P-gp") выявило, что проникновение из крови в головной мозг повышалось от около 7 до около 19-раз. (Пример 1). Полученные данные показали авторам изобретения, что Соединение I переносилось из ЦНС посредством P-gp переносчика, и что соединение у грызунов по существу распределялось по периферии.
Важно, что авторы изобретения дополнительно определили эффективную дозу Соединения I для лечения ОИЗ или ОДК у людей с использованием множественных подходов, описанных ниже, на основании фармакокинетических и фармакологических данных для Соединения I и для высоко распределяемого по периферии антагониста опиоидных рецепторов алвимопана. Во всех случаях рассчитанная эффективная доза Соединения I для лечения ОИЗ или ОДК была неожиданно существенно ниже дозы, которая влияет на ЦНС, что определяли измеряемыми эффектами на человеческие фармакодинамические маркеры в отношении антагонизма к опиоидным рецепторам в ЦНС. Следовательно, авторы изобретения обнаружили, что Соединение I является эффективным опиоидным антагонистом, который в очень низких дозах достаточно распределяется у людей на периферии, чтобы быть применимым для лечения ОИЗ или ОДК и других состояний, описанных в настоящем описании, где очень желательно селективное ингибирование опиоидных рецепторов на периферии, в противоположность ингибирования и периферических опиоидных рецепторов и рецепторов в ЦНС.
Предварительные результаты клинического исследования I фазы многократных нарастающих доз, проводимого с Соединением I у пациентов с ОИЗ, возникающим в результате хронической терапии опиоидами, показало, что такие низкие дозы, как 0,10 мг и 0,25 мг хорошо переносились и давали желаемые фармакологические эффекты.
4. КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
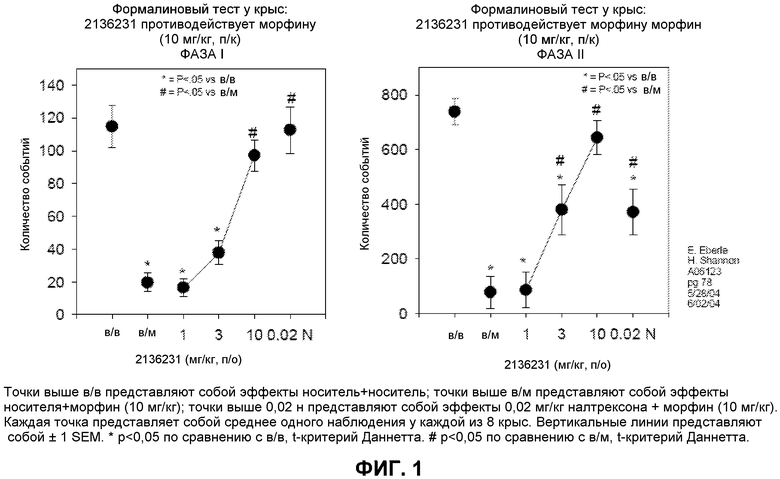
Фиг. 1: Результаты формалинового теста у крыс. Антагонист опиоидных рецепторов центрального действия налтрексон (вводимый подкожно) оказался более чем в 100 раз более эффективным, чем Соединение I (2136231, вводимое перорально) в обратном развитии опиоидного обезболивания у крыс.
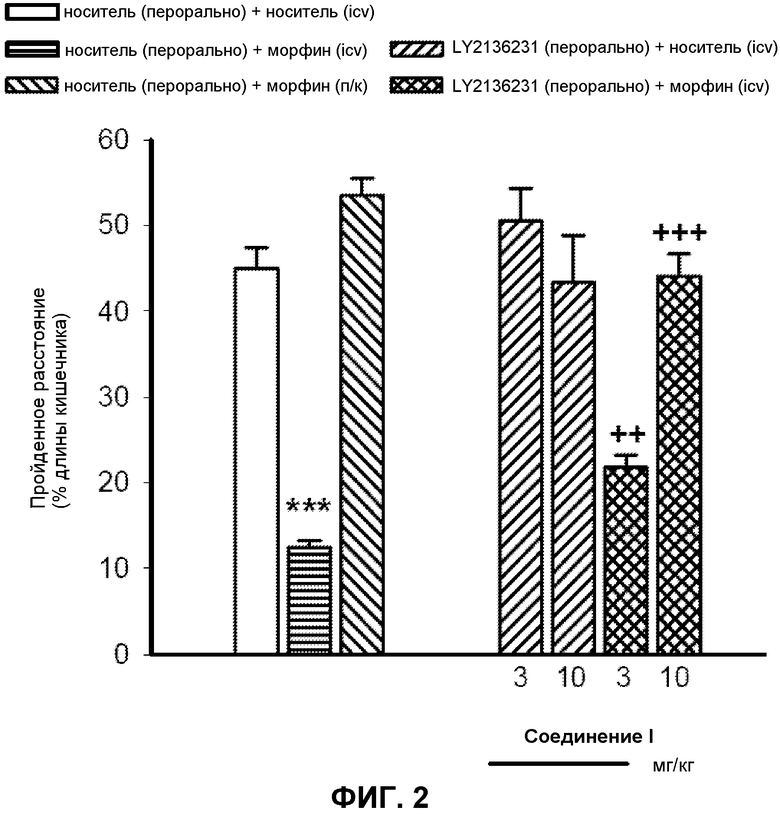
Фиг. 2: Результаты перорального введения Соединения I на обратное развитие ингибирования желудочно-кишечного (ЖК) транзита у мышей, вызываемого интрацеребровентрикулярным (непосредственно в ЦНС) введением морфина. Минимальная эффективная доза Соединения I, требуемая для начала обратного развития ингибирующего эффекта вводимого центрально морфина на транзит ЖК составила около 3,0 мг/кг.
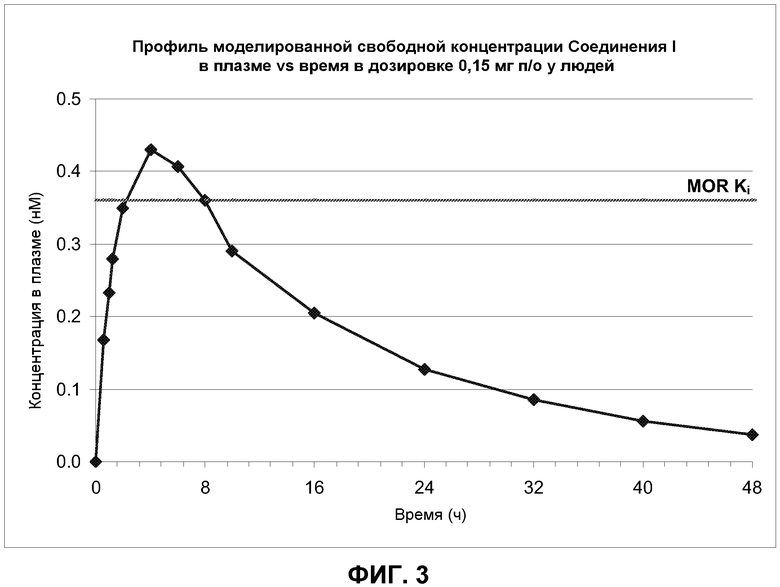
Фиг. 3: Моделированный профиль свободного Соединения I, даваемого в виде 0,15 мг пероральной дозы, в плазме относительно времени у людей. "MOR Ki” (сплошная горизонтальная линия) представляет собой измеренную Ki Соединения I для человеческого μ-опиоидного рецептора.
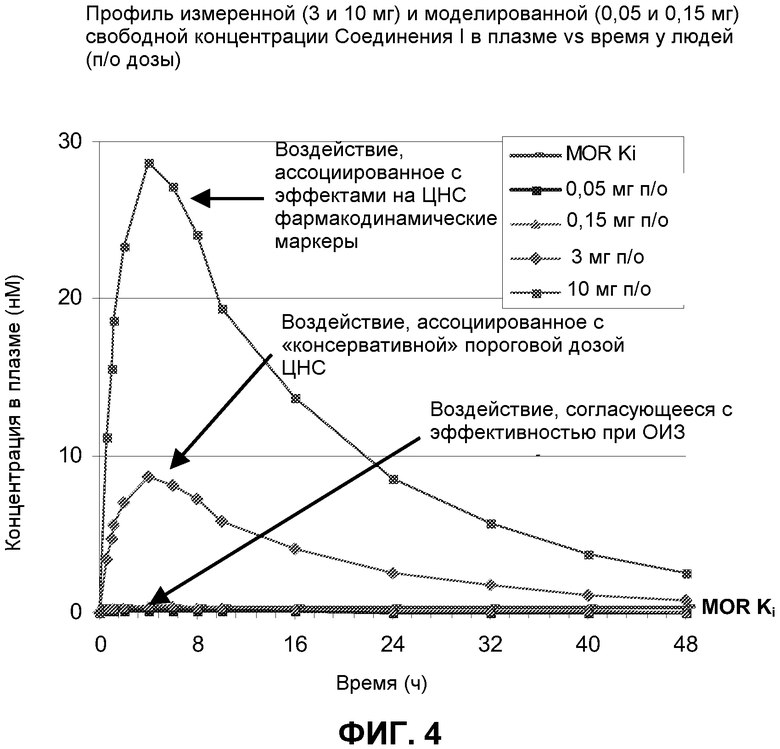
Фиг. 4: Измеренный (3 мг и 10 мг) и смоделированный (0,15 мг и 0,05 мг) свободного Соединения I, даваемого людям в указанных дозах, в плазме относительно времени. MOR Ki” (сплошная горизонтальная линия) представляет собой измеренную Ki Соединения I для человеческого μ-опиоидного рецептора.
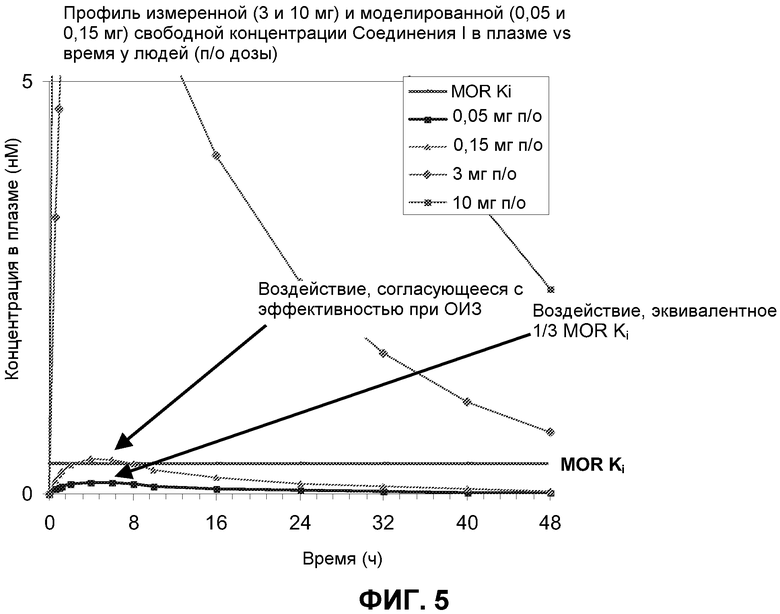
Фиг. 5: (Расширение Y-оси Фиг. 4): Измеренный (3 мг и 10 мг) и смоделированный (0,15 мг и 0,05 мг) профиль свободного Соединения I, даваемого людям в указанных дозах, в плазме относительно времени. “MOR Ki” (сплошная горизонтальная линия) представляет собой измеренную Ki Соединения I для человеческого μ-опиоидного рецептора.
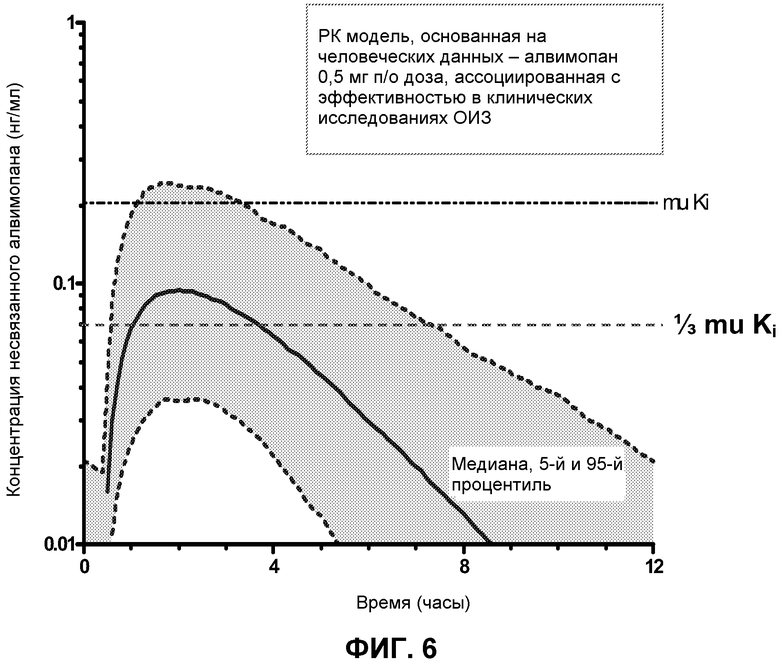
Фиг. 6: Профиль свободного Алвимопана в плазме относительно времени (моделирование на основании данных) у пациентов с ОИЗ для пероральной дозы 0,5 мг, т.е. дозы, ассоциированной с эффективностью в клинических исследованиях.
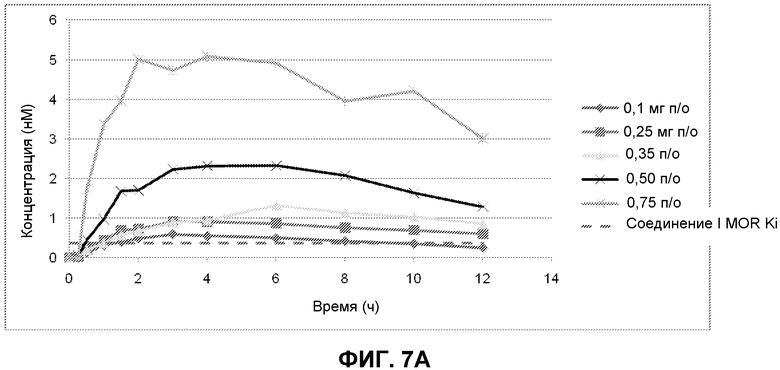
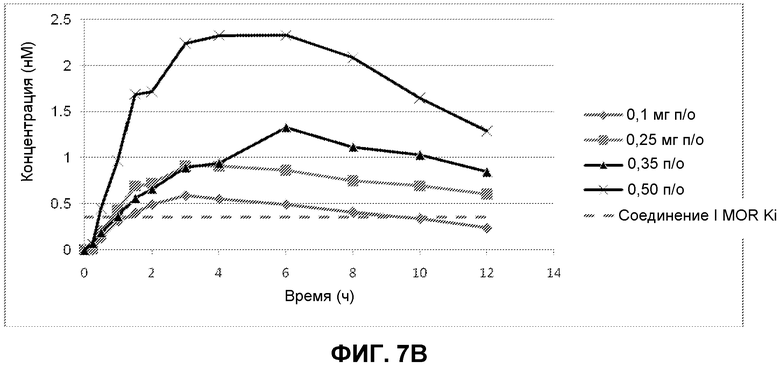
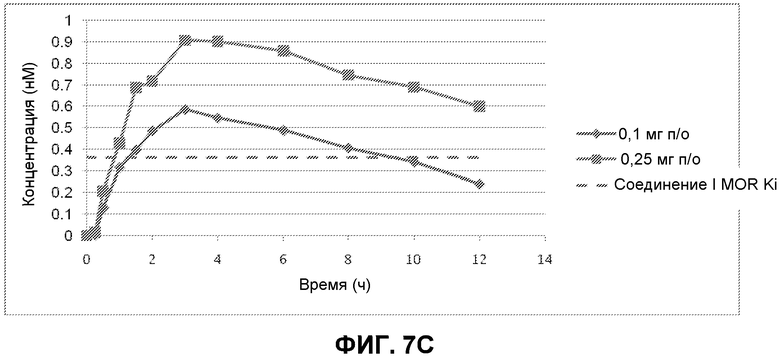
Фиг. 7A-7C: Профили концентрации Соединения I в плазме относительно времени, измеренные в клиническом исследовании I фазы пациентов с ОИЗ в течение интервала введения 12 часов. Уровни Соединения I в плазме измеряли через 15 мин, 30 мин, 60 мин, 90 мин, 2 ч, 3 ч, 4 ч, 6 ч, 8 ч, 10 ч и 12 ч после первого введения. Измеренная MOR Ki Соединения I показана пунктирной линией. Фиг. 7A показывает уровни Соединения I в плазме пациентов для каждой из исследуемых пяти доз. На фиг. 7B показаны уровни Соединения I в плазме пациентов, которым вводили 0,1 мг, 0,25 мг, 0,35 мг и 0,50 мг Соединения I. На фиг. 7C показаны уровни Соединения I в плазме пациентов, которым вводили 0,1 мг и 0,25 мг Соединения I.
5. ПОДРОБНОЕ ОПИСАНИЕ
Настоящее описание относится к способам селективной модуляции активности μ- , δ- и/или κ-опиоидных рецепторов на периферии по сравнению с ЦНС, включающим контакт μ-, δ- и/или κ-опиоидных рецепторов с эффективным количеством 5-(2-метокси-4-{[2-(тетрагидропиран-4-ил)этиламино]метил}фенокси)пиразин-2-карбоксамида (Соединение I). Соединение I ранее было описано как сильный центрально активный опиоидный антагонист. См. Патент США No. 7381719, который таким образом включен в виде ссылки полностью. В различных вариантах осуществления изобретения настоящее описание относится к способам лечения или профилактики состояния, ассоциированного с активацией μ-, δ- и/или κ-опиоидных рецепторов на периферии. В определенных вариантах осуществления изобретения описание относится к способам лечения или профилактики состояния, ассоциированного с активацией μ-опиоидных рецепторов на периферии.
В некоторых вариантах осуществления изобретения настоящее описание относится к способам лечения или профилактики расстройств желудочно-кишечного тракта путем введения пациенту терапевтически эффективного количества Соединения I, или его фармацевтически приемлемой соли. В частности, настоящее описание относится к способам лечения или профилактики расстройств желудочно-кишечного тракта у пациента, возникающих в результате применения опиоидных анальгетиков, без уменьшения обезболивания или развития центральной отмены опиоидов, которые включают введение пациенту терапевтически эффективного количества Соединения I, или его фармацевтически приемлемой соли. В некоторых специфических вариантах осуществления изобретения настоящее описание относится к способам лечения или профилактики ОИЗ у пациента без уменьшения обезболивания, обеспечиваемого опиоидным агонистом, или развития центральной отмены опиоидов, включающим введение пациенту терапевтически эффективного количества Соединения I или его фармацевтически приемлемой соли. В различных вариантах осуществления изобретения настоящее описание относится к способам лечения или профилактики ОДК у пациента без уменьшения обезболивания, обеспечиваемого опиоидным агонистом, или развития центральной отмены опиоидов, включающим введение пациенту терапевтически эффективного количества Соединения I, или его фармацевтически приемлемой соли.
В различных вариантах осуществления изобретения настоящее описание относится к применению Соединения I для получения лекарственного средства для селективной модуляции активности μ-, δ- и/или κ-опиоидных рецепторов на периферии, по сравнению с ЦНС. В различных вариантах осуществления изобретения настоящее описание относится к применению Соединения I для получения лекарственного средства для лечения или профилактики состояния, ассоциированного с активацией μ-, δ- и/или κ-опиоидных рецепторов на периферии. В определенных вариантах осуществления изобретения описание относится к применению Соединения I для получения лекарственного средства для лечения или профилактики состояния, ассоциированного с активацией μ-опиоидных рецепторов на периферии.
В определенных вариантах осуществления изобретения настоящее описание относится к применению эффективного количества Соединения I или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или профилактики заболеваний желудочно-кишечного тракта у пациента. В частности настоящее описание относится к применению Соединения I или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или профилактики желудочно-кишечных расстройств у пациента, возникающих в результате применения опиоидных анальгетиков, без уменьшения обезболивания или развития центральной отмены опиоидов. В некоторых специфических вариантах осуществления изобретения настоящее описание относится к применению Соединения I для получения лекарственного средства для лечения или профилактики ОИЗ у пациента без уменьшения обезболивания, обеспечиваемого опиоидными агонистами, или развития центральной отмены опиоидов. В некоторых специфических вариантах осуществления изобретения настоящее описание относится к применению Соединения I для получения лекарственного средства для лечения или профилактики ОДК у пациента без уменьшения обезболивания, обеспечиваемого опиоидными агонистами, или развития центральной отмены опиоидов.
Фразы "лечение", "процесс лечения", и подобные включают облегчение или прекращение состояния или его симптома, а также ускорение выздоровления от состояния. В одном варианте осуществления изобретения лечение включает ингибирование, например, снижение общей частоты эпизодов состояния или его симптомов.
Фразы "предотвращение", "профилактика", и подобные включают предупреждение развития состояния или его симптомов.
Термин "пациент" включает, но не ограничивается, человека или нечеловекообразное животное, такое как, например, корова, мартышка, павиан, шимпанзе, лошадь, овца, свинья, курица, индейка, перепелка, кошка, собака, мышь, крыса, кролик или морская свинка.
Термин "опиоид", как используется в настоящем описании, относится к классу веществ для лечения боли, который включает натуральные или синтетические соединения, которые связываются с и являются агонистами одного или более μ-, δ- и κ-опиоидных рецепторов.
5.1. Соединение по формуле I
В определенных вариантах осуществления изобретения настоящее описание относится к способу лечения или профилактики состояния у пациента, ассоциированного с активацией периферических опиоидных рецепторов, включающему введение пациенту эффективного количества 5-(2-метокси-4-{[2-(тетрагидропиран-4-ил)этиламино]метил}фенокси)пиразин-2-карбоксамида, имеющего структуру, показанную на формуле (I):
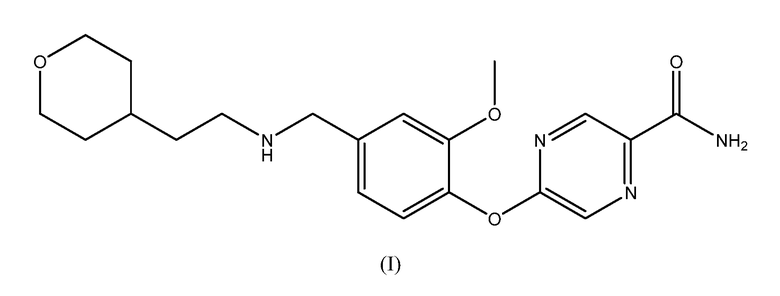
или его фармацевтически приемлемой соли.
Фраза "фармацевтически приемлемая соль", как используется в настоящем описании, представляет собой любую соль, которая может быть получена из Соединения I, включая соль, образованную из основной функциональной группы Соединения I, такой как азотная группа. Иллюстративные соли включают, но не ограничиваются, сульфат, цитрат, ацетат, трифторацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малат, малеат, гентисинат, фумарат, глюконат, глюкуронат, сахарат, формат, бензоат, глютамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, и памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Специалист в области техники понимает, что аддитивные соли кислот Соединения I могут быть получены путем реакции соединений с соответствующей кислотой посредством множества известных способов.
В определенных вариантах осуществления изобретения описание относится к другим формам Соединения I, таким как пролекарства, радиоактивно меченные формы, сольваты (например, гидраты, или аддитивные соединения, которые содержат кислоту в избытке количества основных атомов азота из-за водородных связей), аморфные солидные формы и кристаллические солидные формы.
Соединение I может быть получено любым способом, известным в области техники. В определенных вариантах осуществления изобретения Соединение I может быть синтезировано с использованием исходных материалов 5-(4-формил-2-метоксифенокси)пиразин-2-карбоксамида и 2-(тетрагидропиран-4-ил)этиламина и протокола и реагентов, указанных в Примере 720 патента США No. 7381719, который таким образом включен в виде ссылки полностью.
5.2. Терапевтическое применение
Благодаря своей активности в качестве периферически-селективного антагониста опиоидных рецепторов, Соединение I преимущественно, применяют у людей и в ветеринарии для лечения или профилактики состояния, которое может быть облегчено селективным антагонизмом в отношении опиоидных рецепторов на периферии. Соединение I можно вводить любому пациенту, требующему ингибирования периферических опиоидных рецепторов. В некоторых вариантах осуществления изобретения Соединение I преимущественно применяют для лечения или профилактики состояния, которое может быть облегчено селективным антагонизмом в отношении периферических μ-опиоидных рецепторов. В различных вариантах осуществления изобретения Соединение I применяют для лечения или профилактики состояния, выбираемого из, но не ограничиваясь, послеоперационной непроходимости кишечника, послеоперационной тошноты и рвоты, опиоид-индуцированной тошноты и рвоты, опиоид-индуцированного подавления дыхания, опиоид-индуцированного запора, опиоид-индуцированной дисфункции кишечника, хронического идиопатического запора, синдрома раздраженного кишечника с преобладанием запора, псевдообструкции кишечника, отложенного опорожнения желудка, непереносимости энтерального питания, наркотической непроходимости кишечника, кишечной непроходимости, ускорения желудочно-кишечного восстановления после операции и опиоид-индуцированного вздутия. В некоторых предпочтительных вариантах осуществления изобретения Соединение I применяют для лечения или профилактики расстройств моторики желудочно-кишечного тракта у пациента. В определенных вариантах осуществления изобретения пациентом является человек.
В некоторых вариантах осуществления изобретения благодаря его сильного и селективного антагонизма в отношении периферических опиоидных рецепторов по сравнению с центральными опиоидными рецепторами, Соединение I применяют для лечения или профилактики состояния у пациента, возникающего в результате применения опиоидов, без уменьшения их обезболивающего эффекта или развития центральной отмены. В определенных вариантах осуществления изобретения, Соединение I применяют для лечения или профилактики ОИЗ без уменьшения обезболивающего эффекта опиоидов или развития центральной отмены опиоидов. В некоторых вариантах осуществления изобретения, Соединение I применяют для лечения или профилактики ОДК без уменьшения обезболивающих эффектов опиоидов или развития центральной отмены опиоидов.
5.3. Терапевтические композиции и способы введения
При введении пациенту Соединение I можно вводить как компонент композиции, которая включает фармацевтически приемлемый носитель или вспомогательное вещество. Композиции, включающие Соединение I, можно вводить перорально. Композиции также можно вводить любым другим удобным путем, например, путем инфузии или болюсной инъекции, путем абсорбции через эпителиальные или кожно-слизистые покровы (например, слизистую полости рта, прямой кишки и кишечника и др.) и можно вводить вместе со вторым терапевтически активным веществом (например, слабительным, размягчителем стула или опиоидным анальгетиком). Введение может быть системным или локальным. Известны различные системы доставки, например, инкапсуляция в липосомы, микрочастицы, микрокапсулы, множества частиц, капсулы и др. могут использоваться для введения Соединения I.
Способы введения включают, но не ограничиваются, внутрикожный, внутримышечный, интраперитонеальный, парентеральный, внутривенный, подкожный, интраназальный, пероральный, сублингвальный, трансдермальный, ректальный, путем ингаляции или местный. В большинстве случаев введение приводит к высвобождению Соединения I в кровоток. В предпочтительных вариантах осуществления изобретения введение не приводит к высвобождению в ЦНС в фармакологически значимых концентрациях.
Легочное введение также может использоваться, например, с использованием ингалятора или небулайзера, и композиции с аэрозольным веществом или посредством перфузии во фторуглероде или синтетическом легочном сурфактанте. В определенных вариантах осуществления изобретения, Соединение I может быть рецептировано в виде суппозитория, с традиционными наполнителями и вспомогательными веществами, такими как триглицериды.
Когда Соединение I включают для парентерального введения путем инъекции (например, непрерывной инфузии или болюсной инъекции), композиция для парентерального ведения может быть в форме суспензии, раствора, эмульсии в масляном или водном носителе и такие композиции могут дополнительно включать фармацевтически необходимые добавки, такие как один или более стабилизирующих агентов, диспергирующих агентов и подобных. Соединение I также может находиться в форме порошка для восстановления в виде инъекционной композиции.
В другом варианте осуществления изобретения Соединение I можно доставлять в пузырьке, в частности липосоме (см. Langer, Science 249: 1527-1533 (1990); и Treat et al., Liposomes in the Therapy of Infectious Disease and Cancer 317-327 and 353-365 (1989)).
В еще одном варианте осуществления изобретения Соединение I можно доставлять в системе с контролируемым высвобождением или системе с непрерывным высвобождением (см., например, Goodson, "Dental Applications" (pp. 115-138) in Medical Applications of Controlled Release, Vol. 2, Applications and Evaluation, R.S. Langer and D.L. Wise eds., CRC Press (1984)). Могут быть использованы другие системы с контролируемым или непрерывным высвобождением, обсуждаемые в обзоре Langer, Science 249: 1527-1533 (1990). В одном варианте осуществления изобретения может быть использован насос (Langer, Science 249: 1527-1533 (1990); Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al, Surgery 88:507 (1980); и Saudek et al., N. Engl. J. Med. 321:574 (1989)). В другом варианте осуществления изобретения могут быть использованы полимерные материалы (см. Medical Applications of Controlled Release (Langer and Wise eds., 1974); Controlled Drug Bioavailability, Drug Product Design and Performance (Smolen and Ball eds., 1984); Ranger and Peppas, J. Macromol. Sci. Rev. Macromol. Chem. 23:61 (1983); Levy et al, Science 228: 190 (1985); During et al, Ann. Neurol. 25:351 (1989); и Howard et al, J. Neurosurg. 71: 105 (1989)).
Композиции могут необязательно включать подходящее количество фармацевтически приемлемого вспомогательного вещества, чтобы обеспечить форму для соответствующего введения пациенту. Таким фармацевтическим вспомогательным веществом может быть разбавитель, суспендирующий агент, растворитель, вяжущее вещество, дезинтегрирующее вещество, консервант, краситель, смазывающее вещество и подобные. Фармацевтическое вспомогательное вещество может быть жидкостью, такой как вода или масло, включая таковые нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и подобные. Фармацевтическим вспомогательным веществом может быть солевой раствор, гуммиарабик, желатин, паста крахмала, тальк, кератин, коллоидный диоксид кремния, мочевина и подобные. Кроме того, могут быть использованы добавочные, стабилизирующие, загущающие, смазывающие и красящие средства. В одном варианте осуществления изобретения фармацевтически приемлемое вспомогательное вещество является стерильным при введении пациенту. Вода является особенно применимым вспомогательным веществом, когда Соединение по формуле (I) вводят внутривенно. Солевые растворы и водный раствор декстрозы и глицерин также могут использоваться в качестве жидких вспомогательных веществ, особенно для инъекционных растворов. Подходящие фармацевтические вспомогательные вещества также включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропиленгликоль, воду, этанол и подобные. Композиции, при желании, также могут содержать минорные количества увлажняющих или эмульгирующих веществ, или рН буферных веществ. Специфические примеры фармацевтически приемлемых носителей и вспомогательных веществ, которые могут быть использованы для рецептирования пероральных лекарственных форм, описаны в Handbook of Pharmaceutical Excipients, American Pharmaceutical Association (1986).
Композиции, включающие Соединение I, могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, гранул, капсул, капсул, содержащих жидкости, порошков, композиций с непрерывным высвобождением, суппозиториев, эмульсий, аэрозолей, спреев, суспензий, сублингвальных разлагающихся лекарственных форм или любых других форм, подходящих для применения. В одном варианте осуществления изобретения композиция находится в форме капсулы (см., например, патент США No. 5698155). Другие примеры подходящих фармацевтических вспомогательных веществ описаны в Remington's Pharmaceutical Sciences 1447-1676 (Alfonso R. Gennaro ed., 19th ed. 1995), включенном в настоящее описание в виде ссылки.
В некоторых вариантах осуществления изобретения Соединение I рецептируют в соответствии с обычными методиками, как композицию, адаптированную для перорального введения людям. Соединение I для перорального введения может быть в форме таблеток, капсул, гелевых капсул, каплетов, пастилок, сублингвальных рассасывающихся твердых лекарственных форм, водных или масляных растворов, суспензий, гранул, порошков, эмульсий, сиропов или эликсиров, например. Когда Соединение I включают в пероральные таблетки, такие таблетки могут быть прессованными таблетками, растертыми таблетками (например, порошковые или разрушенные таблетки), таблетками, покрытыми кишечнорастворимой оболочкой, таблетками, покрытыми сахаром, таблетками, покрытыми пленкой, множественно прессованными таблетками или многослойными таблетками. Методики и композиции для получения твердых лекарственных форм описаны в Pharmaceutical Dosage Forms: Tablets (Lieberman, Lachman and Schwartz, eds., 2nd ed.) опубликованном Marcel Dekker, Inc. Методики и композиции для получения таблеток (прессованных и литых), капсул (твердых и мягких желатиновых) и пилюль также описаны в Remington's Pharmaceutical Sciences 1553-1593 (Arthur Osol, ed., 16th ed., Mack Publishing, Easton, PA 1980).
Жидкие пероральные лекарственные формы включают водные и неводные растворы, эмульсии, суспензии и растворы и/или суспензии, восстанавливаемые из нешипучих гранул, необязательно содержащие один или более подходящих растворителей, консервантов, эмульгирующих средств, суспендирующих средств, разбавителей, подсластителей, красителей, ароматизаторов и подобных. Методики и композиции для получения жидких пероральных лекарственных форм описаны в Pharmaceutical Dosage Forms: Disperse Systems, (Lieberman, Rieger and Banker, eds.), опубликованном Marcel Dekker, Inc.
Перорально вводимая композиция может содержать одно или более средств, например, подсластителей, таких как фруктоза, аспартам или сахарин; ароматизаторов, таких как мята перечная, винтергриновое масло или вишня; красителей; и консервантов для обеспечения фармацевтически приятной на вкус композиции. Более того, имея форму таблеток или пилюль, композиции могут быть покрыты оболочкой для замедления разложения и абсорбции в желудочно-кишечном тракте, таким образом обеспечивая непрерывное действие в течение длительного периода времени. Селективно проницаемые мембраны, окружающие осмотически активное движущееся соединение, также являются подходящими для перорально вводимых композиций. В таких последних случаях жидкость из окружающей капсулу среды пропитывает движущееся соединение, которое набухает, вытесняя вещество или композицию вещества через отверстия. Такие системы доставки могут обеспечивать профиль доставки по существу нулевого порядка в противоположность пиковым профилям композиций с немедленным высвобождением. Задерживающий по времени материал, такой как моностеарат глицерина или стеарат глицерина, также может быть использован. Пероральные композиции могут включать стандартные вспомогательные вещества, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза и карбонат магния. В одном варианте осуществления изобретения вспомогательные средства имеют фармацевтическую категорию.
Перорально вводимые композиции могут быть рецептированы так, чтобы высвобождать активный ингредиент в нижнем отделе желудочно-кишечного тракта и, особенно, в толстой кишке. Такие лекарственные формы для высвобождения активного ингредиента в толстой кишке могут включать полимеры, имеющие pH-зависимую растворимость, которые растворяются при pH толстой кишки, но не при рН тонкой кишки; полимеры, которые имеют медленную или pH-зависимую скорость набухания, растворения или разложения, так что лекарственная форма растворяется в толстой кишке скорее, чем в тонкой кишке; полимеры, которые разлагаются микробными ферментами в толстой кишке; или полимеры, которые образуют слой, который разрушается повышенным давлением в просвете, вызванным перистальтическими волнами. В других вариантах осуществления изобретения композиции включают капсулы гидроксипропилметилцеллюлозы, покрытые оболочкой из материалов, которые обеспечивают высвобождение в толстой кишке, такие как описанные в патенте США No. 7094425. Еще одни композиции для высвобождения в толстой кишке описаны в патенте США No. 6368629 и включают лекарственные формы, которые покрыты кислотолабильной оболочкой, которая растворяется энтеробактериями.
Когда Соединение I необходимо вводить парентерально, оно может находиться, например, в форме изотонического стерильного раствора. Альтернативно, когда Соединение I предназначено для ингаляций, оно может быть рецептировано в сухом аэрозоле или может быть рецептировано в водном или частично водном растворе.
В другом варианте осуществления изобретения Соединение I может быть рецептировано для внутривенного введения. Обычно композиции для внутривенного введения включают стерильный изотонический водный буфер. Когда необходимо, композиции также могут включать растворитель. Композиция для внутривенного введения может необязательно включать местный анестетик, такой как бензокаин или прилокаин, для уменьшения боли в месте инъекции. Обычно, ингредиенты поставляются или раздельно или смешанными вместе в стандартной лекарственной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметически закупоренном контейнере, таком как ампула или саше, показывающих количество активного вещества. Когда Соединение I необходимо вводить путем инфузии, оно может поставляться, например, с инфузионной бутылью, содержащей стерильную воду или солевой раствор фармакологического качества. Когда Соединение I вводят путем инъекции, может быть обеспечена ампула стерильной воды для инъекций или солевого раствора, так что ингредиенты могут быть смешаны перед введением.
В определенных вариантах осуществления изобретения, Соединение I находится в лекарственной форме вместе с опиоидным анальгетиком. Опиоидные анальгетики, которые могут быть рецептированы с Соединением I, включают, но не ограничиваются, алфентанил, бупренорфин, буторфанол, кодеин, дезоцин, дигидрокодеин, фентанил, гидрокодон, гидроморфон, леворфанол, меперидин (петидин), метадон, морфин, налбуфин, оксикодон, оксиморфон, пентазоцин, пропирам, пропоксифен, суфентанил и трамадол. Другие опиоидные анальгетики для включения в лекарственную форму, содержащую Соединение I, очевидны специалисту в области техники.
5.4. Терапевтические дозировки
Количество Соединения I, которое является эффективным для лечения ОИЗ или ОДК у людей, экстраполировано из фармакокинетических и фармакологических данных с использованием расчетов, основанных на множестве подходов - например, (i) сравнение фармакокинетических и фармакологических данных для Соединения I с фармакокинетическими и фармакологическими данными для распределяемого по периферии антагониста опиоидных рецепторов алвимопана из исследований эффективности у людей при ОИЗ, или (ii) расчеты, основанные на дозировке Соединения I, которая обеспечит максимальные свободные концентрации в плазме (Cmax), равные или более чем Ki Соединения I для μ-опиоидного рецептора, как указано ниже в примере 2. С использованием множества подходов, общая дозировка Соединения I, которая является эффективной в лечении ОИЗ или ОДК без антагонизма в отношении μ-опиоидных рецепторов в ЦНС и, следовательно, уменьшения опиоидного обезболивания или развития центральной отмены опиоидов, рассчитывали как приблизительно 0,1 мг/день, для введения или один или два раза в сутки. Количество Соединения I, эффективное для лечения ОИЗ или ОДК, которое экстраполируется из фармакокинетических и фармакологических данных, как описано выше, подтверждали в клинических исследованиях I фазы у пациентов с ОИЗ как приблизительно 0,1 мг/сутки.
В определенных вариантах осуществления изобретения крайняя доза, т.е. кратность различия между рассчитанной эффективной дозой Соединения I для лечения ОИЗ или ОДК и средней эффективной дозой, определяемой путем экспериментов, требуемых для противодействия эффектам морфина в ЦНС, составляет от около 25 до около 83. См. пример 2. Соответственно было обнаружено, что в низких дозах, требуемых для лечения ОИЗ или ОДК, Соединение I значительно распределяется на периферии и, следовательно, маловероятно, чтобы оно влияло на опиоидное обезболивание или вызывало центральную отмену опиоидов.
Подходящие эффективные дозировки для лечении ОИЗ или ОДК или других состояний, описанных в настоящем описании, у среднего мужчины (например, массой около 70 кг), варьируются от около 0,01 мг до около 1,5 мг дозы, полученной всем организмом, в сутки. В определенных вариантах осуществления изобретения подходящие эффективные дозировки варьируются от около 0,02 мг до около 1,25 мг дозы, полученной всем организмом, в сутки, например, от около 0,03 мг до около 1,0 мг дозы, полученной всем организмом, в сутки, например, от около 0,04 мг до около 0,75 мг дозы, полученной всем организмом, в сутки, например, от около 0,05 до около 0,5 мг дозы, полученной всем организмом, в сутки.
В определенных вариантах осуществления изобретения подходящая эффективная дозировка варьируется от около 0,1 до около 1 мг дозы, полученной всем организмом, в сутки. В различных вариантах осуществления изобретения подходящая эффективная дозировка варьируется от около 0,1 до около 0,75 мг дозы, полученной всем организмом в сутки, например, от около 0,1 до около 0,5 мг дозы, полученной всем организмом в сутки, например, от около 0,1 до около 0,35 мг дозы, полученной всем организмом в сутки, например, от около 0,1 до около 0,25 мг дозы, полученной всем организмом в сутки.
В различных вариантах осуществления изобретения подходящие эффективные дозировки варьируются от около 0,01 мг до около 1,0 мг дозы, полученной всем организмом в сутки, например, от около 0,02 мг до около 0,9 мг дозы, полученной всем организмом в сутки, например, от около 0,03 мг до около 0,8 мг дозы, полученной всем организмом в сутки, например, от около 0,04 мг до около 0,7 мг дозы, полученной всем организмом в сутки, например от около 0,05 мг до около 0,6 мг дозы, полученной всем организмом в сутки, например, от около 0,06 мг до около 0,5 мг дозы, полученной всем организмом в сутки, например, от около 0,07 мг до около 0,4 мг дозы, полученной всем организмом в сутки, например от около 0,08 мг до около 0,3 мг дозы, полученной всем организмом в сутки.
В еще дополнительных вариантах осуществления изобретения подходящие эффективные дозировки для лечения ОИЗ или ОДК или других состояний, описанных в настоящем описании у среднего мужчины (например, массой около 70 кг) варьируются от около 0,05 мг до около 0,5 мг дозы, полученной всем организмом в сутки, например, от около 0,06 мг до около 0,25 мг дозы, полученной всем организмом в сутки, например, от около 0,07 мг до около 0,2 мг дозы, полученной всем организмом в сутки, например, от около 0,08 мг до около 0,15 мг дозы, полученной всем организмом в сутки.
В различных вариантах осуществления изобретения подходящая эффективная дозировка для лечения ОИЗ или ОДК или других состояний, описанных в настоящем описании, у среднего мужчины (например, массой около 70 кг) варьируется от около 0,01 мг до около 0,5 мг дозы, полученной всем организмом два раза в сутки (BID), например, от около 0,02 мг до около 0,45 мг дозы, полученной всем организмом два раза в сутки, например, от около 0,03 мг до около 0,4 мг дозы, полученной всем организмом два раза в сутки, например, от около 0,04 мг до около 0,35 мг дозы, полученной всем организмом два раза в сутки, например, от около 0,05 мг до около 0,3 мг дозы, полученной всем организмом два раза в сутки, например, от около 0,06 мг до около 0,25 мг дозы, полученной всем организмом два раза в сутки, например, от около 0,07 мг до около 0,2 мг дозы, полученной всем организмом два раза в сутки, например, от около 0,08 мг до около 0,15 мг дозы, полученной всем организмом два раза в сутки.
Подходящие эффективные дозировки для лечения ОИЗ или ОДК или других состояний, описанных в настоящем описании, варьируются от около 0,0001 мг/кг/сутки до около 0,02 мг/кг/сутки. В определенных вариантах осуществления изобретения подходящие эффективные дозировки варьируются от около 0,0003 мг/кг/сутки до около 0,017 мг/кг/сутки, например, от около 0,0004 мг/кг/сутки до около 0,014 мг/кг/сутки, например, от около 0,0005 мг/кг/сутки до около 0,01 мг/кг/сутки, например, от около 0,0007 мг/кг/сутки до около 0,007 мг/кг/сутки.
В различных вариантах осуществления изобретения подходящие эффективные дозировки варьируются от около 0,0001 мг/кг/сутки до около 0,014 мг/кг/сутки, например, от около 0,0003 мг/кг/сутки до около 0,013 мг/кг/сутки, например, от около 0,0004 мг/кг/сутки до около 0,011 мг/кг/сутки, например, от около 0,0006 мг/кг/сутки до около 0,01 мг/кг/сутки, например, от около 0,0007 мг/кг/сутки до около 0,009 мг/кг/сутки, например, от около 0,0009 мг/кг/сутки до около 0,007 мг/кг/сутки, например, от около 0,001 мг/кг/сутки до около 0,006 мг/кг/сутки, например, от около 0,001 мг/кг/сутки до около 0,004 мг/кг/сутки.
В других вариантах осуществления изобретения подходящие дозировки для лечения ОИЗ или ОДК или других состояний, описанных в настоящем описании, варьируются от около 0,0007 мг/кг/сутки до около 0,007 мг/кг/сутки, например, от около 0,0009 мг/кг/сутки до около 0,004 мг/кг/сутки, например, от около 0,001 мг/кг/сутки до около 0,003 мг/кг/сутки, например, от около 0,001 мг/кг/сутки до около 0,002 мг/кг/сутки.
В различных вариантах осуществления изобретения подходящие эффективные дозировки для лечения ОИЗ или ОДК или других состояний, описанных в настоящем описании, варьируются от около 0,00015 мг/кг до около 0,007 мг/кг два раза в сутки, например, от около 0,0003 мг/кг до около 0,006 мг/кг два раза в сутки, например, от около 0,0004 мг/кг до около 0,004 мг/кг два раза в сутки, например, от около 0,0006 мг/кг до около 0,005 мг/кг два раза в сутки, например, от около 0,0007 мг/кг до около 0,004 мг/кг два раза в сутки, например, от около 0,0009 мг/кг до около 0,004 мг/кг два раза в сутки, например, от около 0,001 мг/кг до около 0,003 мг/кг два раза в сутки, например, от около 0,001 мг/кг до около 0,002 мг/кг два раза в сутки.
В определенных вариантах осуществления изобретения Соединение I вводят пациенту, который чувствителен к его эффектам и, следовательно, таким образом требует более низкой дозы для получения эффекта в лечении состояния, как описано в настоящем описании. В некоторых вариантах осуществления изобретения более низкая эффективная доза дает свободную концентрацию Соединения I в плазме, которая составляет около 0,75Ki. В других вариантах осуществления изобретения более низкая эффективная доза дает свободную концентрацию в плазме, которая составляет около 0,5 Ki. В дополнительных вариантах осуществления изобретения более низкая эффективная доза дает свободную концентрацию в плазме, которая составляет около 0,33Ki. В еще дополнительных вариантах осуществления изобретения более низкая эффективная дозировка дает свободную концентрацию в плазме Соединения I, которая составляет около 0,75Kb. В еще дополнительных вариантах осуществления изобретения более низкая эффективная доза дает свободную концентрацию в плазме, которая составляет около 0,5Kb. В различных вариантах осуществления изобретения более низкая эффективная доза дает концентрацию в плазме, которая составляет около 0,33Kb.
Понимают, что количество Соединения I, которое является эффективным для лечения или профилактики состояния, описанного в настоящем описании, может быть определено стандартными клиническими методиками. Кроме того, исследования in vitro и/или in vivo необязательно могут быть использованы для улучшения идентификации оптимальных диапазонов дозировок. Точная используемая дозировка также будет зависеть, например, от пути введения, композиции, выраженности заболевания, и уровня наркотического обезболивания, и может быть определена в соответствии с мнением практикующего врача и/или обстоятельств каждого пациента. В других примерах варианты обязательно возникают в зависимости от, среди других факторов, массы и физического состояния (например, функции печени и почек, тяжести основного заболевания) пациенту, получающего лечение, заболевания, подвергаемого лечению, тяжести симптомов, частоты интервала введения и наличия каких-либо опасных побочных эффектов.
Понятно, что в некоторых вариантах осуществления изобретения дозировку в сутки можно вводить в виде разовой дозы. В других вариантах осуществления изобретения суточную дозировку можно вводить в виде поделенной дозы. В других вариантах осуществления изобретения дозу Соединения I можно вводить по необходимости (PRN).
В определенных вариантах осуществления изобретения Соединение I вводят перед или после введения опиоидного анальгетика. В других вариантах осуществления изобретения Соединение I вводят одновременно с введением опиоидного анальгетика. В некоторых вариантах осуществления изобретения Соединение I и опиоидный анальгетик можно вводить тем же путем введения (например, перорально). В других вариантах осуществления изобретения Соединение I и опиоидный анальгетик вводят различными путями введения. В определенных вариантах осуществления изобретения, когда Соединение I и опиоидный анальгетик вводят вместе, опиоидный анальгетик и Соединение I вводят в лекарственной форме, содержащей разовую дозу (например, в капсуле, совместно рецептированной таблетке или рассасываемой сублингвальной твердой лекарственной форме).
6. ПРИМЕРЫ
Пример 1: Фармакокинетика и фармакология Соединения I в неклинических моделях
Эффективность Соединения I в ЦНС по сравнению с налтрексоном
Крысам вводили раздражающий формалин и 10 мг/кг морфина подкожно. Степень обезболивания определяли по снижению количества раз, которое крыса лизала или обращала внимание на место введения формалина (события). Крысам вводили или 0,02 мг/кг налтрексона (подкожная доза) или 1, 3 или 10 мг/кг Соединения I (пероральная дозировка) для определения способности соединений отменять обезболивающий эффект морфина. Было обнаружено, что налтрексон приблизительно в 100 раз более эффективен, чем Соединение I в отмене эффектов морфина в ЦНС крыс. (Фиг. 1) Налтрексон и Соединение I имели сравнимое сродство к μ-опиоидным рецепторам. Отдельные эксперименты показали, что Соединение I имеет высокую пероральную биодоступность у крыс. Обратное развитие индуцированного морфином обезболивания посредством антагониста опиоидных рецепторов в формалиновом тесте, вероятно, происходит преимущественно за счет центрально-опосредованного эффекта. Несоответствие эффективности предполагает, что Соединение I имеет существенно более низкий уровень проникновения в ЦНС, чем налтрексон.
Эффект Соединения I в ЦНС и на периферии
Мышам вводили или 10 мкг/кг морфина в желудочки головного мозга или 1 мг/кг морфина подкожно. Степень желудочно-кишечного транзита угольной пищи у мышей измеряли в отсутствие Соединения I и в присутствии различных доз Соединения I, чтобы определить способность Соединения I вызывать обратное развитие ингибирования желудочно-кишечного (ЖК) транзита, индуцированного морфином. Минимальную эффективную дозу Соединения I, требуемую для обратного развития ингибирования ЖК транзита у мышей, которым вводили морфин непосредственно в ЦНС, определяли как пероральную дозу около 3,0 мг/кг. (Фиг.2). Наоборот, эффективная доза Соединения I, требуемая для обратного развития ингибирования ЖК транзита у мышей, которым вводили морфин системно, определяли как пероральную дозу около 0,16 мг/кг. Следовательно, Соединение I было приблизительно в 20 раз более сильным в обратном развитии периферических эффектов морфина в замедлении ЖК транзита по сравнению с центральными эффектами морфина в замедлении ЖК транзита. Это предполагает, что Соединение I было около 20 раз более эффективным в антагонизме в отношении опиоидных рецепторов на периферии, чем в ЦНС.
Распределение Соединения I в плазме и головном мозге мышей дикого типа и нокаутированных по P-гликопротеиновому переносчику
Мышам дикого типа или нокаутированным по P-гликопротеину (P-gp) вводили 2,5 мг/кг Соединения I внутривенно. Мышей умерщвляли и количество Соединения I в крови и в головном мозге оценивали с использованием стандартных методик. Результаты проведенных экспериментов показали, что в плазме крови мышей дикого типа было обнаружено в 17 раз больше Соединения I, чем в головном мозге. Более того, проникновение Соединения I через гематоэнцефалический барьер увеличивалось от 7 до 19 раз у нокаутированных мышей, которые были дефицитны по P-gp переносчику. Результаты проведенных экспериментов показали, что Соединение I активно переносилось из ЦНС посредством P-gp, приводя к статическому выведению Соединения I из ЦНС, и что Соединение I, следовательно, у мышей существенно распределялось на периферии.
Пример 2: Рассчитанная эффективная доза Соединения I для лечения ОИЗ или ОДК у людей и определение достаточности распределения по периферии, при отсутствии влияния на центральное обезболивание или развития центральной отмены опиоидов
Неклинические исследования на животных, описанные выше, показали, что Соединение I проявляет некоторую степень распределения по периферии у мышей и крыс, и дополнительно предварительно обозначили основной механизм(ы), посредством которых Соединение I выводится из ЦНС, т.е. Соединение I является субстратом для выводящего переносчика P-gp. Однако ключевые вопросы представляют собой следующие, являются ли полученные данные значимыми для людей, и какой вклад они могут оказывать на терапевтическое применение Соединения I для лечения состояний у людей.
Главный вопрос представляет собой следующий, является ли Соединение I у людей достаточно распределяемым по периферии, чтобы быть целесообразным для лечения состояний, в частности ОИЗ или ОДК, полагаясь на селективный антагонизм в отношении опиоидных рецепторов на периферии по сравнению с антагонизмом в отношении опиоидных рецепторов в ЦНС, что будет мешать центрально-опосредованному обезболиванию и вызывать неприятные и потенциально опасные симптомы отмены опиоидов. Для решения этой проблемы, необходимо определить следующее: (i) наименьшую дозу ("пороговую дозу") Соединения I, которая дает антагонизм в отношении опиоидных рецепторов в ЦНС; и (ii) дозы Соединения I, которые, вероятно, дают достаточный уровень антагонизма в отношении опиоидных рецепторов в периферических тканях для эффективного лечения ОИЗ или ОДК.
Расчет наименьшей дозы Соединения I, которая дает антагонизм в отношении опиоидных рецепторов в ЦНС
Определение наименьшей дозы Соединения I, которая дает антагонизм в отношении опиоидных рецепторов, осуществляли непосредственно путем изучения сообщаемого эффекта Соединения I на фармакодинамические маркеры антагонизма в отношении центральных опиоидных рецепторов, который оценивали в клинических исследованиях Фазы I с разовой и множеством доз, т.е., обратного развития индуцированного морфином миоза (действие на диаметр зрачка) и увеличение адренокортикотропного гормона (АКТГ) и кортизола. Наблюдаемая доза Соединения I, полученная всем организмом, ассоциированная с пороговым обращением индуцированного морфином миоза, составила 10 мг. Более того, наблюдаемая доза Соединения I, полученная всем организмом, ассоциированная с пороговым увеличением АКТГ и кортизола, составила между 10 и 25 мг. Затем проводили консервативную оценку дозы, полученной всем организмом, для антагонизма в отношении центральных опиоидных рецепторов путем уменьшения таких наблюдаемых пороговых доз с помощью полулогарифмического фактор {т.е., 3-кратно). Следовательно, минимальные дозы Соединения I, ассоциированные с фармакологически значимым антагонизмом в отношении опиоидных рецепторов в ЦНС, были консервативно оценены как находящиеся в диапазоне от около 3 мг до около 10 мг.
Расчет дозы Соединения I, которая ожидаемо даст антагонизм в отношении опиоидных рецепторов в периферических тканях, достаточный для эффективного лечения ОИЗ или ОДК
Существует ряд подходов к определению эффективной дозы Соединения I для лечения ОИЗ или ОДК. Четыре перечислены ниже. В зависимости от подхода делают ряд основных предположений в расчете эффективной дозы Соединения I для лечения ОИЗ или ОДК: (i) μ-опиоидный рецептор является основной мишенью Соединения I для получения эффективности в лечении ОИЗ или ОДК, хотя другие опиоидные рецепторы также могут играть некоторую роль, (ii) Системное присутствие Соединения I на периферии (но не в ЦНС) достаточно для получения устойчивой эффективности в лечении ОИЗ или ОДК. Следовательно, расчеты основаны на системных концентрациях в плазме в противоположность возможным местным или локальным эффектам в ткани кишечника, хотя это также может вносить некоторый вклад в эффективность, (iii) Фармакокинетические свойства, особенно пероральная биодоступность Соединения I будут приблизительно сходными у здоровых добровольцев и у пациентов с ОИЗ или ОДК. (iv) Фармакокинетические параметры (в частности Cmax, период полужизни (t1/2) и площадь под кривой (AUC) для Соединения I продолжают быть дозозависимыми при нисходящем диапазоне доз приблизительно от 1 мг до 0,05 мг. Допущения (iii) и (iv) были целесообразными, т.к. было показано, что Соединение I имеет высоко согласованную и дозозависимую пероральную фармакокинетику в диапазоне доз от 1 мг до 100 мг. Более того, последующие эксперименты показали, что Соединение I имеет приблизительно 100% пероральную биодоступность у зеленых макак в диапазоне доз от 0,1 мг/кг до 0,5 мг/кг.
Первым подходом был подсчет, основанный на сравнении фармакокинетических и фармакологических данных для высоко распределяемого на периферии антагониста опиоидных рецепторов алвимопана. В частности, фармакокинетические и фармакологические данные, определенные для Соединения I, сравнивали с фармакокинетическими и фармакологическими данными для алвимопана, полученными в исследованиях эффективности 2 фазы для лечения пациентов с ОИЗ или ОДК. Webster et al. (2008) Pain 137:428-440. Вопросом, требующим ответа, было, какая доза Соединения I даст сравнимые системные уровни антагонизма в отношении μ-опиоидных рецепторов на периферии, что является функцией афинности двух лекарственных препаратов (Ki) в отношении μ-опиоидных рецепторов, концентраций лекарственных средств (оцениваемых по значениям Cmax) в плазме, и выраженности связывания с белками плазмы. Ki алвимопана и Соединения I определяли путем связывания рецептора in vitro в мембранах клеток CHO, экспрессирующих клонированные человеческие μ-опиоидные рецепторы. Как показано в таблице 1, Ki алвимопана к μ-опиоидным рецепторам составила 0,27 нМ и Ki Соединения I к μ-опиоидным рецепторам составила 0,36 нМ. Средний уровень в плазме свободного алвимопана Cmax после эффективной дозы 0,5 мг два раза в сутки алвимопана пациентам, страдающим от ОИЗ или ОДК в клинических исследованиях 2 фазы измеряли как приблизительно 0,1 нг/мл. Средний свободный уровень в плазме Cmax после 1 мг разовой пероральной дозы Соединения I здоровым лицам измеряли как 1,15 нг/мл. Для таких исходных расчетов свободное лекарственное средство оценивали с использованием связывания с мышиными белками плазмы, как замену связывания с человеческими белками плазмы; последующие экспериментальные данные подтвердили, что такие значения были действительно сравнимыми (см. Таблицу 1).
Фармакологические и фармакокинетические данные алвимопана и Соединения I
73,8 (человек)
2 После дозы 1 мг (ДИ 1,66-2,16)
3 Были проведены исходные расчеты с использованием данных у мышей, предполагая, что человеческие значения будут сравнимыми.
Исследования 1 фазы показали, что Соединение I имеет приблизительно линейные взаимоотношения между дозой и Cmax в плазме и площадью под кривой (AUC) в диапазоне доз от 1 до 100 мг. Доза Соединения I, необходимая для достижения Cmax равной 0,1 нг/мл (т.е. свободной концентрации алвимопана в плазме, эффективной для лечения ОИЗ или ОДК), следовательно, может быть оценена путем линейного экстраполирования на более низкие дозы, т.е. предполагая линейное взаимоотношение между дозой и Cmax в дозах менее чем 1 мг. С использованием такого подхода доза Соединения I, необходимая для получения Cmax свободного лекарственного средства в плазме 0,1 нг/мл, составила 0,087 мг. Относительную Ki двух Соединений (таблица 1) учитывали в определении дозы Соединения I, требуемой для достижения фармакологически эквивалентных уровней антагонизма в отношении μ-опиоидных рецепторов до такового, ассоциированного с клинически эффективной дозой алвимопана. Посредством простой пропорции полученное указывает, что неожиданно низкая доза Соединения I 0,12 мг будет эффективной в лечении ОИЗ или ОДК. Важно, что такая доза является в 25-83 раза ниже, чем дозы, ассоциированные с антагонизмом в отношении центральных опиоидных рецепторов, ясно показывая, что, при наличии центральной активности в более высоких дозах, Соединение I является все еще достаточно распределенным по периферии для лечения ОИЗ или ОДК в очень низких дозах, не влияя на центральное опиоидное обезболивание или не вызывая центральной отмены опиоидов.
Вторым подходом был расчет, основанный на эффективности (Κi) Соединения I, в качестве антагониста в отношении μ-опиоидных рецепторов. В таком случае фармакокинетические и фармакологические данные для Соединения I использовали для определения дозы Соединения, которая даст системную концентрацию свободного лекарственного средства в плазме (Cmax) на периферии, равную Κi для μ-опиоидных рецепторов (т.е., 0,36 нМ, как определено посредством связывания in vitro человеческого μ-опиоидного рецептора в клетках CHO - таблица 1). Как обсуждается выше, средний свободный уровень в плазме Cmax после 1 мг разовой пероральной дозы Соединения I здоровым людям измеряли как 1,15 нг/мл, или 2,98 нМ (молекулярная масса Соединения I: 386,4 г/моль). Предполагая линейное взаимоотношение между дозой и Cmax для доз ниже 1 мг, дозу Соединения I, необходимую для достижения 0,36 нМ свободного лекарственного средства, рассчитывали как неожиданно низкую дозу, полученную всем организмом 0,12 мг. Также полученная доза была в 25-83 раза ниже, чем дозы, ассоциированные с антагонизмом в отношении центральных опиоидных рецепторов, аналогично показывая, что при наличии центральной активности в более высоких дозах, Соединение I все еще достаточно распределяется по периферии для лечения ОИЗ или ОДК в очень низких дозах, не влияя на центральное опиоидное обезболивание или не вызывая центральной отмены опиоидов.
Третьим подходом было создание фармакокинетической модели для Соединения I в низких дозах. Это было осуществлено путем предположения линейного взаимоотношения между дозой и всеми параметрами времени в плазме для дозы Соединения I 1 мг, и экстраполируя их на более низкие дозы. Такая модель показывает, что после введения людям 0,15 мг Соединения I свободные концентрации в плазме Соединения были около или выше Ki к μ-опиоидным рецепторам (0,36 нМ) в течение около 6 часов (Фиг. 3), т.е., достаточно времени для получения эффективного сигнала. Полученная доза является от 20 до 67 раз ниже, чем дозы, ассоциированные с антагонизмом в отношении центральных опиоидных рецепторов, снова показывая, что, при наличии центральной активности в более высоких дозах, Соединение I является достаточно распределенным по периферии для лечения ОИЗ или ОДК в очень низких дозах, не влияя на центральное опиоидное обезболивание или не вызывая центральную отмену опиоидов (Фиг. 4 и фиг. 5).
Четвертым подходом было оценить клиническую фармакокинетическую модель для алвимопана, которая предполагает период воздействия концентрации свободного лекарственного средства, которая составляет только приблизительно 0,33 Ki для μ-опиоидных рецепторов, может быть достаточной для получения эффективности у пациентов с ОИЗ. (Фиг. 6) С использованием фармакокинетической модели и предположений, описанных выше, доза Соединения I 0,5 мг приводила к свободным концентрациям в плазме около или выше 0,33 Ki μ-опиоидного рецептора (0,36 нМ) в течение более чем 4 часов, т.е. достаточного времени для получения сигнала эффективности. Такая доза была в 60-200 раз ниже, чем дозы, ассоциированные с антагонизмом в отношении центральных опиоидных рецепторов, снова показывая, что, при наличии центральной активности в более высоких дозах, Соединение I все еще является достаточно распределяемым по периферии для лечения ОИЗ или ОДК не влияя на центральное опиоидное обезболивание или не вызывая центральной отмены опиоидов.
В дозах 1-3 мг, Соединение I имеет измеряемый период полужизни в плазме у людей приблизительно 12 часов. Если существует возможность в некоторой степени накопления лекарственного средства при схемах повторного введения, дозировки, ассоциированные с эффективностью для лечения ОИЗ или ОДК могут быть ощутимо ниже, чем дозы, рассчитанные выше, т.е. такими как от 0,01 до 0,02 мг дозы, полученной всем организмом один или два раза в сутки (для мужчины весом приблизительно 70 кг).
Пример 3: Клиническое исследование I фазы с многократно нарастающими дозами, проводимое с Соединением I; предварительные результаты
Целью клинического исследования I фазы с множеством нарастающих доз было оценить безопасность, переносимость, фармакокинетику и клинический эффект многократно нарастающих доз Соединения I, вводимых два раза в сутки (BID), пациентам, которые имеют опиоид-индуцированные запоры, (ОИЗ), как результат хронической терапии опиоидами для постоянной нераковой боли. Первой частью исследования было рандомизированное, двойное слепое, плацебо контролируемое исследование с многократно нарастающими дозами в течение которого пациенты получали 4 пероральных дозы исследуемого средства в течение 2 дней, относящихся к единице исследования. Каждая из групп доз 0,10 мг, 0,25 мг, 0,35 мг, 0,50 мг и 0,75 мг два раза в сутки включала 4 пациентов, и рандомизация была несбалансированна, с соотношением 3:1 лечения Соединением I (n=3) к лечению плацебо (n=1). Группа 0,75 мг два раза в сутки включала только 2 пациентов. Оценки клинических эффектов включали следующие показатели, которые оценивали начиная непосредственно после первой дозы исследуемого средства до отмены в день 3: (i) время до первого опорожнения кишечника после первой дозы исследуемого средства; (ii) количество опорожнений кишечника; и (iii) баллы комфорта опорожнений кишечника, масса стула и консистенция стула, измеренные по Bristol Stool Scale для каждого опорожнения кишечника, которые происходили, когда пациент относился к группе исследования.
Для фармакокинетических анализов образцы крови получали от каждого пациента в день 1 приблизительно за 1 час до первого введения средства исследования (время 0) и в каждый из последующих моментов времени после первого введения средства исследования: 15 мин, 30 мин, 60 мин, 90 мин, 2 ч, 3 ч, 4 ч, 6 ч, 8 ч, 10 ч, и 12 ч. Фиг. 7 A, 7B и 7C показывают уровень в плазме Соединения I, полученный после первой дозы в течение периода введения 12 ч и для каждой из 5 исследуемых доз (0,10 мг, 0,25 мг, 0,35 мг, 0,50 мг и 0,75 мг два раза в сутки). Как показано на фиг. 7A, все дозировки обеспечивали концентрации в плазме, которые были выше MOR Ki Соединения I [Ki (MOR) = 0,36 нМ], что показано пунктирной линией. Только в наименьшей дозе (0,1 мг) концентрация падала ниже MOR Ki перед окончанием интервала введения через 12 часов после первого введения; и даже в этой дозе концентрации были выше MOR Ki в течение почти 9 часов {см. фиг. 7C). Предварительные данные показывают, что дозы 0,10 мг и 0,25 мг хорошо переносились и давали желательные фармакологические эффекты.
Все публикации, патенты, патентные заявки и другие документы, представленные в настоящей заявке, таким образом включены в виде ссылки полностью для любых целей в той степени, как будто каждая отдельная публикация, патент, патентная заявка или другой документ отдельно предназначены для включения в виде ссылки для любых целей.
Тогда как были проиллюстрированы и описаны различные специфические варианты осуществления изобретения, понимают, что различные изменения могут быть сделаны без отклонения от рамок и тенденции изобретения(й).
Группа изобретений относится к медицине, а именно к способу лечения или профилактике опиоид-индуцированного запора или опиоид-индуцированной дисфункции кишечника у пациентов без снижения центрально опосредованного опиоидного обезболивания или развития симптомов центральной отмены опиоидов, ассоциированного с активацией опиоидных рецепторов на периферии. Для этого пациенту вводят эффективное количество 5-(2-метокси-4-{[2-(тетрагидропиран-4-ил)-этиламино]метил}-фенокси)пиразин-2-карбоксамида (Соединение I) или его фармацевтически приемлемой соли. Группа изобретений обеспечивает лечение или профилактику частых побочных эффектов у пациентов, которые принимают опиоиды в течение несколько дней. 3 н. и 9 з.п. ф-лы, 9 ил., 1 табл., 3 пр.
1. Фармацевтическая композиция в стандартной лекарственной форме для лечения опиоид-индуцированного запора, содержащая от около 0,01 мг до около 0,5 мг соединения формулы (I):
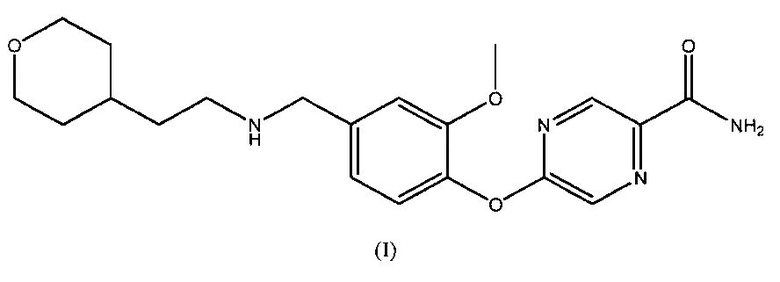
или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель.
2. Фармацевтическая композиция по п. 1, которая пригодна для перорального введения.
3. Фармацевтическая композиция по п. 1, которая представляет собой таблетку.
4. Фармацевтическая композиция по любому одному из пп. 1-3, которая содержит около 0,25 мг соединения формулы (I) или его фармацевтически приемлемой соли.
5. Фармацевтическая композиция по любому одному из пп. 1-3, которая содержит около 0,5 мг соединения формулы (I) или его фармацевтически приемлемой соли.
6. Способ лечения опиоид-индуцированного запора, включающий введение пациенту терапевтически эффективного количества соединения формулы (I):
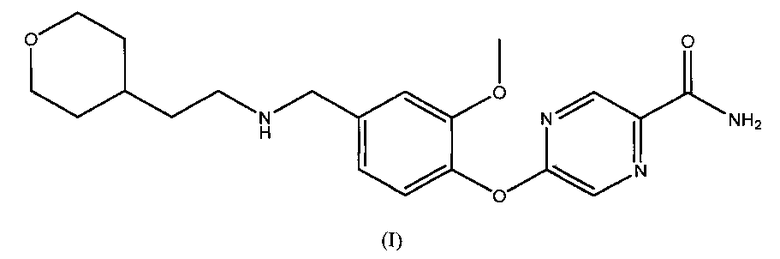
или его фармацевтически приемлемой соли в количестве в диапазоне от около 0,01 мг до около 0,5 мг в сутки.
7. Способ по п. 6, где соединение формулы (I) вводят вместе с опиоидным анальгетиком.
8. Способ по п. 6 или 7, где соединение формулы (I) или его фармацевтически приемлемую соль вводят пациенту в количестве около 0,5 мг в сутки.
9. Применение соединения формулы (I):

или его фармацевтически приемлемой соли для лечения опиоид-индуцированного запора, где соединение формулы (I) или его фармацевтически приемлемую соль вводят перорально два раза в сутки в общем количестве от 0,1 до 0,5 мг в сутки.
10. Применение по п. 9, где соединение формулы (I) или его фармацевтически приемлемую соль вводят пациенту в количестве 0,5 мг в сутки.
11. Применение по п. 9, где соединение формулы (I) или его фармацевтически приемлемую соль вводят пациенту в количестве 0,25 мг.
12. Применение по любому одному из пп. 9-11, где пациент одновременно получает опиоидный анальгетик.
| US20080255152 А1, 16.10.2008 | |||
| US2006217372 А1, 28.09.20068 | |||
| FRIEDMAN J.D., Opioid antagonists in the treatment of opioid-induced consitipation and pruritus, Ann | |||
| Pharmacotherapy, 2001, 35, pp 85-91 | |||
| CHANG HY et al.,Opioid-induced bowel dysfunction.,Current Treat Options | |||
| Gastroenterol., 2008, 11, pp | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2015-09-10—Публикация
2010-09-17—Подача