Область техники, к которой относится изобретение
Изобретение относится к области тонкой органической химии, включая синтез физиологически активных соединений, и касается нового способа получения производных 7-(гетеро)арил-4,5,6,7-тетрагидро[1,2,3]триазоло[1,5-a]-пиридина.
Уровень техники
Производные 7-(гетеро)арил-4,5,6,7-тетрагидро[1,2,3]триазоло[1,5-a]пиридина представляют собой конформационно-ограниченные аналоги 1-бензил-и 1-(гетероарил)метил-5-замещенных триазолов, являющихся агонистами/антагонистами ванилоидных рецепторов [G. Appendino, S. Bacchiega, A. Minassi, М.G. Cascio, L. De Petrocellis, V. Di Marzo Angew. Chem. Int. Ed. 2007, 46, 9312], ингибиторами гистондеацетилаз [Y. Chen, M. Lopez-Sanchez, D.N. Savoy, D.D. Billadeau, G.S. Dow, A.P. Kozikowski J. Med. Chem. 2008, 51, 3437], проявляющих антибактериальную [D. Linares, O. Bottzeck, O. Pereira, A. Praud-Tabaries, Y. Blache Bioorg. Med. Chem. Lett. 2011, 21, 6751] и другие виды физиологической активности.
Конформационно-жесткие и конформационно-ограниченные аналоги различных физиологически активных соединений представляют большой интерес как потенциальные лекарственные средства с повышенной активностью и селективностью. Однако для 7-арил-4,5,6,7-тетрагидро[1,2,3]триазоло[1,5-a]пиридина к настоящему времени был описан лишь один малоэффективный двухстадийный способ синтеза (выход менее 20%), основанный на реакции весьма дорогостоящего триметилсилилазида с 1-арилгекс-5-ин-1-олом в присутствии эфирата трехфтористого бора в толуоле с последующим кипячением [T. Koike, M. Nakamura, Y. Tomata, T. Takai, Y. Hoashi, Y. Kajita, T. Tsukamoto, M. Kamata, US 2012/0059030 A1 (2012)].
Раскрытие изобретения
Способ получения производных 7-(гетеро)арил-4,5,6,7-тетрагидро[1,2,3]триазоло[1,5-a]пиридина общей формулы II, где Ar означает фенил, возможно содержащий алкильные или алкокси-заместители, или пиридил, заместители R1 и R2 одинаковы и означают C(O)OR, где R - алкил, заключающийся в том, что 1-азидо-1-[(гетеро)арил.]пропан общей формулы I, где Ar, R1 и R2 имеют указанные выше значения, подвергают взаимодействию с пропаргилбромидом в среде толуола и сухого ДМФА в соотношении 1:1 (объемные) при комнатной температуре и в присутствии суспензии NaH в минеральном масле, предварительно приготовленной при 0°C.
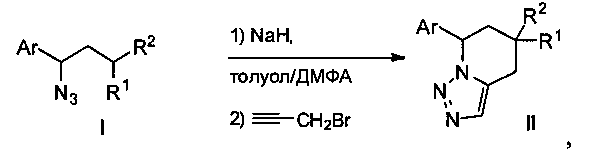
Осуществление изобретения
Реакцию 1-азидо-1-[(гетеро)арил]пропанов I, содержащих в положении 3 две акцепторные группы, с основанием (NaH) и пропаргилбромидом проводят в смеси толуола и сухого ДМФА при комнатной температуре, в результате чего образуются искомые производные 7-(гетеро)арил-4,5,6,7-тетрагидро[1,2,3]триазоло[1,5-a]пиридина II.
Ниже следуют примеры, иллюстрирующие синтез производных 7-(гетеро)арил-4,5,6,7-тетрагидро[1,2,3]триазоло[1,5-a]пиридина II.
Пример 1
Диметиловый эфир 7-фенил-6,7-дигидро[1,2,3]триазоло[1,5-a]пиридин-5,5(4H)-дикарбоновой кислоты
К охлажденной до 0°C суспензии NaH (24 мг, 0.6 ммоль, 60% суспензия в минеральном масле) в смеси толуола (0.5 мл) и сухого ДМФА (0.5 мл) при постоянном перемешивании в атмосфере аргона добавляли одной порцией диметиловый эфир (2-азидо-2-фенилэтил)малоновой кислоты (139 мг, 0.5 ммоль). После окончания прибавления реакционную смесь отогревали до комнатной температуры и перемешивали в течение 20 мин. Затем по каплям добавляли пропаргилбромид (80% раствор в толуоле, 113 мг, 0.76 ммоль) и дополнительно перемешивали в течение 1.5 ч, после чего реакционную смесь выливали в насыщенный раствор NH4Cl (3 мл), экстрагировали этилацетатом (3×3 мл). Объединенный органический слой промывали водой (1×3 мл) и насыщенным раствором NaCl (4×2 мл), сушили безводным Na2SO4. Растворитель упаривали, продукт выделяли методом колоночной хроматографии на SiO2 (элюент - петролейный эфир:диэтиловый эфир = 1:1). Выход 78% (123 мг). Прозрачное вязкое масло. Rf=0.29 (этилацетат - гексан, 1:1).
Вычислено для C16H17N3O4: C, 60.94; H, 5.43; N, 13.33%.
Найдено: C, 60.79; H, 5.46; N, 13.04%.
Спектр 1H ЯМР (ДМСО-d6, 600 МГц), (δ, м.д. и КССВ, J, Гц): 2.52 (дд, 2J=14.3, 3J=10.3 Гц, 1H, СН2), 3.05 (ддд, 2J=14.3, 3J=5.4, 4J=2.1 Гц, 1H, CH2), 3.38 (д, 2J=16.6 Гц, 1H, CH2), 3.66 (с, 3H, CH3), 3.61 (дд, 2J=16.6, 4J=2.1 Гц, 1H, CH2), 3.77 (с, 3H, CH3), 5.62 (дд, 3J=5.4, 3J=10.3 Гц, 1H, CH), 7.13 (уш.д, 3J=7.4 Гц, 2H, Ph), 7.33-7.35 (м, 1H, Ph), 7.37-7.39 (м, 2H, Ph), 7.62 (с, 1H, CHN).
Спектр 13C ЯМР (ДМСО-d6, 150 МГц), (δ, м.д. и КССВ, J, Гц): 26.63 (1J=137 Гц, CH2), 38.13 (1J=136 Гц, CH2), 52.09 (C), 53.10 (1J=148 Гц, CH3), 53.18 (1J=148 Гц, CH3), 58.42 (1J=149 Гц, CH), 126.81 (2×CH), 128.40 (CH), 128.83 (2×CH), 130.78 (CH), 131.86 (C), 139.07 (C), 169.22 (CO2Me), 169.70 (CO2Me).
Пример 2
Диметиловый эфир 7-(4-метилфенил)-6,7-дигидро[1,2,3]триазоло[1,5-a]пиридин-5,5(4H)-дикарбоновой кислоты
К охлажденной до 0°C суспензии NaH (24 мг, 0.6 ммоль, 60% суспензия в минеральном масле) в смеси толуола (0.5 мл) и сухого ДМФА (0.5 мл) при постоянном перемешивании в атмосфере аргона добавляли одной порцией диметиловый эфир [2-азидо-2-(4-метилфенил)этил]малоновой кислоты (146 мг, 0.5 ммоль). После окончания прибавления реакционную смесь отогревали до комнатной температуры и перемешивали в течение 20 мин. Затем по каплям добавляли пропаргилбромид (80% раствор в толуоле, 113 мг, 0.76 ммоль) и дополнительно перемешивали в течение 1.5 ч, после чего реакционную смесь выливали в насыщенный раствор NH4Cl (3 мл), экстрагировали этилацетатом (3×3 мл). Объединенный органический слой промывали водой (1×3 мл) и насыщенным раствором NaCl (4×2 мл), сушили безводным Na2SO4. Растворитель упаривали, продукт выделяли методом колоночной хроматографии на SiO2 (элюент - петролейный эфир:диэтиловый эфир = 1:1). Выход 69% (114 мг). Прозрачное вязкое масло. Rf=0.36 (этилацетат - гексан, 1:1).
Вычислено для C17H19N3O4: C, 62.00; H, 5.81;N, 12.76%.
Найдено: C, 62.04; H, 5.76; N, 12.43%.
Спектр 1H ЯМР (ДМСО-d6, 600 МГц), (δ, м. д. и КССВ, J, Гц): 2.30 (с, 3H, CH3), 2.62 (дд, 2J=14.2, 3J=10.4 Гц, 1H, CH2), 2.78 (ддд, 2J=14.2, 3J=5.3, 4J=1.6 Гц, 1H, CH2), 3.39 (д, 2J=16.4 Hz, 1H, CH2), 3.52 (дд, 2J=16.4, 4J=1.6 Hz, 1H, CH2), 3.58 (с, 3H, CH3O), 3.70 (с, 3H, CH3O), 5.51 (дд, 3J=10.4, 3J=5.3 Гц, 1H, CHAr), 7.11 (д, 3J=8.0 Гц, 2H, Ar), 7.19 (д, 3J=8.0 Гц, 2H, Ar), 7.64 (с, 1H, CHN).
Спектр 13C ЯМР (ДМСО-d6, 150 МГц), (δ, м.д. и КССВ, J, Гц): 20.66 (1JCH=126 Гц, CH3), 25.74 (1JCH=136 Гц, CH2), 36.77 (1JCH=136 Гц, CH2), 51.29 (C), 53.06 (1JCH=149 Гц, CH3O), 53.35 (1JCH=149 Гц, CH3O), 57.14 (1JCH=147 Гц, CH), 127.23 (1JCH=159 Гц, 2×CH, Ar), 128.98 (1JCH=158 Гц, 2×CH, Ar), 130.29 (1JCH=193 Гц, CHN), 132.65 (C), 136.57 (C), 137.40 (C), 169.26 (CO2Me), 169.41 (CO2Me).
Пример 3
Диметиловый эфир 7-(4-метоксифенил)-6,7-дигидро[1,2,3]триазоло[1,5-a]пиридин-5,5(4H)-дикарбоновой кислоты
К охлажденной до 0°C суспензии NaH (42 мг, 1.04 ммоль, 60% суспензия в минеральном масле) в смеси толуола (0.86 мл) и сухого ДМФА (0.86 мл) при постоянном перемешивании в атмосфере аргона добавляли одной порцией диметиловый эфир [2-азидо-2-(4-метоксифенил)этил]малоновой кислоты (265 мг, 0.86 ммоль). После окончания прибавления реакционную смесь отогревали до комнатной температуры и перемешивали в течение 20 мин. Затем по каплям добавляли пропаргилбромид (80% раствор в толуоле, 193 мг, 1.30 ммоль) и дополнительно перемешивали в течение 1.5 ч, после чего реакционную смесь выливали в насыщенный раствор NH4Cl (3 мл), экстрагировали этилацетатом (3×3 мл). Объединенный органический слой промывали водой (1×3 мл) и насыщенным раствором NaCl (4×2 мл), сушили безводным Na2SO4. Растворитель упаривали, продукт выделяли методом колоночной хроматографии на SiO2 (элюент - петролейный эфир:диэтиловый эфир = 1:1). Выход 71% (185 мг). Желтоватое вязкое масло. Rf=0.20 (этилацетат - гексан, 1:1).
Вычислено для C17H19N3O5: C, 59.12; H, 5.55; N, 12.17%.
Найдено: C, 59.09; H, 5.80; N, 11.97%.
Спектр 1H ЯМР (ДМСО-d6, 600 МГц), (δ, м.д. и КССВ, J, Гц): 2.64 (дд, 2J=14.1, 3J=10.5 Гц, 1H, CH2), 2.76 (ддд, 2J=14.1, 3J=5.2, 4J=1.5 Гц, 1H, CH2), 3.38 (д, 2J=16.4 Гц, 1H, CH2), 3.52 (дд, 2J=16.4, 4J=1.5 Гц, 1H, CH2), 3.61 (с, 3H, CH3O), 3.71 (с, 3H, CH3O), 3.76 (с, 3H, CH3O), 5.51 (дд, 3J=10.5, 3J=5.2 Гц, 1H, CHAr), 6.93 (д, 3J=8.8 Гц, 2H, Ar), 7.17 (д, 3J=8.8 Гц, 2H, Ar), 7.63 (с, 1H, CHN).
Спектр 13C ЯМР (ДМСО-d6, 150 МГц), (δ, м. д. и КССВ, J, Гц): 25.75 (1JCH=136 Гц, CH2), 36.77 (1JCH=135 Гц, CH2), 51.37 (C), 53.08 (1JCH=148 Гц, CH3O), 53.32 (1JCH=148 Гц, CH3O), 55.16 (1JCH=144 Гц, CH3O), 56.90 (1JCH=146 Гц, CH), 113.84 (2×CH, Ar), 128.66 (2×CH, Ar), 130.28 (CHN), 131.38 (C), 132.58 (C), 159.06 (C), 169.28 (CO2Me), 169.46 (CO2Me).
Пример 4
Диметиловый эфир 7-(3,4,5-триметоксифенил)-6,7-дигидро[1,2,3]триазоло[1,5-a]пиридин-5,5(4H)-дикарбоновой кислоты
К охлажденной до 0°C суспензии NaH (24 мг, 0.6 ммоль, 60% суспензия в минеральном масле) в смеси толуола (0.5 мл) и сухого ДМФА (0.5 мл) при постоянном перемешивании в атмосфере аргона добавляли одной порцией диметиловый эфир [2-азидо-2-(3,4,5-триметоксифенил)этил]малоновой кислоты (184 мг, 0.5 ммоль). После окончания прибавления реакционную смесь отогревали до комнатной температуры и перемешивали в течение 20 мин. Затем по каплям добавляли пропаргилбромид (80% раствор в толуоле, 113 мг, 0.76 ммоль) и дополнительно перемешивали в течение 2 ч, после чего реакционную смесь выливали в насыщенный раствор NH4Cl (3 мл), экстрагировали этилацетатом (3×3 мл). Объединенный органический слой промывали водой (1×3 мл) и насыщенным раствором NaCl (4×2 мл), высушили безводным Na2SO4. Растворитель упаривали, продукт выделяли методом колоночной хроматографии на SiO2 (элюент - петролейный эфир:диэтиловый эфир = 1:1). Выход 68% (131 мг). Желтоватое вязкое масло. Rf=0.54 (этилацетат).
Вычислено для C19H23N3O7: C, 56.29; H, 5.72; N, 10.37%.
Найдено:C, 56.39; H, 5.55; N, 10.10%.
Спектр 1H ЯМР (ДМСО-d6, 600 МГц), (δ, м.д. и КССВ, J, Гц):2.45 (дд, 2J=14.4, 3J=10.4 Гц, 1H, CH2), 2.99 (ддд, 2J=14.4, 3J=5.4, 4J=1.9 Гц, 1H, CH2), 3.33 (д, 2J=16.7 Гц, 1H, CH2), 3.62 (дд, 2J=16.7, 4J=1.9 Гц, 1H, CH2), 3.65 (с, 3H, CH3), 3.71 (с, 3H, CH3), 3.75 (с, 6H, 2×CH3), 3.77 (с, 3H, CH3), 5.48 (дд, 3J=5.4, 3J=10.4 Гц, 1H, CH), 6.27 (с, 2H, Ar), 7.55 (с, 1H, CHN).
Спектр 13C ЯМР (ДМСО-d6, 150 МГц), (δ, м.д. и КССВ, J, Гц): 26.49 (1J=139 Гц, CH2), 38.03 (1J=136 Гц, CH2), 51.90 (C), 53.37 (1J=148 Гц, CH3), 53.43 (1J=148 Гц, CH3), 56.13 (1J=145 Гц, 2×CH3), 58.67 (1J=146 Гц, CH), 60.69 (1J=145 Гц, CH3), 104.04 (2×CH, Ar), 131.01 (CHN), 131.94 (C, Ar), 134.39 (C, Ar), 138.06 (CN), 153.58 (2×C, Ar), 169.28 (CO2Me), 169.76 (CO2Me).
Пример 5
Диметиловый эфир 7-(3-пиридил)-6,7-дигидро[1,2,3]триазоло[1,5-a]пиридин-5,5(4H)-дикарбоновой кислоты
К охлажденной до 0°C суспензии NaH (36 мг, 0.91 ммоль, 60% суспензия в минеральном масле) в смеси толуола (0.75 мл) и сухого ДМФА (0.75 мл) при постоянном перемешивании в атмосфере аргона добавляли одной порцией диметиловый эфир [2-азидо-2-(3-пиридил)этил)малоновой кислоты (139 мг, 0.5 ммоль). После окончания прибавления реакционную смесь отогревали до комнатной температуры и перемешивали в течение 20 мин. Затем по каплям добавляли пропаргилбромид (80% раствор в толуоле, 113 мг, 0.76 ммоль) и дополнительно перемешивали в течение 1.5 ч, после чего реакционную смесь выливали в насыщенный раствор NH4Cl (3 мл), экстрагировали этилацетатом (3×3 мл). Объединенный органический слой промывали водой (1×3 мл) и насыщенным раствором NaCl (4×2 мл), сушили безводным Na2SO4. Растворитель упаривали, продукт выделяли методом колоночной хроматографии на SiO2 (элюент - петролейный эфир:диэтиловый эфир = 1:1). Выход 53% (126 мг). Прозрачное густое масло. Rf=0.13 (этилацетат).
Вычислено для C15H16N4O4: C, 56.96; H, 5.10, N, 17.71%.
Найдено: C, 56.70; H, 4.99, N, 17.59%.
Спектр 1H ЯМР (ДМСО-d6, 600 МГц), (δ, м. д. и КССВ, J, Гц): 2.44 (дд, 2J=14.3, 3J=10.4 Гц, 1H, CH2), 2.98 (ддд, 2J=14.3, 3J=5.4, 4J=1.8 Гц, 1H, CH2), 3.29 (д, 2J=16J Гц, 1H, CH2), 3.59 (с, 3H, CH3), 3.61 (дд, 2J=16.7, 4J=1.8 Гц, 1H, CH2), 3.68 (с, 3H, CH3), 5.58 (дд, 3J=5.4, 3J=10.4 Гц, 1H, CH), 7.22 (дд, 3J=4.8, 3J=7.9 Гц, 1H, Py), 7.31 (уш.д, 3J=7.9 Гц, 1H, Py), 7.52 (с, 1H, CHN), 8.45 (д, 4J=1.1 Гц, 1H, Py), 8.51 (дд, 3J=4.8, 4J=1.1 Гц, 1H, Py).
Спектр 13C ЯМР (ДМСО-d6, 150 МГц), (δ, м.д. и КССВ, J, Гц): 26.45 (lJ=136 Гц, CH2), 37.53 (1J=136 Гц, CH2), 51.78 (C), 53.40 (1J=148 Гц, CH3), 53.48 (lJ=148 Гц, CH3), 56.18 (lJ=147 Гц, CH), 123.67 (CH), 131.08 (CH), 132.05 (C, Ar), 134.41 (CH), 134.55 (C), 148.58 (CH), 149.86 (CH), 169.05 (CO2Me), 169.49 (CO2Me).
Таким образом, предлагаемое техническое решение позволяет получать производные 7-(гетеро)арил-4,5,6,7-тетрагидро[1,2,3]триазоло[1,5-a]пиридина в одну стадию, без использования катализаторов, с высокими выходами и широким разнообразием заместителей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 5-АМИНОСПИРО[2.3]ГЕКСАН-1-КАРБОНОВОЙ КИСЛОТЫ | 2017 |
|
RU2659404C1 |
| ФТОРСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ТЕВИНОЛА И ОРВИНОЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2012 |
|
RU2506265C1 |
| НОВЫЕ 2',5'-ДИАРИЛСПИРО[ИНДОЛ-3,3'-ПИРРОЛИДИН]-2(1Н)-ОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2730287C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ЭТИЛ-3-[(ОКСИФЕНИЛ)МЕТИЛ]АЛЮМИНАЦИКЛОПЕНТАНОВ | 2013 |
|
RU2540089C1 |
| Производные пиримидина - ингибиторы репродукции вирусов, относящихся к роду Orthoflavivirus | 2023 |
|
RU2831118C1 |
| ПРОИЗВОДНЫЕ ПИРИДОКСИНА С НЕЛИНЕЙНЫМИ ОПТИЧЕСКИМИ СВОЙСТВАМИ | 2012 |
|
RU2501801C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗО[7,8]АЗОНИНО[5,4-b]ИНДОЛОВ, 7,9-ЭТЕНОАЗЕЦИНО[5,4-b]ИНДОЛОВ И 7,9-ЭТАНОАЗЕЦИНО[5,4-b]ИНДОЛОВ | 2009 |
|
RU2397984C1 |
| СПИРО[2.3]ГЕКСАНОВЫЕ АМИНОКИСЛОТЫ - КОНФОРМАЦИОННО-ЖЕСТКИЕ АНАЛОГИ γ-АМИНОМАСЛЯНОЙ КИСЛОТЫ - И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2629357C1 |
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| Способ получения 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов | 2022 |
|
RU2802631C1 |
Изобретение относится к способу получения производных 7-(гетеро)арил-4,5,6,7-гетрагидро[1,2,3]триазоло[1,5-a]пиридина общей формулы II,

где Ar означает фенил, возможно содержащий алкильные или алкокси-заместители, или пиридил, заместители R1 и R2 одинаковы и означают C(O)OR, где R - алкил, заключающемуся в том, что 1-азидо-1-[(гетеро)арил]пропан общей формулы I, где Ar, R1 и R2 имеют указанные выше значения, подвергают взаимодействию с пропаргилбромидом в среде толуола и сухого ДМФА в объемном соотношении 1:1 при комнатной температуре и в присутствии суспензии NaH в минеральном масле, предварительно приготовленной при 0°C. Технический результат: получение производных 7-(гетеро)арил-4,5,6,7-гетрагидро[1,2,3]триазоло[1,5-a]пиридина в одну стадию, без использования катализаторов, с высоким выходом. 5 пр.
Способ получения производных 7-(гетеро)арил-4,5,6,7-гетрагидро[1,2,3]триазоло[1,5-a]пиридина общей формулы II,

где Ar означает фенил, возможно содержащий алкильные или алкокси-заместители, или пиридил, заместители R1 и R2 одинаковы и означают C(O)OR, где R - алкил, заключающийся в том, что 1-азидо-1-[(гетеро)арил]пропан общей формулы I, где Ar, R1 и R2 имеют указанные выше значения, подвергают взаимодействию с пропаргилбромидом в среде толуола и сухого ДМФА в объемном соотношении 1:1 при комнатной температуре и в присутствии суспензии NaH в минеральном масле, предварительно приготовленной при 0°C.
| RU 2008119460 A, 27.11.2009 | |||
| ПРОИЗВОДНЫЕ 8-МЕТОКСИ[1,2,4]ТРИАЗОЛО[1,5-a]ПИРИДИНА И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 2002 |
|
RU2297416C2 |
| US 20120059030 A1, 08.03.2012 | |||
Авторы
Даты
2015-09-20—Публикация
2013-07-08—Подача