Изобретение относится к способу получения 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов общей формулы 1:
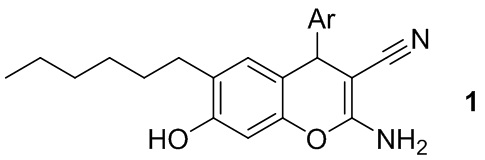
где Ar = замещенный ароматический заместитель,
являющихся промежуточными продуктами в синтезе различных гетероциклических соединений и биологически активных молекул [Litvinov Y. M., Shestopalov A. M. Synthesis, structure, chemical reactivity, and practical significance of 2-amino-4H-pyrans // Advances in Heterocyclic Chemistry, 2011, Vol. 103, P. 175-260; Tashrifi Z., Mohammadi-Khanaposhtani M., Hamedifar H., Larijani B., Ansari S., Mahdavi M. Synthesis and pharmacological properties of polysubstituted 2-amino-4H-pyran-3-carbonitrile derivatives // Molecular Diversity, 2020, Vol. 24, № 4, P. 1385-1431].
В литературе описан способ получения 2-амино-6-гексил-7-гидрокси-4-(4-хлорфенил)-4H-хромен-3-карбонитрила 1а с выходом 89% реакцией 4-гексилрезорцина 2 с 4-хлорбензилиденмалононитрилом 3а в этаноле в присутствии пиперидина при нагревании, с последующей перекристаллизацией из этанола [Abd-El-Aziz A. S., El-Agrody A. M., Bedair A. H., Corkery T. C., Ata A. // Heterocycles, 2004, Vol. 63, N 8, p. 1793-1812]:
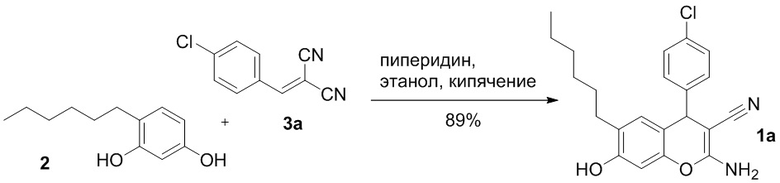
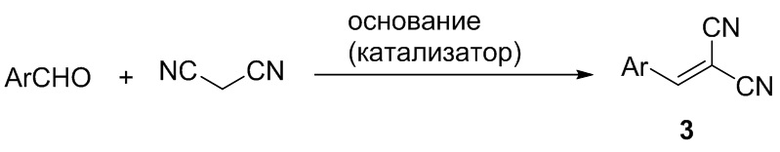
Недостатком этого способа является необходимость последующей очистки продукта, а также необходимость предварительного получения 4-хлорбензилиденмалононитрила 3а. Необходимая дополнительная стадия получения арилиденмалононитрилов 3 реализуется через конденсацию малононитрила с ароматическими альдегидами в присутствии оснований (Схема 2) [Freeman F. Chemistry of malononitrile // Chemical Reviews, 1969, Vol. 69, № 5, P. 591-624; Fatiadi A. J. New applications of malononitrile in organic chemistry – part I // Synthesis. 1978. № 3. P. 165-204]; реакция протекает с высокими выходами, но в любом случае требует дополнительных этапов выделения, очистки и идентификации продукта:
Известен способ получения 2-амино-4-(4-бромфенил)-6-гексил-7-гидрокси-4H-хромен-3-карбонитрила 1б с выходом 67% реакцией 4-гексилрезорцина 2 с 4-бромбензилиденмалононитрилом 3б в этаноле в присутствии морфолина при нагревании, с последующей перекристаллизацией из этанола [Шаранин Ю.А., Клокол Г.В. // Журнал органической химии, 1983, Т.19, № 8, с. 1782-1784]:
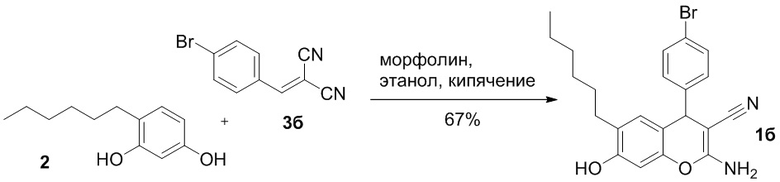
Недостатком этого способа является необходимость последующей очистки продукта, а также необходимость предварительного получения 4-бромбензилиденмалононитрила 3б.
Наиболее близким аналогом (прототипом) к предлагаемому техническому решению является способ получения 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов 1 реакцией 4-гексилрезорцина 2 с арилиденмалононитрилами 3 в присутствии каталитических количеств морфолина в этаноле при кипячении в течении 5 минут, с последующим выдерживанием реакционной массы 24-48 ч для завершения кристаллизации и последующей очисткой через перекристаллизацию продуктов из этанола [Клокол Г.В., Шаранина Л.Г., Нестеров В.Н., Шкловер В.Е., Шаранин Ю.А., Стручков Ю.Т. // Журнал органической химии, 1987, Т.23, № 2, с. 412-421], Выходы продуктов колеблются от умеренных до высоких (50-85%).
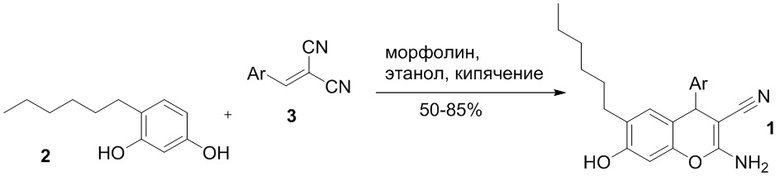
Недостатком этого способа является необходимость последующей очистки продукта, зачастую умеренные (50-60%) выходы, а также необходимость предварительного получения арилиденмалононитрилов 3.
Задачей изобретения является усовершенствование способа получения 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов 1.
Техническим результатом предлагаемого способа является сокращение числа стадий синтеза и увеличение выходов целевых продуктов.
Технический результат предлагаемого изобретения достигается путем трехкомпонентного взаимодействия 4-гексилрезорцина 2 с ароматическими альдегидами и малононитрилом в среде толуола при нагревании в присутствии каталитических количеств морфолина. При этом сокращается число стадий для получения 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов 1, так как отсутствует необходимость предварительного получения арилиденмалононитрилов 3 в индивидуальном виде. Арилиденмалононитрилы 3 генерируются в реакционной среде из ароматических альдегидов и малононитрила, и сразу же вступают в реакцию с 4-гексилрезорционом 2. За счет сокращения числа стадий увеличивается выход 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов 1 в расчете на малононитрил. Дополнительным преимуществом предлагаемого решения является отсутствие этапа очистки целевых продуктов через перекристаллизацию – 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилы 1 сразу получаются в аналитически чистом виде, поскольку возможные примеси (арилиденмалононитрилы 3 или 4-гексилрезорцин 2) растворимы в толуоле лучше, чем продукты реакции. Толуол является предпочтительным растворителем. Найдено, что проведение реакции в спиртах (этанол, бутанол) дает более низкие выходы за счет лучшей растворимости целевых продуктов в этих растворителях. Образующаяся в ходе взаимодействия вода не оказывает влияния на ход реакции, и поэтому необходимость выведения воды из сферы реакции (например, с помощью насадки Дина-Старка) отсутствует. Реакция протекает:
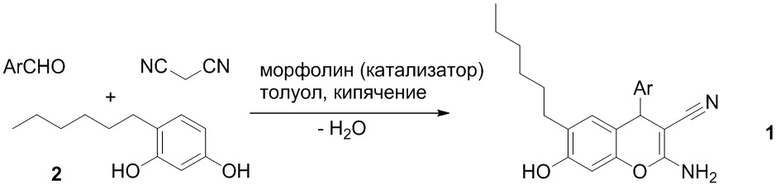
где Ar = замещенный ароматический заместитель.
Общими признаками предлагаемого способа и прототипа являются:
- использование 4-гексилрезорцина в качестве исходного реагента;
- использование в качестве катализатора каталитических количеств морфолина;
Отличительными признаками являются:
- использование ароматических альдегидов и малононитрила вместо арилиденмалононитрилов;
- использование толуола как растворителя;
- отсутствие стадии очистки целевых продуктов через перекристаллизацию.
Пример 1. Получение 2-амино-6-гексил-7-гидрокси-4-(4-хлорфенил)-4H-хромен-3-карбонитрила 1а.
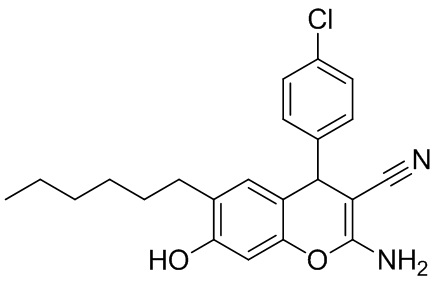
В круглодонную термостойкую колбу объемом 50 мл, снабженную обратным холодильником, помещают 0,30 г (4,54 ммоль) малононитрила, 0,64 г (4,54 ммоль) 4-хлорбензальдегида, 10 мл толуола и 3 капли морфолина. Смесь перемешивают до полного растворения. К полученному желтому раствору добавляют 0,88 г (4,54 ммоль) 4-гексилрезорцина 2, реакционную массу кипятят до завершения реакции (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент – этилацетат). Затем смесь выливают в химический стакан объемом 100 мл, охлаждают до комнатной температуры и выдерживают до завершения кристаллизации. Осадок отфильтровывают, промывают толуолом (7 мл) и петролейным эфиром (3 мл), высушивают при 60 °С. Дополнительное количество продукта осаждается из маточного раствора при упаривании толуольного фильтрата при комнатной температуре (25 °С). Получают 2-амино-6-гексил-7-гидрокси-4-(4-хлорфенил)-4H-хромен-3-карбонитрил 1а в виде бледно-оранжевого порошка в аналитически чистом виде (ТСХ), выход 90%. ИК-спектр, ν, см-1: 3468 сл, 3331 с (O–H, N–H); 2955 сл, 2922 с, 2870 сл, 2854 с (С–Н), 2197 с (C≡N). ЯМР 1H (400 МГц, ДМСО-d6), δH, м.д.: 0.78 т (3H, CH3, 3J = 6.0 Гц), 1.13-1.17 м (6Н, 3 СН2), 1.34-1.37 м (2Н, СН2), 2.33 т (2H, CH2, 3J = 7.1 Гц), 4.62 с (1Н, Н4), 6.44 уш.с (1Н, Н8), 6.60 уш.с (1Н, Н5), 6.88 уш.с (2Н, NH2), 7.16 (д, 2H, Ar, 3J = 8.0 Гц), 7.34 (д, 2H, Ar, 3J = 8.0 Гц), 9.62 (уш. с, 1H, OH). ЯМР 13C DEPTQ (101 МГц, ДМСО-d6), δC, м.д.: 13.9* (CH3), 22.1 (CH2), 28.3 (CH2), 29.0 (CH2), 29.1 (CH2), 31.1 (CH2), 39.4* (C4H), 55.8 (C3), 101.8* (C8H), 112.6 (C4a), 120.7 (CN), 125.6 (C1 Ar), 128.5* (2CH Ar), 129.3* (2CH Ar), 129.6* (C5H Ar), 131.2 (C4Cl), 145.5 (C Ar), 146.7 (C Ar), 154.7 (C8a), 160.4 (C2). Найдено, %: C 68.95; H 6.13; N 7.30. C22H23ClN2O2 (М 382.88). Вычислено, %: C 69.01; H 6.05; N 7.32.
Пример 2. Получение 2-амино-4-(4-бромфенил)-6-гексил-7-гидрокси-4H-хромен-3-карбонитрила 1б.
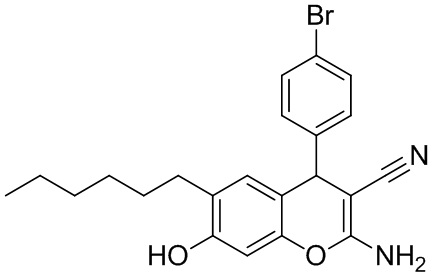
В круглодонную термостойкую колбу объемом 50 мл, снабженную обратным холодильником, помещают 0,30 г (4,54 ммоль) малононитрила, 0,84 г (4,54 ммоль) 4-бромбензальдегида, 10 мл толуола и 3 капли морфолина. Смесь перемешивают до полного растворения. К полученному желтому раствору добавляют 0,88 г (4,54 ммоль) 4-гексилрезорцина 2, реакционную массу кипятят до завершения реакции (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент – этилацетат). Затем смесь выливают в химический стакан объемом 100 мл, охлаждают до комнатной температуры и выдерживают до завершения кристаллизации. Осадок отфильтровывают, промывают толуолом (7 мл) и петролейным эфиром (3 мл), высушивают при 60 °С. Дополнительное количество продукта осаждается из маточного раствора при упаривании толуольного фильтрата при комнатной температуре (25 °С). Получают 2-амино-4-(4-бромфенил)-6-гексил-7-гидрокси-4H-хромен-3-карбонитрил 1б в виде бледно-оранжевого порошка в аналитически чистом виде (ТСХ), выход 89 %. Спектральные данные идентичны таковым, приведенным в работе [Шаранин Ю.А., Клокол Г.В. // Журнал органической химии, 1983, Т.19, № 8, с. 1782-1784]
Пример 3. Получение 2-амино-6-гексил-4-(3,4-диметоксифенил)-7-гидрокси-4H-хромен-3-карбонитрила 1в.
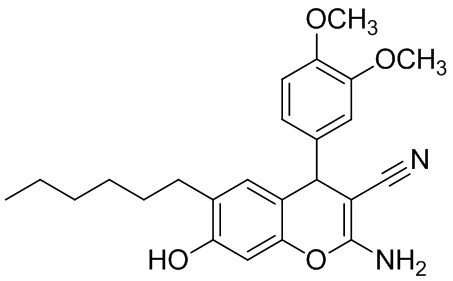
В круглодонную термостойкую колбу объемом 50 мл, снабженную обратным холодильником, помещают 0,30 г (4,54 ммоль) малононитрила, 0,76 г (4,54 ммоль) 3,4-диметоксибензальдегида, 10 мл толуола и 3 капли морфолина. Смесь перемешивают до полного растворения. К полученному желтому раствору добавляют 0,88 г (4,54 ммоль) 4-гексилрезорцина 2, реакционную массу кипятят до завершения реакции (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент – этилацетат). Затем смесь выливают в химический стакан объемом 100 мл, охлаждают до комнатной температуры и выдерживают до завершения кристаллизации. Осадок отфильтровывают, промывают толуолом (7 мл) и петролейным эфиром (3 мл), высушивают при 60 °С. Дополнительное количество продукта осаждается из маточного раствора при упаривании толуольного фильтрата при комнатной температуре (25 °С). Получают 2-амино-6-гексил-4-(3,4-диметоксифенил)-7-гидрокси-4H-хромен-3-карбонитрил 1в в виде бледно-оранжевого порошка в аналитически чистом виде (ТСХ), выход 82%. ИК-спектр, ν, см-1: 3470 сл, 3435 с, 3323 с, 3194 сл (O–H, N–H); 3005 сл, 2953 с, 2932 с, 2866 ср, 2835 сл (С–Н), 2197 с (C≡N). ЯМР 1H (400 МГц, ДМСО-d6), δH, м.д.: 0.79 т (3H, CH3, 3J = 6.3 Гц), 1.13-1.17 м (6Н, 3 СН2), 1.34-1.40 м (2Н, СН2), 2.31-2.39 м (2H, CH2), 3.69 с (3Н, MeO), 3.70 с (3Н, MeO), 4.52 с (1Н, Н4), 6.44 уш.с (1Н, Н8), 6.64 дд (1Н, Ar, 4J = 2.0 Гц, 3J = 8.3 Гц), 6.65 уш.с (1Н, Н5), 6.71 уш.с (2Н, NH2), 6.74 д (1Н, Ar, 4J = 2.0 Гц), 6.84 д (1Н, Ar, 3J = 8.3 Гц), 9.49 (уш. с, 1H, OH). ЯМР 13C (101 МГц, ДМСО-d6), δC, м.д.: 13.8 (CH3), 22.0 (CH2), 28.3 (CH2), 29.0 (CH2), 29.1 (CH2), 31.1 (CH2), 39.6 (C4H), 55.42 (MeO), 55.44 (MeO), 56.5 (C3), 101.7 (C8H), 111.3 (С Ar), 111.9 (С Ar), 113.3 (C4a), 119.4 (CN), 120.8 (С Ar), 125.2 (C Ar), 125.4 (C Ar), 128.1 (С Ar), 128.8 (С Ar), 129.5 (C Ar), 138.9 (C Ar), 146.6 (C Ar), 147.5 (C–MeO), 148.6 (C–MeO), 154.4 (C8a), 160.2 (C2). Найдено, %: C 70.70; H 7.11; N 6.67. C24H28N2O4 (М 408.49). Вычислено, %: C 70.57; H 6.91; N 6.86.
Пример 4. Получение 2-амино-6-гексил-7-гидрокси-4-(4-фторфенил)-4H-хромен-3-карбонитрила 1г.
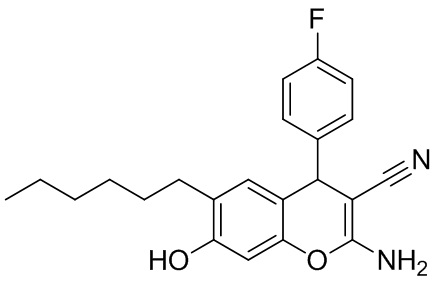
В круглодонную термостойкую колбу объемом 50 мл, снабженную обратным холодильником, помещают 0,30 г (4,54 ммоль) малононитрила, 0,5 мл (4,54 ммоль) 4-фторбензальдегида, 10 мл толуола и 3 капли морфолина. Смесь перемешивают до полного растворения. К полученному желтому раствору добавляют 0,88 г (4,54 ммоль) 4-гексилрезорцина 2, реакционную массу кипятят до завершения реакции (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент – этилацетат). Затем смесь выливают в химический стакан объемом 100 мл, охлаждают до комнатной температуры и выдерживают до завершения кристаллизации. Осадок отфильтровывают, промывают толуолом (7 мл) и петролейным эфиром (3 мл), высушивают при 60 °С. Дополнительное количество продукта осаждается из маточного раствора при упаривании толуольного фильтрата при комнатной температуре (25 °С). Получают 2-амино-6-гексил-7-гидрокси-4-(4-фторфенил)-4H-хромен-3-карбонитрил 1г в виде оранжевых кристаллов в аналитически чистом виде (ТСХ), выход 80 %. Спектральные данные идентичны таковым, приведенным в работе [Клокол Г.В., Шаранина Л.Г., Нестеров В.Н., Шкловер В.Е., Шаранин Ю.А., Стручков Ю.Т. // Журнал органической химии, 1987, Т.23, № 2, с. 412-421]
Пример 5. Получение 2-амино-6-гексил-4-(4-метоксифенил)-7-гидрокси-4H-хромен-3-карбонитрила 1д.
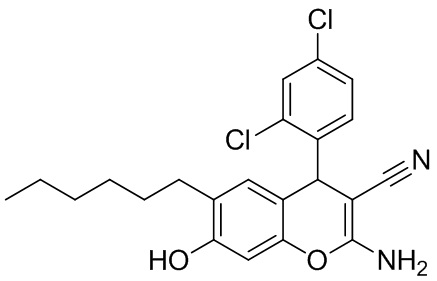
В круглодонную термостойкую колбу объемом 50 мл, снабженную обратным холодильником, помещают 0,30 г (4,54 ммоль) малононитрила, 0,795 г (4,54 ммоль) 2,4-дихлорбензальдегида, 10 мл толуола и 3 капли морфолина. Смесь перемешивают до полного растворения. К полученному желтому раствору добавляют 0,88 г (4,54 ммоль) 4-гексилрезорцина 2, реакционную массу кипятят до завершения реакции (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент – этилацетат). Затем смесь выливают в химический стакан объемом 100 мл, охлаждают до комнатной температуры и выдерживают до завершения кристаллизации. Осадок отфильтровывают, промывают толуолом (7 мл) и петролейным эфиром (3 мл), высушивают при 60 °С. Дополнительное количество продукта осаждается из маточного раствора при упаривании толуольного фильтрата при комнатной температуре (25 °С). Получают 2-амино-6-гексил-7-гидрокси-4-(2,4-дихлорфенил)-4H-хромен-3-карбонитрила 1д в виде бледно-оранжевого порошка в аналитически чистом виде (ТСХ), выход 79 %. ИК-спектр, ν, см-1: 3423 с, ш, 3344 с, ш, 3246 ср, 3221 ср (O–H, N–H); 2957 ср, 2930 с, 2872 сл, 2856 с (С–Н), 2179 с (C≡N). ЯМР 1H (400 МГц, ДМСО-d6), δH, м.д.: 0.78 т (3H, CH3, 3J = 6.6 Гц), 1.11-1.16 м (6Н, 3 СН2), 1.31-1.38 м (2Н, СН2), 2.33 т (2H, CH2, 3J = 7.5 Гц), 5.10 с (1Н, Н4), 6.46 с (1Н, Н8), 6.53 с (1Н, Н5), 6.89 уш.с (2Н, NH2), 7.17 (д, 1H, H6 2,4-Cl2C6H3, 3J = 8.5 Гц), 7.36 (дд, 1H, H5 2,4-Cl2C6H3, 3J = 8.5 Гц, 4J = 2.1 Гц), 7.53 (д, 1H, H3 2,4-Cl2C6H3, 4J = 2.1 Гц), 9.63 (уш. с, 1H, OH). ЯМР 13C (101 МГц, ДМСО-d6), δC, м.д.: 13.8 (CH3), 22.1 (CH2), 28.1 (CH2), 28.8 (CH2), 28.9 (CH2), 31.0 (CH2), 36.9 (C4H), 54.5 (C3), 101.9 (C8H), 111.3 (C4a), 120.2 (CN), 125.7 (C1 Ar), 128.0 (C5 Ar), 128.8 (C3 Ar), 129.0 (C5), 132.0 (C6 Ar), 132.1 (С-Cl Ar), 132.7 (С-Cl Ar), 142.0 (C6), 146.8 (C7), 155.0 (C8a), 160.6 (C2). Найдено, %: C, 63.25; H, 5.44; N, 6.61. C22H22Cl2N2O2 (М 417.33). Вычислено, %: C, 63.32; H, 5.31; N, 6.71.
Пример 6. Получение 2-амино-6-гексил-4-(3-нитрофенил)-7-гидрокси-4H-хромен-3-карбонитрила 1ж.
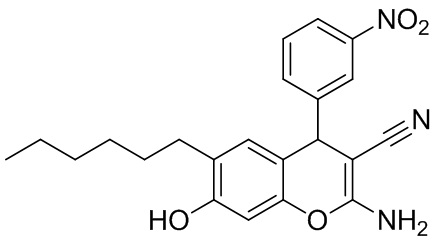
В круглодонную термостойкую колбу объемом 50 мл, снабженную обратным холодильником, помещают 0,30 г (4,54 ммоль) малононитрила, 0,69 г (4,54 ммоль) 3-нитробензальдегида, 10 мл толуола и 3 капли морфолина. Смесь перемешивают до полного растворения. К полученному желтому раствору добавляют 0,88 г (4,54 ммоль) 4-гексилрезорцина 2, реакционную массу кипятят до завершения реакции (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент – этилацетат). Полученный раствор разбавляют хлористым метиленом, профильтровывают через слой силикагеля и упаривают растворитель в вакууме. Получают 2-амино-6-гексил-7-гидрокси-4-(3-нитрофенил)-4H-хромен-3-карбонитрила 1а в виде желтого масла в аналитически чистом виде (ТСХ), выход 80 %. ИК-спектр, ν, см-1: 3460 с, ш, 3342 с, ш, 3201 ср (O–H, N–H); 2955 ср, 2926 с, 2856 с (С–Н), 2189 с (C≡N), 1526 с, 1348 с (NO2). ЯМР 1H (400 МГц, CDCl3), δH, м.д.: 0.81 т (3H, CH3, 3J = 6.5 Гц), 1.20-1.28 м (6Н, 3 СН2), 1.42-1.44 м (2Н, СН2), 2.37-2.48 м (2H, CH2), 4.77 с (1Н, Н4), 4.82 уш.с (2Н, NH2), 5.00 очень уш. с (1Н, ОН), 6.47 уш.с (1Н, Н8), 6.58 уш.с (1Н, Н5), 7.46-7.50 м (1Н, H5 3-NO2C6H4), 7.56 д (1Н, H6 3-NO2C6H4, 3J = 7.6 Гц), 8.02 уш.с (1Н, H2 3-NO2C6H4), 8.09 д (1Н, H4 3-NO2C6H4, 3J = 8.2 Гц). ЯМР 13C (101 МГц, CDCl3), δC, м.д.: 14.0 (CH3), 22.5 (CH2), 28.9 (CH2), 29.4 (CH2), 29.5 (CH2), 31.5 (CH2), 40.3 (C4H), 59.3 (C3), 103.0 (C8H), 112.5 (C4a), 119.8 (CN), 122.3 (C4H 3-NO2C6H4), 122.7 (C2H 3-NO2C6H4), 127.0 (C Ar), 129.7 (C5H 3-NO2C6H4), 130.0 (C5H Ar), 134.1 (C6H 3-NO2C6H4), 146.9 (C Ar), 147.2 (C Ar), 148.5 (С Ar), 154.0 (C8a), 159.8 (C2). Найдено, %: C, 67.25; H, 6.03; N, 10.52. C22H23N3O4 (М 393,44). Вычислено, %: C, 67.16; H, 5.89; N, 10.68.
Как видно из приведенных примеров конкретного выполнения, выходы 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов 1 возрастают, а число стадий сокращается при введении в реакцию с 4-гексилрезорцином 2 ароматических альдегидов и малононитрила вместо арилиденмалононитрилов 3 в толуоле как растворителе в присутствии каталитических количеств морфолина.
На основании изложенного следует вывод, что предлагаемое техническое решение является новым, обладает отличительными признаками и может быть масштабировано для использования в тонком органическом синтезе.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов | 2022 |
|
RU2792625C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-АРИЛ-2-ОКСО-2Н-ХРОМЕН-3-КАРБОНИТРИЛОВ | 2015 |
|
RU2577524C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФАНИЛПРОИЗВОДНЫХ 2-АМИНО-4Н-ХРОМЕН-3-КАРБОНИТРИЛ(КСИЛАТ)ОВ | 2021 |
|
RU2761922C1 |
| 7-(2-Арил-1-циановинил)-3-фенил-1,2,3,4-тетрагидропиразоло[1,5-a][1,3,5]триазин-8-карбонитрилы в качестве антидотов 2,4-Д на подсолнечнике | 2023 |
|
RU2803727C1 |
| Способ получения замещенных 2-аминобута-1,3-диен-1,1,3-трикарбонитрилов | 2022 |
|
RU2792619C1 |
| Применение 1,6-диамино-4-арил-2-оксо-1,2-дигидропиридин-3,5-дикарбонитрилов в качестве антидотов 2,4-Д на подсолнечнике | 2024 |
|
RU2826751C1 |
| Способ получения 4-арил-7,9-диметил-2-оксо-1,2-дигидротиено[2,3-b:4,5-b']дипиридин-3-карбонитрилов | 2024 |
|
RU2830752C1 |
| ПРОИЗВОДНЫЕ АРИЛМЕТОКСИ ИЗОИНДОЛИНА И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ИХ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2567753C2 |
| Азопроизводные аминофенолов, обладающие способностью ингибировать образование конечных продуктов гликирования | 2024 |
|
RU2839138C1 |
| СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЙ С ИСПОЛЬЗОВАНИЕМ ЗАМЕЩЕННЫХ ПИРАЗОЛОВ | 2001 |
|
RU2290179C2 |
Изобретение относится к способу получения 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов общей формулы 1, которые являются промежуточными продуктами в синтезе различных гетероциклических соединений и биологически активных молекул. Согласно предлагаемому способу 4-гексилрезорцин вводят в реакцию с ароматическими альдегидами ArCHO и малононитрилом в среде толуола при кипячении в присутствии каталитических количеств морфолина. В указанных формулах Ar представляет собой замещенный ароматический заместитель. Технический результат: предлагаемый способ позволяет сократить число стадий синтеза и увеличить выход целевых продуктов. 6 пр.
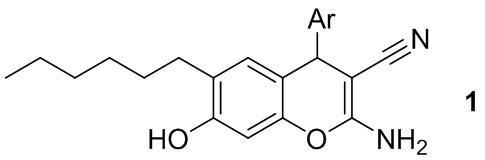
Способ получения 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов общей формулы 1
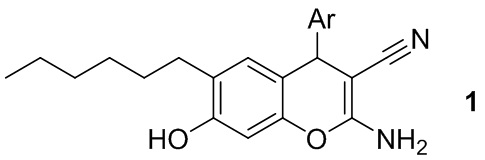
где Ar - замещенный ароматический заместитель, отличающийся тем, что 4-гексилрезорцин вводят в реакцию с ароматическими альдегидами ArCHO, где Ar представляет собой замещенный ароматический заместитель, и малононитрилом в среде толуола при кипячении в присутствии каталитических количеств морфолина.
| Г.В | |||
| КЛОКОЛ и др., Реакции циклизации нитрилов | |||
| XXIII | |||
| Присоединение активных фенолов к электронодефицитным этиленам, сопровождающееся циклизацией в 2-амино-4Н-бензо[b]пираны | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ применения поваренной соли в нагревательной закалочной ванне при высоких температурах | 1923 |
|
SU412A1 |
| Ю.А | |||
| ШАРАНИН и др., | |||
Авторы
Даты
2023-08-30—Публикация
2022-11-29—Подача